JP2021531280A - 神経変性疾患を処置するためのCAR−Tregベースの治療 - Google Patents
神経変性疾患を処置するためのCAR−Tregベースの治療 Download PDFInfo
- Publication number
- JP2021531280A JP2021531280A JP2021502704A JP2021502704A JP2021531280A JP 2021531280 A JP2021531280 A JP 2021531280A JP 2021502704 A JP2021502704 A JP 2021502704A JP 2021502704 A JP2021502704 A JP 2021502704A JP 2021531280 A JP2021531280 A JP 2021531280A
- Authority
- JP
- Japan
- Prior art keywords
- disease
- protein
- glial
- marker
- treg
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 208000015122 neurodegenerative disease Diseases 0.000 title claims abstract description 43
- 230000004770 neurodegeneration Effects 0.000 title claims abstract description 42
- 238000002560 therapeutic procedure Methods 0.000 title 1
- 210000004498 neuroglial cell Anatomy 0.000 claims abstract description 63
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 50
- 210000003289 regulatory T cell Anatomy 0.000 claims abstract description 49
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 47
- 238000000034 method Methods 0.000 claims abstract description 42
- 201000002212 progressive supranuclear palsy Diseases 0.000 claims abstract description 38
- 239000000203 mixture Substances 0.000 claims abstract description 37
- 208000018737 Parkinson disease Diseases 0.000 claims abstract description 36
- 230000001506 immunosuppresive effect Effects 0.000 claims abstract description 32
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims abstract description 30
- 208000024827 Alzheimer disease Diseases 0.000 claims abstract description 25
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 claims abstract description 21
- 208000004051 Chronic Traumatic Encephalopathy Diseases 0.000 claims abstract description 16
- 208000017004 dementia pugilistica Diseases 0.000 claims abstract description 16
- 208000023105 Huntington disease Diseases 0.000 claims abstract description 10
- 208000024777 Prion disease Diseases 0.000 claims abstract description 8
- 102000002233 Myelin-Oligodendrocyte Glycoprotein Human genes 0.000 claims description 49
- 108010000123 Myelin-Oligodendrocyte Glycoprotein Proteins 0.000 claims description 49
- 239000003550 marker Substances 0.000 claims description 31
- 230000002518 glial effect Effects 0.000 claims description 30
- 210000004248 oligodendroglia Anatomy 0.000 claims description 20
- 102100028496 Galactocerebrosidase Human genes 0.000 claims description 19
- 108010042681 Galactosylceramidase Proteins 0.000 claims description 19
- 102000023732 binding proteins Human genes 0.000 claims description 15
- 108091008324 binding proteins Proteins 0.000 claims description 15
- 230000009870 specific binding Effects 0.000 claims description 15
- 230000000694 effects Effects 0.000 claims description 14
- 102000006386 Myelin Proteins Human genes 0.000 claims description 11
- 108010083674 Myelin Proteins Proteins 0.000 claims description 11
- 102000006639 indoleamine 2,3-dioxygenase Human genes 0.000 claims description 11
- 108020004201 indoleamine 2,3-dioxygenase Proteins 0.000 claims description 11
- 210000005012 myelin Anatomy 0.000 claims description 11
- KISWVXRQTGLFGD-UHFFFAOYSA-N 2-[[2-[[6-amino-2-[[2-[[2-[[5-amino-2-[[2-[[1-[2-[[6-amino-2-[(2,5-diamino-5-oxopentanoyl)amino]hexanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxypropanoyl]amino]-5-oxopentanoyl]amino]-5-(diaminomethylideneamino)p Chemical compound C1CCN(C(=O)C(CCCN=C(N)N)NC(=O)C(CCCCN)NC(=O)C(N)CCC(N)=O)C1C(=O)NC(CO)C(=O)NC(CCC(N)=O)C(=O)NC(CCCN=C(N)N)C(=O)NC(CO)C(=O)NC(CCCCN)C(=O)NC(C(=O)NC(CC(C)C)C(O)=O)CC1=CC=C(O)C=C1 KISWVXRQTGLFGD-UHFFFAOYSA-N 0.000 claims description 10
- 102100036608 Aspartate aminotransferase, cytoplasmic Human genes 0.000 claims description 10
- 108010026759 Cytoplasmic Aspartate Aminotransferase Proteins 0.000 claims description 10
- 102000004190 Enzymes Human genes 0.000 claims description 10
- 108090000790 Enzymes Proteins 0.000 claims description 10
- 101800000263 Acidic protein Proteins 0.000 claims description 9
- 210000005036 nerve Anatomy 0.000 claims description 9
- 239000012634 fragment Substances 0.000 claims description 7
- 102100022464 5'-nucleotidase Human genes 0.000 claims description 6
- 102100028682 Claudin-11 Human genes 0.000 claims description 6
- 108050007280 Claudin-11 Proteins 0.000 claims description 6
- 102100029722 Ectonucleoside triphosphate diphosphohydrolase 1 Human genes 0.000 claims description 6
- 102000003886 Glycoproteins Human genes 0.000 claims description 6
- 108090000288 Glycoproteins Proteins 0.000 claims description 6
- 101000678236 Homo sapiens 5'-nucleotidase Proteins 0.000 claims description 6
- 101001012447 Homo sapiens Ectonucleoside triphosphate diphosphohydrolase 1 Proteins 0.000 claims description 6
- 206010061218 Inflammation Diseases 0.000 claims description 5
- 239000002771 cell marker Substances 0.000 claims description 5
- 230000004054 inflammatory process Effects 0.000 claims description 5
- 230000003278 mimic effect Effects 0.000 claims description 3
- 125000003275 alpha amino acid group Chemical group 0.000 claims 2
- 208000034189 Sclerosis Diseases 0.000 claims 1
- 150000001875 compounds Chemical class 0.000 abstract description 37
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 28
- 201000010099 disease Diseases 0.000 abstract description 26
- 230000001225 therapeutic effect Effects 0.000 abstract description 15
- 238000011282 treatment Methods 0.000 abstract description 14
- 108020001507 fusion proteins Proteins 0.000 abstract description 4
- 230000001363 autoimmune Effects 0.000 abstract description 3
- 206010062016 Immunosuppression Diseases 0.000 abstract description 2
- 210000004027 cell Anatomy 0.000 description 61
- 210000003169 central nervous system Anatomy 0.000 description 27
- 230000027455 binding Effects 0.000 description 25
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 19
- 201000006417 multiple sclerosis Diseases 0.000 description 13
- 210000002569 neuron Anatomy 0.000 description 13
- 239000003814 drug Substances 0.000 description 11
- 238000002360 preparation method Methods 0.000 description 11
- 210000001744 T-lymphocyte Anatomy 0.000 description 10
- 239000000725 suspension Substances 0.000 description 10
- 239000004480 active ingredient Substances 0.000 description 9
- 229940079593 drug Drugs 0.000 description 9
- 238000000684 flow cytometry Methods 0.000 description 9
- 230000028993 immune response Effects 0.000 description 9
- 238000002347 injection Methods 0.000 description 9
- 239000007924 injection Substances 0.000 description 9
- 239000000546 pharmaceutical excipient Substances 0.000 description 9
- 238000010186 staining Methods 0.000 description 9
- 239000003795 chemical substances by application Substances 0.000 description 8
- 238000009472 formulation Methods 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 239000008194 pharmaceutical composition Substances 0.000 description 8
- 239000003826 tablet Substances 0.000 description 8
- 238000002965 ELISA Methods 0.000 description 7
- 235000014966 Eragrostis abyssinica Nutrition 0.000 description 7
- 239000000796 flavoring agent Substances 0.000 description 7
- 235000003599 food sweetener Nutrition 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 230000007246 mechanism Effects 0.000 description 7
- 239000003765 sweetening agent Substances 0.000 description 7
- -1 troches Substances 0.000 description 7
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 230000030833 cell death Effects 0.000 description 6
- 235000013355 food flavoring agent Nutrition 0.000 description 6
- 238000001802 infusion Methods 0.000 description 6
- 230000036961 partial effect Effects 0.000 description 6
- 238000002600 positron emission tomography Methods 0.000 description 6
- 230000002829 reductive effect Effects 0.000 description 6
- 239000000375 suspending agent Substances 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- 238000010171 animal model Methods 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 210000004556 brain Anatomy 0.000 description 5
- 235000014113 dietary fatty acids Nutrition 0.000 description 5
- 239000003085 diluting agent Substances 0.000 description 5
- 239000002270 dispersing agent Substances 0.000 description 5
- 239000003937 drug carrier Substances 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- 150000002148 esters Chemical class 0.000 description 5
- 239000000194 fatty acid Substances 0.000 description 5
- 229930195729 fatty acid Natural products 0.000 description 5
- 150000004665 fatty acids Chemical class 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 235000019198 oils Nutrition 0.000 description 5
- 239000003755 preservative agent Substances 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 239000000080 wetting agent Substances 0.000 description 5
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 4
- 206010065390 Inflammatory pain Diseases 0.000 description 4
- ZCYVEMRRCGMTRW-AHCXROLUSA-N Iodine-123 Chemical compound [123I] ZCYVEMRRCGMTRW-AHCXROLUSA-N 0.000 description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 4
- 206010028980 Neoplasm Diseases 0.000 description 4
- 208000007400 Relapsing-Remitting Multiple Sclerosis Diseases 0.000 description 4
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 4
- 239000007900 aqueous suspension Substances 0.000 description 4
- 238000002619 cancer immunotherapy Methods 0.000 description 4
- 230000008614 cellular interaction Effects 0.000 description 4
- 239000003086 colorant Substances 0.000 description 4
- 238000002591 computed tomography Methods 0.000 description 4
- 239000007859 condensation product Substances 0.000 description 4
- 230000034994 death Effects 0.000 description 4
- 230000006866 deterioration Effects 0.000 description 4
- 239000002552 dosage form Substances 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- 125000005647 linker group Chemical group 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 230000003557 neuropsychological effect Effects 0.000 description 4
- 239000004006 olive oil Substances 0.000 description 4
- 235000008390 olive oil Nutrition 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 206010063401 primary progressive multiple sclerosis Diseases 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 238000002603 single-photon emission computed tomography Methods 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 230000008685 targeting Effects 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 3
- 102100027581 Forkhead box protein P3 Human genes 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 229920000084 Gum arabic Polymers 0.000 description 3
- 101000861452 Homo sapiens Forkhead box protein P3 Proteins 0.000 description 3
- 102000000588 Interleukin-2 Human genes 0.000 description 3
- 108010002350 Interleukin-2 Proteins 0.000 description 3
- 241000713666 Lentivirus Species 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 210000000447 Th1 cell Anatomy 0.000 description 3
- 210000000068 Th17 cell Anatomy 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 235000010489 acacia gum Nutrition 0.000 description 3
- 239000000205 acacia gum Substances 0.000 description 3
- 235000010443 alginic acid Nutrition 0.000 description 3
- 239000000783 alginic acid Substances 0.000 description 3
- 229920000615 alginic acid Polymers 0.000 description 3
- 229960001126 alginic acid Drugs 0.000 description 3
- 150000004781 alginic acids Chemical class 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 230000006470 autoimmune attack Effects 0.000 description 3
- 230000009286 beneficial effect Effects 0.000 description 3
- 230000008499 blood brain barrier function Effects 0.000 description 3
- 210000001218 blood-brain barrier Anatomy 0.000 description 3
- 229910000019 calcium carbonate Inorganic materials 0.000 description 3
- 201000011510 cancer Diseases 0.000 description 3
- 210000001159 caudate nucleus Anatomy 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 239000007884 disintegrant Substances 0.000 description 3
- 239000012636 effector Substances 0.000 description 3
- 238000004520 electroporation Methods 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 238000010230 functional analysis Methods 0.000 description 3
- 102000037865 fusion proteins Human genes 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 230000008004 immune attack Effects 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 210000003000 inclusion body Anatomy 0.000 description 3
- 230000002757 inflammatory effect Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 229940057995 liquid paraffin Drugs 0.000 description 3
- 210000003622 mature neutrocyte Anatomy 0.000 description 3
- 210000000274 microglia Anatomy 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 210000001577 neostriatum Anatomy 0.000 description 3
- 208000004296 neuralgia Diseases 0.000 description 3
- 238000002610 neuroimaging Methods 0.000 description 3
- 230000002981 neuropathic effect Effects 0.000 description 3
- 208000021722 neuropathic pain Diseases 0.000 description 3
- 230000002093 peripheral effect Effects 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 208000032207 progressive 1 supranuclear palsy Diseases 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 210000002637 putamen Anatomy 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 239000000829 suppository Substances 0.000 description 3
- 239000006188 syrup Substances 0.000 description 3
- 235000020357 syrup Nutrition 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 231100000331 toxic Toxicity 0.000 description 3
- 230000002588 toxic effect Effects 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- IZHVBANLECCAGF-UHFFFAOYSA-N 2-hydroxy-3-(octadecanoyloxy)propyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)COC(=O)CCCCCCCCCCCCCCCCC IZHVBANLECCAGF-UHFFFAOYSA-N 0.000 description 2
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 206010051290 Central nervous system lesion Diseases 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101001115699 Homo sapiens Myelin-oligodendrocyte glycoprotein Proteins 0.000 description 2
- 102000003814 Interleukin-10 Human genes 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 101001013647 Mus musculus Methionine synthase Proteins 0.000 description 2
- 206010033799 Paralysis Diseases 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 2
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 239000003429 antifungal agent Substances 0.000 description 2
- 229940121375 antifungal agent Drugs 0.000 description 2
- 210000004227 basal ganglia Anatomy 0.000 description 2
- 238000004820 blood count Methods 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000006727 cell loss Effects 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 230000006020 chronic inflammation Effects 0.000 description 2
- 208000037976 chronic inflammation Diseases 0.000 description 2
- 210000004443 dendritic cell Anatomy 0.000 description 2
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 2
- 230000001627 detrimental effect Effects 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 210000003162 effector t lymphocyte Anatomy 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000007903 gelatin capsule Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 2
- 102000047972 human MOG Human genes 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 229940121354 immunomodulator Drugs 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 229940076144 interleukin-10 Drugs 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 239000004922 lacquer Substances 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 230000002045 lasting effect Effects 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- 210000004558 lewy body Anatomy 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 238000002595 magnetic resonance imaging Methods 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 2
- 230000007659 motor function Effects 0.000 description 2
- 210000002161 motor neuron Anatomy 0.000 description 2
- 239000002324 mouth wash Substances 0.000 description 2
- 229940051866 mouthwash Drugs 0.000 description 2
- 239000002105 nanoparticle Substances 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 210000002682 neurofibrillary tangle Anatomy 0.000 description 2
- 230000000926 neurological effect Effects 0.000 description 2
- 231100000344 non-irritating Toxicity 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000000346 nonvolatile oil Substances 0.000 description 2
- 229950005751 ocrelizumab Drugs 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 229940127557 pharmaceutical product Drugs 0.000 description 2
- 229920000314 poly p-methyl styrene Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 230000001144 postural effect Effects 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 201000008628 secondary progressive multiple sclerosis Diseases 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 210000004500 stellate cell Anatomy 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 210000003523 substantia nigra Anatomy 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 102000013498 tau Proteins Human genes 0.000 description 2
- 108010026424 tau Proteins Proteins 0.000 description 2
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 2
- 230000004797 therapeutic response Effects 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- 239000013598 vector Substances 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 1
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- PZNPLUBHRSSFHT-RRHRGVEJSA-N 1-hexadecanoyl-2-octadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[C@@H](COP([O-])(=O)OCC[N+](C)(C)C)COC(=O)CCCCCCCCCCCCCCC PZNPLUBHRSSFHT-RRHRGVEJSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- SPCKHVPPRJWQRZ-UHFFFAOYSA-N 2-benzhydryloxy-n,n-dimethylethanamine;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 SPCKHVPPRJWQRZ-UHFFFAOYSA-N 0.000 description 1
- IJRKANNOPXMZSG-SSPAHAAFSA-N 2-hydroxypropane-1,2,3-tricarboxylic acid;(2r,3s,4r,5r)-2,3,4,5,6-pentahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O.OC(=O)CC(O)(C(O)=O)CC(O)=O IJRKANNOPXMZSG-SSPAHAAFSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 1
- ZKHQWZAMYRWXGA-KQYNXXCUSA-N Adenosine triphosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-N 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 241000239290 Araneae Species 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 101100131052 Caenorhabditis elegans mog-1 gene Proteins 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 239000004380 Cholic acid Substances 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 206010061819 Disease recurrence Diseases 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 229920001917 Ficoll Polymers 0.000 description 1
- 206010056696 Gaze palsy Diseases 0.000 description 1
- 102000001398 Granzyme Human genes 0.000 description 1
- 108060005986 Granzyme Proteins 0.000 description 1
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 1
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 1
- 101000716065 Homo sapiens C-C chemokine receptor type 7 Proteins 0.000 description 1
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- 101001137987 Homo sapiens Lymphocyte activation gene 3 protein Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 102000017578 LAG3 Human genes 0.000 description 1
- SMEROWZSTRWXGI-UHFFFAOYSA-N Lithocholsaeure Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)CC2 SMEROWZSTRWXGI-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 208000002740 Muscle Rigidity Diseases 0.000 description 1
- 102000047918 Myelin Basic Human genes 0.000 description 1
- 101710107068 Myelin basic protein Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 102100021079 Ornithine decarboxylase Human genes 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 108010053210 Phycocyanin Proteins 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920002873 Polyethylenimine Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 101710093543 Probable non-specific lipid-transfer protein Proteins 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 244000273928 Zingiber officinale Species 0.000 description 1
- 235000006886 Zingiber officinale Nutrition 0.000 description 1
- UYRDHEJRPVSJFM-VSWVFQEASA-N [(1s,3r)-3-hydroxy-4-[(3e,5e,7e,9e,11z)-11-[4-[(e)-2-[(1r,3s,6s)-3-hydroxy-1,5,5-trimethyl-7-oxabicyclo[4.1.0]heptan-6-yl]ethenyl]-5-oxofuran-2-ylidene]-3,10-dimethylundeca-1,3,5,7,9-pentaenylidene]-3,5,5-trimethylcyclohexyl] acetate Chemical compound C[C@@]1(O)C[C@@H](OC(=O)C)CC(C)(C)C1=C=C\C(C)=C\C=C\C=C\C=C(/C)\C=C/1C=C(\C=C\[C@]23[C@@](O2)(C)C[C@@H](O)CC3(C)C)C(=O)O\1 UYRDHEJRPVSJFM-VSWVFQEASA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000003044 adaptive effect Effects 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- UDMBCSSLTHHNCD-KQYNXXCUSA-N adenosine 5'-monophosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O UDMBCSSLTHHNCD-KQYNXXCUSA-N 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 108010004469 allophycocyanin Proteins 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 238000009175 antibody therapy Methods 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 230000009118 appropriate response Effects 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 210000001130 astrocyte Anatomy 0.000 description 1
- 230000006472 autoimmune response Effects 0.000 description 1
- 210000003050 axon Anatomy 0.000 description 1
- 230000003376 axonal effect Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- OGBUMNBNEWYMNJ-UHFFFAOYSA-N batilol Chemical class CCCCCCCCCCCCCCCCCCOCC(O)CO OGBUMNBNEWYMNJ-UHFFFAOYSA-N 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 239000012166 beeswax Substances 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- WHGYBXFWUBPSRW-FOUAGVGXSA-N beta-cyclodextrin Chemical class OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO WHGYBXFWUBPSRW-FOUAGVGXSA-N 0.000 description 1
- 239000003613 bile acid Substances 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 210000005056 cell body Anatomy 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- 210000003591 cerebellar nuclei Anatomy 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 229930002875 chlorophyll Natural products 0.000 description 1
- 235000019804 chlorophyll Nutrition 0.000 description 1
- ATNHDLDRLWWWCB-AENOIHSZSA-M chlorophyll a Chemical compound C1([C@@H](C(=O)OC)C(=O)C2=C3C)=C2N2C3=CC(C(CC)=C3C)=[N+]4C3=CC3=C(C=C)C(C)=C5N3[Mg-2]42[N+]2=C1[C@@H](CCC(=O)OC\C=C(/C)CCC[C@H](C)CCC[C@H](C)CCCC(C)C)[C@H](C)C2=C5 ATNHDLDRLWWWCB-AENOIHSZSA-M 0.000 description 1
- 235000019416 cholic acid Nutrition 0.000 description 1
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 1
- 229960002471 cholic acid Drugs 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 210000003690 classically activated macrophage Anatomy 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 230000010485 coping Effects 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 1
- 229960003964 deoxycholic acid Drugs 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 229910000393 dicalcium diphosphate Inorganic materials 0.000 description 1
- 235000019821 dicalcium diphosphate Nutrition 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- 229960000520 diphenhydramine Drugs 0.000 description 1
- 239000001177 diphosphate Substances 0.000 description 1
- XPPKVPWEQAFLFU-UHFFFAOYSA-J diphosphate(4-) Chemical compound [O-]P([O-])(=O)OP([O-])([O-])=O XPPKVPWEQAFLFU-UHFFFAOYSA-J 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 230000028436 dopamine uptake Effects 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 208000033068 episodic angioedema with eosinophilia Diseases 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 235000010228 ethyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004403 ethyl p-hydroxybenzoate Substances 0.000 description 1
- 229940043351 ethyl-p-hydroxybenzoate Drugs 0.000 description 1
- NUVBSKCKDOMJSU-UHFFFAOYSA-N ethylparaben Chemical compound CCOC(=O)C1=CC=C(O)C=C1 NUVBSKCKDOMJSU-UHFFFAOYSA-N 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 238000012637 gene transfection Methods 0.000 description 1
- 235000008397 ginger Nutrition 0.000 description 1
- 210000001905 globus pallidus Anatomy 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 229940074045 glyceryl distearate Drugs 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 210000004884 grey matter Anatomy 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- FBPFZTCFMRRESA-UHFFFAOYSA-N hexane-1,2,3,4,5,6-hexol Chemical compound OCC(O)C(O)C(O)C(O)CO FBPFZTCFMRRESA-UHFFFAOYSA-N 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 239000012642 immune effector Substances 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 230000002584 immunomodulator Effects 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 238000002650 immunosuppressive therapy Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 229940102213 injectable suspension Drugs 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 238000009413 insulation Methods 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- HXWLAJVUJSVENX-HFIFKADTSA-N ioflupane I(123) Chemical compound C1([C@H]2C[C@@H]3CC[C@@H](N3CCCF)[C@H]2C(=O)OC)=CC=C([123I])C=C1 HXWLAJVUJSVENX-HFIFKADTSA-N 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- SMEROWZSTRWXGI-HVATVPOCSA-N lithocholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 SMEROWZSTRWXGI-HVATVPOCSA-N 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000003340 mental effect Effects 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 230000002297 mitogenic effect Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000000337 motor cortex Anatomy 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000003007 myelin sheath Anatomy 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 230000000626 neurodegenerative effect Effects 0.000 description 1
- 238000010984 neurological examination Methods 0.000 description 1
- 230000007658 neurological function Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 230000009437 off-target effect Effects 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 208000021090 palsy Diseases 0.000 description 1
- 238000004091 panning Methods 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 230000009268 pathologic speech processing Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 239000002304 perfume Substances 0.000 description 1
- UTIQDNPUHSAVDN-UHFFFAOYSA-N peridinin Natural products CC(=O)OC1CC(C)(C)C(=C=CC(=CC=CC=CC=C2/OC(=O)C(=C2)C=CC34OC3(C)CC(O)CC4(C)C)C)C(C)(O)C1 UTIQDNPUHSAVDN-UHFFFAOYSA-N 0.000 description 1
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 1
- 210000001428 peripheral nervous system Anatomy 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 238000009101 premedication Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 201000000196 pseudobulbar palsy Diseases 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 239000000700 radioactive tracer Substances 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000009711 regulatory function Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- SIIICDNNMDMWCI-YJNKXOJESA-N rti-55 Chemical compound C1([C@H]2C[C@@H]3CC[C@@H](N3C)[C@H]2C(=O)OC)=CC=C(I)C=C1 SIIICDNNMDMWCI-YJNKXOJESA-N 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 238000013341 scale-up Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 229910001467 sodium calcium phosphate Inorganic materials 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 239000008347 soybean phospholipid Substances 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 210000004281 subthalamic nucleus Anatomy 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 210000001685 thyroid gland Anatomy 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- ODLHGICHYURWBS-LKONHMLTSA-N trappsol cyclo Chemical compound CC(O)COC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)COCC(O)C)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1COCC(C)O ODLHGICHYURWBS-LKONHMLTSA-N 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/462—Cellular immunotherapy characterized by the effect or the function of the cells
- A61K39/4621—Cellular immunotherapy characterized by the effect or the function of the cells immunosuppressive or immunotolerising
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/46432—Nervous system antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Cell Biology (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Biophysics (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Virology (AREA)
- Zoology (AREA)
- Developmental Biology & Embryology (AREA)
- Biotechnology (AREA)
- Hematology (AREA)
- Psychology (AREA)
- Gastroenterology & Hepatology (AREA)
- Dermatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
Description
本出願は、2018年3月27日出願の米国仮出願第62/648,684号(その内容は、その全体において参考として援用される)の優先権および利益を主張する。
本発明は、種々の神経変性疾患(例えば、進行性核上性麻痺およびパーキンソン病)に関する免疫応答および炎症を特異的に調節するCAR−Treg組成物およびその使用方法を提供する。
パーキンソン病(PD)、アルツハイマー病(AD)、ハンチントン病、筋萎縮性側索硬化症(ALS)、および進行性核上性麻痺(PSP)のような神経変性疾患は、かなりの数の人々に影響を及ぼしており、しばしば、急激な物理的および/または精神的悪化ならびに死亡を生じる。それらの疾患の治癒、ならびに症状の管理および悪化を遅らせることに焦点を当てる処置は、既知でない。
本発明の組成物および方法は、制御性Tリンパ球(Treg)またはTreg細胞によって発現される免疫抑制タンパク質を使用して、中枢神経系(CNS)におけるグリア細胞を標的とする神経変性性免疫応答を調節する。Tregまたは免疫抑制タンパク質を、グリア細胞マーカーを特異的に認識しかつ結合するキメラ抗原レセプター(CAR)または単鎖可変フラグメント(scFv)のいずれかに連結することによって、上記免疫抑制性Tregまたはタンパク質は、炎症を低減し、CNSを自己免疫による攻撃から防御するように、CNSのグリア細胞を誘導する。
本発明は、種々の神経変性疾患の自己免疫構成要素を調節するための組成物に関する。本明細書で提供される組成物および方法は、グリア細胞特異的マーカーを標的として、免疫抑制分子(例えば、TregまたはTregによって発現される免疫抑制タンパク質)をCNSに誘導し、進行性核上性麻痺(PSP)、アルツハイマー病(AD)、ハンチントン病、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)、慢性外傷性脳症(CTE)、またはプリオン病のような疾患の神経変性性効果に寄与する自己免疫による攻撃を妨害する。
特許、特許出願、特許公報、学術雑誌、書籍、論文、ウェブコンテンツのような他の文書への言及および引用は、本開示全体を通じて行われている。全てのこのような文書は、全ての目的のためにそれらの全体において本明細書に参考として援用される。
本発明の種々の改変およびその多くのさらなる実施形態は、本明細書で示されかつ記載されるものに加えて、本明細書で引用される科学文献および特許文献への言及を含め、本文書の全内容から当業者に明らかになる。本明細書における主題は、本発明の実施に適合され得る重要な情報、例示およびガイダンスを、その種々の実施形態およびその均等物において含む。
試験デザイン
進行性核上性麻痺(PSP)を有する参加者は、エキソビボで拡大増殖された自家CD4+CDl27lo/−CD25+ CAR−制御性T細胞(Treg)の1回の注入を受ける。CAR−Tregを、中枢神経系(CNS)において特異的に発現される糖タンパク質であるミエリン−希突起膠細胞タンパク質(MOG)を特異的に認識し、脳における免疫寛容および抗炎症効果を誘導するようにデザインする。
1.有害事象
2.検査の異常
3.注入反応
4.感染に関連する合併症
5.PSPの経過に対する潜在的な負の影響
1.PSP患者における臨床パラメーター、神経心理学的パラメーター、放射線医学的パラメーターおよび生化学的パラメーターに対するCNS特異的CAR−Tregの効果を評価する
2.アルツハイマー病(AD)を含む他の神経変性疾患におけるCNS特異的CAR−Tregの潜在的な治療上の使用法に関する兆候を得る
3.神経変性障害に関するCAR−Tregの潜在的有効性への価値ある洞察を提供し得るプラシーボを対照とした潜在的なフェーズII無作為化二重盲検において兆候を得る。
臨床評価および神経心理学的評価: 包含基準および排除基準の詳細な説明、ならびに臨床評価(運動および神経心理学的)および神経画像診断評価を、以前(Giordano et al., J. Transl. Med. 2014; Canesi et al., J. Transl. Med. 2016(本明細書に参考として援用される))に報告されたように行う。患者は、神経学的検査を受けて、以下のスケールを使用して運動機能が評価される:統一パーキンソン病評価スケール(UPDRS パートIII、運動スコア)、ホーエン・ヤール重症度分類(Hoehn and Yahr staging)(H&Y)、PSP評価スケール(PSP−RS)(Goetz et al., Mov. Disord. 2004; Golbe et al., Brain 2007(これらの各々の内容は、本明細書に参考として援用される)。ミニメンタルステート評価(MMSE)をまた、以前(Folstein et al. J. Psychiatr. Res. 1975(本明細書に参考として援用される))に記載されたように行う。全てのこれらの検査を、ベースライン時および各追跡点(細胞投与の1ヶ月後、3ヶ月後、6ヶ月後、および12ヶ月後)において評価する。UPDRSおよびPSP−RSスコアが、ベースラインと比較して30%より大きく減少しなかった場合、およびH&Y重症度分類が規定された時点で変化しなかった場合、「安定」として臨床状態を分類する(Canesi et al., J. Transl. Med. 2016(本明細書に参考として援用される))。
Treg単離および拡大増殖(expansion): ポリTregを選択し、3種の細胞表面マーカー(CD4、CD25、およびCD127)に基づいて、PSPを有する5名の個体から拡大増殖して、以前(Putnam et al., Diabetes 2009; Bluestone et al., Sci. Transl. Med., 2015(本明細書に参考として援用される))に記載されたように末梢血に存在するFOXP3+ Tregを精製する。
− 拡大増殖したTregの全体の純度および安定性を評価するためのFOXP3座のエンハンサー領域のDNAメチル化状態。
− リンパ球表現型を評価するためのサイトカイン生成(IFNγ、IL−4、IL−5およびIL−17)。
− 拡大増殖した細胞の機能的潜在能力を決定するためのインビトロ抑制活性。
MOG特異的CAR−Tregの1回の投与を、各患者に対して行う(2.6×109 CAR−Treg/患者)。細胞を、少なくとも5名のPSP患者に投与する。患者は、アセトアミノフェンおよびジフェンヒドラミンでの前投薬を受ける。CAR−Tregを、末梢静脈ラインを介して10〜30分かけて注入する。注入の前および後に、次いで、少なくとも1時間にわたって15分ごとに、次いで、最初の4時間について1時間ごとに、および20時間について4時間ごとに、バイタルサインを測定する。種々の血球数を伴う化学的性質および全血球カウントを、臨床研究ユニットから退院する前に翌日に反復する。患者を、注入後4日目に、次いで、4週間にわたって1週間に1回、次いで、1年間にわたって13週間ごとに1回、および2年間にわたって26週間ごとに1回、追跡評価のために診察する。有害事象に関する電話モニタリングを、5年間にわたって6ヶ月毎に継続し、その後、最後のクリニック訪問を行う。
PSP患者における臨床パラメーター、神経心理学的パラメーター、放射線医学的パラメーターおよび生化学的パラメーターに対するCNS特異的CAR−Tregの効果を、上記のように評価する。試験は全て、各追跡点で行う:細胞投与後1ヶ月、3ヶ月、6ヶ月、および12ヶ月。
疾患を引き起こす、損傷を与える免疫応答を止める免疫抑制制御性Tリンパ球(Treg)の構成要素を利用する多発性硬化症(MS)の薬物を、開発および試験する。全世界のMS市場は、約215億ドルであるが、MSの最も一般的な形態に関して承認された薬物は、顕著な副作用を伴うが若干の疾患修飾を与えるに過ぎない。MSのより重篤な形態に関しては、処置選択肢は、わずか1種の最近承認された薬物に限られている。
抗MOGハイブリドーマを、CROを通じて、組換えヒトMOGでマウスを免疫することによって生成する。VH遺伝子およびVL遺伝子をクローニングし、抗scFv分子。VHおよびVLの配向、ならびにリンカー(scFv間のまたは各scFv内部の)は、GTIPの安定性、発現レベルおよび結合能力に大きく影響を及ぼし得る。場合によっては、これらの形態のうちの1つのみが、機能的分子を生成する。従って、VH−VLのいくつかの配向を、小規模に発現させ、スケールアップ生成の前に試験する。接続するリンカー、中心リンカー、次いで、Treg関連酵素または模倣物へと接続するとともに4種の抗MOG scFvをコードする発現構築物を、生成する。
GTIPを、マウスのMSの急性および慢性のEAEモデルにおいて試験する。ミエリン塩基性タンパク質(MBP)、骨髄炎症性細胞(マクロファージおよび好中球)および抗MBP抗体に対して特異的なTh1、Th17、CTL(血液およびCNS)のレベルを測定する。免疫学的応答は、疾患進行と相関する。投与を、後期ステージMSにおける潜在的用途への洞察を得るために変化させる。生成物を通常のマウスにおいて投与して、任意の潜在的オフターゲット効果への洞察を得る。
臨床試験を行って、MSにおける疾患修飾薬剤としてのGTIPの有効性を試験する。その生成物を、第1使用薬(first use drug)に応答しないRRMS患者において最初に試験する。安全性および耐容性を、抗体治療に関するものに類似の投与レジメンを使用して測定する(例えば、最初に2週間ごとに3回のi.v.用量、次いで、20週間にわたって4週間ごと)。フェーズ2試験において、一次尺度は、減少した疾患再発頻度および脳病変である。二次尺度は、血中において減少した炎症性サイトカイン、Th1/Th17細胞および他の白血球レベルである。副作用は、感染しやすさの増大を含み得る。これらの試験は、再発頻度において49%までの低減を示す他の第2使用薬に対して、上記化合物の有効性を本発明者らが基準にする(benchmark)ことを可能にする。上記生成物が受容可能な有効性レベルを示す場合、それらは、PPMS患者におけるより長期間のフェーズ2臨床試験に入る。一次尺度は、運動機能の低下の遅延および低減した脳病変であり、二次尺度は、血中において減少した炎症性サイトカイン、Th1/Th17細胞および他の白血球のレベルである。
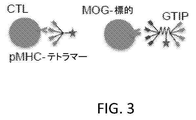
テトラマー結合アッセイを使用して、図3に示されるように、標的細胞へのGITP結合の結合力を、T細胞に対する既知のテトラマー(Ober, B et al, 2000 Int Immunol(本明細書に参考として援用される))のものと、比較する。B6.2.16 CTL上のTCRに対するH−Yペプチド/MHC H−2Db(pMHC)テトラマーの相対的結合力を、細胞染色およびフローサイトメトリー(FCM)を使用する2つのパラメーターを決定することによって測定する。これらは、テトラマー染色(細胞洗浄後)の最大染色を与えるために必要とされる濃度および半減期(t1/2)である。MOG標的細胞を、非接着性標的細胞(例えば、RMAまたはJurkat細胞)の遺伝子トランスフェクションによって生成する。抗体染色およびフローサイトメトリー(FCM)は、MOGの表面発現を確認する。抗体染色およびFCMは、CTL上にB6.2.16 TCRと同じMOGレベルを有するトランスフェクト体を同定する。標識GITPタンパク質でのMOG標的細胞の染色の最大染色および半減期を測定し、図4および5に示されるように、CTLおよびpMHCテトラマーのものと比較する。その目的は、CTLおよびpMHCテトラマーのものに匹敵するかまたはこれより良好な細胞相互作用の結合力を有するGITPを生成することである。GITP分子におけるテトラマー抗MOG scFvが、このバーを下回る場合、scFvのバランス(valance)結合価は増大され得る。さらにより高い結合価が必要とされる場合、ナノ粒子足場が、標的細胞結合のための必要な結合力を達成するために使用され得る。
MOG標的細胞に結合したGTIPがTエフェクター(Teff)細胞の増殖を抑制する能力を試験する。所定のスカベンジャーIE(以下の表1を参照のこと)のテトラマーから構成されるGTIPは、MOG標的細胞に結合され、洗浄され、次いで、増殖しつつあるヒトTeff(例えば、抗CD3/CD28およびIL−2刺激の3日後に標準的手順を使用して生成される)とともにインキュベートされる(図6の中央の列)。
MOGに特異的なscFvを発現するCAR分子が、Treg細胞をMOG発現標的細胞に、生理学的に意味のあるT細胞:標的細胞相互作用に近い相対的結合力で結合させる能力を測定するために、アッセイが使用される。比較のために使用される生理学的に意味のあるT細胞:標的細胞相互作用は、CTL:ペプチド/MHC(pMHC)/標的細胞相互作用である。これは、細胞−細胞結合体のためのフローサイトメトリー(FCM)ベースのアッセイ(Opferman, JT et al., 2001 Int Immunol.(本明細書に参考として援用される))を使用して行われる。
ヒトファージディスプレイscFvライブラリーの親和性パニングによって、ヒトMOGに対して特異的なscFv抗体を生成した。QC SDS−PAGEを、ライブラリースクリーニングの前に行って、標的の純度を評価した。非特異的結合因子を低減するために、プレカウンター選択(pre−counter selection)を、ポリスチレン平底プレートおよびブロッキング緩衝液を使用して、先ず標的化スクリーニングの前に上記ファージライブラリーに対して行った。
Claims (29)
- 被験体において神経変性疾患を処置するための方法であって、前記方法は、前記被験体に、神経組織を保護しかつ前記神経組織における炎症を低減するために治療上有効な量の、グリア細胞マーカーに特異的に結合するキメラ抗原レセプター(CAR)を各々発現する制御性T細胞(Treg)を投与し、それによって、前記神経変性疾患を処置する工程を包含し、ただし前記神経変性疾患は多発性硬化症ではない、方法。
- 前記被験体はヒトである、請求項1に記載の方法。
- 前記グリア細胞マーカーは、希突起膠細胞糖タンパク質(MOG)、希突起膠細胞マーカー01(OM1)、希突起膠細胞マーカー04(OM4)、神経/グリアマーカー2(NG2)、A2B5、ガラクトシルセラミダーゼ(GALC)、ミエリン塩基性タンパク質(MBP)、グリア線維性酸性タンパク質(GFAP)、およびミエリン希突起膠細胞特異的タンパク質(MOSP)からなる群より選択される、請求項1に記載の方法。
- 前記グリア細胞マーカーは、ミエリン希突起膠細胞糖タンパク質(MOG)である、請求項3に記載の方法。
- 前記神経変性疾患は、進行性核上性麻痺(PSP)、アルツハイマー病(AD)、ハンチントン病、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)、慢性外傷性脳症(CTE)、およびプリオン病からなる群より選択される、請求項1に記載の方法。
- 前記神経変性疾患は、進行性核上性麻痺(PSP)である、請求項5に記載の方法。
- 前記神経変性疾患は、アルツハイマー病(AD)である、請求項5に記載の方法。
- 前記神経変性疾患は、パーキンソン病(PD)である、請求項5に記載の方法。
- 多発性硬化症ではない神経変性疾患を処置するために治療上有効な量において複数の操作された制御性T細胞(Treg)を含む組成物であって、前記複数の操作されたTregの各々は、グリア細胞マーカーに特異的に結合するキメラ抗原レセプター(CAR)を発現する、組成物。
- 前記グリア細胞マーカーは、ミエリン希突起膠細胞糖タンパク質(MOG)、希突起膠細胞マーカー01(OM1)、希突起膠細胞マーカー04(OM4)、神経/グリアマーカー2(NG2)、A2B5、ガラクトシルセラミダーゼ(GALC)、ミエリン塩基性タンパク質(MBP)、グリア線維性酸性タンパク質(GFAP)、およびミエリン希突起膠細胞特異的タンパク質(MOSP)からなる群より選択される、請求項9に記載の組成物。
- 前記グリア細胞マーカーは、ミエリン希突起膠細胞糖タンパク質(MOG)である、請求項9に記載の組成物。
- 前記神経変性疾患は、進行性核上性麻痺(PSP)、パーキンソン病(PD)、アルツハイマー病、ハンチントン病、筋萎縮性側索硬化症(ALS)、慢性外傷性脳症(CTE)、およびプリオン病からなる群より選択される、請求項9に記載の組成物。
- 前記神経変性疾患は、進行性核上性麻痺(PSP)である、請求項12に記載の組成物。
- 前記神経変性疾患は、アルツハイマー病(AD)である、請求項12に記載の組成物。
- 前記神経変性疾患は、パーキンソン病(PD)である、請求項12に記載の組成物。
- 制御性T細胞(Treg)によって発現される分子に連結されたグリア細胞特異的結合タンパク質を含む、操作されたタンパク質。
- Tregによって発現される前記分子は、細胞外免疫抑制酵素である、請求項16に記載の操作されたタンパク質。
- Tregによって発現される前記分子は、CD73、CD39、インドールアミン2,3−ジオキシゲナーゼ(IDO)、およびグルタミン酸オキサロ酢酸トランスアミナーゼ1(GOT1)からなる群より選択される、請求項17に記載の操作されたタンパク質。
- 前記グリア細胞特異的結合タンパク質は、抗体分子のテトラマー単鎖可変フラグメント(scFv)である、請求項16に記載の操作されたタンパク質。
- 前記グリア細胞特異的結合タンパク質は、ミエリン希突起膠細胞糖タンパク質(MOG)、希突起膠細胞マーカー01(OM1)、希突起膠細胞マーカー04(OM4)、神経/グリアマーカー2(NG2)、A2B5、ガラクトシルセラミダーゼ(GALC)、ミエリン塩基性タンパク質(MBP)、グリア線維性酸性タンパク質(GFAP)、およびミエリン希突起膠細胞特異的タンパク質(MOSP)からなる群より選択されるマーカーに結合する、請求項16に記載の操作されたタンパク質。
- 前記グリア細胞特異的結合タンパク質は、ミエリン希突起膠細胞糖タンパク質(MOG)に結合する、請求項20に記載の操作されたタンパク質。
- 前記グリア細胞特異的結合タンパク質は、配列番号4、6、および12からなる群より選択されるアミノ酸配列を含む抗体分子の単鎖可変フラグメント(scFv)である、請求項21に記載の操作されたタンパク質。
- 制御性T細胞(Treg)によって発現される分子の活性を模倣する分子に連結されたグリア細胞特異的結合タンパク質を含む、操作されたタンパク質。
- Tregによって発現される前記分子は、細胞外免疫抑制酵素である、請求項23に記載の操作されたタンパク質。
- Tregによって発現される前記分子は、CD73、CD39、インドールアミン2,3−ジオキシゲナーゼ(IDO)、およびグルタミン酸オキサロ酢酸トランスアミナーゼ1(GOT1)からなる群より選択される、請求項24に記載の操作されたタンパク質。
- 前記グリア細胞特異的結合タンパク質は、抗体分子のテトラマー単鎖可変フラグメント(scFv)である、請求項23に記載の操作されたタンパク質。
- 前記グリア細胞特異的結合タンパク質は、ミエリン希突起膠細胞糖タンパク質(MOG)、希突起膠細胞マーカー01(OM1)、希突起膠細胞マーカー04(OM4)、神経/グリアマーカー2(NG2)、A2B5、ガラクトシルセラミダーゼ(GALC)、ミエリン塩基性タンパク質(MBP)、グリア線維性酸性タンパク質(GFAP)、およびミエリン希突起膠細胞特異的タンパク質(MOSP)からなる群より選択されるマーカーに結合する、請求項23に記載の操作されたタンパク質。
- 前記グリア細胞特異的結合タンパク質は、ミエリン希突起膠細胞糖タンパク質(MOG)に結合する、請求項27に記載の操作されたタンパク質。
- 前記グリア細胞特異的結合タンパク質は、配列番号4、6、および12からなる群より選択されるアミノ酸配列を含む抗体分子の単鎖可変フラグメント(scFv)である、請求項28に記載の操作されたタンパク質。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024063938A JP2024086870A (ja) | 2018-03-27 | 2024-04-11 | 神経変性疾患を処置するためのCAR-Tregベースの治療 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862648684P | 2018-03-27 | 2018-03-27 | |
| US62/648,684 | 2018-03-27 | ||
| PCT/US2019/023395 WO2019190879A1 (en) | 2018-03-27 | 2019-03-21 | Car-treg-based therapies for treating neurodegenerative diseases |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024063938A Division JP2024086870A (ja) | 2018-03-27 | 2024-04-11 | 神経変性疾患を処置するためのCAR-Tregベースの治療 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021531280A true JP2021531280A (ja) | 2021-11-18 |
| JPWO2019190879A5 JPWO2019190879A5 (ja) | 2022-03-24 |
Family
ID=68060734
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021502704A Pending JP2021531280A (ja) | 2018-03-27 | 2019-03-21 | 神経変性疾患を処置するためのCAR−Tregベースの治療 |
| JP2024063938A Pending JP2024086870A (ja) | 2018-03-27 | 2024-04-11 | 神経変性疾患を処置するためのCAR-Tregベースの治療 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024063938A Pending JP2024086870A (ja) | 2018-03-27 | 2024-04-11 | 神経変性疾患を処置するためのCAR-Tregベースの治療 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20210023137A1 (ja) |
| EP (1) | EP3773629A4 (ja) |
| JP (2) | JP2021531280A (ja) |
| KR (1) | KR20210135921A (ja) |
| CN (1) | CN112867496A (ja) |
| AU (1) | AU2019242381A1 (ja) |
| CA (1) | CA3095298A1 (ja) |
| WO (1) | WO2019190879A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA3095298A1 (en) * | 2018-03-27 | 2019-10-03 | Aztherapies, Inc. | Car-treg-based therapies for treating neurodegenerative diseases |
| EP4139458A1 (en) | 2020-04-23 | 2023-03-01 | AZTherapies, Inc. | Cellular ablation of hla-class i mhc |
| WO2021243275A2 (en) * | 2020-05-28 | 2021-12-02 | Aztherapies, Inc. | Car-treg-based therapies for treating neurgdegenerative diseases |
| JP2024532516A (ja) * | 2021-09-03 | 2024-09-05 | サンガモ セラピューティクス,インコーポレイテッド | Mog結合タンパク質及びその使用 |
| WO2023047098A2 (en) * | 2021-09-21 | 2023-03-30 | Quell Therapeutics Ltd | Anti-p75ntr chimeric antigen receptor |
| GB202113673D0 (en) | 2021-09-24 | 2021-11-10 | Reflection Therapeutics Ltd | Targeted cell therapies |
| GB202113674D0 (en) | 2021-09-24 | 2021-11-10 | Reflection Therapeutics Ltd | Targeted cell therapies |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007140971A2 (en) * | 2006-06-06 | 2007-12-13 | F. Hoffmann-La Roche Ag | Cell adhesion proteins as biomarker for alzheimer's disease |
| WO2008006103A2 (en) * | 2006-07-07 | 2008-01-10 | Wyeth | Nogo receptor functional motifs, peptide mimetics, and mutated functional motifs related thereto, and methods of using the same |
| US8790642B2 (en) * | 2008-08-29 | 2014-07-29 | Genentech, Inc. | Cross-reactive and bispecific anti-IL-17A/F antibodies |
| CN103635486B (zh) * | 2011-02-11 | 2017-05-17 | 纪念斯隆-凯特琳癌症中心 | Hla限制性、肽特异性的抗原结合蛋白 |
| US20140348808A1 (en) * | 2011-05-19 | 2014-11-27 | Olga De La Rosa | Cell populations having immunoregulatory activity, methods for the preparation and uses thereof |
| CN103965357B (zh) * | 2013-12-31 | 2016-08-17 | 嘉和生物药业有限公司 | 一种抗人rankl抗体 |
| US10471103B2 (en) * | 2014-12-30 | 2019-11-12 | The Brigham And Women's Hospital, Inc. | Methods to improve cell therapy |
| WO2016161372A1 (en) * | 2015-04-01 | 2016-10-06 | President And Fellows Of Harvard College | Immunoconjugates for programming or reprogramming of cells |
| WO2016164637A1 (en) * | 2015-04-07 | 2016-10-13 | Alector Llc | Anti-sortilin antibodies and methods of use thereof |
| US11648268B2 (en) * | 2015-12-09 | 2023-05-16 | Memorial Sloan Kettering Cancer Center | Immune cell compositions and methods of using same |
| CA3095298A1 (en) | 2018-03-27 | 2019-10-03 | Aztherapies, Inc. | Car-treg-based therapies for treating neurodegenerative diseases |
| WO2021243275A2 (en) * | 2020-05-28 | 2021-12-02 | Aztherapies, Inc. | Car-treg-based therapies for treating neurgdegenerative diseases |
-
2019
- 2019-03-21 CA CA3095298A patent/CA3095298A1/en active Pending
- 2019-03-21 EP EP19776538.1A patent/EP3773629A4/en active Pending
- 2019-03-21 CN CN201980035934.XA patent/CN112867496A/zh active Pending
- 2019-03-21 WO PCT/US2019/023395 patent/WO2019190879A1/en unknown
- 2019-03-21 KR KR1020207030758A patent/KR20210135921A/ko not_active Application Discontinuation
- 2019-03-21 JP JP2021502704A patent/JP2021531280A/ja active Pending
- 2019-03-21 AU AU2019242381A patent/AU2019242381A1/en active Pending
- 2019-03-21 US US17/041,835 patent/US20210023137A1/en active Pending
-
2024
- 2024-04-11 JP JP2024063938A patent/JP2024086870A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US20210023137A1 (en) | 2021-01-28 |
| CA3095298A1 (en) | 2019-10-03 |
| EP3773629A4 (en) | 2022-01-19 |
| KR20210135921A (ko) | 2021-11-16 |
| CN112867496A (zh) | 2021-05-28 |
| EP3773629A1 (en) | 2021-02-17 |
| WO2019190879A1 (en) | 2019-10-03 |
| AU2019242381A1 (en) | 2020-11-19 |
| JP2024086870A (ja) | 2024-06-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2021531280A (ja) | 神経変性疾患を処置するためのCAR−Tregベースの治療 | |
| Uccelli et al. | Safety, tolerability, and activity of mesenchymal stem cells versus placebo in multiple sclerosis (MESEMS): a phase 2, randomised, double-blind crossover trial | |
| Zhang et al. | Stable intracerebral transplantation of neural stem cells for the treatment of paralysis due to ischemic stroke | |
| Hao et al. | Central nervous system (CNS)–resident natural killer cells suppress Th17 responses and CNS autoimmune pathology | |
| JP2021119197A (ja) | 癌治療のための併用免疫療法及びサイトカイン制御療法 | |
| JP2022046822A (ja) | 中枢神経系の疾患および障害を処置するための組成物および方法 | |
| JP2021521776A (ja) | Mage−b2特異性を有するt細胞受容体およびその使用 | |
| TW202024120A (zh) | 靶向樹突狀細胞之胞外囊泡及其用途 | |
| JP2024012513A (ja) | フルオレセイン結合エーテルリン脂質(fl-ple)で標識された腫瘍に対して最適なt細胞機能を示すフルオレセイン特異的car | |
| TWI717848B (zh) | 抗體於治療神經退化性疾病的用途 | |
| Rinaldi et al. | Therapeutic effect of bifidobacterium administration on experimental autoimmune myasthenia gravis in Lewis rats | |
| Manjunatha et al. | Multiple sclerosis: therapeutic strategies on the horizon | |
| US20230210899A1 (en) | CAR-Treg-Based Therapies Targeting Myelin Oligodendrocyte Glycoprotein (MOG) for Treating Neurodegenerative Diseases | |
| Rodriguez et al. | Invited article: human natural autoantibodies in the treatment of neurologic disease | |
| JP2023021131A (ja) | 免疫を調節するペプチド、ポリペプチド又は細胞を作製する方法 | |
| Loftus et al. | Autologous attenuated T-cell vaccine (Tovaxin®) dose escalation in multiple sclerosis relapsing–remitting and secondary progressive patients nonresponsive to approved immunomodulatory therapies | |
| Pei et al. | Bifidobacterium modulation of tumor immunotherapy and its mechanism | |
| Tanaka et al. | Adoptive transfer of neoantigen-specific T-cell therapy is feasible in older patients with higher-risk myelodysplastic syndrome | |
| US11103486B2 (en) | Treatment of autoimmune disorders and infections using antagonists of SGK1 activity | |
| Kraus et al. | Regulation of autoreactive CD4 T cells by FoxO1 signaling in CNS autoimmunity | |
| Meng et al. | Pediatric Anti-Glyr Antibody-Associated Progressive Encephalomyelitis with Rigidity and Myoclonus-A Case Report and Literature Review | |
| Modarres Mousavi et al. | Review on the third international neuroinflammation congress and student festival of neuroscience in mashhad university of medical sciences | |
| US20190328781A1 (en) | Manufacturing methods for cell-based therapeutic compositions | |
| Redfern | Role of regulatory T cells in the pathogenesis and therapeutics of neuromyelitis optica spectrum disorder | |
| JP2024538064A (ja) | ミクログリア活性化を抑制するための方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210513 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20220131 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20220131 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220315 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220315 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230329 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230629 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230828 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230929 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20231211 |