JP2018505658A - Pd−1アンタゴニストに対する応答の遺伝子シグネチャーバイオマーカーを得るための系および方法 - Google Patents
Pd−1アンタゴニストに対する応答の遺伝子シグネチャーバイオマーカーを得るための系および方法 Download PDFInfo
- Publication number
- JP2018505658A JP2018505658A JP2017530266A JP2017530266A JP2018505658A JP 2018505658 A JP2018505658 A JP 2018505658A JP 2017530266 A JP2017530266 A JP 2017530266A JP 2017530266 A JP2017530266 A JP 2017530266A JP 2018505658 A JP2018505658 A JP 2018505658A
- Authority
- JP
- Japan
- Prior art keywords
- gene
- tumor
- genes
- cancer
- signature
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B20/00—ICT specially adapted for functional genomics or proteomics, e.g. genotype-phenotype associations
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B20/00—ICT specially adapted for functional genomics or proteomics, e.g. genotype-phenotype associations
- G16B20/20—Allele or variant detection, e.g. single nucleotide polymorphism [SNP] detection
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B30/00—ICT specially adapted for sequence analysis involving nucleotides or amino acids
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B40/00—ICT specially adapted for biostatistics; ICT specially adapted for bioinformatics-related machine learning or data mining, e.g. knowledge discovery or pattern finding
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B40/00—ICT specially adapted for biostatistics; ICT specially adapted for bioinformatics-related machine learning or data mining, e.g. knowledge discovery or pattern finding
- G16B40/30—Unsupervised data analysis
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16H—HEALTHCARE INFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR THE HANDLING OR PROCESSING OF MEDICAL OR HEALTHCARE DATA
- G16H50/00—ICT specially adapted for medical diagnosis, medical simulation or medical data mining; ICT specially adapted for detecting, monitoring or modelling epidemics or pandemics
- G16H50/30—ICT specially adapted for medical diagnosis, medical simulation or medical data mining; ICT specially adapted for detecting, monitoring or modelling epidemics or pandemics for calculating health indices; for individual health risk assessment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
Abstract
Description
本発明の系および方法は、本明細書においては「遺伝子発現プラットフォーム」と称される正規化(標準化)(normalization)遺伝子セットと臨床応答遺伝子セットとの組合せに基づいており、本発明者らは、複数の腫瘍型に関するPD−1アンタゴニストに対する抗腫瘍応答と相関する治療前腫瘍内RNA発現レベル(「遺伝子シグネチャー(gene signature)」)を有する複数の遺伝子の種々のセットを得るための手段として、これを設計した。また、この遺伝子発現プラットフォームは、シグネチャーにおける個々の遺伝子の相関に対する相対的寄与を重みづけし、遺伝子シグネチャーにおける遺伝子の全ての正規化RNAレベルの算術複合体(本明細書において「遺伝子シグネチャースコア」と称される)を生成するスコア化アルゴリズムを得るのに有用である、と本発明者らは考えている。関心のある同じ腫瘍型を有しPD−1アンタゴニストで治療された患者のコホートに関して得られた抗腫瘍応答および遺伝子シグネチャースコアを比較することにより、本発明者らは、PD−1アンタゴニストに対する抗腫瘍応答を達成する可能性がより高い又は低いことよって患者を分類するカットオフスコアが選択されうる、と考えている。個々の腫瘍型に関する予測シグネチャースコアは本明細書においては遺伝子シグネチャーバイオマーカーと称される。本発明により得られた遺伝子シグネチャーバイオマーカーに関して腫瘍が陽性の試験結果を示す患者は、該遺伝子シグネチャーバイオマーカーに関して腫瘍が陰性の試験結果を示す患者より、PD−1アンタゴニストによる治療から利益を得る可能性が高い。
I.略語
本発明の詳細な説明および実施例の全体にわたって、以下の略語を用いる。
CDR 相補性決定領域
CHO チャイニーズハムスター卵巣
CR 完全応答
DFS 無病生存
FFPE ホルマリン固定パラフィン包埋
FR フレームワーク領域
IHC 免疫組織化学または免疫組織化学的
irRC 免疫関連応答基準
NCBI National Center for Biotechnology Information
NPV 正味予測値
OR 全応答
OS 全生存
PD 進行性疾患
PD−1 プログラム死1
PD−L1 プログラム細胞死1リガンド1
PD−L2 プログラム細胞死1リガンド2
PFS 無進行生存(PFS)
PPV 陽性予測値
PR 部分的応答
Q2W 2週間ごとに1用量
Q3W 3週間ごとに1用量
RECIST 固形腫瘍における応答評価基準
ROC 受信者動作特性
SD 安定した疾患
VH 免疫グロブリン重鎖可変領域
VK 免疫グロブリンカッパ軽鎖可変領域
II.定義
本発明がより容易に理解されうるように、ある科学技術用語を以下に明確に定義する。本明細書中の他の箇所において特に示されていない限り、本明細書中で用いられる全ての他の科学技術用語は、本発明が属する技術分野の当業者に一般に理解されている意味を有する。
本発明者らは、前記の表1に挙げられている57個の臨床応答遺伝子および11個の正規化遺伝子の遺伝子発現プラットフォームを構築し、更に、前記の表2に示されている遺伝子シグネチャーを特定した。該遺伝子シグネチャーは臨床応答遺伝子セットにおいて表されており、複数の腫瘍型にわたるペンブロリズマブに対する応答と相関する。これらの遺伝子シグネチャーのそれぞれに共通する幾つかの遺伝子が存在するため、本発明者らは、PD−1アンタゴニストに対する応答を予測する遺伝子シグネチャーバイオマーカーが、これらの任意のシグネチャーに関して、および表1における臨床応答遺伝子の2〜57個の任意の組合せを含む他の遺伝子シグネチャーに関して得られうることを提案する。表1における各遺伝子のRNAレベルを測定し、ついで、関心のある各遺伝子シグネチャーにおける遺伝子のみに関する正規化RNAレベルからシグネチャースコアを算出することにより、単一遺伝子発現分析系を用いて、異なる遺伝子シグネチャーおよび異なる腫瘍型に関する遺伝子シグネチャースコアを得、評価して、PD−1アンタゴニストに対する抗腫瘍応答の候補バイオマーカーを得ることが可能である。
遺伝子シグネチャースコアは、例えばロジスティックまたはコックス回帰における線形予測のようなフィット化(適合)モデル係数を用いてシグネチャースコアを決定する多変量統計モデルへの入力共変量のセットとして、全臨床応答遺伝子セットまたはその任意のサブセットを使用することにより取得しうる。多変量法の1つの具体例は弾性ネットモデリング(Zou & Hastie,2005,J.R.Statist Soc.B 67(2):301−320;Simonら,2011,J.Statistical Software 39(5):1−13)の使用であり、これは、ペナルティパラメータを選択するために交差検定と共にラッソ(lasso)およびリッジ(ridge)回帰のペナルティの間のハイブリッドを用いる罰金付(penalized)回帰アプローチである。臨床応答遺伝子の全てではなくともほとんどのRNA発現レベルは予測的なものであると予想されるため、1つの実施形態においては、L1ペナルティパラメータは、リッジ回帰を有効に行うために非常に低く設定されうる。
本明細書に記載されている系および方法を用いて得られる遺伝子シグネチャーおよび遺伝子シグネチャーバイオマーカーは、PD−1アンタゴニストでの治療から臨床利益を得る可能性が非常に高い癌患者を特定するために有用でありうる。この有用性は種々の研究および商業的用途におけるそのようなバイオマーカーの使用を支持し、これらには、遺伝子シグネチャーバイオマーカーに関して陽性または陰性の試験結果を患者が示すかどうかに基づいて患者が選択されるPD−1アンタゴニストの臨床試験、患者の遺伝子シグネチャースコアを決定するための及び遺伝子シグネチャーバイオマーカーに関して陽性または陰性として患者を分類するための診断方法および製品、患者の遺伝子シグネチャースコアまたはバイオマーカー状態に基づいて患者の薬物療法を適合させる個別化治療方法、ならびに遺伝子シグネチャーバイオマーカーに関して陽性の試験結果を示す患者の治療に使用されるPD−1アンタゴニストを含む医薬組成物および薬品が含まれるが、これに限定されるものではない。
遺伝子シグネチャースコアは、対象(被験者)から摘出された腫瘍組織のサンプルにおいて決定される。該腫瘍は原発性または再発性であることが可能であり、任意の型、任意のステージ(病期)(例えば、ステージI、II、IIIもしくはIVまたは他の段階分け系の等価体)および/または組織学のものでありうる。対象は、任意の年齢、性別、治療歴ならびに/または寛解の度合および持続期間のものでありうる。
本明細書に記載されている方法および産物のいずれかにより治療される個体は、腫瘍を有すると診断されたヒト被験者であり、被験者の腫瘍のサンプルは、本明細書に記載されている遺伝子発現プラットフォームを使用して誘導される遺伝子シグネチャーバイオマーカーの存在または非存在に関する試験において使用するために利用可能または入手可能である。
adrozole)、ボロゾール(vorozole)、レトロゾール(letrozole)およびアナストロゾール(anastrozole);ならびに抗アンドロゲン、例えばフルタミド(flutamide)、ニルタミド(nilutamide)、ビカルタミド(bicalutamide)、ロイプロリド(leuprolide)およびゴセレリン(goserelin);ならびに前記のいずれかのものの医薬上許容される塩、酸または誘導体。
1.関心のある少なくとも1つの腫瘍型に関してPD−1アンタゴニストに対する抗腫瘍応答を予測する遺伝子シグネチャーバイオマーカーを得る方法であって、
(a)該腫瘍型を有すると診断された患者コホートにおける各患者から治療前腫瘍サンプルを得、
(b)該コホートにおける各患者に関して、PD−1アンタゴニストでの治療の後に抗腫瘍応答値を得、
(c)遺伝子発現プラットフォームにおいて各遺伝子に関して各腫瘍サンプルにおける生RNAレベルを測定し、
ここで、該遺伝子発現プラットフォームは約50〜約60個の遺伝子の臨床応答遺伝子セットおよび約10〜約12個のハウスキーピング遺伝子の正規化遺伝子セットを含み、該臨床応答遺伝子の約90%は、該抗腫瘍応答と正に相関する腫瘍内RNAレベルを示し、該臨床応答遺伝子の約10%は、該抗腫瘍応答と負に相関する腫瘍内RNAレベルを示し、
(d)該正規化遺伝子の測定RNAレベルを用いて、該臨床応答遺伝子の測定生RNAレベルのそれぞれを各腫瘍サンプルに関して正規化し、
(e)関心のある遺伝子シグネチャーにおける各腫瘍サンプルおよび各遺伝子に関して、その遺伝子の所定の増倍係数を用いて該正規化RNA発現レベルを重み付けし、
(f)各患者に関して、該重み付けRNA発現レベルを加えて、該コホートにおける各患者に関する遺伝子シグネチャースコアを得、
(g)該腫瘍サンプルの全てに関する遺伝子シグネチャースコアと該コホートにおける患者の全てに関する抗腫瘍応答値とを比較して、目標のバイオマーカーの臨床有用性基準を満たすように患者コホートを分類する該遺伝子シグネチャースコアに関するカットオフを選択することを含む方法。
(a)遺伝子発現プラットフォームにおいて各遺伝子に関して該腫瘍サンプルにおける生RNAレベルを測定し、ここで、該遺伝子発現プラットフォームは約50〜約60個の遺伝子の臨床応答遺伝子セットおよび約10〜約12個のハウスキーピング遺伝子の正規化遺伝子セットを含み、該臨床応答遺伝子の約90%は、該抗腫瘍応答と正に相関する腫瘍内RNAレベルを示し、該臨床応答遺伝子の約10%は、該抗腫瘍応答と負に相関する腫瘍内RNAレベルを示し、
(b)該正規化遺伝子の測定RNAレベルを用いて、該腫瘍型に関する所定の遺伝子シグネチャーにおける各臨床応答遺伝子に関する測定生RNAレベルを正規化し、ここで、該所定遺伝子シグネチャーは該臨床応答遺伝子の少なくとも2つからなり、
(c)所定の増倍係数を用いて各正規化RNA値を重み付けし、
(d)該重み付けRNA発現レベルを加えて、遺伝子シグネチャースコアを得、
(e)得られたスコアを該遺伝子シグネチャーおよび腫瘍型に関して基準スコアと比較し、
(f)バイオマーカー陽性またはバイオマーカー陰性として該腫瘍サンプルを分類することを含み、
ここで、得られたスコアが該基準スコア以上である場合には、該腫瘍サンプルをバイオマーカー陽性として分類し、得られたスコアが該基準スコア未満である場合には、該腫瘍サンプルをバイオマーカー陰性として分類する、方法。
(i)臨床応答遺伝子のセットおよび正規化遺伝子のセットからなる遺伝子発現プラットフォームにおける各遺伝子の生RNA発現レベルを測定するためのサンプル分析装置、ならびに
(ii)(a)該正規化遺伝子の測定RNAレベルを用いて、該腫瘍型に関する所定の遺伝子シグネチャーにおける各臨床応答遺伝子に関する測定生RNAレベルを正規化し、
(b)所定の増倍係数を用いて各正規化RNA値を重み付けし、
(c)該重み付けRNA発現レベルを加えて、遺伝子シグネチャースコアを得、
(d)得られたスコアを該遺伝子シグネチャーおよび腫瘍型に関して基準スコアと比較し、
(e)バイオマーカー陽性またはバイオマーカー陰性として該腫瘍サンプルを分類するために、測定されたRNA発現レベルを受信し、分析するためのコンピュータプログラムを含み、
ここで、得られたスコアが該基準スコア以上である場合には、該腫瘍サンプルをバイオマーカー陽性として分類し、得られたスコアが該基準スコア未満である場合には、該腫瘍サンプルをバイオマーカー陰性として分類する、系。
(a)該遺伝子シグネチャーにおける各遺伝子に関する該腫瘍サンプルにおける生RNAレベルを測定し、ここで、該遺伝子シグネチャーは、表3Bに記載されている14−遺伝子アップ−ダウンシグネチャーおよび18−遺伝子アップ−ダウンシグネチャーからなる群から選択され、
(b)表1Cに記載されている正規化遺伝子の測定されたRNAレベルを用いて、選択されたシグネチャーにおける各遺伝子に関して該測定生RNAレベルを正規化し、
(c)各正規化RNA値に、選択されたシグネチャーに関する表3Bに記載されている対応スコア化重みを掛け算して、重み付けRNA発現値を得、
(d)該重み付けRNA発現値を加えて遺伝子シグネチャースコアを得ることを含む方法。
実施例1.FFPE組織からの全RNAの単離、およびそれに続く、NanoString nCounter(商標)系を使用する遺伝子発現分析
本実施例は、後記実施例に記載されているFFPE腫瘍サンプルにおける遺伝子発現を分析するために用いた方法を記載する。NanoString nCounter(商標)遺伝子発現プラットフォーム(NanoString Technologies,Seattle,WA)上の分析のためにFFPE組織のスライドから全RNAを単離した。RNA抽出前に、全組織切片を該スライドからマクロダイセクトし/擦り取り、200μLの100% エタノールを含有する1.5mLの標識エッペンドルフチューブに移した。交差汚染の可能性を避けるために、各サンプルに新鮮な外科用メスを使用した。ついでサンプルを脱パラフィンし、プロテアーゼで消化した[FFPE組織用Ambion(登録商標)RecoverAll(商標)全核酸単離キット(Cat no.AM1975)における推奨プロトコールを用いた]。前記のAmbion RecoverAll(商標)キット(Cat no.AM1975)を使用し、該製造業者の推奨指示に従い、全RNA抽出を行った。NanoString nCounter(商標)系を使用して遺伝子発現プロファイリングを行うまで、全RNAを−80℃で保存した。
本発明者らはここで、表1に示されている遺伝子発現プラットフォームのための57個の臨床応答遺伝子を選択した。これは、この遺伝子セットがペンブロリズマブでの治療に対する種々の腫瘍型の臨床結果を予測しうるという証拠の蓄積に基づくものであった。
2.以下の臨床結果尺度の3つ全てに関する黒色腫の発見遺伝子セットにわたって推定FDR<33%を達成した:BOR、PFSおよびOS;または
3.表2に示されているPD−L1、IFNg、拡張免疫またはTCRシグナリングシグネチャーに含まれた。
1)まず、該メタ分析から、p値の順位付けにより、最も関連している上位100個の特徴のなかに現れなかった、かつ、遺伝子B2Mでもなく、表2におけるシグニチャー(胃コホートにおいて試験時までに特定されていたシグニチャー)のいずれのメンバー遺伝子でもなかった予備的な51遺伝子の一覧の一部であった10個の遺伝子を除去し、
2)3つ全ての適応にわたる多変量分析により特定された16個の新たな予測的遺伝子を追加することにより得られた。
40名の頭頸部癌患者、29名の膀胱癌患者および33名の胃癌患者に関する表1における57臨床応答遺伝子セットの正規化治療前腫瘍内RNA発現レベルおよび治療後PFSCox PFS時間に関して、弾性ネットメタ分析を行った。該モデル(実際上はリッジ回帰)において全57個の臨床応答遺伝子を含むようにL1ペナルティを0.001に設定し、交差検証を用いてL2ペナルティの値を選択した。該モデルは、PFS分布における適応(症状)特異的相違および患者の能力状態の特異的効果を捕捉する項に加えて、57個の遺伝子のそれぞれに関する係数を含んでいた。この回帰をフィットさせる前に、ハウスキーピング正規化遺伝子発現レベルをそれらの平均によりセンタリングし、それらの標準偏差によりスケーリングした(各癌適応内)。図3のX軸上にプロットされた最終シグネチャースコアは、交差検証フィット、実際上は、ハウスキーピング正規化遺伝子(センタリングおよびスケーリングされたもの)の線形結合からのハザード関数の「線形予測因子」であり、ここで、重み付けは前記の57個の遺伝子に関する推定モデル係数(および、異なる適応を同じグラフ内にプロットするために必要な適応特異的モデル項)により特定される。図3は、PFS時間に対してプロットされた、メタ分析において用いられた患者に関するモデル由来遺伝子シグネチャースコアを示す。
図6は、潜在的カットオフが漸増値に設定された場合の抗腫瘍応答値として最良全応答(BOR)を用いた場合の頭頸部癌におけるIFNgシグネチャーに関する遺伝子シグネチャースコアの推定臨床診断有用性プロファイルを示す。シグネチャースコアが与えられた応答の確率を示すロジスティック回帰モデルと組合されたIFNgシグネチャースコアの経験分布を用いて、PPV(カットオフ以上のシグネチャースコアを有する患者における応答率)、NPV(カットオフ未満のシグネチャースコアを有する患者における非応答率)およびカットオフ以上のシグネチャースコアの患者の罹患率に関するプロファイルを算出した。このプロファイルは、与えられたカットオフを選択する影響を理解するために用いられうる。したがって、例えば、IFNg遺伝子シグネチャースコアの臨床有用性プロファイルは、〜0.3のカットオフが〜90% NPV、〜40% PPVを達成し、H/N患者の〜25%のバイオマーカー高亜群罹患率をもたらすことを示唆している。あるいは、〜0.10のカットオフは〜92% NPV、〜33% PPV、および〜40%のバイオマーカー高亜群罹患率を達成するであろう。カットオフを選択し、PD−1アンタゴニストでの治療に関する応答者の選択および非応答者の除外の感度および特異性を理解するのを助けるために、ROC曲線分析を臨床有用性のこの評価と組合せることが可能である。
本実施例は、表3に挙げられているシグネチャースコア化重みの2セットの取得および有用性を記載する。各スコア化重みセットは、そのそれぞれのメタ分析に含まれる重複した癌組織学的特徴を有していた。どちらのセットの場合も、該スコア化法に対する入力情報は表1における57個の個別の臨床応答遺伝子の正規化RNA発現レベルのセットであった。シグネチャーにおける各臨床応答遺伝子に関する及び表1Cにおける各正規化遺伝子に関する測定生RNAのlog(10)変換を行い、正規化遺伝子のlog10変換RNAレベルの算術平均を算出し、各臨床応答遺伝子に関するlog10変換RNAレベルから該算出平均を差し引くことにより、測定(例えば、生)RNA発現値を正規化した。これらの正規化値(適応内のいずれの更なる標準化をも伴わない)は弾性ネットフィッティングの入力情報であった。後記の全ての場合には更に、用いた弾性ネットモデルは組織学、ベースライン性能状態、および組織学とベースライン性能状態との相互作用に関する項を含んでいた(そして、弾性ネット下で適用された罰則化(penalization)もモデル推定中にこれらの項に適用された)。
セット1.1
L2ペナルティを決定するための交差検証を伴う無進行生存(PFS)のコックス(Cox)メタ分析において一定の低レベルのL1ペナルティを用いた弾性ネットフィット下で誘導された線形結合。L1およびL2ペナルティの選択値における最終コックスPFSモデルフィットからの回帰係数をそれらのそれぞれの遺伝子と掛け算し、ついで、得られた重み付き値を合計してシグネチャースコアを得る。回帰係数のこれらの値(すなわち、重み)は表3Aにおけるセット1.1に挙げられている。
L2ペナルティを決定するための交差検証を伴う最良全応答(BOR)のロジスティック回帰メタ分析において一定の低レベルのL1ペナルティを用いた弾性ネットフィット下で誘導された線形結合。L1およびL2ペナルティの選択値における最終ロジスティックモデルフィットからの回帰係数をそれらのそれぞれの遺伝子に関する正規化RNA発現レベルと掛け算し、ついで、得られた重み付き値を合計してシグネチャースコアを得る。回帰係数のこれらの値(すなわち、重み)は表3Aにおけるセット1.2に挙げられている。
セット2.1
L2ペナルティを決定するために交差検証を用い、コックス(Cox)無進行生存(PFS)メタ分析において一定の低レベルのL1ペナルティを用いた弾性ネットフィット下で誘導された線形結合。L1およびL2ペナルティの選択値における最終コックスPFSモデルフィットからの回帰係数をそれらのそれぞれの遺伝子に関する正規化RNA発現レベルと掛け算し、ついで、得られた重み付き値を合計してシグネチャースコアを得る。回帰係数のこれらの値(すなわち、重み)は表3Aにおけるセット2.1に挙げられている。
L2ペナルティを決定するために交差検証を用い、最良全応答のロジスティック回帰メタ分析において一定の低レベルのL1ペナルティを用いた弾性ネットフィット下で誘導された線形結合。L1およびL2ペナルティの選択値における最終ロジスティックモデルフィットからの回帰係数をそれらのそれぞれの遺伝子に関する正規化RNA発現レベルと掛け算し、ついで、得られた重み付き値を合計してシグネチャースコアを得る。回帰係数のこれらの値(すなわち、重み)は表3Aにおけるセット2.2に挙げられている。
コックス(Cox)無進行生存(PFS)メタ分析においてL1およびL2の両ペナルティを決定するために交差検証を用いた弾性ネットフィット下で取得された線形結合。L1およびL2ペナルティの選択値における最終コックスPFSモデルフィットからの回帰係数をそれらのそれぞれの遺伝子に関する正規化RNA発現レベルと掛け算し、ついで、得られた重み付き値を合計してシグネチャースコアを得る。回帰係数のこれらの値(すなわち、重み)は表3Aにおけるセット2.3および表3Bの第2列に挙げられている。
ロジスティック回帰メタ分析においてL1およびL2の両ペナルティを決定するために交差検証を用いた弾性ネットフィット下で取得された線形結合。L1およびL2ペナルティの選択値における最終ロジスティックモデルフィットからの回帰係数をそれらのそれぞれの遺伝子に関する正規化RNA発現レベルと掛け算し、ついで、得られた重み付き値を合計してシグネチャースコアを得る。回帰係数のこれらの値(すなわち、重み)は表3Aにおけるセット2.4および表3Bの第3列に挙げられている。
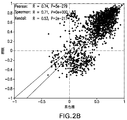
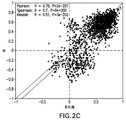
重み付け係数を使用して得られるシグネチャースコアの臨床有用性を例示するために、図7および8は、セット1.1の重みを使用して算出されたシグネチャースコア上の推定カットオフの関数としての、予想されるPPVおよびNPVプロファイル(複数の適応にわたる平均)の推定を示す。これらの予想プロファイルは、組合されたKEYNOTE−028およびKEYNOTE−012データの階層的ベイジアンメタ分析を用いて算出された。実線曲線は[後位(posterior)中央値(median)により捕捉された]PPVの予想値の推定を示し、該曲線の上および下の点線は該予想値上の90% 信頼区間の上限および下限を示す。
1.Sharpe,A.H,Wherry,E.J.,Ahmed R.,and Freeman G.J.The function of programmed cell death 1 and its ligands in regulating autoimmunity and infection.Nature Immunology(2007);8:239−245.
2.Dong Hら,Tumor−associated B7−H1 promotes T−cell apoptosis:a potential mechanism of immune evasion.Nat Med.2002 Aug;8(8):793−800.
3.Yangら,PD−1 interaction contributes to the functional suppression of T−cell responses to human uveal melanoma cells in vitro.Invest Ophthalmol Vis Sci.2008 Jun;49(6(2008):49:2518−2525.
4.Ghebehら,The B7−H1(PD−L1)T lymphocyte−inhibitory molecule is expressed in breast cancer patients with infiltrating ductal carcinoma:correlation with important high−risk prognostic factors.Neoplasia(2006)8:190−198.
5.Hamanishi Jら,Programmed cell death 1 ligand 1 and tumor−infiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer.Proceeding of the National Academy of Sciences(2007):104:3360−3365.
6.Thompson RHら,Significance of B7−H1 overexpression in kidney cancer.Clinical genitourin Cancer(2006):5:206−211.
7.Nomi,T.Sho,M.,Akahori,T.,ら,Clinical significance and therapeutic potential of the programmed death− 1 ligand/programmed death−1 pathway in human pancreatic cancer.Clinical Cancer Research(2007);13:2151−2157.
8.Ohigashi Yら,Clinical significance of programmed death−1 ligand−1 and programmed death−1 ligand 2 expression in human esophageal cancer.Clin.Cancer Research(2005):11:2947−2953.
9.Inmanら,PD−L1(B7−H1)expression by urothelial carcinoma of the bladder and BCG−induced granulomata:associations with localized stage progression.Cancer(2007):109:1499−1505.
10.Shimauchi Tら,Augmented expression of programmed death−1 in both neoplasmatic and nonneoplastic CD4+ T−cells in adult T−cell Leukemia/ Lymphoma.Int.J.Cancer(2007):121:2585−2590.
11.Gaoら,Overexpression of PD−L1 significantly associates with tumor aggressiveness and postoperative recurrence in human hepatocellular carcinoma.Clinical Cancer Research(2009)15:971−979.
12.Nakanishi J.Overexpression of B7−H1(PD−L1)significantly associates with tumor grade and postoperative prognosis in human urothelial cancers.Cancer Immunol Immunother.(2007)56:1173− 1182.
13.Hinoら,Tumor cell expression of programmed cell death−1 is a prognostic factor for malignant melanoma.Cancer(2010):00:1−9.
14.Ghebeh H.Foxp3+ tregs and B7−H1+/PD−1+ T lymphocytes co−infiltrate the tumor tissues of high−risk breast cancer patients:implication for immunotherapy.BMC Cancer.2008 Feb 23;8:57.
15.Ahmadzadeh Mら,Tumor antigen−specific CD8 T cells infiltrating the tumor express high levels of PD−1 and are functionally impaired.Blood(2009)114:1537−1544.
16.Thompson RHら,PD−1 is expressed by tumor infiltrating cells and is associated with poor outcome for patients with renal carcinoma.Clinical Cancer Research(2007)15:1757−1761.
本明細書中に引用されている全ての参考文献を、各個の刊行物、データベースエントリー(例えば、GenBank配列またはGeneIDエントリー)、特許出願または特許が参照により本明細書に組み入れられると具体的かつ個別に示されている場合と同様に、参照により本明細書に組み入れることとする。参照により組み入れるというこの陳述は、そのような引用が、参照により組み入れるという宣誓陳述の直前直後にない場合であっても、37 C.F.R.§1.57(b)(1)に従い、各個の刊行物、データベースエントリー(例えば、Genbank配列またはGeneIDエントリー)、特許出願または特許[それらのそれぞれは37 C.F.R.§1.57(b)(2)に従い明らかに特定されるものである]に関連づけることを出願人が意図しているものである。参照により組み入れるという宣誓陳述が明細書中に含まれている場合、それは、参照により組み入れるというこの一般的(general)陳述を何ら弱めるものではない。本明細書における参考文献の引用は、該参考文献が関連先行技術であると自認するものではなく、また、それは、これらの刊行物または文書の内容または日付に関して何ら自認するものでもない。
Claims (24)
- 関心のある少なくとも1つの腫瘍型に関してPD−1アンタゴニストに対する抗腫瘍応答を予測する遺伝子シグネチャーバイオマーカーを得る方法であって、
(a)該腫瘍型を有すると診断された患者コホートにおける各患者から治療前腫瘍サンプルを得、
(b)該コホートにおける各患者に関して、PD−1アンタゴニストでの治療の後に抗腫瘍応答値を得、
(c)遺伝子発現プラットフォームにおいて各遺伝子に関して各腫瘍サンプルにおける生RNAレベルを測定し、
ここで、遺伝子発現プラットフォームは約50〜約60個の遺伝子の臨床応答遺伝子セットおよび約10〜約12個のハウスキーピング遺伝子の正規化遺伝子セットを含み、該臨床応答遺伝子の約90%は、該抗腫瘍応答と正に相関する腫瘍内RNAレベルを示し、該臨床応答遺伝子の約10%は、該抗腫瘍応答と負に相関する腫瘍内RNAレベルを示し、
(d)該正規化遺伝子の測定RNAレベルを用いて、該臨床応答遺伝子の測定生RNAレベルのそれぞれを各腫瘍サンプルに関して正規化し、
(e)関心のある遺伝子シグネチャーにおける各腫瘍サンプルおよび各遺伝子に関して、その遺伝子の所定の増倍係数を用いて該正規化RNA発現レベルを重み付けし、
(f)各患者に関して、該重み付けRNA発現レベルを加えて、該コホートにおける各患者に関する遺伝子シグネチャースコアを得、
(g)該腫瘍サンプルの全てに関する遺伝子シグネチャースコアと該コホートにおける患者の全てに関する抗腫瘍応答値とを比較して、目標のバイオマーカーの臨床有用性基準を満たすように患者コホートを分類する該遺伝子シグネチャースコアに関するカットオフを選択することを含む方法。 - 選択されたカットオフ以上の遺伝子シグネチャースコアを有する腫瘍型の任意の腫瘍サンプルをバイオマーカー陽性として定め、選択されたカットオフ未満の遺伝子シグネチャースコアを有する腫瘍型の任意の腫瘍サンプルをバイオマーカー陰性として定めることを更に含む、請求項1または2記載の方法。
- PD−1アンタゴニストがペンブロリズマブ(pembrolizumab)である、請求項1〜3のいずれか1項記載の方法。
- 腫瘍型が膀胱癌、胃癌、頭頸部癌、トリプルネガティブ乳癌、肛門癌、胆道癌、結腸直腸癌、食道癌、卵巣癌または黒色腫である、請求項1〜4のいずれか1項記載の方法。
- 各臨床応答遺伝子に関する所定の増倍係数が整数1に等しい、請求項1〜5のいずれか1項記載の方法。
- 特定の腫瘍型を有すると診断された患者から摘出された腫瘍サンプルを、PD−1アンタゴニストに対する該腫瘍型の抗腫瘍応答の遺伝子シグネチャーバイオマーカーの存在または非存在に関して試験するための方法であって、該方法が、
(a)遺伝子発現プラットフォームにおいて各遺伝子に関して該腫瘍サンプルにおける生RNAレベルを測定し、ここで、遺伝子発現プラットフォームは約50〜約60個の遺伝子の臨床応答遺伝子セットおよび約10〜約12個のハウスキーピング遺伝子の正規化遺伝子セットを含み、該臨床応答遺伝子の約90%は、該抗腫瘍応答と正に相関する腫瘍内RNAレベルを示し、該臨床応答遺伝子の約10%は、該抗腫瘍応答と負に相関する腫瘍内RNAレベルを示し、
(b)該正規化遺伝子の測定RNAレベルを用いて、該腫瘍型に関する所定の遺伝子シグネチャーにおける各臨床応答遺伝子に関する測定生RNAレベルを正規化し、ここで、該所定遺伝子シグネチャーは該臨床応答遺伝子の少なくとも2つからなり、
(c)所定の増倍係数を用いて各正規化RNA値を重み付けし、
(d)該重み付けRNA発現レベルを加えて、遺伝子シグネチャースコアを得、
(e)得られたスコアを該遺伝子シグネチャーおよび腫瘍型に関して基準スコアと比較し、
(f)バイオマーカー陽性またはバイオマーカー陰性として該腫瘍サンプルを分類することを含み、
ここで、得られたスコアが該基準スコア以上である場合には、該腫瘍サンプルをバイオマーカー陽性として分類し、得られたスコアが該基準スコア未満である場合には、該腫瘍サンプルをバイオマーカー陰性として分類する、方法。 - 遺伝子発現プラットフォームが表1における遺伝子からなる、請求項7記載の方法。
- PD−1アンタゴニストがペンブロリズマブ(pembrolizumab)である、請求項8または9記載の方法。
- 腫瘍型が膀胱癌、胃癌、頭頸部癌、トリプルネガティブ乳癌、肛門癌、胆道癌、結腸直腸癌、食道癌、卵巣癌または黒色腫である、請求項8〜10のいずれか1項記載の方法。
- 所定の遺伝子シグネチャーが表3Aにおける57個の遺伝子からなり、重み付け工程が、表3Aに挙げられている重みセットからスコア化重みセットを選択し、該遺伝子のそれぞれに関する正規化RNA値に、選択されたスコア化重みセットにおける対応重みを掛け算することを含む、請求項8〜11のいずれか1項記載の方法。
- 所定の遺伝子シグネチャーが表3Aにおける57個の遺伝子からなり、所定の増倍係数が整数1である、請求項8〜11のいずれか1項記載の方法。
- 特定の腫瘍型を有すると診断された患者から摘出された腫瘍サンプルをPD−1アンタゴニストに対する該腫瘍型の抗腫瘍応答の遺伝子シグネチャーバイオマーカーの存在または非存在に関して試験するための系であって、該系が、
(i)臨床応答遺伝子のセットおよび正規化遺伝子のセットからなる遺伝子発現プラットフォームにおける各遺伝子の生RNA発現レベルを測定するためのサンプル分析装置、ならびに
(ii)(a)該正規化遺伝子の測定RNAレベルを用いて、該腫瘍型に関する所定の遺伝子シグネチャーにおける各臨床応答遺伝子に関する測定生RNAレベルを正規化し、
(b)所定の増倍係数を用いて各正規化RNA値を重み付けし、
(c)該重み付けRNA発現レベルを加えて、遺伝子シグネチャースコアを得、
(d)得られたスコアを該遺伝子シグネチャーおよび腫瘍型に関して基準スコアと比較し、
(e)バイオマーカー陽性またはバイオマーカー陰性として該腫瘍サンプルを分類するために、測定されたRNA発現レベルを受信し、分析するためのコンピュータプログラムを含み、
ここで、得られたスコアが該基準スコア以上である場合には、該腫瘍サンプルをバイオマーカー陽性として分類し、得られたスコアが該基準スコア未満である場合には、該腫瘍サンプルをバイオマーカー陰性として分類する、系。 - 遺伝子発現プラットフォームが表1における遺伝子からなる、請求項14記載の系。
- 所定の増倍係数が、表3Aに挙げられているスコア化重みセットから選択されるスコア化重みのセットのメンバーである、請求項14記載の系。
- 表1に表されている遺伝子シグネチャーに関する正規化RNA発現スコアを得るために腫瘍サンプルをアッセイするためのキットであって、
(a)表1における遺伝子のそれぞれにより発現される転写産物に特異的に結合しうるハイブリダイゼーションプローブのセット、および
(b)各ハイブリダイゼーションプローブと形成される特異的ハイブリダイゼーション複合体の数を定量するために設計された試薬のセット
を含むキット。 - 遺伝子シグネチャーバイオマーカーに関して腫瘍のサンプルが陽性であるか陰性であるかを決定し、該バイオマーカーに関して腫瘍が陽性である場合には、PD−1アンタゴニストを患者に投与し、該バイオマーカーに関して腫瘍が陰性である場合には、PD−1アンタゴニストを含まない癌治療剤を患者に投与することを含む、腫瘍を有する患者の治療方法であって、該遺伝子シグネチャーバイオマーカーが、表1における臨床応答遺伝子の少なくとも2つを含む遺伝子シグネチャーに関するものである、方法、
- 遺伝子シグネチャーが表1Aおよび1Bにおける57個の臨床応答遺伝子または表1Aにおける51個の臨床応答遺伝子からなる、請求項18記載の方法。
- PD−1アンタゴニストに対する抗腫瘍応答と相関する遺伝子シグネチャーに関するシグネチャースコアを得るために患者から摘出された腫瘍サンプルを試験する方法であって、
(a)該遺伝子シグネチャーにおける各遺伝子に関して、及び正規化遺伝子セットにおける各遺伝子に関して、該腫瘍サンプルにおける生RNAレベルを測定し、ここで、該遺伝子シグネチャーおよび正規化遺伝子セットは、以下の表に記載されている遺伝子からなり、
(c)各正規化RNA値に、以下の表に記載されている対応スコア化重みを掛け算して、重み付けRNA発現値を得、
- PD−1アンタゴニストがニボルマブ(nivolumab)、ペンブロリズマブ(pembrolizumab)、ペンブロリズマブバイオシミラーまたはペンブロリズマブ変異体である、請求項21記載の方法。
- 患者が食道癌を有すると診断されている、請求項21〜23のいずれか1項記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462089538P | 2014-12-09 | 2014-12-09 | |
| US62/089,538 | 2014-12-09 | ||
| US201562160284P | 2015-05-12 | 2015-05-12 | |
| US62/160,284 | 2015-05-12 | ||
| PCT/US2015/064445 WO2016094377A1 (en) | 2014-12-09 | 2015-12-08 | System and methods for deriving gene signature biomarkers of response to pd-1 antagonists |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018505658A true JP2018505658A (ja) | 2018-03-01 |
| JP2018505658A5 JP2018505658A5 (ja) | 2018-12-27 |
Family
ID=56108044
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017530266A Pending JP2018505658A (ja) | 2014-12-09 | 2015-12-08 | Pd−1アンタゴニストに対する応答の遺伝子シグネチャーバイオマーカーを得るための系および方法 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US11377693B2 (ja) |
| EP (1) | EP3230498B1 (ja) |
| JP (1) | JP2018505658A (ja) |
| KR (1) | KR20170086661A (ja) |
| CN (1) | CN107109700A (ja) |
| AU (2) | AU2015360736A1 (ja) |
| BR (1) | BR112017012222A2 (ja) |
| CA (1) | CA2968406A1 (ja) |
| MX (1) | MX2017007535A (ja) |
| RU (1) | RU2017123117A (ja) |
| WO (1) | WO2016094377A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021521439A (ja) * | 2018-04-13 | 2021-08-26 | エックス4 ファーマシューティカルズ, インコーポレイテッド | がん血清バイオマーカーおよびその使用方法 |
| JP2022511502A (ja) * | 2018-12-05 | 2022-01-31 | ジェネンテック, インコーポレイテッド | がんの免疫療法のための診断方法及び診断用組成物 |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI531652B (zh) | 2005-12-02 | 2016-05-01 | 美國紐約大學西奈山醫學院 | 表現非原生表面蛋白質之嵌合病毒及其用途 |
| ES2437327T3 (es) | 2007-06-18 | 2014-01-10 | Merck Sharp & Dohme B.V. | Anticuerpos para el receptor PD-1 humano de muerte programada |
| MY180687A (en) | 2013-03-14 | 2020-12-07 | Icahn School Med Mount Sinai | Newcastle disease viruses and uses thereof |
| DK3081576T3 (da) | 2013-12-12 | 2019-10-21 | Shanghai hengrui pharmaceutical co ltd | Pd-1-antistof, antigenbindende fragment deraf og medicinsk anvendelse deraf |
| SG11201607130RA (en) | 2014-02-27 | 2016-09-29 | Viralytics Ltd | Combination method for treatment of cancer |
| JP6767096B2 (ja) * | 2014-12-11 | 2020-10-14 | リティックス バイオファーマ エイエス | 免疫チェックポイント阻害剤の組み合わせ |
| EP3839510A3 (en) | 2015-04-17 | 2021-08-25 | Merck Sharp & Dohme Corp. | Blood-based biomarkers of tumor sensitivity to pd-1 antagonists |
| JP2019510785A (ja) | 2016-04-08 | 2019-04-18 | エックス4 ファーマシューティカルズ, インコーポレイテッド | 癌を処置する方法 |
| US10438699B2 (en) * | 2016-05-10 | 2019-10-08 | Macau University Of Science And Technology | Method and system for determining an association of biological features with a medical condition |
| US11515008B2 (en) | 2016-10-07 | 2022-11-29 | Omniseq, Inc. | Methods and systems for determining personalized t'herapies |
| EP3546591A4 (en) * | 2016-11-24 | 2020-08-12 | Daiichi Sankyo Company, Limited | METHOD FOR PREDICTING SUSCEPTIBILITY OF CANCER TO TREATMENT WITH A PD-1 IMMUNE CHECKPOINT INHIBITOR |
| JOP20190256A1 (ar) | 2017-05-12 | 2019-10-28 | Icahn School Med Mount Sinai | فيروسات داء نيوكاسل واستخداماتها |
| WO2019213478A1 (en) | 2018-05-04 | 2019-11-07 | Nanostring Technologies, Inc. | Gene expression assay for measurement of dna mismatch repair deficiency |
| US20210123919A1 (en) | 2018-05-14 | 2021-04-29 | Merck Sharp & Dohme Corp. | Biomarkers for a combination therapy comprising lenvatinib and a pd-1 antagonist |
| AU2019275404A1 (en) * | 2018-05-21 | 2020-12-03 | Nanostring Technologies, Inc. | Molecular gene signatures and methods of using same |
| WO2020005068A2 (en) * | 2018-06-29 | 2020-01-02 | Stichting Het Nederlands Kanker Instituut-Antoni van Leeuwenhoek Ziekenhuis | Gene signatures and method for predicting response to pd-1 antagonists and ctla-4 antagonists, and combination thereof |
| CN114127315A (zh) * | 2019-05-30 | 2022-03-01 | 百时美施贵宝公司 | 鉴定适合于免疫肿瘤学(i-o)疗法的受试者的方法 |
| US20220290247A1 (en) * | 2019-08-09 | 2022-09-15 | The Regents Of The University Of California | Compositions and methods for diagnosis and treatment of bladder cancer |
| US20220380854A1 (en) * | 2019-11-04 | 2022-12-01 | Merck Sharp & Dohme Corp. | ANGIOGENESIS AND mMDSC GENE EXPRESSION BASED BIOMARKER OF TUMOR RESPONSE TO PD-1 ANTAGONISTS |
| WO2021110927A1 (en) * | 2019-12-04 | 2021-06-10 | Servicio Andaluz De Salud | Method to predict the response to cancer treatment with anti-pd1 immunotherapy |
| CN111088360A (zh) * | 2020-01-17 | 2020-05-01 | 暨南大学 | Pd1-ctla4和/或pdl2-ctla4在制备预测aml预后试剂盒中的应用 |
| WO2022135402A1 (zh) * | 2020-12-24 | 2022-06-30 | 信达生物制药(苏州)有限公司 | Pd-l1和/或mhc-2生物标记物在预测肺癌患者治疗疗效中的用途 |
| WO2023001874A1 (en) * | 2021-07-22 | 2023-01-26 | Asylia Diagnostics Bv | Biomarkers for therapy response after immunotherapy |
| WO2023130072A1 (en) | 2022-01-03 | 2023-07-06 | Checkmate Pharmaceuticals, Inc. | Transcriptional biomarkers for response to innate immune activators |
| WO2023244632A1 (en) * | 2022-06-17 | 2023-12-21 | Merck Sharp & Dohme Llc | Genome wide tumor derived gene expression based signatures associated with poor prognosis for melanoma patients with early stage disease |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014151006A2 (en) * | 2013-03-15 | 2014-09-25 | Genentech, Inc. | Biomarkers and methods of treating pd-1 and pd-l1 related conditions |
| WO2014194293A1 (en) * | 2013-05-30 | 2014-12-04 | Amplimmune, Inc. | Improved methods for the selection of patients for pd-1 or b7-h4 targeted therapies, and combination therapies thereof |
Family Cites Families (55)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5202231A (en) | 1987-04-01 | 1993-04-13 | Drmanac Radoje T | Method of sequencing of genomes by hybridization of oligonucleotide probes |
| US5525464A (en) | 1987-04-01 | 1996-06-11 | Hyseq, Inc. | Method of sequencing by hybridization of oligonucleotide probes |
| US5700637A (en) | 1988-05-03 | 1997-12-23 | Isis Innovation Limited | Apparatus and method for analyzing polynucleotide sequences and method of generating oligonucleotide arrays |
| GB8822228D0 (en) | 1988-09-21 | 1988-10-26 | Southern E M | Support-bound oligonucleotides |
| US5143854A (en) | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| US5527681A (en) | 1989-06-07 | 1996-06-18 | Affymax Technologies N.V. | Immobilized molecular synthesis of systematically substituted compounds |
| US5547839A (en) | 1989-06-07 | 1996-08-20 | Affymax Technologies N.V. | Sequencing of surface immobilized polymers utilizing microflourescence detection |
| US5424186A (en) | 1989-06-07 | 1995-06-13 | Affymax Technologies N.V. | Very large scale immobilized polymer synthesis |
| US5242974A (en) | 1991-11-22 | 1993-09-07 | Affymax Technologies N.V. | Polymer reversal on solid surfaces |
| US5744101A (en) | 1989-06-07 | 1998-04-28 | Affymax Technologies N.V. | Photolabile nucleoside protecting groups |
| DE3924454A1 (de) | 1989-07-24 | 1991-02-07 | Cornelis P Prof Dr Hollenberg | Die anwendung von dna und dna-technologie fuer die konstruktion von netzwerken zur verwendung in der chip-konstruktion und chip-produktion (dna chips) |
| EP0430881A3 (en) | 1989-11-29 | 1991-10-23 | Ciba-Geigy Ag | Photochromic compounds, process for their preparation and their use |
| US5288644A (en) | 1990-04-04 | 1994-02-22 | The Rockefeller University | Instrument and method for the sequencing of genome |
| US5412087A (en) | 1992-04-24 | 1995-05-02 | Affymax Technologies N.V. | Spatially-addressable immobilization of oligonucleotides and other biological polymers on surfaces |
| US5384261A (en) | 1991-11-22 | 1995-01-24 | Affymax Technologies N.V. | Very large scale immobilized polymer synthesis using mechanically directed flow paths |
| US5324633A (en) | 1991-11-22 | 1994-06-28 | Affymax Technologies N.V. | Method and apparatus for measuring binding affinity |
| ATE173767T1 (de) | 1992-04-03 | 1998-12-15 | Perkin Elmer Corp | Proben zusammensetzung und verfahren |
| US5554501A (en) | 1992-10-29 | 1996-09-10 | Beckman Instruments, Inc. | Biopolymer synthesis using surface activated biaxially oriented polypropylene |
| US5503980A (en) | 1992-11-06 | 1996-04-02 | Trustees Of Boston University | Positional sequencing by hybridization |
| DE4311230C2 (de) | 1993-04-02 | 1996-12-19 | Mannesmann Ag | Nicht-spurgebundenes Fahrzeug mit Elektromotor |
| US5837832A (en) | 1993-06-25 | 1998-11-17 | Affymetrix, Inc. | Arrays of nucleic acid probes on biological chips |
| US5470710A (en) | 1993-10-22 | 1995-11-28 | University Of Utah | Automated hybridization/imaging device for fluorescent multiplex DNA sequencing |
| US5472672A (en) | 1993-10-22 | 1995-12-05 | The Board Of Trustees Of The Leland Stanford Junior University | Apparatus and method for polymer synthesis using arrays |
| US6156501A (en) | 1993-10-26 | 2000-12-05 | Affymetrix, Inc. | Arrays of modified nucleic acid probes and methods of use |
| US5429807A (en) | 1993-10-28 | 1995-07-04 | Beckman Instruments, Inc. | Method and apparatus for creating biopolymer arrays on a solid support surface |
| US5631734A (en) | 1994-02-10 | 1997-05-20 | Affymetrix, Inc. | Method and apparatus for detection of fluorescently labeled materials |
| US5571639A (en) | 1994-05-24 | 1996-11-05 | Affymax Technologies N.V. | Computer-aided engineering system for design of sequence arrays and lithographic masks |
| US5556752A (en) | 1994-10-24 | 1996-09-17 | Affymetrix, Inc. | Surface-bound, unimolecular, double-stranded DNA |
| US5624711A (en) | 1995-04-27 | 1997-04-29 | Affymax Technologies, N.V. | Derivatization of solid supports and methods for oligomer synthesis |
| US5545531A (en) | 1995-06-07 | 1996-08-13 | Affymax Technologies N.V. | Methods for making a device for concurrently processing multiple biological chip assays |
| US5661028A (en) | 1995-09-29 | 1997-08-26 | Lockheed Martin Energy Systems, Inc. | Large scale DNA microsequencing device |
| US6022963A (en) | 1995-12-15 | 2000-02-08 | Affymetrix, Inc. | Synthesis of oligonucleotide arrays using photocleavable protecting groups |
| CA2268740C (en) | 1996-11-06 | 2010-07-20 | Sequenom, Inc. | High density immobilization of nucleic acids |
| AU746737B2 (en) | 1996-11-06 | 2002-05-02 | Sequenom, Inc. | Compositions and methods for immobilizing nucleic acids to solid supports |
| US6077674A (en) | 1999-10-27 | 2000-06-20 | Agilent Technologies Inc. | Method of producing oligonucleotide arrays with features of high purity |
| CN1753912B (zh) | 2002-12-23 | 2011-11-02 | 惠氏公司 | 抗pd-1抗体及其用途 |
| AU2005243410B2 (en) | 2004-05-14 | 2010-04-22 | Rosetta Genomics Ltd. | Micronas and uses thereof |
| CN109485727A (zh) | 2005-05-09 | 2019-03-19 | 小野药品工业株式会社 | 程序性死亡-1(pd-1)的人单克隆抗体及使用抗pd-1抗体来治疗癌症的方法 |
| DK1907424T3 (en) | 2005-07-01 | 2015-11-09 | Squibb & Sons Llc | HUMAN MONOCLONAL ANTIBODIES TO PROGRAMMED death ligand 1 (PD-L1) |
| ES2437327T3 (es) | 2007-06-18 | 2014-01-10 | Merck Sharp & Dohme B.V. | Anticuerpos para el receptor PD-1 humano de muerte programada |
| US20090123930A1 (en) * | 2007-11-09 | 2009-05-14 | Wu Thomas D | Methods and compositions for diagnostic use in cancer patients |
| US20110223188A1 (en) | 2008-08-25 | 2011-09-15 | Solomon Langermann | Targeted costimulatory polypeptides and methods of use to treat cancer |
| BRPI0917592B1 (pt) | 2008-12-09 | 2021-08-17 | Genentech, Inc | Anticorpo anti-pd-l1, composição, artigos manufaturados e usos de uma composição |
| WO2011066342A2 (en) | 2009-11-24 | 2011-06-03 | Amplimmune, Inc. | Simultaneous inhibition of pd-l1/pd-l2 |
| WO2011094483A2 (en) | 2010-01-29 | 2011-08-04 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Immune gene signatures in cancer |
| MX341076B (es) | 2011-03-31 | 2016-08-04 | Merck Sharp & Dohme | Formulaciones estables de anticuerpos para el receptor humano pd-1 de meurte programada y tratamientos relacionados. |
| CN103842030B (zh) | 2011-08-01 | 2018-07-31 | 霍夫曼-拉罗奇有限公司 | 使用pd-1轴结合拮抗剂和mek抑制剂治疗癌症的方法 |
| WO2013078378A1 (en) * | 2011-11-23 | 2013-05-30 | Amgen Inc. | Methods of treatment using an antibody against interferon gamma |
| PL2872646T3 (pl) | 2012-07-12 | 2018-03-30 | Institut National De La Santé Et De La Recherche Médicale (Inserm) | Sposoby przewidywania czasu przeżycia i responsywności na leczenie pacjenta cierpiącego na nowotwór lity z sygnaturą przynajmniej 7 genów |
| WO2014015006A1 (en) * | 2012-07-19 | 2014-01-23 | Tensorcom, Inc. | Method and apparatus for a 60 ghz endfire antenna |
| US10626463B2 (en) | 2012-08-03 | 2020-04-21 | Icahn School Of Medicine At Mount Sinai | Biomarker associated with risk of melanoma reoccurrence |
| EP3084005A4 (en) | 2013-12-17 | 2017-08-02 | Merck Sharp & Dohme Corp. | Pd-l1 gene signature biomarkers of tumor response to pd-1 antagonists |
| EP3084003A4 (en) | 2013-12-17 | 2017-07-19 | Merck Sharp & Dohme Corp. | Ifn-gamma gene signature biomarkers of tumor response to pd-1 antagonists |
| EP3084001A4 (en) | 2013-12-17 | 2017-07-12 | Merck Sharp & Dohme Corp. | Gene signature biomarkers of tumor response to pd-1 antagonists |
| EP3839510A3 (en) | 2015-04-17 | 2021-08-25 | Merck Sharp & Dohme Corp. | Blood-based biomarkers of tumor sensitivity to pd-1 antagonists |
-
2015
- 2015-12-08 WO PCT/US2015/064445 patent/WO2016094377A1/en active Application Filing
- 2015-12-08 JP JP2017530266A patent/JP2018505658A/ja active Pending
- 2015-12-08 BR BR112017012222A patent/BR112017012222A2/pt not_active Application Discontinuation
- 2015-12-08 MX MX2017007535A patent/MX2017007535A/es unknown
- 2015-12-08 KR KR1020177018558A patent/KR20170086661A/ko not_active Application Discontinuation
- 2015-12-08 CN CN201580072918.XA patent/CN107109700A/zh active Pending
- 2015-12-08 EP EP15868101.5A patent/EP3230498B1/en active Active
- 2015-12-08 RU RU2017123117A patent/RU2017123117A/ru not_active Application Discontinuation
- 2015-12-08 AU AU2015360736A patent/AU2015360736A1/en not_active Abandoned
- 2015-12-08 CA CA2968406A patent/CA2968406A1/en not_active Abandoned
- 2015-12-08 US US15/533,769 patent/US11377693B2/en active Active
-
2020
- 2020-07-08 AU AU2020204557A patent/AU2020204557A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014151006A2 (en) * | 2013-03-15 | 2014-09-25 | Genentech, Inc. | Biomarkers and methods of treating pd-1 and pd-l1 related conditions |
| WO2014194293A1 (en) * | 2013-05-30 | 2014-12-04 | Amplimmune, Inc. | Improved methods for the selection of patients for pd-1 or b7-h4 targeted therapies, and combination therapies thereof |
Non-Patent Citations (1)
| Title |
|---|
| NANOSTRING TECHNOLOGIES, INC. (MULTIPLEXED CANCER IMMUNE RESPONSE ANALYSIS), JPN6019040674, September 2014 (2014-09-01), pages 1 - 8, ISSN: 0004499107 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021521439A (ja) * | 2018-04-13 | 2021-08-26 | エックス4 ファーマシューティカルズ, インコーポレイテッド | がん血清バイオマーカーおよびその使用方法 |
| JP2022511502A (ja) * | 2018-12-05 | 2022-01-31 | ジェネンテック, インコーポレイテッド | がんの免疫療法のための診断方法及び診断用組成物 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2020204557A1 (en) | 2020-07-30 |
| US11377693B2 (en) | 2022-07-05 |
| CN107109700A (zh) | 2017-08-29 |
| RU2017123117A3 (ja) | 2019-07-17 |
| US20180327848A1 (en) | 2018-11-15 |
| CA2968406A1 (en) | 2016-06-16 |
| EP3230498B1 (en) | 2023-01-18 |
| MX2017007535A (es) | 2017-08-10 |
| KR20170086661A (ko) | 2017-07-26 |
| AU2015360736A1 (en) | 2017-06-01 |
| EP3230498A4 (en) | 2018-08-01 |
| BR112017012222A2 (pt) | 2018-01-30 |
| WO2016094377A1 (en) | 2016-06-16 |
| EP3230498A1 (en) | 2017-10-18 |
| RU2017123117A (ru) | 2019-01-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3230498B1 (en) | System and methods for deriving gene signature biomarkers of response to pd-1 antagonists | |
| ES2844799T3 (es) | Biomarcadores sanguíneos de sensibilidad tumoral a antagonistas de PD-1 | |
| US20160312295A1 (en) | Gene signature biomarkers of tumor response to pd-1 antagonists | |
| US20160304969A1 (en) | Ifn-gamma gene signature biomarkers of tumor response to pd-1 antagonists | |
| US20160312297A1 (en) | Pd-l1 gene signature biomarkers of tumor response to pd-1 antagonists | |
| JP2021524744A (ja) | 分子遺伝子シグネチャーとその使用方法 | |
| US20210008135A1 (en) | Biomarkers for cancer therapeutics | |
| TW202039580A (zh) | 用於癌症免疫療法之診斷方法及組合物 | |
| US20220112564A1 (en) | Gene expression based biomarker of tumor response to pd-1 antagonists | |
| JP7236164B2 (ja) | 治療法に対する応答を予測する薬剤及び方法 | |
| US20220380854A1 (en) | ANGIOGENESIS AND mMDSC GENE EXPRESSION BASED BIOMARKER OF TUMOR RESPONSE TO PD-1 ANTAGONISTS | |
| WO2023244632A1 (en) | Genome wide tumor derived gene expression based signatures associated with poor prognosis for melanoma patients with early stage disease | |
| WO2022245692A1 (en) | Treatment of cancer patients with setd2 biomarker alteration with a pd-1 antagonist | |
| JP2023510847A (ja) | 癌の治療方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170926 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181116 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20181116 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20190924 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20191023 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200117 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200422 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200908 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20201202 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20210511 |