本発明は、癌を治療するための方法を提供する。本発明の方法は、疾患の発生、進行または再発を抑制または予防するアネキシンV結合活性を提供する有効量の薬剤を対象に投与することを含む。本発明では、本組成物の投与は、当業者に既知の各種方法及び送達システムのいずれかを用いて遂行または実施することができる。投与は、例えば、静脈内に、移植によって、経粘膜的に、経皮的に、筋肉内に、髄腔内に、及び皮下に実施することができる。多数の日常的に使用される薬剤担体を用いている、以下に記載した送達システムは、アネキシンV組成物の投与に想定される多数の実施形態の代表例にすぎない。
本方法及び本組成物を記載するにあたり、本発明は記載される特定の方法または組成物に限定されず、当然、これらが変化し得るものと理解すべきである。また、本発明の範囲は添付の特許請求の範囲によってのみ制限されるため、本明細書で使用される用語は特定の実施形態の記載のみを目的としており、限定を意図するものではない。
値の範囲が設けられている場合、その内容について特に明確な指示がない限り、下限単位の10分の1まで、その範囲の上限と下限の間に入る各値も明確に開示されるものと理解される。ある規定された範囲内のいずれかの規定値または間に入る値と、その規定された範囲内のいずれか他方の規定値または間に入る値との間の狭い範囲もそれぞれ、本発明の範囲内に包含される。これらの狭い範囲の上限と下限は独立して、その範囲内に包含される場合もあれば、その範囲から除外される場合もあり、その狭い範囲内に上限と下限のいずれかまたは両方を含む、あるいはいずれも含まない場合の各範囲もまた、規定された範囲内でいずれかが具体的に除外されていないことを条件として、本発明の範囲内に包含される。規定された範囲が上限と下限の一方または両方を含む場合、その一方または両方を除いた範囲もまた本発明の範囲内に含まれる。
本明細書で別段の定義がない限り、本明細書で使用される全ての技術的用語及び科学的用語は、本発明が属する分野の当業者に共通して理解されるものと同じ意味を有している。本明細書に記載するものと同様または同等であるいかなる方法及び材料も本発明の実施または試験に使用することができるが、一部の可能性のある好ましい方法及び材料を後述する。本明細書で言及する全ての刊行物は、刊行物の引用箇所と関連して方法及び/または材料が開示及び記載されているように参照により本明細書に組み込まれる。矛盾がある点に関して、本開示は組み込まれた刊行物のいかなる開示にも優先するものと理解される。
本開示を読めば当業者には明らかであるように、本明細書に記載及び例示された個々の実施形態はそれぞれ、本発明の範囲または趣旨を逸脱せずに、他のいくつかの実施形態のいずれかの特徴と容易に分離できる、またはその特徴と組み合わせることができる別々の成分及び特徴を有している。記述される方法はいずれも、記述された事象の順番で実施しても、あるいは論理的に起こり得る他のいかなる順番で実施してもよい。
本明細書及び添付の特許請求の範囲において使用される場合、単数形「a」、「an」及び「the」は、その内容について別段の明確な指示がない限り、複数の指示対象物を包むことに留意すべきである。したがって、例えば「a cell(細胞)」に関する言及は、複数のこのような細胞を含み、「the peptide(ペプチド)」に関する言及は、例えばポリペプチドなどの、当業者に既知である1つ以上のペプチド及びその等価物に関する言及を含むなどである。
本明細書で述べる刊行物は、本出願の提出日に先立つその開示のためだけに提供される。本明細書のいかなる内容も、本発明が先行発明を理由としてこのような刊行物に先行する権利を与えられないことを容認するものとは見なされない。更に、提示された刊行物の日付は実際の出版日と異なる場合があり、それぞれ確認を要する場合がある。
定義
本明細書で使用される「治療」、「治療すること」、「治療する」などの用語は一般に、望ましい薬学的効果及び/または生理学的効果を得ることを指す。効果は、疾患もしくは症状(複数可)を完全にもしくは部分的に予防する点では予防的であり得、ならびに/または、疾患及び/もしくは疾患に起因する有害反応の部分的もしくは完全な安定化もしくは治癒という点では治療的であり得る。用語「治療」は、哺乳動物、特にヒトの疾患のいずれかの治療を包含し、(a)疾患または症状の素因を有し得るが、まだそれを有すると診断されていない対象に疾患及び/または症状(複数可)が起こることを防止すること;(b)疾患及び/または症状(複数可)を阻害する、すなわち、その進行を阻止すること;または(c)疾患症状(複数可)を緩和すること、すなわち、疾患及び/または症状(複数可)の退縮を引き起こすことを含む。治療を必要とする者には、既に罹患している者(例えば、癌を有する者、感染症を有する者など)に加え、予防が望ましい者(例えば、癌に対する感受性が増加している者、感染症の可能性が増加している者、癌を有すると疑われる者、感染症潜伏の疑いがある者など)を含む。
治療的処置とは、投与前に対象が罹患している場合の処置であり、予防的処置とは、投与前に対象が罹患していない場合の処置である。いくつかの実施形態では、対象は治療前に罹患する可能性が増加しているか、あるいは罹患が疑われる。いくつかの実施形態では、対象は罹患する可能性が高いことが疑われる。
「相当する細胞」は、比較される別の細胞のものと細胞型が同一である細胞を意味するものとする。相当する細胞の例は、同じ細胞株由来の細胞である。
タンパク質の発現を「特異的に阻害する」とは、そのタンパク質の発現を、(a)他のいずれかのタンパク質の発現よりも、または(b)ほぼ10以下の他のタンパク質の発現よりも阻害することを意味するものとする。
「適した条件」とは、この用語が使用される状況によって異なる意味を有するものとする。すなわち、抗体と関連して使用される場合、この用語は、抗体とその対応する抗原との結合を可能にする条件を意味するものとする。この用語が核酸ハイブリダイゼーションと関連して使用される場合、この用語は、少なくとも15ヌクレオチド長の核酸とそれに相補的な配列を有する核酸とのハイブリダイズを可能にする条件を意味するものとする。薬剤を細胞に接触させることと関連して使用される場合、この用語は、接触可能である薬剤が細胞に進入し、その意図される機能を実行できる条件を意味するものとする。一実施形態では、本明細書で使用される場合、用語「適した条件」は生理学的条件を意味する。
用語「レシピエント」、「個体」、「対象」、「宿主」及び「患者」は、本明細書で同じ意味で用いられ、診断、治療または療法が望まれるいずれかの哺乳動物対象、特にヒトを指す。治療を目的とする「哺乳動物」は、哺乳動物として分類されるいずれかの動物を指し、ヒト、家畜及び農場動物、ならびに動物園の動物、競技用動物または愛玩動物、例えば、イヌ、ウマ、ネコ、ウシ、ヒツジ、ヤギ、ブタなどを含む。好ましくは、哺乳動物はヒトである。
「治療的有効量」または「治療量」は、望ましい臨床的結果を得る(すなわち、治療的有効性を達成する)ために十分な量である。治療的有効量は、1回以上の投与で投与され得る。本発明の目的では、アネキシンVの治療的有効量は、自然免疫応答を増加させることにより、疾患状態(例えば、癌)の進行を軽減、緩和、安定、退縮、予防、緩徐化または遅延化するために十分な量である。したがって、治療的有効量のアネキシンV剤は、癌細胞の直接殺傷または貪食殺傷を増加させる有効量で、癌細胞上のホスファチジルセリンと免疫細胞、例えば調節性T細胞、貪食細胞、NK細胞などとの結合を抑制する。
用語「特異的結合」、「特異的に結合する」などは、溶液または反応混合物中の他の分子または部分と比較して、ある分子に非共有的にまたは共有的に選択的に結合することを指す(例えば、アネキシンVは、ホスファチジルセリンに特異的に結合する)。いくつかの実施形態では、1つの分子が別の分子に対して特異的に結合するとき、その分子の親和性が、10-5M以下(例えば、10-6M以下、10-7M以下、10-8M以下、10-9M以
下、10-10M以下、10-11M以下、10-12M以下、10-13M以下、10-14M以下、10-15M以下、または10-16M以下)のKD(解離定数)である特徴を有する。「親和性」とは結合の強度を指し、KDの減少と相関して結合親和性は増加する。
本明細書で使用される場合、用語「特異的結合要素」は、特異的結合対の要素を指す(すなわち、特異的結合対とは2つの分子、通常2種類の分子であり、この2つの分子のうちの一方、例えば第1の特異的結合要素は、他方の分子、例えば第2の特異的結合要素に、非共有的手段によって特異的に結合している)。
用語「ポリペプチド」、「ペプチド」及び「タンパク質」は、本明細書で同じ意味で使用され、アミノ酸残基のポリマーを指す。この用語はまた、1つ以上のアミノ酸残基が対応する天然アミノ酸の人工的な化学的模倣体であるアミノ酸ポリマー、ならびに天然アミノ酸ポリマー及び非天然アミノ酸ポリマーにも適用される。
患者に関する用語「試料」は、血液及び生物由来の他の液体試料、固体組織試料、例えば生検標本または組織培養物もしくはそれから得たもしくは単離された細胞、及びそれらの子孫を包含する。この定義には、その入手後に任意の方法で、例えば試薬による処理、洗浄、またはある細胞集団、例えば癌細胞の濃縮などの操作をされた試料も含む。この定義にはまた、特定の種類の分子、例えば核酸、ポリペプチドなどを濃縮した試料も含む。
用語「生体試料」は臨床試料を包含し、また外科切除によって得られた組織、生検によって得られた組織、培養物中の細胞、細胞上清、細胞溶解物、組織試料、臓器、骨髄、血液、血漿、血清なども含む。「生体試料」は、標的細胞または正常対照細胞を含む試料、あるいはこのような細胞またはそれらから得られる生体液(例えば、癌性細胞、感染細胞など)を含むと疑われる試料、例えばこのような細胞から得られるポリヌクレオチド及び/またはポリペプチドを含む試料(例えば、細胞溶解物、またはポリヌクレオチド及び/またはポリペプチドを含むその他の細胞抽出物)を含む。患者からの罹患細胞を含む生体試料には、非罹患細胞も含まれる場合がある。
アネキシンV(PAP−I、リポコルチン−V)は、高親和性を有する(例えば10-9〜10-10Mの範囲のKdを有する)負に荷電したリン脂質類と結合することによって、強力な抗凝固剤として作用する。アネキシンVは、負に荷電したリン脂質分子周辺でシールドを形成する。この形成により、リン脂質の凝固(血液凝固)反応への移行が阻害され、リン脂質と免疫調節性細胞との相互作用が阻止される。ヒトアネキシンVの遺伝子配列は、Genbank(NM_001154)で参照することができる。結晶及び分子構造は、Romisch and Paques(1992)J.Mol.Biol.223(3),683−704に記載されている。アネキシンVポリペプチドまたは生物学的活性断片及びその変異体などが、癌治療に使用されている。いくつかの実施形態では、アネキシンVは、野生型配列またはネイティブ配列を有する。他の実施形態では、アネキシンVは、アネキシンV−128突然変異体タンパク質である。
アネキシンVの活性断片は、完全長アネキシンVと共通する機能的特性または結合特性を有する。アネキシンVのエピトープ断片は、完全長アネキシンVに結合するモノクローナル抗体と結合する。アネキシンVの「活性」とは、そのタンパク質によって実行される何らかの結合機能を意味するものとする。
本発明の方法で使用することができるアネキシンVポリペプチドは、少なくとも約50の連続アミノ酸、通常は少なくとも約100の連続アミノ酸、少なくとも約150の連続アミノ酸、少なくとも約200の連続アミノ酸、少なくとも約250の連続アミノ酸を含み、またこれには、限定されないがヒトアネキシンVタンパク質またはその修飾体を含む、アネキシンVタンパク質の最大320の連続アミノ酸が含まれる場合もあり、更に記載された配列に加えて当技術分野において既知である融合ポリペプチドを含む場合がある。アネキシンV配列は、あらゆる哺乳動物または鳥類の種、例えば霊長類種、特にヒト;マウス、ラット及びハムスターを含む齧歯類;ウサギ;ウマ、ウシ、イヌ科、ネコ科などに由来し得る。特に目的とするのはヒトタンパク質である。
本発明のいくつかの実施形態では、アネキシンVタンパク質またはその機能的断片を患者に投与する。本発明に有用なアネキシンVポリペプチドはまた、天然アネキシンVポリペプチドなどの誘導体、変異体及び生物学的活性断片を含む。「変異体」ポリペプチドは、ネイティブ配列ポリペプチドと100%未満の配列同一性を有する、以下に定める生物学的活性ポリペプチドを意味する。このような変異体として、1つ以上のアミノ酸残基がネイティブ配列のN末端もしくはC末端に、またはその内部に付加されたポリペプチド;約1〜40のアミノ酸残基が欠失し、場合により1つ以上のアミノ酸残基によって置換されたポリペプチド;及び得られた生成物が非天然アミノ酸を有するようにアミノ酸残基が共有結合により修飾された、上記ポリペプチドの誘導体が挙げられる。通常、生物学的活性変異体は、ネイティブ配列ポリペプチドとのアミノ酸配列同一性が少なくとも約90%、好ましくは少なくとも95%、より好ましくは少なくとも約99%であるアミノ酸配列を有する。
上記に示すアネキシンVペプチドの配列を、当技術分野で既知である各種方法で改変し、配列中に目的とする変化を生じさせることができる。配列変化は、置換、挿入または欠失であり得る。このような改変を利用して、安定性、特異性などに影響を及ぼすことにより、タンパク質の特性を変更することができる。クローン遺伝子のin vitro突然変異誘発の技術は既知である。突然変異をスキャンするプロトコルの例は、Gustin et al.,Biotechniques 14:22(1993);Barany,Gene 37:111−23(1985);Colicelli et al.,Mol Gen Genet 199:537−9(1985);及びPrentki et al.,Gene 29:303−13(1984)で参照することができる。部位特異的突然変異誘発の方法は、Sambrook et al.,Molecular Cloning:A Laboratory Manual,CSH Press 1989,pp.15.3−15.108;Weiner et al.,Gene 126:35−41 (1993);Sayers et al.,Biotechniques 13:592−6(1992);Jones and Winistorfer,Biotechniques 12:528−30(1992);Barton et al.,Nucleic Acids Res 18:7349−55(1990);Marotti and Tomich,Gene Anal Tech 6:67−70(1989);及びZhu Anal Biochem 177:120−4(1989)で参照することができる。
タンパク質は、種々の目的に応じて、多種多様な他のオリゴペプチドまたはタンパク質と連結してもよい。本ペプチドの発現をもたらすことによって、各種の発現後修飾を達成することができる。例えば、適切なコード配列を用いることにより、ファルネシル化またはプレニル化をもたらすことができる。このペプチドをPEG化すると、ポリエチレンオキシ基により血流中での存続期間を延長することができる。ペプチドはまた、通常は2つのタンパク質が正常に連結されない他のタンパク質と組み合わせて融合タンパク質にすることもできる。例えば、毒素(例えばリシン、アブリン、ジフテリア毒素など)と、または標的細胞の特定部分を標的化できる特異的結合剤と補体結合できるIgGアイソタイプのFcなどである。
アネキシンVは、例えば、生体内安定性を増加させるために、付加的な官能性を与える別のポリペプチドと融合してもよい。一般にこのような融合相手は安定血漿タンパク質であり、例えばこれは、融合物として存在するとき、特にこのような安定血漿タンパク質が免疫グロブリン定常ドメインである場合、アネキシンVの生体内血漿半減期を延長できる。
本方法に使用されるアネキシンVは、真核細胞または原核細胞から産生されても、in vitroで合成されてもよい。タンパク質が原核細胞によって産生される場合、更にこれをアンフォールディング、例えば熱変性、DTT還元などにより処理しても、更に当技術分野で既知の方法を使用してリフォールディングしてもよい。シンセサイザーを使用して、天然アミノ酸を非天然アミノ酸で置換してもよい。具体的な配列及び調製方法は、利便性、経済性、要求される純度等によって決定される。
一次配列を変更しないことを目的とする修飾には、ポリペプチドの化学誘導体化、例えば、アシル化、アセチル化、カルボキシル化、アミド化などを含む。これにはグリコシル化修飾も含まれ、例えばこれは、その合成及び処理過程または更なる処理工程でポリペプチドのグリコシル化パターンを変更することによるもの、例えば、哺乳動物のグリコシル化または脱グリコシル化酵素など、グリコシル化に影響を及ぼす酵素にポリペプチドを曝露することによるものである。また、アミノ酸残基、例えばホスホチロシン、ホスホセリンまたはホスホトレオニンをリン酸化した配列も包含される。
本発明には、通常の分子生物学的技術及び合成化学を使用して修飾し、それによってタンパク質分解耐性を改善した、または溶解度特性を最適化した、または治療薬としてより適したものにしたポリペプチドも含まれる。このようなポリペプチドの類似体としては、天然L−アミノ酸以外、例えばD−アミノ酸または非天然合成アミノ酸の残基を含有するものが挙げられる。D−アミノ酸は、アミノ酸残基の一部または全部が置換されていてもよい。
必要に応じて、種々の基を合成過程または発現時にペプチドに導入して、他の分子との、または表面との連結を可能にすることができる。したがって、チオエーテルの生成にシステインを、金属イオン錯体との結合にヒスチジンを、アミドまたはエステルの形成にカルボキシル基を、アミドの形成にアミノ基を使用することなどが可能である。
ポリペプチドはまた、組み換え合成の従来法に従って単離及び精製してもよい。発現宿主から溶解物を調製し、その溶解物をHPLC、排除クロマトグラフィー、ゲル電気泳動、アフィニティクロマトグラフィーまたはその他の精製技術を使用して精製してよい。ほとんどの場合、使用される組成物は、所望の生成物の少なくとも20重量%、より一般的には少なくとも約75重量%、好ましくは少なくとも約95重量%を占め、また治療目的には、生成物の調製方法及びその精製と関連する汚染物質に対して、通常少なくとも約99.5重量%を占める。通常、パーセンテージは総タンパク質に基づく。
本発明の一実施形態では、アネキシンVポリペプチドは、約320あたりのアミノ酸長のポリペプチド配列から本質的になり、上記のようなアネキシンVペプチドの配列を有する。本明細書に記載するポリペプチドの文脈で「から本質的になる」は、ポリペプチドがアネキシンV配列から構成され、配列が場合により、ポリペプチドの基本的な特徴(複数可)に実質的に影響を及ぼさない1つ以上のアミノ酸または他の残基に隣接していることを意味する。
本明細書で使用される場合、用語「免疫チェックポイント阻害剤」は、1つ以上のチェックポイントタンパク質を完全にまたは部分的に還元、阻害、拮抗または調節する分子を指す。チェックポイントタンパク質は、T細胞活性または機能を調節する。例えばCTLA−4とそのリガンドCD 80及びCD86;ならびにPDIとそのリガンドPDLl及びPDL2など、多数のチェックポイントタンパク質が既知である(Pardoll,Nature Reviews Cancer 12:252−264,2012)。これらのタンパク質は、T細胞応答の共刺激または阻害性相互作用を担う。免疫チェックポイントタンパク質は、自己寛容性、ならびに生理的免疫応答の期間及び程度を調節して維持する。免疫チェックポイント阻害剤は抗体を含むか、または抗体から誘導される。
本明細書で使用される場合、用語「抗体」は、任意のアイソタイプもしくはサブクラスのグリコシル化及び非グリコシル化免疫グロブリンの両方、または特異的結合のために無傷抗体と拮抗するその抗原結合領域への言及を含み、別段の指定のない限り、モノクローナル抗体、二重特異性抗体、低分子化抗体、ドメイン抗体、合成抗体、抗体模倣薬、キメラ抗体、ヒト化抗体、ヒト抗体、抗体融合物、抗体複合体、一本鎖抗体、抗体誘導体、抗体類似体及びそのそれぞれの断片を含む。また、このような抗体が全体的または部分的に、免疫付与を介して、組み換え技術によって、in vitro合成手段によって、またはそれ以外の方法で生成されるかどうかにかかわらず、抗体の免疫学的断片(例えば、Fab、Fab'、F(ab')2またはscFv)も含まれる。したがって、用語「抗体」は、例えば、(a)ヒト免疫グロブリン遺伝子が導入された動物(例えば、マウス)から単離された抗体、またはそれから調製されるハイブリドーマ、(b)抗体を発現するようにトランスフェクトされた宿主細胞から(例えばトランスフェクトーマから)単離された抗体、(c)組み換え、組み合わせ抗体ライブラリから単離された抗体、及び(d)免疫グロブリン遺伝子配列の他のDNA配列へのスプライシングを伴う、その他いずれかの手段によって調製、発現、作製または単離された抗体など、組み換え手段によって調製、発現、作製または単離されるものを含む。このような抗体は、2つの異なる種の動物の生殖細胞系列の免疫グロブリン配列に由来する可変及び定常領域を有する。しかしながら、ある種の実施形態では、このような抗体は、in vitro突然変異誘発(またはヒト免疫グロブリン配列が導入された動物が使用される場合、in vivo体細胞突然変異誘発)を施すことができ、したがって、抗体のVH及びVL領域のアミノ酸配列は、特定の種(例えば、ヒト)の生殖細胞系列のVH及びVL配列に由来するか、またはそれに関連する一方で、in vivoでのその種の抗体生殖細胞系列のレパートリ内には天然で存在しない可能性がある配列である。別段の指示がない限り、用語「抗体」は、2つの完全長重鎖及び2つの完全長軽鎖を含む抗体に加えて、その誘導体、変異体、断片及び突然変異体を含む。場合によっては、「抗体」は、重鎖のみを含み得るラクダ科の動物で自然発生する抗体など、より少ない鎖を含む可能性がある。
本明細書で使用される場合、用語「投与」は、対象またはシステムへの組成物の投与を指す。動物の対象への(例えば、ヒトへの)投与は、任意の適切な経路により行うことができる。例えば、いくつかの実施形態では、投与は、気管支(気管支への滴下注入によるものを含む)、頬側、経腸、真皮中(interdermal)、動脈内、皮内、胃内、髄内、筋肉内、鼻腔内、腹腔内、クモ膜下腔内、静脈内、脳室内、特定の器官内(例えば肝臓内)、粘膜、経鼻、経口、直腸、皮下、舌下、局所、気管(気管内への滴下注入によるものを含む)、経皮、膣内及び硝子体により行うことができる。いくつかの実施形態では、投与は、断続的な投薬を含む場合がある。いくつかの実施形態では、投与は、少なくとも選択された期間にわたる持続的投薬(例えば、潅流)を含む場合がある。当技術分野で既知のように、抗体療法は一般に非経口的に(例えば、静脈内注射または皮下注射により)投与される。
本発明の方法は、照射を受けた癌細胞の殺傷に役立ち、腫瘍の免疫細胞に近接して抗原を放出させる、局所腫瘍放射線療法などの放射線療法を含む、細胞減少療法と、照射された腫瘍に対する局所免疫応答を促進し、照射域外の転移性疾患部位に免疫系を反応させる免疫療法(IT)との併用を提供する。
放射線療法は、抗原提示細胞に対する抗原提示及びT細胞反応を増強することが知られている。腫瘍抗原を提示するAPCによってT細胞活性化を制御する因子としては、TCR:MHC相互作用、共刺激及びサイトカインが挙げられる。共刺激は、T細胞及び抗原提示細胞の細胞表面に常在する共刺激性及び共阻害性受容体/リガンド対の集合によって決定される。共刺激は有効な適応免疫応答を発生させ、免疫記憶を生成するために必要とされる。CD28、ICOS、HVEM、CD27、CD30、CD40L、OX40、4−1BB、TIM−1及びSLAMは、主要な共刺激受容体である。
例えば、電離放射線(IR)は癌患者の約60%の治療に使用されており、治療する領域の細胞を損傷または破壊するエネルギーを堆積させることにより治療する。本発明の目的では、従来的用量及びレジメンで、または減少した用量で送達することができる。放射線による細胞損傷は非特異的であり、DNAに対する複合的な効果を伴う。療法の有効性は、癌細胞への細胞損傷が正常細胞に対してよりも大きいかどうかで決まる。放射線療法は、あらゆるタイプの癌治療に使用することができる。一部のタイプの放射線療法は、光子(例えばX線またはガンマ線)を要する。放射線を癌細胞に送達するための別の技術は、放射線量が小領域に集中するように、放射性インプラントを腫瘍または体腔に直接留置する内部放射線療法である。電離放射線の好適な線量は、少なくとも約2Gy〜約10Gy以下の範囲であり得、通常は約5Gyである。紫外線の好適な線量は、少なくとも約5J/m2〜約50J/m2以下の範囲であり得、通常は約10J/m2である。
局所投与されるアジュバントとは異なり、アネキシンVのような共刺激増強療法は、単回用量として静脈内に投与して、侵襲的手順を伴わずに、RT後に局所反応を「ブースト」することができる。この方法では、アネキシンVを、内部腫瘍標的または単一の症候性転移に向けた局所RTと同時使用し、RTに伴う免疫応答を促進し、全身性(アブスコパル)免疫応答を起こすことができる。
本明細書で使用される場合、用語「併用療法」は、対象が2つ以上の治療レジメン(例えば、2つ以上の治療薬)に同時に曝露される状況を指す。いくつかの実施形態では、2つ以上の薬剤は同時に投与され得る。いくつかの実施形態では、このような薬剤は逐次的に投与され得る。いくつかの実施形態では、このような薬剤は重複する投薬レジメンで投与される。
本明細書で使用される場合、用語「投薬レジメン」は、通常は一定期間を隔てて対象に個別に投与される一群の単位用量(通常は2種類以上)を指す。いくつかの実施形態では、所与の治療薬は推奨される投薬レジメンを有し、これは1種以上の用量を含むことができる。いくつかの実施形態では、投薬レジメンは、各々互いに同じ長さの期間を隔てた複数の用量を含む。いくつかの実施形態では、投薬レジメンは、複数の用量と、個々の用量を隔てる少なくとも2通りの期間とで構成される。いくつかの実施形態では、投薬レジメン内の全用量は同じ分量の単位用量である。いくつかの実施形態では、投薬レジメン内の異なる用量は、異なる分量である。いくつかの実施形態では、投薬レジメンは、第1の投与分量である第1の用量、続いて第1の投与分量とは異なる第2の投与分量である1種以上の追加用量で構成される。いくつかの実施形態では、投薬レジメンは、第1の投与分量である第1の用量、続いて第1の投与分量と同じ第2の投与分量である1種以上の追加用量で構成される。いくつかの実施形態では、関連する集団全体に投与したとき、投薬レジメンが、所望するまたは有益な結果と相関する(すなわち、治療的投薬レジメンである)。
文脈上明らかでない限り、本発明の全ての要素、ステップまたは特徴は他の要素、ステップまたは特徴と組み合わせて使用することができる。
分子生化学及び細胞生化学についての一般的方法は、Molecular Cloning:A Laboratory Manual,3rd Ed.(Sambrook et al.,Harbor Laboratory Press 2001);Short Protocols in Molecular Biology,4th Ed.(Ausubel et al.eds.,John Wiley & Sons 1999);Protein Methods(Bollag et al.,John Wiley & Sons 1996);Nonviral Vectors for Gene Therapy(Wagner et al.eds.,Academic Press 1999);Viral Vectors(Kaplift & Loewy eds.,Academic Press 1995);Immunology Methods Manual(I.Lefkovits ed.,Academic Press 1997)及びCell and Tissue Culture:Laboratory Procedures in Biotechnology(Doyle&Griffiths,John Wiley & Sons 1998)のような標準教科書で参照することができる。本開示で参照される遺伝子操作のための試薬、クローニングベクター及びキットは、商業ベンダー、例えばBioRad、Stratagene、Invitrogen、Sigma−Aldrich及びClonTechから入手可能である。
本発明は、本発明者により見出された、または提唱された特定の実施形態に関して記載されており、本発明の実施に好適な態様を含む。本開示を考慮すれば、本発明の意図する範囲から逸脱することなく、例示された特定の実施形態に多数の変更及び改変を行えることを当業者は理解されよう。例えば、コドンの冗長性を理由に、タンパク質配列に影響を及ぼすことなく、基本となるDNA配列を変えることができる。更に、生物機能的等価性を考慮して、種類または量に関して生物学的作用に影響を及ぼすことなく、タンパク質構造を変化、特に保存的に変化させることができる。このような変更は全て、添付の特許請求の範囲の範囲内に包含されることが意図される。
方法
癌免疫療法
一態様では、本発明は、腫瘍細胞成長を伴う免疫抑制を阻害することによって癌を治療する方法を開示する。本発明の方法は、有効量のアネキシンVを投与して、腫瘍細胞上のPSを阻害し、それによって腫瘍細胞と免疫調節性細胞との間の望ましくない相互作用を阻害する。
いくつかの実施形態では、アネキシンVの投与方法は、例えば、免疫チェックポイント阻害剤を標的とする抗体と組み合わせて投与することにより、腫瘍細胞と免疫調節性細胞との間の相互作用を標的とする第2の療法と併用される。併用により、個々の療法の効果、すなわちアネキシンVまたはチェックポイント阻害剤の単独療法としての効果と比較して、腫瘍成長または生存率に対して相乗的な効果を与えることができる。
癌免疫療法は、免疫系を利用して癌を拒絶する。主たる根拠は、患者の免疫系を刺激して、疾患の原因となる悪性腫瘍細胞を攻撃することである。免疫療法は、患者の免疫付与によって(この場合、患者自身の免疫が、破壊すべき標的として腫瘍細胞を認識するよう仕向けられる)、または免疫抑制を阻害する治療薬の投与によって(この場合、腫瘍細胞を破壊するため患者の免疫系が補充される)達成することができる。
免疫系はそれが遭遇する環境因子に自己と非自己との間の識別に基づいて応答するため、癌の発生の結果生じる多くの種類の腫瘍細胞は、患者自身の免疫系によってある程度忍容される。これは腫瘍細胞が本質的に、適正な調節制御なしに成長、分裂及び拡散している患者自身の細胞であるからである。しかしながら、この事実に反して、多くの種類の腫瘍細胞は、細胞型及び/またはその環境に不適切であるか、または通常は生物の発達期にのみ存在する異常な抗原を提示する。他の種類の腫瘍細胞は、健康な細胞の表面に希有であるか、または存在しない細胞表面受容体を提示し、これは、腫瘍細胞の無秩序な成長及び分裂を引き起こす細胞シグナル伝達経路の活性化を担う。免疫系の効力及び特異性にもかかわらず、腫瘍抗原を用いたワクチン接種は、一般にマウス及びヒトの癌を根絶することができない。
本発明の方法は、体の自然防御系が癌細胞に対して作用できるようにする。限定されないがヒトアネキシンVタンパク質またはその活性断片もしくはその誘導体を含む、治療量のアネキシンV剤で対象を治療するための方法を提供する。本発明の方法には、治療的有効量のアネキシンV剤を対象に投与するステップを含む。
治療的有効量のアネキシンV剤の投与は、多数の異なる方法で実施することができる。治療的有効量の好適な投与は、単回用量の投与を必要とする場合もあれば、毎日、週2回、毎週、2週毎に1回、1か月に1回、毎年などの用量の投与を必要とする場合もある。
ヒトでの有効量は、最大約50μg/kg、最大約100μg/kg、最大約250μg/kg、最大約500μg/kg、最大約750μg/kg、最大約1mg/kg、最大約1.5mg/kg、最大約2mg/kg、最大約5mg/kg、最大約7.5mg/kg、最大約10mg/kg、最大約20mg/kgであってよい。有効量のアネキシンVは、限定されないが、化学療法薬、放射線療法、抗癌生物剤(例えば腫瘍抗原、VEGFなどを標的とするモノクローナル抗体)などを含む、他の治療モダリティと組み合わせてもよい。
場合によって、治療的有効量は、濃度が段階的に上昇する(すなわち、漸増用量)2種以上の用量で投与される。この場合、(i)用量全てが治療量であるか、または(ii)治療量以下の用量(または、2種以上の治療量以下の用量を最初に投与し、前記の段階的上昇により治療量を得る。段階的に上昇する濃度(すなわち、漸増用量)を示す一つの非限定的な例として、治療量以下の用量から始めて、治療的有効量を毎週投与することができ、また以後の各用量を一定の単位(例えば、0.5mg/kg単位)で、または可変的な単位で治療量に達するまで増加させることができ、その時点で投与を中止しても、継続してもよい(例えば、持続的治療量)。いくつかの実施形態では、治療的有効量の投与は持続的注入であってもよく、用量を経時的に変更する(例えば、段階的に増加する)こともできる。いくつかの実施形態では、放射線療法、免疫チェックポイント阻害剤などとの併用療法でも投与される。
投与量及び頻度は、患者での薬剤の半減期に応じて変化し得る。このようなガイドラインは活性薬剤の分子量に合わせて調整されることを当業者は理解されよう。投与量は、局所投与(例えば内部腫瘍など)か、全身投与(例えばi.m.、i.p.、i.v.など)かによっても異なる場合がある。
本明細書で使用される場合、用語「癌」は、異常な制御不可能な細胞成長によって引き起こされた種々の病状を指す。「癌性細胞」と称される、癌を引き起こすことが可能な細胞は、特徴的な性質、例えば制御不可能な増殖、不死性、転移性潜在力、急激な成長及び増殖速度、ならびに/またはある種の典型的な形態学的特徴を有する。癌は、腫瘍または複数の腫瘍の存在を(例えば、臨床的または放射線的手段によって)検出すること、腫瘍内の細胞または別の生体試料から(例えば、組織生検から)の細胞を試験すること、癌の指標である血液マーカーを測定すること、及び癌の指標である遺伝子型を検出することを含むがこれに限定されない多数の方法のいずれかで検出され得る。しかしながら、上記検出方法の1種以上で結果が陰性であっても、必ずしも癌の非存在性を示すものとは限らない。例えば、癌治療に対して完全な応答を示した患者が、以後の再発によって明らかとなるように、依然として癌を有している場合がある。
本明細書で使用される場合、用語「癌」は、癌腫(例えば、上皮内癌、浸潤癌、転移癌)、及び前癌性病状、すなわち、その組織学的起源に依存しない新しい形質変化を含む。用語「癌」は、いかなるステージ、グレード、組織形態学的特徴、侵襲性、罹患組織の攻撃性もしくは悪性度、または細胞凝集に限定されない。特に、ステージ0の癌、ステージIの癌、ステージIIの癌、ステージIIIの癌、ステージIVの癌、グレードIの癌、グレードIIの癌、グレードIIIの癌、悪性癌及び原発性癌腫が含まれる。
本発明の本方法を使用して治療できる癌の種類としては、副腎皮質癌、肛門癌、再性不良性貧血、胆管癌、膀胱癌、骨癌、骨転移、脳癌、中枢神経系(CNS)癌、末梢神経系(PNS)癌、乳癌、子宮頸癌、小児非ホジキンリンパ腫、大腸及び直腸癌、子宮内膜癌、食道癌、ユーイング腫瘍群(例えばユーイング肉腫)、眼癌、胆嚢癌、胃腸カルチノイド腫瘍、消化管間質腫瘍、妊娠性絨毛性疾患、有毛細胞白血病、ホジキンリンパ腫、カポジ肉腫、腎臓癌、喉頭及び下咽頭癌、急性リンパ性白血病、急性骨髄性白血病、小児白血病、慢性リンパ性白血病、慢性骨髄性白血病、肝癌、肺癌、肺カルチノイド腫瘍、非ホジキンリンパ腫、男性の乳癌、悪性中皮腫、多発性骨髄腫、骨髄異形成症候群、骨髄増殖性疾患、鼻腔及び副鼻腔癌、鼻咽頭癌、神経芽細胞腫、口腔及び中咽頭癌、骨肉腫、卵巣癌、膵癌、陰茎癌、下垂体腫瘍、前立腺癌、網膜芽細胞腫、横紋筋肉腫、唾液腺癌、肉腫、黒色腫皮膚癌、非黒色腫皮膚癌、胃癌、精巣癌、胸腺癌、甲状腺癌、子宮癌(例えば子宮肉腫)、移行上皮癌、膣癌、外陰癌、中皮腫、扁平(squarnous)細胞もしくは類表皮癌、気管支腺腫、絨毛癌(choriocarinoma)、頭頚部癌、悪性奇形腫またはワルデンシュトレーム・マクログロブリン血症が挙げられるが、これらに限定されない。
好ましい実施形態では、本方法は、固形腫瘍、例えば、結腸癌、肺癌、肝癌、乳癌、前立腺癌、卵巣癌または膵癌の治療に使用される。
臨床有効性
本発明の本方法による癌の治療中及び以後の腫瘍成長と疾患の進行を監視した。臨床有効性は当技術分野に既知のいずれかの方法で測定することができる。いくつかの実施形態では、本治療方法の臨床有効性を臨床的有用率(CBR)の測定によって決定する。
臨床的有用率は、完全奏功(CR)の患者、部分寛解(PR)の患者数、及び療法終了から少なくとも6か月の時点で安定疾患(SD)を有する患者数の比率合計を求めることによって測定する。この式を簡略的に表すとCBR=CR+PR+SD月数である。いくつかの実施形態では、本治療方法のCBRは少なくとも約50%である。いくつかの実施形態では、本治療方法のCBRは、少なくとも約55%、60%、65%、70%、75%、80%、85%、90%、95%またはそれ以上である。
医薬組成物
好適なアネキシンV剤を、治療用途として、例えばヒトの治療に適した医薬組成物で提供することができる。いくつかの実施形態では、本発明の医薬組成物は、1種以上の本発明の治療物質またはその薬学的に許容される塩、エステルもしくは溶媒和物を含む。いくつかの他の実施形態では、アネキシンV剤の使用は、別の治療薬(例えば、別の抗癌剤)と組み合わせた使用を含む。1種以上の本発明のアネキシンV剤を含む治療製剤は、所望の純度を有するアネキシンV剤を場合により生理学的に許容される担体、賦形剤または安定剤と混合することによって(Remington’s Pharmaceutical Sciences 16th edition,Osol,A.Ed.(1980))、凍結乾燥製剤または水溶液の形態で保存用に調製される。アネキシンV剤の組成物は、良好な医療慣例と整合した方法で製剤化され、投薬され、投与される。これに関連して考慮する因子としては、治療する特定の疾患、治療する特定の哺乳動物、個々の患者の臨床的病状、疾患の原因、薬剤の送達部位、投与方法、投与計画、及び医療従事者に既知であるその他の因子が挙げられる。
アネキシンV剤は、あらゆる好適な手段によって、特に非経口的に投与することができる。非経口注入は、筋肉内、静脈内(ボーラス(bollus)及び点滴)、動脈内、腹腔内、髄腔内、腫瘍内または皮下投与を含む。
アネキシンV剤は、必須ではないが、活性を増強するまたはそれ以外の治療的効果を増加させる、1種以上の薬剤と共に製剤化される場合がある。一般に、これら薬剤は、上記で使用されたものと同一の投与量かつ投与経路で、または従来採用されてきた投与量の約1〜99%で使用される。
アネキシンV剤は、活性治療薬及び別の薬学的に許容される賦形剤を含む医薬組成物として投与されることが多い。好ましい形態は、意図された投与様式及び治療用途によって異なる。この組成物はまた、望まれる製剤に応じて、動物またはヒトへの投与を目的とした医薬組成物の製剤化に一般に使用されるビヒクルとして定義されている、薬学的に許容される非毒性担体または希釈剤も含む。希釈剤は、併用薬の生物学的活性に影響を与えないように選択される。このような希釈剤の例は、蒸留水、リン酸緩衝生理食塩水、リンゲル液、デキストロース液及びハンクス液である。加えて、医薬組成物または製剤は他の担体、アジュバント、または非毒性、非治療的、非免疫学的安定剤等を含んでもよい。
更に他のいくつかの実施形態では、医薬組成物はまた、代謝の遅い大型の巨大分子、例えばタンパク質、多糖類、例えばキトサン、ポリ乳酸、ポリグルコール酸及びコポリマー(例えば、ラテックス機能化セファロース(商標)、アガロース、セルロースなど)、ポリマー性アミノ酸、アミノ酸コポリマー、ならびに脂質凝集体(例えば、油滴またはリポソーム)を含んでもよい。
担体は、直接的な共有結合またはリンカー基を介した共有結合のいずれか、及び非共有的会合を含む、様々な方法で薬剤を担持してよい。好適な共有結合担体は、アルブミンなどのタンパク質、ペプチド、及びアミノデキストランなどの多糖を含み、その各々が結合部分に対する複数の部位を有する。担体はまた、非共有結合などの非共有的会合によってまたはカプセル化によって、抗CD47薬または刺激剤を担持してもよい。本発明の目的では、担体の性質は水溶性または不溶性のいずれでもあり得る。当業者は、抗CD47薬及び/または刺激剤の結合に適した他の担体を理解しているか、または規定の実験を用いてそれを確認できるであろう。
許容される担体、賦形剤または安定剤は、採用される用量及び濃度でレシピエントに対して非毒性であり、リン酸、クエン酸及び他の有機酸などの緩衝液;アスコルビン酸及びメチオニンを含む抗酸化剤;防腐剤(例えば、オクタデシルジメチルベンジル(octadecyidimethylbenzyl)アンモニウムクロリド;ヘキサメトニウムクロリド;ベンザルコニウムクロリド、ベンゼトニウムクロリド;フェノール、ブチルもしくはベンジルアルコール;アルキルパラベン、例えばメチルもしくはプロピルパラベン;カテコール;レゾルシノール;シクロヘキサノール:3−ペンタノール;及びm−クレゾール);低分子量(約10残基未満)ポリペプチド;血清アルブミン、ゼラチン、もしくは免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニンもしくはリジンなどのアミノ酸;グルコース、マンノースもしくはデキストリンを含む、単糖、二糖、及び他の炭化水素;EDTAなどのキレート剤;スクロース、マンニトール、トレハロースまたはソルビトールなどの糖類;塩を形成する対イオン、例えばナトリウム;金属錯体(例えば、Zn−タンパク質錯体);ならびに/または非イオン性界面活性剤、例えばTWEEN(商標)、PLURONICS(商標)またはポリエチレングリコール(PEG)を含む。in vivo投与に使用される製剤は、無菌でなければならない。これは、無菌濾過膜を通した濾過によって容易に達成される。
活性成分はまた、例えば、コアセルベーション技術によってまたは界面重合によって調製されたマイクロカプセル、例えば、それぞれヒドロキシメチルセルロースまたはゼラチンマイクロカプセル及びポリ(メチルメタクリレート)マイクロカプセルに、コロイド薬物送達システム(例えば、リポソーム、アルブミンマイクロスフェア、マイクロエマルジョン、ナノ粒子及びナノカプセル)に、またはマクロエマルジョンに封入されてもよい。このような技術は、Remington’s Pharmaceutical Sciences 16th edition,Osol,A.Ed.(1980)に開示されている。
放射性核種剤に特異的な担体及びリンカーは、放射性ハロゲン化小分子及びキレート化合物を含む。放射性核種キレートは、金属または酸化金属、放射性核種を結合するためのドナー原子として窒素及び硫黄原子を含有するものを含むキレート化合物から形成され得る。
本発明においてイメージング部分として使用するためのX線撮影部分は、比較的大型の原子、例えば金、イリジウム、テクネチウム、バリウム、タリウム、ヨウ素及びそれらの同位体を有する化合物及びキレートを含む。低毒性のX線撮影イメージング部分、例えばヨウ素またはヨウ素同位体を本発明の方法で利用することが好ましい。このような部分は、許容される化学的リンカーまたはキレート担体によってアネキシンV剤と複合体化され得る。本発明で使用する陽電子放出部分は、アネキシンV剤とのフッ素化反応によって容易に複合体化され得る18Fを含む。
典型的には、組成物は、溶液または懸濁液のいずれかの注射液として調製してもよく、また溶液中または懸濁液中の注射前の液状ビヒクルに適した固体形態で調製してもよい。製剤は、上述のようなアジュバンド効果増強のための、ポリ乳酸、ポリグリコール酸またはコポリマーなどのリポソームまたは微粒子に乳化またはカプセル化することができる。Langer,Science 249:1527,1990 and Hanes,Advanced Drug Delivery Reviews 28:97−119,1997。本発明の薬剤は、活性成分の徐放またはパルス放出を可能にするような方法で製剤化できる、デポ注射またはインプラント製剤の形態で投与することができる。医薬組成物は一般に、無菌で、実質的に等張に、及び米国食品医薬品局のGood Manufacturing Practice(GMP)規制の全てに完全に合致するように製剤化される。
アネキシンV剤の毒性は、細胞培養物または実験動物における標準の薬学的手順によって、例えばLD50(集団の50%致死量)またはLD100(集団の100%致死量)を測定することによって決定することができる。毒性と治療効果との用量比が治療指数である。これらの細胞培養アッセイ及び動物試験から得たデータは、ヒトでの使用に合わせて治療投与量の範囲及び/または初回刺激投与量の範囲を更に最適化する際に使用することができる。正確な処方、投与経路及び投与量は、患者の病状を考慮して個々の医師が選択することができる。
併用療法
いくつかの実施形態では、本方法は、それを必要とする対象への放射線療法、抗腫瘍剤またはその薬学的に許容される塩もしくはプロドラッグを投与することを更に含む。いくつかの実施形態では、抗腫瘍薬は、抗腫瘍アルキル化剤、抗腫瘍代謝拮抗剤、抗腫瘍抗生物質、植物由来抗腫瘍剤、抗腫瘍有機白金化合物、抗腫瘍カンプトテシン誘導体、抗腫瘍チロシンキナーゼ阻害剤、モノクローナル抗体、インターフェロン、生物学的応答調節物質、及び抗腫瘍活性をもつその他の薬剤、またはこれらの薬学的に許容される塩を含むが、これらに限定されない。本明細書で使用される場合、用語「併用療法」は、対象が2つ以上の治療レジメン(例えば、2つ以上の治療薬)に同時に曝露される状況を指す。いくつかの実施形態では、2つ以上の薬剤は同時に投与され得る。いくつかの実施形態では、このような薬剤は逐次的に投与され得る。いくつかの実施形態では、このような薬剤は重複する投薬レジメンで投与される。
いくつかの実施形態では、本方法は、以下の1つ以上の療法を本明細書で開示される本方法と組み合わせて、それを必要とする対象を治療することを更に含む。
本発明での使用に適した抗悪性腫瘍性の抗腫瘍薬としては、アルキル化剤、代謝拮抗剤、天然の抗悪性腫瘍剤、ホルモン性の抗悪性腫瘍剤、血管新生阻害剤、分化誘導試薬、RNA阻害剤、抗体または免疫治療剤、遺伝子治療剤、小分子酵素阻害剤、生物学的応答調節物質及び抗転移剤が挙げられるが、これらに限定されない。
アルキル化剤は、癌細胞のDNAのような巨大分子のアルキル化によって作用することが知られ、通常これは強力な求電子剤である。この活性によって、DNA合成及び細胞分裂が中断され得る。本明細書での使用に適したアルキル化剤の例としては、シクロホスファミド、イホスファミド、クロラムブシル、エストラムスチン、メクロレタミン塩酸塩、メルファラン及びウラシルマスタードを含む、ナイトロジェンマスタードならびにその類似体及び誘導体が挙げられる。アルキル化剤の他の例としては、アルキルスルホネート(例えば、ブスルファン)、ニトロソウレア(例えば、カルムスチン、ロムスチン、及びストレプトゾシン)、トリアゼン(例えば、ダカルバジン及びテモゾロミド)、エチレンジアミン/メチルメラミン(例えば、アルトレタミン及びチオテパ)、及びメチルヒドラジン誘導体(例えば、プロカルバジン)が挙げられる。アルキル化剤群には、カルボプラチン、シスプラチン、及びオキサリプラチンを含むアルキル化様の白金含有薬が含まれる。
代謝拮抗性抗悪性腫瘍剤は、天然の代謝産物と構造的に類似しており、また核酸及びタンパク質の合成などの癌細胞の正常な代謝過程に関与する。代謝拮抗性抗悪性腫瘍剤は、癌細胞の代謝過程を阻害する程度に天然の代謝産物と異なっている。本発明での使用に適した代謝拮抗性抗悪性腫瘍剤は、それが影響を及ぼす代謝過程に応じて分類することができ、これには葉酸、ピリミジン、プリン及びシチジンの類似体及び誘導体を含み得るが、これらに限定されない。本明細書での使用に適した薬剤のうち葉酸系のメンバーには、限定されないが、メトトレキサート(アメトプテリン)、ペメトレキセドならびにその類似体及び誘導体が含まれる。本明細書での使用に適したピリミジン剤としては、限定されないが、シタラビン、フロクスウリジン、フルオロウラシル(5−フルオロウラシル)、カペシタビン、ゲムシタビン、ならびにその類似体及び誘導体が挙げられる。本明細書での使用に適したプリン剤としては、限定されないが、メルカプトプリン(6−メルカプトプリン)、ペントスタチン、チオグアニン、クラドリビン、ならびにその類似体及び誘導体が挙げられる。本明細書での使用に適したシチジン剤としては、限定されないが、シタラビン(シトシンアラビノシド(cytosine arabinodside)、アザシチジン(5−アザシチジン)ならびにその類似体及び誘導体が挙げられる。
天然の抗悪性腫瘍剤は、抗有糸分裂剤、抗悪性腫瘍性抗生物質、カンプトテシン類似体及び酵素を含む。本明細書での使用に適した抗有糸分裂剤としては、限定されないが、ビンブラスチン、ビンクリスチン、ビンデシン、ビノレルビンのようなビンカアルカロイドならびにその類似体及び誘導体が挙げられる。これらはマダガスカルニチニチソウ植物に由来し、通常、細胞周期のM期に特異的で、癌細胞の微小管のチューブリンと結合する。本明細書での使用に適したその他の抗有糸分裂剤にはポドフィロトキシンがあり、これには、限定されないが、エトポシド、テニポシドならびにその類似体及び誘導体が含まれる。これらの試薬は主として細胞周期のG2期及び後期S期を標的とするものである。
天然の抗悪性腫瘍剤にはこのほか、抗悪性腫瘍性抗生物質がある。抗悪性腫瘍性抗生物質とは、通常は癌細胞DNAとの相互作用により抗腫瘍特性を示す抗微生物剤のことである。本明細書での使用に適した抗悪性腫瘍性抗生物質としては、限定されないが、ベロマイシン、ダクチノマイシン、ドキソルビシン、イダルビシン、エピルビシン、マイトマイシン、ミトキサントロン、ペントスタチン、プリカマイシンならびにその類似体及び誘導体が挙げられる。
天然の抗悪性腫瘍剤の分類にはまた、本明細書での使用に適したカンプトテシン類似体及び誘導体が含まれ、カンプトテシン、トポテカン及びイリノテカンが挙げられる。これらの薬剤は、主として核酵素のトポイソメラーゼIを標的とすることによって作用する。天然の抗悪性腫瘍剤の別のサブクラスには酵素のL−アスパラギナーゼ及びその変異体がある。L−アスパラギナーゼは、循環血中でのアスパラギンからアスパラギン酸とアンモニアへの加水分解を触媒することにより、一部の癌細胞からL−アスパラギンを奪うことによって作用する。
ホルモン抗悪性腫瘍剤は主として、前立腺組織、乳房組織、子宮内膜組織、卵巣組織に随伴するホルモン依存癌細胞、リンパ腫及び白血病に作用する。このような組織は、グルココルチコイド、プロゲスチン、エストロゲン及びアンドロゲンのような部類の薬剤に対して応答性があり、これに依存する。アゴニストまたはアンタゴニストである類似体及び誘導体はいずれも、本発明での腫瘍の治療の使用に適している。本明細書での使用に適したグルココルチコイドアゴニスト/アンタゴニストの例は、デキサメタゾン、コルチゾール、コルチコステロン、プレドニソン、ミフェプリストン(RU486)、その類似体及び誘導体である。本明細書での使用に適したプロゲスチンアゴニスト/アンタゴニスト薬剤のサブクラスとしては、限定されないが、ヒドロキシプロゲステロン、メドロキシプロゲステロン、酢酸メゲステロール、メフェプリストン(RU486)、ZK98299、その類似体及び誘導体が挙げられる。本明細書での使用に適したエストロゲンアゴニスト/アンタゴニスト薬剤のサブクラスの例としては、限定されないが、エストロゲン、タモキシフェン、トレミフェン、RU58668、SR16234、ZD164384、ZK191703、フルベストラント、その類似体及び誘導体が挙げられる。本明細書での使用に適した、エストロゲン産生を阻害するアロマターゼ阻害剤の例としては、限定されないが、アンドロステンジオン、ホルメスタン、エキセメスタン、アミノグルテチミド、アナストロゾール、レトロゾール、その類似体及び誘導体が挙げられる。本明細書での使用に適したアントロゲンアゴニスト/アンタゴニスト薬剤のサブクラスの例としては、限定されないが、テストステロン、ジヒドロテストステロン、フルオキシメステロン、テストラクトン、テストステロンエナンテート、テストステロンプロピオネート、ゴナドトロピン放出ホルモンアゴニスト/アンタゴニスト(例えば、リュープロリド、ゴセレリン、トリプトレリン、ブセレリン)、ジエチルスチルベストロール、アバレリクス、シプロテロン、フルタミド、ニルタミド、ビカルタミド、その類似体及び誘導体が挙げられる。
血管新生阻害剤は腫瘍の血管新生を阻害することによって作用する。血管新生阻害剤は、小分子剤、抗体剤及びRNAの機能を標的とする薬剤を含めた多種多様な薬剤を包含する。本明細書での使用に適した血管新生阻害剤の例としては、限定されないが、ラニビズマブ、ベバシズマブ、SU11248、PTK787、ZK222584、CEP−7055、アンジオザイム、ダルテパリン、サリドマイド、スラミン、CC−5013、コンブレタスタチンA4ホスフェート、LY317615、ダイズイソフラボン、AE−941、インターフェロンアルファ、PTK787/ZK222584、ZD6474、EMD121974、ZD6474、BAY543−9006、セレコキシブ、ハロフジノン臭化水素酸塩、ベバシズマブ、その類似体、変異体または誘導体が挙げられる。
分化誘導剤は、癌細胞の分化を誘導する機序を介して腫瘍成長を阻害する。本明細書での使用に適したこのような薬剤のサブクラスとしては、限定されないが、ビタミンA類似体またはレチノイド及びペルオキシソーム増殖因子活性化受容体アゴニスト(PPAR)が挙げられる。本明細書での使用に適したレチノイドとしては、限定されないが、ビタミンA、ビタミンAアルデヒド(レチナール)、レチノイン酸、フェンレチニド、9−シス−レチノイド酸、13−シス−レチノイド酸、全トランス−レチノイン酸、イソトレチノイン、トレチノイン、パルミチン酸レチニル、その類似体及び誘導体が挙げられる。本明細書での使用に適したPPARのアゴニストとしては、限定されないが、トログリタゾン、シグリタゾン、テサグリタザル、その類似体及び誘導体が挙げられる。
抗体薬は、癌細胞中に発現する標的に選択的に結合し、複合体を利用して標的に随伴する細胞を殺傷するか、または癌細胞を破壊する体の免疫応答を誘発することができる。免疫療法薬は、ポリクローナル抗体またはモノクローナル抗体を含むことができる。この抗体は、ヒト以外の動物(例えば、マウス)とヒトの要素から構成されてもよく、全体がヒト要素から構成されてもよい(「ヒト化抗体」)。本明細書での使用に適したモノクローナル免疫療法薬の例としては、限定されないが、CD−20タンパク質を標的とするリツキシマブ、トシブツモマブ(tosibtumomab)、イブリツモマブが挙げられる。本明細書での使用に適した他の例としては、トラスツズマブ、エドレコロマブ、ベバシズマブ、セツキシマブ、癌胎児性抗原抗体、ゲムツズマブ、アレムツズマブ、マパツムマブ、パニツムマブ、EMD72000、TheraCIM hR3、2C4、HGS−TR2J及びHGS−ETR2が挙げられる。
遺伝子治療薬は、遺伝子のコピーを患者の特定の細胞群に挿入して、癌細胞と非癌細胞の両方を標的化することができる。遺伝子治療の目標は、改変遺伝子を機能遺伝子と置き換えること、癌に対する患者の免疫応答を刺激すること、癌細胞の化学療法に対する感受性を高めること、「自殺」遺伝子を癌細胞に配置すること、または血管新生を阻害することであり得る。遺伝子は、ウイルス、リポソームまたはその他の担体もしくはベクターを使用して標的細胞に送達してよい。これは、遺伝子−担体組成物を、患者に直接注入するか、またはex vivo、すなわち細胞を感染させ、患者に戻すことにより行うことができる。このような組成物は、本発明の使用に適している。
ナノメートルサイズの粒子は、個々の分子またはバルク固体のどちらからも得ることができない新たな光学的、電子工学的及び構造的特性を有する。このナノ粒子を使用して、腫瘍特異的リガンドまたはモノクローナル抗体などの、腫瘍標的部分に結合させると、癌特異的受容体、腫瘍抗原(バイオマーカー)及び腫瘍血管系を高い親和性と精度で標的化することができる。癌ナノ療法の製剤化及び製造工程は、米国特許第7,179,484号の特許、及びM.N.Khalid,P.Simard,D.Hoarau,A.Dragomir,J.Leroux,Long Circulating Poly(Ethylene Glycol)Decorated Lipid Nanocapsules Deliver Docetaxel to Solid Tumors,Pharmaceutical Research,23(4),2006の論文に開示されており、そのすべては全体として参照により本明細書に組み込まれる。
限定はされないが、siRNA、shRNA、microRNAを含むRNAを使用して、遺伝子発現を調節し、癌を治療することができる。二本鎖オリゴヌクレオチドは、一本鎖のオリゴヌクレオチド配列が二本目のオリゴヌクレチド配列に対して相補性である、二本の別々のオリゴヌクレオチド配列の組み立てにより形成される。このような二本鎖オリゴヌクレオチドは一般に、2本の独立したオリゴヌクレオチドから(例えば、siRNA)、または2つに折り畳まれて二重鎖構造を形成する単一の分子から(例えば、shRNA、すなわちショートヘアピンRNA)組み立てられる。当技術分野で既知であるこれらの二本鎖ヌクレオチドはすべて、二重鎖の各鎖が異なるヌクレオチド配列であり、一方のヌクレオチド配列領域(ガイド配列、すなわちアンチセンス配列)のみが標的核酸配列に対して相補性を有し、他方の鎖(センス配列)は、標的核酸配列に対して相同性であるヌクレオチド配列を含むという点で、共通した機能を有している。
マイクロRNA(miRNA)は、遺伝子発現を調節する約21〜23ヌクレオチド長の一本鎖RNA分子である。miRNAは、DNAから転写されるがタンパク質に翻訳されない遺伝子(ノンコーディングRNA)によってコードされる。代わりに、pri−miRNAと呼ばれる一次転写産物からpre−miRNAと呼ばれる短いステムループ構造へ、最終的には機能的miRNAへと処理される。成熟したmiRNA分子は1つ以上のメッセンジャーRNA(mRNA)分子と部分的に相補性であり、その主要な機能は遺伝子発現を下方調節することである。
特定のRNAを阻害する薬剤を利用して、癌表現型と関連するメッセンジャーRNA(「mRNA」)の発現または翻訳を阻害することができる。本明細書での使用に適した、このような物質の例としては、限定されないが、短鎖干渉RNA(「siRNA」)、リボザイム及びアンチセンスオリゴヌクレオチドが挙げられる。本明細書での使用に適したRNA阻害剤の具体例としては、限定されないが、Cand5、Sirna−027、ホミビルセン及びアンジオザイムが挙げられる。
ある種の小分子治療薬は、チロシンキナーゼ酵素活性、または上皮成長因子受容体(「EGFR」)もしくは血管内皮成長因子受容体(「VEGFR」)などの特定の細胞受容体の下流シグナル伝達シグナルを標的とすることができる。このような小分子治療薬による標的化は抗癌効果をもたらし得る。本明細書での使用に適したこのような薬剤の例としては、限定されないが、イマチニブ、ゲフィチニブ、エルロチニブ、ラパチニブ、カネルチニブ、ZD6474、ソラフェニブ(BAY43−9006)、ERB−569ならびにその類似体及び誘導体が挙げられる。
ある種のタンパク質または小分子剤は、直接的な抗腫瘍効果または間接的な効果を介して抗癌治療に使用することができる。本明細書での使用に適した直接作用型の薬剤の例としては、限定されないが、レチノイド及びレチノイド誘導体などの分化誘導試薬が挙げられる。本明細書での使用に適した間接作用型の薬剤としては、限定されないが、免疫またはその他の系を修飾または増強する薬剤、例えばインターフェロン、インターロイキン、造血成長因子(例えば、エリスロポエチン)及び抗体(モノクローナル及びポリクローナル)などが挙げられる。
癌細胞が原発腫瘍部位から体内の他の場所に拡散する過程を癌転移と呼ぶ。ある種の薬剤は、癌細胞の拡散を阻害するよう設計された抗転移特性を有する。本明細書での使用に適したこのような薬剤の例としては、限定されないが、マリマスタット、ベバシズマブ、トラスツズマブ、リツキシマブ、エルロチニブ、MMI−166、GRN163L、ハンターキラーペプチド、組織メタロプロテイナーゼ阻害物質(TIMP)、その類似体、誘導体及び変異体が挙げられる。
ある種の医薬剤は、癌の初期発生の予防、または再発もしくは転移の予防に使用することができる。いくつかの実施形態では、本方法での癌治療には、化学予防薬の使用を伴う。本明細書での使用に適した化学予防薬の例としては、限定されないが、タモキシフェン、ラロキシフェン、チボロン、ビスホスホネート、イバンドロネート、エストロゲン受容体修飾物質、アロマターゼ阻害剤(レトロゾール、アナストロゾール)、黄体形成ホルモン放出ホルモンアゴニスト、ゴセレリン、ビタミンA、レチナール、レチノイン酸、フェンレチニド、9−シス−レチノイド酸、13−シス−レチノイド酸、全トランス−レチノイン酸、イソトレチノイン、トレチノイド(tretinoid)、ビタミンB6、ビタミンB12、ビタミンC、ビタミンD、ビタミンE、シクロオキシゲナーゼ阻害剤、非ステロイド性抗炎症薬(NSAID)、アスピリン、イブプロフェン、セレコキシブ、ポリフェノール、ポリフェノールE、緑茶抽出物、葉酸、グルカル酸、インターフェロンアルファ、アネトールジチオールチオン、亜鉛、ピリドキシン、フィナステリド、ドキサゾシン、セレニウム、インドール−3−ガルビナル(carbinal)、アルファ−ジフルオロメチルオミチン(difluoromethylomithine)、カロチノイド、ベータ−カロチン、リコピン、抗酸化剤、コエンザイムQ10、フラボノイド、ケルセチン、クルクミン、カテキン、没食子酸エピガロカテキン、N−アセチルシステイン、インドール−3−カルビノール、イノシトール六リン酸、イソフラボン、グルカン酸(glucanic acid)、ローズマリー、大豆、ノコギリヤシ及びカルシウムが挙げられる。本発明の使用に適した化学予防薬の追加例は癌ワクチンである。これは、予防接種処置で標的となる癌細胞タイプの全部または一部を有する患者への免疫付与を通じて行うことができる。
いくつかの実施形態では、本方法による癌治療は、抗悪性腫瘍剤により生じる副作用を緩和できる医薬剤の投与を伴う。本明細書での使用に適したこのような薬剤は、限定されないが、制吐薬、抗粘膜炎薬、疼痛処理剤、感染抑制剤及び抗貧血/抗血小板剤が挙げられる。本明細書での使用に適した制吐薬の例としては、限定されないが、5−ヒドロキシトリプタミン3受容体アンタゴニスト、メトクロプラミド、ステロイド、ロラゼパム、オンダンセトロン、カンナビノイド、その類似体及び誘導体が挙げられる。本明細書での使用に適した抗粘膜炎薬の例としては、限定されないが、パリフェルミン(ケラチノサイト成長因子)、グルカゴン様ペプチド2、テデュグルチド、L−グルタミン、アミフォスチン及び繊維芽細胞成長因子20が挙げられる。本明細書での使用に適した疼痛処理剤の例としては、限定されないが、オピオイド、オピエート及び非ステロイド性抗炎症化合物が挙げられる。本明細書での使用に適した感染抑制剤の例としては、限定されないが、抗菌剤、例えばアミノグリコシド、ペニシリン、セファロスポリン、テトラサイクリン、クリンダマイシン、リンコマイシン、マクロライド、バンコマイシン、カルバペネム、モノバクタム、フルオロキノロン、スルホンアミド、ニトロフラントイン、その類似体及び誘導体が挙げられる。本明細書での使用に適した化学療法に伴う貧血または血小板減少を治療できる薬剤の例としては、限定されないが、エリスロポエチン及びトロンボポエチンが挙げられる。
キット
本方法で使用するためのキットも提供される。本キットには、アネキシンV剤、例えば野生型または突然変異体アネキシンVタンパク質が含まれる。いくつかの実施形態では、薬剤は、剤形(例えば、治療的に有効な剤形)で提供される。いくつかの実施形態では、抗CD47剤が、2種以上の異なる剤形(例えば、2種以上の異なる治療的に有効な剤形)で提供される。キットに関して、薬剤は液体または固体形態で従来の包装(例えば、スティックパック、用量包装など)により提供することができる。
上記構成品に加えて、本キットは、(ある種の実施形態では)本方法を実施するための指示を更に含んでよい。このような指示は、本キットに種々の形態で存在してよく、その1つ以上がキットに存在してよい。この指示の存在し得る一形態は、キットの包装、添付文書等において、好適な媒体または基材にプリントされた情報、例えば情報がプリントされた1枚または複数枚の用紙として存在する。この指示の更に別の形態は、情報が記録されたコンピューター読み取り可能媒体、例えば、ディスケット、コンパクトディスク(CD)、フラッシュドライブなどである。存在し得るこの指示の更に別の形態は、インターネット経由で遠隔地から情報にアクセスする際に使用できるウェブサイトアドレスである。キットは、本発明の方法による治療に適したPS陽性癌細胞の検出及びイメージングのための造影剤を更に含んでよい。
本発明について詳細に説明してきたが、本発明の趣旨または範囲から逸脱することなく、種々の変更及び改変がなされ得ることが当業者には明らかであろう。
実験
本発明の作製及び使用方法の完全な開示及び説明を当業者に提供するため、以下の実施例を示す。また、以下の実施例は、発明者が発明とみなすものの範囲を限定することを意図せず、そしてまた以下の実験が実施された全てのまたは唯一の実験であることを意味することも意図しない。使用した数字(例えば、量、温度など)に関しては正確性を確保するよう努力したが、一部の実験誤差及び偏差は当然含まれる。別段の指示がない限り、部は重量部であり、分子量は重量平均分子量であり、温度はセ氏温度であり、圧力は大気圧または大気圧付近である。
実施例1
一連の実験において、図1に示すように、4T1腫瘍(同系、未分化、マウス乳癌)保持Balb/cマウスに、2m/kg用量の野生型アネキシンVを腹腔内注射(i.p.)により単回または分割投与すると、腫瘍成長が有意に抑制され、更に24時間のタンパク質の単回投与により退縮することが見出された。2日目の反復投薬で効果が増強され、48〜72時間で徐々に減少が見られた。
血液クリアランスを図2に示す。アネキシンVの効果は、注入速度及び循環するアネキシンVの延長(すなわち、血液クリアランスの延長)に依存する可能性が高い。腹腔内注射による投薬は、血液中のアネキシンVの半減期を8分から3.5時間に増加させる。例えば12〜24時間にわたるアネキシンVの低速な静脈内注入による投与によって、同様の結果を得ることができる。
実施例2
腫瘍が誘発する自然免疫応答の免疫抑制を阻害する方法としてのアネキシンVの使用
1週間にわたる毎日の最大NOAEL(ラットでの無毒性量=2.5mg/kg/日)投薬での組み換え野生型アネキシンVの低速な持続的注入を用いて、未分化型トリプルネガティブ乳房腫瘍でのPS誘発性の免疫抑制を逆転する方法を記載する。rh−アネキシンVは、PSに対して高い結合親和性を有する内因性のヒトタンパク質(MW=36,000)である。rh−アネキシンVは、過去の臨床試験で造影剤として広範に試験され、300人超の患者へのタンパク質の2回以上の静脈内注射後、有害事象がないことが報告された。アネキシンVの抗腫瘍免疫活性機序はPD−1及びCTLA−4抗体を含む他の種類の免疫療法に依存せず、これらを有するアネキシンVと他の薬剤との間の相乗的な相互作用が期待される。更に、アネキシンVの注入は、局所的な放射線療法後のアポトーシス腫瘍、ならびに放射線照射域外の疾患部位の識別を相乗的に増強し得る。
大部分のヒト腫瘍に対する免疫応答の欠如は、アポトーシス腫瘍細胞内に含まれる特定の腫瘍関連抗原(TAA)に対するPS媒介性の末梢性寛容の発生によって、部分的に説明することができる。アポトーシスを受ける細胞は通常、全身性の「eat meシグナル」としての役割を果たす高レベルのPSを発現し、これによってNK細胞、T細胞及び単球/マクロファージ(MΦ)を含む自然免疫系が、死細胞を識別し、炎症反応を誘発せずに無害に除去する。他方で、貪食作用の閾値を下回る可逆的な中レベルのPS露出が、生存腫瘍細胞ならびに代謝ストレスを受けた細胞または活性Tリンパ球に観察される場合もある。腫瘍細胞及び腫瘍反応性Tリンパ球の表面にのみ存在する高または中レベルのPSは、自然免疫系と適応免疫系の両方によるTAAの識別及び応答を抑制するのに十分である。
PSの免疫抑制効果は、TIM−4(T細胞免疫グロブリンドメイン及びムチンドメイン含有分子4)を含む、PSと特異的に結合する新たに記述された、いくつかの免疫細胞受容体によって媒介される。TIM−4は、T細胞/膜貫通、免疫グロブリン及びムチン(TIM)遺伝子ファミリーのメンバーであり、MΦ及び樹状細胞(DC)に限定して発現する。TIM−4は、アポトーシス細胞の貪食作用を媒介し、非アポトーシス細胞上の中レベルのPS露出を識別して応答することもできる。腫瘍細胞上での高レベル及び中レベル両方のPSと、TAA反応性Tリンパ球は、活性(M1)から寛容原性(M2、TAM=腫瘍随伴マクロファージ)表現型へのMΦの転移を誘発する。M2表現型を有するTAM(↑IL−10及びTGF−β、↓IL−12)は、腫瘍特異的なTreg(調節性T細胞)、すなわちTAAによるCD8+(細胞傷害性)T細胞(CTL)の活性化を能動的に抑制する細胞の発生を誘発する。TAMはまた、DC成熟を予防し、DCによって提示されるTAAによるナイーブCD4+T細胞のクロスプライミングを阻害して、NK(ナチュラルキラーT細胞)とのDC共刺激性の細胞間相互作用を抑制する。骨髄由来幹細胞、すなわちMDSCはまた、PS+細胞の摂取またはそれとの接触に対して高度に免疫抑制性であり、腫瘍特異的Tregのクローン性増殖を誘発することにより、腫瘍特異的CTL細胞の機能を阻害することもできる。MDSCはまた、ナイーブCD4+細胞を腫瘍特異的Tregに変換することもできる。TAM及びMDSCのPSを媒介した貪食作用の阻害は、腫瘍特異的CTLに対するTregの免疫抑制効果を妨げることが期待される。
アネキシンVとマウスキメラPS結合抗体(バビツキシマブ)はいずれも、免疫系によるPS依存的な認識を阻害することにより、腫瘍細胞の抗原性の増加に使用されている。アネキシンVは、Mφによる死腫瘍細胞のクリアランスをDCへと移行すると同時に、M1活性(↑IL−1β及びTNF−α、↓TGF−β)も増加させることにより、アポトーシス腫瘍細胞の貪食作用の阻害にも使用されている。興味深いことに、アネキシンVによるアポトーシス腫瘍細胞のMφ貪食作用の阻害は、成熟したDCによる死腫瘍細胞またはそのTAAのクリアランス及び処理に影響を及ぼさなかった。また、PS媒介性の貪食作用のアネキシンVによる阻害に応答して、アポトーシス腫瘍細胞のクリアランスが遅延されることで、第2の壊死の開始(アポトーシス細胞がATPを使い果たした後)まで猶予ができ、TAAの免疫原性が更に高まる。ヒト用途の抗PS抗体のマウスキメラ形態であるバビツキシマブは、現在複数の第III相臨床試験の試験段階である。残念ながら、先頃バビツキシマブは、PSと直接結合するのではなく、アネキシンVと比較して限定的なPS親和性をもつ血清タンパク質であるベータ−2糖タンパク質1との特異的結合を介して間接的に結合することが見出された。PSとの高特異性をもつ完全なヒト化形態の抗PS抗体も、in vivoでの複数のマウスモデルで腫瘍の局在化に失敗しており、特異性を問わず、抗PS誘導性抗体による腫瘍の標的化が有効な治療戦略であるかどうかに疑念が投げかけられている。
腫瘍照射後のアネキシンVの腫瘍内注射または照射後の腫瘍細胞ワクチンへのアネキシンVの添加は、in vivoでの複数の動物モデルにおいて大幅な免疫応答の増強が観察されている。電離放射線により、照射域外の腫瘍成長を抑制でき(アブスコパル効果)、その結果、RTに応答して免疫応答が全身的な癌細胞の排除に関与し得るという結論も認識されている。RTと、全身投与されたアネキシンVによるPS阻害は、相乗効果を与えることができる。最後に、遺伝子操作された神経芽細胞腫細胞株によるアネキシンVの内因性分泌によるPSの阻害は、免疫適格性マウス腫瘍モデルで有意な抗腫瘍応答を促進した。更に、アネキシンVを分泌する神経芽細胞腫瘍の自己拒絶がT細胞依存性であり、マウスの40%で長時間持続することが見出された。
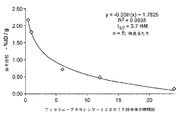
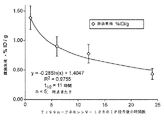
本発明者らは本明細書で、野生型アネキシンVを2〜4mg/kgの1日用量で8〜10日にわたり腹腔内注射(i.p.)すると、図3及び4に示すように、高侵襲性の免疫不全乳癌であるBalb/cマウスでの正所性同系4T1腋窩脂肪体腫瘍の成長を、対照と比較して60〜70%減少させるのに極めて有効であったことを示す。また本発明者らは、図5及び6に示すように、i.p.経路の注射は、Tc99m−アネキシンV−128の循環半減期を3.7時間に有意に延長し、同時にTc99m−アネキシンV−128の腫瘍内での滞留半減期を、11時間を優に超えるまでに増加させることを見出した。このデータから、アネキシンV(すなわちアネキシンV−128)は、他の免疫治療と組み合わせて低速の静脈内注射として投与される場合、アジュバントとして有用であることがわかる。
4T1(急速に成長し、転移性が高い)またはJC(成長が遅く、侵襲性が少ない)免疫不全同系乳癌の癌細胞株(いずれもルシフェラーゼを発現する細胞株)を、若年の雌性成熟BALB/Cマウスの左腋窩乳房脂肪体に正所的に移植する。腫瘍サイズが6〜7mmに達した後、腫瘍保持マウス(n=15/群)に、腹腔内に配置された浸透圧ポンプ(1007D、Alzet)によって1週間の持続的なアネキシンV注入(2mg/kg/d)の送達を受けさせた後、無治療対照と比較した腫瘍サイズ及び生存率を逐次測定する。別のマウス群では、原発腫瘍を切除し、1週間してマウスが回復してから、ポンプを移植し、1週間のアネキシンV注入を開始した。このマウスを引き続き、毎週BLI(生物発光イメージング)し、無治療対照と比較した転移性腫瘍成長ならびに生存率を検出及び評価する。以上の実験を、抗マウスPD−1及びCLTA−4抗体(10mg/kgをipで隔週4用量ずつ)を用いた免疫チェックポイント療法を加えて繰り返し、原発性または転移性疾患のいずれかをもつマウスでのアネキシンV注入療法との相乗効果を試験する。
(重要臓器に照射しないように腫瘍先端への局所的送達を容易にするため)右側腹部に皮下移植された原発性JC及び4T1腫瘍(6〜7mmサイズ)での1週間のアネキシンV注入療法の効果を測定する。小動物用X線光線(直径2cmの照射域)を使用して、単回線量30Gyを、鉛の治具に動かないように拘束された無麻酔マウスに照射する。アネキシンVで処置したマウスでの、照射を受けた原発腫瘍の成長及び生存率を、被照射対照と比較する。別のマウス群で、放射線と1週間のアネキシンV注入療法を完了した後、側腹部の原発腫瘍を切除して、マウスを引き続き毎週BLIし、転移性腫瘍の負荷ならびに生存率を逐次モニタリングして、アネキシンVを注入していない被照射マウスと比較する。この実験を、抗マウスPD−1及びCLTA−4抗体(10mg/kgをipで隔週4用量ずつ)を加えて繰り返し、原発性または転移性疾患のいずれかをもつ被照射マウスでのアネキシンV注入療法との相乗効果を試験する。