JP2016509494A - 医療用封止剤組成物及びその使用方法 - Google Patents
医療用封止剤組成物及びその使用方法 Download PDFInfo
- Publication number
- JP2016509494A JP2016509494A JP2015549500A JP2015549500A JP2016509494A JP 2016509494 A JP2016509494 A JP 2016509494A JP 2015549500 A JP2015549500 A JP 2015549500A JP 2015549500 A JP2015549500 A JP 2015549500A JP 2016509494 A JP2016509494 A JP 2016509494A
- Authority
- JP
- Japan
- Prior art keywords
- composition
- medical
- sealant composition
- skin
- component
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 161
- 239000000565 sealant Substances 0.000 title claims abstract description 83
- 238000000034 method Methods 0.000 title claims abstract description 49
- 229920001971 elastomer Polymers 0.000 claims abstract description 38
- 239000005060 rubber Substances 0.000 claims abstract description 34
- 239000004215 Carbon black (E152) Substances 0.000 claims abstract description 23
- 229930195733 hydrocarbon Natural products 0.000 claims abstract description 23
- 150000002430 hydrocarbons Chemical class 0.000 claims abstract description 23
- 239000004971 Cross linker Substances 0.000 claims abstract description 15
- 125000000524 functional group Chemical group 0.000 claims abstract description 8
- 239000003054 catalyst Substances 0.000 claims description 17
- 238000002560 therapeutic procedure Methods 0.000 claims description 17
- 239000003431 cross linking reagent Substances 0.000 claims description 15
- 239000003085 diluting agent Substances 0.000 claims description 13
- 229920001195 polyisoprene Polymers 0.000 claims description 13
- 229920002367 Polyisobutene Polymers 0.000 claims description 8
- 229920000642 polymer Polymers 0.000 claims description 7
- 230000009977 dual effect Effects 0.000 claims description 3
- 239000002480 mineral oil Substances 0.000 claims description 3
- 235000010446 mineral oil Nutrition 0.000 claims description 3
- 206010052428 Wound Diseases 0.000 description 42
- 208000027418 Wounds and injury Diseases 0.000 description 42
- 238000007789 sealing Methods 0.000 description 37
- 210000003491 skin Anatomy 0.000 description 35
- 239000000463 material Substances 0.000 description 18
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 11
- 239000012530 fluid Substances 0.000 description 8
- 239000006260 foam Substances 0.000 description 8
- 229920000459 Nitrile rubber Polymers 0.000 description 7
- 239000005062 Polybutadiene Substances 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- 229920002857 polybutadiene Polymers 0.000 description 7
- 229920002943 EPDM rubber Polymers 0.000 description 6
- 239000011324 bead Substances 0.000 description 6
- 210000002615 epidermis Anatomy 0.000 description 6
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 6
- 229920003049 isoprene rubber Polymers 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 4
- 239000000806 elastomer Substances 0.000 description 4
- 210000000416 exudates and transudate Anatomy 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 229920000515 polycarbonate Polymers 0.000 description 4
- 239000004417 polycarbonate Substances 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 229920003048 styrene butadiene rubber Polymers 0.000 description 4
- 239000004820 Pressure-sensitive adhesive Substances 0.000 description 3
- YKSADNUOSVJOAS-UHFFFAOYSA-N [bis[(dimethyl-$l^{3}-silanyl)oxy]-phenylsilyl]oxy-dimethylsilicon Chemical compound C[Si](C)O[Si](O[Si](C)C)(O[Si](C)C)C1=CC=CC=C1 YKSADNUOSVJOAS-UHFFFAOYSA-N 0.000 description 3
- 239000000853 adhesive Substances 0.000 description 3
- 230000001070 adhesive effect Effects 0.000 description 3
- 229920005549 butyl rubber Polymers 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 230000035876 healing Effects 0.000 description 3
- 229910052697 platinum Inorganic materials 0.000 description 3
- 229920001084 poly(chloroprene) Polymers 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- WZJUBBHODHNQPW-UHFFFAOYSA-N 2,4,6,8-tetramethyl-1,3,5,7,2$l^{3},4$l^{3},6$l^{3},8$l^{3}-tetraoxatetrasilocane Chemical compound C[Si]1O[Si](C)O[Si](C)O[Si](C)O1 WZJUBBHODHNQPW-UHFFFAOYSA-N 0.000 description 2
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- SBURHUAIGVFSSI-UHFFFAOYSA-N bis(dimethylsilyloxy)-diphenylsilane Chemical compound C=1C=CC=CC=1[Si](O[SiH](C)C)(O[SiH](C)C)C1=CC=CC=C1 SBURHUAIGVFSSI-UHFFFAOYSA-N 0.000 description 2
- 230000036760 body temperature Effects 0.000 description 2
- VLLYOYVKQDKAHN-UHFFFAOYSA-N buta-1,3-diene;2-methylbuta-1,3-diene Chemical compound C=CC=C.CC(=C)C=C VLLYOYVKQDKAHN-UHFFFAOYSA-N 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 239000002131 composite material Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 229920001296 polysiloxane Polymers 0.000 description 2
- 229920002635 polyurethane Polymers 0.000 description 2
- 239000004814 polyurethane Substances 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- 230000037303 wrinkles Effects 0.000 description 2
- RRHPTXZOMDSKRS-PHFPKPIQSA-L (1z,5z)-cycloocta-1,5-diene;dichloropalladium Chemical compound Cl[Pd]Cl.C\1C\C=C/CC\C=C/1 RRHPTXZOMDSKRS-PHFPKPIQSA-L 0.000 description 1
- PDJQCHVMABBNQW-MIXQCLKLSA-L (1z,5z)-cycloocta-1,5-diene;rhodium;dichloride Chemical compound [Cl-].[Cl-].[Rh].[Rh].C\1C\C=C/CC\C=C/1.C\1C\C=C/CC\C=C/1 PDJQCHVMABBNQW-MIXQCLKLSA-L 0.000 description 1
- SLLDDDJWIRFAGU-UHFFFAOYSA-N 1,2-dichlorocycloocta-1,5-diene Chemical compound ClC1=C(Cl)CCC=CCC1 SLLDDDJWIRFAGU-UHFFFAOYSA-N 0.000 description 1
- CEBKHWWANWSNTI-UHFFFAOYSA-N 2-methylbut-3-yn-2-ol Chemical compound CC(C)(O)C#C CEBKHWWANWSNTI-UHFFFAOYSA-N 0.000 description 1
- KMMCAFRMHUZFTJ-UHFFFAOYSA-N 2-methylbuta-1,3-diene 2-methylprop-1-ene styrene Chemical compound CC(C)=C.CC(=C)C=C.C=CC1=CC=CC=C1 KMMCAFRMHUZFTJ-UHFFFAOYSA-N 0.000 description 1
- ROGIWVXWXZRRMZ-UHFFFAOYSA-N 2-methylbuta-1,3-diene;styrene Chemical compound CC(=C)C=C.C=CC1=CC=CC=C1 ROGIWVXWXZRRMZ-UHFFFAOYSA-N 0.000 description 1
- INYHZQLKOKTDAI-UHFFFAOYSA-N 5-ethenylbicyclo[2.2.1]hept-2-ene Chemical compound C1C2C(C=C)CC1C=C2 INYHZQLKOKTDAI-UHFFFAOYSA-N 0.000 description 1
- CGBFEZOPOFSTTA-UHFFFAOYSA-L Cl[Pt](C1C=CC=C1)(C1C=CC=C1)Cl Chemical compound Cl[Pt](C1C=CC=C1)(C1C=CC=C1)Cl CGBFEZOPOFSTTA-UHFFFAOYSA-L 0.000 description 1
- 229920001634 Copolyester Polymers 0.000 description 1
- 229920000181 Ethylene propylene rubber Polymers 0.000 description 1
- 244000043261 Hevea brasiliensis Species 0.000 description 1
- UIEXFJVOIMVETD-UHFFFAOYSA-N P([O-])([O-])[O-].[Pt+3] Chemical class P([O-])([O-])[O-].[Pt+3] UIEXFJVOIMVETD-UHFFFAOYSA-N 0.000 description 1
- 229920005830 Polyurethane Foam Polymers 0.000 description 1
- 229920001247 Reticulated foam Polymers 0.000 description 1
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 1
- 239000002174 Styrene-butadiene Substances 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 150000001343 alkyl silanes Chemical class 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- 238000005452 bending Methods 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000000560 biocompatible material Substances 0.000 description 1
- DSVRVHYFPPQFTI-UHFFFAOYSA-N bis(ethenyl)-methyl-trimethylsilyloxysilane;platinum Chemical compound [Pt].C[Si](C)(C)O[Si](C)(C=C)C=C DSVRVHYFPPQFTI-UHFFFAOYSA-N 0.000 description 1
- 150000004758 branched silanes Chemical class 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000006229 carbon black Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 1
- 210000004207 dermis Anatomy 0.000 description 1
- 150000001993 dienes Chemical class 0.000 description 1
- LDCRTTXIJACKKU-ARJAWSKDSA-N dimethyl maleate Chemical compound COC(=O)\C=C/C(=O)OC LDCRTTXIJACKKU-ARJAWSKDSA-N 0.000 description 1
- HMHFTWLQMZUPSJ-UHFFFAOYSA-N dimethyl(2-methylpropylsilyl)silane Chemical compound C[SiH]([SiH2]CC(C)C)C HMHFTWLQMZUPSJ-UHFFFAOYSA-N 0.000 description 1
- UOUILILVWRHZSH-UHFFFAOYSA-N dimethyl-tris[(dimethyl-$l^{3}-silanyl)oxy]silyloxysilicon Chemical compound C[Si](C)O[Si](O[Si](C)C)(O[Si](C)C)O[Si](C)C UOUILILVWRHZSH-UHFFFAOYSA-N 0.000 description 1
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 230000005489 elastic deformation Effects 0.000 description 1
- 239000013536 elastomeric material Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- RCNRJBWHLARWRP-UHFFFAOYSA-N ethenyl-[ethenyl(dimethyl)silyl]oxy-dimethylsilane;platinum Chemical group [Pt].C=C[Si](C)(C)O[Si](C)(C)C=C RCNRJBWHLARWRP-UHFFFAOYSA-N 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 229920001903 high density polyethylene Polymers 0.000 description 1
- 239000004700 high-density polyethylene Substances 0.000 description 1
- 239000000416 hydrocolloid Substances 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 238000006459 hydrosilylation reaction Methods 0.000 description 1
- 229920002681 hypalon Polymers 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- FPYJFEHAWHCUMM-UHFFFAOYSA-N maleic anhydride Chemical compound O=C1OC(=O)C=C1 FPYJFEHAWHCUMM-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 229920003052 natural elastomer Polymers 0.000 description 1
- 229920001194 natural rubber Polymers 0.000 description 1
- 125000003518 norbornenyl group Chemical class C12(C=CC(CC1)C2)* 0.000 description 1
- -1 open cell Polymers 0.000 description 1
- 125000000962 organic group Chemical group 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- 239000010702 perfluoropolyether Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- PKELYQZIUROQSI-UHFFFAOYSA-N phosphane;platinum Chemical class P.[Pt] PKELYQZIUROQSI-UHFFFAOYSA-N 0.000 description 1
- HRGDZIGMBDGFTC-UHFFFAOYSA-N platinum(2+) Chemical compound [Pt+2] HRGDZIGMBDGFTC-UHFFFAOYSA-N 0.000 description 1
- SYKXNRFLNZUGAJ-UHFFFAOYSA-N platinum;triphenylphosphane Chemical compound [Pt].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 SYKXNRFLNZUGAJ-UHFFFAOYSA-N 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920006389 polyphenyl polymer Polymers 0.000 description 1
- 229920001021 polysulfide Polymers 0.000 description 1
- 239000005077 polysulfide Substances 0.000 description 1
- 150000008117 polysulfides Polymers 0.000 description 1
- 239000011496 polyurethane foam Substances 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 229910000077 silane Inorganic materials 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229920001897 terpolymer Polymers 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- DYXYFYSDMOOWRX-UHFFFAOYSA-N tris(dimethylsilyloxy)-methylsilane Chemical compound C[SiH](C)O[Si](C)(O[SiH](C)C)O[SiH](C)C DYXYFYSDMOOWRX-UHFFFAOYSA-N 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L24/00—Surgical adhesives or cements; Adhesives for colostomy devices
- A61L24/04—Surgical adhesives or cements; Adhesives for colostomy devices containing macromolecular materials
- A61L24/043—Mixtures of macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
- A61L15/58—Adhesives
-
- A61F13/05—
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
- A61L15/58—Adhesives
- A61L15/585—Mixtures of macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0009—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials
- A61L26/0014—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials obtained by reactions only involving carbon-to-carbon unsaturated bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0009—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials
- A61L26/0052—Mixtures of macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0061—Use of materials characterised by their function or physical properties
- A61L26/0071—Plasticisers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/90—Negative pressure wound therapy devices, i.e. devices for applying suction to a wound to promote healing, e.g. including a vacuum dressing
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L15/00—Compositions of rubber derivatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/00491—Surgical glue applicators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2202/00—Special media to be introduced, removed or treated
- A61M2202/0014—Special media to be introduced, removed or treated removed from the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2209/00—Ancillary equipment
- A61M2209/08—Supports for equipment
- A61M2209/088—Supports for equipment on the body
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08C—TREATMENT OR CHEMICAL MODIFICATION OF RUBBERS
- C08C19/00—Chemical modification of rubber
- C08C19/25—Incorporating silicon atoms into the molecule
Abstract
Description
実施形態1は、医療用封止剤組成物であって、
少なくとも1つのヒドロシリル化−架橋性官能基を有する不飽和ゴム炭化水素と、1分子当たり少なくとも1つのSiH基を有する架橋剤とを、含み、35℃で20分未満で硬化可能である、医療用封止剤組成物である。
医療用物品を提供することと、
少なくとも1つのヒドロシリル化−架橋性官能基を有する不飽和ゴム炭化水素と、1分子当たり平均少なくとも1つのSiH基を有する架橋剤とを含む組成物を提供することと、
該組成物を、該組成物が未硬化状態のときに、該医療用物品及び該皮膚のうちの一方又は両方に適用することと、
該医療用物品を該皮膚に適用することと、
該組成物を硬化させ、該医療用物品と該皮膚との間に封止剤を形成することと、を含む、方法である。
実施例で利用した材料を表1に示す。
硬化
サンプルを、35℃のオーブンに配置して硬化させた。サンプルを、5分毎に取り出し、視覚的及び触覚的に評価した。サンプルを軽く触り、その弾性、並びに指先に残った材料の量を観察した。サンプルが弾性を示し、かつ指先に材料が残らなかった場合、サンプルが完全に硬化したと決定した。硬化時間を、分単位又は時間単位で計測した。
硬化済封止剤の硬度(ショアA)を、タイプAデュロメータ(モデル306L、PCT(商標)Instuments、Los Angeles、CA)で計測した。全ての計測は、硬化の3日後に室温で実施した。
粘着は、硬化の3日後に室温で、サンプルに軽く触れることによって評価した。粘着に、低、中、又は高の評価を割り当てた。
各配合物の粘度(架橋剤及び触媒の添加なし)を、Brookfield粘度計(モデルDV−II+PRO、Middleboro、MA)で計測した。全ての計測は、23℃において1〜5rpmのLV−3スピンドルで実施した。
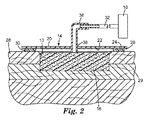
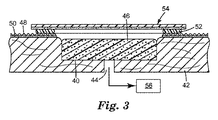
真空封止試験を、図3〜4に示される実験的な陰圧創傷閉鎖療法システムで実行した。図4に示される通り、模擬の創傷床40を、直径3.81cm、深さ1.91cmのポリカーボネートブロック42の部分を除去することによって作り出し、創傷40が形成された患者の身体を模擬した。真空取り付けのために模擬の創傷床の底部に0.48cmの穴44を開けた。図3に示される通り、連続気泡ポリウレタン発泡体46(GranuFoam(商標)、KCI Inc.、San Antonio、TX)を、マニホールドとして使用し、模擬の創傷床40に配置した。構造化フィルム48(HDPE 21002、エンボス#124、50ミクロン、83mm、Huhtamaki Inc.、De Soto、KS)を、ポリカーボネートブロックの上部表面に、接着剤50で取り付け、粗い皮膚様表面を模倣した。ポリカーボネートブロック42を、試験前に約10分間35℃に加熱し、体温を模擬した。
実施例3の封止剤玉縁を、いくつかの表面に分注し、室温で1日間放置させた。表5は、封止剤玉縁が各表面からきれいに除去されたことを実証する。
成分A
ポリイソプレン(70部)及びポリイソブチレン希釈剤(30部)を、機械的撹拌機(IKA(商標)RW16 Basic、IKA Works,Inc.、Wilmington、DE)で、均一になるまで混合した。Pt触媒(0.7部)を添加し、機械的撹拌機で混合した。これが成分Aである。
ポリイソプレン(70部)及びポリイソブチレン希釈剤(30部)を機械的撹拌機で、均一になるまで混合した。TMCTS架橋剤(3.5部)を添加し、機械的撹拌機で混合した。これが成分Bである。
実施例1(E−1)を、約20mLの成分A及び成分Bそれぞれを、VPS混合チップ(#70201033167、3M Company、St.Paul、MN)を備えるカートリッジ分注器(MixPac #0610441824,Sulzer Mixpac Ltd.、Salem、NH)に搭載された50mLのカートリッジ(MixPac #0610441804、Sulzer Mixpac Ltd.、Salem、NH)に充填することによって、調製した。封止剤(成分A及び成分Bの混合)の玉縁を室温のガラススライド上に分注し、35℃のオーブンに配置して硬化させた。実施例E−2〜E−4を、表2に示される配合物で、E−1の通りに調製した。
C−1〜C−6を、表2に示される配合物で、E−1の通りに調製した。
硬化、硬度、粘着、及び粘度の実施例及び比較例の結果を表3に示す。
Claims (22)
- 医療用封止剤組成物であって、
少なくとも1つのヒドロシリル化−架橋性官能基を有する不飽和ゴム炭化水素と、1分子当たり少なくとも1つのSiH基を有する架橋剤とを、含み、35℃で20分未満のうちに硬化可能である、医療用封止剤組成物。 - 前記組成物が、35℃で15分未満のうちに硬化可能である、請求項1に記載の医療用封止剤組成物。
- 前記組成物が、35℃で10分未満のうちに硬化可能である、請求項1又は2に記載の医療用封止剤組成物。
- 請求項1〜3のいずれかに記載の医療用封止剤組成物を含む陰圧創傷閉鎖療法システム。
- 医療用物品を皮膚に連結する方法であって、
医療用物品を提供することと、
少なくとも1つのヒドロシリル化−架橋性官能基を有する不飽和ゴム炭化水素と、1分子当たり平均で少なくとも1つのSiH基を有する架橋剤とを含む組成物を提供することと、
前記組成物を、前記組成物が未硬化状態のときに、前記医療用物品及び前記皮膚のうちの一方又は両方に適用することと、
前記医療用物品を前記皮膚に適用することと、
前記組成物を硬化させて、前記医療用物品と前記皮膚との間に封止剤を形成することと、を含む、方法。 - 前記封止剤を適用することが、二重カートリッジ自動混合送達システムから前記封止剤を分注することを含む、請求項5に記載の方法。
- 前記医療用物品が、陰圧創傷閉鎖療法システムの構成要素であり、医療用物品を提供することが、前記構成要素を提供することを含み、前記組成物を前記医療用物品及び前記皮膚のうちの一方又は両方に適用することが、前記組成物を前記構成要素及び前記皮膚のうちの一方又は両方に適用することを含み、前記医療用物品を、前記組成物を適用した後に、前記皮膚に適用することが、前記構成要素を前記皮膚に適用することを含む、請求項5又は6に記載の方法。
- 前記組成物が、少なくとも15,000cPの粘度を有する第1の(未硬化)状態を有する、請求項1〜4のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜7のうちのいずれかに記載の方法。
- 前記組成物が、少なくとも20,000cPの粘度を有する第1の状態を有する、請求項1〜4及び8のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜8のうちのいずれかに記載の方法。
- 前記組成物が、少なくとも45,000cPの粘度を有する第1の状態を有する、請求項1〜4及び8〜9のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜9のうちのいずれかに記載の方法。
- 前記組成物が、硬化後に約10〜約50の範囲のショア硬度を有する第2の状態を形成する、請求項1〜4及び8〜10のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜10のうちのいずれかに記載の方法。
- 前記組成物が、硬化後に約15〜約40の範囲のショア硬度を有する第2の状態を形成する、請求項1〜4及び8〜11のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜11のうちのいずれかに記載の方法。
- 前記組成物が、硬化後に約15〜約35の範囲のショア硬度を有する第2の状態を形成する、請求項1〜4及び8〜12のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜12のうちのいずれかに記載の方法。
- 前記不飽和ゴム炭化水素が、ポリイソプレンを含む、請求項1〜4及び8〜13のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜13のうちのいずれかに記載の方法。
- 前記ポリイソプレンが、約10000〜約90000の範囲の分子量を有する、請求項14に記載の医療用封止剤組成物又は方法。
- 前記組成物が、ポリマー希釈剤をさらに含む、請求項1〜4及び8〜15のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜15のうちのいずれかに記載の方法。
- 前記ポリマー希釈剤が、非反応性ゴム、鉱物油、又はそれらの組み合わせを含む、請求項16に記載の医療用封止剤組成物又は方法。
- 前記ポリマー希釈剤が、ポリイソブチレンを含む、請求項16又は17に記載の医療用封止剤組成物又は方法。
- 前記組成物が、触媒をさらに含む、請求項1〜4及び8〜18のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜18のうちのいずれかに記載の方法。
- 前記組成物が、前記不飽和ゴム炭化水素を含む第1の成分と、前記不飽和ゴム炭化水素及び前記架橋剤を含む第2の成分とを含む、2成分系である、請求項1〜4及び8〜19のうちのいずれかに記載の医療用封止剤組成物、又は請求項5〜19のうちのいずれかに記載の方法。
- 前記第1の成分が、触媒をさらに含む、請求項20に記載の医療用封止剤組成物又は方法。
- 前記2成分系の前記第1の成分及び前記第2の成分を、使用前に、別々にしておく、請求項20又は21に記載の医療用封止剤組成物又は方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261738521P | 2012-12-18 | 2012-12-18 | |
| US61/738,521 | 2012-12-18 | ||
| PCT/US2013/074855 WO2014099637A1 (en) | 2012-12-18 | 2013-12-13 | Medical sealant composition and method of using same |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016509494A true JP2016509494A (ja) | 2016-03-31 |
| JP2016509494A5 JP2016509494A5 (ja) | 2017-01-05 |
Family
ID=49883303
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015549500A Pending JP2016509494A (ja) | 2012-12-18 | 2013-12-13 | 医療用封止剤組成物及びその使用方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20150306273A1 (ja) |
| EP (1) | EP2934610A1 (ja) |
| JP (1) | JP2016509494A (ja) |
| CN (1) | CN104884098A (ja) |
| CA (1) | CA2895418A1 (ja) |
| WO (1) | WO2014099637A1 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20150159066A1 (en) | 2011-11-25 | 2015-06-11 | Smith & Nephew Plc | Composition, apparatus, kit and method and uses thereof |
| US20160120706A1 (en) | 2013-03-15 | 2016-05-05 | Smith & Nephew Plc | Wound dressing sealant and use thereof |
| JP6715598B2 (ja) | 2013-03-15 | 2020-07-01 | スミス アンド ネフュー ピーエルシーSmith & Nephew Public Limited Company | 創傷ドレッシングおよび治療方法 |
| US10695226B2 (en) | 2013-03-15 | 2020-06-30 | Smith & Nephew Plc | Wound dressing and method of treatment |
| US11718753B2 (en) * | 2020-05-28 | 2023-08-08 | Ethicon, Inc. | Topical skin closure compositions and systems |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007534344A (ja) * | 2003-06-10 | 2007-11-29 | メールンリユーケ ヘルス ケアー アーベー | エラストマー形成バリヤー製剤 |
| JP2009508550A (ja) * | 2005-09-15 | 2009-03-05 | スミス アンド ネフュー ピーエルシー | 組織からの作用物質を用いる装置 |
| JP2009509012A (ja) * | 2005-09-21 | 2009-03-05 | カール・フロイデンベルク・カーゲー | ゴムコンパウンド |
| JP2011516167A (ja) * | 2008-04-04 | 2011-05-26 | スリーエム イノベイティブ プロパティズ カンパニー | マイクロポンプを有する創傷ドレッシング |
| WO2012069793A1 (en) * | 2010-11-25 | 2012-05-31 | Smith & Nephew Plc | Compositions i-i and products and uses thereof |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3159601A (en) | 1962-07-02 | 1964-12-01 | Gen Electric | Platinum-olefin complex catalyzed addition of hydrogen- and alkenyl-substituted siloxanes |
| US3220972A (en) | 1962-07-02 | 1965-11-30 | Gen Electric | Organosilicon process using a chloroplatinic acid reaction product as the catalyst |
| US3159662A (en) | 1962-07-02 | 1964-12-01 | Gen Electric | Addition reaction |
| US5169890A (en) * | 1991-10-11 | 1992-12-08 | Ciba-Geigy Corporation | Thermoplastic hot melt adhesive |
| CA2221974A1 (en) | 1996-11-25 | 1998-05-25 | Kaneka Corporation | Curable composition |
| US6972309B1 (en) * | 2004-06-17 | 2005-12-06 | The Goodyear Tire & Rubber Company | Cure system for polyisoprene rubber |
-
2013
- 2013-12-13 EP EP13814376.3A patent/EP2934610A1/en not_active Withdrawn
- 2013-12-13 CA CA2895418A patent/CA2895418A1/en not_active Abandoned
- 2013-12-13 WO PCT/US2013/074855 patent/WO2014099637A1/en active Application Filing
- 2013-12-13 US US14/652,457 patent/US20150306273A1/en not_active Abandoned
- 2013-12-13 JP JP2015549500A patent/JP2016509494A/ja active Pending
- 2013-12-13 CN CN201380066503.2A patent/CN104884098A/zh active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007534344A (ja) * | 2003-06-10 | 2007-11-29 | メールンリユーケ ヘルス ケアー アーベー | エラストマー形成バリヤー製剤 |
| JP2009508550A (ja) * | 2005-09-15 | 2009-03-05 | スミス アンド ネフュー ピーエルシー | 組織からの作用物質を用いる装置 |
| JP2009509012A (ja) * | 2005-09-21 | 2009-03-05 | カール・フロイデンベルク・カーゲー | ゴムコンパウンド |
| JP2011516167A (ja) * | 2008-04-04 | 2011-05-26 | スリーエム イノベイティブ プロパティズ カンパニー | マイクロポンプを有する創傷ドレッシング |
| WO2012069793A1 (en) * | 2010-11-25 | 2012-05-31 | Smith & Nephew Plc | Compositions i-i and products and uses thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| US20150306273A1 (en) | 2015-10-29 |
| EP2934610A1 (en) | 2015-10-28 |
| WO2014099637A1 (en) | 2014-06-26 |
| CN104884098A (zh) | 2015-09-02 |
| CA2895418A1 (en) | 2014-06-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11931226B2 (en) | Wound dressing sealant and use thereof | |
| US11638666B2 (en) | Composition, apparatus, kit and method and uses thereof | |
| US20210401630A1 (en) | Wound dressing with adhesive margin | |
| JP2016509494A (ja) | 医療用封止剤組成物及びその使用方法 | |
| AU2014229779B2 (en) | Wound dressing sealant and use thereof | |
| US11534523B2 (en) | Silicone absorbent adhesive layer | |
| CN104937035B (zh) | 可室温固化的硅氧烷基凝胶 | |
| JP2015507671A (ja) | 親水性シリコーンゲル接着剤 | |
| CN103998558A (zh) | 高粘度有机硅粘合剂 | |
| CN115666666A (zh) | 新型抗微生物局部皮肤闭合组合物和系统 | |
| JP5332055B2 (ja) | 皮膚用シリコーン系粘着剤組成物及び皮膚用シリコーン系貼付材 | |
| US20240139035A1 (en) | Wound dressing sealant and use thereof | |
| EP2968647B1 (en) | Wound dressing sealant and use thereof | |
| BR112015014160B1 (pt) | Curativo de ferida, e método de produção de um curativo de ferida |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161115 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20161115 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170724 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170801 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171031 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20171120 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20171128 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20180515 |