JP2015510486A - 硫化水素を二硫化炭素に変換する方法 - Google Patents
硫化水素を二硫化炭素に変換する方法 Download PDFInfo
- Publication number
- JP2015510486A JP2015510486A JP2014557717A JP2014557717A JP2015510486A JP 2015510486 A JP2015510486 A JP 2015510486A JP 2014557717 A JP2014557717 A JP 2014557717A JP 2014557717 A JP2014557717 A JP 2014557717A JP 2015510486 A JP2015510486 A JP 2015510486A
- Authority
- JP
- Japan
- Prior art keywords
- hydrogen sulfide
- gas stream
- bromide
- bromine
- molecular weight
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- QGJOPFRUJISHPQ-UHFFFAOYSA-N Carbon disulfide Chemical compound S=C=S QGJOPFRUJISHPQ-UHFFFAOYSA-N 0.000 title claims abstract description 111
- 238000000034 method Methods 0.000 title claims abstract description 74
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical compound S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 title claims abstract description 43
- 229910000037 hydrogen sulfide Inorganic materials 0.000 title claims abstract description 42
- 239000007789 gas Substances 0.000 claims abstract description 69
- 238000006243 chemical reaction Methods 0.000 claims abstract description 44
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims abstract description 40
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims abstract description 39
- 229910052794 bromium Inorganic materials 0.000 claims abstract description 39
- 150000001335 aliphatic alkanes Chemical class 0.000 claims abstract description 36
- 150000002430 hydrocarbons Chemical class 0.000 claims abstract description 33
- 229930195733 hydrocarbon Natural products 0.000 claims abstract description 32
- 239000000203 mixture Substances 0.000 claims abstract description 22
- 150000001336 alkenes Chemical class 0.000 claims abstract description 21
- 230000008569 process Effects 0.000 claims abstract description 20
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 claims description 95
- 229910000042 hydrogen bromide Inorganic materials 0.000 claims description 44
- 239000003054 catalyst Substances 0.000 claims description 35
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 claims description 21
- 239000004215 Carbon black (E152) Substances 0.000 claims description 16
- 150000001347 alkyl bromides Chemical class 0.000 claims description 15
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 claims description 14
- JHJLBTNAGRQEKS-UHFFFAOYSA-M sodium bromide Chemical compound [Na+].[Br-] JHJLBTNAGRQEKS-UHFFFAOYSA-M 0.000 claims description 10
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 claims description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 6
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 5
- 238000005868 electrolysis reaction Methods 0.000 claims description 5
- 229910052760 oxygen Inorganic materials 0.000 claims description 5
- 239000001301 oxygen Substances 0.000 claims description 5
- 230000015572 biosynthetic process Effects 0.000 abstract description 26
- QGJOPFRUJISHPQ-NJFSPNSNSA-N carbon disulfide-14c Chemical compound S=[14C]=S QGJOPFRUJISHPQ-NJFSPNSNSA-N 0.000 abstract description 4
- 238000001311 chemical methods and process Methods 0.000 abstract description 3
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 102
- 238000005893 bromination reaction Methods 0.000 description 23
- 239000003345 natural gas Substances 0.000 description 21
- 239000000047 product Substances 0.000 description 21
- 230000031709 bromination Effects 0.000 description 19
- 238000003786 synthesis reaction Methods 0.000 description 18
- HNPSIPDUKPIQMN-UHFFFAOYSA-N dioxosilane;oxo(oxoalumanyloxy)alumane Chemical compound O=[Si]=O.O=[Al]O[Al]=O HNPSIPDUKPIQMN-UHFFFAOYSA-N 0.000 description 17
- GZUXJHMPEANEGY-UHFFFAOYSA-N bromomethane Chemical compound BrC GZUXJHMPEANEGY-UHFFFAOYSA-N 0.000 description 16
- 239000000243 solution Substances 0.000 description 14
- 229910000323 aluminium silicate Inorganic materials 0.000 description 12
- 239000010457 zeolite Substances 0.000 description 12
- 239000000126 substance Substances 0.000 description 11
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 9
- 229910021536 Zeolite Inorganic materials 0.000 description 8
- 239000000446 fuel Substances 0.000 description 8
- 239000007788 liquid Substances 0.000 description 8
- 238000000926 separation method Methods 0.000 description 8
- 239000000571 coke Substances 0.000 description 7
- 238000010586 diagram Methods 0.000 description 7
- 229940102396 methyl bromide Drugs 0.000 description 7
- 238000003860 storage Methods 0.000 description 7
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 6
- DIKBFYAXUHHXCS-UHFFFAOYSA-N bromoform Chemical compound BrC(Br)Br DIKBFYAXUHHXCS-UHFFFAOYSA-N 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 238000010521 absorption reaction Methods 0.000 description 5
- 239000003949 liquefied natural gas Substances 0.000 description 5
- 239000011777 magnesium Substances 0.000 description 5
- 230000008929 regeneration Effects 0.000 description 5
- 238000011069 regeneration method Methods 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 229910052717 sulfur Inorganic materials 0.000 description 5
- 239000011593 sulfur Substances 0.000 description 5
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- -1 alkali metal cations Chemical class 0.000 description 4
- 238000005342 ion exchange Methods 0.000 description 4
- 150000002500 ions Chemical class 0.000 description 4
- 229910052749 magnesium Inorganic materials 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 4
- 230000003647 oxidation Effects 0.000 description 4
- 238000007254 oxidation reaction Methods 0.000 description 4
- 238000007086 side reaction Methods 0.000 description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- OTMSDBZUPAUEDD-UHFFFAOYSA-N Ethane Chemical compound CC OTMSDBZUPAUEDD-UHFFFAOYSA-N 0.000 description 3
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 125000003118 aryl group Chemical group 0.000 description 3
- 229910052788 barium Inorganic materials 0.000 description 3
- 229950005228 bromoform Drugs 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 238000009833 condensation Methods 0.000 description 3
- 230000005494 condensation Effects 0.000 description 3
- 230000009849 deactivation Effects 0.000 description 3
- FJBFPHVGVWTDIP-UHFFFAOYSA-N dibromomethane Chemical compound BrCBr FJBFPHVGVWTDIP-UHFFFAOYSA-N 0.000 description 3
- 239000002803 fossil fuel Substances 0.000 description 3
- 239000003502 gasoline Substances 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- XDAHMMVFVQFOIY-UHFFFAOYSA-N methanedithione;sulfane Chemical compound S.S=C=S XDAHMMVFVQFOIY-UHFFFAOYSA-N 0.000 description 3
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 3
- 239000001294 propane Substances 0.000 description 3
- 238000011084 recovery Methods 0.000 description 3
- 229910052712 strontium Inorganic materials 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical group C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 239000006096 absorbing agent Substances 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 150000003842 bromide salts Chemical class 0.000 description 2
- 239000001273 butane Substances 0.000 description 2
- 229910052792 caesium Inorganic materials 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- 238000005341 cation exchange Methods 0.000 description 2
- 239000003518 caustics Substances 0.000 description 2
- 239000003245 coal Substances 0.000 description 2
- 239000010779 crude oil Substances 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 239000003317 industrial substance Substances 0.000 description 2
- 239000011261 inert gas Substances 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 2
- 229910052759 nickel Inorganic materials 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 238000004062 sedimentation Methods 0.000 description 2
- 239000004071 soot Substances 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- MPPPKRYCTPRNTB-UHFFFAOYSA-N 1-bromobutane Chemical compound CCCCBr MPPPKRYCTPRNTB-UHFFFAOYSA-N 0.000 description 1
- CYNYIHKIEHGYOZ-UHFFFAOYSA-N 1-bromopropane Chemical compound CCCBr CYNYIHKIEHGYOZ-UHFFFAOYSA-N 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 241000269350 Anura Species 0.000 description 1
- 239000002028 Biomass Substances 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical group [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 1
- 229920000298 Cellophane Polymers 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 1
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical group [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical group [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229920000557 Nafion® Polymers 0.000 description 1
- 101150101537 Olah gene Proteins 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical group [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 229920000297 Rayon Polymers 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 235000019647 acidic taste Nutrition 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000003905 agrochemical Substances 0.000 description 1
- 239000000809 air pollutant Substances 0.000 description 1
- 231100001243 air pollutant Toxicity 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 238000010936 aqueous wash Methods 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- RDHPKYGYEGBMSE-UHFFFAOYSA-N bromoethane Chemical compound CCBr RDHPKYGYEGBMSE-UHFFFAOYSA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 238000001354 calcination Methods 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 238000002485 combustion reaction Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 239000002274 desiccant Substances 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 239000003344 environmental pollutant Substances 0.000 description 1
- 239000002816 fuel additive Substances 0.000 description 1
- 229910052733 gallium Inorganic materials 0.000 description 1
- 238000010574 gas phase reaction Methods 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 238000005470 impregnation Methods 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 239000013067 intermediate product Substances 0.000 description 1
- 239000012263 liquid product Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 229910001509 metal bromide Inorganic materials 0.000 description 1
- 239000012968 metallocene catalyst Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 239000010815 organic waste Substances 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 231100000572 poisoning Toxicity 0.000 description 1
- 230000000607 poisoning effect Effects 0.000 description 1
- 231100000719 pollutant Toxicity 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 238000000197 pyrolysis Methods 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 239000002964 rayon Substances 0.000 description 1
- 238000007670 refining Methods 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 238000005201 scrubbing Methods 0.000 description 1
- 239000010865 sewage Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- BFKJFAAPBSQJPD-UHFFFAOYSA-N tetrafluoroethene Chemical group FC(F)=C(F)F BFKJFAAPBSQJPD-UHFFFAOYSA-N 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 238000010977 unit operation Methods 0.000 description 1
- 229910052720 vanadium Inorganic materials 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B32/00—Carbon; Compounds thereof
- C01B32/70—Compounds containing carbon and sulfur, e.g. thiophosgene
- C01B32/72—Carbon disulfide
- C01B32/75—Preparation by reacting sulfur or sulfur compounds with hydrocarbons
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B32/00—Carbon; Compounds thereof
- C01B32/70—Compounds containing carbon and sulfur, e.g. thiophosgene
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B7/00—Halogens; Halogen acids
- C01B7/09—Bromine; Hydrogen bromide
- C01B7/096—Bromine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C1/00—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon
- C07C1/26—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon starting from organic compounds containing only halogen atoms as hetero-atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C17/00—Preparation of halogenated hydrocarbons
- C07C17/093—Preparation of halogenated hydrocarbons by replacement by halogens
- C07C17/10—Preparation of halogenated hydrocarbons by replacement by halogens of hydrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10L—FUELS NOT OTHERWISE PROVIDED FOR; NATURAL GAS; SYNTHETIC NATURAL GAS OBTAINED BY PROCESSES NOT COVERED BY SUBCLASSES C10G, C10K; LIQUEFIED PETROLEUM GAS; ADDING MATERIALS TO FUELS OR FIRES TO REDUCE SMOKE OR UNDESIRABLE DEPOSITS OR TO FACILITATE SOOT REMOVAL; FIRELIGHTERS
- C10L3/00—Gaseous fuels; Natural gas; Synthetic natural gas obtained by processes not covered by subclass C10G, C10K; Liquefied petroleum gas
- C10L3/06—Natural gas; Synthetic natural gas obtained by processes not covered by C10G, C10K3/02 or C10K3/04
- C10L3/10—Working-up natural gas or synthetic natural gas
- C10L3/101—Removal of contaminants
- C10L3/102—Removal of contaminants of acid contaminants
- C10L3/103—Sulfur containing contaminants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2529/00—Catalysts comprising molecular sieves
- C07C2529/04—Catalysts comprising molecular sieves having base-exchange properties, e.g. crystalline zeolites, pillared clays
- C07C2529/06—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof
- C07C2529/40—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof of the pentasil type, e.g. types ZSM-5, ZSM-8 or ZSM-11
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10L—FUELS NOT OTHERWISE PROVIDED FOR; NATURAL GAS; SYNTHETIC NATURAL GAS OBTAINED BY PROCESSES NOT COVERED BY SUBCLASSES C10G, C10K; LIQUEFIED PETROLEUM GAS; ADDING MATERIALS TO FUELS OR FIRES TO REDUCE SMOKE OR UNDESIRABLE DEPOSITS OR TO FACILITATE SOOT REMOVAL; FIRELIGHTERS
- C10L2290/00—Fuel preparation or upgrading, processes or apparatus therefore, comprising specific process steps or apparatus units
- C10L2290/38—Applying an electric field or inclusion of electrodes in the apparatus
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10L—FUELS NOT OTHERWISE PROVIDED FOR; NATURAL GAS; SYNTHETIC NATURAL GAS OBTAINED BY PROCESSES NOT COVERED BY SUBCLASSES C10G, C10K; LIQUEFIED PETROLEUM GAS; ADDING MATERIALS TO FUELS OR FIRES TO REDUCE SMOKE OR UNDESIRABLE DEPOSITS OR TO FACILITATE SOOT REMOVAL; FIRELIGHTERS
- C10L2290/00—Fuel preparation or upgrading, processes or apparatus therefore, comprising specific process steps or apparatus units
- C10L2290/54—Specific separation steps for separating fractions, components or impurities during preparation or upgrading of a fuel
- C10L2290/541—Absorption of impurities during preparation or upgrading of a fuel
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10L—FUELS NOT OTHERWISE PROVIDED FOR; NATURAL GAS; SYNTHETIC NATURAL GAS OBTAINED BY PROCESSES NOT COVERED BY SUBCLASSES C10G, C10K; LIQUEFIED PETROLEUM GAS; ADDING MATERIALS TO FUELS OR FIRES TO REDUCE SMOKE OR UNDESIRABLE DEPOSITS OR TO FACILITATE SOOT REMOVAL; FIRELIGHTERS
- C10L2290/00—Fuel preparation or upgrading, processes or apparatus therefore, comprising specific process steps or apparatus units
- C10L2290/54—Specific separation steps for separating fractions, components or impurities during preparation or upgrading of a fuel
- C10L2290/543—Distillation, fractionation or rectification for separating fractions, components or impurities during preparation or upgrading of a fuel
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10L—FUELS NOT OTHERWISE PROVIDED FOR; NATURAL GAS; SYNTHETIC NATURAL GAS OBTAINED BY PROCESSES NOT COVERED BY SUBCLASSES C10G, C10K; LIQUEFIED PETROLEUM GAS; ADDING MATERIALS TO FUELS OR FIRES TO REDUCE SMOKE OR UNDESIRABLE DEPOSITS OR TO FACILITATE SOOT REMOVAL; FIRELIGHTERS
- C10L2290/00—Fuel preparation or upgrading, processes or apparatus therefore, comprising specific process steps or apparatus units
- C10L2290/54—Specific separation steps for separating fractions, components or impurities during preparation or upgrading of a fuel
- C10L2290/545—Washing, scrubbing, stripping, scavenging for separating fractions, components or impurities during preparation or upgrading of a fuel
Abstract
硫化水素を含有するガス流から二硫化炭素を形成する方法。低分子量アルカンおよび硫化水素を含有する気体流を、約250℃〜約530℃の温度で、充分な臭素と接触させて、実質的に全ての前記硫化水素を二硫化炭素に変換し得る。気体流は、約0.001〜約20mol%の硫化水素を含有し得る。臭素:硫化水素のモル比は約2:1であってよい。本発明は、一般に、アルカンおよび臭素との反応によってガス流から硫化水素を除去して二硫化炭素を形成する方法、ならびに、1つ以上の実施形態において、低分子量アルカンを高級炭化水素、オレフィンまたはそれらの混合物に変換する化学工程における生成物として二硫化炭素を形成することに関する。
Description
発明の背景
本発明は、一般に、アルカンおよび臭素との反応によってガス流から硫化水素を除去して二硫化炭素を形成する方法、ならびに、1つ以上の実施形態において、低分子量アルカンを高級炭化水素、オレフィンまたはそれらの混合物に変換する化学工程における生成物として二硫化炭素を形成することに関する。
本発明は、一般に、アルカンおよび臭素との反応によってガス流から硫化水素を除去して二硫化炭素を形成する方法、ならびに、1つ以上の実施形態において、低分子量アルカンを高級炭化水素、オレフィンまたはそれらの混合物に変換する化学工程における生成物として二硫化炭素を形成することに関する。
化石燃料である天然ガスは、メタンおよび他の軽質アルカンから主に成り、世界中で大量に発見されている。他の化石燃料と比較した場合、天然ガスは、一般に、よりクリーンなエネルギー源である。例えば、原油は不純物、例えば重金属を一般に含有し、それらは天然ガスには一般に見られない。他の例として、燃焼天然ガスは、放出される熱エネルギー単位当たり、燃焼石炭よりかなり少ない二酸化炭素を発生させる。しかし、他の化石燃料に代わる天然ガスの使用に関して課題がある。天然ガスが発見されている多くの場所は人口の多い地域から離れており、従って、天然ガスのための有効なパイプライン構造および/または市場需要がない。天然ガスの低密度により、より人口の多い地域への気体状態での輸送は高コストである。従って、天然ガスを気体状態で輸送し得る距離には、現実的かつ経済的制約がある。
液化天然ガス(「LNG」と呼ばれることが多い)を形成するための天然ガスの極低温液化は、天然ガスをより経済的に遠距離輸送するのに使用されることが多い。しかし、このLNG法は一般に高コストであり、LNGを扱うために、限られた再ガス化設備がごくわずかな国に存在するだけである。より高い密度および価値により、液体としてより経済的に輸送できる高分子量炭化水素に天然ガスを変換することによって、天然ガス、特に、人口の多い地域から離れた場所で生産されるストランデッド天然ガスの市場を、有意に拡大することができる。天然ガスを高分子量炭化水素に変換する多くの方法が開発されているが、これらの方法は、限られた商業的実行可能性により、広範囲に工業的に受け入れられていない。一般に、これらの方法は、それらの使用を制限する望ましくないエネルギーおよび/または炭素効率という課題を有する。
さらに、硫化水素(H2S)は、多くの天然ガス貯留槽、または他のガス源、例えば、ごみ処理場、下水処理場などからの有機廃棄物の嫌気性微生物学的分解から生じる「バイオガス」に見られる毒性かつ腐食性の汚染物質である。従って、硫化水素は、使用前にガス流から除去する必要がある。硫化水素は毒性であるので、銅管および天然ガス燃焼機器に見られる他の金属を腐食させる可能性があり、ガス流に残っている場合は、燃焼して大気汚染物質である有害な硫黄酸化物(SOx)になり得る。ガスが化学品または燃料の製造工程、例えば「ガスからメタノール」、「ガスからアンモニア」または「ガスから液体」(フィッシャー・トロプシュ)法の供給原料として使用される場合、硫化水素は、ガス変換工程に使用される触媒を急速に失活または「被毒」させ得るので、除去しなければならない。
硫化水素は一般に、水性アミンのような化学溶媒または商品名Selexolで市販されているある種の方法に使用されるような物理溶媒を使用して、再循環および再生H2S選択的溶媒法を用いてH2S汚染ガス流から先ず分離し得る。硫化水素は、クラウス法によって元素硫黄にさらに変換し得る。溶融硫黄は一般に、加熱された鉄道車両またはタンクローリで液体として輸送され、硫酸、硫酸アンモニウムまたは他の工業用化学物質、例えば二硫化炭素を製造するために使用される。
二硫化炭素(CS2)は、レーヨン、セロファンならびに種々の他の工業用および農業用化学物質の製造に使用される貴重な化学中間体である。大部分の二硫化炭素(CS2)は、現在、メタンと元素硫黄との高温反応によって製造されており、大部分の該元素硫黄は原油の精製または天然ガスの処理に由来するH2Sから製造されている。このように、メタンおよび硫黄からのCS2の製造は間接的多段階法であり、多くの場合、別々の場所での硫化水素、硫黄およびメタン成分の分離、取扱いおよび処理を必要とする。
従って、処理されているガス流の他の成分から硫化水素を分離することを必要とせずに、硫化水素を二硫化炭素に直接的に変換する方法が求められている。
発明の概要
前記および他の目的を達成するため、および本発明の目的に従って、本明細書において具体的に示され広範囲に記載されているように、本発明の1つの実施形態は、低分子量アルカンおよび硫化水素を含有する気体流をある温度で充分な臭素と接触させて、実質的に全ての前記硫化水素を二硫化炭素に変換することを含む方法である。
前記および他の目的を達成するため、および本発明の目的に従って、本明細書において具体的に示され広範囲に記載されているように、本発明の1つの実施形態は、低分子量アルカンおよび硫化水素を含有する気体流をある温度で充分な臭素と接触させて、実質的に全ての前記硫化水素を二硫化炭素に変換することを含む方法である。
本発明の他の実施形態は、臭化アルキル、二硫化炭素および臭化水素を形成するために、低分子量アルカンおよび硫化水素を含有する気体流をある温度で臭素と接触させ、少なくとも一部の臭化アルキルを、好適な触媒、臭化水素および二硫化炭素の存在下に反応させて、高分子量炭化水素、オレフィンまたはそれらの混合物を形成することを含む方法である。
発明の詳細な説明
本明細書に記載されている方法の供給原料として使用し得るガス流は、一般に、低分子量アルカンを含有する。本説明を通じて使用されている「低分子量アルカン」は、メタン、エタン、プロパン、ブタン、ペンタンまたはこれらの各アルカンの2つ以上の混合物を指す。低分子量アルカンは、任意の好適な源、例えば、低分子量アルカンを与える天然または合成の任意ガス源に由来し得る。本発明の方法に使用される低分子量アルカンの源の例は、下記を包含するが、それらに限定されない:天然ガス、炭層メタン、再ガス化された液化天然ガス、ガス水和物および/または包接化合物(chlathrate)に由来するガス、有機物質またはバイオマスの嫌気性分解に由来するガス、タールサンドの処理に由来するガス、ならびに合成的に製造された天然ガスまたはアルカン。いくつかの実施形態において、これらの組合せが好適な場合もある。
本明細書に記載されている方法の供給原料として使用し得るガス流は、一般に、低分子量アルカンを含有する。本説明を通じて使用されている「低分子量アルカン」は、メタン、エタン、プロパン、ブタン、ペンタンまたはこれらの各アルカンの2つ以上の混合物を指す。低分子量アルカンは、任意の好適な源、例えば、低分子量アルカンを与える天然または合成の任意ガス源に由来し得る。本発明の方法に使用される低分子量アルカンの源の例は、下記を包含するが、それらに限定されない:天然ガス、炭層メタン、再ガス化された液化天然ガス、ガス水和物および/または包接化合物(chlathrate)に由来するガス、有機物質またはバイオマスの嫌気性分解に由来するガス、タールサンドの処理に由来するガス、ならびに合成的に製造された天然ガスまたはアルカン。いくつかの実施形態において、これらの組合せが好適な場合もある。
本発明の種々の実施形態において使用し得る臭素の好適な源は、下記を包含するが、それらに限定されない:元素臭素、臭素塩、臭化水素酸、金属臭化物塩など。組合せも好適であり得るが、当業者が認めるように、多くの源を使用することにより付加的な問題が生じ得る。本発明の方法およびシステムの特定の実施形態を、以下に説明する。方法に含まれる一次化学反応と考えられる反応の重要な態様を、それらの反応が起こると考えられるので詳しく記載するが、副反応が起こり得ることを理解すべきである。本明細書において何らかの特定の副反応の記載がないことは、その反応が起こらないことを意味すると考えるべきでない。逆に言えば、記載されているものが網羅的または限定的であると考えるべきでない。さらに、本発明の方法のいくつかの態様を模式的に示す図面が提示されているが、これらの図面は、本発明の任意の特定方法を限定するものとみなすべきでない。
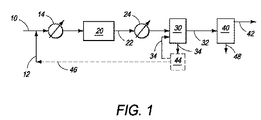
本発明の方法およびシステムの特定実施形態のいくつかの態様を一般的に示すブロックフロー図が図1に示されており、該図は、ガス流からの低レベルの硫化水素の直接的除去、および販売、貯蔵またはさらなる処理のための硫化水素の二硫化炭素への変換のためのスタンドアロンプロセスを示す。メタンを含有し、他の低分子量アルカンおよび約0.001〜約20.0mol%の硫化水素も含有し得るガス流を、好適なラインまたはコンジット10で運び、初めに、ライン12からの好適な源からの臭素と化合させ、熱交換器14において約250℃〜約530℃の温度に加熱することができ、該熱交換器において、臭素が最初に液状で存在する場合、臭素を蒸発させる。混合物を、ライン10から臭素化反応器20に導入してもよい。低分子量アルカンおよび硫化水素を含有する気体流と臭素との反応からのどの反応生成物においても有意な元素硫黄が検出できないので、硫化水素は、低分子量アルカン、例えばメタンとの反応性より臭素との反応性が高いと考えられることを出願人は見出した。元素硫黄が反応機構における中間体として形成される場合、硫黄は、明らかに、メタンまたは臭化メチルと急速に反応する。実際の反応機構にかかわらず、全体的正味反応は以下のようであると考えられる:
2H2S+4Br2+CH4 → CS2+8HBr
H2Sが過剰のメタンの存在下に検出できないレベルに実質的に完全に除去され得るという事実によって立証されるように、硫化水素は、明らかに、メタンおよび他の低分子量アルカンとの反応性より臭素(Br2)との反応性が高いと考えられる。
2H2S+4Br2+CH4 → CS2+8HBr
H2Sが過剰のメタンの存在下に検出できないレベルに実質的に完全に除去され得るという事実によって立証されるように、硫化水素は、明らかに、メタンおよび他の低分子量アルカンとの反応性より臭素(Br2)との反応性が高いと考えられる。
主にメタンから成るアルカン流からのH2Sの除去のみに前記工程が使用される一般的な場合を考える場合、臭素化反応器20に導入される混合物における乾燥臭素蒸気:硫化水素のモル比は、好ましくは、約2:1の化学量論比に近いと考えられる。熱交換器14に加えてまたはそれの代わりに、臭素化反応器20は、約250℃〜約530℃の範囲の反応開始温度に混合物を加熱することができる入口予熱ゾーン(図示せず)を有し得る。
二硫化炭素および臭化水素を含有する臭素化反応器20からの流出ガス流を、ライン22によって輸送し、熱交換器24によって約50℃〜約120℃の温度に冷却し、次に、HBrをガス流から除去する1つ以上の容器から成り得る臭化水素除去ユニット30に導入し得る。HBrは極性の容易にイオン化される化合物であるので、その除去はガス流の洗浄を含み得る。ガス流を水と接触させた場合、臭化水素が選択的に溶解して、臭化水素酸を形成し得る。ガス流を苛性アルカリ溶液、例えば水酸化ナトリウム水溶液と接触させた場合、臭化水素が水酸化ナトリウムと反応して、臭化ナトリウムを形成する。得られたHBrまたはNaBrは、HBr変換ステージ44において空気によるかまたは化学的酸化または電気分解によって洗浄液流34から除去されて元素臭素を形成でき、これをライン46によってライン12の臭素に再循環でき、これをライン10のガス流と化合させ得る。
得られた二硫化炭素含有ガス流を、ライン32によって運び、分離ステージ40に導入して、ライン48によって二硫化炭素を除去し得る。二硫化炭素は、容易輸送可能かつ有用な工業用液体溶媒であり、または種々の化学的方法によってさらに処理してもよい。二硫化炭素は比較的高い分子量を有するので、二硫化炭素をガス流から除去する1つの方法は凝縮である。例えば、二硫化炭素の標準沸点は約46℃であり、従って、ガス流をこの温度より低く冷却することによって二硫化炭素が蒸気流から凝縮し、液体生成物として除去される。より高い圧力での操作は、ガス流からの二硫化炭素の凝縮の程度を増加させることができ、さらに、多段階ユニット操作、例えば還流吸収装置は、二硫化炭素除去効率を実質的に増加し得る。硫化水素および二硫化炭素を実質的に含有しない得られたガス流は、さらなる処理、貯蔵または販売のためにライン42によって輸送し得る。
図2に示されている代替的実施形態において、方法は、ユニット30における臭化水素分離が蒸留によって行なわれる以外は、図1に示されている実施形態と実質的に同様である。硫化水素および二硫化炭素を実質的に含有しない得られたガス流は、さらなる処理、貯蔵または販売のためにライン31によってユニット30から除去でき、二硫化炭素はさらなる処理、貯蔵または販売のためにライン33によって除去し得る。臭化水素(HBr)は、図2のブロックフロー図に示されているようにステージ44における化学的酸化によって元素臭素に変換でき、この場合、臭化水素はライン35によってHBr変換ステージ44に導入でき、空気または酸素もライン41によってHBr変換ステージ44に導入し得る。変換ステージ44において、元素臭素の形成が下記の一般的な全体的反応に従って起こると考えられる:
4HBr(g)+O2(g) → 2Br2(g)+2H2O(g)
4HBr(g)+O2(g) → 2Br2(g)+2H2O(g)
図2の実施形態において、二硫化炭素を残留ガス流から除去するための別個分離ステージ40の必要性をなくし得る。
残留酸化剤(酸素または空気)および水はそれぞれライン43および45によってステージ44から除去でき、元素臭素(Br2)はライン46および12によって再循環させて、低分子量アルカンおよび約0.001〜約20.0mol%の硫化水素を含有するライン10の供給ガス流と混合し得る。
ユニット44における臭化水素変換は電気分解によって行なわれ、図3に示されているように、1つ以上の膜型電解槽44を使用し得る。この実施形態において、希薄臭化水素水溶液を、臭化水素除去ユニットとして機能する1つ以上の吸収カラム30の上部近くに導入し、臭素化反応器20からの二硫化炭素および臭化水素を含有する流出ガス流を、ライン22によって吸収カラム30の下部近くに導入し得る。二硫化炭素は分離相として凝縮し、臭化水素は希薄臭化水素水溶液に溶解させることができ、それによって濃HBr溶液を形成し、該溶液はライン34によって沈降タンク38に輸送することができ、硫化水素および二硫化炭素を実質的に含有しない得られたガス流を、さらなる処理、貯蔵または販売のためにライン42によって吸収カラム30から除去し得る。当業者に明らかなように、必要に応じて、補給水をライン37によって吸収カラム30に添加し得る。
沈降タンク38において、二硫化炭素が濃HBr溶液から分離し、さらなる処理、貯蔵または販売のためにライン39によって除去し得る。濃HBr溶液は、1つ以上の電解槽44に輸送し得る。電解槽における膜または隔膜は、アノード側からカソード側へのH+イオンの流動を可能にするが、アノード側からカソード側へのBr−イオンおよびBr2の流れを遅らせる。好ましくは、膜は、陽イオン交換膜またはプロトン交換膜、例えば、スルホン化テトラフルオロエチレンをベースとするフルオロポリマー−コポリマー(例えば、商品名Nafion(登録商標)で販売)、または類似機能陽イオン交換膜であってよい。好ましくは、反応を駆動するために必要とされる電気化学的電位が最小限になるように、濃臭化水素酸溶液が約48wt%HBrまたはその付近になるように溶液循環速度を調節し得る。得られる臭素豊富溶液はライン34によって1つ以上の電解槽から除去でき、好ましくは少なくとも約70℃、より好ましくは約90℃に熱交換器52によって加熱され、次に、ライン34によって臭素(Br2)ストリッパーカラム50に運び得る。臭素ストリッパーカラムにおいて、低分子量アルカン(例えばメタン)および約0.001〜約20.0mol%の硫化水素を含有する入口ガス流10が蒸発し、Br2を加熱溶液からストリップする。次に、ライン36を通ってBr2ストリッパーから出るストリップされた溶液は、熱交換器53によって少なくとも50℃、より好ましくは約30℃に冷却でき、それによって溶液中の微量臭素がHBr吸収装置30において精製低分子量(例えばメタン)ガスに奪われない。
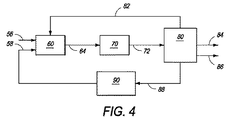
本発明の方法およびシステムの他の実施形態のいくつかの態様を一般的に示すブロックフロー図が図4に示されており、該図において、硫化水素を二硫化炭素に変換する本発明の方法を、ガスから燃料または化学物質への工程に組み込み得る。主にメタンを含有し、他の低分子量アルカンも含有してよく、約0.001〜20.0mol%の硫化水素を含有するガス流を、約1バール〜約75バールの圧力で、ライン、パイプまたはコンジット56によって輸送または搬送し、臭素化反応器60に供給し得る。乾燥臭素蒸気をライン、パイプまたはコンジット58によって輸送または搬送でき、これも臭素化反応器60に供給し得る。ガス流および乾燥臭素蒸気は、図2に示されているように、臭素化反応器60に別々に導入してもよく、または当業者に明らかなように流入前に混合してもよい。存在する硫化水素を変換するために、第一量の臭素(好ましくは、存在するH2Sのモル比の2倍に等しい)を添加する。入口ガス流に存在するより高い反応性の硫化水素の存在下に、好ましい過剰メタン:臭素比を得るために、第二量の臭素も添加され、それによって反応器60に導入される混合物における低分子量メタン:乾燥臭素蒸気のモル比は約2.5:1を上回り、より好ましくは約3:1に等しい。反応器60は、混合物を約250℃〜約530℃の反応開始温度に加熱することができる入口予熱ゾーン(図示せず)を有してもよい。
臭素化反応器60において、約250℃〜約600℃の温度、約1バール〜約80バール、より好ましくは約1バール〜約30バールの圧力で、低分子量アルカンを乾燥臭素蒸気と発熱反応させて、気体状臭化アルキルおよび臭化水素酸蒸気を生成し得る。本開示により当業者に明らかなように、臭素化反応器60における臭素化反応は、発熱性均一気相反応または不均一触媒反応であってよい。臭素化反応器60において使用し得る好適な触媒の非限定的な例は、下記を包含する:白金、パラジウム、または支持不定比(non−stiochiometric)金属オキシハロゲン化物、例えばFeOxBryまたはFeOxClyまたは支持金属オキシハロゲン化物、例えば、TaOF3、NbOF3、ZrOF2、SbOF3(それらはOlahら、J.Am.Chem.Soc.1985,107,7097−7105に記載されている)。操作温度範囲の上限は、臭素化反応の発熱的性質により供給混合物が加熱される反応開始温度範囲の上限より高くなり得ると考えられる。メタンの場合、臭化メチルの形成は、下記の一般的な全体的反応に従って起こると考えられる:
CH4(g)+Br2(g) → CH3Br(g)+HBr(g)
CH4(g)+Br2(g) → CH3Br(g)+HBr(g)
均一気相臭素化反応のフリーラジカル機構により、ジ−ブロモメタンおよびいくらかのトリ−ブロモメタンおよび他の臭化アルキルも形成し得る。しかし、本発明の方法によるこの反応は、臭素化反応器60で使用されるアルカン:臭素比および温度および滞留時間により、臭化メチルへの比較的高度の選択性を伴って起こることが多い。例えば、メタンの臭素化の場合、約3:1のメタン:臭素比、約500℃の温度および約60秒の滞留時間が、モノハロゲン化臭化メチルへの選択性を平均約90%に増加させると考えられる。これらの条件において、いくらかのジブロモメタン、および検出限界に近い極少量のトリブロモメタンも臭素化反応において形成し得る。約2.6:1のより低いメタン:臭素比、約400℃のより低い温度、およびたった約5〜10秒のより短い滞留時間を使用した場合、モノハロゲン化臭化メチルへの選択性は約65〜75%の範囲に減少し得る。約2.5:1より有意に低いメタン:臭素比において、臭化メチルへの許容し得ない低選択性が生じ、さらに、望ましくないジ−ブロモメタン、トリ−ブロモメタンおよび炭素すすの有意な形成が観察される。高級アルカン、例えば、エタン、プロパンおよびブタンも臭素化でき、モノおよび多重臭素化化学種、例えば、臭化エチル、臭化プロピルおよび臭化ブチルを生じ得る。しかし、これらの高級アルカンは実質的にメタンより反応性であるので、これらはポリ臭素化され、メタンの有意な反応が起こる前にすすを形成し得る。従って、高級アルカンの臭素化はメタンの臭素化とは別に行なうべきである。
図1に関して記載したように、硫化水素は、明らかに、メタンとの反応性より臭素との反応性が高く、従って、ガス流に存在するどの硫化水素も二硫化炭素に優先的に変換される。実際の反応機構にかかわらず、全体的正味反応は以下のようであると考えられる:
2H2S+4Br2+CH4 → CS2+8HBr
H2Sが過剰のメタンの存在下に検出できないレベルに実質的に完全に除去されるという事実によって立証されるように、H2Sは、明らかに、メタンとの反応性よりBr2との反応性が高い。
2H2S+4Br2+CH4 → CS2+8HBr
H2Sが過剰のメタンの存在下に検出できないレベルに実質的に完全に除去されるという事実によって立証されるように、H2Sは、明らかに、メタンとの反応性よりBr2との反応性が高い。
臭化アルキル、二硫化炭素、臭化水素および任意の未反応低分子量アルカンを含有する流出物を、ライン64によって臭素化反応器60から引きあげ得る。この流出物を、合成反応器70に流す前に、当業者に明らかなように、任意の好適な手段、例えば熱交換器(図示せず)によって部分的に冷却し得る。流出物が部分的に冷却される温度は、合成反応器70において臭化アルキルを高分子量炭化水素に変換することが所望される場合は約150℃〜約420℃であり、合成反応器70において臭化アルキルをオレフィンに変換することが所望される場合は約150℃〜約450℃である。合成反応器70は、オレフィン、高分子量炭化水素またはそれらの混合物を含有する生成物を形成するために、アルキル単位をオリゴマー化すると考えられる。合成反応器70において、臭化アルキルは、約150℃〜約450℃の温度範囲および約1〜80バールの圧力において、好適な触媒上で発熱反応して、所望生成物(例えば、オレフィンおよび高分子量炭化水素)を生じ得る。この反応の間に存在する二硫化炭素は、有意な反応を受けないか、または合成反応器において使用される触媒の堆積または「被毒」を生じると考えられる。
合成反応器70において使用される触媒は、炭化水素を生成するために臭素化アルカンの変換を触媒するのに好適な種々の物質のいずれかであってよい。特定の実施形態において、合成反応器70は触媒の固定床33を有し得る。ある種の状況において、特に、より大規模な用途において、合成触媒の流動床または移動床も使用してよく、それらはいくつかの利点、例えばコークスの一定除去および生成物組成に対する安定した選択性を有し得る。好適な触媒の例は、酸性イオン交換体であるという共通の機能を有し、かつ合成結晶性アルミノシリケートオキシド骨格も有するかなり広範囲な物質を包含する。特定の実施形態において、結晶性アルミノシリケートオキシド骨格中のアルミニウムの部分は、マグネシウム、ホウ素、ガリウムおよび/またはチタンで置換されていてもよい。特定の実施形態において、結晶性アルミノシリケートオキシド骨格におけるケイ素の部分は、リンで任意に置換されていてもよい。結晶性アルミノシリケート触媒は、一般に、結晶性アルミノシリケートオキシド骨格構造内に有意なアニオン電荷を有し、それは、例えばH、Li、Na、KまたはCsの群、またはMg、Ca、SrまたはBaの群から選択される元素のカチオンによって平衡化し得る。ゼオライト触媒は一般にナトリウム型で得られるが、プロトン性または水素型(水酸化アンモニウムとのイオン交換、次に、か焼することによる)が好ましく、または混合プロトン性/ナトリウム型も使用し得る。ゼオライトは、他のアルカリ金属カチオン、例えばLi、KまたはCs、アルカリ土類金属カチオン、例えばMg、Ca、SrまたはBa、または遷移金属カチオン、例えばNi、Mn、V、Wとのイオン交換によるか、または酸での処理によって修飾し得る。そのような化学処理および次のイオン交換は、電荷平衡化カウンターイオンに取って代わることができるが、さらにオキシド骨格中のイオンにも部分的に取って代わることができ、その結果、脱アルミニウム、またはオキシド骨格の結晶作製および構造の他の修飾も生じる。結晶性アルミノシリケートまたは置換結晶性アルミノシリケートは、微孔性またはメソ多孔性結晶性アルミノシリケートを包含し得るが、特定の実施形態において、合成微孔性結晶性ゼオライトも包含でき、例えば、ZSM−5のようなMFI構造であることができる。さらに、結晶性アルミノシリケートまたは置換結晶性アルミノシリケートは、特定の実施形態において、次に、Mg、Ca、SrまたはBa塩の水溶液で含浸し、か焼し、次に酸溶液で洗浄し得る。特定の実施形態において、合成微孔性ゼオライトを、ハロゲン化物塩、例えば臭化物塩、例えばMgBr2であってよい塩の水溶液で含浸し、か焼し、次に酸洗浄せず、Mgが触媒上に添加剤として残り得る。任意に、結晶性アルミノシリケートまたは置換結晶性アルミノシリケートは、約0.1〜約1重量%のPt、約0.1〜5重量%のPd、または約0.1〜約5重量%のNiを金属状態でさらに含有し得る。そのような物質は主に初めは結晶性であるが、いくつかの結晶性触媒は、初期のイオン交換または含浸または化学的脱アルミニウム処理によるか、または反応条件における操作によって、または再生の間に、いくらかの脱アルミニウム、結晶化度の減少またはそれらの両方を受けることがあり、従って、有意な非晶質性も有することがあり、それでもなお有意な、場合によっては向上した活性、および減少したコークスへの選択性を保持し得ることに注目すべきである。
合成反応器70において使用される特定の触媒は、例えば、所望される特定の炭化水素生成物に依存する。例えば、C3、C4およびC5+ガソリン範囲芳香族化合物およびより重質な炭化水素フラクションを主に有する炭化水素生成物が所望される場合、ZSM−5ゼオライト触媒を使用し得る。オレフィンおよびC5+生成物の混合物を含有する炭化水素生成物を製造することが所望される場合、X型またはY型ゼオライト触媒またはSAPOゼオライト触媒を使用し得る。好適なゼオライトの例は、X型、例えば10−X、またはY型ゼオライトを包含するが、異なる細孔径および酸性度を有する他のゼオライトを本発明の実施形態に使用し得る。
触媒の他に、合成反応器70が操作される温度は、所望される特定生成物への反応の選択性および変換を決定する重要なパラメータである。例えば、X型またはY型ゼオライト触媒が使用され、オレフィンの製造が所望される場合、合成反応器70を約250℃〜500℃の範囲内の温度で操作することが望ましいと考えられる。または、約250℃〜420℃の少し低い温度範囲で操作されるZSM−5ゼオライト触媒を含む実施形態において、合成反応器における環化反応は、C7+フラクションが主に置換芳香族化合物および主にC3〜C5+範囲の軽質アルカンを含有するように起こる。意外にも、ごく少ないエタンまたはC2〜C3オレフィン成分が生成物に見出される。
ZSM−5触媒上で、約100〜約2500hr−1の範囲のGHSVにおいて、400℃に近づく温度上昇において反応する臭化メチルを含有するガス混合物の例において、臭化メチル変換は90%以上に増加するが、C5+炭化水素への選択性は減少し、より軽質な工程生成物、特にプロパンへの選択性は増加する。550℃を超える温度において、臭化メチルのメタンおよび炭素質コークスへの高変換が生じ得ると考えられる。約350℃〜420℃の範囲の好ましい操作温度において、反応の副生成物として、より少ない量のコークスが、操作中に経時的に、触媒上に蓄積し得る。コークスの蓄積は、反応条件および供給ガスの組成に依存して何百時間にもおよぶ時間にわたって、触媒活性の減少を生じ得るので問題となり得る。約400℃を超えるより高い反応温度、特に約420℃より高い温度は、メタンの形成に関係し、臭化アルキルの熱分解およびカーボンまたはコークスの形成、従って触媒の失活速度の増加を助長すると考えられる。反対に、範囲の下端の温度、特に約350℃より低い温度も、触媒からのより重質な生成物の脱離速度の減少により、失活の一因となり得る。従って、合成反応器70において、約350℃〜約450℃の範囲、好ましくは約375℃〜約420℃の範囲の操作温度が、パス当たりのより高い変換に対するより低い炭素質コークス形成または触媒上の重質生成物蓄積(これは必要とされる触媒量、リサイクルレートおよび機器寸法を最小限にする)によって、所望されるC5+炭化水素への選択性の増加とより低い失活速度とのバランスをとる。
いくつかの実施形態において、触媒がインサイチュで定期的に再生され得る。触媒再生の1つの好適な方法において、反応器70を通常のプロセスフローから分離し、それを約1〜約5バールの範囲の圧力、約400℃〜約650℃の範囲の高温で、不活性ガスによってパージする。これは、実行可能である限り、触媒に吸着された未反応臭化アルキルおよびより重質な炭化水素生成物を除去すべきである。任意に、次に、約1バール〜約30バールの範囲の圧力、約400℃〜約650℃の範囲の高温において、反応器70に空気または不活性ガス希釈空気または酸素を添加することによって触媒を酸化してもよい。二酸化炭素、一酸化炭素および残留空気または不活性ガスは、再生時間中に反応器70から排出し得る。
いくつかの実施形態において、流動床または移動床反応器システムを、固定床合成反応器の代わりに使用し得る。そのような実施形態において、触媒再生は、当業者に明らかなように、分離再生反応器において継続的または断続的に行なうことができる。
合成反応器70からの流出物(これは、二硫化炭素、未反応低分子量アルカン、臭化水素およびオレフィン、高分子量炭化水素またはそれらの混合物を含有する)を、ライン72によって合成反応器70から引きあげ、生成物分離ユニット80に輸送し得る。ユニット80は、下記のような任意の好適な臭化水素除去法を使用することができる:水性洗浄液流の使用、または天然ガスまたは精油所ガス流を処理してオレフィンおよび高分子量炭化水素のような生成物を回収するために使用される脱水および液体回収法、例えば、固体床乾燥剤吸着、それに続く冷却凝縮、極低温膨張、または吸収油もしくは本発明の方法に使用し得る他の溶媒の循環。未反応アルカンは、ライン82によって臭素化反応器60に再循環させることができ、C3+炭化水素生成物および二硫化炭素は、それぞれライン84および86によって、さらなる処理、貯蔵または販売のために輸送される。
生成物分離ユニット80からの流出洗浄液流(これは、一般に、HBrを溶解させるために水を使用した場合は臭化水素酸であり、ガス流を苛性アルカリ溶液と接触させた場合は水酸化ナトリウム水溶液である)は、ライン88によって臭素回収ユニット90に輸送される。HBrまたはNaBrは、臭素回収ユニット90において、空気または化学的酸化または電気分解によって、流出洗浄液流から除去されて、元素臭素を形成し、これをライン58によって臭素化反応器60に再循環し得る。
本発明の方法を、臭素化および合成段階を含む「ガスから燃料」法に組み込まれたものとして前記に説明し図4に示したが、硫化水素を二硫化炭素に変換することが望ましいと考えられる他の化学的方法(「ガスからメタノール」、「ガスからアンモニア」および「ガスから液体」(フィッシャー・トロプシュ)法を包含するがそれらに限定されない)に本発明の方法を組み込み得ることが、本説明により当業者に明らかである。
本発明の方法の特定の実施形態が本明細書に記載されている。該方法に含まれる主要化学反応であると考えられる重要な態様を、それらが起こると考えられるので詳しく記載したが、副反応が起こり得ることを理解すべきである。本明細書に任意の特定副反応の記載がないことは、その反応が起こらないことを意味するものと考えるべきでない。逆に言えば、記載されているものが網羅的または限定的であると考えるべきでない。さらに、本発明の方法のいくつかの態様を模式的に示す図面が提示されているが、これらの図面は、本発明の何らかの特定方法を限定するものとみなすべきでない。
本明細書に使用されている「高分子量炭化水素」という用語は、C3鎖およびより長い炭化水素鎖を有する炭化水素を意味する。いくつかの実施形態において、高分子量炭化水素を直接的に製品(例えば、LPG、自動車燃料など)として使用し得る。他の例において、高分子量炭化水素流を、さらなる処理のための、中間生成物として、または供給原料として使用し得る。他の例において、高分子量炭化水素をさらに処理して、例えば、ガソリングレード燃料、ディーゼルグレード燃料、および燃料添加剤を製造し得る。いくつかの実施形態において、本発明の方法によって得られる高分子量炭化水素を、下記のものとして直接的に使用することができる:実質的芳香族含有量を有する自動車ガソリン燃料として、燃料混合原料として、またはさらなる処理のための供給原料として、例えば、ポリスチレンまたは関連ポリマーのような芳香族ポリマーを製造する工程の芳香族供給原料として、またはポリオレフィンを製造する工程のオレフィン供給材料として。本明細書において使用されている「オレフィン」という用語は、2〜6個の炭素原子および少なくとも1個の炭素−炭素二重結合を有する炭化水素を意味する。オレフィンは、所望であれば、さらに処理することができる。例えば、いくつかの例において、本発明の方法によって製造されたオレフィンを、重合反応(例えば、メタロセン触媒を使用する反応)においてさらに反応させて、プラスチックまたは合成潤滑剤のような多くの最終製品に有用となり得るポリ(オレフィン)を製造し得る。
高分子量炭化水素、オレフィンまたはそれらの混合物の最終用途は、下記の方法のオリゴマー化部分で使用される特定の触媒、ならびに工程に使用される操作パラメータに依存し得る。他の用途は、本開示により当業者に明らかである。
いくつかの実施形態において、本発明は、供給ガス流を、好適な臭素源からの臭素と反応させて、臭化アルキルを製造することを含む。本明細書において使用されている「臭化アルキル」という用語は、モノ−、ジ−およびトリ−臭素化アルカン、およびそれらの組合せを意味する。次に、オレフィン、高分子量炭化水素またはそれらの混合物を形成するために、これらの臭化アルキルを好適な触媒上で反応させることができる。
従って、本発明は、前記の目的および利点ならびにそれらに伴うものを達成するために充分に適合される。本明細書の教示により当業者に明らかな、異なっているが同等の方法で、本発明を改変し実施し得るので、先に開示した特定の実施形態は例示するものにすぎない。個々の実施形態について記載したが、本発明は、それらの全ての実施形態の全ての組合せを包含する。さらに、下記の特許請求の範囲に記載されている以外は、本明細書に示されている構成または設計の詳細は何ら限定されるものではない。従って、先に開示した特定の例示的実施形態は変更または改変し得ることが明らかであり、全てのそのような変化は、本発明の範囲および趣旨に含まれるとみなされる。先に開示した全ての数値および範囲は、若干変化し得る。下限および上限を有する数値範囲が示されている場合は必ず、その範囲内のあらゆる数値およびあらゆる包含されている範囲が明確に開示されているものとする。
Claims (20)
- 低分子量アルカンおよび硫化水素を含有する気体流を、ある温度で、充分な臭素と接触させて、実質的に全ての前記硫化水素を二硫化炭素に変換する工程
含む方法。 - 前記気体流が約0.001〜約20mol%の硫化水素を含有する、請求項1に記載の方法。
- 前記温度が約250℃〜約530℃である、請求項1に記載の方法。
- 臭素:硫化水素のモル比が約2:1である、請求項1に記載の方法。
- 前記硫化水素の二硫化炭素への変換の間に、臭化水素も形成される、請求項1に記載の方法であって、前記方法は、
少なくとも一部の前記臭化水素を前記ガス流から除去する工程
さらに含む方法。 - 前記除去する工程が、臭化水素を選択的に溶解させて臭化水素酸を形成するために、前記ガス流を水と接触させる工程を含む、請求項5に記載の方法。
- 前記除去する工程が、前記ガス流を水酸化ナトリウム水溶液と接触させ、前記臭化水素が前記水酸化ナトリウムと反応して臭化ナトリウムを形成する工程を含む、請求項5に記載の方法。
- 前記除去する工程が、前記ガス流を蒸留する工程を含む、請求項1に記載の方法。
- 少なくとも一部の前記臭化水素を臭素に変換する工程をさらに含む、請求項5に記載の方法。
- 前記変換する工程が、前記少なくとも一部の前記臭化水素を酸素と反応させる工程を含む、請求項9に記載の方法。
- 前記変換する工程が、電気分解を含む、請求項9に記載の方法。
- 臭化アルキル、二硫化炭素および臭化水素を形成するために、低分子量アルカンおよび硫化水素を含有する気体流を、ある温度で、臭素と接触させる工程、
少なくとも一部の前記臭化アルキルを、好適な触媒、前記臭化水素および前記二硫化炭素の存在下に反応させて、高分子量炭化水素、オレフィンまたはそれらの混合物を形成する工程、
を含む方法。 - 前記気体流が約0.001〜約20mol%の硫化水素を含有する、請求項12に記載の方法。
- 前記温度が約250℃〜約600℃である、請求項12に記載の方法。
- 少なくとも一部の前記臭化水素を、前記高分子量炭化水素、オレフィンまたはそれらの混合物から除去する工程をさらに含む、請求項12に記載の方法。
- 前記除去する工程が、臭化水素を選択的に溶解させて臭化水素酸を形成するために、前記高分子量炭化水素、オレフィンまたはそれらの混合物を、水と接触させる工程を含む、請求項15に記載の方法。
- 前記除去する工程が、前記高分子量炭化水素、オレフィンまたはそれらの混合物を水酸化ナトリウム水溶液と接触させ、前記臭化水素が前記水酸化ナトリウムと反応して臭化ナトリウムを形成する工程を含む、請求項15に記載の方法。
- 少なくとも一部の臭化水素を臭素に変換する工程をさらに含む、請求項15に記載の方法。
- 前記変換する工程が、少なくとも一部の臭化水素を酸素と反応させる工程を含む、請求項18に記載の方法。
- 前記変換する工程が、電気分解を含む、請求項18に記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261599498P | 2012-02-16 | 2012-02-16 | |
| US61/599,498 | 2012-02-16 | ||
| US13/760,291 | 2013-02-06 | ||
| US13/760,291 US20130217938A1 (en) | 2012-02-16 | 2013-02-06 | Processes for converting hydrogen sulfide to carbon disulfide |
| PCT/US2013/025706 WO2013122916A1 (en) | 2012-02-16 | 2013-02-12 | Processes for converting hydrogen sulfide to carbon disulfide |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2015510486A true JP2015510486A (ja) | 2015-04-09 |
Family
ID=48982769
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014557717A Pending JP2015510486A (ja) | 2012-02-16 | 2013-02-12 | 硫化水素を二硫化炭素に変換する方法 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20130217938A1 (ja) |
| EP (1) | EP2814792A4 (ja) |
| JP (1) | JP2015510486A (ja) |
| KR (1) | KR20140133580A (ja) |
| CN (1) | CN104271538A (ja) |
| AU (1) | AU2013221804A1 (ja) |
| CA (1) | CA2864792A1 (ja) |
| IL (1) | IL234060A0 (ja) |
| IN (1) | IN2014DN07137A (ja) |
| MX (1) | MX2014009863A (ja) |
| RU (1) | RU2014137320A (ja) |
| SG (1) | SG11201404974UA (ja) |
| WO (1) | WO2013122916A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080275284A1 (en) | 2004-04-16 | 2008-11-06 | Marathon Oil Company | Process for converting gaseous alkanes to liquid hydrocarbons |
| US8367884B2 (en) | 2010-03-02 | 2013-02-05 | Marathon Gtf Technology, Ltd. | Processes and systems for the staged synthesis of alkyl bromides |
| US8815050B2 (en) | 2011-03-22 | 2014-08-26 | Marathon Gtf Technology, Ltd. | Processes and systems for drying liquid bromine |
| US8829256B2 (en) | 2011-06-30 | 2014-09-09 | Gtc Technology Us, Llc | Processes and systems for fractionation of brominated hydrocarbons in the conversion of natural gas to liquid hydrocarbons |
| US8802908B2 (en) | 2011-10-21 | 2014-08-12 | Marathon Gtf Technology, Ltd. | Processes and systems for separate, parallel methane and higher alkanes' bromination |
| US9193641B2 (en) | 2011-12-16 | 2015-11-24 | Gtc Technology Us, Llc | Processes and systems for conversion of alkyl bromides to higher molecular weight hydrocarbons in circulating catalyst reactor-regenerator systems |
| WO2017147681A1 (en) | 2016-03-04 | 2017-09-08 | Bogdan Wojak | Sulphur-assisted carbon capture and utilization (ccu) methods and systems |
| US11472924B2 (en) * | 2018-12-20 | 2022-10-18 | Gas Technology Institute | Methods and systems to decarbonize natural gas using sulfur to produce hydrogen and polymers |
| WO2021198175A1 (en) * | 2020-03-30 | 2021-10-07 | Total Se | Gas to olefins process with coproduction of hydrogen together with electrified reactional section |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3240564A (en) * | 1966-03-15 | Manufacture (if carbon desulfhde | ||
| US2809930A (en) * | 1954-11-18 | 1957-10-15 | American Dev Corp | Removal of sulfur compounds from fluids |
| LU87923A1 (de) * | 1991-04-24 | 1992-11-16 | Euratom | Verfahren zum entfernen von schwefelwasserstoff und/oder schwefelkohlenstoff aus abgasen |
| US5385650A (en) * | 1991-11-12 | 1995-01-31 | Great Lakes Chemical Corporation | Recovery of bromine and preparation of hypobromous acid from bromide solution |
| US8173851B2 (en) * | 2004-04-16 | 2012-05-08 | Marathon Gtf Technology, Ltd. | Processes for converting gaseous alkanes to liquid hydrocarbons |
| US7601320B2 (en) * | 2005-04-21 | 2009-10-13 | Shell Oil Company | System and methods for producing oil and/or gas |
| CN101289162B (zh) * | 2008-05-24 | 2011-01-12 | 孔庆然 | 一种由硫化氢生产氢气和二硫化碳的方法 |
| US20090312586A1 (en) * | 2008-06-13 | 2009-12-17 | Marathon Gtf Technology, Ltd. | Hydrogenation of multi-brominated alkanes |
| WO2010107696A1 (en) * | 2009-03-16 | 2010-09-23 | Shell Oil Company | An integrated process to coproduce aromatic hydrocarbons and ethylene and propylene |
| US20110015458A1 (en) * | 2009-07-15 | 2011-01-20 | Marathon Gtf Technology, Ltd. | Conversion of hydrogen bromide to elemental bromine |
-
2013
- 2013-02-06 US US13/760,291 patent/US20130217938A1/en not_active Abandoned
- 2013-02-12 IN IN7137DEN2014 patent/IN2014DN07137A/en unknown
- 2013-02-12 MX MX2014009863A patent/MX2014009863A/es unknown
- 2013-02-12 RU RU2014137320A patent/RU2014137320A/ru not_active Application Discontinuation
- 2013-02-12 KR KR20147025802A patent/KR20140133580A/ko not_active Application Discontinuation
- 2013-02-12 JP JP2014557717A patent/JP2015510486A/ja active Pending
- 2013-02-12 AU AU2013221804A patent/AU2013221804A1/en not_active Abandoned
- 2013-02-12 CN CN201380014188.9A patent/CN104271538A/zh active Pending
- 2013-02-12 CA CA2864792A patent/CA2864792A1/en not_active Abandoned
- 2013-02-12 WO PCT/US2013/025706 patent/WO2013122916A1/en active Application Filing
- 2013-02-12 SG SG11201404974UA patent/SG11201404974UA/en unknown
- 2013-02-12 EP EP13749494.4A patent/EP2814792A4/en not_active Withdrawn
-
2014
- 2014-08-11 IL IL234060A patent/IL234060A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| SG11201404974UA (en) | 2014-10-30 |
| IN2014DN07137A (ja) | 2015-04-24 |
| CA2864792A1 (en) | 2013-08-22 |
| US20130217938A1 (en) | 2013-08-22 |
| EP2814792A4 (en) | 2015-11-04 |
| EP2814792A1 (en) | 2014-12-24 |
| AU2013221804A1 (en) | 2014-09-25 |
| IL234060A0 (en) | 2014-09-30 |
| RU2014137320A (ru) | 2016-04-10 |
| WO2013122916A1 (en) | 2013-08-22 |
| KR20140133580A (ko) | 2014-11-19 |
| CN104271538A (zh) | 2015-01-07 |
| MX2014009863A (es) | 2015-02-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8173851B2 (en) | Processes for converting gaseous alkanes to liquid hydrocarbons | |
| JP2015510486A (ja) | 硫化水素を二硫化炭素に変換する方法 | |
| US7674941B2 (en) | Processes for converting gaseous alkanes to liquid hydrocarbons | |
| CA2625459C (en) | Process for converting gaseous alkanes to olefins and liquid hydrocarbons | |
| US9206093B2 (en) | Process for converting gaseous alkanes to liquid hydrocarbons | |
| US7348464B2 (en) | Process for converting gaseous alkanes to liquid hydrocarbons | |
| US8642822B2 (en) | Processes for converting gaseous alkanes to liquid hydrocarbons using microchannel reactor | |
| CA2561133C (en) | Process for converting gaseous alkanes to liquid hydrocarbons | |
| US9133078B2 (en) | Processes and systems for the staged synthesis of alkyl bromides | |
| US20140179963A1 (en) | Process and system for recovering components from alkyl bromide synthesis |