JP2015508780A - 免疫不全患者のインフルエンザ及びパラインフルエンザウイルスを処置するための方法、化合物、及び組成物 - Google Patents
免疫不全患者のインフルエンザ及びパラインフルエンザウイルスを処置するための方法、化合物、及び組成物 Download PDFInfo
- Publication number
- JP2015508780A JP2015508780A JP2014557870A JP2014557870A JP2015508780A JP 2015508780 A JP2015508780 A JP 2015508780A JP 2014557870 A JP2014557870 A JP 2014557870A JP 2014557870 A JP2014557870 A JP 2014557870A JP 2015508780 A JP2015508780 A JP 2015508780A
- Authority
- JP
- Japan
- Prior art keywords
- patient
- das181
- virus
- infection
- sialidase
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/47—Hydrolases (3) acting on glycosyl compounds (3.2), e.g. cellulases, lactases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/12—Mucolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/01018—Exo-alpha-sialidase (3.2.1.18), i.e. trans-sialidase
Abstract
Description
ヒトパラインフルエンザウイルス(PIV)は呼吸器疾患の一般的な原因である。4種類のヒトPIVの臨床的及び疫学的特徴は異なる。PIV−1及びPIV−2感染症は、喉頭気管気管支炎又は声帯並びに上気道及び中気道のその他の部分の周辺の膨張に関連している。PIV−3はしばしば細気管支炎及び肺炎に関連している。PIV−4は一般的に、他の種類のヒトPIVより症状が穏やかである。
I.小さく、脂肪族であり、非極性又はわずかに極性の残基:Ala、Ser、Thr、Pro、Gly
II.負に帯電した極性残基及びそのアミド;Asp、Asn、Glu、Gln
III.正に帯電した極性残基:His、Arg、Lys
IV.大きな脂肪族非極性残基:Met、Leu、Ile、Val、Cys
V.大きな芳香族残基:Phe、Try、Trp
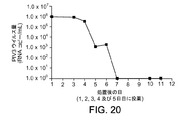
DAS181がPIVの臨床単離株を抑制できることを示すインビトロ実験を以下に記載する。PIVの臨床単離株はPIVの研究室株より患者に感染するPIVにより似ているので、この実験は意味がある。このウイルスで確立されたウイルス複製を50%抑制するのに必要な有効濃度(EC50)は約4nM DAS181であった。
ドライアイス上で受け取った試料を分析時まで−80℃で保存した。分析の準備ができた時、サンプルを、LLC−MK2細胞を用いてウイルスについて試験し、ウイルス感染について評価した(ウイルスの種類及び株)。感染が確認された場合、ウイルスを2回、ウイルスストックの増幅が充分になるまで継代した。ウイルスの成長特性の特徴解析及びDAS181の有効抑制用量を確立した。
DAS181は1〜10nMの全ての濃度でこのPIV3臨床株を効果的に抑制する。確立されたEC50は約4nMであり、これは、このアッセイで調べたほとんどのインフルエンザ株を抑制するのに必要なEC50より低い。細胞培養中の感染中のDAS181処置は、経時的ウイルス放出を効果的に2log超低減する。低MOIで感染した場合、PIV3感染により誘発される細胞毒性及び細胞死が感染後3日目までにかなり生じる。標準プラークアッセイ及びプラーク減少アッセイの改変により、これらのアッセイの一貫性及び実行可能性を向上させることができる。これらのデータは、現在知られているDAS181の能力を種々のPIV単離株の効果的抑制にまで拡張し、DAS181によるPIV臨床単離株の抑制を実証している。
細胞及びウイルス:元のLLC−MK2細胞をATCC(マナサス、バージニア州)から受け取り、最低限の回数継代(4回未満)して複数のソースバイアルを得た。細胞は、研究対象試料を受け取る前に解凍し、試験サンプル接種前に少なくとも2回継代した。
実験デザイン及び結果
別個の実験で、PIV3の第2臨床単離株を試験した。参照(実験室適合)株と比べて、この臨床単離株は、培養中でより速く成長し、24時間以内に培養全体にすぐに広がるプラークを形成した。このウイルスは更に、非常に高いタイターに成長し、このことは、この特定のPIV3株の病原性が高いことを示している。このウイルスに対して確立されたEC50は約28nMであった。
DAS181は10〜1000nMの全ての濃度でこのPIV3の臨床単離株を効果的に抑制する。確立されたEC50は28nMであった。細胞培養中の感染期間中のDAS181処置は、活性感染サイクル中に経時的ウイルス放出を約1log効果的に低減した。低MOIで感染させてDAS181で処置しなかった場合、PIV3感染により誘発される細胞毒性及び細胞死が感染後3日目までに実質的に見られ、DAS181処置は、ウイルス誘発細胞毒性から細胞単層を保護する。これらのデータは、現在知られているDAS181の能力を種々のPIV単離株の効果的抑制に拡張し、更に、PIV3の臨床単離株に対して、更には最も病原性の高い株と見なされるものに対してさえDAS181が有効であることを示している。
細胞及びウイルス:元のLLC−MK2細胞をATCC(マナサス、バージニア州)から受け取り、複数のソースバイアルを得るために最低限の回数(4回未満)継代した。細胞は、研究対象試料を受け取る前に解凍し、試験サンプル接種前に少なくとも2回継代した。PIV3を含む試料をLLC−MK2細胞に接種し、2回継代して大量のウイルス上清を得た。ウイルスの特徴を維持するために細胞培養中で最低限継代したウイルス上清を回収した。
PIV3感染を診断された18ヶ月の乳児(女性)でDAS181処置を開始した。この乳児は、同時に急性リンパ性白血病(ALL)も診断された。既存の動物毒性学データに基づいて最初の保存的投薬プランを作製した。患者の年齢のため、薬物は噴霧化形態でしか送達することができなかった。この症例で用いたネブライザーを表1に示す。
有害作用の症状が観察されず、患者が臨床的に安定していた場合、噴霧化の時間を4分間に延ばし、その後の2日間、再度症状をモニタリングした。
患者は、AMLで末梢血液幹細胞の移植を受けた61歳の男性であった。移植後の経過は、皮膚のGVHD、RSV肺炎、病因不明の肺小結節、及びGVHDによるものと思われる膀胱の症状のエピソード(これに対して患者はステロイドで処置されている)を合併していた。翌年、患者は咳、呼吸困難、及び胸部痛により外部の病院に来た。患者はBALの経験があり、アデノウイルス肺炎の可能性に対してシドホビルを開始しており、進行性の呼吸不全で7月1日に病院を移った。患者は血中アデノウイルス(86,000コピー/ml)を有することが見出され、PCRにより上咽頭サンプル中にアデノウイルス(Ct=38.4)及びPIV−3(Ct=32.3)を有していた。シドホビルが続けられた(1mg/kg、週3回)。患者に挿管し、この時点でBALはアデノウイルス又は他の病原体を示さなかったが、DFA及びPCRによりPIV−3陽性であった(Ct=18.8)。処置前、患者の状態は徐々に悪化してきており、換気サポート(FIO2=約90%、10mm PEEP)の必要性が増してきていた。気管吸引物はCt=13でPIV3に陽性であり、おそらく非常に高いウイルス量であった。
この患者は、間質性肺疾患の可能性があると評価された47歳の女性であった。この患者は、過敏性肺炎の可能性が診断され、ステロイドで処置された。患者は呼吸不全で入院した。この患者から回収したBALは、定性的PCR(呼吸器系ウイルスパネル)でPIV−3に陽性であった。他の診断検査は全て陰性であった。この患者でびまん性肺炎が観察され、患者は酸素化のためにECMOに維持された。
患者4は、7ヶ月の男性であり、基礎疾患としてSCIDS(T−/B+NK−)を有し、骨髄移植後GVHDを合併しており、持続性のPIV3感染で来院した。DAS181処置前にPIV3感染は約6週間持続し、患者は全期間にわたり持続的に酸素を必要とした。患者は、機械的換気が必要なまで進行し、更に肺炎が診断され、これはステロイド及び抗生物質による21日間の処置コースで処置された。患者はIVIGを受けたが、パラインフルエンザは持続した。胸部X線が異常で持続的に低酸素であり、持続的な酸素の補充が必要であったが、患者から抜管した。患者は、自家骨髄移植を受け骨髄移植後のGVHDに免疫抑制を受けた後、更に病気が悪化した。呼吸器系フィルムアレイPCRによりDAS181処置の前にPIV3感染が確認された。更に、直接蛍光分析(DFA)によりPIV3が確認された。
患者5は、左肺の移植を受けた、クローン病、糖尿病、及び間質性肺疾患の病歴がある59歳の男性であった。患者は、重度のクローン病に対する毎月のアダリムマブ療法に加えて、毎日5mgのタクロリムス、ミコフェノール酸モフェチル、及びプレドニゾンの慢性維持免疫抑制レジメンで維持されていた。患者の移植後の経過は、気管支軟化症並びに呼吸器多核体ウイルス(RSV)肺炎及びクレブシエラ肺炎を含む複数の気道感染症を合併していた。患者は、これらの呼吸器系感染症の後、ほぼ自身のベースラインに戻った。
患者6は、乳癌の病歴及び同種HSCT後の処置に関連するAMLがある51歳の女性であった。白血病の寛解にも関わらず、患者は、ミコフェノール酸モフェチル、イマチニブ、及び慢性ステロイドによる処置が必要な慢性的な慢性移植片対宿主病及び閉塞性細気管支炎症候群を発症していた。患者は、日常生活の基本的活動を行えないほどに、呼吸困難の急激な増加を発症していた。患者は更に、新規に発熱及び持続性乾性咳嗽を発症した。患者は更なるケアのために入院した。胸部CTにより、広汎なすりガラス様陰影及びいくつかの気管支血管の結節状陰影が示された。入院時の上咽頭スワブのPCRは、パラインフルエンザ1(PIV1)について陽性であり、インフルエンザ及びRSVについて陰性であった。気管支肺胞洗浄を行い、PIV1のPCRは再度陽性であった。患者は持続性の乾性咳、労作時呼吸困難、及び2Lの補充酸素の要求を示した。
患者7は、右肺移植を受けた特発性肺線維症(IPF)の病歴がある64歳の女性であった。患者の最初の移植後の経過は、プラズマフェレシス及びIVIGにより管理される急性体液性拒絶反応を合併しており、MMF又はイムランに耐えることができず、そのためプレドニゾン及びタクロリムスで維持されていた。入院の数週間前、患者の夫は上気道感染症になり、順調に回復した。その後、患者は息切れ及び咳の増加を経験し始め、80%の在宅酸素療法(home O2 saturation)を受け、その後、臨床施設に入院した。気管支鏡検査(BAL)では、細菌若しくは真菌感染症又はPJPの証拠は示されなかったが、PCRではPIV3陽性であった。その後、患者は悪化する低酸素症を発症し、大流量酸素サポート及びモニタリングのために集中治療室に移された。患者は大流量酸素サポートを必要としつづけ、改善の証拠はなく、FiO2は65%のままであった。患者の免疫抑制は可能な限り最低限に抑えられていた。
患者8は、再発性疾患に同種HSCTを受けたホジキン病の病歴がある57歳の男性であった。患者はその後再発し、ドナーリンパ球輸注を受けた。患者の臨床経過は、移植片対宿主病(GVHD)を合併していた。
エアゾール製剤中で用いるためのDAS181の調製
DAS181(1.0〜10.0mg/mL)のストック水溶液は少なくとも1週間2〜8℃で保存することができる。より低濃度の投薬溶液を毎日新たに調製し、使用時まで周囲条件で貯蔵するか冷蔵する。投薬溶液を得るために、ストック溶液を生理食塩水又は他の製薬用の好適な水溶液中に希釈することができる。
発明をその詳細な説明との関連で説明したが、上記の説明は例示であり、添付の特許請求の範囲により定義される本発明の範囲を限定しないと理解されるべきである。他の態様、利点、及び変更例が添付の特許請求の範囲に含まれる。
Claims (46)
- 患者を処置する方法であって、治療有効量のシアリダーゼ活性を有するポリペプチドを含む液体組成物を前記患者の気道に投与することを含む、方法。
- 前記患者が、インフルエンザウイルス又はパラインフルエンザウイルスに感染している、請求項1に記載の方法。
- 前記患者が呼吸機能低下を患っている、請求項1に記載の方法。
- 前記液体組成物が水性組成物である、請求項1に記載の方法。
- 前記患者の呼吸機能が、ドライパウダー吸入器の使用に不適当である、請求項1に記載の方法。
- 前記液体が、ネブライザー、気化器、気管内チューブ、鼻腔スプレー、加圧噴霧式定量吸入器、又は呼吸作動式(breath activated)加圧噴霧式定量吸入器を用いて投与される、請求項1に記載の方法。
- 前記液体組成物中のポリペプチドの濃度が0.1〜10.0mg/mLである、請求項1に記載の方法。
- 前記液体組成物中のポリペプチドの濃度が0.5〜2.0mg/mLである、請求項6に記載の方法。
- 前記ポリペプチドが、配列番号1と少なくとも90%同一である、請求項1に記載の方法。
- 前記タンパク質が、配列番号1又は2を含む、請求項1に記載の方法。
- 1回の投薬で0.001〜5mg/kgの前記ポリペプチドが前記患者に投与される、請求項1に記載の方法。
- 0.1〜100mgの前記ペプチドが30日間又はそれ未満にわたり前記患者に投与される、請求項1に記載の方法。
- 前記投与が、1〜30日間毎日なされる、請求項11に記載の方法。
- 1日に0.1〜10mgのポリペプチドが投与される、請求項1に記載の方法。
- 1日に有効用量0.1〜10mgのポリペプチドが投与される、請求項1に記載の方法。
- 前記投与が、1〜10ミクロンのMMADを有する液体組成物のエアゾール粒子を投与することを含む、請求項1に記載の方法。
- 前記患者が、呼吸補助を必要とする、請求項1に記載の方法。
- 前記患者が、挿管される、請求項17に記載の方法。
- 免疫不全患者のパラインフルエンザ又はインフルエンザウイルス感染を低減又は処置する方法であって、治療有効量のシアリダーゼ活性を有するタンパク質を含む組成物を前記患者の気道に投与することを含む方法。
- パラインフルエンザ又はインフルエンザウイルスの感染のリスクがある免疫不全患者を処置する方法であって、治療有効量のシアリダーゼ活性を有するタンパク質を前記患者の気道に投与することを含む方法。
- 前記免疫不全患者が、原発性免疫不全症を患っている、請求項19又は20に記載の方法。
- 前記免疫不全患者が、続発性免疫不全症を患っている、請求項19又は20に記載の方法。
- 前記免疫不全患者が、免疫抑制療法で処置されている又はされたことがある、請求項19又は20に記載の方法。
- 前記免疫不全患者が、化学療法剤で処置されている又はされたことがある、請求項19又は20に記載の方法。
- 前記免疫不全患者が、移植患者である、請求項23に記載の方法。
- 前記タンパク質が、配列番号1と少なくとも90%同一である、請求項1又は2に記載の方法。
- 前記タンパク質が、配列番号1又は2を含む、請求項19又は20に記載の方法。
- 前記組成物が、1又は複数の追加的化合物を含む、請求項19又は20に記載の方法。
- 前記投与が、鼻腔スプレーの使用によるものである、請求項19〜28に記載の方法。
- 前記投与が、吸入器の使用によるものである、請求項19〜28に記載の方法。
- 前記タンパク質が、シアリダーゼ又はその活性部分を含む、請求項19又は20に記載の方法。
- 前記シアリダーゼ又はその活性部分が、Clostridium perfringensシアリダーゼ若しくはその触媒ドメイン、Actinomyces viscosusシアリダーゼ若しくはその触媒ドメイン、Arthrobacter ureafaciensシアリダーゼ若しくはその触媒ドメイン、Micromonospora viridifaciensシアリダーゼ若しくはその触媒ドメインヒトNeu2シアリダーゼ若しくはその触媒ドメイン、又はヒトNeu4シアリダーゼ若しくはその触媒ドメインと少なくとも90%同一のアミノ酸配列を含む、請求項31に記載の方法。
- 前記シアリダーゼ又はその活性部分が、Actinomyces viscosusシアリダーゼ又はその触媒ドメインと少なくとも90%同一である、請求項32に記載の方法。
- 前記ペプチドが、アンカリングドメインを含み、前記アンカリングドメインが、グリコサミノグリカン(GAG)結合ドメインである、請求項31に記載の方法。
- 前記GAG結合ドメインが、ヒト血小板因子4のGAG結合ドメイン、ヒトインターロイキン8のGAG結合ドメイン、ヒトアンチトロンビンIIIのGAG結合ドメイン、ヒトアポタンパク質EのGAG結合ドメイン、ヒト血管関連遊走タンパク質のGAG結合ドメイン、又はヒトアンフィレギュリンのGAG結合ドメインと少なくとも90%同一なアミノ酸配列を含む、請求項34に記載の方法。
- 前記投与が、ネブライザー、気化器、気管内チューブ、鼻腔スプレー、ドライパウダー吸入器、加圧噴霧式定量吸入器、又は呼吸作動式加圧噴霧式定量吸入器による、請求項19〜28に記載の方法。
- 前記組成物が液体の形態である、請求項19又は20に記載の方法。
- 前記組成物がドライパウダーの形態である、請求項19又は20に記載の方法。
- PIV感染を患っている患者のPIVウイルス量を減少させる方法であって、前記患者にDAS181を含む組成物を投与することを含む方法。
- 前記組成物が、前記患者の気道に投与される、請求項39に記載の方法。
- 前記組成物が、ネブライザー又はドライパウダー吸入器を用いて投与される、請求項40に記載の方法。
- 前記患者が免疫不全である、請求項39に記載の方法。
- PIV感染を患っている患者の肺機能を向上させる方法であって、前記患者にDAS181を含む組成物を投与することを含む方法。
- 前記組成物が、前記患者の気道に投与される、請求項43に記載の方法。
- 前記組成物が、ネブライザー又はドライパウダー吸入器を用いて投与される、請求項44に記載の方法。
- 前記患者が免疫不全である、請求項43に記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261600545P | 2012-02-17 | 2012-02-17 | |
| US61/600,545 | 2012-02-17 | ||
| US201261727627P | 2012-11-16 | 2012-11-16 | |
| US61/727,627 | 2012-11-16 | ||
| PCT/US2013/026754 WO2013123521A1 (en) | 2012-02-17 | 2013-02-19 | Methods, Compounds and Compositions for Treatment of Parainfluenza Virus in Immunocompromised Patients |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015508780A true JP2015508780A (ja) | 2015-03-23 |
| JP2015508780A5 JP2015508780A5 (ja) | 2016-04-21 |
Family
ID=48984833
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014557870A Pending JP2015508780A (ja) | 2012-02-17 | 2013-02-19 | 免疫不全患者のインフルエンザ及びパラインフルエンザウイルスを処置するための方法、化合物、及び組成物 |
Country Status (9)
| Country | Link |
|---|---|
| US (4) | US20130280332A1 (ja) |
| EP (1) | EP2841092B1 (ja) |
| JP (1) | JP2015508780A (ja) |
| CN (2) | CN109529026A (ja) |
| AU (3) | AU2013221230A1 (ja) |
| CA (1) | CA2864746A1 (ja) |
| HK (1) | HK1207975A1 (ja) |
| IL (2) | IL234116B (ja) |
| WO (1) | WO2013123521A1 (ja) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103180318B (zh) | 2010-05-14 | 2017-05-10 | 达那-法伯癌症研究所 | 雄性避孕组合物以及使用方法 |
| CA2799403C (en) | 2010-05-14 | 2020-01-21 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for treating leukemia |
| BR112012029005A2 (pt) | 2010-05-14 | 2016-07-26 | Dana Farber Cancer Inst Inc | composições e métodos de tratamento de neoplasia, doença inflamatória e outros distúrbios |
| US9975896B2 (en) | 2013-07-25 | 2018-05-22 | Dana-Farber Cancer Institute, Inc. | Inhibitors of transcription factors and uses thereof |
| CA2929652A1 (en) | 2013-11-08 | 2015-05-14 | Dana-Farber Cancer Institute, Inc. | Combination therapy for cancer using bromodomain and extra-terminal (bet) protein inhibitors |
| JP2017504653A (ja) | 2014-01-31 | 2017-02-09 | ダナ−ファーバー キャンサー インスティテュート, インコーポレイテッド | ジアミノピリミジンベンゼンスルホン誘導体およびその使用 |
| JP2017504651A (ja) | 2014-01-31 | 2017-02-09 | ダナ−ファーバー キャンサー インスティテュート, インコーポレイテッド | ジアゼパン誘導体の使用 |
| US10925881B2 (en) | 2014-02-28 | 2021-02-23 | Tensha Therapeutics, Inc. | Treatment of conditions associated with hyperinsulinaemia |
| RU2017104898A (ru) | 2014-08-08 | 2018-09-10 | Дана-Фарбер Кэнсер Инститьют, Инк. | Дигидроптеридиноновые производные и их применения |
| JP2017526741A (ja) | 2014-08-08 | 2017-09-14 | ダナ−ファーバー キャンサー インスティテュート, インコーポレイテッド | ジアゼパン誘導体およびその使用 |
| SG11201703414VA (en) | 2014-10-27 | 2017-05-30 | Tensha Therapeutics Inc | Bromodomain inhibitors |
| EP3214935A4 (en) | 2014-11-06 | 2018-08-29 | Dana-Farber Cancer Institute, Inc. | Ezh2 inhibitors and uses thereof |
| AU2015342895A1 (en) * | 2014-11-06 | 2017-05-18 | Dana-Farber Cancer Institute, Inc. | Use of compositions modulating chromatin structure for graft versus host disease (GVHD) |
| US20180177852A1 (en) * | 2015-06-08 | 2018-06-28 | Ansun Biopharma, Inc. | Treatment of human metapneumovirus |
| CA2986441A1 (en) | 2015-06-12 | 2016-12-15 | Dana-Farber Cancer Institute, Inc. | Combination therapy of transcription inhibitors and kinase inhibitors |
| RU2018112953A (ru) | 2015-09-11 | 2019-10-14 | Дана-Фарбер Кэнсер Инститьют, Инк. | Ацетамидтиенотриазолодиазепины и пути их применения |
| SG10202007090UA (en) | 2015-09-11 | 2020-08-28 | Dana Farber Cancer Inst Inc | Cyano thienotriazolodiazepines and uses thereof |
| KR20180081809A (ko) | 2015-11-25 | 2018-07-17 | 다나-파버 캔서 인스티튜트 인크. | 2가 브로모도메인 억제제 및 그의 용도 |
| WO2017184999A1 (en) | 2016-04-22 | 2017-10-26 | Dana-Farber Cancer Institute, Inc. | Ezh2 inhibitors and uses thereof |
| MX2022006319A (es) * | 2019-11-25 | 2022-10-27 | Ansun Biopharma Inc | Suministro de celulas inmunitarias de sialidasa a celulas cancerosas, celulas inmunitarias y microambiente tumoral. |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009524667A (ja) * | 2006-01-24 | 2009-07-02 | ネクスバイオ,インク. | 高分子マイクロスフェアの調製技術 |
| WO2011057081A1 (en) * | 2009-11-06 | 2011-05-12 | Nexbio, Inc. | Methods, compounds and compositions for treatment and prophylaxis in the respiratory tract |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8245708B2 (en) * | 2002-05-07 | 2012-08-21 | The Research Foundation Of State University Of New York | Methods, devices and formulations for targeted endobronchial therapy |
| WO2004022128A2 (en) * | 2002-09-06 | 2004-03-18 | Chrysalis Technologies Incorporated | Liquid aerosol formulations and aerosol generating devices and methods for generating aerosols |
| US8084036B2 (en) | 2002-11-22 | 2011-12-27 | Nexbio, Inc. | Broad spectrum anti-viral therapeutics and prophylaxis |
| US7807174B2 (en) | 2002-11-22 | 2010-10-05 | Nexbio, Inc. | Class of therapeutic protein based molecules |
-
2013
- 2013-02-19 CA CA2864746A patent/CA2864746A1/en not_active Abandoned
- 2013-02-19 US US13/770,991 patent/US20130280332A1/en not_active Abandoned
- 2013-02-19 CN CN201811368987.7A patent/CN109529026A/zh active Pending
- 2013-02-19 CN CN201380009763.6A patent/CN104203267A/zh active Pending
- 2013-02-19 EP EP13749329.2A patent/EP2841092B1/en active Active
- 2013-02-19 WO PCT/US2013/026754 patent/WO2013123521A1/en active Application Filing
- 2013-02-19 AU AU2013221230A patent/AU2013221230A1/en not_active Abandoned
- 2013-02-19 JP JP2014557870A patent/JP2015508780A/ja active Pending
-
2014
- 2014-08-13 IL IL234116A patent/IL234116B/en active IP Right Grant
-
2015
- 2015-01-26 US US14/605,572 patent/US20150132274A1/en not_active Abandoned
- 2015-09-04 HK HK15108646.4A patent/HK1207975A1/xx unknown
-
2017
- 2017-02-10 US US15/430,288 patent/US20170151315A1/en not_active Abandoned
- 2017-11-10 AU AU2017258955A patent/AU2017258955A1/en not_active Abandoned
-
2019
- 2019-09-05 AU AU2019226190A patent/AU2019226190B2/en not_active Ceased
-
2020
- 2020-03-10 IL IL273194A patent/IL273194B2/en unknown
- 2020-07-31 US US16/945,776 patent/US20210046165A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009524667A (ja) * | 2006-01-24 | 2009-07-02 | ネクスバイオ,インク. | 高分子マイクロスフェアの調製技術 |
| WO2011057081A1 (en) * | 2009-11-06 | 2011-05-12 | Nexbio, Inc. | Methods, compounds and compositions for treatment and prophylaxis in the respiratory tract |
Non-Patent Citations (2)
| Title |
|---|
| CLINICAL INFECTIOUS DISEASES, vol. 53, no. 7, JPN6016046059, 2011, pages e77-e80 * |
| JOURNAL OF INFECTIOUS DISEASES, vol. 202, no. 2, JPN6016046060, 2010, pages 234 - 241 * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20210046165A1 (en) | 2021-02-18 |
| AU2019226190B2 (en) | 2021-10-07 |
| IL273194A (en) | 2020-04-30 |
| AU2013221230A1 (en) | 2014-10-02 |
| AU2019226190A1 (en) | 2019-09-26 |
| CN104203267A (zh) | 2014-12-10 |
| US20150132274A1 (en) | 2015-05-14 |
| HK1207975A1 (en) | 2016-02-19 |
| CN109529026A (zh) | 2019-03-29 |
| AU2017258955A1 (en) | 2017-12-14 |
| EP2841092A1 (en) | 2015-03-04 |
| IL273194B2 (en) | 2023-02-01 |
| US20130280332A1 (en) | 2013-10-24 |
| EP2841092A4 (en) | 2015-09-16 |
| IL273194B (en) | 2022-10-01 |
| IL234116B (en) | 2020-03-31 |
| EP2841092B1 (en) | 2023-12-06 |
| CA2864746A1 (en) | 2013-08-22 |
| WO2013123521A1 (en) | 2013-08-22 |
| US20170151315A1 (en) | 2017-06-01 |
| EP2841092C0 (en) | 2023-12-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2019226190B2 (en) | Methods, compounds and compositions for treatment of influenza and parainfluenza patients | |
| Rajnik et al. | Features, evaluation, and treatment of coronavirus (COVID-19) | |
| CN115605508A (zh) | 用于治疗冠状病毒感染和所产生的炎症诱导的肺损伤的方法 | |
| JP5970465B2 (ja) | ペプチドおよびウイルス・ノイラミニダーゼ阻害剤を含んでなる組成物 | |
| US20210322390A1 (en) | Sphingosine kinase 2 inhibitor for treating coronavirus infection | |
| US20220362272A1 (en) | Medicament for prevention or treatment of rhinovirus infection | |
| CN115701984A (zh) | 治疗 | |
| CN112546046B (zh) | 盐酸阿比朵尔在制备治疗肺纤维化疾病药物中的应用 | |
| US20230149429A1 (en) | Use of a nitrogen-containing bisphosphonate in combination with a glucocorticoid in preventing or treating viral pneumonia | |
| CN108926707A (zh) | Pf4的抗rsv应用 | |
| EP2544705B1 (en) | Interferon beta for use in the treatment of lower respiratory tract illness caused by influenza | |
| JP2023520929A (ja) | コロナウイルス感染症の処置のための方法 | |
| EP4232073B1 (en) | New dosage regimen for inhaled vasoactive intestinal polypeptide | |
| US20230000845A1 (en) | Biomarkers of coronavirus pneumonia | |
| EP4248986A1 (en) | Use of polypeptide having superoxide dismutase activity and extracellular vesicles for treatment or prevention of respiratory viral infection | |
| WO2024005563A1 (ko) | 편도유래줄기세포를 유효성분으로 포함하는 감염성 폐 질환의 예방 또는 치료용 조성물 | |
| WO2021195883A1 (zh) | TFF2蛋白和IFN-κ蛋白联用在治疗新型冠状病毒感染中的应用 | |
| WO2023198757A1 (en) | Alpha-1-antitrypsin for treating paramyxoviridae or orthomyxoviridae infections | |
| KR20230124613A (ko) | 바이러스 유래의 호흡기 감염을 치료하기 위한 펩타이드 | |
| JP2023526200A (ja) | SARS-CoV-2感染症の予防または治療のための適合溶質 | |
| US20220025019A1 (en) | Methods and compositions for preventing or treating acute exacerbations with polyclonal immunoglobulin | |
| CN116472054A (zh) | 用于改善SARS-CoV-2感染患者的预后的吸入型干扰素-β | |
| CN111803635A (zh) | 小分子抑制剂在治疗呼吸道病毒性肺炎上的应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160219 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160219 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20161128 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161206 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170306 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170508 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170606 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20171107 |