JP2014515364A - 放射能標識グルタミニルシクラーゼ阻害剤 - Google Patents
放射能標識グルタミニルシクラーゼ阻害剤 Download PDFInfo
- Publication number
- JP2014515364A JP2014515364A JP2014511862A JP2014511862A JP2014515364A JP 2014515364 A JP2014515364 A JP 2014515364A JP 2014511862 A JP2014511862 A JP 2014511862A JP 2014511862 A JP2014511862 A JP 2014511862A JP 2014515364 A JP2014515364 A JP 2014515364A
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- cycloalkyl
- phenyl
- alkoxy
- substituted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- RNGLCHLCMNNQGL-UHFFFAOYSA-N Cc1cnc[n]1CCCNC(Cc(cc1OC)ccc1OC)=S Chemical compound Cc1cnc[n]1CCCNC(Cc(cc1OC)ccc1OC)=S RNGLCHLCMNNQGL-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/041—Heterocyclic compounds
- A61K51/044—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine, rifamycins
- A61K51/0453—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine, rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/04—X-ray contrast preparations
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/06—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations
- A61K49/08—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by the carrier
- A61K49/10—Organic compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B59/00—Introduction of isotopes of elements into organic compounds ; Labelled organic compounds per se
- C07B59/002—Heterocyclic compounds
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Optics & Photonics (AREA)
- Physics & Mathematics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Radiology & Medical Imaging (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
【選択図】なし
Description
本発明は、イメージング剤として、特に、しかし排他的ではなく神経疾患の検出用の医療用イメージング剤としての放射能標識グルタミニルシクラーゼ(QC)阻害剤の使用に関する。本発明は、前記放射能標識阻害剤を含む医薬組成物並びに神経疾患を検出する方法及びキットにも関する。
グルタミニルシクラーゼ(QC, EC 2.3.2.5)は、アンモニアを遊離しながらの、N-末端グルタミン残基のピログルタミン酸(pGlu*)への分子内環化を触媒する。QCは、1963年にMesserにより熱帯植物カリカ・パパイヤ(Carica papaya)のラテックスから最初に単離された(Messer, M.の文献(1963 Nature 4874, 1299))。24年後、対応する酵素活性が、動物の下垂体において発見された(Busby, W. H. J.らの文献(1987 J Biol Chem 262, 8532-8536);Fischer, W. H.及びSpiess, J.の文献(1987 Proc Natl Acad Sci USA 84, 3628-3632))。哺乳動物のQCに関して、QCによるGlnのpGluへの転換を、TRH及びGnRHの前駆体について示すことができた(Busby, W. H. J.らの文献(1987 J Biol Chem 262, 8532-8536);Fischer, W. H.及びSpiess, J.の文献(1987 Proc Natl Acad Sci USA 84, 3628-3632))。加えて、最初のQC局在化実験は、ウシ下垂体におけるQCの触媒の推定生成物との同時局在を明らかにし、ペプチドホルモン合成において示唆された機能を更に改良した(Bockers, T. M.らの文献(1995 J Neuroendocrinol 7, 445-453))。対照的に、植物のQCの生理機能は、あまり明確ではない。C.パパイヤ由来の酵素の場合、病原性微生物に対する植物防御における役割が示唆された(El Moussaoui, A.らの文献(2001 Cell Mol Life Sci 58, 556-570))。他の植物に由来する推定上のQCが、配列比較により最近同定された(Dahl, S. W.らの文献(2000 Protein Expr Purif 20, 27-36))。しかしこれらの酵素の生理機能は依然曖昧である。
本発明の第1の態様によると、イメージング剤として使用するための放射能標識グルタミニルシクラーゼ(QC)阻害剤が与えられる。
R1は、ヘテロアリール、-カルボシクリル-ヘテロアリール、-C2-6アルケニルヘテロアリール、-C1-6アルキルヘテロアリール、又は(CH2)aCR5R6(CH2)bヘテロアリールを表し、ここで、a及びbは独立して、0〜5の整数を表し、但し、a+b=0〜5であり、かつR5及びR6が、それらの結合する炭素と共にC3-C5シクロアルキル基を形成するアルキレンであり;
ここで、上記のヘテロアリール基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
かつここで、上記のカルボシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R2は、H、C1-8アルキル、アリール、ヘテロアリール、カルボシクリル、ヘテロシクリル、-C1-4アルキルアリール、-C1-4アルキルヘテロアリール、-C1-4アルキルカルボシクリル、又は-C1-4アルキルヘテロシクリルを表し;
ここで、上記のアリール基及びヘテロアリール基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、C1-6アルコキシ-C1-6アルコキシ-、ニトロ、ハロゲン、ハロC1-6アルキル、ハロC1-6アルコキシ、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-N(C1-4アルキル)(C1-4アルキル)-N(C1-4アルキル)(C1-4アルキル)、-C1-4アルキル-N(C1-4アルキル)(C1-4アルキル)、-C1-4アルコキシ-N(C1-4アルキル)(C1-4アルキル)、-N(C3-8シクロアルキル)(C3-8シクロアルキル)、-N(-C1-6アルキル-C1-6アルコキシ)(-C1-6アルキル-C1-6アルコキシ)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
かつここで、上記のカルボシクリル基及びヘテロシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、-C(O)C1-6アルキル、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
或いはR2は、フェニルにより置換されたフェニル、単環式ヘテロアリール基により置換されたフェニル、フェノキシにより置換されたフェニル、ヘテロシクリルにより置換されたフェニル、ヘテロシクリルがフェニルにより置換されている該ヘテロシクリルにより置換されたフェニル、-O-C1-4アルキル-ヘテロシクリルにより置換されたフェニル、ベンジルオキシにより置換されたフェニル、カルボシクリルにより置換されたフェニル、カルボシクリルがヘテロシクリルにより置換されている該カルボシクリルにより置換されたフェニル、-O-カルボシクリルにより置換されたフェニル、フェニルにより置換されたヘテロシクリル、フェニルにより置換されたカルボシクリル、カルボシクリルに縮合したフェニル、ヘテロシクリルに縮合したフェニル、-C1-4アルキル(フェニルにより置換されたフェニル)、-C1-4アルキル(単環式ヘテロアリール基により置換されたフェニル)、-C1-4アルキル(単環式ヘテロシクリル基により置換されたフェニル)、-C1-4アルキル(-O-カルボシクリル基により置換されたフェニル)、-C1-4アルキル(ベンジルオキシにより置換されたフェニル)、-C1-4アルキル(任意に置換されたカルボシクリルに縮合した任意に置換されたフェニル)、又はC1-4アルキル(任意に置換されたヘテロシクリルに縮合した任意に置換されたフェニル)を表し;
ここで、上記のフェニル基、ベンジルオキシ基、及びヘテロアリール基のいずれも、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく、かつここで、上記のカルボシクリル基及びヘテロシクリル基のいずれも、メチル、フェニル、オキソ、ハロゲン、ヒドロキシル、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R3は、H、-C1-4アルキル、又はアリールを表し;
ここで、上記のアリールは、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
或いは、R2とR3は結合して、1個以上のC1-2アルキル基により任意に置換されたカルボシクリル環を形成し;
或いは、R2とR3は結合して、フェニルに縮合したカルボシクリル環を形成し、ここで、上記のカルボシクリル及び/又はフェニルは、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
或いは、R2とR3は結合して、単環式ヘテロアリールに縮合したカルボシクリル環を形成し、ここで、上記のカルボシクリル及び/又はヘテロアリールは、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
Xは、C=O、O、S、CR7R8、-O-CH2-、又は-CH2-CH2-を表し;
Yは、CHR9、C=O、又はC=Sを表し;
XがO又はSを表す場合、ZがCHR10を表さなければならないように、Zは、-N-R4、O、又はCHR10を表し;
或いは、X及びZは、その位置で縮合しかつ1個以上のハロゲン又はC1-2アルキル基により任意に置換されているフェニル環の2個の隣接炭素原子を表し;
R4は、H、-C1-8アルキル、-C(O)C1-6アルキル、又は-NH2を表し;
R7及びR8は独立して、H、-C1-4アルキル、又はアリールを表し;
ここで、上記のアリールは、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)により、任意に置換されてよく;
R9及びR10は独立して、H又はメチルを表し;
但し、-Y-Z-X-の部分は、-C(=O)-N(-R4)-C(=O)-又は-C(=S)-N(-R4)-C(=O)-以外の部分を表すことを条件とする)。
さらなる実施態様において、式(I)の化合物は、1-(1H-ベンゾ[d]イミダゾール-5-イル)-5-(4-プロポキシフェニル)イミダゾリジン-2-オンである:
式(I)aの化合物は、WO 2010/026212A1(Probiodrug AG)の実施例12に記載されている。
式(I)bの化合物は、WO 2010/026212A1(Probiodrug AG)の実施例14に記載されている。
R1は、-C1-6アルキル、-アリール、-C1-6アルキルアリール、-シクロアルキル、-C1-6アルキルシクロアルキル、-ヘテロアリール、-C1-6アルキルヘテロアリール、-ヘテロシクリル、-C1-6アルキルヘテロシクリル、フェニルにより置換された-シクロアルキル、フェノキシにより置換された-シクロアルキル、シクロアルキルにより置換された-フェニル、フェノキシにより置換された-フェニル、フェニルにより置換された-フェニル、フェニルにより置換されたヘテロシクリル、フェニルにより置換されたヘテロアリール、ヘテロシクリルにより置換されたフェニル、ヘテロアリールにより置換されたフェニル、-O-シクロアルキルにより置換されたフェニル、又は-シクロアルキル-ヘテロシクリルにより置換されたフェニルを表し;
かつここで、上記のアリール、シクロアルキル、ヘテロシクリル、ヘテロアリール、フェニル、又はフェノキシ基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されていてよく;
R2は、-C1-6アルキル、C1-6ハロアルキル、-アリール、-C1-6アルキルアリール、-シクロアルキル、-C1-6アルキルシクロアルキル、-ヘテロアリール、-C1-6アルキルヘテロアリール、-ヘテロシクリル、又は-C1-6アルキルヘテロシクリルを表し;
かつここで、上記のアリール、ヘテロアリール、又はヘテロシクリル基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されていてよく;
R3は、C1-6アルキル又はC1-6ハロアルキルを表し;
nは、0から3から選択される整数を表し;かつ
Raは、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)を表す)。
さらなる実施態様において、グルタミニルシクラーゼ(QC)阻害剤は、本明細書中で先に定義された式(I)又は式(II)の化合物である。
さらなる実施態様において、式(II)の化合物は、1-(1H-ベンゾ[d]イミダゾール-6-イル)-5-(2,3-ジフルオロフェニル)-3-メトキシ-4-メチル-1H-ピロール-2(5H)-オンである:
さらなる実施態様において、式(II)の化合物は、(R)-1-(1H-ベンゾ[d]イミダゾール-6-イル)-5-(2,3-ジフルオロフェニル)-3-メトキシ-4-メチル-1H-ピロール-2(5H)-オンである:
R1は、-C3-8-カルボシクリル-ヘテロアリール、-C2-6アルケニルヘテロアリール、-C1-6アルキルヘテロアリール、又は(CH2)aCR5R6(CH2)bヘテロアリール(式中、a及びbは独立して、0〜5の整数を表し、但し、a+b=0〜5であり、かつR5及びR6が、それらの結合する炭素と共にC3-C5シクロアルキル基を形成するアルキレンである)、又は二環式ヘテロアリール基を表し;
ここで、上記のヘテロアリール基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
かつここで、上記のカルボシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R2は、C1-8アルキル、アリール、ヘテロアリール、カルボシクリル、ヘテロシクリル、-C1-4アルキルアリール、-C1-4アルキルヘテロアリール、-C1-4アルキルカルボシクリル、又は-C1-4アルキルヘテロシクリルを表し;
ここで、上記のアリール基及びヘテロアリール基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
かつここで、上記のカルボシクリル基及びヘテロシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
或いはR2は、フェニルにより置換されたフェニル、単環式ヘテロアリール基により置換されたフェニル、ベンジルオキシにより置換されたフェニル、カルボシクリルに縮合したフェニル、ヘテロシクリルに縮合したフェニル、-C1-4アルキル(フェニルにより置換されたフェニル)、-C1-4アルキル(単環式ヘテロアリール基により置換されたフェニル)、-C1-4アルキル(ベンジルオキシにより置換されたフェニル)、-C1-4アルキル(任意に置換されたカルボシクリルに縮合した任意に置換されたフェニル)、又は-C1-4アルキル(任意に置換されたヘテロシクリルに縮合した任意に置換されたフェニル)を表し;
ここで、上記のフェニル基、ベンジルオキシ基、及びヘテロアリール基のいずれも、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく、かつここで、上記のカルボシクリル基及びヘテロシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R3は、H、-C1-4アルキル、又はアリールを表し;
ここで、上記のアリールは、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
或いは、R2とR3は結合して、1個以上のC1-2アルキル基により任意に置換されたカルボシクリル環を形成し;
或いは、R2とR3は結合して、フェニルに縮合したカルボシクリル環を形成し、ここで、上記のカルボシクリル及び/又はフェニルは、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
或いは、R2とR3は結合して、単環式ヘテロアリールに縮合したカルボシクリル環を形成し、ここで、上記のカルボシクリル及び/又はヘテロアリールは、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R4は、H、-C1-8アルキル、-C(O)C1-6アルキル、又は-NH2を表し;
Xは、O又はSを表し;かつ
Yは、O又はSを表す)。
一実施態様において、放射能標識グルタミニルシクラーゼ(QC)阻害剤は、式(IV)の化合物である:
例えば、式(IV)の化合物は、スキームAに示される方法に従って製造することができる:
本発明のさらなる態様によると、全ての互変異性体及び立体異性体を含む本明細書に定義される放射能標識化合物、又はその医薬として許容し得る塩、溶媒和物、若しくは多形体を、1種以上の医薬として許容し得る賦形剤と組み合わせて含む医薬組成物が提供される。
遊離の化合物とそれらの塩又は溶媒和物の形態の化合物との間の密接な関係を考慮すると、ある化合物がこの文脈で言及される場合、対応する塩、溶媒和物、又は多形体も、そのようなものがその状況下で可能又は適切であるという条件で意図される。
グルタミニルシクラーゼ(QC)阻害剤の塩及び溶媒和物並びに医薬における使用に好適なその生理機能のある誘導体は、対イオン又は会合する溶媒が医薬として許容し得るものである。しかし、医薬として許容し得るものでない対イオン又は会合する溶媒を有する塩又は溶媒和物も、例えば、他の化合物並びにそれらの医薬として許容し得る塩及び溶媒和物の製造における中間体として使用するために、本発明の範囲内にある。
さらに、化合物の結晶形態のいくつかは多形体として存在することがあり、それ自他本発明に含まれるものとする。さらに、化合物のいくつかは、水(すなわち水和物)と、又は通常の有機溶媒と溶媒和物を形成することがあり、そのような溶媒和物も本発明の範囲内に包含されるものとする。塩を含む化合物は、それらの水和物の形態で得ることもでき、又は結晶化に使用された他の溶媒を含むこともある。
例えば、懸濁剤、エリキシル剤、及び液剤などの液体経口調合物のために、好適な担体及び添加剤は、好都合には、水、グリコール、油類、アルコール、着香剤、防腐剤、着色剤などを含み得る。例えば、散剤、カプセル剤、ゲルキャップ剤、及び錠剤などの固体経口調合物のために、好適な担体及び添加剤は、デンプン、糖類、希釈剤、顆粒化剤、潤滑剤、結合剤、崩壊剤などを含む。
崩壊剤には、デンプン、メチルセルロース、寒天、ベントナイト、キサンタンガムなどがあるが、これらに限定されない。
好適な非限定的な神経疾患の例には、軽度認識障害、アルツハイマー病、家族性英国型認知症、家族性デンマーク型認知症、ダウン症候群における神経変性、及びハンチントン病がある。特定の一実施態様において、該神経疾患はアルツハイマー病である。
一実施態様において、本発明の阻害剤又は組成物は、アミロイドペプチドの検出に使用される。
一実施態様において、本発明の阻害剤又は組成物は、神経原線維濃縮体のタウタンパク質の検出に使用される。
一実施態様において、神経疾患は、本明細書に定義される阻害剤の老人斑に対する親和性を測定することにより検出される。
一実施態様において、神経疾患は、本明細書に定義される阻害剤のタウ凝集物に対する親和性を測定することにより検出される。
一実施態様において、該検出は、ガンマ線イメージング、磁気共鳴イメージング、磁気共鳴分光法、又は蛍光分光法を利用して実施される。
([ベンゾイミダゾール-2-14C]式(I)bの化合物((I)cの化合物)の製造)
(中間体1)
([ベンゾイミダゾール-2-11C]式(I)bの化合物((I)dの化合物)の製造)
室温で1.5時間後の最終トレーサー溶液の安定性:>98%(n=6)
(1-(1H-ベンゾイミダゾール-5-イル)-5-(4-プロポキシフェニル-[13C6]-イミダゾリジン-2-オン(式(I)eの化合物)の製造)
(中間体1:プロポキシベンゼン-[13C6])
(1-(1H-ベンゾ[d]イミダゾール-5-イル)-5-(4-ヒドロキシフェニル-[13C6]-イミダゾリジン-2-オン(式(I)fの化合物)の製造)
([ベンゾイミダゾール-2-14C]式(II)a及び(II)bの化合物(式(II)c及び(II)dの化合物)の製造)
(中間体1)
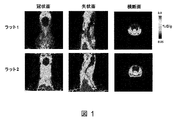
(ラットにおける小動物PETパイロット試験)
2匹の雌のSprague-Dawleyラットを化合物(I)dにより処理した。
ラット1:500μl 0.9% NaCl/EtOH(9/1、v/v)に溶解させた109.5MBqの化合物(I)dを、尾の静脈に静脈注射した。標識化合物(I)dの比放射能は23.7GBq/μmolであった。ラット1に投与した化合物(I)dの最終投与量は0.009mg/kgであった。
ラット2:29.5MBqの化合物(I)dに加えて0.57mgの未標識形態の化合物(I)dを尾の静脈に静脈注射した。ラット2に投与した化合物(I)dの最終投与量は3.8mg/kgであった。
ラット1及び2の頭部の60分動的PETスキャンを実施した。PETスキャンの終わりに、血漿試料を眼窩後領域から採取した。PET累積画像を図1に示す。
Claims (36)
- イメージング剤として使用するための放射能標識グルタミニルシクラーゼ(QC)阻害剤。
- 全ての互変異性体及び立体異性体を含む式(I)の化合物、若しくはその医薬として許容し得る塩、溶媒和物、若しくは多形体:
R1は、ヘテロアリール、-カルボシクリル-ヘテロアリール、-C2-6アルケニルヘテロアリール、-C1-6アルキルヘテロアリール、又は(CH2)aCR5R6(CH2)bヘテロアリールを表し、ここで、a及びbは独立して、0〜5の整数を表し、但し、a+b=0〜5であり、かつR5及びR6が、それらの結合する炭素と共にC3-C5シクロアルキル基を形成するアルキレンであり;
ここで、上記のヘテロアリール基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
かつここで、上記のカルボシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R2は、H、C1-8アルキル、アリール、ヘテロアリール、カルボシクリル、ヘテロシクリル、-C1-4アルキルアリール、-C1-4アルキルヘテロアリール、-C1-4アルキルカルボシクリル、又は-C1-4アルキルヘテロシクリルを表し;
ここで、上記のアリール基及びヘテロアリール基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、C1-6アルコキシ-C1-6アルコキシ-、ニトロ、ハロゲン、ハロC1-6アルキル、ハロC1-6アルコキシ、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-N(C1-4アルキル)(C1-4アルキル)-N(C1-4アルキル)(C1-4アルキル)、-C1-4アルキル-N(C1-4アルキル)(C1-4アルキル)、-C1-4アルコキシ-N(C1-4アルキル)(C1-4アルキル)、-N(C3-8シクロアルキル)(C3-8シクロアルキル)、-N(-C1-6アルキル-C1-6アルコキシ)(-C1-6アルキル-C1-6アルコキシ)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
かつここで、上記のカルボシクリル基及びヘテロシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、-C(O)C1-6アルキル、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
或いはR2は、フェニルにより置換されたフェニル、単環式ヘテロアリール基により置換されたフェニル、フェノキシにより置換されたフェニル、ヘテロシクリルにより置換されたフェニル、ヘテロシクリルがフェニルにより置換されている該ヘテロシクリルにより置換されたフェニル、-O-C1-4アルキル-ヘテロシクリルにより置換されたフェニル、ベンジルオキシにより置換されたフェニル、カルボシクリルにより置換されたフェニル、カルボシクリルがヘテロシクリルにより置換されている該カルボシクリルにより置換されたフェニル、-O-カルボシクリルにより置換されたフェニル、フェニルにより置換されたヘテロシクリル、フェニルにより置換されたカルボシクリル、カルボシクリルに縮合したフェニル、ヘテロシクリルに縮合したフェニル、-C1-4アルキル(フェニルにより置換されたフェニル)、-C1-4アルキル(単環式ヘテロアリール基により置換されたフェニル)、-C1-4アルキル(単環式ヘテロシクリル基により置換されたフェニル)、-C1-4アルキル(-O-カルボシクリル基により置換されたフェニル)、-C1-4アルキル(ベンジルオキシにより置換されたフェニル)、-C1-4アルキル(任意に置換されたカルボシクリルに縮合した任意に置換されたフェニル)、又はC1-4アルキル(任意に置換されたヘテロシクリルに縮合した任意に置換されたフェニル)を表し;
ここで、上記のフェニル基、ベンジルオキシ基、及びヘテロアリール基のいずれも、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく、かつここで、上記のカルボシクリル基及びヘテロシクリル基のいずれも、メチル、フェニル、オキソ、ハロゲン、ヒドロキシル、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R3は、H、-C1-4アルキル、又はアリールを表し;
ここで、上記のアリールは、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
或いは、R2とR3は結合して、1個以上のC1-2アルキル基により任意に置換されたカルボシクリル環を形成し;
或いは、R2とR3は結合して、フェニルに縮合したカルボシクリル環を形成し、ここで、上記のカルボシクリル及び/又はフェニルは、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
或いは、R2とR3は結合して、単環式ヘテロアリールに縮合したカルボシクリル環を形成し、ここで、上記のカルボシクリル及び/又はヘテロアリールは、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
Xは、C=O、O、S、CR7R8、-O-CH2-、又は-CH2-CH2-を表し;
Yは、CHR9、C=O、又はC=Sを表し;
XがO又はSを表す場合、ZがCHR10を表さなければならないように、Zは、-N-R4、O、又はCHR10を表し;
或いは、X及びZは、その位置で縮合し、かつ1個以上のハロゲン又はC1-2アルキル基により任意に置換されているフェニル環の2個の隣接炭素原子を表し;
R4は、H、-C1-8アルキル、-C(O)C1-6アルキル、又は-NH2を表し;
R7及びR8は独立して、H、-C1-4アルキル、又はアリールを表し;
ここで、上記のアリールは、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)により、任意に置換されてよく;
R9及びR10は独立して、H又はメチルを表し;
但し、-Y-Z-X-の部分は、-C(=O)-N(-R4)-C(=O)-又は-C(=S)-N(-R4)-C(=O)-以外の部分を表すことを条件とする)、
又は、全ての互変異性体及び立体異性体を含む式(II)の化合物、若しくはその医薬として許容し得る塩、溶媒和物、若しくは多形体:
R1は、-C1-6アルキル、-アリール、-C1-6アルキルアリール、-シクロアルキル、-C1-6アルキルシクロアルキル、-ヘテロアリール、-C1-6アルキルヘテロアリール、-ヘテロシクリル、-C1-6アルキルヘテロシクリル、フェニルにより置換された-シクロアルキル、フェノキシにより置換された-シクロアルキル、シクロアルキルにより置換された-フェニル、フェノキシにより置換された-フェニル、フェニルにより置換された-フェニル、フェニルにより置換されたヘテロシクリル、フェニルにより置換されたヘテロアリール、ヘテロシクリルにより置換されたフェニル、ヘテロアリールにより置換されたフェニル、-O-シクロアルキルにより置換されたフェニル、又は-シクロアルキル-ヘテロシクリルにより置換されたフェニルを表し;
かつここで、上記のアリール、シクロアルキル、ヘテロシクリル、ヘテロアリール、フェニル、又はフェノキシ基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されていてよく;
R2は、-C1-6アルキル、C1-6ハロアルキル、-アリール、-C1-6アルキルアリール、-シクロアルキル、-C1-6アルキルシクロアルキル、-ヘテロアリール、-C1-6アルキルヘテロアリール、-ヘテロシクリル、又は-C1-6アルキルヘテロシクリルを表し;
かつここで、上記のアリール、ヘテロアリール、又はヘテロシクリル基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されていてよく;
R3は、C1-6アルキル又はC1-6ハロアルキルを表し;
nは、0から3から選択される整数を表し;かつ
Raは、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)を表す)
である、請求項1記載の阻害剤。 - 全ての互変異性体及び立体異性体を含む式(III)の化合物、又はその医薬として許容し得る塩、溶媒和物、若しくは多形体である、請求項1記載の阻害剤:
R1は、-C3-8-カルボシクリル-ヘテロアリール、-C2-6アルケニルヘテロアリール、-C1-6アルキルヘテロアリール、又は(CH2)aCR5R6(CH2)bヘテロアリール(式中、a及びbは独立して、0〜5の整数を表し、但し、a+b=0〜5であり、かつR5及びR6が、それらの結合する炭素と共にC3-C5シクロアルキル基を形成するアルキレンである)、又は二環式ヘテロアリール基を表し;
ここで、上記のヘテロアリール基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
かつここで、上記のカルボシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R2は、C1-8アルキル、アリール、ヘテロアリール、カルボシクリル、ヘテロシクリル、-C1-4アルキルアリール、-C1-4アルキルヘテロアリール、-C1-4アルキルカルボシクリル、又は-C1-4アルキルヘテロシクリルを表し;
ここで、上記のアリール基及びヘテロアリール基のいずれも、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
かつここで、上記のカルボシクリル基及びヘテロシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
或いはR2は、フェニルにより置換されたフェニル、単環式ヘテロアリール基により置換されたフェニル、ベンジルオキシにより置換されたフェニル、カルボシクリルに縮合したフェニル、ヘテロシクリルに縮合したフェニル、-C1-4アルキル(フェニルにより置換されたフェニル)、-C1-4アルキル(単環式ヘテロアリール基により置換されたフェニル)、-C1-4アルキル(ベンジルオキシにより置換されたフェニル)、-C1-4アルキル(任意に置換されたカルボシクリルに縮合した任意に置換されたフェニル)、又は-C1-4アルキル(任意に置換されたヘテロシクリルに縮合した任意に置換されたフェニル)を表し;
ここで、上記のフェニル基、ベンジルオキシ基、及びヘテロアリール基のいずれも、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく、かつここで、上記のカルボシクリル基及びヘテロシクリル基のいずれも、C1-4アルキル、オキソ、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R3は、H、-C1-4アルキル、又はアリールを表し;
ここで、上記のアリールは、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、-C1-6チオアルキル、-SOC1-4アルキル、-SO2C1-4アルキル、C1-6アルコキシ-、-O-C3-8シクロアルキル、C3-8シクロアルキル、-SO2C3-8シクロアルキル、-SOC3-6シクロアルキル、C3-6アルケニルオキシ-、C3-6アルキニルオキシ-、-C(O)C1-6アルキル、-C(O)OC1-6アルキル、C1-6アルコキシ-C1-6アルキル-、ニトロ、ハロゲン、シアノ、ヒドロキシル、-C(O)OH、-NH2、-NHC1-4アルキル、-N(C1-4アルキル)(C1-4アルキル)、-C(O)N(C1-4アルキル)(C1-4アルキル)、-C(O)NH2、-C(O)NH(C1-4アルキル)、及び-C(O)NH(C3-10シクロアルキル)から選択される1個以上の基により任意に置換されてもよく;
或いは、R2とR3は結合して、1個以上のC1-2アルキル基により任意に置換されたカルボシクリル環を形成し;
或いは、R2とR3は結合して、フェニルに縮合したカルボシクリル環を形成し、ここで、上記のカルボシクリル及び/又はフェニルは、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
或いは、R2とR3は結合して、単環式ヘテロアリールに縮合したカルボシクリル環を形成し、ここで、上記のカルボシクリル及び/又はヘテロアリールは、C1-4アルキル、ハロゲン、及びC1-4アルコキシから選択される1個以上の基により任意に置換されてもよく;
R4は、H、-C1-8アルキル、-C(O)C1-6アルキル、又は-NH2を表し;
Xは、O又はSを表し;かつ
Yは、O又はSを表す)。 - 単一の放射能標識を含む、請求項1〜5のいずれか一項記載の阻害剤。
- 前記放射能標識が、2H(Dすなわち重水素)、3H(Tすなわちトリチウム)、11C、13C、14C、13N、15N、15O、17O、18O、18F、35S、36Cl、82Br、75Br、76Br、77Br、123I、124I、125I、及び131Iからなる群から選択される、請求項1〜6のいずれか一項記載の阻害剤。
- 前記放射能標識が、11C、13C、18F、19F、120I、123I、131I、75Br、及び76Brからなる群から選択される、請求項1〜6のいずれか一項記載の組成物。
- 前記放射能標識が11Cである、請求項8記載の阻害剤。
- 前記放射能標識が14Cである、請求項7記載の阻害剤。
- 前記放射能標識が13Cである、請求項7記載の阻害剤。
- 神経疾患の検出におけるイメージング剤として使用される、請求項1〜19のいずれか一項記載の阻害剤。
- 全ての互変異性体及び立体異性体を含む、請求項1〜19のいずれか一項記載の放射能標識化合物又はその医薬として許容し得る塩、溶媒和物、若しくは多形体を、1種以上の医薬として許容し得る賦形剤と組み合わせて含む医薬組成物。
- 神経疾患の検出におけるイメージング剤として使用するための、請求項21記載の医薬組成物。
- 前記神経疾患が、アルツハイマー病などの、軽度認識障害、アルツハイマー病、家族性英国型認知症、家族性デンマーク型認知症、ダウン症候群における神経変性、及びハンチントン病である、請求項20又は請求項22に記載の阻害剤又は組成物。
- アミロイドペプチドの検出において使用するための、請求項20〜23のいずれか一項記載の阻害剤又は組成物。
- 神経原線維濃縮体のタウタンパク質の検出において使用するための、請求項20〜24のいずれか一項記載の阻害剤又は組成物。
- 脳組織中の老人斑及び/又は神経原線維濃縮体のイメージング及び検出の方法であって、神経疾患の検出のために、請求項1〜19のいずれか一項記載の阻害剤により該組織を処理することを含む、前記方法。
- 前記神経疾患が、請求項1〜19のいずれか一項記載の阻害剤の老人斑に対する親和性を測定することにより検出される、請求項26記載の方法。
- 前記神経疾患が、請求項1〜19のいずれか一項記載の阻害剤のタウ凝集物に対する親和性を測定することにより検出される、請求項26記載の方法。
- 脳組織中のアミロイド沈着物のエクスビボ又はインビトロ検出の方法であって、アミロイド沈着物の検出のために、請求項1〜19のいずれか一項記載の阻害剤により該組織を処理することを含む、前記方法。
- 患者のアミロイド沈着物のインビボ検出の方法であって、請求項1〜19のいずれか一項記載の阻害剤の有効量を該患者に投与すること及び該化合物の該患者へのアミロイド沈着物に対する結合レベルを検出することを含む、前記方法。
- 脳組織中のタウタンパク質のエクスビボ又はインビトロ検出の方法であって、神経原線維濃縮体の検出のために、請求項1〜19のいずれか一項記載の阻害剤により該組織を処理することを含む、前記方法。
- 患者の神経原線維濃縮体のインビボ検出の方法であって、請求項1〜19のいずれか一項記載の阻害剤の有効量を該患者に投与すること及び該化合物のタウタンパク質への結合レベルを検出することを含む、前記方法。
- 前記検出が、ガンマ線イメージング、磁気共鳴イメージング、磁気共鳴分光法、又は蛍光分光法を利用して実施される、請求項26〜32のいずれか一項記載の方法。
- ガンマ線イメージングによる前記検出が、PET又はSPECTである、請求項33記載の方法。
- 神経疾患を診断するためのキットであって、請求項21記載の医薬組成物及び請求項26〜34のいずれか一項記載の方法に従って該キットを使用するための説明書を含む、前記キット。
- 前記神経疾患が、アルツハイマー病などの、軽度認識障害、アルツハイマー病、家族性英国型認知症、家族性デンマーク型認知症、ダウン症候群における神経変性、及びハンチントン病である、請求項35記載のキット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161490654P | 2011-05-27 | 2011-05-27 | |
| US61/490,654 | 2011-05-27 | ||
| PCT/EP2012/059649 WO2012163773A1 (en) | 2011-05-27 | 2012-05-24 | Radiolabelled glutaminyl cyclase inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014515364A true JP2014515364A (ja) | 2014-06-30 |
| JP2014515364A5 JP2014515364A5 (ja) | 2015-06-25 |
Family
ID=46149465
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014511862A Pending JP2014515364A (ja) | 2011-05-27 | 2012-05-24 | 放射能標識グルタミニルシクラーゼ阻害剤 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US8945510B2 (ja) |
| EP (1) | EP2714098A1 (ja) |
| JP (1) | JP2014515364A (ja) |
| KR (1) | KR20140028076A (ja) |
| CN (1) | CN103561776B (ja) |
| AU (1) | AU2012264951A1 (ja) |
| BR (1) | BR112013030341A2 (ja) |
| CA (1) | CA2835014A1 (ja) |
| EA (1) | EA028533B1 (ja) |
| IL (1) | IL229187A (ja) |
| MX (1) | MX2013013946A (ja) |
| SG (2) | SG10201604304RA (ja) |
| WO (1) | WO2012163773A1 (ja) |
| ZA (1) | ZA201308329B (ja) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EA029451B1 (ru) | 2013-03-15 | 2018-03-30 | Пробиодруг Аг | Новые ингибиторы |
| CN104230778B (zh) * | 2014-07-14 | 2017-01-04 | 大连大学 | β-烃氧酰基-γ-烃基-N-烃基-γ-丁内酰胺的合成方法 |
| MY194204A (en) | 2014-08-04 | 2022-11-21 | Nuevolution As | Optionally fused heterocyclyl-substituted derivatives of pyrimidine useful for the treatment of inflammatory, metabolic, oncologic and autoimmune diseases |
| US10513515B2 (en) | 2017-08-25 | 2019-12-24 | Biotheryx, Inc. | Ether compounds and uses thereof |
| EP3830093A1 (en) | 2018-07-27 | 2021-06-09 | Biotheryx, Inc. | Bifunctional compounds as cdk modulators |
| KR102230832B1 (ko) * | 2019-06-17 | 2021-03-24 | (주) 메디프론디비티 | N-치환된 티오우레아 또는 우레아 유도체 및 이를 유효성분으로 함유하는 글루타미닐 사이클레이즈 활성 관련 질환의 예방 또는 치료용 약학적 조성물 |
| MX2022007265A (es) | 2019-12-20 | 2022-09-09 | Nuevolution As | Compuestos activos frente a receptores nucleares. |
| EP4126875A1 (en) | 2020-03-31 | 2023-02-08 | Nuevolution A/S | Compounds active towards nuclear receptors |
| MX2022012260A (es) | 2020-03-31 | 2022-11-30 | Nuevolution As | Compuestos activos frente a receptores nucleares. |
| EP4143329A2 (en) | 2020-04-28 | 2023-03-08 | Anwita Biosciences, Inc. | Interleukin-2 polypeptides and fusion proteins thereof, and their pharmaceutical compositions and therapeutic applications |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010012828A2 (en) * | 2008-07-31 | 2010-02-04 | Probiodrug Ag | Glutaminyl cyclase as a diagnostic / prognostic indicator for neurodegenerative diseases |
| WO2010026212A1 (en) * | 2008-09-04 | 2010-03-11 | Probiodrug Ag | Novel inhibitors |
| JP2010509284A (ja) * | 2006-11-09 | 2010-03-25 | プロビオドルグ エージー | 潰瘍、癌及び他の疾患の治療のためのグルタミニルシクラーゼの阻害薬としての3−ヒドロキシ−1,5−ジヒドロ−ピロール−2−オン誘導体 |
| WO2011029920A1 (en) * | 2009-09-11 | 2011-03-17 | Probiodrug Ag | Heterocylcic derivatives as inhibitors of glutaminyl cyclase |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL302387A (ja) | 1963-01-09 | |||
| US5304367A (en) * | 1990-11-16 | 1994-04-19 | New York University | In vivo brain imaging agent and method for diagnosis of psychiatric disorders |
| US7732162B2 (en) * | 2003-05-05 | 2010-06-08 | Probiodrug Ag | Inhibitors of glutaminyl cyclase for treating neurodegenerative diseases |
| BRPI0507485A (pt) * | 2004-02-05 | 2007-07-10 | Probiodrug Ag | inibidores novos de glutaminil ciclase |
| EP2808020A1 (en) | 2006-04-21 | 2014-12-03 | The Government Of The United States, As Represented by The Secretary Of Health And Human Services | Beta-Amyloid Pet Imaging Agents |
| WO2010111303A2 (en) | 2009-03-23 | 2010-09-30 | Siemens Medical Solutions Usa, Inc. | Imaging agents for detecting neurological disorders |
| CN102791704B (zh) | 2010-03-10 | 2015-11-25 | 前体生物药物股份公司 | 谷氨酰胺酰环化酶(qc, ec 2.3.2.5)的杂环抑制剂 |
-
2012
- 2012-05-24 SG SG10201604304RA patent/SG10201604304RA/en unknown
- 2012-05-24 CN CN201280025603.6A patent/CN103561776B/zh not_active Expired - Fee Related
- 2012-05-24 MX MX2013013946A patent/MX2013013946A/es unknown
- 2012-05-24 CA CA 2835014 patent/CA2835014A1/en not_active Abandoned
- 2012-05-24 SG SG2013081567A patent/SG194770A1/en unknown
- 2012-05-24 WO PCT/EP2012/059649 patent/WO2012163773A1/en active Application Filing
- 2012-05-24 EP EP12723476.3A patent/EP2714098A1/en not_active Withdrawn
- 2012-05-24 AU AU2012264951A patent/AU2012264951A1/en not_active Abandoned
- 2012-05-24 BR BR112013030341A patent/BR112013030341A2/pt not_active IP Right Cessation
- 2012-05-24 EA EA201301334A patent/EA028533B1/ru not_active IP Right Cessation
- 2012-05-24 JP JP2014511862A patent/JP2014515364A/ja active Pending
- 2012-05-24 US US13/479,826 patent/US8945510B2/en not_active Expired - Fee Related
- 2012-05-24 KR KR20137033449A patent/KR20140028076A/ko not_active Application Discontinuation
-
2013
- 2013-10-31 IL IL229187A patent/IL229187A/en not_active IP Right Cessation
- 2013-11-06 ZA ZA2013/08329A patent/ZA201308329B/en unknown
-
2014
- 2014-12-15 US US14/570,350 patent/US9610368B2/en not_active Expired - Fee Related
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010509284A (ja) * | 2006-11-09 | 2010-03-25 | プロビオドルグ エージー | 潰瘍、癌及び他の疾患の治療のためのグルタミニルシクラーゼの阻害薬としての3−ヒドロキシ−1,5−ジヒドロ−ピロール−2−オン誘導体 |
| WO2010012828A2 (en) * | 2008-07-31 | 2010-02-04 | Probiodrug Ag | Glutaminyl cyclase as a diagnostic / prognostic indicator for neurodegenerative diseases |
| WO2010026212A1 (en) * | 2008-09-04 | 2010-03-11 | Probiodrug Ag | Novel inhibitors |
| WO2011029920A1 (en) * | 2009-09-11 | 2011-03-17 | Probiodrug Ag | Heterocylcic derivatives as inhibitors of glutaminyl cyclase |
Also Published As
| Publication number | Publication date |
|---|---|
| ZA201308329B (en) | 2015-02-25 |
| AU2012264951A1 (en) | 2013-12-12 |
| US9610368B2 (en) | 2017-04-04 |
| US20120301398A1 (en) | 2012-11-29 |
| CN103561776A (zh) | 2014-02-05 |
| MX2013013946A (es) | 2014-01-31 |
| CN103561776B (zh) | 2016-08-31 |
| US20150104389A1 (en) | 2015-04-16 |
| KR20140028076A (ko) | 2014-03-07 |
| SG10201604304RA (en) | 2016-07-28 |
| NZ617581A (en) | 2016-03-31 |
| EP2714098A1 (en) | 2014-04-09 |
| IL229187A (en) | 2017-04-30 |
| SG194770A1 (en) | 2013-12-30 |
| EA201301334A1 (ru) | 2014-05-30 |
| EA028533B1 (ru) | 2017-11-30 |
| WO2012163773A1 (en) | 2012-12-06 |
| US8945510B2 (en) | 2015-02-03 |
| IL229187A0 (en) | 2013-12-31 |
| BR112013030341A2 (pt) | 2016-11-29 |
| CA2835014A1 (en) | 2012-12-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2014515364A (ja) | 放射能標識グルタミニルシクラーゼ阻害剤 | |
| AU2012304359B2 (en) | Compositions, methods, and systems for the synthesis and use of imaging agents | |
| RU2376282C2 (ru) | Стереоселективный синтез аминокислот для получения изображения опухоли | |
| EP3143011B1 (en) | Deuterated heterocyclic compounds and their use as imaging agents | |
| US20120263646A1 (en) | Imaging agents and their use for the diagnostic in vivo of neurodegenerative diseases, notably alzheimer's disease and derivative diseases | |
| JP2011529086A (ja) | Ad病変を同定するために有用な造影剤 | |
| US20190282714A1 (en) | Radioligands for imaging the ido1 enzyme | |
| US20110217234A1 (en) | Imaging ligands | |
| SagsttaS'Transversa | Heiser et al.(43) Pub. Date: Nov. 29, 2012 | |
| US20220118117A1 (en) | Modulators of metabotropic glutamate receptor 4 | |
| US20210322582A1 (en) | Radioactive imidazothiadiazole derivative compound | |
| KR20230022470A (ko) | 방사성 동위원소가 표지된 바이오틴 유도체 화합물 및 이를 유효성분으로 포함하는 암 진단용 조성물 | |
| NZ617581B2 (en) | Radiolabelled glutaminyl cyclase inhibitors | |
| CN116217505A (zh) | 用于诊断或治疗表达前列腺特异性膜抗原癌症的新型标记靶向剂 | |
| JP2021102593A (ja) | タウを画像化する新規化合物 | |
| JP2020023455A (ja) | モノアミンオキシダーゼbイメージングプローブ | |
| MICAD Research Team | [123I/125I] 6-Iodo-2-(4´-dimethylamino)-phenyl-imidazo [1, 2-a] pyridine |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150427 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150427 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160223 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160520 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20160920 |