JP2014124097A - 核酸分析用カートリッジ及び核酸分析装置 - Google Patents
核酸分析用カートリッジ及び核酸分析装置 Download PDFInfo
- Publication number
- JP2014124097A JP2014124097A JP2012280770A JP2012280770A JP2014124097A JP 2014124097 A JP2014124097 A JP 2014124097A JP 2012280770 A JP2012280770 A JP 2012280770A JP 2012280770 A JP2012280770 A JP 2012280770A JP 2014124097 A JP2014124097 A JP 2014124097A
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- cartridge
- container
- flow path
- extraction container
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 108020004707 nucleic acids Proteins 0.000 title claims abstract description 258
- 102000039446 nucleic acids Human genes 0.000 title claims abstract description 258
- 150000007523 nucleic acids Chemical class 0.000 title claims abstract description 258
- 238000004458 analytical method Methods 0.000 title claims abstract description 91
- 238000011084 recovery Methods 0.000 claims abstract description 21
- 238000000605 extraction Methods 0.000 claims description 83
- 239000000523 sample Substances 0.000 claims description 59
- 239000012472 biological sample Substances 0.000 claims description 57
- 239000007788 liquid Substances 0.000 claims description 41
- 238000006243 chemical reaction Methods 0.000 claims description 30
- 238000003860 storage Methods 0.000 claims description 18
- 210000004209 hair Anatomy 0.000 claims description 7
- 239000010409 thin film Substances 0.000 claims 7
- 238000007599 discharging Methods 0.000 claims 1
- 238000004321 preservation Methods 0.000 abstract 1
- 239000007787 solid Substances 0.000 abstract 1
- 108020004414 DNA Proteins 0.000 description 51
- 210000004027 cell Anatomy 0.000 description 49
- 239000003153 chemical reaction reagent Substances 0.000 description 38
- 238000000034 method Methods 0.000 description 38
- 239000000243 solution Substances 0.000 description 35
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 32
- 210000004379 membrane Anatomy 0.000 description 24
- 239000012528 membrane Substances 0.000 description 24
- 230000007246 mechanism Effects 0.000 description 23
- 238000010586 diagram Methods 0.000 description 19
- 238000002156 mixing Methods 0.000 description 17
- 239000000463 material Substances 0.000 description 16
- 230000008569 process Effects 0.000 description 16
- 238000003752 polymerase chain reaction Methods 0.000 description 15
- 239000012634 fragment Substances 0.000 description 13
- 239000012298 atmosphere Substances 0.000 description 11
- 238000010438 heat treatment Methods 0.000 description 11
- 238000005259 measurement Methods 0.000 description 11
- 230000004544 DNA amplification Effects 0.000 description 10
- 238000001514 detection method Methods 0.000 description 10
- 238000001962 electrophoresis Methods 0.000 description 10
- 238000012856 packing Methods 0.000 description 10
- 108091092878 Microsatellite Proteins 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- -1 polypropylene Polymers 0.000 description 9
- 229920001971 elastomer Polymers 0.000 description 8
- 239000005060 rubber Substances 0.000 description 8
- 230000003321 amplification Effects 0.000 description 7
- 238000003199 nucleic acid amplification method Methods 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 238000009739 binding Methods 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- 230000027455 binding Effects 0.000 description 5
- 239000012530 fluid Substances 0.000 description 5
- 238000003780 insertion Methods 0.000 description 5
- 230000037431 insertion Effects 0.000 description 5
- 229910021645 metal ion Inorganic materials 0.000 description 5
- 238000007789 sealing Methods 0.000 description 5
- 239000011324 bead Substances 0.000 description 4
- 238000004925 denaturation Methods 0.000 description 4
- 230000036425 denaturation Effects 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 230000000087 stabilizing effect Effects 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 239000004094 surface-active agent Substances 0.000 description 4
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 3
- 238000005251 capillar electrophoresis Methods 0.000 description 3
- 230000006037 cell lysis Effects 0.000 description 3
- 239000002738 chelating agent Substances 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- 239000000428 dust Substances 0.000 description 3
- 239000010419 fine particle Substances 0.000 description 3
- 238000012252 genetic analysis Methods 0.000 description 3
- 230000005484 gravity Effects 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- 239000012488 sample solution Substances 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 230000003584 silencer Effects 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 238000003466 welding Methods 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- FSVCELGFZIQNCK-UHFFFAOYSA-N N,N-bis(2-hydroxyethyl)glycine Chemical compound OCCN(CCO)CC(O)=O FSVCELGFZIQNCK-UHFFFAOYSA-N 0.000 description 2
- 101710163270 Nuclease Proteins 0.000 description 2
- 229930182556 Polyacetal Natural products 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- 239000004743 Polypropylene Substances 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- XECAHXYUAAWDEL-UHFFFAOYSA-N acrylonitrile butadiene styrene Chemical compound C=CC=C.C=CC#N.C=CC1=CC=CC=C1 XECAHXYUAAWDEL-UHFFFAOYSA-N 0.000 description 2
- 229920000122 acrylonitrile butadiene styrene Polymers 0.000 description 2
- 239000004676 acrylonitrile butadiene styrene Substances 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000005520 cutting process Methods 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 229910010272 inorganic material Inorganic materials 0.000 description 2
- 239000011147 inorganic material Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 238000000465 moulding Methods 0.000 description 2
- 229920001707 polybutylene terephthalate Polymers 0.000 description 2
- 229920000515 polycarbonate Polymers 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- 229920000139 polyethylene terephthalate Polymers 0.000 description 2
- 239000005020 polyethylene terephthalate Substances 0.000 description 2
- 229920006324 polyoxymethylene Polymers 0.000 description 2
- 229920001955 polyphenylene ether Polymers 0.000 description 2
- 229920001155 polypropylene Polymers 0.000 description 2
- 229920002223 polystyrene Polymers 0.000 description 2
- 229920002689 polyvinyl acetate Polymers 0.000 description 2
- 239000011118 polyvinyl acetate Substances 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 229920001169 thermoplastic Polymers 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- FCKYPQBAHLOOJQ-NXEZZACHSA-N 2-[[(1r,2r)-2-[bis(carboxymethyl)amino]cyclohexyl]-(carboxymethyl)amino]acetic acid Chemical compound OC(=O)CN(CC(O)=O)[C@@H]1CCCC[C@H]1N(CC(O)=O)CC(O)=O FCKYPQBAHLOOJQ-NXEZZACHSA-N 0.000 description 1
- 125000000022 2-aminoethyl group Chemical group [H]C([*])([H])C([H])([H])N([H])[H] 0.000 description 1
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 1
- 229920000178 Acrylic resin Polymers 0.000 description 1
- 239000004925 Acrylic resin Substances 0.000 description 1
- 229920000089 Cyclic olefin copolymer Polymers 0.000 description 1
- FCKYPQBAHLOOJQ-UHFFFAOYSA-N Cyclohexane-1,2-diaminetetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)C1CCCCC1N(CC(O)=O)CC(O)=O FCKYPQBAHLOOJQ-UHFFFAOYSA-N 0.000 description 1
- 238000013382 DNA quantification Methods 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 1
- 229920000459 Nitrile rubber Polymers 0.000 description 1
- 108091093105 Nuclear DNA Proteins 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 235000004522 Pentaglottis sempervirens Nutrition 0.000 description 1
- 239000005062 Polybutadiene Substances 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 229920000297 Rayon Polymers 0.000 description 1
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 1
- 108091035286 Strbase Proteins 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 229920006311 Urethane elastomer Polymers 0.000 description 1
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 1
- 229920000800 acrylic rubber Polymers 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 238000005452 bending Methods 0.000 description 1
- 239000007998 bicine buffer Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 229920005549 butyl rubber Polymers 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 150000001925 cycloalkenes Chemical class 0.000 description 1
- 230000006837 decompression Effects 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- HQQADJVZYDDRJT-UHFFFAOYSA-N ethene;prop-1-ene Chemical group C=C.CC=C HQQADJVZYDDRJT-UHFFFAOYSA-N 0.000 description 1
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 1
- 238000012840 feeding operation Methods 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000010794 food waste Substances 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000004519 grease Substances 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000009434 installation Methods 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 229920003049 isoprene rubber Polymers 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 238000007403 mPCR Methods 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 239000007769 metal material Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 210000002200 mouth mucosa Anatomy 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 210000002850 nasal mucosa Anatomy 0.000 description 1
- 210000000633 nuclear envelope Anatomy 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 229920001084 poly(chloroprene) Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920002857 polybutadiene Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000005077 polysulfide Substances 0.000 description 1
- 229920001021 polysulfide Polymers 0.000 description 1
- 150000008117 polysulfides Polymers 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 239000002964 rayon Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000007790 scraping Methods 0.000 description 1
- 229910000077 silane Inorganic materials 0.000 description 1
- 229920002379 silicone rubber Polymers 0.000 description 1
- 239000004945 silicone rubber Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 230000003746 surface roughness Effects 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229920001187 thermosetting polymer Polymers 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 238000011282 treatment Methods 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
Images
Abstract
【解決手段】核酸分析用カートリッジにおいて、核酸抽出液を保存する抽出液保存容器と、核酸の抽出を行う核酸抽出容器と、鋳型となる核酸分子を供給するPCR容器とを具備し、抽出液保存容器と核酸抽出容器とは核酸抽出液を送液する第1の流路で接続され、核酸抽出容器とPCR容器とは核酸分子を送液する第2の流路で接続され、第1の流路の中心線と核酸抽出容器の底部に対して垂直方向の中心線、または第2の流路の中心線とPCR容器の底部に対して垂直方向の中心線の少なくとも一方がねじれ位置の関係になるように配置されていることを特徴とする。
【選択図】図3
Description
ここでは、本発明の理解を容易にするため、特定の実施形態について詳細な説明を行うが、本発明はここに記載した内容に限定されるものではない。また各実施例は適宜組み合せることが可能であり、当該組み合せ形態についても本明細書は開示している。
図1は核酸分析用カートリッジ1の全体概略を平面図で示す。図1に示す核酸分析用カートリッジ1はコントロールサンプルを含む合計8サンプルを同時に解析できる構成例である。
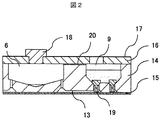
核酸分析用カートリッジ1は、試薬が封入されて内部に試薬を保持する試薬封入部屋(2,3)、試薬溶液を分岐するための分岐部屋4、試薬溶液を混合する混合部屋6、加熱される加熱部屋(7,10)とこれらの部屋を結ぶ流路13を持つ。ここで、試薬封入部屋としては、Master mix封入部屋2、Primer mix封入部屋3、電気泳動マーカ封入部屋8、ホルムアミド封入部屋9、サンプル溶解液封入部屋12がある。加熱部屋としては、DNA増幅を行うDNA増幅加熱部屋7、DNA変性加熱部屋10がある。
また、上記の試薬封入部屋、分岐部屋、混合部屋、及び加熱部屋以外の部屋として、測定サンプルを挿入する測定サンプル挿入部屋5とキャピラリが挿入されるキャピラリ挿入部屋11がある。なお、本図ではキャピラリの一端のみ図示しているが、キャピラリは図に対して奥方向に延在して設けられている。
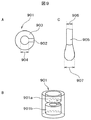
核酸分析用カートリッジ1は、核酸抽出容器301と抽出液保存容器302とPCR反応容器303とが弁機構付き流路304、305とで連結された構造を有しており、抽出液保存容器302には細胞などの生体試料から核酸を抽出する溶液である核酸抽出液306が封入されている。生体試料307を付着させたサンプル回収器具308を核酸抽出容器301に挿入した後にフタ309を閉め、弁付き流路304を通じて抽出液保存容器302から核酸抽出液306を核酸抽出容器301へ送り、サンプル回収器具308に付着した生体試料307から核酸を抽出する。抽出された核酸を含む核酸抽出溶液を弁付き流路305を通じてPCR反応容器303に輸送することで、PCR反応系に鋳型となる核酸分子を供給する。この際、解析対象とする生体試料307以外の核酸分子が、核酸抽出液に混入することを防ぐために、各容器301,302,303はフィルム310やフタ309によって外気から遮断された構造となっている。
核酸抽出液306の組成としては、少なくとも一種類ずつ以上の界面活性剤と2価金属イオンに対するキレーターを含むことが好ましい。界面活性剤によって細胞膜や核膜を破壊しDNAを溶液中に開放すると同時に、2価金属イオン依存性のヌクレアーゼによってDNAが分解される減少を防ぐためである。このような界面活性剤として、例えば、SDSやTween20、Triton X−100、NP−40などを挙げることが出来る。また2価金属イオンキレーターとしては、EDTA(Ethylenediamine−N, N, N’,N’−tetraacetic acid)、CyDTA(trans−1,2−Diaminocyclohexane−N, N, N’,N’−tetraacetic acid)、Bicine(N, N−Bis(2−hydroxyethyl)glycine)、EGTA(O, O’−Bis(2−aminoethyl)ethyleneglycol−N, N, N’,N’−tetraacetic acid)などが挙げられる。
すなわち、スワブの全周に新鮮な核酸抽出液を供給することで細胞溶解が均一かつ短時間で進行することを助け、また、抽出容器内全体を広く攪拌混合することが可能となるためである。
前述までの構造で核酸溶液601を均一化することが出来たが、溶液の中には細胞から核酸を抽出した後の残りである細胞残渣602が存在している。この細胞残渣はPCR反応を含む次工程以降にとって不要な不純物であり、反応の阻害や流路のつまりなどを発生させ得る要因のため除去することが好ましい。そのため核酸溶液601を次工程に送るための流路603は、核酸抽出容器401の底面よりも高い位置で核酸抽出容器401と交わる構造とした。具体的には流路603と核酸抽出容器401の交差する位置を底面から1mm以上高い位置に設置した。この構造により、次工程への細胞残渣の持ち込み量を最小限に抑えることが出来る。
このような中空の回収流路を形成するには、二枚以上の材質の貼り合せや、光造型、3Dプリンタなどが挙げられる。コストや量産性の観点からは、二種類の構造物の貼り合せが好ましい。
まず、起毛構造を持ったスワブにおいてその起毛部の長さを、回収対象となる細胞の直径と同程度の長さに抑えることで、回収細胞量のばらつきを抑えることに成功した構造について図7〜8を用いて説明する。
例えば、口腔粘膜細胞では、凡そ直径30〜40μm(ミクロン)の扁平な構造の中に直径7μm(ミクロン)の核を有している。しかし、このような細胞の回収に起毛構造701を持った通常のスワブ(例えば、COPAN社製 4N6 FLOQ SWABでは約0.9〜1mm程度)を用いると、図7に示すように細胞702はスワブ起毛構造701の外縁部に優先的に付着し、その後回収のために粘膜にこすりつけるたびに、スワブ軸703方向に細胞が付着する。このように細胞直径に対して十分に長い起毛701を用いることは、細胞の回収率や細胞回収量の面では有利に働くが、細胞回収量の安定化という面では、不利に作用する。付着可能な細胞の最大容量が大きく、拭う際の強さや回数などの回収プロトコルによって、何層の細胞が回収されるかが変わってしまうためである。
この二つの実施形態では、スワブに付着させた生体試料の内の一部だけを核酸抽出反応に供することで、生体試料の量としてのばらつきを抑えている。
スワブ全周に付着した細胞のうち一部だけを核酸回収容器に投入する構造について図9を用いて説明する。この構造では核酸抽出容器901の内壁面に切りかけ902を持った突起903を持つことを特徴とする。この突起によって狭められた通過部直径904をスワブ905の軸の直径906以上サンプル付着部の直径907未満とすることで、スワブ全周に付着していた細胞のうち大半を突起903で削りつつ切りかけ部分902を通過した生体試料を核酸抽出工程に供する物である。この構造により核酸抽出量のばらつきを押さえることが出来る。また通過部直径904を軸直径906の200%以下かつ切りかけ902の幅を軸直径以下とすることで、円柱状のスワブを核酸抽出容器901の中心に固定する作用を持つ、この場合図4における窪み402を省略することも出来る。
また、この方式では、市販のスワブを用いてサンプル投入量を制限するため、図8で説明した実施例のようにスワブを新規に作成する必要が無く、低コストでの実装が可能である。
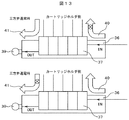
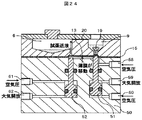
核酸分析装置は、カートリッジホルダ26、送液・温調ユニット27、送液ポンプ28、電気泳動キャピラリ29、レーザユニット30、検出ユニット31、コントロール基板ユニット32からなる。
送液を行う前準備として、まずは、カートリッジホルダ26と空気圧制御システムを接続させる前に送液ポンプ28を駆動させる。三方弁37はノーマルクローズのため、送液ポンプ28と三方弁37間の圧力が高まる。その状態で圧力調整弁35にて適切な圧力に調整する。その後、各三方弁37を通電し、空気圧流路40を開放し、空気圧流路41を閉じる。すると、カートリッジホルダ26に接続される配管に空気が送られるため、その状態でスピードコントローラ38にてカートリッジホルダ26へ接続される各配管の流量を調整する。空気の圧力、流量の調整が終了してから、カートリッジホルダ26に空気圧制御システムを接続し、カートリッジホルダ26に核酸分析用カートリッジ1をセットする。
2…Master Mix封入部屋、
3…Primer Mix封入部屋、
4…分岐部屋、
5…測定サンプル封入部屋、
6…混合部屋、
7…DNA増幅加熱部屋、
8…電気泳動マーカ封入部屋、
9…ホルムアミド封入部屋、
10…DNA変性加熱部屋、
11…キャピラリ挿入部屋、
12…サンプル溶解液封入部屋、
13…流路、
14…カートリッジ本体、
15…メンブレン、
16…上蓋、
17…フィルム、
18…ゴム栓、
19…栓、
20…空気穴、
26…カートリッジホルダ、
27…送液・温調ユニット、
28…送液ポンプ、
29…電気泳動キャピラリ、
30…レーザユニット、
31…検出ユニット、
32…コントロール基板ユニット、
34…フィルタ、
35…空気圧調整弁、
36…三方弁マニホールド、
37…三方弁、
38…スピードコントローラ、
39…サイレンサ、
40…空気圧流路、
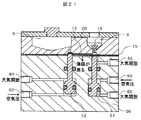
50…カートリッジホルダ本体、
51,52…ピン、
53,54,55,56…パッキン、
57…封止用突起、
58,59,60,61,62…空気圧ポート、
301,401,901…核酸抽出容器、
302,405…抽出液保存容器、
303…PCR反応容器、
304,305,404…弁機構付き流路、
306…核酸抽出液、
307…生体試料、
308…サンプル回収器具、
309…フタ、
310…フィルム、
402…窪み、
403,905,1001…スワブ、
406…流路の中心軸、
501…バッフル構造、
601…核酸溶液、
602…細胞残渣、
701…起毛構造、
702,801…細胞、
703…スワブの軸、
802…スワブ起毛部、
803…スワブ軸部分、
902…切りかけ、
903…突起、
904…通過部直径、
906…軸直径、
907…サンプル付着部直径、
908…スワブ挿し込み口、
909…核酸抽出容器、
1002…開口窓、
1003…キャップ構造。
Claims (16)
- 核酸抽出反応を行う機能を有する核酸分析用カートリッジにおいて、
生体試料から核酸を抽出する核酸抽出液を保存する抽出液保存容器と、前記核酸の抽出を行う核酸抽出容器と、PCR反応系に鋳型となる核酸分子を供給するPCR容器と、を具備し、
前記抽出液保存容器と前記核酸抽出容器とは前記核酸抽出液を送液する第1の流路で接続され、
前記核酸抽出容器と前記PCR容器とは鋳型となる核酸分子を送液する第2の流路で接続され、
前記第1の流路の中心線と前記核酸抽出容器の底部に対して垂直方向の中心線、あるいは前記第2の流路の中心線と前記PCR容器の底部に対して垂直方向の中心線の少なくとも一方が互いにねじれ位置の関係になるように配置されていることを特徴とする核酸分析用カートリッジ。 - 前記生体試料から核酸を回収する生体試料回収器具を前記核酸抽出容器の収納部に収納し、前記生体試料から核酸を回収することを特徴とする請求項1に記載の核酸分析用カートリッジ。
- 前記生体試料回収器具に円柱形状のスワブを用いる場合であって、前記核酸抽出容器は前記収納部底部の中心を含む領域が、該スワブの揺動を抑制する凹み形状を有することを特徴とする請求項2に記載の核酸分析用カートリッジ。
- 前記第1の流路の前記核酸抽出容器への接続は、前記第1の流路の中心線に沿う方向に引かれた前記核酸抽出容器の側壁における仮想の接線と、前記サンプル回収器具の外周部における仮想の接線との間に前記流路の中心線の延長線が通過するように接続配置されていることを特徴とする請求項1に記載の核酸分析用カートリッジ。
- 前記核酸抽出容器は、円柱形状であることを特徴とする請求項3に記載の核酸分析用カートリッジ。
- 前記第2の流路の下端は、前記核酸抽出容器の底面から縦方向に1mm以上高い位置に配設されていることを特徴とする請求項2に記載の核酸分析用カートリッジ。
- 前記スワブの側壁に配列された起毛を有する起毛構造を有し、
前記起毛の長さが、前記核酸の回収対象となる細胞の直径に対して0.5〜1.5倍の範囲にあることを特徴とする請求項3に記載の核酸分析用カートリッジ。 - 前記スワブの側壁に配列された起毛を有する起毛構造を有し、
前記起毛の長さが、前記核酸の回収対象となる細胞の直径の0.5倍以上で200μm以下であることを特徴とする請求項3に記載の核酸分析用カートリッジ。 - 前記核酸抽出容器の収納部は、前記スワブに付着した生体試料の一部を剥離させるための構造を有することを特徴とする請求項3に記載の核酸分析用カートリッジ。
- 前記核酸抽出容器の収納部は、前記スワブの一部を前記核酸抽出溶液に接触させるための開口窓を前記収納部の側壁に有することを特徴とする請求項3に記載の核酸分析用カートリッジ。
- 前記核酸抽出容器の収納部に、前記収納部と別構造体で構成され開口窓を有する構造物が挿入されることを特徴とする請求項2に記載の核酸分析用カートリッジ。
- 前記流路の一部が弾性体薄膜によって構成され、
前記弾性体薄膜への圧力を制御する空気圧制御装置上に載置され、
前記空気圧制御装置により前記弾性体薄膜への圧力を変動させることにより、前記弾性体薄膜を変形させて送液を行うことを特徴とする請求項1に記載の核酸分析用カートリッジ。 - 核酸抽出反応を行う機能を有する核酸分析用カートリッジと、
前記核酸分析用カートリッジを保持するカートリッジホルダと、
前記カートリッジホルダに接続された空気圧制御装置とを有し、
前記核酸分析用カートリッジは、
生体試料から核酸を抽出する核酸抽出液を保存する抽出液保存容器と、前記核酸の抽出を行う核酸抽出容器と、PCR反応系に鋳型となる核酸分子を供給するPCR容器と、を具備し、
前記抽出液保存容器と前記核酸抽出容器とは前記核酸抽出液を送通する第1の流路で接続され、
前記核酸抽出容器と前記PCR容器と鋳型となる核酸分子を送通する第2の流路で接続され、
前記第1の流路の中心線と前記核酸抽出容器の底部に対して垂直方向の中心線、あるいは前記第2の流路の中心線と前記PCR容器の底部に対して垂直方向の中心線の少なくとも一方が互いにねじれ位置の関係になるように配置され、
前記空気圧制御装置を用いて前記抽出液保存容器内と前記核酸抽出容器内と前記第1の流路内、あるいは前記核酸抽出容器内と前記PCR容器内と前記第2の流路内のそれぞれの空気の吸引・吐出をすることで、前記核酸抽出液、あるいは前記核酸分子を送液することを特徴とする核酸分析装置。 - 前記核酸分析用カートリッジを構成する前記第1および第2の流路の一部が弾性体薄膜を備え、
前記空気圧制御装置により前記弾性体薄膜への圧力を変動させることにより、前記弾性体薄膜を変形させて送液を行うことを特徴とする請求項13に記載の核酸分析装置。 - 前記核酸分析用カートリッジは、前記生体試料から核酸を回収する生体試料回収器具を前記核酸抽出容器の収納部に収納し、前記生体試料から核酸を回収することを特徴とする請求項13に記載の核酸分析装置。
- 前記生体試料回収器具に円柱形状のスワブを用いる場合であって、前記核酸抽出容器は前記収納部底部の中心を含む領域が、該スワブの揺動を抑制する凹み形状を有することを特徴とする請求項15に記載の核酸分析装置。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012280770A JP2014124097A (ja) | 2012-12-25 | 2012-12-25 | 核酸分析用カートリッジ及び核酸分析装置 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012280770A JP2014124097A (ja) | 2012-12-25 | 2012-12-25 | 核酸分析用カートリッジ及び核酸分析装置 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014124097A true JP2014124097A (ja) | 2014-07-07 |
| JP2014124097A5 JP2014124097A5 (ja) | 2015-11-12 |
Family
ID=51404158
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012280770A Pending JP2014124097A (ja) | 2012-12-25 | 2012-12-25 | 核酸分析用カートリッジ及び核酸分析装置 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2014124097A (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016049064A (ja) * | 2014-09-01 | 2016-04-11 | 国立研究開発法人産業技術総合研究所 | マイクロチップを用いたpcr装置 |
| KR20190031999A (ko) * | 2017-09-19 | 2019-03-27 | (주)로봇앤드디자인 | Dna 처리 장치 |
Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07504570A (ja) * | 1992-03-04 | 1995-05-25 | ザ リージェンツ オブ ザ ユニバーシティ オブ ミシガン | ヒトの幹細胞および/または造血細胞を維持,生育するための方法,組成物および装置 |
| JP2000346838A (ja) * | 1999-03-30 | 2000-12-15 | Kikkoman Corp | 検体検査用器具及び拭取検査用器具 |
| JP2005274471A (ja) * | 2004-03-26 | 2005-10-06 | Hitachi High-Technologies Corp | 分注装置及びそれを備えた自動分析装置 |
| JP2008518617A (ja) * | 2004-11-04 | 2008-06-05 | ウェルチ・アライン・インコーポレーテッド | 迅速診断アッセイ |
| JP2008542775A (ja) * | 2005-06-08 | 2008-11-27 | コパン イノヴェーション リミテッド | 生体試料の採取、収集および移送のための装置 |
| JP2010166859A (ja) * | 2009-01-23 | 2010-08-05 | Olympus Corp | 生体組織処理装置 |
| WO2011112746A2 (en) * | 2010-03-09 | 2011-09-15 | Netbio, Inc. | Unitary biochip providing sample-in to results-out processing and methods of manufacture |
| JP2011234666A (ja) * | 2010-05-10 | 2011-11-24 | Sanyo:Kk | 綿棒 |
| WO2012083572A1 (zh) * | 2010-12-24 | 2012-06-28 | 江苏世泰实验器材有限公司 | 定量生物采样植绒拭子及其制造方法 |
| JP2012517020A (ja) * | 2009-02-03 | 2012-07-26 | ネットバイオ・インコーポレーテッド | 核酸精製 |
-
2012
- 2012-12-25 JP JP2012280770A patent/JP2014124097A/ja active Pending
Patent Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07504570A (ja) * | 1992-03-04 | 1995-05-25 | ザ リージェンツ オブ ザ ユニバーシティ オブ ミシガン | ヒトの幹細胞および/または造血細胞を維持,生育するための方法,組成物および装置 |
| JP2000346838A (ja) * | 1999-03-30 | 2000-12-15 | Kikkoman Corp | 検体検査用器具及び拭取検査用器具 |
| JP2005274471A (ja) * | 2004-03-26 | 2005-10-06 | Hitachi High-Technologies Corp | 分注装置及びそれを備えた自動分析装置 |
| JP2008518617A (ja) * | 2004-11-04 | 2008-06-05 | ウェルチ・アライン・インコーポレーテッド | 迅速診断アッセイ |
| JP2008542775A (ja) * | 2005-06-08 | 2008-11-27 | コパン イノヴェーション リミテッド | 生体試料の採取、収集および移送のための装置 |
| JP2010166859A (ja) * | 2009-01-23 | 2010-08-05 | Olympus Corp | 生体組織処理装置 |
| JP2012517020A (ja) * | 2009-02-03 | 2012-07-26 | ネットバイオ・インコーポレーテッド | 核酸精製 |
| WO2011112746A2 (en) * | 2010-03-09 | 2011-09-15 | Netbio, Inc. | Unitary biochip providing sample-in to results-out processing and methods of manufacture |
| JP2011234666A (ja) * | 2010-05-10 | 2011-11-24 | Sanyo:Kk | 綿棒 |
| WO2012083572A1 (zh) * | 2010-12-24 | 2012-06-28 | 江苏世泰实验器材有限公司 | 定量生物采样植绒拭子及其制造方法 |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016049064A (ja) * | 2014-09-01 | 2016-04-11 | 国立研究開発法人産業技術総合研究所 | マイクロチップを用いたpcr装置 |
| KR20190031999A (ko) * | 2017-09-19 | 2019-03-27 | (주)로봇앤드디자인 | Dna 처리 장치 |
| KR101990599B1 (ko) | 2017-09-19 | 2019-06-18 | (주)로봇앤드디자인 | Dna 처리 장치 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8642293B2 (en) | Disposable device for analyzing a liquid sample containing a nucleic acid with a nucleic acid amplification apparatus | |
| EP2440941B1 (en) | Sheath flow devices and methods | |
| US6893879B2 (en) | Method for separating analyte from a sample | |
| RU2380418C1 (ru) | Сменный микрофлюидный модуль для автоматизированного выделения и очистки нуклеиновых кислот из биологических образцов и способ выделения и очистки нуклеиновых кислот с его использованием | |
| JP5980030B2 (ja) | 生化学処理装置 | |
| JP2020515815A (ja) | デジタルマイクロ流体デバイスおよび方法 | |
| JP5954532B2 (ja) | 核酸抽出用デバイス、核酸抽出用キット、核酸抽出用装置及び核酸抽出方法 | |
| US20220315916A1 (en) | Sample extraction and preparation device | |
| KR20120044918A (ko) | 핵산 정제 | |
| RU110746U1 (ru) | Устройство для одновременного автоматизированного выделения и очистки нуклеиновых кислот из нескольких биологических образцов | |
| CA3137151C (en) | Analyte collecting device, and analyte collecting method and analyte inspection system using same | |
| US10670579B2 (en) | Device and method for separating a fluid mixture such as blood | |
| AU2015215950B2 (en) | Nucleic Acid Purification | |
| JP2014124097A (ja) | 核酸分析用カートリッジ及び核酸分析装置 | |
| US20150284710A1 (en) | Method of manipulating solid carriers and an apparatus of manipulating solid carriers | |
| JPWO2007055165A1 (ja) | 核酸の分離方法、核酸検査用マイクロリアクタ、核酸検査システム | |
| WO2023137139A2 (en) | Mechanical microfluidic manipulation | |
| US20230381770A1 (en) | Sample Preparation Cartridge and System | |
| JP2014081329A (ja) | 核酸分析カートリッジ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150925 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150925 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20160415 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160517 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160714 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160913 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20170307 |