JP2013528362A - 結合ドメイン - Google Patents
結合ドメイン Download PDFInfo
- Publication number
- JP2013528362A JP2013528362A JP2013505452A JP2013505452A JP2013528362A JP 2013528362 A JP2013528362 A JP 2013528362A JP 2013505452 A JP2013505452 A JP 2013505452A JP 2013505452 A JP2013505452 A JP 2013505452A JP 2013528362 A JP2013528362 A JP 2013528362A
- Authority
- JP
- Japan
- Prior art keywords
- amino acid
- immunoglobulin
- domain
- isolated polypeptide
- polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 230000027455 binding Effects 0.000 title claims description 97
- 238000009739 binding Methods 0.000 title claims description 87
- 108060003951 Immunoglobulin Proteins 0.000 claims abstract description 87
- 102000018358 immunoglobulin Human genes 0.000 claims abstract description 87
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract description 38
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 claims abstract description 37
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 claims abstract description 37
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 71
- 229920001184 polypeptide Polymers 0.000 claims description 68
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 68
- 108090000623 proteins and genes Proteins 0.000 claims description 64
- 150000001413 amino acids Chemical class 0.000 claims description 55
- 239000000539 dimer Substances 0.000 claims description 46
- 239000000427 antigen Substances 0.000 claims description 45
- 102000036639 antigens Human genes 0.000 claims description 45
- 108091007433 antigens Proteins 0.000 claims description 45
- 238000000034 method Methods 0.000 claims description 31
- 239000003446 ligand Substances 0.000 claims description 24
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 claims description 20
- 238000000569 multi-angle light scattering Methods 0.000 claims description 20
- 150000007523 nucleic acids Chemical group 0.000 claims description 19
- 108020004707 nucleic acids Proteins 0.000 claims description 14
- 102000039446 nucleic acids Human genes 0.000 claims description 14
- 210000004602 germ cell Anatomy 0.000 claims description 10
- 239000003814 drug Substances 0.000 claims description 7
- 238000005259 measurement Methods 0.000 claims description 5
- -1 Kabat amino acid Chemical class 0.000 claims description 4
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 4
- 230000001965 increasing effect Effects 0.000 claims description 3
- 239000008194 pharmaceutical composition Substances 0.000 claims description 3
- 230000035772 mutation Effects 0.000 abstract description 46
- 125000000539 amino acid group Chemical group 0.000 abstract description 3
- 108010026228 mRNA guanylyltransferase Proteins 0.000 description 61
- 102000004169 proteins and genes Human genes 0.000 description 49
- 235000018102 proteins Nutrition 0.000 description 48
- 235000001014 amino acid Nutrition 0.000 description 42
- 210000004027 cell Anatomy 0.000 description 42
- 239000000178 monomer Substances 0.000 description 37
- 239000000243 solution Substances 0.000 description 34
- 102000008100 Human Serum Albumin Human genes 0.000 description 27
- 108091006905 Human Serum Albumin Proteins 0.000 description 27
- 239000006228 supernatant Substances 0.000 description 19
- 238000002741 site-directed mutagenesis Methods 0.000 description 15
- 241000588724 Escherichia coli Species 0.000 description 14
- 238000004458 analytical method Methods 0.000 description 13
- 238000006243 chemical reaction Methods 0.000 description 13
- 239000013604 expression vector Substances 0.000 description 13
- 238000012216 screening Methods 0.000 description 12
- 239000000872 buffer Substances 0.000 description 11
- 229960003669 carbenicillin Drugs 0.000 description 11
- FPPNZSSZRUTDAP-UWFZAAFLSA-N carbenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)C(C(O)=O)C1=CC=CC=C1 FPPNZSSZRUTDAP-UWFZAAFLSA-N 0.000 description 11
- 239000013598 vector Substances 0.000 description 11
- 230000000694 effects Effects 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 8
- 102000007562 Serum Albumin Human genes 0.000 description 7
- 108010071390 Serum Albumin Proteins 0.000 description 7
- 238000013103 analytical ultracentrifugation Methods 0.000 description 7
- 238000010494 dissociation reaction Methods 0.000 description 7
- 230000005593 dissociations Effects 0.000 description 7
- 239000002953 phosphate buffered saline Substances 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- 238000005119 centrifugation Methods 0.000 description 6
- 239000012634 fragment Substances 0.000 description 6
- 239000002773 nucleotide Substances 0.000 description 6
- 125000003729 nucleotide group Chemical group 0.000 description 6
- 108020004705 Codon Proteins 0.000 description 5
- 108020004414 DNA Proteins 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 230000001580 bacterial effect Effects 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 239000000523 sample Substances 0.000 description 5
- 238000006467 substitution reaction Methods 0.000 description 5
- 230000008685 targeting Effects 0.000 description 5
- 102000009027 Albumins Human genes 0.000 description 4
- 108010088751 Albumins Proteins 0.000 description 4
- 241000192016 Finegoldia magna Species 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 4
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 4
- 210000003527 eukaryotic cell Anatomy 0.000 description 4
- 229940072221 immunoglobulins Drugs 0.000 description 4
- 108091008146 restriction endonucleases Proteins 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 239000012591 Dulbecco’s Phosphate Buffered Saline Substances 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 241000235058 Komagataella pastoris Species 0.000 description 3
- 101000686985 Mouse mammary tumor virus (strain C3H) Protein PR73 Proteins 0.000 description 3
- 102000008300 Mutant Proteins Human genes 0.000 description 3
- 108010021466 Mutant Proteins Proteins 0.000 description 3
- 108010076504 Protein Sorting Signals Proteins 0.000 description 3
- 239000002518 antifoaming agent Substances 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 230000001268 conjugating effect Effects 0.000 description 3
- 238000004132 cross linking Methods 0.000 description 3
- 238000007405 data analysis Methods 0.000 description 3
- 238000000113 differential scanning calorimetry Methods 0.000 description 3
- 238000006471 dimerization reaction Methods 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 230000009977 dual effect Effects 0.000 description 3
- 238000004520 electroporation Methods 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Natural products O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 210000001236 prokaryotic cell Anatomy 0.000 description 3
- 239000012460 protein solution Substances 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 231100000617 superantigen Toxicity 0.000 description 3
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 3
- 230000007704 transition Effects 0.000 description 3
- 239000013638 trimer Substances 0.000 description 3
- 108010032595 Antibody Binding Sites Proteins 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 241000251730 Chondrichthyes Species 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 2
- 101100421450 Drosophila melanogaster Shark gene Proteins 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 244000070010 Erythrina variegata Species 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- 108010088406 Glucagon-Like Peptides Proteins 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 102100033732 Tumor necrosis factor receptor superfamily member 1A Human genes 0.000 description 2
- 101710187743 Tumor necrosis factor receptor superfamily member 1A Proteins 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 230000009824 affinity maturation Effects 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 2
- 229960000723 ampicillin Drugs 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 108091006004 biotinylated proteins Proteins 0.000 description 2
- 210000002421 cell wall Anatomy 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000012856 packing Methods 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- XZVBUSAPGMMCSW-UHFFFAOYSA-L 2-amino-3-methyl-4h-imidazol-5-one;dichloroplatinum Chemical compound Cl[Pt]Cl.CN1CC(=O)N=C1N.CN1CC(=O)N=C1N XZVBUSAPGMMCSW-UHFFFAOYSA-L 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- OCKGFTQIICXDQW-ZEQRLZLVSA-N 5-[(1r)-1-hydroxy-2-[4-[(2r)-2-hydroxy-2-(4-methyl-1-oxo-3h-2-benzofuran-5-yl)ethyl]piperazin-1-yl]ethyl]-4-methyl-3h-2-benzofuran-1-one Chemical compound C1=C2C(=O)OCC2=C(C)C([C@@H](O)CN2CCN(CC2)C[C@H](O)C2=CC=C3C(=O)OCC3=C2C)=C1 OCKGFTQIICXDQW-ZEQRLZLVSA-N 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 235000010585 Ammi visnaga Nutrition 0.000 description 1
- 244000153158 Ammi visnaga Species 0.000 description 1
- 235000002198 Annona diversifolia Nutrition 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- 241000228257 Aspergillus sp. Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 101100007328 Cocos nucifera COS-1 gene Proteins 0.000 description 1
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 102000052510 DNA-Binding Proteins Human genes 0.000 description 1
- 101710096438 DNA-binding protein Proteins 0.000 description 1
- 101150082070 Dab gene Proteins 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 102100028471 Eosinophil peroxidase Human genes 0.000 description 1
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 101150009006 HIS3 gene Proteins 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 229940122199 Insulin secretagogue Drugs 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 241000282838 Lama Species 0.000 description 1
- 241000282852 Lama guanicoe Species 0.000 description 1
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 241000221961 Neurospora crassa Species 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- 241001452677 Ogataea methanolica Species 0.000 description 1
- 108091008606 PDGF receptors Proteins 0.000 description 1
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 101100394989 Rhodopseudomonas palustris (strain ATCC BAA-98 / CGA009) hisI gene Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 241000235347 Schizosaccharomyces pombe Species 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- 101100079498 Solanum lycopersicum NCED1 gene Proteins 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 108010022394 Threonine synthase Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 241001416177 Vicugna pacos Species 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 230000008484 agonism Effects 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 238000001286 analytical centrifugation Methods 0.000 description 1
- 235000021120 animal protein Nutrition 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 230000002494 anti-cea effect Effects 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 238000002306 biochemical method Methods 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 238000013378 biophysical characterization Methods 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 210000004671 cell-free system Anatomy 0.000 description 1
- 230000008614 cellular interaction Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 108010057085 cytokine receptors Proteins 0.000 description 1
- 102000003675 cytokine receptors Human genes 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 102000004419 dihydrofolate reductase Human genes 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 239000013024 dilution buffer Substances 0.000 description 1
- 125000002228 disulfide group Chemical group 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000003505 heat denaturation Methods 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000002998 immunogenetic effect Effects 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- MGXWVYUBJRZYPE-YUGYIWNOSA-N incretin Chemical class C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)[C@@H](C)O)[C@@H](C)CC)C1=CC=C(O)C=C1 MGXWVYUBJRZYPE-YUGYIWNOSA-N 0.000 description 1
- 239000000859 incretin Substances 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000004068 intracellular signaling Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 210000004896 polypeptide structure Anatomy 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- 239000011535 reaction buffer Substances 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 1
- 238000001448 refractive index detection Methods 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000002702 ribosome display Methods 0.000 description 1
- 102220053235 rs563500712 Human genes 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000004062 sedimentation Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 230000037432 silent mutation Effects 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 239000013595 supernatant sample Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 101150118377 tet gene Proteins 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000002076 thermal analysis method Methods 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 239000007160 ty medium Substances 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/241—Tumor Necrosis Factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
- C07K16/247—IL-4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3007—Carcino-embryonic Antigens
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/569—Single domain, e.g. dAb, sdAb, VHH, VNAR or nanobody®
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Oncology (AREA)
- Peptides Or Proteins (AREA)
Abstract
本発明は、免疫グロブリン単一可変ドメインの単量体状態を安定化する、免疫グロブリン軽鎖アミノ酸配列(VL)中のアミノ酸残基に関する。具体的には、本発明は、DPK9フレームワークVκドメイン抗体を安定化するいくつかの変異を記載するが、他を排除するものではない。
【選択図】図3
【選択図】図3
Description
本発明は、免疫グロブリン単一可変ドメインの単量体状態を安定化する、免疫グロブリン軽鎖アミノ酸配列(VL)中のアミノ酸残基に関する。具体的には、本発明は、DPK9フレームワークVKドメイン抗体の単量体状態を安定化するいくつかの変異を記載するが、他を排除するものではない。
ドメイン抗体は、抗原に結合する、既知の最小の抗体フラグメントであって、これは免疫グロブリンの重鎖もしくは軽鎖(それぞれVHおよびVL)の強固な可変領域を含んでいる(総説として、たとえば、Holt et al. (2003) Trends in Biotechnology Vol.21, No.11 p. 484-490)。
特異的な標的分子/抗原と結合する、ヒト抗体軽鎖および重鎖可変ドメイン抗体(VκおよびVH dAb)、ラクダ科動物VHHドメイン(ナノボディ)、および新規サメ抗原受容体などのいくつかのドメイン抗体が、免疫治療薬として開発されている(たとえば、Enever et al. Current Opinion in Biotechnology (2009); 20: 1-7を参照されたい)。
免疫治療薬としてのドメイン抗体の開発は、一本鎖Fvの場合に確立されたのと同じアプローチに従ってなされ、この開発では、dAbファージディスプレイライブラリーをスクリーニングして標的結合ポリペプチドを選択した後、抗体親和性(KD)を改善するために親和性成熟を行う。適当な方法は、たとえば、WO 2005/118642に記載されている。
ドメイン抗体の性質の1つは、それが単量体もしくは多量体(特に二量体)の形で存在し、しかも標的と結合しうることである。単量体dAbは、標的のクロスリンクを防止することが好都合であるような(たとえば、標的が受容体チロシンキナーゼ、たとえばTNFR1などの細胞表面受容体であるような)特定の標的もしくは状況に好ましいといえる。場合によっては、二量体もしくは多量体として結合すると、細胞表面上の受容体の、受容体クロスリンクを引き起こす可能性があり、そのため、受容体アゴニズムおよび有害な受容体シグナル伝達を増大させる可能性がある。あるいはまた、二量体を形成するdAbは、標的クロスリンクを確実にするために、またはアビディティー効果による結合の向上、安定性もしくは溶解性の改善などのために好ましいこともある。
ドメイン抗体のような小さいフラグメントの利点の一つは、フォーマッティングおよびターゲティングアプローチのために他の分子と組み合わせて使用できる点である。こうしたターゲティングアプローチには、同時に複数の標的と結合するためのマルチドメイン構築物の作製が含まれる。たとえば、ドメインのうち1つがアルブミンのような血清タンパク質と結合するマルチドメイン構築物を作製することができる。血清アルブミンと結合するドメイン抗体(AlbudAbs(商標名))は、たとえば、WO 05/118642に記載され、ドメイン融合パートナーに、それ自体で延長された血中半減期をもたらすことができる。
マルチドメイン構築物の関わる特定のターゲティングアプローチのために、たとえば、AlbudAbが血清アルブミンと結合したdAb-AlbudAb(商標名)のような二重標的化分子を作製すべき場合には、上記のように単量体dAbを使用することが好ましいが、それは、dAbの二量体化が、たとえば、高分子量タンパク質凝集物の形成をもたらす可能性があるためである。
したがって、免疫グロブリンの集団が、用途に応じて、単量体もしくは二量体の割合を増加させるように、ニーズにしたがって、免疫グロブリンを適合させられることが必要である。このように、特定の用途のための単量体もしくは二量体を開発するために、最初から、単量体もしくは二量体を高い割合で有するライブラリーを選択することができる。これによって、薬物を、より有効に疾患を治療するという目的に適合させることが可能になると考えられる。あるいはまた、ニーズに合わせるために、存在するdAbまたは”親”dAbの二量体化状態を変化させることも望ましいといえる。
単量体もしくは二量体dAbの生成を優先的に選択できることは、これらのdAbをフォーマッティング、および、たとえば二重標的化分子に使用する場合、いっそうの柔軟性を与える。
Holt et al. (2003) Trends in Biotechnology Vol.21, No.11 p. 484-490
Enever et al. Current Opinion in Biotechnology (2009); 20: 1-7
本発明は、免疫グロブリン軽鎖アミノ酸配列(VL)中のアミノ酸残基を記載するが、この残基は免疫グロブリン単一可変ドメインの単量体状態を安定化するものである。具体的には、本発明は、DPK9フレームワークVKドメイン抗体の単量体状態を安定化するいくつかの変異を記載する。したがって、本発明は、要求される単一可変ドメイン免疫グロブリンの望ましい性質に応じて、高い割合で、または低い割合で単量体もしくは二量体を有する、VLドメイン抗体のライブラリーの設計に適用され、すなわち、単量体状態と二量体状態のどちらが好ましいかに応じて、変異はさまざまに異なる可能性がある。したがって、本発明は、さらに数多くの、望ましい性質を有するdAb候補を単離する方法を提供する。
したがって、第1の態様において、本発明は、バリアント免疫グロブリン軽鎖単一可変ドメインを含む単離されたポリペプチドを提供するものであって、この前記バリアントは、ヒト生殖系列の抗体遺伝子セグメントにコードされるフレームワーク領域のアミノ酸配列を含んでおり、36、38、43、44、46および87位のアミノ酸のうち少なくとも1つは置換されているが、前記の位置はKabatのアミノ酸ナンバリングシステムにより割り当てられたものである。免疫グロブリン分子内部のCDRおよびフレームワーク(FR)領域の位置、およびナンバリングシステムは、Kabatらによって示された(Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, U.S. Government Printing Office (1991))。アミノ酸番号が示される、本発明のあらゆる態様もしくは実施形態において、位置はKabatによって割り当てられる。
言及することができる、本発明のもう1つの実施形態によれば、バリアント免疫グロブリン軽鎖単一可変ドメインを含む単離されたポリペプチドが与えられるが、この前記バリアントは、ヒト生殖系列の抗体遺伝子セグメントによってコードされるフレームワーク領域のアミノ酸配列を含み、さらに38、43、および44位のアミノ酸のうち少なくとも1つが置換されたものであって、前記位置はKabatアミノ酸ナンバリングシステムにしたがって割り当てられた。
ある実施形態において、前記バリアント免疫グロブリン軽鎖単一可変ドメインは、VL免疫グロブリン軽鎖単一可変ドメインである。さらに他の実施形態において、前記バリアント免疫グロブリン軽鎖単一可変ドメインは、ヒトVL免疫グロブリン軽鎖単一可変ドメインである。免疫グロブリン軽鎖単一可変ドメインは、ヒト生殖系列抗体遺伝子セグメントによってコードされるフレームワーク領域を有する親VLアミノ酸配列であり、バリアントは、元のVH境界面の38、43、もしくは44位の少なくとも1つに変異を有することが好適である。同様に好適であるのは、免疫グロブリン軽鎖単一可変ドメインが、ヒト生殖系列抗体遺伝子セグメントによってコードされるフレームワーク領域を有する親VLアミノ酸配列であり、バリアントが、元のVH境界面の36、46、もしくは87位の少なくとも1つに変異を有することである。
ある実施形態において、単離されたポリペプチドもしくはバリアントは、実質的に、溶液中で二量体である。当然のことながら、本明細書で使用される「実質的に」という言葉は、標準条件(MALLS/ 実験の項を参照されたい;PBSバッファー、タンパク質濃度1mg/ml)下でのMALLSによる測定により、理論的分子量より10%以上高く、二量体分子の分子量以下の、平均分子量を示すタンパク質の割合を意味する。さまざまなレベルの測定分子量は、すでに、上記条件下でdAbタンパク質が二量体化する程度および傾向を示した。この実施形態において、バリアントは次のアミノ酸、Q38、A43もしくはP44の少なくとも1つを有する。バリアント免疫グロブリン軽鎖単一可変ドメインは、SEC MALLSによる測定で、実質的に二量体であることが適当である。溶液中で実質的に二量体であって、少なくともQ38、A43もしくはP44の少なくとも1つを有するバリアントは、ヒト生殖系列配列DPK9に由来しないヒト生殖系列抗体遺伝子配列によってコードされる免疫グロブリンフレームワーク領域を有することが適当である。ある実施形態において、免疫グロブリン軽鎖親VL配列は、本明細書に記載のDOM7h-8ではない。
別の実施形態において、単離されたポリペプチドもしくはバリアントは、実質的に、溶液中で単量体である。この実施形態において、バリアントは、アミノ酸Q38がアミノ酸R、N、D、EまたはGのいずれかで置換されたアミノ酸配列を含有することが適当である。バリアントは、アミノ酸A43がD、I、L、F、TまたはWで置換されたアミノ酸配列を含有することが適当である。A43が置換されている実施形態において、それがDで置き換えられていることが適当である。別の実施形態において、バリアントは、アミノ酸A43がK、YまたはEで置換されたアミノ酸配列を含有する。バリアントは、アミノ酸P44がR、N、D、C、Q、E、H、I、L、K、M、F、T、YまたはVで置換されたアミノ酸配列を含有することが適当である。別の実施形態において、バリアントは、アミノ酸P44がAで置き換えられたアミノ酸配列を含有する。もう一つの実施形態において、バリアントは、アミノ酸Y36がA、Q、G、S、TまたはVで置換されたアミノ酸配列を含有する。別の実施形態において、バリアントはアミノ酸Y46がR、D、Q、EまたはFで置換されたアミノ酸配列を含有する。Y46が置換されている実施形態において、それがDで置換されていることが適当である。別の実施形態において、バリアントは、アミノ酸配列Y87がD、C、LまたはFで置換されたアミノ酸配列を含有する。Y87が置換されている実施形態において、それがLで置換されていることが適当である。ある実施形態において、バリアントは、上記実施形態のいずれかによる任意のアミノ酸置換を、6残基のうち任意の2つ、または3つ以上、たとえば4、5、もしくは6つ、任意に組み合わせて含む。
本発明の任意の態様もしくは実施形態の、ある実施形態において、バリアント免疫グロブリン単一可変ドメインは、VLドメインであるか、またはそれに由来するものであって、κ系統VL(Vκ)が適当である。いくつかのヒトVκ系統が知られている。ある実施形態において、VLはκI系統VLであり、本明細書に記載のκI系統、DPK9が適当である。
別の実施形態において、単離されたポリペプチドは、免疫グロブリン単一可変ドメインである。
本発明の別の態様において、36、38、43、44、46または87位の少なくとも1つが変異していることを特徴とする、Vκ DPK9免疫グロブリンドメインが与えられるが、前記位置はKabatのナンバリングにしたがって決定される。言及することができる本発明の別の態様において、38、43または44位の少なくとも1つが変異していることを特徴とする、Vκ DPK9免疫グロブリンドメインが与えられるが、前記位置はKabatのナンバリングにしたがって決定される。当然のことながら、本明細書で使用される「置換された」という用語は、アミノ酸置換を指しており、この場合、天然型Vκ DPK9免疫グロブリンドメインの特定のアミノ酸が別のアミノ酸に変異し、もしくは置換されている。36位がA、Q、G、S、TまたはVから選択されるアミノ酸に変異していることが適当であり、前記位置はKabatのナンバリングにしたがって決定される。38位がR、N、D、EおよびGから選択されるアミノ酸に変異していることが適当であり、前記位置はKabatのナンバリングにしたがって決定される。43位がD、I、L、F、K、E、TおよびWから選択されるアミノ酸に変異していることが適当であり、前記位置はKabatのナンバリングにしたがって決定される。44位がR、N、D、C、Q、E、H、I、L、K、M、F、T、YおよびVから選択されるアミノ酸に変異していることが適当であり、前記位置はKabatのナンバリングにしたがって決定される。46位が、R、D、Q、EまたはFから選択される、たとえばDのようなアミノ酸に変異していることが適当であり、前記位置はKabatのナンバリングにしたがって決定される。87位がD、C、LまたはFから選択される、たとえばLのようなアミノ酸に変異していることが適当であり、前記位置はKabatのナンバリングにしたがって決定される。ある実施形態において、Vκ DPK9免疫グロブリンドメインは、本発明の任意の実施形態によるアミノ酸変異のうち任意の2つを組み合わせて含んでいる。本発明のVκ DPK9免疫グロブリンドメインは、溶液中で、実質的に単量体であることが適当である。本発明のポリペプチドもしくは免疫グロブリンの生物物理学的性質は、任意の適当な方法にしたがって測定することができる。いくつかの適当な方法を本明細書の実施例の項に記載する。ある実施形態において、本発明のVκ DPK9免疫グロブリンドメインは、SEC MALLSによる測定で、実質的に単量体状態である。
ある実施形態において、本発明にしたがって単離されたポリペプチドもしくは免疫グロブリンドメインが与えられるが、前記単離されたポリペプチドもしくは免疫グロブリンは、標的リガンドに対する結合特異性を有する。前記単離されたポリペプチドもしくは免疫グロブリンは、抗原結合活性を示すことが適当である。ある実施形態において、標的リガンドはヒト抗原である。
別の実施形態では、本発明の任意の態様もしくは実施形態にしたがって、単離されたポリペプチドもしくは免疫グロブリンドメインが与えられるが、この場合、前記単離されたポリペプチドは、36、38、43、44、46もしくは87位の少なくとも1つの位置にフレームワーク変異を有するものであって、解離平衡定数KDの減少の結果として、親分子と比べて、ヒト血清アルブミンに対する抗原結合活性が改善された。
別の実施形態において、本発明は、本発明のポリペプチドもしくは免疫グロブリンを含む、ポリペプチドのリストを提供するが、このポリペプチドの少なくとも60、70、75、80、85、または90%は、SEC MALLSまたはAUCによる測定で、単量体の形をとる(実施例の項を参照されたい)。
また他の態様は、36、38、43、44、46もしくは87位のアミノ酸の少なくとも1つが変異している、本発明のポリペプチドもしくはバリアント免疫グロブリン軽鎖可変ドメイン領域を含有するライブラリーを提供するが、前記位置はKabatのナンバリングにしたがって割り当てられる。
言及することができるさらに他の態様は、38、43、および44位のアミノ酸の少なくとも1つが変異している、本発明のポリペプチドもしくはバリアント免疫グロブリン軽鎖可変ドメイン領域を含有するライブラリーを提供するが、前記位置はKabatのナンバリングにしたがって割り当てられる。
本発明のさらに別の態様は、43位がD、I、L、KまたはEから選択される、Vκ免疫グロブリンドメインのライブラリーを提供する。
本発明のさらに別の態様は、46位がR、D、Q、EまたはFから選択され、たとえばDである、Vκ免疫グロブリンドメインのライブラリーを提供する。
本発明のさらに別の態様は、87位がD、C、LまたはFから選択され、たとえばLである、Vκ免疫グロブリンドメインのライブラリーを提供する。
ある実施形態において、ライブラリーはVκ DPK9ライブラリーである。
もう一つの態様は、本発明にしたがってポリペプチドもしくはバリアント免疫グロブリン軽鎖可変ドメイン領域を発現させるためのライブラリーであって、前記ポリペプチドもしくは免疫グロブリン軽鎖可変ドメインをコードする一連の核酸配列を含む前記ライブラリーを提供する。
本発明のポリペプチドもしくは免疫グロブリン軽鎖単一可変ドメインをコードする核酸のライブラリーも与えられる。ある態様において、本発明は、本発明に基づくリストもしくはライブラリーを提供するが、この前記ライブラリーはCDR領域中にさらに多様性を含んでいる。CDR領域における多様性は、適当な方法によって生じさせることができる。
別の態様は、本発明のポリペプチドもしくは免疫グロブリン軽鎖単一可変ドメインをコードする核酸を提供する。
本発明は、本発明のポリペプチドもしくは免疫グロブリン単一可変ドメインを含有する医薬組成物、ならびに薬剤として使用するための本発明のポリペプチドもしくは免疫グロブリン単一可変ドメインを提供する。前記医薬組成物は、当業者によく知られているさまざまな投与形態に適しており、製薬上許容される担体もしくは添加物を含有することができる。さらに、本発明は、本発明のポリペプチドもしくは免疫グロブリン単一可変ドメインを、治療の必要のある患者に投与することを含む、治療法を提供する。
本発明のポリペプチドもしくは免疫グロブリン軽鎖単一可変ドメインは、もっと大きな融合分子、または二重特異性もしくは多重特異性分子の一部となっていてもよい。適当な大型構築物には、dAb-dAb、mAb-dAb、またはdAb-ポリペプチド構築物がある。
本発明はさらに、本発明にしたがって変異を導入することを含む、dAbを作製するためのプロセスを提供する。
発明の詳細な説明
本明細書では、明瞭かつ簡潔な明細書を書くことができるように、実施形態に準拠して本発明を説明した。本発明から離れることなしに実施形態をさまざまに組み合わせ、または分けることができることが、意図され、理解される。
本明細書では、明瞭かつ簡潔な明細書を書くことができるように、実施形態に準拠して本発明を説明した。本発明から離れることなしに実施形態をさまざまに組み合わせ、または分けることができることが、意図され、理解される。
特に断らない限り、本明細書で使用される科学技術用語はすべて、当技術分野(たとえば、細胞培養、分子遺伝学、核酸化学、ハイブリダイゼーション技術および生化学)の当業者によって普通に理解されるのと同じ意味を有する。分子、遺伝、および生化学的方法(全般的には、Sambrook et al., Molecular Cloning: A Laboratory Manual, 2d ed. (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. 、およびAusubel et al., Short Protocols in Molecular Biology (1999) 4th Ed, John Wiley & Sons, Inc.を参照すべきであり、これらは参考として本明細書に組み入れられる)および化学的方法のための標準的な技術が使用される。
本明細書で使用される「免疫グロブリン」は、抗体分子に特徴的な、免疫グロブリンフォールドを保持するポリペプチドのファミリーを表し、それは2つのβシートおよび、通常は、保存されたジスルフィド結合を含んでいる。免疫グロブリンスーパーファミリーのメンバーは、in vivoで細胞間相互作用および非細胞性相互作用の多くの態様に関与するが、これには、免疫系における広範な役割(たとえば、抗体、T細胞受容体分子など)、細胞接着への関与(たとえば、ICAM分子)、および細胞内シグナル伝達(たとえば、PDGF受容体のような受容体分子)が含まれる。本発明は、結合ドメインを有するすべての免疫グロブリンスーパーファミリー分子に適用可能である。
本明細書で使用される「ドメイン」は、タンパク質の残りの部分とは独立して三次構造を保持する、折り畳まれたタンパク質構造を指す。概して、ドメインは、タンパク質の個別の機能的性質に関与するものであって、多くの場合、タンパク質の残りの部分および/またはドメインの、機能の損失なしに、他のタンパク質に加えたり、取り除いたり、または移動させることができる。単一抗体可変ドメインもしくは免疫グロブリン単一可変ドメインは、抗体可変ドメインに特徴的な配列を含有する、折り畳まれたポリペプチドドメインを意味する。したがって、これには、完全な抗体可変ドメインおよび改変された可変ドメイン(たとえば、この改変可変ドメインでは、1つもしくは複数のループが、抗体可変ドメインに特徴的でない配列で置き換えられている)、または、トランケートされ、あるいはN-もしくはC-末端伸長を含む、抗体可変ドメインが含まれるが、さらに、少なくともある程度は全長ドメインの結合活性および特異性を保持する、可変ドメインの折り畳みフラグメントも含まれる。
「Vκ DPK9免疫グロブリンドメイン」(「DPκ9」とも記す)は、ヒトフレームワークO12/O2/DPK9に由来する免疫グロブリンドメインである。このようなドメインは、ヒトフレームワークJk1由来の配列をさらに含有してもよい。免疫グロブリンドメインは、他のヒトフレームワーク領域に由来してもよい。ヒトVκドメインの構造的レパートリーの解析は、たとえば、Tomlinson et al. (1995), EMBO J, 14; p. 1628-38に記載されている。それに加えて、マウスおよびヒトの生殖系列遺伝子レパートリー間の構造上の相違は、たとえば、Amalgro et al. (1998); Immunogenetics; 47; p. 355-363に記載されている。
「免疫グロブリン単一可変ドメイン」という表現は、異なる、もしくは他の、V領域もしくはドメインとは独立して、抗原もしくはエピトープと特異的に結合する結合ドメイン、または抗体可変ドメイン(VH、VHH、VL)を指す。免疫グロブリン単一可変ドメインは、他の可変領域もしくは可変ドメインとともに一定のフォーマットで(たとえばホモ、またはヘテロ多量体として)存在することができるが、この場合、他の領域もしくはドメインは、免疫グロブリン単一可変ドメインによる抗原結合のために必要とはされない(すなわち、この場合、免疫グロブリン単一可変ドメインは、追加の可変ドメインとは独立して、抗原と結合する)。「ドメイン抗体」もしくは「dAb」は、本明細書で使用される「免疫グロブリン単一可変ドメイン」である。「単一抗体可変ドメイン」もしくは「抗体単一可変ドメイン」は、本明細書で使用される「免疫グロブリン単一可変ドメイン」と同じである。免疫グロブリン単一可変ドメインは、ある実施形態では、ヒト抗体可変ドメインであるが、齧歯類(たとえばWO 00/29004に記載、その内容は参考としてその全体を本明細書に組み入れられる)、テンジクザメ、およびラクダ科動物VHH dAbなどの他種由来の単一抗体可変ドメインも含まれる。ラクダ科動物VHHは、ラクダ、ラマ、アルパカ、ヒトコブラクダ、およびグアナコなどの種に由来する免疫グロブリン単一可変ドメインポリペプチドであって、これらの動物は自然に軽鎖を欠いた重鎖抗体を産生する。VHHはヒト化することができる。
本発明のすべての態様において、当該の、もしくはそれぞれの、免疫グロブリン単一可変ドメインは、抗体重鎖および軽鎖単一可変ドメイン、たとえばVH、VLおよびVHHから独立して選択される。抗体重鎖ドメインはVHもしくはVH、VHH、VHHもしくはVHHで表される。抗体軽鎖ドメインはVLもしくはVLで示される。免疫グロブリン軽鎖単一可変ドメインに関する「バリアント」とは、天然に存在する生殖系列もしくは親免疫グロブリン軽鎖のアミノ酸配列を含有するが、1つもしくは複数のアミノ酸が異なっているものである。すなわち、「バリアント」は、その起源である、天然に存在する配列または「親」配列と比較して1つもしくは複数のアミノ酸の相違を含有する。「親」配列は、天然に存在する免疫グロブリン軽鎖単一可変ドメイン配列、生殖系列免疫グロブリン軽鎖配列、または当該抗原と結合することが確認されている免疫グロブリン軽鎖単一可変ドメインのアミノ酸配列であることが適当である。ある実施形態において、親配列は、それぞれWO2005093074およびWO04101790に記載の4Gまたは6Gライブラリーのようなライブラリーから選択することができる。
「系統」は、同じ「親」クローンに由来する一連の免疫グロブリン単一可変ドメインを表す。たとえば、いくつかのバリアントクローンを含む系統は、親もしくは出発免疫グロブリン単一可変ドメインから、多様化、部位特異的変異誘発、エラーを起こしやすい、またはエラーを加えたライブラリーの作製によって、作製することができる。結合分子は、親和性成熟のプロセスで作製することが適当である。適当な免疫グロブリン軽鎖単一可変ドメインを特定するためのアッセイおよびスクリーニング法は、たとえば、PCT/EP2010/052008およびPCT/EP2010/052007に記載されている。「親」配列としては、本明細書に記載のDOM7h-8のような免疫グロブリン単一可変ドメインが挙げられる。前記バリアントは、CDR配列中に変異を含んでいてもよく、そうした変異が抗原特異性の相違の一因となることが適当である。
ある実施形態において、親配列は、溶液状態(たとえば、MALLSおよび/またはSEC MALLSまたはAUCによって測定される)および熱安定性(たとえばDSCで測定される)を含めて、生物物理学的特性の1つもしくはいくつかを改善するよう、本発明にしたがって改変することができる。ある実施形態において、バリアントは、免疫グロブリン軽鎖単一可変ドメイン中の1つもしくは複数のアミノ酸位置にアミノ酸置換を有する。本発明の免疫グロブリン軽鎖単一可変ドメインは、溶液中で単量体、二量体、三量体、または多量体を形成することができる。さまざまなオリゴマーが互いに平衡状態となることができる。平衡は、迅速であることもあるが、緩慢であることもある。「実質的に単量体である」とは、単一可変ドメインの主たる形態が、溶液中で単量体であることを意味する。溶液状態は、本明細書に記載のSEC-MALLS、またはAUCで測定することができる。本発明が(実質的に)純粋な単量体を提供することが適当である。ある実施形態において、dAbは少なくとも70、75、80、85、90、95、98、99、99.5%または100%純粋な単量体である。同様に、「実質的に二量体である」とは、溶液中の主たる形態が二量体型であることを意味する。ある実施形態において、dAbの二量体型は少なくとも70、75、80、85、90、95、98、99、99.5%または100%純粋な二量体である。単量体/二量体状態をSEC MALLSで測定する場合、dAb濃度は5〜10μMの範囲内であれば適当である。
ある実施形態において、本発明の免疫グロブリン単一可変ドメイン、ポリペプチドもしくはリガンドは、任意の抗体フォーマットとして提供することができる。本明細書で使用される「抗体フォーマット」は、抗原に対する結合特異性を構造に付与するために、1つもしくは複数の抗体可変ドメインを組み込むことができる、任意の適当なポリペプチド構造を表す。さまざまな、適当な抗体フォーマット、たとえば、キメラ抗体、ヒト化抗体、ヒト抗体、一本鎖抗体、二重特異性抗体、抗体重鎖、抗体軽鎖、抗体重鎖および/または軽鎖のホモ二量体およびヘテロ二量体、前記のいずれかの抗原結合フラグメント(たとえば、Fvフラグメント(例、一本鎖Fv (scFv)、ジスルフィド結合したFv)、Fabフラグメント、Fab’ フラグメント、F(ab’)2 フラグメント)、一本鎖抗体可変ドメイン(たとえば、dAb、VH、VHH、VL)、および前記のいずれかの改変型(たとえば、ポリエチレングリコールもしくは他の適当なポリマー、またはヒト化VHHの共有結合によって修飾されている)が当技術分野で知られている。
本明細書で使用される「抗体」は、自然に抗体を産生する任意の種に由来するか、組換えDNA技術で作製されるかにかかわらず;たとえば、血清、B細胞、ハイブリドーマ、トランスフェクトーマ、酵母または細菌から単離されるかどうかにかかわらず、IgG、IgM、IgA、IgDもしくはIgE、またはフラグメント(たとえば、Fab、F(ab’)2、Fv、ジスルフィド結合Fv、scFv、閉構造多重特異性抗体、ジスルフィド結合scFv、diabody)を意味する。
本明細書に記載される「抗原」は、本発明の結合ドメインが結合する分子である。典型的には、抗原は、抗体リガンドと結合して、in vivoで抗体応答を引き起こす能力を有する。抗原はたとえば、ポリペプチド、タンパク質、核酸、または他の分子であってもよい。
本明細書で使用される「標的」という表現は、結合部位を有するポリペプチドドメインが結合することができる、生物学的分子(たとえば、ペプチド、ポリペプチド、タンパク質、脂質、炭水化物)を表す。標的は、たとえば、細胞内標的(たとえば、細胞内タンパク質標的)、可溶性標的(たとえば分泌型)、または細胞表面標的(たとえば、膜タンパク質、受容体タンパク質)とすることができる。標的は疾患に関与する分子であって、前記標的と本発明の結合分子との結合が、前記疾患の改善または治療に役立つことがあれば好適である。標的抗原は、ポリペプチド、タンパク質、もしくは核酸であるか、またはその一部とすることができるが、これらは天然に存在していても、合成であってもよい。これに関連して、本発明のリガンドは、標的抗原と結合して、アンタゴニストもしくはアゴニスト(たとえばEPO受容体アゴニスト)として作用することができる。当業者には当然のことながら、選択は数多くさまざまである。それはたとえば、ヒトもしくは動物タンパク質、サイトカイン、サイトカイン受容体(このサイトカイン受容体には、サイトカイン類の受容体が含まれる)、酵素、酵素の補助因子、またはDNA結合タンパク質とすることができる。
ある実施形態において、本発明の免疫グロブリン単一可変ドメインもしくはポリペプチドは、「二重特異性リガンド」の一部であるとすることができるが、この「二重特異性リガンド」は、第1の抗原もしくはエピトープ結合部位(たとえば、第1の免疫グロブリン単一可変ドメイン)、および第2の抗原もしくはエピトープ結合部位(たとえば、第2の免疫グロブリン単一可変ドメイン)を含むリガンドを指すものであって、この結合部位もしくは可変ドメインは、2つの抗原(たとえば、異なる抗原、または同一抗原の2コピー)と、または単一特異性免疫グロブリンが通常は結合しない、同一抗原上の2つのエピトープと、結合する能力を有する。たとえば、2つのエピトープは同一抗原上に存在してもよいが、同一エピトープではないか、または単一特異性リガンドが結合するほど近接していない。ある実施形態において、本発明の二重特異性リガンドは、異なる特異性を有する結合部位もしくは可変ドメインで構成されるが、同じ特異性を有する相互補完的な可変ドメインペア(すなわちVH/VLペア)を含まない(すなわち、単一結合部位を形成しない)。
二重特異性リガンド、および二重特異性リガンドを調製するための適当な方法は、WO 2004/058821、WO 2004/003019、およびWO 03/002609に記載されており、これらの公開された国際出願のそれぞれ教示する内容全体は、参考として本明細書に組み入れられる。
ある実施形態において、本発明の免疫グロブリン単一可変ドメインを用いて、二重もしくは多重特異性組成物または融合ポリペプチドを作製することができる。したがって、本発明の免疫グロブリン単一可変ドメインを、より大きな構築物の中で使用することができる。適当な構築物には、抗-SA免疫グロブリン単一可変ドメイン(dAb)とモノクローナル抗体、NCE、タンパク質もしくはポリペプチドとの融合タンパク質などがある。したがって、本発明の抗-SA免疫グロブリン単一可変ドメインを用いて、多重特異性分子、たとえば、dAb-dAb(すなわち、一方が抗-SA dAbである2つ結合した免疫グロブリン単一可変ドメイン)、mAb-dAbまたはポリペプチド-dAb構築物などの二重特異性分子を構築することができる。これらの構築物において、抗-SA dAb(AlbudAb(登録商標))成分は、血清アルブミン(SA)との結合によって、半減期の延長をもたらす。適当なmAb-dAb、およびこれらの構築物を作製するための方法は、たとえば、WO2009/068649に記載されている。
それに加えて、WO04003019およびWO2008/096158は、抗-SA免疫グロブリン単一可変ドメイン(dAb)などの抗血清アルブミン(SA)結合部分を明らかにしており、これは治療上有用な半減期を有する。これらの文書は、単量体抗-SA dAb、ならびにそのようなdAbを含有する多重特異性リガンド、たとえば、TNFR1などの標的抗原と特異的に結合する、抗-SA dAbおよびdAbを含有するリガンドを記載する。2種以上に由来する血清アルブミンと特異的に結合する結合部分、たとえば、ヒト/マウス交差反応性抗-SA dAbが公表されている。
WO05118642およびWO2006/059106は、薬物の半減期を長くするために、抗-SA免疫グロブリン単一可変ドメインのような抗-SA結合部分を薬物に結合させる(コンジュゲート化または複合体化)という着想を記載している。タンパク質、ペプチドおよび新規化学物質(NCE)薬物が開示および例示されている。WO2006/059106は、インスリン分泌促進薬、たとえば、グルカゴン様ペプチド(GLP)-1などのインクレチンホルモンの半減期を長くするためにこのコンセプトを使用することを記載する。
Holt et al, “Anti-Serum albumin domain antibodies for extending the half-lives of short lived drugs”, Protein Engineering, Design & Selection, vol 21, no 5, pp283-288, 2008についても言及しておく。
本発明はまた、請求されたポリペプチドのカノニカル構造を提供する。ドメイン抗体(dAb)の構造および配列の分析から、6つの抗原結合ループ(VHドメインから3つおよびVκドメインから3つ)は、主鎖の立体構造、またはカノニカル構造のレパートリーが少ないことが示された(Chothia C & Lesk AM. (1987). Canonical structures for the hypervariable regions of immunoglobulins. J Mol Biol. 196, 901-17; Chothia et al. (1989). Conformations of immunoglobulin hypervariable regions. Nature, 342, 877-883; Tomlinson et al. (1995) 上記)。
カノニカル構造は、下記によって決定される:
1.抗原結合ループの長さ;
2.ループそれ自体および抗体フレームワークの中の、重要な部位にある特有の残基。
1.抗原結合ループの長さ;
2.ループそれ自体および抗体フレームワークの中の、重要な部位にある特有の残基。
ヒトVκドメインのカノニカル構造は、Tomlinson et al., (1995)に記載されている。
本明細書におけるヒトVκドメインに対する言及は、κ軽鎖遺伝子012/02/DPK9およびJK1を含む単一のフレームワークを基本として、抗原結合部位の位置に側鎖の多様性が組み込まれている。このフレームワークによってコードされるVκドメインのカノニカル構造は、2:1:1 (Tomlinson et al., 1995)である。3つのループ(L1、L2、L3)のそれぞれのカノニカル構造にとって構造上重要な残基は、これらの主鎖の立体構造を保つために、通常、多様化されない。
本発明はまた、本明細書に記載のリガンド(単一可変ドメイン、融合タンパク質、ポリペプチド、二重特異性リガンド、および多重特異性リガンド)をコードする、単離された、および/または組換え型の、核酸分子を提供する。
本発明はまた、本発明の組換え核酸分子を含有するベクターを提供する。ある実施形態において、ベクターは、本発明の組換え核酸分子に機能しうるように連結された、1つもしくは複数の発現調節領域もしくは配列を含有する、発現ベクターである。本発明は、本発明の組換え核酸分子またはベクターを含有する、組換え宿主細胞も提供する。適当なベクター(たとえば、プラスミド、ファジミド)、発現調節領域、宿主細胞、ならびに本発明の組換え宿主細胞を作製するための方法は、当業者によく知られており、本明細書では実施例をさらに記載する。
適当な発現ベクターは、いくつかの成分、たとえば複製開始点、選択可能なマーカー遺伝子、1つもしくは複数の発現調節領域、たとえば転写調節領域(例、プロモーター、エンハンサー、ターミネーター)および/または1つもしくは複数の翻訳シグナル、シグナル配列またはリーダー配列などを含有することができる。発現調節領域およびシグナル配列が存在する場合、ベクターまたは他の起源が、それらを提供することができる。たとえば、抗体鎖をコードするクローン化された核酸の、転写および/または翻訳調節配列を用いて、発現を指示することができる。
所望の宿主細胞で発現させるためにプロモーターを提供することができる。プロモーターは、構成的であっても、誘導性であってもよい。たとえば、プロモーターは、抗体、抗体鎖、またはその一部をコードする核酸に、その核酸の転写を指示できるよう、機能的に連結することができる。原核宿主用(たとえば、大腸菌用にはlac、tac、T3、T7プロモーター)および真核宿主用(たとえば、サルウイルス40初期もしくは後期プロモーター、ラウス肉腫ウイルス末端反復配列プロモーター、サイトメガロウイルスプロモーター、アデノウイルス後期プロモーター)にさまざまな適当なプロモーターが利用できる。
それに加えて、発現ベクターは典型的には、ベクターを保有する宿主細胞を選択するための選択マーカー、ならびに、複製可能な発現ベクターの場合には、複製開始点を含有する。抗生物質耐性もしくは薬剤耐性を付与する産物をコードする遺伝子は一般的な選択マーカーであって、原核細胞にも(たとえば、ラクタマーゼ遺伝子(アンピシリン耐性)、テトラサイクリン耐性のためのTet遺伝子)、真核細胞にも(たとえば、ネオマイシン(G418またはジェネテシン)、gpt(ミコフェノール酸)、アンピシリン、またはハイグロマイシン耐性遺伝子)使用することができる。ジヒドロ葉酸還元酵素マーカー遺伝子は、さまざまな宿主において、メトトレキサートを用いた選択を可能にする。宿主の栄養要求性マーカーの遺伝子産物をコードする遺伝子(たとえば、LEU2、URA3、HIS3)は、しばしば酵母で選択可能なマーカーとして使用される。ウイルス(たとえばバキュロウイルス)もしくはファージベクター、ならびに、宿主細胞のゲノム中に組み込むことができるベクター、たとえばレトロウイルスベクター、の使用も考えられる。哺乳動物細胞および原核細胞(大腸菌)、昆虫細胞(ショウジョウバエ属(Drosophila)Schnieder S2細胞、Sf9)および酵母(P. methanolica、P. pastoris、S. cerevisiae)で発現させるための適当な発現ベクターは当技術分野でよく知られている。
適当な宿主細胞は、大腸菌(E. coli)、枯草菌(B. subtilis)、および/または他の適当な細菌を含む原核細胞;真核細胞、たとえば真菌もしくは酵母細胞(例、ピキア・パストリス(Pichia pastoris)、アスペルギルス属菌(Aspergillus sp.)、出芽酵母(Saccharomyces cerevisiae)、分裂酵母(Schizosaccharomyces pombe)、アカパンカビ(Neurospora crassa))、または他の下等真核細胞、ならびに高等真核生物の細胞、たとえば昆虫(例、ショウジョウバエ属(Drosophila)Schnieder S2細胞、Sf9昆虫細胞 (WO 94/26087 (O’Connor))、哺乳動物(例、COS細胞、たとえばCOS-1 (ATCC受入番号CRL-1650)およびCOS-7 (ATCC 受入番号CRL-1651)、CHO (たとえば、ATCC受入番号CRL-9096、CHO DG44 (Urlaub, G. and Chasin, LA., Proc. Natl. Acad. Sci. USA, 77(7):4216-4220 (1980)))、293 (ATCC受入番号CRL-1573)、HeLa (ATCC受入番号CCL-2)、CV1 (ATCC受入番号CCL-70)、WOP (Dailey, L., et al., J. Virol., 54:739-749 (1985)、3T3、293T (Pear, W. S., et al., Proc. Natl. Acad. Sci. U.S.A., 90:8392-8396 (1993)、NSO細胞、SP2/0、HuT 78細胞など)、または植物(例、タバコ)由来の細胞とすることができる。(たとえば、Ausubel, F.M. et al., eds. Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons Inc. (1993)を参照されたい。)ある実施形態において、宿主細胞は、分離された宿主細胞であり、多細胞生物(たとえば、植物または動物)の一部ではない。ある実施形態において、宿主細胞はヒト以外の宿主細胞である。
ある実施形態において、本発明のポリペプチドもしくは免疫グロブリン単一可変ドメインは、適当な発現系で発現されると分泌される。本発明のアミノ酸置換または変異が発現の損失を招かないことが適当である。
追加の発現系としては、たとえば、に記載のような無細胞系がある。さらに別の実施形態において、PCT/GB2005/003243およびWO2006/046042に記載のような無細胞発現系を用いて、可変ドメインの発現を達成することができる。
本発明の実施形態に適用することができる開示の詳細に関する、WO200708515、161ページ、24行〜189ページ、10行に言及しておく。この開示は、それが本明細書の文中に明確に掲載されて本発明の実施形態に関わるとして、また、下記の請求項に組み入れるべき内容に明確な裏付けを与えるために、参考として本明細書に組み入れられる。これには、「免疫グロブリンに基づくリガンドの調製」、「ライブラリーベクター系」、「ライブラリー構築」、「単一可変ドメインの組み合わせ」、「リガンドの性質検討」、「治療用および診断用の組成物および使用」、ならびに「機能しうるように連結する」、「ナイーブな」、「予防」、「抑制」、「治療」、「治療上有効な用量」および「有効な」の定義について詳細を提供する、WO200708515、161ページ、24行〜189ページ、10行に示される内容が含まれる。
(実施例)
方法
SECおよびSEC MALLS(多角度光散乱検出器付きサイズ排除クロマトグラフィー)は、溶液中の巨大分子の特徴を明らかにするための非破壊的手法である。簡単に述べると、(通常、DulbeccoのPBSバッファー中1mg/mlの濃度の)タンパク質は、その流体力学的性質にしたがって、PBS中でサイズ排除クロマトグラフィー(使用したカラム:Tosoh Biosciences TSK gel3000 G3000SWXLおよびSuperdex200 または75 10/300GL、それぞれ(カタログ番号:17-5175-01および17-5174-01))により分離される。
方法
SECおよびSEC MALLS(多角度光散乱検出器付きサイズ排除クロマトグラフィー)は、溶液中の巨大分子の特徴を明らかにするための非破壊的手法である。簡単に述べると、(通常、DulbeccoのPBSバッファー中1mg/mlの濃度の)タンパク質は、その流体力学的性質にしたがって、PBS中でサイズ排除クロマトグラフィー(使用したカラム:Tosoh Biosciences TSK gel3000 G3000SWXLおよびSuperdex200 または75 10/300GL、それぞれ(カタログ番号:17-5175-01および17-5174-01))により分離される。
分離後、散乱光に対するタンパク質の性向を、多角度光散乱(MALLS)検出器(Wyatt, US)を用いて測定した。タンパク質が検出器を通過する間の散乱光の強度を、角度の関数として測定する。屈折率(RI)検出器により測定されたタンパク質濃度と合わせて得られたこの測定値によって、適当な等式を用いて分子量の計算が可能となる(解析ソフトウェアAstra v.5.3.4.12の必須部分)。溶出ピークの中間点での最高濃度は、約8-10μMであり、これが、結果的に、MALLSがタンパク質の溶液中での(単量体/二量体)状態を測定する濃度となる。
示差走査熱量測定(DSC)は、サンプルおよび基準物の温度を上げるのに必要とされる熱量の差を温度の関数として測定する、熱分析の技術である。それは、タンパク質における広範な温度遷移を調べるために使用することができるが、融解温度ならびに熱力学パラメーターの測定に有用である。手短に述べると、タンパク質を、180℃/時間(通常PBS中1mg/ml)という一定の割合で加熱し、熱変性に伴う検出可能な熱容量変化を温度の関数として測定する。遷移中点(Tm)を測定するが、これは、タンパク質の50%が未変性コンフォメーションをとり、残りの50%が変性している温度とされている。この状況で、調べたタンパク質の大半は、完全に可逆的にアンフォールドするわけではないので、DSCは、見かけの遷移中点(appTm)を測定した。TmもしくはappTmが高いほど、分子はいっそう安定である。この実施例で使用したソフトウェアパッケージはOriginR v7.0383 (OriginLab)であった。
分析用超遠心(AUC):沈降平衡は溶液の分子量を測定するための方法である(たとえば、Lebowitz et al. Protein Science (2002), 11:2067-2079に記載)。
本実施例において、3つの6-チャネル平衡セルに、原液サンプルを10、20、30、150、200、300、400、500および600倍希釈して作製した9つのタンパク質溶液(540〜90μg/mlの範囲)を入れた。各サンプルチャネルに、120μlタンパク質溶液を入れ、対照チャネルには、Dulbeccoリン酸緩衝生理食塩水(DPBS)希釈バッファーを入れた。上記のセルをAN90-TIローターに入れ、吸光度およびレイリー光学干渉計(屈折率検出)を備えたBeckman Coulter ProteomeLab XL-1分析用遠心機の中に設置した。3つの最高濃度について280nmで吸光度スキャンを記録した;最低濃度については230nmを用いた。温度は25℃に設定した。
その後ローターを25,000rpmの回転状態とした。次に、25,000rpmで12、16、および20時間後にセルをスキャンした。ベースライン補正を実験的に測定するために、運転終了時にローター速度を48,000rpmに上げ、1つの「オーバースピード」スキャンを8時間後に記録した。
KDALTONプログラム(Alliance Protein Laboratories, Philo et al. (1994), J.Biol.Chem.,269, p. 27840-27846; Philo, J.S. (2000), Methods Enzymol. 321, 100-120)を用いて、得られたデータを解析した。ポリペプチドの偏比容は、SENDTERPプログラム(Laue et al. (1992) In: Analytical ultracentrifugation in biochemistry and polymer science. S.E.Harding, A.J.Rowe, and J.C.Horton, eds, Royal Society of Chemistry, pp.90-125)を用いて、(与えられたアミノ酸配列から計算される)理論的アミノ酸組成に基づいて、25℃で0.7256 ml/gと算出された。DPBSの溶媒密度は、25℃で、以前行った測定に基づいて1.03994 g/mlとした。
Biacore解析:表面プラズモン共鳴(SPR)(BIAcore(商標名)、GE Healthcare)実験は、リガンド(dAb)の、その抗原(たとえば血清アルブミン、Protein Lなど)に対する結合反応速度およびKDの測定を可能にする。
単一のアルブミン結合dAb(AlbudAb(商標名))の、その抗原に対する結合親和性(KD)を測定するために、精製dAbを、HBS-EP BIAcoreバッファー中で5000 nMから39 mM(5000 nM、2500 nM、1250 nM、625 nM、312 nM、156 nM、78 nM、39 nM)までのAlbudAb濃度で、(1級アミンカップリングでCM5チップ(BIAcore)上に固定化された)ヒト血清アルブミン上に40μl/分の流速で注入した。データ解析は、機器のソフトウェア(Bia-evaluation 3.2 RC1)を用いて、通常の確立されたアルゴリズムにしたがって行った。データ解析は次のパラメーター:
KD − [M]
ka − [M-1*sec-1]
kd − [sec-1]
をもたらすが、このKDは解離平衡定数、Mはモル濃度、Kaは会合速度定数、Kdは解離速度定数、およびsecは時間・秒である。
KD − [M]
ka − [M-1*sec-1]
kd − [sec-1]
をもたらすが、このKDは解離平衡定数、Mはモル濃度、Kaは会合速度定数、Kdは解離速度定数、およびsecは時間・秒である。
dAb溶液状態を予測するためのProtein L結合速度論の利用:Protein L(PpLとも称する)は、Peptostreptococcus magnusの細胞壁で最初に発見されたB細胞スーパー抗原であって(Bjorck L. (1998) Protein L. A novel bacterial cell wall protein with affinity for Ig L chains. J Immunol, 15;140(4):1194-7)、フレームワーク1領域内の残基との相互作用によって、κアイソタイプの免疫グロブリン(Ig)軽鎖可変ドメイン(Vκ)と結合する(M. Graille, E. Stura, N. Housden, J. Beckingham, S. Bottomley, D. Beale, M. Taussig, B. Sutton, M. Gore, J. Charbonnier (2001) Complex between Peptostreptococcus magnus Protein L and a Human Antibody Reveals Structural Convergence in the Interaction Modes of Fab Binding Proteins. Structure, Volume 9, Issue 8, Pages 679-687)。菌株に応じて、Protein Lは、4つ(P. magnus菌株312)または5つ(P. magnus菌株3316)の、相同な(>70%タンパク質配列同一性)、タンデムのVκ結合ドメインを含み、これは可動性ペプチドリンカー領域で隔てられている(Kastern W, Sjobring U, Bjorck L. (1992) Structure of peptostreptococcal protein L and identification of a repeated immunoglobulin light chain-binding domain. J Biol Chem., 25;267(18):12820-5)。Protein Lがある種のVκドメインを含有するIgGまたはFab分子と結合すると、強いアビディティ効果が見られるが、この効果は、複数のProtein Lドメインが存在すること、ならびに単一Protein Lドメイン内に高親和性および低親和性の結合界面が存在することの両方によってもたらされると推定される(Kastern et al., 1992)。
当該dAbの溶液状態と相関する上記アビディティ効果の調節が観察されること、すなわち、単量体、二量体、および他のオリゴマー状態が、適正な条件下で、Protein Lに対して差のある結合反応速度を示すことが想定された。このように、Protein L結合反応速度論を、dAbの溶液状態を決定するための代用物として使用することができる。したがって、リアルタイム速度論的Protein L:dAb結合データは、代表的な溶液状態のdAbパネルに対する表面プラズモン共鳴(BIAcore)によって得られた。
4-ドメインProtein L(P. magnus3316由来;Sigma, P3101)およびビオチン化Protein A(別称b-PpA;Sigma P2165)を、pH 4.5酢酸バッファー(BIAcore)中で10μg/mlに希釈し、BIAcore CM5チップに固定化した。この結果、下記を保持するチップとなった:Fc1 = ブランク、Fc2 = 363RU b-PpA、およびFc3 = 311RU Protein L。チップ表面へのdAbの再結合を最小限にとどめるために、Protein Lの表面密度は低く、しかも流速は高くして使用した。
既知の代表的な溶液状態(SEC MALLSによりあらかじめ測定)の8つの精製Vκ dAbのパネルは、HBS-EPで2.5μMに希釈した後、156 nMまで全体で5段階に2倍段階希釈した。結合は、各希釈物100μlを流速50μl/分で注入し、BIAcore 3000(BIAcore, Sweden)機器上で600秒の解離時間をとることによって測定した。チップ表面は、サイクルの間に、pH 2.5グリシンバッファー(BIAcore)の25μlパルスで再生した。
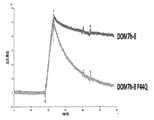
2.5μMのdAbのProtein L結合解析に関する代表的なセンサーグラムデータを示す(図1)。示されたセンサーグラムの配置および形は、調べた各dAbの濃度範囲の全体で維持された。
Protein Lで誘導体化したチップの全体にdAbを注入した後、会合段階の終点(反応ポイント1、図1参照)、および解離段階に入って5分の時点(反応ポイント2、図1参照)に設定したレポートポイントを用いて、これらの時点でProtein Lに結合したdAbの量を得ることができる(関連対照フローセルから得られた値を上記データから差し引く)。下記の等式を用いて、5分の時点で結合したdAbの割合(%B5とも呼ばれる)を決定することができる:Resp 1/Resp2 = %B5。
当該dAbが単量体であるならば、%B5は低い(典型的には0-5)が、当該dAbが二量体であれば、%B5は高くなる(典型的には60-100)。問題のdAbサンプルが単量体と二量体溶液状態の間の平衡状態で存在する場合、または単量体と二量体の混合物からなる場合、%B5の値は、単量体と二量体dAbの%B5の間となる。したがって、%B5値は、当該dAbの予想される溶液状態を数字で表すものである。
Vκ単量体および二量体に関するProtein L結合反応速度には明確な差異が示されたので、解離の速度および程度に基づいて、溶液状態間の区別が可能となった。それぞれのdAbに関する曲線の相対的配置および形は、分析した濃度に関わりなく不変であったことに留意すべきである。ラングミュア(Langmuir)1:1モデルへのカーブフィッティングは、on-rateについてはこれが急激すぎると判断されたので試みられず、off-rate(kd)に関するフィッティングは、解離曲線の激しい二相性により妨げられた。
関連の対照dAbを用いて、単量体および二量体が見いだされる範囲を明らかにすることができるので、dAbの溶液状態を予測することができる。
さまざまなV L 免疫グロブリン単一可変ドメインにおけるA43D変異の影響
抗原に対する結合親和性を有するいくつかのdAbを取り上げ、変異を導入して、43位のアミノ酸(A)を(D)で置き換えた。変異は、部位特異的変異誘発によって導入した。
抗原に対する結合親和性を有するいくつかのdAbを取り上げ、変異を導入して、43位のアミノ酸(A)を(D)で置き換えた。変異は、部位特異的変異誘発によって導入した。
下記のdAbを取り上げた:
PEP1-5-19 (抗TNFα dAb):
DIQMTQSPSSLSASVGDRVTITCRASQSIDSYLHWYQQKPGKAPKLLIYSASELQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQVVWRPFTFGQGTKVEIKR (配列番号1)
DOM15-10 (抗ヒトVEGF dAb)
DIQMTQSPSSLSASVGDRVTITCRASQWIGPELSWYQQKPGKAPKLLIYHTSILQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYMFQPRTFGQGTKVEIRR (配列番号2)
DOM13-25-3 (抗CEA dAb)
DIQMTQSPSSLSASVGDRVTITCRASQSIGPWLSWYQQKPGKAPKLLFYQVSRLQSGVPSRFSGSGSGTDFTLTIISLQPEDFATYYCQQNLAPPYTFGQGTKVEIKR (配列番号3)
DOM9-155-25 (抗IL-4 抗Fcn dAb)
DIQMTQSPSSLSASVGDRVTITCRASRPISDWLHWYQQKPGKAPKLLIAWASTLDSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQEGWGPPTFGQGTKVEIKR (配列番号4)
DOM7h-14 (抗HSA dAb)
DIQMTQSPSSLSASVGDRVTITCRASQWIGSQLSWYQQKPGKAPKLLIMWRSSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCAQGAALPRTFGQGTKVEIKR (配列番号5)
溶液中の状態は上記のようにSEC-MALLSで測定した:
PEP1-5-19 (抗TNFα dAb):
DIQMTQSPSSLSASVGDRVTITCRASQSIDSYLHWYQQKPGKAPKLLIYSASELQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQVVWRPFTFGQGTKVEIKR (配列番号1)
DOM15-10 (抗ヒトVEGF dAb)
DIQMTQSPSSLSASVGDRVTITCRASQWIGPELSWYQQKPGKAPKLLIYHTSILQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYMFQPRTFGQGTKVEIRR (配列番号2)
DOM13-25-3 (抗CEA dAb)
DIQMTQSPSSLSASVGDRVTITCRASQSIGPWLSWYQQKPGKAPKLLFYQVSRLQSGVPSRFSGSGSGTDFTLTIISLQPEDFATYYCQQNLAPPYTFGQGTKVEIKR (配列番号3)
DOM9-155-25 (抗IL-4 抗Fcn dAb)
DIQMTQSPSSLSASVGDRVTITCRASRPISDWLHWYQQKPGKAPKLLIAWASTLDSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCLQEGWGPPTFGQGTKVEIKR (配列番号4)
DOM7h-14 (抗HSA dAb)
DIQMTQSPSSLSASVGDRVTITCRASQWIGSQLSWYQQKPGKAPKLLIMWRSSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCAQGAALPRTFGQGTKVEIKR (配列番号5)
溶液中の状態は上記のようにSEC-MALLSで測定した:
表1:dAbおよびA43D変異体の生物物理学的性質
元の境界面の残基で変異誘発させたDOM7h-8またはDOM7h-14ライブラリーの調製および解析
背景:ヒト軽鎖サブグループhuVκI (DPK9) に由来する2つのVκ dAbを変異解析のために選択したが、そのDOM7h-8 (WO05/118642に記載) およびDOM7h-14 (WO2008/096158に記載)は、いずれもヒト血清アルブミン(HSA)と結合する。便宜のために、使用されたDOM7h-8クローンは、Bsa I制限酵素認識部位を除去するサイレント変異を有する(↓ は制限酵素が切断する部位を示す;制限酵素認識部位は、51位のサイレントなCからTへの変異によって破壊される)。ヒトVκ軽鎖はProtein Lに結合する(下記のより詳細に記載する)。Protein L結合の維持は、免疫グロブリンドメインの適切なフォールディングを明確に示す。
背景:ヒト軽鎖サブグループhuVκI (DPK9) に由来する2つのVκ dAbを変異解析のために選択したが、そのDOM7h-8 (WO05/118642に記載) およびDOM7h-14 (WO2008/096158に記載)は、いずれもヒト血清アルブミン(HSA)と結合する。便宜のために、使用されたDOM7h-8クローンは、Bsa I制限酵素認識部位を除去するサイレント変異を有する(↓ は制限酵素が切断する部位を示す;制限酵素認識部位は、51位のサイレントなCからTへの変異によって破壊される)。ヒトVκ軽鎖はProtein Lに結合する(下記のより詳細に記載する)。Protein L結合の維持は、免疫グロブリンドメインの適切なフォールディングを明確に示す。
使用したDOM7h-8およびDOM7h-14のヌクレオチドおよびアミノ酸配列は下記の通りである:
DOM7h-8
ヌクレオチド配列:
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATC↓TGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCAGAGCATTAGCAGCTATTTAAATTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATCGGAATTCCCCTTTGCAAAGTGGGGTCCCATCACGTTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCTACGTACTACTGTCAACAGACGTATAGGGTGCCTCCTACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGG (配列番号6)
アミノ酸配列:
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYRNSPLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQTYRVPPTFGQGTKVEIKR (配列番号7)
DOM7h-14
ヌクレオチド配列:
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCAGTGGATTGGGTCTCAGTTATCTTGGTACCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCATGTGGCGTTCCTCGTTGCAAAGTGGGGTCCCATCACGTTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCTACGTACTACTGTGCTCAGGGTGCGGCGTTGCCTAGGACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGG (配列番号8)
アミノ酸配列:
DIQMTQSPSSLSASVGDRVTITCRASQWIGSQLSWYQQKPGKAPKLLIMWRSSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCAQGAALPRTFGQGTKVEIKR (配列番号9)
上記dAbの生化学的性質を以下に示す。
DOM7h-8
ヌクレオチド配列:
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATC↓TGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCAGAGCATTAGCAGCTATTTAAATTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATCGGAATTCCCCTTTGCAAAGTGGGGTCCCATCACGTTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCTACGTACTACTGTCAACAGACGTATAGGGTGCCTCCTACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGG (配列番号6)
アミノ酸配列:
DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYRNSPLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQTYRVPPTFGQGTKVEIKR (配列番号7)
DOM7h-14
ヌクレオチド配列:
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCAGTGGATTGGGTCTCAGTTATCTTGGTACCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCATGTGGCGTTCCTCGTTGCAAAGTGGGGTCCCATCACGTTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCTACGTACTACTGTGCTCAGGGTGCGGCGTTGCCTAGGACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGG (配列番号8)
アミノ酸配列:
DIQMTQSPSSLSASVGDRVTITCRASQWIGSQLSWYQQKPGKAPKLLIMWRSSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCAQGAALPRTFGQGTKVEIKR (配列番号9)
上記dAbの生化学的性質を以下に示す。
表2:DOM7h-8およびDOM7h-14の生物物理学的性質および抗原結合化学量論。
DOM7h-8は二量体としてHSAと結合する(表2を参照されたい)。元のVH/VL境界面にある残基を分析のために選択した。これらの変異は、dAbに抗原結合活性を与える超可変CDR領域とは対照的に、Vκドメイン抗体の保存されたフレームワーク領域内にある。
DOM7h-14はPBS中250μM未満の濃度で主に単量体として存在する(表2を参照されたい)。DOM7h-14を含めることによって、すでに主として単量体状態であるdAbの抗原結合およびProtein L結合活性に及ぼす、変異の影響を評価することが可能になる。
実施例2A - DOM7h-8
DOM7h-8については、元のVH/VL境界面にある残基、Q38、A43およびP44の変異を有する3つの個別のライブラリーを作製した:
大腸菌発現ベクターpDOM5の中のDOM7h-8を鋳型として用いて、部位特異的変異誘発によって変異を導入した(pDOM5はLacZプロモーターの制御下で、pUC119に基づく発現ベクターである)。部位特異的変異誘発は、鋳型である100 ngプラスミドDNA、およびそれぞれ必要な変異を含有する相補的プライマーを用いて、PCRによって行った。反応は、2.5U PfuTurboポリメラーゼ (Stratagene)をPCR混合物 [100ng プラスミドテンプレート、プライマー (各2μM)、dNTP (各0.2mM)、1% (v/v) ホルムアミド/1x PfuTurboバッファー(Stratagene)]に添加することにより、ホットスタートで開始した。反応は次の温度サイクルで行った[94℃ 2分;18回 (94℃ 30秒、55℃ 30秒、および68℃ 20分);68℃ 2分;10℃保持]。PCR反応物をQIAquick PCR精製キット(Qiagen)で精製し、50μl H2Oで溶出した。精製DNAを、DpnI(New England Biolabs)で1時間、制限酵素消化して、インプットプラスミドテンプレートを除去した。制限酵素処理したDNAサンプルをエタノール沈殿して、5μl H2Oに懸濁した。沈殿したDNAを、2xTY/カルベニシリン0.1 mg/mlプレート上に蒔いた、化学的にコンピテントにした大腸菌細胞に入れて形質転換し、37℃にて一晩インキュベートした。
DOM7h-8については、元のVH/VL境界面にある残基、Q38、A43およびP44の変異を有する3つの個別のライブラリーを作製した:
大腸菌発現ベクターpDOM5の中のDOM7h-8を鋳型として用いて、部位特異的変異誘発によって変異を導入した(pDOM5はLacZプロモーターの制御下で、pUC119に基づく発現ベクターである)。部位特異的変異誘発は、鋳型である100 ngプラスミドDNA、およびそれぞれ必要な変異を含有する相補的プライマーを用いて、PCRによって行った。反応は、2.5U PfuTurboポリメラーゼ (Stratagene)をPCR混合物 [100ng プラスミドテンプレート、プライマー (各2μM)、dNTP (各0.2mM)、1% (v/v) ホルムアミド/1x PfuTurboバッファー(Stratagene)]に添加することにより、ホットスタートで開始した。反応は次の温度サイクルで行った[94℃ 2分;18回 (94℃ 30秒、55℃ 30秒、および68℃ 20分);68℃ 2分;10℃保持]。PCR反応物をQIAquick PCR精製キット(Qiagen)で精製し、50μl H2Oで溶出した。精製DNAを、DpnI(New England Biolabs)で1時間、制限酵素消化して、インプットプラスミドテンプレートを除去した。制限酵素処理したDNAサンプルをエタノール沈殿して、5μl H2Oに懸濁した。沈殿したDNAを、2xTY/カルベニシリン0.1 mg/mlプレート上に蒔いた、化学的にコンピテントにした大腸菌細胞に入れて形質転換し、37℃にて一晩インキュベートした。
プライマーは次のとおりであった。
Q38 (プライマー:
5’-GCAGCTATTTAAATTGGTATCAGNNKAAACCAGGGAAAGCCCC-3’ (配列番号10);
5’-GGGGCTTTCCCTGGTTTMNNCTGATACCAATTTAAATAGCTGC-3’ (配列番号11))、
A43 (プライマー:
5’-CAGCAGAAACCAGGGAAANNKCCTAAGCTCCTGATCTATCGG-3’ (配列番号12);
5’-CCGATAGATCAGGAGCTTAGGMNNTTTCCCTGGTTTCTGCTG-3’ (配列番号13))、
P44 (プライマー:
5’-CAGCAGAAACCAGGGAAAGCCNNKAAGCTCCTGATCTATCGGAATTCCC-3’ (配列番号14);
5’-GGGAATTCCGATAGATCAGGAGCTTMNNGGCTTTCCCTGGTTTCTGCTG-3’ (配列番号15))。
5’-GCAGCTATTTAAATTGGTATCAGNNKAAACCAGGGAAAGCCCC-3’ (配列番号10);
5’-GGGGCTTTCCCTGGTTTMNNCTGATACCAATTTAAATAGCTGC-3’ (配列番号11))、
A43 (プライマー:
5’-CAGCAGAAACCAGGGAAANNKCCTAAGCTCCTGATCTATCGG-3’ (配列番号12);
5’-CCGATAGATCAGGAGCTTAGGMNNTTTCCCTGGTTTCTGCTG-3’ (配列番号13))、
P44 (プライマー:
5’-CAGCAGAAACCAGGGAAAGCCNNKAAGCTCCTGATCTATCGGAATTCCC-3’ (配列番号14);
5’-GGGAATTCCGATAGATCAGGAGCTTMNNGGCTTTCCCTGGTTTCTGCTG-3’ (配列番号15))。
多様性を導入するために使用されるNNKコドンは、20個のアミノ酸すべてとTAG終止コドンをコードする。Protein Lと結合すると確認されたクローンは、プライマーDOM8(AGCGGATAACAATTTCACACAGGA (配列番号16))を用いて配列決定した。
各ライブラリーから96個のコロニーを無作為に採取して96ウェルプレートフォーマットに入れ、メーカーの説明書(Novagen)にしたがって、OnEx溶液1、2および3を添加した1 ml 2xTY 0.1mg/ml カルベニシリン中で発現させた。培養物はInforsHT振盪器内で、950 rpm高湿度で3日間、30℃にて増殖させた。細胞を遠心分離(ベンチトップSorvall遠心機にて4.5k rpm、30分)によりペレットとし、上清75μlを等量のHBS-EPバッファー(GE Healthcare)に加えた。発現した上清を、ストレプトアビジンコートBIAcoreチップ(495 RU)に結合したビオチン化Protein L(Pierce)を用いて、Protein Lの結合についてBIAcoreでスクリーニングした。Protein Lとの結合が確認されたクローンは、プライマーDOM8(上記の配列番号16)を用いて配列決定した。
Q38、A43およびP44位でのアミノ酸変異のすべてを得るために、ライブラリーのランダムスクリーニングでは確認されなかったクローンを部位特異的変異誘発によって作製したが、これには、表3に挙げたプライマーとともに、鋳型として、大腸菌発現ベクターpDOM5中のDOM7h-8を使用した。
DOM7h-8変異体のスクリーニング: コグネイトHSA結合およびスーパー抗原Protein Lに対するdAb結合活性の特徴を明らかにするために、細菌上清からの精製の前後で、Q38、A43、またはP44位のDOM7h-8変異体をBIAcoreでスクリーニングした。精製タンパク質に対してSECおよびSEC MALLSを使用し、親dAbおよび変異体のオリゴマー化状態の特徴を明らかにした。
Protein LおよびHSA結合活性に関する細菌上清中のdAbのスクリーニング:細菌クローンを採取して96ウェルプレートフォーマットに入れ、メーカーの説明書(Novagen)にしたがって、OnEx溶液1、2および3を添加した1 ml 2xTY 0.1mg/ml カルベニシリン中で発現させた。培養物はInforsHT振盪器内で、950 rpm高湿度で3日間、30℃にて増殖させた。細胞を遠心分離(ベンチトップSorvall遠心機にて4.5k、30分)によりペレットとし、上清75μlを等量のHBS-EPバッファー(GE Healthcare)に加えた。希釈された上清を、CM5 BIAcoreチップ(789 RU)にカップリングしたProtein L(Sigma)および同じCM5チップ(6036RU)上の別のフローセルに結合したHSAを用いて、Protein Lの結合についてBIAcoreでスクリーニングした(表4〜6を参照されたい)。
Protein LおよびHSA結合をアッセイするための、ならびにSECおよびSEC MALLS分析のための、V κ dAbの精製:メーカーの説明書(Novagen)にしたがって、OnEx溶液1、2および3を添加した2xTY カルベニシリン100μg/ml、消泡剤、中の0.5 l培養において、Q38、A43、またはP44位でのDOM7h-8変異体を発現する全クローンからタンパク質を発現させた。培養物は、InforsHT振盪器内で、250 rpmで3日間、30℃にて増殖させた。培養物は、ベンチトップ遠心機で45分間4,500rpmで遠心分離し、回転させながら2時間Streamline Protein L 15mlにバッチ結合させることによって、清澄化した上清からタンパク質を精製した。高塩濃度PBSバッファーで十分に洗浄した後、0.1Mグリシン pH 2を用いてタンパク質を、>95%の純度で樹脂から溶出した。さらに生化学的/生物物理学的な性質検討を行う前に、タンパク質を濃縮し、バッファーをPBSに交換した。
1μM、500nM、250nM、125nM、62.5nMおよび31.25nMの濃度範囲の精製タンパク質は、CM5チップ上の別々のフローセルにカップリングした、Protein L(311RU)との結合およびHSA(559RU)との結合について、BIAcoreでアッセイした。親分子DOM7h-8(二量体)より有意に早くProtein Lから解離するクローンは、安定な単量体か、または二量体と平衡状態にある単量体のいずれかであるとされた(図2;表4〜6を参照されたい)。精製タンパク質は、HSA結合についても分析し、抗原と接触するdAbのCDR領域のコンフォメーションに及ぼす変異の影響を評価した(表4〜6を参照されたい)。
表4-6:DOM7h-8発現上清および精製タンパク質のBIAcoreおよび生物物理学的分析。網掛けした行は、DOM7h-8 Vκ dAb二量体を単量体化する変異を特定する。(xはBIAcoreチップ上に固定化されたリガンドに結合しないことを示す;√ はBIAcoreチップ上に固定化されたリガンドとの良好な結合を示す;√wはBIAcoreチップ上に固定化されたリガンドとの弱い結合を示す;Mは単量体を示す;Dは二量体を示す;M/Dは二量体と平衡状態にある単量体を示す;D/Tはサンプル中にdAb二量体および三量体が存在することを示す;* は平衡状態でないM/Dが、より単量体に向かう傾向があることを示す)。
結論:P44での変異は、DOM7h-8の溶液中の状態を変化させる。いくつかの変異が二量体DOM7h-8を単量体化する。
2B) DOM7h-14
DOM7h-14について、元のVH/VL境界面にある残基、Q38、A43およびP44に変異を有する3つの個別のライブラリーを作製した。大腸菌発現ベクターpDOM5の中のDOM7h-14を鋳型として使用し、さらに上記のようにNNKコドンを用いて、部位特異的変異誘発によって変異を導入した。プライマーは次のとおりであった:
Q38
(プライマー:
5’-GGGTCTCAGTTATCTTGGTACCAGNNKAAACCAGGGAAAGCCCC-3’ (配列番号37);
5’-GGGGCTTTCCCTGGTTTMNNCTGGTACCAAGATAACTGAGACCC-3’ (配列番号38))
A43
(プライマー:
5’-CAGCAGAAACCAGGGAAANNKCCTAAGCTCCTGATCATGTGG-3’ (配列番号39);
5’-CCACATGATCAGGAGCTTAGGMNNTTTCCCTGGTTTCTGCTG-3’ (配列番号40)); または
P44
(プライマー:
5’-CAGCAGAAACCAGGGAAAGCCNNKAAGCTCCTGATCATGTGGCGTTCC-3’ (配列番号41);
5’-GGAACGCCACATGATCAGGAGCTTMNNGGCTTTCCCTGGTTTCTGCTG-3’(配列番号42))
スクリーニングするために、ライブラリーで大腸菌HB2151細胞を形質転換した。
DOM7h-14について、元のVH/VL境界面にある残基、Q38、A43およびP44に変異を有する3つの個別のライブラリーを作製した。大腸菌発現ベクターpDOM5の中のDOM7h-14を鋳型として使用し、さらに上記のようにNNKコドンを用いて、部位特異的変異誘発によって変異を導入した。プライマーは次のとおりであった:
Q38
(プライマー:
5’-GGGTCTCAGTTATCTTGGTACCAGNNKAAACCAGGGAAAGCCCC-3’ (配列番号37);
5’-GGGGCTTTCCCTGGTTTMNNCTGGTACCAAGATAACTGAGACCC-3’ (配列番号38))
A43
(プライマー:
5’-CAGCAGAAACCAGGGAAANNKCCTAAGCTCCTGATCATGTGG-3’ (配列番号39);
5’-CCACATGATCAGGAGCTTAGGMNNTTTCCCTGGTTTCTGCTG-3’ (配列番号40)); または
P44
(プライマー:
5’-CAGCAGAAACCAGGGAAAGCCNNKAAGCTCCTGATCATGTGGCGTTCC-3’ (配列番号41);
5’-GGAACGCCACATGATCAGGAGCTTMNNGGCTTTCCCTGGTTTCTGCTG-3’(配列番号42))
スクリーニングするために、ライブラリーで大腸菌HB2151細胞を形質転換した。
DOM7h-14のQ38、A43、またはP44位での全アミノ酸バリアントの単離:プライマーDOM8(上記配列番号16)およびDOM9(CGCCAGGGTTTTCCCAGTCACGAC (配列番号75))を用いて、Q38、A43、もしくはP44位で変異させたDOM7h-14ライブラリーからランダムに選択した96コロニーについて、コロニースクリーンPCRを行った。PCR産物を、DOM8(上記配列番号16)を用いて配列決定し、Protein L結合を分析して、全dAbが発現されること、ならびにそれらがProtein L結合を維持していることを確認した。
最初のスクリーニングの試みから得られないクローンは、下記のプライマーを用いて、部位特異的変異誘発で作製した(表7):
表7:NNKライブラリーにおいて確認されなかったQ38、A43、またはP44位でのDOM7h-14変異体を作製するための部位特異的変異誘発用プライマーペア
表7:NNKライブラリーにおいて確認されなかったQ38、A43、またはP44位でのDOM7h-14変異体を作製するための部位特異的変異誘発用プライマーペア
DOM7h-14変異体のスクリーニング:Vκ dAbの構造、ひいては抗原結合活性に影響を及ぼすQ38、A43、またはP44での変異の可能性を特徴付けるために、単量体Vκ dAb DOM7h-14のQ38、A43、またはP44位での全アミノ酸バリアントを、Protein LおよびHSA結合活性についてBIAcoreでスクリーニングした。同一チップ上の別々のフローセルに存在するProtein Lとの結合は、dAb発現が生じたこと、または損なわれなかったことを確認した。
Protein LおよびHSA結合に関する発現上清のスクリーニング:細菌クローンを採取して96ウェルプレートフォーマットに入れ、メーカーの説明書(Novagen)にしたがって、OnEx溶液1、2および3を添加した1 ml 2xTY 0.1mg/ml カルベニシリン中で発現させた。培養物はInforsHT振盪器内で、950 rpm高湿度で3日間、30℃にて増殖させた。細胞を遠心分離(ベンチトップSorvall遠心機にて4.5k、30分)によりペレットとし、上清75μlを等量のHBS-EPバッファー(GE Healthcare)に加えた。発現上清を、CM5 BIAcoreチップ(789 RU)にカップリングしたProtein L(Sigma)および同じCM5チップ(6036RU)上の別のフローセルにカップリングしたHSAを用いて、Protein Lの結合についてBIAcoreでスクリーニングした(表8を参照されたい)。
表8:Protein Lおよび抗原(HSA)結合に関するDOM7h-14発現上清のBIAcore分析。(√は結合を示す;ndは未測定を示す)。
結論:調べたすべての変異体は、Protein Lに結合し、HSA結合を維持しているので、これは変異がdAb構造ひいては抗原結合に影響を与えないことを示す。
PEP1-5-19 P44変異体のスクリーニング
別のクローンで変異を引き起こすことの効果を究明するために、プライマーとともに、大腸菌発現ベクターpDOM5内のPEP1-5-19を鋳型として使用して、PEP1-5-19のP44での変異を部位特異的変異誘発により引き起こした。
別のクローンで変異を引き起こすことの効果を究明するために、プライマーとともに、大腸菌発現ベクターpDOM5内のPEP1-5-19を鋳型として使用して、PEP1-5-19のP44での変異を部位特異的変異誘発により引き起こした。
5’-GCAGAAACCAGGGAAAGCCNNKAAGCTCCTGATCTATAGTGC-3’ (配列番号57)、
5’-GCACTATAGATCAGGAGCTTMNNGGCTTTCCCTGGTTTCTGC-3’(配列番号58)。
5’-GCACTATAGATCAGGAGCTTMNNGGCTTTCCCTGGTTTCTGC-3’(配列番号58)。
親PEP1-5-19、ならびにPEP1-5-19 P44ライブラリーからランダムに選択した94コロニーを、96ウェルプレートフォーマットで、メーカーの説明書(Novagen)にしたがって、OnEx溶液1、2および3を添加した1 ml 2xTY 0.1mg/ml カルベニシリン中で発現させた。培養物はInforsHT振盪器内で、950 rpm高湿度で3日間、30℃にて増殖させた。細胞を遠心分離(ベンチトップSorvall遠心機にて4.5k rpm、30分)によりペレットとし、上清75μlを等量のHBS-EPバッファー(GE Healthcare)に加えた。発現上清を、CM5 BIAcoreチップにカップリングしたProtein L(Sigma)を用いて、Protein Lの結合についてBIAcore(311RU)でスクリーニングした。すべてのクローンはプライマーDOM8(上記配列番号16)を用いて配列決定した。親分子PEP1-5-19(二量体)より有意に早くProtein Lから解離するクローンは、安定な単量体か、または二量体と平衡状態にある単量体のいずれかであるとされた(表9を参照されたい)。
表9:Protein L結合に関するPEP1-5-19 P44変異体の上清スクリーニング(Dは二量体を示す;Mは単量体を示す;M/Dは単量体/二量体を示す;ndは配列決定した94クローンの中に変異体が特定されなかったため未測定)。
結論:P44位でのDOM7h-8変異体について見られたように、変異は、元の二量体PEP1-5-19の溶液中の状態を変化させた。
43位で変異させたナイーブなV κ dAbプールの構築
元のVH/VL境界面での変異が、ナイーブライブラリーに関連するdAbライブラリーの単量体含量を高める可能性について、さらに理解を深めるために、4G Vκ dAbライブラリー(WO2005093074に記載)を用いて、部位特異的変異誘発により43位に変異を導入した。このアプローチによって、普遍的で幅広い視点で変異を分析することが可能となるが、それは、特定の変異が、さまざまなCDRの組み合わせおよび組成を越えて有効となることを示唆する。
元のVH/VL境界面での変異が、ナイーブライブラリーに関連するdAbライブラリーの単量体含量を高める可能性について、さらに理解を深めるために、4G Vκ dAbライブラリー(WO2005093074に記載)を用いて、部位特異的変異誘発により43位に変異を導入した。このアプローチによって、普遍的で幅広い視点で変異を分析することが可能となるが、それは、特定の変異が、さまざまなCDRの組み合わせおよび組成を越えて有効となることを示唆する。
プライマーは、Fw 2の43位をA43A、-D、-K、-R、-E、-Iまたは-L のいずれかに変更するようにStratagene Quikchangeプライマー設計ソフトウェアで設計し、Sigmaで合成された(OD 1μmolスケールまで合成し、PAGEで合成した)。
プライマー配列:
A43A_fwd: gcagaaaccagggaaagcccctaagctcctgatc (配列番号59)
A43A_rev: gatcaggagcttaggggctttccctggtttctgc (配列番号60)
A43D_fwd: gcagaaaccagggaaagaccctaagctcctgatc (配列番号61)
A43D_rev: gatcaggagcttagggtctttccctggtttctgc (配列番号62)
A43K_fwd: aaattggtaccagcagaaaccagggaaaaagcctaagctcctgatc (配列番号63)
A43K_rev: gatcaggagcttaggctttttccctggtttctgctggtaccaattt (配列番号64)
A43R_fwd: gtaccagcagaaaccagggaaacggcctaagctcctg (配列番号65)
A43R_rev: caggagcttaggccgtttccctggtttctgctggtac (配列番号66)
A43E_fwd: cagcagaaaccagggaaagagcctaagctcctgatctatg (配列番号67)
A43E_rev: catagatcaggagcttaggctctttccctggtttctgctg (配列番号68)
A43I_fwd: ggtaccagcagaaaccagggaaaatccctaagctcct (配列番号69)
A43I_rev: aggagcttagggattttccctggtttctgctggtacc (配列番号70)
A43L_fwd: tggtaccagcagaaaccagggaaactgcctaagctcctga (配列番号71)
A43L_rev: tcaggagcttaggcagtttccctggtttctgctggtacca (配列番号72)
50 mlの2 x TY培地 + カルベニシリン100μg/mlに、pDOM10グリセロール原液中のナイーブ4G Vκライブラリー50μlを接種し、37℃にて一晩インキュベートした。Qiagen QIAfilter midi-prepを用いて、メーカーの使用説明書にしたがって、プラスミドDNAを単離した。pDOM10は、dAbの可溶性発現のために設計されたプラスミドベクターである。これはpUC119ベクターを基にしており、発現はLacZプロモーターの制御下である。dAbの上清中への発現は、dAb遺伝子をN末端で、一般的なGASリーダーシグナルペプチド(WO2005093074参照)に融合させることによって確実となった。それに加えて、FLAGタグがdAbのC末端に付加された。
A43A_fwd: gcagaaaccagggaaagcccctaagctcctgatc (配列番号59)
A43A_rev: gatcaggagcttaggggctttccctggtttctgc (配列番号60)
A43D_fwd: gcagaaaccagggaaagaccctaagctcctgatc (配列番号61)
A43D_rev: gatcaggagcttagggtctttccctggtttctgc (配列番号62)
A43K_fwd: aaattggtaccagcagaaaccagggaaaaagcctaagctcctgatc (配列番号63)
A43K_rev: gatcaggagcttaggctttttccctggtttctgctggtaccaattt (配列番号64)
A43R_fwd: gtaccagcagaaaccagggaaacggcctaagctcctg (配列番号65)
A43R_rev: caggagcttaggccgtttccctggtttctgctggtac (配列番号66)
A43E_fwd: cagcagaaaccagggaaagagcctaagctcctgatctatg (配列番号67)
A43E_rev: catagatcaggagcttaggctctttccctggtttctgctg (配列番号68)
A43I_fwd: ggtaccagcagaaaccagggaaaatccctaagctcct (配列番号69)
A43I_rev: aggagcttagggattttccctggtttctgctggtacc (配列番号70)
A43L_fwd: tggtaccagcagaaaccagggaaactgcctaagctcctga (配列番号71)
A43L_rev: tcaggagcttaggcagtttccctggtttctgctggtacca (配列番号72)
50 mlの2 x TY培地 + カルベニシリン100μg/mlに、pDOM10グリセロール原液中のナイーブ4G Vκライブラリー50μlを接種し、37℃にて一晩インキュベートした。Qiagen QIAfilter midi-prepを用いて、メーカーの使用説明書にしたがって、プラスミドDNAを単離した。pDOM10は、dAbの可溶性発現のために設計されたプラスミドベクターである。これはpUC119ベクターを基にしており、発現はLacZプロモーターの制御下である。dAbの上清中への発現は、dAb遺伝子をN末端で、一般的なGASリーダーシグナルペプチド(WO2005093074参照)に融合させることによって確実となった。それに加えて、FLAGタグがdAbのC末端に付加された。
部位特異的変異誘発反応は、Stratagene Quikchange IIキットを用いて、下記を除いてメーカーのプロトコールにしたがって行った。反応は次のように実施した:(50μl反応液あたり)5μl 10x反応バッファー、1.55μl(120 ng)pDOM10ナイーブ4G Vκ Midiprep、1.25μlフォワードプライマー(125 ng)、1.25μlリバースプライマー(125 ng)、1μl dNTPミックス、38.95μl滅菌水、1μl Pfu ultra。変異誘発は以下のPCRプログラムで行った。1.95℃ 30秒、2.95℃ 30秒、3.55℃ 1分、4.68℃ 4分、5.ステップ2〜4を17サイクル、6.4℃に保持。1μl Dpn Iを各反応液に添加し、37℃にて1時間インキュベートした。
5μlの各Dpn I消化反応液を、50μlに分けたエレクトロコンピテントなHB2151大腸菌細胞と混合し、0.2 cmエレクトロポレーションキュベット(Biorad)に入れて30分間氷上でインキュベートし、標準的な大腸菌K12の設定(2.5 kV/cm、25μF、200Ω)でエレクトロポレーションすることによって、形質転換した。950μlの加温したSOC培地(Invitrogen, 15544-034)を、エレクトロポレーション後直ちに加え、14 ml Falconチューブに移し、37℃にて200 rpmで1時間インキュベートした。回収培養物のすべてをLB + カルベニシリン100μg/mlに蒔き(330μl x 3)、37℃にて一晩インキュベートした。QPix2XT (Genetix)を用いて、クローンを採取して、125μl 2 x TY + 2%グルコース + 100 μg/mlカルベニシリンを容れた96ウェルプレート(Corning)に入れ、37℃にて、250 rpmで一晩、加湿インキュベーター(New Brunswick)内でインキュベートした。
発現培養は、各ライブラリープールから2プレートについて準備した:1 ml TB + 個別のOnEx (Invitrogen)成分(1L培地あたり:20 ml溶液1、50 ml溶液2、1 ml溶液3) + カルベニシリン100μg/ml + 消泡剤 (A204, Sigma) 2滴を2 ml深型ウェル・ブロックに加えた。培養物は30℃にて750 rpm、湿度85%で3日間インキュベートした。その後、粗製上清を集め、4℃にて4500 rpmで30分間遠心して清澄化し、-80℃で保存した。
ナイーブライブラリーをバックグラウンドとしてA43D、-K、-R、-E、-Iおよび-Lについて、単量体化能力、発現、および安定化効果をランク付けする
上記A43変異体ライブラリーから作製された粗製上清サンプルを、上記方法の項で記載のように、BIAcore 3000機器(BIAcore, Sweden)を用いてProtein L結合により分析した。2つの別々のBIAcore CM5チップを用いてデータを収集した;2つのチップはいずれも、フローセル2および3(Fc2およびFc3)において小量(約500〜700 RU)のProtein Lで誘導体化されており、フローセル1(Fc1)においてブランクの活性化-不活化表面を有する。結果を図3に示す。
上記A43変異体ライブラリーから作製された粗製上清サンプルを、上記方法の項で記載のように、BIAcore 3000機器(BIAcore, Sweden)を用いてProtein L結合により分析した。2つの別々のBIAcore CM5チップを用いてデータを収集した;2つのチップはいずれも、フローセル2および3(Fc2およびFc3)において小量(約500〜700 RU)のProtein Lで誘導体化されており、フローセル1(Fc1)においてブランクの活性化-不活化表面を有する。結果を図3に示す。
データ解析は、Microsoft Excelにエクスポートされた、Fc2-1またはFc3-1からのレポートポイントテーブルを用いて行った。2つのレポートポイントは上記方法に含まれ、%B5値が得られた。この%B5値を用いてクローンをランク付けした。対照dAb DOM7h-8(二量体対照、64% ±5)およびDOM4-130-54(単量体対照、4% ±5)に対する%B5値を用いて、クローンを、単量体(SM)、二量体(SD)、または迅速平衡状態(RE)として分類した。
DOM4-130-54のアミノ酸配列および核酸配列は下記の通りである:
DOM4-130-54
ヌクレオチド配列:
ATGTTATTTAAATCATTATCAAAATTAGCAACCGCAGCAGCATTTTTTGCAGGCGTGGCAACAGCGTCGACGGACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCAGGATATTTACCTGAATTTAGACTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCAATTTTGGTTCCGAGTTGCAAAGTGGTGTCCCATCACGTTTCAGTGGCAGTGGATATGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTCGCTACGTACTACTGTCAACCGTCTTTTTACTTCCCTTATACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGGGCGGCCGCAGAACAAAAACTCATCTCAGAAGAGGATCTGAATTAATAA (配列番号73)
アミノ酸配列
MLFKSLSKLATAAAFFAGVATASTDIQMTQSPSSLSASVGDRVTITCRASQDIYLNLDWYQQKPGKAPKLLINFGSELQSGVPSRFSGSGYGTDFTLTISSLQPEDFATYYCQPSFYFPYTFGQGTKVEIKRA (配列番号74)。
DOM4-130-54
ヌクレオチド配列:
ATGTTATTTAAATCATTATCAAAATTAGCAACCGCAGCAGCATTTTTTGCAGGCGTGGCAACAGCGTCGACGGACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCAGGATATTTACCTGAATTTAGACTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCAATTTTGGTTCCGAGTTGCAAAGTGGTGTCCCATCACGTTTCAGTGGCAGTGGATATGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTCGCTACGTACTACTGTCAACCGTCTTTTTACTTCCCTTATACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGGGCGGCCGCAGAACAAAAACTCATCTCAGAAGAGGATCTGAATTAATAA (配列番号73)
アミノ酸配列
MLFKSLSKLATAAAFFAGVATASTDIQMTQSPSSLSASVGDRVTITCRASQDIYLNLDWYQQKPGKAPKLLINFGSELQSGVPSRFSGSGYGTDFTLTISSLQPEDFATYYCQPSFYFPYTFGQGTKVEIKRA (配列番号74)。
次の場合はクローンをスプレッドシート分析から除外した:レスポンス1 = <50 RU、かつレスポンス2 = 負の値、もしくはレスポンス1 = 負の値、または配列決定から43位の残基がAである(これがSDMによって変更されたライブラリーの場合)ことが判明した場合、または配列決定から推定上対をなしていないシステイン残基がdAb中に存在することが判明した場合。
表10:GraphPad Prismソフトウェアで計算した、図2.0に関する統計学的まとめ
結論:Protein L BIAcoreスクリーンはA43ライブラリーの中でProtein L結合に相違があることを明らかにしたと思われた。概要グラフおよび表(図3、表10)、ならびにセンサーグラムの視覚的検討によって、各ライブラリーにわたるデータの全体的な傾向を判定することができる。単量体様結合プロフィールの強化が、A43D、A43IおよびA43Lライブラリーでもっとも明確に認められた - これはA43残基の、上記残基のいずれかへの置換もしくは変異が、結果として単量体集団を多く含有するライブラリーをもたらすことを示す。平均%B5値のわずかな減少がA43KおよびA43Eライブラリーで見られたが、A43RライブラリーはWT(A43A)と同等の値を生じた。
結論:Protein L BIAcoreスクリーンはA43ライブラリーの中でProtein L結合に相違があることを明らかにしたと思われた。概要グラフおよび表(図3、表10)、ならびにセンサーグラムの視覚的検討によって、各ライブラリーにわたるデータの全体的な傾向を判定することができる。単量体様結合プロフィールの強化が、A43D、A43IおよびA43Lライブラリーでもっとも明確に認められた - これはA43残基の、上記残基のいずれかへの置換もしくは変異が、結果として単量体集団を多く含有するライブラリーをもたらすことを示す。平均%B5値のわずかな減少がA43KおよびA43Eライブラリーで見られたが、A43RライブラリーはWT(A43A)と同等の値を生じた。
SD(DOM7h-8)およびSM(DOM4-130-54)対照は、分析した14プレートの全体にわたって非常に再現性の高い%B5値を示し、このことは、使用したBIAcoreチップが多くの再生サイクルを越えてその結合能力を保持していることを示唆した。
Y36、L46またはY87でのDOM7h-8変異体
DOM7h-8について、さらに3つの追加のライブラリーを、元のVH/VL境界面の残基:Y36、L46およびY87での変異によって作製した。変異は、実施例2Aに記載の部位特異的変異誘発によって、下記のプライマーを用いて導入した:
Y36 (プライマー:
5’-GCAGCTATTTAAATTGGNNKCAGCAGAAACCAGGGAAAGCCCCTAAG-3’ (配列番号76);
5’-CTTAGGGGCTTTCCCTGGTTTCTGCTGMNNCCAATTTAAATAGCTGC-3’ (配列番号77))
L46 (プライマー:
5’-CCAGGGAAAGCCCCTAAGNNKCTGATCTATCGGAATTCCCCTTTG-3’ (配列番号78);
5’-CAAAGGGGAATTCCGATAGATCAGMNNCTTAGGGGCTTTCCCTGG-3’ (配列番号79))
Y87 (プライマー:
5’-CCTGAAGATTTTGCTACGTACNNKTGTCAACAGACGTATAG-3’ (配列番号80);
5’-CTATACGTCTGTTGACAMNNGTACGTAGCAAAATCTTCAGG-3’ (配列番号81))。
DOM7h-8について、さらに3つの追加のライブラリーを、元のVH/VL境界面の残基:Y36、L46およびY87での変異によって作製した。変異は、実施例2Aに記載の部位特異的変異誘発によって、下記のプライマーを用いて導入した:
Y36 (プライマー:
5’-GCAGCTATTTAAATTGGNNKCAGCAGAAACCAGGGAAAGCCCCTAAG-3’ (配列番号76);
5’-CTTAGGGGCTTTCCCTGGTTTCTGCTGMNNCCAATTTAAATAGCTGC-3’ (配列番号77))
L46 (プライマー:
5’-CCAGGGAAAGCCCCTAAGNNKCTGATCTATCGGAATTCCCCTTTG-3’ (配列番号78);
5’-CAAAGGGGAATTCCGATAGATCAGMNNCTTAGGGGCTTTCCCTGG-3’ (配列番号79))
Y87 (プライマー:
5’-CCTGAAGATTTTGCTACGTACNNKTGTCAACAGACGTATAG-3’ (配列番号80);
5’-CTATACGTCTGTTGACAMNNGTACGTAGCAAAATCTTCAGG-3’ (配列番号81))。
多様性を導入するために使用されるNNKコドンは、全20個のアミノ酸およびTAG終止コドンをコードする。各ライブラリーからコロニーをランダムに採取して、プライマーDOM8およびDOM9(前記)を用いてコロニーPCRを行った。手短に述べると、単一コロニーをつまようじで採取して、23μlPlatinum Blue PCR Supermix、1μl DOM8 (10μM)および1μl DOM9 (10μM)を含有するPCR混合液に入れた。反応はEppendorf Mastercycler Gradient内で次のような温度サイクルで行った:95℃ 5分;30x(95℃ 30秒、55℃ 30秒、72℃ 1分30秒)。選別されたコロニーは、レプリカ平板法で2x TY Carb (0.1 mg/ml)寒天平板上に蒔いて37℃で一晩培養するか、または100μl 2x TY Carb (0.1 mg/ml)に接種してInfors HT振盪器で37℃にて250 rpmで一晩培養した。
Y36、L46およびY87位での全アミノ酸バリアントを得るために、ライブラリーのランダムスクリーニングで確認されなかったクローンを、大腸菌発現ベクターpDOM5中のDOM7h-8を鋳型として用い、表11に記載のプライマーを用いた、部位特異的変異誘発により作製した。
表11:ランダムスクリーニングで発見されなかったY36、L46およびY87変異体を作製するためのプライマー。
Y36、L46またはY87位でのDOM7h-8変異体は、HSAおよびスーパー抗原Protein Lに対するdAb結合活性を特徴付けるために、BIAcoreによって、精製タンパク質としてスクリーニングした。
Q38、A43またはP44位でのDOM7h-8変異体を発現するすべてのクローンに由来するタンパク質を、メーカーの説明書(Novagen)にしたがってOnEx溶液1、2および3を添加した、2xTYカルベニシリン100μg/ml、消泡剤中で、50 ml培養で発現させた。培養物はInforsHT振盪器において250 rpmで30℃にて3日間培養した。細胞を、遠心分離(ベンチトップSorvall遠心機において4.5Kで30分)によりペレットとし、発現されたdAbを上清から、PCC48(The Automation Partnership)を用いてProtein Lに対するアフィニティクロマトグラフィーにより精製した。
精製タンパク質は、可能な限り、1μMで、CM5チップ上の別々のフローセルにカップリングしたProtein L(311RU)との結合、およびHSA(559RU)との結合についてBIAcoreでアッセイした。親分子DOM7h-8(二量体)より有意に早くProtein Lから解離するクローンは、安定な単量体、または二量体と平衡状態にある単量体であるとされた。精製タンパク質は、HSA結合についても分析し、抗原と接触するdAbのCDR領域のコンフォメーションに及ぼす変異の影響を評価した(表12を参照されたい)。
表12:DOM7h-8精製タンパク質のProtein Lおよび抗原(HSA)結合に関するBIAcore分析(√ は結合することを示す;xは結合しないことを示す;Mは単量体を示す;Dは二量体を示す;M/Dは二量体と平衡状態にある単量体を示す;ndは未測定を示す)。全体をハイライトした変異体は単量体化して、HSA結合は壊れているが、L46DおよびY87L変異体は抗原結合を保持し、かつ安定な単量体を形成する。
結論:DOM7h-8親dAb分子の一部の変異体は、もはやHSAと結合しないが、それでもなお親の二量体状態は維持しており、それはProtein L結合の結果に基づく。これは、これらの変異が、見かけ上、Protein L結合部位の完全性、または分子の二量体化状態に影響を与えることなく、HSA結合パラトープのコンフォメーションを破壊することを示唆する。Y36、L46またはY87でのいくつかの変異は、DOM7h-8を単量体化すると思われる。変異体L46DおよびY87Lは、DOM7h-8の単量体化を引き起こし、かつHSA結合を保持することが明らかになった。
A43IおよびA43D変異は、下記のプライマーとともに、鋳型として大腸菌発現ベクターpET30a中のDOM7h-11-15を用いた部位特異的変異誘発によって、DOM7h-11-15に導入された:
A43I (プライマー:
5’-CAGCAGAAACCAGGGAAAATTCCTAAGCTCCTGATCCTT-3’ (配列番号102)
5’-AAGGATCAGGAGCTTAGGAATTTTCCCTGGTTTCTGCTG-3’ (配列番号103))
A43D (プライマー:
5’-CAGCAGAAACCAGGGAAAGATCCTAAGCTCCTGATCCTT-3’ (配列番号104)
5’-AAGGATCAGGAGCTTAGGATCTTTCCCTGGTTTCTGCTG-3’ (配列番号105))
DOM7h-11-15のアミノ酸配列および核酸配列は次の通りである:
DOM7h-11-15ヌクレオチド配列:
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCGTCCGATTGGGACGATGTTAAGTTGGTACCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCCTTGCTTTTTCCCGTTTGCAAAGTGGGGTCCCATCACGTTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCTACGTACTACTGCGCGCAGGCTGGGACGCATCCTACGACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGG (配列番号106)
DOM7h-11-15アミノ酸配列:
DIQMTQSPSSLSASVGDRVTITCRASRPIGTMLSWYQQKPGKAPKLLILAFSRLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCAQAGTHPTTFGQGTKVEIKR (配列番号107)
A43IおよびA43D変異は、下記のプライマーとともに、鋳型として大腸菌発現ベクターpET30a中のDOM7h-14-10を用いた部位特異的変異誘発によって、DOM7h-14-10に導入された:
A43I (プライマー:
5’-CAGCAGAAACCAGGGAAAATTCCTAAGCTCCTGATCATG-3’ (配列番号108)
5’-CATGATCAGGAGCTTAGGAATTTTCCCTGGTTTCTGCTG-3’ (配列番号109))
A43D (プライマー:
5’-CAGCAGAAACCAGGGAAAGATCCTAAGCTCCTGATCATG-3’ (配列番号110)
5’-CATGATCAGGAGCTTAGGATCTTTCCCTGGTTTCTGCTG-3’ (配列番号111))
DOM7h-14-10のアミノ酸配列および核酸配列は次の通りである:
DOM7h-14-10ヌクレオチド配列:
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCAGTGGATTGGGTCTCAGTTATCTTGGTACCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCATGTGGCGTTCCTCGTTGCAAAGTGGGGTCCCATCACGTTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCTACGTACTACTGTGCTCAGGGTTTGAGGCATCCTAAGACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGG (配列番号112)
DOM7h-14-10アミノ酸配列:
DIQMTQSPSSLSASVGDRVTITCRASQWIGSQLSWYQQKPGKAPKLLIMWRSSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCAQGLRHPKTFGQGTKVEIKR (配列番号113)。
A43I (プライマー:
5’-CAGCAGAAACCAGGGAAAATTCCTAAGCTCCTGATCCTT-3’ (配列番号102)
5’-AAGGATCAGGAGCTTAGGAATTTTCCCTGGTTTCTGCTG-3’ (配列番号103))
A43D (プライマー:
5’-CAGCAGAAACCAGGGAAAGATCCTAAGCTCCTGATCCTT-3’ (配列番号104)
5’-AAGGATCAGGAGCTTAGGATCTTTCCCTGGTTTCTGCTG-3’ (配列番号105))
DOM7h-11-15のアミノ酸配列および核酸配列は次の通りである:
DOM7h-11-15ヌクレオチド配列:
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCGTCCGATTGGGACGATGTTAAGTTGGTACCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCCTTGCTTTTTCCCGTTTGCAAAGTGGGGTCCCATCACGTTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCTACGTACTACTGCGCGCAGGCTGGGACGCATCCTACGACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGG (配列番号106)
DOM7h-11-15アミノ酸配列:
DIQMTQSPSSLSASVGDRVTITCRASRPIGTMLSWYQQKPGKAPKLLILAFSRLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCAQAGTHPTTFGQGTKVEIKR (配列番号107)
A43IおよびA43D変異は、下記のプライマーとともに、鋳型として大腸菌発現ベクターpET30a中のDOM7h-14-10を用いた部位特異的変異誘発によって、DOM7h-14-10に導入された:
A43I (プライマー:
5’-CAGCAGAAACCAGGGAAAATTCCTAAGCTCCTGATCATG-3’ (配列番号108)
5’-CATGATCAGGAGCTTAGGAATTTTCCCTGGTTTCTGCTG-3’ (配列番号109))
A43D (プライマー:
5’-CAGCAGAAACCAGGGAAAGATCCTAAGCTCCTGATCATG-3’ (配列番号110)
5’-CATGATCAGGAGCTTAGGATCTTTCCCTGGTTTCTGCTG-3’ (配列番号111))
DOM7h-14-10のアミノ酸配列および核酸配列は次の通りである:
DOM7h-14-10ヌクレオチド配列:
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACCGTGTCACCATCACTTGCCGGGCAAGTCAGTGGATTGGGTCTCAGTTATCTTGGTACCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCATGTGGCGTTCCTCGTTGCAAAGTGGGGTCCCATCACGTTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCTACGTACTACTGTGCTCAGGGTTTGAGGCATCCTAAGACGTTCGGCCAAGGGACCAAGGTGGAAATCAAACGG (配列番号112)
DOM7h-14-10アミノ酸配列:
DIQMTQSPSSLSASVGDRVTITCRASQWIGSQLSWYQQKPGKAPKLLIMWRSSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCAQGLRHPKTFGQGTKVEIKR (配列番号113)。
親であるDOM7h-11-15、およびA43DもしくはA43I変異体、ならびに親のDOM7h-14-10、およびA43DもしくはA43I変異体のタンパク質を、2xTY培地中でOnEx Autoinduction System (Invitrogen, UK)を用いて、大腸菌細胞から発現させて精製した。精製親タンパク質もしくは変異タンパク質とHSAとの結合を、559 RU HSAをカップリングさせた低密度CM5チップを用いてBiacore 2000で分析した(実施例の方法を参照されたい)。タンパク質は1μM、0.5μM、0.25μM、62 nM、32 nM、16 nMおよび8 nM濃度で分析した。
DOM7h-11-15のKDは3.8 mMであり、DOM7h-11-15 A43I変異体のKDは6.4 nMである。変異体の抗原親和性は単量体のDOM7h-11-15親より1000倍向上している。A43DおよびA32I変異体の単量体状態は、分析用超遠心によって、別個に実証された。
DOM7h-14-10のKDは26nMであり、A43IおよびA43D変異体のKDはそれぞれ11.7および13.1nMである。変異体は単量体DOM7h-14-10より抗原親和性が2倍向上している。A43DおよびA43I変異体の単量体状態は、分析用遠心によって、別個に実証された。
表13:精製親タンパク質もしくは変異タンパク質とHSAとの結合分析の結果
結論:驚くべきことに、抗体可変ドメインの元の境界面での変異が、パラトープに有利な影響を及ぼすことが示され、それによってドメイン抗体の抗原結合親和性が改善された。
結論:驚くべきことに、抗体可変ドメインの元の境界面での変異が、パラトープに有利な影響を及ぼすことが示され、それによってドメイン抗体の抗原結合親和性が改善された。
参考文献:
Bathelemy et al., 2007. Comprehensive analysis of the factors contributing to the stability and solubility of autonomous human VH domains. J Biol Chem 283 p3639-3654.
Chatellier et al., 1996. Functional mapping of the conserved residues located at the VL and VH domain interface of a Fab. J Mol Biol 246 p1-6.
Chothia et al., 1985. Domain association in immunoglobulin molecules the packing of variable domains. J Mol Biol 186 651-663.
Famm et al., 2008. Thermodynamically stable aggregation resistant antibody domains through directed evolution. J Mol Biol 376 p926-931.
Jespers et al., 2004. Aggregation-resistant domain antibodies selected on phage by heat denaturation. Nature Biotech 22 p1161-1165.
Matsuura and Pluckthun 2003. Selection based on the folding properties of proteins with ribosome display. FEBS 539 p24-28.
Matsuura and Pluckthun 2004. Strategies for selection from protein libraries composed of de novo designed secondary structure modules. Origins of life and evolution of the biosphere 34 p151-157.
Raffen et al., 1998. Reengineering immunoglobulin domain interactions by introduction of charged residues. Protein Engineering 11 p303-309.
Sieber et al., 1998. Selecting proteins with improved stability by a phage-based method. Nature 16 p955-960.
Stevens et al., 1980. Self-association of the human immunoglobulin кI light chains: role of the third hypervariable region. PNAS 77 pe 1144-1148.
米国特許第6,485,943号。Method for altering antibody light chain interactions.
Vargas-Madrazo and Paz-Garcia 2003. An improved model of association for VH-VL immunoglobulin domains: asymmetries between VH and VL in the packing of some of the interface residues. J Mol Recog 16 p113-120.
Bathelemy et al., 2007. Comprehensive analysis of the factors contributing to the stability and solubility of autonomous human VH domains. J Biol Chem 283 p3639-3654.
Chatellier et al., 1996. Functional mapping of the conserved residues located at the VL and VH domain interface of a Fab. J Mol Biol 246 p1-6.
Chothia et al., 1985. Domain association in immunoglobulin molecules the packing of variable domains. J Mol Biol 186 651-663.
Famm et al., 2008. Thermodynamically stable aggregation resistant antibody domains through directed evolution. J Mol Biol 376 p926-931.
Jespers et al., 2004. Aggregation-resistant domain antibodies selected on phage by heat denaturation. Nature Biotech 22 p1161-1165.
Matsuura and Pluckthun 2003. Selection based on the folding properties of proteins with ribosome display. FEBS 539 p24-28.
Matsuura and Pluckthun 2004. Strategies for selection from protein libraries composed of de novo designed secondary structure modules. Origins of life and evolution of the biosphere 34 p151-157.
Raffen et al., 1998. Reengineering immunoglobulin domain interactions by introduction of charged residues. Protein Engineering 11 p303-309.
Sieber et al., 1998. Selecting proteins with improved stability by a phage-based method. Nature 16 p955-960.
Stevens et al., 1980. Self-association of the human immunoglobulin кI light chains: role of the third hypervariable region. PNAS 77 pe 1144-1148.
米国特許第6,485,943号。Method for altering antibody light chain interactions.
Vargas-Madrazo and Paz-Garcia 2003. An improved model of association for VH-VL immunoglobulin domains: asymmetries between VH and VL in the packing of some of the interface residues. J Mol Recog 16 p113-120.
Claims (35)
- バリアント免疫グロブリン軽鎖単一可変ドメインを含有する単離されたポリペプチドであって、前記バリアントが、ヒト生殖系列抗体遺伝子セグメントによりコードされるフレームワーク領域のアミノ酸配列を含有し、その36、38、43、44、46、および87位のアミノ酸のうち少なくとも1つが置換されており、前記の位置はKabatのアミノ酸ナンバリングシステムにしたがって割り当てられたものである、前記単離されたポリペプチド。
- 前記バリアント免疫グロブリン軽鎖単一可変ドメインがヒトVL免疫グロブリン軽鎖単一可変ドメインである、請求項1に記載の単離されたポリペプチド。
- バリアントが実質的に溶液中で二量体である、請求項1または2に記載の単離されたポリペプチド。
- バリアントが、次のアミノ酸、Y36、Q38、A43、P44、L46、またはY87のうち少なくとも1つを有する、請求項3に記載の単離されたポリペプチド。
- バリアントが実質的に溶液中で単量体である、請求項1または2に記載の単離されたポリペプチド。
- バリアントが、アミノ酸Y36をアミノ酸A、Q、G、S、T、またはVのいずれかで置き換えたアミノ酸配列を含む、請求項5に記載の単離されたポリペプチド。
- バリアントが、アミノ酸Q38をアミノ酸R、N、D、E、またはGのいずれかで置き換えたアミノ酸配列を含む、請求項5または6に記載の単離されたポリペプチド。
- バリアントが、アミノ酸A43をD、I、L、F、T、またはWで置き換えたアミノ酸配列を含む、請求項5〜7のいずれか1つに記載の単離されたポリペプチド。
- バリアントが、アミノ酸P44をR、N、D、C、Q、E、H、I、L、K、M、F、T、Y、またはVで置き換えたアミノ酸配列を含む、請求項5〜8のいずれか1つに記載の単離されたポリペプチド。
- バリアントが、アミノ酸L46をアミノ酸R、D、Q、E、またはFのいずれか、たとえばDで置き換えたアミノ酸配列を含む、請求項5〜9のいずれか1つに記載の単離されたポリペプチド。
- バリアントが、アミノ酸Y87をアミノ酸D、C、L、またはFのいずれか、たとえばLで置き換えたアミノ酸配列を含む、請求項5〜10のいずれか1つに記載の単離されたポリペプチド。
- VLがκ系統VL(Vκ)である、請求項2〜11のいずれか1つに記載の単離されたポリペプチド。
- VLがκI系統VLである、請求項12に記載の単離されたポリペプチド。
- VLがκI系統、DPK9である、請求項13に記載の単離されたポリペプチド。
- Kabatのナンバリング法にしたがって決定された位置である36、38、43、44、46、または87位の少なくとも1つが変異していることを特徴とする、Vκ DPK9免疫グロブリンドメイン。
- Kabatのナンバリング法にしたがって決定された位置である36位が、A、Q、G、S、T、またはVから選択されるアミノ酸に変異していることを特徴とする、請求項15に記載のVκ DPK9免疫グロブリンドメイン。
- Kabatのナンバリング法にしたがって決定された位置である38位が、R、N、D、E、およびGから選択されるアミノ酸に変異していることを特徴とする、請求項15または16に記載のVκ DPK9免疫グロブリンドメイン。
- Kabatのナンバリング法にしたがって決定された位置である43位が、D、I、L、F、T、K、E、およびWから選択されるアミノ酸に変異していることを特徴とする、請求項15〜17のいずれか1つに記載のVκ DPK9免疫グロブリンドメイン。
- Kabatのナンバリング法にしたがって決定された位置である44位が、R、N、D、C、Q、E、H、I、L、K、M、F、T、Y、およびVから選択されるアミノ酸に変異していることを特徴とする、請求項15〜18のいずれか1つに記載のVκ DPK9免疫グロブリンドメイン。
- Kabatのナンバリング法にしたがって決定された位置である46位が、R、D、Q、E、Fから選択されるアミノ酸、たとえばD、に変異していることを特徴とする、請求項15〜19のいずれか1つに記載のVκ DPK9免疫グロブリンドメイン。
- Kabatのナンバリング法にしたがって決定された位置である87位が、D、C、L、Fから選択されるアミノ酸、たとえばL、に変異していることを特徴とする、請求項15〜20のいずれか1つに記載のVκ DPK9免疫グロブリンドメイン。
- SEC MALLSでの測定により実質的に単量体である、請求項15〜21のいずれか1つに記載のVκ DPK9免疫グロブリンドメイン。
- 前記単離されたポリペプチドもしくは免疫グロブリンドメインが標的リガンドに対する結合特異性を有する、請求項1〜22のいずれか1つに記載の単離されたポリペプチドまたは免疫グロブリンドメイン。
- 前記単離されたポリペプチドの抗原結合活性が、結合速度定数Kaの増大の結果として改善された、請求項1〜22のいずれか1つに記載の単離されたポリペプチドまたは免疫グロブリンドメイン。
- ポリペプチドの少なくとも70%が単量体の形をとる、請求項1〜24のいずれか1つに記載のポリペプチドもしくは免疫グロブリンを含むポリペプチドのリスト。
- Kabatのナンバリングシステムにしたがって割り当てられた位置である36、38、43、44、46、または87位のアミノ酸の少なくとも1つが変異している、請求項1〜24のいずれか1つに記載のポリペプチドまたはバリアント免疫グロブリン軽鎖可変ドメイン領域を含むライブラリー。
- 43位がD、I、L、K、またはEから選択される、Vκ免疫グロブリンドメインのライブラリー。
- 46位がR、D、Q、E、またはFから選択され、たとえばDである、Vκ免疫グロブリンドメインのライブラリー。
- 87位がD、C、L、またはFから選択され、たとえばLである、Vκ免疫グロブリンドメインのライブラリー。
- 請求項1〜24のいずれか1つに記載のポリペプチドもしくはバリアント免疫グロブリン軽鎖可変ドメイン領域を発現させるためのライブラリーであって、前記ポリペプチドもしくは免疫グロブリン軽鎖可変ドメインをコードする一連の核酸配列を含む、前記ライブラリー。
- 請求項1〜24のいずれか1つに記載のポリペプチドもしくは免疫グロブリン軽鎖単一可変ドメインをコードする核酸のライブラリー。
- 前記ライブラリーがCDR領域内にさらに多様性を有する、請求項25に記載のリスト、または請求項26〜31のいずれか1つに記載のライブラリー。
- 請求項1〜24のいずれか1つに記載のポリペプチドもしくは免疫グロブリン軽鎖単一可変ドメインをコードする核酸。
- 請求項1〜24のいずれか1つに記載のポリペプチドもしくは免疫グロブリン単一可変ドメインを含有する医薬組成物。
- 薬剤として使用するための、請求項1〜24のいずれか1つに記載のポリペプチドもしくは免疫グロブリン単一可変ドメイン。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US32625810P | 2010-04-21 | 2010-04-21 | |
| US61/326,258 | 2010-04-21 | ||
| PCT/EP2011/056220 WO2011131659A2 (en) | 2010-04-21 | 2011-04-19 | Binding domains |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2013528362A true JP2013528362A (ja) | 2013-07-11 |
Family
ID=44121747
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013505452A Pending JP2013528362A (ja) | 2010-04-21 | 2011-04-19 | 結合ドメイン |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20130045895A1 (ja) |
| EP (1) | EP2560992A2 (ja) |
| JP (1) | JP2013528362A (ja) |
| CA (1) | CA2796932A1 (ja) |
| WO (1) | WO2011131659A2 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PE20120001A1 (es) * | 2009-02-19 | 2012-02-12 | Glaxo Group Ltd | Dominios variables simples anti-albumina de suero mejorados |
| KR20250099289A (ko) | 2014-05-16 | 2025-07-01 | 아블린쓰 엔.브이. | 개선된 면역글로불린 가변 도메인 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008500830A (ja) * | 2004-06-01 | 2008-01-17 | ドマンティス リミテッド | 増加した血清半減期を有する二重特異性融合抗体 |
| WO2008096158A2 (en) * | 2007-02-08 | 2008-08-14 | Domantis Limited | Antibody single variable domains against serum albumin |
| JP2009531028A (ja) * | 2006-03-17 | 2009-09-03 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | 安定化されたポリペプチド化合物 |
| WO2010017595A1 (en) * | 2008-08-14 | 2010-02-18 | Arana Therapeutics Limited | Variant domain antibodies |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1994026087A2 (en) | 1993-05-14 | 1994-11-24 | Connor Kim C O | Recombinant protein production and insect cell culture and process |
| US6485943B2 (en) | 1995-01-17 | 2002-11-26 | The University Of Chicago | Method for altering antibody light chain interactions |
| IL127127A0 (en) | 1998-11-18 | 1999-09-22 | Peptor Ltd | Small functional units of antibody heavy chain variable regions |
| DE60237282D1 (de) | 2001-06-28 | 2010-09-23 | Domantis Ltd | Doppelspezifischer ligand und dessen verwendung |
| EP1600459A3 (en) | 2002-06-28 | 2005-12-07 | Domantis Limited | Ligand |
| CA2511910A1 (en) | 2002-12-27 | 2004-07-15 | Domantis Limited | Dual specific single domain antibodies specific for a ligand and for the receptor of the ligand |
| CA2525120C (en) | 2003-05-14 | 2013-04-30 | Domantis Limited | A process for recovering polypeptides that unfold reversibly from a polypeptide repertoire |
| EP2172553A1 (en) | 2004-03-24 | 2010-04-07 | Domantis Limited | Gas1 universal leader |
| GB0423871D0 (en) | 2004-10-27 | 2004-12-01 | Domantis Ltd | Method |
| RU2428431C2 (ru) | 2004-12-02 | 2011-09-10 | Домантис Лимитед | Слитые конструкции лекарственного средства и конъюгаты |
| US20070012251A1 (en) | 2005-07-07 | 2007-01-18 | Martin Zucker | Seal arrangement with corrosion barrier and method |
| WO2009068649A2 (en) | 2007-11-30 | 2009-06-04 | Glaxo Group Limited | Antigen-binding constructs |
-
2011
- 2011-04-19 JP JP2013505452A patent/JP2013528362A/ja active Pending
- 2011-04-19 CA CA2796932A patent/CA2796932A1/en not_active Abandoned
- 2011-04-19 EP EP11714991A patent/EP2560992A2/en not_active Withdrawn
- 2011-04-19 US US13/642,200 patent/US20130045895A1/en not_active Abandoned
- 2011-04-19 WO PCT/EP2011/056220 patent/WO2011131659A2/en not_active Ceased
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008500830A (ja) * | 2004-06-01 | 2008-01-17 | ドマンティス リミテッド | 増加した血清半減期を有する二重特異性融合抗体 |
| JP2009531028A (ja) * | 2006-03-17 | 2009-09-03 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | 安定化されたポリペプチド化合物 |
| WO2008096158A2 (en) * | 2007-02-08 | 2008-08-14 | Domantis Limited | Antibody single variable domains against serum albumin |
| WO2010017595A1 (en) * | 2008-08-14 | 2010-02-18 | Arana Therapeutics Limited | Variant domain antibodies |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2011131659A2 (en) | 2011-10-27 |
| WO2011131659A3 (en) | 2011-12-29 |
| EP2560992A2 (en) | 2013-02-27 |
| US20130045895A1 (en) | 2013-02-21 |
| CA2796932A1 (en) | 2011-10-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI826880B (zh) | 白細胞介素21突變體以及其用途 | |
| JP6797862B2 (ja) | 遺伝子操作された免疫グロブリン重鎖−軽鎖対およびその使用 | |
| KR102105776B1 (ko) | Csf1r에 결합하는 항체들 | |
| JP2023514013A (ja) | Claudin18.2結合部分及びそれらの使用 | |
| US11499150B2 (en) | Selecting for developability of polypeptide drugs in eukaryotic cell display systems | |
| US9562101B2 (en) | Lectin-like oxidized LDL receptor 1 antibodies and methods of use | |
| KR20170138494A (ko) | 항-tyr03 항체 및 이의 용도 | |
| WO2021219048A1 (zh) | 一种靶向nkg2a和pd-l1的双特异性抗体及应用 | |
| KR20210076918A (ko) | 4-1bb 및 종양-관련 항원에 결합하는 항체 작제물 및 이의 용도 | |
| KR20220146456A (ko) | 글리피칸-3(gpc3)을 표적화하는 항체 및 키메라 항원 수용체 및 이의 이용 방법 | |
| KR20210084509A (ko) | 항체 라이브러리 및 방법 | |
| CN114835810A (zh) | 一种抗pd-1纳米抗体及其应用 | |
| CN115558023A (zh) | 抗cd3抗体及其用途 | |
| WO2021143914A1 (zh) | 一种激活型抗ox40抗体、生产方法及应用 | |
| CN119698294A (zh) | 结合γ-δT细胞受体的变体抗体 | |
| JP2013528362A (ja) | 結合ドメイン | |
| JP2024521987A (ja) | ジスルフィド結合した結合ポリペプチドのスクリーニング及び発現の方法 | |
| KR20230131183A (ko) | Gucy2c 결합 분자 및 이의 용도 | |
| WO2021010888A1 (en) | Novel bssl antibodies | |
| US20220372168A1 (en) | Multispecific fgf21 receptor agonists and their uses | |
| JP2025533779A (ja) | Gccを標的とする抗体及びキメラ抗原受容体並びにそれらの使用方法 | |
| CN117597365A (zh) | 多特异性fgf21受体激动剂及其应用 | |
| CN119390839B (zh) | 靶向钙粘蛋白17的人源化纳米抗体及其应用 | |
| KR20220087488A (ko) | Pd-l1 결합 분자 | |
| WO2024255756A1 (zh) | 基于共同轻链产生双特异性抗体的方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140328 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150507 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20151020 |