JP2013522232A - N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−n’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミドの水和結晶性形状 - Google Patents
N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−n’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミドの水和結晶性形状 Download PDFInfo
- Publication number
- JP2013522232A JP2013522232A JP2012557269A JP2012557269A JP2013522232A JP 2013522232 A JP2013522232 A JP 2013522232A JP 2012557269 A JP2012557269 A JP 2012557269A JP 2012557269 A JP2012557269 A JP 2012557269A JP 2013522232 A JP2013522232 A JP 2013522232A
- Authority
- JP
- Japan
- Prior art keywords
- oxy
- cancer
- methyloxy
- morpholin
- fluorophenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/472—Non-condensed isoquinolines, e.g. papaverine
- A61K31/4725—Non-condensed isoquinolines, e.g. papaverine containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/20—Oxygen atoms
- C07D215/22—Oxygen atoms attached in position 2 or 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Quinoline Compounds (AREA)
Abstract
本発明は、N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド、化合物(I)の結晶性水和物に関する。本発明は、プロテインキナーゼ活性の調節作用を利用することによって、癌を処置する方法を提供する。また、本発明は、化合物(I)の結晶性水和物と、薬学的に許容される賦形剤とを含む医薬組成物を提供する。
【選択図】なし
【選択図】なし
Description
関連出願の相互参照
本出願は、2010年3月12日に出願された米国出願第61/313,192号の合衆国法典第35巻第119条に基づく優先権を主張し、それぞれの内容全体を参照により本明細祖に組み込まれるものとする。
本出願は、2010年3月12日に出願された米国出願第61/313,192号の合衆国法典第35巻第119条に基づく優先権を主張し、それぞれの内容全体を参照により本明細祖に組み込まれるものとする。
本発明は、N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミドの水和結晶性形状に関する。本発明はまた、本発明の結晶性形状を含む医薬組成物に関する。本発明はさらに、N-[3-フルオロ-4-({6-(メチロキシ)-7-[(3-モルホリン-4-イルプロピル)オキシ]-キノリン-4-イル}オキシ)フェニル]-N'-(4-フルオロフェニル)シクロプロパン-1,1-ジカルボサミドの結晶性水和物を用いるキナーゼシグナル伝達を阻害する、制御するおよび/または調節することによって癌を処置する方法に関する。
従来から、癌の処置における劇的な改善は、新しい機序を介して作用する治療薬を同定することと関連している。癌の処置に利用されることができる1機序は、プロテインキナーゼ活性の調節である。これはプロテインキナーゼ活性化を介するシグナル伝達が腫瘍細胞の特徴の多くに関与しているからである。プロテインキナーゼのシグナル伝達は、たとえば、腎癌、胃癌、頭頸部癌、肺癌、乳癌、前立腺癌、および結腸直腸癌;肝細胞癌;ならびに脳腫瘍細胞の成長と増殖に特に関連する。
プロテインキナーゼは、受容体型または非受容体型に分類することができる。受容体型チロシンキナーゼは、多様な生物活性を有する多数の膜貫通受容体で構成されている。受容体型チロシンキナーゼの詳細な考察については、Plowmanら、DN&P7(6):334−339,1994を参照されたい。プロテインキナーゼとそれらのリガンドは、種々の細胞活性において重要な役割を果たしており、プロテインキナーゼの酵素活性を制御解除すると、癌に関連した細胞の制御できない成長などの、細胞特性の変化をもたらしうることもある。腫瘍学的徴候に加えて、キナーゼシグナル伝達の変化は、たとえば、免疫学的障害、循環器疾患、炎症性疾患、および変性疾患を含む多数の他の病理学的疾患に関与する。したがって、プロテインキナーゼは小分子創薬の魅力的な標的である。特に、血管新生抑制および抗増殖性活性対して小分子調節のための格好の標的としては、受容体型チロシンキナーゼc−Met、KDR、c−Kit、Axl、flt−3、およびflt−4が挙げられる。
キナーゼc−Metとは、ヘテロ二量体受容体チロシンキナーゼ(RTK)のサブファミリーの原型メンバーであり、Met、RonおひびSeaが含まれる。c−Metのための内因性リガンドは、肝細胞増殖因子(HGF)、すなわち血管新生の強力な誘導因子である。HGFがc−Metと結合すると、自己リン酸化を介して受容体の活性を誘導し、受容体依存性シグナル伝達の増加をもたらし、この増加により細胞成長および浸潤が促進される。抗HGF抗体またはHGFアンタゴニストは、in vivoで腫瘍転移を阻害することが示されている(Maulikら、Cytokine & Growth Factor Reviews 2002 13,41−59を参照されたい)。c−Metの過剰発現は、乳腺腫瘍、結腸腫瘍、腎腫瘍、肺腫瘍、扁平上皮細胞骨髄性白血病、血管腫、黒色腫、星状細胞腫、およびグリア芽細胞腫を含む種々の腫瘍型で示されている。c−Metのキナーゼドメインにおいて変異のさらなる活性化が、遺伝性および散発性の腎臓乳頭腫と扁平上皮癌で特定された。(たとえば、Maulikら,Cytokine & Growth Factor reviews 2002 13,41−59; Longatiら,Curr Drug Targets 2001, 2,41−55; Funakoshiら,Clinica Chimica Acta 2003 1−23を参照されたい)。
上皮成長因子(EGF)、血管内皮成長因子(VEGF)およびエフリンシグナル伝達を抑制することで、細胞増殖と血管新生、すなわち腫瘍成長と生存に必要とされる2つの重要な細胞プロセスを防止することになる。キナーゼKDR(キナーゼインサートドメイン受容体チロシンキナーゼとよぶ)およびflt−4(fms様チロシンキナーゼ4)は、両方のVEGF受容体である。EGF、VEGFおよびエフリンシグナル伝達を抑制することで、細胞増殖と血管新生、すなわち腫瘍成長と生存に必要とされる2つの重要な細胞プロセスを防止することになる。Matter A.,治療標的としての腫瘍血管新生、Drug Discovery Today(2001)、6(19)、1005−1024.EGF受容体およびVEGF受容体は、小分子阻害の望ましい標的である。VEGFファミリーのすべてのメンバーは、細胞表面でチロシンキナーゼ受容体(VEGF)に結合することによって細胞応答を刺激し、それらを二量体化して、トランスリン酸化を介して活性化させる。VEGF受容体には、免疫グロブリン様ドメイン、1回膜貫通領域、および分裂チロシンキナーゼドメインを含む細胞内部分を有する細胞外部分がある。VEGFは、VEGFR−1およびVEGFR−2に結合する。VEGFR−2は、VEGFに対する既知の細胞応答のほぼすべてを媒介することが知られている。
キナーゼc−Kit(幹細胞因子受容体または造血幹細胞因子受容体(steel factor receptor)とも呼ばれる)は、血小板由来成長因子受容体サブファミリーに属する3型受容体チロシンキナーゼ(RTK)である。c−Kitおよびc−Kitリガンドの過剰発現は、ヒト消化管間質腫瘍、肥満細胞症、胚細胞腫瘍、急性骨髄性白血病(AML)、NKリンパ腫、小細胞肺癌、神経芽細胞腫、婦人科腫瘍および結腸癌を含む種々のヒト疾患で記述されている。さらに、c−Kitの発現上昇は、神経線維腫症1型(NF−1)、間葉腫瘍、GISTおよび肥満細胞疾患、ならびに活性化c−Kitに付随した他の疾患に関連した組織異常増殖の発生に関することもある。
キナーゼflt−3(fms様チロシンキナーゼ3)は、大部分のAML患者において、膜近傍領域またはキナーゼドメインの活性化ループのいずれかで、変異を介して構成的に活性化される(Reilly,Leuk.Lymphoma 2003 44:1−7)。
したがって、特に上述のc−Met、VEGFR2、KDR、c−Kit、Axl、flt−3、およびflt−4を含むキナーゼのシグナル伝達を特異的に阻害する、制御する、および/または調節する小分子化合物は、異常な細胞増殖および血管新生を伴う病態を処置または防止するする手段として特に望ましい。そのような小分子の一つは、N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド、化合物(I)であり、以下の化学構造を有する:
特許文献1は、化合物(I)(実施例25、30、36、42、43および44)の合成を記述し、またキナーゼのシグナル伝達を阻害する、制御する、および/または調節するためのこの分子の治療活性を開示している(アッセイ、表4、記載事項312)。化合物(I)は測定され、約0.6ナノモル(nM)のc−Met IC50値であった。2008年11月13日に出願された米国仮出願第61/199,088号に対する優先権を主張する、国際出願PCT/US09/064341号は、化合物(I)のスケールアップした合成を記述している。
治療効果は治療薬に関する一番の関心事であるが、固体形状はその開発にとって同様に重要である。通常、薬物開発者は、良好な水溶性(溶解速度を含む)、貯蔵安定性、吸湿性、製剤化適性、および再現性などの所望の特性を有する結晶性形状の発見に努力している。所望のすべての特性は、薬物のプロセス可能性、製造、および/またはバイオアベイラビリティに影響しうる。したがって、これらの望ましい特性の一部またはすべてを有する1つまたは複数の結晶性形状を発見することは、薬物開発に非常に重要である。
本発明は、N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド、化合物(I)の結晶性水和物に関する。この化合物はいくつかの水和状態で可変水和物として存在する。本発明は、プロテインキナーゼ活性の調節作用を利用することによって、癌の処置する方法を提供する。上述のように、プロテインキナーゼ活性化を介するシグナル伝達は、腫瘍細胞の特徴の多くに関与する。プロテインキナーゼシグナル伝達は、たとえば、腎癌(たとえば乳頭状腎細胞癌)、胃癌(たとえば転移性胃癌)、頭頸部癌(たとえば扁平上皮癌)、肺癌、乳癌、前立腺癌、および結腸直腸癌、扁平上皮細胞骨髄性白血病、血管腫、黒色腫、星状細胞腫、グリア芽細胞腫、肝細胞癌、遺伝性および散発性の腎臓乳頭腫に、ならびに脳腫瘍細胞の成長と増殖に特に関連する。
したがって、本発明は癌を処置する方法にも関連する。これらの方法は、化合物(I)の少なくとも1種類の結晶性水和物の治療有効量を、それを必要とする被験者に投与することを含む。
別の実施形態では、本発明は、制限できない異常な細胞活性および/または不要な細胞活性と関連する疾患または障害を処置する方法を提供する。これらの方法は、化合物(I)の少なくとも1種類の結晶性水和物の治療有効量を、それを必要とする被験者に投与することを含む。
本発明は、化合物(I)の少なくとも1種類の結晶性水和物および薬学的に許容される賦形剤の治療有効量を含む医薬組成物を提供する。
N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド、化合物(I)の結晶性水和物
本発明は、いくつかの水和状態で可変水和物として存在する化合物(I)の結晶性水和物に関する。該水和物は、化合物(I)に比べて、約0.1モル当量の水から約1モル当量の水まで変化する。下記の実施例では、本発明による化合物(I)のこれらの結晶性水和物について、それらの調製と特徴づけを含み説明する。これらの結晶性形状は、同形脱溶媒和物およびチャネル水和物としても知られている可変水和物であり、その水和度は、ほぼ無水から、一水和物にほぼ等しい化学量論の上限までに及ぶ。(Stephenson,G.A.; Groleau,E.G.; Kleeman,R.L.; Xu,W.; Rigsbee,D.R. J. Pharm. Sci. 1998,87,536−42)。化合物の固体は、溶解度、融点、X線粉末回折、固体NMR分光法、およびRaman分光法などのさまざまな物性によって特徴づけられることができる。通常、化合物の異なる結晶性形状は、それらのXRPDパターンまたは固体NMRピークなどのそれぞれの分析データを比較することによって、他と区別して特定し、または特徴づけることができる。本例では、本発明の複数の水和状態から、1つの形状と一貫した類似点を含む固体特徴づけデータが得られる。これらの類似点は、表1でのピークによって明示される。表1は、XRPDパターン、固体NMRスペクトル、およびRamanスペクトルからの特性ピークを示しており、これらのピークは水和状態の範囲で共通している。
本発明は、いくつかの水和状態で可変水和物として存在する化合物(I)の結晶性水和物に関する。該水和物は、化合物(I)に比べて、約0.1モル当量の水から約1モル当量の水まで変化する。下記の実施例では、本発明による化合物(I)のこれらの結晶性水和物について、それらの調製と特徴づけを含み説明する。これらの結晶性形状は、同形脱溶媒和物およびチャネル水和物としても知られている可変水和物であり、その水和度は、ほぼ無水から、一水和物にほぼ等しい化学量論の上限までに及ぶ。(Stephenson,G.A.; Groleau,E.G.; Kleeman,R.L.; Xu,W.; Rigsbee,D.R. J. Pharm. Sci. 1998,87,536−42)。化合物の固体は、溶解度、融点、X線粉末回折、固体NMR分光法、およびRaman分光法などのさまざまな物性によって特徴づけられることができる。通常、化合物の異なる結晶性形状は、それらのXRPDパターンまたは固体NMRピークなどのそれぞれの分析データを比較することによって、他と区別して特定し、または特徴づけることができる。本例では、本発明の複数の水和状態から、1つの形状と一貫した類似点を含む固体特徴づけデータが得られる。これらの類似点は、表1でのピークによって明示される。表1は、XRPDパターン、固体NMRスペクトル、およびRamanスペクトルからの特性ピークを示しており、これらのピークは水和状態の範囲で共通している。
本発明の結晶性水和物は、これらのセットの特性のあるピークを別々に、もしくはその組み合わせで、もしくはそのサブセットによって特徴づけられることもある。たとえば、一般の医薬賦形剤による干渉を受けないピークの組み合わせおよびサブセットを用いて、結晶性水和物を特徴づけることも可能である。
本明細書で開示される化合物(I)の結晶性水和物は、各々と比較して、および他の形状に比較して利点がありうる。そのような利点は、特定の製剤もしくはプロセシングのために、または中間体として1つの形状を用いることを示唆することもある。たとえば、化合物(I)の結晶性水和物は、水性製剤中で本発明の水和物に変わる性質を有する。
下記実施例で示すように、化合物(I)の結晶性水和物は、水性溶媒中に化合物(I)を溶解し、次いでその水溶液から化合物(I)の結晶性水和物を結晶化させることによって調製されてもよい。水性溶媒は、水または水と有機溶媒の組み合わせ、たとえば水とアセトンの組み合わせでもよい。あるいは、化合物(I)の結晶性水和物は、その水和度を増加または減少させる条件下で、かつ十分な時間の間、化合物(I)を湿度室に置くことで調製してもよい。湿度室は、湿度を制御した閉環境であってもまたは開放環境であってもよい。開放環境では、結晶性化合物(I)の水和物がその開放環境にさらされる場合、その湿度が水和に変化をももたらすのに十分なレベルである。
処置方法
処置方法
上記のように、化合物(I)は、特にc−Met、KDR、c−Kit、Axl、flt−3、およびflt−4を含むキナーゼのシグナル伝達を特異的に阻害する、制御する、および/または調節するその能力において、有益な治療特性を有する。これにより、化合物(I)は、異常な細胞増殖および血管新生を伴う病態を処置するおよび/または防止する治療薬として特に望ましいものとなる。
したがって、本発明は、プロテインキナーゼ活性の調節作用を利用することによって、癌の処置および/または防止の方法を提供する。上記のように、プロテインキナーゼ活性化を介するシグナル伝達は、腫瘍細胞の特徴の多くに関与する。プロテインキナーゼシグナル伝達は、たとえば、腎癌(たとえば乳頭状腎細胞癌、散発性腎乳頭腫)、胃癌(たとえば転移性胃癌)、頭頸部癌(たとえば扁平上皮癌)、肺癌(たとえば非小細胞肺癌)、乳癌、前立腺癌、および結腸直腸癌、扁平上皮細胞骨髄性白血病、血管腫、黒色腫、脳癌(たとえば星状細胞腫、グリア芽細胞腫)、および肝細胞癌に特に関連する。
したがって、本発明は癌を処置するおよび/または防止する方法に関する。該方法は、本発明によるN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド、化合物(I)の結晶性水和物の治療有効量を、それを必要とする被験者に投与することを含む。投与される化合物(I)の結晶性水和物は、本発明の結晶性水和物および結晶性水和物の混合物のいずれかであってもよい。処置される被験者は、通常、哺乳類であり、ほとんどの場合ヒトである。処置される癌は、望ましくは上述の一つであり、たとえば腎癌、胃癌、頭頚部癌、肺癌、乳癌、前立腺癌、結腸直腸癌、扁平上皮細胞骨髄性白血病、血管腫、黒色腫、星状細胞腫、グリア芽細胞腫、遺伝性および散発性の腎臓乳頭腫、扁平上皮癌、および脳腫瘍であるが、しかし、本発明による化合物(I)の結晶性水和物が有効である癌のいずれの種類であり得る。
本発明の医薬組成物
本発明の医薬組成物
本発明は、本発明によるN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド、化合物(I)の少なくとも1種類の結晶性水和物の治療有効量と、少なくとも1種類の薬学的に許容される担体(薬学的に許容される賦形剤としても知られている)とを含む医薬組成物に関する。上記のように、化合物(I)の結晶性水和物は、異常な細胞増殖および血管新生を伴う疾患状態の処置および/または防止にとって治療的に有用である。化合物(I)の結晶性水和物は、国際公開第WO2005−030140号に記述されているようにキナーゼのシグナル伝達を阻害する、制御するおよび/または調節するために治療活性を有する。それらの病態を処置するための医薬組成物は、本発明による化合物(I)の少なくとも1種類の結晶性水和物の治療有効量を含み、特定の疾患の患者の処置に応じて適切なキナーゼのシグナル伝達を阻害する、制御するおよび/または調節する。本発明の医薬組成物は、本発明による化合物(I)の結晶性水和物を含む任意の剤型であってもよい。医薬組成物は、たとえば、錠剤、カプセル剤、液体懸濁剤、注射剤、局所剤、または経皮剤であってもよい。医薬組成物は、通常、本発明の化合物(I)の少なくとも1種類の結晶性水和物を約1重量パーセント〜約99重量パーセント、および好適な医薬賦形剤を99重量パーセント〜1重量パーセント含む。一例では、医薬組成物は、本発明の化合物(I)の結晶性水和物が約5重量パーセントと約75重量パーセントとの間にあり、該組成物の残り部分は、後述のような好適な医薬賦形剤または他のアジュバントである。
本発明により、キナーゼのシグナル伝達(本明細書では医薬組成物に関して考察する)を阻害する、制御するおよび/または調節するのに十分な「N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミドの結晶性水和物の治療有効量」とは、異常な細胞増殖および血管新生を伴う種々の癌のいずれかを患う患者を処置するのに十分な任意の量をいう。いずれの特定の患者の処置に必要とされる実際の量は、処置される病態およびその重症度;使用される特定の医薬組成物;患者の年齢、体重、総体的な健康状態、性別と食習慣;投与方法;投与時期;投与経路;および本発明による化合物(I)の結晶性水和物の排出速度;処置期間;使用される特定の化合物と組み合わせでまたは同時に用いられる任意の薬物;および医療技術分野で周知の他のそのような因子を含む種々の因子に依存する。これらの因子は、Goodman and Gilman’s “The Pharmacological Basis of Therapeutics”, Tenth Edition, A. Gilman, J. Hardman and L. Limbird, eds.,McGraw−Hill Press, 155−173, 2001に考察されている。本発明による化合物(I)の結晶性水和物、およびそれらを含む医薬組成物は、癌のために処置をされる患者に一般に投与される抗癌剤または他の薬剤との組み合わせで用いてもよい。また、結晶性水和物は、単一の医薬組成物において1種類または複数のそのような薬剤と共製剤化されてもよい。
医薬組成物の種類により、薬学的に許容される担体を医療技術分野で既知の担体からいずれか1種類をまたは組み合わせて選択してもよい。薬学的に許容される担体の選択は、用いられる剤形および所望の投与方法に依存する。本発明の医薬組成物、すなわち本発明の化合物(I)の結晶性水和物を含む医薬組成物の場合、担体は、本発明の化合物(I)の特定の結晶性水和物を実質的に維持するために選択されなければならない。言い換えれば、担体は、本発明の化合物(I)の結晶性水和物を実質的に変化させてはならない。あるいはその逆で担体は、たとえば、望ましくないいずれかの生物学的効果を引き起こすことによって、あるいはその逆で該医薬組成物のいかなる他の成分と有害な様式で相互作用することによって、本発明による化合物(I)の結晶性水和物と不適合であってはならない。
本発明の医薬組成物は、医薬製剤技術分野で既知の方法(たとえば、Remington’s Pharmaceutical Sciences, 18th Ed.,(Mack Publishing Company, Easton, Pa.,1990)を参照されたい)によって調製されてもよい。固体剤形では、化合物(I)の少なくとも1種類の結晶性水和物は、クエン酸ナトリウムまたは第二リン酸カルシウムまたは当業者にとって既知のいずれか他の賦形剤などの薬学的に許容される賦形剤のうちの少なくとも1種類と混合させてもよい。既知の賦形剤には、たとえば:(a)充填剤または増量剤、たとえばデンプン、ラクトース、ショ糖、グルコース、マンニトール、およびケイ酸、(b)結合剤、たとえばセルロース誘導体、デンプン、アルギン酸塩、ゼラチン、ポリビニルピロリドン、ショ糖、およびアカシアゴム、(c)湿潤剤、たとえばグリセロール、(d)崩壊剤、たとえば寒天、炭酸カルシウム、ジャガイモまたはタピオカのデンプン、アルギン酸、クロスカルメロースナトリウム、複合ケイ酸塩、および炭酸ナトリウム、(e)溶液遅延剤、たとえばパラフィン、(f)吸収促進剤、たとえば第四級アンモニウム化合物、(g)湿潤剤、たとえばセチルアルコール、およびモノステアリン酸グリセリン、ステアリン酸マグネシウムなど、(h)吸着剤、たとえばカオリンおよびベントナイト、ならびに(i)潤滑剤、たとえばタルク、ステアリン酸カルシウム、ステアリン酸マグネシウム、固体ポリエチレングリコール、硫酸ラウリルナトリウム、またはそれらの混合物がある。カプセル剤、錠剤およびピルの場合、剤形は緩衝剤を含んでもよい。
医薬製剤技術分野で既知の薬学的に許容されるアジュバントも、本発明の医薬組成物で用いてもよい。これらのアジュバントとしては、保存剤、湿潤剤、懸濁剤、甘味剤、香味料、芳香剤、乳化剤、および予製剤が挙げられるが、これらに限定されるものではない。微生物の作用の防止は、種々の抗菌剤および抗真菌剤、たとえばパラベン、クロロブタノール、フェノール、ソルビン酸等によって確実に行われうる。また、等張剤、たとえば糖、塩化ナトリウム等を含むことが望ましいこともある。また必要に応じて、本発明の医薬組成物は、これらに限定されないが、湿潤剤または乳化剤、pH緩衝剤、抗酸化剤等を含む少量の補助物質、たとえば、特にクエン酸、モノラウリン酸ソルビタン、トリエタノールアミンオレイン酸、ブチル化ヒドロキシトルエンを含んでもよい。
上述のように、固体剤形は、腸溶コーティングおよび当技術分野で周知の他のコーティングなどのコーティングとシェルで調製されることができる。固体剤形は乳白剤を含んでもよく、また、遅延様式で腸管の特定の部分において活性化合物もしくは化合物を放出するような組成物である。使用されることができる埋め込み組成物の例は、重合物質およびワックスである。活性化合物、すなわち化合物(I)の少なくとも1種類の結晶性水和物は、適切な場合、上述の賦形剤の1つまたは複数とともに、マイクロカプセル化形状でもよい。
活性化合物に加えて、懸濁液剤は、懸濁剤、たとえばエトキシ化イソステアリルアルコール、ポリオキシエチレンソルビトールとソルビタンエステル、微結晶セルロース、アルミニウムメタヒドロキシド、ベントナイト、寒天およびトラガント、またはこれらの物質の混合物等を含んでもよい。
直腸内投与のための組成物は、たとえば、本発明の化合物をたとえば、カカオバター、ポリエチレングリコールまたは坐薬ワックスのような好適な非刺激性賦形剤または担体と混合させることで調製されることができる坐薬であり、座薬ワックスは、常温で固体であるが、体温で液体であり、したがって好適な体腔内では融解し、その中の活性化合物を放出する。
本発明の化合物(I)の結晶性水和物は、調製される間、維持されるので、本発明の固体剤形は本発明の医薬組成物に望ましい。カプセル剤、錠剤、ピル、粉末剤、および顆粒剤を含む、経口投与のための固体剤形は、特に望ましい。そのような固体剤形では、活性化合物は、少なくとも1種類の不活性な、薬学的に許容される賦形剤(薬学的に許容される担体としても既知である)と混合される。化合物(I)の結晶性水和物の純粋な形状で、または適切な医薬組成物の形での投与は、承認された投与様式のいずれかを介して、または同様の効能を果たす薬剤として行われることができる。このように、投与は、たとえば、錠剤、座薬、ピル、軟ゼラチンカプセルと硬ゼラチンカプセル剤、粉末剤、液剤、座薬、またはエアロゾル剤等の固体、半固体、凍結乾燥粉末、または液体の剤形の形状で、好ましくは、正確な投与量を単一投与に適した単位投与剤形で、たとえば経口的に、経鼻的に、非経口的に(静脈内、筋肉内、もしくは皮下に)、局所的に、経皮的に、膣内に、膀胱内に、嚢内に、または直腸に行うことができる。1つの好ましい投与経路は、処置される病態の重症度によって調節することができる簡便な投与計画を用いる経口投与である。
実施例
実施例1.N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド結晶性水和物、化合物(I)の調製および物理的特徴づけ
1.1.1.化合物(I)結晶性水和物の調製
4.9614gの化合物(I)と、50mLのn−プロパノールとを250mLのビーカーに加えて結晶性水和物を調製した。この懸濁液を200rpmで、磁気スターラーバーで撹拌しながら、90℃まで加熱した。2時間後に、固体を琥珀色の溶液中で完全に溶解させた。1時間および2時間の時点で、蒸発の影響を考慮して、10mLのn−プロパノールを加えて、溶液の量を50mLに戻した。次いで、1.6マイクロメートルのガラス繊維フィルターに溶液を通して加熱濾過した。次いで、ビーカー中の溶液を一晩乾燥させて粉末にした。次いでこの粉末を、アセトンと水を1:1で混合した150mLの溶液中で再溶解させ、蒸発を防ぐためにホイルでふたをして、一晩(16時間)スラリーにした。次いで、スラリー化した固体を減圧濾過によって収集した。回収した最終的な重量は、3.7324gであった(75パーセント収率)。このバッチを、分析の数日前まで、周囲条件で保管した。
実施例1.N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド結晶性水和物、化合物(I)の調製および物理的特徴づけ
1.1.1.化合物(I)結晶性水和物の調製
4.9614gの化合物(I)と、50mLのn−プロパノールとを250mLのビーカーに加えて結晶性水和物を調製した。この懸濁液を200rpmで、磁気スターラーバーで撹拌しながら、90℃まで加熱した。2時間後に、固体を琥珀色の溶液中で完全に溶解させた。1時間および2時間の時点で、蒸発の影響を考慮して、10mLのn−プロパノールを加えて、溶液の量を50mLに戻した。次いで、1.6マイクロメートルのガラス繊維フィルターに溶液を通して加熱濾過した。次いで、ビーカー中の溶液を一晩乾燥させて粉末にした。次いでこの粉末を、アセトンと水を1:1で混合した150mLの溶液中で再溶解させ、蒸発を防ぐためにホイルでふたをして、一晩(16時間)スラリーにした。次いで、スラリー化した固体を減圧濾過によって収集した。回収した最終的な重量は、3.7324gであった(75パーセント収率)。このバッチを、分析の数日前まで、周囲条件で保管した。
Karl Fisheの含水量の測定は、標準方法を用いて行われた。含水量を、703Tiスターラーを備えたBrinkmann KF1V4 Metrohm 756 Coulometerと、Hydranal Coulomat AG試薬とを使用して測定した。試料を固体として容器に入れた。1滴定あたり、約30〜35mgの試料を使用した。実施例1.1.2で調製した結晶性化合物(I)の試料を2連で測定し、平均含水量が2.5パーセント(w/w)であった。各複製は0.1パーセント以内で一致した。
重量測定による蒸気収着(GVS)研究は、標準方法を用いて行った。試料は、DVSCFRソフトウェアを使って、動的蒸気収着分析器(Surface Measurement Systems)上で移動させた。試料のサイズは、概して10mgであった。以下で説明するように、水分吸着脱着等温線を測定した。25℃で行った標準等温実験は、2サイクルで行う。40パーセントRHで開始し、10パーセントRH間隔で、湿度を90パーセントRHまで増加させて、湿度を0パーセントRHまで減少させ、再び湿度を90パーセントRHまで増加させ、最終的に湿度を0パーセントRHまで減少させた。実施例1.1.1で調製した結晶性化合物(I)は、25℃および90パーセント湿度で2.5重量パーセントの増加を示した。GVS収着および脱着の曲線を図1−Aに示す。GVS収着および脱着の曲線を図1−Aに示す。GVSの結果は、水和物が同形の脱溶媒和物としてふるまうという根拠を示した(Stephenson, G.A.; Groleau, E.G.; Kleeman, R.L.; Xu, W.; Rigsbee, D.R. J. Pharm. Sci. 1998, 87,536−42)。
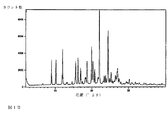
実施例1.1,1で調製した化合物(I)の結晶性水和物のX線粉末回折パターンは、PANalytical X’Pert Pro回折計を使用して得た。ゼロバックグラウンドシリコン挿入試料ホルダーの上で試料を静かに平らにした。2回連続して、2°〜50°のθスキャン範囲を、Cu κ−α放射線源および40kVと45mAの発生装置電源とともに使用した。40.7秒のステップ時間とともに0.017角度/ステップの2θステップサイズを使用した。試料を30rpmで回転させた。実験は、室温および周囲湿度で行った。図1−Bは、実施例1.1.1からのN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド結晶性水和物のXRPDパターンを示す。実験°2θ+0.1°2θでの以下のピークは、XRPDパターンで特定した:6.6、9.0、10.2、12.0、12.2、13.1、13.3、14.6、15.6、16.2、17.0、17.1、17.4、18.2、18.4、18.7、20.0、20.3、20.8、21.7、22.1、23.1、23.4、23.8、24.2、24.5、25.0。これらは通常、結晶剤形の特定のために好まれるので25°2θ未満のピークだけを得た。ピークの全リストまたはそのサブセットは、化合物(I)の水和物を特徴づけるのに十分であると思われる。
DSCサーモグラムは、TA Instruments Q2000示差走査熱量計を使用して得た。実施例1.1.1で調製した2.1500mgの化合物(I)結晶性水和物の試料質量を、アルミニウムDSCパンに直接秤量した。手で圧力をかけて、パンの各部分を押すことで該パンを密閉した(ゆるいふたの構成も知られている)。温度は、25℃から225℃まで10℃/分で急昇した。137.4℃のピークの融解温度および44.2J/gの熱流量を融解吸熱に関して測定した。融解事象の後、再結晶が無水物に生じ、次いで194.1℃で融解する。DSCサーモグラムを図1−Cに示す。発熱事象を上方方向でプロットする。
TGAサーモグラムをTA Instruments Q500 Thermogravimetric Analyzerを使用して得た。当試料パンの風袋重量を量り、実施例1.1.1で調製した化合物(I)結晶性水和物、9.9760ミリグラムをパンに置いた。温度は、25℃から300℃まで10℃/分で急昇させた。2.97パーセントの重量減少が160℃まで観察され、200℃を超えて分解からのさらなる重量減少が観察された。TGAサーモグラムを図1−Dに示す。
1.1.2.異なる水和状態の化合物(I)結晶性水和物の調製
1.1.2.異なる水和状態の化合物(I)結晶性水和物の調製
150mgアリコートを5つ、実施例1.1.1で調製した結晶性水和物のバッチから取り、10mLのねじ蓋付バイアルに入れた。バイアルの蓋を取り外して、これらのアリコート各々を乾燥剤(Dri−Rite(登録商標)、ケイ酸三カルシウム、2〜3パーセントRH)、飽和臭化リチウム(6パーセントRH)、飽和塩化リチウム(11パーセントRH)、飽和塩化マグネシウム(33パーセントRH)、飽和塩化ナトリウム(75パーセントRH)とともに容器に保管した。2週間後、分析のために試料を取り出して、キャップで直ちに封をした。
実施例1.1.2で調製した化合物(I)結晶性水和物の固体NMRスペクトルを399.87MHzの1H周波数で作動するBruker Avance 400三重共鳴分光計を用いて得た。Bruker4−mm三重共鳴マジック角回転プローブによる交差分極パルスシーケンスを用いて、8kHzのローター周波数で13C NMRスペクトルを採取した。75〜90kHzの線出力ランプを1Hチャネルで用いて交差分極効率を高めた。回転サイドバンドを5パルス全サイドバンドサプレッションパルスシーケンスによって除去した。同じ分光計とプローブを用いて、12.5kHzのローター周波数で交差分極パルスシーケンスと回転を用いて、19Fスペクトルを採取した。図1−Eは、実施例1.1.3で調製した化合物(I)結晶性水和物の5つの水和状態の固体13C NMRスペクトルを示す。13C NMRピーク位置を、0ppm(百万分率)でテトラメチルシランに比べて説明し、かつ±0.2ppmの精度で示す。すべての水和状態に共通している固体13C NMRスペクトルからの水和物の特性ピークは、173.3、160.9、158.6、155.3、152.7、149.8、135.4、125.4、100.3、67.1、54.6、26.1、および22.6ppm±0.2ppmでのピークまたはそのサブセットを含む。このリストに加えて、図1−Eでは、水和状態の変化としてシフトする他のピークが観察される。図1−Fは、実施例1.1.2で調製した化合物(I)結晶性水和物の5つの水和状態の固体19F NMRスペクトルを示す。計測器のばらつきおよび較正のために、固体19F NMRスペクトルは、CFC13に比べて、±0.4ppmの精度で−116.3および−125.1ppmのピークを示した。固体19FNMRの両ピークは、水和物の特性と考えられる。13Cおよび19F固体NMRスペクトルの結果で観察された微妙であるが容易に検出できる変化は、物質が同形の様式で脱着することを示唆していると思われる。
実施例1.1.2で調製された化合物(I)結晶性水和物のフーリエ変換(FT)Ramanスペクトルは、液体窒素で冷却したゲルマニウム検出器と、ビデオ制御付属品付電動ステージとを備えたThermo Nicolet960分光計を用いて得た。1.064マイクロメートルのレーザーを0.55Wの出力設定で用いた。粉末試料を顕微鏡のガラススライド上に配置して、ステージを使用して直接ビームの中に置いた。1−mmのレーザースポットサイズを用いて、2cm−1解像度で512走査を収集した。種々の水和状態の化合物(I)の結晶性水和物のFT−Ramanスペクトルを図1−Gに示す。以下のピーク(Ramanシフト、cm−1±2cm−1)は、FT Ramanスペクトルで、調査した湿度範囲を超えて変化しないことが観察された:1623、1503、1436、1337、901、853、779、744、708、634。
1.1.3.異なる水和状態の化合物(I)結晶性水和物の可変湿度XRPDによる特徴づけ
1.1.3.異なる水和状態の化合物(I)結晶性水和物の可変湿度XRPDによる特徴づけ
化合物(I)結晶性水和物の試料は、実施例1.1.1での方法に類似した方法を用いて調製した。0.3〜0.9の活性を有するアセトン/水の混合物中でスラリー化することによって調製した化合物(I)水和物の一連のバッチを組み合わせて本研究で使用した単一のバッチを作った。Anton−Parr TTK450温度ステージと、SYCOS−H Gas Humidifierとを備えたBruker D8 Advance X線粉末回折計上で可変湿度XRPDを行った。約30mgの物質をステンレス鋼試料ホルダーに詰めて、静かに平らにした。以下の取得パラメータを用いた:Cu κ−α放射線、40mA、40kV、走査範囲2°〜40°2θにわたり、0.017°2θのステップサイズを用いる連続走査様式、ステップ時間0.1秒。図1−Hは、40パーセントRHの初期条件で、減圧を適用した(ほぼ0パーセントRHに達するために)直後に、減圧を適用してから125分後、および物質が40パーセンRHに戻ってから得た結晶性水和物のXRPDパターンを示す。最初の時点および最終時点でのXRPDパターンは、周囲条件で収集したパターンと一致した。これを図1−Bに示す。実験的な°2θ±0.2°2θでの以下ピークは、試料を乾燥させた場合も変化しなかったピークとしてXRPDパターンで特定した:9.0、10.2、12.0、15.6、16.2、19.9、20.3、22.1および24.4。ピークの全リストまたはそのサブセットは、化合物(I)の結晶性水和物を特徴づけるのに十分であると思われる。
Claims (17)
- 結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物。
- N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミドに比べて、水和度が約0.1モル当量の水分から約1モル当量の水分に及ぶ、請求項1に記載の結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物。
- 173.3、160.9、158.6、155.3、152.7、149.8、135.4、125.4、100.3、67.1、54.6、26.1、および22.6ppm±0.2ppmにピークを有する固体13C NMRスペクトル;
CFCl3に比べて−116.8および−128.6ppm±0.4ppmにピークを有する固体19F NMRスペクトル;
9.0、10.2、12.0、15.6、16.2、19.9、20.3、22.1、および24.4°2θ±0.2°2θにピークを有するX線粉末回折パターン;ならびに
1623、1503、1436、1337、901、853、779、744、708、および634±2cm−1にピークを有するRamanスペクトル;
のうち、少なくとも1つを特徴とする、請求項1に記載の結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物。 - 173.3、160.9、158.6、155.3、152.7、149.8、135.4、125.4、100.3、67.1、54.6、26.1、および22.6ppm±0.2ppmにピークを有する固体13C NMRスペクトル;
CFCl3に比べて−116.8およびー128.6ppm±0.4ppmにピークを有する固体19F NMRスペクトル;
9.0、10.2、12.0、15.6、16.2、19.9、20.3、22.1、および24.4°2θ±0.2°2θにピークを有するX線粉末回折パターン;ならびに
1623、1503、1436、1337、901、853、779、744、708、および634±2cm−1にピークを有するRamanスペクトル;
のうち、少なくとも2つを特徴とする、請求項3に記載の結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物。 - N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミドに比べて、水和度が約0.1モル当量の水分から約1モル当量の水分に及ぶ、請求項4に記載の結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物。
- 医薬組成物であって、請求項1に記載の結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物の治療有効量と、薬学的に許容される賦形剤とを含む医薬組成物。
- 癌を処置する方法であって、請求項1に記載の結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物の治療有効量を、それを必要とする被験者に投与するステップを含む方法。
- 前記被験者がヒトである、請求項7に記載の方法。
- 前記処置される癌が腎癌、胃癌、頭頚部癌、肺癌、乳癌、前立腺癌、結腸直腸癌、扁平上皮細胞骨髄性白血病、血管腫、黒色腫、扁平上皮癌、肝細胞癌および脳癌からなる群から選択される、請求項7に記載の方法。
- 前記処置される癌が乳頭状腎細胞癌、扁平上皮癌および転移性胃癌からなる群から選択される、請求項9に記載の方法。
- 前記癌が肝細胞癌である、請求項9に記載の方法。
- 癌を処置する方法であって、請求項3に記載の結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物の治療有効量を、それを必要とする被験者に投与するステップを含み、前記処置される癌が腎癌、胃癌、頭頚部癌、肺癌、乳癌、前立腺癌、結腸直腸癌、扁平上皮細胞骨髄性白血病、血管腫、黒色腫、扁平上皮癌、肝細胞癌および脳癌からなる群から選択される方法。
- 前記被験者がヒトである、請求項12に記載の方法。
- 前記処置される癌が細胞癌、扁平上皮癌および転移性胃癌からなる群から選択される、請求項12に記載の方法。
- 前記癌が肝細胞癌である、請求項12に記載の方法。
- 請求項1に記載の結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物を調製する方法であって、
水性溶媒中にN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミドを溶解するステップと、
該水溶液から結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物を結晶化させるステップとを含む方法。 - 請求項1に記載の結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物を調製する方法であって、
結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物を、結晶性のN−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−N’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミド水和物の水和度を増加または減少させる条件下で、かつ十分な時間の間、湿度室に置くステップを含む方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US31319210P | 2010-03-12 | 2010-03-12 | |
| US61/313,192 | 2010-03-12 | ||
| PCT/US2011/028035 WO2011112896A1 (en) | 2010-03-12 | 2011-03-11 | Hydrated crystalline forms of n-[3-fluoro-4-({6-(methyloxy)-7-[(3-morpholin-4-ylpropyl)oxy]-quinolin-4-yl}oxy)phenyl]-n'-(4-fluorophenyl)cyclopropane-1,1-dicarboxamide |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2013522232A true JP2013522232A (ja) | 2013-06-13 |
| JP2013522232A5 JP2013522232A5 (ja) | 2014-04-24 |
Family
ID=43875241
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012557269A Pending JP2013522232A (ja) | 2010-03-12 | 2011-03-11 | N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−n’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミドの水和結晶性形状 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US20130143881A1 (ja) |
| EP (1) | EP2545038A1 (ja) |
| JP (1) | JP2013522232A (ja) |
| KR (1) | KR20130038206A (ja) |
| CN (1) | CN102933551A (ja) |
| AR (1) | AR080584A1 (ja) |
| AU (1) | AU2011224203A1 (ja) |
| CA (1) | CA2792852A1 (ja) |
| EA (1) | EA201290906A1 (ja) |
| MX (1) | MX2012010506A (ja) |
| SG (1) | SG184040A1 (ja) |
| TW (1) | TW201202228A (ja) |
| WO (1) | WO2011112896A1 (ja) |
| ZA (1) | ZA201206679B (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017199903A1 (ja) * | 2016-05-16 | 2017-11-23 | 帝人ファーマ株式会社 | キノリン誘導体の結晶 |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010083414A1 (en) | 2009-01-16 | 2010-07-22 | Exelixis, Inc. | Malate salt of n- (4- { [ 6, 7-bis (methyloxy) quin0lin-4-yl] oxy}phenyl-n' - (4 -fluorophenyl) cyclopropane-1-dicarboxamide, and crystalline forms therof for the treatment of cancer |
| UA108618C2 (uk) | 2009-08-07 | 2015-05-25 | Застосування c-met-модуляторів в комбінації з темозоломідом та/або променевою терапією для лікування раку | |
| BR112013000980B1 (pt) | 2010-07-16 | 2022-08-16 | Exelixis, Inc | Composições farmacêuticas moduladoras de c-met |
| DK2621481T4 (da) | 2010-09-27 | 2023-01-09 | Exelixis Inc | Dobbelte inhibitorer af MET og VEGF til behandling af kastrationsresistent prostatacancer og osteoblastiske knoglemetastaser |
| EA033513B1 (ru) | 2011-02-10 | 2019-10-31 | Exelixis Inc | Способы получения хинолиновых соединений и фармацевтических композиций, содержащих такие соединения |
| US20120252840A1 (en) | 2011-04-04 | 2012-10-04 | Exelixis, Inc. | Method of Treating Cancer |
| MX2013012695A (es) | 2011-05-02 | 2014-03-27 | Exelixis Inc | Metodo para el tratamiento del cancer y el dolor por cancer de hueso. |
| CA2848512A1 (en) | 2011-09-22 | 2013-03-28 | Exelixis, Inc. | Method for treating osteoporosis |
| CN110511158A (zh) | 2011-10-20 | 2019-11-29 | 埃克塞里艾克西斯公司 | 制备喹啉衍生物的方法 |
| EP2844254A1 (en) | 2012-05-02 | 2015-03-11 | Exelixis, Inc. | A dual met - vegf modulator for treating osteolytic bone metastases |
| CN105121412B (zh) | 2013-03-15 | 2019-07-12 | 埃克塞里艾克西斯公司 | N-(4-{[6,7-双(甲基氧基)喹啉-4-基]氧基}苯基)-n′-(4-氟苯基)环丙烷-1,1-二甲酰胺的代谢物 |
| ES2927651T3 (es) | 2013-04-04 | 2022-11-10 | Exelixis Inc | Forma de dosificación de cabozantinib y uso en el tratamiento del cáncer |
| KR102354963B1 (ko) | 2014-02-14 | 2022-01-21 | 엑셀리시스, 인코포레이티드 | N-{4-[(6,7-다이메톡시퀴놀린-4-일)옥시]페닐}-n'-(4-플루오로페닐) 사이클로프로판-1,1-다이카복스아마이드의 결정질 고체 형태, 제조 방법 및 사용 방법 |
| US10159666B2 (en) | 2014-03-17 | 2018-12-25 | Exelixis, Inc. | Dosing of cabozantinib formulations |
| CN106715397B (zh) | 2014-07-31 | 2021-07-23 | 埃克塞里艾克西斯公司 | 制备氟-18标记的卡博替尼及其类似物的方法 |
| EA034992B1 (ru) | 2014-08-05 | 2020-04-15 | Экселиксис, Инк. | Комбинации лекарственных средств для лечения множественной миеломы |
| RU2748549C2 (ru) | 2016-04-15 | 2021-05-26 | Экселиксис, Инк. | Способ лечения почечно-клеточного рака с использованием n-(4-(6,7-диметоксихинолин-4-илокси)фенил)-n'-(4-фторфенил)циклопропан-1,1-дикарбоксамида, (2s)-гидроксибутандиоата |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007506777A (ja) * | 2003-09-26 | 2007-03-22 | エグゼリクシス, インコーポレイテッド | c−Metモジュレーターおよびその使用 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ597695A (en) * | 2009-07-17 | 2014-05-30 | Exelixis Inc | Crystalline forms of n-[3-fluoro-4-({ 6-(methyloxy)-7-[(3-morpholin-4-ylpropyl)oxy]-quinolin-4-yl} oxy)phenyl]-n’-(4-fluorophenyl)cyclopropane-1, 1-dicarboxamide |
-
2011
- 2011-03-11 WO PCT/US2011/028035 patent/WO2011112896A1/en active Application Filing
- 2011-03-11 JP JP2012557269A patent/JP2013522232A/ja active Pending
- 2011-03-11 CN CN2011800137314A patent/CN102933551A/zh active Pending
- 2011-03-11 TW TW100108394A patent/TW201202228A/zh unknown
- 2011-03-11 EP EP11709589A patent/EP2545038A1/en not_active Withdrawn
- 2011-03-11 MX MX2012010506A patent/MX2012010506A/es not_active Application Discontinuation
- 2011-03-11 AU AU2011224203A patent/AU2011224203A1/en not_active Abandoned
- 2011-03-11 SG SG2012067732A patent/SG184040A1/en unknown
- 2011-03-11 EA EA201290906A patent/EA201290906A1/ru unknown
- 2011-03-11 US US13/634,275 patent/US20130143881A1/en not_active Abandoned
- 2011-03-11 KR KR1020127025322A patent/KR20130038206A/ko not_active Application Discontinuation
- 2011-03-11 CA CA2792852A patent/CA2792852A1/en not_active Abandoned
- 2011-03-14 AR ARP110100801A patent/AR080584A1/es unknown
-
2012
- 2012-09-06 ZA ZA2012/06679A patent/ZA201206679B/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007506777A (ja) * | 2003-09-26 | 2007-03-22 | エグゼリクシス, インコーポレイテッド | c−Metモジュレーターおよびその使用 |
Non-Patent Citations (1)
| Title |
|---|
| 有機化合物結晶作製ハンドブック −原理とノウハウ−, JPN6011053065, 25 July 2008 (2008-07-25), pages 57 - 84, ISSN: 0002998939 * |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017199903A1 (ja) * | 2016-05-16 | 2017-11-23 | 帝人ファーマ株式会社 | キノリン誘導体の結晶 |
| JPWO2017199903A1 (ja) * | 2016-05-16 | 2019-02-28 | 帝人ファーマ株式会社 | キノリン誘導体の結晶 |
| US10626089B2 (en) | 2016-05-16 | 2020-04-21 | GBOO1, Inc. | Quinoline derivative in crystal form |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2012010506A (es) | 2012-10-15 |
| US20130143881A1 (en) | 2013-06-06 |
| KR20130038206A (ko) | 2013-04-17 |
| TW201202228A (en) | 2012-01-16 |
| EP2545038A1 (en) | 2013-01-16 |
| ZA201206679B (en) | 2013-05-29 |
| AU2011224203A1 (en) | 2012-10-04 |
| WO2011112896A1 (en) | 2011-09-15 |
| CN102933551A (zh) | 2013-02-13 |
| CA2792852A1 (en) | 2011-09-15 |
| EA201290906A1 (ru) | 2013-03-29 |
| AR080584A1 (es) | 2012-04-18 |
| SG184040A1 (en) | 2012-10-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2013522232A (ja) | N−[3−フルオロ−4−({6−(メチロキシ)−7−[(3−モルホリン−4−イルプロピル)オキシ]−キノリン−4−イル}オキシ)フェニル]−n’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボサミドの水和結晶性形状 | |
| US11123338B2 (en) | C-met modulator pharmaceutical compositions | |
| US8673912B2 (en) | Crystalline Forms on N-[3-fluoro-4-({6-(methyloxy)-7-[(3-morpholin-4-ylpropyl)oxy]-quinolin-4-yl}oxy)phenyl]-N′-(4-fluorophenyl)cyclopropane-1,1-dicarboxamide |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140304 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140304 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150204 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150625 |