JP2012505239A - 心臓治療用の多血小板血漿製剤 - Google Patents
心臓治療用の多血小板血漿製剤 Download PDFInfo
- Publication number
- JP2012505239A JP2012505239A JP2011531182A JP2011531182A JP2012505239A JP 2012505239 A JP2012505239 A JP 2012505239A JP 2011531182 A JP2011531182 A JP 2011531182A JP 2011531182 A JP2011531182 A JP 2011531182A JP 2012505239 A JP2012505239 A JP 2012505239A
- Authority
- JP
- Japan
- Prior art keywords
- concentration
- composition
- prp
- disease
- whole blood
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000004623 platelet-rich plasma Anatomy 0.000 title claims abstract description 271
- 238000011282 treatment Methods 0.000 title claims description 66
- 210000002216 heart Anatomy 0.000 title claims description 43
- 238000002360 preparation method Methods 0.000 title claims description 11
- 239000000203 mixture Substances 0.000 claims abstract description 238
- 210000004369 blood Anatomy 0.000 claims abstract description 105
- 239000008280 blood Substances 0.000 claims abstract description 105
- 210000001772 blood platelet Anatomy 0.000 claims abstract description 58
- 208000010125 myocardial infarction Diseases 0.000 claims abstract description 47
- 210000000265 leukocyte Anatomy 0.000 claims abstract description 32
- 210000002808 connective tissue Anatomy 0.000 claims abstract description 30
- 238000002560 therapeutic procedure Methods 0.000 claims abstract description 22
- 230000010410 reperfusion Effects 0.000 claims abstract description 21
- 210000003743 erythrocyte Anatomy 0.000 claims abstract description 20
- 230000006907 apoptotic process Effects 0.000 claims abstract description 17
- 102000001554 Hemoglobins Human genes 0.000 claims abstract description 9
- 108010054147 Hemoglobins Proteins 0.000 claims abstract description 9
- 238000000034 method Methods 0.000 claims description 69
- 210000001519 tissue Anatomy 0.000 claims description 66
- 238000012384 transportation and delivery Methods 0.000 claims description 60
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 52
- 201000010099 disease Diseases 0.000 claims description 48
- 210000004027 cell Anatomy 0.000 claims description 29
- 230000000302 ischemic effect Effects 0.000 claims description 29
- 210000000440 neutrophil Anatomy 0.000 claims description 28
- 108090000623 proteins and genes Proteins 0.000 claims description 25
- 238000004458 analytical method Methods 0.000 claims description 20
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 16
- 230000002068 genetic effect Effects 0.000 claims description 16
- 210000004698 lymphocyte Anatomy 0.000 claims description 16
- 239000001301 oxygen Substances 0.000 claims description 16
- 229910052760 oxygen Inorganic materials 0.000 claims description 16
- 210000001616 monocyte Anatomy 0.000 claims description 15
- 229940079593 drug Drugs 0.000 claims description 14
- 239000003814 drug Substances 0.000 claims description 14
- 230000000451 tissue damage Effects 0.000 claims description 13
- 231100000827 tissue damage Toxicity 0.000 claims description 13
- 206010003119 arrhythmia Diseases 0.000 claims description 12
- 210000005003 heart tissue Anatomy 0.000 claims description 12
- 206010043255 Tendonitis Diseases 0.000 claims description 11
- 210000003979 eosinophil Anatomy 0.000 claims description 11
- 230000036961 partial effect Effects 0.000 claims description 11
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 claims description 10
- 206010028980 Neoplasm Diseases 0.000 claims description 10
- 230000006793 arrhythmia Effects 0.000 claims description 10
- 229960002897 heparin Drugs 0.000 claims description 10
- 229920000669 heparin Polymers 0.000 claims description 10
- 208000028867 ischemia Diseases 0.000 claims description 10
- 208000037816 tissue injury Diseases 0.000 claims description 10
- 208000000491 Tendinopathy Diseases 0.000 claims description 9
- 208000002240 Tennis Elbow Diseases 0.000 claims description 9
- 230000001154 acute effect Effects 0.000 claims description 9
- 102000004169 proteins and genes Human genes 0.000 claims description 9
- 230000004044 response Effects 0.000 claims description 9
- 201000011510 cancer Diseases 0.000 claims description 8
- 239000003527 fibrinolytic agent Substances 0.000 claims description 8
- 210000002381 plasma Anatomy 0.000 claims description 8
- 229960000103 thrombolytic agent Drugs 0.000 claims description 8
- 238000001914 filtration Methods 0.000 claims description 7
- -1 tPA Chemical compound 0.000 claims description 7
- 201000011275 Epicondylitis Diseases 0.000 claims description 6
- 238000004113 cell culture Methods 0.000 claims description 6
- 230000005484 gravity Effects 0.000 claims description 6
- 201000004415 tendinitis Diseases 0.000 claims description 6
- 102000004190 Enzymes Human genes 0.000 claims description 5
- 108090000790 Enzymes Proteins 0.000 claims description 5
- 238000005119 centrifugation Methods 0.000 claims description 5
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 claims description 4
- 239000005552 B01AC04 - Clopidogrel Substances 0.000 claims description 4
- 208000012902 Nervous system disease Diseases 0.000 claims description 4
- 229960001138 acetylsalicylic acid Drugs 0.000 claims description 4
- 238000010171 animal model Methods 0.000 claims description 4
- 239000000427 antigen Substances 0.000 claims description 4
- 102000036639 antigens Human genes 0.000 claims description 4
- 108091007433 antigens Proteins 0.000 claims description 4
- GKTWGGQPFAXNFI-HNNXBMFYSA-N clopidogrel Chemical compound C1([C@H](N2CC=3C=CSC=3CC2)C(=O)OC)=CC=CC=C1Cl GKTWGGQPFAXNFI-HNNXBMFYSA-N 0.000 claims description 4
- 238000005094 computer simulation Methods 0.000 claims description 4
- 229940000406 drug candidate Drugs 0.000 claims description 4
- 239000003550 marker Substances 0.000 claims description 4
- 229940020573 plavix Drugs 0.000 claims description 4
- 210000003296 saliva Anatomy 0.000 claims description 4
- 150000003384 small molecules Chemical class 0.000 claims description 4
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 3
- 206010024453 Ligament sprain Diseases 0.000 claims description 3
- 208000010332 Plantar Fasciitis Diseases 0.000 claims description 3
- 238000003018 immunoassay Methods 0.000 claims description 3
- 210000004417 patella Anatomy 0.000 claims description 3
- 230000002829 reductive effect Effects 0.000 claims description 3
- 210000000513 rotator cuff Anatomy 0.000 claims description 3
- 238000012360 testing method Methods 0.000 claims description 3
- 206010065433 Ligament rupture Diseases 0.000 claims description 2
- 208000018737 Parkinson disease Diseases 0.000 claims description 2
- 208000026278 immune system disease Diseases 0.000 claims description 2
- 150000002632 lipids Chemical class 0.000 claims description 2
- 208000031225 myocardial ischemia Diseases 0.000 claims description 2
- 208000017520 skin disease Diseases 0.000 claims description 2
- 239000012190 activator Substances 0.000 claims 1
- 230000004217 heart function Effects 0.000 claims 1
- 210000003127 knee Anatomy 0.000 claims 1
- 238000012544 monitoring process Methods 0.000 claims 1
- 238000012216 screening Methods 0.000 claims 1
- 230000000747 cardiac effect Effects 0.000 abstract description 29
- 239000000523 sample Substances 0.000 description 18
- 230000006378 damage Effects 0.000 description 15
- 238000001356 surgical procedure Methods 0.000 description 15
- 230000000694 effects Effects 0.000 description 14
- 230000014509 gene expression Effects 0.000 description 13
- 208000014674 injury Diseases 0.000 description 13
- 208000027418 Wounds and injury Diseases 0.000 description 12
- 241000282414 Homo sapiens Species 0.000 description 11
- 239000003795 chemical substances by application Substances 0.000 description 11
- 238000003384 imaging method Methods 0.000 description 11
- 210000004351 coronary vessel Anatomy 0.000 description 10
- 241001465754 Metazoa Species 0.000 description 9
- 230000000638 stimulation Effects 0.000 description 9
- 239000000499 gel Substances 0.000 description 8
- 210000004165 myocardium Anatomy 0.000 description 8
- 235000018102 proteins Nutrition 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 238000007876 drug discovery Methods 0.000 description 7
- 238000002347 injection Methods 0.000 description 7
- 239000007924 injection Substances 0.000 description 7
- 230000008439 repair process Effects 0.000 description 7
- 239000003356 suture material Substances 0.000 description 7
- 102000003952 Caspase 3 Human genes 0.000 description 6
- 108090000397 Caspase 3 Proteins 0.000 description 6
- 230000017531 blood circulation Effects 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 238000002595 magnetic resonance imaging Methods 0.000 description 6
- 230000003288 anthiarrhythmic effect Effects 0.000 description 5
- 239000003146 anticoagulant agent Substances 0.000 description 5
- 210000004204 blood vessel Anatomy 0.000 description 5
- 230000002526 effect on cardiovascular system Effects 0.000 description 5
- 230000010247 heart contraction Effects 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 210000002435 tendon Anatomy 0.000 description 5
- 102000004625 Aspartate Aminotransferases Human genes 0.000 description 4
- 108010003415 Aspartate Aminotransferases Proteins 0.000 description 4
- 108010035532 Collagen Proteins 0.000 description 4
- 102000008186 Collagen Human genes 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 208000010496 Heart Arrest Diseases 0.000 description 4
- 206010061216 Infarction Diseases 0.000 description 4
- 208000006117 ST-elevation myocardial infarction Diseases 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- 239000003416 antiarrhythmic agent Substances 0.000 description 4
- 210000001367 artery Anatomy 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 229920001436 collagen Polymers 0.000 description 4
- 229960005188 collagen Drugs 0.000 description 4
- 238000002591 computed tomography Methods 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 230000035876 healing Effects 0.000 description 4
- 230000007574 infarction Effects 0.000 description 4
- 210000005240 left ventricle Anatomy 0.000 description 4
- 210000003041 ligament Anatomy 0.000 description 4
- 238000007896 magnetic source imaging Methods 0.000 description 4
- 238000002493 microarray Methods 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 231100000241 scar Toxicity 0.000 description 4
- 210000001186 vagus nerve Anatomy 0.000 description 4
- FUFLCEKSBBHCMO-UHFFFAOYSA-N 11-dehydrocorticosterone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 FUFLCEKSBBHCMO-UHFFFAOYSA-N 0.000 description 3
- 102000011727 Caspases Human genes 0.000 description 3
- 108010076667 Caspases Proteins 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 3
- MFYSYFVPBJMHGN-ZPOLXVRWSA-N Cortisone Chemical compound O=C1CC[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 MFYSYFVPBJMHGN-ZPOLXVRWSA-N 0.000 description 3
- MFYSYFVPBJMHGN-UHFFFAOYSA-N Cortisone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)(O)C(=O)CO)C4C3CCC2=C1 MFYSYFVPBJMHGN-UHFFFAOYSA-N 0.000 description 3
- 206010019280 Heart failures Diseases 0.000 description 3
- 208000034693 Laceration Diseases 0.000 description 3
- 208000023178 Musculoskeletal disease Diseases 0.000 description 3
- 206010073713 Musculoskeletal injury Diseases 0.000 description 3
- 208000000770 Non-ST Elevated Myocardial Infarction Diseases 0.000 description 3
- 206010058156 Reperfusion arrhythmia Diseases 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 206010000891 acute myocardial infarction Diseases 0.000 description 3
- 229940124599 anti-inflammatory drug Drugs 0.000 description 3
- 229940127219 anticoagulant drug Drugs 0.000 description 3
- 210000000709 aorta Anatomy 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 210000001124 body fluid Anatomy 0.000 description 3
- 239000010839 body fluid Substances 0.000 description 3
- 210000004413 cardiac myocyte Anatomy 0.000 description 3
- 239000002872 contrast media Substances 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 229960004544 cortisone Drugs 0.000 description 3
- 230000007850 degeneration Effects 0.000 description 3
- 238000001647 drug administration Methods 0.000 description 3
- 238000002593 electrical impedance tomography Methods 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 238000003780 insertion Methods 0.000 description 3
- 230000037431 insertion Effects 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 230000007383 nerve stimulation Effects 0.000 description 3
- 230000001575 pathological effect Effects 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- 230000033764 rhythmic process Effects 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000009662 stress testing Methods 0.000 description 3
- 238000002604 ultrasonography Methods 0.000 description 3
- 210000003462 vein Anatomy 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- 102100032367 C-C motif chemokine 5 Human genes 0.000 description 2
- 102100032366 C-C motif chemokine 7 Human genes 0.000 description 2
- 102100036150 C-X-C motif chemokine 5 Human genes 0.000 description 2
- 206010007559 Cardiac failure congestive Diseases 0.000 description 2
- 102000055007 Cartilage Oligomeric Matrix Human genes 0.000 description 2
- 101710176668 Cartilage oligomeric matrix protein Proteins 0.000 description 2
- 102000004420 Creatine Kinase Human genes 0.000 description 2
- 108010042126 Creatine kinase Proteins 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 101000947186 Homo sapiens C-X-C motif chemokine 5 Proteins 0.000 description 2
- 101000947178 Homo sapiens Platelet basic protein Proteins 0.000 description 2
- 101000582950 Homo sapiens Platelet factor 4 Proteins 0.000 description 2
- 206010021143 Hypoxia Diseases 0.000 description 2
- 102000003855 L-lactate dehydrogenase Human genes 0.000 description 2
- 108700023483 L-lactate dehydrogenases Proteins 0.000 description 2
- 206010061223 Ligament injury Diseases 0.000 description 2
- 108700011259 MicroRNAs Proteins 0.000 description 2
- 102100036154 Platelet basic protein Human genes 0.000 description 2
- 102100030304 Platelet factor 4 Human genes 0.000 description 2
- KKEYFWRCBNTPAC-UHFFFAOYSA-N Terephthalic acid Chemical compound OC(=O)C1=CC=C(C(O)=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-N 0.000 description 2
- 108090000190 Thrombin Proteins 0.000 description 2
- 206010052428 Wound Diseases 0.000 description 2
- 240000008042 Zea mays Species 0.000 description 2
- 235000016383 Zea mays subsp huehuetenangensis Nutrition 0.000 description 2
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 238000002399 angioplasty Methods 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 238000002617 apheresis Methods 0.000 description 2
- 238000010009 beating Methods 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- BLFLLBZGZJTVJG-UHFFFAOYSA-N benzocaine Chemical compound CCOC(=O)C1=CC=C(N)C=C1 BLFLLBZGZJTVJG-UHFFFAOYSA-N 0.000 description 2
- 238000004820 blood count Methods 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 230000009134 cell regulation Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000002586 coronary angiography Methods 0.000 description 2
- 210000003748 coronary sinus Anatomy 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 238000002716 delivery method Methods 0.000 description 2
- 239000011350 dental composite resin Substances 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 238000007895 electrical source imaging Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 238000012252 genetic analysis Methods 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 238000011065 in-situ storage Methods 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 210000005246 left atrium Anatomy 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 235000009973 maize Nutrition 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 239000002679 microRNA Substances 0.000 description 2
- 210000004115 mitral valve Anatomy 0.000 description 2
- 238000007479 molecular analysis Methods 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 230000002107 myocardial effect Effects 0.000 description 2
- 230000006654 negative regulation of apoptotic process Effects 0.000 description 2
- 230000001537 neural effect Effects 0.000 description 2
- 238000012148 non-surgical treatment Methods 0.000 description 2
- 230000036407 pain Effects 0.000 description 2
- 230000035790 physiological processes and functions Effects 0.000 description 2
- 230000006659 positive regulation of apoptotic process Effects 0.000 description 2
- 238000002600 positron emission tomography Methods 0.000 description 2
- 230000008929 regeneration Effects 0.000 description 2
- 238000011069 regeneration method Methods 0.000 description 2
- 210000005241 right ventricle Anatomy 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 238000004088 simulation Methods 0.000 description 2
- 238000002603 single-photon emission computed tomography Methods 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 210000000130 stem cell Anatomy 0.000 description 2
- 229960004072 thrombin Drugs 0.000 description 2
- 230000002537 thrombolytic effect Effects 0.000 description 2
- 230000017423 tissue regeneration Effects 0.000 description 2
- 238000003325 tomography Methods 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- 210000005166 vasculature Anatomy 0.000 description 2
- 210000000596 ventricular septum Anatomy 0.000 description 2
- UCTWMZQNUQWSLP-VIFPVBQESA-N (R)-adrenaline Chemical compound CNC[C@H](O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-VIFPVBQESA-N 0.000 description 1
- 229930182837 (R)-adrenaline Natural products 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- IJRKANNOPXMZSG-SSPAHAAFSA-N 2-hydroxypropane-1,2,3-tricarboxylic acid;(2r,3s,4r,5r)-2,3,4,5,6-pentahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O.OC(=O)CC(O)(C(O)=O)CC(O)=O IJRKANNOPXMZSG-SSPAHAAFSA-N 0.000 description 1
- 206010067484 Adverse reaction Diseases 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 206010003694 Atrophy Diseases 0.000 description 1
- 108010081589 Becaplermin Proteins 0.000 description 1
- 201000006474 Brain Ischemia Diseases 0.000 description 1
- 101710155834 C-C motif chemokine 7 Proteins 0.000 description 1
- 206010007513 Cardiac aneurysm Diseases 0.000 description 1
- 206010008120 Cerebral ischaemia Diseases 0.000 description 1
- 108010055166 Chemokine CCL5 Proteins 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 102000012422 Collagen Type I Human genes 0.000 description 1
- 108010022452 Collagen Type I Proteins 0.000 description 1
- 102000001187 Collagen Type III Human genes 0.000 description 1
- 108010069502 Collagen Type III Proteins 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000002330 Congenital Heart Defects Diseases 0.000 description 1
- 229920001651 Cyanoacrylate Polymers 0.000 description 1
- 102000005927 Cysteine Proteases Human genes 0.000 description 1
- 108010005843 Cysteine Proteases Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 238000000018 DNA microarray Methods 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- 102000016942 Elastin Human genes 0.000 description 1
- 108010014258 Elastin Proteins 0.000 description 1
- 101150021185 FGF gene Proteins 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 102100021866 Hepatocyte growth factor Human genes 0.000 description 1
- 206010019909 Hernia Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000797762 Homo sapiens C-C motif chemokine 5 Proteins 0.000 description 1
- 101000797758 Homo sapiens C-C motif chemokine 7 Proteins 0.000 description 1
- 101000898034 Homo sapiens Hepatocyte growth factor Proteins 0.000 description 1
- 101001033249 Homo sapiens Interleukin-1 beta Proteins 0.000 description 1
- 101001076408 Homo sapiens Interleukin-6 Proteins 0.000 description 1
- 101000973997 Homo sapiens Nucleosome assembly protein 1-like 4 Proteins 0.000 description 1
- 101000868152 Homo sapiens Son of sevenless homolog 1 Proteins 0.000 description 1
- 206010021639 Incontinence Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 1
- 102000048143 Insulin-Like Growth Factor II Human genes 0.000 description 1
- 108090001117 Insulin-Like Growth Factor II Proteins 0.000 description 1
- 102100039065 Interleukin-1 beta Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 108090001007 Interleukin-8 Proteins 0.000 description 1
- 206010060820 Joint injury Diseases 0.000 description 1
- 208000016593 Knee injury Diseases 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 239000002616 MRI contrast agent Substances 0.000 description 1
- MWCLLHOVUTZFKS-UHFFFAOYSA-N Methyl cyanoacrylate Chemical compound COC(=O)C(=C)C#N MWCLLHOVUTZFKS-UHFFFAOYSA-N 0.000 description 1
- 102000036675 Myoglobin Human genes 0.000 description 1
- 108010062374 Myoglobin Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 101710098940 Pro-epidermal growth factor Proteins 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 208000024288 Rotator Cuff injury Diseases 0.000 description 1
- 206010039227 Rotator cuff syndrome Diseases 0.000 description 1
- 206010040825 Skin depigmentation Diseases 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 206010042434 Sudden death Diseases 0.000 description 1
- GKLVYJBZJHMRIY-OUBTZVSYSA-N Technetium-99 Chemical compound [99Tc] GKLVYJBZJHMRIY-OUBTZVSYSA-N 0.000 description 1
- 206010043248 Tendon rupture Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 102000003929 Transaminases Human genes 0.000 description 1
- 108090000340 Transaminases Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 102000004903 Troponin Human genes 0.000 description 1
- 108090001027 Troponin Proteins 0.000 description 1
- 102000013394 Troponin I Human genes 0.000 description 1
- 108010065729 Troponin I Proteins 0.000 description 1
- 102000004987 Troponin T Human genes 0.000 description 1
- 108090001108 Troponin T Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 210000003815 abdominal wall Anatomy 0.000 description 1
- 238000002679 ablation Methods 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 210000001361 achilles tendon Anatomy 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 238000011374 additional therapy Methods 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000006838 adverse reaction Effects 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 230000003444 anaesthetic effect Effects 0.000 description 1
- 210000003423 ankle Anatomy 0.000 description 1
- 230000002424 anti-apoptotic effect Effects 0.000 description 1
- 230000002924 anti-infective effect Effects 0.000 description 1
- 229960005475 antiinfective agent Drugs 0.000 description 1
- 210000001765 aortic valve Anatomy 0.000 description 1
- 238000003782 apoptosis assay Methods 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 230000001746 atrial effect Effects 0.000 description 1
- 210000003157 atrial septum Anatomy 0.000 description 1
- 230000037444 atrophy Effects 0.000 description 1
- 210000003651 basophil Anatomy 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 229960005274 benzocaine Drugs 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 229920001222 biopolymer Polymers 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 239000010836 blood and blood product Substances 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 229940125691 blood product Drugs 0.000 description 1
- 230000036770 blood supply Effects 0.000 description 1
- 230000036471 bradycardia Effects 0.000 description 1
- 208000006218 bradycardia Diseases 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 210000005242 cardiac chamber Anatomy 0.000 description 1
- 206010061592 cardiac fibrillation Diseases 0.000 description 1
- 238000007675 cardiac surgery Methods 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 206010008118 cerebral infarction Diseases 0.000 description 1
- 230000009693 chronic damage Effects 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 239000000701 coagulant Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 208000028831 congenital heart disease Diseases 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000000875 corresponding effect Effects 0.000 description 1
- 238000001804 debridement Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000000779 depleting effect Effects 0.000 description 1
- 239000007933 dermal patch Substances 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000002059 diagnostic imaging Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- XEYBRNLFEZDVAW-ARSRFYASSA-N dinoprostone Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=O XEYBRNLFEZDVAW-ARSRFYASSA-N 0.000 description 1
- 229960002986 dinoprostone Drugs 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 238000007877 drug screening Methods 0.000 description 1
- 239000003596 drug target Substances 0.000 description 1
- 239000002961 echo contrast media Substances 0.000 description 1
- 238000002592 echocardiography Methods 0.000 description 1
- 230000001700 effect on tissue Effects 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 229920002549 elastin Polymers 0.000 description 1
- 238000002001 electrophysiology Methods 0.000 description 1
- 230000007831 electrophysiology Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000001839 endoscopy Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000001973 epigenetic effect Effects 0.000 description 1
- 229960005139 epinephrine Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- 210000001105 femoral artery Anatomy 0.000 description 1
- 210000003191 femoral vein Anatomy 0.000 description 1
- 210000004700 fetal blood Anatomy 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 230000002600 fibrillogenic effect Effects 0.000 description 1
- 230000009969 flowable effect Effects 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000012631 food intake Nutrition 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000001879 gelation Methods 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- 238000002695 general anesthesia Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 210000002064 heart cell Anatomy 0.000 description 1
- 210000003709 heart valve Anatomy 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000003601 intercostal effect Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- XQZXYNRDCRIARQ-LURJTMIESA-N iopamidol Chemical compound C[C@H](O)C(=O)NC1=C(I)C(C(=O)NC(CO)CO)=C(I)C(C(=O)NC(CO)CO)=C1I XQZXYNRDCRIARQ-LURJTMIESA-N 0.000 description 1
- 230000004171 ischemic cascade Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 210000004731 jugular vein Anatomy 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 238000007897 laser optical imaging Methods 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 239000003589 local anesthetic agent Substances 0.000 description 1
- 230000008338 local blood flow Effects 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000010297 mechanical methods and process Methods 0.000 description 1
- 230000005226 mechanical processes and functions Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 208000037891 myocardial injury Diseases 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 238000002355 open surgical procedure Methods 0.000 description 1
- KHPXUQMNIQBQEV-UHFFFAOYSA-N oxaloacetic acid Chemical compound OC(=O)CC(=O)C(O)=O KHPXUQMNIQBQEV-UHFFFAOYSA-N 0.000 description 1
- 238000006213 oxygenation reaction Methods 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 238000013146 percutaneous coronary intervention Methods 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000002831 pharmacologic agent Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 238000000554 physical therapy Methods 0.000 description 1
- 230000009894 physiological stress Effects 0.000 description 1
- 108010017843 platelet-derived growth factor A Proteins 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 230000005522 programmed cell death Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- XEYBRNLFEZDVAW-UHFFFAOYSA-N prostaglandin E2 Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CC=CCCCC(O)=O XEYBRNLFEZDVAW-UHFFFAOYSA-N 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000009790 rate-determining step (RDS) Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 238000002694 regional anesthesia Methods 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000000250 revascularization Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 230000036186 satiety Effects 0.000 description 1
- 235000019627 satiety Nutrition 0.000 description 1
- 230000036573 scar formation Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 229940126586 small molecule drug Drugs 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 230000003637 steroidlike Effects 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 238000011477 surgical intervention Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229940056501 technetium 99m Drugs 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- BKVIYDNLLOSFOA-OIOBTWANSA-N thallium-201 Chemical compound [201Tl] BKVIYDNLLOSFOA-OIOBTWANSA-N 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000013151 thrombectomy Methods 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 230000008467 tissue growth Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000008736 traumatic injury Effects 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 238000012285 ultrasound imaging Methods 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 230000001515 vagal effect Effects 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 210000001631 vena cava inferior Anatomy 0.000 description 1
- 210000002620 vena cava superior Anatomy 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/19—Platelets; Megacaryocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/15—Cells of the myeloid line, e.g. granulocytes, basophils, eosinophils, neutrophils, leucocytes, monocytes, macrophages or mast cells; Myeloid precursor cells; Antigen-presenting cells, e.g. dendritic cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/16—Blood plasma; Blood serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/18—Erythrocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
- A61K38/49—Urokinase; Tissue plasminogen activator
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6809—Methods for determination or identification of nucleic acids involving differential detection
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/502—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects
- G01N33/5023—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects on expression patterns
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5091—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing the pathological state of an organism
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Virology (AREA)
- Developmental Biology & Embryology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Physics & Mathematics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Microbiology (AREA)
- Food Science & Technology (AREA)
- Tropical Medicine & Parasitology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Cardiology (AREA)
- Neurology (AREA)
- Heart & Thoracic Surgery (AREA)
- Neurosurgery (AREA)
- Wood Science & Technology (AREA)
Abstract
Description
本出願は、2008年10月9日に出願された米国特許仮出願第61/104,074号の優先権を請求するものであり、これは参照によりその全体が本明細書に組み込まれる。
著しい臨床集団が依然として存在する。広範な使用にも関わらず、経口抗炎症薬投与の有用性は、対照研究では証明されていない。幾つかの研究では、非ステロイド薬投与が、実際に靱帯傷害の治癒プロセスに対して有害作用を示す場合があることが更に示唆されている。また、外側上顆炎の症例の病理学的試料には、急性炎症細胞は見出されていない。コルチゾン注射剤は、腱症の治療において議論が別れており、急性靱帯傷害では禁忌とされている。幾つかの研究では、短期追跡調査ではコルチゾンで治療された患者に改善が認められたが、1年を超えるより長期的な結果では、高い症状再発率及び有効率が不確かに過ぎないことが明らかにされている。これら注射剤には、糖尿病患者において、腱断裂、感染症、皮膚色素脱失、皮下萎縮、及び血糖値上昇のリスクもある。手術的処置には、関連する病理学的腱のデブリドマン及び修復が含まれる。しかしながら、観血手術又は関節鏡下手術には、深部感染症、神経血管構造の損傷、及び瘢痕形成等の多くの潜在的な合併症がある。また、外科手術は高額であり、領域又は全身麻酔に伴う追加的なリスクがある。
該患者から血液試料を取得するステップ、
該血液試料からPRPを取得するステップ、
該PRPから分析を取得するステップ、及び
該患者に由来するPRPの分析を、その疾患を有する集団のPRPから得られた分析と比較するステップ、及び
該患者のPRPの分析が、該疾患集団のPRPの分析と一致することを決定し、それにより該疾患を診断するステップ。好ましい実施形態では、分析は、イムノアッセイ又は遺伝子プロファイルである。
る。好ましくは、デバイスは、チャンバーである。より好ましくは、チャンバー内の条件には、以下のうちの1つ又は複数が含まれる:低酸素分圧、高酸素分圧、低pH、高pH、低圧力、高圧力、低UV、高UV、低温、及び高温。
種々の医学的状態を治療するために使用することができる生物学的組成物が提供される。本生物学的組成物は、一般的に、全血中の濃度より高い濃度の白血球及び血小板を含む多血小板血漿を含む。結合組織では、このPRP組成物を使用して、傷害、創傷、外傷、病変、及び/又は組織変性により損傷を受けた組織を治療することができる。心臓組織では、このPRP組成物を、急性MI後の虚血組織を治療するために使用して、心筋組織を保存し、再増殖を促進することができる。加えて、PRP組成物は、アポトーシスを遅延又は停止させ、梗塞サイズを低減させ、心不整脈を減少させ、及び/又は細胞機能を回復させることができる。
きる。PRPを使用して処理することができる結合組織損傷の例には、これらに限定されないが、外側上顆炎(つまり、テニス肘)、足底筋膜炎、膝蓋腱炎(つまり、ジャンパー膝)、アキレス腱炎、回旋筋腱板腱炎、足首捻挫、及び靱帯裂傷が含まれる。組織損傷は、これらに限定されないが、X線画像法、磁気共鳴画像法(MRI)、及び超音波画像法等の、1つ又は複数の医用画像技術を使用して特定することができる。心筋層に対する損傷を治療するために、PRP組成物は、MIが特定されると、緊急処置室で及び/又は救急医療供給者により送達することができる。他の場合では、PRP組成物は、MI後の再灌流療法中に送達してもよい。
PRP組成物は、一般的に、全血と比べて高い濃度の血小板及びWBCを含む。典型的には、RBC及びヘモグロビンの濃度は抑制されている。幾つかの変法では、血小板及びWBCの濃度は、PRP組成物が、損傷組織及び/又は虚血組織を効果的に治療する可能性を増加させるように指定される。
00,000〜約2,500,000個、約2,500,000〜約5,000,000個、又は約5,000,000〜約7,000,000個の血小板を含んでいてもよい。
より本明細書に組み込まれる。
PRP組成物は、ヒト又は動物の全血供給源に由来するPRPを含んでいてもよい。PRPは、自己供給源、同種異系供給源、単一供給源、又は貯溜供給源の血小板及び/又は血漿から調製することができる。PRPを得るためには、全血を、例えば血液採取用注射器を使用して採取してもよい。採取される血液の量は、例えば、所望のPRP量、患者の健康、結合組織損傷及び/又はMIの重症度又は位置、準備したPRPの有効性、又は任意の適切な要因の組合せを含む、多数の要因に依存する場合がある。任意の好適な量の血液を採取することができる。例えば、約20cc〜約150ccの血液を採取することができる。より具体的には、約27cc〜約110cc又は約27cc〜約55ccの血液を採取することができる。幾つかの実施形態では、血液は、結合組織損傷及び/又はMIに現在罹患しているか、又は以前に罹患したことがある患者から採取してもよい。患者自身の血液から製作されたPRPは、有害反応又は感染症のリスクを著しく低減することができる。
再懸濁してもよい。
〜約7.5であってもよく、約7.4であってもよい。例えば、緩衝剤は、8.4%重炭酸ナトリウムであってもよい。これら実施形態では、全血から単離されたPRPの1cc毎に、0.05ccの8.4%重炭酸ナトリウムを添加してもよい。幾つかの実施形態では、注射器は、PRP及び重炭酸塩を混合するためにゆっくりと振とうしてもよい。
幾つかの変法では、PRP組成物は、患者への送達前に分析及び/又は改変することができる。PRP組成物は、例えば、治療される状態、初期全血球数、患者の遺伝子プロファイル、及び他の好適な因子に基づいて改変することができる。
定された遺伝子マーカーは、遺伝子チップ又は他の遺伝子発現技術等の遺伝子ツールを使用して検出可能であってもよい。幾つかの場合、試験することができる遺伝子には、これらに限定されないが、I型コラーゲン(COL1A1)、III型コラーゲン(COL3A1)、軟骨オリゴマーマトリックスタンパク質(COMP)、マトリックスメタロプロテアーゼ−3(MMP−3)、及びマトリックスメタロプロテアーゼ−13(MMP−13)が含まれる。そのような遺伝子ツールは、発現レベルの変化を測定するために、又は疾患状態に関連している可能性がある一塩基多型(SNP)を検出するために使用することができる。Affymetrix社製Gene Chip(登録商標)、Applied Microarrays社製CodeLink(登録商標)、及びEppendorf社製DualChip&Silverquant(登録商標)を含む、多数の遺伝子チップが市販されている。
本発明の実施形態は、創薬における、本明細書に記載の多血小板血漿組成物の使用に関する。PRP組成物は、疾患モデル等のモデル系、好ましくは哺乳動物モデルに、又はヒト研究の過程に、又は植物等の哺乳動物以外の系に投与される。遺伝子発現に対する投与PRP組成物の効果がモニターされる。例えば、1つの実施形態では、細胞培養系におけるPRP組成物の効果が、細胞の分子分析により研究される。DNA、RNA、マイクロRNA、及び/又はエピジェネティックマーカーを評価して、特定の障害に対する薬物の効能が決定される。幾つかの好ましい実施形態では、律速段階又はクリティカルパスで作用する既存の又は新規のタンパク質を発見するために、多血小板血漿が虚血組織又は細胞のアポトーシスを防止する機序が研究される。その後このタンパク質は精製され、疾患の治療において低分子薬として使用される。薬物の用量も評価される。
イクロアレイ、RNA、マイクロRNA、エピジェネティクス、又は他の分子分析技術を使用して、モデルにおけるPRP治療による遺伝子発現の変化を決定する。細胞遺伝子発現のパターンが評価及び分析される。特定された分子が精製される。特定の疾患を治療するための薬物が生成され、効能が試験される。具体的には、特定の疾患又は状態を治療するために使用することができる酵素、タンパク質、又は分子が特定される。
PRP組成物は、任意の好適な用量で送達することができる。幾つかの実施形態では、用量は、約1cc〜約3cc、約3cc〜約5cc、約5cc〜約10cc、又は約10cc〜約20cc、又はそれ以上であってもよい。用量は、医学的処置に従って(例えば、処置の特定の時点で)及び/又はスケジュールに従って送達することができる。例えば、PRP組成物は、待機的除細動の前に、その処置を開始する約24時間、約12時間、約6時間、約2時間、及び/又は約1時間前に送達してもよい。
きる。幾つかの実施形態では、PRPをコーティングした縫合材料は、冷凍で、及び/又は低酸素濃度又は高酸素濃度下で保管してもよい。幾つかの実施形態では、PRPは、単独で、又は縫合糸、ネジ、ステント、埋め込み不能なデバイス、若しくは他のデバイス等の固定デバイスと組合せて、低酸素分圧及び/又は高酸素分圧、低pH及び/又は高pH、低圧力及び/又は高圧力、低UV及び/又は高UV又は他の光条件、低温及び/又は高温等の種々の条件下で、インキュベート又は保管してもよい。すなわち、チャンバー中の酸素分圧、pH、圧力、UV若しくは他の光、又は温度の条件は、生理学的及び/又は周囲条件とは異なる。
従って、梗塞の特定タイプ及び/又は位置は、PRP組成物を患者に送達する前に特定してもよく、又は特定されていなくともよい。例えば、患者が、急性MIを罹患したことがあるか又は現在罹患していると単に決定することで十分な場合がある。従って、ECGは、PRPを送達するために必ずしも必要とされるわけではない。無論、ECGの使用は、ある状況では有益であり得る。例えば、調製及び使用されるPRP組成物の量は、MIが上昇ST部分を伴うかどうかに基づいて異なっていてもよい。幾つかの変法では、ECGを記録する前に全血を採取して、PRP組成物の調製を始める。その後、ECGを使用して、適切な送達機構を、PRP組成物の調製と同時に決定することができる。
入することができる。その後、送達デバイスの遠位端部を、心筋層の表面に対して配置することができ、1つ又は複数の針を組織へ進めることができる。PRP組成物の1つ又は複数の成分を送達した後、もしあれば、針を撤収することができる。その後送達デバイスは、組成物の1つ又は複数の成分を更に送達するために再配置してもよく、又は患者から取り除いてもよい。その後、標準的技術を使用して切開部を閉じることができる。
使用して、単一位置への単一送達を行ってもよく、又は複数のデバイスを使用して、単一位置への単一送達を行ってもよい。送達デバイスは、少なくとも1つの再使用可能な針又はカテーテルを備えていてもよい。幾つかの実施形態は、自動投薬システム(例えば、注射器押出システム)を有する送達デバイスを備えていてもよい。自動投薬システムは、各用量を事前に決定し、目盛りで設定することを可能にしてもよい(可変でもよく又は固定でもよい)幾つかの実施形態では、イオン泳動デバイスを使用して、PRP組成物を虚血組織に送達することができる。
虚血組織に接する組織に送達されてもよい。同様に、本組成物は、虚血組織及び他の心臓組織の領域の任意の組合せに送達されてもよい。
キットは、本明細書に記載の任意のデバイス、部品、又はデバイス及び/若しくは部品の組合せを含んでいてもよい。例えば、キットは、1つ又は複数の調製デバイス、1つ又は複数の送達デバイス、1つ又は複数の収集デバイス、及び/又は使用説明書を含んでいてもよい。1つ又は複数の調製デバイスは、PRPを調製するためのものであり、例えば、遠心機を含んでいてもよい。1つ又は複数の送達デバイスは、損傷結合組織に、又はMIを治療するために心臓の領域に、PRPを含むPRP組成物を送達するように構成されていてもよい。1つ又は複数の収集デバイスは、1つ又は複数の注射器、アフェレーシス針、又は患者から血液を収集するための他のデバイスを含んでいてもよい。患者は、MI及び/又は結合組織損傷を現在罹患しているか又は過去に罹患していてもよい。キットの部品は、滅菌容器に包装されていてもよい。キットは、1つ又は複数の使い捨て部品を含んでいてもよい。説明書は、文字又は絵文字の形態であってもよく、又は音声テープ、音声CD、ビデオテープ、DVD、又はCD−ROM等を含む記録媒体にあってもよい。
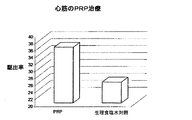
Biomet社製GPSシステム、Depuy社製Symphony機、Medtronic社製Magellan機、Harvest社(プリマス、マサチューセッツ州)、Genesis Enterprises社、Sorin Medical社、及びRegen Lab社製のもの等の遠心機ユニットを使用して、PRPを調製した。およそ55ccのヒト全血を、標準的滅菌注射器を使用して採取し、血液凝固阻止のために5ccのクエン酸デキストロース溶液と混合し、その後製造業者のプロトコールに従って遠心沈降して、血小板を単離した。その後これら血小板を、およそ3ccの血漿に再懸濁した。種々の濃度が、図1の表に示されている。
心臓発作が疑われる患者の全血を、緊急処置室に運び込まれた直後に採取する。血液を臨床検査用に送ってもよいが、ヘパリン、TPA、plavix、アスピリン、及び/又は他の薬理学的作用剤又は介入作用剤の投与前に、多血小板血漿(PRP)を調製するために十分な余分の血液も採取されている。PRPは、再灌流療法開始後の送達用に取っておくか、及び/又はそのような介入の前に送達する。
多血小板血漿を、in−vitro、動物、又はヒトモデルにおける虚血再灌流治験(心臓発作等の)に使用する。組織又は細胞の発現分析を、様々な時点で行う。マイクロアレイ出力のコンピューター分析を行って、アポトーシス、細胞調節、又は任意の新規若しくは既存のシグナル経路のマーカーの特異的上方制御又は下方制御を捜し出す。PRPに応答して上方制御又は下方制御された遺伝子を特定する。これら特定された遺伝子に効果を及ぼす薬物を、虚血状態に対するそれらの効果について試験する。遺伝子発現に基づいて、心臓発作、脳卒中、又は外傷性傷害で生じる場合があるもの等の、虚血又は再灌流組織の問題を治療するのに有用な薬物を特定する。
PRP組成物を使用する治療を、in vitro、動物、又はヒトモデルにおける癌治験で使用する。例えば、PRPを腫瘍に又は腫瘍の周辺に注射することができる。遺伝子発現に対する治療の効果を、マイクロアレイを使用して決定する。マイクロアレイ出力のコンピューター分析を行って、アポトーシス、細胞調節、又は任意の新規若しくは既存のシグナル経路のマーカーの特異的上方制御又は下方制御を捜し出す。治療が成功した個体の遺伝子発現に基づいて、有効な治療に応答して上方制御又は下方制御された遺伝子を特定する。特定された遺伝子に効果を及ぼす薬物を、これらに限定されないが、脳癌、肺癌、乳癌、結腸癌、又は他の腫瘍性疾患を含む、いずれか又は全てのタイプの癌の治療に使用する。
実施例3及び4のように、PRP組成物を使用する。これらに限定されないが、腱、靭帯、軟骨、脊椎円板、筋肉、又は硬骨等を含む結合組織傷害等の別の疾患状態又は障害が、特定される。様々な用量又は製剤の多血小板血漿又はその誘導体を添加した及び添加しない細胞又は組織の遺伝子発現を評価するために、特定のプロトコールを開発する。その後、この発現を分析して、そのような障害に関する薬物開発の新規な標的を探し出す。
Claims (45)
- 全血に由来し、全血中の血小板濃度の少なくとも約1.1倍である第1の濃度の血小板と、
全血に由来し、少なくとも全血中の白血球濃度である第2の濃度の白血球を含み、前記白血球が、
全血中の単球濃度の少なくとも2倍である第3の濃度の単球、
全血中のリンパ球濃度の少なくとも2倍である第4の濃度のリンパ球、及び
全血中の好酸球濃度の約1.5倍である第5の濃度の好酸球を含む組成物。 - 前記第1の濃度が、全血中の血小板濃度の2〜8倍である、請求項1に記載の組成物。
- 前記第1の濃度が、全血中の血小板濃度の約4倍〜約6倍である、請求項1に記載の組成物。
- 前記第1の濃度が、1マイクロリットル当たり約500,000〜約1,500,000個の血小板、より好ましくは1マイクロリットル当たり約600,000〜約900,000個の血小板である、請求項1に記載の組成物。
- 前記第2の濃度が、全血中の白血球濃度の4〜8倍である、請求項1に記載の組成物。
- 前記第2の濃度が、1マイクロリットル当たり約15,000〜約50,000個の白血球である、請求項1に記載の組成物。
- 前記第3の濃度が、全血中の単球濃度の約8倍未満である、請求項1に記載の組成物。
- 前記3の濃度が、1マイクロリットル当たり約1,000〜約5,000個の単球である、請求項1に記載の組成物。
- 前記第4の濃度が、全血中のリンパ球濃度の約8倍未満である、請求項1に記載の組成物。
- 前記4の濃度が、1マイクロリットル当たり約5,000〜約20,000個のリンパ球である、請求項1に記載の組成物。
- 前記第5の濃度が、1マイクロリットル当たり約200〜約1,000個の好酸球である、請求項1に記載の組成物。
- 全血中の赤血球濃度未満である第6の濃度の赤血球を更に含み、前記第6の濃度が、全血中の赤血球濃度の約0.1〜約0.9倍である、請求項1に記載の組成物。
- 全血中のヘモグロビン濃度の約0.25倍である第7の濃度のヘモグロビンを更に含む、請求項1に記載の組成物。
- 前記第7の濃度が、1デシリットル当たり約5グラム未満、より好ましくは1デシリットル当たり約3.5グラム未満である、請求項13に記載の組成物。
- 前記白血球が、第8の濃度の好中球を更に含み、前記第8の濃度が、全血中の好中球の濃度未満である、請求項1に記載の組成物。
- 前記好中球が除去されている、請求項15に記載の組成物。
- 前記第8の濃度が、全血中の好中球濃度の約4倍〜約8倍である、請求項15に記載の組成物。
- 前記第8の濃度が、1マイクロリットル当たり約10,000〜約40,000個の好中球である、請求項15に記載の組成物。
- 前記組成物が、遠心分離、重力ろ過、又は直接細胞選別により、全血から調製される、請求項1に記載の組成物。
- 心臓の状態を治療するための方法であって、
急性虚血、心筋梗塞、不整脈、アポトーシス、又は心機能低下からなる群から選択される患者の心臓の状態を特定すること;及び
請求項1〜19のいずれかに記載の組成物を前記患者に送達して、前記心臓の状態を治療することを含む方法。 - 前記患者の全血に由来する前記組成物を調製することを更に含む、請求項20に記載の方法。
- 前記組成物を送達する前に、前記組成物に対する適合性に関して多血小板血漿を試験することを更に含む、請求項20に記載の方法。
- 急性虚血性組織損傷が、直近の24時間以内に生じた、請求項20に記載の方法。
- 心筋梗塞を治療する再灌流療法が、直近の24時間以内に行われ、前記組成物の送達が、前記再灌流療法の前又は後の約24時間以内に行われる、請求項20に記載の方法。
- 損傷結合組織を治療するための方法であって、
外側上顆炎、足底筋膜炎、膝蓋腱炎、アキレス腱炎、回旋筋腱板腱炎、足首捻挫、及び靱帯裂傷からなる群から選択される患者の損傷結合組織を特定すること、及び
請求項1〜19のいずれかに記載の組成物を前記患者に送達して、前記損傷結合組織を治療することを含む方法。 - 前記患者の全血に由来する前記組成物を調製することを更に含む、請求項37に記載の方法。
- 患者からPRPを調製するための方法であって、
前記患者から血液を採取すること、
前記血液からPRPを調製すること、及び
前記患者に再灌流療法を施すことを含み、血栓溶解剤が、前記血液を採取する前に前記患者に投与されていない方法。 - 前記血栓溶解剤が、ヘパリン、tPA、PLAVIX(登録商標)、及びアスピリンからなる群から選択される、請求項27に記載の方法。
- 前記患者が、前記血液を採取する前の少なくとも2時間、好ましくは1日間、より好ましくは2週間、更により好ましくは1か月間、血栓溶解剤を受容していない、請求項27に記載の方法。
- 前記血液からのPRPの調製が、
前記血液から血漿画分を取得するステップ、
前記血漿画分から血小板を単離するステップ、
低減された量の血漿中に前記血小板を再懸濁するステップ、及び
前記再懸濁された血小板に7.3〜7.5のpHをもたらすようにpHを調整して多血小板血漿組成物を準備するステップを含み、前記多血小板血漿の活性化因子が前記多血小板血漿組成物に添加されていない、請求項27に記載の方法。 - 疾患又は状態を治療するための薬物候補を特定するための方法であって、
請求項1〜19のいずれかに記載の多血小板血漿組成物を、疾患又は状態を罹患している個体に、又は細胞培養、コンピュータモデル、及び動物モデルからなる群から選択されるその疾患の疾患モデルに、治療として投与すること、
前記疾患又は状態を罹患している個体、又はその疾患の前記モデルにおいて、前記治療の効能をモニターすること、
前記治療に応答する個体又は前記治療に応答する前記モデルからの結果を選択すること、
前記応答個体又は応答モデルから血液、唾液、又は組織試料を取得すること、
前記試料を、所定のマーカー(複数可)について分析すること、
前記試料の分析を、前記治療に応答しない前記疾患の個体又はモデルと比較すること、及び
前記治療に応答する被検体を特定すること、及び
前記被検体に影響を及ぼす薬物についてスクリーニングし、それにより前記疾患又は状態を治療するための薬物候補を特定することを含む方法。 - 前記治療に応答しない前記個体又はモデルが、前記疾患又は状態を有していない、請求項31に記載の方法。
- 前記治療に応答しない前記個体又はモデルが、前記疾患又は状態を有しているが、前記治療に応答しない、請求項31に記載の方法。
- 前記疾患又は状態が、虚血、癌、免疫系疾患、結合組織傷害、皮膚疾患、及び神経系疾患からなる群から選択される、請求項31に記載の方法。
- 前記疾患又は状態が虚血であり、前記虚血が心虚血である、請求項34に記載の方法。
- 前記疾患又は状態が癌であり、前記癌が脳癌である、請求項34に記載の方法。
- 前記疾患又は状態が、肘、肩、又は膝の腱症である結合組織傷害である、請求項34に記載の方法。
- 前記疾患又は状態が、パーキンソン病である神経系疾患である、請求項34に記載の方法。
- 前記治療が、PRP組成物を、腫瘍、心臓組織、又は結合組織に投与することを含む、請求項31に記載の方法。
- 前記PRP組成物が、全血の濃度の0〜0.9のレベルである好中球を含む、請求項31に記載の方法。
- 前記分析が、遺伝子プロファイルを決定することを含む、請求項31に記載の方法。
- 前記分析が、タンパク質、脂質、抗体、抗原、酵素、又は低分子のレベルを測定することを含む、請求項31に記載の方法。
- 患者の疾患診断をするための方法であって
前記患者から血液試料を取得すること、
前記血液試料からPRPを取得すること、
前記PRPから分析を取得すること、及び
前記患者に由来する前記PRPの前記分析を、前記疾患を有する集団のPRPから得られた分析と比較すること、及び
前記患者の前記PRPの分析が、前記疾患集団の前記PRPの前記分析と一致することを決定し、それにより前記疾患を診断することを含み、
前記分析が、イムノアッセイ又は遺伝子プロファイルである方法。 - 請求項1〜19のいずれか1つに記載の多血小板血漿を、単独で又はステント、縫合糸、ネジ、及び埋め込み可能なデバイスからなる群から選択される固定デバイスと組合せて含むデバイス。
- 前記デバイスが、チャンバーであり、前記チャンバー内の条件が、低酸素分圧、高酸素分圧、低pH、高pH、低圧力、高圧力、低UV、高UV、低温、及び高温のうちの1つ又は複数を含む、請求項44に記載のデバイス。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10407408P | 2008-10-09 | 2008-10-09 | |
| US61/104,074 | 2008-10-09 | ||
| PCT/US2009/060061 WO2010042762A1 (en) | 2008-10-09 | 2009-10-08 | Platelet rich plasma formulations for cardiac treatments |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012505239A true JP2012505239A (ja) | 2012-03-01 |
| JP2012505239A5 JP2012505239A5 (ja) | 2012-11-22 |
Family
ID=42099040
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011531182A Pending JP2012505239A (ja) | 2008-10-09 | 2009-10-08 | 心臓治療用の多血小板血漿製剤 |
Country Status (4)
| Country | Link |
|---|---|
| US (6) | US8440459B2 (ja) |
| EP (1) | EP2337617A4 (ja) |
| JP (1) | JP2012505239A (ja) |
| WO (1) | WO2010042762A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2022239870A1 (ja) * | 2021-05-14 | 2022-11-17 | セルソース株式会社 | 血液由来成長因子含有組成物及びその調製方法 |
| JP7175055B1 (ja) | 2021-05-14 | 2022-11-18 | セルソース株式会社 | 血液由来成長因子含有組成物及びその調製方法 |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6811777B2 (en) | 2002-04-13 | 2004-11-02 | Allan Mishra | Compositions and minimally invasive methods for treating incomplete connective tissue repair |
| US7608258B2 (en) * | 2002-04-13 | 2009-10-27 | Allan Mishra | Method for treatment of tendinosis using platelet rich plasma |
| US7678780B2 (en) * | 2003-12-29 | 2010-03-16 | Allan Mishra | Method of treating cancer using platelet releasate |
| US7462268B2 (en) | 2004-08-20 | 2008-12-09 | Allan Mishra | Particle/cell separation device and compositions |
| US20100112081A1 (en) | 2008-10-07 | 2010-05-06 | Bioparadox, Llc | Use of platelet rich plasma composition in the treatment of cardiac conduction abnormalities |
| EP2337617A4 (en) | 2008-10-09 | 2013-06-12 | Bioparadox Llc | SQUARE PLASMA FORMULATIONS FOR HEART TREATMENTS |
| WO2011028733A1 (en) * | 2009-09-04 | 2011-03-10 | Allan Mishra | Compositions and minimally invasive methods for treating cancer |
| WO2011127071A1 (en) * | 2010-04-05 | 2011-10-13 | Allan Mishra | Platelet rich plasma formulations |
| WO2014126931A1 (en) * | 2013-02-15 | 2014-08-21 | Victor Steven | Stable platelet- rich-plasma compositions and methods of use |
| US20140356893A1 (en) | 2013-06-04 | 2014-12-04 | Allan Mishra | Compositions and methods for using platelet-rich plasma for drug discovery, cell nuclear reprogramming, proliferation or differentiation |
| US11340212B2 (en) * | 2017-04-21 | 2022-05-24 | Greyledge Technologies, Llc | Biological fluid composition categorization method |
| US20180353542A1 (en) * | 2017-06-08 | 2018-12-13 | Allan Kumar Mishra | Mononuclear-rich, platelet-rich plasma compositions and methods of use thereof |
| WO2021091855A1 (en) * | 2019-11-04 | 2021-05-14 | Alkahest, Inc. | Blood plasma fractions for use in muscle regeneration |
| WO2024040248A2 (en) * | 2022-08-19 | 2024-02-22 | The Regents Of The University Of California | Biomaterial for wound regenerative healing |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060127382A1 (en) * | 2004-08-20 | 2006-06-15 | Allan Mishra | Particle/cell separation device and compositions |
| WO2007112135A2 (en) * | 2006-03-23 | 2007-10-04 | Medtronic Vascular, Inc. | Methods and systems for treating injured cardiac tissue |
| US20080045964A1 (en) * | 2006-08-16 | 2008-02-21 | Allan Mishra | Device for cartilage repair |
| US20080089867A1 (en) * | 2006-10-13 | 2008-04-17 | Brian Fernandes | Method of increasing retention, survival and proliferation of transplanted cells in vivo |
Family Cites Families (69)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4414108A (en) | 1980-05-09 | 1983-11-08 | The United States Of America As Represented By The Department Of Health And Human Services | Apparatus and method for continuous countercurrent extraction and particle separation |
| CA1244774A (en) | 1983-11-09 | 1988-11-15 | Thomas Jefferson University | Medium for storing blood platelets |
| US5165938A (en) | 1984-11-29 | 1992-11-24 | Regents Of The University Of Minnesota | Wound healing agents derived from platelets |
| US5178883A (en) | 1984-11-29 | 1993-01-12 | Regents Of The University Of Minnesota | Method for promoting hair growth |
| US4957742A (en) | 1984-11-29 | 1990-09-18 | Regents Of The University Of Minnesota | Method for promoting hair growth |
| US5428008A (en) | 1989-04-14 | 1995-06-27 | Prp, Inc. | Therapeutic composition of micellar structures capable of promoting hemotasis |
| US5599558A (en) | 1989-09-15 | 1997-02-04 | Curative Technologies, Inc. | Selecting amounts of platelet releasate for efficacious treatment of tissue |
| IL95641A0 (en) | 1989-09-15 | 1991-06-30 | Curative Tech Inc | Preparation of a platelet releasate product |
| US5147776A (en) | 1990-02-26 | 1992-09-15 | University Of Iowa Research Foundation | Use of 2,5-anhydromannitol for control of pH during blood storage |
| US5641622A (en) | 1990-09-13 | 1997-06-24 | Baxter International Inc. | Continuous centrifugation process for the separation of biological components from heterogeneous cell populations |
| US5474891A (en) | 1991-10-30 | 1995-12-12 | Thomas Jefferson University | Plasma-based platelet concentrate preparations with additive |
| US5785869A (en) | 1992-02-10 | 1998-07-28 | Baxter International Inc. | Method for creating a leukocyte rich sample from a mixed population of blood cells |
| US5403272A (en) | 1992-05-29 | 1995-04-04 | Baxter International Inc. | Apparatus and methods for generating leukocyte free platelet concentrate |
| DE69332756T2 (de) | 1992-05-29 | 2004-02-19 | University Of North Carolina At Chapel Hill | Im immobilisierten zustand getrocknete pharmazeutische verträgliche menschliche blutplättchen |
| US5494590A (en) | 1992-06-11 | 1996-02-27 | Becton Dickinson | Method of using anticoagulant solution in blood separation |
| WO1995008640A1 (en) | 1993-09-23 | 1995-03-30 | E.I. Du Pont De Nemours And Company | An electrophoretic method for the isolation and separation of microorganisms |
| US5662813A (en) | 1994-10-21 | 1997-09-02 | Bioseparations, Inc. | Method for separation of nucleated fetal erythrocytes from maternal blood samples |
| US7169547B2 (en) | 1994-12-05 | 2007-01-30 | New York Blood Center, Inc. | High concentration white blood cells as a therapeutic product |
| US5789147A (en) | 1994-12-05 | 1998-08-04 | New York Blood Center, Inc. | Method for concentrating white cells from whole blood by adding a red cell sedimentation reagent to whole anticoagulated blood |
| US5585007A (en) | 1994-12-07 | 1996-12-17 | Plasmaseal Corporation | Plasma concentrate and tissue sealant methods and apparatuses for making concentrated plasma and/or tissue sealant |
| US5614204A (en) | 1995-01-23 | 1997-03-25 | The Regents Of The University Of California | Angiographic vascular occlusion agents and a method for hemostatic occlusion |
| US5510102A (en) | 1995-01-23 | 1996-04-23 | The Regents Of The University Of California | Plasma and polymer containing surgical hemostatic adhesives |
| US5643786A (en) | 1995-01-27 | 1997-07-01 | The United States Of America As Represented By The Department Of Health And Human Services | Method for isolating dendritic cells |
| US5733545A (en) * | 1995-03-03 | 1998-03-31 | Quantic Biomedical Partners | Platelet glue wound sealant |
| US5834418A (en) | 1996-03-20 | 1998-11-10 | Theratechnologies, Inc. | Process for the preparation of platelet growth factors extract |
| DE19781869T1 (de) | 1996-04-30 | 2000-03-16 | Medtronic Inc | Verfahren zur Herstellung eines autologen Fibrin-Blutstillungsmittels |
| WO2000062828A1 (en) | 1996-04-30 | 2000-10-26 | Medtronic, Inc. | Autologous fibrin sealant and method for making the same |
| EP0988552B1 (en) | 1997-06-10 | 2010-11-24 | Lpath, Inc. | Methods for early detection of heart disease |
| US6098631A (en) | 1998-01-21 | 2000-08-08 | The Regents Of The University Of Michigan | Compositions and methods for treating autoimmune disease |
| US7771719B1 (en) | 2000-01-11 | 2010-08-10 | Genentech, Inc. | Pharmaceutical compositions, kits, and therapeutic uses of antagonist antibodies to IL-17E |
| FR2781485B1 (fr) * | 1998-07-21 | 2003-08-08 | Denis Barritault | Polymeres biocompatibles leur procede de preparation et les compositions les contenant |
| ATE324831T1 (de) | 1998-08-26 | 2006-06-15 | Neomend Inc | Kit zur in-situ-erzeugung chemisch verbundener mechanischer barrieren oder abdeckstrukturen für eine punktionsstelle in einem blutgefäss |
| US6432119B1 (en) | 1999-03-17 | 2002-08-13 | Angiotrax, Inc. | Apparatus and methods for performing percutaneous myocardial revascularization and stimulating angiogenesis using autologous materials |
| DE19960504A1 (de) | 1999-12-15 | 2001-08-16 | Curasan Ag | Regenerationsmittel |
| EP2330219A3 (en) * | 2000-04-14 | 2011-11-23 | Metabolon, Inc. | Method for drug discovery, disease treatment and diagnosis using metabolomics |
| AU2001259449A1 (en) | 2000-05-03 | 2001-11-12 | Eligix, Inc. | Whole blood separator apparatus and method of use |
| US6922685B2 (en) | 2000-05-22 | 2005-07-26 | Mci, Inc. | Method and system for managing partitioned data resources |
| US6554801B1 (en) | 2000-10-26 | 2003-04-29 | Advanced Cardiovascular Systems, Inc. | Directional needle injection drug delivery device and method of use |
| US7740623B2 (en) | 2001-01-13 | 2010-06-22 | Medtronic, Inc. | Devices and methods for interstitial injection of biologic agents into tissue |
| US6942880B1 (en) | 2001-04-09 | 2005-09-13 | Medtronic, Inc. | Autologous platelet gel having beneficial geometric shapes and methods of making the same |
| US20030152639A1 (en) | 2001-07-03 | 2003-08-14 | Calvin Britton | Novel wound healing composition not containing bovine-derived activating reagents |
| US7357947B2 (en) | 2001-09-10 | 2008-04-15 | Biomet, Inc. | Bone graft material incorporating demineralized bone matrix and lipids |
| CA2455964A1 (en) | 2001-12-05 | 2003-06-19 | Gambro, Inc. | Methods and apparatus for separation of blood components |
| US7241281B2 (en) | 2002-04-08 | 2007-07-10 | Thermogenesis Corporation | Blood component separation method and apparatus |
| US7211191B2 (en) | 2004-09-30 | 2007-05-01 | Thermogenesis Corp. | Blood component separation method and apparatus |
| US6811777B2 (en) * | 2002-04-13 | 2004-11-02 | Allan Mishra | Compositions and minimally invasive methods for treating incomplete connective tissue repair |
| US7608258B2 (en) | 2002-04-13 | 2009-10-27 | Allan Mishra | Method for treatment of tendinosis using platelet rich plasma |
| US7806845B2 (en) | 2002-04-24 | 2010-10-05 | Biomet Biologics, Llc | Blood separation and concentration system |
| US6905612B2 (en) | 2003-03-21 | 2005-06-14 | Hanuman Llc | Plasma concentrate apparatus and method |
| US20030205538A1 (en) | 2002-05-03 | 2003-11-06 | Randel Dorian | Methods and apparatus for isolating platelets from blood |
| US20040182795A1 (en) | 2003-03-21 | 2004-09-23 | Randel Dorian | Apparatus and method for concentration of plasma from whole blood |
| US6982038B2 (en) | 2002-06-14 | 2006-01-03 | Medtronic, Inc. | Centrifuge system utilizing disposable components and automated processing of blood to collect platelet rich plasma |
| US20070225614A1 (en) | 2004-05-26 | 2007-09-27 | Endothelix, Inc. | Method and apparatus for determining vascular health conditions |
| EP1569510B1 (en) * | 2002-09-27 | 2011-11-02 | The General Hospital Corporation | Microfluidic device for cell separation and uses thereof |
| US7291450B2 (en) | 2003-03-28 | 2007-11-06 | Smith & Nephew, Inc. | Preparation of a cell concentrate from a physiological solution |
| US7927591B2 (en) * | 2004-02-19 | 2011-04-19 | The Cbr Institute For Biomedical Research, Inc. | Conformation specific antibodies |
| US20060095121A1 (en) | 2004-10-28 | 2006-05-04 | Medtronic Vascular, Inc. | Autologous platelet gel on a stent graft |
| US7708152B2 (en) | 2005-02-07 | 2010-05-04 | Hanuman Llc | Method and apparatus for preparing platelet rich plasma and concentrates thereof |
| US8316434B2 (en) * | 2005-02-23 | 2012-11-20 | At&T Intellectual Property I, L.P. | Centralized access control system and methods for distributed broadband access points |
| WO2007002554A2 (en) | 2005-06-23 | 2007-01-04 | Medtronic Vascular, Inc. | Methods and systems for treating injured cardiac tissue |
| US20070172472A1 (en) * | 2005-06-23 | 2007-07-26 | Asha Nayak | Methods and Systems for Treating Injured Cardiac Tissue |
| EP2073788B9 (en) | 2006-09-28 | 2023-01-11 | The Children's Medical Center Corporation | Methods and collagen products for tissue repair |
| US20090053208A1 (en) | 2007-08-20 | 2009-02-26 | Medtronic Vascular, Inc. | Methods and Systems for Improving Tissue Perfusion |
| WO2010005557A2 (en) | 2008-07-07 | 2010-01-14 | Arteriocyte Medical Systems, Inc. | Biological therapeutic compositions and methods thereof |
| US20100112081A1 (en) | 2008-10-07 | 2010-05-06 | Bioparadox, Llc | Use of platelet rich plasma composition in the treatment of cardiac conduction abnormalities |
| EP2337617A4 (en) | 2008-10-09 | 2013-06-12 | Bioparadox Llc | SQUARE PLASMA FORMULATIONS FOR HEART TREATMENTS |
| US8177072B2 (en) | 2008-12-04 | 2012-05-15 | Thermogenesis Corp. | Apparatus and method for separating and isolating components of a biological fluid |
| US8921037B2 (en) | 2008-12-16 | 2014-12-30 | Bo Han | PF4-depleted platelet rich plasma preparations and methods for hard and soft tissue repair |
| WO2011127071A1 (en) * | 2010-04-05 | 2011-10-13 | Allan Mishra | Platelet rich plasma formulations |
-
2009
- 2009-10-08 EP EP09819913.6A patent/EP2337617A4/en not_active Ceased
- 2009-10-08 JP JP2011531182A patent/JP2012505239A/ja active Pending
- 2009-10-08 US US12/576,101 patent/US8440459B2/en active Active
- 2009-10-08 WO PCT/US2009/060061 patent/WO2010042762A1/en active Application Filing
-
2011
- 2011-12-21 US US13/333,082 patent/US8444969B2/en active Active
-
2013
- 2013-05-07 US US13/889,153 patent/US20130243879A1/en not_active Abandoned
-
2017
- 2017-06-08 US US15/617,384 patent/US20170274015A1/en not_active Abandoned
-
2019
- 2019-07-19 US US16/517,148 patent/US20200179455A1/en not_active Abandoned
-
2021
- 2021-11-11 US US17/454,586 patent/US20220313739A1/en not_active Abandoned
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060127382A1 (en) * | 2004-08-20 | 2006-06-15 | Allan Mishra | Particle/cell separation device and compositions |
| WO2007112135A2 (en) * | 2006-03-23 | 2007-10-04 | Medtronic Vascular, Inc. | Methods and systems for treating injured cardiac tissue |
| US20080045964A1 (en) * | 2006-08-16 | 2008-02-21 | Allan Mishra | Device for cartilage repair |
| US20080089867A1 (en) * | 2006-10-13 | 2008-04-17 | Brian Fernandes | Method of increasing retention, survival and proliferation of transplanted cells in vivo |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2022239870A1 (ja) * | 2021-05-14 | 2022-11-17 | セルソース株式会社 | 血液由来成長因子含有組成物及びその調製方法 |
| JP7175055B1 (ja) | 2021-05-14 | 2022-11-18 | セルソース株式会社 | 血液由来成長因子含有組成物及びその調製方法 |
| JP2022176421A (ja) * | 2021-05-14 | 2022-11-29 | セルソース株式会社 | 血液由来成長因子含有組成物及びその調製方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20130243879A1 (en) | 2013-09-19 |
| US8440459B2 (en) | 2013-05-14 |
| US20220313739A1 (en) | 2022-10-06 |
| WO2010042762A1 (en) | 2010-04-15 |
| US20100092444A1 (en) | 2010-04-15 |
| EP2337617A4 (en) | 2013-06-12 |
| EP2337617A1 (en) | 2011-06-29 |
| US20120093941A1 (en) | 2012-04-19 |
| US20170274015A1 (en) | 2017-09-28 |
| US20200179455A1 (en) | 2020-06-11 |
| US8444969B2 (en) | 2013-05-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220313739A1 (en) | Platelet rich plasma formulations and use thereof | |
| US20220195391A1 (en) | Platelet-rich plasma compositions and methods of preparation | |
| US20230129268A1 (en) | Platelet rich plasma formulations | |
| US20240082301A1 (en) | Use of platelet rich plasma composition in the treatment of cardiac conduction abnormalities | |
| JP2010285440A (ja) | 治療複合物 | |
| Kaeser et al. | Autologous adult cortical cell transplantation enhances functional recovery following unilateral lesion of motor cortex in primates: a pilot study | |
| UA123503C2 (uk) | Застосування триентину для доставки міді в ішемізовану тканину | |
| US20140329322A1 (en) | Method of differentiating glioblastoma cells | |
| US20220233585A1 (en) | Mononuclear-rich, platelet-rich plasma compositions and methods of use thereof | |
| Dzhyvak et al. | Potentials and impact of platelet-rich plasma (PRP) on the regenerative properties of muscle tissue. | |
| US20100233282A1 (en) | Device and methods for delivery of bioactive materials to the right side of the heart | |
| JP6525889B2 (ja) | 自己骨髄由来の幹細胞の迅速な注入 | |
| Spadaccio et al. | In situ electrostimulation drives a regenerative shift in the zone of infarcted myocardium | |
| AU2019463156B2 (en) | Activated mesenchymal stem cells for treating limb ischemia | |
| Sadraddin | Antiarrhythmic effect of human bone marrow-dereived CD271+ mesenchymal stem cells tested in vivo using a new infarction-re-infarction mouse model | |
| US20120171181A1 (en) | Compositions and minimally invasive methods for treating cancer | |
| Mehran et al. | The HEP@ NET study: an internet-based registry examining the efficacy of heparin coating in patients undergoing coronary stent implantation | |
| JP2009507522A (ja) | 損傷のある心臓組織を処置する方法およびシステム | |
| Humans | Myocardial Cellular Implantation: Scaling |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121002 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20121002 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20131122 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20131122 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140107 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140407 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20140408 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140507 |