JP2011508199A - 標的粒子を検出するためのマイクロエレクトロニクスセンサデバイス - Google Patents
標的粒子を検出するためのマイクロエレクトロニクスセンサデバイス Download PDFInfo
- Publication number
- JP2011508199A JP2011508199A JP2010538959A JP2010538959A JP2011508199A JP 2011508199 A JP2011508199 A JP 2011508199A JP 2010538959 A JP2010538959 A JP 2010538959A JP 2010538959 A JP2010538959 A JP 2010538959A JP 2011508199 A JP2011508199 A JP 2011508199A
- Authority
- JP
- Japan
- Prior art keywords
- target
- light beam
- sensor device
- target particle
- modulation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/1717—Systems in which incident light is modified in accordance with the properties of the material investigated with a modulation of one or more physical properties of the sample during the optical investigation, e.g. electro-reflectance
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/55—Specular reflectivity
- G01N21/552—Attenuated total reflection
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/648—Specially adapted constructive features of fluorimeters using evanescent coupling or surface plasmon coupling for the excitation of fluorescence
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/1717—Systems in which incident light is modified in accordance with the properties of the material investigated with a modulation of one or more physical properties of the sample during the optical investigation, e.g. electro-reflectance
- G01N2021/1721—Electromodulation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/1717—Systems in which incident light is modified in accordance with the properties of the material investigated with a modulation of one or more physical properties of the sample during the optical investigation, e.g. electro-reflectance
- G01N2021/1727—Magnetomodulation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/06—Illumination; Optics
- G01N2201/069—Supply of sources
- G01N2201/0691—Modulated (not pulsed supply)
Abstract
Description
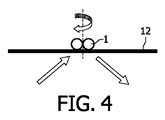
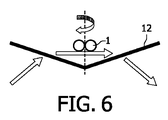
b) 前記センサユニットの感度領域についての、前記結合面での結合した標的粒子の運動を選択的に誘起する「作動ユニット」。本明細書においては、「前記感度領域についての運動」とは、前記感度領域内部での運動及び/又は前記感度領域の境界を交差する運動である。一般的には、前記作動ユニットは、適切な効果を適用することで、標的粒子の所望の運動-たとえば周囲の試料流体の力学的振動若しくは流体力学的運動、又は、外部印加される磁力及び/若しくは静電力によって誘起される前記標的粒子の振動-を実現して良い。前記運動は、前記標的粒子の結合が壊されずに保持されるようなものでなければならない。典型的には前記運動は振動である。
c) 前記センサユニットのセンサ信号を評価する「評価モジュール」。前記評価は、前記作動ユニットによって誘起された前記の結合した標的粒子の運動を考慮する。このため、前記の誘起された運動は、別個の測定によって検出されるか、又は、好適には前記作動ユニットの制御入力から推定されて良い。従って前記評価モジュールは典型的には、前記センサユニットと前記作動ユニットのいずれとも結合する。前記結合は、専用の(アナログ)電子回路及び/又は関連するソフトウエアが実装されたデジタルデータ処理ハードウエアによって実現されて良い。
a) センサユニットによってセンサ信号を測定する手順であって、前記センサ信号は前記センサユニットの感度領域内に標的粒子が存在することを示す、手順、
b) 前記センサユニットについての前記の結合した標的粒子の運動を作動ユニットによって選択的に誘起する手順、
c) 前記標的粒子の誘起された運動を考慮しながら前記センサ信号を評価モジュールによって評価する手順、
を有する。
本発明の上記態様及び他の態様は以降で説明する(複数の)実施例を参照することで明らかとなる。これらの実施例は添付図面の助けを借りた例として記載されている。
(1) カメラのフレーム速度を変調周波数に位相ロックすること、及び
(2) 照射(シャッターを開く)時間を十分に短く調節することによって変調周期の(一部)をサンプリングすること、
によって解決することができる。
Claims (13)
- キャリアの結合面の結合位置と結合する標的粒子を検査するマイクロエレクトロニクスセンサデバイスであって:
センサ信号を供するセンサユニットであって、前記センサ信号は当該センサユニットの感度領域内に標的粒子が存在することを示す、センサユニット;
前記センサユニットの感度領域についての、前記結合面での結合した標的粒子の運動を選択的に誘起する作動ユニット;及び、
前記作動ユニットによって誘起された前記の結合した標的粒子の運動を考慮するセンサ信号を評価する評価モジュール;
を有するマイクロエレクトロニクスセンサデバイス。 - キャリアの結合面の結合位置に結合する標的粒子を検査する方法であって:
センサユニットによってセンサ信号を測定する手順であって、前記センサ信号は前記センサユニットの感度領域内に標的粒子が存在することを示す、手順;
前記センサユニットについての前記の結合した標的粒子の運動を作動ユニットによって選択的に誘起する手順;及び、
前記標的粒子の誘起された運動を考慮しながら前記センサ信号を評価モジュールによって評価する手順;
を有する方法。 - 前記標的粒子が、前記感度領域内の前記センサユニットの各異なる感度の領域を通り抜けるように運動することを特徴とする、請求項1に記載のマイクロエレクトロニクスセンサデバイス又は請求項2に記載の方法。
- 前記標的粒子が、磁場又は電場との相互作用によって運動することを特徴とする、請求項1に記載のマイクロエレクトロニクスセンサデバイス又は請求項2に記載の方法。
- 前記の結合した標的粒子の誘起された運動が、好適には変調周波数によって周期的に変調されることを特徴とする、請求項1に記載のマイクロエレクトロニクスセンサデバイス又は請求項2に記載の方法。
- 前記の結合した標的粒子の誘起された運動が、非球形状を有するように設計された標的粒子の手段によって、前記標的粒子を貫通する軸の周りで変調されることを特徴とする、請求項1に記載のマイクロエレクトロニクスセンサデバイス又は請求項2に記載の方法。
- 前記センサ信号が、前記結合面での入射光ビームの減衰全内部反射から得られる光を有する出力光ビームから得られることを特徴とする、請求項1に記載のマイクロエレクトロニクスセンサデバイス又は請求項2に記載の方法。
- 前記入射光ビームが、好適には入力周波数で周期的に変調されることを特徴とする、請求項7に記載のマイクロエレクトロニクスセンサデバイス又は方法。
- 前記出力光ビームがカメラによって検出され、該カメラは、
(a) 前記出力光ビームの変調周波数ωに位相ロックされるが、ωよりも小さい周波数;及び、
(b) 前記出力光ビームの変調周期(T=2π/ω)よりも短い露光時間;
の条件で露光される、
請求項7又は8に記載のマイクロエレクトロニクスセンサデバイス又は方法。 - 前記センサ信号が、特に前記標的粒子の誘起された運動の変調、及び/又は入射光ビームの変調について復調されることを特徴とする、請求項1に記載のマイクロエレクトロニクスセンサデバイス又は請求項2に記載の方法。
- 前記標的粒子の誘起された運動の変調が、前記の復調されたセンサ信号において入射光ビームの変調に対する側帯域として現れることを特徴とする、請求項10に記載のマイクロエレクトロニクスセンサデバイス又は方法。
- 前記センサ信号は、前記のセンサユニットの感度領域内での標的粒子の存在及び/又は量について、及び/又は前記標的粒子と前記結合表面との間の結合の結合特性について評価されることを特徴とする、請求項1に記載のマイクロエレクトロニクスセンサデバイス又は請求項2に記載の方法。
- 本発明はさらに、分子診断、生物学的な試料分析、又は化学的な試料分析についての請求項1乃至12に記載のマイクロエレクトロニクスセンサデバイスの利用。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP07123741 | 2007-12-20 | ||
| PCT/IB2008/054541 WO2009083814A2 (en) | 2007-12-20 | 2008-10-31 | Microelectronic sensor device for the detection of target particles |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2011508199A true JP2011508199A (ja) | 2011-03-10 |
| JP2011508199A5 JP2011508199A5 (ja) | 2012-02-16 |
Family
ID=40671102
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010538959A Pending JP2011508199A (ja) | 2007-12-20 | 2008-10-31 | 標的粒子を検出するためのマイクロエレクトロニクスセンサデバイス |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US8486689B2 (ja) |
| EP (1) | EP2225547B1 (ja) |
| JP (1) | JP2011508199A (ja) |
| CN (1) | CN101903758B (ja) |
| BR (1) | BRPI0822092A8 (ja) |
| RU (1) | RU2489704C2 (ja) |
| WO (1) | WO2009083814A2 (ja) |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011080935A (ja) * | 2009-10-09 | 2011-04-21 | Konica Minolta Holdings Inc | 測定方法及び表面プラズモン増強蛍光測定装置 |
| JP2012215553A (ja) * | 2011-03-30 | 2012-11-08 | Toshiba Corp | 光導波路型測定システム、測定方法及び光導波路型センサチップ |
| JP2013506125A (ja) * | 2009-09-28 | 2013-02-21 | コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ | 物質決定装置 |
| JP2014025951A (ja) * | 2013-10-28 | 2014-02-06 | Konica Minolta Inc | 測定方法及び表面プラズモン増強蛍光測定装置 |
| JP2014531029A (ja) * | 2011-10-20 | 2014-11-20 | コーニンクレッカ フィリップス エヌ ヴェ | 培養期間を用いた磁性粒子の検出 |
| JP2015021889A (ja) * | 2013-07-22 | 2015-02-02 | コニカミノルタ株式会社 | 表面プラズモン増強蛍光測定方法および表面プラズモン増強蛍光測定装置 |
| JP2015021818A (ja) * | 2013-07-18 | 2015-02-02 | コニカミノルタ株式会社 | 表面プラズモン増強蛍光測定装置および表面プラズモン増強蛍光測定方法 |
| JP2015025820A (ja) * | 2014-11-04 | 2015-02-05 | 株式会社東芝 | 光導波路型測定システムおよび糖化ヘモグロビンの測定方法 |
| US9274104B2 (en) | 2011-03-30 | 2016-03-01 | Kabushiki Kaisha Toshiba | Measuring system using optical waveguide, measuring device, measuring method, optical waveguide type sensor chip, and magnetic fine particle |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120077206A1 (en) | 2003-07-12 | 2012-03-29 | Accelr8 Technology Corporation | Rapid Microbial Detection and Antimicrobial Susceptibility Testing |
| WO2005027714A2 (en) | 2003-07-12 | 2005-03-31 | Accelr8 Technology Corporation | Sensitive and rapid biodetection |
| US8797028B2 (en) * | 2007-10-25 | 2014-08-05 | Koninklijke Philips N.V. | Sensor device for target particles in a sample |
| CN102656443B (zh) * | 2009-12-18 | 2016-01-20 | 皇家飞利浦电子股份有限公司 | 物质确定设备 |
| EP2513636B1 (en) | 2009-12-18 | 2020-08-05 | Koninklijke Philips N.V. | Substance determining apparatus |
| WO2011151778A1 (en) | 2010-06-02 | 2011-12-08 | Koninklijke Philips Electronics N.V. | Sample carrier with light refracting structures |
| WO2012122314A2 (en) | 2011-03-07 | 2012-09-13 | Accelr8 Technology Corporation | Rapid cell purification systems |
| US10254204B2 (en) | 2011-03-07 | 2019-04-09 | Accelerate Diagnostics, Inc. | Membrane-assisted purification |
| EP2541230A1 (en) * | 2011-06-30 | 2013-01-02 | Koninklijke Philips Electronics N.V. | Detection of clusters of magnetic particles |
| DE102011088880A1 (de) * | 2011-12-16 | 2013-06-20 | Robert Bosch Gmbh | Schlauchbeutelmaschine zur Abfüllung eines Produkts |
| US9677109B2 (en) | 2013-03-15 | 2017-06-13 | Accelerate Diagnostics, Inc. | Rapid determination of microbial growth and antimicrobial susceptibility |
| US9759651B2 (en) * | 2014-12-23 | 2017-09-12 | Magellan Diagnostics, Inc. | Combination optical hemoglobin and electrochemical lead assay |
| CN104777136B (zh) * | 2015-03-25 | 2018-06-19 | 深圳市贝沃德克生物技术研究院有限公司 | 基于表面等离子共振技术的生物标志物检测方法与系统 |
| EP3278115A2 (en) | 2015-03-30 | 2018-02-07 | Accelerate Diagnostics, Inc. | Instrument and system for rapid microorganism identification and antimicrobial agent susceptibility testing |
| US10253355B2 (en) | 2015-03-30 | 2019-04-09 | Accelerate Diagnostics, Inc. | Instrument and system for rapid microorganism identification and antimicrobial agent susceptibility testing |
| US10928305B2 (en) | 2015-06-30 | 2021-02-23 | Imec Vzw | Modulation of luminescent dyes |
| CN105929149B (zh) * | 2016-04-26 | 2018-09-11 | 中国科学院电子学研究所 | 一种基于磁富集和全内反射的光学检测仪 |
| RU177920U1 (ru) * | 2016-11-30 | 2018-03-15 | Общество с ограниченной ответственностью "ГемаКор Лабс" (ООО "ГемаКор Лабс") | Устройство мониторинга пространственно-временной динамики тромбина |
| JP7290243B2 (ja) * | 2019-03-29 | 2023-06-13 | Tianma Japan株式会社 | ガス検知装置 |
| US11467093B2 (en) * | 2019-10-24 | 2022-10-11 | Ming Chuan University | Electrical polarity adjustable biosensor based on lossy mode resonance, biosensing system, and method of using the same |
| CN115615960B (zh) * | 2022-12-14 | 2023-03-21 | 中节能(达州)新材料有限公司 | 一种玻璃微珠涂层反光性能测试平台 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003098075A (ja) * | 2001-09-26 | 2003-04-03 | Fuji Photo Film Co Ltd | 全反射減衰を利用したセンサー |
| JP2006071300A (ja) * | 2004-08-31 | 2006-03-16 | Hitachi Ltd | 生化学物質検出装置 |
| JP2006322878A (ja) * | 2005-05-20 | 2006-11-30 | Matsushita Electric Ind Co Ltd | サンプル中のリガンドの分析方法及びサンプル中のリガンドを分析する装置 |
| JP2006337038A (ja) * | 2005-05-31 | 2006-12-14 | Matsushita Electric Ind Co Ltd | サンプル中のリガンドの分析方法およびサンプル中のリガンドを分析する装置 |
| WO2007132367A1 (en) * | 2006-05-09 | 2007-11-22 | Koninklijke Philips Electronics N.V. | Accurate magnetic biosensor |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL103674A0 (en) * | 1991-11-19 | 1993-04-04 | Houston Advanced Res Center | Method and apparatus for molecule detection |
| WO1993016383A1 (en) | 1992-02-08 | 1993-08-19 | Genera Technologies Limited | Methods of analysis |
| US6333200B1 (en) * | 1998-07-27 | 2001-12-25 | University Of Delaware | Miniaturized immunosensor assembled from colloidal particles between micropatterned electrodes |
| CN1185492C (zh) * | 1999-03-15 | 2005-01-19 | 清华大学 | 可单点选通式微电磁单元阵列芯片、电磁生物芯片及应用 |
| RU2166751C1 (ru) * | 2000-03-09 | 2001-05-10 | Никитин Петр Иванович | Способ анализа смеси биологических и/или химических компонентов с использованием магнитных частиц и устройство для его осуществления |
| AU2001268500A1 (en) * | 2000-06-14 | 2001-12-24 | Board Of Regents, The University Of Texas System | Dielectrically-engineered microparticles |
| EP1448991A2 (en) * | 2001-04-09 | 2004-08-25 | Fraunhofer-Gesellschaft Zur Förderung Der Angewandten Forschung E.V. | Activated enzyme-linked detection systems for detecting and quantifying nucleid acids, antigens, antibodies and other analytes |
| US20030013185A1 (en) * | 2001-06-21 | 2003-01-16 | Ravi Saraf | Electro-optical detection device |
| US20030068655A1 (en) | 2001-09-12 | 2003-04-10 | Protiveris, Inc. | Microcantilever apparatus and methods for detection of enzymes |
| WO2005027714A2 (en) * | 2003-07-12 | 2005-03-31 | Accelr8 Technology Corporation | Sensitive and rapid biodetection |
| US20070023643A1 (en) * | 2005-02-01 | 2007-02-01 | Nolte David D | Differentially encoded biological analyzer planar array apparatus and methods |
| WO2006134569A2 (en) * | 2005-06-17 | 2006-12-21 | Koninklijke Philips Electronics N.V. | Rapid magnetic biosensor with integrated arrival time measurement |
| CN101029776B (zh) * | 2006-02-27 | 2011-10-05 | 李建民 | 一种热管太阳能热能利用系统 |
| CN101438159A (zh) * | 2006-05-09 | 2009-05-20 | 皇家飞利浦电子股份有限公司 | 用于浓度测量的微电子传感器装置 |
| US20090109441A1 (en) * | 2006-05-16 | 2009-04-30 | Nile Hartman | Method and apparatus for enhancing waveguide sensor signal |
| EP1972927A1 (en) * | 2007-03-14 | 2008-09-24 | Koninklijke Philips Electronics N.V. | Microelectronic sensor device for detecting label particles |
| US8797028B2 (en) * | 2007-10-25 | 2014-08-05 | Koninklijke Philips N.V. | Sensor device for target particles in a sample |
-
2008
- 2008-10-31 CN CN2008801211159A patent/CN101903758B/zh active Active
- 2008-10-31 US US12/747,529 patent/US8486689B2/en active Active
- 2008-10-31 BR BRPI0822092A patent/BRPI0822092A8/pt not_active IP Right Cessation
- 2008-10-31 WO PCT/IB2008/054541 patent/WO2009083814A2/en active Application Filing
- 2008-10-31 JP JP2010538959A patent/JP2011508199A/ja active Pending
- 2008-10-31 RU RU2010130170/28A patent/RU2489704C2/ru not_active IP Right Cessation
- 2008-10-31 EP EP08866200.2A patent/EP2225547B1/en active Active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003098075A (ja) * | 2001-09-26 | 2003-04-03 | Fuji Photo Film Co Ltd | 全反射減衰を利用したセンサー |
| JP2006071300A (ja) * | 2004-08-31 | 2006-03-16 | Hitachi Ltd | 生化学物質検出装置 |
| JP2006322878A (ja) * | 2005-05-20 | 2006-11-30 | Matsushita Electric Ind Co Ltd | サンプル中のリガンドの分析方法及びサンプル中のリガンドを分析する装置 |
| JP2006337038A (ja) * | 2005-05-31 | 2006-12-14 | Matsushita Electric Ind Co Ltd | サンプル中のリガンドの分析方法およびサンプル中のリガンドを分析する装置 |
| WO2007132367A1 (en) * | 2006-05-09 | 2007-11-22 | Koninklijke Philips Electronics N.V. | Accurate magnetic biosensor |
| JP2009536342A (ja) * | 2006-05-09 | 2009-10-08 | コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ | 正確な磁気バイオセンサ |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013506125A (ja) * | 2009-09-28 | 2013-02-21 | コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ | 物質決定装置 |
| JP2011080935A (ja) * | 2009-10-09 | 2011-04-21 | Konica Minolta Holdings Inc | 測定方法及び表面プラズモン増強蛍光測定装置 |
| JP2012215553A (ja) * | 2011-03-30 | 2012-11-08 | Toshiba Corp | 光導波路型測定システム、測定方法及び光導波路型センサチップ |
| US9274104B2 (en) | 2011-03-30 | 2016-03-01 | Kabushiki Kaisha Toshiba | Measuring system using optical waveguide, measuring device, measuring method, optical waveguide type sensor chip, and magnetic fine particle |
| JP2014531029A (ja) * | 2011-10-20 | 2014-11-20 | コーニンクレッカ フィリップス エヌ ヴェ | 培養期間を用いた磁性粒子の検出 |
| JP2015021818A (ja) * | 2013-07-18 | 2015-02-02 | コニカミノルタ株式会社 | 表面プラズモン増強蛍光測定装置および表面プラズモン増強蛍光測定方法 |
| JP2015021889A (ja) * | 2013-07-22 | 2015-02-02 | コニカミノルタ株式会社 | 表面プラズモン増強蛍光測定方法および表面プラズモン増強蛍光測定装置 |
| JP2014025951A (ja) * | 2013-10-28 | 2014-02-06 | Konica Minolta Inc | 測定方法及び表面プラズモン増強蛍光測定装置 |
| JP2015025820A (ja) * | 2014-11-04 | 2015-02-05 | 株式会社東芝 | 光導波路型測定システムおよび糖化ヘモグロビンの測定方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2225547A2 (en) | 2010-09-08 |
| RU2489704C2 (ru) | 2013-08-10 |
| US20100267165A1 (en) | 2010-10-21 |
| BRPI0822092A2 (pt) | 2015-06-30 |
| CN101903758B (zh) | 2013-05-08 |
| CN101903758A (zh) | 2010-12-01 |
| EP2225547B1 (en) | 2016-07-27 |
| WO2009083814A2 (en) | 2009-07-09 |
| WO2009083814A3 (en) | 2009-10-15 |
| RU2010130170A (ru) | 2012-01-27 |
| US8486689B2 (en) | 2013-07-16 |
| BRPI0822092A8 (pt) | 2016-03-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2011508199A (ja) | 標的粒子を検出するためのマイクロエレクトロニクスセンサデバイス | |
| JP6205041B2 (ja) | マイクロエレクトロニクスセンサデバイス、読み取り装置及び検出方法 | |
| RU2476858C2 (ru) | Устройство датчика для целевых частиц в пробе | |
| RU2502985C2 (ru) | Носитель для оптического детектирования в малых объемах образца | |
| US7652768B2 (en) | Chemical sensing apparatus and chemical sensing method | |
| JP5643825B2 (ja) | 物質決定装置 | |
| JP5295149B2 (ja) | 生体物質分析方法並びにそれに用いられる生体物質分析セル、チップおよび装置 | |
| JP6225114B2 (ja) | クラスタ検出に関する装置 | |
| US20120062219A1 (en) | Sensor device for magnetic particles with a high dynamic range | |
| JP2011503536A (ja) | マイクロエレクトロニクスセンサ | |
| WO2008142492A1 (en) | Method for detecting label particles | |
| JP2010540924A (ja) | 目標成分の検出に対するセンサ装置 | |
| CN102713571B (zh) | 具有成像光学元件的传感器设备 | |
| US20110235037A1 (en) | Sensor device for detecting target particles by frustrated total internal reflection | |
| US20100253323A1 (en) | Magnetic washing for biosensor | |
| JP2011505572A (ja) | 標識粒子を用いた流体内分子測定方法 | |
| JPWO2011049044A1 (ja) | 磁性微粒子を用いるバイオセンサ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111027 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111220 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20130128 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130305 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130604 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20131210 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140409 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20140417 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20140613 |