JP2010533717A - 覚醒を促進する方法 - Google Patents
覚醒を促進する方法 Download PDFInfo
- Publication number
- JP2010533717A JP2010533717A JP2010517021A JP2010517021A JP2010533717A JP 2010533717 A JP2010533717 A JP 2010533717A JP 2010517021 A JP2010517021 A JP 2010517021A JP 2010517021 A JP2010517021 A JP 2010517021A JP 2010533717 A JP2010533717 A JP 2010533717A
- Authority
- JP
- Japan
- Prior art keywords
- substituted
- unsubstituted
- compound
- alkyl
- salt
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 *Oc1ccc(C(F)(F)F)cc1 Chemical compound *Oc1ccc(C(F)(F)F)cc1 0.000 description 2
- HLTXMYBSWCHNHN-UHFFFAOYSA-N CC(c1c2)=Nc(cccc3)c3Oc1ccc2Cl Chemical compound CC(c1c2)=Nc(cccc3)c3Oc1ccc2Cl HLTXMYBSWCHNHN-UHFFFAOYSA-N 0.000 description 1
- GOGYLLAYEPAJIB-UHFFFAOYSA-N COC(C(c1ccccc1)I)=O Chemical compound COC(C(c1ccccc1)I)=O GOGYLLAYEPAJIB-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/27—Esters, e.g. nitroglycerine, selenocyanates of carbamic or thiocarbamic acids, meprobamate, carbachol, neostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/407—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with other heterocyclic ring systems, e.g. ketorolac, physostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
- A61K31/5513—1,4-Benzodiazepines, e.g. diazepam or clozapine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/553—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having at least one nitrogen and one oxygen as ring hetero atoms, e.g. loxapine, staurosporine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/26—Psychostimulants, e.g. nicotine, cocaine
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Emergency Medicine (AREA)
- Anesthesiology (AREA)
- Pulmonology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Psychiatry (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Hydrogenated Pyridines (AREA)
- Plural Heterocyclic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
本発明は、カルバモイルエステルまたはその医薬的に許容される塩を投与することによって、個体における覚醒を促進する方法に関する。
Description
関連出願
本出願は、2007年7月18日に提出した米国特許出願第60/961,207号に対する優先権およびその利益を主張するものであって、該出願は参照することにより本明細書に援用される。
本出願は、2007年7月18日に提出した米国特許出願第60/961,207号に対する優先権およびその利益を主張するものであって、該出願は参照することにより本明細書に援用される。
発明の背景
さまざまな物質、例えばカフェイン、モダフィニル、エフェドリン、およびアンフェタミンを含む物質が、覚醒を促進するために用いられている。
さまざまな物質、例えばカフェイン、モダフィニル、エフェドリン、およびアンフェタミンを含む物質が、覚醒を促進するために用いられている。
カフェインは、世界で最も広く用いられている薬物の1つである。カフェインは、心血管系および中枢神経系の刺激、利尿、ならびに平滑筋の弛緩を含む広範囲の所望の、および所望でない薬理効果を有する。カフェインは、特に心理的ストレスを伴う収縮期圧および拡張期圧の増加ももたらし、さらには心拍数の減少ももたらす。1または2カップのコーヒーに相当する量のカフェインの摂取は、注目すべき生理的効果の原因となる。就寝前に摂取すると、カフェインは通常、睡眠開始を遅延させ、総睡眠時間を短縮し、睡眠の深さを減少させる。カフェインを用いた後、睡眠者はより容易に覚醒し、睡眠中により動き、睡眠の質の低下を報告する。より大用量のカフェインは、特に非常用者に与えられると、頭痛、イライラ(jitteriness)、および頻脈の原因となる。カフェインは、脳の多くの部分において神経活動(neutral activity)を上昇させ、疲労を遅らせ、単純な知的作業の実行および持久力を含む肉体労働の実行を増強するが、振戦の誘導が原因で、カフェインは細かい運動神経を損ないうる。
同様に、プロビジル(Provigil(登録商標))としても知られているモダフィニルは、新規の覚醒促進薬である。モダフィニルは、ナルコレプシー、閉塞性睡眠時無呼吸/低呼吸症候群(OSAHS)、および交代勤務睡眠障害(SWSD)において過剰な眠気を減少させるものとしてFDAによって認可されている。モダフィニルの覚醒促進作用は、アンフェタミンおよびメチルフェニデートなどの交感神経刺激薬と類似している。モダフィニルが覚醒を促進する正確な機序は未知である。典型的な治療濃度では、モダフィニルは例えば、ノルエピネフリン、セロトニン、ドーパミン、GABA、アデノシン、ヒスタミンH3、メラトニン、またはベンゾジアゼピンなどの睡眠または覚醒を制御する特定の神経伝達物質の受容体に結合しないことが知られている。モダフィニルは、夜間の睡眠の開始、維持、質または量にも影響せず、日中に自発的に眠る能力にも影響しない。その覚醒促進効果に加えて、モダフィニルは動物において自発運動活性を増加させ、ヒトにおいて他のCNS刺激薬に典型的な精神活性および陶酔効果、気分、知覚、思考、および感覚の変化を生じる。コカインを自己投与するように前もって訓練されたサルにおけるその自己投与によって証明されたように、モダフィニルは強化特性を有する。モダフィニルは、動物モデルにおいて精神刺激薬様であるとしても部分的に識別された。モダフィニルで治療される患者において、発疹および精神有害事象が報告されている。
アンフェタミン、ペモリン、メチルフェニデート、およびエフェドリンなどの他の中枢神経系刺激薬も、覚醒を促進するために用いられうる。しかしながら、これらの薬物の乱用の可能性は周知である。これらの薬物で身体的および精神的覚醒は増加するが、特に薬物の刺激効果が徐々に消えていくに従って、頭痛、激越(agitation)、不快、および疲労がしばしば副作用として起こる。
それゆえ、異なった、または優れた副作用特性を有するさらなる覚醒促進薬、特に現存する医薬の欠点を克服する医薬が必要である。
発明の概要
本発明は、本発明の化合物を投与することによって、個体における覚醒を促進する方法である。本発明の方法に用いられる化合物は、コリンエステラーゼ阻害活性を有するカルバモイルエステルである。
本発明は、本発明の化合物を投与することによって、個体における覚醒を促進する方法である。本発明の方法に用いられる化合物は、コリンエステラーゼ阻害活性を有するカルバモイルエステルである。
本発明は、式:
[式中、
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換であり;
R3は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R4は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択される]
を有する化合物またはその医薬的に許容される塩を個体へ投与することを含む、個体における覚醒を促進する方法に関する。
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換であり;
R3は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R4は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択される]
を有する化合物またはその医薬的に許容される塩を個体へ投与することを含む、個体における覚醒を促進する方法に関する。
本発明は、覚醒障害、過眠症、睡眠時無呼吸、中枢性の睡眠障害、疲労、ナルコレプシーと関連する日中の過剰な眠気、うつ病性障害または抗うつ薬治療と関連する疲労および過剰な眠気から選択される障害または状態を患う個体における覚醒を促進する方法に関する。覚醒障害および状態は、多発性硬化症と関連する疲労、ならびに交代勤務睡眠障害、睡眠時無呼吸、盲目の個体における脱同期化障害、時間帯域変化症候群、交代勤務睡眠障害、不規則睡眠パターン、睡眠相遅延症候群(delayed sleep syndrome)、および睡眠相前進症候群(advanced sleep syndrome)などの概日リズム障害を含む。
本発明は、個体における覚醒を促進し、それによって覚醒障害、過眠症、睡眠時無呼吸、中枢性の睡眠障害、疲労、ナルコレプシーと関連する日中の過剰な眠気、うつ病性障害または抗うつ薬治療と関連する疲労および過剰な眠気から選択される障害または状態について個体を治療する方法に関する。
本発明は、個体において覚醒を増強し、または睡眠リズムの規則性を増大させる方法に関する。
発明の詳細な記載
本発明の特徴および他の詳細は、本発明の段階として、または本発明の部分の組み合わせとして、ここでより詳細に記載され、特許請求の範囲に指摘されるであろう。本発明の特定の実施態様は例証の目的で示されており、本発明を限定する目的で示されているのではないということは理解されるであろう。本発明の原理的特徴は、本発明の範囲から逸脱することなく様々な実施態様において利用されうる。
本発明の特徴および他の詳細は、本発明の段階として、または本発明の部分の組み合わせとして、ここでより詳細に記載され、特許請求の範囲に指摘されるであろう。本発明の特定の実施態様は例証の目的で示されており、本発明を限定する目的で示されているのではないということは理解されるであろう。本発明の原理的特徴は、本発明の範囲から逸脱することなく様々な実施態様において利用されうる。
本発明の1つの態様は、式:
[式中、
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換であり;
R3は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R4は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択される]
を有する化合物またはその塩を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換であり;
R3は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R4は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択される]
を有する化合物またはその塩を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
1つの態様では、本発明は、R3、R4、およびR5の少なくとも1つが非置換アルキルである化合物またはその塩を投与することを含む、覚醒を促進する方法を含む。別の態様では、本発明は、R3、R4、およびR5の少なくとも2つが非置換アルキルである化合物またはその医薬的に許容される塩を投与することを含む。別の態様では、本発明は、R3、R4、およびR5が各々非置換アルキルである化合物またはその医薬的に許容される塩を投与することを含む。別の態様では、本発明は、非置換アルキルがメチルである化合物またはその医薬的に許容される塩を投与することを含む。
1つの態様では、本発明は、R1が水素である化合物またはその塩を投与することを含む、覚醒を促進する方法を含む。1つの態様では、本発明は、R1が非置換アルキルである化合物またはその塩を投与することを含む。別の態様では、本発明は、R1がメチルである化合物またはその塩を投与することを含む。別の態様では、本発明は、R1が水素およびメチルから選択される化合物またはその塩を投与することを含む。1つの態様では、本発明は、R1が置換アルキルである化合物またはその塩を投与することを含む。別の態様では、本発明は、R1がアルキニルで置換されているアルキルである化合物またはその塩を投与することを含む。別の態様では、本発明は、R1が
である化合物またはその塩を投与することを含む。
1つの態様では、本発明は、R1およびR2が、それらが結合している窒素原子と一緒になって5または6員環を形成している化合物またはその塩を投与することを含む、覚醒を促進する方法を含む。別の態様では、本発明は、R1およびR2が、それらが結合している窒素原子と一緒になって6員環を形成している化合物またはその塩を投与することを含む、覚醒を促進する方法を含む。別の態様では、本発明は、R1およびR2ならびにそれらが結合している窒素によって形成される6員環が少なくとも1、2、または3つの置換基で置換されている化合物またはその塩を投与することを含む。1つの態様では、本発明は、R1およびR2ならびにそれらが結合している窒素によって形成される6員環がピペリジンおよびピペラジンからなる群から選択される化合物またはその塩を投与することを含む。別の態様では、本発明は、R1およびR2ならびにそれらが結合している窒素によって形成される6員環が2位または4位で置換されている化合物またはその塩を投与することを含む。
別の態様では、本発明は、R1およびR2ならびにそれらが結合している窒素によって形成される環が、少なくとも1つの芳香環を含む基で置換されている化合物またはその塩を投与することを含む。別の態様では、本発明は、R1およびR2ならびにそれらが結合している窒素によって形成される環が、
から選択される基で置換されている化合物またはその塩を投与することを含む。別の態様では、本発明は、R1およびR2ならびにそれらが結合している窒素によって形成される環が、
で置換されている化合物またはその塩を投与することを含む。
別の態様では、本発明は、R1およびR2ならびにそれらが結合している窒素によって形成される環が三環式環で置換されている化合物またはその塩を個体へ投与することを含む。別の態様では、本発明は、R1およびR2ならびにそれらが結合している窒素原子によって形成される環が、
で置換されている化合物またはその塩を投与することを含む。
1つの態様では、本発明は、R2がアラルキル、シクロアルキル、アルキル、およびヘテロアラルキルからなる群から選択され、さらにR2が任意に置換されている化合物またはその塩を投与することを含む。別の態様では、本発明は、アラルキル、アルキル、およびヘテロアラルキルであるR2のアルキル部分が炭素原子2個の長さを有する化合物またはその塩を投与することを含む。別の態様では、本発明は、アラルキル、アルキル、およびヘテロアラルキルであるR2のアルキル部分が炭素原子3個の長さを有する化合物またはその塩を投与することを含む。
別の態様では、本発明は、R2が置換アルキル、非置換アルキル、置換シクロアルキル、非置換シクロアルキル、置換アリール、非置換アリール、置換三環式環、非置換三環式環、置換アルケニル三環式環、非置換アルケニル三環式環、非置換アリールオキシ、置換アリールオキシ、非置換オキシム、および置換オキシムで置換されている化合物またはその塩を個体へ投与することを含む。
1つの態様では、本発明は、R2が置換アラルキルである化合物またはその塩を投与することを含む。1つの態様では、本発明は、R2が非置換アルキルおよび置換フェノキシからなる群から選択される置換基で置換されているアラルキルである化合物またはその塩を投与することを含む。1つの態様では、本発明は、R2がメチルで置換されているアラルキル、例えば、
[式中、R1、R3、R4およびR5は本明細書で記載している通りである]である化合物またはその塩を投与することを含む。
1つの態様では、本発明は、R2が
からなる群から選択される置換基で置換されているアラルキルである化合物またはその塩を投与することを含む。別の態様では、本発明は、R2が置換アルキルである化合物またはその塩を投与することを含む。1つの態様では、本発明は、R2が非置換アルキル、非置換シクロアルキル、非置換三環式環、非置換アルケニル三環式環、非置換オキシム、および置換オキシムからなる群から選択される置換基で置換されているアルキルである化合物またはその塩を投与することを含む。
1つの態様では、本発明は、R2がシクロヘキシルで置換されているアルキルである化合物またはその塩を投与することを含む。別の態様では、本発明は、R2が
で置換されているアルキルである化合物またはその塩を投与することを含む。別の態様では、本発明は、R2が
で置換されているアルキルである化合物またはその塩を含む。
別の態様では、本発明は、R2が置換シクロアルキルである化合物またはその塩を投与することを含む。1つの態様では、本発明は、R2がシクロプロピルである化合物またはその塩を投与することを含む。別の態様では、本発明は、R2が1,2,3,4−テトラヒドロナフタレンである化合物またはその塩を投与することを含む。1つの態様では、本発明は、R2がアリールで置換されているシクロアルキルである化合物またはその塩を投与することを含む。別の態様では、本発明は、R2が置換フェニルおよび非置換フェニルからなる群から選択される置換基で置換されているシクロアルキルであり、さらにフェニルが少なくとも1つのハロゲンで任意に置換されている化合物またはその塩を投与することを含む。別の態様では、本発明は、R2がフェニルで置換されているシクロアルキルであり、フェニルが少なくとも1つの塩素で置換されている化合物またはその塩を投与することを含む。
別の態様では、本発明は、R2が置換ヘテロアラルキルである化合物またはその塩を投与することを含む。1つの態様では、本発明は、ヘテロアラルキルのアルキル部分がアリールオキシで置換されている化合物またはその塩を投与することを含む。1つの態様では、本発明は、アリールオキシが
である化合物またはその塩を投与することを含む。
1つの態様では、本発明は、第1表の化合物またはその医薬的に許容される塩を個体へ投与することを含む、個体における覚醒を促進する方法を含む。別の態様では、本発明は、化合物2、3、4、5、5A、6、7、7A、8、9、9A、10、11、13、14、15、16、17、18、20、23、および29から選択される化合物を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
1つの態様では、本発明は、式:
[式中、
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換である]
を有する化合物またはその塩を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換である]
を有する化合物またはその塩を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
1つの態様では、本発明は、式:
[式中、
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R6は非置換アリール、置換アリール、非置換シクロアルキル、置換シクロアルキル、非置換三環式環、および置換三環式環からなる群から選択され;
R7は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R8は水素、非置換アルキル、置換アルキル、置換アリールオキシ、非置換アリールオキシからなる群から選択され;
sは0または1であり;
tは0または1であるが、ただしsとtの両方が0ということはない;
-----は欠如しているか、またはそのすぐ上に示している結合と一緒になって二重結合を形成する]
を有する化合物またはその塩を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R6は非置換アリール、置換アリール、非置換シクロアルキル、置換シクロアルキル、非置換三環式環、および置換三環式環からなる群から選択され;
R7は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R8は水素、非置換アルキル、置換アルキル、置換アリールオキシ、非置換アリールオキシからなる群から選択され;
sは0または1であり;
tは0または1であるが、ただしsとtの両方が0ということはない;
-----は欠如しているか、またはそのすぐ上に示している結合と一緒になって二重結合を形成する]
を有する化合物またはその塩を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
1つの態様では、本発明は、式:
[式中、
XはNまたはCHであり;
R9は水素、置換三環式環、非置換三環式環、置換アリール、非置換アリールからなる群から選択され;
さらにピペリジンおよびピペラジン環は任意に置換されている]
を有する化合物またはその医薬的に許容される塩を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
XはNまたはCHであり;
R9は水素、置換三環式環、非置換三環式環、置換アリール、非置換アリールからなる群から選択され;
さらにピペリジンおよびピペラジン環は任意に置換されている]
を有する化合物またはその医薬的に許容される塩を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
1つの態様では、本発明は、化合物または塩が、医薬的に許容される担体を含む医薬組成物として投与される、個体における覚醒を促進する方法を含む。別の態様では、本発明は、医薬的に許容される塩である塩を投与することを含む。
1つの態様では、本発明は、第1表の化合物またはその医薬的に許容される塩および医薬的に許容される担体を含む医薬組成物を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
別の態様では、本発明は、2、3、4、5、5A、6、7、7A、8、9、9A、10、11、13、14、15、16、17、18、20、23、および29から選択される化合物またはその医薬的に許容される塩ならびに医薬的に許容される担体を含む医薬組成物を個体へ投与することを含む、個体における覚醒を促進する方法を含む。
本発明の1つの態様は、個体が覚醒障害、過眠症、睡眠時無呼吸、中枢性の睡眠障害、疲労、ナルコレプシーと関連する日中の過剰な眠気、うつ病性障害または抗うつ薬治療と関連する疲労および過剰な眠気から選択される障害または状態を患う、個体における覚醒を促進する方法を含む。
本発明の別の態様は、覚醒を促進し、それによって覚醒障害、過眠症、睡眠時無呼吸、中枢性の睡眠障害、疲労、ナルコレプシーと関連する日中の過剰な眠気、大うつ病性障害または抗うつ薬治療と関連する疲労および過剰な眠気から選択される障害または状態について、個体を治療する方法を含む。
1つの態様では、本発明は、覚醒促進剤としてカルバモイルエステルを個体へ投与することによって覚醒障害を治療する方法を含む。1つの態様では、本発明は、覚醒促進剤としてカルバモイルエステルを個体へ投与することによって、睡眠時無呼吸を治療する方法を含む。1つの態様では、本発明は、覚醒促進剤としてカルバモイルエステルを個体へ投与することによって、中枢性の睡眠障害を治療する方法を含む。1つの態様では、本発明は、覚醒促進剤としてカルバモイルエステルを個体へ投与することによって、疲労を治療する方法を含む。1つの態様では、本発明は、覚醒促進剤としてカルバモイルエステルを個体へ投与することによって、ナルコレプシーと関連する日中の過剰な眠気を治療する方法を含む。1つの態様では、本発明は、覚醒促進剤としてカルバモイルエステルを個体へ投与することによって、大うつ病性障害と関連する疲労および過剰な眠気を治療する方法を含む。1つの態様では、本発明は、抗うつ薬治療と関連する疲労および過剰な眠気を治療する方法を含む。
疲労および過剰な眠気は、大うつ病性障害の症状の中に含まれ、抗うつ薬治療と関連する有害事象となり得、しばしばSSRI抗うつ薬治療では不十分な治療しかできない残存症状である。抗うつ薬治療は、下記の抗うつ薬での治療を含み、これらに限定されない:三環系抗うつ薬、選択的セロトニン再取り込み阻害剤(SSRI)、セロトニンおよびノルアドレナリン再取り込み阻害剤、モノアミンオキシダーゼ阻害剤ならびにモノアミンオキシダーゼA型。別の態様では、抗うつ薬はシタロプラム、フルオキセチン、フルオキセチン塩酸塩、パロキセチン、パロキセチン塩酸塩、およびクロミプラミン塩酸塩から選択される。
1つの態様では、本発明は過眠症に関するが、これは日中の過剰な眠気(EDS)または長時間の夜間の睡眠の再発性エピソードによって特徴づけられる状態である。夜間の睡眠の欠如または中断のために疲労を感じることとは異なり、過眠症を患う人々は、日中、しばしば仕事中、食事中、または会話中などの不適切な時に繰り返しうたた寝することを余儀なくされる。これらの日中のうたた寝は、通常、症状の軽減をもたらさない。患者はしばしば長い睡眠からの覚醒が困難であり、頭がぼんやりするかもしれない。他の症状は、不安症、炎症の増加、エネルギーの減少、不穏状態、思考力の遅れ、発話の遅れ、食欲の減退、幻覚、および記憶障害を含みうる。一部の患者は、家庭環境、社会的環境、職業環境、または他の環境において働く能力を失う。1つの態様では、本発明は、覚醒促進剤としてカルバモイルエステルを個体へ投与することを含む、過眠症を治療する方法を含む。別の態様では、本発明は、興奮剤としてカルバモイルエステルを個体へ投与することを含む、過眠症を治療する方法を含む。
別の態様では、本発明は、覚醒障害または状態が概日リズム障害および多発性硬化症と関連する疲労から選択される、覚醒を促進する方法を含む。
1つの態様では、本発明は、概日リズム障害が交代勤務睡眠障害、睡眠時無呼吸、盲目の個体における脱同期化障害、時間帯域変化症候群、交代勤務睡眠障害、不規則睡眠パターン、睡眠相遅延症候群(delayed sleep syndrome)、および睡眠相前進症候群(advanced sleep syndrome)から選択される、覚醒を促進する方法を含む。別の態様では、本発明は、概日リズム障害が交代勤務睡眠障害、睡眠時無呼吸、および盲目の個体における脱同期化障害から選択される、覚醒を促進する方法を含む。
1つの態様では、本発明は睡眠時無呼吸に関する。睡眠時無呼吸は、睡眠中の呼吸停止によって特徴づけられる睡眠障害である。各エピソードは、無呼吸と呼ばれ、呼吸が1回以上欠損するほど十分長く持続し、該エピソードは睡眠の間中、繰り返し起こる。いずれかの無呼吸発作の標準的定義は、最小10秒の呼吸間隔を含み、神経覚醒(C3、C4、O1、もしくはO2で測定したEEG周波数における3秒以上のシフト)、3〜4%以上の血中酸素不飽和度、または覚醒と不飽和度の両方を伴う。睡眠時無呼吸は、睡眠ポリグラフと呼ばれる一晩の睡眠検査で診断される。
睡眠時無呼吸の臨床的に有意な水準は、無呼吸のいずれかの型の1時間当たり5つ以上のエピソードとして定義される(睡眠ポリグラフより)。睡眠時無呼吸の3つの異なる型がある:中枢性、閉塞性、および複合型(すなわち、中枢性と閉塞性の組み合わせ)があり、それぞれ症例の0.4%、84%および15%を構成する。中枢性睡眠時無呼吸においては、呼吸は呼吸努力の欠如によって中断される;閉塞性睡眠時無呼吸においては、呼吸努力にもかかわらず、空気の循環の物理的障害によって呼吸は中断される。複合型(または「混合型」)睡眠時無呼吸においては、事象自体の間に中枢性の特徴から閉塞性の特徴への移行がある。
1つの態様では、本発明は、カルバモイルエステルを個体へ投与することによる中枢性の睡眠障害を治療する方法を含む。別の態様では、本発明は、カルバモイルエステルを個体へ投与し、睡眠時無呼吸症候群の間に起こる無呼吸の回数を減少させることによって中枢性の睡眠障害を治療する方法を含む。1つの態様では、カルバモイルエステルを投与することによる中枢性の睡眠障害の治療は、日中の傾眠および夜間の睡眠の質の改善に寄与する。
1つの態様では、本発明は、個体がCPAPで睡眠時無呼吸の治療をされる、個体における覚醒を促進する方法を含む。「CPAP」または「持続的気道陽圧法」は、睡眠時無呼吸および他の睡眠関連呼吸障害(いびきを含む)の治療用の機械装置である。CPAP装置での治療は、典型的には患者の鼻または口を経由して投与される。
CPAP治療では、被験者は睡眠の際に、鼻の上にタイトフィットのプラスチックマスクを着用する。マスクはコンプレッサーに結合しているが、これは空気を鼻に通し、被験者の気道内に陽圧を生じさせる。方法の原理は、気道を加圧すると機械的「スプリンティング」作用がもたらされ、これが気道虚脱を防ぎ、または減少させ、それゆえ、閉塞性睡眠時無呼吸を防ぎ、または減少させる、というものである。CPAP治療を経験するほとんどの被験者に効果的な治療反応が観察されるが、多くの被験者は装置または圧力に耐えることができず、治療を拒否する。さらに、最近の秘密モニタリング調査によると、CPAP治療での長期コンプライアンスが非常に悪いということが実証された。被験者は睡眠中に彼らのマスクを取り除くことが知られている。
別の態様では、本発明は多発性硬化症(MS)と関連する疲労に関する。多発性硬化症は、米国において若年成人の最も一般的な無力化神経疾患の1つであり、推定400,000人が疾患を有する。MSは盲目、麻痺、協調運動障害、および腸または膀胱機能障害などの様々な無力化神経障害の原因となりうるが、同様に重篤に無力化し得、はっきりと表れない症状は疲労である。本明細書で用いられている「疲労」は、力の減退、または刺激に反応する能力の減退を含む。該疲労の効果的な治療は、多発性硬化症と関連する疲労または眠気を軽減すること、さらに多発性硬化症の個体における覚醒を促進することを含む。MS疲労の機序は、ほとんど解明されていない。それは、中枢神経系内の神経伝導異常、および神経障害に起因するエネルギー需要の増加に起因している。MS疲労のいくつかの特徴は、身体機能および日常生活の活動との干渉、熱による悪化、ならびに一日の終わりでの悪化である。1つの態様では、本発明は、個体における多発性硬化症疲労の症状を改善または防止する有効量にて、カルバモイルエステルを個体へ投与することを含む、多発性硬化症と関連する疲労を治療する方法を含む。別の態様では、本発明は、多発性硬化症と関連する疲労または眠気を軽減し、さらに多発性硬化症の個体における覚醒を促進することを含む。
本発明の1つの態様は、式:
[式中、
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換であり;
R3は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R4は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択される]
を有する化合物またはその医薬的に許容される塩を個体へ投与することを含む、個体における覚醒を増強し、または睡眠リズムの規則性を増大させる方法を含む。
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換であり;
R3は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R4は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択される]
を有する化合物またはその医薬的に許容される塩を個体へ投与することを含む、個体における覚醒を増強し、または睡眠リズムの規則性を増大させる方法を含む。
1つの態様では、本発明は、投与される化合物またはその塩が乱用の可能性を減少させる、覚醒を促進する方法を含む。本発明の1つの態様では、化合物または塩の投与後、個体において精神刺激薬様効果が観察されない。精神刺激薬は、幸福感の原因となり、疲労およびうつ状態を減少させ、食欲を増加させる薬物である。精神刺激薬は、気分変化および睡眠障害の原因ともなりうる。本発明の別の態様では、投与される化合物またはその医薬的に許容される塩は、用量を制限する副作用を有する。本発明の1つの態様では、副作用は悪心である。
本発明の別の態様では、化合物または塩の投与は、個体におけるリバウンド傾眠過剰の原因とならない。用語「傾眠過剰」は、特に日中の過剰な睡眠の必要性を指す。「突発性傾眠過剰」は、原因不明の過剰な日中の睡眠の必要性を意味する。本発明の別の態様では、化合物またはその医薬的に許容される塩の投与は、個体における高体温の原因とならない。用語「高体温」は、体温増加を指す。本発明の別の態様では、化合物またはその塩の投与は、個体における低体温の原因となりうる。用語「低体温」は、体温低下を指す。1つの態様では、個体における体温低下は≧0.5℃である。本発明の別の態様では、化合物または医薬的に許容される塩の投与は、運動高進の原因とならない、すなわち化合物または医薬的に許容される塩の投与は、被験者があちこちへ運動することを増加させる原因とならない。
1つの態様では、本発明は、化合物または塩の有効量を投与することを含む。1つの態様では、塩は医薬的に許容される塩である。別の態様では、本発明は、その治療を必要とする個体へ化合物またはその医薬的に許容される塩を投与する、覚醒を促進する方法を含む。
1つの態様では、本発明は、化合物またはその医薬的に許容される塩が、経腸的に、非経口的に、経口的に、または筋肉内に投与されることを含む。1つの態様では、本発明は、化合物または塩の最小有効量(MED)が経口で≦8mg/kgである、化合物またはその塩を投与することによって個体における覚醒を促進する方法を含む。
本発明の1つの態様は、本明細書で記載している個体における覚醒を促進する方法を実施するためのキットを含む。
別の態様では、本発明は、個体における覚醒を促進する薬剤の製造における、
[式中、
R1、R2、R3、R4、R5、R5A、R6、R7、R8、s、t、-----、XおよびR9は本明細書で記載している通りである]
から選択される式を有する化合物またはその塩の使用を含む。
R1、R2、R3、R4、R5、R5A、R6、R7、R8、s、t、-----、XおよびR9は本明細書で記載している通りである]
から選択される式を有する化合物またはその塩の使用を含む。
1つの態様では、本発明は、個体における覚醒を促進する薬剤の製造における、第1表の化合物またはその塩の使用を含む。
本発明の別の態様は、覚醒障害、過眠症、睡眠時無呼吸、中枢性の睡眠障害、疲労、ナルコレプシーと関連する日中の過剰な眠気、うつ病性障害または抗うつ薬治療と関連する疲労および過剰な眠気から選択される障害または状態を患う個体における覚醒を促進する薬剤の製造を含む。
本発明の別の態様は、個体における覚醒を促進する薬剤を製造し、それによって覚醒障害、過眠症、睡眠時無呼吸、中枢性の睡眠障害、疲労、ナルコレプシーと関連する日中の過剰な眠気、うつ病性障害または抗うつ薬治療と関連する疲労および過剰な眠気から選択される障害または状態について個体を治療することを含む。
1つの態様では、本発明は、個体における覚醒を促進する薬剤の製造における、化合物2、3、4、5、5A、6、7、7A、8、9、9A、10、11、13、14、15、16、17、18、20、23、および29から選択される化合物またはその塩の使用を含む。
別の態様では、本発明は、アセチルコリンエステラーゼを阻害する化合物を投与することによって覚醒を促進する方法を含む。1つの態様では、本発明は、化合物がブチリルコリンエステラーゼよりもアセチルコリンエステラーゼを選択的に阻害する場合を含む。1つの態様では、化合物は少なくとも3倍、4倍、5倍、8倍、または10倍、ブチリルコリンエステラーゼよりもアセチルコリンエステラーゼに対してより選択的である。
特に、カルバモイルエステルは、コリンエステラーゼに結合する化合物(例えば、アセチルコリン(ACh))と競合することによってコリンエステラーゼを阻害すると考えられている。図1に示すように、カルバモイルエステルはコリンエステラーゼに結合し、カルバモイル化酵素を形成する。コリンエステラーゼは、神経伝達物質AChなどの化合物を不活性化することができない場合、カルバモイルエステルの非存在下では、コリンエステラーゼが神経伝達物質に作用する程度まで阻害される。カルバモイル化酵素の加水分解は、例えば、その内在性基質アセチルコリンの加水分解によって形成されるアセチル化酵素の加水分解よりもはるかに遅い。カルバモイル化酵素が加水分解されると、カルバモイルエステル分子によるコリンエステラーゼの阻害は終わる。カルバモイル化酵素の加水分解の際に放出されたアミンなどの化合物は、少なくとも薬理活性物質の成分になる。
少なくとも薬理活性物質の成分になるアミン基を含むカルバモイルエステルの加水分解は、酵素(例えばコリンエステラーゼ)による加水分解、または酸(例えば胃酸)などの酵素以外による加水分解でありうる。1つの実施態様では、コリンエステラーゼを阻害するカルバモイルエステルは、アミン基を含み、それはコリンエステラーゼとの反応による加水分解の際に、少なくとも薬理活性物質の成分になる。
本明細書で用いられている語句「酵素との反応による加水分解の際」は、カルバモイルエステルと酵素の2段階プロセスの反応を指し、カルバモイル化酵素の形成、およびH2Oとの反応によるカルバモイル化酵素の分解からなる。
同様に、本明細書で用いられている語句「コリンエステラーゼとの反応による加水分解の際」は、カルバモイルエステルと酵素コリンエステラーゼの2段階プロセスの反応を指し、カルバモイル化酵素の形成、およびH2Oとの反応によるカルバモイル化酵素の分解からなる。
本発明のカルバモイルエステルによって阻害されるコリンエステラーゼは、例えば、アセチルコリンエステラーゼ(AChE)またはブチリルコリンエステラーゼ(BuChE)からなる群から選択される少なくとも1つのメンバーでありうる。カルバモイルエステルは、AChEだけを、もしくはBuChEだけを阻害し得、またはAChEおよびBuChEの両方を、同様のまたは異なった程度まで阻害しうる。
AChEは興奮性膜上に存在し、AChを不活性化する。興奮性膜は、シナプス前ニューロンまたはシナプス後ニューロンでありうる。AChEは、特異的コリンエステラーゼとも呼ばれる。BuChEは興奮性膜上および血液細胞などの非神経組織上に存在する(Darvesh, S. et al., Nature Reviews 4: 131-138 (2003)、その内容は全体として参照することにより本明細書に援用される)。BuChEは、シュードコリンエステラーゼまたは非特異的コリンエステラーゼとも呼ばれる。AChEおよびBuChEは、中枢神経系(脳および脊髄)、末梢神経系ならびに自律神経系(副交感神経系および交感神経系)におけるコリン作動性神経伝達の制御因子である。
カルバモイル化酵素のカルバメート結合の加水分解の際に、アミンを含む化合物などの放出された化合物は、少なくとも薬理活性物質の成分になる。本明細書で用いられている用語「少なくとも薬理活性物質の成分になる」は、カルバモイル化酵素の加水分解の結果として生じたアミン含有化合物などの化合物の放出を指す。カルバモイル化酵素の加水分解によって放出された化合物は、薬理活性物質の少なくとも一部である。1つの実施態様では、カルバモイル化酵素の加水分解によって放出された化合物は、プロドラッグである。本明細書で用いられている用語「プロドラッグ」は、本発明のカルバモイルエステルなどの化合物を指し、治療計画において所望の実際の薬物ではないが、投与され、代謝のプロセスによって治療において所望の実際の薬物へ変化させられる化合物である。次いでプロドラッグは、薬理活性物質を放出するように修飾されうる。別の実施態様では、カルバモイル化酵素の加水分解によって放出された化合物は、それ自体、薬理活性物質でありうる。それゆえ、本発明のカルバモイルエステルは、コリンエステラーゼの阻害剤としての、および薬理活性物質用の送達ビヒクルとしての2つの役割を有する。
本明細書で用いられている用語「薬理活性物質」は、直接的または間接的に生物学的プロセスに関与する分子(例えば、神経伝達物質、ペプチド、タンパク質)の活性、局在および/または発現を変化させることによって、生物学的プロセスに影響する化合物を指す。
用語「自発運動活性」は、あちこちに運動することを指す。精神薬理学において、実験動物の自発運動活性は、これらの薬物の行動への効果を評価するためにしばしばモニターされる。自発運動活性は有用であり、薬物の一次評価にしばしば用いられる。
用語「本発明の化合物」は、本発明の方法に用いられ、本明細書に記載されているカルバモイルエステルを指す。本発明の方法に用いられるカルバモイルエステルは、カルバメート官能基、例えば、−OC(O)NH−;アルキルが任意に置換されているN−アルキルカルバメート −OC(O)N(アルキル);R1およびR2が環を形成し、該環が任意に置換されている−OC(O)NR1R2、を含む化合物である。
本明細書で用いられている用語「置換(置換されている)」は、指定原子上のいずれか1つまたはそれ以上の水素が、示された群から選択された基に置換されていることを意味するが、ただし指定原子の標準原子価を超過しておらず、置換が安定な化合物をもたらすものでなければならない。
化学結合について点線表示を示す化学構造は、結合が任意に存在することを示す。例えば、実線の単結合に隣接して描かれた点線は、結合が単結合または二重結合のいずれかでありうることを示す。
単独またはより大きな基の一部として用いられる用語「アルキル」は、1〜12個の炭素原子を含む直鎖、分枝鎖の両方、または環式飽和炭化水素鎖を含む。用語「低級アルキル」は、C1−6アルキルを意味し、C1、C2、C3、C4、C5、およびC6アルキル基を含むことを意図する。
本明細書で用いられている「シクロアルキル」は、シクロプロピル、シクロブチル、またはシクロペンチルなどの飽和環基を含むことを意図する。C3−8シクロアルキルは、C3、C4、C5、C6、C7、およびC8シクロアルキル基を含むことを意図する。
本明細書で用いられている「ハロ」または「ハロゲン」は、フルオロ、クロロ、ブロモ、およびヨード置換基を指す。
本明細書で用いられている「ヘテロアルキル」は、1つ以上の炭素原子がヘテロ原子によって置換されているアルキル基である。
単独または「アラルキル」もしくは「アラルコキシ」にあるようなより大きな基の一部として用いられる用語「アリール」は、5〜約14個の炭素原子を有する炭素環式芳香環系(例えばフェニル)、縮合多環式芳香環系(例えば、ナフチルおよびアントラセニル)ならびに炭素環式非芳香環系に縮合した芳香環系(例えば、1,2,3,4−テトラヒドロナフチルおよびインダニル)である。
単独または「ヘテロアラルキル」もしくは「ヘテロアリールアルコキシ」にあるようなより大きな基の一部として用いられる用語「ヘテロアリール」は、5〜14員を有し、少なくとも1つのヘテロ原子を有する芳香環系を指す。好ましくは、ヘテロアリールは1〜約4個のヘテロ原子を有する。好ましいヘテロアルキルは、ヘテロ原子が酸素、硫黄、窒素、ホスホラーゼ(phosphorase)およびハライドからなる群から選択されるものである。ヘテロアリール環の例は、ピラゾリル、フラニル、イミダゾリル、イソオキサゾリル、オキサジアゾリル、オキサゾリル、ピロリル、ピリジル、ピリミジニル、プリニル、ピリダジニル、ピラジニル、チアゾリル、チアジアゾリル、イソチアゾリル、トリアゾリル、チエニル、4,6−ジヒドロ−チエノ[3,4−c]ピラゾリル、5,5−ジオキシド−4,6−ジヒドロチエノ[3,4−c]ピラゾリル、チアナフテニル、1,4,5,6,−テトラヒドロシクロペンタピラゾリル、カルバゾリル、ベンズイミダゾリル、ベンゾチエニル、ベンゾフラニル、インドリル、アザインドリル、インダゾリル、キノリニル、ベンゾトリアゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、ベンゾオキサゾリル、ベンズイミダゾリル、イソキノリニル、イソインドリル、アクリジニル、およびベンゾイサゾリルを含む。好ましいヘテロアリール基は、ピラゾリル、フラニル、ピリジル、キノリニル、インドリルおよびイミダゾリルである。
本明細書で用いられている「アラルキル」基は、1〜12個の炭素原子を有する直鎖状または分枝鎖状アルキル基によって化合物と結合しているアリール置換基である。1つの態様では、アリール置換基は、1〜6個の炭素原子を有する直鎖状または分枝鎖状アルキル基、すなわち低級アルキル基によって化合物と結合している。アラルキル基のアルキル部分は、任意に置換されている。
本明細書で用いられている「ヘテロシクロアルキル」または「(ヘテロ環)アルキル」基は、1〜12個の炭素原子を有する直鎖状または分枝鎖状アルキル基によって化合物と結合しているヘテロ環置換基である。1つの態様では、ヘテロ環置換基は、1〜6個の炭素原子を有する直鎖状または分枝鎖状アルキル基、すなわち低級アルキル基によって化合物と結合している。ヘテロシクロアルキルまたは(ヘテロ環)アルキル基のアルキル部分は、任意に置換されている。
本明細書で用いられている「ヘテロアラルキル」基は、1〜12個の炭素原子を有する直鎖状または分枝鎖状アルキル基によって化合物と結合しているヘテロアリール置換基である。1つの態様では、ヘテロアリール置換基は、1〜6個の炭素原子を有する直鎖状または分枝鎖状アルキル基、すなわち低級アルキル基によって化合物と結合している。ヘテロアラルキル基のアルキル部分は、任意に置換されている。
アリール(アラルキル、アラルコキシなどを含む)またはヘテロアリール(ヘテロアラルキルおよびヘテロアラルコキシなどを含む)は、1つ以上の置換基を含んでよい。適切な置換基の例は、脂肪族基、アリール基、ハロアルコキシ基、ヘテロアリール基、ハロおよびヒドロキシを含む。
本明細書で用いられている語句「医薬的に許容される」は、信頼できる医学的判断の範囲内で、ヒトおよび動物の組織と接触して使用されるのに適切であり、過剰な毒性、炎症、アレルギー反応、もしくは他の障害または合併症をもたらすことのない、合理的な便益/リスク比に見合った、化合物、物質、組成物、および/または剤形を指す。
本明細書で用いられている「医薬的に許容される塩」は、親カルバモイルエステルがその酸性または塩基性塩を製造することによって修飾された、開示化合物の誘導体を指す。医薬的に許容される塩の例は、アミンなどの塩基性残基の鉱酸塩または有機酸塩;カルボン酸などの酸性残基のアルカリ塩または有機塩;などを含み、これらに限定されない。医薬的に許容される塩は、形成された親化合物の通常の無毒性塩または第4級アンモニウム塩、例えば無毒性の無機酸または有機酸から得られた塩を含む。例えば、該通常の無毒性塩は、2−アセトキシ安息香酸、2−ヒドロキシエタンスルホン酸、酢酸、アスコルビン酸、ベンゼンスルホン酸、安息香酸、重炭酸、炭酸、クエン酸、エデト酸、エタンジスルホン酸、エタンスルホン酸、フマル酸、グルコペプトン酸、グルコン酸、グルタミン酸、グリコール酸、グリコリルアルサニル酸、ヘキシルレゾルシン(hexylresorcinic)酸、ヒドラバム(hydrabamic)酸、臭化水素酸、塩酸、ヨウ化水素酸、ヒドロキシマレイン酸、ヒドロキシナフトエ酸、イセチオン酸、乳酸、ラクトビオン酸、ラウリルスルホン酸、マレイン酸、リンゴ酸、マンデル酸、メタンスルホン酸、ナプシル(napsylic)酸、硝酸、シュウ酸、パモン酸、パントテン酸、フェニル酢酸、リン酸、ポリガラクツロン酸、プロピオン酸、サリチル酸、ステアリン酸、サブ酢酸(subacetic)、コハク酸、スルファミン酸、スルファニル酸、硫酸、タンニン酸、酒石酸、およびトルエンスルホン酸から選択される無機酸および有機酸から得られた塩を含み、これらに限定されない。
本発明の医薬的に許容される塩は、通常の化学的方法によって、塩基性または酸性部分を含む親化合物から合成されうる。一般的に、該塩は水もしくは有機溶媒中、またはこれら2つの混合液中で、これらの化合物の遊離酸または塩基形態を化学量論量の適切な塩基または酸と反応させることによって調製されうる;一般的に、エーテル、酢酸エチル、エタノール、イソプロパノール、またはアセトニトリルなどの非水媒体が好ましい。適切な塩のリストは、「Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, Easton, PA, USA, p. 1445 (1990)」に見ることができる。
芳香族カルバモイルエステルなどの本発明のカルバモイルエステルを調製する方法は、当業者の知識の範囲内である(例えば、米国特許第5,665,880号;第5,677,457号;および国際公開第97/14694号を参照のこと。これらの内容は全体として参照することによって本明細書に援用される)。
1つの実施態様では、芳香族カルバモイルエステルの合成は、化合物のアミン基を活性化して活性アミンを形成することによって達成されうる。活性アミンは単離され得、別の化合物のフェノール基と反応してカルバモイルエステルを形成しうる。例えば、1級アミンはイソシアネートに変換されうる。あるいは、アミンは塩化カルバモイルに変換されうる。例えば、アミンを、塩化カルボニル(例えばホスゲン、トリホスゲン)を含む活性化剤と反応させることによって、アミンを、ニトロフェニルオキシカルボニル基(例えばビス−4−ニトロフェニルカーボネート、4−ニトロフェニルクロロホルメート)を含む活性化剤と反応させることによって、またはアミンを、カルボニルジイミダゾールと反応させることによってアミンは活性化され得、インサイツでカルバモイルエステルを形成する用途にも用いられうる。アミンの活性化およびカルバモイルエステルの形成の個々の段階は、様々な薬剤、例えば酸、塩基、および求核剤を、単独で、または組み合わせて用いることによって触媒されうる。
別の実施態様では、カルバモイルエステルの合成は、化合物のフェノール基を活性化して活性フェノールを形成することによって達成されうる。活性フェノールは、別の化合物のアミン基と反応する。フェノールの活性化は様々な方法で行われ得、例えばフェノールを、塩化カルボニル(例えば、ホスゲン、トリホスゲン)を含む活性化剤と反応させることによって、フェノールをニトロフェニルオキシカルボニル基(例えば、ビス−4−ニトロフェニルカーボネート、4−ニトロフェニルクロロホルメート)を含む活性化剤と反応させることによって、またはフェノールをカルボニルジイミダゾールと反応させることによって行われうる。フェノールの活性化およびカルバモイルエステルの形成の個々の段階は、様々な薬剤、例えば酸、塩基、および求核剤を、単独で、または組み合わせて用いることによって触媒されうる。
カルバモイルエステルは、NMRを含む周知の分析方法によって分析されうる。
カルバモイルエステルは、例えば、酢酸エチル中でエセロリン内のフェノール性ヒドロキシル基をカルボニルジイミダゾール(CDI)と反応させ、次いで酢酸およびアミンを添加することによって合成され得、結果、芳香族カルバモイルエステルが形成される(Gao et al., J. Heterocyclic Chem 37:331-333 (2000)、その内容は全体として参照することによって本明細書に援用される)。
エセロリンからの芳香族カルバモイルエステルの形成には、塩化カルバモイルを用いることが記載されている(Marta, et al., Bichimica et Biophysica Acta 1120:262-266 (1992); Marta, et al., Biomed Biochem Acta 47:285-288 (1998); Marta, et al., Life Sci. 43:1921-1928 (1988)、その内容は全体として参照することによって本明細書に援用される)。
フェノール性ヒドロキシル基と塩化カルバモイルの反応も、芳香族カルバモイルエステルの合成について記載されている(Toda, et al., Bioorg Med Chem 11:1935-1955 (2003), Kogen, et al., Org Lett 4:3359-3362 (2002), Mustazza, et al., Eur J. Med Chem 37:91-109 (2002)およびSterling, et al., J Med Chem 45:5260-5279 (2002)、その全内容は全体として参照することによって本明細書に援用される)。
本明細書で用いられている用語「覚醒促進」または「覚醒を促進する」は、個体の覚醒の持続時間の顕著な増加を指す。1つの態様では、本発明の化合物が投与された個体においてリバウンド傾眠過剰がない。別の態様では、個体に生じた低体温が、覚醒促進用に個体へ投与された化合物によるCNS浸透のマーカーとして用いられる。1つの態様では、眠気が減少、すなわち、精神的覚醒状態が増加し、またはカルバモイルエステルの投与のきっかけとなったより深い眠気の状態へさらに進行することを防止する。用語「眠気」は当該技術分野において認識されており、精神的覚醒状態の減少を含む。
「l−アンフェタミン」および「d−アンフェタミン」などを指す場合に用いられる用語「アンフェタミン」は、式XXIIによって表される化合物を意味し、そのプロドラッグならびに他の構造および機能誘導体を含み、1級アミン基は置換に用いることができる。好ましい実施態様では、アンフェタミンは式XXII:
によって表される化合物である。
d−アンフェタミンおよびl−アンフェタミンのラセミ混合物は、dl、(+,−)、(Å)、DLまたは(R)(S)と呼ばれる。
式XXVは、レボ−アンフェタミン硫酸塩またはl−アンフェタミン硫酸塩とも呼ばれる。式XXVは分子式C18H28N2O4S、分子量368.50を有する。式XXVのIUPAC化学名は(−)−1−メチル−2−フェニルエチルアミン硫酸塩(2:1)、およびCAS化学名は(−)−_−メチルフェネチルアミン硫酸塩(2:1)である。
式XXVIIは、レボ−メタンフェタミン塩酸塩、l−メタンフェタミン塩酸塩またはレボメタンフェタミン塩酸塩とも呼ばれる。式XXVIIは、分子式C10H16NClを有する。
式XXVIIIは、レボ−メタンフェタミン、レボ−デスオキシエフェドリン、l−デスオキシエフェドリンまたはレブメタンフェタミンとも呼ばれる。式XXVIIIは、分子式C10H15Nおよび分子量149.24を有する。
本明細書で用いられている「薬剤(〜剤、〜薬)」は、刺激性(例えば、活性化剤)または阻害性(例えば、遮断薬)でありうる、物理的、化学的または生物学的効果を生じうる化合物を指す。刺激性の薬剤は、アゴニストでありうる。阻害性の薬剤は、アンタゴニストまたはインバースアゴニストでありうる。インバースアゴニストは、受容体で活性化される活動を下方制御し、それによって受容体に対してアゴニストと反対の様式で作用する化合物または分子である。薬剤は部分的アゴニストでありうる。それゆえ、インバースアゴニストまたは部分的インバースアゴニストの露出または投与は、アゴニストの露出または投与と比較して反応の減少をもたらしうる。
本明細書で用いられている「修飾因子」は、生物学的経路または受容体媒介シグナル伝達経路を制御する、調節する、または適合させる化合物を指す。修飾因子は、生物学的経路または受容体媒介シグナル伝達経路を刺激または阻害しうる。
カルバモイルエステルによって放出された薬理活性物質は、交感神経刺激薬、アドレナリン作動薬、ノルアドレナリン作動薬、ドーパミン作動薬、セロトニン作動薬、モノアミンオキシダーゼ阻害剤、およびCOMT阻害剤からなる群から選択される少なくとも1つのメンバーである。
本発明のカルバモイルエステルは、コリンエステラーゼ活性を阻害し得、その阻害能力はIC50で表されうる。本明細書で用いられている用語「IC50」は、例えばタンパク質(例えば、受容体)への競合分子の結合を50%減少させることによって、または活性(例えば、コリンエステラーゼ活性)の水準を50%減少させることによって、活性または効果を50%阻害する薬物、化合物、分子またはカルバモイルエステルの濃度を指す。
本明細書で用いられている「個体」は、いずれかの哺乳類である。哺乳類は、げっ歯類(ラット、マウスもしくはモルモットなど)、家畜(イヌもしくはネコなど)、反芻動物(ウマもしくはウシなど)または霊長類(サルもしくはヒトなど)でありうる。好ましい実施態様では、個体はヒトである。
本発明のカルバモイルエステルは、単回用量または複数回用量にて、本発明の方法、医薬組成物、キットおよびアッセイにおいて利用されうる。複数回用量は1日の中の複数回用量として、2日間以上にわたって投与される1日1回の用量として、2日間以上にわたって毎日投与される複数回用量として、または間の日の複数回用量の前または後のいずれか特定の日の単回用量として投与されうる。複数回用量は、1日、数日間、1週間、数週間、1ヶ月間、数ヶ月間、1年間または数年間にわたって投与されうる。
本発明のカルバモイルエステルは、覚醒を増加させるように個体へ急性的に(短時間に、もしくは短期間に)または慢性的に(持続的に、もしくは長期間に)投与されうる。例えば、本発明のカルバモイルエステルは、カルバモイルエステルを個体へ1日、数日間、1週間、数週間、1ヶ月間、数ヶ月間または数年間にわたって1日1回、1日複数回(例えば、2回、3回、4回)投与することによる覚醒促進に用いられうる。本発明のカルバモイルエステルは、必要に応じて個体によって投与されうる。
1つの実施態様では、カルバモイルエステルの用量は、約0.1mg、約1mg、約2.5mg、約5mg、約10mg、約15mg、約20mg、約25mg、約40mg、約50mg、約75mg、約90mg、約100mg、約150mg、約200mg、約250mg、約500mg、約750mgまたは約1000mgでありうる。
別の実施態様では、カルバモイルエステルの用量は、約1mg〜約100mg;約2mg〜約50mg;または約5mg〜約25mgでありうる。
さらに別の実施態様では、複数回用量の各用量は、約0.1mg、約1mg、約2.5mg、約5mg、約10mg、約20mg、約25mg、約40mg、約50mg、約75mg、約90mg、約100mg、約150mg、約200mg、約250mg、約500mg、約750mgまたは約1000mgでありうる。
さらなる実施態様では、複数回用量の各用量は、約1mg〜約100mg;約2mg〜約50mg;または約5mg〜約25mgでありうる。
カルバモイルエステルは覚醒促進用に投与され、または有効量にて本発明のアッセイおよびキットにおいて利用される。用語「有効量(effective amount)」、「有効量(amount effective)」または「治療上の有効量」は、カルバモイルエステルまたは薬理活性物質の量を指す場合、治療効果に十分なカルバモイルエステルまたは薬理活性物質の量、または用量(例えば、覚醒を促進するのに十分な量;眠気を減少させるのに十分な量;精神的覚醒を増加させるのに十分な量;MS疲労の症状を防ぐのに十分な量;疲労を軽減するのに十分な量)として定義される。
カルバモイルエステルは、本発明のキットおよびアッセイにおいて、許容される担体と共に、覚醒促進用に任意に用いられうる。許容される担体の選択は、方法、キットまたはアッセイに依存するであろう。例えば、インビトロの方法、アッセイまたはキットにおける許容される担体は、生理食塩水、適切な緩衝液または細胞培養液でありうる。
本発明のカルバモイルエステルは単独で投与され得、または経腸もしくは非経口適用に適切であり、方法に利用される化合物と有害な反応をしない通常の賦形剤、例えば、医薬的に、または生理的に、許容される有機または無機担体物質との混合物として投与されうる。適切な医薬的に許容される担体は、水、塩溶液(リンガー溶液など)、アルコール、油、ゼラチン、およびラクトース、アミロースまたはデンプンなどの炭水化物、脂肪酸エステル、ヒドロキシメチルセルロース、ならびにポリビニルピロリジンを含む。該製剤は滅菌され得、所望の場合には、本発明の方法で利用される化合物と有害な反応をしない滑沢剤、防腐剤、安定剤、湿潤剤、乳化剤、浸透圧に影響する塩、緩衝液、着色剤、および/または芳香族物質などの助剤と混合されうる。製剤は、所望の場合には、代謝低下を減少させる他の活性物質とも組み合わせられうる。
カルバモイルエステルの投与方法は、経口投与(錠剤またはカプセル剤など)である。カルバモイルエステルは単独で、または混合物と組み合わせて、ある期間にわたって単回用量または2用量以上にて投与され得、所望の効果(例えば、覚醒の持続時間の増加)を与えうる。
カルバモイルエステルは、個体において標的部位へ投与されうる。
非経口適用が必要または所望である場合、カルバモイルエステルに特に適切な混合物は注射液、滅菌溶液、好ましくは油性溶液もしくは水溶液、さらには懸濁液、乳剤、または坐剤を含む埋め込み剤である。特に、非経口投与用の担体は、デキストロース、生理食塩水、純水、エタノール、グリセロール、プロピレングリコール、落花生油、ゴマ油、ポリオキシエチレンブロックポリマーなどの水溶液を含む。アンプルは、簡便な単位用量である。本発明の方法、アッセイまたはキットに利用されるカルバモイルエステルは、リポソームにも組み込まれ得、または経皮ポンプもしくはパッチによって投与されうる。本発明における使用に適切な医薬混合物は当業者に周知であり、例えば、Pharmaceutical Sciences(17th Ed., Mack Pub. Co., Easton, PA)および国際公開第96/05309号に記載されており、その内容は参照することにより本明細書に援用される。
個体へ投与される用量および頻度(単回用量または複数回用量)は、例えば、必要な覚醒の持続時間の増加、送達される薬理活性物質;個体の大きさ、年齢、性別、健康、体重、ボディ・マス・インデックスおよび食事;覚醒促進の性質および程度、併用療法の種類、状態もしくは障害による合併症、または治療されるヒトの他の健康関連障害を含む、様々な要因に依存して変化しうる。
他の治療計画または治療薬は、覚醒促進用に利用される本発明のカルバモイルエステルと共に用いられうる。確立された用量(例えば、頻度および持続時間)の調節および操作は、十分に当業者の能力の範囲内である。
本発明は下記の実施例によってさらに例証されるが、これらは発明を限定することは決して意図していない。
本発明のさらなる利点および特徴は、下記の実施例からよりはっきりと理解されるであろう。これらの実施例は、決して発明を限定することを意味せず、例示する目的で示されている。
実施例
実施例
実施例1 S−リバ−アトモキセチン(5)の合成
(S)−(−)−3'−ヒドロキシフェニルエチルジメチルアミン(96mg、0.58mmol)(1)を4mLの乾燥酢酸エチルに溶解した。N,N'−カルボニルジイミダゾール粉末(283mg、1.74mmol)を加え、混合物を室温で20時間撹拌した。酢酸(313mg、5.22mmol)を混合物に加え、次いで162mgの(−)−アトモキセチン(4、0.63mmol)を加えた。生じた混合物を室温で一晩撹拌した。飽和炭酸水素ナトリウム溶液を混合物に加え、水層と有機層を分離した。水層を酢酸エチルで2回抽出した。有機層を混合し、NaHCO3で乾燥させ、蒸発させ、シリカゲルカラムで精製し(1%トリエチルアミンを含むヘキサン中の25%酢酸エチルで溶出した)、101mgのカルバモイルエステル(5)(0.23mmol、収率39.0%)を得た。
(S)−(−)−3'−ヒドロキシフェニルエチルジメチルアミン(96mg、0.58mmol)(1)を4mLの乾燥酢酸エチルに溶解した。N,N'−カルボニルジイミダゾール粉末(283mg、1.74mmol)を加え、混合物を室温で20時間撹拌した。酢酸(313mg、5.22mmol)を混合物に加え、次いで162mgの(−)−アトモキセチン(4、0.63mmol)を加えた。生じた混合物を室温で一晩撹拌した。飽和炭酸水素ナトリウム溶液を混合物に加え、水層と有機層を分離した。水層を酢酸エチルで2回抽出した。有機層を混合し、NaHCO3で乾燥させ、蒸発させ、シリカゲルカラムで精製し(1%トリエチルアミンを含むヘキサン中の25%酢酸エチルで溶出した)、101mgのカルバモイルエステル(5)(0.23mmol、収率39.0%)を得た。
カルバモイルエステル(5)はNMRによって確認した。塩酸塩の1H−NMR(CDCl3,400MHz):δ1.808 and 1.825(d,3H,J=6.8Hz,CH3),2.090−2.320(m,2H),2.262(ma) and 2.325(mi)(s,3H,CH3),2.506−2.541(m,3H,CH3),2.658−2.698(m,3H,CH3),3.002(ma) and 3.082(mi)(s,3H,CH3),3.520−3.575(m,1H,CH),3.662−3.700 and 3.892−3.961(m,1H,CH),4.048−4.123(m,1H,CH),5.180−5.252(m,1H,CH),6.535−6.582(m,1H,CH arom.),6.729−6.787 and 6.902−6.957(m,3H,3xCH arom.),7.007−7.086(m,2H,2xCH arom.),7.224−7.428(m,7H,7xCH arom.),12.620(bs,1H,HCl).
下記の手順に従って、遊離塩基5を塩酸塩に変換した:
カルバモイルエステル(5)をクロロホルム(1mmolの遊離塩基5につき3mL)に溶解した。エーテル中の1M塩酸溶液(1.5〜2モル当量)を0℃で滴加した。塩酸の添加完了後、混合物を室温になるまで温めた。溶媒を蒸発によって取り除き、残渣を真空下で乾燥させ、白色〜灰白色固体のカルバモイルエステル(5)の塩酸塩を得た。
カルバモイルエステル(5)をクロロホルム(1mmolの遊離塩基5につき3mL)に溶解した。エーテル中の1M塩酸溶液(1.5〜2モル当量)を0℃で滴加した。塩酸の添加完了後、混合物を室温になるまで温めた。溶媒を蒸発によって取り除き、残渣を真空下で乾燥させ、白色〜灰白色固体のカルバモイルエステル(5)の塩酸塩を得た。
実施例2 S−リバ−L−メタンフェタミン(7)の合成:
0℃で10mLの乾燥ジクロロメタン(0.86mmol)中の0.12g(0.72mmol)の(−)−3'−ヒドロキシフェニルエチルジメチルアミン(1)および0.22g(2.17mmol)のトリエチルアミンの溶液に、4−ニトロフェニルクロロホルメートの粉末(0.179g、0.86mmol)を加えた。溶液を0℃で5分間撹拌し、次いで室温でさらに30分間撹拌した。次いで、2mLの乾燥ジクロロメタン中の0.107gの1−メタンフェタミン(6)の溶液を加え、得られる溶液を室温で2時間撹拌した。溶媒を蒸発させ、残渣をシリカゲルカラムにかけた。化合物(7)を、1%トリエチルアミンを含む酢酸エチル中の3%アセトンで溶出した。化合物(7)を含む画分を混合し、濃縮し、0.15gの化合物(7)(0.44mmol、収率61%)を得た。
0℃で10mLの乾燥ジクロロメタン(0.86mmol)中の0.12g(0.72mmol)の(−)−3'−ヒドロキシフェニルエチルジメチルアミン(1)および0.22g(2.17mmol)のトリエチルアミンの溶液に、4−ニトロフェニルクロロホルメートの粉末(0.179g、0.86mmol)を加えた。溶液を0℃で5分間撹拌し、次いで室温でさらに30分間撹拌した。次いで、2mLの乾燥ジクロロメタン中の0.107gの1−メタンフェタミン(6)の溶液を加え、得られる溶液を室温で2時間撹拌した。溶媒を蒸発させ、残渣をシリカゲルカラムにかけた。化合物(7)を、1%トリエチルアミンを含む酢酸エチル中の3%アセトンで溶出した。化合物(7)を含む画分を混合し、濃縮し、0.15gの化合物(7)(0.44mmol、収率61%)を得た。
化合物(7)はNMRによって確認した。1H−NMR(CDCl3,300MHz):δ1.192(mi) and 1.275(ma)(d,3H,J=6.8Hz,CH3),1.305 and 1.326(d,3H,J=3.0Hz,CH3),2.162 and 2.167(s,6H,2xCH3),2.746(dd,1H,J=13.7 and 6.8Hz,CHH),2.850(dd,1H,J=13.7 and 6.8Hz,CHH),2.868 and 2.886(s,3H,CH3),3.165−3.217(m,1H,CH),4.558−4.633(m,1H,CH),6.665 and 6.855(bd,1H,J=7.9Hz,CH arom.),6.723 and 6.928(bs,1H,CH arom.),7.065(bd,1H,J=7.2Hz,CH arom.),7.176−7.305(m,6H,CH arom.).
実施例3A S−リバ−L−アンフェタミン(9)の合成
室温で、140mLのジクロロメタン中の7.34gのl−アンフェタミン硫酸塩(8)(40mmol)の懸濁液に、ジイソプロピルエチルアミン(5.16g、40mmol)およびCDI粉末(6.48g、40mmol)を加えた。生じた混合物を室温で1時間撹拌した。乾燥トルエン(120ml)中の0.8gの水素化ナトリウム(鉱油中の60%分散液)と30分間混合した(−)−3'−ヒドロキシフェニルエチルジメチルアミン(1)(3.3g、20mmol)を混合物に加え、ジクロロメタンを減圧下で除去した。得られた懸濁液を一晩撹拌しながら85℃まで加熱した。反応混合物を0.5M塩酸(200ml)で抽出した。水層を酢酸エチルで洗浄し、0℃で炭酸水素ナトリウムおよび0.5N NaOHによってpH〜11まで塩基性化し、酢酸エチルで抽出した(3x100ml)。有機層を混合し、硫酸ナトリウムで乾燥させ、蒸発させた。残渣をシリカゲルカラムで精製した。ヘキサン中の20〜30%酢酸エチルと1%トリエチルアミンとの混合液での溶出によって、1.53gのカルバモイルエステル(9)(4.7mmol、収率23.5%)を得た。
室温で、140mLのジクロロメタン中の7.34gのl−アンフェタミン硫酸塩(8)(40mmol)の懸濁液に、ジイソプロピルエチルアミン(5.16g、40mmol)およびCDI粉末(6.48g、40mmol)を加えた。生じた混合物を室温で1時間撹拌した。乾燥トルエン(120ml)中の0.8gの水素化ナトリウム(鉱油中の60%分散液)と30分間混合した(−)−3'−ヒドロキシフェニルエチルジメチルアミン(1)(3.3g、20mmol)を混合物に加え、ジクロロメタンを減圧下で除去した。得られた懸濁液を一晩撹拌しながら85℃まで加熱した。反応混合物を0.5M塩酸(200ml)で抽出した。水層を酢酸エチルで洗浄し、0℃で炭酸水素ナトリウムおよび0.5N NaOHによってpH〜11まで塩基性化し、酢酸エチルで抽出した(3x100ml)。有機層を混合し、硫酸ナトリウムで乾燥させ、蒸発させた。残渣をシリカゲルカラムで精製した。ヘキサン中の20〜30%酢酸エチルと1%トリエチルアミンとの混合液での溶出によって、1.53gのカルバモイルエステル(9)(4.7mmol、収率23.5%)を得た。
カルバモイルエステル(9)はNMRによって確認した。1H−NMR(CDCl3,300MHz):δ1.179(d,3H,J=6.6Hz,CH3),1.331(d,3H,J=6.7Hz,CH3),2.174(s,6H,2xCH3),2.789(dd,1H,J=13.4 and 7.2Hz,CHH),2.832(dd,1H,J=13.4 and 5.9Hz,CHH),3.228(q,1H,J=6.7Hz,CH),3.980−4.062(m,1H,CH),4.856(bd,1H,J=7.2Hz,NH),6.955(bd,1H,J=7.4Hz,CH arom.),7.018(bs,1H,CH arom.),7.095(bd,1H,J=7.7Hz,CH arom.)7.186−7.303(m,6H,CH arom.).
実施例3B:S−リバ−L−アンフェタミン(9)の別途合成
(S)−(−)−3'−ヒドロキシフェニルエチルジメチルアミン(1)(1.2g、7.3mmol)を20mLの乾燥酢酸エチルに溶解した。N,N'−カルボニルジイミダゾール粉末(2.37g、14.6mmol)を加え、混合物を85℃で一晩撹拌した。0℃まで冷却した後、3.3gの酢酸(55.0mmol)を加え、次いで2.8gのl−アンフェタミン(8)(20.7mmol)を加えた。混合物を室温で36時間撹拌した。水(20ml)および1M塩酸(20ml)を加え、水層と有機層を分離した。有機層を0.5M塩酸で抽出した。水層を混合し、エーテルで2回洗浄し、NaHCO3および0.5N NaOHでpH〜11まで塩基性化し、エーテルで抽出した。エーテル層をNaHCO3で乾燥させ、蒸発させ、シリカゲルクロマトグラフィーで精製した。ヘキサン中の25%酢酸エチルと1%トリエチルアミンとの混合液での溶出により、0.93gのカルバモイルエステル(9)(2.85mmol、収率39%)を得た。
(S)−(−)−3'−ヒドロキシフェニルエチルジメチルアミン(1)(1.2g、7.3mmol)を20mLの乾燥酢酸エチルに溶解した。N,N'−カルボニルジイミダゾール粉末(2.37g、14.6mmol)を加え、混合物を85℃で一晩撹拌した。0℃まで冷却した後、3.3gの酢酸(55.0mmol)を加え、次いで2.8gのl−アンフェタミン(8)(20.7mmol)を加えた。混合物を室温で36時間撹拌した。水(20ml)および1M塩酸(20ml)を加え、水層と有機層を分離した。有機層を0.5M塩酸で抽出した。水層を混合し、エーテルで2回洗浄し、NaHCO3および0.5N NaOHでpH〜11まで塩基性化し、エーテルで抽出した。エーテル層をNaHCO3で乾燥させ、蒸発させ、シリカゲルクロマトグラフィーで精製した。ヘキサン中の25%酢酸エチルと1%トリエチルアミンとの混合液での溶出により、0.93gのカルバモイルエステル(9)(2.85mmol、収率39%)を得た。
実施例4 S−リバ−デスメチルセレギリン(11)の合成:
トリホスゲン(85.5mg、0.28mmol)を2mLの乾燥ジクロロメタンに溶解した。この溶液に、0℃で1mLの乾燥ジクロロメタン中の145mgのデスメチルセレギリン(10)(0.84mmol)および110mgのジイソプロピルエチルアミン(DIEA)(0.85mol)の混合物を加え、10分間反応させた。混合物を室温で60時間撹拌し、次いで室温で1時間撹拌した乾燥アセトニトリル中の(−)−α−3'−ヒドロキシフェニルエチルジメチルアミン(1)(92mg、0.55mmol)および水素化ナトリウム(68mg、鉱油中の60%分散液)の懸濁液に加えた。生じた混合物を室温で一晩撹拌した。上記混合物の溶媒を減圧下で除去した。残渣を0.5M塩酸に溶解し、エーテルで洗浄した。水層を炭酸水素ナトリウムで塩基性化し、酢酸エチルで抽出した(3x20ml)。有機層を0.5N NaOH(200ml)で洗浄し、硫酸ナトリウムで乾燥させ、蒸発させた。残渣をシリカゲルカラム(1%トリエチルアミンを含むヘキサン中の30〜60%酢酸エチルで溶出した)で精製し、185mgのカルバモイルエステル(11)(0.508mmol、収率92.3%)を得た。
トリホスゲン(85.5mg、0.28mmol)を2mLの乾燥ジクロロメタンに溶解した。この溶液に、0℃で1mLの乾燥ジクロロメタン中の145mgのデスメチルセレギリン(10)(0.84mmol)および110mgのジイソプロピルエチルアミン(DIEA)(0.85mol)の混合物を加え、10分間反応させた。混合物を室温で60時間撹拌し、次いで室温で1時間撹拌した乾燥アセトニトリル中の(−)−α−3'−ヒドロキシフェニルエチルジメチルアミン(1)(92mg、0.55mmol)および水素化ナトリウム(68mg、鉱油中の60%分散液)の懸濁液に加えた。生じた混合物を室温で一晩撹拌した。上記混合物の溶媒を減圧下で除去した。残渣を0.5M塩酸に溶解し、エーテルで洗浄した。水層を炭酸水素ナトリウムで塩基性化し、酢酸エチルで抽出した(3x20ml)。有機層を0.5N NaOH(200ml)で洗浄し、硫酸ナトリウムで乾燥させ、蒸発させた。残渣をシリカゲルカラム(1%トリエチルアミンを含むヘキサン中の30〜60%酢酸エチルで溶出した)で精製し、185mgのカルバモイルエステル(11)(0.508mmol、収率92.3%)を得た。
カルバモイルエステル(11)はNMRによって確認した。1H−NMR(CDCl3,300MHz):δ1.339(d,3H,J=6.6Hz,CH3),1.327−1.415(m,3H,CH3),2.187(s,6H,2xCH3)、2.215−2.258(m,1H,CH),2.843−2.870(m,1H,CH),3.063(dd,1H,J=13.5 and 7.5Hz,CHH),3.230(q,1H,J=6.6Hz,CH),4.043−4.118(m,2H,2xCH),4.372−4.411(m,1H,CH),6.846−7.024(m,2H,2xCH arom.),7.108(bd,1H,J=7.7Hz,CH arom.),7.202−7.313(m,6H,CH arom.).
実施例5 S−リバ−D−アンフェタミン(20)の合成:
(S)−(−)−3'−ヒドロキシフェニルエチルジメチルアミン(1)(81mg、0.49mmol)を4mLの乾燥酢酸エチルに溶解した。N,N'−カルボニルジイミダゾール粉末(199mg、1.23mmol)を加え、混合物を室温で20時間撹拌した。酢酸(184mg、3.07mmol)を加え、次いで186mgのd−アンフェタミン(19)酢酸塩(0.96mmol)を加えた。混合物を室温で一晩撹拌した。水(5ml)および1M塩酸(5ml)を加え、水層と有機層を分離した。有機層を0.5M塩酸で抽出した。水層を混合し、エーテルで2回洗浄し、NaHCO3および0.5N NaOHでpH〜11まで塩基性化し、次いでエーテルで抽出した。エーテル層をNaHCO3で乾燥させ、蒸発させ、シリカゲルカラムで精製し(1%トリエチルアミンを含むヘキサン中の25%酢酸エチルで溶出した)、95mgのカルバモイルエステル(20)(0.29mmol、収率59.4%)を得た。
(S)−(−)−3'−ヒドロキシフェニルエチルジメチルアミン(1)(81mg、0.49mmol)を4mLの乾燥酢酸エチルに溶解した。N,N'−カルボニルジイミダゾール粉末(199mg、1.23mmol)を加え、混合物を室温で20時間撹拌した。酢酸(184mg、3.07mmol)を加え、次いで186mgのd−アンフェタミン(19)酢酸塩(0.96mmol)を加えた。混合物を室温で一晩撹拌した。水(5ml)および1M塩酸(5ml)を加え、水層と有機層を分離した。有機層を0.5M塩酸で抽出した。水層を混合し、エーテルで2回洗浄し、NaHCO3および0.5N NaOHでpH〜11まで塩基性化し、次いでエーテルで抽出した。エーテル層をNaHCO3で乾燥させ、蒸発させ、シリカゲルカラムで精製し(1%トリエチルアミンを含むヘキサン中の25%酢酸エチルで溶出した)、95mgのカルバモイルエステル(20)(0.29mmol、収率59.4%)を得た。
カルバモイルエステル(20)はNMRによって確認した。1H−NMR(CDCl3,300MHz):δ1.192(d,3H,J=6.6Hz,CH3),1.367(d,3H,J=6.7Hz,CH3),2.205(s,6H,2xCH3),2.759(dd,1H,J=13.4 and 7.2Hz,CHH),2.896(dd,1H,J=13.4 and 5.9Hz,CHH),3.295(q,1H,J=6.6Hz,CH),3.990−4.044(m,1H,CH),4.847(bd,1H,J=7.2Hz,NH),6.966(bd,1H,J=7.4Hz,CH arom.),6.976(bs,1H,CH arom.),7.114(bd,1H,J=7.7Hz,CH arom.),7.191−7.324(m,6H,CH arom.)。
実施例6:化合物合成
本発明の化合物は、当業者に周知の方法を用いたRa−フェノールとQ−Hのカップリングによって製造される。例えば、
[式中、Raはリバスチグミンまたはフィゾスチグミンなどのスチグミン用の適切なフェニル置換基を表し、Qはアミン含有薬理活性物質を表す]によって製造される。例えば、
である。
本発明の化合物は、当業者に周知の方法を用いたRa−フェノールとQ−Hのカップリングによって製造される。例えば、
実施例7:S−リバスチグミンおよびl−アンフェタミンからの本発明の化合物の精製
S−リバスチグミンおよびl−アンフェタミンから得られたカルバモイルエステルのサンプルを水(30mL)に溶解し、Na2CO3の2.0M水溶液を用いてpH〜10に調節した。次いで、カルバモイルエステル遊離塩基をジクロロメタンで抽出し(2X30mL)、乾燥させ(Na2SO4)、ロトバップ(rotovap)を用いて濃縮した。溶媒としてヘプタン(74%)、酢酸エチル(25%)およびトリエチルアミン(1%)を用いたシリカカラムに残渣を通した。ロトバップ(rotovap)を用いて画分を蒸発させ、高真空下で一晩乾燥させた。残渣を水(6mL)に入れ、次いで2.0M塩酸(3mL)を加え、透明な均一溶液を得た。次いで凍結乾燥させ、カルバモイルエステル塩酸塩(278mg、HPLC純度>99%)を得た。カルバモイルエステルは下記の通りである:
。
S−リバスチグミンおよびl−アンフェタミンから得られたカルバモイルエステルのサンプルを水(30mL)に溶解し、Na2CO3の2.0M水溶液を用いてpH〜10に調節した。次いで、カルバモイルエステル遊離塩基をジクロロメタンで抽出し(2X30mL)、乾燥させ(Na2SO4)、ロトバップ(rotovap)を用いて濃縮した。溶媒としてヘプタン(74%)、酢酸エチル(25%)およびトリエチルアミン(1%)を用いたシリカカラムに残渣を通した。ロトバップ(rotovap)を用いて画分を蒸発させ、高真空下で一晩乾燥させた。残渣を水(6mL)に入れ、次いで2.0M塩酸(3mL)を加え、透明な均一溶液を得た。次いで凍結乾燥させ、カルバモイルエステル塩酸塩(278mg、HPLC純度>99%)を得た。カルバモイルエステルは下記の通りである:
凍結乾燥した物質は白色の流動性粉末(free flowing powder)であったが、サンプルとしては、精製および凍結乾燥前は粘着性があり、動かしにくかった。
実施例8Aおよび8B:本発明の化合物の塩酸塩の調製
実施例8A:本発明の化合物をクロロホルム(化合物1mmolにつき3mL)に溶解する。エーテル中の1M塩酸溶液(1.5〜2モル当量)を0℃で滴加する。塩酸の添加完了後、混合物を室温まで温める。溶媒を蒸発によって除去し、残渣を真空下で乾燥させ、化合物の塩酸塩を得る。
実施例8A:本発明の化合物をクロロホルム(化合物1mmolにつき3mL)に溶解する。エーテル中の1M塩酸溶液(1.5〜2モル当量)を0℃で滴加する。塩酸の添加完了後、混合物を室温まで温める。溶媒を蒸発によって除去し、残渣を真空下で乾燥させ、化合物の塩酸塩を得る。
実施例8B:化合物を水に溶解し、Na2CO3の2.0M水溶液を用いてpH〜10に調節する。次いで化合物をジクロロメタン(2X30mL)で抽出し、乾燥させ(Na2SO4)、濃縮する。溶媒としてヘプタン(74%)、酢酸エチル(25%)およびトリエチルアミン(1%)を用いたシリカカラムに残渣を通す。ロトバップ(rotovap)を用いて画分を蒸発させ、高真空下で一晩乾燥させる。残渣を水(6mL)に入れ、次いで2.0M塩酸(3mL)を加える。次いで溶液を凍結乾燥し、その塩酸塩として化合物を得る。
実施例9:化合物はインビトロでアセチルコリンエステラーゼを阻害する:
本実験で使用した全ての試薬は、分析グレードのものであった。ヨウ化アセチルチオコリン、5,5'−ジチオビス−(2−ニトロ)安息香酸(DTNB)およびヒト組換えアセチルコリンエステラーゼ(C1682)は、シグマ・ケミカル社(Sigma Chemical Co(St. Louis, MO))から購入した。
本実験で使用した全ての試薬は、分析グレードのものであった。ヨウ化アセチルチオコリン、5,5'−ジチオビス−(2−ニトロ)安息香酸(DTNB)およびヒト組換えアセチルコリンエステラーゼ(C1682)は、シグマ・ケミカル社(Sigma Chemical Co(St. Louis, MO))から購入した。
化合物のアセチルコリンエステラーゼ活性は、エルマンら(Ellmann, et al. (Biochem. Pharmacol., 7:88-95 (1961)))の比色法の修正によって25℃で決定した。酵素、化合物またはスチグミンおよび緩衝液を30分間プレインキュベートした。プレインキュベーション期間の終わりに、基質であるアセチルチオコリンを加えた。最終アッセイ混合物は、10mMトリス緩衝液(pH8)、0.3mMアセチルチオコリン、0.33mM DTNBおよび0.08U/mlの酵素を含んだ。少なくとも5通りの異なる濃度の化合物またはスチグミンをIC50実験によってアッセイした。
アセチルチオコリンの加水分解は、チオコリンとDTNBの間の複合体の形成の測定によって間接的にモニターした。マイクロプレート分光光度計(Polarstar, BMG Labtech)を利用して405nmでの光学濃度を5分間記録し、時間に対してプロットした。様々な阻害剤濃度についての初速度の逆数を濃度に対してプロットし(Dixon Plot)、x切片の反対の値としてIC50値(酵素活性が50%阻害される濃度)を得た(Burlingham, et al., J.Chem.Ed., 80:214-218 (2003))。
ブチリルコリンエステラーゼの阻害は、当該技術分野で周知の方法、例えば「Alcala Molel M. et al. (2003) Characterization of the anticholinesterase activity of two new tacrin-huperzine A hybrids. Neuropharmacology, 44(6), 749-755」を用いて決定した。
これらのデータは、本発明の化合物がインビトロでアセチルコリンエステラーゼを阻害することを示す。カルバモイルエステルによるアセチルコリンエステラーゼの阻害は、リバスチグミンなどのスチグミンによるアセチルコリンエステラーゼの阻害よりも大きくなりうる。スチグミンから合成されるカルバモイルエステルは、スチグミンと比較して同様の、または増加した活性を有する。例えば、カルバモイルエステル(14)は、リバスチグミンと比較して10倍増加した酵素活性を有する。それゆえ、既知の酵素活性を有するカルバモイルエステルであるスチグミンの構造変化は、スチグミンの酵素阻害活性を減少させなかった。逆に、カルバモイルエステルによるブチリルコリンエステラーゼの阻害は、リバスチグミンなどのスチグミンによるブチリルコリンエステラーゼの阻害よりも低くなりうる。ブチリルコリンエステラーゼ阻害よりもアセチルコリンエステラーゼ阻害に向かうこのシフトは、カルバモイルエステルの予想外の利点である。CNSにおいてアセチルコリンエステラーゼはブチリルコリンエステラーゼよりも相対的により多く発現している一方で、末梢組織においてブチリルコリンエステラーゼはアセチルコリンエステラーゼよりもより多く発現しているため、CNSにおいてカルバモイルエステルはスチグミンよりもそれらの標的酵素に対してより選択的であり、それゆえ認容性に対する有効性の比率が改善すると予想される。
実施例10:本発明の化合物は脳内のコリンエステラーゼを阻害する:
オスのウィスターラットの腹腔内(i.p.)に、リバスチグミンまたは本発明の化合物を注射した。リバスチグミンまたはカルバモイルエステルの用量は、最小の副作用でコリン作動性の行動的効果をもたらし、動物による認容性は良好であった。注射後3時間で動物を断頭し、脳を迅速に取り除いた。脳組織をさいの目に切って小片にし、氷上に置き、ポリトロンPT1200(Kinematic AG)を用いて0.1%トリトンXおよびプロテアーゼ阻害剤を含む10ml氷冷トリス中で直ちにホモジナイズした。抽出緩衝液中のプロテアーゼ阻害剤は、アンチパイン(10μM)、アプロチニン(5TIU/mgタンパク質)、ベスタチン(60nm)、ロイペプチン(10μM)およびペプスタチン(1μM)であった。最終アッセイ混合物中のホモジネートの最終希釈度は、120倍であった。
オスのウィスターラットの腹腔内(i.p.)に、リバスチグミンまたは本発明の化合物を注射した。リバスチグミンまたはカルバモイルエステルの用量は、最小の副作用でコリン作動性の行動的効果をもたらし、動物による認容性は良好であった。注射後3時間で動物を断頭し、脳を迅速に取り除いた。脳組織をさいの目に切って小片にし、氷上に置き、ポリトロンPT1200(Kinematic AG)を用いて0.1%トリトンXおよびプロテアーゼ阻害剤を含む10ml氷冷トリス中で直ちにホモジナイズした。抽出緩衝液中のプロテアーゼ阻害剤は、アンチパイン(10μM)、アプロチニン(5TIU/mgタンパク質)、ベスタチン(60nm)、ロイペプチン(10μM)およびペプスタチン(1μM)であった。最終アッセイ混合物中のホモジネートの最終希釈度は、120倍であった。
全コリンエステラーゼ活性は、上記のようにエルマンら(Ellmann, et al. (Biochem. Pharmacol.,7:88-95 (1961)))の比色法の修正によって決定した。アセチルチオコリンの加水分解は、チオコリンとDTNBの間の複合体の形成の測定によって間接的にモニターした。マイクロプレート分光光度計(Polarstar、BMG Labtech)を用いて405nmでの光学濃度を5分間記録し、時間に対してプロットした。グラフの直線部分の勾配から初速度を計算した。
ホモジネートのタンパク質含有量についてコリンエステラーゼ活性を正規化した。相対的コリンエステラーゼ活性を、生理食塩水で治療されるラットの正規化コリンエステラーゼ活性に対する、対照化合物またはカルバモイルエステルで治療されるラットの正規化コリンエステラーゼ活性の比率として計算した。
これらのデータは、本発明の化合物の全身投与が、哺乳類の脳内の全コリンエステラーゼ活性の阻害をもたらすことを示す。カルバモイルエステルは、リバスチグミンと比較して、最小の副作用で脳内のコリンエステラーゼ活性の阻害の有意な増加をもたらした。それゆえ、本発明のカルバモイルエステルは、現在入手可能なコリンエステラーゼ阻害剤と比較してより少ない副作用で、コリンエステラーゼを阻害する方法において利用されうる。
実施例11:本発明の化合物のインビトロスクリーニング
様々な複合体についてのインビトロスクリーニングアッセイは、「Ellman GL et al., Biochem Pharmacol., 7:88-95 (1961)」および「Nadarajah B, J. Anal. Toxicol., 16:192-193 (1992)」に記載された方法に従って実施したが、その両方は全体として参照することにより本明細書に援用される。アッセイ方法は、下記に従って実施した:
様々な複合体についてのインビトロスクリーニングアッセイは、「Ellman GL et al., Biochem Pharmacol., 7:88-95 (1961)」および「Nadarajah B, J. Anal. Toxicol., 16:192-193 (1992)」に記載された方法に従って実施したが、その両方は全体として参照することにより本明細書に援用される。アッセイ方法は、下記に従って実施した:
実施例13:カルバモイルエステルによる低体温の誘導
コリン作動性アゴニストは、中枢作用機序を通じて低体温の原因となる(Freedman et al, 1989. Direct measurement of muscarinic agents in the central nervous system of mice using ex vivo binding. Eur. J. Pharmacol. 174:253-260)。低体温は、中枢作用性の用量およびインビボでのアセチルコリンエステラーゼ阻害剤の作用の持続時間を決定する方法として用いられうる(Rupniak et al, 1992. Reversal of cognitive impairment by heptyl physostigmine, a long-lasting cholinesterase inhibitor, in primates. J. Neurol. Sci. 107:246-249)。本発明は、カルバモイルエステルはアセチルコリンエステラーゼの阻害後にのみCNS内で共役アミンを遊離するであろうことを前提としているため、低体温の誘導はインビトロおよびインビボで検出されたアセチルコリンエステラーゼ阻害との有用な相関を提供する。
コリン作動性アゴニストは、中枢作用機序を通じて低体温の原因となる(Freedman et al, 1989. Direct measurement of muscarinic agents in the central nervous system of mice using ex vivo binding. Eur. J. Pharmacol. 174:253-260)。低体温は、中枢作用性の用量およびインビボでのアセチルコリンエステラーゼ阻害剤の作用の持続時間を決定する方法として用いられうる(Rupniak et al, 1992. Reversal of cognitive impairment by heptyl physostigmine, a long-lasting cholinesterase inhibitor, in primates. J. Neurol. Sci. 107:246-249)。本発明は、カルバモイルエステルはアセチルコリンエステラーゼの阻害後にのみCNS内で共役アミンを遊離するであろうことを前提としているため、低体温の誘導はインビトロおよびインビボで検出されたアセチルコリンエステラーゼ阻害との有用な相関を提供する。
リバスチグミンと同様に、カルバモイルエステル(化合物A、B、C、およびD)の皮下投与は、用量関連の体温低下をもたらした。低体温は、>0.5℃の温度低下として定義した。表A1は、各化合物についての最小有効量(MED)を示す。
実施例13:低体温の測定および用量範囲の決定、ならびにコリン作動性効果の時間経過
本発明の化合物についての低体温の誘導は、「Freedman, et al., European Journal of Pharmacology, 187 (1990), 193-199」に記載された方法に従って決定したが、該記載は参照することにより本明細書に援用される。低体温はAChE阻害剤についてのCNS浸透のマーカーである。
本発明の化合物についての低体温の誘導は、「Freedman, et al., European Journal of Pharmacology, 187 (1990), 193-199」に記載された方法に従って決定したが、該記載は参照することにより本明細書に援用される。低体温はAChE阻害剤についてのCNS浸透のマーカーである。
本発明の化合物のコリン作動性効果についての用量範囲および時間経過は、下記のように決定した。
対象:208匹のオスのCD IGS(スプラーグ・ドーリー由来)ラットに126〜150グラムを与え、実験の開始前約1週間、ケージ当たり4匹を維持し、規則的な明/暗周期(0600〜1800に明かりをつける)を与え、適宜食物および水を与えた。
装置:注射は、1mLツベルクリン注射器に25ゲージの5/8インチ針をつけて行った。観察は、5.5x10インチのポリカーボネートラットハウジングケージ内で行った。温度は、ラット直腸プローブでModel BAT−12電子体温計を用いて測定した。
化合物調製:試験化合物を、例えば0.9%生理食塩水に溶解した。低用量についての濃縮物は、より高い濃縮物から一定分量を取り、希釈することによって調製した。試験化合物が十分に可溶性である場合、注射容量は1mL/kgであった。可溶性が低い場合、最大注射容量は5mL/kgであった。投与経路は皮下注射であった。
サンプルプロトコールは下記の通りである:
含まれる治療群(N=3、生理食塩水については6)
生理食塩水
(S)−リバスチグミンを1、3、10、30、および100mg/kg
(R)−リバスチグミンを1、3、10、30、および100mg/kg
試験化合物は1、3、10、30、および100mg/kgで投与した
含まれる治療群(N=3、生理食塩水については6)
生理食塩水
(S)−リバスチグミンを1、3、10、30、および100mg/kg
(R)−リバスチグミンを1、3、10、30、および100mg/kg
試験化合物は1、3、10、30、および100mg/kgで投与した
手順:ラットをホームケージ内の試験室へ運んだ。ベースライン温度は、注射の直前に測定した。皮下注射後、ラットを観察ケージ内に置いた。注射後0.5、1、2、および4時間で、肉眼で見える兆候を簡単に観察し;唾液分泌について、欠如する、明らかにある、または多量である、としてスコア化し;直腸温度を測定した。唾液分泌スコアおよび温度はこの制約内で決定したが、最も顕著な肉眼で見える兆候のみに注目した。4時間後の観察点で、または苦悩の兆候が観察された場合はもっと早くに、ラットをCO2吸入によって安楽死させた。
データ分析:各時点での肉眼で見える兆候、唾液分泌スコア、および温度を検査のために表にした。
実施例18:カルバモイルエステルによる覚醒促進
特定の臨床状態は、運転などの日常生活の活動を行う能力を妨げうる眠気の予測不可能な発作によって特徴づけられる。例えば、ナルコレプシー、および交代勤務への適応などの概日リズムの妨害である。該状態について現在認可されている治療薬は、アンフェタミンおよびモダフィニルである。入手可能な治療薬の有意な限定は、リバウンド傾眠過剰および乱用の可能性を含む。
特定の臨床状態は、運転などの日常生活の活動を行う能力を妨げうる眠気の予測不可能な発作によって特徴づけられる。例えば、ナルコレプシー、および交代勤務への適応などの概日リズムの妨害である。該状態について現在認可されている治療薬は、アンフェタミンおよびモダフィニルである。入手可能な治療薬の有意な限定は、リバウンド傾眠過剰および乱用の可能性を含む。
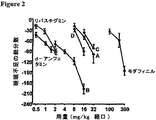
明かりをつけた5時間後、様々な用量範囲の試験化合物またはビヒクルをオスのウィスターラットに投与した(CT−5)。別々に隔離された記録チャンバー内で生存するラットから、治療前および後の30時間、EEG、EMG、自発運動活性、飲料関連および食物関連活性、ならびに体温を同時にモニターした。ハイプニオン社(Hypnion, Inc. (Lexington、MA))が商標権を持つリアルタイムハードウェアおよびソフトウェア技術であるSCORE2004(登録商標)を用いて、睡眠覚醒弁別を実施した。基準化合物、すなわちd−アンフェタミン、リバスチグミン、モダフィニル、と下記のカルバモイルエステル試験化合物との間で比較を行った:
d−アンフェタミンまたはモダフィニルの投与は、用量依存的様式にて覚醒の持続時間を増加させた(すなわち、睡眠不足の総分数を増加させた)。覚醒促進剤として認可されていないが、リバスチグミンも覚醒を増加させた(図2)。より高用量の基準化合物は、認容性のために試験をしなかった。同様に、カルバモイルエステルA、B、C、およびDは、覚醒の用量関連の増加をもたらした。これらの中で、化合物Bは、試験した基準化合物で見られた値を上回る予想外に長期の覚醒の増加をもたらした(図2)。
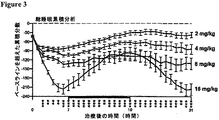
リバスチグミンと異なり、リバウンド傾眠過剰はカルバモイルエステルである化合物Bの投与後には観察されなかった(図3)。これは、カルバモイルエステルの成分であるスチグミンまたはアミンの既知の作用からは予想されなかった予想外の発見である。
カルバモイルエステルである化合物Bは、体温および自発運動活性へのその効果に関しても、他の予想外の様式にて基準化合物と異なっている。d−アンフェタミンと異なり、化合物Bは体温増加(高体温)をもたらさず、むしろ反対の体温減少(低体温;図4)をもたらした。
さらに、d−メタンフェタミンと異なり、化合物Bは運動高進をもたらさなかったが、これは刺激活性の欠如を示している(図5)。
化合物Bの精神刺激活性の欠如についてのさらなる証拠は、実施例19に示す。
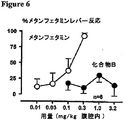
実施例19:薬物弁別パラダイムにおけるカルバモイルエステルの精神刺激薬様効果の欠如
薬物弁別は、薬物乱用傾向の評価を可能にするオペラントパラダイムである(Yasar & Bergman, 1994. Amphetamine-like effect of l-deprenyl (selegiline) in drug discrimination studies. Clin. Pharmacol. Therap. 56 (S78), 768-773)。このパラダイムにおいて、新規化合物の精神刺激特性は、メタンフェタミンを生理食塩水と弁別するように訓練されたラットにおいて決定されうる。空腹のラットを最初に試験装置内に置き、2つのレバーのいずれかを押すと固形飼料の送達をもたらすことを学習させる。一度レバー押しを確立すると、ラットはメタンフェタミンで前治療された場合、食物を得るために(例えば)左側のレバーを選択しなければならないということを学習する。他の日に、ラットをビヒクルで前治療すると、食物を得るために今度は反対のレバーを選択しなければならない。このように、ラットは、そのレバーの選択を導くために、精神刺激薬によって生まれる内受容性の手掛かりを用いることを学習しなければならない。一度所定の基準についてレバー押しを確立すると、試験化合物が投与されうる。この期間、いずれかのレバーを押すと食物をもたらすため、ラットがメタンフェタミンレバーを選択するのかそれとも生理食塩水レバーを選択するのかを調べる試験を可能にする。ラットがメタンフェタミンレバーを選択した場合、試験薬物が刺激汎化を示したという;すなわち、それはラットによってメタンフェタミン様であると認知されている。化合物Bの投与後(0.1〜3.2mg/kg 腹腔内、図6;または0.32〜10mg/kg 経口)、ラットはメタンフェタミンレバーを選択しなかったが、これは刺激汎化の欠如を示している。これらの発見は、化合物Bが精神刺激薬の乱用傾向を伴わずに覚醒促進活性を有しうることを示唆する。
薬物弁別は、薬物乱用傾向の評価を可能にするオペラントパラダイムである(Yasar & Bergman, 1994. Amphetamine-like effect of l-deprenyl (selegiline) in drug discrimination studies. Clin. Pharmacol. Therap. 56 (S78), 768-773)。このパラダイムにおいて、新規化合物の精神刺激特性は、メタンフェタミンを生理食塩水と弁別するように訓練されたラットにおいて決定されうる。空腹のラットを最初に試験装置内に置き、2つのレバーのいずれかを押すと固形飼料の送達をもたらすことを学習させる。一度レバー押しを確立すると、ラットはメタンフェタミンで前治療された場合、食物を得るために(例えば)左側のレバーを選択しなければならないということを学習する。他の日に、ラットをビヒクルで前治療すると、食物を得るために今度は反対のレバーを選択しなければならない。このように、ラットは、そのレバーの選択を導くために、精神刺激薬によって生まれる内受容性の手掛かりを用いることを学習しなければならない。一度所定の基準についてレバー押しを確立すると、試験化合物が投与されうる。この期間、いずれかのレバーを押すと食物をもたらすため、ラットがメタンフェタミンレバーを選択するのかそれとも生理食塩水レバーを選択するのかを調べる試験を可能にする。ラットがメタンフェタミンレバーを選択した場合、試験薬物が刺激汎化を示したという;すなわち、それはラットによってメタンフェタミン様であると認知されている。化合物Bの投与後(0.1〜3.2mg/kg 腹腔内、図6;または0.32〜10mg/kg 経口)、ラットはメタンフェタミンレバーを選択しなかったが、これは刺激汎化の欠如を示している。これらの発見は、化合物Bが精神刺激薬の乱用傾向を伴わずに覚醒促進活性を有しうることを示唆する。
均等物
本発明はその好ましい実施態様を参照して詳細に示され、記載されてきたが、添付の特許請求の範囲に含まれる本発明の範囲から逸脱することなく、形式および詳細において様々な変更がその中になされてよいことは当業者であれば理解できるであろう。
本発明はその好ましい実施態様を参照して詳細に示され、記載されてきたが、添付の特許請求の範囲に含まれる本発明の範囲から逸脱することなく、形式および詳細において様々な変更がその中になされてよいことは当業者であれば理解できるであろう。
Claims (51)
- 式:
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換であり;
R3は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R4は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択される]
を有する化合物またはその医薬的に許容される塩を個体へ投与することを含む、個体における覚醒を促進する方法。 - R3、R4、およびR5の少なくとも1つが非置換アルキルである化合物またはその塩を含む、請求項1の方法。
- 非置換アルキルがメチルである化合物またはその塩を含む、請求項1〜2のいずれか1項の方法。
- R3が結合している立体中心の立体配置がS立体配置である化合物またはその塩を含む、請求項1〜3のいずれか1項の方法。
- R3が結合している立体中心の立体配置がR立体配置である化合物またはその塩を含む、請求項1〜3のいずれか1項の方法。
- R1が水素である化合物またはその塩を含む、請求項1〜5のいずれか1項の方法。
- R1が非置換アルキルである化合物またはその塩を含む、請求項1〜5のいずれか1項の方法。
- R1が置換アルキルである化合物またはその塩を含む、請求項1〜5のいずれか1項の方法。
- R1およびR2が、それらが結合している窒素原子と一緒になって5または6員環を形成している化合物またはその塩を含む、請求項1〜5のいずれか1項の方法。
- 6員環が少なくとも1つの置換基で置換されている化合物またはその塩を含む、請求項9の方法。
- 6員環がピペリジンおよびピペラジンからなる群から選択される化合物またはその塩を含む、請求項9〜10のいずれか1項の方法。
- 6員環が2位で置換されている化合物またはその塩を含む、請求項9〜11のいずれか1項の方法。
- 6員環が4位で置換されている化合物またはその塩を含む、請求項9〜11のいずれか1項の方法。
- R2がアラルキル、シクロアルキル、アルキル、およびヘテロアラルキルからなる群から選択され、さらにR2が任意に置換されている化合物またはその塩を含む、請求項1〜8のいずれか1項の方法。
- アラルキル、アルキル、およびヘテロアラルキルのアルキル部分が炭素原子2個の長さを有する化合物またはその塩を含む、請求項15の方法。
- R2が置換アルキル、非置換アルキル、置換シクロアルキル、非置換シクロアルキル、置換アリール、非置換アリール、置換三環式環、非置換三環式環、置換アルケニル三環式環、非置換アルケニル三環式環、非置換アリールオキシ、置換アリールオキシ、非置換オキシム、および置換オキシムで置換されている化合物またはその塩を含む、請求項15の方法。
- R2が置換アラルキルである化合物またはその塩を含む、請求項15の方法。
- アラルキルが非置換アルキルおよび置換フェノキシからなる群で置換されている化合物またはその塩を含む、請求項18の方法。
- R2が置換アルキルである化合物またはその塩を含む、請求項15の方法。
- アルキルが非置換アルキル、非置換シクロアルキル、非置換三環式環、非置換アルケニル三環式環、非置換オキシム、および置換オキシムからなる群で置換されている化合物またはその塩を含む、請求項20の方法。
- R2が置換シクロアルキルである化合物またはその塩を含む、請求項15の方法。
- シクロアルキルがアリールで置換されている化合物またはその塩を含む、請求項22の方法。
- R2が置換ヘテロアラルキルである化合物またはその塩を含む、請求項15の方法。
- ヘテロアラルキルのアルキル部分がアリールオキシで置換されている化合物またはその塩を含む、請求項24の方法。
- 第1表の化合物またはその塩を個体へ投与することを含む、個体における覚醒を促進する方法。
- 式:
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換である]
を有する化合物またはその塩を個体へ投与することを含む、個体における覚醒を促進する方法。 - 式:
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R6は非置換アリール、置換アリール、非置換シクロアルキル、置換シクロアルキル、非置換三環式環、および置換三環式環からなる群から選択され;
R7は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R8は水素、非置換アルキル、置換アルキル、置換アリールオキシ、非置換アリールオキシからなる群から選択され;
sは0または1であり;
tは0または1であるが、ただしsとtの両方が0ということはない;
-----は欠如しているか、またはそのすぐ上に示している結合と一緒になって二重結合を形成する]
を有する化合物またはその塩を個体へ投与することを含む、個体における覚醒を促進する方法。 - 化合物または医薬的に許容される塩が、医薬的に許容される担体を含む医薬組成物として投与される、請求項1〜29のいずれか1項の方法。
- 個体が覚醒障害、過眠症、睡眠時無呼吸、中枢性の睡眠障害、疲労、ナルコレプシーと関連する日中の過剰な眠気、うつ病性障害または抗うつ薬治療と関連する疲労および過剰な眠気から選択される障害または状態を患う、請求項1〜30のいずれか1項の方法。
- 覚醒障害、過眠症、睡眠時無呼吸、中枢性の睡眠障害、疲労、ナルコレプシーと関連する日中の過剰な眠気、うつ病性障害または抗うつ薬治療と関連する疲労および過剰な眠気から選択される障害または状態について個体を治療するための、請求項1〜31のいずれか1項の方法。
- 覚醒障害または状態が概日リズム障害および多発性硬化症と関連する疲労から選択される、請求項32の方法。
- 概日リズム障害が交代勤務睡眠障害、睡眠時無呼吸、盲目の個体における脱同期化障害、時間帯域変化症候群、交代勤務睡眠障害、不規則睡眠パターン、睡眠相遅延症候群(delayed sleep syndrome)、および睡眠相前進症候群(advanced sleep syndrome)から選択される、請求項33の方法。
- 概日リズム障害が交代勤務睡眠障害、睡眠時無呼吸、および盲目の個体における脱同期化障害から選択される、請求項33の方法。
- 個体がCPAPで睡眠時無呼吸の治療をされる、請求項34〜35のいずれか1項の覚醒を促進する方法。
- 式:
R1は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R2は置換アルキル、非置換アラルキル、置換アラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換ヘテロアラルキル、置換ヘテロアラルキル、非置換アリール、置換アリール、非置換ヘテロアリール、置換ヘテロアリール、非置換シクロアルキル、置換シクロアルキル、非置換ヘテロシクロアルキルおよび置換ヘテロシクロアルキルからなる群から選択され;
またはR1およびR2はそれらが結合している窒素原子と一緒になって、5もしくは6員環を形成し、さらに該環は置換もしくは非置換であり;
R3は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R4は水素、非置換アルキル、および置換アルキルからなる群から選択され;
R5は水素、非置換アルキル、および置換アルキルからなる群から選択される]
を有する化合物またはその医薬的に許容される塩を個体へ投与することを含む、個体において覚醒を増強し、または睡眠リズムの規則性を増大させる方法。 - 化合物またはその医薬的に許容される塩が乱用の可能性を減少させる、請求項1〜37のいずれか1項の方法。
- 化合物または医薬的に許容される塩の投与後、個体において精神刺激薬様効果が観察されない、請求項1〜38のいずれか1項の方法。
- 化合物またはその医薬的に許容される塩が用量を制限する副作用を有する、請求項1〜39のいずれか1項の方法。
- 副作用が悪心である、請求項40の方法。
- 化合物またはその医薬的に許容される塩が、経腸的に、非経口的に、経口的に、または筋肉内に投与される、請求項1〜41のいずれかの方法。
- 化合物がブチリルコリンエステラーゼよりもアセチルコリンエステラーゼを選択的に阻害する、請求項1〜42のいずれか1項の方法。
- 化合物または医薬的に許容される塩の投与が個体におけるリバウンド傾眠過剰の原因とならない、請求項1〜43のいずれか1項の方法。
- 化合物またはその医薬的に許容される塩の投与が個体における高体温の原因とならない、請求項1〜44のいずれか1項の方法。
- 化合物またはその医薬的に許容される塩の投与が個体における低体温の原因となる、請求項1〜45のいずれか1項の方法。
- 化合物または医薬的に許容される塩の投与が運動高進の原因とならない、請求項1〜46のいずれか1項の方法。
- 化合物または医薬的に許容される塩の最小有効量(MED)が経口で≦8mg/kgである、請求項1〜47のいずれか1項の方法。
- 請求項1〜48のいずれか1項の方法を実施するためのキット。
- 個体における覚醒を促進する薬剤の製造における、第1表の化合物またはその塩の使用。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US96120707P | 2007-07-18 | 2007-07-18 | |
| PCT/US2008/008773 WO2009011901A2 (en) | 2007-07-18 | 2008-07-18 | Methods for promoting wakefulness |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010533717A true JP2010533717A (ja) | 2010-10-28 |
| JP2010533717A5 JP2010533717A5 (ja) | 2011-09-01 |
Family
ID=39832375
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010517021A Withdrawn JP2010533717A (ja) | 2007-07-18 | 2008-07-18 | 覚醒を促進する方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20090048229A1 (ja) |
| EP (1) | EP2182938A2 (ja) |
| JP (1) | JP2010533717A (ja) |
| CN (1) | CN101795683A (ja) |
| AU (1) | AU2008276459A1 (ja) |
| CA (1) | CA2693110A1 (ja) |
| WO (1) | WO2009011901A2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018076359A (ja) * | 2011-07-28 | 2018-05-17 | ケムファーム・インコーポレーテッド | メチルフェニデート−プロドラッグ、その製造法及び使用法 |
| WO2019112007A1 (ja) * | 2017-12-07 | 2019-06-13 | 国立大学法人 筑波大学 | 鎮痛薬による眠気の予防または治療薬 |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2677241A1 (en) | 2007-02-02 | 2008-08-14 | Colucid Pharmaceuticals, Inc. | Compounds that inhibit cholinesterase |
| AU2010232496A1 (en) * | 2009-04-02 | 2011-11-24 | Colucid Pharmaceuticals, Inc. | Compositions of cholinesterase inhibitors |
| ES2545836B1 (es) * | 2014-03-13 | 2016-07-07 | Elaborados Castellano, S.L. | Composición potenciadora de vigilia, y usos de la misma |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3600427A (en) * | 1967-05-08 | 1971-08-17 | Anthony J Verbiscar | Phenyl carbamate latentiated phenethylamines |
| IL74497A (en) * | 1985-03-05 | 1990-02-09 | Proterra Ag | Pharmaceutical compositions containing phenyl carbamate derivatives and certain phenyl carbamate derivatives |
| US4791107A (en) * | 1986-07-16 | 1988-12-13 | Hoechst-Roussel Pharmaceuticals, Inc. | Memory enhancing and analgesic 1,2,3,3A,8,8A-hexahydro-3A,8 (and) 1,3A,8)-di(and tri)methylpyrrolo(2,3-B)indoles, compositions and use |
| NL195004C (nl) * | 1987-03-04 | 2003-11-04 | Novartis Ag | Fenylcarbamaat bevattend farmaceutisch preparaat. |
| US5187165A (en) * | 1987-05-15 | 1993-02-16 | Hoechst-Roussel Pharmaceuticals Inc. | Memory enhancing and analgesic 1,2,3a,8,8a-hexahydro-3a,8(and 1,3a,8)-di(and tri)methylpyrrolo[2,3-b]indoles |
| IT1251166B (it) * | 1991-08-09 | 1995-05-04 | Chiesi Farma Spa | Derivati di geneserina,loro preparazione e composizioni farmaceutiche che li contengono |
| US5302721A (en) * | 1992-07-21 | 1994-04-12 | Hoechst-Roussel Pharmaceuticals Incorporated | Method of preparation of physostigmine carbamate derivatives from eseretholes |
| US5409948A (en) * | 1992-11-23 | 1995-04-25 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Method for treating cognitive disorders with phenserine |
| SE9504537D0 (sv) * | 1995-12-19 | 1995-12-19 | Jan Hedner | Sätt att behandla och diagnosticera andningsstörningar under sömn och medel för utförande av sättet |
| US5665880A (en) * | 1996-10-31 | 1997-09-09 | Hoechst Marion Roussel, Inc. | Method of preparation of physostigmine carbamate derivatives from eseretholes |
| US5677457A (en) * | 1996-12-19 | 1997-10-14 | Hoechst Marion Roussel, Inc. | Method of preparation of physostigmine carbamate derivatives from eseroline ethers |
| SI0949920T1 (sl) * | 1997-07-09 | 2006-10-31 | Axonyx | Visoko selektivni butirilholinesterazni inhibitorji za zdravljenje in diagnozo Alzheimerjeve bolezni in demenc |
| SE9803760D0 (sv) * | 1998-11-04 | 1998-11-04 | Jan Hedner | Sätt att behandla och diagnostisera syndromet restless legs och motsvarande medel |
| AU2003298514A1 (en) * | 2002-05-17 | 2004-05-04 | Eisai Co., Ltd. | Methods and compositions using cholinesterase inhibitors |
| WO2005016327A2 (en) * | 2003-08-13 | 2005-02-24 | Janssen Pharmaceutica, N.V. | Treatment of sleep disorders with cholinesterase inhibitors |
| US7795307B2 (en) * | 2003-10-21 | 2010-09-14 | Colucid Pharmaceuticals, Inc. | Carbamoyl esters that inhibit cholinesterase and release pharmacologically active agents |
| CA2677241A1 (en) * | 2007-02-02 | 2008-08-14 | Colucid Pharmaceuticals, Inc. | Compounds that inhibit cholinesterase |
| WO2008137923A2 (en) * | 2007-05-07 | 2008-11-13 | Chelsea Therapeutics, Inc. | Droxidopa and pharmaceutical composition thereof for the treatment of mood disorders, sleep disorders, or attention deficit disorders |
-
2008
- 2008-07-18 JP JP2010517021A patent/JP2010533717A/ja not_active Withdrawn
- 2008-07-18 WO PCT/US2008/008773 patent/WO2009011901A2/en active Application Filing
- 2008-07-18 CN CN200880105586A patent/CN101795683A/zh active Pending
- 2008-07-18 US US12/218,813 patent/US20090048229A1/en not_active Abandoned
- 2008-07-18 CA CA2693110A patent/CA2693110A1/en not_active Abandoned
- 2008-07-18 AU AU2008276459A patent/AU2008276459A1/en not_active Abandoned
- 2008-07-18 EP EP08780244A patent/EP2182938A2/en not_active Withdrawn
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018076359A (ja) * | 2011-07-28 | 2018-05-17 | ケムファーム・インコーポレーテッド | メチルフェニデート−プロドラッグ、その製造法及び使用法 |
| WO2019112007A1 (ja) * | 2017-12-07 | 2019-06-13 | 国立大学法人 筑波大学 | 鎮痛薬による眠気の予防または治療薬 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2693110A1 (en) | 2009-01-22 |
| AU2008276459A1 (en) | 2009-01-22 |
| WO2009011901A3 (en) | 2009-03-26 |
| CN101795683A (zh) | 2010-08-04 |
| WO2009011901A2 (en) | 2009-01-22 |
| EP2182938A2 (en) | 2010-05-12 |
| US20090048229A1 (en) | 2009-02-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11753368B2 (en) | Treatment of sleep-wake disorders | |
| JP4676961B2 (ja) | コリンエステラーゼを阻害し、薬理活性物質を放出するカルバモイルエステル類 | |
| JP5253737B2 (ja) | D3アゴニスト性治療薬としての(s)−2−n−プロピルアミノ−5−ヒドロキシテトラリン | |
| KR101754045B1 (ko) | 항코넥신제로서의 플레카이니드의 용도 및 향정신 약물 효과를 증강시키는 방법 | |
| TW200845959A (en) | Use of prodrugs of GABA analogs for treating diseases | |
| TW200924748A (en) | Masked carboxylate neopentyl sulfonyl ester cyclization release prodrugs of acamprosate, compositions thereof, and methods of use | |
| JP2014062108A (ja) | モノアミン再取り込み阻害薬としてのフェニル置換シクロアルキルアミン | |
| CN112930175A (zh) | 治疗癫痫的方法 | |
| JP2010533717A (ja) | 覚醒を促進する方法 | |
| JP2001525390A (ja) | 抗痙攣薬および中枢神経系活性ビス(フルオロフェニル)アルキルアミド類 | |
| KR20210014164A (ko) | 히스타민-3 수용체 역작용제에 의한 치료 방법 | |
| US20100256229A1 (en) | Compositions of cholinesterase inhibitors | |
| WO2023028092A2 (en) | Fluorinated empathogens | |
| CA2730596A1 (en) | Stigmine conjugates for substance use disorders |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110715 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110715 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20120425 |