JP2010533705A - 抗菌ペプチドまたはその阻害剤を用いた疾病治療 - Google Patents
抗菌ペプチドまたはその阻害剤を用いた疾病治療 Download PDFInfo
- Publication number
- JP2010533705A JP2010533705A JP2010516648A JP2010516648A JP2010533705A JP 2010533705 A JP2010533705 A JP 2010533705A JP 2010516648 A JP2010516648 A JP 2010516648A JP 2010516648 A JP2010516648 A JP 2010516648A JP 2010533705 A JP2010533705 A JP 2010533705A
- Authority
- JP
- Japan
- Prior art keywords
- cathelicidin
- disease
- use according
- peptide
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- A61K38/1729—Cationic antimicrobial peptides, e.g. defensins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
- A61P31/06—Antibacterial agents for tuberculosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
【選択図】 図1
Description
抗菌ペプチド(AMP)は単独で、あるいは多数の抗菌ペプチド(AMP)が組み合わさった結果のいずれかで、効力を発揮する。
記載された好適な実施形態のさらなる特徴によれば、被験体に複数回投与では約2.4時投与の間隔で、2〜30回、約30日まで行う投与の医薬組成物を同定する。
本明細書で用いられる「抗菌ペプチド(AMP)」という用語は、いかなるカテリシジンも含まれ、そして/または当該分子の自然発生変異体、当該自然突然変異体/多型変異体/当該分子の対立遺伝子、または当該分子のいかなる合成変異体なども含まれる。本明細書で用いられる「抗菌ペプチド様分子(AML)」という用語は、カテリシジンの生物活性にかなり類似している生物活性を保有するいかなる分子も含まれ、カテリシジンの生物活性を大いに促進するいかなる分子を含まれ、そして/または、構造的にカテリシジンとの相同性の高いいかなる分子も含まれる。そのような場合に、定義される相同性は、0% から 60%まで、60% から 70%まで、70% から80%まで、 80% から 90%まで、90% から99%までの間で区分できる。
本明細書で用いられるドミナントネガティブ突然変異体とは、天然ペプチドの生物活性および/または薬理活性に要する活性点でアミノ酸残基位置を変更する位置で、対応する野生型天然バージョンと相対的な、配列に少なくとも1つの位置に関して変化したポリペプチドまたはコーディング領域の配列のことを言う。従って、下に挙げている、あるいはここで想定するドミナントネガティブ突然変異体もしくはカテリシジンペプチド断片は、AMPまたはカテリシジンペプチドの 少なくとも1つのアミノ酸に関して変更(置き換えもしくは/あるいは削除)を示すポリペプチド種を含むが、これらに限定されない。 さらに、本発明のドミナントネガティブ突然変異体の実施例は、ペプチドをコード化する核酸、またはペプチド自体である。また、それはAMP断片、またはカテリシジン hCAP-18 の断片から成り、(SEQ. ID. NOs:1-58)に記載されている。
SEQID1:fdiscdkdnkrfallgdffrkskekigkefkrivqrikdflrnlvprtes, SEQID2:discdkdnkrfallg dffrkskekigkefkrivqrikdflrnlvprtes SEQID3:Iscdkdnkrfallgdffrkskekigkefkrivqrikd flrnlvprtes, SEQ ID 4:Scdkdnkrfallgdffrkskekig kefkrivqrikdflrnlvprtes, SEQ ID 5:
Cdkdnkrfallgdffrkskekigkefkrivqrikdflrnlvprtes SEQ ID 6:Dkdnkrfallgdffrkskekig kefkrivqrikdflrnlvprtes, SEQ ID 7:kdnkrfallgdffrkskekigkefkrivqrikdflrnlvprtes,
SEQ ID 8:dnkrfallgdffrkskekigkefkrivqrikdflrnlvprtes, SEQ ID 9:nkrfallgdffrk skekig kefkrivqrikdflrnlvprtes, SEQ ID 10:krfallgdffrkskekigkefkrivqrikdflrnlvprtes,
SEQ ID 11:rfallgdffrkskekigkefkrivqrikdflrnlvprtes, SEQ ID 12:fallgdffrkskekig kefkrivqrikdflrnlvprtes, SEQ ID 13:allgdffrkskekigkefkrivqrikdflrnlvprtes, SEQ ID 14:llgdffrkskekigkefkrivqrikdflrnlvprtes, SEQ ID 15:lgdffrkskekigkefkrivqrikdflrn
lvprtes, SEQ ID 16:gdffrkskekigkefkrivqrikdflrnlvprtes, SEQ ID 17:dffrkskekigk
efkrivqrikdflrnlvprtes, SEQ ID 18:ffrkskekigkefkrivqrikdflrnlvprtes, SEQ ID 19:frkskekigkefkrivqrikdflrnlvprtes, SEQ ID 20:rkskekigkefkrivqrikdflrnlvprtes, SEQ ID 21:kskekigkefkrivqrikdflrnlvprtes, SEQ ID 22:skekigkefkrivqrikdflrnlvprtes, SEQ ID 23:llgdffrkskekigkefkrivqrikdflrnlvprte, SEQ ID 24:llgdffrkskekigkefkri
vqrikdflrnlvprt, SEQ ID 25:llgdffrkskekigkefkrivqrikdflrnlvpr, SEQ ID 26:llgdffrkskekigkefkrivqrikdflrnlvp, SEQ ID 27:llgdffrkskekigkefkrivqrikdflrnlv, SEQ ID 28:llgdffrkskekigkefkrivqrikdflrnl, SEQ ID 29:llgdffrkskekIgkefkrivqrikdflrn, SEQ ID 30:llgdffrkskekigkefkrivqrikdflr,SEQ ID 31:llgdffrkskekigkefkrivqrikdfl, SEQ ID 32:llgdffrkskekigkefkrivqrikdf, SEQ ID 33:llgdffrkskekigkefkrivqrikd,SEQ ID 34:llgdffrkskekigkefkrivqrik,SEQ ID 35:llgdffrkskekigkefkrivqri, SEQ ID 36:llgdffrkskekigkefkrivqr, SEQ ID 37:llgdffrkskekigkefkrivq, SEQ ID 38:llgdffrkskekigkefkriv, SEQ ID 39:llgdffrkskekigkefkri, SEQ ID 40:efkriv, SEQ ID 41:kefkrivq, SEQ ID 42:gkefkrivqr, SEQ ID 43:igkefkrivqri, SEQ ID 44:kigkefkrivqrik, SEQ ID 45:ekigkefkrivqrikd, SEQ ID 46:kekigkefkrivqrikdf, SEQ ID 47:skekigkefkrivqrikdfl, SEQ ID 48:skekigkefkrivqrikdflrnlvprtes, SEQ ID 48:kskekigkefkrivqrikdflr, SEQ ID 50:rkskekigkefkrivqrikdflrn, SEQ ID 51:frkskekigkefkrivqrikdflrnl, SEQ ID 52:ffrkskekigkefkrivqrikdflrnlv, SEQ ID 53:dffrkskekigkefkrivqrikdflrnlvp, SEQ ID 54:gdffrkskekigkefkrivqrikdflrnlvpr, SEQ ID 55:lgdffrkskekigkefkrivqrikdflrnlvprt.
RL-37:RLGNFFRKVKEKIGGGLKKVGQKIKDFLGNLVPRTAS アカゲザル(Rhesus monkey), CAP18:GLRKRLRKFRNKIKEKLKKIGQKIQGLLPKLAPRTDY ウサギ(Rabbit)、 CRAMP:GLLRKGGEKIGEKLKKIGQKIKNFFQKLVPQPE マウス(Mouse), rCRAMP:GLVRKGGEKFGEKLRKIGQKIKEFFQKLALEIEQ ラット(rat), CAP11:(GLRKKFRKTRKRIQKLGRKIGKTGRKVWKAWREYGQIPYPCRI) Guinea,
イヌ(Canine) cath:KKIDRLKELITTGGQKIGEKIRRIGQRIKDFFKNLQPREEKS,
Bac5:RFRPPIRRPPIRPPFYPPFRPPIRPPIFPPIRPPFRPPLGPFP-NH2 ウシ(Cow),
Bac7:RRIRPRPPRLPRPRPRPLPFPRPGPRPIPRPLPFPRPGPRPIPRPLPFPRPGPRPIPRPL ウシ(Cow),BMAP-27:GRFKRFRKKFKKLFKKLSPVIPLLHL-NH2 ウシ(Cow),
BMAP-28:GGLRSLGRKILRAWKKYGPIIVPIIRI-NH2ウシ(Cow),
BMAP-34:GLFRRLRDSIRRGQQKILEKARRIGERIKDIFR-NH2 ウシ(Cow),
Indolicidin(インドリシジン):ILPWKWPWWPWRR-NH2 ウシ(Cow), ドデカペプチド(Dodecapeptide):RLCRIVVIRVCR ウシ(Cow), Water buffalo cath GLPWILLRWLFFR-NH2 Water buffalo, OADode:RYCRIIFLRVCR ヒツジ(Sheep), SMAP-29:RGLRRLGRKIAHGVKKYGPTVLRIIRIA-NH2 ヒツジ(Sheep), SMAP-34:GLFGRLRDSLQRGGQKILEKAERIWCKIKDIFR-NH2 ヒツジ(Sheep), OaBac5 RFRPPIRRPPIRPPFRPPFRPPVRPPIRPPFRPPFRPPIGPFP-NH2 ヒツジ(Sheep), OaBac6:RRLRPRHQHFPSERPWPKPLPLPLPRPGPRPWPKPLPLPL
PRPGLRPWPKPL ヒツジ(Sheep),OaBac7.5:RRLRPRRPRLPRPRPRPRPRPRSLPLPRPQP
RRIPRPILLPWRPPRPIPRPQIQPIPRWLヒツジ(Sheep),OaBac11:RRLRPRRPRL
PRPRPRPRPRPRSLPLPRPKPRPIPRPLPLPRPRPKPIPRPLPLPRPRPRRIPRPLPLPRPRPRPIPRPLPLPQPQPSPIPRPLヒツジ(Sheep), ChBac5:RFRPPIRRPPIRPPFNPPFRPP
VRPPFRPPFRPPFRPPIGPFP-NH2Goat,eCATH-1:LAKSFLRMRILLPRRKILLAS, eCATH-2:KRRHWFPLSFQEFLEQLRRFRDQLPFP ウマ(Horse), eCATH-3 KRFHSVGSLIQRHQQMIRDKSEATRHGIRIITRPKLLLAS, PR-39:RRRPRPPYLPRPRPPPFFPPRLPPRIPPGFPPRFPPRFP-NH2, ブタ(Pig), AFPPPN
VPGPRFPPPNFPGPRFPPPNFPGPRFPPPNFPGPRFPPPNFPGPPFPPPIFPGPWFPPPPPFRPPPFGPPRFP- NH2 ブタ(Pig), Prophenin-2:AFPPPNVPGPRFPPPNVPG
PRFPPPNFPGPRFPPPNFPGPRFPPPNFPGPPFPPPIFPGPWFPPPPPFRPPPFGPPRFP- NH2 ブタ(Pig), Protegrin-1:RGGRLCYCRRRFCVCVGR-NH2 Pig, RGGRLCYCRRRFCICV-NH2 ブタ(Pig), Protegrin-3:RGGGLCYCRRRFCVCVGR-NH2 ブタ(Pig) ,Protegrin-4:RGGGLCYCRRRFCVCVGR-NH2 ブタ(Pig) ,Protegrin-5:RGGRLCYCRPRFCVCVGR-NH2,ブタ(Pig),PMAP-23:RIIDLLWRVRRPQK
PKFVTVWVR ブタ(Pig), PMAP-36:GRFRRLRKKTRKRLKKIGKVLKWIPPIV
GSIPLGC-NH2ブタ(Pig), PMAP-37:GLLSRLRDFLSDRGRRLGEKIERIGQKIKDL
SEFFQS chCATH-B1:(Proc Natl Acad Sci U S A. 2007 Sep 18;104(38):15063-8) chicken,Canine cathelicidin (K9CATH):(Dev Comp Immunol.2007;31(12):1278-96),Fowlicidin-3:(FEBS J. 2007 Jan;274(2):418-28.), (J Biol Chem.2006 Feb 3;281(5):2858-67), (Immunogenetics.2004 Jun;56(3):170-7.) chicken,CMAP27:(Vet Immunol Immunopathol.2005 Jul 15;106(3-4):321-7),
Fish (cathelicidin from Atlantic cod and Atlantic salmon) Maier VH et al.Mol Immunol. 2008 Jul 7.
ペプチドのLPS (リポ多糖体)中和作用の促進や向炎症性活性の低下についても記載されている。当該ペプチド、例えば、18-mer LLKKK または GKE および P60、P60.4、 P60.4-Ac、CAP11 (11 kDaのカチオン性抗菌ポリペプチド(cationic antibacterial polypeptide) )、CAP18、GSLL-39、SMAP-29や、当該ペプチドの発見方法については、非特許文献1に記載されている
さらに、本書で上述し特許請求の範囲に記載する本発明の様々な実施形態および態様の各実験による裏付けが、以下の実施例に見出される。
次に挙げる実施例内の全動物実験は、エルサレム動物管理倫理委員会のヘブライ大学(EAEモデル、肥満モデル、インスリン抵抗性および歯周炎モデル)と米国テネシー大学(CIAモデルおよび骨粗鬆症モデルいずれかが認可したガイドラインの下で施行された。
本発明者らはcathelicidin(カテリシジン)を調整することで関節炎などの疾患に使用できると仮定する。本発明の実施化のために、関節リウマチ、シェーグレン症および強皮症、皮膚筋炎、全身性エリテマトーデス、サルコイドーシスなどの炎症または自己免疫に関連するヒト疾患のコラーゲン誘導関節炎マウスモデルの最適治療として、34a.a.カテリシジン(mCRAMP) (GLLRKGGEKIGEKLKKIGQKIKNFFQKLVPQPEQを使用する方法を下記のように初めて立証しており、それによって先行技術の制限を克服した。
この生体内(in-vivo)実験は、 コラーゲン誘導関節炎マウスモデルを使用する。
抗菌ペプチド (AMPs):マウスカテリシジン mCRAMP 34a.a.用合成ペプチドを、バイオサイト株式会社(Biosight Ltd) (イスラエル)から購入した。 Chick native CII (Sigma (シグマ社)または Chondrex(コンドレックス社)から購入)、 a1(II) 鎖 または CIIの CB11断片。酢酸10 mM 、0.2-umフィルター でろ過したフロイント不完全アジュバント(FIA、例、 Difco社)。 ヒト型結核菌(Mycobacterium tuberculosis) (菌株H37Ra; 熱殺菌済み; 農漁業食糧省(Ministry of Agriculture ,Fisheries, and Food)、中央獣医学研究所 (Central Veterinary Laboratory)( 住所:英国のウェーブリッジ、サリー)に依頼し入手した)。DBA/1JLacJ マウス (ジャクソンラボ(Jackson-Labs) )
方法:本モデルのプロトコルは公表文献 Nature Protocols (ネイチャープロトコル誌)に記載している(Brand DD et al.2007;2(5):1269-75). 雄9‐11週齢DBA/マウス 9-11を一時的にこれらの施設で使用した。マウスを実験群と、対照群の2群に分け、Mycobacterium butyricum の加熱死菌4 mg/mlに補充したフロイント完全アジュバントと乳化したウシCII 100 μg含有液 50 μl を全マウスの尾底部に免疫付与した。マウスを免疫付与する間、イソフルラン吸入麻酔を行なった。免疫付与日と同じ日に、マウスはまた、対照群にビークル(150mM)または、実験群に実験用ペプチドを1.5mg/kgの濃度で投与した。免疫処置後から2日間および4日間は、1.0 mg/kgまで投与量を削減。7日目から、72日目まで0.8 mg/kgの投与量で 投与した。全治療は、月曜日、水曜日、金曜日の週3回で行われ、各治療で投与部位を交代させながら、ペプチドまたは対照群にビークル(vehicle)を腹腔内投与した。実験開始時に全マウスの体重を測定し、投与量を算出した。マウスは0、21,46日目に、体重測定を行った。46日目に体重を測定した(平均 1.6グラム増) 。体重に応じて投与量を調節した。
本実験で、各群10匹の両群のマウス(治療群10匹、対照群11匹)を比較検討した。治療群に週3回、mCRAMP (0.8mg/Kg)を腹腔内投与し、対照群にも同様に同じ日に治療群と並行して 生理食塩水を投与した。
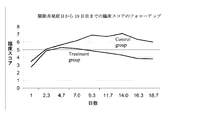
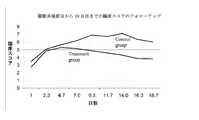
統計分析の結果 :関節炎の進行において治療群と対照群の間に著しい有意差が認められた (p=0.0037)。(1日目の発症から19日目の発症まで測定された重症度スコアの平均値の差から求めたt検定で有意差がみられた)。
関節炎発生率-対照群では、自己免疫性関節炎の進行速度および発症率が、DBA/1マウスよりも高かった。対照群は44日目までに発症率が100%に達した。それに対し、治療群(ペプチド投与)の発症率は対照群より若干低く、関節炎進行速度も遅いように思われる。同様に、治療群のマウス1匹当たりの患肢数は、95%信頼区間で示すと対照群よりも有意に低かった。
関節炎の重症度−関節炎の重症度は(上記のように配点した)炎症度および患肢数に基づいて分析した。下記の図に見られるように、マウス1匹あたりの重症度スコアの平均値を分析すると、2群間に有意差が認められた。これらのデータで、関節炎発症率の差はいく分認められるが、重症度の差は、関節炎発症率以上に明確に認められる。
CIA(コラーゲン誘導関節炎)には通常体重減少が認められ、疾病重症度の判断因子となる。 対照群は治療群より体重が増えていなかった。ゆえに、21日目から46日目までの体重を比較し、マン・ホイットニー有意検定で、46日目の体重を21日目の体重で割って算出した2群間(対照群対治療群)の重量にわずかに有意差がみられた (P < 0.05, 両側検定).対照群の平均の(21日目から46日目まで)体重増加量は、2.1%で、治療群の方は5.4%であった。
関節炎肢の重症度および発症率の結果および統計的分析については図1〜6に示されている。
例 2
多発性硬化症 (MS)は未知の病因である中枢神経系(CNS) の 免疫介在性脱髄疾患である。本実験でのカテリシジンの投与形態は、注射 (IP)であった。
材料および方法: C57BL/6マウスによるミエリンタンパク質 (MOG)-ペプチド誘導性EAEのプロトコル
実験的自己免疫性脳脊髄炎(EAE)スコア :実験的自己免疫性脳脊髄炎(EAE)を0から6までの7段階で評価した:0, 機能障害は認められない; 1,尻尾を引きずる; 2,尻尾を引きずり、後肢不全麻痺が認められる; 3,1度以上の後肢完全麻痺が認められる; 4,後肢全体および背部に完全麻痺が認められる; 5, 背部に完全麻痺および前肢不全麻痺が認められる; 6, 死亡.
実験的自己免疫性脳脊髄炎(EAE)治療 :イスラエル、カルミエルにあるバイオサイト社(Biosight Ltd)から購入した配列:GLLRKGGEKIGEKLKKIGQKIKNFFQKLVPQPEQのカテリシジンペプチドのPBS希釈液を治療群に、PBSを対照群に、それぞれマウスに投与した。カテリシジンを無菌PBSで希釈し、一回の使用分を解凍して使用できるように分けて−20℃で保存した。 マウスにMOG/CFA の免疫付与日から48日間、週3回(日曜−火曜−木曜)で約200ul(体重によって調節)の投与量で腹腔内投与した。 60日間のEAEの臨床スコアを算出した。
結果:結果は図 7、 8、 9に表示している。
図8のグラフのように、50日目までの臨床スコアを示すグラフが表示されている。
したがって、カテリシジンまたはその類似体またはその断片は、神経系、中枢神経系炎症疾患の治療用薬剤として使用できる。
例 3
抗体および LL-37の 混合物 は30分間常温で培養した。
細菌を加えた (40マイクロリットルの容量 )。 混合物 は3時間37℃で振動を与えながら培養した。長時間で細菌を培養するには使用した容量が少なかったので、その時点でLB培地を加え、その混合物をさらに2−3時間培養した。細菌濃度は光学濃度 (OD) 測定で、推定490であった。
治療で用いるカテリシジン−高血糖または低血糖、低血圧または高血圧などの関連疾病、腺/炎症性疾患、肥満、アテローム性動脈硬化、そして歯周炎および糖尿病による創傷治癒不良などの糖尿病関連の疾病
背景: 本実験では、カテリシジンを用いてインスリン抵抗性や血糖値を阻止できることを立証し、糖尿病や糖尿病関連の疾病用新薬であることを示している。
Lipopolysaccharide (LPS)-mediated inflammatory response may modulate pathways implicated in insulin resistance (J Clin Endocrinol Metab 85: 3770?3778, 2000)。
VPQPEQ.統計を出す際に、各マウスの2時間経過後の割合を得るため、投与時(t=0)各被験体の 2時間後( T= 2hrs.)のグルコース値を T=0の値で割り、統計を算出した。全割合の平均値を算出し、スチューデントのt検定を行った。
治療群はインスリン感受性が低下しないように保護されており、対照群と比べ2時間でグルコース値が下がっている。 対照群の方は、高脂肪飼料を摂取しているので、グルコース値は高いままで、インスリン抵抗性を示している。高脂肪飼料を4週間摂取すると対照群のように通常発現するインスリン抵抗性が、理療群の方では、発現しないように保護されている。
そのデータをグラフに示したものが 図12にある。
肥満、太りすぎおよび歯周炎などの関連疾患および糖尿病関連諸疾患の治療でのカテリシジン効能
背景:慢性的な高脂肪食はインスリン抵抗性、肥満および代謝性疾患の発症を促進する。糖尿病および肥満はインスリン抵抗性や軽度の炎症を特徴とする代謝性疾患である。 本実験では、カテリシジンまたはカテリシジン断片または類似体を用いて肥満を阻止できることを立証し、肥満および肥満関連緒疾病の疾病用新薬であることを示している。使用されたin-vivo マウスモデルについては (Diabetes 56:1761?1772, 2007) に記載されている。
最初の実験:マウスは、一時的に21日間通常の非高脂肪飼料を与えられ、マウスの体重の平均値 を測定した。10週齢のDBA/1マウスの2群(治療群と対照群)で各群10匹ずつ。実験開始日に、対照群にはビークル(150mM 生理食塩水)を投与し、実験群にはカテリシジンmCRAMPペプチドを1.5mg/kgの濃度で投与した。を(実験群に)1.5mg/kgの濃度で投与。その後2日間および4日間、1.0 mg/kgまで投与量を削減。7日目から、21日目まで0.8 mg/kgの投与量で 投与した。全治療は、月曜日、水曜日、金曜日の週3回で行われ、各治療で投与部位を交代させながら、ペプチドまたは対照群にビークル(vehicle)を腹腔内投与した。
例 6
背景:骨吸収、骨分解または骨形成に対するカテリシジンの効果について、またコラーゲン誘導関節炎のマウスモデルで対照群の患肢とカテリシジン治療を受けた患肢を比較し、骨分解、炎症または骨吸収の状態すべてに違いがみられるかどうか、また歯周炎におけるLPS誘導骨粗鬆症のカテリシジン治療群対対照群の比較についても検討してきた (J Clin Periodontol 2004; 31:596?603)。また、両群の炎症のみられない関節および骨を検査し、比較検討した。
カテリシジンを治療群に腹腔内投与し、対照群と比較検討した。マウス肢の足関節から採取した骨組織サンプルを分析し、ヘマトキシリン・エオジン染色法(H&E)免疫組織化学的染色およびTRAP 染色技術(酸性ホスファターゼ、白血球 製品番号, 387 A シグマアルドリッチ社製 )を用いて破骨細胞数を数えた。
8つの群の炎症状態を比較検討した: 2つの群:対照群と治療群の肢に炎症が誘発されたが炎症度は同じであった。 さらに2つの群:対照群と治療群の肢に炎症が認められなかった。 さらに2つの群:対照群と治療群の肢に炎症が誘発されたが炎症度は違っていた。
さらに2つの群:対照群と治療群の肢にLPSを投与して炎症を誘発し、下顎骨の骨形態に差異が生じることが分かった。この方法を利用することにより、破骨細胞そして免疫細胞または炎症細胞の活性を検査することで骨分解、炎症または骨吸収を検討することが可能となった。
両群のマウスが同じ炎症度である場合でも、対照群マウスの方が活発な破骨細胞の数がより多く、また骨吸収および骨分解が顕著に認められる。
結果および考察: カテリシジンは、骨粗鬆症、強直性脊椎炎、変形性関節炎および歯周炎の例でみられるように、骨浸食または再吸収を阻止し、これらの疾病の治療薬として使用できる。
本データは、カテリシジンが以下の治療で使用できる適正な薬剤候補として、納得できるように示している:骨粗鬆症、強直性脊椎炎、変形性関節炎、歯周炎、骨髄炎、骨肉腫、骨形成不全症、バジェット病、骨軟骨種、骨軟化症、骨髄炎、大理石骨病、腎性骨ジストロフィー、単房性骨棘、骨腫瘍、頭蓋骨癒合症、内軟骨腫、線維性骨異形成、骨巨細胞腫、感染性関節炎、骨髄炎、クリぺル−ファイル症候群、脚長不等、離断性骨軟骨症、歯周炎による骨量の低下。
例 7
背景:炎症、自己免疫および/または皮膚細胞/組織の増殖/分化の不均衡に関連する疾病には、乾癬やふけなどの疾病多くの疾病が含まれるが、当疾病に対する最適治療は、今のところ存在しない。乾癬皮膚での血管形成および 上皮形成は LL-37などの AMPsで増強される。 (Koczulla, R. et al., 2003. J.Clin.Invest 111:1665-1672; Heilborn, JD. et al., 2003. J Invest Dermatol 120:379-389).当該疾病の最適な治療法は皮膚細胞/組織の増殖/分化の異常調節に関わる因子を特定し、当該疾病を治療するのに当該因子の活性を阻止することのできる化合物を使用することである。
糖尿病治療用カテリシジン断片またはその類似体の使用
ベータ細胞( Beta-Cells)のインビトロ研究(in-vitro studies)
背景:No optimal therapy exists for treatment of type 1 diabetes.1型糖尿病の治療で最適治療法がない。当該疾病の最適な治療法は、ベータ細胞の成長を促進すことに関与している因子を同定することである。本発明の実施化に向けて、1型糖尿病の最適な治療を実現するため、抗菌ペプチド(AMP)の重要な役割を特定し、またベータ細胞の増殖成長を促すカテリシジンの能力を立証しており、それによって先行技術の制限を克服した。
材料および方法: 抗菌ペプチドヒトカテリシジン LL-37:LLGDFFRKSKEKIGKEFKRIVQRIKDFLRNLVPRTESを米国 アナスペック社( AnaSpec)から購入した。, USA (カタログ番号:61302)。カテリシジン(2ug/ml) 培養し、対照群と比較検討した。
走化性アッセイ法.
走化性アッセイ法. 0.5% のBSA (シグマアルドリッチ社) 含有の RPMI培地(ベイト ヘメク(Beit Haemek)社)にある細胞(例.好中球、単球、T細胞、HEK293;1.0-3.0 x 106 cells/mlの濃度で25μリットル)を5μ細孔径(ニューロプローブ)で96-well ChemoTxディスポーザブル走化性測定装置の上に置く。0.5%のBSAを加えたまたは加えていない RPMI培地にある試薬の10倍段階希釈液をチャンバーの底に流し込む。 37℃の5%の二酸化炭素の空気中で、60‐600分の間インキュベートし、走化性物質の各濃度で、倒立顕微鏡を利用して 遊走した細胞数を数えた。
本発明は、その特定の実施形態に併せて説明されてきたが、多くの変更、修正および変形例が当業者に明らかになるであろうことは明白である従って、本願は、添付の特許請求の精神および広い範囲に制限されている本発明の任意の変更、修正および変形例を包含するものと意図されている。本明細書中で言及するすべての刊行物、特許出願、そしてアクセッション番号によって識別される配列は、各個々の刊行物、特許出願またはアクセッション番号によって識別される配列が、具体的に、個別に参照により本明細書に組み込まれるべく指示されている場合と同じレベルで、その全体が参照により本明細書に組み込まれる。さらに、本願書中の文献の引用また識別情報を、本発明に対して先行技術として利用可能であることの承認として解釈してはならない。
Claims (15)
- 疾患治療用薬剤の調合において、哺乳類のカテリシジンまたはその有効な断片またはカテリシジンまたは、その断片の有効な修飾されたフォームを使用する方法。
- 前記病状が、自己免疫性炎症性疾患、代謝性および炎症性疾患、炎症性皮膚疾患、軽度の炎症性疾患、胃腸炎、骨の炎症、呼吸器の炎症からなる群から選択される炎症に関係する疾病である請求項1に記載の使用法。
- 前記病状が、間節炎、多発性硬化症、乾癬、肥満、過剰体重、インスリン抵抗性、骨粗鬆症、糖尿病および炎症性大腸炎以下の疾病からなる群から選択される疾病であることを特徴とする請求項1に記載の使用法
- 病状が、クローン病または潰瘍性大腸炎である請求項1に記載の使用法:
- 病状が、骨粗鬆症である請求項1に記載の使用法:
- 病状が、骨粗鬆症である請求項1に記載の使用法:
- 病状が、インスリン抵抗性である請求項1に記載の使用法:
- 病状が、乾癬である請求項1に記載の使用法:
- 病状が、慢性の閉塞性肺疾患(COPD)である請求項1に記載の使用法:
- 前述の化合物がLL-37 ペプチドおよび配列番号2に示すペプチドからなる群から選択される先行請求項のいずれか1項に記載の使用法
- 前記化合物が、N末端修飾、C末端修飾、ペプチド結合修飾、背骨修
飾そして残基修飾からなる群から選択される少なくとも1個の修飾を含むカテリシジンまたはその有効な断片の有効な修飾されたフォームである請求項1から10までのいずれか一項に記載の使用法。 - 前述の化合物がLL-37 ペプチドおよび番号2に示すペプチドからなる群から選択される請求項11に記載ざれる使用法.
- 前述の化合物が少なくとも非天然アミノ酸を包含する請求項1から10までのいずれかに記載の使用法。
- 哺乳類のカテリシジンまたはその有効な断片、またはカテリシジンまたはその断片の有効な修飾されたフォームそして 薬学的に受容可能な賦形剤またはキャリアである有効成分として含まれている医薬組成物。
- 組成物が、吸入可能な医薬組成物である請求項14に記載の医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IL184611A IL184611A0 (en) | 2007-07-15 | 2007-07-15 | Disease treatment via antimicrobial peptides or their inhibitors |
| IL187627A IL187627A0 (en) | 2007-11-26 | 2007-11-26 | Disease treatment via antimicrobial peptides or their inhibitors |
| PCT/IL2008/000977 WO2009010968A2 (en) | 2007-07-15 | 2008-07-15 | Disease treatment via antimicrobial peptides or their inhibitors |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014157915A Division JP5860937B2 (ja) | 2007-07-15 | 2014-08-01 | 抗菌ペプチドまたはその阻害剤を用いた疾病治療 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010533705A true JP2010533705A (ja) | 2010-10-28 |
| JP2010533705A5 JP2010533705A5 (ja) | 2011-08-18 |
Family
ID=39944436
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010516648A Pending JP2010533705A (ja) | 2007-07-15 | 2008-07-15 | 抗菌ペプチドまたはその阻害剤を用いた疾病治療 |
| JP2014157915A Expired - Fee Related JP5860937B2 (ja) | 2007-07-15 | 2014-08-01 | 抗菌ペプチドまたはその阻害剤を用いた疾病治療 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014157915A Expired - Fee Related JP5860937B2 (ja) | 2007-07-15 | 2014-08-01 | 抗菌ペプチドまたはその阻害剤を用いた疾病治療 |
Country Status (5)
| Country | Link |
|---|---|
| EP (1) | EP2200628A2 (ja) |
| JP (2) | JP2010533705A (ja) |
| AU (1) | AU2008277257B2 (ja) |
| CA (1) | CA2696833A1 (ja) |
| WO (1) | WO2009010968A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220049982A (ko) * | 2020-10-15 | 2022-04-22 | 서울대학교산학협력단 | 펩타이드 ll-37을 발현하는 효모를 포함하는 화장료 조성물 |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101351474A (zh) * | 2005-12-29 | 2009-01-21 | 堪萨斯州立大学研究基金会 | 抗微生物导管素肽 |
| WO2009043465A2 (en) * | 2007-09-11 | 2009-04-09 | Mondobiotech Laboratories Ag | Use of beta-endorphin as a therapeutic agent |
| EP2187934A1 (en) * | 2007-09-11 | 2010-05-26 | Mondobiotech Laboratories AG | Use of fertirelin and delta-endorphin as therapeutic agents |
| EP2525814A4 (en) * | 2010-01-22 | 2013-09-11 | Univ Louisville Res Found | METHODS OF TREATING OR PREVENTING PERIODONTITIS AND PARODONTIST-RELATED DISEASES |
| CA2790818A1 (en) * | 2010-02-25 | 2011-09-01 | University Of Manitoba | Modulation of cytokine-induced chronic inflammatory responses |
| EP3140315A1 (en) | 2014-05-09 | 2017-03-15 | Universiteit Utrecht Holding B.V. | New cath2 derivatives |
| DE202014007548U1 (de) | 2014-09-16 | 2014-12-02 | Pegasor Oy | Vorrichtung zur Spülung einer Partikelmessvorrichtung |
| WO2017098474A1 (en) | 2015-12-09 | 2017-06-15 | Universidade Do Minho | Antimicrobial peptide-loaded hyaluronic acid-based formulations, method of production and uses thereof |
| CN108570103B (zh) * | 2018-04-03 | 2019-07-30 | 东北农业大学 | 一种富含色氨酸抗菌肽wk12及其制备方法和应用 |
| CN111375051A (zh) * | 2018-12-29 | 2020-07-07 | 江苏吉锐生物技术有限公司 | 一种多肽在制备预防和治疗人乳头瘤病毒感染制剂的应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005040201A1 (en) * | 2003-10-21 | 2005-05-06 | The Regents Of The University Of California | Human cathelicidin antimicrobial peptides |
| JP2006514106A (ja) * | 2002-12-19 | 2006-04-27 | ヒルマン,イチャク | 抗菌ペプチド阻害剤による疾患治療 |
| JP2006518375A (ja) * | 2003-01-29 | 2006-08-10 | リポペプチド・アクチエボラーグ | 創傷治癒のための、カテリシジンll−37、および、それらの誘導体の使用 |
Family Cites Families (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL154600B (nl) | 1971-02-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen. |
| NL154598B (nl) | 1970-11-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van laagmoleculire verbindingen en van eiwitten die deze verbindingen specifiek kunnen binden, alsmede testverpakking. |
| NL154599B (nl) | 1970-12-28 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen, alsmede testverpakking. |
| US3901654A (en) | 1971-06-21 | 1975-08-26 | Biological Developments | Receptor assays of biologically active compounds employing biologically specific receptors |
| US3853987A (en) | 1971-09-01 | 1974-12-10 | W Dreyer | Immunological reagent and radioimmuno assay |
| US3867517A (en) | 1971-12-21 | 1975-02-18 | Abbott Lab | Direct radioimmunoassay for antigens and their antibodies |
| NL171930C (nl) | 1972-05-11 | 1983-06-01 | Akzo Nv | Werkwijze voor het aantonen en bepalen van haptenen, alsmede testverpakkingen. |
| US3850578A (en) | 1973-03-12 | 1974-11-26 | H Mcconnell | Process for assaying for biologically active molecules |
| US3935074A (en) | 1973-12-17 | 1976-01-27 | Syva Company | Antibody steric hindrance immunoassay with two antibodies |
| US3996345A (en) | 1974-08-12 | 1976-12-07 | Syva Company | Fluorescence quenching with immunological pairs in immunoassays |
| US4034074A (en) | 1974-09-19 | 1977-07-05 | The Board Of Trustees Of Leland Stanford Junior University | Universal reagent 2-site immunoradiometric assay using labelled anti (IgG) |
| US3984533A (en) | 1975-11-13 | 1976-10-05 | General Electric Company | Electrophoretic method of detecting antigen-antibody reaction |
| US4036945A (en) | 1976-05-03 | 1977-07-19 | The Massachusetts General Hospital | Composition and method for determining the size and location of myocardial infarcts |
| US4098876A (en) | 1976-10-26 | 1978-07-04 | Corning Glass Works | Reverse sandwich immunoassay |
| GB1585061A (en) | 1977-03-15 | 1981-02-25 | Nat Res Dev | Synthesis of peptides |
| US4331647A (en) | 1980-03-03 | 1982-05-25 | Goldenberg Milton David | Tumor localization and therapy with labeled antibody fragments specific to tumor-associated markers |
| US4879219A (en) | 1980-09-19 | 1989-11-07 | General Hospital Corporation | Immunoassay utilizing monoclonal high affinity IgM antibodies |
| US5011771A (en) | 1984-04-12 | 1991-04-30 | The General Hospital Corporation | Multiepitopic immunometric assay |
| US4666828A (en) | 1984-08-15 | 1987-05-19 | The General Hospital Corporation | Test for Huntington's disease |
| US4801531A (en) | 1985-04-17 | 1989-01-31 | Biotechnology Research Partners, Ltd. | Apo AI/CIII genomic polymorphisms predictive of atherosclerosis |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5272057A (en) | 1988-10-14 | 1993-12-21 | Georgetown University | Method of detecting a predisposition to cancer by the use of restriction fragment length polymorphism of the gene for human poly (ADP-ribose) polymerase |
| CA2006008C (en) | 1988-12-20 | 2000-02-15 | Donald J. Kessler | Method for making synthetic oligonucleotides which bind specifically to target sites on duplex dna molecules, by forming a colinear triplex, the synthetic oligonucleotides and methods of use |
| US5192659A (en) | 1989-08-25 | 1993-03-09 | Genetype Ag | Intron sequence analysis method for detection of adjacent and remote locus alleles as haplotypes |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| ES2246502T3 (es) | 1990-08-29 | 2006-02-16 | Genpharm International, Inc. | Animales no humanos transgenicos capaces de producir anticuerpos heterologos. |
| US5189178A (en) | 1990-11-21 | 1993-02-23 | Galardy Richard E | Matrix metalloprotease inhibitors |
| US5239078A (en) | 1990-11-21 | 1993-08-24 | Glycomed Incorporated | Matrix metalloprotease inhibitors |
| US20020123476A1 (en) | 1991-03-19 | 2002-09-05 | Emanuele R. Martin | Therapeutic delivery compositions and methods of use thereof |
| US6933286B2 (en) | 1991-03-19 | 2005-08-23 | R. Martin Emanuele | Therapeutic delivery compositions and methods of use thereof |
| US6235887B1 (en) | 1991-11-26 | 2001-05-22 | Isis Pharmaceuticals, Inc. | Enhanced triple-helix and double-helix formation directed by oligonucleotides containing modified pyrimidines |
| US5281521A (en) | 1992-07-20 | 1994-01-25 | The Trustees Of The University Of Pennsylvania | Modified avidin-biotin technique |
| US5721138A (en) | 1992-12-15 | 1998-02-24 | Sandford University | Apolipoprotein(A) promoter and regulatory sequence constructs and methods of use |
| US5807718A (en) | 1994-12-02 | 1998-09-15 | The Scripps Research Institute | Enzymatic DNA molecules |
| US5770380A (en) | 1996-09-13 | 1998-06-23 | University Of Pittsburgh | Synthetic antibody mimics--multiple peptide loops attached to a molecular scaffold |
| US20030120037A1 (en) | 1999-09-22 | 2003-06-26 | Ji Ming Wang | Utilization of FPRL1 as a functional receptor by serum amyloid a (SAA) |
| WO2001021188A1 (en) | 1999-09-22 | 2001-03-29 | The Government Of The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Utilization of fprl1 as a functional receptor by serum amyloid a (saa) |
| US20020164685A1 (en) | 2000-01-31 | 2002-11-07 | Rosen Craig A. | Nucleic acids, proteins, and antibodies |
| DE10029167B8 (de) | 2000-06-19 | 2015-07-02 | Leica Microsystems Cms Gmbh | Verfahren und Vorrichtung zur Temperaturstabilisierung optischer Bauteile |
| US20020072495A1 (en) * | 2000-09-21 | 2002-06-13 | Oleg Chertov | LL-37 is an immunostimulant |
| US6610472B1 (en) | 2000-10-31 | 2003-08-26 | Genetastix Corporation | Assembly and screening of highly complex and fully human antibody repertoire in yeast |
| JP2002288642A (ja) | 2001-03-27 | 2002-10-04 | Nec Corp | 掌紋部位分割装置とその掌紋部位分割方法、及び掌紋部位分割プログラム |
| US6839808B2 (en) | 2001-07-06 | 2005-01-04 | Juniper Networks, Inc. | Processing cluster having multiple compute engines and shared tier one caches |
-
2008
- 2008-07-15 WO PCT/IL2008/000977 patent/WO2009010968A2/en active Application Filing
- 2008-07-15 CA CA2696833A patent/CA2696833A1/en not_active Abandoned
- 2008-07-15 JP JP2010516648A patent/JP2010533705A/ja active Pending
- 2008-07-15 AU AU2008277257A patent/AU2008277257B2/en not_active Ceased
- 2008-07-15 EP EP08776610A patent/EP2200628A2/en not_active Withdrawn
-
2014
- 2014-08-01 JP JP2014157915A patent/JP5860937B2/ja not_active Expired - Fee Related
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006514106A (ja) * | 2002-12-19 | 2006-04-27 | ヒルマン,イチャク | 抗菌ペプチド阻害剤による疾患治療 |
| JP2006518375A (ja) * | 2003-01-29 | 2006-08-10 | リポペプチド・アクチエボラーグ | 創傷治癒のための、カテリシジンll−37、および、それらの誘導体の使用 |
| WO2005040201A1 (en) * | 2003-10-21 | 2005-05-06 | The Regents Of The University Of California | Human cathelicidin antimicrobial peptides |
Non-Patent Citations (3)
| Title |
|---|
| JPN6013010454; 感染・炎症・免疫, Vol.31,NO.4 p.326-329 (2001) * |
| JPN6013010456; 炎症・再生, Vol.21,NO.2 p.109-115 (2001) * |
| JPN6013010458; Ulcer Res., Vol.33 No.1 p.54-61 (2006) * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220049982A (ko) * | 2020-10-15 | 2022-04-22 | 서울대학교산학협력단 | 펩타이드 ll-37을 발현하는 효모를 포함하는 화장료 조성물 |
| KR102475936B1 (ko) | 2020-10-15 | 2022-12-09 | 코스맥스 주식회사 | 펩타이드 ll-37을 발현하는 효모를 포함하는 화장료 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2008277257A1 (en) | 2009-01-22 |
| AU2008277257B2 (en) | 2014-03-06 |
| WO2009010968A3 (en) | 2009-05-28 |
| EP2200628A2 (en) | 2010-06-30 |
| CA2696833A1 (en) | 2009-01-22 |
| JP2015028022A (ja) | 2015-02-12 |
| WO2009010968A2 (en) | 2009-01-22 |
| JP5860937B2 (ja) | 2016-02-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5860937B2 (ja) | 抗菌ペプチドまたはその阻害剤を用いた疾病治療 | |
| KR101862291B1 (ko) | 이상 섬유모세포 증식 및 세포외 기질 침착을 특징으로 하는 질병, 질환, 또는 과정을 예방하거나 치료하기 위한 조성물 및 방법 | |
| US9359405B2 (en) | Antagonists of the interleukin-1 receptor | |
| CN102027007A (zh) | 长效的y2和/或y4受体激动剂 | |
| EP3434279B1 (en) | Conjugate vaccine targeting disorder-causing in vivo protein | |
| KR20190135470A (ko) | 방사능 상해 방지 및 조직 재생 촉진을 위한 조성물 및 방법 | |
| EP3149049B1 (en) | Il-22 for use in treating metabolic disorders | |
| US4916117A (en) | Treatment of inflammation using alpha 1-antichymotrypsin | |
| US20080090757A1 (en) | Kahalalide Compositions for the Treatment of Psoriasis | |
| EP2240195A1 (en) | Treatment of melanoma with alpha thymosin peptides in combination with antibodies against cytotoxic t lymphocyte-associated antigen 4 (ctla4) | |
| CN103764669A (zh) | 抗炎药物产品 | |
| CZ2004479A3 (cs) | Farmaceutický prostředek, jeho použití a sestava ho obsahující | |
| US20150018268A1 (en) | Multivalent synthetic compounds as antibiotic treatment | |
| JP7423523B2 (ja) | ディフェンシンによる移植片対宿主病の予防と治療 | |
| JP2012505207A (ja) | 慢性閉塞性肺疾患の予防用または治療用の薬剤組成物 | |
| KR102017973B1 (ko) | 항-b형 간염 바이러스 x 단백질 폴리펩티드 약제 | |
| JP2023524765A (ja) | 新規タンパク質、ならびにその治療的および美容的利用 | |
| JP2019501129A (ja) | 短い合成ペプチド及びその使用 | |
| US20150150939A1 (en) | Apolipoprotein Mixtures | |
| KR20200061573A (ko) | 신규 펩타이드 및 이를 포함하는 약제학적 조성물 | |
| US20230203107A1 (en) | Peptide for treating sepsis derived from rv3364c protein of mycobacterium tuberculosis | |
| JP3034032B2 (ja) | 腸疾患用薬剤 | |
| EP3189847A1 (en) | Therapeutic or prophylactic agent for itching skin diseases | |
| Porta et al. | Myotoxin a, crotamine and defensin homologs in reptile venoms | |
| KR20170069997A (ko) | 미리스토일화된 렙틴-관련된 펩티드 및 이들의 용도 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100315 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110701 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110705 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120112 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120201 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130305 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130603 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130610 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130703 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130710 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130730 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140402 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20140520 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20140521 |