JP2010527700A - 医療用バルーンおよびその製造方法 - Google Patents
医療用バルーンおよびその製造方法 Download PDFInfo
- Publication number
- JP2010527700A JP2010527700A JP2010509461A JP2010509461A JP2010527700A JP 2010527700 A JP2010527700 A JP 2010527700A JP 2010509461 A JP2010509461 A JP 2010509461A JP 2010509461 A JP2010509461 A JP 2010509461A JP 2010527700 A JP2010527700 A JP 2010527700A
- Authority
- JP
- Japan
- Prior art keywords
- polymer
- medical balloon
- polymer material
- groups
- balloon
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L29/00—Materials for catheters, medical tubing, cannulae, or endoscopes or for coating catheters
- A61L29/12—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material
- A61L29/126—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having a macromolecular matrix
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M25/00—Catheters; Hollow probes
- A61M25/10—Balloon catheters
- A61M25/104—Balloon catheters used for angioplasty
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Composite Materials (AREA)
- Materials Engineering (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Materials For Medical Uses (AREA)
Abstract
Description
本開示の1つ以上の実施形態の詳細は、添付の図面に示され、以下の記載に述べられる。他の特徴および利点は、詳細な説明、図面、および特許請求の範囲から明白になるであろう。
非遺伝子治療薬としては、(a)ヘパリン、ヘパリン誘導体、ウロキナーゼおよびPPack(デキストロフェニルアラニンプロリンアルギニンクロロメチルケトン)およびチロシンのような抗血栓剤;(b)デキサメタゾン、プレドニゾロン、コルチコステロン、ブデソニド、エストロゲン、スルファサラジンおよびメサラミンのような、非ステロイド性抗炎症剤(NSAID)を含む抗炎症剤;(c)パクリタキセル、5−フルオロウラシル、シスプラチン、ビンブラスチン、ビンクリスチン、エポチロン、エンドスタチン、アンギオスタチン、アンギオペプチン、ラパマイシン(シロリムス)、バイオリムス、タクロリムス、エベロリムス、平滑筋細胞増殖阻害能を有するモノクローナル抗体、およびチミジンキナーゼ阻害剤のような抗腫瘍薬/抗増殖剤/抗有糸分裂薬(anti-miotic agents);(d)リドカイン、ブピカインおよびロピバカインのような麻酔剤;(e)D−Phe−Pro−Argクロロメチルケトン、RGDペプチド含有化合物、ヘパリン、ヒルジン、抗トロンビン化合物、血小板受容体アンタゴニスト、抗トロンビン抗体、抗血小板受容体抗体、アスピリン、プロスタグランジン阻害剤、抗血小板薬およびダニ由来抗血小板ペプチドのような抗凝血剤;(f)増殖因子、転写活性化因子および翻訳促進因子のような血管細胞増殖促進剤;(g)増殖因子阻害剤、増殖因子受容体アンタゴニスト、転写抑制因子、翻訳抑制因子、複製阻害剤、阻害抗体、増殖因子に対する抗体、増殖因子および細胞毒素から成る二官能分子、並びに抗体および細胞毒素から成る二官能分子のような血管細胞増殖阻害剤;(h)プロテインキナーゼおよびチロシンキナーゼ阻害剤(例えば、チロホスチン、ゲニステイン、キノキサリン);(i)プロスタサイクリンアナログ;(j)コレステロール降下剤、(k)アンギオポエチン;(l)トリクロサン、セファロスポリン、アミノグリコシドおよびニトロフラントインのような抗菌剤;(m)細胞毒性薬、細胞増殖抑制剤および細胞増殖影響因子(cell proliferation affectors);(n)血管拡張剤;(o)内因性血管作用機構に干渉する薬剤、(p)モノクローナル抗体のような白血球動員阻害剤;(q)サイトカイン、(r)ホルモン;(s)アリベンドール、アンブセタミド、アミノプロマジン、アポアトロピン、ベボニウムメチルサルフェート、ビエタミベリン、ブタベリン、臭化ブトロピウム、n−ブチルスコポラミン臭化物、カロベリン、臭化シメトロピウム、シンナメドリン、クレボプリド、臭化水素酸コニイン、塩酸コニイン、ヨウ化シクロニウム、ジフェメリン、ジイソプロミン、ジオキサフェチルブチラート、臭化ジポニウム、ドロフェニン、臭化エメプロニウム、エタベリン、フェクレミン、フェナラミド、フェノベリン、フェンピプラン、臭化フェンピベリニウム(fenpiverinium bromide) 、臭化フェントニウム(fentonium bromide) 、フラボキサート、フロプロピオン、グルコン酸、グアイアクタミン、ヒドラミトラジン、ヒメクロモン、レイオピロール、メベベリン、モキサベリン、ナフィベリン、オクタミルアミン、オクタベリン、塩化オキシブチニン、ペンタピペリド、塩酸フェナマシド(phenamacide hydrochloride) 、フロログルシノール、臭化ピナベリウム、ピペリラート(piperilate)、ピポキソラン塩酸塩(pipoxolan hydrochloride) 、プラミベリン、臭化プリフィニウム、プロペリジン、プロピバン(propivane) 、プロピロマジン、プロザピン、ラセフェミン、ロシベリン、スパスモリトール(spasmolytol) 、ヨウ化スチロニウム、スルトロポニウム(sultroponium)、ヨウ化チエモニウム、臭化チキジウム、チロプラミド、トレピブトン、トリクロミル(tricromyl)、トリホリウム(trifolium) 、トリメブチン、トロペンジル(tropenzile)、塩化トロスピウム、臭化キセニトロピウム(xenytropium bromide) 、ケトロラックのような鎮痙薬、およびそれらの医薬として許容される塩が挙げられる。
本発明の多数の実施形態について説明してきた。しかしながら、本開示の趣旨および範囲から逸脱することなく、様々な変更がなされ得ることが理解されるだろう。
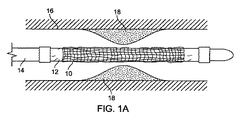
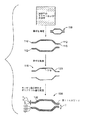
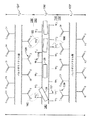
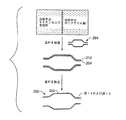
図10は3層を有するバルーン壁を示しているが、バルーン壁はより多くの層を有することができる。例えば、バルーンは5層、7層、9層、11層、13層、または15層またはそれ以上の数の層、例えば21層を有することができる。
Claims (29)
- ポリマー材料と、
前記ポリマー材料内に存在する充填材と
を含有する複合材料を含むバルーン壁を備えた医療用バルーンであって、
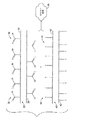
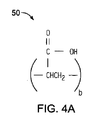
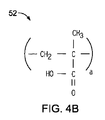
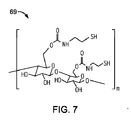
前記ポリマー材料は、複数のカルボン酸基を有する第1ポリマー鎖を備えた第1ポリマー材料と、複数のアミノ基、ヒドロキシル基、チオール基、またはこれらの基の混合物を有する第2ポリマー鎖を備えた第2ポリマー材料との反応生成物を含有する、医療用バルーン。 - 第1ポリマー材料は、ポリアクリル酸、ポリメタクリル酸、ポリ(エチレン−co−アクリル酸、ポリ(2−エチルアクリル酸)、ポリ(2−プロピルアクリル酸)およびそれらの混合物のうちから選択される、請求項1に記載の医療用バルーン。
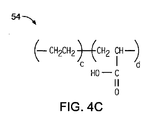
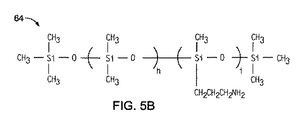
- 第2ポリマー材料は、キトサン、ポリ[ジメチルシロキサン−co−(3−アミノプロピル)メチルシロキサン]、ポリビニルアルコール、ポリ(ビニルアルコール−co−ビニルアセテート)、ポリ(スチレン−co−アリルアルコール)およびそれらの混合物のうちから選択される、請求項1に記載の医療用バルーン。
- 第1ポリマー鎖は、各々、約6〜約10,000個のカルボン酸基を有する、請求項1に記載の医療用バルーン。
- 第2ポリマー鎖の各々の上に結合した第一級アミノ基、ヒドロキシル基および/またはチオール基の総個数は、約6〜約10,000個である、請求項1に記載の医療用バルーン。
- 第1ポリマー材料の数平均分子量は、ポリエチレングリコール標準物質と比較した測定において、約2,500〜350,000である。請求項1に記載の医療用バルーン。
- 第2ポリマー材料の数平均分子量は、ポリエチレングリコール標準物質と比較した測定において、約2,500〜350,000である、請求項1に記載の医療用バルーン。
- 前記充填材は、炭素の同素体、水素結合基で官能化された炭素の同素体、金属、金属酸化物、半金属酸化物、粘土、セラミックスおよびそれらの混合物のうちから選択される、請求項1に記載の医療用バルーン。
- 前記充填材は、ポリマー材料の全体にわたってほぼ均一に分散されている、請求項1に記載の医療用バルーン。
- 前記充填材は、複合材料の厚さにわたって、別個の長手方向の層をなすように配列されている、請求項1に記載の医療用バルーン。
- 前記反応生成物は、第1ポリマー材料と第2ポリマー材料との間のイオン性複合体を含む、請求項1に記載の医療用バルーン。
- 前記反応生成物は、第1ポリマー材料と第2ポリマー材料との酸塩基複合体を含む、請求項1に記載の医療用バルーン。
- 前記反応生成物は、アミド結合、エステル結合および/またはチオエステル結合によって、反応した第2鎖に共有結合された反応した第1鎖を含む、請求項1に記載の医療用バルーン。
- 反応した第1ポリマー鎖は、複合材料の厚さにわたって、反応した第2ポリマー鎖と混じり合っている、請求項1に記載の医療用バルーン。
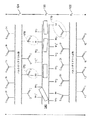
- 前記複合材料は、反応した第1ポリマー材料を含む第1層と、内部に分散した充填材を有する反応した第2ポリマー材料を含む第2層とを備える、請求項1に記載の医療用バルーン。
- 第1層もまた内部に分散した充填材を有する、請求項15に記載の医療用バルーン。
- 第1層は、ほぼ未反応の第1ポリマー材料を含むバルク第1ポリマー材料部分と、前記バルク第1ポリマー部分から延びる反応した第1ポリマー部分とを含み、第2層は、ほぼ未反応の第2ポリマー材料を含むバルク第2ポリマー材料部分と、前記バルク第2ポリマー部分から延びる反応した第2ポリマー部分とを含む、請求項1に記載の医療用バルーン。
- 前記複合材料は40MPaを超える引張強度を有する、請求項1に記載の医療用バルーン。
- 前記複合材料は50S/cmを超える導電率を有する、請求項1に記載の医療用バルーン。
- ポリマー材料と、
前記ポリマー材料内に存在する充填材と
を含有する複合材料を含むバルーン壁を備えた医療用バルーンであって、
前記複合ポリマー材料は40S/cmを超える導電率を有する、医療用バルーン。 - 前記ポリマー材料は、複数の離間したカルボン酸基を有する第1ポリマー鎖を備えた第1ポリマー材料と、複数の離間した第1級アミノ基、ヒドロキシル基、チオール基、またはこれらの基の混合物を有する第2ポリマー鎖を備えた第2ポリマー材料との反応生成物を含有する、請求項20に記載の医療用バルーン。
- ポリマー材料と、
前記ポリマー材料内に存在する充填材と
を含有する複合材料を含むバルーン壁を備えた医療用バルーンであって、
前記複合ポリマー材料は40MPaを超える引張強度を有する、医療用バルーン。 - 前記引張強度が75MPaを超える、請求項22に記載の医療用バルーン。
- 前記ポリマー材料は、複数の離間したカルボン酸基を有する第1ポリマー鎖を備えた第1ポリマー材料と、複数の離間した第1級アミノ基、ヒドロキシル基、チオール基、またはこれらの基の混合物を有する第2ポリマー鎖を備えた第2ポリマー材料との反応生成物を含有する、請求項22に記載の医療用バルーン。
- 基材を提供する工程と、
前記基材上に第1ポリマー材料および第2ポリマー材料、ならびに/または第1ポリマー材料および第2ポリマー材料の反応生成物を堆積させる工程と
を含む医療用バルーンの製造方法であって、
第1ポリマー材料は、複数のカルボン酸基を有する第1ポリマー鎖を含み、第2ポリマー材料は、複数のアミノ基、ヒドロキシル基、チオール基、またはこれらの基の混合物を有する第2ポリマー鎖を含む、方法。 - 第1ポリマー材料および第2ポリマー材料は、同時に堆積される、請求項25に記載の方法。
- 第1ポリマー材料または第2ポリマー材料は、他方のポリマー材料の前に堆積される、請求項25に記載の方法。
- 第1ポリマー材料および第2ポリマー材料は、それぞれのポリマーの溶液または分散物から、それぞれのポリマーを前記基材上に噴霧することにより堆積される、請求項25に記載の方法。
- 前記基材を除去する工程をさらに含む、請求項25に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11/804,654 US20080287984A1 (en) | 2007-05-18 | 2007-05-18 | Medical balloons and methods of making the same |
| PCT/US2008/063816 WO2009014793A2 (en) | 2007-05-18 | 2008-05-16 | Medical balloons and the methods of making the same |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010527700A true JP2010527700A (ja) | 2010-08-19 |
| JP2010527700A5 JP2010527700A5 (ja) | 2011-09-15 |
Family
ID=40028306
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010509461A Pending JP2010527700A (ja) | 2007-05-18 | 2008-05-16 | 医療用バルーンおよびその製造方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20080287984A1 (ja) |
| EP (1) | EP2160208B1 (ja) |
| JP (1) | JP2010527700A (ja) |
| CA (1) | CA2687572A1 (ja) |
| WO (1) | WO2009014793A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5844752B2 (ja) * | 2011-02-15 | 2016-01-20 | テルモ株式会社 | ステントデリバリーシステムの製造方法 |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI0806727B8 (pt) | 2007-01-21 | 2021-06-22 | Hemoteq Ag | método para o revestimento de um cateter de balão |
| US9192697B2 (en) | 2007-07-03 | 2015-11-24 | Hemoteq Ag | Balloon catheter for treating stenosis of body passages and for preventing threatening restenosis |
| US9040072B2 (en) * | 2007-12-07 | 2015-05-26 | Ethicon, Inc. | Use of coupling agents to improve the interface in absorbable polymer composites |
| US8389083B2 (en) * | 2008-10-17 | 2013-03-05 | Boston Scientific Scimed, Inc. | Polymer coatings with catalyst for medical devices |
| WO2011005421A2 (en) | 2009-07-10 | 2011-01-13 | Boston Scientific Scimed, Inc. | Use of nanocrystals for a drug delivery balloon |
| US10080821B2 (en) | 2009-07-17 | 2018-09-25 | Boston Scientific Scimed, Inc. | Nucleation of drug delivery balloons to provide improved crystal size and density |
| WO2011090569A1 (en) | 2009-12-30 | 2011-07-28 | Boston Scientific Scimed, Inc. | Drug-delivery balloons |
| WO2012031236A1 (en) | 2010-09-02 | 2012-03-08 | Boston Scientific Scimed, Inc. | Coating process for drug delivery balloons using heat-induced rewrap memory |
| WO2013022458A1 (en) | 2011-08-05 | 2013-02-14 | Boston Scientific Scimed, Inc. | Methods of converting amorphous drug substance into crystalline form |
| WO2013028208A1 (en) | 2011-08-25 | 2013-02-28 | Boston Scientific Scimed, Inc. | Medical device with crystalline drug coating |
| US11124609B2 (en) | 2016-08-05 | 2021-09-21 | Seabourne Solutions, Llc | Polymeric coatings for metal surfaces |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH03207376A (ja) * | 1989-11-13 | 1991-09-10 | Scimed Life Syst Inc | 膨張カテーテル |
| JPH06507101A (ja) * | 1991-04-26 | 1994-08-11 | ボストン サイエンティフィック コーポレーション | 医療用押し出しバルーン及びこのバルーンを用いたカテーテル |
| US6290721B1 (en) * | 1992-03-31 | 2001-09-18 | Boston Scientific Corporation | Tubular medical endoprostheses |
| JP2003513702A (ja) * | 1999-10-25 | 2003-04-15 | ボストン サイエンティフィック リミテッド | 寸法安定バルーン |
| US20050181014A1 (en) * | 2004-02-12 | 2005-08-18 | Richard Robert E. | Polymer-filler composites for controlled delivery of therapetic agents from medical articles |
| JP2008500105A (ja) * | 2004-05-24 | 2008-01-10 | ボストン サイエンティフィック リミテッド | 医療器具システム |
| WO2008024477A2 (en) * | 2006-08-25 | 2008-02-28 | Boston Scientific Scimed, Inc. | Polymeric/ceramic composite materials for use in medical devices |
| JP2008534121A (ja) * | 2005-03-30 | 2008-08-28 | ボストン サイエンティフィック リミテッド | 医療器具に使用するためのポリマー/セラミック複合材料 |
| JP2009528895A (ja) * | 2006-03-06 | 2009-08-13 | ボストン サイエンティフィック リミテッド | 電気的に整列させた長尺状の粒子を有する医療機器 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5478320A (en) * | 1989-11-29 | 1995-12-26 | Cordis Corporation | Puncture resistant balloon catheter and method of manufacturing |
| US6004289A (en) * | 1990-05-15 | 1999-12-21 | Medtronic Ave, Inc. | Multiple layer high strength balloon for dilatation catheter |
| US7108826B2 (en) * | 1994-03-02 | 2006-09-19 | Boston Scientific Scimed, Inc. | High compliance, high strength catheter balloons useful for treatment of gastrointestinal lesions |
| US6146356A (en) * | 1994-03-02 | 2000-11-14 | Scimed Life Systems, Inc. | Block copolymer elastomer catheter balloons |
| US7883693B2 (en) * | 1995-12-18 | 2011-02-08 | Angiodevice International Gmbh | Compositions and systems for forming crosslinked biomaterials and methods of preparation of use |
| US6124007A (en) * | 1996-03-06 | 2000-09-26 | Scimed Life Systems Inc | Laminate catheter balloons with additive burst strength and methods for preparation of same |
| US6232434B1 (en) * | 1996-08-02 | 2001-05-15 | Duke University Medical Center | Polymers for delivering nitric oxide in vivo |
| US6358227B1 (en) * | 1997-09-10 | 2002-03-19 | Scimed Life Systems, Inc. | Dilatation catheter balloon made from pen based homopolymer or random copolymer |
| JP2005503865A (ja) * | 2001-09-28 | 2005-02-10 | ボストン サイエンティフィック リミテッド | ナノ材料からなる医療デバイス及びそれを利用した治療方法 |
| US7029732B2 (en) * | 2002-02-28 | 2006-04-18 | Boston Scientific Scimed, Inc. | Medical device balloons with improved strength properties and processes for producing same |
| US8398693B2 (en) * | 2004-01-23 | 2013-03-19 | Boston Scientific Scimed, Inc. | Electrically actuated medical devices |
| US7371231B2 (en) * | 2004-02-02 | 2008-05-13 | Boston Scientific Scimed, Inc. | System and method for performing ablation using a balloon |
| US7744644B2 (en) * | 2004-03-19 | 2010-06-29 | Boston Scientific Scimed, Inc. | Medical articles having regions with polyelectrolyte multilayer coatings for regulating drug release |
| US7758892B1 (en) * | 2004-05-20 | 2010-07-20 | Boston Scientific Scimed, Inc. | Medical devices having multiple layers |
-
2007
- 2007-05-18 US US11/804,654 patent/US20080287984A1/en not_active Abandoned
-
2008
- 2008-05-16 JP JP2010509461A patent/JP2010527700A/ja active Pending
- 2008-05-16 EP EP08826554A patent/EP2160208B1/en not_active Not-in-force
- 2008-05-16 CA CA002687572A patent/CA2687572A1/en not_active Abandoned
- 2008-05-16 WO PCT/US2008/063816 patent/WO2009014793A2/en active Application Filing
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH03207376A (ja) * | 1989-11-13 | 1991-09-10 | Scimed Life Syst Inc | 膨張カテーテル |
| JPH06507101A (ja) * | 1991-04-26 | 1994-08-11 | ボストン サイエンティフィック コーポレーション | 医療用押し出しバルーン及びこのバルーンを用いたカテーテル |
| US6290721B1 (en) * | 1992-03-31 | 2001-09-18 | Boston Scientific Corporation | Tubular medical endoprostheses |
| JP2003513702A (ja) * | 1999-10-25 | 2003-04-15 | ボストン サイエンティフィック リミテッド | 寸法安定バルーン |
| US20050181014A1 (en) * | 2004-02-12 | 2005-08-18 | Richard Robert E. | Polymer-filler composites for controlled delivery of therapetic agents from medical articles |
| JP2008500105A (ja) * | 2004-05-24 | 2008-01-10 | ボストン サイエンティフィック リミテッド | 医療器具システム |
| JP2008534121A (ja) * | 2005-03-30 | 2008-08-28 | ボストン サイエンティフィック リミテッド | 医療器具に使用するためのポリマー/セラミック複合材料 |
| JP2009528895A (ja) * | 2006-03-06 | 2009-08-13 | ボストン サイエンティフィック リミテッド | 電気的に整列させた長尺状の粒子を有する医療機器 |
| WO2008024477A2 (en) * | 2006-08-25 | 2008-02-28 | Boston Scientific Scimed, Inc. | Polymeric/ceramic composite materials for use in medical devices |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5844752B2 (ja) * | 2011-02-15 | 2016-01-20 | テルモ株式会社 | ステントデリバリーシステムの製造方法 |
| US9636243B2 (en) | 2011-02-15 | 2017-05-02 | Terumo Kabushiki Kaisha | Stent delivery system |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2160208A2 (en) | 2010-03-10 |
| US20080287984A1 (en) | 2008-11-20 |
| WO2009014793A3 (en) | 2009-10-22 |
| WO2009014793A2 (en) | 2009-01-29 |
| EP2160208B1 (en) | 2013-03-06 |
| CA2687572A1 (en) | 2009-01-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2010527700A (ja) | 医療用バルーンおよびその製造方法 | |
| US20080188825A1 (en) | Catheters and medical balloons | |
| US20110160659A1 (en) | Drug-Delivery Balloons | |
| CN106730275B (zh) | 用于组织治疗的孔隙率可控的装置、使用方法和制造方法 | |
| EP2512542B1 (en) | Method for coating balloon catheters for delivering therapeutic agents | |
| JP5139060B2 (ja) | 多層を有する医療用デバイス | |
| US8690822B2 (en) | Drug delivery medical devices | |
| JP5185630B2 (ja) | 医療器具およびその製造方法 | |
| ES2726815T3 (es) | Dispositivos, sistemas y métodos de revestimiento retráctil | |
| EP2068962B1 (en) | Endoprostheses | |
| EP1991285B1 (en) | Balloon catheter having nanotubes | |
| EP1986727B1 (en) | Catheter with porous Balloon | |
| US20070282425A1 (en) | Drug delivery spiral coil construct | |
| JP2007508121A (ja) | 血管形成術用バルーン | |
| JP2011513005A (ja) | シース被覆を備えたバルーンカテーテル装置 | |
| WO2005092242A1 (en) | Stent with differently coated inside and outside surfaces |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110513 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110801 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130319 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130619 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130626 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130719 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130726 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20131022 |