JP2010515913A - マイクロ流体装置 - Google Patents
マイクロ流体装置 Download PDFInfo
- Publication number
- JP2010515913A JP2010515913A JP2009545234A JP2009545234A JP2010515913A JP 2010515913 A JP2010515913 A JP 2010515913A JP 2009545234 A JP2009545234 A JP 2009545234A JP 2009545234 A JP2009545234 A JP 2009545234A JP 2010515913 A JP2010515913 A JP 2010515913A
- Authority
- JP
- Japan
- Prior art keywords
- energization
- microfluidic
- teeth
- chamber
- layer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 239000012530 fluid Substances 0.000 claims abstract description 63
- 238000004891 communication Methods 0.000 claims abstract description 15
- 239000002245 particle Substances 0.000 claims description 136
- 230000005291 magnetic effect Effects 0.000 claims description 106
- 239000000523 sample Substances 0.000 claims description 77
- 238000000034 method Methods 0.000 claims description 67
- 238000002156 mixing Methods 0.000 claims description 55
- 239000011324 bead Substances 0.000 claims description 53
- 239000004020 conductor Substances 0.000 claims description 48
- 239000012491 analyte Substances 0.000 claims description 30
- 230000000739 chaotic effect Effects 0.000 claims description 25
- 230000035699 permeability Effects 0.000 claims description 18
- 230000008859 change Effects 0.000 claims description 16
- 108020004707 nucleic acids Proteins 0.000 claims description 13
- 102000039446 nucleic acids Human genes 0.000 claims description 13
- 150000007523 nucleic acids Chemical class 0.000 claims description 13
- 239000012139 lysis buffer Substances 0.000 claims description 11
- 239000000243 solution Substances 0.000 claims description 10
- 239000000463 material Substances 0.000 claims description 8
- WYTGDNHDOZPMIW-RCBQFDQVSA-N alstonine Natural products C1=CC2=C3C=CC=CC3=NC2=C2N1C[C@H]1[C@H](C)OC=C(C(=O)OC)[C@H]1C2 WYTGDNHDOZPMIW-RCBQFDQVSA-N 0.000 claims description 6
- 230000003321 amplification Effects 0.000 claims description 6
- 238000003199 nucleic acid amplification method Methods 0.000 claims description 6
- 230000009089 cytolysis Effects 0.000 claims description 5
- 239000007788 liquid Substances 0.000 claims description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 4
- 239000003146 anticoagulant agent Substances 0.000 claims description 4
- 229940127219 anticoagulant drug Drugs 0.000 claims description 4
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 claims description 4
- 239000010931 gold Substances 0.000 claims description 4
- 229910052737 gold Inorganic materials 0.000 claims description 4
- 230000003993 interaction Effects 0.000 claims description 3
- 239000011534 wash buffer Substances 0.000 claims description 3
- 238000010828 elution Methods 0.000 claims description 2
- 239000012149 elution buffer Substances 0.000 claims description 2
- 238000000605 extraction Methods 0.000 claims description 2
- 230000000717 retained effect Effects 0.000 claims description 2
- 235000012239 silicon dioxide Nutrition 0.000 claims description 2
- 239000000377 silicon dioxide Substances 0.000 claims description 2
- 238000002032 lab-on-a-chip Methods 0.000 claims 5
- 108020004414 DNA Proteins 0.000 description 35
- 238000001514 detection method Methods 0.000 description 23
- 238000009396 hybridization Methods 0.000 description 12
- 238000013461 design Methods 0.000 description 11
- 230000008569 process Effects 0.000 description 11
- 238000004088 simulation Methods 0.000 description 11
- 229910000889 permalloy Inorganic materials 0.000 description 10
- 239000008280 blood Substances 0.000 description 9
- 210000004369 blood Anatomy 0.000 description 9
- 238000004804 winding Methods 0.000 description 9
- 239000006249 magnetic particle Substances 0.000 description 8
- 238000000926 separation method Methods 0.000 description 8
- 238000009792 diffusion process Methods 0.000 description 7
- 238000002372 labelling Methods 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 239000000356 contaminant Substances 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 5
- 239000004926 polymethyl methacrylate Substances 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 239000000758 substrate Substances 0.000 description 5
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 4
- 239000004793 Polystyrene Substances 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 230000008878 coupling Effects 0.000 description 4
- 238000010168 coupling process Methods 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 239000004205 dimethyl polysiloxane Substances 0.000 description 4
- 235000013870 dimethyl polysiloxane Nutrition 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 239000011521 glass Substances 0.000 description 4
- CXQXSVUQTKDNFP-UHFFFAOYSA-N octamethyltrisiloxane Chemical compound C[Si](C)(C)O[Si](C)(C)O[Si](C)(C)C CXQXSVUQTKDNFP-UHFFFAOYSA-N 0.000 description 4
- 238000004987 plasma desorption mass spectroscopy Methods 0.000 description 4
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 4
- 229920002223 polystyrene Polymers 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 239000010409 thin film Substances 0.000 description 4
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000006037 cell lysis Effects 0.000 description 3
- 230000010354 integration Effects 0.000 description 3
- SZVJSHCCFOBDDC-UHFFFAOYSA-N iron(II,III) oxide Inorganic materials O=[Fe]O[Fe]O[Fe]=O SZVJSHCCFOBDDC-UHFFFAOYSA-N 0.000 description 3
- 229910052710 silicon Inorganic materials 0.000 description 3
- 239000010703 silicon Substances 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 230000036962 time dependent Effects 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 238000000018 DNA microarray Methods 0.000 description 2
- 108091028043 Nucleic acid sequence Proteins 0.000 description 2
- 229910004298 SiO 2 Inorganic materials 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 238000003491 array Methods 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000005669 field effect Effects 0.000 description 2
- 230000005484 gravity Effects 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 230000001788 irregular Effects 0.000 description 2
- 230000002934 lysing effect Effects 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 239000011325 microbead Substances 0.000 description 2
- 229910052759 nickel Inorganic materials 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 230000005298 paramagnetic effect Effects 0.000 description 2
- 230000000737 periodic effect Effects 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 238000003380 quartz crystal microbalance Methods 0.000 description 2
- 230000004043 responsiveness Effects 0.000 description 2
- 239000012798 spherical particle Substances 0.000 description 2
- 238000012731 temporal analysis Methods 0.000 description 2
- 238000000700 time series analysis Methods 0.000 description 2
- 235000012431 wafers Nutrition 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- 230000004544 DNA amplification Effects 0.000 description 1
- 238000007400 DNA extraction Methods 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 238000002806 Stokes method Methods 0.000 description 1
- 230000001133 acceleration Effects 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 229910045601 alloy Inorganic materials 0.000 description 1
- 239000000956 alloy Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 229910001566 austenite Inorganic materials 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 238000012742 biochemical analysis Methods 0.000 description 1
- 239000000560 biocompatible material Substances 0.000 description 1
- 239000013060 biological fluid Substances 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 229910052729 chemical element Inorganic materials 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 230000035602 clotting Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 238000005094 computer simulation Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000004720 dielectrophoresis Methods 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000011143 downstream manufacturing Methods 0.000 description 1
- 238000003708 edge detection Methods 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 230000005662 electromechanics Effects 0.000 description 1
- 238000005370 electroosmosis Methods 0.000 description 1
- 238000003891 environmental analysis Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 238000003205 genotyping method Methods 0.000 description 1
- 230000020169 heat generation Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 238000003475 lamination Methods 0.000 description 1
- 238000001459 lithography Methods 0.000 description 1
- 239000000696 magnetic material Substances 0.000 description 1
- 230000005415 magnetization Effects 0.000 description 1
- 238000005404 magnetometry Methods 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 238000002493 microarray Methods 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000007479 molecular analysis Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 229910000595 mu-metal Inorganic materials 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 238000000206 photolithography Methods 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920002939 poly(N,N-dimethylacrylamides) Polymers 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/50273—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means or forces applied to move the fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J19/00—Chemical, physical or physico-chemical processes in general; Their relevant apparatus
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/30—Micromixers
- B01F33/3032—Micromixers using magneto-hydrodynamic [MHD] phenomena to mix or move the fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F25/00—Flow mixers; Mixers for falling materials, e.g. solid particles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/30—Micromixers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/45—Magnetic mixers; Mixers with magnetically driven stirrers
- B01F33/452—Magnetic mixers; Mixers with magnetically driven stirrers using independent floating stirring elements
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502746—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means for controlling flow resistance, e.g. flow controllers, baffles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502761—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip specially adapted for handling suspended solids or molecules independently from the bulk fluid flow, e.g. for trapping or sorting beads, for physically stretching molecules
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/416—Systems
- G01N27/447—Systems using electrophoresis
- G01N27/44756—Apparatus specially adapted therefor
- G01N27/44791—Microapparatus
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0647—Handling flowable solids, e.g. microscopic beads, cells, particles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0627—Sensor or part of a sensor is integrated
- B01L2300/0645—Electrodes
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/087—Multiple sequential chambers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/043—Moving fluids with specific forces or mechanical means specific forces magnetic forces
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/25—Chemistry: analytical and immunological testing including sample preparation
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Health & Medical Sciences (AREA)
- Analytical Chemistry (AREA)
- Dispersion Chemistry (AREA)
- Clinical Laboratory Science (AREA)
- Hematology (AREA)
- Physics & Mathematics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Fluid Mechanics (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Electrochemistry (AREA)
- Organic Chemistry (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Physical Or Chemical Processes And Apparatus (AREA)
- Micromachines (AREA)
- Automatic Analysis And Handling Materials Therefor (AREA)
Abstract
i)入口と、ii)少なくとも第1および第2の通電構造を含む第1の層であって、少なくとも第1および第2の通電構造のそれぞれが複数の歯を備える、第1の層と、iii)入口と流体連通しかつ第1の層の少なくとも第1および第2の通電構造の上方に配置された第1のマイクロ流体チャンバを含む第2の層と、iv)少なくとも第3および第4の通電構造を含む第3の層であって、少なくとも第3および第4の通電構造のそれぞれが複数の歯を備える、第3の層とを備えるマイクロ流体装置であって、少なくとも第3および第4の通電構造が、第1のマイクロ流体チャンバの上方になるように第3の層内に配置され、第3の通電構造の歯は、第1の通電構造の歯の上方に実質的に垂直に配置され、第4の通電構造の歯は、第2の通電構造の歯の上方に実質的に垂直に配置され、歯が、実質的に楕円形先端部を有するステムを有する、マイクロ流体装置。
【選択図】図1
【選択図】図1
Description
本発明は、マイクロ流体装置(microfluidic device)、およびマイクロ流体装置を使用して生体試料(biological sample)から検体を分離し検出する方法に関する。
過去10年にわたって、機械構成部品の小型化と、機械構成部品と微小電気システム(micro−electrical system)の一体化とを基礎とする微小電気機械システム(Micro−Electro−Mechanical System)(MEMS)の出現は、マイクロメートル程度の様々な構造体および装置を製作する可能性をもたらしてきた。この技術は、半導体産業によって開発されたものとほとんど同じ製造技術、設備および材料を巧みに利用している。MEMS応用の範囲は、著しく伸びており、主としてマイクロセンサ(micro−sensor)およびマイクロアクチュエータ(micro−actuator)の分野にある。近年、生化学分析システムのMEMS装置への小型化および集積化が大きな関心事になっており、これは、マイクロ総分析システム(Micor Total Analysis Systems)(μ−TAS)またはラボオンチップ(Lab−on−a−Chip)(LOC)システムの発明につながっている。
従来の装置に勝るμ−TASの主要な利点としては、製造コストの低下、品質および作業時間に関連する分析性能の向上、小型、廃棄性、正確な検出、最小の人為的干渉、および消費電力の低減がある。さらに、遺伝子タイピングおよび他の分子解析の適用を制約するレアケミカル(rare chemical)および試料の問題は、μ−TASの使用によって解決されている。
しかし、コア分野において多くの実績があり、例えば、DNAの増幅を促進するためのPCRをマイクロチップフォーマット(microchip format)で小型化しており、DNA精製法の小型化へ向けて与えられる労力は少なくなってきている。実際には、現在実証されているマイクロ流体装置またはマイクロアレイ装置のほとんどが、単一機能を追求しており、精製済みDNAまたは均質な試料を入力試料として使用している。一方、臨床および環境分析における実際の適用では、全血または汚染環境流体と同じくらい複雑かつ不均質な試料の処理を必要とする。試料の調製が複雑であるため、最も利用可能なバイオチップシステムは、依然として、従来のベンチトップ法を用いてこの初期段階のオフチップを実行している。その結果、後端検出プラットフォームの急速な進展は、迅速分析装置のさらなる発展を妨げるボトルネックを、「実」試料が使用される前端試料調製にシフトさせてきた。現在知られているマイクロ流体装置に関連する問題は、これらのプラットフォームにおいて効率的なカオス的混合を行うことであり、これには、通常、移動部分と、障害物と、溝と、ねじれ蛇行チャネルまたは3次元蛇行チャネルとが存在する必要がある。しかし、これらの構成要素からなる構造は複雑になる傾向があり、多層積層や多段階フォトリソグラフィなどの複雑な製造プロセスを必要とする。
Suzuki,H.ら(J.microelectromechanical systems、2004、Vol.13、No.5、779〜790)は磁力駆動式カオス混合器を開示しており、この混合器では、試料とビーズの混合を容易にするために、マイクロチャネル内の物理的障害物が、磁気ビーズを前後に操作するように働く、チャネルのベースに埋め込まれた微小導体と共に使用される。
EP1462174A1は、磁気ビーズをX位置とY位置の間で制御移送するための装置を開示しており、磁気ビーズは、電流密度が非定常である三角形状の通電構造によって生成された一連の局所磁場を順次印加することによって移送され、したがって、ビーズは、最高電荷密度を有する領域内の通電構造の先端部に蓄積することになる。
WO2006004558は、誘電泳動力を利用して試料から所望の細胞を保持し回収する、生体試料を保存し溶解させるためのバイオチップを開示している。
本発明の一目的は、例えばマイクロチャネルまたはチャンバ内での流体の混合を改善するとともに、より簡単な製造を可能とし、さらに従来技術の問題、特に全血試料の凝固を解決または軽減するマイクロ流体装置を提供することである。
本発明によれば、マイクロ流体装置であって、
i)入口と、
ii)少なくとも第1および第2の通電構造を含む第1の層であって、少なくとも第1および第2の通電構造のそれぞれが複数の歯を備え、第1および第2の通電構造の歯は、第1の通電構造の歯が第2の通電構造の歯の間に配置されるように場合によりオフセットされる、第1の層と、
iii)入口と流体連通しかつ第1の層の少なくとも第1および第2の通電構造の上方に配置された第1のマイクロ流体チャンバを含む第2の層と、
iv)少なくとも第3および第4の通電構造を含む第3の層であって、少なくとも第3および第4の通電構造のそれぞれが複数の歯を備え、第3および第4の通電構造の歯は、第3の通電構造の歯が第4の通電構造の歯の間に配置されるように場合によりオフセットされる、第3の層と
を備え、
少なくとも第3および第4の通電構造が、第1のマイクロ流体チャンバの上方になるように第3の層内に配置され、したがって、第3の通電構造の歯は、第1の通電構造の歯の上方に実質的に垂直に配置されるか、または第1の通電構造の歯からオフセットされ、第4の通電構造の歯は、第2の通電構造の歯の上方に実質的に垂直に配置されるか、または第2の通電構造の歯からオフセットされ、
歯が、実質的に楕円形の先端部を有するステムを有する、マイクロ流体装置が提供される。
i)入口と、
ii)少なくとも第1および第2の通電構造を含む第1の層であって、少なくとも第1および第2の通電構造のそれぞれが複数の歯を備え、第1および第2の通電構造の歯は、第1の通電構造の歯が第2の通電構造の歯の間に配置されるように場合によりオフセットされる、第1の層と、
iii)入口と流体連通しかつ第1の層の少なくとも第1および第2の通電構造の上方に配置された第1のマイクロ流体チャンバを含む第2の層と、
iv)少なくとも第3および第4の通電構造を含む第3の層であって、少なくとも第3および第4の通電構造のそれぞれが複数の歯を備え、第3および第4の通電構造の歯は、第3の通電構造の歯が第4の通電構造の歯の間に配置されるように場合によりオフセットされる、第3の層と
を備え、
少なくとも第3および第4の通電構造が、第1のマイクロ流体チャンバの上方になるように第3の層内に配置され、したがって、第3の通電構造の歯は、第1の通電構造の歯の上方に実質的に垂直に配置されるか、または第1の通電構造の歯からオフセットされ、第4の通電構造の歯は、第2の通電構造の歯の上方に実質的に垂直に配置されるか、または第2の通電構造の歯からオフセットされ、
歯が、実質的に楕円形の先端部を有するステムを有する、マイクロ流体装置が提供される。
この態様の一変形例では、マイクロ流体装置であって、
i)入口と、
ii)複数の歯を備える少なくとも第1の通電構造を含む第1の層と、
iii)入口と流体連通しかつ第1の層の少なくとも第1および第2の通電構造の上方に配置された第1のマイクロ流体チャンバを含む第2の層と、
iv)複数の歯を備える少なくとも第2の通電構造を含む第3の層と
を備え、
第2の通電構造が、第1のマイクロ流体チャンバの上方になるように第3の層内に配置され、したがって、第2の通電構造の歯は、第1の通電構造の歯の上方に実質的に垂直に配置されるか、または第1の通電構造の歯からオフセットされ、
歯が、実質的に楕円形の先端部を有するステムを有する、マイクロ流体装置が提供される。
i)入口と、
ii)複数の歯を備える少なくとも第1の通電構造を含む第1の層と、
iii)入口と流体連通しかつ第1の層の少なくとも第1および第2の通電構造の上方に配置された第1のマイクロ流体チャンバを含む第2の層と、
iv)複数の歯を備える少なくとも第2の通電構造を含む第3の層と
を備え、
第2の通電構造が、第1のマイクロ流体チャンバの上方になるように第3の層内に配置され、したがって、第2の通電構造の歯は、第1の通電構造の歯の上方に実質的に垂直に配置されるか、または第1の通電構造の歯からオフセットされ、
歯が、実質的に楕円形の先端部を有するステムを有する、マイクロ流体装置が提供される。
この変形例は、装置の第1の層および第3の層が、それぞれ第1および第2の通電構造、および第3および第4の通電構造ではない通電構造を含む限りにおいて異なることが分かる。しかし、これは、第1および第3の層内に別の通電構造を含む可能性を除外するものではない。
第1の層か第3の層のどちらかの通電構造は、構造の個々の歯が互いに向き合うように配向され得るような方向の折り返しまたは変化を含むように配向され得る。個々の歯は、互いにオフセットされていてもよい。
本発明の第1の態様(上記に定義したいずれかの変形例による装置を含む)の以下の論議では、説明される好ましい特徴が、必要な変更を加えて本発明のこの態様のいずれかの変形例に適用され得ることが理解される。
オフセットという用語は、第1および第2の通電構造の歯の可能な間隔の範囲を含むことが理解される。歯は、例えば、規則正しく、第1および第2の通電構造の歯の間を同じ空間間隔で離間され得るが、必ずしもそうである必要はない。第1の通電構造の歯は、例えば、その歯が第2の通電構造の歯の間の中間位置に、あるいは歯の間隔の一部分の位置に存在するようにオフセットされてもよい。オフセットという用語はまた、通電構造の歯の不規則な間隔や通電構造自体の不規則な間隔も含む。
歯は、通電構造の経路に沿った突出部を意味すると理解される。したがって、各歯の形状は別の形状および構造を含むことができ、例えば、突出部のステム部は楕円形先端部で終端することができる。
通電構造は、「鍵型」または「多数巻き鍵型」と称される種類のものとすることができる。そのような構成の実施例の空間配置が、図18〜20に示されている。
楕円形という用語は、卵形または円形形態を有する先端部を意味することが理解される。好ましい一実施形態では、先端部は円形である。
本発明者らは、装置の歯の楕円形状は、先端部の磁場だけが強くなる三角形などの歯の他の形状と比べると、歯の周囲により均等に分布する磁場を引き起こすことを見出している。
通電構造は、第1および第3の層に埋め込まれることが好ましい。通電構造は、第1および第3の層の表面の0.1μm〜10μm下方にあることがより好ましい。0.1μm〜5μm下方にあることがさらに好ましい。0.1μm〜2μm下方にあることが最も好ましい。
装置は、装置によって生成される磁場を増大させるために、マイクロチャネルより遠位にある第1および/または第3の層内に位置するか、または第1および/または第3の層に隣接して位置する高透磁率(例えばパーマロイ)層を含むことができることが、当業者には明らかである。
好ましい一実施形態では、第1のマイクロ流体チャンバは、実質的にまっすぐなチャネルである。別の好ましい実施形態では、実質的にまっすぐなチャネルは、入口に近接したチャンバを形成する大き目の寸法をもつ領域を有する。
装置が使用されているとき、この領域は、試料液体が混合され得る比率を増大させるように働くことが見出されている。これは、試料が例えば全血を濃縮または凝固させやすい液体である特定の用途である。血液の試料としての使用は、家庭用またはポイントオブケア用として設計された装置を特に対象とする。というのは、試料は、単に針を刺すことによって容易に得ることができるからである。
特に好ましい実施形態では、入口はより大きな寸法をもつ領域内に直接通じており、通電装置はこの領域内にまで延びており、したがって、試料が装置に入るとすぐに試料のカオス的混合が始まる。
第1および/または第3の層は、第5の通電構造をさらに含むことが好ましい。第5の通電構造は、入口より遠位にあるように位置することがより好ましい。
好ましい一実施形態では、第1のマイクロ流体チャンバは、溶解および抽出ユニットを形成する。特に好ましい一実施形態では、装置は、全血の分析に有用である。
マイクロ流体装置は、第1のマイクロ流体チャンバと流体連通する第2のマイクロ流体チャンバをさらに備え、第2のマイクロ流体チャンバは、増幅チャンバであることが好ましい。増幅チャンバは、PCRチャンバであることがより好ましい。
そのような増幅チャンバは、例えば、Young,S.S.ら(J.Micromechanics and Micoengineering、2003 13、768〜774)によって記述されているように、当分野で周知なので、当業者なら第2のチャンバを含むことができるはずであることが理解される。
別の実施形態では、マイクロ流体装置は、第2のマイクロ流体チャンバと流体連通する第3のマイクロ流体チャンバを備え、上記第3の流体チャンバは、検体の存在を検出するためのセンサを備える。
特に好ましい実施形態では、センサは、相互インダクタンス装置を含む。
別の好ましい実施形態では、マイクロ流体装置は、流体をチャンバからチャンバへ移動させるための少なくとも1つの一体型ポンプを備える。一体型ポンプは、磁気ポンプであることが好ましい。
マイクロ流体装置は、通電構造のそれぞれに電圧を所定の順序で所定の期間にわたって別々に印加するための手段をさらに備えることが好ましい。
この期間は、1〜10秒の範囲内であることが好ましく、5秒未満であることがより好ましい。
マイクロ流体装置は、少なくとも第1の流体貯蔵器をさらに備えることが好ましい。
一実施形態では、少なくとも第1の貯蔵器は、第1のマイクロ流体チャンバと流体連通する。少なくとも第1の貯蔵器は、装置に組み込まれることが好ましい。
別の実施形態では、第1のマイクロ流体チャンバは、第1の流体貯蔵器を形成する。
流体は、超常磁性ビーズを含むことが好ましい。
流体は、溶解バッファ(lysis buffer)も含むことがより好ましい。
別の実施形態では、マイクロ流体装置は、少なくとも第2の流体貯蔵器をさらに備える。
流体は、他の構成要素を含むことができ、例えば、場合により抗凝血剤を含むことができることは明らかである。
本発明の第2の態様によれば、生体分子を含む試料を調製するためのラボオンチップシステムが提供され、このラボオンチップシステムは、
a)第1の態様による装置と、
b)試料および流体を第1のマイクロ流体チャンバに導入するための手段と
を備える。
a)第1の態様による装置と、
b)試料および流体を第1のマイクロ流体チャンバに導入するための手段と
を備える。
この態様の一変形例では、生体分子を含む試料を調製するためのラボオンチップシステムが提供され、このラボオンチップシステムは、
a)第1の態様の変形例の装置と、
b)試料および流体を第1のマイクロ流体チャンバに導入するための手段と
を備える。
a)第1の態様の変形例の装置と、
b)試料および流体を第1のマイクロ流体チャンバに導入するための手段と
を備える。
この変形例は、関連する装置が上述の第1の態様の変形例による装置である限りにおいて異なることが分かる。
本発明の第2の態様(本発明の装置のいずれかの変形例を備えるシステムを含む)の以下の論議では、説明される好ましい特徴が、必要な変更を加えて本発明のこの態様のいずれかの変形例に適用され得ることが理解される。
装置の第1、第2、第3および第4の通電構造は、電圧を所定の順序で印加されることが好ましい。
好ましい一実施形態では、第5の通電構造が、第1のマイクロ流体チャンバ内に超常磁性粒子を保持するように働く。
超常磁性粒子は、任意の適当な直径を有することができ、好ましくは、50nm〜10μmの平均直径を有することが理解される。例えば、3μmの平均直径が検討される。他の直径も可能である。
超常磁性粒子は、対象の検体に結合するように機能化されることが好ましい。検体は、核酸であることがより好ましい。
好ましい一実施形態では、システムは、第1のマイクロ流体チャンバと流体連通する洗浄バッファを備える第2の貯蔵器をさらに備える。システムは、第1のマイクロ流体チャンバと流体連通する溶出バッファを含む第3の貯蔵器をさらに備えることがより一層好ましい。
試料は、任意の適当な生体材料でよいことが理解される。試料は、少なくとも1つの細胞を含むことが好ましい。試料は、全血試料を含むことがより好ましい。
好ましい一実施形態では、流体は、溶解バッファをさらに含む。
さらに好ましい一実施形態では、流体は、抗凝血剤をさらに含む。
本発明の第3の態様によれば、試料から生体分子を含む検体を分離させるための方法が提供され、この方法は、
i)試料を第1の態様による装置の入口に導入するステップと、
ii)超常磁性粒子を含む流体を装置の第1のマイクロ流体チャンバに導入するステップと、
iii)装置の第1、第2、第3および第4の通電構造に電圧を所定の順番に印加し、それによって第1、第2、第3および第4の通電構造に電流を流すステップと
を備え、
ステップi)は、ステップii)の前に、またはステップii)と同時に、またはステップii)の後で実施することができ、上記超常磁性粒子は、対象の検体に結合するように機能化され、
ステップiii)は、ステップi)と同時に、またはステップi)の直後に実施され、
上記電流により通電構造は非永久的に磁化されるようになり、それによってマイクロ流体チャンバ内で上記超常磁性粒子を3次元で磁気作動させることになり、上記超常磁性粒子の上記磁気作動が上記試料と上記流体のカオス的混合を引き起こして、機能化された超常磁性粒子が検体と接触する機会を増大させることになる。
i)試料を第1の態様による装置の入口に導入するステップと、
ii)超常磁性粒子を含む流体を装置の第1のマイクロ流体チャンバに導入するステップと、
iii)装置の第1、第2、第3および第4の通電構造に電圧を所定の順番に印加し、それによって第1、第2、第3および第4の通電構造に電流を流すステップと
を備え、
ステップi)は、ステップii)の前に、またはステップii)と同時に、またはステップii)の後で実施することができ、上記超常磁性粒子は、対象の検体に結合するように機能化され、
ステップiii)は、ステップi)と同時に、またはステップi)の直後に実施され、
上記電流により通電構造は非永久的に磁化されるようになり、それによってマイクロ流体チャンバ内で上記超常磁性粒子を3次元で磁気作動させることになり、上記超常磁性粒子の上記磁気作動が上記試料と上記流体のカオス的混合を引き起こして、機能化された超常磁性粒子が検体と接触する機会を増大させることになる。
この態様の変形例では、試料から生体分子を含む検体を分離させるための方法が提供され、上記方法は、
i)試料を第1の態様の変形例による装置の入口に導入するステップと、
ii)超常磁性粒子を含む流体を装置の第1のマイクロ流体チャンバに導入するステップと、
iii)装置の通電構造に電圧を所定の順番に印加し、それによって装置の通電構造に電流を流すステップと
を備え、
ステップi)は、ステップii)の前に、またはステップii)と同時に、またはステップii)の後で実施することができ、上記超常磁性粒子は、対象の検体に結合するように機能化され、
ステップiii)は、ステップi)と同時に、またはステップi)の直後に実施され、
上記電流により通電構造は非永久的に磁化されるようになり、それによってマイクロ流体チャンバ内で上記超常磁性粒子を3次元で磁気作動させることになり、上記超常磁性粒子の上記磁気作動が上記試料と上記流体のカオス的混合を引き起こして、機能化された超常磁性粒子が検体と接触する機会を増大させることになる。
i)試料を第1の態様の変形例による装置の入口に導入するステップと、
ii)超常磁性粒子を含む流体を装置の第1のマイクロ流体チャンバに導入するステップと、
iii)装置の通電構造に電圧を所定の順番に印加し、それによって装置の通電構造に電流を流すステップと
を備え、
ステップi)は、ステップii)の前に、またはステップii)と同時に、またはステップii)の後で実施することができ、上記超常磁性粒子は、対象の検体に結合するように機能化され、
ステップiii)は、ステップi)と同時に、またはステップi)の直後に実施され、
上記電流により通電構造は非永久的に磁化されるようになり、それによってマイクロ流体チャンバ内で上記超常磁性粒子を3次元で磁気作動させることになり、上記超常磁性粒子の上記磁気作動が上記試料と上記流体のカオス的混合を引き起こして、機能化された超常磁性粒子が検体と接触する機会を増大させることになる。
この変形例は、関連する装置が上述の第1の態様の変形例による装置である限りにおいて異なることが分かる。
本発明の第2の態様(本発明の装置のいずれかの変形例を備えるシステムを含む)の以下の論議では、説明される好ましい特徴が、必要な変更を加えて本発明のこの態様のいずれかの変形例に適用され得ることが理解される。
上述のように、装置の歯の楕円形状は、先端部の磁場だけが強くなる三角形などの歯の他の形状とは対照的に、歯の周囲により均等に分布する磁場を引き起こすことを見出している。これは、ビーズのカオス的運動による混合を高めることになる。
好ましい一実施形態では、装置は、第5の通電構造をさらに備え、第5の通電構造は、ステップiii)の後で電圧を印加され、超常磁性粒子は、磁気相互作用によって第5の通電構造に付着され保持される。
各通電構造を流れる電流は、100mA〜10Aの範囲内であることが好ましい。100mA〜750mAであることがより好ましい。500mA未満であることが最も好ましい。
好ましい一実施形態では、この方法は、好ましくは、超常磁性粒子が第5の通電構造上に保持されていれば、装置の第1のマイクロ流体チャンバに洗浄溶液を導入するステップをさらに備える。
この方法は、装置の第1のマイクロ流体チャンバに溶出溶液を導入するさらなるステップを場合により備える。
好ましい一実施形態では、電圧は、ビーズが第1のマイクロ流体チャンバ内の所定の位置に移動できるように、第1、第2、第3および第4の通電装置のそれぞれに十分長い間印加される。
第3の態様の方法の一実施形態では、通電構造は、1、4、3、2の順に電圧を印加される。しかし、電圧は、超常磁性粒子を含む流体と試料との最適混合を得るように、通電構造に任意の所望の順序で印加され得ることが当業者には明らかであろう。
本発明の好ましい一実施形態では、試料は、少なくとも1つの細胞を含む。試料は、血液試料であることがより好ましい。
試料が少なくとも1つの細胞を含んでいるとき、流体は溶解バッファをさらに含み、試料とバッファを混合することによって細胞を溶解させることが好ましい。
検体は、核酸であることが好ましい。DNAがより好ましい。
第3の態様の方法は、好ましくは、検体の存在を検出するさらなるステップを備える。
試料が第1のマイクロ流体チャンバを流れる速度は、20〜100μm/sの範囲内であることが好ましい。
本発明の第4の態様によれば、試料内の検体の存在を検出するための装置であって、
i)相互インダクタと、
ii)渦巻き相互インダクタに隣接する第1の表面と反対側の第2の表面とを有する絶縁層と、
ii)少なくとも1つのプローブが固定されている第1の表面と、第1の表面の反対側にありかつ絶縁層の第2の表面に隣接するように配置された第2の表面とを有する試料接触層と
を備え、
相互インダクタが、第1のコイルおよび第2のコイルを備える、装置が提供される。
i)相互インダクタと、
ii)渦巻き相互インダクタに隣接する第1の表面と反対側の第2の表面とを有する絶縁層と、
ii)少なくとも1つのプローブが固定されている第1の表面と、第1の表面の反対側にありかつ絶縁層の第2の表面に隣接するように配置された第2の表面とを有する試料接触層と
を備え、
相互インダクタが、第1のコイルおよび第2のコイルを備える、装置が提供される。
第4の態様の好ましい一実施形態では、相互インダクタは、円形渦巻きコイル、正方形渦巻きコイル、蛇行積層渦巻きコイル、または城郭状積層型導体を備える。
好ましい一実施形態では、第1および第2のコイルは、第1のコイルが第2のコイルの上方に垂直に位置するように配置される。
別の好ましい実施形態では、第1および第2のコイルは、巻き合わされる。
検体の存在は、第1のコイルに交流電流を流し、第2のコイルで誘導電圧の変化を観測することによって検出されることが、当業者によって理解されるであろう。
プローブは、核酸であることが好ましい。プローブは、DNAであることがより好ましい。
好ましい一実施形態では、装置は、絶縁層より遠位にある渦巻き相互インダクタに隣接して位置するパーマロイなどの適切な高透磁率材料層をさらに備える。
絶縁層は、二酸化ケイ素を含むことが好ましい。
固定化層(immobilisation layer)は、任意の適当な材料、例えば金、アガロースまたはSi3N4を含み得ることが理解される。固定化層は、金を含むことが好ましい。
本発明の第5の態様によれば、液体試料中の検体を検出する方法であって、
a)検体を含有する試料を、検体に結合するように機能化された磁気ビーズと接触させるステップと、
b)磁気ビーズを試料から分離させるステップと、
c)ビーズを第4の態様の装置と接触させるステップであって、試料接触層上に固定された少なくとも1つのプローブが検体に結合し、それによって磁気ビーズを表面に保持する、ステップと、
d)渦巻き相互インダクタの相互インダクタンスの変化を測定するステップと
を備え、
相互インダクタンスの増大が、試料中の検体の存在を示す、方法が提供される。
a)検体を含有する試料を、検体に結合するように機能化された磁気ビーズと接触させるステップと、
b)磁気ビーズを試料から分離させるステップと、
c)ビーズを第4の態様の装置と接触させるステップであって、試料接触層上に固定された少なくとも1つのプローブが検体に結合し、それによって磁気ビーズを表面に保持する、ステップと、
d)渦巻き相互インダクタの相互インダクタンスの変化を測定するステップと
を備え、
相互インダクタンスの増大が、試料中の検体の存在を示す、方法が提供される。
検体は、核酸であることが好ましい。
プローブは、核酸であることがより好ましい。
磁気ビーズは、例えば常磁性ビーズとすることができる。
次に、本発明について、以下の図を参照しながらより詳細に説明する。
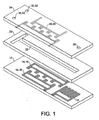
図1に示されているマイクロ混合器10は、3つの蛇行導体14、16、18を埋め込まれた、ガラスから形成されたベース層12を備える。PDMSから形成されている中心層20は、蛇行導体14、16、18の上方に位置する直線チャネル22を含み、ガラスから形成されている上層24は、上層24に埋め込まれた別の2つの蛇行導体26、28と、2つの入口ポート30、32と、出口ポート36とを有する。
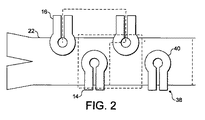
装置の寸法の一例が図2に示されており、同図には1つの混合ユニットの上面図が境界線と共に示されている。各混合ユニットは、各導体からの2つの隣接する歯を含む。チャネル22は、幅が150μm、深さが50μmである。導体14、16は、円形先端部40を有する歯38の形をしており、断面の高さが35μm、断面の幅が35μmであり、導体の円形先端部40の中心間距離は、x方向に100μm、y方向に65μmである。上部導体14および下部導体16の各列は、電源に交互に接続される。混合操作周期は2つの段階から構成される。最初の半周期に導体配列の一方がオンにされ、もう1つの方はオフにされる。次の半周期に導体配列の状態は逆にされる。各混合ユニットは、対向する導体配列からの2つの隣接する歯38から構成され、混合器は、互いに接続されている一連のかかる混合ユニットから構成される。3次元構成では、導体の切替えは、0.25サイクルごとに行われる。
図3は、半周期の作動の間に、750mAの電流が一方の導体配列に注入され、反対側の配列で切られているときに、導体の円形先端部40付近に磁場が生成された状態の1つの歯38を示す。濃淡マップは、導体表面の上方10μmの所の磁場強度の変化を示しており、この場合、円形先端部の中心(P点)での磁場の最大値は約6000A/mである。磁場強度が最大値になる導体付近および導体先端の円の内側にある粒子に、最大の力(5.5pN)が加えられる。磁場は中心点Pで最大であるが、粒子に加わる力はこの点では比較的小さい。これは、磁力が点Pの近傍でほとんど一定である磁場の勾配に比例するということによるものである。導体から遠ざかるとき、この力は、磁気モーメントに影響を与えることになる磁場の劇的な減少によって著しく低下する。
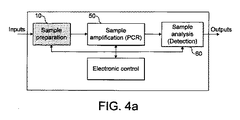
図1および図2に示されているマイクロ流体装置は、図4aおよび図4bに概略的に示されているような「ラボオンチップ」装置に組み込むことができる。図4aでは、この装置は、増幅チャンバ50と検出器を備える試料分析ユニット60とに直列に連接された、図1に示されているような試料調製装置10を備える。
図4bは、試料調製装置10をより詳細に示す。この装置は、混合領域に連接された入口からマイクロポンプまでと入口より遠位にある分離領域とを備える。
DNA試料の分離および調製のための、図4に示されているようなラボオンチップの使用は、4つのステップ、すなわち
・細胞溶解
・DNA結合
・汚染物を浄化/分離するための洗浄
・再懸濁
を含む。
・細胞溶解
・DNA結合
・汚染物を浄化/分離するための洗浄
・再懸濁
を含む。
最初の2つのステップは、カオス混合器内で実行され、続いて、下流プロセスが分離器内で実行される。最初に、ヒト血液と粒子を含む溶解バッファとが、例えば直接注入によって、または重力下で、または下流に印加された負圧によって、または外部ポンプもしくは一体型マイクロポンプを使用して、2つの入口ポートを経由して装置に、例えばマイクロチャネルに導入される。粒子の混合は、微小導体によって生成された局所の時間依存性磁場を印加して磁気泳動力による粒子の運動でカオス的移流を作り出すことによって実行される。埋め込まれた高アスペクト比の導体により、比較的大きい電流が強磁場を生成して磁性粒子を移動させることができる。上部ガラスウェハと下部ガラスウェハの両方についている導体は、効率的な空間混合を実行するために必要である。溶解バッファに適切な濃度の粒子を使用すると、粒子のカオス的移流が流体パターンに変えられ、したがって、溶解バッファと血液を混合することができる。混合および細胞溶解の間、解放されたDNA分子は粒子の表面上に吸着される。
混合後、次いで、全溶液は下流に流され、無傷のDNA/粒子は、チャネルの下部に製作された別の蛇行導体を使用することによって他の汚染物から分離される。チャンバを使用する実施形態では、1つ(または複数)の下部コイルは、この目的のために利用され得る。この導体は、一定の直流電流によって活性化され、生成された磁場により、粒子はチャネルの下面に集められ、他の汚染物は流れで洗い落とされる。
続いて、洗浄バッファがチャネルに導入され、それによって残留汚染物を洗浄し除去する。最後に、導体はオフされ、再懸濁バッファがシステムに注入され、精製済みDNA/粒子はシステム内で再懸濁される。次に、DNAは、DNA/粒子複合体を、標準PCRプロトコルによって必要とされている65℃を超える温度に加熱したときに解放されるので、試料はPCRに直接使用され得る。
カオス的マイクロ流体混合器の設計
機能化されたナノ粒子およびマイクロ粒子またはビーズは、化学結合のための大きな比表面積を与えるとともに、バイオアッセイ用「移動基板」および生体内応用(Gijs 2004)として有利に使用され得る。磁鉄鉱(Fe3O4)または磁鉄鉱の酸化型磁赤鉄鉱(γ−Fe2O3)の存在により、磁性粒子は外部磁場内で磁化される。この外部磁場は、永久磁石または電磁石によって生成されるものであり、これらの粒子を磁気泳動力によって操作し、それによって液体中での粒子の移動を引き起こすために使用され得る。粒子が小型であるため、すなわち100μmから5nmまでの範囲(Pankhurstら 2003)であるため、粒子は、外部磁場が除去されると粒子の磁気特性を失い、超常磁性特性を示す。この追加の利点は、粒子が作動用ラベルとして使用される後続の分析で、所望の生物学的存在、例えば細胞、DNA、RNA、たんぱく質などをそれらの自然環境から分離させるために利用されている。生体細胞/粒子複合体を汚染物から分離させる前に、磁性粒子は、標的細胞を含有する生体流体溶液全体にわたって分散させられるべきである。これは、粒子を有する標的にタグ付けするのに役立つ混合プロセスによって行われる。次の段階では、磁性粒子に付着された細胞だけが、分離プロセスで分離されることになり、生体流体混合物の残り部分は、磁力によって影響を受けないままである。磁気泳動力に基づくマイクロ装置内での粒子の分離は、文献(Choiら 2001;Doら 2004;Ramadanら 2006)で報告されている。
機能化されたナノ粒子およびマイクロ粒子またはビーズは、化学結合のための大きな比表面積を与えるとともに、バイオアッセイ用「移動基板」および生体内応用(Gijs 2004)として有利に使用され得る。磁鉄鉱(Fe3O4)または磁鉄鉱の酸化型磁赤鉄鉱(γ−Fe2O3)の存在により、磁性粒子は外部磁場内で磁化される。この外部磁場は、永久磁石または電磁石によって生成されるものであり、これらの粒子を磁気泳動力によって操作し、それによって液体中での粒子の移動を引き起こすために使用され得る。粒子が小型であるため、すなわち100μmから5nmまでの範囲(Pankhurstら 2003)であるため、粒子は、外部磁場が除去されると粒子の磁気特性を失い、超常磁性特性を示す。この追加の利点は、粒子が作動用ラベルとして使用される後続の分析で、所望の生物学的存在、例えば細胞、DNA、RNA、たんぱく質などをそれらの自然環境から分離させるために利用されている。生体細胞/粒子複合体を汚染物から分離させる前に、磁性粒子は、標的細胞を含有する生体流体溶液全体にわたって分散させられるべきである。これは、粒子を有する標的にタグ付けするのに役立つ混合プロセスによって行われる。次の段階では、磁性粒子に付着された細胞だけが、分離プロセスで分離されることになり、生体流体混合物の残り部分は、磁力によって影響を受けないままである。磁気泳動力に基づくマイクロ装置内での粒子の分離は、文献(Choiら 2001;Doら 2004;Ramadanら 2006)で報告されている。
それにもかかわらず、レイノルズ数がしばしば1未満である微小規模装置では、混合は、乱流がないため、ささいなタスクではない。そのような状況では、混合は分子拡散だけに頼る。小さい球状分子の中での比較的大きな球体の希薄溶液の拡散係数は、下記のストークスアインシュタインの式によって推定される(Mitchell 2004)。
ここで、KBはボルツマン定数、Tは絶対温度、μは溶液の動的粘度、そしてdは拡散粒子の直径である。拡散時定数τは、拡散距離の2乗に比例しており(τ=L2/D)、100μm離れて水溶液中に分散された直径1μmの粒子の場合、最長で105秒程度である。明らかに、そのような拡散時間は現実的でなく、何らかの改善したメカニズムが、混合プロセスを容易にするために使用される必要がある。
ここで、KBはボルツマン定数、Tは絶対温度、μは溶液の動的粘度、そしてdは拡散粒子の直径である。拡散時定数τは、拡散距離の2乗に比例しており(τ=L2/D)、100μm離れて水溶液中に分散された直径1μmの粒子の場合、最長で105秒程度である。明らかに、そのような拡散時間は現実的でなく、何らかの改善したメカニズムが、混合プロセスを容易にするために使用される必要がある。
拡散プロセスを強化するために、様々なタイプのフィード構成を有する(複数)積層が、受動マイクロ混合器で使用されている(Kochら 1999)。この考えは、狭い混合チャネルを使用して拡散距離スケールを短縮するものである。Split−and−recombine(SAR)構成(Haverkampら 1999)は、流れを分割し後で接合することによって混合を向上させることができる。そのような構成は、連続した複数積層パターンを作り出し、界面積を増大させる。しかし、粒子を含む流体の混合に積層を使用することの1つの欠点は、狭いチャネル内で目詰まりする確率が高いことである。もう1つの手法は、受動装置において特殊な空間的幾何形状および構造(例えば、障害物(Wangら 2002)、3次元チャネル(Liuら 2000)、溝(Stroock 2002)など)を製作することによるか、あるいは能動装置において外力(例えば、誘電泳動場(Devalら 2002)、電気浸透場(Linら 2004)、圧力場(Deshmukhら 2000)、温度場(Tsaiら 2002)など)を加えることによって、カオス的移流を発生させることである。カオス的移流は、界面積を増大させ、続いて、混合プロセスを向上させる。最近、分離に加えて、磁気泳動力が、溶液中の粒子の混合を向上させるために利用されている(Ridaら 2003;Rongら 2003;Suzukiら 2004)。ここで、カオス的磁性粒子をベースとするマイクロ混合器の設計、および様々な駆動パラメータで装置を特性化するための数値モデルについて説明する。この目的のために、電磁モデルとマイクロ流体モデルと粒子動力学モデルとを組み合わせたものが使用されている。
導体が、磁気泳動力(以後、磁力)、したがって粒子運動のカオス的パターンを作り出すとともに、生体細胞のラベリングを強化するために利用される。2つの流れ、すなわち標的細胞の懸濁液と粒子を含むバッファとが、チャネルに導入され、圧力駆動流によって操縦される(図2参照)。細胞は、チャネルの上半分の部分にある主流を流れ(懸濁生体流体の対流によって運ばれる)、磁性粒子の運動は、周囲の流れ場と2つの蛇行導体配列の周期的活性化によって生成された局所的な時間依存性磁場とによって影響を受ける。上流側および下流側の様々な位置からの粒子が、最大磁場が存在する最寄りの活性化された先端部の中心の方に吸引される。カオス的パターンが、適切な構造的幾何形状と導体への周期的電流注入とを利用することによる粒子運動で作られ、それによってチャネル内の粒子の広がりを高める。
粒子に加わる磁力は、外部磁場勾配および粒子の磁化の関数である。脱イオン水では、直線領域内の粒子に与えられる磁力は、次式によって表される。
ここで、dは球状粒子の直径であり、
Hは外部磁場であり、
Fmは磁力であり、
μrは粒子の比透磁率であり、
μ0は真空の透磁率である。
ここで、dは球状粒子の直径であり、
Hは外部磁場であり、
Fmは磁力であり、
μrは粒子の比透磁率であり、
μ0は真空の透磁率である。
磁力は外部磁場の勾配に沿って印加され、粒子はより高い磁場領域の方に吸引される。この研究(M−280、Dynabeads、Dynal、Oslo、Norway)に使用された参照粒子の比透磁率および直径は、それぞれ2.83および1.76μmである。
磁力は3次元であり、かつその力のz成分は下方に向いており、これらの力は、重力とともに、粒子をチャネルの下部の方に引っ張り、粒子の運動を2次元パターンに制限することに留意されたい。実際、この成分は、粒子のカオス的運動には寄与せず、混合プロセスに影響しないと考えられる。したがって、この研究では、チャネル下部の表面に近接する平坦な力が対象とされ、シミュレーション手順は2次元ベースで行われる。
媒質に対する粒子の運動は、クリーピング流れと考えられ、したがって、粒子にかかる抗力は、ストークス法によって求めることができる。磁力および抗力による粒子の速度は、ニュートンの第2の法則である次式によって説明することができる。
ここで、mpは粒子の質量であり、Vは流体に対する粒子の相対速度であり、μは動的粘度であり、dは粒子の直径である。Vmという用語は、磁力がかけられた後、粒子が到達する終端速度である。使用された粒子(密度1.4g/cm3)および室温での水の粘度(0.001kg/ms)の場合の粒子緩和時間(τ=d2ρ/18μ)は、0.1μs程度である。したがって、運動の加速段階は無視することができ、粒子は、遅延なしに磁力に反応すると考えられる。各瞬時の粒子の総合速度(Vp)は、流れ場による速度(Vf)と磁場による速度(Vm)との和になるはずである。
ここで、mpは粒子の質量であり、Vは流体に対する粒子の相対速度であり、μは動的粘度であり、dは粒子の直径である。Vmという用語は、磁力がかけられた後、粒子が到達する終端速度である。使用された粒子(密度1.4g/cm3)および室温での水の粘度(0.001kg/ms)の場合の粒子緩和時間(τ=d2ρ/18μ)は、0.1μs程度である。したがって、運動の加速段階は無視することができ、粒子は、遅延なしに磁力に反応すると考えられる。各瞬時の粒子の総合速度(Vp)は、流れ場による速度(Vf)と磁場による速度(Vm)との和になるはずである。
2次元の数値シミュレーションは、粒子間に磁気相互作用または流体力学的相互作用がないこと(一方向結合)、および、粒子が個々に移動しているかのように粒子の運動が処理されることを前提として実施される。この前提は、小粒子が懸濁液中で低濃度である、すなわち1015粒子数/m3未満である場合に有効である(C.MikkelsenおよびH.Bruus、「Microfluidic capturing−dynamics of paramagnetic bead suspensions」、Lab Chip、Vol.5、pp.1293〜7、2005)。ニュートン流体(水)場および時間依存性磁場は、市販のmultihysics finite element package(マルチフィジックス有限要素パッケージ) Comsol(COMSOL、英国)を使用して計算され、これらの場による粒子の速度が引き出される。次いで、粒子の軌道が、Matlabでオイラー積分法(次式)を用いて速度の和を積分することによって求められる。
細胞の軌道は、細胞が磁気的に非活動状態にあることを除けば、同じラグランジュ追跡法を用いて得られる。最適化され得る構造的幾何形状および寸法(先に説明済み)、そしてまた、予備研究から得られた、熱発生が問題でない許容電流量(750mA)は、複数の定数パラメータおよび2つの駆動パラメータと見なされることがあり、磁気活性化周波数および流速が変化する。周波数と速度の比は、無次元のストローハル数(St)(次式)に比例する。
ここで、fは周波数であり、Lは特性長(この場合、2つの隣接する歯の間の距離)であり、Vは流体の平均速度である。シミュレーションは、St=0.2〜1の範囲で行われる。生物学的存在のサイズは、数ナノメートル(たんぱく質)から数マイクロメートル(細胞)の範囲とすることができる。この研究では、細胞は、直径1μmの球と見なされる。見掛け流速は、10−3程度のレイノルズ数をもたらす10μm/s程度であり、流れが層状であることを示す。
ここで、fは周波数であり、Lは特性長(この場合、2つの隣接する歯の間の距離)であり、Vは流体の平均速度である。シミュレーションは、St=0.2〜1の範囲で行われる。生物学的存在のサイズは、数ナノメートル(たんぱく質)から数マイクロメートル(細胞)の範囲とすることができる。この研究では、細胞は、直径1μmの球と見なされる。見掛け流速は、10−3程度のレイノルズ数をもたらす10μm/s程度であり、流れが層状であることを示す。
混合度およびシステムの効率を定量的に求めるために、2つの基準が、シミュレーションパラメータの調査対象範囲に対して計算される。標的細胞のラベリング効率は、混合器を特性化するための主要指標として使用された。この方法は、粒子および細胞の軌道を監視して、粒子と細胞の混合領域内での衝突(もしあれば)を予測するという考えを使用している(H.Suzukiら、「A chaotic mixer for magnetic bead−based micro cell sorter」、J.Microlectromech.Syst.,Vol.13、779〜90、2004)。球状粒子の中心と細胞の中心との間の距離がそれらの半径の和よりも小さくなると、衝突が起こり、次いで細胞が粒子に付着されると考えられる。複数細胞の単一粒子への付着が可能であり、各衝突の後、粒子の軌道は、新たな自由体示力図を用いて再計算されなければならない。駆動力は細胞/粒子複合体についても同じである(磁力が単に粒子に印加される)が、抗力係数は、付着細胞の数に応じて変更される必要がある。続いて、ラベリング効率(LE)、すなわち入った細胞の総数に対するタグ付き細胞の割合が、混合プロセスの一定期間にわたって計算される。
規定指標の補足である最大リアプノフ指数(λ)が、磁性粒子のカオス的移流を混合品質の共通の定義として定量化するために用いられた。この場合、スプロットの方法(J.C.Sprott、Chaos and Time−Series Analysis、Oxford University Press、Oxford、2003)が、最大リアプノフ指数(以後、λ1)を計算するために使用される。この方法は、最初に近接する2つの粒子を追跡するという一般的な考えを利用し、粒子の平均対数分離率を計算する。数値的手順が図5に示されている。任意粒子の場合、選択された粒子から微小距離d(0)にある仮想粒子が検討され、これらの粒子の軌跡が追跡される。各時間ステップの最後に、実粒子と仮想粒子との間の新たな距離d(t)、さらにln|d(t)/d(0)|が計算される。次いで、仮想粒子は、仮想粒子と実粒子の接続線に沿って、距離d(0)を置いて配置される。このプロセスをいくつかの時間ステップで繰り返した後、λ1は、次式によって収束され求められる。
ここで、Δtは1つの時間ステップの期間であり、nはステップ数である。様々な粒子に対するλ1の検討により、概略20秒後にλ1は収束値に近づくことが分かる。したがって、LEとλ1の両指標は、混合期間20秒にわたって計算される。
ここで、Δtは1つの時間ステップの期間であり、nはステップ数である。様々な粒子に対するλ1の検討により、概略20秒後にλ1は収束値に近づくことが分かる。したがって、LEとλ1の両指標は、混合期間20秒にわたって計算される。
図6aは、粒子および細胞の、3.5個の混合ユニット内で移流する間の位置を示す。生体細胞(赤点、図の上部分)および磁性粒子(青点、図の下部分)が、それぞれ区域の上半分および下半分の左側から同じ濃度で第1の混合ユニット(交差線A−A)に入る。磁気作動がないとき、細胞と粒子は共に、その初期区域内にとどまり、単純にポアズイユ流れの放射線速度プロファイルの流線をたどる。この状況では、タグ付けが、チャネルの中心領域内だけで2等分部分間の界面に沿って行われ得る。すべての寸法が、特性長に正規化される。
図6bは、同じ混合ユニット内での磁気作動(St=0.4、V=40μm/s)の典型的な効果を様々なスナップショットで示す。外部場が印加されると、粒子は流線ならびに界面を横切って進む。したがって、粒子は、粒子が細胞に遭遇しタグを付けることができる上方部分内に広がる機会を見つける。磁気的に非活動状態の細胞は、摂動が適用されなかったときに、以前の状況と同じ挙動をすることになる。観察され得るように、チャネルの中心線から程遠いいくつかの粒子は、この領域における磁力が、下方アレイが活性化される半周期の間にその粒子を吸引するほど強くはないので、下方部分内にとどまる。
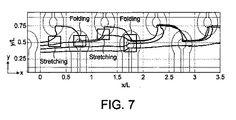
提案されたマイクロ混合器におけるカオス的移流の基本原理を説明するために、図7に示されているような4個の粒子の軌道は、混合器内での典型的な軌道と考えられる。粒子は、St=0.2かつV=45μm/sであるときに、第1の混合ユニット内で10μmmの間隔をあけて均等に解放される。最初の半周期の間、第1のアレイ(導体I)はオンであり、第2のアレイ(導体II)はオフである。粒子Iは、y方向の強い磁力を感知し、この方向に移動する傾向があるが、主流によってx方向に移流される。ポアズイユ流れの抗力と磁力の両方を決定する、チャネル内の粒子の位置に応じて、粒子Iは、x方向の正または負の速度をもつことができることに留意されたい。粒子2は、導体Iからさらに離れており、最初の半周期の間に完全に上方に吸引される機会を見つけることはない。したがって、当初隣接していた2個の粒子は分岐して、長方形で印が付けられているストレッチングメカニズムを引き起こす。この段階では、粒子Iは、様々な流線と交差する標的細胞にさらされ、衝突した場合にその細胞を捕獲する。
後続の半周期では、電流が導体IIに注入され、導体Iの電流は切られる。この段階では、粒子1は、以前の位置から自由に移動し、磁力の十分強い領域に接近するまで主流によってさらに移流され、その結果、導体IIの中心に引っ張られる。粒子2は、y方向の小さい大きさの磁力を受けるが、x方向の磁力によって主流よりも早く移動する傾向がある。この段階では、粒子2は、標的細胞があれば、1本の主流に沿って標的細胞に接近しタグ付けする。離れた2本の軌道が集まり、いくつかの動作条件でも交錯するフォールディングが達成される。連続するストレッチングおよびフォールディングをこのように引き起こすことができ、これがカオスの基本原理である。
導体Iから離れすぎていて吸引されない粒子3および4は、流体によって流れに沿って引っ張られ、チャネルの上半分の方に除々に移動する。2〜3の混合ユニットを通過した後、ほとんど全部の粒子が、細胞の領域まで到達し、2つの導体の先端部に限定されるカオス領域内で動揺する。
最大リアプノフ指数の計算では、21個の粒子が、最初の混合ユニットの上半分内に初期位置として均等に分散され、(1が、それぞれの個々の粒子に対して計算される(図8参照)。時限は、粒子が粒子の(1の一定値に近づいたときに20秒である。上方部分(細胞が存在する)内の全領域にわたってカオスの程度を定量化するために、21個の粒子の(1の平均値が採用される。図9は、様々な駆動パラメータに対するLEの変化(St=0.2〜1)を示しており、各グラフは、一定流体速度(V=30〜50μm/s)に対するLEの値を表す。同じ駆動パラメータ範囲にわたって計算された(1の結果が、図10に示されている。(1のグローバル変動は、様々なバルク流速にとって理想に近い。すなわち、最大カオスはSt=0.4で起こり、最小カオスはSt=0.8で起こる。LEは、0.6未満のストローハル数で同様の挙動を示し、これは、カオスの増大がラベル付き細胞の増加につながることを意味する。
(1およびLEの最大値は、St=0.4で実現され、それぞれ0.36および67%である。さらに大きいストローハル数(すなわち0.8)では、2つの指標は異なる変化を示す。高いバルク流速(40μm/s)では、2つの指標間の良好な一致が依然として観察され得るが、速度が低下した場合、2つの指標は相反する挙動を示す。低い流速では、いくつかの粒子は、その粒子が上方導体アレイ内の1つの先端部の中心に吸引されるまで移流される。チャネル壁付近では、流速は、チャネルの中心領域よりもずっと低い。磁力は導体の中心で著しく大きいので、これらの粒子は、この領域に付着されることになる。電流が反対側のアレイに切り替えられた後でも、流体速度が低いために、粒子は、前の導体から脱出する機会をもつことはない。したがって、次の期間に、粒子は、同じ領域の方へ急に引っ張られ、再び捕獲されることになる。そのような動作条件では、混合器は一部分しかカオス的でなく、混合は不完全である。しかし、捕獲された粒子は、複数の細胞にタグ付けすることができる固定ポストのように働き、それによってLE値を増大させる。効率は比較的高いが、実際には、捕獲された粒子がチャネルを詰まらせ得るという難しい問題がある。しかし、ストローハル数が小さいとき、すなわちより長い時限の場合、粒子は、たとえ速度が低くてもこれらの中心から離れる機会をもつ。
2次元数値の検討は、マイクロ混合器の効率を特性化するために行われる。最大ラベリング効率は67%であることが分かる。カオス的移流の指標としてのリアプノフ指数は、ストローハル数に大きく依存することが分かっており、最大カオス強さは、0.4に近いストローハル数で実現される。混合器のラベリング効率は、独立した指標としては使用できないことが示されている。したがって、両指標は、装置を特性化しながら考慮される必要がある。
本発明による装置の製造
本発明による装置(チップとしても知られている)は、例えば、MEMS技術の基本構成要素を使用して製造され得る。MEMS技術は、基板上に材料の薄膜を堆積させ、フォトリソグラフィ画像によって薄膜の上面にパターン付きマスクを付着させ、かつ薄膜をマスクに対して選択的にエッチングする能力を有する。実際の装置を形成するのは、これらの作業の構造化シーケンスである。
本発明による装置(チップとしても知られている)は、例えば、MEMS技術の基本構成要素を使用して製造され得る。MEMS技術は、基板上に材料の薄膜を堆積させ、フォトリソグラフィ画像によって薄膜の上面にパターン付きマスクを付着させ、かつ薄膜をマスクに対して選択的にエッチングする能力を有する。実際の装置を形成するのは、これらの作業の構造化シーケンスである。
MEMSプロセスは、PMMA/ガラス/シリコン/ポリスチレンなどの剛性基板材料で始まる。基板の上面上に、高透磁率層(例えばパーマロイ/ニッケル)が、例えば、分子線プロセスを用いてエンボス加工または堆積され得る。次いで、SiO2/PMMA/PDMS/ポリスチレンからなる絶縁層が、透過性層の上面上に堆積され得る。通電構造(コイル構造としても知られている)は、マスクおよびリソグラフィを用いてこの表面上に電気めっきされ得る。次いで、PDMS/PMMA/ポリスチレンからなる薄膜が、平面を形成するために、コイルの上面上にスピンコーティングされ得る。
マイクロ流体チャネル/チャンバが、例えば、所望の厚み、例えば150ミクロンの厚みの事前に準備されたPDMA/PMMA/ポリスチレンのキャストを用いて構成されてもよく、このシートから打ち出される。この後者の構造は、コイル電極を収容した2枚の同一剛性基板構造の間に挟まれ、プラズマボンディングを用いて接合される。入口ポートおよび出口ポートは、例えば、この構造をパンチングまたはドリルで穴あけしたものとすることができる。
概念実証チップ
以下の説明は、図17〜22に示されている本発明の実施形態に関する。
以下の説明は、図17〜22に示されている本発明の実施形態に関する。
これらの実施形態では、適度に生体適合性のある材料(例えばPDMS)からなりかつ厚み約150マイクロメートルの中央薄面が、中央薄面を貫通して形成された、好ましくは長方形の中心孔を有する。この孔の長さと幅は、適切な最終チャンバ容積、すなわち20マイクロリットルを与えるように計算される。この構成要素は、主要な溶解/混合チャンバの中心部を形成しており、厚み10〜100マイクロメートルの2つの類似材料層または適合性材料層の間に挟まれることによって閉鎖されている。これらのカバープレートは、チャンバへの入口ポート路および出口ポート路を可能にし、したがって形成できるようにする孔を担持する。
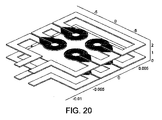
通電構造(すなわち1つまたは複数のコイル)が、例えば通電構造が空洞の周囲に対称的に配置されるように、これらの薄層のそれぞれの上または中に配置される。図17〜20を参照されたい。これらのコイルへの接続部は、この複合平面構造の縁部に引き出される。
このような通電構造は、適切にスイッチされた電流が供給されると、磁場を形成させるとともに、空洞の主平面に対して垂直方向に折れさせる。
磁場強度は、パーマロイ合金、ニッケル、ミューメタルなどの適度に透過性のある磁性材料の裏当てを導入することによってさらに増幅される。この層と平面電磁石コイルとの金属接触を阻止するために、厚みが100マイクロメートル未満の絶縁層が導入される。
最後に、組立体全体は、PMMAなどの材料でできた2枚の外板の間に挟まれており、それによって、
1)システムに構造的剛性を与える機能と、
2)入口/出口ポートの固定部として働く機能と、
3)マイクロ流体網および電気回路網が密閉されるための清潔な環境を確保にする機能と
を果たす。
1)システムに構造的剛性を与える機能と、
2)入口/出口ポートの固定部として働く機能と、
3)マイクロ流体網および電気回路網が密閉されるための清潔な環境を確保にする機能と
を果たす。
概念実証の結果
以下の論議は、図21に示されている概念実証チップ、および図22に示されている、上記チップを使用して得られた結果に関する。
以下の論議は、図21に示されている概念実証チップ、および図22に示されている、上記チップを使用して得られた結果に関する。
FCS内4×106細胞数/mlと超常磁性ビーズを含有する溶解バッファ(Dynabeads DNA Direct Universal、製品番号630.06)とが、この装置を試験するために使用された。それぞれ10マイクロリットルが、入口ポートを介して溶解チャンバ内に直接搬送された。注入試料は、以下の6つの混合条件のうちの1つを1分間受けた。
・混合なし(制御)
・50mA 4Hz
・100mA 4Hz
・150mA 4Hz
・200mA 4Hz
・200mA 0.2Hz
・混合なし(制御)
・50mA 4Hz
・100mA 4Hz
・150mA 4Hz
・200mA 4Hz
・200mA 0.2Hz
各混合条件の後、DNA付着ビーズは、溶解チャンバから収集され洗浄され、ビーズ上に吸収されたDNAは、加熱ブロック内において65℃で5分間加熱することによって溶出された。上澄み(溶出されたDNAを含有する)が磁場を使用して取り除かれた。PCRが試料に対して実行された。使用されたハイパーラダー(hyperladder)は、1Kb DNAエクステンションラダー(extension ladder)であった。得られた結果は、図22に示されている。
したがって、本発明による装置と上述の混合条件とを使用したときに、細胞の溶解が起こり、その後PCRを成功させることができた。対照的に、混合なしの制御条件下では、PCRは成功しなかった。したがって、本発明者らは、成功した微小規模の細胞の1分未満での混合および溶解を、本発明による装置を使用して実証する。
インダクタンスセンサの設計
従来、DNAハイブリダイゼーション検出(hybridization detection)が、蛍光タグ付け技術および光学読取り技術を用いて行われている。これらの技術は、特定のプロトコルが熟練技術者によって高価な機器を用いて追従される従来の生物学研究所で有効である。さらに、従来のDNA検出は、全プロセスに追加費用を付加する、時間のかかる手順である。これらの問題を解決するため、全プロセスを最小化し単一の使い捨てチップに組み入れるために、10年超にわたって相当な努力がなされてきた。光学的方法によるDNA検出は、信頼性があり盛んに実行されているが、電子チップ上に容易には実装することができない。小型化の可能性がある代替方法が、近年調査されている。これらの方法の中には、電気化学技法(R.M.Umekら、「Electronic detection of nucleic acids, a versatile platform for molecular diagnostics」、J.Molecular Diagnostics、Vol.3、74〜84、2001)、圧電センサ(T.Tatsumaら、「Multichannel quartz crystal microbalance」、Anal.Chem.,Vol.71、No.17、pp.3632〜3636、Sep.1999)、インピーダンスベースの技法(F.Patolskyら、「Highly sensitive amplified electronic detection of DNA by biocatalyzed precipitation of an insoluble product onto electrodes」、Chemistry − A European Journal、Vol.9、pp.1137〜1145、2003)、およびキャパシタンス技法(E.Souteyrandら、「Direct detection of the hybridization of synthetic homo−oligomer DNA sequences by field effect」、J.Phys.Chem.B、Vol.101、pp.2980〜2985、1997)がある。ミクロンサイズの磁気ビーズもまた、DNA検出にラベルとして広く使用されている(J.Fritzら、「Electronic detection of DNA by its intrinsic molecular charge」、Proc.Nat.Acad.Sci.,Vol.99、No.22、pp.14 142〜6、2002) (L,Moreno−Hagelseibら、「Sensitive DNA electrical detection based on interdigitated A1/A1203 microelectrodes」、Sens.Actuators B、Chem.,Vol.98、pp.269〜274、2004) (P.A.Besseら、「Detection of a single magnetic microbead using a miniaturized silicon Hall sensor」、Appl.Phys.Lett.,Vol.80、pp.4199〜4201、2002)。磁気ビーズを使用することにより、DNAの簡単な操縦が可能となり、したがって、混合および分離プロトコルを容易にすることもできる(D.R.Baseltら、「A biosensor based on magnetoresistance technology」、Biosens.Bioeleectron.,Vol.13、No.7〜8、pp.731〜739、Oct.1998) (J.C. Rifeら、「Design and performance of GMR sensors for the detection of magnetic microbeads in biosensors」、Sens.Actuators A、phys.,Vol.107、No.3、pp.209〜218、2003)。
従来、DNAハイブリダイゼーション検出(hybridization detection)が、蛍光タグ付け技術および光学読取り技術を用いて行われている。これらの技術は、特定のプロトコルが熟練技術者によって高価な機器を用いて追従される従来の生物学研究所で有効である。さらに、従来のDNA検出は、全プロセスに追加費用を付加する、時間のかかる手順である。これらの問題を解決するため、全プロセスを最小化し単一の使い捨てチップに組み入れるために、10年超にわたって相当な努力がなされてきた。光学的方法によるDNA検出は、信頼性があり盛んに実行されているが、電子チップ上に容易には実装することができない。小型化の可能性がある代替方法が、近年調査されている。これらの方法の中には、電気化学技法(R.M.Umekら、「Electronic detection of nucleic acids, a versatile platform for molecular diagnostics」、J.Molecular Diagnostics、Vol.3、74〜84、2001)、圧電センサ(T.Tatsumaら、「Multichannel quartz crystal microbalance」、Anal.Chem.,Vol.71、No.17、pp.3632〜3636、Sep.1999)、インピーダンスベースの技法(F.Patolskyら、「Highly sensitive amplified electronic detection of DNA by biocatalyzed precipitation of an insoluble product onto electrodes」、Chemistry − A European Journal、Vol.9、pp.1137〜1145、2003)、およびキャパシタンス技法(E.Souteyrandら、「Direct detection of the hybridization of synthetic homo−oligomer DNA sequences by field effect」、J.Phys.Chem.B、Vol.101、pp.2980〜2985、1997)がある。ミクロンサイズの磁気ビーズもまた、DNA検出にラベルとして広く使用されている(J.Fritzら、「Electronic detection of DNA by its intrinsic molecular charge」、Proc.Nat.Acad.Sci.,Vol.99、No.22、pp.14 142〜6、2002) (L,Moreno−Hagelseibら、「Sensitive DNA electrical detection based on interdigitated A1/A1203 microelectrodes」、Sens.Actuators B、Chem.,Vol.98、pp.269〜274、2004) (P.A.Besseら、「Detection of a single magnetic microbead using a miniaturized silicon Hall sensor」、Appl.Phys.Lett.,Vol.80、pp.4199〜4201、2002)。磁気ビーズを使用することにより、DNAの簡単な操縦が可能となり、したがって、混合および分離プロトコルを容易にすることもできる(D.R.Baseltら、「A biosensor based on magnetoresistance technology」、Biosens.Bioeleectron.,Vol.13、No.7〜8、pp.731〜739、Oct.1998) (J.C. Rifeら、「Design and performance of GMR sensors for the detection of magnetic microbeads in biosensors」、Sens.Actuators A、phys.,Vol.107、No.3、pp.209〜218、2003)。
この実施例は、検出可能な粒子としてDNA鎖に付着された磁気ビーズを使用するDNAハイブリダイゼーション検出センサに関する。DNAハイブリダイゼーションによる磁気ビーズ濃度の増大が、インダクタンス変動の形で検出される。様々なタイプの磁気ビーズに対する平面渦巻きコイルセンサの応答性が調査され、センサの性能に対するコイル幾何形状ならびに周波数の効果が数値的に評価される。1つのコイルについて与えられた結果および数学的分析から、複数のコイルの場合を推定することができる。
DNAハイブリダイゼーション検出用の本発明のセンサ100が、図11に示されている。センサ100はコア102を備え、コア102は、上部の絶縁層104と下部のパーマロイ層106との間に挟まれた平面渦巻きインダクタである。絶縁層104は透過性層108で覆われ、透過性層108にはプローブDNA110が付着し固定され得る。この層は、金めっきまたはSiO2−Si3N4上に任意の標準的な表面処理したものとすることができる。標的DNA112で機能化された磁気ビーズが、この表面に付着される。標的DNAとプローブDNAの特定のハイブリダイゼーションにより、この表面108の上方に磁気ビーズ層112を形成することになる。この層は、高透磁率であり、インダクタの磁気コアの半分として働く。下にあるパーマロイ層106は、磁気コアの残り半分として働き、磁気回路を完成させる。この磁気回路の形成は、磁束が容易に通過できるようにし、コイルインダクタンスの増大につながる。この性質は、ハイブリダイゼーションプロセスの検出に用いられる。
インダクタンスに影響を及ぼすパラメータ
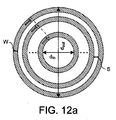
渦巻きコイルのインダクタンスは、種々の幾何学的ならびに物理的パラメータの関数である。図12に示されている重要な幾何学的パラメータを以下のとおり定義する。
dout:コイル外径
din:コイル内径
tc:導体の厚み
tp:パーマロイ層の厚み
渦巻きコイルのインダクタンスは、種々の幾何学的ならびに物理的パラメータの関数である。図12に示されている重要な幾何学的パラメータを以下のとおり定義する。
dout:コイル外径
din:コイル内径
tc:導体の厚み
tp:パーマロイ層の厚み
巻線間距離Sおよび導体厚みwの効果は、フィルファクタ(FF)という用語で表される。磁気ビーズの比透磁率μrBと、ハイブリダイゼーション後に形成されたビーズ層の厚みtBは、コイルインダクタンスに影響を及ぼす物理的パラメータである。
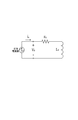
センサの電気モデル
センサの電気モデルは、図13に示されている。コイルは交流電流源によって駆動され、コイル電圧はセンサ出力として測定される。ビード層の形成後、コイルインダクタンスは増大し、センサ出力VSは変化する。この電圧のこの振幅は、ハイブリダイゼーションを検出するために使用される。VSの振幅は、次式で表すことができる。
センサの電気モデルは、図13に示されている。コイルは交流電流源によって駆動され、コイル電圧はセンサ出力として測定される。ビード層の形成後、コイルインダクタンスは増大し、センサ出力VSは変化する。この電圧のこの振幅は、ハイブリダイゼーションを検出するために使用される。VSの振幅は、次式で表すことができる。
ハイブリダイゼーションの発生によるビード層の存在を示すために、電圧VSは測定され、電圧VSの正規化変化が計算される。電流源の周波数は、RCが一定である範囲内で選択され得る。これは、特定のセンサおよび電流源周波数で、電圧VSは単にインダクタンスLCに依存し、したがって、VSの正規化変化は次式で計算され得ることを意味する。
δVsが上記に説明した様々な幾何学的パラメータおよび物理的パラメータに対して変化する道筋を理解するために、Lcの変化は数値で計算される。次いで、これは、コイル電圧が様々なパラメータ値によってどのようにして変化するのかを決定するために使用される。
上述のコンセプトに基づいて、センサの3次元モデルが、有限要素パッケージCOMSOL FEMLAB Multiphysics v.3.2を使用してシミュレートされた。このシミュレーションに使用されたモデルの詳細が、図12に示されている。このモデルは、有効厚さ2μmと様々な比透磁率とを有する磁気ビーズ層に対してシミュレートされた。式3に記載されているコイルインダクタンスの正規化変化は、ハイブリダイゼーション前後に数値計算され、その結果が図14に示されている。
図14のグラフは、δLが、様々なμrB値について外径doutに対してどのように変化するのかを示す。他のパラメータに採用された値は、次の表1に示されている。
図14に示されているように、比透磁率のそれぞれの値に対して、センサ出力は、Dmaxで示され得る特定のdout値で最大である。Dmax値は、図14に破曲線で示されているように、μrBに対して増大していることに留意されたい。
信号に対するパーマロイの影響を最小限に抑えるために、パーマロイからなる非常に厚い層(μrp=100μm)が使用されている。また、大きい空間領域(7mm×14mm)が、計算誤差を最小限に抑えるために採用されている。
最大応答性を有するセンサを設計するためには、様々なビード透磁率および導体厚みに関する最適コイル直径Dmaxを有することが有用である。図15aのグラフは、μrBおよびtcに関するDmaxのシミュレーション結果を示す。コイルの最適直径と導体厚みとが知られると、これは、出力信号の大きさを求めるために有用である。これらの情報は、図15bのグラフから得ることができ、図15bは、ビード透磁率および導体厚みに関する、Dmaxの最適値に対応する最大変化ΔLmax=δL(Dmax時)を示す。
センサ出力に対する周波数の効果
周波数に対するセンサ出力の挙動を見るために、量δVsが、様々なビード透磁率に対して計算される。パラメータ値は表1にあるとおりであり、シミュレーション結果は図16に示されている。比透磁率および周波数のそれぞれの値について、センサ出力は、この場合もDmaxで示される特定のdout値で最大である。図16aのグラフは、これらの値が周波数にどう関係しているのかを示す。
によって正規化された対応するセンサ出力ΔVs=δVs(Dmax時)は、図16bにグラフで示されている。
周波数に対するセンサ出力の挙動を見るために、量δVsが、様々なビード透磁率に対して計算される。パラメータ値は表1にあるとおりであり、シミュレーション結果は図16に示されている。比透磁率および周波数のそれぞれの値について、センサ出力は、この場合もDmaxで示される特定のdout値で最大である。図16aのグラフは、これらの値が周波数にどう関係しているのかを示す。
によって正規化された対応するセンサ出力ΔVs=δVs(Dmax時)は、図16bにグラフで示されている。
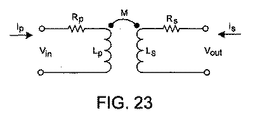
センサ設計の変形例
センサに使用される好ましい実施形態は、変圧器配置を利用する。図23は、変圧器の単純化モデルを示す。直列抵抗RpおよびRsは、それぞれ1次巻線および2次巻線の導体のオーム抵抗である。式(1)は、このモデルの様々なパラメータ間の関係を示す。
センサに使用される好ましい実施形態は、変圧器配置を利用する。図23は、変圧器の単純化モデルを示す。直列抵抗RpおよびRsは、それぞれ1次巻線および2次巻線の導体のオーム抵抗である。式(1)は、このモデルの様々なパラメータ間の関係を示す。
1次巻線が交流電流源に接続され、2次電圧が高インピーダンス装置によって測定された場合、2次電流Is=0であり、式(1)は次式となる。
Vout=−XMIp (2)
ここで、XM=ωMは、相互インダクタンスMによるリアクタンスである。式(2)は、XMおよびIpに依存する2次電圧を与える。Ipは一定であるので、測定される2次電圧は、相互インダクタンスMの直接的な尺度である。相互インダクタンスは、1次巻線および2次巻線の自己インダクタンスと結合係数kmとによって次式で表すことができる。
ここで、XM=ωMは、相互インダクタンスMによるリアクタンスである。式(2)は、XMおよびIpに依存する2次電圧を与える。Ipは一定であるので、測定される2次電圧は、相互インダクタンスMの直接的な尺度である。相互インダクタンスは、1次巻線および2次巻線の自己インダクタンスと結合係数kmとによって次式で表すことができる。
図24の変圧器構成のいずれかが採用された場合、1次自己インダクタンスと2次自己インダクタンスは等しく(Lp=Ls)、式(3)は次式となる。
M=kmLp (4)
M=kmLp (4)
式(4)からのMを式(2)に代入すると、次式が得られる。
Vout=−kmXLpIp (5)
Vout=−kmXLpIp (5)
式(5)で表されているように、出力電圧は、1次(または2次)リアクタンスならびに結合係数kmに正比例する。この結果に基づいてコンピュータシミュレーションすることにより、様々な直径および導体厚みのコイルに対する出力電圧が計算され、様々な透磁率の磁気ビーズに対するセンサの最適性能が得られている。
シミュレーションは、磁気ビーズを有するセンサ表面の理想的な完全適用範囲を得るために実施されている。磁気ビードの適用範囲が部分的である場合、出力信号(ΔL.max)およびDmaxは、比例して減少する。
円形コイル設計に加えて、他の様々な構成のコイル設計もセンサに利用され得る。これらは、図25〜27に示されている。
参考文献
R.M.Umekら“Electronic detection of nucleic acids,a versatile platform for molecular diagnostics,”J.Molecular Diagnostics,vol.3,pp.74−84,2001.
T.Tatsuma,Y.Watanabe,N.Oyama,K.Kitakizaki,and M.Haba,“Multichannel quartz crystal microbalance,”Anal.Chem.,vol.71,no.17,pp.3632−3636,Sep.1999.
F.Patolsky,A.Lichtenstein,I.Willner,“Highly sensitive amplified electronic detection of DNA by biocatalyzed precipitation of an insoluble product onto electrodes,”Chemistry−A European Journal,vol.9,pp.1137−1145,2003.
E.Souteyrand,J.P.Cloarec,J.R.Martin,C.Wilson,I.Lawrence,S.Mikkelsen,and M.F.Lawrence,“Direct detection of the hybridization of synthetic homo−oligomer DNA sequences by field effect,”J.Phys .Chem.B,vol.101,pp.2980−2985,1997.
J.Fritz,E.B.Cooper,S.Gaudet,P.K.Sorger,and S.R.Manalis,“Electronic detection of DNA by its intrinsic molecular charge,”Proc.Nat.Acad.Sci.,vol.99,no.22,pp.14 142−6,2002.
L,Moreno−Hagelsieb,P.E.Lobert,R.Pampin,D.Bourgeois,J.Remacle,D.Flandre,“Sensitive DNA electrical detection based on interdigitated A1/A12O3 microelectrodes,”Sens.Actuators B,Chem.,vol.98,pp.269−274,2004.
P.A.Besse,G.Boero,M.Demirre,V.Pott,and R.Popovic,“Detection of a single magnetic microbead using a miniaturized silicon Hall sensor,”Appl.Phys .Lett.,vol.80,pp.4199−4201,2002.
D.R.Baselt,G.U.Lee,M.Natesan,S.W.Metzger,P.E.Sheehan,and R.J.Colton,“A biosensor based on magnetoresistance technology,”Biosens.Bioeleectron.,vol.13,no.7−8,pp.731−739,Oct.1998.
J.C.Rife,M.M.Miller,P.E.Sheehan,C.R.Tamanaha,M.Tondra,and L.J.Whitman,“Design and performance of GMR sensors for the detection of magnetic microbeads in biosensors,”Sens.Actuators A,Phys.,vol.107,no.3,pp.209−218,2003.
H.Suzuki,C.M.Ho,and N.Kasagi,“A chaotic mixer for magnetic bead−based micro cell sorter,”J.Microelectromech.Syst.,vol.13,pp.779−790,2004.
J.Do,J.W.Choi,and C.H.Ahn,“Low−cost magnetic interdigitated array on a plastic wafer,”IEEE Trans.Magnetics,vol.40,pp.3009−3011,2004.
J.W.Choi,T.M.Liakopoulos,and C.H.Ahn,“An on−chip magnetic bead separator using spiral electromagnets with semi−encapsulated permalloy,”Biosens.Bioelectron.,vol.16,pp.409−16,2001.
Q.Ramadan,V.Samper,D.Poenar,and C.Yu,“Magnetic−based microfluidic platform for biomolecular separation,”Biomed Microdevices,vol.8,pp.151−8,2006.
R.Rong,J.W.Choi,and C.H.Ahn,“A novel magnetic chaotic mixer for in−flow mixing of magnetic beads,”in Proc.Of the 7th Int.Conf.on Miniaturized Chemical and Biochemical Analysts Systems,California,2003,pp.335−8.
T.B.Jones,Electromechanics of Particles,Cambridge University Press,Cambridge,1995.
C.Mikkelsen and H.Bruus,“Microfluidic capturing−dynamics of paramagnetic bead suspensions,”Lab Chip,vol.5,pp.1293−7,2005.
J.C.Sprott,Chaos and Time−Series Analysis,Oxford University Press,Oxford,2003.
R.M.Umekら“Electronic detection of nucleic acids,a versatile platform for molecular diagnostics,”J.Molecular Diagnostics,vol.3,pp.74−84,2001.
T.Tatsuma,Y.Watanabe,N.Oyama,K.Kitakizaki,and M.Haba,“Multichannel quartz crystal microbalance,”Anal.Chem.,vol.71,no.17,pp.3632−3636,Sep.1999.
F.Patolsky,A.Lichtenstein,I.Willner,“Highly sensitive amplified electronic detection of DNA by biocatalyzed precipitation of an insoluble product onto electrodes,”Chemistry−A European Journal,vol.9,pp.1137−1145,2003.
E.Souteyrand,J.P.Cloarec,J.R.Martin,C.Wilson,I.Lawrence,S.Mikkelsen,and M.F.Lawrence,“Direct detection of the hybridization of synthetic homo−oligomer DNA sequences by field effect,”J.Phys .Chem.B,vol.101,pp.2980−2985,1997.
J.Fritz,E.B.Cooper,S.Gaudet,P.K.Sorger,and S.R.Manalis,“Electronic detection of DNA by its intrinsic molecular charge,”Proc.Nat.Acad.Sci.,vol.99,no.22,pp.14 142−6,2002.
L,Moreno−Hagelsieb,P.E.Lobert,R.Pampin,D.Bourgeois,J.Remacle,D.Flandre,“Sensitive DNA electrical detection based on interdigitated A1/A12O3 microelectrodes,”Sens.Actuators B,Chem.,vol.98,pp.269−274,2004.
P.A.Besse,G.Boero,M.Demirre,V.Pott,and R.Popovic,“Detection of a single magnetic microbead using a miniaturized silicon Hall sensor,”Appl.Phys .Lett.,vol.80,pp.4199−4201,2002.
D.R.Baselt,G.U.Lee,M.Natesan,S.W.Metzger,P.E.Sheehan,and R.J.Colton,“A biosensor based on magnetoresistance technology,”Biosens.Bioeleectron.,vol.13,no.7−8,pp.731−739,Oct.1998.
J.C.Rife,M.M.Miller,P.E.Sheehan,C.R.Tamanaha,M.Tondra,and L.J.Whitman,“Design and performance of GMR sensors for the detection of magnetic microbeads in biosensors,”Sens.Actuators A,Phys.,vol.107,no.3,pp.209−218,2003.
H.Suzuki,C.M.Ho,and N.Kasagi,“A chaotic mixer for magnetic bead−based micro cell sorter,”J.Microelectromech.Syst.,vol.13,pp.779−790,2004.
J.Do,J.W.Choi,and C.H.Ahn,“Low−cost magnetic interdigitated array on a plastic wafer,”IEEE Trans.Magnetics,vol.40,pp.3009−3011,2004.
J.W.Choi,T.M.Liakopoulos,and C.H.Ahn,“An on−chip magnetic bead separator using spiral electromagnets with semi−encapsulated permalloy,”Biosens.Bioelectron.,vol.16,pp.409−16,2001.
Q.Ramadan,V.Samper,D.Poenar,and C.Yu,“Magnetic−based microfluidic platform for biomolecular separation,”Biomed Microdevices,vol.8,pp.151−8,2006.
R.Rong,J.W.Choi,and C.H.Ahn,“A novel magnetic chaotic mixer for in−flow mixing of magnetic beads,”in Proc.Of the 7th Int.Conf.on Miniaturized Chemical and Biochemical Analysts Systems,California,2003,pp.335−8.
T.B.Jones,Electromechanics of Particles,Cambridge University Press,Cambridge,1995.
C.Mikkelsen and H.Bruus,“Microfluidic capturing−dynamics of paramagnetic bead suspensions,”Lab Chip,vol.5,pp.1293−7,2005.
J.C.Sprott,Chaos and Time−Series Analysis,Oxford University Press,Oxford,2003.
Claims (63)
- i)入口と、
ii)少なくとも第1および第2の通電構造を含む第1の層であって、前記少なくとも第1および第2の通電構造のそれぞれが複数の歯を備え、前記第1および第2の通電構造の前記歯が、前記第1の通電構造の前記歯が前記第2の通電構造の前記歯の間に配置されるように、場合によりオフセットされる、第1の層と、
iii)前記入口と流体連通しかつ前記第1の層の前記少なくとも第1および第2の通電構造の上方に配置された第1のマイクロ流体チャンバを含む第2の層と、
iv)少なくとも第3および第4の通電構造を含む第3の層であって、前記少なくとも第3および第4の通電構造のそれぞれが複数の歯を備え、前記第3および第4の通電構造の前記歯が、前記第3の通電構造の前記歯が前記第4の通電構造の前記歯の間に配置されるように、場合によりオフセットされる、第3の層と
を備えるマイクロ流体装置であって、
前記少なくとも第3および第4の通電構造が、前記第1のマイクロ流体チャンバの上方になるように前記第3の層内に配置され、したがって、前記第3の通電構造の前記歯が、前記第1の通電構造の前記歯の上方に実質的に垂直に配置されるか、または前記第1の通電構造の前記歯からオフセットされ、前記第4の通電構造の前記歯が、前記第2の通電構造の前記歯の上方に実質的に垂直に配置されるかまたは前記第2の通電構造の前記歯からオフセットされ、
前記歯が、実質的に楕円形の先端部を有するステムを有する、マイクロ流体装置。 - 前記通電構造が、前記第1および第3の層に埋め込まれる、請求項1に記載のマイクロ流体装置。
- 前記通電構造が、前記第1および第3の層の表面の0.1μm〜10μm下方にある、請求項2に記載のマイクロ流体装置。
- 前記第1のマイクロ流体チャンバが、実質的にまっすぐなチャネルである、請求項1〜3のいずれか一項に記載のマイクロ流体装置。
- 前記実質的にまっすぐなチャネルが、前記入口に近接した大き目の寸法をもつ領域を有する、請求項4に記載のマイクロ流体装置。
- 前記入口が、より大きな寸法をもつ領域内に直接通じている、請求項5に記載のマイクロ流体装置。
- 前記第1および/または第3の層が、第5の通電構造をさらに含む、請求項1〜5のいずれか一項に記載のマイクロ流体装置。
- 前記第5の通電構造が、前記入口より遠位にあるように位置する、請求項7に記載のマイクロ流体装置。
- 前記第1のマイクロ流体チャンバが、溶解および抽出ユニットを形成する、請求項1〜8のいずれか一項に記載のマイクロ流体装置。
- 前記第1のマイクロ流体チャンバと流体連通する第2のマイクロ流体チャンバをさらに備え、前記第2のマイクロ流体チャンバが、増幅チャンバである、請求項1〜9のいずれか一項に記載のマイクロ流体装置。
- 前記増幅チャンバが、多重化PCRチャンバである、請求項10に記載のマイクロ流体装置。
- 前記第2のマイクロ流体チャンバと流体連通する第3のマイクロ流体チャンバをさらに備え、前記第3の流体チャンバが、検体の存在を検出するためのセンサを備える、請求項1〜11のいずれか一項に記載のマイクロ流体装置。
- 流体の一方のチャンバから第2のチャンバへの移動に影響を与えるための少なくとも1つの一体型マイクロポンプをさらに備える、請求項1〜12いずれか一項に記載のマイクロ流体装置。
- 前記一体化ポンプが、磁気ポンプである、請求項13に記載のマイクロ流体装置。
- 前記通電構造のそれぞれに電圧を所定の順序で所定の期間にわたって別々に印加するための手段をさらに備える、請求項1〜14のいずれか一項に記載のマイクロ流体装置。
- 少なくとも第1の流体貯蔵器をさらに備える、請求項1〜15のいずれか一項に記載のマクロ流体装置。
- 前記少なくとも第1の貯蔵器が、前記第1のマイクロ流体チャンバと流体連通する、請求項16に記載のマイクロ流体装置。
- 前記少なくとも第1の貯蔵器が、前記装置に組み込まれる、請求項16または17に記載のマイクロ流体装置。
- 前記第1のマイクロ流体チャンバが、前記第1の流体貯蔵器を形成する、請求項16に記載のマイクロ流体装置。
- 前記流体が、超常磁性ビーズを含む、請求項16〜19のいずれか一項に記載のマイクロ流体装置。
- 前記流体が、溶解バッファを含む、請求項16〜19のいずれか一項に記載のマイクロ流体装置。
- 少なくとも第2の流体貯蔵器をさらに備える、請求項16〜21のいずれか一項に記載のマクロ流体装置。
- 前記流体が、場合により抗凝血剤を含む、請求項16〜22のいずれか一項に記載のマイクロ流体装置。
- i)入口と、
ii)複数の歯を備える少なくとも第1の通電構造を含む第1の層と、
iii)前記入口と流体連通しかつ前記第1の層の前記少なくとも第1および第2の通電構造の上方に配置された第1のマイクロ流体チャンバを含む第2の層と、
iv)複数の歯を備える第2の通電構造を少なくとも含む第3の層と
を備えるマイクロ流体装置であって、
前記第2の通電構造が、前記第1のマイクロ流体チャンバの上方になるように前記第3の層内に配置され、したがって、前記第2の通電構造の前記歯が、前記第1の通電構造の前記歯の上方に実質的に垂直に配置されるか、または前記第1の通電構造の前記歯からオフセットされ、
前記歯が、実質的に楕円形の先端部を有するステムを有する、マイクロ流体装置。 - 生体分子を含む試料を調製するためのラボオンチップシステムであって、
a)請求項20〜30のいずれか一項の前記装置と、
b)前記試料および前記流体を前記第1のマイクロ流体チャンバに導入するための手段と
を備える、ラボオンチップシステム。 - 前記装置の前記第1、第2、第3および第4の通電構造が、電圧を所定の順序で印加される、請求項25に記載のラボオンチップシステム。
- 第5の通電構造が、前記第1のマイクロ流体チャンバ内に前記超常磁性粒子を保持するように働く、請求項25または26に記載のラボオンチップシステム。
- 前記超常磁性粒子が、50nm〜10μmの平均直径を有する、請求項25〜27のいずれか一項に記載のラボオンチップシステム。
- 前記超常磁性粒子が、対象の検体に結合するように機能化される、請求項25〜28のいずれか一項に記載のラボオンチップシステム。
- 前記検体が、核酸である、請求項29に記載のラボオンチップシステム。
- 前記第1のマイクロ流体チャンバと流体連通する洗浄バッファを備える第2の貯蔵器をさらに備える、請求項25〜30のいずれか一項に記載のラボオンチップシステム。
- 前記第1のマイクロ流体チャンバと流体連通する溶出バッファを含む第3の貯蔵器をさらに備える、請求項25〜31のいずれか一項に記載のラボオンチップシステム。
- 前記試料が、少なくとも1つの細胞を含む、請求項25〜32のいずれか一項に記載のラボオンチップシステム。
- 前記流体が、溶解バッファをさらに含む、請求項25〜33のいずれか一項に記載のラボオンチップシステム。
- 前記流体が、抗凝血剤をさらに含む、請求項25〜34のいずれか一項に記載のラボオンチップシステム。
- 生体分子を含む試料を調製するためのラボオンチップシステムであって、
a)請求項24の前記装置と、
b)前記試料および前記流体を前記第1のマイクロ流体チャンバに導入するための手段と
を備えるラボオンチップシステム。 - 試料から生体分子を含む検体を分離させるための方法であって、
i)前記試料を請求項1〜23のいずれか一項の前記装置の前記入口に導入するステップと、
ii)超常磁性粒子を含む流体を前記装置の前記第1のマイクロ流体チャンバに導入するステップと、
iii)前記装置の前記第1、第2、第3および第4の通電構造に電圧を所定の順番に印加し、それによって前記装置の前記第1、第2、第3および第4の通電構造に電流を流すステップと
を備え、
ステップi)が、ステップii)の前に、またはステップii)と同時に、またはステップii)の後で実施することができ、前記超常磁性粒子が、対象の前記検体に結合するように機能化され、
ステップiii)が、ステップi)と同時に、またはステップi)の直後に実施され、
前記電流により前記通電構造が非永久的に磁化されるようになり、それによって前記マイクロ流体チャンバ内で前記超常磁性粒子を3次元で磁気作動させることになり、前記超常磁性粒子の前記磁気作動が前記試料と前記流体のカオス的混合を引き起こして、前記機能化された超常磁性粒子が検体と接触する機会を増大させることになる、方法。 - 前記装置が、第5の通電構造をさらに備え、前記第5の通電構造が、ステップiii)の後で電圧を印加され、前記超常磁性粒子が、磁気相互作用によって前記第5の通電構造に付着され保持される、請求項37に記載の方法。
- 前記マイクロ流体チャンバが、実質的にまっすぐなチャネルの形をとる、請求項37または38に記載の方法。
- 各通電構造を流れる前記電流が、100mA〜10Aの範囲内である、請求項37〜39のいずれか一項に記載の方法。
- 各通電構造を流れる前記電流が、500mA未満である、請求項40に記載の方法。
- 前記装置の前記第1のマイクロ流体チャンバに洗浄溶液を導入するステップをさらに備える、請求項37〜41のいずれか一項に記載の方法。
- 前記装置の前記第1のマイクロ流体チャンバに再懸濁溶液を導入するステップをさらに備える、請求項37〜41のいずれか一項に記載の方法。
- 前記装置の前記第1のマイクロ流体チャンバに溶出溶液を導入するステップをさらに備える、請求項37〜43のいずれか一項に記載の方法。
- 前記電圧が、前記ビーズが前記第1のマイクロ流体チャンバ内の所定の位置に移動できるように、前記第1、第2、第3および第4の通電装置のそれぞれに十分長い間印加される、請求項37〜44のいずれか一項に記載の方法。
- 前記通電構造が、1、4、3、2の順に電圧を印加される、請求項37〜45のいずれか一項に記載の方法。
- 前記試料が、少なくとも1つの細胞を含む、請求項37〜46のいずれか一項に記載の方法。
- 前記流体が、溶解バッファを含む、請求項37〜47のいずれか一項に記載の方法。
- 前記溶解バッファと前記少なくとも1つの細胞とを混合することによって前記細胞を溶解させる、請求項48に記載の方法。
- 前記検体が、核酸である、請求項37〜49のいずれか一項に記載の方法。
- 前記核酸の存在を検出するさらなるステップを備える、請求項37〜50のいずれか一項に記載の方法。
- 前記試料が前記第1のマイクロ流体チャンバを流れる速度が、20〜100μm/sである、請求項37〜51のいずれか一項に記載の装置。
- 試料から生体分子を含む検体を分離させるための方法であって、
i)前記試料を請求項24の前記装置の前記入口に導入するステップと、
ii)超常磁性粒子を含む流体を前記装置の前記第1のマイクロ流体チャンバに導入するステップと、
iii)前記装置の前記通電構造に電流が流れるように、前記装置の前記通電構造に電圧を所定の順番に印加するステップと
を備え、
ステップi)が、ステップii)の前に、またはステップii)と同時に、またはステップii)の後で実施することができ、前記超常磁性粒子が、対象の前記検体に結合するように機能化され、
ステップiii)が、ステップi)と同時に、またはステップi)の直後に実施され、
前記電流により前記通電構造が非永久的に磁化されるようになり、それによって前記マイクロ流体チャンバ内で前記超常磁性粒子を3次元で磁気作動させることになり、前記超常磁性粒子の前記磁気作動が前記試料と前記流体のカオス的混合を引き起こして、前記機能化された超常磁性粒子が前記検体と接触する機会を増大させることになる、方法。 - 試料内の検体の存在を検出するための装置であって、
i)相互インダクタと、
ii)前記相互インダクタに隣接する第1の表面と反対側の第2の表面とを有する絶縁層と、
iii)少なくとも1つのプローブが固定されている第1の表面と、前記第1の表面の反対側にありかつ前記絶縁層の前記第2の表面に隣接するように配置された第2の表面とを有する固定化層と
を備え、
前記相互インダクタが、第1のコイルおよび第2のコイルを備える、装置。 - 前記相互インダクタが、円形渦巻きコイル、正方形渦巻きコイル、蛇行積層渦巻きコイル、または城郭状積層型導体を備える、請求項54に記載の装置。
- 前記プローブが、核酸である、請求項54または55に記載の装置。
- 前記プローブが、DNAである、請求項56に記載の装置。
- 前記絶縁層より遠位にある前記渦巻き相互インダクタに隣接して位置する高透磁率材料層をさらに備える、請求項54〜57のいずれか一項に記載の装置。
- 前記絶縁層が、二酸化ケイ素を含む、請求項54〜58のいずれか一項に記載の装置。
- 前記試料接触層が、金を含む、請求項54〜59のいずれか一項に記載の装置。
- 液体試料中の検体を検出する方法であって、
a)前記検体を含有する前記試料を、前記検体に結合するように機能化された磁気ビーズと接触させるステップと、
b)前記磁気ビーズを前記試料から分離させるステップと、
c)前記ビーズを請求項54〜60のいずれか一項の前記装置と接触させるステップであって、前記固定化層上に固定された前記少なくとも1つのプローブが前記検体に結合し、それによって前記磁気ビーズを前記表面に保持する、ステップと、
d)前記渦巻き相互インダクタの前記相互インダクタンスの変化を測定するステップと
を備え、
前記相互インダクタンスの増大が、前記試料中の前記検体の存在を示す、方法。 - 前記検体が、核酸である、請求項61に記載の方法。
- 前記プローブが、核酸である、請求項61または62に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0700653A GB2446204A (en) | 2007-01-12 | 2007-01-12 | A Microfluidic device |
| PCT/GB2008/000094 WO2008084245A2 (en) | 2007-01-12 | 2008-01-11 | Microfluidic device |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010515913A true JP2010515913A (ja) | 2010-05-13 |
| JP2010515913A5 JP2010515913A5 (ja) | 2011-03-03 |
Family
ID=37809900
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009545234A Withdrawn JP2010515913A (ja) | 2007-01-12 | 2008-01-11 | マイクロ流体装置 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20100216126A1 (ja) |
| EP (1) | EP2117714A2 (ja) |
| JP (1) | JP2010515913A (ja) |
| KR (1) | KR20090104102A (ja) |
| CN (1) | CN101631616A (ja) |
| AU (1) | AU2008204364A1 (ja) |
| BR (1) | BRPI0806582A2 (ja) |
| CA (1) | CA2675079A1 (ja) |
| GB (1) | GB2446204A (ja) |
| MX (1) | MX2009007447A (ja) |
| WO (1) | WO2008084245A2 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018173414A (ja) * | 2012-03-16 | 2018-11-08 | スタット−ダイアグノスティカ アンド イノベーション, エス. エル. | 統合された移送モジュールを有する試験カートリッジ |
| WO2021050723A1 (en) * | 2019-09-10 | 2021-03-18 | The Johns Hopkins University | Device and method for genetic analysis of plant materials in remote testing sites |
| WO2023203925A1 (ja) * | 2022-04-20 | 2023-10-26 | 株式会社日立ハイテク | 自動分析装置 |
Families Citing this family (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102008003792A1 (de) * | 2008-01-10 | 2009-07-16 | Robert Bosch Gmbh | Verfahren zum Herstellen einer Mikropumpe sowie Mikropumpe |
| GB0818609D0 (en) | 2008-10-10 | 2008-11-19 | Univ Hull | apparatus and method |
| SG175303A1 (en) | 2009-04-27 | 2011-11-28 | Ei Spectra Llc | Pipette instrument |
| CN102481575B (zh) * | 2009-09-11 | 2015-07-01 | 皇家飞利浦电子股份有限公司 | 用于运输磁珠或可磁化珠的装置和方法 |
| US20130018256A1 (en) * | 2009-11-25 | 2013-01-17 | Hanoch Kislev | Probing system for measuring the direction and speed of mucus flow in vivo |
| JP5250574B2 (ja) * | 2010-02-10 | 2013-07-31 | 富士フイルム株式会社 | マイクロ流路デバイス |
| GB2483858A (en) * | 2010-09-21 | 2012-03-28 | Univ Hull | Amplifying nucleic acids using microfluidic device to perform PRC |
| MY155579A (en) * | 2010-09-28 | 2015-11-03 | Mimos Berhad | Micromixing device for miniturization for use in microfluidic applications |
| CN102692515B (zh) * | 2011-03-23 | 2014-09-17 | 成功大学 | 血液凝固测试用的生医晶片与其制造方法及用途 |
| GB201109203D0 (en) * | 2011-06-01 | 2011-07-13 | Carclo Technical Plastics Ltd | Fluid flow control |
| US9044729B2 (en) * | 2012-07-27 | 2015-06-02 | International Park Of Creativity | Methods and devices for electromagnetic amplification of nucleic acids |
| US10040018B2 (en) | 2013-01-09 | 2018-08-07 | Imagine Tf, Llc | Fluid filters and methods of use |
| US9506934B2 (en) * | 2013-04-29 | 2016-11-29 | Honeywell International Inc. | Polymer test cartridge mixer for cell lysis |
| TW201445135A (zh) * | 2013-05-23 | 2014-12-01 | Nat Applied Res Laboratories | 以複合電動力捕捉並分析生物微粒的方法與晶片 |
| US9861920B1 (en) | 2015-05-01 | 2018-01-09 | Imagine Tf, Llc | Three dimensional nanometer filters and methods of use |
| US10730047B2 (en) | 2014-06-24 | 2020-08-04 | Imagine Tf, Llc | Micro-channel fluid filters and methods of use |
| US10124275B2 (en) | 2014-09-05 | 2018-11-13 | Imagine Tf, Llc | Microstructure separation filters |
| US10758849B2 (en) | 2015-02-18 | 2020-09-01 | Imagine Tf, Llc | Three dimensional filter devices and apparatuses |
| CN104748656B (zh) * | 2015-03-20 | 2018-06-26 | 江苏大学 | 基于巨磁阻的微流控磁珠位置检测方法与装置 |
| US10118842B2 (en) | 2015-07-09 | 2018-11-06 | Imagine Tf, Llc | Deionizing fluid filter devices and methods of use |
| USD804682S1 (en) * | 2015-08-10 | 2017-12-05 | Opko Diagnostics, Llc | Multi-layered sample cassette |
| US10479046B2 (en) | 2015-08-19 | 2019-11-19 | Imagine Tf, Llc | Absorbent microstructure arrays and methods of use |
| WO2017041782A1 (de) * | 2015-09-11 | 2017-03-16 | Leibniz-Institut Für Photonische Technologien E.V. | Anordnung für die individualisierte patientenblutanalyse |
| US10207266B2 (en) * | 2015-09-29 | 2019-02-19 | Foxconn Interconnect Technology Limited | Microfluidic device for detecting cells of blood |
| CN108430634B (zh) * | 2015-11-30 | 2021-04-20 | 快速定量微生物学股份有限公司 | 微流体装置、组件和从样品提取颗粒的方法 |
| CN107344125A (zh) * | 2016-05-05 | 2017-11-14 | 李榕生 | 流体驱动方式特异的廉价的艾滋病诊断用微流控装置 |
| USD812242S1 (en) * | 2016-07-13 | 2018-03-06 | Precision Nanosystems Inc | Microfluidic cartridge |
| USD800336S1 (en) * | 2016-07-13 | 2017-10-17 | Precision Nanosystems Inc | Microfluidic cartridge |
| WO2018119401A2 (en) * | 2016-12-22 | 2018-06-28 | Daktari Diagnostics, Inc. | Devices and methods for determining one or more analytes in fluids |
| CN106655703B (zh) * | 2016-12-23 | 2019-04-16 | 上海大学 | 导电液体微量驱动装置及其应用 |
| CA3057501C (en) * | 2017-04-21 | 2021-10-26 | Abaxis, Inc. | Systems, devices and methods for microfluidic analysis |
| CN107384776A (zh) * | 2017-08-04 | 2017-11-24 | 深圳市合川医疗科技有限公司 | 微流控芯片 |
| US11642669B2 (en) | 2017-10-18 | 2023-05-09 | Group K Diagnostics, Inc. | Single-layer microfluidic device and methods of manufacture and use thereof |
| CN108536013B (zh) * | 2018-03-29 | 2021-02-26 | 宁波大学 | 终端封闭微通道中粒子移动耦合模型控制方法 |
| CN110433876B (zh) * | 2018-05-03 | 2022-05-17 | 香港科技大学 | 微流控装置及其制造方法、口罩和过滤悬浮颗粒的方法 |
| USD879999S1 (en) | 2018-11-02 | 2020-03-31 | Group K Diagnostics, Inc. | Microfluidic device |
| DE102019200109A1 (de) * | 2019-01-08 | 2020-07-09 | Robert Bosch Gmbh | Mikrofluidische Vorrichtung und Analysegerät für eine mikrofluidische Vorrichtung |
| KR102203994B1 (ko) * | 2019-01-25 | 2021-01-18 | 한국기술교육대학교 산학협력단 | 감염원에 대한 항생제 감수성 검사용 유체 칩 및 이의 제조방법 |
| USD951479S1 (en) * | 2019-06-24 | 2022-05-10 | Precision Nanosystems Inc. | Microfluidic cartridge |
| CN111190022A (zh) * | 2020-01-07 | 2020-05-22 | 中国科学院半导体研究所 | 基于谐振式传感器的生化检测系统及检测方法 |
| USD993443S1 (en) * | 2020-02-04 | 2023-07-25 | Ut-Battelle, Llc | Microfluidic glass chip interface bracket |
| USD989342S1 (en) * | 2020-02-04 | 2023-06-13 | Ut-Battelle, Llc | Microfluidic polymer chip interface bracket |
| USD1016324S1 (en) * | 2020-07-08 | 2024-02-27 | NanoCav, LLC | Biological cell processing chip |
| CN114100704B (zh) * | 2020-09-22 | 2022-12-06 | 中国科学院深圳先进技术研究院 | 一种磁分选微流控芯片及其制作方法 |
| USD983405S1 (en) * | 2021-04-15 | 2023-04-11 | Cytoaurora Biotechnologies, Inc. | Microfluidic chip |
| CN113522385B (zh) * | 2021-07-14 | 2022-07-22 | 中新国际联合研究院 | 一种磁性数字微流体的移动结构及其自动化设备 |
| CN113858540B (zh) * | 2021-10-08 | 2023-07-28 | 佛山华智新材料有限公司 | 微流控芯片及其制造方法 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1350095B1 (en) * | 2000-06-14 | 2015-12-09 | The Board Of Regents, The University Of Texas System | Method and apparatus for combined magnetophoretic and dielectrophoretic manipulation of analyte mixtures |
| GB0200705D0 (en) * | 2002-01-14 | 2002-02-27 | Univ Cambridge Tech | Fluid movement |
| EP1462174B1 (en) * | 2003-03-28 | 2006-08-30 | Interuniversitair Microelektronica Centrum Vzw | Method for the controlled transport of magnetic beads and device for executing said method |
| EP1462173A1 (en) * | 2003-03-28 | 2004-09-29 | Interuniversitair Micro-Elektronica Centrum (IMEC) | Method for the controlled transport of magnetic beads and devices for the method |
| EP1774308A4 (en) * | 2004-07-06 | 2010-01-06 | Agency Science Tech & Res | BIOCHIP FOR SORTING AND LYSE BIOLOGICAL SAMPLES |
| KR100634525B1 (ko) * | 2004-11-23 | 2006-10-16 | 삼성전자주식회사 | 복수 개의 전자석이 배치되어 있는 마이크로채널을포함하는 미세유동 장치, 그를 이용하여 시료를 혼합하는방법 및 세포를 용해하는 방법 |
-
2007
- 2007-01-12 GB GB0700653A patent/GB2446204A/en not_active Withdrawn
-
2008
- 2008-01-11 AU AU2008204364A patent/AU2008204364A1/en not_active Abandoned
- 2008-01-11 CA CA002675079A patent/CA2675079A1/en not_active Abandoned
- 2008-01-11 JP JP2009545234A patent/JP2010515913A/ja not_active Withdrawn
- 2008-01-11 BR BRPI0806582-9A patent/BRPI0806582A2/pt not_active IP Right Cessation
- 2008-01-11 MX MX2009007447A patent/MX2009007447A/es not_active Application Discontinuation
- 2008-01-11 EP EP08701775A patent/EP2117714A2/en not_active Withdrawn
- 2008-01-11 WO PCT/GB2008/000094 patent/WO2008084245A2/en active Application Filing
- 2008-01-11 CN CN200880007915A patent/CN101631616A/zh active Pending
- 2008-01-11 KR KR1020097016827A patent/KR20090104102A/ko not_active Application Discontinuation
- 2008-01-12 US US12/442,993 patent/US20100216126A1/en not_active Abandoned
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018173414A (ja) * | 2012-03-16 | 2018-11-08 | スタット−ダイアグノスティカ アンド イノベーション, エス. エル. | 統合された移送モジュールを有する試験カートリッジ |
| WO2021050723A1 (en) * | 2019-09-10 | 2021-03-18 | The Johns Hopkins University | Device and method for genetic analysis of plant materials in remote testing sites |
| WO2023203925A1 (ja) * | 2022-04-20 | 2023-10-26 | 株式会社日立ハイテク | 自動分析装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20090104102A (ko) | 2009-10-05 |
| GB2446204A (en) | 2008-08-06 |
| EP2117714A2 (en) | 2009-11-18 |
| CN101631616A (zh) | 2010-01-20 |
| CA2675079A1 (en) | 2008-07-17 |
| WO2008084245A2 (en) | 2008-07-17 |
| MX2009007447A (es) | 2010-03-01 |
| US20100216126A1 (en) | 2010-08-26 |
| BRPI0806582A2 (pt) | 2014-05-06 |
| GB0700653D0 (en) | 2007-02-21 |
| WO2008084245A3 (en) | 2009-03-19 |
| AU2008204364A1 (en) | 2008-07-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2010515913A (ja) | マイクロ流体装置 | |
| Gijs et al. | Microfluidic applications of magnetic particles for biological analysis and catalysis | |
| Pamme | Magnetism and microfluidics | |
| Luo et al. | Magnetically driven microfluidics for isolation of circulating tumor cells | |
| Cardoso et al. | Challenges and trends in magnetic sensor integration with microfluidics for biomedical applications | |
| Jamshaid et al. | Magnetic particles: From preparation to lab-on-a-chip, biosensors, microsystems and microfluidics applications | |
| Chen et al. | Concentration and purification of human immunodeficiency virus type 1 virions by microfluidic separation of superparamagnetic nanoparticles | |
| Lien et al. | Purification and enrichment of virus samples utilizing magnetic beads on a microfluidic system | |
| EP1916032B1 (en) | Manipulation of magnetic or magnetizable objects using combined magnetophoresis and dielectrophoresis | |
| Chen et al. | A review on micromixers actuated with magnetic nanomaterials | |
| US20040009614A1 (en) | Magnetic bead-based arrays | |
| US20090283407A1 (en) | Method for using magnetic particles in droplet microfluidics | |
| Afshar et al. | Magnetic particle dosing and size separation in a microfluidic channel | |
| US20070080062A1 (en) | Coated metal structures and methods of making and using thereof | |
| Rong et al. | An on-chip magnetic bead separator for biocell sorting | |
| KR101026103B1 (ko) | 유전영동 및 자기영동을 이용한 다중 탐지 방법 및 장치 | |
| Surendran et al. | Microfluidic devices for magnetic separation of biological particles: a review | |
| Alnaimat et al. | Magnetophoresis and microfluidics: A great union | |
| CN107177478B (zh) | 用于提高细胞纯度磁分选的三维微流控芯片及方法 | |
| Zhang et al. | Magnetic cell separation | |
| Ahn et al. | Development of a generic microfluidic system for electrochemical immunoassay-based remote bio/chemical sensors | |
| James et al. | Monolithic surface micromachined fluidic devices for dielectrophoretic preconcentration and routing of particles | |
| Deman et al. | Magnetophoresis in bio-devices | |
| Ganguly et al. | Magnetic-particle-based microfluidics | |
| Ning | Microfluidic devices for cell separation and sample concentration |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110111 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110111 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20120124 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20120124 |