JP2010512306A - 抗炎症特性が増強され、細胞毒性特性が減少したポリペプチドおよび関連する方法 - Google Patents
抗炎症特性が増強され、細胞毒性特性が減少したポリペプチドおよび関連する方法 Download PDFInfo
- Publication number
- JP2010512306A JP2010512306A JP2009534723A JP2009534723A JP2010512306A JP 2010512306 A JP2010512306 A JP 2010512306A JP 2009534723 A JP2009534723 A JP 2009534723A JP 2009534723 A JP2009534723 A JP 2009534723A JP 2010512306 A JP2010512306 A JP 2010512306A
- Authority
- JP
- Japan
- Prior art keywords
- region
- sialic acid
- antibody
- igg
- polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Abstract
Description
本出願は、2006年4月5日に出願された米国仮特許出願第60/789,384号に対して優先権を主張する、2007年4月3日に出願されたPCT特許出願第PCT/US07/08396号の一部継続出願であり、これらは双方とも参考で本明細書中に引用される。本出願はまた、2006年10月27日に出願されたPCT特許出願第PCT/US06/41791号、及び2005年11月7日に出願された米国仮特許出願第60/734,196号に対して優先権を主張する、2007年4月3日に出願されたPCT特許出願第PCT/US07/08396号に対して優先権を主張し、これらは双方とも参考で本明細書中に引用される。
本発明に至る研究は、一部、国立衛生研究所認可番号AI034662によって支援された。したがって、米国政府が、本発明についてある程度権利を有しうる。
本発明は、炎症性疾患の治療を目的とした、治療用ポリペプチドを設計する新規な方法に関する。
本発明は、そのような方法および分子を提供することによって前述の要求を満たすものである。一態様において、本発明は、少なくとも一つのIgG Fc領域を含み、未精製の抗体調製物とは性質の異なる単離ポリペプチドであって、該単離ポリペプチドのシアル化能(sialylation)が未精製の抗体調製物より高い、単離ポリペプチドを提供する。一実施形態では、該少なくとも一つのIgG Fc領域を有する単離ポリペプチドは、α2,6結合により各末端シアル酸部分に結合する少なくとも一つのガラクトース部分でグリコシル化され、該ポリペプチドが未精製抗体に比してより高い抗炎症活性を有する。一実施形態では、該少なくとも一つのIgG Fc領域を有する単離ポリペプチドは、α2,6結合により各末端シアル酸部分に結合する少なくとも一つのガラクトース部分でグリコシル化され、該ポリペプチドが未精製の抗体調製物に比してFc活性化レセプターに対する結合能が低い。さらなる実施形態では、Fc活性化レセプターがFcγRIIA、FcγRIICおよびFcγRIIIAからなる群より選択される。
本発明者らは、驚くべきことに、IgG Fcドメインの細胞毒性および抗炎症反応が、Fcに結合したコア多糖のシアル化が異なることに起因することを見出した。IgG抗体の細胞毒性は、シアル化時に低減する;逆に、IVIGの抗炎症活性は増強される。IgG シアル化は、抗原特異的免疫反応の誘導によって制御されることが示され、したがって、抗原投与によって、定常状態の固有の抗炎症分子から、適応的、炎症性種にIgGを転換する新規な方法を提供する。Fc−シアル化IgGはマクロファージ上の固有のレセプターに結合し、次に阻害性Fcγレセプター(FcγR)をアップレギュレートし、これにより自己抗体が仲介する病変に対する保護が生じる。概して、Ravetch and Nimmerjahn,J. Experim. Medicine 24(1):11−15(2007)を参照。
本明細書および請求項を通じて、免疫グロブリン重鎖における残基のナンバリングは、本明細書に参照として明示的に引用される、Kabat et al.,Sequences of Proteins of Immunological Interest,5th Ed. Public Health Service,National Institutes of Health,Bethesda,Md.(1991)に記載されるようなEU indexのものである。「Kabatに記載されるようなEU index」とは、ヒトIgG1 EU抗体の残基ナンバリングを指す。
本発明のポリペプチドは、N−結合型グリコシル化が可能なホスト発現系、すなわち、ホスト細胞中で発現させることができる。通常、このようなホスト発現系としては、細菌の、真菌の、植物の、脊椎動物または無脊椎動物の発現系が挙げられる。一実施形態において、ホスト細胞は、チャイニーズハムスター卵巣(CHO)細胞系(例えば、CHO−K1;ATCC CCL−61)、Green Monkey細胞系(COS)(例えばCOS1(ATCC CRL−1650)、COS 7(ATCC CRL−1651))等の哺乳類細胞;マウス細胞(例えばNS/0)、Baby Hamster Kidney(BHK)細胞系(例えば、ATCC CRL−1632またはATCC CCL−10)、またはヒト細胞(例えば、HEK 293(ATCC CRL−1573))、または例えば、American Type Culture Collection、Rockville、Md.等の公的な寄託機関から入手可能な他の適当な細胞系である。さらに、鱗翅目細胞系(Lepidoptora cell line)、例えばSf9、等の昆虫細胞系、植物細胞系、真菌細胞系、例えば、サッカロマイセス・セレヴィシエ(Saccharomyces cerevisiae)、ピキア・パストリス(Pichia pastoris)、Hansenula spp等の酵母、またはB. subtilis等のBacillus、またはEschericiae coliを用いた細菌の発現系が使用できる。場合によっては、ヒトIgGのFc領域上で通常見られるように複雑な、二分岐の糖となるためには、ホスト細胞への修飾がN−結合型グリコシル化およびグリカン成熟が確実に起こるために必要とされる場合もあることが理解されるであろう。
少なくとも一つのIgG Fc領域を有するポリペプチドを含む治療製剤は、所望の精製度を有する本発明のポリペプチドを、必要であれば生理学的に許容される担体、賦形剤または安定化剤と混合することによって、凍結乾燥製剤または水溶液の形態で、保管用に製造されうる(例えば、Remington’s Pharmaceutical Sciences 16th edition,Osol,A.Ed.(1980)参照)。許容される担体、賦形剤または安定化剤は、用いられる投与量および濃度で患者に無毒であり、これらとしては、リン酸塩、クエン酸塩、および他の有機酸等のバッファー;アスコルビン酸およびメチオニン等の抗酸化剤;(オクタデシルジメチルベンジルアンモニウムクロライド;塩化ヘキサメトニウム;塩化ベンザルコニウム、塩化ベンゼトニウム;フェニル、ブチルまたはベンジルアルコール;メチルまたはプロピルパラベン等のアルキルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3−ペンタノール;およびm−クレゾール等の)防腐剤;低分子量(約10残基未満の)ポリペプチド;血清アルブミン、ゼラチン、または免疫グロブリン等のタンパク質;ポリビニルピロリドン等の親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン、またはリシン等のアミノ酸;グルコース、マンノース、またはデキストリン等の単糖、二糖、および他の糖質;EDTA等のキレート剤;スクロース、マンニトール、トレハロースまたはソルビトール等の糖;ナトリウムのような塩形成対イオン;金属錯体(例えば、Zn−タンパク質錯体);および/またはTWEEN(登録商標)、PLURONICS(登録商標)またはポリエチレングリコール(PEG)等のノニオン界面活性剤が挙げられる。
本発明のポリペプチドは、未修飾および/または未精製の抗体と比較してシアル酸の量が増加するように、さらに精製または修飾してもよい。この目的に到達するために多数の方法が存在する。一つの方法では、例えば、IVIG等の、未精製のポリペプチド源を、シアル酸に結合することが知られているレクチンを有するカラムに通過させる。当業者は、レクチンが異なれば、ガラクトースとシアル酸との間でのα2,6結合およびα2,3結合に対する親和性が異なることを理解するであろう。ゆえに、特定のレクチンを選択することによりシアル酸とガラクトースとの間の所望の結合型を有する抗体を増加することができるであろう。一実施形態においては、レクチンをセウヨウニワトコ(Sambuccus nigra)から分離する。当業者であれば、セウヨウニワトコ(Sambuccus nigra)のアグルチニン(SNA)が(2−6)結合によりガラクトースまたはN−アセチルガラクトサミンに結合するシアル酸に特異的であることを理解するであろう。Shibuya et al,J. Biol. Chem.,262:1596−1601(1987)。これに対して、イヌエンジュ(Maakia amurensis)(「MAA」)レクチンは、(2−3)結合によりガラクトースに結合するシアル酸に結合する。Wang et al,J Biol Chem.,263:4576−4585(1988)。
IgGの特定の糖型が抗体のエフェクター機能を調節することに関与するかどうかを究明するために、特定のIgGモノクローナル抗体の細胞毒性wp仲介する際の特定のAsn297に結合した炭水化物の役割を調べた。前記(6)で記載されるのと同様にして293個の細胞中でIgG1、2aまたは2bスイッチ変異体のいずれかとして発現している、6A6ハイブリドーマ由来の、抗血小板抗体を、これらの具体的な炭水化物組成および構造を決定するために質量分析によって分析した。これらの抗体は、最小限のシアル酸残基を含む。セイヨウニワトコ(Sambucus nigra)レクチンアフィニティークロマトグラフィーによるシアル酸含有種の濃縮(enrichment)によって、シアル酸含有量が60〜80倍高い抗体を産生した。シアル化および非シアル化6A6−IgG1および2b抗体の血小板クリアランスを媒介する能力を比較すると、シアル化とインビボ活性との間で逆相関を示した。6A6 IgG抗体のシアル化により、生物学的活性が40〜80%低下した。
マウス
C57BL/6およびNODマウスは、Jackson Laboratory(バーハーバー、メイン州)から購入した。FcyRIIB−/−マウスは、発明者の研究室で作製され、C57BL/バックグラウンドに対して12世代戻し交配された。C57BL/6バックグラウンド(K/B)のKRN TCRトランスジェニックマウスは、D.MathisおよびC.Benoist(ハーバードメディカルスクール、ボストン、マサチューセッツ州)から贈与され、NODマウスと交配させて、K/BxNマウスを作製した。8〜10週齢のメスマウスを全ての実験に用い、ロックフェラーユニバーシティ動物施設で飼育した。全ての実験は連邦法および機関ガイドラインにしたがって行われ、ロックフェラーユニバーシティ(ニューヨーク、ニューヨーク州)によって認証された。
6A6抗体スイッチ変異体を、293T細胞の一過性トランスフェクションを行ない、次いでNimmerjahn and Ravetch,Science 310,1510(2005)に記載されるのと同様にしてプロテインGにより精製することによって作製した。シアル酸リッチな抗体変異体を、Sambucus nigra agglutinin(SNA)アガロース(Vector Laboratories、バーリンゲーム、カリフォルニア州)を用いたレクチンアフィニティークロマトグラフィーによってこれらの抗体調製物から分離した。シアル酸含有量が高いことは、レクチンブロットによって確認した(下記参照)。静脈注射用ヒト免疫グロブリン(IVIG、10%マルトース中5%、クロマトグラフィー精製)は、Octapharma(Hemdon、バージニア州)から購入した。Kaneko Y. et al.,Exp. Med. in press(2006)に記載されるのと同様にして、ヒトIVIGの消化を行なった。簡単に述べると、IVIGを37℃で1時間0.5mg/mlパパインによって消化し、2.5mg/mlヨードアセトアミドを添加することによって止めた。得られたFabおよびFcフラグメントを、HiPrep 26/60 S−200HRカラム(GE Healthcare、ピスカタウェイ、ニュージャージー州)で、未消化IVIGから分離した後、プロテインGカラム(GE Healthcare)およびプロテインLカラム(Pierce、ロックフォード、イリノイ州)を用いてFcおよびFabフラグメントを精製した。フラグメントの純度は、抗−ヒトIgG FabまたはFcに特異的な抗体(Jackson ImmunoResearch、West Grove、ペンシルバニア州)を用いて免疫ブロット法によって確認した。純度は、99%より高いと判断された。F4/80抗体はSerotec(オックスフォード、イギリス)社製である。Ly 17.2抗体は、Caltag(バーリンゲーム、カリフォルニア州)社製である。ヒツジ抗糸球体基底膜(GBM)抗血清(腎毒性血清(nephrotoxic serum)、NTS)は、M.P.Madaio(ペンシルバニア大学、フィラデルフィア、ペンシルバニア州)から贈与された。C−末端のヘキサ−ヒスチジンタグを含む可溶性Fc レセプターを、293T細胞の一過性トランスフェクションによって作製し、製造元(Qiagen社)によって示されるのと同様にして、Ni−NTAアガロースを用いて細胞培養上清から精製した。
シアル酸含有量が増加したIVIGの調製
シアル酸はIVIGの抗炎症活性に必要であると思われるので、この抗炎症活性には高投与量(1g/kg)が必要であるという根拠は、全IgG調製物中のシアル化IgGの限定濃度でありうる。IVIGをSNA−レクチンアフィニティカラムで分画して、シアル酸修飾グリカン構造が濃縮されたIgG分子を得た。
ポリクローナルIgGもまたシアル化されうる軽鎖または重鎖可変領域のOおよびN結合型グリカンをIVIG中の含むので、我々は、SNA−リッチなIgG調製物の抗炎症活性の増加がFc上のN−結合型グリコシル化部位のシアル化が増加した結果であることを、確認した。Fc−フラグメントは、未分画化のおよびSNA分画されたIVIGから作製し、それらのインビボ活性を試験した。インタクトIgGで観察されたように、未分画化のIVIGから作製したFc−フラグメントと比較した場合に、SNA−精製Fcフラグメントはインビボにおける保護効果を向上した。これに対して、Fabフラグメントはこのインビボアッセイにおいて何ら抗炎症活性を示さなかった。したがって、IVIGの抗炎症活性には高投与量が必要であることは、全調製物中に存在するシアル化IgGの寄与がより小さいことに起因している可能性がある。シアル酸結合レクチンクロマトグラフによってこれらのフラクションを濃縮することは、その結果として抗炎症活性を増加した。
グッドパスチャー症候群のマウスモデル
このモデルでは、マウスを最初にアジュバントを併用したヒツジIgGで感作し、4日後にヒツジ抗マウス糸球体基底膜調製物を注射した(腎毒性血清、NTS)。簡単に述べると、CFA中ヒツジIgG(Serotec)200μgをマウスに腹腔内に予め免疫した後、4日後に体重グラムあたりNTS血清2.5μlを静脈注射した。血液を、抗GBM抗血清を注射してから4日後に未処理コントロールマウスから集め、血清IgGをプロテインG(GE Healthcare、プリンストン、ニュージャージー州)およびNHS−活性化セファロースカラム(GE Healthcare、プリンストン、ニュージャージー州)にヒツジIgGを共有結合することによって作製される、セファロース結合ヒツジIgGカラム、アフィニティークロマトグラフィーで精製した。
SNA+(Sambuccus Nigra Agglutinin) IVIG FcのSequential Maldi−Tof分析を行ない、上記したITP、RAおよび腎毒性腎炎モデルで保護特性を示したシアル化IgG Fcフラクションの構造を決定した。Maldi−Tofで生じたグリカンピークを単離し、さらに分画して、ガラクトース−シアル酸構造が得られるまで再分析した。インビボで抗炎症活性を有する高濃度のガラクトース−シアル酸構造物のフットプリントヒストグラム(図1A)を、シアル酸結合の標準物である、a2−3シアリルラクトース(図1B)およびa2−6シアリルラクトース(図1C)のヒストグラムと比較した。標準物質の付号のついたピーク(signature peak)は矢印で識別され、それぞれ、a2−3(図1B)またはa2−6(図1C)では矢印で示され、サンプルから得られたピークと比較する。
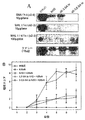
図2Aで示されるように、IVIG FcフラグメントのグリカンMaldi−Tof MS分析から、末端にガラクトースが存在しない(ピークG0)、1個のガラクトースが存在する(ピークG1)、2個のガラクトースが存在する(ピークG2)、またはシアル酸が存在する(「末端シアル酸」と記載される括弧で示される)構造物が示される。2,3または2,6シアル化IgG Fcのインビボ活性を測定するために、サンプルをシアリダーゼで処理した後、ガラクトーストランスフェラーゼで処理して、G0(ガラクトースなし)およびG1(1個のガラクトース)をG2(完全にガラクトシル化)に変換して、シアル化の可能性のある部位を増やした。図2Bに示されるように、ECLによって測定される末端ガラクトースの相対的なバンド強度比をクマシーをのせたコントロールと比較することによって、過剰ガラクトシル化(hypergalactosylation)が確認された。インビトロのシアル化を、2−6シアリルトランスフェラーゼ(「ST6Gal」)または2−3シアリルトランスフェラーゼ(「ST3Gal」)のいずれかを用いて行ない、SNAでは2−6結合(上段)またはECL(中段)およびクマシー(下段)では2−3結合をレクチンブロットによって確認した。インビトロでのシアル化Fcが炎症を阻害する能力を評価する(図2D)ために、マウスに、0.66mgの2−6シアル化Fc(黒三角)または0.66mgの2−3シアル化Fc(赤三角)のいずれかを投与した。1時間後、0.2mlのK/BxN血清を投与し、足底の腫れ(臨床スコア)を次の7日間モニターした。抗炎症活性は、2,6シアル化IgG Fcフラグメントでは観察されたが、2,3シアル化分子では観察されなかった。これらの結果は上記データと一致し、これから2,6シアル酸−ガラクトースの優先的結合がシアル化IgGの抗炎症活性に関与していることが示される。
IVIGを結合に特異的なシアリダーゼ(SA)で処理し、消化物をレクチンブロットで確認した(図3A)。上段は、IVIGの2−6結合(左レーン)、および2−3SA tx IVIG(中央レーン)では染色が確認され、陽性Sambucus nigraレクチン(SNA)を示すが、2−3,6SA tx IVIG(右レーン)では染色が確認されなかった。中段は、a2−3シアル酸結合に関するドットブロットであり(MAL I)、フェチュイン陽性コントロールでのみ陽性の染色が示される;100μgのタンパク質を1ドット当たりのせる。下段は、クマシーをのせたコントロールを示す。10μg/レーンがブロットおよびゲルで示される。シアル酸部分の特異的な除去効果を調べるために、マウスに、1g/kgのIVIG調製物を投与した後、200μlのK/BxN血清を投与した。図3Bに示されるように、K/BxN血清が投与されたマウス(白丸)では、1週間の間中、臨床スコアによって測定される際の、足底の腫れが観察された。IVIGで処置されたマウスでは、a2−3SA tx IVIGで処置されたマウス(白三角)と同様、わずかなむくみが観察された(黒三角)が、2−3,6SA tx IVIGが投与されたマウス(赤四角)は足底の腫れが保護されなかった。
Claims (31)
- 少なくとも一つのIgG Fc領域を含み、未精製の抗体調製物とは性質の異なる単離ポリペプチドであって、該単離ポリペプチドのシアル化能が該未精製の抗体調製物より高い、単離ポリペプチド。
- 該少なくとも一つのIgG Fc領域がα2,6結合により各末端シアル酸部分に結合する少なくとも一つのガラクトース部分でグリコシル化され、該ポリペプチドが未精製の抗体調製物に比してより高い抗炎症活性を有する、請求項1に記載の単離ポリペプチド。
- 該少なくとも一つのIgG Fc領域がα2,6結合により各末端シアル酸部分に結合する少なくとも一つのガラクトース部分でグリコシル化され、該ポリペプチドが未精製の抗体調製物に比してFc活性化レセプターに対する結合能が低い、請求項1または2に記載の単離ポリペプチド。
- 該Fc活性化レセプターがFcγRIIA、FcγRIICおよびFcγRIIIAからなる群より選択される、請求項3に記載の単離ポリペプチド。
- ヒトのIgG1、IgG2、IgG3またはIgG4 Fc領域を有し、未精製抗体に比してα2,6結合により各シアル酸末端部分に結合する少なくとも一つのガラクトース部分の含量が高い、請求項1〜4のいずれか1項に記載の単離ポリペプチド。
- in vitroでの抗炎症性が向上した、請求項1〜5のいずれか1項に記載の単離ポリペプチド。
- in vivoでの抗炎症性が向上した、請求項1〜6のいずれか1項に記載の単離ポリペプチド。
- 天然に存在する抗体源由来である、請求項1〜7のいずれか1項に記載の単離ポリペプチド。
- 組換え抗体源由来である、請求項1〜7のいずれか1項に記載の単離ポリペプチド。
- 該未修飾抗体がIVIGを有する、請求項1〜7のいずれか1項に記載の単離ポリペプチド。
- 少なくとも一つのガラクトース部分とタンパク質の多糖鎖中の各末端シアル酸との間のα2,6結合を生じる活性が向上した細胞系由来である、請求項1〜7のいずれか1項に記載の単離ポリペプチド。
- α−(2,6)シアリルトランスフェラーゼによる処理で修飾される、請求項1〜11のいずれか1項に記載の単離ポリペプチド。
- 精製される、請求項1〜12のいずれか1項に記載の単離ポリペプチド。
- 請求項1〜13のいずれか1項に記載の単離ポリペプチドおよび適当な担体または希釈剤を含む薬剤。
- Fc領域の多糖鎖のシアル化能(sialylation)を変更することを有する、Fc領域を含むポリペプチドの性質の調節方法。
- 該性質は、未精製の抗体調製物より抗炎症活性が高い、請求項15に記載の方法。
- シアル化を変更する段階が、
末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖を有する少なくとも一のFc領域を含む複数のポリペプチド、および末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖が欠損する少なくとも一のFc領域を含む複数のポリペプチドを含む、少なくとも一のFc領域を含むポリペプチドの未精製源を用意し;さらに
末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖が欠損する少なくとも一のFc領域を含む複数のポリペプチドに対する末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖を有する少なくとも一のFc領域を含む複数のポリペプチドの割合を増加させる、
ことを有する、請求項15または16に記載の方法。 - 該少なくとも一のFc領域を含むポリペプチドの未精製源は、ヒトの未精製IgG抗体を含む、請求項15〜17のいずれか1項に記載の方法。
- 該少なくとも一のFc領域を含むポリペプチドの未精製源は、発現系に核酸配列を含むベクターを発現させることから提供され、ここで、該核酸配列はIgG抗体に翻訳される、請求項15〜18のいずれか1項に記載の方法。
- 該発現システムは、細菌、真菌、植物、脊椎動物及び無脊椎動物の発現系、ならびにこれらの組合せからなる群より選択されるN−結合グリコシル化(N−linked glycosylation)が可能である修飾宿主発現系を有する、請求項19に記載の方法。
- 末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖が欠損する少なくとも一のFc領域を含む複数のポリペプチドに対する末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖を有する少なくとも一のFc領域を含む複数のポリペプチドの割合を増加させる段階が、末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖が欠損する少なくとも一のFc領域を含むポリペプチドを除去することによって達成される、請求項15〜20のいずれか1項に記載の方法。
- 該除去は、物理的または化学的方法によって達成される、請求項21に記載の方法。
- 該除去は、HPLC、レクチンアフィニティクロマトグラフィー、高pHアニオン交換クロマトグラフィー、及びこれらの組合せからなる群より選択される方法によって達成される、請求項21に記載の方法。
- 該レクチンアフィニティクロマトグラフィーは、ガラクトース部分と末端シアル酸との間のα2,3結合に対するよりα2,6結合に対する方が親和性の低いレクチンを用いて実施される、請求項23に記載の方法。
- 末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖が欠損する少なくとも一のFc領域を含む複数のポリペプチドに対する末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖を有する少なくとも一のFc領域を含む複数のポリペプチドの割合を増加させる段階が、末端シアル酸がα2,6結合を介してガラクトース部分に連結してなる多糖鎖を有する少なくとも一のFc領域を含むポリペプチドの未精製源を増やすこと(enrichment)によって達成される、請求項15〜24のいずれか1項に記載の方法。
- 該増やすこと(enrichment)は、HPLC、レクチンアフィニティクロマトグラフィー、高pHアニオン交換クロマトグラフィー、及びこれらの組合せからなる群より選択される方法によって達成される、請求項25に記載の方法。
- 該レクチンアフィニティクロマトグラフィーは、ガラクトース部分と末端シアル酸との間のα2,3結合に対するよりα2,6結合に対する方が親和性の高いレクチンを用いて実施される、請求項26に記載の方法。
- 該増やすことは、少なくとも一のFc領域を含むポリペプチドに結合する糖質と末端シアル酸との間のα2,6結合を作製する酵素との化学反応によって実施される、請求項25〜27のいずれか1項に記載の方法。
- 該酵素は、α−(2,6)シアリルトランスフェラーゼである、請求項28に記載の方法。
- 治療上有効な量の、請求項1〜14のいずれか1項に記載のポリペプチドを、患者に投与することを有する、炎症性疾患の治療方法。
- 該炎症性疾患は、関節炎、血小板減少症、および腎炎からなる群より選択される、請求項30に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/US2006/041791 WO2007055916A2 (en) | 2005-11-07 | 2006-10-27 | Reagents, methods and systems for selecting a cytotoxic antibody or variant thereof |
| PCT/US2007/008396 WO2007117505A2 (en) | 2006-04-05 | 2007-04-03 | Polypeptides with enhanced anti-inflammatory and decreased cytotoxic properties and relating methods |
| PCT/US2007/072771 WO2008057634A2 (en) | 2006-10-26 | 2007-07-03 | Polypeptides with enhanced anti-inflammatory and decreased cytotoxic properties and relating methods |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010512306A true JP2010512306A (ja) | 2010-04-22 |
| JP2010512306A5 JP2010512306A5 (ja) | 2012-08-16 |
Family
ID=40792829
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009534723A Pending JP2010512306A (ja) | 2006-10-27 | 2007-07-03 | 抗炎症特性が増強され、細胞毒性特性が減少したポリペプチドおよび関連する方法 |
Country Status (3)
| Country | Link |
|---|---|
| JP (1) | JP2010512306A (ja) |
| CA (1) | CA2666308C (ja) |
| IL (1) | IL197920A0 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014508759A (ja) * | 2011-02-24 | 2014-04-10 | サノフイ | シアリル化抗体の生産の方法 |
| JP2016512426A (ja) * | 2013-03-11 | 2016-04-28 | ジェンザイム・コーポレーション | 糖類工学による部位特異的抗体−薬物コンジュゲーション |
| KR20210060359A (ko) * | 2019-11-18 | 2021-05-26 | 건국대학교 산학협력단 | 시알산화된 면역글로불린을 유효성분으로 포함하는 염증성 질환의 치료용 조성물 |
| US11186638B2 (en) | 2011-09-12 | 2021-11-30 | Genzyme Corporation | Anti-αβTCR antibody |
| US11697690B2 (en) | 2014-03-19 | 2023-07-11 | Genzyme Corporation | Site-specific glycoengineering of targeting moieties |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001507215A (ja) * | 1997-01-16 | 2001-06-05 | サイテル コーポレイション | 組換え糖タンパク質のインビトロでの実用的なシアリル化 |
| WO2002030954A1 (fr) * | 2000-10-06 | 2002-04-18 | Kyowa Hakko Kogyo Co., Ltd. | Procede de purification d'un anticorps |
| JP2002541854A (ja) * | 1999-04-15 | 2002-12-10 | クルセル ホラント ベスローテン フェンノートシャップ | ヒト細胞における組み換え蛋白質の生産 |
-
2007
- 2007-07-03 JP JP2009534723A patent/JP2010512306A/ja active Pending
- 2007-07-03 CA CA2666308A patent/CA2666308C/en active Active
-
2009
- 2009-04-05 IL IL197920A patent/IL197920A0/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001507215A (ja) * | 1997-01-16 | 2001-06-05 | サイテル コーポレイション | 組換え糖タンパク質のインビトロでの実用的なシアリル化 |
| JP2002541854A (ja) * | 1999-04-15 | 2002-12-10 | クルセル ホラント ベスローテン フェンノートシャップ | ヒト細胞における組み換え蛋白質の生産 |
| WO2002030954A1 (fr) * | 2000-10-06 | 2002-04-18 | Kyowa Hakko Kogyo Co., Ltd. | Procede de purification d'un anticorps |
Non-Patent Citations (4)
| Title |
|---|
| JPN6012037052; Biochem Biophys Res Commun. Vol.286, No.2, 20010817, p.243-249 * |
| JPN6012037054; Science Vol.313, No.5787, 20060804, p.670-673 * |
| JPN6012037058; Science Vol.313, No.5787, 20060804, p.1-21 * |
| JPN6013012266; Mol Immunol. Vol.44, No.7, 20061011, p.1524-1534 * |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014508759A (ja) * | 2011-02-24 | 2014-04-10 | サノフイ | シアリル化抗体の生産の方法 |
| US11186638B2 (en) | 2011-09-12 | 2021-11-30 | Genzyme Corporation | Anti-αβTCR antibody |
| JP2016512426A (ja) * | 2013-03-11 | 2016-04-28 | ジェンザイム・コーポレーション | 糖類工学による部位特異的抗体−薬物コンジュゲーション |
| US11807690B2 (en) | 2013-03-11 | 2023-11-07 | Genzyme Corporation | Hyperglycosylated binding polypeptides |
| US11697690B2 (en) | 2014-03-19 | 2023-07-11 | Genzyme Corporation | Site-specific glycoengineering of targeting moieties |
| KR20210060359A (ko) * | 2019-11-18 | 2021-05-26 | 건국대학교 산학협력단 | 시알산화된 면역글로불린을 유효성분으로 포함하는 염증성 질환의 치료용 조성물 |
| KR102549282B1 (ko) * | 2019-11-18 | 2023-06-30 | 건국대학교 산학협력단 | 시알산화된 면역글로불린을 유효성분으로 포함하는 염증성 질환의 치료용 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2666308C (en) | 2014-09-23 |
| IL197920A0 (en) | 2011-08-01 |
| CA2666308A1 (en) | 2008-05-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6686058B2 (ja) | 抗炎症特性が増強され、細胞毒性特性が減少したポリペプチドおよび関連する方法 | |
| US20220162290A1 (en) | Polypeptides With Enhanced Anti-Inflammatory And Decreased Cytotoxic Properties And Relating Methods | |
| JP2011506476A (ja) | 抗炎症性が促進しかつ細胞毒性が低減したポリペプチドおよび関連する方法 | |
| US20120134988A1 (en) | Polypeptides with enhanced anti-inflammatory and decreased cytotoxic properties and relating methods | |
| EP2091969A2 (en) | Polypeptides with enhanced anti-inflammatory and decreased cytotoxic properties and relating methods | |
| CA2666308C (en) | Polypeptides with enhanced anti-inflammatory and decreased cytotoxic properties and relating methods | |
| NZ597651A (en) | Polypeptides with enhanced anti-inflammatory and decreased cytotoxic properties and relating methods | |
| US20110150867A1 (en) | Polypeptides with enhanced anti-inflammatory and decreased cytotoxic properties and relating methods |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100628 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100806 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120629 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120717 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121017 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20121019 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130319 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130924 |