JP2010503486A - 内部人工器官 - Google Patents
内部人工器官 Download PDFInfo
- Publication number
- JP2010503486A JP2010503486A JP2009528482A JP2009528482A JP2010503486A JP 2010503486 A JP2010503486 A JP 2010503486A JP 2009528482 A JP2009528482 A JP 2009528482A JP 2009528482 A JP2009528482 A JP 2009528482A JP 2010503486 A JP2010503486 A JP 2010503486A
- Authority
- JP
- Japan
- Prior art keywords
- bioerodible
- protective coating
- endoprosthesis
- implantable endoprosthesis
- stent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/08—Materials for coatings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/148—Materials at least partially resorbable by the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2210/00—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2210/0004—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof bioabsorbable
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0014—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis
- A61F2250/003—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis differing in adsorbability or resorbability, i.e. in adsorption or resorption time
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0014—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis
- A61F2250/003—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis differing in adsorbability or resorbability, i.e. in adsorption or resorption time
- A61F2250/0031—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis differing in adsorbability or resorbability, i.e. in adsorption or resorption time made from both resorbable and non-resorbable prosthetic parts, e.g. adjacent parts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0014—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis
- A61F2250/0036—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis differing in thickness
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0067—Means for introducing or releasing pharmaceutical products into the body
Landscapes
- Health & Medical Sciences (AREA)
- Public Health (AREA)
- Heart & Thoracic Surgery (AREA)
- Veterinary Medicine (AREA)
- Vascular Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Surgery (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Cardiology (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Transplantation (AREA)
- Prostheses (AREA)
- Media Introduction/Drainage Providing Device (AREA)
- Materials For Medical Uses (AREA)
Abstract
Description
保護される。内部人工器官は、対象(例えばヒト患者)への植込後、所定の手法、所定の時間またはその両方により侵食されるように構成される。例えば、侵食の所定の手法は、内部人工器官の内部から内部人工器官の外部へ、または内部人工器官の第1の端部から内部人工器官の第2の端部へであってよい。内部人工器官の多くは、身体物質と接触することが所望されるまで身体物質との接触から保護される、複数の部分を有する。内部人工器官が制御されない分解を示す可能性は低減され、分解は制御されている。内部人工器官は植込後に身体から除去される必要がない場合がある。そのような内部人工器官の植え込まれた管腔が再狭窄を示すことは少ない。この内部人工器官の血栓形成は少なくなる。一部の内部人工器官は治療剤を送達するように構成される。一部の内部人工器官は細胞増殖(内皮化)を支持する表面を有する。
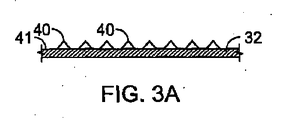
2の壁32は、複数の突起40が延びている外面41を有する。そのような突起40は、バルーン12の拡張中に内側保護コーティングに孔を穿つ、内側保護コーティングを切る、または引っ掻くように構成されており、内側コーティング13”を通じて延びている複数の破損箇所36を生成する。これらの破損箇所36によって、血液などの体液が生侵食性本体11と直接接触し、生侵食を開始することが可能となる。バルーンは、ステント10上の所定の位置に対応する所定の位置に、突起40を備えることが可能である。これによって、ステント10がどのように生侵食するかをユーザが制御することが可能となる。例えば、一端においてのみ保護コーティングに孔を穿つことによって、長手方向の一端から長手方向の他端へのステントの生侵食が可能となる。適切な突起を有するバルーンには、切開バルーン(cutting balloon)が含まれる。適切なバルーンは、オブライエン(O’Brien)による米国特許第7,070,576号明細書およびラディシュ(Radisch)による米国特許第7,011,670号明細書に記載されている。これに加えて、またはこれに代えて、送達システムは、送達中にステントを覆うとともに後退されてステントを配備する、シース33を備えることが可能である。シースは、シースが後退されるときに突起がステントの外側のコーティング13を破損させるように、切開部35(例えば、高分子シース本体に埋め込まれた金属突起)を備えることが可能である。破損機構を選択することによって、ステントの内部においてのみ、外部においてのみ、または内部および外部の両方において、コーティングを破損させることが可能である。ステント送達については、例えば、ワン(Wang)による米国特許第5,195,969号明細書、ハムリン(Hamlin)による米国特許第5,270,086号明細書およびレーダー−デヴェンス(Raeder−Devens)による米国特許第6,726,712号明細書にさらに記載されている。また、ステントおよびステント送達の例としては、ボストン・サイエンティフィック・サイムド(ミネソタ州、メープル・グローブ)から入手可能なRadius(登録商標)またはSymbiot(登録商標)システムが挙げられる。
び1%の希土類元素;86〜97%のマグネシウム、0〜8%のリチウム、2〜4%のアルミニウムおよび1〜2%の希土類元素;8.5〜9.5%のアルミニウム、0.15〜0.4%のマンガン、0.45〜0.9%の亜鉛および残余のマグネシウム;4.5〜5.3%のアルミニウム、0.28〜0.5%のマンガンおよび残余のマグネシウム;55〜65%のマグネシウム、30〜40%のリチウムおよび0〜5%の他の金属、希土類元素またはその両方、など)。マグネシウム合金は、AZ91D、AM50AおよびAE42の名称によって入手可能である(これらはMagnesium−Elektron Corporation(英国)から入手可能である)。他の侵食性金属または合金(例えば、亜鉛−チタン合金およびナトリウム−マグネシウム合金)については、ボルツ(Bolz)による米国特許第6,287,332号明細書;ホイブライン(Heublein)による米国特許出願公開第2002/0004060号明細書;カーゼ(Kaese)による米国特許出願公開第2003/0221307号明細書;ストロガノフ(Stroganov)による米国特許第3,687,135号明細書;およびパーク(Park)によるScience and Technology of Advanced Materials、2001年、第2巻、p.73〜78に記載されている。保護コーティング13を形成可能な生侵食性セラミックの例には、ベータ−リン酸三カルシウム(β−TCP)、β−TCPとハイドロキシアパタイトとの混合物、CaHPO4、CaHPO4−2H2O、CaCO3およびCaMg(CO3)2が含まれる。他の生侵食性セラミックについては、ツィンマーマン(Zimmermann)による米国特許第6,908,506号明細書およびリー(Lee)による米国特許第6,953,594号明細書に説明されている。
して保護コーティングを生成する。別の例として、本体はマグネシウムまたはマグネシウム合金であってよく、保護コーティング13は生侵食性本体11をフッ化水素で処理することによって製造されてよい。そのような処置中、フッ化水素は本体11のマグネシウムと反応してフッ化マグネシウム保護コーティングを生成する。
ラオマル(Straumal)らによるThin Solid Films、2001年、第383巻、p.224−226に記載されている。
って、生侵食性本体と身体物質との間の直接接触が可能となり、それらの部位にて生侵食が開始される。このひび割れは無作為に発生してもよく、選択位置にてコーティングをより硬くまたは脆くすることによって(例えば、選択位置にてコーティングを架橋させることによってなど)、選択した位置にて形成されることが可能である。
い領域109が形成される。例えば、本体の生侵食性材料がマグネシウムである場合、薄い領域109は、プレ・ステントをフッ化水素水溶液に浸漬することによって、またはフッ化水素ガスへプレ・ステントを露出することによって形成されることが可能である。フッ化水素はマグネシウムと反応し、フッ化マグネシウムを形成する。
、抗体および細胞毒素からなる二機能性分子などの血管細胞増殖抑制剤;(h)プロテインキナーゼおよびチロシン・キナーゼ抑制剤(例えば、チロホスチン、ゲニステイン、キノキサリン);(i)プロスタシクリン類似化合物;(j)コレステロール低下剤;(k)アンジオポエチン;(l)トリクロサン、セファロスポリン、アミノグリコシドおよびニトロフラントインなどの抗生物質;(m)細胞毒素剤、細胞増殖抑制剤および細胞増殖影響剤;(n)血管拡張剤;(o)内部的な血管増殖機構に干渉する薬剤;(p)モノクローナル抗体など白血球漸増抑制剤;(q)サイトカイン;(r)ホルモン;(s)アリベンドール、アンブセタミド、アミノプロマジン、アポアトロピン、メチル硫酸ベボニウム、ビエタミベリン、ブタベリン、ブトロピウムブロミド、n−ブチルスコポラミンブロミド、カロベリン、シメトロピウムブロミド、シンナメドリン、クレボプリド、コニイン臭化水素酸塩、コニイン塩酸塩、サイクロニウム沃化物、ジフェメリン、ジイソプロミン、ジオキサフェチルブチレート、ジポニウムブロミド、ドロフェニン、エメプロニウムブロミド、エタベリン、フェクレミン、フェナラミド、フェノベリン、フェンピプラン、フェンピベリニウムブロミド、フェントニウムブロミド、フラボキサート、フロプロピオン、グルコン酸、グアイアクタミン、ヒドラミトラジン、ヒメクロモン、レイオピロール、メベベリン、モキサベリン、ナフィベリン、オクタミルアミン、オクタベリン、塩化オキシブチニン、ペンタピペリド、フェナマシド塩酸塩、フロログルシノール、ピナベリウムブロミド、ピペリレート、ピポキソラン塩酸塩、プラミベリン、プリフィニウムブロミド、プロペリジン、プロピバン、プロピロマジン、プロザピン、ラセフェミン、ロシベリン、スパスモリトール、スチロニウム沃化物、サルトロポニウム、チエモニウム沃化物、チキジウムブロミド、チロプラミド、トレピブトン、トリクロミル、トリフォリウム、トリメブチン、トロペンジル、塩化トロスピウム、ゼニトロピウムブロミド、ケトロラクおよびそれらの薬学的に許容可能な塩などの鎮痙薬。
Forest、Sindbisなど)、レンチウイルス、単純ヘルペスウイルス、複製型ウイルス(replication competent virus)(例えば、ONYX−015)、およびハイブリッドベクターなどのウイルスベクターと、人工染色体およびミニ染色体、プラスミドDNAベクター(例えば、pCOR)、カチオン性重合体(例えば、ポリエチレンイミン、ポリエチレンイミン(PEI))、グラフト共重合体(例えば、ポリエーテル−PEI、ポリエチレンオキシド−PEI)、中性の重合体である
PVP、SP1017(SUPRATEK)、カチオン性脂質などの脂質、リポソーム、リポプレックス、ナノ粒子、またはマイクロ粒子などの非ウイルスベクター(タンパク質導入ドメイン(PTD)などのターゲットシーケンスを有するものも有しないものも含め)とが含まれる。
生侵食性本体が管状の形態である(ステントの長手方向軸に沿って正面から見たときの断面が円形である)実施形態について示した(例えば、図2)が、管の断面が非円形であってもよい。例えば、ステントの長手方向軸に沿って見たとき、管は、正方形、矩形、六角形または八角形であってよい。
よい。
Claims (18)
- 生侵食性の本体と保護コーティングとを備える植込型内部人工器官であって、前記保護コーティングは、前記内部人工器官が体内において非拡張状態にあるとき、前記生侵食性本体と身体の物質との間の直接接触を妨げるとともに、植込時、非拡張状態から拡張状態へと拡張すると、もはや前記生侵食性本体と前記身体物質との間の直接接触を妨げない、植込型内部人工器官。
- 非拡張状態から拡張状態へと拡張すると、もはや前記保護コーティングは前記生侵食性本体と前記身体物質との間の直接接触を妨げない程度まで薄くなる請求項1に記載の植込型内部人工器官。
- 非拡張状態から拡張状態へと拡張すると、もはや前記保護コーティングは前記生侵食性本体と前記身体物質との間の直接接触を妨げない程度までひび割れる請求項1に記載の植込型内部人工器官。
- 前記生侵食性本体は管状の形態である請求項1に記載の植込型内部人工器官。
- 前記生侵食性本体は、鉄、マグネシウム、亜鉛、アルミニウム、カルシウムおよびそれらの合金から選択される生侵食性金属材料を含む請求項1に記載の植込型内部人工器官。
- 前記生侵食性本体は生侵食性高分子材料を含む請求項1に記載の植込型内部人工器官。
- 前記保護コーティングは非生侵食性の材料を含む請求項1に記載の植込型内部人工器官。
- 前記非生侵食性材料は高分子材料またはセラミックである請求項7に記載の植込型内部人工器官。
- 前記非生侵食性材料はシリコンの酸化物またはチタンの酸化物を含むセラミックである請求項8に記載の植込型内部人工器官。
- 前記保護コーティングは生侵食性高分子材料を含む請求項1に記載の植込型内部人工器官。
- 前記生侵食性本体は生侵食性の金属を含み、前記保護コーティングは生侵食性の金属の酸化物またはフッ化物を含む請求項1に記載の植込型内部人工器官。
- 前記保護コーティングは治療剤を含む請求項1に記載の植込型内部人工器官。
- 前記保護コーティングの厚さは前記内部人工器官の長手方向の長さに沿って10%を超えて変化する請求項1に記載の植込型内部人工器官。
- 前記内部人工器官は、前記保護コーティングの外面から前記内部人工器官の内部へ延びている複数の離間された凹部を形成する請求項1に記載の植込型内部人工器官。
- 各凹部は約2.5μm〜約35μmの開口部直径を有し、凹部間の間隔は約10μm〜約75μmである請求項14に記載の植込型内部人工器官。
- 請求項1の植込型内部人工器官を送達する方法であって、
植込型内部人工器官を提供することと、
管腔内の部位へ前記植込型内部人工器官を送達することと、
管腔内で前記植込型内部人工器官を拡張させることと、
前記保護コーティングを破壊し、前記コーティングを通じて前記生侵食性本体と前記身体物質とを直接接触させることと、からなる方法。 - 破壊は拡張中に実行される請求項16に記載の方法。
- 破壊は保護コーティングに孔を穿つことを含む請求項16に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US84547806P | 2006-09-18 | 2006-09-18 | |
| PCT/US2007/078429 WO2008036554A2 (en) | 2006-09-18 | 2007-09-13 | Endoprostheses |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010503486A true JP2010503486A (ja) | 2010-02-04 |
| JP2010503486A5 JP2010503486A5 (ja) | 2012-06-21 |
Family
ID=39110858
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009528482A Pending JP2010503486A (ja) | 2006-09-18 | 2007-09-13 | 内部人工器官 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20080071358A1 (ja) |
| EP (1) | EP2068963B1 (ja) |
| JP (1) | JP2010503486A (ja) |
| AT (1) | ATE530210T1 (ja) |
| CA (1) | CA2663559A1 (ja) |
| WO (1) | WO2008036554A2 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018139647A1 (ja) * | 2017-01-30 | 2018-08-02 | 株式会社日本医療機器技研 | 高機能生体吸収性ステント |
| US11248282B2 (en) | 2017-01-10 | 2022-02-15 | Fuji Light Metal Co., Ltd. | Magnesium alloy |
| US11685975B2 (en) | 2018-07-09 | 2023-06-27 | Japan Medical Device Technology Co., Ltd. | Magnesium alloy |
Families Citing this family (93)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6306166B1 (en) * | 1997-08-13 | 2001-10-23 | Scimed Life Systems, Inc. | Loading and release of water-insoluble drugs |
| US7713297B2 (en) | 1998-04-11 | 2010-05-11 | Boston Scientific Scimed, Inc. | Drug-releasing stent with ceramic-containing layer |
| AU2002345328A1 (en) | 2001-06-27 | 2003-03-03 | Remon Medical Technologies Ltd. | Method and device for electrochemical formation of therapeutic species in vivo |
| WO2007011708A2 (en) | 2005-07-15 | 2007-01-25 | Micell Technologies, Inc. | Stent with polymer coating containing amorphous rapamycin |
| CA2615452C (en) | 2005-07-15 | 2015-03-31 | Micell Technologies, Inc. | Polymer coatings containing drug powder of controlled morphology |
| US8840660B2 (en) | 2006-01-05 | 2014-09-23 | Boston Scientific Scimed, Inc. | Bioerodible endoprostheses and methods of making the same |
| US8089029B2 (en) | 2006-02-01 | 2012-01-03 | Boston Scientific Scimed, Inc. | Bioabsorbable metal medical device and method of manufacture |
| US20070224235A1 (en) | 2006-03-24 | 2007-09-27 | Barron Tenney | Medical devices having nanoporous coatings for controlled therapeutic agent delivery |
| US8187620B2 (en) | 2006-03-27 | 2012-05-29 | Boston Scientific Scimed, Inc. | Medical devices comprising a porous metal oxide or metal material and a polymer coating for delivering therapeutic agents |
| US8048150B2 (en) | 2006-04-12 | 2011-11-01 | Boston Scientific Scimed, Inc. | Endoprosthesis having a fiber meshwork disposed thereon |
| CA2650590C (en) | 2006-04-26 | 2018-04-03 | Micell Technologies, Inc. | Coatings containing multiple drugs |
| US8815275B2 (en) | 2006-06-28 | 2014-08-26 | Boston Scientific Scimed, Inc. | Coatings for medical devices comprising a therapeutic agent and a metallic material |
| JP2009542359A (ja) | 2006-06-29 | 2009-12-03 | ボストン サイエンティフィック リミテッド | 選択的被覆部を備えた医療装置 |
| CA2659761A1 (en) | 2006-08-02 | 2008-02-07 | Boston Scientific Scimed, Inc. | Endoprosthesis with three-dimensional disintegration control |
| WO2008033711A2 (en) | 2006-09-14 | 2008-03-20 | Boston Scientific Limited | Medical devices with drug-eluting coating |
| US8057534B2 (en) | 2006-09-15 | 2011-11-15 | Boston Scientific Scimed, Inc. | Bioerodible endoprostheses and methods of making the same |
| EP2959925B1 (en) | 2006-09-15 | 2018-08-29 | Boston Scientific Limited | Medical devices and methods of making the same |
| EP2399616A1 (en) | 2006-09-15 | 2011-12-28 | Boston Scientific Scimed, Inc. | Bioerodible endoprosthesis with biostable inorganic layers |
| WO2008034031A2 (en) | 2006-09-15 | 2008-03-20 | Boston Scientific Limited | Bioerodible endoprostheses and methods of making the same |
| CA2663762A1 (en) | 2006-09-18 | 2008-03-27 | Boston Scientific Limited | Endoprostheses |
| US7981150B2 (en) * | 2006-11-09 | 2011-07-19 | Boston Scientific Scimed, Inc. | Endoprosthesis with coatings |
| US20080294236A1 (en) * | 2007-05-23 | 2008-11-27 | Boston Scientific Scimed, Inc. | Endoprosthesis with Select Ceramic and Polymer Coatings |
| WO2008083190A2 (en) | 2006-12-28 | 2008-07-10 | Boston Scientific Limited | Bioerodible endoprostheses and methods of making same |
| EP2111184B1 (en) | 2007-01-08 | 2018-07-25 | Micell Technologies, Inc. | Stents having biodegradable layers |
| US11426494B2 (en) | 2007-01-08 | 2022-08-30 | MT Acquisition Holdings LLC | Stents having biodegradable layers |
| JP4906926B2 (ja) | 2007-01-21 | 2012-03-28 | ヘモテック アーゲー | 身体管腔の狭窄の治療および切迫再狭窄の予防のための医療器具 |
| US8431149B2 (en) | 2007-03-01 | 2013-04-30 | Boston Scientific Scimed, Inc. | Coated medical devices for abluminal drug delivery |
| US8070797B2 (en) | 2007-03-01 | 2011-12-06 | Boston Scientific Scimed, Inc. | Medical device with a porous surface for delivery of a therapeutic agent |
| US8067054B2 (en) | 2007-04-05 | 2011-11-29 | Boston Scientific Scimed, Inc. | Stents with ceramic drug reservoir layer and methods of making and using the same |
| US7976915B2 (en) | 2007-05-23 | 2011-07-12 | Boston Scientific Scimed, Inc. | Endoprosthesis with select ceramic morphology |
| US9192697B2 (en) | 2007-07-03 | 2015-11-24 | Hemoteq Ag | Balloon catheter for treating stenosis of body passages and for preventing threatening restenosis |
| US8002823B2 (en) | 2007-07-11 | 2011-08-23 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| US7942926B2 (en) | 2007-07-11 | 2011-05-17 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| JP2010533563A (ja) | 2007-07-19 | 2010-10-28 | ボストン サイエンティフィック リミテッド | 吸着抑制表面を有する内部人工器官 |
| DE102007034363A1 (de) * | 2007-07-24 | 2009-01-29 | Biotronik Vi Patent Ag | Endoprothese |
| US8815273B2 (en) | 2007-07-27 | 2014-08-26 | Boston Scientific Scimed, Inc. | Drug eluting medical devices having porous layers |
| US7931683B2 (en) | 2007-07-27 | 2011-04-26 | Boston Scientific Scimed, Inc. | Articles having ceramic coated surfaces |
| US8221822B2 (en) | 2007-07-31 | 2012-07-17 | Boston Scientific Scimed, Inc. | Medical device coating by laser cladding |
| WO2009020520A1 (en) | 2007-08-03 | 2009-02-12 | Boston Scientific Scimed, Inc. | Coating for medical device having increased surface area |
| US8052745B2 (en) | 2007-09-13 | 2011-11-08 | Boston Scientific Scimed, Inc. | Endoprosthesis |
| US7938855B2 (en) | 2007-11-02 | 2011-05-10 | Boston Scientific Scimed, Inc. | Deformable underlayer for stent |
| US8029554B2 (en) | 2007-11-02 | 2011-10-04 | Boston Scientific Scimed, Inc. | Stent with embedded material |
| US8216632B2 (en) | 2007-11-02 | 2012-07-10 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| US8118857B2 (en) * | 2007-11-29 | 2012-02-21 | Boston Scientific Corporation | Medical articles that stimulate endothelial cell migration |
| US20090240323A1 (en) * | 2008-03-20 | 2009-09-24 | Medtronic Vascular, Inc. | Controlled Degradation of Magnesium Stents |
| SG192523A1 (en) | 2008-04-17 | 2013-08-30 | Micell Technologies Inc | Stents having bioabsorbable layers |
| WO2009131911A2 (en) * | 2008-04-22 | 2009-10-29 | Boston Scientific Scimed, Inc. | Medical devices having a coating of inorganic material |
| US8932346B2 (en) | 2008-04-24 | 2015-01-13 | Boston Scientific Scimed, Inc. | Medical devices having inorganic particle layers |
| US7998192B2 (en) | 2008-05-09 | 2011-08-16 | Boston Scientific Scimed, Inc. | Endoprostheses |
| US20090287301A1 (en) * | 2008-05-16 | 2009-11-19 | Boston Scientific, Scimed Inc. | Coating for medical implants |
| JP5207480B2 (ja) | 2008-05-30 | 2013-06-12 | 株式会社ナントー精密 | インプラント体及びその製造方法並びに歯科用インプラント |
| US8236046B2 (en) | 2008-06-10 | 2012-08-07 | Boston Scientific Scimed, Inc. | Bioerodible endoprosthesis |
| EP2303350A2 (en) | 2008-06-18 | 2011-04-06 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| WO2011009096A1 (en) | 2009-07-16 | 2011-01-20 | Micell Technologies, Inc. | Drug delivery medical device |
| CA2946195A1 (en) | 2008-07-17 | 2010-01-21 | Micell Technologies, Inc. | Drug delivery medical device |
| DE102008040640A1 (de) * | 2008-07-23 | 2010-01-28 | Biotronik Vi Patent Ag | Endoprothese und Verfahren zur Herstellung derselben |
| US7985252B2 (en) | 2008-07-30 | 2011-07-26 | Boston Scientific Scimed, Inc. | Bioerodible endoprosthesis |
| US8382824B2 (en) | 2008-10-03 | 2013-02-26 | Boston Scientific Scimed, Inc. | Medical implant having NANO-crystal grains with barrier layers of metal nitrides or fluorides |
| US8389083B2 (en) * | 2008-10-17 | 2013-03-05 | Boston Scientific Scimed, Inc. | Polymer coatings with catalyst for medical devices |
| US8231980B2 (en) | 2008-12-03 | 2012-07-31 | Boston Scientific Scimed, Inc. | Medical implants including iridium oxide |
| WO2010101901A2 (en) | 2009-03-02 | 2010-09-10 | Boston Scientific Scimed, Inc. | Self-buffering medical implants |
| US8071156B2 (en) | 2009-03-04 | 2011-12-06 | Boston Scientific Scimed, Inc. | Endoprostheses |
| FR2942804B1 (fr) * | 2009-03-09 | 2011-08-19 | Arkema France | Carburant aviation contenant une proportion de composes organiques ex-biomasse |
| JP2012522589A (ja) | 2009-04-01 | 2012-09-27 | ミシェル テクノロジーズ,インコーポレイテッド | 被覆ステント |
| CA2759015C (en) | 2009-04-17 | 2017-06-20 | James B. Mcclain | Stents having controlled elution |
| WO2010124098A2 (en) * | 2009-04-24 | 2010-10-28 | Boston Scientific Scimed, Inc. | Use of drug polymorphs to achieve controlled drug delivery from a coated medical device |
| US8287937B2 (en) | 2009-04-24 | 2012-10-16 | Boston Scientific Scimed, Inc. | Endoprosthese |
| US8382823B2 (en) * | 2009-05-28 | 2013-02-26 | Snu R&Db Foundation | Biodegradable stent and method for manufacturing the same |
| ES2550634T3 (es) | 2009-07-10 | 2015-11-11 | Boston Scientific Scimed, Inc. | Uso de nanocristales para un balón de suministro de fármaco |
| WO2011008393A2 (en) * | 2009-07-17 | 2011-01-20 | Boston Scientific Scimed, Inc. | Nucleation of drug delivery balloons to provide improved crystal size and density |
| EP2338534A2 (de) * | 2009-12-21 | 2011-06-29 | Biotronik VI Patent AG | Medizinisches Implantat, Beschichtungsverfahren sowie Implantationsverfahren |
| US20110160839A1 (en) * | 2009-12-29 | 2011-06-30 | Boston Scientific Scimed, Inc. | Endoprosthesis |
| WO2011097103A1 (en) * | 2010-02-02 | 2011-08-11 | Micell Technologies, Inc. | Stent and stent delivery system with improved deliverability |
| WO2011119573A1 (en) | 2010-03-23 | 2011-09-29 | Boston Scientific Scimed, Inc. | Surface treated bioerodible metal endoprostheses |
| US10232092B2 (en) | 2010-04-22 | 2019-03-19 | Micell Technologies, Inc. | Stents and other devices having extracellular matrix coating |
| US9072618B2 (en) | 2010-05-06 | 2015-07-07 | Biotronik Ag | Biocorrodable implant in which corrosion may be triggered or accelerated after implantation by means of an external stimulus |
| US20130172853A1 (en) | 2010-07-16 | 2013-07-04 | Micell Technologies, Inc. | Drug delivery medical device |
| US8889211B2 (en) | 2010-09-02 | 2014-11-18 | Boston Scientific Scimed, Inc. | Coating process for drug delivery balloons using heat-induced rewrap memory |
| WO2012054129A1 (en) | 2010-10-18 | 2012-04-26 | Boston Scientific Scimed, Inc. | Drug eluting medical device utilizing bioadhesives |
| US20130018448A1 (en) * | 2011-07-12 | 2013-01-17 | Boston Scientific Scimed, Inc. | Drug elution medical device |
| CA2841360A1 (en) | 2011-07-15 | 2013-01-24 | Micell Technologies, Inc. | Drug delivery medical device |
| US8669360B2 (en) | 2011-08-05 | 2014-03-11 | Boston Scientific Scimed, Inc. | Methods of converting amorphous drug substance into crystalline form |
| WO2013028208A1 (en) | 2011-08-25 | 2013-02-28 | Boston Scientific Scimed, Inc. | Medical device with crystalline drug coating |
| US10188772B2 (en) | 2011-10-18 | 2019-01-29 | Micell Technologies, Inc. | Drug delivery medical device |
| JP6133983B2 (ja) | 2012-07-13 | 2017-05-24 | ボストン サイエンティフィック サイムド,インコーポレイテッドBoston Scientific Scimed,Inc. | 心耳用閉塞装置およびその製造方法 |
| WO2014042875A1 (en) | 2012-09-12 | 2014-03-20 | Boston Scientific Scimed, Inc. | Adhesive stent coating for anti-migration |
| WO2014065941A1 (en) | 2012-10-25 | 2014-05-01 | Boston Scientific Scimed, Inc. | Stent having a tacky silicone coating to prevent stent migration |
| AU2014248508B2 (en) | 2013-03-12 | 2018-11-08 | Micell Technologies, Inc. | Bioabsorbable biomedical implants |
| US10272606B2 (en) | 2013-05-15 | 2019-04-30 | Micell Technologies, Inc. | Bioabsorbable biomedical implants |
| EP3427766B1 (en) | 2013-08-08 | 2020-09-23 | Boston Scientific Scimed, Inc. | Dissolvable or degradable adhesive polymer to prevent stent migration |
| EP3373829A1 (en) | 2015-11-13 | 2018-09-19 | Cardiac Pacemakers, Inc. | Bioabsorbable left atrial appendage closure with endothelialization promoting surface |
| WO2019161072A1 (en) | 2018-02-14 | 2019-08-22 | Boston Scientific Scimed, Inc. | Occlusive medical device |
| DE102018128206B4 (de) * | 2018-11-12 | 2024-09-19 | Innovent E.V. | Verfahren zur Erzeugung einer Magnesiumfluoridschicht auf einer Magnesiumlegierung und damit hergestellte Bauteile |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030033007A1 (en) * | 2000-12-22 | 2003-02-13 | Avantec Vascular Corporation | Methods and devices for delivery of therapeutic capable agents with variable release profile |
| JP2003275228A (ja) * | 2002-03-20 | 2003-09-30 | Terumo Corp | 医療用管状体およびその製造方法 |
| JP2004524891A (ja) * | 2001-01-29 | 2004-08-19 | ジー ファースト,ジョセフ | 照射ステントコーティング |
| WO2005042045A1 (de) * | 2003-11-03 | 2005-05-12 | Blue Membranes Gmbh | Verfahren zur beschichtung von implantaten mittels eines druckverfahrens |
| US20060193892A1 (en) * | 2001-10-26 | 2006-08-31 | Icon Medical Corp. | Polymer biodegradable medical device |
Family Cites Families (99)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US425855A (en) * | 1890-04-15 | Car-pusher or pinch-bar | ||
| US3560362A (en) * | 1966-08-03 | 1971-02-02 | Japan Atomic Energy Res Inst | Method and apparatus for promoting chemical reactions by means of radioactive inert gases |
| US3569660A (en) * | 1968-07-29 | 1971-03-09 | Nat Res Dev | Laser cutting apparatus |
| US4002877A (en) * | 1974-12-13 | 1977-01-11 | United Technologies Corporation | Method of cutting with laser radiation and liquid coolant |
| US4634502A (en) * | 1984-11-02 | 1987-01-06 | The Standard Oil Company | Process for the reductive deposition of polyoxometallates |
| US4725273A (en) * | 1985-08-23 | 1988-02-16 | Kanegafuchi Kagaku Kogyo Kabushiki Kaisha | Artificial vessel having excellent patency |
| CH670760A5 (ja) * | 1986-06-02 | 1989-07-14 | Sulzer Ag | |
| US5091205A (en) * | 1989-01-17 | 1992-02-25 | Union Carbide Chemicals & Plastics Technology Corporation | Hydrophilic lubricious coatings |
| US5079203A (en) * | 1990-05-25 | 1992-01-07 | Board Of Trustees Operating Michigan State University | Polyoxometalate intercalated layered double hydroxides |
| US5195969A (en) * | 1991-04-26 | 1993-03-23 | Boston Scientific Corporation | Co-extruded medical balloons and catheter using such balloons |
| US5292558A (en) * | 1991-08-08 | 1994-03-08 | University Of Texas At Austin, Texas | Process for metal deposition for microelectronic interconnections |
| US5811447A (en) * | 1993-01-28 | 1998-09-22 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| JP2961287B2 (ja) * | 1991-10-18 | 1999-10-12 | グンゼ株式会社 | 生体管路拡張具、その製造方法およびステント |
| DK0617594T3 (da) * | 1991-12-12 | 1998-02-02 | Target Therapeutics Inc | Adskillelig udstøderkarokklusionsspiralkonstruktion med sammenlåsningskobling |
| US5599352A (en) * | 1992-03-19 | 1997-02-04 | Medtronic, Inc. | Method of making a drug eluting stent |
| JPH07505316A (ja) * | 1992-03-31 | 1995-06-15 | ボストン サイエンティフィック コーポレーション | 医療用ワイヤ |
| GEP20002074B (en) * | 1992-05-19 | 2000-05-10 | Westaim Tech Inc Ca | Modified Material and Method for its Production |
| US5385776A (en) * | 1992-11-16 | 1995-01-31 | Alliedsignal Inc. | Nanocomposites of gamma phase polymers containing inorganic particulate material |
| US5464650A (en) * | 1993-04-26 | 1995-11-07 | Medtronic, Inc. | Intravascular stent and method |
| US5716981A (en) * | 1993-07-19 | 1998-02-10 | Angiogenesis Technologies, Inc. | Anti-angiogenic compositions and methods of use |
| US5721049A (en) * | 1993-11-15 | 1998-02-24 | Trustees Of The University Of Pennsylvania | Composite materials using bone bioactive glass and ceramic fibers |
| US5743172A (en) * | 1994-11-28 | 1998-04-28 | Gold Medal Products Co. | Automatic popcorn popper with thermal controller |
| US6981986B1 (en) * | 1995-03-01 | 2006-01-03 | Boston Scientific Scimed, Inc. | Longitudinally flexible expandable stent |
| US5605696A (en) * | 1995-03-30 | 1997-02-25 | Advanced Cardiovascular Systems, Inc. | Drug loaded polymeric material and method of manufacture |
| BR9608021A (pt) * | 1995-04-19 | 1999-03-02 | Schneider Inc | Dispositivo expansível revestido de libertação de droga |
| US6027742A (en) * | 1995-05-19 | 2000-02-22 | Etex Corporation | Bioresorbable ceramic composites |
| AU716005B2 (en) * | 1995-06-07 | 2000-02-17 | Cook Medical Technologies Llc | Implantable medical device |
| EP0765660A3 (en) * | 1995-09-28 | 1998-09-23 | Takeda Chemical Industries, Ltd. | Microcapsules comprising 2-piperazinone-1-acetic acid compounds |
| US5788626A (en) * | 1995-11-21 | 1998-08-04 | Schneider (Usa) Inc | Method of making a stent-graft covered with expanded polytetrafluoroethylene |
| US5830217A (en) * | 1996-08-09 | 1998-11-03 | Thomas J. Fogarty | Soluble fixation device and method for stent delivery catheters |
| US5869141A (en) * | 1996-11-04 | 1999-02-09 | The Boeing Company | Surface pretreatment for sol coating of metals |
| US6013591A (en) * | 1997-01-16 | 2000-01-11 | Massachusetts Institute Of Technology | Nanocrystalline apatites and composites, prostheses incorporating them, and method for their production |
| US5830229A (en) * | 1997-03-07 | 1998-11-03 | Micro Therapeutics Inc. | Hoop stent |
| US10028851B2 (en) * | 1997-04-15 | 2018-07-24 | Advanced Cardiovascular Systems, Inc. | Coatings for controlling erosion of a substrate of an implantable medical device |
| DE19731021A1 (de) * | 1997-07-18 | 1999-01-21 | Meyer Joerg | In vivo abbaubares metallisches Implantat |
| DE19734972A1 (de) * | 1997-08-13 | 1999-02-18 | Cerdec Ag | Goldhaltige nanoporöse Aluminiumoxid-Membranen, Verfahren zu deren Herstellung und deren Verwendung |
| DE19746735C2 (de) * | 1997-10-13 | 2003-11-06 | Simag Gmbh Systeme Und Instr F | NMR-Bildgebungsverfahren zur Darstellung, Positionsbestimmung oder funktionellen Kontrolle einer in ein Untersuchungsobjekt eingeführten Vorrichtung und Vorrichtung zur Verwendung in einem derartigen Verfahren |
| US6212434B1 (en) * | 1998-07-22 | 2001-04-03 | Cardiac Pacemakers, Inc. | Single pass lead system |
| EP0966979B1 (de) * | 1998-06-25 | 2006-03-08 | Biotronik AG | Implantierbare, bioresorbierbare Gefässwandstütze, insbesondere Koronarstent |
| US6755856B2 (en) * | 1998-09-05 | 2004-06-29 | Abbott Laboratories Vascular Enterprises Limited | Methods and apparatus for stenting comprising enhanced embolic protection, coupled with improved protection against restenosis and thrombus formation |
| US6358276B1 (en) * | 1998-09-30 | 2002-03-19 | Impra, Inc. | Fluid containing endoluminal stent |
| US6042597A (en) * | 1998-10-23 | 2000-03-28 | Scimed Life Systems, Inc. | Helical stent design |
| US6419692B1 (en) * | 1999-02-03 | 2002-07-16 | Scimed Life Systems, Inc. | Surface protection method for stents and balloon catheters for drug delivery |
| US6214037B1 (en) * | 1999-03-18 | 2001-04-10 | Fossa Industries, Llc | Radially expanding stent |
| US6368658B1 (en) * | 1999-04-19 | 2002-04-09 | Scimed Life Systems, Inc. | Coating medical devices using air suspension |
| DE60038374T2 (de) * | 1999-05-31 | 2009-03-12 | Sumitomo Electric Industries, Ltd. | Prothese für blutgefässe |
| DE19950386A1 (de) * | 1999-10-19 | 2001-05-10 | Miladin Lazarov | Biokompatibler Gegenstand |
| US6338739B1 (en) * | 1999-12-22 | 2002-01-15 | Ethicon, Inc. | Biodegradable stent |
| US6451177B1 (en) * | 2000-01-21 | 2002-09-17 | Applied Materials, Inc. | Vault shaped target and magnetron operable in two sputtering modes |
| JP4545888B2 (ja) * | 2000-06-08 | 2010-09-15 | 株式会社泉精器製作所 | 固液分離装置 |
| US20030018380A1 (en) * | 2000-07-07 | 2003-01-23 | Craig Charles H. | Platinum enhanced alloy and intravascular or implantable medical devices manufactured therefrom |
| US6451373B1 (en) * | 2000-08-04 | 2002-09-17 | Advanced Cardiovascular Systems, Inc. | Method of forming a therapeutic coating onto a surface of an implantable prosthesis |
| US6506437B1 (en) * | 2000-10-17 | 2003-01-14 | Advanced Cardiovascular Systems, Inc. | Methods of coating an implantable device having depots formed in a surface thereof |
| US20040030377A1 (en) * | 2001-10-19 | 2004-02-12 | Alexander Dubson | Medicated polymer-coated stent assembly |
| DE50107779D1 (de) * | 2001-01-05 | 2006-03-02 | Jacqueline Yvonne Hausdorf | Durch korrosion abbaubare metallische medizinische implantate |
| EP1383522B1 (en) * | 2001-04-23 | 2006-04-05 | Nucryst Pharmaceuticals Corp. | A medicament or a dressing containing a metal such as silver, gold, platinum or palladium as an antimicrobial agent and their use in the treatment of inflammatory skin conditions |
| US6656216B1 (en) * | 2001-06-29 | 2003-12-02 | Advanced Cardiovascular Systems, Inc. | Composite stent with regioselective material |
| US6676987B2 (en) * | 2001-07-02 | 2004-01-13 | Scimed Life Systems, Inc. | Coating a medical appliance with a bubble jet printing head |
| US6632231B2 (en) * | 2001-08-23 | 2003-10-14 | Scimed Life Systems, Inc. | Segmented balloon catheter blade |
| US20030060873A1 (en) * | 2001-09-19 | 2003-03-27 | Nanomedical Technologies, Inc. | Metallic structures incorporating bioactive materials and methods for creating the same |
| US7157096B2 (en) * | 2001-10-12 | 2007-01-02 | Inframat Corporation | Coatings, coated articles and methods of manufacture thereof |
| DE10163107C1 (de) * | 2001-12-24 | 2003-07-10 | Univ Hannover | Magnesium-Werkstück und Verfahren zur Ausbildung einer korrosionsschützenden Deckschicht eines Magnesium-Werkstücks |
| WO2003063733A1 (en) * | 2002-01-31 | 2003-08-07 | Radi Medical Systems Ab | Stent |
| DE10207161B4 (de) * | 2002-02-20 | 2004-12-30 | Universität Hannover | Verfahren zur Herstellung von Implantaten |
| WO2003092554A1 (en) * | 2002-05-03 | 2003-11-13 | The General Hospital Corporation | Involuted endovascular valve and method of construction |
| US6696666B2 (en) * | 2002-07-03 | 2004-02-24 | Scimed Life Systems, Inc. | Tubular cutting process and system |
| US20040004063A1 (en) * | 2002-07-08 | 2004-01-08 | Merdan Kenneth M. | Vertical stent cutting process |
| DE10237572A1 (de) * | 2002-08-13 | 2004-02-26 | Biotronik Meß- und Therapiegeräte GmbH & Co. Ingenieurbüro Berlin | Stent mit polymerer Beschichtung |
| US6696667B1 (en) * | 2002-11-22 | 2004-02-24 | Scimed Life Systems, Inc. | Laser stent cutting |
| US20080051866A1 (en) * | 2003-02-26 | 2008-02-28 | Chao Chin Chen | Drug delivery devices and methods |
| DE10311729A1 (de) * | 2003-03-18 | 2004-09-30 | Schultheiss, Heinz-Peter, Prof. Dr. | Endovaskuläres Implantat mit einer mindestens abschnittsweisen aktiven Beschichtung aus Ratjadon und/oder einem Ratjadon-Derivat |
| US20060041182A1 (en) * | 2003-04-16 | 2006-02-23 | Forbes Zachary G | Magnetically-controllable delivery system for therapeutic agents |
| FI20045223A (fi) * | 2004-06-15 | 2005-12-16 | Bioretec Oy | Monitoiminen biohajoava komposiitti ja kirurginen implantti, joka käsittää mainitun komposiitin |
| US20050025805A1 (en) * | 2003-07-28 | 2005-02-03 | Adam Heller | Osmium compounds for reduction of adverse inflammation |
| US20050038501A1 (en) * | 2003-08-12 | 2005-02-17 | Moore James E. | Dynamic stent |
| US6979473B2 (en) * | 2004-03-15 | 2005-12-27 | Boston Scientific Scimed, Inc. | Method for fine bore orifice spray coating of medical devices and pre-filming atomization |
| US7078108B2 (en) * | 2004-07-14 | 2006-07-18 | The Regents Of The University Of California | Preparation of high-strength nanometer scale twinned coating and foil |
| US20060025848A1 (en) * | 2004-07-29 | 2006-02-02 | Jan Weber | Medical device having a coating layer with structural elements therein and method of making the same |
| DE102004043232A1 (de) * | 2004-09-07 | 2006-03-09 | Biotronik Vi Patent Ag | Endoprothese aus einer Magnesiumlegierung |
| DE102004043231A1 (de) * | 2004-09-07 | 2006-03-09 | Biotronik Vi Patent Ag | Endoprothese aus einer Magnesiumlegierung |
| DE102004044679A1 (de) * | 2004-09-09 | 2006-03-16 | Biotronik Vi Patent Ag | Implantat mit geringer Radialfestigkeit |
| US7229471B2 (en) * | 2004-09-10 | 2007-06-12 | Advanced Cardiovascular Systems, Inc. | Compositions containing fast-leaching plasticizers for improved performance of medical devices |
| US9011831B2 (en) * | 2004-09-30 | 2015-04-21 | Advanced Cardiovascular Systems, Inc. | Methacrylate copolymers for medical devices |
| US7344560B2 (en) * | 2004-10-08 | 2008-03-18 | Boston Scientific Scimed, Inc. | Medical devices and methods of making the same |
| US20080003431A1 (en) * | 2006-06-20 | 2008-01-03 | Thomas John Fellinger | Coated fibrous nodules and insulation product |
| GB2424223C (en) * | 2005-03-07 | 2011-02-02 | Massachusetts Inst Technology | Biomaterial. |
| CN104146795B (zh) * | 2005-04-05 | 2017-11-10 | 万能医药公司 | 可降解的植入式医疗装置 |
| DE102005031868A1 (de) * | 2005-07-04 | 2007-01-18 | Biotronik Vi Patent Ag | Arzneimitteldepot zur parenteralen, insbesondere intravaskulären Arzneimittelfreisetzung |
| US20070034615A1 (en) * | 2005-08-15 | 2007-02-15 | Klaus Kleine | Fabricating medical devices with an ytterbium tungstate laser |
| US20070038290A1 (en) * | 2005-08-15 | 2007-02-15 | Bin Huang | Fiber reinforced composite stents |
| US7524726B2 (en) * | 2005-08-17 | 2009-04-28 | International Rectifier Corporation | Method for fabricating a semiconductor device |
| US7597924B2 (en) * | 2005-08-18 | 2009-10-06 | Boston Scientific Scimed, Inc. | Surface modification of ePTFE and implants using the same |
| US20070045252A1 (en) * | 2005-08-23 | 2007-03-01 | Klaus Kleine | Laser induced plasma machining with a process gas |
| US9265866B2 (en) * | 2006-08-01 | 2016-02-23 | Abbott Cardiovascular Systems Inc. | Composite polymeric and metallic stent with radiopacity |
| US20080069854A1 (en) * | 2006-08-02 | 2008-03-20 | Inframat Corporation | Medical devices and methods of making and using |
| US20080033522A1 (en) * | 2006-08-03 | 2008-02-07 | Med Institute, Inc. | Implantable Medical Device with Particulate Coating |
| DE102006038235A1 (de) * | 2006-08-07 | 2008-02-14 | Biotronik Vi Patent Ag | Verbesserung der Stabilität biodegradierbarer metallischer Stents, Verfahren und Verwendung |
| US20080069858A1 (en) * | 2006-09-20 | 2008-03-20 | Boston Scientific Scimed, Inc. | Medical devices having biodegradable polymeric regions with overlying hard, thin layers |
| WO2008117315A1 (en) * | 2007-03-23 | 2008-10-02 | Invatec Technology Center Gmbh | Endoluminal prosthesis |
-
2007
- 2007-09-13 EP EP07842459A patent/EP2068963B1/en not_active Not-in-force
- 2007-09-13 AT AT07842459T patent/ATE530210T1/de not_active IP Right Cessation
- 2007-09-13 CA CA002663559A patent/CA2663559A1/en not_active Abandoned
- 2007-09-13 JP JP2009528482A patent/JP2010503486A/ja active Pending
- 2007-09-13 WO PCT/US2007/078429 patent/WO2008036554A2/en active Application Filing
- 2007-09-13 US US11/855,096 patent/US20080071358A1/en not_active Abandoned
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030033007A1 (en) * | 2000-12-22 | 2003-02-13 | Avantec Vascular Corporation | Methods and devices for delivery of therapeutic capable agents with variable release profile |
| JP2004524891A (ja) * | 2001-01-29 | 2004-08-19 | ジー ファースト,ジョセフ | 照射ステントコーティング |
| US20060193892A1 (en) * | 2001-10-26 | 2006-08-31 | Icon Medical Corp. | Polymer biodegradable medical device |
| JP2003275228A (ja) * | 2002-03-20 | 2003-09-30 | Terumo Corp | 医療用管状体およびその製造方法 |
| WO2005042045A1 (de) * | 2003-11-03 | 2005-05-12 | Blue Membranes Gmbh | Verfahren zur beschichtung von implantaten mittels eines druckverfahrens |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11248282B2 (en) | 2017-01-10 | 2022-02-15 | Fuji Light Metal Co., Ltd. | Magnesium alloy |
| WO2018139647A1 (ja) * | 2017-01-30 | 2018-08-02 | 株式会社日本医療機器技研 | 高機能生体吸収性ステント |
| US11160674B2 (en) | 2017-01-30 | 2021-11-02 | Japan Medical Device Technology Co., Ltd. | High performance bioabsorbable stent |
| US11685975B2 (en) | 2018-07-09 | 2023-06-27 | Japan Medical Device Technology Co., Ltd. | Magnesium alloy |
Also Published As
| Publication number | Publication date |
|---|---|
| ATE530210T1 (de) | 2011-11-15 |
| EP2068963B1 (en) | 2011-10-26 |
| WO2008036554A3 (en) | 2008-05-15 |
| CA2663559A1 (en) | 2008-03-27 |
| WO2008036554A2 (en) | 2008-03-27 |
| EP2068963A2 (en) | 2009-06-17 |
| US20080071358A1 (en) | 2008-03-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2010503486A (ja) | 内部人工器官 | |
| US8002821B2 (en) | Bioerodible metallic ENDOPROSTHESES | |
| JP2010503483A (ja) | 医療装置 | |
| ES2356274T3 (es) | Endoprótesis biodegradables y procedimientos de fabricación de las mismas. | |
| JP5572686B2 (ja) | 分解性の移植可能な医療装置 | |
| JP5204666B2 (ja) | 生体侵食性体内プロテーゼ、およびその製造方法 | |
| EP2398521B1 (en) | Bioerodible endoprosthesis | |
| US20080071357A1 (en) | Controlling biodegradation of a medical instrument | |
| US20100145436A1 (en) | Bio-erodible Stent | |
| JP2010508999A (ja) | コーティングを備えた内部人工器官 | |
| US20090240324A1 (en) | Drug Eluting Stent and Method of Making the Same | |
| WO2007087069A2 (en) | Biodegradable device | |
| JP2011502580A (ja) | 多孔質貯蔵部および非ポリマー拡散層を備えた内部人工器官 | |
| JP2010540103A (ja) | 制御拡散用のフィルタインサートを含む医療デバイス | |
| US7892595B2 (en) | Implantable device coating system and method |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100913 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110822 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20120301 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120502 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121106 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130423 |