JP2009534109A - 接着促進剤を含むコーティングを有する医療デバイス - Google Patents
接着促進剤を含むコーティングを有する医療デバイス Download PDFInfo
- Publication number
- JP2009534109A JP2009534109A JP2009506630A JP2009506630A JP2009534109A JP 2009534109 A JP2009534109 A JP 2009534109A JP 2009506630 A JP2009506630 A JP 2009506630A JP 2009506630 A JP2009506630 A JP 2009506630A JP 2009534109 A JP2009534109 A JP 2009534109A
- Authority
- JP
- Japan
- Prior art keywords
- coating
- stent
- region
- therapeutic agent
- coating composition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/16—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/86—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure
- A61F2/90—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure
- A61F2/91—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheet material or tubes, e.g. perforated by laser cuts or etched holes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0014—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis
- A61F2250/0035—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof having different values of a given property or geometrical feature, e.g. mechanical property or material property, at different locations within the same prosthesis differing in release or diffusion time
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0067—Means for introducing or releasing pharmaceutical products into the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/404—Biocides, antimicrobial agents, antiseptic agents
- A61L2300/406—Antibiotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/416—Anti-neoplastic or anti-proliferative or anti-restenosis or anti-angiogenic agents, e.g. paclitaxel, sirolimus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/60—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a special physical form
- A61L2300/606—Coatings
- A61L2300/608—Coatings having two or more layers
- A61L2300/61—Coatings having two or more layers containing two or more active agents in different layers
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Surgery (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Materials For Medical Uses (AREA)
Abstract
【選択図】図3
Description
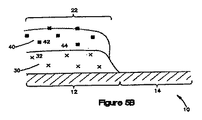
この実施形態において、第1コーティング領域22はまた、第1コーティング組成物30の上に配置される第2コーティング組成物40を有する。第2コーティング組成物40は、層を形成することができる。また、第2コーティング組成物40は、第1治療剤42を有し、第2ポリマー44も含むことができる。特定の実施形態において、第1コーティング組成物30の第1ポリマー34は、第2コーティング組成物40の第2ポリマー44と同一であってよい。他の実施形態において、第1コーティング組成物30の第1ポリマー34は、第2コーティング組成物40の第2ポリマー44と異なってよい。いくつかの実施形態において、第2コーティング組成物40は、第1コーティング組成物30の接着促進剤32と同一または異なる接着促進剤を含むこともできる。
コーティングの第2コーティング領域24は、層を形成することができる第2コーティング組成物40を有する。第2コーティング組成物40は、第1コーティング組成物30の第1接着促進剤32と同一であり得る第2治療剤52を含む。第2コーティング組成物40は、第1治療剤42と同一または異なってよい第2治療剤62を含むことができる。第2コーティング組成物40は、第1組成物中のポリマーと同一であり得るポリマーを含むこともできる。さらに、第2コーティング領域は、接着促進剤、ポリマーおよび/または治療剤のいずれかを有するコーティング組成物の1つまたは複数の付加的層を含むことができる。
本発明のコーティングされた医療デバイスは、患者の体内に挿入および植込むことができる。本発明に適した医療デバイスは、限定するものではないが、ステント、外科用ステープル、バルーンカテーテル、中心静脈カテーテル、動脈カテーテルなどのカテーテル、ガイドワイヤ、カニューラ、心臓ペースメーカリードまたはリードチップ、心臓細動除去器リードまたはリードチップ、植込み可能血管進入ポート、血液保存バッグ、血液チューブ、血管または他のグラフト、大動脈内バルーンポンプ、心臓弁、心臓血管縫合糸、総合的人工心臓、心室補助ポンプ、および血液酸素供給器、血液フィルタ、心房中隔欠損デバイス、人工腎臓ユニット、血液潅流ユニットまたは血漿交換ユニットなど実体のないデバイスを含める。
本発明で使用される用語「治療剤」は、薬剤、遺伝物質および生体物質を包括し、「生体活性物質」と互換的に使用することができる。一実施形態において、治療剤は、抗再狭窄剤である。他の実施形態において、治療剤は、平滑筋細胞増殖、収縮、遊走または活動過剰を阻止する。好適な治療剤の非限定的例は、ヘパリン、ヘパリン誘導体、ウロキナーゼ、デキストロフェニルアラニン・プロリン・アルギニン・クロロメチルケトン(PPack)、エノキサプリン、アンギオペプチン、ヒルジン、アセチルサリチル酸、タクロリムス、エベロリムス、ラパマイシン(シロリムス)、ピメクロリムス、アムロジピン、ドキサゾジン、グルココルチコイド、べータメタゾン、デキサメタゾン、プレドニゾロン、コルチコステロン、ブデゾニド、スルファサラジン、ロシグリタゾン、マイコフェノール酸、メサラミン、パクリタキセル、5ーフルオロウラシル、シスプラチン、ビンブラスチン、ビンクリスチン、エポチロン、メトトレキセート、アザチオプリン、アドリアマイシン 、ムタマイシン、エンドスタチン、アンジオスタチン、チミジンキナーゼ阻害剤、クラドリビン、リドカイン、ブピバカイン、ロピバカイン、D−Phe−Pro−Argクロロメチルケトン、血小板レセプター拮抗剤、抗トロンビン抗体、抗血小板レセプター抗体、アスピリン、ジピリダモール、プロタミン、ヒルジン、プロスタグランジン阻害剤、血小板凝集阻害剤、トラピジル、リプロスチン、ダニ由来抗血小板ペプチド製剤、5−アザシチジン、血管内皮成長因子、成長因子レセプター、転写活性剤、翻訳促進剤、抗増殖剤、成長因子阻害剤、成長因子レセプター拮抗剤、転写リプレッサー、翻訳リプレッサー、複製阻害剤、阻害性抗体、抗成長因子抗体、成長因子とシトトキシンとを含む二機能性分子、抗体とシトトキシンとを含む二機能性分子、コレステロール降下剤、血管拡張剤、内因性血管作動性機序干渉剤、抗酸化剤、プロブコール、抗生物質、ペニシリン、セフォキシチン、オキサシリン、トブラナイシン、血管形成物質、線維芽細胞成長因子、エストロゲン、エストラジオール(E2)、エストリオール(E3)、17−βエストラジオール、ジゴキシン、β遮断剤、カプトプリル、エナロプリル、スタチン類、ステロイド類、ビタミン類、パクリタキセル(ならびにその誘導体、類似体、またはたんぱく質結合パクリタキセル、例えばAbraxane(商標))、2’−サクシニール−タキソール、2’−サクシニール−タキソールトリエタノールアミン、2’−グルタリル−タキソール、2’−グルタリル−タキソールトリエタノールアミン塩、N−(ジメチルアミノエチル)グルタミンを含む2’−O−エステル、N−(ジメチルアミノエチル)グルタミド塩酸塩を含む2’−O−エステル、ニトログリセリン、酸化二窒素、一酸化窒素、抗生物質、アスピリン、ジギタリス、エストロゲン、エストラジオールおよびグリコシド類を含める。一実施形態において、治療剤は、平滑筋細胞増殖阻害剤または抗生物質である。好ましい実施形態において、治療剤は、タキソール(例えばTaxol(登録商標)など)またはその類似体または誘導体である。別の好ましい実施形態において、治療剤は、パクリタキセル、またはその類似体、または誘導体である。さらに別の好ましい実施形態において、治療剤は、エリトロマイシン、アンフォテリシン、ラパマイシン、アドリアマイシンなどの抗生物質である。
・ヘパリン、ヘパリン誘導体、ウロキナーゼ、それに、PPack(デキストロフェニルアラニン・プロリン・アルギニン・クロロメチルケトン)などの抗血栓剤;
・エノクサプリン、アンジオペプチン、または平滑筋細胞の増殖を遮断することのできるモノクロナール抗体、ヒルジン、アセチルサリチル酸、タクロリムス、エベロリムス、アムロジピンおよびデキサゾシンなどの抗増殖剤;
・グルココルチコイド、βメタゾン、デキサメタゾン、プレドニソロン、コルチコステロン、ブデソニド、エストロゲン、スルファサラジン、ロシグリタゾン、マイコフェノール酸およびメサラミンなどの抗炎症剤;
・パクリタキセル、5−フルオロウラシル、シスプラチン、ビンブラスチン、ビンクリスチン、エポチロン、メトトリキセート、アザチオプリン、アドリアマイシン およびムタマイシン;エンドスタチン、アンジオスタチンおよびチミジンキナーゼ阻害剤、クラドリビン、タキソールおよびその類似体または誘導体などの抗腫瘍/抗増殖/抗縮瞳剤;
・リドカイン、ブピバカイン、それに、ロピバカインなどの麻酔剤;
・D−Phe−Pro−Argクロロメチルケトン、RGDペプチド含有製剤、ヘパリン、アンチトロンビン製剤、血小板レセプター拮抗剤、抗トロンビン抗体、抗血小板レセプター抗体、アスピリン(アスピリンは更に、鎮痛・解熱・抗炎症剤に分類される)、ジピリダモール、プロタミン、ヒルジン、プロスタグランジン阻害剤、血小板凝集阻害剤、トラピジルまたはリプロスチンなどの抗血小板剤、およびダニ由来抗血小板ペプチド製剤などの抗凝血剤;
・RNAまたはDNAのメタボライトにも分類され、細胞の成長を阻害し、ある種の癌細胞にアポプトーシスを誘発する5−アザシチジンなどのDNA脱メチル化剤;
・成長因子、血管内皮成長因子(VEGF、VEGF−2を含む全てのタイプ)、成長因子レセプター、転写活性剤および翻訳促進剤等の血管細胞成長促進剤;
・抗増殖剤、成長因子阻害剤、成長因子レセプター拮抗剤、転写リプレッサー、翻訳リプレッサー、複製阻害剤、阻害性抗体、抗成長因子抗体、成長因子とシトトキシンとを含む二機能性分子、および抗体とシトトキシンとを含む二機能性分子など血管細胞成長阻害剤;
・コレステロール降下剤、血管拡張剤および内因性血管作動性機序干渉剤;
・プロブコールなどの抗酸化剤;
・ペニシリン、セフォキシチン、オキサシリン、トブラナイシン、およびラパマイシン(シロリムス)などの抗生物質;
・酸性および塩基性の線維芽細胞成長因子、エストラジオール(E2)、エストリオール(E3)、および17−βエストラジオールを含めたエストロゲンなどの血管形成物質;・ジゴキシン、β遮断剤、およびカプトプリル、エナロプリル、スタチン類、およびその関連製剤を含めたアンジオテンシン変換酵素(ACE)阻害剤などの心臓発作処置薬;
・シロリムスやエベロリムスなどのマクロライド系薬剤。
一実施形態において、治療剤は、たんぱく質合成、DNA合成、紡錘糸形成、細胞増殖、細胞移動、微小管形成、微小繊維形成、細胞外マトリックス合成、細胞外マトリックス分泌、または細胞体積の増大など、細胞の代謝を変化させる、または細胞のある種の作用を阻害することが可能である。 別の実施形態において、治療剤は、細胞増殖および/または細胞移動を阻害することが可能である。
コーティング組成物を形成するのに有益なポリマーは、生体適合性であり、特に、体内へデバイスを挿入または植込む場合、身体組織への刺激を回避するものでなければならない。このようなポリマーの例は、限定するものではないが、ポリウレタン類、ポリイソブチレンおよびそのコポリマー類、シリコン類およびポリエステル類を含める。他の好適なポリマーは、ポリオレフィン類、ポリイソブチレン 、エチレン−アルファオレフィンコポリマー類、アクリル系ポリマー類およびコポリマー類、ポリ塩化ビニルなどのハロゲン化ビニルのポリマー類およびコポリマー類、ポリビニルメチルエーテルなどのポリビニルエーテル類、ポリフッ化ビニリデンやポリ塩化ビニリデンなどのポリハロゲン化ビニリデン類、ポリアクリロニトリル、ポリビニルケトン類、ポリスチレンなどのポリビニル芳香族、ポリビニルアセテートなどのポリビニルエステル類、ビニルモノマーのコポリマー類、エチレン−メタクリル酸メチルコポリマー類などのビニルモノマーとオレフィンとのコポリマー類、アクリロニトリル−スチレンコポリマー類、ABS樹脂類、エチレン−ビニルアセテートコポリマー類、ナイロン66およびポリカプロラクトンなどのポリアミド類、アルキド樹脂類、ポリカーボネート類、ポリオキシエチレン類、ポリイミド類、ポリエーテル類、エポキシ樹脂類、ポリウレタン類、レーヨン−トリアセテート、セルロース、酢酸セルロース、酪酸セルロース、酢酸酪酸セルロース、セロファン、硝酸セルロース、プロピオン酸セルロース、セルロースエーテル類、カルボキシメチルセルロース、コラーゲン類、キチン類、ポリ乳酸、ポリグリコール酸およびポリ乳酸−ポリエチレンオキシドコポリマー類を含める。例えば、ポリマーは、伸張および伸縮などの機械的条件に曝される医療デバイスの一部に付加されるため、ポリマーは、シリコン(ポリシロキサンおよび置換ポリシロキサン)、ポリウレタン類、熱可塑性エラストマー類、エチレン−酢酸ビニルコポリマー類、ポリオレフィン系エラストマー類およびEPDMラバー類などエラストマー性のポリマー類から選択することが好ましい。ステントが過重または応力を受ける際も、コーティングがストラットの表面に良好に付着することができるようにポリマーが選択される。さらに、コーティングは、単一タイプのポリマーを使用することによって形成することができるが、ポリマーの多様な組み合わせを利用することもできる。
親水性ポリマーまたはモノマーの例は、限定するものではないが、(メタ)アクリル酸、またはそのアルカリ金属塩類もしくはアンモニウム塩;(メタ)アクリルアミド;(メタ)アクリロニトリル;これらのポリマーに、マレイン酸やフマル酸などの不飽和二塩基酸類、または以上のポリマーに不飽和二塩基酸類の半エステル、または不飽和二塩基酸類の付加エステル類あるいは半エステル類のアルカリ金属塩あるいはアンモニウム塩などを付加したもの;以上のポリマーに、例えば、2−アクリルアミド−2−メチルプロパンスルホン酸、2−(メタ)アクリロイレタンスルホン酸などの不飽和スルホン酸、またはそれらのアルカリ金属塩あるいはアンモニウム塩などを付加したもの;および(メタ)アクリル酸2−ヒドロキシエチル、および(メタ)アクリル酸2−ヒドロキシプロピルを含める。
本発明において接着促進剤として使用することができる材料は、接着促進剤を含まない治療剤の放出と比較して、コーティングからの治療剤の放出速度を遅くすることが可能なものを含め、限定するものではないが、スチレンとエチレン/ブチレンのコポリマー類、酸化イリジウムとスルホン化スチレンイソブチレンのコポリマー類を含める。
11:側壁
12:第一領域
13:ストラット
14:第2領域
15:開口
16:第1側壁面
20:コーティング
22:第1コーティング領域
24:第2コーティング領域
30:第1コーティング組成物
32:第1接着促進剤
40:第2コーティング組成物
42:第1治療剤
44、54:ポリマー
50:第3コーティング組成物
52:第2治療剤
60:第4コーティング組成物
62:第2接着促進剤
64:第4ポリマー
90:分岐ステント
92:基幹部
93:分岐領域
94:第1腸骨レッグ
95:小孔
96:第2腸骨レッグ
Claims (30)
- (a)中に開口を有し、患者の血管内に永続的に植え込むように設計された血管内側壁ステント構造体と、
(b)(1)前記ステント構造体の第1領域上に配置され、第1接着促進剤を含む第1コーティング組成物と、第1治療剤を含み、前記第1コーティング組成物の上に配置される第2コーティング組成物とを有する第1コーティング領域、および
(2)前記ステント構造体の第2領域上に配置され、第2治療剤を含む第3コーティング組成物を有し、前記第3コーティング組成物が実質的に前記接着促進剤を含まない、第2コーティング領域を有する、前記ステント構造体の上に配置されるコーティングとを備える植込み可能ステント。 - 前記第2コーティング領域が実質的に、いかなる接着促進剤も含まない、請求項1に記載のステント。
- 前記第1コーティング領域からの前記第1治療剤の放出速度が、前記第2コーティング領域からの前記第2治療剤の放出速度より遅くなるように、前記第1接着促進剤が、前記第1コーティング領域からの前記第1治療剤の放出速度を遅くする、請求項1に記載のステント。
- 前記第1および第2コーティング領域が、前記ステント構造体の前記開口を保持するために、前記ステント構造体と一致する、請求項1に記載のステント。
- 前記第1コーティング領域が、前記第2コーティング領域に隣接する、請求項1に記載のステント。
- 前記第1接着促進剤が、パリレン、スチレンおよびエチレン/ブチレンのコポリマー、酸化イリジウムまたはスルホン化スチレンイソブチレンコポリマーを有する、請求項1に記載のステント。
- 前記第1接着促進剤が、前記第1コーティング組成物の約10重量パーセントより少ない、請求項1に記載のステント。
- 前記第1または前記第2治療剤が、パクリタキセルを有する、請求項1に記載のステント。
- 前記第1または前記第2治療剤が、抗生物質を有する、請求項1に記載のステント。
- 前記第1または前記第2治療剤が、ラパマイシン、エベロリムス、タクロリムスまたはピメクロリムスを有する、請求項1に記載のステント。
- 前記第1または前記第2治療剤が、抗再狭窄剤を有する、請求項1に記載のステント。
- 前記第1または前記第2治療剤が、平滑筋細胞増殖、収縮、遊走または活動過剰を阻止する、請求項1に記載のステント。
- 前記第2または第3コーティング組成物が、ポリマーを含む、請求項1に記載のステント。
- 前記ステント構造体が、2つの端部部分と、前記2つの端部部分の間に配置される中間部分とを有し、前記ステント構造体の前記第1領域が、前記端部部分であり、前記ステント構造体の前記第2領域が、前記中間部分である、請求項1に記載のステント。
- 前記ステントが、分岐ステントであり、前記ステント構造体の前記第2領域が、側部分岐小孔を覆う前記分岐ステントの領域である、請求項1に記載のステント。
- (a)中に開口を有し、患者の血管内に永続的に植え込むように設計された血管内側壁ステント構造体と、
(b)(1)前記ステント構造体の第1領域上に配置され、接着促進剤を含む第1コーティング組成物と、治療剤を含み、前記第1コーティング組成物の上に配置される第2コーティング組成物とを有する第1コーティング領域、および
(2)前記ステント構造体の第2領域上に配置され、前記第1コーティング領域と隣接し、前記第2コーティング組成物を有し、実質的にいかなる接着促進剤も含まない第2コーティング領域を有する、前記ステント構造体上に配置されるコーティングとを備える植込み可能ステント。 - (a)中に開口を有し、患者の血管内に永続的に植え込むように設計された血管内の金属製、バルーン拡張可能側壁ステント構造体と、
(b)(1)前記ステント構造体の第1領域上に配置され、接着促進剤を含む第1コーティング組成物と、抗再狭窄剤を含み、前記第1コーティング組成物の上に配置される第2コーティング組成物とを有する第1コーティング領域、および
(2)前記ステント構造体の第2領域上に配置され、前記第1コーティング領域と隣接し、前記第2コーティング組成物を有し、実質的にいかなる接着促進剤も含まない第2コーティング領域を有する、前記ステント構造体上に配置されるコーティングとを備え、
前記第1および第2コーティング領域が、前記開口を保持するために、前記側壁ステント構造体の前記開口と一致する植込み可能ステント。 - (a)開口を有し、患者の血管内に永続的に植え込むように設計された血管内側壁ステント構造体と、
(b)(1)前記ステント構造体の第1領域上に配置され、第1接着促進剤および第1治療剤を含む第1コーティング組成物を有する第1コーティング領域、および
(2)前記ステント構造体の第2領域上に配置され、第2接着促進剤および第2治療剤を含む第2コーティング組成物を有する第2コーティング領域を有する、前記ステント構造体上に配置されるコーティングとを備え、
前記第1コーティング領域からの前記第1治療剤の放出速度が、前記第2コーティング領域からの前記第2治療剤の放出速度より遅くなるように、前記第1接着促進剤が、前記第1コーティング領域からの前記第1治療剤の放出速度を遅くする植込み可能ステント。 - 前記第1および第2コーティング領域が、前記開口を保持するために、前記側壁ステント構造体の前記開口と一致する、請求項18に記載のステント。
- 前記第1コーティング領域が、前記第2コーティング領域に隣接する、請求項18に記載のステント。
- 前記第1および第2接着促進剤が、同一である、請求項18に記載のステント。
- 前記第1コーティング組成物中の前記接着促進剤の重量パーセントが、前記第2コーティング組成物中の前記接着促進剤の重量パーセントと異なる、請求項21に記載のステント。
- 前記第1または前記第2治療剤が、パクリタキセルを有する、請求項18に記載のステント。
- 前記第1または前記第2治療剤が、抗生物質を有する、請求項18に記載のステント。
- 前記第1または前記第2治療剤が、ラパマイシン、エベロリムス、タクロリムスまたはピメクロリムスを有する、請求項18に記載のステント。
- 前記第1または前記第2治療剤が、抗再狭窄剤を有する、請求項18に記載のステント。
- 前記第1または前記第2治療剤が、平滑筋細胞増殖、収縮、遊走または活動過剰を阻止する、請求項18に記載のステント。
- 前記ステント構造体が、2つの端部部分と、前記2つの端部部分の間に配置される中間部分とを有し、前記ステント構造体の前記第1領域が、前記端部部分であり、前記ステント構造体の前記第2領域が、前記中間部分である、請求項18に記載のステント。
- 前記ステントが、分岐ステントであり、前記ステント構造体の前記第2領域が、側部分岐小孔を覆う前記分岐ステントの領域である、請求項18に記載のステント。
- (a)中に開口を有し、患者の血管内に永続的に植え込むように設計された血管内の金属製、バルーン拡張可能側壁ステント構造体と、
(b)(1)前記ステント構造体の第1領域上に配置され、第1接着促進剤および抗再狭窄剤を含む第1コーティング組成物を有する第1コーティング領域、および
(2)前記ステント構造体の第2領域上に配置され、第2接着促進剤および前記抗再狭窄剤を含む第2コーティング組成物を有する第2コーティング領域を有する、前記ステント構造体上に配置されるコーティングとを備え、
前記第1コーティング領域からの前記抗再狭窄剤の放出速度が、前記第2コーティング領域からの前記抗再狭窄剤の放出速度より遅くなるように、前記第1接着促進剤が、前記第1コーティング領域からの前記抗再狭窄剤の放出速度を遅くさせ、
前記第1および第2コーティング領域が、前記開口を保持するために、前記側壁ステント構造体の前記開口と一致する植込み可能ステント。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11/409,468 US7879086B2 (en) | 2006-04-20 | 2006-04-20 | Medical device having a coating comprising an adhesion promoter |
| PCT/US2007/009805 WO2007124137A1 (en) | 2006-04-20 | 2007-04-19 | Medical device having a coating comprising an adhesion promoter |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009534109A true JP2009534109A (ja) | 2009-09-24 |
| JP2009534109A5 JP2009534109A5 (ja) | 2012-07-12 |
Family
ID=38434734
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009506630A Pending JP2009534109A (ja) | 2006-04-20 | 2007-04-19 | 接着促進剤を含むコーティングを有する医療デバイス |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US7879086B2 (ja) |
| EP (1) | EP2010243A1 (ja) |
| JP (1) | JP2009534109A (ja) |
| CA (1) | CA2649695A1 (ja) |
| WO (1) | WO2007124137A1 (ja) |
Families Citing this family (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7713297B2 (en) | 1998-04-11 | 2010-05-11 | Boston Scientific Scimed, Inc. | Drug-releasing stent with ceramic-containing layer |
| CN105233349B (zh) | 2005-07-15 | 2019-06-18 | 胶束技术股份有限公司 | 包含受控形态的药物粉末的聚合物涂层 |
| US20070224235A1 (en) | 2006-03-24 | 2007-09-27 | Barron Tenney | Medical devices having nanoporous coatings for controlled therapeutic agent delivery |
| US8187620B2 (en) | 2006-03-27 | 2012-05-29 | Boston Scientific Scimed, Inc. | Medical devices comprising a porous metal oxide or metal material and a polymer coating for delivering therapeutic agents |
| CA2650590C (en) | 2006-04-26 | 2018-04-03 | Micell Technologies, Inc. | Coatings containing multiple drugs |
| US20070264303A1 (en) * | 2006-05-12 | 2007-11-15 | Liliana Atanasoska | Coating for medical devices comprising an inorganic or ceramic oxide and a therapeutic agent |
| US8815275B2 (en) | 2006-06-28 | 2014-08-26 | Boston Scientific Scimed, Inc. | Coatings for medical devices comprising a therapeutic agent and a metallic material |
| US8771343B2 (en) | 2006-06-29 | 2014-07-08 | Boston Scientific Scimed, Inc. | Medical devices with selective titanium oxide coatings |
| WO2008022258A2 (en) * | 2006-08-16 | 2008-02-21 | Surmodics, Inc. | Methods and materials for increasing the adhesion of elution control matrices to substrates |
| CA2662808A1 (en) | 2006-09-14 | 2008-03-20 | Boston Scientific Limited | Medical devices with drug-eluting coating |
| US7981150B2 (en) | 2006-11-09 | 2011-07-19 | Boston Scientific Scimed, Inc. | Endoprosthesis with coatings |
| US8070797B2 (en) | 2007-03-01 | 2011-12-06 | Boston Scientific Scimed, Inc. | Medical device with a porous surface for delivery of a therapeutic agent |
| US8431149B2 (en) | 2007-03-01 | 2013-04-30 | Boston Scientific Scimed, Inc. | Coated medical devices for abluminal drug delivery |
| US7914807B2 (en) | 2007-03-05 | 2011-03-29 | Boston Scientific Scimed, Inc. | Medical devices having improved performance |
| US8067054B2 (en) | 2007-04-05 | 2011-11-29 | Boston Scientific Scimed, Inc. | Stents with ceramic drug reservoir layer and methods of making and using the same |
| BRPI0810370A2 (pt) * | 2007-04-17 | 2014-10-29 | Micell Technologies Inc | Stent revestido, e, método para preparar um stent |
| US7976915B2 (en) | 2007-05-23 | 2011-07-12 | Boston Scientific Scimed, Inc. | Endoprosthesis with select ceramic morphology |
| US8425591B1 (en) | 2007-06-11 | 2013-04-23 | Abbott Cardiovascular Systems Inc. | Methods of forming polymer-bioceramic composite medical devices with bioceramic particles |
| US8002823B2 (en) | 2007-07-11 | 2011-08-23 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| US7942926B2 (en) | 2007-07-11 | 2011-05-17 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| US9284409B2 (en) | 2007-07-19 | 2016-03-15 | Boston Scientific Scimed, Inc. | Endoprosthesis having a non-fouling surface |
| US7931683B2 (en) | 2007-07-27 | 2011-04-26 | Boston Scientific Scimed, Inc. | Articles having ceramic coated surfaces |
| US8815273B2 (en) | 2007-07-27 | 2014-08-26 | Boston Scientific Scimed, Inc. | Drug eluting medical devices having porous layers |
| WO2009018340A2 (en) | 2007-07-31 | 2009-02-05 | Boston Scientific Scimed, Inc. | Medical device coating by laser cladding |
| JP2010535541A (ja) | 2007-08-03 | 2010-11-25 | ボストン サイエンティフィック リミテッド | 広い表面積を有する医療器具用のコーティング |
| US8216632B2 (en) | 2007-11-02 | 2012-07-10 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| US7938855B2 (en) | 2007-11-02 | 2011-05-10 | Boston Scientific Scimed, Inc. | Deformable underlayer for stent |
| US8029554B2 (en) | 2007-11-02 | 2011-10-04 | Boston Scientific Scimed, Inc. | Stent with embedded material |
| US8535358B2 (en) | 2007-11-19 | 2013-09-17 | Medical Facets, Llc | Bone screw and method for manufacturing the same |
| US8112870B2 (en) | 2007-11-19 | 2012-02-14 | Medical Facets Llc | Bone screw and method for manufacturing the same |
| EP2271380B1 (en) | 2008-04-22 | 2013-03-20 | Boston Scientific Scimed, Inc. | Medical devices having a coating of inorganic material |
| WO2009132176A2 (en) | 2008-04-24 | 2009-10-29 | Boston Scientific Scimed, Inc. | Medical devices having inorganic particle layers |
| US9220811B2 (en) * | 2008-09-22 | 2015-12-29 | Boston Scientific Scimed, Inc. | Implantable or insertable medical devices |
| US8231980B2 (en) | 2008-12-03 | 2012-07-31 | Boston Scientific Scimed, Inc. | Medical implants including iridium oxide |
| US8071156B2 (en) | 2009-03-04 | 2011-12-06 | Boston Scientific Scimed, Inc. | Endoprostheses |
| US8287937B2 (en) | 2009-04-24 | 2012-10-16 | Boston Scientific Scimed, Inc. | Endoprosthese |
| CN102274550B (zh) * | 2010-06-13 | 2014-11-26 | 上海微创医疗器械(集团)有限公司 | 一种介入医疗器械 |
| EP2811926B1 (en) | 2012-02-09 | 2019-04-10 | Orthopedic Medical Channels, LLC | Bone screw |
| PL2814402T3 (pl) | 2012-02-13 | 2019-04-30 | Medical Facets Llc | Śruba kostna ze skośnym ścięciem |
| CN110003715B (zh) * | 2019-03-27 | 2021-08-10 | 山东华诺日化有限公司 | 一种塑料编织袋印刷用醇溶性墨水及其制备方法 |
| CN116173381A (zh) * | 2022-12-19 | 2023-05-30 | 上海百心安生物技术股份有限公司 | 一种新型可控制药物释放的药物球囊导管及其应用 |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040225345A1 (en) * | 2003-05-05 | 2004-11-11 | Fischell Robert E. | Means and method for stenting bifurcated vessels |
| WO2005000164A1 (de) * | 2003-06-23 | 2005-01-06 | Biotronik Gmbh & Co. Kg | Stent mit einem beschichtungssystem |
| WO2005007035A1 (en) * | 2003-07-07 | 2005-01-27 | Medtronic Vascular | Coated stent with timed release of multiple therapeutic agents to inhibit restenosis adjacent to the stent ends |
| WO2005011766A1 (en) * | 2003-07-31 | 2005-02-10 | Scimed Life Systems, Inc. | Implantable or insertable medical devices containing graft copolymer for controlled delivery of therapeutic agents |
| JP2005523119A (ja) * | 2002-04-24 | 2005-08-04 | サン バイオメディカル, リミテッド | 薬物送達脈管内ステントおよび再狭窄を処置するための方法 |
| WO2005099621A2 (en) * | 2004-04-09 | 2005-10-27 | Xtent, Inc. | Topographic coatings and coating methods for medical devices |
| WO2006020274A1 (en) * | 2004-07-19 | 2006-02-23 | Boston Scientific Scimed, Inc. | Medical devices and materials containing isobutylene copolymer |
| JP2006509598A (ja) * | 2002-12-16 | 2006-03-23 | アドヴァンスド カーディオヴァスキュラー システムズ, インコーポレイテッド | 植え込み可能な器具用の被覆及びその形成方法 |
| WO2006039634A2 (en) * | 2004-09-30 | 2006-04-13 | Boston Scientific Scimed, Inc | Implantable medical devices containing phenolic compound |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE445884B (sv) | 1982-04-30 | 1986-07-28 | Medinvent Sa | Anordning for implantation av en rorformig protes |
| SE453258B (sv) | 1986-04-21 | 1988-01-25 | Medinvent Sa | Elastisk, sjelvexpanderande protes samt forfarande for dess framstellning |
| KR0147482B1 (ko) | 1993-01-19 | 1998-08-01 | 알렌 제이. 스피겔 | 피복 복합 스텐트 |
| US5449373A (en) | 1994-03-17 | 1995-09-12 | Medinol Ltd. | Articulated stent |
| US6099562A (en) | 1996-06-13 | 2000-08-08 | Schneider (Usa) Inc. | Drug coating with topcoat |
| US6790228B2 (en) * | 1999-12-23 | 2004-09-14 | Advanced Cardiovascular Systems, Inc. | Coating for implantable devices and a method of forming the same |
| US6398807B1 (en) | 2000-01-31 | 2002-06-04 | Scimed Life Systems, Inc. | Braided branching stent, method for treating a lumen therewith, and process for manufacture therefor |
| US7951392B2 (en) * | 2002-08-16 | 2011-05-31 | Boston Scientific Scimed, Inc. | Microarray drug delivery coatings |
| US20040059409A1 (en) | 2002-09-24 | 2004-03-25 | Stenzel Eric B. | Method of applying coatings to a medical device |
| EP1569762B1 (en) | 2002-10-22 | 2007-10-03 | Medtronic Vascular, Inc. | Stent with intermittent coating |
| US20040230298A1 (en) * | 2003-04-25 | 2004-11-18 | Medtronic Vascular, Inc. | Drug-polymer coated stent with polysulfone and styrenic block copolymer |
| US20040236416A1 (en) * | 2003-05-20 | 2004-11-25 | Robert Falotico | Increased biocompatibility of implantable medical devices |
| US20040260318A1 (en) * | 2003-05-23 | 2004-12-23 | Angiotech International Ag | Anastomotic connector devices |
| US20060093643A1 (en) | 2004-11-04 | 2006-05-04 | Stenzel Eric B | Medical device for delivering therapeutic agents over different time periods |
| US7935379B2 (en) * | 2005-11-14 | 2011-05-03 | Boston Scientific Scimed, Inc. | Coated and imprinted medical devices and methods of making the same |
-
2006
- 2006-04-20 US US11/409,468 patent/US7879086B2/en not_active Expired - Fee Related
-
2007
- 2007-04-19 EP EP07755889A patent/EP2010243A1/en not_active Withdrawn
- 2007-04-19 JP JP2009506630A patent/JP2009534109A/ja active Pending
- 2007-04-19 WO PCT/US2007/009805 patent/WO2007124137A1/en active Application Filing
- 2007-04-19 CA CA002649695A patent/CA2649695A1/en not_active Abandoned
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005523119A (ja) * | 2002-04-24 | 2005-08-04 | サン バイオメディカル, リミテッド | 薬物送達脈管内ステントおよび再狭窄を処置するための方法 |
| JP2006509598A (ja) * | 2002-12-16 | 2006-03-23 | アドヴァンスド カーディオヴァスキュラー システムズ, インコーポレイテッド | 植え込み可能な器具用の被覆及びその形成方法 |
| US20040225345A1 (en) * | 2003-05-05 | 2004-11-11 | Fischell Robert E. | Means and method for stenting bifurcated vessels |
| WO2005000164A1 (de) * | 2003-06-23 | 2005-01-06 | Biotronik Gmbh & Co. Kg | Stent mit einem beschichtungssystem |
| WO2005007035A1 (en) * | 2003-07-07 | 2005-01-27 | Medtronic Vascular | Coated stent with timed release of multiple therapeutic agents to inhibit restenosis adjacent to the stent ends |
| WO2005011766A1 (en) * | 2003-07-31 | 2005-02-10 | Scimed Life Systems, Inc. | Implantable or insertable medical devices containing graft copolymer for controlled delivery of therapeutic agents |
| WO2005099621A2 (en) * | 2004-04-09 | 2005-10-27 | Xtent, Inc. | Topographic coatings and coating methods for medical devices |
| WO2006020274A1 (en) * | 2004-07-19 | 2006-02-23 | Boston Scientific Scimed, Inc. | Medical devices and materials containing isobutylene copolymer |
| WO2006039634A2 (en) * | 2004-09-30 | 2006-04-13 | Boston Scientific Scimed, Inc | Implantable medical devices containing phenolic compound |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2007124137A1 (en) | 2007-11-01 |
| EP2010243A1 (en) | 2009-01-07 |
| CA2649695A1 (en) | 2007-11-01 |
| US7879086B2 (en) | 2011-02-01 |
| US20070250159A1 (en) | 2007-10-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7879086B2 (en) | Medical device having a coating comprising an adhesion promoter | |
| US8187620B2 (en) | Medical devices comprising a porous metal oxide or metal material and a polymer coating for delivering therapeutic agents | |
| US8431149B2 (en) | Coated medical devices for abluminal drug delivery | |
| JP5185263B2 (ja) | 治療薬および金属材料を含む医療装置用コーティング | |
| US8147539B2 (en) | Stent with a coating for delivering a therapeutic agent | |
| US8070797B2 (en) | Medical device with a porous surface for delivery of a therapeutic agent | |
| US20070190104A1 (en) | Coating comprising an adhesive polymeric material for a medical device and method of preparing the same | |
| JP2008518681A (ja) | 生体組織との接触面積を大きくした処置薬をデリバリーするためのステント | |
| US20090198321A1 (en) | Drug-Coated Medical Devices for Differential Drug Release | |
| US20080215136A1 (en) | Differential drug release from a medical device | |
| JP2009535165A (ja) | 医療用デバイスのための治療薬を含んだ非粘質コーティング |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20090721 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20090811 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100409 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20120301 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120525 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20120525 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20120606 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120619 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20121113 |