JP2009523154A - キメラおよびヒト化抗ヒトil−13抗体 - Google Patents
キメラおよびヒト化抗ヒトil−13抗体 Download PDFInfo
- Publication number
- JP2009523154A JP2009523154A JP2008549873A JP2008549873A JP2009523154A JP 2009523154 A JP2009523154 A JP 2009523154A JP 2008549873 A JP2008549873 A JP 2008549873A JP 2008549873 A JP2008549873 A JP 2008549873A JP 2009523154 A JP2009523154 A JP 2009523154A
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- asthma
- seq
- human
- antigen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 108090000176 Interleukin-13 Proteins 0.000 title description 287
- 102000003816 Interleukin-13 Human genes 0.000 title description 286
- 101001076430 Homo sapiens Interleukin-13 Proteins 0.000 claims abstract description 210
- 102000019207 human interleukin-13 Human genes 0.000 claims abstract description 209
- 238000000034 method Methods 0.000 claims abstract description 113
- 208000006673 asthma Diseases 0.000 claims abstract description 94
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 75
- 201000010099 disease Diseases 0.000 claims abstract description 49
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 30
- 208000035475 disorder Diseases 0.000 claims abstract description 23
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims abstract description 18
- 206010012438 Dermatitis atopic Diseases 0.000 claims abstract description 18
- 201000008937 atopic dermatitis Diseases 0.000 claims abstract description 18
- 238000004519 manufacturing process Methods 0.000 claims abstract description 18
- 230000003176 fibrotic effect Effects 0.000 claims abstract description 14
- 230000027455 binding Effects 0.000 claims description 216
- 241000282414 Homo sapiens Species 0.000 claims description 149
- 210000004027 cell Anatomy 0.000 claims description 112
- 239000012634 fragment Substances 0.000 claims description 90
- 239000000427 antigen Substances 0.000 claims description 82
- 108091007433 antigens Proteins 0.000 claims description 82
- 102000036639 antigens Human genes 0.000 claims description 82
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 44
- 238000011282 treatment Methods 0.000 claims description 27
- 108091033319 polynucleotide Proteins 0.000 claims description 21
- 102000040430 polynucleotide Human genes 0.000 claims description 21
- 239000002157 polynucleotide Substances 0.000 claims description 21
- 125000000539 amino acid group Chemical group 0.000 claims description 18
- 239000003937 drug carrier Substances 0.000 claims description 18
- 230000000694 effects Effects 0.000 claims description 18
- 239000013598 vector Substances 0.000 claims description 18
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 17
- 150000003431 steroids Chemical class 0.000 claims description 17
- 150000001413 amino acids Chemical class 0.000 claims description 16
- 239000003814 drug Substances 0.000 claims description 16
- 241000282567 Macaca fascicularis Species 0.000 claims description 15
- 208000017604 Hodgkin disease Diseases 0.000 claims description 13
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 13
- 201000010105 allergic rhinitis Diseases 0.000 claims description 13
- 210000004978 chinese hamster ovary cell Anatomy 0.000 claims description 13
- 208000036971 interstitial lung disease 2 Diseases 0.000 claims description 13
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 claims description 12
- 206010039085 Rhinitis allergic Diseases 0.000 claims description 12
- 230000001419 dependent effect Effects 0.000 claims description 11
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 10
- 208000011231 Crohn disease Diseases 0.000 claims description 10
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 claims description 10
- 201000009961 allergic asthma Diseases 0.000 claims description 10
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 claims description 10
- 239000003246 corticosteroid Substances 0.000 claims description 9
- 201000004409 schistosomiasis Diseases 0.000 claims description 9
- 208000019425 cirrhosis of liver Diseases 0.000 claims description 8
- 229960001334 corticosteroids Drugs 0.000 claims description 8
- 230000000750 progressive effect Effects 0.000 claims description 8
- 230000009885 systemic effect Effects 0.000 claims description 8
- 210000004185 liver Anatomy 0.000 claims description 7
- 239000002609 medium Substances 0.000 claims description 7
- 239000000203 mixture Substances 0.000 claims description 7
- 229950011485 pascolizumab Drugs 0.000 claims description 7
- 208000009657 Aspirin-Induced Asthma Diseases 0.000 claims description 6
- 208000004554 Leishmaniasis Diseases 0.000 claims description 6
- 208000034189 Sclerosis Diseases 0.000 claims description 6
- 208000029771 childhood onset asthma Diseases 0.000 claims description 6
- 210000003527 eukaryotic cell Anatomy 0.000 claims description 6
- 238000005469 granulation Methods 0.000 claims description 6
- 230000003179 granulation Effects 0.000 claims description 6
- 210000004962 mammalian cell Anatomy 0.000 claims description 6
- 208000024696 nocturnal asthma Diseases 0.000 claims description 6
- 230000022983 regulation of cell cycle Effects 0.000 claims description 6
- 208000024716 acute asthma Diseases 0.000 claims description 5
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 4
- 239000012679 serum free medium Substances 0.000 claims description 4
- 241000282693 Cercopithecidae Species 0.000 claims description 3
- 241000288906 Primates Species 0.000 claims description 3
- 239000003795 chemical substances by application Substances 0.000 claims description 3
- 230000024203 complement activation Effects 0.000 claims description 2
- 230000000116 mitigating effect Effects 0.000 claims description 2
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 claims 1
- 230000003993 interaction Effects 0.000 abstract description 39
- 102000005962 receptors Human genes 0.000 abstract description 36
- 108020003175 receptors Proteins 0.000 abstract description 36
- 108060003951 Immunoglobulin Proteins 0.000 abstract description 13
- 102000018358 immunoglobulin Human genes 0.000 abstract description 13
- 229940072221 immunoglobulins Drugs 0.000 abstract description 4
- 239000000243 solution Substances 0.000 description 60
- 241000699666 Mus <mouse, genus> Species 0.000 description 53
- 102000004388 Interleukin-4 Human genes 0.000 description 49
- 239000006180 TBST buffer Substances 0.000 description 49
- 108090000978 Interleukin-4 Proteins 0.000 description 47
- 230000014509 gene expression Effects 0.000 description 43
- 238000002965 ELISA Methods 0.000 description 42
- 108090000623 proteins and genes Proteins 0.000 description 39
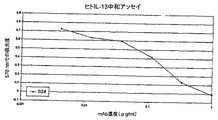
- 238000006386 neutralization reaction Methods 0.000 description 37
- 238000003556 assay Methods 0.000 description 33
- 230000000903 blocking effect Effects 0.000 description 33
- 241000588724 Escherichia coli Species 0.000 description 32
- 230000004071 biological effect Effects 0.000 description 30
- 230000001965 increasing effect Effects 0.000 description 30
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 26
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 25
- 210000004072 lung Anatomy 0.000 description 25
- 102000004169 proteins and genes Human genes 0.000 description 25
- 102000004127 Cytokines Human genes 0.000 description 24
- 108090000695 Cytokines Proteins 0.000 description 24
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 24
- 235000018102 proteins Nutrition 0.000 description 24
- 238000004166 bioassay Methods 0.000 description 23
- 238000002474 experimental method Methods 0.000 description 23
- -1 isocytochrome C Proteins 0.000 description 23
- 235000001014 amino acid Nutrition 0.000 description 22
- 208000026935 allergic disease Diseases 0.000 description 21
- 230000004044 response Effects 0.000 description 21
- 206010016654 Fibrosis Diseases 0.000 description 20
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 20
- 229940024606 amino acid Drugs 0.000 description 20
- 238000010790 dilution Methods 0.000 description 20
- 239000012895 dilution Substances 0.000 description 20
- 230000004761 fibrosis Effects 0.000 description 20
- 238000001516 cell proliferation assay Methods 0.000 description 18
- 230000003472 neutralizing effect Effects 0.000 description 18
- 208000005069 pulmonary fibrosis Diseases 0.000 description 18
- 206010020751 Hypersensitivity Diseases 0.000 description 17
- 125000003275 alpha amino acid group Chemical group 0.000 description 16
- 241000699670 Mus sp. Species 0.000 description 15
- 108010076504 Protein Sorting Signals Proteins 0.000 description 15
- 239000011545 carbonate/bicarbonate buffer Substances 0.000 description 15
- 230000004663 cell proliferation Effects 0.000 description 15
- 239000012636 effector Substances 0.000 description 15
- 210000001519 tissue Anatomy 0.000 description 14
- 241001465754 Metazoa Species 0.000 description 13
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 13
- 210000001744 T-lymphocyte Anatomy 0.000 description 13
- 150000001875 compounds Chemical class 0.000 description 13
- 239000003112 inhibitor Substances 0.000 description 13
- 239000000463 material Substances 0.000 description 13
- 230000002829 reductive effect Effects 0.000 description 13
- 238000003118 sandwich ELISA Methods 0.000 description 13
- 238000006467 substitution reaction Methods 0.000 description 13
- 108020004414 DNA Proteins 0.000 description 12
- 101710112634 Interleukin-13 receptor subunit alpha-2 Proteins 0.000 description 12
- 102100020793 Interleukin-13 receptor subunit alpha-2 Human genes 0.000 description 12
- 238000002835 absorbance Methods 0.000 description 12
- 238000011161 development Methods 0.000 description 12
- 230000018109 developmental process Effects 0.000 description 12
- 108010017511 Interleukin-13 Receptors Proteins 0.000 description 11
- 206010028980 Neoplasm Diseases 0.000 description 11
- 230000007815 allergy Effects 0.000 description 11
- 239000005557 antagonist Substances 0.000 description 11
- 238000005516 engineering process Methods 0.000 description 11
- 210000003979 eosinophil Anatomy 0.000 description 11
- 241000283707 Capra Species 0.000 description 10
- 108010073807 IgG Receptors Proteins 0.000 description 10
- 102000004559 Interleukin-13 Receptors Human genes 0.000 description 10
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 description 10
- 229920001213 Polysorbate 20 Polymers 0.000 description 10
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 10
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 10
- 238000004458 analytical method Methods 0.000 description 10
- 125000004432 carbon atom Chemical group C* 0.000 description 10
- 238000004140 cleaning Methods 0.000 description 10
- 229940079593 drug Drugs 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 230000004054 inflammatory process Effects 0.000 description 10
- 238000013507 mapping Methods 0.000 description 10
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 10
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 10
- 239000013641 positive control Substances 0.000 description 10
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 9
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 101001002709 Homo sapiens Interleukin-4 Proteins 0.000 description 9
- 101000960969 Homo sapiens Interleukin-5 Proteins 0.000 description 9
- 206010061218 Inflammation Diseases 0.000 description 9
- 102000000743 Interleukin-5 Human genes 0.000 description 9
- 108010002616 Interleukin-5 Proteins 0.000 description 9
- 239000007983 Tris buffer Substances 0.000 description 9
- 239000002253 acid Substances 0.000 description 9
- 210000002950 fibroblast Anatomy 0.000 description 9
- 102000055229 human IL4 Human genes 0.000 description 9
- 102000055228 human IL5 Human genes 0.000 description 9
- 230000002757 inflammatory effect Effects 0.000 description 9
- 230000035772 mutation Effects 0.000 description 9
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 9
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 8
- 101000746373 Homo sapiens Granulocyte-macrophage colony-stimulating factor Proteins 0.000 description 8
- 208000002200 Respiratory Hypersensitivity Diseases 0.000 description 8
- 230000010085 airway hyperresponsiveness Effects 0.000 description 8
- 210000003719 b-lymphocyte Anatomy 0.000 description 8
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 8
- 102000046157 human CSF2 Human genes 0.000 description 8
- 239000000523 sample Substances 0.000 description 8
- 210000002966 serum Anatomy 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 108010006654 Bleomycin Proteins 0.000 description 7
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 7
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 7
- 101710112663 Interleukin-13 receptor subunit alpha-1 Proteins 0.000 description 7
- 102100020791 Interleukin-13 receptor subunit alpha-1 Human genes 0.000 description 7
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 7
- 208000024340 acute graft versus host disease Diseases 0.000 description 7
- 238000013357 binding ELISA Methods 0.000 description 7
- 229960001561 bleomycin Drugs 0.000 description 7
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 7
- 210000004369 blood Anatomy 0.000 description 7
- 239000008280 blood Substances 0.000 description 7
- 239000003085 diluting agent Substances 0.000 description 7
- 239000013604 expression vector Substances 0.000 description 7
- 210000004408 hybridoma Anatomy 0.000 description 7
- 238000000338 in vitro Methods 0.000 description 7
- 210000003097 mucus Anatomy 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 6
- 206010009900 Colitis ulcerative Diseases 0.000 description 6
- 206010014950 Eosinophilia Diseases 0.000 description 6
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 6
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 6
- 102000004457 Granulocyte-Macrophage Colony-Stimulating Factor Human genes 0.000 description 6
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 6
- 229940123932 Phosphodiesterase 4 inhibitor Drugs 0.000 description 6
- 201000001263 Psoriatic Arthritis Diseases 0.000 description 6
- 208000036824 Psoriatic arthropathy Diseases 0.000 description 6
- 241000700159 Rattus Species 0.000 description 6
- 102000011017 Type 4 Cyclic Nucleotide Phosphodiesterases Human genes 0.000 description 6
- 108010037584 Type 4 Cyclic Nucleotide Phosphodiesterases Proteins 0.000 description 6
- 239000013566 allergen Substances 0.000 description 6
- 238000001574 biopsy Methods 0.000 description 6
- 230000015556 catabolic process Effects 0.000 description 6
- 230000001684 chronic effect Effects 0.000 description 6
- 238000006731 degradation reaction Methods 0.000 description 6
- 210000002510 keratinocyte Anatomy 0.000 description 6
- 230000003902 lesion Effects 0.000 description 6
- 125000005647 linker group Chemical group 0.000 description 6
- 239000003550 marker Substances 0.000 description 6
- 239000013642 negative control Substances 0.000 description 6
- 230000008506 pathogenesis Effects 0.000 description 6
- 239000002587 phosphodiesterase IV inhibitor Substances 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 239000006228 supernatant Substances 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- 238000011830 transgenic mouse model Methods 0.000 description 6
- MSYGAHOHLUJIKV-UHFFFAOYSA-N 3,5-dimethyl-1-(3-nitrophenyl)-1h-pyrazole-4-carboxylic acid ethyl ester Chemical compound CC1=C(C(=O)OCC)C(C)=NN1C1=CC=CC([N+]([O-])=O)=C1 MSYGAHOHLUJIKV-UHFFFAOYSA-N 0.000 description 5
- 208000012657 Atopic disease Diseases 0.000 description 5
- 206010006458 Bronchitis chronic Diseases 0.000 description 5
- 241000244203 Caenorhabditis elegans Species 0.000 description 5
- 206010014561 Emphysema Diseases 0.000 description 5
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 5
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 5
- 206010054949 Metaplasia Diseases 0.000 description 5
- 241000699660 Mus musculus Species 0.000 description 5
- 241000282898 Sus scrofa Species 0.000 description 5
- 235000004279 alanine Nutrition 0.000 description 5
- 125000000217 alkyl group Chemical group 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 230000001580 bacterial effect Effects 0.000 description 5
- 206010006451 bronchitis Diseases 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 208000007451 chronic bronchitis Diseases 0.000 description 5
- 238000010367 cloning Methods 0.000 description 5
- 239000003623 enhancer Substances 0.000 description 5
- 230000004927 fusion Effects 0.000 description 5
- 230000013595 glycosylation Effects 0.000 description 5
- 238000006206 glycosylation reaction Methods 0.000 description 5
- 230000012010 growth Effects 0.000 description 5
- 230000009610 hypersensitivity Effects 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 210000003292 kidney cell Anatomy 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 230000015689 metaplastic ossification Effects 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 230000008488 polyadenylation Effects 0.000 description 5
- 210000002345 respiratory system Anatomy 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- 210000004881 tumor cell Anatomy 0.000 description 5
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 4
- 241000244188 Ascaris suum Species 0.000 description 4
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 4
- 206010013975 Dyspnoeas Diseases 0.000 description 4
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 4
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 4
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 4
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 4
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 4
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 4
- 102000011779 Nitric Oxide Synthase Type II Human genes 0.000 description 4
- 108010076864 Nitric Oxide Synthase Type II Proteins 0.000 description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 description 4
- 206010035226 Plasma cell myeloma Diseases 0.000 description 4
- 201000004681 Psoriasis Diseases 0.000 description 4
- 241000283984 Rodentia Species 0.000 description 4
- 241000714474 Rous sarcoma virus Species 0.000 description 4
- 108010090804 Streptavidin Proteins 0.000 description 4
- 210000004241 Th2 cell Anatomy 0.000 description 4
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 4
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 4
- 201000006704 Ulcerative Colitis Diseases 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 238000009825 accumulation Methods 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 239000000048 adrenergic agonist Substances 0.000 description 4
- 229940126157 adrenergic receptor agonist Drugs 0.000 description 4
- 125000002877 alkyl aryl group Chemical group 0.000 description 4
- 125000005213 alkyl heteroaryl group Chemical group 0.000 description 4
- 238000010171 animal model Methods 0.000 description 4
- 150000001450 anions Chemical class 0.000 description 4
- 210000004899 c-terminal region Anatomy 0.000 description 4
- HXGBXQDTNZMWGS-RUZDIDTESA-N darifenacin Chemical compound C=1C=CC=CC=1C([C@H]1CN(CCC=2C=C3CCOC3=CC=2)CC1)(C(=O)N)C1=CC=CC=C1 HXGBXQDTNZMWGS-RUZDIDTESA-N 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 230000003247 decreasing effect Effects 0.000 description 4
- 208000033679 diabetic kidney disease Diseases 0.000 description 4
- 210000002744 extracellular matrix Anatomy 0.000 description 4
- 125000001072 heteroaryl group Chemical group 0.000 description 4
- 230000036039 immunity Effects 0.000 description 4
- 230000005847 immunogenicity Effects 0.000 description 4
- 230000006698 induction Effects 0.000 description 4
- 230000028709 inflammatory response Effects 0.000 description 4
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 4
- 230000018711 interleukin-13 production Effects 0.000 description 4
- 210000004698 lymphocyte Anatomy 0.000 description 4
- 229960005108 mepolizumab Drugs 0.000 description 4
- 201000000050 myeloid neoplasm Diseases 0.000 description 4
- 210000000581 natural killer T-cell Anatomy 0.000 description 4
- 229910052757 nitrogen Inorganic materials 0.000 description 4
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 4
- 230000037361 pathway Effects 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 230000001737 promoting effect Effects 0.000 description 4
- 230000001185 psoriatic effect Effects 0.000 description 4
- 230000010076 replication Effects 0.000 description 4
- 230000019491 signal transduction Effects 0.000 description 4
- FBOUYBDGKBSUES-VXKWHMMOSA-N solifenacin Chemical compound C1([C@H]2C3=CC=CC=C3CCN2C(O[C@@H]2C3CCN(CC3)C2)=O)=CC=CC=C1 FBOUYBDGKBSUES-VXKWHMMOSA-N 0.000 description 4
- 230000004083 survival effect Effects 0.000 description 4
- 230000003827 upregulation Effects 0.000 description 4
- 125000006652 (C3-C12) cycloalkyl group Chemical group 0.000 description 3
- 239000004475 Arginine Substances 0.000 description 3
- 206010003645 Atopy Diseases 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- 101100069857 Caenorhabditis elegans hil-4 gene Proteins 0.000 description 3
- 206010011224 Cough Diseases 0.000 description 3
- 101100135868 Dictyostelium discoideum pde3 gene Proteins 0.000 description 3
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 3
- XIQVNETUBQGFHX-UHFFFAOYSA-N Ditropan Chemical compound C=1C=CC=CC=1C(O)(C(=O)OCC#CCN(CC)CC)C1CCCCC1 XIQVNETUBQGFHX-UHFFFAOYSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- 206010020880 Hypertrophy Diseases 0.000 description 3
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 3
- 102000008070 Interferon-gamma Human genes 0.000 description 3
- 108010074328 Interferon-gamma Proteins 0.000 description 3
- 108010038486 Interleukin-4 Receptors Proteins 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- 239000004472 Lysine Substances 0.000 description 3
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 description 3
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- 206010039710 Scleroderma Diseases 0.000 description 3
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 3
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 3
- 108010002120 Type II Interleukin-4 Receptors Proteins 0.000 description 3
- 102000000535 Type II Interleukin-4 Receptors Human genes 0.000 description 3
- 230000001154 acute effect Effects 0.000 description 3
- 238000005273 aeration Methods 0.000 description 3
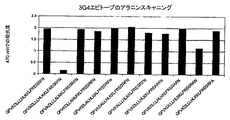
- 238000012867 alanine scanning Methods 0.000 description 3
- 229960004784 allergens Drugs 0.000 description 3
- 229960000723 ampicillin Drugs 0.000 description 3
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- 229940125715 antihistaminic agent Drugs 0.000 description 3
- 239000000739 antihistaminic agent Substances 0.000 description 3
- 230000006907 apoptotic process Effects 0.000 description 3
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 3
- 125000003118 aryl group Chemical group 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 229940112129 campath Drugs 0.000 description 3
- 201000011510 cancer Diseases 0.000 description 3
- 239000004202 carbamide Substances 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 230000037319 collagen production Effects 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 239000013078 crystal Substances 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 230000034994 death Effects 0.000 description 3
- 230000002950 deficient Effects 0.000 description 3
- 230000008021 deposition Effects 0.000 description 3
- 108020001096 dihydrofolate reductase Proteins 0.000 description 3
- 238000006471 dimerization reaction Methods 0.000 description 3
- 229940088598 enzyme Drugs 0.000 description 3
- 210000002919 epithelial cell Anatomy 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 3
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 3
- 210000002175 goblet cell Anatomy 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 229960001340 histamine Drugs 0.000 description 3
- 210000003630 histaminocyte Anatomy 0.000 description 3
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 3
- 230000016784 immunoglobulin production Effects 0.000 description 3
- 230000008595 infiltration Effects 0.000 description 3
- 238000001764 infiltration Methods 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 210000005265 lung cell Anatomy 0.000 description 3
- 210000002540 macrophage Anatomy 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 229960000485 methotrexate Drugs 0.000 description 3
- 210000001616 monocyte Anatomy 0.000 description 3
- 210000003205 muscle Anatomy 0.000 description 3
- 230000010807 negative regulation of binding Effects 0.000 description 3
- VWZPIJGXYWHBOW-UHFFFAOYSA-N otilonium bromide Chemical compound [Br-].CCCCCCCCOC1=CC=CC=C1C(=O)NC1=CC=C(C(=O)OCC[N+](C)(CC)CC)C=C1 VWZPIJGXYWHBOW-UHFFFAOYSA-N 0.000 description 3
- 238000012261 overproduction Methods 0.000 description 3
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 3
- 238000002823 phage display Methods 0.000 description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 229940044551 receptor antagonist Drugs 0.000 description 3
- 239000002464 receptor antagonist Substances 0.000 description 3
- 108700015048 receptor decoy activity proteins Proteins 0.000 description 3
- 230000007115 recruitment Effects 0.000 description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 description 3
- 239000012266 salt solution Substances 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 238000011476 stem cell transplantation Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 238000004114 suspension culture Methods 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 239000003656 tris buffered saline Substances 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- XWTYSIMOBUGWOL-UHFFFAOYSA-N (+-)-Terbutaline Chemical compound CC(C)(C)NCC(O)C1=CC(O)=CC(O)=C1 XWTYSIMOBUGWOL-UHFFFAOYSA-N 0.000 description 2
- GZCWLCBFPRFLKL-UHFFFAOYSA-N 1-prop-2-ynoxypropan-2-ol Chemical compound CC(O)COCC#C GZCWLCBFPRFLKL-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical class NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- OSJPPGNTCRNQQC-UWTATZPHSA-N 3-phospho-D-glyceric acid Chemical compound OC(=O)[C@H](O)COP(O)(O)=O OSJPPGNTCRNQQC-UWTATZPHSA-N 0.000 description 2
- LSLYOANBFKQKPT-DIFFPNOSSA-N 5-[(1r)-1-hydroxy-2-[[(2r)-1-(4-hydroxyphenyl)propan-2-yl]amino]ethyl]benzene-1,3-diol Chemical compound C([C@@H](C)NC[C@H](O)C=1C=C(O)C=C(O)C=1)C1=CC=C(O)C=C1 LSLYOANBFKQKPT-DIFFPNOSSA-N 0.000 description 2
- 102000013563 Acid Phosphatase Human genes 0.000 description 2
- 108010051457 Acid Phosphatase Proteins 0.000 description 2
- 208000000884 Airway Obstruction Diseases 0.000 description 2
- 101710187578 Alcohol dehydrogenase 1 Proteins 0.000 description 2
- 102100034035 Alcohol dehydrogenase 1A Human genes 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 102100039705 Beta-2 adrenergic receptor Human genes 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 206010006482 Bronchospasm Diseases 0.000 description 2
- 102100024167 C-C chemokine receptor type 3 Human genes 0.000 description 2
- 101710149862 C-C chemokine receptor type 3 Proteins 0.000 description 2
- ZKLPARSLTMPFCP-UHFFFAOYSA-N Cetirizine Chemical compound C1CN(CCOCC(=O)O)CCN1C(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 ZKLPARSLTMPFCP-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- 108091026890 Coding region Proteins 0.000 description 2
- 102000008186 Collagen Human genes 0.000 description 2
- 108010035532 Collagen Proteins 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 241000701022 Cytomegalovirus Species 0.000 description 2
- 208000000059 Dyspnea Diseases 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 206010064212 Eosinophilic oesophagitis Diseases 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 102000003834 Histamine H1 Receptors Human genes 0.000 description 2
- 108090000110 Histamine H1 Receptors Proteins 0.000 description 2
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 2
- 101100286681 Homo sapiens IL13 gene Proteins 0.000 description 2
- 101001003135 Homo sapiens Interleukin-13 receptor subunit alpha-1 Proteins 0.000 description 2
- 101001003132 Homo sapiens Interleukin-13 receptor subunit alpha-2 Proteins 0.000 description 2
- 102000009490 IgG Receptors Human genes 0.000 description 2
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 2
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 2
- 102000004877 Insulin Human genes 0.000 description 2
- 108090001061 Insulin Proteins 0.000 description 2
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 2
- 102000003960 Ligases Human genes 0.000 description 2
- 108090000364 Ligases Proteins 0.000 description 2
- 101710099301 Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 102000018697 Membrane Proteins Human genes 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- 108010006035 Metalloproteases Proteins 0.000 description 2
- 102000005741 Metalloproteases Human genes 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 229940121948 Muscarinic receptor antagonist Drugs 0.000 description 2
- JAUOIFJMECXRGI-UHFFFAOYSA-N Neoclaritin Chemical compound C=1C(Cl)=CC=C2C=1CCC1=CC=CN=C1C2=C1CCNCC1 JAUOIFJMECXRGI-UHFFFAOYSA-N 0.000 description 2
- 229930193140 Neomycin Natural products 0.000 description 2
- 108020005187 Oligonucleotide Probes Proteins 0.000 description 2
- 102000016979 Other receptors Human genes 0.000 description 2
- 206010057249 Phagocytosis Diseases 0.000 description 2
- 229940123263 Phosphodiesterase 3 inhibitor Drugs 0.000 description 2
- 102000011755 Phosphoglycerate Kinase Human genes 0.000 description 2
- 206010036790 Productive cough Diseases 0.000 description 2
- 206010057190 Respiratory tract infections Diseases 0.000 description 2
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 2
- GIIZNNXWQWCKIB-UHFFFAOYSA-N Serevent Chemical compound C1=C(O)C(CO)=CC(C(O)CNCCCCCCOCCCCC=2C=CC=CC=2)=C1 GIIZNNXWQWCKIB-UHFFFAOYSA-N 0.000 description 2
- 101001099217 Thermotoga maritima (strain ATCC 43589 / DSM 3109 / JCM 10099 / NBRC 100826 / MSB8) Triosephosphate isomerase Proteins 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 2
- NDAUXUAQIAJITI-UHFFFAOYSA-N albuterol Chemical compound CC(C)(C)NCC(O)C1=CC=C(O)C(CO)=C1 NDAUXUAQIAJITI-UHFFFAOYSA-N 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000001078 anti-cholinergic effect Effects 0.000 description 2
- 229940124599 anti-inflammatory drug Drugs 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000003305 autocrine Effects 0.000 description 2
- 210000003651 basophil Anatomy 0.000 description 2
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 2
- 229940092714 benzenesulfonic acid Drugs 0.000 description 2
- 108010014499 beta-2 Adrenergic Receptors Proteins 0.000 description 2
- 229960000074 biopharmaceutical Drugs 0.000 description 2
- 230000007885 bronchoconstriction Effects 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 229960001803 cetirizine Drugs 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 238000012412 chemical coupling Methods 0.000 description 2
- 210000000038 chest Anatomy 0.000 description 2
- 239000000812 cholinergic antagonist Substances 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 208000037976 chronic inflammation Diseases 0.000 description 2
- 208000037893 chronic inflammatory disorder Diseases 0.000 description 2
- 238000005352 clarification Methods 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 206010009887 colitis Diseases 0.000 description 2
- 229920001436 collagen Polymers 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 230000009260 cross reactivity Effects 0.000 description 2
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 2
- 125000000753 cycloalkyl group Chemical group 0.000 description 2
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 230000007123 defense Effects 0.000 description 2
- 229960001271 desloratadine Drugs 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 238000000502 dialysis Methods 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 229940013628 enablex Drugs 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 201000000708 eosinophilic esophagitis Diseases 0.000 description 2
- 210000005175 epidermal keratinocyte Anatomy 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 229960001022 fenoterol Drugs 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- 229960003592 fexofenadine Drugs 0.000 description 2
- RWTNPBWLLIMQHL-UHFFFAOYSA-N fexofenadine Chemical compound C1=CC(C(C)(C(O)=O)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 RWTNPBWLLIMQHL-UHFFFAOYSA-N 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 229960000289 fluticasone propionate Drugs 0.000 description 2
- WMWTYOKRWGGJOA-CENSZEJFSA-N fluticasone propionate Chemical compound C1([C@@H](F)C2)=CC(=O)C=C[C@]1(C)[C@]1(F)[C@@H]2[C@@H]2C[C@@H](C)[C@@](C(=O)SCF)(OC(=O)CC)[C@@]2(C)C[C@@H]1O WMWTYOKRWGGJOA-CENSZEJFSA-N 0.000 description 2
- 229960002848 formoterol Drugs 0.000 description 2
- BPZSYCZIITTYBL-UHFFFAOYSA-N formoterol Chemical compound C1=CC(OC)=CC=C1CC(C)NCC(O)C1=CC=C(O)C(NC=O)=C1 BPZSYCZIITTYBL-UHFFFAOYSA-N 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 229930195712 glutamate Natural products 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 2
- 206010020718 hyperplasia Diseases 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 239000003018 immunosuppressive agent Substances 0.000 description 2
- 229940124589 immunosuppressive drug Drugs 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 229940125396 insulin Drugs 0.000 description 2
- 229960003130 interferon gamma Drugs 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Chemical group CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 2
- 229960000310 isoleucine Drugs 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 229960003088 loratadine Drugs 0.000 description 2
- JCCNYMKQOSZNPW-UHFFFAOYSA-N loratadine Chemical compound C1CN(C(=O)OCC)CCC1=C1C2=NC=CC=C2CCC2=CC(Cl)=CC=C21 JCCNYMKQOSZNPW-UHFFFAOYSA-N 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 108700025647 major vault Proteins 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 2
- 229960004927 neomycin Drugs 0.000 description 2
- 108010068617 neonatal Fc receptor Proteins 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- 239000002751 oligonucleotide probe Substances 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 230000008782 phagocytosis Effects 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- 239000002570 phosphodiesterase III inhibitor Substances 0.000 description 2
- RMHMFHUVIITRHF-UHFFFAOYSA-N pirenzepine Chemical compound C1CN(C)CCN1CC(=O)N1C2=NC=CC=C2NC(=O)C2=CC=CC=C21 RMHMFHUVIITRHF-UHFFFAOYSA-N 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 238000011533 pre-incubation Methods 0.000 description 2
- 150000003141 primary amines Chemical class 0.000 description 2
- 230000000770 proinflammatory effect Effects 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- 229940080818 propionamide Drugs 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- MNDBXUUTURYVHR-UHFFFAOYSA-N roflumilast Chemical compound FC(F)OC1=CC=C(C(=O)NC=2C(=CN=CC=2Cl)Cl)C=C1OCC1CC1 MNDBXUUTURYVHR-UHFFFAOYSA-N 0.000 description 2
- 229960002052 salbutamol Drugs 0.000 description 2
- 229960004017 salmeterol Drugs 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 208000013220 shortness of breath Diseases 0.000 description 2
- 230000009450 sialylation Effects 0.000 description 2
- 210000001626 skin fibroblast Anatomy 0.000 description 2
- 206010040882 skin lesion Diseases 0.000 description 2
- 231100000444 skin lesion Toxicity 0.000 description 2
- 229960003855 solifenacin Drugs 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 208000024794 sputum Diseases 0.000 description 2
- 210000003802 sputum Anatomy 0.000 description 2
- 239000012089 stop solution Substances 0.000 description 2
- 239000013589 supplement Substances 0.000 description 2
- 210000001179 synovial fluid Anatomy 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 229960000195 terbutaline Drugs 0.000 description 2
- ZFXYFBGIUFBOJW-UHFFFAOYSA-N theophylline Chemical compound O=C1N(C)C(=O)N(C)C2=C1NC=N2 ZFXYFBGIUFBOJW-UHFFFAOYSA-N 0.000 description 2
- OOGJQPCLVADCPB-HXUWFJFHSA-N tolterodine Chemical compound C1([C@@H](CCN(C(C)C)C(C)C)C=2C(=CC=C(C)C=2)O)=CC=CC=C1 OOGJQPCLVADCPB-HXUWFJFHSA-N 0.000 description 2
- 230000004565 tumor cell growth Effects 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical compound C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 1
- TWHNMSJGYKMTRB-KXYUELECSA-N (2r,3r)-2,3-dihydroxybutanedioic acid;2-[(1r)-3-[di(propan-2-yl)amino]-1-phenylpropyl]-4-methylphenol Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O.C1([C@@H](CCN(C(C)C)C(C)C)C=2C(=CC=C(C)C=2)O)=CC=CC=C1 TWHNMSJGYKMTRB-KXYUELECSA-N 0.000 description 1
- PDNHLCRMUIGNBV-UHFFFAOYSA-N 1-pyridin-2-ylethanamine Chemical compound CC(N)C1=CC=CC=N1 PDNHLCRMUIGNBV-UHFFFAOYSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- SVUOLADPCWQTTE-UHFFFAOYSA-N 1h-1,2-benzodiazepine Chemical compound N1N=CC=CC2=CC=CC=C12 SVUOLADPCWQTTE-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- ZKLPARSLTMPFCP-OAQYLSRUSA-N 2-[2-[4-[(R)-(4-chlorophenyl)-phenylmethyl]-1-piperazinyl]ethoxy]acetic acid Chemical compound C1CN(CCOCC(=O)O)CCN1[C@@H](C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 ZKLPARSLTMPFCP-OAQYLSRUSA-N 0.000 description 1
- SMNDYUVBFMFKNZ-UHFFFAOYSA-N 2-furoic acid Chemical compound OC(=O)C1=CC=CO1 SMNDYUVBFMFKNZ-UHFFFAOYSA-N 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000000175 2-thienyl group Chemical group S1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- CVDXFPBVOIERBH-JWQCQUIFSA-N 4-[(4ar,10bs)-9-ethoxy-8-methoxy-2-methyl-3,4,4a,10b-tetrahydro-1h-benzo[c][1,6]naphthyridin-6-yl]-n,n-di(propan-2-yl)benzamide Chemical compound N([C@@H]1CCN(C)C[C@@H]1C=1C=C(C(=CC=11)OC)OCC)=C1C1=CC=C(C(=O)N(C(C)C)C(C)C)C=C1 CVDXFPBVOIERBH-JWQCQUIFSA-N 0.000 description 1
- MRHCSNNEUHXNIC-UHFFFAOYSA-N 9-benzylpurin-6-amine Chemical class C1=NC=2C(N)=NC=NC=2N1CC1=CC=CC=C1 MRHCSNNEUHXNIC-UHFFFAOYSA-N 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 101710187573 Alcohol dehydrogenase 2 Proteins 0.000 description 1
- 101710133776 Alcohol dehydrogenase class-3 Proteins 0.000 description 1
- 208000035285 Allergic Seasonal Rhinitis Diseases 0.000 description 1
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 1
- 241000244186 Ascaris Species 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 241000228212 Aspergillus Species 0.000 description 1
- 241000351920 Aspergillus nidulans Species 0.000 description 1
- 241000228245 Aspergillus niger Species 0.000 description 1
- 101710192393 Attachment protein G3P Proteins 0.000 description 1
- 241000713842 Avian sarcoma virus Species 0.000 description 1
- MBUVEWMHONZEQD-UHFFFAOYSA-N Azeptin Chemical compound C1CN(C)CCCC1N1C(=O)C2=CC=CC=C2C(CC=2C=CC(Cl)=CC=2)=N1 MBUVEWMHONZEQD-UHFFFAOYSA-N 0.000 description 1
- 241000194108 Bacillus licheniformis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 241000701822 Bovine papillomavirus Species 0.000 description 1
- VOVIALXJUBGFJZ-KWVAZRHASA-N Budesonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@H]3OC(CCC)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O VOVIALXJUBGFJZ-KWVAZRHASA-N 0.000 description 1
- 102100021943 C-C motif chemokine 2 Human genes 0.000 description 1
- 101710155857 C-C motif chemokine 2 Proteins 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- QGBIFMJAQARMNQ-QISPFCDLSA-N C1([C@@H](F)C2)=CC(=O)CC[C@]1(C)[C@]1(F)[C@@H]2[C@@H]2C[C@H]3O[C@@H](CCC)O[C@@]3(SC)[C@@]2(C)C[C@@H]1O Chemical compound C1([C@@H](F)C2)=CC(=O)CC[C@]1(C)[C@]1(F)[C@@H]2[C@@H]2C[C@H]3O[C@@H](CCC)O[C@@]3(SC)[C@@]2(C)C[C@@H]1O QGBIFMJAQARMNQ-QISPFCDLSA-N 0.000 description 1
- 102000001902 CC Chemokines Human genes 0.000 description 1
- 108010040471 CC Chemokines Proteins 0.000 description 1
- 108010059108 CD18 Antigens Proteins 0.000 description 1
- 102000017926 CHRM2 Human genes 0.000 description 1
- 102000017925 CHRM3 Human genes 0.000 description 1
- 101150060249 CHRM3 gene Proteins 0.000 description 1
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 241000282461 Canis lupus Species 0.000 description 1
- 101710169873 Capsid protein G8P Proteins 0.000 description 1
- 108010084457 Cathepsins Proteins 0.000 description 1
- 102000005600 Cathepsins Human genes 0.000 description 1
- 102000004003 Chemokine CCL11 Human genes 0.000 description 1
- 108010082548 Chemokine CCL11 Proteins 0.000 description 1
- 206010008469 Chest discomfort Diseases 0.000 description 1
- 108010022172 Chitinases Proteins 0.000 description 1
- 102000012286 Chitinases Human genes 0.000 description 1
- 241000282552 Chlorocebus aethiops Species 0.000 description 1
- 101150012960 Chrm2 gene Proteins 0.000 description 1
- LUKZNWIVRBCLON-GXOBDPJESA-N Ciclesonide Chemical compound C1([C@H]2O[C@@]3([C@H](O2)C[C@@H]2[C@@]3(C[C@H](O)[C@@H]3[C@@]4(C)C=CC(=O)C=C4CC[C@H]32)C)C(=O)COC(=O)C(C)C)CCCCC1 LUKZNWIVRBCLON-GXOBDPJESA-N 0.000 description 1
- 101100007328 Cocos nucifera COS-1 gene Proteins 0.000 description 1
- 102000012422 Collagen Type I Human genes 0.000 description 1
- 108010022452 Collagen Type I Proteins 0.000 description 1
- 241000557626 Corvus corax Species 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 101100189582 Dictyostelium discoideum pdeD gene Proteins 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 108090000204 Dipeptidase 1 Proteins 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 241000588914 Enterobacter Species 0.000 description 1
- 241000588921 Enterobacteriaceae Species 0.000 description 1
- 101710146739 Enterotoxin Proteins 0.000 description 1
- 241000588698 Erwinia Species 0.000 description 1
- 241000588722 Escherichia Species 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical class NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 208000027445 Farmer Lung Diseases 0.000 description 1
- 108010021472 Fc gamma receptor IIB Proteins 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- 108010003471 Fetal Proteins Proteins 0.000 description 1
- 102000004641 Fetal Proteins Human genes 0.000 description 1
- 241000724791 Filamentous phage Species 0.000 description 1
- 208000000666 Fowlpox Diseases 0.000 description 1
- 241000700662 Fowlpox virus Species 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 102000030595 Glucokinase Human genes 0.000 description 1
- 108010021582 Glucokinase Proteins 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 208000009889 Herpes Simplex Diseases 0.000 description 1
- 102000005548 Hexokinase Human genes 0.000 description 1
- 108700040460 Hexokinases Proteins 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000935587 Homo sapiens Flavin reductase (NADPH) Proteins 0.000 description 1
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 1
- 101000741967 Homo sapiens Presequence protease, mitochondrial Proteins 0.000 description 1
- 102000003839 Human Proteins Human genes 0.000 description 1
- 108090000144 Human Proteins Proteins 0.000 description 1
- 241000701109 Human adenovirus 2 Species 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 108700002232 Immediate-Early Genes Proteins 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 238000012404 In vitro experiment Methods 0.000 description 1
- 102100025087 Insulin receptor substrate 1 Human genes 0.000 description 1
- 101710201824 Insulin receptor substrate 1 Proteins 0.000 description 1
- 102100025092 Insulin receptor substrate 2 Human genes 0.000 description 1
- 101710201820 Insulin receptor substrate 2 Proteins 0.000 description 1
- 108090000174 Interleukin-10 Proteins 0.000 description 1
- 102000003814 Interleukin-10 Human genes 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- 102000000646 Interleukin-3 Human genes 0.000 description 1
- 102000010787 Interleukin-4 Receptors Human genes 0.000 description 1
- 108010002335 Interleukin-9 Proteins 0.000 description 1
- 102000000585 Interleukin-9 Human genes 0.000 description 1
- 108090000769 Isomerases Proteins 0.000 description 1
- 102000004195 Isomerases Human genes 0.000 description 1
- 241000588748 Klebsiella Species 0.000 description 1
- 241000235649 Kluyveromyces Species 0.000 description 1
- 241000235058 Komagataella pastoris Species 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical group CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 239000000867 Lipoxygenase Inhibitor Substances 0.000 description 1
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 1
- 102100029205 Low affinity immunoglobulin gamma Fc region receptor II-b Human genes 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- 101710156564 Major tail protein Gp23 Proteins 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 1
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 1
- 102000003792 Metallothionein Human genes 0.000 description 1
- 108090000157 Metallothionein Proteins 0.000 description 1
- FQISKWAFAHGMGT-SGJOWKDISA-M Methylprednisolone sodium succinate Chemical compound [Na+].C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@](O)(C(=O)COC(=O)CCC([O-])=O)CC[C@H]21 FQISKWAFAHGMGT-SGJOWKDISA-M 0.000 description 1
- UCHDWCPVSPXUMX-TZIWLTJVSA-N Montelukast Chemical compound CC(C)(O)C1=CC=CC=C1CC[C@H](C=1C=C(\C=C\C=2N=C3C=C(Cl)C=CC3=CC=2)C=CC=1)SCC1(CC(O)=O)CC1 UCHDWCPVSPXUMX-TZIWLTJVSA-N 0.000 description 1
- 101001076402 Mus musculus Interleukin-13 Proteins 0.000 description 1
- 102000014415 Muscarinic acetylcholine receptor Human genes 0.000 description 1
- 108050003473 Muscarinic acetylcholine receptor Proteins 0.000 description 1
- 108010046068 N-Acetyllactosamine Synthase Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 101150098694 PDE5A gene Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108010067372 Pancreatic elastase Proteins 0.000 description 1
- 102000016387 Pancreatic elastase Human genes 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 108010087702 Penicillinase Proteins 0.000 description 1
- 102000010292 Peptide Elongation Factor 1 Human genes 0.000 description 1
- 108010077524 Peptide Elongation Factor 1 Proteins 0.000 description 1
- 108010090127 Periplasmic Proteins Proteins 0.000 description 1
- 108010069341 Phosphofructokinases Proteins 0.000 description 1
- 102000001105 Phosphofructokinases Human genes 0.000 description 1
- 102000012288 Phosphopyruvate Hydratase Human genes 0.000 description 1
- 108010022181 Phosphopyruvate Hydratase Proteins 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 1
- 229920002535 Polyethylene Glycol 1500 Polymers 0.000 description 1
- 241001505332 Polyomavirus sp. Species 0.000 description 1
- 102100038632 Presequence protease, mitochondrial Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 241000588769 Proteus <enterobacteria> Species 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 241000238711 Pyroglyphidae Species 0.000 description 1
- 108010011939 Pyruvate Decarboxylase Proteins 0.000 description 1
- 208000035977 Rare disease Diseases 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 206010038468 Renal hypertrophy Diseases 0.000 description 1
- 208000037656 Respiratory Sounds Diseases 0.000 description 1
- 241000219061 Rheum Species 0.000 description 1
- 208000036284 Rhinitis seasonal Diseases 0.000 description 1
- 238000011579 SCID mouse model Methods 0.000 description 1
- VPMWDFRZSIMDKW-YJYMSZOUSA-N Salmefamol Chemical compound C1=CC(OC)=CC=C1C[C@@H](C)NC[C@H](O)C1=CC=C(O)C(CO)=C1 VPMWDFRZSIMDKW-YJYMSZOUSA-N 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 241000235347 Schizosaccharomyces pombe Species 0.000 description 1
- 206010070834 Sensitisation Diseases 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 241000607720 Serratia Species 0.000 description 1
- 241000607715 Serratia marcescens Species 0.000 description 1
- 241000607768 Shigella Species 0.000 description 1
- 206010070835 Skin sensitisation Diseases 0.000 description 1
- RXZMMZZRUPYENV-VROPFNGYSA-N Solifenacin succinate Chemical compound OC(=O)CCC(O)=O.C1([C@H]2C3=CC=CC=C3CCN2C(O[C@@H]2C3CCN(CC3)C2)=O)=CC=CC=C1 RXZMMZZRUPYENV-VROPFNGYSA-N 0.000 description 1
- 102100038803 Somatotropin Human genes 0.000 description 1
- 241000187747 Streptomyces Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 201000009594 Systemic Scleroderma Diseases 0.000 description 1
- 206010042953 Systemic sclerosis Diseases 0.000 description 1
- 230000005867 T cell response Effects 0.000 description 1
- 101150006914 TRP1 gene Proteins 0.000 description 1
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 description 1
- GUGOEEXESWIERI-UHFFFAOYSA-N Terfenadine Chemical compound C1=CC(C(C)(C)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 GUGOEEXESWIERI-UHFFFAOYSA-N 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- DQHNAVOVODVIMG-UHFFFAOYSA-M Tiotropium bromide Chemical compound [Br-].C1C(C2C3O2)[N+](C)(C)C3CC1OC(=O)C(O)(C=1SC=CC=1)C1=CC=CS1 DQHNAVOVODVIMG-UHFFFAOYSA-M 0.000 description 1
- 241001149964 Tolypocladium Species 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 241000223259 Trichoderma Species 0.000 description 1
- 102000001400 Tryptase Human genes 0.000 description 1
- 108060005989 Tryptase Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- 108010000134 Vascular Cell Adhesion Molecule-1 Proteins 0.000 description 1
- 102100023543 Vascular cell adhesion protein 1 Human genes 0.000 description 1
- 101710135349 Venom phosphodiesterase Proteins 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- IXKSXJFAGXLQOQ-XISFHERQSA-N WHWLQLKPGQPMY Chemical compound C([C@@H](C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)C1=CNC=N1 IXKSXJFAGXLQOQ-XISFHERQSA-N 0.000 description 1
- 206010047924 Wheezing Diseases 0.000 description 1
- 238000012452 Xenomouse strains Methods 0.000 description 1
- 241000235013 Yarrowia Species 0.000 description 1
- OEXHQOGQTVQTAT-SSZRJXQFSA-N [(1r,5s)-8-methyl-8-propan-2-yl-8-azoniabicyclo[3.2.1]octan-3-yl] (2r)-3-hydroxy-2-phenylpropanoate Chemical compound C1([C@H](CO)C(=O)OC2C[C@H]3CC[C@@H](C2)[N+]3(C)C(C)C)=CC=CC=C1 OEXHQOGQTVQTAT-SSZRJXQFSA-N 0.000 description 1
- RVCSYOQWLPPAOA-CVPHZBIISA-M [(5s)-spiro[8-azoniabicyclo[3.2.1]octane-8,1'-azolidin-1-ium]-3-yl] 2-hydroxy-2,2-diphenylacetate;chloride Chemical compound [Cl-].[N+]12([C@H]3CCC2CC(C3)OC(=O)C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CCCC1 RVCSYOQWLPPAOA-CVPHZBIISA-M 0.000 description 1
- CDKNUFNIFGPFSF-AYVLZSQQSA-N [(8s,9s,10r,11s,13s,14s,17r)-11-hydroxy-10,13-dimethyl-3-oxo-17-(2-propanoylsulfanylacetyl)-2,6,7,8,9,11,12,14,15,16-decahydro-1h-cyclopenta[a]phenanthren-17-yl] butanoate Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)CSC(=O)CC)(OC(=O)CCC)[C@@]1(C)C[C@@H]2O CDKNUFNIFGPFSF-AYVLZSQQSA-N 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- XLAKJQPTOJHYDR-QTQXQZBYSA-M aclidinium bromide Chemical compound [Br-].C([C@@H](C(CC1)CC2)OC(=O)C(O)(C=3SC=CC=3)C=3SC=CC=3)[N+]21CCCOC1=CC=CC=C1 XLAKJQPTOJHYDR-QTQXQZBYSA-M 0.000 description 1
- 229960005012 aclidinium bromide Drugs 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 230000009824 affinity maturation Effects 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 230000008484 agonism Effects 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 150000003973 alkyl amines Chemical class 0.000 description 1
- 208000037884 allergic airway inflammation Diseases 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 230000009285 allergic inflammation Effects 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 210000001132 alveolar macrophage Anatomy 0.000 description 1
- 229960005260 amiodarone Drugs 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 230000001088 anti-asthma Effects 0.000 description 1
- 230000002924 anti-infective effect Effects 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 239000000924 antiasthmatic agent Substances 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 229960005475 antiinfective agent Drugs 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 150000001483 arginine derivatives Chemical class 0.000 description 1
- GVTLDPJNRVMCAL-UHFFFAOYSA-N arofylline Chemical compound C1=2N=CNC=2C(=O)N(CCC)C(=O)N1C1=CC=C(Cl)C=C1 GVTLDPJNRVMCAL-UHFFFAOYSA-N 0.000 description 1
- 229950009746 arofylline Drugs 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 239000010425 asbestos Substances 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- GXDALQBWZGODGZ-UHFFFAOYSA-N astemizole Chemical compound C1=CC(OC)=CC=C1CCN1CCC(NC=2N(C3=CC=CC=C3N=2)CC=2C=CC(F)=CC=2)CC1 GXDALQBWZGODGZ-UHFFFAOYSA-N 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 229940098165 atrovent Drugs 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 229960004574 azelastine Drugs 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 229940092705 beclomethasone Drugs 0.000 description 1
- 229940049706 benzodiazepine Drugs 0.000 description 1
- 150000005528 benzodioxoles Chemical class 0.000 description 1
- 108010051210 beta-Fructofuranosidase Proteins 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 102000006635 beta-lactamase Human genes 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- SXDBWCPKPHAZSM-UHFFFAOYSA-M bromate Inorganic materials [O-]Br(=O)=O SXDBWCPKPHAZSM-UHFFFAOYSA-M 0.000 description 1
- SXDBWCPKPHAZSM-UHFFFAOYSA-N bromic acid Chemical compound OBr(=O)=O SXDBWCPKPHAZSM-UHFFFAOYSA-N 0.000 description 1
- 229960004436 budesonide Drugs 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 102100029175 cGMP-specific 3',5'-cyclic phosphodiesterase Human genes 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 description 1
- 230000007211 cardiovascular event Effects 0.000 description 1
- 238000005341 cation exchange Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 238000012832 cell culture technique Methods 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000011712 cell development Effects 0.000 description 1
- 230000006041 cell recruitment Effects 0.000 description 1
- 230000009134 cell regulation Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- KEWHKYJURDBRMN-XSAPEOHZSA-M chembl2134724 Chemical compound O.[Br-].O([C@H]1C[C@H]2CC[C@@H](C1)[N+]2(C)C(C)C)C(=O)C(CO)C1=CC=CC=C1 KEWHKYJURDBRMN-XSAPEOHZSA-M 0.000 description 1
- 230000014564 chemokine production Effects 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 230000001713 cholinergic effect Effects 0.000 description 1
- 238000011210 chromatographic step Methods 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 208000021735 chronic enteritis Diseases 0.000 description 1
- 208000020832 chronic kidney disease Diseases 0.000 description 1
- 229960003728 ciclesonide Drugs 0.000 description 1
- YNNUSGIPVFPVBX-NHCUHLMSSA-N clemastine Chemical compound CN1CCC[C@@H]1CCO[C@@](C)(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 YNNUSGIPVFPVBX-NHCUHLMSSA-N 0.000 description 1
- 229960002881 clemastine Drugs 0.000 description 1
- 208000035850 clinical syndrome Diseases 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 1
- 238000005094 computer simulation Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 229960000265 cromoglicic acid Drugs 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 238000005138 cryopreservation Methods 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000001120 cytoprotective effect Effects 0.000 description 1
- 229960002677 darifenacin Drugs 0.000 description 1
- UQAVIASOPREUIT-VQIWEWKSSA-N darifenacin hydrobromide Chemical compound Br.C=1C=CC=CC=1C([C@H]1CN(CCC=2C=C3CCOC3=CC=2)CC1)(C(=O)N)C1=CC=CC=C1 UQAVIASOPREUIT-VQIWEWKSSA-N 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000011118 depth filtration Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 229940076405 detrol Drugs 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- ZZVUWRFHKOJYTH-UHFFFAOYSA-N diphenhydramine Chemical compound C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 ZZVUWRFHKOJYTH-UHFFFAOYSA-N 0.000 description 1
- 230000009266 disease activity Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- VLARUOGDXDTHEH-UHFFFAOYSA-L disodium cromoglycate Chemical compound [Na+].[Na+].O1C(C([O-])=O)=CC(=O)C2=C1C=CC=C2OCC(O)COC1=CC=CC2=C1C(=O)C=C(C([O-])=O)O2 VLARUOGDXDTHEH-UHFFFAOYSA-L 0.000 description 1
- 229940099170 ditropan Drugs 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 230000029036 donor selection Effects 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 230000002222 downregulating effect Effects 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 239000000428 dust Substances 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 239000003602 elastase inhibitor Substances 0.000 description 1
- 208000028208 end stage renal disease Diseases 0.000 description 1
- 201000000523 end stage renal failure Diseases 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 239000000147 enterotoxin Substances 0.000 description 1
- 231100000655 enterotoxin Toxicity 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000002327 eosinophilic effect Effects 0.000 description 1
- 201000001564 eosinophilic gastroenteritis Diseases 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 208000024711 extrinsic asthma Diseases 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 230000003352 fibrogenic effect Effects 0.000 description 1
- 229960000676 flunisolide Drugs 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 229940044627 gamma-interferon Drugs 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 208000021302 gastroesophageal reflux disease Diseases 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 238000003209 gene knockout Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 230000007614 genetic variation Effects 0.000 description 1
- 108060003196 globin Proteins 0.000 description 1
- 102000018146 globin Human genes 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 1
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 1
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 1
- 230000002414 glycolytic effect Effects 0.000 description 1
- 230000036433 growing body Effects 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 230000000004 hemodynamic effect Effects 0.000 description 1
- 125000005885 heterocycloalkylalkyl group Chemical group 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 238000005734 heterodimerization reaction Methods 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 239000012510 hollow fiber Substances 0.000 description 1
- 229940046533 house dust mites Drugs 0.000 description 1
- 102000056549 human Fv Human genes 0.000 description 1
- 108700005872 human Fv Proteins 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000005965 immune activity Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000037189 immune system physiology Effects 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 230000014828 interferon-gamma production Effects 0.000 description 1
- 102000014909 interleukin-1 receptor activity proteins Human genes 0.000 description 1
- 108040006732 interleukin-1 receptor activity proteins Proteins 0.000 description 1
- 229940028885 interleukin-4 Drugs 0.000 description 1
- 230000017307 interleukin-4 production Effects 0.000 description 1
- 210000004347 intestinal mucosa Anatomy 0.000 description 1
- 210000001955 intestinal smooth muscle cell Anatomy 0.000 description 1
- 230000004068 intracellular signaling Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 201000010659 intrinsic asthma Diseases 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 239000001573 invertase Substances 0.000 description 1
- 235000011073 invertase Nutrition 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- OEXHQOGQTVQTAT-JRNQLAHRSA-N ipratropium Chemical compound O([C@H]1C[C@H]2CC[C@@H](C1)[N@@+]2(C)C(C)C)C(=O)C(CO)C1=CC=CC=C1 OEXHQOGQTVQTAT-JRNQLAHRSA-N 0.000 description 1
- 229960001888 ipratropium Drugs 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 231100000021 irritant Toxicity 0.000 description 1
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 201000008627 kidney hypertrophy Diseases 0.000 description 1
- 238000011813 knockout mouse model Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 238000011031 large-scale manufacturing process Methods 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 239000003199 leukotriene receptor blocking agent Substances 0.000 description 1
- 150000002617 leukotrienes Chemical class 0.000 description 1
- 229960001508 levocetirizine Drugs 0.000 description 1
- 230000005980 lung dysfunction Effects 0.000 description 1
- 230000004199 lung function Effects 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000004066 metabolic change Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- FXXQDYPNDZFBMV-UHFFFAOYSA-N methyl 5-cyano-5-[3-(cyclopropylmethoxy)-4-(difluoromethoxy)phenyl]-2-oxocyclohexane-1-carboxylate Chemical compound C1CC(=O)C(C(=O)OC)CC1(C#N)C1=CC=C(OC(F)F)C(OCC2CC2)=C1 FXXQDYPNDZFBMV-UHFFFAOYSA-N 0.000 description 1
- 229960004584 methylprednisolone Drugs 0.000 description 1
- 238000001471 micro-filtration Methods 0.000 description 1
- 238000007799 mixed lymphocyte reaction assay Methods 0.000 description 1
- QLIIKPVHVRXHRI-CXSFZGCWSA-N mometasone Chemical class C1CC2=CC(=O)C=C[C@]2(C)[C@]2(Cl)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CCl)(O)[C@@]1(C)C[C@@H]2O QLIIKPVHVRXHRI-CXSFZGCWSA-N 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 229960005127 montelukast Drugs 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- DPHDSIQHVGSITN-UHFFFAOYSA-N n-(3,5-dichloropyridin-4-yl)-2-[1-[(4-fluorophenyl)methyl]-5-hydroxyindol-3-yl]-2-oxoacetamide Chemical compound C1=C(C(=O)C(=O)NC=2C(=CN=CC=2Cl)Cl)C2=CC(O)=CC=C2N1CC1=CC=C(F)C=C1 DPHDSIQHVGSITN-UHFFFAOYSA-N 0.000 description 1
- 238000001728 nano-filtration Methods 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 229960002259 nedocromil sodium Drugs 0.000 description 1
- NXFQHRVNIOXGAQ-YCRREMRBSA-N nitrofurantoin Chemical compound O1C([N+](=O)[O-])=CC=C1\C=N\N1C(=O)NC(=O)C1 NXFQHRVNIOXGAQ-YCRREMRBSA-N 0.000 description 1
- 229960000564 nitrofurantoin Drugs 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229960000470 omalizumab Drugs 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 229960000426 otilonium bromide Drugs 0.000 description 1
- LCELQERNWLBPSY-SPJIBDPASA-M oxitropium Chemical compound [Br-].C1([C@@H](CO)C(=O)OC2C[C@@H]3[N+]([C@@H](C2)[C@H]2[C@@H]3O2)(C)CC)=CC=CC=C1 LCELQERNWLBPSY-SPJIBDPASA-M 0.000 description 1
- NVOYVOBDTVTBDX-PMEUIYRNSA-N oxitropium Chemical compound CC[N+]1(C)[C@H]2C[C@@H](C[C@@H]1[C@H]1O[C@@H]21)OC(=O)[C@H](CO)C1=CC=CC=C1 NVOYVOBDTVTBDX-PMEUIYRNSA-N 0.000 description 1
- 229960000797 oxitropium Drugs 0.000 description 1
- 229960005434 oxybutynin Drugs 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 229950009506 penicillinase Drugs 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000037081 physical activity Effects 0.000 description 1
- 229960004633 pirenzepine Drugs 0.000 description 1
- 229960003073 pirfenidone Drugs 0.000 description 1
- ISWRGOKTTBVCFA-UHFFFAOYSA-N pirfenidone Chemical compound C1=C(C)C=CC(=O)N1C1=CC=CC=C1 ISWRGOKTTBVCFA-UHFFFAOYSA-N 0.000 description 1
- 229920001993 poloxamer 188 Polymers 0.000 description 1
- 229920002704 polyhistidine Polymers 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 238000010837 poor prognosis Methods 0.000 description 1
- 230000023603 positive regulation of transcription initiation, DNA-dependent Effects 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000002206 pro-fibrotic effect Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 230000001823 pruritic effect Effects 0.000 description 1
- 210000003456 pulmonary alveoli Anatomy 0.000 description 1
- 201000009732 pulmonary eosinophilia Diseases 0.000 description 1
- 230000009325 pulmonary function Effects 0.000 description 1
- 239000003379 purinergic P1 receptor agonist Substances 0.000 description 1
- 239000000296 purinergic P1 receptor antagonist Substances 0.000 description 1
- MIXMJCQRHVAJIO-TZHJZOAOSA-N qk4dys664x Chemical compound O.C1([C@@H](F)C2)=CC(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2C[C@H]3OC(C)(C)O[C@@]3(C(=O)CO)[C@@]2(C)C[C@@H]1O.C1([C@@H](F)C2)=CC(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2C[C@H]3OC(C)(C)O[C@@]3(C(=O)CO)[C@@]2(C)C[C@@H]1O MIXMJCQRHVAJIO-TZHJZOAOSA-N 0.000 description 1
- 230000036647 reaction Effects 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 210000001350 reed-sternberg cell Anatomy 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 210000001533 respiratory mucosa Anatomy 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 229910052895 riebeckite Inorganic materials 0.000 description 1
- 229950004432 rofleponide Drugs 0.000 description 1
- IXTCZMJQGGONPY-XJAYAHQCSA-N rofleponide Chemical compound C1([C@@H](F)C2)=CC(=O)CC[C@]1(C)[C@]1(F)[C@@H]2[C@@H]2C[C@H]3O[C@@H](CCC)O[C@@]3(C(=O)CO)[C@@]2(C)C[C@@H]1O IXTCZMJQGGONPY-XJAYAHQCSA-N 0.000 description 1
- 229960002586 roflumilast Drugs 0.000 description 1
- 229950001879 salmefamol Drugs 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 208000017022 seasonal allergic rhinitis Diseases 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000010187 selection method Methods 0.000 description 1
- 230000008313 sensitization Effects 0.000 description 1
- 210000000717 sertoli cell Anatomy 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 238000007390 skin biopsy Methods 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 231100000370 skin sensitisation Toxicity 0.000 description 1
- 239000000779 smoke Substances 0.000 description 1
- 230000000391 smoking effect Effects 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 229940046810 spiriva Drugs 0.000 description 1
- DQHNAVOVODVIMG-RGECMCKFSA-M spiriva Chemical compound [Br-].C([C@@H]1[N+]([C@H](C2)[C@@H]3[C@H]1O3)(C)C)C2OC(=O)C(O)(C=1SC=CC=1)C1=CC=CS1 DQHNAVOVODVIMG-RGECMCKFSA-M 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 238000005728 strengthening Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 125000003107 substituted aryl group Chemical group 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000013595 supernatant sample Substances 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 210000005222 synovial tissue Anatomy 0.000 description 1
- 201000004595 synovitis Diseases 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- 229960001967 tacrolimus Drugs 0.000 description 1
- QJJXYPPXXYFBGM-SHYZHZOCSA-N tacrolimus Natural products CO[C@H]1C[C@H](CC[C@@H]1O)C=C(C)[C@H]2OC(=O)[C@H]3CCCCN3C(=O)C(=O)[C@@]4(O)O[C@@H]([C@H](C[C@H]4C)OC)[C@@H](C[C@H](C)CC(=C[C@@H](CC=C)C(=O)C[C@H](O)[C@H]2C)C)OC QJJXYPPXXYFBGM-SHYZHZOCSA-N 0.000 description 1
- 229950004218 talizumab Drugs 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229960000351 terfenadine Drugs 0.000 description 1
- 229960005383 terodiline Drugs 0.000 description 1
- UISARWKNNNHPGI-UHFFFAOYSA-N terodiline Chemical compound C=1C=CC=CC=1C(CC(C)NC(C)(C)C)C1=CC=CC=C1 UISARWKNNNHPGI-UHFFFAOYSA-N 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 229960000278 theophylline Drugs 0.000 description 1
- 229940126622 therapeutic monoclonal antibody Drugs 0.000 description 1
- LERNTVKEWCAPOY-DZZGSBJMSA-N tiotropium Chemical compound O([C@H]1C[C@@H]2[N+]([C@H](C1)[C@@H]1[C@H]2O1)(C)C)C(=O)C(O)(C=1SC=CC=1)C1=CC=CS1 LERNTVKEWCAPOY-DZZGSBJMSA-N 0.000 description 1
- 229940110309 tiotropium Drugs 0.000 description 1
- 230000017423 tissue regeneration Effects 0.000 description 1
- 229960004045 tolterodine Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 210000003437 trachea Anatomy 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000031998 transcytosis Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 229960002117 triamcinolone acetonide Drugs 0.000 description 1
- YNDXUCZADRHECN-JNQJZLCISA-N triamcinolone acetonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H]3OC(C)(C)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O YNDXUCZADRHECN-JNQJZLCISA-N 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- XLRPYZSEQKXZAA-OCAPTIKFSA-N tropane Chemical group C1CC[C@H]2CC[C@@H]1N2C XLRPYZSEQKXZAA-OCAPTIKFSA-N 0.000 description 1
- 229960001530 trospium chloride Drugs 0.000 description 1
- RVCSYOQWLPPAOA-DHWZJIOFSA-M trospium chloride Chemical compound [Cl-].[N+]12([C@@H]3CC[C@H]2CC(C3)OC(=O)C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CCCC1 RVCSYOQWLPPAOA-DHWZJIOFSA-M 0.000 description 1
- 239000002750 tryptase inhibitor Substances 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 238000010396 two-hybrid screening Methods 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 229910021642 ultra pure water Inorganic materials 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 239000012498 ultrapure water Substances 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- BDIAUFOIMFAIPU-UHFFFAOYSA-N valepotriate Natural products CC(C)CC(=O)OC1C=C(C(=COC2OC(=O)CC(C)C)COC(C)=O)C2C11CO1 BDIAUFOIMFAIPU-UHFFFAOYSA-N 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229940063390 vesicare Drugs 0.000 description 1
- 229950000339 xinafoate Drugs 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/10—Anthelmintics
- A61P33/12—Schistosomicides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/10—Cells modified by introduction of foreign genetic material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Genetics & Genomics (AREA)
- Biomedical Technology (AREA)
- Pulmonology (AREA)
- Immunology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Zoology (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Tropical Medicine & Parasitology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Neurosurgery (AREA)
- Hematology (AREA)
- Epidemiology (AREA)
- Otolaryngology (AREA)
- Cell Biology (AREA)
- Neurology (AREA)
- Oncology (AREA)
- Mycology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
本発明は、免疫グロブリン、特に、ヒトインターロイキン13(hIL−13)と特異的に結合する抗体に関する。本発明の抗体は、hIL−13とヒトIL−13受容体との相互作用のモジュレーションに反応する、さまざまな疾患もしくは障害の治療に使用することができる。このような疾患には、重症喘息、アトピー性皮膚炎、COPD、およびさまざまな線維性疾患がある。前記抗体を含んでなる医薬組成物、および製造方法も記載する。
【選択図】図13
【選択図】図13
Description
本発明は、インターロイキン-13(IL-13)、特にヒトIL-13(hIL-13)に特異的に結合する免疫グロブリンに関する。本発明のある実施形態は、hIL-13に特異的に結合する抗体に関する。本発明はまた、前記免疫グロブリンによって疾患もしくは障害を治療する方法、前記免疫グロブリンを含んでなる医薬組成物、ならびに製造方法に関する。本発明の他の態様は、以下の記述から明らかにする。
インターロイキン-13(IL-13)
IL-13は、本来、炎症性サイトカインの産生を阻害するT細胞由来サイトカインとして報告された、12kDaの分泌型サイトカインである。構造研究から、IL-13は2つのジスルフィド結合によって保持される4へリックスバンドル構造を有することが示されている。IL-13は、4つのグリコシル化可能な部位を有するが、ラット肺由来の天然型IL-13の分析から、IL-13は非グリコシル化分子として産生されることが示された。NSOおよびCOS-7細胞からのヒトIL-13の発現によって、上記の所見は確認されている(Eisenmesserら、J. Mol. Biol. 2001 310(1):231-241; Moyら、J. Mol. Biol 2001 310(1):219-230; Cannon-Carlsonら、Protein Expression and Purification 1998 12(2):239-248)。
IL-13は、本来、炎症性サイトカインの産生を阻害するT細胞由来サイトカインとして報告された、12kDaの分泌型サイトカインである。構造研究から、IL-13は2つのジスルフィド結合によって保持される4へリックスバンドル構造を有することが示されている。IL-13は、4つのグリコシル化可能な部位を有するが、ラット肺由来の天然型IL-13の分析から、IL-13は非グリコシル化分子として産生されることが示された。NSOおよびCOS-7細胞からのヒトIL-13の発現によって、上記の所見は確認されている(Eisenmesserら、J. Mol. Biol. 2001 310(1):231-241; Moyら、J. Mol. Biol 2001 310(1):219-230; Cannon-Carlsonら、Protein Expression and Purification 1998 12(2):239-248)。
IL-13は、活性化されたTh2細胞、マスト細胞、好塩基球、樹状細胞、ケラチノサイトおよびNKT(ナチュラルキラーT)細胞を含めたさまざまなタイプの細胞によって産生される、多面的な(pleiotropic)サイトカインである。IL-13はまた、Th0、Th1、CD8およびナイーブCD45RA+ T細胞によっても産生される可能性がある。IL-13は、IL-4と一部重複する免疫調節作用を有するが、この重複性は、IL-4およびIL-13の受容体の共通成分によって説明することができる。IL-13は、IL-4RαおよびIL-13Rα1鎖からなるヘテロ二量体であるII型IL-4受容体を介して、シグナル伝達する。IL-13Rα1は、低い親和性でIL-13と結合する(Kd=2〜10 nM)が、IL-4Rαと対になった場合には高い親和性で結合し(Kd=400 pM)、シグナル伝達を行う機能的なIL-13受容体を形成し(ヒト受容体は本明細書中で「hIL-13R」と呼ぶ)、その結果、JAK/STATおよびIRS-1/IRS-2経路の活性化をもたらす。もう一つのIL-13受容体鎖(IL-13Rα2)も特徴が明らかになっており、これは高い親和性でIL-13と結合する(Kd=250 pM)。IL-13Rα2は、デコイ受容体として機能すると考えられている。IL-13は、IL-13Rα2を介してシグナル伝達を行い(Fichter-Feigl 2006 Nature Medicine 12:99-106)TGFβ1を誘導することもできるが、そのために喘息病変に付随する線維形成を助長する可能性がある。IL-13の機能的受容体は、気道上皮、平滑筋、マスト細胞、好酸球、好塩基球、B細胞、線維芽細胞、単球およびマクロファージなどの広範な細胞上で発現される。T細胞にはIL-13の機能的受容体はない(Hiltonら、PNAS 1996 93(1):497-501; Caputら、J. Biol. Chem. 1996 271(28):16921-16926; Hershey GK, J.Allergy Clin. Immunol. 2003 111(4):677-690)。
IL-13およびIL-4はいずれも、アレルギー関連の炎症を促進し、細菌、ウイルスおよび細胞内病原体に起因する炎症を抑制することによって、免疫ならびに炎症反応を変化させるよう機能する。IL-13の主な生物学的効果には、B細胞増殖の誘導およびIgEに対するアイソタイプスイッチの調節;B細胞および単球上でのMHC IIおよびCD23発現の誘導;内皮細胞上のVCAM-1のアップレギュレーション;ケモカイン産生の調節;マスト細胞、好酸球および好中球機能の活性化、ならびに単球およびマクロファージ集団における炎症誘発性遺伝子の発現の阻害が含まれる。IL-13は、T細胞に対する増殖促進効果をまったく示さない。したがって、IL-13は、IL-4とは異なり、CD4 T細胞からTh2型細胞への最初の分化には重要ではないようであり、むしろアレルギー性炎症のエフェクターの面で重要であると思われる(McKenzieら、PNAS 1993 90(8):3735-3739; Wynn TA, Annu. Rev. Immunol. 2003 21:425-456)。
IL-13と喘息
喘息は、下気道の炎症に起因する慢性肺疾患であって、再発性の呼吸障害を特徴とする。患者の気道は敏感であり、症状がない場合にも常にある程度、腫れ、または炎症を起こしている。炎症は、気道の狭小化をもたらし、空気の肺への流入および肺からの流出を減少させ、呼吸を困難にして、喘鳴、胸苦しさ、および咳嗽をもたらす。喘息は、アレルゲン(たとえば、イエダニ、花粉、カビ)、刺激物質(たとえば、煙、有害なガス、悪臭)、呼吸器感染症、運動および乾燥した気候に対する過敏性によって引き起こされる。こうした誘因が気道を刺激すると、気道の内側が腫れてさらに炎症を起こし、次に、粘液が気道を塞ぎ、気道の周囲の筋肉が締まり、最後には呼吸が困難で負担のかかる状態となって、喘息の症状が現れる。
喘息は、下気道の炎症に起因する慢性肺疾患であって、再発性の呼吸障害を特徴とする。患者の気道は敏感であり、症状がない場合にも常にある程度、腫れ、または炎症を起こしている。炎症は、気道の狭小化をもたらし、空気の肺への流入および肺からの流出を減少させ、呼吸を困難にして、喘鳴、胸苦しさ、および咳嗽をもたらす。喘息は、アレルゲン(たとえば、イエダニ、花粉、カビ)、刺激物質(たとえば、煙、有害なガス、悪臭)、呼吸器感染症、運動および乾燥した気候に対する過敏性によって引き起こされる。こうした誘因が気道を刺激すると、気道の内側が腫れてさらに炎症を起こし、次に、粘液が気道を塞ぎ、気道の周囲の筋肉が締まり、最後には呼吸が困難で負担のかかる状態となって、喘息の症状が現れる。
喘息の炎症および他の病変が、空気アレルゲンおよび他の刺激に対するTh2応答の調節不全によって促進されるという有力な証拠が動物モデルおよび患者から、得られている(Busseら、Am. J. Resp. Crit. Care Med.1995 152(1):388-393)。具体的には、IL-13は、気道過敏性、好酸球増加、杯細胞化生および粘液分泌過多などの、肺におけるさまざまな細胞応答を促進する主要なエフェクターサイトカインであると考えられている。
喘息におけるIL-13の役割に関する臨床上の証拠
IL-13をコードする遺伝子は、染色体5q31上にある。この領域はIL-3、IL-4、IL-5、IL-9およびGM-CSFをコードする遺伝子も含んでおり、喘息と関連づけられている。喘息およびアトピーに伴うIL-13の遺伝的変異が、プロモーターおよびコード領域の両方で発見されている(Vercelli D, Curr. Opin. Allergy Clin. Immunol. 2002 2(5):389-393)。コード変異体、Q130 IL-13(本明細書中で「Q130 IL-13」と呼ぶ)の機能研究データが利用可能である。第4エクソン中に見られる+2044 GからAへの一塩基多型(SNP)は、結果として130位(Q130 IL-13)でアルギニンからグルタミンへの置換をもたらす。また、配列番号9では、これは110位に相当し、ここでは成熟ヒトIL-13アミノ酸配列の先頭にある最初の「G」アミノ酸残基が1位であることにも留意されたい。この変異体は、日本人およびヨーロッパ人において喘息、IgEレベルの上昇、ならびにアトピー性皮膚炎に付随することが明らかとなっている。Q130 IL-13は、野生型IL-13と比較して高い安定性を有すると考えられている。また、Q130 IL-13はIL-13Rα2デコイ受容体に対する親和性がわずかに低いが、こうした所見と符合して、Q130 IL-13変異体に対してホモ接合性の患者では、ホモ接合性でない患者と比較して、血清IL-13レベル中央値が高いことが明らかになっている。これらの結果は、Q130 IL-13がIL-13の局所および全身濃度に影響を及ぼす可能性があることを示している(Kazuhikoら、J. Allergy Clin. Immunol. 2002 109(6):980-987)。
IL-13をコードする遺伝子は、染色体5q31上にある。この領域はIL-3、IL-4、IL-5、IL-9およびGM-CSFをコードする遺伝子も含んでおり、喘息と関連づけられている。喘息およびアトピーに伴うIL-13の遺伝的変異が、プロモーターおよびコード領域の両方で発見されている(Vercelli D, Curr. Opin. Allergy Clin. Immunol. 2002 2(5):389-393)。コード変異体、Q130 IL-13(本明細書中で「Q130 IL-13」と呼ぶ)の機能研究データが利用可能である。第4エクソン中に見られる+2044 GからAへの一塩基多型(SNP)は、結果として130位(Q130 IL-13)でアルギニンからグルタミンへの置換をもたらす。また、配列番号9では、これは110位に相当し、ここでは成熟ヒトIL-13アミノ酸配列の先頭にある最初の「G」アミノ酸残基が1位であることにも留意されたい。この変異体は、日本人およびヨーロッパ人において喘息、IgEレベルの上昇、ならびにアトピー性皮膚炎に付随することが明らかとなっている。Q130 IL-13は、野生型IL-13と比較して高い安定性を有すると考えられている。また、Q130 IL-13はIL-13Rα2デコイ受容体に対する親和性がわずかに低いが、こうした所見と符合して、Q130 IL-13変異体に対してホモ接合性の患者では、ホモ接合性でない患者と比較して、血清IL-13レベル中央値が高いことが明らかになっている。これらの結果は、Q130 IL-13がIL-13の局所および全身濃度に影響を及ぼす可能性があることを示している(Kazuhikoら、J. Allergy Clin. Immunol. 2002 109(6):980-987)。
アトピー性および非アトピー性喘息のいずれにおいても、IL-13レベルの上昇が測定された。ある研究において、平均血清IL-13レベルが測定されたが、正常な対照患者では8 pg/mlであるのに対して、喘息患者では50 pg/mlであった(Leeら、J. Asthma 2001 38(8):665-671)。IL-13レベルの増加は、血漿、気管支肺胞洗浄液、肺生検試料および痰においても測定された(Berryら、J Allergy Clin. Immunol 2004 114(5):1106-1109; Kroegelら、Eur Respir. J. 1996 9(5):899-904; Huangら、J. Immunol. 1995 155(5):2688-2694; Humbertら、J. Allergy Clin. Immunol. 1997 99(5):657-665)。
喘息にIL-13が関与することのin vivo証拠
いくつかの研究から、アレルギー性喘息の急性および慢性マウスモデルのいずれにおいても、病状の進行にIL-13が果たす、重要なエフェクターとしての役割が明らかになっている。これらのモデルでは、高親和性IL-13受容体(IL-13Rα2)または抗IL-13ポリクローナル抗体を用いて、マウスIL-13の生物活性を中和した。アレルゲン投与時にIL-13を遮断することによって、OVA誘発性の気道過敏、好酸球増加および杯細胞化生が完全に抑制された。これに対して、感作後およびアレルゲン投与期間中の、IL-4に対する抗体の投与は、喘息の発現の一部だけを軽減した。したがって、外来のIL-4およびIL-13はどちらも、喘息様の発現を誘導する能力を有するが、IL-13のエフェクター活性はIL-4よりすぐれていると思われる。これらのデータが、免疫誘導における(特にTh2細胞の発生および気道への動員、ならびにIgE産生に関する)IL-4の主要な役割を示唆するのに対して、IL-13は、気道過敏、粘液の過剰産生および細胞性炎症を含めた、さまざまなエフェクターの帰結に主に関与していると考えられる(Wills-Karpら、Science 1998 282:2258-2261; Grunigら、Science 1998 282:2261-2263; Taubeら、J. Immunol. 2002 169:6482-6489; Bleaseら、J. Immunol 2001 166(8):5219-5224)。
いくつかの研究から、アレルギー性喘息の急性および慢性マウスモデルのいずれにおいても、病状の進行にIL-13が果たす、重要なエフェクターとしての役割が明らかになっている。これらのモデルでは、高親和性IL-13受容体(IL-13Rα2)または抗IL-13ポリクローナル抗体を用いて、マウスIL-13の生物活性を中和した。アレルゲン投与時にIL-13を遮断することによって、OVA誘発性の気道過敏、好酸球増加および杯細胞化生が完全に抑制された。これに対して、感作後およびアレルゲン投与期間中の、IL-4に対する抗体の投与は、喘息の発現の一部だけを軽減した。したがって、外来のIL-4およびIL-13はどちらも、喘息様の発現を誘導する能力を有するが、IL-13のエフェクター活性はIL-4よりすぐれていると思われる。これらのデータが、免疫誘導における(特にTh2細胞の発生および気道への動員、ならびにIgE産生に関する)IL-4の主要な役割を示唆するのに対して、IL-13は、気道過敏、粘液の過剰産生および細胞性炎症を含めた、さまざまなエフェクターの帰結に主に関与していると考えられる(Wills-Karpら、Science 1998 282:2258-2261; Grunigら、Science 1998 282:2261-2263; Taubeら、J. Immunol. 2002 169:6482-6489; Bleaseら、J. Immunol 2001 166(8):5219-5224)。
補足実験において、トランスジェニックマウスでの過剰発現、または野生型マウス気管内へのIL-13タンパク質の滴下によって、肺のIL-13レベルを上昇させた。いずれの設定においても、喘息様の特徴、すなわち、コリン作動性の刺激に対する非特異的な気道過敏、肺好酸球増加、上皮細胞過形成、粘液細胞化生、上皮下の線維化、気道閉塞およびシャルコー−ライデン様結晶が誘導された。さらに、IL-13は肺においてマトリックスメタロプロテアーゼおよびカテプシンプロテアーゼの強力な刺激因子であり、その結果として気腫性の変化、および粘液化生をもたらすことが明らかになった。したがって、IL-13は、喘息、およびCOPD疾患の発現のいずれにおいても、重要なエフェクター分子である可能性がある(Zhuら、J. Clin. Invest. 1999 103(6):779-788; Zhengら、J. Clin. Invest. 2000 106(9):1081-1093)。
これらのデータは、妥当性が十分確認された動物モデルにおいて、IL-13活性が、アレルギー性喘息の主要な臨床的および病理学的特徴のうちのいくつかを生じさせるのに、必要かつ十分であることを示している。
慢性閉塞性肺疾患(COPD)
COPDは、肺気腫および慢性気管支炎を含めたいくつかの臨床的症候群を包含する総称である。症状は喘息に類似しているので、COPDは同じ薬物で治療することができる。COPDは、慢性で進行性のほとんど不可逆的な気道閉塞によって特徴づけられる。病気の経過への個体の寄与は不明であるが、喫煙が症例の90%の原因であると考えられている。症状には、咳嗽、慢性気管支炎、息切れ、および呼吸器感染症がある。この疾患は最終的には、重篤な身体障害および死に至る。2年間にわたって少なくとも3カ月間ほぼ毎日、咳または痰の出る病歴を有し、他に説明のつかない患者には、慢性気管支炎と診断する。肺気腫は、気腔の異常な永久的拡張、および肺胞壁の破壊を特徴とする。
COPDは、肺気腫および慢性気管支炎を含めたいくつかの臨床的症候群を包含する総称である。症状は喘息に類似しているので、COPDは同じ薬物で治療することができる。COPDは、慢性で進行性のほとんど不可逆的な気道閉塞によって特徴づけられる。病気の経過への個体の寄与は不明であるが、喫煙が症例の90%の原因であると考えられている。症状には、咳嗽、慢性気管支炎、息切れ、および呼吸器感染症がある。この疾患は最終的には、重篤な身体障害および死に至る。2年間にわたって少なくとも3カ月間ほぼ毎日、咳または痰の出る病歴を有し、他に説明のつかない患者には、慢性気管支炎と診断する。肺気腫は、気腔の異常な永久的拡張、および肺胞壁の破壊を特徴とする。
IL-13は、COPDの発症に関与する可能性がある。COPDを発症するヒト喫煙者は、肺実質中に多くの炎症性細胞型(好中球、マクロファージ、好酸球)を有する。IL-13は、炎症誘発性Th2サイトカインであり、したがって肺気腫を進行させる。Zhengらは、IL-13トランスジェニックマウスにおいて、気道上皮へのIL-13の過剰発現を目指した。これらの動物は気道および肺実質の炎症、ならびに気腫を発現した。また、これらの動物は慢性気管支炎を思わせる粘液化生も発現した(J. Clin. Invest. 2000 106(9):1081-1093)。
アレルギー性喘息に伴うIL-13プロモーターの多形性(-1055のCからT)も、健康な対照と比較して、COPD患者で頻度が高いことが報告されている。これは、COPDを発現する危険性の増加において、IL-13プロモーターの多形性が果たす機能的役割を示唆している(Kraanら、Genes and Immunity 2002 3:436-439)。さらに、無症状の喫煙者と比べて、慢性気管支炎の喫煙者では、IL-13およびIL-4陽性細胞数の増加が観察された(Miottoら、Eur. Resp. J. 2003 22:602-608)。しかしながら、重い肺気腫患者の肺におけるIL-13発現レベルを評価する最近の研究からは、IL-13レベルと疾患との間に関連性は見出されなかった(Bouttenら、Thorax 2004 59:850-854)。
アトピー性皮膚炎およびアレルギー性鼻炎を含めたアレルギー性疾患
IL-13は、アトピー性鼻炎およびアトピー性皮膚炎などのアトピー性疾患にも関与する。アレルギー性鼻炎は、米国において最も多く見られるアトピー性疾患であり、最大25%までの成人、および40%を超える子供が罹患していると推定される。アレルギー性鼻炎と喘息との間には、密接な関係が存在する。いずれの疾患も、共通の免疫病理および病態生理を有する;これらは、鼻組織および気管支組織中の好酸球およびTh2リンパ球が関与する、類似した免疫学的過程を有する。Th2サイトカイン、特にIL-4およびIL-5の過剰生成は、アレルギー性疾患の発病機序の根本をなしていると考えられる。IL-13は、いくつかの特徴およびエフェクター機能をIL-4と共有しているが、このことは、IL-4およびIL-13の受容体利用の機能上の重複、細胞内シグナル伝達成分、ならびに遺伝子構成と相まって、ヒトの即時型過敏症のin vivoでの促進もしくは維持にIL-13が役割を果たす(間接的ではあるが)有力な証拠を提供する。これは、季節性アレルギー性鼻炎のアトピー患者が、Ag依存性であるがポリクローナルではない活性化に反応して、IL-13応答の有意な強化を示すことを明らかにしたLiらによって、確認された(Liら、J Immunol 1998;161:7007)。
IL-13は、アトピー性鼻炎およびアトピー性皮膚炎などのアトピー性疾患にも関与する。アレルギー性鼻炎は、米国において最も多く見られるアトピー性疾患であり、最大25%までの成人、および40%を超える子供が罹患していると推定される。アレルギー性鼻炎と喘息との間には、密接な関係が存在する。いずれの疾患も、共通の免疫病理および病態生理を有する;これらは、鼻組織および気管支組織中の好酸球およびTh2リンパ球が関与する、類似した免疫学的過程を有する。Th2サイトカイン、特にIL-4およびIL-5の過剰生成は、アレルギー性疾患の発病機序の根本をなしていると考えられる。IL-13は、いくつかの特徴およびエフェクター機能をIL-4と共有しているが、このことは、IL-4およびIL-13の受容体利用の機能上の重複、細胞内シグナル伝達成分、ならびに遺伝子構成と相まって、ヒトの即時型過敏症のin vivoでの促進もしくは維持にIL-13が役割を果たす(間接的ではあるが)有力な証拠を提供する。これは、季節性アレルギー性鼻炎のアトピー患者が、Ag依存性であるがポリクローナルではない活性化に反応して、IL-13応答の有意な強化を示すことを明らかにしたLiらによって、確認された(Liら、J Immunol 1998;161:7007)。
アトピー性皮膚炎は、よく見られる慢性再発性の、きわめて掻痒性の炎症性皮膚疾患である。アトピー性皮膚炎患者の病変皮膚は、炎症性T細胞浸潤によって組織学的に特徴づけられるが、これは、急性期に、IL-4、IL-5およびIL-13発現が優勢であることと関連している(Simonら、J Allergy Clin Immunol 2004;114:887; Hamidら、J Allergy Clin Immunol 1996; 98: 225)。さらに、Tazawaらは、IL-13 mRNA(しかしIL-4ではない)がアトピー性皮膚炎患者の亜急性および慢性皮膚病変において有意にアップレギュレーとされていることを明らかにした(Tazawaら、Arch Derm Res 2004;296:459)。IL-13を発現する循環血中のCD4+およびCD8+ T細胞の頻度も、こうした患者において有意に増加している(Alekszaら、British J Dermatol 2002;147;1135)。この増加したIL-13活性は、結果として血清IgEレベルの上昇をもたらし、その結果アトピー性皮膚炎の発病の一因となると考えられている。さらに、新生児CD4+ T細胞によるIL-13産生の増加は、アレルギー性疾患、特にアトピー性皮膚炎をのちに発現する危険性の高い新生児を識別するための有用なマーカーである(Ohshimaら、Pediatr Res 2002; 51:195)。アトピー性皮膚炎の病因におけるIL-13の重要性についてのもう一つの証拠は、Simonらにより提供された(Simonら、J Allergy Clin Immunol 2004; 114:887);タクロリムス軟膏(サイトカイン産生の細胞内シグナル伝達経路を阻害する免疫抑制薬)を用いた局所的治療の結果、IL-13を含めたTh2サイトカインの局所発現の有意な減少に伴って、アトピー性皮膚病変の有意な臨床的および組織学的改善がもたらされた。その上、IL-13 Rα2(IL-4Rαと共に、IL-13に対する機能的受容体を形成する、細胞表面タンパク質)は、アトピー性皮膚炎患者の皮膚の基底層直上のケラチノサイト上で過剰発現されることが示されており、IL-13は、IL-13 Rα2のmRNAを、in vitroでアップレギュレートすることができた(Wongpiyabovornら、J Dermatol Science 2003;33:31)。
以上のデータは、総合すると、IL-13モノクローナル抗体などの、IL-13を標的とするインターベンションが、ヒトアレルギー性疾患の治療に有効な方法を提供しうることを示す。
食道好酸球増加
食道における好酸球の蓄積は、胃食道逆流症、好酸球性食道炎、好酸球性胃腸炎、および寄生虫感染症などの多様な疾患の患者によく見られる医学的な問題である。食道の好酸球増加はアレルギー反応と関係があり、マウスに空気アレルゲンを繰り返し投与することによって、アレルギー性の気道炎症と食道好酸球増加との関連が確認された。Th2細胞は、直接的にも間接的にも、炎症経路およびエフェクター経路を活性化する、IL-4およびIL-13を含めた一連のサイトカインを分泌することによって、好酸球関連炎症を引き起こすと考えられる。IL-13は、Th2細胞によって大量に産生され、アレルギー性疾患の複数の特徴(たとえばIgE産生、粘液過剰産生、好酸球の動員および生存、ならびに気道過敏症)を制御するので、特に重要であると考えられる。好酸球は、好酸球性炎症反応において、in vitro、ex vivo、およびin vivo条件下で、GM-CSFおよび/またはIL-5に曝露した後に、機能的に活性のあるIL-13を産生することができる。(Schmid-Grendelmeier J Immunology, 2002, 169: 1021-1027)。野生型、STAT-6欠損、エオタキシン-1欠損、もしくはIL-5欠損マウスの肺に、気管内投与でIL-13を投与することによって、IL-13によって引き起こされる肺の炎症が食道好酸球増加症の発現に関係していることが確認された(Mishraら. Gastroenterol 2003;125:1419)。まとめると、これらのデータは、食道好酸球増加におけるIL-13の役割の証拠を提供する。
食道における好酸球の蓄積は、胃食道逆流症、好酸球性食道炎、好酸球性胃腸炎、および寄生虫感染症などの多様な疾患の患者によく見られる医学的な問題である。食道の好酸球増加はアレルギー反応と関係があり、マウスに空気アレルゲンを繰り返し投与することによって、アレルギー性の気道炎症と食道好酸球増加との関連が確認された。Th2細胞は、直接的にも間接的にも、炎症経路およびエフェクター経路を活性化する、IL-4およびIL-13を含めた一連のサイトカインを分泌することによって、好酸球関連炎症を引き起こすと考えられる。IL-13は、Th2細胞によって大量に産生され、アレルギー性疾患の複数の特徴(たとえばIgE産生、粘液過剰産生、好酸球の動員および生存、ならびに気道過敏症)を制御するので、特に重要であると考えられる。好酸球は、好酸球性炎症反応において、in vitro、ex vivo、およびin vivo条件下で、GM-CSFおよび/またはIL-5に曝露した後に、機能的に活性のあるIL-13を産生することができる。(Schmid-Grendelmeier J Immunology, 2002, 169: 1021-1027)。野生型、STAT-6欠損、エオタキシン-1欠損、もしくはIL-5欠損マウスの肺に、気管内投与でIL-13を投与することによって、IL-13によって引き起こされる肺の炎症が食道好酸球増加症の発現に関係していることが確認された(Mishraら. Gastroenterol 2003;125:1419)。まとめると、これらのデータは、食道好酸球増加におけるIL-13の役割の証拠を提供する。
腫瘍適応症
もう一つの重要な関心領域は、特定の種類の腫瘍増殖を阻害するために、L-13またはIL-13受容体を標的とすることにある。1型T細胞性宿主防御は、in vivoで最適な腫瘍拒絶を仲介すると考えられており、Th2型反応への偏りは、腫瘍拒絶の阻止および/または腫瘍再発の促進の一因となる可能性がある(Kobayashi Mら、J. Immunol. 1998; 160:5869)。移植可能な腫瘍細胞株を用いたいくつかの動物実験は、Stat6、IL-4、およびIL-13(一部はNKT細胞によって産生される)が、腫瘍拒絶を阻害する能力を有することを実証することによって、上記の考えを支持している(Terabeら、Nat. Immunol. 2000;1:515; Kachaら、J. Immunol. 2000;165:6024-28; Ostrand-Rosenbergら、J. Immunol. 2000;165:6015)。Stat-6非存在下での強力な抗腫瘍活性は、腫瘍特異的なIFNg産生およびCTL活性の増強に起因すると考えられた。さらに、NKT細胞の減少が、同時に起こる腫瘍再発の増加によって、IL-13産生を低下させることが明らかとなっているが、これは、NKT細胞によって一部が産生されるIL-13が、免疫監視に重要であることを示す(Terabeら、Nat. Immunol. 2000; 1:515)。このように、上記の発見は、IL-13阻害薬、またはIL-13 mAbを含めた新規IL-13拮抗薬が、腫瘍細胞に対する免疫応答のダウンレギュレーションにおいて、IL-13が果たす負の調節を妨げることによって、癌の免疫治療薬として有効となり得ることを示唆する。
もう一つの重要な関心領域は、特定の種類の腫瘍増殖を阻害するために、L-13またはIL-13受容体を標的とすることにある。1型T細胞性宿主防御は、in vivoで最適な腫瘍拒絶を仲介すると考えられており、Th2型反応への偏りは、腫瘍拒絶の阻止および/または腫瘍再発の促進の一因となる可能性がある(Kobayashi Mら、J. Immunol. 1998; 160:5869)。移植可能な腫瘍細胞株を用いたいくつかの動物実験は、Stat6、IL-4、およびIL-13(一部はNKT細胞によって産生される)が、腫瘍拒絶を阻害する能力を有することを実証することによって、上記の考えを支持している(Terabeら、Nat. Immunol. 2000;1:515; Kachaら、J. Immunol. 2000;165:6024-28; Ostrand-Rosenbergら、J. Immunol. 2000;165:6015)。Stat-6非存在下での強力な抗腫瘍活性は、腫瘍特異的なIFNg産生およびCTL活性の増強に起因すると考えられた。さらに、NKT細胞の減少が、同時に起こる腫瘍再発の増加によって、IL-13産生を低下させることが明らかとなっているが、これは、NKT細胞によって一部が産生されるIL-13が、免疫監視に重要であることを示す(Terabeら、Nat. Immunol. 2000; 1:515)。このように、上記の発見は、IL-13阻害薬、またはIL-13 mAbを含めた新規IL-13拮抗薬が、腫瘍細胞に対する免疫応答のダウンレギュレーションにおいて、IL-13が果たす負の調節を妨げることによって、癌の免疫治療薬として有効となり得ることを示唆する。
Th1型関連抗腫瘍防御を強めることに加えて、IL-13阻害剤はまた、より直接的に、腫瘍細胞の増殖を阻止することができる。たとえば、B細胞慢性リンパ球性白血病(B-CLL)およびホジキン病において、IL-13はアポトーシスを阻止するか、または腫瘍細胞の増殖を促進する(Chaouchiら、Blood 1996; 87:1022; Kappら、J. Exp Med. 1999; 189:1939)。B-CLLは、白血病細胞でのアポトーシスの欠陥を伴う、Bリンパ球由来の臨床的に多様な疾患である。IL-13は、直接的な増殖因子として作用しないと考えられるが、腫瘍細胞をin vitroで自発的アポトーシスから保護し(Chaouchiら、Blood 1996; 87:1022; Laiら、J. Immunol.1999; 162:78)、腫瘍細胞死の防止によってB-CLLに寄与することができる。
ホジキン病は、主として若年成人を襲い、米国において年間約7,500件を数える、リンパ腫の一種である。この癌は、大きな多核のホジキン/リード-シュテルンベルク細胞(H/RS)の存在によって特徴づけられる。大多数の症例では、悪性細胞集団はB細胞から生じる。いくつかのホジキン病由来細胞株、ならびにホジキンリンパ腫患者から採取したリンパ節組織は、IL-13および/またはIL-13受容体を過剰発現する。(Kappら、J. Exp Med. 1999;189:1939, Billardら、Eur Cytokine Netw 1997;8:19; Skinniderら、Blood 2001; 97:250; Oshimaら、Cell Immunol 2001 ;211:37)。中和抗IL-13 mAbもしくはIL-13拮抗薬は、用量依存性の様式でH/RS細胞の増殖を阻害することが示されている(Kappら、J. Exp Med. 1999; 189:1939; Oshimaら、Cell Immunol 2001; 211:37)。同様に、移植されたホジキン病由来細胞株を有するNOD/SCIDマウスに、可溶性IL-13Rα2デコイ受容体を投与することによって、腫瘍の発現および増殖が遅くなり、生存期間が増加したが、このことは、IL-13の中和が、in vitroおよびin vivoでのホジキンリンパ腫の増殖を抑制することができることを示す(Trieuら、Cancer Research 2004;64:3271)。まとめると、これらの研究は、IL-13が、自己分泌の様式で、H/RS細胞の増殖を刺激することを示している(Kappら、J. Exp Med. 1999; 189:1939; Ohshimaら、Histopathology 2001; 38:368)。
したがって、IL-13の中和は、腫瘍細胞の増殖を阻害するのと同時に抗腫瘍性の防御を強めることによって、ホジキン病および他のB細胞関連癌の、魅力的で有効な治療法となる可能性がある。
炎症性腸疾患
炎症性腸疾患(IBD)の病因にIL-13の果たしうる役割がある。炎症性腸疾患は、潰瘍性大腸炎、クローン病および分類不能な大腸炎として臨床的に分類される、いくつかの疾患を包含する。その主要な症状は、腸管粘膜のTh1およびTh2リンパ球の活性化の不均衡による過剰免疫反応に起因する、慢性腸炎である。これは、クローン病(Bamiasら、Gastroenterol 2005; 128:657)および潰瘍性大腸炎(Hellerら、Immunity 2002; 17:629)の動物モデルで実証された。IL-13 Rα2-Fcの投与によるIL-13の中和は、ヒト潰瘍性大腸炎のマウスTh2モデルにおいて、大腸炎を予防した(Hellerら、Immunity 2002; 17:629)。さらに、このモデルにおいてIL-13の産生は、急速にIL-4の産生に取って代わり、IL-13の産生は、NKT細胞の刺激によって誘導される可能性があるが、こうしたことは、組織の損傷が、上皮細胞に対するIL-13の毒性作用の結果として生じる可能性があることを示唆している。これらの発見を支持するヒトでのデータがいくつか存在する:潰瘍性大腸炎患者からのIL-13陽性直腸生検標本の出現頻度は、炎症性および非炎症性の対照被験者よりも有意に高く、急性潰瘍性大腸炎では、非急性潰瘍性大腸炎よりも高率のIL-4およびIL-13の発現が観察された(Inoueら、Am J Gastroenterol 1999;94:2441)。それに加えて、Akidoらは、クローン病患者の腸部分から得られた外筋層における免疫活性の特徴を明らかにし、IL-4およびIL-13が、STAT-6経路を介して腸平滑筋細胞の過剰収縮性をもたらすことを見出した。著者らは、この経路がクローン病において腸の筋肉の過剰収縮性の一因となる可能性があると結論づけた(Akihoら、Am J Physiol Gastrointest Liver Physiol 2005; 288:619)。
炎症性腸疾患(IBD)の病因にIL-13の果たしうる役割がある。炎症性腸疾患は、潰瘍性大腸炎、クローン病および分類不能な大腸炎として臨床的に分類される、いくつかの疾患を包含する。その主要な症状は、腸管粘膜のTh1およびTh2リンパ球の活性化の不均衡による過剰免疫反応に起因する、慢性腸炎である。これは、クローン病(Bamiasら、Gastroenterol 2005; 128:657)および潰瘍性大腸炎(Hellerら、Immunity 2002; 17:629)の動物モデルで実証された。IL-13 Rα2-Fcの投与によるIL-13の中和は、ヒト潰瘍性大腸炎のマウスTh2モデルにおいて、大腸炎を予防した(Hellerら、Immunity 2002; 17:629)。さらに、このモデルにおいてIL-13の産生は、急速にIL-4の産生に取って代わり、IL-13の産生は、NKT細胞の刺激によって誘導される可能性があるが、こうしたことは、組織の損傷が、上皮細胞に対するIL-13の毒性作用の結果として生じる可能性があることを示唆している。これらの発見を支持するヒトでのデータがいくつか存在する:潰瘍性大腸炎患者からのIL-13陽性直腸生検標本の出現頻度は、炎症性および非炎症性の対照被験者よりも有意に高く、急性潰瘍性大腸炎では、非急性潰瘍性大腸炎よりも高率のIL-4およびIL-13の発現が観察された(Inoueら、Am J Gastroenterol 1999;94:2441)。それに加えて、Akidoらは、クローン病患者の腸部分から得られた外筋層における免疫活性の特徴を明らかにし、IL-4およびIL-13が、STAT-6経路を介して腸平滑筋細胞の過剰収縮性をもたらすことを見出した。著者らは、この経路がクローン病において腸の筋肉の過剰収縮性の一因となる可能性があると結論づけた(Akihoら、Am J Physiol Gastrointest Liver Physiol 2005; 288:619)。
したがって、IL-13 mAbは、場合によっては他のサイトカインを標的とする分子と組み合わせて、IBDの進行を止める、または遅らせる方法を提供することができる。
乾癬および乾癬性関節炎
乾癬は、ケラチノサイトの過剰増殖、および免疫性細胞浸潤物を特徴とする慢性皮膚疾患であり、この浸潤物は、表皮ケラチノサイトの表現型に影響を及ぼす可能性のあるさまざまなサイトカインを産生する、活性化T細胞を含有する。CDw60は、乾癬皮膚の基底層および基底層真上の乾癬性ケラチノサイトの表面でアップレギュレートされる、糖鎖を有する分子である。乾癬病変に由来するT細胞から分泌されるIL-4およびIL-13は、ケラチノサイト表面でのCDw60の発現を、強力にアップレギュレートすることが明らかになったが(Skovら、Am J Pathol 1997;15:675)、インターフェロン-γは、培養ケラチノサイト表面でのIL-4/IL-13の関与によるCDw60の誘導を阻害した(Huangら、J Invest Dermatol 2001;116:305)。したがって、乾癬表皮ケラチノサイト上でのCDw60の発現は、少なくともある程度は、病変内部の活性化T細胞により分泌されたIL-13によって、誘導されると考えられる。さらに、IL-13 Rα1およびIL-4Rαは、いっしょになってIL-13受容体複合体を形成する細胞表面タンパク質であるが、乾癬患者および乾癬でない患者由来の皮膚生検では発現が異なっており(Cancino-Diazら、J Invest Dermatol 2002;119:1114; Wongpiyabovornら、J Dermatol Science 2003;33:31)、in vitro実験では、IL-13がIL-13 Rα1の発現をアップレギュレートすることができる(がIL-4はできない)ことが実証された(Wongpiyabovornら、J Dermatol Science 2003;33:31)。IL-13はさまざまな細胞型に影響を与えるので、上記の研究は、IL-13受容体が乾癬の初期炎症プロセスに関与する可能性があることを示唆する。
乾癬は、ケラチノサイトの過剰増殖、および免疫性細胞浸潤物を特徴とする慢性皮膚疾患であり、この浸潤物は、表皮ケラチノサイトの表現型に影響を及ぼす可能性のあるさまざまなサイトカインを産生する、活性化T細胞を含有する。CDw60は、乾癬皮膚の基底層および基底層真上の乾癬性ケラチノサイトの表面でアップレギュレートされる、糖鎖を有する分子である。乾癬病変に由来するT細胞から分泌されるIL-4およびIL-13は、ケラチノサイト表面でのCDw60の発現を、強力にアップレギュレートすることが明らかになったが(Skovら、Am J Pathol 1997;15:675)、インターフェロン-γは、培養ケラチノサイト表面でのIL-4/IL-13の関与によるCDw60の誘導を阻害した(Huangら、J Invest Dermatol 2001;116:305)。したがって、乾癬表皮ケラチノサイト上でのCDw60の発現は、少なくともある程度は、病変内部の活性化T細胞により分泌されたIL-13によって、誘導されると考えられる。さらに、IL-13 Rα1およびIL-4Rαは、いっしょになってIL-13受容体複合体を形成する細胞表面タンパク質であるが、乾癬患者および乾癬でない患者由来の皮膚生検では発現が異なっており(Cancino-Diazら、J Invest Dermatol 2002;119:1114; Wongpiyabovornら、J Dermatol Science 2003;33:31)、in vitro実験では、IL-13がIL-13 Rα1の発現をアップレギュレートすることができる(がIL-4はできない)ことが実証された(Wongpiyabovornら、J Dermatol Science 2003;33:31)。IL-13はさまざまな細胞型に影響を与えるので、上記の研究は、IL-13受容体が乾癬の初期炎症プロセスに関与する可能性があることを示唆する。
乾癬性関節炎は、炎症性および抗炎症性サイトカインの両方が関与する滑膜炎を特徴とする。さまざまな種類の関節炎におけるIL-13の役割は、ますます多くの関心を受けつつある。Spadaroらは、乾癬性関節炎および関節リウマチ患者の滑液中のIL-13レベルが、変形性関節症患者よりも有意に高いことを観察した。さらに、乾癬性関節炎患者において、滑液のIL-13レベルは、血清中のレベルよりも有意に高く、IL-13の滑液/血清比は、関節リウマチ群よりも乾癬性関節炎群で顕著に高かったが、これは、乾癬性関節炎患者の滑膜組織において局所的に産生されたIL-13の果たしうる役割を示唆している(Spadaroら、Ann Rheum Dis 2002; 61:174)。
他の疾患におけるIL-13の潜在的な役割
急性移植片対宿主病は、幹細胞移植後の病的状態および死亡の深刻な原因であり、ドナーとレシピエントとの間のヒト白血球抗原(HLA)不適合の度合いに直接関係している。Jordanらは、最初に、IL-13を、非血縁、不適合のMLR(混合リンパ球反応;最初のHLAタイピング後にドナー選択を細かく調整するin vitroアッセイ)の際に、多量に産生される典型的なTh2サイトカインとして同定した(Jordanら、J Immunol Methods; 2002;260:1)。同グループはのちに、ドナーT細胞によるIL-13産生が、非血縁ドナー幹細胞移植後の急性移植片対宿主病(aGVHD)を予測することを示した(Jordanら、Blood 2004; 103:717)。幹細胞移植後の、重篤なIII度のaGVHD患者はいずれも、そのドナーが非常に高い移植前IL-13反応を生じたドナーであったが、このことは、IL-13レベルとaGVHDとの有意な関連を実証し、IL-13が、aGVHDに伴う一部の病変の、直接的な原因となる可能性を提起する。したがって、IL-13の特異的阻害に基づく治療は、幹細胞移植後のaGVHDの治療に有用であると考えられる。
急性移植片対宿主病は、幹細胞移植後の病的状態および死亡の深刻な原因であり、ドナーとレシピエントとの間のヒト白血球抗原(HLA)不適合の度合いに直接関係している。Jordanらは、最初に、IL-13を、非血縁、不適合のMLR(混合リンパ球反応;最初のHLAタイピング後にドナー選択を細かく調整するin vitroアッセイ)の際に、多量に産生される典型的なTh2サイトカインとして同定した(Jordanら、J Immunol Methods; 2002;260:1)。同グループはのちに、ドナーT細胞によるIL-13産生が、非血縁ドナー幹細胞移植後の急性移植片対宿主病(aGVHD)を予測することを示した(Jordanら、Blood 2004; 103:717)。幹細胞移植後の、重篤なIII度のaGVHD患者はいずれも、そのドナーが非常に高い移植前IL-13反応を生じたドナーであったが、このことは、IL-13レベルとaGVHDとの有意な関連を実証し、IL-13が、aGVHDに伴う一部の病変の、直接的な原因となる可能性を提起する。したがって、IL-13の特異的阻害に基づく治療は、幹細胞移植後のaGVHDの治療に有用であると考えられる。
糖尿病性腎症は、西欧諸国において末期腎不全の主な原因の1つである。1型糖尿病による腎症の発生率は減少しつつあるが、2型糖尿病は、現在、米国、日本および欧州において、腎不全の最も多い単一原因である。さらに、この患者群は、心血管系イベントに起因する非常に高い死亡率のため、維持透析の予後が非常に悪い。現在、血行動態変化、代謝変化および構造変化は絡み合っていることが次第に明らかとなり、さまざまな酵素、転写因子および成長因子がこの疾患の病因に関与することが確認されている。特に、TGF-βは、腎肥大の発現、および細胞外基質成分の蓄積に重要であり、腎臓におけるコラーゲン生成を仲介する上で、きわめて重要なサイトカインとみなされている(Cooper. Diabetologia 2001; 44:1957; Wolf. Eur J Clin Invest 2004; 34 (12): 785)。実験的糖尿病性腎症およびヒト糖尿病性腎症において、TGF-1の生物活性は増加し、糖尿病マウスへのTGF-β1抗体の投与は、腎機能の改善をもたらし、細胞外基質の蓄積を減少させた。最近、IL-13は、肺線維症のトランスジェニックマウスモデルにおいて、TGF-β1の産生および活性化、ならびにコラーゲン沈着を制御することにより、少なくともある程度、その作用に関与することが示されており(Leeら、J. Exp. Med. 2001; 194:809; Zhuら、J. Clin. Invest. 1999; 103:779)、それによって、IL-13とTGF-βとの直接的な機能的関連が確立された。したがって、糖尿病の腎臓においてTGF-β1活性の制御にIL-13が果たす同様な役割が想定され、IL-13を標的とするインターベンションが糖尿病性腎症の管理に役立つ可能性がある。
線維性疾患
肺線維症は、肺が不適切かつ有害に瘢痕化した疾患であり、身体障害、そして多くの場合、死をもたらす。この用語には、明確に区別できる病因、病状、ならびに治療への反応を示す、さまざまな別個の疾患が含まれる。一部の例では、線維症の原因は特定されている。原因としては:(1)アスベストもしくはケイ素、または超硬合金の粉塵といった、線維化を促進する物質の吸入(2)患者が有機物質に対して、線維症につながる特異な反応を示す、前記有機物質の吸入(たとえば農夫肺)(3)薬物、たとえば、ニトロフラントイン、アミオダロンおよびメトトレキサート(4)全身性硬化症または関節リウマチといった全身性炎症性疾患との関連、が挙げられる。
肺線維症は、肺が不適切かつ有害に瘢痕化した疾患であり、身体障害、そして多くの場合、死をもたらす。この用語には、明確に区別できる病因、病状、ならびに治療への反応を示す、さまざまな別個の疾患が含まれる。一部の例では、線維症の原因は特定されている。原因としては:(1)アスベストもしくはケイ素、または超硬合金の粉塵といった、線維化を促進する物質の吸入(2)患者が有機物質に対して、線維症につながる特異な反応を示す、前記有機物質の吸入(たとえば農夫肺)(3)薬物、たとえば、ニトロフラントイン、アミオダロンおよびメトトレキサート(4)全身性硬化症または関節リウマチといった全身性炎症性疾患との関連、が挙げられる。
しかしながら、多くの場合、原因または基礎症状は特定されていない。多くのこうした患者は、特発性肺線維症(IPF)と診断される。これは比較的稀な疾患である(有病率20/100000)。診断は、特定のX線および病理学的特徴、特にCTもしくは肺生検で蜂窩肺と結び付けられる、確定原因が存在しないことに基づく。この疾患は通常、高齢の患者(>50)に見られるが、多くの場合、死に至る進行性肺機能障害の過酷な経過をたどり、生存期間の中央値は2〜5年と見積もられる。さらに、患者は、数ヶ月から数年にわたって進行する息切れというもっとも不快な経験をする。これは、最初は身体活動を制限するが、末期には(数ヶ月も続く可能性があるが)患者は安静時にも息切れし、さらには酸素に頼ることになる。
現在、この疾患の満足できる治療は存在しない。現行の治療は、一般に、副腎皮質ステロイド、およびアザチオプリンなどの免疫抑制薬という形をとっている。しかしながら、副腎皮質ステロイドは患者の多くで奏効しないことがあり、その副作用が状況を悪化させる可能性がある。最近の大規模試験で生存改善の傾向が示されたインターフェロンγ、およびパーフェニドン(pirfenidone)を含めて、研究開発中の多数の有望な治療法がある。
IL-13、ならびにTh2の表現型に関わるサイトカインが、組織修復において線維症の過程に関与するという証拠が存在する(Wynn TA, Nat. Rev. Immunol. 2004 4:583-594; Jakubzickら、Am. J. Pathol. 2004 164(6):1989-2001; Jakubzickら、Immunol. Res. 2004 30(3):339-349; Jakubzickら、J. Clin. Pathol. 2004 57:477-486)。IL-13およびIL-4は、さまざまな線維性疾患に関与する。住血吸虫によって引き起こされる肝線維症はIL-13依存性であると考えられ、IL-13が強皮症の病因に関与するという限られた証拠がある(Hasegawaら、J. Rheumatol. 1997 24:328-332; Riccieriら、Clin. Rheumatol. 2003 22:102-106)。
肺線維症に関して、in vitro研究により、IL-13が線維形成性の表現型を促進することが示された。動物実験から、人為的に誘導された線維症モデルにおいてIL-13発現レベルが上昇すること、ならびにIL-13を除去することによって線維症を軽減できることが明らかになっている。
IL-13は、線維化表現型を促進する。細胞レベルでは、IL-13が線維症を促進するいくつかの機序が存在する。シグナル経路、および前記のさまざまな機序の重要性は明確ではない。
IL-13が線維芽細胞に作用して、コラーゲンの産生を促進するのと同時にその分解を阻害し、それによって線維化表現型に有利に働くという証拠が存在する。皮膚線維芽細胞は、IL-13受容体(すなわちII型IL-4受容体)を有しており、培養皮膚線維芽細胞をIL-13に曝露することによって、コラーゲン産生のアップレギュレーションがもたらされる(Orienteら、J. Pharmacol. Exp. Ther. 2000 292:988-994)。IL-4も、同様ではあるがより一過性の効果を有する。ヒト肺線維芽細胞株(ICIG7)はII型IL-4受容体を発現する(Jinninら、J. Biol. Chem 2004 279:41783-41791)。この細胞をIL-13に曝露することによって、さまざまな炎症性および線維化促進メディエータ、GM-CSF、G-CSF、VCAMβ1インテグリンの分泌が促進される(Doucetら、Int. Immunol. 1998 10(10):1421-1433)。
IL-13は、IL-1αによって誘導されるマトリックスメタロプロテアーゼ1および3タンパク質の、皮膚線維芽細胞による産生を阻害するが、これは細胞外マトリックスの分解を低下させる傾向がある(Orienteら、J. Pharmacol. Exp. Ther. 2000 292:988-994)。IL-13は、TGF-βと相乗的に、喘息気道の生検で得られたヒト線維芽細胞に作用して、メタロプロテアーゼ1の組織インヒビター(TIMP-1)の発現を促進する。細胞外マトリックスの分解は、マトリックスメタロプロテアーゼによってもたらされ、マトリックスメタロプロテアーゼはTIMP-1によって阻害される。したがって、このIL-13の作用は、マトリックスの分解を低下させる傾向にある(Zhouら、Am. J. Physiol. Cell Physiol. 2005 288:C435-C442)。
トランスジェニックマウスにおけるIL-13の過剰発現は、上皮下の線維化、上皮細胞肥大、杯細胞過形成、結晶沈着(哺乳類酸性キチナーゼ)、気道過敏性、間質の線維化、2型細胞肥大および界面活性物質の蓄積をもたらす(Zhuら、J. Clin. Invest. 1999 103(6):779-788)。
異なる系統のマウスは、ブレオマイシン誘発性肺線維症に対して異なる感受性を有する。感受性のあるC57B1/6Jマウスは、ブレオマイシンに反応してIL-13、IL-13RαおよびIL-4(ならびにTGFβ、TNFRαおよびIL-1R)の迅速なアップレギュレーションを示す。感受性のないBALB/cマウスはIL-13のアップレギュレーションを示さない。
Belperioら(Am. J. Respir. Cell Mol. Biol. 2002 27:419-427)は、マウスのブレオマイシン線維症モデルにおいて、IL-13、IL-4およびCCケモカインC10の発現、ならびに役割を研究した。肺組織のIL-13およびIL-4レベルはいずれも、ブレオマイシンに反応して増加した。ポリクローナル抗IL-13抗体を用いてIL-13を事前に中和すると、肺のヒドロキシプロリンレベルによって評価されるように、ブレオマイシンに反応した肺線維症が有意に軽減された。同モデルにおいてIL-4の発現が増加したにもかかわらず、IL-4の中和は肺線維症に影響を与えなかった。
BALB/cマウスにおいてFITCによって誘発された急性肺線維症の別のモデルでは、(ノックアウト状態で)IL-13が存在しないと、肺線維症から保護されたが、IL-4はそうではなかった。IL-13ノックアウトにおいて、IL-4のノックアウトが保護を追加することはなかった(Kolodsickら、J. Immunol. 2004 172:4068-4076)。IL-13非存在の保護効果は、肺への細胞動員の差異によるものではない:すべてのノックアウトおよびBALB/cにおいて、動員された全細胞数は同様であり、したがって最初の炎症性成分は影響を受けていないと考えられる。好酸球の動員は、BALB/cと比較して、IL-4およびIL-13ノックアウトにおいて低いが、IL-4 -/-が線維症から保護されなかったので、これで線維症の差異を説明することはできない。おそらく驚くべきことに、IL10、MCP-1、γインターフェロン、TGF-iを含めて、IL-13+/+と−/−との間に、サイトカインレベルの差異はなかった。それに加えて、同数の線維芽細胞がFITC後のさまざまな動物の肺から分離されたが、IL-13−/−マウスでは、コラーゲンIの産生が減少している。このことは、IL-13の欠損が単に炎症反応を予防しているのではなくて、むしろより具体的な線維化抑制の役割を有していることを示す。IL-13が、TGF-iを介してその線維化作用を発揮する可能性があることが示唆された(Leeら、J. Exp. Med. 2001 194:809-821)。しかしながら、このFITCモデルにおいて、TGF-iの発現は、IL-13ノックアウトマウスで減少しなかった。
インターロイキン4は、IL-13も同じ受容体を介して作用するので、IL-13と同様の効果を示すことが予想される。IL-4は、ブレオマイシン誘発性肺線維症に罹患しているマウスの肺において有意にアップレギュレートされる(Gharaee-Kermaniら、Cytokine 2001 15:138-147)。しかながら、Izbickiら(Am. J. Physiol. Lung Cell Mol. Physiol 2002 283(5):L1110-L1116)は、IL-4を過剰発現するC57BL6/Jマウス、IL-4ノックアウト、および野生型において、ブレオマイシン誘発性肺線維症を比較したが、IL-4が肺線維症に関与しているという証拠は見つからなかった。線維症は、IL-4ノックアウトで軽減されず、IL-4を過剰発現するマウスでは線維化のレベルが増加していた。
IL-13のBALサイトカインレベルは、さまざまなタイプの肺線維症に罹患している患者において、相当なばらつきはあるが有意に上昇している。IL-13の発現は、肺線維症患者から得た肺胞マクロファージにおいて有意にアップレギュレートされている。
最も強力な臨床上の証拠は、ミシガン大学(University of Michigan)での研究によってもたらされる。Jakubzickおよびその同僚は、肺線維症患者の肺の外科生検で、IL-13およびIL-4、ならびにその受容体の遺伝子発現について研究を行った。IL-13の遺伝子発現は、IPFに罹患した肺の標本の方が、健常者または他の肺線維性疾患由来の肺よりも著しく高かった。IPF/UIP患者から培養した線維芽細胞は、正常な肺または他のタイプの肺線維症の患者の生検から得られた組織および線維芽細胞と比較して、IL-13およびIL-4受容体の発現の増加を示す。具体的には、疾患活動性の中心点であると推定される線維芽細胞の病巣が、これらの受容体について特に強力に染色される(Jakubzickら、J. Immunol 2003 171:2684-2693; Jakubzickら、Am. J. Pathol. 2003 162:1475-1486; Jakubzickら、Am. J. Pathol. 2004 164(6):1989-2001; Jakubzickら、Immunol. Res. 2004 30(3):339-349; Jakubzickら、J. Clin. Pathol. 2004 57:477-486)。
一般的にTh2サイトカイン、具体的にはIL-13が、線維化を進める表現型を促進するという十分なin vitroの証拠が存在する。少なくとも2つの動物モデルにおいて、化学的に引き起こされる線維化は、(遺伝子ノックアウトで、または抗IL-13抗体により)IL-13を除去することによって、軽減できることが明らかになった。一部の証拠から、肺線維症の促進においては、IL-13がIL-4よりも重要であることが示されている。肺線維症におけるIL-13の役割に関する臨床的な証拠は、IL-13およびその受容体がIPF患者の肺では制御されていないことを示唆する。
増加しつつある多数のデータは、住血吸虫症による肝線維症、およびさまざまなタイプの肺線維症(たとえば、IPF[他の箇所で記述]、強皮症)を含めて、さまざまな線維性疾患の治療のために、IL-13に基づく治療法が果たす重要な役割を示唆する。
IL-4およびIL-13を単独で阻害する実験から、いくつかのモデルにおいてIL-13が線維症の支配的なエフェクターサイトカインであると確認された(Chiaramonteら、J. Clin. Invest. 1999;104: 777-785; Bleaseら、J. Immunol. 2001; 166:5219; Kumarら、Clin. Exp. Allergy 2002; 32:1104)。住血吸虫症において、虫卵の引き起こす炎症反応はIL-13の遮断によって影響を受けなかったが、慢性感染動物でのコラーゲン沈着は、IL-4が継続して減少せずに産生されているにもかかわらず85%を超えて減少した(Chiaramonteら、J. Clin. Invest. 1999; 104: 777; Chiaramonteら、Hepatology 2001; 34:273)。
hIL-13のアミノ酸配列を配列番号9として記載する。(これは成熟タンパク質配列である、すなわち、シグナル配列は存在しない)。
hIL-13をコードするポリヌクレオチドを配列番号10に記載する。(これは成熟タンパク質配列のDNA配列である、すなわち、シグナル配列は存在しない)。
本明細書内に記載の特許および参考文献(本出願が優先権を主張するあらゆる特許出願を含む)はすべて、明示的に、しかも完全に、参考として本明細書に含めるものとする。
最近、IL-13に対して免疫応答を生じさせる喘息治療用ワクチンが報告された(国際公開公報WO02/070711号)。環境アレルゲンに対する皮膚の感作にIL-13が果たす役割も、最近報告された(Herrickら、The Journal of Immunology, 2003, 170:2488-2495)。
本発明は、hIL-13と結合して、hIL-13の、hIL-13Rの2つの鎖との結合を阻害する、すなわちhIL-13Rα1鎖およびhIL-13Rα2鎖のいずれとの結合も阻害する、抗体を提供する。
発明の概要
したがって、本発明は、hIL-13と特異的に結合して、hIL-13の活性を中和する抗体、またはその抗原結合フラグメントを提供する。本発明は、hIL-13と特異的に結合し、CDRH3を含んでなる抗体、またはその抗原結合フラグメントを提供するが、このCDRH3は、配列番号3に記載の配列の変異体であるか、または前記変異体のCDRH3内の1個もしくは2個のアミノ酸残基が配列番号3の対応する位置にあるアミノ酸とは異なる変異体である。本発明のある実施形態において、このようなアミノ酸残基の差異は保存的置換である。
したがって、本発明は、hIL-13と特異的に結合して、hIL-13の活性を中和する抗体、またはその抗原結合フラグメントを提供する。本発明は、hIL-13と特異的に結合し、CDRH3を含んでなる抗体、またはその抗原結合フラグメントを提供するが、このCDRH3は、配列番号3に記載の配列の変異体であるか、または前記変異体のCDRH3内の1個もしくは2個のアミノ酸残基が配列番号3の対応する位置にあるアミノ酸とは異なる変異体である。本発明のある実施形態において、このようなアミノ酸残基の差異は保存的置換である。
本発明の抗体、およびその抗原結合フラグメントに関連して、本明細書を通じて使用される「特異的に結合する」という表現は、抗体がhIL-13とは結合するが、他のヒトタンパク質、特にヒトIL-4とは、結合しない、または有意な結合はしないことを意味する。しかしながら、この表現は、本発明の抗体がカニクイザルIL-13とも交差反応する可能性があることを排除するものではない。
本発明の抗体、およびその抗原結合フラグメントに関連して、本明細書を通じて使用される「中和する」という表現は、本発明の抗体および抗原結合フラグメントの存在下で、IL-13の生物活性が、そうした抗体およびその抗原結合フラグメントの非存在下でのIL-13活性と比べて低下することを意味する。中和の程度は、いくつかの方法で、たとえば、以下の実施例に記載のアッセイを用いて、たとえば、例として実施例3.3〜3.5に記載のように実施することができるTF-1細胞増殖アッセイで、測定することができる。このアッセイにおいてIL-13の中和は、中和抗体の存在下でのTF-1細胞増殖の減少を算定することによって測定される。
抗体もしくはその抗原結合フラグメントが中和する能力を有する場合、このことは、hIL-13とその受容体の間の相互作用の阻害を示す。ヒトIL-13に対する中和活性を有するとみなされる抗体は、実施例3.3、3.4もしくは3.5に記載のTF-1細胞増殖アッセイにおいて100μg/ml未満、もしくは80μg/ml未満のND50を有すると思われる。
本発明のもう1つの態様において、本明細書で例証される抗体、たとえば、実施例3.3、3.4もしくは3.5に記載の、TF-1細胞増殖アッセイにおいてH2L1の中和活性を保持する抗体と同等の中和活性を有する、抗体もしくはその抗原結合フラグメントが与えられる。
本明細書で使用される場合、「モジュレートする」という用語は、IL-13とその受容体との結合の阻害、および/またはIL-13とその受容体との相互作用の阻止とそれによるhIL-13/hIL-13Rシグナル伝達経路の脱共役を意味する。これは、hIL-13Rα1およびhIL-13Rα2の一方もしくは両方の阻害、および/または遮断とすることができる。本明細書で使用される場合、hIL-13受容体は、これら2つの受容体の一方、または両方を意味する。IL-13とその受容体との結合の阻害は、いくつかの方法で、たとえば、下記の実施例に記載のアッセイ(例を挙げると、実施例6.5および6.6に記載のようなELISA法)を用いて、測定することができる。
本発明の抗体、およびその抗原結合フラグメントは、治療用の抗体およびその抗原結合フラグメントであり、すなわち治療法での使用に適しているといえる。
ある態様において、hIL-13と特異的に結合し、配列番号3に記載の配列からなるCDRH3を含んでなる、抗体およびその抗原結合フラグメントが与えられる。
ある実施形態において、本発明の抗体およびその抗原結合フラグメントは、ヒトIL-13を中和する。
別の実施形態において、本発明の抗体およびその抗原結合フラグメントは、ヒトIL-13とその受容体との結合をモジュレートする。
本発明のもう一つの態様において、hIL-13Rと特異的に結合し、hIL-13とhIL-13Rとの相互作用をモジュレートする、抗体およびその抗原結合フラグメントが与えられる。
ある実施形態において、本発明の抗体は少なくとも、hIL-13とhIL-13Rとの相互作用を阻害するが、また、hIL-13とhIL-13Rとの相互作用を遮断してhIL-13/hIL-13Rシグナル伝達経路を脱共役する可能性もある。
別の実施形態において、本発明は、抗体および抗原結合フラグメントのCDRH3が、配列番号3の配列を含んでなる、前記抗体および抗原結合フラグメントを提供する。もう1つの実施形態では、本発明の抗体およびその抗原結合フラグメントは、以下の配列CDRH2: 配列番号2、CDRH1: 配列番号1、CDRL1: 配列番号4、CDRL2: 配列番号5、およびCDRL3: 配列番号6のうち1つもしくは複数を追加して含んでなる。さらに別の実施形態において、本発明は、上記CDR配列をヒトフレームワークの状況下で、たとえばヒト化抗体もしくはそのフラグメントとして、含んでなる。
本発明の別の態様において、hIL-13と特異的に結合し、下記のCDRを含んでなる、抗体およびその抗原結合フラグメントが与えられる:
CDRH1: 配列番号1
CDRH2: 配列番号2
CDRH3: 配列番号3
CDRL1: 配列番号4
CDRL2: 配列番号5
CDRL3: 配列番号6
CDRH1: 配列番号1
CDRH2: 配列番号2
CDRH3: 配列番号3
CDRL1: 配列番号4
CDRL2: 配列番号5
CDRL3: 配列番号6
本発明のある実施形態において、抗体および抗原結合フラグメントのCDRのうち1つもしくは複数は、上に挙げた配列に記載のCDRの変異体を包含することができる。それぞれの変異CDRは、上記配列中の対応する位置にあるアミノ酸残基とは異なるアミノ酸残基を1個もしくは2個含むものである。こうしたアミノ酸残基の置換は、保存的置換であって、たとえば、ある疎水性アミノ酸を別の疎水性アミノ酸の代わりに使用する。例としては、ロイシンをバリンもしくはイソロイシンで置換する。
本明細書を通じて、抗体配列中のアミノ酸残基は、Kabatの方式にしたがって番号が付けられている。同様に、「CDR」、「CDRL1」、「CDRL2」、「CDRL3」、「CDRH1」、「CDRH2」、「CDRH3」という用語は、重鎖の30位がCDRの一部であるとみなされる以外は、Kabatら、免疫学的に注目されるタンパク質の配列(Sequences of proteins of Immunological Interest)、NIH, 1987に記載のKabatの番号付け方式に従う。
本明細書で使用される「〜を含んでなる」という用語は、「〜からなる」を意味の一部として組み込んでいる。
本発明のもう一つの態様において、配列番号7に記載の配列を含んでなるVHドメイン、および配列番号8に記載の配列を含んでなるVLドメインを含んでなる、抗体およびその抗原結合フラグメントが与えられる。
本発明のもう一つの態様において、配列番号7、11、12、13および14からなる群から選択される配列を含んでなる、抗体の単離されたVHドメインが与えられる。ある実施形態において、抗体の単離されたVHドメインは、配列番号7、11、12、13および14からなる群から選択される、抗体の単離されたVHドメインからなるか、または本質的に前記ドメインからなる。
本発明の別の態様において、配列番号7、11、12、13および14からなる群から選択されるVHドメインを含んでなる、抗体およびその抗原結合フラグメントが与えられる。
本発明の別の態様において、hIL-13と特異的に結合し、少なくともhIL-13とhIL-13Rとの相互作用を阻害する抗体が与えられるが、その抗体は配列番号18の重鎖、ならびに配列番号22、23、および24からなる群から選択される軽鎖を含んでなる。
本発明の別の態様において、hIL-13と特異的に結合し、少なくともhIL-13とhIL-13Rとの相互作用を阻害する抗体が与えられるが、その抗体は配列番号19の重鎖、ならびに配列番号22、23、および24からなる群から選択される軽鎖を含んでなる。
本発明の別の態様において、hIL-13と特異的に結合し、少なくともhIL-13とhIL-13Rとの相互作用を阻害する抗体が与えられるが、その抗体は配列番号20の重鎖、ならびに配列番号22、23、および24からなる群から選択される軽鎖を含んでなる。
本発明の別の態様において、hIL-13と特異的に結合し、少なくともhIL-13とhIL-13Rとの相互作用を阻害する抗体が与えられるが、その抗体は配列番号21の重鎖、ならびに配列番号22、23、および24からなる群から選択される軽鎖を含んでなる。
本発明の別の態様において、配列番号18の重鎖および配列番号22の軽鎖を含んでなる抗体のhIL-13との結合を阻害する、抗体およびその抗原結合フラグメントが与えられる。
本発明にしたがって、ヒト化抗体が与えられるが、その抗体は配列番号11のVHドメイン、ならびに配列番号15、16および17からなる群から選択されるVLドメインを含んでなる。
本発明にしたがって、ヒト化抗体が与えられるが、その抗体は配列番号12のVHドメイン、ならびに配列番号15、16および17からなる群から選択されるVLドメインを含んでなる。
本発明にしたがって、ヒト化抗体が与えられるが、その抗体は配列番号13のVHドメイン、ならびに配列番号15、16および17からなる群から選択されるVLドメインを含んでなる。
本発明にしたがって、ヒト化抗体が与えられるが、その抗体は配列番号14のVHドメイン、ならびに配列番号15、16および17からなる群から選択されるVLドメインを含んでなる。
本発明にしたがって、配列番号90、99、102、103、105、106、107、108、109、110、111、112および114に記載のペプチドと結合するが、配列番号100、101、104および113に記載のペプチドとは結合しない、抗体およびその抗原結合フラグメントが与えられるが、この結合は、本明細書に例示される抗体、たとえば実施例6.4に記載のELISAアッセイにおいてヒトIL-13ペプチドとの3G4結合と同様の結合活性を保持する抗体、と同等の結合活性を有すると定義される。
本発明の別の態様において、hIL-13とhIL-13Rとの間の相互作用のモジュレーションに反応する疾患もしくは障害(たとえば、喘息、COPD、アレルギー性鼻炎、アトピー性皮膚炎)に苦しむヒト患者を治療する方法が与えられるが、その方法は、前記患者に治療上有効な量の、本明細書に記載の抗体もしくはその抗原結合フラグメントを投与するステップを含んでなる。
hIL-13とhIL-13Rとの相互作用のモジュレーションに反応する疾患もしくは障害の治療用薬剤の製造に、本発明の抗体を使用することも与えられる。
もう1つの態様において、本発明は、治療に使用するのに適した抗IL-13抗体を選択する方法を提供するが、その方法は、i) hIL-13R α1と特異的に結合する抗体を提供すること、ii) その抗体がhIL-13Rα2と特異的に結合するかどうかを判断すること、ならびにステップii)において結合する抗体を、さらなる開発に向けて選択することを含んでなる。
発明の詳細な説明
本発明の抗体は、インタクトな抗体もしくはそのフラグメント;ヒト、キメラ、もしくはヒト化抗体;ならびに単一特異性もしくは二重特異性とすることができる。
本発明の抗体は、インタクトな抗体もしくはそのフラグメント;ヒト、キメラ、もしくはヒト化抗体;ならびに単一特異性もしくは二重特異性とすることができる。
1. 抗体の構造
1.1 インタクトな抗体
インタクトな抗体としては、少なくとも2つの重鎖および2つの軽鎖を含んでなるヘテロ多量体糖タンパク質がある。IgMを除いて、インタクトな抗体は通常、2つの同一の軽(L)鎖、および2つの同一の重(H)鎖からなる、約150 kDaのヘテロ四量体糖タンパク質である。典型的には、それぞれの軽鎖は、1つのジスルフィド共有結合によって重鎖に連結されているが、異なる免疫グロブリンアイソタイプの重鎖間のジスルフィド結合の数はさまざまである。それぞれの重鎖および軽鎖は、鎖内ジスルフィド橋も有している。それぞれの重鎖は、一端に1つの可変領域(VH)を有し、続いていくつかの定常領域がある。それぞれの軽鎖は1つの可変領域(L)およびその他端に1つの定常領域を有する;軽鎖の定常領域は重鎖の最初の定常領域と並んでおり、軽鎖可変領域は重鎖可変領域と並んでいる。ほとんどの脊椎動物種由来の抗体の軽鎖は、定常領域のアミノ酸配列に基づいて、κおよびλと呼ばれる2タイプのうち1つに帰属することができる。それらの重鎖の定常領域のアミノ酸配列に応じて、ヒト抗体は5つの異なるクラス、IgA、IgD、IgE、IgGおよびIgMに帰属することができる。IgGおよびIgAは、サブクラスIgG1、IgG2、IgG3およびIgG4;ならびにIgA1およびIgA2に、さらに細かく分類することができる。動物種による変異体が存在し、マウスおよびラットは、少なくともIgG2a、IgG2bを有する。抗体の可変領域は、抗体に結合特異性を付与し、特定の領域が相補性決定領域(CDR)と呼ばれる特別な可変性を示す。可変領域のうち比較的保存される部分は、フレームワーク領域(FR)と呼ばれる。インタクトな重鎖および軽鎖のそれぞれの可変領域は、3つのCDRによって結合された4つのFRを含んでなる。各鎖のCDRは、FR領域によってきわめて近接してまとまった状態で保持され、他方の鎖のCDRとともに、抗体の抗原結合部位の形成をもたらす。定常領域は、直接的には、抗体の抗原との結合に関与しないが、抗体依存性細胞傷害(ADCC)への関与、Fcγ受容体への結合を介した食作用への関与、新生児Fc受容体(FcRn)による半減期/クリアランス速度への関与、ならびに補体カスケードのC1q成分を介した補体依存性細胞傷害への関与といった、さまざまなエフェクター機能を示す。
1.1 インタクトな抗体
インタクトな抗体としては、少なくとも2つの重鎖および2つの軽鎖を含んでなるヘテロ多量体糖タンパク質がある。IgMを除いて、インタクトな抗体は通常、2つの同一の軽(L)鎖、および2つの同一の重(H)鎖からなる、約150 kDaのヘテロ四量体糖タンパク質である。典型的には、それぞれの軽鎖は、1つのジスルフィド共有結合によって重鎖に連結されているが、異なる免疫グロブリンアイソタイプの重鎖間のジスルフィド結合の数はさまざまである。それぞれの重鎖および軽鎖は、鎖内ジスルフィド橋も有している。それぞれの重鎖は、一端に1つの可変領域(VH)を有し、続いていくつかの定常領域がある。それぞれの軽鎖は1つの可変領域(L)およびその他端に1つの定常領域を有する;軽鎖の定常領域は重鎖の最初の定常領域と並んでおり、軽鎖可変領域は重鎖可変領域と並んでいる。ほとんどの脊椎動物種由来の抗体の軽鎖は、定常領域のアミノ酸配列に基づいて、κおよびλと呼ばれる2タイプのうち1つに帰属することができる。それらの重鎖の定常領域のアミノ酸配列に応じて、ヒト抗体は5つの異なるクラス、IgA、IgD、IgE、IgGおよびIgMに帰属することができる。IgGおよびIgAは、サブクラスIgG1、IgG2、IgG3およびIgG4;ならびにIgA1およびIgA2に、さらに細かく分類することができる。動物種による変異体が存在し、マウスおよびラットは、少なくともIgG2a、IgG2bを有する。抗体の可変領域は、抗体に結合特異性を付与し、特定の領域が相補性決定領域(CDR)と呼ばれる特別な可変性を示す。可変領域のうち比較的保存される部分は、フレームワーク領域(FR)と呼ばれる。インタクトな重鎖および軽鎖のそれぞれの可変領域は、3つのCDRによって結合された4つのFRを含んでなる。各鎖のCDRは、FR領域によってきわめて近接してまとまった状態で保持され、他方の鎖のCDRとともに、抗体の抗原結合部位の形成をもたらす。定常領域は、直接的には、抗体の抗原との結合に関与しないが、抗体依存性細胞傷害(ADCC)への関与、Fcγ受容体への結合を介した食作用への関与、新生児Fc受容体(FcRn)による半減期/クリアランス速度への関与、ならびに補体カスケードのC1q成分を介した補体依存性細胞傷害への関与といった、さまざまなエフェクター機能を示す。
したがって、ある実施形態において、本発明者らは、hIL-13と特異的に結合するインタクトな抗体を提供するが、その抗体はhIL-13とhIL-13Rとの間の相互作用をモジュレートするものであって、たとえば、その抗体はhIL-13とその受容体との間の相互作用を阻害する。インタクトな抗体は、上記の任意のアイソタイプまたはそのサブクラスの定常領域を含んでなることができる。ある実施形態において、抗体は、IgGアイソタイプ、特にIgG1のある抗体である。抗体は、ラット、マウス、ウサギ、霊長類、またはヒトとすることができる。ある典型的な実施形態において、抗体は、霊長類(カニクイザル、旧世界サル、もしくは大型類人猿など、たとえば、国際公開WO99/55369, WO93/02108を参照されたい)またはヒトである。
もう1つの実施形態において、配列番号3のCDRH3を含んでなる、単離されたインタクトな抗体が与えられる。また別の実施形態において、配列番号1、2、3、4、5および6のCDRを含む可変領域を含んでなるインタクトな抗体が与えられる。
別の実施形態において、配列番号7の配列を含んでなるVHドメイン、および配列番号8の配列のVLドメインを含んでなる、単離されたインタクトなマウス抗体もしくはその抗原結合フラグメントが与えられる。
1.1.2 ヒト抗体
ヒト抗体は、当業者に知られているいくつかの方法によって作製することができる。ヒト抗体は、ヒト骨髄腫もしくはマウス-ヒトヘテロ骨髄腫細胞株を用いて、ハイブリドーマ法によって作製することができる。Kozbor、 J.Immunol 133, 3001, (1984)、およびBrodeur, Monoclonal Antibody Production Techniques and Applications, 51-63ページ (Marcel Dekker Inc, 1987)を参照されたい。別法としては、ファージライブラリもしくはトランスジェニックマウスの使用が挙げられるが、これらはいずれもヒトV領域レパートリーを利用する(Winter G, (1994), Annu.Rev.Immunol 12,433-455, Green LL (1999), J.Immunol.methods 231, 11-23を参照されたい)。
ヒト抗体は、当業者に知られているいくつかの方法によって作製することができる。ヒト抗体は、ヒト骨髄腫もしくはマウス-ヒトヘテロ骨髄腫細胞株を用いて、ハイブリドーマ法によって作製することができる。Kozbor、 J.Immunol 133, 3001, (1984)、およびBrodeur, Monoclonal Antibody Production Techniques and Applications, 51-63ページ (Marcel Dekker Inc, 1987)を参照されたい。別法としては、ファージライブラリもしくはトランスジェニックマウスの使用が挙げられるが、これらはいずれもヒトV領域レパートリーを利用する(Winter G, (1994), Annu.Rev.Immunol 12,433-455, Green LL (1999), J.Immunol.methods 231, 11-23を参照されたい)。
マウスの免疫グロブリン遺伝子座がヒト免疫グロブリン遺伝子セグメントで置き換えられた、いくつかの系統のトランスジェニックマウスが現在利用可能である(Tomizuka K, (2000) PNAS 97,722-727; Fishwild D.M (1996) Nature Biotechnol. 14,845-851, Mendez MJ, 1997, Nature Genetics, 15,146-156を参照されたい)。抗原によるチャレンジ後に、上記のマウスはヒト抗体のレパートリー(そこから目的の抗体を選択することができる)を産生することができる。特に注目すべきは、放射線照射したマウスにヒトリンパ球を移植するTrimera(商標名)システム(Eren Rら、(1998) Immunology 93:154-161を参照されたい)、ヒト(もしくは他種)のリンパ球に、大量プールin vitro抗体産生手順を効果的に受けさせた後、デコンボリュート、限界希釈および選択手順を行うSelected Lymphocyte Antibody System(SLAM、Babcookら、PNAS (1996) 93:7843-7848を参照されたい)、ならびにXenomouse II(商標名)(Abgenix Inc)である。
ファージディスプレイ技術を用いて、ヒト抗体(およびそのフラグメント)を作製することができる。McCafferty、Nature, 348, 552-553 (1990) およびGriffiths ADら、 (1994) EMBO 13:3245-3260を参照されたい。この技術によって、抗体Vドメイン遺伝子は、M13もしくはfdといった繊維状バクテリオファージの主要な、もしくはマイナーなコートタンパク質遺伝子内にインフレームでクローニングされ、ファージ粒子の表面に機能的抗体フラグメントとしてディスプレイされる(通常、ヘルパーファージの助けを要する)。抗体の機能上の特性に基づく選択の結果、そうした特性を示す抗体をコードする遺伝子が選択される。ファージディスプレイ法を用いて、上記疾患もしくは障害に苦しむ個体、あるいは免疫化されていないヒトドナーから採取された、ヒトB細胞より作製されたライブラリから、抗原特異的抗体を選択することができる(Marks; J.Mol.Bio. 222,581-597, 1991を参照されたい)。Fcドメインを含むインタクトなヒト抗体が求められる場合には、望ましい定常領域を含む哺乳類発現ベクター中に、ファージディスプレイに由来するフラグメントを再クローニングして、安定した発現細胞株を確立する必要がある。
親和性成熟(Marks; Bio/technol 10,779-783 (1992))の技術を用いて、結合親和性を向上させることができるが、この場合、H鎖およびL鎖V領域を天然に存在する変異体で順次置き換えて、結合親和性の向上に基づいて選択することによって、ヒト一次抗体の親和性は向上する。「エピトープインプリンティング」といった上記技法の変法も、現在では利用することができる。国際公開WO 93/06213を参照されたい。また、Waterhouse; Nucl.Acids Res 21, 2265-2266 (1993)も参照されたい。
したがって、もう一つの実施形態において、hIL-13と特異的に結合し、hIL-13とhIL-13Rとの間の相互作用をモジュレートする(たとえば、hIL-13とその受容体との間の相互作用を阻害する)、単離されたインタクトなヒト抗体もしくはその抗原結合フラグメントが与えられる。
別の態様において、hIL-13と特異的に結合し、hIL-13とhIL-13Rとの間の相互作用をモジュレートする(たとえば、これは、hIL-13とその受容体との間の相互作用を阻害する)、配列番号3のCDRH3を含んでなる単離されたインタクトなヒト抗体もしくはその抗原結合フラグメントが与えられる。もう一つの態様において、上記配列番号1、2、3、4、5および6のCDRを含む可変領域を含んでなる、単離されたインタクトなヒト抗体もしくはその抗原結合フラグメントが与えられる。
1.2 キメラおよびヒト化抗体
インタクトな非ヒト抗体をヒトの疾患もしくは障害の治療に使用することは、現在十分に立証されている免疫原性の問題を引き起こす可能性を伴い、すなわち、患者の免疫系はインタクトな非ヒト抗体を非自己と認識して、中和応答を開始する可能性がある。これは、ヒト患者への非ヒト抗体の複数回投与で特にはっきりと認められる。こうした問題を克服するために、長年にわたってさまざまな技法が開発されてきたが、こうした技法は、一般に、免疫した動物、たとえばマウス、ラットもしくはウサギから非ヒト抗体を得ることの相対的な容易さを維持する一方で、インタクトな抗体における非ヒトアミノ酸配列の構成割合を減らすことを必要とする。概して、これを達成するために2つのアプローチが用いられてきた。第1はキメラ抗体であって、これは一般に、ヒト定常領域に融合された非ヒト(たとえば、マウスなどの齧歯類)可変領域を含んでなる。抗体の抗原結合部位は可変領域内に局在するので、キメラ抗体は、抗原に対するその結合親和性を維持するが、ヒト定常領域のエフェクター機能を獲得しているため、上記のようなエフェクター機能を果たすことができる。キメラ抗体は、典型的には、組換えDNA法を用いて作製される。従来の方法を用いて(たとえば、本発明の抗体のHおよびL鎖をコードする遺伝子、例としては上記の配列番号1、2、3、4、5および6をコードするDNAと、特異的に結合することができるオリゴヌクレオチドプローブを使用することによって)、抗体をコードするDNA(たとえばcDNA)を単離し、配列を決定する。ハイブリドーマ細胞は、こうしたDNAの典型的な供給源となる。単離したら、DNAを発現ベクターに入れ、その発現ベクターを次に、本来免疫グロブリンを産生しない大腸菌、COS細胞、CHO細胞もしくは骨髄腫細胞といった宿主細胞にトランスフェクトして、抗体を合成させる。DNAは、ヒトLおよびH鎖のコード配列を、対応する非ヒト(たとえばマウス)HおよびL定常領域の代わりに用いることによって、改変することができる。たとえば、Morrison; PNAS 81, 6851 (1984)を参照されたい。
インタクトな非ヒト抗体をヒトの疾患もしくは障害の治療に使用することは、現在十分に立証されている免疫原性の問題を引き起こす可能性を伴い、すなわち、患者の免疫系はインタクトな非ヒト抗体を非自己と認識して、中和応答を開始する可能性がある。これは、ヒト患者への非ヒト抗体の複数回投与で特にはっきりと認められる。こうした問題を克服するために、長年にわたってさまざまな技法が開発されてきたが、こうした技法は、一般に、免疫した動物、たとえばマウス、ラットもしくはウサギから非ヒト抗体を得ることの相対的な容易さを維持する一方で、インタクトな抗体における非ヒトアミノ酸配列の構成割合を減らすことを必要とする。概して、これを達成するために2つのアプローチが用いられてきた。第1はキメラ抗体であって、これは一般に、ヒト定常領域に融合された非ヒト(たとえば、マウスなどの齧歯類)可変領域を含んでなる。抗体の抗原結合部位は可変領域内に局在するので、キメラ抗体は、抗原に対するその結合親和性を維持するが、ヒト定常領域のエフェクター機能を獲得しているため、上記のようなエフェクター機能を果たすことができる。キメラ抗体は、典型的には、組換えDNA法を用いて作製される。従来の方法を用いて(たとえば、本発明の抗体のHおよびL鎖をコードする遺伝子、例としては上記の配列番号1、2、3、4、5および6をコードするDNAと、特異的に結合することができるオリゴヌクレオチドプローブを使用することによって)、抗体をコードするDNA(たとえばcDNA)を単離し、配列を決定する。ハイブリドーマ細胞は、こうしたDNAの典型的な供給源となる。単離したら、DNAを発現ベクターに入れ、その発現ベクターを次に、本来免疫グロブリンを産生しない大腸菌、COS細胞、CHO細胞もしくは骨髄腫細胞といった宿主細胞にトランスフェクトして、抗体を合成させる。DNAは、ヒトLおよびH鎖のコード配列を、対応する非ヒト(たとえばマウス)HおよびL定常領域の代わりに用いることによって、改変することができる。たとえば、Morrison; PNAS 81, 6851 (1984)を参照されたい。
第2のアプローチは、可変領域をヒト化することによって抗体の非ヒト含量を減少させる、ヒト化抗体の作製に関する。ヒト化について2つの技術が広く支持されている。第1は、CDRグラフティングによるヒト化である。CDRは抗体のN末端近くにループを作り、そこで、フレームワーク領域によってもたらされるスキャフォールドに嵌め込まれた表面を形成する。抗体の抗原結合特異性は、主として、その抗体のCDR表面のトポグラフィーおよび化学的性質によって決まる。次いで、これらの特徴は、個別のCDRのコンフォメーションによって、CDRの相対的配置によって、ならびにCDRを構成する残基の側鎖の性質および配置によって決定される。免疫原性の大幅な低下は、非ヒト(たとえばマウス)抗体(「ドナー」抗体)のCDRのみを、ヒトのフレームワーク(「アクセプターフレームワーク」)および定常領域上にグラフティングすることによって達成することができる(Jonesら、 (1986) Nature 321,522-525、ならびにVerhoeyen Mら、(1988) Science 239, 1534-1536を参照されたい)。しかしながら、CDRグラフティングは本質的に、抗原結合特性の完全な保持をもたらさない可能性があり、有意な抗原結合親和性を回復したいならば、ドナー抗体のフレームワーク残基(「復帰突然変異」と呼ばれることもある)の一部をヒト化分子内に保持する必要があることが、多くの場合、明らかになっている(Queen C ら、(1989) PNAS 86, 10,029-10,033, Co, Mら、(1991) Nature 351, 501-502を参照されたい)。この場合、ヒトフレームワーク(FR)を用意するために、非ヒトドナー抗体に対して最大の配列相同性を示すヒトV領域をデータベースから選択する。ヒトFRは、ヒトコンセンサスもしくは個別のヒト抗体のどちらからも選択することができる。必要ならば、ドナー抗体由来の重要残基を、ヒトアクセプターフレームワーク内に置換して入れて、CDRコンフォメーションを保存する。抗体のコンピューターモデリングを用いることができるが、それは、このような構造的に重要な残基を同定するのに役立つ。国際公開WO99/48523を参照されたい。
別法として、ヒト化は、「veneering」のプロセスによって行うことができる。特異なヒトおよびマウス免疫グロブリンの重鎖および軽鎖可変領域の統計分析によって、露出した残基の正確なパターンがヒトとマウスの抗体で異なること、ならびにほとんどの個々の表面位置は、少数の異なる残基を強く優先して選ぶことが明らかになった(Padlan E.A.ら、(1991) Mol.Immunol.28, 489-498、およびPedersen J.T.ら、(1994) J.Mol.Biol. 235; 959-973を参照されたい)。したがって、そのフレームワーク領域内の、ヒト抗体に通常存在するものとは異なる、露出した残基を取り替えることによって、非ヒトFvの免疫原性を低下させることができる。タンパク質の抗原性は、表面への接近可能性と相関しうるので、表面残基を置き換えることは、マウス可変領域をヒトの免疫系に「見えない」ようにするのに十分であると考えられる(Mark G.E.ら、(1994)、実験薬理学ハンドブック(Handbook of Experimental Pharmacology)第113号より:モノクローナル抗体の薬理学(The pharmacology of monoclonal Antibodies)、Springer-Verlag、105-134ページも参照されたい)。こうしたヒト化の手順は、抗体の表面だけを変更し、支持する残基はそのままになっているので、「veneering」と呼ばれる。
当業者は、抗体をヒト化する他の方法が存在し、文献から利用可能であることを認識している。
したがって、本発明の別の実施形態において、ヒト定常領域(IgGアイソタイプ、たとえばIgG1のものとすることができる)と融合した非ヒト(たとえば、齧歯類)可変領域を含んでなるキメラ抗体であって、hIL-13と特異的に結合し、hIL-13とhIL-13Rとの相互作用をモジュレートする(たとえば、hIL-13とその受容体との相互作用を阻害する)、前記キメラ抗体が与えられる。
別の実施形態において、非ヒト(たとえば、齧歯類)可変領域およびヒト定常領域(IgGアイソタイプ、たとえばIgG1のものとすることができる)を含んでなるキメラ抗体であって、hIL-13と特異的に結合し、配列番号3のCDRH3をさらに含んでなる、前記キメラ抗体が与えられる。こうした抗体は、IgGアイソタイプ、たとえばIgG1、のヒト定常領域をさらに含むことができる。
別の実施形態において、非ヒト(たとえば、齧歯類)可変領域およびヒト定常領域(IgGアイソタイプ、たとえばIgG1のものとすることができる)を含んでなるキメラ抗体であって、hIL-13と特異的に結合し、配列番号1、2、3、4、5および6のCDRを含んでなる、前記キメラ抗体が与えられる。
別の実施形態において、配列番号7のVHドメインおよび配列番号8のVLドメイン、ならびにIgGアイソタイプ、たとえばIgG1のヒト定常領域を含んでなるキメラ抗体であって、hIL-13と特異的に結合し、hIL-13とhIL-13Rとの相互作用をモジュレートする(たとえば、hIL-13とその受容体との相互作用を阻害する)、前記キメラ抗体が与えられる。
別の実施形態において、hIL-13と特異的に結合し、hIL-13とhIL-13Rとの相互作用をモジュレートする(たとえば、hIL-13とその受容体との相互作用を阻害する)、ヒト化抗体もしくはその抗原結合フラグメントが与えられる。
別の実施形態において、hIL-13と特異的に結合し、配列番号3のCDRH3を含んでなる、ヒト化抗体もしくはその抗原結合フラグメントが与えられる。こうした抗体は、IgGアイソタイプ、たとえばIgG1のヒト定常領域を含んでなることができる。
別の実施形態において、hIL-13と特異的に結合し、配列番号1、2、3、4、5および6のCDRを含んでなる、ヒト化抗体もしくはその抗原結合フラグメントが与えられる。こうした抗体は、IgGアイソタイプ、たとえばIgG1のヒト定常領域を含んでなることができる。
本発明にしたがって、配列番号11からなる群から選択されるVHドメイン、および配列番号15、16、17からなる群から選択されるVLドメインを含んでなる、ヒト化抗体が与えられる。こうした抗体は、IgGアイソタイプ、たとえばIgG1のヒト定常領域を含んでなることができる。
本発明にしたがって、配列番号12からなる群から選択されるVHドメイン、および配列番号15、16、17からなる群から選択されるVLドメインを含んでなる、ヒト化抗体が与えられる。こうした抗体は、IgGアイソタイプ、たとえばIgG1のヒト定常領域を含んでなることができる。
本発明にしたがって、配列番号13からなる群から選択されるVHドメイン、および配列番号15、16、17からなる群から選択されるVLドメインを含んでなる、ヒト化抗体が与えられる。こうした抗体は、IgGアイソタイプ、たとえばIgG1のヒト定常領域を含んでなることができる。
本発明にしたがって、配列番号14からなる群から選択されるVHドメイン、および配列番号15、16、17からなる群から選択されるVLドメインを含んでなる、ヒト化抗体が与えられる。こうした抗体は、IgGアイソタイプ、たとえばIgG1のヒト定常領域を含んでなることができる。
別の実施形態において、配列番号11のVHドメインおよび配列番号15のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号12のVHドメインおよび配列番号15のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号13のVHドメインおよび配列番号15のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号14のVHドメインおよび配列番号15のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号11のVHドメインおよび配列番号16のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号12のVHドメインおよび配列番号16のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号13のVHドメインおよび配列番号16のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号14のVHドメインおよび配列番号16のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号11のVHドメインおよび配列番号17のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号12のVHドメインおよび配列番号17のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号13のVHドメインおよび配列番号17のVLドメインを含んでなるヒト化抗体が与えられる。
別の実施形態において、配列番号14のVHドメインおよび配列番号17のVLドメインを含んでなるヒト化抗体が与えられる。
もう1つの実施形態において、hIL-13と特異的に結合するヒト化抗体もしくはその抗原結合フラグメントであって、前記抗体もしくはフラグメントは、配列番号3のCDRH3を含んでなり、場合によりさらに配列番号1、2、4、5および6のCDRのうち1つもしくは複数を含んでなるが、ここでヒトアクセプター重鎖フレームワークの10、30、67、69、71、73および93位からなる群から選択される残基のうち1つもしくは複数、ならびにヒトアクセプター軽鎖フレームワークの76および98位にある1つもしくは2つの残基が、CDRH3の由来するドナー抗体のフレームワーク(配列番号7に記載)に存在する、対応する残基によって置換されている、前記ヒト化抗体もしくはその抗原結合フラグメントが与えられる。
別の実施形態において、hIL-13と特異的に結合するヒト化抗体もしくはその抗原結合フラグメントであって、前記抗体もしくはフラグメントは、配列番号3のCDRH3を含んでなり、場合によりさらに配列番号1、2、4、5および6のCDRのうち1つもしくは複数を含んでなるが、ここでヒト重鎖フレームワークは以下の残基(もしくはその保存的置換)のうち1つもしくは複数(たとえば全部)を含んでなり、
位置 残基
10 D
30 I
67 A
69 L
71 A
73 K
93 T
しかも、軽鎖フレームワークは以下の残基(もしくはその保存的置換)のうち1つもしくは2つを含んでなる、
76 N
98 L
前記ヒト化抗体もしくはその抗原結合フラグメントが与えられる。
位置 残基
10 D
30 I
67 A
69 L
71 A
73 K
93 T
しかも、軽鎖フレームワークは以下の残基(もしくはその保存的置換)のうち1つもしくは2つを含んでなる、
76 N
98 L
前記ヒト化抗体もしくはその抗原結合フラグメントが与えられる。
当業者には明白なことであるが、「由来する」という用語は、それが物質の物理的起源であるという意味で、起源を明らかにするのみならず、その物質と(一次アミノ酸配列に関して)構造的に同一であるもののその基準起源から生じたのではない物質も明示することを意図するものである。したがって、「CDRH3の由来するドナー抗体に存在する、対応する残基」は、かならずしもドナー抗体から精製されたものである必要はない。
当業者には当然のことであるが、ある種のアミノ酸置換は、「保存的」であると見なされる。アミノ酸は、側鎖の性質に基づいてグループに分けられており、本発明の抗体もしくはその抗原結合フラグメントの結合親和性をすべて維持する、または実質的にすべて維持する、グループ内の置換は保存的置換と見なされる。表1を参照されたい。
本発明にしたがって、配列番号18、19、20、21からなる群から選択される重鎖、ならびに配列番号22、23、24からなる群から選択される軽鎖を含んでなる、ヒト化抗体が与えられる。
本発明のある実施形態において、配列番号18の重鎖および配列番号22の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号19の重鎖および配列番号22の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号20の重鎖および配列番号22の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号21の重鎖および配列番号22の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号18の重鎖および配列番号23の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号19の重鎖および配列番号23の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号20の重鎖および配列番号23の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号21の重鎖および配列番号23の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号18の重鎖および配列番号24の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号19の重鎖および配列番号24の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号20の重鎖および配列番号24の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号21の重鎖および配列番号24の軽鎖を含んでなる、hIL-13と特異的に結合するヒト化抗体が与えられる。
本発明のある実施形態において、配列番号1〜3に記載のCDRのそれぞれを含んでなる、ヒトもしくはヒト化重鎖可変領域が与えられる。本発明の別の実施形態において、ヒト重鎖可変領域のより大きい配列内に配列番号1〜3に記載のCDRを含んでなる、ヒト化重鎖可変領域が与えられる。さらに別の実施形態において、ヒト化重鎖可変領域は、アクセプター抗体フレームワーク内に配列番号1〜3に記載のCDRを含んでなり、該アクセプター抗体フレームワークは、マウス3G4ドナー抗体重鎖可変領域(配列番号7)に対して40%を越える同一性、または50%を越える、または60%を越える、または65%を越える同一性を該フレームワーク領域において有する。
本発明のある態様において、抗体は、配列番号44のアミノ酸配列を含んでなり、さらに、10、30、67、69、71、73、93位 (Kabatの番号付け方式)のうち1もしくは複数箇所にいくつかの置換を含む、重鎖可変領域を含んでなる;ここで、それぞれの置換アミノ酸残基は、配列番号7(ドナー抗体3G4の重鎖可変領域)の対応する位置のアミノ酸残基で置き換えられ、置換数は0から7の間である。他の実施形態において、置換の数は0、または1、または2、または3、または4、または5、または6、または7である。
本発明のある実施形態において、配列番号4〜6に記載のCDRのそれぞれを含んでなる、ヒトもしくはヒト化軽鎖可変領域が与えられる。本発明の別の実施形態において、ヒト軽鎖可変領域のより大きい配列内に配列番号4〜6に記載のCDRを含んでなる、ヒト化軽鎖可変領域が与えられる。さらに別の実施形態において、ヒト化軽鎖可変領域は、アクセプター抗体フレームワーク内に配列番号4〜6に記載のCDRを含んでなり、該アクセプター抗体フレームワークは、マウス3G4ドナー抗体軽鎖可変領域(配列番号8)に対して40%を越える同一性、または50%を越える、または60%を越える、または65%を越える同一性を該フレームワーク領域において有する。
本発明のある態様において、抗体は、配列番号45のアミノ酸配列を含んでなり、さらに76、98位 (Kabatの番号付け方式)のうち1もしくは複数箇所にいくつかの置換を含む、軽鎖可変領域を含んでなる;ここで、それぞれの置換アミノ酸残基は、配列番号8(ドナー抗体3G4の軽鎖可変領域)の対応する位置のアミノ酸で置き換えられ、置換数は0から2の間である。他の実施形態において、置換の数は、0、または1、または2である。
1.3 二重特異性抗体
二重特異性抗体は、少なくとも2つの異なるエピトープに対して結合特異性を有する抗体である。こうした抗体を作製する方法は当技術分野で知られている。従来、二重特異性抗体の組換え生産は、2つの免疫グロブリンH鎖-L鎖対の同時発現を基本とし、その2つのH鎖が異なる結合特異性を有する。Millsteinら、Nature 305 537-539 (1983)、国際公開WO93/08829 およびTrauneckerら、EMBO, 10, 1991, 3655-3659を参照されたい。H鎖とL鎖のランダムな組み合わせのため、10種の異なる抗体構造の混合物が生じる可能性があり、そのうち1つだけが求める結合特異性を有するものである。別のアプローチは、ヒンジ領域の少なくとも一部、CH2およびCH3領域を含む重鎖定常領域に、望ましい結合特異性を有する可変領域を融合することが必要となる。軽鎖との結合に必要な部位を含有するCH1領域が、融合物の少なくとも1つに存在するようにすることが好ましい。これらの融合物、および、必要ならば、L鎖をコードするDNAを、別々の発現ベクターに挿入した後、適当な宿主生物にコトランスフェクトする。2つの鎖、もしくは3つすべての鎖のコード配列を1つの発現ベクターに挿入することも可能ではある。ある好ましいアプローチにおいて、二重特異性抗体は、一方のアームに第1の結合特異性を有するH鎖と、他方のアームに第2の結合特異性を与えるH-L鎖対とから構成される。国際公開WO94/04690を参照されたい。また、Sureshら、Methods in Enzymology 121, 210, 1986も参照されたい。
二重特異性抗体は、少なくとも2つの異なるエピトープに対して結合特異性を有する抗体である。こうした抗体を作製する方法は当技術分野で知られている。従来、二重特異性抗体の組換え生産は、2つの免疫グロブリンH鎖-L鎖対の同時発現を基本とし、その2つのH鎖が異なる結合特異性を有する。Millsteinら、Nature 305 537-539 (1983)、国際公開WO93/08829 およびTrauneckerら、EMBO, 10, 1991, 3655-3659を参照されたい。H鎖とL鎖のランダムな組み合わせのため、10種の異なる抗体構造の混合物が生じる可能性があり、そのうち1つだけが求める結合特異性を有するものである。別のアプローチは、ヒンジ領域の少なくとも一部、CH2およびCH3領域を含む重鎖定常領域に、望ましい結合特異性を有する可変領域を融合することが必要となる。軽鎖との結合に必要な部位を含有するCH1領域が、融合物の少なくとも1つに存在するようにすることが好ましい。これらの融合物、および、必要ならば、L鎖をコードするDNAを、別々の発現ベクターに挿入した後、適当な宿主生物にコトランスフェクトする。2つの鎖、もしくは3つすべての鎖のコード配列を1つの発現ベクターに挿入することも可能ではある。ある好ましいアプローチにおいて、二重特異性抗体は、一方のアームに第1の結合特異性を有するH鎖と、他方のアームに第2の結合特異性を与えるH-L鎖対とから構成される。国際公開WO94/04690を参照されたい。また、Sureshら、Methods in Enzymology 121, 210, 1986も参照されたい。
本発明のある実施形態において、二重特異性抗体が提供されるが、その抗体の少なくとも一方の結合特異性はhIL-13に対するものであって、前記抗体は、hIL-13とhIL-13Rとの相互作用をモジュレートし、たとえば、その場合前記抗体は、hIL-13とその受容体との相互作用を阻害する。こうした抗体は、IgGアイソタイプ、たとえばIgG1のヒト定常領域をさらに含むことができる。ある実施形態において、二重特異性治療用抗体は、hIL-13に対する第1の結合特異性を有し、hIL-13とhIL-13Rとの相互作用をモジュレートする(たとえば、hIL-13とその受容体との相互作用を阻害する)が、さらにhIL-4に対する第2の結合特異性を有しており、hIL-4とhIL-4Rとの相互作用をモジュレートする(たとえば、hIL-4とその受容体との相互作用を阻害する)。
本発明のある実施形態において、二重特異性抗体が提供されるが、その抗体の少なくとも1つの結合特異性はhIL-13に対するものであり、前記抗体は、配列番号3のCDRH3を含んでなる。こうした抗体は、IgGアイソタイプ、たとえばIgG1のヒト定常領域をさらに含むことができる。
本発明のある実施形態において、二重特異性抗体が提供されるが、その抗体の少なくとも1つの結合特異性はhIL-13に対するものであり、前記抗体は、少なくとも配列番号1、2、3、4、5および6のCDRを含んでなる。こうした抗体は、IgGアイソタイプ、たとえばIgG1のヒト定常領域をさらに含むことができる。
1.4 抗体フラグメント
本発明のある実施形態において、hIL-13とhIL-13Rとの相互作用をモジュレートする抗体フラグメントが提供されるが、この場合、たとえば、該フラグメントはhIL-13とその受容体との相互作用を阻害する。こうしたフラグメントは、インタクトな、および/またはヒト化された、および/またはキメラな抗体の機能的抗原結合フラグメント、たとえば、上記抗体のFab、Fab'、F(ab')2、Fv、ScFvフラグメントとすることができる。従来、こうしたフラグメントは、インタクトな抗体のタンパク質分解によって、たとえばパパイン分解によって(たとえば、国際公開WO 94/29348を参照されたい)作製されるが、遺伝子組換えによる形質転換宿主細胞から直接産生させることもできる。ScFvの作製については、Birdら、(1988) Science, 242, 423-426を参照されたい。それに加えて、抗体フラグメントは、下記のさまざまな遺伝子工学技術を用いて作製することができる。
本発明のある実施形態において、hIL-13とhIL-13Rとの相互作用をモジュレートする抗体フラグメントが提供されるが、この場合、たとえば、該フラグメントはhIL-13とその受容体との相互作用を阻害する。こうしたフラグメントは、インタクトな、および/またはヒト化された、および/またはキメラな抗体の機能的抗原結合フラグメント、たとえば、上記抗体のFab、Fab'、F(ab')2、Fv、ScFvフラグメントとすることができる。従来、こうしたフラグメントは、インタクトな抗体のタンパク質分解によって、たとえばパパイン分解によって(たとえば、国際公開WO 94/29348を参照されたい)作製されるが、遺伝子組換えによる形質転換宿主細胞から直接産生させることもできる。ScFvの作製については、Birdら、(1988) Science, 242, 423-426を参照されたい。それに加えて、抗体フラグメントは、下記のさまざまな遺伝子工学技術を用いて作製することができる。
Fvフラグメントは、その2つの鎖の相互作用エネルギーがFabフラグメントより低いと思われる。VHおよびVLドメインの結合を安定化するために、これらのドメインは、ペプチド(Birdら、(1988) Science 242, 423-426、Hustonら、PNAS, 85, 5879-5883)、ジスルフィド橋(Glockshuberら、(1990) Biochemistry, 29, 1362-1367)、および「knob in hole」変異(Zhuら、(1997), Protein Sci., 6, 781-788)によって連結されている。ScFvフラグメントは、当業者によく知られている方法によって作製することができる。Whitlowら、(1991) Methods companion Methods Enzymol, 2, 97-105 およびHustonら、(1993) Int.Rev.Immunol 10, 195-217を参照されたい。ScFvは、大腸菌(E. coli)などの細菌細胞内で産生させることができるが、真核細胞内で産生させる方が好ましい。ScFvの不利な点は、産物が一価であること、そのために多価結合による結合力の増加が不可能になること、ならびに半減期が短いことである。こうした問題を克服するための試みには、二価(ScFv')2があるが、これは、追加のC末端システインを含有するScFvから、化学的カップリングによって(Adamsら、(1993) Can.Res 53, 4026-4034、およびMcCartneyら、(1995) Protein Eng. 8, 301-314)、または不対C末端システイン残基を含有するScFvの、自然発生的な部位特異的二量体化によって(Kipriyanovら、(1995) Cell. Biophys 26, 187-204を参照されたい)作製される。あるいはまた、ペプチドリンカーを3〜12残基に短縮して「ダイアボディ(diabody)」を形成することによって、ScFvに多量体を形成させることができる。Holligerら、PNAS (1993), 90, 6444-6448を参照されたい。リンカーをさらに小さくすることで、ScFv三量体(「トリアボディ」、Korttら、(1997) Protein Eng, 10, 423-433を参照されたい)および四量体(「テトラボディ」、Le Gallら、(1999) FEBS Lett, 453, 164-168を参照されたい)をもたらすことができる。二価ScFv分子の構築は、「ミニ抗体(miniantibody)」(Packら、(1992) Biochemistry 31, 1579-1584を参照されたい)および「ミニボディ」(Huら、(1996), Cancer Res. 56, 3055-3061を参照されたい)を形成することができるタンパク質二量体化モチーフとの遺伝子融合によっても、達成することができる。ScFv-ScFvタンデム((ScFv)2)は、第3のペプチドリンカーによって2つのScFv単位を連結することによって作製することもできる。Kuruczら、(1995) J.Immol.154, 4576-4582を参照されたい。二重特異性ダイアボディは、ある抗体のVLドメインに短いリンカーで連結された、別の抗体由来のVHドメインからなる、2つの一本鎖融合産物の非共有結合によって作製することができる。Kipriyanovら、(1998), Int. J. Can 77, 763-772を参照されたい。このような二重特異性ダイアボディの安定性は、ジスルフィド橋、もしくは上記の「knob in hole」変異を導入することによって、または2つのハイブリッドScFvフラグメントがペプチドリンカーを介して連結される、一本鎖ダイアボディ(ScDb)を形成することによって、高めることができる。Kontermannら、(1999) J. Immunol. Methods 226 179-188を参照されたい。四価の二重特異性分子は、たとえば、ScFvフラグメントを、IgG分子のCH3ドメインに、またはヒンジ領域を介してFabフラグメントに、融合することによって得られる。Colomaら、(1997) Nature Biotechnol. 15, 159-163を参照されたい。あるいはまた、四価の二重特異性分子は、二重特異性一本鎖ダイアボディの融合によって作製されている(Altら、(1999) FEBS Lett 454, 90-94を参照されたい)。より小さい四価の二重特異性分子は、ヘリックス-ループ-ヘリックスモチーフ含有リンカーによるScFv-ScFvタンデムの二量体化(DiBiミニ抗体、Mullerら、(1998) FEBS Lett 432, 45-49を参照されたい)、または分子内対合を妨げる配向で4つの抗体可変領域(VHおよびVL)を含む一本鎖分子の二量体化(タンデムダイアボディ、Kipriyanovら、(1999) J.Mol.Biol. 293, 41-56を参照されたい)のいずれかによって、作製することもできる。二重特異性F(ab')2フラグメントは、Fab'フラグメントの化学的カップリングによって、またはロイシンジッパーによるヘテロ二量体化によって作製することができる(Shalabyら、(1992) J.Exp.Med. 175, 217-225、およびKostelnyら、(1992), J.Immunol. 148, 1547-1553を参照されたい)。また、単離されたVHおよびVLドメイン(Domantis plc)も利用できる。米国特許第6, 248,516号;第6,291,158号;第6, 172,197号を参照されたい。
ある実施形態において、hIL-13と特異的に結合して、hIL-13とhIL-13Rとの相互作用をモジュレートする(たとえば、hIL-13とその受容体との相互作用を阻害する)抗体フラグメント(たとえば、ScFv、Fab、Fab'、F(ab')2)、または上記のように遺伝子工学的に作製された抗体フラグメントが提供される。抗体フラグメントは、配列番号3の配列を含むCDRH3を、場合により配列番号1、2、4、5および6に記載の配列のうち1つもしくは複数を含む追加のCDRとともに、含むことができる。
本発明の抗体のVHおよびVL領域を含むScFvを作製することができる。たとえば、ScFvは、配列番号12および15を含むか、またはたとえば、配列番号13および15を含むこともある。これは、本発明のポリヌクレオチド、たとえば配列番号93および94に記載の配列、またはたとえば、配列番号28および31に記載の配列によって、作製できるであろう。本発明のある実施形態では、配列番号93および94に記載の配列によってコードされるタンパク質を含んでなるScFvが提供される。
1.5 ヘテロコンジュゲート抗体
ヘテロコンジュゲート抗体も本発明の実施形態をなすものである。ヘテロコンジュゲート抗体は、任意の好都合な架橋結合法を用いて形成される、共有結合で結ばれた2つの抗体からなる。たとえば、米国特許第4,676,980号を参照されたい。
ヘテロコンジュゲート抗体も本発明の実施形態をなすものである。ヘテロコンジュゲート抗体は、任意の好都合な架橋結合法を用いて形成される、共有結合で結ばれた2つの抗体からなる。たとえば、米国特許第4,676,980号を参照されたい。
1.6 他の改変
抗体のFc領域と、さまざまなFc受容体(FcγR)との相互作用は、抗体のエフェクター機能を仲介すると考えられるが、このエフェクター機能には、抗体依存性細胞傷害(ADCC)、補体結合、食作用、および抗体の半減期/クリアランスが含まれる。希望する特性に応じて、本発明の抗体のFc領域のさまざまな改変を行うことができる。たとえば、本来なら溶解性の抗体を非溶解性にするFc領域内の特異的変異が、欧州特許第0629 240B1号および同第0307 434B2号に詳述されており、また、抗体にサルベージ(salvage)受容体結合エピトープを組み込んで、血中半減期を延ばすことができる。米国特許第5,739,277を参照されたい。現在知られているヒトFcγ受容体には5つあり、FcγR(I)、FcRγIIa、FcγRIIb、FcγRIIIaおよび新生児FcRnである。Shieldsら、(2001) J. Biol. Chem 276, 6591-6604は、共通のIgG1残基のセットがすべてのFcγRとの結合に関与しているが、FcγRIIおよびFcγRIIIは、この共通のセットの外側にある別個の部位を利用することを明らかにした。一群のIgG1残基は、Pro-238、Asp-265、Asp-270、Asn-297およびPro-239をアラニンに変えると、すべてのFcγRへの結合を低下させた。いずれもIgG CH2ドメインに存在し、CH1およびCH2をつなぐヒンジ部の近くでクラスターを形成している。FcγRIは、結合のためにIgG1残基の共通セットのみを用いるが、FcγRIIおよびFcγRIIIは、共通セットに加えて、別個の残基とも相互作用する。一部の残基の変更は、FcγRIIとの結合のみを低下させ(たとえば、Arg-292)、またはFcγRIIIとの結合のみを低下させた(たとえば、Glu-293)。ある変異体は、FcγRIIもしくはFcγRIIIに対する結合の強化を示したが、もう一方の受容体との結合には影響を与えなかった(たとえば、Ser-267Alaは、FcγRIIに対する結合は強化したが、FcγRIIIとの結合には影響しなかった)。また他の変異体は、FcγRIIもしくはFcγRIIIに対する結合の強化を示したが、もう一方の受容体との結合は低下した(たとえば、Ser-298AlaはFcγRIIIに対する結合を強化したが、FcγRIIとの結合は低下した)。FcγRIIIaに関して、もっともよく結合するIgG1変異体は、Ser-298、Glu-333およびLys-334でのアラニン置換の組み合わせを有していた。新生児FcRn受容体は、抗体クリアランスおよび組織にわたるトランスサイトーシスのどちらにも関与していると考えられる(Junghans R. P (1997) Immunol. Res 16. 29-57 およびGhetieら、(2000) Annu. Rev. Immunol. 18, 739-766を参照されたい)。ヒトFcRnと直接相互作用すると確定されたヒト残基には、Ile253、Ser254、Lys288、Thr307、Gln311、Asn434およびHis435がある。本実施例に記載のこれらの位置のうち任意箇所での切り替えは、血中半減期の増加、および/または本発明の抗体のエフェクター特性の変更を可能にすることができる。
抗体のFc領域と、さまざまなFc受容体(FcγR)との相互作用は、抗体のエフェクター機能を仲介すると考えられるが、このエフェクター機能には、抗体依存性細胞傷害(ADCC)、補体結合、食作用、および抗体の半減期/クリアランスが含まれる。希望する特性に応じて、本発明の抗体のFc領域のさまざまな改変を行うことができる。たとえば、本来なら溶解性の抗体を非溶解性にするFc領域内の特異的変異が、欧州特許第0629 240B1号および同第0307 434B2号に詳述されており、また、抗体にサルベージ(salvage)受容体結合エピトープを組み込んで、血中半減期を延ばすことができる。米国特許第5,739,277を参照されたい。現在知られているヒトFcγ受容体には5つあり、FcγR(I)、FcRγIIa、FcγRIIb、FcγRIIIaおよび新生児FcRnである。Shieldsら、(2001) J. Biol. Chem 276, 6591-6604は、共通のIgG1残基のセットがすべてのFcγRとの結合に関与しているが、FcγRIIおよびFcγRIIIは、この共通のセットの外側にある別個の部位を利用することを明らかにした。一群のIgG1残基は、Pro-238、Asp-265、Asp-270、Asn-297およびPro-239をアラニンに変えると、すべてのFcγRへの結合を低下させた。いずれもIgG CH2ドメインに存在し、CH1およびCH2をつなぐヒンジ部の近くでクラスターを形成している。FcγRIは、結合のためにIgG1残基の共通セットのみを用いるが、FcγRIIおよびFcγRIIIは、共通セットに加えて、別個の残基とも相互作用する。一部の残基の変更は、FcγRIIとの結合のみを低下させ(たとえば、Arg-292)、またはFcγRIIIとの結合のみを低下させた(たとえば、Glu-293)。ある変異体は、FcγRIIもしくはFcγRIIIに対する結合の強化を示したが、もう一方の受容体との結合には影響を与えなかった(たとえば、Ser-267Alaは、FcγRIIに対する結合は強化したが、FcγRIIIとの結合には影響しなかった)。また他の変異体は、FcγRIIもしくはFcγRIIIに対する結合の強化を示したが、もう一方の受容体との結合は低下した(たとえば、Ser-298AlaはFcγRIIIに対する結合を強化したが、FcγRIIとの結合は低下した)。FcγRIIIaに関して、もっともよく結合するIgG1変異体は、Ser-298、Glu-333およびLys-334でのアラニン置換の組み合わせを有していた。新生児FcRn受容体は、抗体クリアランスおよび組織にわたるトランスサイトーシスのどちらにも関与していると考えられる(Junghans R. P (1997) Immunol. Res 16. 29-57 およびGhetieら、(2000) Annu. Rev. Immunol. 18, 739-766を参照されたい)。ヒトFcRnと直接相互作用すると確定されたヒト残基には、Ile253、Ser254、Lys288、Thr307、Gln311、Asn434およびHis435がある。本実施例に記載のこれらの位置のうち任意箇所での切り替えは、血中半減期の増加、および/または本発明の抗体のエフェクター特性の変更を可能にすることができる。
他の改変には、本発明の抗体のグリコシル化変異体がある。抗体の定常領域内の保存された位置でのグリコシル化は、抗体機能、特に上記のようなエフェクター機能に重大な影響を及ぼすことが知られている。たとえば、Boydら、(1996), Mol. Immunol. 32, 1311-1318を参照されたい。1つもしくは複数の糖鎖を付加、置換、欠失もしくは修飾した、本発明の抗体もしくはその抗原結合フラグメントのグリコシル化変異体が想定される。アスパラギン-X-セリン、もしくはアスパラギン-X-スレオニンモチーフの導入は、糖鎖を酵素的に連結することができる部位を作り出すので、それを用いて、抗体のグリコシル化を操作することができる。Rajuら、(2001) Biochemistry 40, 8868-8876において、TNFR-IgGイムノアドヘシンの末端シアリル化は、β-1,4-ガラクトシルトランスフェラーゼおよび/またはα-2,3-シアリルトランスフェラーゼによる再ガラクトシル化および/または再シアリル化により増加した。末端シアリル化の増加は、免疫グロブリンの半減期を増加させると考えられる。抗体は、ほとんどの糖タンパク質と同様に、典型的にはグリコフォームの混合物として産生される。こうした混合物は、抗体を真核生物、とりわけ哺乳類細胞内で産生させたとき、特に明らかである。特定したグリコフォームを製造するために、さまざまな方法が開発されてきた。Zhangら、Science (2004), 303, 371、 Searsら、Science, (2001) 291, 2344、 Wackerら、(2002) Science, 298 1790、Davisら、(2002) Chem. Rev. 102, 579、Hangら、(2001) Acc. Chem. Res 34, 727を参照されたい。したがって、本発明は、前記抗体もしくはその抗原結合フラグメントの特定された数(たとえば7個以下、例として5個以下、たとえば2または1個)のグリコフォームを含んでなる、本明細書に記載の複数の(モノクローナル)抗体(IgG1アイソタイプ、たとえばIgG1とすることができる)を想定する。
本発明のさらに他の実施形態には、ポリエチレングリコール(PEG)、ポリプロピレングリコールもしくはポリオキシアルキレンといった、非タンパク質性ポリマーと結合した本発明の抗体もしくはその抗原結合フラグメントが含まれる。タンパク質のPEGとの結合は、タンパク質の半減期を長くするのと同時に、タンパク質の抗原性および免疫原性を低下させるための確立された技術である。分子量および形状(直鎖もしくは分枝)の異なるPEG化の使用は、インタクトな抗体、ならびにFab'フラグメントで検討されている。Koumenis I.L.ら、(2000) Int. J. Pharmaceut. 198:83-95を参照されたい。
2. 生産方法
本発明の抗体は、ポリクローナル集団として作製することができるが、モノクローナル集団として(すなわち、抗原の特定の結合部位に対する同一抗体からなる実質的に均一な集団として)作製するほうが好ましい。集団が2つ以上の抗体種を意味することは、当然、当業者には明らかである。本発明の抗体は、ヤギ(Pollockら、(1999), J. Immunol. Methods 231:147-157を参照されたい)、ニワトリ(Morrow KJJ (2000) Genet. Eng. News 20:1-55を参照されたい)、マウス(Pollockら)、または植物(Doran PM, (2000) Curr. Opinion Biotechnol. 11, 199-204、Ma JK-C (1998), Nat. Med. 4; 601-606、Baez Jら、BioPharm (2000) 13: 50-54、Stoger Eら、(2000) Plant Mol. Biol. 42:583-590を参照されたい)といったトランスジェニック生物内で産生することができる。抗体はまた、化学合成によっても作製することができる。しかしながら、本発明の抗体は、典型的には、当業者によく知られている組換え細胞培養技術を用いて作製される。抗体をコードするポリヌクレオチドを単離し、その後のクローニング(増幅)もしくは発現のために、複製可能なベクターに挿入する。特に宿主細胞がCHOもしくはNSOである場合(下記を参照されたい)、1つの有用な発現系は、グルタミン酸シンテターゼ系(Lonza Biologicsが販売しているものなど)である。抗体をコードするポリヌクレオチドは、従来の方法(たとえば、オリゴヌクレオチドプローブ)によって、容易に単離され、配列決定される。使用可能なベクターには、プラスミド、ウイルス、ファージ、トランスポゾン、ミニ染色体(プラスミドがその典型的な具体例である)がある。一般にこうしたベクターは、発現を促進するために、軽鎖および/または重鎖ポリヌクレオチドに機能的に連結された、シグナル配列、複製起点、1つもしくは複数のマーカー遺伝子、エンハンサーエレメント、プロモーター、および転写終結配列をさらに含有する。軽鎖および重鎖をコードするポリヌクレオチドは、別々のベクター内に挿入し、同一の宿主細胞にトランスフェクトすることができるが、必要に応じて、重鎖および軽鎖をともに同一ベクター内に挿入して、宿主細胞にトランスフェクトすることができる。このように、本発明の一態様に従って、本発明の抗体もしくはその抗原結合フラグメントの軽鎖および/または重鎖をコードするベクターを構築する方法が提供されるが、その方法は、本発明の抗体の軽鎖および/または重鎖をコードするポリヌクレオチドをベクター内に挿入することを含んでなる。
本発明の抗体は、ポリクローナル集団として作製することができるが、モノクローナル集団として(すなわち、抗原の特定の結合部位に対する同一抗体からなる実質的に均一な集団として)作製するほうが好ましい。集団が2つ以上の抗体種を意味することは、当然、当業者には明らかである。本発明の抗体は、ヤギ(Pollockら、(1999), J. Immunol. Methods 231:147-157を参照されたい)、ニワトリ(Morrow KJJ (2000) Genet. Eng. News 20:1-55を参照されたい)、マウス(Pollockら)、または植物(Doran PM, (2000) Curr. Opinion Biotechnol. 11, 199-204、Ma JK-C (1998), Nat. Med. 4; 601-606、Baez Jら、BioPharm (2000) 13: 50-54、Stoger Eら、(2000) Plant Mol. Biol. 42:583-590を参照されたい)といったトランスジェニック生物内で産生することができる。抗体はまた、化学合成によっても作製することができる。しかしながら、本発明の抗体は、典型的には、当業者によく知られている組換え細胞培養技術を用いて作製される。抗体をコードするポリヌクレオチドを単離し、その後のクローニング(増幅)もしくは発現のために、複製可能なベクターに挿入する。特に宿主細胞がCHOもしくはNSOである場合(下記を参照されたい)、1つの有用な発現系は、グルタミン酸シンテターゼ系(Lonza Biologicsが販売しているものなど)である。抗体をコードするポリヌクレオチドは、従来の方法(たとえば、オリゴヌクレオチドプローブ)によって、容易に単離され、配列決定される。使用可能なベクターには、プラスミド、ウイルス、ファージ、トランスポゾン、ミニ染色体(プラスミドがその典型的な具体例である)がある。一般にこうしたベクターは、発現を促進するために、軽鎖および/または重鎖ポリヌクレオチドに機能的に連結された、シグナル配列、複製起点、1つもしくは複数のマーカー遺伝子、エンハンサーエレメント、プロモーター、および転写終結配列をさらに含有する。軽鎖および重鎖をコードするポリヌクレオチドは、別々のベクター内に挿入し、同一の宿主細胞にトランスフェクトすることができるが、必要に応じて、重鎖および軽鎖をともに同一ベクター内に挿入して、宿主細胞にトランスフェクトすることができる。このように、本発明の一態様に従って、本発明の抗体もしくはその抗原結合フラグメントの軽鎖および/または重鎖をコードするベクターを構築する方法が提供されるが、その方法は、本発明の抗体の軽鎖および/または重鎖をコードするポリヌクレオチドをベクター内に挿入することを含んでなる。
本発明の他の態様においては、配列番号25に記載の配列を含んでなるマウスVHドメインをコードするポリヌクレオチドが提供される。
本発明の別の態様においては、配列番号26に記載の配列を含んでなるマウスVLドメインをコードするポリヌクレオチドが提供される。
別の実施形態においては、配列番号27、28、29、30からなる群から選択される配列を含んでなるVHドメインをコードするポリヌクレオチドが提供される。
別の実施形態においては、配列番号31、32、33からなる群から選択される配列を含んでなるVLドメインをコードするポリヌクレオチドが提供される。
本発明にしたがって、本発明の重鎖をコードするポリヌクレオチドが提供されるが、そのポリヌクレオチドは、配列番号34、35、36、37からなる群から選択される。
本発明にしたがって、本発明の軽鎖をコードするポリヌクレオチドが提供されるが、そのポリヌクレオチドは、配列番号38、39、40からなる群から選択される。
遺伝子コードの重複性(redundancy)のため、本発明のポリペプチドをコードする本明細書に記載のポリヌクレオチドの代わりとなるポリヌクレオチドも利用可能であることは、当業者にはすぐにわかることである。
3.1 シグナル配列
本発明の抗体は、成熟タンパク質のN末端に特異的な切断部位を有する、異種シグナル配列を含む融合タンパク質として作製することができる。シグナル配列は、宿主細胞によって認識されて、プロセシングされるべきである。原核生物の宿主細胞については、シグナル配列は、アルカリホスファターゼ、ペニシリナーゼ、または耐熱性エンテロトキシンIIリーダーとすることができる。酵母分泌のためには、シグナル配列は、酵母インベルターゼリーダー、α因子リーダー、または酸ホスファターゼリーダーとすることができる。国際公開WO90/13646を参照されたい。哺乳類細胞株では、ウイルス分泌リーダー、たとえば単純ヘルペスgDシグナル、ならびに天然免疫グロブリンシグナル配列が利用できる。典型的には、シグナル配列は、本発明の抗体をコードするDNAに、リーディングフレーム内で連結される。
本発明の抗体は、成熟タンパク質のN末端に特異的な切断部位を有する、異種シグナル配列を含む融合タンパク質として作製することができる。シグナル配列は、宿主細胞によって認識されて、プロセシングされるべきである。原核生物の宿主細胞については、シグナル配列は、アルカリホスファターゼ、ペニシリナーゼ、または耐熱性エンテロトキシンIIリーダーとすることができる。酵母分泌のためには、シグナル配列は、酵母インベルターゼリーダー、α因子リーダー、または酸ホスファターゼリーダーとすることができる。国際公開WO90/13646を参照されたい。哺乳類細胞株では、ウイルス分泌リーダー、たとえば単純ヘルペスgDシグナル、ならびに天然免疫グロブリンシグナル配列が利用できる。典型的には、シグナル配列は、本発明の抗体をコードするDNAに、リーディングフレーム内で連結される。
3.2 複製起点
複製起点は当技術分野でよく知られており、pBR322がほとんどのグラム陰性細菌に適合し、2μプラスミドがほとんどの酵母に適合し、さらに、さまざまなウイルス由来のもの、たとえば、SV40、ポリオーマ、アデノウイルス、VSVもしくはBPVはほとんどの哺乳類細胞に適している。一般に、複製起点の成分は、哺乳類発現ベクターには必要でないが、SV40は、初期プロモーターを含有しているので使用することができる。
複製起点は当技術分野でよく知られており、pBR322がほとんどのグラム陰性細菌に適合し、2μプラスミドがほとんどの酵母に適合し、さらに、さまざまなウイルス由来のもの、たとえば、SV40、ポリオーマ、アデノウイルス、VSVもしくはBPVはほとんどの哺乳類細胞に適している。一般に、複製起点の成分は、哺乳類発現ベクターには必要でないが、SV40は、初期プロモーターを含有しているので使用することができる。
3.3 選択マーカー
典型的な選択遺伝子は、(a)抗生物質もしくは他の毒素(たとえば、アンピシリン、ネオマイシン、もしくはテトラサイクリン)に対する耐性を付与するタンパク質をコードするか、または(b)栄養要求性の欠乏を補完する、もしくは複合培地で利用できない栄養素を補充するタンパク質をコードする。選択方式は、宿主細胞の増殖の停止を伴ってもよい。本発明の抗体をコードする遺伝子による形質転換が成功した細胞は、たとえば選択マーカーによって付与された薬剤耐性のために、生き残る。もう一つの例はいわゆるDHFR選択マーカーであるが、この場合、形質転換体はメトトレキサート存在下で培養される。典型的な実施形態では、メトトレキサートの量を増加させて細胞を培養し、目的の外来遺伝子のコピー数を増幅させる。CHO細胞は、DHFR選択に特に有用な細胞株である。さらにもう一つの例は、グルタミン酸シンテターゼ発現系(Lonza Biologics)である。酵母での使用に適した選択遺伝子はtrp1遺伝子である。Stinchcombら、Nature 282, 38, 1979を参照されたい。
典型的な選択遺伝子は、(a)抗生物質もしくは他の毒素(たとえば、アンピシリン、ネオマイシン、もしくはテトラサイクリン)に対する耐性を付与するタンパク質をコードするか、または(b)栄養要求性の欠乏を補完する、もしくは複合培地で利用できない栄養素を補充するタンパク質をコードする。選択方式は、宿主細胞の増殖の停止を伴ってもよい。本発明の抗体をコードする遺伝子による形質転換が成功した細胞は、たとえば選択マーカーによって付与された薬剤耐性のために、生き残る。もう一つの例はいわゆるDHFR選択マーカーであるが、この場合、形質転換体はメトトレキサート存在下で培養される。典型的な実施形態では、メトトレキサートの量を増加させて細胞を培養し、目的の外来遺伝子のコピー数を増幅させる。CHO細胞は、DHFR選択に特に有用な細胞株である。さらにもう一つの例は、グルタミン酸シンテターゼ発現系(Lonza Biologics)である。酵母での使用に適した選択遺伝子はtrp1遺伝子である。Stinchcombら、Nature 282, 38, 1979を参照されたい。
3.4 プロモーター
本発明の抗体の発現に適したプロモーターは、抗体をコードするDNA/ポリヌクレオチドに、機能するように連結される。原核生物宿主のためのプロモーターには、proAプロモーター、βラクタマーゼおよびラクトースプロモーター系、アルカリホスファターゼ、トリプトファンおよびハイブリッドプロモーター、たとえばTacがある。酵母細胞での発現に適したプロモーターには、3-ホスホグリセリン酸キナーゼまたは他の解糖系酵素、たとえばエノラーゼ、グリセルアルデヒド3リン酸デヒドロゲナーゼ、ヘキソキナーゼ、ピルビン酸デカルボキシラーゼ、ホスホフルクトキナーゼ、グルコース6リン酸イソメラーゼ、3-ホスホグリセリン酸ムターゼおよびグルコキナーゼがある。誘導性酵母プロモーターには、アルコールデヒドロゲナーゼ2、イソチトクロームC、酸ホスファターゼ、メタロチオネイン、および窒素代謝またはマルトース/ガラクトース利用を担う酵素が含まれる。哺乳類細胞株における発現のためのプロモーターには、ウイルスプロモーター、たとえば、ポリオーマ、鶏痘およびアデノウイルス(たとえばアデノウイルス2)、ウシパピローマウイルス、トリ肉腫ウイルス、サイトメガロウイルス(具体的には前初期遺伝子プロモーター)、レトロウイルス、B型肝炎ウイルス、アクチン、ラウス肉腫ウイルス(RSV)プロモーター、ならびに初期もしくは後期シミアンウイルス40がある。当然、プロモーターの選択は、発現に使用される宿主細胞との適切な適合性に基づく。したがって、ある実施形態において、RSVおよび/またはSV40および/またはCMVプロモーター、本発明の軽鎖V領域(VL)をコードするDNA、κC領域を、ネオマイシンおよびアンピシリン耐性選択マーカーとともに含有する第1のプラスミド、ならびにRSVまたはSV40プロモーター、本発明の重鎖V領域(VH)をコードするDNA、γ1定常領域をコードするDNA、DHFRおよびアンピシリン耐性マーカーを含有する第2のプラスミドが提供される。
本発明の抗体の発現に適したプロモーターは、抗体をコードするDNA/ポリヌクレオチドに、機能するように連結される。原核生物宿主のためのプロモーターには、proAプロモーター、βラクタマーゼおよびラクトースプロモーター系、アルカリホスファターゼ、トリプトファンおよびハイブリッドプロモーター、たとえばTacがある。酵母細胞での発現に適したプロモーターには、3-ホスホグリセリン酸キナーゼまたは他の解糖系酵素、たとえばエノラーゼ、グリセルアルデヒド3リン酸デヒドロゲナーゼ、ヘキソキナーゼ、ピルビン酸デカルボキシラーゼ、ホスホフルクトキナーゼ、グルコース6リン酸イソメラーゼ、3-ホスホグリセリン酸ムターゼおよびグルコキナーゼがある。誘導性酵母プロモーターには、アルコールデヒドロゲナーゼ2、イソチトクロームC、酸ホスファターゼ、メタロチオネイン、および窒素代謝またはマルトース/ガラクトース利用を担う酵素が含まれる。哺乳類細胞株における発現のためのプロモーターには、ウイルスプロモーター、たとえば、ポリオーマ、鶏痘およびアデノウイルス(たとえばアデノウイルス2)、ウシパピローマウイルス、トリ肉腫ウイルス、サイトメガロウイルス(具体的には前初期遺伝子プロモーター)、レトロウイルス、B型肝炎ウイルス、アクチン、ラウス肉腫ウイルス(RSV)プロモーター、ならびに初期もしくは後期シミアンウイルス40がある。当然、プロモーターの選択は、発現に使用される宿主細胞との適切な適合性に基づく。したがって、ある実施形態において、RSVおよび/またはSV40および/またはCMVプロモーター、本発明の軽鎖V領域(VL)をコードするDNA、κC領域を、ネオマイシンおよびアンピシリン耐性選択マーカーとともに含有する第1のプラスミド、ならびにRSVまたはSV40プロモーター、本発明の重鎖V領域(VH)をコードするDNA、γ1定常領域をコードするDNA、DHFRおよびアンピシリン耐性マーカーを含有する第2のプラスミドが提供される。
3.5 エンハンサーエレメント
必要に応じて、たとえば、高等真核生物での発現のために、ベクター内でプロモーターエレメントに機能しうるように連結されたエンハンサーエレメントを使用することができる。適当な哺乳類エンハンサー配列には、グロビン、エラスターゼ、アルブミン、フェトプロテインおよびインスリン由来のエンハンサー要素が含まれる。あるいはまた、SV40エンハンサー(bp100-270)、サイトメガロウイルス初期プロモーターエンハンサー、ポリーマエンハンサー、バキュロウイルスエンハンサー、またはマウスIgG2a遺伝子座といった、真核細胞ウイルス起源のエンハンサーエレメントを使用してもよい(国際公開WO04/009823を参照されたい)。エンハンサーは、ベクター上で、プロモーターの上流の部位に位置することが好ましい。
必要に応じて、たとえば、高等真核生物での発現のために、ベクター内でプロモーターエレメントに機能しうるように連結されたエンハンサーエレメントを使用することができる。適当な哺乳類エンハンサー配列には、グロビン、エラスターゼ、アルブミン、フェトプロテインおよびインスリン由来のエンハンサー要素が含まれる。あるいはまた、SV40エンハンサー(bp100-270)、サイトメガロウイルス初期プロモーターエンハンサー、ポリーマエンハンサー、バキュロウイルスエンハンサー、またはマウスIgG2a遺伝子座といった、真核細胞ウイルス起源のエンハンサーエレメントを使用してもよい(国際公開WO04/009823を参照されたい)。エンハンサーは、ベクター上で、プロモーターの上流の部位に位置することが好ましい。
3.5.5 ポリアデニル化シグナル
真核細胞系では、ポリアデニル化シグナルが、本発明の抗体をコードするDNA/ポリヌクレオチドに、機能しうるように連結される。こうしたシグナルは典型的には、オープンリーシングフレームの3'側に置かれる。哺乳類の系で、限定的でない例としては、成長ホルモン、伸長因子1αおよびウイルス(たとえば、SV40)遺伝子、またはレトロウイルスのロング・ターミナル・リピート由来のシグナルが挙げられる。酵母系では、ポリアデニル化/終結シグナルの限定的でない例として、ホスホグリセリン酸キナーゼ(PGK)およびアルコールデヒドロゲナーゼ1(ADH)遺伝子由来のシグナルが挙げられる。原核細胞系では、ポリアデニル化シグナルは一般的には必要とされず、その代わりにもっと短く明確な転写終結配列を用いるのが通例である。当然、ポリアデニル化/終結配列の選択は、発現に使用される宿主との適切な適合性に基づいて行われる。
真核細胞系では、ポリアデニル化シグナルが、本発明の抗体をコードするDNA/ポリヌクレオチドに、機能しうるように連結される。こうしたシグナルは典型的には、オープンリーシングフレームの3'側に置かれる。哺乳類の系で、限定的でない例としては、成長ホルモン、伸長因子1αおよびウイルス(たとえば、SV40)遺伝子、またはレトロウイルスのロング・ターミナル・リピート由来のシグナルが挙げられる。酵母系では、ポリアデニル化/終結シグナルの限定的でない例として、ホスホグリセリン酸キナーゼ(PGK)およびアルコールデヒドロゲナーゼ1(ADH)遺伝子由来のシグナルが挙げられる。原核細胞系では、ポリアデニル化シグナルは一般的には必要とされず、その代わりにもっと短く明確な転写終結配列を用いるのが通例である。当然、ポリアデニル化/終結配列の選択は、発現に使用される宿主との適切な適合性に基づいて行われる。
3.6 宿主細胞
本発明の抗体をコードするベクターをクローニングし、または発現させるのに適した宿主細胞は、原核細胞、酵母、もしくは高等真核細胞である。適当な原核細胞には、真正細菌、例を挙げると、腸内細菌科、エシェリキア属(Escherichia)たとえば大腸菌(E. coli)(たとえば、ATCC 31,446; 31,537; 27,325)、エンテロバクター属(Enterobacter)、エルウィニア属(Erwinia)、クレブシエラ属(Klebsiella)、プロテウス属(Proteus)、サルモネラ属(Salmonella)たとえばネズミチフス菌(Salmonella typhimurium)、セラチア属(Serratia)たとえばSerratia marcescens、および赤痢菌属(Shigella)など、ならびにバシラス属(Bacilli)の枯草菌(B. subtilis)およびB. licheniformis(DD 266 710を参照されたい)など、シュードモナス属(Pseudomonas)の緑膿菌(P. aeruginosa)など、さらにストレプトミセス属(Streptomyces)がある。酵母宿主細胞のうち、サッカロミセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス・ポンベ(schizosaccharomyces pombe)、クルイベロミセス属(Kluyveromyces)(たとえば、ATCC 16,045; 12,424; 24178; 56,500)、ヤロウィア属(yarrowia)(欧州特許第402, 226号)、ピキア・パストリス(Pichia Pastoris)(欧州特許第183, 070号、Pengら、J.Biotechnol. 108 (2004) 185-192も参照されたい)、カンジダ属(Candida)、トリコデルマ・リーシア(Trichoderma reesia)(欧州特許第244, 234号)、ペニシリン属(Penicillin)、トリポクラジウム属(Tolypocladium)ならびにアスペルギルス属(Aspergillus)宿主、たとえばアスペルギルス・ニデュランス(A. nidulans)およびクロコウジカビ(A. niger)も想定される。
本発明の抗体をコードするベクターをクローニングし、または発現させるのに適した宿主細胞は、原核細胞、酵母、もしくは高等真核細胞である。適当な原核細胞には、真正細菌、例を挙げると、腸内細菌科、エシェリキア属(Escherichia)たとえば大腸菌(E. coli)(たとえば、ATCC 31,446; 31,537; 27,325)、エンテロバクター属(Enterobacter)、エルウィニア属(Erwinia)、クレブシエラ属(Klebsiella)、プロテウス属(Proteus)、サルモネラ属(Salmonella)たとえばネズミチフス菌(Salmonella typhimurium)、セラチア属(Serratia)たとえばSerratia marcescens、および赤痢菌属(Shigella)など、ならびにバシラス属(Bacilli)の枯草菌(B. subtilis)およびB. licheniformis(DD 266 710を参照されたい)など、シュードモナス属(Pseudomonas)の緑膿菌(P. aeruginosa)など、さらにストレプトミセス属(Streptomyces)がある。酵母宿主細胞のうち、サッカロミセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス・ポンベ(schizosaccharomyces pombe)、クルイベロミセス属(Kluyveromyces)(たとえば、ATCC 16,045; 12,424; 24178; 56,500)、ヤロウィア属(yarrowia)(欧州特許第402, 226号)、ピキア・パストリス(Pichia Pastoris)(欧州特許第183, 070号、Pengら、J.Biotechnol. 108 (2004) 185-192も参照されたい)、カンジダ属(Candida)、トリコデルマ・リーシア(Trichoderma reesia)(欧州特許第244, 234号)、ペニシリン属(Penicillin)、トリポクラジウム属(Tolypocladium)ならびにアスペルギルス属(Aspergillus)宿主、たとえばアスペルギルス・ニデュランス(A. nidulans)およびクロコウジカビ(A. niger)も想定される。
原核生物および酵母宿主細胞は、具体的に本発明で想定はされるが、しかしながら、本発明の宿主細胞は、高等真核細胞であることが好ましい。適当な高等真核生物宿主細胞には、哺乳類細胞、たとえば、COS-1 (ATCC番号 CRL 1650)、COS-7 (ATCC CRL 1651)、ヒト胚性腎細胞株293、仔ハムスター腎細胞(BHK) (ATCC CRL.1632)、BHK570 (ATCC番号: CRL 10314)、293 (ATCC番号CRL 1573)、チャイニーズハムスター卵巣細胞CHO(たとえば、CHO-K1、ATCC番号: CCL 61、DHFR-CHO細胞株、たとえばDG44など(Urlaubら、(1986) Somatic Cell Mol.Genet.12, 555-556を参照されたい))、特に懸濁培養に適したCHO細胞株、マウスセルトリ細胞、サル腎細胞、アフリカミドリザル腎細胞(ATCC CRL-1587)、HELA細胞、イヌ腎細胞(ATCC CCL 34)、ヒト肺細胞(ATCC CCL 75)、Hep G2および骨髄腫もしくはリンパ腫細胞、たとえばNS0(米国特許第5,807,715号を参照されたい)、Sp2/0、Y0が含まれる。
したがって、本発明のある実施形態において、本明細書に記載の抗体もしくはその抗原結合フラグメントの重鎖および/または軽鎖をコードするベクターを含んでなる、安定して形質転換された宿主細胞が提供される。こうした宿主細胞は、好ましくは、軽鎖をコードする第1のベクター、および前記重鎖をコードする第2のベクターを含んでなる。
細菌発酵
細菌系は、抗体フラグメントの発現に特に適している。こうしたフラグメントは、細胞内、もしくはペリプラズム内に局在する。当業者に知られている方法にしたがって、不溶性ペリプラズムタンパク質を抽出し、リフォールディングして活性タンパク質を形成することができる。Sanchezら、(1999) J. Biotechnol. 72, 13-20およびCupit PMら、(1999) Lett Appl Microbiol, 29, 273-277を参照されたい。
細菌系は、抗体フラグメントの発現に特に適している。こうしたフラグメントは、細胞内、もしくはペリプラズム内に局在する。当業者に知られている方法にしたがって、不溶性ペリプラズムタンパク質を抽出し、リフォールディングして活性タンパク質を形成することができる。Sanchezら、(1999) J. Biotechnol. 72, 13-20およびCupit PMら、(1999) Lett Appl Microbiol, 29, 273-277を参照されたい。
3.7 細胞培養法
本発明の抗体もしくはその抗原結合フラグメントをコードするベクターで形質転換された宿主細胞は、当業者に知られている方法によって培養することができる。宿主細胞は、スピナーフラスコ、ローラーボトル、または中空糸の系で培養することができるが、大規模生産のためには、特に懸濁培養用に撹拌槽型リアクターを使用することが好ましい。撹拌槽は、たとえば、スパージャー、バッフルもしくは低剪断インペラを用いて、通気に適合させることが好ましい。気泡塔およびエアリフトリアクターには、空気もしくは酸素気泡による直接通気を用いることができる。宿主細胞を無血清培地中で培養する場合、通気プロセスの結果として細胞が損傷するのを防ぐのに役立つ、プルロニックF-68のような細胞保護物質を添加することが好ましい。宿主細胞の特性に応じて、マイクロキャリアを、足場依存性細胞株の増殖基質として使用することができるが、細胞を懸濁培養に適応させることもできる(こちらが一般的である)。宿主細胞、特に無脊椎動物宿主細胞の培養は、流加培養、反復バッチ処理(Drapeauら、(1994) cytotechnology 15: 103-109を参照されたい)、延長バッチ法もしくは潅流培養といった、さまざまな運転モードを利用することができる。組換えによって形質転換された哺乳類宿主細胞は、ウシ胎仔血清(FCS)のような血清含有培地で培養することができるが、こうした宿主細胞は、Keenら、(1995) Cytotechnology 17:153-163に記載の合成無血清培地、またはProCHO-CDMもしくはUltraCHO(商標名)(Cambrex NJ, USA)といった市販の培地中で、必要ならば、グルコースなどのエネルギー源および組換えインスリンのような合成増殖因子を添加して、培養することが好ましい。宿主細胞の無血清培養は、その細胞が無血清条件での増殖に適応していることを必要とすると考えられる。1つの適応法は、こうした宿主細胞を血清含有培地で培養し、宿主が無血清条件に適応するようになるように、培地の80%を無血清培地に繰り返し交換することである(たとえば、Scharfenberg Kら、(1995)「動物細胞工学」(Animal Cell technology)より: 21世紀に向けた開発(Developments towar
ds the 21st century)(Beuvery E.C.ら、編)、619-623ページ, Kluwer Academic publishersを参照されたい)。
本発明の抗体もしくはその抗原結合フラグメントをコードするベクターで形質転換された宿主細胞は、当業者に知られている方法によって培養することができる。宿主細胞は、スピナーフラスコ、ローラーボトル、または中空糸の系で培養することができるが、大規模生産のためには、特に懸濁培養用に撹拌槽型リアクターを使用することが好ましい。撹拌槽は、たとえば、スパージャー、バッフルもしくは低剪断インペラを用いて、通気に適合させることが好ましい。気泡塔およびエアリフトリアクターには、空気もしくは酸素気泡による直接通気を用いることができる。宿主細胞を無血清培地中で培養する場合、通気プロセスの結果として細胞が損傷するのを防ぐのに役立つ、プルロニックF-68のような細胞保護物質を添加することが好ましい。宿主細胞の特性に応じて、マイクロキャリアを、足場依存性細胞株の増殖基質として使用することができるが、細胞を懸濁培養に適応させることもできる(こちらが一般的である)。宿主細胞、特に無脊椎動物宿主細胞の培養は、流加培養、反復バッチ処理(Drapeauら、(1994) cytotechnology 15: 103-109を参照されたい)、延長バッチ法もしくは潅流培養といった、さまざまな運転モードを利用することができる。組換えによって形質転換された哺乳類宿主細胞は、ウシ胎仔血清(FCS)のような血清含有培地で培養することができるが、こうした宿主細胞は、Keenら、(1995) Cytotechnology 17:153-163に記載の合成無血清培地、またはProCHO-CDMもしくはUltraCHO(商標名)(Cambrex NJ, USA)といった市販の培地中で、必要ならば、グルコースなどのエネルギー源および組換えインスリンのような合成増殖因子を添加して、培養することが好ましい。宿主細胞の無血清培養は、その細胞が無血清条件での増殖に適応していることを必要とすると考えられる。1つの適応法は、こうした宿主細胞を血清含有培地で培養し、宿主が無血清条件に適応するようになるように、培地の80%を無血清培地に繰り返し交換することである(たとえば、Scharfenberg Kら、(1995)「動物細胞工学」(Animal Cell technology)より: 21世紀に向けた開発(Developments towar
ds the 21st century)(Beuvery E.C.ら、編)、619-623ページ, Kluwer Academic publishersを参照されたい)。
培地中に分泌された本発明の抗体は、さまざまな技法を用いて回収および精製され、目的の用途に適した精製度を与えることができる。たとえば、本発明の抗体をヒト患者の治療に使用するには、一般に少なくとも95%の純度、より典型的には98%、もしくは99%以上の純度が要求される(粗製の培地と対比して)。第1の例では、細胞片を培地から、一般には、遠心によって除去し、次に、たとえば、精密濾過、限外濾過および/または深層濾過を用いて、清澄化ステップを行う。さまざまな他の技法、たとえば、透析およびゲル電気泳動、ならびにクロマトグラフ法、例としてヒドロキシアパタイト(HA)、アフィニティクロマトグラフィー(状況に応じて、ポリヒスチジンのようなアフィニティタグ標識システムを含む)および/または疎水性相互作用クロマトグラフィー(HIC、米国特許第5, 429,746号を参照されたい)が利用できる。ある実施形態において、本発明の抗体は、さまざまな清澄化ステップの後、Protein AもしくはGアフィニティクロマトグラフィーを用いて捕捉し、次いでさらに、イオン交換および/またはHAクロマトグラフィー、陰イオンもしくは陽イオン交換、サイズ排除クロマトグラフィーといったクロマトグラフィーステップ、および硫安沈澱を行う。一般に、さまざまなウイルス除去ステップも行われる(たとえば、DV-20フィルターなどを用いたナノ濾過)。こうしたさまざまなステップの後、少なくとも75mg/ml以上、たとえば100mg/ml以上の本発明の抗体もしくはその抗原結合フラグメントを含む精製(好ましくはモノクローナル)調製物が得られ、したがってその調製物が本発明の実施形態を構成する。適切なことに、この調製物は本発明の抗体の凝集体を実質的に含まない。
4. 医薬組成物
上記の本発明の抗体の精製調製物(特にモノクローナル調製物)を、アトピー性疾患、たとえば喘息、アレルギー性鼻炎、COPDといった、ヒトの疾患および障害の治療に用いる医薬組成物に組み入れることができる。典型的には、こうした組成物は、許容される医薬慣習で知られ、必要とされる、製薬上許容される担体を含んでなる。たとえば、Remingtons Pharmaceutical Sciences, 第16版、(1980), Mack Publishing Coを参照されたい。このような担体の例としては、適当なバッファーでpH5〜8の範囲内に緩衝化された、生理食塩水、リンガー溶液もしくはブドウ糖溶液のような滅菌担体がある。注射用(たとえば、静脈内、腹腔内、皮内、皮下、筋肉内もしくは門脈内投与による)または持続点滴用の医薬組成物は、目に見える粒子状物質のない適切な状態で、0.1ng〜100mgの抗体、好ましくは5mg〜25mgの抗体を含有することができる。このような医薬組成物を調製する方法は、当業者によく知られている。ある実施形態において、医薬組成物は、0.1ng〜100mgの本発明の抗体を、状況に応じて使用説明書と共に、単位投与形態中に含んでなる。本発明の医薬組成物は、当業者に周知の、もしくは明白な方法にしたがって投与前に再調製されるように、凍結乾燥されていてもよい。本発明の実施形態がIgG1アイソタイプを有する本発明の抗体を含んでなる場合、クエン酸塩(たとえば、クエン酸ナトリウム)またはEDTAまたはヒスチジンといった銅のキレート剤を医薬組成物に添加して、このアイソタイプの抗体の、銅を介した分解の度合いを低下させることができる。欧州特許第0612251号を参照されたい。抗hIL-13治療は、経口で、吸入で、局所的に(たとえば、眼内、鼻腔内、直腸、皮膚の創傷内)行うことができる。
上記の本発明の抗体の精製調製物(特にモノクローナル調製物)を、アトピー性疾患、たとえば喘息、アレルギー性鼻炎、COPDといった、ヒトの疾患および障害の治療に用いる医薬組成物に組み入れることができる。典型的には、こうした組成物は、許容される医薬慣習で知られ、必要とされる、製薬上許容される担体を含んでなる。たとえば、Remingtons Pharmaceutical Sciences, 第16版、(1980), Mack Publishing Coを参照されたい。このような担体の例としては、適当なバッファーでpH5〜8の範囲内に緩衝化された、生理食塩水、リンガー溶液もしくはブドウ糖溶液のような滅菌担体がある。注射用(たとえば、静脈内、腹腔内、皮内、皮下、筋肉内もしくは門脈内投与による)または持続点滴用の医薬組成物は、目に見える粒子状物質のない適切な状態で、0.1ng〜100mgの抗体、好ましくは5mg〜25mgの抗体を含有することができる。このような医薬組成物を調製する方法は、当業者によく知られている。ある実施形態において、医薬組成物は、0.1ng〜100mgの本発明の抗体を、状況に応じて使用説明書と共に、単位投与形態中に含んでなる。本発明の医薬組成物は、当業者に周知の、もしくは明白な方法にしたがって投与前に再調製されるように、凍結乾燥されていてもよい。本発明の実施形態がIgG1アイソタイプを有する本発明の抗体を含んでなる場合、クエン酸塩(たとえば、クエン酸ナトリウム)またはEDTAまたはヒスチジンといった銅のキレート剤を医薬組成物に添加して、このアイソタイプの抗体の、銅を介した分解の度合いを低下させることができる。欧州特許第0612251号を参照されたい。抗hIL-13治療は、経口で、吸入で、局所的に(たとえば、眼内、鼻腔内、直腸、皮膚の創傷内)行うことができる。
本発明の抗体を投与するための有効投与量および治療計画は、一般に、経験的に決定され、患者の年齢、体重および健康状態、ならびに治療すべき疾患もしくは障害といった要因に左右される。こうした要因は主治医の裁量の範囲内にある。適当な投与量を選択する際の指針は、たとえばSmithら、(1977)「ヒトの診断および治療における抗体」(Antibodies in human diagnosis and therapy)、Raven Press, New Yorkに見出すことができるが、概して1mg〜1000mgである。
治療すべき疾患もしくは障害(特に喘息)に応じて、治療上有効な量の本発明の抗体を含んでなる医薬組成物を、治療上有効な量のもう一つの薬剤、たとえば、抗炎症薬(たとえば、副腎皮質ステロイドまたはNSAID)、抗コリン薬(具体的には、M1/M2/M3 受容体拮抗薬)、β2アドレナリン受容体作動薬、抗感染薬(たとえば、抗生物質、抗ウイルス薬)、抗ヒスタミン薬、PDE4阻害薬とともに、同時に、別々に、または順次、使用することができる。β2アドレナリン受容体作動薬の例には、サルメテロール、サルブタモール、ホルモテロール、サルメファモール(salmefamol)、フェノテロール、テルブタリンがある。好ましい長時間作用型β2アドレナリン受容体作動薬には、国際公開WO02/66422A、WO02/270490、WO02/076933、WO03/024439およびWO03/072539に記載のものがある。適当な副腎皮質ステロイドには、メチルプレドニゾロン、プレドニゾロン、デキサメタゾン、プロピオン酸フルチカゾン、6α, 9α-ジフルオロ-17α-[(2-フラニルカルボニル)オキシ]-11β-ヒドロキシ-16α-メチル-3-オキソ-アンドロスタ-1,4-ジエン-17β-カルボチオ酸S-フルオロメチルエステル、6α, 9α-ジフルオロ-11β-ヒドロキシ-16α-メチル-3-オキソ-17α-プロピオニルオキシ-アンドロスタ-1,4-ジエン-17β-カルボチオ酸S-(2-オキソ-テトラヒドロ-フラン-3S-イル) エステル、ベクロメタゾンエステル(たとえば、17-プロピオン酸エステル、もしくは17,21-ジプロピオン酸エステル)、ブデソニド、フルニソリド、モメタゾンエステル(たとえば、フロ酸エステル)、トリアムシノロンアセトニド、ロフレポニド(rofleponide)、シクレソニド(16α,17-[[(R)-シクロヘキシルメチレン]ビス(オキシ)]-11β, 21-ジヒドロキシ-プレグナ-1,4-ジエン-3,20-ジオン)、プロピオン酸ブチキソコート(butixocort propionate)、RPR-106541、およびST-126がある。好ましい副腎皮質ステロイドには、プロピオン酸フルチカゾン、6α,9α-ジフルオロ-11β-ヒドロキシ-16α-メチル-17α-[(4-メチル-1,3-チアゾール-5-カルボニル)オキシ]-3-オキソ-アンドロスタ-1,4-ジエン-17β-カルボチオ酸 S-フルオロメチルエステル、および6α,9α-ジフルオロ-17α-[(2-フラニルカルボニル)オキシ]-11β-ヒドロキシ-16α-メチル-3-オキソ-アンドロスタ-1,4-ジエン-17β-カルボチオ酸 S-フルオロメチルエステルがあるが、6α,9α-ジフルオロ-17α-[(2-フラニルカルボニル)オキシ]-11β-ヒドロキシ-16α-メチル-3-オキソ-アンドロスタ-1,4-ジエン-17β-カルボチオ酸 S-フルオロメチルエステルの方が好ましい。
グルココルチコイドのアゴニズム作用を有する非ステロイド系化合物は、トランス活性化に比してトランス抑制についての選択性を有し、併用療法に有用であると考えられるが、これらの化合物には、国際公開WO03/082827、WO01/10143、WO98/54159、WO04/005229、WO04/009016、WO04/009017、WO04/018429、WO03/104195、WO03/082787、WO03/082280、WO03/059899、WO03/101932、WO02/02565、WO01/16128、WO00/66590、WO03/086294、WO04/026248、WO03/061651、WO03/08277に記載の化合物がある。
適当な抗炎症薬には、非ステロイド系抗炎症薬(NSAID)がある。
適当なNSAIDとしては、クロモグリク酸ナトリウム、ネドクロミルナトリウム、ホスホジエステラーゼ(PDE)阻害薬(たとえば、テオフィリン、PDE4阻害薬、もしくは混合PDE3/PDE4阻害薬)、ロイコトリエン拮抗薬、ロイコトリエン合成阻害薬(たとえば、モンテルカスト)、iNOS阻害薬、トリプターゼおよびエラスターゼ阻害薬、β-2インテグリン拮抗薬およびアデノシン受容体作動薬もしくは拮抗薬(たとえば、アデノシン2A作動薬)、サイトカイン拮抗薬(たとえば、CCR3拮抗薬などのケモカイン拮抗薬、)もしくはサイトカイン合成阻害薬、または5-リポキシゲナーゼ阻害薬がある。適当な他のβ2アドレナリン受容体作動薬には、サルメテロール(たとえば、キシナホ酸塩として)、サルブタモール(たとえば、硫酸塩もしくは遊離塩基として)、ホルモテロール(たとえば、フマル酸塩として)、フェノテロール、またはテルブタリン、ならびにそれらの塩が挙げられる。iNOS(誘導型一酸化窒素合成酵素)阻害薬は経口投与用であることが好ましい。適当なiNOS阻害薬には、国際公開WO93/13055、WO98/30537、WO02/50021、WO95/34534およびWO99/62875に記載のものがある。適当なCCR3阻害薬には、国際公開WO02/26722に記載のものが含まれる。
特に興味深いのは、本発明の抗体を、ホスホジエステラーゼ4(PDE4)阻害薬と併せて使用することである。本発明のこの態様に有用なPDE4特異的阻害薬は、PDE4酵素を阻害することが知られている、またはPDE4阻害薬として作用することが判明している、PDE4のみの阻害薬である任意の化合物であって、PDE4のみならず、PDEファミリーの他のPDE、たとえばPDE3およびPDE5も阻害する化合物ではないと考えられる。
該当する化合物には、cis-4-シアノ-4-(3-シクロペンチルオキシ-4-メトキシフェニル)シクロヘキサン-1-カルボン酸、2-カルボメトキシ-4-シアノ-4-(3-シクロプロピルメトキシ-4-ジフルオロメトキシフェニル)シクロヘキサン-1-オン、およびcis-[4-シアノ-4-(3-シクロプロピルメトキシ-4-ジフルオロメトキシフェニル)シクロヘキサン-1-オール]がある。また、cis-4-シアノ-4-[3-(シクロペンチルオキシ)-4-メトキシフェニル]シクロヘキサン-1-カルボン酸(シロミラストとしても知られている)およびその塩、エステル、プロドラッグ、もしくは物理的形態が、1996年9月3日発行の米国特許第5,552,438号に記載されている;この特許、ならびにそれに開示される化合物は、参考としてその全体を本明細書に含めるものとする。
Elbion社製AWD-12-281(Hofgen, N.ら、15th EFMC Int Symp Med Chem (9月6-10日、Edinburgh) 1998、要旨集P.98;CAS参照番号247584020-9); NCS-613 (INSERM)と称する9-ベンジルアデニン誘導体;Chiroscience社およびSchering-Plough社が提供するD-4418; CI-1018 (PD-168787)として同定され、Pfizer社に帰属するベンゾジアゼピンPDE4阻害薬; 国際公開WO99/16766で協和発酵によって開示されたベンゾジオキソール誘導体; 協和発酵のK-34; Napp社製 V-11294A(Landells, L.J.ら、Eur Resp J [Annu Cong Eur Resp Soc (9月19-23日、Geneva) 1998] 1998, 12 (補遺28): 要旨集P.2393);Byk-Gulden社製 ロフルミラスト(CAS参照番号162401-32-3)およびフタラジノン(国際公開WO99/47505、その開示は参考として本明細書に含めるものとする);Byk-Gulden社、現在はAltana社が製造および公開した、混合PDE3/PDE4阻害薬である、プマフェントリン(Pumafentrine)、(-)-p-[(4aR*,10bS*)-9-エトキシ-1,2,3,4,4a,10b-ヘキサヒドロ-8-メトキシ-2-メチルベンゾ[c][1,6]ナフチリジン-6-イル]-N,N-ジイソプロピルベンズアミド;Almirall-Prodesfarma社により開発中のアロフィリン(arofylline); Vernalis社のVM554/UM565;またはT-440 (田辺製薬;Fuji, K.ら、J Pharmacol Exp Ther,1998, 284(1): 162)、およびT2585。
該当するさらに他の化合物が、公開国際特許出願WO04/024728 (Glaxo Group Ltd)、PCT/EP2003/014867 (Glaxo Group Ltd) およびPCT/EP2004/005494 (Glaxo Group Ltd)に開示されている。
適当な抗コリン薬は、ムスカリン受容体で拮抗剤として作用する化合物であり、具体的には、M1 もしくはM3受容体の拮抗剤、M1/M3 もしくはM2/M3受容体の二重拮抗剤、またはM1/M2/M3受容体の汎用拮抗剤である化合物である。吸入投与用の化合物の例としては、イプラトロピウム(たとえば、臭化物として、CAS 22254-24-6、アトロベントという商品名で販売)、オキシトロピウム(たとえば、臭化物として、CAS 30286-75-0)およびチオトロピウム(たとえば、臭化物として、CAS 136310-93-5、スピリーバという商品名で販売)がある。レバトロパン酸(たとえば、臭化水素酸塩として、CAS 262586-79-8)、および国際公開WO01/04118に開示されたLAS-34273も興味深い。経口投与用の化合物の例としては、ピレンゼピン(CAS 28797-61-7)、ダリフェナシン(CAS 133099-04-4、もしくは臭素酸塩についてはCAS 133099-07-7、エナブレックス(Enablex)の商品名で販売)、オキシブチニン(CAS 5633-20-5、ジトロパン(Ditropan)の商品名で販売)、テロジリン (CAS 15793-40-5)、トルテロジン(CAS 124937-51-5、または酒石酸塩についてはCAS 124937-52-6 、デトロール(Detrol)の商品名で販売)、オチロニウム(otilonium)(たとえば、臭化物として、CAS 26095-59-0、Spasmomenの商品名で販売)、塩化トロスピウム(CAS 10405-02-4)およびソリフェナシン(CAS 242478-37-1、またはコハク酸塩についてはCAS 242478-38-2、YM-905としても知られている、ベシケア(Vesicare)の商品名で販売)が挙げられる。
式中、トロパン環に付いているアルキル鎖の好ましい向きはエンドである;
R31 およびR32は、好ましくは1〜6個の炭素原子を有する直鎖もしくは分枝鎖低級アルキル基、5〜6個の炭素原子を有するシクロアルキル基、6〜10個の炭素原子を有するシクロアルキル-アルキル、2-チエニル、2-ピリジル、フェニル、4個以下の炭素原子を有するアルキル基で置換されたフェニル、および4個以下の炭素原子を有するアルコキシ基で置換されたフェニルからなる群から独立して選択される;
X- は、N原子の正電荷に随伴する陰イオンを表す。X- は塩化物、臭化物、ヨウ化物、硫酸、ベンゼンスルホン酸、およびトルエンスルホン酸の陰イオンとすることができるがそれらに限定されず、
たとえば、下記を包含する:
(3-endo)-3-(2,2-ジ-2-チエニルエテニル)-8,8-ジメチル-8-アゾニアビシクロ[3.2.1]オクタン臭化物;
(3-endo)-3-(2,2-ジフェニルエテニル)-8,8-ジメチル-8-アゾニアビシクロ[3.2.1]オクタン臭化物;
(3-endo)-3-(2,2-ジフェニルエテニル)-8,8-ジメチル-8-アゾニアビシクロ[3.2.1]オクタン 4-メチルベンゼンスルホン酸;
(3-endo)-8,8-ジメチル-3-[2-フェニル-2-(2-チエニル)エテニル]-8-アゾニアビシクロ[3.2.1]オクタン臭化物;および/または
(3-endo)-8,8-ジメチル-3-[2-フェニル-2-(2-ピリジニル)エテニル]-8-アゾニアビシクロ[3.2.1]オクタン臭化物。
R31 およびR32は、好ましくは1〜6個の炭素原子を有する直鎖もしくは分枝鎖低級アルキル基、5〜6個の炭素原子を有するシクロアルキル基、6〜10個の炭素原子を有するシクロアルキル-アルキル、2-チエニル、2-ピリジル、フェニル、4個以下の炭素原子を有するアルキル基で置換されたフェニル、および4個以下の炭素原子を有するアルコキシ基で置換されたフェニルからなる群から独立して選択される;
X- は、N原子の正電荷に随伴する陰イオンを表す。X- は塩化物、臭化物、ヨウ化物、硫酸、ベンゼンスルホン酸、およびトルエンスルホン酸の陰イオンとすることができるがそれらに限定されず、
たとえば、下記を包含する:
(3-endo)-3-(2,2-ジ-2-チエニルエテニル)-8,8-ジメチル-8-アゾニアビシクロ[3.2.1]オクタン臭化物;
(3-endo)-3-(2,2-ジフェニルエテニル)-8,8-ジメチル-8-アゾニアビシクロ[3.2.1]オクタン臭化物;
(3-endo)-3-(2,2-ジフェニルエテニル)-8,8-ジメチル-8-アゾニアビシクロ[3.2.1]オクタン 4-メチルベンゼンスルホン酸;
(3-endo)-8,8-ジメチル-3-[2-フェニル-2-(2-チエニル)エテニル]-8-アゾニアビシクロ[3.2.1]オクタン臭化物;および/または
(3-endo)-8,8-ジメチル-3-[2-フェニル-2-(2-ピリジニル)エテニル]-8-アゾニアビシクロ[3.2.1]オクタン臭化物。
式中:
指示されたH原子はエキソの位置にある;
R41- は、N原子の正電荷に随伴する陰イオンを表す。R41- は、塩化物、臭化物、ヨウ化物、硫酸、ベンゼンスルホン酸、およびトルエンスルホン酸の陰イオンとすることができるがそれらに限定されない;
R42 およびR43は、直鎖もしくは分枝鎖低級アルキル基(好ましくは1〜6個の炭素原子を有する)、シクロアルキル基(5〜6個の炭素原子を有する)、シクロアルキル-アルキル(6〜10個の炭素原子を有する)、ヘテロ原子としてNもしくはOを含むヘテロシクロアルキル(5〜6個の炭素原子を有する)、ヘテロ原子としてNもしくはOを含むヘテロシクロアルキル-アルキル(6〜10個の炭素原子を有する)、アリール、場合により置換されていてもよいアリール、ヘテロアリール、ならびに場合により置換されていてもよいヘテロアリールからなる群から独立して選択される;
R44は、(C1-C6)アルキル、(C3-C12)シクロアルキル、(C3-C7)ヘテロシクロアルキル、(C1-C6)アルキル(C3-C12)シクロアルキル、(C1-C6)アルキル(C3-C7)ヘテロシクロアルキル、アリール、ヘテロアリール、(C1-C6)アルキル-アリール、(C1-C6)アルキル-ヘテロアリール、-OR45, -CH2OR45、-CH2OH、-CN、-CF3、-CH2O(CO)R46、-CO2R47、-CH2NH2、-CH2N(R47)SO2R45、-SO2N(R47)(R48)、-CON(R47)(R48)、-CH2N(R48)CO(R46)、-CH2N(R48)SO2(R46)、-CH2N(R48)CO2(R45)、-CH2N(R48)CONH(R47)からなる群から選択される;
R45は、(C1-C6)アルキル、(C1-C6)アルキル(C3-C12)シクロアルキル、 (C1-C6)アルキル (C3-C7)ヘテロシクロアルキル、 (C1-C6)アルキル-アリール、(C1-C6)アルキル-ヘテロアリールからなる群から選択される;
R46は、(C1-C6)アルキル、(C3-C12)シクロアルキル、(C3-C7)ヘテロシクロアルキル、(C1-C6)アルキル(C3-C12)シクロアルキル、 (C1-C6)アルキル(C3-C7)ヘテロシクロアルキル、アリール、ヘテロアリール、(C1-C6)アルキル-アリール、(C1-C6)アルキル-ヘテロアリールからなる群から選択される;
R47 およびR48は、H、(C1-C6)アルキル、(C3-C12)シクロアルキル、(C3-C7)ヘテロシクロアルキル、(C1-C6)アルキル(C3-C12)シクロアルキル、 (C1-C6)アルキル(C3-C7)ヘテロシクロアルキル、(C1-C6)アルキル-アリール、および(C1-C6)アルキル-ヘテロアリールからなる群から独立して選択されるが、たとえば、下記を包含する:
(endo)-3-(2-メトキシ-2,2-ジ-チオフェン-2-イル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピオニトリル;
(endo)-8-メチル-3-(2,2,2-トリフェニル-エチル)-8-アザ-ビシクロ[3.2.1]オクタン;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピオンアミド;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピオン酸;
(endo)-3-(2-シアノ-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
(endo)-3-(2-シアノ-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン 臭化物;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロパン-1-オール;
N-ベンジル-3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピオンアミド;
(endo)-3-(2-カルバモイル-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
1-ベンジル-3-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-尿素;
1-エチル-3-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-尿素;
N-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-アセトアミド;
N-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-ベンズアミド;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジ-チオフェン-2-イル-プロピオニトリル;
(endo)-3-(2-シアノ-2,2-ジ-チオフェン-2-イル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
N-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-ベンゼンスルホンアミド;
[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-尿素;
N-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-メタンスルホンアミド;および/または
(endo)-3-{2,2-ジフェニル-3-[(1-フェニル-メタノイル)-アミノ]-プロピル}-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン臭化物。
指示されたH原子はエキソの位置にある;
R41- は、N原子の正電荷に随伴する陰イオンを表す。R41- は、塩化物、臭化物、ヨウ化物、硫酸、ベンゼンスルホン酸、およびトルエンスルホン酸の陰イオンとすることができるがそれらに限定されない;
R42 およびR43は、直鎖もしくは分枝鎖低級アルキル基(好ましくは1〜6個の炭素原子を有する)、シクロアルキル基(5〜6個の炭素原子を有する)、シクロアルキル-アルキル(6〜10個の炭素原子を有する)、ヘテロ原子としてNもしくはOを含むヘテロシクロアルキル(5〜6個の炭素原子を有する)、ヘテロ原子としてNもしくはOを含むヘテロシクロアルキル-アルキル(6〜10個の炭素原子を有する)、アリール、場合により置換されていてもよいアリール、ヘテロアリール、ならびに場合により置換されていてもよいヘテロアリールからなる群から独立して選択される;
R44は、(C1-C6)アルキル、(C3-C12)シクロアルキル、(C3-C7)ヘテロシクロアルキル、(C1-C6)アルキル(C3-C12)シクロアルキル、(C1-C6)アルキル(C3-C7)ヘテロシクロアルキル、アリール、ヘテロアリール、(C1-C6)アルキル-アリール、(C1-C6)アルキル-ヘテロアリール、-OR45, -CH2OR45、-CH2OH、-CN、-CF3、-CH2O(CO)R46、-CO2R47、-CH2NH2、-CH2N(R47)SO2R45、-SO2N(R47)(R48)、-CON(R47)(R48)、-CH2N(R48)CO(R46)、-CH2N(R48)SO2(R46)、-CH2N(R48)CO2(R45)、-CH2N(R48)CONH(R47)からなる群から選択される;
R45は、(C1-C6)アルキル、(C1-C6)アルキル(C3-C12)シクロアルキル、 (C1-C6)アルキル (C3-C7)ヘテロシクロアルキル、 (C1-C6)アルキル-アリール、(C1-C6)アルキル-ヘテロアリールからなる群から選択される;
R46は、(C1-C6)アルキル、(C3-C12)シクロアルキル、(C3-C7)ヘテロシクロアルキル、(C1-C6)アルキル(C3-C12)シクロアルキル、 (C1-C6)アルキル(C3-C7)ヘテロシクロアルキル、アリール、ヘテロアリール、(C1-C6)アルキル-アリール、(C1-C6)アルキル-ヘテロアリールからなる群から選択される;
R47 およびR48は、H、(C1-C6)アルキル、(C3-C12)シクロアルキル、(C3-C7)ヘテロシクロアルキル、(C1-C6)アルキル(C3-C12)シクロアルキル、 (C1-C6)アルキル(C3-C7)ヘテロシクロアルキル、(C1-C6)アルキル-アリール、および(C1-C6)アルキル-ヘテロアリールからなる群から独立して選択されるが、たとえば、下記を包含する:
(endo)-3-(2-メトキシ-2,2-ジ-チオフェン-2-イル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピオニトリル;
(endo)-8-メチル-3-(2,2,2-トリフェニル-エチル)-8-アザ-ビシクロ[3.2.1]オクタン;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピオンアミド;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピオン酸;
(endo)-3-(2-シアノ-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
(endo)-3-(2-シアノ-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン 臭化物;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロパン-1-オール;
N-ベンジル-3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピオンアミド;
(endo)-3-(2-カルバモイル-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
1-ベンジル-3-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-尿素;
1-エチル-3-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-尿素;
N-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-アセトアミド;
N-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-ベンズアミド;
3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジ-チオフェン-2-イル-プロピオニトリル;
(endo)-3-(2-シアノ-2,2-ジ-チオフェン-2-イル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
N-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-ベンゼンスルホンアミド;
[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-尿素;
N-[3-((endo)-8-メチル-8-アザ-ビシクロ[3.2.1]オクタ-3-イル)-2,2-ジフェニル-プロピル]-メタンスルホンアミド;および/または
(endo)-3-{2,2-ジフェニル-3-[(1-フェニル-メタノイル)-アミノ]-プロピル}-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン臭化物。
本発明において有用な、より好ましい化合物には、下記が含まれる:
(endo)-3-(2-メトキシ-2,2-ジ-チオフェン-2-イル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
(endo)-3-(2-シアノ-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
(endo)-3-(2-シアノ-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン臭化物;
(endo)-3-(2-カルバモイル-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
(endo)-3-(2-シアノ-2,2-ジ-チオフェン-2-イル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;および/または
(endo)-3-{2,2-ジフェニル-3-[(1-フェニル-メタノイル)-アミノ]-プロピル}-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン臭化物。
(endo)-3-(2-メトキシ-2,2-ジ-チオフェン-2-イル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
(endo)-3-(2-シアノ-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
(endo)-3-(2-シアノ-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン臭化物;
(endo)-3-(2-カルバモイル-2,2-ジフェニル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;
(endo)-3-(2-シアノ-2,2-ジ-チオフェン-2-イル-エチル)-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン ヨウ化物;および/または
(endo)-3-{2,2-ジフェニル-3-[(1-フェニル-メタノイル)-アミノ]-プロピル}-8,8-ジメチル-8-アゾニア-ビシクロ[3.2.1]オクタン臭化物。
適当な抗ヒスタミン薬(H1受容体拮抗薬とも呼ばれる)には、H1受容体を阻害し、ヒトに使用するのに安全である、既知の多数の拮抗薬のうち任意の1つもしくは複数が含まれる。第1世代拮抗薬には、エタノールアミン、エチレンジアミン、およびアルキルアミンの誘導体、たとえば、ジフェニルヒドラミン、ピリルアミン、クレマスチン、クルロフェニラミンがある。第2世代拮抗薬は、非鎮痛性であって、ロラタジン、デスロラタジン、テルフェナジン、アステミゾール、アクリバスチン、アゼラスチン、レボセチリジン、フェキソフェナジン、およびセチリジンが挙げられる。
好ましい抗ヒスタミン薬の例には、ロラタジン、デスロラタジン、フェキソフェナジンおよびセチリジンがある。
他に考えられる組み合わせは、抗IL-4薬(たとえば、パスコリズマブ(pascolizumab)のような抗IL-4抗体)および/または抗IL-5薬(たとえば、メポリズマブ(mepolizumab)のような抗IL-5抗体)および/または抗IgE薬(たとえば、オマリズマブ(ゾレアXolair(商標名))またはタリズマブ(talizumab)といった抗IgE抗体)と併用して、本発明の抗体を使用することを包含する。
好都合にも、このような別の薬剤を伴う、また状況に応じて使用説明書を伴う、本発明の抗体もしくはその抗原結合フラグメントのキット・オブ・パーツを含んでなる医薬組成物も、本発明で想定される。
本発明はさらに、hIL-13とhIL-13Rとの相互作用のモジュレーションに反応する疾患の治療に使用するために、治療上有効な量の、本明細書に記載の治療用モノクローナル抗体もしくはその抗原結合フラグメントを含んでなる医薬組成物を想定する。
本発明にしたがって、治療上有効な量の治療用モノクローナルヒト化抗体を含んでなる医薬組成物が提供されるが、この抗体は、配列番号11、12、13、14からなる群から選択されるVHドメイン、および配列番号15、16、17からなる群から選択されるVLドメインを含んでなる。
本発明にしたがって、配列番号18、19、20、21からなる群から選択される重鎖、および配列番号22、23、24からなる群から選択される軽鎖を含むモノクローナル抗体を含んでなる医薬組成物が提供される。
本発明にしたがって、配列番号18の重鎖および配列番号22の軽鎖を含むモノクローナル抗体、ならびに製薬上許容される担体を含んでなる医薬組成物が提供される。
本発明にしたがって、配列番号18の重鎖および配列番号22の軽鎖を含む(または、基本的にそれらからなる)モノクローナル抗体、ならびに製薬上許容される担体を含んでなる医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号18の重鎖および配列番号22の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号18の重鎖および配列番号23の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号18の重鎖および配列番号24の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号19の重鎖および配列番号22の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号19の重鎖および配列番号23の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号19の重鎖および配列番号24の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号20の重鎖および配列番号22の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号20の重鎖および配列番号23の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号20の重鎖および配列番号24の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号21の重鎖および配列番号22の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号21の重鎖および配列番号23の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
本発明にしたがって、製薬上許容される担体、ならびに、配列番号21の重鎖および配列番号24の軽鎖を含む抗体のモノクローナル集団を治療上有効な量で含んでなる、医薬組成物が提供される。
5. 臨床用途
本発明の抗体は、アトピー性疾患/障害、および慢性炎症性疾患/障害の治療に用いることができる。特に興味深いのは、その抗体を喘息の治療に使用することであって、喘息はたとえば、アレルギー性喘息、特に重症喘息(副腎皮質ステロイドの全身投与を含めて、現行の治療に反応しない喘息;Busse WW ら、J Allergy Clin. Immunol 2000, 106: 1033-1042を参照されたい)、「難治性の(difficult)」喘息(処方された吸入ステロイドの最大推奨用量であっても、コントロールが得られないという特徴を有する喘息のタイプとして定義される、Barnes PJ (1998), Eur Respir J 12:1208-1218を参照されたい)、「不安定な(brittle)」喘息(重篤で不安定な喘息の患者であって、高用量の吸入ステロイドを用いても、最大呼気流量(PEF)の幅広い変動性が維持される患者のサブグループを示す、Ayres JGら、(1998) Thorax 58:315-321を参照されたい)、夜間喘息、月経前喘息、ステロイド抵抗性喘息(Woodcock AJ (1993) Eur Respir J 6:743-747を参照されたい)、ステロイド依存性喘息(高用量の経口ステロイドによってのみコントロール可能な喘息として定義される)、アスピリン誘発喘息、成人発症喘息、小児喘息である。本発明の抗体を用いて、急性の喘息発作(喘息重積状態)を予防し、頻度を減らし、またはその影響を緩和することができる。また、本発明の抗体を用いて、喘息治療に使用される他の薬剤の必要とされる投薬を(投与量としても、投薬頻度としても)減らすこともできる。たとえば、本発明の抗体を用いて、副腎皮質ステロイド治療のような、喘息のステロイド治療に必要な投薬を減らすことができる(「ステロイド節約」)。本発明の抗体で治療することができる、他の疾患もしくは障害には、アトピー性皮膚炎、アレルギー性鼻炎、クローン病、慢性閉塞性肺疾患(COPD)、好酸球性食道炎、線維性疾患もしくは障害、たとえば特発性肺線維症、全身性進行性硬化症(強皮症)、肝線維症、肝肉芽種、住血吸虫症、リーシュマニア症、ならびに細胞周期制御に関する疾患、たとえば、ホジキン病、B細胞慢性リンパ球性白血病がある。本発明の抗体で治療す
ることができるさらに他の疾患もしくは障害は、たとえば上記の、本発明の背景に詳しく述べられている。
本発明の抗体は、アトピー性疾患/障害、および慢性炎症性疾患/障害の治療に用いることができる。特に興味深いのは、その抗体を喘息の治療に使用することであって、喘息はたとえば、アレルギー性喘息、特に重症喘息(副腎皮質ステロイドの全身投与を含めて、現行の治療に反応しない喘息;Busse WW ら、J Allergy Clin. Immunol 2000, 106: 1033-1042を参照されたい)、「難治性の(difficult)」喘息(処方された吸入ステロイドの最大推奨用量であっても、コントロールが得られないという特徴を有する喘息のタイプとして定義される、Barnes PJ (1998), Eur Respir J 12:1208-1218を参照されたい)、「不安定な(brittle)」喘息(重篤で不安定な喘息の患者であって、高用量の吸入ステロイドを用いても、最大呼気流量(PEF)の幅広い変動性が維持される患者のサブグループを示す、Ayres JGら、(1998) Thorax 58:315-321を参照されたい)、夜間喘息、月経前喘息、ステロイド抵抗性喘息(Woodcock AJ (1993) Eur Respir J 6:743-747を参照されたい)、ステロイド依存性喘息(高用量の経口ステロイドによってのみコントロール可能な喘息として定義される)、アスピリン誘発喘息、成人発症喘息、小児喘息である。本発明の抗体を用いて、急性の喘息発作(喘息重積状態)を予防し、頻度を減らし、またはその影響を緩和することができる。また、本発明の抗体を用いて、喘息治療に使用される他の薬剤の必要とされる投薬を(投与量としても、投薬頻度としても)減らすこともできる。たとえば、本発明の抗体を用いて、副腎皮質ステロイド治療のような、喘息のステロイド治療に必要な投薬を減らすことができる(「ステロイド節約」)。本発明の抗体で治療することができる、他の疾患もしくは障害には、アトピー性皮膚炎、アレルギー性鼻炎、クローン病、慢性閉塞性肺疾患(COPD)、好酸球性食道炎、線維性疾患もしくは障害、たとえば特発性肺線維症、全身性進行性硬化症(強皮症)、肝線維症、肝肉芽種、住血吸虫症、リーシュマニア症、ならびに細胞周期制御に関する疾患、たとえば、ホジキン病、B細胞慢性リンパ球性白血病がある。本発明の抗体で治療す
ることができるさらに他の疾患もしくは障害は、たとえば上記の、本発明の背景に詳しく述べられている。
本発明のある実施形態において、副腎皮質ステロイドによる治療に反応しない喘息性疾患に罹患したヒト患者を治療する方法が提供されるが、その方法は、治療上有効な量の本発明の抗体を前記患者に投与するステップを含んでなる。
別の実施形態では、ヒト患者において急性の喘息発作を予防する方法が提供されるが、その方法は、治療上有効な量の本発明の抗体を前記患者に投与するステップを含んでなる。
別の実施形態では、ヒト患者において急性の喘息発作の頻度を減らす、および/またはその影響を緩和する方法が提供されるが、その方法は、治療上有効な量の本発明の抗体を前記患者に投与するステップを含んでなる。
本発明のもう一つの実施形態では、ヒト患者において炎症性および/またはアレルギー性傷害後に、ヘルパーT細胞の応答をTh1型応答に偏らせる方法を提供するが、その方法は、治療上有効な量の本発明の抗体もしくはその抗原結合フラグメントを、前記患者に投与するステップを含んでなる。
本発明の別の実施形態において、重い喘息のような、喘息に苦しむ、Q130hIL-13変異体を有するヒト患者を治療する方法が提供されるが、その方法は、治療上有効な量の本発明の抗体もしくはその抗原結合フラグメントを、前記患者に投与するステップを含んでなる。
本発明は、主としてヒトの疾患もしくは障害の治療について説明してきたが、本発明は、ヒト以外の哺乳類の同様の疾患もしくは障害の治療にも使用することができる。
ここで、本発明をほんの例として説明することにする。
1. モノクローナル抗体の生産およびマウスモノクローナル抗体3G4の特性解析
5匹のSJLマウスを、それぞれ2μgの大腸菌由来組換えヒトIL-13 (Cambridge Bioscience、カタログ番号CH-013)を用いて、腹腔内注射により免疫した。マウスの脾細胞を取り出し、Bリンパ球を、PEG1500 (Boehringer社)を用いて、P3X細胞由来のマウス骨髄腫細胞と融合させてハイブリドーマを作製した。個別のハイブリドーマ細胞株を限界希釈によってクローン化した(E HarlowおよびD Lane)。単一コロニーを含有するウェルを顕微鏡で確認し、上清の活性を調べた。最も活性のあるクローンの細胞を低温保存、抗体生産などのために増殖させた。
5匹のSJLマウスを、それぞれ2μgの大腸菌由来組換えヒトIL-13 (Cambridge Bioscience、カタログ番号CH-013)を用いて、腹腔内注射により免疫した。マウスの脾細胞を取り出し、Bリンパ球を、PEG1500 (Boehringer社)を用いて、P3X細胞由来のマウス骨髄腫細胞と融合させてハイブリドーマを作製した。個別のハイブリドーマ細胞株を限界希釈によってクローン化した(E HarlowおよびD Lane)。単一コロニーを含有するウェルを顕微鏡で確認し、上清の活性を調べた。最も活性のあるクローンの細胞を低温保存、抗体生産などのために増殖させた。
最初に、ハイブリドーマ上清を、大腸菌発現組換えdet-1タグ付きヒトIL-13タンパク質(当研究所で作製)に対する結合活性について、サンドウィッチアッセイ法でスクリーニングした。上記で陽性の株の二次スクリーニングは、det-1タグ付きヒトIL-13タンパク質との結合を検出するBIAcore(商標名)法を用いて完了させた。上記ハイブリドーマから得られたサンプルは、次に、TF-1細胞増殖バイオアッセイで、大腸菌発現組換えヒトIL-13(Cambridge Bioscience、カタログ番号CH-013)の生物活性を中和する能力についてテストした。
ヒトIL-13中和バイオアッセイから同定された陽性株は、限界希釈によってサブクローン化して、安定なモノクローナル細胞株を得た。無血清条件下で細胞工場で増殖させた、上記ハイブリドーマから得られた免疫グロブリンは、固定化Protein Aカラムを用いて精製した。この精製mAbを次に、同じ3つのアッセイ系で再スクリーニングした。
モノクローナル抗体3G4は、ヒトIL-13の生物活性を中和する強力な抗体として同定された。
3G4抗体は、配列番号7に記載のVH領域アミノ酸配列を有する。
3G4抗体は、配列番号8に記載のVL領域アミノ酸配列を有する。
キメラ抗体は、3G4マウスモノクローナル抗体から可変領域を取り出し、それをヒトIgG1/k野生型C領域にグラフティングすることによって構築された。ヒトシグナル配列(配列番号43に示す)を上記構築物の構築に使用した。このキメラ抗体を3G4Cと名付けた。
1.1 大腸菌発現組換えヒトIL-13との結合
3G4は、サンドウィッチELISAにおいて大腸菌発現組換えヒトIL-13と結合したが、その方法は実施例6.1に記載のように行った(図1を参照されたい)。
3G4は、サンドウィッチELISAにおいて大腸菌発現組換えヒトIL-13と結合したが、その方法は実施例6.1に記載のように行った(図1を参照されたい)。
1.2 TF-1細胞増殖バイオアッセイにおける大腸菌発現組換えヒトおよびカニクイザルIL-13の中和
TF-1細胞は、ヒトIL-13およびカニクイザルIL-13に反応して増殖する。バイオアッセイは、ヒトおよびカニクイザルIL-13誘導性TF-1細胞増殖に対する抗IL-13 mAbの中和能力を評価するために開発された。この方法は実施例6.2に記載のように行った。
TF-1細胞は、ヒトIL-13およびカニクイザルIL-13に反応して増殖する。バイオアッセイは、ヒトおよびカニクイザルIL-13誘導性TF-1細胞増殖に対する抗IL-13 mAbの中和能力を評価するために開発された。この方法は実施例6.2に記載のように行った。
カニクイザルIL-13のアミノ酸配列およびcDNA配列(シグナル配列は含まない)は、それぞれ、配列番号41および配列番号42に記載される。
3G4は、TF-1細胞バイオアッセイにおいて組換えヒトIL-13の生物活性を中和した(図2aを参照されたい)。
3G4は、ヒトIL-13よりは弱いがカニクイザルIL-13の生物活性を中和した(図3を参照されたい)。
TF-1細胞バイオアッセイにおいて、モノクローナル抗体3G4による約10 ng/mlの大腸菌発現組換えヒトIL-13生物活性の中和について0.13μg/mlの平均ND50値が算出された。
TF-1細胞バイオアッセイにおいて、モノクローナル抗体3G4による約10 ng/mlの大腸菌発現組換えカニクイザルIL-13生物活性の中和については、0.29μg/mlの平均ND50値が算出された。[ND50(中和用量)値は、指定のIL-13濃度に反応したTF-1細胞の増殖を50%だけ減少させるのに必要なモノクローナル抗体の濃度である]。
1.3 TF-1細胞増殖バイオアッセイにおける哺乳類発現(CHO細胞)ヒトIL-13の中和
CHO細胞から発現されたヒトIL-13に対するモノクローナル抗体3G4の中和能力をTF-1細胞増殖アッセイで評価した。この方法は、実施例6.2に記載のように行った。3G4は、哺乳類発現ヒトIL-13を、市販の抗ヒトIL-13ポリクローナル試薬より強く中和した。TF-1細胞バイオアッセイにおいて、モノクローナル抗体3G4による約20 ng/mlの哺乳類発現ヒトIL-13の中和について0.31μg/mlのND50値が算出された。図4を参照されたい。
CHO細胞から発現されたヒトIL-13に対するモノクローナル抗体3G4の中和能力をTF-1細胞増殖アッセイで評価した。この方法は、実施例6.2に記載のように行った。3G4は、哺乳類発現ヒトIL-13を、市販の抗ヒトIL-13ポリクローナル試薬より強く中和した。TF-1細胞バイオアッセイにおいて、モノクローナル抗体3G4による約20 ng/mlの哺乳類発現ヒトIL-13の中和について0.31μg/mlのND50値が算出された。図4を参照されたい。
1.4 TF-1細胞増殖バイオアッセイにおける組換えQ130ヒトIL-13変異体の中和
大腸菌発現組換えQ130ヒトIL-13(Peprotech社、カタログ番号200-13A)に対するモノクローナル抗体3G4の中和能力を、TF-1細胞増殖アッセイで評価した。この方法は、実施例6.2に記載のように行った。3G4は、Q130ヒトIL-13を、市販の抗ヒトIL-13ポリクローナル試薬より強く中和した。TF-1細胞バイオアッセイにおいて、モノクローナル抗体3G4による約60 ng/mlのQ130ヒトIL-13生物活性の中和について0.025μg/mlのND50値が算出された。図5を参照されたい。
大腸菌発現組換えQ130ヒトIL-13(Peprotech社、カタログ番号200-13A)に対するモノクローナル抗体3G4の中和能力を、TF-1細胞増殖アッセイで評価した。この方法は、実施例6.2に記載のように行った。3G4は、Q130ヒトIL-13を、市販の抗ヒトIL-13ポリクローナル試薬より強く中和した。TF-1細胞バイオアッセイにおいて、モノクローナル抗体3G4による約60 ng/mlのQ130ヒトIL-13生物活性の中和について0.025μg/mlのND50値が算出された。図5を参照されたい。
1.5 BIAcore(商標名)解析
組換えヒトおよびカニクイザルIL-13に対する3G4マウスmAbの親和性を、BIAcore(商標名)(表面プラズモン共鳴)解析によって評価した。表2を参照されたい。
組換えヒトおよびカニクイザルIL-13に対する3G4マウスmAbの親和性を、BIAcore(商標名)(表面プラズモン共鳴)解析によって評価した。表2を参照されたい。
BIAcore(商標名)解析は、抗マウスIgG捕捉抗体を用いて行った。製造元の推奨にしたがって、抗マウスIgG抗体を、第一級アミンカップリングによってCM5チップ上に結合させた。その後3G4親マウスmAbをこの表面上に捕捉させ、ヒトもしくはカニクイザルIL-13を規定の濃度で通過させた。表面を温和な酸溶出条件によって再生して抗マウスIgG表面に戻したが、このことは、その後のIL-13結合事象のための抗体捕捉能力に有意な影響を及ぼさなかった。この実験はBiacore 3000で実施し、この装置に付属する評価ソフトウェアを用いて解析した。データは1:1結合モデルによって解析した。ヒトIL-13結合に関するデータは、組換え大腸菌発現Det-1タグ付きヒトIL-13ならびに市販の組換え大腸菌発現タグなしヒトIL-13試薬(Peprotech社製)を用いて得られた。組換え大腸菌発現カニクイザルIL-13はGSK社で作製された。Biacoreの操作はすべて、25℃で行った。
Det-1タグ付きヒトIL-13については、データは2つの独立した実験から得られたが、いずれの実験も2回反復で行った。データは、これらの結果の平均および標準偏差(括弧内)として提示される。
ヒトIL-13(Peprotech社製)およびカニクイザルIL-13(GSK社で作製)については、データは1つの実験(2回反復)の結果である。
上記のデータに関して、2回反復実験を一緒に解析して、その実験について1つの値を得た。
これらのデータは、3G4マウスmAbが、ヒトIL-13に対して非常に高い結合親和性を有しており、カニクイザルIL-13に対する3G4マウスmAbの結合親和性は、比較すると弱いことを示す。
2. クローン3G4のヒト化
2.1 配列解析
3G4可変領域の配列と、他のマウスおよびヒト免疫グロブリン配列との比較を行った。これは、FASTAおよびBLASTプログラムを用いて、検索によって行った。
2.1 配列解析
3G4可変領域の配列と、他のマウスおよびヒト免疫グロブリン配列との比較を行った。これは、FASTAおよびBLASTプログラムを用いて、検索によって行った。
3G4の以下のフレームワーク残基が、抗体のCDRグラフト(ヒト化)型をデザインする際に、重要となる可能性があると確認された:
位置 3G4 VH
10 D
30 I
93 T
位置はKabatらの番号付けシステムに従う。
位置 3G4 VH
10 D
30 I
93 T
位置はKabatらの番号付けシステムに従う。
位置 3G4 VL
98 L
98 L
3G4 VHに適したヒトアクセプターフレームワークが同定された:配列番号44
3G4 VLに適したヒトアクセプターフレームワークが同定された:配列番号45
配列番号44には、CRDH1およびH2が存在し、CDRH3はXXXXXXXXXXで表される。配列番号45には、CRDL1およびL2が存在し、CDRL3はXXXXXXXXXで表される。
3G4 VLに適したヒトアクセプターフレームワークが同定された:配列番号45
配列番号44には、CRDH1およびH2が存在し、CDRH3はXXXXXXXXXXで表される。配列番号45には、CRDL1およびL2が存在し、CDRL3はXXXXXXXXXで表される。
CDRグラフティングにおいては、典型的には、十分な結合を得るために、ドナー抗体由来の1個以上のフレームワーク残基を、アクセプターフレームワーク内のそれらのオルソログの代わりに含めることが必要である。上に挙げたものに加えて、以下のマウスフレームワーク残基も、ヒト化抗体デザインにおいて保持される可能性があると考えられた:
位置 (Kabat#) 3G4 V H ヒトV H
10 D E
30 I T
67 A V
69 L M
71 A R
73 K T
93 T A
位置 (Kabat#) 3G4 V H ヒトV H
10 D E
30 I T
67 A V
69 L M
71 A R
73 K T
93 T A
位置 (Kabat#) マウス3G4 V L ヒトV L
76 N S
98 L F
76 N S
98 L F
異なる復帰突然変異を有する4つのヒト化VH構築物をデザインし、十分な活性を有するヒト化抗体を得た。これらにH1からH4の番号を付す。
H1は、特定のアクセプター配列への3G4 VH CDRのCDRグラフトからなる。加えて、H1は、30位にマウス残基(イソロイシン)を含有する。これはKabatの定義のCDRの外側にあるが、ChothiaのCDR H1定義内に含まれる。この場合、この残基は、真のフレームワーク復帰突然変異ではなく、CDRの一部であると考えられる。
H2は、H1と同じであるが、93位のアミノ酸がアラニンに代えてスレオニンであるという復帰突然変異を有する。
H3は、H2と同じであるが、10位のアミノ酸がグルタミン酸に代えてアスパラギン酸であるという追加の復帰突然変異を有する。
H4は、H3と同じであるが、4つの追加の復帰突然変異を、67位(バリンの代わりにアラニン)、69位(メチオニンの代わりにロイシン)、71位(アルギニンの代わりにアラニン)および73位(スレオニンの代わりにリジン)に含有する。
異なる復帰突然変異を有する3つのヒト化VL構築物をデザインし、十分な活性を有するヒト化抗体を得た。これらにL1からL3の番号を付す。
L1は、特定のアクセプター配列への3G4 VL CDRのCDRグラフトからなり、Kabatの定義のCDRを用いている。
L2は、L1と同じであるが、98位のアミノ酸がフェニルアラニンの代わりにロイシンであるという復帰突然変異を有する。
L3は、L2と同じであるが、76位のアミノ酸がセリンの代わりにアスパラギンであるという追加の復帰突然変異を有する。
ヒト化V H 構築物H1:
配列番号11
ヒト化V H 構築物H2:
配列番号12
ヒト化V H 構築物H3:
配列番号13
ヒト化V H 構築物H4:
配列番号14
ヒト化V L 構築物L1:
配列番号15
ヒト化V L 構築物L2:
配列番号16
ヒト化V L 構築物L3:
配列番号17
配列番号11
ヒト化V H 構築物H2:
配列番号12
ヒト化V H 構築物H3:
配列番号13
ヒト化V H 構築物H4:
配列番号14
ヒト化V L 構築物L1:
配列番号15
ヒト化V L 構築物L2:
配列番号16
ヒト化V L 構築物L3:
配列番号17
2.2 3G4のヒト化
ヒト化VHおよびVL構築物は、RldおよびRln哺乳類発現ベクターにクローニングするための制限酵素切断部位と、ヒトシグナル配列とを含む、重複するオリゴヌクレオチドのde novo構築によって調製された。ヒトγ1野生型定常領域を含有するRldにクローニングするために、Hind IIIおよびSpe I制限部位を導入して、ヒトシグナル配列(配列番号43)を含有するVHドメインを構成した。ヒトκ定常領域を含有するRlnにクローニングするために、Hind IIIおよびBsiW I制限部位を導入し、ヒトシグナル配列を含有するVLドメインを構成した。これは本質的に国際公開WO 2004/014953に記載されるとおりである。
ヒト化VHおよびVL構築物は、RldおよびRln哺乳類発現ベクターにクローニングするための制限酵素切断部位と、ヒトシグナル配列とを含む、重複するオリゴヌクレオチドのde novo構築によって調製された。ヒトγ1野生型定常領域を含有するRldにクローニングするために、Hind IIIおよびSpe I制限部位を導入して、ヒトシグナル配列(配列番号43)を含有するVHドメインを構成した。ヒトκ定常領域を含有するRlnにクローニングするために、Hind IIIおよびBsiW I制限部位を導入し、ヒトシグナル配列を含有するVLドメインを構成した。これは本質的に国際公開WO 2004/014953に記載されるとおりである。
3. ヒト化抗体の発現および特性解析
ヒト化VH構築物(H1、H2、H3およびH4)および2つのヒト化VL構築物(L1およびL2)は、Rld hCγ1wtおよびRln hCκ哺乳類発現ベクターにおいて調製した。重鎖-軽鎖のプラスミドの組み合わせ(H1L1、H1L2、H2L1、H2L2、H3L1、H3L2、H4L1、H4L2)をCHO細胞に一過性にコトランスフェクトし、小さなスケールで発現させて、8種の異なるヒト化抗体を得た。
ヒト化VH構築物(H1、H2、H3およびH4)および2つのヒト化VL構築物(L1およびL2)は、Rld hCγ1wtおよびRln hCκ哺乳類発現ベクターにおいて調製した。重鎖-軽鎖のプラスミドの組み合わせ(H1L1、H1L2、H2L1、H2L2、H3L1、H3L2、H4L1、H4L2)をCHO細胞に一過性にコトランスフェクトし、小さなスケールで発現させて、8種の異なるヒト化抗体を得た。
CHO細胞上清中に産生された抗体、およびその後の精製抗体のバッチを、活性についてはヒトIL-13結合ELISAおよびヒトIL-13中和バイオアッセイで分析し、また、ヒトIL-13との結合についてはBIAcore(商標名)で分析した。8つのヒト化mAbはすべて、上記のそれぞれのアッセイにおいて、ヒトIL-13の結合および/または中和を示した。H2L1およびH3L1がさらなる解析のために選択されたが、それは、復帰突然変異の数を限定することになるものの、ヒトIL-13中和バイオアッセイにおいて、またBIAcore(商標名)によるヒトIL-13との結合において性能がより優れていたためである。
3.1 大腸菌発現組換えヒトIL-13との結合
3G4C、H2L1およびH3L1は、サンドウィッチELISAにおいて同様に、大腸菌発現組換えヒトIL-13と結合した。方法は実施例6.1Aに記載のように行った。表3は、平均ED50値を示す(図10も参照されたい)。[ED50(有効用量)は、このELISAにおいて、IL-13に対する最大結合の半値に必要とされる抗体の濃度である]。
3G4C、H2L1およびH3L1は、サンドウィッチELISAにおいて同様に、大腸菌発現組換えヒトIL-13と結合した。方法は実施例6.1Aに記載のように行った。表3は、平均ED50値を示す(図10も参照されたい)。[ED50(有効用量)は、このELISAにおいて、IL-13に対する最大結合の半値に必要とされる抗体の濃度である]。
3G4、3G4C、H2L1およびH3L1は、ELISAで、ヒトIL-13のヒトIL-13受容体鎖(IL13Rα1およびIL13Rα2)との結合を阻害することも示された。この方法は、実施例6.5および6.6に記載のように行った。
図19は、IL13Rα1との結合の阻害を実証するデータを示す。
図19は、3G4、3G4C、H2L1およびH3L1が、同じような強さで、ヒトIL-13のIL13Rα1との結合を阻害することを示す。
図20は、3G4、3G4C、H2L1およびH3L1が、同じような強さで、ヒトIL-13のIL13Rα2との結合を阻害することを示す。
3.2 天然ヒトIL-13との結合
HDLM-2細胞株(骨髄を起源とするReed-Steinberg様細胞株)は、ヒトIL-13を産生し、それを増殖のために自己分泌の様式で利用する。この天然ヒトIL-13は、HDLM-2細胞上清中に分泌される。これを使用して、実施例6.1Bに記載の方法によって、天然ヒトIL-13に対する3G4、3G4C、H2L1およびH3L1の結合を評価したが、4つの抗体はいずれも、親3G4 mAbに非常によく似た性能で、HDLM-2細胞上清中の天然ヒトIL-13と結合した。図18を参照されたい。
HDLM-2細胞株(骨髄を起源とするReed-Steinberg様細胞株)は、ヒトIL-13を産生し、それを増殖のために自己分泌の様式で利用する。この天然ヒトIL-13は、HDLM-2細胞上清中に分泌される。これを使用して、実施例6.1Bに記載の方法によって、天然ヒトIL-13に対する3G4、3G4C、H2L1およびH3L1の結合を評価したが、4つの抗体はいずれも、親3G4 mAbに非常によく似た性能で、HDLM-2細胞上清中の天然ヒトIL-13と結合した。図18を参照されたい。
3.3 TF-1細胞増殖バイオアッセイにおける大腸菌発現ヒトおよびカニクイザルIL-13の中和
3G4、3G4C、H2L1およびH3L1は、大腸菌発現組換えヒトおよびカニクイザルIL-13の生物活性を中和した。方法は実施例6.2Aに記載のように行った。
3G4、3G4C、H2L1およびH3L1は、大腸菌発現組換えヒトおよびカニクイザルIL-13の生物活性を中和した。方法は実施例6.2Aに記載のように行った。
3G4、3G4C、H2L1およびH3L1は、大腸菌発現組換えカニクイザルIL-13の生物活性を中和したが、その程度はヒトIL-13より弱かった。[ND50(中和用量)は、一定濃度のIL-13に反応するTF-1細胞の増殖を50%だけ減少させるのに必要とされるmAbの濃度である]。
3G4の平均ND50値は、TF-1アッセイにおいて約10 ng/mlの大腸菌発現組換えヒトIL-13の生物活性の中和について計算すると、0.049μg/mlであった。表5の結果は、4回の反復実験の平均である。得られた値は、以前に得られたND50値より約2分の1に低くなっているが、同等である(実施例1.2を参照されたい)。
親3G4マウスmAbによって達成される大腸菌発現ヒトIL-13の中和のレベルは、キメラ3G4によって達成されるのと同等である。H2L1およびH3L1の能力は、親3G4マウスmAbおよびキメラ3G4と比べて低下した。
3G4親の平均ND50値は34μg/mlである。これは、TF-1アッセイにおいて約10 ng/mlの大腸菌発現組換えカニクイザルIL-13の生物活性の中和について算出された。この値は、親3G4について以前報告された値と同様であった(実施例1.2を参照されたい)。H2L1およびH3L1も、カニクイザルIL-13に対しては3G4と同様の能力を示した。
3.4 TF-1細胞増殖バイオアッセイにおける哺乳類発現(CHO細胞)ヒトIL-13の中和
CHO細胞から発現されたヒトIL-13に対する、モノクローナル抗体3G4、3G4C、H2L1およびH3L1の中和能力を、実施例6.2Aに記載の方法にしたがって、TF-1細胞増殖アッセイで評価した。
CHO細胞から発現されたヒトIL-13に対する、モノクローナル抗体3G4、3G4C、H2L1およびH3L1の中和能力を、実施例6.2Aに記載の方法にしたがって、TF-1細胞増殖アッセイで評価した。
3G4、3G4C、H2L1およびH3L1は、組換えCHO発現ヒトIL-13の生物活性を中和した(表6および図13を参照されたい)。[ND50(中和用量)は、一定濃度のIL-13に反応するTF-1細胞の増殖を50%だけ減少させるのに必要とされるmAbの濃度である]。
3G4親の平均ND50値は0.05μg/mlである。これは、TF-1細胞バイオアッセイにおいて約10 ng/mlの哺乳類発現ヒトIL-13の中和について算出された。この値は、以前得られたものと異なる(実施例1.3を参照されたい)。しかしながら、TF-1細胞の増殖を刺激するために使用されたヒトIL-13の量が、この実験では以前使用した量より低かった(10 ng/ml)。
親3G4 mAbによって達成されるCHO発現ヒトIL-13の中和のレベルは、3G4Cに関するレベルよりわずかに良好であった。H2L1およびH3L1の能力は、親3G4mAbおよびキメラ3G4のどちらと比べても低下していた。
3.5 TF-1細胞増殖バイオアッセイにおける組換えQ130ヒトIL-13変異体の中和
大腸菌発現組換えQ130ヒトIL-13に対する3G4、3G4C、H2L1およびH3L1の中和能力を、TF-1細胞増殖アッセイで評価した。方法は、実施例6.2Aに記載のように行った。
大腸菌発現組換えQ130ヒトIL-13に対する3G4、3G4C、H2L1およびH3L1の中和能力を、TF-1細胞増殖アッセイで評価した。方法は、実施例6.2Aに記載のように行った。
0.274μg/mlのND50値が得られた。これは以前に得られたND50値とは異なる(実施例1.4を参照されたい)。このアッセイを数回反復して行い、これらのND50値を確認した。2組の実験(異なる時点で実施)で使用された市販のQ130ヒトIL-13標品の特性は、これら2組のデータについて認められた差異を説明することができる。
3.6 BIAcore(商標名)解析
組換えヒトおよびカニクイザルIL-13に対する3G4、3G4C、H2L1およびH3L1の親和性をBIAcore(商標名)解析で評価した。表8、9および10を参照されたい。
組換えヒトおよびカニクイザルIL-13に対する3G4、3G4C、H2L1およびH3L1の親和性をBIAcore(商標名)解析で評価した。表8、9および10を参照されたい。
BIAcore(商標名)解析は、Protein Aキャプチャーを用いて行った。簡単に述べると、製造元の推奨にしたがって、Protein Aを、第一級アミンカップリングによってCM5チップ上に結合した。その後キメラ抗体もしくはヒト化抗体をこの表面上に捕捉させ、ヒトもしくはカニクイザルIL-13を規定の濃度で通過させた。表面は、温和な酸溶出条件によって再生させて、Protein A表面に戻したが、このことは、その後のIL-13結合事象のための抗体捕捉能力に有意な影響を及ぼさなかった。この実験はBiacore 3000およびT100 Biacoreの機器で実施したが、データは機器に付属する評価ソフトウェアを用いて解析し、1:1結合モデルに当てはめた。データは2つの機器でわずかに異なっていたが、キメラおよびヒト化抗体のヒトIL-13との結合の速度論に見られる差異は2つの機器で同様であった。ヒトIL-13に関する結合データは、すべての構築物について1:1モデルによく適合したが、カニクイザルIL-13との結合については適合性が悪く、このように適合性が悪く解析が困難であるために、実際の値が報告された値よりも少し悪い(たとえば、2〜3倍の差)可能性が生じた。データは、タグなしヒトIL-13もしくはカニクイザルIL-13(Peprotech社製)を用いて得られた。Biacoreの操作はすべて、25℃で行った。
キメラ3G4については、データは4つの独立した実験から得られた(そのうち2つは2回反復で行い、各反復実験を別々に解析した)。H2L1およびH3L1ヒト化mAbについては、データは、2回反復で実施された2つの独立した実験から得られた(各反復実験を別々に解析した)。データは、これらの結果の平均および標準偏差(括弧内)として示される。
データは2つの独立した実験から得られ、これらの結果の平均および標準偏差(括弧内)として示される。
データは1回の実験から得られた。
3G4キメラ抗体ならびにヒト化mAb H2L1およびH3L1は、ヒトIL-13に対する結合親和性と比べて低い親和性でカニクイザルIL-13と結合する。
3.7 ヒトIL-13との結合に対する3G4C、H2L1およびH3L1の特異性
ヒトIL-13に対する3G4C、H2L1およびH3L1の特異性は、結合ELISAでヒトIL-4、ヒトIL-5およびヒトGM-CSFに対する交差反応性の可能性を解析することによって評価した。この方法は、それぞれ6.7、6.8、および6.9項に記載のように行った。図15、16および17を参照されたい。これらのmAbは、最大30μg/mlまでのmAb濃度で、ヒトIL-4、ヒトIL-5およびヒトGM-CSFに対する交差反応性を示すことなく、IL-13との結合に対して特異的であることがわかった。3G4キメラは30μg/mlで、ヒトIL-5に対してある程度の結合を示すようにみえたが、ヒト化mAb H2L1およびH3L1については同様の濃度でこうしたことは観察されなかったので、これはおそらく、ピペッティングエラーのためである。
ヒトIL-13に対する3G4C、H2L1およびH3L1の特異性は、結合ELISAでヒトIL-4、ヒトIL-5およびヒトGM-CSFに対する交差反応性の可能性を解析することによって評価した。この方法は、それぞれ6.7、6.8、および6.9項に記載のように行った。図15、16および17を参照されたい。これらのmAbは、最大30μg/mlまでのmAb濃度で、ヒトIL-4、ヒトIL-5およびヒトGM-CSFに対する交差反応性を示すことなく、IL-13との結合に対して特異的であることがわかった。3G4キメラは30μg/mlで、ヒトIL-5に対してある程度の結合を示すようにみえたが、ヒト化mAb H2L1およびH3L1については同様の濃度でこうしたことは観察されなかったので、これはおそらく、ピペッティングエラーのためである。
4. ビオチン化ペプチドを用いた3G4のエピトープマッピング
一連のエピトープマッピング実験を行って、IL-13のどのアミノ酸残基が3G4マウスmAbの結合に必要であるかを決定した。
一連のエピトープマッピング実験を行って、IL-13のどのアミノ酸残基が3G4マウスmAbの結合に必要であるかを決定した。
4.1 ヒトおよびカニクイザルIL-13上の3G4マウスmAb結合エピトープのおおまかなマッピング
4個ずつずらしたビオチン化16merペプチドを合成し、ヒトおよびカニクイザルIL-13上の、マウスmAb 3G4によって認識される結合エピトープの位置をマッピングした。実施例6.3に記載のELISA法を用いて、固定化されたビオチン化ペプチドの、親マウスmAb 3G4との結合を検出した。
4個ずつずらしたビオチン化16merペプチドを合成し、ヒトおよびカニクイザルIL-13上の、マウスmAb 3G4によって認識される結合エピトープの位置をマッピングした。実施例6.3に記載のELISA法を用いて、固定化されたビオチン化ペプチドの、親マウスmAb 3G4との結合を検出した。
16merの特注ペプチドの詳細:88 x 16 mers、オフセット(シフトするアミノ酸の数)4 (オーストラリアのMimotopes社製)。
フォーマット: ペプチド25および44 = ビオチン-SGSG-ペプチド-酸
ペプチド2〜24および27〜43 = ビオチン-SGSG-ペプチド-アミド
フォーマット: ペプチド25および44 = ビオチン-SGSG-ペプチド-酸
ペプチド2〜24および27〜43 = ビオチン-SGSG-ペプチド-アミド
結果は、3G4マウスmAbが以下に示す2つのペプチドに結合することを示した(図6も参照されたい)。
ペプチド25はヒトIL-13に由来する。
ペプチド44はカニクイザルIL-13に由来する。
NB: 太字は、ヒトIL-13とカニクイザルIL-13オルソログとの残基の相違を示す。
ペプチド25はヒトIL-13に由来する。
ペプチド44はカニクイザルIL-13に由来する。
NB: 太字は、ヒトIL-13とカニクイザルIL-13オルソログとの残基の相違を示す。
4.2 ビオチン化ペプチドを用いたヒトおよびカニクイザルIL-13上の3G4マウスmAb結合エピトープの詳細なマッピング
マウスmAb 3G4に対するヒトIL-13上の最小の結合エピトープは、ペプチド配列QFVKDLLLHLKKLFREGRFN (配列番号90)を中心としてそれに基づく一連のペプチドを用いて決定した。ペプチドは、マウスmAb 3G4に対する正確な結合エピトープ一次構造を明らかにするために、この親ペプチド配列のNまたはC末端のいずれか一方から1つのアミノ酸を順次取り除いて得られた。同様の方法をとって、カニクイザルIL-13との結合をマッピングした。
マウスmAb 3G4に対するヒトIL-13上の最小の結合エピトープは、ペプチド配列QFVKDLLLHLKKLFREGRFN (配列番号90)を中心としてそれに基づく一連のペプチドを用いて決定した。ペプチドは、マウスmAb 3G4に対する正確な結合エピトープ一次構造を明らかにするために、この親ペプチド配列のNまたはC末端のいずれか一方から1つのアミノ酸を順次取り除いて得られた。同様の方法をとって、カニクイザルIL-13との結合をマッピングした。
ELISA法(実施例6.4に記載のように行った)を用いて、固定化されたビオチン化ペプチドの親マウスmAb 3G4との結合を検出した(図7aおよび7b)。
その結果から、親マウスmAb 3G4は、ヒトIL-13のC末端領域の最小アミノ酸エピトープLLHLKKLFREG (配列番号91)と結合することが示される。しかしながら、(ヒトIL-13配列中の)上記ペプチド配列のN末端に隣接する2つのアミノ酸(DおよびL)も結合にとって重要である可能性があり、それは、これらの残基が存在すると結合シグナルが強められるためである。同様に(ヒトIL-13配列中の)上記ペプチド配列のC末端に隣接する3つのアミノ酸(R、FおよびN)も結合に重要である可能性があり、それは、RおよびF残基が存在すると結合シグナルが失われるが、N残基があると結合シグナルが回復するためである。
カニクイザルIL-13の一連のペプチドに対するマウスmAb 3G4の結合についても、同様の結果が得られた。その結果から、親マウスmAb 3G4は、カニクイザルIL-13のC末端領域の最小アミノ酸エピトープLLVHLKKLFREG (配列番号98)と結合することが示される。しかしながら、(カニクイザルIL-13配列中の)上記ペプチド配列のN末端に隣接する1つのアミノ酸(D)も結合にとって重要である可能性があり、それは、この残基が存在すると結合シグナルが強められるためである。同様に(カニクイザルIL-13配列中の)上記ペプチド配列のC末端に隣接する3つのアミノ酸(Q、FおよびN)も結合に重要である可能性があり、それは、QおよびF残基が存在すると結合シグナルが失われるが、N残基があると結合シグナルが回復するためである。
4.3 ビオチン化ペプチドを用いたマウスmAb 3G4結合エピトープのアラニンスキャニング
ヒトIL-13のマウスmAb 3G4との相互作用に関与する重要な残基を同定するために、親ペプチド配列QFVKDLLLHLKKLFREGRFN (配列番号90)を用いて、アラニンスキャニング法を行った。この分析のために、表11に記載のペプチドを入手した(AnaSpec Inc)が、これらのペプチドでは、親QFVKDLLLHLKKLFREGRFN (配列番号90)エピトープのLKKLFRE (配列番号92)部分におけるそれぞれのアミノ酸位置で、1つのアミノ酸がアラニン残基に順次置き換えられた。
ヒトIL-13のマウスmAb 3G4との相互作用に関与する重要な残基を同定するために、親ペプチド配列QFVKDLLLHLKKLFREGRFN (配列番号90)を用いて、アラニンスキャニング法を行った。この分析のために、表11に記載のペプチドを入手した(AnaSpec Inc)が、これらのペプチドでは、親QFVKDLLLHLKKLFREGRFN (配列番号90)エピトープのLKKLFRE (配列番号92)部分におけるそれぞれのアミノ酸位置で、1つのアミノ酸がアラニン残基に順次置き換えられた。
ELISA法を(実施例6.4の記載と同様に)用いて、固定化されたビオチン化ペプチドの親マウスmAb 3G4との結合を検出した(図8を参照されたい)。
これらのデータから、ヒトIL-13とマウスmAb 3G4の相互作用に関与する重要なアミノ酸残基は、少なくとも107位のアルギニン(R)、103位のリジン(K)および104位のリジン(K)であることが確認される。これらの番号付けは国際公開WO2006/003407に記載の通りである。
上記の分析は、最小結合エピトープのうちLKKLFRE (配列番号92)の部分だけを詳しく調べたが、表12に示すそれ以外の一連のペプチドも入手して(Mimotopes)、アラニンスキャニング研究を最小結合エピトープ内の他のアミノ酸残基に拡大した。
この場合もやはり、ELISA法を(実施例6.4の記載と同様に)用いて、固定化されたビオチン化ペプチドの親マウスmAb 3G4との結合を検出した。図9を参照されたい(この実験において、ペプチドQFVKDLLLHLKKLFREGRFN (配列番号90)は、最大結合を示す陽性対照であり、ペプチドQFVKDLLLHLKKLFAEGRFN (配列番号104)は、最小結合を示す陰性対照である)。
これらのデータから、親マウスmAb 3G4のヒトIL-13との相互作用にとって111位のフェニルアラニン(F)残基も重要であることが示唆される。この残基の番号付けは、国際公開WO2006/003407に記載されたとおりである。
5. カニクイザル喘息モデルにおけるヒト化抗IL-13 mAbの有効性
この実施例は、予測的なものである。
カニクイザル(Macaca fascicularis)において、ブタ回虫(Ascaris suum(A. Suum))によって引き起こされる気管支収縮のモデルは、ヒトの喘息にもっともよく似た、関連性のある非臨床モデルとして広く認識されている(Patterson Rら、Trans. Assoc. Am. Physicians 1980 93:317-325; Patterson Rら、J. Lab. Clin. Med. 1983 101:864-872)。
この実施例は、予測的なものである。
カニクイザル(Macaca fascicularis)において、ブタ回虫(Ascaris suum(A. Suum))によって引き起こされる気管支収縮のモデルは、ヒトの喘息にもっともよく似た、関連性のある非臨床モデルとして広く認識されている(Patterson Rら、Trans. Assoc. Am. Physicians 1980 93:317-325; Patterson Rら、J. Lab. Clin. Med. 1983 101:864-872)。
このモデルにおいて、ブタ回虫に対して生まれつき肺に感受性を有する動物を霧状にしたブタ回虫に曝露して、喘息反応を誘発する。この喘息反応の特徴は、気道過敏(AHR)、気管支肺胞洗浄(BAL)液中で測定される細胞浸潤、および血中IgEレベルを評価することによって、明らかにすることができる。実験法は、Mauser PらによってAm. J. Resp. Crit. Care Med. 1995 204:467-472に、ならびにEvanoff HらによってImmunologic Investigation 1992 21:39にすでに記載された方法と同様である。
この実験は、特定の用量のブタ回虫抗原に対して陽性の気管支収縮反応を示した、侵入用にあらかじめ選択された30匹の動物を使用する。
ブタ回虫は、最適反応用量(ORD)で各動物に投与される。それは、エアロゾル吸入(1回の投与につき、ネブライザーを用いて呼吸15回にわたって与えられる)によって、RL(肺抵抗)を少なくとも40%増加させ、ならびにCDYN(ダイナミックコンプライアンス)を少なくとも35%減少させる、ブタ回虫のあらかじめ決定された用量である。
実験は2つのフェーズで行う。フェーズ1では、静脈内(i/v)ヒスタミンチャレンジ(ベースラインから少なくとも30%のRLの増加を引き起こすのに十分なヒスタミンの投与(PC30))に反応して、AHRを、ブタ回虫抗原投与(第9および10日にブタ回虫がエアロゾル吸入によって各動物に最適な既定の用量で投与されるとき)の前(第一日のベースラインの肺機能評価)、および後(第11日)にも評価する。
フェーズ2は、動物が抗体による治療を受ける以外は、フェーズ1と同じであって(下記を参照されたい)、各抗体は、第1、5および9日に約30mg/kgを静脈内注射によって3回投与される。
第1群 (n=12): ヒト化抗IL-13 mAb (30mg/kg)
第2群 (n=12): ヒト化抗IL-13 mAb (30mg/kg) およびパスコリズマブ(Pascolizumab) (ヒト化抗IL-4 mAb、30mg/kg)
第3群 (n=6): 担体のみ、陰性対照治療
第2群 (n=12): ヒト化抗IL-13 mAb (30mg/kg) およびパスコリズマブ(Pascolizumab) (ヒト化抗IL-4 mAb、30mg/kg)
第3群 (n=6): 担体のみ、陰性対照治療
フェーズ1および2から得られるAHR計測値は、Buxco肺機能システムを用いて、ヒスタミンに応じて、圧力および気流、すなわち肺抵抗(RL)およびダイナミックコンプライアンス(CDYN)を読み取ることによって計算する。ブタ回虫抗原チャレンジ後と比較したベースラインからの最大のパーセンテージ変化は、フェーズ1および2について、すなわち抗体治療あり、またはなしで比較し、これらのデータを用いてAHRの発現を評価した。
さらに、BALサンプルを、フェーズ1および2の第1および11日に採取し、細胞浸潤、特に好酸球増加を測定する。IgEレベルをモニターするために血清サンプルも採取する。
6.1 ヒトまたはカニクイザルIL-13結合ELISA
このアッセイは、ヒトまたはカニクイザルIL-13に対する抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
このアッセイは、ヒトまたはカニクイザルIL-13に対する抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
6.1.1 材料
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL-13 (大腸菌発現、Cambridge Biosciences社製、カタログ番号CH1-013)
3. カニクイザルIL-13 (GlaxoSmithkline社製)
4. ヤギ抗ヒトIL-13ポリクローナル抗体(R+D Systems社、カタログ番号AF-213-NA)
5. 抗ヒトIgG-HRP (Sigm社a、カタログ番号A-6029)
6. 抗マウスIgG-HRP (Sigma、カタログ番号A-9309)
7. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
8. TBST [Tris緩衝塩類溶液 (6.06g Tris + 8.06g NaCl + 0.2g KCl + H20 で1Lとする) + 0.05% Tween 20]
9. BSA (Sigma、A-7030)
10. OPD (Sigma、カタログ番号P-9187)
11. 硫酸
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL-13 (大腸菌発現、Cambridge Biosciences社製、カタログ番号CH1-013)
3. カニクイザルIL-13 (GlaxoSmithkline社製)
4. ヤギ抗ヒトIL-13ポリクローナル抗体(R+D Systems社、カタログ番号AF-213-NA)
5. 抗ヒトIgG-HRP (Sigm社a、カタログ番号A-6029)
6. 抗マウスIgG-HRP (Sigma、カタログ番号A-9309)
7. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
8. TBST [Tris緩衝塩類溶液 (6.06g Tris + 8.06g NaCl + 0.2g KCl + H20 で1Lとする) + 0.05% Tween 20]
9. BSA (Sigma、A-7030)
10. OPD (Sigma、カタログ番号P-9187)
11. 硫酸
6.1.2 方法
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー(Sigmaカタログ番号C-3041、メーカーの使用説明書にしたがって調製)中5ug/mlのヤギ抗ヒトIL-13ポリクローナル抗体(R+D Systems、カタログ番号AF-213-NA;メーカーの使用説明書にしたがって500μg/mlの原液濃度で調製し、分割して−20℃にて保存) 50ulでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキング、室温で1時間インキュベート
5. TBSTで3回洗浄(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. ウェル当たり20 ng(50μl容量中)のヒトIL-13(Cambridge Bioscience、カタログ番号CH1-013;メーカーの使用説明書にしたがって100ng/μlの原液濃度で調製し、分割して−20℃にて保存)、またはウェル当たり20 ngのカニクイザルIL-13をブロッキング溶液中として加え、室温で1時間インキュベートする
7. TBSTで3回洗浄
8. ブロッキング溶液に溶解した50μlの抗体サンプル(必要ならば、終点力価データを得るために滴定する)を加え、室温にて1時間インキュベートする
9. TBSTで3回洗浄する
10. 3G4キメラ抗体もしくはヒト化抗体については、ブロッキング溶液中1/2000希釈の抗ヒトIgG-HRP(Sigma、カタログ番号A-6029)をウェル当たり50μl使用し、室温にて1時間で、結合を検出する。3G4マウスモノクローナル抗体については、ブロッキング溶液中1/1000希釈の抗マウスIgG-HRP(Sigma、カタログ番号A-9309)をウェル当たり50μl使用し、室温にて1時間で、結合を検出する
11. TBSTで3回洗浄
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。発色時間は〜12分とする。
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー(Sigmaカタログ番号C-3041、メーカーの使用説明書にしたがって調製)中5ug/mlのヤギ抗ヒトIL-13ポリクローナル抗体(R+D Systems、カタログ番号AF-213-NA;メーカーの使用説明書にしたがって500μg/mlの原液濃度で調製し、分割して−20℃にて保存) 50ulでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキング、室温で1時間インキュベート
5. TBSTで3回洗浄(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. ウェル当たり20 ng(50μl容量中)のヒトIL-13(Cambridge Bioscience、カタログ番号CH1-013;メーカーの使用説明書にしたがって100ng/μlの原液濃度で調製し、分割して−20℃にて保存)、またはウェル当たり20 ngのカニクイザルIL-13をブロッキング溶液中として加え、室温で1時間インキュベートする
7. TBSTで3回洗浄
8. ブロッキング溶液に溶解した50μlの抗体サンプル(必要ならば、終点力価データを得るために滴定する)を加え、室温にて1時間インキュベートする
9. TBSTで3回洗浄する
10. 3G4キメラ抗体もしくはヒト化抗体については、ブロッキング溶液中1/2000希釈の抗ヒトIgG-HRP(Sigma、カタログ番号A-6029)をウェル当たり50μl使用し、室温にて1時間で、結合を検出する。3G4マウスモノクローナル抗体については、ブロッキング溶液中1/1000希釈の抗マウスIgG-HRP(Sigma、カタログ番号A-9309)をウェル当たり50μl使用し、室温にて1時間で、結合を検出する
11. TBSTで3回洗浄
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。発色時間は〜12分とする。
6.1A ヒトIL-13結合のELISA
このアッセイは、ヒトIL-13に対する抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法であるが、実施例6.1に記載の方法とは少しだけ異なる。
このアッセイは、ヒトIL-13に対する抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法であるが、実施例6.1に記載の方法とは少しだけ異なる。
6.1A.1 材料
1. Costar 96ウェルEIAプレート(Corning Costarカタログ番号3369)
2. ヒトIL-13(Peprotechカタログ番号200-13)
3. ヤギ抗ヒトIL-13ポリクローナル抗体(R+D Systemsカタログ番号AF-213-NA)
4. 抗ヒトκ軽鎖-HRP (Sigma、カタログ番号A7164)
5. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
6. TBST [Tris緩衝塩類溶液 (6.06g Tris + 8.06g NaCl + 0.2g KCl + H20 で1Lとする) + 0.05% Tween 20]
7. BSA (Sigma A-7030)
8. OPD (Sigma、カタログ番号P-9187)
9. 硫酸
1. Costar 96ウェルEIAプレート(Corning Costarカタログ番号3369)
2. ヒトIL-13(Peprotechカタログ番号200-13)
3. ヤギ抗ヒトIL-13ポリクローナル抗体(R+D Systemsカタログ番号AF-213-NA)
4. 抗ヒトκ軽鎖-HRP (Sigma、カタログ番号A7164)
5. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
6. TBST [Tris緩衝塩類溶液 (6.06g Tris + 8.06g NaCl + 0.2g KCl + H20 で1Lとする) + 0.05% Tween 20]
7. BSA (Sigma A-7030)
8. OPD (Sigma、カタログ番号P-9187)
9. 硫酸
6.1A.2 方法
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Costar E1A/RIA ELISAプレートを、炭酸/炭酸水素塩バッファー(Sigmaカタログ番号C-3041、メーカーの使用説明書にしたがって調製)中5μg/mlのヤギ抗ヒトIL-13ポリクローナル抗体(R+D Systems、カタログ番号AF-213-NA;メーカーの使用説明書にしたがって500μg/mlの原液濃度で調製し、分割して−20℃にて保存) 50μlでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキング、室温で1時間、または4℃にて最低一晩インキュベート
5. TBSTで2回洗浄(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. ウェル当たり20 ng(50μl容量中)のヒトIL-13(Peprotech、カタログ番号200-13;メーカーの使用説明書にしたがって100ng/μlの原液濃度で調製し、一定量に分割して−20℃にて保存)を加え、ブロッキング溶液で希釈し、室温で1時間インキュベートする
7. TBSTで2回洗浄
8. ブロッキング溶液中の抗体サンプル(必要ならば、終点力価データを得るために滴定する) 50μlを加え、室温にて1時間インキュベートする
9. TBSTで2回洗浄する
10. 3G4キメラ抗体もしくはヒト化抗体については、ブロッキング溶液で1/2000希釈した抗ヒトκ軽鎖-HRP(Sigma、カタログ番号A-7164)をウェル当たり50μl使用し、室温にて1時間で、結合を検出する
11. TBSTで2回洗浄する
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Costar E1A/RIA ELISAプレートを、炭酸/炭酸水素塩バッファー(Sigmaカタログ番号C-3041、メーカーの使用説明書にしたがって調製)中5μg/mlのヤギ抗ヒトIL-13ポリクローナル抗体(R+D Systems、カタログ番号AF-213-NA;メーカーの使用説明書にしたがって500μg/mlの原液濃度で調製し、分割して−20℃にて保存) 50μlでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキング、室温で1時間、または4℃にて最低一晩インキュベート
5. TBSTで2回洗浄(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. ウェル当たり20 ng(50μl容量中)のヒトIL-13(Peprotech、カタログ番号200-13;メーカーの使用説明書にしたがって100ng/μlの原液濃度で調製し、一定量に分割して−20℃にて保存)を加え、ブロッキング溶液で希釈し、室温で1時間インキュベートする
7. TBSTで2回洗浄
8. ブロッキング溶液中の抗体サンプル(必要ならば、終点力価データを得るために滴定する) 50μlを加え、室温にて1時間インキュベートする
9. TBSTで2回洗浄する
10. 3G4キメラ抗体もしくはヒト化抗体については、ブロッキング溶液で1/2000希釈した抗ヒトκ軽鎖-HRP(Sigma、カタログ番号A-7164)をウェル当たり50μl使用し、室温にて1時間で、結合を検出する
11. TBSTで2回洗浄する
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
6.1B 天然ヒトIL-13結合ELISA
このアッセイは、天然ヒトIL-13に対する抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
このアッセイは、天然ヒトIL-13に対する抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
6.1B.1 材料
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. 天然ヒトIL-13 (HDLM-2細胞上清)
3. 抗ヒトIL13抗体 (Pharmingen、カタログ番号554570)
4. ビオチン化抗ヒトIL13抗体 (Pharmingen、カタログ番号555054)
5. ストレプトアビジン-HRP (Sigmaカタログ番号E2886)
6. 炭酸/炭酸水素塩バッファー (Sigma、カタログ番号C-3041)
7. RPMI + 20%FBS + 2mMグルタミン
8. PBST (PBS + 0.05% Tween 20)
9. BSA (Sigma A-7030)
10. OPD (Sigma、カタログ番号P-9187)
11. 硫酸
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. 天然ヒトIL-13 (HDLM-2細胞上清)
3. 抗ヒトIL13抗体 (Pharmingen、カタログ番号554570)
4. ビオチン化抗ヒトIL13抗体 (Pharmingen、カタログ番号555054)
5. ストレプトアビジン-HRP (Sigmaカタログ番号E2886)
6. 炭酸/炭酸水素塩バッファー (Sigma、カタログ番号C-3041)
7. RPMI + 20%FBS + 2mMグルタミン
8. PBST (PBS + 0.05% Tween 20)
9. BSA (Sigma A-7030)
10. OPD (Sigma、カタログ番号P-9187)
11. 硫酸
6.1B.2 方法
1. ブロッキング溶液はPBST中1% BSAである
2. 洗浄溶液はPBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー中5μg/mlの3G4キメラもしくはヒト化抗体、または2μg/ml抗ヒトIL-13(Pharmingenカタログ番号554570)希釈物50ulでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 1% BSA/PBST 200μlでブロッキング、室温で1時間インキュベート
5. PBSTで3回洗浄する
6. RPMI + 20%FBS + 2mMグルタミン溶液で希釈した、HDLM2上清サンプル(滴定済み)中に存在する天然IL-13を50μl加え、室温にて1時間インキュベートする
7. PBSTで3回洗浄する
8. PBST + 1%BSAで希釈した、ビオチン化抗ヒトIL-13 1μg/ml (Pharmingen、カタログ番号555054)をウェル当たり50μl加え、室温にて1時間インキュベートする
9. PBSTで3回洗浄する。
1. ブロッキング溶液はPBST中1% BSAである
2. 洗浄溶液はPBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー中5μg/mlの3G4キメラもしくはヒト化抗体、または2μg/ml抗ヒトIL-13(Pharmingenカタログ番号554570)希釈物50ulでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 1% BSA/PBST 200μlでブロッキング、室温で1時間インキュベート
5. PBSTで3回洗浄する
6. RPMI + 20%FBS + 2mMグルタミン溶液で希釈した、HDLM2上清サンプル(滴定済み)中に存在する天然IL-13を50μl加え、室温にて1時間インキュベートする
7. PBSTで3回洗浄する
8. PBST + 1%BSAで希釈した、ビオチン化抗ヒトIL-13 1μg/ml (Pharmingen、カタログ番号555054)をウェル当たり50μl加え、室温にて1時間インキュベートする
9. PBSTで3回洗浄する。
10. PBST + 1%BSAで希釈した1/1000希釈のストレプトアビジン-HRPコンジュゲートをウェルあたり50μl加える。室温で1時間インキュベートする
11. TBSTで3回洗浄する
12. ウェルあたり100μlのOPD(Sigmaカタログ番号P-9187、メーカーの使用説明書にしたがって調製)で発色させ、ウェルあたり50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る
11. TBSTで3回洗浄する
12. ウェルあたり100μlのOPD(Sigmaカタログ番号P-9187、メーカーの使用説明書にしたがって調製)で発色させ、ウェルあたり50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る
6.2 IL-13中和バイオアッセイ(TF-1細胞増殖アッセイ)
これは、抗IL-13抗体の中和能力を測定するために使用することができるIL-13バイオアッセイである。下記の方法は、組換えヒトもしくはカニクイザルIL-13を使用する。哺乳類発現ヒトIL-13もしくはQ130ヒトIL-13変異体も、このアッセイに使用することができる。
これは、抗IL-13抗体の中和能力を測定するために使用することができるIL-13バイオアッセイである。下記の方法は、組換えヒトもしくはカニクイザルIL-13を使用する。哺乳類発現ヒトIL-13もしくはQ130ヒトIL-13変異体も、このアッセイに使用することができる。
6.2.1 材料
1. TF-1 細胞株(当研究所で得られたTF-1細胞株、NB、ATCCの細胞株も利用できる)
2. 96ウェル組織培養プレート(Invitrogen)
3. ヒトIL-13(Cambridge Bioscience、カタログ番号CH1-013)
4. CellTiter 96非放射性細胞増殖アッセイ(Promega、カタログ番号G4000)
1. TF-1 細胞株(当研究所で得られたTF-1細胞株、NB、ATCCの細胞株も利用できる)
2. 96ウェル組織培養プレート(Invitrogen)
3. ヒトIL-13(Cambridge Bioscience、カタログ番号CH1-013)
4. CellTiter 96非放射性細胞増殖アッセイ(Promega、カタログ番号G4000)
6.2.2 方法
1. TH-1細胞バイオアッセイにおいて、抗ヒトIL-13 mAbが組換えヒトもしくはカニクイザルIL-13の生物活性を中和する能力を測定する方法
2. このアッセイは、滅菌96ウェル組織培養プレート(Invitrogen)において無菌条件下で実施する
3. 10ng/mlのヒトIL-13(Cambridge Bioscience、カタログ番号CH1-013;クラス2の組織培養フード内で無菌操作によって、メーカーの使用説明書にしたがって100ng/μlの原液濃度で調製し、小量ずつ分割して−20℃で保存)または10ng/mlのカニクイザルIL-13(GSK製)を、抗ヒトIL-13 mAbのさまざまな希釈物(6μg/mlから3倍希釈で0.025μg/mlまで下げる)とともに、総量50μlとして37℃にて1時間プレインキュベートする。IL-13は含有するが抗ヒトIL-13 mAbは含有しない陽性対照ウェルも含められる。さらに、陰性対照ウェルは、IL-13も抗ヒトIL-13 mAbも含有しない。このプレインキュベーションには、タンパク質結合性の低い滅菌丸底96ウェルプレートを使用する。(ここで留意すべきは、細胞が加わる今後の段階では、IL-13および抗ヒトIL-13 mAbの濃度が半分になることである)
4. 2x105/mlのTF-1細胞50μlを滅菌96ウェル組織培養プレートにまく。1時間プレインキュベートした後、IL-13および抗ヒトIL-13 mAbサンプルを細胞に加える。最終的なアッセイ容量100μlは、抗ヒトIL-13 mAbのさまざまな希釈物、組換えIL-13およびTF-1細胞を含有しており、37℃にて〜70時間、加湿したCO2インキュベーター内でインキュベートする
5. 〜66時間の時点で、ウェルをスキャンして、ウェルが無菌であること、ならびに細菌汚染が生じていないことを確認する
6. インキュベーションの最後の4時間は、ウェルあたり15μlの濾過滅菌したMTT基質(Promegaカタログ番号G4000、メーカーの使用説明書にしたがって調製)を加えた状態とする
7. 100μlの停止溶液(MTTキットで与えられる)で反応を止め、代謝されたブルーホルマザン産物を溶解させる。少なくとも2時間放置した後、ピペット内を上下させて結晶の溶解を助ける。あるいはまた、プレートシーラーで覆って4℃で一晩静置し、次に翌日ピペット内を上下させる(ピペット操作の点ではこちらのほうが容易である)
8. 570nmの波長で、96ウェルプレートリーダー内の各ウェルに入っている溶液の吸光度を読み取る
9. 抗ヒトIL-13 mAbがヒトもしくはカニクイザルIL-13の生物活性を中和する能力は、一定量のヒトもしくはカニクイザルIL-13(5ng/ml)の生物活性を50%だけ中和するのに必要な抗ヒトIL-13 mAbの濃度(=ND50)として表される。必要とされる濃度が低いほど、中和能力は強力である。
1. TH-1細胞バイオアッセイにおいて、抗ヒトIL-13 mAbが組換えヒトもしくはカニクイザルIL-13の生物活性を中和する能力を測定する方法
2. このアッセイは、滅菌96ウェル組織培養プレート(Invitrogen)において無菌条件下で実施する
3. 10ng/mlのヒトIL-13(Cambridge Bioscience、カタログ番号CH1-013;クラス2の組織培養フード内で無菌操作によって、メーカーの使用説明書にしたがって100ng/μlの原液濃度で調製し、小量ずつ分割して−20℃で保存)または10ng/mlのカニクイザルIL-13(GSK製)を、抗ヒトIL-13 mAbのさまざまな希釈物(6μg/mlから3倍希釈で0.025μg/mlまで下げる)とともに、総量50μlとして37℃にて1時間プレインキュベートする。IL-13は含有するが抗ヒトIL-13 mAbは含有しない陽性対照ウェルも含められる。さらに、陰性対照ウェルは、IL-13も抗ヒトIL-13 mAbも含有しない。このプレインキュベーションには、タンパク質結合性の低い滅菌丸底96ウェルプレートを使用する。(ここで留意すべきは、細胞が加わる今後の段階では、IL-13および抗ヒトIL-13 mAbの濃度が半分になることである)
4. 2x105/mlのTF-1細胞50μlを滅菌96ウェル組織培養プレートにまく。1時間プレインキュベートした後、IL-13および抗ヒトIL-13 mAbサンプルを細胞に加える。最終的なアッセイ容量100μlは、抗ヒトIL-13 mAbのさまざまな希釈物、組換えIL-13およびTF-1細胞を含有しており、37℃にて〜70時間、加湿したCO2インキュベーター内でインキュベートする
5. 〜66時間の時点で、ウェルをスキャンして、ウェルが無菌であること、ならびに細菌汚染が生じていないことを確認する
6. インキュベーションの最後の4時間は、ウェルあたり15μlの濾過滅菌したMTT基質(Promegaカタログ番号G4000、メーカーの使用説明書にしたがって調製)を加えた状態とする
7. 100μlの停止溶液(MTTキットで与えられる)で反応を止め、代謝されたブルーホルマザン産物を溶解させる。少なくとも2時間放置した後、ピペット内を上下させて結晶の溶解を助ける。あるいはまた、プレートシーラーで覆って4℃で一晩静置し、次に翌日ピペット内を上下させる(ピペット操作の点ではこちらのほうが容易である)
8. 570nmの波長で、96ウェルプレートリーダー内の各ウェルに入っている溶液の吸光度を読み取る
9. 抗ヒトIL-13 mAbがヒトもしくはカニクイザルIL-13の生物活性を中和する能力は、一定量のヒトもしくはカニクイザルIL-13(5ng/ml)の生物活性を50%だけ中和するのに必要な抗ヒトIL-13 mAbの濃度(=ND50)として表される。必要とされる濃度が低いほど、中和能力は強力である。
6.2.A IL-13中和バイオアッセイ(TF-1細胞増殖アッセイ)
これは、抗IL-13抗体の中和能力を測定するために使用することができるIL-13バイオアッセイである。下記の方法は、組換えヒトもしくはカニクイザルIL-13を使用する。哺乳類発現ヒトIL-13もしくはQ130ヒトIL-13変異体も、このアッセイに使用することができる。ここで留意すべきは、この方法が実施例6.2に記載の方法と少しだけ異なることである。
これは、抗IL-13抗体の中和能力を測定するために使用することができるIL-13バイオアッセイである。下記の方法は、組換えヒトもしくはカニクイザルIL-13を使用する。哺乳類発現ヒトIL-13もしくはQ130ヒトIL-13変異体も、このアッセイに使用することができる。ここで留意すべきは、この方法が実施例6.2に記載の方法と少しだけ異なることである。
6.2.A.1 材料
1. TF-1細胞株(当研究所で得られたTF-1細胞株、 NB、ATCCの細胞株も利用できる)
2. 96ウェル組織培養プレート(Corning costar、カタログ番号3596)
3. ヒトIL-13 (Peprotech、カタログ番号200-13)
4. ヒトIL-13 (CHO細胞発現)、GSK社製。
1. TF-1細胞株(当研究所で得られたTF-1細胞株、 NB、ATCCの細胞株も利用できる)
2. 96ウェル組織培養プレート(Corning costar、カタログ番号3596)
3. ヒトIL-13 (Peprotech、カタログ番号200-13)
4. ヒトIL-13 (CHO細胞発現)、GSK社製。
5. ヒトIL-13 Q130変異体(Peprotech、カタログ番号200-13A)
6. カニクイザルIL-13(GSK社製)。
6. カニクイザルIL-13(GSK社製)。
7. ポリクローナル抗ヒトIL13 (R&D systems AF-213-NA)
8. 96ウェル組織培養プレート(Corning costar、カタログ番号3790)
9. CellTiter 96非放射性細胞増殖アッセイ(Promega、カタログ番号G4000)
8. 96ウェル組織培養プレート(Corning costar、カタログ番号3790)
9. CellTiter 96非放射性細胞増殖アッセイ(Promega、カタログ番号G4000)
6.2.A.2 方法
1. TH-1細胞バイオアッセイにおいて、抗ヒトIL-13 mAbが組換えヒトもしくはカニクイザルIL-13の生物活性を中和する能力を測定する方法
2. このアッセイは、滅菌96ウェル組織培養プレート(Corning costar、カタログ番号3596)において無菌条件下で実施する。すべてのテストは3回反復で行う
3. 10ng/mlのヒトIL-13(Peprotech、カタログ番号200-13)、または10ng/mlのCHO発現ヒトIL13(GSK社製)、または60ng/mlのヒトIL13 Q130変異体(Peprotech、カタログ番号200-13A)、または10ng/mlのカニクイザルIL-13(GSK社製)(クラス2の組織培養フード内で無菌操作によって、メーカーの使用説明書にしたがって原液濃度で市販のAbを調製し、小量ずつ分割して−20℃で保存)を、抗ヒトIL-13 mAbのさまざまな希釈物(6μg/ml、2μg/mlもしくは180μg/mlから3倍希釈で、それぞれ0.025μg/ml、0.008μg/mlもしくは0.74μg/mlまで下げる)とともに、総量50μlとして37℃にて1時間プレインキュベートする。IL-13は含有するが抗ヒトIL-13 mAbは含有しない陽性対照ウェルも含められる。さらに、陰性対照ウェルは、IL-13も抗ヒトIL-13 mAbも含有しない。このプレインキュベーションには、タンパク質結合性の低い滅菌丸底96ウェルプレートを使用する(Corning costar、カタログ番号3790)。(ここで留意すべきは、細胞が加わる今後の段階では、IL-13および抗ヒトIL-13 mAbの濃度が半分になることである。)
4. 2x105/mlのTF-1細胞50μlを滅菌96ウェル組織培養プレート(Corning costar、カタログ番号3596)にまく。1時間プレインキュベートした後、IL-13および抗ヒトIL-13 mAbサンプルを細胞に加える。最終的なアッセイ容量100μlは、抗ヒトIL-13 mAbのさまざまな希釈物、組換えIL-13およびTF-1細胞を含有しており、37℃にて3日間、加湿したCO2インキュベーター内でインキュベートする
5. ウェルをスキャンして、ウェルが無菌であること、ならびに細菌汚染が生じていないことを確認する
6. インキュベーションの最後の4時間は、ウェルあたり15μlのMTT基質(Promegaカタログ番号G4000)を加えた状態とする
7. 100μlの停止溶液(MTTキットで与えられる)で反応を止め、代謝されたブルーホルマザン産物を溶解させる。少なくとも2時間室温で放置した後、〜30分間プレートシェーカー上でプレートを振盪する。あるいはまた、プレートシーラーで覆って4℃で一晩静置した後、〜30分間プレートシェーカー上でプレートを振盪する。570nmの波長で、96ウェルプレートリーダー内の各ウェルに入っている溶液の吸光度を読み取る
8. 抗ヒトIL-13 mAbがヒトもしくはカニクイザルIL-13の生物活性を中和する能力は、一定量のヒトもしくはカニクイザルIL-13の生物活性を50%だけ中和するのに必要な抗ヒトIL-13 mAbの濃度(=ND50)として表される。必要とされる濃度が低いほど、中和能力は強力である。
1. TH-1細胞バイオアッセイにおいて、抗ヒトIL-13 mAbが組換えヒトもしくはカニクイザルIL-13の生物活性を中和する能力を測定する方法
2. このアッセイは、滅菌96ウェル組織培養プレート(Corning costar、カタログ番号3596)において無菌条件下で実施する。すべてのテストは3回反復で行う
3. 10ng/mlのヒトIL-13(Peprotech、カタログ番号200-13)、または10ng/mlのCHO発現ヒトIL13(GSK社製)、または60ng/mlのヒトIL13 Q130変異体(Peprotech、カタログ番号200-13A)、または10ng/mlのカニクイザルIL-13(GSK社製)(クラス2の組織培養フード内で無菌操作によって、メーカーの使用説明書にしたがって原液濃度で市販のAbを調製し、小量ずつ分割して−20℃で保存)を、抗ヒトIL-13 mAbのさまざまな希釈物(6μg/ml、2μg/mlもしくは180μg/mlから3倍希釈で、それぞれ0.025μg/ml、0.008μg/mlもしくは0.74μg/mlまで下げる)とともに、総量50μlとして37℃にて1時間プレインキュベートする。IL-13は含有するが抗ヒトIL-13 mAbは含有しない陽性対照ウェルも含められる。さらに、陰性対照ウェルは、IL-13も抗ヒトIL-13 mAbも含有しない。このプレインキュベーションには、タンパク質結合性の低い滅菌丸底96ウェルプレートを使用する(Corning costar、カタログ番号3790)。(ここで留意すべきは、細胞が加わる今後の段階では、IL-13および抗ヒトIL-13 mAbの濃度が半分になることである。)
4. 2x105/mlのTF-1細胞50μlを滅菌96ウェル組織培養プレート(Corning costar、カタログ番号3596)にまく。1時間プレインキュベートした後、IL-13および抗ヒトIL-13 mAbサンプルを細胞に加える。最終的なアッセイ容量100μlは、抗ヒトIL-13 mAbのさまざまな希釈物、組換えIL-13およびTF-1細胞を含有しており、37℃にて3日間、加湿したCO2インキュベーター内でインキュベートする
5. ウェルをスキャンして、ウェルが無菌であること、ならびに細菌汚染が生じていないことを確認する
6. インキュベーションの最後の4時間は、ウェルあたり15μlのMTT基質(Promegaカタログ番号G4000)を加えた状態とする
7. 100μlの停止溶液(MTTキットで与えられる)で反応を止め、代謝されたブルーホルマザン産物を溶解させる。少なくとも2時間室温で放置した後、〜30分間プレートシェーカー上でプレートを振盪する。あるいはまた、プレートシーラーで覆って4℃で一晩静置した後、〜30分間プレートシェーカー上でプレートを振盪する。570nmの波長で、96ウェルプレートリーダー内の各ウェルに入っている溶液の吸光度を読み取る
8. 抗ヒトIL-13 mAbがヒトもしくはカニクイザルIL-13の生物活性を中和する能力は、一定量のヒトもしくはカニクイザルIL-13の生物活性を50%だけ中和するのに必要な抗ヒトIL-13 mAbの濃度(=ND50)として表される。必要とされる濃度が低いほど、中和能力は強力である。
6.3. エピトープをおおまかにマッピングするELISA
このアッセイは、ヒトもしくはカニクイザルIL-13ペプチドへのマウスmAb 3G4の結合を検出するELISAを示す。
このアッセイは、ヒトもしくはカニクイザルIL-13ペプチドへのマウスmAb 3G4の結合を検出するELISAを示す。
6.3.1 材料
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ImmunoPure(登録商標)ストレプトアビジン (Pierce、カタログ番号21125)
3. PBST (リン酸緩衝塩類溶液 + 0.05% Tween 20)
4. BSA (Sigma A-7030)
5. ヒトおよびカニクイザルIL-13の16merペプチド、オフセット=4 (Mimotopes特注)
6. 陽性対照および陰性対照の20merペプチド(Mimotopes特注により提供される)
7. 3G4マウスmAb
8. 対照Ab (Mimotopes特注によって提供される)
9. ウサギ抗マウスIg HRPコンジュゲート(DAKO、コード番号P0260)
10. OPD (Sigma、カタログ番号P-9187)
11. 3M 硫酸
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ImmunoPure(登録商標)ストレプトアビジン (Pierce、カタログ番号21125)
3. PBST (リン酸緩衝塩類溶液 + 0.05% Tween 20)
4. BSA (Sigma A-7030)
5. ヒトおよびカニクイザルIL-13の16merペプチド、オフセット=4 (Mimotopes特注)
6. 陽性対照および陰性対照の20merペプチド(Mimotopes特注により提供される)
7. 3G4マウスmAb
8. 対照Ab (Mimotopes特注によって提供される)
9. ウサギ抗マウスIg HRPコンジュゲート(DAKO、コード番号P0260)
10. OPD (Sigma、カタログ番号P-9187)
11. 3M 硫酸
6.3.2 方法
1. ブロッキング溶液は3% BSA+PBSTである
2. 洗浄溶液はPBSTである
3. Nunc Maxisorp ELISAプレートを、希釈剤としてPBSTを用いて、5μg/ml ImmunoPure(登録商標)ストレプトアビジン (Pierce、カタログ番号21125、メーカーの使用説明書にしたがって1mg/mlの原液濃度で調製し、分割して+4℃で保存)100μlでコーティングする。37℃で一晩インキュベートし、溶液を乾燥させる
4. 3% BSA/PBST 200μlでブロッキングする。プレートシーラーを加えて室温で1時間インキュベートする
5. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. 2回反復で、希釈剤としてPBSTを用いて、各ペプチド(メーカーの使用説明書にしたがって200μlの40%アセトニトリル60%水に溶解した後、同溶媒による10倍希釈物を一定量に分割し、−20℃にて保存する)の1000倍希釈物をウェルあたり100μl加える(対照ウェルは除く)
7. 対照ウェルには、2回反復で、希釈剤としてPBSTを用いて、対照ペプチド(メーカーの使用説明書にしたがって1mlの40%アセトニトリル60%水に溶解し、−20℃にて保存する)の10倍希釈物をウェルあたり100μl加える。プレートシーラーを加え、振盪台の上で室温にて1時間インキュベートする
8. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
9. PBST中1.506μg/mlマウスmAbを、ウェル当たり100μl加える
10. 希釈剤としてPBSTを用いた対照抗体の4、16および32倍希釈物(メーカーに提供されたまま使用し、−20℃で保存)だけを、対照ウェルに、ウェルあたり100μl 加える。プレートシーラーを加え、振盪台の上でrtp(常温常圧)にて1時間インキュベートする
11. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
12. 希釈剤としてPBSTを用いたウサギ抗マウスIg HRPコンジュゲート(DAKO、コード番号P0260、提供されたまま使用し、+4℃にて保存)の2,000倍希釈物を、ウェルあたり100μl加える。プレートシーラーを加え、振盪台の上でrtpにて1時間インキュベートする
13. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
14. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。発色時間は〜10分とする。
1. ブロッキング溶液は3% BSA+PBSTである
2. 洗浄溶液はPBSTである
3. Nunc Maxisorp ELISAプレートを、希釈剤としてPBSTを用いて、5μg/ml ImmunoPure(登録商標)ストレプトアビジン (Pierce、カタログ番号21125、メーカーの使用説明書にしたがって1mg/mlの原液濃度で調製し、分割して+4℃で保存)100μlでコーティングする。37℃で一晩インキュベートし、溶液を乾燥させる
4. 3% BSA/PBST 200μlでブロッキングする。プレートシーラーを加えて室温で1時間インキュベートする
5. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. 2回反復で、希釈剤としてPBSTを用いて、各ペプチド(メーカーの使用説明書にしたがって200μlの40%アセトニトリル60%水に溶解した後、同溶媒による10倍希釈物を一定量に分割し、−20℃にて保存する)の1000倍希釈物をウェルあたり100μl加える(対照ウェルは除く)
7. 対照ウェルには、2回反復で、希釈剤としてPBSTを用いて、対照ペプチド(メーカーの使用説明書にしたがって1mlの40%アセトニトリル60%水に溶解し、−20℃にて保存する)の10倍希釈物をウェルあたり100μl加える。プレートシーラーを加え、振盪台の上で室温にて1時間インキュベートする
8. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
9. PBST中1.506μg/mlマウスmAbを、ウェル当たり100μl加える
10. 希釈剤としてPBSTを用いた対照抗体の4、16および32倍希釈物(メーカーに提供されたまま使用し、−20℃で保存)だけを、対照ウェルに、ウェルあたり100μl 加える。プレートシーラーを加え、振盪台の上でrtp(常温常圧)にて1時間インキュベートする
11. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
12. 希釈剤としてPBSTを用いたウサギ抗マウスIg HRPコンジュゲート(DAKO、コード番号P0260、提供されたまま使用し、+4℃にて保存)の2,000倍希釈物を、ウェルあたり100μl加える。プレートシーラーを加え、振盪台の上でrtpにて1時間インキュベートする
13. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
14. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。発色時間は〜10分とする。
6.4. エピトープを詳細にマッピングするELISA
このアッセイは、ヒトもしくはカニクイザルIL-13ペプチドへのmAb 3G4の結合を検出するELISAを示す。
このアッセイは、ヒトもしくはカニクイザルIL-13ペプチドへのmAb 3G4の結合を検出するELISAを示す。
6.4.1 材料
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ImmunoPure(登録商標) ストレプトアビジン (Pierce、カタログ番号21125)
3. PBST (リン酸緩衝塩類溶液 + 0.05% Tween 20)
4. BSA (Sigma A-7030)
5. ヒトおよびカニクイザルIL-13の部分的なウィンドウネット(window net)ペプチド(NおよびC末端の両端から一度にアミノ酸1つずつトランケートした14mer;Mimotopes特注)
6. 陽性対照および陰性対照の16merペプチド(事前のMimotopes特注により提供される)
7. 3G4 mAb(当研究所製)
8. ヤギ抗マウスIgG(FC特異的)HRPコンジュゲート抗体(Sigma A-9309)
9. OPD (Sigma、カタログ番号P-9187)
10. 3M 硫酸
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ImmunoPure(登録商標) ストレプトアビジン (Pierce、カタログ番号21125)
3. PBST (リン酸緩衝塩類溶液 + 0.05% Tween 20)
4. BSA (Sigma A-7030)
5. ヒトおよびカニクイザルIL-13の部分的なウィンドウネット(window net)ペプチド(NおよびC末端の両端から一度にアミノ酸1つずつトランケートした14mer;Mimotopes特注)
6. 陽性対照および陰性対照の16merペプチド(事前のMimotopes特注により提供される)
7. 3G4 mAb(当研究所製)
8. ヤギ抗マウスIgG(FC特異的)HRPコンジュゲート抗体(Sigma A-9309)
9. OPD (Sigma、カタログ番号P-9187)
10. 3M 硫酸
6.4.2 方法
1. ブロッキング溶液は3% BSA+PBSTである
2. 洗浄溶液はPBSTである
3. Nunc Maxisorp ELISAプレートを、超純水に溶解した5μg/ml ImmunoPure(登録商標)ストレプトアビジン (Pierce、カタログ番号21125、メーカーの使用説明書にしたがって1mg/mlの原液濃度で調製し、+4℃で保存)100μlでコーティングする。37℃で一晩インキュベートする
4. 3% BSA/PBST 200μlでブロッキングする。プレートシーラーを加えて4℃で一晩インキュベートする
5. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. 2回反復で、希釈剤として3% BSA/PBSTを用いて、各ペプチド(メーカーの使用説明書にしたがって200μlの40%アセトニトリル60%水に溶解し、−20℃にて保存する)の1000倍希釈物をウェルあたり100μl加える。プレートシーラーを加え、振盪台の上で室温にて1時間インキュベートする
7. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
8. 3% BSA/PBSTで希釈した3μg/ml mAbを、ウェル当たり100μl加える。プレートシーラーを加え、振盪台の上で室温にて1時間インキュベートする
9. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
10. 希釈剤として3% BSA/PBSTを用いたヤギ抗マウスIgG HRPコンジュゲート抗体(Sigma A-9309、提供されたまま使用し、+4℃にて保存)の1,000倍希釈物を、ウェルあたり100μl加える。プレートシーラーを加え、振盪台の上で室温にて1時間インキュベートする
11. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。発色時間は〜10分とする。
1. ブロッキング溶液は3% BSA+PBSTである
2. 洗浄溶液はPBSTである
3. Nunc Maxisorp ELISAプレートを、超純水に溶解した5μg/ml ImmunoPure(登録商標)ストレプトアビジン (Pierce、カタログ番号21125、メーカーの使用説明書にしたがって1mg/mlの原液濃度で調製し、+4℃で保存)100μlでコーティングする。37℃で一晩インキュベートする
4. 3% BSA/PBST 200μlでブロッキングする。プレートシーラーを加えて4℃で一晩インキュベートする
5. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. 2回反復で、希釈剤として3% BSA/PBSTを用いて、各ペプチド(メーカーの使用説明書にしたがって200μlの40%アセトニトリル60%水に溶解し、−20℃にて保存する)の1000倍希釈物をウェルあたり100μl加える。プレートシーラーを加え、振盪台の上で室温にて1時間インキュベートする
7. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
8. 3% BSA/PBSTで希釈した3μg/ml mAbを、ウェル当たり100μl加える。プレートシーラーを加え、振盪台の上で室温にて1時間インキュベートする
9. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
10. 希釈剤として3% BSA/PBSTを用いたヤギ抗マウスIgG HRPコンジュゲート抗体(Sigma A-9309、提供されたまま使用し、+4℃にて保存)の1,000倍希釈物を、ウェルあたり100μl加える。プレートシーラーを加え、振盪台の上で室温にて1時間インキュベートする
11. PBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。発色時間は〜10分とする。
6.5 ヒトIL-13のヒトIL-13Rα1鎖との結合のELISA
このELISAは、抗体が、ヒトIL-13のヒトIL-13Rα1鎖との結合を阻害することができるかどうかを判定する。
このELISAは、抗体が、ヒトIL-13のヒトIL-13Rα1鎖との結合を阻害することができるかどうかを判定する。
6.5.1 材料
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL13Rα1-Fc (R&D Systems、カタログ番号146-IR)
3. ヒトIL-13 (当研究所で作製)
4. ビオチン化抗ヒトIL-13 (R&D Systems、カタログ番号BAF213)
5. ストレプトアビジン-HRP (Sigmaカタログ番号E2886)
6. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
7. TBST [Tris緩衝塩類溶液(6.06g Tris + 8.06g NaCl + 0.2g KCl + H20で1Lとする) + 0.05% Tween 20]
8. BSA (Sigma A-7030)
9. OPD (Sigma、カタログ番号P-9187)
10. 硫酸
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL13Rα1-Fc (R&D Systems、カタログ番号146-IR)
3. ヒトIL-13 (当研究所で作製)
4. ビオチン化抗ヒトIL-13 (R&D Systems、カタログ番号BAF213)
5. ストレプトアビジン-HRP (Sigmaカタログ番号E2886)
6. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
7. TBST [Tris緩衝塩類溶液(6.06g Tris + 8.06g NaCl + 0.2g KCl + H20で1Lとする) + 0.05% Tween 20]
8. BSA (Sigma A-7030)
9. OPD (Sigma、カタログ番号P-9187)
10. 硫酸
6.5.2 方法
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー中5μg/mlのヒトIL-13Rα1−Fc、50ulでコーティングする。プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキングし、rtpで1時間インキュベートする
5. TBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. 総容量50μlで、0.4ng/μl ヒトIL-13を、ブロッキング溶液中の抗体サンプル(滴定済み)とともに30分間プレインキュベートする。プレインキュベートしたサンプルを、受容体でコーティングしたELISAプレートに加え、室温で1時間インキュベートする
7. TBSTで3回洗浄する
8. 1μg/mlに希釈したビオチン化抗ヒトIL-13をウェル当たり50μl使用して、結合したヒトIL-13をすべて検出する。室温で1時間インキュベートする
9. TBSTで3回洗浄する
10. 1/1000希釈のストレプトアビジン-HRPコンジュゲートをウェルあたり50μl加える。室温で1時間インキュベートする
11. TBSTで3回洗浄する
12. ウェルあたり100μlのOPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、ウェルあたり50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー中5μg/mlのヒトIL-13Rα1−Fc、50ulでコーティングする。プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキングし、rtpで1時間インキュベートする
5. TBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. 総容量50μlで、0.4ng/μl ヒトIL-13を、ブロッキング溶液中の抗体サンプル(滴定済み)とともに30分間プレインキュベートする。プレインキュベートしたサンプルを、受容体でコーティングしたELISAプレートに加え、室温で1時間インキュベートする
7. TBSTで3回洗浄する
8. 1μg/mlに希釈したビオチン化抗ヒトIL-13をウェル当たり50μl使用して、結合したヒトIL-13をすべて検出する。室温で1時間インキュベートする
9. TBSTで3回洗浄する
10. 1/1000希釈のストレプトアビジン-HRPコンジュゲートをウェルあたり50μl加える。室温で1時間インキュベートする
11. TBSTで3回洗浄する
12. ウェルあたり100μlのOPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、ウェルあたり50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
6.6 ヒトIL-13のヒトIL-13Rα2鎖との結合のELISA
このELISAは、抗体が、ヒトIL-13のヒトIL-13Rα2鎖との結合を阻害することができるかどうかを判定する。
このELISAは、抗体が、ヒトIL-13のヒトIL-13Rα2鎖との結合を阻害することができるかどうかを判定する。
6.6.1 材料
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL13Rα2-Fc (R&D Systems、カタログ番号614-IR)
3. ヒトIL-13 (当研究所で作製)
4. ビオチン化抗ヒトIL-13 (R&D Systems、カタログ番号BAF213)
5. ストレプトアビジン-HRP
6. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
7. TBST [Tris緩衝塩類溶液(6.06g Tris + 8.06g NaCl + 0.2g KCl + H20で1Lとする) + 0.05% Tween 20]
8. BSA (Sigma A-7030)
9. OPD (Sigma、カタログ番号P-9187)
10. 硫酸
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL13Rα2-Fc (R&D Systems、カタログ番号614-IR)
3. ヒトIL-13 (当研究所で作製)
4. ビオチン化抗ヒトIL-13 (R&D Systems、カタログ番号BAF213)
5. ストレプトアビジン-HRP
6. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
7. TBST [Tris緩衝塩類溶液(6.06g Tris + 8.06g NaCl + 0.2g KCl + H20で1Lとする) + 0.05% Tween 20]
8. BSA (Sigma A-7030)
9. OPD (Sigma、カタログ番号P-9187)
10. 硫酸
6.6.2 方法
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー中5μg/mlのヒトIL-13Rα2−Fc、50ulでコーティングする。プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキングし、rtpで1時間インキュベートする
5. TBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. 総容量50μlで、0.01ng/μl ヒトIL-13を、ブロッキング溶液中の抗体サンプル(滴定済み)とともに60分間プレインキュベートする。プレインキュベートしたサンプルを、受容体でコーティングしたELISAプレートに加え、室温で1時間インキュベートする
7. TBSTで3回洗浄する
8. 0.5μg/mlに希釈したビオチン化抗ヒトIL-13をウェル当たり50μl使用して、結合したヒトIL-13をすべて検出する。室温で1時間インキュベートする
9. TBSTで3回洗浄する
10. 1/1000希釈のストレプトアビジン-HRPコンジュゲートをウェルあたり50μl加える。室温で1時間インキュベートする
11. TBSTで3回洗浄する
12. ウェルあたり100μlのOPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、ウェルあたり50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。発色時間は〜2分とする。
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー中5μg/mlのヒトIL-13Rα2−Fc、50ulでコーティングする。プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキングし、rtpで1時間インキュベートする
5. TBSTで3回洗浄する(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. 総容量50μlで、0.01ng/μl ヒトIL-13を、ブロッキング溶液中の抗体サンプル(滴定済み)とともに60分間プレインキュベートする。プレインキュベートしたサンプルを、受容体でコーティングしたELISAプレートに加え、室温で1時間インキュベートする
7. TBSTで3回洗浄する
8. 0.5μg/mlに希釈したビオチン化抗ヒトIL-13をウェル当たり50μl使用して、結合したヒトIL-13をすべて検出する。室温で1時間インキュベートする
9. TBSTで3回洗浄する
10. 1/1000希釈のストレプトアビジン-HRPコンジュゲートをウェルあたり50μl加える。室温で1時間インキュベートする
11. TBSTで3回洗浄する
12. ウェルあたり100μlのOPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、ウェルあたり50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。発色時間は〜2分とする。
6.7 ヒトIL-4結合のELISA
このアッセイは、ヒトIL-4への抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
このアッセイは、ヒトIL-4への抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
6.7.1 材料
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL-4(R+D Systems、カタログ番号204IL)
3. ヤギ抗ヒトIL-4ポリクローナル抗体(R+D Systemsカタログ番号AF-204-NA)
4. ビオチン化ラット抗ヒトIL-4抗体(R & D systems、カタログ番号BAF204)
5. 抗マウスIgG-HRP(Dako、カタログ番号P0260)
6. 抗ヒトκ軽鎖-HRP(Sigma A7164)
7. ストレプトアビジン-HRP(Sigmaカタログ番号E2886)
8. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
9. TBST [Tris緩衝塩類溶液 (6.06g Tris + 8.06g NaCl + 0.2g KCl + H20 で1Lとする) + 0.05% Tween 20]
10. BSA (Sigma A-7030)
11. OPD (Sigma、カタログ番号P-9187)
12. 硫酸
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL-4(R+D Systems、カタログ番号204IL)
3. ヤギ抗ヒトIL-4ポリクローナル抗体(R+D Systemsカタログ番号AF-204-NA)
4. ビオチン化ラット抗ヒトIL-4抗体(R & D systems、カタログ番号BAF204)
5. 抗マウスIgG-HRP(Dako、カタログ番号P0260)
6. 抗ヒトκ軽鎖-HRP(Sigma A7164)
7. ストレプトアビジン-HRP(Sigmaカタログ番号E2886)
8. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
9. TBST [Tris緩衝塩類溶液 (6.06g Tris + 8.06g NaCl + 0.2g KCl + H20 で1Lとする) + 0.05% Tween 20]
10. BSA (Sigma A-7030)
11. OPD (Sigma、カタログ番号P-9187)
12. 硫酸
6.7.2 方法
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー(Sigmaカタログ番号C-3041、メーカーの使用説明書にしたがって調製)中5μg/mlのヤギ抗ヒトIL-4ポリクローナル抗体(R+D Systems、カタログ番号AF-204-NA;メーカーの使用説明書にしたがって500μg/mlの原液濃度で調製し、分割して−20℃にて保存) 50μlでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキングし、常温常圧(rtp)で1時間インキュベートする
5. TBSTで2回洗浄(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. ブロッキング溶液中1 ng/ml(50μl容量中)のヒトIL-4を加え、室温で1時間インキュベートする
7. TBSTで3回洗浄
8. ブロッキング溶液中の抗体サンプル(必要ならば、終点力価データを得るために滴定する) 50μlを加え、rtpで1時間インキュベートする。ヒトIL-4に対する結合の陽性対照として、ビオチン化抗ヒトIL-4モノクローナル抗体(滴定済み)を使用する
9. TBSTで3回洗浄する
10. 3G4マウスモノクローナル抗体については、ブロッキング溶液で1/2000希釈した抗マウスIgG-HRP(Dako、カタログ番号P0260)をウェルあたり50μl用いて、rtpにて1時間で、結合を検出する。3G4キメラ抗体もしくはヒト化抗体については、ブロッキング溶液で1/2000希釈した抗ヒトκ軽鎖-HRP(Sigma、カタログ番号A-7164)をウェル当たり50μl使用し、rtpにて1時間で、結合を検出する。陽性対照のビオチン化ラット抗ヒトIL-4モノクローナル抗体については、ブロッキング溶液で1/1000希釈したストレプトアビジン-HRPコンジュゲート抗体(Sigmaカタログ番号E2886)を用いて、rtpにて1時間で、結合を検出する
11. TBSTで3回洗浄する
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー(Sigmaカタログ番号C-3041、メーカーの使用説明書にしたがって調製)中5μg/mlのヤギ抗ヒトIL-4ポリクローナル抗体(R+D Systems、カタログ番号AF-204-NA;メーカーの使用説明書にしたがって500μg/mlの原液濃度で調製し、分割して−20℃にて保存) 50μlでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキングし、常温常圧(rtp)で1時間インキュベートする
5. TBSTで2回洗浄(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. ブロッキング溶液中1 ng/ml(50μl容量中)のヒトIL-4を加え、室温で1時間インキュベートする
7. TBSTで3回洗浄
8. ブロッキング溶液中の抗体サンプル(必要ならば、終点力価データを得るために滴定する) 50μlを加え、rtpで1時間インキュベートする。ヒトIL-4に対する結合の陽性対照として、ビオチン化抗ヒトIL-4モノクローナル抗体(滴定済み)を使用する
9. TBSTで3回洗浄する
10. 3G4マウスモノクローナル抗体については、ブロッキング溶液で1/2000希釈した抗マウスIgG-HRP(Dako、カタログ番号P0260)をウェルあたり50μl用いて、rtpにて1時間で、結合を検出する。3G4キメラ抗体もしくはヒト化抗体については、ブロッキング溶液で1/2000希釈した抗ヒトκ軽鎖-HRP(Sigma、カタログ番号A-7164)をウェル当たり50μl使用し、rtpにて1時間で、結合を検出する。陽性対照のビオチン化ラット抗ヒトIL-4モノクローナル抗体については、ブロッキング溶液で1/1000希釈したストレプトアビジン-HRPコンジュゲート抗体(Sigmaカタログ番号E2886)を用いて、rtpにて1時間で、結合を検出する
11. TBSTで3回洗浄する
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
6.8 ヒトIL-5結合のELISA
このアッセイは、ヒトIL-5への抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
このアッセイは、ヒトIL-5への抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
6.8.1 材料
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL-5(R+D Systems、カタログ番号205IL)
3. 抗ヒトIL-5ポリクローナル抗体(R+D Systemsカタログ番号AF-205-NA)
4. 抗ヒトIL-5メポリズマブ(当社製、臨床用グレード)
5. 抗マウスIgG-HRP(Dako、カタログ番号P0260)
6. 抗ヒトκ軽鎖-HRP(Sigma A7164)
7. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
8. TBST [Tris緩衝塩類溶液 (6.06g Tris + 8.06g NaCl + 0.2g KCl + H20 で1Lとする) + 0.05% Tween 20]
9. BSA (Sigma A-7030)
10. OPD (Sigma、カタログ番号P-9187)
11. 硫酸
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies, 4-39454A)
2. ヒトIL-5(R+D Systems、カタログ番号205IL)
3. 抗ヒトIL-5ポリクローナル抗体(R+D Systemsカタログ番号AF-205-NA)
4. 抗ヒトIL-5メポリズマブ(当社製、臨床用グレード)
5. 抗マウスIgG-HRP(Dako、カタログ番号P0260)
6. 抗ヒトκ軽鎖-HRP(Sigma A7164)
7. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
8. TBST [Tris緩衝塩類溶液 (6.06g Tris + 8.06g NaCl + 0.2g KCl + H20 で1Lとする) + 0.05% Tween 20]
9. BSA (Sigma A-7030)
10. OPD (Sigma、カタログ番号P-9187)
11. 硫酸
6.8.2 方法
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー(Sigmaカタログ番号C-3041、メーカーの使用説明書にしたがって調製)中5μg/mlのヤギ抗ヒトIL-5ポリクローナル抗体(R+D Systems、カタログ番号AF-205-NA;メーカーの使用説明書にしたがって500μg/mlの原液濃度で調製し、分割して−20℃にて保存) 50μlでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキングし、常温常圧(rtp)で1時間インキュベートする
5. TBSTで3回洗浄(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. ブロッキング溶液中100 ng/ml(50μl容量中)のヒトIL-5(R+D Systems、カタログ番号205IL)を加え、室温で1時間インキュベートする
7. TBSTで3回洗浄
8. ブロッキング溶液中の抗体サンプル(必要ならば、終点力価データを得るために滴定する) 50μlを加え、rtpで1時間インキュベートする。ヒトIL-5に対する結合の陽性対照として、抗ヒトIL-5メポリズマブ抗体(滴定済み)を使用する
9. TBSTで3回洗浄する
10. 3G4マウスモノクローナル抗体については、ブロッキング溶液で1/2000希釈した抗マウスIgG-HRP(Dako、カタログ番号P0260)をウェルあたり50μl用いて、rtpにて1時間で、結合を検出する。3G4キメラ抗体もしくはヒト化抗体および抗IL-5メポリズマブについては、ブロッキング溶液で1/2000希釈した抗ヒトκ軽鎖-HRP(Sigma、カタログ番号A-7164)をウェル当たり50μl使用し、rtpにて1時間で、結合を検出する
11. TBSTで3回洗浄する
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
1. ブロッキング溶液は3% BSA+TBSTである
2. 洗浄溶液はTBSTである
3. Nunc Maxisorp ELISAプレートを、炭酸/炭酸水素塩バッファー(Sigmaカタログ番号C-3041、メーカーの使用説明書にしたがって調製)中5μg/mlのヤギ抗ヒトIL-5ポリクローナル抗体(R+D Systems、カタログ番号AF-205-NA;メーカーの使用説明書にしたがって500μg/mlの原液濃度で調製し、分割して−20℃にて保存) 50μlでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/TBST 100μlでブロッキングし、常温常圧(rtp)で1時間インキュベートする
5. TBSTで3回洗浄(1回の洗浄につきウェル当たり、少なくとも200μlの洗浄溶液)
6. ブロッキング溶液中100 ng/ml(50μl容量中)のヒトIL-5(R+D Systems、カタログ番号205IL)を加え、室温で1時間インキュベートする
7. TBSTで3回洗浄
8. ブロッキング溶液中の抗体サンプル(必要ならば、終点力価データを得るために滴定する) 50μlを加え、rtpで1時間インキュベートする。ヒトIL-5に対する結合の陽性対照として、抗ヒトIL-5メポリズマブ抗体(滴定済み)を使用する
9. TBSTで3回洗浄する
10. 3G4マウスモノクローナル抗体については、ブロッキング溶液で1/2000希釈した抗マウスIgG-HRP(Dako、カタログ番号P0260)をウェルあたり50μl用いて、rtpにて1時間で、結合を検出する。3G4キメラ抗体もしくはヒト化抗体および抗IL-5メポリズマブについては、ブロッキング溶液で1/2000希釈した抗ヒトκ軽鎖-HRP(Sigma、カタログ番号A-7164)をウェル当たり50μl使用し、rtpにて1時間で、結合を検出する
11. TBSTで3回洗浄する
12. 100μl OPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
6.9 ヒトGM-CSF結合のELISA
このアッセイは、ヒトGM-CSFへの抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
このアッセイは、ヒトGM-CSFへの抗体の結合を検出するELISAを説明する。それはサンドウィッチELISA法である。
6.9.1 材料
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies、4-39454A)
2. ヒトGM-CSF(臨床用、当社製)
3. 抗ヒトGM-CSFモノクローナル抗体(R+D Systems、カタログ番号MAB215)
4. 抗マウスIgG-HRP(Dako、カタログ番号P0260)
5. 抗ヒトκ軽鎖-HRP(Sigma A7164)
6. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
7. PBST(PBS + 0.05% Tween 20)
8. BSA (Sigma A-7030)
9. OPD (Sigma、カタログ番号P-9187)
10. 硫酸
1. Nunc Immunoplate 1 F96 Maxisorp (Life Technologies、4-39454A)
2. ヒトGM-CSF(臨床用、当社製)
3. 抗ヒトGM-CSFモノクローナル抗体(R+D Systems、カタログ番号MAB215)
4. 抗マウスIgG-HRP(Dako、カタログ番号P0260)
5. 抗ヒトκ軽鎖-HRP(Sigma A7164)
6. 炭酸/炭酸水素塩バッファー(Sigma、カタログ番号C-3041)
7. PBST(PBS + 0.05% Tween 20)
8. BSA (Sigma A-7030)
9. OPD (Sigma、カタログ番号P-9187)
10. 硫酸
6.9.2 方法
1. ブロッキング溶液は3% BSA+PBSTである
2. 洗浄溶液はPBSTである
3. Nunc Maxisorp ELISAプレートを、PBS中2μg/mlのヒトGM-CSF希釈物50μlでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/PBST 200μlでブロッキングし、常温常圧(rtp)で1時間インキュベートする
5. PBSTで3回洗浄する
6. ブロッキング溶液中の抗体サンプル(終点力価データを得るために滴定済み)50μlを加え、rtpで1時間インキュベートする。ヒトGM-CSFに対する結合の陽性対照として、抗ヒトGM-CSF(R&D systems、カタログ番号MAB215)抗体(滴定済み)を使用する
7. PBSTで3回洗浄する
8. GM-CSFマウスモノクローナル抗体については、ブロッキング溶液で1/2000希釈した抗マウスIgG-HRP(Dako、カタログ番号P0260)をウェルあたり50μl用いて、rtpにて1時間で、結合を検出する。3G4キメラ抗体もしくはヒト化抗体については、ブロッキング溶液で1/2000希釈した抗ヒトκ軽鎖-HRP(Sigma、カタログ番号A-7164)をウェル当たり50μl使用し、rtpにて1時間で、結合を検出する
9. PBSTで3回洗浄する
10. 100μlのOPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
1. ブロッキング溶液は3% BSA+PBSTである
2. 洗浄溶液はPBSTである
3. Nunc Maxisorp ELISAプレートを、PBS中2μg/mlのヒトGM-CSF希釈物50μlでコーティングし、プレートシーラーで覆って、4℃にて一晩インキュベートする
4. 3% BSA/PBST 200μlでブロッキングし、常温常圧(rtp)で1時間インキュベートする
5. PBSTで3回洗浄する
6. ブロッキング溶液中の抗体サンプル(終点力価データを得るために滴定済み)50μlを加え、rtpで1時間インキュベートする。ヒトGM-CSFに対する結合の陽性対照として、抗ヒトGM-CSF(R&D systems、カタログ番号MAB215)抗体(滴定済み)を使用する
7. PBSTで3回洗浄する
8. GM-CSFマウスモノクローナル抗体については、ブロッキング溶液で1/2000希釈した抗マウスIgG-HRP(Dako、カタログ番号P0260)をウェルあたり50μl用いて、rtpにて1時間で、結合を検出する。3G4キメラ抗体もしくはヒト化抗体については、ブロッキング溶液で1/2000希釈した抗ヒトκ軽鎖-HRP(Sigma、カタログ番号A-7164)をウェル当たり50μl使用し、rtpにて1時間で、結合を検出する
9. PBSTで3回洗浄する
10. 100μlのOPD(Sigma、カタログ番号P-9187;メーカーの使用説明書にしたがって調製)で発色させ、50μlの3M H2SO4で停止させて、490nmの吸光度を読み取る。
Claims (46)
- hIL-13と特異的に結合する抗体もしくはその抗原結合フラグメントであって、配列番号3に記載のCDRH3またはその変異体を含んでなり、該変異体は、前記CDRH3の1個または2個のアミノ酸残基が配列番号3の対応する位置にあるアミノ酸残基と異なるものである、上記の抗体もしくはその抗原結合フラグメント。
- 抗体もしくはその抗原結合フラグメントがヒトIL-13を中和する、請求項1に記載の抗体もしくはその抗原結合フラグメント。
- 抗体もしくはその抗原結合フラグメントが、ヒトIL-13とその受容体との結合をモジュレートする、請求項1または2に記載の抗体もしくはその抗原結合フラグメント。
- CDRH3が配列番号3の配列を含んでなる、請求項1〜3のいずれか1つに記載の抗体もしくはその抗原結合フラグメント。
- 抗体もしくはその抗原結合フラグメントが、1つ以上の次の配列CDRH2: 配列番号2、CDRH1: 配列番号1、CDRL1: 配列番号4、CDRL2: 配列番号5、およびCDRL3: 配列番号6、または前記CDRの1個もしくは2個のアミノ酸残基が配列番号の対応する位置にあるアミノ酸残基と異なるその変異体をさらに含んでなる、請求項1〜4のいずれか1つに記載の抗体もしくはその抗原結合フラグメント。
- 抗体もしくはその抗原結合フラグメントが以下のCDR:
CDRH1: 配列番号1
CDRH2: 配列番号2
CDRH3: 配列番号3
CDRL1: 配列番号4
CDRL2: 配列番号5
CDRL3: 配列番号6
を含んでなる、請求項1〜5のいずれか1つに記載の抗体もしくはその抗原結合フラグメント。 - 配列番号90、99、102、103、105、106、107、108、109、110、111、112および114に記載のペプチドと結合するが、配列番号100、101、104および113に記載のペプチドとは結合しない、抗体もしくはその抗原結合フラグメント。
- 配列番号91に記載のエピトープと特異的に結合する、請求項1〜7のいずれか1つに記載の抗体もしくはその抗原結合フラグメント。
- 抗体がインタクトな抗体である、請求項1〜8のいずれか1つに記載の抗体もしくはその抗原結合フラグメント。
- 抗体がラット、マウス、霊長類(カニクイザル、旧世界サル、もしくは大型類人猿)、またはヒト抗体である、請求項9に記載の抗体もしくはその抗原結合フラグメント。
- 抗体がヒト化もしくはキメラ抗体である、請求項1〜9のいずれか1つに記載の抗体。
- 抗体がヒト定常領域を含んでなる、請求項9〜11のいずれか1つに記載の抗体。
- 抗体がIgGアイソタイプの定常領域を含んでなる、請求項9〜12のいずれか1つに記載の抗体。
- 抗体がIgG1、IgG2またはIgG4である、請求項13に記載の抗体。
- 配列番号7のVHドメインおよび配列番号8のVLドメインを含んでなる、請求項6に記載の抗体。
- 配列番号12のVHドメインおよび配列番号15のVLドメインを含んでなる、請求項6に記載のヒト化抗体。
- 配列番号13のVHドメインおよび配列番号15のVLドメインを含んでなる、請求項6に記載のヒト化抗体。
- IgGアイソタイプ(たとえば、IgG1またはIgG4)のヒト定常領域をさらに含んでなる、請求項16または17に記載のヒト化抗体。
- 配列番号19の重鎖および配列番号22の軽鎖を含んでなる、ヒト化抗体。
- 配列番号20の重鎖および配列番号22の軽鎖を含んでなる、ヒト化抗体。
- フラグメントがFab、Fab'、F(ab')2、Fv、ダイアボディ、トリアボディ、テトラボディ、ミニ抗体、ミニボディ、単離VH、単離VLである、請求項1〜8のいずれか1つに記載の抗原結合フラグメント。
- フラグメントがScFvを含んでなる、またはScFvからなる、請求項21に記載の抗原結合フラグメント。
- 前記抗体が、ADCCおよび/または補体活性化を低下させるような変異型Fc領域を含んでなる、請求項1〜20のいずれか1つに記載の抗体。
- 第1および第2のベクターを含んでなる、組換えによって形質転換またはトランスフェクトされた宿主細胞であって、前記第1のベクターは前記請求項のいずれか1つに記載の抗体の重鎖をコードするポリヌクレオチドを含んでなり、前記第2のベクターは前記請求項のいずれか1つに記載の軽鎖をコードするポリヌクレオチドを含んでなる、上記の宿主細胞。
- 前記細胞が真核細胞である、請求項24に記載の宿主細胞。
- 前記細胞が哺乳類細胞である、請求項25に記載の宿主細胞。
- 前記細胞がCHO細胞またはNS0細胞である、請求項26に記載の宿主細胞。
- 請求項1〜20のいずれか1つ、または請求項23に記載の抗体を製造する方法であって、請求項24〜27のいずれか1つに記載の宿主細胞を無血清培地中で培養するステップを含んでなる、上記方法。
- 前記抗体が宿主細胞によって培地中に分泌される、請求項28に記載の方法。
- 前記抗体が、前記抗体含有培地に対して、少なくとも95%以上(たとえば、98%以上)にさらに精製される、請求項29に記載の方法。
- 請求項1〜23のいずれか1つに記載の抗体もしくはその抗原結合フラグメント、ならびに製薬上許容される担体を含んでなる、医薬組成物。
- 請求項31に記載の組成物を使用説明書とともに含んでなる、キット・オブ・パーツ。
- 治療上有効な量の請求項1〜23のいずれか1つに記載の抗体もしくは抗原結合フラグメントを投与するステップを含んでなる、喘息に罹患したヒト患者を治療する方法。
- 前記患者が、アレルギー性喘息、重症喘息、難治性喘息、不安定喘息、夜間喘息、月経前喘息、ステロイド抵抗性喘息、ステロイド依存性喘息、アスピリン誘発喘息、成人発症喘息、小児喘息から選択される喘息に罹患している、請求項33に記載の方法。
- 副腎皮質ステロイドによる治療に反応しない喘息性疾患に罹患したヒト患者を治療する方法であって、治療上有効な量の請求項1〜23のいずれか1つに記載の抗体もしくは抗原結合フラグメントを前記患者に投与するステップを含んでなる、上記方法。
- ヒト患者において急性喘息発作を予防する方法であって、治療上有効な量の請求項1〜23のいずれか1つに記載の抗体を前記患者に投与するステップを含んでなる、上記方法。
- ヒト患者において急性喘息発作の頻度を減らす、および/またはその影響を緩和する方法であって、治療上有効な量の請求項1〜23のいずれか1つに記載の抗体を前記患者に投与するステップを含んでなる、上記方法。
- アトピー性皮膚炎、アレルギー性鼻炎、クローン病、COPD、線維性疾患もしくは障害、たとえば特発性肺線維症、全身性進行性硬化症、肝線維症、肝肉芽種、住血吸虫症、リーシュマニア症、細胞周期制御に関する疾患、たとえばホジキン病、B細胞慢性リンパ球性白血病からなる群から選択される疾患もしくは障害に罹っているヒト患者を治療する方法であって、治療上有効な量の請求項1〜23のいずれか1つに記載の抗体をヒト患者に投与するステップを含んでなる、上記方法。
- アレルギー性喘息、重症喘息、難治性喘息、不安定喘息、夜間喘息、月経前喘息、ステロイド抵抗性喘息、ステロイド依存性喘息、アスピリン誘発喘息、成人発症喘息、小児喘息、アトピー性皮膚炎、アレルギー性鼻炎、クローン病、COPD、線維性疾患もしくは障害、たとえば特発性肺線維症、全身性進行性硬化症、肝線維症、肝肉芽種、住血吸虫症、リーシュマニア症、細胞周期制御に関する疾患、たとえばホジキン病、B細胞慢性リンパ球性白血病からなる群から選択される、疾患もしくは障害を治療するための薬剤の製造における、請求項1〜23のいずれか1つに記載の抗体もしくはその抗原結合フラグメントの使用。
- アレルギー性喘息、重症喘息、難治性喘息、不安定喘息、夜間喘息、月経前喘息、ステロイド抵抗性喘息、ステロイド依存性喘息、アスピリン誘発喘息、成人発症喘息、小児喘息、アトピー性皮膚炎、アレルギー性鼻炎、クローン病、COPD、線維性疾患もしくは障害、たとえば特発性肺線維症、全身性進行性硬化症、肝線維症、肝肉芽種、住血吸虫症、リーシュマニア症、細胞周期制御に関する疾患、たとえばホジキン病、B細胞慢性リンパ球性白血病からなる群から選択される、疾患もしくは障害に罹患したヒト患者を治療する方法であって、治療上有効な量の請求項1〜23のいずれか1つに記載の抗体、および治療上有効な量の抗IL-4モノクローナル抗体を投与することを含んでなる、上記方法。
- 抗IL-4モノクローナル抗体が、請求項1〜23のいずれか1つに記載の抗体と、同時に、順次、または別々に投与される、請求項40に記載の方法。
- 抗IL-4モノクローナル抗体がパスコリズマブ(pascolizumab)である、請求項40または41に記載の方法。
- アレルギー性喘息、重症喘息、難治性喘息、不安定喘息、夜間喘息、月経前喘息、ステロイド抵抗性喘息、ステロイド依存性喘息、アスピリン誘発喘息、成人発症喘息、小児喘息、アトピー性皮膚炎、アレルギー性鼻炎、クローン病、COPD、線維性疾患もしくは障害、たとえば特発性肺線維症、全身性進行性硬化症、肝線維症、肝肉芽種、住血吸虫症、リーシュマニア症、細胞周期制御に関する疾患、たとえばホジキン病、B細胞慢性リンパ球性白血病からなる群から選択される、疾患もしくは障害を治療するための薬剤の製造における、請求項1〜23のいずれか1つに記載の抗体、およびパスコリズマブ(pascolizumab)のような抗IL-4モノクローナル抗体の使用。
- アレルギー性喘息、重症喘息、難治性喘息、不安定喘息、夜間喘息、月経前喘息、ステロイド抵抗性喘息、ステロイド依存性喘息、アスピリン誘発喘息、成人発症喘息、小児喘息、アトピー性皮膚炎、アレルギー性鼻炎、クローン病、COPD、線維性疾患もしくは障害、たとえば特発性肺線維症、全身性進行性硬化症、肝線維症、肝肉芽種、住血吸虫症、リーシュマニア症、細胞周期制御に関する疾患、たとえばホジキン病、B細胞慢性リンパ球性白血病からなる群から選択される、疾患もしくは障害を治療するためのキット・オブ・パーツの製造における、請求項1〜23のいずれか1つに記載の抗体、およびパスコリズマブ(pascolizumab)のような抗IL-4モノクローナル抗体の使用。
- 請求項1〜23のいずれか1つに記載の抗体、および製薬上許容される担体を含んでなる第1の医薬組成物、ならびにパスコリズマブ(pascolizumab)のような抗IL-4モノクローナル抗体および製薬上許容される担体を含んでなる第2の医薬組成物を、場合により使用説明書とともに、含んでなる、キット・オブ・パーツ。
- 請求項1〜23のいずれか1つに記載の第1の抗体、およびパスコリズマブ(pascolizumab)のような抗IL-4抗体である第2の抗体、ならびに製薬上許容される担体を含んでなる医薬組成物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB0600488.1A GB0600488D0 (en) | 2006-01-11 | 2006-01-11 | Immunoglobulins |
| PCT/EP2007/050219 WO2007080174A2 (en) | 2006-01-11 | 2007-01-10 | Chimeric and humanised anti-human il-13 antibodies |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009523154A true JP2009523154A (ja) | 2009-06-18 |
| JP2009523154A5 JP2009523154A5 (ja) | 2010-02-18 |
Family
ID=35997844
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008549873A Pending JP2009523154A (ja) | 2006-01-11 | 2007-01-10 | キメラおよびヒト化抗ヒトil−13抗体 |
Country Status (18)
| Country | Link |
|---|---|
| EP (1) | EP1976881A2 (ja) |
| JP (1) | JP2009523154A (ja) |
| KR (1) | KR20080113201A (ja) |
| CN (1) | CN101370829A (ja) |
| AR (1) | AR058955A1 (ja) |
| AU (1) | AU2007204372A1 (ja) |
| BR (1) | BRPI0706481A2 (ja) |
| CA (1) | CA2635972A1 (ja) |
| CR (1) | CR10161A (ja) |
| EA (1) | EA200801520A1 (ja) |
| GB (1) | GB0600488D0 (ja) |
| IL (1) | IL192207A0 (ja) |
| MA (1) | MA30156B1 (ja) |
| NO (1) | NO20082767L (ja) |
| PE (1) | PE20081185A1 (ja) |
| TW (1) | TW200736274A (ja) |
| WO (1) | WO2007080174A2 (ja) |
| ZA (1) | ZA200805526B (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013508387A (ja) * | 2009-10-20 | 2013-03-07 | アボット・ラボラトリーズ | プロテインaアフィニティークロマトグラフィーを利用した抗il−13抗体の単離精製 |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7910708B2 (en) | 2005-10-21 | 2011-03-22 | Novartis Ag | Anti-IL13 human antibodies |
| TWI422387B (zh) | 2006-05-25 | 2014-01-11 | Glaxo Group Ltd | 免疫球蛋白 |
| EP2050764A1 (en) * | 2007-10-15 | 2009-04-22 | sanofi-aventis | Novel polyvalent bispecific antibody format and uses thereof |
| JP2012509658A (ja) * | 2008-11-26 | 2012-04-26 | グラクソ グループ リミテッド | Il−13に結合するリガンド |
| RU2015132478A (ru) | 2009-03-05 | 2015-12-10 | Эббви Инк. | Связывающие il-17 белки |
| GB0904214D0 (en) | 2009-03-11 | 2009-04-22 | Ucb Pharma Sa | Biological products |
| TW201107345A (en) | 2009-05-28 | 2011-03-01 | Glaxo Group Ltd | Immunoglobulins |
| MX2013004212A (es) * | 2010-10-15 | 2013-09-02 | Medimmune Ltd | Terapias para mejorar la funcion pulmonar. |
| NZ713202A (en) | 2010-12-16 | 2017-12-22 | Genentech Inc | Diagnosis and treatments relating to th2 inhibition |
| PL3235508T3 (pl) | 2011-03-16 | 2021-07-12 | Sanofi | Kompozycje zawierające białko podobne do przeciwciała z podwójnym regionem v |
| CA2924873A1 (en) | 2013-10-23 | 2015-04-30 | Genentech, Inc. | Methods of diagnosing and treating eosinophilic disorders |
| PE20161171A1 (es) | 2014-02-21 | 2016-11-08 | Genentech Inc | Anticuerpos bioespecificos anti-il-13/il-17 y sus usos referencia cruzada a solicitudes relacionadas |
| WO2015155710A1 (en) | 2014-04-11 | 2015-10-15 | Novartis Ag | Methods of selectively treating asthma using il-13 antagonists |
| CA2977285A1 (en) | 2015-03-16 | 2016-09-22 | F. Hoffmann-La Roche Ag | Methods of detecting and quantifying il-13 and uses in diagnosing and treating th2-associated diseases |
| US20190086392A1 (en) | 2016-03-21 | 2019-03-21 | Inserm (Institut National De La Sante Et De La Recherch Medicale) | Methods for diagnosis and treatment of solar lentigo |
| US20190359722A1 (en) * | 2017-01-23 | 2019-11-28 | Toyo University | Anti-epha2 antibody and immunological detection of epha2 using same |
| CN109776677B (zh) * | 2017-11-15 | 2023-11-03 | 尚华科创投资管理(江苏)有限公司 | 一种人源化抗il-13抗体及其制备方法和应用 |
| CN107909501B (zh) * | 2017-12-05 | 2020-12-01 | 创新先进技术有限公司 | 气味与行为的关联方法、气味社交方法及装置 |
| CA3226165A1 (en) | 2018-02-09 | 2019-08-15 | Genentech, Inc. | Therapeutic and diagnostic methods for mast cell-mediated inflammatory diseases |
| WO2020092015A1 (en) | 2018-11-02 | 2020-05-07 | University Of Rochester | Therapeutic mitigation of epithelial infection |
| CN114008079A (zh) * | 2019-03-20 | 2022-02-01 | 贾夫林肿瘤学公司 | 抗adam12抗体和嵌合抗原受体以及包含其的组合物和方法 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004019975A2 (en) * | 2002-08-30 | 2004-03-11 | Glaxo Group Limited | Il-14 vaccine for the treatment of asthma and atopic disorders |
| WO2004096849A2 (en) * | 2003-04-25 | 2004-11-11 | University Of Manitoba | Peptide-based cytokine/chemokine vaccines against allergy |
| WO2005062967A2 (en) * | 2003-12-23 | 2005-07-14 | Tanox, Inc. | Novel anti-il 13 antibodies and uses thereof |
| WO2006003407A2 (en) * | 2004-07-01 | 2006-01-12 | Glaxo Group Limited | Chimeric and humanised monoclonal antibodies against inteleukin- 13 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7501121B2 (en) * | 2004-06-17 | 2009-03-10 | Wyeth | IL-13 binding agents |
-
2006
- 2006-01-11 GB GBGB0600488.1A patent/GB0600488D0/en not_active Ceased
-
2007
- 2007-01-09 AR ARP070100082A patent/AR058955A1/es unknown
- 2007-01-09 TW TW096100833A patent/TW200736274A/zh unknown
- 2007-01-09 PE PE2007000018A patent/PE20081185A1/es not_active Application Discontinuation
- 2007-01-10 CA CA002635972A patent/CA2635972A1/en not_active Abandoned
- 2007-01-10 JP JP2008549873A patent/JP2009523154A/ja active Pending
- 2007-01-10 BR BRPI0706481-0A patent/BRPI0706481A2/pt not_active IP Right Cessation
- 2007-01-10 AU AU2007204372A patent/AU2007204372A1/en not_active Abandoned
- 2007-01-10 WO PCT/EP2007/050219 patent/WO2007080174A2/en active Application Filing
- 2007-01-10 KR KR1020087019555A patent/KR20080113201A/ko not_active Application Discontinuation
- 2007-01-10 EA EA200801520A patent/EA200801520A1/ru unknown
- 2007-01-10 EP EP07703766A patent/EP1976881A2/en not_active Withdrawn
- 2007-01-10 CN CNA2007800022973A patent/CN101370829A/zh active Pending
-
2008
- 2008-06-16 IL IL192207A patent/IL192207A0/en unknown
- 2008-06-16 NO NO20082767A patent/NO20082767L/no not_active Application Discontinuation
- 2008-06-24 ZA ZA200805526A patent/ZA200805526B/xx unknown
- 2008-07-11 MA MA31108A patent/MA30156B1/fr unknown
- 2008-07-17 CR CR10161A patent/CR10161A/es not_active Application Discontinuation
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004019975A2 (en) * | 2002-08-30 | 2004-03-11 | Glaxo Group Limited | Il-14 vaccine for the treatment of asthma and atopic disorders |
| WO2004096849A2 (en) * | 2003-04-25 | 2004-11-11 | University Of Manitoba | Peptide-based cytokine/chemokine vaccines against allergy |
| WO2005062967A2 (en) * | 2003-12-23 | 2005-07-14 | Tanox, Inc. | Novel anti-il 13 antibodies and uses thereof |
| WO2006003407A2 (en) * | 2004-07-01 | 2006-01-12 | Glaxo Group Limited | Chimeric and humanised monoclonal antibodies against inteleukin- 13 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013508387A (ja) * | 2009-10-20 | 2013-03-07 | アボット・ラボラトリーズ | プロテインaアフィニティークロマトグラフィーを利用した抗il−13抗体の単離精製 |
Also Published As
| Publication number | Publication date |
|---|---|
| GB0600488D0 (en) | 2006-02-22 |
| BRPI0706481A2 (pt) | 2011-03-29 |
| NO20082767L (no) | 2008-10-06 |
| CR10161A (es) | 2008-11-26 |
| EA200801520A1 (ru) | 2009-02-27 |
| TW200736274A (en) | 2007-10-01 |
| CN101370829A (zh) | 2009-02-18 |
| MA30156B1 (fr) | 2009-01-02 |
| WO2007080174A2 (en) | 2007-07-19 |
| AR058955A1 (es) | 2008-03-05 |
| EP1976881A2 (en) | 2008-10-08 |
| KR20080113201A (ko) | 2008-12-29 |
| ZA200805526B (en) | 2009-10-28 |
| IL192207A0 (en) | 2008-12-29 |
| CA2635972A1 (en) | 2007-07-19 |
| AU2007204372A1 (en) | 2007-07-19 |
| PE20081185A1 (es) | 2008-10-07 |
| WO2007080174A3 (en) | 2007-12-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5102616B2 (ja) | 免疫グロブリン | |
| JP2009523154A (ja) | キメラおよびヒト化抗ヒトil−13抗体 | |
| US8399630B2 (en) | Engineered anti-IL-13 antibodies, compositions, methods and uses | |
| US20210009701A1 (en) | Antibodies against g-csfr and uses thereof | |
| US20060115475A1 (en) | Toll like receptor 3 antagonists, methods and uses | |
| WO2020038454A1 (zh) | 结合人il-4r的抗体、其抗原结合片段及其医药用途 | |
| US20140255388A1 (en) | Toll like receptor 3 antagonists, methods and uses | |
| CN101039960B (zh) | 抗il-13的嵌合人源化单克隆抗体 | |
| MX2008008946A (en) | Chimeric and humanised anti-human il-13 antibodies | |
| RU2773927C2 (ru) | Cd131-связывающие белки и их применения | |
| MXPA06007181A (en) | Novel anti-il 13 antibodies and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091218 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20091218 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120403 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120925 |