JP2008531696A - 心臓の組織を治療するための方法および組成 - Google Patents
心臓の組織を治療するための方法および組成 Download PDFInfo
- Publication number
- JP2008531696A JP2008531696A JP2007558097A JP2007558097A JP2008531696A JP 2008531696 A JP2008531696 A JP 2008531696A JP 2007558097 A JP2007558097 A JP 2007558097A JP 2007558097 A JP2007558097 A JP 2007558097A JP 2008531696 A JP2008531696 A JP 2008531696A
- Authority
- JP
- Japan
- Prior art keywords
- blood
- tvemf
- stem cells
- cells
- expanded
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0647—Haematopoietic stem cells; Uncommitted or multipotent progenitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/193—Colony stimulating factors [CSF]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K2035/124—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells the cells being hematopoietic, bone marrow derived or blood cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/20—Cytokines; Chemokines
- C12N2501/22—Colony stimulating factors (G-CSF, GM-CSF)
Abstract
本発明は、哺乳類の血液幹細胞、好ましくはCD34+/CD38−細胞のTVEMF拡張、TVEMF拡張された細胞からもたらされる組成、および、上記組成で、心臓の病気を処置または心臓の組織を治療する方法に関する。
Description
本発明は、心臓の組織を治療および/または再生する方法、および、そのような治療および/または再生を提供する組成に関する。
哺乳類の、特に人間の心臓の組織の再生は、長い間医学界の念願であった。一部の組織においては、人間の組織の治療は、ドナーからの同類の組織の移植によって大部分が成し遂げられた。まず、双子のへリック(Herrick)兄弟の一方から他方への腎臓移植から始まり、後に世界的に有名になった、南アフリカの医師クリスチャン・バーナード(Christian Barnard)による1967年12月3日のデニス・ダーバル(Denise Darval)からルイス・ワシュカンスキー(Louis Washkansky)への心臓移植、組織移植は末期症状の患者の延命の広く受け入れられた方法である。
最初の使用から、哺乳類の組織の移植は、大きな問題に遭遇した。最初に、体の自然な免疫システムに起因する組織の拒絶である(ワシュカンスキーは、手術後18日しか生存していない)。体の免疫システムの問題を克服するために、免疫システムを抑制するために数々の拒絶反応抑制剤(例えばイムラン、シクロスポリン)がすぐに開発され、これにより、拒絶の前に組織の使用を延長した。しかしながら拒絶の問題は、組織移植の代替を必要とし続ける。
近年、研究者達は組織移植の代替として多能性胚幹細胞の使用の実験をした。胚幹細胞の使用の裏にある理論は、胚幹細胞は、ほとんどの任意の体の組織の再生に、理論上利用することができるというものである。しかしながら、組織の再生のための胚幹細胞の使用も、問題に遭遇した。これらの問題のなかでもより深刻なものは、胚幹細胞の移植には限られた可制御性があること、腫瘍へと成長する場合があること、および研究用に使用できる人間の胚幹細胞は、患者の免疫システムによって拒絶されること(ネイチャー(Nature), June 17, 2002年6月17日:ピアソン(Pearson)、「幹細胞はダブルを望む(Stem Cell Hopes Double)」、2002年6月21にオンラインで発行されたnews@nature.com)。さらに、胚幹細胞の使用の普及には、倫理上、道徳上および政治的関心の問題があり、使用の普及には依然として疑問が呈されている。
幹細胞の多能性は、骨髄から見つかった、成人の幹細胞から最初に発見された。C.M.バーファイユ(Verfaille, CM. et al)等の成人の骨髄に由来する間葉幹細胞の多能性。ネイチャー417、6月20日オンラインで発行;ピアソン(Pearson)、「幹細胞はダブルを望む(Stem Cell Hopes Double)」、2002年6月21にオンラインで発行された news@nature.com)に引用されたドイ;10.1038/ネイチャー00900, (2002);ドイ:10.1038/news020617-11.
ボイセ(Boyse)等の特許文献1は、貧血、悪性腫瘍、自己免疫疾患、および、様々な免疫機能障害および欠損症などの様々な病気および疾患の処置または予防における、低温保存、および低温保存された胎児または新生児の血液の有用性を開示する。またボイセは、異種遺伝子配列の使用とともに、遺伝子治療における造血再構成の使用を開示する。しかしながら、ボイセの開示は、治療法の使用のための細胞の拡張には至らない。コーセル(CorCell)、臍帯血バンクは、臍帯血幹細胞の拡張、低温保存、および移植についての統計を提供する。「臍帯血幹細胞の拡張」、臍帯血インフォーメーションシート、コーセル法人(2003)。一つの拡張プロセスは、セントラルコラーゲンベースのマトリックスを有するバイオリアクタの利用を開示する。リサーチセンターユーリッヒ:バイオリアクタからの血液幹細胞、2001年5月17日プレスリリース。
幹細胞の拡張に関与する分子機構を解明するための努力が研究において続けられている。例えば、コールセルアーティクルは、デルタ−1という名のシグナル分子が臍帯血幹細胞の発生を助けることを開示している。オーイシ(Ohishi)K等:デルタ−1は、人間のCD34+/CD38−臍帯血細胞の、髄質および胸腺の複製能を強化する。臨床試験学会誌110:1165−1174(2002)。
そのため、臓器移植または胚幹細胞の利用に基づかない、心臓の組織を治療する方法の提供へのニーズがある。
本発明は、好ましくはTVEMF拡張された、好ましくはTVEMF拡張された血液由来の成人の幹細胞を含有する血液幹細胞組成を用いることによる、心臓の組織を治療および心臓細胞を補給するための方法および、体の自己治療能力に関する。心臓の治療を必要とする哺乳類、好ましくは人間を処置するための本発明の方法は、その体積当たりの数が、それが由来する血液の体積当たりの数よりも少なくとも7倍にTVEMF拡張された、血液由来の拡張された成人の幹細胞であり、TVEMF拡張された幹細胞が三次元形状および細胞間支持および細胞間形状を維持したものの、治療上効果的な量を哺乳類へ投与することを含む。上記方法は、人間の体のシステムが損傷した心臓の組織を効果的に治療するために血液細胞を利用することを許容するのに十分な期間、このような投与をすることを含む。
また、本発明は、一部は、好ましくは幹細胞がTVEMF拡張されたものである、哺乳類、好ましくは人間の心臓の組織を治療するための血液幹細胞組成に関する。また、本発明は、体積当たり数が、原料物質(例えば、TVEMF拡張前の幹細胞の血液原料)のそれよりも少なくとも7倍多い幹細胞;および血液幹細胞が、自然由来(すなわち原料)の血液の幹細胞と同じまたは本質的に同じ三次元形状および細胞間支持および細胞間形状を有する、哺乳類、好ましくは人間からの血液幹細胞に関する。そのような細胞は、ここに記載されるTVEMF拡張プロセスによって作られることが好ましい。また、本発明は、薬剤として許容可能なキャリア、低温保存薬、および細胞培養培地を含む、他の所望の成分が添加された、これらの細胞を含有する血液幹細胞組成に関する。
また、本発明は、TVEMFバイオリアクタの培養チャンバ内に血液混合物を配置すること;および上記血液混合物にTVEMFを受けさせ、TVEMF拡張された血液幹細胞および幹細胞組成を調製するために、TVEMFバイオリアクタ内で血液幹細胞をTVEMF拡張することによる、幹細胞を調製するプロセスおよび心臓の組織を治療するための幹細胞組成に関する。好ましくは、細胞に印加されるTVEMFが、約0.05〜約6.0ガウスである。また、本発明は、上記拡張された幹細胞の温度を一年以上の間−120℃から−196℃に下げ、その後、上記細胞を哺乳類へ導入するのに適した温度まで、温度を上げることによる、拡張された幹細胞を低温保存する方法に関する。
またここには、心臓の組織を治療するための組成、および、そのような組成および/または拡張された血液幹細胞自身の、心臓の組織の治療または再生のための薬の調製における使用を含有する。
図の詳細な説明
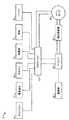
簡単に言うと、回転TVEMFバイオリアクタは、細胞培養チャンバと、時間的に変化する電磁気力源とを含有する。作動において、血液混合物が上記細胞培養チャンバ内に配置される。上記細胞培養チャンバは、時間的に変化する電磁気力源によって、上記チャンバにおいて時間的に変化する電磁気力が生じている間である、一定期間の間回転される。一定期間が経過すると、TVEMF拡張された血液混合物はチャンバから除去される。より複雑なTVEMFバイオリアクタシステムにおいては、図2〜5に示すように時間的に変化する電磁気力源がTVEMFバイオリアクタと一体化していてもよいが、図6〜8に示すようにバイオリアクタに隣接していてもよい。さらに、上記細胞に栄養を提供する、細胞培養培地のような流体キャリアまたはバッファ(後述するように、血液混合物に添加される培地と似ているものが好ましい)は、定期的に補給および除去することができる。好ましいTVEMFバイオリアクタは、ここで述べられる。
簡単に言うと、回転TVEMFバイオリアクタは、細胞培養チャンバと、時間的に変化する電磁気力源とを含有する。作動において、血液混合物が上記細胞培養チャンバ内に配置される。上記細胞培養チャンバは、時間的に変化する電磁気力源によって、上記チャンバにおいて時間的に変化する電磁気力が生じている間である、一定期間の間回転される。一定期間が経過すると、TVEMF拡張された血液混合物はチャンバから除去される。より複雑なTVEMFバイオリアクタシステムにおいては、図2〜5に示すように時間的に変化する電磁気力源がTVEMFバイオリアクタと一体化していてもよいが、図6〜8に示すようにバイオリアクタに隣接していてもよい。さらに、上記細胞に栄養を提供する、細胞培養培地のような流体キャリアまたはバッファ(後述するように、血液混合物に添加される培地と似ているものが好ましい)は、定期的に補給および除去することができる。好ましいTVEMFバイオリアクタは、ここで述べられる。
図1を参照すると、好ましくは回転細胞培養チャンバである細胞培養チャンバ19、酸素供給器21、好ましくはメインポンプ15の使用による、培養キャリアの指向性のある流れを促進する機器、および、これらには限定されないが、栄養素3、バッファ5、フレッシュな培地7、サイトカイン9、成長因子11、およびホルモン13などの培養キャリア必需品の選択的な投入のための供給マニホールド17を有する、哺乳類の細胞を育てるための、全体的なバイオリアクタ培養システムにおける培養キャリアフローループ1の好ましい態様を説明する。この好ましい態様においては、メインポンプ15が、流体キャリアに酸素が送り込まれ、細胞培養チャンバ19へと通過される所である酸素供給器21へと、フレッシュな流体キャリアを提供する。細胞培養チャンバ19からの使用済みの流体キャリアにおける廃棄物は、除去され、廃棄物18へと送られ、残りの細胞培養キャリアは、酸素供給器21を通って細胞培養チャンバ19へとポンプ15によってリサイクルされる前に、必要に応じてフレッシュな装入物を受け取る所であるマニホールド17へと戻される。
上記培養キャリアフローループ1において培養キャリアは、図1に示されるように、上記チャンバ19において生きている細胞培養を通り、培養キャリアフローループ1を回って循環される。このループ1においては、細胞培養リアクタチャンバ19内における状態を一定に維持するケミカルセンサー(図示せず)に応えて調整される。二酸化炭素の圧力の制御および酸または塩基の導入はpHを是正する。細胞の呼吸を支援するために、酸素窒素、および二酸化炭素がガス交換システム(図示せず)に溶解されている。閉ループ1は、循環しているガスキャパシタンスに酸素を添加し、そこから二酸化炭素を除去する。図1は本発明において用いることができる、培養キャリアフローループの好ましい一態様であるが、本発明はこのように限定されるものではない。これらには限定されないが、酸素、栄養素、バッファ、フレッシュな培地、サイトカイン、成長因子、およびホルモンなどの培養キャリアのバイオリアクタへの投入は、廃棄物および二酸化炭素の制御および除去できるものであれば、手動で行なっても、自動で行なっても、またはその他の制御された手段によって行なってもよい。
図2および3は、一体化された時間的に変化する電磁気力源を有するTVEMFバイオリアクタ10の好ましい態様を説明する。図4は、好ましい形態で本発明において用いるための回転可能なTVEMFバイオリアクタ10の断面図である。図4の上記TVEMFバイオリアクタ10は、一体化された時間的に変化する電磁気力源と共に説明されている。図5もまた、一体化された時間的に変化する電磁気力源を有するTVEMFバイオリアクタの好ましい態様を説明する。図6〜8は、隣接する時間的に変化する電磁気力源を有する回転バイオリアクタを示す。
図2を参照すると、図2には本発明のTVEMFバイオリアクタ10の好ましい態様の高められた側面図である。図2は、ベース112によって支持されるモータハウジング111を含有する。モータ113は上記モータハウジング111の内部に取り付けられており、第一ワイヤ114および第二ワイヤ115によって、コントロールノブ117をまわすことによってモータ113の速度を付加的に制御することができる制御手段を有するコントロールボックス116に接続されている。上記モータハウジング111は、モータシャフト118の中央が、これらには限定されないがプラスチックを含む透明な物質から成ることが好ましい長手方向のチャンバ119の配置における、地球の面に平行となるように、モータシャフト118が長手方向の状態でモータシャフト118がハウジング111を貫いて伸張するようにセットされたモータ113をその内部に有する。
好ましい態様において、長手方向のチャンバ119は、その長手方向の軸が地球の面に平行の状態で、その長手方向の軸の周りを上記チャンバ119が回転するように、上記シャフト118に接続されている。上記チャンバ119には、ワイヤコイル120が巻きつけられている。上記ワイヤコイル120のサイズおよび巻きつけられる回数は、好ましくは0.1mA〜1000mAの方形波電流がワイヤコイル120に供給されたときに、好ましくは0.05ガウス〜6ガウスの時間的に変化する電磁気力がチャンバ119ないで発生する程度である。上記ワイヤコイル120は、第一リングおよび第二リング122に、ワイヤ123および124によってシャフト118の端部に接続されている。これらのリング121、122はその後、コイル120に電流がコンスタントに供給されている間は上記チャンバ119が回転できるような状態で、第一電磁気送出ワイヤ125および第二電磁気送出ワイヤ128によって接続される。電磁気発生装置126は、ワイヤ125、128へ接続されている。上記電磁気発生装置126は、電磁気発生装置ノブ127をまわすことで出力を調整することにより、ワイヤ125、128およびコイル120へ方形波を供給する。
図3は、本発明において用いることができる、図2に示されるTVEMFバイオリアクタ10の側面斜視図である。
図4は、好ましくは透明であり、その内部に血液混合物を含有するように構成された培養チャンバ230を有する回転TVEMFバイオリアクタ10を説明する。上記回転TVEMFバイオリアクタ10は、内側円筒形管状ガラス部材293および外側管状ガラス部材294を受け入れるように配置された、第一228および第二229横接面を有する、第一290および第二291円筒形横端部キャップ部材を含む、外側ハウジング220をさらに含有する。適切な圧力シールが提供されている。内側293および外側294管状部材の間には、細胞の成長のための適切な培養温度を得るために用いられる環状ワイヤヒータ296がある。上記ワイヤヒータ296は、培養チャンバ230へ時間的に変化する電界を供給するための時間的に変化する電磁気力装置としても用いられもよく、または、図5に示されるように、時間的に変化する電磁気力を供給するために、別個のワイヤコイル144が用いられてもよい。第一横端部キャップ部材290および第二横端部キャップ部材291は、上記チャンバ230内における混合物のより円滑な流れを促進するための上記横面228、229に隣接する内側曲面を有する。上記第一横端部キャップ部材290および第二横端部キャップ部材291はそれぞれ、入力シャフト223および出力シャフト225にそれぞれ回転可能に受け入れられる、第一中央流体移送ジャーナル部材292および第二中央流体移送ジャーナル部材295を有する。各移送ジャーナル部材294、295は、横端部キャップ部材290、291の凹部を有するカウンター穴に座するように、フランジを有し、シャフト223、225に対する長手方向の動きに対し、第一ロックワッシャおよびリング297と、第二ロックワッシャおよびリング298とによって取り付けられている。各ジャーナル部材294、295は、長手方向に伸張する、円周方向に配置された通路に接続された中間環状凹部を有する。ジャーナル部材292、295の各環状凹部はそれぞれ、横端部キャップ部材290および291の第一半径方向に配置された通路278および第二半径方向に配置された通路279によって、第一入力カップリング203および第二入力カップリング204へ連結されている。半径方向の通路278または279内のキャリアは、ジャーナル部材294または295の第一環状凹部および長手方向通路を通って流れてジャーナル部材292、295を通ったキャリアのアクセスを許容し、アクセスがシャフト223、225の回りの円周方向である、ジャーナル292、295の各端部へと流れる。
横端部キャップ部材290および291には、入力223および出力225シャフト上に外側ハウジング220をそれぞれ支持するボールベアリングを含む、第一管状ベアリングハウジング205、および第二管状ベアリングハウジング206が取り付けられている。上記第一ベアリングハウジング205には、入力223および出力シャフトおよび長手方向の軸221の周りの回転方向における、回転可能な駆動を外側ハウジング220に提供するための、第一スプロケットギア210が取り付けられている。上記第一ベアリングハウジング205および第二ベアリングハウジング206も、ワイヤヒータ296および任意の他のセンサの電気的取り出しのための設備を有する。
内側フィルタアセンブリ235は、その長さに沿った打ち抜き穴または開口を有する内側215および外側216管状部材を含み、打ち抜き穴を有する第一217および第二218内側フィルタアセンブリ端部キャップ部材を有する。上記内側管状部材215は、中央に配置されたインターロッキングカップリング部を有する二つの部品から構成され、各部品は端部キャップ217または218に取り付けられている。上記外側管状部材216は、第一217および第二内側フィルタアセンブリ端部キャップの間に据え付けられている。
上記端部キャップ部材217、218はそれぞれ、入力シャフト223および出力シャフト225上に回転可能に支持されている。上記内側部材215は、ピンおよびインターフィッティング溝219によって、出力シャフト225へ、回転可能に取り付けられている。10ミクロン織を有するポリエステル布224は、外側部材216の外側面の上に配置され、各端部においてOリングに取り付けられている。上記内側部材215がカップリングピンによって出力駆動シャフト225のスロットへ取り付けられているため、上記出力駆動シャフト225は、内側部材215を回転させることができる。上記内側部材215は、外側部材216を支持する第一217および第二218端部キャップによって連結されている。上記出力シャフト225は、第一固定ハウジング240内のベアリングを貫いて伸張し、第一スプロケットギア241へ連結されている。図に示されているように、出力シャフト225は、流体キャリアの流れが上記固定ハウジング240を通って上記内側部材215からでられるように、シールの間に配置された第一固定ハウジング240内の第一ポートまたは通路289から、上記内側部材215まで伸張する管状穴222を有する。
上記内側部材235用の第一217および第二218端部キャップと、外側ハウジング220のジャーナル292、295との間には、ブレード部材50aおよび50b用の第一227および第二226ハブがある。入力シャフト223上の第二ハブ226は、第二ハブ226が入力シャフト223と一緒に回転するように、ピン231によって入力シャフト223へ連結される。各ハブ227、226は、ハブを通ったキャリアの移送用の、軸方向に伸張する通路を有する。
入力シャフト223は、上記入力シャフト223の回転可能な支持のために、第二固定ハウジング260内のベアリングを貫いて伸張する。第二長手方向の通路267は、フェースプレートおよびハウジング260の間の第二環状凹部232内に配置されたリテイニングワッシャおよびリングの中間の位置まで、入力シャフト223を貫いて伸張する。第二端部キャップ部材291内の第三半径方向通路272は、上記凹部内の流体キャリアが第二端部キャップ部材291から出ることを許容する。図示していないが、第三通路272は、パイプおよびYジョイントを貫いて、各通路278および279を連結する。
図4に、第一軸に沿って伸張し、上記チャンバ230の角233と交差して、狭い開口234を形成する第一穴237である、サンプルポートが示されている。上記穴237は、カウンター穴、および、円筒形バルブ部材236をねじ込むことにより受け入れるためのネジリングを一端に有する。上記バルブ部材236は、開口234にかみ合うための補足的に形成された先端を有し、上記チャンバの内装へわずかに突き出る。上記バルブ部材236上のOリング243は、シールを提供する。第二軸に沿った第二穴244は、Oリング243および開口234の間の位置において、第一穴237と交差する。エラストマーまたはプラスチックストッパー245は、第二穴244を塞ぎ、サンプルを取り出すために、皮下注射器と共に入れることができる。サンプルを取り出すために、上記バルブ部材236は、上記開口234および穴244に近づくために引っ込められる。注射器はその後、サンプルを抽出するために用いることができ、上記開口234は再び閉じられてもよい。TVEMFバイオリアクタ10の内装には、外部の汚染物は到達しない。
作動においてキャリアは、第二ポートまたは通路226へ、シャフト通路へ投入され、そこから第三半径方向通路272を介して、第一半径方向に配置された278および第二半径方向に配置された通路279に投入される。ジャーナル292、294の長手方向通路を介してチャンバ230にキャリアが入ると、ハブ227、226の端部面228、229にぶつかり、通路を通り、ハブ227、226内を軸方向と共に半径方向に分散する。ハブ227,226を通過するキャリアは端部キャップ部材217、218にぶつかり、半径方向に分散する。流入する流体キャリアは、このように長手方向軸221から半径方向外側に離れ、各端部からドーナツ形に流れ、ポリエステル布224およびフィルタアセンブリ235の開口を介して外へ出て、通路266および289を介して外へ出る。外側ハウジング220、チャンバ230および内側フィルタアセンブリ235の回転の回転速度および方向を制御することにより、任意の所望のタイプのキャリアアクションを得ることができる。しかしながら、フレッシュな流体キャリアの連続的な供給とともに、植物回転器作動を得ることができるといる事実も重要である。
一体化された環状ワイヤヒータ296を用いて時間的に変化する電磁気力が供給されない場合は、他の好ましい時間的に変化する電磁気力源によって供給することができる。例えば、図6〜8は、一体化された時間的に変化する電磁気力を有してはいないが、代わりに隣接する時間的に変化する電磁気力装置を有する、バイオリアクタ内の細胞培養へ電磁気力を提供する、時間的に変化する電磁気力装置140を説明する。具体的には、図6は、時間的に変化する電磁気力装置140の好ましい態様である。図6は、支持ベース145、支持146の回りに巻かれたワイヤコイル147を有するベース145上に支持された円筒形コイル支持146を含有する装置140の高められた側面斜視図である。図7は、図6に示された時間的に変化する電磁気力装置140の前面斜視図である。図8は、作動においてバイオリアクタ148の全体は、支持ベース145によって支持され、ワイヤコイル147によって巻きつけられている円筒形コイル支持146内へ装入されていることを説明する、時間的に変化する電磁気力装置140の前面斜視図である。時間的に変化する電磁気力装置140はバイオリアクタ148に隣接しているため、時間的に変化する電磁気力装置140はリユースできる。さらに、時間的に変化する電磁気力装置140はバイオリアクタ148に隣接しているため、装置140は、好ましくは回転して、全てのタイプのバイオリアクタにおいて電磁気力を発生するために用いることができる。
作動においては、TVEMF拡張中は、本発明のTVEMFバイオリアクタ10は、細胞培養チャンバ内に血液混合物を含有する。TVEMF拡張中は、血液混合物を含有するチャンバの回転速度は、血液混合物が長手方向軸に、またはその周りに留まるように、見極めおよび調整されてもよい。増加する回転速度は、壁への衝突の防止を保証する。例えば、回転サイクルの下方側において血液混合物内の血液幹細胞が過剰に内側および下側に、回転サイクルの上方において過剰に外側および不十分に上側に落下する場合、回転の増加が好ましい。付随的に、壁への衝突を最小に抑える回転速度と、血液幹細胞の三次元形状および細胞間支持および細胞間形状を維持する強度とを、好ましく選択することを使用者にアドバイスする。本発明の好ましい速度は、5〜120RPM、より好ましくは10〜30RPMである。
血液混合物は、好ましい透明な培養チャンバを介して視覚的に好ましく見極めることができ、手動で調整することができる。血液混合物の見極めおよび調整は、TVEMFバイオリアクタ10内における血液幹細胞の位置をモニターするセンサ(例えばレーザー)によって自動化することができる。過剰な細胞の動きを示すセンサの読みは、メカニズムがそれに従って回転速度を調整することを自動的にもたらす。
さらに、作動においては、血液混合物を含有するチャンバにおける望ましい電磁界、好ましくは0.05ガウス〜6ガウスの範囲内を方形波出力が発生させるように電磁気力装置は作動され、調整されることを本発明は意図する。
方形波は約2から約25サイクル/秒、より好ましくは約5〜約20サイクル/秒、例えば約10サイクル/秒の周波数を有することが好ましく、導体は約1〜1000mA、好ましくは1〜6mAのRMS値を有する。しかしながら、これらのパラメータは本発明のTVEMFを限定するものではなく、本発明の他の態様に基づいて異なる。TVEMFは、例えばEN131細胞センサガウスメータなどの、標準的な装置によって測定することができる。
本発明の範囲を逸脱することなく、本発明において意図された時間的に変化する電磁気力に曝される回転バイオリアクタにおける様々な改良することができ、ここに含まれる全ての事項は説明することを意図したものであり、限定するものではない。
本発明の好ましい態様の詳細な説明
本発明は、人間の心臓の組織の治療、補給および再生の方法に関する。本発明は、後述する好ましい態様によってより詳細に説明されるが、これらに限定されるものではない。
本発明の好ましい態様においては、心臓の組織の治療、補給、再生において体を助けることができる、成人の幹細胞を調製する方法が記載されている。血球は、患者から除去される。これらの細胞の亜種は、現在は成人の幹細胞とみなされる。成人の幹細胞を含む、上記血球は、ここに記載されるようにバイオリアクタ内に配置される。上記バイオリアクタ容器は、上記血球がそれらの三次元形状および細胞間支持および細胞間形状を維持するための浮遊を提供する速度において回転される。上記細胞がリアクタ内にある間、栄養素が供給され、ホルモン、サイトカイン、または成長因子および/または遺伝子組み換え物にさらされてもよく、有毒物質が除去されることが好ましい。一般的に有毒物質は、死んだ細胞の有毒な顆粒状物質および顆粒球およびマクロファージの有毒物質を含有する、血球から除去される。これらの細胞の亜種は拡張されて、大量の細胞を作り出す。細胞の拡張は、十分な時間、好ましくは7日以内に、少なくとも7倍に細胞が拡張するように制御される。その後細胞は、静脈内または直接または治療される心臓の組織に直近に注入され、体の自然なシステムが心臓の組織の治療および再生をすることを許容する。さらに、この方法においては、好ましくは細胞の遺伝子組み換えによって、血液幹細胞の治癒的な特性を変更するように操作されてもよい。
以下の定義は、記載および本発明の文脈において定義された用語の理解において助けることを意図したものである。上記定義は、本願を通じて記載されていることよりも狭い意味に、これらの用語を限定することを意図したものではない。さらに、TVEMFに関しては、数々の定義が含まれる−この点に関する全ての定義は、特に互いを補足するものと考えられるべきであり、互いに反するものとして解釈されてはならない。
本願を通じて用いられている用語「成人幹細胞」とは、区別されておらず、より区別された細胞を生じさせる可能性がある、多能性細胞である。本発明において成人幹細胞は、好ましくはCD34+/CD38−である。成人幹細胞は、身体の幹細胞としても知られており、胚から直接由来する胚幹細胞ではない。
本願を通じて用いられている用語「血液」とは、末梢血または臍帯血であり、哺乳類における成人の血液幹細胞の二つの主な源である。「末梢血」は、全身血液であり;すなわち、哺乳類内を全身的に循環する、または循環された血液である。哺乳類は胎児を意味するものではない。本発明の目的のために、同一の循環ループの異なる部位に位置する末梢血間を区別する理由はない。「臍帯血」とは、胎児または幼児のへその帯および/または胎盤からの血液である。臍帯血は、知られている幹細胞の、最も富んだ源の一つである。「帯」とは、いかなる形においても本発明の「臍帯血」を、へその帯の血液に限定することを意図したものではない;胎児または幼児の胎盤の血液は、へその帯の血液と融合性がある。本発明の目的のためには、同一の循環ループの異なる部位に位置する血液間を区別する理由はない。
本願を通じて用いられている用語「血液細胞」とは、血液からの細胞である;「末梢血細胞」とは、末梢血からの細胞である;および「臍帯血細胞」とは、臍帯血からの細胞である。複製可能な血液細胞はTVEMFバイオリアクタにおいてTVEMF拡張されてもよく、本発明の組成内に存在していてもよい。
本願を通じて用いられている用語「血液幹細胞」とは、血液からの成人幹細胞である。血液幹細胞は、上述したように身体の幹細胞としても知られている成人幹細胞であり、胚から直接由来する胚幹細胞ではない。好ましくは、本発明の血液幹細胞はCD34+/CD38−細胞である。
本願を通じて用いられている用語「血液幹細胞組成」、またはその関連とは、(1)その体積当たりの数が、自然由来の血液源よりも少なくとも7倍多く、自然由来の血液幹細胞と同じまたは極めて似ている三次元形状および細胞間支持および細胞間形状を有する、および/または(2)上述した三次元形状および支持を維持し、TVEMF拡張を行なった、のいずれかの本発明の血液幹細胞である。薬剤として許容可能なキャリア、プラズマ(plasma)、血液、アルブミン、細胞培養培地、成長因子、銅キレート剤、ホルモン、バッファ、低温保存薬またはそのほかの物質である、ある種のキャリアが、本発明の血液幹細胞組成における血液幹細胞と共に用いられる。自然由来の血液の参照は、そのオリジナル血液(すなわち末梢、帯、混合末梢または帯、またはその他)源を有する本発明の血液幹細胞と比較されることが好ましい。しかしながら、そのような比較ができない場合は、自然由来の血液は、好ましくは本発明の血液幹細胞の源と同じ哺乳類の種の、そのような血液の平均的または一般的な特性と比較することができる。
本発明の「薬剤血液幹細胞組成」は、哺乳類、好ましくは人間への投与に適した、血液幹細胞組成である。このような組成は、拡張(好ましくはTVEMF拡張)された血液幹細胞の、治療上効果的な量を有する。拡張された血液幹細胞の治療上効果的な量は、(この明細書の他の場所でも記載されているが)好ましくは少なくとも1000幹細胞、より好ましくは少なくとも104幹細胞、さらに好ましくは少なくとも105幹細胞、さらに好ましくは少なくとも107〜109幹細胞、または1012幹細胞などのさらに多い幹細胞である。1以上の投薬において、そのような数の拡張された幹細胞が投与されてもよい。本願を通じて示されているように、患者に投与される幹細胞の数は、本発明に従って拡張することによって増加されたとして、源の血液においてもともと入手可能な幹細胞の数に制限されてもよい。学説に拘束されることなく、投与後に、体に使われなかった幹細胞は、単に、自然の体のシステムによって除去されると考えられる。
本願を通じて用いられている用語「血液混合物」とは、TVEMFバイオリアクタ(例えば細胞培養チャンバ内)に配置されることができる細胞の成長のための培地などの、細胞の拡張を助ける物質を有する血液/血液細胞の混合物である。上記「血液混合物」血液細胞は、単に全血液を細胞培養培地などの物資と混合することによって、血液混合物内に存在してもよい。また、血液混合物は、血液幹細胞を含有し、本願を通じて記載されているように、「バッフィーコート」などの血液からの細胞プレパレーションで作られていてもよい。好ましくは、血液混合物はCD34+/CD38−血液幹細胞およびダルベッコ(ダルベッコ)培地(DMEM)を含有する。好ましくは、血液混合物の約半分が、DMEMなどの細胞培養培地である。
本願を通じて用いられている用語「TVEMF」とは、「時間的に変化する電磁気力(Time Varying Electromagnetic Force)」である。上述したように、本発明のTVEMFは、(フーリエ曲線に従った)方形波である。好ましくは、上記方形波は、約10サイクル/秒の周波数、および導体は約1〜1000mA、好ましくは1〜6mAのRMS値を有する。しかしながら、これらのパラメータは、本発明の他の態様に基づいて異なるものであり、本発明のTVEMFを限定することを意図したものではない。TVEMFは、例えばEN131細胞センサガウスメータなどの標準的な装置によって測定することができる。
本願を通じて用いられている用語「TVEMFバイオリアクタ」とは、TVEMFが付与されるものである、上述した図の詳細な説明により十分に記載されている、回転バイオリアクタである。バイオリアクタに付与されるTVEMFは、好ましくは0.05から6.0ガウスの範囲であり、好ましくは0.05〜0.5ガウスである。TVEMFバイオリアクタの例(これらには限定されないが)については、例えば図2、3、4および5を参照のこと。単純な態様においては、本発明のTVEMFバイオリアクタは、適切なガウスレベル(TVEMF付与)において含有される血液混合物に回転を提供し、その中の血液細胞(幹細胞を含む)の拡張を許容する。好ましくは、TVEMFバイオリアクタは、成長培地(好ましくは添加物も)の交換および血液混合物の酸素供給を許容する。TVEMFバイオリアクタは、数日間以上の間の細胞成長用のメカニズムを提供する。学説に拘束されることなく、TVEMFバイオリアクタは上記バイオリアクタ内の細胞にTVEMFを施し、TVEMFが細胞を通過する、または曝され、このようにして細胞はTVEMF拡張される。TVEMF拡張中のTVEMFバイオリアクタの回転は、血流細胞が三次元形状および細胞間支持および細胞間形状を維持するように、壁への衝突頻度および強度を最小にすることを助けるように、好ましくは5〜120rpmの速度であり、より好ましくは10〜30rpmである。
本願を通じて用いられている用語「TVEMF拡張された血液細胞」とは、TVEMFバイオリアクタ内に配置され、約0.05から6.0ガウスのTVEMFに曝された後に、その体積当たりの数が増加した血液細胞である。体積当たりの細胞数の増加は、TVEMFバイオリアクタにおける細胞が複製され、細胞の全数が増加した結果である。体積当たりの細胞数の増加は、明白に、単に流体の体積を減少すること、例えば血液の体積を70mlから10mlに減少することにより、1ml当たりの細胞数を増加すること、によるものではない。
本願を通じて用いられている用語「TVEMF拡張された血液幹細胞」とは、TVEMFバイオリアクタ内に配置され、約0.05から6.0ガウスのTVEMFに曝された後に、その体積当たりの数が増加した血液幹細胞である。体積当たりの幹細胞の増加は、TVEMFバイオリアクタにおける細胞が複製され、バイオリアクタ内の幹細胞の全数が増加した結果である。体積当たりの幹細胞の増加は、明白に、単に流体の体積を減少すること、例えば血液の体積を70mlから10mlに減少することにより、1ml当たりの幹細胞数を増加すること、によるものではない。
本願を通じて用いられている用語「TVEMF拡張する」とは、TVEMF(回転)バイオリアクタ内のTVEMF存在下で複製(分裂および成長)する、TVEMFバイオリアクタにおける細胞のステップである。血液幹細胞(好ましくはCD34+/CD38−幹細胞)は、好ましくはさらなる分化を行なうことなく複製し、本発明に従って拡張された全てまたはほとんど全てCD34+/CD38−幹細胞は複製するが、バイオリアクタ内にある間は分化しない。「ほとんど全て」とは、少なくとも70%、好ましくは少なくとも80%、より好ましくは少なくとも90%、特に好ましくは少なくとも95%、さらに好ましくは少なくとも97%、最も好ましくは少なくとも99%のCD34+/CD38−細胞が分化しないことであり、TVEMF拡張中は、これらはもはやCD34+/CD38−ではない。
本願を通じて用いられている用語「TVEMF拡張」とは、TVEMFバイオリアクタ内で約0.05から約6.0ガウスのTVEMFに細胞を曝すことにより、血液、好ましくは血液幹細胞の数を増加するプロセスである。好ましくは、体積当たりの血液幹細胞の数は、オリジナルの血液源の少なくとも7倍である。本発明に従ったTVEMFバイオリアクタ内での末梢血幹細胞の拡張は、血液幹細胞が、TVEMF拡張の前の血液幹細胞と同じまたは本質的に同じ三次元形状および細胞間支持および細胞間形状を維持するまたは有することをもたらす。TVEMF拡張の他の態様もまた、本発明の血液幹細胞の優秀な特性をもたらす。学説に拘束されることなく、TVEMF拡張は、その三次元形状および細胞間支持および形状を維持する血液幹細胞の高濃度をもたらすだけではない。学説に拘束されることなく、TVEMFは、TVEMF拡張中に幹細胞のある特性、例えば成長を促進する遺伝子のアップレギュレーション、または成長を阻害する遺伝子のダウンレギュレーション、に影響を与えることがある。全体として、TVEMF拡張は、分化ではなく、血液幹細胞の成長の促進をもたらす。
本願を通じて用いられている用語「TVEMF拡張された細胞」とは、TVEMF拡張プロセスが行なわれた細胞である。
本願を通じて、用語「治療」、「補給」および「再生」が用いられる。これらの用語は、互いに排他的であることを意味するものではなく、むしろ、全体的な組織の治療に関連する。
本願を通じて、心臓の組織の治療、心臓の病気の処置、または心臓の状態の処置の参照は、排他的なものを意味するものではなく、むしろ、ここに記載されているように、幹細胞の投与から組織における改善がもたらされるものである、全体的な組織の治療の対象に関する。本発明の一部は、症候性の、および場合によっては生命を脅かす心臓の病気または状態の処置に関するが、本発明は、軽微な治療の処置、および、哺乳類(好ましくは人間)の健康において症状または問題が認識される前の、初期の段階での拡張された幹細胞の導入による心臓の病気または状態の防止/予防をも含むことを意図する。
本願を通じて用いられている用語「有毒物質」または関連する用語は、細胞、好ましくは血液幹細胞、に有毒であるもの;または患者に有毒なものである。特に、用語有毒物質は、血液に特有または独特な物質(例えば末梢血における鎌状細胞、妊婦の尿または臍帯血における廃棄物またはその他の組織または廃棄物)とともに、死んだ細胞、マクロファージに関する。他の有毒物質は、本願を通じて記載されている。血液からの有毒物質の除去は、この技術、特に患者に対する血液製品の導入に関する技術、において公知である。
本願を通じて用いられている用語「骨髄のアフェレーシス」とは、骨に針を挿入し、骨髄を抽出することである。このようなアフェレーシスはこの技術において公知である。
本願を通じて用いられている用語「自己由来」とは、ドナー(拡張される前の血液幹細胞の源)および患者が同一の哺乳類である状況である。本発明は自己由来の心臓の組織の治療および補給を含む。
本願を通じて用いられている用語「同種異系」とは、ドナー(拡張される前の血液幹細胞の源)および患者が同一の哺乳類ではない状況である。本発明は同種異系の心臓の組織の治療および補給を含む。
本願を通じて用いられている用語「CD34+」とは、血球の表面上に表面抗原(CD34)が存在していることである。CD34プロテインは、開発の全ての段階において、造血幹細胞の表面上に存在する。
本願を通じて用いられている用語「CD38−」とは、血球の表面上に表面抗原(CD38)が欠如していることである。CD38は、本発明の幹細胞の表面上には存在しない。
本願を通じて用いられている用語「細胞間形状」とは、他の細胞に関する細胞の空間、間の距離、および物理的な関係を含む、細胞の形状である。例えば、本発明のTVEMF拡張された幹細胞は、塊(body)として互いの関係を維持する。拡張された細胞は、細胞間の自然な空間に拘束されており、一方、例えば二次元拡張容器と比べると、そのような空間は維持されない。
本願を通じて用いられている用語「細胞間支持」とは、一つの細胞が、隣接する細胞に提供する支持である。例えば、健康な組織および細胞は、化学的、ホルモン性、(適用すべき/適切な)神経性などの相互作用を、体内の他の細胞と維持する。本発明においては、これらの相互作用は正常に機能するパラメータ内に維持され、このことは例えば、それらが(このようなことが自然の血液環境においてなされない限り)有毒または損害を与える信号を他の細胞に送信し始めないことを意味する。
本願を通じて用いられている用語「三次元形状」とは、三次元状態(それらの自然の状態と同じまたは極めて近い)における細胞の形状であり、例えば細胞が平らおよび/または引き伸ばされるものである、シャーレで成長した細胞に見られる二次元形状に対するものである。
上記三つの、本発明の幹細胞の細胞間支持および形状および三次元形状の維持に関する各定義については、用語「本質的に同じ」とは、本発明のTVEMF拡張された細胞において通常の形状および支持が提供され、正常に機能しない、組織の治療をすることができない、または他の細胞に対して有毒または有害となるように、例えば細胞が変化されないことを意味する。
本願を通じて用いられる、上記で定義された用語またはその他の用語に関する他の記載は、上記の定義によって限定されることを意図するものではなく、上記定義に貢献することができる。本発明の様々な態様に関する情報は、本願を通じて提供され、それが含まれる個所のみに限定されることを意図するものではなく、本発明を全体として理解するために貢献することを意図したものである。
本発明は、心臓の組織の治療、補給および再生のためのTVEMF拡張された血液幹細胞を提供することに関する。本発明は、ここに記載されるように、好ましい態様によってより十分に記載されることができるが、それらに限定することを意図したものではない。
作動方法−TVEMF拡張された血液幹細胞組成の調製
本発明の好ましい態様においては、体において、心臓の組織の治療、補給、および再生を助ける、TVEMF拡張された血液幹細胞の調製方法が記載されている。
本発明の好ましい態様においては、体において、心臓の組織の治療、補給、および再生を助ける、TVEMF拡張された血液幹細胞の調製方法が記載されている。
この好ましい方法において、血液は、例えば本願を通じて記載され、および、この技術において公知なように、好ましくは公知なように注射器を介して、哺乳類、好ましくは霊長類、より好ましくは人間から採取される。血液は採取され、すぐに拡張されて用いられても、使用するために拡張されたまたは拡張されていない形態で低温保存されてもよい。血液は、対象を脅かさない程度の量のみが哺乳類から採取される。好ましくは約10〜500ml、より好ましくは100〜300ml、さらに好ましくは150〜200mlの血液が採取される。本発明にかかる血液の採取は限定されないが、例えば哺乳類の血液を直接採取出手段、1以上の源から血液をプールすること、例えば「血液バンク」からの低温保存された末梢血または臍帯血、または後の使用のために別に保存された血液を含む、市販のまたはその他の源から血液を入手することによる、血液の間接的な採取を含んでもよい。
一般的には、哺乳類から直接採取する場合は、好ましくは抗凝固薬を含む、1以上の注射器内に抽出される。上記血液は、注射器内で保管されても、他の容器に移されてもよい。血液はその後、白血球、赤血球およびプラズマの、そのパーツに分離されてもよい。これは、遠心分離機(血液が分離するまで、血液の容器をスピンする装置)または沈殿(血液の容器に沈殿物を投入し、血液を分離させるプロセス)のいずれかによって行なうことができる。次に、底に赤血球(RBC)、中間に白血球(WBC)、およびトップにプラズマに分離されたら、白血球は保存するために取り除かれる。「バッフィーコート」としても知られる中間層は、興味のある血液幹細胞を含む;血液の他の部分は必要ない。ある血液バンクでは、これは彼等の処理の限度である。しかしながら、他のバンクは、WBCから単核細胞(この場合、白血球の部分集合)を除去することによってバッフィーコートを処理する。全ての人はこの方法に同意しないため、保存する量は少なく、細胞を保存するためには低温窒素が少量必要である。
血液細胞を分離する他の方法は、コーベ(Cobe)スペクトラ細胞分離機などの分離機において、採取された全ての血液に対して1以上(好ましくは3)ラウンドの連続流白血球搬出を行なうことである。そのような処理は、他の血液細胞から、一つの核を有する血液細胞を分離する。幹細胞は、一つの核を有する群の一部である。この技術においては、血球を分離する他の方法も公知である。
血液サンプルからRBCを除去することが好ましい。人々が同じHLAタイプ(幹細胞の移植のために必要)を有していても、彼等は同じ血液型ではないかもしれない。RBCを除去することにより、幹細胞移植への不都合な反応を最小限にすることができる。RBCを除外することにより、幹細胞サンプルは、より多くの人々との適合性を有する、より高い可能性を有する。またRBCは、解凍される際に破裂し、遊離ヘモグロビンを放出することがある。このタイプのヘモグロビンは、移植を受ける人々の腎臓に深刻な影響を与えることがある。加えて、RBCが破裂すると、幹細胞の生存度が低下する。
また、特に血液を低温保存または他の哺乳類へ血液を移植する場合、HIV/AIDS、肝炎、白血病、または免疫疾患などの伝染性または遺伝性の病気がないかどうか確かめるために、血液の検査をしてもよい。そのような病気がある場合、上記血液は廃棄されても、将来の使用者が考慮すべき、関連するリスクを認識した上で使用されてもよい。
本発明の他の態様においては、血球は、心臓の治療を必要とする人または、治療を必要としないドナーから得られてもよい。採取する前にドナーは、3日以上12時間毎に、その後4日目には一度、6ng/kgの量のG−CSFで処置をされてもよい。好ましい方法においては、近い量のGM−CSFも投与される。その後血液がドナーから採取され、コーベスペクトラ細胞分離機などの分離機を通じて、3ラウンドの連続流白血球搬出を、ドナーの全血液体積に対して行なうことにより、PBCが分離されてもよい。
本発明の他の態様においては、血球はドナーから得られてもよい。採取する前にドナーは、3日以上12時間毎に、その後4日目には一度、G−CSF(好ましくは0.3ng〜5μg、より好ましくは1ng/kg〜100ng/kg、さらに好ましくは5ng/kg〜20ng/kg、特に好ましくは6ng/kgの量)で処置をされてもよい。好ましい方法においては、近い量のGM−CSFも投与される。他の代用としては、GM−CSFを単独で、または他の成長因子分子、インターロイキンを用いることである。その後血液がドナーから採取され、全体として血液混合物に用いられても、最初に本願を通じて記載されているように、幹細胞(CD34+/CD38−)を含む細胞片(細胞片s)に分離されて、拡張されるべき血液混合物の調製に用いられてもよい。細胞は、例えばコーベスペクトラ細胞分離機などの分離機を通じて、3ラウンドの連続流白血球搬出を、ドナーの全血液体積に対して行なうことにより分離されてもよい。ドナーはここで記載されている心臓の組織の治療を必要としているため、同じドナーに拡張された幹細胞を導入することが好ましい。しかしながら、ここに示されているように、異質遺伝子型の導入も使用することができる。他の採取前投与も、当業者にとって明らかである。
血液から赤血球が除去され、血液幹細胞を含む残りの細胞が、適切な培地と共に、ここで記載されているようなTVEMFバイオリアクタ(「血液混合物」参照)に配置されることが好ましい。本発明のより好ましい態様においては、TVEMFバイオリアクタに配置される細胞物質は、上述された(本願を通じて記載されているように、血液幹細胞を含む)「バッフィーコート」のみである。他の態様は、異なる血液製剤を調製するために、他の非幹細胞および末梢血の成分を除去することを含む。そのような血液製剤は、唯一の残留する血液成分として、CD34+/CD38−血液幹細胞を有してもよい。血液細胞の非幹細胞タイプの除去は、これらには限定されないが、沈殿および遠心分離などのネガティブ分離(negative separation)によって達成することができる。この技術においては、様々なネガティブ分離が公知である。しかしながら、ポジティブ選択技術(positive selection techniques)も用いることができ、本発明では好ましい。血液の様々な成分を除去し、CD34+/CD38−をポジティブに選択するための方法がこの技術において公知であり、所望の血液幹細胞を溶解する、または取り返しがつかない程に害するものでなければ用いることができる。例えば、CD34+/CD38−用の親和性メソッドを用いることができる。上述したような「バッフィーコート」が血液から調製され、その中のCD34+/CD38−細胞がTVEMF拡張用にバッフィーコートから分離されることが好ましい。
採取された血液、または上述したような所望の細胞片は、TVEMF拡張が生じるために、TVEMFバイオリアクタ内に配置されなければならない。上述したように、用語「血液混合物」は、細胞が拡張することを許容する、細胞の成長のための培地などの、TVEMFバイオリアクタ内に配置される物質と共に、血液(または所望の細胞片、例えば赤血球を有さない血液、または「バッフィーコート」細胞、または、好ましくは血液から分離されたCD34+/CD38−血液幹細胞)の混合物を含有する。細胞が成長および拡張することを許容する培地である、細胞培養培地は、この技術において公知である。細胞が拡張することを許容する物質は細胞培養培地であることが好ましく、ダルベッコ培地がより好ましい。もちろん、細胞培地の成分は、幹細胞を殺す、または損傷してはならない。TVEMF拡張の前または最中に、他の成分も末梢血に添加されてもよい。例えば、ダルベッコ培地、さらに5%(または他の所望の量、例えば約1%〜約10%)の人間の血清アルブミンが補足され、血液がバイオリアクタ内に配置されてもよい。成長因子、銅キレート剤、サイトカイン、ホルモンおよび他の物質に限定されないが、TVEMF拡張を促進する、血液混合物への他の添加物が、バイオリアクタに配置される前に、バイオリアクタの外または内で血液に添加されてもよい。TVEMF拡張用の血液混合物を調製するために、一個体(約10ml〜約500ml、より好ましくは約100ml〜約300ml、特に好ましくは約150〜約200mlの量の人間の血液が好ましい)から採取された血液の全体積が、ダルベッコ培地(DMEM)および補足された5%の人間の血清アルブミンなどの細胞培養培地と混合されることが好ましい。例えば、50から100mlの血液サンプルについては、バイオリアクタ内に配置されたときに血液混合物の全体積が約75〜約200mlになるため、約25〜約100mlのDMEM/5%の人間の血清アルブミンが用いられることが好ましい。一般的なルールとして、採取された血液が多いほどよく;例えば一個体からの採取が100mlを超える場合、その血液における全ての使用が好ましい。例えば(同じまたは異なる源からの)血液をプールすることによって、より多い体積が入手可能な場合、1以上の投与が好ましい。血液がプールされ、共にTVEMF拡張される場合は、還流TVEMFバイオリアクタの使用が特に有用である。
本発明の銅キレート剤は、任意の非有毒性銅キレート剤でよく、ペニシラミンまたは塩化トリエンチンが好ましい。より好ましくは、上記ペニシラミンはDMSOに溶解された D(-)−2−アミノ−3−メルカプト−3−メチルブタン酸(σ-アルドリッチ)であり、約10ppmの量で血液混合物に添加される。血液がその後哺乳類から直接採取されるため、上記銅キレート剤も哺乳類へ投与されてもよい。そのような投与は、哺乳類から血液を採取する前の1日を越えることが好ましく、より好ましくは2日をこえる。銅キレート剤の目的、血液混合物そのものに添加される場合も、哺乳類の血液ドナーに投与される場合も、その両方の場合も、TVEMF拡張される前の血液における銅の量を低減することである。学説に拘束されることなく、入手可能な銅の量の低減は、TVEMF拡張を促進すると考えられる。
用語「TVEMFバイオリアクタ内に配置される」は、限定されるものではない−バイオリアクタの完全に外で血液混合物が作られ、その後上記混合物がバイオリアクタ内に配置される。また、血液混合物はバイオリアクタの内で完全に混合されてもよい。例えば、血液(またはその細胞片)がバイオリアクタ内に配置され、既にバイオリアクタ内にある、またはバイオリアクタに同時に添加される、または血液の後にバイオリアクタに添加される、ダルベッコ培地および5%人間の血清アルブミンのいずれかが補足されてもよい。
本発明の好ましい血液混合物は、以下を含む:血液サンプルのバッフィーコートから分離されたCD34+/CD38−幹細胞;および、CD34+/CD38−細胞を有し、全体積で約150〜250ml、好ましくは約200mlのダルベッコ培地。さらに好ましくは、血液混合物にはG−CSF(顆粒球-コロニー刺激性因子)が含まれる。好ましくは、G−CSFが、血液幹細胞のTVEMF拡張を促進するのに十分な量において存在する。さらに好ましくは、TVEMF拡張前の待つに存在するG−CSFの量は、約25〜約200ng/ml血液混合物であり、より好ましくは約50〜約150ng/ml、特に好ましくは約100ng/mlである。
TVEMFバイオリアクタ容器(血液幹細胞を含む血液混合物を含有する)は、血液幹細胞のサスペンションが三次元形状および細胞間支持および細胞間形状を維持することを提供する速度で回転される。好ましくは、回転速度は5〜120rpm、より好ましくは10〜30rpmである。これらの回転速度は限定されるものではなく;少なくとも一部は、バイオリアクタの種類および細胞培養チャンバおよびそこに配置されるサンプルのサイズに依る。細胞がTVEMFバイオリアクタ内にある間、細胞は、栄養素が供給され、およびフレッシュな培地(例えばDMEMおよび5%の人間の血清アルブミン;流体キャリアの上記説明を参照)が供給され、ホルモン、サイトカイン、および/または成長因子(好ましくはG−CSF)に曝され;有毒物質が除去されることが好ましい。TVEMFバイオリアクタ内の血液細胞から除去される有毒物質は、死んだ細胞の有毒な粒および顆粒球の有毒物質およびマクロファージを含有する。細胞のTVEMF拡張は、細胞が好ましくは少なくとも7倍に拡張(体積当たりの数が増加)するように制御される。好ましくは、血液幹細胞(存在する場合は他の細胞と共に)少なくとも4日、好ましくは約7〜約14日、より好ましくは約7〜10日、特に好ましくは約7日TVEMF拡張される。TVEMF拡張は、TVEMFバイオリアクタにおいて160日まで継続されてもよい。TVEMF拡張が160日を越えて長く生じる場合、そのような長い拡張は本発明の好ましい態様ではない。
好ましくは、TVEMF拡張はTVEMFバイオリアクタにおいて、約26℃〜約41℃、より好ましくは約37℃の温度で行なわれる。
TVEMF拡張されている細胞の全体的な拡張をモニターする一つの方法は、目視検査である。血液幹細胞は一般的に暗い赤い色である。好ましくは、血液混合物を形成するために使用される培地は、薄い色または透明である。いったんバイオリアクタの回転が始まり、TVEMFが付与されると、細胞は好ましくは、細胞の色が付いた塊を培地が囲むように、バイオリアクタ容器の中央に集まる。酸素供給およびその他の栄養素の添加は、バイオリアクタに設けられた可視化(一般的には透明なプラスチック)窓を介しての細胞の塊の見え方を曇らせない場合が多い。塊の形成は、幹細胞が三次元形状および細胞間支持および細胞間形状を維持するのを助けるために重要である;もしも塊が散乱し、細胞がバイオリアクタ容器の壁に接触するように見えたら、細胞の塊の集中化が再び形成されるように、回転速度が増加(手動または自動)される。TVEMFバイオリアクタ内の細胞のおよその増加数を暗示するために、形成し始めたばかりの細胞の塊の目視可能な直径の測定は、その後の塊の直径と比較することができる。TVEMF拡張中の細胞の数の増加の測定は、従来のバイオリアクタの技術において公知の数々の方法によって得ることができる。塊のサイズの増加をモニターし、測定するために、自動センサがTVEMFバイオリアクタに含まれていてもよい。
TVEMF拡張プロセスは、例えば、バイオリアクタ内で細胞が塊を維持することを確実にするための細胞の塊の形成をチェックし、細胞の塊が散乱し始めたら、バイオリアクタの回転を増加させる、検査の専門家によって、注意深くモニターされてもよい。バイオリアクタ内の細胞の塊および血液混合物の粘度をモニターする自動システムが、細胞の塊をモニターしてもよい。細胞の塊の粘度の変化は、TVEMF拡張プロセスを開始してから2日という早い時点で明らかにあることがあり、そのころにTVEMFバイオリアクタの回転速度が増加されてもよい。TVEMFバイオリアクタの速度は、TVEMF拡張を通じて変更されてもよい。好ましくは、TVEMF拡張されている細胞がTVEMFバイオリアクタ容器の壁に接触しないように、適時に調整される。
また、例えば、検査の専門家が、TVEMF拡張の間、1日一回または2日に一回、手動で(例えば注射器で)フレッシュな培地および、上述したような栄養素および成長因子などの好ましい他の所望の添加物をバイオリアクタに添加し、細胞廃棄物および有毒物質を含む古い培地を抜き出してもよい。また、フレッシュな培地および他の添加物は、TVEMF拡張の間自動でTVEMFバイオリアクタに汲み上げられ、廃棄物が自動で除去されてもよい。
血液幹細胞は、TVEMFバイオリアクタ内に配置され、TVEMF拡張されてから約7〜約14日で、元の数の少なくとも7倍に増加してもよい。好ましくは、約7〜10日、より好ましくは約7日、TVEMF拡張される。そのため、幹細胞の数の測定は、TVEMF拡張中に行なう必要はない。本願を通じて記載され、上述したように、本発明のTVEMF拡張された血液幹細胞は、自然由来の、TVEMF拡張されていない血液幹細胞と、同じまたは本質的に同じ三次元形状および細胞間支持および細胞間形状を有する。
TVEMF拡張の完了の際、TVEMFバイオリアクタ内の細胞物質は、本発明の組成中に、本発明の幹細胞を含有する。さらなる使用のために、様々な物質が上記組成から除去され、または添加されてもよい。本発明の他の態様は、例えば本願を通じて記載される組織などの、体のシステムまたは組織の治療、補給および組織の再生を助けるように機能する、生体外の哺乳類血液幹細胞組成に関する。上記組成は、好ましくは由来する血液の、少なくとも7倍の体積当たりの血液幹細胞の数の量においてTVEMF拡張された血液幹細胞を含有する。例えば、好ましくは、X個の血液幹細胞が特定の体積において、TVEMFバイオリアクタ内に配置された場合、TVEMF拡張後に、TVEMFバイオリアクタ内の血液幹細胞の数は、(拡張プロセスの間の細胞の除去がなければ)少なくとも7Xである。この少なくとも7倍の拡張は、本発明が作用するために必須ではなく、この拡張は治療目的において特に好ましい。例えば、所望であれば、TVEMF拡張された細胞の量は、自然由来の血液における血液幹細胞の数のたった2倍でもよい。好ましくは、TVEMF拡張された細胞は、自然由来の血液における血液幹細胞の体積当たりの数の、約4倍〜約25倍の範囲内である。また、本発明は、上記血液幹細胞が、自然由来の哺乳類の血液よりも少なくとも7倍多い体積当たりの数で存在し;上記血液幹細胞が、自然由来の血液の幹細胞と同じまたは近いまたは本質的に同じ三次元形状および細胞間支持および細胞間形状を有する、哺乳類からの血液幹細胞を含有する、組成に関する。本発明の組成は、これらに限定はされないが、プラズマ、血液、アルブミン、細胞培養培地、成長因子、銅キレート剤、ホルモン、バッファまたは低温保存薬を含む、薬剤として許容可能なキャリアを含有する。「薬剤として許容可能なキャリア」とは、哺乳類、好ましくは人間への幹細胞の導入を許容する薬剤を意味する。このようなキャリアは、特に、例えば、血液、プラズマ、アルブミンなどの輸液用に用いることができる任意の物質;また、好ましくは上記組成が導入される哺乳類からの塩水またはバッファ(好ましくはアルブミンが補足されたバッファ)などの、ここに記載される物質を含む。用語哺乳類への組成の「導入」は、動物への組成の「投与」を意味する。好ましくは、哺乳類への本発明の幹細胞の投与は、静脈内に行なわれる。しかしながら、この技術においてよく知られているように、他の形態の投与が用いられてもよい。特に、例えば、損傷の部位に可能な限り近くに幹細胞を持っていくために、心臓または心臓の近くの組織への直接の注入が用いられてもよい。例えば心臓麻痺、心筋梗塞の処置のためには、幹細胞以外の細胞を少し含む、または全く含まない幹細胞組成が心臓の筋肉へ直接注入されることが好ましい。より好ましくは、例えば、0.3ng〜5μg、より好ましくは1ng/kg〜l00ng/kg、さらに好ましくは5ng/kg〜20ng/kg、特に好ましくは6ng/kgの量における、G−CSFの許容量で注入される。幹細胞の投与は、技術の一般的な状態において記載されているように、薬剤キャリアと共に生じるばあいがある。「許容可能なキャリア」は一般的に、本発明の血液幹細胞が生き延びる任意の物質、すなわち、TVEMF拡張後、低温保存の前後、ほ乳類への導入(投与)の前の細胞にとって有毒ではないものである。そのようなキャリアはこの技術において公知であり、本願を通じてこのような目的のためのものとして記載されている物質を含む、多くの種類の物質を含む。例えば、プラズマ、血液、アルブミン、細胞培養バイチ、バッファおよび低温保存薬の全ては、本発明の許容可能なキャリアである。望ましいキャリアの一部は、所望の用途に依る。
この技術において公知の他の拡張方法(TVEMFを用いないもの)は、血液幹細胞の三次元形状および細胞間支持を維持した状態で、自然由来の血液の少なくとも7倍の量の血液幹細胞を提供しない。TVEMF拡張された血液幹細胞は、それが由来する血液と同じまたは本質的に同じ、または維持した三次元形状および細胞間支持および細胞間形状を有する。上記組成は、TVEMF拡張された血液幹細胞を有していてもよく、ダルベッコ培地または低温保存用の溶液中に浮遊していることが好ましい。上記組成は、例えば死んだ細胞および有毒物質または顆粒球含有物およびマクロファージなどの、粒状の有毒物質を含まないことが好ましい。上記組成は、組成の温度を−120℃〜−196℃の温度に下げ、治療または他の用途のために必要となるまで、低温保存組成の温度をその範囲に維持することにより、TVEMF拡張された血液幹細胞を含有する低温保存組成であってもよい。後述するように、低温保存の前に、組成からできるだけ多くの有毒物質を除去することが好ましい。
本発明の他の態様は、低温保存を行った、またはTVEMF拡張が完了した直後のいずれかの、TVEMF拡張され血液幹細胞の薬剤組成で、心臓の組織の再生行う方法に関する。細胞は、例えば静脈内、または治療される組織へ直接注入によって哺乳類の体、好ましくは人間に導入されてもよく、体の自然のシステムが、心臓の組織を治療および再生されることを許容する。好ましくは、哺乳類の体に導入される組成は、投与されたTVEMF拡張された血液幹細胞へ、悪い反応をもたらすことがある、有毒物質および他の物質を含まない。上記細胞は、特に病気が発生し、病気ではない細胞が必要な、個々の血球を必要とする処置または研究である、処置または研究のためにすぐに利用できる。その後の人生において心臓の組織の治療が必要な人のためには、保存された拡張された末梢血または臍帯血が有用である。臍帯血は、心臓の組織の治療である心臓の状態その他を発現しやすい子供の場合は特に望まれる。
実施例I-TVEMFバイオリアクタにおける実際の細胞のTVEMF拡張
下記の表1に示すように、末梢血が採取され、末梢血細胞が拡張された。
下記の表1に示すように、末梢血が採取され、末梢血細胞が拡張された。
A)細胞の採取および維持
人間の末梢血(75ml;約0.75×106細胞/ml)が、上述したように注射器によって15人の人間のドナーから採取され、血液混合物を調製するために、20%の、5%人間アルブミン(HA)、100ng/mlの組み換え型人間G-CSF(アムゲン社(Amgen Inc.),サウザンドオークス(Thousand Oaks)、CA)、および100ng/ml組み換え型人間幹細胞因子(SCF)(Amgen)で補足された、約75mlのイスコーヴェ変性された(Iscove’s modified)ダルベッコ培地(IMDM)(GIBCO、グランドアイランド、NY)内に、10人のドナーから採取された血液が浮遊された。各血液サンプルの一部は、「コントロール」サンプルとした。図2および3に示されるTVEMFバイオリアクタ内に、末梢血混合物が配置された。TVEMF拡張は、37℃、通常の空気O2/N比の6%二酸化炭素で生じた。TVEMFバイオリアクタは、最初は一分間に10回転(rpm)の速度で回転され、その後、末梢血細胞のバイオリアクタにおける浮遊を維持するように、本願を通じて記載されているように、必要に応じて調整された。6mAの時間的に変化する電流がバイオリアクタに付与された。末梢血混合物に付与された方形波TVEMFは、約0.5ガウス(周波数:約10サイクル/秒)であった。TVEMFバイオリアクタにおける末梢血混合物中の培養培地は、1〜2日毎に交換/フレッシュにされた。10日目に、細胞はTVEMFバイオリアクタから除去され、PBSで洗浄され、分析された。結果は下記の表1に示す通りである。コントロールデータは、拡張されていない人間の末梢血のサンプルであり;拡張されたサンプルは、TVEMF拡張後の各コントロールサンプルである。
人間の末梢血(75ml;約0.75×106細胞/ml)が、上述したように注射器によって15人の人間のドナーから採取され、血液混合物を調製するために、20%の、5%人間アルブミン(HA)、100ng/mlの組み換え型人間G-CSF(アムゲン社(Amgen Inc.),サウザンドオークス(Thousand Oaks)、CA)、および100ng/ml組み換え型人間幹細胞因子(SCF)(Amgen)で補足された、約75mlのイスコーヴェ変性された(Iscove’s modified)ダルベッコ培地(IMDM)(GIBCO、グランドアイランド、NY)内に、10人のドナーから採取された血液が浮遊された。各血液サンプルの一部は、「コントロール」サンプルとした。図2および3に示されるTVEMFバイオリアクタ内に、末梢血混合物が配置された。TVEMF拡張は、37℃、通常の空気O2/N比の6%二酸化炭素で生じた。TVEMFバイオリアクタは、最初は一分間に10回転(rpm)の速度で回転され、その後、末梢血細胞のバイオリアクタにおける浮遊を維持するように、本願を通じて記載されているように、必要に応じて調整された。6mAの時間的に変化する電流がバイオリアクタに付与された。末梢血混合物に付与された方形波TVEMFは、約0.5ガウス(周波数:約10サイクル/秒)であった。TVEMFバイオリアクタにおける末梢血混合物中の培養培地は、1〜2日毎に交換/フレッシュにされた。10日目に、細胞はTVEMFバイオリアクタから除去され、PBSで洗浄され、分析された。結果は下記の表1に示す通りである。コントロールデータは、拡張されていない人間の末梢血のサンプルであり;拡張されたサンプルは、TVEMF拡張後の各コントロールサンプルである。
表1から分かるように、末梢血細胞のTVEMF拡張は、拡張されていないコントロールに比べ、10日間で細胞の数がほぼ10倍になり、対応するCD34+細胞が増加した。細胞が成長する場所である、培養培地は、1〜2日毎に1回交換/フレッシュにされた。
B)TVEMF拡張された細胞の分析
コントロールおよび拡張されたサンプルの全細胞数は、計測チャンバ(マイクログリットを有する、特別に作られた顕微鏡スライドにコントロール細胞浮遊または拡張されたサンプルのいずれかの体積を配置し、サンプル内の細胞の数を計測するために用いられる、血球計などの装置)で得られた。コントロールサンプルおよび10日間拡張された後のサンプル中の、全細胞計測の結果を表1に示す。
コントロールおよび拡張されたサンプルの全細胞数は、計測チャンバ(マイクログリットを有する、特別に作られた顕微鏡スライドにコントロール細胞浮遊または拡張されたサンプルのいずれかの体積を配置し、サンプル内の細胞の数を計測するために用いられる、血球計などの装置)で得られた。コントロールサンプルおよび10日間拡張された後のサンプル中の、全細胞計測の結果を表1に示す。
表1中の対応するCD34+の表示は、以下のように決定される:その中の他の細胞から、人間CD34+選択キット(イージーセップポジティブセレクション(EasySep positive selection)、ステムセルテクノロジーズ(StemCell Technologies))で、拡張されたサンプルのCD34+細胞が分離され、上述したように計測チャンバで計測され、FACスキャンフロー血球計算器(ベクトンーディッキンソン(Becton-Dickinson))で確認する。CFU−GEMMおよびCFU−GMがクローン形成法によって測定された。細胞生存度 (生存能力のある細胞は生きていて、生存能力がない細胞は死んでいる)は排除試験によって決定された。全ての拡張されたサンプルにおける「あり」の結果は、全細胞測定に対応して、CD34+細胞の数が増加したことを示す。
C)造血コロニー形成細胞の量の増加
このTVEMF拡張組織培養システムにおけるドナーの末梢血細胞の培養は、造血コロニー形成細胞の数を劇的に増加させる。分離分析において決定されるように、CFU−GM(7倍まで)およびCFU−GEMM(9倍まで)コロニー形成細胞の数のコンスタントな増加は、明らかな平坦域がなく、7日目まで観測された。
このTVEMF拡張組織培養システムにおけるドナーの末梢血細胞の培養は、造血コロニー形成細胞の数を劇的に増加させる。分離分析において決定されるように、CFU−GM(7倍まで)およびCFU−GEMM(9倍まで)コロニー形成細胞の数のコンスタントな増加は、明らかな平坦域がなく、7日目まで観測された。
D)CD34+細胞の増加
このTVEMF拡張組織培養システムにおける通常のドナーからのMNCの培養は、CD34+細胞の数を劇的に増加させる。分離分析において決定されるように、CD34+細胞の平均数は、6日目までに10倍に増加し、6日目には平坦であった。
このTVEMF拡張組織培養システムにおける通常のドナーからのMNCの培養は、CD34+細胞の数を劇的に増加させる。分離分析において決定されるように、CD34+細胞の平均数は、6日目までに10倍に増加し、6日目には平坦であった。
作動方法−心臓の組織の治療
以下に、人間における心臓の組織の治療のための、実例となる手順を記載する。そのほかの標準血管再生治療用のオプションがなく、深刻な虚血性心疾患がある15人の患者が、上記手順に参加するものとして識別される。患者は、逐次的に登録されれ、最初の10人の患者は治療グループに、あとの5人の患者はコントロールグループに割り当てられた。全ての患者は、登録時において、最大耐性量の薬物治療におかれた。以下の試験対象患者基準が、患者の登録に要求された:(1)単光子放射型コンピュータ断層撮影法(SPECT)によって検出される、可逆性血流欠損を伴う慢性冠状動脈不全;(2)左心室(LV)駆出分画(EF)<40%;(3)冠動脈造影によって評価するところによる、経皮または外科的血行再建の不適任;および(4)署名された、インフォームドコンセント。この研究においては、以下の除外基準の一つにでも当てはまる場合は、患者は登録されない:(1)経皮の手順のための血管アクセスを得ることの困難性;(2)以前のまたは最近の、患者の短期間生存に影響を与え得る、新生組織形成またはその他の併存疾患履歴;(3)重大な心室律動不整(持続した心室頻脈);(4)LV動脈瘤;(5)説明の付かない、ベースライン異常検査所見の異常;(6)異常な放射性物質のアスペクトを有する骨組織;(7)初期の血液学の病気;(8)研究への登録の3ヶ月以内の急性心筋梗塞;(9)2Dドップラー心エコー図による心室内の血栓の存在;(10)手順時における、血行動態の不安定化;(11)心房性細動;または(12)患者を過度の危険を与えうる任意の状態。
以下に、人間における心臓の組織の治療のための、実例となる手順を記載する。そのほかの標準血管再生治療用のオプションがなく、深刻な虚血性心疾患がある15人の患者が、上記手順に参加するものとして識別される。患者は、逐次的に登録されれ、最初の10人の患者は治療グループに、あとの5人の患者はコントロールグループに割り当てられた。全ての患者は、登録時において、最大耐性量の薬物治療におかれた。以下の試験対象患者基準が、患者の登録に要求された:(1)単光子放射型コンピュータ断層撮影法(SPECT)によって検出される、可逆性血流欠損を伴う慢性冠状動脈不全;(2)左心室(LV)駆出分画(EF)<40%;(3)冠動脈造影によって評価するところによる、経皮または外科的血行再建の不適任;および(4)署名された、インフォームドコンセント。この研究においては、以下の除外基準の一つにでも当てはまる場合は、患者は登録されない:(1)経皮の手順のための血管アクセスを得ることの困難性;(2)以前のまたは最近の、患者の短期間生存に影響を与え得る、新生組織形成またはその他の併存疾患履歴;(3)重大な心室律動不整(持続した心室頻脈);(4)LV動脈瘤;(5)説明の付かない、ベースライン異常検査所見の異常;(6)異常な放射性物質のアスペクトを有する骨組織;(7)初期の血液学の病気;(8)研究への登録の3ヶ月以内の急性心筋梗塞;(9)2Dドップラー心エコー図による心室内の血栓の存在;(10)手順時における、血行動態の不安定化;(11)心房性細動;または(12)患者を過度の危険を与えうる任意の状態。
処置グループにおけるベースライン評価は、完全な臨床治療の評価(履歴および健康診断)、研究室の評価(完全な血液カウント、血液化学、C反応性たんぱく質[CRP]、脳性ナトリウム利尿ペプチド[BNP]、クレアチンキナーゼ[CK]−MBおよびトロポニン血清レベル)、傾斜したスレッドミルプロトコルでの運動負荷試験、2Dドップラー心エコー図、ジピリダモールSPECT血流スキャン、および24時間ホルターモニターを含む。
コントロールグループには、24時間ホルターモニター、CK−MBおよびトロポニン血清レベル以外の、上述したベースライン評価を行なう。
処置グループの患者は、手順の直前に、血清CRP、完全な血液カウント、CK、トロポニン、およびBNPレベル測定およびECGを行った。手順の直後に、他のECGおよび2Dドップラー心エコー図が行なわれ、24時間ホルターモニターが始められる。血清CRP、CK、およびトロポニンレベルも、24時間において評価される。患者は、上記手順の注入後、48時間モニターされる。
例えば実施例Iに従って調製されたTVEMF拡張された血液幹細胞は、5%の人間の血清アルブミンを含有するヘパリン塩水で徹底的に洗浄され、細胞の塊を除去するために、例えば100μmのナイロンメッシュでろ過される。細胞は、薬剤TVEMF拡張された血液幹細胞組成としての注入のために、5%の人間の血清アルブミンを含有する塩水中で再懸濁される。上記組成のごく一部は、細胞のカウントおよびトリパンブルー除外での生存能力試験のために用いられる。細胞の生存能力は、表1に示された結果と同様に、>98%となることが期待される。
顆粒球-マクロファージコロニー形成単位およびCD45loCD34+細胞間の高い相関関係が見られた。上述したように、推測される間葉系前駆リネージ(progenitor mesenchymal lineage)の存在を測定するために、線維芽細胞コロニー形成分析が行われてもよい。上記組成のバクテリアおよび菌性の培養は、それが陰性であることを確認するために行われる。
フルオレセインイソチオシアネート(ファーミンゲン(Pharmingen));フィコエリトリン(PE)、またはPerCP:ベクトンーディッキンソン(Becton Dickinson)からの、パン白血球マーカー(クローンHI30)としての抗CD45、造血前駆マーカー(クローンHPCA−II)としての抗−CD34、パン−T−細胞マーカー(クローンSK7)としての抗−CD3、T−細胞亜種マーカー(クローンSK3)としての抗−CD4、および、T−細胞亜種マーカー(クローンSKl)としての抗−CD8;カタログラボラトリーズ(Caltag Laboratories (Burlingame, Calif))からの、単球マーカー(クローンTUK4)としての抗−CD14、パン−B−細胞マーカー(クローンSJ25−C1)としての抗−CD19、およびNK-細胞マーカー(クローンNKI ribl−1)としての抗-CD56;およびベックマン−クールター(Beckman-Coulter)からの、抗-HLA−DR(MHC−II、クローンB8.12.2)でビオチニル化または共役のいずれかで、下記の抗体が入手可能である。ビオチニル化された抗体は、ストレプトアビジンPECy7カタログラボラトリーズ)で明らかにされてもよい。全核を成す骨髄細胞浮遊における白血球母集団の確認のために、三色免疫蛍光分析が用いられてもよい。着色後、製造業者の手順に従って、赤血球はベクトンーディッキンソン溶解バッファ溶液または同様の溶液に溶解され、各サンプルにおける白血球の割合を評価するためにCD45抗体が用いられた。データの取得および分析は、セルクエスト(CellQuest)3.1ソフトウェア(ベクトンーディッキンソン)を有するカリバー(Calibur)などの、蛍光活性化細胞分類装置において行なわれてもよい。
細胞注入処置グループにおいては、研究室からの薬剤TVEMF拡張された血液幹細胞組成の予想される到着の1時間前に、患者は心臓カテーテル研究室へ連れて来られる。バイプレインLV血管造影での、左心カテーテルが行なわれる。続いて、上述したように、左心室の電気機械マッピング(EMM)が行なわれる。処置の一般的な領域は、前のSPECT血流イメージングによって、虚血性と確認されたエリアと一致することにより、選択される。上記電気機械マップは、その後、その領域内の生存心筋(単極ボルト>6.9mV)を確認することによって、特定の処置エリアを対象とするために用いられる。機械的な活動の減少を伴うアリア(ローカルリニアショートニング<12%、冬眠心筋を示す)が好ましい。
NOGA注入カテーテルは、0°および90°フレックスにおいてニードルエクステンションを調整し、薬剤TVEMF拡張された血液幹細胞組成拡張された幹細胞の0.1ccを、ニードルのデッドスペースを満たすために配置することによって、調製することができる。上記注入カテーテルの先端は、大動脈弁を横切り、目的のエリア内へと配置され、各注入場所は、細胞が注入される前に慎重に評価される。LV壁への細胞の注入の前に、下記の基準が満たされなくてはならない:(1)LV壁への、カテーテルの垂直位置;(2)優れたループの安定性(<4mm);(3)潜在的な電圧>6.9mV;および(4)心筋内へのニードルのエクステンションにおける、速すぎる心室収縮の存在。0.2ccが処置グループの各患者に15回注入され、期待される全細胞の量は約1400万細胞/0.2ccである。導入される幹細胞の好ましい数は、本願を通じて記載されており、最も好ましくは約107〜109幹細胞である。コントロールグループは、幹細胞を含まない注入を受けてもよい。処置された、およびされていない(コントロール)の、全ての患者について、2ヶ月間の、非観血性のフォローアップの評価が行なわれた。
予測された最大Vo2は、患者の作業負荷を調整するために用いられる。スレッドミル速度は、始めは時速0.5マイルであり、傾斜は0%〜10%、計画された運動の継続時間は10分である。心エコーのデータが分析される。イメージがデジタルで記録され、オフラインで分析されてもよい。収縮末期容量(ESV)、拡張末期容量(EDV)、およびEFが、標準プロトコルに従って測定される。
ジピリダモールストレスおよび休息SPECTイメージングが、ベースラインおよびフォローアップにおいて、同じストレス手順で行なわれる。テクネチウム−99mセスタミビ(sestamibi)の約740MBqが、休息およびストレス後において、4分間の、体重1kg当たり、1分間に142μgの輸液速度で、ジピリダモール輸液と共に注入される。1時間後、140−keVの光電ピーク上の中心の15%ウィンドーを用いて、SPECTイメージングが開始される。取得は、1−ディテクターガンマカメラ(1-detector gamma camera (Ecam, Siemens))で、180°上で32プロジェクションを取得した(右前斜位45°〜左後斜位45°)(低エネルギー、高解像視準;64×64マトリックス;およびプロジェクション当たり35秒)。左心室の、短軸および垂直および水平長軸の断層写真が、適切な補間で座標変換を行なうことにより、再建されたトランスアクシャル断層写真から抽出されてもよい。弱化または散乱修正は付与されなかった。定量的なSPECT分析は、例えば、ICONワークステーションコンピュータ(Siemens)または同様のセットアップによって行なわれる。上記分析は、最大カウント周プロファイルを確認するための品質制御チェックを除き、完全に自動化されたソフトウェアパッケージを用いて行なわれる。大まかには、先端方向および最も基本的な断層撮影短軸スライス、LVチャンバの中心軸、および心筋のカウントサーチのための制限半径を含むプロセスパラメータは、自動的に由来する。短軸断層写真は、左心室のボディーのサンプリングには円筒型アプローチで、LVアペックスのサンプリングには球面アプローチで、最大カウント周プロファイルサンプルテクニック(maximum-count circumferential profile sampling technique)を用いることにより、その後サンプル化される。ポーラーマップディスプレイおよび定量的な値は、その後、ストレス心筋血流欠損エクステントおよび感度を示すために生じる。
コントロールグループの患者には、不必要な危険を回避するための、その後のフォローアップにおいて、NOGAマッピングまたは繰り返されるLV血管造影図が行なわれる。
処置グループの患者には、IV血管造影図およびEMMから成る、4ヶ月間の観血性のフォローアップ評価がされる。LV血管造影は、5Fピッグテールカテーテルを用いた、大腿骨アプローチを通じて行なわれてもよい。全ての血管造影図は、安定した洞律動の期間中の、2プレート−30°右前斜位図および60°左前斜位図−において得られる。心室体積は、速すぎる脈拍の最中または後には測定されない。較正デバイスとして、40mm球が用いられた。
EMMは、15mmの充填閾値の、確立された基準に従って行なわれた。ポイントの取得後、標準安定性基準(位置安定性;<4mm、ループ安定性<6mm、およびサイクル長さ変位<10%)に適合しないポイント、ST−セグメントエレベーション中に取得されたポイント、および左心室に関連しないポイント(例えば心房におけるもの)である、インナーポイントを除外するための一連のフィルタ(中程度の設定)で、プロセス後分析が行なわれる。
マッピングおよび注入のための、全手順期間は、約81±19分である。電気機械的マップは、平均92±16ポイントを含有していてもよい。患者は、平均値2±0.7セグメント(下方6、側方14、前方2、および中隔5)において、平均15±2細胞組成注入を受ける。1400万個の細胞の各注入は、0.2ccの体積においてもたらされる。
注入された細胞の2〜3%(約400,000/mm2)が、造血前駆細胞(CD45IoCD34+)となると期待される。同様に、注入された細胞の約0.1%(約15,000/mm2)が、初期造血前駆細胞(CD45loCD34+HLA―DR―)となることが期待され、注入された細胞の約25〜30%(約4,000,000/mm2)が、CD4+T−細胞(CD45+CD3+CD4+)となることが期待される。注入された細胞の約15%(約2,200,000/mm2)が、CD8+T−細胞(CD45+CD3+CD8+)となることが期待され、注入された細胞の約2%(約1,600,000/mm2)が、B細胞(CD45+CD19+)となることが期待される。注入された細胞の約10%(約1,400,000/mm2)が、単球(CD45+CD14+)となることが期待さ、注入された細胞の約1〜2%(約150,000/mm2)NK細胞(CD45+CD56+)となることが期待される。
これらの実験から期待される結果は、コントロールグループと比較した場合、処置グループの患者は、2ヶ月のフォローアップにおいて、心臓麻痺および狭心症症状の経験がより少ないことであり、両方とも、ニューヨーク心臓協会(New York Heart Association (NYHA))およびカナダ心臓血管協会狭心症スコア(Canadian Cardiovascular Society Angina Score (CCSAS))分布によるものである。ベースライン運動試験変動(METおよび最大Vo2)は、2つのグループで同様である。しかしながら、処置グループにおけるフォローアップにおいては、METおよび最大Vo2における劇的な増加が見られる。NYHAクラスは、TVEMF拡張された幹細胞での処置の後は半分になるが、拡張された幹細胞なしでは、同じままである。CCSASもまた、処置の後は、処置の前の半分より少なくなることが期待されるが、処置されていない患者については、実質的な変化はない。最大Vo2は、処置した場合は約35%の増加が期待されるが、処置なしの場合は、実質的な変化はない。心エコー図、ESV、体積は、処置した場合は約15%減少するが、処置なしの場合は、増加する。SPECT、全可逆的欠損は、処置した場合は約80%減少するが、処置なしの場合は、増加する。
EMMにおいては、セグメント分析が、注入されたセグメントの劇的なメカニカルな改善を明らかにする。注入部位におけるメカニカル機能の劇的な改善が示される。
このように、ここに記載される処置によって、劇的な心臓の治療が成し遂げられたことが分かる。もし、TVEMF拡張された幹細胞が静脈内に挿入されたら、治療に要する期間が長くなるかもしれないが、同様の結果が達成されることが期待される。
動物モデルまたはその他の心臓の組織の治療が望まれる状況において行なわれた実験は、本発明の心臓の組織の治療の、組織学または病理学上の分析、またはその他の所望の分析における成果を提供する。
作動方法−低温保存
上述したように、哺乳類、好ましくは人間から血液が採取される。少なくとも赤血球は、血液から除去されることが好ましい。上記血液幹細胞(所望の他の細胞および培地とともに)TVEMFバイオリアクタ内に配置され、時間的に変化する電磁気力にさらされ、拡張される。TVEMF拡張前にRBCが除去されない場合は、それらはTVEMF拡張後に除去されることが好ましい。TVEMF拡張された細胞は、低温保存されてもよい。TVEMF拡張された血液幹細胞の低温保存の方法およびそのような細胞を含有する組成についての更なる詳細は、ここに、特に以下に提供されている。
上述したように、哺乳類、好ましくは人間から血液が採取される。少なくとも赤血球は、血液から除去されることが好ましい。上記血液幹細胞(所望の他の細胞および培地とともに)TVEMFバイオリアクタ内に配置され、時間的に変化する電磁気力にさらされ、拡張される。TVEMF拡張前にRBCが除去されない場合は、それらはTVEMF拡張後に除去されることが好ましい。TVEMF拡張された細胞は、低温保存されてもよい。TVEMF拡張された血液幹細胞の低温保存の方法およびそのような細胞を含有する組成についての更なる詳細は、ここに、特に以下に提供されている。
TVEMF拡張後、TVEMF拡張された血液幹細胞を含む、TVEMF拡張された細胞は、少なくとも一つの低温保存薬を含有する、少なくとも一つの低温保存容器に移されてもよい。上記TVEMF拡張された血液幹細胞は、培地およびTVEMF拡張中に存在するその他の成分を除去するために、最初に溶液(例えば、バッファ溶液または所望の低温保存薬溶液)で洗浄され、その後、細胞の低温保存を許容する溶液に混合されることが好ましい。そのような溶液は一般的に、低温保存薬、低温保存溶液または低温保存剤と呼ばれている。上記細胞は適切な低温保存容器へ移され、上記容器は、通常は−120℃〜−196℃、好ましくは−130℃〜−150℃の温度へ下げられ、その温度が維持される。 冷凍プロセス中の幹細胞への損傷をなくす、または少なくとも損傷を最小にするために、この温度の低下は、ゆっくり、かつ、慎重に行われることが好ましい。必要であれば、細胞の温度(ほぼ低温保存容器の温度)は、人間の体に細胞を導入するのに適した(通常は室温付近から体温付近まで)温度まで上げられ、例えば本願を通じて記載されているように、哺乳類の体、好ましくは人間に、TVEMF拡張された細胞が導入されてもよい。
冷凍細胞は、普通は破壊的である。学説に拘束されることなく、冷却中に、細胞内の水が凍結する。その後、細胞膜における浸透圧効果、細胞脱水、溶液濃度、および氷結晶形成によって損傷が生じる。細胞の外側で氷が形成すると、入手可能な水が溶液から除去され、細胞から引き抜かれて浸透脱水、および、細胞を破壊しかねない溶液濃度の上昇をもたらす。(議論については、マズール(Mazur)、P., 1977, Cryobiology 14:251-272を参照のこと)
異なる物質は、異なる凝固点を有する。低温保存の準備ができている血液幹細胞組成は、結晶化および冷凍プロセスからの細胞壁の損傷を最小にするために、可能な限り少ない汚染物質を含むことが好ましい。
(a)低温保存薬の使用、(b)冷凍速度の制御、および(c)劣化反応を最小にするために十分低い温度おいて保存する、琴似より損傷効果は低減または回避さえもすることができる。
本発明においては、低温保存剤の含有が好ましい。
用いることができる低温保存剤はこれらには限定されないが、ジメチルスルホキシド(DMSO)(Lovelock、J. E.およびBishop、M. W. H., 1959、ネイチャー(Nature)183:1394-1395; Ashwood-Smith、M. J., 1961、ネイチャー190:1204-1205)の十分な量、グリセロール、ポリビニルピロリジン(Rinfret、A. P., 1960、Ann. N. Y. Acad. Sci. 85:576)、ポリエチレングリコール(Sloviter, H. A. and Ravdin, R. G., 1962, Nature 196:548)、アルブミン、デキストラン、スクロース、エチレングリコール、i-エリスリトール、D-リビトール、D-マンニトール(Rowe, A. W., et al., 1962, Fed. Proc. 21:157)、D-ソルビトール、i-イノシトール、D-ラクトース、塩化コリン(Bender, M. A., et al., 1960, J. Appl. Physiol. 15:520)、アミノ酸- グルコース溶液またはアミノ酸(Phan The Tran and Bender, M. A., 1960, Exp. Cell Res. 20:651)、メタノール、アセトアミド、グリセロールモノアセテート(Lovelock, J. E., 1954, Biochem. J. 56:265), および無機塩 (Phan The Tran and Bender, M. A., 1960, Proc. Soc. Exp. Biol. Med. 104:388; Phan The Tran and Bender, M. A., 1961, in Radiobiology, Proceedings of the Third Australian Conference on Radiobiology, Ilbery, P. L. T., ed., Butterworth, London, p. 59)を含む。好ましい態様においては、DMSOが用いられる。液体である、DMSOは、低濃度においては、細胞に有毒である。小さい分子であることにより、DMSOは細胞に自由に浸透し、水と混合されて、その凍結性を改善し、氷の形成からの損傷を防止することにより、細胞内の細胞小器官を保護する。プラズマの添加(例えば20〜25%までの濃度)は、DMSOの保護効果を増加させる。DMSOの添加後、4℃を超える温度においては、約1%の濃度のDMSOが有毒となりうるため、細胞は0℃以下に維持されなければならない。私が選択した好ましい低温保存剤は、全組成用のTVEMF拡張された末梢血幹細胞との組み合わせにおいて:60〜80%アミノ酸−グルコース溶液中の、20〜40%ジメチルスルホキシド溶液;15〜25%ヒドロキシエチルでんぷん溶液;4〜6%グリセロール、3〜5%グルコースおよび6〜10%デキストランT10;15〜25%ポリエチレングリコール;および75〜85%アミノ酸−グルコース溶液である。上述した低温保存薬の量は、全組成における、低温保存薬の全量(組成に添加される物質の量のみではなく)であることが好ましい。
用いることができる低温保存剤はこれらには限定されないが、ジメチルスルホキシド(DMSO)(Lovelock、J. E.およびBishop、M. W. H., 1959、ネイチャー(Nature)183:1394-1395; Ashwood-Smith、M. J., 1961、ネイチャー190:1204-1205)の十分な量、グリセロール、ポリビニルピロリジン(Rinfret、A. P., 1960、Ann. N. Y. Acad. Sci. 85:576)、ポリエチレングリコール(Sloviter, H. A. and Ravdin, R. G., 1962, Nature 196:548)、アルブミン、デキストラン、スクロース、エチレングリコール、i-エリスリトール、D-リビトール、D-マンニトール(Rowe, A. W., et al., 1962, Fed. Proc. 21:157)、D-ソルビトール、i-イノシトール、D-ラクトース、塩化コリン(Bender, M. A., et al., 1960, J. Appl. Physiol. 15:520)、アミノ酸- グルコース溶液またはアミノ酸(Phan The Tran and Bender, M. A., 1960, Exp. Cell Res. 20:651)、メタノール、アセトアミド、グリセロールモノアセテート(Lovelock, J. E., 1954, Biochem. J. 56:265), および無機塩 (Phan The Tran and Bender, M. A., 1960, Proc. Soc. Exp. Biol. Med. 104:388; Phan The Tran and Bender, M. A., 1961, in Radiobiology, Proceedings of the Third Australian Conference on Radiobiology, Ilbery, P. L. T., ed., Butterworth, London, p. 59)を含む。好ましい態様においては、DMSOが用いられる。液体である、DMSOは、低濃度においては、細胞に有毒である。小さい分子であることにより、DMSOは細胞に自由に浸透し、水と混合されて、その凍結性を改善し、氷の形成からの損傷を防止することにより、細胞内の細胞小器官を保護する。プラズマの添加(例えば20〜25%までの濃度)は、DMSOの保護効果を増加させる。DMSOの添加後、4℃を超える温度においては、約1%の濃度のDMSOが有毒となりうるため、細胞は0℃以下に維持されなければならない。私が選択した好ましい低温保存剤は、全組成用のTVEMF拡張された末梢血幹細胞との組み合わせにおいて:60〜80%アミノ酸−グルコース溶液中の、20〜40%ジメチルスルホキシド溶液;15〜25%ヒドロキシエチルでんぷん溶液;4〜6%グリセロール、3〜5%グルコースおよび6〜10%デキストランT10;15〜25%ポリエチレングリコール;および75〜85%アミノ酸−グルコース溶液である。上述した低温保存薬の量は、全組成における、低温保存薬の全量(組成に添加される物質の量のみではなく)であることが好ましい。
血液細胞および低温保存剤以外の他の物質は、低温保存される本発明の組成中に存在してもよく、本発明のTVEMF拡張された血液幹細胞組成の低温保存は、例えば上述した冷凍のメカニズムに関して記載されたような理由により、可能な限り少ない他の物質とともにされることが好ましい。
本発明のTVEMF拡張された血液幹細胞組成は、約−120℃から約−196℃の範囲の温度、好ましくは約−130℃から約−196℃の温度、より好ましくは約−130℃から約−150℃の温度まで冷却されることが好ましい。
制御されたゆっくりな冷却速度は重大である。異なる低温保存剤(Rapatz, G., et al., 1968, Cryobiology 5(l):18-25) および異なる細胞の種類は、異なる最適な冷却速度を有する(末梢細胞の生存における冷却速度の効果(およびそれらの移植可能性)については例えば、Rowe, A. W. and Rinfret, A. P., 1962, Blood 20:636;Rowe, A. W., 1966, Cryobiology 3(1):12-18; Lewis, J. P., et al., 1967, Transfusion 7(l):17-32;およびMazur, P., 1970, Science 168:939-949参照)。水が氷に変わる、溶融相の熱は、最小にされるべきである。冷却手順は、例えばプログラムできる冷凍装置またはメタノールバス手順によって行うことができる。
プログラムできる冷凍機器は、最適な冷却速度の決定を可能とし、再現可能で標準的な冷却を促進する。クリオームド(Cryomed)またはプラナー(Planar)などのプログラム可能な制御された速度の冷凍庫は、所望の冷却速度曲線への冷凍管理のチューニングを可能にする。他の許容可能な冷凍庫は、例えば、サンヨーモディ(Modi)MDF−1155ATN−152CおよびモデルMDF−2136ATN −135C、プリンストンクリオテック(Princeton CryoTech)TEC 2000である。例えば、10%DMSOおよび20%プラズマにおける血液細胞またはCD34+/CD38−細胞の場合、0℃〜−200℃からの最適な速度は1〜3℃/分である。
好ましい態様においては、この冷却速度は、本発明の細胞に用いることができる。細胞を含有する低温保存容器は、低温で安定であり、冷凍および解凍の両方の効果的な制御のために、迅速な熱交換を可能にしなくてはならない。いくつかの少量(1〜2ml)のためにはシールされたプラスチックの小瓶 (例えばヌンク(Nunc)、Wheaton cryules)またはガラスアンプルを用いることができ、より多い量(100〜200ml)は、冷却中のよりよい熱交換のために、金属板の間に保持されたポリオレフィンの袋(例えばデルムド(Delmed))内で冷凍することができる。(袋に入った骨髄細胞は、偶然にも約3℃/分の冷却速度をもたらした、−80℃の冷凍庫内にそれらを配置することにより、うまく冷凍することができた)。
他の態様においては、冷却のメタノールバス方法を用いることができる。上記メタノールバス方法は、大きなスケールで、いくつかの小さいアイテムの所定の低温保存に最適である。上記方法は、手動での冷却速度の制御も、速度をモニターするための記録も必要としない。好ましい態様においては、DMSOで処置された細胞が氷で前もって冷却され、順番に、−130℃の機械的な冷蔵庫(例えばハリス(Harris)またはレヴコ(Revco))に配置される、冷やされたメタノールを含有するトレーに移される。メタノールバスおよびサンプルの熱電対測定は、1〜3℃の所望の冷却速度を示す。少なくとも2時間後、試料は−80℃の温度に達し、永久保存のために、液体窒素(−196℃)内に直接配置されてもよい。
冷凍完了後、TVEMF拡張された幹細胞は、長期低温保存容器(冷凍庫など)に即座に移されてもよい。好ましい態様においては、細胞は液体窒素(−196℃)またはその上記(−165℃)内で低温保存されてもよい。保存温度は、−120℃、好ましくは−130℃より低くなければならない。このような保存は、熱の漏れおよび窒素のロスが極めて最小に維持される、極めて低い真空および内部の超断熱を有する大きなサーモス容器に似た、高効率液体窒素冷蔵庫の利用によって大幅に促進される。
この細胞の低温保存に好ましい機器および手順は、細胞の温度を−130℃より低く下げるために彼らの手順を利用する、サーモジェニシス社(Thermogenesis Corp., Rancho Cordovo, CA)である。上記細胞は、冷凍および保存の間、サーモジェニシスプラズマバッグ内に保持される。
他の冷凍庫は市販されている。例えば、「バイオアーチブ(BioArchive)」冷凍庫は、冷凍するだけではなく、血液または本発明の細胞などの低温保存サンプルの在庫を調べ、例えば、一度に3,626個の冷凍血液のバッグを管理する。この冷凍庫は、指示されると、特定のサンプルを取り出すロボットアームを有し、他のいかなるサンプルも邪魔されない、または暖かい温度にさらされないことを保証する。他の市販されている冷凍庫は、これらには限定されないが、サンヨーモデルMDF−1155 ATN−152CおよびモデルMDF−2136 ATN−135C、およびプリンストンクリオテックTEC 2000を含む。
TVEMF拡張された血液幹細胞組成の温度が−120℃、好ましくは−130℃よりも下げられた後に、サーモジェニシス冷凍庫などの機器内に保持されてもよい。それらの温度は、約−120℃〜−196℃、好ましくは−130℃から−150℃の温度に維持される。本発明の低温保存された、TVEMF拡張された血液幹細胞組成の温度は、長期間にわたって−120℃を超えるべきではない。
本発明にかかる低温保存された、TVEMF拡張された血液幹細胞、またはその組成は、必要な時に解凍されるように、無期限に冷凍されていてもよい。例えば組成は、18年まで冷凍されていてもよい。さらに長い期間、多分血液ドナーの寿命と同じ長さでも役に立つであろう。
必要であれば、細胞が中に入ったバッグが、サーモジェニシスプラズマ解凍機(Thermogenesis Plasma Thawer)などの解凍システムまたは、サオモライン解凍機シリーズ(Thermoline Thawer series)などのその他の解凍機器内に配置されてもよい。上記低温保存された組成の温度は、室温まで上げられる。低温保存剤と混合された細胞の解凍の他の好ましい方法においては、液体窒素内に保存された、本発明の低温保存されたTVEMF拡張された血液幹細胞組成を有するバッグが、液体窒素のガス相に15分間配置され、外気室温に5分間さらされ、最終的に37℃の水浴で、できるだけ即座に解凍されてもよい。解凍されたバッグの内容物は、すぐに、2.5%(重量/体積)の人間血清アルブミン、および、5%(重量/体積)のデキストラン40(Solplex 40; Sifra, Verona, イタリア)を生理食塩液に含む同体積の溶液で希釈され、その後400gで10分間遠心分離されてもよい。上記浮遊物は除去され、沈殿した細胞は、フレッシュなアルブミン/デキストラン溶液中で再懸濁される。高張性抗凍結剤の除去のためには、ルビンスタイ(Rubinstein)、P等の「親族ではない者の骨髄再構成のための、胎盤/臍帯血の処理および低温保存(Processing and cryopreservation of placental/umbilical cord blood for unrelated 骨髄 reconstitution)」Proc. Natl Acad. Sd. 92:10119-1012 (1995);好ましい細胞解凍の方法のバリエーションはラッザリ(Lazzari)L等の「臍帯血からの造血前駆細胞の生体外拡張における低温保存の効果の評価(Evaluation of the effect of cryopreservation on ex vivo expansion of 造血前駆s from cord blood)」骨髄 Trans. 28:693-698 (2001)を参照のこと。
上記細胞の温度が室温まで上げられた後に、それらは研究または再生治療に用いることができる。解凍されたTVEMF拡張された血液幹細胞組成は、哺乳類、好ましくは人間に直接導入されてもよく、または、例えば所望の研究のために、解凍された形態で用いられてもよい。解凍された細胞がその中に存在する溶液は、完全に洗浄除去されても、他と交換されても、または添加されてもよく、所望の操作をすることができる。哺乳類の体に導入される前に、好ましくは、そのような導入の直前に近い時に、種々の添加物が解凍された組成(または、低温保存されていない、TVEMF拡張された血液幹細胞組成)へ添加されてもよい。そのような添加物は、これらには限定されないが、成長因子、銅キレート剤、サイトカイン、ホルモン、適切なバッファまたは希釈剤を含む。G−CSFが添加されることが好ましい。人間には、約20〜約40μg/体重1kgの量においてG−CSFが添加されることがより好ましく、約30μg/体重1kgの量がさらに好ましい。また、導入前に、TVEMF拡張された血液幹細胞組成は、例えば輸血に伴う、哺乳類自身の、または、適切なドナーのプラズマ、血液またはアルブミン、または他の物質と混合されてもよい。上記解凍された血液幹細胞は、例えば処置のために用いることが望まれる薬剤への悪い反応があるか、またはそれらを処置に用いることができるかを試験するために用いることができる。
米国においては、組織の再生のための、拡張された血液幹細胞の使用をFDAが承認していないが、そのような承認は、目前に迫っている。拡張された血液幹細胞の十分な量の直接の注入は、心臓の組織の治療および再生に用いることができるはずである。
本発明のTVEMF拡張された血液幹細胞組成は、組織の治療または再生、または所望の病気または状態の処置を達成するのに十分な、治療上効果的な量において、哺乳類、好ましくは人間に導入されるべきである。外傷が生じ、即時の組織の治療が必要な場合は特に、好ましくは1度に全て、1ml当たりに107から109個の幹細胞を有する、TVEMF拡張された血液幹細胞組成の少なくとも20mlが任意の処置に用いられることが好ましい。この量は、75〜80kgの人間において特に好ましい。哺乳類に導入される組成におけるTVEMF拡張された血液幹細胞の量は、その一部は、血液物質源(特にかなり限られた量のみが入手可能であるばあい)内に存在する細胞の数に依存する。患者に導入されるTVEMF拡張された血液幹細胞の好ましい範囲は、例えば、1ml当たりに107から109個の幹細胞を有する、TVEMF拡張された血液幹細胞組成の約10ml〜約50ml、または潜在的にそれ以上である。当然ながら、哺乳類に投与される、高濃度の任意の物質は、有毒または致命的であり得るが、例えば少なくとも7倍のTVEMF拡張後など、TVEMF拡張された血液幹細胞の全ての導入は、TVEMF拡張された血液幹細胞における過剰投与をもたらすとは考えにくい。いくつものドナーから、または同一のドナーからの複数の採取からの血液が用いられると、哺乳類へ導入される血液幹細胞の数は、高くなりうる。また、患者に導入されるTVEMF細胞の投与量は、1個体からの採取から提供される血液の量によって限定されるものではなく;複数の投与、例えば1日1回または2回、または1週間に1回、または他の投与期間が、より容易に用いることができる。また、組織が処置されるが、組織の種類が、入手可能な限り多くのTVEMF拡張された血液幹細胞の使用、またはより少ない投与量の使用を正当化する。例えば、肝臓が最も処置しやすく、必要とする幹細胞は他の組織よりも少ない。
当然のことながら、上述した態様は主にTVEMF拡張された血液幹細胞を低温保存することに関するが、すでに低温保存された拡張されていない血液幹細胞を解凍した後、またはTVEMF拡張されていない血液幹細胞において、TVEMF拡張が生じてもよい。また、低温保存が望まれる場合は、細胞の冷凍の前および後の両方にTVEMF拡張が生じてもよい。例えば、血液バンクは、いつかそのようなものが必要となる場合に備えて、冷凍保存において、血液幹細胞を含有する低温保存された組成を有する。そのような組成は、従来の方法によって解凍され、その後、ここに記載されているようなTVEMFプロセスのバリエーションを含む、ここに記載されているように、TVEMF拡張されてもよい。その後、そのようなTVEMF拡張された血液幹細胞は、上述したように、本発明の組成であると考えられる。低温保存される前のTVEMF拡張が好ましく、例えば、外傷が生じた場合、患者の血液幹細胞は既に拡張されており、治療のための貴重な、余分な日数を必要としない。
また、好ましくはないが、本発明のTVEMF拡張された血液幹細胞は、低温保存され、その後解凍され、使用されない場合は、再び低温保存されてもよいことに注目すべきである。細胞が冷凍される前に、好ましくはTVEMF拡張(すなわち、サイズにおいてではなく、数において)される。細胞は、冷凍される前に既に拡張されている場合でも、冷凍されて解凍された後に拡張されてもよい。
血液幹細胞の拡張は、数日かかる場合がある。生死にかかわる状況、または外傷の場合、特に細胞の再導入の前に研究が完了する必要がある場合など、血液幹細胞の即時の供給が重要な状況においては、血液幹細胞の拡張を待つための数日間がない場合がある。そのため、処置の1分の遅れが生死を別つ緊急の場合を見越して、生まれたときから、そのような拡張された血液幹細胞が入手可能であることが特に望ましい。
また、当然のことながら、本願の上記TVEMF拡張された血液幹細胞は、TVEMF拡張後に低温保存され、またはされずに、哺乳類、好ましくは源の哺乳類(血液の源の哺乳類)に導入されてもよい。しかしながら、そのような導入は、源の哺乳類(自己由来)のみに限定されない;上記TVEMF拡張された細胞は、異なる哺乳類(同種異系)に移されてもよい。
また、当然のことながら、血液は、本発明用の成人の幹細胞の好ましい源であるが、骨髄からの成人幹細胞も、本発明における血液幹細胞と同様の方法で、TVEMF拡張され、用いられてもよい。骨髄は幹細胞のすぐに利用できる源ではないが、アフェレーシス治療または、ある他の高価および苦痛を伴う方法を介して採取できるはずである。
また本発明は、例えば心臓の病気または状態に関連した、心臓の組織を研究するための方法を含む。上記方法は、例えば、病気の状態用の試験システムに、血液幹細胞組成を導入することを含む。そのようなシステムは、これらに限定はされないが、例えば病気の哺乳類、病気を研究するための適切な動物モデル、または上記病気を研究するためのインビトロ検査システムを含んでもよい。TVEMF拡張された血液幹細胞は、心臓に関連する病気のために可能性のある処置のための研究に用いることができる。
本発明の血液幹細胞は、拡張、保存、および解凍のプロセスの間中、それらの三次元形状およびそれらの細胞間支持および細胞間形状を維持する。
ここに好ましい態様が説明されたが、当業者は、本発明が様々な変更および改良を含むことを理解するであろう。本発明の範囲は、上述した態様に限定されることを意図したものではない。
Claims (21)
- その体積当たりの数が、自然由来の血液よりも少なくとも7倍多い、拡張された血液幹細胞であり、自然由来の血液の幹細胞と本質的に同じ三次元形状および細胞間支持および細胞間形状を有する前記血液幹細胞を含有する薬剤血液幹細胞組成の、治療上効果的な量を哺乳類へ投与する工程を含有する、心臓の組織を治療する方法。
- その体積当たりの数が、自然由来の血液よりも少なくとも2倍多い、TVEMF拡張された血液幹細胞であり、自然由来の血液の幹細胞と本質的に同じ三次元形状および細胞間支持および細胞間形状を有する前記血液幹細胞を含有する薬剤血液幹細胞組成の、治療上効果的な量を哺乳類へ投与する工程を含有する、心臓の組織を治療する方法。
- 前記TVEMF拡張された血液幹細胞の体積当たりの数が、少なくとも7倍多いことを特徴とする、請求項2にかかる方法。
- 前記投与工程が、哺乳類の末梢血流、心臓に隣接する組織、または心臓の組織の少なくとも一つへ、前記薬剤血液幹細胞組成を投与することを含有することを特徴とする、請求項3の方法。
- 前記薬剤血液幹細胞組成が、人間のGM−CSFおよび人間のG−CSFの少なくとも一つをさらに含有することを特徴とする、請求項3の方法。
- 前記哺乳類が人間であることを特徴とする、請求項3の方法。
- a.TVEMFバイオリアクタの培養チャンバ内に、血液混合物を配置する工程と;
b.前記血液混合物にTVEMFを受けさせ、TVEMF拡張された血液幹細胞の体積当たりの数が、TVEMFバイオリアクタ内に配置された血液幹細胞の体積当たりの数の7倍を超えるまで、TVEMFバイオリアクタ内で血液幹細胞をTVEMF拡張する工程と;
c.薬剤血液幹細胞組成を調製するために、前記TVEMF拡張された細胞を、許容可能な薬剤キャリアと混合する工程と;を、前記投与工程に先立って、さらに含有する、請求項3の方法。 - 前記TVEMF拡張された細胞から、有毒物質を除去することをさらに含有する、請求項7の方法。
- 前記TVEMFが、約0.05〜約6.0ガウスであることを特徴とする、請求項7にかかる方法。
- TVEMFバイオリアクタ内に前記血液混合物を配置するのに先立って、血液を採取する工程をさらに含有し、
前記血液が、自己由来源から採取されることを特徴とする、請求項7にかかる方法。 - TVEMFバイオリアクタ内に前記血液混合物を配置するのに先立って、血液を採取する工程をさらに含有し、
前記血液が、同種異系源から採取されることを特徴とする、請求項7にかかる方法。 - TVEMFバイオリアクタ内に前記血液混合物を配置するのに先立って、血液を採取する工程をさらに含有し、
前記血液が、哺乳類、血液バンク、病院、および低温保存された血液サンプルの少なくとも一つから採取されることを特徴とする、請求項11にかかる方法。 - 前記血液混合物が、他の血液成分から分離されたCD34+/CD38−血液幹細胞を含有することを特徴とする、請求項7の方法。
- 前記血液混合物が、他の血液成分から分離されたバッフィーコートを含有することを特徴とする、請求項7の方法。
- 前記血液混合物が、赤血球を含まないことを特徴とする、請求項7の方法。
- 前記哺乳類へ投与されるTVEMF拡張された血液幹細胞の、治療上効果がある量が、約107〜109幹細胞/mlの約20mlであることを特徴とする、請求項2の方法。
- 自然由来の血液の、少なくとも7倍多い体積当たりの数の拡張された血液幹細胞を含有する、哺乳類の心臓の組織を治療するための薬剤血液幹細胞組成であって、
前記血液幹細胞が、自然由来の血液の幹細胞と本質的に同じ三次元形状および細胞間支持および細胞間形状を有することを特徴とする、薬剤血液幹細胞組成。 - 自然由来の血液の、少なくとも2倍多い体積当たりの数のTVEMF拡張された血液幹細胞を含有する、哺乳類の心臓の組織を治療するための薬剤血液幹細胞組成であって、
前記血液幹細胞が、自然由来の血液の幹細胞と本質的に同じ三次元形状および細胞間支持および細胞間形状を有することを特徴とする、薬剤血液幹細胞組成。 - 前記TVEMF拡張された血液幹細胞の体積当たりの数が、少なくとも7倍多いことを特徴とする、請求項18にかかる薬剤血液幹細胞組成。
- プラズマ(plasma)、血液、アルブミン、および5%の人間の血清アルブミンを有する塩水から成る群から選択された、少なくとも一つの薬剤として許容可能なキャリアをさらに含有する、請求項19にかかる組成。
- 心臓の組織の治療のための薬の調製における、請求項17から請求項20の組成の使用。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US65728705P | 2005-02-28 | 2005-02-28 | |
| PCT/US2006/006829 WO2006093860A2 (en) | 2005-02-28 | 2006-02-27 | Method and composition for repairing heart tissue |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008531696A true JP2008531696A (ja) | 2008-08-14 |
| JP2008531696A5 JP2008531696A5 (ja) | 2009-04-16 |
Family
ID=36941686
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007558097A Pending JP2008531696A (ja) | 2005-02-28 | 2006-02-27 | 心臓の組織を治療するための方法および組成 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20060193836A1 (ja) |
| EP (1) | EP1853301A2 (ja) |
| JP (1) | JP2008531696A (ja) |
| KR (1) | KR20070112205A (ja) |
| CN (1) | CN101166541A (ja) |
| BR (1) | BRPI0608277A2 (ja) |
| CA (1) | CA2599332A1 (ja) |
| EA (1) | EA200701599A1 (ja) |
| IL (1) | IL185557A0 (ja) |
| MX (1) | MX2007010451A (ja) |
| WO (1) | WO2006093860A2 (ja) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20070114378A (ko) * | 2005-02-28 | 2007-12-03 | 리제네텍 인코포레이티드 | 말초혈액으로부터 유도된 쉽게 이용가능한 세포 물질을 제공하는 방법 및 그의 조성물 |
| US20110076255A1 (en) | 2005-11-07 | 2011-03-31 | Pecora Andrew L | Compositions and methods for treating progressive myocardial injury due to a vascular insufficiency |
| US8637005B2 (en) | 2005-11-07 | 2014-01-28 | Amorcyte, Inc. | Compositions and methods of vascular injury repair |
| ES2485387T3 (es) | 2005-11-07 | 2014-08-13 | Amorcyte, Inc. | Composiciones y métodos de reparación de lesiones vasculares |
| US20090081752A1 (en) * | 2007-09-24 | 2009-03-26 | Dennis Robert G | Bioreactor, kit and method of using same |
| US8993231B2 (en) * | 2008-03-18 | 2015-03-31 | Marshall University Research Corporation | Methods for stem cell production and therapy |
| RU2497532C2 (ru) * | 2008-12-03 | 2013-11-10 | Эморсайт, Инк. | Композиции, улучшающие перфузию в области инфаркта и способы восстановления сосудистого повреждения |
| SG11201603166UA (en) | 2013-10-24 | 2016-05-30 | Ospedale San Raffaele Srl | Method |
| US9410143B1 (en) | 2014-06-10 | 2016-08-09 | Endonovo Therapeutics, Inc. | Biological molecules produced by electromagnetically stimulating living mammalian cells |
| CN111313782B (zh) * | 2020-01-20 | 2022-03-01 | 江苏新安电器股份有限公司 | 基于免疫算法的感应电机无源性控制方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002044346A2 (de) * | 2000-11-29 | 2002-06-06 | William Rader | Stammzellen, verfahren zu deren expansion in vitro sowie deren verwendung |
| US20040076620A1 (en) * | 2002-09-03 | 2004-04-22 | Donnie Rudd | Method of repairing primate mammalian tissue |
| WO2004045666A1 (ja) * | 2002-11-15 | 2004-06-03 | Kyushu Tlo Company, Limited. | 臓器の再生方法 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5192553A (en) * | 1987-11-12 | 1993-03-09 | Biocyte Corporation | Isolation and preservation of fetal and neonatal hematopoietic stem and progenitor cells of the blood and methods of therapeutic use |
| US5026650A (en) * | 1988-06-30 | 1991-06-25 | The United States Of Amercia As Represented By The Administrator Of The National Aeronautics And Space Administration | Horizontally rotated cell culture system with a coaxial tubular oxygenator |
| US5155034A (en) * | 1988-06-30 | 1992-10-13 | The United States Of America As Represented By The Administrator Of The National Aeronautics And Space Administration | Three-dimensional cell to tissue assembly process |
| US4988623A (en) * | 1988-06-30 | 1991-01-29 | The United States Of America As Represented By The Administrator Of The National Aeronautics And Space Administration | Rotating bio-reactor cell culture apparatus |
| US6962698B1 (en) * | 1998-02-17 | 2005-11-08 | Gamida Cell Ltd. | Methods of controlling proliferation and differentiation of stem and progenitor cells |
| US20020159984A1 (en) * | 1999-11-12 | 2002-10-31 | Quality Biological, Inc. | Cultivation of cells for long term engraftment |
| US6485963B1 (en) * | 2000-06-02 | 2002-11-26 | The United States Of America As Represented By The Administrator Of The National Aeronautics And Space Administration | Growth stimulation of biological cells and tissue by electromagnetic fields and uses thereof |
| US20050084962A1 (en) * | 2003-08-20 | 2005-04-21 | Bruce Simon | Methods of treatment using electromagnetic field stimulated stem cells |
| US20080057042A1 (en) * | 2005-01-27 | 2008-03-06 | Donnie Rudd | Method of providing readily available cellular material derived from cord blood, and a composition thereof |
| US20080050348A1 (en) * | 2006-02-27 | 2008-02-28 | Donnie Rudd | Method and composition for repairing heart tissue |
| US20080075700A1 (en) * | 2006-02-27 | 2008-03-27 | Wolf David A | Method and composition for treating diabetes |
-
2006
- 2006-02-27 BR BRPI0608277-7A patent/BRPI0608277A2/pt not_active IP Right Cessation
- 2006-02-27 EA EA200701599A patent/EA200701599A1/ru unknown
- 2006-02-27 WO PCT/US2006/006829 patent/WO2006093860A2/en active Application Filing
- 2006-02-27 EP EP06736205A patent/EP1853301A2/en not_active Withdrawn
- 2006-02-27 MX MX2007010451A patent/MX2007010451A/es not_active Application Discontinuation
- 2006-02-27 US US11/363,575 patent/US20060193836A1/en not_active Abandoned
- 2006-02-27 CN CNA2006800143013A patent/CN101166541A/zh active Pending
- 2006-02-27 CA CA002599332A patent/CA2599332A1/en not_active Abandoned
- 2006-02-27 JP JP2007558097A patent/JP2008531696A/ja active Pending
- 2006-02-27 KR KR1020077021371A patent/KR20070112205A/ko not_active Application Discontinuation
-
2007
- 2007-08-28 IL IL185557A patent/IL185557A0/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002044346A2 (de) * | 2000-11-29 | 2002-06-06 | William Rader | Stammzellen, verfahren zu deren expansion in vitro sowie deren verwendung |
| US20040076620A1 (en) * | 2002-09-03 | 2004-04-22 | Donnie Rudd | Method of repairing primate mammalian tissue |
| WO2004045666A1 (ja) * | 2002-11-15 | 2004-06-03 | Kyushu Tlo Company, Limited. | 臓器の再生方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1853301A2 (en) | 2007-11-14 |
| BRPI0608277A2 (pt) | 2009-11-24 |
| CA2599332A1 (en) | 2006-09-08 |
| EA200701599A1 (ru) | 2008-04-28 |
| KR20070112205A (ko) | 2007-11-22 |
| CN101166541A (zh) | 2008-04-23 |
| US20060193836A1 (en) | 2006-08-31 |
| MX2007010451A (es) | 2007-11-08 |
| WO2006093860A3 (en) | 2007-04-12 |
| WO2006093860A2 (en) | 2006-09-08 |
| IL185557A0 (en) | 2008-01-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2008531696A (ja) | 心臓の組織を治療するための方法および組成 | |
| JP2008531051A (ja) | すぐに利用できる末梢血由来の細胞物質を提供する方法およびその組成 | |
| US20060188984A1 (en) | Method of providing readily available cellular material derived from cord blood, and a composition thereof | |
| US20080050348A1 (en) | Method and composition for repairing heart tissue | |
| US20080075700A1 (en) | Method and composition for treating diabetes | |
| US20060193838A1 (en) | Method and composition for treating diabetes | |
| JP5379340B2 (ja) | ヒト自己前駆幹細胞を培養する培地とその応用 | |
| Templin et al. | Transcoronary delivery of bone marrow cells to the infarcted murine myocardium: feasibility, cellular kinetics, and improvement in cardiac function | |
| US20080075704A1 (en) | Method of providing readily available cellular material derived from peripheral blood, and a composition thereof | |
| US20080171020A1 (en) | Method and composition for repairing epithelial and other cells and tissue | |
| WO2013168402A1 (ja) | デキストラン含有肺塞栓形成予防用哺乳動物細胞懸濁液 | |
| WO2009025722A1 (en) | Method and composition for repairing heart tissue | |
| WO2007058929A2 (en) | Composition for reducing problems associated with sickle cell disease using low temperature storage | |
| CA2597954A1 (en) | Method and composition for repairing heart tissue | |
| CA2597963A1 (en) | Method of providing readily available cellular material derived from peripheral blood and a composition thereof | |
| CA2595744A1 (en) | Method of providing readily available cellular material derived from cord blood, and a composition thereof | |
| CA2597972A1 (en) | Method and composition for treating diabetes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090226 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090226 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110913 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120228 |