JP2007509984A - 色素上皮由来因子、その新規な生物活性及びその使用方法 - Google Patents
色素上皮由来因子、その新規な生物活性及びその使用方法 Download PDFInfo
- Publication number
- JP2007509984A JP2007509984A JP2006538385A JP2006538385A JP2007509984A JP 2007509984 A JP2007509984 A JP 2007509984A JP 2006538385 A JP2006538385 A JP 2006538385A JP 2006538385 A JP2006538385 A JP 2006538385A JP 2007509984 A JP2007509984 A JP 2007509984A
- Authority
- JP
- Japan
- Prior art keywords
- pedf
- disease
- peptide
- tissue
- amino acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/16—Central respiratory analeptics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/81—Protease inhibitors
- G01N2333/8107—Endopeptidase (E.C. 3.4.21-99) inhibitors
- G01N2333/811—Serine protease (E.C. 3.4.21) inhibitors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/08—Hepato-biliairy disorders other than hepatitis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/12—Pulmonary diseases
- G01N2800/125—Adult respiratory distress syndrome
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/16—Ophthalmology
- G01N2800/164—Retinal disorders, e.g. retinopathy
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/26—Infectious diseases, e.g. generalised sepsis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/28—Neurological disorders
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Oncology (AREA)
- Diabetes (AREA)
- General Physics & Mathematics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Pathology (AREA)
- Biochemistry (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Pulmonology (AREA)
- Marine Sciences & Fisheries (AREA)
- Heart & Thoracic Surgery (AREA)
- Epidemiology (AREA)
- Vascular Medicine (AREA)
- Gastroenterology & Hepatology (AREA)
- Rheumatology (AREA)
- Zoology (AREA)
Abstract
Description
本出願は、2003年10月29日出願の米国特許仮出願第60/515,374号の優先権を主張するものである。
本発明は、本明細書に記載の特定の材料および方法のみに限定されるものではないことを理解されたい。本明細書で使用される用語は、特定の実施形態を説明するためのものであり、本発明の範囲を限定するためのものではなく、本発明の範囲は請求項によってのみ限定されることも理解されたい。本明細書で使用されているように、特に明記されていない限り、単数形の「a」、「an」、および「the」は、複数形も含むものである。例えば、「眼の組織(eye tissue)」は、当業者に公知の複数の細胞が含まれる。
PEDFおよびVEGFの様々な活性における関係は、完全には明確にはなっていない。初期の研究で、PEDFが神経突起の生成を誘導すること13、VEGFが血管新生および血管透過性を促進すること1〜3、33〜35が示された。PEDFの抗血管新生活性の報告によって、血管新生におけるPEDFとVEGFとの関係が明らかにされた。様々な種類の神経細胞において、PEDFおよびVEGFは同様な活性を有し、両方とも神経栄養性であり神経保護性である5、25、36。このように、VEGFは3種類の活性、すなわち、(i)血管新生の促進、(ii)神経細胞の生存と増殖の促進、および(iii)血管透過性の促進、を有している。
本発明には、血管透過性を阻害し、血管新生を阻害し、神経保護を促進するための、全長の色素上皮由来因子(PEDF、Steeleら、1993年、Proc. Natl. Acad. USA 90(4): 1526〜1530参照)およびPEDFのすべての誘導体、特にPEDF 44 AAペプチドおよびその相同体、の使用も含まれる。本発明は、特にPEDF 44 AAペプチドおよびその相同体を含む、全長PEDF、抗血管新生または抗血管透過性のPEDFの誘導体の何れをもコードする核酸の使用を包含するものである。
本明細書で用いる場合には、本セクションで示される以下の用語はそれぞれ独自の意味を有するものである。
アスパラギン酸、Asp、D;グルタミン酸/グルタミン酸塩、Glu、E;
リシン、Lys、K;アルギニン、Arg、R;ヒスチジン、His、H;
チロシン、Tyr、Y;システイン、Cys、C;アスパラギン、Asn、N;
グルタミン、Gln、Q;セリン、Ser、S;トレオニン、Thr、T;
グリシン、Gly、G;アラニン、Ala、A;バリン、Val、V;
ロイシン、Leu、L;イソロイシン、Ile、I;メチオニン、Met、M;
プロリン、Pro、P;フェニルアラニン、Phe、F;トリプトファン、Trp、W
以下のセクションでは、ペプチドの修飾およびペプチドの合成について記載する。当然ながら、本発明の方法において有用なペプチドは、活性に影響することなく修飾されているアミノ酸残基を取り込めるものと理解されたい。例えば、遮断基、すなわち「望ましくない分解」からN末端およびC末端を保護するおよび/または安定化するのに適した化学的置換基を末端に含むように誘導することができ、「望ましくない分解」には、化合物の機能に影響する、すなわち末端で化合物を逐次的に分解する、可能性のある末端での化合物のすべての種類の酵素的分解、化学的分解、または生化学的分解が含まれる。
グリシン、アラニン;
バリン、イソロイシン、ロイシン;
アスパラギン酸、グルタミン酸;
アスパラギン、グルタミン;
セリン、トレオニン;
リシン、アルギニン;
フェニルアラニン、チロシン;
本明細書で用いる「薬剤」または「化合物」という用語は、PEDFの生物学的作用を模倣するまたは達成する能力を有する、例えば、タンパク質または薬剤等の分子を示す。一般に、異なる薬剤濃度の複数のアッセイ混合物を並行して分析し、様々な濃度に対する反応差を求める。通常、これらの濃度の内の一つ、すなわち濃度がゼロまたは検出域以下のもの、が陰性対照として使用される。
本明細書に記載する方法のいずれかを用いて同定され、本明細書に開示する疾患の治療のために製剤して投与できる、化合物を説明する。
(実施例)
次の実施例に於いて、以下にしめされる方法および材料を用いた。
ヒト組換えPEDFを、引用文献19に記載のようにして、ヒトの胎児の腎臓癌細胞293で産生した。引用文献43に記載の手順に従って、条件設定した媒体を用いてPEDFタンパク質を精製した。EDFは、モノ S FPLCカラムを通しNaClの直線勾配をかけてP溶出した(20mMのNaH2PO4、pH6.2、0mMか〜500mMのNaCl;10%のグリセロール)。
3種類のペプチド(図4a)を合成した。PEDFペプチド(PEDFpep)は、PEDFタンパク質の78番から121番のアミノ酸残基(GenBank(商標)の受託番号P36955)に相当する。ACTペプチド(ACTpep)は、PEDFタンパク質の73番から118番のアミノ酸残基(受託番号P01011)に相当する。キメラペプチド(CHIMERApep)は長さが44個のアミノ酸であり、PEDFからの40個のアミノ酸残基にACTまたはHSP47(受託番号P29043)からの4個のアミノ酸残基を加えたものである。
6〜8週齢のC57BL/6Jマウスを、視力および眼科学研究協会の眼および視力研究における動物の使用に関する説明に基づいて処置した。麻酔するために、0.3〜0.4mlのリン酸塩緩衝生理食塩水(PBS、1.06mMのKH2PO4、0.15MのNaCl、および3.00mMのNa2HPO4、pH7.4)中に溶解した20mg/kgのケタミン、20mg/kgのキシラジンおよび800mg/kgのウレタンをそれぞれのマウスに筋肉注射した。10倍に希釈した、1μlのマウスVEGF164(PBS中で12.6ng/μl、R & D Systems社、ミネアポリス、ミネソタ州)を、先端の直径が13〜20μmで20°の斜端のガラスピペットを用いてマウスの一方の眼に注入した。もう一方の眼には、同じ容積のPBSのみを、または、12.6ngのVEGF164および20倍モルのPEDF(232ng)、ACT(278ng)、HSP47(278ng)、PEDFpep(28.1ng)、ACTpep(29.7ng)、またはCHIMERApep(28.2ng)を含有するPBSを注入した。
硝子体内注入の24時間後に、各瞳孔を1%の硫酸アトロピン1滴で膨張させた。25%のフルオレセイン0.1mlを腹腔内注入した後、Kowa Genesisカメラで連続的に網膜の写真をとった。最初の写真は、フルオレセインの腹腔内注入から20秒以内にとった。右目と左目の網膜写真を交互に撮影する際の経過時間は平均で10秒であった。フルオレセインの漏出は、不明瞭な血管の境界が蛍光でますます不明瞭になることで示された。
本発明者らは、Qaumら記載の方法44を一部変更して用いた。簡単に説明すると、各マウスの硝子体内にタンパク質またはペプチドを注入し、エバンスブルー44を頚静脈に注射した。2時間後に、血液200μlを採取し、エバンスブルーの量を測定した。網膜を押し出して、硝子体および付着している網膜の色素上皮と分離した。
引用文献45に記載のように、ウシの網膜毛細血管内皮細胞(BRCEC)を単離して培養した。アセチル化低密度リポタンパク質で標識した1,1’−ジオクタデシル−3,3,3’,3’−テトラメチル−インドカルボシアミンパークロレート(DiI−Ac−LDL;Biomedical Technologies社、ストートン、マサチューセッツ州)で処理した後に、BRCECを蛍光細胞選別機でさらに精製した。継代5〜継代9の細胞を、D型バリンおよび2%ウシ胎児性血清を含むMEM中で一晩、飢餓状態にした。ポリカーボネートフィルター(孔径10μm、PVPF;Osmonic社、ミネトンカ、ミネソタ州)を100μg/μlのコラーゲンで被覆した。MEM D型バリン(28μl)内の四分割した試験サンプル、およびMEM D型バリン(50μl)内の104個の細胞をそれぞれ、細胞走化性チャンバー(microchemotaxis chamber)(NeuroProbe社、ガイタースベルグ、メリーランド州)の下側のウェルと上側のウェルに配置した。37℃で8時間インキュベートした後、フィルターの上側表面の遊走しなかった細胞を除去し、フィルターをハリス社のヘマトキシリンで染色した。各試験サンプルについて、各フィールド毎に400倍で四分割した試験サンプルの細胞数をカウントした。四つのフィールドの合計細胞数から、四分割分の平均細胞数および標準誤差を計算した。ベースライン遊走は、タンパク質またはペプチドを加えないMEM D型バリンで遊走した細胞数とした。ベースラインとVEGFを加えて遊走した細胞数との差を最大合計遊走とした。
結果はすべて平均±標準誤差で表わした。スチューデントのt−検定をペアで行い、同じ動物の眼を比較した。一元配置ANOVAでグループ間の相違を分析した。p<0.05の場合、統計的に有意な相違があるとされた。
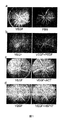
臨床的な診断法であるフルオレセイン血管造影法によって、VEGFが誘導する血管透過性を本発明の因子が調節する効果を写真で確認する。反対側の眼に比べて片方の目で蛍光が減少したのは、両方の目に注入された本発明の薬剤に起因するものである。VEGFは血管透過性を亢進する28ため、生理食塩水を注入した反対側の眼に比べ、VEGF164(ヒトのVEGF165と相同なマウスの分子種)を注入した眼におけるフルオレセインの漏出は予想通り増大した(図1a)。PEDFをVEGF164と共に注入すると、VEGFが誘導する血管透過性は認められなかった(図1b)。
VEGFが誘導する血管透過性に対するPEDFの阻害効果を定量し確認するために、改変されたエバンスブルーアッセイ32を行った。フルオレセイン血管造影実験の際に硝子体内にPEDFを注入したマウスの24時間後の血管内のエバンスブルーの量を測定した。PEDFはVEGFが誘導する血管透過性をほぼ消滅せしめ(95.6±21.2%)、一方、ACTおよびHSP47は識別できる効果を示さなかった(阻害はそれぞれ、3.4±18.2%および19.4±22.3%であった)(図2)。これらのデータは、フルオレセイン血管造影実験で定性的に認められたこと、すなわち、PEDFはVEGFが誘導する網膜の血管透過性を阻害することを裏付ける。
PEDFの神経栄養活性/神経保護活性は44個のアミノ酸領域に同定されている24、25ため、この領域が血管透過性の調節活性も有しているものかと考えた。ヒトPEDFの78番〜121番のアミノ酸残基からなるPEDFpepの等モル量を、全長PEDFの代わりに硝子体内に注入した。フルオレセイン血管造影アッセイにおいて、PEDFpepはVEGFが誘導する血管透過性を効果的に阻害した(図3a)。ACTの相当する領域からの46個のアミノ酸のペプチド(73番〜118番、ACTpepと呼ぶ)は、VEGFが誘導する血管透過性に何れの効果も示さなかった。
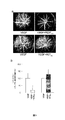
生理活性に必要なアミノ酸残基を同定するため、ACT、HSP47、およびPEDFの配列および結晶学的構造を比較し(図4a、b)、キーとなる主要な残基を評価するため、PEDF内の四つの候補アミノ酸残基を選択した。引用文献24、25および本発明者らの予備研究により、活性な部位としてPEDFの78番〜121番の残基を指定した。結晶構造から、44個のアミノ酸の領域には、完璧な二次構造要素のs6B、hB、およびhC、1巻きのhD、ならびに結合性のループ31が含まれている。s6BおよびhBはPEDFの内部に隠れている。要素のhC、hDおよびそれらを結びつけるループは、大部分が露出し、アクセス可能な表面を形成している。このため、本発明者らは、hC、結合性のループ、および一巻きのhDが含まれる、99番〜121番の領域に的を絞った。
発明者らは、血管新生活性の代わりに、ウシの網膜毛細血管内皮細胞(BRCEC)を備えた細胞走化性チャンバーアッセイ(microchemotaxis chamber assay)を用いた。PEDFは、用量依存的に、0.5nMの50%抑制濃度(IC50)で、VEGFにより促進された内皮細胞の遊走を阻害した。ACTおよびHSP47は同濃度で、遊走活性に対して効果を示さなかった。PEDFと同様に、PEDFpepは、用量依存的に、3.0nMのIC50で、VEGFにより促進された内皮細胞の遊走を効果的に阻害した。ACTpepもCHIMERApepも同じアッセイにおいて効果を示さなかった(図5b)。したがって、内皮細胞の遊走は、同じ4個のアミノ酸残基に依存する。
1. Senger,D.R.ら、腫瘍細胞は、腹水の蓄積を促進する、血管透過性因子を分泌する、Science 219,983〜5(1983年)(Senger, D. R. et al. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid. Science 219,983-5 (1983))
2. Connolly,D.T.ら、腫瘍の血管透過性因子は内皮細胞の増殖および血管新生を刺激する、J.Clin.Invest.84、1470〜8(1983年)(Connolly, D. T. et al. Tumor vascular permeability factor stimulates endothelial cell growth and angiogenesis. J. Clin. Invest. 84, 1470-8 (1983))
3. keck,P.J.ら、血管透過性因子、内皮細胞の遊走はPDGFに関係する、Science 246、1309〜1312(1989年) ( Keck, P. J. et al. Vascular permeability factor, an endothelial cell mitogen related to PDGF. Science 246,1309-12 (1989))
4. Oosthuyse,B.ら、血管内皮細胞の増殖因子からの低酸素症応答要素の除去が運動ニューロンの変性を誘導する、Nat. Genet. 28、131〜138(2001年)(Oosthuyse, B. et al. Deletion of the hypoxia-response element in the vascular endothelial growth factor promoter causes motor neuron degeneration. Nat Genet 28, 131-8 (2001) )
5. Sondell, M.,Lundborg,G.およびKanje,M.、血管内皮細胞の増殖因子は神経栄養活性を有し、軸索の成長を刺激し、末梢神経系における内皮細胞の生存およびシュワン細胞の増殖を促進する、J. Neurosci. 19、5731〜5740(1999年)(Sondell, M. , Lundborg, G. & Kanje, M. Vascular endothelial growth factor has neurotrophic activity and stimulates axonal outgrowth, enhancing cell survival and Schwann cell proliferation in the peripheral nervous system. J Neurosci 19,5731-40 (1999))
6. Wick,A.ら、前提条件としての低酸素状態における神経保護には、血管内皮細胞増殖因子受容体およびAktの継続的な活性化が必要である、J.Neurosci. 22、6401〜6407(2002年)(Wick, A. et al. Neuroprotection by hypoxic preconditioning requires sequential activation of vascular endothelial growth factor receptor and Akt. J Neurosci 22,6401-7 (2002))
7. Waltenberger, J., Claesson−Welsh,L., Siegbahn, A., Shibuya,M.およびheldin, C. H.、KDRおよびFlt1の異なる信号伝達特性、血管内皮細胞増殖因子の二つの受容体、J. Biol. Chem.、269、26988〜26995(1994年)( Waltenberger, J., Claesson-Welsh, L., Siegbahn, A., Shibuya, M. & Heldin, C.H. Different signal transduction properties of KDR and Fltl, two receptors for vascular endothelial growth factor. JBiol Chem 269,26988-95 (1994))
8. Gille,H.ら、Flt−1(VEGFR−1)およびKDR(VEGFR−2)の生物学的効果および発信特性の分析。新規な受容体特異的な血管内皮細胞増殖因子変異体を用いた再評価、J. Biol. Chem. 、276、3222〜3230(2001年)(Gille, H. et al. Analysis of biological effects and signaling properties of Flt-1 (VEGFR-1) and KDR (VEGFR-2). A reassessment using novel receptor-specific vascular endothelial growth factor mutants. J Biol Chem 276,3222-30 (2001))
9. Bernatchez, P.N.,Soker,S.およびSirois,M. G.、血管内皮細胞増殖因子は内皮細胞の増殖、遊走に影響し、血小板活性化因子の合成はFlk−1に依存する、J. Biol. Chem.、274、31047〜31054(1999年)(Bernatchez, P. N. , Soker, S. & Sirois, M. G. Vascular endothelial growth factor effect on endothelial cell proliferation, migration, and platelet-activating factor synthesis is 274,31047-54 (1999))
10. Steele, F. R., Chader, G. J., Johnson, L. V.およびTombran−Tink,J.、色素上皮由来因子:細胞栄養活性およびセリンプロテアーゼ阻害体遺伝子ファミリーの一員としての同定、Proc. Natl. Acad. Sci. USA 90、1526〜1530(1993年)(Steele, F. R. , Chader, G. J. , Johnson, L. V. & Tombran-Tink, J. Pigment epithelium-derived factor: neurotrophic activity and identification as a member of the serine protease inhibitor gene family. Proc Natl Acad Sci USA 90,1526-30 (1993))
11. Becerra, S. P., Sagasti, A., Spinella, P.およびNotario, V.、色素上皮由来因子は非阻害性セルピンと同様の挙動を示す。細胞栄養活性にセルピンの反応性ループは不要である。J.Biol.Chem.、270、25992〜25999(1995年)(Becerra, S. P. , Sagasti, A. , Spinella, P. & Notario, V. Pigment epithelium-derived factor behaves like a noninhibitory serpin. activity does not require the serpin reactive loop. JBiol Chem 270,25992-9 (1995))
12. Dafforn, T. R.,Della,M.およびMiller,A.D.、熱ショックタンパク質47(Hsp47)の分子的相互作用およびそれらのコラーゲン生合成における意味、J. Biol. Chem.、276、49310〜49319(2001年)(Dafforn, T. R., Della, M. & Miller, A. D. The molecular interactions of heat shock protein 47 (Hsp47) and their implications for collagen biosynthesis. J Biol Chem 276,49310-9 (2001))
13. Tombran−Tink,J.およびJohnson,L.V.、ヒトRPE細胞で調整された培地でインキュべートされた網膜芽細胞の神経分化、Invest. Ophthalmol.Vis.Sci.30、1700〜7(1989年)(Tombran-Tink, J. & Johnson, L. V. Neuronal differentiation of retinoblastoma cells induced by medium conditioned by human RPE cells. Invest Ophthalmol Vis Sci 30, 1700-7 (1989))
14. Tombran−Tink,J.,Chader, G. G. およびJohnson, L. V.、PEDF:強力な神経分化活性を有する色素上皮由来因子、Exp. Eye Res. 53、411〜4(1991年) ( Tombran-Tink, J. , Chader, G. G. & Johnson, L. V. PEDF: a pigment epithelium-derived factor with potent neuronal differentiative activity. Exp Eye Res 53,411-4 (1991))
15. Becerra,S.P.ら、大腸菌におけるヒト胎児性色素上皮由来因子の過剰発現。機能的に活性な神経栄養因子。、J. Biol. Chem.、268、23148〜23156(1993年)(Becerra, S. P. et al. Overexpression of fetal human pigment epithelium-derived factor in Escherichia coli. A functionally active neurotrophic factor. JBiol Chem 268,23148-56 (1993))
16. Seigel,G.M.ら、色素上皮由来因子および光受容体間マトリックス洗浄による網膜芽細胞Y79の分化:腫瘍発生能に対する効果。、Growth Factors 10、289〜97(1994年)(Seigel, G. M. et al. Differentiation of Y79 retinoblastoma cells with pigment epithelial-derived factor and interphotoreceptor matrix wash: effects on tumorigenicity. Growth Factors 10,289-97 (1994))
17. Dawson,D.W.ら、色素上皮由来因子:血管新生の強力な阻害剤、Science 285、245〜8(1999年)(Dawson, D. W. et al. Pigment epithelium-derived factor: a potent inhibitor of angiogenesis. Science 285, 245-8 (1999))
18. Stellmach,V.,Crawford,S.E.,Zhou,W.およびBouck, N.、天然の抗血管新生剤である色素上皮由来因子による虚血誘発性網膜症の予防、Proc. Natl. Acad. Sci. USA 98、2593〜7(2001年)(Stellmach, V., Crawford, S. E. , Zhou, W. & Bouck, N. Prevention of ischemia- induced retinopathy by the natural ocular antiangiogenic agent pigment epithelium-derived factor. Proc Natl Acad Sci USA 98,2593-7 (2001))
19. Duh,E.J.ら、色素上皮由来因子は、虚血誘発性網膜血管新生ならびにVEGF誘発性の遊走および増殖を抑制する。、Invest. Ophthalmol. Vis. Sci. 43、821〜9(2002年)(Duh, E. J. et al. Pigment epithelium-derived factor suppresses ischemia-induced retinal neovascularization and VEGF-induced migration and growth. Invest Ophthalmol Vis Sci 43, 821-9 (2002))
20. Gao,G.ら、褐色ドブネズミおよびSDラットでの、網膜血管新生症に対する感受性の相違に寄与する、虚血調節における血管内皮増殖因子と色素上皮由来因子の違い、Diabetes 51、1218〜25(2002年)(Gao, G. et al. Difference in ischemic regulation of vascular endothelial growth factor and pigmentepithelium--derived factor in brown norway and sprague dawley rats contributing to different susceptibilities to retinal neovascularization. Diabetes 51,1218-25 (2002))
21. Gao,G.ら、血管内皮増殖因子のダウンレギュレーションと色素上皮由来因子のアップレギュレーション:プラスミノゲンクリングル5の抗血管新生活性において考えられる機序、J. Biol. Chem.、277、9492〜7(2002年)(Gao, G. et al. Down-regulation of vascular endothelial growth factor and up- regulation of pigment epithelium-derived factor: a possible mechanism for the anti-angiogenic activity of plasminogen kringle 5. JBiol Chem 277, 9492-7 (2002))
22. Gao,G.ら、虚血誘発性網膜血管新生症におけるVEGFとPEDFのアンバランスな発現、FEBS Lett. 489、270〜276(2001年)(Gao, G. et al. Unbalanced expression of VEGF and PEDF in ischemia-induced retinal neovascularization. FEBS Lett 489, 270-6 (2001))
23. Ohno−Matsui, K.ら、年齢が関係する斑変性の新規な機序:抗血管新生因子のVEGFとPEDFとの平衡シフト、J. Cell Physiol. 189、323〜33(2001年)(Ohno-Matsui, K. et al. Novel mechanism for age-related macular degeneration: an equilibrium shift between the angiogenesis factors VEGF and PEDF. J Cell Physiol 189, 323-33 (2001))
24. Alberdi, E., Aymerich,M.S. およびBecerra, S. P.、色素上皮由来因子(PEDF)と網膜芽細胞および小脳顆粒状ニューロンへの結合。PEDF受容体の証拠、J. Biol. Chem.、274、31605〜12(1999年)(Alberdi, E. , Aymerich, M. S. & Becerra, S. P. Binding of pigment epithelium- derived factor (PEDF) to retinoblastoma cells and cerebellar granule neurons. Evidencefor for a PEDF receptor. J. Biol Chem 274,31605-12 (1999))
25. Bilak,M.M.ら、色素上皮由来因子の神経保護分子領域の同定および運動ニューロン上のその結合部位、J. Neurosci. 22、9378〜86(2002年)(Bilak, M. M. et al. Identification of the neuroprotective molecular region of pigment epithelium-derived factor and its binding sites on motor neurons. J Neurosci 22,9378-86 (2002))
26. Cao,W.ら、色素上皮由来因子は、培養した網膜ニューロンを過酸化水素が誘導する細胞死から保護する、J. Neurosci. Res. 57、789〜800(1999年)(Cao, W. et al. Pigment epithelium-derived factor protects cultured retinal neurons against hydrogen peroxide-induced cell death. J Neurosci Res 57, 789-800 (1999))
27. Taniwaki,T.,Becerra,S.P.,Chader,G. J.およびSchwartz,J.P.、色素上皮由来因子は、培養中の小脳顆粒状細胞が生存するための因子である、J. Neurochem. 64、2509〜17(1995年) (Taniwaki, T., Becerra, S. P. , Chader, G. J. & Schwartz, J. P. Pigment epithelium-derived factor is a survival factor for cerebellar granule cells in culture. J Neurochem 64,2509-17 (1995)
28. Derevjanik,N.L.ら、マウスにおける血液−網膜バリアの整合性の定性的評価、Invest. Ophthalmol. Vis. Sci. 43、2462〜7(2002年)(Derevjanik, N. L. et al. Quantitative assessment of the integrity of the blood- retinal barrier in mice. Invest Ophthalmol Vis Sci 43,2462-7 (2002))
29. Gettins,P.G.、セルピンの構造、機序、および機能、Chen. Rev.102、4751〜4804(2002年) (Gettins, P. G. Serpin structure, mechanism, and function. Chem Rev 102, 4751-804 (2002))
30. Becerra,S.P.、PEDFに関する構造−機能の研究。神経栄養活性を有する非阻害性セルピン、Adv.Exp.Med.Biol.、425、223〜37(1997年)(Becerra, S. P. Structure-function studies on PEDF. A noninhibitory serpin with neurotrophic activity. Adv Exp Med Biol 425, 223-37 (1997))
31. Simonovic, M., Gettins, P. G.およびVolz,K.、強力な抗血管新生因子および神経突起成長誘導因子である、ヒトPEDFの結晶構造、Proc. Natl. Acad. Sci. USA 98、11131〜5(2001年)(Simonovic, M. , Gettins, P. G. & Volz, K. Crystal structure of human PEDF, a potent anti-angiogenic and neurite growth-promoting factor. Proc Natl Acad Sci USA 98,11131-5 (2001))
32. Xu, Q. Qaum, T. およびAdamis, A. P.、エバンスブルーを用いる血液−網膜バリアの破壊の高感度定量、Invest. Ophthalmol. Vis. Sci.、42、789〜94(2001年)(Xu, Q. , Qaum, T. & Adamis, A. P. Sensitive blood-retinal barrier breakdown quantitation using Evans blue. Invest Ophthalmol Vis Sci 42,789-94 (2001))
33. Conn,G.ら、ラットグリオーマ由来細胞系からの糖タンパク質血管内皮細胞分裂促進因子の精製、Proc.Natl.Acad.Sci.USA、87、1323〜7(1990年)(Conn, G. et al. Purification of a glycoprotein vascular endothelial cell mitogen from a rat glioma-derived cell line. Proc Natl Acad Sci USA 87,1323-7 (1990))
34. Gospodarowicz,D.,Abraham,J.A.およびSchilling,J.、下垂体由来小胞星状細胞によって産生された血管内皮細胞分裂促進因子の単離と特徴付け、Proc.Natl.Acad.Sci.USA、86、7311〜7315(1989年)(Gospodaroqicz, D. , Abraham, J. A. & Schilling, J. Isolation and characterization of a vascular endothelial cell mitogen produced by pituitary-derived folliculo stellate cells. Proc Natl Acad Sci USA 86, 7311-5 (1989))
35. Leung,D.W.,Cachianes,G.,Kuang,W.J.,Goeddel, D. V.およびFerrara, N.、血管内皮増殖因子は分泌された血管新生分裂促進因子である、Science、246、1306〜9(1989年)(Leung, D. W. , Cachianes, G. , Kuang, W. J. , Goeddel, D. V. & Ferrara, N. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science 246,1306-9 (1989))
36. Gettins,P.G.,Simonovic,M.およびVolz, K. 強力な抗血管新生特性および神経突起成長促進特性を有するセルピンである、色素上皮由来因子(PEDF)、Biol. Chem. 、383、1677〜1682(2002年)(Gettins, P. G. , Simonovic, M. & Volz, K. Pigment epithelium-derived factor (PEDF), a serpin with potent anti-angiogenic and neurite outgrowth-promoting properties. Biol Chem 383, 1677-82 (2002))
37. Clermomt,A.C.,Cahill,M.T.,Bursell,S.E.,Bouck,N.およびAiello,L.P.、色素上皮由来因子(PEDF)は、内皮細胞増殖因子(VEGF)が誘導する網膜透過性および血流をインビボで阻害する、Invest. Ophthalmol.Vis.Sci.、42、S92(2001年)(Clermont, A. C. , Cahill, M. T. , Bursell, S. E. , Bouck, N. & Aiello, L. P. Pigment epithelium-derived factor (PEDF) inhibits vascular endothelial growth factor (VEGF) -induced retinal permeability and blood flow in vivo. Invest Ophthalmol Vis Sci 42, S92 (2001))
38. Aiello,L.P.およびWong,J.S.、色素上皮由来因子の糖尿病性血管の合併症における役割り、Kidney Int.Suppl.77、S113〜119(2000年)(Aiello, L. P. & Wong, J. S. Role of vascular endothelial growth factor in diabetic vascular complications. Kidney Int Suppl 77, S113-9 (2000))
39. Meyer,C.,Notari,L.およびBecerra,S.P.、色素上皮由来因子上のタイプIコラーゲン結合部位のマッピング。その抗血管新生活性の意味、J. Biol. Chem. (2002年)(Meyer, C. , Notari, L. & Becerra, S. P. Mapping the type I collagen binding site on pigment epithelium-derived factor. Implications for its antiangiogenic activity. J Biol Chem (2002))
40. Roberts,D.L.,Weix,D.J.,Dahms,N.M.およびKim, J. J. 、リソソーム酵素認識の分子的基礎:カチオン依存性マンノース6−ホスフェート受容体の三次元構造、Cell 93、639〜48(1998年)(Roberts, D. L. , Weix, D. J. , Dahms, N. M. & Kim, J. J. Molecular basis of lysosomal enzyme recognition: three-dimensional structure of the cation- dependent mannose 6-phosphate receptor. Cell 93, 639-48 (1998))
41. Tong,P.Y.,Gregory,W.およびKornfeld,S.、カチオン依存性マンノース6−ホスフェート受容体のリガンドとの相互作用:マンノース6−ホスフェート結合のストイキオメトリー、J.Biol.Chem.、264、7962〜9(1989年)(Tong, P. Y. , Gregory, W. & S. Ligand interactions of the cation- independent mannose 6-phosphate receptor. The stoichiometry of mannose 6- phosphate binding. J Biol Chem 264,7962-9 (1989))
42. Tong,P.Y.およびKornfeld,S.、カチオン依存性マンノース6−ホスフェート受容体のリガンドとの相互作用:カチオン独立性マンノース6−ホスフェート受容体との比較、J.Biol.Chem.、264、7970〜7975(1989年)(Tong, P. Y. S. Ligand interactions of the cation-dependent mannose 6-phosphate receptor. Comparison with the cation-independent mannose 6-phosphate receptor. J Biol Chem 264,7970-5 (1989))
43. Stratikos E.,Alberdi,E.,Gettins,P.G.およびBecerra,S.P.、組換えヒト色素上皮由来因子(PEDF):真核細胞で過剰発現され、分泌されたPEDFの特徴付け、Protein Sci. 、5、2575〜82(1996年)(Stratikos, E. , Alberdi, E. , Gettins, P. G. & Becerra, S. P. Recombinant human pigment epithelium-derived factor (PEDF): characterization of PEDF overexpressed and secreted by eukaryotic cells. Protein Sci 5,2575-82 (1996))
44. Qaum,T.ら、初期の糖尿病における、VEGF誘導血液−網膜バリアの破壊、Invest.Ophthalmol.Vis.Sci.、42、2408〜13(2001年)(Qaum, T. et al. VEGF-initiated blood-retinal barrier breakdown in early diabetes. Invest Ophthalmol Vis Sci 42,2408-13 (2001))
45. Gardner, T. W.、ヒスタミン、ZO−1および糖尿病性網膜症における血液−網膜バリアの透過性の亢進、Trans.Am.Ophthalmol.Soc.、93、583〜621(1995年)(Gardner, T. W. Histamine, ZO-1 and increased blood-retinal barrier permeability in diabetic retinopathy. Trans Am Ophthalmol Soc 93,583-621 (1995))
Claims (56)
- 治療有効量のPEDFを患者に投与することを含む、血管透過性の亢進が関与する疾患に罹患している患者を治療する方法。
- PEDFが配列番号1で表されるアミノ酸配列を有する、請求項1に記載の方法。
- 疾患が敗血症である、請求項1に記載の方法。
- 疾患が急性呼吸窮迫症候群である、請求項1に記載の方法。
- 疾患がネフローゼ症候群である、請求項1に記載の方法。
- 疾患が糖尿病性腎症である、請求項1に記載の方法。
- 疾患が増殖性の糖尿病性網膜症である、請求項1に記載の方法。
- 治療有効量のPEDF 44 AAペプチドを患者に投与することを含む、血管透過性の亢進が関与する疾患に罹患している患者を治療する方法。
- PEDF 44 AAペプチドが配列番号2で表されるアミノ酸配列を有する、請求項8に記載の方法。
- 疾患が敗血症である、請求項8に記載の方法。
- 疾患が急性呼吸窮迫症候群である、請求項8に記載の方法。
- 疾患がネフローゼ症候群である、請求項8に記載の方法。
- 疾患が糖尿病性腎症である、請求項8に記載の方法。
- 疾患が増殖性の糖尿病性網膜症である、請求項8に記載の方法。
- アミノ酸残基の101番目のグルタミン酸、103番目のイソロイシン、112番目のロイシン及び115番目のセリンが置換されていない、治療有効量のPEDF 44 AAペプチドの相同体を患者に投与することを含む、血管透過性の亢進が関与する疾患に罹患している患者を治療する方法。
- 相同体が、配列番号3で表されるアミノ酸配列を有するPEDF 44 AAペプチドと相同な配列を有するものである、請求項15に記載の方法。
- 疾患が敗血症である、請求項15に記載の方法。
- 疾患が急性呼吸窮迫症候群である、請求項15に記載の方法。
- 疾患がネフローゼ症候群である、請求項15に記載の方法。
- 疾患が糖尿病性腎症である、請求項15に記載の方法。
- 疾患が増殖性の糖尿病性網膜症である、請求項15に記載の方法。
- PEDF受容体を活性化する薬剤の治療有効量を患者に投与することを含む、血管透過性の亢進が関与する疾患に罹患している患者を治療する方法。
- 薬剤が小分子である、請求項23に記載の方法。
- 疾患が敗血症である、請求項23に記載の方法。
- 疾患が急性呼吸窮迫症候群である、請求項23に記載の方法。
- 疾患がネフローゼ症候群である、請求項23に記載の方法。
- 疾患が糖尿病性腎症である、請求項23に記載の方法。
- 疾患が増殖性の糖尿病性網膜症である、請求項23に記載の方法。
- 外因性PEDFが組織内の血管透過性を低減させるのに十分な条件下で、当該外因性PEDFを組織の内皮細胞に投与することを含む、組織内の血管透過性を低減させる方法。
- 外因性PEDF 44 AAペプチドが組織内の血管透過性を低減させるのに十分な条件下で、当該外因性PEDF 44 AAペプチドを組織の内皮細胞に投与することを含む、組織内の血管透過性を低減させる方法。
- 外因性PEDF 44 AAペプチドの相同体が組織内の血管透過性を低減させるのに十分な条件下で、当該外因性PEDF 44 AAペプチドの相同体を組織の内皮細胞に投与することを含む、組織内の血管透過性を低減させる方法。
- 相同体の、アミノ酸残基の101番目のグルタミン酸、103番目のイソロイシン、112番目のロイシン及び115番目のセリンが置換されていない、請求項32に記載の方法。
- 組織が眼組織である、請求項30〜33に記載の方法。
- 組織が肺組織である、請求項30〜33に記載の方法。
- 組織が腎臓組織である、請求項30〜33に記載の方法。
- 治療有効量のPEDF 44 AAペプチドを患者に投与することを含む、血管新生の亢進が関与する疾患に罹患している患者を治療する方法。
- PEDF 44 AAペプチドが配列番号2で表されるアミノ酸配列を有する、請求項37に記載の方法。
- 疾患が癌である、請求項37に記載の方法。
- 疾患が増殖性の糖尿病性網膜症である、請求項37に記載の方法。
- アミノ酸残基の101番目のグルタミン酸、103番目のイソロイシン、112番目のロイシン及び115番目のセリンが置換されていない、治療有効量のPEDF 44 AAペプチドの相同体を患者に投与することを含む、血管新生の亢進が関与する疾患に罹患している患者を治療する方法。
- 相同体が、PEDF 44 AAペプチドと相同な配列である配列番号3で表されるアミノ酸配列を有する、請求項15に記載の方法。
- 疾患が癌である、請求項15に記載の方法。
- 疾患が増殖性の糖尿病性網膜症である、請求項15に記載の方法。
- PEDF受容体を活性化する薬剤の治療有効量を患者に投与することを含む、血管新生の亢進が関与する疾患に罹患している患者を治療する方法。
- 薬剤が小分子である、請求項23に記載の方法。
- 疾患が癌である、請求項23に記載の方法。
- 疾患が増殖性の糖尿病性網膜症である、請求項23に記載の方法。
- 外因性PEDF 44 AAペプチドが組織内の血管透過性を低減させるのに十分な条件下で、当該外因性PEDF 44 AAペプチドを組織の内皮細胞に投与することを含む、組織内の血管新生を低減させる方法。
- 外因性PEDF 44 AAペプチドの相同体が組織内の血管透過性を低減させるのに十分な条件下で、当該外因性PEDF 44 AAペプチドの相同体を組織の内皮細胞に投与することを含む、組織内の血管新生を低減させる方法。
- 相同体の、アミノ酸残基の101番目のグルタミン酸、103番目のイソロイシン、112番目のロイシン及び115番目のセリンが置換されていない、請求項50に記載の方法。
- 組織が眼組織である、請求項49〜51に記載の方法。
- 組織が癌性組織である、請求項49〜51に記載の方法。
- 治療有効量のPEDF 44 AAペプチドを患者に投与することを含む、神経障害が関与する疾患に罹患している患者を治療する方法。
- PEDF 44 AAペプチドが配列番号2で表されるアミノ酸配列を有する、請求項8に記載の方法。
- 疾患が神経変性疾患である、請求項54に記載の方法。
- 疾患が虚血誘発性のものである、請求項54に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US51537403P | 2003-10-29 | 2003-10-29 | |
| PCT/US2004/036245 WO2005041887A2 (en) | 2003-10-29 | 2004-10-29 | Pigment epithelium-derived factor, novel biological activity and methods of use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007509984A true JP2007509984A (ja) | 2007-04-19 |
| JP2007509984A5 JP2007509984A5 (ja) | 2007-12-13 |
Family
ID=34549400
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006538385A Pending JP2007509984A (ja) | 2003-10-29 | 2004-10-29 | 色素上皮由来因子、その新規な生物活性及びその使用方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20080293626A1 (ja) |
| EP (1) | EP1684692A2 (ja) |
| JP (1) | JP2007509984A (ja) |
| CN (1) | CN101014358A (ja) |
| AU (1) | AU2004285562B2 (ja) |
| WO (1) | WO2005041887A2 (ja) |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009116529A1 (ja) | 2008-03-18 | 2009-09-24 | 国立大学法人 北海道大学 | ポリペプチドおよび当該ポリペプチドを含む医薬組成物 |
| JP2013507373A (ja) * | 2009-10-08 | 2013-03-04 | ニューロテック ユーエスエー, インコーポレイテッド | 被包された細胞ベースの送達系におけるpedfの使用 |
| JP2015529669A (ja) * | 2012-09-17 | 2015-10-08 | マクカイ メモリアル ホスピタル | 脱毛症及び/又は毛髪色素脱失を治療するためのpedf由来のポリペプチドの使用 |
| JP2015530392A (ja) * | 2012-09-20 | 2015-10-15 | マクカイ メモリアル ホスピタル | 変形性関節症を治療するためのpedf−由来のポリペプチドの使用 |
| JP2015530391A (ja) * | 2012-09-19 | 2015-10-15 | マクカイ メモリアル ホスピタル | 皮膚老化を予防及び/又は改善するためのpedf−由来ポリペプチドの使用 |
| JP2017511128A (ja) * | 2014-03-26 | 2017-04-20 | トカジェン インコーポレーテッド | 免疫刺激活性を有するレトロウイルスベクター |
| JP2017222676A (ja) * | 2017-07-05 | 2017-12-21 | マクカイ メモリアル ホスピタル | 皮膚老化を予防及び/又は改善するためのpedf−由来ポリペプチドの使用 |
| JP2018021044A (ja) * | 2017-08-10 | 2018-02-08 | マクカイ メモリアル ホスピタル | 脱毛症及び/又は毛髪色素脱失を治療するためのpedf由来のポリペプチドの使用 |
| JP2018508528A (ja) * | 2015-03-02 | 2018-03-29 | ザ ボード オブ トラスティーズ オブ ザ ユニバーシティ オブ イリノイ | 血管新生阻害ペプチド |
| JP2019533722A (ja) * | 2016-10-07 | 2019-11-21 | ブリム バイオテクノロジー インクBrim Biotechnology, Inc. | Pedf由来短ペプチドを含む組成物およびその使用 |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2004324918B2 (en) | 2004-11-16 | 2011-10-06 | Yeda Research And Development Co.Ltd. At The Weizmann Institute Of Science | Variants of pigment epithelium derived factor and uses thereof |
| WO2006091459A2 (en) * | 2005-02-24 | 2006-08-31 | Joslin Diabetes Center, Inc. | Compositions and methods for treating vascular permeability |
| AU2006313318B2 (en) | 2005-11-14 | 2012-04-05 | Yeda Research And Development Co. Ltd. At The Weizmann Institute Of Science | Improved variants of pigment epithelium derived factor and uses thereof |
| US20090069241A1 (en) * | 2006-02-15 | 2009-03-12 | Yale University | Compositions and Methods for Use of Pigment Epithelial Derived Factor (PEDF) Peptide Fragments |
| ES2329636B2 (es) * | 2006-02-17 | 2010-07-26 | Universitat De Valencia, Estudi General (Participa Con El 70%) | Uso del factor pedf para inducir la auto-renovacion de celulas madre. |
| WO2008091692A2 (en) * | 2007-01-25 | 2008-07-31 | Joslin Diabetes Center, Inc. | Methods of diagnosing, treating, and preventing increased vascular permeability |
| EP2508196B1 (en) * | 2011-03-23 | 2018-09-26 | Mackay Memorial Hospital | Use of PEDF-derived polypeptides for promoting stem cells proliferation and wound healing |
| US20130046283A1 (en) * | 2011-05-05 | 2013-02-21 | Medtronic Vascular, Inc. | Methods and intravascular treatment devices for treatment of atherosclerosis |
| TWI554521B (zh) * | 2011-10-19 | 2016-10-21 | 台灣基督長老教會馬偕醫療財團法人馬偕紀念醫院 | 色素上皮衍生因子衍生之多胜肽於治療禿髮和/或毛髮脫色之用途 |
| CN102757497B (zh) * | 2012-07-16 | 2014-09-17 | 中山大学 | 一种抗pedf单克隆抗体及其制备方法和应用 |
| TWI449532B (zh) * | 2012-09-19 | 2014-08-21 | Mackay Memorial Hospital | 色素上皮衍生因子衍生之多胜肽於預防和/或緩和皮膚老化之用途 |
| TWI491407B (zh) * | 2012-09-20 | 2015-07-11 | Mackay Memorial Hospital | 色素上皮衍生因子衍生之多胜肽於治療骨性關節炎之用途 |
| WO2015038891A2 (en) | 2013-09-13 | 2015-03-19 | The Penn State Research Foundation | Functional peptide analogs of pedf |
| EA202092366A1 (ru) * | 2018-04-08 | 2021-01-26 | Брим Байотекнолоджи, Инк. | Применение происходящих из pedf коротких пептидов при лечении остеоартрита |
| CN111760019B (zh) * | 2019-08-16 | 2023-09-05 | 董红燕 | Pedf在制备保护慢性肺损伤药物中的应用 |
| CN112390877B (zh) * | 2019-08-16 | 2022-10-04 | 董红燕 | Pedf衍生多肽组合物及其在制备保护肺损伤药物中的应用 |
| AU2020366245A1 (en) * | 2019-10-06 | 2022-04-28 | Brim Biotechnology, Inc. | Compositions comprising PEDF-derived short peptides (PDSP) and uses thereof |
| CN114057831B (zh) * | 2020-08-07 | 2024-03-12 | 三凡生技研发股份有限公司 | 促进血管增生的短链胜肽及其促进糖尿病伤口愈合的用途 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001062725A2 (en) * | 2000-02-23 | 2001-08-30 | Northwestern University | Methods and compositions for inhibiting angiogenesis |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20010021382A1 (en) * | 1991-03-29 | 2001-09-13 | Genentech, Inc. | Vascular endothelial cell growth factor antagonists |
| US6451763B1 (en) * | 1992-06-04 | 2002-09-17 | The United States Of America As Represented By The Department Of Health And Human Services | Retinal pigmented epithelium derived neurotrophic factor and methods of use |
| US7105496B2 (en) * | 1998-07-23 | 2006-09-12 | Northwestern University | Methods and compositions for inhibiting angiogenesis |
| US6821775B1 (en) * | 2000-02-11 | 2004-11-23 | Genvec, Inc. | Viral vector encoding pigment epithelium-derived factor |
| WO2001075454A2 (en) * | 2000-04-03 | 2001-10-11 | Oxford Glycosciences (Uk) Ltd. | Diagnosis and treatment of alzheimer's disease |
| IL147444A0 (en) * | 2002-01-03 | 2002-08-14 | Yeda Res & Dev | Process for the production of pigment epithelium derived factor (pedf) from human blood and uses thereof |
| US20030158112A1 (en) * | 2002-02-15 | 2003-08-21 | Johns Hopkins University School Of Medicine | Selective induction of apoptosis to treat ocular disease |
| WO2004028559A1 (en) * | 2002-09-26 | 2004-04-08 | The Board Of Trustees Of The University Of Illinois | Anti-angiogenic fragments of pigment epithelium-derived factor (pedf) |
| CA2507036A1 (en) * | 2002-12-02 | 2004-06-17 | Genvec, Inc. | Materials and methods for treating ocular-related disorders |
| WO2005089811A1 (en) * | 2004-03-12 | 2005-09-29 | Genvec, Inc. | Materials for treating vascular leakage in the eye |
-
2004
- 2004-10-29 CN CNA200480039358XA patent/CN101014358A/zh active Pending
- 2004-10-29 JP JP2006538385A patent/JP2007509984A/ja active Pending
- 2004-10-29 AU AU2004285562A patent/AU2004285562B2/en not_active Ceased
- 2004-10-29 EP EP04810174A patent/EP1684692A2/en not_active Withdrawn
- 2004-10-29 WO PCT/US2004/036245 patent/WO2005041887A2/en active Application Filing
-
2006
- 2006-04-26 US US11/413,118 patent/US20080293626A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001062725A2 (en) * | 2000-02-23 | 2001-08-30 | Northwestern University | Methods and compositions for inhibiting angiogenesis |
Non-Patent Citations (3)
| Title |
|---|
| JPN6010069916; SALTI,H.I. et al: 'Diabetes-Induced Retinal Vascular Permeability is Reversed by Intravitreal Injection of Pigment Epit' ARVO Annual Meeting Abstract Vol.43, 2002, Abstract No.3864 * |
| JPN6010069918; MA,J. et al: 'TREATMENT OF RETINAL EDEMA USING PEPTIDE ANGIOGENIC INHIBITORS' ARVO Annual Meeting Abstract Vol.44, 200305, Abstract No.4029 * |
| JPN6012002310; BILAK,M.M. et al: 'Identification of the neuroprotective molecular region of pigment epithelium-derived factor and its' J Neurosci Vol.22, No.21, 2002, p.9378-86 * |
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009116529A1 (ja) | 2008-03-18 | 2009-09-24 | 国立大学法人 北海道大学 | ポリペプチドおよび当該ポリペプチドを含む医薬組成物 |
| JP2013507373A (ja) * | 2009-10-08 | 2013-03-04 | ニューロテック ユーエスエー, インコーポレイテッド | 被包された細胞ベースの送達系におけるpedfの使用 |
| JP2015529669A (ja) * | 2012-09-17 | 2015-10-08 | マクカイ メモリアル ホスピタル | 脱毛症及び/又は毛髪色素脱失を治療するためのpedf由来のポリペプチドの使用 |
| US9938328B2 (en) | 2012-09-17 | 2018-04-10 | Mackay Memorial Hospital | Use of PEDF-derived polypeptides for treating alopecia and/or hair depigmentation |
| JP2015530391A (ja) * | 2012-09-19 | 2015-10-15 | マクカイ メモリアル ホスピタル | 皮膚老化を予防及び/又は改善するためのpedf−由来ポリペプチドの使用 |
| US9815878B2 (en) | 2012-09-19 | 2017-11-14 | Mackay Memorial Hospital | Use of PEDF-derived polypeptides for preventing and/or ameliorating skin aging |
| US9777048B2 (en) | 2012-09-20 | 2017-10-03 | Mackay Memorial Hospital | Use of PEDF-derived polypeptides for treating osteoarthritis |
| JP2015530392A (ja) * | 2012-09-20 | 2015-10-15 | マクカイ メモリアル ホスピタル | 変形性関節症を治療するためのpedf−由来のポリペプチドの使用 |
| JP2017511128A (ja) * | 2014-03-26 | 2017-04-20 | トカジェン インコーポレーテッド | 免疫刺激活性を有するレトロウイルスベクター |
| JP2018508528A (ja) * | 2015-03-02 | 2018-03-29 | ザ ボード オブ トラスティーズ オブ ザ ユニバーシティ オブ イリノイ | 血管新生阻害ペプチド |
| JP2019533722A (ja) * | 2016-10-07 | 2019-11-21 | ブリム バイオテクノロジー インクBrim Biotechnology, Inc. | Pedf由来短ペプチドを含む組成物およびその使用 |
| JP2017222676A (ja) * | 2017-07-05 | 2017-12-21 | マクカイ メモリアル ホスピタル | 皮膚老化を予防及び/又は改善するためのpedf−由来ポリペプチドの使用 |
| JP2018021044A (ja) * | 2017-08-10 | 2018-02-08 | マクカイ メモリアル ホスピタル | 脱毛症及び/又は毛髪色素脱失を治療するためのpedf由来のポリペプチドの使用 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1684692A2 (en) | 2006-08-02 |
| AU2004285562A1 (en) | 2005-05-12 |
| US20080293626A1 (en) | 2008-11-27 |
| AU2004285562B2 (en) | 2011-06-09 |
| WO2005041887A3 (en) | 2005-11-24 |
| WO2005041887A2 (en) | 2005-05-12 |
| CN101014358A (zh) | 2007-08-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2007509984A (ja) | 色素上皮由来因子、その新規な生物活性及びその使用方法 | |
| Duh et al. | Pigment epithelium-derived factor suppresses ischemia-induced retinal neovascularization and VEGF-induced migration and growth | |
| CA2298018C (en) | Methods and compositions for inhibiting angiogenesis | |
| JPH09510093A (ja) | 血管内皮細胞増殖因子2 | |
| JP2009153517A (ja) | 色素上皮誘導因子:pedf遺伝子の特性評価、ゲノム構成および配列 | |
| JP2002505873A (ja) | 血管内皮増殖因子2 | |
| US7723313B2 (en) | Methods and compositions for inhibiting angiogenesis | |
| JP2004505619A (ja) | 血管内皮増殖因子2 | |
| US8530416B2 (en) | Variants of pigment epithelium derived factor and uses thereof | |
| US6919309B2 (en) | Methods and compositions for inhibiting angiogenesis | |
| JP2002507546A (ja) | 角質細胞増殖因子−2の治療的使用 | |
| US20030064917A1 (en) | Methods and compositions for inhibiting angiogenesis | |
| EP1265627B1 (en) | Pharmaceutical compositions for inhibiting angiogenesis by pedf fragments | |
| US7105481B2 (en) | Method for stimulating connective tissue growth or wound healing | |
| US20020077289A1 (en) | Angiostatin and endostatin binding proteins and methods of use | |
| US20040110131A1 (en) | Thrombospondin-1 type 1 repeat polypeptides | |
| CA2410699C (en) | Methods and compositions for inhibiting angiogenesis | |
| CA2477867A1 (en) | Peptides, dna's, rna's, and compounds for inhibiting or inducing adrenomedullin activity, and use of the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20071026 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20071026 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101214 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110307 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110314 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110614 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120124 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120411 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120418 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20121023 |