JP2006527741A - 細胞遊走の阻害剤 - Google Patents
細胞遊走の阻害剤 Download PDFInfo
- Publication number
- JP2006527741A JP2006527741A JP2006516231A JP2006516231A JP2006527741A JP 2006527741 A JP2006527741 A JP 2006527741A JP 2006516231 A JP2006516231 A JP 2006516231A JP 2006516231 A JP2006516231 A JP 2006516231A JP 2006527741 A JP2006527741 A JP 2006527741A
- Authority
- JP
- Japan
- Prior art keywords
- prommp
- cells
- integrin
- mmp
- peptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6489—Metalloendopeptidases (3.4.24)
- C12N9/6491—Matrix metalloproteases [MMP's], e.g. interstitial collagenase (3.4.24.7); Stromelysins (3.4.24.17; 3.2.1.22); Matrilysin (3.4.24.23)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/07—Tetrapeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70546—Integrin superfamily
- C07K14/70553—Integrin beta2-subunit-containing molecules, e.g. CD11, CD18
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Molecular Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Biomedical Technology (AREA)
- Toxicology (AREA)
- Immunology (AREA)
- Wood Science & Technology (AREA)
- Rheumatology (AREA)
- General Engineering & Computer Science (AREA)
- Cell Biology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Pain & Pain Management (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Epidemiology (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Enzymes And Modification Thereof (AREA)
Abstract
本発明は、αMインテグリンのIドメインに結合することによりαMインテグリンとproMMP−9との間の複合体形成を阻害し、好中球遊走を阻止することが見出されたペプチド化合物に関する。上記ペプチド化合物は、ヘキサペプチド配列HFDDDEを含む。上記ペプチド化合物は、炎症性病態の予防及び治療において有用である。
Description
本発明は、αMインテグリンのIドメインに結合することによりαMインテグリンとproMMP−9との複合体形成を阻害し、こうして好中球遊走を阻止するペプチド化合物に関する。上記ペプチド化合物は、炎症性病態の治療において有用である。
多形核好中球(PMN)は血液白血球の大部分を占め、侵入微生物に対する食作用と殺菌作用により急性炎症に中心的に関与する。好中球は、アズール親和性顆粒、特殊顆粒、ゼラチナーゼ顆粒、分泌小胞という4つの顆粒コンパートメントを含み、アズール親和性顆粒はミエロペルオキシダーゼ(MPO)を、特殊顆粒はラクトフェリン(LF)を、ゼラチナーゼ顆粒はゼラチナーゼを、分泌小胞は潜在性アルカリホスファターゼを、それぞれ、高濃度に含有することが特徴である。エラスターゼ(参考文献1)、コラゲナーゼ(参考文献2)、MMP−9などのタンパク質分解酵素はこれらの顆粒中に局在しており、タンパク質分解酵素は、白血球が骨髄を抜け出して体循環に進入し、炎症部位に集合するために重要な役割を果たす(参考文献3)。
MMP−9は組織再構成(tissue remodeling)、組織修復及び創傷治癒に関与し、慢性関節リウマチ(参考文献4)や多発性硬化症(参考文献5)などの炎症性疾患のマーカーである。PMN(多形核好中球)は骨髄での成熟の最終段階にMMP−9を産生し、MMP−9は潜在的形態(proMMP−9)としてゼラチナーゼ顆粒に貯蔵される。細胞が刺激を受けると、細胞内顆粒が急速に移動し、原形質膜と融合する。プロテインキナーゼC経路のような特定のシグナル伝達カスケードを開始させる細胞外刺激に応答して、酵素前駆体proMMP−9が誘導・分泌される(参考文献6、7)。MMP−9はまた、ヒト白血球を補体C5aアナフィラトキシン(参考文献8)や腫瘍壊死因子−α(TNF−α)(参考文献9)などの可溶性アゴニストで処理したときにも放出される。細胞外基質への細胞接着もまたproMMP−9やその他のMMP類を分泌させることが知られる刺激である(参考文献10、11)。MMP−9の選択的な発現は、PMNにおけるαMβ2インテグリンのリガンドとの結合(参考文献10)やTリンパ腫細胞におけるαLβ2インテグリンのリガンドとの結合の結果として誘導される(参考文献12)。
その結果、下記の3つの異なる形態のproMMP−9が細胞外空間に放出されることがザイモグラフィーで検出される: 92kDaのモノマー、200kDaのホモダイマー、及び好中球ゼラチナーゼ関連リポカリン(NGAL)(輸送タンパク質のリポカリンファミリー中の25kDaのもの)にMMP−9が結合した120kDaの複合体。proMMP−9の活性化は、プロティナーゼにより細胞外から行なうことができ、また、水銀化合物または反応性酸素種を用いて化学的に行なうこともできる(参考文献13、14)。活性化されると、分泌されたMMP−9は、細胞外空間に存在する組織性メタロプロテアーゼインヒビター(TIMP)とα2−マクログロブリンにより阻害され得る。しかし、TIMPは好中球表面のMMP−9は弱く阻害するだけである(参考文献15)。従って、細胞表面への局在化は、MMP活性調節の次の段階を構成する。
最近、本発明者らは、白血病細胞をホルボールエステルで活性化すると、proMMP−2ゼラチナーゼとproMMP−9ゼラチナーゼが白血病細胞表面にαLβ2インテグリンやαMβ2インテグリンとの複合体として現れることを示した(参考文献16、FI20030923)。β2インテグリン類(CD11/CD18)は大半の白血球機能に重要な役割をもつ(参考文献17、18)。以下の4種類のインテグリンが知られている: 白血球に多いαLβ2型、顆粒球に多いαMβ2型、そして単核白血球とマクロファージに多いαXβ2型とαDβ2型。これらインテグリンの細胞性リガンドは、免疫グロブリンスーパーファミリーに属する細胞間接着分子(ICAMs)−1〜5である。白血球インテグリンが完全な機能を発揮するためには活性化されることが必要である(参考文献17)。Tリンパ球は最も詳細に研究されており、活性化はT細胞受容体を介して起こる(参考文献17、19)のであり、プロテインキナーゼCが関与する可能性がある(参考文献20)。顆粒球では、αMβ2インテグリンは細胞内の特殊顆粒に存在することが知られており、活性化により細胞表面に移動する(参考文献21)。移動のメカニズムや、関与する細胞成分はよく分かっていない。
本発明者らは、MMP触媒ドメインに存在すると考えられるproMMP−9の主要なインテグリン認識配列のマッピングを行なった(参考文献16)。この配列はインテグリンαMのIドメインにバイオパニングで見出されたファージディスプレイペプチドにより模倣されたものであり、最も活性の高いペプチドはADGACILWMDDGWCGAAG(DDGW)であった。本願では、本発明者らは、PMNでのproMMP−9/αMβ2複合体の発生とPMN遊走における役割について研究した。本発明者らは、proMMP−9とαMβ2との複合体が細胞のゼラチナーゼ顆粒中ですでに形成されており、また、細胞活性化にともなうゼラチナーゼ顆粒の放出とともに上記複合体が細胞表面に移動することを見出した。さらに、MMP−9の触媒ドメインに由来するわずか6アミノ酸の長さのペプチドでも、proMMP−9のβ2インテグリンへの結合と競合することができた。ヘキサペプチドとDDGWのいずれもが、in vitroとin vivoの両方でPMNの遊走を弱めたが、これは、MMP−インテグリン複合体がPMNの運動性に関与することを示唆する。
発明の概要
組換えMMP−9ドメインでの実験により、インテグリンと相互作用する部位がMMP−9の触媒ドメイン上に存在するという本発明者らの知見がさらに裏付けられた。本発明者らは、わずか6残基の長さの、活性なIドメイン結合性ペプチドを開発した。このペプチドHFDDDEはMMP−9触媒ドメインの直鎖状配列に対応し、proMMP−9のαMβ2インテグリンへの結合またはproMMP−9の精製したαMβ2インテグリンIドメインへの結合と効率的に競合する。このペプチドのアミノ酸配列を乱すと活性を示さないので、負に帯電したアミノ酸の順序が活性に不可欠であることを示す。ファージディスプレイに由来するペプチドDDGWと同様に、HFDDDEは細胞結合型proMMP−9を脱離させ、in vitroとin vivoの両方で好中球の遊走を阻害した。これらの結果は、proMMP−9とαMβ2インテグリンとの複合体が好中球の運動性に重要であることを示唆するが、このペプチドがproMMP−9以外のβ2インテグリンリガンドにも影響する可能性は排除できない。しかし、DDGWとHFDDDEが、(休止した好中球ではなく)活性化好中球のトランスウェルでの遊走と内皮貫通遊走(transwell and transendothelial migration)を阻害したことは、これらのペプチドの作用の特異性を示すものである。CTT、抗MMP−9抗体及び抗インテグリン抗体を用いて、本発明者らは、上記ペプチドがproMMP−9とαMβ2インテグリンの両方を必要とする好中球遊走を阻害することを示した。同様に、THP−1細胞系列を用いて、本発明者らは、proMMP−9が、β2インテグリンが指揮する好中球遊走に少なくともin vitro条件下で関与することを知見した。
組換えMMP−9ドメインでの実験により、インテグリンと相互作用する部位がMMP−9の触媒ドメイン上に存在するという本発明者らの知見がさらに裏付けられた。本発明者らは、わずか6残基の長さの、活性なIドメイン結合性ペプチドを開発した。このペプチドHFDDDEはMMP−9触媒ドメインの直鎖状配列に対応し、proMMP−9のαMβ2インテグリンへの結合またはproMMP−9の精製したαMβ2インテグリンIドメインへの結合と効率的に競合する。このペプチドのアミノ酸配列を乱すと活性を示さないので、負に帯電したアミノ酸の順序が活性に不可欠であることを示す。ファージディスプレイに由来するペプチドDDGWと同様に、HFDDDEは細胞結合型proMMP−9を脱離させ、in vitroとin vivoの両方で好中球の遊走を阻害した。これらの結果は、proMMP−9とαMβ2インテグリンとの複合体が好中球の運動性に重要であることを示唆するが、このペプチドがproMMP−9以外のβ2インテグリンリガンドにも影響する可能性は排除できない。しかし、DDGWとHFDDDEが、(休止した好中球ではなく)活性化好中球のトランスウェルでの遊走と内皮貫通遊走(transwell and transendothelial migration)を阻害したことは、これらのペプチドの作用の特異性を示すものである。CTT、抗MMP−9抗体及び抗インテグリン抗体を用いて、本発明者らは、上記ペプチドがproMMP−9とαMβ2インテグリンの両方を必要とする好中球遊走を阻害することを示した。同様に、THP−1細胞系列を用いて、本発明者らは、proMMP−9が、β2インテグリンが指揮する好中球遊走に少なくともin vitro条件下で関与することを知見した。
発明の詳細な説明
本発明者らは最近、proマトリックスメタロプロティナーゼ、特にproMMP−9が、白血球β2インテグリンに対する強力なリガンドであることを示した。本願では、好中球の主要なMMPとインテグリンであるproMMP−9とαMβ2インテグリンを研究した。休止した好中球では、proMMP−9/αMβ2インテグリン複合体は細胞内顆粒中に検出されるが、細胞が活性化された後は、細胞表面に移動することが免疫沈降法と二重免疫蛍光法で示される。複合体形成のさらなる証拠としては、好中球及びαMβ2をトランスフェクトしたL細胞は、固定化したproMMP−9またはその組換え触媒ドメインに対する結合(即ち、β2インテグリン依存性の結合)を示したが、一方、野生型のL細胞と白血球接着不全症(LAD)細胞は、そのような結合を示さなかった、ということが挙げられる。αMインテグリンのIドメンインに結合してproMMP−9との複合体形成を阻害するペプチドは、in vitroの内皮貫通アッセイ(transendothelial assay)とin vivoのチオグリコレート誘発腹膜炎で好中球遊走を阻害した。これらの結果は、proMMP−9/αMβ2複合体の移動が、好中球遊走を導く細胞表面機構の一部であることを示唆する。
本発明者らは最近、proマトリックスメタロプロティナーゼ、特にproMMP−9が、白血球β2インテグリンに対する強力なリガンドであることを示した。本願では、好中球の主要なMMPとインテグリンであるproMMP−9とαMβ2インテグリンを研究した。休止した好中球では、proMMP−9/αMβ2インテグリン複合体は細胞内顆粒中に検出されるが、細胞が活性化された後は、細胞表面に移動することが免疫沈降法と二重免疫蛍光法で示される。複合体形成のさらなる証拠としては、好中球及びαMβ2をトランスフェクトしたL細胞は、固定化したproMMP−9またはその組換え触媒ドメインに対する結合(即ち、β2インテグリン依存性の結合)を示したが、一方、野生型のL細胞と白血球接着不全症(LAD)細胞は、そのような結合を示さなかった、ということが挙げられる。αMインテグリンのIドメンインに結合してproMMP−9との複合体形成を阻害するペプチドは、in vitroの内皮貫通アッセイ(transendothelial assay)とin vivoのチオグリコレート誘発腹膜炎で好中球遊走を阻害した。これらの結果は、proMMP−9/αMβ2複合体の移動が、好中球遊走を導く細胞表面機構の一部であることを示唆する。
この研究において本発明者らは、PMN(多形核好中球)は細胞内顆粒中にproMMP−9/αMβ2複合体を形成し、この複合体は、細胞がホルボールエステルまたは炎症性メディエイターにより活性化されたときに細胞表面に移動する、ということを示す証拠を提示する。proMMP−9はαMβ2インテグリンと同じ細胞内顆粒中に局在することは知られているが、proMMP−9とαMβ2インテグリンとが細胞内で会合することは従来知られていない。proMMP−9がαMインテグリンIドメインに直接結合できるということは、アクセサリー分子が介在する可能性は排除できないが、内在性proMMP−9とαMβ2インテグリンとの相互作用が直接的に行なわれることを示唆するものである。これまで、内在性好中球エラスターゼ、プロティナーゼ3とカテプシンGは全てαMβ2インテグリンに結合することが報告されている。従って、αMβ2インテグリンは一部のプロティナーゼに特異的なキャリア機能を有する可能性がある。本発明者らは、ICAM−1またはフィブリノーゲンはproMMP−9の結合と競合しないこと、及び、proMMP−9/αMβ2複合体に対するDDGWペプチド阻害剤はICAM−1、フィブリノーゲンまたはLLG−C4−GSTへの白血球の一次接着を阻害できないが、それでも細胞遊走を阻害する、ということを見出した。これらの結果は、αMβ2に結合したproMMP−9は白血球の一次接着には必須ではないが、細胞浸潤の他の段階に必須であり、おそらくインテグリンによる基質タンパク質への結合を解除する際に必須であるものと考えられる。
THP−1白血病細胞の代謝ラベルにより、本発明者らは[35S]−メチオニンパルス後2時間以内に、インテグリン鎖が最初に明確に視認できる状態になった時に、インテグリン抗体がproMMP−9と共沈することを示した。これらの結果は、proMMP−9とインテグリンの会合はインテグリンの形成後の早期に起こる現象であり、また、免疫沈降物はエンドサイトーシスまたはリサイクル中のインテグリンではないということを示す。このことは、活性化されていないPMNにおいてproMMP−9とαMβ2の大幅な細胞内共局在化を示す二重免疫蛍光法による研究結果と一致するものである。PMAにより誘発された脱顆粒に続き、染色の拡散が観察され、共局在化が細胞表面に移動した。また、細胞表面画分からの共沈が最も強く生じた。これらの結果は、あらかじめ形成されたproMMP−9/αMβ2複合体の細胞内プールから細胞表面への移動が活性化後にすばやく起きることを示している。この考え方のほうが、「分泌されたMMPが細胞表面のインテグリンに結合する」という考え方よりも、MMP/インテグリン複合体形成のメカニズムの説明として確度が高い。まず第一に、インテグリンは細胞内で結合したproMMP−9を、細胞外のMMP阻害剤やインテグリンリガンドから競合されることなく適切な場所に移動することができる。第二に、αMβ2のIドメインは活性化MMP−9には結合しないので、インテグリンは、proMMP−9活性化のタイミングと活性化触媒の放出を調節できる。
白血球β2インテグリンは白血球の移動性に関与する。αMまたはαLのノックアウトマウスによる研究も、炎症性刺激に応答してβ2インテグリンが白血球接着活性、遊走活性及び貪食活性を仲介することの重要性を示す。I型白血球接着不全症(LAD−1)の患者から採取した白血球は、proMMP−9を発現するのに、β2インテグリンサブユニットに欠陥があるので適切な遊走ができず、これは、proMMP−9のみでは細胞遊走能は付与されないことを示す。本発明者らは、LAD−1細胞は先導端(leading edge)にMMP−9の免疫反応性を発現するが、固定化したproMMP−9には接着しないことを見出した。野生型L細胞について非常に似た結果が得られており、野生型L細胞は固定化したproMMP−9には接着できないが、αMβ2をトランスフェクトすると、proMMP−9に接着できるようになる。PMNによる実験では、proMMP−9は、細胞内の「不活性」インテグリン及びPMA、C5aまたはTNFαなどの刺激で活性化された細胞外のインテグリンの両方と会合することが示される。LAD−1細胞においてβ2インテグリンの不存在下に(pro)MMP−9がどのようにして細胞表面に配置されるのかは不明である。MMP−9については他に数多くの結合タンパク質が公知文献に報告されている。
細胞遊走アッセイにより、細胞運動性の2つの方式が明らかになった。即ち、β2インテグリン依存性で、DDGWやその他のペプチドで阻害されるものと、β2インテグリン非依存性で、ペプチドで阻害されないものである。従って、好中球遊走におけるproMMP−9の役割について文献の議論が分かれているのは驚くにあたらない。実験モデルと動物種により、好中球遊走におけるプロテアーゼの機能を支持する研究もあるし、支持しない研究もある。刺激の違いにより異なる遊走方式を示す細胞の能力により、このような矛盾の多くに説明がつく。β2インテグリンとMMPに非依存性の白血球遊走は、in vitro条件下に3次元のコラーゲン中で観察される白血球のアメーバ様の動き(これはMMP阻害剤に非感受性である)に対応する可能性がある。
MMP−9完全欠損マウスにおいても、チオグリコレートで誘導された腹膜炎で好中球遊走が見られ、また、TNF−αで処理した内皮細胞の間を好中球がin vitroでトランスマイグレーションする。しかし、MMP類の機能はオーバーラップすることが知られており、MMP−9以外のMMP類がMMP−9欠損を補うことができる。本発明者らはこれまでに、proMMP−2とαMβ2インテグリンとの複合体を見出したが、本研究では、好中球MMP−8もまた精製したインテグリンIドメインに結合できることを示す。HFDDDE配列は分泌型MMP類に高度に保存されており、多くのMMP類に由来するそのようなペプチドはpepspot膜アッセイでαMIドメインに結合できる(参考文献16、FI20030923)。MMP−9ノックアウトマウスではどのMMP−インテグリン複合体が機能するのかはまだ不明である。さらに、他のプロティナーゼ(例えばエラスターゼやウロキナーゼ)へのαMβ2インテグリンの結合能が好中球の浸潤に影響するであろうと考えられる。
DDGWとHFDDDEはマウス腹膜炎モデルのin vivoで高い活性を示したが、いずれのペプチドも別な種類のβ2インテグリンリガンドを阻害する潜在能力も有するため、上記の活性がどの程度までproMMP−9の阻害に起因するのかは不明である。β2インテグリンリガンドの中にはDDGW様配列を有するものがあり、そのようなリガンドにはMMPの他に少なくとも補体iC3bとトロンボスポンジン−1が含まれる。本発明者らの得た結果から、特定のβ2インテグリンが指揮する好中球の運動機構の一部を、proMMP−9とαMβ2との複合体が構成している可能性が示唆される。
従って本発明は、新規なペプチド化合物に関し、さらに詳しくは、ヘキサペプチド配列 HFDDDEを有するペプチド化合物に関する。上記ペプチド化合物は、好中球遊走を阻害するための医薬として用いることができる。そのような阻害活性はin vitro とin vivo の実験の両方で示された。従って、上記ペプチド化合物は炎症性病態の予防と治療において有用である。
従って、本発明はヘキサペプチド配列 HFDDDEを有する化合物に関し、特に、好中球遊走の阻害に用いることを特徴とする化合物と炎症性病態の予防及び治療に用いることを特徴とする化合物に関する。
本発明はまた、本発明の化合物を有効成分として含有する、好中球遊走に起因する病態の治療用医薬組成物に関する。
本発明の他の1つの態様においては、有効成分としての本発明の化合物と薬学的に許容される担体とを含んでなる医薬組成物が開示される。
本発明のさらなる1つの態様においては、好中球遊走に起因する病態の治療処置または予防処置のための方法であって、本発明の化合物を、処置を必要とする哺乳類に対し、好中球遊走を阻害するのに有効な量を投与することを含む方法が開示される。本発明の具体的な態様としては、炎症性病態の予防または治療のための方法が挙げられる。
本願で使用する略語
HMEC ヒト微小血管内皮細胞
PMN 多形核好中球
CTT CTTHWGFTLCペプチド
CTT W→A CTTHAGFTLCペプチド
LLG−C4 CPCFLLGCCペプチド
DDGW ADGACILWMDDGWCGAAGペプチド
HSA ヒト血清アルブミン
KKGW ADGACILWMKKGWCGAAGペプチド
LF ラクトフェリン
MPO ミエロペルオキシダーゼ
NGAL 好中球ゼラチナーゼ関連リポカリン
GPA グリコールホリンA
TAT−2 腫瘍関連トリプシノーゲン−2
HMEC ヒト微小血管内皮細胞
PMN 多形核好中球
CTT CTTHWGFTLCペプチド
CTT W→A CTTHAGFTLCペプチド
LLG−C4 CPCFLLGCCペプチド
DDGW ADGACILWMDDGWCGAAGペプチド
HSA ヒト血清アルブミン
KKGW ADGACILWMKKGWCGAAGペプチド
LF ラクトフェリン
MPO ミエロペルオキシダーゼ
NGAL 好中球ゼラチナーゼ関連リポカリン
GPA グリコールホリンA
TAT−2 腫瘍関連トリプシノーゲン−2
なお本明細書中、発明の背景技術を説明するため、また、特に本発明の実施態様に関する詳細を補うために言及又は使用する各種刊行物及びその他の文献は、言及したことにより本明細書中に組み込まれたものとする。以下、実施例によって本発明をさらに詳しく説明する。
好中球調製物及び細胞系
多形核好中球(PMN)を、クエン酸デキストロース中で抗凝固処理された末梢血から単離した。赤血球を2%デキストランT−500を用いて遠心分離で沈殿させ、得られた白血球を多く含有する上清をペレット化し、生理食塩水に再懸濁し、リンホプレップ(Lymphoprep)(ノルウェー国、オスロ、Nyegaard製)を用いて、400gで30分間遠心分離し、多形核細胞を血小板及び単核球から分離した(参考文献22)。PMNの純度は95%より高く、典型的に好酸球の比率は2%より低い。細胞生存率を、MTT(3−[4,5−ジメチルチアゾール−2−イル]−2,5−ジフェニル テトラゾリウムブロマイド)アッセイを製造者(Roche)の説明書に従って用いて測定した。
多形核好中球(PMN)を、クエン酸デキストロース中で抗凝固処理された末梢血から単離した。赤血球を2%デキストランT−500を用いて遠心分離で沈殿させ、得られた白血球を多く含有する上清をペレット化し、生理食塩水に再懸濁し、リンホプレップ(Lymphoprep)(ノルウェー国、オスロ、Nyegaard製)を用いて、400gで30分間遠心分離し、多形核細胞を血小板及び単核球から分離した(参考文献22)。PMNの純度は95%より高く、典型的に好酸球の比率は2%より低い。細胞生存率を、MTT(3−[4,5−ジメチルチアゾール−2−イル]−2,5−ジフェニル テトラゾリウムブロマイド)アッセイを製造者(Roche)の説明書に従って用いて測定した。
S. Mustjoki(ヘルシンキ大学、ハートマン インスティテュート)より寄贈されたヒト微小血管内皮細胞(HMEC−1)(参考文献23)を、RPMI 1640中で、2mM グルタミン、100IU/ml ペニシリン、100 μg/ml ストレプトマイシンを含有する10% FBSの存在下で生育した。ヒト単球性THP−1細胞を公知の方法(参考文献24、25)で維持した。I型白血球接着不全症(LAD−1)細胞、野生型及びαMβ2−トランスフェクト型L929マウス線維芽細胞はDr. Jean-Pierre Cartron(フランス国、パリ、INSERM)からの寄贈である。これらの細胞を、公知の方法(参考文献26)で維持し、αMβ2の発現を蛍光活性化細胞分類法(FACS、カルフォルニア州、サンホセ、Becton Dickinson)によって試験した。
抗体とその他の試薬
モノクローナル抗体MEM170とモノクローナル抗体OKM10は、αMインテグリンサブユニットに対する抗体である(参考文献25)。抗MMP−9モノクローナル抗体(GE−213)はLab Vision(カルフォルニア州、フリーモン)から入手し、抗MMP−9ポリクローナル抗体はSanta Cruz Biotechnology(カリフォルニア州、サンタクルーズ)から入手した。公知のアフィニティ精製した抗MMP−9抗体(参考文献3)も用いた。対照モノクローナル抗体として、マウスIgG(オーストラリア国、ホーソン、Silenius製)及び抗グリコホリンA(GPA)(ATCC)を用いた。抗トリプシノーゲン−2(TAT−2)抗体をウサギポリクローナル抗体の対照とした(参考文献27)。ペルオキシダーゼ結合抗GSTモノクローナル抗体はSanta Cruz Biotechnologyから入手した。マウスαMインテグリンに対するラット抗体(MCA74)及びFITC結合抗ラット抗体(Fab’)2はSerotec(英国、オックスフォード)より購入した。ペプチドであるCTT、W→A CTT、LLG−C4、DDGW及びKKGWは公知である(参考文献16、28)。HFDDDEペプチド及びDFEDHDペプチドはNeosystem(フランス国、ストラスブール)に特別注文した。proMMP−8はCalbiochemから、proMMP−9はRocheから購入した。フルオロリン酸ジイソプロピルはAldrich Chemical Company Inc.(ドイツ国、シュタインハイム)から入手した。ヒトCa5はCalbiochem(カリフォルニア州、ラ・ホーヤ、Biosciences, Inc.)から、組換えTNF−αはSigma-Aldrich(ミズーリ州、セントルイス)から購入した。
モノクローナル抗体MEM170とモノクローナル抗体OKM10は、αMインテグリンサブユニットに対する抗体である(参考文献25)。抗MMP−9モノクローナル抗体(GE−213)はLab Vision(カルフォルニア州、フリーモン)から入手し、抗MMP−9ポリクローナル抗体はSanta Cruz Biotechnology(カリフォルニア州、サンタクルーズ)から入手した。公知のアフィニティ精製した抗MMP−9抗体(参考文献3)も用いた。対照モノクローナル抗体として、マウスIgG(オーストラリア国、ホーソン、Silenius製)及び抗グリコホリンA(GPA)(ATCC)を用いた。抗トリプシノーゲン−2(TAT−2)抗体をウサギポリクローナル抗体の対照とした(参考文献27)。ペルオキシダーゼ結合抗GSTモノクローナル抗体はSanta Cruz Biotechnologyから入手した。マウスαMインテグリンに対するラット抗体(MCA74)及びFITC結合抗ラット抗体(Fab’)2はSerotec(英国、オックスフォード)より購入した。ペプチドであるCTT、W→A CTT、LLG−C4、DDGW及びKKGWは公知である(参考文献16、28)。HFDDDEペプチド及びDFEDHDペプチドはNeosystem(フランス国、ストラスブール)に特別注文した。proMMP−8はCalbiochemから、proMMP−9はRocheから購入した。フルオロリン酸ジイソプロピルはAldrich Chemical Company Inc.(ドイツ国、シュタインハイム)から入手した。ヒトCa5はCalbiochem(カリフォルニア州、ラ・ホーヤ、Biosciences, Inc.)から、組換えTNF−αはSigma-Aldrich(ミズーリ州、セントルイス)から購入した。
細胞画分(subcellular fraction)
PMNを、3×107個/mlでクレブズ−リンガーリン酸塩(Krebs-Ringer phosphate)(130mM NaCl、5mM KCl、1.27mM MgSO4、0.95 mM CaCl2、5mM グルコース、10mM NaH2PO4/Na2HPO4(pH7.4))に懸濁した。PMNを酢酸ミリスチン酸ホルボール(phorbol myristate acetate)(PMA;2μg/ml)と一緒に、またはなしで+37°Cで15分間インキュベートし、その後25mmol/L フルオロリン酸ジイソプロピルと共に氷上で5分間インキュベートし、上清(S0)を採取した。顆粒画分(granule fractions)を公知の方法(参考文献29)で精製した。端的に言うと、PMNを、ナイトロジェン キャビテーション法(nitrogen cavitation)で破砕し、細胞残渣を遠心分離で除去した。得られた上清(postnuclear supernatant)(S1)に、パーコール(Percoll)を用いて3層の密度勾配(1.050/1.090/1.120g/ml)を形成し、+4°Cで30分間遠心した。画分1〜6、7〜12、13〜18、及び19〜24(各1ml)を採取し、4つの異なるグループとしてプールした。最後の画分(25〜30)に、透明な細胞質ゾル(S2)が存在した。分取したものについて、個々の区分(括弧内に示す)に対応するマーカータンパク質の存在を試験した:MPO(αバンド/アズール親和性)、LF(β1バンド/特殊)、ゼラチナーゼ(β2バンド/ゼラチナーゼ)、アルブミン(γバンド/分泌小胞及び原形質膜)(参考文献21)。タンパク質レベルをサンドイッチELISAアッセイで測定した。
PMNを、3×107個/mlでクレブズ−リンガーリン酸塩(Krebs-Ringer phosphate)(130mM NaCl、5mM KCl、1.27mM MgSO4、0.95 mM CaCl2、5mM グルコース、10mM NaH2PO4/Na2HPO4(pH7.4))に懸濁した。PMNを酢酸ミリスチン酸ホルボール(phorbol myristate acetate)(PMA;2μg/ml)と一緒に、またはなしで+37°Cで15分間インキュベートし、その後25mmol/L フルオロリン酸ジイソプロピルと共に氷上で5分間インキュベートし、上清(S0)を採取した。顆粒画分(granule fractions)を公知の方法(参考文献29)で精製した。端的に言うと、PMNを、ナイトロジェン キャビテーション法(nitrogen cavitation)で破砕し、細胞残渣を遠心分離で除去した。得られた上清(postnuclear supernatant)(S1)に、パーコール(Percoll)を用いて3層の密度勾配(1.050/1.090/1.120g/ml)を形成し、+4°Cで30分間遠心した。画分1〜6、7〜12、13〜18、及び19〜24(各1ml)を採取し、4つの異なるグループとしてプールした。最後の画分(25〜30)に、透明な細胞質ゾル(S2)が存在した。分取したものについて、個々の区分(括弧内に示す)に対応するマーカータンパク質の存在を試験した:MPO(αバンド/アズール親和性)、LF(β1バンド/特殊)、ゼラチナーゼ(β2バンド/ゼラチナーゼ)、アルブミン(γバンド/分泌小胞及び原形質膜)(参考文献21)。タンパク質レベルをサンドイッチELISAアッセイで測定した。
ゼラチンザイモグラフィー、免疫沈降及び免疫ブロット法
顆粒画分を1%(v/v) Triton−X−100のリン酸緩衝生理食塩水溶液(PBS)で、氷冷しながら溶解し、溶解産物を+4°Cで10分間遠心分離することにより不純物を除去した。溶解産物を、0.2%ゼラチンを含有する8% SDS−ポリアクリルアミドゲルを用いたゼラチンザイモグラフィーで分析した(参考文献27)。免疫沈降を行う前に、溶解産物をプロテインG−セファロースと共に、+4°Cで30分間インキュベートすることにより予備清掃(preclear)した。遠心分離後、得られた上清を、抗MMP−9ポリクローナル抗体または抗αMモノクローナル抗体(OKM−10)を用いて免疫沈降に付した。プロテインG−セファロースと共に+4°Cで1時間インキュベートした後、免疫複合体をペレット化し、Triton X−100溶解緩衝液で3回洗浄し、PBSで1回洗浄した。2−メルカプトエタノールを含有するLaemmliサンプル緩衝液で可溶化し、試料を4〜15% 勾配 SDS−PAGEゲル(カリフォルニア州、ハーキュリーズ、Bio-Rad laboratories)で電気泳動させ、半乾燥電気泳動(semidry electrophoresis)を15Vで30分行うことによってニトロセルロース膜に移した(ドイツ国、ダッセル、Schleicher & Schuell)。上記の膜を5% 粉ミルクと0.05% Tween20を含有するPBS溶液に+4°Cで一晩浸漬することによって、非特異的結合をブロッキングした。上記の膜をαMモノクローナル抗体(MEM170)(10μg/ml)と共に室温で2時間インキュベートした後、西洋ワサビ結合ウサギ抗マウスIgG(1:1000 希釈液;デンマーク国、コペンハーゲン、DAKO A/S)と共に25°Cで30分間インキュベートした。数回洗浄した後、高感度化学発光システム(Enhanced ChemiLuminescence system)(Amersham Pharmacia Biotech製)を、製造者の説明書に従って用いて、ブロットを展開した。結合した抗体を膜から除去し、抗MMP−9ポリクローナル抗体でリプローブした。適切な二次抗体を用いた。免疫検出の後は毎回、膜をTBS中に+4°Cで保存した。
顆粒画分を1%(v/v) Triton−X−100のリン酸緩衝生理食塩水溶液(PBS)で、氷冷しながら溶解し、溶解産物を+4°Cで10分間遠心分離することにより不純物を除去した。溶解産物を、0.2%ゼラチンを含有する8% SDS−ポリアクリルアミドゲルを用いたゼラチンザイモグラフィーで分析した(参考文献27)。免疫沈降を行う前に、溶解産物をプロテインG−セファロースと共に、+4°Cで30分間インキュベートすることにより予備清掃(preclear)した。遠心分離後、得られた上清を、抗MMP−9ポリクローナル抗体または抗αMモノクローナル抗体(OKM−10)を用いて免疫沈降に付した。プロテインG−セファロースと共に+4°Cで1時間インキュベートした後、免疫複合体をペレット化し、Triton X−100溶解緩衝液で3回洗浄し、PBSで1回洗浄した。2−メルカプトエタノールを含有するLaemmliサンプル緩衝液で可溶化し、試料を4〜15% 勾配 SDS−PAGEゲル(カリフォルニア州、ハーキュリーズ、Bio-Rad laboratories)で電気泳動させ、半乾燥電気泳動(semidry electrophoresis)を15Vで30分行うことによってニトロセルロース膜に移した(ドイツ国、ダッセル、Schleicher & Schuell)。上記の膜を5% 粉ミルクと0.05% Tween20を含有するPBS溶液に+4°Cで一晩浸漬することによって、非特異的結合をブロッキングした。上記の膜をαMモノクローナル抗体(MEM170)(10μg/ml)と共に室温で2時間インキュベートした後、西洋ワサビ結合ウサギ抗マウスIgG(1:1000 希釈液;デンマーク国、コペンハーゲン、DAKO A/S)と共に25°Cで30分間インキュベートした。数回洗浄した後、高感度化学発光システム(Enhanced ChemiLuminescence system)(Amersham Pharmacia Biotech製)を、製造者の説明書に従って用いて、ブロットを展開した。結合した抗体を膜から除去し、抗MMP−9ポリクローナル抗体でリプローブした。適切な二次抗体を用いた。免疫検出の後は毎回、膜をTBS中に+4°Cで保存した。
インテグリンIドメインとMMP−9組換えタンパク質の発現と精製
GST−αMIドメイン融合タンパク質及びGST−αLIドメイン融合タンパク質を、公知の方法で発現させ、精製した(参考文献30)。トロンビン(Sigma製)を用いてGSTをαMIドメインから切り離し、FPLCシステム(Pharmacia製)を用いたモノ S HR5/5カラムによるイオン交換クロマトグラフィでIドメインを精製した。ΔMMP−9及びFnIIドメインの精製については別の場で発表する(参考文献33)。組換えタンパク質の純度はSDS−PAGEで確認した。
GST−αMIドメイン融合タンパク質及びGST−αLIドメイン融合タンパク質を、公知の方法で発現させ、精製した(参考文献30)。トロンビン(Sigma製)を用いてGSTをαMIドメインから切り離し、FPLCシステム(Pharmacia製)を用いたモノ S HR5/5カラムによるイオン交換クロマトグラフィでIドメインを精製した。ΔMMP−9及びFnIIドメインの精製については別の場で発表する(参考文献33)。組換えタンパク質の純度はSDS−PAGEで確認した。
MMP−9ドメインとα M Iドメインの相互作用
ICAM−1、フィブリノゲン、proMMP−8、proMMP−9または組換えドメイン(0.5μgのPBS溶液/ウェル)をプラスチック製96ウェルプレートに+4°Cで16時間被覆し、ウェルを、3% ウシ血清アルブミン(BSA)のPBS溶液を用いて室温で2時間ブロッキングに付した。GST−αMIドメインの結合を、実質的に第一優先権出願に記載の通り測定した。逆方向のアッセイ(reverse assay)においては、GST−αMIドメインで被覆し、proMMP−9の結合をGE−213抗体を用いて測定した。実験を行う前に、競合ペプチドをαMIドメインと共に20分間プレインキュベートした。
ICAM−1、フィブリノゲン、proMMP−8、proMMP−9または組換えドメイン(0.5μgのPBS溶液/ウェル)をプラスチック製96ウェルプレートに+4°Cで16時間被覆し、ウェルを、3% ウシ血清アルブミン(BSA)のPBS溶液を用いて室温で2時間ブロッキングに付した。GST−αMIドメインの結合を、実質的に第一優先権出願に記載の通り測定した。逆方向のアッセイ(reverse assay)においては、GST−αMIドメインで被覆し、proMMP−9の結合をGE−213抗体を用いて測定した。実験を行う前に、競合ペプチドをαMIドメインと共に20分間プレインキュベートした。
代謝放射性同位元素標識法(metabolic radiolabelling)及び免疫沈降
非活性化、または50nMのPMAにより活性化させたTHP−1細胞(1×107個)を[35S]−メチオニンを用いて生合成的に標識した(biosynthetic labeling)(参考文献31)。細胞を、メチオニンを含有せず、透析した、加熱不活性化10%ウシ胎仔血清を含有する培地に懸濁し、+37°Cで10分間、50μCi/mlの[35S]−メチオニンでパルス標識(pulsed-labelling)した。細胞を素早く洗浄し、10% FCSを含有する完全培地で+37°Cで、後述の所定時間インキュベートした。細胞をペレット化し、冷却したPBSを2mlずつ3回(30分後、2時間後及び4時間後)添加することにより標識付けを停止させた。洗浄の後、細胞を1% Triton X−100、10μg/ml アプロチニン、10μg/ml ロイペプチン及び1mM フッ化フェニルメチルスルフォニルのPBS溶液で溶解し、超遠心分離法で不純物を除去し、プロテインG−セファロースで予備清掃した。溶解産物を、アフィニティ精製したウサギ抗MMP−9抗体とαMモノクローナル抗体(OKM−10)(3μg/ml)で免疫沈降した。ヒトIgG1を対照抗体とした。プロテインG−セファロースと共に+4°Cで1時間インキュベートした後、免疫複合体をペレット化して洗浄し、7.5% SDS−PAGEゲル上で泳動させた。ゲルをエンハンサー(Amplify、Amersham Biosciences製)で処理し、ろ紙上で乾燥させ、Kodak X-Omat ARフィルムに−70°Cで1週間曝露した。
非活性化、または50nMのPMAにより活性化させたTHP−1細胞(1×107個)を[35S]−メチオニンを用いて生合成的に標識した(biosynthetic labeling)(参考文献31)。細胞を、メチオニンを含有せず、透析した、加熱不活性化10%ウシ胎仔血清を含有する培地に懸濁し、+37°Cで10分間、50μCi/mlの[35S]−メチオニンでパルス標識(pulsed-labelling)した。細胞を素早く洗浄し、10% FCSを含有する完全培地で+37°Cで、後述の所定時間インキュベートした。細胞をペレット化し、冷却したPBSを2mlずつ3回(30分後、2時間後及び4時間後)添加することにより標識付けを停止させた。洗浄の後、細胞を1% Triton X−100、10μg/ml アプロチニン、10μg/ml ロイペプチン及び1mM フッ化フェニルメチルスルフォニルのPBS溶液で溶解し、超遠心分離法で不純物を除去し、プロテインG−セファロースで予備清掃した。溶解産物を、アフィニティ精製したウサギ抗MMP−9抗体とαMモノクローナル抗体(OKM−10)(3μg/ml)で免疫沈降した。ヒトIgG1を対照抗体とした。プロテインG−セファロースと共に+4°Cで1時間インキュベートした後、免疫複合体をペレット化して洗浄し、7.5% SDS−PAGEゲル上で泳動させた。ゲルをエンハンサー(Amplify、Amersham Biosciences製)で処理し、ろ紙上で乾燥させ、Kodak X-Omat ARフィルムに−70°Cで1週間曝露した。
免疫蛍光染色
PMN及びLAD−1細胞を、20nM PMAで+37°Cで15分間処理するか、或いは未処理のままで、ポリ−L−リシンで被覆したカバーガラスに付着させ、2.5% パラフォルムアルデヒド中で、0.1% Triton X−100の存在下または非存在下で、+25°Cで10分間固定化し、数回洗浄した。上記細胞を20%(v/v)ウサギ血清及び3% BSAのPBS溶液を用いて、室温で30分間ブロッキングした。細胞をウサギ抗MMP−9ポリクローナル抗体及びマウス抗αM抗体(MEM170)(1:250で希釈)と共にインキュベートした。PBSで洗浄した後、二次抗体であるローダミン(TRITC)結合抗ウサギ抗体またはFITC結合抗マウス抗体(Fab’)2(DAKO製)を1:500に希釈したものと30分間インキュベートした。得られた試料をカバーガラスに載せ、+4°Cの暗所で保存した。αMβ2及びMMP−9の細胞内分布を、蛍光顕微鏡法により、63倍の油浸対物レンズ及びライカTCS SP2スキャンユニットを備えた共焦点顕微鏡(ライカ マルチバンド共焦点イメージングスペクトロフォトメーター(Leica multi band confocal imagine spectrophotometer)を用いて調べた。
PMN及びLAD−1細胞を、20nM PMAで+37°Cで15分間処理するか、或いは未処理のままで、ポリ−L−リシンで被覆したカバーガラスに付着させ、2.5% パラフォルムアルデヒド中で、0.1% Triton X−100の存在下または非存在下で、+25°Cで10分間固定化し、数回洗浄した。上記細胞を20%(v/v)ウサギ血清及び3% BSAのPBS溶液を用いて、室温で30分間ブロッキングした。細胞をウサギ抗MMP−9ポリクローナル抗体及びマウス抗αM抗体(MEM170)(1:250で希釈)と共にインキュベートした。PBSで洗浄した後、二次抗体であるローダミン(TRITC)結合抗ウサギ抗体またはFITC結合抗マウス抗体(Fab’)2(DAKO製)を1:500に希釈したものと30分間インキュベートした。得られた試料をカバーガラスに載せ、+4°Cの暗所で保存した。αMβ2及びMMP−9の細胞内分布を、蛍光顕微鏡法により、63倍の油浸対物レンズ及びライカTCS SP2スキャンユニットを備えた共焦点顕微鏡(ライカ マルチバンド共焦点イメージングスペクトロフォトメーター(Leica multi band confocal imagine spectrophotometer)を用いて調べた。
細胞接着
MMP−9タンパク質(200nM PBS溶液)を+4℃で16時間かけて被覆したマイクロタイターウェルを、3% BSAのPBS溶液で、室温で1時間ブロッキングした。αMβ2インテグリン L−細胞トランスフェクタント及びPMN(1×105個/ウェル)を2mM MgCl2と0.1%BSAを添加したRPMI培地に懸濁し、PMA(20nM)で20分間活性化、或いはC5a(50nM)またはTNF−α(10nM)で+37℃で4時間活性化した。野生型L926細胞及びLAD−1細胞を対照として用いた。細胞を、所定の抗体(20μg/ml)またはペプチド(50μM)で、+37℃で30分間処理し、無血清倍地で2回洗浄し、マイクロタイターウェル中で、+37℃で30分間インキュベートした。ウェルをPBSで洗浄し、接着細胞の数をフォスファターゼアッセイで定量した(参考文献25)。
MMP−9タンパク質(200nM PBS溶液)を+4℃で16時間かけて被覆したマイクロタイターウェルを、3% BSAのPBS溶液で、室温で1時間ブロッキングした。αMβ2インテグリン L−細胞トランスフェクタント及びPMN(1×105個/ウェル)を2mM MgCl2と0.1%BSAを添加したRPMI培地に懸濁し、PMA(20nM)で20分間活性化、或いはC5a(50nM)またはTNF−α(10nM)で+37℃で4時間活性化した。野生型L926細胞及びLAD−1細胞を対照として用いた。細胞を、所定の抗体(20μg/ml)またはペプチド(50μM)で、+37℃で30分間処理し、無血清倍地で2回洗浄し、マイクロタイターウェル中で、+37℃で30分間インキュベートした。ウェルをPBSで洗浄し、接着細胞の数をフォスファターゼアッセイで定量した(参考文献25)。
細胞遊走
PMNには孔サイズが3μmの、THP−1細胞には8μmのCostar製24−トランスウェル遊走チェンバー(24-transwell migration chambers)を用いて細胞遊走を行った。β2インテグリンに指揮される遊走を研究するため、チェンバーの膜の両面をLLG−C4−GSTインテグリンリガンド(40μg/ml)または対照としてGSTで被覆し、10%血清含有培地でブロッキングした(参考文献16)。内皮貫通遊走を研究するために、コンフルエントなHMEC(4×105 個/ウェル)をゼラチンで被覆した膜の上側で5日間生育した。3日後に培地を交換した。PBSでHMEC層を2回洗浄した後、C5a(50nM)、TNF−α(10ng/ml)、または培地のみを下室に添加して化学走性活性化を+37℃で4時間行った。その後、培養物を再度2回洗浄して全ての試薬を除去した。PMNまたはTHP−1細胞を、研究したペプチド阻害剤または抗体と1時間プレインキュベートしてから、上室へ移動した(100μl RPMI/0.1%BSAまたは10%FCS含有完全培地中に1×105個)。PMNをLLG−C4−GST被覆膜を通して2時間、HMEC単分子層を通して30分間遊走させた。THP−1細胞を16時間遊走させた。遊走しなかった細胞を上部表面から綿棒で除去し、フィルターを通過した細胞をクリスタルバイオレットで染色して数えた。
PMNには孔サイズが3μmの、THP−1細胞には8μmのCostar製24−トランスウェル遊走チェンバー(24-transwell migration chambers)を用いて細胞遊走を行った。β2インテグリンに指揮される遊走を研究するため、チェンバーの膜の両面をLLG−C4−GSTインテグリンリガンド(40μg/ml)または対照としてGSTで被覆し、10%血清含有培地でブロッキングした(参考文献16)。内皮貫通遊走を研究するために、コンフルエントなHMEC(4×105 個/ウェル)をゼラチンで被覆した膜の上側で5日間生育した。3日後に培地を交換した。PBSでHMEC層を2回洗浄した後、C5a(50nM)、TNF−α(10ng/ml)、または培地のみを下室に添加して化学走性活性化を+37℃で4時間行った。その後、培養物を再度2回洗浄して全ての試薬を除去した。PMNまたはTHP−1細胞を、研究したペプチド阻害剤または抗体と1時間プレインキュベートしてから、上室へ移動した(100μl RPMI/0.1%BSAまたは10%FCS含有完全培地中に1×105個)。PMNをLLG−C4−GST被覆膜を通して2時間、HMEC単分子層を通して30分間遊走させた。THP−1細胞を16時間遊走させた。遊走しなかった細胞を上部表面から綿棒で除去し、フィルターを通過した細胞をクリスタルバイオレットで染色して数えた。
マウス炎症モデル
31〜32週齢のBalb/cマウスの腹腔内に、3%(w/v)チオグリコレートの無菌生理食塩水を注射した(参考文献32)。ペプチド(100μl中に5〜500μg)を尾静脈に注射した。3時間後に動物を安楽死させ、腹膜細胞を、10mlの無菌PBSを腹膜壁より注射することによって採取した。洗浄液中に存在する赤血球細胞を低張溶解法(hypotonic lysis)により除去した。細胞を遠心分離機にかけ、1mlの無菌0.25% BSA/クレブズ−リンガー溶液に再懸濁した。上清も採取しゼラチンザイモグラフィーで分析した。0.1%クリスタルバイオレットで染色し、100倍の対物レンズを備えた光学顕微鏡を用いて好中球の数を決定した。免疫蛍光染色をするために、細胞をポリ−L−リシン被覆カバーガラスに結合させ、2.5% パラホルムアルデヒドのPBS溶液を用いて+4℃で30分間固定化し、数回洗浄した。Fcレセプターを20%のウサギ血清及び3% BSAのPBS溶液の存在下でブロッキングした。その後細胞を抗MMP−9ポリクローナル抗体及びαMモノクローナル抗体(MCA74)と30分間インキュベートした。PBSで洗浄した後、二次抗体であるローダミン(TRITC)結合抗ウサギ抗体またはFITC結合抗ラット抗体(Fab’)2とさらに30分間インキュベートした。試料を共焦点顕微鏡で調べた。動物実験はヘルシンキ大学倫理委員会の承認を得た。
31〜32週齢のBalb/cマウスの腹腔内に、3%(w/v)チオグリコレートの無菌生理食塩水を注射した(参考文献32)。ペプチド(100μl中に5〜500μg)を尾静脈に注射した。3時間後に動物を安楽死させ、腹膜細胞を、10mlの無菌PBSを腹膜壁より注射することによって採取した。洗浄液中に存在する赤血球細胞を低張溶解法(hypotonic lysis)により除去した。細胞を遠心分離機にかけ、1mlの無菌0.25% BSA/クレブズ−リンガー溶液に再懸濁した。上清も採取しゼラチンザイモグラフィーで分析した。0.1%クリスタルバイオレットで染色し、100倍の対物レンズを備えた光学顕微鏡を用いて好中球の数を決定した。免疫蛍光染色をするために、細胞をポリ−L−リシン被覆カバーガラスに結合させ、2.5% パラホルムアルデヒドのPBS溶液を用いて+4℃で30分間固定化し、数回洗浄した。Fcレセプターを20%のウサギ血清及び3% BSAのPBS溶液の存在下でブロッキングした。その後細胞を抗MMP−9ポリクローナル抗体及びαMモノクローナル抗体(MCA74)と30分間インキュベートした。PBSで洗浄した後、二次抗体であるローダミン(TRITC)結合抗ウサギ抗体またはFITC結合抗ラット抗体(Fab’)2とさらに30分間インキュベートした。試料を共焦点顕微鏡で調べた。動物実験はヘルシンキ大学倫理委員会の承認を得た。
統計分析
得られた結果をF−検定(F-test)(分散分析(ANOVA))で分析し、グループ間で有意差が出た場合には、続いて、ダンカンの多重範囲検定(Duncan's Multiple Range test)に付した。用いたプログラムはウィンドウズ用SPSSの8.0版である。
得られた結果をF−検定(F-test)(分散分析(ANOVA))で分析し、グループ間で有意差が出た場合には、続いて、ダンカンの多重範囲検定(Duncan's Multiple Range test)に付した。用いたプログラムはウィンドウズ用SPSSの8.0版である。
ゼラチナーゼの細胞からの脱離に対するペプチドの効果
THP−1細胞(50,000個/100μl)を無血清RPMI培地で、200μMの本発明のペプチドの存在下または非存在下で16時間、所定の方法でインキュベートした。THP−1細胞からの上清とマウス腹腔内液をゼラチンザイモグラフィーで分析した。ゼラチン分解活性を濃度計でスキャニングして定量した。
THP−1細胞(50,000個/100μl)を無血清RPMI培地で、200μMの本発明のペプチドの存在下または非存在下で16時間、所定の方法でインキュベートした。THP−1細胞からの上清とマウス腹腔内液をゼラチンザイモグラフィーで分析した。ゼラチン分解活性を濃度計でスキャニングして定量した。
結果
proMMP−9/α M β 2 複合体の細胞内での形成
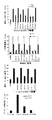
休止状態のPMNをαM抗体とMMP−9抗体で染色することにより、Triton X−100による透過処理後に強い細胞内共局在化が示された(図1のA)。透過処理をしていない細胞では、そのような共局在化は見られず、もしMMP−9が細胞表面に存在したとしてもごくわずかであった(図1のB)。細胞内顆粒のエクソサイトーシスを引き起こすPMA処理を行った後、細胞内の染色が減少し、αMβ2インテグリンとMMP−9が細胞表面に共局在した(図1のC−D)。エクソサイトーシスをC5aで引き起こした場合も同様の結果が得られた(データは示さない)。二重免疫蛍光染色の対照として、αMβ2を欠くB細胞由来のLAD−1細胞系(図1のE)を用いた。PMA刺激の後、LAD−1細胞がproMMP−9を分泌したことがザイモグラフィー分析で検出され、分泌されたproMMP−9は細胞表面に発現したが分布は好中球の場合とは異なり、MMP−9は細胞の先導端に局在した。
proMMP−9/α M β 2 複合体の細胞内での形成
休止状態のPMNをαM抗体とMMP−9抗体で染色することにより、Triton X−100による透過処理後に強い細胞内共局在化が示された(図1のA)。透過処理をしていない細胞では、そのような共局在化は見られず、もしMMP−9が細胞表面に存在したとしてもごくわずかであった(図1のB)。細胞内顆粒のエクソサイトーシスを引き起こすPMA処理を行った後、細胞内の染色が減少し、αMβ2インテグリンとMMP−9が細胞表面に共局在した(図1のC−D)。エクソサイトーシスをC5aで引き起こした場合も同様の結果が得られた(データは示さない)。二重免疫蛍光染色の対照として、αMβ2を欠くB細胞由来のLAD−1細胞系(図1のE)を用いた。PMA刺激の後、LAD−1細胞がproMMP−9を分泌したことがザイモグラフィー分析で検出され、分泌されたproMMP−9は細胞表面に発現したが分布は好中球の場合とは異なり、MMP−9は細胞の先導端に局在した。
proMMP−9とαMβ2の細胞内共局在化は、PMN顆粒において、細胞表面への移動の前にproMMP−9/αMβ2インテグリン複合体が形成されることを示唆した。PMAで処理した細胞及び未処理の細胞由来のアズール親和性画分(αバンド)、特殊画分(β1バンド)、ゼラチナーゼ画分(β2バンド)、及び原形質膜を含む分泌小胞画分(γバンド)を、3段階の非連続的Percoll勾配で精製した。各画分の純度は、顆粒特異的マーカーで測定した。MPOをアズール親和性顆粒のマーカー;LF及びNGALを特殊顆粒のマーカー;MMP−9をゼラチナーゼ顆粒のマーカー;ヒト血清アルブミン(HSA)を分泌小胞のマーカー;そしてヒト白血球抗原(HLA)を原形質膜のマーカーとして用いた(図2)。PMAが顆粒マーカーの大部分を細胞外環境に放出させたが、MPOはアズール親和性顆粒から部分的に放出されただけであった。NGALは特殊顆粒から上清(S0)に75%放出され、LFは90%放出された。同様に、ゼラチナーゼ顆粒中ではMMP−9の含有量は90%減少し、S0上清中では増加した。HSAは85%が分泌小胞から放出され、S0上清中で多量に検出された。原形質膜のマーカーであるHLAは、比較的一定であった。細胞を活性化すると、HSA、NGAL、LF及びMMP−9のレベルは上清(postnuclear supernatant)(S1)中で大幅に減少した。細胞質ゾル画分(S2)はこれらのマーカーを有さなかったが、これは細胞分画(subcellular fractionation)によって完全な顆粒(intact granule)を単離したことを示している。
顆粒画分の免疫ブロット分析により、proMMP−9が、細胞画分において、αMβ2インテグリンと類似の分布を示すことが示された(図3のA)。休止状態のPMNにおいて、proMMP−9とαMβ2の大部分がβ2バンドに見られ、β1バンド及びγバンドにおいてはより少なかった。免疫蛍光分析の結果と一致して、PMAはβ2バンド含有量の減少を引き起こした。ゼラチンザイモグラフィーによる画分の分析により、同様に、PMAが細胞内proMMP−9単量体及び二量体、ならびにそのNGALとの複合体の量を減少させたことが示された(図3のB)。酵素前駆体proMMP−9は、分泌小胞及び原形質膜を示すγバンド、及び細胞外環境(extracellular milieu)(S0)において見られた。
非活性化PMNにおいて、αMインテグリン抗体であるOKM−10は、β1バンド、β2バンド及びγバンドから165kDaのαM鎖を免疫沈降させた。92kDaのproMMP−9はβ2バンドから共沈した(図3のC)。細胞をPMAで刺激すると、αM鎖はβ1バンド及びγバンドから免疫沈降したが、β2バンドからはそれ以上免疫沈降しなかった。上記インテグリン抗体は、proMMP−9のみをγバンドから共沈させた。可溶性αMIドメインを加えることにより、共沈が阻止された。
proMMP−9とαMβ2インテグリンとの内因性の複合体の生合成を、このような研究に適したTHP−1白血病細胞系を用いて調べた。上記の複合体を[35S]−メチオニンでパルス標識した細胞から免疫沈降によって2時間及び4時間の時点で上記複合体を検出した(図3のD、レーン5及び8)。OKM10抗体はαM鎖とproMMP−9を共沈した。αM鎖は、抗MMP−9抗体との免疫沈降物中に弱く検出されただけであり(レーン4及び7)、これはリガンドと結合していないproMMP−9が過剰量存在するためであると考えられる。対照抗体は、αMもproMMP−9も共沈しなかった(レーン3、6及び9)。
proMMP−9/α M β 2 インテグリン複合体のペプチド阻害剤は好中球遊走を阻害する
本発明者らの以前の研究において、pepspot分析により、proMMP−9がインテグリンと相互作用する部位はproMMP−9の触媒ドメインに存在する20個のアミノ酸配列(QGDAHFDDDELWSLGKGVVV)であることが示された(第一優先権書類を参照されたい)。pepspotシステムによる更なるスクリーニングにより、この配列をヘキサペプチドHFDDDEにまで短縮しても充分なインテグリン結合活性が達成されることが分かった(データは示さない)。そのような短い配列がproMMP−9の生物活性部位であることを確認するために、まず、細菌で発現させたMMP−9の組換えドメインを作成した(図4のA)。ΔMMP−9はproドメイン(Pro)と触媒ドメインからなるが、ヘモペキシンドメインを欠いている。II型フィブロネクチン繰返し配列(FnII)は重要な基質結合領域なので、これも別の組換えタンパク質として作成した。pro触媒ドメイン構築体ΔMMP−9は、野生型proMMP−9とほぼ同じ効率でαMのIドメインと結合した(図4のB)。FnIIタンパク質は活性をほとんど欠いていた。固相pepspot分析で同定されたHFDDDEペプチドをペプチド合成で製造すると高い活性を示し、proMMP−9のαMIドメインへの結合を阻害し、その際、20μMでIC50を達成した(図4のC)。結合されたproMMP−9の決定は、FnIIドメインにあるエピトープを認識するGE−213抗体を用いて行なった(データは示さない)。配列を乱したスクランブルペプチドDFEDHD(同じ負に帯電したアミノ酸を有する)は活性を示さなかった。HFDDDEは、ファージディスプレイで発見した上述のαMIドメイン結合性ペプチドであるDDGWと同様に活性であった。DDGWの対照用ペプチドであるKKGWは効果を示さなかった。MMPファミリーのペプチドにはHFDDDE配列が高度に保存されているので、本発明者らは、αMIドメインの、ヒト好中球コラゲナーゼであるMMP−8への結合についても調べた。Iドメインは、proMMP−9に対するのと同様に、proMMP−8に対して、DDGWで阻害可能な結合を示した(図4のD)。ICAM−1とフィブリノゲンはいずれのproMMPとも競合せず、このことは、Iドメインにおいては、基質タンパク質とproMMPに対する結合部位が異なることを示唆する。
本発明者らの以前の研究において、pepspot分析により、proMMP−9がインテグリンと相互作用する部位はproMMP−9の触媒ドメインに存在する20個のアミノ酸配列(QGDAHFDDDELWSLGKGVVV)であることが示された(第一優先権書類を参照されたい)。pepspotシステムによる更なるスクリーニングにより、この配列をヘキサペプチドHFDDDEにまで短縮しても充分なインテグリン結合活性が達成されることが分かった(データは示さない)。そのような短い配列がproMMP−9の生物活性部位であることを確認するために、まず、細菌で発現させたMMP−9の組換えドメインを作成した(図4のA)。ΔMMP−9はproドメイン(Pro)と触媒ドメインからなるが、ヘモペキシンドメインを欠いている。II型フィブロネクチン繰返し配列(FnII)は重要な基質結合領域なので、これも別の組換えタンパク質として作成した。pro触媒ドメイン構築体ΔMMP−9は、野生型proMMP−9とほぼ同じ効率でαMのIドメインと結合した(図4のB)。FnIIタンパク質は活性をほとんど欠いていた。固相pepspot分析で同定されたHFDDDEペプチドをペプチド合成で製造すると高い活性を示し、proMMP−9のαMIドメインへの結合を阻害し、その際、20μMでIC50を達成した(図4のC)。結合されたproMMP−9の決定は、FnIIドメインにあるエピトープを認識するGE−213抗体を用いて行なった(データは示さない)。配列を乱したスクランブルペプチドDFEDHD(同じ負に帯電したアミノ酸を有する)は活性を示さなかった。HFDDDEは、ファージディスプレイで発見した上述のαMIドメイン結合性ペプチドであるDDGWと同様に活性であった。DDGWの対照用ペプチドであるKKGWは効果を示さなかった。MMPファミリーのペプチドにはHFDDDE配列が高度に保存されているので、本発明者らは、αMIドメインの、ヒト好中球コラゲナーゼであるMMP−8への結合についても調べた。Iドメインは、proMMP−9に対するのと同様に、proMMP−8に対して、DDGWで阻害可能な結合を示した(図4のD)。ICAM−1とフィブリノゲンはいずれのproMMPとも競合せず、このことは、Iドメインにおいては、基質タンパク質とproMMPに対する結合部位が異なることを示唆する。
インテグリンが活性化された後、PMNはproMMP−9への接着能力を示した。PMAで刺激したPMNは、proMMP−9に対するのとほとんど同じ強度で、マイクロタイターウェルに塗布したΔMMP−9に結合した(図5のA)。PMNをC5aまたはTNF−αで刺激すると同様の結果が得られ、PMNの接着が3倍となった(図5のB)。FnIIドメインはPMNの接着を支持しなかった。PMNの接着はHFDDDE(50μM)、DDGW(50μM)、可溶性αMIドメイン、MEM170抗体により阻害され(図5のC)、β2インテグリンが指揮する結合であることを示した。対照ペプチド(DFEDHD、KKGW)及び無関係なモノクロナール抗体(抗GPA抗体)は効果を示さなかった。CTTペプチドはMMP−9の触媒ドメインに結合したが、MMP阻害活性を欠くW→A CTT対照ペプチドは結合せず(未公開の結果)、また、CTTペプチドはPMNの接着を阻害した。MMP−9抗体は部分的に阻害した。
本発明者らはまた、トランスフェクトによりαMβ2を発現したL細胞(αMβ2-transfected L cells)についても調べてみた。αMβ2発現L細胞トランスフェクタントは、PMNと同様に、proMMP−9とΔMMP−9に結合し、そして、IドメインリガンドとMMP−9阻害剤は結合を弱めた(図5のD)。トランスフェクトした細胞はまた、FnIIドメインに弱い接着を示したが、調べたペプチドと抗体はこの結合を阻害しなかった。野生型のL細胞とLAD−1のいずれもproMMP−9やそのドメインには結合しなかった。
PMNのin vitroでの遊走をトランスウェルフィルターアッセイで研究した。人工的なβ2インテグリンリガンドLLG−C4−GSTで被覆することにより、細胞遊走がβ2インテグリンに依存するようになる(参考文献16,25)。PMAで活性化したPMNのLLG−C4−GST層中での遊走は、GST層中における遊走の5倍であった(図6のA)。HFDDDE(200μM)は、PMAで刺激された細胞の遊走を阻害したが、不活性化細胞の基礎的遊走は阻害しなかった。DDGW、CTT、MEM170(20μg/ml)及び抗MMP−9ポリクロナール抗体(20μg/ml)は類似の活性を示し、PMAで活性化した細胞の遊走のみに影響を与えた。対照ペプチドと対照抗体(抗TAT−2)は効果を示さなかった。内皮貫通遊走アッセイ(transendothelial migration assay)からも同様の結果が得られた(図6のB)。C5aまたはTNF−αによる化学走性によりPMNのトランスマイグレーション(transmigration)が5〜10倍に増加し、また、それをDDGW、HFDDDE及びCTTが阻害したが、対照ペプチドは阻害しなかった。同様に、αM抗体とMMP−9抗体は阻害したが、対照抗体(抗GPA抗体)は阻害しなかった。本発明者らはまた、LLG−C4−GSTで被覆したトランスウェルフィルターを通過するTHP−1白血病細胞の遊走に対して各種ペプチドが与える影響を調べた。結果はPMNの場合におけるのと同じであった。HFDDDE、DDGW及びCTTはTHP−1の遊走を阻害したが、対照ペプチドは阻害しなかった(図6のC)。
DDGWペプチドに関する以前の研究により、DDGWペプチドがTHP−1細胞からproMMP−9を脱離させることができることが示されている(FI2003/0923)。本発明者らはまた、HFDDDEペプチドもproMMP−9を脱離させることができるが、DDGWペプチドを用いた場合ほど有効性が高くないことを見出した(図6のD)。配列を乱したスクランブルペプチドはproMMP−9の脱離を誘導しなかった。16時間のインキュベーションの間、各種ペプチドはproMMP−2の分泌に影響しなかった。
好中球のin vivoでの遊走を調べるために、本発明者らはチオグリコレートで誘発したマウス腹膜炎モデルを用いた。チオグリコレートで刺激してから3時間以内に腹腔に浸潤した細胞の大部分は、クリスタルバイオレット染色によりPMNであると判定された。この炎症モデルにおいては、DDGWペプチドとHFDDDEペプチドは強いin vivo活性を示した(図7のA)。DDGWペプチドまたはHFDDDEペプチドを尻尾へ静脈注射することでPMNの腹腔内蓄積を阻害した。対照として用いたKKGWペプチドとDFEDHDペプチドは効果を示さなかった。DDGWペプチドとHFDDDEペプチドの効果は濃度依存性であり、DDGWペプチドの投与量50μg/マウスとHFDDDEペプチドの投与量500μg/マウスで、90%までの阻害を達成できた。DDGWペプチドは、5μg/マウスの投与量(0.1mg/マウス組織1kgの有効量に相当する)でさえも活性を示した。チオグリコレートで刺激した後、PBSを用いた対照と比較して約20倍のPMNが腹腔内に存在していた。採取した炎症性PMNは、proMMP−9/αMβ2複合体の存在について二重免疫蛍光法で染色した(図7のB)。PBS注射の後に採取した細胞は上記複合体を欠いており、インテグリンを発現していたが、細胞表面MMP−9を有さなかった(図7のC)。採取した腹腔液の上清をザイモグラフィーで分析したところ、PBSの場合と比較して、チオグリコレートがゼラチナーゼレベルの上昇を誘導したことが示された(図7のD)。DDGWペプチドとHFDDDEペプチドは、細胞遊走の阻害にともない、ゼラチナーゼレベルの上昇を防止したが、スクランブルペプチドはそのような活性を示さなかった。
参考文献
1. Dewald, B., R. Rindlerludwig, U. Bretz, and M. Baggiolini. 1975. Subcellular-localization and heterogeneity of neutral proteases in neutrophilic polymorphonuclear leukocytes. J. Exp. Med. 141:709.
2. Murphy, G., U. Bretz, M. Baggiolini, and J. J. Reynolds. 1980. The latent collagenase and gelatinase of human polymorphonuclear neutrophil leukocytes. Biochem. J. 192:517.
3. Kjeldsen, L., O. W. Bjerrum, J. Askaa, and N. Borregaard. 1992. Subcellular-localization and release of human neutrophil gelatinase, confirming the existence of separate gelatinase-containing granules. Biochem. J. 287:603.
4. Opdenakker, G., P. E. van den Steen, and J. van Damme. 2001. Gelatinase B: a tuner and amplifier of immune functions. Trends Immunol. 22:571.
5. Gijbels, K., S. Masure, H. Carton, and G. Opdenakker. 1992. Gelatinase in the cerebrospinal-fluid of patients with multiple-sclerosis and other inflammatory neurological disorders. J. Neuroimmunol. 41:29.
6. Xie, B., A. Laouar, and E. Huberman. 1998. Fibronectin-mediated cell adhesion is required for induction of 92-kDa type IV collagenase/gelatinase (MMP-9) gene expression during macrophage differentiation - The signaling role of protein kinase C-beta. J. Biol. Chem. 273:11576.
7. Liu, J. F., M. Crepin, J. M. Liu, D. Barritault, and D. Ledoux. 2002. FGF-2 and TPA induce matrix metalloproteinase-9 secretion in MCF-7 cells through PKC activation of the Ras/ERK pathway. Biochem. Biophys. Res. Commun. 293:1174.
8. Takafuji, S., A. Ishida, Y. Miyakuni, and T. Nakagawa. 2003. Matrix metalloproteinase-9 release from human leukocytes. J. Invest. Allerg. Clin. Immunol. 13:50.
9. Robinson, S. C., K. A. Scott, and F. R. Balkwill. 2002. Chemokine stimulation of monocyte matrix metalloproteinase-9 requires endogenous TNF-alpha. Eur. J. Immunol. 32:404.
10. Wize, J., I. Sopata, A. Smerdel, and S. Maslinski. 1998. Ligation of selectin L and integrin CD11b/CD18 (Mac-1) induces release of gelatinase B (MMP-9) from human neutrophils. Inflamm. Res. 47:325.
11. Galt, S. W., S. Lindemann, D. Medd, L. L. Allen, L. W. Kraiss, E. S. Harris, S. M. Prescott, T. M. McIntyre, A. S. Weyrich, and G. A. Zimmerman. 2001. Differential regulation of matrix metalloproteinase-9 by monocytes adherent to collagen and platelets. Circ. Res. 89:509.
12. Aoudjit, F., E. F. Potworowski, and Y. St-Pierre. 1998. Bi-directional induction of matrix metalloproteinase-9 and tissue inhibitor of matrix metalloproteinase-1 during T lymphoma endothelial cell contact: Implication of ICAM-1. J. Immunol. 160:2967.
13. Mazzieri, R., L. Masiero, L. Zanetta, S. Monea, M. Onisto, S. Garbisa, and P. Mignatti. 1997. Control of type IV collagenase activity by components of the urokinase-plasmin system: A regulatory mechanism with cell-bound reactants. EMBO J. 16:2319.
14. Ramos-DeSimone, N., E. Hahn-Dantona, J. Sipley, H. Nagase, D. L. French, and J. P. Quigley. 1999. Activation of matrix metalloproteinase-9 (MMP-9) via a converging plasmin/stromelysin-1 cascade enhances tumor cell invasion. J. Biol. Chem. 274:13066.
15. Owen, C. A., Z. M. Hu, B. Barrick, and S. D. Shapiro. 2003. Inducible expression of TIMP-resistant matrix metalloproteinase-9 on the cell surface of neutrophils. Am. J. Respir. Cell Mol. Biol. 29:283.
16. Stefanidakis, M., M. Bjorklund, E. Ihanus, C. G. Gahmberg, and E. Koivunen. 2003. Identification of a negatively charged peptide motif within the catalytic domain of progelatinases that mediates binding to leukocyte b2 integrins. J. Biol. Chem. 278:34674.
17. Dustin, M. L., and T. A. Springer. 1989. T-cell receptor cross-linking transiently stimulates adhesiveness through LFA-1. Nature 341:619.
18. Gahmberg, C. G. 1997. Leukocyte adhesion: CD11/CD18 integrins and intercellular adhesion molecules. Curr. Opin. Cell Biol. 9:643.
19. Springer, T. A. 1990. Adhesion receptors of the immune-system. Nature 346:425.
20. Fagerholm, S., T. J. Hilden, and C. G. Gahmberg. 2002. Lck tyrosine kinase is important for activation of the CD11a/CD18-integrins in human T lymphocytes. Eur. J. Immunol. 32:1670.
21. Sengelov, H., P. Follin, L. Kjeldsen, K. Lollike, C. Dahlgren, and N. Borregaard. 1995. Mobilization of granules and secretory vesicles during in-vivo exudation of human neutrophils. J. Immunol. 154:4157.
22. Boyum, A. 1968. Isolation of mononuclear cells and granulocytes from human blood. Isolation of mononuclear cells by one centrifugation and of granulocytes by combining centrifugation and sedimentation at 1g. Scand. J. Clin. Lab Invest. 97:77.
23. Mustjoki, S., R. Alitalo, E. Elonen, O. Carpen, C. G. Gahmberg, and A. Vaheri. 2001. Intercellular adhesion molecule-1 in extravasation of normal mononuclear and leukaemia cells. Br. J. Haematol. 113:989.
24. Koivunen, E., W. Arap, H. Valtanen, A. Rainisalo, O. P. Medina, P. Heikkila, C. Kantor, C. G. Gahmberg, T. Salo, Y. T. Konttinen, T. Sorsa, E. Ruoslahti, and R. Pasqualini. 1999. Tumor targeting with a selective gelatinase inhibitor. Nat. Biotechnol. 17:768.
25. Koivunen, E., T. M. Ranta, A. Annila, S. Taube, A. Uppala, M. Jokinen, G. van Willigen, E. Ihanus, and C. G. Gahmberg. 2001. Inhibition of beta(2) integrin-mediated leukocyte cell adhesion by leucine-leucine-glycine motif-containing peptides. J. Cell Biol. 153:905.
26. Hermand, P., M. Huet, I. Callebaut, P. Gane, E. Ihanus, C. G. Gahmberg, J. P. Cartron, and P. Bailly. 2000. Binding sites of leukocyte beta(2) integrins (LFA-1, Mac-1) on the human ICAM-4/LW blood group protein. J. Biol. Chem. 275:26002.
27. Sorsa, T., T. Salo, E. Koivunen, J. Tyynela, Y. T. Konttinen, U. Bergmann, A. Tuuttila, E. Niemi, O. Teronen, P. Heikkila, H. Tschesche, J. Leinonen, S. Osman, and U. H. Stenman. 1997. Activation of type IV procollagenases by human tumor-associated trypsin-2. J. Biol. Chem. 272:21067.
28. Bjorklund, M., H. Valtanen, H. Savilahti, and E. Koivunen. 2003. Use of intein-directed peptide biosynthesis to improve serum stability and bioactivity of a gelatinase inhibitory peptide. Comb. Chem. High Throughput Screen. 6:29.
29. Kjeldsen, L., H. Sengelov, and N. Borregaard. 1999. Subcellular fractionation of human neutrophils on Percoll density gradients. J. Immunol. Methods 232:131.
30. Ihanus, E., L. Uotila, A. Toivanen, M. Stefanidakis, P. Bailly, J. P. Cartron, and C. G. Gahmberg. 2003. Characterization of ICAM-4 binding to the I domains of the CD11a/CD18 and CD11b/CD18 leukocyte integrins. Eur. J. Biochem. 270:1710.
31. Jokinen, M., C. G. Gahmberg, and L. C. Andersson. 1979. Biosynthesis of the major human red-cell sialoglycoprotein, glycophorin-A, in a continuous cell-line. Nature 279:604.
32. Ajuebor, M. N., A. M. Das, L. Virag, R. J. Flower, C. Szabo, and M. Perretti. 1999. Role of resident peritoneal macrophages and mast cells in chemokine production and neutrophil migration in acute inflammation: Evidence for an inhibitory loop involving endogenous IL-10. J. Immunol. 162:1685.
33. Submitted manuscript: Mikael Bjorklund, Pia Heikkila and Erkki Koivunen. Title: Peptide inhibition of catalytic and noncatalytic activities of matrix metalloproteinase-9 blocks tumor cell migration and invasion.
1. Dewald, B., R. Rindlerludwig, U. Bretz, and M. Baggiolini. 1975. Subcellular-localization and heterogeneity of neutral proteases in neutrophilic polymorphonuclear leukocytes. J. Exp. Med. 141:709.
2. Murphy, G., U. Bretz, M. Baggiolini, and J. J. Reynolds. 1980. The latent collagenase and gelatinase of human polymorphonuclear neutrophil leukocytes. Biochem. J. 192:517.
3. Kjeldsen, L., O. W. Bjerrum, J. Askaa, and N. Borregaard. 1992. Subcellular-localization and release of human neutrophil gelatinase, confirming the existence of separate gelatinase-containing granules. Biochem. J. 287:603.
4. Opdenakker, G., P. E. van den Steen, and J. van Damme. 2001. Gelatinase B: a tuner and amplifier of immune functions. Trends Immunol. 22:571.
5. Gijbels, K., S. Masure, H. Carton, and G. Opdenakker. 1992. Gelatinase in the cerebrospinal-fluid of patients with multiple-sclerosis and other inflammatory neurological disorders. J. Neuroimmunol. 41:29.
6. Xie, B., A. Laouar, and E. Huberman. 1998. Fibronectin-mediated cell adhesion is required for induction of 92-kDa type IV collagenase/gelatinase (MMP-9) gene expression during macrophage differentiation - The signaling role of protein kinase C-beta. J. Biol. Chem. 273:11576.
7. Liu, J. F., M. Crepin, J. M. Liu, D. Barritault, and D. Ledoux. 2002. FGF-2 and TPA induce matrix metalloproteinase-9 secretion in MCF-7 cells through PKC activation of the Ras/ERK pathway. Biochem. Biophys. Res. Commun. 293:1174.
8. Takafuji, S., A. Ishida, Y. Miyakuni, and T. Nakagawa. 2003. Matrix metalloproteinase-9 release from human leukocytes. J. Invest. Allerg. Clin. Immunol. 13:50.
9. Robinson, S. C., K. A. Scott, and F. R. Balkwill. 2002. Chemokine stimulation of monocyte matrix metalloproteinase-9 requires endogenous TNF-alpha. Eur. J. Immunol. 32:404.
10. Wize, J., I. Sopata, A. Smerdel, and S. Maslinski. 1998. Ligation of selectin L and integrin CD11b/CD18 (Mac-1) induces release of gelatinase B (MMP-9) from human neutrophils. Inflamm. Res. 47:325.
11. Galt, S. W., S. Lindemann, D. Medd, L. L. Allen, L. W. Kraiss, E. S. Harris, S. M. Prescott, T. M. McIntyre, A. S. Weyrich, and G. A. Zimmerman. 2001. Differential regulation of matrix metalloproteinase-9 by monocytes adherent to collagen and platelets. Circ. Res. 89:509.
12. Aoudjit, F., E. F. Potworowski, and Y. St-Pierre. 1998. Bi-directional induction of matrix metalloproteinase-9 and tissue inhibitor of matrix metalloproteinase-1 during T lymphoma endothelial cell contact: Implication of ICAM-1. J. Immunol. 160:2967.
13. Mazzieri, R., L. Masiero, L. Zanetta, S. Monea, M. Onisto, S. Garbisa, and P. Mignatti. 1997. Control of type IV collagenase activity by components of the urokinase-plasmin system: A regulatory mechanism with cell-bound reactants. EMBO J. 16:2319.
14. Ramos-DeSimone, N., E. Hahn-Dantona, J. Sipley, H. Nagase, D. L. French, and J. P. Quigley. 1999. Activation of matrix metalloproteinase-9 (MMP-9) via a converging plasmin/stromelysin-1 cascade enhances tumor cell invasion. J. Biol. Chem. 274:13066.
15. Owen, C. A., Z. M. Hu, B. Barrick, and S. D. Shapiro. 2003. Inducible expression of TIMP-resistant matrix metalloproteinase-9 on the cell surface of neutrophils. Am. J. Respir. Cell Mol. Biol. 29:283.
16. Stefanidakis, M., M. Bjorklund, E. Ihanus, C. G. Gahmberg, and E. Koivunen. 2003. Identification of a negatively charged peptide motif within the catalytic domain of progelatinases that mediates binding to leukocyte b2 integrins. J. Biol. Chem. 278:34674.
17. Dustin, M. L., and T. A. Springer. 1989. T-cell receptor cross-linking transiently stimulates adhesiveness through LFA-1. Nature 341:619.
18. Gahmberg, C. G. 1997. Leukocyte adhesion: CD11/CD18 integrins and intercellular adhesion molecules. Curr. Opin. Cell Biol. 9:643.
19. Springer, T. A. 1990. Adhesion receptors of the immune-system. Nature 346:425.
20. Fagerholm, S., T. J. Hilden, and C. G. Gahmberg. 2002. Lck tyrosine kinase is important for activation of the CD11a/CD18-integrins in human T lymphocytes. Eur. J. Immunol. 32:1670.
21. Sengelov, H., P. Follin, L. Kjeldsen, K. Lollike, C. Dahlgren, and N. Borregaard. 1995. Mobilization of granules and secretory vesicles during in-vivo exudation of human neutrophils. J. Immunol. 154:4157.
22. Boyum, A. 1968. Isolation of mononuclear cells and granulocytes from human blood. Isolation of mononuclear cells by one centrifugation and of granulocytes by combining centrifugation and sedimentation at 1g. Scand. J. Clin. Lab Invest. 97:77.
23. Mustjoki, S., R. Alitalo, E. Elonen, O. Carpen, C. G. Gahmberg, and A. Vaheri. 2001. Intercellular adhesion molecule-1 in extravasation of normal mononuclear and leukaemia cells. Br. J. Haematol. 113:989.
24. Koivunen, E., W. Arap, H. Valtanen, A. Rainisalo, O. P. Medina, P. Heikkila, C. Kantor, C. G. Gahmberg, T. Salo, Y. T. Konttinen, T. Sorsa, E. Ruoslahti, and R. Pasqualini. 1999. Tumor targeting with a selective gelatinase inhibitor. Nat. Biotechnol. 17:768.
25. Koivunen, E., T. M. Ranta, A. Annila, S. Taube, A. Uppala, M. Jokinen, G. van Willigen, E. Ihanus, and C. G. Gahmberg. 2001. Inhibition of beta(2) integrin-mediated leukocyte cell adhesion by leucine-leucine-glycine motif-containing peptides. J. Cell Biol. 153:905.
26. Hermand, P., M. Huet, I. Callebaut, P. Gane, E. Ihanus, C. G. Gahmberg, J. P. Cartron, and P. Bailly. 2000. Binding sites of leukocyte beta(2) integrins (LFA-1, Mac-1) on the human ICAM-4/LW blood group protein. J. Biol. Chem. 275:26002.
27. Sorsa, T., T. Salo, E. Koivunen, J. Tyynela, Y. T. Konttinen, U. Bergmann, A. Tuuttila, E. Niemi, O. Teronen, P. Heikkila, H. Tschesche, J. Leinonen, S. Osman, and U. H. Stenman. 1997. Activation of type IV procollagenases by human tumor-associated trypsin-2. J. Biol. Chem. 272:21067.
28. Bjorklund, M., H. Valtanen, H. Savilahti, and E. Koivunen. 2003. Use of intein-directed peptide biosynthesis to improve serum stability and bioactivity of a gelatinase inhibitory peptide. Comb. Chem. High Throughput Screen. 6:29.
29. Kjeldsen, L., H. Sengelov, and N. Borregaard. 1999. Subcellular fractionation of human neutrophils on Percoll density gradients. J. Immunol. Methods 232:131.
30. Ihanus, E., L. Uotila, A. Toivanen, M. Stefanidakis, P. Bailly, J. P. Cartron, and C. G. Gahmberg. 2003. Characterization of ICAM-4 binding to the I domains of the CD11a/CD18 and CD11b/CD18 leukocyte integrins. Eur. J. Biochem. 270:1710.
31. Jokinen, M., C. G. Gahmberg, and L. C. Andersson. 1979. Biosynthesis of the major human red-cell sialoglycoprotein, glycophorin-A, in a continuous cell-line. Nature 279:604.
32. Ajuebor, M. N., A. M. Das, L. Virag, R. J. Flower, C. Szabo, and M. Perretti. 1999. Role of resident peritoneal macrophages and mast cells in chemokine production and neutrophil migration in acute inflammation: Evidence for an inhibitory loop involving endogenous IL-10. J. Immunol. 162:1685.
33. Submitted manuscript: Mikael Bjorklund, Pia Heikkila and Erkki Koivunen. Title: Peptide inhibition of catalytic and noncatalytic activities of matrix metalloproteinase-9 blocks tumor cell migration and invasion.
配列番号1 インテグリンIドメイン結合テトラペプチド
配列番号2 インテグリンIドメイン結合ヘキサペプチド
配列番号3 環状CTTペプチド
配列番号4 CTTペプチドのAla置換体
配列番号5 LLG−C4ペプチド
配列番号6 DDGW全長配列
配列番号7 DDGWの対照ペプチド
配列番号8 KKGW全長ペプチド
配列番号9 HFDDDEペプチドに対する、スクランブル(配列並べ替え)による対照ペプチド
配列番号10 インテグリンと相互作用する部位
配列番号2 インテグリンIドメイン結合ヘキサペプチド
配列番号3 環状CTTペプチド
配列番号4 CTTペプチドのAla置換体
配列番号5 LLG−C4ペプチド
配列番号6 DDGW全長配列
配列番号7 DDGWの対照ペプチド
配列番号8 KKGW全長ペプチド
配列番号9 HFDDDEペプチドに対する、スクランブル(配列並べ替え)による対照ペプチド
配列番号10 インテグリンと相互作用する部位
Claims (9)
- ヘキサペプチド配列 HFDDDEを有する化合物。
- 請求項1の化合物を有効成分として含有する医薬。
- 請求項1の化合物を有効成分として含有する、好中球遊走の阻害剤。
- 請求項1の化合物を有効成分として含有する、炎症性病態の予防及び治療のための医薬。
- 請求項1の化合物と薬学的に許容される担体とを含んでなる医薬組成物。
- 請求項1の化合物を有効成分として含有する、好中球遊走に起因する病態の予防用及び治療用医薬組成物。
- 請求項1の化合物を有効成分として含有する、炎症性病態の予防用及び治療用医薬組成物。
- 好中球遊走に起因する病態の治療処置または予防処置のための方法であって、ヘキサペプチド配列 HFDDDEを有する化合物を、処置を必要とする哺乳類に対し、好中球遊走を阻害するのに有効な量を投与することを含む方法。
- 炎症性病態の治療処置または予防処置のための方法であって、ヘキサペプチド配列 HFDDDEを有する化合物を、処置を必要とする哺乳類に対し、好中球遊走を阻害するのに有効な量を投与することを含む方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FI20030923A FI20030923A (fi) | 2003-06-19 | 2003-06-19 | Leukosyytti-proMMP-9/beta2-integriinikompleksin inhibiittorit |
| FI20040616A FI20040616A0 (fi) | 2004-04-29 | 2004-04-29 | Solumigraation inhibiittorit |
| PCT/FI2004/000376 WO2004110478A1 (en) | 2003-06-19 | 2004-06-21 | Inhibitors of cell migration |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006527741A true JP2006527741A (ja) | 2006-12-07 |
| JP2006527741A5 JP2006527741A5 (ja) | 2007-08-02 |
Family
ID=33553915
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006516230A Withdrawn JP2006527740A (ja) | 2003-06-19 | 2004-06-21 | 白血球におけるproMMP−9/β2インテグリン複合体の阻害剤 |
| JP2006516231A Withdrawn JP2006527741A (ja) | 2003-06-19 | 2004-06-21 | 細胞遊走の阻害剤 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006516230A Withdrawn JP2006527740A (ja) | 2003-06-19 | 2004-06-21 | 白血球におけるproMMP−9/β2インテグリン複合体の阻害剤 |
Country Status (3)
| Country | Link |
|---|---|
| EP (2) | EP1644032A1 (ja) |
| JP (2) | JP2006527740A (ja) |
| WO (2) | WO2004110477A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012507307A (ja) * | 2008-11-04 | 2012-03-29 | インデックス・ファーマシューティカルズ・アクチエボラーグ | 多形核細胞の動員および/または遊走を減少させる化合物および方法 |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080280833A1 (en) * | 2005-01-31 | 2008-11-13 | Bernard Degryse | Therapeutic Peptides Derived from Urokinase Plasminogen Activator Receptor |
| EP1924595A2 (en) * | 2005-08-12 | 2008-05-28 | Cartela R & D AB | Novel peptides and uses thereof |
| GB2429012A (en) * | 2005-08-12 | 2007-02-14 | Cartela Ab | Polypeptides capable of binding an integrin I-domain. |
| US8003110B1 (en) * | 2011-01-24 | 2011-08-23 | Matthias W. Rath | Metalloproteinase oligopeptides and their therapeutic use |
| CN110650751A (zh) | 2017-03-22 | 2020-01-03 | 儿童医学中心公司 | Lrp1结合剂及其用途 |
| WO2018175765A1 (en) * | 2017-03-22 | 2018-09-27 | Children's Medical Center Corporation | Prss2 inhibition |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5817750A (en) * | 1995-08-28 | 1998-10-06 | La Jolla Cancer Research Foundation | Structural mimics of RGD-binding sites |
| US20030022835A1 (en) * | 1998-04-29 | 2003-01-30 | Genesis Research And Development Corporation Limited | Compositions isolated from skin cells and methods for their use |
| GB9809764D0 (en) * | 1998-05-07 | 1998-07-08 | Isis Innovation | MMP-9 Gene polymorphisms |
| ATE435031T1 (de) * | 1999-07-13 | 2009-07-15 | Univ Southern California | Methode und zusammensetzung zur angiogenese- inhibierung mit antagonisten gegen mmp-9 und beta1-integrine |
| AU4347701A (en) * | 2000-03-01 | 2001-09-12 | Corixa Corp | Compositions and methods for the detection, diagnosis and therapy of hematological malignancies |
| US7034134B2 (en) * | 2001-04-26 | 2006-04-25 | Bristol-Myers Squibb Company | Polynucleotide encoding a novel metalloprotease highly expressed in the testis, MMP-29 |
| AU2002364707A1 (en) * | 2002-04-23 | 2003-11-10 | Duke University | Atherosclerotic phenotype determinative genes and methods for using the same |
-
2004
- 2004-06-21 JP JP2006516230A patent/JP2006527740A/ja not_active Withdrawn
- 2004-06-21 EP EP04742119A patent/EP1644032A1/en not_active Withdrawn
- 2004-06-21 EP EP04742118A patent/EP1644031A1/en not_active Withdrawn
- 2004-06-21 WO PCT/FI2004/000375 patent/WO2004110477A1/en not_active Application Discontinuation
- 2004-06-21 WO PCT/FI2004/000376 patent/WO2004110478A1/en not_active Application Discontinuation
- 2004-06-21 JP JP2006516231A patent/JP2006527741A/ja not_active Withdrawn
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012507307A (ja) * | 2008-11-04 | 2012-03-29 | インデックス・ファーマシューティカルズ・アクチエボラーグ | 多形核細胞の動員および/または遊走を減少させる化合物および方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1644032A1 (en) | 2006-04-12 |
| JP2006527740A (ja) | 2006-12-07 |
| WO2004110478A1 (en) | 2004-12-23 |
| EP1644031A1 (en) | 2006-04-12 |
| WO2004110477A1 (en) | 2004-12-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8158585B2 (en) | Cross-β structure comprising amyloid-binding proteins and methods for detection of the cross-β structure, for modulating cross-β structures fiber formation and modulating cross-β structure-mediated toxicity | |
| Brownstein et al. | Annexin II mediates plasminogen-dependent matrix invasion by human monocytes: enhanced expression by macrophages | |
| Witko-Sarsat et al. | Presence of Proteinase 3 in Secretory Vesicles: Evidence of a Novel, Highly Mobilizable Intracellular Pool Distinct From Azurophil Granules: Presented in part at the 17th European Workshop on the Cell Biology of Phagocytes, Catania, Italy, May 1998. | |
| Noh et al. | Role of urokinase receptor in tumor progression and development | |
| Stefanidakis et al. | Intracellular and cell surface localization of a complex between αMβ2 integrin and promatrix metalloproteinase-9 progelatinase in neutrophils | |
| US20070003552A1 (en) | Cross-beta structure comprising amyloid binding proteins and methods for detection of the cross-beta structure, for modulating cross-beta structures fibril formation and for modulating cross-beta structure-mediated toxicity and method for interfering with blood coagulation | |
| CA2233670C (en) | Mutant plasminogen activator-inhibitor type 1 (pai-1) and uses thereof | |
| Rostagno et al. | Chromosome 13 dementias | |
| JP2014237651A (ja) | 活性化プロテインcおよび不活性化プロテインcに対するモノクロナール抗体 | |
| KR101154550B1 (ko) | 폰 빌레브란트 인자 특이적 절단 효소에 대한 항체 및그것을 이용한 분석계 | |
| Deryugina et al. | Prointegrin maturation follows rapid trafficking and processing of MT1‐MMP in Furin‐Negative Colon Carcinoma LoVo Cells | |
| Talamagas et al. | Abeta (1–40)-induced secretion of matrix metalloproteinase-9 results in sAPPα release by association with cell surface APP | |
| JP2006527741A (ja) | 細胞遊走の阻害剤 | |
| Engelholm et al. | The urokinase receptor associated protein (uPARAP/endo180): a novel internalization receptor connected to the plasminogen activation system | |
| EP1313504B1 (en) | Methods and compositions for inhibiting angiogenesis | |
| US20070099839A1 (en) | Inhibitors of cell migration | |
| Ossowski et al. | The role of plasminogen activator receptor in cancer invasion and dormancy. | |
| Bai et al. | Cathepsins in atherosclerosis | |
| CN114981661A (zh) | 用于诊断与嗜中性粒细胞胞外陷阱相关的纤溶功能不全的方法 | |
| Reid | Plasminogen activators and their inhibitor synthesized by human mesangial cells and other cell types | |
| Kelly | A neutral protease of the neutrophil surface: role in the proteolysis of C-reactive protein and fibrinogen | |
| Gómez-Rodríguez | Role of matrix metalloproteinase-10 after hindlimb ischemia | |
| Williams | A novel proinflammatory role for annexin A1 in neutrophil transendothelial migration. | |
| Leong | The PAI-1-vitronectin-vimentin ternary complex: mechanism of extracellular assembly and role in transplant vasculopathy | |
| Gellert | uPAR interaction and regulation of natural killer cell integrins: Implications for the modulation of NK cell migration and invasion |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070618 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070618 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20071012 |