発明の概要
ある種の態様として、本発明により、本明細書で「アドザイム」と呼ぶ、新しい部類の遺伝子工学的に改変されたタンパク質構築物、ならびにアドザイムの使用および生成に関連した方法および組成物が提供される。アドザイムは、一つまたは複数の触媒ドメインを一つまたは複数の標的化部分(または「アドレス」)と連結するキメラタンパク質構築物である。アドザイムの触媒ドメインは、例えば、切断、化学修飾(転換)または異性化により、予め選択した基質(「標的」または「標的基質」)を一つまたは複数の産物に変換する反応を触媒する酵素的に活性な部位を有する。そのような産物は、基質に対する活性が変化し、任意に活性が増加もしくは減少しているかまたは質的に異なる活性を有する可能性がある。
ある種の局面として、本発明により、基質を一つまたは複数の産物に変換する化学反応を触媒する触媒ドメインと、基質上のまたは基質の機能する近傍のアドレス部位に可逆的に結合する標的化部分とを含むアドザイムが提供される。標的化部分は、アドレス部位と可逆的に結合することが好ましい。任意に、前記の標的化部分と前記の触媒ドメインは、相互に対し異種である。一般に、前記の標的化部分は、単独で与えられた場合、基質に結合し、および前記の触媒ドメインは、単独で与えられた場合、前記の基質を一つまたは複数の産物に変換する化学反応を触媒する。
ある種の態様として、アドザイムの触媒ドメインと標的化ドメインは、ポリペプチドリンカーで連結されて、融合タンパク質を形成する。融合タンパク質は、化学結合および同時翻訳を含む、さまざまな方法で作り出すことができる。好ましい態様として、融合タンパク質は、組換え核酸によりコードされる同時翻訳融合タンパク質である。ある種の態様として、融合タンパク質のリンカーは、非構造化ペプチドである。任意に、リンカーはSer4GlyまたはSerGly4の繰り返しを一個または複数個含む。好ましい態様として、リンカーは、アドザイムが、触媒ドメインまたは標的化部分単独よりも基質に対して効果的であるような、触媒ドメインと標的化部分との間の立体構造を与えるように選択される。例えば、リンカーは、アドザイムが基質との反応に関して、触媒ドメインまたは標的化部分よりも強力であるように選択することができる。リンカーは、標的化部分が基質を酵素ドメインに、標的化部分がない場合に存在すると思われるよりも少なくとも5倍高い有効濃度で提示するように選択することができる。
ある種の態様として、アドザイムは、触媒ドメインと標的化部分が基質に対し有効となる幾何学的配置で、免疫グロブリンの定常ドメインを含む免疫グロブリンの少なくとも一部分に連結される、免疫グロブリン融合体である。例えば、アドザイムは、免疫グロブリン重鎖の定常部と触媒ドメインとを含む第一融合タンパク質および免疫グロブリン重鎖の定常部と基質上のまたは基質の機能する近傍のアドレス部位と可逆的に結合する標的化ドメインとを含む第二融合タンパク質を含むことができる。免疫グロブリン部分は、ジスルフィド結合により二量体化するFc部分であることが好ましい。
ある種の態様として、アドザイムは、基質との反応に関して、一つまたは複数の所望の特性を有するように設計される。多くの場合、そのような特性は、アドザイムの所望の効果を基質に及ぼすのに重要であると思われる。例えば、アドザイムは、触媒ドメインまたは標的化部分単独の効力よりも少なくとも2倍高い、および好ましくは触媒ドメインまたは標的化部分単独の効力よりも少なくとも3、5、10、20倍またはそれ以上高い効力を有することができる。アドザイムは、103 M-1s-1またはそれ以上のkon、および任意に104 M-1s-1、105 M-1s-1、106 M-1s-1、107 M-1s-1またはそれ以上のkonを有することができる。アドザイムは、0.1 sec-1またはそれ以上のkcat、および任意に1 sec-1、10 sec-1、50 sec-1またはそれ以上のkcatを有することができる。アドザイムは、触媒ドメインのKmよりも少なくとも5、10、25、50もしくは100倍またはそれ以上低いKDを有することができる。アドザイムは、10-4 sec-1またはそれ以上のkoff、および任意に10-3 sec-1、10-2 sec-1、またはそれ以上のkoffを有することができる。アドザイムは、触媒ドメイン単独の触媒効率よりも少なくとも5倍高い触媒効率、および任意に触媒ドメインのものよりも少なくとも10倍、20倍、50倍または100倍高い触媒効率を有することができる。アドザイムは、触媒ドメイン単独のKmよりも少なくとも5倍、10倍、20倍、50倍または100倍低いKmを有することができる。アドザイムは、実際の基質濃度よりも少なくとも5倍、10倍、20倍、50倍または100倍高い有効基質濃度を有することができる。ある種の好ましい態様として、アドザイムは、上記の特性のうちの二つまたはそれ以上を組み合わせるように設計されるものと思われる。
触媒ドメインのなかには、選択の基質に対して所望の効果を達成するいずれかの酵素ドメインを本質的に含めることができる。触媒ドメインは、基質のペンダント基の一つまたは複数を修飾するように選択することができる。基質は不斉原子を含むことができ、および触媒ドメインは立体異性体の比率を変化させることができる。触媒ドメインは、ポリペプチド基質の翻訳後修飾、例えば、グリコシル化、リン酸化、硫酸化、脂肪酸修飾、アルキル化、プレニル化またはアシル化のレベルを変化させることができる。選択できる酵素ドメインの例には、プロテアーゼ、エステラーゼ、アミダーゼ、ラクタマーゼ、セルラーゼ、オキシダーゼ、オキシドレダクターゼ、レダクターゼ、トランスフェラーゼ、ヒドロラーゼ、イソメラーゼ、リガーゼ、リパーゼ、ホスホリパーゼ、ホスファターゼ、キナーゼ、スルファターゼ、リゾチーム、グリコシダーゼ、ヌクレアーゼ、アルドラーゼ、ケトラーゼ、リアーゼ、シクラーゼ、リバース・トランスクリプターゼ、ヒアルロニダーゼ、アミラーゼ、セレブロシダーゼおよびキチナーゼが含まれる。触媒ドメインのタイプにかかわらず、アドザイムは、特に被検体に投与される溶液中のアドザイム濃度にほぼ等しいアドザイム濃度で、自己触媒反応(例えば、分子間または分子内反応)に抵抗性であることが望ましいかもしれない。ある種の態様として、アドザイムは、化学反応の産物が基質のアンタゴニストとなるように、基質に作用する。
ある種の好ましい態様として、アドザイムの触媒ドメインには、活性時に、ポリペプチド基質の少なくとも一つのペプチド結合を切断する、プロテアーゼドメインが含まれる。一般に、アドザイムは、プロテアーゼの触媒ドメインによる切断に抵抗性となるように設計することが望ましいものと思われる。プロテアーゼドメインは、酵素前駆体(不活性型)として作製し、その後、使用前に活性化することができる。アドザイムは、可逆的プロテアーゼ阻害剤の存在下で細胞培養物から精製することができ、そのような阻害剤は、その後の加工処理または保存作業において含有されていてもよい。
標的化部分には、アドレス部位(例えば、直接型アドザイム(direct adzyme)の場合には基質上のまたは近接型アドザイム(proximity adzyme)の場合には、基質の機能する近傍に生ずる分子上の)に結合するいずれかの分子または分子会合体を本質的に含めることができる。多くの態様の場合、標的化部分には、ポリペプチドまたはポリペプチド複合体、特に抗体または抗体の抗原結合部位を含むポリペプチドが含まれるものと思われる。例えば、標的化部分には、モノクローナル抗体、FabおよびF(ab)2、scFv、重鎖可変領域および軽鎖可変領域を含めることができる。任意に、標的化部分は、基質に結合するように遺伝子工学的に改変された人工タンパク質またはペプチド配列である。ある種の態様として、標的化部分は、ポリアニオン系またはポリカチオン系結合物質である。任意に、標的化部分は、オリゴヌクレオチド、ポリサッカライドまたはレクチンである。ある種の態様として、基質は受容体であり、標的化部分は受容体に結合するリガンド(またはその結合部分)を含む。ある種の態様として、基質は受容体リガンドであり、標的化部分は受容体のリガンド結合部分、特に可溶性のリガンド結合部分を含む。
アドザイムは、治療用途、工業的用途、環境用途および微細加工での用途を含む、さまざまな技術的用途で、本質的にいずれかの敏感に反応する基質を標的とするのに使用することができる。好ましい態様として、アドザイムの基質は、齧歯類、ヒト以外の霊長類またはヒトのような哺乳動物由来である。好ましい態様として、基質は、ヒト患者に内在する。ある種の態様として、基質は、細胞により産生される生体分子、例えば、ポリペプチド、ポリサッカライド、核酸、脂質、または小分子である。ある種の態様として、基質は、拡散性の細胞外分子、および好ましくは受容体を介した細胞シグナル伝達を誘発する細胞外または細胞内受容体に作用できる細胞外シグナル伝達分子である。任意に、細胞外シグナル伝達分子は、炎症性サイトカインのような、細胞外シグナル伝達ポリペプチド分子である。好ましい態様として、基質は、インターロイキン-1(例えば、IL-1α、IL-1β)またはTNF-αである。ある種の態様として、基質は、ポリペプチドホルモン、成長因子および/またはサイトカイン、特に炎症性サイトカインである。任意に、アドザイムは、基質の炎症誘発活性を低下させるように作用する。基質は、以下の中から選択することができる: 4本ヘリックスバンドル因子、EGF様因子、インスリン様因子、β-トレフォイル(trefoil)因子およびシステイン・ノット因子。ある種の態様として、基質は、受容体、特に一部が細胞外表面に露出した受容体である。任意に、基質は、ヘテロマー受容体複合体の特異的受容体サブユニットである。ある種の態様として、基質は、アミロイド沈着または動脈硬化性プラークのような、生体分子による癒着の成分となる生体分子である。ある種の態様として、基質は、細胞内生体分子であって、そのような場合、標的細胞に侵入できるアドザイム、例えば、細胞内へのアドザイムのトランスサイトーシスを促進するトランスサイトーシス部分をさらに含むアドザイムを使用することが望ましいかもしれない。ある種の態様として、基質は、原生動物、真菌、細菌またはウイルスのような、病原体により産生される生体分子である。基質は、プリオンタンパク質とすることができる。好ましい態様として、基質はヒト患者に内在する。そのような態様の場合、アドザイムは、生理学的濃度の豊富なヒト血清タンパク質、例えば、血清アルブミンまたは豊富なグロビンの存在下で基質に対して有効であることが好ましい。
好ましい態様として、アドザイムの基質はTNFαである。直接型アドザイムの場合、標的化部分はTNFαに結合する。触媒ドメインには、TNFα活性を低下させるプロテアーゼが含まれることが好ましい。例えば、プロテアーゼは、以下の中から選択することができる: MT1-MMP; MMP12; トリプターゼ; MT2-MMP; エラスターゼ; MMP7; キモトリプシン; およびトリプシン。標的化部分は、TNFα受容体の可溶性部分およびTNFαに結合する一本鎖抗体の中から選択することができるが、他の標的化部分も可能である。好ましい標的化部分は、TNFα受容体1(TNFR1)のsp55部分である。
別の好ましい態様として、アドザイムの基質は、IL-1αまたはIL-1βのような、インターロイキン-1である。直接型アドザイムの場合、標的化部分は、インターロイキン-1基質に結合する。触媒ドメインには、IL-1の生物活性を低下させるプロテアーゼが含まれることが好ましい。
一つの局面として、本発明により、基質を酵素的に変化させるためのアドザイムであって、前記の基質を一つまたは複数の産物に変換する化学反応を触媒する触媒ドメインと、前記の基質上のアドレス部位とまたは基質の機能する近傍に生ずる第二の分子上のアドレス部位と可逆的に結合する標的化部分とを含み、その際に、前記の標的化部分と前記の触媒ドメインは、相互に対し異種であり、前記の標的化部分は、単独で与えられた場合、基質に結合し、前記の触媒ドメインは、単独で与えられた場合、前記の基質を一つまたは複数の産物に変換する化学反応を触媒し、および前記のアドザイムは、前記の基質との反応に関して、一つまたは複数の所望の特性を有するアドザイムが提供される。例えば、この局面の場合、アドザイムは、触媒ドメインまたは標的化部分単独よりも少なくとも2倍高い、および好ましくは、触媒ドメインまたは標的化部分単独の効力よりも少なくとも3、5、10、20倍またはそれ以上高い効力を有することができる。アドザイムは、103 M-1s-1またはそれ以上のkon、および任意に104 M-1s-1、105 M-1s-1、106 M-1s-1、107 M-1s-1またはそれ以上のkonを有することができる。アドザイムは、0.1 sec-1またはそれ以上のkcat、および任意に1 sec-1、10 sec-1、50 sec-1またはそれ以上のkcatを有することができる。アドザイムは、触媒ドメインのKmよりも少なくとも5、10、25、50もしくは100倍またはそれ以上低いKDを有することができる。アドザイムは、10-4 sec-1またはそれ以上のkoff、および任意に10-3 sec-1のkoff、10-2 sec-1、またはそれ以上のkoffを有することができる。アドザイムは、触媒ドメイン単独の触媒効率よりも少なくとも5倍高い触媒効率、および任意に触媒ドメインのものよりも少なくとも10倍、20倍、50倍または100倍高い触媒効率を有することができる。アドザイムは、触媒ドメイン単独のKmよりも少なくとも5倍、10倍、20倍、50倍または100倍低いKmを有することができる。アドザイムは、実際の基質濃度よりも少なくとも5倍、10倍、20倍、50倍または100倍高い有効基質濃度を有することができる。ある種の好ましい態様として、アドザイムは、上記の特性のうちの二つまたはそれ以上を組み合わせるように設計されるものと思われる。
基質分子との反応に関してそのような特性の一つまたは複数を有するアドザイムのある種の態様として、アドザイムの触媒ドメインと標的化ドメインは、ポリペプチドおよびリンカーで連結されて、融合タンパク質を形成する。融合タンパク質は、化学結合および同時翻訳を含む、さまざまな方法で作り出すことができる。好ましい態様として、融合タンパク質は、組換え核酸によりコードされる同時翻訳融合タンパク質である。ある種の態様として、融合タンパク質のリンカーは、非構造化ペプチドである。任意に、リンカーはSer4GlyまたはSerGly4の繰り返しを一個または複数個含む。好ましい態様として、リンカーは、アドザイムが、触媒ドメインまたは標的化部分単独よりも基質に対して効果的であるような、触媒ドメインと標的化部分との間の立体構造を与えるように選択される。例えば、リンカーは、アドザイムが基質との反応に関して、触媒ドメインまたは標的化部分よりも強力であるように選択することができる。リンカーは、標的化部分が基質を酵素ドメインに、標的化部分がない場合に存在すると思われるよりも少なくとも5倍高い有効濃度で提示するように選択することができる。
そのような特性の一つまたは複数を有するアドザイムのある種の態様として、アドザイムは、触媒ドメインと標的化部分が基質に対し有効となる幾何学的配置で、免疫グロブリンの定常ドメインを含む免疫グロブリンの少なくとも一部分に連結される、免疫グロブリン融合体である。例えば、アドザイムは、免疫グロブリン重鎖の定常部と触媒ドメインとを含む第一融合タンパク質および免疫グロブリン重鎖の定常部と基質上のまたは基質の機能する近傍のアドレス部位と可逆的に結合する標的化ドメインとを含む第二融合タンパク質を含むことができる。免疫グロブリン部分は、ジスルフィド結合により二量体化するFc部分であることが好ましい。
そのような特性の一つまたは複数を有するアドザイムのある種の態様として、触媒ドメインのなかには、選択の基質に対して所望の効果を達成するいずれかの酵素ドメインを本質的に含めることができる。触媒ドメインは、基質のペンダント基の一つまたは複数を修飾するように選択することができる。基質は不斉原子を含むことができ、および触媒ドメインは立体異性体の比率を変化させることができる。触媒ドメインは、ポリペプチド基質の翻訳後修飾、例えば、グリコシル化、リン酸化、硫酸化、脂肪酸修飾、アルキル化、プレニル化またはアシル化のレベルを変化させることができる。選択できる酵素ドメインの例には、プロテアーゼ、エステラーゼ、アミダーゼ、ラクタマーゼ、セルラーゼ、オキシダーゼ、オキシドレダクターゼ、レダクターゼ、トランスフェラーゼ、ヒドロラーゼ、イソメラーゼ、リガーゼ、リパーゼ、ホスホリパーゼ、ホスファターゼ、キナーゼ、スルファターゼ、リゾチーム、グリコシダーゼ、ヌクレアーゼ、アルドラーゼ、ケトラーゼ、リアーゼ、シクラーゼ、リバース・トランスクリプターゼ、ヒアルロニダーゼ、アミラーゼ、セレブロシダーゼおよびキチナーゼが含まれる。触媒ドメインのタイプにかかわらず、アドザイムは、特に被検体に投与される溶液中のアドザイム濃度にほぼ等しいアドザイム濃度で、自己触媒反応(例えば、分子間または分子内反応)に抵抗性であることが望ましいかもしれない。ある種の態様として、アドザイムは、化学反応の産物が基質のアンタゴニストとなるように、基質に作用する。
基質との反応に関して上記の特性の一つまたは複数を有するアドザイムのある種の好ましい態様として、アドザイムには、活性時に、ポリペプチド基質の少なくとも一つのペプチド結合を切断する、プロテアーゼドメインが含まれる。一般に、アドザイムは、プロテアーゼの触媒ドメインによる切断に抵抗性となるように設計することが望ましいものと思われる。プロテアーゼドメインは、酵素前駆体(不活性型)として作製し、その後、使用前に活性化することができる。アドザイムは、可逆的プロテアーゼ阻害剤の存在下で細胞培養物から精製することができ、そのような阻害剤は、その後の加工処理または保存作業において含有されていてもよい。
基質との反応に関して上記の特性の一つまたは複数を有するアドザイムのある種の態様として、標的化部分には、アドレス部位(例えば、直接型アドザイムの場合には基質上のまたは近接型アドザイムの場合には、基質の機能する近傍に生ずる分子上の)に結合するいずれかの分子または分子会合体を本質的に含めることができる。多くの態様の場合、標的化部分には、ポリペプチドまたはポリペプチド複合体、特に抗体または抗体の抗原結合部位を含むポリペプチドが含まれるものと思われる。例えば、標的化部分には、モノクローナル抗体、FabおよびF(ab)2、scFv、重鎖可変領域および軽鎖可変領域を含めることができる。任意に、標的化部分は、基質に結合するように遺伝子工学的に改変された人工タンパク質またはペプチド配列である。ある種の態様として、標的化部分は、ポリアニオン系またはポリカチオン系結合物質である。任意に、標的化部分は、オリゴヌクレオチド、ポリサッカライドまたはレクチンである。ある種の態様として、基質は受容体であり、標的化部分は受容体に結合するリガンド(またはその結合部分)を含む。ある種の態様として、基質は受容体リガンドであり、標的化部分は受容体のリガンド結合部分、特に可溶性のリガンド結合部分を含む。
基質との反応に関して上記の特性の一つまたは複数を有するアドザイムのある種の態様として、基質は、細胞により産生される生体分子、例えば、ポリペプチド、ポリサッカライド、核酸、脂質、または小分子である。ある種の態様として、基質は、拡散性の細胞外分子、および好ましくは受容体を介した細胞シグナル伝達を誘発する細胞外または細胞内受容体に作用できる細胞外シグナル伝達分子である。任意に、細胞外シグナル伝達分子は、炎症性サイトカインのような、細胞外シグナル伝達ポリペプチド分子である。好ましい態様として、基質は、インターロイキン-1(例えば、IL-1α、IL-1β)またはTNF-αである。ある種の態様として、基質は、ポリペプチドホルモン、成長因子および/またはサイトカイン、特に炎症性サイトカインである。任意に、アドザイムは、基質の炎症誘発活性を低下させるように作用する。基質は、4本ヘリックスバンドル因子、EGF様因子、インスリン様因子、β-トレフォイル因子およびシステイン・ノット因子からなる群より選択することができる。ある種の態様として、基質は、受容体、特に一部が細胞外表面に露出した受容体である。任意に、基質は、ヘテロマー受容体複合体の特異的受容体サブユニットである。ある種の態様として、生体分子は、アミロイド沈着または動脈硬化性プラークのような、生体分子による癒着の成分である。ある種の態様として、基質は、細胞内生体分子であって、そのような場合、標的細胞に侵入できるアドザイム、例えば、細胞内へのアドザイムのトランスサイトーシスを促進するトランスサイトーシス部分をさらに含むアドザイムを使用することが望ましいかもしれない。ある種の態様として、基質は、原生動物、真菌、細菌またはウイルスのような、病原体により産生される生体分子である。基質は、プリオンタンパク質とすることができる。好ましい態様として、基質はヒト患者に内在する。そのような態様の場合、アドザイムは、生理学的濃度の豊富なヒト血清タンパク質、例えば、血清アルブミンまたは豊富なグロビンの存在下で基質に対して有効であることが好ましい。
基質との反応に関して上記の特性の一つまたは複数を有するアドザイムの好ましい態様として、アドザイムの基質はTNFαである。直接型アドザイムの場合、標的化部分はTNFαに結合する。触媒ドメインには、TNFα活性を低下させるプロテアーゼが含まれることが好ましい。例えば、プロテアーゼは、以下の中から選択することができる: MT1-MMP; MMP12; トリプターゼ; MT2-MMP; エラスターゼ; MMP7; キモトリプシン; およびトリプシン。標的化部分は、TNFα受容体の可溶性部分およびTNFαに結合する一本鎖抗体の中から選択することができるが、他の標的化部分も可能である。好ましい標的化部分は、TNFα受容体1(TNFR1)のsp55部分である。
基質との反応に関して上記の特性の一つまたは複数を有するアドザイムの別の好ましい態様として、アドザイムの基質は、IL-1αまたはIL-1βのような、インターロイキン-1である。直接型アドザイムの場合、標的化部分は、インターロイキン-1基質に結合する。触媒ドメインには、IL-1の生物活性を低下させるプロテアーゼが含まれることが好ましい。
一つの局面として、本発明により、基質を酵素的に変化させるためのアドザイムであって、前記の基質を一つまたは複数の産物に変換する化学反応を触媒する触媒ドメインと、前記の基質上のアドレス部位とまたは基質の機能する近傍に生ずる第二の分子上のアドレス部位と可逆的に結合する標的化部分とを含み、その際に、基質は細胞外シグナル伝達分子であり、前記の標的化部分と前記の触媒ドメインは、相互に対し異種であり、前記の標的化部分は、単独で与えられた場合、基質に結合し、前記の触媒ドメインは、単独で与えられた場合、前記の基質を一つまたは複数の産物に変換する化学反応を触媒し、および前記のキメラタンパク質構築物は、前記の基質との反応に関して、前記の触媒ドメインまたは標的化部分よりも効力があるアドザイムが提供される。
細胞外シグナル伝達分子を標的とするアドザイムのある種の態様として、アドザイムの触媒ドメインと標的化ドメインは、ポリペプチドおよびリンカーで連結されて、融合タンパク質を形成する。融合タンパク質は、化学結合および同時翻訳を含む、さまざまな方法で作り出すことができる。好ましい態様として、融合タンパク質は、組換え核酸によりコードされる同時翻訳融合タンパク質である。ある種の態様として、融合タンパク質のリンカーは、非構造化ペプチドである。任意に、リンカーはSer4GlyまたはSerGly4の繰り返しを一個または複数個含む。好ましい態様として、リンカーは、アドザイムが、触媒ドメインまたは標的化部分単独よりも基質に対して効果的であるような、触媒ドメインと標的化部分との間の立体構造を与えるように選択される。例えば、リンカーは、アドザイムが基質との反応に関して、触媒ドメインまたは標的化部分よりも強力であるように選択することができる。リンカーは、標的化部分が基質を酵素ドメインに、標的化部分がない場合に存在すると思われるよりも少なくとも5倍高い有効濃度で提示するように選択することができる。
細胞外シグナル伝達分子を標的とするアドザイムのある種の態様として、アドザイムは、触媒ドメインと標的化部分が基質に対し有効となる幾何学的配置で、免疫グロブリンの定常ドメインを含む免疫グロブリンの少なくとも一部分に連結される、免疫グロブリン融合体である。例えば、アドザイムは、免疫グロブリン重鎖の定常部と触媒ドメインとを含む第一融合タンパク質および免疫グロブリン重鎖の定常部と基質上のまたは基質の機能する近傍のアドレス部位と可逆的に結合する標的化ドメインとを含む第二融合タンパク質を含むことができる。免疫グロブリン部分は、ジスルフィド結合により二量体化するFc部分であることが好ましい。
細胞外シグナル伝達分子を標的とするアドザイムのある種の態様として、アドザイムは、基質との反応に関して、一つまたは複数の所望の特性を有するように設計される。多くの場合、そのような特性は、アドザイムの所望の効果を基質に及ぼすのに重要であると思われる。例えば、アドザイムは、触媒ドメインまたは標的化部分単独よりも少なくとも2倍高い、および好ましくは触媒ドメインまたは標的化部分単独の効力よりも少なくとも3、5、10、20倍またはそれ以上高い効力を有することができる。アドザイムは、103 M-1s-1またはそれ以上のkon、および任意に104 M-1s-1、105 M-1s-1、106 M-1s-1、107 M-1s-1またはそれ以上のkonを有することができる。アドザイムは、0.1 sec-1またはそれ以上のkcat、および任意に1 sec-1、10 sec-1、50 sec-1またはそれ以上のkcatを有することができる。アドザイムは、触媒ドメインのKmよりも少なくとも5、10、25、50もしくは100倍またはそれ以上低いKDを有することができる。アドザイムは、10-4 sec-1またはそれ以上のkoff、および任意に10-2 sec-1のkoff、10-2 sec-1、またはそれ以上のkoffを有することができる。アドザイムは、触媒ドメイン単独の触媒効率よりも少なくとも5倍高い触媒効率、および任意に触媒ドメインのものよりも少なくとも10倍、20倍、50倍または100倍高い触媒効率を有することができる。アドザイムは、触媒ドメイン単独のKmよりも少なくとも5倍、10倍、20倍、50倍または100倍低いKmを有することができる。アドザイムは、実際の基質濃度よりも少なくとも5倍、10倍、20倍、50倍または100倍高い有効基質濃度を有することができる。ある種の好ましい態様として、アドザイムは、上記の特性のうちの二つまたはそれ以上を組み合わせるように設計されるものと思われる。
細胞外シグナル伝達分子を標的とするアドザイムのある種の態様として、触媒ドメインのなかには、選択の基質に対して所望の効果を達成するいずれかの酵素ドメインを本質的に含めることができる。触媒ドメインは、基質のペンダント基の一つまたは複数を修飾するように選択することができる。基質は不斉原子を含むことができ、および触媒ドメインは立体異性体の比率を変化させることができる。触媒ドメインは、ポリペプチド基質の翻訳後修飾、例えば、グリコシル化、リン酸化、硫酸化、脂肪酸修飾、アルキル化、プレニル化またはアシル化のレベルを変化させることができる。選択できる酵素ドメインの例には、プロテアーゼ、エステラーゼ、アミダーゼ、ラクタマーゼ、セルラーゼ、オキシダーゼ、オキシドレダクターゼ、レダクターゼ、トランスフェラーゼ、ヒドロラーゼ、イソメラーゼ、リガーゼ、リパーゼ、ホスホリパーゼ、ホスファターゼ、キナーゼ、スルファターゼ、リゾチーム、グリコシダーゼ、ヌクレアーゼ、アルドラーゼ、ケトラーゼ、リアーゼ、シクラーゼ、リバース・トランスクリプターゼ、ヒアルロニダーゼ、アミラーゼ、セレブロシダーゼおよびキチナーゼが含まれる。触媒ドメインのタイプにかかわらず、アドザイムは、特に被検体に投与される溶液中のアドザイム濃度にほぼ等しいアドザイム濃度で、自己触媒反応(例えば、分子間または分子内反応)に抵抗性であることが望ましいかもしれない。ある種の態様として、アドザイムは、化学反応の産物が基質のアンタゴニストとなるように、基質に作用する。ある種の態様として、アドザイムは、化学反応の産物が基質のアンタゴニストとなるように、基質に作用する。
細胞外シグナル伝達分子を標的とするアドザイムのある種の好ましい態様として、アドザイムには、活性時に、ポリペプチド基質の少なくとも一つのペプチド結合を切断する、プロテアーゼドメインが含まれる。一般に、アドザイムは、プロテアーゼの触媒ドメインによる切断に抵抗性となるように設計することが望ましいものと思われる。プロテアーゼドメインは、酵素前駆体(不活性型)として作製し、その後、使用前に活性化することができる。アドザイムは、可逆的プロテアーゼ阻害剤の存在下で細胞培養物から精製することができ、そのような阻害剤は、その後の加工処理または保存作業において含有されていてもよい。
細胞外シグナル伝達分子を標的とするアドザイムのある種の態様として、標的化部分には、アドレス部位(例えば、直接型アドザイムの場合には基質上のまたは近接型アドザイムの場合には、基質の機能する近傍に生ずる分子上の)に結合するいずれかの分子または分子会合体を本質的に含めることができる。多くの態様の場合、標的化部分には、ポリペプチドまたはポリペプチド複合体、特に抗体または抗体の抗原結合部位を含むポリペプチドが含まれるものと思われる。例えば、標的化部分には、モノクローナル抗体、FabおよびF(ab)2、scFv、重鎖可変領域および軽鎖可変領域を含めることができる。任意に、標的化部分は、基質に結合するように遺伝子工学的に改変された人工タンパク質またはペプチド配列である。ある種の態様として、標的化部分は、ポリアニオン系またはポリカチオン系結合物質である。任意に、標的化部分は、オリゴヌクレオチド、ポリサッカライドまたはレクチンである。ある種の態様として、基質は受容体リガンドであり、標的化部分は受容体のリガンド結合部分、特に可溶性のリガンド結合部分を含む。
細胞外シグナル伝達分子を標的とするアドザイムのある種の態様として、基質は、受容体を介した細胞シグナル伝達を誘発する細胞外または細胞内受容体に作用する細胞外シグナル伝達分子であることが好ましい。任意に、細胞外シグナル伝達分子は、炎症性サイトカインのような、細胞外シグナル伝達ポリペプチド分子である。好ましい態様として、基質は、インターロイキン-1(例えば、IL-1α、IL-1β)またはTNF-αである。ある種の態様として、基質は、ポリペプチドホルモン、成長因子および/またはサイトカイン、特に炎症性サイトカインである。任意に、アドザイムは、基質の炎症誘発活性を低下させるように作用する。基質は、4本ヘリックスバンドル因子、EGF様因子、インスリン様因子、β-トレフォイル因子およびシステイン・ノット因子からなる群より選択することができる。好ましい態様として、基質はヒト患者に内在する。そのような態様の場合、アドザイムは、生理学的濃度の豊富なヒト血清タンパク質、例えば、血清アルブミンまたは豊富なグロビンの存在下で基質に対して有効であることが好ましい。
細胞外シグナル伝達分子を標的とするアドザイムの好ましい態様として、アドザイムの基質はTNFαである。直接型アドザイムの場合、標的化部分はTNFαに結合する。触媒ドメインには、TNFα活性を低下させるプロテアーゼが含まれることが好ましい。例えば、プロテアーゼは、以下の中から選択することができる: MT1-MMP; MMP12; トリプターゼ; MT2-MMP; エラスターゼ; MMP7; キモトリプシン; およびトリプシン。標的化部分は、TNFα受容体の可溶性部分およびTNFαに結合する一本鎖抗体の中から選択することができるが、他の標的化部分も可能である。好ましい標的化部分は、TNFα受容体1(TNFR1)のsp55部分である。
細胞外シグナル伝達分子を標的とするアドザイムの別の好ましい態様として、アドザイムの基質は、IL-1αまたはIL-1βのような、インターロイキン-1である。直接型アドザイムの場合、標的化部分は、インターロイキン-1基質に結合する。触媒ドメインには、IL-1の生物活性を低下させるプロテアーゼが含まれることが好ましい。
一つの局面として、本発明により、基質を酵素的に変化させるためのアドザイムであって、前記の基質を一つまたは複数の産物に変換する化学反応を触媒する触媒ドメインと、前記の基質上のアドレス部位とまたは基質の機能する近傍に生ずる第二の分子上のアドレス部位と可逆的に結合する標的化ドメインと、前記の触媒ドメインと前記の標的化ドメインとを連結するリンカーとを含むポリペプチドを含み、その際に、前記の基質は受容体であり、前記の標的化部分と前記の触媒ドメインは、相互に対し異種であり、前記の標的化ドメインは、単独で与えられた場合、基質に結合し、前記の触媒ドメインは、単独で与えられた場合、前記の基質を一つまたは複数の産物に変換する化学反応を触媒し、および前記のキメラタンパク質構築物は、前記の基質との反応に関して、前記の触媒ドメインまたは標的化部分よりも効力があるアドザイムが提供される。
受容体を標的とするアドザイムのある種の態様として、アドザイムの触媒ドメインと標的化ドメインは、ポリペプチドおよびリンカーで連結されて、融合タンパク質を形成する。融合タンパク質は、化学結合および同時翻訳を含む、さまざまな方法で作り出すことができる。好ましい態様として、融合タンパク質は、組換え核酸によりコードされる同時翻訳融合タンパク質である。ある種の態様として、融合タンパク質のリンカーは、非構造化ペプチドである。任意に、リンカーはSer4GlyまたはSerGly4の繰り返しを一個または複数個含む。好ましい態様として、リンカーは、アドザイムが、触媒ドメインまたは標的化部分単独よりも基質に対して効果的であるような、触媒ドメインと標的化部分との間の立体構造を与えるように選択される。例えば、リンカーは、アドザイムが基質との反応に関して、触媒ドメインまたは標的化部分よりも強力であるように選択することができる。リンカーは、標的化部分が基質を酵素ドメインに、標的化部分がない場合に存在すると思われるよりも少なくとも5倍高い有効濃度で提示するように選択することができる。
受容体を標的とするアドザイムのある種の態様として、アドザイムは、触媒ドメインと標的化部分が基質に対し有効となる幾何学的配置で、免疫グロブリンの定常ドメインを含む免疫グロブリンの少なくとも一部分に連結される、免疫グロブリン融合体である。例えば、アドザイムは、免疫グロブリン重鎖の定常部と触媒ドメインとを含む第一融合タンパク質および免疫グロブリン重鎖の定常部と基質上のまたは基質の機能する近傍のアドレス部位と可逆的に結合する標的化ドメインとを含む第二融合タンパク質を含むことができる。免疫グロブリン部分は、ジスルフィド結合により二量体化するFc部分であることが好ましい。
受容体を標的とするアドザイムのある種の態様として、基質との反応に関して、アドザイムは、一つまたは複数の所望の特性を有するように設計される(アドザイムは、一つまたは複数の所望の特性を有する)。多くの場合、そのような特性は、アドザイムの所望の効果を基質に及ぼすのに重要であると思われる。例えば、アドザイムは、触媒ドメインまたは標的化部分単独よりも少なくとも2倍高い、および好ましくは触媒ドメインまたは標的化部分単独の効力よりも少なくとも3、5、10、20倍またはそれ以上高い効力を有することができる。アドザイムは、103 M-1s-1またはそれ以上のkon、および任意に104 M-1s-1、105 M-1s-1、106 M-1s-1、107 M-1s-1またはそれ以上のkonを有することができる。アドザイムは、0.1 sec-1またはそれ以上のkcat、および任意に1 sec-1、10 sec-1、50 sec-1またはそれ以上のkcatを有することができる。アドザイムは、触媒ドメインのKmよりも少なくとも5、10、25、50もしくは100倍またはそれ以上低いKDを有することができる。アドザイムは、10-4 sec-1またはそれ以上のkoff、および任意に10-2 sec-1のkoff、10-2 sec-1、またはそれ以上のkoffを有することができる。アドザイムは、触媒ドメイン単独の触媒効率よりも少なくとも5倍高い触媒効率、および任意に触媒ドメインのものよりも少なくとも10倍、20倍、50倍または100倍高い触媒効率を有することができる。アドザイムは、触媒ドメイン単独のKmよりも少なくとも5倍、10倍、20倍、50倍または100倍低いKmを有することができる。アドザイムは、実際の基質濃度よりも少なくとも5倍、10倍、20倍、50倍または100倍高い有効基質濃度を有することができる。ある種の好ましい態様として、アドザイムは、上記の特性のうちの二つまたはそれ以上を組み合わせるように設計されるものと思われる。
受容体を標的とするアドザイムのある種の態様として、触媒ドメインのなかには、選択の基質に対して所望の効果を達成するいずれかの酵素ドメインを本質的に含めることができる。触媒ドメインは、基質のペンダント基の一つまたは複数を修飾するように選択することができる。基質は不斉原子を含むことができ、および触媒ドメインは立体異性体の比率を変化させることができる。触媒ドメインは、ポリペプチド基質の翻訳後修飾、例えば、グリコシル化、リン酸化、硫酸化、脂肪酸修飾、アルキル化、プレニル化またはアシル化のレベルを変化させることができる。選択できる酵素ドメインの例には、プロテアーゼ、エステラーゼ、アミダーゼ、ラクタマーゼ、セルラーゼ、オキシダーゼ、オキシドレダクターゼ、レダクターゼ、トランスフェラーゼ、ヒドロラーゼ、イソメラーゼ、リガーゼ、リパーゼ、ホスホリパーゼ、ホスファターゼ、キナーゼ、スルファターゼ、リゾチーム、グリコシダーゼ、ヌクレアーゼ、アルドラーゼ、ケトラーゼ、リアーゼ、シクラーゼ、リバース・トランスクリプターゼ、ヒアルロニダーゼ、アミラーゼ、セレブロシダーゼおよびキチナーゼが含まれる。触媒ドメインのタイプにかかわらず、アドザイムは、特に被検体に投与される溶液中のアドザイム濃度にほぼ等しいアドザイム濃度で、自己触媒反応(例えば、分子間または分子内反応)に抵抗性であることが望ましいかもしれない。ある種の態様として、アドザイムは、化学反応の産物が基質のアンタゴニストとなるように、基質に作用する。ある種の態様として、アドザイムは、化学反応の産物が基質のアンタゴニストとなるように、基質に作用する。
受容体を標的とするアドザイムのある種の好ましい態様として、アドザイムには、活性時に、ポリペプチド基質の少なくとも一つのペプチド結合を切断する、プロテアーゼドメインが含まれる。一般に、アドザイムは、プロテアーゼの触媒ドメインによる切断に抵抗性となるように設計することが望ましいものと思われる。プロテアーゼドメインは、酵素前駆体(不活性型)として作製し、その後、使用前に活性化することができる。アドザイムは、可逆的プロテアーゼ阻害剤の存在下で細胞培養物から精製することができ、そのような阻害剤は、その後の加工処理または保存作業において含有されていてもよい。
受容体を標的とするアドザイムのある種の態様として、標的化部分には、アドレス部位(例えば、直接型アドザイムの場合には基質上のまたは近接型アドザイムの場合には、基質の機能する近傍に生ずる分子上の)に結合するいずれかの分子または分子会合体を本質的に含めることができる。多くの態様の場合、標的化部分には、ポリペプチドまたはポリペプチド複合体、特に抗体または抗体の抗原結合部位を含むポリペプチドが含まれるものと思われる。例えば、標的化部分には、モノクローナル抗体、FabおよびF(ab)2、scFv、重鎖可変領域および軽鎖可変領域を含めることができる。任意に、標的化部分は、基質に結合するように遺伝子工学的に改変された人工タンパク質またはペプチド配列である。ある種の態様として、標的化部分は、ポリアニオン系またはポリカチオン系結合物質である。任意に、標的化部分は、オリゴヌクレオチド、ポリサッカライドまたはレクチンである。標的化部分には、受容体に結合するリガンド(またはその結合部分)を含めることができる。
受容体を標的とするアドザイムのある種の態様として、基質は、一部が細胞外表面に露出した受容体である。任意に、基質は、ヘテロマー受容体複合体の特異的受容体サブユニットである。好ましい態様として、基質はヒト患者に内在する。そのような態様の場合、アドザイムは、生理学的濃度の豊富なヒト血清タンパク質、例えば、血清アルブミンまたは豊富なグロビンの存在下で基質に対して有効であることが好ましい。
受容体を標的とするアドザイムの好ましい態様として、アドザイムの基質は、TNFR1またはTNFR2のようなTNFα受容体である。直接型アドザイムの場合、標的化部分は受容体に結合する。触媒ドメインには、TNFα刺激による受容体活性を低下させるプロテアーゼが含まれることが好ましい。標的化部分は、TNFαの受容体結合部分およびその受容体に結合する一本鎖抗体の中から選択することができるが、他の標的化部分も可能である。
受容体を標的とするアドザイムの別の好ましい態様として、アドザイムの基質は、インターロイキン-1受容体(IL-1R)である。直接型アドザイムの場合、標的化部分は、IL-1Rに結合する。触媒ドメインには、IL-1Rの生物活性を低下させるプロテアーゼが含まれることが好ましい。
さらなる局面として、本発明により、基質を酵素的に変化させるためのアドザイムであって、前記の基質を一つまたは複数の産物に変換する化学反応を触媒する触媒ドメインと、前記の基質上のアドレス部位とまたは基質の機能する近傍に生ずる第二の分子上のアドレス部位と可逆的に結合する標的化部分とを含み、その際に、前記の産物の一つまたは複数が、前記基質の活性のアンタゴニストとなるアドザイムが提供される。
基質のアンタゴニストを生成するアドザイムのある種の態様として、アドザイムの触媒ドメインと標的化ドメインは、ポリペプチドおよびリンカーで連結されて、融合タンパク質を形成する。融合タンパク質は、化学結合および同時翻訳を含む、さまざまな方法で作り出すことができる。好ましい態様として、融合タンパク質は、組換え核酸によりコードされる同時翻訳融合タンパク質である。ある種の態様として、融合タンパク質のリンカーは、非構造化ペプチドである。任意に、リンカーはSer4GlyまたはSerGly4の繰り返しを一個または複数個含む。好ましい態様として、リンカーは、アドザイムが、触媒ドメインまたは標的化部分単独よりも基質に対して効果的であるような、触媒ドメインと標的化部分との間の立体構造を与えるように選択される。例えば、リンカーは、アドザイムが基質との反応に関して、触媒ドメインまたは標的化部分よりも強力であるように選択することができる。リンカーは、標的化部分が基質を酵素ドメインに、標的化部分がない場合に存在すると思われるよりも少なくとも5倍高い有効濃度で提示するように選択することができる。
基質のアンタゴニストを生成するアドザイムのある種の態様として、アドザイムは、触媒ドメインと標的化部分が基質に対し有効となる幾何学的配置で、免疫グロブリンの定常ドメインを含む免疫グロブリンの少なくとも一部分に連結される、免疫グロブリン融合体である。例えば、アドザイムは、免疫グロブリン重鎖の定常部と触媒ドメインとを含む第一融合タンパク質および免疫グロブリン重鎖の定常部と基質上のまたは基質の機能する近傍のアドレス部位と可逆的に結合する標的化ドメインとを含む第二融合タンパク質を含むことができる。免疫グロブリン部分は、ジスルフィド結合により二量体化するFc部分であることが好ましい。
基質のアンタゴニストを生成するアドザイムのある種の態様として、基質との反応に関して、アドザイムは、一つまたは複数の所望の特性を有するように設計される(アドザイムは、一つまたは複数の所望の特性を有する)。多くの場合、そのような特性は、アドザイムの所望の効果を基質に及ぼすのに重要であると思われる。例えば、アドザイムは、触媒ドメインまたは標的化部分単独よりも少なくとも2倍高い、および好ましくは触媒ドメインまたは標的化部分単独の効力よりも少なくとも3、5、10、20倍またはそれ以上高い効力を有することができる。アドザイムは、103 M-1s-1またはそれ以上のkon、および任意に104 M-1s-1、105 M-1s-1、106 M-1s-1、107 M-1s-1またはそれ以上のkonを有することができる。アドザイムは、0.1 sec-1またはそれ以上のkcat、および任意に1 sec-1、10 sec-1、50 sec-1またはそれ以上のkcatを有することができる。アドザイムは、触媒ドメインのKmよりも少なくとも5、10、25、50もしくは100倍またはそれ以上低いKDを有することができる。アドザイムは、10-4 sec-1またはそれ以上のkoff、および任意に10-2 sec-1のkoff、10-2 sec-1、またはそれ以上のkoffを有することができる。アドザイムは、触媒ドメイン単独の触媒効率よりも少なくとも5倍高い触媒効率、および任意に触媒ドメインのものよりも少なくとも10倍、20倍、50倍または100倍高い触媒効率を有することができる。アドザイムは、触媒ドメイン単独のKmよりも少なくとも5倍、10倍、20倍、50倍または100倍低いKmを有することができる。アドザイムは、実際の基質濃度よりも少なくとも5倍、10倍、20倍、50倍または100倍高い有効基質濃度を有することができる。ある種の好ましい態様として、アドザイムは、上記の特性のうちの二つまたはそれ以上を組み合わせるように設計されるものと思われる。
基質のアンタゴニストを生成するアドザイムのある種の態様として、触媒ドメインのなかには、選択の基質に対して所望の効果を達成するいずれかの酵素ドメインを本質的に含めることができる。触媒ドメインは、基質のペンダント基の一つまたは複数を修飾するように選択することができる。基質は不斉原子を含むことができ、および触媒ドメインは立体異性体の比率を変化させることができる。触媒ドメインは、ポリペプチド基質の翻訳後修飾、例えば、グリコシル化、リン酸化、硫酸化、脂肪酸修飾、アルキル化、プレニル化またはアシル化のレベルを変化させることができる。選択できる酵素ドメインの例には、プロテアーゼ、エステラーゼ、アミダーゼ、ラクタマーゼ、セルラーゼ、オキシダーゼ、オキシドレダクターゼ、レダクターゼ、トランスフェラーゼ、ヒドロラーゼ、イソメラーゼ、リガーゼ、リパーゼ、ホスホリパーゼ、ホスファターゼ、キナーゼ、スルファターゼ、リゾチーム、グリコシダーゼ、ヌクレアーゼ、アルドラーゼ、ケトラーゼ、リアーゼ、シクラーゼ、リバース・トランスクリプターゼ、ヒアルロニダーゼ、アミラーゼ、セレブロシダーゼおよびキチナーゼが含まれる。触媒ドメインのタイプにかかわらず、アドザイムは、特に被検体に投与される溶液中のアドザイム濃度にほぼ等しいアドザイム濃度で、自己触媒反応(例えば、分子間または分子内反応)に抵抗性であることが望ましいかもしれない。ある種の態様として、アドザイムは、化学反応の産物が基質のアンタゴニストとなるように、基質に作用する。ある種の態様として、アドザイムは、化学反応の産物が基質のアンタゴニストとなるように、基質に作用する。
基質のアンタゴニストを生成するアドザイムのある種の好ましい態様として、アドザイムには、活性時に、ポリペプチド基質の少なくとも一つのペプチド結合を切断する、プロテアーゼドメインが含まれる。一般に、アドザイムは、プロテアーゼの触媒ドメインによる切断に抵抗性となるように設計することが望ましいものと思われる。プロテアーゼドメインは、酵素前駆体(不活性型)として作製し、その後、使用前に活性化することができる。アドザイムは、可逆的プロテアーゼ阻害剤の存在下で細胞培養物から精製することができ、そのような阻害剤は、その後の加工処理または保存作業において含有されていてもよい。
基質のアンタゴニストを生成するアドザイムのある種の態様として、標的化部分には、アドレス部位(例えば、直接型アドザイムの場合には基質上のまたは近接型アドザイムの場合には、基質の機能する近傍に生ずる分子上の)に結合するいずれかの分子または分子会合体を本質的に含めることができる。多くの態様の場合、標的化部分には、ポリペプチドまたはポリペプチド複合体、特に抗体または抗体の抗原結合部位を含むポリペプチドが含まれるものと思われる。例えば、標的化部分には、モノクローナル抗体、FabおよびF(ab)2、scFv、重鎖可変領域および軽鎖可変領域を含めることができる。任意に、標的化部分は、基質に結合するように遺伝子工学的に改変された人工タンパク質またはペプチド配列である。ある種の態様として、標的化部分は、ポリアニオン系またはポリカチオン系結合物質である。任意に、標的化部分は、オリゴヌクレオチド、ポリサッカライドまたはレクチンである。標的化部分には、受容体に結合するリガンド(またはその結合部分)を含めることができる。
基質のアンタゴニストを生成するアドザイムのある種の態様として、基質は、細胞により産生される生体分子、例えば、ポリペプチド、ポリサッカライド、核酸、脂質、または小分子である。ある種の態様として、基質は、拡散性の細胞外分子、および好ましくは受容体を介した細胞シグナル伝達を誘発する細胞外または細胞内受容体に作用できる細胞外シグナル伝達分子である。任意に、細胞外シグナル伝達分子は、炎症性サイトカインのような、細胞外シグナル伝達ポリペプチド分子である。好ましい態様として、基質は、インターロイキン-1(例えば、IL-1α、IL-1β)またはTNF-αである。ある種の態様として、基質は、ポリペプチドホルモン、成長因子および/またはサイトカイン、特に炎症性サイトカインである。任意に、アドザイムは、基質の炎症誘発活性を低下させるように作用する。基質は、4本ヘリックスバンドル因子、EGF様因子、インスリン様因子、β-トレフォイル因子およびシステイン・ノット因子からなる群より選択することができる。ある種の態様として、基質は、受容体、特に一部が細胞外表面に露出した受容体である。任意に、基質は、ヘテロマー受容体複合体の特異的受容体サブユニットである。ある種の態様として、生体分子は、アミロイド沈着または動脈硬化性プラークのような、生体分子による癒着の成分である。ある種の態様として、基質は、細胞内生体分子であって、そのような場合、標的細胞に侵入できるアドザイム、例えば、細胞内へのアドザイムのトランスサイトーシスを促進するトランスサイトーシス部分をさらに含むアドザイムを使用することが望ましいかもしれない。ある種の態様として、基質は、原生動物、真菌、細菌またはウイルスのような、病原体により産生される生体分子である。基質は、プリオンタンパク質とすることができる。好ましい態様として、基質はヒト患者に内在する。そのような態様の場合、アドザイムは、生理学的濃度の豊富なヒト血清タンパク質、例えば、血清アルブミンまたは豊富なグロビンの存在下で基質に対して有効であることが好ましい。
好ましい態様として、アドザイムの基質はTNFαである。直接型アドザイムの場合、標的化部分はTNFαに結合する。触媒ドメインには、TNFα活性を低下させるプロテアーゼが含まれることが好ましい。例えば、プロテアーゼは、以下の中から選択することができる: MT1-MMP; MMP12; トリプターゼ; MT2-MMP; エラスターゼ; MMP7; キモトリプシン; およびトリプシン。標的化部分は、TNFα受容体の可溶性部分およびTNFαに結合する一本鎖抗体の中から選択することができるが、他の標的化部分も可能である。好ましい標的化部分は、TNFα受容体1(TNFR1)のsp55部分である。
別の好ましい態様として、アドザイムの基質は、IL-1αまたはIL-1βのような、インターロイキン-1である。直接型アドザイムの場合、標的化部分は、インターロイキン-1基質に結合する。触媒ドメインには、IL-1の生物活性を低下させるプロテアーゼが含まれることが好ましい。
一つの局面として、本発明により、基質を酵素的に変化させるためのアドザイムであって、前記の基質の少なくとも一つのペプチド結合を切断して、一つまたは複数の産物を生成する触媒ドメインと、前記の基質上のアドレス部位とまたは基質の機能する近傍に生ずる第二の分子上のアドレス部位と可逆的に結合するポリペプチド標的化ドメインとを含み、その際に、前記のアドザイムは、触媒ドメインによる切断に抵抗性であり、前記の標的化部分は、単独で与えられた場合、基質に結合し、前記の触媒ドメインは、単独で与えられた場合、前記の基質の少なくとも一つのペプチド結合を切断して、一つまたは複数の産物を生成し、および前記のキメラタンパク質構築物は、前記の基質との反応に関して、前記の触媒ドメインまたは標的化部分よりも効力があるアドザイムが提供される。
タンパク質分解アドザイムのある種の態様として、アドザイムの触媒ドメインと標的化ドメインは、ポリペプチドおよびリンカーで連結されて、融合タンパク質を形成する。融合タンパク質は、化学結合および同時翻訳を含む、さまざまな方法で作り出すことができる。好ましい態様として、融合タンパク質は、組換え核酸によりコードされる同時翻訳融合タンパク質である。ある種の態様として、融合タンパク質のリンカーは、非構造化ペプチドである。任意に、リンカーはSer4GlyまたはSerGly4の繰り返しを一個または複数個含む。好ましい態様として、リンカーは、アドザイムが、触媒ドメインまたは標的化部分単独よりも基質に対して効果的であるような、触媒ドメインと標的化部分との間の立体構造を与えるように選択される。例えば、リンカーは、アドザイムが基質との反応に関して、触媒ドメインまたは標的化部分よりも強力であるように選択することができる。リンカーは、標的化部分が基質を酵素ドメインに、標的化部分がない場合に存在すると思われるよりも少なくとも5倍高い有効濃度で提示するように選択することができる。
タンパク質分解アドザイムのある種の態様として、アドザイムは、触媒ドメインと標的化部分が基質に対し有効となる幾何学的配置で、免疫グロブリンの定常ドメインを含む免疫グロブリンの少なくとも一部分に連結される、免疫グロブリン融合体である。例えば、アドザイムは、免疫グロブリン重鎖の定常部と触媒ドメインとを含む第一融合タンパク質および免疫グロブリン重鎖の定常部と基質上のまたは基質の機能する近傍のアドレス部位と可逆的に結合する標的化ドメインとを含む第二融合タンパク質を含むことができる。免疫グロブリン部分は、ジスルフィド結合により二量体化するFc部分であることが好ましい。
タンパク質分解アドザイムのある種の態様として、基質との反応に関して、アドザイムは、一つまたは複数の所望の特性を有するように設計される(アドザイムは、一つまたは複数の所望の特性を有する)。多くの場合、そのような特性は、アドザイムの所望の効果を基質に及ぼすのに重要であると思われる。例えば、アドザイムは、触媒ドメインまたは標的化部分単独よりも少なくとも2倍高い、および好ましくは触媒ドメインまたは標的化部分単独の効力よりも少なくとも3、5、10、20倍またはそれ以上高い効力を有することができる。アドザイムは、103 M-1s-1またはそれ以上のkon、および任意に104 M-1s-1、105 M-1s-1、106 M-1s-1、107 M-1s-1またはそれ以上のkonを有することができる。アドザイムは、0.1 sec-1またはそれ以上のkcat、および任意に1 sec-1、10 sec-1、50 sec-1またはそれ以上のkcatを有することができる。アドザイムは、触媒ドメインのKmよりも少なくとも5、10、25、50もしくは100倍またはそれ以上低いKDを有することができる。アドザイムは、10-4 sec-1またはそれ以上のkoff、および任意に10-2 sec-1のkoff、10-2 sec-1、またはそれ以上のkoffを有することができる。アドザイムは、触媒ドメイン単独の触媒効率よりも少なくとも5倍高い触媒効率、および任意に触媒ドメインのものよりも少なくとも10倍、20倍、50倍または100倍高い触媒効率を有することができる。アドザイムは、触媒ドメイン単独のKmよりも少なくとも5倍、10倍、20倍、50倍または100倍低いKmを有することができる。アドザイムは、実際の基質濃度よりも少なくとも5倍、10倍、20倍、50倍または100倍高い有効基質濃度を有することができる。ある種の好ましい態様として、アドザイムは、上記の特性のうちの二つまたはそれ以上を組み合わせるように設計されるものと思われる。
タンパク質分解アドザイムのある種の態様として、基質は、細胞により産生されるポリペプチドである。ある種の態様として、基質は、拡散性の細胞外ポリペプチド、および好ましくは受容体を介した細胞シグナル伝達を誘発する細胞外または細胞内受容体に作用できる細胞外シグナル伝達ポリペプチド分子である。任意に、基質は炎症性サイトカインである。好ましい態様として、基質は、インターロイキン-1(例えば、IL-1α、IL-1β)またはTNF-αである。ある種の態様として、基質は、ポリペプチドホルモン、成長因子および/またはサイトカイン、特に炎症性サイトカインである。任意に、アドザイムは、基質の炎症誘発活性を低下させるように作用する。基質は、4本ヘリックスバンドル因子、EGF様因子、インスリン様因子、β-トレフォイル因子およびシステイン・ノット因子からなる群より選択することができる。ある種の態様として、基質は、受容体、特に一部が細胞外表面に露出した受容体である。任意に、基質は、ヘテロマー受容体複合体の特異的受容体サブユニットである。ある種の態様として、生体分子は、アミロイド沈着または動脈硬化性プラークのような、生体分子による癒着の成分である。ある種の態様として、基質は、細胞内生体分子であって、そのような場合、標的細胞に侵入できるアドザイム、例えば、細胞内へのアドザイムのトランスサイトーシスを促進するトランスサイトーシス部分をさらに含むアドザイムを使用することが望ましいかもしれない。ある種の態様として、基質は、原生動物、真菌、細菌またはウイルスのような、病原体により産生される生体分子である。基質は、プリオンタンパク質とすることができる。好ましい態様として、基質はヒト患者に内在する。そのような態様の場合、アドザイムは、生理学的濃度の豊富なヒト血清タンパク質、例えば、血清アルブミンまたは豊富なグロビンの存在下で基質に対して有効であることが好ましい。
一般に、タンパク質分解アドザイムの場合、アドザイムは、プロテアーゼの触媒ドメインによる切断に抵抗性となるように設計することが望ましいものと思われる。プロテアーゼドメインは、酵素前駆体(不活性型)として作製し、その後、使用前に活性化することができる。アドザイムは、可逆的プロテアーゼ阻害剤の存在下で細胞培養物から精製することができ、そのような阻害剤は、その後の加工処理または保存作業において含有されていてもよい。
タンパク質分解アドザイムのある種の態様として、標的化部分には、アドレス部位(例えば、直接型アドザイムの場合には基質上のまたは近接型アドザイムの場合には、基質の機能する近傍に生ずる分子上の)に結合するいずれかの分子または分子会合体を本質的に含めることができる。多くの態様の場合、標的化部分には、ポリペプチドまたはポリペプチド複合体、特に抗体または抗体の抗原結合部位を含むポリペプチドが含まれるものと思われる。例えば、標的化部分には、モノクローナル抗体、FabおよびF(ab)2、scFv、重鎖可変領域および軽鎖可変領域を含めることができる。任意に、標的化部分は、基質に結合するように遺伝子工学的に改変された人工タンパク質またはペプチド配列である。ある種の態様として、標的化部分は、ポリアニオン系またはポリカチオン系結合物質である。任意に、標的化部分は、オリゴヌクレオチド、ポリサッカライドまたはレクチンである。ある種の態様として、基質は受容体であり、標的化部分は受容体に結合するリガンド(またはその結合部分)を含む。ある種の態様として、基質は受容体リガンドであり、標的化部分は受容体のリガンド結合部分、特に可溶性のリガンド結合部分を含む。
好ましい態様として、アドザイムの基質はTNFαである。直接型アドザイムの場合、標的化部分はTNFαに結合する。触媒ドメインには、TNFα活性を低下させるプロテアーゼが含まれることが好ましい。例えば、プロテアーゼは、以下の中から選択することができる: MT1-MMP; MMP12; トリプターゼ; MT2-MMP; エラスターゼ; MMP7; キモトリプシン; およびトリプシン。標的化部分は、TNFα受容体の可溶性部分およびTNFαに結合する一本鎖抗体の中から選択することができるが、他の標的化部分も可能である。好ましい標的化部分は、TNFα受容体1(TNFR1)のsp55部分である。
別の好ましい態様として、アドザイムの基質は、IL-1αまたはIL-1βのような、インターロイキン-1である。直接型アドザイムの場合、標的化部分は、インターロイキン-1基質に結合する。触媒ドメインには、IL-1の生物活性を低下させるプロテアーゼが含まれることが好ましい。
一つの局面として、本発明により、基質を酵素的に変化させるためのアドザイムであって、前記の基質を一つまたは複数の産物に変換する化学反応を触媒する触媒ドメインと、前記の基質上のアドレス部位とまたは基質の機能する近傍に生ずる第二の分子上のアドレス部位と可逆的に結合する標的化ドメインと、前記の触媒ドメインと前記の標的化ドメインとを連結するリンカーとを含むポリペプチドを含み、その際に、前記の基質は細胞外シグナル伝達ポリペプチド分子であり、前記の標的化部分と前記の触媒ドメインは、相互に対し異種であり、前記の標的化ドメインは、単独で与えられた場合、前記の基質に結合し、前記の触媒ドメインは、単独で与えられた場合、前記の基質を一つまたは複数の産物に変換する化学反応を触媒し、および前記のアドザイムは、前記の基質との反応に関して、前記の触媒ドメインまたは標的化部分よりも効力があるアドザイムが提供される。
ある種の局面として、本発明により、受容体を介した細胞外ポリペプチド基質のシグナル伝達活性を阻害するためのアドザイムであって、受容体を介したポリペプチドのシグナル伝達活性を阻害するようにポリペプチド基質の少なくとも一つのペプチド結合のタンパク質分解切断を触媒するプロテアーゼドメインと、前記のポリペプチド基質上のアドレス部位と可逆的に結合する標的化ドメインとを含む誘導タンパク質であり、その際に、前記の標的化ドメインと前記のプロテアーゼドメインは、相互に対し不連続かつ異種であるアドザイムが提供される。任意に、アドザイムは、前記のプロテアーゼドメインによる切断に抵抗性である。任意に、プロテアーゼドメインは酵素前駆体である。任意に、プロテアーゼドメインは、セリンプロテイナーゼ、システインプロテアーゼ、スレオニンプロテアーゼ、アスパラギン酸プロテアーゼおよびメタロプロテイナーゼの中から選択される。任意に、アドザイムは、プロテアーゼドメインのプロテアーゼ活性を阻害する可逆的プロテアーゼ阻害剤の存在下で細胞培養物から精製される。ある種の態様として、アドザイムは、基質との反応に関して、一つまたは複数の特性を有する。多くの場合、そのような特性は、アドザイムの所望の効果を基質に及ぼすのに重要であると思われる。例えば、アドザイムは、触媒ドメインまたは標的化部分単独よりも少なくとも2倍高い、および好ましくは触媒ドメインまたは標的化部分単独の効力よりも少なくとも3、5、10、20倍またはそれ以上高い効力を有することができる。アドザイムは、103 M-1s-1またはそれ以上のkon、および任意に104 M-1s-1、105 M-1s-1、106 M-1s-1、107 M-1s-1またはそれ以上のkonを有することができる。アドザイムは、0.1 sec-1またはそれ以上のkcat、および任意に1 sec-1、10 sec-1、50 sec-1またはそれ以上のkcatを有することができる。アドザイムは、触媒ドメインのKmよりも少なくとも5、10、25、50もしくは100倍またはそれ以上低いKDを有することができる。アドザイムは、10-4 sec-1またはそれ以上のkoff、および任意に10-2 sec-1のkoff、10-2 sec-1、またはそれ以上のkoffを有することができる。アドザイムは、触媒ドメイン単独の触媒効率よりも少なくとも5倍高い触媒効率、および任意に触媒ドメインのものよりも少なくとも10倍、20倍、50倍または100倍高い触媒効率を有することができる。アドザイムは、触媒ドメイン単独のKmよりも少なくとも5倍、10倍、20倍、50倍または100倍低いKmを有することができる。アドザイムは、実際の基質濃度よりも少なくとも5倍、10倍、20倍、50倍または100倍高い有効基質濃度を有することができる。ある種の好ましい態様として、アドザイムは、上記の特性のうちの二つまたはそれ以上を組み合わせるように設計されるものと思われる。任意に、基質は炎症性サイトカインである。好ましい態様として、基質は、インターロイキン-1(例えば、IL-1α、IL-1β)またはTNF-αである。ある種の態様として、基質は、ポリペプチドホルモン、成長因子および/またはサイトカイン、特に炎症性サイトカインである。任意に、アドザイムは、基質の炎症誘発活性を低下させるように作用する。基質は、4本ヘリックスバンドル因子、EGF様因子、インスリン様因子、β-トレフォイル因子およびシステイン・ノット因子からなる群より選択することができる。好ましい態様として、基質はヒト患者に内在する。そのような態様の場合、アドザイムは、生理学的濃度の豊富なヒト血清タンパク質、例えば、血清アルブミンまたは豊富なグロビンの存在下で基質に対して有効であることが好ましい。融合タンパク質のアドザイムは、化学結合および同時翻訳を含む、さまざまな方法で作り出すことができる。好ましい態様として、融合タンパク質は、組換え核酸によりコードされる同時翻訳融合タンパク質である。ある種の態様として、融合タンパク質のリンカーは、非構造化ペプチドである。任意に、リンカーはSer4GlyまたはSerGly4の繰り返しを一個または複数個含む。好ましい態様として、リンカーは、アドザイムが、触媒ドメインまたは標的化部分単独よりも基質に対して効果的であるような、触媒ドメインと標的化部分との間の立体構造を与えるように選択される。例えば、リンカーは、アドザイムが基質との反応に関して、触媒ドメインまたは標的化部分よりも強力であるように選択することができる。リンカーは、標的化部分が基質を酵素ドメインに、標的化部分がない場合に存在すると思われるよりも少なくとも5倍高い有効濃度で提示するように選択することができる。標的化ドメインには、アドレス部位(例えば、直接型アドザイムの場合には基質上のまたは近接型アドザイムの場合には、基質の機能する近傍に生ずる分子上の)に結合するいずれかの分子または分子会合体を本質的に含めることができる。多くの態様の場合、標的化ドメインには、一本鎖抗体のような、抗体の抗原結合部位が含まれるものと思われる。任意に、標的化部分は、基質に結合するように遺伝子工学的に改変された人工タンパク質またはペプチド配列である。好ましい態様として、アドザイムの基質はTNFαである。直接型アドザイムの場合、標的化部分はTNFαに結合する。触媒ドメインには、TNFα活性を低下させるプロテアーゼが含まれることが好ましい。例えば、プロテアーゼは、以下の中から選択することができる: MT1-MMP; MMP12; トリプターゼ; MT2-MMP; エラスターゼ; MMP7; キモトリプシン; およびトリプシン。標的化部分は、TNFα受容体の可溶性部分およびTNFαに結合する一本鎖抗体の中から選択することができるが、他の標的化部分も可能である。好ましい標的化部分は、TNFα受容体1(TNFR1)のsp55部分である。別の好ましい態様として、アドザイムの基質は、IL-1αまたはIL-1βのような、インターロイキン-1である。直接型アドザイムの場合、標的化部分は、インターロイキン-1基質に結合する。触媒ドメインには、IL-1の生物活性を低下させるプロテアーゼが含まれることが好ましい。
一つの局面として、本発明により、受容体を介した細胞外ポリペプチド基質のシグナル伝達活性を阻害するためのアドザイムであって、免疫グロブリン融合複合体であるアドザイムが提供される。例えば、そのようなアドザイムは、以下を含むことができる: 第二融合タンパク質に結合した第一融合タンパク質であって、その際に、第一融合タンパク質は、免疫グロブリン重鎖の定常部と、受容体を介したポリペプチドのシグナル伝達活性を阻害するようにポリペプチド基質の少なくとも一つのペプチド結合のタンパク質分解切断を触媒するプロテアーゼドメインとを含み、およびその際に、第二融合タンパク質は、免疫グロブリン重鎖の定常部と、前記のポリペプチド基質上のアドレス部位と可逆的に結合する標的化ドメインとを含み、その際に、前記の標的化ドメインと前記のプロテアーゼドメインは、相互に対し不連続かつ異種である。
ある種の局面として、本発明により、所望の用途、例えば、治療用途、工業的用途、環境用途または微細加工で用いるアドザイム調製物が提供される。そのような調製物は、アドザイム製剤と呼ぶことができる。ある種の態様として、本発明により、ヒト患者の治療用途のためのアドザイム製剤であって、本明細書に開示されるいずれかのアドザイムを含む製剤が提供される。任意に、製剤には、薬学的に有効な担体がさらに含まれる。任意に、アドザイム製剤は、アドザイムの自己触媒的な修飾が阻害されるように製剤化される。任意に、アドザイムには、プロテアーゼである触媒ドメインが含まれ、そしてある種の態様として、製剤には、前記のプロテアーゼの可逆的阻害剤、好ましくは、ヒト患者に投与するのに安全な可逆的阻害剤が含まれる。任意に、治療用途のためのアドザイム製剤には、実質的に発熱物質がない。アドザイム製剤は、使用説明書とともに包装することができる。例えば、治療用途のためのアドザイム製剤は、患者への投与に関する使用説明書とともに包装することができる。
ある種の局面として、本発明により、本明細書に開示されるいずれかのアドザイムの基質の活性と関連がある疾患の治療で用いる薬剤を作製するための方法であって、患者、好ましくはヒト患者に投与するためのアドザイムを製剤化する段階を含む方法が提供される。ある種の局面として、本発明により、炎症性またはアレルギー性疾患の治療で用いる薬剤の作製方法であって、その必要性があるヒト患者への投与を目的として、アドザイムを製剤化する段階を含み、アドザイムの基質が炎症性サイトカインである方法が提供される。
ある種の局面として、本発明により、アドザイムの基質の活性と関連がある疾患の治療方法であって、その必要性があるヒト患者にアドザイムの治療有効量を投与する段階を含む方法が提供される。ある種の局面として、アドザイムは、アレルギー性疾患の炎症の治療方法であって、その必要性があるヒト患者にアドザイムの治療有効量を投与する段階を含み、アドザイムの基質が炎症性サイトカインである方法で使用することができる。
ある種の局面として、本発明により、アドザイムのさまざまなポリペプチド部分のいずれかをコードする核酸、および特に融合タンパク質のアドザイムをコードする組換え核酸が提供される。そのような核酸は、適当な宿主細胞中でアドザイムの発現を導く発現ベクターに組み込むことができる。本発明により、そのような核酸およびベクターを含む細胞がさらに提供される。ある種の態様として、本発明により、第一コード配列を含む第一核酸と第二コード配列を含む第二核酸とを含む細胞であって、第一コード配列は、免疫グロブリン重鎖と触媒ドメインとを含む第一融合タンパク質をコードし、第二コード配列は、免疫グロブリン重鎖と標的化ドメインとを含む第二融合タンパク質をコードする細胞が提供される。例えば、細胞は、適当な培養条件で、第一融合タンパク質と第二融合タンパク質との二量体であるFc融合タンパク質の構築物を含むアドザイムを分泌することが好ましい。
ある種の局面として、本発明により、アドザイムの製造方法が提供される。そのような方法には、細胞でのポリペプチド成分の発現を含めることができる。そのような方法には、さまざまなアドザイム成分の化学的連結を含めることができる。一つの態様として、この方法には、発現ベクターによりコードされるアドザイムを細胞に産生させるような条件で、融合タンパク質のアドザイムを産生させるための発現ベクターを有する細胞を培養する段階; および実質的に純粋となるまでアドザイムを精製する段階が含まれる。一つの態様として、この方法には、発現ベクターによりコードされるアドザイムを細胞に産生させるような条件で、免疫グロブリン融合体を産生するように設計された細胞を培養する段階; および実質的に純粋となるまでアドザイムを精製する段階が含まれる。ある種の態様として、実質的に純粋となるまでアドザイムを精製する段階には、触媒ドメインの自己触媒反応活性を阻害する可逆的阻害剤の使用が含まれ、および特に、アドザイムの触媒ドメインがプロテアーゼドメインである場合には、実質的に純粋となるまでアドザイムを精製する段階には、触媒ドメインのプロテアーゼ活性を阻害する可逆的プロテアーゼ阻害剤の使用が含まれる。
さらなる局面として、本発明により、所望の特性を有するアドザイムの設計および製造方法、ならびに所望の特性を有するアドザイム、例えば、治療的に有効なアドザイムの設計および販売を含む事業の運営方法が提供される。
本発明の態様および実践、他の態様、ならびにその特性および特徴は、続く説明、図面および特許請求の範囲から明らかになるものと思われる。
本発明の詳細な説明
I. 概要
本発明により、本明細書で「アドザイム」と呼ばれる、新たな部類の人工的に作り出されたタンパク質構築物、ならびにアドザイムの使用および産出と関連する方法および組成物が提供される。アドザイムは、一つまたは複数の触媒ドメインを一つまたは複数の標的化部分(または「アドレス」)と連結させたキメラタンパク質構築物である。アドザイムの触媒ドメインは、例えば、切断、化学修飾(転換)または異性化により、予め選択した基質(「標的」または「標的基質」)を一つまたは複数の産物に変換する反応を触媒する酵素的に活性な部位を有する。一般に、触媒ドメインは、アドザイムを介した反応による一つまたは複数の産物が、選択の基質と比べて定性的にまたは定量的に異なる活性を有するように選択される。単なる例証として、アドザイムは、選択の基質の親和性、効力、選択性、溶解性、免疫原性、半減期、クリアランス(例えば、腎機能または肝機能による)、体内分布または他の薬物動態特性のような機能特性を変化させることができる。場合によっては、アドザイムを介した反応による産物は、それ自体が、選択基質の活性のアンタゴニストとなる。
標的化部分(または「アドレス」)は、例えば、可溶性もしくは膜結合性の生体分子、または生体分子による癒着の成分(例えば、プラークまたは他のタンパク質を含んだ不溶性凝集体)のような、所定の「アドレス結合部位」(本明細書では同様に「アドレス部位」)を認識でき且つこれに可逆的に結合できる部分である。ある種のタイプのアドザイム(「直接型アドザイム」と呼ばれる)の場合、標的化部分は、標的分子に結合する。ある種のタイプのアドザイム(「近接型アドザイム」と呼ばれる)の場合、標的化部分は、基質の機能する近傍に生ずる傾向がある分子に結合する。「部分」という用語は、単一分子またはその一部分(例えば、アドレス結合部位に結合するポリペプチドまたは糖質)のほか、分子の組み合わせ(例えば、アドレス結合部位に結合する抗体)を含むものと理解されるべきである。
アドザイムでは、少なくとも一つの標的化部分が少なくとも一つの触媒ドメインと操作可能に結合される。アドザイムは、単一のポリペプチド鎖(例えば、融合タンパク質)またはポリペプチド鎖および/もしくは共有結合か非共有結合により連結された他の分子の会合体とすることができる。アドザイムの構成成分の結合方法にかかわらず、少なくとも一つの標的化部分と一つの触媒ドメインとが、操作可能に結合されなければならない。「操作可能に結合される」という用語は、触媒ドメインと標的化部分との間の関係を記述するのに本明細書で使用される場合、予め選択した基質の活性を化学的に変化させるかまたは別の方法でその活性に影響を及ぼす際に、結合された触媒ドメインと標的化部分の有効性が、標的化部分または触媒ドメイン単独の有効性よりも大きい、および同様に、標的化部分と触媒ドメインの双方を組み合わせて、但し相互と結合していない状態で使用したとき(例えば、標的を、別になった触媒ドメインと別になった標的化部分の双方と同時に接触させる場合)の有効性よりも大きいことを意味する。以下のように、アドザイムは、リンカー、つまり安定性または体内分布などに影響を与える部分のような、他の成分を同様に含むことができる。
アドザイムの構成部分と比べたアドザイムの有効性は、さまざまな方法で評価することができる。例えば、有効性は、アドザイムがその構成部分と比べて、予め選択した基質の生物活性に影響を及ぼす効力という点で評価することができる。別の例として、有効性は、アドザイムと予め選択した基質との間の反応を記述する速度定数または平衡定数を、構成部分とその標的基質との間の反応に当てはまるその定数と比較するという点で評価することができる。アドザイムが哺乳動物で用いられるものである態様の場合、アドザイムの少なくとも一つの触媒ドメインと少なくとも一つの標的化部分とは、これらの部分が生理条件下で(例えば、全血、血清、細胞培養条件、またはリン酸緩衝生理食塩水pH 7中で)、操作可能に結合されているように結合される。アドザイムが他の目的で用いられるものである場合(例えば、環境汚染物質の修飾または分子反応の成分の修飾)、アドザイムの少なくとも一つの触媒ドメインと少なくとも一つの標的化部分とは、これらの部分が予想のまたは所望の反応条件下で、操作可能に結合されているように結合される。
単なる例証として、アドザイムは、TNF-αを、活性が低下した、活性がないまたはアンタゴニスト活性を有する一つまたは複数の産物に変換し、その結果、関節リウマチまたはTNF-α活性と関連した他の病状のような、TNF-αと関連した病状を改善するように、TNF-αを切断するかまたは別の方法で修飾する触媒ドメインを含むことができる。
特定の作用機序に縛られることを望むわけではないが、標的化部分は、予め選択した標的基質に結合する(直接型アドザイム)かまたは予め選択した標的基質と同じ近傍に生ずる別の分子に結合し(近接型アドザイム)、その結果、標的基質の位置でまたは近傍で触媒ドメインの濃度を増加させるように機能するものと予想される。このようにして、アドザイムは、標的基質の位置でまたは近傍で自己濃縮しており、触媒ドメインまたは結合ドメイン単独と比べて、標的基質と反応し且つ標的基質の活性を変化させるうえで、より一層の有効性を有する。標的反応に関する有効性の向上の結果として、アドザイムは、標的基質に対し、他の標的とされない(潜在的な)、触媒ドメインの基質と比べて、いっそう高い選択性および/または触媒効率を有する。
この場合もやはり、特定の理論に縛られることを望むわけではないが、ある種のアドザイムの場合、標的基質に対し比較的速いkon速度が望ましいものと予想される。少なくとも103 M-1s-1のkonが望ましいかもしれない。ある種の態様で有用とできる他の速度および性能パラメータは、以下に記述されている。
ほとんどの態様において、アドザイムの調節成分が相互に対し異種であることは、これらのドメインが、単一分子または分子会合体の一部分として天然には見られない、および従って、これらの態様のアドザイムは、天然に存在する物質ではないことを意味する。アドザイム中に含まれる種々の各ドメインおよび部分、それら自体は、天然に存在するタンパク質もしくはタンパク質の断片、または他の天然に存在する生体分子(例えば、糖質、脂質または非タンパク性因子)、または人工的に作り出されたもしくは完全な合成分子とすることができる。
ほとんどの態様において、触媒ドメインには、酵素活性を有するポリペプチドが含まれる。ある種の好ましい態様として、標的化部分には、ポリペプチドが含まれる。一般に、アドザイムの少なくとも一つの触媒ドメインおよび少なくとも一つの標的化部分は、「モジュール」実体、すなわち、独立して触媒または結合剤として機能できる実体の中から選択される。例えば、アドザイムは、(1) ポリペプチドを含み且つ酵素活性を有する触媒ドメインと、(2) ポリペプチドを含み且つアドレス結合部位に結合する標的化ドメインと、任意で、(3) 触媒ドメインおよび標的化ドメインが操作可能に結合されるように構成されたポリペプチドリンカーとを含む、単一の融合タンパク質とすることができる。別の例として、アドザイムは、免疫グロブリン融合体の構築物のタイプとすることができ、その際に、第一融合タンパク質は、第一のFc鎖に融合された触媒ドメインを含みおよび第二融合タンパク質は、第二のFc鎖に融合された標的化ドメインを含み、ならびにその際に、第一および第二のFc鎖は、触媒ドメインおよび標的化ドメインを操作可能に結合させるように結合される。
広義の範疇のアドザイムのなかに、さまざまな下位範疇または部類のアドザイムを識別することができる。上述のように、そのような二つの部類は、本明細書で「直接型」アドザイムおよび「近接型」アドザイムと呼ばれる。直接型アドザイムの場合、標的化部分は、標的基質に結合する。触媒ドメインは、標的化部分が結合したのと同じタイプの分子に作用する。ある種の態様として、これには、触媒ドメインがその分子を変化させるのに、標的化部分が標的基質から解離することが必要となる。直接型アドザイムの濃度および標的基質の濃度のような、さまざまな条件に応じて、直接型アドザイムの触媒ドメインは、標的化部分が結合するもしくは結合した標的基質に主に作用することができる、または直接型アドザイムは、ある基質に作用できるが、その一方で、その標的化部分には別の基質が結合する。機構に縛られることを望むわけではないが、標的基質が比較的低い濃度で存在する場合(多細胞生物の細胞外液中の大部分の細胞外シグナル伝達分子の場合のように)、直接型アドザイムは、標的化部分が結合するまたは結合した標的基質に主に作用するものと一般に予想される。近接型アドザイムの場合、標的化部分は、共有結合的に標的基質の一部ではない分子に結合する。その代わりに、標的化部分は、標的基質の機能する近傍に見出されると予想される分子に結合する。「機能する近傍」とは、アドザイムが、触媒ドメインおよび標的化部分単独または非結合的な組み合わせの場合よりも高い有効性で標的基質と反応する、標的基質の近傍に、アドレス結合部位が十分な濃度でまたは十分な安定性で存在することを指す。アドレス結合部位と標的基質との間の機能する近傍の存在は、アドザイムの使用を意図する環境で(例えば、ヒトの体内で、汚染土壌の場所で)、最も正確に評価されるが、その一方で、アドザイムが標的にすると予測される細胞のタイプに関連した細胞の培養のような、合理的な実験系で、またはアドレス結合部位およびアドザイムが、所望の環境において予想されるものにかなり近い濃度で存在する、精製タンパク質の混合物で、アドザイムが適当な有効性を示す場合には、アドザイムは、近接型アドザイムと考えることができる。ある種の態様として、標的化部分は、標的基質に対して拡散が制約された分子に結合することから、いかなる理由であれ、標的基質とアドレス結合部位とは、共有結合することも、解放されてバラバラに拡散することもないということを意味している。例えば、標的化部分は受容体複合体のあるタンパク質を結合することができ、その一方で、触媒ドメインは受容体複合体の別のタンパク質に作用する。別の例として、標的化部分は、細胞膜に組み込まれたタンパク質に結合することができ、および標的基質も同様に、細胞膜に組み込まれているかまたは結合されているとすることができる。「直接型アドザイム」および「間接型アドザイム」という用語は、アドザイムを設計するうえで別の問題を提起する異なる概念であるが、実際には、相互に全く排他的であるというわけではないかもしれいない。例えば、標的化部分は、標的基質にも、標的基質の機能する近傍に生ずる別の分子にも結合することができる。
さらに識別可能な部類のアドザイムは「随伴型アドザイム(contingent adzyme)」である。「随伴型アドザイム」という用語は、標的基質の近傍で触媒的に活性化されるかまたは上方制御されるが、但し、他の場所では、例えば阻害により、活性が低いアドザイム構築物を指す。直接型および接近型の双方のアドザイムを改変して、標的化ドメインのその同族パートナーとの相互作用が、例えば、アロステリックな、競合的な、または非競合的な機構により触媒ドメインの活性を変化させる、随伴型アドザイムとすることができる。
例示として、特定の標的に対して親和性を有する種々の抗体(例えば、抗-TNFαおよび抗-EGF受容体)が、ある種の疾患に対する有効な治療薬として利用されており、そうすると、本明細書の教示により、抗体単独よりも効力の高いアドザイムを設計できるものと予想される。
さらなる局面として、本発明により、本発明のアドザイムと薬学的に許容される担体とを含む薬学的組成物、ならびにアドザイムを薬学的に許容される担体と組み合わせることによる、ヒトに用いる薬剤を作製するための方法が提供される。
別の局面として、本発明により、疾患を患う被検体(例えば、ヒト)を治療するための方法が提供される。この方法には、治療的に、予防的にまたは鎮痛的に有効な量のアドザイムを投与する段階(例えば、医薬製剤を使用する段階)、それよって疾患を患う被検体を治療する段階が含まれる。一つの態様として、疾患は可溶性分子と関連しており、そしてアドザイムは、その可溶性分子を生物学的に不活性とするのに効果的な量で被検体に投与される。
II. 定義
便宜上、本明細書、実施例、および添付の特許請求の範囲に使用される一部の用語をここに集めた。特別の定めのない限り、本明細書で使用される全ての技術用語および科学用語は、当業者が通常理解しているのと同じ意味を有する。
本明細書では、「アプタマー」という用語には、標的化部分を指す場合、標的基質または関連分子と相互作用する、例えば、アドザイムに対するアドレス部位に結合するオリゴヌクレオチドが含まれる。
本明細書では、「生物学的に不活性な」という用語は、標的生体分子と関連する場合、その生物学的機能が下方制御される、例えば、抑制されるかまたは排除されることを指すように意図される。例えば、標的がTNFαである場合、生物学的な不活性化には、NFKBにより媒介される炎症反応が阻害される、他の炎症性サイトカインの分泌が阻害される、TNFによる内皮細胞の凝血促進活性の誘導が阻害される; 内皮細胞上の受容体とのTNFの結合が阻害される; TNFによる腫瘍退行活性および腫瘍における線維素沈着の誘導が促進される; ならびに/または腫瘍細胞に対して、TNFによる細胞傷害活性および受容体結合活性が影響されないもしくは促進されるようなTNFαの改変が含まれるものと思われる。例えば、TNFαをメチル化できる触媒ドメイン(例えば、Yamamoto R.ら (1989) Protein Engineering 2(7):553〜8に記述されているような、15HisでのTNFαのメチル化)により、TNFαを不活性化できるものと思われる。
「Kcat」、または「代謝回転数」という用語は、Eを基質で飽和した時、単位時間当たり酵素1分子について反応産物に変換される基質の数である。
「kcat/Km」という用語は、基質の濃度が低い(例えば、飽和していない)ときに酵素がいかにして振る舞うかという尺度となる見掛けの二次速度定数である。kcat/Kmの上限は、拡散限界、すなわち、酵素と基質がともに拡散する速度である。kcat/Kmは、酵素に対する「触媒効率」としても知られる。
「触媒効率」という用語は、アドザイムに適用した場合、少なくともミカエリス-メンテンの反応速度論モデルを用いて合理的にモデル化できるアドザイムに対して、基質の濃度が、アドザイムに対するミカエリス-メンテン定数(Km)よりも十分に(少なくとも10倍)低い(すなわち、[S]<<Kmの場合)ときのアドザイムの見掛けの二次速度定数である。分離して得られた多くの単純な触媒ドメインの場合、触媒効率は、比率kcat/Kmとして定義することができる(上記を参照されたい)。
ミカエリス-メンテンのモデルが当てはまるほとんどの場合、触媒効率は、アドザイムに対しておよびその酵素成分に対して異なると思われる、すなわち、アドザイムの触媒効率は、k
cat/K
mではない。アドザイムに対し、ν
maxおよびK
mの双方が同様に異なる。ミカエリス-メンテンの疑似定常状態解析が有効(一般に、[AE]o << [S]o、式中、[AE]oはアドザイムの初期濃度である)であり且つ基質による妨害(holdup)を無視できる場合には、これらの量に対して単純な閉じた表現を導くことができる。
式中、νmax AEおよびνmax Eは、それぞれアドザイムおよびその酵素成分に対する最大速度であり; Km AEおよびKm Eは、それぞれアドザイムおよびその酵素成分に対するKmである。上付き文字「AS」は、その速度定数がアドレス/標的化部分のものであることを示し、その定数は、アドレスに対する個別の実験により決定される; 上付き文字「ES」は、その速度定数が酵素/触媒部分のものであることを示し、その定数は、酵素に対する個別の実験により決定される。標的基質の[S]effまたは「有効濃度」は、濃度単位によるアドザイムの幾何学的パラメータである。
「キメラタンパク質構築物」は、少なくとも二つの異種部分、例えば、相互に対し異種であり、共有的にまたは非共有結合的に結び付いて、複合体を形成する触媒ドメインおよびアドレスを含む集団である。キメラタンパク質構築物は、非タンパク性分子を含むことができる。
本文脈上で「分化」とは、異なる機能特性を有する細胞またはより特殊化され且つさらに分裂もしくは分化できない最終分化細胞への転化に近づいた細胞と関連することが知られているマーカーを発現する細胞の形成を指す。
「融合タンパク質」とは、少なくとも二つの異種のアミノ酸配列が、骨格アミド結合を介して共有結合的に結合されて、例えば、一つの連続したポリペプチドを形成した、キメラタンパク質である。
本明細書では、標的基質の活性を「調節する」または「変化させる」という用語は、他の何らかの方法で標的の活性を阻害すること、刺激すること、上方制御すること、下方制御すること、活性化すること、不活性化すること、または修飾することを含むように意図される。
ポリヌクレオチド配列(DNA、RNA)は、発現制御配列がそのポリヌクレオチド配列の転写および翻訳を制御するおよび調節する場合、発現制御配列に「操作可能に連結されて」いる。「操作可能に連結される」という用語には、発現されるポリヌクレオチド配列の前に適当な開始シグナル(例えば、ATG)を有すること、ならびに発現制御配列の制御下でポリヌクレオチド配列の発現を、およびポリヌクレオチド配列によりコードされる所望のポリペプチドの産生を可能とする正しい読み枠を維持することが含まれる。
「薬学的に許容される塩」という用語は、本発明の化合物の生理学的におよび薬学的に許容される塩、すなわち、親化合物の所望の生物活性を保持し且つ好ましくない毒物学的作用をその化合物に与えない塩を指す。
「ポリヌクレオチド配列」および「ヌクレオチド配列」という用語はまた、本明細書で同義的に使用される。
本明細書では、「タンパク質」とは、本質的に20種類のアミノ酸のうちのいずれかからなる高分子化合物である。従って、タンパク質は、さまざまな修飾(例えば、グリコシル化、リン酸化)または非アミノ酸を含むことができる。「ポリペプチド」は、比較的大きなポリペプチドに関して使用されることが多く、「ペプチド」は小さなポリペプチドに関して使用されることが多いが、当技術分野において、これらの用語の用法は重複しており且つ変化する。
本明細書では、「増殖している」および「増殖」とは、有糸分裂中の細胞を指す。
国際生化学・分子生物学連合(1984)により、ペプチド結合加水分解酵素(サブクラス 酵素番号3.4.)のサブセットに対して「ペプチダーゼ」という用語を使用することが推奨されている。広く使用されているプロテアーゼという用語は、ペプチダーゼと同義語である。ペプチダーゼには、二つの群の酵素、つまりエンドペプチダーゼとエキソペプチダーゼが含まれる。エンドペプチダーゼは、タンパク質内部の位置でペプチド結合を切断し、エキソペプチダーゼは、N末端またはC末端から順番にアミノ酸を除去する。
「プロテイナーゼ」という用語は、エンドペプチダーゼの同義語としても使用される。プロテイナーゼは、その触媒機構に従って分類される。次の5つの機構上の分類が、国際生化学・分子生物学連合により承認されている: セリンプロテイナーゼ、システインプロテイナーゼ、アスパラギン酸プロテイナーゼ、スレオニンプロテイナーゼ、およびメタロプロテイナーゼ。
触媒作用のタイプによるこの分類は、プロテアーゼの進化的関係に基づいたファミリーによる分類によって拡張されることが示唆されている(Rawlings, N.D.およびBarrett, A.J., (1993), Biochem. J., 290, 205〜218)。この分類は、SwissProtデータベースで得られる。
これらの5つの機構上の分類に加えて、未確認の触媒機構のプロテアーゼに割り当てられる酵素名称の区分が存在する。このことから、その触媒機構が同定されていないことが示唆され、および新たなタイプのプロテアーゼが実際に存在するという可能性が残っている。
「セリンプロテイナーゼ」という部類には、次の二つの異なるファミリーが含まれる: キモトリプシン、トリプシンまたはエラスターゼまたはカリクレインのような哺乳動物酵素を含むキモトリプシン・ファミリー、およびスブチリシンのような細菌酵素を含むスブチリシン・ファミリー。一般的な三次元構造は、この二つのファミリーで異なっているが、しかしこれらは同じ活性部位の構造を持っており、触媒反応は同じ機構を介して進行する。セリンプロテイナーゼは、基質の残基と相互作用する、種々の酵素サブサイトにおけるアミノ酸置換と関連した異なる基質特異性を示す(SchechterおよびBergerの命名法を参照されたい)。触媒3残基を形成する次の3残基は、触媒プロセスに不可欠である: His-57、Asp-102およびSer-195(キモトリプシノーゲンでの番号付け)。
「システインプロテイナーゼ」ファミリーには、パパイン、アクチニジンまたはブロメラインのような植物プロテアーゼ、いくつかの哺乳動物リソソーム性カテプシン、サイトゾル性カルパイン(カルシウムにより活性化)、およびいくつかの寄生虫(例えば、トリパノソーマ属、住血吸虫)プロテアーゼが含まれる。パパインは、その典型であり、ファミリーのなかで最も研究されている一員である。セリンプロテイナーゼと同様に、触媒反応は、共有結合中間体の形成を介して進行し、システインおよびヒスチジン残基を必要とする。必須のCys-25およびHis-159(パパインでの番号付け)は、それぞれSer-195およびHis-57と同じ役割を果たす。求核基はヒドロキシル基ではなくチオラートイオンである。チオラートイオンは、His-159による隣接のイミダゾール基とのイオン対の形成を介して安定化される。求核攻撃は、双方の段階でチオラート-イミダゾリウムイオンの対であって、水分子は必要とされない。
「アスパラギン酸プロテイナーゼ」の多くは、ペプシン・ファミリーに属している。ペプシン・ファミリーには、ペプシンおよびキモシンのような消化酵素のほかにリソソーム性カテプシンD、レニンのようなプロセシング酵素、ならびにある種の真菌プロテアーゼ(ペニシロペプシン 、リゾプスペプシン、エンドチアペプシン)が含まれる。第二のファミリーには、レトロペプシンとも呼ばれるAIDSウイルス(HIV)由来のプロテアーゼのようなウイルスプロテイナーゼが含まれる。セリンおよびシステインプロテイナーゼとは対照的に、アスパラギン酸プロテイナーゼによる触媒反応には、4面体型中間体が存在するが、共有結合中間体は必要とされない。求核攻撃は、次の二つの同時に起こるプロトン移動により達成される: 一方は水分子から2つのカルボキシル基の2残基へのもの、およびもう一方はその2残基から基質のカルボニル酸素へのものであり、同時発生的なCO-NH結合の切断を伴う。「プッシュ-プル」機構と呼べる、この一般的な酸-塩基触媒反応により、非共有結合的な中性の4面体型中間体が形成される。
「メタロプロテイナーゼ」は、細菌、真菌のほかに高等生物に見出される。これらは、その配列およびその構造が大きく異なるが、しかし大部分の酵素には、触媒的に活性な亜鉛(Zn)原子が含まれる。場合によっては、亜鉛がコバルトまたはニッケルのような別の金属に、活性が損なわれることなく置換され得る。細菌性のサーモリシンは、十分に特徴付けられており、その結晶構造から、2つのヒスチジンおよび1つのグルタミン酸が亜鉛に結合していることが示唆される。多くの酵素は、配列HEXXH (SEQ ID NO:)を含んでおり、この配列により、亜鉛に対する2つのヒスチジン配位子が提供されるが、第3の配位子はグルタミン酸(サーモリシン、ネプリライシン、アラニルアミノペプチダーゼ)またはヒスチジン(アスタシン)である。他のファミリーは、Zn原子の異なる結合様式を示す。この触媒反応機構により、亜鉛に結合する水分子が切れやすい結合のカルボニル基を攻撃後、非共有結合的な4面体型中間体が形成される。この中間体は、離脱基へのグルタミン酸のプロトンの移動によりさらに分解される。
プロテイナーゼ、例えば、セリンおよびシステインプロテイナーゼならびに同様のものとのペプチドの相互作用について論ずる場合、本出願では、SchechterおよびBergerの命名法を利用する[(1967) Biochem. Biophys. Res. Commun. 27:157〜162)]。基質または阻害剤の個々のアミノ酸残基は、P1、P2などと指定され、酵素の対応サブサイトはS1、S2などと指定される。基質の切れやすい結合はP1-P1'である。
ペプチド基質に対する結合部位は、酵素の全表面にわたる一連の「特異性サブサイト」からなる。「特異性サブサイト」という用語は、酵素に対する基質の一部分と相互作用できる酵素表面のポケットまたは他の部位を指す。
本明細書では、タンパク質に関して「組換え」とは、タンパク質が、例えば、原核生物、真核生物によるまたはインビトロ発現系での組換え核酸の発現から生じることを意味する。組換え核酸は、任意の天然には存在しない核酸配列または人間の介入の結果として生み出された、核酸配列の組み合わせである。
「基質」という用語は、酵素により、触媒的に作用を受けて、産物に化学的に変換される、酵素の基質を指す。
「立体異性体」という用語は、同一の化学構造を有するが、しかしながら空間中での原子または原子団の配置に関して異なった、化合物を指す。特に、「鏡像異性体」とは、お互いに対し重ね合わすことのできない鏡像にある、化合物の二つの立体異性体を指す。一方で、「偏左右異性体」とは、二つまたはそれ以上の不斉中心を持った立体異性体であって、お互いに対し鏡像にはない分子を指す。不斉中心の命名法に関して、用語「D」および「L」配置は、IUPACの推奨により定義される通りである。用語の使用に関して、偏左右異性体、ラセミ体、および鏡像異性体は、ペプチド調製物の立体化学を説明するように、その通常の文脈のなかで使用される。
「転写調節配列」とは、開始シグナル、エンハンサー、およびプロモーターのような核酸配列であって、これらと操作可能に連結された、タンパク質をコードする配列の転写を誘導するかまたは制御する配列を指すように、本明細書を通して使用される総称である。いくつかの例では、組換え遺伝子の転写は、発現を意図する細胞型において組換え遺伝子の発現を制御するプロモーター配列(または他の転写調節配列)の制御下にある。また、当然のことながら、組換え遺伝子は、天然型のタンパク質の転写を制御する配列と同じかまたは異なる転写調節配列の制御下とすることができる。
本明細書では、「ベクター」という用語は、核酸分子であって、これに連結された別の核酸を輸送できる分子を指す。好ましいベクターは、これに連結される核酸の自律的複製および/または発現が可能なものである。ベクターに操作可能に連結された遺伝子の発現を誘導できるベクターは、本明細書で「発現ベクター」と呼ばれる。
III. 典型的な態様
アドザイムは、少なくとも二つの調節部分、つまり標的化部分と触媒ドメインとを含む。標的基質の活性を変化させることに関して、アドザイムは、触媒ドメインまたは標的化部分単独と比べていっそう効力が高い。
触媒ドメインは、有機配位子もしくは補因子、または金属イオンのような他の成分を含むことができるが、タンパク質に基づく場合が多い。これには、自身は反応で消費されることなく基質と反応する、触媒的に活性な部位が含まれる。触媒ドメインは、一般的に、基質の一つまたは複数の結合を変化させる、例えば、結合を切断する、結合中の一つまたは複数の原子を取り除く(酸化または還元を含む)、および/または結合に関与する原子の空間的配置を変化させる。標的基質上の化学修飾の部位は、本明細書で「基質部位」と呼ばれる。
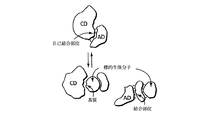
標的化部分は、標的基質と同じかまたは結合した所定の分子、すなわち、可溶性のまたは膜結合性の細胞内または細胞外標的生体分子の表面のようなアドレス結合部位を認識し且つこれに結合する。その効果はどちらの例でも、アドザイム構築物に「アドレス指定能力」を与えること、すなわち、標的基質に対する触媒ドメインの接近性を増加させて、それにより、その基質に対する触媒効率を増加させるために、標的基質の近傍で構築物の局所濃度を増加させることである。
標的化部分および触媒ドメインは、共有結合的に結合させるかまたは非共有結合性の手段により結合させることができる。例えば、それらの部分は、介在配列を入れてまたは入れないで、二つのタンパク質ドメインの融合により、単一のポリペプチド鎖を形成させるように、またはポリペプチド鎖のアミノもしくはカルボキシ末端、または側鎖の誘導により共有結合的に結合させることができる。ある種の好ましい態様として、標的化部分および触媒ドメインは、単一の組換え核酸構築物の発現により同時翻訳の融合体として産生される。各種の部分をタンパク質ドメイン間のような非共有結合的な相互作用、一般的な架橋結合配位子との相互作用などにより結合させることもできる。
アドザイムの概念は、補充的手法を利用して、適当な環境で利用することができる。ここでは、多選択性結合剤が投与される。多選択性結合剤のアドレスは、目的とする標的生体分子上のまたは近傍の結合部位と複合体化する。アドレスの一部分に結合するまたはそれを構成する、シャペロンタンパク質または多選択性結合剤の他の構造は、体内に既に存在している酵素、または同時投与される酵素的に活性な部分のような触媒ドメインと複合体化する表面を提示する。その結果、多選択性結合剤は、アドレスと触媒ドメインとの間の複合体形成を誘導する。結合部位に対するアドレスの親和性は、標的生体分子の近傍で触媒ドメインの有効濃度を増加させるのに役立つ。
アドザイムのアドレスおよび触媒ドメインは、協調して、相乗的作用をもたらすことが多い。標的は、単独で使用される触媒ドメインにより、そのkmおよびkcatにより決定される効力で調節される、例えば、切断により阻害されることができる。標的は同様に、単独で使用されるアドレスを規定する分子(単純に従来薬として作用する)と結合することにより、そのKaにより決定される効力で阻害されることができる。標的の調節量は、多くの場合、標準的なアッセイ法により客観的に測定することができる。従って、各機構を介して独立的に引き起こされた調節は、多くの場合、少なくとも大ざっぱに定量化することができる。少なくとも一部のアドザイム構築物の場合、同じkmおよびkcatを有する触媒ドメインと、同じKaを有するアドレスとの最適化された組み合わせを含むアドザイムは、単独で作用する個々の成分(触媒および標的化)の効力の合計の少なくとも10倍、102倍、103倍、場合によっては104倍の効力を有すると認められることが多いものと思われる。
標的化部分および/または触媒ドメイン単独に対して、製薬学的な場面でアドザイムの機能的な改善を表現するための別の方法は、ある種の好ましい態様において、アドザイムは、インビボで標的基質の活性を変化させるのに、触媒ドメインおよび/または標的化部分(例えば、中和部分の場合)単独よりも少なくとも2倍低い、およびより好ましくは少なくとも5倍、10倍、場合によっては100倍低い有効量(ED50)を有すると思われることである。
標的基質がアドザイムにより不活性型に分解される態様の場合、その効力は、「HL50」、例えば、標的基質のインビボ半減期(T1/2)を50パーセントに低下させるのに必要とされるアドザイムの濃度という観点で表現することができる。アドザイムの効力および選択性が高いほど、HL50濃度は、触媒ドメイン単独と比べて低くなる。ある種の好ましい態様として、アドザイムのHL50は、触媒ドメイン単独よりも少なくとも2倍低い、およびより好ましくは少なくとも5倍、10倍、場合によっては100倍低い。
ある種の態様として、アドザイムは、標的基質との触媒反応に対して、少なくとも104 M-1sec-1、およびさらにより好ましくは、少なくとも105 M-1sec-1、場合によっては少なくとも106 M-1sec-1の触媒効率を有する。
ある種の態様として、アドザイムは、標的基質との触媒反応に対して、触媒ドメイン単独よりも少なくとも5倍高い、およびさらにより好ましくは、少なくとも10倍、50倍、場合によっては100倍高い触媒効率を有する。
ある種の治療用途では、アドザイムの効力と特異性との均衡を保つことが重要であると思われる。効力と特異性との良好な均衡は、下記の設計基準を通して達成することができる。
この基準で設計されたアドザイムの態様の場合、触媒ドメインは非常に弱く、場合によっては、100、10、または1 M
-1s
-1しかない触媒効率、場合によってはそれよりも低い触媒効率を有するものと思われる。このように、効力と特異性との均衡を保つように設計されるアドザイムは、弱い酵素ドメインからもたらされるべきである。
ある種の態様として、標的化部分のk
off速度は、基質およびアドザイム反応産物に対して同様であるものと思われ、アドレスに結合した際の高い基質親和性およびその産物の迅速放出には、k
off速度を最適化することが望ましいものと思われる。これらの態様の場合、最適k
off速度は、0.001 sec
-1、0.01 sec
-1、0.1 sec
-1、またはそれ以上とすることができ、および下記により近似値を求めることができる。
[S]eff<<Km Eである場合、Km Eは酵素のKmである(アドザイムのものではない)。上式のkon AS(アドザイムのkon)は、以下の式2のk1と同じである。
二つのドメインの、その双方が独立して基質を結合する、融合タンパク質の場合、「基質の有効濃度」、つまり[S]effは、二つのドメイン、基質に結合している独立したアドレスドメインに対する会合平衡定数の、その基質および産物に結合している融合タンパク質に対する全体の会合平衡定数の商である。この定義は、図1およびZhou, J. Mol. Biol. (2003) 329, 1〜8の式2に従う。[S]effを決定するために必要とされる3つの平衡定数のそれぞれは、標準的な結合アッセイにより測定することができる。速度論的解析を行う場合、融合タンパク質中の各ドメインに対する微視的オフ速度は、リンカーの存在により影響を受けないものとさらに仮定される。
ある種の態様として、アドザイムは、標的基質との触媒反応に対して、触媒ドメイン単独よりも少なくとも5倍低い、およびさらに好ましくは少なくとも10倍、50倍、場合によっては100倍低いKmを有する。
概して、アドザイムは、酵素攻撃の部位を有する任意の生体分子標的と相互作用するように設計することが可能であり、およびアドレスに対する結合部位は、溶媒接触可能とする。従って、標的生体分子もアドレスに対する結合剤も可溶性の生体分子または膜結合性の生体分子とすることができる。細胞外標的はタンパク質構築物にいっそう接近しやすく、従って、好ましいが、標的は細胞内標的とすることができる。
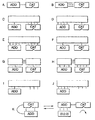
図1を参照して、本発明を活用できる種々の構築物を例証する概略図が、図1A〜1Kとして記載されている。図1Aの場合、最も単純なアドザイムと思われるが、アドレス(ADD)が触媒ドメイン(CAT)に共有結合的に結合されている。そのような構築物は、図示されるように、柔軟性のあるもしくは柔軟性のないリンカーにより結合された二つの別個の球形タンパク質ドメインとして、または分子表面のある部分アドレスとして機能し且つ別の部分が触媒的に活性な部位として機能する単一の球形タンパク質により具体化することができる。図1Bの場合、各ドメインは複合体化される、すなわち、それぞれがそのパートナーの表面に可逆的に結合する表面を含む。図1C〜1Fの場合、アドレスおよび触媒ドメインは、シャペロンタンパク質を介して結び付けられており、その一方または双方がリンカーのような共有結合または非共有結合的なタンパク質-タンパク質複合体形成を介してそのシャペロンに連結されている。図1Gおよび1Hの場合、アドレスおよび触媒ドメインのそれぞれが、共有結合的にまたは非共有結合的に、シャペロンタンパク質のドメインに連結されており、およびシャペロンドメインは、ともに非共有結合的に複合体化されている。
図1Iおよび1Jは、本発明の補充的態様を活用するための一つの方法を図示している。これらの構築物は、図示されるように、所定の触媒ドメイン、すなわち、体内に既に存在している酵素または構築物と同時投与される酵素に特異的な結合表面を規定する、シャペロンタンパク質に連結された(共有結合的にまたは非共有結合的に)アドレスを含む。このタイプの構築物は、完全に機能的なアドザイムがインビボで組み立てられるように、標的に対するアドレスの親和性により媒介された、標的生体分子の近くに酵素を補充することで機能する。もちろん、そのような酵素補充型の構築物は、それらが、標的上のまたは標的に隣接する結合部位に結合するアドレスとして機能する結合表面と、酵素に特異的に結合するように機能する結合表面とを有するように供与される他の形態で具体化することも可能であると思われる。例えば、補充による構築物は、単一の球形タンパク質として、または触媒ドメインに対する結合表面を規定する球形タンパク質および生体適合性高分子化合物の鎖を介してその球形タンパク質に連結させた、標的に親和性を有する小分子として具体化することができる。
酵素反応が完結後、アドザイムは、標的(もはや産物に変換された)から解離し、標的の別分子に結合し且つ作用するように移動し、この結果、代謝回転が生ずる。アドザイムのこの特徴の結果として、その薬物性構築物は、薬物/標的の化学量論に直接的に依存しない。これにより、重要な技術的利点が得られる、および疾患と関連した可溶性の生体分子を阻害する抗体または小分子の使用に付随する、毒性の問題を回避することが可能になる。
下記式は、アドレス(A)と標的生体分子(S)上のその結合部位との間の、および産物(P)をもたらす、アドザイムの酵素的に活性な部位(E)と標的基質(S)との間の考え得る2通りのアドザイム(A-E)の相互作用を図解している。
反応1は通常の触媒反応であり、この場合、反応がアドレスに対して結合部位を提示しない基質によって起こり得るように、アドレスは関与しない。アドザイム(A-E)と生体分子(S)の双方が低濃度で存在する場合、標的基質は、酵素ポケット(E)に対してオン速度K
1を有し、そのポケットと複合体A-E---Sを形成し、K
catに依存する速度で産物Pに変換されて解放される。
反応2は、標的基質Sの結合部位が、アドレスと結合部位との間の相互作用(E---S間の親和性よりも高いと思われる親和性により)の形成を介してアドザイムに結合する場合に起こり、その結果、オン速度K1で複合体S---AEを形成する。アドザイムの適当な構造、例えば、リンカーの長さまたは複合体およびその標的の立体化学が可能であると仮定すれば、この複合体は速度k2で、標的基質がアドレスおよび酵素ポケットと同時に相互作用する中間状態に入ることができる。この状態において、標的基質は、kcatにより律則される速度で産物Pに変換されて、その後、速度k3でアドザイムから解離する。
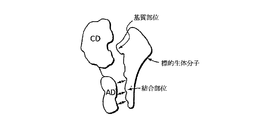
さまざまな形態のアドザイムの機能性および構造は、図2A〜2Jを参照してより良く理解することができる。図2Aは、アドザイムがその目的とする生体分子に結合した瞬間のインサイチューのアドザイムを描いている。この場合、アドザイムは、酵素的に活性な部位を有する触媒ドメイン(CD)とタンパク質の別の表面により定義されるアドレス(AD)とを規定する単一の球形タンパク質として具体化されている。アドレスは、この場合、標的生体分子の表面として具体化されている、結合部位と可逆的に結合する。標的基質部位は、触媒ドメインの酵素的に活性な部位による即効性の酵素攻撃を受けやすい。
図2Bは、アドレスが、柔軟性のあるリンカーにより触媒ドメインに結合された小分子であり、この分子が目的とする標的生体分子上の結合部位と可逆的に直接結合していることを除いて、図2Aと類似の構築物を示す。
図2Cは、アドレスおよび触媒ドメインが柔軟性のある鎖により結合された、図2Bと類似のアドザイムである。この場合も先と同様に、標的生体分子の一部分として図示された、結合部位とのアドレスドメインの結合が、図示されるように、標的の近くで触媒ドメインの局所濃度を増加させる効果的な働きをする。アドレスドメインおよび触媒ドメインは、柔軟性のあるリンカー、またはアドレスドメインの結合により、触媒ドメインがその標的生体分子の化学変化を誘導する位置に提示されるように、柔軟性が低い構造体(示されていない)を介して連結させることができる。
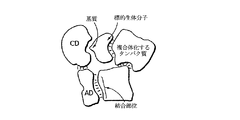
図2Dのアドザイムは、結合部位および標的生体分子が、この場合には、細胞膜のような膜に組み込まれているように図示された、別の分子種であることを除いて、図2Cと同様である。図2A〜2Cの態様と同様に、この場合には誘引分子として機能するものの認識部位とのアドレスドメインの結合が、標的の近くで触媒ドメインの局所濃度を増加させる効果的な働きをする。細胞上の二つのタンパク質の濃度が重要である場合、特にそれらが脂質ラフトまたは同様のものにおいて相互作用することが知られている場合には、一方の分子を結合部位として利用し、触媒的に調節されることになる他方の分子に構築物を引き付けることができる。
図2Eのアドザイムは、アドレスドメインおよび触媒ドメインが、相互に非共有結合的に直接会合されていることを除いて、図2Cと同様である。このタイプの会合の例には、任意にジスルフィド結合、相補的ヌクレオチドのハイブリダイゼーションにより安定化された、二量体化、または細胞内に遍在するタイプのタンパク質-タンパク質複合体形成が含まれる。
図2Fは、アドレスドメインが、標的生体分子とは別になっているがしかしその分子と複合体化された誘引生体分子に結合するように設計されていることを除いて、図2Eと同様のアドザイムの態様を示す。それでもやはり、図のように、結合によって、触媒ドメインの近くで標的およびその基質部位の有効濃度が増加する。
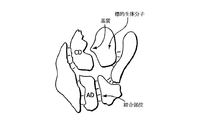
図2Gは、標的生体分子が、第三の複合体化タンパク質を介して、結合部位を提示する別のタンパク質と複合体化されていることを除いて、図2Fと同じである。
図2Hは、アドレスおよび触媒ドメインが、第三のシャペロンタンパク質を介して非共有結合的に会合され、活性な複合体を形成しているアドザイムの態様を図示する。図2Dと同様に、その目的とする標的生体分子は、脂質二重層内に埋まっているように図示されており、結合部位は、脂質二重層内の別の分子上に存在しているように図示されている。この場合も先と同様に、それでもやはり、結合によって、触媒ドメインの近くで標的およびその基質部位の有効濃度が増加する。
図2Iは、アドレスドメインが、標的生体分子の直上の結合部位に結合することを除いて、図2Hと同様のアドザイムの態様を図示する。
図2Jは、アドザイムのアドレスドメインおよび触媒ドメインが、シャペロンタンパク質との複合体形成を介してつなぎ合わされていることを除いて、図2Gと同様である。ADおよびCDが非共有結合的に複合体化されている構築物の全てにおいて、触媒ドメイン(またはシャペロンタンパク質)に結合するアドレスドメインの表面は、標的またはトリガー分子の結合部位に結合する表面と同じであってもまたは異なっていてもよい。
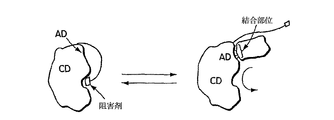
アドザイムのさらなる任意機能は、「人工的な随伴性(engineered contingency)」、すなわち、標的またはアドザイムに対して親和性を有する別のトリガー分子もしくは誘引分子が存在する場合に、その標的と反応できるようになる一群のアドザイムの作製である。図1Kは、随伴型アドザイムの背景にある基本的な考え方を図示している。図示されるように、アドレスは、触媒ドメインに対して親和性を有しており、アドレスが触媒ドメインに結合して、その酵素活性を阻害できるように設定されている。標的が存在する場合には、アドレスに対する競合が起こって、結果的に、触媒ドメインを解放し、その目的とする標的の化学変化を引き起こす。
別の言い方をすれば、随伴型アドザイム構築物は、トリガー分子が存在しない場合には不活性である(低い酵素活性を有する)が、しかしトリガー分子、例えば、標的が存在する場合には活性になる(Legendre D.ら(1999) Nature Biotechnology 17:67〜72; Legendre D.ら(2002) Protein Science 11:1506〜1518; Soumillion P.およびFastrez J. (2001) Current Opinion in Biotechnology 12:387〜394を参照されたい)。このタイプのアドザイムには同様に、触媒ドメインおよびアドレスが必要とされる。しかしながら、この場合には、アドレスの結合は、触媒ドメインの触媒部位を解き放って、その活性を増強する作用を有する。これは、例証として図3A〜3Gに図示される、いくつかの方法で達成することができる。これらについては、随伴型アドザイムの項でさらに詳細に記述する。
アドレスおよび触媒ドメイン、ならびに選択的なシャペロンタンパク質、これらの部分の関係を特徴付けるリンカーおよび他の構造に加えて、アドザイムは、その構成成分のいずれかと操作可能に連結された一つまたは複数の融合パートナー(例えば、N末端またはC末端融合体)、またはタンパク質ドメインのループ中の付加もしくは置換配列をさらに含むことができる。アドザイムは同様に、ポリマー側鎖、小分子、または金属イオンを含むことができる。これらの部分は、例えば、アドザイムを高次構造的に制限されたもしくは安定な形に制限することができる; アドザイムを細胞内もしくは細胞外区画に局在可能とする標的化配列としての機能を果すことができる; アドザイムもしくはアドザイムをコードする核酸の精製もしくは単離の補助となることができる; アドザイムに所望の可溶性を与える働きをすることができる; またはアドザイムもしくはアドザイムをコードする核酸分子に対する分解からの安定化もしくは保護(例えば、タンパク質分解に対する抵抗性)を与えることができる。アドザイムは、必要に応じて、上記の融合パートナーのうちの一つまたはいずれかの組み合わせを含むことができる。
融合パートナーは、例えば、(ヒスチジン)
6-tag、グルタチオンS-トランスフェラーゼ、プロテインA、ジヒドロ葉酸リダクターゼ、タグ・100エピトープ
c-mycエピトープ
FLAG(登録商標)-エピトープ
lacZ、CMP(カルモジュリン結合ペプチド)、HAエピトープ
プロテインCエピトープ
またはVSVエピトープ
とすることができる。
融合パートナーは同様に、膜移行ドメイン、すなわち、細胞膜を透過可能であって、付着させたペプチドをインビボで細胞の内外へ輸送するのに使用されるペプチドとすることができる。使用可能な膜移行ドメインには、以下に限定されることはないが、アンテナペディアホメオドメインタンパク質の第3ヘリックスおよびHIV-1タンパク質Tatまたはその変異体が含まれる。さらなる膜移行ドメインは、当技術分野において周知であり、例えば、Derossiら、(1994) J. Biol. Chem. 269, 10444〜10450; Lindgrenら、(2000) Trends Pharmacol. Sci. 21, 99〜103; Hoら、Cancer Research 61, 474〜477 (2001); 米国特許第5,888,762号; 米国特許第6,015,787号; 米国特許第5,846,743号; 米国特許第5,747,641号; 米国特許第5,804,604号; ならびに公開されたPCT公開国際公開公報第98/52614号、国際公開公報第00/29427号および国際公開公報第99/29721号に記述されているものを含む。
A. 典型的な標的化部分
当然のことながら、さまざまな構成要素を主題のアドザイム中の標的化部分として使用することができる。基本的には、標的化部分は、標的基質と関連した所定の特性(「アドレス部位」)に可逆的に結合する。標的化部分により、アドザイムをアドレス部位と選択的に、または相対的に選択的に結合可能とする化学的性質(例えば、疎水性、立体的および/またはイオン性)を有する一つまたは複数の表面が供与される。多くの態様の場合、アドレスは、触媒ドメインとの関連で規定される調節タンパク質(ペプチドを含む)ドメインであろう。例えば、標的化部分は、抗体、またはアドレス部位に結合する能力を保持している抗体の断片とすることができる。従って、標的化部分は、FabおよびF(ab)2断片、一本鎖抗体(scFv)、二重特異性抗体、さらにはアドレス部位に結合する抗体の重鎖または軽鎖の可変領域を含む断片を含んだ、モノクローナル抗体のような抗体および抗体断片由来とすることができる。
例えば、アドザイムの標的基質が受容体リガンドである場合、主題のアドザイムで用いるのに適当に適合させることができるタンパク質の他の例には、受容体のリガンド結合ドメインが含まれる。逆に、アドザイムが、標的基質として受容体を対象とする場合には、標的化部分は、受容体リガンドとすることができる。そのようなリガンドには、ポリペプチド成分と小分子リガンドの双方が含まれる。
さらに他の態様として、標的化部分は、アドレス部位との結合に対する反応速度および選択性に基づいて、選択した、例えば、合成的に進化させた人工ポリペプチド配列とすることができる。
標的化部分は同様に、オリゴヌクレオチド、ポリサッカライド、ポリアミノペプチド(例えば、ポリ-アスパラギン酸、ポリ-グルタミン酸、ポリ-リジンまたはポリ-アルギニン)のような、ポリアニオン系またはポリカチオン系結合物質とすることができる。ある種の態様として、そのような標的化部分は、生理学的pHでその構造全体にわたって多くの負電荷または正電荷を維持する。アドレスは同様に、タンパク質核酸(PNA)、ロック核酸(LNA)またはヌクレオチド配列、例えば、一本鎖のDNAまたはRNAとすることができる。
標的化部分は同様に、小分子であって、標的基質と関連したアドレス部位に結合させるために、その反応速度および選択性に基づいて選択された小分子とすることができる。
特定のアドザイムで使用するのに適した特異性、選択性および結合反応速度を同定するのに利用できるポリペプチド/ペプチド、核酸(アプタマー)および小分子部分のライブラリーを作製するための周知の技術がいくつか存在する。例えば、「Method for selection of proteins using RNA-protein fusions」という名称の米国特許第6258558号および「Directed evolution of novel binding proteins」という名称の米国特許第5837500号に記述されているような技術を、主題のアドザイムの作製に使用するためのペプチドまたはポリペプチド標的化部分の同定に使用するのに容易に適応することができる。同様に、当技術分野において以前に報告されているアプタマーの調製を、適当な標的化部分を作製するのに適応することができる。例えば、Tuerk Science 249:505〜510 (1990); Klug Mol Biol Reports 20:97〜107 (1994); およびMorrisら、PNAS 95:2902〜2907 (1998)、ならびに米国特許第5,843,701号および米国特許第5,843,653号を参照されたい。
アドレスは、少なくとも約5、10、15、20、25、30、35、40、45、50、55、60、70、80、90または100アミノ酸残基長とすることができる。上記に列挙される値の任意の組み合わせを上限および/または下限として使用した範囲は、本発明に含まれることが意図される。
ある種の好ましい態様として、アドレス部位がアドザイム反応産物(例えば、触媒ドメインによって作用を受けた標的基質)に結合している場合と比べて、アドレス部位が未改変の標的基質に結合している場合、アドレス部位との結合に対する解離定数(Kd)がより低い(親和性がより高い)および/またはKoff反応速度がより遅い。すなわち、アドザイム反応産物への標的基質の変換により、アドレス結合部位に対する標的化部分の親和性が低下して、反応産物からのアドザイムの解離が促進される。ある種の態様として、標的基質と比べてアドザイム反応産物に対する標的化部分のKdは、少なくとも5倍高く、およびさらにより好ましくは10倍、100倍、場合によっては1000倍高く、ならびに/またはアドザイム反応産物に対する標的化部分のKoff反応速度は、標的基質に対するKoff反応速度と比べて、少なくとも5倍速く、およびさらにより好ましくは10倍、100倍、場合によっては1000倍速い。
直接型アドザイムのある種の態様として、アドレス部位および基質部位は、標的基質との標的化部分の結合により、標的の基質部位に作用する触媒ドメインの能力が妨げられるという意味で重なり合っている。この妨害は、立体的な閉鎖の結果、またはアドザイムの両部分を標的基質と同時に相互作用可能とするアドザイムおよび/もしくは標的基質の柔軟性の欠如による可能性がある。他の態様として、アドレスおよび基質部位は十分に隔置されており、そしてアドザイムは十分な立体的柔軟性を有するので、アドザイムが標的基質を修飾するのに、標的化部分の解離が必要とされない。多くの態様の場合、アドザイムは、特に、二つの成分間のリンカーを適当に選択することから得られる、触媒ドメインと標的化部分との間の機能的な協同性が存在するように、得られたアドザイムの親和性が触媒ドメインと標的化部分の親和性の和よりも少なくとも2倍高く、およびさらにより好ましくは少なくとも5倍、10倍、100倍、場合によっては500倍高くなるように設計されるものと思われる。
場合によっては、標的化部分そのものが標的基質の活性を阻害する。例えば、標的化部分は、標的基質が媒介する固有の活性または相互作用を阻害する遮断剤または中和剤とすることができる。そのような場合、アドザイムは、阻害剤よりも少なくとも5倍高い効力を有することが好ましく、およびさらにより好ましくは標的化部分単独よりも少なくとも10倍、100倍、場合によっては1000倍高い効力を有する。
他の態様として、標的化部分そのものは、標的基質の活性に有意な効果を及ぼすことはない。
タンパク質分解ドメインに対する二つ以上の基質認識配列のように、触媒ドメインの予想基質部位が標的基質に二つ以上存在する場合、標的化部分は、その部位のうちの一つに対するアドザイムの選択性/選好性を増強させるように選択することができる。これは、例えば、その部位のうちの一つに作用する触媒ドメインの能力を立体的に妨害するような形で、標的基質に結合する標的化部分を使用することにより達成することができる。他の態様として、標的化部分を使用して、所望の基質部位の近傍で触媒ドメインの濃度を増加させることができる。
ある種の態様として、アドザイムは、二つまたはそれ以上のアドレス/標的化部分を含むことができ、これらは同一にまたは別にすることができる(すなわち、その各々のKdを同一にまたは別にすることができる)。そのような態様では、有効基質濃度[S]effがアドレス(または標的化部分)の最高の個別Kdよりも高い場合、標的基質に対するアドザイムの有効Kdは、10-15 M(フェムトモル)にまで低くなり得る。
ある種の態様として、標的化部分は、反応条件の下で可溶性である標的基質、例えば、可溶性タンパク質に結合する。多くの場合、これらの可溶性のタンパク質基質は、比較的低濃度で、例えば、0.1 μM未満、およびたいてい10 nM未満で、反応環境に存在するものと思われる。そのような態様、および本明細書のある他の態様の場合、アドザイム中にて供与する場合、標的基質との結合に関して比較的速いKon、例えば、103 M-1s-1またはそれ以上、例えば、少なくとも104 M-1s-1、105 M-1s-1、場合によっては106 M-1s-1のkonを有する直接型アドザイムをもたらす、標的化部分を選択することが望ましいかもしれない。
(i) 典型的な標的生体分子
ある種の態様として、主題のアドザイムは、例えば、溶媒接触可能な細胞外および細胞内基質、ならびに膜会合基質の細胞外または細胞質部分を含む、生物学的に活性のある分子(「標的生体分子」)を対象とする。これらのなかには、以下に限定されることはないが、タンパク質およひペプチド基質、核酸、脂質、細胞外因子(例えば、ステロイドおよび神経伝達物質)を含む小分子ならびに細胞内二次メッセンジャー(例えば、リン酸化イノシトールおよびcAMP)のような部類の基質が含まれる。主題のアドザイムを使用して、生物学的関連性のある標的基質の機能的性能を変化させることにより、細胞の、遺伝子発現、形態、細胞接着、成長、増殖、遊走、分化および/または生存度のような細胞過程を変化させることができる。
標的基質はアドザイムにより、標的基質と比べて生物活性に一つまたは複数の相違(例えば、標的基質の生物活性の全てまたはほぼ全ての消失を含む)を有する一つまたは複数の産物を生成するように改変することができる。例えば、それら自体が酵素である標的基質の場合、主題のアドザイムを使用して、その標的基質に固有の酵素活性を変化させることができる。例えば、アドザイムを使用して、エラスターゼ(嚢胞性線維症、急性呼吸窮迫症候群、および気腫の治療で)または転移に関与するマトリックスメタロプロテアーゼのようなプロテアーゼを阻害することができる。その他の態様として、アドザイムは、例えば、いくつか挙げると受容体-リガンド相互作用、タンパク質-タンパク質相互作用、タンパク質-脂質相互作用、タンパク質-DNAまたはタンパク質-RNA相互作用を変化させることにより、他の生物学的成分との標的基質の相互作用能を変化させる。この点において、アドザイムを使用して、標的基質の固有活性または結合活性を増加または減少させることができる。アドザイムを使用して、標的基質の半減期または体内分布を変化させることもできる。
場合によっては、アドザイムを使用して、未改変生体分子の機能的アンタゴニストに標的分子を変換することができる。単なる例証として、受容体相互作用を介して作用するポリペプチド因子の場合、アドザイムは、標的基質の同族受容体と相互作用できない産物を生成させるのではなく、標的基質を、受容体に結合できるが、しかしながら未改変の標的基質により可能とされる受容体の活性化レベルを誘導できない産物に変化させるように選択することができる。このように、アドザイムは、(a) ポリペプチド因子の濃度を低下させること、および(b) ポリペプチド因子に対する受容体の有効濃度を低下させるアンタゴニストを生成させることにより、ポリペプチド因子の機能を阻害する。このシステムの好ましい態様として、産物は、標的基質の活性の阻害に関して、10 μMまたはそれ以下のKiを有する、およびさらにより好ましくは10 μM、100 nM、10 nM、場合によっては1 nM未満のKiを有する。
(a) 細胞外標的
ある種の態様として、アドザイムは、細胞の完全に外側に通常位置する標的分子および細胞膜中に挿入されてはいるものの細胞外の環境に露出している部分を有する標的分子を含む、細胞外標的を対象とする。例えば、拡散性細胞外分子(例えば、成長因子、血清タンパク質、抗体、任意の拡散性小分子、細胞外ヌクレオチド、脂質)、不溶性凝集体の一部となる細胞外分子(例えば、β-アミロイドタンパク質、動脈硬化性プラークの構成成分、不溶性フィブリン線維)、膜会合タンパク質および他の膜結合成分(例えば、膜貫通タンパク質、脂質、膜会合ポリサッカライド)、ならびに組織化された細胞外マトリックスの構成成分またはそれと関連する構成成分を含む、いくつかの部類の細胞外標的が認識可能である。
従って、主題のアドザイムを使用して、自己分泌シグナル伝達(自己-シグナル伝達)、傍分泌シグナル伝達(近傍の細胞間)、および/または内分泌シグナル伝達(長距離にわたる、通常、血流または他の体液を介する)のような細胞表面を介したシグナル伝達を変化させる、例えば、阻害するまたは増強することができる。主題のアドザイムを使用して、接触分泌シグナル伝達、例えば、細胞接触によるシグナル伝達の結果を変化させることもできる。
異なる種類の細胞外標的の種々の実例が、拮抗性のアドザイムを治療に使用できる関連症状とともに、下記の表Iに示されている。
拡散性の細胞外分子のなかに、さらなる下位範疇を認識できる。好ましい態様として、アドザイムの標的は、ある細胞により産生される分子であって、他の細胞の応答を引き起こす初期効果を有する分子を意味する、細胞外シグナル伝達分子である。細胞外シグナル伝達分子の例には、大部分の成長因子およびサイトカイン、神経伝達物質、ホルモン、ならびにプロスタグランジンが含まれる。多くの細胞外シグナル伝達分子は実際に、シグナル伝達機能を実行するさらに大きな集団の一部分である; 例えば、TGF-β1は、ジスルフィド結合により連結される112アミノ酸の鎖を二つ含んでおり、2つのポリペプチド鎖のどちらもアドザイムの標的とされる細胞外シグナル伝達分子であると考えることができる。抗体は、明らかに「細胞外シグナル伝達分子」という用語のなかには含まれない。
ある種の態様として、細胞外シグナル伝達分子は、膜結合受容体の細胞外部分に結合して、細胞内のシグナル伝達現象を引き起こす分子である。ある種の態様として、細胞外シグナル伝達分子は、細胞に侵入して細胞内受容体に結合し、細胞内のシグナル伝達現象を引き起こす分子である(例えば、ステロイドホルモン、さまざまな病原菌のヘアピンタンパク質)。
特に好ましい態様として、アドザイムの標的は、例えば、体液中に見出すことができるような細胞外シグナル伝達ポリペプチド分子、例えば、成長因子、サイトカイン、ポリペプチドホルモンまたは同様のものである。ある種の好ましい態様として、標的とされる基質は、1 μM未満、さらにより好ましくは、0.1 μM、10 nM、1 nM、0.1 nM、10 pM、場合によっては1 pM未満の濃度で、血清または他の体液中に存在する、シグナル伝達分子、特に、シグナル伝達ポリペプチド分子である。触媒ドメインは、シグナル伝達分子を、同族受容体とのその相互作用を変化させる(例えば、結合の抑制または受容体活性化の制限)、他の可溶性因子とのタンパク質複合体のその形成能を変化させる、その半減期を変化させるおよび/またはその体内分布を変化させる形で改変するように選択される。
ある種の好ましい態様として、アドザイムは、細胞外因子により誘発されるシグナル伝達のレベルを変化させる。「シグナル伝達」という用語には、細胞内へのおよび細胞膜を介した細胞外環境からの物理シグナルまたは化学シグナルの処理が含まれることが意図される。シグナル伝達は、酵素(例えば、プロテアーゼ、またはリン酸化パターンもしくは他の翻訳後修飾を変化させることができる酵素)の活性化/不活性化、イオンチャネルの活性化もしくは細胞内のイオン貯蔵、グアニンヌクレオチド結合タンパク質媒介物を介したエフェクター酵素の活性化、二次メッセンジャーの発生(例えば、GTP加水分解、カルシウム動員、インシトールリン酸、環状ヌクレオチド、糖ヌクレオチドまたはNOもしくはO3のような溶解ガスの形成)、細胞内イオン(Ca+2、Zn+2、Na+、K+)の再分配、および/または転写因子の直接的活性化(または阻害)のような、さまざまな機構の一つまたは複数を介して起こり得る。シグナル伝達は、結果として細胞に生理学的変化、例えば、形態、細胞接着、走化性、薬剤耐性、成長、増殖、死(アポトーシスまたはネクローシス)、エフェクター機能、マトリクスの分泌などの変化を引き起こすことができる。
膜貫通受容体との、可溶性成長因子のような、細胞外シグナル伝達分子の結合による細胞内シグナルの誘導は、かなり生物学的に重要である。多くの場合、タンパク質因子による受容体-受容体相互作用の促進は、シグナル伝達過程の誘導において重要な初期段階である。ある種の好ましい態様として、主題のアドザイムを使用して、(i) 4本ヘリックスバンドル因子、(ii) EGF様因子、(iii) インスリン様因子、(iv) β-トレフォイル因子および(v) システイン・ノット因子として知られるタンパク質因子のスーパーファミリーのうちの一つから選択されるタンパク質因子のような、誘導性タンパク質因子の生物学的機能/性能を変化させることができる。これらの部類の範囲に入る典型的な基質が、表IIに掲載されている。
特定の細胞外シグナル伝達分子および適当なアドザイムを用いて治療できる、これらの標的と関連した症状の例が、下記の表IIIに掲載されている。
ある特に好ましい態様として、標的とされる基質は、腫瘍壊死因子(TNF-α)、インターロイキン-6(IL-6)またはインターロイキン-1b(IL-1b)のような炎症性サイトカインであり、アドザイムを治療的に使用して、炎症を軽減させることができる。
ある種の他の好ましい態様として、標的基質は、副腎皮質刺激ホルモン、アミリンペプチド、ボンベシン、カルシトニン、コレシストキニン(CCK-8)、ガストリン、グリセンチン、GLP-1、GLP-2、PYY、NPY、GIP、グルカゴン、ヒト絨毛膜ゴナドトロピン(α)、ヒト絨毛膜ゴナドトロピン(β)、ヒト卵胞刺激ホルモン(β2)、ヒト成長ホルモン、インスリン、黄体化ホルモン、膵臓ポリペプチド、副甲状腺ホルモン、胎盤性ラクトゲン、プロインスリン、プロラクチン、セクレトグラニンII、ソマトスタチン、サイログロブリン、甲状腺刺激ホルモン、血管活性腸管ポリペプチドのような、ポリペプチドホルモンである。
主題のアドザイムに対する他の典型的な基質には、以下からなる群より選択されるポリペプチド性因子が含まれる: 顆粒球コロニー刺激因子(G-CSF)、骨髄単球性成長因子、インターロイキン-3、インターロイキン-7、白血病抑制因子(LIF)、オンコスタチンM、毛様体神経栄養因子(CNTF)、コリン作動性分化因子(CDF)、インターロイキン-4、インターロイキン-13、インターロイキン-16、インターロイキン-17、インターフェロン-α(IFN-α)、インターフェロン-β(IFN-β)、インターフェロン-τ(IFN-τ)、インターフェロン-ω(IFN-ω)、インターロイキン-5、顆粒球マクロファージコロニー刺激因子(GM-CSF)、マクロファージコロニー刺激因子(M-CSF)、インターロイキン-10、インターロイキン1-α(IL1-α)、インターロイキン1-β(IL1-β)、ゴナドトロピン、神経成長因子(NGF)、血小板第4因子(PF-4)、bTG、GRO、9E3、HLA-A2、マクロファージ炎症性タンパク質1α(MIP-1α)、マクロファージ炎症性タンパク質1β(MIP-1β)、黒色腫成長刺激タンパク質(MGSA)、4-1BBリガンド、ADF、自己分泌型運動促進因子、B61、ベータセルリン、カルジオトロピン-1、CD27リガンド、CD30リガンド、CD40リガンド、CeK5受容体リガンド、EMAP-II、ENA-78、好酸球カチオン性タンパク質、エピレグリン、赤血球由来成長促進因子、エリスロポエチン、Fasリガンド、フィブロシン、FIC、GDNF、増殖/分化因子-5、インターロイキン-1受容体アンタゴニスト、インターロイキン-3、インターロイキン-6、インターロイキン-7、インターロイキン-9、インターロイキン-11、インターロイキン-12、インターロイキン-13、インターロイキン-14、インターロイキン-15、リンフォタクチン、LT-β、リンフォトキシン、MCP-2、MCP-3、メガポエチン(Megapoietin)、黒色腫由来増殖調節タンパク質、単球走化性タンパク質-1、マクロファージ遊走阻止因子、Neu分化因子、オンコスタチンM、OX40リガンド、胎盤成長因子、PLF、分散因子、スティール因子(Steel Factor)、TCA 3、トロンボポエチン、血管内皮細胞増殖因子、骨形成タンパク質、インターロイキン-1受容体アンタゴニスト、単球走化性タンパク質-1、c-Kitリガンド(幹細胞因子)、CXCケモカイン、CCケモカイン、リンフォタクチン、およびC-X3-Cケモカイン(フラクタルカイン/ニューロタクチン)。
他の態様として、アドザイムは、例えば、細胞表面受容体、イオンチャネル、トランスポーター、接着分子、脂質、またはポリサッカライドもしくはグリコサミノグリカンのような細胞外マトリクスの活性を変化させるため、細胞表面と結び付く基質を対象とする。
ある種の好ましい態様として、標的基質は、細胞表面の受容体タンパク質またはイオンチャネルである。例えば、アドザイムは、リガンド結合反応速度および/または受容体のシグナル伝達活性を変化させる形で、リガンド結合受容体タンパク質を改変させるように設計することができる。主題のアドザイムに対する基質となり得る受容体タンパク質には、細胞外分子(すなわち、ホルモン、成長因子、ペプチド、イオン)と相互作用して、細胞内のシグナルを調節する任意の受容体またはチャネルが含まれる。例えば、アドザイムの標的基質は、蛇行受容体(例えば、Gタンパク質結合受容体)、酵素結合受容体(例えば、受容体チロシンキナーゼ、受容体セリン/スレオニンキナーゼ、受容体タンパク質チロシンキナーゼ、受容体グアニル酸シクラーゼ、または受容体酸化窒素シンターゼ)、またはイオンチャネル(イオンチャネル結合受容体を含む)上の部位とすることができる。アドザイムにより改変できる典型的な受容体には、いくつか挙げると、サイトカイン受容体;マルチサブユニットの免疫認識受容体(MIRR)、ケモカイン受容体;成長因子受容体、または化学誘因性ペプチド受容体、神経ペプチド受容体、光受容体、神経伝達物質受容体、およびポリペプチド性ホルモン受容体が含まれる。細胞表面受容体のさらなる例は、適当に標的化が行われたアドザイムの投与により治療可能な関連症状とともに、表IVに示されている。
主題のアドザイムに対する細胞表面結合標的または細胞外マトリクス標的のさらなる例には、細胞接着分子、例えば、セレクチン、インテグリンおよび他のヘミデスモソームタンパク質、カドヘリン、ラミニン、CD44アイソフォーム、プロテオグリカン(例えば、シンデカン)、Igスーパーファミリー(IgCAM)タンパク質、カテニン(例えば、α、βおよびγカテニン)およびカドヘリン(例えば、E-カドヘリンまたはP-カドヘリン)、ガレクチン、コラーゲン、エラスチン、フィブリン、ならびに同様のものが含まれる。
ある種の態様として、アドザイムは、分化抗原群(CD)タンパク質、例えば、CD 1a、CD2 (LFA-2)、CD3、CD4、CD5、CD6、CD7、CD8、CD9 (運動性関連タンパク質-1)、CD10 (CALLA)、CD11b (Mac-l)、CD11b、CD13、CD14、CD15、CD16、CD18 (b2)、CD19、CD20、CD21、CD22 (BL-CAM)、CD23、CD25 (インターロイキン-2受容体)、CD27、CD29 (b1)、CD30、CD31 (PECAM-1)、CD34 (内皮細胞マーカー)、CD35、CD37、CD38、CD39、CD40、CD40L (CD154)、CD41 (GPIIb/IIIa)、CD42b (GPIb)、CD43、CD44 (H-CAM)、CD44変異体3、CD44変異体4、CD44変異体5、CD44変異体6、CD45 (白血球共通抗原)、CD45RA、CD45RB、CD45RO、CD48、CD49b (VLA-2)、CD49c (VLA-3)、CD49f (VLA-6)、CD50 (ICAM- 3)、CD51、CD54 (ICAM-1)、CD56 (NCAM)、CD57、CD58 (LFA-3)、CD61 (GPIIIa)、CD61(GPIIIa)、CD62E (E-セレクチン)、CD62L (L-セレクチン)、CD62P (P-セレクチン)、CD63 (黒色腫マーカー)、CD66a (CEACAM1)、CD66e (癌胎児性抗原)、CD68、CD69、CD71 (トランスフェリン受容体)、CD72、CD74、CDw75、CD79a、CD81、CD82、CD83、CD95 (Fas)、CD99 (MIC2)、CD104、CD105 (エンドグリン)、CD106 (VCAM-1)、CD117 (c-kitオンコプロテイン)、CD134 (OX40)、CD137、CD138 (シンデカン-1)、CD141 (トロンボモジュリン)、CD141 (トロンボモジュリン)、CD143 (ACE)、CD146 (MCAM)、CD147(EMMPRIN)、CDw150 (SLAM)、CD151 (PETA-3)、CD154 (CD40L)、CD162、CD163、CD166 (ALCAM)、CD168(RHAMM)、またはCD179aに作用する。
ある種の好ましい態様として、アドザイムの基質は、セレクチン、例えば、CD62ファミリータンパク質である。他の好ましい態様として、アドザイムの基質は、免疫グロブリンスーパーファミリータンパク質 (IgCAM)、例えば、CD2ファミリータンパク質、CD22、CD31、CD48、CD50、CD54、CD56、CD58、CD66a、CD83、CD106、CD146、CD147、CDw150またはCD166である。さらに他の好ましい態様として、アドザイムの基質は、インテグリン、例えば、CD49ファミリー、CD51、CD29、CD11b、CD18、CD41、CD61またはCD104である。
種々の野生型および病理学的に改変された物質に対する細胞接着、およびそのエンドサイトーシスを媒介する細胞表面タンパク質であって、細胞内シグナル伝達、脂質代謝、および病原菌に対する宿主防御に関与する、スカベンジャー受容体クラスA(SR-A、CD204)、スカベンジャー受容体-BI (SR-BI)またはCD36の活性を変化させるのに、ある種の主題のアドザイムを使用することができる。
コラーゲン分解性アドザイムを例えば、水生生物、ポリコラゲナーゼ-Kまたはファーメンコル(Fermenkol)由来のコラゲナーゼ触媒ドメインを用いて調製し、ポリペプチド基質(野生型または部分的に変性したコラーゲン型、エラスチン、フィブリン、ヘモグロビン、およびカゼイン)の強力な加水分解を引き起こすことができる。そのようなアドザイムは、医療用途および美容用途の双方で利用性がある。
ある種の態様として、受容体または他の細胞表面分子のリガンド(またはその結合部分)をアドレス部分として使用することができる。ある種の態様として、アドザイムは、標的細胞上の特定の細胞表面タンパク質またはマトリクスに結合するのに有効な一つまたは複数のリガンドと結合させることができ、それにより、標的細胞へのアドザイムの分離を促進させることができる。例えば、アドザイムは、同様にリガンドを含む融合タンパク質とすることができる。単に例証するため、特定の細胞型への本発明のアドザイムの標的化で用いるのに適したリガンドの例を下記の表Vに掲載する。
受容体リガンドのアンタゴニスト用のアドザイムに関するある種の態様として、アドザイムは、リガンド誘発性のシグナル伝達のレベルを減少させるように受容体を変化させるが、しかしながら受容体がその同族リガンドに結合する能力を実質的に損なうことがないものと思われる。このように、アドザイムは、シグナル伝達に関して機能喪失した受容体の生成に対する結果としてだけでなく、その異なるように不活性化された受容体が、依然として機能的な受容体からリガンドを隔離するための競合的結合剤として作用することもできるので、リガンドに拮抗する。または、アドザイムは、構成的に活性な受容体産物をもたらすように選択することができる、例えば、その場合、アドザイムは、受容体の誘導性リガンドのアゴニストとして作用することができる。
ある種の態様として、対象とするアドザイム基質は、ヘテロマー受容体複合体、例えば、二つまたはそれ以上の異なる受容体サブユニットを含む受容体複合体であると思われる。例えば、免疫系および造血系を調節する大部分のインターロイキンおよびサイトカインに対する受容体は、I型サイトカイン受容体ファミリーに属する。これらの分子は、その各サイトカインに対して高親和性結合を示すのに、そしてその生物学的機能を調節するのに多鎖の受容体複合体を形成する。ほとんどの場合、これらの機能的な受容体複合体は、gp130タンパク質のようなクラスIサイトカイン受容体ファミリーに同じくある、共通のシグナル伝達受容体成分を共有する。固有の受容体サブユニットと特異的に反応するが、しかし共通サブユニットの機能を実質的に損なうことがないアドザイムは、特定のリガンドのアンタゴニストとして、アドザイムの選択性を高めるのに使用することができる。
または、他のリガンド-受容体複合体、例えば、関心のあるリガンドに対する受容体複合体の形成と競合するものに固有の受容体サブユニットを選択的に不活性化するアドザイムは、関心のあるリガンドのアゴニストとすることができる。
さらに他の態様として、アドザイムは、生体分子による癒着の一部となる細胞外分子を対象とする。生体分子による癒着は、生体分子の好ましくない集団であって、通例、集団中にともに通常見出されることのない成分の寄せ集めが、通例、構成成分の連続的な付加によって長い時間をかけて成長したものである。癒着は、一般に非拡散性となるほど十分に大きく(血栓は循環系に拡散し得る癒着ではあるが)、そして一般に標準的な宿主細胞のサイズよりも大きい。生体分子による癒着には、多くの場合、死細胞および生細胞のほかに細胞外マトリックスが含まれるものと思われる。生体分子による癒着の例には、アミロイド沈着、例えば、アルツハイマー病に典型的なβ-アミロイドペプチドの沈着もしくはII型糖尿病性アミロイド沈着、コラーゲン沈着、タンパク質沈着、動脈硬化性プラーク、好ましくない脂肪の塊、好ましくない骨の塊、血栓、または嚢胞が含まれる。ある種の態様として、アドザイムは、生体分子による癒着に関わる一つまたは複数の細胞外分子を標的とし、且つそのような標的に癒着の部分的なまたは完全な分解をもたらすようなかたちで作用するように設計される。アルツハイマー病と関連するアミロイド沈着の中にたいてい存在しているタンパク質の例には、アミロイドβ-ペプチド[Aβ(1-42)]およびトランスサイレチンが含まれる。タンパク質の凝集は、アルツハイマー病、パーキンソン病、および全身性アミロイドーシスを含む、さまざまな疾患と結び付けられている。これらの疾患のほとんどは、アミロイド原線維と呼ばれる、高度に整列し且つβ-シートに富む凝集体の形成と関連付けられる。WTトランスサイレチン(TTR)またはTTR変異体による原線維形成は、それぞれ、全身性アミロイドーシスおよび家族性アミロイドポリニューロパシーと関連付けられている。α-サイヌクレイン(α-syn)によるアミロイド原線維形成は、パーキンソン病の神経変性と関連付けられている。動脈硬化性プラークには、さまざまな異なる構成成分が含まれ得る。ある種の構成成分の例には、石灰化した物質(例えば、ハイドロキシアパタイト)、コレステロール結晶、コラーゲンマトリックス、マクロファージ泡沫細胞、平滑筋細胞、脂質に富んだアテローム様物質(特にコレステロールおよびそのエステルに富む)、肥満細胞、マトリックスメタロプロテイナーゼ(例えば、MMP-1コラゲナーゼ、MMP-2およびMMP-9ゼラチナーゼ)が含まれる。動脈硬化性プラークの破裂が危険な血栓現象と関連付けられることを考慮すると、プラークを安定化させる(例えば、プラーク中のメタロプロテイナーゼを標的とすることにより)アドザイムを設計することまたはヘパリンのような、抗血栓剤と組み合わせてプラーク分解性アドザイムを使用することが望ましいかもしれない。
多くの場合、生体分子による癒着には、生物の他の部分において適当な役割を有するさまざまな生体分子が組み合わさっている: 従って、癒着中に主に存在している分子を選択的に標的とすることまたは癒着の近傍でアドザイム濃度を増大させる、異なるアドレス部分を複数備えたアドザイムを提供することが望ましいかもしれない。
(b) 細胞内標的
ある種の態様として、アドザイムは、細胞内標的に向けることができる。細胞内標的の例には、細胞内受容体(例えば、多くのステロイドホルモン受容体)、好ましくない症状で過剰発現されるかまたは好ましくない症状に別の方法で関与する酵素、好ましくない症状に関与する細胞内シグナル伝達タンパク質(例えば、腫瘍性タンパク質、炎症性シグナル伝達タンパク質)および転写因子が含まれる。
典型的な態様として、アドザイムは、核内受容体を変化させる。多くの核内受容体は、リガンド依存的な転写因子として見られる。これらの受容体により、主にホルモンである細胞外シグナルと、転写応答との間の直接的なつながりが得られる。これらの転写活性化機能は、ステロイドホルモン、ビタミンD、エクダイソン、レチノイン酸および甲状腺ホルモンのような、原形質膜を容易に通過して、細胞内のその受容体に結合する、内在性の小分子により調節される。例えば、主題のアドザイムを使用して、例えば、関心のあるホルモンに対する応答を阻害するため、受容体複合体を分解することにより、または関心のあるホルモンに対する受容体複合体の形成と別の方法で競合する、他の受容体二量体のためのサブユニットを分解することにより(アドザイムが、そのホルモンのアゴニストとなるように)、特定のホルモンまたは他の核内受容体のリガンドに対する細胞の応答性を変化させることができる。
ある種の細胞内標的の例が、適当な標的化アドザイムで治療できる関連症状とともに、下記の表VIに示されている。
細胞内標的に関する態様として、細胞内で産生されるまたは細胞内へ移行するように設計されるアドザイムを有することが一般に望ましいと思われる。ある種の態様として、アドザイムは、標的細胞による取り込みを促進する、例えば、細胞外の環境からの初期段階の取り込みを促進する一つまたは複数の官能基を含むことができる。一つの態様として、主題のアドザイムは、細胞内局在を促進するため、細胞膜を越えたアドザイムの移行を推進する「内在化ペプチド」を含む。内在化ペプチドは、それ自体、比較的高い比率で、例えば、トランスサイトーシスにより細胞膜を横断することができる。内在化ペプチドを、例えば、アドザイムに結合する。ある種の態様として、アドザイムは、細胞内へ導入される核酸、例えば、ウイルスベクターまたは裸のもしくは被包性の核酸ベクターから発現させることができる。アドザイムの細胞内産生用の核酸は、以下の「核酸組成物」という題の項に記述されている。
一つの態様として、内在化ペプチドは、ショウジョウバエのアンテペネペディア(antepennepedia)タンパク質、またはその相同体由来である。アンテペネペディアホメオタンパク質の60アミノ酸長のホメオドメインは、生体膜を通って移行することが実証されており、そのドメインと組となった異種ペプチドおよび有機化合物の移行を促進させることができる。例えば、Derossiら、(1994) J Biol Chem 269:10444〜10450; およびPerezら、(1992) J Cell Sci 102:717〜722を参照されたい。最近、このタンパク質の16アミノ酸長ほどの短さの断片で、内在化を推進させるのに十分であることが実証された。Derossiら、(1996) J Biol Chem 271:18188〜18193を参照されたい。本発明により、膜透過輸送を増加させるのに十分なアンテペネペディアタンパク質(またはその相同体)の少なくとも一部分を含むアドザイムが意図される。
内在化ペプチドの他の例は、HIV転写因子(TAT)タンパク質である。このタンパク質は、4つのドメインに分けられるように思われる(Kuppuswamyら、(1989) Nucl. Acids Res. 17:3551〜3561)。精製TATタンパク質は、組織培養で細胞により取り込まれ(FrankelおよびPabo、(1989) Cell 55 :1189〜1193)、そしてペプチド、例えば、TATの残基37〜62に相当する断片は、インビトロで細胞により迅速に取り込まれる(GreenおよびLoewenstein、(1989) Cell 55:1179〜1188)。高塩基性領域により、核への内在化部分の内在化および標的化が媒介される(Rubenら、(1989) J. Virol. 63:1〜8)。高塩基性領域、例えば、
の中に含まれる配列を含むペプチドまたは類似体をアドザイムのなかに使用して、内在化を補助することができる。
他の典型的なアドザイムは、アドザイムの膜透過輸送を増加させるため、十分な部分のマストパラン(T. Higashijimaら、(1990) J. Biol. Chem. 265:14176)を含むように作製することができる。
特定の理論に拘束されることを望むわけではないが、疎水性ポリペプチドおよび有機分子はまた、受容体を介したトランスサイトーシスによって膜を横断できる運搬用ペプチドに、そのポリペプチドを連結するかまたは結合させることにより、膜障壁を越えて生理的に輸送できるということが知られている。この種の適当な内在化ペプチドは、例えば、ヒストン、インスリン、トランスフェリン、ベーシックナアルブミン、プロラクチンおよびインスリン様成長因子I(IGF-I)、インスリン様成長因子II(IGF-II)または他の成長因子の全体または一部分を用いて作製することができる。例えば、 毛細血管細胞上のインスリン受容体に親和性を示し、血糖の低下でインスリンよりも効果が低いインスリン断片は、受容体を介したトランスサイトーシスによる膜透過輸送能を有することが見出されており、従って、主題のアドザイムに対する内在化ペプチドとしての機能を果すことができる。好ましい成長因子由来の内在化ペプチドには、
のようなEGF(上皮成長因子)由来のペプチド; TGF-β(形質転換成長因子β)由来のペプチド; PDGF(血小板由来成長因子)またはPDGF-2由来のペプチド; IGF-I(インスリン様成長因子)またはIGF-II由来のペプチド; およびFGF(線維芽細胞増殖因子)由来のペプチドが含まれる。
別の部類の輸送化/内在化ペプチドは、pH依存的な膜結合を示す。酸性pHでらせん構造をとる内在化ペプチドの場合、内在化ペプチドは、両親媒性の特性を備えている、例えば、疎水性と親水性双方の結合界面を有する。より具体的には、約5.0〜5.5のpH範囲内で、内在化ペプチドは、標的膜への成分の挿入を促進するα-ヘリックスの、両親媒性構造を形成する。α-ヘリックスを誘発する酸性pH環境は、例えば、細胞エンドソーム内に存在する低いpH環境で見出すことができる。そのような内在化ペプチドを使用して、エンドサイトーシス機構によって取り込まれた主題のアドザイムの、エンドソーム区画から細胞質への輸送を促進させることができる。
好ましいpH依存的な膜結合内在化ペプチドには、グルタミン酸、メチオニン、アラニンおよびロイシンのような、ヘリックス形成残基が高い割合で含まれる。さらに、好ましい内在化ペプチド配列には、pH 5〜7の範囲内にpKa値を有するイオン性残基が含まれ、その結果、pH 5で十分に非電荷性の膜結合ドメインがペプチド内に存在することとなり、標的細胞膜への挿入が可能になるものと思われる。
この点で特に好ましいpH依存的な膜結合内在化ペプチドは、
であり、これにはSubbaraoら(Biochemistry 26:2964, 1987)によるペプチド配列の修飾が示されている。このペプチド配列のなかで、最初のアミノ酸残基(Xaa1)は、標的化タンパク質複合体への内在化ペプチドの化学結合を促進する、システインまたはリジンのような、特異な残基であることが好ましい。アミノ酸残基(Xaa2-Xaa3)は、異なる膜に対して、内在化ペプチドの親和性を調節するように選択することができる。例えば、残基2と3の双方がlysまたはargである場合、内在化ペプチドは、陰性の表面電荷を有する脂質の膜または斑に結合する能力を有するものと思われる。残基2-3が中性アミノ酸である場合、内在化ペプチドは、中性の膜の中に入り込むものと思われる。
さらに他の好ましい内在化ペプチドには、アポリポタンパク質A-1およびBのペプチド; ペプチド毒素、例えば、メリチン、ボンボリチン、δ溶血素およびパルダキシン; 抗生物質ペプチド、例えば、アラメチシン; ペプチドホルモン、例えば、カルシトニン、副腎皮質刺激ホルモン放出因子、βエンドルフィン、グルカゴン、副甲状腺ホルモン、膵臓ポリペプチド; ならびに多数の分泌タンパク質のシグナル配列に相当するペプチドが含まれる。さらに、典型的な内在化ペプチドは、酸性pHで内在化ペプチドのα-ヘリックス特性を促進させる置換基の付着により修飾することができる。
孔形成タンパク質またはペプチドも同様に、本明細書で内在化ペプチドとして役立ち得る。孔形成タンパク質またはペプチドは、例えば、C9補体タンパク質、細胞溶解性T細胞分子またはNK細胞分子から得るまたはそれらに由来することができる。これらの成分は、膜中に環状構造を形成することができ、従って、結合させたアドザイムを、膜を通して細胞内部に輸送させることができる。
(c) 感染性または外来性の標的
アドザイムのさらなる部類の標的は、感染性のまたは別の点で好ましくない外来性の病原体、例えば、原生生物、酵母、細菌、ウイルスおよびプリオンならびにさまざまな複合体と関連した標的である。ある種の態様として、アドザイムは、ピリンまたは他の接着タンパク質のような、細菌の表面に露出している毒性因子、フラジェリン、または他の運動性タンパク質、宿主細胞の細胞質への細菌細胞の侵入を促進させるタンパク質を標的とする。ある種の態様として、アドザイムは、細胞溶解を引き起こすのに十分、細菌の細胞壁または細胞膜の構造成分を破壊するように標的化される。ある種の態様として、アドザイムは、ウイルス粒子の生存性または宿主細胞への進入に必要とされるウイルスのタンパク質または他の構成成分、例えば、ウイルス被膜または外被のタンパク質を標的とする。別の例として、アドザイムは、毒素、毒液、好ましくない外来性の化学物質または重金属を標的とすることができる。
(d) 開発された治療薬が標的とする分子
効果的なアドザイムを設計するための一つの新たな手法は、モノクローナル抗体および可溶性の受容体部分のような、標的分子との結合によって作用する、治療効果のある薬剤が標的とする分子を同定することである。好ましい態様として、標的分子は、FDA承認の、市販の治療用結合剤である。結合剤が効果的に標的とすることができる分子は同様に、その結合剤に比べてさらに高い有効性を供与するアドザイムの標的にすることができるものと予想される。
ある種の態様として、アドザイムは、CD52のアンタゴニストである。そのようなアドザイムは、B細胞慢性リンパ球性リンパ腫(CLL)に対する治療の一部として使用することができる。CD52は、正常のおよび悪性のBおよびTリンパ球、NK細胞、単球、マクロファージ、ならびに男性生殖器系の組織の表面に発現する21〜28 kDの糖タンパク質である。Campath(登録商標)(アレムツズマブ)は、組換えDNA由来のヒト化CD52モノクローナル抗体(Campath-1H)である。Campathの利用に伴う一つの問題は血液毒性であり、この毒性は、30 mgを超える単回用量または1週当たり90 mgを超える累積用量を投与した場合に発生する傾向がある。従って、主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)を使用することが可能であり、一般に、下記の他の疾患のアドザイムによる治療の場合も同様である。CD52を効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、アドザイムは、TNF-αのアンタゴニストである。そのようなアドザイムは、関節リウマチ、クローン病および潰瘍性大腸(結腸)炎を含む炎症性腸疾患(IBD) に対する治療の一部として使用することができる。ヒトTNF-αは17 kDaの非糖化タンパク質であり、その一方で、マウスTNF-αはN-グリコシル化されている。TNF-αは、幅広い生物活性を示し、そしてIBD問題全体の重要な要素であることが見出されている。エンブレル(Enbrel)(エタネルセプト; Immunex)およびレミケード(Remicade)(インフリキシマブ; Centocor)は、関節リウマチおよびクローン病の重症例に使用されるTNF-α抗体である。この二つの薬剤は、機序が極めてよく似ており、つい最近になって承認された、ヒト抗体の構造にいっそう忠実な、TNF抗体ヒュミラ(Humira)(アダリムマブ; Abbott)も同様である。主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)を使用することができる。TNF-αを効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、アドザイムは、HER2/neu受容体のアンタゴニストである。そのようなアドザイムは、転移性乳がんおよび/またはHER2の過剰発現を伴う、再発性のもしくは難治性の卵巣がんもしくは原発性腹膜がんに対する治療の一部として使用することができる。HER2(またはc-erbB2)がん原遺伝子は、上皮成長因子受容体1(EGFR1)と構造的に関連した、185 kDaの膜貫通型受容体タンパク質をコードする。HER2タンパク質の過剰発現が原発性乳がんの25%〜30%で認められる。ハーセプチン(HERCEPTIN)(トラスツズマブ)は、細胞に基づくアッセイにおいて高い親和性(Kd = 5 nM)でHER2の細胞外ドメインに選択的に結合する、組換えDNA由来のヒト化モノクローナル抗体である。この抗体はヒト化マウスIgG1κである。HERCEPTIN投与の利用に伴う一つの問題は、重篤な過敏性反応(アナフィラキシーを含む)、注入反応、および肺イベントである。従って、主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)を使用することができる。HER2を効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、アドザイムは、CD33のアンタゴニストである。そのようなアドザイムは、成人の急性白血病のうちで最もよく見られるタイプである、急性骨髄性白血病(AML)に対する治療の一部として使用することができる。CD33抗原は、骨髄単球性系統の白血病芽球および未成熟な正常細胞の表面に見出されるが、しかしながら正常な造血幹細胞には見出されない、シアル酸依存的な接着タンパク質である。「ミロターグ(Mylotarg)」(注射用のゲムツズマブオゾガマイシン)は、ミクロモノスポラ・エキノスポラ種カリケンシス(Micromonospora echinospora ssp. calichensis)菌の発酵から単離された、細胞傷害性の抗腫瘍抗生物質カリケアマイシンを結合させた組換えヒト化IgG4κ抗体からなる化学療法薬剤である。Mylotargの抗体部分は、CD33抗原に特異的に結合する。Mylotargの利用に伴う副作用には、アナフィラキシー、注入反応、肺イベント、および肝毒性を含む、過敏性反応が含まれる。従って、主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)を使用することができる。CD33を効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、アドザイムは、CD3のアンタゴニストである。そのようなアドザイムは、急性の腎臓の、ステロイド抵抗性の心臓の、またはステロイド抵抗性の肝臓の同種移植拒絶反応のような、移植拒絶反応に対する治療の一部として使用することができる。OKT3(または「ムロモナブ-CD3」)は、ヒトT細胞のCD3抗原に対するマウスモノクローナル抗体であり、この抗体は、免疫抑制剤として機能する。この抗体は、生化学的に精製されたIgG2a免疫グロブリンである。この抗体は、T細胞の機能に必要不可欠な、ヒトT細胞表面のCD3糖タンパク質に向けられる。CD3 T細胞受容体分子複合体の発現を可逆的に喪失しているものの依然としてCD4およびCD8抗原を持つ、調節された細胞は、機能的に免疫不全であることが明らかにされている。従って、主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)を使用することができる。CD3を効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、アドザイムは、gpIIb/IIIaのアンタゴニストである。そのようなアドザイムは、急性心筋梗塞症/不安定狭心症に対する治療の一部として使用することができる。アブシキマブ(Abciximab)(ReoPro(登録商標))は、ヒト-マウスのキメラモノクローナル抗体7E3のFab断片である。Abciximabは、ヒト血小板の糖タンパク質(GP) IIb/IIIa(aIIbb3)受容体に結合して、血小板凝集を阻害する。Abciximabは同様に、血小板にならびに内皮細胞および平滑筋細胞の血管壁に見出されるビトロネクチン(avb3)受容体にも結合する。主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなFabまたはscFv誘導体)を使用することができる。gpIIb/IIIaを効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、アドザイムは、CD20のアンタゴニストである。そのようなアドザイムは、CD20陽性の、濾胞性の、非ホジキンリンパ腫のような、非ホジキンリンパ腫(NHL)に対する治療の一部として使用することができる。CD20抗原は、正常および悪性Bリンパ球の表面に見出される。RITUXAN(登録商標)(リタキシマブ(Rituximab))抗体は、正常および悪性Bリンパ球の表面に見出されるCD20抗原に対する遺伝子組換えキメラ・マウス/ヒトモノクローナル抗体である。この抗体は、マウス軽鎖および重鎖可変領域の配列ならびにヒト定常領域の配列を含む、IgG1κ免疫グロブリンである。Rituximabは、CD20抗原に対し、約8.0 nMの結合親和性を有する。第二の承認薬ゼバリン(ZEVALIN)(イブリツモマブ・チウキセタン(Ibritumomab Tiuxetan))は、モノクローナル抗体のIbritumomabとリンカー-キレーターtiuxetanの[N-[2-ビス(カルボキシメチル)アミノ]-3-(p-イソチオシアネートフェニル)-プロピル]-[N-[2-ビス(カルボキシメチル)アミノ]-2-(メチル)-エチル]グリシンとの間の安定なチオ尿素共有結合から得られた免疫複合体である。このリンカー-キレーターにより、インジウム-111またはイットリウム-90に対する高親和性の、高次構造的に制限された配位部位が供与される。ZEVALINの抗体部分は、CD20抗原に対するマウスIgG1κモノクローナル抗体のIbritumomabである。第三の薬剤ベキサール(Bexxar)(トシツモマブ(tositumomab)およびヨード-131 tositumomab)は、Rituxan抵抗性であり且つ化学療法後に再発した、悪性転換を伴うおよび伴わない、CD20陽性の、濾胞性の、非ホジキンリンパ腫を患う患者の治療のための別の承認薬である。主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなFabまたはscFv誘導体)を使用することができる。CD20を効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、アドザイムは、RSV Fタンパク質のアンタゴニストである。そのようなアドザイムは、RSV感染症に対する治療の一部として使用することができる。SYNAGIS(登録商標)(パリビズマブ(PALIVIZUMAB))は、組換えDNA技術により産生されたヒト化モノクローナル抗体(IgG1k)であって、呼吸器合胞体ウイルス(RSV)のFタンパク質のA抗原部位の中のエピトープに向けられている。Palivizumabは、ヒト(95%)およびマウス(5%)抗体配列の複合体である。主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなFabまたはscFv誘導体)を使用することができる。RSV Fタンパク質を効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、アドザイムは、CD25のアンタゴニストである。そのようなアドザイムは、移植拒絶反応に対する治療の一部として使用することができる。Zenapax(登録商標)(ダクリズマブ(daclizumab))は、活性化した(但し、休止していない)リンパ球の表面に発現されるヒト高親和性IL-2受容体のαサブユニット(p55α、CD25、またはTacサブユニット)に特異的に結合する、組換えDNA技術により産生された、免疫抑制性の、ヒト化IgG1モノクローナル抗体である。この薬剤は、高親和性IL-2受容体に結合し、これによって、IL-2によるTacの結合、およびリンパ球の活性化を阻害する。従って、このモノクローナル抗体は、純粋な結合阻害剤として機能する。主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなFabまたはscFv誘導体)を使用することができる。CD25を効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、アドザイムは、IL-1のアンタゴニストである。そのようなアドザイムは、関節リウマチに対する治療の一部として使用することができる。RAの病因は、深刻かつ慢性的な関節の炎症を引き起こす複雑な過程である。インターロイキン-1(IL-1)は、RAの主要な仲介物質であり、そしてRA患者の関節液中に豊富に存在することが見出されている重要な炎症性サイトカインである。キネレット(Kineret)(登録商標)(アナキンラ(anakinra))は、ヒトインターロイキン-1受容体アンタゴニスト(IL-1Ra)の組換え、非グリコシル化型である。Kineret(登録商標)は、そのアミノ末端に1個のメチオニン残基の付加がある点で野生型ヒトIL-1Raと異なる。Kineret(登録商標)は、幅広い組織および器官で発現される、インターロイキン-1タイプI受容体(IL-1RI)とのIL-1の結合を競合的に阻害することにより、IL-1の生物活性を遮断する。従って、Kineret(登録商標)は、純粋な結合阻害剤として機能する。主題のアドザイムは、その触媒的性質によって、はるかに少ない用量で投与することが可能であり、より良好な治療の代替物になるものと期待される。アドザイムのアドレスドメインには、同一のモノクローナル抗体またはその機能的誘導体(例えば、本出願にあるようなFabまたはscFv誘導体)を使用することができる。IL-1を効果的に消化できるプロテアーゼの一団を、触媒ドメインとして使用することができる。
ある種の態様として、IgE(免疫グロブリンE)をアドザイムの標的とすることができる。IgEは、宿主を寄生虫の侵入から防御する抗体のクラスである。IgEは、肥満細胞および好酸球と相互作用して、宿主を寄生虫の侵入から防御する。IgE-免疫細胞複合体は同様に、多くのアレルギー反応または過敏性反応、例えば、枯草熱、喘息、じんましんおよびアナフィラキシーにも関与する。IgEのFc部分に対する細胞上の受容体には、二つの主要なタイプが存在する。高親和性受容体は、肥満細胞および好塩基球に主に見出される。低親和性受容体は、CD23細胞に見出される。IgEは、これらに結合して、抗原受容体として機能する。Xolair(商標)は、IgEのFc部分に向けられた、そして喘息の治療に有効なヒト化モノクローナル抗体である。IgE活性を標的とし且つ低下させる(一般に、Fc部分を標的化することにより)アドザイムを使用して、喘息を治療することができる。アドザイムのアドレスドメインには、モノクローナル抗体もしくはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)、またはIgE受容体に対する可溶性リガンド結合部分を使用することができる。IgEを効果的に消化できるプロテアーゼの一団のうちの一つまたは複数を、触媒ドメインとして使用することができる。
ある種の態様として、VEGF(血管内皮増殖因子)をアドザイムの標的とすることができる。VEGFは、血管形成(新しい血管壁の形成)、特に腫瘍で重要な役割を果たし、既存の腫瘍の血管の維持にも関与する。VEGFは、ホモ二量体であり、ジスルフィド結合される。成熟型で、121、165、189、または206アミノ酸のポリペプチド単量体をコードする、VEGFの4つのヒトスプライス変異体が同定されている。2つの受容体チロシンキナーゼ(RTK)Flt-1およびFIk-1は、高い親和性でVEGFを結合する。Avastin(商標)は、VEGFに対する治験中の組換えヒト化抗体であり、転移性結腸直腸がん患者の生存性の改善に有効性を示す。VEGFの活性を標的とし且つ低下させるアドザイムを使用して、種々のがん、特に結腸直腸がんを治療することができる。アドザイムのアドレスドメインには、モノクローナル抗体もしくはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)、またはVEGF受容体に対する可溶性リガンド結合部分を使用することができる。VEGFを効果的に消化できるプロテアーゼの一団のうちの一つまたは複数を、触媒ドメインとして使用することができる。
ある種の態様として、EGFR (上皮成長因子受容体)をアドザイムの標的とすることができる。EGFRは、頭頚部がん、結腸直腸がん、膵臓がん、肺がん、食道がん、腎細胞がん、前立腺がん、膀胱がん、子宮頚/子宮がん、卵巣がんおよび乳がんを含む、多くの細胞型について高い割合で発現している。ERBITUX(商標)(以前にはIMC-C225として知られる)は、EGFRに結合して、EGFが腫瘍に対する受容体の活性化およびシグナル伝達を惹起する能力を遮断する、特異性の高いキメラ化モノクローナル抗体である。この遮断により、腫瘍の浸潤および転移、細胞修復ならびに血管形成を含むEGFRの活性化による効果を阻害することにより、腫瘍増殖が阻害される結果となる。ERBITUX(商標)は、ヒトがんの動物モデルにおいて化学療法や放射線と併用されている。これらの前臨床的な所見から、化学療法または放射線と併用した場合、ERBITUX(商標)治療により、結果的に腫瘍の排除および動物の長期生存をもたらす一層の抗腫瘍効果が得られることが示唆されている。EGFRの存在、リガンド結合能またはシグナル伝達能を標的とし且つ低下させるアドザイムを使用して、および特に、さらに一つまたは複数の化学療法薬と併用することで、種々のがん、特に結腸直腸がんを治療するかまたは予防することができる。アドザイムのアドレスドメインには、モノクローナル抗体もしくはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)、またはEGFRに対する可溶性リガンド(例えば、EGF)を使用することができる。EGFRの細胞外部分を効果的に消化できるプロテアーゼの一団のうちの一つまたは複数を、触媒ドメインとして使用することができる。
ある種の態様として、β-1およびβ-7のような、一つまたは複数のα-4インテグリンをアドザイムの標的とすることができる。インテグリンは膜貫通タンパク質であり、α-4-β1(VLA-4)およびα-4-β-7インテグリンは、白血球細胞、特にTリンパ球および好酸球が、炎症部位で血管壁を通り抜けて、後にこれらの細胞が炎症過程に関与することになる体内組織中へ移行するのに役立つ。Antegren(登録商標)は、β-1とβ-7インテグリンの双方に結合し且つこれらを遮断し、結果的に炎症に対する多くの細胞型の寄与を阻止するヒト化モノクローナル抗体である; Antegren(登録商標)は、クローン病の治療に対して有効性を示す。これらのインテグリンの存在またはリガンド結合能を標的とし且つ低下させるアドザイムを使用して、種々の炎症性疾患、特にクローン病を治療するかまたは予防することができる。アドザイムのアドレスドメインには、モノクローナル抗体もしくはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)、または標的とするα-4インテグリンに対する可溶性リガンドを使用することができる。標的とするインテグリンの細胞外部分を効果的に消化できるプロテアーゼの一団のうちの一つまたは複数を、触媒ドメインとして使用することができる。
ある種の態様として、CCR-5をアドザイムの標的とすることができる。ヒトCCR5ケモカイン受容体は、7回疎水性膜貫通ドメインを有するG(タンパク質)結合受容体のロドプシンスーパーファミリーの一員である。CCR5は、RANTES、MIP-1βおよびMIP-1αを結合する(Raport, C.J.ら、(1996) J. Biol. Chem. 271:17161)。CCRは、マクロファージ指向性HIV-1ウイルスによる感染を促進し、RANTES、MIP-1αおよびMIP-1βは、マクロファージ指向性HIV-1単離株による感受性細胞の感染を抑制することができる(Choe, H.ら、(1996) Cell 85:1135. Cocchi, F.ら、(1995) Science 270:1811)。CCR-5を標的とした親和性薬剤は承認されていないが、CCR-5はHIV感染に関与しており、CCR-5の存在またはHIV結合能を標的とし且つ低下させるアドザイムを使用して、喘息および他のアレルギー反応を治療するかまたは予防することができる。アドザイムのアドレスドメインには、モノクローナル抗体もしくはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)、またはCCR-5に対する可溶性リガンドを使用することができる。CCR-5の細胞外部分を効果的に消化できるプロテアーゼの一団のうちの一つまたは複数を、触媒ドメインとして使用することができる。
ある種の態様として、インターロイキン-4をアドザイムの標的とすることができる。ヒトIL-4は、活性化T細胞、肥満細胞、および好塩基球により産生される多機能性サイトカインである。IL-4の生物学的作用は、特異的な細胞表面受容体とのIL-4の結合により媒介される。IL-4に対する機能的な高親和性受容体には、リガンド結合サブユニット(IL-4R)および受容体複合体のリガンド結合親和性を調節できる第二サブユニット(β鎖)が含まれる。IL-2受容体複合体のγ鎖は、IL-4受容体複合体の機能的なβ鎖でもある。成熟型IL-4は、129アミノ酸のタンパク質である(Yokota,T.ら、1986, Proc. Natl. Acad. Sci. USA 83:5894)。IL-4活性は、例えば、ヒト因子依存性細胞株TF-1を用いた細胞増殖アッセイで測定することができる(Kitamuraら、1989 J. Cell Physiol. 140:323)。IL-4を標的とした親和性薬剤は承認されていないが、IL-4はアレルギーおよび喘息に関与しており、IL-4の活性を標的とし且つ低下させるアドザイムを使用して、喘息および他のアレルギー反応を治療するかまたは予防することができる。アドザイムのアドレスドメインには、モノクローナル抗体もしくはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)、またはIL-4受容体の可溶性リガンド結合部分を使用することができる。IL-4を効果的に消化できるプロテアーゼの一団のうちの一つまたは複数を、触媒ドメインとして使用することができる。
ある種の態様として、IL-13をアドザイムの標的とすることができる。IL-13を標的とした親和性薬剤は承認されていないが、IL-13は、喘息および種々のアレルギーに関与するサイトカインとして広く認識されている。成熟型ヒトIL-13は、GenBankアクセッション番号P35225に記述されているような配列を有する112アミノ酸のポリペプチドである(McKenzieら、1993, PNAS USA 90:3735〜3739)。IL-13活性は、例えば、ヒト因子依存性細胞株TF-1を用いた細胞増殖アッセイで測定することができる(Kitamuraら、1989 J. Cell Physiol. 140:323)。IL-13の活性を標的とし且つ低下させるアドザイムを使用して、喘息および他のアレルギー反応を治療するかまたは予防することができる。アドザイムのアドレスドメインには、モノクローナル抗体もしくはその機能的誘導体(例えば、本出願にあるようなscFv誘導体)、またはIL-13受容体の可溶性リガンド結合部分を使用することができる。IL-13を効果的に消化できるプロテアーゼの一団のうちの一つまたは複数を、触媒ドメインとして使用することができる。
(i) TNFαアンタゴニスト
ある種の態様として、主題のアドザイムは、TNFαアンタゴニスト、例えば、「TNFαアンタゴニストのアドザイム」である。TNFαは、17 kDのタンパク質サブユニットの可溶性ホモ三量体である。TNFαには膜結合性の26 kDの前駆体型も存在する。強力な炎症性サイトカインTNFの多機能活性は、構造的に関連してはいるが、しかしながら機能的には異なる二つの受容体p55およびp75(これらは肥満細胞型で共に発現している)により媒介される。その生物活性を及ぼすには、TNFα(ホモ三量体分子)は、架橋結合および細胞シグナル伝達を引き起こす、少なくとも二つの細胞表面受容体に結合する必要がある。古くからTNFαに起因するとされてきた生物学的応答の大部分は、p55により媒介される。対照的に、p75は、TNFαを無効にすることでTNFアンタゴニストとして、および細胞表面でのTNFαとp55との間の相互作用を促進させることでTNFαアゴニストとして機能することが提唱されている。インビボでTNFαの活性を媒介するおよび調節する際のp55およびp75の役割が、これらの受容体の遺伝的欠損マウスで調べられている。さまざまな宿主防御反応および炎症反応の選択的欠損が、p55またはp55とp75の双方を欠いたマウスで観測されるが、p75を欠いたマウスでは観測されない。これらのモデルにおいて、p75がないことで、p55の活性が損なわれることはなく、p55を介したシグナル伝達の必須要素としてのp75の生理学的役割に相反している。対照的に、p75を欠いたマウスにおける肺の炎症の悪化および劇的に増加した内毒素による血清TNFα濃度から、TNFαを介した炎症反応の抑制に関するp75の主要な役割が示唆される。
p55受容体(TNF-R55、TNF-RI、またはTNFRαとも呼ばれる)は、結果的にTNFαの細胞傷害活性、抗ウイルス活性および増殖(刺激)活性をもたらすシグナルを伝達することが示されている55 kdの糖タンパク質である。p75受容体(TNF-R75、TNF-RII、またはTNFRαとも呼ばれる)は、細胞傷害および増殖シグナルに加えて結果的にGM-CSFの分泌をもたらすシグナルを伝達することが同様に示されている75 kDaの糖タンパク質である。二つの受容体の細胞外ドメインは、28%の相同性を有し、そして多数の保存されたシステイン残基を特徴する四つのサブドメインのセットを共通して有する。しかしながら、p75受容体は、膜貫通ドメインに隣接した、プロリン残基に富み且つO-結合型糖鎖付加の部位を含んだ領域を有することにより、異なっている。興味深いことに、二つの受容体の細胞質ドメインは、明らかな相同性を共有しておらず、このことは、それらの受容体が異なるシグナルを細胞内部に伝達できるという観測結果と一致する。
さらに説明すると、TNFαアンタゴニストのアドザイムは、一つまたは複数のTNFα標的化部分により、例えば、体液中のTNFαに向けることができる。典型的なTNFα標的化部分には、以下に限定されることはないが、TNFα受容体の細胞外ドメイン(またはその適当な部分)、抗-TNFα抗体もしくはその抗原結合断片、またはTNFαを(選択的に)結合するペプチドもしくは小分子が含まれる。
ある種の好ましい態様として、標的化部分は、p75またはp55受容体の細胞外リガンド結合ドメイン、例えば、TNFαに特異的に結合するのに十分な部分に由来する。例えば、標的化部分には、ヒトp75タンパク質(Swiss-Protアクセッション番号P20333)のLeu23〜Asp257のようなp75のリガンド結合断片、またはヒトp55タンパク質(Swiss-Protアクセッション番号P19438)のIle22〜Thr211のようなp55のリガンド結合断片を含めることができる。ある種の態様として、主題のアドザイムの標的化部分は、オネルセプト(Onercept)(完全なヒト可溶性p55断片)またはエタナルセプト(Etanercept)(Enbrel(登録商標)、二つのp75の細胞外断片がヒトIgG1のFc部分に連結された二量体構築物)から作り出すことができる。
他の好ましい態様として、標的化部分は、TNFαに結合する抗体、またはその抗原結合ドメインに由来する。例えば、モノクローナル抗-TNFα抗体を用いて作製できる主題のアドザイムは、インフリキシマブ(Remicade(登録商標))、またはその重鎖および軽鎖の一方もしくは双方の可変ドメイン、例えば、Fv断片に由来する。インフリキシマブは、高親和性マウス抗-HuTNFα中和抗体のFv領域に連結された、ヒト(Hu)IgG1κの定常領域からなるモノクローナル抗-TNFαヒト/マウスキメラ抗体である。同様に、主題のアドザイムは、アダリムマブとしても知られる、ヒト抗-TNF抗体D2E7由来の標的化部分を含むことができる。
さらに他の態様として、TNFα標的化部分は、ペプチドである。例えば、Guoら(2002) Di Yi Jun Yi Da Xue Xue Bao. 22 (7):597には、ファージディスプレイ法によるTNFα結合ペプチドのスクリーニングが記述されている。その文献には、TNFαを標的とするアドザイムを作製するのに利用できると思われる多数の短いペプチドが教示されている。単なる例証として、TNFαの標的化部分は、配列ALWHWWHまたは(T/S)WLHWWAを有するペプチドとすることができる。
TNFαの活性を変化させるように作用する特定のアドザイムの能力は、当技術分野においてよく知られている、種々の細胞に基づくおよび無細胞のアッセイ系のいずれかを利用してアッセイすることができる。典型的なアッセイには、以下に限定されることはないが、L929アッセイ、内皮細胞の凝血促進アッセイ、腫瘍の線維素沈着アッセイ、細胞傷害アッセイ、腫瘍退行アッセイ、受容体結合アッセイ、マウスモデル系での関節指数アッセイ、および同様のものが含まれる。TNFαアンタゴニストのアドザイムのある種の好ましい態様として、その生物活性には、以下のうちの一つまたは複数が含まれるものと思われる: L929細胞でのTNFαの細胞傷害性の阻害; ヒト皮膚繊維芽細胞による細胞結合性IL1の発現およびプロスタグランジンE2産生の遮断; 単球系細胞株U937とのTNFα結合の遮断; ヒト好中球におけるTNFαによる呼吸バーストの遮断; TNF刺激による好中球のルシゲニン依存的な化学発光反応およびスーパーオキシドの形成の遮断; 走化性ペプチドfMLPとの反応に対するTNFαのプライミング能の顕著な低下; ヒトColo205腫瘍細胞株におけるクラスI抗原の発現の遮断; IFN-γにより誘発されたHLA-DR抗原の発現とのTNFαによる相乗作用への影響(但し、IFN-γ活性には影響を及ぼさないことが好ましい)。
ある種の態様として、TNFαアンタゴニストのアドザイムは、それ自体がTNFαのアンタゴニストとなる産物を産生するように、基質のTNFαタンパク質を改変するものと思われる。例えば、アドザイムは、TNFαポリペプチド中のある部位を切断して、例えば、p55受容体に結合する能力を保有するが、しかしながら野生型TNFαのアンタゴニストとなるように、受容体を活性化する能力が大いに低下した(例えば、細胞傷害反応を誘発する能力が低下した)産物を産生する触媒ドメインを含むことができる。例えば、切断産物は、野生型TNFαと相互作用して、受容体に結合するが、しかしながら受容体のシグナル伝達を活性化できない、安定な混合型三量体を形成する能力を保持することができる。さらに説明すると、アドザイムによる切断の標的とできるヒトTNFα分子内の部位は、残基29〜34、71〜73、86、および143〜146にまたはその近傍に位置する可能性がある。例えば、トリプシン様の特異性を有する触媒ドメインは、ヒトTNFαのArg44を選択的に切断するアドザイムで使用することができる。同様に、グランザイムBの触媒ドメインを含むアドザイムを使用して、Asp143を標的とすることができる。これらの領域内の残基は、TNFαの細胞傷害活性に重要であると考えられている。アドザイムによる、アンタゴニスト活性と低下した細胞傷害性とを兼ね備えた切断産物は、前述のスクリーニングアッセイにより同定することができる。
主題のTNFαアンタゴニストのアドザイムを使用して、さまざまなTNF関連疾患、例えば、TNFα濃度の上昇と関連する、TNFα濃度の上昇から生じる、および/またはTNFα濃度の上昇に反応して起こる疾患または疾病を治療することができる。そのような疾患は、TNFα活性レベルの一時的なもしくは慢性的な上昇と、および/またはTNFα活性の局所的なもしくは全身的な増加と関連する可能性がある。そのような疾患には、以下に限定されることはないが、関節炎および炎症性腸疾患のような炎症性疾患、ならびに鬱血性心不全が含まれる。
TNFαは、軟骨および骨の分解、接着分子の誘導、血管内皮細胞に対する凝血促進活性の誘導、好中球およびリンパ球の接着の増加、ならびにマクロファージ、好中球および血管内皮細胞からの血小板活性化因子の放出刺激のような、結果的に組織傷害をもたらす炎症性作用を引き起こす。ある種の好ましい態様として、TNFαアンタゴニストのアドザイムは、TNFαの炎症活性を減少させる。
最近の証拠から同様に、TNFαは、感染症、免疫疾患、新生物病変、自己免疫病変および移植片対宿主疾患と関連付けられる。例えば、TNFαは、発熱、倦怠感、食欲不振、および悪液質を含む、グラム陰性菌敗血症および内毒素性ショックで中心的な役割を果すと考えられている。内毒素は、単球/マクロファージの産生ならびにTNFαおよび他のサイトカインの分泌を強力に活性化する(Kombluthら、J. Immunol. 137:2585〜2591 (1986))。循環血液中のTNFα濃度は、グラム陰性菌敗血症を患う患者で増加する。従って、主題のTNFαアンタゴニストのアドザイムを、炎症性疾患、自己免疫疾患、ウイルス、細菌および寄生虫感染症、悪性腫瘍、ならびに神経変性(neurogenerative)疾患に対する治療プロトコルの一部として、例えば、関節リウマチおよびクローン病の治療法に対して使用することができる。
TNFαは同様に、がんの悪液質、感染病変、および他の異化状態にも関与するという証拠がある。従って、TNFαアンタゴニストのアドザイムを使用して、そのような疾患と関連した筋萎縮、または悪液質が患者の治療で問題になるそれ以外のものを軽減することもできる。
従って、本発明により、主題のアドザイムを、以下に限定されることはないが、関節リウマチ、若年性関節リウマチ、全身型発症若年性関節リウマチ、乾癬性関節炎、強直性脊椎炎、胃潰瘍、血清反応陰性関節症、変形性関節症、炎症性腸疾患、潰瘍性大腸(結腸)炎、全身性エリテマトーデス、抗リン脂質症候群、虹彩毛様体炎/ブドウ膜炎/視神経炎、特発性肺線維症、全身性血管炎/ヴェグナー肉芽腫症、類肉腫症、睾丸炎/精管切除術、アレルギー性/アトピー性疾患、喘息、アレルギー性鼻炎、湿疹、アレルギー性接触皮膚炎、アレルギー性結膜炎、過敏性肺臓炎、移植、臓器移植拒絶反応、移植片対宿主疾患、全身性炎症反応症候群、敗血症候群、グラム陽性菌敗血症、グラム陰性菌敗血症、培養陰性敗血症、真菌性敗血症、好中球減少性の発熱、尿路性敗血症、髄膜炎菌血症、外傷/出血、熱傷、電離放射線の暴露、急性膵炎、成人呼吸窮迫症候群、関節リウマチ、アルコール性肝炎、慢性炎症性病変、類肉腫症、クローン病変、鎌状赤血球性貧血、糖尿病、ネフローゼ、アトピー性疾患、過敏性反応、アレルギー性鼻炎、枯草熱、通年性鼻炎、結膜炎、子宮内膜症、喘息、じんま疹、全身性アナフィラキシー、皮膚炎、悪性貧血、溶血性疾患、血小板減少症、いずれかの臓器または組織の移植片拒絶反応、腎臓移植拒絶反応、心臓移植拒絶反応、肝臓移植拒絶反応、膵臓移植拒絶反応、肺移植拒絶反応、骨髄移植(BMT)拒絶反応、皮膚同種移植片拒絶反応、軟骨移植片拒絶反応、骨移植片拒絶反応、小腸拒絶反応、胎児胸腺移植拒絶反応、副甲状腺移植拒絶反応、いずれかの臓器または組織の異種移植片拒絶反応、同種移植片拒絶反応、抗受容体による過敏性反応、バセドウ病、レイノー病、B型インスリン抵抗性糖尿病、喘息、重症筋無力症、抗体媒介性細胞傷害、III型過敏性反応、全身性エリテマトーデス、POEMS症候群(多発性神経炎、臓器肥大症、内分泌障害、単クローン性免疫グロブリン血症、および皮膚変化症候群)、多発性神経炎、臓器肥大症、内分泌障害、単クローン性免疫グロブリン血症、皮膚変化症候群、抗リン脂質症候群、天疱瘡、強皮症、混合性結合組織病、特発性アジソン病、糖尿病、慢性活動性肝炎、原発性胆汁性肝硬変症、白斑、脈管炎、MI心膜切開後症候群、IV型過敏症、接触性皮膚炎、過敏性肺臓炎、同種移植片拒絶反応、細胞内生物が原因の肉芽腫、薬剤過敏性、代謝性/特発性、ウィルソン病、ヘモクロマトーシス(hemachromatosis)、α-1-アンチトリプシン欠乏症、糖尿病性網膜症; 橋本甲状腺炎、骨粗鬆症、視床下部-下垂体-副腎系評価、原発性胆汁性肝硬変症、甲状腺炎、脳脊髄炎、悪液質、嚢胞性線維症、新生児慢性肺障害、慢性閉塞性肺疾患(COPD)、家族性血球食細胞性リンパ組織球症(familial hematophagocytic lymphohistiocytosis)、皮膚病変、乾癬、脱毛症、ネフローゼ症候群、腎炎、糸球体腎炎、急性腎不全、血液透析、尿毒症、毒性、子癇前症、okt3による治療、抗cd3療法、サイトカイン療法、化学療法、放射線療法(例えば、無力症、貧血症、悪液質、および同様のものを含むがこれらに限定されることはない)、慢性サリチル酸中毒などのうちの少なくとも一つを含む、細胞、組織、臓器、動物、または患者で、少なくとも一つの免疫関連疾患の重症度を調節するかまたは軽減するための治療の一部として使用できる方法が提供される。
一つの態様として、TNFαのアドザイムは、ヘリコバクターピロリによる胃炎のような、高ガストリン血症を治療するために使用される。
本発明により同様に、以下に限定されることはないが、心臓性のスタン症候群(cardiac stun syndrome)、心筋梗塞症、鬱血性心不全、発作、虚血性発作、出血、動脈硬化症、アテローム性動脈硬化症、再狭窄、糖尿病患者の動脈硬化性(ateriosclerotic)疾患、高血圧症、動脈性高血圧症、腎血管性高血圧症、失神、ショック、心臓血管系の梅毒、心不全、肺性心、原発性肺高血圧症、心臓不整脈、心房異所性拍動、心房粗動、心房性細動(持続性または発作性)、体外循環後症候群、心肺バイパス炎症反応、無秩序性または多源性心房性頻拍、規則的なQRS幅の狭い頻拍、特異的不整脈(specific arrythmia)、心室細動、ヒス束不整脈、房室ブロック、脚ブロック、虚血性心筋症、冠動脈疾患、狭心症、心筋梗塞症、心筋症、拡張型鬱血性心筋症、拘束型心筋症、心臓弁膜症、心内膜炎、心膜疾患、心臓腫瘍、大動脈および末梢動脈瘤(aordic and peripheral aneuryisms)、大動脈解離、大動脈の炎症、腹大動脈およびその分枝の閉塞(occulsion)、末梢血管障害、閉塞性(occulsive)動脈疾患、末梢アテローム硬化性疾患(peripheral atherlosclerotic disease)、閉塞性血栓血管炎(thromboangitis obliterans)、末梢動脈機能障害、レイノー現象およびレイノー病、肢端チアノーゼ、肢端紅痛症、静脈疾患、静脈血栓症、拡張蛇行静脈、動静脈瘻、リンパ水腫、脂肪性浮腫、不安定狭心症、再潅流傷害、成人呼吸窮迫症候群(post pump syndrome)、虚血性再潅流傷害などのうちの少なくとも一つを含む、細胞、組織、臓器、動物、または患者で、少なくとも一つの心臓血管疾患を調節するかまたは治療することを目的として、主題のTNFαアンタゴニストのアドザイムを使用するための方法が提供される。
本発明により同様に、以下に限定されることはないが、急性または慢性の細菌感染症、細菌、ウイルスおよび真菌感染症を含む、急性および慢性の寄生過程または感染過程、HIV感染症/HIV神経障害、髄膜炎、肝炎(A、BもしくはC、または同様のもの)、敗血症性関節炎、腹膜炎、肺炎、喉頭蓋炎、大腸菌感染症、溶血性尿毒症症候群/血栓性血小板減少性紫斑病、マラリア、デング出血熱、リーシュマニア症、ハンセン病、毒素性ショック症候群、連鎖球菌性筋炎、ガス壊疽、マイコバクテリウム・ツベルクローシス、マイコバクテリウム・アビウム・イントラセルラール(mycobacterium avium intracellulare)、ニューモシスティス・カリニ肺炎、骨盤感染症、精巣炎/精巣上体炎(epidydimitis)、レジオネラ、ライム病、インフルエンザ、エプスタイン-バーウイルス、バイタル関連血球貪食症候群(vital-associated hemaphagocytic syndrome)、バイタル脳炎(vital encephalitis)/無菌性髄膜炎などのうちの少なくとも一つを含む、細胞、組織、臓器、動物または患者で、少なくとも一つの感染症を調節するかまたは治療することを目的として、主題のTNFαアンタゴニストのアドザイムを使用するための方法が提供される。
本発明により同様に、以下に限定されることはないが、白血病、急性白血病、急性リンパ性白血病(ALL)、B細胞、T細胞またはFAB ALL、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、慢性リンパ球性白血病(CLL)、ヘアリー細胞白血病、骨髄異形成症候群(myelodyplastic syndrome)(MDS)、リンパ腫、ホジキン病、悪性リンパ腫、非ホジキンリンパ腫、バーキットリンパ腫、多発性骨髄腫、カポジ肉腫、結腸直腸がん、膵臓がん、鼻咽頭がん、悪性組織球増殖症、腫瘍随伴症候群/悪性高カルシウム血症、充実性腫瘍、腺がん、肉腫、悪性黒色腫、血管腫、転移性疾患、がん関連の骨吸収、がん関連の骨痛などのうちの少なくとも一つを含む、細胞、組織、臓器、動物または患者で、少なくとも一つの悪性疾患を調節するかまたは治療するための方法が提供される。
本発明により同様に、以下に限定されることはないが、神経変性疾患、多発性硬化症、片頭痛、エイズ痴呆、多発性硬化症および急性横断性脊髄炎のような脱髄疾患; 皮質脊髄系の病変のような錐体外路疾患および小脳疾患; 脳幹神経節疾患または小脳疾患; ハンチントン舞踏病および老人舞踏病のような多動性疾患; CNSドーパミン受容体を遮断する薬剤により誘発される疾患のような薬剤性運動障害; パーキンソン病のような運動不全病; 進行性核上麻痺; 小脳の器質性病変; 脊髄性運動失調症、フリードライヒ運動失調症、小脳皮質変性症、多系統変性症(メンシェル型、デジェリーヌ・トーマス型、シャイ・ドレーガー型、およびマチャド・ヨーゼフ型)のような脊髄小脳変性症; 全身性疾患(レフサム病、無βリポタンパク血症(abetalipoprotemia)、運動失調症、毛細血管拡張症、およびミトコンドリア多系統疾患); 多発性硬化症、急性横断性脊髄炎のような脱髄性の中核疾患; および神経原性筋萎縮症のような運動単位の疾患(筋萎縮性側索硬化症、乳児脊髄性筋萎縮症および若年性脊髄性筋萎縮症のような前角細胞変性); アルツハイマー病; 中年期のダウン症; びまん性レビー小体病; 老人性レビー小体型痴呆; ウェルニッケ-コルサコフ症候群; 慢性アルコール依存症; クロイツフェルト-ヤコブ病; 亜急性硬化性全汎脳炎、ハレルフォルデン-スパッツ病(Hallerrorden-Spatz disease); および拳闘家痴呆などのうちの少なくとも一つを含む、細胞、組織、臓器、動物または患者で、少なくとも一つの神経疾患を調節するかまたは治療するため、TNFαアンタゴニストのアドザイムを使用する方法が提供される。
TNFαアンタゴニストのアドザイムは、抗リウマチ剤(例えば、メトトレキサート、オーラノフィン、アウロチオグルコース、アザチオプリン、エタナーセプト、金チオリンゴ酸ナトリウム、硫酸ヒドロキシクロロキン、レフルノミド、スルファサラジン)、筋肉弛緩剤、麻酔剤、非ステロイド抗炎症薬(NSAID)、鎮痛剤、麻酔剤、鎮静剤、局部麻酔剤、神経筋遮断薬、抗菌薬(例えば、アミノグリコシド、抗真菌剤、駆虫薬、抗ウイルス薬、カルバペネム、セファロスポリン、フルオロキノロン(flurorquinolone)、マクロライド、ペニシリン、スルホンアミド、テトラサイクリン、他の抗菌薬)、乾癬薬、副腎皮質ステロイド、タンパク同化ステロイド、糖尿病関連薬、ミネラル、栄養素、甲状腺薬、ビタミン、カルシウム関連ホルモン、止瀉薬、鎮咳薬、制吐薬、抗潰瘍薬、下剤、抗凝血剤、エリスロポエチン(例えば、エポエチンα)、フィルグラスチム(例えば、G-CSF、ニュウポゲン)、サルグラモスチム(GM-CSF、ロイカイン)、免疫接種、免疫グロブリン、免疫抑制剤(例えば、バシリキシマブ、サイクロスポリン、ダクリズマブ)、成長ホルモン、ホルモン補充薬、エストロゲン受容体モジュレーター、散瞳薬、毛様筋調節薬、アルキル化剤、代謝拮抗剤、分裂抑制剤、放射性医薬品、抗うつ剤、抗躁薬、抗精神病薬、抗不安薬、睡眠薬、交感神経興奮剤、興奮剤、ドネペジル、タクリン、喘息薬、βアゴニスト、吸入用ステロイド剤、ロイコトリエン阻害剤、メチルキサンチン、クロモリン、エピネフリンまたは類似体、ドマーゼα(domase alpha)(プルモザイム(Pulmozyme))、サイトカインまたはサイトカインアンタゴニストから選択される少なくとも一つのような、他の薬剤の前に、それと同時に、および/またはその後に(本明細書では「と同時に」として見なされる)投与することができる。
主題のアドザイムは同様に、マイトジェン活性化タンパク質(MAP)キナーゼ阻害剤のような、TNF受容体のシグナル伝達を抑制するおよび/または阻害する化合物; メタロプロテイナーゼ阻害剤のような、膜型TNFの切断を遮断するおよび/または阻害する化合物; アンジオテンシン変換酵素(ACE)阻害剤(例えば、カプトプリル)のような、TNF活性を遮断するおよび/または阻害する化合物; およびMAPキナーゼ阻害剤のような、TNFの産生および/または合成を遮断するおよび/または阻害する化合物と同時に投与することもできる。
(ii) IL-1bアンタゴニスト
ある種の態様として、主題のアドザイムは、インターロイキン-1アンタゴニスト、例えば、「インターロイキン-1アンタゴニストのアドザイム」である。インターロイキン-1は、複数の細胞型で先天性および適応性免疫反応を媒介する、多機能の炎症性サイトカインである。関節炎、喘息/アレルギー、骨粗鬆症、および発作を含む多くの疾患に関与すると考えられている(概説としては、Dinarello (1998) Int. Rev. Immunol. 16, 457〜499を参照されたい)。IL-1ファミリーは実質的に、類似の生物活性を有する二つのタンパク質IL-1αおよびIL-1βのほかに、IL-1受容体アンタゴニスト(IL-1ra)と呼ばれる非シグナル伝達リガンドからなる。三つのタンパク質は全て、擬似の3回対称を持つ樽型のβ-トレフォイルを形成する、12β鎖からなる類似の三次構造を示す。IL-1βは、IL-1の全身的作用を媒介する主要な循環血液中のサイトカインであると考えられている。
IL-1は、膜会合IL1R-Iを結合および活性化することにより、その生物作用を及ぼす。IL-1R修飾タンパク質(AcP)と呼ばれる、第二の受容体は、直接的なリガンド結合には関与していないが、しかしながらIL-1とIL1R-Iとの複合体をなすことにより、IL-1によるシグナル伝達に必要とされる。IL1R-IおよびAcPはどちらも、三つのIg様ドメインを有する細胞外部分と保存されたシグナル伝達モチーフを含んだ細胞内部分とを含む。IL1R-IおよびAcPのものに類似した細胞外構造を有するが、しかしながら細胞内側の末端が切断され、シグナルを伝達することができない、II型IL-1R(IL1R-II)と呼ばれる第三のIL-1受容体が存在する。この受容体は、高い親和性でIL-1を結合して、その活性を中和することにより、囮として作用する。また、IL1R-IIは、タンパク質分解的に切断されることで、細胞表面からその細胞外ドメインを放出する。このことから、IL-1βに高い親和性を有するが、IL-1αには低い親和性を有するのみで、IL-1raには実質的に親和性がない、可溶性の受容体(sIL1R-II)が生ずる。
ある種の好ましい態様として、主題のアドザイムは、体液中に存在する、IL-1、特にIL-1βに作用するIL-1アンタゴニストのアドザイムである。そのようなアドザイムで用いるのに適した典型的なIL-1の標的化部分には、以下に限定されることはないが、IL-1受容体の細胞外ドメインもしくはその適当な一部分、IL1R-IIもしくはその一部分、抗IL-1抗体もしくはその結合断片、またはIL-1を(選択的に)結合するペプチドもしくは小分子が含まれる。
ある種の好ましい態様として、標的化部分は、IL1R-II、例えば、Il-1βに特異的に結合するのに十分な一部分に由来する。例えば、標的化部分は、ヒトIL1R-IIタンパク質(GIアクセッション番号640248、PRIアクセッション番号2IRT_A)由来のIL1R-IIのリガンド結合ドメインを含むことができる。
IL-1アンタゴニストのアドザイムの阻害活性は、当技術分野においてよく知られている、種々の細胞に基づくおよび無細胞のアッセイ系のいずれかを利用してアッセイすることができる。例えば、IL-1アンタゴニストのアドザイムは、移植片対宿主疾患を治療するために使用できる免疫抑制分子をインビボで同定するのに有用な、フィトヘマグルチニンA(PHA)アッセイおよび混合リンパ球反応(MLR)を利用して同定することができる。これらのアッセイから得られる結果は、一般に、そのインビボ有効性の予測となる。
アドザイムを評価するのに使用される他のアッセイは、免疫応答性の阻害に関するものであり、植物由来の有糸分裂誘発物質によるリンパ球の分裂刺激を含む。最も広く用いられている植物分子は、PHAである。PHAは、リンパ球の亜集団の有糸分裂誘発を引き起こす真の抗原刺激とは異なり、多数のリンパ球でDNA合成を非特異的に刺激するが、PHA刺激に対する患者リンパ球の感受性は、患者の全体的な免疫応答と相関することが示されている。
従って、混合リンパ球反応とPHAアッセイの双方に関し、免疫抑制性のIL-1アンタゴニストのアドザイムを同定するのに、これらが有用であることが理解されよう。
上記の免疫抑制アッセイに加えて、第二の混合リンパ球反応アッセイを使用することもできる。第二の混合リンパ球アッセイは、第一の混合リンパ球反応アッセイとは、これらが最初の刺激性細胞に応答する、はるかに多くの初回刺激を受けた応答細胞を使用するという点が異なる。そのような応答細胞の存在は、進行中の免疫反応における免疫記憶の表れである。第二の混合リンパ球アッセイを実行するための操作手順には、上記の第一のリンパ球反応アッセイを行う段階、および第一の混合リンパ球反応で増殖がほとんどまたは全く示されなくなる約9〜10日後に生存細胞を回収する段階が含まれる。一般に、初代の投入細胞の10%〜50%が生きた状態で回収される。その後、これらの細胞を第二の混合リンパ球反応で使用する。
主題のアドザイムは同様に、IL-1を介したサイトカイン産生を遮断するその能力についてアッセイすることができる。脾臓細胞、リンパ節細胞または胸腺細胞のサイトカイン産生および/または増殖に対するアッセイは、当技術分野においてよく知られている。
さらに他の態様として、主題のアドザイムは、造血性細胞およびリンパ球産生細胞の増殖および分化に対するその効果について評価することができる。
ある種の態様として、IL-1アンタゴニストのアドザイムは、それ自体がIL1βのアンタゴニストとなる産物を産生するように、基質のIL-1βタンパク質を改変するものと思われる。例えば、アドザイムは、IL-1βポリペプチド中のある部位を切断して、例えば、IL1受容体に結合する能力を保有するが、しかしながら野生型Il-1βのアンタゴニストとなるように、受容体を活性化する能力が大いに低下した産物を産生する触媒ドメインを含むことができる。さらに説明すると、ヒトIL-1βのArg127残基は、トリプシン様の特異性を備えた触媒ドメインを有するアドザイムによる切断の標的とすることができる。Arg127の変異は、受容体の結合親和性に対してわずかな影響を及ぼすのみであるが、IL-1βの生物活性を大いに低下させることが実証されている。
本発明のIL-1アンタゴニストのアドザイムにより治療または予防できるIL-1を介した疾患には、以下に限定されることはないが、炎症性疾患、自己免疫疾患、増殖症、感染症、および変性疾患が含まれる。本発明のIL-1アンタゴニストのアドザイムにより治療または予防できるアポトーシスを介した疾患には、変性疾患が含まれる。
治療または予防できる炎症性疾患には、以下に限定されることはないが、変形性関節症、急性膵炎、慢性膵炎、喘息、および成人呼吸窮迫症候群が含まれる。炎症性疾患は、変形性関節症または急性膵炎であることが好ましい。
治療または予防できる自己免疫疾患には、以下に限定されることはないが、糸球体腎炎(glomeralonephritis)、関節リウマチ、全身性エリテマトーデス、強皮症、慢性甲状腺炎、バセドウ病、自己免疫性胃炎、インスリン依存性糖尿病(I型)、自己免疫性溶血性貧血、自己免疫性好中球減少症、血小板減少症、慢性活動性肝炎、重症筋無力症、多発性硬化症、炎症性腸疾患、クローン病、乾癬、および移植片対宿主疾患が含まれる。自己免疫疾患は、関節リウマチ、炎症性腸疾患、クローン病、または乾癬であることが好ましい。
治療または予防できる骨破壊性疾患には、以下に限定されることはないが、骨粗鬆症および多発性骨髄腫に伴う骨疾患が含まれる。
治療または予防できる増殖症には、以下に限定されることはないが、急性骨髄性白血病、慢性骨髄性白血病、転移性悪性黒色腫、カポジ肉腫、および多発性骨髄腫が含まれる。
治療または予防できる感染症には、以下に限定されることはないが、敗血症、敗血性ショックおよび細菌性赤痢が含まれる。
本発明のIL-1アンタゴニストのアドザイムにより治療または予防できる、IL-1を介した変性疾患または壊死性疾患には、以下に限定されることはないが、アルツハイマー病、パーキンソン病、脳虚血、および心筋虚血が含まれる。変性疾患はアルツハイマー病であることが好ましい。
本発明のIL-1アンタゴニストのアドザイムにより治療または予防できる、アポトーシスを介した変性疾患には、以下に限定されることはないが、アルツハイマー病、パーキンソン病、脳虚血、心筋虚血、脊髄性筋萎縮症、多発性硬化症、AIDS関連脳炎、HIV関連脳炎、老化、脱毛症、および発作が原因の神経障害が含まれる。
(e) 非治療的な状況における生体分子標的
多くの非医療的用途で使用できるアドザイムには、以下に限定されることはないが、農業、環境保護、食料などが含まれ、従って、そのようなアドザイムが標的とされるものと思われる。
アドザイムを使用して、栄養価を高めることおよび飼料成分、例えば、大麦および小麦ベースの飼料から抗栄養因子を取り除くことができる。そのようなアドザイムに対する標的には、グルテンミール、食物繊維、プリオン(例えば、牛海綿状脳症の原因物質PrP)、ダイオキシン、殺虫剤、除草剤、デンプン、脂質、セルロース、ペクチン、ある種の糖質(例えば、乳糖、麦芽糖)および多糖類を含めることができる。
アドザイムは、廃棄物処理、織物業もしくは紙生産のような工業プロセスで、または本質的には、酵素を利用するいずれかの他のプロセス(但し、酵素を有効性が向上したアドザイムに置き換えることができる場合)で使用することができる。そのような用途に対する標的の例には、セルロース、ヘミセルロース、ペクチン、リグニン、デンプン、過酸化物、リン酸塩および硝酸塩が含まれる。
アドザイムを界面活性剤または他の洗浄剤のなかで使用することができ、その結果、選択の土壌または菌株を標的とした除去が可能である。そのようなアドザイムに対する標的には、クロロフィル、ヘモグロビン、ヘム基、炭化水素、アビジン、オボアルブミン、および種々の色素および染料を含めることができる。
アドザイムは、油、殺虫剤、除草剤および廃棄物のような種々の環境汚染物を化学製品から浄化するために使用することができる。そのようなアドザイムに対する標的には、炭化水素、ハロゲン化炭化水素(特に、芳香族部分を含むハロゲン化炭化水素)、シアン化物、一酸化炭素、亜酸化窒素、重金属、有機金属化合物、有機リン酸塩およびカルバミン酸塩が含まれる。
B. 典型的な触媒ドメイン
本明細書では、「触媒ドメイン」という用語には、標的に作用して化学変化を引き起こし、それによりその活性を調節できる任意の部分、すなわち、標的内部の反応を触媒できる部分が含まれる。触媒ドメインは、天然に存在する酵素、その触媒的に活性な断片、または遺伝子工学的に改変された酵素、例えば、セリンプロテアーゼ活性モチーフを含むように設計されたタンパク質のような、酵素活性を有するように遺伝子工学的に改変されたタンパク質とすることができる。触媒ドメインには、標的に所望の化学変化を引き起こすのに有効なアミノ酸の配列だけが含まれる必要がある。これらは、天然酵素のN末端またはC末端切断型、変異型、酵素前駆体、または完全な球状ドメインとすることができる。触媒ドメインは、非タンパク質性の生理的に適合した触媒とすることができる。
酵素触媒ドメインは、酵素的に活性な部位であって、単独では無差別的で、その部位が認識する多くの生体分子上の脆弱部位と結合する酵素的に活性な部位を含むことができ、およびそのドメインは、相対的に不十分な反応速度を有することができる。これらの特徴はどちらも、通常、理にかなった薬物開発とは対極にあるとはいえ、しかしながらアドザイム構築物では好ましいことが多く、その場合には、アドレスが所望の標的生体分子に対する選好性を指定し、且つその結合特性が反応速度を支配する、すなわち、触媒的に活性な部位と標的との間の選択的衝突を確実とする。
触媒ドメインは同様に、標的が他の酵素(例えば、被検体中に既に存在している酵素)により認識されて作用を受けるように、標的を修飾するタンパク質とすることもできる。別の態様として、触媒ドメインは、標的の構造を変化させて、その結果、その活性を阻害するかまたは亢進させる部分とすることができる。多くの天然に存在する酵素は、他の酵素を活性化するので、これらを本発明により活用することができる。
アドザイムの触媒部分は、プロテアーゼ、グリコシダーゼ、リパーゼ、もしくは他のヒドロラーゼ、またはイソメラーゼ、トランスフェラーゼ(キナーゼを含む)、リアーゼ、オキシドレダクターゼ、オキシダーゼ、アルドラーゼ、ケトラーゼ、グリコシダーゼ、トランスフェラーゼおよび同様のものを含む、他の酵素活性とすることができる。
他の潜在的に有用性のある酵素には、CH-OHを与える基、つまりアルデヒドもしくはオキソ、CH-CH、CH-NH2、CH-NH、NADHまたはNADPH、他の窒素化合物、硫黄、ヘム、ジフェノール、水素、分子状酸素の取込みで単供与体、対供与体、-CH2基、還元型フラボドキシン、鉄-硫黄タンパク質、および酸化金属イオンに作用するもの、ならびに受容体としてスーパーオキシドラジカルまたはペルオキシドに作用するもの(ペルオキシダーゼ)のようなオキシドレダクターゼが含まれる。「オキシドレダクターゼ」という用語には、分子の還元または酸化を触媒する酵素が含まれる。オキシドレダクターゼの例には、デヒドロゲナーゼ、レダクターゼ、オキシダーゼ、オキシゲナーゼ、ヒドロラーゼ、およびペルオキシダーゼが含まれる。
トランスフェラーゼには、ある分子から別の分子への原子団の転移を触媒する酵素が含まれる。有用なトランスフェラーゼの触媒ドメインは、炭素基、含窒素基、リン含有基、硫黄含有基、セレン含有基、またはアルデヒドもしくはケトン残基を転移させ、そしてアシルトランスフェラーゼまたはアルキルもしくはアリール基を転移するグリコシルトランスフェラーゼが含まれる。トランスフェラーゼの例には、アミノトランスフェラーゼ、キナーゼ、およびミリストラーゼ(myristolase)が含まれる。
他の潜在的に有用性のある酵素には、炭素-炭素、炭素-酸素、炭素-窒素、炭素-硫黄、炭素-ハロゲン化物およびリン-酸素リアーゼが含まれる。リアーゼは、小分子を二重結合に付加する。リアーゼの例には、シンターゼ、デカルボキシラーゼおよびデヒドラターゼが含まれる。
アドザイムは、リガーゼドメイン、例えば、炭素-酸素結合、炭素-硫黄結合、炭素-窒素結合、炭素-炭素結合、およびリン酸エステル結合の形成を触媒する触媒ドメインを含むことができる。リガーゼは、二つまたはそれ以上の分子をともに連結する結合形成反応を触媒する。リガーゼの例には、カルボキシラーゼおよびシンテターゼが含まれる。
イソメラーゼ、ラセマーゼ、エピメラーゼ、シス-トランス・イソメラーゼ、分子内オキシドレダクターゼ、分子内トランスフェラーゼ(ムターゼ)、分子内リアーゼも同様に、潜在的に有用性がある。
グリコシダーゼは同様に、アドザイムの触媒ドメインの出所源とすることができる。これらの酵素は、タンパク性基質の糖質構造を改変できる糖分解酵素と定義され、そして他のタンパク質との標的基質の糖質媒介性相互作用(例えば、リガンド-受容体相互作用)が生物活性に重要であるような、または糖質が標的基質の半減期もしくは体内分布に影響を及ぼすような場合に有用とすることができる。リゾチームは、多糖類を対象とした加水分解酵素の一例である。
同様に、リパーゼは、膜構造を変化させるアドザイムに使用することができる。
各タイプの酵素の多くの例が識別されており、公共のデータベース、例えば、SwissProt、PIR、PRF、または米国国立バイオテクノロジー情報センター(NCBI)が管理するデータベースのなかで見出すことができる。さらに、多くの酵素に対する高解像度の三次元構造座標は、構造バイオインフォマティクス共同研究所(RCSB)が管理するデータベースのなかで見出すことができる。未解決のタンパク質構造は、多くの場合、スレッディングとして知られる方法を使って予測することができる。スレッディング・アルゴリズムは、文献に報告されており、そしてAlexandrov N.N.ら、(1998) Bioinformatics 14:206〜11, Labesse Gら、(1997) Proteins 1:38〜42, Xu, Y.ら、(1999). Protein Eng., 12:899〜907, Russel A. J.ら、(2002) Proteins 47:496〜505、およびReva, B.ら、(2002) Proteins 47:180〜93のなかで見出すことができる。
好ましい態様として、触媒ドメインは、プロテアーゼである。この目的で利用できる、プロテアーゼ、またはその触媒的に活性な断片には、セリンプロテアーゼ、システインプロテアーゼ、アスパラギン酸もしくは酸性プロテアーゼ、メタロプロテアーゼまたは標的基質のアミド骨格を切断できる他のプロテアーゼが含まれる。
ある種の好ましい態様として、主題のアドザイムは、例えば、国際生化学・分子生物学連合(1984)が酵素番号3.4.-.-のサブクラスとして指定する酵素を用いて得ることができるような、ペプチダーゼ触媒活性を取り入れる。例えば、主題の方法を利用して、アミノペプチダーゼ(酵素番号3.4.11.-)、ジペプチダーゼ(酵素番号3.4.13.-)、ジペプチジル-ペプチダーゼもしくはトリペプチジル-ペプチダーゼ(酵素番号3.4.14.-)、ペプチジル-ジペプチダーゼ(酵素番号3.4.15.-)、セリン型カルボキシペプチダーゼ(酵素番号3.4.16.-)、メタロカルボキシペプチダーゼ(酵素番号3.4.17.-)、システイン型カルボキシペプチダーゼ(酵素番号3.4.18.-)、ωペプチダーゼ(酵素番号3.4.19.-)、セリンプロテイナーゼ(酵素番号3.4.21.-)、システインプロテイナーゼ(酵素番号3.4.22.-)、アスパラギン酸プロテイナーゼ(酵素番号3.4.23.-)、メタロプロテイナーゼ(酵素番号3.4.24.-)、または作用不明のプロテイナーゼ(酵素番号3.4.99.-)の特異性を決定することができる。主題のアドザイムで用いるのに適合できる典型的なペプチド・ヒドロリアーゼには、以下が含まれる:
3.4.11.1 ロイシルアミノペプチダーゼ
3.4.11.2 膜アミノペプチダーゼ
3.4.11.3 シスチニルアミノペプチダーゼ
3.4.11.4 トリペプチドアミノペプチダーゼ
3.4.11.5 プロリルアミノペプチダーゼ
3.4.11.6 アミノペプチダーゼB
3.4.11.7 グルタミルアミノペプチダーゼ
3.4.11.9 Xaa-Proアミノペプチダーゼ
3.4.11.10 細菌性ロイシルアミノペプチダーゼ
3.4.11.13 クロストリジウムアミノペプチダーゼ
3.4.11.14 細胞質ゾルアラニルアミノペプチダーゼ
3.4.11.15 リシルアミノペプチダーゼ
3.4.11.16 Xaa-Trpアミノペプチダーゼ
3.4.11.17 トリプトファニルアミノペプチダーゼ
3.4.11.18 メチオニルアミノペプチダーゼ
3.4.11.19 D-立体特異的アミノペプチダーゼ
3.4.11.20 アミノペプチダーゼEy
3.4.11.22 液胞アミノペプチダーゼI
3.4.13.3 Xaa-Hisジペプチダーゼ
3.4.13.4 Xaa-Argジペプチダーゼ
3.4.13.5 Xaa-メチル-Hisジペプチダーゼ
3.4.13.6 Cys-Glyジペプチダーゼ
3.4.13.7 Glu-Gluジペプチダーゼ
3.4.13.8 Pro-Xaaジペプチダーゼ
3.4.13.9 Xaa-Proジペプチダーゼ
3.4.13.12 Met-Xaaジペプチダーゼ
3.4.13.17 非立体特異的ジペプチダーゼ
3.4.13.18 細胞質ゾル非特異的ジペプチダーゼ
3.4.13.19 膜ジペプチダーゼ
3.4.13.20 β-Ala-Hisジペプチダーゼ
3.4.14.1 ジペプチジル-ペプチダーゼI
3.4.14.2 ジペプチジル-ペプチダーゼII
3.4.14.4 ジペプチジル-ペプチダーゼIII
3.4.14.5 ジペプチジル-ペプチダーゼIV
3.4.14.6 ジペプチジル-ジペプチダーゼ
3.4.14.9 トリペプチジル-ペプチダーゼI
3.4.14.10 トリペプチジル-ペプチダーゼII
3.4.14.11 Xaa-Proジペプチジル-ペプチダーゼ
3.4.15.1 ペプチジル-ジペプチダーゼA
3.4.15.4 ペプチジル-ジペプチダーゼB
3.4.15.5 ペプチジル-ジペプチダーゼDcp
3.4.16.2 リソソーマルPro-Xカルボキシペプチダーゼ
3.4.16.4 セリン-D型-Ala-D-Alaカルボキシペプチダーゼ
3.4.16.5 カルボキシペプチダーゼC
3.4.16.6 カルボキシペプチダーゼD
3.4.17.1 カルボキシペプチダーゼA
3.4.17.2 カルボキシペプチダーゼB
3.4.17.3 リジン(アルギニン)カルボキシペプチダーゼ
3.4.17.4 Gly-Xカルボキシペプチダーゼ
3.4.17.6 アラニンカルボキシペプチダーゼ
3.4.17.7 Transferred entry: 3.4.19.10.
3.4.17.8 ムラモイルペンタペプチドカルボキシペプチダーゼ
3.4.17.10 カルボキシペプチダーゼH
3.4.17.11 グルタミン酸カルボキシペプチダーゼ
3.4.17.12 カルボキシペプチダーゼM
3.4.17.13 ムラモイルテトラペプチドカルボキシペプチダーゼ
3.4.17.14 亜鉛D-Ala-D-Alaカルボキシペプチダーゼ
3.4.17.15 カルボキシペプチダーA2
3.4.17.16 膜Pro-Xカルボキシペプチダーゼ
3.4.17.17 チューブリニル-Tyrカルボキシペプチダーゼ
3.4.17.18 カルボキシペプチダーゼT
3.4.17.19 耐熱性カルボキシペプチダーゼ1
3.4.17.20 カルボキシペプチダーゼU
3.4.17.21 グルタミン酸カルボキシペプチダーゼII
3.4.17.22 メタロカルボキシペプチダーゼD
3.4.18.1 システイン型カルボキシペプチダーゼ
3.4.19.1 アシルアミノアシル-ペプチダーゼ
3.4.19.2 ペプチジル-グリシンアミダーゼ
3.4.19.3 ピログルタミル-ペプチダーゼI
3.4.19.5 β-アスパルチル-ペプチダーゼ
3.4.19.6 ピログルタミル-ペプチダーゼII
3.4.19.7 N-ホルミルメチオニル-ペプチダーゼ
3.4.19.8 プテロイルポリ-γ-グルタミン酸カルボキシペプチダーゼ
3.4.19.9 γ-グルタミルヒドロラーゼ
3.4.19.11 γ-D-グルタミル-メソ-ジアミノピメレートペプチターゼI
3.4.21.1 キモトリプシン
3.4.21.2 キモトリプシンC
3.4.21.3 メトリジン
3.4.21.4 トリプシン
3.4.21.5 トロンビン
3.4.21.6 凝固因子Xa
3.4.21.7 プラスミン
3.4.21.8 Transferred entry: 3.4.21.34および3.4.21.35.
3.4.21.9 エンテロペプチダーゼ
3.4.21.10 アクロシン
3.4.21.11 Transferred entry: 3.4.21.36および3.4.21.37.
3.4.21.12 α-細胞溶解エンドペプチダーゼ
3.4.21.19 グルタミルエンドペプチダーゼ
3.4.21.20 カテプシンG
3.4.21.21 凝固因子VIIa
3.4.21.22 凝固因子IXa
3.4.21.25 ククミシン
3.4.21.26 プロリルオリゴペプチダーゼ
3.4.21.27 凝固因子XIa
3.4.21.32 ブラキュリン(Brachyurin)
3.4.21.34 血漿カリクレイン
3.4.21.35 組織カリクレイン
3.4.21.36 膵エラスターゼ
3.4.21.37 白血球エラスターゼ
3.4.21.38 凝固因子XIIa
3.4.21.39 チマーゼ
3.4.21.41 補体成分C1r
3.4.21.42 補体成分C1s
3.4.21.43 古典的-補体活性化経路C3/C5転化酵素
3.4.21.45 補体因子I
3.4.21.46 補体因子D
3.4.21.47 代替-補体活性化経路C3/C5転化酵素
3.4.21.48 セレビシン(Cerevisin)
3.4.21.49 ハイポデルミンC(Hypodermin C)
3.4.21.50 リシルエンドペプチダーゼ
3.4.21.53 エンドペプチダーゼ La
3.4.21.54 γ-レニン
3.4.21.55 ベノンビンAB(Venombin AB)
3.4.21.57 ロイシルエンドペプチダーゼ
3.4.21.59 トリプターゼ
3.4.21.60 スクテラリン
3.4.21.61 ケキシン
3.4.21.62 スブチリシン
3.4.21.63 オリジン(Oryzin)
3.4.21.64 プロテイナーゼK
3.4.21.65 サーモマイコリン(Thermomycolin)
3.4.21.66 サーミターゼ(Thermitase)
3.4.21.67 エンドペプチダーゼSo
3.4.21.68 T-プラスミノーゲン活性化因子
3.4.21.69 プロテインC (活性化)
3.4.21.70 膵エンドペプチターゼE
3.4.21.71 膵エラスターゼII
3.4.21.72 IgA-特異的セリン・エンドペプチターゼ
3.4.21.73 U-プラスミノーゲン活性化因子
3.4.21.74 ベノンビンA(Venombin A)
3.4.21.75 フリン(Furin)
3.4.21.76 ミエロブラスチン
3.4.21.77 セメノゲラーゼ(Semenogelase)
3.4.21.78 グランザイム A
3.4.21.79 グランザイム B
3.4.21.80 ストレプトグリシンA(Streptogrisin A)
3.4.21.81 ストレプトグリシンB
3.4.21.82 グルタミルエンドペプチターゼII
3.4.21.83 オリゴペプチターゼB
3.4.21.84 リムルス凝固因子 C
3.4.21.85 リムルス凝固因子 B
3.4.21.86 リムルス凝固酵素
3.4.21.87 オンプチン(Omptin)
3.4.21.88 lexAリプレッサー
3.4.21.89 シグナルペプチダーゼI
3.4.21.90 トーガビリン(Togavirin)
3.4.21.91 フラビリン(Flavirin)
3.4.21.92 エンドペプチダーゼ Clp
3.4.21.93 プロタンパク質転化酵素1
3.4.21.94 プロタンパク質転化酵素2
3.4.21.95 ヘビ毒因子V活性化因子
3.4.21.96 ラクトセピン(Lactocepin)
3.4.22.1 カテプシン B
3.4.22.2 パパイン
3.4.22.3 フィカイン
3.4.22.6 キモパパイン
3.4.22.7 アスクレパイン(Asclepain)
3.4.22.8 クロストリパイン
3.4.22.10 ストレプトパイン(Streptopain)
3.4.22.14 アクチンダイン(Actinidain)
3.4.22.15 カテプシン L
3.4.22.16 カテプシン H
3.4.22.17 カルパイン
3.4.22.24 カテプシン T
3.4.22.25 グリシルエンドペプチターゼ
3.4.22.26 がん凝血促進因子(Cancer procoagulant)
3.4.22.27 カテプシン S
3.4.22.28 ピコルナイン 3C(Picornain 3C)
3.4.22.29 ピコルナイン 2A
3.4.22.30 カリカイン(Caricain)
3.4.22.31 アナナイン
3.4.22.32 茎ブロメライン(Stem bromelain)
3.4.22.33 果実ブロメライン(Fruit bromelain)
3.4.22.34 レグマイン
3.4.22.35 ヒストリセイン(Histolysain)
3.4.22.36 カスパーゼ-1
3.4.22.37 ジンジパインR
3.4.22.38 カテプシンK
3.4.23.1 ペプシン A
3.4.23.2 ペプシン B
3.4.23.3 ガストリクシン
3.4.23.4 キモシン
3.4.23.5 カテプシン D
3.4.23.12 ネオペンテシン(Neopenthesin)
3.4.23.15 レニン
3.4.23.16 レトロペプシン
3.4.23.17 プロ-オピオメラノコルチン変換酵素
3.4.23.18 アスぺルギロペプチンI(Aspergillopepsin I)
3.4.23.19 アスぺルギロペプチンII
3.4.23.20 ペニシロペプシン(Penicillopepsin)
3.4.23.21 リゾプスペプシン(Rhizopuspepsin)
3.4.23.22 エンドチアペプシン(Endothiapepsin)
3.4.23.23 ムコロペプシン(Mucoropepsin)
3.4.23.24 カンジダペプシン(Candidapepsin)
3.4.23.25 サッカロペプシン(Saccharopepsin)
3.4.23.26 ロドトルラペプシン(Rhodotorulapepsin)
3.4.23.27 フィサロペプシン(Physaropepsin)
3.4.23.28 アクロシリンドロペプシン(Acrocylindropepsin)
3.4.23.29 ポリポロペプシン(Polyporopepsin)
3.4.23.30 ピクノポロペプシン(Pycnoporopepsin)
3.4.23.31 シタリドペプシンA(Scytalidopepsin A)
3.4.23.32 シタリドペプシンB
3.4.23.33 キサントモナペプシン(Xanthomonapepsin)
3.4.23.34 カテプシン E
3.4.23.35 バリアペプシン(Barrierpepsin)
3.4.23.36 シグナルペプチダーゼII
3.4.23.37 シュードモナペプシン(Pseudomonapepsin)
3.4.23.38 プラスメプシンI
3.4.23.39 プラスメプシンII
3.4.23.40 フィテプシン(Phytepsin)
3.4.24.1 アトロリシンA(Atrolysin A)
3.4.24.3 微生物コラゲナーゼ
3.4.24.6 ロイコリシン
3.4.24.7 間質性コラゲナーゼ
3.4.24.11 ネプリリシン
3.4.24.12 エンベリシン(Envelysin)
3.4.24.13 IgA-特異的メタロエンドペプチダーゼ
3.4.24.14 プロコラーゲン N-エンドペプチダーゼ
3.4.24.15 チメットオリゴペプチダーゼ(Thimet oligopeptidase)
3.4.24.16 ニューロリシン
3.4.24.17 ストロメリシン1
3.4.24.18 メプリンA
3.4.24.19 プロコラーゲン C-エンドペプチダーゼ
3.4.24.20 ペプチジル-Lysメタロエンドペプチダーゼ
3.4.24.21 アスタシン
3.4.24.22 ストロメリシン2
3.4.24.23 マトリリシン
3.4.24.24 ゼラチナーゼ A
3.4.24.25 アエロモノリシン(Aeromonolysin)
3.4.24.26 シュードリシン
3.4.24.27 サーモリシン
3.4.24.28 バシロリシン
3.4.24.29 オーレオリシン(Aureolysin)
3.4.24.30 ココリシン(Coccolysin)
3.4.24.31 マイコリシン(Mycolysin)
3.4.24.32 β-溶解性メタロエンドペプチダーゼ
3.4.24.33 ペプチジル-Aspメタロエンドペプチダーゼ
3.4.24.34 好中球コラゲナーゼ
3.4.24.35 ゼラチナーゼ B
3.4.24.36 レイシュマノリシン(Leishmanolysin)
3.4.24.37 サッカロリシン(Saccharolysin)
3.4.24.38 オートリシン
3.4.24.39 デューテロシン(Deuterolysin)
3.4.24.40 セラリシン
3.4.24.41 アトロリシンB
3.4.24.42 アトロリシンC
3.4.24.43 アトロザーゼ(Atroxase)
3.4.24.44 アトロリシンE
3.4.24.45 アトロリシンF
3.4.24.46 アダマリシン(Adamalysin)
3.4.24.47 ホリリシン(Horrilysin)
3.4.24.48 ルベリシン(Ruberlysin)
3.4.24.49 ボスロパシン(Bothropasin)
3.4.24.50 ボスロリシン(Bothrolysin)
3.4.24.51 オピオリシン(Ophiolysin)
3.4.24.52 トリメレリシンI(Trimerelysin I)
3.4.24.53 トリメレリシンII
3.4.24.54 ムクロリシン(Mucrolysin)
3.4.24.55 ピトリリシン(Pitrilysin)
3.4.24.56 インスリシン(Insulysin)
3.4.24.57 O-シアロ糖タンパク質エンドペプチダーゼ
3.4.24.58 ルセルリシン(Russellysin)
3.4.24.59 ミトコンドリア中間体ペプチダーゼ(Mitochondrial intermediate peptidase)
3.4.24.60 ダクチリシン(Dactylysin)
3.4.24.61 ナルジリシン(Nardilysin)
3.4.24.62 マグノリシン(Magnolysin)
3.4.24.63 メプリンB
3.4.24.64 ミトコンドリアプロセシングペプチダーゼ
3.4.24.65 マクロファージエラスターゼ
3.4.24.66 コリオリシンL(Choriolysin L)
3.4.24.67 コリオリシンH
3.4.24.68 テントキシリシン(Tentoxilysin)
3.4.24.69 ボントキシリシン(Bontoxilysin)
3.4.24.70 オリゴペプチダーゼA
3.4.24.71 エンドセリン変換酵素1
3.4.24.72 ファイブロラーゼ(Fibrolase)
3.4.24.73 ジャララジン(Jararhagin)
3.4.24.74 フラジリシン(Fragilysin)
3.4.99.46 多重触媒性エンドペプチダーゼ複合体(Multicatalytic endopeptidase complex)
ある種の好ましい態様として、本発明において触媒部分として有用なプロテアーゼには: キモトリプシン、トリプシン、エラスターゼ、プラスミン、組織型プラスミノーゲン活性化因子(t-PA)、ウロキナーゼ(UK)、一本鎖ウロキナーゼ(scu-PA)、トロンビン、カリクレイン、アクロシン、カテプシンG、凝固因子VIIa、IXaおよびXIaのようなセリンプロテアーゼ; カテプシンB、パパイン、フィシン、キモパパイン、クロストリパインおよびカテプシンLのようなシステインプロテアーゼ; ならびにペプシン、キモシンおよびカテプシンDのような酸性プロテアーゼが含まれる。
ヒト白血球由来の白血球エラスターゼ(Sigmaカタログ番号E1508); ヒト唾液由来の膵エラスターゼ(Sigmaカタログ番号E1633); ヒト血漿由来のプラスミン(Sigmaカタログ番号P4895); ヒト黒色腫細胞培養物由来の一本鎖t-PA(Sigmaカタログ番号T7776); 組換え二本鎖t-PA(Sigmaカタログ番号T4654); ヒト腎臓細胞由来のウロキナーゼ(Sigmaカタログ番号U5004); ヒト尿由来のウロキナーゼ(Sigmaカタログ番号U6876); トリプシン(Sigmaカタログ番号T8003); およびα-キモトリプシン(Sigmaカタログ番号C7762)を含め、多くの精製セリンプロテアーゼが市販されている。
他の有用な酵素には: 膵リパーゼ; リポタンパク質リパーゼ; モノグリセリドリパーゼ; スフィンゴシル-グルコピラノシド; スフィンゴミエリナーゼ; ホスホイノシチド; ホスホリパーゼ; カルボキシペプチダーゼ、アミノペプチダーゼおよびジペプチダーゼのようなペプチダーゼ; グルコシダーゼ; グルカナーゼ; ガラクトシダーゼ; マンノシダーゼ; アミラーゼならびにデキストリナーゼが含まれる。
アドザイムの触媒ドメインは同様に、遺伝子工学的に改変された酵素、例えば、セリンプロテアーゼ活性モチーフを含むように設計されたタンパク質のような、酵素活性を有するように遺伝子工学的に改変されたタンパク質に由来することができる(例えば、Quemenurら、(1998) Nature 391:301〜304およびLiuら、(1998) Molecular Immunology 15:1069〜1077を参照されたい)。
さらなる例として、触媒部分は、触媒抗体とすることができる。関心のあるほぼどのような分子をも選択的に結合する抗体を作製できるので、この技術により、選択性が高い触媒を要件に合わせて作製する可能性が得られる。触媒抗体の作製方法は、Lernerら、(1991) Science 252:659; Benkovicら、(1990) Science 250:1135; Tramontanoら、(1986) Science 234:1566により開示されている。または、触媒抗体を作製するための抗体のテーラリング(適合化)は、ウォークスルー式(walk-through)変異誘発のような方法により行うことができる(PCT公開PCT/US91/02362を参照されたい、参照として本明細書に組み入れられる)。
C. キメラ・アドザイムの作製
触媒部分は、多くの方法で、例えば、組換え核酸からの同時翻訳(例えば、融合タンパク質)または、あまり好ましくない態様として、化学結合により、標的化部分に連結することができる。
(i) 組換え融合タンパク質として作製
本発明のアドザイムは、触媒部分と標的化部分とを一本の連続的なポリペプチド鎖として含む、融合タンパク質として構築することができる。融合タンパク質の調製時、融合遺伝子は、標的化部分、触媒部分に対する配列、および任意に、二つの断片の橋渡しをするペプチドリンカー配列をコードするDNAを含むように構築する。この融合タンパク質を作製するため、酵素全体をクローニングし、タンパク質の一部として発現させることができる、またあるいは、触媒部分を含む適当な断片を使用することができる。同様に、クローニングした、受容体または抗体のような標的化部分のコード配列全体、またあるいは、病原体の表面成分を結合できる分子の断片を使用することができる。翻訳産物が所望の融合タンパク質となるように、融合遺伝子を作製するための組換えDNA技術の利用は、当技術分野においてよく知られている。遺伝子のコード配列とその調節領域の双方を設計し直して、タンパク質産物の機能特性、産生されるタンパク質の量、またはタンパク質を産生させる細胞型を変化させることができる。遺伝子のコード配列は、例えば、その一部を異なる遺伝子のコード配列と融合させて、融合タンパク質をコードする新たな雑種遺伝子を作り出すことにより、大幅に改変することができる。融合タンパクの作製方法の例は、PCT出願PCT/US87/02968、PCT/US89/03587およびPCT/US90/07335、ならびにTrauneckerら、(1989) Nature 339:68に記述されている。
シグナルペプチドは、細胞からのタンパク質の分泌を容易にする。典型的なシグナルペプチドは、マウス・インターロイキン-7(IL-7; Namenら、Nature 333:571; 1988)のリーダー配列のアミノ末端25アミノ酸である。他のシグナルペプチドをさらに使用することもでき、IL-7リーダー配列中の特定のヌクレオチドを、アミノ酸配列は変化させないで変化させることができる。さらに、リーダー配列として機能するIL-7配列の能力に影響を及ぼさないアミノ酸交換を行うことができる。シグナルペプチドを融合アドザイムの標的ドメインまたは触媒ドメインに付加させることができ、その結果、これらのドメインが移入核酸から細胞により合成される際に、分泌されたアドザイムの標的および触媒ドメインがオリゴマー化して、細胞外標的、例えば、サイトカインに作用する成熟型アドザイムを形成するものと思われる。
場合によっては、異なるタンパク質に由来するキメラタンパク質の部分間にポリペプチドリンカー領域を導入することが必要となる可能性がある。このリンカーにより、融合タンパク質の柔軟性を一層促進させることができ、その結果、部分間の立体障害が低下することで、さまざまな部分が標的と自由におよび(任意に)同時に相互作用することが可能になるほか、各タンパク質の適当な折り畳みの発生を可能にする。リンカーは、タンパク質の二つのドメイン間にランダムコイルで存在することが決定された配列のような、天然起源のものとすることができる。または、リンカーは、合成起源のものとすることができる。例えば、配列(Gly4Ser)nを合成非構造型リンカーとして使用することができる。このタイプのリンカーは、Hustonら、(1988) PNAS 85:4879; ならびに米国特許第5,091,513号および米国特許第5,258,498号に記述されている。天然に存在するヒト起源の非構造型リンカーが好ましい。これらでは、免疫原性の危険が低下するためである。
アドレスと触媒ドメインとを連結するリンカーの長さおよび組成は、最適化することができる。例えば、Zhou (J. Mol. Biol. 329: 1〜8, 2003)らは、それぞれが第一の分子に対して親和性を有する、第二および第三の分子(例えば、二つのscFv)を連結することによって、第一の分子に対する親和性を増強するための数量化理論を詳細に報告している。予測される親和性の増強は、実際に、D1.3およびHyHEL-10のscFv断片からなる雌鶏卵リゾチームに対する二重特異性抗体にほぼ等しいことが見出されている。この理論を広く適応できることは、柔軟性のあるリンカーにより制約されるタンパク質間の相互作用に関するさまざまな例から実証されており、この理論により、柔軟性のあるリンカーにより制約されるタンパク質間の相互作用に対する大綱が得られる。
理論の最も単純な事例として、リンカーは、その唯一の効果が二つの抗体断片間の距離を制約する鎖となるように柔軟性である。その結果、これは下記式で示された:
Ceff = p(d0) (Eq. a)
式中、p(r)は、距離rを有するようなL残基数を持つ柔軟性のあるリンカーの両端ベクトルに対する確立密度であり、およびd0は、その連結される断片が抗原に結合する場合の実際の両端距離である。L残基数からなる柔軟性のあるペプチドリンカーは、下記のような、ミミズ様の鎖としてモデル化することができる:
p(r)=(3/41p1c)3/2exp(-3r2/41p1c)(1-51p/41c+2r2/1c 2-33r4/801p13 c-791p 2/1601c 2-
329r21p/120lc 3+6799r4/1600lc 4-3441r6/28001p1c 5+1089r8/128001p 21c 6) (Eq. b)
式中、b=3.8Åは、一番近いCα-Cα距離であり、ならびにlc=bLおよびlp=3Åは、ペプチドリンカーの、それぞれ、輪郭長さおよび持続長である。通常、p(d0)は、ミリモル範囲またはそれ以上の範囲にあり、および従って、連結による戦略は、抗体断片の会合定数が103 M-1よりもはるかに大きいので、有意な親和性の増強をもたらすものと予想される。式(a)は、DNA結合ドメインの連結による親和性の増強を十分に予測することが認められている(Zhou, Biochemistry 40, 15069〜15073頁, 2001)。
理論モデルに基づけば、Zhouの図2(参照として組み入れられる)は、いくつかの所定のd0値、例えば、10Å、20Å、30Å、40Å、50Å、および60ÅでのLおよびp(d0)の関係を記述している。このリンカー理論には、二つの重要な現実的な側面が組み入れられている。第一に、結合状態では、リンカーの両端距離は、結合複合体の構造により決定される特定の値(d0)近くに保たれる。第二に、非結合状態では、両端距離の分布p(r)は均一ではないが、しかし半たわみ性のポリマー鎖、例えば、ポリペプチド鎖に適当なものとなる。エントロピーの理由から、ポリマー鎖は、ゼロまたは完全な輪郭長さlcに近づく両端距離となった立体構造の見本を取ることはめったになく、従って、p(r)は、rの中間値で最大となる。所定の両端距離d0に、p(d0)が最大となるlc(またはL)の値も存在する(Zhouの図2を参照されたい)。従って、ペプチドリンカーの鎖長を最適化して、親和性の最大増強をもたらすことができる。
アドザイムのリンカー設計との関連で、いったんアドレスおよび触媒ドメインが選択されれば、標的-アドザイム親和性複合体の分子モデルを得ることができる。d0、つまり、リンカーがアドレスにつながる点とリンカーが酵素につながる点との間の距離は、アドレスも酵素ドメインも親和性複合体の状態で存在していても、例えば、標的-アドザイム親和性複合体の3-D構造から容易に決定することができる。多くのサイトカインの構造が解明されている(http://cmbi.bjmu.edu.cn/cmbidata/cgf/CGF_Database/cytweb/cyt_strucs/index.htmlのサイトカイン・ウェブ・サイト(Cytokine Web site)を参照されたい)。既知構造のサイトカインに配列相同性を有する他のサイトカイン、ならびに標的-アドザイム複合体の構造は、分子モデリングにより日常的に得ることができる。
いったんd0値が得られれば、Zhouの図2を利用して、最も可能性の高いp(d0)値に対して最適なLを見つけ出すことができる。例えば、d0が約20Åであると決定される場合、Zhouの図2から、このd0値で、最も可能性の高いp(d0)値は約20 mMであることと、このp(d0)値は約10〜15アミノ酸のリンカー長に相当することが示唆される。ここで留意すべきは、20Åよりも大きなd0値で、最大p(d0)値は急速にピークに達して、非常にゆっくりと減少し、従って、適当なリンカー長を選択する際に、かなりの柔軟性が可能となることである。さらに、ここでの方法は、比較的不正確なd0値の予測にかなり寛容である。Zhouの図2で、異なるd0値に対する曲線は、特に長いリンカー長(例えば、40アミノ酸を超える)および大きなd0値(30〜60Å)の場合、収束する傾向があるためである。例えば、d0が30Åである場合、ピークのp(d0)値は約3〜4 mMである。d0が40Åである場合、ピークのp(d0)値は、およそ35〜40残基のほぼ同じリンカー長で、約1.5 mMにわずかに減少するだけである。
融合遺伝子の作製技術はよく知られている。本質的に、異なるポリペプチド配列をコードするさまざまなDNA断片の連結は、連結のため平滑断端にしたまたは互い違いの断端にした末端、適当な末端を与えるための制限酵素消化、必要に応じて付着末端を埋めること、好ましくない連結を避けるためのアルカリホスファターゼ処理、および酵素による連結を利用する、従来技術により行われる。別の態様として、融合遺伝子は、自動DNA合成装置を含む、従来技術により合成することができる。または、二つの連続的な遺伝子断片間に、後に融合遺伝子配列を生成させるためにアニール可能な相補的突出部を生じさせるアンカープライマーを用いて、遺伝子断片のPCR増幅を行うことができる(例えば、Current Protocols in Molecular Biology, Ausubelら(編)、John Wiley & Sons: 1992を参照されたい)。
融合タンパク質は、リーダー(またはシグナルペプチド)配列、免疫グロブリンの一部分(例えば、Fc部分、以下を参照されたい)または他のオリゴマー化配列のほかに、高い抗原性部分をコードする配列、ヘキサヒスチジン部分または融合タンパク質の簡易精製もしくは迅速検出の手段になる他の要素を含む、さらなる配列を含むことができる。
融合タンパク質分子を発現させるには、融合遺伝子構築物に対し、転写および翻訳調節要素ならびに他の非翻訳配列を含めることが望ましいかもしれない。例えば、構成性および誘導性プロモーター、エンハンサーまたはインヒビターを含む調節要素を組み込むことができる。
(ii) 化学結合剤の使用
当業者に知られる多数の化学架橋剤が存在する。本発明の場合、好ましい架橋剤は、段階的な方法でタンパク質を連結させるのに使用できる、ヘテロ二官能性架橋剤である。ヘテロ二官能性架橋剤により、タンパク質を連結させるのに特異性の高い連結方法を設計できるようになり、その結果、同一タンパク質の重合体のような、好ましくない副反応の発生を減少させることができる。多種多様なヘテロ二官能性架橋剤が当技術分野において知られている。これらのなかには、スクシニミジル4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレート(SMCC)、m-マレイミドベンゾイル-N-ヒドロキシスクシンイミドエステル(MBS); N-スクシニミジル(4-ヨードアセチル)アミノベンゾエート(SIAB)、スクシニミジル4-(p-マレイミドフェニル)ブチレート(SMPB)、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC); 4-スクシニミジルオキシカルボニル-a-メチル-a-(2-ピリジルジチオ)-トルエン(SMPT)、N-スクシニミジル3-(2-ピリジルジチオ)プロピオネート(SPDP)、スクシニミジル6-[3-(2-ピリジルジチオ)プロピオネート]ヘキサノエート(LC-SPDP)が含まれる。N-ヒドロキシスクシンイミド部分を有する架橋剤は、一般に、より高い水溶性を有するN-ヒドロキシスルホスクシンイミド類似体として得ることができる。さらに、連結鎖内にジスルフィド架橋を有する架橋剤は、インビボでのリンカー切断の量を減少させるため、代わりにアルキル誘導体として合成することができる。
ヘテロ二官能性架橋剤に加えて、ホモ二官能性および光反応性架橋剤を含む、多くの他の架橋剤が存在する。スベリン酸ジスクシニミジル(DSS)、ビスマレイミドヘキサン(BMH)およびジメチルピメリミデート-2 HCl(DMP)は、有用なホモ二官能性架橋剤の例であり、ビス-[β-(4-アジドサリシルアミド)エチル]ジスルフィド(BASED)およびN-スクシニミジル-6(4'-アジド-2'-ニトロフェニル-アミノ)ヘキサノエート(SANPAH)は、本発明で用いるのに有用な光反応性架橋剤の例である。タンパク質結合技術の概説としては、Meansら(1990) Bioconjugate Chemistry 1:2〜12を参照されたい。上記に含まれる、ある特に有用な部類のヘテロ二官能性架橋剤には、第一級アミン反応基、N-ヒドロキシスクシンイミド(NHS)、またはその水溶性類似体のN-ヒドロキシスルホスクシンイミド(スルホ-NHS)が含まれる。アルカリ性pHで第一級アミン(リジンのε基)は、プロトン化されておらず、求核攻撃によりNHSエステルまたはスルホ-NHSエステルに反応する。この反応の結果、アミド結合の形成、および副産物としてNHSまたはスルホ-NHSの放出が起こる。
ヘテロ二官能性架橋剤の一部として有用な別の反応基は、チオール反応基である。一般的なチオール反応基には、マレイミド、ハロゲン、およびピリジルジスルフィドが含まれる。マレイミドは、わずかに酸性〜中性(pH 6.5〜7.5)の条件下で、数分以内に遊離スルフヒドリル(システイン残基)と特異的に反応する。ハロゲン(ヨードアセチル基)は、生理的pHで-SH基と反応する。これらの反応基はどちらも安定なチオエーテル結合の形成をもたらす。
ヘテロ二官能性架橋剤の第三の構成成分は、スペーサーアームまたは架橋である。架橋は二つの反応末端を連結する構造体である。架橋の最も明らかな特性は、立体障害に対するその効果である。ある場合には、架橋が長ければ、ずっと容易に、二つの複合生体分子を連結するのに必要な距離の橋渡しをすることができる。
ヘテロ二官能性試薬を用いたタンパク質-タンパク質複合体の調製は、アミン反応とスルフヒドリル反応とを含む二段階工程であり、そのような工程は、本明細書に即して言えば、一般に当技術分野においてよく知られている。例えば、Partisら、(1983) J. Pro. Chem. 2:263; Ellmanら、(1958) Arch. Biochem. Biophys. 74:443; Riddlesら、(1979) Anal. Biochem. 94:75; Blattlerら、(1985) Biochem 24:1517を参照されたい。
(iii) 多量体構築物
本発明のある種の態様として、主題のアドザイムは、触媒ドメインおよび標的化ドメインが別々のポリペプチド鎖にある、多量体複合体である。これらの二つのドメインは、合成時に、成熟型のアドザイムを形成するように結び付けることができる。
例えば、一つの態様として、アドザイムは、重鎖可変領域(VH)および軽鎖可変領域(VL)が標的化ドメインおよび触媒ドメインと置換された、抗体(例えば、Fc融合)の形態をとる(標的化ドメインまたは触媒ドメインのどちらをVH領域またはVL領域のどちらに置換してもよい)。例えば、膜会合タンパク質由来の細胞外ドメインと免疫グロブリン重鎖定常領域とを含む可溶性タンパク質が、Fanslowら、J. Immunol. 149:65, 1992によりおよびNoelleら、Proc. Nad. Acad. Sci. U.S.A. 89:6550, 1992により報告された。
ある種の態様として、アドザイムは、標的化部分として機能できる適当な重鎖および軽鎖に連結された第一のFc部分と、触媒ドメインに融合された第二のFc部分とを含む。
触媒ドメインまたは標的化ドメインを含む融合タンパク質は、免疫グロブリン由来のポリペプチドをコードする核酸を用いて調製することができる。抗体由来のポリペプチドのさまざまな部分(Fcドメインを含む)に融合された異種ポリペプチドを含む、融合タンパク質の調製は、例えば、Ashkenaziら、(PNAS USA 88:10535, 1991)およびByrnら、(Nature 344:677, 1990)により報告されている。本発明の一つの態様として、アドザイムは、触媒ドメインを抗体の第一のFc領域(例えば、IgG1)におよび標的化ドメインを抗体の第二のFc領域に融合させることにより作製される。Fcポリペプチドは、触媒ドメインまたは標的化ドメインのC末端に融合されることが好ましい。各Fc融合タンパク質をコードする遺伝子融合体を適当な発現ベクターに挿入する。Fc融合タンパク質は、組換え発現ベクターで形質転換した宿主細胞中で発現されて、抗体分子のように会合することができ、すると、鎖間ジスルフィド結合がFcポリペプチド間に生じ、その結果、所望のアドザイムが得られる。融合タンパク質が抗体の重鎖と軽鎖の双方で作製される場合、触媒ドメインと標的化ドメインとを複数備えたアドザイムを形成することが可能である。
ある種の態様として、一つまたは複数の免疫グロブリン融合タンパク質を含むアドザイムは、少なくとも一つの免疫グロブリン重鎖定常領域のドメインと会合した免疫グロブリン軽鎖定常領域を利用することができる。別の態様として、免疫グロブリン軽鎖定常領域を、免疫グロブリン蝶番部に連結された少なくとも一つの免疫グロブリン重鎖定常領域のドメインと会合させる。ある一連の態様として、免疫グロブリン軽鎖定常領域を非免疫グロブリンポリペプチドのポリペプチド鎖(例えば、触媒ドメインまたはポリペプチド標的化ドメイン)と、読み枠を合わせて連結し、そして少なくとも一つの重鎖定常領域と会合させる。好ましい一連の態様として、可変領域を少なくとも一つの免疫グロブリン重鎖定常領域と、その上流に且つ適切な読み枠で連結させる。別の一連の態様として、免疫グロブリン重鎖を非免疫グロブリンポリペプチドのポリペプチド鎖と、読み枠を合わせて連結し、そして免疫グロブリン軽鎖定常領域と会合させる。さらに別の一連の態様として、非免疫グロブリンポリペプチド二量体または受容体類似体のポリペプチド鎖を、免疫グロブリン蝶番部に連結された少なくとも一つの免疫グロブリン重鎖定常領域と連結し、そして免疫グロブリン軽鎖定常領域と会合させる。好ましい一連の態様として、免疫グロブリン可変領域を免疫グロブリン軽鎖定常領域と、その上流に且つ適切な読み枠で連結させる。
本明細書では「Fcポリペプチド」という用語には、抗体のFc領域由来のポリペプチドの野生型および改変型が含まれる。二量体化を促進させる蝶番部を含んだそのようなポリペプチドの切断型も含まれる。PCT公開国際公開公報第93/10151号に記述されている、一つの適当なFcポリペプチドは、N末端蝶番部から野生型C末端に及ぶ一本鎖ポリペプチドである。血清半減期の向上、空間配向の変化などを伴ったFcポリペプチドの改変型を使用することが望ましいかもしれない。免疫グロブリン重鎖定常領域のドメインには、γ、α、ε、μ、およびδクラスを含む免疫グロブリン重鎖のいずれかのクラスのCH1、CH2、CH3、およびCH4が含まれる。特に好ましい免疫グロブリン重鎖定常領域のドメインは、ヒトCH1である。免疫グロブリン可変領域には、VH、Vκ、またはVλが含まれる。免疫グロブリンをコードするDNA配列は、当技術分野において知られる種々のゲノムライブラリーまたはcDNAライブラリーからクローニングすることができる。そのようなDNA配列をプローブに基づく方法によって単離する技術は、従来技術であり、当業者によく知られている。そのようなDNA配列を単離するためのプローブは、公のDNA配列に基づくことができる(例えば、Hieterら、Cell 22: 197〜207, 1980を参照されたい)。または、Mullisら(米国特許第4,683,195号)およびMullis(米国特許第4,683,202号) (参照として本明細書に組み入れられる)により開示されるポリメラーゼ連鎖反応(PCR)法を使用することができる。そのようなDNA配列の単離を目的としたライブラリーの選択およびプローブの選択は、当業者のレベルの範囲内である。
免疫グロブリン融合体の調製に用いる宿主細胞には、外来性DNAを形質転換または形質導入することができ、培養で増殖させることができる真核細胞、例えば、培養哺乳動物細胞および真菌細胞が含まれる。酵母の種(例えば、サッカロマイセス(Saccharomvces)種、シゾサッカロマイセス(Schizosaccharomyces)種)、または糸状菌(例えば、アスペルギルス(Aspergillus)種、ニューロスポラ(Neurospora)種)を含む、真菌細胞を本発明のなかで宿主細胞として使用することができる。酵母のサッカロマイセス・セルビシエ(Saccharomyces cerevisiae)菌が特に好ましい。
前述の態様のそれぞれで、分子リンカーを任意に、アドザイム構築物の残りの部分と二量体化ドメインとの間に置いて、共有結合的に結合させてもよい。
別の態様として、種々のオリゴマー形成ドメインを使用して、別々に合成された標的化ドメインと触媒ドメインとを一緒にすることができる。
そのようなオリゴマー化ドメインの部類の一つは、ロイシンジッパーである。
国際公開公報第94/10308 A1号およびその関連の米国特許第5,716,805号(全て参照として本明細書に組み入れられる)には、二つの別々の異種ポリペプチドを二量体化する/オリゴマー化するためのロイシンジッパー・オリゴマー形成ドメインの使用が記述されている。二つの別々の異種ポリペプチドのそれぞれが、ロイシンジッパー・オリゴマー形成ドメインを有する融合タンパク質として合成される。一つの態様として、ロイシンジッパー・ドメインは、特異的タンパク質分解酵素を用いた切断により、融合タンパク質から取り除くことができる。別の態様として、ヘテロオリゴマータンパク質は、選択的にヘテロオリゴマーを形成するロイシンジッパー・ドメインを利用して調製される。
ロイシンジッパー・ドメインは、もともといくつかのDNA結合タンパク質で同定された(Landschulzら、Science 240:1759, 1988)。ロイシンジッパー・ドメインは、これらの(および他の)タンパク質に存在する保存されたペプチドドメインであって、タンパク質の二量体化に関与するドメインを指すのに使用される用語である。ロイシンジッパー・ドメイン(本明細書ではオリゴマー化ドメイン、またはオリゴマー形成ドメインとも呼ばれる)には、7アミノ酸ごとに4または5個のロイシン残基が含まれる。
ロイシンジッパー・ドメインの例は、酵母の転写因子GCN4やラット肝に見られる熱安定性DNA結合タンパク質に見出されるものである(C/EBP; Landschulzら、Science 243:1681, 1989)。二つの核形質転換タンパク質fosおよびjunにもロイシンジッパー・ドメインが見られ、マウスがん原遺伝子c-mycの遺伝子産物にも同様に見られる(Landschulzら、Science 240:1759, 1988)。核腫瘍遺伝子fosおよびjunの産物は、ロイシンジッパー・ドメインを含み、選択的にヘテロ二量体を形成する(O'Sheaら、Science 245:646, 1989 ; TurnerおよびTjian, Science 243:1689, 1989)。ロイシンジッパー・ドメインは、これらのタンパク質の生物活性(DNA結合)に不可欠である。
パラミクソウイルス、コロナウイルス、麻疹ウイルスおよび多くのレトロウイルスを含む、いくつかの異なるウイルスの融合誘導タンパク質もロイシンジッパー・ドメインを保有する(BucklandおよびWild, Nature 338: 547, 1989; Britton, Nature 353:394, 1991; DelwartおよびMosialos, AIDS Research and Human Retroviruses 6:703, 1990)。これらのウイルス融合誘導タンパク質のロイシンジッパー・ドメインは、タンパク質の膜貫通領域近傍にある。このことから、ロイシンジッパー・ドメインが融合誘導タンパク質のオリゴマー構造の一因となる可能性が示唆されている。ウイルス融合誘導タンパク質のオリゴマー形成は、融合細孔の形成に関与している(Spruceら、PNAS 88:3523, 1991)。ロイシンジッパー・ドメインは、熱ショック転写因子のオリゴマー形成に関与することも最近になって報告されている(Rabindranら、Science 259:230, 1993)。
従って、ある種の態様として、アドザイム構成成分の二量体化ドメインには、ロイシンジッパー・ドメインのような、コイルドコイル二量体化ドメインが含まれる。ロイシンジッパー・ドメインには、少なくとも4つのロイシン・ヘプタッドが含まれることが好ましい。一つの好ましい態様として、ロイシンジッパー・ドメインは、FosまたはJunのロイシンジッパー・ドメインである。
他に多くのいわゆる「束形成ドメイン」が存在しており、これらは、触媒ドメインと標的ドメインとを結び付ける上述のロイシンジッパー・ドメインの機能と本質的に同じ働きをする。例えば、国際公開公報第99/10510 A2号(参照として本明細書に組み入れられる)には、束形成ドメインを含むタンパク質に、相互とのまたは束形成ドメインを含む他のタンパク質とのタンパク質-タンパク質相互作用を介して多量体(「束」)を形成誘導する任意のドメインを含む束形成ドメインが記述されている。これらの束形成ドメインの例には、lacリプレッサー四量体化ドメイン、p53四量体化ドメイン、ロイシンジッパー・ドメイン、およびこれらから派生したドメインであって、観測可能な束形成活性を持つドメインのようなドメインが含まれる。束形成ドメインを含むタンパク質は、相互と複合体をなして、個々のタンパク質分子の束を形成することができる。そのような束形成は、これが、タンパク質分子を連結する架橋剤(すなわち、それ自体は、なかなか外れない(pertinacious)束形成ドメインを含まない架橋剤)の存在を必要としないという意味で「恒常的」である。
上述のように、束形成ドメインは、タンパク質-タンパク質相互作用を介して、同類のドメインと相互作用し、タンパク質の「束」の形成を誘導する。束形成ドメインを含むタンパク質のさまざなオーダーのオリゴマー(二量体、三量体、四量体など)は、束形成ドメインの選択に応じて、形成させることができる。
一つの態様として、四量体化ドメインを融合タンパク質の中に組み込むことで、四量体のクラスタまたは束の恒常的な会合をもたらす。大腸菌ラクトースリプレッサー四量体化ドメイン(アミノ酸46〜360; Chakerianら、(1991) J. Biol. Chem. 266.1371; Albertiら、(1993) EMBO J. 12:3227; およびLewisら、(1996) Nature 271:1247)は、この部類の説明となる。その他に実例となる四量体化ドメインには、p53の残基322〜355由来のもの(Wangら、(1994) Mol. Cell. Biol. 14:5182; Cloreら、(1994) Science 265:386)が含まれる。Halazonetisの米国特許第5,573,925号も参照されたい。
さらに別の態様として、触媒ドメインと標的ドメインのそれぞれを「リガンド結合ドメイン」に融合させてもよく、これにより、小分子に結合するとすぐに、触媒ドメインと標的ドメインとが結び付けられるものと思われる(「小分子を介したオリゴマー形成」)。
本発明の実践で用いるリガンド結合ドメインを含む融合タンパク質は、さまざまな分子機構のうちの一つを介して機能することができる。
ある種の態様として、リガンド結合ドメインにより、適当なリガンド結合ドメインを持つ融合タンパク質分子がリガンドを介して架橋結合することができる。これらの場合、リガンドは、少なくとも二価であり、二つの融合タンパク質に結合し、そして標的遺伝子の発現を活性化させる、架橋結合したヘテロ二量体複合体を形成することにより、二量体化媒介物として機能する。例えば、国際公開公報第94/18317号、国際公開公報第96/20951号、国際公開公報第96/06097号、国際公開公報第97/31898号および国際公開公報第96/41865号を参照されたい。
架橋結合に基づく二量体化システムの場合、融合タンパク質は、リガンド結合ドメインを一つまたは複数含む(場合によっては、そのようなドメインを二つ、三つ、四つ、またはそれ以上含む)ことができ、そしてさらに、例えば、主題のアドザイムの触媒ドメインまたは標的ドメインを含む、リガンド結合ドメインに対して異種性のさらなるドメインを一つまたは複数含むことができる。
一般に、任意のリガンド/リガンド結合ドメイン対をそのような系で使用することができる。例えば、リガンド結合ドメインに対し、リガンドが知られているかまたは同定できる限り、リガンド結合ドメインは、FKBP、サイクロフィリンのようなイムノフィリン、FRBドメイン、ホルモン受容体タンパク質、抗体などに由来することができる。
ほとんどの場合、受容体ドメインは、その野生型ドメインまたは切断された活性部分と同様、少なくとも約50アミノ酸、および約350アミノ酸未満、通常、200アミノ酸未満であると思われる。その結合ドメインは、小さく(25 kDa未満、ウイルスベクターで効率的な形質導入を可能とするため)、単量性で、非免疫原性であることが好ましいものと思われ、そして前述のように合成で得られ、細胞透過性で、無毒性のリガンドを持つ必要がある。
リガンド結合ドメインは、それ自体は遺伝子産物ではない(すなわち、タンパク質ではない)リガンドに向けられ(すなわち、結合し)、約5 kD未満および好ましくは約2.5 kD未満の分子量を有し、そして任意に細胞透過性であることが好ましい。多くの場合、リガンドは、オリゴマー形成調節因子としてのその用途の妨げになる固有の薬理活性または毒性を有さないことが好ましいものと思われる。
リガンド結合ドメインをコードするDNA配列は、いろいろな理由で突然変異誘発にかけることができる。突然変異誘発されたリガンド結合ドメインは、いっそう高い結合親和性をもたらすことができる、リガンド結合ドメインの変異型と天然型との間でリガンドによる識別を可能とすることができる、リガンド-リガンド結合ドメイン対を設計する機会を得ることができるなど。リガンド結合ドメインの変化のなかには、リガンド結合に関与することまたはリガンド依存的な立体構造変化と関連があることが知られているアミノ酸の直接変化を含めることができる。または、一つには、コンビナトリアル技術を利用したランダム変異導入法を採用することができる。どちらの場合にも、突然変異によるリガンド結合ドメインは、適当な原核生物または真核生物の宿主で発現させて、その後、所望のリガンド結合特性または立体構造特性を目的としてスクリーニングすることができる。FKBP、サイクロフィリンおよびFRBドメインに関する例は、国際公開公報第94/18317号、国際公開公報第96/06097号、国際公開公報第97/31898号および国際公開公報第96/41865号に詳細に開示されている。例えば、一つには、FKBP12でPhe36をAlaにおよび/またはAsp37をGlyもしくはAlaに変化させて、リガンドFK506もしくはFK520またはその類似体、模倣体、二量体もしくは他の誘導体の位置9または10に置換基を適応させることができる。特に、Tyr26、Phe36、Asp37、Tyr82およびPhe99のうちの一つまたは複数の代わりにVal、Ala、Gly、Metまたは他の小さなアミノ酸を含む変異型FKBP12ドメインは、C9および/またはC10に修飾を含むFK506タイプおよびFKタイプのリガンドに対する受容体ドメインとしてならびにその合成対応物として特に興味深い(例えば、国際公開公報第97/31898号を参照されたい)。実例となる現在興味深いFKBPドメインの変異には、下記も含まれる。

表III: 記載事項は、1文字表記による野生型アミノ酸および配列位置、最後に変異体の置換アミノ酸を特定している。従って、F36Vは、位置36のフェニルアラニンがバリンにより置換されているヒトFKBP12配列を表す。F36V/F99Aは、位置36および99のフェニルアラニンがそれぞれ、バリンおよびアラニンに置換されている二重変異を示す。
FKBP:ラパマイシン複合体(「FRB」)に結合するドメインの実例は、ヒトFRAPの残基2025〜2113を含む約89アミノ酸の配列を含むものである。関心のある他のFRAP由来配列には、アミノ酸2024〜2113からなる93アミノ酸の配列が含まれる。同様の考慮は、薬物のFRAP結合部分において、ラパマイシンに対して修飾(すなわち、「バンプ付け」された)を含むラパマイシン類似体(ラパログ)とのFKBP複合体に選択的に結合する変異型FRAP由来ドメインの創生に適用することができる。例えば、一つには、C7位に-OMe以外の置換を持つラパログを用いて、ヒトFRAPのFRBペプチド配列に基づくがしかしながら残基Tyr2038、Phe2039、Thr2098、Gln2099、Trp2101およびAsp2102のうちの一つまたは複数に対するアミノ酸置換を持つFRBとの選択的結合を得ることができる。典型的な変異には、Y2038H、Y2038L、Y2038V、Y2038A、F2039H、F2039L、F2039A、 F2039V、D2102A、T2098A、T2098N、T2098LおよびT2098Sが含まれる。C28位に-OH以外の置換および/またはC30位に=O以外の置換を持つラパログを利用して、Glu2032に対するアミノ酸置換を持つFRAPタンパク質との選択的結合を得ることができる。典型的な変異には、E2032AおよびE2032Sが含まれる。上記の位置に一つまたは複数のアミノ酸置換を含んだFRBを含むタンパク質、それらの位置で無作為化されたタンパク質またはペプチドのライブラリー(すなわち、それらの残基で種々の置換アミノ酸を含む)、タンパク質ドメイン全体を無作為化するライブラリー、またはこれらの変異体セットの組み合わせを、上述の手順を利用して作製し、バンプ付きラパログに選択的に結合する変異型FRAPを同定する。
本発明で有用な他のマクロライド結合ドメイン(その変異体を含む)が、当技術分野において報告されている。例えば、国際公開公報第96/41865号、国際公開公報第96/136131号、国際公開公報第96/061111号、国際公開公報第96/061101号、国際公開公報第96/060971号、国際公開公報第96/127961号、国際公開公報第95/053891号、国際公開公報第95/026842号を参照されたい。
タンパク質をコードする配列のインビロト突然変異誘発またはコンビナトリアル変異を利用できることで、異なるリガンドに対する結合親和性をスクリーニングできるタンパク質ライブラリーの生成が可能となる。例えば、一つには、結合タンパク質をコードするDNA配列の一つまたは複数の部位で、1〜5個、5〜10個、または10個もしくはそれ以上のコドンの配列を無作為化し、発現構築物を作製して、単細胞微生物に発現構築物を導入し、改変された配列からなるライブラリーを開発することができる。その後、一つには、このライブラリーを一つまたは複数のリガンドに対するコードポリペプチドの結合親和性についてスクリーニングすることができる。導入する細胞に適合した最も親和性の高い配列を、その後、所定のリガンドに対するリガンド結合ドメインとして使用することができる。リガンドは、内在性タンパク質とのリガンドの結合のレベルを決定するのに望ましい宿主細胞で評価することができる。結合特性は、改変されたリガンド結合ドメインに対するリガンド結合親和性を内在性タンパク質に対する親和性と比較するようにして、そのような各リガンドに対して決定することができる。最良の結合特性を有するリガンドを、その後、リガンドとして使用することができるものと思われる。非限定的な例として、上記を行う際に、ファージディスプレイ法を利用することができる。
その他の態様として、抗体サブユニット、例えば、重鎖または軽鎖、具体的には断片、より具体的には可変領域の全てもしくは一部分、または一本鎖抗体は、リガンド結合ドメインとして使用することができる。抗体は、薬学的に許容されるハプテンに対して調製することができ、そして個々の抗体サブユニットを結合親和性についてスクリーニングすることができる。抗体サブユニットをコードするcDNAを単離し、定常領域、一部の可変領域の欠失、可変領域の突然変異誘発などにより改変させて、リガンドに対して適当な親和性を有する結合タンパク質ドメインを得ることができる。このように、ほとんどすべての生理学的に許容されるハプテンは、リガンドとして利用することができる。抗体単位の代わりに、特に結合ドメインが周知である場合には、天然受容体を利用することができる。本発明のいくつかの態様で、融合タンパク質は、二つ以上のリガンド結合ドメインを含む。例えば、DNA結合ドメインを2つ、3つもしくは4つまたはそれ以上のリガンド結合ドメインに連結することができる。複数のリガンド結合ドメインが存在することは、リガンドを介した架橋結合により、DNA結合ドメインを含む融合タンパク質に転写活性化ドメインを含む複数の融合タンパク質が補充可能とされることを意味する。
架橋結合/二量体化システム
結合タンパク質ドメインまたはリガンド結合ドメインが知られているかまたはそのドメインを同定できるどのようなリガンドも、本発明を実践するうえで、そのようなリガンド結合ドメインと組み合わせて使用することができる。
架橋結合オリゴマー形成に基づいたシステムに有用なリガンドまたは他の成分に関して、広範な指針および例が国際公開公報第94/18317号に示されている。FKBP、サイクロフィリンのようなイムノフィリン、および/またはFRBドメインに対するリガンドに基づいたシステムが特に興味深い。架橋結合に利用できるリガンド結合ドメイン/リガンド対の実例には、以下に限定されることはないが、FKBP/FK1012、FKBP/合成二価FKBPリガンド(国際公開公報第96/06097号および国際公開公報第97/31898号を参照されたい)、FRB/ラパマイシンまたはその類似体: FKBP(例えば、国際公開公報第93/33052号、国際公開公報第96/41865号およびRiveraら、「A humanized system for pharmacologic control of gene expression」、Nature Medicine 2(9):1028〜1032 (1997)を参照されたい)、サイクロフィリン/サイクロスポリン(例えば、国際公開公報第94/18317号を参照されたい)、FKBP/FKCsA/サイクロフィリン(例えば、Belshawら、1996, PNAS 93:4604〜4607を参照されたい)、DHFR/メトトレキサート(例えば、Licitraら、1996, Proc. Natl. Acad. Sci. USA 93:12817〜12821を参照されたい)、およびDNAジャイレース/クメルミシン(例えば、Farrarら、1996, Nature 383:178〜181を参照されたい)が含まれる。本発明に適合できる、リガンドおよびリガンド結合ドメインに対する多数の変異および改変、ならびにそれらを設計する、選択するおよび/または特徴付けるための方法論は、引用の参考文献に開示されている。
さらに、ARIAD Pharmaceutical社のARGENT(商標)ホモ二量体化キットおよびARGENT(商標)ヘテロ二量体化キットに記述されているもののような、小分子二量体化剤をこのために使用することができる。ARGENT(商標) 調節ホモ二量体化キットには、小分子「二量体化剤」を添加することにより、遺伝子工学的に改変された融合タンパク質二分子を結び付けるための試薬が含まれている。キットを使用して、通常は互いと相互作用しない任意の二つのタンパク質を結び付けることができる。
二つの部類の二量体化剤がある。ホモ二量体化剤には、二つの同一の結合モチーフが組み込まれており、従って、これを使用して、同じ二量体化剤結合モチーフを含む二つのタンパク質の会合を誘導することができる。ヘテロ二量体化剤には、二つのタンパク質のそれぞれに一方がある、二つの異なる結合モチーフが組み込まれており、従って、これを使用して、これらの二量体化剤結合モチーフを含む二つのタンパク質の会合を誘導することができる。ARGENT(商標)キットにより同様に、ホモ二量体化剤またはヘテロ二量体化剤、および適当な融合タンパク質を作製するためのDNAベクターが提供される。
ARGENTキットの試薬は、ヒトタンパク質FKBP12(FK506結合タンパク質を表す、FKBP)およびその小分子リガンドに基づいている。FKBPは、天然物由来の免疫抑制剤FK506およびラパマイシンの初期の細胞内標的となる豊富な細胞質タンパク質である。SchreiberおよびCrabtree研究所が開発した初代のホモ二量体化剤システムの場合(Science 262: 1019〜24, 1993)、二量体化剤は、免疫抑制活性が除かれるような形で、二分子のFK506を化学的に連結させることにより作製された。FK1012と呼ばれる、得られた分子は、野生型FKBPドメインを含む融合タンパク質を架橋結合することができた。
第二世代のFKBPホモ二量体化剤AP1510がその後に開発された(Amaraら、Proc Natl Acad Sci USA 94: 10618〜23, 1997)。AP1510は、完全に合成されることに加えて、FK1012よりも小さくかつ単純であることや多くの用途でいっそう強力であるという利点を有する。他の改良型も開発されている(Clacksonら、Proc Natl Acad Sci USA 95: 10437〜42, 1998; AP1903, AP20187)。AP20187に基づくシステムは、より低い濃度で機能するという利点を有しており、そしてAP20187はAP1510よりも良好な薬物動態特性を有するため、これをインビボで使用することが可能となる。他の類似システムを同様に使用して、二つの高分子を結び付けることができる。例えば、Linら(J. Am. Chem. Soc., 122, 4247〜4248, 2000; Chem. & Eng. News, 78, 52, 2000にも特集されている)は、インビボでのタンパク質二量体化の効果的な化学誘発剤として、デキサメタゾン-メトトレキサートを使用している。
iv. 一般的な方法論
丸ごとの動物内部での(またはその内部で用いるための)細胞の遺伝子組換えに関する本発明の適用において、その種に由来するペプチド配列の使用が、できれば好ましい。例えば、ヒトの治療に関する適用の場合、ヒトタンパク質由来の触媒ドメインまたは標的化ドメインを使用することで、免疫原性反応の危険性を最小限にすることができる。例えば、標的化部分として使用する一本鎖抗体は、ヒト化またはヒト由来一本鎖抗体であることが好ましい。同様に、Fc部分またはオリゴマー形成ドメインのような、アドザイムの他の部分は、アドザイムを使用する種に適合させることができる。
E. アドザイムの種々の特性
(i) 血清半減期
本発明のある種の態様として、主題のアドザイムは、血清半減期の向上または減少を示すように設計するかまたは改変することができる。血清半減期の向上は、治療効果を達成するために必要とされる投薬頻度を減らすのに望ましい可能性がある。例えば、アドザイムとある種の細胞外シグナル伝達分子のような、豊富にない(例えば、フェムト-またはピコ-モルの)基質との間の反応速度は、数日から数週間の時間的尺度で起こり得る; 従って、アドザイムが数日または数週間体内にとどまることを可能とする血清半減期は、望ましいものと思われ、そして必要とされる投薬頻度を減らすものと思われる。従って、ある種の態様として、アドザイムの血清半減期は、少なくとも1日、および好ましくは2、3、5、10、20または50日またはそれ以上である。血清半減期の減少は、例えば、基質の素早い変化により、一般に所望の治療効果が達成され、持続性のアドザイム活性による付加利益が少ないような、緊急の状況において望ましい可能性がある。実際に、非常に高濃度の、短い半減期のアドザイムを輸送することが可能であり、その結果、高い水準の治療効果が速やかに達成されるが、しかしアドザイムは、高用量と関連し得る副作用を減らすように体内から即座に除去される。緊急の状況の例には、種々の毒素による中毒(この場合、アドザイムにより、毒素が中和されるかまたは別の方法で除去される)、ならびに敗血症または他の激しい発熱(この場合、IL-1もしくはTNF-αのような内因性発熱物質、または細菌リポポリサッカライドのような外因性発熱物質の除去により、治療目的が達成され得る)が含まれる。
血清半減期は、分解、不活性化型への修飾および腎臓によるクリアランス(排除)を含む、さまざまな要因により決定され得る。例えば、ポリペプチドのN末端またはC末端残基に作用するペプチダーゼに対する抵抗性を与える効果的な手法は、ポリペプチド末端に化学基を付加することであり、その結果、修飾されたポリペプチドは、もはやペプチダーゼに対する基質ではなくなる。一つのそのような化学修飾は、片端または両端でのポリペプチドのグリコシル化である。ある種の化学修飾、特にポリエチレングリコール(「ペグ化」)およびN末端グリコシル化は、ヒト血清中でのポリペプチドの半減期を増加させることが明らかにされている(Molineux (2003), Pharmacotherapy 8 Pt 2:3S〜8S. Powellら(1993), Pharma. Res. 10: 1268〜1273)。血清での安定性を促進させる他の化学修飾には、以下に限定されることはないが、炭素1〜20個の低アルキル基からなるN末端アルキル基、例えば、アセチル基の付加、および/またはC末端アミドもしくは置換型アミド基の付加が含まれる。
ある種の態様として、アドザイムの流体力学的体積を増加させため、アドザイムを修飾することができ、それによって、特に、腎臓からの排泄を低下させることができる。例えば、ポリエチレングリコールのような、不活性ポリマーによる修飾は、腎臓を介した排泄を減少させる傾向がある。ポリマーは、任意の効果的な分子量のものとしてよく、そして分枝していても分枝していなくてもよい。ポリエチレングリコールの場合、好ましい分子量は、取り扱いおよび製造を容易とするため、約1 kDa〜約100 kDaである(「約」という用語は、ポリエチレングリコール調製物の中に、記述の分子量よりも重い分子もあれば、軽い分子もあると考えられることを示している)。所望の治療プロファイル(例えば、所望とされる持続放出の期間、もしあれば生物活性に対する効果、取り扱いの容易さ、抗原性の程度または欠如および治療用タンパク質または類似体へのポリエチレングリコールの他の周知の作用)に応じて、他のサイズを使用することができる。例えば、ポリエチレングリコールは、約200、1000、5000、15,000、30,000 、50,000、もしくは100,000 kDaまたはそれ以上の平均分子量を有することができる。ポリエチレングリコールは、分枝構造を有していてもよい。分枝ポリエチレングリコールは、例えば、米国特許第5,643,575号; Morpurgoら、Appl. Biochem. Biotechnol. 56: 59〜72 (1996); Vorobjevら、Nucleosides Nucleotides 18: 2745〜2750 (1999); およびCalicetiら、Bioconjug. Chem. 10:638〜646 (1999)に記述されている。ポリエチレングリコール分子(または他の化学成分)は、触媒または標的化部分に対する影響を考慮しながらアドザイムに結合させることができる。当業者が利用できる数多くの結合法がある、例えば、欧州特許第0401384号(参照として本明細書に組み入れられる)(G-CSFへのPEGの結合)。同様に、Malikら、Exp. Hematol. 20:1028〜1035 (1992)(トレシルクロライドを用いたGM-CSFのペグ化を報告している)を参照されたい。例えば、ポリエチレングリコールは、反応基、例えば、遊離型アミノまたはカルボキシル基により、アミノ酸残基を介して共有結合的に結合させることができる。反応基は、活性化ポリエチレングリコール分子を結合させることができるものである。遊離型アミノ基を有するアミノ酸残基には、リジン残基およびN末端アミノ酸残基を含めることができる; 遊離型カルボキシル基を有するアミノ酸残基には、アルパラギン酸残基、グルタミン酸残基およびC末端アミノ酸残基を含めることができる。ポリエチレングリコール分子を結合させるための反応基として、スルフヒドリル基を使用することもできる。治療目的に好ましいのは、アミノ基での結合、例えば、N末端またはリジン基での結合である。
アドザイムは、腎臓からの排泄を低下させため、約50キロダルトンまたはそれ以上の分子量を有するように設計することができる。
N末端のD-アミノ酸の存在により同様に、それ以外にはL-アミノ酸を含むポリペプチドの血清での安定性が増す。N末端残基に作用するエキソペプチダーゼは、D-アミノ酸を基質として利用できないためである。同様に、C末端のD-アミノ酸の存在によっても、ポリペプチドが安定化される。C末端残基に作用する血清エキソペプチダーゼは、D-アミノ酸を基質として利用できないためである。これらの末端修飾を除いて、N末端のおよび/またはC末端のD-アミノ酸を有するポリペプチドのアミノ酸配列は、通常、もとのL-アミノ酸ポリペプチドの配列と同一である。
ポリペプチドの配列中の天然アミノ酸を非天然アミノ酸に置換することにより、生物活性を含む所望の特性を与えるかまたは増強させることができる。そのような置換により、例えば、N末端に作用するエキソペプチダーゼによるタンパク質分解に対する抵抗性を与えることができる。非天然アミノ酸を有するポリペプチドの合成は、日常業務であり且つ当技術分野において周知である(例えば、上記に引用のCollerら、(1993)を参照されたい)。
別の態様として、アドザイム・ペプチドを特定のポリペプチドに融合させて、血清での安定性または半減期の向上/増加を達成する。例えば、国際公開公報第97/34631 A1号には、免疫グロブリン様ドメインおよびその一部分、例えば、抗体Fc-蝶番断片、細断片および生物学的半減期が長くなった変異ドメインをコードする組換えベクターが記述されている。そのようなベクターを使用し、宿主細胞による発現を通じて、そのようなドメインを有する大量の融合体を産生させることができる。これらの抗体FcおよびFc-蝶番ドメインは、完全な抗体と同じインビボ安定性を有する。その出願書類には、インビボ半減期が増加するように遺伝子工学的に改変されたドメインも開示されている。これらのDNA構築物およびタンパク質ドメインは、例えば、治療および診断用途のために安定性および寿命が増加した組換えアドザイム(またはアドザイム成分)を産生させるため、本発明で用いるのに適合させることができる。
具体的には、国際公開公報第97/34631 A1号には、免疫グロブリン様ドメインおよびその一部分、例えば、抗体Fc断片および細断片ならびにインビボ半減期が長くなったFc-蝶番ドメインをコードする組換えベクターが記述されている。本発明を種々の免疫グロブリン様ドメインの産生により例示する場合、抗体Fc-蝶番、Fc、CH2-蝶番およびCH3ドメイン; ならびに、例えば、LSFと呼ばれる変異体のような、インビボ半減期が長くなった人工Fc-蝶番ドメインが含まれる。さらに、他の免疫グロブリン様ドメインは、その中に記述される方法を利用して発現させることができる。
以前の研究から、CH2ドメインが抗体の異化の制御に重要な役割を果たし得ることや、CH3ドメイン中の配列が関与し得ることが示唆されている(Ellersonら、1976, Muellerら、1990; Pollockら、1990; Kimら、1994a: Medesanら、1997)。CH2ドメインの糖残基の存在は、重要ではあってもわずかな(minor if significant)影響を及ぼすように思われ、そして影響の度合いは、アイソタイプに依存する(TaoおよびMorrison, 1989)。
マウスIgG1およびヒト定常領域由来の組換えCH2-蝶番、CH3、FcおよびFc-蝶番断片を宿主細胞から発現させた。CH3ドメイン、Fc断片およびFc-蝶番断片は全て、ホモ二量体タンパク質になることが見出された。FcおよびCH3ドメインの場合、二量体は、非共有結合的に会合されており、おそらく非共有的な相互作用により安定化されている。Fc-蝶番二量体の場合、断片は、蝶番部のシステイン間の-S-S-架橋により共有結合的に結合されている。これらのドメインを使用して、アドザイムの標的および触媒ドメインを二量体化することもできる。
宿主細胞で発現後に精製された、免疫グロブリンFc-蝶番およびFc断片は、天然の抗体分子と同じインビボ安定性を有する。以前の研究の結果から、組換えアグリコシル化(aglycosylated)Fc-蝶番またはFc断片は、完全なグリコシル化IgG1分子と同じインビボ安定性を有することが実証された。組換えアグリコシル化Fc-蝶番断片は、完全なグリコシル化IgG1免疫グロブリン分子のものと同様の0相(0 phase)を有することが見出された。実際に、Fc-蝶番の除去により、半減期のわずかな減少が引き起こされた(Kimら、1995)。これらの結果から、マウスIgG1アイソタイプの場合、糖残基の存在は、インビボ安定性に必要であるようには思われないが、それでもなおわずかな役割を果たし得ることが示唆される。タンパク質化学を利用して得られた以前のデータから、CH2ドメインがインビボ安定性に関与することが示唆された(Ellersonら、1976)が、最近の研究では、CH3ドメイン中の残基も同様にマウスIgG2aおよびIgG2bアイソタイプの異化制御に関与し得ることが示された(Pollockら、1990)。
(ii) 投薬頻度
多くの場合、アドザイムは、注射もしくは患者にいくらか不快感を起こし得る別の投与経路により投与することができる、またはアドザイムは、安全な投与のため内科医もしくは他の医療専門家の補助を必要とするかもしれない。そういった場合には、1日に1回またはそれより少ない投薬頻度で治療的に有効なアドザイムを設計することが望ましいかもしれない、および好ましくは、アドザイムは、1週間に1回、2週間に1回、4週間に1回、8週間に1回またはそれより少ない頻度で投与された場合に有効である。
アドザイムに対する有効な投薬頻度の範囲は、アドザイムのさまざまな特性に依存することができる。例えば、血清半減期が短いアドザイムほど、それだけ短期間有効である傾向となり、その結果、いっそう頻繁な投薬スケジュールになる。血清半減期を長くまたは減少できる種々のアドザイムの特性が、上に述べられている。
体内の薬物貯蔵所は、アドザイムが効果的である時間を伸ばすことができる。投薬直後に、多くの薬物は、脂肪貯蔵所または種々の細胞透過液のような体内区画に蓄積し、その後、そこから薬物は長い時間をかけてゆっくり放出される。同様に、薬物は、アルブミンまたはα1-糖タンパク質のような血清タンパク質により強固に結合され、および従って、不活性な、保護結合型として血清中に保持されることができ、そこから薬物は、長い時間をかけてゆっくり放出されることができる。従って、アドザイムは、長期間のアドザイム有効性を供与する貯蔵所の形成を促進するように設計することができる。そのような態様の場合、アドザイムは、初回高用量(「負荷量」)で投与し、その後、副次的に小用量(「維持量」)で投与することができる。
アドザイムは同様に、長期間の効果を有するように製剤化し且つ投与することができる。例えば、アドザイムは、長い時間をかけてアドザイムをゆっくり放出する「持続性薬剤」を患者内に形成するように製剤化し且つ投与することができる。持続性薬剤形は、アドザイムが、生分解性高分子(例えば、ポリ乳酸、アルギン酸塩)でできた微粒子の中にカプセル封入され、そしてその微粒子からゆっくり放出されるものとすることができる。他の持続性薬剤の材料には、ゼルフォームスポンジおよびProLease(登録商標)システム(Alkermes社、Cambridge, MA)が含まれる。
(iii) 選択性
多くの場合、アドザイムは、特定の環境への輸送を目的として設計されるものと思われる。例えば、ヒトに用いる多くのアドザイムは、血流への輸送および/または血流中での活性を目的として設計されるものと思われる。本明細書では、アドザイムは、産業または環境の場面に用いるような、他の状況に用いるために設計することができる。一般に、標的に対するアドザイムの有効性を阻害する非標的分子との相互作用を減少させるようにアドザイムを設計することが望ましいものと思われる、または、言い換えれば、アドザイムが使用される環境にある予想レベルの他の成分の存在下で標的に対して活性であるアドザイムを設計することが望ましいものと思われる。
ある種の態様として、アドザイムは、例えば、多くの細胞外シグナル伝達分子のような、血液中にある基質に対して有効であるように設計される。そのようなアドザイムは、標的に影響を及ぼすアドザイムの能力を阻害すると思われる他の血液成分との相互作用を最少化するように設計することができる。アドザイムは、理論的解釈に基づいてもしくは実証的研究に基づいて、またはその双方に基づいてそのように設計することができる。ある種の態様として、アドザイムは、一つまたは複数の比較的豊富な血液成分の存在下で、標的に対する有効性を保持する。アドザイムは、一つまたは複数の血液成分、および特に豊富な血液成分の存在下で、標的に対する活性を試験することができる。例えば、アドザイムは、血清アルブミン(例えば、ヒト血清アルブミンまたは他の生物特異的なアルブミン)、トランスサイレチン(「レチノール結合タンパク質」)、α-1グロブリン(例えば、a-1プロテアーゼインヒビター[α-1アンチトリプシン]、α-1糖タンパク質、高密度リポタンパク質[HDL])、α-2グロブリン(α-2マクログロブリン、アンチトロンビンIII、セルロプラスミン、ハプトグロビン)、β-グロブリン(例えば、βおよびプレβリポタンパク質[LDLおよびVLDL]、C3、C反応性タンパク質、遊離ヘモグロビン、プラスミノーゲンおよびトランスフェリン)、γ-グロブリン(主に免疫グロブリン)のような、一つまたは複数の豊富な血清タンパク質の存在下で、標的に対する活性を試験することができる。ある種の態様として、本発明のアドザイムは、予想される(すなわち、患者の生理的状態に依存して、生理的に)濃度の一つまたは複数の血液成分、例えば、一つまたは複数の豊富な血清タンパク質の存在下で標的に対して活性である。任意で、アドザイムは、予想される濃度の豊富な血清タンパク質の存在下で標的に対して活性である、および任意で、アドザイムは、予想される濃度の豊富な血清タンパク質よりも4分の1、2分の1、2、5もしくは10倍またはそれ以上多い濃度の豊富な血清タンパク質により著しく影響を受けない。好ましい態様として、アドザイムは、血液中に見出されると予想される標的ポリペプチドと相互作用する触媒ドメインを含む、および任意で、触媒ドメインはプロテアーゼ活性を有する。他の豊富な血液成分には、種々の細胞型のいずれか、およびその表面に見出される分子が含まれる。一般的な血液細胞型には、赤血球、血小板、好中球、リンパ球、好塩基球、好酸球および単球が含まれる。
(vi) 自己触媒反応に対する抵抗性
ある種の態様として、アドザイムの触媒ドメインは、アドザイムそのものとの反応を触媒することができ、その結果、アドザイムの変化をもたらすことができる。「自己触媒反応」と呼ばれる、このタイプの反応は、触媒ドメインとその同一アドザイムのどこか他の部分(例えば、リンカー、標的化部分または他の部分)との間、または第一のアドザイムの触媒ドメインと第二のアドザイムの部分(例えば、触媒ドメイン、リンカー、標的化部分)との間(の反応)とすることができる。前者は、後者に比べて、アドザイムが患者または他の場面に投入された後に起こると予想されるような、非常に低いアドザイム濃度で、有効になる傾向があるものと思われる。アドザイム相互間型の自己触媒反応は、アドザイムの調製(例えば、細胞培養物からの精製およびその後の濃縮)、保存の間および被検体への投与用に調製された任意の混合物(静脈内投与用に生理食塩水と混合したアドザイムの1回分)中のような、より高濃度で起こる可能性が最も高い。
ほとんどのタイプの触媒ドメインに対し、自己触媒反応は、これが仮に起こるとしても、比較的重要ではない現象であると思われる。例えば、グリコシル化、異性化またはリン酸化を媒介する触媒ドメインは、たとえそのドメインが実際に自己触媒反応を受けたとしても、アドザイムの活性に影響を及ぼさないかもしれない。しかしながら、ある状況においては、アドザイムの修飾、とりわけアドレス成分の結合部分にまたは触媒ドメインの活性部分に起こる修飾は、アドザイムがその標的に効果的に作用する能力に支障を来す可能性がある。多くのタイプの触媒ドメインは、あるタイプの補因子(例えば、キナーゼの場合にはATP、糖転移酵素の場合には糖質)を必要とし、従って、自己触媒反応は、そのような補因子がない場合には起こらないものと思われる。このような状況では、アドザイム調製物に存在する補因子がほとんどないまたはないことを確実にすることで調製または保存の間、自己触媒反応を回避することができる。
プロテアーゼ活性を有するかまたは他の方法でアドザイムを分解できる触媒ドメインが特に懸念される。プロテアーゼは、多くの場合、いかなる補因子も必要とせず、従って、自己タンパク質分解活性がアドザイムの産生または使用の任意の段階で生じ得る。自己タンパク質分解を阻止するため、さまざまな手法をとることができる。
一つの態様として、標的が存在しない場合には、プロテアーゼが低いレベルで活性であるように、アドザイムを設計することができる、またはプロテアーゼドメインを選択することができる。例えば、本明細書に記載の随伴型アドザイムの説明を参照されたい。
ある種の態様として、プロテアーゼに対する脆弱部位は、任意のポリペプチド・アドレスドメイン、触媒ドメインまたはリンカーのような、アドザイムのさまざまな部分から遺伝子工学的に取り除くことができる。これは、選択した成分の配列を改変することにより、または所望のプロテアーゼドメインによる切断に抵抗性を示す成分を初めから選択することにより達成することができる。トリプシンは、内部トリプシン脆弱部位を有しており、不活性化に向けたトリプシン作用の影響を受けやすいが、しかしながらトリプシンに抵抗性のトリプシン変異体を作製することができる。多くの場合、理論上のプロテアーゼ感受性部位は、さまざまなドメインに存在しているが、しかし、実際には、おそらく折り畳みまたは他の立体障害により実行可能なプロテアーゼ基質ではない。例えば、本出願人らは、p55(TNFR)-トロンビン融合タンパク質のアドザイムが、p55(TNFR)ポリペプチド内のトロンビン切断部位の存在にもかかわらず、自己触媒性のタンパク質分解を受けないことを見出した。そのような折り畳みは、一価のまたは二価の陽イオン(例えば、カリウム、カルシウム、亜鉛、鉄)または陰イオン(例えば、リン酸、塩素、ヨウ素)のような作用物質、ならびに非イオン性の、両性イオン性のおよびイオン性の界面活性剤の有無により調整することができる。
ある種の態様として、一本鎖抗体のようなアドレスドメインまたは他の足場に基づくアドレスドメインは、インビトロRNA選択により到達することができる。インビトロ選択により、プロテアーゼに感受性が低いアドレスドメインの選択およびそれにより酵素ドメインが切断できないアドレスドメインの構築が可能とされる。同様の手法を、アドザイムに組み込まれるリンカー、免疫グロブリン部分または他のポリペプチドに利用することができる。
自己タンパク質分解を抑える別の手段は、触媒ドメインを酵素前駆体として産生させて、使用直前(例えば、患者への送達)にアドザイムを活性化することである。酵素前駆体または前駆体タンパク質部分を、使用時に切断される(例えば、既知の血清活性プロテアーゼにより)ように設計することもできる。ある種の酵素前駆体の切断が、プロテアーゼドメインからN末端方向で起こるということは、活性化後、プロテアーゼドメインが、切断部位に対してN末端にあるポリペプチド部分から分離されることを意味する。プロテアーゼドメインからN末端方向で起こる酵素前駆体の切断は、活性化後、プロテアーゼドメインが、切断部位に対してN末端にあるポリペプチド部分から分離されることを意味する。ある種の酵素前駆体の切断が、プロテアーゼドメインからC末端方向で起こるということは、活性化後、プロテアーゼドメインが、切断部位に対してC末端にあるポリペプチド部分から分離されることを意味する。従って、酵素前駆体を含む融合タンパク質は、プロテアーゼドメインが、活性化と同時に融合タンパク質の他の関連部分から分離されないように(もしそれが意図されないならば)設計されるべきである。
さらなる態様として、可逆的な競合阻害剤を利用することができる。そのような阻害剤は、容易に除去できるように選択されることが好ましい。医薬品に用いる阻害剤は、保存または投与前の高濃度では効果的な阻害を可能とするが、しかしながら希釈後すぐに作用部位で(例えば、患者体内で)プロテアーゼを放出するKiを有するように選択することができる。阻害剤は、無毒性であるかそうでなければ臨床的に承認されるように選択されることが好ましい。阻害剤はアドザイムの産生および精製の間に使用することもできる。多くのプロテアーゼは、金属の補因子を必要とするので、そのようなプロテアーゼは、多くの場合、EDTA、EGTA、BHT、またはポリアニオン(例えば、ポリリン酸塩)のようなキレート剤を用いた製剤により可逆的に阻害することができる。
さらなる態様として、プロテアーゼに対する脆弱部位は、翻訳後修飾することができる。プロテアーゼに対する脆弱部位は、リン酸化もしくはメチル化もしくはグリコシル化によりまたはプロテアーゼドメインが結合できないように化学的に修飾することができる。
単なる実例として、競合阻害剤のベンザミジンを使用して、トリプシノーゲン-p55抗-TNFのアドザイムにおいてトリプシンの作用を遮断した。ベンザミジンにより、トリプシノーゲン・アドザイムの一過性の遺伝子導入発現においてアドザイムの収量が増加した。ベンザミジン、ボロン酸または他のプロテアーゼ阻害剤をアドザイムの製造に役立てることができる。MMP7の触媒ドメインに関して、チオルファン、イロマスタット、FN 439、ガラルジンまたはマリマスタットのような阻害剤を使用することができる。
F. アドザイム設計のための典型的方法
アドザイムの重要な利点は、生体分子エンジニアが、薬物設計に付いて回る複数の技術的難問のいくつかを同時にではなく連続的に解決することを可能にする技術的手法および設計手法の余地があるということである。薬物は、高い効力で標的を結合するだけでなく、薬理作用の一つまたは組み合わせを有する必要がある。所定の薬物の発見/設計を実行する場合、候補分子は、以下の特性のさまざまな組み合わせを示す必要がある: 血液中での適度な溶解性、意図しない標的を有意に阻害しないこと(特異性が高いほど良い)、標的位置で有効濃度を達成すること、皮膚、腸、細胞膜、または血液脳関門のような生物学的障壁を通過すること、有毒代謝物を有していないこと、必要な生物学的利用能の達成を可能とする速度で、腎臓または肝臓障害なしに排泄されること、一般に処方されている薬剤を妨害しないこと、アルブミンもしくは他の生体分子との複合体形成または組織区画での隔離を回避すること、および合成的に扱いやすいこと。これらの特性のうち全ての必要な組み合わせを同時に示す単一の分子的実体(化合物)を発見するまたは設計することは非常に困難である。
その一方、アドザイムを含む個々の分子成分、例えば、アドレスおよび触媒ドメインを、それぞれ関心のある標的に結合するまたはその標的を改変する能力について個別にスクリーニングすることができる。これらの部分に対する構造の候補は、新たな生体分子に関してますます増加する公の知識ならびにその分子生物学および薬理学に関する理解を深めることにより支えられる技術的努力から得ることができる。既存の活性酵素を突然変異させて、新たな特異性を付与するようなアドレスをその酵素に与えることができる。Nixonらは、Proc. Natl. Acad. Sci. USA, Biochemistry 第94巻、1069頁、1997のなかで、他の酵素の異なる機能部分から活性酵素を構築する手法を検証している。各機能についてふさわしい候補をさまざまなタイプの連結方法により、ともに連結させることができる。例えば、それらの候補は、伸縮的もしくは構造的アミノ酸配列または他の共有結合を介して結合された、ループの中に挿入することができる。候補構築物は、各ドメインの結合または触媒部分とは別に隔置されたアミノ酸配列または他の構造を、非共有結合的に複合体化する、または両ドメインと複合体化する候補シャペロンタンパク質を介して複合体化するその能力について選択することにより作製される。多くの実験構築物は、同時並行で作製されると考えられる、および構築物のライブラリーを所望の活性についてスクリーニングし、活性種を突然変異誘発により進化させるかまたは別の方法で変化させて、特性を向上させる隣接化学空間を模索できると考えられる。
アドレスドメインは、インビボおよびインビトロアッセイにより選択することができる。アドレスは、直接的結合に対するアッセイまたは標的分子の活性を測定するアッセイを利用して、関心のある標的に結合する能力について試験することができる。標的分子とのアドレスの結合を測定するために利用できる方法には、生物物理学的技術および生化学的技術が含まれる。例えば、生物物理学的方法には、内部蛍光に依るまたは外部標識の添加に依る蛍光技術、例えば、蛍光エネルギー移動、蛍光異方性、結合による標的分子またはアドレスドメインの内部蛍光の変化が含まれる(Lakowitz, J. R. (1983) Principles of Fluorescence Spectroscopy, Plenum Press, New Yorkを参照されたい)。表面プラズモン共鳴(Sjolander, S.およびUrbaniczky, C. (1991) Anal. Chem. 63:2338〜2345ならびにSzaboら (1995) Curr. Opin. Struct. Biol. 5:699〜705)を利用して、反応体のいずれかを標識することなく、実時間で生物特異的相互作用を研究することができる(例えば、BIAcore)。表面プラズモン共鳴の光学現象の変化は、生体分子間の実時間反応の指標として利用することができる。
標的分子に結合するアドレスドメインの能力を試験するために利用できる生化学的技術には、免疫沈降およびアフィニティークロマトグラフィーのような技術が含まれる。
さらに、両分子のうちの一方を放射性同位体、例えば、125I、35S、14C、もしくは3Hまたは他の検出可能な標識、例えば、酵素により標識することができ、そして二つの分子の間の相互作用を、一方の分子を特異的に単離し且つその第一の分子と結合した第二の分子の量を測定することにより測定することができる。放射性同位体の場合には、単離される放射性標識タンパク質の量は、放出放射線のカウンティングによりまたはシンチレーションカウンティングにより測定することができる。または、化合物を、例えば、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ、またはルシフェラーゼで標識することができ、そして酵素標識を、産物への適当な基質の変換を決定することにより検出することができる。
アドレスドメイン(例えば、標的特異ペプチド、標的特異一本鎖抗体)は、文献の既知例から、好ましくはヒトタンパク質の例から選び出すことができる。または、アドレスドメインは、ファージディスプレイ法、酵母ディスプレイ法、リボソームディスプレイ法、および細菌ディスプレイ法を含むがこれらに限定されることはない、数多くの組換えディスプレイ法のいずれかにより同定することができる。アドレスドメインのライブラリー、例えば、ペプチドまたは抗体ライブラリーを調製するおよびスクリーニングするための方法は、当技術分野においてよく知られており、そして米国特許第6,156,511号; 米国特許第5,733,731号; 米国特許第5,580, 717号; 米国特許第5,498, 530号; 米国特許第5,922,545号; 米国特許第5,830,721号; 米国特許第5,811, 238号; 米国特許第5,605, 793号; 米国特許第5,571, 698号; 米国特許第5,223, 409号; 米国特許第5,198, 346号; 米国特許第5,096, 815号; 米国特許第5,403, 484号; 米国特許第6,180, 336号; 米国特許第5,994, 519号; 米国特許第6,172, 197号; 米国特許第6,140, 471号; 米国特許第5,969, 108号; 米国特許第5,872, 215号; 米国特許第5,871, 907号; 米国特許第5,858, 657号; 米国特許第5,837, 242号; 米国特許第5,733, 743号; 米国特許第5,962, 255号; 米国特許第5,565, 332号; および米国特許第5,514,548号(これらのそれぞれの内容が、参照として本明細書に組み入れられる)に記述されるものを含む。ライブラリーを機能的に選別するかまたはスクリーニングして、所望の特性(例えば、標的に対する親和性、シグナル対ノイズ比など)を示す特異的なアドレスドメインを同定することができる。組換えディスプレイ法を利用して、アドレスドメインの候補を同定することもできる。有用な組換えディスプレイ法には、以下に限定されることはないが、ファージディスプレイ法(Hoogenboomら、Immunol Today 2000 Aug;21(8): 371〜8を参照されたい)、一本鎖抗体ディスプレイ法(Daughertyら、(1999) Protein Eng 12 (7): 613〜21; Makeyevら、FEBS Lett 1999 Feb 12; 444 (2-3): 177〜80を参照されたい)、レトロウイルスディスプレイ法(Kaymanら、J Virol 1999 Mar; 73 (3): 1802〜8を参照されたい)、細菌表面ディスプレイ法(Earhart, Methods Enzymol 2000; 326: 506〜16を参照されたい)、酵母表面ディスプレイ法(Shustaら、Curr Opin Biotechnol 1999 Apr; 10 (2):117〜22を参照されたい)、リボソームディスプレイ法(Schaffitzelら、J Immunol Methods 1999 Dec 10; 231 (1-2): 119〜35を参照されたい)、ツーハイブリッド系(例えば、米国特許第5,580,736号および米国特許第5,955,280号を参照されたい)、スリーハイブリッド系、およびその派生法が含まれる。組換えディスプレイ法により、標的、例えば、タンパク質を結合できるアドレスドメインが同定される(例えば、Bacaら、Proc Natl Acad Sci USA 1997 Sep 16;94(19):10063〜8; Katz, Biomol Eng 1999 Dec 31;16(1-4):57〜65; Hanら、J Biol Chem 2000 May 19;275(20):14979〜84; Whaleyら、Nature 2000 Jun 8;405(6787):665〜8; Fuhら、J Biol Chem 2000 Jul 14;275(28):21486〜91; Joungら、Proc Natl Acad Sci USA 2000 Jun 20;97(13):7382〜7; Giannattasioら、Antimicrob Agents Chemother 2000 Ju1;44(7):1961〜3を参照されたい)。
触媒ドメインは、その活性に基づいてスクリーニングすることができる。試験される各分子の特異活性に応じて、その分子に適したアッセイを利用することができる。例えば、触媒ドメインがプロテアーゼである場合、プロテアーゼをスクリーニングするのに利用されるアッセイは、プロテアーゼが生成する切断産物を検出するアッセイ、例えば、クロマトグラフィーまたはゲル電気泳動に基づくアッセイとすることができる。別の例として、標的基質を標識することができ、そしてその標識産物が切断されると、例えば、切断による標的基質の蛍光の変化により検出可能な産物が産生されることができる。
別の例として、触媒ドメインは、キナーゼとすることができる。これらの触媒ドメインをスクリーニングするのに利用されるアッセイでは、関心のある標的の中に共有結合的に組み込まれるリン酸の量を測定することができる。例えば、関心のある標的の中に組み込まれるリン酸は、シンチレーションカウンタを用いて、放射線の放出を測定することにより定量化できるリン酸の放射性同位体とすることができる。
注目すべきは、分子としてのアドレスドメイン、標的、基質、阻害剤、および酵素的に活性な部位の間の相互作用の薬力学(結合および力学的特性)が、本発明を具体化する候補構築物の重要な特性になる場合が多いということである。従って、会合および解離特性、オン速度、オフ速度、および触媒反応速度が、各種の構築物で互いに影響し合い、所望の特性を達成する。これらの特性は、理論的な、構造に基づく設計および本明細書に開示される、適当な活性についてスクリーニングされる、多様な候補構築物、またはそのサブパーツの製作を組み合わせることで分子の中に設計される。
所望の活性を目的として触媒ドメインを調製するおよびスクリーニングするための方法は、当技術分野においてよく知られており、そして、例えば、米国特許第6,383,775号および米国特許仮出願第60/414,688号(これらのそれぞれの全内容が、参照として本明細書に組み入れられる)に記述されている。
アドレスドメインおよび触媒ドメインが単一分子の中に組み込まれたら、次にアドザイムのライブラリーを作製することができる。関心のある特異標的を改変する能力を目的として、得られたライブラリーをスクリーニングすることができる。適当な生物機能に対するアッセイを利用して、触媒ドメインが行う修飾の量を定量化することができる。好ましい態様として、触媒ドメインはプロテアーゼであり、およびアッセイは、標的分子の切断により産生される切断産物の量を測定するものである。選択のライブラリーメンバーの生物物理学的パラメータ、例えば、kcatまたはKmを測定することも効果的で有り得る。別の態様として、アドザイムのライブラリーをスクリーニングするためのアッセイは、標的分子またはその標的分子により調節される下流分子の生物活性を測定するアッセイとすることができる。
アドザイム、またはアドザイムの群が、選択またはスクリーニングで同定されたら、1ラウンドまたは複数ラウンドの突然変異誘発および当技術分野において知られる方法に従ったさらなる選択/スクリーニングにより、その特性をさらに高めることができる。さらに、プロテアーゼのような、一般的な実用性がある触媒ドメインを、全く異なる目的のために設計された構築物に使用することができる。
アドレスドメイン、リンカー、および酵素の組み合わせを含むアドザイムのライブラリーは、標準的な分子生物学プロトコルを利用して作製することができる。アドレスドメインまたは酵素ドメインは、アドザイムのN末端にすることができる。サイズ/長さ、組成(アミノ酸配列)を変化させてもよい。アドレスドメイン、リンカー、および酵素ドメインをコードする核酸を、操作可能に連結されたプロモーターおよび転写調節因子の制御下として、適当な発現ベクターにおいて組換え融合し且つクローニングすることができる。構築物は、組換え産物の精製を容易にするエピトープタグを含むこともできる。
異なるアドレスドメイン、リンカー、および酵素ドメインの所望の組み合わせは、例えば、所望の数の候補アドザイムをしらみつぶしに構築することにより、もたらすことができる。次いで、これらのアドザイムのそれぞれをアドザイムそのものに対し、もしくはアドザイムの標的に対し、またはその双方に対し、一つまたは複数のインビボおよび/またはインビトロ機能アッセイで個別に試験し且つ比較することができる。
アドザイム、またはアドザイムの群が、選択またはスクリーニングで同定されたら、1ラウンドまたは複数ラウンドの突然変異誘発および当技術分野において知られる方法に従ったさらなる選択/スクリーニングにより、その特性をさらに高めることができる。さらに、プロテアーゼのような、一般的な実用性がある触媒ドメインを、全く異なる目的のために設計された構築物に使用することができる。
例えば、米国特許第6,171,820号には、親の鋳型ポリヌクレオチドから、一連の突然変異を起こした子のポリヌクレオチドを産生する迅速かつ容易な方法であって、それによって元のコドン位置ごとに、20種類の天然にコードされるアミノ酸のそれぞれをコードする少なくとも一つの置換コドンが引き起こされる方法が記述されている。従って、この特許により同様に、親の鋳型ポリペプチドから、一連の突然変異を起こした子のポリペプチドを産生する方法であって、ここで、元のアミノ酸位置ごとに、20種類の天然にコードされるアミノ酸のそれぞれが示される方法が提供される。記載の方法は、「位置飽和突然変異誘発」、または単純に「飽和突然変異誘発」と呼ばれ、および上記の他の突然変異誘発法と組み合わせて利用することができる。この方法を適合させて、アドザイムが所望の生物学的特性を示すように、最終的に選択したアドレスドメイン、リンカー、および酵素ドメインの組み合わせを微調整する/最適化することができる。
G. 随伴型アドザイム
一つの重要な部類のアドザイムとして、触媒ドメインの活性が、アドレス結合部位(標的または標的関連分子上の)とのアドレスの結合により調節される。従って、触媒ドメインの活性は、標的そのものにより、標的関連分子により、またはアドザイム分子そのものの一部分により調節することができる。この部類の構築物の場合、触媒ドメインそのものが、「マスクされる」かまたは立体的に障害されており、従って、アドレスにアドレス結合部位が結合していないときには、ほとんど不活性である。いったんアドレスがアドレス結合部位を認識し且つ結合すると(例えば、アドザイムがその標的に到達したとき)、そのような障害が解かれ、その結果、活性な触媒ドメインが露出されて、標的に作用する。
このタイプのいわゆる「随伴型アドザイム」には、多くの態様があるものと思われる。
一つの態様として、随伴型アドザイムは単に、例えば、自己阻害ドメインの存在により、触媒的に活性な部位をマスクする立体構造に保たれる。アドレス結合部位とのアドレスの結合により、アドザイムの立体構造変化が引き起こされ、その結果、触媒ドメインのマスキング効果が解除される。または、触媒ドメインのマスキングは、アドザイム活性が必要される時におよび/または場所に、自己阻害ドメインに結合する分子を投与することにより解除することができる。実際に、転写因子のなかにはこの戦略を採用して、その活性を調節しているものもある。例えば、ショウジョウバエ(Drosophila)ホメオドメイン転写因子Bicoid(Bcd)の小ドメインは、ホメオドメインのすぐN末端側(残基52〜91)に位置し、ショウジョウバエ細胞でのBcd活性を抑制している。自己阻害ドメインと呼ばれる、このドメインは、Bcdの他のどの配列にも依存しない独立分子として機能し、異種性活性化因子の活性を抑制することができる。Bcdのこのドメインは、DNA結合または細胞内分布のその特性に影響を及ぼさない。自己阻害ドメインに点突然変異があるBcd誘導体は、ショウジョウバエ胚でのパターン形成および遺伝子発現に著しく影響を及ぼすことから、自己阻害ドメインの適切な時間的および空間的調節が、生物学的機能にとって考え得るばかりでなく不可欠であることが示唆される。実際に、証拠から、自己阻害ドメインの作用には、CtBPまたはdSAP18以外のショウジョウバエ補因子が必要とされることが示唆される。これらの結果から、胚発生の間の転写活性化因子および分子形態形成因子としてのBcdの適切な作用は、新規の補抑制体または複合体との相互作用を介した、それ自体の活性の下方制御に依存していることが示唆される(Zhaoら、Development 129, 1669〜1680, 2002)。
別の例として、補体活性化第2経路の活性化に不可欠であり且つ典型的なトリプシン様の折り畳みを示す、補体セリンプロテアーゼFactor Dには、自己阻害ループの存在による典型的な活性部位の立体構造が含まれ、そのループは、他のセリンプロテアーゼ複合体における多くのペプチド模倣阻害剤の結合位置と重なっている。Pro-factor Dは、活性な触媒3残基の立体構造、自己触媒ループの方向転換した(flipped)立体構造、ならびにトリプシノーゲン、キモトリプシノーゲン、およびプレトロンビン-2のものと同様の柔軟な活性化ドメインの立体構造を示す。
別の態様として、アドザイムは、アドザイム表面上の自己結合部位(「SBS」)の存在により、触媒ドメインをマスクする立体構造に保持されることができる。SBSは、触媒ドメインの内部または近傍とすることができ、アドレスドメインとの結合に向けられるアドレス結合部位と競合する。アドレス結合部位が存在しない場合、本来なら酵素的に活性な触媒部位は、例えば、アドレスとSBSとの間の、または結合された小分子阻害剤とSBSとの間の分子内相互作用により立体的にまたはアロステリックに阻害される。アドザイムが標的の位置にまたは近傍にあるときのような、アドレス結合部位が存在する場合、アドザイムの分子内相互作用の安定性が低下するかまたはなくなり、その結果、酵素的に活性な触媒部位の活性が増加し、標的に作用する。従って、この部類の態様として、アドザイムの触媒ドメインは、アドレスに対するアドレス結合剤(これはスイッチまたはトリガー(引き金)として機能する)の存在に応じて、作動される、またはスイッチを入れられる(高い反応速度を示す)、もしくは切られる(低い反応速度を示す)。アドレス結合剤が存在する場合、分子内相互作用が解除され(競合的に解かれ)、その結果、触媒ドメインが解放されて、その標的に作用する。
随伴型アドザイムの一つの際立った特徴は、これが、他の場所よりも標的の部位で、またはアドザイム活性が最も必要とされるときに、高い潜在的酵素活性を有するということである。このことは、薬物開発に役立つ重要な技術的利点となる。すなわち、構築物が、意図しない標的に反応する機会を減少させることにより、特異性を増大させるおよび毒性を減少させる課題に役立ち得るからである。このタイプの構築物の場合、標的または標的関連分子に対するアドレスの親和性は、SBSに対するアドレスの親和性よりも高いことが好ましい。
随伴型アドザイムの関連形態として、分子スケールで可動性の小分子阻害剤が、柔軟性のあるリンカーにより触媒ドメインに結合される。リンカーのなかに、標的生体分子もしくは他のトリガー分子に対するアドレスドメインが含まれるか、または触媒的に活性な部位とは別の触媒ドメインの部位により、アドレス表面が規定されるかのいずれかである。トリガー分子または標的生体分子が存在しない場合、阻害剤が触媒ドメインの酵素活性を、その活性ポケットの内側に結合して、そのポケットへの接近を遮断することにより阻害する。トリガー分子または標的生体分子が存在する場合、リンカー上のアドレスドメインまたはアドレス表面が、トリガー分子または標的生体分子上の結合部位と結合して、阻害剤を押しのけて触媒ドメインの活性ポケットから遠ざける複合体を形成し、その結果、酵素活性が増加する。
さらに別の形態として、アドレスドメインが、リンカーを介して触媒ドメインに結合され、これは、標的上の結合部位が存在しない場合、アドレスドメインを、触媒ドメインへの接近を阻害するかまたは別の方法で触媒ドメインの活性を妨害するような位置に立体的に配置させる。結合部位が存在する場合、アドレスドメインとのその会合によって、リンカーの二次構造が乱れることで、アドレスドメインを触媒ドメインから遠ざけて、その結果、触媒ドメインが解放されて、その標的生体分子と反応する。
随伴型アドザイムに関するいくつかの典型的な態様が、下記に詳細に記述される。しかし、当然のことながら、これらの実例は網羅的ではなく、いかなる点においてであれ、限定するものと見なされるべきではない。当業者であれば、容易に、本発明の一般的原理を理解し且つわずかな変更をともなう記述していない類似の態様を想像するものと思われる。
図3Aは、柔軟性のあるリンカーにより触媒ドメインに共有結合的に結合された、アドレスドメインとして機能する一本鎖抗体(scFv)を含む随伴型アドザイムの態様の略図であり、これには、構築物のアドレスが構築物の触媒ドメインと結合している、すなわち、分子内反応に関与しているため、「自己結合部位」と呼ばれる、scFvに対するエピトープまたは結合部位も定義されている。標的生体分子または他のトリガー分子が存在しない場合、アドレスが触媒ドメインの自己結合部位に結合し、その結果、その触媒活性を阻害する。結合部位を提示する標的生体分子または他のトリガー分子が存在する場合、この分子がscFvアドレスと結合するために競合し、その結果、標的生体分子と反応するように触媒ドメインが解放されて、その活性が、例えば、少なくとも100倍に、および好ましくは103〜109倍に増加する。
ゼロのまたは低い標的濃度の環境では、アドレスは、触媒ドメイン上の自己結合部位と結合する傾向があり、および従って、触媒ドメインが疑似標的との反応を引き起こすことが抑制される。アドレスドメインは、触媒ドメイン上の自己結合部位と標的の双方と結合する必要があるという最低必要条件、および自己結合部位は、結合時に触媒ドメインの活性を阻害するように配置する必要があるという最低必要条件に加えて、標的に対するアドレスドメインの親和性が、結合部位に対するその親和性よりも高い必要があるということが好ましい。この場合、熱力学によれば、標的により自己結合部位からアドレスが移動される傾向があるので、触媒ドメインの活性化が促進される。さらに、アドレスドメインからの標的のオフ速度は、その標的上のアドレスの平均滞留時間が、酵素反応時間に対して、匹敵する、好ましくは、ずっと長くなるのではなく、わずかに長くなるだけ高い(速い)必要があるということが好ましい。また一方、標的が、アドレスに対するその親和性を減少させる触媒ドメインにより変換される際に、標的上の結合部位は、化学的変化またはアロステリック変化を受けることが好ましい。これにより、代謝回転が促進される。
前述の薬力学的特性は、抗体、抗体様構築物(scFvなど)、または、例えば、ライブラリーから選択される、もしくは標的生体分子上の結合部位に結合するように設計されるペプチドを利用することにより、好都合に達成することができる。この場合、エピトープマッピング法または他の従来法により、標的上の結合部位を構成するアミノ酸の配列を決定することができる、およびその配列またはわずかに改変させた、親和性が低下した配列を一つまたは複数の触媒ドメインのループ中のさまざまな候補位置に組み込むことができる。これらの位置は、触媒ドメインを特徴付ける構造データに基づいて、酵素部位の構造を維持するように、但し、挿入したエピトープにscFvまたは他のアドレスが結合したときに、その構造を塞ぐかまたはアロステリックに変化させるように選択される。改変させた酵素の候補のうちでどれが触媒活性を保持しているかを決定した後、標的にも酵素上のループにも結合するアドレスを、柔軟性のポリマー鎖または他の柔軟性の直線状成分を介して触媒ドメインに結合させる。同様に、触媒ドメインの酵素活性部位の活性の不活化または有意な減少を示す構造が発見されるまで、種々のリンカー長および結合位置を試験して、複数の改変させた活性酵素のそれぞれに対し、さまざまな構築物を作製することができる。図3Aおよび以下に概説される、このタイプの構築物は、標的が存在しない場合には活性が低い。scFvが自己結合部位に結合して、酵素部位を立体空間的に妨害するためである。標的が存在する場合には、標的とscFvとの間の競合結合により、酵素部位が解放される。
図3Bは、アドレスドメインを含む柔軟性のあるリンカーを介して触媒ドメインに共有結合的に結合された、小分子または小ペプチド阻害剤を含む随伴型アドザイムの態様の略図である。この構築物は、アドレスドメインに対する結合剤が存在しないかまたは低濃度である場合、阻害剤が触媒ドメインの結合ポケットと結合するため、酵素的に不活性であり(阻害され)、その結果、その活性が減少するかまたはなくなる。この図で標的生体分子の表面上にあるように描かれている、結合部位が存在する場合、阻害剤が酵素ポケットから立体空間的に押しのけられ、その結果、そのポケットが解放されて、標的と相互作用する。そのような小ペプチドは、基質の酵素結合ドメインに配列が類似していてもよい。阻害剤は、結合剤が存在しない場合には酵素部位の内側に配置され、結合剤が存在する場合には酵素部位とは別に隔置されることと、アドレスは、標的の局所濃度を増加させる働きをすることが重要な特徴である。
図3Cは、アドレスドメインを含む柔軟性のあるリンカーを介して触媒ドメインに共有結合的に結合された小分子阻害剤(例えば、小ペプチド阻害剤)含む、図3Bに類似の随伴型アドザイムの別の態様の略図である。この場合も同様に、この構築物は、アドレスドメインに対する結合剤が存在しないかまたは低濃度である場合、阻害剤が触媒ドメインの結合ポケットと結合するため、酵素的に不活性であり(阻害され)、その結果、その活性が減少するかまたはなくなる。この図で標的生体分子の表面上にあるように同様に描かれている、結合部位が存在する場合、阻害剤が酵素ポケットから立体空間的に押しのけられ、その結果、そのポケットが解放されて、標的と相互作用する。この場合、標的生体分子の別分子、またはアドレスドメインから直に放出された分子が、酵素の結合ポケットで反応する。このタイプのアドザイムは、図3Bのものとして同様に構築することができる。
図3Dは、図3Aに類似の随伴型アドザイムの態様の漫画であるが、但し、触媒ドメインの酵素ポケットへの基質の接近を阻害する自己結合部位を含む位置で、触媒ドメインと共有結合的に複合体形成されたアドレスドメインを示している。標的生体分子およびその基質部位は、この図で、二部分からなるタンパク質複合体のうちの一部分として描かれている。アドレスドメインは、標的生体分子とは別の複合体上の表面と結合して、三部分からなる複合体を形成するように描かれている。図示されるように、触媒ドメインと結合して、その酵素活性を阻害するアドレスドメインの部分は、トリガー分子の結合部位と結合する部分とは異なることができる。さらに、説明図は、触媒阻害の機構として立体障害を描いているが、その一方で、アドレスドメインは、アロステリックに酵素を阻害することができる。このタイプのアドザイムは、アドレスおよび触媒ドメインが共有結合的相互作用を介して複合体化されるときに、触媒ドメイン上の活性部位がマスクされるように、アドレスドメインに触媒ドメイン結合配列を加えることにより構築することができる。
図3Eは、さらに別の態様の随伴型アドザイムの略図である。この態様の場合、干渉アドレスドメインは、触媒ドメインに共有結合的にまたは非共有結合的に結合されているのではなく、シャペロンタンパク質に結合されており、シャペロンタンパク質は触媒ドメインと結合されている。この構築物は、結合部位が存在しない場合、アドレスドメインが結合ポケットに近傍の触媒ドメインと結合するため、酵素的に不活性であり(立体的に阻害され)、その結果、その活性が減少するかまたはなくなる。この図で標的生体分子の表面上にあるように描かれている、結合部位が存在する場合、アドレスドメインが酵素ポケット近傍の干渉位置から立体空間的に押しのけられ、その結果、そのポケットが解放されて、標的と相互作用する。このタイプのアドザイムを構築するため、シャペロン結合ドメインを触媒ドメインとアドレスの双方の中に組み込んで、シャペロンの結合を容易にすることができる。本明細書の小分子による二量体化の項には、アドレスドメインと触媒ドメインとを結び付ける方法に関する種々の態様が記述されている。
図3Fは、さらに別の態様の随伴型アドザイムの略図である。この図では、アドレスドメインが、シャペロンタンパク質を介して触媒ドメインと非共有結合的に複合体化されている。アドレスドメインにより認識される標的または他の分子が存在しない場合、触媒ドメインの活性は、アドレスドメインに連結され且つ酵素ポケットにある小分子阻害剤により妨害される。標的生体分子が存在する場合、アドレスドメインが、シャペロンタンパク質から競合的に解離して、その結果、酵素ポケットから阻害剤が引き抜かれる。標的生体分子が存在する場合、アドレスドメインが標的とのおよびシャペロンタンパク質との結合で競合して、小分子を押しのけることで、結果的に触媒ドメインが解放されて、その標的に作用する。
図3Gは、図3Bの構築物に類似の随伴型アドザイムを描いているが、この図では、単一の球形タンパク質のドメインが、アドレスドメインと触媒ドメインの双方を含むように描かれている。アドレスに対する結合部位を提示するトリガー分子が存在する場合、小分子阻害剤が触媒ドメインの結合ポケットから競合的に押しやられ、その結果、そのポケットが解放されて、標的生体分子の化学変化を引き起こす。
随伴型アドザイムの候補が、アドレス結合部位が存在しない場合に相対的に不活性である一方で、アドレス結合剤が存在する場合に活性化されているかどうかを試験するため、随伴型アドザイムの明白な触媒活性をこれらの二つの条件で測定することができ、そしてアドレス結合剤の存在下での明白な触媒活性は、アドレス結合剤なしのものよりも少なくとも2倍、3倍、5倍、10倍、20倍、50倍、100倍、場合によってはそれ以上になると予想される。例えば、随伴型アドザイムの活性は、触媒ドメインを露出できない基質(例えば、アドレスに結合しない基質)を用いて、任意のアドレス結合剤の非存在下で測定することができる。アドレス結合剤の存在下で随伴型アドザイムの活性を測定するため、同じ基質を使用することができるが、但し反応系には、それそのものがアドザイムにより作用されないアドレス結合剤(例えば、アドザイムがプロテアーゼである場合、タンパク質分解に抵抗性)も含まれる。言い換えれば、アドザイムの活性は、触媒ドメインを解放するアドレス結合剤を存在させてまたは存在させないで、同じ基質により比較する。
H. アドザイムを用いた治療方法
本発明により同様に、疾患、例えば、可溶性分子または溶媒接触可能な分子と関連した疾患を患う患者の治療方法が提供される。この方法には、治療的に、予防的に、または鎮痛的に有効な量の本発明のアドザイムを被検体に投与する段階、それよって疾患を患う被検体を治療する段階が含まれる。一般に、アドザイムは、細胞外の体液中のまたは細胞表面上の溶媒接触可能なシグナル伝達因子により媒介される任意の疾患を治療するために設計および使用することができる。
可溶性分子と関連した疾患には、可溶性または膜結合性の生体分子、例えば、サイトカインもしくは成長因子またはGPCRにより引き起こされるまたはそれと関連した(例えば、直接的にまたは間接的に)、疾患、疾病、または病状が含まれる。そのような疾患の例には、喘息、乾癬、関節リウマチ、変形性関節症、乾癬性関節炎、炎症性腸疾患(クローン病、潰瘍性大腸(結腸)炎)、敗血症、脈管炎、および滑液包炎のような炎症性疾患; 狼瘡、リウマチ性多発筋痛症、強皮症、ウェグナー肉芽腫症、側頭動脈炎、クリオグロブリン血症、および多発性硬化症のような自己免疫疾患; 移植拒絶反応; 骨粗鬆症; 固形腫瘍(例えば、肺、CNS、結腸、腎臓、および膵臓)を含むがん; アルツハイマーおよび他の神経変性疾患; アテローム性動脈硬化症; ウイルス(例えば、HIVまたはインフルエンザ)感染症; 慢性ウイルス(例えば、エプスタイン-バー、サイトメガロウイルス、単純ヘルペスウイルス)感染症; ならびに毛細血管拡張性運動失調症が含まれる。
アドザイムは、抗体、人工構築物、または小分子の代わりとして抗-TNF療法に使用することができる。これらを使用して、ウェグナー血管炎(Wegner's vasculititus)、乾癬、強直性脊椎炎、乾癬性関節炎、クローン病および他のIBD、ならびに関節リウマチを治療することができる。これらを細菌およびウイルスにより引き起こされた感染症の日常または迅速処置のために使用して、その結果、細胞表面タンパク質または循環血液中の毒素もしくは免疫複合体を介して病原菌を直接的に攻撃することもできる。TNFのほかに特に有望な可溶性の標的には、IgE、C5、TGFβ、VEGF、およびIL-1のようなインターロイキンが含まれる。
アドザイムは、温血動物、特にヒトを含む哺乳動物で使用することができる。好ましい態様として、被検体は霊長類である。さらにより好ましい態様として、霊長類はヒトである。
本明細書では、被検体に「投与する」という用語には、非経口経路または経口経路による送達、つまり筋肉注射、皮下/皮内注射、静脈注射、口腔投与、経皮的送達および直腸経路、結腸経路、膣経路、鼻腔内経路または呼吸管経路による投与を含む、被検体中の所望の部位への組成物の送達に適したいずれかの経路により、被検体に本発明のアドザイム、例えば、医薬製剤のアドザイムを投薬する、送達するまたは適用することが含まれる。本発明の触媒装置を遺伝子治療アプローチにより投与することもでき、ここで、その構築物をコードするヌクレオチドは患者に投与されて、標的細胞に移行するかまたは移送され、細胞に進入し、そして発現して、治療用に遺伝子工学的に改変されたインテリジェントな装置を細胞に供与する。
本発明のアドザイムは、単独で、または特定の病理学的過程を調節する他の薬剤と組み合わせて供与することができる。例えば、本発明のアドザイムは、可溶性分子と関連したまたはその分子により引き起こされた疾患の治療に有用な他の周知の薬剤と組み合わせて投与することができる。本発明の方法で使用できる周知の薬剤は、Harrison's Principles of Internal Medicine, 第13版、T. R. Harrisonら(編) McGraw-Hill N. Y., N Y; およびthe Physicians Desk Reference 第50版 1997, Oradell New Jersey, Medical Economics社(これらの全内容が参照として本明細書に明示的に組み入れられる)のなかで見出すことができる。本発明のアドザイムおよび付加的な薬剤は、同じ薬学的組成物としてまたは異なる薬学的組成物(同じ時間にまたは異なる時間に)として被検体に投与することができる。一つの態様として、一つまたは複数の標的に特異的な一つまたは複数のアドザイムを被検体に同時に投与する。別の態様として、アドザイムの別々のドメイン(すなわち、アドレスドメインおよび触媒ドメイン)を被検体に別々に投与することができる。そのような態様の場合、アドレスドメインおよび触媒ドメインは、インビボで会合して、アドザイムを形成する。
I. アドザイムの非医学的使用
本発明により同様に、以下に限定されることはないが、農業、環境保護、食料などを含む、多くの非医学的用途におけるアドザイムのさまざまな使用が提供される。
例えば、主題のアドザイムには、動物飼料/ペットフードの製造、精白、エタノール製造、および食品加工を含む、農業における幅広い用途を見出すことができる。
動物飼料/ペットフード
アドザイムを使用して、栄養価を高めることや大麦および小麦ベースの飼料のような飼料の成分から抗栄養因子を除去することができる。グルテンミールおよびグルテン繊維のようなトウモロコシ加工副産物をアドザイムにより改良することもできる。実際に、最近の数多くの食品安全性の危機(BSE、ダイオキシンの恐怖など)から、動物飼料は、公衆衛生に対する公害および動物由来の食品の安全性に関する国民の信頼性(public condifence)の低下を招き得るものであると見なす必要があることが明らかになった。
一つの態様として、プロテアーゼを飼料の成分に存在する好ましくない栄養素に特異的なアドレスに連結させて、それによって、そのような成分の分解/除去を引き起こすことができる。そのようなアドザイムを使った消化の付加利益は、分解された(不活性な)タンパク質因子が今度はタンパク質の栄養源(ペプチド断片)となることである。例えば、Caugheyら(J. Virol. 2135〜2141, Vol 68, No. 4, Apr 1994)により、プロテアーゼ抵抗性のPrP(プリオン病であるBSEの原因)の明白な前駆体、つまりプロテアーゼ感受性のPrPは、コンゴレッドおよび高度に硫酸化されたグリコサミノグリカンであるヘパリンに結合することが報告された。従って、コンゴレッドまたはある種の硫酸化グリカンからなるアドレスドメインと、プロテアーゼ感受性のPrPを分解できるプロテアーゼからなる触媒ドメインとを含む、アドザイムを使用して、ある種の動物飼料を前処理し、プリオン病の伝染の危険性を低下させることができる。
関連する態様として、本発明のアドザイムは、典型的な飼料に使用されるトウモロコシ、小麦、大麦および大豆由来の繊維素またはタンパク質の溶解性を増加させることにより、栄養摂取および消化性を向上させる、廃棄物を減少させるならびに給餌費用を低減させる食品添加物のような他の酵素とともに使用することができる。アドザイムで使用できる他の酵素には、プロテアーゼ(タンパク質消化酵素)、アミラーゼ(糖質消化酵素)、リパーゼ(脂肪消化酵素)、セルラーゼ(繊維素消化酵素)、ラクターゼ(乳糖消化酵素)、インベルターゼ、マルターゼ(糖質消化酵素)、および/またはα-ガラクトシダーゼ(豆の消化酵素)が含まれる。
燃料エタノール
クリーンな燃料としてのエタノールへの関心は、これまでになく高まっている。化石燃料は、有限で、再生不能であり、そして公害および地球温暖化を通して環境に害を及ぼすが、しかしながらその供給は、世界のエネルギー需要の80パーセントを超えている。現在の消費速度で、世界の石油埋蔵量は、今後50〜100年のうちに枯渇すると予測されている。爆発的な人口増加や生活水準の向上により、その期間は短縮される可能性がある。エタノール、つまりトウモロコシ、大麦、サトウモロコシおよび小麦のようなでんぷん質の穀物から蒸留された化学物質は、ガソリンよりも燃費が高くて汚染もずっと少ない。農産業だけで、世界中で毎年およそ1兆トンのバイオマス(未使用の穀物、木、牧草、および他の農業「廃棄」物)が生み出され、そのエネルギー価は、地球規模で消費される全エネルギーのそれの5倍にもなる。これらの穀物から得られるでんぷんを発酵性糖に変換した後、酵母によりアルコールに変換する。
セルラーゼが生物燃料の生産に利用されているが、セルラーゼの費用に対する現在の見積もりは、生産されるエタノール1ガロン当たり30〜50セントに及ぶ。価格競争力を高めるうえで、生物燃料の生産の目標は、エタノール1ガロン当たり5セント未満にまでセルラーゼの費用を低下させることである。これには、特異活性もしくは生産効率またはその組み合わせを10倍に増加させることが必要になる。従って、セルラーゼ特異活性の数倍増加(トリコデルマ・リーセイ(Trichoderma reesei)系と比べて)でさえも、この方向性からすると重要な前進になるものと思われる。
従って、この態様の場合、セルラーゼおよび発酵にいっそう適したさらに単純な糖成分へバイオマスを消化できる他の酵素を備えたアドザイムを使用して、燃料エタノールの生産を促進させることができる。アドレスドメインには、クロストリジウム・セルロヴォランス(Clostridium cellulovorans)のセルロース結合タンパク質(CbpA)のcbpA遺伝子によりコードされる約100アミノ酸からなる推定上のセルロース結合ドメインのような、二つ以上の結合ドメインを含めることができる。前述のように、約1 nMのKdを有する二つの同一のアドレスドメインを備えたアドザイムの有効Kdは、約10-15 Mの高い結合値を有するものと思われ、これによりセルロース消化の触媒効率を増加させることができる。
食品加工
アドザイムは、ベーキングを向上させる、タンパク質をより効率的に処理する、食料を保存する、皮革工業において獣皮を処理する、写真用フィルムの加工処理において残留銀を回収する、および紙パルプの加工処理を向上させるような目的で、食品産業において使用することができる。アドザイムの使用により、従来の化学工程ほど過酷ではない処理代替案が得られる。それにより得られる主な利点は、温度およびpHが温和な条件下での処理である。これらの目的に有用なアドザイムのなかには、タンパク質の加水分解にならびにセルロースおよびヘミセルロースの修飾で使用されるものがあり、その他には廃棄物の流れで過酸化水素を分解するのに、または食品用途における酸素およびグルコース除去に有用なものがある。
これらのアドザイムは全て、結合の特異性および/または親和性を促進させることができる複数のアドレスドメインを含有させるだけ、最低限、遺伝子工学的に改変させて、これにより、全体の活性を増加させることができる。
例えば、アドザイムを使用して、焼いた商品のグルテンの品質を向上させること、パンの官能特性および物理的特性を高めること、ならびに特殊調製粉乳からスポーツ飲料までの多様な製品において食肉タンパク質または植物性タンパク質の溶解性、機能性および栄養性を促進させることができる。アドザイムを使用して、でんぷんを、多くの食品および特に清涼飲料水で広く利用される甘味料の高果糖コーンシロップ(HFCS)に変換させることもできる。
紙パルプ産業
キシラナーゼを含むアドザイムは、漂白の後押しに使用することができる、セルラーゼを含むアドザイムは、紙パルプの再生に磨きをかけるのに使用することができる、およびアミラーゼを含むアドザイムは、でんぷんの除去および修飾に使用することができる。
醸造工程の場合
アドザイムを使用して、工程の効率および最終産物を向上させることができる。例えば、αアミラーゼを含むアドザイムは、穀類添加物の加熱調理に使用することができる、βグルカナーゼを含むアドザイムを使用して、糖化および熟成(工程)でろ過を改善させることができる、ならびにグルコアミラーゼを含むアドザイムを使用して、低カロリーのビールを製造することができる。さらに、αアミラーゼおよびグルコアミラーゼを含むアドザイムは、飲用アルコールの製造で使用することができる。
繊維産業
アドザイムは、クリーニングおよび被服管理産業の中のさまざまな用途で有用である。アドザイムの使用は、多くの場合、環境問題を提起する化学物質または工程に取って代わるので、有益である。しかしながら天然に存在する酵素は、ほとんどの場合、産業用には、十分な量または酵素活性/効率で利用することができない。
高コントラストの「軽石でこすって擦り切れた感じの出た」外観を有するデニムの色あせたまたは使い古しの外観は、もともとデニムを大きな業務用洗濯機のなかで軽石を使って洗浄することにより行われていた。そのような工程では、摩耗制御の欠如、織物への損傷、および洗濯機における摩耗および破れは無視できない。同様の効果は、より環境にやさしい方法で、アドザイムを使用して効率的に実現することができる。アドザイムは、糊抜き(アミラーゼ)、デニム仕上げ(セルラーゼ)、綿およびセルロース誘導体のバイオ仕上げ(セルラーゼ)、ならびに過酸化水素の除去(カタラーゼ)に有用である。
パーソナルケア製品
プロテアーゼは、体内でさまざまな高分子の成熟または加水分解機能を行う。これらの機能は、外因的に供給されるアドザイムの適用により促進されるかまたは改変させることができる。例えば、皮膚表面にアドザイムを塗布することにより、表面の油の分解および死んだ皮膚の除去に役立ち得る。従って、皮膚、髪および口腔ケアの用途にアドザイムを使用することで、より若そうな肌、より美しい髪およびより健康な歯と歯茎をもたらす体の自然な働きを補うことが可能である。
洗剤/洗浄剤
他の特に好ましい態様として、主題のアドザイムを使用して、生物活性が有るか無いかにかかわらず、特定の予め選択された分子を標的とし且つ破壊することができる。従って、例えば、さまざまな土壌または染みの成分(例えば、牛乳、血液、卵、草の染み、油の染みなど)を特異的に標的化することができる。例えば、アビジン/卵タンパク質は、例えば、その部位にプロテアーゼを特異的に方向付ける標的化部分としてビオチンを使用することにより、特異的に標的化することができる。その染みは、分解/消化されて、その結果、基礎となる素地から放出される。そのようなアドザイムは、さまざまな洗浄剤で特に有用である。
「土壌」または「染み」という用語は、関心のある素地(例えば、織物)に付いた異物の蓄積を指す。「土壌」または「染み」は、生物活性を持ち得ないが、しかしながら基礎となる素地を変色させる、および/または分解させる働きをし得る。「土壌」は、肉眼で確認できる必要はない。肉眼では確認できないものの、臭気を生み出すまたは細菌増殖を補助する異物の沈着は、本出願との関連では同様に「土壌」と見なされる。典型的な染みまたは土壌には、以下に限定されることはないが、草の染み、血液の染み、牛乳の染み、卵、卵白、および同様のものが含まれる。
本発明のアドザイムは、標的分子を分解することおよび/またはその標的分子の活性を阻害することが望まれるようなさまざまな状況で有用である。従って、例えば、エクスビボ用途において、触媒的アンタゴニストを使用して、特定の分子を特異的に標的化し且つ分解することができる。従って、例えば、清浄作業において、本発明のキメラ分子を利用して、土壌の成分(例えば、タンパク質成分、脂質成分など)を特異的に標的化し且つ分解することができる。化学的合成過程において、または生化学的合成過程(例えば、分析的なまたは工業的な準備において、バイオリアクターにおいてなど)においては、特定の予め選択された分子を特異的に分解することができる。従って、例えば、バイオリアクターにおいて特定の酵素活性(例えば、糖鎖付加)を除去することが望ましい場合、本発明の触媒的アンタゴニストには、標的化部分として、その活性を媒介する酵素(例えば、グリコシルトランスフェラーゼ)に対する基質が含まれる。リアクター中の酵素(受容体)が標的化部分を結合すると、キメラの酵素成分(例えば、ヒドロラーゼ)がリアクターの酵素を分解して、その活性を低下させるかまたは消失させそして同様にその酵素結合部位からキメラそのものを遊離させ、その結果、キメラは自由に別の標的酵素を攻撃できる。
シリコンバイオテクノロジー
生態系では、有機分子は、炭酸カルシウムやシリカのような無機物の核形成や無機質相に対し、および生物学的機能に必要とされる複雑な構造体への微結晶や他のナノスケールの基礎的要素の会合に対し、著しいレベルの制御を及ぼしている(Belcherら、Nature 381, 56〜58, 1996; Faliniら、Science 271: 67〜69, 1996; Cha, Proc. Natl Acad. Sci. USA 96: 361〜365, 1999; Meldrumら、Proc. R. Soc. Lond. B 251: 238〜242, 1993)。ナノスケールの成分を制御された高性能の構造体に会合させるこの能力が、生態系で見出される識別能力および相互作用を模倣するまたは利用する会合法を開発するための熱心な努力を促した(Colvinら、J. Am. Chem. Soc. 144: 5221〜5230, 1992 ; Brustら、Adv. Mater. 7: 795〜797, 1995; Liら、Chem. Mater. 11: 23〜26, 1999; Alivisatosら、Nature 382: 609〜611, 1996; Mirkinら、Nature 382: 607〜609, 1996; Brown, Proc. Natl Acad. Sci. USA 89: 8651〜8655, 1992)。Brown (Proc. Natl Acad. Sci. USA 89: 8651〜8655, 1992 ; およびNature Biotechnol. 15: 269〜272, 1997)により、金属表面および金属酸化物表面との結合に対し、選択性の限られたペプチドの選択の成功について報告されている。別の研究では、コンビナトリアル・ファージ-ディスプレイ・ライブラリーを用い、Whaleyら(Nature 405: 665〜668, 2000)は、この研究手法を拡張させて、使用した構造的に類似する物質の結晶方位および組成に応じて、高い特異性で一連の半導体表面に結合する多数のペプチドを成功裏にスクリーニングし且つ選択した。Whaleyらは、このペプチドによる無機結晶の識別および特異性をGaN、ZnS、CdS、Fe3O4、およびCaCO3を含む、他の基板にまで拡張させている。そのようなペプチドを主題のアドザイムのアドレスドメインとして使用し、マイクロチップ(例えば、タンパク質アレイなど)の所定の領域に、種々の機能性高分子(例えば、ポリペプチド)を特異的に配置する/集積させることができる。
そのような標的アドザイムは、ナノ材料(無機または有機/無機ハイブリッド材料)の標的とする、逐次的な集積/合成を目的として利用することができる。一つの態様として、第一のアドザイムを、アドザイムの機能ドメイン、つまり触媒ドメインが、反応物質/基質に対して一連の工程の第一ステップを行うことができるようにナノ集積ライン/容器(タンク、流通管、および他の適当なデザイン)の第一の領域の表面に配置することができる。次いで、この反応物質を、ナノ集積ライン/容器の第二の領域の表面に配置された第二のアドザイムに移して、工程の次のステップを完了させることができる。この工程は、全ての反応が行われて、最終生成物が出現するまで、工程の引き続くステップに対して繰り返し行うことができる。
カイメンのテチヤ・オウランチア(Tethya aurantia)から単離される、タンパク質のシリカテインは、テトラエトキシシランおよびシリカトリエトキシド(silica triethoxide)から、それぞれシリカおよびシルセスキオキサンのインビトロ重合を触媒する。ナノ集積ラインの特定の領域につなげた場合、このタンパク質を利用して、特定のナノ集積の特異的ステップを行うことができる。
または、異なるアドザイムを異なるチップに付着させることができ、このチップを自動的に反応容器に入れるかまたは取り出して、逐次的な触媒ステップを行うことができる。
そのような標的アドザイムを利用して、シリコンチップ上に(同一のまたは異なる)分子のアレイを構築することもできる。この関連で、主題のアドザイム技術を三次元(3-D)有機/無機ナノスケールアーキテクチャの計画的化学集積と組み合わせることができる。この手法は、表面の化学的誘導化および階層的交互吸着自己組織化法を介して作り出された有機テンプレートの足場で起こる制御された自己組織化の工程に基づく。例えば、任意の2-Dのパターンは、「構造的ナノリソグラフィー」[1]と呼ばれる、新たなナノパターンニング工程を利用して作製することができ、それによって、伝導性AFM(原子間力顕微鏡)チップによりもたらされる電気パルスにより、ある種の高規則性オルガノシラン単層またはシリコン上に自己集積した厚いフィルムのトップ機能に選択的に影響を及ぼす局所の電気化学的転換を引き起こす。このパターンニング工程において、AFMチップは、ナノ電気化学「ペン」の役割を果たし、これにより、化学情報が選択の有機フィルムの上面に非破壊的な方法で刻まれる。このパターン化されたフィルムまたはそのさらに化学修飾された生産物を次に、種々の標的アドザイムによる続く表面自己集積をガイド可能なテンプレートとしてさらに利用し、これにより、各自己集積ステップが、予め集積されたテンプレート構造により与えられる制御を受ける、徐々に進展する自己集積化システムを作り出すことができる。この階層的自己集積法により、0-D(個々のドット)および1-D(ワイヤ)から、3D(超格子)構造まで、可変次元を備えた新たなタイプの有機-無機ナノ複合材料アーキテクチャの計画的集積の選択肢が得られる。
例えば、アレイの表面は、後に付着される多くのアドザイムのうちのいずれかのアドレスが結合できない第一の材料を含むことができる。上記の技術を利用して、表面の第一の領域を改変することができ、その結果、アドザイムの第一のアドレスドメインは、今度は改変された領域に結合することができる。結合が飽和に達しているなら、第一のアドザイムの全てを除去した後、同じ工程を表面上の第二の領域に対して繰り返し行って、第二の領域を露出させることができ、その結果、第二のアドザイム(異なる触媒ドメインを有することができる)が今度は結合することができる。ATMチップが表面の露出を制御しているので、種々のパターンを表面に逐次的に刻み込むことができ、その結果、異なる機能を有するアドザイムを、必要に応じて異なるパターンで表面の異なる領域に選択的に付着させることができる。
突出末端を有する結合からの2D格子を含む、2Dのナノスケールパターンを形成させるのに、DNAモチーフが利用されている(SeemanおよびBelcher, Proc Natl Acad Sci USA. 99 Suppl 2:6451〜5;Apr.30, 2002; Epub 2002 Mar 05を参照されたい)。従って、他の態様として、特定のDNA配列を認識するアドレスを有するアドザイムをそのようなDNA格子に付着させて、パターン化されたアドザイムのアレイを作製することができる。アドレスドメインは、天然に存在するDNA結合ドメインとすることができる、または、例えば、ファージディスプレイ法もしくは他の同様の方法を利用して、特定のDNA結合に対して選択することができる。
J. アドザイム含有組成物
(i) タンパク質調製物
本発明の別の局面は、本発明のアドザイムを含む薬学的組成物に関する。本発明の薬学的組成物には通常、本発明のアドザイムまたは標的組織への形質導入を目的としたそのアドザイムをコードするヌクレオチドと、薬学的に許容される担体とが含まれる。本明細書では、「薬学的に許容される担体」には、ありとあらゆる溶媒、分散媒、コーティング、抗菌剤および抗真菌剤、等張剤および吸収遅延剤、ならびに生理的に適合する同様のものが含まれる。担体のタイプは、意図する投与経路を基にして選択することができる。種々の態様において、担体は、静脈投与、腹腔内投与、皮下投与、筋肉内投与、局所投与、経皮投与または経口投与に適している。
薬学的に許容される担体には、無菌の水性の溶液または分散液および無菌の注射用の溶液または分散液の即時調整用の無菌の粉剤が含まれる。薬学的に活性な物質のためのそのような媒体および媒介物の使用は、当技術分野においてよく知られている。従来のどの媒体または媒介物も活性化合物と不適合である場合を除き、本発明の薬学的組成物におけるその使用が意図される。補助的な活性化合物を組成物に組み込むこともできる。
治療用組成物は通常、製造および保存の条件下で無菌および安定でなければならない。組成物は、溶液、マイクロエマルジョン、リポソーム、または高い薬物濃度に適した他の秩序構造として製剤化することができる。担体は、例えば、水、エタノール、多価アルコール(例えば、グリセロール、プロピレングリコール、およびポリエチレングリコール溶液など)、およびその適当な混合物を含む、溶媒または分散媒とすることができる。適当な流動性は、例えば、レシチンのようなコーティングの使用により、分散液の場合には必要とれる粒子サイズの維持によりおよび界面活性剤の使用により維持することができる。多くの場合、組成物中に等張剤、例えば、糖質、マンニトール、ソルビトールのような多価アルコール、または塩化ナトリウムが含まれることが好ましいものと思われる。注射用組成物の持続吸収は、組成物中に吸収を遅らせる媒介物、例えば、モノステアリン酸塩およびゼラチンを含有させることによりもたらすことができる。さらに、アドザイムは、持続放出製剤のなかで、例えば、持続放出性重合体を含む組成物のなかで投与することができる。アドザイムは、インプラントおよびマイクロカプセル送達系を含む、放出制御製剤のような、化合物を迅速放出から保護する担体とともに調製することができる。エチレン酢酸ビニール、酸無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、ポリ乳酸およびポリ乳酸ポリグリコール酸共重合体(PLG)のような、生体分解性の、生体適合性重合体を使用することができる。そのような製剤の調製方法の多くは、当業者に広く知られている。
無菌注射剤は、必要量のアドザイムを適当な溶媒中に、必要に応じて、上記に列挙した成分の一つとまたは組み合わせとともに組み込んだ後、ろ過滅菌して調製することができる。一般に、分散液は、基本的な分散媒と上記に列挙したうちの必要とされる他の成分とを含む無菌媒体中にアドザイムを組み込むことにより調製することができる。無菌注射剤の調製用の無菌粉剤の場合、好ましい調製方法は、活性成分に加えていずれかの付加的な所望の成分の粉末を、予め無菌ろ過したその溶液から得られる凍結乾燥法および真空乾燥法である。
投与経路に応じて、アドザイムは、酵素、酸および薬剤を不活性化し得る他の天然条件の作用からこれを保護する物質でコーティングすることができる。例えば、アドザイムは、酵素阻害剤と同時投与される適当な担体もしくは希釈剤に入れてまたはリポソームのような適当な担体に入れて被検体に投与することができる。薬学的に許容される希釈剤には、生理食塩水および水性緩衝溶液が含まれる。酵素阻害剤には、膵臓トリプシン阻害剤、ジイソプロピルフルオロリン酸(DEP)およびトラジロールが含まれる。リポソームには、従来のリポソームに加えて水中油中水型エマルジョンが含まれる(Strejan,ら、(1984) J. Neuroimmunol 7: 27)。分散液は、グリセロール、ポリエチレングリコール溶液、およびその混合液中でならびに油中で調製することもできる。保存および使用の通常条件の下では、これらの調製物は、微生物の増殖を予防するために保存剤を含むことができる。
組成物中の活性剤(すなわち、本発明のアドザイム)は、治療的に有効な量で組成物中に製剤化されることが好ましい。「治療的に有効な量」とは、標的の活性の調節のような、所望の治療結果を達成し、その結果、特定の病状の治療コースに影響を及ぼすのに必要な用量におよび期間に、有効な量を指す。アドザイムの治療的に有効な量は、個体の病状、年齢、性別、および体重、ならびにアドザイムが個体で所望の反応を誘発する能力のような要因に応じて変化する可能性がある。投与計画を調整して、最適な治療反応を供与することができる。治療的に有効な量とは同様に、アドザイムによる何らかの毒性作用または有害な影響よりも治療的に有効な効果が上回る量である。別の態様として、アドザイムは、予防的に有効な量で組成物中に製剤化される。「予防的に有効な量」とは、所望の予防結果、例えば、予防を目的とした標的(例えば、TNFαまたはTNFβ)の活性の調節を達成するのに必要な用量におよび期間に、有効な量を指す。通常、予防用量は、疾患の初期段階の前にまたはその時点で被検体に使用されるので、予防的に有効な量は、治療的に有効な量よりも少なくなるものと思われる。
組成物中のアドザイムの量は、個体の病状、年齢、性別、および体重のような要因に応じて変化する可能性がある。投与計画を調整して、最適な治療反応を供与することができる。例えば、単回の大量瞬時投与を行うことができる、数回の分割用量を長い期間をかけて投与することができるまたは用量を比例的に減少させるかもしくは治療状況の緊急性を適応して増加させることができる。投与および投与単位の均一性を簡略化するために、非経口組成物を投与単位形態で製剤化することが特に有利である。本明細書で投与単位形態とは、処置する哺乳動物の被検体への単一投与に適した物理的に不連続な単位であって、それぞれが、必要とされる薬学的担体に関連して所望の治療効果をもたらすように計算された所定の量の活性化合物を含有する単位を指す。本発明の投与単位形態の仕様は、(a) 活性化合物に特有の特徴および達成すべき特定の治療効果、ならびに(b) 個体ごとの感受性に合わせてそのような活性化合物を配合するのに当技術分野に付いて回る制限により決定されるおよびそれらに直接的に依存する。
本発明別の局面により、アドザイムを呼吸管に輸送するためのエアロゾルが提供される。気道には、下気道(これには気管支および細気管支への分岐部に至る気管が含まれる)に先行する、中咽頭および喉頭を含む、上気道が含まれる。上下気道は、誘導気管支と呼ばれる。終末細気管支が次に呼吸細気管支に分かれ、これが次に最終的な呼吸域、肺胞、または肺深部に通じる。
本明細書では、吸入による投与は、経口および/または経鼻とすることができる。エアロゾル輸送用の薬剤装置の例には、定量吸入器(MDI)、ドライパウダー吸入器(DPI)、およびエアジェット噴霧器が含まれる。主題のアドザイムの輸送に容易に適応できる、吸入による典型的な核酸輸送系は、例えば、米国特許第5,756,353号; 米国特許第5,858,784号; およびPCT出願国際公開公報第98/31346号、国際公開公報第98/10796号、国際公開公報第00/27359号、国際公開公報第01/54664号、国際公開公報第02/060412号に記述されている。使用できる他のエアロゾル製剤は、米国特許第6,294,153号; 米国特許第6,344,194号; 米国特許第6,071,497号、およびPCT出願国際公開公報第02/066078号、国際公開公報第02/053190号、国際公開公報第01/60420号、国際公開公報第00/66206号に記述されている。
ヒト肺は、数分から数時間に及ぶ期間にわたって、加水分解的に除去可能な沈着したエアロゾルを除去するかまたは迅速に分解することができる。上気道では、繊毛上皮が「粘液線毛のエスカレーター」に寄与し、これにより、粒子は気道から口内へ押し流される(Pavia, D., Aerosols and the Lung: Clinical and Experimental Aspects中の「LungMucociliary Clearance」、Clarke, S. W.およびPavia, D.(編)、Butterworths, London, 1984)。肺深部では、肺胞のマクロファージが、粒子をその沈着直後に貪食することができる(Warheitら、Microscopy Res. Tech., 26: 412〜422 (1993); ならびにBrain, J. D., The Reticuloendothelial System中の「Physiology and Pathophysiology of Pulmonary Macrophages」、S. M. ReichardおよびJ. Filkins(編)、Plenum, New. York., 315〜327頁, 1985)。肺深部、または肺胞は、アドザイムの全身輸送を目的とした吸入治療用エアロゾルの主な標的である。
好ましい態様として、特に、アドザイムの全身投与が望まれる場合、エアロゾル化アドザイムは、微粒子として製剤化される。直径0.5〜10ミクロンの微粒子は、肺に浸透して、その結果、天然の障壁のほとんどを通り抜けることができる。咽喉を飛び越えて進むのに、10ミクロン未満の直径が必要とさる; 吐き出されるのを回避するのに、0.5ミクロンまたはそれ以上の直径が必要とされる。
本発明のアドザイムは、薬学的組成物中に、その化合物が組成物中で唯一の活性剤となるように製剤化することができる。または、薬学的組成物は、さらなる活性剤を含むことができる。例えば、二つまたはそれ以上の本発明のアドザイムを組み合わせて使用することができる。
(ii) 核酸組成物
本発明の別の局面により、主題のアドザイム体を発現させるための発現ベクターが提供される。例えば、アドザイムのポリペプチドをコードするヌクレオチド配列を含み、そのコード配列が少なくとも一つの転写調節配列に操作可能に連結された、発現ベクターが意図される。本発明のアドザイム・ポリペプチドの発現を導くための調節配列は、当技術分野において認識されており、そして多くの汎用的な基準により選択される。典型的な調節配列は、Goeddel; Gene Expression Technology: Methods in Enzymology, Academic Press, San Diego, CA (1990)に記述されている。例えば、操作可能に連結した場合にDNA配列の発現を制御する、さまざまな発現制御配列のいずれかをこれらのベクターのなかで使用して、本発明のアドザイムのポリペプチドをコードするDNA配列を発現させることができる。そのような有用な発現制御配列には、例えば、SV40の初期および後期プロモーター、アデノウイルスまたはサイトメガロウイルスの極初期プロモーター、lac系、trp系、TACまたはTRC系、T7 RNAポリメラーゼにより発現誘導されるT7プロモーター、3-ホスホグリセレートキナーゼまたは他の糖分解酵素に対するプロモーター、酸性ホスファターゼ、例えば、Pho5のプロモーター、および酵母α-接合因子のプロモーターや原核細胞もしくは真核細胞またはそのウイルスの遺伝子の発現を制御することが知られている他の配列、ならびにその種々の組み合わせが含まれる。当然のことながら、発現ベクターの設計は、形質転換する標的宿主細胞の選択のような要因に依存する可能性がある。さらに、ベクターのコピー数、そのコピー数の制御能およびベクターがコードする他のタンパク質、例えば、抗生物質マーカーの発現も同様に考慮すべきである。
明らかなように、主題の遺伝子構築物を使用して、培養で増殖させた細胞中で主題のアドザイム・ポリペプチドを発現させる、例えば、精製のため、アドザイム・ポリペプチドを含む、タンパク質またはポリペプチドを産生させることができる。
本発明は同様に、主題のポリペプチドのうちの一つを発現させるため、組換え遺伝子を形質導入した宿主細胞に関する。宿主細胞は任意の原核細胞または真核細胞とすることができる。例えば、本発明のアドザイム・ポリペプチドは、大腸菌のような細菌細胞、昆虫細胞(バキュロウイルス)、酵母、または哺乳動物細胞で発現させることができる。他の適当な宿主細胞は、当業者に周知である。
従って、本発明はさらに、主題のアドザイム・ポリペプチドの産生方法に関する。例えば、関心のあるタンパク質をコードする発現ベクターを形質導入した宿主細胞を、タンパク質の発現を引き起こす適当な条件の下で培養することができる。タンパク質は、分泌シグナル配列を包含させることで分泌させて、タンパク質を含有する培地および細胞の混合物から単離することができる。または、タンパク質を細胞質に保持させて、細胞を収集し、溶解し、それからタンパク質を単離することができる。細胞培養物には、宿主細胞、培地および他の副産物が含まれる。細胞培養に適した培地は、当技術分野においてよく知られている。タンパク質は、イオン交換クロマトグラフィー法、ゲルろ過クロマトグラフィー法、限外ろ過法、電気泳動法、およびタンパク質の特定のエピトープに特異的な抗体を用いた免疫アフィニティー精製法を含む、タンパク質を精製するための当技術分野において知られる方法を用いて、細胞培地、宿主細胞、またはその双方から単離することができる。
従って、本発明のアドザイム・ポリペプチドのコード配列を使用して、微生物または真核細胞過程により、組換え型のタンパク質を産生させることができる。発現ベクターのような遺伝子構築物へのポリヌクレオチド配列の連結、および宿主、つまり真核細胞(酵母、鳥類、昆虫または哺乳動物)または原核細胞(細菌細胞)の宿主への形質転換または形質導入は、標準的な操作手順である。
組換えタンパク質を産生させる発現媒体には、プラスミドおよび他のベクターが含まれる。例えば、アドザイム・ポリペプチドの発現に適したベクターには、以下のタイプのプラスミドが含まれる: 大腸菌のような原核細胞における発現用のpBR322-由来のプラスミド、pEMBL-由来のプラスミド、pEX-由来のプラスミド、pBTac-由来のプラスミドおよびpUC-由来のプラスミド。
酵母で組換えタンパク質を発現させるのに、多数のベクターが存在する。例えば、YEp24、YIp5、YEp51、YEp52、pYES2、およびYRp17は、S・セルビシエへの遺伝子構築物の導入に有用なクローニングおよび発現媒体である(例えば、Broachら、(1983) Experimental Manipulation of Gene Expression中、M. Inouye(編) Academic Press、83頁を参照されたい、これは参照として本明細書に組み入れられる)。これらのベクターは、pBR322 ori(複製起点)の存在により大腸菌でおよび酵母2ミクロンプラスミドの複製決定因子によりS・セルビシエで複製することができる。独立栄養選択または対抗選択を多くの場合、酵母で使用することができる。さらに、アンピシリンのような薬剤耐性マーカーを細菌で使用することができる。
好ましい哺乳動物発現ベクターには、細菌でベクターの増殖を促進させる原核生物の配列と、真核細胞で発現される一つまたは複数の真核細胞の転写単位の双方が含まれる。pcDNAI/amp、pcDNAI/neo、pRc/CMV、pSV2gpt、pSV2neo、pSV2-dhfr、pTk2、pRSVneo、pMSG、pSVT7、pko-neoおよびpHyg由来のベクターは、真核細胞の形質導入に適した哺乳動物発現ベクターの例である。これらのベクターのいくつかは、原核細胞と真核細胞の双方で複製および薬剤耐性選択を容易にするため、pBR322のような細菌プラスミド由来の配列で改変されている。または、ウシ乳頭腫ウイルス(BPV-1)、またはエプスタイン-バーウイルス(pHEBo、pREP-由来およびp205)のようなウイルスから取り出して作った誘導体を、真核細胞におけるタンパク質の一過性発現に使用することができる。他のウイルス(レトロウイルスを含む)発現系は、下記の、遺伝子治療送達系の記述のなかで見出すことができる。プラスミドの調製および宿主生物の形質転換で利用できる種々の方法は、当技術分野においてよく知られている。原核細胞と真核細胞の双方に適した他の発現系、ならびに一般的な組換え操作手順については、Molecular Cloning: A Laboratory Manual、第2版、Sambrook、FritschおよびManiatis(編) (Cold Spring Harbor Laboratory Press, 1989) 第16および17章を参照されたい。場合によっては、バキュロウイルス発現系を利用して、組換えアドザイム・ポリペプチドを発現させることが望ましいかもしれない。そのようなバキュロウイルス発現系の例には、pVL-由来ベクター(例えば、pVL1392、pVL1393およびpVL941)、pAcUW-由来ベクター(例えば、pAcUW1)、およびpBlueBac-由来ベクター(例えば、β-galを含むpBlueBac III)が含まれる。
さらに他の態様として、主題の発現構築物は、組換えレトロウイルス、アデノウイルス、アデノ随伴ウイルス、および単純ヘルペスウイルス-1を含むウイルスのベクター、または組換え細菌プラスミドもしくは真核細胞プラスミドへの主題の遺伝子の挿入により得られる。以下により詳細に記述するように、そのような態様の主題の発現構築物は、特に、さまざまなインビボおよびエクスビボ遺伝子治療手順で用いることが意図される。
レトロウイルスベクターおよびアデノ随伴ウイルスベクターは一般に、インビボで外来性遺伝子を特に、ヒトへ移送するのに最適な組換え遺伝子送達系であると理解されている。これらのベクターにより、細胞への遺伝子の効果的な送達が得られ、そして遺伝子導入された核酸は、宿主の染色体DNAに安定的に組み込まれる。レトロウイルスの使用の前提条件は、特に、細胞集団における野生型ウイルスの伝播の可能性に関して、その使用の安全性を確実にすることである。複製能欠損型レトロウイルスのみを産生する特殊化した細胞株(「パッケージング細胞」と呼ばれる)の開発により、遺伝子治療に対するレトロウイルスの利用性が高まっており、欠損型レトロウイルスは、遺伝子治療を目的とした遺伝子導入で用いるのに十分に特徴付けられている(概説としては、Miller, A.D. (1990) Blood 76:271を参照されたい)。従って、レトロウイルスのコード配列(gag、pol、env)の部分を、本発明のアドザイム・ポリペプチドをコードする核酸に置き換えた組換えレトロウイルスを構築することで、レトロウイルスの複製を不完全にさせることができる。次いで、複製能欠損型レトロウイルスを、ヘルパーウイルスを利用して標的細胞に感染させるために使用され得るビリオンの中に、標準的な技術によりパッケージングする。組換えレトロウイルスを産生するためのおよびそのようなウイルスをインビトロでまたはインビボで細胞に感染させるための操作手順は、Current Protocols in Molecular Biology, Ausubel, F.M.ら(編) Greene Publishing Associates, (1989), 第9.10〜9.14節および他の標準的な実験マニュアルのなかで見出すことができる。適当なレトロウイルスの例には、当業者によく知られているpLJ、pZIP、pWEおよびpEMが含まれる。レトロウイルスは、神経細胞、上皮細胞、内皮細胞、リンパ球、筋芽細胞、肝細胞、骨髄細胞を含む、多くの異なる細胞型に、インビトロでおよび/またはインビボで種々の遺伝子を導入するのに使用されている(例えば、Eglitisら、(1985) Science 230:1395〜1398; DanosおよびMulligan, (1988) PNAS USA 85:6460〜6464; Wilsonら、(1988) PNAS USA 85:3014〜3018; Armentanoら、(1990) PNAS USA 87:6141〜6145; Huberら、(1991) PNAS USA 88:8039〜8043; Ferryら、(1991) PNAS USA 88:8377〜8381; Chowdhuryら、(1991) Science 254:1802〜1805; van Beusechemら、(1992) PNAS USA 89:7640〜7644; Kayら、(1992) Human Gene Therapy 3:641〜647; Daiら、(1992) PNAS USA 89:10892〜10895; Hwuら、(1993) J. Immunol. 150:4104〜4115; 米国特許第4,868,116号; 米国特許第4,980,286号; PCT出願国際公開公報第89/07136号; PCT出願国際公開公報第89/02468号; PCT出願国際公開公報第89/05345号; およびPCT出願国際公開公報第92/07573号を参照されたい)。
さらに、ウイルス粒子の表面上のウイルスパッケージングタンパク質を改変することで、レトロウイルスのおよび従ってレトロウイルスに基づくベクターの感染範囲を制限することが可能であることが明らかにされている(例えば、PCT公開
国際公開公報第93/25234号、国際公開公報第94/06920号および国際公開公報第94/11524号を参照されたい)。例えば、レトロウイルスベクターの感染範囲を改変するための戦略には、ウイルス外皮タンパク質への細胞表面抗原に特異的な抗体の結合(Rouxら、(1989) PNAS USA 86: 9079〜9083; Julanら、(1992) J. Gen Virol 73:3251〜3255; およびGoudら、(1983) Virology 163: 251〜254)、またはウイルス外皮タンパク質への細胞表面リガンドの結合(Nedaら、(1991) J. Biol. Chem. 266: 14143〜14146)が含まれる。結合は、アドザイム・ポリペプチド(例えば、一本鎖抗体/外皮ポリペプチドのアドザイム)の作製によるほか、タンパク質または他の種類(例えば、外皮タンパク質をアシアロ糖タンパク質に変換するラクトース)との化学的架橋結合の形態とすることができる。この技術は、特定の組織型との感染を制限するかまたはその反対に誘導するのに有用である一方で、エコトロピックベクターをアンホトロピックベクターに変換するために利用することもできる。
本発明で有用な別のウイルス遺伝子送達系では、アデノウイルス由来のベクターを利用する。アデノウイルスのゲノムを、そのゲノムは関心のある遺伝子産物をコードしているが、しかし正常な溶菌型のウイルス生活環で複製するその能力という点では不活性であるように、操作することができる(例えば、Berknerら、(1988) BioTechniques 6: 616; Rosenfeldら、(1991) Science 252: 431〜434; およびRosenfeldら、(1992) Cell 68: 143〜155を参照されたい)。アデノウイルス菌株Ad5型dl324または他のアデノウイルス菌株(例えば、Ad2、Ad3、Ad7など)由来の適当なアデノウイルスベクターは、当業者によく知られている。組換えアデノウイルスは、これらが非分裂細胞に感染できないことや気道上皮細胞(上記に引用のRosenfeldら、(1992))、内皮細胞(Lemarchandら、(1992) PNAS USA 89:6482〜6486)、肝細胞(HerzおよびGerard, (1993) PNAS USA 90:2812〜2816)および筋肉細胞(Quantinら、(1992) PNAS USA 89:2581〜2584)を含む、多種多様な細胞型に感染させるのに使用できるという点で、特定の環境において有利になる可能性がある。さらに、そのウイルス粒子は比較的、安定であり且つ精製および濃縮しやすく、上記のように、感染性の範囲に影響を及ぼすために改変することができる。さらに、導入されたアデノウイルスDNA(およびその内部に含まれる外来性DNA)は、宿主細胞のゲノム中には組み込まれずに、エピソームのままであるため、導入されたDNA(例えば、レトロウイルスDNA)が宿主ゲノム中に組み込まれた位置での挿入突然変異の結果として起こり得る潜在的な問題を回避することができる。さらに、外来性DNAに対するアデノウイルスゲノムの積載能力は、他の遺伝子送達ベクターに比べて大きい(最高8キロベースまで)(Berknerら、前掲; Haj-AhmandおよびGraham (1986) J. Virol. 57:267)。現在使用されておりおよび従って本発明に好ましい複製能欠損型アデノウイルスベクターのほとんどは、ウイルスE1およびE3遺伝子の全てまたは一部が欠失されているが、しかしアデノウイルスの遺伝物質の80%も保持している(例えば、Jonesら、(1979) Cell 16: 683; Berknerら、前掲; およびGrahamら、Methods in Molecular Biology中、E.J. Murray(編) (Humana, Clifton, NJ, 1991) 第7巻 109〜127頁を参照されたい)。組み込まれたキメラ遺伝子の発現は、例えば、E1Aプロモーター、主要後期プロモーター(MLP)および関連したリーダー配列、ウイルスE3プロモーター、または外来的に付加されたプロモーター配列の制御下とすることができる。
主題のキメラ遺伝子の送達に有用なさらに別のウイルスベクター系は、アデノ随伴ウイルス(AAV)である。アデノ随伴ウイルスは、効率的な複製および増殖型の生活環のためのヘルパーウイルスとして、アデノウイルスまたはヘルペスウイルスのような、別のウイルスを必要とする天然に存在する欠損ウイルスである(概説としては、Muzyczkaら、Curr. Topics in Micro. and Immunol. (1992) 158:97〜129を参照されたい)。このウイルスは、そのDNAを非分裂細胞に組み込みことができる数少ないウイルスのうちの一つでもあり、安定な組み込みを高頻度に示す(例えば、Flotteら、(1992) Am. J. Respir. Cell. Mol. Biol. 7 :349〜356 ; Samulskiら、(1989) J. Virol.63:3822〜3828; およびMcLaughlinら、(1989) J. Virol. 62:1963〜1973を参照されたい)。AAVのわずか300塩基対しか含まないベクターをパッケージングすることができおよび統合することができる。外来性DNAのためのスペースは、約4.5 kbに限定される。Tratschinら、(1985) Mol. Cell. Biol. 5:3251〜3260に記述されているようなAAVベクターを使用して、DNAを細胞に導入することができる。AAVベクターを用いて、さまざまな核酸が異なる細胞型に導入されている(例えば、Hermonatら、(1984) PNAS USA 81:6466〜6470; Tratschinら、(1985) Mol. Cell. Biol. 4:2072〜2081; Wondisfordら、(1988) Mol. Endocrinol. 2:32〜39; Tratschinら、(1984) J. Virol. 51:611〜619; およびFlotteら、(1993) J. Biol. Chem. 268:3781〜3790を参照されたい)。
遺伝子治療に応用できる他のウイルスベクター系が、ヘルペスウイルス、ワクシニアウイルス、およびいくつかのRNAウイルスから得られている。特に、ヘルペスウイルスベクターにより、中枢神経系および眼組織の細胞に組換え遺伝子を残留させるための特有の戦略が得られる(Peposeら、(1994) Invest Ophthalmol Vis Sci 35:2662〜2666)。
ウイルス送達法に加えて、上記に説明したもののように、非ウイルス(送達)法を利用して、動物の組織でタンパク質の発現をもたらすこともできる。ほとんどの非ウイルス遺伝子導入法は、高分子の取り込みおよび細胞内輸送ために哺乳動物細胞が利用する通常の機構に依存する。好ましい態様として、本発明の非ウイルス遺伝子送達系は、標的細胞による遺伝子の取り込みのためのエンドサイトーシス経路に依存する。このタイプの典型的な遺伝子送達系には、リポソームに由来する系、ポリリジン複合体、および人工ウイルス外皮が含まれる。
典型的な態様として、アドザイム含有ポリペプチドを、表面に正電荷を持つリポソーム(例えば、リポフェクチン)の中に閉じ込めることができ、そして(任意に)これを標的組織の細胞表面抗原に対する抗体で標識する(Mizunoら、(1992) No Shinkei Geka 20:547〜551; PCT公開国際公開公報第91/06309号; 日本国特許出願第1047381号; および欧州特許公開第EP-A-43075号)。例えば、神経膠腫細胞のリポフェクションは、神経膠腫関連抗原に対するモノクローナル抗体で標識したリポソームを用いて行うことができる(Mizunoら、(1992) Neurol. Med. Chir. 32:873〜876)。
さらに別の例証となる態様として、遺伝子送達系には、ポリリジンのような遺伝子標的化部分と架橋結合された抗体または細胞表面リガンドが含まれる(例えば、PCT公開国際公開公報第93/04701号、国際公開公報第92/22635号、国際公開公報第92/20316号、国際公開公報第92/19749号、および国際公開公報第92/06180号を参照されたい)。例えば、主題の遺伝子構築物のうちのいずれかを使用して、ポリカチオン、例えば、ポリリジンに結合された抗体を含む可溶性ポリヌクレオチドリンカーにより、インビボの特定細胞に遺伝子導入することができる(米国特許第5,166,320号を参照されたい)。また、当然のことながら、エンドサイトーシスを介した主題の核酸構築物の効率的な送達は、エンドソーム構造からの遺伝子の漏出を促進させる薬剤を用いて向上させることができる。例えば、アデノウイルス全体またはインフルエンザHAの遺伝子産物の膜融合ペプチドを、DNA含有エンドソームの効率的な破壊を引き起こすための送達系の一部として利用することができる(Mulliganら、(1993) Science 260〜926; Wagnerら、(1992) PNAS USA 89:7934; およびChristianoら、(1993) PNAS USA 90:2122)。
臨床の場面で、遺伝子送達系を、それぞれが当技術分野においてよく知られている、多数の方法のうちのいずれかによりに患者の体内に導入することができる。
例えば、遺伝子送達系の医薬品を全身的に、例えば、静脈内注射により導入することができ、そして標的細胞における構築物の特異的形質導入が、遺伝子送達媒体により得られる遺伝子導入の特異性、遺伝子の発現を制御する転写調節配列による細胞型もしくは組織型発現、またはその組み合わせから優位に起こる。他の態様として、動物への導入をかなり局所化することで、遺伝子の初期送達をいっそう制限する。例えば、遺伝子送達媒体をカテーテルにより(米国特許第5,328,470号を参照されたい)または定位的注入により(例えば、Chenら、(1994) PNAS USA 91: 3054〜3057)導入することができる。
本発明を以下の実施例によりさらに説明するが、それらは限定であると解釈されるべきではない。本明細書中に引用される全ての参考文献、特許書類および公表された特許出願書類の中身、ならびに図面および配列一覧表は、参照として本明細書に組み入れられる。
実施例
以下の実施例は、例示のみを目的としており、いかなる点においてであれ、限定するものと見なされるべきではない。
実施例1 アドレスおよび酵素ドメインの化学的架橋結合
アドザイムは、少なくとも二つの方法で、つまり(A) 化学的架橋結合によりおよび(B) 組換えDNA技術により作製することができる。
架橋結合は、当技術分野においてよく知られる技術により行われる。手短に言えば、一方のタンパク質ドメインのN末端(または表面の利用可能なリジン)をSPDPと反応させ、その一方で、もう一方のタンパク質ドメインのN末端(または表面の利用可能なリジン)をSMCCと反応させる。その後、二つのドメインを反応させ、このようにして、ドメインを連結するジスルフィド架橋を形成させる。このような方法で連結させた場合、二つのドメイン間の推定距離は、約14Åである。
グルタルアルデヒドを使用して、一方のタンパク質のN末端をもう一方のタンパク質のC末端と架橋結合させることもできる。
化学的架橋結合に関して当技術分野においてよく知られるこれらの方法および類似の方法を利用して、アドレス(例えば、下記のscFv Ab)を触媒ドメイン(例えば、トロンビンまたはその酵素前駆体)と連結させることができる。
実施例2: モデルアドザイムの実験系
両ドメイン(アドレスドメインおよび触媒ドメイン)の機能を維持し且つより高い標的特異性を与えるアドザイム(例えば、二官能性タンパク質)を作製するため、本出願人らは、プレトロンビンを酵素ドメインとしておよびインフルエンザウイルスのヘマグルチニン(血球凝集素)ペプチド(HA) [18]に特異的な一本鎖抗体をアドレスドメインとして用い、以下のモデルアドザイムの実験系を設計した。そのようなアドザイムは、酵素ドメイン単独のタンパク質分解活性と比較して、アドレスドメインが結合した基質に対するタンパク質分解活性が増大していた。タンパク質分解性のアドザイムは、不活性な酵素前駆体として発現され且つ精製される。しばしば、酵素前駆体は、触媒部位を遮断するアミノ末端配列を有する。特定の活性部位での切断により、遮断ペプチドが取り除かれて、プロテアーゼの活性化につながる。活性化により、アドザイムの二つのドメインが切り離されないことを確実にするため、酵素ドメインは、アドレスドメインに対しN末端に配置されることが好ましい。以下の実施例により、アドレスドメインのみ、酵素ドメインのみおよび柔軟性のあるポリペプチドリンカーを介してアドレスドメインと酵素ドメインとを結合させたアドザイムを含む成分の構築、発現および精製(以下の図4および5を参照されたい)が記述される。部分的に一段階精製した後、これらの組換えタンパク質を活性化させて、アドレスドメインの結合部位を含んだまたは欠失した基質に対するタンパク質分解活性について調べた。略図によるモデルアドザイムおよび個々の成分を図4に示す。
図4の場合、異種発現系からの分泌を可能とするように設計したN末端のリーダーペプチドと免疫検出および精製を可能とするC末端のタンデムのmycおよびHis6タグとを含んだ、pSecTag2Aベクター系(Invitrogen, Carlsbad, CA)の中で、全ての成分を組み立てた。アドレスドメインは、インフルエンザウイルスのヘマグルチニン(HA)エピトープDVPDYA (SEQ ID NO:) [18]を認識した、モノクローナル抗体mAb26/9由来の一本鎖抗体(scFvαHA)とした。酵素ドメインは、プレトロンビン(ヒトプレトロンビンの残基315〜622; アクセッション番号AAC63054)、つまり第Xa因子を用いて活性化できるトロンビンの酵素前駆体とした。アドレスおよび酵素ドメインは、15アミノ酸のリンカー([GGGGS]3, SEQ ID NO:)で連結させた。DVPDYA (SEQ ID NO:)および次善最適のトロンビン切断部位(例えば、GGVR, SEQ ID NO:)を含む標的に対して試験した場合、アドザイムのトロンビンドメインは、scFvドメイン(アドレスドメイン)によるDVPDYA (SEQ ID NO:)との結合を介して達成されるペプチドの高い局所濃度により、切断の促進を示す。
アドザイムのN末端およびC末端融合体の双方を種々のタグ(myc、His6、V5)で作製する。異なるリンカーの組成および長さを使う。例えば、以下の構築物を作製することができる: トロンビン-タグ-COOH; scFvαHA-タグ-COOH; N-トロンビン-リンカー-scFvαHA-タグ-COOH; N-scFvαHA-リンカー-トロンビン-タグ-COOH; N-scFvαHA-リンカー-トロンビン-リンカー-scFvαHA-タグ-COOH; またはscFv抗-HAとともに二つのトロンビン単位をタンデムに有する構築物。
HAエピトープに対する一本鎖抗体およびプレトロンビンを、Invitrogenから得たpSecTag2AベクターのHindIIIおよびXhoI部位に個別にクローニングして、その後の生化学的な性質決定のため、培地中に分泌されるタンパク質を産生させる。プレトロンビンは、第Xa因子またはエカリンにより活性化される不活性型である。プレトロンビン(G
4S)
3-scHAおよびscHA(G
4S)
3-プレトロンビンを、重複/組換えPCR(下記の表Xに記述されるオリゴを用いて)により組み立てて、HindIIIおよびXhoI断片としてpSecTag2Aベクターにクローニングする。これらは、C末端にタグとしてmycおよびHis
6を含んでいるものと思われる。斜線は、シグナルペプチドで切断の起こる箇所を示す。プレトロンビン(G
4S)
3scFvαHAのアミノ酸配列は、以下である。
pSecTag2から作製したときのscHA(G
4S)
3プレトロンビンのアミノ酸配列は、以下である。
試験した基質には、以下が含まれる: S1、つまりscFvαHAにより認識される高親和性のエピトープ
が、タンパク質分解の標的部位に連結されている
; およびS2、つまりタンパク質分解の標的のみ(PT: NH
2-GGVR-p-ニトロアニリド)。基質の結合および切断配列を変えながら他の合成ペプチド基質も作製した。トロンビン切断部位は、Backesら、(2000) Nature Biotechnology 18:187〜193の教示に基づいて選択した。代替選択物には、最良の切断部位としてIle-Thr-Pro-Argおよび不十分な標的としてIle-Thr-Leu-Argが含まれる。
トロンビン活性による基質中のArg残基とp-ニトロアニリドとの間のペプチド結合の切断により、遊離型のp-ニトロアニリン(pNA) (これは、分光光度の監視により405 nmで可視の黄色を有する)が放出される。
2.1. モデルアドザイム成分の産生: 構築、発現、精製および活性化
成分は、下記のように、pSecTag2Aベクターに構築し、哺乳動物細胞で一過性に発現させて、条件培地から精製した。
手短に言えば、哺乳動物発現ベクターpSecTag2A(カタログ番号V90020; Invitrogen, Carlsbad, CA)を全ての構築物の骨格として使用した。ポリリンカーの上流はマウスIgκ鎖V-J2-Cシグナルペプチドであり、下流はmycおよびHis6タグ、TAA停止コドンならびにウシ成長ホルモンポリアデニル化シグナルである。このベクターの他の注目すべき特徴は、挿入されたコード配列ならびに選択可能マーカーのゼオシンおよびアンピシリンの発現を誘導するサイトメガロウイルス(CMV)プロモーターである。個々の成分に相当するcDNAをPCRにより産生させて、5'末端のHindIIIおよび3'末端のXhoIを利用して、読み枠を維持するようにポリリンカーに直接的にクローニングした。アドレス成分(scFvαHA)は、scFvαHA(engeneOS, Waltham, MA)のコード配列を含む鋳型プラスミドから増幅させた; プレトロンビンは、完全長のヒトcDNAクローン(ResGen; カタログ番号FL1001)から増幅させた、および; アドザイムは、N末端のプレトロンビンドメインとC末端のアドレスドメインとの間に15アミノ酸のリンカー(GGGGS)3 (SEQ ID NO:)を挿入するように設計した重複PCRにより作製した。全ての構築物を配列確認した。
一過性の形質導入は、T175フラスコの中で培養した293T細胞2×106個で、Fugene (Roche, Indianapolis, IN)を用いて行った。分泌された成分を含むフラスコ6個から条件培地を、発現が最大量に到達した時点(第4、5または7日目、つまり構築物に依存)で回収し、50 mM NaH2P04、300 mM NaCl、5 mMイミダゾール(緩衝液A)に対して、4℃で一晩、緩衝液を一度交換しつつ浄化および透析した。精製のため、透析した上清をNi-NTA (Qiagen, CA)樹脂と(透析した上清200 ml当たりスラリー状の樹脂0.4 mlまたは0.8 ml)、4℃で16時間インキュベートした。得られたスラリーを600 gで4℃にて10分間遠心した。上清を除去し、「素通り」の試料として取っておいた。次いで、結合したタンパク質を含む樹脂を緩衝液A 10 mlに再懸濁し、3回洗浄(各4℃で10分)して、ビーズを3 mm径のWhatmanろ紙付きの3 ml シリンジの上に手動で添加した。50 mM NaH2P04、300 mM NaCl、1 Mイミダゾールで、溶出(各0.5〜1 ml)を3回行った。溶出した材料物質を、保存のためリン酸緩衝生理食塩水の中でまたは第Xa因子を用いた活性化のためTris緩衝生理食塩水 + 1 mM CaCl2の中で透析した。
図5に示されるように、モデルアドザイムのプレトロンビン-(GGGGS)3-scFvαHA (SEQ ID NO:)を293T細胞で一過性に発現させて、条件培地を第7日目に回収した。材料物質を上記のように処理し且つ精製した。各分画の等価な分量に相当する試料を4〜20%ポリアクリルアミドゲルに添加して、Tris-グリシン-SDS緩衝液(Novex)中で電気泳動した。パネルA: ウエスタンブロット-電気泳動後、ゲルをニトロセルロース膜に電気的にブロットし、その膜を抗-myc抗体(Invitrogen, Carlsbad, CA)で染色した。レーン(1) ロード; (2) 素通り; (3) 洗浄液1; (4) 洗浄液3; (5) 溶出液1; (6) 溶出液2; (7) 溶出液3; (8) サンプルローディングバッファー中で煮沸した樹脂; (9) Cruz分子量マーカー(Santa Cruz Biotechnology, Santa Cruz, CA)。パネルB: 銀染色したゲル。レーン(1) 出発物質; (2) 素通り; (3) 洗浄液1; (4) 洗浄液3; (5) 分子量標準物質SeeBlue Plus 2; (6) 溶出液1; (7) 溶出液2; (8) 溶出液3; (9) サンプルローディングバッファー中で煮沸した樹脂; (10) 分子量標準物質SeeBlue Plus 2。
モデルアドザイム調製物の電気泳動分析の例を図5に示す。分泌された完全長のアドザイムが、予想通り、抗-myc抗体で〜70 kDa(パネルA)に検出された。この分析のなかで銀染色したゲル(パネルB)に基づくと、推定されるアドザイム純度は約10〜20%である。並行して産生した個々のアドレスおよび酵素成分は、モデルアドザイムと同様の収率および純度であった(データは示されていない)。
酵素ドメインを含有する精製アドザイム成分は、プレトロンビンをArg 320で切断し、その結果、N末端からの49個のアミノ酸軽鎖を放出させて、259アミノ酸の活性なトロンビン重鎖を産生する、第Xa因子を用いて活性化した。図6に示した例の場合、ウエスタンブロットによる活性化処理から、第Xa因子を用いた活性化によって、予想通り、モデルアドザイムの分子量が〜6 kDaだけ減少したことが示された。
具体的には、精製したプレトロンビンおよびアドザイム成分を、50 mM Tris pH 8、0.1 M NaCl,1mM CaCl2に対して4℃で一晩透析し、その後、タンパク質濃度を決定した。活性化は、ビオチオン化第Xa因子(Roche)を用いて行った。本出願人らは、活性化されるプレトロンビンの推定純度(〜10%)を明らかにする操作手順を適応し、これにより、ビオチオン化第Xa因子1 μgを総タンパク質4.44 μgにつき、室温で3時間使用した。活性化後、ビオチオン化第Xa因子をキットに付属のストレプトアビジンビーズにより除去し、そして活性化成分を、ウエスタンブロットにより分析し、生化学試験(下記を参照されたい)に使用した。
図6に示されるように、本発明者らのモデルアドザイム調製物(図5を参照されたい)を、第Xa因子による活性化の前後で抗-myc抗体を用いてウエスタンブロットにより分析した: TBS中で透析した部分精製モデルアドザイム(レーン1); 第Xa因子による活性化反応物(レーン2); 第Xa因子の除去後の活性化反応物(レーン3); 除去に使用したストレプトアビジンビーズ(レーン4); およびCruz分子量標準物質(レーン5、Santa Cruz Biotechnology, CA)。
これらの例は、本出願人らにより、組換えアドザイム成分の調製および活性化を目的とした信頼性の高い生産方法が開発されたことを実証するものである。T175フラスコ2〜6個の標準的な調製により、材料となる組換えタンパク質2〜3 mgが得られた。これらの材料物質は、下記の生化学的機能に関する分析試験の全てに十分であった。
2.2. アドザイムの結合および酵素活性の特徴付け
アドレスドメイン、酵素ドメインおよびアドザイムの特性(表1を参照されたい)の有意義な比較を確実にするため、本出願人らは、1) 標的エピトープとの結合を測定する; 2) 十分に特徴付けられた標準物質と活性を比較するおよび; 3) 対照基質に対しタンパク質分解活性を標準化するために設計した一連の対照実験を完成させた。
標的エピトープとの結合
本実験により、アドザイムのアドレスドメインの結合特性を評価した。本出願人らは、ビオチオン化ペプチドを用い、サンドイッチELISA形式で種々の成分の結合活性を評価した。精製した成分をPBSに対して透析し、抗-myc抗体(mAb 9E10; Sigma)でコーティングしたプレートに捕捉し、次いで、高親和性エピトープ(下線)を含んだビオチオン化標的ペプチド
との結合ついてELISA法により分析した。結合したペプチドをストレプトアビジン-西洋ワサビペルオキシダーゼ検出系(Quantablue; Pierce, Rockford, IL)により定量化した。アドレスドメインのみならびに活性化型および酵素前駆体型双方のアドザイムは、1モル当たりかなりの量のペプチドを結合した。しかしながら、酵素ドメインのみでは、予想通り、測定可能な量のペプチドを結合できなかった。
モデルアドザイムの血栓溶解活性
モデルアドザイムのタンパク質分解活性を特徴付けることで、アドレスドメインまたはポリペプチドリンカーのどちらかが、その酵素特性に影響を及ぼすかどうかを決定するのに役立つ。
本出願人らは、市販のトロンビン調製物(Sigma, St Louis, Mo)に対するモデルアドザイムの活性をトロンビンのトリペプチド基質の標準的な蛍光または比色誘導体、つまりトシル-gly-pro-arg-(p-ニトロアニリン、pNAまたはアミノメチルクマリンAMC、Sigma)に関して比較した。キュベットベースの蛍光アッセイで5分間の経時変化に対して活性を監視した。そのアッセイでは、放出されたフルオロフォアのAMC(383 nmで励起、455 nmで発光)をPerkin Elmer LS55分光蛍光光度計中で測定した。遊離型AMCに対する標準曲線に基づき、任意の蛍光単位 対 時間に関して得られたデータを単位時間当たりに加水分解された基質分子に変換した。反応速度を基質濃度の範囲(0〜50 μM)にわたって決定し、そしてトリペプチド基質に対するKm値をLine-Weaver-Burkeプロットにより決定した。これらの研究から、市販のヒト・トロンビンおよび活性化したモデルアドザイムは、この標準基質に対して同程度のKm値、つまりそれぞれ4.2 μMおよび3.9 μMを有し、その値は、文献値と十分一致していた。
第二に、本出願人らは、基質S1およびS2に対するトロンビンの特異性定数(Kcat/Km)を決定した。どちらの基質にもトロンビン切断部位が含まれており、そして基質S1にはまた、抗-HA一本鎖抗体により認識される高親和性エピトープも含まれている。S1 (HAE-PT)またはS2 (PT)に対するトロンビンの選択性の有意な相違には、別の対照基質の選択が必要になるものと思われる。本出願人らは、濃度範囲3 μM〜25 μMの基質S1およびS2の蛍光誘導体に対し、標準的なヒト・トロンビン調製物(Sigma)のタンパク質分解活性を異なる2濃度(0.0033 NIH 単位/mlおよび0.01 NIH 単位/ml)で測定した。本出願人らは、トシル-GPR-AMC基質のKm値を決定するために利用した同じ操作手順(上記を参照されたい)に従った。KmおよびVmax値は、Line-Weaver-Burkeプロットから算出した。活性のおよび全体の酵素濃度(Etotal)は、活性部位の不可逆的阻害剤D-Phe-Pro-Arg-クロロメチルケトン (D-FPR-CMK)を用いた活性部位の滴定から決定した。これらの実験により、Sigma社のトロンビンのタンパク質分解活性に関する0.0033 NIH 単位/mlおよび0.01 NIH 単位/mlでの絶対的酵素濃度(Etotal)の計算のためのデータが得られた。これらのデータから、本出願人らは、Kcat = Vmax/ Etotalを算出し、それからS1およびS2それぞれに対し、8.9 μM-1sec-1および10.3 μM-1sec-1として基質に対する特異性定数Kcat/Kmを導いた。これらの値が互角であったことから、トロンビンはそれぞれの基質に、等価な選択性およびタンパク質分解活性で作用していたことが示唆された。このように、高親和性エピトープは、トロンビン活性に影響を及ぼさない。
タンパク質分解活性の標準化
本出願人らは、モデルアドザイムのトロンビン-(GGGGS)3scFvαHAの酵素活性を標準的なヒト・トロンビンに関して定量化することを必要とした。高親和性のHA結合部位を欠いた、市販のトリペプチドであるトシル-GPR-pNA (Sigma)を基質として使用した。Arg残基の後ろのペプチド結合の切断により、405 nmで可視的な発色団p-ニトロアニリン(pNA)が放出される。本出願人らは、第Xa因子で活性化前後のアドザイム成分の相対的なタンパク質分解活性を、その成分1 ml当たりのトロンビン活性の単位として決定した。第Xa因子は、市販の基質に対し活性がない。そのような実験の一つから得られたデータが、以下の図7に示されている。これにより、アドザイム調製物の酵素活性に基づく標準化ならびに基質S1およびS2に対するアドザイムと市販の天然型トロンビンの等価な活性の比較が可能となった。
具体的には、図7に示されるように、タンパク質分解活性は、市販の酵素標準物質(3.3 nMヒトαトロンビン、Sigma)に対してさまざまな量の試験成分を用い、Spectramaxプレートリーダー(Molecular Devices)にて吸光度405 nmでpNAの放出を監視することにより、プレート形式で決定した。遊離型p-ニトロアニリンに対する標準曲線に基づき、吸光度単位 対 時間に関して得られたデータを単位時間当たり酵素1分子について加水分解された基質分子に変換した。
本実験の結果から、このモデルとなるアドザイム調製物トロンビン-(GGGGS)3scFvαHAは: 1) 活性化前には検出可能な活性がないおよび; 2) 標準的なトロンビン調製物に対して標準化することができる-この場合、5 μl/ml活性化モデルアドザイムが3.3 nM (0.1 NIH U/ml)トロンビンに等価であることが明らかになった。D-FPR-CMKを用いた活性化試料の活性部位の滴定から、標準化が独立的に検証された。それ故、アドザイム調製物のタンパク質分解活性が、トロンビン標準物質に対して標準化された。
要約すれば、これらの対照実験から、以下のことが明らかになった: 1) アドレスドメインを介した高親和性エピトープとの結合および酵素ドメインの連結によって、結合活性は阻害されなかった; 2) 活性化したモデルアドザイムのトロンビン-(GGGGS)3scFvαHAは、標準的なトロンビン基質に対し、トロンビンに匹敵するKm値を有していた; 3) トロンビンは、基質S1およびS2に対して等価な特異性を有していた; 4) 検出可能なタンパク質分解活性を得るには、第Xa因子を用いた活性化が必要とされた; および5) 本出願人らにより、アドザイム調製物のタンパク質分解活性を市販のトロンビン標準物質に対して標準化することが可能になった。この一連の対照実験により、アドレスドメインに対する高親和性エピトープを含んだまたは欠いた基質に関して、アドザイムおよび単離した成分を試験するおよび比較するための基礎が得られた。
2.3. アドザイムの機能試験
本出願人らにより、アドザイム、つまりプレトロンビンの酵素ドメインが15アミノ酸のポリペプチドにより、アドレスドメインとして、HAエピトープに対する一本鎖抗体に連結された、トロンビン-(GGGGS)3scFvαHAが設計された。トロンビンは、HAエピトープを結合しないまたは切断しないが、しかしながらその標的とする基質部位GGVR (SEQ ID NO:)を、S1との関連であれS2との関連であれ、同じ親和性で結合する。トロンビン-scFvαHAアドザイムのなかの活性化トロンビン成分も同様に、S1のGGVR (SEQ ID NO:)を同じ親和性で結合する; しかしながら、アドザイムの概念から、抗-HA抗体に結合されたトロンビンは、抗体の典型的な高い親和性でHAエピトープを含有する基質に結合して、アドザイムの反応速度に影響を及ぼし得ることが予想される。アドザイムはトロンビンと比較して、酵素活性を増大させた可能性が予想された。
トロンビンまたはトロンビン-(GGGGS)3scFvαHAアドザイムとともに基質S1およびS2を用いた反応速度実験の場合; 以下のことが予想される: 1) アドレスドメインのみ(A)では、両基質に対して不活性(-)である; 2) 酵素のみ(B)およびアドザイム(D)は、トロンビン切断部位のみの基質S2に対して等価な(+)タンパク質分解活性を有する; 3) アドザイムは、基質S2に対するよりもまたは両基質に対する酵素のみ(+)よりも基質S1(S1は、高親和性エピトープとトロンビン切断部位の双方を有する)に対して活性が高い(+++); ならびに5) 連結されていないアドレスドメインと酵素ドメインとの化学量論的混合物(C)は、両基質に対して酵素ドメインのみと等価(+)であり(表1を参照されたい)且つアドザイムよりも(活性が)低い。
(表1) 直線状のペプチド基質に対して試験したモデルアドザイムのトロンビン-(GGGGS)
3scFvαHAおよび構成成分
アドザイム活性はアドレスドメインにより誘導される
トロンビンのみ(B)に対するモデルアドザイム(D)のタンパク質分解活性は、アドレスドメインに対する高親和性エピトープを含んだ(S1上)または欠いた(S2上)基質に関して比較した。この実験の結果は、以下の図8に示されている。
具体的には、図8の場合、基質S1およびS2からのタンパク質分解によるpNAの放出は、石英キュベット中の2分間の経時変化を吸光度405 nmで監視することにより追跡した。反応は、標準化実験で決定した、適合させた活性な酵素濃度(3.3 nM)(図6を参照されたい)を含有するトロンビンランニング緩衝液(50 mM Tris-HCl pH 8、0.1 M NaCl、0.1% ポリエチレングリコール8000)のなかで行った。反応は、25 μMまで基質を添加して開始させた。
トシル-GPR-pNA基質を用いて決定しおよび従って標準化した、活性化したトロンビン-(GGGGS)3scFvαHAアドザイムおよび活性化した市販のトロンビンの等価な活性をS1およびS2に対して試験した。図8に示されるように、アドザイムとトロンビン双方に対する反応速度は、どちらのアドザイム調製物もトロンビンに対して標準化されていたので、予想通り、トロンビン切断部位のみを含むS2基質に関して同じである。しかしながら、予想通り、モデルアドザイムは、トロンビン切断部位に加えて高親和性エピトープを含んでいた基質S1に対してさらに高い活性を示した。反応速度が2倍に増加している。基質上にこの高親和性エピトープが存在することで、トロンビン単独の活性が変化することはなかった。活性化のない場合には、アドザイムは、検出可能なタンパク質分解活性を示さなかった。従って、トロンビン-(GGGGS)3scFvαHAアドザイムの活性の増強は、高親和性エピトープを結合することにより、酵素活性を基質に向けるアドレスドメインの存在によって促進される。
アドザイム活性の増強には、アドレスおよび酵素ドメインの連結が必要とされる アドザイム活性の増強には、同一のポリペプチド鎖でのアドレスおよび酵素ドメインの連結(D)が必要とされるかどうか、またはアドレスドメインとトロンビンとの化学量論的混合物(C)が同様に十分機能するかどうかを決定するため、本出願人らは、アドレスドメインに対する高親和性エピトープを含んだ基質S1に関し、これらの二つのタンパク質分解活性を比較した。この比較のデータは、図9に示されている。
具体的には、図9の場合、精製したアドレスドメインscFvαHAを3.3 nM(BradfordアッセイおよびCoomassie Blueで染色したゲルから推定される純度率に基づいて積算した濃度)で使用した。
この実験の結果から明らかに、別個のアドレスドメインと酵素トロンビンとをともに混合しても、モデルアドザイムで観測されたタンパク質分解速度の促進が生じなかったことが示される。興味深いことに、本出願人らは、この混合物がトロンビンよりもわずかに活性が低いことに気付いた。連結されていないアドレスドメインが、タンパク質分解の部位へのトロンビンによる接近をわずかに阻害したのかもしれない。さらに、アドレスドメインのみでは、検出可能な活性が示されなかった。従って、アドレスと酵素ドメインとを連結することで、別々のドメインの化学量論的混合物に比べて、タンパク質分解速度の協調的利益がもたらされた。
これらの研究により、予想されたアドザイムの機能が支持され且つ確認された。モデルアドザイムの設計により、個々の成分の機能は保存され且つ化学量論的混合物に比べて協調的利益がもたらされた。この技術を同様に、TNF-αまたはIL-1のような、臨床的に関連性のある標的タンパク質に特定的なタンパク質分解性のアドザイムを産生するために適用するこができる。
実施例3. TNF-αの生物活性を選択的に不活性化するアドザイム
本実施例により、TNFαの生物活性を選択的に不活性化するアドザイムの構築および最適化について記述する。
例えば、TNFαの選択的な触媒作用的不活性化を目的とした96種類のアドザイム構造体を設計して、少なくとも半分を標準的な分子生物学技術により構築する。これらのアドザイム構造体には、2種類の酵素触媒ドメイン、3種類のアドレスドメインおよび16種類のリンカーだけからなる組み合わせ(リンカーなしを含む)が含まれる。
具体的には、酵素はカチオン性トリプシンおよびMMP7である; アドレスドメインはSp55、Sp55_2.6、およびscFvである; リンカーは、アミノ酸0、10、20、30、40、または50個のリンカー(GGGGSの繰り返し単位に相当)、FcIgG1(こぶ型変異)、FcIgG1(穴型変異)、FcIgG2(こぶ型変異)、FcIgG2(穴型変異)、FcIgG3(こぶ型変異)、FcIgG3(穴型変異)、FcIgG2-(G4S)2穴型変異、FcIgG2-(G4S)4穴型変異、FcIgG2-(G4S)3穴型変異、FcIgG2-(G4S)4穴型変異である。こぶ型および穴型の変異とは、主にヘテロ二量体の二重特異性抗体を引き起こすと見なされていた、CH3ドメインの対合になる変異(S354C:T366'W/Y349C:T366S:L368'A:Y407'V)を指す(Merchantら、Nature Biotechnology, 1998, 16, 677〜681頁)。
次いで、これらのアドザイムのうちの6種類を作り出し、精製し、そして生物活性について試験する。これらのアドザイムのうちの一つまたは複数が、有用なアドザイムに不可欠な基準を満たす、つまり個々の成分の機能を保存し且つ二つのドメインのポリペプチド結合による協調的利益をもたらす。具体的には、アドザイムは、アドレスもしくは酵素のみよりも、または個々のドメインの化学量論的混合物よりもTNFαをより効果的に不活性化する。
本出願人らは、可溶性TNF受容体から選択されるアドレスドメインがヒトカチオン性トリプシンの触媒ドメインに連結されてなる、一連の3種類のTNFαを標的とするアドザイムプロテアーゼを構築し、発現させて、その最初の特徴づけを行った。産生されたアドザイムを分析して、結合およびタンパク質分解活性を定量化した。
3.1. TNFα特異的アドザイムの設計
3つの成分、つまり酵素、リンカーおよびアドレスドメインは、効果的に連携して働き、TNFαの触媒性アンタゴニストをもたらす。この特定の実施例の場合、酵素ドメインはN末端に配置されることが好ましいが、他にアドザイムを設計する場合、酵素ドメインは、融合タンパク質のC末端、場合によってはその内部とすることができる。この場合、酵素ドメインは、酵素前駆体としてコード化され、そしてTNFαを不活性化できるタンパク質分解活性を有する。アドレスドメインは、TNFαを高い選択性で結合し、そしてリンカーは、酵素とアドレスドメインとの機能的な結び付きをもたらして、TNFαの触媒作用的不活性化における協調性を補助するものと思われる。
a. 酵素ドメインの選択
市販されている、酵素前駆体として発現可能である、およびTNFαを切断し且つ不活性化すると予想されるプロテアーゼを目的とした文献および公共のドメイン・データベース(MEROPS: http://www.merops.sanger.ac.uk)の調査[19-24]により、20種類の候補プロテアーゼを選択するに至った。次いで、TNF細胞傷害アッセイを利用して、これらのプロテアーゼをTNFαの不活性化について試験した。具体的には、TNFによる機能的TNFα受容体TNFR-1の活性化[10,25]によって、アポトーシス細胞死に至る。これを細胞に基づくアッセイで定量化することができる[26]。このアッセイは、TNFαの生物活性の不活性化を目的として20種類のプロテアーゼをスクリーニングする基礎として役立った(以下、図10、表2を参照されたい)。
具体的には、図10の場合、L929マウス結合組織繊維芽細胞(ATCCカタログ♯CCL-1)を使用して、TNFαにより誘導される細胞死をPromega (Madison, WI)のCellTiter96(登録商標) AQueous One Solution Cell Proliferation Assay系で生物検定した。この系により、生細胞の数を決定するための比色法が提供される。手短に言えば、各試験プロテアーゼについて、5 μM TNFα溶液を37℃で一晩消化させて、その後、消化溶液の8回の段階希釈液について、生物活性を決定した。データは、TNFαの各希釈での3重測定の平均値である。トリプシンおよびMMP7によるTNFαの不活性化の例が、図に示されている。20種類全てのプロテアーゼに関する試験の結果が、表2に要約されている。
より具体的には、96ウェルプレートに、1ウェル当たりL929細胞10,000個を蒔き、そしてCO2湿潤インキュベーターに入れて、DMEM + 10% FBSの中で一晩培養した。アクチノマイシンDを全てのウェルに加え(終濃度1 μg/mL)、そしてウェル中で100 pg/ml〜1 μg/mlに及ぶ終濃度となるようにヒトTNFα(RDI, Flanders, NJ)を添加することで、標準的なTNFα生存曲線を作成した。TNFαのプロテアーゼ消化試料を同様に、各ウェルの一列方向に希釈かつ添加した。TNFαの各希釈液に対し、3重測定を行った。CO2湿潤インキュベーターに入れて一晩インキュベーションした後、予め混合したMTS/PES 20 μlを各ウェルに添加して、37℃で2〜4時間、インキュベーションを継続した。代謝的に活性な生細胞により、アッセイ試薬(MTS/PESには、テトラゾリウム化合物が含まれる)が、組織培養培地に可溶性の、ホルマザン産物に還元された。4時間後、プレートリーダー中で490 nmの吸光度を測定し、生細胞の数を決定した。操作手順の詳細の全てが、Promega Technical Bulletin No. 245に示されていた。
(表2) TNFαの不活性化について試験したプロテアーゼ
TNFαを試験プロテアーゼにより、37℃での一晩のインキュベーションにて消化し、その後、図10に記載の生物活性を分析した。12種類のプロテアーゼはTNFαに対して活性がなかった; 8種類はさまざまなレベルの活性を持っていた。括弧内の数値は、図10に示される曲線に類似の不活性化曲線から50%生存レベルで算出されたTNFα活性の対数(log)減少を反映している。
TNFα標準に対する生存曲線から、100 pg/ml〜10 ng/mlまでは、生存の急激な減少が示される(図10)。〜600 pg/ml TNFα参照標準の存在下では、わずか10%の細胞しか生存していない。これは、MMP7またはトリプシンで消化したTNFαの等価な希釈液に対する、それぞれ40%および70%の生存率とは対照的である。トリプシンで消化したTNFαの希釈曲線は、右方向に一貫して移動しており、TNFαの生物活性がTNFα参照標準と比べて2logを上回って低下していることが示唆された。MMP7(図10)を含む、表2に掲載の酵素全てについて、同様の研究を行った。キモトリプシンは、TNFαに対する最も活性の高いプロテアーゼであった(TNFαの生物活性が2.74log低下)。しかしながら、キモトリプシンでも同様に顕著な自己分解が示された(データは示されていない)。これは、酵素の自己切断部位を取り除くことにより改善される可能性がある(上記を参照されたい)。これらの酵素の全てが、抗-TNFアドザイムの酵素成分の候補である。
b. アドレスドメインの選択
アドレスドメインは、TNFαを高い特異性で、高い親和性で結合することが好ましいものと思われ、そして触媒ドメインによるタンパク質分解切断に抵抗性であることが好ましいものと思われる。結合ドメインの協調方法の数量モデル[27]およびトロンビンのモデルアドザイムに関する本発明者らの経験(上記)から、TNFα特異的アドザイムに適した一連の結合親和性が示唆された。アドレスドメインは、TNFαをnM程度のKaffinity値で結合する二つの別個の出所源、つまりTNFR-1 p55細胞外ドメインおよびGenetastix (San Jose, CA)から入手されるまたは標準的なディスプレイ技術から自家で作製されるTNFαに対する一本鎖抗体由来とすることできる。
sp55アドレスドメインを完全長のヒトTNFR-1の細胞外ドメインから構築し、そしてTNFαとのその結合性を特徴付けた。手短に言えば、CD120A遺伝子(アクセッション番号NM_001065; IMAGEクローン4131360, Invitrogen, Carlsbad, CA)によりコードされるヒトTNFR-1を鋳型として使用し、TNFR-1の細胞外ドメイン(タンパク質アクセッション番号P19438) [28]の残基30〜211を増幅させて、完全長のsp55を構築した。評価できる他のアドレスドメインには、sp55Δ4 (残基22〜167) [29]またはsp55ドメイン2.6 (残基41〜150) [30]のような、sTNFR-1のサブドメインを含めることができる。これらのサブドメインは、完全な細胞外ドメインよりも小さく、および従って、タンパク質分解に対する感受性が低下している。アドレスドメインの重要な機能は、標的を高い親和性で結合することであるため、TNFαとのsp55の結合を間接的ELISA形式により定量化して、機能的なアドレスドメインの存在について確認した(図11)。
手短に言えば、図11の場合、アドレスドメインを293T細胞で一過性に発現させ、そしてNi-NTAでコーティングしたウェルに捕捉した。TNFαとの結合は、S-Tag(商標)系(Novagen, Madison, WI)を用いて定量化した。S-Tag(商標)系は、西洋ワサビペルオキシダーゼ(HRP)が結合した、リボヌクレアーゼS-タンパク質との15アミノ酸のS-Tagペプチドの相互作用に基づく、タンパク質のタグ付けと検出系である。本出願人らは、N末端のS-Tag(商標)を含んだヒトTNFα融合タンパク質を構築し、発現させて、精製し、その後、この試薬(S-TNF)を使用して、sp55アドレスドメインの結合活性を定量化した(縦縞)。S-tagがないTNFαのバックグラウンド(対照)の結合が、斜線のボックスで示されている。
より具体的には、図11の場合、回収しそして遠心により清浄化した、条件培地を緩衝液(0.5 % BSA Fraction V、0.05 % Tween-20の1×PBS pH 7.4溶液)に1:10に希釈した。振盪させながら室温で1時間、発現タンパク質をNi-NTAでコーティングしたウェル(HisSorbプレート、カタログ#35061, Qiagen)に捕捉させ、それから0.05 % Tween-20の1×PBS溶液で4回洗浄して、未結合の材料物質を除去した。TNFαとの結合は、1ウェル当たり、アッセイ用緩衝液で1 μg/mLとしたS-TNF (または対照TNFα)100 μlを添加し、引き続いて、振盪させながら室温で1時間インキュベーションすることで決定した。プレートを0.05 % Tween-20の1×PBS溶液で4回洗浄し、その後、S-タンパク質HRP(アッセイ用緩衝液での1:2000の希釈液100 μL/ウェル、Novagen, Madison, WI)を添加して、振盪させながら室温でさらに1時間インキュベートした。0.05 % Tween-20の1×PBS溶液での最後の洗浄工程を4回行って、S-タンパク質- HRPを除去し、その後、HRPの基質であるテトラメチルベンジジン(TMB; Sigma T 4444, St. Louis, MO) 100 μLをウェルごとに添加した。5〜45分間、色を発色させて、その後、Spectramaxプレートリーダー(Molecular Devices)にて吸光度を370 nmで測定した。
図11から、対照試料(対照: S-TNF; 模擬の形質導入細胞から得た条件培地)での非特異的結合と比べてS-TNF結合(縦縞)が3倍に上昇していることが示される。このアッセイの場合、結合は6〜12%の条件培地で飽和するように思われ、そして希釈系列から、結合は、発現させたsp55を加えた量に比例することが示された。S-tagがないTNFαは、S-タンパク質-HRPで検出されなかった(斜線のボックス)。これらの結果から、発現させたsp55のアドレスドメインがTNFαを結合できることが示された。
アドレスドメインとしてsp55を使用する代わりとして、1種類の抗-TNFαscFV抗体をGenetastix (San Jose, CA)から入手した18種類のセットから選択できる。これらのscFV抗体は、TNFα結合活性を有するとして、Genetastixがその特許技術(www.genetastix.com)を利用して同定した。手短に言えば、ヒトscFvcDNAライブラリーは、ヒトの脾臓、リンパ節および末梢血リンパ球から、VHおよびVL配列を増幅させて、その配列をGAL4活性化ドメイン(AD)と読み枠を合わせて組み立て作製した。18種類のscFvが、ヒトTNFα-lexA DNA結合ドメインを、酵母にて細胞内に同時発現させた場合に結合するとして同定された。GenetastixのscFv発現ベクターは、細菌周辺質の発現ベクターpET25B (Novagen, Madison, WI)の形態で得られた。標準的な組換えDNA法を利用して、scFvコード配列をpSecTag2Aベクターにサブクローニングした。次いで、構築物を配列決定して、その構造を検証した。これらのscFv抗-TNFα抗体は、前にアドザイム成分について記述したように、発現させ且つ精製し、その後、TNFαとの結合について分析した。間接的ELISA法をS-Tag(商標)系(上記、図11を参照されたい)に基づいたTNFαについて利用し、アドレスドメインとして用いた場合にTNFαとの高親和性結合を示す、18種類のscFvのうちの1つを同定する。特定のscFvの選択は、さまざまな構造体のその相対結合強度のランク付けに基づく。プロトタイプのアドザイムが同定された時点で、TNFαに対する結合親和性のさらなる定量決定を含めることができる。
c. リンカーの選択
リンカーの重要な機能は、融合タンパク質の中で触媒ドメインとアドレスドメインとを連結させて、協調的な機能をもたらすことである。リンカーの長さは、実験的に調べることができる。本出願人らは、柔軟性のペンタペプチドGGGGSのトリプルリピート(または「3回の繰り返し」)により、酵素およびアドレスドメインの機能的な連結が可能になることを見出した。このリンカーは長さが、α-ヘリックス構造で23.60Åから伸張鎖で50.72Åに及び得る。初期のアドザイムは、リンカーとしてアミノ酸0個(分子内消化を最少化するため)、アミノ酸3個(AAA)およびアミノ酸20個(繰り返し4回のG
4S)で構築された。構築中のさらなるリンカー長は、繰り返し2回のG
4S(アミノ酸10個)、繰り返し6回のG
4S(アミノ酸30個)、繰り返し8回のG
4S(アミノ酸40個)および繰り返し10回のG
4S(アミノ酸50個)である。
d. アドザイム構造体
現在、哺乳動物細胞でのトリプシンの異種発現について、文献報告はない。このように、エンテロキナーゼにより活性化され得る酵素前駆体を発現させることには慎重である可能性がある。従って、トリプシノーゲンを、リーダー配列と読み枠を合わせておよびリンカーとアドレスドメインのN末端にならびにC末端のタンデムのmyc-His6タグと読み枠を合わせてクローニングした。
N-マウスIgκリーダー配列-トリプシノーゲン-0aa-sp55-myc-His6 tgn-0-sp55
N-マウスIgκリーダー配列-トリプシノーゲン-AAA-sp55-myc-His6 tgn-3-sp55
N-マウスIgκリーダー配列-(G4S)4-トリプシノーゲン-20aa-sp55-myc-His6 tgn-20-sp55
e. 触媒ドメインによるアドザイムの自己(self-)または自己(auto-)分解
触媒ドメインとしてプロテアーゼを利用するアドザイムの場合、アドレスドメイン、触媒ドメインまたはリンカーの完全性および活性に影響を及ぼし得る、自己(self-)または自己(auto-)分解に抵抗性のアドザイムを産生することが一般に好ましいものと思われる。
従って、潜在的なアドレスドメインを、プロテアーゼ攻撃に対するその感受性について試験することができる。潜在的なプロテアーゼとアドレスドメインとのセットが十分に大きいならば、プロテアーゼが標的を攻撃するが、しかしアドレスドメインを攻撃しない組み合わせがある可能性が高い。従って、潜在的アドザイムの比較的大きなライブラリーを作製して、これらの候補アドザイムのなかで、アドレスドメイン、リンカー、および酵素ドメインの最適な組み合わせをスクリーニングすることが有利であるかもしれない。一本鎖抗体は、そのβシート構造により、もともとプロテアーゼ作用に対してずっと抵抗性である可能性がある。いったん選択したら、アドレスおよび酵素ドメインの連結調整を利用して、自己分解を最少化することができる。リンカーの剛性の増大、各アドザイムドメインの自由度の制限またはアドレスおよび酵素を標的の方向に、但し相互から離して配向させるリンカードメインの適用が可能である。さらに、アドレスドメインは、一本鎖抗体のもののような、進化したタンパク質の足場に基づいて設計することができ、そしてそのような足場を、攻撃を受けやすい保存位置で再び遺伝子工学的に改変して、突然変異誘発によりプロテアーゼ感受性部位を取り除くことができる。あるいはまたは組み合わせとして、アドザイムまたはリンカー領域内のプロテアーゼ部位を、例えば、ディスプレイの進歩的技術の使用によって選択することができる。
さらに、ある種の酵素は、酵素ドメイン内の自己分解を受ける可能性がある。例えば、トリプシンはR122で自己分解を受ける。自己分解部位を突然変異させて、自己分解を防ぐことができる(例えば、R122Hは、自己分解経路の不活性化および従って遺伝性膵炎に直結する活性なトリプシンの過剰発現をもたらす、ヒト・トリプシンI遺伝子の突然変異である[31])。プロテアーゼドメインを酵素前駆体として発現させて、自己分解のレベルを最小化するおよびアドザイムを不活性型として維持することができる。アドザイムは、使用の直前に活性化することができる、またはアドザイムは、触媒部位を遮断し、その部位の効果を弱めてアドザイムを活性とできる、阻害剤とともに保存することができる。
3.2. アドザイムの産生
組換えアドザイムは、pSecTag2Aベクター系または哺乳動物細胞での一過性発現のための他の同等に機能的な系を用いて作製することができる。アドザイムは、例えば、His6タグをニッケル樹脂に結合させることにより、条件培地から精製することができる。さらなる技術的詳細は、上記の、実施例の第3.1.a.項に記述されている。本項で作製したアドザイム構築物の全ては、配列確認されている。
a. アドザイム構築物
この特定の実施例の場合、酵素ドメインは、ヒト・トリプシンの酵素前駆体であるが、ヒトMMP7を用いた類似の構築物も得られる。ヒト・トリプシンI(カチオン性トリプシン)は、PRSS1遺伝子(アクセッション#NM_002769)によりコードされる。トリプシノーゲンIのポリペプチドの触媒ドメインおよび一部分は、IMAGEクローン3950350および394971(Invitrogen, Carlsbad, CA)から増幅(残基16〜247)して、pSecTag2Aにクローニングする。活性化ペプチド(18〜94)と触媒ドメイン(95〜267)とをコードする、ヒトMMP7(アクセッション番号BC003635)の残基18〜267は、IMAGEクローン3545760 (Open Biosystems, Huntsville, AL)から増幅して、pSecTag2Aにクローニングする(データは示されていない)。
同様にこの特定の実施例の場合、使用するアドザイムドメインは、sp55であるが、scFV抗-TNFα抗体のような他のアドザイムドメインを使用することもできる(どちらも18個の有力候補のセットから選択された)。これらの構築物は全て、完成した時点で、DNA配列決定により検証する。
トリプシノーゲン (tgn)のアミノ酸配列は、以下である:
pSecTag2Aから発現されるトリプシノーゲン-0aa-sp55 (tgn-0-sp55)のアミノ酸配列は、以下である:
pSecTag2Aから発現されるトリプシノーゲン-3aa-sp55 (tgn-3-sp55)のアミノ酸配列は、以下である:
pSecTag2Aから発現されるトリプシノーゲン-20aa-sp55 (tgn-20-sp55)のアミノ酸配列は、以下である:
さらに、sp55も同様の方法でpSecTagにクローニングした。pSecTag2Aから発現されるsp55のアミノ酸配列は、以下である:
アドザイムは、重複PCR法を利用して、3種類の異なるリンカーを介して連結された個々の酵素およびアドレスドメインから構築される; モデルのトロンビンアドザイムに対して行ったのと同様(前の実施例を参照されたい)。構築物は、DNA配列決定により検証された。
b. アドザイムの発現
293T細胞での一過性発現をT175フラスコの中で行う。ベンザミジン、つまり18 μMのKiを有するトリプシン活性の小分子拮抗阻害剤を終濃度1 mMまで添加して、トリプシノーゲンおよびトリプシノーゲン・アドザイムの発現を安定化させる。条件培地を24時間間隔で回収するか、または最長で72時間まで蓄積させる。
抗-myc抗体を用いたウエスタンブロッティングにより分析した典型的な発現例が、以下の図12に示されている。レーン2で抗-myc抗体のシグナルの強さが増しており、小分子のトリプシン阻害剤ベンザミジンの安定化作用を実証している。リンカーとして0、3および20アミノ酸を含むアドザイムは、同様のレベルで発現されており(レーン3〜5)、そしてベンザミジンの存在により同様に安定化されている。myc反応性のバンドは、およそ51 kDaの予期されたサイズのものである。最後に、sp55も同様にトリプシノーゲンに匹敵する量で産生されており、そして発現はベンザミジンの存在により影響を受けていない。
手短に言えば、形質導入から24時間に分泌されたタンパク質を蓄積後の等量の条件培地を、4〜20% TGS (Novex)ゲルで電気泳動し、ニトロセルロース膜に電気的にブロットして、抗-myc抗体で染色した。
c. アドザイムの精製
一つの態様として、His6-ニッケル法が、好ましい精製法である。この方法は、迅速であり、簡単でありそして大量の場合にはカラム形式でまたは並行アッセイ試験の場合には96ウェル形式で利用可能である。しかしながら、多くの他の代替精製法を利用することができる。例えば、一つの選択は、樹脂の中にプロテアーゼ阻害剤を取り込んだ、ベンザミジン・セファロース・カラム・クロマトグラフィー(Pharmacia, NJ)とすることができる。精製タンパク質の標準的な性質決定には、抗-myc抗体を用いたウエスタン分析ならびにアドザイム調整物の純度および回収率を評価するために銀染色したゲルが含まれる。産生されたアドザイムをさらに分析して、結合およびタンパク質分解活性を定量化することができる。
d. 組換えタンパク質の定量
一つの態様として、アドザイムは、カルボキシ末端にタンデムのmyc-His6タグを付けて構築することができる。ELISA法を発展させて、表面上のNi-NTAに結合した組換えタンパク質を定量化するためにc-mycタグを検出する。これにより、任意の生化学的分析および生物学的検定法で使用するアドザイムの量を標準化するのに役立つ。
以下の方法を利用して、サンドイッチELISA法により、タンデムのmycおよびHis6タグを含む異種発現タンパク質を定量化することができる。要約すると、組換えタンパク質を含有する希釈した条件培地を、Ni-NTAでコーティングしたHisSorbマイクロタイタープレート(カタログ番号35061 Qiagen, Valencia, CA)のウェルの中でインキュベートし、その後、抗-myc-HRP(カタログ番号R951-25, Invitrogen, Carlsbad, CA)と反応させる。次いで、結合した組換え物質を色素生産性基質とのインキュベーションにより検出する。標準曲線は、捕捉された物質の定量化を可能とするタンデムのmyc His6タグを含む精製した組換えsp55(市販のELISA(キット)(カタログ番号QIA98, Oncogene Research Products, Madison, WI)を利用して別個に定量化した)と並行して作成した。模擬の形質導入細胞から得た条件培地は、陰性対照として役立てた。
要約すると、形質導入から得た条件培地を、アッセイ用緩衝液(0.5 % BSA Fraction V、0.05 % Tween-20の1×PBS pH 7.4溶液)に直接希釈して、終量100 μL/ウェルとした。既知量の標準物質sp55をアッセイ用緩衝液に同様の方法で段階希釈した。Ni-NTA表面への組換えタンパク質のHis6タグの結合は、室温で30分間、ゆっくり振盪させながら進行させた。次いで、抗-myc-HRPを全てのウェルに、ウェル中の終量が150 μLとなるようにして1:1500の最終希釈率で添加した。結合は、室温で2時間、ゆっくり振盪させながら進行させた。His6-捕捉タンパク質との抗-mycの結合後、ウェルを洗浄用緩衝液(0.05% Tween 20を含有するPBS)で6回洗浄し、そしてブロットし、乾燥させた。その後、色素生産性基質TMB(Sigmaカタログ♯T-4444)を各ウェルに、終量100 μLまで添加した。370 nmの吸光度の増加をマイクロタイタープレートUV/VISリーダー(Molecular Devices SPECTRAmax 384 Plus)により監視した。試料は全て二重でアッセイする。
この定量化法により、トリプシノーゲン・アドザイムの平均収量は、1 μg/mLと推定された。
3.3 TNFα特異的アドザイムの生化学的分析
この項では、TNFαに対して作製されたアドザイムの結合およびタンパク質分解活性を定量化するための方法について記述する。
a. アドザイムの結合
アドザイムのアドレスドメインの機能性、例えば、TNFαとの結合は、上記のTNFα結合アッセイによりおよび活性化前にL929アッセイでTNFα活性を単独で阻害するアドレスドメインの能力により定量化される。p55の細胞外ドメインを有するアドザイムは、同時並行の対照として組換えp55とともに試験した。アドザイムタンパク質は、アドレスドメイン単独と類似の特異的結合特性(タンパク質1分子当たりに結合されるTNFの量)および結合親和性を示す。
または、以下の方法を利用して、改変型ELISA様アッセイにより、組換え発現されたアドザイム内部での機能的なTNFαアドレスドメインの存在を確証することができる。要約すると、マイクロタイタープレートのウェルをTNFαで予めコーティングし、その後、候補アドザイムを含有する希釈した条件培地と反応させる。機能的な、高親和性のTNFα結合ドメインを発現するアドザイム(および従って、マイクロタイタープレートの洗浄後にマイクロタイタープレートに保持される)の検出は、引き続いて、アドザイム内部の検出用タグに特異的な、色素生産性の酵素複合体および対照構築物の捕捉、次いで色素生産性基質の添加により達成される。アドザイムの捕捉および検出があると予想されない対照ウェルを含めることや、検出用タグまたはTNFα特異的アドレスドメインをコードしない類似構築物を同時並行して評価することで、発現されたアドザイムのなかに、固定化されたTNFαに特異的に結合する、機能的なTNFα特異的アドレスドメインが含まれるという証拠が得られる。通常、一つまたは複数の可逆的なまたは不可逆的なプロテアーゼ阻害剤をアッセイ用緩衝液に含有させて、アドザイムの自己触媒活性またはタンパク質分解活性を阻止し、それにより、アドザイムおよび/またはアッセイ用試薬の分解を抑えることもできる。
実例として、TNFαに特異的なヒト・トリプシノーゲン含有アドザイムのアッセイについて記述する。マイクロタイタープレート(Nunc-ImmunoModule, MaxiSorp Surface)のウェルを、リン酸緩衝生理食塩水(PBS), pH 7.2に希釈した、濃度1 μg/mLの組換えヒトTNFα(RDIカタログ#RDI-301X) 100 μL/ウェルで予めコーティングした。同じくらいの数のウェルに、PBS 100 μLのみを加えた。その後、マイクロタイタープレートを4℃で一晩(約16時間)インキュベートした。ウェルから液体を除去して、マイクロタイタープレートを洗浄用緩衝液(0.05% Tween 20を含有するPBS)で2回洗浄した。ブロッキング/希釈用緩衝液(0.05% Tween 20および0.05%ウシ血清アルブミン[BSA; Fraction V, RIA & ELISA用、Calbiochem カタログ#125593]を含有するPBS) 200 μL/ウェルを添加して、マイクロタイタープレートの全ウェルをブロッキングした。マイクロタイタープレートを、ゆっくり振盪させながら室温で2時間インキュベートした。ブロッキング溶液をウェルから除去し、そして293T細胞での一過性のアドザイム形質導入から得た条件培地の1 mM ベンザミジン(Sigmaカタログ#B-6506)含有ブロッキング/希釈用緩衝液への1:10の希釈液100 μL/ウェルを、TNFαを含有するウェルにおよびTNFαを含有しないウェルに添加した。プレートをゆっくり振盪させながら室温で1時間インキュベートした。液体の除去後、マイクロタイタープレートのウェルを洗浄用緩衝液で4回洗浄した。その後、ウェルに、1 mM ベンザミジン含有ブロッキング/希釈用緩衝液に1:2000に希釈した西洋ワサビペルオキシダーゼ結合抗-myc抗体(抗-myc-HRP; Invitrogenカタログ#46-0709)を加えた。マイクロタイタープレートをゆっくり振盪させながら室温で1時間インキュベートした。液体の除去および上記にあるように洗浄した後、基質(TMB, Sigmaカタログ#T-4444) 100 μL/ウェルを各ウェルに添加した。370 nmの吸光度の増加をマイクロタイタープレートUV/VISリーダー(Molecular Devices SPECTRAmax 384 Plus)により監視した。
図15に示される結果は、代表的な実験からのものであり、一枚のマイクロタイタープレート上にて三重で評価した試料および実験対照に対する平均ODおよび標準偏差を示す。図に示されるように、アドザイム構築物と、固定化されたTNFαに結合でき且つ同様にc-myc抗体配列を含む対照タンパク質だけが、370 nmでバックグラウンドを超える陽性シグナルを発生している。この範疇に含まれたのは、リンカーを含んでいないトリプシノーゲン-p55FLアドザイム(Tgn-0-p55FL)ならびに3アミノ酸(Tgn-3-p55FL)および20アミノ酸(Tgn-20-p55FL)のリンカーを含むものである。予想通り、p55FL-myc-his構築物(p55L)を含む陽性対照試料も同様に、結合して、バックグラウンドを超える陽性シグナルを発出している。トリプシノーゲン-myc-hisからなる構築物は、おそらく高親和性アドレスドメイン(p55FL)がない場合にはTNFαに対する親和性が著しく低下するため、バックグラウンドを超えて結合しなかった。同様に、形質導入のベクター対照(pSECTAG2A)から得た条件培地では、バックグラウンドを超える陽性シグナルが示されなかった。バックグラウンド、つまりTNFαを含んだまたは含んでいないウェルとの抗-myc抗体の非特異結合は、「緩衝液対照」から明らかなように無視できた。
本実施例ではTNFαとの結合を検出しているが、当然のことながら、このアッセイ形式は標的分子のいずれにも汎用的である。本明細書に記述されるアッセイの一つの利点は、アドザイムの偶発的な自己活性化/タンパク質分解および/または内在性プロテアーゼによる活性化を阻止するため、アドザイムを発現させる間の細胞培養液中におよびアッセイ用緩衝液中に可逆的プロテアーゼ阻害剤が含まれることである。これを酵素前駆体および/または活性なプロテアーゼの発現のための一般的な解決策として利用することができる。重要なことには、一つまたは複数のプロテアーゼ阻害剤を、タンパク質の定量化および標的特異性の確認のために(本実施例に示されるように)アッセイ用緩衝液中に含有させることもできる。この汎用法により、自己触媒的な傾向があるおよび/または活性が高いアドザイムの取り扱いに関する懸念が軽減される。
b. アドザイムの活性化
アドザイムの酵素ドメインの活性化は、製造元の推奨に従って37℃でインキュベートすることにより行われる。その進行状況は、SDS-PAGE法およびウエスタンブロッティング法(例えば、図7を参照されたい)により監視することができる。エンテロキナーゼ(Novagen, Madison, WI)をトリプシノーゲンの活性化のために使用した。インビトロTNFαアッセイの場合、エンテロキナーゼを活性化後に除去する必要はない。エンテロキナーゼは、TNFαに対するタンパク質分解活性がないことおよびL929バイオアッセイに影響を及ぼさないことが確認されているためである。
本出願人らは、組換え産生されたHis6タグ含有アドザイムまたは酵素に対し、プレート上での捕捉、活性化およびタンパク質分解アッセイを行うための方法を開発した。要約すると、組換えタンパク質を含有する希釈した条件培地を、Ni-NTAでコーティングしたHisSorbマイクロタイタープレートのウェルの中でインキュベートし、その後、エンテロキナーゼで処理し、そして適当なペプチド基質を加える。本実施例で使用されるペプチド基質は、前に記述した、トシル-GPR-AMC(カタログ番号444228, Sigma, St. Louis, MO)である。基質中のArg残基とAMCとの間のペプチド結合のタンパク質分解により、遊離型の蛍光性AMC(励起383 nm、発光455 nm)が放出される。sp55またはベクターの形質導入由来の条件培地を含めることで、形質導入細胞での偶発的なプロテアーゼ発現ならびにアッセイ条件の下での基質のバックグラウンドおよび加水分解に対する重要な陰性対照が得られる。
手短に言えば、組換えタンパク質を含有する条件培地をアッセイ用緩衝液(0.5 % BSA Fraction V、0.05 % Tween-20の1×PBS pH 7.4溶液)に直接希釈して、終量100 μL/ウェルとした。通常、1ウェル当たり5〜25%の条件培地により、良好な線形応答が得られた。Ni-NTA表面への組換えタンパク質のHis6タグの結合は、室温で2時間、ゆっくり振盪させながら進行させた。His6-捕捉タンパク質との抗-mycの結合後、ウェルを洗浄用緩衝液(0.05% Tween 20を含有するPBSまたはPBST、洗浄1回につき200 μL)で6回洗浄し、そしてブロットして乾燥させた。この段階によりベンザミジンの除去も達成され、ベンザミジンは除去しないとアッセイにおけるその後の段階を阻害するものと思われる。酵素前駆体の活性化は、終量100 μLのPBST中の1 Uエンテロキナーゼ(EK, カタログ番号69066, Novagen, Madison, WI)の添加により達成される。活性化は、37℃で1時間行った。相等しい試料一式に、エンテロキナーゼを加えなかったが、但し同様にインキュベーションを行った。最後に、10 μM トシル-GPR-AMCを含有するトリプシン消化用緩衝液(100 mM Tris pH 8、5 mM CaCl2)の添加前に、ウェルをPBSTで6回洗浄した。タンパク質分解活性は、Gemini EMマイクロプレート分光蛍光光度計(Molecular Devices, CA)を用い、383 nmの励起に続く455 nmの蛍光を監視することにより追跡した。
図13は、異なる組換えタンパク質に対し、2時間のインキュベーションの終了時点で検出された蛍光を比較した代表的な実験の寸評を示す。捕捉された組換えトリプシノーゲンおよびトリプシノーゲン・アドザイムのエンテロキナーゼによる活性化がない場合には、タンパク質分解活性は無視できる(縞模様の棒)。このアッセイ形式の場合、sp55およびベクターの形質導入由来の条件培地には、蛍光のバックグラウンドレベルからも明らかなように、人為産物を引き起こし得る、検出可能な量のプロテアーゼが含まれていない。しかしながら、エンテロキナーゼ処理の後、トリプシノーゲンおよびアドザイム(tgn-0-p55, tgn-20-p55, tgn-3-p55)は、活性化なしの対照と比べて4〜7倍高いレベルの蛍光からも明らかなように、顕著なタンパク質分解量を示す。
他方で、MMP7は、有機水銀化合物の酢酸 p-アミノフェニル第二水銀(APMA, Calbiochem 164610)で活性化され、そしてAPMAは、供給業者から提供される説明指示書に従って除去され得る(およびされるものと思われる)。
c. 合成ペプチド基質を用いたタンパク質分解アッセイ
活性化後のアドザイムの触媒ドメインのタンパク質分解活性を、上記の直線状の合成ペプチド基質で測定した。タンパク質分解活性は、さまざまな量のアドザイムおよび市販の酵素標準物質に対する基質を用いて、上記のようなプレート形式で測定した。基質(トシル-GPR-AMC)の切断は、蛍光発生原AMCの放出により監視した。代表的な実験のデータが、以下の図14に示されており、この場合、形質導入由来の条件培地(形質導入後24時間)をNi-NTAプレートに結合させ、プレート上で活性化させて、固定濃度(10 μM)の基質(トシル-GPR-AMC)を用いてタンパク質分解活性をアッセイした。
MMP7のタンパク質分解活性のアッセイには、蛍光発生基質(ジニトロフェニル-RPLALWRS; Calbiochemカタログ番号444228)を使用することができる。
アドザイムの生化学的分析データを使用して、生物活性の評価のために、アドザイム調製物の濃度およびタンパク質分解活性を標準化することができる。
3.4. アドザイムの生物活性試験
TNFαに対するアドザイムの生物活性および選択性を決定するため、アドザイムを使用して、TNFαを不活性化することができる、および生物活性をTNFαによるL929細胞死バイオアッセイで定量化することができる。選択性は、TNFα単独およびヒト血清アルブミン(HSA)と混合したTNFαのアドザイムによる不活性化を比較することにより決定することができる。可溶性TNFα受容体p55をTNFαの化学量論的遮断物として役立てることができる。
L929バイオアッセイは、生物学的に活性なTNFαに対する厳密な試験である。アッセイは、12種類の全てのアドザイムに加えて、4種類の個々のアドレスおよび酵素ドメインを一つずつおよび組み合わせた調製物を用いて行う。いずれの場合にも、標準化した量の精製アドザイム(上記で評価したような)をTNFα単独またはHSAを加えたTNFαと混合して、37℃で4時間および一晩インキュベートする。一晩の消化は、標準的な操作手順に相当する。予備実験の結果に続けて、必要に応じ、経時変化試験を行うことができる。残存活性をL929バイオアッセイによりアッセイすることができる。
トリプシンドメインの場合、酵素ドメイン単独でTNFαを不活性化して、生存曲線を2 logだけ右方向に移動させているものと予想される(図10、表2)。その一方、効果的なアドザイムは、さらに大きな右方移動をもたらすおよび/またはその移動をずっと低い濃度で若しくはより急速(例えば、一晩とは対照的に4時間)にもたらすものと予想される。TNFαの不活性化の10倍増強(右方への不活性化曲線1log単位の移動)は、触媒タンパク質性アンタゴニストとしてのアドザイムの潜在性に関する説得力のある証明である。さらに、アドレスドメイン単独では、TNFαを最低限不活性化する(化学量論的結合により)だけであり、そしてアドレスおよび酵素ドメインの混合物では、酵素ドメイン単独と同じとなるに過ぎないはずである。全てのアドザイムの生物活性を適合モル濃度でランク付けすることができ、そしてTNFαを不活性化するそれらの選択性を分析することができる。
選択性は、混合実験(例えば、Davisら、2003を参照されたい)で実証することができる、つまりアドザイムを使用して、TNFα単独およびHSAを加えたTNFαを消化し、そして消化物をバイオアッセイで分析することができる(図10を参照されたい)。ヒト血清アルブミンは、この混合実験には最もふさわしい選択である。ヒト血清アルブミンは、血清中に高濃度で存在しており、TNFα特異的アドザイムの選択作用にとって難関になる可能性が最も高い。全てのアドザイムの初期試験は、TNFαに対し10倍モル過剰のHSAを用いて行うことができる。選択的でないアドザイムは、競合基質が存在する場合、生物活性の低下を示すものと予想される。しかしながら、選択的アドザイムは、過剰なHSAが存在する場合でも十分な生物活性を保持するはずである。この最初の試験を通過するアドザイムは、混合物中にいっそう高濃度のHSAを存在させてこの分析を繰り返すことでさらに比較することができる。この場合も同様に、HSAの存在下でどの程度の生物活性が保持されているかに従って、アドザイムをランク付けすることができる。数ラウンドの競合(試験)により、TNFαの生物活性的かつ選択的な触媒性アンタゴニストとなる構造が明らかになるはずである。
実施例4. アドザイムシステムを研究するための反応速度モデルの利用
アドザイムの性能の数学的モデルを開発するため、反応速度論を(Eq-2)に示される、直接型アドザイムの反応網に適用した。そのようなモデルを使用して、アドザイムのパラメータを設計および最適化することができる、ならびにアドザイムの重要な機能特性、例えば、アドザイムが不活性化できる基質の量を予測することができる。
本実施例の場合、3つの異なる薬剤による基質不活性化の総量のシミュレーションを、アドザイムの効力をその構成ドメインの効力と個々に比較する目的で行った。3つの薬剤は、以下とした:
1. kon = 106 M-1s-1およびkoff = 10-3 s-1 (KD = 1 nM)を有するアドレス
2. kon = 103 M-1s-1、koff = 10-3 s-1、およびkcat = 1 s-1 (Km = 10-3 M)を有する酵素
3. 上記のアドレスおよび酵素の特性、ならびに[S]eff = 10-6 Mを有する直接型アドザイム。
薬剤の初期濃度を50 pMとし、そして標的基質の初期濃度を5 pMとした。これらの3つの薬剤のそれぞれにより不活性化された基質の総量は、図16に示されている。
具体的には、図16は、アドザイム、アドレス、および酵素の性能を比較した運動学的モデルの結果を示している。この結果から、アドザイムにより、アドレスまたは酵素単独よりも極めて多くの基質が不活性化されることが示唆される。
例えば、酵素それだけでは、あまりにも弱過ぎてそのような低(pM)濃度で基質を不活性化することができない。このため、酵素による基質不活性化の総量は、ゼロと有意差がない。アドレスは、一部の基質を素早く結合し且つ不活性化するが、しかし基質の濃度はアドレスのKDよりもずっと低いので、結合により急速に平衡が制約されて、アドレスは全基質の約0.25 pM、または5%を不活性化できるに過ぎない。アドザイムは、アドレスと同様に基質を素早く結合し且つ不活性化するが、但しアドザイムは、アドザイム-基質複合体を産物に変換することもできるので、結果的に平衡の制約が除去される。
本実施例から、モデルアドザイムにより、アドレスおよび酵素の機能性が相乗的に組み合わされることが示される。その効力は、アドレスおよび酵素単独の和よりも著しく高い。
等価物
当業者であれば、単なる日常実験の使用、本明細書に記述される本発明の特定の態様に対する多くの等価物を認識するか、または確認することができるであろう。そのような等価物は、以下の特許請求の範囲により包含されることが意図される。