JP2005532296A - アジュバントにより増強される免疫療法 - Google Patents
アジュバントにより増強される免疫療法 Download PDFInfo
- Publication number
- JP2005532296A JP2005532296A JP2003586306A JP2003586306A JP2005532296A JP 2005532296 A JP2005532296 A JP 2005532296A JP 2003586306 A JP2003586306 A JP 2003586306A JP 2003586306 A JP2003586306 A JP 2003586306A JP 2005532296 A JP2005532296 A JP 2005532296A
- Authority
- JP
- Japan
- Prior art keywords
- ligand
- adjuvant
- hapten
- immunogen
- host
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
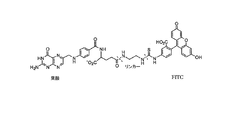
- 0 C*C(CCCC(NCC[N+])=O)NC(c(cc1)ccc1NCc(cn1)nc2c1N=C(N)NC2=O)=O Chemical compound C*C(CCCC(NCC[N+])=O)NC(c(cc1)ccc1NCc(cn1)nc2c1N=C(N)NC2=O)=O 0.000 description 3
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/21—Interferons [IFN]
- A61K38/212—IFN-alpha
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/704—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin attached to a condensed carbocyclic ring system, e.g. sennosides, thiocolchicosides, escin, daunorubicin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2013—IL-2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/385—Haptens or antigens, bound to carriers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/643—Albumins, e.g. HSA, BSA, ovalbumin or a Keyhole Limpet Hemocyanin [KHL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/04—Amoebicides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/10—Anthelmintics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55577—Saponins; Quil A; QS21; ISCOMS
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6012—Haptens, e.g. di- or trinitrophenyl (DNP, TNP)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
- A61K2039/6081—Albumin; Keyhole limpet haemocyanin [KLH]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Virology (AREA)
- Molecular Biology (AREA)
- Communicable Diseases (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Biotechnology (AREA)
- Hematology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Steroid Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
Description
(腹腔内にL1210A白血病を有するDBAマウスにおけるサポニン(サイトカインと共に)増強性免疫療法の治療効果)
(M109癌細胞を腹腔内に注射したBalb/cマウスの生存を延ばしたサポニン増強性(サイトカインと共に)免疫療法)
(腹腔内にM109腫瘍を持つ1日齢のBalb/cマウスにおけるサポニン増強性E17免疫療法単独(サイトカインなし)の効果)
(腹腔内にM109腫瘍を持つ7日齢のBalb/cマウスにおけるサポニン増強性E17免疫療法単独(サイトカインなし)の効果)
(M109癌細胞を皮下に持つBalb/cマウスにおいて腫瘍の成長を妨げたサポニン増強性(サイトカインと共に)免疫療法)
Claims (26)
- 病原性細胞集団を潜む予備免疫された宿主動物において、内因性の免疫応答が介在する、該集団の特異的排除を増強する方法であって、
該細胞集団のメンバーがリガンドに対する到達可能な結合部位を有し、
免疫原またはハプテンが宿主における内因性の抗体により認識されるかもしくは宿主における免疫細胞によって直接認識される、免疫原またはリガンドに結合させたハプテンを含有する組成物を宿主に投与する工程を包含する方法において、
該免疫原または免疫原性のハプテン−キャリア結合体およびTH1偏向性アジュバントを用いて該宿主を予備免疫して既存の免疫を導き出す工程を包含する改善方法。 - 細胞殺傷剤、腫瘍侵入増強剤、化学療法剤、抗菌剤、細胞傷害性免疫細胞および内因性の免疫応答を刺激し得る化合物からなる群から選択される治療因子を含有する、少なくとも1つの追加の組成物を宿主に投与する工程をさらに包含する、請求項1に記載の方法。
- 前記アジュバントが、非改変サポニンアジュバントおよび改変サポニンアジュバントからなる群から選択される、請求項1に記載の方法。
- 前記改変サポニンアジュバントは、脂質が改変されている、請求項3に記載の方法。
- 前記アジュバントがキラヤサポニンアジュバントである、請求項1に記載の方法。
- 改変サポニンアジュバントが脂質改変キラヤサポニンアジュバントである、請求項4に記載の方法。
- 前記宿主がハプテン−キャリア結合体を含有する組成物で予備免疫される、請求項1に記載の方法。
- 前記ハプテンがフルオレセインおよびジニトロフェニルからなる群から選択される、請求項7に記載の方法。
- 病原性細胞の集団を潜む宿主動物において、該病原性細胞の集団を排除するために、免疫応答を増強する方法であって、
該病原性細胞がリガンドに対する到達可能な結合部位を有し、
該方法が、TH1偏向性アジュバントを宿主に投与する工程およびリガンドに結合させた免疫原を含有する組成物を宿主に投与する工程を包含する、方法。 - 細胞殺傷剤、腫瘍侵入増強剤、化学療法剤、抗菌剤、細胞傷害性免疫細胞および内因性の免疫応答を刺激し得る化合物からなる群から選択される治療因子を含有する、少なくとも1つの追加の組成物を宿主に投与する工程をさらに包含する、請求項9に記載の方法。
- 前記アジュバントが非改変サポニンアジュバントおよび改変サポニンアジュバントからなる群から選択される、請求項9に記載の方法。
- 前記改変サポニンアジュバントが脂質改変されている、請求項11に記載の方法。
- 前記アジュバントがキラヤサポニンアジュバントである、請求項9に記載の方法。
- 前記改変サポニンアジュバントが脂質改変キラヤサポニンアジュバントである、請求項12に記載の方法。
- 前記ハプテンがフルオレセインおよびジニトロフェニルからなる群から選択される、治療有効量のTH1偏向性アジュバントおよびハプテン−キャリア結合体を含有する組成物。
- 治療有効量のTH1偏向性アジュバントおよびリガンド−免疫原結合体を含有する組成物。
- 前記ハプテンがフルオレセインおよびジニトロフェニルからなる群から選択される、TH1偏向性アジュバントおよびハプテン−キャリア結合体を含有するキット。
- TH1偏向性アジュバント、ハプテン−キャリア結合体およびリガンド−ハプテン結合体を含有するキット。
- TH1偏向性アジュバントおよびリガンド−免疫原結合体を含有するキット。
- 前記免疫原がハプテンである、請求項19に記載のキット。
- 前記ハプテンがフルオレセインおよびジニトロフェニルからなる群から選択される、請求項20に記載のキット。
- 治療因子をさらに含有する、請求項18に記載のキット。
- 前記治療因子がサイトカインを含有する、請求項22に記載のキット。
- 治療因子をさらに含有する、請求項19に記載のキット。
- 前記治療因子がサイトカインを含有する、請求項24に記載のキット。
- TH1偏向性アジュバント、免疫原およびリガンド−免疫原結合体を含有するキット。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US37381802P | 2002-04-19 | 2002-04-19 | |
| PCT/US2003/011663 WO2003089593A2 (en) | 2002-04-19 | 2003-04-16 | Adjuvant enhanced immunotherapy |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010157088A Division JP2011012065A (ja) | 2002-04-19 | 2010-07-09 | アジュバントにより増強される免疫療法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005532296A true JP2005532296A (ja) | 2005-10-27 |
| JP2005532296A5 JP2005532296A5 (ja) | 2006-06-08 |
Family
ID=29251090
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003586306A Pending JP2005532296A (ja) | 2002-04-19 | 2003-04-16 | アジュバントにより増強される免疫療法 |
| JP2010157088A Pending JP2011012065A (ja) | 2002-04-19 | 2010-07-09 | アジュバントにより増強される免疫療法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010157088A Pending JP2011012065A (ja) | 2002-04-19 | 2010-07-09 | アジュバントにより増強される免疫療法 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20030198643A1 (ja) |
| EP (1) | EP1496934A4 (ja) |
| JP (2) | JP2005532296A (ja) |
| CN (1) | CN1662251B (ja) |
| AR (1) | AR039429A1 (ja) |
| AU (1) | AU2003224989B2 (ja) |
| CA (1) | CA2482924A1 (ja) |
| IL (1) | IL164546A0 (ja) |
| NZ (1) | NZ536609A (ja) |
| TW (1) | TW200406220A (ja) |
| WO (1) | WO2003089593A2 (ja) |
| ZA (1) | ZA200408427B (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011503203A (ja) * | 2007-11-15 | 2011-01-27 | エンドサイト,インク. | 接合体を投与する方法 |
| JP2014169281A (ja) * | 2013-02-05 | 2014-09-18 | Nitto Denko Corp | ワクチン組成物 |
| JPWO2016204271A1 (ja) * | 2015-06-19 | 2018-04-05 | 国立大学法人静岡大学 | 免疫機能発達促進剤及び成長促進剤 |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL211872B1 (pl) * | 2000-03-31 | 2012-07-31 | Purdue Research Foundation | Kompozycja farmaceutyczna |
| WO2002087424A2 (en) | 2001-05-02 | 2002-11-07 | Purdue Research Foundation | Treatment and diagnosis of macrophage mediated disease |
| EP2168598A1 (en) * | 2001-09-28 | 2010-03-31 | Purdue Research Foundation | Method of Treatment Using Ligand-Immunogen Conjugates |
| US8043602B2 (en) | 2002-02-07 | 2011-10-25 | Endocyte, Inc. | Folate targeted enhanced tumor and folate receptor positive tissue optical imaging technology |
| US8043603B2 (en) * | 2002-02-07 | 2011-10-25 | Endocyte, Inc. | Folate targeted enhanced tumor and folate receptor positive tissue optical imaging technology |
| BRPI0407727A (pt) * | 2003-02-21 | 2006-05-02 | Hasumi Llc Dba Shukokai Intern | adjuvante de vacina de linfócito humano |
| ATE412897T1 (de) | 2003-05-30 | 2008-11-15 | Purdue Research Foundation | Diagnoseverfahren für atherosklerose |
| WO2006071754A2 (en) * | 2004-12-23 | 2006-07-06 | Purdue Research Foundation | Positron emission tomography imaging method |
| JP2008537778A (ja) | 2005-03-30 | 2008-09-25 | パーデュー・リサーチ・ファウンデーション | 細胞の葉酸ビタミン受容体の定量化による癌予後診断法 |
| CN103285392A (zh) | 2005-04-26 | 2013-09-11 | 卫材R&D管理株式会社 | 用于癌症免疫疗法的组合物和其用途 |
| WO2007006041A2 (en) | 2005-07-05 | 2007-01-11 | Purdue Research Foundation | Imaging and therapeutic method using monocytes |
| ATE499112T1 (de) * | 2005-09-01 | 2011-03-15 | Celgene Corp | Immunologische verwendungen von immunmodulatorischen verbindungen für einen impfstoff und therapie gegen infektionskrankheiten |
| WO2007038346A2 (en) | 2005-09-23 | 2007-04-05 | Purdue Research Foundation | Multiphoton in vivo flow cytometry method and device |
| US20070134259A1 (en) * | 2005-11-21 | 2007-06-14 | David Bundle | Methods and compositions for pharmacologially controlled targeted immunotherapy |
| US8168164B2 (en) * | 2006-02-03 | 2012-05-01 | Purdue Research Foundation | Targeted conjugates and radiation |
| US20080152648A1 (en) * | 2006-09-26 | 2008-06-26 | Alexion Pharmaceuticals, Inc. | Compositions and methods for enhancing an adjuvant |
| WO2008057437A2 (en) | 2006-11-03 | 2008-05-15 | Purdue Research Foundation | Ex vivo flow cytometry method and device |
| AU2008213702B2 (en) * | 2007-02-07 | 2014-04-24 | Purdue Research Foundation | Positron emission tomography imaging method |
| EP2164525A2 (en) * | 2007-05-25 | 2010-03-24 | Purdue Research Foundation | Method of imaging localized infections |
| US20090012009A1 (en) * | 2007-06-01 | 2009-01-08 | Low Philip S | Composition and Method for Treating Inflammatory Disease |
| CA2903629A1 (en) * | 2013-03-15 | 2014-09-25 | Newlink Genetics Corporation | Carbohydrate-modified glycoproteins and uses thereof |
| WO2018187259A1 (en) * | 2017-04-05 | 2018-10-11 | University Of Miami | Methods and compositions for stimulating the immune system |
| CN109061172B (zh) * | 2018-09-21 | 2021-07-06 | 中国烟草总公司郑州烟草研究院 | 一种检测仲丁灵的酶联免疫试剂盒及其应用 |
| WO2020200481A1 (en) * | 2019-04-05 | 2020-10-08 | Biontech Rna Pharmaceuticals Gmbh | Treatment involving interleukin-2 (il2) and interferon (ifn) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001074382A1 (en) | 2000-03-31 | 2001-10-11 | Purdue Research Foundation | Method of treatment using ligand-immunogen conjugates |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US39583A (en) * | 1863-08-18 | Improved variable exhaust for locomotives | ||
| US31252A (en) * | 1861-01-29 | Improvement in iron ties for cotton-bales | ||
| US2816110A (en) * | 1956-11-23 | 1957-12-10 | Merck & Co Inc | Methods for the production of substituted pteridines |
| US4713249A (en) * | 1981-11-12 | 1987-12-15 | Schroeder Ulf | Crystallized carbohydrate matrix for biologically active substances, a process of preparing said matrix, and the use thereof |
| US4659655A (en) * | 1981-11-25 | 1987-04-21 | Bio-Response, Inc. | Method for isolating product-producing cells |
| US5140104A (en) * | 1982-03-09 | 1992-08-18 | Cytogen Corporation | Amine derivatives of folic acid analogs |
| US5266333A (en) * | 1985-03-06 | 1993-11-30 | American Cyanamid Company | Water dispersible and water soluble carbohydrate polymer compositions for parenteral administration of growth hormone |
| US5062171A (en) * | 1986-09-09 | 1991-11-05 | Kinetic Concepts, Inc. | Patient support air bags and related system with connectors for detachable mounting of the bags |
| DE69023900D1 (de) * | 1989-02-24 | 1996-01-11 | Univ California | Gentechnologisch veränderte immunglobuline. |
| US5108921A (en) * | 1989-04-03 | 1992-04-28 | Purdue Research Foundation | Method for enhanced transmembrane transport of exogenous molecules |
| US5688488A (en) * | 1989-04-03 | 1997-11-18 | Purdue Research Foundation | Composition and method for tumor imaging |
| CA2090105A1 (en) * | 1990-08-29 | 1992-03-01 | Jean-Paul Soulillou | Protein polyligands joined to a stable protein core |
| US6335434B1 (en) * | 1998-06-16 | 2002-01-01 | Isis Pharmaceuticals, Inc., | Nucleosidic and non-nucleosidic folate conjugates |
| US5159079A (en) * | 1991-12-20 | 1992-10-27 | Eli Lilly And Company | 2-piperidones as intermediates for 5-deaza-10-oxo- and 5-deaza-10-thio-5,6,7,8-tetrahydrofolic acids |
| US5747024A (en) * | 1993-03-08 | 1998-05-05 | Immunex Corporation | Vaccine adjuvant comprising interleukin-15 |
| US5417982A (en) * | 1994-02-17 | 1995-05-23 | Modi; Pankaj | Controlled release of drugs or hormones in biodegradable polymer microspheres |
| US5547668A (en) * | 1995-05-05 | 1996-08-20 | The Board Of Trustees Of The University Of Illinois | Conjugates of folate anti-effector cell antibodies |
| US6080725A (en) * | 1997-05-20 | 2000-06-27 | Galenica Pharmaceuticals, Inc. | Immunostimulating and vaccine compositions employing saponin analog adjuvants and uses thereof |
| WO2001047552A1 (en) * | 1999-09-08 | 2001-07-05 | Sloane-Kettering Institute For Cancer Research | Polysialic acid-klh conjugate vaccine |
| US20020039583A1 (en) * | 1999-09-30 | 2002-04-04 | Subjeck John R. | Stress protein compositions and methods for prevention and treatment of cancer and infectious disease |
| EP2168598A1 (en) * | 2001-09-28 | 2010-03-31 | Purdue Research Foundation | Method of Treatment Using Ligand-Immunogen Conjugates |
-
2003
- 2003-04-16 JP JP2003586306A patent/JP2005532296A/ja active Pending
- 2003-04-16 EP EP03721690A patent/EP1496934A4/en not_active Ceased
- 2003-04-16 CA CA002482924A patent/CA2482924A1/en not_active Abandoned
- 2003-04-16 AR ARP030101333A patent/AR039429A1/es unknown
- 2003-04-16 NZ NZ536609A patent/NZ536609A/en not_active IP Right Cessation
- 2003-04-16 AU AU2003224989A patent/AU2003224989B2/en not_active Ceased
- 2003-04-16 CN CN038144425A patent/CN1662251B/zh not_active Expired - Fee Related
- 2003-04-16 WO PCT/US2003/011663 patent/WO2003089593A2/en active Application Filing
- 2003-04-17 US US10/417,903 patent/US20030198643A1/en not_active Abandoned
- 2003-04-18 TW TW092109085A patent/TW200406220A/zh unknown
-
2004
- 2004-10-13 IL IL16454604A patent/IL164546A0/xx unknown
- 2004-10-18 ZA ZA200408427A patent/ZA200408427B/xx unknown
-
2010
- 2010-07-09 JP JP2010157088A patent/JP2011012065A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001074382A1 (en) | 2000-03-31 | 2001-10-11 | Purdue Research Foundation | Method of treatment using ligand-immunogen conjugates |
Non-Patent Citations (5)
| Title |
|---|
| JPN6010063280; RAGUPATHI,G. et al: 'A preclinical study comparing approaches for augmenting the immunogenicity of a heptavalent KLH-conj' Cancer Immunol Immunother Vol.52, No.10, 2003, p.608-16 |
| JPN6010063281; SLOVIN,S.F. et al: 'A bivalent conjugate vaccine in the treatment of biochemically relapsed prostate cancer: a study of' Vaccine Vol.23, No.24, 2005, p.3114-22 |
| JPN6010063283; GATHURU,J.K. et al: 'Identification of DHBcAg as a potent carrier protein comparable to KLH for augmenting MUC1 antigenic' Vaccine Vol.23, No.39, 2005, p.4727-33 |
| JPN7009002024; Lu Y, Low PS: 'Folate targeting of haptens to cancer cell surfaces mediates immunotherapy of syngeneic murine tumor' Cancer Immunol Immunother. 51(3), 20020319, 153-162 * |
| JPN7009002025; Kim SK, Ragupathi G, Cappello S, Kagan E, Livingston PO: 'Effect of immunological adjuvant combinations on the antibody and T-cell response to vaccination wit' Vaccine 19(4-5), 2001, 530-537 * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011503203A (ja) * | 2007-11-15 | 2011-01-27 | エンドサイト,インク. | 接合体を投与する方法 |
| JP2014169281A (ja) * | 2013-02-05 | 2014-09-18 | Nitto Denko Corp | ワクチン組成物 |
| US10076491B2 (en) | 2013-02-05 | 2018-09-18 | Nitto Denko Corporation | Vaccine composition |
| JPWO2016204271A1 (ja) * | 2015-06-19 | 2018-04-05 | 国立大学法人静岡大学 | 免疫機能発達促進剤及び成長促進剤 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1496934A2 (en) | 2005-01-19 |
| NZ536609A (en) | 2007-11-30 |
| WO2003089593A3 (en) | 2003-12-24 |
| TW200406220A (en) | 2004-05-01 |
| CN1662251B (zh) | 2012-10-10 |
| AU2003224989A1 (en) | 2003-11-03 |
| IL164546A0 (en) | 2005-12-18 |
| AR039429A1 (es) | 2005-02-16 |
| CN1662251A (zh) | 2005-08-31 |
| WO2003089593A2 (en) | 2003-10-30 |
| JP2011012065A (ja) | 2011-01-20 |
| CA2482924A1 (en) | 2003-10-30 |
| US20030198643A1 (en) | 2003-10-23 |
| AU2003224989B2 (en) | 2008-12-04 |
| ZA200408427B (en) | 2007-03-28 |
| EP1496934A4 (en) | 2006-08-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2011012065A (ja) | アジュバントにより増強される免疫療法 | |
| CA2405299C (en) | Method of treatment using ligand-immunogen conjugates | |
| EP1434603B1 (en) | Method of treatment using ligand-immunogen conjugates | |
| AU2001256970A1 (en) | Method of treatment using ligand-immunogen conjugates | |
| JP5554713B2 (ja) | 接合体を投与する方法 | |
| US8168164B2 (en) | Targeted conjugates and radiation | |
| KR20050016350A (ko) | 어쥬번트 보강된 면역요법 | |
| ZA200207768B (en) | Method of treatment using ligand-immunogen conjugates. | |
| AU2002353785A1 (en) | Method of Treatment Using Ligand-Immunogen Conjugates |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060414 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060414 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090428 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090727 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090803 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090925 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20091002 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091028 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100309 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100709 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20101001 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20101105 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120131 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120203 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120229 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120305 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120402 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120406 |