JP2005514053A - グラム陽性細菌のリポタイコ酸に特異的なオプソニン性モノクローナルおよびキメラ抗体 - Google Patents
グラム陽性細菌のリポタイコ酸に特異的なオプソニン性モノクローナルおよびキメラ抗体 Download PDFInfo
- Publication number
- JP2005514053A JP2005514053A JP2003559425A JP2003559425A JP2005514053A JP 2005514053 A JP2005514053 A JP 2005514053A JP 2003559425 A JP2003559425 A JP 2003559425A JP 2003559425 A JP2003559425 A JP 2003559425A JP 2005514053 A JP2005514053 A JP 2005514053A
- Authority
- JP
- Japan
- Prior art keywords
- mab
- lta
- variable region
- antibodies
- light chain
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 241000192125 Firmicutes Species 0.000 title claims abstract description 27
- 230000001662 opsonic effect Effects 0.000 title claims description 34
- 239000002253 acid Substances 0.000 title abstract description 22
- 150000001413 amino acids Chemical class 0.000 claims description 70
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 65
- 238000009739 binding Methods 0.000 claims description 57
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 53
- 230000027455 binding Effects 0.000 claims description 50
- 229920001184 polypeptide Polymers 0.000 claims description 49
- 238000000034 method Methods 0.000 claims description 40
- 241000191963 Staphylococcus epidermidis Species 0.000 claims description 39
- 210000004027 cell Anatomy 0.000 claims description 37
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 30
- 210000004408 hybridoma Anatomy 0.000 claims description 25
- 239000008194 pharmaceutical composition Substances 0.000 claims description 14
- 238000004519 manufacturing process Methods 0.000 claims description 11
- 239000000203 mixture Substances 0.000 claims description 11
- MSFSPUZXLOGKHJ-UHFFFAOYSA-N Muraminsaeure Natural products OC(=O)C(C)OC1C(N)C(O)OC(CO)C1O MSFSPUZXLOGKHJ-UHFFFAOYSA-N 0.000 claims description 7
- 108010013639 Peptidoglycan Proteins 0.000 claims description 7
- 150000007523 nucleic acids Chemical class 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 6
- 108020004707 nucleic acids Proteins 0.000 claims description 6
- 102000039446 nucleic acids Human genes 0.000 claims description 6
- 230000002163 immunogen Effects 0.000 claims description 4
- 230000000890 antigenic effect Effects 0.000 claims description 3
- 125000003275 alpha amino acid group Chemical group 0.000 claims 5
- 241000894006 Bacteria Species 0.000 abstract description 73
- 206010057249 Phagocytosis Diseases 0.000 abstract description 17
- 230000008782 phagocytosis Effects 0.000 abstract description 17
- 238000000338 in vitro Methods 0.000 abstract description 2
- 230000001954 sterilising effect Effects 0.000 abstract 1
- 238000004659 sterilization and disinfection Methods 0.000 abstract 1
- 108091007433 antigens Proteins 0.000 description 71
- 102000036639 antigens Human genes 0.000 description 71
- 239000000427 antigen Substances 0.000 description 70
- 238000003556 assay Methods 0.000 description 66
- 108090000623 proteins and genes Proteins 0.000 description 46
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 45
- 241000699666 Mus <mouse, genus> Species 0.000 description 41
- 235000018102 proteins Nutrition 0.000 description 38
- 102000004169 proteins and genes Human genes 0.000 description 38
- 239000000243 solution Substances 0.000 description 31
- 239000012634 fragment Substances 0.000 description 29
- 239000013612 plasmid Substances 0.000 description 27
- 230000000694 effects Effects 0.000 description 25
- 239000011780 sodium chloride Substances 0.000 description 25
- 230000001580 bacterial effect Effects 0.000 description 24
- 238000011282 treatment Methods 0.000 description 23
- 108060003951 Immunoglobulin Proteins 0.000 description 22
- 102000018358 immunoglobulin Human genes 0.000 description 22
- 108020004414 DNA Proteins 0.000 description 21
- 108700022034 Opsonin Proteins Proteins 0.000 description 21
- 208000015181 infectious disease Diseases 0.000 description 21
- 241001465754 Metazoa Species 0.000 description 20
- 239000002953 phosphate buffered saline Substances 0.000 description 20
- 239000000523 sample Substances 0.000 description 20
- 238000002965 ELISA Methods 0.000 description 19
- 239000006228 supernatant Substances 0.000 description 18
- 241000699670 Mus sp. Species 0.000 description 17
- 241000191940 Staphylococcus Species 0.000 description 17
- 238000006243 chemical reaction Methods 0.000 description 17
- 238000010790 dilution Methods 0.000 description 16
- 239000012895 dilution Substances 0.000 description 16
- 230000014207 opsonization Effects 0.000 description 16
- 239000000499 gel Substances 0.000 description 15
- 210000003719 b-lymphocyte Anatomy 0.000 description 14
- 238000002360 preparation method Methods 0.000 description 14
- 239000000047 product Substances 0.000 description 14
- 230000000844 anti-bacterial effect Effects 0.000 description 13
- 239000013598 vector Substances 0.000 description 13
- 239000002299 complementary DNA Substances 0.000 description 12
- 230000006870 function Effects 0.000 description 12
- 238000011534 incubation Methods 0.000 description 12
- 210000002966 serum Anatomy 0.000 description 12
- 238000002835 absorbance Methods 0.000 description 11
- 238000010367 cloning Methods 0.000 description 11
- 238000003018 immunoassay Methods 0.000 description 11
- 210000000440 neutrophil Anatomy 0.000 description 11
- 238000000746 purification Methods 0.000 description 11
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 10
- 239000000872 buffer Substances 0.000 description 10
- 230000004044 response Effects 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 9
- 108091028043 Nucleic acid sequence Proteins 0.000 description 9
- 230000003115 biocidal effect Effects 0.000 description 9
- 239000013615 primer Substances 0.000 description 9
- 230000001681 protective effect Effects 0.000 description 9
- 230000002829 reductive effect Effects 0.000 description 9
- 210000001519 tissue Anatomy 0.000 description 9
- 241000295644 Staphylococcaceae Species 0.000 description 8
- 210000002421 cell wall Anatomy 0.000 description 8
- 238000002649 immunization Methods 0.000 description 8
- 230000003053 immunization Effects 0.000 description 8
- 238000000159 protein binding assay Methods 0.000 description 8
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 8
- OOIBFPKQHULHSQ-UHFFFAOYSA-N (3-hydroxy-1-adamantyl) 2-methylprop-2-enoate Chemical compound C1C(C2)CC3CC2(O)CC1(OC(=O)C(=C)C)C3 OOIBFPKQHULHSQ-UHFFFAOYSA-N 0.000 description 7
- 238000012286 ELISA Assay Methods 0.000 description 7
- 239000003242 anti bacterial agent Substances 0.000 description 7
- 229940088710 antibiotic agent Drugs 0.000 description 7
- 230000000295 complement effect Effects 0.000 description 7
- 229940009976 deoxycholate Drugs 0.000 description 7
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 7
- 210000001539 phagocyte Anatomy 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 238000005406 washing Methods 0.000 description 7
- PVGATNRYUYNBHO-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(2,5-dioxopyrrol-1-yl)butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCN1C(=O)C=CC1=O PVGATNRYUYNBHO-UHFFFAOYSA-N 0.000 description 6
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 6
- 241000283707 Capra Species 0.000 description 6
- 239000007995 HEPES buffer Substances 0.000 description 6
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 6
- 229910019142 PO4 Inorganic materials 0.000 description 6
- 239000011543 agarose gel Substances 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 238000005119 centrifugation Methods 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 239000002773 nucleotide Substances 0.000 description 6
- 125000003729 nucleotide group Chemical group 0.000 description 6
- 230000000625 opsonophagocytic effect Effects 0.000 description 6
- 239000010452 phosphate Substances 0.000 description 6
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 6
- 230000002265 prevention Effects 0.000 description 6
- 230000008569 process Effects 0.000 description 6
- 206010003445 Ascites Diseases 0.000 description 5
- 208000035143 Bacterial infection Diseases 0.000 description 5
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 5
- 108010065152 Coagulase Proteins 0.000 description 5
- 206010041925 Staphylococcal infections Diseases 0.000 description 5
- 208000022362 bacterial infectious disease Diseases 0.000 description 5
- 239000002775 capsule Substances 0.000 description 5
- 239000000969 carrier Substances 0.000 description 5
- 230000001413 cellular effect Effects 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 210000003527 eukaryotic cell Anatomy 0.000 description 5
- 239000013604 expression vector Substances 0.000 description 5
- 230000028993 immune response Effects 0.000 description 5
- 210000000987 immune system Anatomy 0.000 description 5
- 229940072221 immunoglobulins Drugs 0.000 description 5
- 230000002147 killing effect Effects 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- UAIUNKRWKOVEES-UHFFFAOYSA-N 3,3',5,5'-tetramethylbenzidine Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 UAIUNKRWKOVEES-UHFFFAOYSA-N 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 229920001213 Polysorbate 20 Polymers 0.000 description 4
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 239000012228 culture supernatant Substances 0.000 description 4
- 230000029087 digestion Effects 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 150000004676 glycans Chemical class 0.000 description 4
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 4
- 230000016784 immunoglobulin production Effects 0.000 description 4
- 210000004962 mammalian cell Anatomy 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- 230000009871 nonspecific binding Effects 0.000 description 4
- 230000001717 pathogenic effect Effects 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 4
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 4
- 229920001282 polysaccharide Polymers 0.000 description 4
- 239000005017 polysaccharide Substances 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 229960005322 streptomycin Drugs 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 229920001059 synthetic polymer Polymers 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 238000000108 ultra-filtration Methods 0.000 description 4
- 229960005486 vaccine Drugs 0.000 description 4
- 108010077805 Bacterial Proteins Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 239000012980 RPMI-1640 medium Substances 0.000 description 3
- 241000191967 Staphylococcus aureus Species 0.000 description 3
- 230000001464 adherent effect Effects 0.000 description 3
- 230000005875 antibody response Effects 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- -1 epitope Proteins 0.000 description 3
- 239000013613 expression plasmid Substances 0.000 description 3
- 239000012894 fetal calf serum Substances 0.000 description 3
- 239000007863 gel particle Substances 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 230000002458 infectious effect Effects 0.000 description 3
- 238000003780 insertion Methods 0.000 description 3
- 230000037431 insertion Effects 0.000 description 3
- 210000002540 macrophage Anatomy 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 210000004379 membrane Anatomy 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 229920005615 natural polymer Polymers 0.000 description 3
- 230000000242 pagocytic effect Effects 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 229920000136 polysorbate Polymers 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 125000003396 thiol group Chemical group [H]S* 0.000 description 3
- 239000003053 toxin Substances 0.000 description 3
- 231100000765 toxin Toxicity 0.000 description 3
- 108700012359 toxins Proteins 0.000 description 3
- 239000001974 tryptic soy broth Substances 0.000 description 3
- 108010050327 trypticase-soy broth Proteins 0.000 description 3
- 206010069754 Acquired gene mutation Diseases 0.000 description 2
- 229920000936 Agarose Polymers 0.000 description 2
- 208000031729 Bacteremia Diseases 0.000 description 2
- 208000034309 Bacterial disease carrier Diseases 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- 206010011409 Cross infection Diseases 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 239000012506 Sephacryl® Substances 0.000 description 2
- 206010040047 Sepsis Diseases 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- 241000191984 Staphylococcus haemolyticus Species 0.000 description 2
- 101710120037 Toxin CcdB Proteins 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 210000000628 antibody-producing cell Anatomy 0.000 description 2
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 2
- 239000006161 blood agar Substances 0.000 description 2
- 238000011088 calibration curve Methods 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 238000007398 colorimetric assay Methods 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 210000001508 eye Anatomy 0.000 description 2
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 2
- 230000005714 functional activity Effects 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 238000007429 general method Methods 0.000 description 2
- 238000007654 immersion Methods 0.000 description 2
- 238000010255 intramuscular injection Methods 0.000 description 2
- 239000007927 intramuscular injection Substances 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 230000000116 mitigating effect Effects 0.000 description 2
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 230000035699 permeability Effects 0.000 description 2
- 238000001558 permutation test Methods 0.000 description 2
- 108091033319 polynucleotide Proteins 0.000 description 2
- 102000040430 polynucleotide Human genes 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- 230000017854 proteolysis Effects 0.000 description 2
- 238000012205 qualitative assay Methods 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 239000008299 semisolid dosage form Substances 0.000 description 2
- 239000012679 serum free medium Substances 0.000 description 2
- 239000001632 sodium acetate Substances 0.000 description 2
- 235000017281 sodium acetate Nutrition 0.000 description 2
- 230000037439 somatic mutation Effects 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000000528 statistical test Methods 0.000 description 2
- 238000010254 subcutaneous injection Methods 0.000 description 2
- 239000007929 subcutaneous injection Substances 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 1
- NRBDPSFGHNZPRE-UHFFFAOYSA-N 1-hydroxypyrrolidine-2,5-dione;2-iodoacetic acid Chemical compound OC(=O)CI.ON1C(=O)CCC1=O NRBDPSFGHNZPRE-UHFFFAOYSA-N 0.000 description 1
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- KIUMMUBSPKGMOY-UHFFFAOYSA-N 3,3'-Dithiobis(6-nitrobenzoic acid) Chemical compound C1=C([N+]([O-])=O)C(C(=O)O)=CC(SSC=2C=C(C(=CC=2)[N+]([O-])=O)C(O)=O)=C1 KIUMMUBSPKGMOY-UHFFFAOYSA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- UZOVYGYOLBIAJR-UHFFFAOYSA-N 4-isocyanato-4'-methyldiphenylmethane Chemical compound C1=CC(C)=CC=C1CC1=CC=C(N=C=O)C=C1 UZOVYGYOLBIAJR-UHFFFAOYSA-N 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 108010069112 Complement System Proteins Proteins 0.000 description 1
- 102000000989 Complement System Proteins Human genes 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 239000003155 DNA primer Substances 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 238000000729 Fisher's exact test Methods 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 238000003794 Gram staining Methods 0.000 description 1
- 101710154606 Hemagglutinin Proteins 0.000 description 1
- 101000582320 Homo sapiens Neurogenic differentiation factor 6 Proteins 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- RJQXTJLFIWVMTO-TYNCELHUSA-N Methicillin Chemical compound COC1=CC=CC(OC)=C1C(=O)N[C@@H]1C(=O)N2[C@@H](C(O)=O)C(C)(C)S[C@@H]21 RJQXTJLFIWVMTO-TYNCELHUSA-N 0.000 description 1
- 208000034486 Multi-organ failure Diseases 0.000 description 1
- 208000010718 Multiple Organ Failure Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101100370002 Mus musculus Tnfsf14 gene Proteins 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 206010061308 Neonatal infection Diseases 0.000 description 1
- 102100030589 Neurogenic differentiation factor 6 Human genes 0.000 description 1
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 1
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 206010035148 Plague Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 101710176177 Protein A56 Proteins 0.000 description 1
- 238000010802 RNA extraction kit Methods 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 108010073443 Ribi adjuvant Proteins 0.000 description 1
- 241000282849 Ruminantia Species 0.000 description 1
- 241001221452 Staphylococcus faecalis Species 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 201000005010 Streptococcus pneumonia Diseases 0.000 description 1
- 241000193998 Streptococcus pneumoniae Species 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 102400000368 Surface protein Human genes 0.000 description 1
- 108010055044 Tetanus Toxin Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 108010059993 Vancomycin Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 241000607479 Yersinia pestis Species 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000007818 agglutination assay Methods 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- 238000002266 amputation Methods 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 239000010775 animal oil Substances 0.000 description 1
- 230000000941 anti-staphylcoccal effect Effects 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 201000005008 bacterial sepsis Diseases 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 235000015278 beef Nutrition 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 238000009640 blood culture Methods 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- MRUCFNWPEGEZSP-UHFFFAOYSA-N butanoic acid;pyrrole-2,5-dione Chemical compound CCCC(O)=O.O=C1NC(=O)C=C1 MRUCFNWPEGEZSP-UHFFFAOYSA-N 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 238000000546 chi-square test Methods 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 238000007820 coagulation assay Methods 0.000 description 1
- 239000007382 columbia agar Substances 0.000 description 1
- 239000006781 columbia blood agar Substances 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 238000012866 crystallographic experiment Methods 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 235000013365 dairy product Nutrition 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000002498 deadly effect Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 206010014665 endocarditis Diseases 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000001976 enzyme digestion Methods 0.000 description 1
- 210000001339 epidermal cell Anatomy 0.000 description 1
- 230000008029 eradication Effects 0.000 description 1
- 230000003628 erosive effect Effects 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 210000003495 flagella Anatomy 0.000 description 1
- 108010074605 gamma-Globulins Proteins 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000003709 heart valve Anatomy 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 230000002949 hemolytic effect Effects 0.000 description 1
- 244000038280 herbivores Species 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000012678 infectious agent Substances 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 230000008611 intercellular interaction Effects 0.000 description 1
- 229940100601 interleukin-6 Drugs 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- JDNTWHVOXJZDSN-UHFFFAOYSA-N iodoacetic acid Chemical compound OC(=O)CI JDNTWHVOXJZDSN-UHFFFAOYSA-N 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- JJTUDXZGHPGLLC-UHFFFAOYSA-N lactide Chemical compound CC1OC(=O)C(C)OC1=O JJTUDXZGHPGLLC-UHFFFAOYSA-N 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 108010026228 mRNA guanylyltransferase Proteins 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000012092 media component Substances 0.000 description 1
- 210000001806 memory b lymphocyte Anatomy 0.000 description 1
- 230000031864 metaphase Effects 0.000 description 1
- 229960003085 meticillin Drugs 0.000 description 1
- 239000011325 microbead Substances 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 208000029744 multiple organ dysfunction syndrome Diseases 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 230000036963 noncompetitive effect Effects 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 230000003571 opsonizing effect Effects 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 108010040473 pneumococcal surface protein A Proteins 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920001467 poly(styrenesulfonates) Polymers 0.000 description 1
- 229960002796 polystyrene sulfonate Drugs 0.000 description 1
- 239000011970 polystyrene sulfonate Substances 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 238000011533 pre-incubation Methods 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 235000004252 protein component Nutrition 0.000 description 1
- 239000011535 reaction buffer Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 239000003161 ribonuclease inhibitor Substances 0.000 description 1
- 238000010079 rubber tapping Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000004062 sedimentation Methods 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 229960005480 sodium caprylate Drugs 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- BYKRNSHANADUFY-UHFFFAOYSA-M sodium octanoate Chemical compound [Na+].CCCCCCCC([O-])=O BYKRNSHANADUFY-UHFFFAOYSA-M 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000012089 stop solution Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 229940118376 tetanus toxin Drugs 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 239000006150 trypticase soy agar Substances 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 229960003165 vancomycin Drugs 0.000 description 1
- MYPYJXKWCTUITO-LYRMYLQWSA-N vancomycin Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=C2C=C3C=C1OC1=CC=C(C=C1Cl)[C@@H](O)[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@H]3C(=O)N[C@H]1C(=O)N[C@H](C(N[C@@H](C3=CC(O)=CC(O)=C3C=3C(O)=CC=C1C=3)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)O2)=O)NC(=O)[C@@H](CC(C)C)NC)[C@H]1C[C@](C)(N)[C@H](O)[C@H](C)O1 MYPYJXKWCTUITO-LYRMYLQWSA-N 0.000 description 1
- MYPYJXKWCTUITO-UHFFFAOYSA-N vancomycin Natural products O1C(C(=C2)Cl)=CC=C2C(O)C(C(NC(C2=CC(O)=CC(O)=C2C=2C(O)=CC=C3C=2)C(O)=O)=O)NC(=O)C3NC(=O)C2NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(CC(C)C)NC)C(O)C(C=C3Cl)=CC=C3OC3=CC2=CC1=C3OC1OC(CO)C(O)C(O)C1OC1CC(C)(N)C(O)C(C)O1 MYPYJXKWCTUITO-UHFFFAOYSA-N 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/12—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria
- C07K16/1267—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-positive bacteria
- C07K16/1271—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-positive bacteria from Micrococcaceae (F), e.g. Staphylococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/12—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria
- C07K16/1267—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-positive bacteria
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Communicable Diseases (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
Description
本出願は、2001年12月21日付けで出願された米国仮特許出願第60/343,503号(弁理士の事務処理番号7787.6008)に基づくものであり、その利権を主張する。この仮出願の開示内容全体は、参照により本明細書に援用され、組み入れられるものとする。また、本出願は、米国特許第5,571,511号、米国特許第5,955,074号および米国特許出願第09/097,055号(1998年6月15日出願)にも関連し、それらは全て、参照により特に本明細書に組み入れられるものとする。
本発明は、免疫学および感染症の分野において、グラム陽性細菌、特に表面にリポタイコ酸を有する細菌に特異的な抗体に関する。本発明は、モノクローナル抗体およびキメラ抗体、ならびにそれらのフラグメント、領域および誘導体を包含する。本発明はさらに、それらの抗体のオプソニン活性を増大させる可変領域の配列に関する。本発明の抗体は、診断、予防および治療の用途に使用可能である。
本発明は、広義には、グラム陽性細菌のリポタイコ酸(LTA)に結合する、反応性で、オプソニン性であり、防護作用を有するモノクローナルでキメラの抗体を包含する。この抗体はまた、細菌全体にも結合して、食作用を増進し、細菌をin vitroで死滅させ、in vivoでの致死性感染からの防護を増強する。本発明はさらに、共通して高度な配列相同性を有する、LTAに対するオプソニン性抗体を包含する。本発明はまた、2以上の異なる抗LTA抗体に由来する可変領域を有する抗体も包含する。
本明細書では、用語「抗体」には、全長抗体およびその部分が含まれる。全長抗体は、1対、またはより一般には2対のポリペプチド鎖をもち、各対は、軽鎖と重鎖とを含む。それぞれの重鎖または軽鎖は、2つの領域、すなわち可変部(抗原に対する認識および結合を付与する)と(局在化および細胞間相互作用と関連のある)定常部とに分けられる。したがって、全長抗体は、一般に、2箇所の重鎖定常部(HCまたはCH)、2箇所の重鎖可変部(HVもしくはVH)、2箇所の軽鎖定常部(LCまたはCL)、および2箇所の重鎖可変部(LVまたはVL)を含む(図2)。1本または複数の軽鎖は、λ鎖でもκ鎖でもよい。したがって、本発明の実施形態では、抗体は、少なくとも1箇所の重鎖可変部および1箇所の軽鎖可変部を含み、抗体が抗原を結合するようになっている。
本発明は、グラム陽性スタフィロコッカス属のリポタイコ酸(LTA)に結合する、モノクローナル抗体ならびにキメラ、ヒト化および完全ヒト抗体、ならびにそれらのフラグメント、誘導体および領域を含むマウス抗体を提供する。グラム陽性細菌は、グラム陰性細菌とは違って、細胞壁の構造の違いによってグラム染色を取り込む。グラム陰性細菌の細胞壁は、2枚の向かい合うリン脂質−タンパク質リーフレットのユニークな外膜からなり、内側のリーフレットでは通常のリン脂質であるが、外側のリーフレットでは極めて毒性の強いリポ多糖体である。グラム陽性細菌の細胞壁は、それに比べて非常にシンプルであり、2つの主要な構成要素であるペプチドグリカンとタイコ酸、ならびにさらに別の炭水化物およびタンパク質を含み、種によって異なる。
5型黄色ブドウ球菌は、受託番号49521でATCCに寄託されている。
ハイブリドーマ96-105CE11IF6(M110)は、1997年6月13日に受託番号HB-12368でATCCに寄託されている。
アイソタイプは、Zymed Laboratories(カタログ番号90-6550)から入手したマウス免疫グロブリンアイソタイプ・キットを使用して決定した。
本発明の結合アッセイでは、免疫グロブリンは、ブドウ球菌全細胞(whole cell)調製物またはLTAやPepGなどの細菌細胞壁成分調製物と共にインキュベートする。結合アッセイは、凝集アッセイ、凝固アッセイ、比色アッセイ、蛍光結合アッセイ、または当業者に知られている他の適切なアッセイでよい。特に適切なアッセイは、酵素結合免疫吸着アッセイ(ELISA)またはラジオイムノアッセイ(RIA)である。結合は、直接に検出するが、当業者に知られている競合もしくは非競合結合法を使用して間接的に検出することもできる。
抗原に結合する抗体は、必ずしもオプソニン化を強化し、または感染からの防御を増強するものではない。したがって、オプソニン化アッセイを使用して、抗体の機能活性を判定した。
プレートを一定に激しく振盪させながら37℃でインキュベートした。ゼロ時間目、すなわちサンプル抗体を最初に加えたとき、および2時間のインキュベート後に、10μlの一定量を各ウェルから採取した。各サンプル・ウェルから収集した各アリコート中の生存細菌数を決定するために、各アリコートを、0.1%のBSA水溶液に加えて20倍希釈し(PMNを溶解するため)、すばやいピペット操作によって激しく混合し、血液寒天プレート(Remel、カタログ番号01-202、または等価物)上で、37℃で終夜培養した。オプソニン活性は、2時間で採取したサンプルから観察された細菌集落数と、0時間で採取したサンプルから観察された細菌集落数とを比較して測定した。IPI Minicountコロニーカウンターを使用して集落を数えた。
ハイブリドーマおよびモノクローナル抗体の作製
マウスをS.アウレウス由来のリポタイコ酸(LTA)のコンジュゲートで免疫することにより、該LTAに対して抗体を生起させた。以下に述べるようにして調製したLTAコンジュゲートLTA/PspA、LTA/SIA/TTおよびLTA/GMBS/TTを使用した。
M120のオプソニン活性
オプソニンアッセイは、実質的には上記の「Neutrophil-mediated Opsonophagocytic Bacteriacidal Assay」という標題で記載されているようにして行った。M120を、実質的にはMEP Hypercel gel(BiSepra)の製造元により記載されているようにして腹水から精製した。33mlの緩衝液A(50mM Tris、5mM EDTA、pH 8)を17mlのマウス腹水に添加し、次に、A462ローターを用い、Eppendorfモデル5810R遠心分離機で4000rpmにて15分間遠心分離した。溶液をWhatman GD/XP PES 0.45μメンブラン(カタログ番号:6994-2504)を用いて濾過したところ、濾過後の希釈腹水の容量は47mlであった。溶液を1cm×7cmのMEPハイパーセルカラム(緩衝液Aで平衡化してあるもの)に1.8ml/分の速度でローディングした。OD280が0.05未満になるまで、カラムを緩衝液Aで、次に緩衝液A+25mMカプリル酸ナトリウムで洗浄した。次に、OD280が0.05未満になるまで、カラムを水で洗浄した。カラムを緩衝液B(50mM酢酸ナトリウム、5mM EDTA、pH4)で溶出させ、溶出液を70滴/分の速度で回収した。主要ピーク(プールA)およびその後縁部(プールB)を別々にプールし、PBS(2回×2L)で4℃にて透析した。透析した溶液をMillex GV装置(Millipore)を用いて滅菌濾過した。OD280によれば、プールAは3.2mg/mlの抗体を含み、プールBは0.25mg/mlの抗体を含んでいた。
M120可変領域のクローニング
全RNAを、4×106個の凍結00-107 GG12 ID12ハイブリドーマ細胞から、Midi RNA単離キット(Qiagen)を用い、製造元の手順に従って単離した。RNAを0.03U/μgのPrime RNaseインヒビター(Sigma)を含有する10mM Tris、0.1mM EDTA(pH8.4)に溶解して、最終濃度を0.25μg/μlとした。
組換えキメラマウス/ヒト抗体分子の作製
次に、組換えキメラマウス/ヒト抗体分子を作製するために、重鎖および軽鎖の可変領域を、哺乳動物発現プラスミドベクターにサブクローニングした。M120抗体のヒト/マウスキメラをA120と命名し、M110抗体のヒト/マウスキメラをA110と命名する(1998年6月15日出願の米国特許出願第09/097,055号を参照)。
A120およびA110の抗LTAヒト/マウスキメラ抗体の比較
抗LTAヒト/マウスキメラ抗体A110は、米国特許出願第09/097,055号(参照により本明細書に組み入れられる)に先に記載されている。抗LTAヒト/マウスキメラ抗体A110およびA120の結合活性を、LTAに対してELISAで比較した。
抗LTA抗体A110およびA120のオプソニン活性の比較
精製したヒト/マウスキメラA110およびA120、ならびにマウスM120のMAbを、上記で「Neutrophil-Mediated Opsonophagocytic Bactericidal Assay」という標題で記載されているようにして、それらのオプソニン活性についてアッセイした。簡単に説明すると、精製したA110抗体、A120抗体またはM120抗体の希釈物を、マイクロタイタープレートのウェル内で好中球(PMN)と合わせた。対数増殖中期の細菌を各ウェルに加え、続いて免疫グロブリン飢餓ヒト血清(補体(C‘)の供給源となる)を加えた。サンプルを37℃で2時間インキュベートし、次に血液寒天にプレートし、一夜インキュベートして、残存する生細菌の数を求めた。オプソニン活性は「%死滅」として表すが、これは次の式に従って求める:%死滅=100%−N2hr/N0hr[式中、N2hrは、抗体、PMNおよびC’と共に2時間インキュベートした後で形成されるコロニーの数であり、N0hrは、0時間インキュベートした後で形成されるコロニーの数である]。対照の反応物には上記の成分を含めなかった。表10に、A110、A120およびM120の抗体についてのオプソニン活性アッセイの結果を示す。
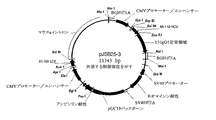
組換えキメラマウス/ヒトA120抗体の一過的産生
プラスミドpJSB25、pJSB26およびpJSB27を、6ウェル組織培養ウェル内でSuperfect (Qiagen)を用いて製造元により記載されているようにして、IMDM+10%ウシ胎仔血清中で増殖させたCOS細胞にトランスフェクトした。2日後、上清を、キメラ抗体の産生および発現された抗体のS.アウレウスLTA抗原への結合能についてアッセイした。
LTAに結合するヒト抗体
当業者であれば、上記のようにマウス抗体をヒト化して処置中のHAMA応答を最低限に抑える代わりに、完全ヒト型の防護作用のある抗LTA抗体を単離することができる。当業者であれば、完全ヒト型の組換え抗体を作製するのに使用可能な周知の別の戦略が沢山ある。1つは、ファージ提示法(59、63)を用いた抗体の作製である。具体的に述べると、ヒトRNAを用いて、バクテリオファージの表面に発現させた抗体の重鎖断片および軽鎖断片のcDNAライブラリーを作製する。これらのライブラリーは、対象の抗原(すなわちLTA)に対してプローブするのに使用でき、続いて、(表面に抗体が発現されているので)結合するファージを単離する。可変領域をコードするDNAを配列決定し、抗体の発現についてクローングする。
マウスで、S.アウレウスのLTAに対してモノクローナル抗体を生起させた。ELISAアッセイにおいてLTAに強く結合した抗体を産生する1つのハイブリドーマをさらにサブクローニングした。ハイブリドーマサブクローン00-107GG12 ID12は、LTAに強く結合するκ軽鎖を有するIgG2aモノクローナル抗体を産生した。このハイブリドーマにより産生される抗体をM120と命名した(実施例1)。
Claims (39)
- 少なくとも1つの軽鎖と少なくとも1つの重鎖とを含むMAbであって、
該少なくとも1つの軽鎖は、配列番号16、10および21から選択される軽鎖可変領域と少なくとも70%の同一性を有するアミノ酸配列を含むポリペプチドを含み;
該少なくとも1つの重鎖は、配列番号12、17および22から選択される重鎖可変領域と少なくとも70%の同一性を有するアミノ酸配列を含むポリペプチドを含み;そして
該MAbはLTAに特異的に結合するものである、上記MAb。 - 同一性の%が少なくとも80%である、請求項1に記載のMAb。
- 同一性の%が少なくとも90%である、請求項1に記載のMAb。
- 配列番号10、12、16、17、21および22から選択されるアミノ酸配列を有する少なくとも1つの可変領域を含む、請求項1に記載のMAb。
- 少なくとも1つの軽鎖、少なくとも1つの重鎖、またはこの両方がキメラまたはヒト化されている、請求項1に記載のMAb。
- 少なくとも1つの軽鎖、少なくとも1つの重鎖、またはこの両方がヒトのものである、請求項1に記載のMAb。
- 重鎖定常領域を含み、その定常領域はヒトIgG、IgA、IgMまたはIgD配列を含む、請求項1に記載のMAb。
- Fab、Fab'、F(ab')2、Fv、SFv、scFvを含む、請求項1に記載のMAb。
- 配列番号16、10および21から選択される軽鎖可変領域と少なくとも70%の同一性を有するアミノ酸配列を含むポリペプチドであって、LTAに特異的に結合するMAb内の可変領域もしくはその部分として機能することができる、上記ポリペプチド。
- 配列番号10、16または21のアミノ酸24〜33、49〜55および88〜73から選択される配列と少なくとも88%の同一性を有する少なくとも1つの領域を含み、その領域が、LTAに特異的に結合するMAb内のCDRもしくはその部分として機能することができる、請求項9に記載のポリペプチド。
- 配列番号10、16または21のアミノ酸1〜23、34〜38、56〜87および97〜106から選択される配列と少なくとも82%の同一性を有する少なくとも1つの領域を含み、その領域が、LTAに特異的に結合するMAb内のフレームワーク領域もしくはその部分として機能することができる、請求項9に記載のポリペプチド。
- 請求項9に記載のポリペプチドを含む、MAb軽鎖。
- キメラ、ヒト化またはヒト型である、請求項12に記載のMAb軽鎖。
- ヒトκまたはλ配列を含む軽鎖定常領域を含む、請求項12に記載のMAb軽鎖。
- 配列番号12、17および22から選択される重鎖可変領域と少なくとも70%の同一性を有するアミノ酸配列を含むポリペプチドであって、LTAに特異的に結合するMAb内の可変領域もしくはその部分として機能することができる上記ポリペプチド。
- 配列番号12、17または22のアミノ酸26〜35および50〜69から選択される配列と少なくとも80%の同一性を有する少なくとも1つの領域を含み、その領域が、LTAに特異的に結合するMAb内のCDR領域もしくはその部分として機能することができる、請求項15に記載のポリペプチド。
- 配列番号12、17または22のアミノ酸1〜25、36〜49、70〜101および115〜125から選択される配列と少なくとも80%の同一性を有する少なくとも1つの領域を含み、その領域が、LTAに特異的に結合するMAb内のフレームワーク領域もしくはその部分として機能することができる、請求項15に記載のポリペプチド。
- 請求項15に記載のポリペプチドを含むMAb重鎖。
- キメラ、ヒト化またはヒトのものである、請求項18に記載のMAb重鎖。
- ヒトIgG、IgA、IgMまたはIgD配列を含む重鎖定常領域を含む、請求項18に記載のMAb重鎖。
- 少なくとも1つの軽鎖と少なくとも1つの重鎖とを含むMAbであって、
LTAに特異的に結合し、かつ
その少なくとも1つの軽鎖は、配列番号10、16または21のアミノ酸24〜33、49〜55または88〜73から選択される配列を含む少なくとも1つのCDRを有する可変領域を含むか、あるいは
その少なくとも1つの軽鎖は、配列番号12、17または22のアミノ酸1〜25、36〜49、70〜101または115〜125から選択される配列を含む少なくとも1つのCDRを有する可変領域を含む、上記MAb。 - A110、A110b、A120、A120bおよび391.4から選択される少なくとも1つの可変ドメインを含む、請求項21に記載のMAb。
- 請求項22に記載のMAbを発現するハイブリドーマ細胞系。
- 請求項1に記載の1つ以上のMAbと薬学的に許容される担体とを含む医薬組成物。
- S.エピデルミディス(S. epidermidis;表皮ブドウ球菌)およびS.アウレウス(S. aureus;黄色ブドウ球菌)に対してオプソニン性である、請求項24に記載の医薬組成物。
- グラム陽性細菌のペプチドグリカン(PepG)に結合する少なくとも1つの抗体をさらに含む、請求項25に記載の医薬組成物。
- 請求項24に記載の医薬組成物を投与することを含む、患者の治療方法。
- 組成物が鼻孔間投与される、請求項27に記載の方法。
- 医薬組成物が、グラム陽性細菌のペプチドグリカン(PepG)に結合する少なくとも1つの抗体をさらに含む、請求項27に記載の方法。
- 組成物が鼻孔間投与される、請求項29に記載の方法。
- a) 抗LTA抗体を誘導する少なくとも1つのLTAまたはLTAのペプチドミメオトープに特異的に結合する少なくとも1つのMAbを選定し、
b) その少なくとも1つのMAbの軽鎖可変領域のポリペプチド配列を決定し、
c) 配列番号16、10および21から選択される軽鎖可変領域と少なくとも70%の同一性を有するポリペプチド配列を選定し、
d) その少なくとも1つのMAbの重鎖可変領域のポリペプチド配列を決定し、
e) 配列番号12、17または22から選択される重鎖可変領域と少なくとも70%の同一性を有するポリペプチド配列を選定し、
f) ステップc)のポリペプチド配列を含む軽鎖を、ステップe)のポリペプチド配列を含む重鎖と組み合わせること、
を含む、請求項1に記載のMAbの作製方法。 - a) 抗LTA抗体を誘導する少なくとも1つのLTAまたはLTAのペプチドミメオトープに特異的に結合する少なくとも1つのMAbを選定し、
b) その少なくとも1つのMAbの軽鎖可変領域のポリペプチド配列を決定し、
d) 配列番号16、10および21から選択される軽鎖可変領域と少なくとも70%の同一性を有するポリペプチド配列を選定すること、
を含む、請求項9に記載のポリペプチドの作製方法。 - a) 抗LTA抗体を誘導する少なくとも1つのLTAまたはLTAのペプチドミメオトープに特異的に結合する少なくとも1つのMAbを選定し、
b) その少なくとも1つのMAbの重鎖可変領域のポリペプチド配列を決定し、
d) 配列番号12、17または22から選択される重鎖可変領域と少なくとも70%の同一性を有するポリペプチド配列を選定すること、
を含む、請求項15に記載のポリペプチドの作製方法。 - 請求項9に記載のポリペプチドをコードする精製された核酸。
- 請求項15に記載のポリペプチドをコードする精製された核酸。
- 1)細胞と、2)請求項1に記載のMAbの発現を指令できる1つ以上の組換え核酸とを含む産生システム。
- 抗原性が高くかつ高度に保存されているエピトープの同定方法であって、
a) 免疫原に特異的に結合する様々なMAbを選定し、
b) そのMAbの可変領域のポリペプチド配列を決定し、
d) 少なくとも2つのそのMAbのポリペプチド配列における同一性を有する領域を同定すること、ここで、該領域は、1)軽鎖可変領域の少なくとも70%の同一性、重鎖可変領域の少なくとも70%の同一性、可変領域内の3つの相補性決定領域(CDR)と比較して少なくとも70%の同一性、可変領域内の少なくとも2つのCDRと比較して少なくとも75%の同一性、1つのCDRにおいて少なくとも80%の同一性、ならびに可変領域のフレームワーク領域(FR)において少なくとも70%の同一性のうち少なくとも1つを含むものである、
を含む上記方法。 - 請求項1に記載の様々なMAbを含む、LTAに結合するMAbのコレクション。
- M110、M120、391.4、またはそれらのキメラもしくはヒト化誘導体のうちの1つ以上を含む、請求項38に記載のコレクション。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US34350301P | 2001-12-21 | 2001-12-21 | |
| US60/343,503 | 2001-12-21 | ||
| PCT/US2002/041033 WO2003059260A2 (en) | 2001-12-21 | 2002-12-23 | Opsonic monoclonal and chimeric antibodies specific for lipoteichoic acid of gram positive bacteria |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008003302A Division JP2008179634A (ja) | 2001-12-21 | 2008-01-10 | グラム陽性細菌のリポタイコ酸に特異的なオプソニン性モノクローナルおよびキメラ抗体 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2005514053A true JP2005514053A (ja) | 2005-05-19 |
| JP2005514053A6 JP2005514053A6 (ja) | 2005-08-04 |
| JP2005514053A5 JP2005514053A5 (ja) | 2006-02-16 |
Family
ID=23346384
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003559425A Pending JP2005514053A (ja) | 2001-12-21 | 2002-12-23 | グラム陽性細菌のリポタイコ酸に特異的なオプソニン性モノクローナルおよびキメラ抗体 |
| JP2008003302A Pending JP2008179634A (ja) | 2001-12-21 | 2008-01-10 | グラム陽性細菌のリポタイコ酸に特異的なオプソニン性モノクローナルおよびキメラ抗体 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008003302A Pending JP2008179634A (ja) | 2001-12-21 | 2008-01-10 | グラム陽性細菌のリポタイコ酸に特異的なオプソニン性モノクローナルおよびキメラ抗体 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20040052779A1 (ja) |
| EP (1) | EP1463479A4 (ja) |
| JP (2) | JP2005514053A (ja) |
| AU (2) | AU2002359794A1 (ja) |
| CA (1) | CA2469715C (ja) |
| WO (1) | WO2003059260A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009539360A (ja) * | 2006-06-06 | 2009-11-19 | クルセル ホランド ベー ヴェー | ブドウ球菌に対する殺活性を有するヒトの結合分子及びその使用方法 |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6610293B1 (en) * | 1997-06-16 | 2003-08-26 | The Henry M. Jackson Foundation For The Advancement Of Military Medicine | Opsonic and protective monoclonal and chimeric antibodies specific for lipoteichoic acid of gram positive bacteria |
| US7250494B2 (en) | 1998-06-15 | 2007-07-31 | Biosynexus Incorporated | Opsonic monoclonal and chimeric antibodies specific for lipoteichoic acid of Gram positive bacteria |
| GB2408573A (en) * | 2003-11-25 | 2005-06-01 | Univ Leicester | Assay for the interaction of L-Ficolin with lipoteichoic acid |
| JP2007519746A (ja) * | 2004-01-29 | 2007-07-19 | バイオシネクサス インコーポレーティッド | ワクチン調製におけるアミノ−オキシ官能基の使用 |
| JP5586952B2 (ja) | 2006-06-06 | 2014-09-10 | クルセル ホランド ベー ヴェー | 腸球菌に対する殺活性を有するヒトの結合分子及びその使用方法 |
| AU2012268821B2 (en) * | 2006-06-06 | 2016-06-02 | Janssen Vaccines & Prevention B.V. | Human binding molecules having killing activity against staphylococci and uses thereof |
| WO2008116118A2 (en) * | 2007-03-20 | 2008-09-25 | Avanir Pharmaceuticals | Fully human antibodies to gram positive bacteria |
| CN102256619A (zh) * | 2008-12-22 | 2011-11-23 | 奥克兰儿童医院及研究中心 | 离体被动保护菌血症实验 |
| WO2010085590A1 (en) * | 2009-01-23 | 2010-07-29 | Biosynexus Incorporated | Opsonic and protective antibodies specific for lipoteichoic acid gram positive bacteria |
| WO2011017101A2 (en) | 2009-07-27 | 2011-02-10 | Fina Biosolutions, Llc | Method for producing protein-carbohydrate vaccines reduced in free carbohydrate |
| BR122022002136B1 (pt) | 2009-12-17 | 2022-08-23 | Fina Biosolutions, Llc | Processo de conjugação de carboidratos na preparação de vacinas conjugadas e suas respectivas vacinas |
| US8383783B2 (en) | 2010-04-23 | 2013-02-26 | Serum Institute Of India, Ltd. | Simple method for simultaneous removal of multiple impurities from culture supernatants to ultralow levels |
| CA2856085C (en) | 2011-11-18 | 2020-06-30 | National Research Council Of Canada | Clostridium difficile lipoteichoic acid and uses thereof |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4596769A (en) * | 1984-03-05 | 1986-06-24 | Temple University | Monoclonal antibodies to peptidoglycan and methods of preparing same |
| CA1341235C (en) * | 1987-07-24 | 2001-05-22 | Randy R. Robinson | Modular assembly of antibody genes, antibodies prepared thereby and use |
| DE69329503T2 (de) * | 1992-11-13 | 2001-05-03 | Idec Pharma Corp | Therapeutische Verwendung von chimerischen und markierten Antikörpern, die gegen ein Differenzierung-Antigen gerichtet sind, dessen Expression auf menschliche B Lymphozyt beschränkt ist, für die Behandlung von B-Zell-Lymphoma |
| US5624904A (en) * | 1993-11-17 | 1997-04-29 | Massachusetts Institute Of Technology | Method for treating gram positive septicemia |
| US5686600A (en) * | 1994-06-28 | 1997-11-11 | Novartis Finance Corporation | Antibodies which bind to insect gut proteins and their use |
| AU6094696A (en) * | 1995-06-05 | 1996-12-24 | Bionebraska, Inc. | Lead binding polypeptides and nucleotides coding therefor |
| MA24512A1 (fr) * | 1996-01-17 | 1998-12-31 | Univ Vermont And State Agrienl | Procede pour la preparation d'agents anticoagulants utiles dans le traitement de la thrombose |
| US6610293B1 (en) * | 1997-06-16 | 2003-08-26 | The Henry M. Jackson Foundation For The Advancement Of Military Medicine | Opsonic and protective monoclonal and chimeric antibodies specific for lipoteichoic acid of gram positive bacteria |
| US7250494B2 (en) * | 1998-06-15 | 2007-07-31 | Biosynexus Incorporated | Opsonic monoclonal and chimeric antibodies specific for lipoteichoic acid of Gram positive bacteria |
-
2002
- 2002-12-20 US US10/323,926 patent/US20040052779A1/en not_active Abandoned
- 2002-12-23 CA CA2469715A patent/CA2469715C/en not_active Expired - Fee Related
- 2002-12-23 WO PCT/US2002/041033 patent/WO2003059260A2/en active Application Filing
- 2002-12-23 JP JP2003559425A patent/JP2005514053A/ja active Pending
- 2002-12-23 EP EP02794357A patent/EP1463479A4/en not_active Ceased
- 2002-12-23 AU AU2002359794A patent/AU2002359794A1/en not_active Abandoned
-
2008
- 2008-01-10 JP JP2008003302A patent/JP2008179634A/ja active Pending
-
2009
- 2009-07-08 AU AU2009202762A patent/AU2009202762B2/en not_active Ceased
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009539360A (ja) * | 2006-06-06 | 2009-11-19 | クルセル ホランド ベー ヴェー | ブドウ球菌に対する殺活性を有するヒトの結合分子及びその使用方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2003059260A3 (en) | 2004-01-15 |
| JP2008179634A (ja) | 2008-08-07 |
| EP1463479A4 (en) | 2006-02-22 |
| US20040052779A1 (en) | 2004-03-18 |
| CA2469715A1 (en) | 2003-07-24 |
| AU2002359794A1 (en) | 2003-07-30 |
| CA2469715C (en) | 2013-02-12 |
| AU2009202762A1 (en) | 2009-07-30 |
| WO2003059260A2 (en) | 2003-07-24 |
| EP1463479A2 (en) | 2004-10-06 |
| AU2009202762B2 (en) | 2012-08-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4691225B2 (ja) | グラム陽性細菌のリポテイコ酸に特異的なオプソニン的かつ防御的モノクローナルおよびキメラ抗体 | |
| US7777017B2 (en) | Nucleic acids encoding opsonic monoclonal and chimeric antibodies specific for lipoteichoic acid of gram positive bacteria | |
| JP2008179634A (ja) | グラム陽性細菌のリポタイコ酸に特異的なオプソニン性モノクローナルおよびキメラ抗体 | |
| US20080014202A1 (en) | Multifunctional monoclonal antibodies directed to peptidoglycan of gram-positive bacteria | |
| AU2009210372B2 (en) | Multifunctional monoclonal antibodies directed to peptidoglycan of gram-positive bacteria | |
| JP2016507470A (ja) | S.アウレウス(S.aureus)表面決定基に対する抗体 | |
| JP2005514053A6 (ja) | グラム陽性細菌のリポタイコ酸に特異的なオプソニン性モノクローナルおよびキメラ抗体 | |
| JP2006514636A (ja) | 抗ブドウ球菌療法およびワクチンの標的としての壁テイコイン酸 | |
| JP2002513398A (ja) | フィブロネクチン結合タンパク質組成物および使用法 | |
| JP2004514423A (ja) | トランスジェニックxenomouse(登録商標)から獲得されるpeudomonasaeruginosalpsに対するヒト抗体 | |
| KR910002373B1 (ko) | 슈도모나스 에루기노사 편모에 대한 단일클론항체 | |
| US10100103B2 (en) | Opsonic and protective monoclonal antibodies against gram-positive pathogens | |
| AU2012254925B2 (en) | Opsonic monoclonal and chimeric antibodies specific for lipoteichoic acid of gram positive bacteria | |
| AU2006203322A1 (en) | Opsonic and protective monoclonal and chimeric antibodies specific for lipoteichoic acid of gram positive bacteria |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20051222 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20051222 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070710 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20071004 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20071012 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080110 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080226 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080520 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20080527 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080825 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090602 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091002 |