JP2005292007A - 核酸固定化方法およびそれを用いるバイオセンサの製造方法 - Google Patents
核酸固定化方法およびそれを用いるバイオセンサの製造方法 Download PDFInfo
- Publication number
- JP2005292007A JP2005292007A JP2004109363A JP2004109363A JP2005292007A JP 2005292007 A JP2005292007 A JP 2005292007A JP 2004109363 A JP2004109363 A JP 2004109363A JP 2004109363 A JP2004109363 A JP 2004109363A JP 2005292007 A JP2005292007 A JP 2005292007A
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- molecule
- probe
- solution
- spacer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 108020004707 nucleic acids Proteins 0.000 title claims abstract description 79
- 102000039446 nucleic acids Human genes 0.000 title claims abstract description 79
- 150000007523 nucleic acids Chemical class 0.000 title claims abstract description 77
- 238000000034 method Methods 0.000 title claims abstract description 68
- 238000004519 manufacturing process Methods 0.000 title claims description 10
- 239000000523 sample Substances 0.000 claims abstract description 71
- 125000006850 spacer group Chemical group 0.000 claims abstract description 54
- 150000001768 cations Chemical class 0.000 claims abstract description 49
- 239000007790 solid phase Substances 0.000 claims abstract description 32
- 108020004711 Nucleic Acid Probes Proteins 0.000 claims abstract description 15
- 239000002853 nucleic acid probe Substances 0.000 claims abstract description 15
- 230000003100 immobilizing effect Effects 0.000 claims abstract description 4
- 239000010409 thin film Substances 0.000 claims description 17
- 108020004414 DNA Proteins 0.000 claims description 15
- 125000003396 thiol group Chemical group [H]S* 0.000 claims description 13
- 238000012360 testing method Methods 0.000 claims description 10
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 claims description 9
- 229910052737 gold Inorganic materials 0.000 claims description 9
- 239000010931 gold Substances 0.000 claims description 9
- 108091032973 (ribonucleotides)n+m Proteins 0.000 claims description 8
- 229920001223 polyethylene glycol Polymers 0.000 claims description 8
- 108091034117 Oligonucleotide Proteins 0.000 claims description 7
- FKNQFGJONOIPTF-UHFFFAOYSA-N Sodium cation Chemical compound [Na+] FKNQFGJONOIPTF-UHFFFAOYSA-N 0.000 claims description 7
- 229910001415 sodium ion Inorganic materials 0.000 claims description 7
- 239000007787 solid Substances 0.000 claims description 7
- 108091033319 polynucleotide Proteins 0.000 claims description 6
- 102000040430 polynucleotide Human genes 0.000 claims description 6
- 239000002157 polynucleotide Substances 0.000 claims description 6
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 claims description 5
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 claims description 5
- 239000002202 Polyethylene glycol Substances 0.000 claims description 5
- 229910001424 calcium ion Inorganic materials 0.000 claims description 5
- 229910001425 magnesium ion Inorganic materials 0.000 claims description 5
- -1 thiol compound Chemical class 0.000 claims description 5
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 4
- 239000002773 nucleotide Substances 0.000 claims description 4
- 125000003729 nucleotide group Chemical group 0.000 claims description 4
- 102000054765 polymorphisms of proteins Human genes 0.000 claims description 2
- 150000003839 salts Chemical class 0.000 abstract description 10
- 239000000243 solution Substances 0.000 description 31
- 238000001179 sorption measurement Methods 0.000 description 19
- 239000000758 substrate Substances 0.000 description 17
- 239000003298 DNA probe Substances 0.000 description 15
- 238000009396 hybridization Methods 0.000 description 12
- 108020003215 DNA Probes Proteins 0.000 description 10
- 238000002494 quartz crystal microgravimetry Methods 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 230000008859 change Effects 0.000 description 8
- 230000000052 comparative effect Effects 0.000 description 8
- 239000011734 sodium Substances 0.000 description 8
- 238000001514 detection method Methods 0.000 description 7
- 229910052751 metal Inorganic materials 0.000 description 7
- 239000002184 metal Substances 0.000 description 7
- 239000011259 mixed solution Substances 0.000 description 7
- UGZAJZLUKVKCBM-UHFFFAOYSA-N 6-sulfanylhexan-1-ol Chemical compound OCCCCCCS UGZAJZLUKVKCBM-UHFFFAOYSA-N 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 125000000524 functional group Chemical group 0.000 description 6
- 239000000203 mixture Substances 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 5
- 239000011777 magnesium Substances 0.000 description 5
- 238000002156 mixing Methods 0.000 description 5
- 239000002094 self assembled monolayer Substances 0.000 description 5
- 239000013545 self-assembled monolayer Substances 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 108091093037 Peptide nucleic acid Proteins 0.000 description 4
- 125000003277 amino group Chemical group 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 239000010408 film Substances 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 125000003700 epoxy group Chemical group 0.000 description 3
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 3
- 239000008363 phosphate buffer Substances 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- 125000002947 alkylene group Chemical group 0.000 description 2
- VPKDCDLSJZCGKE-UHFFFAOYSA-N carbodiimide group Chemical group N=C=N VPKDCDLSJZCGKE-UHFFFAOYSA-N 0.000 description 2
- 150000001805 chlorine compounds Chemical group 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 239000000356 contaminant Substances 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 125000002228 disulfide group Chemical group 0.000 description 2
- 125000003827 glycol group Chemical group 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000003380 quartz crystal microbalance Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 2
- 239000013076 target substance Substances 0.000 description 2
- KHWCHTKSEGGWEX-RRKCRQDMSA-N 2'-deoxyadenosine 5'-monophosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@H]1C[C@H](O)[C@@H](COP(O)(O)=O)O1 KHWCHTKSEGGWEX-RRKCRQDMSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- 241000252506 Characiformes Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical group Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- NPYPAHLBTDXSSS-UHFFFAOYSA-N Potassium ion Chemical compound [K+] NPYPAHLBTDXSSS-UHFFFAOYSA-N 0.000 description 1
- 239000006087 Silane Coupling Agent Substances 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 229910002367 SrTiO Inorganic materials 0.000 description 1
- 239000007984 Tris EDTA buffer Substances 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 229910001422 barium ion Inorganic materials 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 238000003508 chemical denaturation Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000000280 densification Methods 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 238000007772 electroless plating Methods 0.000 description 1
- 238000009713 electroplating Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 238000012252 genetic analysis Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 238000007733 ion plating Methods 0.000 description 1
- IQPQWNKOIGAROB-UHFFFAOYSA-N isocyanate group Chemical group [N-]=C=O IQPQWNKOIGAROB-UHFFFAOYSA-N 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 125000005647 linker group Chemical group 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000002952 polymeric resin Substances 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 125000003132 pyranosyl group Chemical group 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 229910052814 silicon oxide Inorganic materials 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 238000004544 sputter deposition Methods 0.000 description 1
- 229910001427 strontium ion Inorganic materials 0.000 description 1
- PWYYWQHXAPXYMF-UHFFFAOYSA-N strontium(2+) Chemical compound [Sr+2] PWYYWQHXAPXYMF-UHFFFAOYSA-N 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-N sulfuric acid Substances OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 125000000101 thioether group Chemical group 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 238000007740 vapor deposition Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6832—Enhancement of hybridisation reaction
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y30/00—Nanotechnology for materials or surface science, e.g. nanocomposites
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Wood Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Health & Medical Sciences (AREA)
- Nanotechnology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Genetics & Genomics (AREA)
- Composite Materials (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- General Physics & Mathematics (AREA)
- Materials Engineering (AREA)
- Crystallography & Structural Chemistry (AREA)
- Analytical Chemistry (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Abstract
【解決手段】 核酸を固相担体上に固定化するための核酸固定化方法であって、核酸を含むプローブ分子と、スペーサ分子と、少なくとも1種類の2価の陽イオンまたはその塩と、を含む溶液を調整する工程と、溶液と固相担体とを接触させてインキュベートする工程と、を含む方法。
【選択図】 図1
Description
Peterson, A. W. et al., Nucleic Acids Research, vol. 29, No. 24, 5163-5168 (2001) Tonya M. Herne et al., Journal of American Chemical Society, 119, pp. 8916-8920 (1997)
化することが可能な官能基を示し;AはC1-15の置換基を有してもよいアルキレン基、ポリエチレングリコール基(PEG)を示し;Bは水酸基、アミノ基、フェロセニル基またはカルボキシル基を示す。〕で表される化合物またはその塩が挙げられる。中でも、Bが水酸基であり、AがC6のアルキレン基またはポリエチレングリコール基であるものが好ましい。
プローブ分子として、式dA20−(CH2)6−SHで表される核酸プローブを購入入手した。ここで、dA20とはデオキシアデノシン5’−リン酸を意味する。
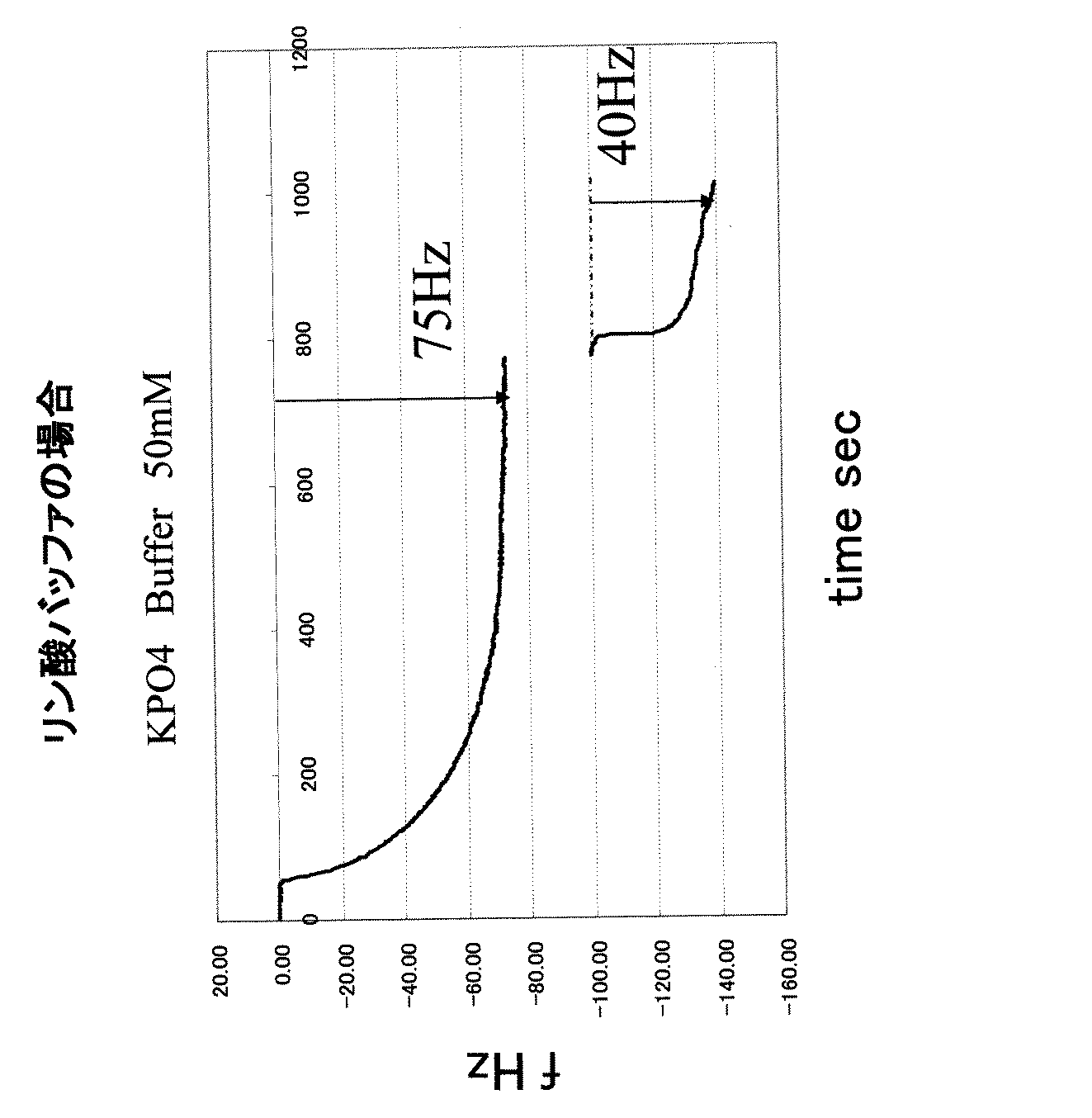
プローブ分子とスペーサ分子の固定化、および固定化されたプローブ分子への標的核酸分子のハイブリダイゼーションは、QCM測定法により測定した。
(3)ハイブリダイゼーション
Δf(coa)は、プローブ分子の吸着量による振動数変化と、スペーサ分子の吸着量による振動数数変化の合計を表すので、プローブ分子が高密度化したことの確認にはならない。そこで次に、プローブ分子と標的核酸とのハイブリダイゼーションによる振動数の減少を測定し、プローブ分子の密度変化を観測した。
Claims (12)
- 核酸を固相担体上に固定化するための核酸固定化方法であって、
核酸を含むプローブ分子と、スペーサ分子と、少なくとも1種類の2価の陽イオンと、を含む溶液を調製する工程と、
前記溶液と前記固相担体とを接触させてインキュベートする工程と、を含む方法。 - 前記2価の陽イオンが、マグネシウムイオンまたはカルシウムイオンである、請求項1に記載の方法。
- 前記溶液が、2価の陽イオンを合計濃度で0.1mM〜100mM含む、請求項1または2に記載の方法。
- 前記溶液が、さらに、1価の陽イオンを合計濃度で10mM〜2M含む、請求項1から3のいずれか1項に記載の方法。
- 前記1価の陽イオンが、ナトリウムイオンである、請求項4に記載の方法。
- 前記核酸分子が、それぞれ修飾されていてもよく、かつ一本鎖である、DNA、RNAまたはPNAからなるポリヌクレオチドまたはオリゴヌクレオチドである、請求項1から5のいずれか1項に記載の方法。
- 前記プローブ分子がチオール基を有する、請求項1から6のいずれか1項に記載の方法。
- 前記スペーサ分子が、水酸基を有するチオール化合物、または一端にチオール基が導入されたポリエチレングリコールである、請求項1から7のいずれか1項に記載の方法。
- 前記固相担体表面のプローブ分子またはスペーサ分子が吸着する領域に、金薄膜が形成されている、請求項7または8に記載の方法。
- 請求項1から9のいずれか1項に記載の核酸固定化方法を用いることを含む、センシング部位として核酸プローブを有するバイオセンサの製造方法。
- 被検試料中の標的核酸分子を検出する方法であって、
請求項10に記載の方法により製造されたバイオセンサと前記被検試料とを接触させてインキュベートする工程と、
前記バイオセンサの核酸プローブにハイブリダイズした核酸の有無を検出する工程と、を含む方法。 - DNA、RNAまたはそれらの一塩基多型検出のための、請求項11に記載の方法。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004109363A JP2005292007A (ja) | 2004-04-01 | 2004-04-01 | 核酸固定化方法およびそれを用いるバイオセンサの製造方法 |
| US11/090,238 US7491496B2 (en) | 2004-04-01 | 2005-03-28 | Method for immobilizing nucleic acid and method for manufacturing biosensor using the same method |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004109363A JP2005292007A (ja) | 2004-04-01 | 2004-04-01 | 核酸固定化方法およびそれを用いるバイオセンサの製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005292007A true JP2005292007A (ja) | 2005-10-20 |
Family
ID=35054822
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004109363A Withdrawn JP2005292007A (ja) | 2004-04-01 | 2004-04-01 | 核酸固定化方法およびそれを用いるバイオセンサの製造方法 |
Country Status (2)
| Country | Link |
|---|---|
| US (1) | US7491496B2 (ja) |
| JP (1) | JP2005292007A (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017018437A1 (ja) * | 2015-07-28 | 2017-02-02 | Jsr株式会社 | アフィニティー担体およびイムノグロブリンを単離する方法 |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010037085A1 (en) | 2008-09-29 | 2010-04-01 | The Board Of Trustees Of The University Of Illinois | Dna sequencing and amplification systems using nanoscale field effect sensor arrays |
| CN110337586B (zh) | 2017-02-22 | 2023-03-10 | 豪夫迈·罗氏有限公司 | 用于检测至少一种流体样品中的至少一种分析物的分析物检测器 |
| EP3728636B1 (en) * | 2017-12-19 | 2024-09-11 | Becton, Dickinson and Company | Particles associated with oligonucleotides |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5705628A (en) * | 1994-09-20 | 1998-01-06 | Whitehead Institute For Biomedical Research | DNA purification and isolation using magnetic particles |
| US6506564B1 (en) * | 1996-07-29 | 2003-01-14 | Nanosphere, Inc. | Nanoparticles having oligonucleotides attached thereto and uses therefor |
| US6287776B1 (en) * | 1998-02-02 | 2001-09-11 | Signature Bioscience, Inc. | Method for detecting and classifying nucleic acid hybridization |
| DE19964220C2 (de) * | 1998-11-23 | 2003-07-03 | Friz Biochem Gmbh | Verfahren zur Herstellung einer modifizierten leitfähigen Oberfläche |
| WO2002000686A2 (en) * | 2000-06-23 | 2002-01-03 | Bioelastics Research, Ltd. | Bioelastomer nanomachines and biosensors |
| AU2001281248A1 (en) | 2000-08-11 | 2002-03-13 | Nanosphere Inc. | Nanoparticles having oligonucleotides attached thereto and uses therefor |
| WO2003018854A2 (en) | 2001-08-27 | 2003-03-06 | Surface Logix, Inc. | Immobilization of biological molecules onto surfaces coated with monolayers |
| JP3979198B2 (ja) | 2002-03-25 | 2007-09-19 | 東レ株式会社 | 核酸固定化担体 |
-
2004
- 2004-04-01 JP JP2004109363A patent/JP2005292007A/ja not_active Withdrawn
-
2005
- 2005-03-28 US US11/090,238 patent/US7491496B2/en not_active Expired - Fee Related
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017018437A1 (ja) * | 2015-07-28 | 2017-02-02 | Jsr株式会社 | アフィニティー担体およびイムノグロブリンを単離する方法 |
| JPWO2017018437A1 (ja) * | 2015-07-28 | 2018-05-17 | Jsr株式会社 | アフィニティー担体およびイムノグロブリンを単離する方法 |
| US10766924B2 (en) | 2015-07-28 | 2020-09-08 | Jsr Corporation | Affinity support and method for isolating immunoglobulin |
Also Published As
| Publication number | Publication date |
|---|---|
| US7491496B2 (en) | 2009-02-17 |
| US20050221362A1 (en) | 2005-10-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Sohrabi et al. | A novel engineered label-free Zn-based MOF/CMC/AuNPs electrochemical genosensor for highly sensitive determination of Haemophilus Influenzae in human plasma samples | |
| US7087148B1 (en) | Binding acceleration techniques for the detection of analytes | |
| US6264825B1 (en) | Binding acceleration techniques for the detection of analytes | |
| US7655129B2 (en) | Binding acceleration techniques for the detection of analytes | |
| AU778556B2 (en) | Binding acceleration techniques for the detection of analytes | |
| Paleček et al. | DNA hybridization at microbeads with cathodic stripping voltammetric detection | |
| JP2003322653A (ja) | プローブ固定支持体及びプローブ固定担体 | |
| US20050244954A1 (en) | Binding acceleration techniques for the detection of analytes | |
| WO2012144631A1 (ja) | 生体分子検出用電極チップ、及び、生体分子検出方法 | |
| US6495328B2 (en) | Substrate for detecting base sequences, method of manufacturing the substrate, and method of detecting base sequences using the substrate | |
| WO2021134133A1 (en) | Electrochemical sensing methods and apparatus for determining drug uptake and retention in cells | |
| US20100035248A1 (en) | Surface-based nucleic acid assays employing morpholinos | |
| JP2005292007A (ja) | 核酸固定化方法およびそれを用いるバイオセンサの製造方法 | |
| JP3788513B2 (ja) | 固相基板上への分子の固定化方法およびそれを用いるバイオセンサの製造方法 | |
| JP4262426B2 (ja) | 核酸断片固定電極及びその利用 | |
| Miyahara et al. | Microbial genetic analysis based on field effect transistors | |
| Morita et al. | Electrochemical SNPs detection using an abasic site-containing DNA on a gold electrode | |
| CN104388555B (zh) | Dna微阵列芯片检测与ⅱ型糖尿病相关的单核苷酸多态性的方法 | |
| JP3979198B2 (ja) | 核酸固定化担体 | |
| Caruana | Hybridization at oligonucleotide sensitive | |
| JP2006010621A (ja) | 非特異的吸着防止方法、該方法を用いたバイオアッセイ用基板の製造方法、相互作用の検出方法、並びに、試薬キット。 | |
| Xiang | Amplified electrochemical bioassays based on bioaffinity interactions | |
| Bartošík | Electrochemical analysis of nucleic acids and proteins for biomedicine | |
| AU2004201066A1 (en) | Binding acceleration techniques for the detection of analytes | |
| Henke et al. | MEASUREMENT OF THE REFRACTIVE INDEX OF COVALENTLY WOBILISED OLIGONUCLEOTJDE FILMS ON FUSED SILICA OPTICAL FIBRES FOR OPTIMISATION OF A NUCLEIC ACID |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20060210 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070207 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070406 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070703 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20070830 |