JP2004537500A - 腫瘍の増殖の阻害および免疫応答の増強のための方法および組成物 - Google Patents
腫瘍の増殖の阻害および免疫応答の増強のための方法および組成物 Download PDFInfo
- Publication number
- JP2004537500A JP2004537500A JP2002555834A JP2002555834A JP2004537500A JP 2004537500 A JP2004537500 A JP 2004537500A JP 2002555834 A JP2002555834 A JP 2002555834A JP 2002555834 A JP2002555834 A JP 2002555834A JP 2004537500 A JP2004537500 A JP 2004537500A
- Authority
- JP
- Japan
- Prior art keywords
- inhibitor
- subject
- virus
- tumor
- administered
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1793—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/208—IL-12
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2812—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55516—Proteins; Peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55522—Cytokines; Lymphokines; Interferons
- A61K2039/55527—Interleukins
- A61K2039/55538—IL-12
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Abstract
Description
(発明の分野)
本発明は、一般に、免疫応答を増強するための方法および組成物に関し、そしてより具体的には、IL−13の発現もしくは活性および/またはNK−T細胞活性を阻害することによって、免疫応答を阻害するための方法および組成物に関する。
【0002】
(発明の背景)
サイトカインIL−13は、数種の生物学的活性に関係している。これらの活性としては、例えば、IgG4およびIgEスイッチングの誘導、生殖細胞系IgE重鎖ε転写の誘導、正常なヒトB細胞におけるCD23の発現、ならびにCD40Lまたは抗CD40mAbの存在下におけるB細胞増殖の誘導が挙げられる。
【0003】
IL−13は、サイトカインIL−4と、いくつかの機能的な特性を共有する。IL−13の多くの報告された活性は、IL−4の活性と類似しているが、IL−13は、活性化されたT細胞またはT細胞クローンに対して、増殖を促進する効果を有さない。
【0004】
IL−13は、標的細胞の表面上で、IL−13レセプター(「IL−13R」)と相互作用することによって、特定の生物学的活性を示す。IL−13RおよびIL−4レセプター(「IL−4R」)は、共通の成分を共有し、この成分は、レセプターの活性化に必要とされる。しかし、IL−13は、IL−4を用いてトランスフェトされた細胞に結合しない。
【0005】
(発明の要旨)
本発明は、IL−13のインヒビターの被験体への投与、または被験体におけるNK−T細胞の機能の崩壊が、腫瘍の再発を阻害するという発見に一部基づいている。従って、本発明は、IL−13インヒビターまたはNK−T細胞インヒビターを被験体に投与することによって、被験体の腫瘍の増殖を阻害する方法を含む。
【0006】
IL−13インヒビターは、好ましくは、無毒のインヒビターである。例えば、このインヒビターは、Pseudomonas体外毒素、リシン、アブリンおよびジフテリア毒素のような細胞傷害部分を欠失する。
【0007】
いくつかの実施形態において、インヒビターは、IL−13ポリペプチドに対するリガンドである。適切なIL−13リガンドの1例は、IL−13レセプターのIL−13結合領域を含むポリペプチドである。
【0008】
好ましくは、このポリペプチドはまた、免疫グロブリンポリペプチドを含む。いくつかの実施形態において、インヒビターは、可溶性哺乳動物(例えば、マウスまたはヒト)IL−13レセプター部分およびヒトIgG1ポリペプチドの領域を含む、融合タンパク質である。好ましいIL−13リガンドは、sIL−13Rα2.Fcであり、これは、Donaldsonら、J.Immunol.161:2317−24,1998に記載されている。
【0009】
別の適切なインヒビターは、IL−13アンタゴニスト(例えば、IL−13ポリペプチドに結合するアンタゴニスト抗体)である。この抗体は、ポリクローナル抗体またはモノクローナル抗体のいずれかであり得る。IL−13に対する抗体は、当該分野で公知の技術を使用して作製され得る。例えば、IL−13ポリペプチドを、動物を免疫するために使用して、IL−13タンパク質と特異的に反応し、そしてIL−13、またはそのフラグメントがそのレセプターに結合するのを阻害し得る、ポリクローナル抗体およびモノクローナル抗体を得ることができる。このような抗体は、免疫原としてIL−13全体を使用して、またはIL−13のフラグメント(例えば、可溶性成熟IL−13)を使用することによって得られ得る。IL−13のより小さなフラグメントをまた使用して、動物を免疫化し得る。このペプチドの免疫原はさらに、カルボキシル末端にシステイン残基を含み得、そしてハプテン(例えば、キーホールカサガイヘモシアニン(keyhole limpet hemocyanin)(KLH))に結合体化される。さらなるペプチド免疫原は、チロシン残基を硫酸化したチロシン残基と置換することによって生成され得る。このようなペプチドを合成する方法は、当該分野において公知である(例えば、Merrifield,J.Amer.Chem.Soc.85,2149−2154,1963に記載される)。
【0010】
腫瘍の増殖または発生はまた、CD1制限NK−T細胞の活性をブロックすることによって阻害される。好ましくは、インヒビターは、CD−1分子に結合する。CD−1結合インヒビターの例としては、抗CD−1抗体または他の可溶性抗CD1リガンドが挙げられる。抗CD1抗体は、当該分野で公知であり、例えば、Roarkら、J.Imm.160:3121−27,1998に記載されている。
【0011】
別の実施形態において、インヒビターは、NK−T細胞特異的マーカーに結合する。NK−T細胞特異的マーカーの例は、Vα24ポリペプチドである。このインヒビターの例は、Vα24ポリペプチドに対する抗体である。この抗体は、モノクローナル抗体またはポリクローナル抗体のいずれかであり、そして上記の方法を使用して生成され得る。Vα24ポリペプチドを認識する抗体は、例えば、Prussinら,J.Immunol.159,5862−70,1997に記載されている。
【0012】
このインヒビターは、一次腫瘍、転移性腫瘍、またはその両方のいずれかの増殖を阻害するために、投与され得る。従って、いくつかの実施形態において、このインヒビターは、被験体において一次腫瘍を検出する前に、例えば、一次腫瘍の増殖を阻害するために、投与される。他の実施形態において、インヒビターは、被験体において一次腫瘍を検出した後に、例えば、一次腫瘍の再発を阻害するため、または転移を阻害するために、投与される。
【0013】
好ましい実施形態において、このインヒビターは、被験体において腫瘍の増殖を阻害するのに十分な量で投与される。例えば、このインヒビターは、治療有効量で投与され得る。「治療有効量」とは、患者の意義ある利益(例えば、腫瘍の症状の緩和、腫瘍の治癒、または腫瘍のサイズもしくは他の特性の減少)を示すのに十分である、薬学的組成物または方法の各活性成分の総量を意味する。
【0014】
被験体は、例えば、動物(例えば、ヒト、イヌ、ネコ、ウマ、ウシ、ブタ、またはげっ歯類)(例えば、マウスもしくはラット)であり得る。
【0015】
被験体は、腫瘍の発達について増加したリスクが存在し得る。「増加したリスク」は、被験体が、1以上の遺伝因子もしくは環境因子、またはその両方が異なる、年齢が一致するコントロールよりも、腫瘍をより発達しそうであることを意味する。例えば、被験体は、被験体に腫瘍の増加したリスクに対する素因を与える遺伝子の対立遺伝子を有し得る。この被験体は、対立遺伝子を遺伝し得、すなわち、被験体は、腫瘍の発達について増加したリスクの家族性の病歴を有し得る。この対立遺伝子は、被験体のプロトオンコジーンまたは腫瘍サプレッサ遺伝子において見出され得る。プロトオンコジーンの例としては、例えば、ras遺伝子およびmyc遺伝子が挙げられる。腫瘍サプレッサ遺伝子の例としては、例えば、網膜芽細胞腫遺伝子、p53遺伝子、BRCA遺伝子、APC、およびDCC遺伝子が挙げられる。環境状態は、公知の発癌物質または疑わしい発癌物質に被験体を曝す状態を含み得る。
【0016】
一般的に、任意のタイプの腫瘍は、インヒビターで処置され得る。好ましくは、この腫瘍は、再発する腫瘍(すなわち、免疫学的監視に供される腫瘍)である。適切な腫瘍の型の例としては、癌腫、肉腫、または血液細胞の癌が挙げられる。従って、腫瘍は、肝臓癌、黒色腫、子宮癌、精巣癌、乳癌、直腸結腸癌、肺癌、前立腺癌、腎細胞癌、頚部癌、膵臓癌、卵巣癌、甲状腺癌、鼻咽頭腫瘍、白血病、およびリンパ腫(例えば、バーキットリンパ腫)であり得る。
【0017】
所望の場合、このインヒビターは、腫瘍の増殖を阻害することが意図される更なる処置レジメンに沿って投与され得る。例えば、さらなる処置レジメンは、腫瘍の増殖を阻害する第2の因子の投与を含み得る。適切な第2の因子は、被験体において、インターフェロンγのレベルを増加させる因子である。この第2の因子は、インターフェロンγ自体であり得る。
【0018】
このインヒビターおよび第2の因子(所望の場合)は、薬学的組成物の形態で提供され得る。任意の適切な投与経路および投薬スケジュールは、インヒビター、またはこのインヒビターを含む薬学的組成物を送達するために使用され得る。このインヒビターが経口投与される場合、インヒビターは、錠剤、カプセル、粉末、溶液、またはエリキシルの形態であり得る。錠剤形態で投与した場合、本発明の薬学的組成物は、固体キャリア(例えば、ゼラチンまたはアジュバント)をさらに含み得る。錠剤、カプセル、および粉末は、5〜95%のインヒビター、そして好ましくは、約25〜90%のインヒビターを含む。液体形状で投与される場合、液体キャリア(例えば、水、石油、動物または植物由来の油(例えば、ピーナッツ油、鉱油、もしくは大豆油、ゴマ油、または合成油))が添加され得る。薬学的組成物の液体形態は、生理学的生理食塩水溶液、デキストロースもしくは他のサッカリド溶液、またはグリコール(例えば、エチレングリコール、プロピレングリコール、またはポリエチレングリコール)をさらに含み得る。液体形態で投与された場合、薬学的組成物は、約0.5〜90重量%のインヒビター、そして好ましくは約1〜50重量%のインヒビターを含む。
【0019】
治療学的に有効量のインヒビターが、静脈内、皮膚、または皮下に注射することによって投与される場合、このインヒビターは、発熱物質を含まない非経口的に受容可能な水溶液の形態である。このような非経口的に受容可能なタンパク質溶液(pH、等張性、安定性などに関するデュー(due)を有する)は、当該分野の技術範囲内である。静脈内、皮膚、または皮下への注射のために、好ましい薬学的組成物は、インヒビターに加えて、等張性ビヒクル(例えば、塩化ナトリウム注射液、リンガー注射液、デキストロース注射液、デキストロースおよび塩化ナトリウム注射液、乳酸リンガー注射液、または他の当該分野で公知のビヒクル)を含む。本発明の薬学的組成物は、安定剤、保存剤、緩衝剤、抗酸化剤、または当業者に公知の添加剤を含み得る。
【0020】
本発明の薬学的組成物中のインヒビターの量は、処置されるべき状態の性質および重篤度、および患者が受けた前処置の性質に依存する。
【0021】
本発明の薬学的組成物を使用する静脈内治療の期間は、処置されるべき疾患の重篤度状態、および各個々の患者の潜在的な特有の応答に依存して変化する。
【0022】
究極的に、担当医は、本発明の薬学的組成物を使用した、静脈治療の適切な期間を決定する。いくつかの実施形態において、インヒビターが、徐放組成物中に提供される。時限放出(time−release)組成物は、マイクロ粒子中に含まれる。
【0023】
マイクロ粒子は、当該分野で公知であり、そして米国特許第6,013,258号において記載されるマイクロ粒子を含む。マイクロ粒子中に含むために適切な材料としては、ポリ−乳酸−co−グリコール酸(PLGA)のようなポリマー材料が挙げられる。
【0024】
IL−13インヒビターまたはNK−T細胞インヒビターを被験体に投与することによって、被験体中でのウイルスの増殖を阻害する方法がまた、本発明の範囲内である。IL−13インヒビターまたはNK−T細胞インヒビターは、本明細書中に記載される、IL−13インヒビターまたはNK−T細胞インヒビターのうちのいずれかであり得る。
【0025】
いくつかの実施形態において、このインヒビターは、ウイルスによって、哺乳動物の慢性的な感染を阻害するのに使用される。このインヒビターは、ウイルスによる急性感染を受けていると診断された哺乳動物被験体に投与される。
【0026】
好ましくは、このインヒビターは、被験体のウイルスへの最初の曝露の前または曝露の間に、投与される。いくつかの実施形態において、ウイルスは、被験体において慢性的な感染を引き起こすか、または引き起こし得る。これらのウイルスとしては、例えば、ヒト免疫不全ウイルス(HIV)、B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)、サイトメガロウイルス(CMV)、エプスタイン−バーウイルス(EBV)、ヒトT細胞白血病ウイルス(HTLV)、およびヒト乳頭腫ウイルス(HPV)(例えば、HPV株16)が挙げられ得る。
【0027】
本発明はまた、IL−13またはNK−T細胞を被験体に投与することによって、被験体における免疫応答を増強する方法を含む。このインヒビターは、IL−13ポリペプチドに対するリガンドを含み得る。いくつかの実施形態において、このインヒビターは、ワクチンに対する応答を増強するように添加される。このインヒビターは、ワクチン接種の前、ワクチン接種と同時に、またはワクチン接種の後に、投与され得る。例えば、このインヒビターは、ワクチンを被験体に導入する前約30日以内と導入後約30日以内との間に投与され得る。
【0028】
このワクチンが、例えば、腫瘍(例えば、本明細書中に列挙される腫瘍型)または病原体に指向され得る。いくつかの実施形態において、この病原体は、ウイルス、細菌、または真核生物細胞である。
【0029】
ウイルスは、例えば、ヒト免疫不全ウイルス(HIV)であり得る。本明細書中に記載される方法において使用されるHIVウイルスは、米国特許第5,932,318号;Ahlersら、J.Immunol.150:5647−65,1993(構築物PCLUS6−18IIIBを記載する);およびAhlersら、AIDS Res.Hum.Retroviruses 12:259−272,1996に記載されるワクチンを含み得る。このペプチドワクチンは、好ましくは、複数の免疫決定因子を提示するHIV−1エンベロープタンパク質のペプチドを含む。このペプチドワクチンは、好ましくは、種々のMHC型を有するマウスにおける、体液性免疫応答と細胞媒介免疫応答との両方を惹起する。このようなペプチドの例は、PCLUS6.1−18IIIB(例えば、米国特許第6,214,347号に記載されている)である。
【0030】
このインヒビターは、予防的または治療的に投与され得、そしてワクチンの予防的送達または治療的送達と組み合わせて投与され得る。
【0031】
所望の場合、このインヒビターは、免疫応答を増強する第2の因子またはさらなる因子と組み合わせて投与され得る。さらなる因子としては、例えば、アジュバント、サイトカイン(例えば、IL−12)、およびGM−CSFが挙げられる。
【0032】
このインヒビターは、さらに、IL−13インヒビターをコードする核酸であり得る。IL−13インヒビターをコードする核酸は、標準的な方法(例えば、Felgnerら、米国特許第5,580,859号に記載される方法)を使用して投与され得る。約1〜200μgのDNAの投薬量が、体重1kgあたりに投与されることが予想される。患者がヒト成人である場合、ワクチン接種のレジメンは、例えば、マイクロ粒子内で送達される場合、10〜100μgの核酸、または100〜1000μgの裸のDNAを、数回(例えば、3〜6回)繰り返して筋肉内投与または皮下投与することを含み得る。
【0033】
他の標準的な送達方法(例えば、微粒子銃による移入、またはエキソビボ処置)がまた使用され得る。エキソビボ処置において、例えば、抗原提示細胞(APC)、樹状細胞、末梢血単核細胞、または骨髄細胞は、患者または適切なドナーから得られ得、そして免疫原組成物を用いてエキソビボで活性化され得、次いで患者に戻される。
【0034】
他に規定されない場合、本明細書中で使用される全ての技術用語および科学用語は、本発明が属する技術分野の当業者によって一般に理解されるのと同一の意味を有する。本明細書に記載されるのと類似または等しい方法および材料が、本発明の実施または試験において使用され得、適切な方法および材料が、以下に記載されている。全ての刊行物、特許出願、特許、および本明細書中に記載される他の参考文献は、その全体が本明細書中で参考として援用されている。競合する場合、本発明の明細書(定義を含む)が、制御する。さらに、材料、方法および例は、例示のためのみであり、限定することを意図するものではない。
【0035】
本発明の他の特徴および利点は、以下の詳細の説明および特許請求の範囲から明らかである。
【0036】
(発明の詳細な説明)
本発明は、被験体における腫瘍増殖を阻害するための組成物および方法を提供する。ウイルス感染を処置するための方法および組成物、ならびに被験体において免疫応答を増強するための方法および組成物もまた提供する。
【0037】
IL−13レセプターの可溶性形態の投与は、マウスモデル系における腫瘍再発を阻害することが見出された。NK−T細胞活性の阻害は、同様に、モデル系における腫瘍再発を阻害することが見出された。これらの結果は、IL−13ポリペプチドおよびNK−T細胞に対するリガンドが免疫応答(腫瘍監視に関係するもの)を阻害するように作用することを示唆する。免疫応答は、IL−13機能および/またはNK−T細胞機能を阻害することによって増強された。
【0038】
この方法および組成物は、被験体において、原発腫瘍増殖または2次腫瘍増殖(転移)のいずれかを阻害するために使用され得る。例えば、この方法および組成物は、原発腫瘍のさらなる増殖を阻害するために、原発腫瘍を診断された被験体での使用に適切である。あるいは、またはさらに、本明細書中で開示される方法および組成物はまた、原発腫瘍の転移の発達を阻害するために使用され得る。
【0039】
本発明は、以下の実施例にさらに説明され、これらの実施例は、添付の特許請求の範囲を制限しない。
【0040】
(実施例1.腫瘍再発のIL−13インヒビター媒介阻害の同定)
この実施例は、腫瘍免疫監視の重要なインヒビターとしてIL−13を同定する研究を説明する。CD4分子に対する抗体を用いたマウスの処置が、腫瘍細胞の注射の10日以内に投与された場合、細胞傷害性T細胞(CTL)媒介腫瘍監視を阻害することを示す研究を最初に提示する。次に、その腫瘍再発が、IL−4 KOマウスにおいて生じるが、IL−4R KOマウスでもシグナルトランスデュサーおよび転写のアクチベーター(STAT)6 KOマウスにおいても生じないことを示す研究が提示される。これらの結果は、IL−13が免疫再発に関係することを示唆する。これらの結果は、CD−4欠損マウスがより低いレベルのIL−13を産生したことを示すこと、ならびに(sIL−13Rα2.Fc)、IL−13インヒビターの投与が腫瘍再発を阻害することを示すデータによって実証される。
【0041】
本明細書中に記載される研究について、雌性BALB/cマウスを、Charles River Breeding Laboratories(Frederick,MD)から購入した。BALB/cバックグラウンドにおける、IL−4ノックアウト(KO)マウス(Noben−Trauthら、Transgenic Res5:487〜91、1996)を、Jackson Laboratory(Bar Harbor,ME)から得た。C57BL/6NK1.1遺伝子座に類遺伝子性のBALB/cマウス系統は、Drs.Anthony Scalzo and Wayne Yokayama(Scalzoら、Immunogenetics 41:148〜51,1995)によって提供された。C57BL/6マウス、IL−4R KO(Noben−Trauthら、Proc.Natl Acad.Sci.USA94;10838〜43,1997)、シグナルトランスデュサーおよび転写のアクチベーター(STAT)6 KOマウス(Kaplanら、Immunity 4:313〜9、1996)およびBALB/cバックグラウンドを有するCD1 KO(Smileyら、Science 275:977〜9、1997)マウスを、病原体を含まない条件下で飼育した。全てのマウスを病原体を含まない動物設備で維持し、そして6〜10週齢で使用した。動物実験は、全て、National Cancer Institute(NCI)Animal Care and Use Committeeによって承認された。
【0042】
15−12RM腫瘍細胞を、BALB/c 3T3線維芽細胞に最初にHIV−1 IIIB gp160をトランスフェクトし、次いで、変異rasおよびmyc遺伝子をトランスフェクトして、これを腫瘍形成性にすることによって作製した(Matsuiら、J.Immunol.163:184〜193、1999)。この細胞およびNeoのみ(18Neo)をトランスフェクトしたコントロールBALB/c 3T3細胞(Takahashiら、Proc.Natl.Acad.Sci.USA 85:3105〜09、1988)を、10%FCS、L−グルタミン、ピルビン酸ナトリウム、非必須アミノ酸、ペニシリン、ストレプトマイシンおよび5×10−5M 2−メルカプトエタノール(ジェネティシン(200μg/ml)(Sigma、St.Louis、MO)を含む)を有するRPMI1640からなる完全T細胞培地(CTM)中で維持した。
【0043】
精製ラット抗マウスCD4 mAB(GK1.5(Wildeら、J.Immunol.131:2178〜2183、1983))を、Frederick Cancer Reserch and Development Center、NCI(Frederick、MD)から得た。IL−13インヒビター、マウスIL−13Rα2およびヒトIgG1の融合タンパク質(sIL−13Rα2.Fc)を、以前に記載(Donaldsonら、J Immunol 161:2317〜24、1998)のように作製し、そしてResearch Support Team at Genetics Institute、Cambridge、MAから得た。抗CD3(2C11(Leoら、Proc.Natl Acad.Sci.USA 84:1374〜78、1987))、抗CD28(37.51)、FITC結合抗CD4(GK1.5)およびPE結合抗NK1.1(PK136)を、Pharmingen(San Diego、CA)から得た。抗Ia磁性ビーズ、抗CD11b磁性ビーズ、抗CD11c磁性ビーズ、抗DX5磁性ビーズ、抗CD4磁性ビーズおよび抗CD8磁性ビーズを、Miltenyi Biotec Inc(Auburn、CA)から購入した。組換えマウスIL−2を、Pharmingenから得た。Trizol、SuperScript cDNA合成キット、およびPCR SuperMixtureを、Life Technologies(Rockville、MD)から購入した。
【0044】
200μlのPBS中の100万個の15−12RM細胞を、マウスの右側腹部に皮下で注射した。インビボでCD4+細胞を欠失させるために、マウスを、示されるように、0.5mgの抗CD4またはコントロールのラットIgG(Sigma、St.Louis、MO)を含む0.2mlのPBSを腹腔内に接種した。いくつかの実験において、マウスを、0.1ml PBSの腹腔内注射によって、0.2mgのIL−13インヒビター(sIL−13Rα2.Fc)を用いて、8日間、1日おきに処置した。
【0045】
T細胞、CD4+T細胞およびCD4+NK−T細胞のインビトロ活性化について、96ウェルプレートを、4℃で一晩、抗CD3(10μl/ml)でコーティングした。プレートを、使用の前にPBSで3回洗浄した。15−12RM注射されたマウス由来の脾細胞の単細胞懸濁物を、注射後に、異なる時点で調製した。T細胞を、Ia、CD11b、CD11cおよびDX5に対する抗体でコーティングされた磁性ビーズを使用することによって、脾細胞からネガティブに選択された。CD4+T細胞を、抗CD8磁性ビーズを使用することによって、T細胞からCD8+細胞を欠失させることによって得た。細胞を、200μl CTM中の96ウェルプレートの1×105/ウェルの密度で培養した。刺激の2日後、100μlの培養培地を各ウェルから獲得し、そしてサイトカイン測定まで、−70℃で保存した。いくつの実施形態において、CD4+T細胞(1×106/ウェル)を、CD1トランスフェクトL細胞(Chenら、J Immunol 159:2240〜9、1997)、またはL細胞(2×104/ウェル)を、抗CD28(10μg/ml)およびIL−2(20単位/ml)を用いて刺激した。1週間後、細胞培養物を収穫し、そしてサイトカイン測定まで、−70℃で保存した。
【0046】
C57BL/6マウスまたはNK1.1遺伝子座について類遺伝子性のBALB/cマウスの脾細胞を、CD4濃縮カラム(Cedar Lane、Westbury、NY)を通過させ、次いで、FACStar(Becton Dickenson、Mountain View、CA)を使用することによって、CD4+ NK1.1+細胞またはCD4+ NK1.1−T細胞について分類した。サイトカインmRNAを検出するために、細胞を、200μl CTM中、96ウェルプレートの、1×105ウェルの密度で培養した。刺激の8時間後、細胞をそれぞれのウェルから回収し、そしてRNA抽出まで−70℃で保存した。サイトカイン測定について、2×104個の精製した細胞を、抗CD3mAbおよび抗CD28mAbのそれぞれ10μg/mlでコーティングした96ウェルプレート中で、刺激した。上清を48時間で回収し、そしてIL−4、IL−13およびIFN−γについてアッセイした。
【0047】
培養上清中のIL−4、IL−13(R&D、Minneapolis、MAまたはEndogen、Woburn、MA)、IFN−γ(R&D)の濃度は、製造業者の指示に従って、ELISAキットによって決定した。全てのサンプルを、3連でアッセイした。
【0048】
いくつかの標的細胞に対するCD8+T細胞の細胞傷害性活性を、4h−51Cr放出アッセイによって測定した。CD8+T細胞を、磁性ビーズ(Milteny Biotec Inc.)を使用して、B細胞、マクロファージ、DC、NK細胞およびCD4+細胞の枯渇によって、脾細胞から精製した。特異的51Cr放出のパーセンテージを、以下のように計算した:
100×(実験的放出−自発的放出)/(最大放出−自発的放出)。
【0049】
最大放出を、5%Triton X−100の添加によって溶解された細胞の上清から決定した。自発的放出を、添加した効果器細胞なしでインキュベートされた標的細胞から決定した。
【0050】
総RNAを、Trizol試薬を用いて、分類されたCD4+NK−T細胞から抽出した。cDNAを、製造業者の指示に従って、Superscript cDNA合成キットを使用することによって合成した。PCRを、GeneAmp 9700 PCRシステム(Perkin−Elmer、Norwalk、CT)によって、0.2μMプライマーを含むSupermixtureを用いて行った。PCRを、94℃で30秒間、55℃で1分間、74℃で1分間の28サイクルで行った。IL−4に対するプライマーを、Promega(Madison、WI)から購入した。使用されたプライマーの配列は、以下の通りであった:IL−13(センス)5’−GACCCAGAGGATATTGCATG−3’(配列番号1);IL−13(アンチセンス)5’−CCAGCAAAGTCTGATGTGAG−3’(配列番号2);HPRT(センス)5’−GTTGGATACAGGCCAGACTTTGTTG−3’(配列番号3);HPRT(アンチセンス)5’−TCGGTATCCGGTCGGATGGGAG−3’(配列番号4)。
【0051】
このデータを、Log−Rank試験を使用して、統計的有意性について分析した。このデータはP<0.05の有意性であるとみなされた。
【0052】
(腫瘍再発に影響する、抗CD4処置のタイミング)
腫瘍再発に対する抗CD4処置のタイミングの効果を、15−12RMマウスモデルにおいて試験した。
【0053】
15−12RM腫瘍細胞を、0日目に、異なる群のBALB/cマウスの右側腹部に、皮下で(s.c.)注射した。抗CD4を、移植の前または移植に続いて、この群の異なるマウスに様々な回数で投与した。抗CD4の投与に続いて腫瘍を発生するマウスのパーセンテージを調べた。
【0054】
結果は、図1Aおよび図1Bに提示される。図1Aは、抗CD4が投与されなかった(コントロール)マウスの群、−3日目〜50日目に投与されたマウスの群、−3日目〜30日目に投与されたマウスの群、または−3日目〜10日目に投与されたマウスの群における腫瘍増殖を示す。図1Bは、抗CD4が、1日目〜50日目に投与されたマウス、10日目〜50日目に投与されたマウス、および20日目〜50日目に投与されたマウスにおける腫瘍増殖を示す。
【0055】
各群のマウスを、15−12RM注射後の示された期間の間に、0.5mgの抗CD4mAb(GK1.5)を用いて腹腔内に接種した。この抗体を、最初の3日間、毎日、次いで週に2回接種した。5匹のマウスを、各群について使用した。−3日目〜10日目、20日目または1日目〜50日目に、コントロールと抗CD4との間で、Log−Rank試験がP<0.02であった。同様の結果が別の実験において得られた。
【0056】
腫瘍は、5日以内に検出可能であった(Matsuiら、J.Immunol.163:184〜193、1999)(図1A、コントロール群)。腫瘍は、10〜15日後に退行し、そして消失した。しかし、腫瘍の再発は、接種の20日〜40日後に観測され、そして再発の腫瘍は、退行しなかった(図1A)。コントロールマウスにおいて観測された腫瘍再発は、腫瘍退行期の間のCD8+CTLによる腫瘍細胞の除去が不完全であるので、生じた。逆に、抗CD4処置マウスにおいて、腫瘍細胞は、最初の増殖の後に完全に除去されて、再発しなかった(図1AおよびMatsuiら、J.Immunol.163:184〜193、1999)。これらの結果は、CD4+T細胞がCTLによる腫瘍細胞に対する免疫監視をネガティブに制御したことを示唆する。
【0057】
CD4+T細胞が腫瘍細胞に特異的なCTLを制御するときを調べるために、マウスを、15−12RM注射の後、異なる間隔で、CD4抗体で処置した(図1A)。15−12RM注射の3日前にCD4抗体を受容することから開始し、そして10日目または20日目に抗体を受容して停止した群のマウスは全て、−3日目〜実験の終了まで処置されたマウスと類似の様式で腫瘍再発に対して耐性であった。抗CD4処置の開始は、1日目まで遅れることができるが、10日目に開始する処置は、後の再発に対して任意の影響を有するには遅すぎた(図1B)。これは、腫瘍細胞に対するCTLの免疫監視が、初期の腫瘍増殖期においてCD4+T細胞によって制御されることを示唆する。最初の10日間のCD4+T細胞の枯渇は、この制御を妨げるのに必要でありそして十分であった。
【0058】
(IL−4R−STAT6によるCTL免疫監視のダウンレギュレーション)
IL−4 KOマウスおよびIL−4R KOマウスを、IL−4およびそのシグナル伝達経路が、CTLによる免疫監視のダウンレギュレーションに関係するか否かを明確にするために使用した。この結果は、図2Aおよび図2Bに示される。図2Aは、コントロールマウス、または抗CD4抗体で処置されたマウスまたはBALB/cバックグラウンドIL−4 KO、IL−4R KO、またはヘテロ接合同腹仔マウスにおいて得られた結果を示し、これらは、1×106個の15−12RM細胞を皮下的に注射された。抗CD4処置された群におけるマウスを、抗CD4 mAbを用いて、15−12RM注射の3日前から注射の日まで毎日処置し、その後、週に2回処置した。7匹のマウスを使用したIL−4R+/−群を除いて、各群について5匹のマウスを使用した。コントロール群とIL−4R−/−群との間のLog−Rank試験は、P<0.05である。示されるこの結果は、類似の結果を有する2つの実験の代表である。
【0059】
図2Bに示される結果について、処置されていないかまたは抗CD4で処置されたかのいずれかである、BALB/c−STAT6 KOマウスまたは野生型BALB/cマウスを、1×106 15−12RM細胞で皮下的に注射した。抗CD4処置された群におけるマウスを、15−12RM注射の3日前から毎日抗CD4mAbで処置し、その後週2回処置した。5匹のマウスを各群について使用した。コントロール群とSTAT6 KO群との間のLog−Rank試験は、P<0.02である。3つの実験のうちの1つの代表的な実験を示す。
【0060】
腫瘍再発は、IL−4 KOマウスにおいて生じた;実際、腫瘍増殖パターンは、コントロールマウスのパターンとは有意に異ならなかった(図2AおよびMatsuiら、J.Immunol.163:184〜193、1999)。対照的に、IL−4R KOマウスにおいて、腫瘍は、最初の増殖および退行の後に再発しなかったが、ヘテロ接合型同腹仔において、腫瘍は、野生型マウスのように再発した(図2A)。
【0061】
STAT6活性化は、IL−4Rシグナル経路を介したシグナル伝達を必要とすることが公知である(Shimodaら,Nature 380:630−3 1996;Takedaら,Nature 380:627−30,1996;およびKaplanら,Immunity 4:313−9,1996)。従って、IL−4R KOマウスで観察されたがIL−4 KOマウスでは観察されなかった保護が、IL−4Rシグナル経路に依存したか否かを調べるために、STAT6 KOマウスを、15−12RMで接種した(図2b)。STAT6 KOマウスは、CD4−涸渇マウスと同様に腫瘍再発に対して耐性であった。このことは、CTLによる免疫学的監視がIL−4R−STAT6シグナル伝達経路を介して制限されるが、この調節はIL−4自体を必要としないことを示唆した。従って、IL−4R−STAT6シグナル伝達経路を介してシグナルを伝達することが公知である唯一の他のサイトカインであるIL−13は、おそらくこの制限にて重要な役割をはたすようである。
【0062】
(CD4涸渇マウスにおけるサイトカイン産生)
T細胞はIL−13およびIL−4の主要な産生者なので、15−12RMを注射したマウス由来のT細胞による両方のサイトカインのインビトロ産生を、抗CD3刺激後にELISAによって測定した。結果を図3に示す。15−12RM細胞の注射の0日後、2日後、4日後、6日後、10日後に、1群あたり2匹のマウスを屠殺し、そしてそれらの脾細胞を収集した。細胞の画分を使用して、T細胞を精製した。15−12RMを注射したマウス由来の100,000個の新しく単離したT細胞を、抗CD3でコーティングしたプレート中で48時間培養した。培養上清を収集し、そして各サイトカインの濃度をELISAによって決定した。この図は、2匹のマウスの平均値を示す。同様の結果がさらなる実験において得られた。
【0063】
コントロールマウス由来のT細胞におけるIL−13およびIL−4両方の産生は、15−12RM注射の2日後という早さで上昇する。IL−13産生およびIL−4産生は、それぞれ、2日目および4日目に最大に達し、次いで、注射の6日後までにベースラインに低下した。CD4涸渇マウス由来のT細胞において、IL−13の産生は2日目にアップレギュレートしたが、そのIL−13の絶対量は15−12RMを注射したコントロールマウス由来の細胞の絶対量よりも50〜75%低かった。さらに、IL−4産生は、15−12RM注射後であってもアップレギュレートされなかった。従って、CD4涸渇マウス由来の脾臓T細胞(これは、腫瘍再発に対して耐性である)は、IL−13およびIL−4の産生が少ない。
【0064】
IFN−γ(これは、この系において腫瘍増殖に対して保護的な役割を果たす(Matsuiら,J.Immunol.163:184−193,1999))の産生を測定した。IL−13産生およびIL−4産生と対照的に、抗CD4処置したマウス由来のT細胞は、コントロールマウス由来の細胞よりも25〜100%多いIFN−γを産生した。これらの結果は、CD4+T細胞の除去が、IL−13およびIL−4の産生を抑制するが、より多くのIFN−γの産生を可能にすることを示唆し、IFN−γは、免疫学的監視に対して必要であることが以前に示されている(Matsuiら,J.Immunol.163:184−193,1999)。
【0065】
(IL−13インヒビター(sIL−13Pα2.Fc)は、腫瘍再発を阻害する)
上記で得られた結果は、IL−13単独が免疫学的監視のダウンレギュレーションに必要であるか、またはIL−4もしくはIL−13のいずれかが再発を予防するのに十分であり、そして両方を排除することが再発を予防するのに必要であるという可能性のいずれかと、適合する。これらの可能性を見分けるために、野生型マウスおよびIL−4 KOマウスの両方においてIL−13インヒビター(sIL−13Rα2.Fc)の効果を試験した。結果を図4Aおよび4Bに示す。コントロールBALB/cマウス、抗CD4もしくはIL−13インヒビター(sIL−13Rα2.Fc)のいずれかを用いて処置したマウス(図4A)、または処置しないかもしくはIL−13インヒビターで処置するかのいずれかのBALB/c−IL−4 KOマウス(図4B)を、1×106個の15−12RM細胞で皮下注射した。抗CD4(0.5mg)を、15−12RMの0日後、1日後、2日後、6日後、および10日後に接種した。IL−13インヒビターで処置した群のマウスを、0日目〜8日目に1日おきにsIL−13Rα2.Fc(0.2mg)で処置した。各群について5匹のマウスを使用した。コントロール群とIL−13インヒビター群との間で、Log−Rank検定によって、p<0.01。IL−4 KO群とIL−4 KO+IL−13インヒビター群との間で、Log−Rank検定によって、p<0.02。これら2つの代表的な1つの実験を示す。
【0066】
IL−13インヒビターを15−12RM注射の0日目後〜8日目後に1日おきに接種したが、腫瘍の初期の増殖および退行を妨げなかった。しかし、IL−4 KOマウス(これは、腫瘍再発に対して抵抗性ではない)をIL−13インヒビターで処置した場合、これらは再発から完全に保護された。野生型マウスをIL−13インヒビターで処置した場合、これらもまた、CD4涸渇マウスおよびIL−13インヒビターで処置したIL−4 KOマウスと同様にふるまった。これらの結果は、この二相性の腫瘍モデルにおいて、IL−4を生成するマウスの能力にかかわらず、IL−13が腫瘍再発に必須であることを示した。
【0067】
(実施例2.NK−T細胞機能を破壊することによる、腫瘍増殖の阻害)
本実施例は、IL−13がNK−T細胞によって産生されること、およびNK−T細胞を欠くCD1 KOマウスが低いレベルのIL−13を産生することを示すデータを示す。本実施例において、CD1 KOマウスにおける腫瘍増殖の阻害もまた示す。
【0068】
(NKT細胞は、IL−13を産生し得る)
IL−13インヒビターを用いた最初の8日間の処置によって、マウスは腫瘍再発から保護された(図4Aおよび4B)。CD4+NK1.1+ T細胞は、TCR活性化の際に大量のIL−4を産生するための最初期細胞の中にある(Chenら,J Immunol 159:2240−9,1997)。
【0069】
従って、CD4+ NKT細胞がIL−13を産生する能力を調べた。BALB/cマウスは利用可能なmAbによって認識されるNK1.1対立遺伝子を発現しないので、NK1.1座位について類遺伝子性であるC57BL/6マウスまたはBALB/cマウス由来のCD4+ NKT細胞を、CD4+ T細胞を精製し、そしてCD4+ NK1.1+集団およびCD4+ NK1.1−集団について分類することによって分類し、そしてこれらを抗CD3抗体で刺激した。
【0070】
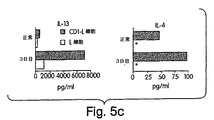
IL−13 mRNAおよびIL−13タンパク質の産生を測定した。結果を図5A〜5Cに示す。C57BL/6マウス由来の新しく分類した脾臓CD4+ NK−T細胞を、プレートに結合した抗CD3(2C11)を用いて8時間刺激した。これらの細胞を収集し、そしてIL−13およびIL−4に対するmRNAを、RT−PCRによって検出した。図5Aは、抗CD3刺激後のCD4+ NK−T細胞におけるIL−13およびIL−4のmRNA発現を示す。
【0071】
図5Bは、CD4+ NK1.1+ T細胞およびCD4+ NK1.1− T細胞によるIL−13およびIL−4の産生を実証する。NK1.1座位について類遺伝子性であるBALB/cマウス由来の新しく分類した脾臓CD4+ NK1.1+ T細胞およびCD4+ NK1.1− T細胞を、プレートに結合した抗CD3(2C11)および抗CD28(37.51)を用いて48時間刺激した。上清を48時間目に収集し、そしてELISAによってIL−4およびIL−13についてアッセイした。
【0072】
CD1トランスフェクトしたL細胞で刺激した、15−12RMを注射したマウス由来のCD4+ T細胞による、IL−13およびIL−4の産生を、図5Cに示す。正常なBALB/cマウスおよび15−12RMを注射したBALB/cマウス(の注射3日後)の脾細胞から精製したCD4+T細胞を、CD1トランスフェクトしたL細胞またはトランスフェクトしていないL細胞を用いて1週間刺激した。抗CD28 mAb(10μg/ml)およびIL−2(20単位/ml)もまた、培養物に添加した。培養上清を収集し、そしてIL−13およびIL−4の濃度をELISAによって決定した。アステリスクは、検出限界より下のレベル(<15.6pg/ml)を示す。
【0073】
IL−13は、抗CD3刺激によってCD4+ NK1.1+T細胞を明瞭に誘導し、一方、CD4+ NK1.1−T細胞はわずかであった(図5Aおよび5B)。さらに、15−12RMを注射したBALB/cマウス由来のCD4+ T細胞をCD1トランスフェクトしたL細胞で刺激した場合、これらは、腫瘍を保有しないマウス由来の細胞よりも、より多くのIL−13およびIL−4を産生した(図5C)が、検出可能なIFN−γは産生しなかった(データは示さず)。図5Cにおける図5Bよりも低いIL−4のレベルは、前者では7日間の培養の間の消費に起因し、一方、後者では48時間での消費に起因し得る。対照的に、精製されたCD4+T細胞はIL−13レセプターを有さないので、サイトカインは消費されないはずである。従って、CD4+NKT細胞は、実際にIL−13を産生し得、そしてこのサイトカインの主要な供給源である。さらに、この活性は、腫瘍保有動物において増強されるようである。
【0074】
(IL−13産生は、CD1 KOマウスにおいて顕著に低下する)
NKT細胞がIL−13の主要な供給源である場合、CD1 KOマウスにおけるその非存在は、IL−13産生を顕著に低下するはずである。従って、15−12RMを注射したCD1 KOマウスのCD4+T細胞におけるIL−13、IL−4およびIFN−γのインビトロ産生を調べた。これらのマウスは、CD1制限されたNKT細胞(CD4+NKT細胞を含む)を欠くが、従来のMHC クラスII制限されたCD4+T細胞は保持する。
【0075】
結果を図6に示す。1群あたり2匹のマウスを屠殺し、そしてその脾細胞を、15−12RM細胞の注射の0日後、2日後、4日後、6日後、10日後に収集した。細胞の画分を使用してCD4+T細胞を精製した。15−12RMを注射したマウス由来の100,000個の新しく単離したT細胞を、抗CD3でコーティングしたプレート中で48時間培養した。培養上清を収集し、そして各サイトカインの濃度をELISAによって決定した。各値は、2匹のマウスの平均を示す。結果は、2つの独立した実験のものを表す。アステリスクは検出限界より下のレベル(<7.8pg/ml)を示す。
【0076】
CD1 KOマウスの脾細胞から精製したCD4+T細胞は、15−12RM注射後にわずかな量のIL−13およびIL−4しか産生せず、一方、野生型マウス由来のCD4+T細胞は、腫瘍接種の2日後、4日後、および10日後に、これらのサイトカインの産生をアップレギュレートした。このことは、大多数のIL−13産生がNKT細胞由来であるかまたはNKT細胞に依存することを示す。逆に言えば、産生されたIFN−γは、野生型マウスの細胞よりもCD1 KOマウスの細胞においてかなり高かった。
【0077】
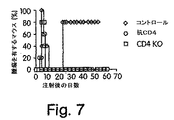
(CD1 KOマウスは、低いレベルの腫瘍再発を示す)
CD4+NKT細胞がIL−13を産生し得、そして実際に多くのIL−13産生を担い、そしてこれらの細胞が従来のCD4+T細胞に加えて抗CD4処置によって涸渇するので、NKT細胞がCTLによる腫瘍免疫学的監視のダウンレギュレーションに重要な役割を果たすと仮説を立てた。この仮説を試験するために、CD1 KOマウスを、15−12RMで接種し、そして抗CD4処置の有りまたは無しで腫瘍増殖の影響を測定した。
【0078】
結果を図7に示す。未処置または抗CD4で処置のいずれかの、BALB/cバックグラウンドのCD1 KOマウスおよび野生型BALB/cマウスを、1×106個の15−12RM細胞を用いて皮下注射した。抗CD4処置群のマウスを、15−12RM注射の3日前から始めてその後1週間に2回、抗CD4(0.5mg)を用いて処置した。5匹のマウスを各群について使用した。コントロール群とCD1 KO群との間で、Log−Rank検定によって、p<0.02。これら4つの代表的な1つの実験を示す。CD1 KOマウスにおいて、腫瘍が最初に増殖し、そして野生型マウスと同じ期間に退行した。しかし、CD1 KOマウスは、抗CD4で処置した野生型マウスと同様に腫瘍再発に対して抵抗性であった。従って、CD1制限されたNKT細胞は免疫学的監視のダウンレギュレーションに必要なようである。
【0079】
抗CD4で処置したマウス(図8A)、CD1 KOマウス(図8B)およびコントロールマウス(図8C)の脾細胞から精製したCD8+T細胞の活性を、いかなるインビトロ刺激も無しで、1μMのP18IIIBでパルスしたか、またはパルスしていない18Neo標的に対して、15−12RM注射の12日後にCTL活性について調べた。これら3つの代表的な1つの実験を、それぞれ図8A〜8Cに示す。
【0080】
CD4涸渇マウスにおいて、腫瘍再発に対する保護は、コントロールマウスの場合よりも、再刺激を伴なわない即座のエキソビボでの、CD8+T細胞のより高いCTL活性と関連するようであった(図8AおよびMatsuiら,J.Immunol.163:184−193,1999)。同じことがCD1 KOマウスに対して適用されるか否かを決定するために、15−12RMを注射したCD1 KOマウス由来の精製されたCD8+T細胞のCTL活性を、腫瘍を注射したコントロールマウスおよび抗CD4で処置したマウス由来のCD8+T細胞のCTL活性と比較した(図8B)。CD1 KO由来の新しく単離したCD8+T細胞(図8B)は、インビトロ刺激無しで、P18IIIBパルスした18Neoを低いレベルで溶解し、一方、インタクトな腫瘍保有マウス由来のCD8+T細胞は、再刺激無しでP18IIIBパルスした18Neoを殺傷しなかった(図8C)。従って、NKT細胞の存在は、エキソビボにおいて即座に、CTL活性の低下を導く。
【0081】
これらを考え合わせると、これらの結果は、腫瘍の初期増殖期(10日以内)における、CD1制限されたCD4+NKT細胞あるいはNKT細胞に依存する他の細胞のいずれかによって産生されるIL−13が、CTL免疫学的監視のネガティブな調節を誘発すること、ならびにこのネイティブな調節がIL−4Rα−STAT6経路を介して媒介されることを実証する。
【0082】
(実施例3.IL−13インヒビターは、合成ペプチドHIVワクチンに対するCTL応答を増強する)
細胞傷害性T細胞リンパ球(CTL)応答の増強に対するIL−13インヒビターの能力を調べた。
【0083】
BALB/cマウスを、エマルジョンアジュバント(Montanide ISA−51)中でGM−CSF(5μg)と混合した合成ペプチドワクチンPCLUS6.1−18IIIB(20nmole)(米国特許第5,932,218号)を用いて、0日目に皮下免疫した。0日目、1日目、2日目、4日目、および6日目の各日に、200μgのIL−13インヒビターIL−13Ra2−Fcを、腹腔内投与した。コントロールは、IL−13インヒビターの代わりにコントロールIgGを受けた。
【0084】
試験マウスおよびコントロールマウスの脾臓(14日後に収集し、そして培養物中で1週間刺激した)におけるその後のCTL応答を測定し、そして図9に示されるグラフにプロットする。標的細胞を、P18IIIBペプチドでコーティングした。
【0085】
有意に高いCTL媒介溶解が、IL−13インヒビターを合成ペプチドHIVワクチンと共にマウスに投与した場合に観察された。これらの結果は、IL−13インヒビター無しでのワクチンと比較した、インヒビターの存在下での細胞傷害性Tリンパ球(CTL)応答の増大を実証する。
【0086】
(他の実施形態)
本発明は本発明の詳細な説明と共に記載してきたが、上記の説明が、例示することを意図し、そして本発明の範囲を限定せず、本発明の範囲は、添付の特許請求の範囲の範囲によって規定されることが、理解される。他の局面、利点、および改変が、上記の特許請求の範囲の範囲内である。
【図面の簡単な説明】
【図1】
図1Aおよび図1Bは、異なる時間間隔で抗CD4を用いて処置したマウスにおける腫瘍の発生を示すグラフである。
【図2】
図2Aおよび図2Bは、IL−4 KO、IL−4R、およびSTAT6 KOマウスにおける腫瘍の発生を示すグラフである。
【図3】
図3A〜3Cは、抗CD3刺激を用いた、5−12RM−注射BALB/cマウス由来のT細胞のサイトカイン産生を示すグラフである。
【図4】
図4Aおよび図4Bは、腫瘍再発に対する、IL−13インヒビターの効果を示すグラフである。
【図5A】
図5Aは、CD4+細胞におけるIL−13およびIL4 mRNAの発現を示す電気泳動図の表示である。
【図5B】
図5Bおよび図5Cは、CD4+NK1.1+およびCD4+NK1.1−T細胞による、IL−13およびIL−4の産生を示すヒストグラムである。
【図5C】
図5Bおよび図5Cは、CD4+NK1.1+およびCD4+NK1.1−T細胞による、IL−13およびIL−4の産生を示すヒストグラムである。
【図6】
図6A〜図6Cは、抗CD3刺激を用いた、15−12RM注射野生型BALB/cマウスおよびCD1 KOマウスからのCD4+T細胞のサイトカイン産生を示すヒストグラムである。
【図7】
図7は、CD1 KOマウスにおける腫瘍の発生を示すグラフである。
【図8】
図8A〜8Cは、15−12RMを注射されたCD1 KOマウスのCTL活性を示すグラフである。
【図9】
図9は、HIVペプチドワクチン、GM−CSF、およびIL−13インヒビターまたはコントロールペプチドのいずれかに曝露された細胞におけるCTL応答を示すグラフである。
Claims (85)
- 被験体において、腫瘍の増殖を阻害する方法であって、該方法はIL−13インヒビターを該被験体に投与する工程を包含し、ここで、該インヒビターがIL−13リガンドを含む、方法。
- 前記インヒビターが、前記被験体において、腫瘍の増殖を阻害するのに十分な量で投与される、請求項1に記載の方法。
- 前記インヒビターが、前記被験体において原発性腫瘍の検出前に投与される、請求項1に記載の方法。
- 前記インヒビターが、前記被験体において原発性腫瘍の検出後に投与される、請求項1に記載の方法。
- 前記被験体が前記腫瘍を発症する高い危険を有する、請求項1に記載の方法。
- 前記被験体が、該被験体において、前記腫瘍を発症する危険性を高める遺伝子の対立遺伝子を有する、請求項1に記載の方法。
- 前記遺伝子が、網膜芽腫遺伝子、p53遺伝子、BRCA遺伝子、APCおよびDCC遺伝子からなる群から選択される癌抑制遺伝子である、請求項6に記載の方法。
- 前記インヒビターが、前記被験体において腫瘍の処置前に投与される、請求項1に記載の方法。
- 前記インヒビターが、前記被験体において腫瘍の外科的切除前、2週間以内に該被験体に投与される、請求項1に記載の方法。
- 前記インヒビターが、前記被験体において腫瘍の外科的切除後、2週間以内に該被験体に投与される、請求項9に記載の方法。
- 前記インヒビターが、前記被験体において腫瘍の処置と同時に投与される、請求項10に記載の方法。
- 前記インヒビターが、前記被験体において腫瘍の処置後に投与される、請求項1に記載の方法。
- 前記インヒビターが、IL−13レセプターのIL−13結合領域を含む、請求項1に記載の方法。
- 前記インヒビターが、免疫グロブリンポリペプチドをさらに含む、請求項13に記載の方法。
- 請求項1に記載の方法であって、ここで、前記インヒビターが、マウスIL−13α2ポリペプチドおよびIgG1ポリペプチドのFc領域を含む融合タンパク質またはヒトIL−13α2ポリペプチドおよびIgG1ポリペプチドのFc領域を含む融合タンパク質である、方法。
- 前記インヒビターが、IL−13に結合する抗体である、請求項1に記載の方法。
- 前記抗体がポリクローナル抗体である、請求項16に記載の方法。
- 前記抗体がモノクローナル抗体である、請求項16に記載の方法。
- 前記インヒビターがIL−13アンタゴニストである、請求項1に記載の方法。
- 前記被験体がヒトである、請求項1に記載の方法。
- 前記腫瘍が、癌腫、肉腫または血球の癌である、請求項1に記載の方法。
- 前記腫瘍が再発性腫瘍である、請求項1に記載の方法。
- 請求項1に記載の方法であって、前記腫瘍が、乳癌、肝臓癌、黒色腫、子宮癌、結腸直腸癌、肺癌、前立腺癌、腎細胞癌、頸部の癌、腎細胞癌腫、膵臓癌、卵巣癌、甲状腺癌、鼻咽頭癌、白血病およびリンパ腫からなる群より選択される、方法。
- 請求項1に記載の方法であって、前記腫瘍が、腎細胞癌腫、黒色腫、精巣癌、白血病およびリンパ腫からなる群より選択される、方法。
- 前記被験体に、腫瘍増殖を阻害する第2の薬剤を投与する工程をさらに包含する、請求項1に記載の方法。
- 前記第2の薬剤が、前記被験体においてインターフェロンγレベルを増大させる、請求項25に記載の方法。
- 前記インヒビターが、前記被験体に全身投与される、請求項1に記載の方法。
- 前記インヒビターが、前記被験体に局所投与される、請求項1に記載の方法。
- 前記インヒビターが、静脈内送達、皮下送達および筋内送達から選択される経路により投与される、請求項1に記載の方法。
- 前記インヒビターが、皮下送達によって投与される、請求項1に記載の方法。
- 前記インヒビターが、遅延放出組成物で投与される、請求項1に記載の方法。
- 前記遅延放出組成物が微粒子を含む、請求項31に記載の方法。
- 前記微粒子がポリ乳酸−co−グリコール酸(PLGA)である、請求項32に記載の方法。
- 被験体において、腫瘍の増殖を阻害する方法であって、該方法はIL−13の非細胞毒性インヒビターを投与する工程を包含する、方法。
- 前記インヒビターが、前記被験体において、IL−13遺伝子の発現を阻害する、請求項34に記載の方法。
- 前記インヒビターが、アンチセンスIL−13核酸またはIL−13リボザイムである、請求項34に記載の方法。
- 前記インヒビターが、前記被験体において、IL−13活性を阻害する、請求項34に記載の方法。
- 前記インヒビターがIL−13レセプターアンタゴニストである、請求項34に記載の方法。
- 前記アンタゴニストが、IL−13レセプターに結合する抗体である、請求項38に記載の方法。
- 前記インヒビターがIL−13レセプターのIL−13結合領域を含む、請求項34に記載の方法。
- 前記インヒビターが免疫グロブリンポリペプチドをさらに含む、請求項34に記載の方法。
- 前記インヒビターがIL−13に結合する抗体である、請求項34に記載の方法。
- 前記抗体がポリクローナル抗体である、請求項42に記載の方法。
- 前記抗体がモノクローナル抗体である、請求項42に記載の方法。
- 被験体において、腫瘍の増殖を阻害する方法であって、該方法は、該被験体において、腫瘍の増殖を阻害するのに十分な量で、NK−T細胞インヒビターを該被験体に投与する工程を包含する、方法。
- 前記細胞が、CD1ポリペプチドを発現する抗原提示細胞に結合する、請求項45に記載の方法。
- 前記インヒビターがCD1分子に結合する、請求項46に記載の方法。
- 前記インヒビターが、Vα24に対するリガンドポリペプチドを含む、請求項45に記載の方法。
- 被験体において、ウイルスの増殖を阻害する方法であって、該方法が、該被験体にIL−13インヒビターを投与する工程を包含し、ここで該インヒビターが、IL−13リガンドを含む、方法。
- 前記インヒビターが、前記ウイルスに対する前記被験体の第一の曝露の前またはその間に投与される、請求項49に記載の方法。
- 請求項49に記載の方法であって、前記ウイルスが、ヒト免疫不全ウイルス(HIV)、B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)、ヒトパピローマウイルス(HPV)、ヒトT細胞白血病ウイルス(HTLV)、サイトメガロウイルス(CMV)およびエプスタイン−バーウイルス(EBV)からなる群より選択される、方法。
- ウイルスによる哺乳動物の慢性感染を阻害する方法であって、該方法は、該哺乳動物にIL−13インヒビターを投与する工程を包含し、該インヒビターは、IL−13リガンドを含み、ここで、該インヒビターは、該ウイルスによる急性感染を患っていると診断される哺乳動物に投与される、方法。
- 請求項52に記載の方法であって、前記ウイルスが、ヒト免疫不全ウイルス(HIV)、B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)、ヒトパピローマウイルス(HPV)、ヒトT細胞白血病ウイルス(HTLV)、サイトメガロウイルス(CMV)およびエプスタイン−バーウイルス(EBV)からなる群より選択される、方法。
- 被験体において、ウイルスの増殖を阻害する方法であって、該方法は、NK−T細胞の活性を阻害する薬剤を、該被験体に投与する工程を包含する、方法。
- 前記細胞がCD−1制限細胞である、請求項54に記載の方法。
- 前記インヒビターがCD1に結合する、請求項55に記載の方法。
- 前記インヒビターがVα24ポリペプチドに対するリガンドを含む、請求項54に記載の方法。
- 請求項54に記載の方法であって、前記ウイルスが、ヒト免疫不全ウイルス(HIV)、B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)、ヒトパピローマウイルス(HPV)、ヒトT細胞白血病ウイルス(HTLV)、サイトメガロウイルス(CMV)およびエプスタイン−バーウイルス(EBV)からなる群より選択される、方法。
- 被験体において、免疫応答を増強させる方法であって、該方法は、該被験体にIL−13インヒビターを投与する工程を包含し、該インヒビターは、IL−13ポリペプチドに対するリガンドを含む、方法。
- 前記被験体にワクチンを導入する工程をさらに包含する、請求項59に記載の方法。
- 前記インヒビターが、前記被験体にワクチンを導入する前、30日以内に投与される、請求項60に記載の方法。
- 前記インヒビターが、前記被験体にワクチンを導入した後、30日以内に投与される、請求項60に記載の方法。
- 前記ワクチンが腫瘍に指向される、請求項60に記載の方法。
- 前記ワクチンが病原に指向される、請求項60に記載の方法。
- 前記病原が、ウイルス、細菌および真核生物細胞からなる群より選択される、請求項64に記載の方法。
- 前記ワクチンが、前記被験体に予防的に投与される、請求項60に記載の方法。
- 前記ワクチンが、前記被験体に治療的に投与される、請求項60に記載の方法。
- 前記ウイルスが、ヒト免疫不全ウイルス(HIV)である、請求項60に記載の方法。
- 前記ワクチンが、前記宿主において細胞傷害性T細胞(CTL)応答を誘発する、請求項68に記載の方法。
- 前記ワクチンがPCLUS6.1−18IIIBペプチドである、請求項60に記載の方法。
- 前記ワクチンがPCLUS6.1−18IIIBペプチドである、請求項69に記載の方法。
- 前記被験体に、免疫応答を増強する第2の薬剤を投与する工程をさらに包含する、請求項60に記載の方法。
- 前記薬剤がIL−12を含む、請求項72に記載の方法。
- 前記被験体において、免疫応答を増強する方法であって、該方法は、該被験体にNK−T細胞のインヒビターを投与する工程を包含する、方法。
- 前記被験体にワクチンを導入する工程をさらに包含する、請求項74に記載の方法。
- 前記インヒビターが、前記被験体にワクチンを導入する前、30日以内に投与される、請求項75に記載の方法。
- 前記インヒビターが、前記被験体にワクチンを導入した後、30日以内に投与される、請求項75に記載の方法。
- 前記ワクチンが腫瘍に指向される、請求項75に記載の方法。
- 前記ワクチンが病原に指向される、請求項75に記載の方法。
- 前記病原が、ウイルス、細菌および真核生物細胞からなる群より選択される、請求項79に記載の方法。
- 前記ワクチンが予防的である、請求項75に記載の方法。
- 前記ワクチンが治療的である、請求項75に記載の方法。
- 前記被験体に、免疫応答を増強する第2の薬剤を投与する工程をさらに包含する、請求項75に記載の方法。
- 前記薬剤がIL−12を含む、請求項83に記載の方法。
- 被験体において、腫瘍の増殖を阻害する方法であって、該方法が、IL−13リガンドをコードする核酸を、該被験体に投与する工程を包含する、方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US69360000A | 2000-10-20 | 2000-10-20 | |
| US31818501P | 2001-09-07 | 2001-09-07 | |
| PCT/US2001/051339 WO2002055100A2 (en) | 2000-10-20 | 2001-10-22 | Method and composition for inhibition of tumor growth and enhancing an immune response |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008262301A Division JP2009046512A (ja) | 2000-10-20 | 2008-10-08 | 腫瘍の増殖の阻害および免疫応答の増強のための方法および組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004537500A true JP2004537500A (ja) | 2004-12-16 |
| JP2004537500A5 JP2004537500A5 (ja) | 2005-04-21 |
Family
ID=26981351
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002555834A Pending JP2004537500A (ja) | 2000-10-20 | 2001-10-22 | 腫瘍の増殖の阻害および免疫応答の増強のための方法および組成物 |
| JP2008262301A Pending JP2009046512A (ja) | 2000-10-20 | 2008-10-08 | 腫瘍の増殖の阻害および免疫応答の増強のための方法および組成物 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008262301A Pending JP2009046512A (ja) | 2000-10-20 | 2008-10-08 | 腫瘍の増殖の阻害および免疫応答の増強のための方法および組成物 |
Country Status (8)
| Country | Link |
|---|---|
| EP (2) | EP1333850B1 (ja) |
| JP (2) | JP2004537500A (ja) |
| AT (1) | ATE405282T1 (ja) |
| AU (1) | AU2002243443A1 (ja) |
| DE (1) | DE60135481D1 (ja) |
| DK (1) | DK1333850T3 (ja) |
| ES (1) | ES2311558T3 (ja) |
| WO (1) | WO2002055100A2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008528643A (ja) * | 2005-02-04 | 2008-07-31 | スルバック アーぺーエス | サバイビンペプチドワクチン |
| JP6029160B2 (ja) * | 2014-02-21 | 2016-11-24 | Idacセラノスティクス株式会社 | 固形がんの治療剤 |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050069546A1 (en) * | 2003-09-30 | 2005-03-31 | Yaron Ilan | Educated NKT cells and their uses in the treatment of immune-related disorders |
| LT2805728T (lt) | 2003-12-23 | 2020-05-25 | Genentech, Inc. | Nauji anti-il 13 antikūnai ir jų naudojimai |
| CA2557724A1 (en) * | 2004-02-27 | 2005-10-06 | Centocor, Inc. | Methods and compositions for treating il-13 related pathologies |
| AR049390A1 (es) | 2004-06-09 | 2006-07-26 | Wyeth Corp | Anticuerpos contra la interleuquina-13 humana y usos de los mismos |
| US7501121B2 (en) | 2004-06-17 | 2009-03-10 | Wyeth | IL-13 binding agents |
| DE602005025525D1 (de) | 2004-11-17 | 2011-02-03 | Amgen Inc | Vollständige humane monoklonale antikörper gegen il-13 |
| HUE052220T2 (hu) | 2006-09-08 | 2021-04-28 | Abbvie Bahamas Ltd | Interleukin-13 kötõfehérjék |
| WO2011003138A1 (en) * | 2009-07-06 | 2011-01-13 | The Australian National University | Immunomodulating compositions comprising interleukin 13 inhibitors and uses therefor |
| NZ609493A (en) | 2010-12-16 | 2015-11-27 | Genentech Inc | Diagnosis and treatments relating to th2 inhibition |
| US8466159B2 (en) | 2011-10-21 | 2013-06-18 | Abbvie Inc. | Methods for treating HCV |
| EP2583680A3 (en) | 2011-10-21 | 2013-06-12 | Abbvie Inc. | Mono (PSI-7977) or combination treatment of DAAs for use in treating HCV |
| ES2572328B1 (es) | 2011-10-21 | 2017-08-24 | Abbvie Inc. | Combinación de al menos dos agentes antivirales de acción directa y ribavirina pero no interferón, para su uso en el tratamiento del vhc |
| US8492386B2 (en) | 2011-10-21 | 2013-07-23 | Abbvie Inc. | Methods for treating HCV |
| RU2016107435A (ru) | 2013-09-13 | 2017-10-18 | Дженентек, Инк. | Композиции и способы обнаружения и количественного определения белка клеток-хозяев в клеточных линиях и рекомбинантные полипептидные продукты |
| SG11201601823TA (en) | 2013-09-13 | 2016-04-28 | Genentech Inc | Methods and compositions comprising purified recombinant polypeptides |
| EP3448392A4 (en) | 2016-04-28 | 2020-01-15 | Emory University | ALCYNE-CONTAINING NUCLEOTIDES AND NUCLEOSIDES THERAPEUTIC COMPOSITIONS AND USES THEREOF |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6294322B1 (en) | 1988-01-26 | 2001-09-25 | The United States Of America As Represented By The Department Of Health And Human Services | Multideterminant peptides that elicit helper T-lymphocyte cytotoxic T-lymphocyte and neutralizing antibody responses against HIV-1 |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| EP0656947A1 (en) * | 1992-08-21 | 1995-06-14 | Schering Corporation | Human interleukin-13 |
| US20010053371A1 (en) * | 1999-01-07 | 2001-12-20 | Waldemar Debinski | Method for diagnosing, imaging, and treating tumors using restrictive receptor for interleukin 13 |
| JPH09150569A (ja) | 1995-11-29 | 1997-06-10 | Riso Kagaku Corp | 色画像形成用シート |
| GB9625899D0 (en) * | 1996-12-13 | 1997-01-29 | Glaxo Group Ltd | Substances and their uses |
| US6013258A (en) | 1997-10-09 | 2000-01-11 | Zycos Inc. | Immunogenic peptides from the HPV E7 protein |
| ES2277460T3 (es) * | 1998-12-14 | 2007-07-01 | Genetics Institute, Llc | Cadena del receptor de la citoquina. |
| CA2362381C (en) * | 1999-02-10 | 2009-12-22 | Welfide Corporation | Amide compounds and medicinal use thereof |
| EP1268794A2 (en) * | 2000-04-07 | 2003-01-02 | Heska Corporation | Compositions and methods related to canine igg and canine il-13 receptors |
-
2001
- 2001-10-22 AT AT01989341T patent/ATE405282T1/de not_active IP Right Cessation
- 2001-10-22 AU AU2002243443A patent/AU2002243443A1/en not_active Abandoned
- 2001-10-22 ES ES01989341T patent/ES2311558T3/es not_active Expired - Lifetime
- 2001-10-22 EP EP01989341A patent/EP1333850B1/en not_active Revoked
- 2001-10-22 JP JP2002555834A patent/JP2004537500A/ja active Pending
- 2001-10-22 DE DE60135481T patent/DE60135481D1/de not_active Expired - Lifetime
- 2001-10-22 DK DK01989341T patent/DK1333850T3/da active
- 2001-10-22 EP EP08105062A patent/EP2027867A1/en not_active Withdrawn
- 2001-10-22 WO PCT/US2001/051339 patent/WO2002055100A2/en active Application Filing
-
2008
- 2008-10-08 JP JP2008262301A patent/JP2009046512A/ja active Pending
Non-Patent Citations (6)
| Title |
|---|
| JPN6008016323, RUTH, J.H., et al., "INTERLEUKIN 4 AND 13 PARTICIPATION IN MYCOBACTERIAL (type−1) AND SCHISTOSOMAL (type−2) ANTIGEN−ELICI", CYTOKINE, 200005, Vol.12, No.5, p.432−444 * |
| JPN6008016324, SERVE, H., et al., "Inhibition of Proliferation and Clonal Growth of Human Brest Cancer Cells by Interleukin 13", CANCER RESEARCH, 19960801, Vol.56, No.15, p.3583−3588 * |
| JPN6008016325, BAILER, R.T., et al., "IL−13 and TNF−α inhibit dual−tropic HIV−1 in primary macrophages by reduction of surface expression", EUROPEAN JOURNAL OF IMMUNOLOGY, 200005, Vol.30, No.5, p.1340−1349 * |
| JPN6008016326, CHIARAMONTE, M.G., et al., "An IL−13 inhibitor blocks the development of hepatic fibrosis during a T−helper type 2−dominated inf", The Journal of Clinical Investigation, 199909, Vol.401, No.6, p.777−785 * |
| JPN6008016327, LOPEZ, M., et al., "IL−13 induces CD34+ cells isolated from G−CSF mobilized blood to differentiate in vitro into potent", Journal of Immunological Methods, 19971027, Vol.208, No.2, p.117−129 * |
| JPN7008003165, LEBEL−BINAY, S., et al., "Experimental gene therapy of cancer using tumor cells engeneered to secrete interleukin−13", EUROPEAN JOURNAL OF IMMUNOLOGY, 199508, Vol.25, No.8, p.2340−2348 * |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008528643A (ja) * | 2005-02-04 | 2008-07-31 | スルバック アーぺーエス | サバイビンペプチドワクチン |
| JP6029160B2 (ja) * | 2014-02-21 | 2016-11-24 | Idacセラノスティクス株式会社 | 固形がんの治療剤 |
| JP2017014254A (ja) * | 2014-02-21 | 2017-01-19 | Idacセラノスティクス株式会社 | 固形がんの治療剤 |
| JPWO2015125652A1 (ja) * | 2014-02-21 | 2017-03-30 | Idacセラノスティクス株式会社 | 固形がんの治療剤 |
| JP2019070056A (ja) * | 2014-02-21 | 2019-05-09 | Idacセラノスティクス株式会社 | 固形がんの治療剤 |
| JP7041439B2 (ja) | 2014-02-21 | 2022-03-24 | Idacセラノスティクス株式会社 | 固形がんの治療剤 |
Also Published As
| Publication number | Publication date |
|---|---|
| ATE405282T1 (de) | 2008-09-15 |
| DE60135481D1 (de) | 2008-10-02 |
| WO2002055100A9 (en) | 2006-05-11 |
| ES2311558T3 (es) | 2009-02-16 |
| WO2002055100A3 (en) | 2003-03-27 |
| AU2002243443A1 (en) | 2002-07-24 |
| JP2009046512A (ja) | 2009-03-05 |
| AU2002243443A8 (en) | 2005-10-13 |
| EP2027867A1 (en) | 2009-02-25 |
| WO2002055100A2 (en) | 2002-07-18 |
| EP1333850B1 (en) | 2008-08-20 |
| DK1333850T3 (da) | 2008-12-01 |
| EP1333850A2 (en) | 2003-08-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2009046512A (ja) | 腫瘍の増殖の阻害および免疫応答の増強のための方法および組成物 | |
| US7504101B2 (en) | Methods for enhancing antigen-specific immune response using antibodies that bind OX-40 | |
| EP1060247B1 (en) | Compositions containing an ox-40 receptor binding agent or a nucleic acid encoding the same and methods for enhancing antigen-specific immune response | |
| JP4787439B2 (ja) | 免疫調節因子であるbaffレセプター(bcma) | |
| US5747037A (en) | Anti-GP39 antibodies | |
| Saha et al. | Combination of CTL‐associated Antigen‐4 blockade and depletion of CD25+ regulatory T cells enhance tumour immunity of dendritic cell‐based vaccine in a mouse model of colon cancer | |
| US20230078665A1 (en) | Cell compositions and methods for cancer therapy | |
| TWI222453B (en) | Ligand for herpes simplex virus entry mediator and methods of use | |
| KR20060130731A (ko) | Tim-1, tim-2 및 tim-4 기능을 조절하여 면역반응을 조절하는 방법 | |
| USRE39789E1 (en) | Tumor therapy | |
| Takayama et al. | Antigen-specific directional target cell lysis by perforin-negative T lymphocyte clones | |
| AU2002302070B2 (en) | Compositions containing an OX-40 receptor binding agent or a nucleic acid encoding the same and methods for enhancing antigen-specific immune response | |
| MXPA00008176A (en) | Compositions containing an ox-40 receptor binding agent or a nucleic acid encoding the same and methods for enhancing antigen-specific immune response | |
| NZ788539A (en) | Anti-gitr antibodies and uses thereof | |
| Sutherland | BAFF regulation of peripheral T cell responses | |
| Rivoltini et al. | Tumor immunology: Clinical perspectives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041012 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080408 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080626 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20080703 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080805 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20080812 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080903 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20080910 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081008 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20081008 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091202 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100216 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100223 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100531 |