JP2004504032A - 性的機能不全の処置用の新規なヒト可溶性分泌エンドペプチダーゼ(sep) - Google Patents
性的機能不全の処置用の新規なヒト可溶性分泌エンドペプチダーゼ(sep) Download PDFInfo
- Publication number
- JP2004504032A JP2004504032A JP2002512384A JP2002512384A JP2004504032A JP 2004504032 A JP2004504032 A JP 2004504032A JP 2002512384 A JP2002512384 A JP 2002512384A JP 2002512384 A JP2002512384 A JP 2002512384A JP 2004504032 A JP2004504032 A JP 2004504032A
- Authority
- JP
- Japan
- Prior art keywords
- polypeptide
- sep
- human sep
- sequence
- human
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 241000282414 Homo sapiens Species 0.000 title claims abstract description 454
- 238000011282 treatment Methods 0.000 title claims abstract description 61
- 201000001880 Sexual dysfunction Diseases 0.000 title claims abstract description 30
- 231100000872 sexual dysfunction Toxicity 0.000 title claims abstract description 29
- 102000005593 Endopeptidases Human genes 0.000 title claims abstract description 18
- 108010059378 Endopeptidases Proteins 0.000 title claims abstract description 18
- 230000003248 secreting effect Effects 0.000 title claims abstract description 8
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 328
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 231
- 229920001184 polypeptide Polymers 0.000 claims abstract description 198
- 108091033319 polynucleotide Proteins 0.000 claims abstract description 118
- 102000040430 polynucleotide Human genes 0.000 claims abstract description 118
- 239000002157 polynucleotide Substances 0.000 claims abstract description 117
- 239000012634 fragment Substances 0.000 claims abstract description 102
- 206010057671 Female sexual dysfunction Diseases 0.000 claims abstract description 72
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract description 69
- 208000021663 Female sexual arousal disease Diseases 0.000 claims abstract description 61
- 230000002265 prevention Effects 0.000 claims abstract description 38
- 239000002299 complementary DNA Substances 0.000 claims abstract description 35
- 201000001881 impotence Diseases 0.000 claims abstract description 26
- 208000010228 Erectile Dysfunction Diseases 0.000 claims abstract description 21
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims abstract description 20
- 238000000034 method Methods 0.000 claims description 180
- 125000003729 nucleotide group Chemical group 0.000 claims description 139
- 239000013598 vector Substances 0.000 claims description 139
- 239000002773 nucleotide Substances 0.000 claims description 137
- 230000000694 effects Effects 0.000 claims description 96
- 150000001875 compounds Chemical class 0.000 claims description 74
- 239000003814 drug Substances 0.000 claims description 47
- 239000000203 mixture Substances 0.000 claims description 32
- 238000004519 manufacturing process Methods 0.000 claims description 31
- 239000008194 pharmaceutical composition Substances 0.000 claims description 27
- 230000000295 complement effect Effects 0.000 claims description 22
- 238000012217 deletion Methods 0.000 claims description 20
- 230000037430 deletion Effects 0.000 claims description 20
- 238000003780 insertion Methods 0.000 claims description 15
- 230000037431 insertion Effects 0.000 claims description 15
- 102100024197 Membrane metallo-endopeptidase-like 1 Human genes 0.000 claims description 13
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 13
- 239000003085 diluting agent Substances 0.000 claims description 11
- 238000001727 in vivo Methods 0.000 claims description 11
- 239000003937 drug carrier Substances 0.000 claims description 8
- 238000012258 culturing Methods 0.000 claims description 7
- 108090000623 proteins and genes Proteins 0.000 description 243
- 210000004027 cell Anatomy 0.000 description 224
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 144
- 230000014509 gene expression Effects 0.000 description 119
- 238000003556 assay Methods 0.000 description 85
- 239000003795 chemical substances by application Substances 0.000 description 83
- 102000004169 proteins and genes Human genes 0.000 description 62
- 239000000758 substrate Substances 0.000 description 61
- 108091028043 Nucleic acid sequence Proteins 0.000 description 59
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 59
- 235000018102 proteins Nutrition 0.000 description 59
- 239000003112 inhibitor Substances 0.000 description 56
- 239000000523 sample Substances 0.000 description 56
- 108091026890 Coding region Proteins 0.000 description 53
- 150000007523 nucleic acids Chemical group 0.000 description 46
- 230000001568 sexual effect Effects 0.000 description 46
- 210000001519 tissue Anatomy 0.000 description 43
- 102000004190 Enzymes Human genes 0.000 description 41
- 108090000790 Enzymes Proteins 0.000 description 41
- 229940088598 enzyme Drugs 0.000 description 41
- 238000009396 hybridization Methods 0.000 description 37
- 235000001014 amino acid Nutrition 0.000 description 35
- VBUWHHLIZKOSMS-RIWXPGAOSA-N invicorp Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)C(C)C)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=C(O)C=C1 VBUWHHLIZKOSMS-RIWXPGAOSA-N 0.000 description 35
- 239000003550 marker Substances 0.000 description 35
- 238000003752 polymerase chain reaction Methods 0.000 description 35
- 108020004414 DNA Proteins 0.000 description 34
- 108010003205 Vasoactive Intestinal Peptide Proteins 0.000 description 34
- 102400000015 Vasoactive intestinal peptide Human genes 0.000 description 34
- 210000004392 genitalia Anatomy 0.000 description 32
- 201000010099 disease Diseases 0.000 description 31
- 229940079593 drug Drugs 0.000 description 31
- 102000003729 Neprilysin Human genes 0.000 description 30
- 241001077878 Neurolaena lobata Species 0.000 description 30
- 230000017531 blood circulation Effects 0.000 description 30
- 210000005036 nerve Anatomy 0.000 description 30
- 230000037007 arousal Effects 0.000 description 29
- 108090000028 Neprilysin Proteins 0.000 description 28
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 28
- 230000000975 bioactive effect Effects 0.000 description 28
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 27
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 27
- 229940024606 amino acid Drugs 0.000 description 27
- 208000035475 disorder Diseases 0.000 description 27
- 206010057672 Male sexual dysfunction Diseases 0.000 description 26
- 150000001413 amino acids Chemical class 0.000 description 26
- 239000000243 solution Substances 0.000 description 26
- 238000012360 testing method Methods 0.000 description 26
- 239000003153 chemical reaction reagent Substances 0.000 description 25
- 230000001965 increasing effect Effects 0.000 description 25
- 108020004999 messenger RNA Proteins 0.000 description 25
- 102000039446 nucleic acids Human genes 0.000 description 25
- 108020004707 nucleic acids Proteins 0.000 description 25
- 210000001550 testis Anatomy 0.000 description 25
- 239000000047 product Substances 0.000 description 24
- 230000017854 proteolysis Effects 0.000 description 24
- 230000004044 response Effects 0.000 description 23
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical group [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 23
- 239000000126 substance Substances 0.000 description 23
- 230000008685 targeting Effects 0.000 description 23
- 238000002744 homologous recombination Methods 0.000 description 22
- 230000006801 homologous recombination Effects 0.000 description 22
- 230000010354 integration Effects 0.000 description 21
- 230000035772 mutation Effects 0.000 description 21
- 230000008569 process Effects 0.000 description 21
- 238000006467 substitution reaction Methods 0.000 description 21
- 230000006870 function Effects 0.000 description 20
- 230000002401 inhibitory effect Effects 0.000 description 20
- 230000005764 inhibitory process Effects 0.000 description 20
- BNRNXUUZRGQAQC-UHFFFAOYSA-N sildenafil Chemical compound CCCC1=NN(C)C(C(N2)=O)=C1N=C2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(C)CC1 BNRNXUUZRGQAQC-UHFFFAOYSA-N 0.000 description 20
- 230000036772 blood pressure Effects 0.000 description 19
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 18
- 238000012216 screening Methods 0.000 description 18
- 210000004102 animal cell Anatomy 0.000 description 17
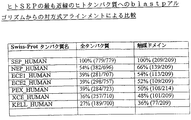
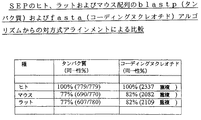
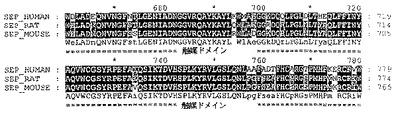
- 108010031441 soluble secreted endopeptidase Proteins 0.000 description 17
- 230000004048 modification Effects 0.000 description 16
- 238000012986 modification Methods 0.000 description 16
- 230000001105 regulatory effect Effects 0.000 description 16
- 108091034117 Oligonucleotide Proteins 0.000 description 15
- 230000027455 binding Effects 0.000 description 15
- 230000001856 erectile effect Effects 0.000 description 15
- 230000001939 inductive effect Effects 0.000 description 15
- 238000002347 injection Methods 0.000 description 15
- 239000007924 injection Substances 0.000 description 15
- 241001465754 Metazoa Species 0.000 description 14
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 14
- 238000007792 addition Methods 0.000 description 14
- 230000000692 anti-sense effect Effects 0.000 description 14
- 210000005226 corpus cavernosum Anatomy 0.000 description 14
- 241000196324 Embryophyta Species 0.000 description 13
- 108030001679 Endothelin-converting enzyme 1 Proteins 0.000 description 13
- 241000588724 Escherichia coli Species 0.000 description 13
- 108010044467 Isoenzymes Proteins 0.000 description 13
- 238000003776 cleavage reaction Methods 0.000 description 13
- 239000002609 medium Substances 0.000 description 13
- 230000007017 scission Effects 0.000 description 13
- 241000283973 Oryctolagus cuniculus Species 0.000 description 12
- 208000006262 Psychological Sexual Dysfunctions Diseases 0.000 description 12
- -1 Sildenafil) Chemical compound 0.000 description 12
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 12
- 239000000975 dye Substances 0.000 description 12
- 238000012239 gene modification Methods 0.000 description 12
- 230000005017 genetic modification Effects 0.000 description 12
- 235000013617 genetically modified food Nutrition 0.000 description 12
- 239000012528 membrane Substances 0.000 description 12
- 239000013612 plasmid Substances 0.000 description 12
- 241000894007 species Species 0.000 description 12
- 230000000638 stimulation Effects 0.000 description 12
- 108090000994 Catalytic RNA Proteins 0.000 description 11
- 102000053642 Catalytic RNA Human genes 0.000 description 11
- 238000003199 nucleic acid amplification method Methods 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- 108091092562 ribozyme Proteins 0.000 description 11
- 108700028369 Alleles Proteins 0.000 description 10
- 241000699666 Mus <mouse, genus> Species 0.000 description 10
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 10
- 102000035195 Peptidases Human genes 0.000 description 10
- 108091005804 Peptidases Proteins 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- 230000003321 amplification Effects 0.000 description 10
- 238000005516 engineering process Methods 0.000 description 10
- 239000013604 expression vector Substances 0.000 description 10
- 230000036541 health Effects 0.000 description 10
- 210000004962 mammalian cell Anatomy 0.000 description 10
- 239000011159 matrix material Substances 0.000 description 10
- 230000001404 mediated effect Effects 0.000 description 10
- 210000003899 penis Anatomy 0.000 description 10
- 238000000746 purification Methods 0.000 description 10
- 229920005989 resin Polymers 0.000 description 10
- 239000011347 resin Substances 0.000 description 10
- 229960003310 sildenafil Drugs 0.000 description 10
- 238000001890 transfection Methods 0.000 description 10
- 241000894006 Bacteria Species 0.000 description 9
- 108020004705 Codon Proteins 0.000 description 9
- 206010049119 Emotional distress Diseases 0.000 description 9
- 238000010171 animal model Methods 0.000 description 9
- 230000001580 bacterial effect Effects 0.000 description 9
- 230000015572 biosynthetic process Effects 0.000 description 9
- 239000000872 buffer Substances 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 230000007423 decrease Effects 0.000 description 9
- 230000009429 distress Effects 0.000 description 9
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 9
- 230000002538 fungal effect Effects 0.000 description 9
- 108020001507 fusion proteins Proteins 0.000 description 9
- 102000037865 fusion proteins Human genes 0.000 description 9
- 230000002068 genetic effect Effects 0.000 description 9
- 238000011160 research Methods 0.000 description 9
- 230000011664 signaling Effects 0.000 description 9
- 238000002560 therapeutic procedure Methods 0.000 description 9
- 101800004490 Endothelin-1 Proteins 0.000 description 8
- 102100029112 Endothelin-converting enzyme 1 Human genes 0.000 description 8
- 102100040513 Endothelin-converting enzyme-like 1 Human genes 0.000 description 8
- 101000967016 Homo sapiens Endothelin-converting enzyme-like 1 Proteins 0.000 description 8
- 239000004365 Protease Substances 0.000 description 8
- 238000010240 RT-PCR analysis Methods 0.000 description 8
- 229940124639 Selective inhibitor Drugs 0.000 description 8
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 230000001413 cellular effect Effects 0.000 description 8
- 230000008859 change Effects 0.000 description 8
- 238000001514 detection method Methods 0.000 description 8
- 230000003834 intracellular effect Effects 0.000 description 8
- 230000007246 mechanism Effects 0.000 description 8
- 230000035479 physiological effects, processes and functions Effects 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- 230000009466 transformation Effects 0.000 description 8
- 230000009261 transgenic effect Effects 0.000 description 8
- 108020005544 Antisense RNA Proteins 0.000 description 7
- 241000193830 Bacillus <bacterium> Species 0.000 description 7
- 241000282412 Homo Species 0.000 description 7
- 206010020565 Hyperaemia Diseases 0.000 description 7
- 241000700159 Rattus Species 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 239000002585 base Substances 0.000 description 7
- 210000004556 brain Anatomy 0.000 description 7
- 230000002759 chromosomal effect Effects 0.000 description 7
- 238000010367 cloning Methods 0.000 description 7
- 239000003184 complementary RNA Substances 0.000 description 7
- 239000003623 enhancer Substances 0.000 description 7
- 230000002708 enhancing effect Effects 0.000 description 7
- 230000002255 enzymatic effect Effects 0.000 description 7
- 229940011871 estrogen Drugs 0.000 description 7
- 239000000262 estrogen Substances 0.000 description 7
- 210000005260 human cell Anatomy 0.000 description 7
- 238000003018 immunoassay Methods 0.000 description 7
- 238000000338 in vitro Methods 0.000 description 7
- 238000010369 molecular cloning Methods 0.000 description 7
- 230000007383 nerve stimulation Effects 0.000 description 7
- 229920001098 polystyrene-block-poly(ethylene/propylene) Polymers 0.000 description 7
- 230000002797 proteolythic effect Effects 0.000 description 7
- 230000002285 radioactive effect Effects 0.000 description 7
- 210000002460 smooth muscle Anatomy 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- 238000013519 translation Methods 0.000 description 7
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 description 6
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 6
- 241000238631 Hexapoda Species 0.000 description 6
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 6
- 108010076504 Protein Sorting Signals Proteins 0.000 description 6
- 108020004511 Recombinant DNA Proteins 0.000 description 6
- 239000005557 antagonist Substances 0.000 description 6
- ZOOGRGPOEVQQDX-UHFFFAOYSA-N cyclic GMP Natural products O1C2COP(O)(=O)OC2C(O)C1N1C=NC2=C1NC(N)=NC2=O ZOOGRGPOEVQQDX-UHFFFAOYSA-N 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 210000003191 femoral vein Anatomy 0.000 description 6
- 238000001802 infusion Methods 0.000 description 6
- 239000000314 lubricant Substances 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 230000018052 penile erection Effects 0.000 description 6
- 238000010647 peptide synthesis reaction Methods 0.000 description 6
- 239000002590 phosphodiesterase V inhibitor Substances 0.000 description 6
- 238000003127 radioimmunoassay Methods 0.000 description 6
- 230000006798 recombination Effects 0.000 description 6
- 238000005215 recombination Methods 0.000 description 6
- 230000028327 secretion Effects 0.000 description 6
- 210000000130 stem cell Anatomy 0.000 description 6
- 229960003604 testosterone Drugs 0.000 description 6
- 239000013603 viral vector Substances 0.000 description 6
- 108010021809 Alcohol dehydrogenase Proteins 0.000 description 5
- 208000024172 Cardiovascular disease Diseases 0.000 description 5
- 102000048186 Endothelin-converting enzyme 1 Human genes 0.000 description 5
- 108700024394 Exon Proteins 0.000 description 5
- 206010020772 Hypertension Diseases 0.000 description 5
- 241001313288 Labia Species 0.000 description 5
- 108090000189 Neuropeptides Proteins 0.000 description 5
- 229940123333 Phosphodiesterase 5 inhibitor Drugs 0.000 description 5
- 108010091086 Recombinases Proteins 0.000 description 5
- 102000018120 Recombinases Human genes 0.000 description 5
- 241000235070 Saccharomyces Species 0.000 description 5
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 5
- 108700019146 Transgenes Proteins 0.000 description 5
- 230000003187 abdominal effect Effects 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 229960004046 apomorphine Drugs 0.000 description 5
- VMWNQDUVQKEIOC-CYBMUJFWSA-N apomorphine Chemical compound C([C@H]1N(C)CC2)C3=CC=C(O)C(O)=C3C3=C1C2=CC=C3 VMWNQDUVQKEIOC-CYBMUJFWSA-N 0.000 description 5
- 230000009286 beneficial effect Effects 0.000 description 5
- 230000015556 catabolic process Effects 0.000 description 5
- 230000003197 catalytic effect Effects 0.000 description 5
- 210000000349 chromosome Anatomy 0.000 description 5
- 238000006731 degradation reaction Methods 0.000 description 5
- 238000003745 diagnosis Methods 0.000 description 5
- 238000009826 distribution Methods 0.000 description 5
- 230000004064 dysfunction Effects 0.000 description 5
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 5
- 229940066758 endopeptidases Drugs 0.000 description 5
- 238000010363 gene targeting Methods 0.000 description 5
- 210000002216 heart Anatomy 0.000 description 5
- 238000000589 high-performance liquid chromatography-mass spectrometry Methods 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 238000005461 lubrication Methods 0.000 description 5
- 244000005700 microbiome Species 0.000 description 5
- 239000003068 molecular probe Substances 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 238000002953 preparative HPLC Methods 0.000 description 5
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 5
- 238000010561 standard procedure Methods 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- 230000002123 temporal effect Effects 0.000 description 5
- 238000013518 transcription Methods 0.000 description 5
- 230000035897 transcription Effects 0.000 description 5
- 230000001131 transforming effect Effects 0.000 description 5
- 210000005253 yeast cell Anatomy 0.000 description 5
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 4
- 206010002091 Anaesthesia Diseases 0.000 description 4
- 102400000967 Bradykinin Human genes 0.000 description 4
- 101800004538 Bradykinin Proteins 0.000 description 4
- 108050009340 Endothelin Proteins 0.000 description 4
- 102000002045 Endothelin Human genes 0.000 description 4
- 101710144982 Endothelin-converting enzyme 2 Proteins 0.000 description 4
- 102100029113 Endothelin-converting enzyme 2 Human genes 0.000 description 4
- 108010092674 Enkephalins Proteins 0.000 description 4
- 108091060211 Expressed sequence tag Proteins 0.000 description 4
- 241000233866 Fungi Species 0.000 description 4
- QXZGBUJJYSLZLT-UHFFFAOYSA-N H-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-OH Natural products NC(N)=NCCCC(N)C(=O)N1CCCC1C(=O)N1C(C(=O)NCC(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CO)C(=O)N2C(CCC2)C(=O)NC(CC=2C=CC=CC=2)C(=O)NC(CCCN=C(N)N)C(O)=O)CCC1 QXZGBUJJYSLZLT-UHFFFAOYSA-N 0.000 description 4
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 4
- 241000235649 Kluyveromyces Species 0.000 description 4
- URLZCHNOLZSCCA-VABKMULXSA-N Leu-enkephalin Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)CNC(=O)CNC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=CC=C1 URLZCHNOLZSCCA-VABKMULXSA-N 0.000 description 4
- 206010024419 Libido decreased Diseases 0.000 description 4
- 108050004622 Membrane metallo-endopeptidase-like 1 Proteins 0.000 description 4
- 241000699670 Mus sp. Species 0.000 description 4
- BDJDTKYGKHEMFF-UHFFFAOYSA-M QSY7 succinimidyl ester Chemical compound [Cl-].C=1C=C2C(C=3C(=CC=CC=3)S(=O)(=O)N3CCC(CC3)C(=O)ON3C(CCC3=O)=O)=C3C=C\C(=[N+](\C)C=4C=CC=CC=4)C=C3OC2=CC=1N(C)C1=CC=CC=C1 BDJDTKYGKHEMFF-UHFFFAOYSA-M 0.000 description 4
- 101001052496 Rattus norvegicus Membrane metallo-endopeptidase-like 1 Proteins 0.000 description 4
- 230000002159 abnormal effect Effects 0.000 description 4
- 125000000539 amino acid group Chemical group 0.000 description 4
- 230000037005 anaesthesia Effects 0.000 description 4
- 239000000427 antigen Substances 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 210000004204 blood vessel Anatomy 0.000 description 4
- QXZGBUJJYSLZLT-FDISYFBBSA-N bradykinin Chemical compound NC(=N)NCCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(=O)NCC(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CO)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)CCC1 QXZGBUJJYSLZLT-FDISYFBBSA-N 0.000 description 4
- 238000004422 calculation algorithm Methods 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 206010012601 diabetes mellitus Diseases 0.000 description 4
- 238000010790 dilution Methods 0.000 description 4
- 239000012895 dilution Substances 0.000 description 4
- 229940000406 drug candidate Drugs 0.000 description 4
- 230000002526 effect on cardiovascular system Effects 0.000 description 4
- 238000004520 electroporation Methods 0.000 description 4
- ZUBDGKVDJUIMQQ-UBFCDGJISA-N endothelin-1 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-UBFCDGJISA-N 0.000 description 4
- 210000001105 femoral artery Anatomy 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 238000010353 genetic engineering Methods 0.000 description 4
- 238000013537 high throughput screening Methods 0.000 description 4
- 238000002657 hormone replacement therapy Methods 0.000 description 4
- 208000017020 hypoactive sexual desire disease Diseases 0.000 description 4
- 230000002452 interceptive effect Effects 0.000 description 4
- 229960002725 isoflurane Drugs 0.000 description 4
- 238000012423 maintenance Methods 0.000 description 4
- 238000013507 mapping Methods 0.000 description 4
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 4
- 238000002703 mutagenesis Methods 0.000 description 4
- 231100000350 mutagenesis Toxicity 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- 210000002569 neuron Anatomy 0.000 description 4
- 230000003472 neutralizing effect Effects 0.000 description 4
- 210000000056 organ Anatomy 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 210000003689 pubic bone Anatomy 0.000 description 4
- 238000011002 quantification Methods 0.000 description 4
- 230000010076 replication Effects 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L sodium carbonate Substances [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000007790 solid phase Substances 0.000 description 4
- 230000009870 specific binding Effects 0.000 description 4
- 230000002381 testicular Effects 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 238000010361 transduction Methods 0.000 description 4
- 230000026683 transduction Effects 0.000 description 4
- 210000001215 vagina Anatomy 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
- 238000009423 ventilation Methods 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- UUUHXMGGBIUAPW-UHFFFAOYSA-N 1-[1-[2-[[5-amino-2-[[1-[5-(diaminomethylideneamino)-2-[[1-[3-(1h-indol-3-yl)-2-[(5-oxopyrrolidine-2-carbonyl)amino]propanoyl]pyrrolidine-2-carbonyl]amino]pentanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-3-methylpentanoyl]pyrrolidine-2-carbon Chemical compound C1CCC(C(=O)N2C(CCC2)C(O)=O)N1C(=O)C(C(C)CC)NC(=O)C(CCC(N)=O)NC(=O)C1CCCN1C(=O)C(CCCN=C(N)N)NC(=O)C1CCCN1C(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C1CCC(=O)N1 UUUHXMGGBIUAPW-UHFFFAOYSA-N 0.000 description 3
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 3
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- 102000007698 Alcohol dehydrogenase Human genes 0.000 description 3
- 108020004491 Antisense DNA Proteins 0.000 description 3
- 208000019901 Anxiety disease Diseases 0.000 description 3
- 241000228212 Aspergillus Species 0.000 description 3
- 241000228245 Aspergillus niger Species 0.000 description 3
- 206010003594 Ataxia telangiectasia Diseases 0.000 description 3
- 101800001288 Atrial natriuretic factor Proteins 0.000 description 3
- 102400001282 Atrial natriuretic peptide Human genes 0.000 description 3
- 101800001890 Atrial natriuretic peptide Proteins 0.000 description 3
- 102100026189 Beta-galactosidase Human genes 0.000 description 3
- 206010008805 Chromosomal abnormalities Diseases 0.000 description 3
- 208000031404 Chromosome Aberrations Diseases 0.000 description 3
- 108010051219 Cre recombinase Proteins 0.000 description 3
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 3
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 3
- 229920002307 Dextran Polymers 0.000 description 3
- 102400000686 Endothelin-1 Human genes 0.000 description 3
- 108010073178 Glucan 1,4-alpha-Glucosidase Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 239000007995 HEPES buffer Substances 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 3
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 3
- 241001529936 Murinae Species 0.000 description 3
- 206010028980 Neoplasm Diseases 0.000 description 3
- 102000015636 Oligopeptides Human genes 0.000 description 3
- 108010038807 Oligopeptides Proteins 0.000 description 3
- 108700026244 Open Reading Frames Proteins 0.000 description 3
- 208000002193 Pain Diseases 0.000 description 3
- 108010067902 Peptide Library Proteins 0.000 description 3
- 108090000882 Peptidyl-Dipeptidase A Proteins 0.000 description 3
- 102000004270 Peptidyl-Dipeptidase A Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 241000283984 Rodentia Species 0.000 description 3
- 241000187747 Streptomyces Species 0.000 description 3
- RHQDFWAXVIIEBN-UHFFFAOYSA-N Trifluoroethanol Chemical compound OCC(F)(F)F RHQDFWAXVIIEBN-UHFFFAOYSA-N 0.000 description 3
- 101710204001 Zinc metalloprotease Proteins 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- 239000000556 agonist Substances 0.000 description 3
- 108090000637 alpha-Amylases Proteins 0.000 description 3
- 239000003816 antisense DNA Substances 0.000 description 3
- 230000036506 anxiety Effects 0.000 description 3
- 230000006383 arousal process Effects 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 108010005774 beta-Galactosidase Proteins 0.000 description 3
- HZZGDPLAJHVHSP-GKHTVLBPSA-N big endothelin Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@@H]2CSSC[C@@H](C(N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CSSC1)C1=CN=CN1 HZZGDPLAJHVHSP-GKHTVLBPSA-N 0.000 description 3
- 239000011230 binding agent Substances 0.000 description 3
- 239000012472 biological sample Substances 0.000 description 3
- 210000001124 body fluid Anatomy 0.000 description 3
- 239000010839 body fluid Substances 0.000 description 3
- 239000001506 calcium phosphate Substances 0.000 description 3
- 229910000389 calcium phosphate Inorganic materials 0.000 description 3
- 235000011010 calcium phosphates Nutrition 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- NSQLIUXCMFBZME-MPVJKSABSA-N carperitide Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)=O)[C@@H](C)CC)C1=CC=CC=C1 NSQLIUXCMFBZME-MPVJKSABSA-N 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 210000003029 clitoris Anatomy 0.000 description 3
- 239000013599 cloning vector Substances 0.000 description 3
- 238000012875 competitive assay Methods 0.000 description 3
- 230000002860 competitive effect Effects 0.000 description 3
- 238000004590 computer program Methods 0.000 description 3
- 210000002808 connective tissue Anatomy 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 238000010511 deprotection reaction Methods 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 238000007877 drug screening Methods 0.000 description 3
- QTTMOCOWZLSYSV-QWAPEVOJSA-M equilin sodium sulfate Chemical compound [Na+].[O-]S(=O)(=O)OC1=CC=C2[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4C3=CCC2=C1 QTTMOCOWZLSYSV-QWAPEVOJSA-M 0.000 description 3
- 239000000284 extract Substances 0.000 description 3
- 230000013595 glycosylation Effects 0.000 description 3
- 238000006206 glycosylation reaction Methods 0.000 description 3
- 210000004408 hybridoma Anatomy 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 238000002513 implantation Methods 0.000 description 3
- 238000007901 in situ hybridization Methods 0.000 description 3
- 230000030214 innervation Effects 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 238000002372 labelling Methods 0.000 description 3
- CUHVIMMYOGQXCV-UHFFFAOYSA-N medetomidine Chemical compound C=1C=CC(C)=C(C)C=1C(C)C1=CNC=N1 CUHVIMMYOGQXCV-UHFFFAOYSA-N 0.000 description 3
- 238000000520 microinjection Methods 0.000 description 3
- 238000005065 mining Methods 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 210000003205 muscle Anatomy 0.000 description 3
- 210000004897 n-terminal region Anatomy 0.000 description 3
- 230000036407 pain Effects 0.000 description 3
- 230000036961 partial effect Effects 0.000 description 3
- 230000007310 pathophysiology Effects 0.000 description 3
- 210000004197 pelvis Anatomy 0.000 description 3
- 230000035790 physiological processes and functions Effects 0.000 description 3
- 239000013641 positive control Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- GMVPRGQOIOIIMI-DWKJAMRDSA-N prostaglandin E1 Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1CCCCCCC(O)=O GMVPRGQOIOIIMI-DWKJAMRDSA-N 0.000 description 3
- 238000010791 quenching Methods 0.000 description 3
- 230000000171 quenching effect Effects 0.000 description 3
- 229940044601 receptor agonist Drugs 0.000 description 3
- 239000000018 receptor agonist Substances 0.000 description 3
- 230000003362 replicative effect Effects 0.000 description 3
- 108091008146 restriction endonucleases Proteins 0.000 description 3
- 230000000717 retained effect Effects 0.000 description 3
- 238000012552 review Methods 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000002864 sequence alignment Methods 0.000 description 3
- 208000012201 sexual and gender identity disease Diseases 0.000 description 3
- 208000015891 sexual disease Diseases 0.000 description 3
- 229910000029 sodium carbonate Inorganic materials 0.000 description 3
- 229910001415 sodium ion Inorganic materials 0.000 description 3
- 238000010532 solid phase synthesis reaction Methods 0.000 description 3
- 230000010473 stable expression Effects 0.000 description 3
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 3
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 description 3
- 241000701161 unidentified adenovirus Species 0.000 description 3
- 241001430294 unidentified retrovirus Species 0.000 description 3
- 238000011144 upstream manufacturing Methods 0.000 description 3
- 230000002227 vasoactive effect Effects 0.000 description 3
- 210000003462 vein Anatomy 0.000 description 3
- 230000035899 viability Effects 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- QDZOEBFLNHCSSF-PFFBOGFISA-N (2S)-2-[[(2R)-2-[[(2S)-1-[(2S)-6-amino-2-[[(2S)-1-[(2R)-2-amino-5-carbamimidamidopentanoyl]pyrrolidine-2-carbonyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-N-[(2R)-1-[[(2S)-1-[[(2R)-1-[[(2S)-1-[[(2S)-1-amino-4-methyl-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]pentanediamide Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(N)=O)NC(=O)[C@@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](N)CCCNC(N)=N)C1=CC=CC=C1 QDZOEBFLNHCSSF-PFFBOGFISA-N 0.000 description 2
- JDKLPDJLXHXHNV-MFVUMRCOSA-N (3s,6s,9r,12s,15s,23s)-15-[[(2s)-2-acetamidohexanoyl]amino]-9-benzyl-6-[3-(diaminomethylideneamino)propyl]-12-(1h-imidazol-5-ylmethyl)-3-(1h-indol-3-ylmethyl)-2,5,8,11,14,17-hexaoxo-1,4,7,10,13,18-hexazacyclotricosane-23-carboxamide Chemical compound C([C@@H]1C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCNC(=O)C[C@@H](C(N[C@@H](CC=2NC=NC=2)C(=O)N1)=O)NC(=O)[C@@H](NC(C)=O)CCCC)C(N)=O)C1=CC=CC=C1 JDKLPDJLXHXHNV-MFVUMRCOSA-N 0.000 description 2
- GMVPRGQOIOIIMI-UHFFFAOYSA-N (8R,11R,12R,13E,15S)-11,15-Dihydroxy-9-oxo-13-prostenoic acid Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CCCCCCC(O)=O GMVPRGQOIOIIMI-UHFFFAOYSA-N 0.000 description 2
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 2
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 2
- RQFCJASXJCIDSX-UHFFFAOYSA-N 14C-Guanosin-5'-monophosphat Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(COP(O)(O)=O)C(O)C1O RQFCJASXJCIDSX-UHFFFAOYSA-N 0.000 description 2
- NRKYWOKHZRQRJR-UHFFFAOYSA-N 2,2,2-trifluoroacetamide Chemical compound NC(=O)C(F)(F)F NRKYWOKHZRQRJR-UHFFFAOYSA-N 0.000 description 2
- OGIYDFVHFQEFKQ-UHFFFAOYSA-N 3-[n-(4,5-dihydro-1h-imidazol-2-ylmethyl)-4-methylanilino]phenol;methanesulfonic acid Chemical compound CS(O)(=O)=O.C1=CC(C)=CC=C1N(C=1C=C(O)C=CC=1)CC1=NCCN1 OGIYDFVHFQEFKQ-UHFFFAOYSA-N 0.000 description 2
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 2
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 2
- 108010085238 Actins Proteins 0.000 description 2
- 208000024827 Alzheimer disease Diseases 0.000 description 2
- 102400000344 Angiotensin-1 Human genes 0.000 description 2
- 101800000734 Angiotensin-1 Proteins 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000194108 Bacillus licheniformis Species 0.000 description 2
- 244000063299 Bacillus subtilis Species 0.000 description 2
- 235000014469 Bacillus subtilis Nutrition 0.000 description 2
- 108010006654 Bleomycin Proteins 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 108090000932 Calcitonin Gene-Related Peptide Proteins 0.000 description 2
- 102000004414 Calcitonin Gene-Related Peptide Human genes 0.000 description 2
- 244000025254 Cannabis sativa Species 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 2
- 108020004635 Complementary DNA Proteins 0.000 description 2
- 102400000011 Cytochrome b-c1 complex subunit 9 Human genes 0.000 description 2
- 101800000778 Cytochrome b-c1 complex subunit 9 Proteins 0.000 description 2
- 241000701022 Cytomegalovirus Species 0.000 description 2
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 description 2
- 206010059866 Drug resistance Diseases 0.000 description 2
- 208000004483 Dyspareunia Diseases 0.000 description 2
- 101100271445 Emericella nidulans (strain FGSC A4 / ATCC 38163 / CBS 112.46 / NRRL 194 / M139) atp9 gene Proteins 0.000 description 2
- 201000009273 Endometriosis Diseases 0.000 description 2
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 2
- 241000283073 Equus caballus Species 0.000 description 2
- 241000588722 Escherichia Species 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- 102000053187 Glucuronidase Human genes 0.000 description 2
- 108010060309 Glucuronidase Proteins 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 241000288105 Grus Species 0.000 description 2
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 2
- 108010033040 Histones Proteins 0.000 description 2
- 101150003028 Hprt1 gene Proteins 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- YQEZLKZALYSWHR-UHFFFAOYSA-N Ketamine Chemical compound C=1C=CC=C(Cl)C=1C1(NC)CCCCC1=O YQEZLKZALYSWHR-UHFFFAOYSA-N 0.000 description 2
- ZQISRDCJNBUVMM-UHFFFAOYSA-N L-Histidinol Natural products OCC(N)CC1=CN=CN1 ZQISRDCJNBUVMM-UHFFFAOYSA-N 0.000 description 2
- ZQISRDCJNBUVMM-YFKPBYRVSA-N L-histidinol Chemical compound OC[C@@H](N)CC1=CNC=N1 ZQISRDCJNBUVMM-YFKPBYRVSA-N 0.000 description 2
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 102000003960 Ligases Human genes 0.000 description 2
- 108090000364 Ligases Proteins 0.000 description 2
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 2
- 102000005741 Metalloproteases Human genes 0.000 description 2
- 108010006035 Metalloproteases Proteins 0.000 description 2
- GCKMFJBGXUYNAG-HLXURNFRSA-N Methyltestosterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@](C)(O)[C@@]1(C)CC2 GCKMFJBGXUYNAG-HLXURNFRSA-N 0.000 description 2
- 102000008299 Nitric Oxide Synthase Human genes 0.000 description 2
- 108010021487 Nitric Oxide Synthase Proteins 0.000 description 2
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 2
- 241000283977 Oryctolagus Species 0.000 description 2
- 238000012408 PCR amplification Methods 0.000 description 2
- 102400000170 PEX Human genes 0.000 description 2
- 101800000990 PEX Proteins 0.000 description 2
- 239000005662 Paraffin oil Substances 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- ZPHBZEQOLSRPAK-UHFFFAOYSA-N Phosphoramidon Natural products C=1NC2=CC=CC=C2C=1CC(C(O)=O)NC(=O)C(CC(C)C)NP(O)(=O)OC1OC(C)C(O)C(O)C1O ZPHBZEQOLSRPAK-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 229920000361 Poly(styrene)-block-poly(ethylene glycol) Polymers 0.000 description 2
- 229940127315 Potassium Channel Openers Drugs 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 241000589516 Pseudomonas Species 0.000 description 2
- IIDJRNMFWXDHID-UHFFFAOYSA-N Risedronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CC1=CC=CN=C1 IIDJRNMFWXDHID-UHFFFAOYSA-N 0.000 description 2
- 206010040070 Septic Shock Diseases 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- 241000700584 Simplexvirus Species 0.000 description 2
- FKNQFGJONOIPTF-UHFFFAOYSA-N Sodium cation Chemical compound [Na+] FKNQFGJONOIPTF-UHFFFAOYSA-N 0.000 description 2
- 102000007637 Soluble Guanylyl Cyclase Human genes 0.000 description 2
- 108010007205 Soluble Guanylyl Cyclase Proteins 0.000 description 2
- 238000002105 Southern blotting Methods 0.000 description 2
- 108091081024 Start codon Proteins 0.000 description 2
- 238000000692 Student's t-test Methods 0.000 description 2
- 101800003906 Substance P Proteins 0.000 description 2
- 102400000096 Substance P Human genes 0.000 description 2
- 241000282887 Suidae Species 0.000 description 2
- 239000004098 Tetracycline Substances 0.000 description 2
- 108010036928 Thiorphan Proteins 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 102000006601 Thymidine Kinase Human genes 0.000 description 2
- 108020004440 Thymidine kinase Proteins 0.000 description 2
- 241000499912 Trichoderma reesei Species 0.000 description 2
- 102000005924 Triose-Phosphate Isomerase Human genes 0.000 description 2
- 108700015934 Triose-phosphate isomerases Proteins 0.000 description 2
- 102000011016 Type 5 Cyclic Nucleotide Phosphodiesterases Human genes 0.000 description 2
- 108010037581 Type 5 Cyclic Nucleotide Phosphodiesterases Proteins 0.000 description 2
- 241000700618 Vaccinia virus Species 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- OZPWNCNLFBVVEN-RFYLDXRNSA-N [(6s,8r,9s,10r,13s,14s,17r)-17-acetyl-6,10,13-trimethyl-3-oxo-2,6,7,8,9,11,12,14,15,16-decahydro-1h-cyclopenta[a]phenanthren-17-yl] acetate;[(9s,13s,14s)-13-methyl-17-oxo-9,11,12,14,15,16-hexahydro-6h-cyclopenta[a]phenanthren-3-yl] hydrogen sulfate;[(8r,9 Chemical compound OS(=O)(=O)OC1=CC=C2[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1.OS(=O)(=O)OC1=CC=C2[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4C3=CCC2=C1.OS(=O)(=O)OC1=CC=C2C(CC[C@]3([C@H]4CCC3=O)C)=C4C=CC2=C1.C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 OZPWNCNLFBVVEN-RFYLDXRNSA-N 0.000 description 2
- 210000000683 abdominal cavity Anatomy 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 108010048241 acetamidase Proteins 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical group C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 239000011543 agarose gel Substances 0.000 description 2
- 102000004139 alpha-Amylases Human genes 0.000 description 2
- 229940024171 alpha-amylase Drugs 0.000 description 2
- 229960000711 alprostadil Drugs 0.000 description 2
- 229960000723 ampicillin Drugs 0.000 description 2
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 2
- 230000003444 anaesthetic effect Effects 0.000 description 2
- 210000003484 anatomy Anatomy 0.000 description 2
- ORWYRWWVDCYOMK-HBZPZAIKSA-N angiotensin I Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C1=CC=C(O)C=C1 ORWYRWWVDCYOMK-HBZPZAIKSA-N 0.000 description 2
- 239000000935 antidepressant agent Substances 0.000 description 2
- 229940005513 antidepressants Drugs 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 210000000702 aorta abdominal Anatomy 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000003491 array Methods 0.000 description 2
- 230000004872 arterial blood pressure Effects 0.000 description 2
- 210000004436 artificial bacterial chromosome Anatomy 0.000 description 2
- 210000001106 artificial yeast chromosome Anatomy 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 108010006060 aviptadil Proteins 0.000 description 2
- 230000003115 biocidal effect Effects 0.000 description 2
- 238000001574 biopsy Methods 0.000 description 2
- 229960001561 bleomycin Drugs 0.000 description 2
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 2
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 210000003679 cervix uteri Anatomy 0.000 description 2
- 230000009918 complex formation Effects 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000002405 diagnostic procedure Methods 0.000 description 2
- 230000035487 diastolic blood pressure Effects 0.000 description 2
- 230000003205 diastolic effect Effects 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 239000003136 dopamine receptor stimulating agent Substances 0.000 description 2
- 230000005782 double-strand break Effects 0.000 description 2
- 210000002257 embryonic structure Anatomy 0.000 description 2
- 210000000750 endocrine system Anatomy 0.000 description 2
- 230000002616 endonucleolytic effect Effects 0.000 description 2
- 210000002889 endothelial cell Anatomy 0.000 description 2
- 210000003038 endothelium Anatomy 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 238000000855 fermentation Methods 0.000 description 2
- 230000004151 fermentation Effects 0.000 description 2
- 230000035558 fertility Effects 0.000 description 2
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 238000004868 gas analysis Methods 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- 210000001654 germ layer Anatomy 0.000 description 2
- 210000004907 gland Anatomy 0.000 description 2
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- RQFCJASXJCIDSX-UUOKFMHZSA-N guanosine 5'-monophosphate Chemical compound C1=2NC(N)=NC(=O)C=2N=CN1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O RQFCJASXJCIDSX-UUOKFMHZSA-N 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 210000003917 human chromosome Anatomy 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 210000004731 jugular vein Anatomy 0.000 description 2
- 229960003299 ketamine Drugs 0.000 description 2
- VCMGMSHEPQENPE-UHFFFAOYSA-N ketamine hydrochloride Chemical compound [Cl-].C=1C=CC=C(Cl)C=1C1([NH2+]C)CCCCC1=O VCMGMSHEPQENPE-UHFFFAOYSA-N 0.000 description 2
- 231100000518 lethal Toxicity 0.000 description 2
- 230000001665 lethal effect Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 238000002483 medication Methods 0.000 description 2
- 229960002985 medroxyprogesterone acetate Drugs 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- CWWARWOPSKGELM-SARDKLJWSA-N methyl (2s)-2-[[(2s)-2-[[2-[[(2s)-2-[[(2s)-2-[[(2s)-5-amino-2-[[(2s)-5-amino-2-[[(2s)-1-[(2s)-6-amino-2-[[(2s)-1-[(2s)-2-amino-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-5 Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)OC)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CCCN=C(N)N)C1=CC=CC=C1 CWWARWOPSKGELM-SARDKLJWSA-N 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 230000001537 neural effect Effects 0.000 description 2
- 208000015122 neurodegenerative disease Diseases 0.000 description 2
- 239000002858 neurotransmitter agent Substances 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 230000036963 noncompetitive effect Effects 0.000 description 2
- 239000002853 nucleic acid probe Substances 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 2
- MRBDMNSDAVCSSF-UHFFFAOYSA-N phentolamine Chemical compound C1=CC(C)=CC=C1N(C=1C=C(O)C=CC=1)CC1=NCCN1 MRBDMNSDAVCSSF-UHFFFAOYSA-N 0.000 description 2
- 229960001999 phentolamine Drugs 0.000 description 2
- BWSDNRQVTFZQQD-AYVHNPTNSA-N phosphoramidon Chemical compound O([P@@](O)(=O)N[C@H](CC(C)C)C(=O)N[C@H](CC=1[C]2C=CC=CC2=NC=1)C(O)=O)[C@H]1O[C@@H](C)[C@H](O)[C@@H](O)[C@@H]1O BWSDNRQVTFZQQD-AYVHNPTNSA-N 0.000 description 2
- 108010072906 phosphoramidon Proteins 0.000 description 2
- 210000002826 placenta Anatomy 0.000 description 2
- 210000001778 pluripotent stem cell Anatomy 0.000 description 2
- 230000008488 polyadenylation Effects 0.000 description 2
- 230000004481 post-translational protein modification Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 150000003180 prostaglandins Chemical class 0.000 description 2
- 235000019419 proteases Nutrition 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- 208000020016 psychiatric disease Diseases 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 238000003259 recombinant expression Methods 0.000 description 2
- 230000004648 relaxation of smooth muscle Effects 0.000 description 2
- 230000001850 reproductive effect Effects 0.000 description 2
- 230000001177 retroviral effect Effects 0.000 description 2
- 210000003497 sciatic nerve Anatomy 0.000 description 2
- 206010039722 scoliosis Diseases 0.000 description 2
- 238000004062 sedimentation Methods 0.000 description 2
- 229940124834 selective serotonin reuptake inhibitor Drugs 0.000 description 2
- 239000012896 selective serotonin reuptake inhibitor Substances 0.000 description 2
- 230000035807 sensation Effects 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 235000004400 serine Nutrition 0.000 description 2
- 230000036332 sexual response Effects 0.000 description 2
- 230000036259 sexual stimuli Effects 0.000 description 2
- 239000013605 shuttle vector Substances 0.000 description 2
- 238000002741 site-directed mutagenesis Methods 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- 210000000813 small intestine Anatomy 0.000 description 2
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 230000019100 sperm motility Effects 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 230000035488 systolic blood pressure Effects 0.000 description 2
- WOXKDUGGOYFFRN-IIBYNOLFSA-N tadalafil Chemical compound C1=C2OCOC2=CC([C@@H]2C3=C(C4=CC=CC=C4N3)C[C@H]3N2C(=O)CN(C3=O)C)=C1 WOXKDUGGOYFFRN-IIBYNOLFSA-N 0.000 description 2
- 229960002180 tetracycline Drugs 0.000 description 2
- 229930101283 tetracycline Natural products 0.000 description 2
- 235000019364 tetracycline Nutrition 0.000 description 2
- 150000003522 tetracyclines Chemical class 0.000 description 2
- LJJKNPQAGWVLDQ-SNVBAGLBSA-N thiorphan Chemical compound OC(=O)CNC(=O)[C@@H](CS)CC1=CC=CC=C1 LJJKNPQAGWVLDQ-SNVBAGLBSA-N 0.000 description 2
- 235000008521 threonine Nutrition 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 238000012250 transgenic expression Methods 0.000 description 2
- 230000014621 translational initiation Effects 0.000 description 2
- 238000001926 trapping method Methods 0.000 description 2
- 231100000588 tumorigenic Toxicity 0.000 description 2
- 230000000381 tumorigenic effect Effects 0.000 description 2
- 235000002374 tyrosine Nutrition 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 210000000689 upper leg Anatomy 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- 230000001720 vestibular Effects 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- 230000029663 wound healing Effects 0.000 description 2
- DNXHEGUUPJUMQT-UHFFFAOYSA-N (+)-estrone Natural products OC1=CC=C2C3CCC(C)(C(CC4)=O)C4C3CCC2=C1 DNXHEGUUPJUMQT-UHFFFAOYSA-N 0.000 description 1
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical compound C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 1
- SJVFAHZPLIXNDH-JOCHJYFZSA-N (2r)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-3-phenylpropanoic acid Chemical compound C([C@H](C(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)C1=CC=CC=C1 SJVFAHZPLIXNDH-JOCHJYFZSA-N 0.000 description 1
- HNICLNKVURBTKV-NDEPHWFRSA-N (2s)-5-[[amino-[(2,2,4,6,7-pentamethyl-3h-1-benzofuran-5-yl)sulfonylamino]methylidene]amino]-2-(9h-fluoren-9-ylmethoxycarbonylamino)pentanoic acid Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1COC(=O)N[C@H](C(O)=O)CCCN=C(N)NS(=O)(=O)C1=C(C)C(C)=C2OC(C)(C)CC2=C1C HNICLNKVURBTKV-NDEPHWFRSA-N 0.000 description 1
- ASWBNKHCZGQVJV-UHFFFAOYSA-N (3-hexadecanoyloxy-2-hydroxypropyl) 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(O)COP([O-])(=O)OCC[N+](C)(C)C ASWBNKHCZGQVJV-UHFFFAOYSA-N 0.000 description 1
- ULYONBAOIMCNEH-HNNXBMFYSA-N (3s)-3-(5-chloro-2-methoxyphenyl)-3-fluoro-6-(trifluoromethyl)-1h-indol-2-one Chemical compound COC1=CC=C(Cl)C=C1[C@@]1(F)C2=CC=C(C(F)(F)F)C=C2NC1=O ULYONBAOIMCNEH-HNNXBMFYSA-N 0.000 description 1
- NCYCYZXNIZJOKI-IOUUIBBYSA-N 11-cis-retinal Chemical compound O=C/C=C(\C)/C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C NCYCYZXNIZJOKI-IOUUIBBYSA-N 0.000 description 1
- PXFBZOLANLWPMH-UHFFFAOYSA-N 16-Epiaffinine Natural products C1C(C2=CC=CC=C2N2)=C2C(=O)CC2C(=CC)CN(C)C1C2CO PXFBZOLANLWPMH-UHFFFAOYSA-N 0.000 description 1
- GCKMFJBGXUYNAG-UHFFFAOYSA-N 17alpha-methyltestosterone Natural products C1CC2=CC(=O)CCC2(C)C2C1C1CCC(C)(O)C1(C)CC2 GCKMFJBGXUYNAG-UHFFFAOYSA-N 0.000 description 1
- UFBJCMHMOXMLKC-UHFFFAOYSA-N 2,4-dinitrophenol Chemical compound OC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O UFBJCMHMOXMLKC-UHFFFAOYSA-N 0.000 description 1
- QRBLKGHRWFGINE-UGWAGOLRSA-N 2-[2-[2-[[2-[[4-[[2-[[6-amino-2-[3-amino-1-[(2,3-diamino-3-oxopropyl)amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2s,3r,4r,5s)-4-carbamoyl-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-4,5-dihydroxy-6-(hydroxymethyl)- Chemical compound N=1C(C=2SC=C(N=2)C(N)=O)CSC=1CCNC(=O)C(C(C)=O)NC(=O)C(C)C(O)C(C)NC(=O)C(C(O[C@H]1[C@@]([C@@H](O)[C@H](O)[C@H](CO)O1)(C)O[C@H]1[C@@H]([C@](O)([C@@H](O)C(CO)O1)C(N)=O)O)C=1NC=NC=1)NC(=O)C1=NC(C(CC(N)=O)NCC(N)C(N)=O)=NC(N)=C1C QRBLKGHRWFGINE-UGWAGOLRSA-N 0.000 description 1
- 108020005345 3' Untranslated Regions Proteins 0.000 description 1
- LINBWYYLPWJQHE-UHFFFAOYSA-N 3-(9h-fluoren-9-ylmethoxycarbonylamino)propanoic acid Chemical compound C1=CC=C2C(COC(=O)NCCC(=O)O)C3=CC=CC=C3C2=C1 LINBWYYLPWJQHE-UHFFFAOYSA-N 0.000 description 1
- OSJPPGNTCRNQQC-UWTATZPHSA-N 3-phospho-D-glyceric acid Chemical compound OC(=O)[C@H](O)COP(O)(O)=O OSJPPGNTCRNQQC-UWTATZPHSA-N 0.000 description 1
- 108010011619 6-Phytase Proteins 0.000 description 1
- RJOXFJDOUQJOMQ-UHFFFAOYSA-N 6-sulfanylidene-3,7-dihydropurin-2-one Chemical compound S=C1NC(=O)NC2=C1NC=N2 RJOXFJDOUQJOMQ-UHFFFAOYSA-N 0.000 description 1
- 206010000060 Abdominal distension Diseases 0.000 description 1
- 102100022900 Actin, cytoplasmic 1 Human genes 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108060003345 Adrenergic Receptor Proteins 0.000 description 1
- 102000017910 Adrenergic receptor Human genes 0.000 description 1
- 241000589158 Agrobacterium Species 0.000 description 1
- 108090000915 Aminopeptidases Proteins 0.000 description 1
- 102000004400 Aminopeptidases Human genes 0.000 description 1
- 206010002383 Angina Pectoris Diseases 0.000 description 1
- 206010002652 Anorgasmia Diseases 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 206010003439 Artificial menopause Diseases 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 241000351920 Aspergillus nidulans Species 0.000 description 1
- 240000006439 Aspergillus oryzae Species 0.000 description 1
- 235000002247 Aspergillus oryzae Nutrition 0.000 description 1
- 101100317631 Aspergillus tubingensis xynA gene Proteins 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 241000972773 Aulopiformes Species 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000304886 Bacilli Species 0.000 description 1
- 241000193744 Bacillus amyloliquefaciens Species 0.000 description 1
- 241001235572 Balantioides coli Species 0.000 description 1
- 241000486634 Bena Species 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 102000005702 Calcium-Activated Potassium Channels Human genes 0.000 description 1
- 108010045489 Calcium-Activated Potassium Channels Proteins 0.000 description 1
- 241000189662 Calla Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 102000005367 Carboxypeptidases Human genes 0.000 description 1
- 108010006303 Carboxypeptidases Proteins 0.000 description 1
- 241000701489 Cauliflower mosaic virus Species 0.000 description 1
- 241001660259 Cereus <cactus> Species 0.000 description 1
- 108091006146 Channels Proteins 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 108020004638 Circular DNA Proteins 0.000 description 1
- 108700010070 Codon Usage Proteins 0.000 description 1
- 241000186216 Corynebacterium Species 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 description 1
- 229920001651 Cyanoacrylate Polymers 0.000 description 1
- 102000004654 Cyclic GMP-Dependent Protein Kinases Human genes 0.000 description 1
- 108010003591 Cyclic GMP-Dependent Protein Kinases Proteins 0.000 description 1
- IVOMOUWHDPKRLL-KQYNXXCUSA-N Cyclic adenosine monophosphate Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-KQYNXXCUSA-N 0.000 description 1
- 102000005927 Cysteine Proteases Human genes 0.000 description 1
- 108010005843 Cysteine Proteases Proteins 0.000 description 1
- 108010080611 Cytosine Deaminase Proteins 0.000 description 1
- 102000000311 Cytosine Deaminase Human genes 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 206010011878 Deafness Diseases 0.000 description 1
- 208000019505 Deglutition disease Diseases 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 238000009007 Diagnostic Kit Methods 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 102000004860 Dipeptidases Human genes 0.000 description 1
- 108090001081 Dipeptidases Proteins 0.000 description 1
- 102000003779 Dipeptidyl-peptidases and tripeptidyl-peptidases Human genes 0.000 description 1
- 108090000194 Dipeptidyl-peptidases and tripeptidyl-peptidases Proteins 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 229940098778 Dopamine receptor agonist Drugs 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 102000051496 EC 3.4.15.- Human genes 0.000 description 1
- 108700035154 EC 3.4.15.- Proteins 0.000 description 1
- 102000057898 EC 3.4.19.- Human genes 0.000 description 1
- 108700033355 EC 3.4.19.- Proteins 0.000 description 1
- 101710121765 Endo-1,4-beta-xylanase Proteins 0.000 description 1
- 108010013369 Enteropeptidase Proteins 0.000 description 1
- 102100029727 Enteropeptidase Human genes 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241001452028 Escherichia coli DH1 Species 0.000 description 1
- 102000018389 Exopeptidases Human genes 0.000 description 1
- 108010091443 Exopeptidases Proteins 0.000 description 1
- 101710089384 Extracellular protease Proteins 0.000 description 1
- 108010074860 Factor Xa Proteins 0.000 description 1
- 208000005050 Familial Hypophosphatemic Rickets Diseases 0.000 description 1
- 208000007984 Female Infertility Diseases 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- 108700005088 Fungal Genes Proteins 0.000 description 1
- 101150094690 GAL1 gene Proteins 0.000 description 1
- 102100028501 Galanin peptides Human genes 0.000 description 1
- 102100039556 Galectin-4 Human genes 0.000 description 1
- 208000018522 Gastrointestinal disease Diseases 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 108700007698 Genetic Terminator Regions Proteins 0.000 description 1
- 208000034951 Genetic Translocation Diseases 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- 208000010412 Glaucoma Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 101150069554 HIS4 gene Proteins 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 102100021519 Hemoglobin subunit beta Human genes 0.000 description 1
- 108091005904 Hemoglobin subunit beta Proteins 0.000 description 1
- 208000009889 Herpes Simplex Diseases 0.000 description 1
- 101100121078 Homo sapiens GAL gene Proteins 0.000 description 1
- 101000608765 Homo sapiens Galectin-4 Proteins 0.000 description 1
- 101000971879 Homo sapiens Kell blood group glycoprotein Proteins 0.000 description 1
- 101001123834 Homo sapiens Neprilysin Proteins 0.000 description 1
- 101100321817 Human parvovirus B19 (strain HV) 7.5K gene Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 206010020571 Hyperaldosteronism Diseases 0.000 description 1
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 1
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 206010021928 Infertility female Diseases 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 102100021447 Kell blood group glycoprotein Human genes 0.000 description 1
- 241001138401 Kluyveromyces lactis Species 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 1
- 229930064664 L-arginine Natural products 0.000 description 1
- 235000014852 L-arginine Nutrition 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ZRJBHWIHUMBLCN-ZUZCIYMTSA-N LSM-5567 Chemical compound N1C(=O)C=CC2=C1C[C@H]1C(=CC)[C@]2(N)CC(C)=C1 ZRJBHWIHUMBLCN-ZUZCIYMTSA-N 0.000 description 1
- 108010059881 Lactase Proteins 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 208000007466 Male Infertility Diseases 0.000 description 1
- 108091022912 Mannose-6-Phosphate Isomerase Proteins 0.000 description 1
- 102000003843 Metalloendopeptidases Human genes 0.000 description 1
- 108090000131 Metalloendopeptidases Proteins 0.000 description 1
- 102000003792 Metallothionein Human genes 0.000 description 1
- 108090000157 Metallothionein Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- ZFMITUMMTDLWHR-UHFFFAOYSA-N Minoxidil Chemical compound NC1=[N+]([O-])C(N)=CC(N2CCCCC2)=N1 ZFMITUMMTDLWHR-UHFFFAOYSA-N 0.000 description 1
- 208000019022 Mood disease Diseases 0.000 description 1
- 208000008238 Muscle Spasticity Diseases 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 102400000064 Neuropeptide Y Human genes 0.000 description 1
- 108091092724 Noncoding DNA Proteins 0.000 description 1
- 238000000636 Northern blotting Methods 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 241000337007 Oceania Species 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 102100037214 Orotidine 5'-phosphate decarboxylase Human genes 0.000 description 1
- 108010055012 Orotidine-5'-phosphate decarboxylase Proteins 0.000 description 1
- 102100028045 P2Y purinoceptor 2 Human genes 0.000 description 1
- 101710096700 P2Y purinoceptor 2 Proteins 0.000 description 1
- 102100028070 P2Y purinoceptor 4 Human genes 0.000 description 1
- 108050009478 P2Y purinoceptor 4 Proteins 0.000 description 1
- 238000010222 PCR analysis Methods 0.000 description 1
- 238000002944 PCR assay Methods 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000031481 Pathologic Constriction Diseases 0.000 description 1
- 208000029082 Pelvic Inflammatory Disease Diseases 0.000 description 1
- 206010034310 Penile pain Diseases 0.000 description 1
- 108010068563 PepT tripeptidase Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- LTQCLFMNABRKSH-UHFFFAOYSA-N Phleomycin Natural products N=1C(C=2SC=C(N=2)C(N)=O)CSC=1CCNC(=O)C(C(O)C)NC(=O)C(C)C(O)C(C)NC(=O)C(C(OC1C(C(O)C(O)C(CO)O1)OC1C(C(OC(N)=O)C(O)C(CO)O1)O)C=1NC=NC=1)NC(=O)C1=NC(C(CC(N)=O)NCC(N)C(N)=O)=NC(N)=C1C LTQCLFMNABRKSH-UHFFFAOYSA-N 0.000 description 1
- 108010035235 Phleomycins Proteins 0.000 description 1
- 102100040402 Phlorizin hydrolase Human genes 0.000 description 1
- 229940099471 Phosphodiesterase inhibitor Drugs 0.000 description 1
- 102100035362 Phosphomannomutase 2 Human genes 0.000 description 1
- 102000012288 Phosphopyruvate Hydratase Human genes 0.000 description 1
- 108010022181 Phosphopyruvate Hydratase Proteins 0.000 description 1
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 241000235648 Pichia Species 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 108010039918 Polylysine Chemical group 0.000 description 1
- 208000005107 Premature Birth Diseases 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 108020004518 RNA Probes Proteins 0.000 description 1
- 239000003391 RNA probe Substances 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 108700005075 Regulator Genes Proteins 0.000 description 1
- 206010038997 Retroviral infections Diseases 0.000 description 1
- 102100040756 Rhodopsin Human genes 0.000 description 1
- 108090000820 Rhodopsin Proteins 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 108010039491 Ricin Proteins 0.000 description 1
- 101150014136 SUC2 gene Proteins 0.000 description 1
- 241000235347 Schizosaccharomyces pombe Species 0.000 description 1
- 108010022999 Serine Proteases Proteins 0.000 description 1
- 102000012479 Serine Proteases Human genes 0.000 description 1
- 208000029901 Sexual arousal disease Diseases 0.000 description 1
- 241000256248 Spodoptera Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 241000701093 Suid alphaherpesvirus 1 Species 0.000 description 1
- 108700026226 TATA Box Proteins 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical group OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 1
- 108700009124 Transcription Initiation Site Proteins 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- 241000223259 Trichoderma Species 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- IVOMOUWHDPKRLL-UHFFFAOYSA-N UNPD107823 Natural products O1C2COP(O)(=O)OC2C(O)C1N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- SECKRCOLJRRGGV-UHFFFAOYSA-N Vardenafil Chemical compound CCCC1=NC(C)=C(C(N=2)=O)N1NC=2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(CC)CC1 SECKRCOLJRRGGV-UHFFFAOYSA-N 0.000 description 1
- 102000012088 Vasoactive Intestinal Peptide Receptors Human genes 0.000 description 1
- 108010075974 Vasoactive Intestinal Peptide Receptors Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 208000031878 X-linked hypophosphatemia Diseases 0.000 description 1
- 208000035724 X-linked hypophosphatemic rickets Diseases 0.000 description 1
- BLGXFZZNTVWLAY-CCZXDCJGSA-N Yohimbine Natural products C1=CC=C2C(CCN3C[C@@H]4CC[C@@H](O)[C@H]([C@H]4C[C@H]33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-CCZXDCJGSA-N 0.000 description 1
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 1
- 101710185494 Zinc finger protein Proteins 0.000 description 1
- 102100023597 Zinc finger protein 816 Human genes 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 230000009102 absorption Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 238000000862 absorption spectrum Methods 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 210000004100 adrenal gland Anatomy 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 230000003281 allosteric effect Effects 0.000 description 1
- 229940125516 allosteric modulator Drugs 0.000 description 1
- 108020004102 alpha-1 Adrenergic Receptor Proteins 0.000 description 1
- 108020004101 alpha-2 Adrenergic Receptor Proteins 0.000 description 1
- 102000015007 alpha-adrenergic receptor activity proteins Human genes 0.000 description 1
- 108040006816 alpha-adrenergic receptor activity proteins Proteins 0.000 description 1
- 102000015009 alpha1-adrenergic receptor activity proteins Human genes 0.000 description 1
- 102000015006 alpha2-adrenergic receptor activity proteins Human genes 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 238000003277 amino acid sequence analysis Methods 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229940126574 aminoglycoside antibiotic Drugs 0.000 description 1
- 239000002647 aminoglycoside antibiotic agent Substances 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 229940125715 antihistaminic agent Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 239000002220 antihypertensive agent Substances 0.000 description 1
- 229940030600 antihypertensive agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 239000003420 antiserotonin agent Substances 0.000 description 1
- CXWQXGNFZLHLHQ-DPFCLETOSA-N apomorphine hydrochloride Chemical compound [H+].[H+].O.[Cl-].[Cl-].C([C@H]1N(C)CC2)C3=CC=C(O)C(O)=C3C3=C1C2=CC=C3.C([C@H]1N(C)CC2)C3=CC=C(O)C(O)=C3C3=C1C2=CC=C3 CXWQXGNFZLHLHQ-DPFCLETOSA-N 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000009697 arginine Nutrition 0.000 description 1
- 210000004507 artificial chromosome Anatomy 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 230000003190 augmentative effect Effects 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 238000000376 autoradiography Methods 0.000 description 1
- 229950000586 aviptadil Drugs 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000003542 behavioural effect Effects 0.000 description 1
- RIOXQFHNBCKOKP-UHFFFAOYSA-N benomyl Chemical compound C1=CC=C2N(C(=O)NCCCC)C(NC(=O)OC)=NC2=C1 RIOXQFHNBCKOKP-UHFFFAOYSA-N 0.000 description 1
- MITFXPHMIHQXPI-UHFFFAOYSA-N benzoxaprofen Natural products N=1C2=CC(C(C(O)=O)C)=CC=C2OC=1C1=CC=C(Cl)C=C1 MITFXPHMIHQXPI-UHFFFAOYSA-N 0.000 description 1
- YBHILYKTIRIUTE-UHFFFAOYSA-N berberine Chemical compound C1=C2CC[N+]3=CC4=C(OC)C(OC)=CC=C4C=C3C2=CC2=C1OCO2 YBHILYKTIRIUTE-UHFFFAOYSA-N 0.000 description 1
- 229940093265 berberine Drugs 0.000 description 1
- QISXPYZVZJBNDM-UHFFFAOYSA-N berberine Natural products COc1ccc2C=C3N(Cc2c1OC)C=Cc4cc5OCOc5cc34 QISXPYZVZJBNDM-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- BLGXFZZNTVWLAY-UHFFFAOYSA-N beta-Yohimbin Natural products C1=CC=C2C(CCN3CC4CCC(O)C(C4CC33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229910002056 binary alloy Inorganic materials 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 210000002459 blastocyst Anatomy 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- SNPPWIUOZRMYNY-UHFFFAOYSA-N bupropion Chemical compound CC(C)(C)NC(C)C(=O)C1=CC=CC(Cl)=C1 SNPPWIUOZRMYNY-UHFFFAOYSA-N 0.000 description 1
- QWCRAEMEVRGPNT-UHFFFAOYSA-N buspirone Chemical compound C1C(=O)N(CCCCN2CCN(CC2)C=2N=CC=CN=2)C(=O)CC21CCCC2 QWCRAEMEVRGPNT-UHFFFAOYSA-N 0.000 description 1
- 229960002495 buspirone Drugs 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 230000003222 cGMP degradation Effects 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 210000004413 cardiac myocyte Anatomy 0.000 description 1
- 230000007211 cardiovascular event Effects 0.000 description 1
- 210000000748 cardiovascular system Anatomy 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 229940062399 cenestin Drugs 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 210000001612 chondrocyte Anatomy 0.000 description 1
- 229940117229 cialis Drugs 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 238000011424 computer programming method Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 108091036078 conserved sequence Proteins 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 238000009223 counseling Methods 0.000 description 1
- 235000019788 craving Nutrition 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 229940095074 cyclic amp Drugs 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 238000004163 cytometry Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- FMGSKLZLMKYGDP-USOAJAOKSA-N dehydroepiandrosterone Chemical compound C1[C@@H](O)CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC=C21 FMGSKLZLMKYGDP-USOAJAOKSA-N 0.000 description 1
- 239000003405 delayed action preparation Substances 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 239000007933 dermal patch Substances 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- 230000010339 dilation Effects 0.000 description 1
- PCHPORCSPXIHLZ-UHFFFAOYSA-N diphenhydramine hydrochloride Chemical compound [Cl-].C=1C=CC=CC=1C(OCC[NH+](C)C)C1=CC=CC=C1 PCHPORCSPXIHLZ-UHFFFAOYSA-N 0.000 description 1
- XPPKVPWEQAFLFU-UHFFFAOYSA-J diphosphate(4-) Chemical compound [O-]P([O-])(=O)OP([O-])([O-])=O XPPKVPWEQAFLFU-UHFFFAOYSA-J 0.000 description 1
- 235000011180 diphosphates Nutrition 0.000 description 1
- 238000011978 dissolution method Methods 0.000 description 1
- 239000002934 diuretic Substances 0.000 description 1
- 229940030606 diuretics Drugs 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 238000007878 drug screening assay Methods 0.000 description 1
- 210000003981 ectoderm Anatomy 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 210000001671 embryonic stem cell Anatomy 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- JJJFUHOGVZWXNQ-UHFFFAOYSA-N enbucrilate Chemical compound CCCCOC(=O)C(=C)C#N JJJFUHOGVZWXNQ-UHFFFAOYSA-N 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 210000003890 endocrine cell Anatomy 0.000 description 1
- 230000007368 endocrine function Effects 0.000 description 1
- 210000001900 endoderm Anatomy 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 230000009088 enzymatic function Effects 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 230000009986 erectile function Effects 0.000 description 1
- 230000000925 erythroid effect Effects 0.000 description 1
- 210000003013 erythroid precursor cell Anatomy 0.000 description 1
- 229940064258 estrace Drugs 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- JKKFKPJIXZFSSB-CBZIJGRNSA-N estrone 3-sulfate Chemical compound OS(=O)(=O)OC1=CC=C2[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1 JKKFKPJIXZFSSB-CBZIJGRNSA-N 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 210000002907 exocrine cell Anatomy 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- XRECTZIEBJDKEO-UHFFFAOYSA-N flucytosine Chemical compound NC1=NC(=O)NC=C1F XRECTZIEBJDKEO-UHFFFAOYSA-N 0.000 description 1
- 229960004413 flucytosine Drugs 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000001917 fluorescence detection Methods 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 231100000221 frame shift mutation induction Toxicity 0.000 description 1
- 230000037433 frameshift Effects 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- IRSCQMHQWWYFCW-UHFFFAOYSA-N ganciclovir Chemical compound O=C1NC(N)=NC2=C1N=CN2COC(CO)CO IRSCQMHQWWYFCW-UHFFFAOYSA-N 0.000 description 1
- 229960002963 ganciclovir Drugs 0.000 description 1
- 230000027119 gastric acid secretion Effects 0.000 description 1
- 238000012817 gel-diffusion technique Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 229960002518 gentamicin Drugs 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 235000004554 glutamine Nutrition 0.000 description 1
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 1
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000005090 green fluorescent protein Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 229940029575 guanosine Drugs 0.000 description 1
- 230000000004 hemodynamic effect Effects 0.000 description 1
- 230000002949 hemolytic effect Effects 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- 230000000544 hyperemic effect Effects 0.000 description 1
- 230000014726 immortalization of host cell Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000000951 immunodiffusion Effects 0.000 description 1
- 238000000760 immunoelectrophoresis Methods 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000003017 in situ immunoassay Methods 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 208000000509 infertility Diseases 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 231100000535 infertility Toxicity 0.000 description 1
- 208000021267 infertility disease Diseases 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 208000002551 irritable bowel syndrome Diseases 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 1
- 229940116108 lactase Drugs 0.000 description 1
- 230000006651 lactation Effects 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- GXESHMAMLJKROZ-IAPPQJPRSA-N lasofoxifene Chemical compound C1([C@@H]2[C@@H](C3=CC=C(C=C3CC2)O)C=2C=CC(OCCN3CCCC3)=CC=2)=CC=CC=C1 GXESHMAMLJKROZ-IAPPQJPRSA-N 0.000 description 1
- 229960002367 lasofoxifene Drugs 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 231100000225 lethality Toxicity 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 230000001050 lubricating effect Effects 0.000 description 1
- 230000002934 lysing effect Effects 0.000 description 1
- 239000006249 magnetic particle Substances 0.000 description 1
- 239000002583 male contraceptive agent Substances 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 229960002140 medetomidine Drugs 0.000 description 1
- 229960004616 medroxyprogesterone Drugs 0.000 description 1
- 210000003593 megakaryocyte Anatomy 0.000 description 1
- 239000000336 melanocortin receptor agonist Substances 0.000 description 1
- 230000009245 menopause Effects 0.000 description 1
- 210000003716 mesoderm Anatomy 0.000 description 1
- 210000005033 mesothelial cell Anatomy 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- OJLOPKGSLYJEMD-URPKTTJQSA-N methyl 7-[(1r,2r,3r)-3-hydroxy-2-[(1e)-4-hydroxy-4-methyloct-1-en-1-yl]-5-oxocyclopentyl]heptanoate Chemical compound CCCCC(C)(O)C\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1CCCCCCC(=O)OC OJLOPKGSLYJEMD-URPKTTJQSA-N 0.000 description 1
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical compound CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 1
- 229960001566 methyltestosterone Drugs 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 229960003632 minoxidil Drugs 0.000 description 1
- 229960005249 misoprostol Drugs 0.000 description 1
- ZAHQPTJLOCWVPG-UHFFFAOYSA-N mitoxantrone dihydrochloride Chemical compound Cl.Cl.O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO ZAHQPTJLOCWVPG-UHFFFAOYSA-N 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 230000036651 mood Effects 0.000 description 1
- 210000000663 muscle cell Anatomy 0.000 description 1
- 229940028444 muse Drugs 0.000 description 1
- 230000000869 mutational effect Effects 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- 230000007498 myristoylation Effects 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 229960001800 nefazodone Drugs 0.000 description 1
- VRBKIVRKKCLPHA-UHFFFAOYSA-N nefazodone Chemical compound O=C1N(CCOC=2C=CC=CC=2)C(CC)=NN1CCCN(CC1)CCN1C1=CC=CC(Cl)=C1 VRBKIVRKKCLPHA-UHFFFAOYSA-N 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 230000004007 neuromodulation Effects 0.000 description 1
- 230000009223 neuronal apoptosis Effects 0.000 description 1
- LBHIOVVIQHSOQN-UHFFFAOYSA-N nicorandil Chemical compound [O-][N+](=O)OCCNC(=O)C1=CC=CN=C1 LBHIOVVIQHSOQN-UHFFFAOYSA-N 0.000 description 1
- 229960002497 nicorandil Drugs 0.000 description 1
- 230000001883 nitrergic effect Effects 0.000 description 1
- 239000002840 nitric oxide donor Substances 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 230000001129 nonadrenergic effect Effects 0.000 description 1
- 230000002536 noncholinergic effect Effects 0.000 description 1
- 230000002474 noradrenergic effect Effects 0.000 description 1
- 230000001473 noxious effect Effects 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 229940126701 oral medication Drugs 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 210000004409 osteocyte Anatomy 0.000 description 1
- 210000003101 oviduct Anatomy 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 210000001696 pelvic girdle Anatomy 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 238000001050 pharmacotherapy Methods 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 235000008729 phenylalanine Nutrition 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000002571 phosphodiesterase inhibitor Substances 0.000 description 1
- 150000008300 phosphoramidites Chemical class 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 238000000554 physical therapy Methods 0.000 description 1
- 230000006461 physiological response Effects 0.000 description 1
- 229940085127 phytase Drugs 0.000 description 1
- 230000001817 pituitary effect Effects 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920000447 polyanionic polymer Polymers 0.000 description 1
- 201000010065 polycystic ovary syndrome Diseases 0.000 description 1
- 229920000656 polylysine Chemical group 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 238000011176 pooling Methods 0.000 description 1
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 1
- 230000001242 postsynaptic effect Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 201000011461 pre-eclampsia Diseases 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 229940063238 premarin Drugs 0.000 description 1
- 206010036596 premature ejaculation Diseases 0.000 description 1
- 239000000955 prescription drug Substances 0.000 description 1
- 201000011264 priapism Diseases 0.000 description 1
- 201000009395 primary hyperaldosteronism Diseases 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 102000017953 prostanoid receptors Human genes 0.000 description 1
- 108050007059 prostanoid receptors Proteins 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 238000013197 protein A assay Methods 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 239000003227 purinergic agonist Substances 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 238000000163 radioactive labelling Methods 0.000 description 1
- 230000009103 reabsorption Effects 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000002040 relaxant effect Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000008085 renal dysfunction Effects 0.000 description 1
- 210000005084 renal tissue Anatomy 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 210000003705 ribosome Anatomy 0.000 description 1
- 235000019515 salmon Nutrition 0.000 description 1
- 210000004706 scrotum Anatomy 0.000 description 1
- 230000001235 sensitizing effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000036303 septic shock Effects 0.000 description 1
- 230000000405 serological effect Effects 0.000 description 1
- 239000000952 serotonin receptor agonist Substances 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000035946 sexual desire Effects 0.000 description 1
- DEIYFTQMQPDXOT-UHFFFAOYSA-N sildenafil citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.CCCC1=NN(C)C(C(N2)=O)=C1N=C2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(C)CC1 DEIYFTQMQPDXOT-UHFFFAOYSA-N 0.000 description 1
- 229960002639 sildenafil citrate Drugs 0.000 description 1
- 238000011125 single therapy Methods 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 210000002363 skeletal muscle cell Anatomy 0.000 description 1
- 230000016160 smooth muscle contraction Effects 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 208000018198 spasticity Diseases 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000036262 stenosis Effects 0.000 description 1
- 208000037804 stenosis Diseases 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 101150038671 strat gene Proteins 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 230000002889 sympathetic effect Effects 0.000 description 1
- 230000005062 synaptic transmission Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 210000001179 synovial fluid Anatomy 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 108700022380 synthetic erythropoiesis Proteins 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 239000000057 synthetic resin Substances 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 208000001608 teratocarcinoma Diseases 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- WZDGZWOAQTVYBX-XOINTXKNSA-N tibolone Chemical compound C([C@@H]12)C[C@]3(C)[C@@](C#C)(O)CC[C@H]3[C@@H]1[C@H](C)CC1=C2CCC(=O)C1 WZDGZWOAQTVYBX-XOINTXKNSA-N 0.000 description 1
- 229960001023 tibolone Drugs 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 239000003106 tissue adhesive Substances 0.000 description 1
- 230000017423 tissue regeneration Effects 0.000 description 1
- 210000003014 totipotent stem cell Anatomy 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 239000012581 transferrin Substances 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 229960003991 trazodone Drugs 0.000 description 1
- PHLBKPHSAVXXEF-UHFFFAOYSA-N trazodone Chemical compound ClC1=CC=CC(N2CCN(CCCN3C(N4C=CC=CC4=N3)=O)CC2)=C1 PHLBKPHSAVXXEF-UHFFFAOYSA-N 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 210000005239 tubule Anatomy 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- 101150101900 uidA gene Proteins 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 210000003708 urethra Anatomy 0.000 description 1
- 210000001635 urinary tract Anatomy 0.000 description 1
- 210000002229 urogenital system Anatomy 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 229960002381 vardenafil Drugs 0.000 description 1
- 230000009723 vascular congestion Effects 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 230000004865 vascular response Effects 0.000 description 1
- 230000006442 vascular tone Effects 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 239000002550 vasoactive agent Substances 0.000 description 1
- 239000005526 vasoconstrictor agent Substances 0.000 description 1
- 230000002883 vasorelaxation effect Effects 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 238000010451 viral insertion Methods 0.000 description 1
- 210000001835 viscera Anatomy 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 229940009065 wellbutrin Drugs 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 238000002424 x-ray crystallography Methods 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
- 101150077833 xlnA gene Proteins 0.000 description 1
- 229960000317 yohimbine Drugs 0.000 description 1
- GQDDNDAYOVNZPG-SCYLSFHTSA-N yohimbine Chemical compound C1=CC=C[C]2C(CCN3C[C@@H]4CC[C@H](O)[C@@H]([C@H]4C[C@H]33)C(=O)OC)=C3N=C21 GQDDNDAYOVNZPG-SCYLSFHTSA-N 0.000 description 1
- AADVZSXPNRLYLV-UHFFFAOYSA-N yohimbine carboxylic acid Natural products C1=CC=C2C(CCN3CC4CCC(C(C4CC33)C(O)=O)O)=C3NC2=C1 AADVZSXPNRLYLV-UHFFFAOYSA-N 0.000 description 1
- AFVLVVWMAFSXCK-UHFFFAOYSA-N α-cyano-4-hydroxycinnamic acid Chemical compound OC(=O)C(C#N)=CC1=CC=C(O)C=C1 AFVLVVWMAFSXCK-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/17—Amides, e.g. hydroxamic acids having the group >N—C(O)—N< or >N—C(S)—N<, e.g. urea, thiourea, carmustine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/18—Sulfonamides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/196—Carboxylic acids, e.g. valproic acid having an amino group the amino group being directly attached to a ring, e.g. anthranilic acid, mefenamic acid, diclofenac, chlorambucil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4015—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil having oxo groups directly attached to the heterocyclic ring, e.g. piracetam, ethosuximide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/433—Thidiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4412—Non condensed pyridines; Hydrogenated derivatives thereof having oxo groups directly attached to the heterocyclic ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
- A61P5/40—Mineralocorticosteroids, e.g. aldosterone; Drugs increasing or potentiating the activity of mineralocorticosteroids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6489—Metalloendopeptidases (3.4.24)
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/05—Animals comprising random inserted nucleic acids (transgenic)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/34—Genitourinary disorders
- G01N2800/344—Disorders of the penis and the scrotum and erectile dysfuncrion
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Neurology (AREA)
- Molecular Biology (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Neurosurgery (AREA)
- Biotechnology (AREA)
- Endocrinology (AREA)
- Reproductive Health (AREA)
- Diabetes (AREA)
- Ophthalmology & Optometry (AREA)
- Pulmonology (AREA)
- Hematology (AREA)
- Pain & Pain Management (AREA)
- Cardiology (AREA)
- Gynecology & Obstetrics (AREA)
- Oncology (AREA)
- Obesity (AREA)
- Urology & Nephrology (AREA)
- Hospice & Palliative Care (AREA)
Abstract
配列番号:2の新規なヒト可溶性分泌エンドペプチダーゼ(SEP)をエンコードしているポリヌクレオチド配列を記載し、およびポリペプチド配列を記載する。該ポリペプチド配列は、(a)配列番号:1または配列番号:5のポリヌクレオチド配列から翻訳される推定のアミノ酸配列を有するポリペプチドおよびその変異体、フラグメント、ホモログ、類似体および誘導体;(b)配列番号:2のポリペプチドおよびその変異体、フラグメント、ホモログ、類似体および誘導体;(c)NCIMB41110のcDNAによってエンコードされたポリペプチドおよびその変異体、フラグメント、ホモログ、類似体および誘導体;または(d)ポリペプチドであって、(i)配列番号:1または配列番号:5のポリヌクレオチドによってエンコードされたポリペプチド、(ii)配列番号:2のポリペプチド、または(iii)NCIMB41110のcDNAによってエンコードされたポリペプチドに少なくとも78%の同一性を有するポリペプチドの内の一つまたはそれを越えるものを含む。このようなポリペプチド配列は、特に、性的機能不全、具体的には、男性勃起機能不全(MED)または女性性的機能不全(FSD)、好ましくは、女性性的興奮障害(FAD)の予防および/または処置において有用である。
Description
【0001】
技術分野
本発明は、酵素に関する。本発明は、更に、その酵素をエンコードしているヌクレオチド配列に関する。
【0002】
詳しくは、本発明は、新規なヒト可溶性分泌エンドペプチダーゼ(SEP)をエンコードしている新規な核酸配列に関する。
本発明は、更に、疾患の診断および予防および/または処置における新規な核酸配列およびアミノ酸配列の使用に関する。
【0003】
本発明は、更に、特に、エンドペプチダーゼ活性をモジュレートしうる、好ましくは、阻害しうる、より好ましくは、選択的に阻害しうる試剤を評価するおよび/またはスクリーニングするための新規な核酸配列およびアミノ酸配列の使用に関する。
【0004】
本発明は、更に、性的機能不全、例えば、女性性的機能不全(FSD)、特に、女性性的興奮障害(FSAD)の予防および/または処置において有用な化合物および医薬組成物に関する。
【0005】
本発明は、また更に、FSD、特に、FSADの予防および/または処置の方法に関する。
本発明は、更に、FSD、特に、FSADの予防および/または処置において有用な化合物をスクリーニングする検定に関する。
【0006】
本発明は、男性性的機能不全、特に、男性勃起機能不全(MED)の予防および/または処置において用いるための化合物および医薬組成物に関する。本明細書中で論及される男性性的機能不全とは、早発射精などの射精障害、無オルガスム症(オルガスムに達し得ない)、または活動低下状態の性的欲求障害(性行為への関心欠如)などの欲求障害、を含む意味である。
【0007】
本発明は、更に、MEDの予防および/または処置の方法に関する。
本発明は、更に、男性性的機能不全、特に、MEDの予防および/または処置において有用な化合物をスクリーニングする検定に関する。
【0008】
発明の背景
ヒト可溶性分泌エンドペプチダーゼ(ヒトSEP)
プロテアーゼは、タンパク質およびペプチドを、そのペプチドまたはタンパク質鎖の主鎖を形成するペプチド結合において切断する酵素のラージファミリーを形成している。プロテアーゼは、細菌からヒトまでの全ての生物において見出されている。ヒトの場合、全遺伝子の約1%(400〜1000)が、プロテアーゼ酵素をエンコードしていると考えらている。それらは、発生期ポリペプチドの活性化および成熟、誤って折りたたまれた且つ損傷したタンパク質の分解、および細胞の内部および外部両方のペプチドおよびタンパク質の制御された代謝回転に関与している。それらの活性は、消化、正常な成長、内分泌機能、創傷治癒、炎症、血管新生、胚発生期の組織再造形、腫瘍転移、心臓血管疾患、神経学的疾患、および細菌、寄生生物およびウイルスの感染を含めた多数の過程に重要である。
【0009】
プロテアーゼは、それらの基質を切断する場所に基づいて広く分類することができる。エキソペプチダーゼには、アミノペプチダーゼ、ジペプチジルペプチダーゼ、トリペプチダーゼ、カルボキシペプチダーゼ、ペプチジルジペプチダーゼ、ジペプチダーゼおよびωペプチダーゼが含まれ、これらは、その基質の末端の残基を切断する。セリンプロテアーゼ、システインプロテアーゼおよびメタロエンドペプチダーゼが含まれるエンドペプチダーゼは、そのペプチド内の配列において切断する。
【0010】
亜鉛メタロプロテアーゼとして知られる重要なエンドペプチダーゼ群は、それらの触媒部位に亜鉛イオンを結合する必要条件を有することによって特徴付けられる。亜鉛メタロプロテアーゼは、クラスに細分することができ(概説については、FEBS Letters 354 (1994) pp.1−6 を参照されたい)、一つのこのようなクラスは、ネプリリシン(neprilysin)(NEP)様亜鉛メタロプロテアーゼである(FASEB Journal, Vol 11,1997 pp.355−384)。このNEPクラスには、構造的に互いに関連している少なくとも7種類の酵素が含まれる(後を参照されたい)。それらは、典型的には、大きいカルボキシ末端細胞外ドメイン、短い膜に広がる領域、およびアミノ末端の短い細胞内ドメインと共になって、膜結合性である。このファミリーの既知のメンバーは、ネプリリシン(NEP、CD10、CALLA、エンケファリナーゼまたはEC3.4.24.11とも称される)、エンドセリン変換酵素(ECE−1およびECE−2)、PEX、KELL、X変換酵素/損傷誘発神経エンドペプチダーゼ(XCE/DINE)、および齧歯類で同定された可溶性分泌エンドペプチダーゼ/ネプリリシンIIと称される酵素(SEP/NEPII;Ghaddar,G et al, Biochem Journal, Vol 347,2000,pp.419−429; Ikeda,K et al, Journal Biological Chemistry, Vol 274,1999,pp.32469−32477; Tanja,O et al, Biochem Biophys Research Communication, Vol 271,2000,pp.565−570; 国際特許出願WO99/53077号)である。このクラスのメンバーの機能は、ペプチド作用性シグナリングに関連していると考えられる。これは、ヒトを含めた大部分の生物で見出される過程であり、ここにおいて、ペプチド分子は、生理学的応答を引き出す“メッセンジャー”として用いられる。典型的には、これは、時々、プロテアーゼによって切断されて活性になる不活性前駆体として、特定の細胞によるペプチドメッセンジャーの生産および放出を伴う。次に、このペプチドの活性型は、それが応答を引き出す別の細胞の表面上の特異的レセプターを結合する。次に、このペプチドは、別のプロテアーゼによる分解によって失活する。
【0011】
NEPは、このクラスの発見される最初のメンバーであった。NEPは、多数の生物ペプチド、例えば、エンケファリン、ブラジキニンおよびサブスタンスP、をタンパク質分解し且つ失活させることができるという点で無差別なプロテアーゼである。それは、通常、疎水性残基のアミノ末端側のペプチドを切断する。NEPは、多数の体組織中で見出されうるが、腎臓において最も量が多い。その生理学的機能は、充分に理解されていないが、NEP“ノックアウト”マウスの表現型からの一つの指標は、それが内毒素ショックの防止に関与しているということである。
【0012】
ECE−1は、NEPに37%一致するタンパク質である。ECE−1は、身体中に広く分布し、不活性な前駆体ペプチドであるビッグエンドセリンをエンドセリンに変換するが、これは、血管緊張を維持するのに重要な強力な血管収縮薬である。ECE−2酵素は、ECE−1とは別個の遺伝子に由来するが、そのアミノ酸配列は、59%の全体相同性で類似している。エンドセリン生産へのECE−2の生理学的重要性は不明である。ECE−2mRNAは、ECE−1mRNAよりはるかに低レベルで存在するが、ECE−1とは異なったpH最適条件を有し、中性pHで不活性であり、pH5.5で最も活性である。
【0013】
KELL酵素は、赤芽球組織で見出されるNEPクラスの臨床的に重要なメンバーである。KELL血液型系の抗原は、輸血への溶血反応を引き起こすことがありうるこのタンパク質に存在する。
【0014】
PEX遺伝子は、低下した腎尿細管リン酸塩再吸収を典型とする優勢な障害である、X連鎖低リン酸血症性くる病と称される障害に遺伝的に連鎖していると同定された。NEPファミリーの他のメンバーとのその近い相同性(49〜60%)に基づき、それは、膜結合性メタロプロテアーゼであるとも予測されるが、基質はまだ発見されていない。
【0015】
XCE(Valdenaire,O et al, Molecular Brain Research, Vol 64,1999,pp.211−221)およびそのラット均等物DINE(Kiryu−Seo,S et al, Proceedings of the National Academy of Science USA, 2000,pp.4345−4350)は、中枢神経系において主に発現される。DINE発現は、ニューロン損傷後にアップレギュレーションされるが、これは、おそらくは、抗酸化酵素のDINEに媒介されるタンパク質分解活性化の結果として、ニューロンアポトーシスを妨げるのを助けると考えられる。XCE/DINEの生理学的基質もまだ同定されていないが、それらの配列から、明らかに、それらはプロテアーゼであると考えられ、そしてDINEについては、合成ペプチド基質を用いてこれが証明されている。
【0016】
齧歯類SEPおよびNEPIIは、ごく最近発見された。それらは91%のアミノ酸同一性を有するので、NEPIIは、マウス酵素であるSEPのラット均等物であると考えられる。それらは、アミノ酸配列がNEPに最も近いこのクラスのメンバーであり、両方とも、ヒトNEPに54%一致する。両者のmRNAは、精巣において極めて量が多く、広範囲の他の組織においても低レベルで検出されることがありうる。ラットNEPIIの場合、そのmRNAは、脳および下垂体においても比較的高レベルで見出されている。哺乳動物細胞中で組換えによって生じる場合、マウスSEPおよびラットNEPIIは両方とも、増殖培地中で見出されうる。これは、それらが、循環することができ、したがって身体中の他の部位でペプチドを切断することができる分泌プロテアーゼでありうるということを示唆している。マウスSEPおよびラットNEPIIは、ECE−1のようなこのクラスのいくつかの他のメンバーと同様、スプライス変異を示す。マウスSEPおよびラットNEPIIの場合、このスプライス変異は、膜の局在化および分泌に関与する配列の変化を含むイソ型を生じる。これの生理学的有意性は不明であるが、これら酵素の膜結合型、循環型、および細胞内在型が存在しうると考えられる。マウスSEPは、エンケファリン、エンドセリン、ビッグエンドセリン、ブラジキニンおよびサブスタンスPを含めた一定範囲の重要な生物ペプチドを切断しうることが分かった。したがって、NEPと同様、それは、かなり広い基質特異性を有するので、別々の組織においていくつかの生理学的機能を有することがありうる。
【0017】
このNEPクラスの酵素は、他のメタロプロテアーゼ酵素と同様、薬物様低分子(例えば、チオルファン(thiorphan)およびホスホラミドン)による阻害に影響を受けやすいことが示されている。これは、ペプチド作用性シグナリングをモジュレートする場合のNEP様酵素のいくつかのメンバーの生理学的機能の現れている性状と一緒に、それらを薬学的介入のための魅力のある標的にする。NEP阻害剤は、心臓血管疾患を含めた適応症のために開発されているが、それらの機能の情報が更に増加するにつれ、NEP様酵素の特異的阻害剤は、性的機能不全(特に、男性性的機能不全、例えば、男性勃起機能不全(MED)、および女性性的機能不全(FSD)、例えば、女性性的興奮障害(FSAD))、早産、子癇前症、子宮内膜症、生殖障害(特に、男性および女性の不妊症、多嚢胞性卵巣症候群、着床不全)、高血圧症、心不全、アンギナ、腎機能不全、周期性水腫、高アルドステロン症、緑内障、喘息、炎症、白血病、痛み、てんかん、情動障害、痴呆および老年性錯乱、肥満症および胃腸障害(特に、下痢および過敏性腸症候群)、敗血症性ショック、胃酸分泌のモジュレーション、および高レニン血症の処置などの多数の他の適応症の予防および/または処置にある役割を有することがありうると考えられる。
【0018】
性的機能不全
性的機能不全(SD)は、男性および女性双方に影響しうる重要な臨床的問題である。SDの原因は、器質的でありうるし、心理学的でもありうる。SDの器質的側面は、典型的には、高血圧症または真性糖尿病に関連した疾患のような潜在する血管疾患によって、処方薬によっておよび/またはうつ病のような精神医学的疾患によって引き起こされる。生理学的因子には、恐怖、行為不安および対人間葛藤が含まれる。SDは、性的行為を損ない、自尊心を傷つけ、そして人間関係を破壊することによって、人格窮迫を引き起こす。臨床において、SD障害は、女性性的機能不全(FSD)障害および男性性的機能不全(MSD)障害に分けられている(Melman et al 1999)。FSDは、女性が性的表現に満足を見出すことが難しいことまたはできないこととして最もよく定義される。男性性的機能不全(MSD)は、概して、男性勃起機能不全(MED)としても知られる勃起機能不全に関連している(Benet et al 1994)。
【0019】
本発明の化合物は、男性の場合の性的機能不全(例えば、男性勃起機能不全−MED)および女性の場合の女性性的機能不全(FSD)、例えば、女性性的興奮障害(FSAD)の予防および/または処置に特に有益である。
【0020】
女性性的機能不全(FSD)
本発明において、FSDは、女性が性的表現に満足を見出すのが難しいことまたはできないこととして定義することができる。FSDは、いくつかの異なった女性性的障害についての集合名である(Leiblum, S. R. (1998). Definition and classification of female sexual disorders. Int. J. Impotence Res., 10,S104−S106; Berman, J. R., Berman, L. & Goldstein, I. (1999). Female sexual dysfunction: Incidence, pathophysiology, evaluations and treatment options. Urology, 54,385−391.)。それら女性は、欲求の欠如、性的興奮またはオルガスムの困難、性交痛、またはこれら問題の組合せを有することがありうる。疾患のいくつかのタイプ、投薬、傷害または心理学的問題は、FSDを引き起こすことがありうる。開発中の処置は、FSDの特定のサブタイプ、優先的には、欲求および性的興奮の障害を処置することを的にしている。
【0021】
FSDのカテゴリーは、正常な女性性的応答の様相、すなわち、欲求、性的興奮およびオルガスムにそれらを対比することによって最もよく定義される(Leiblum, S. R. (1998). Definition and classification of female sexual disorders., Int. J. Impotence Res., 10, S104−S106)。欲求または性欲は、性的表現の動因である。その徴候には、しばしば、関心のある相手と一緒の場合かまたは他の性的刺激にさらされた場合の性的思考が含まれる。性的興奮は、性的刺激への血管応答であり、その重要な成分は、性器充血であり、そしてそれには、増加した膣潤滑、膣の伸長および増加した性器感覚/感受性が含まれる。オルガスムは、性的興奮中に絶頂に達した性的緊張の解放である。
【0022】
したがって、FSDは、女性がこれら様相のいずれか、通常は、欲求、性的興奮またはオルガスムに不十分なまたは不満足な応答をする場合に起こる。FSDカテゴリーには、活動低下状態の性的欲求障害、性的興奮障害、オルガスム障害および性的苦痛障害が含まれる。本発明の化合物は、(女性性的興奮障害の場合のように)性的刺激への性器応答を改善するであろうが、その場合、それは、関連した苦痛、性交に関連した窮迫および不快も改善することができ、したがって、他の女性性的障害を処置することができる。
【0023】
したがって、本発明の好ましい側面により、活動低下状態の性的欲求障害、性的興奮障害、オルガスム障害および性的苦痛障害の処置または予防のための、より好ましくは、性的興奮障害、オルガスム障害および性的苦痛障害の処置または予防のための、そして最も好ましくは、性的興奮障害の処置または予防での薬剤の製造における本発明の化合物の使用を提供する。
【0024】
活動低下状態の性的欲求障害は、女性が性的である欲求を全くまたはほとんど持たないし、性的思考または空想を全くまたはほとんどしない場合に存在する。このタイプのFSDは、自然閉経かまたは外科的閉経のための低テストステロンレベルによって引き起こされることがありうる。他の原因には、疾病、投薬、疲労、うつ病および不安が含まれる。
【0025】
女性性的興奮障害(FSAD)は、性的刺激への不十分な性器応答を特徴とする。性器は、正常な性的興奮を特徴付ける充血をしない。膣壁は充分に潤滑されないので、性交は苦痛である。オルガスムは妨げられうる。性的興奮障害は、閉経時または出産後および授乳期の減少したエストロゲンによって、更には、糖尿病およびアテローム性動脈硬化症のような血管成分を伴う疾病によって引き起こされることがありうる。他の原因は、利尿薬、抗ヒスタミン薬、抗うつ薬、例えば、選択的セロトニン再吸収阻害剤(SSRI)または抗高血圧症薬での処置に起因する。
【0026】
性的苦痛障害(性交疼痛症および膣痙を含む)は、陰茎挿入に起因する痛みを特徴とし、潤滑を減少させる投薬、子宮内膜症、骨盤内炎症性疾患、炎症性腸疾患または尿路の問題によって引き起こされることがありうる。
【0027】
FSDの有病率は、その用語が、そのいくつかは測定し難い問題のいくつかのタイプにわたっているので、そしてFSDを処置することへの関心が比較的最近であるので、判定するのが難しい。多数の女性の性的問題は、直接的には、女性の加齢過程かまたは糖尿病および高血圧症のような慢性疾患に関連している。
【0028】
FSDは、性的応答周期の別々の様相で症状を発現するいくつかのサブタイプから成るので、単一の療法は存在しない。FSDの現行の処置は、主に、心理学的または関連性の問題に集中している。FSDの処置は、より臨床的な且つ基礎的な科学研究がこの医学的問題の研究についてなされるにつれ、徐々に発展している。女性の性的病気は、病態生理学において、特に、女性の性的病気全体の原因となる血管形成機能不全の成分(例えば、FSAD)を有することがありうる個々人について、全て心理学的であるとは限らない。現在のところ、FSDの処置用に認可された薬物はない。経験的薬物療法には、エストロゲン投与(局所にまたはホルモン置換療法としての)、アンドロゲン、またはブスピロンまたはトラゾドンのような気分改変薬が含まれる。これら処置選択は、しばしば、低い効力または許容し得ない副作用のために、満足するものではない。
【0029】
FSDを処置することへの薬理学的関心は比較的最近であるので、療法は、次の、心理学的カウンセリング、一般市販用性的潤滑剤、および他の状態に承認された薬物を含めた治験候補物から成る。これら投薬は、テストステロンかまたは、エストロゲンおよびテストステロンの組合せのホルモン剤、およびより最近では、男性勃起機能不全(MED)に有効であると証明された血管薬から成る。これら試剤で、FSDを処置するのに有効であると示されたものはまだない。
【0030】
考察されるように、本発明の化合物は、女性性的興奮障害(FSAD)の予防および/または処置に特に有用である。
The Diagnostic and Statistical Manual (DSM) IV of the American Psychiatric Association では、女性性的興奮障害(FSAD)を:
“・・・性的興奮状態の性的活性十分な潤滑膨張応答の完了まで到達するまたは維持することが永続的にまたは再発的にできないこと。この障害は、顕著な窮迫または対人間困難を引き起こすに違いない。・・・”と定義している。
【0031】
この興奮応答は、骨盤内の血管うっ血、膣潤滑、および外性器の拡大および膨張から成る。この障害は、顕著な窮迫および/または対人間困難を引き起こす。カップルの性的機能不全を調査している研究は、女性の76%までが性的機能不全の病気を持っていること、および米国の女性の30〜50%がFSDを経験していることを示している(Berman, J. R., Berman, L. A., Werbin, T. J. et al. (1999). Female sexual dysfunction: Anatomy, physiology, evaluation and treatment options. Curr. Opin. Urology, 9, 563−568)。
【0032】
FSADは、閉経前、閉経周辺期および閉経後(±ホルモン置換療法(HRT))の女性を襲う極めて一般的な性的障害である。それは、うつ病、心臓血管疾患、糖尿病および泌尿生殖器(UG)障害のような付随障害に関連している。
【0033】
FSADの一次結果は、充血/膨張の不足、潤滑の不足、および快い性器感覚の不足である。FSADの二次結果は、減少した性的欲求、性交中の苦痛およびオルガスムに達するのが難しいことである。
【0034】
最近になって、FSADの症状を有する患者の少なくとも一部分について、血管が根拠であると仮定され(Goldstein et al., Int. J. Impot. Res., 10, S84−S90, 1998)、動物データがこの見解を支持している(Park et al., Int. J. Impot. Res., 9, 27−37, 1997)。
【0035】
FSADを処置するための薬物候補は、効力について調査中であるが、主として、男性性器への循環を促す勃起機能不全療法である。それらは、二つのタイプの製剤、すなわち、経口または舌下用薬剤(アポモルフィン、フェントラミン、ホスホジエステラーゼ5型阻害剤、例えば、シルデナフィル(Sildenafil))、および注射または男性の場合は経尿道でおよび女性の場合は性器に局所投与されるプロスタグランジン(PGE1)から成る。しかしながら、これら療法で、FSADの処置に有効であることが示されたものはまだない。
【0036】
理論によって拘束されたくはないが、本発明者は、血管作用性腸管ペプチド(VIP)のような神経ペプチドが、女性性的興奮応答の制御、特に、性器血流の制御における主要な神経伝達物質候補であると考えている。VIPおよび他の神経ペプチドは、SEPによって分解される/代謝される。したがって、SEP阻害剤は、興奮中に放出されるVIPの内因性血管弛緩作用を増強するであろう。これは、増進した性器血流およびそれゆえの性器充血などによって、FSADの予防および/または処置をもたらすであろう。本発明者は、SEPの阻害剤が、骨盤神経に刺激されるおよびVIPに誘発される膣および陰核の血流の増加を促すということを示した。更に、本発明者は、SEP阻害剤が、分離された膣壁のVIPおよび神経に媒介される弛緩を促すということを示した。
【0037】
したがって、本発明は、正常な性的興奮応答、すなわち、膣、陰核および陰唇の充血をもたらす増加した性器血流を回復させる手段を提供するのを助けるので好都合である。これは、血漿浸出による増加した膣潤滑、増加した膣コンプライアンス、および増加した性器感受性をもたらすであろう。
【0038】
したがって、本発明は、正常な性的興奮応答を回復させるまたは増強する手段を提供する。
本明細書中の女性性器は:“生殖器は、内部および外部の群から成る。内器官は、骨盤内に位置し、卵巣、卵管、子宮および膣から成る。外器官は、泌尿生殖器隔膜の表面および骨盤帯の下である。それらは、恥丘、大陰唇および小陰唇、陰核、前庭、前庭球、および大前庭腺を含む”(Gray’s Anatomy,C.D.Clemente, 13th American Edition)を意味する。
【0039】
R.J.Levin は、“・・・男性および女性性器は、発生学的に共通の組織原基から発生しているので、男性および女性性器構造は、互いに相同であると論じられている。したがって、陰核は陰茎相同物であり、陰唇は陰嚢の相同物である。・・・”(Levin, R. J. (1991), Exp. Clin. Endocrinol., 98, 61−69)ということを教示している。
【0040】
男性勃起機能不全(MED)
いくらかの個人は、男性勃起機能不全(MED)に苦しむことがありうるといことが知られている。
【0041】
男性勃起機能不全(MED)は:
“・・・満足のいく性的行為のために陰茎勃起を達成するおよび/または維持することができないこと(NIH Consensus Development Panel on Impotence, 1993)・・・”と定義される。
【0042】
全段階(最低限の、中程度のおよび完全なインポテンス)の勃起機能不全(ED)の有病率は、40歳〜70歳の男性の52%であり、70歳を越える男性ではより高い比率であると推定されている(Melman et al 1999)。その状態は、患者およびそのパートナーの生活の質に重大な悪影響を及ぼし、しばしば、うつ病および乏しい自尊心をもたらす増加した不安および緊張を引き起こす。20年前には、MEDは主に心理学的障害であると考えられていたが(Benet et al 1994)、現在は、患者の大部分について、根本的な器質的原因があるということが知られている。結果として、正常な陰茎勃起の機作およびMEDの病態生理学を明らかにすることについて多くの進展がなされた。
【0043】
陰茎勃起は、海綿体平滑筋の収縮および弛緩の平衡および陰茎の脈管構造に依存する血行力学的イベントである(Lerner et al 1993)。海綿体平滑筋は、本明細書中において、体平滑筋または複数の意味で海綿体とも称する。海綿体平滑筋の弛緩は、海綿体の小柱腔中への増加した血流をもたらし、それらが周囲の膜に対して拡大し且つ排出静脈を圧迫するようにさせる。これは、極めて大きい血圧上昇を生じ、これが勃起を引き起こす(Naylor, 1998)。
【0044】
勃起過程中に起こる変化は複雑であり、末梢および中枢の神経系および内分泌系を包含する高度の協調された制御を必要とする(Naylor, 1998)。体平滑筋収縮は、シナプス後α1アドレノセプターの活性化による交感神経ノルアドレナリン作用性神経支配によってモジュレートされる。MEDは、海綿体の内因性平滑筋緊張の増加に関連することがありうる。しかしながら、体平滑筋弛緩過程は、非アドレナリン作用性・非コリン作用性(NANC)神経伝達によって部分的に媒介される。陰茎中で見出される酸化窒素(NO)以外の他のNANC神経伝達物質は、カルシトニン遺伝子関連ペプチド(CGRP)および血管作用性腸管ペプチド(VIP)など多数存在する。この弛緩を媒介する原因となる主な弛緩因子はNOであり、これは、一酸化窒素合成酵素(NOS)によってL−アルギニンから合成される(Taub et al 1993; Chuang et al 1998)。体平滑筋緊張を低下させることは、NOが海綿体の弛緩を引き起こすのを助けうると考えられている。男性の場合の性的興奮の際、NOはニューロンおよび内皮から放出され、平滑筋細胞および内皮中にある可溶性グアニル酸シクラーゼ(sGC)に結合してそれを活性化させて、細胞内サイクリックグアノシン3’,5’−一リン酸(cGMP)レベルの上昇をもたらす。このcGMPの上昇は、プロテインキナーゼG活性化を包含すると考えられる未知の機作によって(おそらくは、Ca2+ポンプの活性化およびCa2+に活性化されるK+チャンネルによって;Chuang et al., 1998)、細胞内カルシウム濃度([Ca2+]i)の減少による海綿体の弛緩をもたらす。
【0045】
クエン酸シルデナフィル(バイアグラ(ViagraTM)とも称される)は、最近、Pfizer によってMEDのための最初の経口薬処置として開発された。シルデナフィルは、ホスホジエステラーゼ5(PDE5)を選択的に阻害することによって海綿体中のcGMP分解を阻害することによって作用し、それによって、cGMPの5’GMPへの加水分解を制限し(Boolel et al., 1996; Jeremy et al., 1997)、そしてそれによって、cGMPの細胞内濃度を増加させて海綿体平滑筋弛緩を容易にする。
【0046】
現在、プロスタグランジン基剤化合物、すなわち、尿道内に(Vivus Inc. から MuseTMとして入手可能)または小針注射によって(Pharmacia & Upjohn から CaverjectTMとして入手可能)投与することができるアルプロスタジル(alprostadil)での処置のような他の利用可能な市販MED療法は全て、不都合であるかおよび/または侵襲性である。他の処置には、真空狭窄装置、血管作用性薬注射または陰茎プロテーゼ植込み(Montague et al., 1996)が含まれる。注射可能な血管作用性薬は高い効力を示すが、陰茎痛、線維症および持続勃起症などの副作用が一般的であるし、注射療法は経口療法ほど好都合ではないので、現在のところ、シルデナフィルが最も好ましい市販療法である。
【0047】
陰茎または海綿体中のまたは勃起機作/過程におけるSEPの発現または機能的役割について、文書による証拠は従来存在しない。
陰茎または海綿体へのまたは代わりに勃起機作/過程におけるSEP阻害剤の機能的または生化学的作用についても、文書による証拠は従来存在しない。
【0048】
膣または陰核海綿体中のまたは女性性的興奮機作/過程におけるSEPの発現または機能的役割について、文書による証拠は従来存在しない。
膣または陰核海綿体中のまたは女性性的興奮機作/過程におけるSEP阻害剤の機能的または生化学的作用についても、文書による証拠は従来存在しない。
【0049】
したがって、本発明の将来性のある知見は、性的機能不全、特に、MEDまたはFSADに苦しむ男性または女性を、可溶性分泌エンドペプチダーゼ阻害剤(SEPi)の使用で処置する能力である。驚くべきことに、本出願人は、SEPiでのSEPの阻害が、神経に刺激される性的興奮過程を有意に増進するということも見出した。
【0050】
本発明は、正常な性的興奮応答、すなわち、男性の場合は陰茎の勃起をもたらす増加した陰茎血流、および女性の場合は性器充血をもたらす増加した膣陰核血流を回復させる手段を提供するので、好都合である。したがって、本発明は、正常な性的興奮応答を回復させるまたは増強する手段を提供する。
【0051】
発明の概要
広範な側面において、本発明は、新規なアミノ酸配列に関する。これに関して、具体的な新規アミノ酸配列が同定されており、本発明がその配列、ならびに、その新規な変異体、フラグメント、誘導体およびホモログを包含するということは理解されるはずである。
【0052】
もう一つの広範な側面において、本発明は、新規な核酸配列に関する。これに関して、具体的な新規核酸配列が同定されており、本発明がその配列、ならびに、その新規な変異体、フラグメント、誘導体およびホモログを包含するということは理解されるはずである。
【0053】
したがって、要するに、本発明のいくつかの側面は、次に関する:
1. 新規なアミノ酸。
2. 新規なヌクレオチド配列。
【0054】
3. これら新規な配列を用いた検定。
4. これら検定の使用によって識別される化合物/組成物。
5. これら新規な配列を含むまたは発現する発現系。
【0055】
6. これら新規な配列に基づく予防および/または処置の方法。
7. これら新規な配列に基づく医薬組成物。
本発明のアミノ酸配列および/または本発明のヌクレオチド配列に関する他の側面には、本発明の配列を含むまたは発現することができる構築物;本発明の配列を含むまたは発現することができるベクター;本発明の配列を含むまたは発現することができるプラスミド;本発明の配列を含むまたは発現することができる組織;本発明の配列を含むまたは発現することができる器官;本発明の配列を含むまたは発現することができる形質転換された宿主;および本発明の配列を含むまたは発現することができる形質転換された生物、が含まれる。本発明は、更に、それらを転移する方法を含めた、微生物中での発現のような、それらを発現する方法を包含する。
【0056】
次の注釈において、“本発明のヌクレオチド配列”および“本発明のアミノ酸配列”の意味は、それぞれ、本明細書中に示されたまたは論じされたヌクレオチド配列のいずれか一つまたはそれを越えるもの、および本明細書中に示されたまたは論じされたアミノ酸配列のいずれか一つまたはそれを越えるものを意味する。更に、本明細書中に用いられるように、“アミノ酸配列”とは、ペプチドまたはタンパク質の配列を意味し、それらの一部分を意味してよい。更に、“本発明のアミノ酸配列”という用語は、“本発明のポリペプチド配列”という句と同義語である。更に、“本発明のヌクレオチド配列”という用語は、“本発明のポリヌクレオチド配列”という句と同義語である。
【0057】
発明の詳細な側面
本発明の一つの側面においては、単離されたおよび/または精製されたポリヌクレオチドであって、
(a)配列番号:2に示されるポリペプチドをエンコードしているポリヌクレオチド;
(b)配列番号:1または配列番号:5のヌクレオチド配列を含むポリヌクレオチド;
(c)NCIMB41110中に含有されるDNAによって発現されたポリペプチドをエンコードしているポリヌクレオチド;
(d)(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも83%の同一性を有するヌクレオチド配列を含むポリヌクレオチド;
(e)(a)〜(d)のいずれか一つのポリヌクレオチドにハイブリッド形成することができるヌクレオチド配列を含むポリヌクレオチド;
(f)(a)〜(e)のいずれか一つのポリヌクレオチドの相補鎖;または
(g)(a)〜(f)のいずれか一つのポリヌクレオチドのポリヌクレオチドフラグメント
の内の一つまたはそれを越えるものを含むポリヌクレオチドを提供する。
【0058】
配列番号:2のポリペプチドについて、それらアミノ酸のいずれか一つまたはそれを越えるものは、それらの類似体でありうる。
本明細書中で用いられる“類似体”という用語は、配列番号:2の配列に類似した配列を有する配列であるが、非有害(すなわち、酵素活性に有害でない)アミノ酸置換または欠失が起こっている配列を意味する。
【0059】
好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも85%の同一性を有するヌクレオチド配列を含む。より好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも87%の同一性を有するヌクレオチド配列を含む。なお一層好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも89%の同一性を有するヌクレオチド配列を含む。また更に好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも90%の同一性を有するヌクレオチド配列を含む。最も好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも95%の同一性を有するヌクレオチド配列を含む。
【0060】
好ましくは、上記のポリヌクレオチドは、アミノ酸配列MGKSEGPVGを含むポリペプチドをエンコードしている。好ましくは、このアミノ酸配列MGKSEGPVGは、そのポリペプチドのアミノ末端にまたはその付近にある。
【0061】
好ましくは、上記のポリヌクレオチドは、ヌクレオチド配列ATGGGGAAGTCCGAAGGCCCCGTGGGGを含む。好ましくは、このヌクレオチド配列ATGGGGAAGTCCGAAGGCCCCGTGGGGは、そのポリヌクレオチドの5’末端にまたはその付近にある。
【0062】
上記のポリヌクレオチドは、好ましくは、可溶性分泌エンドペプチダーゼ(SEP)、好ましくは、ヒトSEPをエンコードしている。
本発明は、更に、上記のポリヌクレオチドの少なくとも15個連続したヌクレオチドを含むポリヌクレオチドプローブもしくはプライマー、またはその相補鎖を提供する。好ましくは、このプローブまたはプライマーは、このSEPコーディング配列を他の配列から特異的に区別することができる。
【0063】
本発明は、また更に、上記のポリヌクレオチドを含むベクターを提供する。
本発明のもう一つの側面により、上記のベクターで形質転換されたまたはトランスフェクションされた宿主細胞を提供する。好ましくは、この宿主細胞は、哺乳動物、細菌または酵母の細胞である。
【0064】
本発明によって更に提供されるのは、上記のポリヌクレオチドの転写されたRNA産物である。
本発明によって更に提供されるのは、上記のこのRNA産物に関してアンチセンスであって、それにハイブリッド形成することができるRNA分子またはそのフラグメントである。
【0065】
上記のポリヌクレオチドに結合することができるリボザイムまたはジンクフィンガータンパク質も、本発明によって提供する。
本発明のまた更にもう一つの側面により、ポリペプチドまたはそのフラグメントを製造する方法であって、宿主細胞を上記のベクターで形質転換しまたはトランスフェクションし、そしてその形質転換された/トランスフェクションされた宿主細胞を、培地中においてこのポリペプチドまたはフラグメントの発現に充分な条件下で培養することを含む方法を提供する。好ましくは、このポリペプチドまたはフラグメントを培地中に分泌させる。この方法は、好ましくは、ポリペプチドまたはフラグメントを培地から回収することを更に含む。
【0066】
本発明は、ポリペプチドまたはそのフラグメントを発現することができる細胞を生じる方法であって、上記のベクターで細胞を形質転換するまたはトランスフェクションすることを含む方法を更に提供する。
【0067】
本発明のもう一つの態様により、上記の方法によって生じた細胞を提供する。更に、上の方法によって生じる上記のポリペプチドまたはそのフラグメントを提供する。
【0068】
本発明のもう一つの側面により、SEP活性を有するポリペプチドであって、
(a)配列番号:1または配列番号:5のポリヌクレオチド配列から翻訳される推定のアミノ酸配列を有するポリペプチドおよびその変異型、フラグメント、ホモログ、類似体および誘導体;
(b)配列番号:2のポリペプチドおよびその変異型、フラグメント、ホモログ、類似体および誘導体;
(c)NCIMB41110のcDNAによってエンコードされたポリペプチドおよびその変異型、フラグメント、ホモログ、類似体および誘導体;または
(d)ポリペプチドであって、(i)配列番号:1または配列番号:5のポリヌクレオチドによってエンコードされたポリペプチド、(ii)配列番号:2のポリペプチド、または(iii)NCIMB41110のcDNAによってエンコードされたポリペプチド、と少なくとも78%の同一性を有するもの
の内の一つまたはそれを越えるものを含むポリペプチドを提供する。
【0069】
好ましくは、このポリペプチドは、(i)配列番号:1または配列番号:5のポリヌクレオチドによってエンコードされたポリペプチド、(ii)配列番号:2のポリペプチド、または(iii)NCIMB41110のcDNAによってエンコードされたポリペプチド、と少なくとも85%、好ましくは、少なくとも90%、より好ましくは、少なくとも95%、最も好ましくは、少なくとも98%の同一性を有する。
【0070】
好ましくは、上記のポリペプチドは、アミノ酸配列MGKSEGPVGを含む。好ましくは、このアミノ酸配列MGKSEGPVGは、そのポリペプチドのアミノ末端にまたはその付近にある。
【0071】
好ましくは、上記のポリペプチドをエンコードしているポリヌクレオチドは、ヌクレオチド配列ATGGGGAAGTCCGAAGGCCCCGTGGGGを含む。好ましくは、このヌクレオチド配列ATGGGGAAGTCCGAAGGCCCCGTGGGGは、そのポリヌクレオチドの5’末端にまたはその付近にある。
【0072】
本発明は更に、上記のポリペプチドに対する抗体を提供する。
本発明は、また更に、上記のポリペプチドをモジュレートする化合物を提供する。好ましくは、この化合物は、そのポリペプチドを阻害するまたは選択的に阻害する。
【0073】
本発明が更に提供するのは、医薬組成物であって、上記の抗体または化合物および1種類またはそれを越える薬学的に許容しうる担体、希釈剤または賦形剤を含む医薬組成物である。
【0074】
本発明のもう一つの側面により、上記のポリペプチドに結合するおよび/またはそれをモジュレートする候補モジュレーターを識別する方法であって、このポリペプチドを候補モジュレーターと接触させ、そしてモジュレーションが起こるかどうか確かめることを含む方法を提供する。
【0075】
好ましくは、この方法は、
(a)(i)上記のポリペプチドの基質ペプチドと(ii)上記のポリペプチドとを、(iii)上記のポリペプチドの候補モジュレーターの存在下で接触させ、ここにおいて、この基質ペプチドは、上記のポリペプチドによるこの基質ペプチドの切断に応答して検出可能なシグナルを与えることができ;そして
(b)上記のポリペプチドによるこの基質ペプチドの切断が、この候補モジュレーターによってモジュレートされたか否かを、この基質ペプチドに関連したこの検出可能なシグナルの存在または不存在を検出することによって確かめる;
ことを含む。
【0076】
好ましくは、この候補モジュレーターは候補阻害剤である。より好ましくは、この基質ペプチドを、少なくとも1種類の蛍光ドナー色素および少なくとも1種類の蛍光アクセプター色素で標識し、そして上記のポリペプチドの候補阻害剤を検出するのに用いられる検定は、蛍光共鳴エネルギー移動(fluorescence resonance energy transfer)(FRET)検定である。最も好ましくは、この標識された基質ペプチドは、ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSYTM−7)−βAla−NH2である。
【0077】
したがって、本発明の好ましい側面により、上記のポリペプチドに結合するおよび/またはそれを阻害する候補阻害剤を識別する方法であって、
(a)(i)上記のポリペプチドの基質ペプチドと(ii)上記のポリペプチドとを、(iii)上記のポリペプチドの候補阻害剤の存在下で接触させ、ここにおいて、この基質ペプチドは、上記のポリペプチドによるこの基質ペプチドの切断に応答して検出可能なシグナルを与えることができ;そして
(b)上記のポリペプチドによるこの基質ペプチドの切断が、この候補阻害剤によって阻害されたか否かを、この基質ペプチドに関連したこの検出可能なシグナルの存在または不存在を検出することによって確かめる;
ことを含む方法を提供する。
【0078】
好ましくは、この基質ペプチドを、少なくとも1種類の蛍光ドナー色素および少なくとも1種類の蛍光アクセプター色素で標識し、そして上記のポリペプチドの候補阻害剤を検出するのに用いられる検定は、蛍光共鳴エネルギー移動(FRET)検定である。最も好ましくは、この標識された基質ペプチドは、ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSYTM−7)−βAla−NH2である。
【0079】
このSEP FRET検定は、NEPと一緒の使用について、Carvalho et al によって開発された検定に基づいている(Carvalho et al., Annal. Biochem. 237, pp.167−173 (1996))。SEP FRET検定は、類似した分子内消光蛍光原性ペプチド基質(similar intramolecularly quenched fluorogenic peptide substrate)を利用するが、蛍光原性ドナー/アクセプター色素の新規な組合せ、具体的には、ローダミングリーン(Molecular Probes, Inc., Eugene, OR, USA)およびQSYTM−7(以下、“QSY−7”または“QSY7”と記す;Molecular Probes, Inc.)を利用する。
【0080】
合成標識基質ペプチドローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2の製造は、実施例部分(以下)に詳述する。
【0081】
本発明の別の側面により、上記のポリペプチドに結合するおよび/またはそれをモジュレートする候補モジュレーターを識別する方法であって、このポリペプチドを候補モジュレーターと接触させ、そしてモジュレーションが起こるかどうか確かめることを含み、
(a)上記のポリペプチドを分泌する細胞と候補モジュレーターを接触させ、このポリペプチドは、このポリペプチドへの候補モジュレーターの結合に関して検出可能なシグナルを与えることができる第二成分に結合していて;この接触は、このポリペプチドに候補モジュレーターを結合させるのに充分な条件下であり;そして
(b)ポリペプチドを結合することができる候補モジュレーターを、この第二成分によって生じるシグナルを検出することによって識別する;
ことを含む方法を提供する。
【0082】
更に、この方法は、
(a)(i)上記のポリペプチドに結合することが知られている検出可能な第一成分および(ii)候補モジュレーターを、上記ポリペプチドを分泌する細胞と接触させ、このポリペプチドは、このポリペプチドへの候補モジュレーターの結合に関して検出可能なシグナルを与えることができる第二成分に結合していて;この接触は、このポリペプチドに候補モジュレーターを結合させるのに充分な条件下であり;そして
(b)この第一成分がポリペプチドに結合するかどうかを、このポリペプチドと第一成分の相互作用により生じるシグナルの不存在またはそれ以外の場合を検出することによって確かめる;
ことを含む。
【0083】
上の方法のいずれかによって識別される候補モジュレーターは、好ましくは、上記のポリペプチドに結合するおよび/またはそれを阻害する、すなわち、好ましくは、候補阻害剤である。
【0084】
さらなるの側面において、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDを処置するのに用いることができる試剤(以下、SEP阻害剤またはSEPiと称する)を識別するための検定方法であって、ある試験薬が、内因性性器充血過程または勃起過程を直接的に増進することができるかどうか決定することを含み;ここにおいて、この増進は、本明細書中に定義の試験薬の存在下における性器血流または空洞内血圧(ICP)(および/または空洞血流)の増強として定義され;試験薬によるこのような増強は、この試験薬が、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置において有用でありうるということを示すものであり、そしてここにおいて、この試験薬がSEPiである検定方法に関する。
【0085】
例として、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDを処置するための、内因性性器興奮または勃起過程を直接的に増進することができる試剤を識別するための検定方法であって、ペプチド(好ましくは、ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2のような蛍光標識ペプチド)の代謝分解を阻害することができる部分を有する試験薬を接触させ、このペプチドは、通常はSEPによって代謝され;そして一定時間後に残っているペプチドの活性および/またはレベルを(例えば、蛍光定量分析によって)測定することを含み;ここにおいて、蛍光によって測定されるペプチドレベルの変化は、この試験薬の効力(IC50)を示し、且つこの試験薬が、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置において有用でありうるということを示すものであり;そしてここにおいて、この試剤がSEPiである検定方法に関する。
【0086】
さらなるの側面において、本発明は、(a)本発明による検定を実施し;(b)内因性性器興奮過程または勃起過程を直接的に増進することができる1種類またはそれを越える試剤を識別し;そして(c)一定量のそれら識別された1種類またはそれを越える試剤を製造する工程を含み;そしてここにおいて、この試剤がSEPiである方法に関する。
【0087】
この側面について、工程(b)で識別された試剤は、例えば、活性を最大限にするように修飾されてよく、その後、工程(a)を繰り返してよい。これら工程は、所望の活性または薬物動態学的プロフィールが得られるまで繰り返してよい。
【0088】
したがって、さらなる側面において、本発明は、(a1)本発明の検定を実施し;(b1)内因性性器興奮過程または勃起過程を直接的に増進することができる1種類またはそれを越える試剤を識別し;(b2)この識別された1種類またはそれを越える試剤を修飾し;(a2)場合により、工程(a1)を繰り返し;そして(c)一定量のそれら識別された1種類またはそれを越える試剤(すなわち、修飾されたもの)を製造する工程を含み;そしてここにおいて、この試剤がSEPiである方法に関する。
【0089】
上記のいずれかの検定(またはその変法)を用いて識別されるいずれかの候補モジュレーター、候補阻害剤、候補選択的阻害剤、試剤(以下、SEP阻害剤またはSEPiと称する)等も、本発明の側面と考えられるということは理解されるはずである。
【0090】
したがって、本発明は、上記の方法(検定)のいずれか一つによって識別される候補モジュレーター、候補阻害剤、候補選択的阻害剤または試剤を提供する。
エンドペプチダーゼは、特に、生物活性ペプチド活性を調節すること(例えば、ペプチド作用性シグナリング過程)に関与しているので、エンドペプチダーゼのモジュレーター(例えば、選択的阻害剤を含めた阻害剤)は、このような活性をモジュレートする場合に用いることができる。
【0091】
ECE−1のようないくつかのエンドペプチダーゼは、生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解に関与している。したがって、エンドペプチダーゼのモジュレーター(例えば、選択的阻害剤を含めた阻害剤)は、このような活性をモジュレートする場合に用いることができる。
【0092】
ヒトSEPは、したがって、生物活性ペプチド活性を調節することおよび/または生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解に関与することがありうる。
【0093】
したがって、本発明は、医薬として用いるための、上記のポリペプチドをモジュレートする抗体、化合物または組成物を提供する。このポリペプチドの阻害剤または選択的阻害剤として作用することができるこのような抗体、化合物または組成物は、したがって、ペプチド作用性シグナリング過程をモジュレートすることのような生物活性ペプチド活性を調節する側面に関する治療的分野においておよび/または生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解において用いることができる。このような治療的に有用な分野には、性的機能不全(例えば、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MED)、妊孕性障害、アルツハイマー病および発作のような神経変性障害、高血圧症のような心臓血管疾患、創傷治癒/組織修復等が含まれるが、これらに制限されるわけではない。
【0094】
したがって、医薬として用いるための上記の抗体、化合物または組成物も提供する。
更に、上記のポリペプチドをモジュレートする必要がある患者の予防および/または処置での薬剤の製造における上の化合物の使用を提供する。
【0095】
更に、上記のポリペプチドを阻害するまたは選択的に阻害する必要がある患者の予防および/または処置での薬剤の製造における上の化合物の使用を提供する。好ましくは、上の化合物のこの使用は、性的機能不全の予防および/または処置用の薬剤の製造の場合である。より好ましくは、この性的機能不全は、男性勃起機能不全(MED)または女性性的機能不全(FSD)である。最も好ましくは、この女性性的機能不全(FSD)は女性性的興奮障害(FSAD)である。
【0096】
本発明のまた更にもう一つの側面により、上記のポリペプチドをモジュレートする必要がある患者の予防および/または処置の方法であって、この患者に治療的有効量の上記の化合物を投与することを含む方法を提供する。
【0097】
更に、上記のポリペプチドを阻害するまたは選択的に阻害する必要がある患者の予防および/または処置の方法であって、この患者に治療的有効量の上記の化合物を投与することを含む方法を提供する。
【0098】
また更に、患者の性的機能不全の予防および/または処置の方法であって、この患者に治療的有効量の上記の化合物を投与することを含む方法を提供する。好ましくは、この性的機能不全は、男性勃起機能不全(MED)または女性性的機能不全(FSD)である。より好ましくは、この女性性的機能不全(FSD)は女性性的興奮障害(FSAD)である。
【0099】
好ましくは、この化合物はポリペプチドであり、この化合物の治療的有効量は、この化合物をエンコードしている且つこの化合物を in vivo で発現するDNAを患者に与えることによって投与される。より好ましくは、この化合物はポリペプチド阻害剤であり、モジュレーションは、上記のポリペプチドの阻害または選択的阻害である。
【0100】
本発明によって更に提供されるのは、上記のポリペプチドをモジュレートする必要がある患者の予防および/または処置用の薬剤の製造における上記の抗体の使用である。好ましくは、このモジュレーションは、上記のポリペプチドの阻害または選択的阻害である。好ましくは、この予防および/または処置は、性的機能不全についてである。より好ましくは、この性的機能不全は、男性勃起機能不全(MED)または女性性的機能不全(FSD)である。最も好ましくは、この女性性的機能不全(FSD)は女性性的興奮障害(FSAD)である。
【0101】
本発明によって更に、上記のポリペプチドをモジュレートする必要がある患者の予防および/または処置の方法であって、この患者に治療的有効量の上記の抗体を投与することを含む方法を提供する。好ましくは、このモジュレーションは、上記のポリペプチドの阻害または選択的阻害である。好ましくは、この予防および/または処置は、性的機能不全についてである。より好ましくは、この性的機能不全は、男性勃起機能不全(MED)または女性性的機能不全(FSD)である。最も好ましくは、この女性性的機能不全(FSD)は女性性的興奮障害(FSAD)である。
【0102】
本発明の好ましい側面は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置において用いるための(または用いられている場合の)SEPi化合物およびSEPi化合物を含有する医薬組成物に関する。この医薬組成物中において、SEPiは、薬学的に許容しうる担体、希釈剤または賦形剤と所望により混合されている。ここで、この組成物は(本明細書中に述べられるいずれかの他の組成物のように)、男性性的機能不全、特に、MED、または女性性的機能不全、特に、FSADの予防および/または処置で引き続き用いるために包装されていてよい。
【0103】
もう一つの側面において、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置用の薬剤(医薬組成物のような)の製造における試剤の使用に関する。
【0104】
もう一つの側面において、本発明は、女性性的機能不全、特に、FSADを患っている女性、または男性性的機能不全、特に、MEDを患っている男性を処置する方法であって、陰核および膣での内因性性器興奮/充血応答または海綿体での勃起過程を増進することができるSEPiをその女性または男性に供給することを含み;ここにおいて、このSEPiは、本明細書中の前に定義の内因性興奮/勃起過程を増進する量で存在し;このSEPiは、薬学的に許容しうる担体、希釈剤または賦形剤と所望により混合され;そしてこのSEPiは本明細書中に定義の通りである方法に関する。
【0105】
もう一つの側面において、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDを処置する方法であって、膣/陰核血流、ICPまたは空洞血流を測定することによって in vivo において(例えば、ウサギにおいて)神経刺激される内因性性器興奮過程または勃起過程をある試剤で増強することにより;ここにおいて、この試剤は、in vitro 検定法において蛍光ペプチド(本明細書中で先述された、および以下に詳述される)の代謝分解を直接的に阻害することができ;この in vitro 検定法は、本発明による検定法であり;そしてこの試剤はSEPiである方法に関する。
【0106】
もう一つの側面において、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置用の医薬組成物の製造における試剤の使用であって、ここにおいて、この試剤は、本発明の検定法によって in vitro で検定された場合に蛍光ペプチドの代謝分解を直接的に阻害することができ;そしてこの試剤はSEPiである使用に関する。
【0107】
好ましくは、本発明による男性および女性の性的機能不全、特に、MEDおよびFSADの予防および/または処置で用いるためのSEP阻害剤(SEPi)は、100nM未満、より好ましくは、50nM未満のIC50を有する。
【0108】
好ましくは、本発明によるSEP阻害剤は、中性エンドペプチダーゼNEP EC3.4.24.11およびアンギオテンシン変換酵素(ACE)に対するより30倍を越える、より好ましくは、50倍を越えるSEP選択性を有する。これは、SEPiを全身に(例えば、口より)投与した場合の心臓血管イベント(例えば、血圧の降下)の見込みを減少させる。好ましくは、SEPiは、更に、エンドセリン変換酵素(ECE)に対するより100倍を越える選択性を有する。
【0109】
SEPi化合物は、実験の項(以下)に示される教示にしたがって製造される。それらを試剤として調べ、そしてそれらが内因性勃起過程を増進するのに有用であり、それによってMEDおよびFSADの予防および/または処置において有用であることが判明した。
【0110】
いずれの特定の理論にも制限されることなく、本明細書中において、SEPを阻害することにより、性的興奮中に放出される、ニューロンによって放出される他の血管作用薬(おそらくは、血管作用性腸管タンパク質(VIP))が増進するということが考えられる。SEPiの使用は、性的刺激中に放出される神経ペプチド(おそらくは、VIP)の作用を増強し、それゆえ、空洞血流を増加させることによる男性勃起機作を増強し、したがって、性器血流を増加させることによる空洞内血圧および女性の充血を増強すると考えられる。
【0111】
更に、本発明の化合物の使用は、非NO依存性NANC経路を増進することによって作用して、MEDおよびFSADを処置する、および陰茎および膣/陰核中の硝酸作用性(nitrergic)シグナリングを増強するまたは容易にすると考えられる。
【0112】
したがって、本発明の好ましい側面により、男性性的機能不全、特に、MED、または女性性的機能不全、特に、FSADの予防および/または処置用の薬剤の製造における、全身投与による(好ましくは、口による、例えば、嚥下可能錠剤またはカプセル剤、または舌下または口腔用製剤)SEPiの使用を提供する。
【0113】
本研究において、本発明者は、男性および女性の性的興奮の生理学についての強壮な再現可能モデルを開発した。このモデルは、麻酔されたウサギを用い、レーザー・ドップラー(Laser Doppler)技法を用いて空洞内血圧および性器血流を監視し、同時に、心臓血管パラメーターを常套的に記録する。本発明者は、試験薬の不存在下および存在下における骨盤神経刺激またはVIPの注入によって引き起こされる陰茎中の空洞内血圧および膣(および陰核さえも)血流の僅かな変化を測定することができる。
【0114】
本発明者は、この動物モデルが、臨床データに直接的に反映すると考えている。したがって、このモデルを用いて、空洞内血圧の増加による陰茎勃起の増進および膣または陰核血流増進を測定するなどの、例えば、MEDおよびFSADの予防および/または処置のための候補薬を研究することができる。
【0115】
したがって、さらなる側面により、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDを処置することができる試剤を識別するのに用いられる動物モデルであって、麻酔された雌または雄の動物の骨盤神経の刺激後のその膣/陰核血流、空洞内血圧および/または空洞血流の変化を測定する手段を含めたその動物を含み;そしてここにおいて、その試剤はSEPiである動物モデルに関する。
【0116】
さらなる側面において、本発明は、FSADまたはMEDを処置するために内因性性器興奮過程または勃起過程を直接的に増進することができる試剤を識別する検定方法であって、本発明の動物モデルにある試剤を投与し;そして内因性性器興奮過程または勃起過程の変化を測定することを含み;ここにおいて、この変化は、定義の試験薬の存在下における動物モデルの膣/陰核血流、空洞内血圧(ICP)(および/または空洞血流)の増強として定義され;そしてその試剤はSEPiである検定方法に関する。
【0117】
さらなる側面において、本発明は、診断方法であって、女性または男性からの試料を単離し;その試料が、女性性的機能不全、好ましくは、FSAD、または男性性的機能不全、好ましくは、MEDを引き起こすような量で存在する物質を含有するかどうか決定することを含み;ここにおいて、その物質は、女性の内因性性器興奮過程または男性の海綿体の勃起過程への直接的作用を有し;しかもその物質は、ある試剤の使用によって有益な作用を得るようにモジュレートされることができ;そしてその試剤はSEPiである診断方法に関する。
【0118】
さらなる側面において、本発明は、単離された女性または男性の試料中の物質を検出する手段を含む診断用組成物またはキットであって;ここにおいて、その手段は、その試料が、女性性的機能不全、好ましくは、FSAD、または男性性的機能不全、好ましくは、MEDを引き起こす物質およびそのような量を含有するか、または性的機能不全、好ましくは、FSADまたはMEDを引き起こすような量であるかどうか決定するのに用いることができ;その物質は、内因性性器興奮過程または勃起過程への直接的作用を有し、しかもその物質は、ある試剤の使用によって有益な作用を得るようにモジュレートされることができ;そしてその試剤はSEPiである診断用組成物またはキットに関する。
【0119】
本発明のいっそうさらなる側面により、本発明のポリペプチドを過剰発現する、過少発現するまたはその標的挿入または欠失を示すように ex vivo または in vivo で遺伝子操作された細胞を提供する。好ましくは、これら in vivo で遺伝子操作された細胞は、非ヒト動物中に含まれる。
【0120】
本発明は、更に、上記のポリペプチドを生じることができる受託番号NCIMB41110として寄託された細胞およびそれに由来しうる変異体および突然変異体を提供する。
【0121】
本発明によって更に提供されるのは、上記のポリペプチドの三次元構造を解明する方法であって、(a)ポリペプチドを精製し;(b)それを結晶化し;そして(c)その構造を、特に、X線結晶学によって解明する工程を含む方法である。
【0122】
さらなる側面において、本発明は、更に、上記のポリペプチドの構造をモデリングする方法であって、(a)既知の三次元構造を有するタンパク質、特に、ロドプシンの配列と一緒にその配列をアラインメントさせ;(b)上記のポリペプチドの検出された配列差を既知の構造上にマッピングし、(c)上記のポリペプチドの相同モデルを得る工程を含む方法に関する。
【0123】
参照しやすくするために、ここで、本発明のこれらおよび更に別の側面を適当な項目タイトルで論じる。しかしながら、各項目の下での教示は、具体的な項目各々に必ずしも制限されない。
【0124】
ヒトSEP酵素
上に説明したように、本発明は、ヒト可溶性分泌エンドペプチダーゼ(ヒトSEP)と称された新規なエンドペプチダーゼ酵素、およびそれをエンコードしているヌクレオチド配列に関する。本発明は、更に、疾患の診断および予防および/または処置におけるそれら新規な核酸配列およびアミノ酸配列の使用に関する。本発明は、更に、エンドペプチダーゼ活性をモジュレートする(好ましくは、阻害するまたは選択的に阻害する)ことができる試剤を評価するおよび/またはスクリーニングするための、それら新規な核酸配列およびアミノ酸配列の使用に関する。本発明は、更に、エンドペプチダーゼ活性をモジュレートする(好ましくは、阻害するまたは選択的に阻害する)ことができる試剤を評価するおよび/またはスクリーニングするための、それら新規な核酸配列およびアミノ酸配列を含むまたは発現する遺伝子操作された宿主細胞に関する。
【0125】
ヒトSEPは、いろいろな源に存在し、およびそれらから入手可能であると考えられる。
例として、ヒトSEPは、心臓血管系、神経系、内分泌系および精巣のいずれか一つまたはそれを越えるものに見出される。
【0126】
本発明者は、更に、SEPが多数の他の源、例えば、齧歯類動物(ネズミ(Ikeda et al., Journal Biological Chemistry, Vol 274,1999,pp.32469−32477)およびラット(NEP II−国際特許出願WO99/53077号))、ウシ、ヒツジ、ブタおよびウマなどにも存在すると考えている。
【0127】
ヒトSEPは、天然に存在する形と同じであってよいが、この側面について、好ましくは、ヒトSEPは、非天然アミノ酸配列である(すなわち、それは、その自然環境中に存在しない)、またはその変異体、ホモログ、フラグメントまたは誘導体である。更に、または代わりに、ヒトSEPは、単離されたヒトSEPおよび/または精製されたヒトSEPである。ヒトSEPは、天然であろうとなかろうと、いずれか適当な源から入手可能でありうるしまたはそれによって生じうるし、またはそれは、合成、半合成またはリコンビナントであってよい。
【0128】
ヒトSEPコーディング配列は、天然に存在する形と同じであってよいが、この側面について、好ましくは、ヒトSEPコーディング配列は、非天然ヌクレオチド配列である(すなわち、それは、その自然環境中に存在しない)、またはその変異体、ホモログ、フラグメントまたは誘導体である。更に、または代わりに、ヒトSEPコーディング配列は、単離されたヒトSEPコーディング配列および/または精製されたヒトSEPコーディング配列である。ヒトSEPコーディング配列は、天然であろうとなかろうと、いずれか適当な源から入手可能でありうるしまたはそれによって生じうるし、またはそれは、合成、半合成またはリコンビナントであってよい。
【0129】
ヒトSEP活性およびスクリーニング
ヒトSEPおよび/またはそのコーディング配列および/またはそれにハイブリッド形成することができる配列は、異なったSEP間の薬物候補の選択性を調べるのに有用である。
【0130】
ヒトSEPは、種々の生物活性ペプチドを加水分解する(タンパク質分解する)ことができると考えられる。
ヒトSEPmRNAは、他の組織と比較して精巣中で最も量が多いということが(本明細書中で)示されている。これは、マウスSEPについて公表されたデータ(Ghaddar et al., Biochemical Journal, Vol 347,2000,pp.419−429)と一致し、この場合のmRNAは、更に、円形および細長い精子細胞に局在している。
【0131】
多様な異なるタンパク質分解活性が、以前に精巣中で識別されたが、ある場合には、それらは、精巣機能に本質的であることが分かっている(例えば、ACE活性)。この組織中におけるその豊富さから、SEPの一つの可能な生理学的役割は、精巣の機能に関連していると考えられる(例えば、妊孕性)。
【0132】
ヒトSEPは、精巣の妊孕性または別の機能の側面に関与している精巣中の特定の生理学的に重要な生物ペプチドを加水分解して、そのペプチドを活性化するかまたは失活させることができる。この(予想される)生理学的ペプチドの正確な性状は、まだ確認されていない。しかしながら、SEPは、ビッグエンドセリン、エンドセリン−1、アンギオテンシン−I、サブスタンスP、ブラジキニン、エンケファリンおよび心房性ナトリウム利尿ペプチド(ANP)を含めた多数の生物ペプチドを加水分解することができる。これらのいくつかは、精巣中で機能することが知られている。エンドセリン−1は、例えば、精巣中で見出されるが、そこにおいてそれは、精細管収縮性を促すのに関与している。興味深いことに、エンドセリン−1をビッグエンドセリンから生じると考えられる精巣内で検出されるその酵素活性(ECE)は、阻害剤ホスホラミドンおよびチオルファンに感受性である。マウスSEPおよびおそらくはヒトSEPも、これら阻害剤に感受性であるので、この活性は、ECEよりもむしろSEPに関連しているかもしれない。ヒトSEP活性を阻害する化合物は、したがって、精巣内エンドセリンレベルを変化(増加または減少)させることがあり、これは、不妊症の予防および/または処置にまたは男性用避妊薬として潜在的に有用でありうる。
【0133】
血管作用性腸管ペプチド(VIP)は、精巣中で役割を果たすもう一つの潜在的ヒトSEP基質である。VIPは、精巣中の血流を増加させ、そして更に、精巣ステロイド合成並びにヒト精子運動性を促すことが分かっている(Siow et al, Archives of Andrology, Vol 43,1999,p.6771)。ヒトSEP活性を阻害する薬物は、精巣中のVIPレベルを、したがって、精巣血流、ステロイド合成または精子運動性をモジュレートするのに有用でありうる。
【0134】
ヒトSEP mRNAは、精巣中で最も量が多いが、それは、逆転写酵素−ポリメラーゼ連鎖反応(RT−PCR)の敏感な方法を用いて、種々の組織中でのより低いレベルを検出することもできる。マウスの場合、SEPは、心臓、脳、脾臓、肺、腎臓、腸および副腎で検出されている。本明細書中において完全長ヒトSEP cDNA配列を単離するのに用いられたcDNAライブラリースクリーニングアプローチも、ヒトの脳、胎盤、小腸および腎組織に由来するライブラリー中でヒトSEP cDNAを識別した。
【0135】
ヒトSEP酵素は、細胞から分泌されることもありうる。したがって、ヒトSEPタンパク質は、精巣中で量が多いことに加えて、身体中の広範囲の他の組織中でも中程度のレベルで見出されるであろうと考えられる。これら組織中において、ヒトSEPは、上述の生物ペプチド基質を加水分解するであろうと考えられる。
【0136】
したがって、SEPの酵素活性を阻害する薬物は、種々の異なった組織中での上述の多数のヒトSEP基質のレベルを変化させるであろうと考えられる。これらヒトSEP基質は、通常は、ペプチド作用性シグナリング過程にしばしば関連している生物学的に活性な分子またはそれらの前駆体であるので、ヒトSEP阻害剤は、性的機能不全(例えば、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MED)および生殖障害、並びに、神経変性障害(例えば、アルツハイマー病および発作)および高血圧症などの心臓血管疾患等のような他の疾患/障害がおそらく含まれるがこれに制限されるわけではない、ペプチド作用性シグナリングに関連した多数の異なった障害の予防および/または処置に有用でありうると考えられる。
【0137】
したがって、ヒトSEPおよび/またはそのコーディング配列および/またはそれにハイブリッド形成することができる配列は、ペプチド作用性シグナリングに関連した疾患の予防および/または処置用の薬物候補をスクリーニングするのに有用でありうる。更に、ヒトSEPおよび/またはそのコーディング配列および/またはそれにハイブリッド形成することができる配列は、上記の記載のような疾患の予防および/または処置用の薬物候補をスクリーニングするのに有用でありうると考えられる。
【0138】
ヒトSEPをコードしているヌクレオチド配列またはヒトSEP酵素自体のどちらかまたは両方を用いて、SEP活性に影響を与えることができる試剤についてスクリーニングすることができる。具体的には、ヒトSEPをコードしているヌクレオチド配列自体を用いて、SEP活性を阻害することができる試剤についてスクリーニングすることができる。更に、ヒトSEPをコードしているヌクレオチド配列またはヒトSEP酵素自体を用いて、SEP活性を選択的に阻害するようにSEP活性に選択的に影響を与える試剤についてスクリーニングすることができる。
【0139】
ヒトSEP活性の測定−ヒトSEP検定
ヒトSEPタンパク質の酵素(タンパク質分解)活性は、例えば、ヒトSEP酵素の試料と基質ペプチドとを緩衝液(例えば、50mM HEPES;pH7.4)中で混合し、その混合物を、SEP活性に適当な温度(典型的には、30〜37℃)で、ヒトSEPが作用してペプチド基質の測定可能な部分を生成物に切断するのに充分な一定時間(1〜3時間など)インキュベートすることを含む検定で測定することができる。その後、タンパク質分解の基質および/または生成物を分析して、その基質がSEP酵素によって切断されたことを示すことができる。
【0140】
ヒトSEPの活性を変化させることができるホスホラミドンおよびチオルファンのような、候補ヒトSEP阻害剤化合物または対照試験化合物の作用は、それらを初期混合物中に、典型的には、0.1nM〜50μMの適当な試験濃度の範囲で含めることによってこのタイプの検定で測定することができる。
【0141】
上のタイプの検定で用いるのに適したSEP酵素の試料は、組換え発現系を用いて生じることができる。これは、典型的には、ヒトSEP cDNAまたは遺伝子(例えば、NCIMB41110より入手可能な発現ベクター)を含有する発現プラスミドを宿主生物または細胞中に導入後、そこでヒトSEPタンパク質を発現させることを含むであろう。SEPタンパク質は、(例えば、哺乳動物細胞中で人為的に発現させる場合)その宿主から増殖培地中に放出される(すなわち、細胞外に分泌される)ことがありうるし、または細胞中に保持されることがありうる(例えば、酵母または昆虫細胞中で人為的に発現させる場合、そこでは、可能性のある不適切な発現は、ヒトSEPを細胞から分泌させないことがあり、したがって、その細胞内部位からの単離を必要とすることがありうる)。典型的には、その宿主は、酵母、昆虫細胞、哺乳動物細胞または細菌でありうる。次に、SEP酵素を、タンパク質精製法を用いる必要がありうる培地または宿主細胞から(例えば、細胞を溶解することによって)回収することができる。
【0142】
前述の検定のためのヒトSEP酵素は、(充分な量が入手可能である場合)適当な組織源から精製されてもよい。この組織には、精巣または脳が含まれうる。 ヒトSEP検定で用いるのに適した基質は、有用な一定時間内に、例えば、5時間以内に測定可能な速度でSEPが切断することができるいずれのペプチドでもありうる。このような基質ペプチドには、エンケファリン、VIP、ブラジキニン、サブスタンスP、ビッグエンドセリン、エンドセリン、アンギオテンシン−IまたはANPのような生物ペプチドと同様であるまたは類似したペプチドが含まれうるが、これらに制限されるわけではない。このペプチドは、検定前、中または後の基質および/または生成物の測定を容易にするであろう蛍光基、着色基、放射性基または他の化学基を含むように修飾されうる。
【0143】
ヒトSEP検定で用いるのに適した好ましい基質は、少なくとも1種類の蛍光ドナー色素および少なくとも1種類の蛍光アクセプター色素で標識されたSEP切断可能合成ペプチドであり、このSEP切断(タンパク質分解)の阻害を検出するのに用いられる検定は、蛍光共鳴エネルギー移動(FRET)検定である。最も好ましくは、この標識された基質ペプチドは、低分子量蛍光原性ペプチド、好ましくは、ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2である。
【0144】
このようなFRETに基づくSEP検定は、NEPと一緒の使用について、Carvalho et al によって開発された検定に基づいている(Carvalho et al., Annal.Biochem. 237,pp.167−173(1996))。SEP FRET検定は、類似の分子内消光蛍光原性ペプチド基質を利用するが、蛍光原性ドナー/アクセプター色素の新規な組合せ、具体的には、ローダミングリーン(Molecular Probes,Inc.)およびQSY7(Molecular Probes,Inc.)を利用する。
【0145】
合成標識基質ペプチドローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2の製造を、実施例の項(以下)に詳述する。
【0146】
ヒトSEP検定で用いるのに適した緩衝液は、その中でヒトSEPが活性であることが判明していて、それ以外には、検定の最終結果の妨げにならないもののいずれかでありうる。通常は、これは、中性pHを維持する緩衝液であろう。このような緩衝液の一例は、50mMトリスCl;pH7.4である。しかしながら、このような緩衝液は、トリスが、温度変動のためにpHを極めて変化させやすいので、ヒトSEP FRET検定で用いるのに好ましくない。したがって、ヒトSEP FRET検定で用いるのに好ましい緩衝液は、50mM HEPES;pH7.4である。
【0147】
ヒトSEP検定での基質および/または生成物の測定方法は、選択されるペプチド基質およびその修飾の性状に依存するであろう。例えば、選択される基質が蛍光基を含有する場合、蛍光計を用いることができる。同様に、基質が放射性標識されている場合、シンチレーション計数計を用いてよい。大部分の基質および生成物は、高速液体クロマトグラフィー(HPLC)または質量分析法を用いて測定することができ、これらは、その基質が放射性標識または蛍光標識を含むように修飾されなかった場合に選択される方法であると考えられる。
【0148】
更に、ヒトSEPをコードしているヌクレオチド配列またはそれに相補的である配列も、検定において、ヒト細胞中のヒトSEPコーディング配列の存在を検出するのに用いることができる。これら検定は、この酵素の組織分布および特定の疾患状態に関するその生物学的妥当性についての情報を提供すると考えられる。
【0149】
本発明は、ヒトSEP(その誘導体、フラグメント、ホモログまたは変異体を含めた)に対する抗体も包含する。ヒトSEPに対する抗体は、検定において、ヒト細胞中のヒトSEPの存在を検出するのに用いることができる。これら検定は、この酵素の組織分布および特定の疾患状態に関するその生物学的妥当性についての情報を提供すると考えられる。
【0150】
本発明は、更に、ヒトSEP配列のスプライス変異体(イソ酵素)を包含する。具体的には、ヒトSEPイソ酵素、それをコードしているヌクレオチド配列、それに相補的であるヌクレオチド配列、およびそれに向けられた抗体のいずれか一つまたはそれを越えるものを検定で用いて、それらイソ酵素の一つに選択的に影響を与える試剤についてスクリーニングすることができる。これら検定は、これらイソ酵素各々の組織分布についての情報を提供し且つ特定の疾患状態に関するこれらイソ酵素各々の生物学的妥当性についての情報を提供すると考えられる。これら検定は、更に、当業者が、特定の組織または特定の疾患状態などにおいて、ヒトSEPの発現または活性に影響を与えるのに有用な試剤について調べ且つそれを識別することを可能にすると考えられる。
【0151】
本発明のポリペプチド
“タンパク質”という用語と同じ意味である“ポリペプチド”という用語には、一本鎖ポリペプチド分子、並びに個々の構成ポリペプチドが共有または非共有手段によって連結されている多重ポリペプチド複合体が含まれる。
【0152】
好ましくは、本発明のポリペプチドは、一本鎖ポリペプチドである。
本発明のポリペプチドは、実質的に単離された形であってよい。このポリペプチドは、ポリペプチドの予定の目的を妨げることがない担体または希釈剤と混合されてよいし、なお実質的に単離されたとみなされてよいということは理解されるであろう。本発明のポリペプチドは、実質的に精製された形であってもよく、この場合、それは、概して、標品中の90%を越える、例えば、95%、98%または99%のポリペプチドが本発明のポリペプチドである標品中のポリペプチドを構成するであろう。本発明のポリペプチドは、それらの精製を助けるように、例えば、ヒスチジン残基の付加によって修飾されてよい。
【0153】
本発明のポリペプチドは、下記のように、合成手段によって(例えば、Geysen et al., 1996 によって記載のように)または組換えによって生じることができる。
【0154】
好ましい態様において、本発明のアミノ酸配列は、それがその自然環境中にある場合、およびそれが、その自然環境中にもあるその天然のヌクレオチドコーディング配列によって発現されている場合、およびそのヌクレオチド配列が、その自然環境中にもあるその天然のプロモーターの制御下にある場合、それ自体では本発明の天然のヒトSEPを包含しない。参照しやすくするために、本発明者は、この好ましい態様を“非天然アミノ酸配列”と称している。
【0155】
本発明の酵素のアミノ酸配列に関する、“変異体”、“ホモログ”、“誘導体”または“フラグメント”という用語には、その配列からのまたはその配列への一つの(またはそれを越える)アミノ酸のいずれかの置換、変異、修飾、交換、欠失または付加が含まれるが、但し、得られた酵素はSEP活性を有する、好ましくは、添付の配列番号:2に示される酵素と少なくとも同程度に生物学的に活性であるという条件付きである。具体的には、“ホモログ”という用語は、構造および/または機能に関する相同性を包含する。配列相同性に関して、好ましくは、配列番号:2に示される配列に、少なくとも78%、より好ましくは、少なくとも85%、より好ましくは、少なくとも90%の相同性が存在する。より好ましくは、配列番号:2に示される配列に、少なくとも95%、より好ましくは、少なくとも98%の相同性が存在する。
【0156】
典型的には、本発明の変異体、ホモログ、誘導体またはフラグメントについて、行われうるアミノ酸置換のタイプは、そのアミノ酸配列の疎水性/親水性を維持すべきである。アミノ酸置換は、例えば、1、2または3〜10、20または30の置換が行われてよいが、但し、その修飾された配列は、本発明によるSEP酵素として作用する能力を保持しているという条件付きである。アミノ酸置換には、例えば、血漿半減期を増加させるための、天然に存在しない類似体の使用が含まれてよい。
【0157】
本発明のアミノ酸配列は、適当な発現系におけるそれをコードしているヌクレオチド配列の発現によって生じることができる。
更に、または代わりに、タンパク質自体は、化学的方法を用いて、ヒトSEPアミノ酸配列を全部または一部分合成して生じうると考えられる。例えば、ペプチドは、固相法によって合成し、樹脂から切断し、そして分取用高性能液体クロマトグラフィーによって精製することができる(例えば、Creighton (1983) Proteins Structures and Molecular Principles, WH Freeman and Co., New York, NY, USA)。これら合成ペプチドの組成は、アミノ酸配列分析またはシークエンス法(例えば、エドマン分解法)によって確認することができる。
【0158】
直接ペプチド合成は、種々の固相法を用いて行うことができ(Roberge JY et al, Science, Vol 269,1995,pp.202−204)、自動合成は、例えば、ABI431A Peptide Synthesizer(Perkin Elmer, Boston, MA, USA)を用いて、製造者によって提供される取扱い説明書にしたがって行ってよい。更に、ヒトSEPのアミノ酸配列またはそのいずれか一部分は、直接合成中に変更されてよいしおよび/または化学的方法を用いて、他のサブユニットからの配列またはそのいずれか一部分と一緒に組み合わされて、変異ポリペプチドを生じてよい。
【0159】
本発明のもう一つの態様において、ヒトSEPの天然の、修飾されたまたは組換えの配列は、異種配列に連結されて、融合タンパク質をエンコードすることができる。例えば、SEP活性の阻害剤のペプチドライブラリーのスクリーニングについて、それは、市販の抗体によって認識される異種エピトープを発現するキメラSEPタンパク質をエンコードするのが有用でありうる。融合タンパク質は、SEP配列とその異種タンパク質配列との間に位置する切断部位を含有するように遺伝子操作することもできるので、そのSEPは、異種部分から切断され且つ精製されることができる。
【0160】
ヒトSEPは、タンパク質精製を容易にするように加えられた一つまたはそれを越える追加のポリペプチドドメインを含む組換えタンパク質として発現されてもよい。このような精製を容易にするドメインには、固定化金属上での精製を可能にするヒスチジン−トリプトファンモジュールのような金属キレートペプチド(Porath J, Protein Expr.Purif., Vol 3,1992,pp.263−281)、固定化免疫グロブリン上での精製を可能にするプロテインAドメイン、およびFLAGS伸長/アフィニティー精製システム中で利用されるドメイン(Immunex Corp, Seattle, WA, USA)が含まれるが、これらに制限されるわけではない。この精製用ドメインとSEPとの間のXA因子またはエンテロキナーゼ(Invitrogen, San Diego, CA, USA)のような切断可能リンカー配列の包含は、精製を容易にするのに有用である。
【0161】
ヒトSEPの特定のアミノ酸配列を、配列番号:2に示す。しかしながら、本発明は、その特定のアミノ酸配列に少なくとも78%の同一性(より好ましくは、少なくとも85%の同一性)を有するアミノ酸配列が含まれると考えられるSEPファミリーからの他のメンバーをエンコードしているアミノ酸配列を包含する。
【0162】
本発明のポリペプチドには、本アミノ酸配列のフラグメントおよびそれらの変異体も含まれる。適当なフラグメントは、少なくとも5、例えば、少なくとも10、12、15または20アミノ酸のサイズであろう。
【0163】
本発明のポリペプチドは、保存置換を含めた一つまたはそれを越える(例えば、少なくとも2、3、5または10の)置換、欠失または挿入を含有するように修飾されてもよい。これら側面を、後の項で考察する。
【0164】
本発明のヌクレオチド配列
本明細書中で用いられる“ヌクレオチド配列”という用語は、オリゴヌクレオチド配列またはポリヌクレオチド配列、および(その一部分などの)その変異体、ホモログ、フラグメントおよび誘導体を意味する。このヌクレオチド配列は、センス鎖であれアンチセンス鎖であれ、二本鎖または一本鎖であってよいゲノムまたは合成またはリコンビナント由来であってよいDNAまたはRNAでありうる。
【0165】
好ましくは、“ヌクレオチド配列”という用語はDNAを意味する。
より好ましくは、“ヌクレオチド配列”という用語は、組換えDNA技術の使用によって製造されるDNA(すなわち、組換えDNA)を意味する。
【0166】
好ましい態様において、本発明のヌクレオチド配列は、それが、その自然環境中にもあるその天然のプロモーターの制御下にある場合、それ自体ではその自然環境中にある本発明の天然のヌクレオチドコーディング配列を包含しない。参照しやすくするために、本発明者は、この好ましい態様を“非天然ヌクレオチド配列”と称している。
【0167】
本発明のヌクレオチド配列は、それらの中に、合成または修飾ヌクレオチドを含んでよい。オリゴヌクレオチドへの多数の異なったタイプの修飾が当該技術分野において知られている。これらには、メチルホスホネートおよびホスホロチオエート主鎖、分子の3’および/または5’末端におけるアクリジンまたはポリリシン鎖の付加が含まれる。本発明の目的について、本明細書中に記載のヌクレオチド配列を、当該技術分野において利用可能ないずれの方法によっても修飾することができるということは理解されるはずである。このような修飾は、本発明のヌクレオチド配列の in vivo 活性または寿命を増進させるように行うことができる。
【0168】
本発明は、更に、本明細書中に示される配列に相補的であるヌクレオチド配列、またはいずれのそれらの誘導体、フラグメントまたは変異体も包含する。配列がそのフラグメントに相補的である場合、その配列は、他の生物等における類似のコーディング配列を識別するプローブに用いることができる。
【0169】
本発明は、更に、本明細書中に示される配列にハイブリッド形成することができるヌクレオチド配列、またはいずれのそれらの誘導体、フラグメントまたは変異体も包含する。
【0170】
本発明は、更に、本明細書中に示される配列に相補的である配列にハイブリッド形成することができるヌクレオチド配列、またはいずれのそれらの誘導体、フラグメントまたは変異体も包含する。
【0171】
“変異体”という用語は、本明細書中に示されるヌクレオチド配列にハイブリッド形成することができる配列に相補的である配列も包含する。
好ましくは、“変異体”という用語は、本明細書中に示されるヌクレオチド配列に、ストリンジェント条件下(例えば、65℃および0.1xSSC{1xSSC=0.15M NaCl,0.015クエン酸Na3 pH7.0})でハイブリッド形成することができる配列に相補的である配列を包含する。
【0172】
本発明は、更に、(本明細書中に示される配列の相補的配列を含めた)本発明のヌクレオチド配列にハイブリッド形成することができるヌクレオチド配列に関する。
【0173】
本発明は、更に、(本明細書中に示される配列の相補的配列を含めた)本発明のヌクレオチド配列にハイブリッド形成することができる配列に相補的であるヌクレオチド配列に関する。
【0174】
本発明の範囲内に更に含まれるのは、本明細書中に示されるヌクレオチド配列に、中間〜最大のストリンジェンシー条件下でハイブリッド形成することができるポリヌクレオチド配列である。
【0175】
好ましい側面において、本発明は、本発明のヌクレオチド配列またはその相補鎖に、ストリンジェント条件下(例えば、65℃および0.1xSSC)でハイブリッド形成することができるヌクレオチド配列を包含する。
【0176】
典型的な核酸は、他に、ヒトSEPタンパク質をエンコードし、および配列番号:1または配列番号:5に示されるDNA配列にハイブリッド形成するヌクレオチド配列として特徴付けることができる。好ましいのは、配列番号:1または配列番号:5に示される配列またはその相補鎖に高ストリンジェンシー条件下でハイブリッド形成するヒトSEPをエンコードしているような配列である。
【0177】
好都合には、本発明は、配列番号:1または配列番号:5に示される配列またはその相補鎖のフラグメントにストリンジェント条件下でハイブリッド形成することができる核酸配列を提供する。好ましくは、そのフラグメントは、15〜50塩基の長さである。好都合には、それは約25塩基の長さである。
【0178】
本発明の好ましい酵素をコードしているヌクレオチド配列に関して、“変異体”、“ホモログ”、“誘導体”または“フラグメント”という用語には、その配列からのまたはその配列への一つの(またはそれを越える)核酸のいずれかの置換、変異、修飾、交換、欠失または付加が含まれるが、但し、得られたヌクレオチド配列は、SEP活性を有する、好ましくは、配列番号:1または配列番号:5に示される配列によってエンコードされた酵素と少なくとも同程度に生物学的に活性である酵素をコードするまたはコードすることができるという条件付きである。具体的には、“ホモログ”という用語は、構造および/または機能に関する相同性を包含するが、但し、得られたヌクレオチド配列は、SEP活性を有する酵素をコードするまたはコードすることができるという条件付きである。配列相同性に関して、好ましくは、配列番号:2に示されるアミノ酸配列をコードしているヌクレオチド配列に、少なくとも83%、より好ましくは、少なくとも85%、より好ましくは、少なくとも90%の相同性が存在する。より好ましくは、配列番号:2に示されるアミノ酸配列をコードしているヌクレオチド配列に、少なくとも95%、より好ましくは、少なくとも98%の相同性が存在する。配列相同性に関して、好ましくは、配列番号:1または配列番号:5に示される配列に、少なくとも83%、より好ましくは、少なくとも87%、より好ましくは、少なくとも90%の相同性が存在する。より好ましくは、配列番号:1または配列番号:5に示される配列に、少なくとも95%、より好ましくは、少なくとも98%の相同性が存在する。
【0179】
示されるように、本発明は、ヒトSEPをエンコードしているDNA配列(好ましくは、cDNA配列)に関する。具体的には、本発明は、ヒトSEPをエンコードしているcDNA配列に関する。
【0180】
本発明は、更に、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含むDNAセグメントに関する。
本発明は、更に、前述のDNA配列またはそれらの対立遺伝子変異が包含された宿主細胞中での発現によって生じるポリペプチドに関する。
【0181】
本発明は、更に、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含むDNAに関し、それを提供する。
本発明は、更に、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含む非天然DNAに関する。
【0182】
本発明の極めて好ましい側面は、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含む組換えDNAに関する。
本発明のポリヌクレオチドには、本発明のポリペプチドをエンコードしている核酸配列が含まれる。一定範囲の異なったポリヌクレオチドが、ある与えられたアミノ酸配列を遺伝コードの縮重の結果としてエンコードするということは理解されるであろう。
【0183】
本明細書中に示されるアミノ酸配列の情報により、本発明のポリペプチドをエンコードするcDNAおよび/またはゲノムクローンなどの部分および完全長の核酸配列を案出することは可能である。例えば、本発明のポリヌクレオチドは、本明細書中に示されるアミノ酸配列をエンコードしている配列に指向するように設計されたプライマーを用いる縮重ポリメラーゼ連鎖反応(PCR)を用いて得ることができる。これらプライマーは、典型的には、多数の縮重位置を含有するであろう。しかしながら、縮重を最小限にするために、たった一つのトリプレットによってコードされるメチオニンのようなアミノ酸を含有する本明細書中に示されるアミノ酸配列の領域をエンコードする配列が選択されるであろう。更に、配列は、PCR法の鋳型DNAとしてその核酸が用いられる生物中でのコドン使用を考慮するように選択されるであろう。PCRは、既知の配列に対する単一配列(非縮重)プライマーを含む配列をクローニングするのに用いられるものより低いストリンジェンシー条件で用いられるであろう。
【0184】
次に、本発明のポリペプチドフラグメントをエンコードする、PCRによって得られた核酸配列を用いて、ハイブリダイゼーションライブラリースクリーニング技術を用いてより大きい配列を得ることができる。例えば、PCRクローンを、放射性原子で標識して、他の種、好ましくは、他の哺乳動物種からのcDNAまたはゲノムライブラリーをスクリーニングするのに用いることができる。ハイブリダイゼーション条件は、典型的には、中〜高ストリンジェンシー条件(例えば、約50℃〜約60℃において0.03M塩化ナトリウムおよび0.03Mクエン酸ナトリウム)であろう。
【0185】
アミノ酸配列の全部または一部分をエンコードしている縮重核酸プローブは、他の種、好ましくは、他の哺乳動物種からのcDNAおよび/またはゲノムライブラリーをプローブするのに用いることもできる。しかしながら、PCR法を行って、追加のスクリーニング法で用いるための単一配列を最初に得ることが好適である。
【0186】
本発明により、ヒトSEP、ポリペプチドのフラグメント、融合タンパク質またはその機能的均等物をエンコードするポリヌクレオチド配列は、適当な宿主細胞中でのヒトSEPの発現を指示する組換えDNA分子を生じるのに用いることができる。遺伝コードの固有の縮重のために、実質的に同じまたは機能的に均等なアミノ酸配列をエンコードする他のDNA配列は、ヒトSEPをクローン化し且つ発現するのに用いることができる。当業者によって理解されるように、天然に存在しないコドンを有する、ヒトSEPをエンコードしているヌクレオチド配列を生じることは好都合でありうる。特定の原核生物または真核生物宿主に好適なコドン(Murray E et al, (1989), Nuc.Acids Res., 17:477−508)は、例えば、ヒトSEP発現の速度を増加させるように、または天然に存在する配列から生じる転写物より長い半減期などの望ましい性状を有する組換えRNA転写物を生じるように選択することができる。
【0187】
上記の技法を用いて得られる本発明のポリヌクレオチド配列は、上記の技法を用いて更に別の相同配列および変異体を得るのに用いることができる。それらは、例えば、それらポリヌクレオチド配列が発現されている特定の宿主細胞についてコドン選択を最適にするように、種々の宿主細胞系において本発明のポリペプチドを発現させる場合に用いるために修飾されてもよい。他の配列変化は、制限酵素認識部位を導入するために、またはそれらポリヌクレオチドによってエンコードされるポリペプチドの性状または機能を変更するために望まれることがありうる。
【0188】
本発明によって用いることができる変更されたヒトSEPポリヌクレオチド配列には、同じまたは機能的に均等なSEPをエンコードするポリヌクレオチドを生じる異なるヌクレオチド残基の欠失、挿入または置換が含まれる。そのタンパク質は、サイレント変化を生じ且つ機能的に均等なSEPを生じるアミノ酸残基の欠失、挿入または置換を有してもよい。計画的なアミノ酸置換は、SEPの生物学的活性が保持される限りにおいて、それら残基の極性、電荷、溶解性、疎水性、親水性および/または両親媒性の性質の類似性に基づいて行われてよい。例えば、陰電荷アミノ酸には、アスパラギン酸およびグルタミン酸が含まれ;陽電荷アミノ酸には、リシンおよびアルギニンが含まれ;そして類似した親水性値を有する非荷電極性頭部基を含むアミノ酸には、ロイシン、イソロイシン、バリン、グリシン、アラニン、アスパラギン、グルタミン、セリン、トレオニン、フェニルアラニンおよびチロシンが含まれる。
【0189】
本発明の範囲内に含まれるのは、ヒトSEPの対立遺伝子である。本明細書中で用いられる“対立遺伝子”または“対立遺伝子配列”は、ヒトSEPの別の形である。対立遺伝子は、突然変異、すなわち、核酸配列の変化によって生じ、そして概して、変更されたmRNAまたはポリペプチドを生じるが、その構造または機能は変更されていてよいしまたはされていなくてよい。いずれの与えられた遺伝子も、対立遺伝子形を有しない、または一つもしくは多数有していてもよい。対立遺伝子を生じる共通の突然変異変化は、概して、アミノ酸の欠失、付加または置換による。これらの変化のタイプの各々は、ある与えられた配列中において単独でまたは他のものとの組合せで1回またはそれを超えて起こりうる。
【0190】
本発明のヌクレオチド配列は、遺伝子産物のクローニング、プロセシングおよび/または発現を修飾する変更が含まれるがこれに制限されるわけではない種々の理由でヒトSEPコーディング配列を変更するために遺伝子操作することができる。例えば、突然変異を、当該技術分野において周知である技法、例えば、部位特異的突然変異誘発を用いて導入して、新しい制限部位を挿入する、グリコシル化パターンを変更するまたはコドン選択を変化させることができる。
【0191】
本発明のポリヌクレオチドは、プライマー、例えば、PCRプライマー、代わりの増幅反応のためのプライマー、プローブであって、例えば、放射性または非放射性標識を用いて慣用的な手段によって明らかになる標識で標識されたものを生じるのに用いることができるし、またはそれらポリヌクレオチドは、ベクター中にクローン化することができる。このようなプライマー、プローブおよび他のフラグメントは、少なくとも15、好ましくは、少なくとも20、例えば、少なくとも25、30または40ヌクレオチドの長さであろうが、これらも、本明細書中で用いられる本発明のポリヌクレオチドという用語によって包含される。
【0192】
本発明のポリヌクレオチドまたはプライマーは、明らかになる標識を有してよい。適当な標識には、32Pまたは35Sのような放射性同位体、酵素標識、またはビオチンのような他のタンパク質標識が含まれる。このような標識は、本発明のポリヌクレオチドまたはプライマーに加えることができるし、当該技術分野において知られている技法によって検出することができる。
【0193】
本発明によるDNAポリヌクレオチドのようなポリヌクレオチドおよびプライマーは、組換えによって、合成によって、または当業者に利用可能ないずれの手段によっても製造することができる。それらも、標準的な技法によってクローン化することができる。
【0194】
概して、プライマーは、所望の核酸配列の一度に一つのヌクレオチドの段階的製造を含む合成手段によって製造されるであろう。自動化された技法を用いてこれを行う技法は、当該技術分野において容易に利用可能である。
【0195】
より長いポリヌクレオチドは、概して、組換え手段を用いて、例えば、PCRクローニング法を用いて製造されるであろう。これは、クローン化することが望まれるヌクレオチド配列の領域に(例えば、約15〜30ヌクレオチドの)1対のプライマーを製造し、それらプライマーを、例えば、真菌、植物または原核細胞から得られるmRNAまたはcDNAと接触させ、所望の領域の増幅をもたらす条件下でポリメラーゼ連鎖反応を行い、増幅されたフラグメントを(例えば、反応混合物をアガロースゲル上で精製することによって)単離し、そして増幅されたDNAを回収することを含むであろう。それらプライマーは、適当な制限酵素認識部位を含有するように設計することができるので、増幅されたDNAは、適当なクローニングベクター中にクローン化することができる。
【0196】
DNA分子は、細胞内安定性および半減期を増加させるように修飾されてよい。可能な修飾には、その分子の5’および/または3’末端のフランキング配列の付加、またはその分子の主鎖中でのホスホジエステラーゼ結合よりむしろホスホロチオエートまたは2’O−メチルの使用が含まれるが、これらに制限されるわけではない。
【0197】
初めの方で述べられたように、本発明は、更に、配列番号:1または配列番号:5に示される配列またはその対立遺伝子変異の全部または一部分にハイブリッド形成することができるヌクレオチド配列に関する。これらヌクレオチド配列は、アンチセンス法において、ヒトSEP発現を修飾するために用いてもよい。或いは、これら配列(またはそれらの一部分)は、プローブとして用いることができるし、またはPCRプライマーとして用いられる場合のこのような配列の全部または一部分を増幅させるのに用いることができる。
【0198】
組換えDNA配列に加えて、ゲノム配列も、薬物発見の場合に有用である。その翻訳されたタンパク質を阻害するよりもむしろ、特定のイソ型のmRNA転写を阻害することが有益でありうる。これは、スプライス変異体が存在し、それら異なったスプライス変異体が異なったプロモーターから転写されうる場合、ヒトSEPについても当てはまりうる。
【0199】
本発明のもう一つの有用性は、DNA配列が、いったん知られると、イソ酵素またはスプライス変異体を特異的に検出する検定を設計するのに必要とされる情報を与えるということである。イソ酵素特異的PCRプライマー対は、イソ酵素またはスプライス変異体の特異的DNA配列の情報に完全に依存する検定の唯一の例である。このような検定は、特定の疾患状態への各々のイソ酵素の組織分布および生物学的関係を評価するイソ酵素についてのmRNAの検出を可能にする。それは、唯一のイソ酵素を天然に発現しうる細胞系の同定、すなわち、組換え遺伝子を発現する必要性をなくするかもしれない発見も可能にする。特定のヒトSEPイソ酵素が特定の疾患状態に関連していることが示されるならば、本発明は、イソ酵素mRNAの存在を検出する診断用検定の設計において有益であると考えられる。
【0200】
ヒトSEP酵素をエンコードしているヌクレオチド配列の生体試料中での異常レベルは、核酸欠失または突然変異のような染色体異常に反映することがありうる。したがって、ヒトSEP酵素をエンコードしているヌクレオチド配列は、ヒトSEPをエンコードしている遺伝子中の欠失、突然変異または染色体転座のような染色体異常を診断用に検出するのに用いることができるプローブの基準を提供する。ヒトSEP遺伝子発現は、このような疾患状態において変更されることがありうるし、またはヒトSEPをエンコードしている遺伝子の領域中に存在する染色体異常がありうる。
【0201】
本発明の別の態様において、ヒトSEPのコーディング配列は、当該技術分野において周知の化学的方法を用いて全部または一部分合成されうる(Caruthers MH et al, (1980), Nuc. Acids Res. Symp. Ser., pp.215−223; Horn T et al, (1980), Nuc. Acids Res. Symp. Ser., pp.225−232 を参照されたい)。
【0202】
天然に存在する
本明細書中で用いられる“天然に存在する”は、天然に見出されるアミノ酸配列を含むヒトSEPに関する。
【0203】
単離された/精製された
本明細書中で用いられる“単離された”および“精製された”という用語は、核酸配列かまたはアミノ酸配列の分子であって、それらの自然環境から取り出され且つそれらが天然に関連している少なくとも一つの他の成分から単離されまたは分離される分子に関する。
【0204】
生物学的に活性な
本明細書中で用いられる“生物学的に活性な”は、天然に存在するヒトSEPの(同程度の必要はないが)類似した構造機能および/または(同程度の必要はないが)類似した調節機能および/または(同程度の必要はないが)類似した生化学的機能および/または(同程度の必要はないが)免疫学的活性を有する、組換えヒトSEPのような本発明によるヒトSEPに関する。具体的には、本発明のヒトSEPは、一定のペプチド基質をタンパク質分解によって切断する能力を有し、これは、本発明のヒトSEP酵素の特徴的な活性の一つである。
【0205】
免疫学的活性
本明細書中で用いられる“免疫学的活性”は、適当な動物または細胞中において特異的免疫応答を引き起こし且つ特異的抗体と結合する、天然の、組換えまたは合成のヒトSEPまたはそのいずれかのオリゴペプチドの能力として定義される。
【0206】
誘導体
アミノ酸配列に関して本明細書中で用いられる“誘導体”という用語には、ヒトSEPの化学修飾が含まれる。このような修飾を代表するものは、アルキル基、アシル基またはアミノ基による水素の交換であると考えられる。
【0207】
欠失
本明細書中で用いられる“欠失”は、それぞれ一つまたはそれを越えるヌクレオチドまたはアミノ酸の残基を欠いているヌクレオチド配列かまたはアミノ酸配列の変化として定義される。
【0208】
挿入/付加
本明細書中で用いられる“挿入”または“付加”は、天然に存在するヒトSEPと比較して、それぞれ一つまたはそれを越えるヌクレオチドまたはアミノ酸の残基の付加を生じているヌクレオチド配列またはアミノ酸配列の変化である。
【0209】
置換
本明細書中で用いられる“置換”は、それぞれ異なったヌクレオチドまたはアミノ酸による一つまたはそれを越えるヌクレオチドまたはアミノ酸の交換によって生じる。
【0210】
ホモログ
本発明のヌクレオチド配列および本発明のアミノ酸配列に関する“ホモログ”という用語は、それら配列の対立遺伝子変異と同意語でありうる。
【0211】
具体的には、本明細書中で用いられる“相同性”という用語は、“同一性”という用語と等しいことがありうる。ここでは、本発明のヌクレオチド配列および本発明のアミノ酸配列に関する配列相同性を、いずれか一つまたはそれを越える配列と別の配列との、その他の配列がヌクレオチド配列への少なくとも83%の同一性およびアミノ酸配列への少なくとも78%の同一性を有するかどうか確かめる簡単な“眼球”比較(すなわち、厳密な比較)によって決定することができる。相対配列相同性(すなわち、配列同一性)は、二つまたはそれを越える配列間の相同性百分率(%)を計算することができる市販の計算機プログラムによって決定することもできる。このような計算機プログラムの典型的な例は、CLUSTALおよびBLASTである。
【0212】
相同性百分率(%)は、連続した配列、すなわち、一つの配列が他の配列と並んでいる配列にわたって計算することができ、一つの配列中の各アミノ酸と他の配列中の該当するアミノ酸とで、一度に一つの残基を直接的に比較することができる。これを、“ギャップなし(ungapped)”アラインメントと称する。典型的には、このようなギャップなしアラインメントは、比較的少数の残基(例えば、50未満の連続したアミノ酸)にわたってのみ行われる。
【0213】
これは、極めて簡単な且つ首尾一貫した方法であるが、例えば、それ以外に一致する配列対の場合、一つの挿入または欠失が続くアミノ酸残基をアラインメントからはずれさせ、それによって、全体的なアラインメントが行われる場合に相同性%を大きく減少させる可能性があるということを考慮することができない。したがって、大部分の配列比較法は、全相同性スコアを過度に不利にすることなく、可能な挿入および欠失を考慮する最適アラインメントを生じるように設計される。これは、配列アラインメント中に“ギャップ”を挿入して、局部相同性を最大にすることを試みることによって達せられる。
【0214】
しかしながら、これら一層複雑な方法は、アラインメント中にある各々のギャップに“ギャップペナルティー”を振り分けるので、一致するアミノ酸の同数について、可能な限り少ないギャップを含む配列アラインメントは、二つの比較される配列間のより高い関係性に反映し、多数のギャップを含むものより高いスコアに達するであろう。典型的には、ギャップの存在について比較的高いコストおよびギャップ中の次の残基各々についてより小さいペナルティーを課す“アフィンギャップコスト(affine gap costs)”を用いる。これは、最も一般的に用いられるギャップ評点システムである。高いギャップペナルティーは、当然ながら、より少ないギャップを含む最適のアラインメントを生じるであろう。大部分のアラインメントプログラムは、ギャップペナルティーを変更させる。しかしながら、配列比較のためにこのようなソフトウェアを用いる場合、デフォルト値を用いることが好適である。例えば、GCG Wisconsin Bestfit パッケージ(下を参照されたい)を用いる場合、アミノ酸配列についてのデフォルト値ギャップペナルティーは、ギャップに−12および伸長毎に−4である。
【0215】
したがって、最大相同性%の計算は、最初に、ギャップペナルティーを考慮した最適アラインメントの作成を必要とする。このようなアラインメントを実施するのに適当な計算機プログラムは、GCG Wisconsin Bestfit パッケージ(University of Wisconsin, U.S.A.; Devereux et al., 1984, Nucleic Acids Research 12:387)である。配列比較を行うことができる他のソフトウェアの例には、BLASTパッケージ(Ausubel et al., 1999 ibid− Chapter 18 を参照されたい)、FASTA(Altschul et al., 1990, J. Mol. Biol., 403−410)およびGENEWORKS比較ツールセット(suite of comparison tools)が含まれるが、これらに制限されるわけではない。BLASTおよびFASTAは両方とも、オフラインおよびオンライン検索に利用可能である(Ausubel et al., 1999 ibid, pages 7−58 to 7−60 を参照されたい)。しかしながら、若干の応用には、GCG Bestfit プログラムを用いるのが好適である。
【0216】
最終相同性%は、同一性の点から測定することができるが、いくつかの場合、アラインメント操作自体、典型的には、全か無か(all−or−nothing)の対比較に基づいていない。その代わり、化学的類似性または進化論的距離に基づく各々の対合比較にスコアを振り分ける階級化した(scaled)類似性スコアマトリックスを用いる。一般的に用いられるこのようなマトリックスの一例は、BLASTプログラムセットのデフォルト値マトリックスであるBLOSUM62マトリックスである。GCG Wisconsin プログラムは、概して、パブリックデフォルト値、または供給される場合、カスタム記号比較表を用いる(更に詳細については使用者マニュアルを参照されたい)。GCGパッケージにパブリックデフォルト値、または他のソフトウェアの場合、BLOSUM62のようなデフォルト値マトリックスを用いるのは好適である。
【0217】
ソフトウェアで最適アラインメントが作成されたら、相同性%、好ましくは、配列同一性%を計算することは可能である。そのソフトウェアは、典型的に、これを配列比較の一部分として行い、数値結果を生じる。
【0218】
示されるように、いくつかの応用について、配列相同性(または同一性)は、いずれか適当な相同性アルゴリズムを用いて、例えば、デフォルト値パラメーターを用いて決定することができる。配列データベースの類似性検索における基本的な問題点の考察については、Altschul et al., (1994) Nature Genetics 6:119−129 を参照されたい。いくつかの応用について、BLASTアルゴリズムを、デフォルト値に設定されるパラメーターと一緒に用いる。BLASTアルゴリズムは、http://www.ncbi.nih.gov/BLAST/blast help.html において詳細に記載されている。好都合には、BLASTによって評価される場合の“実質的な相同性”は、少なくとも約e−7、好ましくは、少なくとも約e−9、そして最も好ましくは、e−10またはそれより低いEXPECT値に合う配列に等しい。BLAST検索におけるEXPECTのデフォルトの閾値は、通常は10である。
【0219】
配列同一性を決定する場合にギャップペナルティーを用いることが可能ならば、好ましくは、次のパラメーターを用いる。
【0220】
【表1】
二つの配列間の同一性および類似性を決定する他の計算機プログラム法には、GCGプログラムパッケージ(Devereux et al., 1984, Nucleic Acids Research 12:387)およびFASTA(Altschul et al., 1990, J. Molec. Biol., pp.403−410)が含まれるが、これらに制限されるわけではない。
【0221】
ポリペプチド変異体および誘導体
本発明のアミノ酸配列に関する“変異体”または“誘導体”という用語には、その配列からのまたは配列への一つの(またはそれを越える)アミノ酸のいずれかの置換、変異、修飾、交換、欠失または付加が含まれるが、但し、得られたアミノ酸配列はヒトSEP活性を有する、好ましくは、配列番号:2に示されるポリペプチドと少なくとも同じ活性を有するという条件付きである。
【0222】
本発明の配列は、本発明で用いるために修飾されてよい。典型的には、その配列のヒトSEP活性を維持する修飾が行われる。アミノ酸置換は、修飾された配列がヒトSEP活性を保持するという条件で、例えば、1、2または3〜10、20または30の置換を行ってよい。アミノ酸置換には、例えば、治療的に投与されるポリペプチドの血漿半減期を増加させるための天然に存在しない類似体の使用が含まれうる。
【0223】
保存的置換は、例えば、下の表にしたがって行われてよい。第二列の同じブロック中、好ましくは、第三列の同じ行中のアミノ酸は、互いに置換されてよい。
【0224】
【表2】
上に示されたように、本発明のタンパク質は、典型的に、組換え手段によって、例えば、本明細書中に記載のように、および/または固相合成のような当業者に周知の技法を用いた合成手段を用いることによって製造される。このような配列の変異体および誘導体には、融合タンパク質であって、少なくとも、別のアミノ酸配列に(直接的にまたは間接的に)連結されている本発明のアミノ酸配列を含む融合タンパク質が含まれる。これら他のアミノ酸配列は、時々、融合タンパク質パートナーと称されるが、典型的には、本発明のアミノ酸配列の抽出および精製を助けるような好ましい官能性を与えるであろう。融合タンパク質パートナーの例には、グルタチオン−S−トランスフェラーゼ(GST)、6xHis、GAL4(DNA結合および/または転写活性化ドメイン)およびβ−ガラクトシダーゼが含まれる。融合タンパク質パートナーと本発明のタンパク質配列との間に、後者の除去を可能にするようにタンパク質分解切断部位を含むことも好都合でありうる。好ましくは、融合タンパク質パートナーは、本発明のタンパク質の機能を妨害しないであろう。
【0225】
ポリヌクレオチド変異体および誘導体
本発明のヌクレオチド配列に関する“変異体”または“誘導体”という用語には、その配列からのまたは配列への一つの(またはそれを越える)核酸のいずれかの置換、変異、修飾、交換、欠失または付加が含まれるが、但し、得られたヌクレオチド配列は、ヒトSEP活性を有する、好ましくは、配列番号:1または配列番号:5に示される配列によってエンコードされるポリペプチドと少なくとも同じ活性を有するポリペプチドをコードするという条件付きである。
【0226】
上に示されたように、配列相同性に関して、好ましくは、配列番号:1または配列番号:5に示される配列に少なくとも83%、より好ましくは、少なくとも85%、より好ましくは、少なくとも90%の相同性がある。より好ましくは、少なくとも95%、より好ましくは、少なくとも98%の相同性がある。ヌクレオチド相同性比較は、上記のように行うことができる。若干の応用について、好ましい配列比較プログラムは、上記のGCG Wisconsin Bestfit プログラムである。デフォルトの評点マトリックスは、一致するヌクレオチド各々に10および各々のミスマッチに−9の対合値を有する。各々のヌクレオチドについて、デフォルトのギャップ生成ペナルティーは−50であり、デフォルトのギャップ伸長ペナルティーは−3である。
【0227】
本明細書中で用いられる“変異体”、“ホモログ”、“フラグメント”および“誘導体”という用語は、それら配列の対立遺伝子変異を包含する。
“変異体”という用語は、本明細書中に示されるヌクレオチド配列にハイブリッド形成することができる配列に相補的である配列も包含する。
【0228】
ハイブリダイゼーション
本明細書中で用いられる“ハイブリダイゼーション”という用語には、“核酸の鎖が塩基対合によって相補鎖と接合する過程”(Coombs J (1994) Dictionary of Biotechnology, Stockton Press, New York NY)、並びに Dieffenbach CW and GS Dveksler(1995, PCR Primer, a Laboratory Manual, Cold Spring Harbor Press, Plainview, NY, USA)に記載のPCR技術で行われるような増幅の過程が含まれるであろう。
【0229】
ハイブリダイゼーション条件は、Berger and Kimmel(1987, Guide to Molecular Cloning Techniques,Methods in Enzymology, Vol 152, Academic Press, San Diego, CA, USA)に示されるように、核酸結合性複合体の融解温度(Tm)に基づき、下に説明されるように定義される“ストリンジェンシー”を与える。
【0230】
ハイブリダイゼーションのストリンジェンシーは、その下でポリ核酸ハイブリッドが安定である条件を意味する。このような条件は、当業者に明らかである。当業者に知られているように、ハイブリッドの安定性は、配列相同性が1%減少する毎に約1〜1.5℃低下するハイブリッドの融解温度(Tm)に反映される。概して、ハイブリッドの安定性は、ナトリウムイオン濃度および温度の関数である。典型的には、ハイブリダイゼーション反応を、より高いストリンジェンシーの条件下で行った後、いろいろなストリンジェンシーの洗浄を行う。
【0231】
本明細書中で用いられるように、高ストリンジェンシーとは、1M Na+中において65〜68℃で安定なハイブリッドを形成するそれら核酸配列だけのハイブリダイゼーションを可能にする条件を意味する。
【0232】
最大ストリンジェンシーは、典型的に、ほぼTm−5℃(プローブのTmより5℃低い温度)で生じる。
高ストリンジェンシーは、プローブのTmより約5℃〜10℃低い温度で生じる。高ストリンジェンシー条件は、例えば、6xSSC、5xデンハート(Denhardt’s)、1%SDS(ドデシル硫酸ナトリウム)、0.1Na+ピロリン酸および非特異的競合物質としての0.1mg/ml変性サケ精子DNAを含有する水溶液中でのハイブリダイゼーションによって提供されうる。ハイブリダイゼーション後、高ストリンジェンシー洗浄は、数段階で、0.2〜0.1xSSC、0.1%SDS中におけるそのハイブリダイゼーション温度で(約30分間)の最終洗浄を含んで行われてよい。
【0233】
中程度または中間のストリンジェンシーは、典型的に、プローブのTmより約10℃〜20℃低い温度で生じる。
低ストリンジェンシーは、典型的に、プローブのTmより約20℃〜25℃低い温度で生じる。
【0234】
当業者に理解されるように、最大ストリンジェンシーハイブリダイゼーションは、同一のポリヌクレオチド配列を識別するまたは検出するのに用いることができるが、中間の(または低)ストリンジェンシーハイブリダイゼーションは、類似したまたは関連したポリヌクレオチド配列を識別するまたは検出するのに用いることができる。
【0235】
中程度のストリンジェンシーとは、上記の溶液中であるが約60〜62℃でのハイブリダイゼーションに均等な条件を意味する。その場合、最終洗浄は、1xSSC、0.1%SDS中においてそのハイブリダイゼーション温度で行われる。
【0236】
低ストリンジェンシーとは、上記の溶液中において約50〜52℃でのハイブリダイゼーションに均等な条件を意味する。その場合、最終洗浄は、2xSSC、0.1%SDS中においてそのハイブリダイゼーション温度で行われる。
【0237】
これら条件が、種々の緩衝液、例えば、ホルムアミド基剤緩衝液および温度を用いて適応され、および再現されてもよいということは理解される。デンハート溶液およびSSCは、他の適当なハイブリダイゼーション緩衝液と同様、当業者に周知である(例えば、Sambrook, et al.,eds.(1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York; または Ausubel, et al.,eds.(1990) Current Protocols in Molecular Biology, John Wiley & Sons,Inc. を参照されたい)。最適ハイブリダイゼーション条件は、プローブの長さおよびGC含量も役割を果たしているので、経験的に決定されるべきである。
【0238】
本明細書中に示されるヌクレオチド配列またはそれらの相補鎖に選択的にハイブリッド形成することができる本発明のポリヌクレオチドは、概して、本明細書中に示される該当するヌクレオチド配列に、少なくとも20個、好ましくは、少なくとも25個または30個、例えば、少なくとも40個、60個または100個またはそれを越える連続したヌクレオチドの領域にわたって、少なくとも83%、好ましくは、少なくとも85%または90%、そしてより好ましくは、少なくとも95%または98%相同であろう。
【0239】
“選択的にハイブリッド形成できる”という用語は、プローブとして用いられるポリヌクレオチドが、本発明の標的ポリヌクレオチドがそのプローブに、バックグラウンドを有意に上回るレベルでハイブリッド形成することが判っている条件下で用いられるということを意味する。このバックグラウンドハイブリダイゼーションは、例えば、スクリーニングされているcDNAまたはゲノムDNAライブラリーの他のポリヌクレオチドのために生じることがありうる。この場合、バックグラウンドとは、そのプローブとライブラリーの非特異的DNAメンバーとの間の相互作用によって生じる、標的DNAで認められる特異的相互作用の10倍未満、好ましくは、100倍未満と同程度の強さであるレベルのシグナルを意味する。この相互作用の強度は、例えば、プローブを、例えば、32Pで放射性標識することによって測定することができる。
【0240】
好ましい側面において、本発明は、本発明のいずれか一つまたはそれを越えるヌクレオチド配列に、ストリンジェント条件下(例えば、65℃および0.1xSSC{1xSSC=0.15M NaCl,0.015クエン酸Na3 pH7.0})でハイブリッド形成することができるヌクレオチド配列を包含する。
【0241】
本発明のポリヌクレオチドが二本鎖である場合、その二重らせんの両鎖は、個々にかまたは組合せで、本発明によって包含される。このポリヌクレオチドが一本鎖である場合、そのポリヌクレオチドの相補的配列も本発明の範囲内に含まれるということは理解されるはずである。
【0242】
本発明の配列に100%相同ではないが、本発明の範囲内であるポリヌクレオチドは、多数の方法によって得ることができる。本明細書中に記載の配列の他の変異体は、例えば、一定範囲の個体、例えば、異なった集団からの個体から作られるDNAライブラリーをプローブすることによって得ることができる。更に、他のウイルス/細菌の、または細胞性のホモログ、特に、哺乳動物細胞(例えば、ウシ、ヒツジ、ブタ、ウマおよび霊長類の細胞)中で見出される細胞性ホモログを得ることができ、このようなホモログおよびそれらのフラグメントは、概して、配列番号:1または配列番号:5に示される配列に選択的にハイブリッド形成することができるであろう。このような配列は、他の動物種から作られるcDNAライブラリーまたはそれに由来するゲノムDNAライブラリーをプローブし、そしてこのようなライブラリーを、中〜高ストリンジェンシー条件下において、配列番号:1または配列番号:5に示される配列の全部または一部分を含むプローブでプローブすることによって得ることができる。同様の考え方が、本発明のポリペプチド配列またはヌクレオチド配列の種ホモログおよび対立遺伝子変異体を得るのに当てはまる。
【0243】
変異体および系統/種ホモログは、本発明の配列中の保存アミノ酸配列をエンコードしている変異体およびホモログ中の配列に指向するように設計されるプライマーを用いるであろう縮重PCRを用いて得ることもできる。保存配列は、例えば、数種類の変異体/ホモログからのアミノ酸配列を整列することによって予想することができる。配列アラインメントは、当該技術分野において知られている計算機ソフトウェアを用いて行うことができる。例えば、GCG Wisconsin PileUp プログラムが広く用いられている。
【0244】
縮重PCRで用いられるプライマーは、一つまたはそれを越える縮重位置を含有するであろうし、しかも既知の配列に対して単一配列プライマーで配列をクローニングするのに用いられるものより低いストリンジェンシー条件で用いられるであろう。
【0245】
或いは、このようなポリヌクレオチドは、特徴的な配列の部位特異的突然変異誘発によって得ることができる。これは、例えば、そのポリヌクレオチド配列が発現されている特定の宿主細胞についてコドン選択を最適にするために配列にサイレントコドン変化が必要とされる場合に有用でありうる。他の配列変化は、制限酵素認識部位を導入するために、またはそれらポリヌクレオチドによってエンコードされるポリペプチドの性状または機能を変更するために望まれることがありうる。
【0246】
本発明のポリヌクレオチドは、プライマー、例えば、PCRプライマー、代わりの増幅反応のためのプライマー、プローブであって、例えば、放射性または非放射性標識を用いて慣用的な手段によって明らかになる標識で標識されたものを生じるのに用いることができるし、またはそれらポリヌクレオチドは、ベクター中にクローン化することができる。このようなプライマー、プローブおよび他のフラグメントは、少なくとも15、好ましくは、少なくとも20、例えば、少なくとも25、30または40ヌクレオチドの長さであろうが、これらも、本明細書中で用いられる本発明のポリヌクレオチドという用語によって包含される。
【0247】
本発明によるDNAポリヌクレオチドおよびプローブのようなポリヌクレオチドは、組換えによって、合成によって、または当業者に利用可能ないずれの手段によっても製造することができる。それらも、標準的な技法によってクローン化することができる。
【0248】
概して、プライマーは、所望の核酸配列の一度に一つのヌクレオチドの段階的製造を含む合成手段によって製造されるであろう。自動化された技法を用いてこれを行う技法は、当該技術分野において容易に利用可能である。
【0249】
より長いポリヌクレオチドは、概して、組換え手段を用いて、例えば、PCRクローニング法を用いて製造されるであろう。これは、クローン化することが望まれる配列の領域に隣接する(例えば、約15〜30ヌクレオチドの)1対のプライマーを製造し、それらプライマーを、動物またはヒト細胞から得られるmRNAまたはcDNAと接触させ、所望の領域の増幅をもたらす条件下でポリメラーゼ連鎖反応を行い、増幅されたフラグメントを(例えば、反応混合物をアガロースゲル上で精製することによって)単離し、そして増幅されたDNAを回収することを含むであろう。それらプライマーは、適当な制限酵素認識部位を含有するように設計してよく、増幅されたDNAは、適当なクローニングベクター中にクローン化することができる。
【0250】
調節配列
好ましくは、本発明のポリヌクレオチドは、選択された宿主細胞によるなどのコーディング配列の発現を提供することができる調節配列に機能可能に連結している。例として、本発明は、このような調節配列に機能可能に連結している本発明のポリヌクレオチドを含むベクターを包含する、すなわち、このベクターは発現ベクターである。
【0251】
“機能可能に連結している”という用語は、記載の化合物が、それらを予定の方式で機能させる関係にある並列を意味する。コーディング配列に“機能可能に連結している”調節配列は、そのコーディング配列の発現が、制御配列に適合しうる条件下で達せられるように連結している。
【0252】
“調節配列”という用語には、プロモーターおよびエンハンサーおよび他の発現調節シグナルが含まれる。
“プロモーター”という用語は、当該技術分野の通常の意味に、例えば、RNAポリメラーゼ結合部位に用いられる。
【0253】
本発明のポリペプチドをエンコードしているポリヌクレオチドの増進された発現は、異種調節領域、例えば、プロモーター、分泌リーダーおよびターミネーター領域の選択によって達せられてもよく、これは、選択された発現宿主からの目的のタンパク質の発現および所望ならば分泌レベルを増加させるのにおよび/または本発明のポリペプチドの発現の誘導可能な制御を行うのに役立つ。
【0254】
好ましくは、本発明のヌクレオチド配列は、少なくともプロモーターに機能可能に連結していてよい。
本発明のポリペプチドをエンコードしている遺伝子本来のプロモーターとは別に、他のプロモーターを用いて、本発明のポリペプチドの発現を支配することができる。そのプロモーターは、所望の発現宿主中での本発明のポリペプチドの発現を支配する場合のその効率について選択されてよい。
【0255】
もう一つの態様において、構成性プロモーターが、本発明の所望のポリペプチドの発現を支配するために選択されてよい。このような発現構築物は、それが、誘導性基質を含有する培地上で発現宿主を培養する必要性を回避するので、追加の利点を与えることがありうる。
【0256】
真菌発現宿主で用いるのに好適である強力な構成性および/または誘導可能プロモーターの例は、キシラナーゼ(xlnA)、フィターゼ、ATPシンテターゼ、サブユニット9(oliC)、トリオースリン酸イソメラーゼ(tpi)、アルコールデヒドロゲナーゼ(AdhA)、α−アミラーゼ(amy)、アミログルコシダーゼ(AG−glaA遺伝子より)、アセトアミダーゼ(amdS)およびグリセルアルデヒド−3−リン酸デヒドロゲナーゼ(gpd)のプロモーターについて真菌遺伝子から入手可能であるものである。
【0257】
強力な酵母プロモーターの例は、アルコールデヒドロゲナーゼ、ラクターゼ、3−ホスホグリセリン酸キナーゼおよびトリオースリン酸イソメラーゼについての遺伝子から入手可能なものである。
【0258】
強力な細菌プロモーターの例は、α−アミラーゼおよびSP02のプロモーター、並びに細胞外プロテアーゼ遺伝子からのプロモーターである。
ハイブリッドプロモーターは、発現構築物の誘導可能な調節を改善するのに用いることもできる。
【0259】
プロモーターには、更に、適当な宿主中での発現を確実にするまたは増加させる特徴が含まれうる。例えば、それら特徴は、Pribnow Box またはTATAボックスのような保存領域でありうる。プロモーターは、他の配列も含有して、本発明のヌクレオチド配列の発現レベルに影響を与えること(維持すること、増進すること、減少させることなど)もできる。例えば、適当な他の配列には、Sh1−イントロンまたはADHイントロンが含まれる。他の配列には、温度、化学物質、光またはストレス誘導性要素のような誘導性要素が含まれる。更に、転写または翻訳を増進させる適当な要素が存在してよい。後者の要素の一例は、TMV5’シグナル配列である(Sleat, Gene, 217,[1987],pp.217−225; および Dawson, Plant Mol. Biol., 23,[1993],p.97 を参照されたい)。
【0260】
分泌
本発明のヒトSEPは、由来細胞から、例えば、精巣中で天然に分泌される。しかしながら、ヒトSEPをエンコードしているポリヌクレオチド配列の突然変異、またはヒトSEPを発現する細胞中での翻訳後修飾の変更またはその不存在は、ヒトSEPの非細胞外分泌(例えば、細胞内沈着)をもたらすことがありうる。このような場合、本発明のポリペプチドを一層容易に回収することができる培地中に、本発明のポリペプチドを発現宿主から分泌させることが望まれる。本発明により、分泌リーダー配列は、所望の発現宿主に基づいて選択されうる。ハイブリッドシグナル配列は、本発明の場合に用いることもできる。
【0261】
異種分泌リーダー配列の典型的な例は、真菌アミログルコシダーゼ(AG)遺伝子(glaA−例えば、アスペルギルス属(Aspergillus)からの18アミノ酸および24アミノ酸両方の型)、a−因子遺伝子(酵母、例えば、サッカロミセス属(Saccharomyces)およびクルイベロミセス属(Kluyveromyces))またはα−アミラーゼ遺伝子(バチルス属(Bacillus))に由来するものである。
【0262】
構築物
“コンジュゲート”、“カセット”および“ハイブリッド”などの用語と同意語である“構築物”という用語には、プロモーターに直接的にまたは間接的に結合した本発明によるヌクレオチド配列が含まれる。間接的結合の例は、本発明のプロモーターおよびヌクレオチド配列の中間の、Sh1−イントロンまたはADHイントロンなどのイントロン配列のような適当なスペーサー基の供給である。直接的または間接的結合が含まれる本発明に関する“融合した”という用語について同じことが当てはまる。各々の場合、それら用語は、野生型遺伝子プロモーターに通常は関連しているタンパク質をコードするヌクレオチド配列の自然の組合せであって、それらが両方ともそれらの自然環境中にある場合を包含しない。
【0263】
この構築物は、それが転移されている、例えば、細菌、好ましくは枯草菌(Bacillus subtilis)のような Bacillus 属の細菌、または植物中での遺伝子構築物の選択を考慮するマーカーを含有するまたは発現することもできる。種々のマーカーが存在するが、例えば、マンノース−6−リン酸イソメラーゼをエンコードするもの(特に、植物について)または抗生物質耐性、例えば、G418、ハイグロマイシン、ブレオマイシン、カナマイシンおよびゲンタマイシンへの耐性を与えるマーカーなどを用いることができる。
【0264】
好ましくは、本発明の構築物は、少なくとも、プロモーターに機能可能に連結した本発明のヌクレオチド配列を含む。
ベクター
“ベクター”という用語には、発現ベクターおよび形質転換ベクターおよびシャトルベクターが含まれる。
【0265】
“発現ベクター”という用語は、in vivo または in vitro 発現の可能な構築物を意味する。
“形質転換ベクター”という用語は、一つの物質を別の物質に転移させることができる構築物を意味し、これは、同じ種のものであってよいしまたは異なった種のものであってよい。その構築物が、大腸菌(E.coli)プラスミドから Bacillus 属のような細菌へのように、一つの種から別の種に転移させることができる場合、この形質転換ベクターは、時々、“シャトルベクター”と称される。それは、E.coli プラスミドからアグロバクテリア菌(Agrobacterium)へ、植物へと転移させることができる構築物でもありうる。
【0266】
本発明のベクターは、下記のような適当な宿主細胞中に形質転換されて、本発明のポリペプチドを発現させることができる。したがって、もう一つの側面において、本発明は、本発明によるポリペプチドを製造する方法であって、上記のような発現ベクターで形質転換されたまたはトランスフェクションされた宿主細胞を、それらポリペプチドをエンコードしているコーディング配列のベクターによって発現させる条件下で培養し、そして発現したポリペプチドを回収することを含む方法を提供する。
【0267】
これらベクターは、例えば、複製開始点、場合により、ポリヌクレオチドの発現のためのプロモーターおよび場合により、そのプロモーターの調節因子を備えた、例えば、プラスミド、ウイルスまたはバクテリオファージ(ファージ)のベクターであってよい。
【0268】
本発明のベクターは、一つまたはそれを越える選択可能マーカー遺伝子を含有してよい。工業用微生物に最も適当な選択システムは、宿主生物中での突然変異を必要としない選択マーカーの群によって形成されるものである。真菌選択マーカーの例は、アセトアミダーゼ(amdS)、ATPシンテターゼ、サブユニット9(oliC)、オロチジン−5’−リン酸デカルボキシラーゼ(pvrA)、フレオマイシンおよびベノミル耐性(benA)の遺伝子である。非真菌選択マーカーの例は、細菌G418耐性遺伝子(これは、酵母で用いることもできるが、糸状菌では用いることができない)、アンピシリン耐性遺伝子(E.coli)、ネオマイシン耐性遺伝子(Bacillus)およびβ−グルクロニダーゼ(GUS)をコードしているE.coli uidA遺伝子である。
【0269】
ベクターは、in vitro で、例えば、RNAの製造に用いることができるし、または宿主細胞をトランスフェクションするのにまたは形質転換するのに用いることができる。
【0270】
したがって、本発明のポリヌクレオチドは、組換えベクター(典型的には、複製可能ベクター)、例えば、クローニングベクターまたは発現ベクター中に包含されることができる。このベクターは、適合しうる宿主細胞中で核酸を複製するのに用いることができる。したがって、さらなる態様において、本発明は、本発明のポリヌクレオチドを製造する方法であって、本発明のポリヌクレオチドを複製可能ベクター中に導入し、そのベクターを適合しうる宿主細胞中に導入し、そしてその宿主細胞を、そのベクターの複製をもたらす条件下で成長させることによる方法を提供する。このベクターは、宿主細胞から回収することができる。適当な宿主細胞は、発現ベクターに関連して下に記載される。
【0271】
本発明は、更に、ヒトSEPのモジュレーター(例えば、阻害剤)の識別のためのスクリーニング法における、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体を発現する遺伝子操作された宿主細胞の使用に関する。このような遺伝子操作された宿主細胞は、ヒトSEP活性をモジュレートすることができるペプチドライブラリーまたは有機分子をスクリーニングするのに用いられうる。抗体、ペプチドまたは有機低分子のようなヒトSEPの阻害剤は、例えば、ヒトSEPに関連した疾患の予防および/または処置用の医薬組成物についての基準を提供するであろう。このような阻害剤は、このような疾患の予防および/または処置のために単独でまたは他の治療薬と組み合わせて投与することができる。
【0272】
本発明は、更に、ヒトSEPタンパク質の in vivo または in vitro 生産のための、またはヒトSEP発現または活性に影響を与えうる試剤についてスクリーニングするための、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体をエンコードしているポリヌクレオチド配列を含む発現ベクターおよび宿主細胞に関する。
【0273】
組織
本明細書中で用いられる“組織”という用語には、組織それ自体および器官が含まれる。
【0274】
宿主細胞
本発明に関して、“宿主細胞”という用語には、本発明の組換えタンパク質をコードするヌクレオチド配列を含むことがありうるいずれかの細胞および/またはそれより得られる生成物が含まれるが、ここにおいて、プロモーターは、その宿主細胞中に存在する場合、本発明によるヌクレオチド配列の発現を可能にすることがありうる。
【0275】
したがって、本発明のさらなる態様は、本発明のポリヌクレオチドで形質転換されたまたはトランスフェクションされた宿主細胞を提供する。好ましくは、このポリヌクレオチドは、このポリヌクレオチドの複製および発現のためにベクター中で運ばれる。それら細胞は、このベクターと適合しうるように選択されるであろうが、例えば、原核性(例えば、細菌細胞)または真核性(すなわち、哺乳動物、真菌、昆虫、原生動物、酵母または植物の細胞)であってよい。
【0276】
グラム陰性細菌E.coli は、異種遺伝子発現のための宿主として広く用いられている。しかしながら、多量の異種タンパク質は、細胞内部に蓄積しがちである。その後のE.coli 細胞内タンパク質のバルクからの所望のタンパク質の精製は、時々難しいことがありうる。
【0277】
E.coli とは対照的に、Bacillus 属からの細菌は、培地中にタンパク質を分泌するそれらの能力のために、異種宿主として極めて適している。宿主として適した他の細菌は、ストレプトマイセス属(Streptomyces)およびシュードモナス属(Pseudomonas)からのものである。
【0278】
宿主細胞中へのポリヌクレオチドの導入は、Sambrook, et al.,eds.(1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, NY, USA に記載の方法によって行うことができる。これらの方法には、リン酸カルシウムトランスフェクション、DEAE−デキストラン媒介トランスフェクション、陽イオン脂質媒介トランスフェクション、エレクトロポレーション、トランスベクション(transvection)、マイクロインジェクション、形質導入、スクレイプローディング(scrape loading)および射出導入(ballistic introduction)が含まれるが、これらに制限されるわけではない。
【0279】
代表的な宿主の例には、細菌細胞(例えば、E.coli、Streptomyces);酵母細胞および Aspergillus のような真菌細胞;ショウジョウバエ属(Drosophila)S2およびスポドプテラ(Spodoptera)SF9細胞のような昆虫細胞;CHO、COS、HEK、HeLaおよび3T3細胞のような動物細胞が含まれる。適当な宿主の選択は、当業者がなすことの範囲内であると考えられる。
【0280】
本発明のポリペプチドをエンコードしているポリヌクレオチドの性状、および/または発現されるタンパク質のさらなるプロセシングへの所望に依存して、酵母または他の真菌のような真核生物宿主が好適でありうる。概して、酵母細胞は、操作するのが一層容易であるので、真菌細胞より好適である。しかしながら、いくつかのタンパク質は、酵母細胞から不十分にしか発現されないかまたは分泌されないし、またはある場合には、適切に処理されない(例えば、酵母中での高グリコシル化)。これらの状況では、別の真菌宿主生物が選択されるべきである。
【0281】
本発明の範囲内の適当な発現宿主の例は、Aspergillus 種(EP−A−0184438号およびEP−A−0284603号に記載のものなど)およびトリコデルマ属(Trichoderma)種のような真菌;エシェリキア属(Escherichia)種または Bacillus 種(EP−A−0134048号およびEP−A−0253455号に記載のものなど)、Streptomyces 種および Pseudomonas 種のような細菌;Kluyveromyces 種(EP−A−0096430号およびEP−A−0301670号に記載のものなど)および Saccharomyces 種のような酵母である。例として、典型的な発現宿主は、クロカビ(Aspergillus niger)、アスペルギルス・ニガー変異ツビジェニス(Aspergillus niger var. tubigenis)、アスペルギルス・ニガー変異アワモリ(Aspergillus niger var. awamori)、アスペルギルス・アクレアティス(Aspergillus aculeatis)、アスペルギルス・ニドゥランス(Aspergillus nidulans)、コウジカビ(Aspergillus oryzae)、トリコデルマ・レエセイ(Trichoderma reesei)、クルイベロマイセス・ラクティス(Kluyveromyces lactis)、枯草菌(Bacillus subtilis)、バチルス・リシェニホルミス(Bacillus licheniformis)、バチルス・アミノリクエファシエンス(Bacillus amyloliquefaciens)、シゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)、ピキア・パストリス(Pichia pastoris)およびパン酵母(Saccharomyces cerevisiae)より選択されてよい。
【0282】
哺乳動物、酵母、昆虫、植物および真菌の宿主細胞などの適当な宿主細胞の使用は、本発明の組換え発現生成物に最適の生物学的活性を与えるのに必要とされることがありうる翻訳後修飾(例えば、ミリストイル化、グリコシル化、先端切断(truncation)、ラピデーション(lapidation)、およびチロシン、セリンまたはトレオニンリン酸化)に備えることができる。
【0283】
生物
本発明に関する“生物”という用語には、本発明による組換えタンパク質をコードするヌクレオチド配列および/またはそれより得られる生成物を含むことがありうる、ヒトを除くいずれかの生物が含まれるが、ここにおいて、プロモーターは、その生物中に存在する場合、本発明によるヌクレオチド配列の発現を可能にすることがありうる。生物の例には、真菌、酵母、植物または原生動物が含まれてよい。
【0284】
本発明に関する“トランスジェニック生物”という用語には、本発明によるタンパク質をコードするヌクレオチド配列および/またはそれより得られる生成物を含む、ヒトを除くいずれかの生物が含まれるが、ここにおいて、プロモーターは、その生物中での本発明によるヌクレオチド配列の発現を可能にすることがありうる。好ましくは、このヌクレオチド配列は、その生物のゲノム中に包含される。
【0285】
“トランスジェニック生物”という用語は、その自然環境中にもある天然のプロモーターの制御下にある場合のその自然環境中にある本発明による天然のヌクレオチドコーディング配列を包含しない。更に、本発明は、それがその自然環境中にある場合、およびそれが、その自然環境中にもあるその天然のヌクレオチドコーディング配列によって発現されている場合、およびそのヌクレオチド配列が、その自然環境中にもあるその天然のプロモーターの制御下にある場合、本発明による天然のタンパク質を包含しない。
【0286】
したがって、本発明のトランスジェニック生物には、本発明によるアミノ酸配列をコードしているヌクレオチド配列のいずれか一つまたは組合せ、本発明による構築物(それらの組合せを含めた)、本発明によるベクター、本発明によるプラスミド、本発明による細胞および本発明による組織またはそれらの生成物、を含む生物が含まれる。形質転換された細胞または生物は、その細胞または生物から容易に回収できると考えられる所望の化合物の許容しうる量を製造しうると考えられる。
【0287】
宿主細胞/宿主生物の形質転換
先に示したように、宿主生物は、原核生物または真核生物でありうる。適当な原核生物宿主の例には、E.coli および Bacillus subtilis が含まれる。原核生物宿主の形質転換についての教示は、当該技術分野においてよく文書化されており、例えば、Sambrook, et al.(Molecular Cloning: A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press, New York, NY, USA)および Ausubel, et al.(Current Protocols in Molecular Biology (1995), John Wiley & Sons,Inc.)を参照されたい。
【0288】
一つの態様において、形質転換された宿主は、哺乳動物細胞、または例えば、昆虫細胞であり、ここにおいて、これら宿主細胞中へのポリヌクレオチドの導入は、例えば、Sambrook, et al.(Molecular Cloning: A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press, New York, NY, USA)に記載の方法によって行うことができる。これら方法には、リン酸カルシウムトランスフェクション、DEAE−デキストラン媒介トランスフェクション、陽イオン脂質媒介トランスフェクション、エレクトロポレーション、トランスベクション、マイクロインジェクション、形質導入、スクレイプローディングおよび射出導入が含まれるが、これらに制限されるわけではない。
【0289】
もう一つの態様において、トランスジェニック生物は酵母でありうる。この点で、酵母は、異種遺伝子発現のためのビヒクルとしても広く用いられてきている。Saccharomyces cerevisiae 種には、異種遺伝子発現のための使用を含めた長い工業使用の歴史がある。Saccharomyces cerevisiae における異種遺伝子の発現は、Goodey et al.(1987, Yeast Biotechnology, D R Berry et al, eds, pp 401−429, Allen and Unwin, London)によっておよび King et al.(1989, Molecular and Cell Biology of Yeasts, E F Walton and G T Yarronton, eds, pp 107−133, Blackie, Glasgow)によって概説されている。
【0290】
いくつかの理由で、Saccharomyces cerevisiae は、異種遺伝子発現によく適している。第一に、それはヒトに非病原性であり、しかも、一定の内毒素を生産することができない。第二に、それには、何百年にも渡るいろいろな目的の商業的利用に続く安全使用の長い歴史がある。これが、広い社会的受容性をもたらしている。第三に、この生物に専念した広範囲にわたる商業的使用および研究は、遺伝学および生理学並びに Saccharomyces cerevisiae に特有の大規模発酵についての豊富な情報をもたらしている。
【0291】
Saccharomyces cerevisiae における異種遺伝子発現および遺伝子産物の分泌の原理についての概説は、E Hinchcliffe and E Kenny(“Yeast as a vehicle for the expression of heterologous genes”, 1993, Yeasts, Vol 5, Anthony H Rose and J Stuart Harrison, eds, 2nd edition, Academic Press Ltd.)によって与えられている。
【0292】
それらの維持のために宿主ゲノムでの組換えを必要とする組込みベクター、および自律複製プラスミドベクターを含めたいくつかのタイプの酵母ベクターが利用可能である。
【0293】
トランスジェニック Saccharomyces を製造するために、本発明のヌクレオチド配列を、酵母での発現用に設計された構築物中に挿入することによって発現構築物を製造する。異種発現に用いられるいくつかのタイプの構築物が開発されている。これら構築物は、本発明のヌクレオチド配列に融合した酵母中で活性なプロモーターを含有するが、通常は、GAL1プロモーターのような酵母起源のプロモーターを用いる。通常は、SUC2シグナルペプチドをエンコードしている配列のような酵母起源のシグナル配列を用いる。酵母中で活性なターミネーターが、この発現系の末端となっている。
【0294】
酵母の形質転換のために、いくつかの形質転換プロトコールが開発されている。例えば、本発明によるトランスジェニック Saccharomyces は、Hinnen et al.(1978, Proceedings of the National Academy of Science of the USA, 75:1929);Beggs, J D(1978, Nature, London, 275:104);および Ito, H et al.(1983, J. Bacteriology 153:163−168)の教示にしたがうことによって製造することができる。
【0295】
形質転換された酵母細胞は、いろいろな選択マーカーを用いて選択される。形質転換に用いられるマーカーの中には、LEU2、HIS4およびTRP1のような多数の栄養要求性マーカー、およびアミノグリコシド抗生物質マーカー、例えば、G418のような支配的な抗生物質耐性マーカーがある。
【0296】
もう一つの宿主生物は植物である。遺伝子修飾された植物の構築における基本原理は、挿入された遺伝物質の安定な維持が得られるように、植物ゲノム中に遺伝情報を挿入することである。
【0297】
遺伝情報を挿入するためのいくつかの技術があるが、その二つの主な原理は、遺伝情報の直接的導入およびベクター系の使用による遺伝情報の導入である。一般的な技術の概説は、Potrykus(Annu Rev Plant Physiol Plant Mol Biol [1991]42:205−225)および Christou(Agro−Food−Industry Hi−Tech, March/April 1994,17−27)による論文に見出されうる。植物の形質転換についての更に別の技術は、EP−A−0449375号に見出されうる。
【0298】
したがって、本発明は、更に、配列番号:1または配列番号:5に示されるヌクレオチド配列またはその誘導体、ホモログ、変異体またはフラグメントで宿主細胞を形質転換する方法を提供する。
【0299】
ヒトSEPヌクレオチドコーディング配列で形質転換された宿主細胞は、そのエンコードされたタンパク質の細胞培養物からの発現および回収に適した条件下で培養することができる。組換え細胞によって生産されるタンパク質は、用いられる配列および/またはベクターに依存して、分泌されてよいしまたは細胞内に含有されていてよい。当業者によって理解されるように、ヒトSEPコーディング配列を含有する発現ベクターは、特定の原核生物または真核生物の細胞膜によってヒトSEPコーディング配列の分泌を支配するシグナル配列で設計されることができる(ヒトSEPがこのようなシグナル配列の不存在下で分泌されない場合)。他の組換え構築物は、可溶性タンパク質の精製を容易にするであろうポリペプチドドメインをエンコードしているヌクレオチド配列に、ヒトSEPコーディング配列をつなぐことができる(Kroll DJ et al. (1993) DNA Cell Biol., Vol 12,pp.441−53;融合タンパク質を含有するベクターについての上記の考察も参照されたい)。
【0300】
遺伝子操作されるまたは遺伝子修飾される
“遺伝子修飾され”ている細胞、好ましくは、動物細胞は、遺伝子操作することによってその細胞中にまたは前駆細胞中に導入される修飾についてヘテロ接合性またはホモ接合性である。修飾を導入するのに利用可能である標準的な遺伝子操作法には、相同的組換え、ウイルスベクター遺伝子トラップ法、照射、化学的突然変異誘発、およびアンチセンスRNAをエンコードしているヌクレオチド配列の単独でのまたは触媒リボザイムとの組合せでのトランスジェニック発現が含まれる。遺伝子修飾に好ましい方法は、相同的組換えおよびウイルスベクター遺伝子トラップ法であり、これらは両方とも、内因性遺伝子を、その遺伝子座中に外来の核酸配列を挿入することによって修飾する。その遺伝子にとって外来の核酸配列は、その遺伝子中に天然に存在しない外因性配列である。この外来のDNAの挿入は、ヒトSEP遺伝子のいずれの領域中でも、例えば、エンハンサー、プロモーター、調節領域、非コーディング領域、コーディング領域、イントロンまたはエクソンで起こりうる。最も好ましい遺伝子操作法は、相同的組換えであるが、ここにおいて、外来の核酸配列は、標的方式において、単独でかまたは内因性遺伝子配列の一部分の欠失と組合せて挿入される。
【0301】
機能的に破壊される
“機能的に破壊され”ているヒトSEP遺伝子とは、破壊された遺伝子によってエンコードされるヒトSEPポリペプチドの細胞活性が、ヒトSEP遺伝子の野生型を通常発現する細胞中で減少するように遺伝子修飾されているヒトSEP遺伝子を意味する。遺伝子修飾が、細胞中のヒトSEP遺伝子の全ての野生型コピーを全て有効に除去する場合(例えば、好ましくは動物細胞である遺伝子修飾された細胞は、ヒトSEP遺伝子破壊についてホモ接合性である、または最初に存在するヒトSEP遺伝子の野生型コピーだけがここで破壊される)、この遺伝子修飾は、野生型ヒトSEP遺伝子を発現する適当な対照細胞と比較して、ヒトSEPポリペプチド活性を減少させる。ヒトSEPポリペプチド活性のこの減少は、減少したヒトSEP遺伝子発現によって生じる(すなわち、ヒトSEPmRNAレベルは、有効に減少し、減少したレベルのヒトSEPポリペプチドを生じる)か、および/または破壊されたヒトSEP遺伝子が、野生型ヒトSEPポリペプチドと比較して低下した機能または安定性を有する突然変異ポリペプチドをエンコードしているためである。好ましくは、遺伝子修飾された細胞中のヒトSEPポリペプチドの活性は、野生型レベルの50%またはそれ未満まで、より好ましくは、25%またはそれ未満まで、そしてなお一層好ましくは、野生型レベルの10%またはそれ未満まで減少する。最も好ましくは、ヒトSEP遺伝子破壊は、ヌル突然変異を引き起こす。
【0302】
遺伝子修飾された動物細胞
機能的に破壊されたヒトSEP遺伝子を含有する“遺伝子修飾された動物細胞”とは、機能的に破壊されたヒトSEP遺伝子を含有するように遺伝子操作することによって生じるヒト細胞を含めた動物細胞、並びに破壊されたヒトSEP遺伝子を遺伝する娘細胞を意味する。これら細胞は、当該技術分野において知られているいずれの標準法によっても、培養物中で遺伝子修飾することができる。培養物中で細胞を遺伝子修飾することに代わるものとして、非ヒト哺乳動物細胞は、ヒトSEP遺伝子破壊を含有する遺伝子修飾された非ヒト哺乳動物から単離されてもよい。本発明の動物細胞は、一次細胞または組織標品、並びに培養に適応した、腫瘍発生性のまたは形質転換された細胞系から得ることができる。これら細胞および細胞系は、例えば、内皮細胞、上皮細胞、島細胞、ニューロンおよび他の神経組織由来細胞、中皮細胞、骨細胞、リンパ球、軟骨細胞、造血細胞、免疫細胞、主要な腺または器官(例えば、肝、肺、心臓、胃、膵臓、腎臓および皮膚)の細胞、筋細胞(骨格筋、平滑筋および心筋からの細胞を含めた)、外分泌または内分泌細胞、線維芽細胞、および胚性および他の全能性または多能性幹細胞(例えば、胚性幹(ES)細胞、ES様細胞、および胚性生殖系列(EG)細胞、および前駆細胞および組織由来幹細胞のような他の幹細胞)に由来する。好ましい遺伝子修飾された細胞は、ES細胞、より好ましくは、マウスまたはラットES細胞、そして最も好ましくは、ヒトES細胞である。
【0303】
ヒトSEP遺伝子での相同的組換えのためのターゲッティングベクター中で用いられる“相同領域”は、ヒトSEP遺伝子の一部分に、または当該技術分野において(例えば、Current Protocols in Human Genetics, unit 4.1, John Wiley & Sons, New York, NY, 2000 に記載のように)知られている標準的な低ストリンジェンシー条件下において相同領域とヒトSEP遺伝子配列との間にハイブリダイゼーションを生じさせるのに充分な程度までヒトSEP遺伝子に隣接している配列に関係がある(すなわち、相補的である)。
【0304】
“ES細胞”または“ES様細胞”とは、不定の自己再生並びに3種類全部の胚葉を代表するものである細胞タイプへの分化が可能である胚、始原生殖細胞、または奇形癌に由来する多能性幹細胞を意味する。
【0305】
“減少する”とは、統計的に有意の減少(すなわち、p<0.1)を意味する。
本発明のヒト細胞を含めた遺伝子修飾された動物細胞は、ヒトSEP遺伝子を機能的に破壊する修飾についてヘテロ接合性またはホモ接合性である。これら動物細胞は、培養物中で細胞を遺伝子操作することによって得られてよいし、または非ヒト哺乳物細胞の場合、遺伝子修飾された非ヒト哺乳動物から細胞を単離してよい。
【0306】
ヒトSEP遺伝子座は、化学的突然変異誘発(Rinchik, Trends in Genetics 7:15−21,1991, Russell, Environmental & Molecular Mutagenesis 23 (Suppl.24) 23−29,1994)、照射(Russell, 上記)、単独でかまたは触媒RNAリボザイム配列との組合せでのヒトSEP遺伝子アンチセンスRNAのトランスジェニック発現(Luyckx et al., Proc. Natl. Acad. Sci. 96:12174−79,1999; Sokol et al., Transgenic Research 5:363−71,1996; Efrat et al., Proc. Natl. Acad. Sci. USA 91:2051−55,1994; Larsson et al., Nucleic Acids Research 22:2242−48,1994)、および下に更に考察される、ヒトSEP遺伝子座中への外来の核酸配列の挿入によるヒトSEP遺伝子の破壊を含めた、当該技術分野において知られているいくつかの遺伝子修飾技術の一つによって機能的に破壊される。好ましくは、この外来の配列は、相同的組換えによってまたはウイルスベクターの挿入によって挿入される。最も好ましくは、ヒトSEP遺伝子破壊の方法は、相同的組換えであり、これには、内因性ヒトSEP遺伝子配列の一部分の欠失が含まれる。
【0307】
外来の配列の組込みは、次の機作の一つまたはそれを越えるものによって、すなわち:ヒトSEP遺伝子の転写または翻訳過程を妨げることによって(例えば、プロモーター認識を妨げることによって、または転写終結部位または翻訳停止コドンをヒトSEP遺伝子中に導入することによって);またはヒトSEP遺伝子コーディング配列を、それがもはや、通常の酵素機能を有するヒトSEPポリペプチドをエンコードしないように変形させることによって(例えば、外来のコーディング配列をヒトSEP遺伝子コーディング配列中に挿入することによって、フレームシフト突然変異または一つまたは複数のアミノ酸置換を導入することによって、または二重乗換えイベントの場合、機能的酵素の発現に必要とされるヒトSEP遺伝子コーディング配列の一部分を欠失することによって);ヒトSEP遺伝子を機能的に破壊する。
【0308】
細胞のゲノム中のヒトSEP遺伝子座中に外来の配列を挿入するためには、この外来のDNA配列を、エレクトロポレーション、リン酸カルシウム沈降、レトロウイルス感染、マイクロインジェクション、ビオリスティクス(biolistics)、リポソームトランスフェクション、DEAE−デキストラントランスフェクションまたはトランスフェリンフェクションのような当該技術分野において知られている標準法によって細胞中に導入する(例えば、Neumann et al., EMBO J. 1:841−845, 1982; Potter et al., Proc. Natl. Acad. Sci USA 81:7161−65, 1984; Chu et al., Nucleic Acids Res. 15:1311−26, 1987; Thomas and Capecchi, Cell 51:503−12, 1987; Baum et al., Biotechniques 17:1058−62, 1994; Biewenga et al., J. Neuroscience Methods 71:67−75, 1997; Zhang et al., Biotechniques 15:868−72, 1993; Ray and Gage, Biotechniques 13:598−603, 1992; Lo, Mol. Cell. Biol. 3:1803−14, 1983; Nickoloff et al., Mol. Biotech. 10:93−101, 1998; Linney et al., Dev. Biol. (Orlando) 213:207−16, 1999; Zimmer and Gruss, Nature 338:150−153, 1989; および Robertson et al., Nature 323:445−48, 1986 を参照されたい)。外来のDNAを細胞中に導入する好ましい方法は、エレクトロポレーションである。
【0309】
相同的組換え
相同的組換えの方法は、ヒトSEP遺伝子を含有する細胞中にヒトSEP遺伝子ターゲッティングベクターを導入することにより、ヒトSEP遺伝子を破壊の標的とする。ヒトSEP遺伝子を破壊の標的とするこのベクターの能力は、ヒトSEP遺伝子に相同であるベクター中のヌクレオチド配列を用いることによって生じる。この相同領域は、このベクターとヒトSEP遺伝子の内因性配列との間のハイブリダイゼーションを容易にする。ハイブリダイゼーションにより、このターゲッティングベクターとゲノム配列との間の乗換えイベントの確率が大きく増加する。この乗換えイベントは、ヒトSEP遺伝子座中へのベクター配列の組込みおよびヒトSEP遺伝子の機能的破壊を引き起こす。
【0310】
ターゲッティングに用いられるベクターの構築に関する一般的な原理は、Bradley et al.(Biotechnol. 10:534,1992)に概説されている。二つの異なった典型的なタイプのベクター、すなわち、挿入ベクターまたは置換ベクターを用いて、相同的組換えによってDNAを挿入することができる。挿入ベクターとは、二本鎖切断部(break)を含むヒトSEP遺伝子相同性領域を含有する環状DNAである。この相同性領域と内因性ヒトSEP遺伝子との間のハイブリダイゼーション後、二本鎖切断部における単一乗換えイベントは、この乗換え部位の内因性遺伝子中へのベクター配列全体の挿入をもたらす。
【0311】
相同的組換えに用いるより好ましいベクターは、置換ベクターであるが、これは、環状よりむしろ共直線性である。ヒトSEP遺伝子中への置換ベクター組込みは、二重乗換えイベント、すなわち、ターゲッティングベクターとヒトSEP遺伝子との間の二つのハイブリダイゼーション部位における乗換えを必要とする。この二重乗換えイベントは、二つの乗換え部位の間に挟まれているベクター配列のヒトSEP遺伝子中への組込み、および本来二つの乗換え部位の間に広がる該当する内因性ヒトSEP遺伝子配列の欠失をもたらす(例えば、Thomas and Capecchi et al., Cell 51:503−12,1987; Mansour et al., Nature 336:348−52,1988; Mansour et al., Proc.Natl.Acad.Sci.USA 87:7688−7692,1990; および Mansour, GATA 7:219−227,1990 を参照されたい)。
【0312】
ターゲッティングベクター中の相同性領域は、概して、少なくとも100ヌクレオチドの長さである。最も好ましくは、この相同性領域は、少なくとも1〜5キロベース(Kb)の長さである。相同性領域に必要な最低限の長さまたは最低限の関係性度は示されていないが、相同的組換えのためのターゲッティング効率は、概して、ターゲッティングベクターとヒトSEP遺伝子座との間の長さおよび関係性度と対応する。置換ベクターが用いられ、そして内因性ヒトSEP遺伝子の一部分が相同的組換えで欠失している場合、更に考慮されるべきことは、内因性ヒトSEP遺伝子の欠失部分のサイズである。内因性ヒトSEP遺伝子のこの部分が1Kbの長さを越える場合、1Kbより長い相同性領域を含むターゲッティングカセットは、組換えの効率を増進させるために推奨される。相同的組換えに有効な配列の選択および使用に関する更に別の指針は、参考文献に記載されている(例えば、Deng and Capecchi, Mol. Cell. Biol. 12:3365−3371, 1992; Bollag et al., Annu. Rev. Genet. 23:199−225, 1989; および Waldman and Liskay, Mol. Cell. Biol. 8:5350−5357, 1988 を参照されたい)。
【0313】
ヒトSEP遺伝子ターゲッティングベクターの構築では、ベクター主鎖として、pBluescript 関連プラスミド(例えば、Bluescript KS+11)、pQE70、pQE60、pQE−9、pBS、pD10、ファージスクリプト、phiX174、pBK ファージミド、pNH8A、pNH16a、pNH18Z、pNH46A、ptrc99a、pKK223−3、pKK233−3、pDR540、およびpRIT5 PWLNEO、pSV2CAT、pXT1、pSG(Stratagene)、pSVK3、PBPV、PMSG、およびpSVL、pBR322およびpBR322に基づくベクター、pBM9、pBR325、pKH47、pBR328、pHC79、ファージ Charon 28、pKB11、pKSV−10、pK19関連プラスミド、pUCプラスミド、およびpGEM系列プラスミドを含めたいろいろなクローニングベクターを用いることができる。これらベクターは、種々の市販元から入手可能である(例えば、 Boehringer Mannheim Biochemicals, Indianapolis, IN; Qiagen, Valencia, CA; Stratagene, La Jolla, CA; Promega, Madison, WI; および New England Biolabs, Beverly, MA:全て米国)。しかしながら、いずれの他のベクター、例えば、プラミド、ウイルスまたはその一部分も、それらが複製可能であり且つ所望の宿主中で生存可能である限り用いることができる。ベクターは、ゲノムが修飾される宿主中でそれを複製することができるようにする配列も含んでいてよい。このようなベクターの使用は、組換えが起こりうる相互作用期間を拡大して、ターゲッティングの効率を増加させることができる(Molecular Biology, ed. Ausubel et al, Unit 9.16, Fig.9.16.1 を参照されたい)。
【0314】
上記のターゲッティングベクターを増殖させるのに用いられる具体的な宿主は、重要ではない。例には、E.coli K12RR1(Bolivar et al., Gene 2:95,1977)、E.coli K12HB101(ATCC番号33694)、E.coli MM21(ATCC番号336780)、E.coli DH1(ATCC番号33849)、E.coli 菌株DH5αおよびE.coliSTBL2が含まれる。或いは、C.cerevisiae のような宿主を用いることができる。上述の宿主は、市販されている(例えば、Stratagene, La Jolla, CA, USA; および Life Technologies, Rockville, MD, USA)。
【0315】
ターゲッティングベクターを生じるためには、ヒトSEP遺伝子ターゲッティング構築物を上記のベクター主鎖に加える。上記のヒトSEP遺伝子ターゲッティング構築物は、少なくとも一つのヒトSEP遺伝子相同性領域を有する。このヒトSEP遺伝子相同性領域を作るためには、ヒトSEP遺伝子に関係した配列を、ポリメラーゼ連鎖反応(PCR)プライマーを製造するための基準として用いる。これらプライマーは、ヒトSEP配列の所望の領域を極めて正確なPCR増幅によって増幅させるために用いる(Mattila et al., Nucleic Acids Res. 19:4967, 1991; Eckert and Kunkel 1:17, 1991; および米国特許第4,683,202号)。ゲノム配列は、ゲノムクローンライブラリーからまたはゲノムDNAの製造から、好ましくは、ヒトSEP遺伝子破壊についてターゲッティングが行われる動物種から得られる。
【0316】
好ましくは、上記のターゲッティング構築物には、正のマーカータンパク質をエンコードしている外因性ヌクレオチド配列も含まれる。ベクター組込み後の正のマーカーの安定な発現は、細胞生存率に影響することなく、識別可能な特性を細胞に与える。したがって、置換ベクターの場合、マーカー遺伝子は、二重乗換えイベント後にそれがヒトSEP遺伝子中に組み込まれるように、二つの隣接している相同性領域の間に位置する。
【0317】
正のマーカータンパク質は選択可能タンパク質であるのが好適であり、このようなタンパク質の細胞中での安定な発現は、選択可能な表現型特性を与える、すなわち、この特性は、それがなければ致死する条件下における細胞の生存を増進させる。したがって、選択可能な条件を課すことにより、ベクター配列を生存率に基づいて首尾よく組み込んでいない他の細胞から、正の選択可能マーカーを安定して発現する細胞を単離することができる。正の選択可能マーカータンパク質(およびそれらの選択試剤)の例には、Neo(G418またはカノマイシン)、Hyg(ハイグロマイシン)、HisD(ヒスチジノール)、Gpt(キサンチン)、Ble(ブレオマイシン)およびHprt(ヒポキサンチン)が含まれる(例えば、Capecchi and Thomas, 米国特許第5,464,764号および Capecchi, Science 244:1288−92, 1989 を参照されたい)。選択可能マーカーに代わるものとして用いることもできる他の正のマーカーには、β−ガラクトシダーゼのようなレポータータンパク質、ホタルルシフェラーゼまたはグリーン蛍光タンパク質が含まれる(例えば、Current Protocols in Cytometry, Unit 9.5 および Current Protocols in Molecular Biology, Unit 9.6, John Wiley & Sons, New York, NY, 2000 を参照されたい)。
【0318】
上記の正の選択スキームは、いずれかの染色体位置へのベクター配列のランダムな非相同的組込みに対して、ヒトSEP遺伝子座に標的相同的組換えによってベクターが組み込まれた細胞間を区別することはない。したがって、相同的組換えに置換ベクターを用いる場合、負の選択可能マーカータンパク質をエンコードしているヌクレオチド配列を含むことも好適である。負の選択可能マーカーの発現は、ある種の試剤にさらされた場合、そのマーカーを発現する細胞の生存率を減少させる(すなわち、そのマーカータンパク質は、特定の選択可能な条件下において細胞にとって致命的になる)。負の選択可能マーカー(およびそれらの致死性試剤)の例には、単純ヘルペスウイルスチミジンキナーゼ(ガンシクロビルまたは1,2−デオキシ−2−フルオロ−α−d−アラビノフラノシル−5−ヨードウラシル)、Hprt(6−チオグアニンまたは6−チオキサンチン)、およびジフテリア毒素、リシン毒素およびシトシンデアミナーゼ(5−フルオロシトシン)が含まれる。
【0319】
負の選択可能マーカーをエンコードしているヌクレオチド配列は、置換ベクターの二つの相同性領域の外側に位置する。この位置にあると、細胞は、ランダムな非相同的組換えによって組込みが生じる場合にのみ、負の選択可能マーカーを単に組込み且つ安定して発現するであろうが、ヒトSEP遺伝子とターゲッティング構築物中の二つの相同性領域との間の相同的組換えは、負の選択可能マーカーをエンコードしている配列を組込みから除外する。したがって、負の条件を課すことにより、ランダムな非相同的組換えによってターゲッティングベクターが組み込まれた細胞は生存率が減少する。
【0320】
正および負の選択可能マーカーの上記組合せは、一連の正および負の選択工程を、相同的組換えによってベクター組込みが行われ、したがって、潜在的に破壊されたヒトSEP遺伝子を有する細胞だけをより効率よく選択するように設計することができるので、好適である。正・負選択スキーム、選択可能マーカーおよびターゲッティング構築物の更に別の例は、例えば、米国特許第号5,464,764、WO94/06908号および Valancius and Smithies, Mol. Cell. Biol. 11:1402, 1991 に記載されている。
【0321】
ベクター組込みによってマーカータンパク質が安定して発現されるために、マーカーコーディング配列がベクター組込みによって内因性ヒトSEP遺伝子プロモーターに機能的に連結するように、ターゲッティングベクターを設計することができる。次に、そのマーカーの発現を、通常はヒトSEP遺伝子を発現する細胞中においてヒトSEP遺伝子プロモーターによって作動させる。或いは、そのベクターのターゲッティング構築物中の各々のマーカーは、ヒトSEP遺伝子プロモーターとは無関係の発現を作動するそれ自体のプロモーターを含有してよい。この後者のスキームは、ヒトSEP遺伝子を典型的に発現しない細胞中においてマーカーの発現を可能にする利点を有する(Smith and Berg, Cold Spring Harbor Symp. Quant. Biol. 49:171, 1984; Sedivy and Sharp, Proc. Natl. Acad. Sci. (USA) 86:227: 1989; Thomas and Capecchi, Cell 51:503, 1987)。
【0322】
マーカー遺伝子発現を作動するのに用いることができる外因性プロモーターには、細胞特異的または段階特異的プロモーター、構成性プロモーター、および誘導性または調節可能プロモーターが含まれる。これらプロモーターの制限されない例には、単純ヘルペスチミジンキナーゼプロモーター、サイトメガロウイルス(CMV)プロモーター/エンハンサー、SV40プロモーター、PGKプロモーター、PMC1−neo、メタロチオネインプロモーター、アデノウイルス後期プロモーター、ワクシニアウイルス7.5Kプロモーター、鳥類のトリβグロビンプロモーター、ヒストンプロモーター(例えば、マウスヒストンH3−614)、βアクチンプロモーター、ニューロン特異的エノラーゼ、筋アクチンプロモーター、およびカリフラワーモザイクウイルス35Sプロモーターが含まれる(概して、Sambrook et al., Molecular Cloning, Vols. I−III, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, および Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY, 2000; Stratagene, La Jolla, CA, USA を参照されたい)。
【0323】
細胞が、ベクター配列を標的ヒトSEP遺伝子座中に組み込まれたかどうか確かめるためには、所望のベクター組込みイベントに特異的であるプライマーまたはゲノムプローブを、PCRまたはサザンブロット分析と組み合わせて用いて、ヒトSEP遺伝子座中への所望のベクター組込みの存在を確認することができる(Erlich et al., Science 252:1643−51,1991; Zimmer and Gruss, Nature 338:150,1989; Mouellic et al., Proc.Natl.Acad.Sci.(USA) 87:4712,1990; および Shesely et al., Proc.Natl.Acad.Sci.(USA) 88:4294,1991)。
【0324】
遺伝子トラップ法
ヒトSEP遺伝子を機能的に破壊するために、外来の核酸配列をヒトSEP遺伝子座中に挿入するのに利用可能なもう一つの方法は、遺伝子トラップ法である。この方法は、エクソンをmRNA中にスプライシングして、遺伝子トラップベクターコーディング配列を遺伝子中にランダム様式で挿入する、全ての哺乳動物細胞に存在する細胞機構を利用する。いったん挿入されると、遺伝子トラップベクターは、トラップされたヒトSEP遺伝子を機能的に破壊しうる突然変異を生じる。相同的組換えとは対照的に、突然変異誘発のためのこのシステムは、極めてランダムな突然変異を生じる。したがって、機能的に破壊されたヒトSEP遺伝子を含有する遺伝子修飾された細胞を得るためには、この特定の突然変異を含有する細胞を、種々の遺伝子のランダム突然変異を含有する細胞のプールから識別し且つ選択しなければならない。
【0325】
遺伝子トラップ用のシステムおよびベクターは、ネズミ細胞および他の細胞タイプを遺伝子修飾する場合の使用について記載されている(例えば、Allen et al., Nature 33:852−55, 1988; Bellen et al., Genes Dev. 3:1288−1300, 1989; Bier et al., Genes Dev. 3:1273−1287, 1989; Bonnerot et al., J. Virol. 66:4982−91, 1992; Brenner et al., Proc. Natl. Acad. Sci. USA 86:5517−21, 1989; Chang et al., Virology 193:737−47, 1993; Friedrich and Soriano, Methods Enzymol. 225:681−701, 1993; Friedrich and Soriano, Genes Dev. 5:1513−23, 1991; Goff, Methods Enzymol. 152:469−81, 1987; Gossler et al., Science 244:463−65, 1989; Hope, Develop. 113:399−408, 1991; Kerr et al., Cold Spring Harb. Symp. Quant. Biol. 2:767−776, 1989; Reddy et al., J. Virol. 65:1507−1515, 1991; Reddy et al., Proc. Natl. Acad. Sci. U.S.A. 89:6721−25, 1992; Skarnes et al., Genes Dev. 6:903−918, 1992; von Melchner and Ruley, J. Virol. 63:3227−3233, 1989; および Yoshida et al, Transgen. Res. 4:277−87, 1995 を参照されたい)。
【0326】
プロモータートラップ(5’トラップ)ベクターは、5’〜3’の順で、スプライスアクセプター配列の後にエクソンを含有するが、これは、典型的に、翻訳開始コドンおよび読み取り枠(ORF)および/または内部リボソームエントリー部位を特徴とする。概して、これらプロモータートラップベクターは、プロモーターも、機能的に連結したスプライスドナー配列も含有しない。したがって、宿主細胞の細胞性ゲノム中への組込み後、そのプロモータートラップベクター配列は、上流の遺伝子の通常のスプライシングを遮断し、末端エクソンとして作用する。ベクターコーディング配列の発現は、適当な読み枠中の破壊された遺伝子のイントロン中へのベクター組込みに依存する。このような場合、細胞性スプライシング機構は、ベクターコーディング配列の上流のトラップされた遺伝子からエクソンをスプライシングする(Zambrowicz et al., WO99/50426号)。
【0327】
上記のプロモータートラップベクターと類似の作用を生じる別の方法は、プロモータートラップベクターのスプライスアクセプターと翻訳開始コドンまたはポリアデニル化配列との間の領域中に存在するまたはそれ以外の場合、その領域中に遺伝子操作される停止コドンの nested セットを包含するベクターである。コーディング配列は、独立リボソームエントリー部位(IRES)を含有するように遺伝子操作することもできるので、そのコーディング配列は、宿主細胞ゲノム中の組込み部位とはほとんど無関係に発現されるであろう。典型的には、必然的ではなく、IRESは、停止コドンの nested セットと連結して用いられる。
【0328】
別のタイプの遺伝子トラップスキームは、3’遺伝子トラップベクターを用いる。このタイプのベクターは、操作上の組合せで、プロモーター領域を含有するが、これは、隣接するコーディング配列、そのコーディング配列、およびコーディング配列エクソンの3’末端を規定するスプライスドナー配列の発現を媒介する。宿主細胞ゲノム中への組込み後、ベクタープロモーターによって発現される転写物は、組み込まれた遺伝子トラップベクター配列の下流に位置するトラップされた遺伝子からスプライスアクセプター配列へとスプライシングされる。したがって、ベクターの組込みは、3’遺伝子トラップカセットのコーディング配列、および末端エクソンおよびそのポリアデニル化シグナルを含めたいずれかの下流細胞性エクソンを含む融合転写物の発現を引き起こす。このようなベクターが遺伝子中に組み込まれる場合、細胞性スプライシング機構は、トラップされた遺伝子の3’エクソンの上流のベクターコーディング配列をスプライシングする。このようなベクターの一つの利点は、3’遺伝子トラップベクターの発現が、遺伝子トラップカセット中のプロモーターによって作動されるので、宿主細胞中で通常発現される遺伝子中への組込みを必要としないということである(Zambrowicz et al., WO99/50426号)。3’遺伝子トラップベクター中に包含されてよい転写プロモーターおよびエンハンサーの例には、ターゲッティングベクターに関して上に論及されたものが含まれる。
【0329】
プロモーターまたは3’遺伝子トラップベクターの構造成分として用いられるウイルスベクター主鎖は、標的細胞のゲノム中に挿入されうる広範囲のベクターより選択されてよい。適当な主鎖ベクターには、単純ヘルペスウイルスベクター、アデノウイルスベクター、アデノ関連ウイルスベクター、レトロウイルスベクター、レンチウイルスベクター、仮性狂犬病ウイルス、α−ヘルペスウイルスベクター等が含まれるが、これらに制限されるわけではない。ウイルスベクター、特に、非複製性細胞を修飾するのに適したウイルスベクター、および外因性ポリヌクレオチド配列の発現と連結したこのようなベクターの使用方法についての詳細な概説は、Viral Vectors: Gene Therapy and Neuroscience Applications, Eds. Caplitt and Loewy, Academic Press, San Diego, 1995 に見出されうる。
【0330】
おそらくは、遺伝子トラップ法にはレトロウイルスベクターが用いられる。これらベクターは、米国特許第5,449,614号に記載されたようなレトロウイルスパッケージング細胞系と連結して用いることができる。非ネズミ哺乳動物細胞を遺伝子修飾の標的細胞として用いる場合、両種性または汎親和性のパッケージング細胞系を用いて、適当なベクターをパッケージすることができる(Ory et al., Pro. Natl. Acad. Sci., USA 93:11400−11406,1996)。現在記載されている3’遺伝子トラップベクターを生じるのに適応させうる代表的なレトロウイルスベクターは、例えば、米国特許第5,521,076号に記載されている。
【0331】
遺伝子トラップ用ベクターは、相同的組換えに用いられるターゲッティングベクターに関して上に論及された正のマーカー遺伝子の一つまたはそれを越えるものを含有してよい。ターゲッティングベクターでのそれらの使用と同様に、これら正のマーカーは、遺伝子トラップ用ベクター中において、細胞ゲノム中にベクターを組み込まれた細胞を識別し且つ選択するのに用いられる。このマーカー遺伝子は、独立リボソームエントリー部位(IRES)を含有するように遺伝子操作されてよいので、そのマーカーは、標的細胞ゲノム中にベクターが組み込まれた位置とはほとんど無関係に発現されるであろう。
【0332】
遺伝子トラップベクターが、感染した宿主細胞のゲノム中にかなりランダムに組み込まれると仮定すると、破壊されたヒトSEP遺伝子を有する遺伝子修飾された細胞は、ランダムなベクター組込みが行われた細胞の集団から識別されなければならない。好ましくは、その細胞集団における遺伝子修飾は、その集団が、それら細胞のゲノム中で見出される本質的にあらゆる遺伝子中で突然変異を示して、破壊されたヒトSEP遺伝子を含む細胞がその集団から識別されることを可能にするように充分なランダムさおよび頻度を有する(Zambrowicz et al., WO99/50426号; Sands et al., WO98/14614号を参照されたい)。
【0333】
破壊されたヒトSEP遺伝子を含有する個々の突然変異細胞系は、突然変異した細胞集団において、例えば、ヒトSEP遺伝子配列中の突然変異を確認するのに逆転写およびPCR(RT−PCR)を用いて識別される。この方法は、クローンをプールすることによって能率的にすることができる。例えば、破壊されたヒトSEP遺伝子を含有する個々のクローンを見出すには、遺伝子トラップベクター中に固定された一つのプライマーおよびヒトSEP遺伝子配列中に位置する別のプライマーを用いてRT−PCRを行う。正のRT−PCR結果は、そのベクター配列がヒトSEP遺伝子転写物中にエンコードされていることを示し、ヒトSEP遺伝子が遺伝子トラップ組込みイベントによって破壊されたことが示される(例えば、Sands et al., WO98/14614号を参照されたい)。
【0334】
時間的、空間的および誘導性の遺伝子破壊
内因性ヒトSEP遺伝子の機能的破壊は、特定の発生段階または細胞周期段階で(時間的破壊)または特定の細胞タイプで(空間的破壊)生じることがありうる。ヒトSEP遺伝子破壊は、ある種の条件が存在する場合、誘導性でもありうる。Cre−Lox系のようなリコンビナーゼ切除系は、特定の発生段階で、特定の組織または細胞タイプで、または特定の環境条件下でヒトSEP遺伝子を活性化させるまたは失活させるのに用いることができる。概して、Cre−Lox技法を利用する方法は、Torres and Kuhn, Laboratory Protocols for Conditional Gene Targeting, Oxford University Press, 1997 によって記載のように行われる。Cre−Lox系について記載されたのと類似した方法も、FLP−FRT系を利用して用いることができる。相同的組換えまたはウイルス挿入によって条件付きで遺伝子を破壊するリコンビナーゼ切除系の使用に関する更に別の指針は、例えば、米国特許第5,626,159号、米国特許第5,527,695号、米国特許第5,434,066号、WO98/29533号、Orban et al., Proc. Natl. Acad. Sci. USA 89:6861−65, 1992; O’Gormann et al., Science 251:1351−55, 1991; Sauer et al., Nucleic Acids Research 17:147−61, 1989; Barinaga, Science 265:26−28, 1994; および Akagi et al., Nucleic Acids Res. 25:1766−73, 1997 に与えられる。一つより多いリコンビナーゼ系を、動物細胞を遺伝子修飾に用いることができる。
【0335】
Cre−Lox系のようなリコンビナーゼ系を用いて、時間的、空間的または誘導性の様式でヒトSEP遺伝子を破壊するのに相同的組換えを用いる場合、ヒトSEP遺伝子コーディング領域の一部分を、loxP部位に隣接したヒトSEP遺伝子コーディング領域を含むターゲッティング構築物によって置き換える。この遺伝子修飾を有する動物細胞は、機能的なloxPに隣接したヒトSEP遺伝子を含有する。ヒトSEP遺伝子破壊の時間的、空間的または誘導性の側面は、所望の空間的に調節された、時間的に調節された、または誘導性のプロモーターそれぞれの制御下において動物細胞中で発現される、追加の導入遺伝子、すなわち、Creリコンビナーゼ導入遺伝子の発現パターンによってもたらされる。Creリコンビナーゼは、組換えのためのloxP部位を標的とする。したがって、Cre発現が活性化されると、loxP部位で組換えが行われて、挟まれたヒトSEP遺伝子コーディング配列が切除され、ヒトSEP遺伝子の機能的破壊が生じる(Rajewski et al., J. Clin. Invest. 98:600−03, 1996; St.−Onge et al., Nucleic Acids Res. 24:3875−77, 1996; Agah et al., J. Clin. Invest. 100:169−79, 1997; Brocard et al., Proc. Natl. Acad. Sci. USA 94:14559−63, 1997; Feil et al., Proc. Natl. Acad. Sci. USA 93:10887−90, 1996; および Kuehn et al., Science 269:1427−29, 1995)。
【0336】
Creリコンビナーゼ導入遺伝子およびloxPに隣接したヒトSEP遺伝子を両方とも含有する細胞は、標準的なトランスジェニック技術によって生じることができる。ヒトSEP遺伝子を時間的、空間的または条件付きで破壊するためのリコンビナーゼ系特異的プロモーターの使用に関する更に別の指針は、例えば、Sauer, Meth. Enz. 225:890−900, 1993, Gu et al., Science 265:103−06, 1994, Araki et al., J. Biochem. 122:977−82, 1997, Dymecki, Proc. Natl. Acad. Sci. 93:6191−96, 1996、および Meyers et al., Nature Genetics 18:136−41, 1998 に見出される。
【0337】
ヒトSEP遺伝子の誘導性破壊は、テトラサイクリン応答性バイナリー系を用いることによって達成することもできる(Gossen and Bujard, Proc. Natl. Acad. Sci. USA 89:5547−51, 1992)。この系は、内因性ヒトSEP遺伝子調節要素、およびテトラサイクリンで制御可能なリプレッサー(TetR)を発現する導入遺伝子中に、Tetプロモーターを導入するように細胞を遺伝子修飾することを含む。このような細胞では、テトラサイクリンの投与は、TetRを活性化させ、順次、これがヒトSEP遺伝子発現を阻害し、したがって、ヒトSEP遺伝子を機能的に破壊する(St.−Onge et al., Nucleic Acids Res. 24:3875−77,1996,米国特許第5,922,927号)。
【0338】
ヒトSEP遺伝子の時間的、空間的および誘導性の破壊のための上記の系は、例えば、WO98/29533号に記載のように遺伝子修飾の方法として遺伝子トラップ法を用いる場合に用いることもできる。
【0339】
遺伝子修飾された動物細胞を生じること
遺伝子修飾のための上記の方法は、実質的には動物に由来する体細胞または幹細胞のいずれのタイプでも、ヒトSEP遺伝子を機能的に破壊するのに用いることができる。本発明の遺伝子修飾された動物細胞には、ヒト細胞を含めた哺乳動物細胞、および鳥類細胞が含まれるが、これらに制限されるわけではない。これら細胞は、培養に適応された、腫瘍発生性のまたは形質転換された細胞系のようないずれかの動物細胞系を遺伝子修飾することに由来してよいし、またはそれらは、所望のヒトSEP遺伝子修飾を有する遺伝子修飾された非ヒト動物から単離されてよい。
【0340】
これら細胞は、破壊されたヒトSEP遺伝子についてヘテロ接合性であってよいしまたはホモ接合性であってよい。ヒトSEP遺伝子破壊についてホモ接合性である細胞(ヒトSEP−/−)を得るために、両方の対立遺伝子の直接的な逐次的ターゲッティングを行うことができる。この方法は、正の選択可能マーカーを再循環することによって容易にすることができる。このスキームにより、正の選択可能マーカーをエンコードしているヌクレオチド配列は、Cre−LoxP系を用いた一つの対立遺伝子の破壊後に除去される。したがって、同様のベクターは、次の回のターゲッティングにおいて、第二のヒトSEP遺伝子対立遺伝子を破壊するのに用いることができる(Abuin and Bradley, Mol. Cell. Biol. 16:1851−56, 1996; Sedivy et al., T. I. G. 15:88−90, 1999; Cruz et al., Proc. Natl. Acad. Sci. (USA) 88:7170−74, 1991; Mortensen et al., Proc. Natl. Acad. Sci. (USA) 88:7036−40, 1991; te Riele et al., Nature (London) 348:649−651, 1990)。
【0341】
ヒトSEP−/−であるES細胞を得るための別の戦略は、ヒトSEP遺伝子破壊にヘテロ接合性である細胞(ヒトSEP+/−)の集団からの細胞のホモジナイゼーションである。この方法は、選択可能薬物耐性マーカーを発現するヒトSEP+/−標的クローンを、極めて高い薬物濃度に対して選択するスキームを用いるが、この選択は、薬物耐性マーカーをエンコードしている配列の二つのコピーを発現する、したがって、ヒトSEP遺伝子破壊にホモ接合性である細胞に有利である(Mortensen et al., Mol. Cell. Biol. 12:2391−95, 1992)。
【0342】
所望の細胞または細胞系の遺伝子修飾後、ヒトSEP遺伝子座は、標準的なPCRによるPCR分析または当該技術分野において知られているサザンブロッティング法によって修飾部位として確かめることができる(例えば、米国特許第4,683,202号;および Erlich et al., Science 252:1643,1991 を参照されたい)。ヒトSEP遺伝子の機能的破壊の更に別の立証は、ヒトSEP遺伝子メッセンジャーRNA(mRNA)レベルおよび/またはヒトSEPポリペプチドレベルが、正常にヒトSEP遺伝子を発現する細胞中で減少するかどうかで行うこともできる。ヒトSEP遺伝子mRNAレベルの尺度は、逆転写酵素に媒介されるポリメラーゼ連鎖反応(RT−PCR)、ノーザンブロット分析または in situ ハイブリダイゼーションを用いることによって得ることができる。細胞によって生産されるヒトSEPポリペプチドの定量化は、例えば、当該技術分野において知られている標準的な免疫検定法によって行うことができる。このような免疫検定には、ラジオイムノアッセイ、ELISA(酵素結合イムノソルベント検定)、“サンドイッチ”免疫検定、イムノラジオメトリックアッセイ、ゲル拡散沈降反応、免疫拡散検定、in situ 免疫検定(例えば、金コロイド、酵素または放射性同位体の標識を用いた)、ウェスタンブロット、2次元ゲル分析、沈降反応、免疫蛍光検定、プロテインA検定、および免疫電気泳動検定のような技術を用いた競合的および非競合的検定システムが含まれるが、これらに制限されるわけではない。
【0343】
好ましい遺伝子修飾された動物細胞は、胚性幹(ES)細胞およびES様細胞である。これら細胞は、マウス(Evans et al., Nature 129:154−156, 1981; Martin, Proc. Natl. Acad. Sci. USA, 78:7634−7638, 1981)、ブタおよびヒツジ(Notanianni et al., J. Reprod. Fert. Suppl., 43:255−260, 1991; Campbell et al., Nature 380:64−68, 1996)、およびヒトを含めた霊長類(Thomson et al., 米国特許第5,843,780号,Thomson et al., Science 282:1145−1147, 1995; および Thomson et al., Proc. Natl. Acad. Sci. USA 92:7844−7848, 1995)などのいろいろな種の着床前の胚および胚盤胞に由来する。
【0344】
これらのタイプの細胞は、多能性である。すなわち、適当な条件下において、それらは、3種類全ての胚葉、すなわち、外胚葉、中胚葉および内胚葉に由来するいろいろな細胞タイプに分化する。培養条件に依り、ES細胞の試料は、幹細胞として無制限に培養されて、単一試料内でいろいろ異なった細胞タイプに分化させることができるし、またはマクロファージ様細胞、ニューロン細胞、心筋細胞、脂肪細胞、平滑筋細胞、内皮細胞、骨格筋細胞、角化細胞、および好酸球、マスト細胞、赤芽球前駆細胞または巨核球などの造血細胞のような特定の細胞タイプに分化するように支配されることができる。支配された分化は、例えば、Keller et al., Curr. Opin. Cell Biol. 7:862−69, 1995, Li et al., Curr. Biol. 8:971, 1998, Klug et al., J. Clin. Invest. 98:216−24,1 996, Lieschke et al., Exp. Hematol. 23:328−34, 1995, Yamane et al., Blood 90:3516−23, 1997, および Hirashima et al., Blood 93:1253−63, 1999 に更に記載されるように、その培養条件において特異的増殖因子またはマトリックス成分を含むことによって達せられる。
【0345】
遺伝子修飾に用いられる具体的な胚性幹細胞系は重要ではないが、典型的なネズミES細胞系には、AB−1(McMahon and Bradley, Cell 62:1073−85, 1990)、E14(Hooper et al., Nature 326:292−95, 1987)、D3(Doetschmann et al., J. Embryol. Exp. Morph. 87:27−45, 1985)、CCE(Robertson et al., Nature 323:445−48, 1986)、RW4(Genome Systems, St. Louis, MO)およびDBA/11acJ(Roach et al., Exp. Cell Res. 221:520−25, 1995)が含まれる。
【0346】
ポリペプチドの製造
本発明によれば、本発明のポリペプチドの製造は、例えば、本発明の一つまたはそれを越えるポリヌクレオチドで形質転換された微生物発現宿主を慣用的な栄養発酵培地中で培養することによって行うことができる。適当な培地の選択は、発現宿主の選択に基づいておよび/または発現構築物の調節必要条件に基づいてよい。このような培地は、当業者に周知である。所望ならば、この培地は、潜在的に混入している他の微生物よりも形質転換された発現宿主に有利な追加の成分を含有してよい。
【0347】
したがって、本発明は、更に、ヒトSEP活性を有するポリペプチドを製造する方法であって、(a)配列番号:1または配列番号:5に示されるヌクレオチド配列またはその誘導体、ホモログ、変異体またはフラグメントで宿主細胞を形質転換し;そして(b)その形質転換された宿主細胞を、このポリペプチドの発現に適した条件下で培養する工程を含む方法を提供する。
【0348】
本発明は、更に、ヒトSEP活性を有するポリペプチドを製造する方法であって、(a)配列番号:1または配列番号:5に示されるヌクレオチド配列またはその誘導体、ホモログ、変異体またはフラグメントで形質転換された宿主細胞を、このポリペプチドの発現に適した条件下で培養し;そして(b)このポリペプチドを宿主細胞培養物から回収する工程を含む方法に関する。
【0349】
本発明は、更に、ヒトSEP活性を有するポリペプチドを製造する方法であって、(a)配列番号:1または配列番号:5に示されるヌクレオチド配列またはその誘導体、ホモログ、変異体またはフラグメントで宿主細胞を形質転換し;(b)この形質転換された宿主細胞を、このポリペプチドの発現に適した条件下で培養し;そして(c)このポリペプチドを宿主細胞培養物から回収する工程を含む方法に関する。
【0350】
リボザイム
リボザイムは、RNAの特異的切断を触媒することができる酵素的RNA分子である。リボザイム作用機作は、相補的な標的RNAへのリボザイム分子の配列特異的ハイブリダイゼーションに続く内ヌクレオチド結合分解性の切断(endonucleolytic cleavage)を含む。本発明の範囲内にあるのは、ヒトSEP RNA配列の内ヌクレオチド結合分解性の切断を特異的に且つ効率よく触媒するよう設計されたハンマーヘッドモチーフリボザイム分子である。
【0351】
いずれか可能なRNA標的中の特異的リボザイム切断部位は、次の配列、GUA、GUUおよびGUCが含まれるリボザイム切断部位について標的分子を走査することによって最初に識別される。いったん識別されると、この切断部位を含有する標的遺伝子の領域に該当する15〜20リボヌクレオチドの短いRNA配列を、オリゴヌクレオチド配列を機能不能にすることがありうる二次構造特徴について評価することができる。候補標的の適合性も、リボヌクレアーゼ保護検定を用いて、相補的オリゴヌクレオチドとのハイブリダイゼーションについての接近容易性を調べることによって評価することができる。
【0352】
本発明のアンチセンスRNAおよびDNA両方の分子およびリボザイムは、RNA分子の合成について当該技術分野において知られているいずれかの方法によって製造することができる。これらには、固相ホスホルアミダイト化学合成のような、オリゴヌクレオチドを化学合成する技法が含まれる。或いは、RNA分子は、アンチセンスRNA分子をエンコードしているDNA配列の in vitro または in vivo 転写によって生じることができる。このようなDNA配列は、T7またはSP6のような適当なRNAポリメラーゼプロモーターと一緒にいろいろなベクター中に包含させることができる。或いは、アンチセンスRNAを構成的にまたは誘導的に合成するアンチセンスcDNAを、細胞系、細胞または組織中に導入することができる。
【0353】
検出
ヒトSEPポリヌクレオチドコーディング配列の存在は、配列番号:1または配列番号:5に示される配列のプローブ、一部分またはフラグメントを用いたDNA−DNAまたはDNA−RNAハイブリダイゼーションまたは増幅によって検出することができる。核酸増幅に基づく検定は、ヒトSEP DNAまたはRNAを含有する形質転換体を検出するための、ヒトSEPコーディング配列に基づくオリゴヌクレオチドまたはオリゴマーの使用を含む。本明細書中で用いられる“オリゴヌクレオチド”または“オリゴマー”は、少なくとも約10ヌクレオチドおよび約60ヌクレオチド程度の、好ましくは、好ましくは、約15〜30ヌクレオチド、そしてより好ましくは、プローブまたはアンプリマー(amplimer)として用いることができる約20〜25ヌクレオチドの核酸配列を意味してよい。好ましくは、オリゴヌクレオチドは、配列番号:1または配列番号:5に示されるヌクレオチド配列の3’領域に由来する。
【0354】
タンパク質に特異的な多クローン性抗体かまたは単クローン性抗体を用いることによるような、ヒトSEPポリペプチドの発現を検出するおよび測定する種々のプロトコールは、当該技術分野において知られている。例には、酵素結合イムノソルベント検定(ELISA)、ラジオイムノアッセイ(RIA)および蛍光活性化セルソーティング(FACS)が含まれる。ヒトSEPポリペプチド上の二つの非干渉性エピトープに反応性の単クローン性抗体を用いる単クローン性二部位免疫検定(two−site, monoclonal−based immunoassay)が好適であるが、競合的結合検定を用いてよい。これらおよび他の検定は、特に、Hampton R et al.(1990, Serological Methods, A Laboratory Manual, APS Press, St Paul, MN, USA)および Maddox DE et al.(1983, J. Exp. Med., 158:1211)に記載されている。
【0355】
いろいろな標識および接合技術は、当業者に知られており、種々の核酸およびアミノ酸検定で用いることができる。ヒトSEPポリヌクレオチド配列を検出するための標識ハイブリダイゼーションまたはPCRプローブを生じる手段には、標識ヌクレオチドを用いるオリゴラベリング、ニックトランスレーション、エンドラベリングまたはPCR増幅が含まれる。或いは、ヒトSEPコーディング配列またはそのいずれか一部分を、mRNAプローブの製造のためのベクター中にクローン化してよい。このようなベクターは、当該技術分野において知られているし、市販されており、そしてT7、T3またはSP6のような適当なRNAポリメラーゼおよび標識ヌクレオチドの付加によって in vitro でRNAプローブを合成するのに用いることができる。
【0356】
Pharmacia Biotech(Piscataway, NJ, USA)、Promega(Madison, WI, USA)および US Biochemical Corporation(Cleaveland, OH, USA)のような多数の会社は、これら手順のための市販のキットおよびプロトコールを供給している。適当なレポーター分子または標識には、放射性核種、酵素、蛍光剤、化学発光剤または発色剤、並びに基質、補助因子、阻害剤、磁性粒子等が含まれる。このような標識の使用を教示する特許には、US−A−3817837号;US−A−3850752号;US−A−3939350号;US−A−3996345号;US−A−4277437号;US−A−4275149号;およびUS−A−4366241号が含まれる。更に、組換え免疫グロブリンを、US−A−4816567号に示されるように生じることができる。
【0357】
特定の分子の発現を定量する更に別の方法には、ヌクレオチドを放射性標識すること(Melby PC et al., 1993, J. Immunol. Methods, Vol 159,pp.235−244)またはビオチニル化すること(Duplaa C et al., 1993, Annal Biochem., Vol 229, p.36)、対照核酸の共増幅、および実験結果を補間する標準曲線が含まれる。多重試料の定量化は、ELISAフォーマットで検定を実施することによって迅速化することができるが、この場合、目的のオリゴマーは、いろいろな希釈度で与えられ、分光測光または熱量測定応答が迅速な定量化を生じる。
【0358】
マーカー遺伝子発現の存在/不存在は、目的の遺伝子も存在するということを示唆するが、その存在および発現は、確かめられるべきである。例えば、ヒトSEPコーディング配列をマーカー遺伝子配列内に挿入する場合、ヒトSEPコーディング領域を含有する組換え細胞は、マーカー遺伝子機能の不存在によって識別することができる。或いは、マーカー遺伝子は、単一プロモーターの制御下にあるヒトSEPコーディング配列と一緒にタンデムに置かれることができる。誘導または選択に応答したマーカー遺伝子の発現は、通常、ヒトSEPの発現も示す。
【0359】
或いは、ヒトSEPのコーディング配列を含有し且つヒトSEPコーディング領域を発現する宿主細胞は、当業者に知られている種々の手順によって識別することができる。これら手順には、核酸またはタンパク質の検出および/または定量化のためのメンブラン、溶液またはチップを基剤とする技術を含めた、DNA−DNAまたはDNA−RNAハイブリダイゼーションおよびタンパク質バイオアッセイまたは免疫検定技術が含まれるが、これらに制限されるわけではない。
【0360】
抗体
本発明のアミノ酸配列は、標準的な技法の使用によるように、そのアミノ酸配列に対する抗体を生じるのに用いることもできる。
【0361】
当該技術分野において周知の手順は、ヒトSEPポリペプチドへの抗体の産生に用いることができる。このような抗体には、多クローン性、単クローン性、キメラ、単鎖、FabフラグメントおよびFab発現ライブラリーによって生じるフラグメントが含まれるが、これらに制限されるわけではない。中和抗体、すなわち、ヒトSEPポリペプチドの生物学的活性を阻害する抗体は、診断薬および治療薬に特に好適である。
【0362】
抗体の産生には、ヤギ、ウサギ、ラット、マウス等を含めた種々の宿主を、免疫原性を保持する阻害剤またはそのいずれか一部分、変異体、ホモログ、フラグメントまたは誘導体またはオリゴペプチドの注射によって免疫感作することができる。宿主の種に依り、種々のアジュバントを用いて免疫学的応答を増加させることができる。このようなアジュバントには、フロイント、水酸化アルミニウムのようなミネラルゲル、およびリゾレシチン、プルロニックポリオール、ポリアニオン、ペプチド、オイルエマルジョン、キーホールリンペットヘモシアニンおよびジニトロフェノールのような界面活性物質が含まれるが、これらに制限されるわけではない。BCG(カルメット・ゲラン桿菌(Bacilli Calmette−Guerin))およびコリネバクテリウム・パルヴム(Corynebacterium parvum)は、用いることができる潜在的に有用なヒトアジュバントである。
【0363】
アミノ酸配列への単クローン性抗体は、培養中の連続的継代細胞系によって抗体分子を産生させるいずれかの技術を用いて製造することもできる。これらには、Koehler and Milstein によって最初に記載されたハイブリドーマ技術(1975, Nature, Vol 256,pp.495−497)、ヒトB細胞ハイブリドーマ技術(Kosbor et al.,(1983), Immunol. Today, Vol 4,p.72; Cote et al.,(1983), Proceedings of the National Academy of Sciences (USA), Vol 80,pp.2026−2030)およびEBVハイブリドーマ技術(Cole et al.,(1985), Monoclonal Antibodies and Cancer Therapy, Alan R Liss Inc., pp.77−96)が含まれるが、これらに制限されるわけではない。更に、“キメラ抗体”の産生のために開発された技術である、適当な抗原特異性および生物学的活性を有する分子を得るためのヒト抗体遺伝子へのマウス抗体遺伝子のスプライシングを用いることができる(Morrison et al.,(1984), Proceedings of the National Academy of Sciences (USA), Vol 81, pp.6851−6855; Neuberger et al.,(1984), Nature, Vol 312, pp.604−608; Takeda et al., (1985), Nature, Vol 314, pp.452−454)。或いは、単鎖抗体の産生について記載された技術(US−A−4946779号)は、阻害剤特異的単鎖抗体を生じるのに適応することができる。
【0364】
抗体は、リンパ球集団において in vivo 産生を引き起こすことによって、または Orlandi et al.(1989, Proceedings of the National Academy of Sciences (USA), Vol 86, pp.3833−3837)および Winter G and Milstein C(1991; Nature, Vol 349, pp.293−299)に開示されたように、極めて特異的な結合性試薬の組換え免疫グロブリンライブラリーまたはパネルをスクリーニングすることによって生じることもできる。
【0365】
ヒトSEPへの特異的結合部位を含有する抗体フラグメントを生じることもできる。例えば、このようなフラグメントには、抗体分子のペプシン消化によって生じることができるF(ab’)2フラグメント、およびこのF(ab’)2フラグメントのジスルフィド架橋を還元させることによって生じることができるFabフラグメントが含まれるが、これらに制限されるわけではない。或いは、Fab発現ライブラリーを、所望の特異性での単クローン性Fabフラグメントの迅速且つ容易な識別を可能にするように構築することができる(Huse WD et al.,(1989), Science, Vol 256, pp.1275−1281)。
【0366】
別の技術は、例えば、ファージが、そのコート表面上でscFvフラグメントをいろいろな相補性決定領域(CDR)とともに発現する場合のファージディスプレイライブラリーをスクリーニングすることを含む。この技術は、当該技術分野において周知である。
【0367】
ヒトSEP特異的抗体は、ヒトSEPポリペプチドの発現に関連した状態および疾患の診断に有用である。確定された特異性を有する多クローン性抗体かまたは単クローン性抗体を用いる競合的結合検定またはイムノラジオメトリックアッセイの種々のプロトコールは、当該技術分野において周知である。このような免疫検定は、典型的に、ヒトSEPポリペプチドとその特異的抗体(または類似したヒトSEP結合性分子)との間の複合体の形成、および複合体形成の測定を含む。特異的ヒトSEPタンパク質上の二つの非干渉性エピトープに反応性の単クローン性抗体を用いる単クローン性二部位免疫検定は好適であるが、競合的結合検定を用いてもよい。これら検定は、Maddox DE et al.(1983, Journal of Experimental Medicine, Vol 158, p.1211)に記載されている。
【0368】
抗ヒトSEP抗体は、異常なペプチドシグナリングを伴う障害、またはヒトSEPの異常な発現を特徴とする他の障害または疾患の診断に有用である。ヒトSEPの診断検定には、ヒト体液、細胞、組織、またはこのような組織の切片または抽出物中でヒトSEPポリペプチドを検出するために抗体および標識を利用する方法が含まれる。本発明のポリペプチドおよび抗体は、修飾してまたは修飾することなく用いることができる。しばしば、これらポリペプチドおよび抗体は、レポーター分子とそれらを共有結合によってかまたは非共有結合によって連結することにより標識されるであろう。いろいろなレポーター分子が当業者に知られている。
【0369】
抗体は、生物試料中に存在する本発明のポリペプチドを、(a)本発明の抗体を提供し;(b)生物試料をこの抗体と一緒に、抗体−抗原複合体を形成させる条件下でインキュベートし;そして(c)この抗体を含む抗体−抗原複合体が形成されるかどうか確認することを含む方法によって検出する方法で用いることができる。
【0370】
これら状況に依って、適当な試料には、精巣または脳のような摘出組織、またはこのような組織に由来する腫瘍性新生物が含まれうる。
本発明の抗体は、固体支持体に結合されてよいし、および/または適当な試薬、対照、取扱い説明書等と一緒に、適当な容器中のキットにパッケージされていてよい。
【0371】
検定/識別方法
本発明は、更に、(ヒト細胞のような)細胞中のヒトSEPの存在を検出する検定方法であって、(a)このような細胞からの(全RNAのような)RNAについて、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異から決定されるようなヒトSEPに特異的である1対のPCRプライマーを用いて逆転写酵素−ポリメラーゼ連鎖反応(RT−PCR)を行い;そして(b)適当なサイズのPCRフラグメントの出現を、アガロースゲル電気泳動などによって検定することを含む方法に関する。
【0372】
本発明は、更に、ヒトSEPの活性および/またはその発現に(阻害するまたはそれ以外には修飾するなどの)影響を与える試剤(化合物、それを含む他の物質または組成物など)を識別する方法であって、ヒトSEPまたはそれをコードするヌクレオチド配列をその試剤と接触させた後、ヒトSEPの活性および/またはその発現を測定することを含む方法に関する。
【0373】
本発明は、更に、ヒトSEPの活性および/またはその発現に(選択的に阻害するまたはそれ以外には選択的に修飾するなどの)選択的に影響を与える試剤(化合物、それを含む他の物質または組成物など)を識別する方法であって、ヒトSEPまたはそれをコードするヌクレオチド配列をその試剤と接触させた後、ヒトSEPの活性および/またはその発現を測定することを含む方法に関する。
【0374】
本発明は、更に、ヒトSEPの活性および/またはその発現に(阻害するまたはそれ以外には修飾するなどの)影響を与える試剤(化合物、それを含む他の物質または組成物など)を識別する方法であって、ヒトSEPの活性および/またはその発現を、(a)配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含む組換えDNAを包含している細胞系、または(b)ヒトSEPを天然に選択的に発現する細胞集団または細胞系中において、その試剤の存在下でまたはその試剤を添加後に測定することを含む方法に関する。好ましくは、ヒトSEPの活性は、上記の検定方法によって決定される。
【0375】
本発明は、更に、ヒトSEPの活性および/またはその発現に(選択的に阻害するまたはそれ以外には選択的に修飾するなどの)選択的に影響を与える試剤(化合物、それを含む他の物質または組成物など)を識別する方法であって、ヒトSEPの活性および/またはその発現を、(a)配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含む組換えDNAを包含している細胞系、または(b)ヒトSEPを天然に選択的に発現する細胞集団または細胞系中において、その試剤の存在下でまたはその試剤を添加後に測定することを含む方法に関する。好ましくは、ヒトSEPの活性は、上記の検定方法によって決定される。
【0376】
本発明は、更に、ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)活性またはそれ(その誘導体、ホモログ、変異体またはフラグメントを含めた)をコードするヌクレオチド配列の発現のモジュレーション(好ましくは、特異的モジュレーション)について試剤をスクリーニングする方法であって、(a)候補試剤を提供し;(b)ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列とその候補試剤とを、適当な条件下でモジュレーションさせるのに充分な時間混合し;そして(c)その候補試剤がヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)活性またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列の発現をモジュレートするかどうか確かめるために、その候補試剤によるヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列のモジュレーションを検出する工程を含む方法に関する。
【0377】
本発明は、更に、ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(その誘導体、ホモログ、変異体またはフラグメントを含めた)をコードするヌクレオチド配列との特異的結合親和性について試剤をスクリーニングする方法であって、(a)候補試剤を提供し;(b)ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列とその候補試剤とを、適当な条件下で結合させるのに充分な時間混合し;そして(c)その候補試剤がヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列に結合するかどうか確かめるために、ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列への候補試剤の結合を検出する工程を含む方法に関する。
【0378】
本発明は、更に、ヒトSEPをモジュレートすることができる試剤を識別する方法であって、(a)その試剤を、ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列と接触させ;(b)工程(a)の混合物を生物活性ペプチドと一緒に、その生物活性ペプチドのタンパク質分解に適した条件下でインキュベートし;(c)生物活性ペプチドタンパク質分解の量を測定し;そして(d)工程(c)の生物活性ペプチドタンパク質分解の量と、その試剤を含むことなくインキュベートされたヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列について得られる生物活性ペプチドタンパク質分解の量とを比較し、それによって、その試剤が生物活性ペプチドタンパク質分解に(阻害するまたは選択的に阻害するなどの)影響を与えるかどうか確認する工程を含む方法に関する。
【0379】
したがって、本発明の一定の態様において、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体、および/またはヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体を発現する細胞系は、エンドペプチダーゼ活性のモジュレーターとして作用する抗体、ペプチド、または有機または無機分子のような他の試剤について、またはそれらの発現についてスクリーニングし、それによって、生物活性ペプチドレベルをモジュレートすることができる治療薬を識別するのに用いることができる。例えば、ヒトSEPの活性を中和することができる抗ヒトSEP抗体は、生物活性ペプチドのヒトSEPタンパク質分解を阻害し、それによって、それらのレベルを増加させるのに用いることができる。或いは、組換え発現されたヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体、またはヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体を発現する細胞系を用いる組合せ化学によって作られるペプチドライブラリーまたは有機ライブラリーのスクリーニングは、生物活性ペプチドのヒトSEPによるタンパク質分解をモジュレートすること(例えば、阻害することまたは選択的に阻害すること)によって機能する治療薬の識別に有用でありうる。合成化合物、天然物、および他の潜在的に生物学的に活性な物質源は、当業者にとって常套的であると考えられる多数の方法でスクリーニングすることができる。例えば、ヒトSEPのN末端領域をエンコードしているヌクレオチド配列は、細胞系中で発現させることができるが、これは、ヒトSEP活性のアゴニストかまたはアンタゴニストであるアロステリックモジュレーターをスクリーニングするのに用いることができる。或いは、ヒトSEPの保存触媒ドメインをエンコードしているヌクレオチド配列を、細胞系中で発現させて、生物活性ペプチドタンパク質分解の阻害剤または選択的阻害剤についてスクリーニングするのに用いることができる。
【0380】
ヒトSEP活性または生物活性ペプチドタンパク質分解を妨げる試験薬の能力は、ヒトSEPレベルまたは生物活性ペプチドレベルを測定することによって決定することができる。
【0381】
したがって、本発明は、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体の生物活性ペプチドタンパク質分解活性をモジュレートすることができる化合物を識別する方法であって、(a)その化合物を、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体と接触させ;(b)工程(a)の混合物を生物活性ペプチドと一緒に、その生物活性ペプチドのタンパク質分解に適した条件下でインキュベートし;(c)生物活性ペプチドタンパク質分解の量を測定し;そして(d)工程(c)の生物活性ペプチドタンパク質分解の量と、その化合物を含むことなくインキュベートされたヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体について得られる生物活性ペプチドタンパク質分解の量とを比較し、それによって、その化合物が生物活性ペプチドタンパク質分解を刺激するまたは阻害するかどうか決定する工程を含む方法に関する。この方法の一つの態様において、フラグメントは、ヒトSEPのN末端領域からであってよく、ヒトSEPのアロステリックモジュレーターを識別する方法を提供する。本発明のもう一つの態様において、このフラグメントは、ヒトSEPのカルボキシ末端領域からであってよく、生物活性ペプチドタンパク質分解の阻害剤または選択阻害剤を識別する方法を提供する。
【0382】
これら生物活性ペプチドは、完全長であってよいしまたはそのフラグメントであってよく、組換えによって、または好ましくは、合成によって生じることができる。好ましくは、これら生物活性ペプチドは、ヒトSEPによってモジュレートされる(好ましくは、タンパク質分解/加水分解によって切断される)ことができる低分子量合成ペプチドである。より好ましくは、これら合成ペプチドを標識する(好ましくは、蛍光標識、より好ましくは、本明細書中に記載のFRET検定で用いることができるような分子内消光性蛍光原性色素で蛍光標識する)。
【0383】
ヒトSEPは、生物活性ペプチド活性を調節することおよび/または生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解に関与しうるので、上記の“生物活性ペプチド(類)”(および同種のもの)への言及は、これら言及が必要な変更を加えて解釈するためにある場合について、適宜、“生物学的に不活性なペプチド(類)”(および同種のもの)への言及を意味するとみなすこともできる。例えば、ヒトSEP活性の阻害が、増加したレベルの生物活性ペプチド(類)をもたらすかもしれない場合、このような阻害は、更に、または代わりに、増加したレベルの生物学的に不活性なペプチド(類)をもたらし、それによって、それらの“活性型”のペプチド(類)の減少したレベルをもたらすかもしれない。
【0384】
ヒトSEPポリペプチド、その免疫原性フラグメントまたはそのオリゴペプチドは、種々の薬物スクリーニング技術のいずれにおいても治療的化合物をスクリーニングするのに用いることができる。このような試験で用いられるポリペプチドは、溶液中でフリーであってよいし、固体支持体に固着されていてよいし、細胞表面上にあってもよいし、または細胞内に位置していてよい。活性の消滅またはヒトSEPポリペプチドと試験される試剤との間の結合性複合体の形成は、測定することができる。
【0385】
したがって、本発明は、ヒトSEPまたはその発現、またはその一部分またはその変異体、ホモログ、フラグメントまたは誘導体のモジュレーション(好ましくは、特異的結合親和性または阻害のような特異的モジュレーション)について一つまたは複数の化合物をスクリーニングする方法であって、一つまたは複数の化合物を提供し;ヒトSEPまたはそれをコードするヌクレオチド配列またはその一部分またはその変異体、ホモログ、フラグメントまたは誘導体と、一つまたは複数の化合物各々とを、適当な条件下でモジュレーションさせるのに充分な時間混合し;そして例えば、(i)複数の化合物各々へのヒトSEP、またはその一部分またはその変異体、ホモログ、フラグメントまたは誘導体の結合を検出し、それによって、ヒトSEPまたはそれをコードするヌクレオチド配列をモジュレートする一つまたは複数の化合物を識別すること;または(ii)複数の化合物各々によるヒトSEP、またはその一部分またはその変異体、ホモログ、フラグメントまたは誘導体の阻害を検出し、それによって、ヒトSEPまたはそれをコードするヌクレオチド配列をモジュレートする(阻害する)一つまたは複数の化合物を識別することを含む方法に関する。このような検定において、これら複数の化合物は、当業者に知られている組合せ化学技術によって生じることができる。
【0386】
薬物スクリーニングのためのもう一つの技法は、ヒトSEPポリペプチドへの適当な結合親和性を有する化合物の高処理スクリーニング(HTS)に提供され、1984年9月13日公開の Geysen, WO84/03564号に詳細に記載された方法に基づいている。要約すると、多数の異なる低分子量ペプチド試験化合物を、プラスチックピンまたは何か他の表面のような固体支持体上で合成する。これらペプチド試験化合物を、ヒトSEPフラグメントと反応させ、洗浄する。次に、結合したヒトSEPを、当該技術分野において周知の方法を適当に適応することなどによって検出する。精製されたヒトSEPは、上述の薬物スクリーニング技術で用いるためにプレート上に直接的にコーティングすることもできる。或いは、非中和抗体を、そのペプチドを捕捉し且つそれを固体支持体上に固定するために用いることができる。
【0387】
本発明は、更に、ヒトSEPを結合することができる中和抗体が、ヒトSEPを結合することについて試験化合物と特異的に競合する競合的薬物スクリーニング検定の使用を包含する。この方式では、これら抗体は、一つまたはそれを越える抗原決定基をヒトSEPと共有するいずれかのペプチドの存在を検出するのに用いることができる。
【0388】
本発明の検定方法は、高処理スクリーニング(HTS)であってよい。この点で、WO84/03564号の教示は、本発明のヒトSEPに適応することができる。
【0389】
US−A−5738985号の教示は、本発明の検定方法に適応することができる。
試剤
本発明は、更に、本発明の検定方法および識別方法によって識別される一つまたはそれを越える試剤を提供する。
【0390】
本発明の試剤は、例えば、有機化合物または無機化合物でありうる。この試剤は、例えば、配列番号:1または配列番号:5に示される配列の全部または一部分についてアンチセンスであるヌクレオチド配列でありうる。好ましくは、この試剤は、SEP活性のモジュレーター、より好ましくは、SEP阻害剤(SEPi)または選択的SEPiであろう。
【0391】
SEPiは、SEPの酵素活性を阻害する、すなわち、それが基質ペプチド、ポリペプチドまたはタンパク質を(タンパク質分解によって)切断するのを妨げる化合物である。
【0392】
本発明は、更に、薬剤として用いるための本発明の試剤(またはその薬学的に許容しうる塩またはその薬学的に許容しうる溶媒和化合物さえも)または前述のいずれかを含有する医薬組成物を提供する。
【0393】
本発明は、更に、泌尿生殖器系、心臓血管系、神経系および内分泌系のいずれか一つまたはそれを越えるものにおける、ヒトSEP活性に(阻害する、選択的に阻害する、モジュレートするまたは拮抗するなどの)影響を与える試剤の使用に関する。
【0394】
診断薬
本発明は、更に、ヒトSEPポリヌクレオチド配列の検出のための診断用組成物を提供する。この診断用組成物は、配列番号:1または配列番号:5に示される配列またはその変異体、ホモログ、フラグメントまたは誘導体、または配列番号:1または配列番号:5に示されるヌクレオチド配列またはその対立遺伝子変異の全部または一部分にハイブリッド形成することができる配列を含んでいてよい。
【0395】
疾患の診断のための基準を提供するには、ヒトSEPポリペプチド発現からの正常値または標準値を決定すべきである。これは、動物かまたはヒトである正常対象から得られる体液または細胞抽出物(例えば、精巣から)と、ヒトSEPポリペプチドへの抗体とを、当該技術分野において周知である複合体形成に適した条件下で混合することによって達せされる。標準的な複合体形成の量は、既知量の抗体が既知濃度の精製ヒトSEPポリペプチドと混合されている陽性対照の希釈列にそれを比較することによって定量することができる。次に、正常な試料から得られる標準値を、ヒトSEPポリペプチド発現に関係がある障害または疾患に潜在的に罹患している対象からの試料により得られる値と比較することができる。標準値と対象値との間の偏差は、その疾患状態の存在を確定する。
【0396】
ヒトSEPポリヌクレオチドまたはそのいずれか一部分は、診断用化合物および/または治療的化合物の基準を提供することができる。診断目的には、ヒトSEPポリヌクレオチド配列を用いて、ヒトSEP活性が関連していることがありうる状態、障害または疾患における遺伝子発現を検出し且つ定量することができる。
【0397】
ヒトSEPをエンコードしているポリヌクレオチド配列は、ヒトSEPの発現に起因する疾患の診断に用いることができる。例えば、ヒトSEPをエンコードしているポリヌクレオチド配列は、ヒトSEP発現の異常を検出するために、血清、滑液または腫瘍生検のような、生検または剖検からの組織または体液のハイブリダイゼーション検定またはPCR検定で用いることができる。このような定性的または定量的方法の形態には、サザンまたはノーザン分析、ドットブロットまたは他のメンブランを基剤とする技術;PCR技術;ディップスティック、ピンまたはチップ技術;およびELISAまたは他の多重試料フォーマット技術が含まれうる。これら技術は全て、当該技術分野において周知であり、実際上、多数の市販の診断用キットの基準である。
【0398】
このような検定は、具体的な治療処置計画の効力を評価するために調整されてよいし、動物実験、臨床試験、または個々の患者の処置を監視する場合に用いることができる。疾患の診断用の基準を提供するためには、ヒトSEP発現についての正常または標準のプロフィールを決定すべきである。これは、動物かまたはヒトである正常対象から得られる体液または細胞抽出物と、ヒトSEPまたはその一部分とを、ハイブリダイゼーションまたは増幅に適した条件下で混合することによって達せされる。標準的なハイブリダイゼーションは、正常対象について得られる値と、既知量の精製ヒトSEPが用いられている同様の実験で行われる陽性対照の希釈列とを比較することによって定量することができる。正常な試料から得られる標準値は、ヒトSEPコーディング配列の発現に関係がある障害または疾患に潜在的に罹患している対象からの試料により得られる値と比較することができる。標準値と対象値との間の偏差は、その疾患状態の存在を確定する。疾患が確定された場合、既存の治療薬を投与し、そして処置プロフィールまたは値を生じることができる。最終的には、その検定を一定の基準で繰り返して、それら値が正常または標準のパターンに向かって進行するまたは復帰するかどうか評価することができる。成功した処置プロフィールは、数日間または数ヶ月間にわたる処置の効力を示すのに用いることができる。
【0399】
本発明は、更に、例えば、疾患状態におけるヒトSEPレベルを診断用に検出し且つ定量するのに用いることができる抗ヒトSEP抗体を生じるための、ヒトSEPポリペプチド、またはその変異体、ホモログ、フラグメントまたは誘導体の使用に関する。
【0400】
本発明は、更に、正対照として用いることができる精製されたヒトSEPおよび抗ヒトSEP抗体を含む、細胞および組織中のヒトSEPの検出のための診断用検定およびキットに関する。このような抗体は、ヒトSEPタンパク質の発現、またはその欠失体、変異体、ホモログ、フラグメントまたは誘導体の発現に関係があるいずれかの疾患状態または状態を検出するための、溶液、メンブランまたは組織を基剤とする技術で用いることができる。
【0401】
プローブ
本発明のもう一つの側面は、ヒトSEPコーディング領域または対立遺伝子などの密接に関係した分子をエンコードしている、ゲノム配列を含めたポリヌクレオチド配列を検出することができる核酸ハイブリダイゼーションまたはPCRプローブの規定である。プローブの特異性、すなわち、それが高度に保存された、保存されたまたは非保存の領域またはドメインに由来するかどうか、およびハイブリダイゼーションまたは増幅の(高、中または低)ストリンジェンシーは、そのプローブが、天然に存在するヒトSEPコーディング配列または関係のある配列だけを識別するかどうか決定するであろう。関係のある核酸配列の検出のためのプローブは、3’領域のようなヒトSEPファミリーメンバーの保存されたまたは高度に保存されたヌクレオチド領域から選択され、しかもこのようなプローブは、縮重プローブのプールで用いることができる。同一ヌクレオチド配列、または最大の特異性が望まれる場所の検出ために、核酸プローブは、非保存ヌクレオチド領域またはヒトSEPポリヌクレオチドの独特の領域から選択される。本明細書中で用いられる“非保存ヌクレオチド領域”という用語は、本明細書中に開示されるヒトSEPコーディング配列に独特であり、既知のSEPのような関係のあるファミリーメンバーに存在しないヌクレオチド領域を意味する。
【0402】
PCRは、US−A−4683195号、US−A−4800195号およびUS−A−4965188号に記載のように、ヒトSEP配列に基づくオリゴヌクレオチドについて更に別の使用を提供する。このようなオリゴマーは、概して、化学合成されるが、それらは、酵素的に生じてよいしまたは組換え体源から製造されてよい。オリゴマーは、概して、二つのヌクレオチド配列、すなわち、特定の遺伝子または状態の識別に最適にされた条件下で用いられるセンス配向(5’→3’)のものおよびアンチセンス配向(3’←5’)のものを含む。同じ二つのオリゴマー、すなわち、nested セットのオリゴマー、またはオリゴマーの縮重プールさえも、密接に関係したDNAまたはRNA配列の検出および/または定量化のために、低いストリンジェント条件下で用いることができる。
【0403】
ヒトSEPの核酸配列は、内因性ゲノム配列をマッピングするために、前に記載されたようなハイブリダイゼーションプローブを生じるのに用いることもできる。この配列は、周知の技法を用いて、特定の染色体にまたはその染色体の特異的領域にマッピングすることができる。これらには、染色体拡大(chromosomal spread)への in situ ハイブリダイゼーション(Verma et al.(1988) Human Chromosomes: A Manual of Basic Techniques, Pergamon Press, New York City, USA)、フローソーティド染色体調製(flow−sorted chromosomal preparations)、または酵母人工染色体(YACs)、細菌人工染色体(BACs)、細菌PI構築または単一染色体cDNAライブラリーのような人工染色体構築が含まれる。
【0404】
染色体標品の in situ ハイブリダイゼーション、および確定された染色体マーカーを用いる連鎖分析のような物理的マッピング技術は、遺伝子地図を拡張する場合に非常に貴重である。遺伝子地図の例は、Science(1995; 270:410f および 1994; 265:1981f)に見出されうる。しばしば、特定のヒト染色体の数またはアームが知られていないとしても、別の哺乳動物種の染色体上の遺伝子の配置が、関連したマーカーを示すことがありうる。新しい配列は、物理的マッピングによって、染色体アームまたはその一部分に割り当てることができる。これは、ポジショナルクローニングまたは他の遺伝子発見技術を用いて疾患遺伝子について探索している研究者に貴重な情報を提供する。毛細管拡張性運動失調(AT)などの疾患または症候群が、特定のゲノム領域への遺伝子連鎖によって大まかに位置決定されると、例えばATが11q22−23(Gatti et al,(1988), Nature, 336:577−580)、その領域へのいずれかの配列マッピングは、更なる研究のための関連遺伝子または調節遺伝子を呈するだろう。本発明のヌクレオチド配列は、正常個体、保持個体または罹患した個体の間で、転座、逆位等による染色体位置の相違を検出するのに用いることもできる。
【0405】
医薬
本発明は、更に、ヒトSEP活性のための処置を必要としている個体を処置するための医薬組成物であって、この活性に(阻害するまたは選択的に阻害するなどの)影響を与える試剤の治療的有効量および薬学的に許容しうる担体、希釈剤または賦形剤を含む組成物を提供する。
【0406】
したがって、本発明は、更に、本発明の試剤(本発明のヌクレオチド配列の発現パターンまたはその発現産物の活性をモジュレートすることができる試剤および/または本発明による検定によって識別される試剤)を含む医薬組成物を包含する。この点で、具体的にはヒト療法について、本発明の試剤は単独で投与することができるにもかかわらず、それらは、概して、予定の投与経路および標準的な医薬慣例に関して選択される医薬担体、賦形剤または希釈剤との混合物で投与されるであろう。
【0407】
例として、本発明の医薬組成物中では、本発明の試剤を、いずれか適当な1種類または複数の結合剤、1種類または複数の滑沢剤、1種類または複数の懸濁化剤、1種類または複数のコーティング剤、または1種類または複数の可溶化剤と混合してよい。
【0408】
概して、本発明の試剤の治療的に有効な1日の経口または静脈内用量は、0.01〜50mg/kg(処置される対象の体重)、好ましくは、0.01〜20mg/kg、より好ましくは、0.1〜20mg/kgの範囲であると考えられる。本発明の試剤は、静脈内注入によって、0.001〜10mg/kg/時の範囲であると考えられる用量で投与されてもよい。
【0409】
したがって、本発明は、ヒトSEP活性のための処置を必要としている個体を処置する方法であって、この個体に有効量の本発明の医薬組成物を投与することを含む方法を提供する。
【0410】
典型的には、医師が、個々の患者に最も適している実際用量を決定するであろうが、それは、具体的な患者の年齢、体重、性別および応答により異なるであろう。上の投薬量は、平均的な場合を代表するものである。当然ながら、より高いまたはより低い投薬量範囲が望ましい個々の場合がありうるし、そのようなものは本発明の範囲内である。
【0411】
適当な場合、これら医薬組成物は、吸入によって;坐剤または膣坐剤の形で;局所には、ローション剤、液剤、クリーム剤、軟膏剤または散布剤の形で;皮膚パッチの使用によって;経口には、デンプンまたはラクトースのような賦形剤を含有する錠剤の形で;または単独でかまたは賦形剤との混合物でのカプセル剤または小卵剤で;または着香剤または着色剤を含有するエリキシル剤、液剤または懸濁剤の形で投与することができるし、またはそれらは、非経口によって、例えば、空洞内、静脈内、筋肉内または皮下に注射することができる。非経口投与には、これら組成物は、他の物質、例えば、その溶液を血液と等張にさせる充分な塩類または単糖類を含有してよい滅菌水性液剤の形で最もよく用いることができる。口腔または舌下投与には、これら組成物は、慣用法で製剤化することができる錠剤または口中錠の形で投与してよい。
【0412】
対象(患者など)への経口、非経口、口腔および舌下投与について、本発明の試剤の1日投薬レベルは、典型的には、10〜500mg(1回または分割用量で)であってよい。したがって、および例として、錠剤またはカプセル剤は、適宜、単回で、または一度に2個またはそれを越えて投与するのに、5〜100mgの活性成分を含有してよい。本発明の試剤を徐放性製剤中で投与することも可能である。
【0413】
ある用途には、概して、ヒトの場合、本発明の試剤の経口投与が好ましい経路であり、最も好都合であり、いくつかの場合には、空洞内(i.c.)投与に関連するような他の投与経路に関連した欠点を回避することができる。レシピエントが、嚥下障害または経口投与後の薬物吸収の欠陥を患っている状況では、薬物を非経口投与してよい。
【0414】
獣医学的使用について、本発明の試剤は、典型的に、通常の獣医学慣例にしたがって適当に許容しうる製剤として投与され、そして獣医外科医が、具体的な動物に最も適当である投薬計画および投与経路を決定するであろう。しかしながら、ヒト処置の場合と同様、獣医学的処置のために試剤を単独で投与することは可能でありうる。
【0415】
典型的に、これら医薬組成物は、ヒトまたは動物使用のためであってよく、いずれか1種類またはそれを越える薬学的に許容しうる希釈剤、担体または賦形剤を含むであろう。医薬担体、賦形剤または希釈剤の選択肢は、予定の投与経路および標準的な医薬慣例に関して選択することができる。上に示されたように、これら医薬組成物は、担体、賦形剤または希釈剤として、またはそれに加えて、いずれか適当な1種類または複数の結合剤、1種類または複数の滑沢剤、1種類または複数の懸濁化剤、1種類または複数のコーティング剤、または1種類または複数の可溶化剤を含んでよい。
【0416】
本発明のいくつかの態様において、これら医薬組成物は、本発明の検定によってスクリーニングされた試剤;配列表または図に示される配列であって、その誘導体、フラグメント、ホモログまたは変異体を含めたもの、または配列番号:1または配列番号:5に示されるヌクレオチド配列にハイブリッド形成することができる配列のいずれか一つと相互作用することができる試剤の内の一つまたはそれを越えるものを含むであろう。
【0417】
本発明の範囲内に含まれるのは、ヒトSEP mRNAを不安定にするように機能するまたはヒトSEPの翻訳を阻害するオリゴヌクレオチド配列、アンチセンスRNAおよびDNA分子、およびリボザイムである。このようなヌクレオチド配列は、生物活性ペプチドのレベルを増加させることが好ましいと考えられる状態で用いることができる。
【0418】
ヒトSEPアンチセンス分子は、例えば、増加したヒトSEP活性に関係した種々の異常な状態の予防および/または処置のための基準を提供することができる。
【0419】
ヒトSEP核酸アンチセンス分子は、生物活性ペプチドレベルを上昇させることが好ましいと考えられる状態においてヒトSEPの活性を阻止するのに用いることができる。
【0420】
レトロウイルス、アデノウイルス、ヘルペスまたはワクシニアウイルスに由来するまたは種々の細菌プラスミドに由来する発現ベクターは、標的細胞集団への組換えヒトSEPセンスまたはアンチセンス分子の送達に用いることができる。当業者に周知である方法を用いて、ヒトSEPを含有する組換えベクターを構築することができる。或いは、組換えヒトSEPを、リポソームで標的細胞に送達することができる。
【0421】
完全長cDNA配列および/またはその調節成分は、研究者が遺伝子機能のセンス(Youssoufian H and H F Lodish,(1993), Mol. Cell Biol., 13:98−104)またはアンチセンス(Eguchi et al,(1991), Annual Rev. Biochem., 60:631−652)研究においてヒトSEPを手段として用いることを可能にする。ゲノムDNAから得られるcDNAまたは制御配列から設計されるオリゴヌクレオチドは、in vitro または in vivo で発現を阻害するのに用いることができる。このような技法は、現在、当該技術分野において周知であり、センスまたはアンチセンスオリゴヌクレオチドまたはより大きいフラグメントを、コーディング領域または制御領域に沿ったいろいろな位置から設計することができる。適当なオリゴヌクレオチドは、20ヌクレオチドの長さでありうるが、これを用いて、ヒトSEP配列または密接に関係した分子をヒトライブラリーから単離することができる。
【0422】
更に、ヒトSEP発現は、エンドペプチダーゼ活性を阻止することによって生物活性ペプチドレベルを増加させることが好ましいと考えられる状態において、高レベルのヒトSEPフラグメントを発現する発現ベクターで細胞または組織をトランスフェクションすることによってモジュレートすることができる。このような構築物は、翻訳できないセンスまたはアンチセンス配列を含む細胞を溢れさせることがありうる。DNA中への組込みが不存在の場合でも、このようなベクターは、そのベクターの全コピーが内因性ヌクレアーゼによって無能力にされるまで、RNA分子を転写し続けることがありうる。このような一過性発現は、非複製性ベクターについては1ヶ月またはそれを越える間、および適当な複製要素がそのベクター系の一部分である場合はなお一層長い間持続することがありうる。
【0423】
ヒトSEPは、生物活性ペプチド活性を調節することおよび/または生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解に関与しうるので、上記の“生物活性ペプチド(類)”(および同種のもの)への言及は、これら言及が必要な変更を加えて解釈するためにある場合について、適宜、“生物学的に不活性なペプチド(類)”(および同種のもの)への言及を意味するとみなすこともできる。例えば、ヒトSEP活性の阻害が、増加したレベルの生物活性ペプチド(類)をもたらすかもしれない場合、このような阻害は、更に、または代わりに、増加したレベルの生物学的に不活性なペプチド(類)をもたらし、それによって、それらの“活性型”のペプチド(類)の減少したレベルをもたらすかもしれない。
【0424】
遺伝子発現の修飾は、プロモーター、エンハンサーおよびイントロンのような、ヒトSEP遺伝子の制御領域へのアンチセンス配列を設計することによって得ることができる。
【0425】
転写開始部位、例えば、リーダー配列の−10〜+10の領域に由来するオリゴヌクレオチドが好適である。アンチセンスRNAおよびDNA分子は、転写物がリボソームに結合するのを妨げることによってmRNAの翻訳を阻止するように設計することもできる。同様に、阻害は、“三重らせん”塩基対合としても知られる Hogeboom 塩基対合法を用いて行うことができる。三重らせん対合は、ポリメラーゼ、転写因子または調節分子の結合のために充分に開く二重らせんの能力に影響する。
【0426】
したがって、本発明は、本発明の試剤(またはその薬学的に許容しうる塩またはその薬学的に許容しうる溶媒和化合物さえも)を薬学的に許容しうる希釈剤、賦形剤または担体と一緒に含む医薬組成物を提供する。
【0427】
この医薬組成物は、獣医学的(すなわち、動物)使用またはヒト使用のためでありうる。
したがって、本発明は、更に、ヒトSEPタンパク質(アンチセンス核酸配列を含めた)の阻害剤またはアンタゴニストの有効量を、薬学的に許容しうる希釈剤、担体または賦形剤(それらの組合せを含めた)との混合物で含む医薬組成物に関する。
【0428】
本発明は、また更に、医薬組成物であって、ヒトSEPポリヌクレオチド配列、ヒトSEPアンチセンス分子、ヒトSEPポリペプチド、タンパク質、ペプチド、または阻害剤、選択的阻害剤、アンタゴニスト(抗体を含めた)またはアゴニストのようなヒトSEP活性の有機モジュレーターの全部または一部分を単独で、または安定化用化合物のような少なくとも1種類の他の試剤との組合せで含んでよく、しかも生理食塩水、緩衝化生理食塩水、デキストロースおよび水が含まれるがこれに制限されないいずれかの滅菌の生体適合性医薬担体中で投与されてよい医薬組成物に関する。
【0429】
医薬組合せ
本発明の医薬組成物は、サイクリックGMPの増強剤またはエンハンサー(ホスホジエステラーゼ5型阻害剤、例えば、Sildenafil、または酸化窒素ドナー、または酸化窒素前駆体、例えば、L−アルギニナーゼなど)および/または中枢作用性製剤(例えば、アポモルフィンまたはメラノタンII(melanotan II)のようなドーパミンレセプターアゴニストまたはメラノコルチン(melanocortin)レセプターアゴニスト)などの1種類またはそれを越える他の薬学的活性剤と組み合わせて用いてよい。アポモルフィンの製剤としての使用についての教示は、US−A−5945117号に見出されうる。その具体的な文書において、アポモルフィンは舌下に送達される。
【0430】
更に、または代わりに、本発明の医薬組成物は、1種類またはそれを越える中性エンドペプチダーゼ(NEP)阻害剤(NEPi)、1種類またはそれを越えるPDE5阻害剤(PDE5i)(例えば、シルデナフィル(sildenafil)(Pfizer)、バルデナフィル(vardenafil)(Bayer BA38−9456)およびIC351(Cialis, Icos Lilly))、1種類またはそれを越えるNPYレセプターアンタゴニスト、1種類またはそれを越えるPDE2型阻害剤、1種類またはそれを越える酸化窒素(NO)ドナー(例えば、NMI−921)、1種類またはそれを越えるドーパミンレセプターアゴニスト(例えば、アポモルフィン、Uprima、Ixsene)、1種類またはそれを越えるメラノコルチンレセプターアゴニスト(例えば、Melanotan IIまたはPT14)、1種類またはそれを越えるカリウムチャンネルオープナー(例えば、KATPチャンネルオープナー(例えば、ミノキシジル、ニコランジル(nicorandil))および/またはカルシウム活性化カリウムチャンネルオープナー(例えば、BMS−204352))、1種類またはそれを越えるα1−アドレノセプターアンタゴニスト(例えば、フェントラミン、Vasofem、Vasomax)、1種類またはそれを越えるVIPレセプターアゴニストまたはVIP類似体(例えば、Ro−125−1533)またはVIPフラグメント、1種類またはそれを越えるα−アドレノセプターアンタゴニストとVIPの組合せ(例えば、Invicorp、Aviptadil)、1種類またはそれを越えるα2−アドレノセプターアンタゴニスト(例えば、ヨヒンビン)、1種類またはそれを越えるエストロゲン、エストロゲンおよびメドロキシプロゲステロンまたは酢酸メドロキシプロゲステロン(MPA)、またはエストロゲンおよびメチルテストステロンホルモン置換療法薬(例えば、HRT、特に、Premarin、Cenestin、Oestrofeminal、Equin、Estrace、Estrofem、Elleste、Solo、Estring、Eastraderm、Eastraderm TTS、Eastraderm Matrix、Dermestril、Premphase、Prempro、Prempak、Premique、Estratest、Estratest HS、Tibolone)、1種類またはそれを越えるテストステロン置換薬(DHEA(デヒドロアンドロステンジオン)、テストステロン(Tostrelle)またはテストステロンインプラント(Organon)を含めた)、1種類またはそれを越えるテストステロン/エストラジオール薬、1種類またはそれを越えるエストロゲンアゴニスト(例えば、Lasofoxifene)、1種類またはそれを越えるセロトニンレセプターアゴニストまたはアンタゴニスト(例えば、5HT1A、5HT2C、5HT2Aおよび5HT3レセプターアゴニストおよびアンタゴニスト;WO00/28993号に記載の)、1種類またはそれを越えるプロスタノイドレセプターアゴニスト(例えば、Muse、アルプロスタジル、ミソプロストール)、1種類またはそれを越えるプリン作動性レセプターアゴニスト(特に、P2Y2およびP2Y4)、または1種類またはそれを越える抗うつ薬(例えば、ビュープロピオン(Wellbutrin)、ミラタザピン(mirratazapine)、ネファゾドン(nefazodone))と組み合わせて用いてよい。
【0431】
好ましくは、上記のこのような組合せで用いられる本発明のこの医薬組成物は、SEPiである。本発明の好ましい組合せは、SEPi+NEPiおよびSEPi+PDE5i、具体的には、SEPi+ Sildenafil である。
【0432】
一般的な方法の参照
概して、本明細書中に述べられる技術は、当該技術分野において周知であるが、具体的には、Sambrook et al., Molecular Cloning, A Laboratory Manual (1989) および Ausubel et al., Short Protocols in Molecular Biology (1990) 4th Ed, John Wiley & Sons, Inc. を参照してよい。PCRは、US−A−4683195号、US−A−4800195号およびUS−A−4965188号に記載されている。
【0433】
寄託
次の試料は、ブダペスト条約にしたがって、承認された受託者 The National Collections of Industrial, Food and Marine Bacteria(NCIMB)at 23 St.Machar Drive, Aberdeen, Scotland, AB24 3RY, United Kingdom に、2001年6月29日に寄託された。
【0434】
NCIMB番号NCIMB41110は、E.coli MSSE82である。
寄託者は、Pfizer Limited, Ramsgate Road, Sandwich, Kent, CT13 9NJ, United Kingdom であった。
【0435】
当業者は、上述のE.coli クローン(NCIMB41110)を、アンピシリンを含有する Luria Broth 中で容易に成長させ、そのクローンのプラスミドDNAを、Sambrook, et al.,eds.(1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, NY, USA に記載のアルカリ溶解法を用いて単離しうる。次に、Sanger et al.(Proceedings of the National Academy of Science (USA), (Dec. 1977), 74(12):5463−5467)によって記載され且つ蛍光検出について Applied Biosystems, Foster City, CA, USA(Applied Biosystems 製造者の参考文献を参照されたい)によって変更されたようなジデオキシターミネーション法を用いて、そのDNAを配列決定し且つヒトSEPを識別しうる。
【0436】
受託番号NCIMB41110として寄託された上述の寄託生物物質を言及する場合に本明細書中で用いられる一つまたは複数の“細胞”という用語は、一つまたは複数の“微生物”または“細菌”という均等な用語と同じ意味である。
【0437】
本発明は、更に、その寄託物から誘導可能なおよび/または発現可能な配列およびそれを含む態様を包含する。本発明は、更に、その寄託物から誘導可能なおよび/または発現可能な部分配列およびそれを含む態様を包含するが、ここにおいて、それら部分配列は、活性ポリペプチド(活性酵素部位)をコードする。本発明は、更に、その寄託物から誘導可能なおよび/または発現可能な配列を含むタンパク質およびそれを含む態様を包含する。本発明は、更に、その寄託物から誘導可能なおよび/または発現可能な部分配列を含むタンパク質およびそれを含む態様を包含するが、ここにおいて、それら部分配列は、活性ポリペプチド(活性酵素部位)をコードする。
【0438】
実施例部分、図面および配列表への序論
本発明を、ここで、単に例として、添付の図面および配列表に関して記載する。
【0439】
【実施例】
実施例部分
実施例1−ヒトSEPの同定
データベースマイニング
ヒトSEPの新規な遺伝子は、プローブとしてネプリリシンタンパク質およびBLASTアルゴリズムを用いてヒト発現配列タグ(ESTs)のデータベースをマイニングすることによって発見した。次に、ESTヒット(データベース=Incyte GoldTM;遺伝子id.=241161)を集合させて、コーディング配列の大きいフラグメントが予想される隣接した配列にした。これは、ネプリリシンタンパク質配列との相同性(60%同一性)によって触媒ドメインに該当する。PCRクローニングのためのプローブは、新規な遺伝子について予想されるコーディング配列のこの領域を用いて設計した。次に、ヒトゲノムデータベースからの未完成の配列を更にマイニングすることで、5個の予想されるエクソンを識別し、これらは、欠けているN末端領域中の同じ新規な遺伝子に属すると仮定された。これは、後に、ヒト精巣ライブラリーから得られる完全長クローンの配列決定後に確認した(下を参照されたい)。
【0440】
新規なヒトSEP配列には、3’UTR、および二つの活性触媒部位の一つを含有するヒトSEPの高度に保存されたC末端領域中のコーディング配列の一部分が含まれる。この新規なヒトSEPは、37アミノ酸のインサートを含有すると考えられる。
【0441】
完全長ヒトSEP cDNAの単離
オリゴヌクレオチド(5’−ctgtcttgatggattggatg−3’)は、5’−RACE(5’cDNA末端の迅速増幅)PCRを用いて、cDNAライブラリーからより長いヒトSEP cDNAを増幅させることができるように隣接した発現配列タグ(ESTs)の上述の集合からの部分ヒトSEP cDNA配列を用いて設計した。
【0442】
次に、12アレイの96ウェルフォーマットヒト Rapid−ScreenTMcDNAライブラリーのパネルを、5’−RACE PCRによってスクリーニングした。ヒトSEPに該当するcDNAを、脳、肝、胎盤、小腸および精巣に由来するライブラリー中で識別した。
【0443】
これらcDNAには、完全長であるものがなかったので、精巣からのそれより長いが部分長のcDNAの内の一つの配列から設計されたプライマー(5’−gtccttggcagtcgaattctcc−3’)を用いてライブラリーのパネルについて更に5’−RACEを行った。これは、単離され且つ両末端から配列決定された精巣ライブラリー中のより長い(約3.0kb)推定上の完全長cDNAクローンを識別した。この完全長ヒトSEPクローンをMSSE82と称し(そしてNCIMBに受託番号NCIMB41110として寄託し)、この完全長クローンを、Genbank 受託番号#AF067196を有するpCMV6−XL4ベクター中にクローン化した。
【0444】
実施例2−ヒトSEP mRNAの組織分布
多重組織メッセンジャーRNAブロットを、ヒトSEPについてプローブした。SEP mRNAは、精巣試料中で検出されたが、他の組織では検出されなかった。
【0445】
完全なヒトSEPコーディング配列に該当するDNAのフラグメントを、PCRにより、SEPクローンMSSE82を鋳型として用いて増幅させた。そのフラグメントを、メガプライムキット(Amersham PLC, UK)を用いて32P dCTPで放射性標識した。その放射性標識されたフラグメントをハイブリダイゼーションプローブとして、いろいろなヒト組織および細胞系の選択(76)から、mRNAを含有する多重組織mRNAアレイ(ドットブロット)(Clontech, USA より)をスクリーニングするのに用いた。ハイブリダイゼーションおよび洗浄後、そのブロットにオートラジオグラフィーを施した。精巣からはシグナルを検出したが、他の組織からは検出されなかった。
【0446】
実施例3−組換えSEP酵素の製造
チャイニーズハムスター卵巣(CHO)細胞の培養物を、リポフェクタミン(lipofectamine)試薬プロトコール(Invitrogen Ltd, Paisley, UK)に記載のリポフェクタミン法を用いて、プラスミドMSSE82でトランスフェクションする。トランスフェクション後24時間または48時間に、細胞培地を採取し、そして3000gで5分間の遠心分離によって細胞破片を除去する。次に、その培地を、50mM HEPES pH7.4/10%グリセロールに対して、“スライド・ア・ライサー(slide a lyser)”(Pierce and Warner, Chester UK より)を用いて4℃で一晩透析する。次に、透析された試料をアリコートで凍結させ、液体窒素下で貯蔵する。
【0447】
実施例4−SEPペプチダーゼ活性の検定
SEP検定
背景
SEP検定は、NEPと一緒の使用について、Carvalho et al. によって開発されたFRET検定に基づく(Carvalho et al., Annal.Biochem. 237,pp.167−173(1996))。このSEP FRET検定は、蛍光原性ドナー/アクセプター色素の新規な組合せ、具体的には、ローダミングリーン(Molecular Probes,Inc.)およびQSY7(Molecular Probes,Inc.)を代用することを除いて、同一ではないが類似した分子内消光蛍光原性ペプチド基質を利用する。
【0448】
SEPのエンドペプチダーゼ活性は、合成ペプチド基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2をタンパク質分解するその能力をモニターすることによって測定する。
【0449】
この検定に選択される二つの発蛍光団(蛍光原性色素)は、オーバーラップする発光および吸収スペクトルを有し、したがって、エネルギー移動に適している。ローダミングリーンは、ドナーとして作用し、485nmで励起した場合、535nmで発光(蛍光)を生じ、順次、QSY7を励起する(FRETが起こっている)。そのQSY7は蛍光的に不活性しているので、535nmより上で発光を生じないし、したがって、シグナルは認められない(ローダミングリーン発光が消光している)。
【0450】
このペプチド基質のArg−Valペプチド結合におけるSEPによる切断(選択的加水分解)時に、ローダミングリーンおよびQSY7部分は別々に移動するので、485nmでの励起では、エネルギー移動はもはや生じることができない。結果として、蛍光の増加は、ローダミングリーンについて535nmで認められる。
【0451】
合成ペプチド基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH 2 の製造
実験:
ペプチド組み立てを、0.25mmol FMOC−PAL−PEG−PS樹脂上で、固相ペプチド合成プロトコールにより、製造者に供給された(Applied Biosystems, Foster City, CA, USA)9−フルオレニルメトキシカルボニル(FMOC)基剤合成サイクルへの変更を用いて完成した。本発明者が変更したサイクルは、20%ピペリジン/N−メチルピロリジノン(NMP)での2x5分間処理でアミノ末端を脱保護し;その効率を、301nmでのUV吸光度により、UV吸光度検出器を介する小アリコートの脱保護溶液の通過によって監視する。別々のカートリッジ中で、入ってくるアミノ酸を、N,N−ジメチルホルムアミド(DMF)中に溶解した各0.9当量の2−(1H−ベンゾトリアゾール−1−イル)−1,1,3,3テトラメチルウロニウムヘキサフルオロリン酸(HBTU)/1−ヒドロキシベンゾトリアゾール(HOBt)で活性化する。2当量のジイソプロピルエチルアミン(DIEA)を加える。同時に、樹脂を続いてNMPで洗浄して、脱保護副生成物を除去する。洗浄液を樹脂から排液させ、そして活性化したアミノ酸エステルを樹脂に移し、アミノ末端にカップリングさせるように20分間撹拌する。残留するカップリング溶液を排液し、樹脂を再度NMPで洗浄する。ペプチド均一性を確実にするために、NMP中の0.4M無水酢酸/0.04M HOBt溶液および12mmol DIEAを樹脂に加えて、いずれの潜在的な未反応部位もアセチル化する。最後に、樹脂をNMPで洗浄し、排液した後、1:1のジクロロメタン/2,2,2−トリフルオロエタノール混合物で洗浄し、排液する。これは、ペプチド合成の一つのサイクルの典型である。完成した合成用樹脂を、Reagent K(King,D.S. et al., (1990), Int.J.Pep.Prot.Res., 32,pp.255−66)を用いて切断し且つ脱保護して、251mg(100%)の粗製ペプチドCP1、エレクトロスプレー質量分析(ERMS)(m/z計算値(calc.)=977.21(MH+ 平均),obs.=977.47)を与える。
【0452】
QSY−7のシステインへの連結:
50mg(51μmol)の粗製CP1を、45mg(52.4μmol)のQSY−7マレイミドを含有する10%DIEA/DMFの溶液中に溶解させた。10分後、その反応を、HPLC−MS分析によって不完全であると判定し、更に30mg(30.7μmol)の粗製ペプチドを加えた。更に30分後、HPLC−MSにより、その反応は完了していると判定し、出発試薬は全て消費した。生成物を、C18分取用HPLCクロマトグラフィーによって単離し、マトリックス支援レーザー脱離イオン化質量分析法(MALDI−MS)によって所望の生成物分子量を示す画分をプールし、凍結乾燥させて、73.7mg(50%)の紫色粉末、CP2、ESMS(m/z calc.=1797.86(MH+ 一同位体),obs.=1797.86)とした。
【0453】
ビス(トリフルオロアセチル)ローダミングリーンのアミノ末端への連結:
73.7mg(41μmol)のCP2を、35mg(52.8μmol)のローダミングリーンカルボン酸,トリフルオロアセトアミド,スクシンイミジルエステル(5(6)−CR 110TFA,SE)*混合異性体*を含有する2%DIEA/DMF溶液中に溶解させた。2時間後、HPLC−MS分析により、その反応は完了していると判定した。生成物を、C4分取用HPLCクロマトグラフィーによって単離し、所望の生成物分子量(MALDI−MS)を示す画分をプールし、凍結乾燥させて、71.4mg(74%)の紫色粉末CP3、ESMS(m/z calc.=2345.92(MH+ 一同位体),obs.=2345.47)とした。
【0454】
ローダミングリーンからのトリフルオロアセチル保護基の除去:
71.4mg(30.4μmol)のCP3を、10mlの4:1のCH3CN/H2O中に溶解させた。これに、200mg(1886μmol)のNa2CO3を加えた。16時間ボルテックスした後、上澄みを不溶性物質からデカントした。反応容器を1mlのDMSOですすぎ洗浄し;これを上澄みと一緒にし、そして生成物を、C4分取用HPLCクロマトグラフィーによって単離した。生成物分子量(MALDI−MS)を示す画分を一緒にし、凍結乾燥させて、64mg(98%)の紫色粉末CP4、ESMS(m/z calc.=2155.54(MH+ 平均),obs.=2155.27)とした。CP4は、所望の合成ペプチド基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2である。
【0455】
物質:
試薬は全て、入手可能な最高の商用純度のものを購入し、そして更に精製することなく用いた。ペプチド合成のための試薬は全て、次のものを除いて、Applied Biosystems, Foster City, CA, USA から購入した。QSYTM−7マレイミド(カタログ番号Q−10257)およびローダミングリーンカルボン酸,トリフルオロアセトアミド,スクシンイミジルエステル(5(6)−CR 110TFA,SE)*混合異性体*(カタログ番号R−6112)は、Molecular Probes,Inc., OR, USA から購入した;FMOC−PAL−PEG−PSは、Perseptive Biosystems, MA, USA(カタログ番号GEN913384)から購入した;FMOC−B−アラニンおよびFMOC−d−フェニルアラニンは、Novabiochem, CA, USA から購入した;FMOC−Arg(Pbf)−OHは、AnaSpec,Inc., CA, USA から購入した;2,2,2−トリフルオロエタノールは、Aldrich, WI,USA から購入した。炭酸ナトリウムは、Fisher, PA, USA から購入した。
【0456】
分取用HPLCクロマトグラフィーは、Vydac(CA, USA)C18(カタログ番号218TP1022)またはC4(カタログ番号214TP1022)カラム上において、10ml/分の流速で、0%〜80%の直線勾配(A=5%CH3CN/0.1%TFA/94.9%H2O,B=100%CH3CN)で30分間にわたって溶離して行って、30秒の時間画分を集めた。分析用HPLC−MSは、Waters(MA, USA)2690 HPLCインレットおよび Waters 996フォトダイオードアレイ検出器と連結された Micromass(Manchester, UK)LCT質量分析計(外部校正される標準に基づく質量)を用いて、Vydac C4(カタログ番号214TP5415)カラム上における0%〜80%の直線勾配(A=5%CH3CN/0.1%TFA/94.9%H2O,B=100%CH3CN)で1ml/分の流速で30分間にわたるクロマトグラフィーを行って実施した。デコンボリューション分子量は、多重荷電実測イオンから、Micromass 変換ソフトウェアを用いて計算した。MALDI−MSは、Perseptive Biosystems Voyager−DEリニア型質量分析計において、αシアノ4−ヒドロキシケイヒ酸マトリックス(Hewlett Packard, CA, USA)を用いて得て、報告した質量は外部校正に基づく。
【0457】
操作(化学構造を含む):
CP4(=合成ペプチド基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSYTM−7)−βAla−NH2)を、鍵中間体CP3を固相ペプチド合成スキーム中に包含させることによって合成する。
【0458】
スキーム1:
【0459】
【化1】
要約すると、FMOC−PAL−PEG樹脂を、収率および時間の効率について最適化される固相ペプチド合成プロトコールを用いて作り上げる。これらサイクル(上記に充分な詳細)は、2回のFMOC脱保護、洗浄、HBTUで活性化したアミノ酸の1回のカップリング、洗浄、キャッピング、そして最後に、初めはNMPで、次に1:1のトリフルオロエタノール/ジクロロメタンでの洗浄を包含する。これら洗浄は、樹脂二次構造を弛緩させるのを助けて、次のサイクル中に次の入ってくるアミノ酸の完全な脱保護および有効なカップリングを可能にする。
【0460】
CP2を、スキーム2にしたがって合成する(上記に充分な詳細):
【0461】
【化2】
このQSY−7タグの包含後、スキーム3にしたがって、二番目の発蛍光団であるローダミングリーンを、ビストリフルオロアセチル保護された色素として加える:
【0462】
【化3】
最後に、トリフルオロアセチル基を、Na2CO3での処理によって除去して、所望の基質CP4を与える:
【0463】
【化4】
検定
検定用の試薬は、最初に、次のように調製する:
基質溶液は、基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2を50mM HEPES緩衝液pH7.4(Sigma, UK)中に2μMの濃度で再懸濁させた後、25mlにつき1個のEDTA不含プロテアーゼ阻害剤混合物錠剤(Roche Diagnostics, UK)を加えることによって調製する。
【0464】
上記のSEP酵素のアリコートを融解させた後、50mM HEPES、pH7.4中に、その50μlが、検定中に約30%の基質を生成物に変換するのに充分な酵素を含有するように、各々の酵素バッチに特異的な所定の因子によって希釈させる。
【0465】
4mlのDMSO+96mlの50mM HEPES pH7.4を含んで成る4%DMSOを調製する。
生成物溶液は、500μlの基質溶液を、250μlの酵素溶液+250μlの4%DMSO溶液に加え、そして37℃で16時間インキュベートすることによって調製する。
【0466】
検定を次のように設定する:
黒色96ウェル微量滴定プレート中において、100μlの基質溶液を50μlの4%DMSO溶液に加える。同様の非特異的バックグラウンドブランクも設定するが、ここにおいて、この50μlの4%DMSO溶液は、更に、40μMホスホルアミドンを含有する。50μlの酵素溶液をその検定およびブランクに加え、その96ウェルプレートをBMGギャラクシー蛍光リーダー中に入れて、Biolise ソフトウェアパッケージで操作する(BMG Lab technologies, Offenberg, Germany)。
【0467】
そのプレートを、蛍光リーダー中において37℃で1時間インキュベートし、蛍光測定値を3分毎に得る(励起(Ex)485nm/発光(Em)535nm)。SEPのタンパク質分解活性は、試料の蛍光の増加速度から非特異的バックグラウンドブランクの蛍光単位の増加速度を差し引いたものに相当する。4回の成功した示数についてそのソフトウェアによって計算される最大速度測定値(MaxV)を、この計算に用いる。
【0468】
同一微量滴定プレート上のウェル中の200μlの生成物から得られる蛍光測定値を用いる。必要ならば、この値を、SEP検定の60分の時点から測定された蛍光単位と一緒に用いて、1時間のインキュベーション時間中にタンパク質分解される基質の百分率(%)を計算する、または測定された蛍光増加速度を、タンパク質分解された基質ng/分/ml(酵素)のような他の有用な単位に変換する。
【0469】
この検定を用いて、Butterworths によって公表された Athel Cornish Bowden, 1979 による Fundamentals of Enzyme Kinetics に記載の標準的な原理にしたがって、VmaxおよびKmのような酵素反応速度論パラメーターを計算する。
【0470】
SEP阻害剤の阻害パラメーターを決定するためのSEP検定の使用
SEP阻害剤(例えば、ホスホルアミドン)ののIC50を決定するために、多重SEP検定を、上記のように、50μlのDMSO溶液(阻害剤の10mM100%DMSO原液の4%DMSO/50mM HEPES pH7.4を用いる適当な希釈によって作られる)中に含まれる一定範囲の試験濃度の阻害剤で行う。適当な標準グラフフィッティング計算機プログラムを用いて、S字形用量反応曲線を、対数阻害剤濃度に対するMaxV(または阻害%または活性%)のプロットに適合させる。IC50は、50%の最大阻害を引き起こす阻害剤濃度として計算する。典型的には、ある与えられたIC50決定値について、半対数単位増加量が異なる一定用量範囲の少なくとも10種類の阻害剤濃度を用いる。
【0471】
この検定を用いて、例えば、Butterworths によって公表された Athel Cornish Bowden, 1979 による Fundamentals of Enzyme Kinetics に記載の標準的な酵素学原理にしたがって、阻害のKiおよびモード(すなわち、この阻害が競合的、混合、非競合的であるかどうか等)を決定する。
【0472】
実施例5−性的興奮の動物モデル
本研究において、本発明者は、男性および女性の性的興奮の生理学についての強壮な再現可能モデルを開発した。このモデルは、麻酔されたウサギを用い、Laser Doppler 技法を用いて空洞内血圧および性器血流を監視し、同時に、心臓血管パラメーターを常套的に記録する。本発明者は、試験薬の不存在下および存在下における骨盤神経刺激またはVIPの注入によって引き起こされる陰茎中の空洞内血圧および膣(および陰核さえも)血流の僅かな変化を測定することができる。
【0473】
本発明者は、この動物モデルが、臨床データに直接的に反映すると考えている。したがって、このモデルを用いて、空洞内血圧の増加による陰茎勃起の増進および膣または陰核血流増進を測定するなどの、MEDおよびFSADの予防および/または処置のための候補薬を研究することができる。
【0474】
男性および女性の性的興奮に関与する潜在的物質としてVIPおよび他の神経ペプチドを識別すること
血管作用性腸管ペプチド(VIP)として知られる前性的(pro−sexual)神経ペプチドを分解するSEPの能力を、例えば、ラジオイムノアッセイ(RIA)であって、Peninsula Laboratories, CA, USA から商業的に入手できるVIP RIAなどを利用することによって測定する。
【0475】
SEP酵素試料、典型的には、5〜100μlの組換えSEP(上記の方法によって製造される)を、VIPペプチド試料、典型的には、1〜10ngと一緒に、50mM HEPES,pH7.4のような緩衝液中において37℃で5時間インキュベートする。これと同一であるが10μMホスホルアミドンも含有する負の対照を設定し、同一に処理する。インキュベーション時間後、試料および負の対照双方に残っているVIPの量を、製造者の取扱説明書によりRIAを用いて決定する。負の対照に対する試料中のVIP量の減少は、SEPのVIPタンパク質分解活性の尺度である。この検定を用いて、例えば、Butterworths によって公表された Athel Cornish Bowden, 1979 による Fundamentals of Enzyme Kinetics に記載の標準的な原理にしたがって、VmaxおよびKmのような酵素反応速度論パラメーターを決定する。
【0476】
実施例6−SEP阻害剤についての動物試験法
女性性的機能不全動物モデル
麻酔プロトコール
雌ニュージーランドウサギ(〜2.5kg)に、Medetomidine(Domitor(登録商標))0.5ml/kg 筋肉内(i.m.)および Ketamine(Vetalar(登録商標))0.25ml/kg 筋肉内(i.m.)の組合せを前投与し、同時に、フェイスマスクによる吸入酸素を維持する。これらウサギを、ベンチレーターに連結された PortexTMカフなし気管内チューブ3IDを用いて気管切開し、そして30〜40呼吸/分の換気速度において、18〜20mlのおよその一回呼吸量および10cmH2Oの最大気道圧で維持する。次に、麻酔薬を Isoflurane に切り替え、2l/分でのO2で換気を続ける。右耳辺縁静脈に、23Gまたは24Gカテーテルを用いてカニューレ挿入し、乳酸加リンガー液を0.5ml/分で灌流させる。このウサギを、侵襲性手術中は3% Isoflurane で維持し、維持麻酔には2%に降下させる。
【0477】
血管のカニューレ挿入
ウサギの左鼠けい部を剃毛し、垂直切開を大腿に沿って約5cmの長さで行う。大腿静脈を露出させ、分離後、薬物および化合物の注入用にPVCカーテル(17G;Portex Limited, Hythe, Kent, UK)をカニューレ挿入する。カニューレ挿入を大腿動脈について繰り返し、カテーテルを10cmの深さまで挿入して、カテーテルが腹大動脈に確実に達するようにする。この動脈カテーテルを Gould システムに連結して、血圧を記録する。血液ガス分析のための試料も、この動脈カテーテルによって採取する。収縮期および拡張期血圧を測定し、そして式[(拡張期x2+収縮期)÷3]を用いて平均動脈血圧を計算する。心拍数は、脈波型酸素飽和度計および Po−ne−mah データ捕捉ソフトウェアシステム(Ponemah Physiology Platform, Gould Instrument Systems,Inc., OH, USA)を用いて測定する。
【0478】
骨盤神経の刺激
腹部正中切開を腹腔中に行う。この切開は、恥骨直上約5cmの長さである。脂肪および筋肉を大まかに切除して、体腔の下に走る下腹神経を露出させる。恥骨の上にある大腿静脈および動脈を損傷させないために、恥骨壁の側弯曲に近い状態を保つことが不可欠である。坐骨神経および骨盤神経は、より深部にあり、ウサギの背側に更に切開後に見出される。坐骨神経がいったん識別されると、骨盤神経は容易に見出される。骨盤神経という用語は、大まかに用いられており;これについての解剖学書では、これら神経を充分に詳細に定義することができない。しかしながら、この神経の刺激は、膣および陰核の血流の増加および骨盤領域の神経支配を引き起こす。この骨盤神経を周囲組織から分離し、Harvard 双極刺激電極をその神経のまわりに置く。この神経を、ある程度の引っ張りを与えるように僅かに持ち上げた後、電極を適所に確保する。約1mlの軽パラフィン油をその神経および電極のまわりに置く。これは、神経への保護潤滑剤として作用し且つ電極の血液混入を防止する。電極を Grass S88 Stimulator につなぐ。骨盤神経を、次のパラメーター、すなわち、5V、0.5msパルス幅、10秒の刺激持続および2〜16Hzの周波数範囲、を用いて刺激する。再現性応答は、神経を15〜20分毎に刺激した場合に得られる。
【0479】
周波数応答曲線を、亜最大下応答として用いる最適周波数を決定するために、各実験の開始時に決定し、通常は4Hzである。試験される1種類または複数の化合物を、大腿静脈により、Harvard 22注入ポンプを用いて注入して、連続15分刺激サイクルを可能にする。
【0480】
Laser Doppler 探針の配置
腹部正中切開を骨盤の尾側末端に行って、骨盤部位を露出させる。結合組織を除去して、陰核膜を露出させ、その壁が小血管から確実に離れているようにする。外部膣壁も、結合組織を全て除去することによって露出させる。一つの Laser Doppler フロー探針を膣内に3cm挿入するので、探針シャフトの半分はまだ見えている。第二探針は、外部陰核壁直上にあるように配置する。次に、これら探針の位置を、シグナルが得られるまで調整する。第二探針を外部膣壁上の血管表面直上に置く。両方の探針を適所にクランプで固定する。
【0481】
膣および陰核の血流を、Po−ne−mah データ捕捉ソフトウェア(Ponemah Physiology Platform, Gould Instrument Systems,Inc.)を用いて Flowmeter から直接的に数値としてか、または Gould チャートレコーダートレースから間接的に記録する。校正は実験開始時に設定する(0〜125ml/分/100g組織)。
【0482】
血管作用性腸管ペプチド(VIP)の注入
注入されるVIP(Bachem, H−3775)の用量は、2.0、6.0、20.0、60.0μg/kg 静脈内(i.v.)であり、0.5ml容量の生理食塩水中で注入する。VIPは、三方タップによって大腿静脈中に500μl/分で注入する Harvard 22ポンプを用いて注入する。VIP注入後、カテーテルをヘパリン加生理食塩水(Hepsaline)で洗浄するので、カテーテル中にはVIPが残っていない。
【0483】
VIP注入を用いた実験には、再現性応答を得られるように最初の感作性用量反応曲線(2〜60μg/kg)のが必要である。Hepsaline(50UI/ml)の最初の注入は、負の対照として作用するように注入する。
【0484】
阻害剤の注入
SEP阻害剤およびビヒクル対照は、VIPと同速度で注入する。SEP阻害剤は、VIP用量反応曲線の前の30分間放置し、骨盤神経刺激の前の15分間放置する。
【0485】
データは、平均性器(膣/陰核)血流±平均の標準誤差(s.e.m.)として表す。有意の変化は、スチューデントt検定を用いて確認する。
男性性的機能不全動物モデル
ウサギ麻酔法
雄ニュージーランドウサギ(〜2.5kg)に、Medetomidine(Domitor(登録商標))0.5ml/kg 筋肉内(i.m.)および Ketamine(Vetalar(登録商標))0.25ml/kg 筋肉内(i.m.)の組合せを前投与し、同時に、フェイスマスクによる吸入酸素を維持する。これらウサギを、ベンチレーターに連結された PortexTMカフなし気管内チューブ3IDを用いて気管切開し、そして30〜40呼吸/分の換気速度において、18〜20mlのおよその一回呼吸量および10cmH2Oの最大気道圧で維持する。次に、麻酔薬を Isoflurane に切り替え、2l/分でのO2で換気を続ける。右耳辺縁静脈に、23Gまたは24Gカテーテルを用いてカニューレ挿入し、乳酸加リンガー液を0.5ml/分で灌流させる。このウサギを、侵襲性手術中は3% Isoflurane で維持し、維持麻酔には2%に降下させる。
【0486】
血管のカニューレ挿入
ウサギの左鼠けい部を剃毛し、垂直切開を大腿に沿って約5cmの長さで行う。大腿静脈を露出させ、分離後、薬物および化合物の注入用にPVCカーテル(17G;Portex Limited)をカニューレ挿入する。或いは、または更に、左頸静脈を露出させ、分離後、薬物および化合物の注入用にPVCカーテル(17G;Portex Limited)をカニューレ挿入する。カニューレ挿入を大腿動脈について繰り返し、カテーテルを10cmの深さまで挿入して、カテーテルが腹大動脈に確実に達するようにする。この動脈カテーテルを Gould システムに連結して、血圧を記録する。血液ガス分析のための試料も、この動脈カテーテルによって採取する。収縮期および拡張期血圧を測定し、そして式[(拡張期x2+収縮期)÷3]を用いて平均動脈血圧を計算する。心拍数は、脈波型酸素飽和度計および Po−ne−mah データ捕捉ソフトウェアシステム(Ponemah Physiology Platform, Gould Instrument Systems, Inc.)を用いて測定する。
【0487】
骨盤神経の刺激
腹部正中切開を腹腔中に行う。この切開は、恥骨直上約5cmの長さである。脂肪および筋肉を大まかに切除して、体腔の下に走る下腹神経を露出させる。恥骨の上にある大腿静脈および動脈を損傷させないために、恥骨壁の側弯曲に近い状態を保つことが不可欠である。坐骨神経および骨盤神経は、より深部にあり、ウサギの背側に更に切開後に見出される。坐骨神経がいったん識別されると、骨盤神経は容易に見出される。骨盤神経という用語は、大まかに用いられており;これについての解剖学書では、これら神経を充分に詳細に定義することができない。しかしながら、この神経の刺激は、空洞内血圧および空洞血流の増加および骨盤領域の神経支配を引き起こす。この骨盤神経を周囲組織から分離し、Harvard 双極刺激電極をその神経のまわりに置く。この神経を、ある程度の引っ張りを与えるように僅かに持ち上げた後、電極を適所に確保する。約1mlの軽パラフィン油をその神経および電極のまわりに置く。これは、神経への保護潤滑剤として作用し且つ電極の血液混入を防止する。電極を Grass S88 Stimulator につなぐ。骨盤神経を、次のパラメーター、すなわち、5V、0.5msパルス幅、16Hzの周波数で20秒の刺激持続を用いて刺激する。再現性応答は、神経を15〜20分毎に刺激した場合に得られる。
【0488】
上のパラメーターを用いた数回の刺激を行って、平均対照応答を決定する。試験される1種類または複数の化合物を、頸静脈により、Harvard 22注入ポンプを用いて注入して、連続15分刺激サイクルを可能にする。陰茎のまわりの皮膚および結合組織を除去して、陰茎を露出させる。カテーテルセット(Insyte−W,Becton−Dickinson 20 Gauge 1.1x48mm,Becton−Dickinson)を、白膜を介して左海綿体腔中に挿入し、針を除去して、軟質カテーテルを残す。このカテーテルを、圧力変換器(Ohmeda 5299−04)によって Gould システムに連結して、空洞内血圧を記録する。空洞内血圧がいったん決定されたら、そのカテーテルを、Vetbond(組織用接着剤,3M)を用いて適所で密封する。心拍数は、脈波型酸素飽和度計および Po−ne−mah データ捕捉ソフトウェアシステム(Ponemah Physiology Platform, Gould Instrument Systems,Inc.)を用いて測定する。
【0489】
空洞内血流は、Po−ne−mah データ捕捉ソフトウェア(Ponemah Physiology Platform, Gould Instrument Systems,Inc.)を用いて Flowmeter から直接的に数値としてかまたは Gould チャートレコーダートレースから間接的に記録する。校正は実験開始時に設定する(0〜125ml/分/100g組織)。
【0490】
阻害剤の注入
SEP阻害剤およびビヒクル対照は、0.1ml/秒の速度で注入する。SEP阻害剤は、骨盤神経刺激の前の15分間放置する。
【0491】
データは、平均空洞内血圧±s.e.m.として表す。有意の変化は、スチューデントt検定を用いて確認する。
【0492】
【配列表】
【0493】
【表3】
【0494】
【表4】
【0495】
【表5】
配列番号:1は、ヒトSEPをコードしているヌクレオチド配列(cDNA)を示す。
【0496】
配列番号:2は、+1読み取り枠中のcDNA配列の翻訳から予想されるヒトSEPタンパク質を示す。
配列番号:3および4は、ヒトSEPをコードしているヌクレオチド配列(cDNA)の同定で用いられるオリゴヌクレオチドプライマー配列を示す。
【0497】
配列番号:5は、5’および3’部分ベクター配列(強調されている)を含めた、ヒトSEPをコードしているヌクレオチド配列(cDNA)を示す。
参考文献
Argiolas, A. et al (1995), Neuromodulation of penile erection. Prog Neurobiol. 47:235−255.
Benet, A. E. et al (1994), Male erectile dysfunction assessment and treatment options. Comp. Ther. 20:669−673.
Boolel, M. et al (1996). Sildenafil, a novel effective oral therapy for male erectile dysfunction. Br. J. of Urology 78:257−261.
Carter AJ. et al (1998). Effect of the selective phosphodiesterase type 5 inhibitor sildenafil on erectile dysfuntion in the anesthetized dog. J. Urol. 160:242−6.
Chiou, W. F. et al (1998). Relaxation of corpus cavernosum and raised intracavernous pressure by berberine in rabbit. Br. J. Pharmacol. 125:1677−1684.
Jeremy, J. Y. et al (1997). Effects of sildenafil,a type−5 cGMP phosphodiesterase inhibitor,and papaverine on cyclic GMP and cyclic AMP levels in the rabbit corpus cavernosum in vitro. Br.J.Urology 79:958−963.
Lerner, S. E. et al (1993). A review of erectile dysfunction: new insights and more questions. J. Urology 149:1246−1255.
Melman, A. & Gingell, J. C. (1999). The epidemiology and pathophysiology of erectile dysfunction. J. Urology 161:5−11.
Montague, D. et al (1996). Clinical guidelines panel on erectile dysfunction: Summary report on the treatment of organic erectile dysfunction. J. Urology 156:2007−2011.
Naylor, A. M. (1998). Endogenous neurotransmitters mediating penile erection. Br. J. Urology 81:424−431.
NIH Consensus Development Panel on Impotence (1993). NIH Consensus Conference Impotence. J.A.M.A. 270:83.
Omote M. (1999). Pharmacological profiles of sildenafil (VIAGRA) in the treatment of erectile dysfuntion: efficacy and drug interaction with nitrate. Nippon Yakurigaku Zasshi. 114:213−8.
Taub. H. C. et al (1993). Relationship between contracion and relaxation in human and rabbit corpus cavernosum. Urology 42:698−704.
Traish AM, et al (1999). Effects of castration and androgen replacement on erectile function in a rabbit model. Endocrinology. 140:1861−8.
【図面の簡単な説明】
【図1】
図1は、ヒトSEP cDNA配列の読み取り枠(ORF)の分析を示す。
【図2】
図2は、blastpアルゴリズムからのペアワイズアラインメントによるヒトSEPの最も密接に関係したヒトタンパク質に対しての比較を示す。
【図3】
図3は、blastp(タンパク質)およびfasta(コーディングヌクレオチド)アルゴリズムからのペアワイズアラインメントによるSEPについてのヒト、ラットおよびマウス配列の比較を示す。
【図4】
図4は、触媒ドメインを示すヒトSEPおよび関係したヒトタンパク質の多重アラインメントを示す。
【図5】
図5は、触媒ドメインを示すヒト、ラットおよびマウスSEPタンパク質の多重アラインメントを示す。
【図6】
図6は、触媒ドメインを示すヒト、ラットおよびマウスSEPコーディング配列の多重アラインメントを示す。
【図7】
図7は、全SEP様タンパク質の多重アラインメントに由来する放射状樹として表される、Neighbour−Joining Distance 法による系統分析を示す。
【図8】
図8は、多重アラインメントの触媒ドメイン領域に由来する放射状樹として表される、Neighbour−Joining Distance 法による系統分析を示す。
技術分野
本発明は、酵素に関する。本発明は、更に、その酵素をエンコードしているヌクレオチド配列に関する。
【0002】
詳しくは、本発明は、新規なヒト可溶性分泌エンドペプチダーゼ(SEP)をエンコードしている新規な核酸配列に関する。
本発明は、更に、疾患の診断および予防および/または処置における新規な核酸配列およびアミノ酸配列の使用に関する。
【0003】
本発明は、更に、特に、エンドペプチダーゼ活性をモジュレートしうる、好ましくは、阻害しうる、より好ましくは、選択的に阻害しうる試剤を評価するおよび/またはスクリーニングするための新規な核酸配列およびアミノ酸配列の使用に関する。
【0004】
本発明は、更に、性的機能不全、例えば、女性性的機能不全(FSD)、特に、女性性的興奮障害(FSAD)の予防および/または処置において有用な化合物および医薬組成物に関する。
【0005】
本発明は、また更に、FSD、特に、FSADの予防および/または処置の方法に関する。
本発明は、更に、FSD、特に、FSADの予防および/または処置において有用な化合物をスクリーニングする検定に関する。
【0006】
本発明は、男性性的機能不全、特に、男性勃起機能不全(MED)の予防および/または処置において用いるための化合物および医薬組成物に関する。本明細書中で論及される男性性的機能不全とは、早発射精などの射精障害、無オルガスム症(オルガスムに達し得ない)、または活動低下状態の性的欲求障害(性行為への関心欠如)などの欲求障害、を含む意味である。
【0007】
本発明は、更に、MEDの予防および/または処置の方法に関する。
本発明は、更に、男性性的機能不全、特に、MEDの予防および/または処置において有用な化合物をスクリーニングする検定に関する。
【0008】
発明の背景
ヒト可溶性分泌エンドペプチダーゼ(ヒトSEP)
プロテアーゼは、タンパク質およびペプチドを、そのペプチドまたはタンパク質鎖の主鎖を形成するペプチド結合において切断する酵素のラージファミリーを形成している。プロテアーゼは、細菌からヒトまでの全ての生物において見出されている。ヒトの場合、全遺伝子の約1%(400〜1000)が、プロテアーゼ酵素をエンコードしていると考えらている。それらは、発生期ポリペプチドの活性化および成熟、誤って折りたたまれた且つ損傷したタンパク質の分解、および細胞の内部および外部両方のペプチドおよびタンパク質の制御された代謝回転に関与している。それらの活性は、消化、正常な成長、内分泌機能、創傷治癒、炎症、血管新生、胚発生期の組織再造形、腫瘍転移、心臓血管疾患、神経学的疾患、および細菌、寄生生物およびウイルスの感染を含めた多数の過程に重要である。
【0009】
プロテアーゼは、それらの基質を切断する場所に基づいて広く分類することができる。エキソペプチダーゼには、アミノペプチダーゼ、ジペプチジルペプチダーゼ、トリペプチダーゼ、カルボキシペプチダーゼ、ペプチジルジペプチダーゼ、ジペプチダーゼおよびωペプチダーゼが含まれ、これらは、その基質の末端の残基を切断する。セリンプロテアーゼ、システインプロテアーゼおよびメタロエンドペプチダーゼが含まれるエンドペプチダーゼは、そのペプチド内の配列において切断する。
【0010】
亜鉛メタロプロテアーゼとして知られる重要なエンドペプチダーゼ群は、それらの触媒部位に亜鉛イオンを結合する必要条件を有することによって特徴付けられる。亜鉛メタロプロテアーゼは、クラスに細分することができ(概説については、FEBS Letters 354 (1994) pp.1−6 を参照されたい)、一つのこのようなクラスは、ネプリリシン(neprilysin)(NEP)様亜鉛メタロプロテアーゼである(FASEB Journal, Vol 11,1997 pp.355−384)。このNEPクラスには、構造的に互いに関連している少なくとも7種類の酵素が含まれる(後を参照されたい)。それらは、典型的には、大きいカルボキシ末端細胞外ドメイン、短い膜に広がる領域、およびアミノ末端の短い細胞内ドメインと共になって、膜結合性である。このファミリーの既知のメンバーは、ネプリリシン(NEP、CD10、CALLA、エンケファリナーゼまたはEC3.4.24.11とも称される)、エンドセリン変換酵素(ECE−1およびECE−2)、PEX、KELL、X変換酵素/損傷誘発神経エンドペプチダーゼ(XCE/DINE)、および齧歯類で同定された可溶性分泌エンドペプチダーゼ/ネプリリシンIIと称される酵素(SEP/NEPII;Ghaddar,G et al, Biochem Journal, Vol 347,2000,pp.419−429; Ikeda,K et al, Journal Biological Chemistry, Vol 274,1999,pp.32469−32477; Tanja,O et al, Biochem Biophys Research Communication, Vol 271,2000,pp.565−570; 国際特許出願WO99/53077号)である。このクラスのメンバーの機能は、ペプチド作用性シグナリングに関連していると考えられる。これは、ヒトを含めた大部分の生物で見出される過程であり、ここにおいて、ペプチド分子は、生理学的応答を引き出す“メッセンジャー”として用いられる。典型的には、これは、時々、プロテアーゼによって切断されて活性になる不活性前駆体として、特定の細胞によるペプチドメッセンジャーの生産および放出を伴う。次に、このペプチドの活性型は、それが応答を引き出す別の細胞の表面上の特異的レセプターを結合する。次に、このペプチドは、別のプロテアーゼによる分解によって失活する。
【0011】
NEPは、このクラスの発見される最初のメンバーであった。NEPは、多数の生物ペプチド、例えば、エンケファリン、ブラジキニンおよびサブスタンスP、をタンパク質分解し且つ失活させることができるという点で無差別なプロテアーゼである。それは、通常、疎水性残基のアミノ末端側のペプチドを切断する。NEPは、多数の体組織中で見出されうるが、腎臓において最も量が多い。その生理学的機能は、充分に理解されていないが、NEP“ノックアウト”マウスの表現型からの一つの指標は、それが内毒素ショックの防止に関与しているということである。
【0012】
ECE−1は、NEPに37%一致するタンパク質である。ECE−1は、身体中に広く分布し、不活性な前駆体ペプチドであるビッグエンドセリンをエンドセリンに変換するが、これは、血管緊張を維持するのに重要な強力な血管収縮薬である。ECE−2酵素は、ECE−1とは別個の遺伝子に由来するが、そのアミノ酸配列は、59%の全体相同性で類似している。エンドセリン生産へのECE−2の生理学的重要性は不明である。ECE−2mRNAは、ECE−1mRNAよりはるかに低レベルで存在するが、ECE−1とは異なったpH最適条件を有し、中性pHで不活性であり、pH5.5で最も活性である。
【0013】
KELL酵素は、赤芽球組織で見出されるNEPクラスの臨床的に重要なメンバーである。KELL血液型系の抗原は、輸血への溶血反応を引き起こすことがありうるこのタンパク質に存在する。
【0014】
PEX遺伝子は、低下した腎尿細管リン酸塩再吸収を典型とする優勢な障害である、X連鎖低リン酸血症性くる病と称される障害に遺伝的に連鎖していると同定された。NEPファミリーの他のメンバーとのその近い相同性(49〜60%)に基づき、それは、膜結合性メタロプロテアーゼであるとも予測されるが、基質はまだ発見されていない。
【0015】
XCE(Valdenaire,O et al, Molecular Brain Research, Vol 64,1999,pp.211−221)およびそのラット均等物DINE(Kiryu−Seo,S et al, Proceedings of the National Academy of Science USA, 2000,pp.4345−4350)は、中枢神経系において主に発現される。DINE発現は、ニューロン損傷後にアップレギュレーションされるが、これは、おそらくは、抗酸化酵素のDINEに媒介されるタンパク質分解活性化の結果として、ニューロンアポトーシスを妨げるのを助けると考えられる。XCE/DINEの生理学的基質もまだ同定されていないが、それらの配列から、明らかに、それらはプロテアーゼであると考えられ、そしてDINEについては、合成ペプチド基質を用いてこれが証明されている。
【0016】
齧歯類SEPおよびNEPIIは、ごく最近発見された。それらは91%のアミノ酸同一性を有するので、NEPIIは、マウス酵素であるSEPのラット均等物であると考えられる。それらは、アミノ酸配列がNEPに最も近いこのクラスのメンバーであり、両方とも、ヒトNEPに54%一致する。両者のmRNAは、精巣において極めて量が多く、広範囲の他の組織においても低レベルで検出されることがありうる。ラットNEPIIの場合、そのmRNAは、脳および下垂体においても比較的高レベルで見出されている。哺乳動物細胞中で組換えによって生じる場合、マウスSEPおよびラットNEPIIは両方とも、増殖培地中で見出されうる。これは、それらが、循環することができ、したがって身体中の他の部位でペプチドを切断することができる分泌プロテアーゼでありうるということを示唆している。マウスSEPおよびラットNEPIIは、ECE−1のようなこのクラスのいくつかの他のメンバーと同様、スプライス変異を示す。マウスSEPおよびラットNEPIIの場合、このスプライス変異は、膜の局在化および分泌に関与する配列の変化を含むイソ型を生じる。これの生理学的有意性は不明であるが、これら酵素の膜結合型、循環型、および細胞内在型が存在しうると考えられる。マウスSEPは、エンケファリン、エンドセリン、ビッグエンドセリン、ブラジキニンおよびサブスタンスPを含めた一定範囲の重要な生物ペプチドを切断しうることが分かった。したがって、NEPと同様、それは、かなり広い基質特異性を有するので、別々の組織においていくつかの生理学的機能を有することがありうる。
【0017】
このNEPクラスの酵素は、他のメタロプロテアーゼ酵素と同様、薬物様低分子(例えば、チオルファン(thiorphan)およびホスホラミドン)による阻害に影響を受けやすいことが示されている。これは、ペプチド作用性シグナリングをモジュレートする場合のNEP様酵素のいくつかのメンバーの生理学的機能の現れている性状と一緒に、それらを薬学的介入のための魅力のある標的にする。NEP阻害剤は、心臓血管疾患を含めた適応症のために開発されているが、それらの機能の情報が更に増加するにつれ、NEP様酵素の特異的阻害剤は、性的機能不全(特に、男性性的機能不全、例えば、男性勃起機能不全(MED)、および女性性的機能不全(FSD)、例えば、女性性的興奮障害(FSAD))、早産、子癇前症、子宮内膜症、生殖障害(特に、男性および女性の不妊症、多嚢胞性卵巣症候群、着床不全)、高血圧症、心不全、アンギナ、腎機能不全、周期性水腫、高アルドステロン症、緑内障、喘息、炎症、白血病、痛み、てんかん、情動障害、痴呆および老年性錯乱、肥満症および胃腸障害(特に、下痢および過敏性腸症候群)、敗血症性ショック、胃酸分泌のモジュレーション、および高レニン血症の処置などの多数の他の適応症の予防および/または処置にある役割を有することがありうると考えられる。
【0018】
性的機能不全
性的機能不全(SD)は、男性および女性双方に影響しうる重要な臨床的問題である。SDの原因は、器質的でありうるし、心理学的でもありうる。SDの器質的側面は、典型的には、高血圧症または真性糖尿病に関連した疾患のような潜在する血管疾患によって、処方薬によっておよび/またはうつ病のような精神医学的疾患によって引き起こされる。生理学的因子には、恐怖、行為不安および対人間葛藤が含まれる。SDは、性的行為を損ない、自尊心を傷つけ、そして人間関係を破壊することによって、人格窮迫を引き起こす。臨床において、SD障害は、女性性的機能不全(FSD)障害および男性性的機能不全(MSD)障害に分けられている(Melman et al 1999)。FSDは、女性が性的表現に満足を見出すことが難しいことまたはできないこととして最もよく定義される。男性性的機能不全(MSD)は、概して、男性勃起機能不全(MED)としても知られる勃起機能不全に関連している(Benet et al 1994)。
【0019】
本発明の化合物は、男性の場合の性的機能不全(例えば、男性勃起機能不全−MED)および女性の場合の女性性的機能不全(FSD)、例えば、女性性的興奮障害(FSAD)の予防および/または処置に特に有益である。
【0020】
女性性的機能不全(FSD)
本発明において、FSDは、女性が性的表現に満足を見出すのが難しいことまたはできないこととして定義することができる。FSDは、いくつかの異なった女性性的障害についての集合名である(Leiblum, S. R. (1998). Definition and classification of female sexual disorders. Int. J. Impotence Res., 10,S104−S106; Berman, J. R., Berman, L. & Goldstein, I. (1999). Female sexual dysfunction: Incidence, pathophysiology, evaluations and treatment options. Urology, 54,385−391.)。それら女性は、欲求の欠如、性的興奮またはオルガスムの困難、性交痛、またはこれら問題の組合せを有することがありうる。疾患のいくつかのタイプ、投薬、傷害または心理学的問題は、FSDを引き起こすことがありうる。開発中の処置は、FSDの特定のサブタイプ、優先的には、欲求および性的興奮の障害を処置することを的にしている。
【0021】
FSDのカテゴリーは、正常な女性性的応答の様相、すなわち、欲求、性的興奮およびオルガスムにそれらを対比することによって最もよく定義される(Leiblum, S. R. (1998). Definition and classification of female sexual disorders., Int. J. Impotence Res., 10, S104−S106)。欲求または性欲は、性的表現の動因である。その徴候には、しばしば、関心のある相手と一緒の場合かまたは他の性的刺激にさらされた場合の性的思考が含まれる。性的興奮は、性的刺激への血管応答であり、その重要な成分は、性器充血であり、そしてそれには、増加した膣潤滑、膣の伸長および増加した性器感覚/感受性が含まれる。オルガスムは、性的興奮中に絶頂に達した性的緊張の解放である。
【0022】
したがって、FSDは、女性がこれら様相のいずれか、通常は、欲求、性的興奮またはオルガスムに不十分なまたは不満足な応答をする場合に起こる。FSDカテゴリーには、活動低下状態の性的欲求障害、性的興奮障害、オルガスム障害および性的苦痛障害が含まれる。本発明の化合物は、(女性性的興奮障害の場合のように)性的刺激への性器応答を改善するであろうが、その場合、それは、関連した苦痛、性交に関連した窮迫および不快も改善することができ、したがって、他の女性性的障害を処置することができる。
【0023】
したがって、本発明の好ましい側面により、活動低下状態の性的欲求障害、性的興奮障害、オルガスム障害および性的苦痛障害の処置または予防のための、より好ましくは、性的興奮障害、オルガスム障害および性的苦痛障害の処置または予防のための、そして最も好ましくは、性的興奮障害の処置または予防での薬剤の製造における本発明の化合物の使用を提供する。
【0024】
活動低下状態の性的欲求障害は、女性が性的である欲求を全くまたはほとんど持たないし、性的思考または空想を全くまたはほとんどしない場合に存在する。このタイプのFSDは、自然閉経かまたは外科的閉経のための低テストステロンレベルによって引き起こされることがありうる。他の原因には、疾病、投薬、疲労、うつ病および不安が含まれる。
【0025】
女性性的興奮障害(FSAD)は、性的刺激への不十分な性器応答を特徴とする。性器は、正常な性的興奮を特徴付ける充血をしない。膣壁は充分に潤滑されないので、性交は苦痛である。オルガスムは妨げられうる。性的興奮障害は、閉経時または出産後および授乳期の減少したエストロゲンによって、更には、糖尿病およびアテローム性動脈硬化症のような血管成分を伴う疾病によって引き起こされることがありうる。他の原因は、利尿薬、抗ヒスタミン薬、抗うつ薬、例えば、選択的セロトニン再吸収阻害剤(SSRI)または抗高血圧症薬での処置に起因する。
【0026】
性的苦痛障害(性交疼痛症および膣痙を含む)は、陰茎挿入に起因する痛みを特徴とし、潤滑を減少させる投薬、子宮内膜症、骨盤内炎症性疾患、炎症性腸疾患または尿路の問題によって引き起こされることがありうる。
【0027】
FSDの有病率は、その用語が、そのいくつかは測定し難い問題のいくつかのタイプにわたっているので、そしてFSDを処置することへの関心が比較的最近であるので、判定するのが難しい。多数の女性の性的問題は、直接的には、女性の加齢過程かまたは糖尿病および高血圧症のような慢性疾患に関連している。
【0028】
FSDは、性的応答周期の別々の様相で症状を発現するいくつかのサブタイプから成るので、単一の療法は存在しない。FSDの現行の処置は、主に、心理学的または関連性の問題に集中している。FSDの処置は、より臨床的な且つ基礎的な科学研究がこの医学的問題の研究についてなされるにつれ、徐々に発展している。女性の性的病気は、病態生理学において、特に、女性の性的病気全体の原因となる血管形成機能不全の成分(例えば、FSAD)を有することがありうる個々人について、全て心理学的であるとは限らない。現在のところ、FSDの処置用に認可された薬物はない。経験的薬物療法には、エストロゲン投与(局所にまたはホルモン置換療法としての)、アンドロゲン、またはブスピロンまたはトラゾドンのような気分改変薬が含まれる。これら処置選択は、しばしば、低い効力または許容し得ない副作用のために、満足するものではない。
【0029】
FSDを処置することへの薬理学的関心は比較的最近であるので、療法は、次の、心理学的カウンセリング、一般市販用性的潤滑剤、および他の状態に承認された薬物を含めた治験候補物から成る。これら投薬は、テストステロンかまたは、エストロゲンおよびテストステロンの組合せのホルモン剤、およびより最近では、男性勃起機能不全(MED)に有効であると証明された血管薬から成る。これら試剤で、FSDを処置するのに有効であると示されたものはまだない。
【0030】
考察されるように、本発明の化合物は、女性性的興奮障害(FSAD)の予防および/または処置に特に有用である。
The Diagnostic and Statistical Manual (DSM) IV of the American Psychiatric Association では、女性性的興奮障害(FSAD)を:
“・・・性的興奮状態の性的活性十分な潤滑膨張応答の完了まで到達するまたは維持することが永続的にまたは再発的にできないこと。この障害は、顕著な窮迫または対人間困難を引き起こすに違いない。・・・”と定義している。
【0031】
この興奮応答は、骨盤内の血管うっ血、膣潤滑、および外性器の拡大および膨張から成る。この障害は、顕著な窮迫および/または対人間困難を引き起こす。カップルの性的機能不全を調査している研究は、女性の76%までが性的機能不全の病気を持っていること、および米国の女性の30〜50%がFSDを経験していることを示している(Berman, J. R., Berman, L. A., Werbin, T. J. et al. (1999). Female sexual dysfunction: Anatomy, physiology, evaluation and treatment options. Curr. Opin. Urology, 9, 563−568)。
【0032】
FSADは、閉経前、閉経周辺期および閉経後(±ホルモン置換療法(HRT))の女性を襲う極めて一般的な性的障害である。それは、うつ病、心臓血管疾患、糖尿病および泌尿生殖器(UG)障害のような付随障害に関連している。
【0033】
FSADの一次結果は、充血/膨張の不足、潤滑の不足、および快い性器感覚の不足である。FSADの二次結果は、減少した性的欲求、性交中の苦痛およびオルガスムに達するのが難しいことである。
【0034】
最近になって、FSADの症状を有する患者の少なくとも一部分について、血管が根拠であると仮定され(Goldstein et al., Int. J. Impot. Res., 10, S84−S90, 1998)、動物データがこの見解を支持している(Park et al., Int. J. Impot. Res., 9, 27−37, 1997)。
【0035】
FSADを処置するための薬物候補は、効力について調査中であるが、主として、男性性器への循環を促す勃起機能不全療法である。それらは、二つのタイプの製剤、すなわち、経口または舌下用薬剤(アポモルフィン、フェントラミン、ホスホジエステラーゼ5型阻害剤、例えば、シルデナフィル(Sildenafil))、および注射または男性の場合は経尿道でおよび女性の場合は性器に局所投与されるプロスタグランジン(PGE1)から成る。しかしながら、これら療法で、FSADの処置に有効であることが示されたものはまだない。
【0036】
理論によって拘束されたくはないが、本発明者は、血管作用性腸管ペプチド(VIP)のような神経ペプチドが、女性性的興奮応答の制御、特に、性器血流の制御における主要な神経伝達物質候補であると考えている。VIPおよび他の神経ペプチドは、SEPによって分解される/代謝される。したがって、SEP阻害剤は、興奮中に放出されるVIPの内因性血管弛緩作用を増強するであろう。これは、増進した性器血流およびそれゆえの性器充血などによって、FSADの予防および/または処置をもたらすであろう。本発明者は、SEPの阻害剤が、骨盤神経に刺激されるおよびVIPに誘発される膣および陰核の血流の増加を促すということを示した。更に、本発明者は、SEP阻害剤が、分離された膣壁のVIPおよび神経に媒介される弛緩を促すということを示した。
【0037】
したがって、本発明は、正常な性的興奮応答、すなわち、膣、陰核および陰唇の充血をもたらす増加した性器血流を回復させる手段を提供するのを助けるので好都合である。これは、血漿浸出による増加した膣潤滑、増加した膣コンプライアンス、および増加した性器感受性をもたらすであろう。
【0038】
したがって、本発明は、正常な性的興奮応答を回復させるまたは増強する手段を提供する。
本明細書中の女性性器は:“生殖器は、内部および外部の群から成る。内器官は、骨盤内に位置し、卵巣、卵管、子宮および膣から成る。外器官は、泌尿生殖器隔膜の表面および骨盤帯の下である。それらは、恥丘、大陰唇および小陰唇、陰核、前庭、前庭球、および大前庭腺を含む”(Gray’s Anatomy,C.D.Clemente, 13th American Edition)を意味する。
【0039】
R.J.Levin は、“・・・男性および女性性器は、発生学的に共通の組織原基から発生しているので、男性および女性性器構造は、互いに相同であると論じられている。したがって、陰核は陰茎相同物であり、陰唇は陰嚢の相同物である。・・・”(Levin, R. J. (1991), Exp. Clin. Endocrinol., 98, 61−69)ということを教示している。
【0040】
男性勃起機能不全(MED)
いくらかの個人は、男性勃起機能不全(MED)に苦しむことがありうるといことが知られている。
【0041】
男性勃起機能不全(MED)は:
“・・・満足のいく性的行為のために陰茎勃起を達成するおよび/または維持することができないこと(NIH Consensus Development Panel on Impotence, 1993)・・・”と定義される。
【0042】
全段階(最低限の、中程度のおよび完全なインポテンス)の勃起機能不全(ED)の有病率は、40歳〜70歳の男性の52%であり、70歳を越える男性ではより高い比率であると推定されている(Melman et al 1999)。その状態は、患者およびそのパートナーの生活の質に重大な悪影響を及ぼし、しばしば、うつ病および乏しい自尊心をもたらす増加した不安および緊張を引き起こす。20年前には、MEDは主に心理学的障害であると考えられていたが(Benet et al 1994)、現在は、患者の大部分について、根本的な器質的原因があるということが知られている。結果として、正常な陰茎勃起の機作およびMEDの病態生理学を明らかにすることについて多くの進展がなされた。
【0043】
陰茎勃起は、海綿体平滑筋の収縮および弛緩の平衡および陰茎の脈管構造に依存する血行力学的イベントである(Lerner et al 1993)。海綿体平滑筋は、本明細書中において、体平滑筋または複数の意味で海綿体とも称する。海綿体平滑筋の弛緩は、海綿体の小柱腔中への増加した血流をもたらし、それらが周囲の膜に対して拡大し且つ排出静脈を圧迫するようにさせる。これは、極めて大きい血圧上昇を生じ、これが勃起を引き起こす(Naylor, 1998)。
【0044】
勃起過程中に起こる変化は複雑であり、末梢および中枢の神経系および内分泌系を包含する高度の協調された制御を必要とする(Naylor, 1998)。体平滑筋収縮は、シナプス後α1アドレノセプターの活性化による交感神経ノルアドレナリン作用性神経支配によってモジュレートされる。MEDは、海綿体の内因性平滑筋緊張の増加に関連することがありうる。しかしながら、体平滑筋弛緩過程は、非アドレナリン作用性・非コリン作用性(NANC)神経伝達によって部分的に媒介される。陰茎中で見出される酸化窒素(NO)以外の他のNANC神経伝達物質は、カルシトニン遺伝子関連ペプチド(CGRP)および血管作用性腸管ペプチド(VIP)など多数存在する。この弛緩を媒介する原因となる主な弛緩因子はNOであり、これは、一酸化窒素合成酵素(NOS)によってL−アルギニンから合成される(Taub et al 1993; Chuang et al 1998)。体平滑筋緊張を低下させることは、NOが海綿体の弛緩を引き起こすのを助けうると考えられている。男性の場合の性的興奮の際、NOはニューロンおよび内皮から放出され、平滑筋細胞および内皮中にある可溶性グアニル酸シクラーゼ(sGC)に結合してそれを活性化させて、細胞内サイクリックグアノシン3’,5’−一リン酸(cGMP)レベルの上昇をもたらす。このcGMPの上昇は、プロテインキナーゼG活性化を包含すると考えられる未知の機作によって(おそらくは、Ca2+ポンプの活性化およびCa2+に活性化されるK+チャンネルによって;Chuang et al., 1998)、細胞内カルシウム濃度([Ca2+]i)の減少による海綿体の弛緩をもたらす。
【0045】
クエン酸シルデナフィル(バイアグラ(ViagraTM)とも称される)は、最近、Pfizer によってMEDのための最初の経口薬処置として開発された。シルデナフィルは、ホスホジエステラーゼ5(PDE5)を選択的に阻害することによって海綿体中のcGMP分解を阻害することによって作用し、それによって、cGMPの5’GMPへの加水分解を制限し(Boolel et al., 1996; Jeremy et al., 1997)、そしてそれによって、cGMPの細胞内濃度を増加させて海綿体平滑筋弛緩を容易にする。
【0046】
現在、プロスタグランジン基剤化合物、すなわち、尿道内に(Vivus Inc. から MuseTMとして入手可能)または小針注射によって(Pharmacia & Upjohn から CaverjectTMとして入手可能)投与することができるアルプロスタジル(alprostadil)での処置のような他の利用可能な市販MED療法は全て、不都合であるかおよび/または侵襲性である。他の処置には、真空狭窄装置、血管作用性薬注射または陰茎プロテーゼ植込み(Montague et al., 1996)が含まれる。注射可能な血管作用性薬は高い効力を示すが、陰茎痛、線維症および持続勃起症などの副作用が一般的であるし、注射療法は経口療法ほど好都合ではないので、現在のところ、シルデナフィルが最も好ましい市販療法である。
【0047】
陰茎または海綿体中のまたは勃起機作/過程におけるSEPの発現または機能的役割について、文書による証拠は従来存在しない。
陰茎または海綿体へのまたは代わりに勃起機作/過程におけるSEP阻害剤の機能的または生化学的作用についても、文書による証拠は従来存在しない。
【0048】
膣または陰核海綿体中のまたは女性性的興奮機作/過程におけるSEPの発現または機能的役割について、文書による証拠は従来存在しない。
膣または陰核海綿体中のまたは女性性的興奮機作/過程におけるSEP阻害剤の機能的または生化学的作用についても、文書による証拠は従来存在しない。
【0049】
したがって、本発明の将来性のある知見は、性的機能不全、特に、MEDまたはFSADに苦しむ男性または女性を、可溶性分泌エンドペプチダーゼ阻害剤(SEPi)の使用で処置する能力である。驚くべきことに、本出願人は、SEPiでのSEPの阻害が、神経に刺激される性的興奮過程を有意に増進するということも見出した。
【0050】
本発明は、正常な性的興奮応答、すなわち、男性の場合は陰茎の勃起をもたらす増加した陰茎血流、および女性の場合は性器充血をもたらす増加した膣陰核血流を回復させる手段を提供するので、好都合である。したがって、本発明は、正常な性的興奮応答を回復させるまたは増強する手段を提供する。
【0051】
発明の概要
広範な側面において、本発明は、新規なアミノ酸配列に関する。これに関して、具体的な新規アミノ酸配列が同定されており、本発明がその配列、ならびに、その新規な変異体、フラグメント、誘導体およびホモログを包含するということは理解されるはずである。
【0052】
もう一つの広範な側面において、本発明は、新規な核酸配列に関する。これに関して、具体的な新規核酸配列が同定されており、本発明がその配列、ならびに、その新規な変異体、フラグメント、誘導体およびホモログを包含するということは理解されるはずである。
【0053】
したがって、要するに、本発明のいくつかの側面は、次に関する:
1. 新規なアミノ酸。
2. 新規なヌクレオチド配列。
【0054】
3. これら新規な配列を用いた検定。
4. これら検定の使用によって識別される化合物/組成物。
5. これら新規な配列を含むまたは発現する発現系。
【0055】
6. これら新規な配列に基づく予防および/または処置の方法。
7. これら新規な配列に基づく医薬組成物。
本発明のアミノ酸配列および/または本発明のヌクレオチド配列に関する他の側面には、本発明の配列を含むまたは発現することができる構築物;本発明の配列を含むまたは発現することができるベクター;本発明の配列を含むまたは発現することができるプラスミド;本発明の配列を含むまたは発現することができる組織;本発明の配列を含むまたは発現することができる器官;本発明の配列を含むまたは発現することができる形質転換された宿主;および本発明の配列を含むまたは発現することができる形質転換された生物、が含まれる。本発明は、更に、それらを転移する方法を含めた、微生物中での発現のような、それらを発現する方法を包含する。
【0056】
次の注釈において、“本発明のヌクレオチド配列”および“本発明のアミノ酸配列”の意味は、それぞれ、本明細書中に示されたまたは論じされたヌクレオチド配列のいずれか一つまたはそれを越えるもの、および本明細書中に示されたまたは論じされたアミノ酸配列のいずれか一つまたはそれを越えるものを意味する。更に、本明細書中に用いられるように、“アミノ酸配列”とは、ペプチドまたはタンパク質の配列を意味し、それらの一部分を意味してよい。更に、“本発明のアミノ酸配列”という用語は、“本発明のポリペプチド配列”という句と同義語である。更に、“本発明のヌクレオチド配列”という用語は、“本発明のポリヌクレオチド配列”という句と同義語である。
【0057】
発明の詳細な側面
本発明の一つの側面においては、単離されたおよび/または精製されたポリヌクレオチドであって、
(a)配列番号:2に示されるポリペプチドをエンコードしているポリヌクレオチド;
(b)配列番号:1または配列番号:5のヌクレオチド配列を含むポリヌクレオチド;
(c)NCIMB41110中に含有されるDNAによって発現されたポリペプチドをエンコードしているポリヌクレオチド;
(d)(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも83%の同一性を有するヌクレオチド配列を含むポリヌクレオチド;
(e)(a)〜(d)のいずれか一つのポリヌクレオチドにハイブリッド形成することができるヌクレオチド配列を含むポリヌクレオチド;
(f)(a)〜(e)のいずれか一つのポリヌクレオチドの相補鎖;または
(g)(a)〜(f)のいずれか一つのポリヌクレオチドのポリヌクレオチドフラグメント
の内の一つまたはそれを越えるものを含むポリヌクレオチドを提供する。
【0058】
配列番号:2のポリペプチドについて、それらアミノ酸のいずれか一つまたはそれを越えるものは、それらの類似体でありうる。
本明細書中で用いられる“類似体”という用語は、配列番号:2の配列に類似した配列を有する配列であるが、非有害(すなわち、酵素活性に有害でない)アミノ酸置換または欠失が起こっている配列を意味する。
【0059】
好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも85%の同一性を有するヌクレオチド配列を含む。より好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも87%の同一性を有するヌクレオチド配列を含む。なお一層好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも89%の同一性を有するヌクレオチド配列を含む。また更に好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも90%の同一性を有するヌクレオチド配列を含む。最も好ましくは、このポリヌクレオチドは、上の(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも95%の同一性を有するヌクレオチド配列を含む。
【0060】
好ましくは、上記のポリヌクレオチドは、アミノ酸配列MGKSEGPVGを含むポリペプチドをエンコードしている。好ましくは、このアミノ酸配列MGKSEGPVGは、そのポリペプチドのアミノ末端にまたはその付近にある。
【0061】
好ましくは、上記のポリヌクレオチドは、ヌクレオチド配列ATGGGGAAGTCCGAAGGCCCCGTGGGGを含む。好ましくは、このヌクレオチド配列ATGGGGAAGTCCGAAGGCCCCGTGGGGは、そのポリヌクレオチドの5’末端にまたはその付近にある。
【0062】
上記のポリヌクレオチドは、好ましくは、可溶性分泌エンドペプチダーゼ(SEP)、好ましくは、ヒトSEPをエンコードしている。
本発明は、更に、上記のポリヌクレオチドの少なくとも15個連続したヌクレオチドを含むポリヌクレオチドプローブもしくはプライマー、またはその相補鎖を提供する。好ましくは、このプローブまたはプライマーは、このSEPコーディング配列を他の配列から特異的に区別することができる。
【0063】
本発明は、また更に、上記のポリヌクレオチドを含むベクターを提供する。
本発明のもう一つの側面により、上記のベクターで形質転換されたまたはトランスフェクションされた宿主細胞を提供する。好ましくは、この宿主細胞は、哺乳動物、細菌または酵母の細胞である。
【0064】
本発明によって更に提供されるのは、上記のポリヌクレオチドの転写されたRNA産物である。
本発明によって更に提供されるのは、上記のこのRNA産物に関してアンチセンスであって、それにハイブリッド形成することができるRNA分子またはそのフラグメントである。
【0065】
上記のポリヌクレオチドに結合することができるリボザイムまたはジンクフィンガータンパク質も、本発明によって提供する。
本発明のまた更にもう一つの側面により、ポリペプチドまたはそのフラグメントを製造する方法であって、宿主細胞を上記のベクターで形質転換しまたはトランスフェクションし、そしてその形質転換された/トランスフェクションされた宿主細胞を、培地中においてこのポリペプチドまたはフラグメントの発現に充分な条件下で培養することを含む方法を提供する。好ましくは、このポリペプチドまたはフラグメントを培地中に分泌させる。この方法は、好ましくは、ポリペプチドまたはフラグメントを培地から回収することを更に含む。
【0066】
本発明は、ポリペプチドまたはそのフラグメントを発現することができる細胞を生じる方法であって、上記のベクターで細胞を形質転換するまたはトランスフェクションすることを含む方法を更に提供する。
【0067】
本発明のもう一つの態様により、上記の方法によって生じた細胞を提供する。更に、上の方法によって生じる上記のポリペプチドまたはそのフラグメントを提供する。
【0068】
本発明のもう一つの側面により、SEP活性を有するポリペプチドであって、
(a)配列番号:1または配列番号:5のポリヌクレオチド配列から翻訳される推定のアミノ酸配列を有するポリペプチドおよびその変異型、フラグメント、ホモログ、類似体および誘導体;
(b)配列番号:2のポリペプチドおよびその変異型、フラグメント、ホモログ、類似体および誘導体;
(c)NCIMB41110のcDNAによってエンコードされたポリペプチドおよびその変異型、フラグメント、ホモログ、類似体および誘導体;または
(d)ポリペプチドであって、(i)配列番号:1または配列番号:5のポリヌクレオチドによってエンコードされたポリペプチド、(ii)配列番号:2のポリペプチド、または(iii)NCIMB41110のcDNAによってエンコードされたポリペプチド、と少なくとも78%の同一性を有するもの
の内の一つまたはそれを越えるものを含むポリペプチドを提供する。
【0069】
好ましくは、このポリペプチドは、(i)配列番号:1または配列番号:5のポリヌクレオチドによってエンコードされたポリペプチド、(ii)配列番号:2のポリペプチド、または(iii)NCIMB41110のcDNAによってエンコードされたポリペプチド、と少なくとも85%、好ましくは、少なくとも90%、より好ましくは、少なくとも95%、最も好ましくは、少なくとも98%の同一性を有する。
【0070】
好ましくは、上記のポリペプチドは、アミノ酸配列MGKSEGPVGを含む。好ましくは、このアミノ酸配列MGKSEGPVGは、そのポリペプチドのアミノ末端にまたはその付近にある。
【0071】
好ましくは、上記のポリペプチドをエンコードしているポリヌクレオチドは、ヌクレオチド配列ATGGGGAAGTCCGAAGGCCCCGTGGGGを含む。好ましくは、このヌクレオチド配列ATGGGGAAGTCCGAAGGCCCCGTGGGGは、そのポリヌクレオチドの5’末端にまたはその付近にある。
【0072】
本発明は更に、上記のポリペプチドに対する抗体を提供する。
本発明は、また更に、上記のポリペプチドをモジュレートする化合物を提供する。好ましくは、この化合物は、そのポリペプチドを阻害するまたは選択的に阻害する。
【0073】
本発明が更に提供するのは、医薬組成物であって、上記の抗体または化合物および1種類またはそれを越える薬学的に許容しうる担体、希釈剤または賦形剤を含む医薬組成物である。
【0074】
本発明のもう一つの側面により、上記のポリペプチドに結合するおよび/またはそれをモジュレートする候補モジュレーターを識別する方法であって、このポリペプチドを候補モジュレーターと接触させ、そしてモジュレーションが起こるかどうか確かめることを含む方法を提供する。
【0075】
好ましくは、この方法は、
(a)(i)上記のポリペプチドの基質ペプチドと(ii)上記のポリペプチドとを、(iii)上記のポリペプチドの候補モジュレーターの存在下で接触させ、ここにおいて、この基質ペプチドは、上記のポリペプチドによるこの基質ペプチドの切断に応答して検出可能なシグナルを与えることができ;そして
(b)上記のポリペプチドによるこの基質ペプチドの切断が、この候補モジュレーターによってモジュレートされたか否かを、この基質ペプチドに関連したこの検出可能なシグナルの存在または不存在を検出することによって確かめる;
ことを含む。
【0076】
好ましくは、この候補モジュレーターは候補阻害剤である。より好ましくは、この基質ペプチドを、少なくとも1種類の蛍光ドナー色素および少なくとも1種類の蛍光アクセプター色素で標識し、そして上記のポリペプチドの候補阻害剤を検出するのに用いられる検定は、蛍光共鳴エネルギー移動(fluorescence resonance energy transfer)(FRET)検定である。最も好ましくは、この標識された基質ペプチドは、ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSYTM−7)−βAla−NH2である。
【0077】
したがって、本発明の好ましい側面により、上記のポリペプチドに結合するおよび/またはそれを阻害する候補阻害剤を識別する方法であって、
(a)(i)上記のポリペプチドの基質ペプチドと(ii)上記のポリペプチドとを、(iii)上記のポリペプチドの候補阻害剤の存在下で接触させ、ここにおいて、この基質ペプチドは、上記のポリペプチドによるこの基質ペプチドの切断に応答して検出可能なシグナルを与えることができ;そして
(b)上記のポリペプチドによるこの基質ペプチドの切断が、この候補阻害剤によって阻害されたか否かを、この基質ペプチドに関連したこの検出可能なシグナルの存在または不存在を検出することによって確かめる;
ことを含む方法を提供する。
【0078】
好ましくは、この基質ペプチドを、少なくとも1種類の蛍光ドナー色素および少なくとも1種類の蛍光アクセプター色素で標識し、そして上記のポリペプチドの候補阻害剤を検出するのに用いられる検定は、蛍光共鳴エネルギー移動(FRET)検定である。最も好ましくは、この標識された基質ペプチドは、ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSYTM−7)−βAla−NH2である。
【0079】
このSEP FRET検定は、NEPと一緒の使用について、Carvalho et al によって開発された検定に基づいている(Carvalho et al., Annal. Biochem. 237, pp.167−173 (1996))。SEP FRET検定は、類似した分子内消光蛍光原性ペプチド基質(similar intramolecularly quenched fluorogenic peptide substrate)を利用するが、蛍光原性ドナー/アクセプター色素の新規な組合せ、具体的には、ローダミングリーン(Molecular Probes, Inc., Eugene, OR, USA)およびQSYTM−7(以下、“QSY−7”または“QSY7”と記す;Molecular Probes, Inc.)を利用する。
【0080】
合成標識基質ペプチドローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2の製造は、実施例部分(以下)に詳述する。
【0081】
本発明の別の側面により、上記のポリペプチドに結合するおよび/またはそれをモジュレートする候補モジュレーターを識別する方法であって、このポリペプチドを候補モジュレーターと接触させ、そしてモジュレーションが起こるかどうか確かめることを含み、
(a)上記のポリペプチドを分泌する細胞と候補モジュレーターを接触させ、このポリペプチドは、このポリペプチドへの候補モジュレーターの結合に関して検出可能なシグナルを与えることができる第二成分に結合していて;この接触は、このポリペプチドに候補モジュレーターを結合させるのに充分な条件下であり;そして
(b)ポリペプチドを結合することができる候補モジュレーターを、この第二成分によって生じるシグナルを検出することによって識別する;
ことを含む方法を提供する。
【0082】
更に、この方法は、
(a)(i)上記のポリペプチドに結合することが知られている検出可能な第一成分および(ii)候補モジュレーターを、上記ポリペプチドを分泌する細胞と接触させ、このポリペプチドは、このポリペプチドへの候補モジュレーターの結合に関して検出可能なシグナルを与えることができる第二成分に結合していて;この接触は、このポリペプチドに候補モジュレーターを結合させるのに充分な条件下であり;そして
(b)この第一成分がポリペプチドに結合するかどうかを、このポリペプチドと第一成分の相互作用により生じるシグナルの不存在またはそれ以外の場合を検出することによって確かめる;
ことを含む。
【0083】
上の方法のいずれかによって識別される候補モジュレーターは、好ましくは、上記のポリペプチドに結合するおよび/またはそれを阻害する、すなわち、好ましくは、候補阻害剤である。
【0084】
さらなるの側面において、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDを処置するのに用いることができる試剤(以下、SEP阻害剤またはSEPiと称する)を識別するための検定方法であって、ある試験薬が、内因性性器充血過程または勃起過程を直接的に増進することができるかどうか決定することを含み;ここにおいて、この増進は、本明細書中に定義の試験薬の存在下における性器血流または空洞内血圧(ICP)(および/または空洞血流)の増強として定義され;試験薬によるこのような増強は、この試験薬が、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置において有用でありうるということを示すものであり、そしてここにおいて、この試験薬がSEPiである検定方法に関する。
【0085】
例として、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDを処置するための、内因性性器興奮または勃起過程を直接的に増進することができる試剤を識別するための検定方法であって、ペプチド(好ましくは、ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2のような蛍光標識ペプチド)の代謝分解を阻害することができる部分を有する試験薬を接触させ、このペプチドは、通常はSEPによって代謝され;そして一定時間後に残っているペプチドの活性および/またはレベルを(例えば、蛍光定量分析によって)測定することを含み;ここにおいて、蛍光によって測定されるペプチドレベルの変化は、この試験薬の効力(IC50)を示し、且つこの試験薬が、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置において有用でありうるということを示すものであり;そしてここにおいて、この試剤がSEPiである検定方法に関する。
【0086】
さらなるの側面において、本発明は、(a)本発明による検定を実施し;(b)内因性性器興奮過程または勃起過程を直接的に増進することができる1種類またはそれを越える試剤を識別し;そして(c)一定量のそれら識別された1種類またはそれを越える試剤を製造する工程を含み;そしてここにおいて、この試剤がSEPiである方法に関する。
【0087】
この側面について、工程(b)で識別された試剤は、例えば、活性を最大限にするように修飾されてよく、その後、工程(a)を繰り返してよい。これら工程は、所望の活性または薬物動態学的プロフィールが得られるまで繰り返してよい。
【0088】
したがって、さらなる側面において、本発明は、(a1)本発明の検定を実施し;(b1)内因性性器興奮過程または勃起過程を直接的に増進することができる1種類またはそれを越える試剤を識別し;(b2)この識別された1種類またはそれを越える試剤を修飾し;(a2)場合により、工程(a1)を繰り返し;そして(c)一定量のそれら識別された1種類またはそれを越える試剤(すなわち、修飾されたもの)を製造する工程を含み;そしてここにおいて、この試剤がSEPiである方法に関する。
【0089】
上記のいずれかの検定(またはその変法)を用いて識別されるいずれかの候補モジュレーター、候補阻害剤、候補選択的阻害剤、試剤(以下、SEP阻害剤またはSEPiと称する)等も、本発明の側面と考えられるということは理解されるはずである。
【0090】
したがって、本発明は、上記の方法(検定)のいずれか一つによって識別される候補モジュレーター、候補阻害剤、候補選択的阻害剤または試剤を提供する。
エンドペプチダーゼは、特に、生物活性ペプチド活性を調節すること(例えば、ペプチド作用性シグナリング過程)に関与しているので、エンドペプチダーゼのモジュレーター(例えば、選択的阻害剤を含めた阻害剤)は、このような活性をモジュレートする場合に用いることができる。
【0091】
ECE−1のようないくつかのエンドペプチダーゼは、生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解に関与している。したがって、エンドペプチダーゼのモジュレーター(例えば、選択的阻害剤を含めた阻害剤)は、このような活性をモジュレートする場合に用いることができる。
【0092】
ヒトSEPは、したがって、生物活性ペプチド活性を調節することおよび/または生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解に関与することがありうる。
【0093】
したがって、本発明は、医薬として用いるための、上記のポリペプチドをモジュレートする抗体、化合物または組成物を提供する。このポリペプチドの阻害剤または選択的阻害剤として作用することができるこのような抗体、化合物または組成物は、したがって、ペプチド作用性シグナリング過程をモジュレートすることのような生物活性ペプチド活性を調節する側面に関する治療的分野においておよび/または生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解において用いることができる。このような治療的に有用な分野には、性的機能不全(例えば、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MED)、妊孕性障害、アルツハイマー病および発作のような神経変性障害、高血圧症のような心臓血管疾患、創傷治癒/組織修復等が含まれるが、これらに制限されるわけではない。
【0094】
したがって、医薬として用いるための上記の抗体、化合物または組成物も提供する。
更に、上記のポリペプチドをモジュレートする必要がある患者の予防および/または処置での薬剤の製造における上の化合物の使用を提供する。
【0095】
更に、上記のポリペプチドを阻害するまたは選択的に阻害する必要がある患者の予防および/または処置での薬剤の製造における上の化合物の使用を提供する。好ましくは、上の化合物のこの使用は、性的機能不全の予防および/または処置用の薬剤の製造の場合である。より好ましくは、この性的機能不全は、男性勃起機能不全(MED)または女性性的機能不全(FSD)である。最も好ましくは、この女性性的機能不全(FSD)は女性性的興奮障害(FSAD)である。
【0096】
本発明のまた更にもう一つの側面により、上記のポリペプチドをモジュレートする必要がある患者の予防および/または処置の方法であって、この患者に治療的有効量の上記の化合物を投与することを含む方法を提供する。
【0097】
更に、上記のポリペプチドを阻害するまたは選択的に阻害する必要がある患者の予防および/または処置の方法であって、この患者に治療的有効量の上記の化合物を投与することを含む方法を提供する。
【0098】
また更に、患者の性的機能不全の予防および/または処置の方法であって、この患者に治療的有効量の上記の化合物を投与することを含む方法を提供する。好ましくは、この性的機能不全は、男性勃起機能不全(MED)または女性性的機能不全(FSD)である。より好ましくは、この女性性的機能不全(FSD)は女性性的興奮障害(FSAD)である。
【0099】
好ましくは、この化合物はポリペプチドであり、この化合物の治療的有効量は、この化合物をエンコードしている且つこの化合物を in vivo で発現するDNAを患者に与えることによって投与される。より好ましくは、この化合物はポリペプチド阻害剤であり、モジュレーションは、上記のポリペプチドの阻害または選択的阻害である。
【0100】
本発明によって更に提供されるのは、上記のポリペプチドをモジュレートする必要がある患者の予防および/または処置用の薬剤の製造における上記の抗体の使用である。好ましくは、このモジュレーションは、上記のポリペプチドの阻害または選択的阻害である。好ましくは、この予防および/または処置は、性的機能不全についてである。より好ましくは、この性的機能不全は、男性勃起機能不全(MED)または女性性的機能不全(FSD)である。最も好ましくは、この女性性的機能不全(FSD)は女性性的興奮障害(FSAD)である。
【0101】
本発明によって更に、上記のポリペプチドをモジュレートする必要がある患者の予防および/または処置の方法であって、この患者に治療的有効量の上記の抗体を投与することを含む方法を提供する。好ましくは、このモジュレーションは、上記のポリペプチドの阻害または選択的阻害である。好ましくは、この予防および/または処置は、性的機能不全についてである。より好ましくは、この性的機能不全は、男性勃起機能不全(MED)または女性性的機能不全(FSD)である。最も好ましくは、この女性性的機能不全(FSD)は女性性的興奮障害(FSAD)である。
【0102】
本発明の好ましい側面は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置において用いるための(または用いられている場合の)SEPi化合物およびSEPi化合物を含有する医薬組成物に関する。この医薬組成物中において、SEPiは、薬学的に許容しうる担体、希釈剤または賦形剤と所望により混合されている。ここで、この組成物は(本明細書中に述べられるいずれかの他の組成物のように)、男性性的機能不全、特に、MED、または女性性的機能不全、特に、FSADの予防および/または処置で引き続き用いるために包装されていてよい。
【0103】
もう一つの側面において、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置用の薬剤(医薬組成物のような)の製造における試剤の使用に関する。
【0104】
もう一つの側面において、本発明は、女性性的機能不全、特に、FSADを患っている女性、または男性性的機能不全、特に、MEDを患っている男性を処置する方法であって、陰核および膣での内因性性器興奮/充血応答または海綿体での勃起過程を増進することができるSEPiをその女性または男性に供給することを含み;ここにおいて、このSEPiは、本明細書中の前に定義の内因性興奮/勃起過程を増進する量で存在し;このSEPiは、薬学的に許容しうる担体、希釈剤または賦形剤と所望により混合され;そしてこのSEPiは本明細書中に定義の通りである方法に関する。
【0105】
もう一つの側面において、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDを処置する方法であって、膣/陰核血流、ICPまたは空洞血流を測定することによって in vivo において(例えば、ウサギにおいて)神経刺激される内因性性器興奮過程または勃起過程をある試剤で増強することにより;ここにおいて、この試剤は、in vitro 検定法において蛍光ペプチド(本明細書中で先述された、および以下に詳述される)の代謝分解を直接的に阻害することができ;この in vitro 検定法は、本発明による検定法であり;そしてこの試剤はSEPiである方法に関する。
【0106】
もう一つの側面において、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDの予防および/または処置用の医薬組成物の製造における試剤の使用であって、ここにおいて、この試剤は、本発明の検定法によって in vitro で検定された場合に蛍光ペプチドの代謝分解を直接的に阻害することができ;そしてこの試剤はSEPiである使用に関する。
【0107】
好ましくは、本発明による男性および女性の性的機能不全、特に、MEDおよびFSADの予防および/または処置で用いるためのSEP阻害剤(SEPi)は、100nM未満、より好ましくは、50nM未満のIC50を有する。
【0108】
好ましくは、本発明によるSEP阻害剤は、中性エンドペプチダーゼNEP EC3.4.24.11およびアンギオテンシン変換酵素(ACE)に対するより30倍を越える、より好ましくは、50倍を越えるSEP選択性を有する。これは、SEPiを全身に(例えば、口より)投与した場合の心臓血管イベント(例えば、血圧の降下)の見込みを減少させる。好ましくは、SEPiは、更に、エンドセリン変換酵素(ECE)に対するより100倍を越える選択性を有する。
【0109】
SEPi化合物は、実験の項(以下)に示される教示にしたがって製造される。それらを試剤として調べ、そしてそれらが内因性勃起過程を増進するのに有用であり、それによってMEDおよびFSADの予防および/または処置において有用であることが判明した。
【0110】
いずれの特定の理論にも制限されることなく、本明細書中において、SEPを阻害することにより、性的興奮中に放出される、ニューロンによって放出される他の血管作用薬(おそらくは、血管作用性腸管タンパク質(VIP))が増進するということが考えられる。SEPiの使用は、性的刺激中に放出される神経ペプチド(おそらくは、VIP)の作用を増強し、それゆえ、空洞血流を増加させることによる男性勃起機作を増強し、したがって、性器血流を増加させることによる空洞内血圧および女性の充血を増強すると考えられる。
【0111】
更に、本発明の化合物の使用は、非NO依存性NANC経路を増進することによって作用して、MEDおよびFSADを処置する、および陰茎および膣/陰核中の硝酸作用性(nitrergic)シグナリングを増強するまたは容易にすると考えられる。
【0112】
したがって、本発明の好ましい側面により、男性性的機能不全、特に、MED、または女性性的機能不全、特に、FSADの予防および/または処置用の薬剤の製造における、全身投与による(好ましくは、口による、例えば、嚥下可能錠剤またはカプセル剤、または舌下または口腔用製剤)SEPiの使用を提供する。
【0113】
本研究において、本発明者は、男性および女性の性的興奮の生理学についての強壮な再現可能モデルを開発した。このモデルは、麻酔されたウサギを用い、レーザー・ドップラー(Laser Doppler)技法を用いて空洞内血圧および性器血流を監視し、同時に、心臓血管パラメーターを常套的に記録する。本発明者は、試験薬の不存在下および存在下における骨盤神経刺激またはVIPの注入によって引き起こされる陰茎中の空洞内血圧および膣(および陰核さえも)血流の僅かな変化を測定することができる。
【0114】
本発明者は、この動物モデルが、臨床データに直接的に反映すると考えている。したがって、このモデルを用いて、空洞内血圧の増加による陰茎勃起の増進および膣または陰核血流増進を測定するなどの、例えば、MEDおよびFSADの予防および/または処置のための候補薬を研究することができる。
【0115】
したがって、さらなる側面により、本発明は、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MEDを処置することができる試剤を識別するのに用いられる動物モデルであって、麻酔された雌または雄の動物の骨盤神経の刺激後のその膣/陰核血流、空洞内血圧および/または空洞血流の変化を測定する手段を含めたその動物を含み;そしてここにおいて、その試剤はSEPiである動物モデルに関する。
【0116】
さらなる側面において、本発明は、FSADまたはMEDを処置するために内因性性器興奮過程または勃起過程を直接的に増進することができる試剤を識別する検定方法であって、本発明の動物モデルにある試剤を投与し;そして内因性性器興奮過程または勃起過程の変化を測定することを含み;ここにおいて、この変化は、定義の試験薬の存在下における動物モデルの膣/陰核血流、空洞内血圧(ICP)(および/または空洞血流)の増強として定義され;そしてその試剤はSEPiである検定方法に関する。
【0117】
さらなる側面において、本発明は、診断方法であって、女性または男性からの試料を単離し;その試料が、女性性的機能不全、好ましくは、FSAD、または男性性的機能不全、好ましくは、MEDを引き起こすような量で存在する物質を含有するかどうか決定することを含み;ここにおいて、その物質は、女性の内因性性器興奮過程または男性の海綿体の勃起過程への直接的作用を有し;しかもその物質は、ある試剤の使用によって有益な作用を得るようにモジュレートされることができ;そしてその試剤はSEPiである診断方法に関する。
【0118】
さらなる側面において、本発明は、単離された女性または男性の試料中の物質を検出する手段を含む診断用組成物またはキットであって;ここにおいて、その手段は、その試料が、女性性的機能不全、好ましくは、FSAD、または男性性的機能不全、好ましくは、MEDを引き起こす物質およびそのような量を含有するか、または性的機能不全、好ましくは、FSADまたはMEDを引き起こすような量であるかどうか決定するのに用いることができ;その物質は、内因性性器興奮過程または勃起過程への直接的作用を有し、しかもその物質は、ある試剤の使用によって有益な作用を得るようにモジュレートされることができ;そしてその試剤はSEPiである診断用組成物またはキットに関する。
【0119】
本発明のいっそうさらなる側面により、本発明のポリペプチドを過剰発現する、過少発現するまたはその標的挿入または欠失を示すように ex vivo または in vivo で遺伝子操作された細胞を提供する。好ましくは、これら in vivo で遺伝子操作された細胞は、非ヒト動物中に含まれる。
【0120】
本発明は、更に、上記のポリペプチドを生じることができる受託番号NCIMB41110として寄託された細胞およびそれに由来しうる変異体および突然変異体を提供する。
【0121】
本発明によって更に提供されるのは、上記のポリペプチドの三次元構造を解明する方法であって、(a)ポリペプチドを精製し;(b)それを結晶化し;そして(c)その構造を、特に、X線結晶学によって解明する工程を含む方法である。
【0122】
さらなる側面において、本発明は、更に、上記のポリペプチドの構造をモデリングする方法であって、(a)既知の三次元構造を有するタンパク質、特に、ロドプシンの配列と一緒にその配列をアラインメントさせ;(b)上記のポリペプチドの検出された配列差を既知の構造上にマッピングし、(c)上記のポリペプチドの相同モデルを得る工程を含む方法に関する。
【0123】
参照しやすくするために、ここで、本発明のこれらおよび更に別の側面を適当な項目タイトルで論じる。しかしながら、各項目の下での教示は、具体的な項目各々に必ずしも制限されない。
【0124】
ヒトSEP酵素
上に説明したように、本発明は、ヒト可溶性分泌エンドペプチダーゼ(ヒトSEP)と称された新規なエンドペプチダーゼ酵素、およびそれをエンコードしているヌクレオチド配列に関する。本発明は、更に、疾患の診断および予防および/または処置におけるそれら新規な核酸配列およびアミノ酸配列の使用に関する。本発明は、更に、エンドペプチダーゼ活性をモジュレートする(好ましくは、阻害するまたは選択的に阻害する)ことができる試剤を評価するおよび/またはスクリーニングするための、それら新規な核酸配列およびアミノ酸配列の使用に関する。本発明は、更に、エンドペプチダーゼ活性をモジュレートする(好ましくは、阻害するまたは選択的に阻害する)ことができる試剤を評価するおよび/またはスクリーニングするための、それら新規な核酸配列およびアミノ酸配列を含むまたは発現する遺伝子操作された宿主細胞に関する。
【0125】
ヒトSEPは、いろいろな源に存在し、およびそれらから入手可能であると考えられる。
例として、ヒトSEPは、心臓血管系、神経系、内分泌系および精巣のいずれか一つまたはそれを越えるものに見出される。
【0126】
本発明者は、更に、SEPが多数の他の源、例えば、齧歯類動物(ネズミ(Ikeda et al., Journal Biological Chemistry, Vol 274,1999,pp.32469−32477)およびラット(NEP II−国際特許出願WO99/53077号))、ウシ、ヒツジ、ブタおよびウマなどにも存在すると考えている。
【0127】
ヒトSEPは、天然に存在する形と同じであってよいが、この側面について、好ましくは、ヒトSEPは、非天然アミノ酸配列である(すなわち、それは、その自然環境中に存在しない)、またはその変異体、ホモログ、フラグメントまたは誘導体である。更に、または代わりに、ヒトSEPは、単離されたヒトSEPおよび/または精製されたヒトSEPである。ヒトSEPは、天然であろうとなかろうと、いずれか適当な源から入手可能でありうるしまたはそれによって生じうるし、またはそれは、合成、半合成またはリコンビナントであってよい。
【0128】
ヒトSEPコーディング配列は、天然に存在する形と同じであってよいが、この側面について、好ましくは、ヒトSEPコーディング配列は、非天然ヌクレオチド配列である(すなわち、それは、その自然環境中に存在しない)、またはその変異体、ホモログ、フラグメントまたは誘導体である。更に、または代わりに、ヒトSEPコーディング配列は、単離されたヒトSEPコーディング配列および/または精製されたヒトSEPコーディング配列である。ヒトSEPコーディング配列は、天然であろうとなかろうと、いずれか適当な源から入手可能でありうるしまたはそれによって生じうるし、またはそれは、合成、半合成またはリコンビナントであってよい。
【0129】
ヒトSEP活性およびスクリーニング
ヒトSEPおよび/またはそのコーディング配列および/またはそれにハイブリッド形成することができる配列は、異なったSEP間の薬物候補の選択性を調べるのに有用である。
【0130】
ヒトSEPは、種々の生物活性ペプチドを加水分解する(タンパク質分解する)ことができると考えられる。
ヒトSEPmRNAは、他の組織と比較して精巣中で最も量が多いということが(本明細書中で)示されている。これは、マウスSEPについて公表されたデータ(Ghaddar et al., Biochemical Journal, Vol 347,2000,pp.419−429)と一致し、この場合のmRNAは、更に、円形および細長い精子細胞に局在している。
【0131】
多様な異なるタンパク質分解活性が、以前に精巣中で識別されたが、ある場合には、それらは、精巣機能に本質的であることが分かっている(例えば、ACE活性)。この組織中におけるその豊富さから、SEPの一つの可能な生理学的役割は、精巣の機能に関連していると考えられる(例えば、妊孕性)。
【0132】
ヒトSEPは、精巣の妊孕性または別の機能の側面に関与している精巣中の特定の生理学的に重要な生物ペプチドを加水分解して、そのペプチドを活性化するかまたは失活させることができる。この(予想される)生理学的ペプチドの正確な性状は、まだ確認されていない。しかしながら、SEPは、ビッグエンドセリン、エンドセリン−1、アンギオテンシン−I、サブスタンスP、ブラジキニン、エンケファリンおよび心房性ナトリウム利尿ペプチド(ANP)を含めた多数の生物ペプチドを加水分解することができる。これらのいくつかは、精巣中で機能することが知られている。エンドセリン−1は、例えば、精巣中で見出されるが、そこにおいてそれは、精細管収縮性を促すのに関与している。興味深いことに、エンドセリン−1をビッグエンドセリンから生じると考えられる精巣内で検出されるその酵素活性(ECE)は、阻害剤ホスホラミドンおよびチオルファンに感受性である。マウスSEPおよびおそらくはヒトSEPも、これら阻害剤に感受性であるので、この活性は、ECEよりもむしろSEPに関連しているかもしれない。ヒトSEP活性を阻害する化合物は、したがって、精巣内エンドセリンレベルを変化(増加または減少)させることがあり、これは、不妊症の予防および/または処置にまたは男性用避妊薬として潜在的に有用でありうる。
【0133】
血管作用性腸管ペプチド(VIP)は、精巣中で役割を果たすもう一つの潜在的ヒトSEP基質である。VIPは、精巣中の血流を増加させ、そして更に、精巣ステロイド合成並びにヒト精子運動性を促すことが分かっている(Siow et al, Archives of Andrology, Vol 43,1999,p.6771)。ヒトSEP活性を阻害する薬物は、精巣中のVIPレベルを、したがって、精巣血流、ステロイド合成または精子運動性をモジュレートするのに有用でありうる。
【0134】
ヒトSEP mRNAは、精巣中で最も量が多いが、それは、逆転写酵素−ポリメラーゼ連鎖反応(RT−PCR)の敏感な方法を用いて、種々の組織中でのより低いレベルを検出することもできる。マウスの場合、SEPは、心臓、脳、脾臓、肺、腎臓、腸および副腎で検出されている。本明細書中において完全長ヒトSEP cDNA配列を単離するのに用いられたcDNAライブラリースクリーニングアプローチも、ヒトの脳、胎盤、小腸および腎組織に由来するライブラリー中でヒトSEP cDNAを識別した。
【0135】
ヒトSEP酵素は、細胞から分泌されることもありうる。したがって、ヒトSEPタンパク質は、精巣中で量が多いことに加えて、身体中の広範囲の他の組織中でも中程度のレベルで見出されるであろうと考えられる。これら組織中において、ヒトSEPは、上述の生物ペプチド基質を加水分解するであろうと考えられる。
【0136】
したがって、SEPの酵素活性を阻害する薬物は、種々の異なった組織中での上述の多数のヒトSEP基質のレベルを変化させるであろうと考えられる。これらヒトSEP基質は、通常は、ペプチド作用性シグナリング過程にしばしば関連している生物学的に活性な分子またはそれらの前駆体であるので、ヒトSEP阻害剤は、性的機能不全(例えば、女性性的機能不全、特に、FSAD、または男性性的機能不全、特に、MED)および生殖障害、並びに、神経変性障害(例えば、アルツハイマー病および発作)および高血圧症などの心臓血管疾患等のような他の疾患/障害がおそらく含まれるがこれに制限されるわけではない、ペプチド作用性シグナリングに関連した多数の異なった障害の予防および/または処置に有用でありうると考えられる。
【0137】
したがって、ヒトSEPおよび/またはそのコーディング配列および/またはそれにハイブリッド形成することができる配列は、ペプチド作用性シグナリングに関連した疾患の予防および/または処置用の薬物候補をスクリーニングするのに有用でありうる。更に、ヒトSEPおよび/またはそのコーディング配列および/またはそれにハイブリッド形成することができる配列は、上記の記載のような疾患の予防および/または処置用の薬物候補をスクリーニングするのに有用でありうると考えられる。
【0138】
ヒトSEPをコードしているヌクレオチド配列またはヒトSEP酵素自体のどちらかまたは両方を用いて、SEP活性に影響を与えることができる試剤についてスクリーニングすることができる。具体的には、ヒトSEPをコードしているヌクレオチド配列自体を用いて、SEP活性を阻害することができる試剤についてスクリーニングすることができる。更に、ヒトSEPをコードしているヌクレオチド配列またはヒトSEP酵素自体を用いて、SEP活性を選択的に阻害するようにSEP活性に選択的に影響を与える試剤についてスクリーニングすることができる。
【0139】
ヒトSEP活性の測定−ヒトSEP検定
ヒトSEPタンパク質の酵素(タンパク質分解)活性は、例えば、ヒトSEP酵素の試料と基質ペプチドとを緩衝液(例えば、50mM HEPES;pH7.4)中で混合し、その混合物を、SEP活性に適当な温度(典型的には、30〜37℃)で、ヒトSEPが作用してペプチド基質の測定可能な部分を生成物に切断するのに充分な一定時間(1〜3時間など)インキュベートすることを含む検定で測定することができる。その後、タンパク質分解の基質および/または生成物を分析して、その基質がSEP酵素によって切断されたことを示すことができる。
【0140】
ヒトSEPの活性を変化させることができるホスホラミドンおよびチオルファンのような、候補ヒトSEP阻害剤化合物または対照試験化合物の作用は、それらを初期混合物中に、典型的には、0.1nM〜50μMの適当な試験濃度の範囲で含めることによってこのタイプの検定で測定することができる。
【0141】
上のタイプの検定で用いるのに適したSEP酵素の試料は、組換え発現系を用いて生じることができる。これは、典型的には、ヒトSEP cDNAまたは遺伝子(例えば、NCIMB41110より入手可能な発現ベクター)を含有する発現プラスミドを宿主生物または細胞中に導入後、そこでヒトSEPタンパク質を発現させることを含むであろう。SEPタンパク質は、(例えば、哺乳動物細胞中で人為的に発現させる場合)その宿主から増殖培地中に放出される(すなわち、細胞外に分泌される)ことがありうるし、または細胞中に保持されることがありうる(例えば、酵母または昆虫細胞中で人為的に発現させる場合、そこでは、可能性のある不適切な発現は、ヒトSEPを細胞から分泌させないことがあり、したがって、その細胞内部位からの単離を必要とすることがありうる)。典型的には、その宿主は、酵母、昆虫細胞、哺乳動物細胞または細菌でありうる。次に、SEP酵素を、タンパク質精製法を用いる必要がありうる培地または宿主細胞から(例えば、細胞を溶解することによって)回収することができる。
【0142】
前述の検定のためのヒトSEP酵素は、(充分な量が入手可能である場合)適当な組織源から精製されてもよい。この組織には、精巣または脳が含まれうる。 ヒトSEP検定で用いるのに適した基質は、有用な一定時間内に、例えば、5時間以内に測定可能な速度でSEPが切断することができるいずれのペプチドでもありうる。このような基質ペプチドには、エンケファリン、VIP、ブラジキニン、サブスタンスP、ビッグエンドセリン、エンドセリン、アンギオテンシン−IまたはANPのような生物ペプチドと同様であるまたは類似したペプチドが含まれうるが、これらに制限されるわけではない。このペプチドは、検定前、中または後の基質および/または生成物の測定を容易にするであろう蛍光基、着色基、放射性基または他の化学基を含むように修飾されうる。
【0143】
ヒトSEP検定で用いるのに適した好ましい基質は、少なくとも1種類の蛍光ドナー色素および少なくとも1種類の蛍光アクセプター色素で標識されたSEP切断可能合成ペプチドであり、このSEP切断(タンパク質分解)の阻害を検出するのに用いられる検定は、蛍光共鳴エネルギー移動(FRET)検定である。最も好ましくは、この標識された基質ペプチドは、低分子量蛍光原性ペプチド、好ましくは、ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2である。
【0144】
このようなFRETに基づくSEP検定は、NEPと一緒の使用について、Carvalho et al によって開発された検定に基づいている(Carvalho et al., Annal.Biochem. 237,pp.167−173(1996))。SEP FRET検定は、類似の分子内消光蛍光原性ペプチド基質を利用するが、蛍光原性ドナー/アクセプター色素の新規な組合せ、具体的には、ローダミングリーン(Molecular Probes,Inc.)およびQSY7(Molecular Probes,Inc.)を利用する。
【0145】
合成標識基質ペプチドローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2の製造を、実施例の項(以下)に詳述する。
【0146】
ヒトSEP検定で用いるのに適した緩衝液は、その中でヒトSEPが活性であることが判明していて、それ以外には、検定の最終結果の妨げにならないもののいずれかでありうる。通常は、これは、中性pHを維持する緩衝液であろう。このような緩衝液の一例は、50mMトリスCl;pH7.4である。しかしながら、このような緩衝液は、トリスが、温度変動のためにpHを極めて変化させやすいので、ヒトSEP FRET検定で用いるのに好ましくない。したがって、ヒトSEP FRET検定で用いるのに好ましい緩衝液は、50mM HEPES;pH7.4である。
【0147】
ヒトSEP検定での基質および/または生成物の測定方法は、選択されるペプチド基質およびその修飾の性状に依存するであろう。例えば、選択される基質が蛍光基を含有する場合、蛍光計を用いることができる。同様に、基質が放射性標識されている場合、シンチレーション計数計を用いてよい。大部分の基質および生成物は、高速液体クロマトグラフィー(HPLC)または質量分析法を用いて測定することができ、これらは、その基質が放射性標識または蛍光標識を含むように修飾されなかった場合に選択される方法であると考えられる。
【0148】
更に、ヒトSEPをコードしているヌクレオチド配列またはそれに相補的である配列も、検定において、ヒト細胞中のヒトSEPコーディング配列の存在を検出するのに用いることができる。これら検定は、この酵素の組織分布および特定の疾患状態に関するその生物学的妥当性についての情報を提供すると考えられる。
【0149】
本発明は、ヒトSEP(その誘導体、フラグメント、ホモログまたは変異体を含めた)に対する抗体も包含する。ヒトSEPに対する抗体は、検定において、ヒト細胞中のヒトSEPの存在を検出するのに用いることができる。これら検定は、この酵素の組織分布および特定の疾患状態に関するその生物学的妥当性についての情報を提供すると考えられる。
【0150】
本発明は、更に、ヒトSEP配列のスプライス変異体(イソ酵素)を包含する。具体的には、ヒトSEPイソ酵素、それをコードしているヌクレオチド配列、それに相補的であるヌクレオチド配列、およびそれに向けられた抗体のいずれか一つまたはそれを越えるものを検定で用いて、それらイソ酵素の一つに選択的に影響を与える試剤についてスクリーニングすることができる。これら検定は、これらイソ酵素各々の組織分布についての情報を提供し且つ特定の疾患状態に関するこれらイソ酵素各々の生物学的妥当性についての情報を提供すると考えられる。これら検定は、更に、当業者が、特定の組織または特定の疾患状態などにおいて、ヒトSEPの発現または活性に影響を与えるのに有用な試剤について調べ且つそれを識別することを可能にすると考えられる。
【0151】
本発明のポリペプチド
“タンパク質”という用語と同じ意味である“ポリペプチド”という用語には、一本鎖ポリペプチド分子、並びに個々の構成ポリペプチドが共有または非共有手段によって連結されている多重ポリペプチド複合体が含まれる。
【0152】
好ましくは、本発明のポリペプチドは、一本鎖ポリペプチドである。
本発明のポリペプチドは、実質的に単離された形であってよい。このポリペプチドは、ポリペプチドの予定の目的を妨げることがない担体または希釈剤と混合されてよいし、なお実質的に単離されたとみなされてよいということは理解されるであろう。本発明のポリペプチドは、実質的に精製された形であってもよく、この場合、それは、概して、標品中の90%を越える、例えば、95%、98%または99%のポリペプチドが本発明のポリペプチドである標品中のポリペプチドを構成するであろう。本発明のポリペプチドは、それらの精製を助けるように、例えば、ヒスチジン残基の付加によって修飾されてよい。
【0153】
本発明のポリペプチドは、下記のように、合成手段によって(例えば、Geysen et al., 1996 によって記載のように)または組換えによって生じることができる。
【0154】
好ましい態様において、本発明のアミノ酸配列は、それがその自然環境中にある場合、およびそれが、その自然環境中にもあるその天然のヌクレオチドコーディング配列によって発現されている場合、およびそのヌクレオチド配列が、その自然環境中にもあるその天然のプロモーターの制御下にある場合、それ自体では本発明の天然のヒトSEPを包含しない。参照しやすくするために、本発明者は、この好ましい態様を“非天然アミノ酸配列”と称している。
【0155】
本発明の酵素のアミノ酸配列に関する、“変異体”、“ホモログ”、“誘導体”または“フラグメント”という用語には、その配列からのまたはその配列への一つの(またはそれを越える)アミノ酸のいずれかの置換、変異、修飾、交換、欠失または付加が含まれるが、但し、得られた酵素はSEP活性を有する、好ましくは、添付の配列番号:2に示される酵素と少なくとも同程度に生物学的に活性であるという条件付きである。具体的には、“ホモログ”という用語は、構造および/または機能に関する相同性を包含する。配列相同性に関して、好ましくは、配列番号:2に示される配列に、少なくとも78%、より好ましくは、少なくとも85%、より好ましくは、少なくとも90%の相同性が存在する。より好ましくは、配列番号:2に示される配列に、少なくとも95%、より好ましくは、少なくとも98%の相同性が存在する。
【0156】
典型的には、本発明の変異体、ホモログ、誘導体またはフラグメントについて、行われうるアミノ酸置換のタイプは、そのアミノ酸配列の疎水性/親水性を維持すべきである。アミノ酸置換は、例えば、1、2または3〜10、20または30の置換が行われてよいが、但し、その修飾された配列は、本発明によるSEP酵素として作用する能力を保持しているという条件付きである。アミノ酸置換には、例えば、血漿半減期を増加させるための、天然に存在しない類似体の使用が含まれてよい。
【0157】
本発明のアミノ酸配列は、適当な発現系におけるそれをコードしているヌクレオチド配列の発現によって生じることができる。
更に、または代わりに、タンパク質自体は、化学的方法を用いて、ヒトSEPアミノ酸配列を全部または一部分合成して生じうると考えられる。例えば、ペプチドは、固相法によって合成し、樹脂から切断し、そして分取用高性能液体クロマトグラフィーによって精製することができる(例えば、Creighton (1983) Proteins Structures and Molecular Principles, WH Freeman and Co., New York, NY, USA)。これら合成ペプチドの組成は、アミノ酸配列分析またはシークエンス法(例えば、エドマン分解法)によって確認することができる。
【0158】
直接ペプチド合成は、種々の固相法を用いて行うことができ(Roberge JY et al, Science, Vol 269,1995,pp.202−204)、自動合成は、例えば、ABI431A Peptide Synthesizer(Perkin Elmer, Boston, MA, USA)を用いて、製造者によって提供される取扱い説明書にしたがって行ってよい。更に、ヒトSEPのアミノ酸配列またはそのいずれか一部分は、直接合成中に変更されてよいしおよび/または化学的方法を用いて、他のサブユニットからの配列またはそのいずれか一部分と一緒に組み合わされて、変異ポリペプチドを生じてよい。
【0159】
本発明のもう一つの態様において、ヒトSEPの天然の、修飾されたまたは組換えの配列は、異種配列に連結されて、融合タンパク質をエンコードすることができる。例えば、SEP活性の阻害剤のペプチドライブラリーのスクリーニングについて、それは、市販の抗体によって認識される異種エピトープを発現するキメラSEPタンパク質をエンコードするのが有用でありうる。融合タンパク質は、SEP配列とその異種タンパク質配列との間に位置する切断部位を含有するように遺伝子操作することもできるので、そのSEPは、異種部分から切断され且つ精製されることができる。
【0160】
ヒトSEPは、タンパク質精製を容易にするように加えられた一つまたはそれを越える追加のポリペプチドドメインを含む組換えタンパク質として発現されてもよい。このような精製を容易にするドメインには、固定化金属上での精製を可能にするヒスチジン−トリプトファンモジュールのような金属キレートペプチド(Porath J, Protein Expr.Purif., Vol 3,1992,pp.263−281)、固定化免疫グロブリン上での精製を可能にするプロテインAドメイン、およびFLAGS伸長/アフィニティー精製システム中で利用されるドメイン(Immunex Corp, Seattle, WA, USA)が含まれるが、これらに制限されるわけではない。この精製用ドメインとSEPとの間のXA因子またはエンテロキナーゼ(Invitrogen, San Diego, CA, USA)のような切断可能リンカー配列の包含は、精製を容易にするのに有用である。
【0161】
ヒトSEPの特定のアミノ酸配列を、配列番号:2に示す。しかしながら、本発明は、その特定のアミノ酸配列に少なくとも78%の同一性(より好ましくは、少なくとも85%の同一性)を有するアミノ酸配列が含まれると考えられるSEPファミリーからの他のメンバーをエンコードしているアミノ酸配列を包含する。
【0162】
本発明のポリペプチドには、本アミノ酸配列のフラグメントおよびそれらの変異体も含まれる。適当なフラグメントは、少なくとも5、例えば、少なくとも10、12、15または20アミノ酸のサイズであろう。
【0163】
本発明のポリペプチドは、保存置換を含めた一つまたはそれを越える(例えば、少なくとも2、3、5または10の)置換、欠失または挿入を含有するように修飾されてもよい。これら側面を、後の項で考察する。
【0164】
本発明のヌクレオチド配列
本明細書中で用いられる“ヌクレオチド配列”という用語は、オリゴヌクレオチド配列またはポリヌクレオチド配列、および(その一部分などの)その変異体、ホモログ、フラグメントおよび誘導体を意味する。このヌクレオチド配列は、センス鎖であれアンチセンス鎖であれ、二本鎖または一本鎖であってよいゲノムまたは合成またはリコンビナント由来であってよいDNAまたはRNAでありうる。
【0165】
好ましくは、“ヌクレオチド配列”という用語はDNAを意味する。
より好ましくは、“ヌクレオチド配列”という用語は、組換えDNA技術の使用によって製造されるDNA(すなわち、組換えDNA)を意味する。
【0166】
好ましい態様において、本発明のヌクレオチド配列は、それが、その自然環境中にもあるその天然のプロモーターの制御下にある場合、それ自体ではその自然環境中にある本発明の天然のヌクレオチドコーディング配列を包含しない。参照しやすくするために、本発明者は、この好ましい態様を“非天然ヌクレオチド配列”と称している。
【0167】
本発明のヌクレオチド配列は、それらの中に、合成または修飾ヌクレオチドを含んでよい。オリゴヌクレオチドへの多数の異なったタイプの修飾が当該技術分野において知られている。これらには、メチルホスホネートおよびホスホロチオエート主鎖、分子の3’および/または5’末端におけるアクリジンまたはポリリシン鎖の付加が含まれる。本発明の目的について、本明細書中に記載のヌクレオチド配列を、当該技術分野において利用可能ないずれの方法によっても修飾することができるということは理解されるはずである。このような修飾は、本発明のヌクレオチド配列の in vivo 活性または寿命を増進させるように行うことができる。
【0168】
本発明は、更に、本明細書中に示される配列に相補的であるヌクレオチド配列、またはいずれのそれらの誘導体、フラグメントまたは変異体も包含する。配列がそのフラグメントに相補的である場合、その配列は、他の生物等における類似のコーディング配列を識別するプローブに用いることができる。
【0169】
本発明は、更に、本明細書中に示される配列にハイブリッド形成することができるヌクレオチド配列、またはいずれのそれらの誘導体、フラグメントまたは変異体も包含する。
【0170】
本発明は、更に、本明細書中に示される配列に相補的である配列にハイブリッド形成することができるヌクレオチド配列、またはいずれのそれらの誘導体、フラグメントまたは変異体も包含する。
【0171】
“変異体”という用語は、本明細書中に示されるヌクレオチド配列にハイブリッド形成することができる配列に相補的である配列も包含する。
好ましくは、“変異体”という用語は、本明細書中に示されるヌクレオチド配列に、ストリンジェント条件下(例えば、65℃および0.1xSSC{1xSSC=0.15M NaCl,0.015クエン酸Na3 pH7.0})でハイブリッド形成することができる配列に相補的である配列を包含する。
【0172】
本発明は、更に、(本明細書中に示される配列の相補的配列を含めた)本発明のヌクレオチド配列にハイブリッド形成することができるヌクレオチド配列に関する。
【0173】
本発明は、更に、(本明細書中に示される配列の相補的配列を含めた)本発明のヌクレオチド配列にハイブリッド形成することができる配列に相補的であるヌクレオチド配列に関する。
【0174】
本発明の範囲内に更に含まれるのは、本明細書中に示されるヌクレオチド配列に、中間〜最大のストリンジェンシー条件下でハイブリッド形成することができるポリヌクレオチド配列である。
【0175】
好ましい側面において、本発明は、本発明のヌクレオチド配列またはその相補鎖に、ストリンジェント条件下(例えば、65℃および0.1xSSC)でハイブリッド形成することができるヌクレオチド配列を包含する。
【0176】
典型的な核酸は、他に、ヒトSEPタンパク質をエンコードし、および配列番号:1または配列番号:5に示されるDNA配列にハイブリッド形成するヌクレオチド配列として特徴付けることができる。好ましいのは、配列番号:1または配列番号:5に示される配列またはその相補鎖に高ストリンジェンシー条件下でハイブリッド形成するヒトSEPをエンコードしているような配列である。
【0177】
好都合には、本発明は、配列番号:1または配列番号:5に示される配列またはその相補鎖のフラグメントにストリンジェント条件下でハイブリッド形成することができる核酸配列を提供する。好ましくは、そのフラグメントは、15〜50塩基の長さである。好都合には、それは約25塩基の長さである。
【0178】
本発明の好ましい酵素をコードしているヌクレオチド配列に関して、“変異体”、“ホモログ”、“誘導体”または“フラグメント”という用語には、その配列からのまたはその配列への一つの(またはそれを越える)核酸のいずれかの置換、変異、修飾、交換、欠失または付加が含まれるが、但し、得られたヌクレオチド配列は、SEP活性を有する、好ましくは、配列番号:1または配列番号:5に示される配列によってエンコードされた酵素と少なくとも同程度に生物学的に活性である酵素をコードするまたはコードすることができるという条件付きである。具体的には、“ホモログ”という用語は、構造および/または機能に関する相同性を包含するが、但し、得られたヌクレオチド配列は、SEP活性を有する酵素をコードするまたはコードすることができるという条件付きである。配列相同性に関して、好ましくは、配列番号:2に示されるアミノ酸配列をコードしているヌクレオチド配列に、少なくとも83%、より好ましくは、少なくとも85%、より好ましくは、少なくとも90%の相同性が存在する。より好ましくは、配列番号:2に示されるアミノ酸配列をコードしているヌクレオチド配列に、少なくとも95%、より好ましくは、少なくとも98%の相同性が存在する。配列相同性に関して、好ましくは、配列番号:1または配列番号:5に示される配列に、少なくとも83%、より好ましくは、少なくとも87%、より好ましくは、少なくとも90%の相同性が存在する。より好ましくは、配列番号:1または配列番号:5に示される配列に、少なくとも95%、より好ましくは、少なくとも98%の相同性が存在する。
【0179】
示されるように、本発明は、ヒトSEPをエンコードしているDNA配列(好ましくは、cDNA配列)に関する。具体的には、本発明は、ヒトSEPをエンコードしているcDNA配列に関する。
【0180】
本発明は、更に、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含むDNAセグメントに関する。
本発明は、更に、前述のDNA配列またはそれらの対立遺伝子変異が包含された宿主細胞中での発現によって生じるポリペプチドに関する。
【0181】
本発明は、更に、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含むDNAに関し、それを提供する。
本発明は、更に、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含む非天然DNAに関する。
【0182】
本発明の極めて好ましい側面は、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含む組換えDNAに関する。
本発明のポリヌクレオチドには、本発明のポリペプチドをエンコードしている核酸配列が含まれる。一定範囲の異なったポリヌクレオチドが、ある与えられたアミノ酸配列を遺伝コードの縮重の結果としてエンコードするということは理解されるであろう。
【0183】
本明細書中に示されるアミノ酸配列の情報により、本発明のポリペプチドをエンコードするcDNAおよび/またはゲノムクローンなどの部分および完全長の核酸配列を案出することは可能である。例えば、本発明のポリヌクレオチドは、本明細書中に示されるアミノ酸配列をエンコードしている配列に指向するように設計されたプライマーを用いる縮重ポリメラーゼ連鎖反応(PCR)を用いて得ることができる。これらプライマーは、典型的には、多数の縮重位置を含有するであろう。しかしながら、縮重を最小限にするために、たった一つのトリプレットによってコードされるメチオニンのようなアミノ酸を含有する本明細書中に示されるアミノ酸配列の領域をエンコードする配列が選択されるであろう。更に、配列は、PCR法の鋳型DNAとしてその核酸が用いられる生物中でのコドン使用を考慮するように選択されるであろう。PCRは、既知の配列に対する単一配列(非縮重)プライマーを含む配列をクローニングするのに用いられるものより低いストリンジェンシー条件で用いられるであろう。
【0184】
次に、本発明のポリペプチドフラグメントをエンコードする、PCRによって得られた核酸配列を用いて、ハイブリダイゼーションライブラリースクリーニング技術を用いてより大きい配列を得ることができる。例えば、PCRクローンを、放射性原子で標識して、他の種、好ましくは、他の哺乳動物種からのcDNAまたはゲノムライブラリーをスクリーニングするのに用いることができる。ハイブリダイゼーション条件は、典型的には、中〜高ストリンジェンシー条件(例えば、約50℃〜約60℃において0.03M塩化ナトリウムおよび0.03Mクエン酸ナトリウム)であろう。
【0185】
アミノ酸配列の全部または一部分をエンコードしている縮重核酸プローブは、他の種、好ましくは、他の哺乳動物種からのcDNAおよび/またはゲノムライブラリーをプローブするのに用いることもできる。しかしながら、PCR法を行って、追加のスクリーニング法で用いるための単一配列を最初に得ることが好適である。
【0186】
本発明により、ヒトSEP、ポリペプチドのフラグメント、融合タンパク質またはその機能的均等物をエンコードするポリヌクレオチド配列は、適当な宿主細胞中でのヒトSEPの発現を指示する組換えDNA分子を生じるのに用いることができる。遺伝コードの固有の縮重のために、実質的に同じまたは機能的に均等なアミノ酸配列をエンコードする他のDNA配列は、ヒトSEPをクローン化し且つ発現するのに用いることができる。当業者によって理解されるように、天然に存在しないコドンを有する、ヒトSEPをエンコードしているヌクレオチド配列を生じることは好都合でありうる。特定の原核生物または真核生物宿主に好適なコドン(Murray E et al, (1989), Nuc.Acids Res., 17:477−508)は、例えば、ヒトSEP発現の速度を増加させるように、または天然に存在する配列から生じる転写物より長い半減期などの望ましい性状を有する組換えRNA転写物を生じるように選択することができる。
【0187】
上記の技法を用いて得られる本発明のポリヌクレオチド配列は、上記の技法を用いて更に別の相同配列および変異体を得るのに用いることができる。それらは、例えば、それらポリヌクレオチド配列が発現されている特定の宿主細胞についてコドン選択を最適にするように、種々の宿主細胞系において本発明のポリペプチドを発現させる場合に用いるために修飾されてもよい。他の配列変化は、制限酵素認識部位を導入するために、またはそれらポリヌクレオチドによってエンコードされるポリペプチドの性状または機能を変更するために望まれることがありうる。
【0188】
本発明によって用いることができる変更されたヒトSEPポリヌクレオチド配列には、同じまたは機能的に均等なSEPをエンコードするポリヌクレオチドを生じる異なるヌクレオチド残基の欠失、挿入または置換が含まれる。そのタンパク質は、サイレント変化を生じ且つ機能的に均等なSEPを生じるアミノ酸残基の欠失、挿入または置換を有してもよい。計画的なアミノ酸置換は、SEPの生物学的活性が保持される限りにおいて、それら残基の極性、電荷、溶解性、疎水性、親水性および/または両親媒性の性質の類似性に基づいて行われてよい。例えば、陰電荷アミノ酸には、アスパラギン酸およびグルタミン酸が含まれ;陽電荷アミノ酸には、リシンおよびアルギニンが含まれ;そして類似した親水性値を有する非荷電極性頭部基を含むアミノ酸には、ロイシン、イソロイシン、バリン、グリシン、アラニン、アスパラギン、グルタミン、セリン、トレオニン、フェニルアラニンおよびチロシンが含まれる。
【0189】
本発明の範囲内に含まれるのは、ヒトSEPの対立遺伝子である。本明細書中で用いられる“対立遺伝子”または“対立遺伝子配列”は、ヒトSEPの別の形である。対立遺伝子は、突然変異、すなわち、核酸配列の変化によって生じ、そして概して、変更されたmRNAまたはポリペプチドを生じるが、その構造または機能は変更されていてよいしまたはされていなくてよい。いずれの与えられた遺伝子も、対立遺伝子形を有しない、または一つもしくは多数有していてもよい。対立遺伝子を生じる共通の突然変異変化は、概して、アミノ酸の欠失、付加または置換による。これらの変化のタイプの各々は、ある与えられた配列中において単独でまたは他のものとの組合せで1回またはそれを超えて起こりうる。
【0190】
本発明のヌクレオチド配列は、遺伝子産物のクローニング、プロセシングおよび/または発現を修飾する変更が含まれるがこれに制限されるわけではない種々の理由でヒトSEPコーディング配列を変更するために遺伝子操作することができる。例えば、突然変異を、当該技術分野において周知である技法、例えば、部位特異的突然変異誘発を用いて導入して、新しい制限部位を挿入する、グリコシル化パターンを変更するまたはコドン選択を変化させることができる。
【0191】
本発明のポリヌクレオチドは、プライマー、例えば、PCRプライマー、代わりの増幅反応のためのプライマー、プローブであって、例えば、放射性または非放射性標識を用いて慣用的な手段によって明らかになる標識で標識されたものを生じるのに用いることができるし、またはそれらポリヌクレオチドは、ベクター中にクローン化することができる。このようなプライマー、プローブおよび他のフラグメントは、少なくとも15、好ましくは、少なくとも20、例えば、少なくとも25、30または40ヌクレオチドの長さであろうが、これらも、本明細書中で用いられる本発明のポリヌクレオチドという用語によって包含される。
【0192】
本発明のポリヌクレオチドまたはプライマーは、明らかになる標識を有してよい。適当な標識には、32Pまたは35Sのような放射性同位体、酵素標識、またはビオチンのような他のタンパク質標識が含まれる。このような標識は、本発明のポリヌクレオチドまたはプライマーに加えることができるし、当該技術分野において知られている技法によって検出することができる。
【0193】
本発明によるDNAポリヌクレオチドのようなポリヌクレオチドおよびプライマーは、組換えによって、合成によって、または当業者に利用可能ないずれの手段によっても製造することができる。それらも、標準的な技法によってクローン化することができる。
【0194】
概して、プライマーは、所望の核酸配列の一度に一つのヌクレオチドの段階的製造を含む合成手段によって製造されるであろう。自動化された技法を用いてこれを行う技法は、当該技術分野において容易に利用可能である。
【0195】
より長いポリヌクレオチドは、概して、組換え手段を用いて、例えば、PCRクローニング法を用いて製造されるであろう。これは、クローン化することが望まれるヌクレオチド配列の領域に(例えば、約15〜30ヌクレオチドの)1対のプライマーを製造し、それらプライマーを、例えば、真菌、植物または原核細胞から得られるmRNAまたはcDNAと接触させ、所望の領域の増幅をもたらす条件下でポリメラーゼ連鎖反応を行い、増幅されたフラグメントを(例えば、反応混合物をアガロースゲル上で精製することによって)単離し、そして増幅されたDNAを回収することを含むであろう。それらプライマーは、適当な制限酵素認識部位を含有するように設計することができるので、増幅されたDNAは、適当なクローニングベクター中にクローン化することができる。
【0196】
DNA分子は、細胞内安定性および半減期を増加させるように修飾されてよい。可能な修飾には、その分子の5’および/または3’末端のフランキング配列の付加、またはその分子の主鎖中でのホスホジエステラーゼ結合よりむしろホスホロチオエートまたは2’O−メチルの使用が含まれるが、これらに制限されるわけではない。
【0197】
初めの方で述べられたように、本発明は、更に、配列番号:1または配列番号:5に示される配列またはその対立遺伝子変異の全部または一部分にハイブリッド形成することができるヌクレオチド配列に関する。これらヌクレオチド配列は、アンチセンス法において、ヒトSEP発現を修飾するために用いてもよい。或いは、これら配列(またはそれらの一部分)は、プローブとして用いることができるし、またはPCRプライマーとして用いられる場合のこのような配列の全部または一部分を増幅させるのに用いることができる。
【0198】
組換えDNA配列に加えて、ゲノム配列も、薬物発見の場合に有用である。その翻訳されたタンパク質を阻害するよりもむしろ、特定のイソ型のmRNA転写を阻害することが有益でありうる。これは、スプライス変異体が存在し、それら異なったスプライス変異体が異なったプロモーターから転写されうる場合、ヒトSEPについても当てはまりうる。
【0199】
本発明のもう一つの有用性は、DNA配列が、いったん知られると、イソ酵素またはスプライス変異体を特異的に検出する検定を設計するのに必要とされる情報を与えるということである。イソ酵素特異的PCRプライマー対は、イソ酵素またはスプライス変異体の特異的DNA配列の情報に完全に依存する検定の唯一の例である。このような検定は、特定の疾患状態への各々のイソ酵素の組織分布および生物学的関係を評価するイソ酵素についてのmRNAの検出を可能にする。それは、唯一のイソ酵素を天然に発現しうる細胞系の同定、すなわち、組換え遺伝子を発現する必要性をなくするかもしれない発見も可能にする。特定のヒトSEPイソ酵素が特定の疾患状態に関連していることが示されるならば、本発明は、イソ酵素mRNAの存在を検出する診断用検定の設計において有益であると考えられる。
【0200】
ヒトSEP酵素をエンコードしているヌクレオチド配列の生体試料中での異常レベルは、核酸欠失または突然変異のような染色体異常に反映することがありうる。したがって、ヒトSEP酵素をエンコードしているヌクレオチド配列は、ヒトSEPをエンコードしている遺伝子中の欠失、突然変異または染色体転座のような染色体異常を診断用に検出するのに用いることができるプローブの基準を提供する。ヒトSEP遺伝子発現は、このような疾患状態において変更されることがありうるし、またはヒトSEPをエンコードしている遺伝子の領域中に存在する染色体異常がありうる。
【0201】
本発明の別の態様において、ヒトSEPのコーディング配列は、当該技術分野において周知の化学的方法を用いて全部または一部分合成されうる(Caruthers MH et al, (1980), Nuc. Acids Res. Symp. Ser., pp.215−223; Horn T et al, (1980), Nuc. Acids Res. Symp. Ser., pp.225−232 を参照されたい)。
【0202】
天然に存在する
本明細書中で用いられる“天然に存在する”は、天然に見出されるアミノ酸配列を含むヒトSEPに関する。
【0203】
単離された/精製された
本明細書中で用いられる“単離された”および“精製された”という用語は、核酸配列かまたはアミノ酸配列の分子であって、それらの自然環境から取り出され且つそれらが天然に関連している少なくとも一つの他の成分から単離されまたは分離される分子に関する。
【0204】
生物学的に活性な
本明細書中で用いられる“生物学的に活性な”は、天然に存在するヒトSEPの(同程度の必要はないが)類似した構造機能および/または(同程度の必要はないが)類似した調節機能および/または(同程度の必要はないが)類似した生化学的機能および/または(同程度の必要はないが)免疫学的活性を有する、組換えヒトSEPのような本発明によるヒトSEPに関する。具体的には、本発明のヒトSEPは、一定のペプチド基質をタンパク質分解によって切断する能力を有し、これは、本発明のヒトSEP酵素の特徴的な活性の一つである。
【0205】
免疫学的活性
本明細書中で用いられる“免疫学的活性”は、適当な動物または細胞中において特異的免疫応答を引き起こし且つ特異的抗体と結合する、天然の、組換えまたは合成のヒトSEPまたはそのいずれかのオリゴペプチドの能力として定義される。
【0206】
誘導体
アミノ酸配列に関して本明細書中で用いられる“誘導体”という用語には、ヒトSEPの化学修飾が含まれる。このような修飾を代表するものは、アルキル基、アシル基またはアミノ基による水素の交換であると考えられる。
【0207】
欠失
本明細書中で用いられる“欠失”は、それぞれ一つまたはそれを越えるヌクレオチドまたはアミノ酸の残基を欠いているヌクレオチド配列かまたはアミノ酸配列の変化として定義される。
【0208】
挿入/付加
本明細書中で用いられる“挿入”または“付加”は、天然に存在するヒトSEPと比較して、それぞれ一つまたはそれを越えるヌクレオチドまたはアミノ酸の残基の付加を生じているヌクレオチド配列またはアミノ酸配列の変化である。
【0209】
置換
本明細書中で用いられる“置換”は、それぞれ異なったヌクレオチドまたはアミノ酸による一つまたはそれを越えるヌクレオチドまたはアミノ酸の交換によって生じる。
【0210】
ホモログ
本発明のヌクレオチド配列および本発明のアミノ酸配列に関する“ホモログ”という用語は、それら配列の対立遺伝子変異と同意語でありうる。
【0211】
具体的には、本明細書中で用いられる“相同性”という用語は、“同一性”という用語と等しいことがありうる。ここでは、本発明のヌクレオチド配列および本発明のアミノ酸配列に関する配列相同性を、いずれか一つまたはそれを越える配列と別の配列との、その他の配列がヌクレオチド配列への少なくとも83%の同一性およびアミノ酸配列への少なくとも78%の同一性を有するかどうか確かめる簡単な“眼球”比較(すなわち、厳密な比較)によって決定することができる。相対配列相同性(すなわち、配列同一性)は、二つまたはそれを越える配列間の相同性百分率(%)を計算することができる市販の計算機プログラムによって決定することもできる。このような計算機プログラムの典型的な例は、CLUSTALおよびBLASTである。
【0212】
相同性百分率(%)は、連続した配列、すなわち、一つの配列が他の配列と並んでいる配列にわたって計算することができ、一つの配列中の各アミノ酸と他の配列中の該当するアミノ酸とで、一度に一つの残基を直接的に比較することができる。これを、“ギャップなし(ungapped)”アラインメントと称する。典型的には、このようなギャップなしアラインメントは、比較的少数の残基(例えば、50未満の連続したアミノ酸)にわたってのみ行われる。
【0213】
これは、極めて簡単な且つ首尾一貫した方法であるが、例えば、それ以外に一致する配列対の場合、一つの挿入または欠失が続くアミノ酸残基をアラインメントからはずれさせ、それによって、全体的なアラインメントが行われる場合に相同性%を大きく減少させる可能性があるということを考慮することができない。したがって、大部分の配列比較法は、全相同性スコアを過度に不利にすることなく、可能な挿入および欠失を考慮する最適アラインメントを生じるように設計される。これは、配列アラインメント中に“ギャップ”を挿入して、局部相同性を最大にすることを試みることによって達せられる。
【0214】
しかしながら、これら一層複雑な方法は、アラインメント中にある各々のギャップに“ギャップペナルティー”を振り分けるので、一致するアミノ酸の同数について、可能な限り少ないギャップを含む配列アラインメントは、二つの比較される配列間のより高い関係性に反映し、多数のギャップを含むものより高いスコアに達するであろう。典型的には、ギャップの存在について比較的高いコストおよびギャップ中の次の残基各々についてより小さいペナルティーを課す“アフィンギャップコスト(affine gap costs)”を用いる。これは、最も一般的に用いられるギャップ評点システムである。高いギャップペナルティーは、当然ながら、より少ないギャップを含む最適のアラインメントを生じるであろう。大部分のアラインメントプログラムは、ギャップペナルティーを変更させる。しかしながら、配列比較のためにこのようなソフトウェアを用いる場合、デフォルト値を用いることが好適である。例えば、GCG Wisconsin Bestfit パッケージ(下を参照されたい)を用いる場合、アミノ酸配列についてのデフォルト値ギャップペナルティーは、ギャップに−12および伸長毎に−4である。
【0215】
したがって、最大相同性%の計算は、最初に、ギャップペナルティーを考慮した最適アラインメントの作成を必要とする。このようなアラインメントを実施するのに適当な計算機プログラムは、GCG Wisconsin Bestfit パッケージ(University of Wisconsin, U.S.A.; Devereux et al., 1984, Nucleic Acids Research 12:387)である。配列比較を行うことができる他のソフトウェアの例には、BLASTパッケージ(Ausubel et al., 1999 ibid− Chapter 18 を参照されたい)、FASTA(Altschul et al., 1990, J. Mol. Biol., 403−410)およびGENEWORKS比較ツールセット(suite of comparison tools)が含まれるが、これらに制限されるわけではない。BLASTおよびFASTAは両方とも、オフラインおよびオンライン検索に利用可能である(Ausubel et al., 1999 ibid, pages 7−58 to 7−60 を参照されたい)。しかしながら、若干の応用には、GCG Bestfit プログラムを用いるのが好適である。
【0216】
最終相同性%は、同一性の点から測定することができるが、いくつかの場合、アラインメント操作自体、典型的には、全か無か(all−or−nothing)の対比較に基づいていない。その代わり、化学的類似性または進化論的距離に基づく各々の対合比較にスコアを振り分ける階級化した(scaled)類似性スコアマトリックスを用いる。一般的に用いられるこのようなマトリックスの一例は、BLASTプログラムセットのデフォルト値マトリックスであるBLOSUM62マトリックスである。GCG Wisconsin プログラムは、概して、パブリックデフォルト値、または供給される場合、カスタム記号比較表を用いる(更に詳細については使用者マニュアルを参照されたい)。GCGパッケージにパブリックデフォルト値、または他のソフトウェアの場合、BLOSUM62のようなデフォルト値マトリックスを用いるのは好適である。
【0217】
ソフトウェアで最適アラインメントが作成されたら、相同性%、好ましくは、配列同一性%を計算することは可能である。そのソフトウェアは、典型的に、これを配列比較の一部分として行い、数値結果を生じる。
【0218】
示されるように、いくつかの応用について、配列相同性(または同一性)は、いずれか適当な相同性アルゴリズムを用いて、例えば、デフォルト値パラメーターを用いて決定することができる。配列データベースの類似性検索における基本的な問題点の考察については、Altschul et al., (1994) Nature Genetics 6:119−129 を参照されたい。いくつかの応用について、BLASTアルゴリズムを、デフォルト値に設定されるパラメーターと一緒に用いる。BLASTアルゴリズムは、http://www.ncbi.nih.gov/BLAST/blast help.html において詳細に記載されている。好都合には、BLASTによって評価される場合の“実質的な相同性”は、少なくとも約e−7、好ましくは、少なくとも約e−9、そして最も好ましくは、e−10またはそれより低いEXPECT値に合う配列に等しい。BLAST検索におけるEXPECTのデフォルトの閾値は、通常は10である。
【0219】
配列同一性を決定する場合にギャップペナルティーを用いることが可能ならば、好ましくは、次のパラメーターを用いる。
【0220】
【表1】
二つの配列間の同一性および類似性を決定する他の計算機プログラム法には、GCGプログラムパッケージ(Devereux et al., 1984, Nucleic Acids Research 12:387)およびFASTA(Altschul et al., 1990, J. Molec. Biol., pp.403−410)が含まれるが、これらに制限されるわけではない。
【0221】
ポリペプチド変異体および誘導体
本発明のアミノ酸配列に関する“変異体”または“誘導体”という用語には、その配列からのまたは配列への一つの(またはそれを越える)アミノ酸のいずれかの置換、変異、修飾、交換、欠失または付加が含まれるが、但し、得られたアミノ酸配列はヒトSEP活性を有する、好ましくは、配列番号:2に示されるポリペプチドと少なくとも同じ活性を有するという条件付きである。
【0222】
本発明の配列は、本発明で用いるために修飾されてよい。典型的には、その配列のヒトSEP活性を維持する修飾が行われる。アミノ酸置換は、修飾された配列がヒトSEP活性を保持するという条件で、例えば、1、2または3〜10、20または30の置換を行ってよい。アミノ酸置換には、例えば、治療的に投与されるポリペプチドの血漿半減期を増加させるための天然に存在しない類似体の使用が含まれうる。
【0223】
保存的置換は、例えば、下の表にしたがって行われてよい。第二列の同じブロック中、好ましくは、第三列の同じ行中のアミノ酸は、互いに置換されてよい。
【0224】
【表2】
上に示されたように、本発明のタンパク質は、典型的に、組換え手段によって、例えば、本明細書中に記載のように、および/または固相合成のような当業者に周知の技法を用いた合成手段を用いることによって製造される。このような配列の変異体および誘導体には、融合タンパク質であって、少なくとも、別のアミノ酸配列に(直接的にまたは間接的に)連結されている本発明のアミノ酸配列を含む融合タンパク質が含まれる。これら他のアミノ酸配列は、時々、融合タンパク質パートナーと称されるが、典型的には、本発明のアミノ酸配列の抽出および精製を助けるような好ましい官能性を与えるであろう。融合タンパク質パートナーの例には、グルタチオン−S−トランスフェラーゼ(GST)、6xHis、GAL4(DNA結合および/または転写活性化ドメイン)およびβ−ガラクトシダーゼが含まれる。融合タンパク質パートナーと本発明のタンパク質配列との間に、後者の除去を可能にするようにタンパク質分解切断部位を含むことも好都合でありうる。好ましくは、融合タンパク質パートナーは、本発明のタンパク質の機能を妨害しないであろう。
【0225】
ポリヌクレオチド変異体および誘導体
本発明のヌクレオチド配列に関する“変異体”または“誘導体”という用語には、その配列からのまたは配列への一つの(またはそれを越える)核酸のいずれかの置換、変異、修飾、交換、欠失または付加が含まれるが、但し、得られたヌクレオチド配列は、ヒトSEP活性を有する、好ましくは、配列番号:1または配列番号:5に示される配列によってエンコードされるポリペプチドと少なくとも同じ活性を有するポリペプチドをコードするという条件付きである。
【0226】
上に示されたように、配列相同性に関して、好ましくは、配列番号:1または配列番号:5に示される配列に少なくとも83%、より好ましくは、少なくとも85%、より好ましくは、少なくとも90%の相同性がある。より好ましくは、少なくとも95%、より好ましくは、少なくとも98%の相同性がある。ヌクレオチド相同性比較は、上記のように行うことができる。若干の応用について、好ましい配列比較プログラムは、上記のGCG Wisconsin Bestfit プログラムである。デフォルトの評点マトリックスは、一致するヌクレオチド各々に10および各々のミスマッチに−9の対合値を有する。各々のヌクレオチドについて、デフォルトのギャップ生成ペナルティーは−50であり、デフォルトのギャップ伸長ペナルティーは−3である。
【0227】
本明細書中で用いられる“変異体”、“ホモログ”、“フラグメント”および“誘導体”という用語は、それら配列の対立遺伝子変異を包含する。
“変異体”という用語は、本明細書中に示されるヌクレオチド配列にハイブリッド形成することができる配列に相補的である配列も包含する。
【0228】
ハイブリダイゼーション
本明細書中で用いられる“ハイブリダイゼーション”という用語には、“核酸の鎖が塩基対合によって相補鎖と接合する過程”(Coombs J (1994) Dictionary of Biotechnology, Stockton Press, New York NY)、並びに Dieffenbach CW and GS Dveksler(1995, PCR Primer, a Laboratory Manual, Cold Spring Harbor Press, Plainview, NY, USA)に記載のPCR技術で行われるような増幅の過程が含まれるであろう。
【0229】
ハイブリダイゼーション条件は、Berger and Kimmel(1987, Guide to Molecular Cloning Techniques,Methods in Enzymology, Vol 152, Academic Press, San Diego, CA, USA)に示されるように、核酸結合性複合体の融解温度(Tm)に基づき、下に説明されるように定義される“ストリンジェンシー”を与える。
【0230】
ハイブリダイゼーションのストリンジェンシーは、その下でポリ核酸ハイブリッドが安定である条件を意味する。このような条件は、当業者に明らかである。当業者に知られているように、ハイブリッドの安定性は、配列相同性が1%減少する毎に約1〜1.5℃低下するハイブリッドの融解温度(Tm)に反映される。概して、ハイブリッドの安定性は、ナトリウムイオン濃度および温度の関数である。典型的には、ハイブリダイゼーション反応を、より高いストリンジェンシーの条件下で行った後、いろいろなストリンジェンシーの洗浄を行う。
【0231】
本明細書中で用いられるように、高ストリンジェンシーとは、1M Na+中において65〜68℃で安定なハイブリッドを形成するそれら核酸配列だけのハイブリダイゼーションを可能にする条件を意味する。
【0232】
最大ストリンジェンシーは、典型的に、ほぼTm−5℃(プローブのTmより5℃低い温度)で生じる。
高ストリンジェンシーは、プローブのTmより約5℃〜10℃低い温度で生じる。高ストリンジェンシー条件は、例えば、6xSSC、5xデンハート(Denhardt’s)、1%SDS(ドデシル硫酸ナトリウム)、0.1Na+ピロリン酸および非特異的競合物質としての0.1mg/ml変性サケ精子DNAを含有する水溶液中でのハイブリダイゼーションによって提供されうる。ハイブリダイゼーション後、高ストリンジェンシー洗浄は、数段階で、0.2〜0.1xSSC、0.1%SDS中におけるそのハイブリダイゼーション温度で(約30分間)の最終洗浄を含んで行われてよい。
【0233】
中程度または中間のストリンジェンシーは、典型的に、プローブのTmより約10℃〜20℃低い温度で生じる。
低ストリンジェンシーは、典型的に、プローブのTmより約20℃〜25℃低い温度で生じる。
【0234】
当業者に理解されるように、最大ストリンジェンシーハイブリダイゼーションは、同一のポリヌクレオチド配列を識別するまたは検出するのに用いることができるが、中間の(または低)ストリンジェンシーハイブリダイゼーションは、類似したまたは関連したポリヌクレオチド配列を識別するまたは検出するのに用いることができる。
【0235】
中程度のストリンジェンシーとは、上記の溶液中であるが約60〜62℃でのハイブリダイゼーションに均等な条件を意味する。その場合、最終洗浄は、1xSSC、0.1%SDS中においてそのハイブリダイゼーション温度で行われる。
【0236】
低ストリンジェンシーとは、上記の溶液中において約50〜52℃でのハイブリダイゼーションに均等な条件を意味する。その場合、最終洗浄は、2xSSC、0.1%SDS中においてそのハイブリダイゼーション温度で行われる。
【0237】
これら条件が、種々の緩衝液、例えば、ホルムアミド基剤緩衝液および温度を用いて適応され、および再現されてもよいということは理解される。デンハート溶液およびSSCは、他の適当なハイブリダイゼーション緩衝液と同様、当業者に周知である(例えば、Sambrook, et al.,eds.(1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York; または Ausubel, et al.,eds.(1990) Current Protocols in Molecular Biology, John Wiley & Sons,Inc. を参照されたい)。最適ハイブリダイゼーション条件は、プローブの長さおよびGC含量も役割を果たしているので、経験的に決定されるべきである。
【0238】
本明細書中に示されるヌクレオチド配列またはそれらの相補鎖に選択的にハイブリッド形成することができる本発明のポリヌクレオチドは、概して、本明細書中に示される該当するヌクレオチド配列に、少なくとも20個、好ましくは、少なくとも25個または30個、例えば、少なくとも40個、60個または100個またはそれを越える連続したヌクレオチドの領域にわたって、少なくとも83%、好ましくは、少なくとも85%または90%、そしてより好ましくは、少なくとも95%または98%相同であろう。
【0239】
“選択的にハイブリッド形成できる”という用語は、プローブとして用いられるポリヌクレオチドが、本発明の標的ポリヌクレオチドがそのプローブに、バックグラウンドを有意に上回るレベルでハイブリッド形成することが判っている条件下で用いられるということを意味する。このバックグラウンドハイブリダイゼーションは、例えば、スクリーニングされているcDNAまたはゲノムDNAライブラリーの他のポリヌクレオチドのために生じることがありうる。この場合、バックグラウンドとは、そのプローブとライブラリーの非特異的DNAメンバーとの間の相互作用によって生じる、標的DNAで認められる特異的相互作用の10倍未満、好ましくは、100倍未満と同程度の強さであるレベルのシグナルを意味する。この相互作用の強度は、例えば、プローブを、例えば、32Pで放射性標識することによって測定することができる。
【0240】
好ましい側面において、本発明は、本発明のいずれか一つまたはそれを越えるヌクレオチド配列に、ストリンジェント条件下(例えば、65℃および0.1xSSC{1xSSC=0.15M NaCl,0.015クエン酸Na3 pH7.0})でハイブリッド形成することができるヌクレオチド配列を包含する。
【0241】
本発明のポリヌクレオチドが二本鎖である場合、その二重らせんの両鎖は、個々にかまたは組合せで、本発明によって包含される。このポリヌクレオチドが一本鎖である場合、そのポリヌクレオチドの相補的配列も本発明の範囲内に含まれるということは理解されるはずである。
【0242】
本発明の配列に100%相同ではないが、本発明の範囲内であるポリヌクレオチドは、多数の方法によって得ることができる。本明細書中に記載の配列の他の変異体は、例えば、一定範囲の個体、例えば、異なった集団からの個体から作られるDNAライブラリーをプローブすることによって得ることができる。更に、他のウイルス/細菌の、または細胞性のホモログ、特に、哺乳動物細胞(例えば、ウシ、ヒツジ、ブタ、ウマおよび霊長類の細胞)中で見出される細胞性ホモログを得ることができ、このようなホモログおよびそれらのフラグメントは、概して、配列番号:1または配列番号:5に示される配列に選択的にハイブリッド形成することができるであろう。このような配列は、他の動物種から作られるcDNAライブラリーまたはそれに由来するゲノムDNAライブラリーをプローブし、そしてこのようなライブラリーを、中〜高ストリンジェンシー条件下において、配列番号:1または配列番号:5に示される配列の全部または一部分を含むプローブでプローブすることによって得ることができる。同様の考え方が、本発明のポリペプチド配列またはヌクレオチド配列の種ホモログおよび対立遺伝子変異体を得るのに当てはまる。
【0243】
変異体および系統/種ホモログは、本発明の配列中の保存アミノ酸配列をエンコードしている変異体およびホモログ中の配列に指向するように設計されるプライマーを用いるであろう縮重PCRを用いて得ることもできる。保存配列は、例えば、数種類の変異体/ホモログからのアミノ酸配列を整列することによって予想することができる。配列アラインメントは、当該技術分野において知られている計算機ソフトウェアを用いて行うことができる。例えば、GCG Wisconsin PileUp プログラムが広く用いられている。
【0244】
縮重PCRで用いられるプライマーは、一つまたはそれを越える縮重位置を含有するであろうし、しかも既知の配列に対して単一配列プライマーで配列をクローニングするのに用いられるものより低いストリンジェンシー条件で用いられるであろう。
【0245】
或いは、このようなポリヌクレオチドは、特徴的な配列の部位特異的突然変異誘発によって得ることができる。これは、例えば、そのポリヌクレオチド配列が発現されている特定の宿主細胞についてコドン選択を最適にするために配列にサイレントコドン変化が必要とされる場合に有用でありうる。他の配列変化は、制限酵素認識部位を導入するために、またはそれらポリヌクレオチドによってエンコードされるポリペプチドの性状または機能を変更するために望まれることがありうる。
【0246】
本発明のポリヌクレオチドは、プライマー、例えば、PCRプライマー、代わりの増幅反応のためのプライマー、プローブであって、例えば、放射性または非放射性標識を用いて慣用的な手段によって明らかになる標識で標識されたものを生じるのに用いることができるし、またはそれらポリヌクレオチドは、ベクター中にクローン化することができる。このようなプライマー、プローブおよび他のフラグメントは、少なくとも15、好ましくは、少なくとも20、例えば、少なくとも25、30または40ヌクレオチドの長さであろうが、これらも、本明細書中で用いられる本発明のポリヌクレオチドという用語によって包含される。
【0247】
本発明によるDNAポリヌクレオチドおよびプローブのようなポリヌクレオチドは、組換えによって、合成によって、または当業者に利用可能ないずれの手段によっても製造することができる。それらも、標準的な技法によってクローン化することができる。
【0248】
概して、プライマーは、所望の核酸配列の一度に一つのヌクレオチドの段階的製造を含む合成手段によって製造されるであろう。自動化された技法を用いてこれを行う技法は、当該技術分野において容易に利用可能である。
【0249】
より長いポリヌクレオチドは、概して、組換え手段を用いて、例えば、PCRクローニング法を用いて製造されるであろう。これは、クローン化することが望まれる配列の領域に隣接する(例えば、約15〜30ヌクレオチドの)1対のプライマーを製造し、それらプライマーを、動物またはヒト細胞から得られるmRNAまたはcDNAと接触させ、所望の領域の増幅をもたらす条件下でポリメラーゼ連鎖反応を行い、増幅されたフラグメントを(例えば、反応混合物をアガロースゲル上で精製することによって)単離し、そして増幅されたDNAを回収することを含むであろう。それらプライマーは、適当な制限酵素認識部位を含有するように設計してよく、増幅されたDNAは、適当なクローニングベクター中にクローン化することができる。
【0250】
調節配列
好ましくは、本発明のポリヌクレオチドは、選択された宿主細胞によるなどのコーディング配列の発現を提供することができる調節配列に機能可能に連結している。例として、本発明は、このような調節配列に機能可能に連結している本発明のポリヌクレオチドを含むベクターを包含する、すなわち、このベクターは発現ベクターである。
【0251】
“機能可能に連結している”という用語は、記載の化合物が、それらを予定の方式で機能させる関係にある並列を意味する。コーディング配列に“機能可能に連結している”調節配列は、そのコーディング配列の発現が、制御配列に適合しうる条件下で達せられるように連結している。
【0252】
“調節配列”という用語には、プロモーターおよびエンハンサーおよび他の発現調節シグナルが含まれる。
“プロモーター”という用語は、当該技術分野の通常の意味に、例えば、RNAポリメラーゼ結合部位に用いられる。
【0253】
本発明のポリペプチドをエンコードしているポリヌクレオチドの増進された発現は、異種調節領域、例えば、プロモーター、分泌リーダーおよびターミネーター領域の選択によって達せられてもよく、これは、選択された発現宿主からの目的のタンパク質の発現および所望ならば分泌レベルを増加させるのにおよび/または本発明のポリペプチドの発現の誘導可能な制御を行うのに役立つ。
【0254】
好ましくは、本発明のヌクレオチド配列は、少なくともプロモーターに機能可能に連結していてよい。
本発明のポリペプチドをエンコードしている遺伝子本来のプロモーターとは別に、他のプロモーターを用いて、本発明のポリペプチドの発現を支配することができる。そのプロモーターは、所望の発現宿主中での本発明のポリペプチドの発現を支配する場合のその効率について選択されてよい。
【0255】
もう一つの態様において、構成性プロモーターが、本発明の所望のポリペプチドの発現を支配するために選択されてよい。このような発現構築物は、それが、誘導性基質を含有する培地上で発現宿主を培養する必要性を回避するので、追加の利点を与えることがありうる。
【0256】
真菌発現宿主で用いるのに好適である強力な構成性および/または誘導可能プロモーターの例は、キシラナーゼ(xlnA)、フィターゼ、ATPシンテターゼ、サブユニット9(oliC)、トリオースリン酸イソメラーゼ(tpi)、アルコールデヒドロゲナーゼ(AdhA)、α−アミラーゼ(amy)、アミログルコシダーゼ(AG−glaA遺伝子より)、アセトアミダーゼ(amdS)およびグリセルアルデヒド−3−リン酸デヒドロゲナーゼ(gpd)のプロモーターについて真菌遺伝子から入手可能であるものである。
【0257】
強力な酵母プロモーターの例は、アルコールデヒドロゲナーゼ、ラクターゼ、3−ホスホグリセリン酸キナーゼおよびトリオースリン酸イソメラーゼについての遺伝子から入手可能なものである。
【0258】
強力な細菌プロモーターの例は、α−アミラーゼおよびSP02のプロモーター、並びに細胞外プロテアーゼ遺伝子からのプロモーターである。
ハイブリッドプロモーターは、発現構築物の誘導可能な調節を改善するのに用いることもできる。
【0259】
プロモーターには、更に、適当な宿主中での発現を確実にするまたは増加させる特徴が含まれうる。例えば、それら特徴は、Pribnow Box またはTATAボックスのような保存領域でありうる。プロモーターは、他の配列も含有して、本発明のヌクレオチド配列の発現レベルに影響を与えること(維持すること、増進すること、減少させることなど)もできる。例えば、適当な他の配列には、Sh1−イントロンまたはADHイントロンが含まれる。他の配列には、温度、化学物質、光またはストレス誘導性要素のような誘導性要素が含まれる。更に、転写または翻訳を増進させる適当な要素が存在してよい。後者の要素の一例は、TMV5’シグナル配列である(Sleat, Gene, 217,[1987],pp.217−225; および Dawson, Plant Mol. Biol., 23,[1993],p.97 を参照されたい)。
【0260】
分泌
本発明のヒトSEPは、由来細胞から、例えば、精巣中で天然に分泌される。しかしながら、ヒトSEPをエンコードしているポリヌクレオチド配列の突然変異、またはヒトSEPを発現する細胞中での翻訳後修飾の変更またはその不存在は、ヒトSEPの非細胞外分泌(例えば、細胞内沈着)をもたらすことがありうる。このような場合、本発明のポリペプチドを一層容易に回収することができる培地中に、本発明のポリペプチドを発現宿主から分泌させることが望まれる。本発明により、分泌リーダー配列は、所望の発現宿主に基づいて選択されうる。ハイブリッドシグナル配列は、本発明の場合に用いることもできる。
【0261】
異種分泌リーダー配列の典型的な例は、真菌アミログルコシダーゼ(AG)遺伝子(glaA−例えば、アスペルギルス属(Aspergillus)からの18アミノ酸および24アミノ酸両方の型)、a−因子遺伝子(酵母、例えば、サッカロミセス属(Saccharomyces)およびクルイベロミセス属(Kluyveromyces))またはα−アミラーゼ遺伝子(バチルス属(Bacillus))に由来するものである。
【0262】
構築物
“コンジュゲート”、“カセット”および“ハイブリッド”などの用語と同意語である“構築物”という用語には、プロモーターに直接的にまたは間接的に結合した本発明によるヌクレオチド配列が含まれる。間接的結合の例は、本発明のプロモーターおよびヌクレオチド配列の中間の、Sh1−イントロンまたはADHイントロンなどのイントロン配列のような適当なスペーサー基の供給である。直接的または間接的結合が含まれる本発明に関する“融合した”という用語について同じことが当てはまる。各々の場合、それら用語は、野生型遺伝子プロモーターに通常は関連しているタンパク質をコードするヌクレオチド配列の自然の組合せであって、それらが両方ともそれらの自然環境中にある場合を包含しない。
【0263】
この構築物は、それが転移されている、例えば、細菌、好ましくは枯草菌(Bacillus subtilis)のような Bacillus 属の細菌、または植物中での遺伝子構築物の選択を考慮するマーカーを含有するまたは発現することもできる。種々のマーカーが存在するが、例えば、マンノース−6−リン酸イソメラーゼをエンコードするもの(特に、植物について)または抗生物質耐性、例えば、G418、ハイグロマイシン、ブレオマイシン、カナマイシンおよびゲンタマイシンへの耐性を与えるマーカーなどを用いることができる。
【0264】
好ましくは、本発明の構築物は、少なくとも、プロモーターに機能可能に連結した本発明のヌクレオチド配列を含む。
ベクター
“ベクター”という用語には、発現ベクターおよび形質転換ベクターおよびシャトルベクターが含まれる。
【0265】
“発現ベクター”という用語は、in vivo または in vitro 発現の可能な構築物を意味する。
“形質転換ベクター”という用語は、一つの物質を別の物質に転移させることができる構築物を意味し、これは、同じ種のものであってよいしまたは異なった種のものであってよい。その構築物が、大腸菌(E.coli)プラスミドから Bacillus 属のような細菌へのように、一つの種から別の種に転移させることができる場合、この形質転換ベクターは、時々、“シャトルベクター”と称される。それは、E.coli プラスミドからアグロバクテリア菌(Agrobacterium)へ、植物へと転移させることができる構築物でもありうる。
【0266】
本発明のベクターは、下記のような適当な宿主細胞中に形質転換されて、本発明のポリペプチドを発現させることができる。したがって、もう一つの側面において、本発明は、本発明によるポリペプチドを製造する方法であって、上記のような発現ベクターで形質転換されたまたはトランスフェクションされた宿主細胞を、それらポリペプチドをエンコードしているコーディング配列のベクターによって発現させる条件下で培養し、そして発現したポリペプチドを回収することを含む方法を提供する。
【0267】
これらベクターは、例えば、複製開始点、場合により、ポリヌクレオチドの発現のためのプロモーターおよび場合により、そのプロモーターの調節因子を備えた、例えば、プラスミド、ウイルスまたはバクテリオファージ(ファージ)のベクターであってよい。
【0268】
本発明のベクターは、一つまたはそれを越える選択可能マーカー遺伝子を含有してよい。工業用微生物に最も適当な選択システムは、宿主生物中での突然変異を必要としない選択マーカーの群によって形成されるものである。真菌選択マーカーの例は、アセトアミダーゼ(amdS)、ATPシンテターゼ、サブユニット9(oliC)、オロチジン−5’−リン酸デカルボキシラーゼ(pvrA)、フレオマイシンおよびベノミル耐性(benA)の遺伝子である。非真菌選択マーカーの例は、細菌G418耐性遺伝子(これは、酵母で用いることもできるが、糸状菌では用いることができない)、アンピシリン耐性遺伝子(E.coli)、ネオマイシン耐性遺伝子(Bacillus)およびβ−グルクロニダーゼ(GUS)をコードしているE.coli uidA遺伝子である。
【0269】
ベクターは、in vitro で、例えば、RNAの製造に用いることができるし、または宿主細胞をトランスフェクションするのにまたは形質転換するのに用いることができる。
【0270】
したがって、本発明のポリヌクレオチドは、組換えベクター(典型的には、複製可能ベクター)、例えば、クローニングベクターまたは発現ベクター中に包含されることができる。このベクターは、適合しうる宿主細胞中で核酸を複製するのに用いることができる。したがって、さらなる態様において、本発明は、本発明のポリヌクレオチドを製造する方法であって、本発明のポリヌクレオチドを複製可能ベクター中に導入し、そのベクターを適合しうる宿主細胞中に導入し、そしてその宿主細胞を、そのベクターの複製をもたらす条件下で成長させることによる方法を提供する。このベクターは、宿主細胞から回収することができる。適当な宿主細胞は、発現ベクターに関連して下に記載される。
【0271】
本発明は、更に、ヒトSEPのモジュレーター(例えば、阻害剤)の識別のためのスクリーニング法における、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体を発現する遺伝子操作された宿主細胞の使用に関する。このような遺伝子操作された宿主細胞は、ヒトSEP活性をモジュレートすることができるペプチドライブラリーまたは有機分子をスクリーニングするのに用いられうる。抗体、ペプチドまたは有機低分子のようなヒトSEPの阻害剤は、例えば、ヒトSEPに関連した疾患の予防および/または処置用の医薬組成物についての基準を提供するであろう。このような阻害剤は、このような疾患の予防および/または処置のために単独でまたは他の治療薬と組み合わせて投与することができる。
【0272】
本発明は、更に、ヒトSEPタンパク質の in vivo または in vitro 生産のための、またはヒトSEP発現または活性に影響を与えうる試剤についてスクリーニングするための、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体をエンコードしているポリヌクレオチド配列を含む発現ベクターおよび宿主細胞に関する。
【0273】
組織
本明細書中で用いられる“組織”という用語には、組織それ自体および器官が含まれる。
【0274】
宿主細胞
本発明に関して、“宿主細胞”という用語には、本発明の組換えタンパク質をコードするヌクレオチド配列を含むことがありうるいずれかの細胞および/またはそれより得られる生成物が含まれるが、ここにおいて、プロモーターは、その宿主細胞中に存在する場合、本発明によるヌクレオチド配列の発現を可能にすることがありうる。
【0275】
したがって、本発明のさらなる態様は、本発明のポリヌクレオチドで形質転換されたまたはトランスフェクションされた宿主細胞を提供する。好ましくは、このポリヌクレオチドは、このポリヌクレオチドの複製および発現のためにベクター中で運ばれる。それら細胞は、このベクターと適合しうるように選択されるであろうが、例えば、原核性(例えば、細菌細胞)または真核性(すなわち、哺乳動物、真菌、昆虫、原生動物、酵母または植物の細胞)であってよい。
【0276】
グラム陰性細菌E.coli は、異種遺伝子発現のための宿主として広く用いられている。しかしながら、多量の異種タンパク質は、細胞内部に蓄積しがちである。その後のE.coli 細胞内タンパク質のバルクからの所望のタンパク質の精製は、時々難しいことがありうる。
【0277】
E.coli とは対照的に、Bacillus 属からの細菌は、培地中にタンパク質を分泌するそれらの能力のために、異種宿主として極めて適している。宿主として適した他の細菌は、ストレプトマイセス属(Streptomyces)およびシュードモナス属(Pseudomonas)からのものである。
【0278】
宿主細胞中へのポリヌクレオチドの導入は、Sambrook, et al.,eds.(1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, NY, USA に記載の方法によって行うことができる。これらの方法には、リン酸カルシウムトランスフェクション、DEAE−デキストラン媒介トランスフェクション、陽イオン脂質媒介トランスフェクション、エレクトロポレーション、トランスベクション(transvection)、マイクロインジェクション、形質導入、スクレイプローディング(scrape loading)および射出導入(ballistic introduction)が含まれるが、これらに制限されるわけではない。
【0279】
代表的な宿主の例には、細菌細胞(例えば、E.coli、Streptomyces);酵母細胞および Aspergillus のような真菌細胞;ショウジョウバエ属(Drosophila)S2およびスポドプテラ(Spodoptera)SF9細胞のような昆虫細胞;CHO、COS、HEK、HeLaおよび3T3細胞のような動物細胞が含まれる。適当な宿主の選択は、当業者がなすことの範囲内であると考えられる。
【0280】
本発明のポリペプチドをエンコードしているポリヌクレオチドの性状、および/または発現されるタンパク質のさらなるプロセシングへの所望に依存して、酵母または他の真菌のような真核生物宿主が好適でありうる。概して、酵母細胞は、操作するのが一層容易であるので、真菌細胞より好適である。しかしながら、いくつかのタンパク質は、酵母細胞から不十分にしか発現されないかまたは分泌されないし、またはある場合には、適切に処理されない(例えば、酵母中での高グリコシル化)。これらの状況では、別の真菌宿主生物が選択されるべきである。
【0281】
本発明の範囲内の適当な発現宿主の例は、Aspergillus 種(EP−A−0184438号およびEP−A−0284603号に記載のものなど)およびトリコデルマ属(Trichoderma)種のような真菌;エシェリキア属(Escherichia)種または Bacillus 種(EP−A−0134048号およびEP−A−0253455号に記載のものなど)、Streptomyces 種および Pseudomonas 種のような細菌;Kluyveromyces 種(EP−A−0096430号およびEP−A−0301670号に記載のものなど)および Saccharomyces 種のような酵母である。例として、典型的な発現宿主は、クロカビ(Aspergillus niger)、アスペルギルス・ニガー変異ツビジェニス(Aspergillus niger var. tubigenis)、アスペルギルス・ニガー変異アワモリ(Aspergillus niger var. awamori)、アスペルギルス・アクレアティス(Aspergillus aculeatis)、アスペルギルス・ニドゥランス(Aspergillus nidulans)、コウジカビ(Aspergillus oryzae)、トリコデルマ・レエセイ(Trichoderma reesei)、クルイベロマイセス・ラクティス(Kluyveromyces lactis)、枯草菌(Bacillus subtilis)、バチルス・リシェニホルミス(Bacillus licheniformis)、バチルス・アミノリクエファシエンス(Bacillus amyloliquefaciens)、シゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)、ピキア・パストリス(Pichia pastoris)およびパン酵母(Saccharomyces cerevisiae)より選択されてよい。
【0282】
哺乳動物、酵母、昆虫、植物および真菌の宿主細胞などの適当な宿主細胞の使用は、本発明の組換え発現生成物に最適の生物学的活性を与えるのに必要とされることがありうる翻訳後修飾(例えば、ミリストイル化、グリコシル化、先端切断(truncation)、ラピデーション(lapidation)、およびチロシン、セリンまたはトレオニンリン酸化)に備えることができる。
【0283】
生物
本発明に関する“生物”という用語には、本発明による組換えタンパク質をコードするヌクレオチド配列および/またはそれより得られる生成物を含むことがありうる、ヒトを除くいずれかの生物が含まれるが、ここにおいて、プロモーターは、その生物中に存在する場合、本発明によるヌクレオチド配列の発現を可能にすることがありうる。生物の例には、真菌、酵母、植物または原生動物が含まれてよい。
【0284】
本発明に関する“トランスジェニック生物”という用語には、本発明によるタンパク質をコードするヌクレオチド配列および/またはそれより得られる生成物を含む、ヒトを除くいずれかの生物が含まれるが、ここにおいて、プロモーターは、その生物中での本発明によるヌクレオチド配列の発現を可能にすることがありうる。好ましくは、このヌクレオチド配列は、その生物のゲノム中に包含される。
【0285】
“トランスジェニック生物”という用語は、その自然環境中にもある天然のプロモーターの制御下にある場合のその自然環境中にある本発明による天然のヌクレオチドコーディング配列を包含しない。更に、本発明は、それがその自然環境中にある場合、およびそれが、その自然環境中にもあるその天然のヌクレオチドコーディング配列によって発現されている場合、およびそのヌクレオチド配列が、その自然環境中にもあるその天然のプロモーターの制御下にある場合、本発明による天然のタンパク質を包含しない。
【0286】
したがって、本発明のトランスジェニック生物には、本発明によるアミノ酸配列をコードしているヌクレオチド配列のいずれか一つまたは組合せ、本発明による構築物(それらの組合せを含めた)、本発明によるベクター、本発明によるプラスミド、本発明による細胞および本発明による組織またはそれらの生成物、を含む生物が含まれる。形質転換された細胞または生物は、その細胞または生物から容易に回収できると考えられる所望の化合物の許容しうる量を製造しうると考えられる。
【0287】
宿主細胞/宿主生物の形質転換
先に示したように、宿主生物は、原核生物または真核生物でありうる。適当な原核生物宿主の例には、E.coli および Bacillus subtilis が含まれる。原核生物宿主の形質転換についての教示は、当該技術分野においてよく文書化されており、例えば、Sambrook, et al.(Molecular Cloning: A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press, New York, NY, USA)および Ausubel, et al.(Current Protocols in Molecular Biology (1995), John Wiley & Sons,Inc.)を参照されたい。
【0288】
一つの態様において、形質転換された宿主は、哺乳動物細胞、または例えば、昆虫細胞であり、ここにおいて、これら宿主細胞中へのポリヌクレオチドの導入は、例えば、Sambrook, et al.(Molecular Cloning: A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press, New York, NY, USA)に記載の方法によって行うことができる。これら方法には、リン酸カルシウムトランスフェクション、DEAE−デキストラン媒介トランスフェクション、陽イオン脂質媒介トランスフェクション、エレクトロポレーション、トランスベクション、マイクロインジェクション、形質導入、スクレイプローディングおよび射出導入が含まれるが、これらに制限されるわけではない。
【0289】
もう一つの態様において、トランスジェニック生物は酵母でありうる。この点で、酵母は、異種遺伝子発現のためのビヒクルとしても広く用いられてきている。Saccharomyces cerevisiae 種には、異種遺伝子発現のための使用を含めた長い工業使用の歴史がある。Saccharomyces cerevisiae における異種遺伝子の発現は、Goodey et al.(1987, Yeast Biotechnology, D R Berry et al, eds, pp 401−429, Allen and Unwin, London)によっておよび King et al.(1989, Molecular and Cell Biology of Yeasts, E F Walton and G T Yarronton, eds, pp 107−133, Blackie, Glasgow)によって概説されている。
【0290】
いくつかの理由で、Saccharomyces cerevisiae は、異種遺伝子発現によく適している。第一に、それはヒトに非病原性であり、しかも、一定の内毒素を生産することができない。第二に、それには、何百年にも渡るいろいろな目的の商業的利用に続く安全使用の長い歴史がある。これが、広い社会的受容性をもたらしている。第三に、この生物に専念した広範囲にわたる商業的使用および研究は、遺伝学および生理学並びに Saccharomyces cerevisiae に特有の大規模発酵についての豊富な情報をもたらしている。
【0291】
Saccharomyces cerevisiae における異種遺伝子発現および遺伝子産物の分泌の原理についての概説は、E Hinchcliffe and E Kenny(“Yeast as a vehicle for the expression of heterologous genes”, 1993, Yeasts, Vol 5, Anthony H Rose and J Stuart Harrison, eds, 2nd edition, Academic Press Ltd.)によって与えられている。
【0292】
それらの維持のために宿主ゲノムでの組換えを必要とする組込みベクター、および自律複製プラスミドベクターを含めたいくつかのタイプの酵母ベクターが利用可能である。
【0293】
トランスジェニック Saccharomyces を製造するために、本発明のヌクレオチド配列を、酵母での発現用に設計された構築物中に挿入することによって発現構築物を製造する。異種発現に用いられるいくつかのタイプの構築物が開発されている。これら構築物は、本発明のヌクレオチド配列に融合した酵母中で活性なプロモーターを含有するが、通常は、GAL1プロモーターのような酵母起源のプロモーターを用いる。通常は、SUC2シグナルペプチドをエンコードしている配列のような酵母起源のシグナル配列を用いる。酵母中で活性なターミネーターが、この発現系の末端となっている。
【0294】
酵母の形質転換のために、いくつかの形質転換プロトコールが開発されている。例えば、本発明によるトランスジェニック Saccharomyces は、Hinnen et al.(1978, Proceedings of the National Academy of Science of the USA, 75:1929);Beggs, J D(1978, Nature, London, 275:104);および Ito, H et al.(1983, J. Bacteriology 153:163−168)の教示にしたがうことによって製造することができる。
【0295】
形質転換された酵母細胞は、いろいろな選択マーカーを用いて選択される。形質転換に用いられるマーカーの中には、LEU2、HIS4およびTRP1のような多数の栄養要求性マーカー、およびアミノグリコシド抗生物質マーカー、例えば、G418のような支配的な抗生物質耐性マーカーがある。
【0296】
もう一つの宿主生物は植物である。遺伝子修飾された植物の構築における基本原理は、挿入された遺伝物質の安定な維持が得られるように、植物ゲノム中に遺伝情報を挿入することである。
【0297】
遺伝情報を挿入するためのいくつかの技術があるが、その二つの主な原理は、遺伝情報の直接的導入およびベクター系の使用による遺伝情報の導入である。一般的な技術の概説は、Potrykus(Annu Rev Plant Physiol Plant Mol Biol [1991]42:205−225)および Christou(Agro−Food−Industry Hi−Tech, March/April 1994,17−27)による論文に見出されうる。植物の形質転換についての更に別の技術は、EP−A−0449375号に見出されうる。
【0298】
したがって、本発明は、更に、配列番号:1または配列番号:5に示されるヌクレオチド配列またはその誘導体、ホモログ、変異体またはフラグメントで宿主細胞を形質転換する方法を提供する。
【0299】
ヒトSEPヌクレオチドコーディング配列で形質転換された宿主細胞は、そのエンコードされたタンパク質の細胞培養物からの発現および回収に適した条件下で培養することができる。組換え細胞によって生産されるタンパク質は、用いられる配列および/またはベクターに依存して、分泌されてよいしまたは細胞内に含有されていてよい。当業者によって理解されるように、ヒトSEPコーディング配列を含有する発現ベクターは、特定の原核生物または真核生物の細胞膜によってヒトSEPコーディング配列の分泌を支配するシグナル配列で設計されることができる(ヒトSEPがこのようなシグナル配列の不存在下で分泌されない場合)。他の組換え構築物は、可溶性タンパク質の精製を容易にするであろうポリペプチドドメインをエンコードしているヌクレオチド配列に、ヒトSEPコーディング配列をつなぐことができる(Kroll DJ et al. (1993) DNA Cell Biol., Vol 12,pp.441−53;融合タンパク質を含有するベクターについての上記の考察も参照されたい)。
【0300】
遺伝子操作されるまたは遺伝子修飾される
“遺伝子修飾され”ている細胞、好ましくは、動物細胞は、遺伝子操作することによってその細胞中にまたは前駆細胞中に導入される修飾についてヘテロ接合性またはホモ接合性である。修飾を導入するのに利用可能である標準的な遺伝子操作法には、相同的組換え、ウイルスベクター遺伝子トラップ法、照射、化学的突然変異誘発、およびアンチセンスRNAをエンコードしているヌクレオチド配列の単独でのまたは触媒リボザイムとの組合せでのトランスジェニック発現が含まれる。遺伝子修飾に好ましい方法は、相同的組換えおよびウイルスベクター遺伝子トラップ法であり、これらは両方とも、内因性遺伝子を、その遺伝子座中に外来の核酸配列を挿入することによって修飾する。その遺伝子にとって外来の核酸配列は、その遺伝子中に天然に存在しない外因性配列である。この外来のDNAの挿入は、ヒトSEP遺伝子のいずれの領域中でも、例えば、エンハンサー、プロモーター、調節領域、非コーディング領域、コーディング領域、イントロンまたはエクソンで起こりうる。最も好ましい遺伝子操作法は、相同的組換えであるが、ここにおいて、外来の核酸配列は、標的方式において、単独でかまたは内因性遺伝子配列の一部分の欠失と組合せて挿入される。
【0301】
機能的に破壊される
“機能的に破壊され”ているヒトSEP遺伝子とは、破壊された遺伝子によってエンコードされるヒトSEPポリペプチドの細胞活性が、ヒトSEP遺伝子の野生型を通常発現する細胞中で減少するように遺伝子修飾されているヒトSEP遺伝子を意味する。遺伝子修飾が、細胞中のヒトSEP遺伝子の全ての野生型コピーを全て有効に除去する場合(例えば、好ましくは動物細胞である遺伝子修飾された細胞は、ヒトSEP遺伝子破壊についてホモ接合性である、または最初に存在するヒトSEP遺伝子の野生型コピーだけがここで破壊される)、この遺伝子修飾は、野生型ヒトSEP遺伝子を発現する適当な対照細胞と比較して、ヒトSEPポリペプチド活性を減少させる。ヒトSEPポリペプチド活性のこの減少は、減少したヒトSEP遺伝子発現によって生じる(すなわち、ヒトSEPmRNAレベルは、有効に減少し、減少したレベルのヒトSEPポリペプチドを生じる)か、および/または破壊されたヒトSEP遺伝子が、野生型ヒトSEPポリペプチドと比較して低下した機能または安定性を有する突然変異ポリペプチドをエンコードしているためである。好ましくは、遺伝子修飾された細胞中のヒトSEPポリペプチドの活性は、野生型レベルの50%またはそれ未満まで、より好ましくは、25%またはそれ未満まで、そしてなお一層好ましくは、野生型レベルの10%またはそれ未満まで減少する。最も好ましくは、ヒトSEP遺伝子破壊は、ヌル突然変異を引き起こす。
【0302】
遺伝子修飾された動物細胞
機能的に破壊されたヒトSEP遺伝子を含有する“遺伝子修飾された動物細胞”とは、機能的に破壊されたヒトSEP遺伝子を含有するように遺伝子操作することによって生じるヒト細胞を含めた動物細胞、並びに破壊されたヒトSEP遺伝子を遺伝する娘細胞を意味する。これら細胞は、当該技術分野において知られているいずれの標準法によっても、培養物中で遺伝子修飾することができる。培養物中で細胞を遺伝子修飾することに代わるものとして、非ヒト哺乳動物細胞は、ヒトSEP遺伝子破壊を含有する遺伝子修飾された非ヒト哺乳動物から単離されてもよい。本発明の動物細胞は、一次細胞または組織標品、並びに培養に適応した、腫瘍発生性のまたは形質転換された細胞系から得ることができる。これら細胞および細胞系は、例えば、内皮細胞、上皮細胞、島細胞、ニューロンおよび他の神経組織由来細胞、中皮細胞、骨細胞、リンパ球、軟骨細胞、造血細胞、免疫細胞、主要な腺または器官(例えば、肝、肺、心臓、胃、膵臓、腎臓および皮膚)の細胞、筋細胞(骨格筋、平滑筋および心筋からの細胞を含めた)、外分泌または内分泌細胞、線維芽細胞、および胚性および他の全能性または多能性幹細胞(例えば、胚性幹(ES)細胞、ES様細胞、および胚性生殖系列(EG)細胞、および前駆細胞および組織由来幹細胞のような他の幹細胞)に由来する。好ましい遺伝子修飾された細胞は、ES細胞、より好ましくは、マウスまたはラットES細胞、そして最も好ましくは、ヒトES細胞である。
【0303】
ヒトSEP遺伝子での相同的組換えのためのターゲッティングベクター中で用いられる“相同領域”は、ヒトSEP遺伝子の一部分に、または当該技術分野において(例えば、Current Protocols in Human Genetics, unit 4.1, John Wiley & Sons, New York, NY, 2000 に記載のように)知られている標準的な低ストリンジェンシー条件下において相同領域とヒトSEP遺伝子配列との間にハイブリダイゼーションを生じさせるのに充分な程度までヒトSEP遺伝子に隣接している配列に関係がある(すなわち、相補的である)。
【0304】
“ES細胞”または“ES様細胞”とは、不定の自己再生並びに3種類全部の胚葉を代表するものである細胞タイプへの分化が可能である胚、始原生殖細胞、または奇形癌に由来する多能性幹細胞を意味する。
【0305】
“減少する”とは、統計的に有意の減少(すなわち、p<0.1)を意味する。
本発明のヒト細胞を含めた遺伝子修飾された動物細胞は、ヒトSEP遺伝子を機能的に破壊する修飾についてヘテロ接合性またはホモ接合性である。これら動物細胞は、培養物中で細胞を遺伝子操作することによって得られてよいし、または非ヒト哺乳物細胞の場合、遺伝子修飾された非ヒト哺乳動物から細胞を単離してよい。
【0306】
ヒトSEP遺伝子座は、化学的突然変異誘発(Rinchik, Trends in Genetics 7:15−21,1991, Russell, Environmental & Molecular Mutagenesis 23 (Suppl.24) 23−29,1994)、照射(Russell, 上記)、単独でかまたは触媒RNAリボザイム配列との組合せでのヒトSEP遺伝子アンチセンスRNAのトランスジェニック発現(Luyckx et al., Proc. Natl. Acad. Sci. 96:12174−79,1999; Sokol et al., Transgenic Research 5:363−71,1996; Efrat et al., Proc. Natl. Acad. Sci. USA 91:2051−55,1994; Larsson et al., Nucleic Acids Research 22:2242−48,1994)、および下に更に考察される、ヒトSEP遺伝子座中への外来の核酸配列の挿入によるヒトSEP遺伝子の破壊を含めた、当該技術分野において知られているいくつかの遺伝子修飾技術の一つによって機能的に破壊される。好ましくは、この外来の配列は、相同的組換えによってまたはウイルスベクターの挿入によって挿入される。最も好ましくは、ヒトSEP遺伝子破壊の方法は、相同的組換えであり、これには、内因性ヒトSEP遺伝子配列の一部分の欠失が含まれる。
【0307】
外来の配列の組込みは、次の機作の一つまたはそれを越えるものによって、すなわち:ヒトSEP遺伝子の転写または翻訳過程を妨げることによって(例えば、プロモーター認識を妨げることによって、または転写終結部位または翻訳停止コドンをヒトSEP遺伝子中に導入することによって);またはヒトSEP遺伝子コーディング配列を、それがもはや、通常の酵素機能を有するヒトSEPポリペプチドをエンコードしないように変形させることによって(例えば、外来のコーディング配列をヒトSEP遺伝子コーディング配列中に挿入することによって、フレームシフト突然変異または一つまたは複数のアミノ酸置換を導入することによって、または二重乗換えイベントの場合、機能的酵素の発現に必要とされるヒトSEP遺伝子コーディング配列の一部分を欠失することによって);ヒトSEP遺伝子を機能的に破壊する。
【0308】
細胞のゲノム中のヒトSEP遺伝子座中に外来の配列を挿入するためには、この外来のDNA配列を、エレクトロポレーション、リン酸カルシウム沈降、レトロウイルス感染、マイクロインジェクション、ビオリスティクス(biolistics)、リポソームトランスフェクション、DEAE−デキストラントランスフェクションまたはトランスフェリンフェクションのような当該技術分野において知られている標準法によって細胞中に導入する(例えば、Neumann et al., EMBO J. 1:841−845, 1982; Potter et al., Proc. Natl. Acad. Sci USA 81:7161−65, 1984; Chu et al., Nucleic Acids Res. 15:1311−26, 1987; Thomas and Capecchi, Cell 51:503−12, 1987; Baum et al., Biotechniques 17:1058−62, 1994; Biewenga et al., J. Neuroscience Methods 71:67−75, 1997; Zhang et al., Biotechniques 15:868−72, 1993; Ray and Gage, Biotechniques 13:598−603, 1992; Lo, Mol. Cell. Biol. 3:1803−14, 1983; Nickoloff et al., Mol. Biotech. 10:93−101, 1998; Linney et al., Dev. Biol. (Orlando) 213:207−16, 1999; Zimmer and Gruss, Nature 338:150−153, 1989; および Robertson et al., Nature 323:445−48, 1986 を参照されたい)。外来のDNAを細胞中に導入する好ましい方法は、エレクトロポレーションである。
【0309】
相同的組換え
相同的組換えの方法は、ヒトSEP遺伝子を含有する細胞中にヒトSEP遺伝子ターゲッティングベクターを導入することにより、ヒトSEP遺伝子を破壊の標的とする。ヒトSEP遺伝子を破壊の標的とするこのベクターの能力は、ヒトSEP遺伝子に相同であるベクター中のヌクレオチド配列を用いることによって生じる。この相同領域は、このベクターとヒトSEP遺伝子の内因性配列との間のハイブリダイゼーションを容易にする。ハイブリダイゼーションにより、このターゲッティングベクターとゲノム配列との間の乗換えイベントの確率が大きく増加する。この乗換えイベントは、ヒトSEP遺伝子座中へのベクター配列の組込みおよびヒトSEP遺伝子の機能的破壊を引き起こす。
【0310】
ターゲッティングに用いられるベクターの構築に関する一般的な原理は、Bradley et al.(Biotechnol. 10:534,1992)に概説されている。二つの異なった典型的なタイプのベクター、すなわち、挿入ベクターまたは置換ベクターを用いて、相同的組換えによってDNAを挿入することができる。挿入ベクターとは、二本鎖切断部(break)を含むヒトSEP遺伝子相同性領域を含有する環状DNAである。この相同性領域と内因性ヒトSEP遺伝子との間のハイブリダイゼーション後、二本鎖切断部における単一乗換えイベントは、この乗換え部位の内因性遺伝子中へのベクター配列全体の挿入をもたらす。
【0311】
相同的組換えに用いるより好ましいベクターは、置換ベクターであるが、これは、環状よりむしろ共直線性である。ヒトSEP遺伝子中への置換ベクター組込みは、二重乗換えイベント、すなわち、ターゲッティングベクターとヒトSEP遺伝子との間の二つのハイブリダイゼーション部位における乗換えを必要とする。この二重乗換えイベントは、二つの乗換え部位の間に挟まれているベクター配列のヒトSEP遺伝子中への組込み、および本来二つの乗換え部位の間に広がる該当する内因性ヒトSEP遺伝子配列の欠失をもたらす(例えば、Thomas and Capecchi et al., Cell 51:503−12,1987; Mansour et al., Nature 336:348−52,1988; Mansour et al., Proc.Natl.Acad.Sci.USA 87:7688−7692,1990; および Mansour, GATA 7:219−227,1990 を参照されたい)。
【0312】
ターゲッティングベクター中の相同性領域は、概して、少なくとも100ヌクレオチドの長さである。最も好ましくは、この相同性領域は、少なくとも1〜5キロベース(Kb)の長さである。相同性領域に必要な最低限の長さまたは最低限の関係性度は示されていないが、相同的組換えのためのターゲッティング効率は、概して、ターゲッティングベクターとヒトSEP遺伝子座との間の長さおよび関係性度と対応する。置換ベクターが用いられ、そして内因性ヒトSEP遺伝子の一部分が相同的組換えで欠失している場合、更に考慮されるべきことは、内因性ヒトSEP遺伝子の欠失部分のサイズである。内因性ヒトSEP遺伝子のこの部分が1Kbの長さを越える場合、1Kbより長い相同性領域を含むターゲッティングカセットは、組換えの効率を増進させるために推奨される。相同的組換えに有効な配列の選択および使用に関する更に別の指針は、参考文献に記載されている(例えば、Deng and Capecchi, Mol. Cell. Biol. 12:3365−3371, 1992; Bollag et al., Annu. Rev. Genet. 23:199−225, 1989; および Waldman and Liskay, Mol. Cell. Biol. 8:5350−5357, 1988 を参照されたい)。
【0313】
ヒトSEP遺伝子ターゲッティングベクターの構築では、ベクター主鎖として、pBluescript 関連プラスミド(例えば、Bluescript KS+11)、pQE70、pQE60、pQE−9、pBS、pD10、ファージスクリプト、phiX174、pBK ファージミド、pNH8A、pNH16a、pNH18Z、pNH46A、ptrc99a、pKK223−3、pKK233−3、pDR540、およびpRIT5 PWLNEO、pSV2CAT、pXT1、pSG(Stratagene)、pSVK3、PBPV、PMSG、およびpSVL、pBR322およびpBR322に基づくベクター、pBM9、pBR325、pKH47、pBR328、pHC79、ファージ Charon 28、pKB11、pKSV−10、pK19関連プラスミド、pUCプラスミド、およびpGEM系列プラスミドを含めたいろいろなクローニングベクターを用いることができる。これらベクターは、種々の市販元から入手可能である(例えば、 Boehringer Mannheim Biochemicals, Indianapolis, IN; Qiagen, Valencia, CA; Stratagene, La Jolla, CA; Promega, Madison, WI; および New England Biolabs, Beverly, MA:全て米国)。しかしながら、いずれの他のベクター、例えば、プラミド、ウイルスまたはその一部分も、それらが複製可能であり且つ所望の宿主中で生存可能である限り用いることができる。ベクターは、ゲノムが修飾される宿主中でそれを複製することができるようにする配列も含んでいてよい。このようなベクターの使用は、組換えが起こりうる相互作用期間を拡大して、ターゲッティングの効率を増加させることができる(Molecular Biology, ed. Ausubel et al, Unit 9.16, Fig.9.16.1 を参照されたい)。
【0314】
上記のターゲッティングベクターを増殖させるのに用いられる具体的な宿主は、重要ではない。例には、E.coli K12RR1(Bolivar et al., Gene 2:95,1977)、E.coli K12HB101(ATCC番号33694)、E.coli MM21(ATCC番号336780)、E.coli DH1(ATCC番号33849)、E.coli 菌株DH5αおよびE.coliSTBL2が含まれる。或いは、C.cerevisiae のような宿主を用いることができる。上述の宿主は、市販されている(例えば、Stratagene, La Jolla, CA, USA; および Life Technologies, Rockville, MD, USA)。
【0315】
ターゲッティングベクターを生じるためには、ヒトSEP遺伝子ターゲッティング構築物を上記のベクター主鎖に加える。上記のヒトSEP遺伝子ターゲッティング構築物は、少なくとも一つのヒトSEP遺伝子相同性領域を有する。このヒトSEP遺伝子相同性領域を作るためには、ヒトSEP遺伝子に関係した配列を、ポリメラーゼ連鎖反応(PCR)プライマーを製造するための基準として用いる。これらプライマーは、ヒトSEP配列の所望の領域を極めて正確なPCR増幅によって増幅させるために用いる(Mattila et al., Nucleic Acids Res. 19:4967, 1991; Eckert and Kunkel 1:17, 1991; および米国特許第4,683,202号)。ゲノム配列は、ゲノムクローンライブラリーからまたはゲノムDNAの製造から、好ましくは、ヒトSEP遺伝子破壊についてターゲッティングが行われる動物種から得られる。
【0316】
好ましくは、上記のターゲッティング構築物には、正のマーカータンパク質をエンコードしている外因性ヌクレオチド配列も含まれる。ベクター組込み後の正のマーカーの安定な発現は、細胞生存率に影響することなく、識別可能な特性を細胞に与える。したがって、置換ベクターの場合、マーカー遺伝子は、二重乗換えイベント後にそれがヒトSEP遺伝子中に組み込まれるように、二つの隣接している相同性領域の間に位置する。
【0317】
正のマーカータンパク質は選択可能タンパク質であるのが好適であり、このようなタンパク質の細胞中での安定な発現は、選択可能な表現型特性を与える、すなわち、この特性は、それがなければ致死する条件下における細胞の生存を増進させる。したがって、選択可能な条件を課すことにより、ベクター配列を生存率に基づいて首尾よく組み込んでいない他の細胞から、正の選択可能マーカーを安定して発現する細胞を単離することができる。正の選択可能マーカータンパク質(およびそれらの選択試剤)の例には、Neo(G418またはカノマイシン)、Hyg(ハイグロマイシン)、HisD(ヒスチジノール)、Gpt(キサンチン)、Ble(ブレオマイシン)およびHprt(ヒポキサンチン)が含まれる(例えば、Capecchi and Thomas, 米国特許第5,464,764号および Capecchi, Science 244:1288−92, 1989 を参照されたい)。選択可能マーカーに代わるものとして用いることもできる他の正のマーカーには、β−ガラクトシダーゼのようなレポータータンパク質、ホタルルシフェラーゼまたはグリーン蛍光タンパク質が含まれる(例えば、Current Protocols in Cytometry, Unit 9.5 および Current Protocols in Molecular Biology, Unit 9.6, John Wiley & Sons, New York, NY, 2000 を参照されたい)。
【0318】
上記の正の選択スキームは、いずれかの染色体位置へのベクター配列のランダムな非相同的組込みに対して、ヒトSEP遺伝子座に標的相同的組換えによってベクターが組み込まれた細胞間を区別することはない。したがって、相同的組換えに置換ベクターを用いる場合、負の選択可能マーカータンパク質をエンコードしているヌクレオチド配列を含むことも好適である。負の選択可能マーカーの発現は、ある種の試剤にさらされた場合、そのマーカーを発現する細胞の生存率を減少させる(すなわち、そのマーカータンパク質は、特定の選択可能な条件下において細胞にとって致命的になる)。負の選択可能マーカー(およびそれらの致死性試剤)の例には、単純ヘルペスウイルスチミジンキナーゼ(ガンシクロビルまたは1,2−デオキシ−2−フルオロ−α−d−アラビノフラノシル−5−ヨードウラシル)、Hprt(6−チオグアニンまたは6−チオキサンチン)、およびジフテリア毒素、リシン毒素およびシトシンデアミナーゼ(5−フルオロシトシン)が含まれる。
【0319】
負の選択可能マーカーをエンコードしているヌクレオチド配列は、置換ベクターの二つの相同性領域の外側に位置する。この位置にあると、細胞は、ランダムな非相同的組換えによって組込みが生じる場合にのみ、負の選択可能マーカーを単に組込み且つ安定して発現するであろうが、ヒトSEP遺伝子とターゲッティング構築物中の二つの相同性領域との間の相同的組換えは、負の選択可能マーカーをエンコードしている配列を組込みから除外する。したがって、負の条件を課すことにより、ランダムな非相同的組換えによってターゲッティングベクターが組み込まれた細胞は生存率が減少する。
【0320】
正および負の選択可能マーカーの上記組合せは、一連の正および負の選択工程を、相同的組換えによってベクター組込みが行われ、したがって、潜在的に破壊されたヒトSEP遺伝子を有する細胞だけをより効率よく選択するように設計することができるので、好適である。正・負選択スキーム、選択可能マーカーおよびターゲッティング構築物の更に別の例は、例えば、米国特許第号5,464,764、WO94/06908号および Valancius and Smithies, Mol. Cell. Biol. 11:1402, 1991 に記載されている。
【0321】
ベクター組込みによってマーカータンパク質が安定して発現されるために、マーカーコーディング配列がベクター組込みによって内因性ヒトSEP遺伝子プロモーターに機能的に連結するように、ターゲッティングベクターを設計することができる。次に、そのマーカーの発現を、通常はヒトSEP遺伝子を発現する細胞中においてヒトSEP遺伝子プロモーターによって作動させる。或いは、そのベクターのターゲッティング構築物中の各々のマーカーは、ヒトSEP遺伝子プロモーターとは無関係の発現を作動するそれ自体のプロモーターを含有してよい。この後者のスキームは、ヒトSEP遺伝子を典型的に発現しない細胞中においてマーカーの発現を可能にする利点を有する(Smith and Berg, Cold Spring Harbor Symp. Quant. Biol. 49:171, 1984; Sedivy and Sharp, Proc. Natl. Acad. Sci. (USA) 86:227: 1989; Thomas and Capecchi, Cell 51:503, 1987)。
【0322】
マーカー遺伝子発現を作動するのに用いることができる外因性プロモーターには、細胞特異的または段階特異的プロモーター、構成性プロモーター、および誘導性または調節可能プロモーターが含まれる。これらプロモーターの制限されない例には、単純ヘルペスチミジンキナーゼプロモーター、サイトメガロウイルス(CMV)プロモーター/エンハンサー、SV40プロモーター、PGKプロモーター、PMC1−neo、メタロチオネインプロモーター、アデノウイルス後期プロモーター、ワクシニアウイルス7.5Kプロモーター、鳥類のトリβグロビンプロモーター、ヒストンプロモーター(例えば、マウスヒストンH3−614)、βアクチンプロモーター、ニューロン特異的エノラーゼ、筋アクチンプロモーター、およびカリフラワーモザイクウイルス35Sプロモーターが含まれる(概して、Sambrook et al., Molecular Cloning, Vols. I−III, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, および Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY, 2000; Stratagene, La Jolla, CA, USA を参照されたい)。
【0323】
細胞が、ベクター配列を標的ヒトSEP遺伝子座中に組み込まれたかどうか確かめるためには、所望のベクター組込みイベントに特異的であるプライマーまたはゲノムプローブを、PCRまたはサザンブロット分析と組み合わせて用いて、ヒトSEP遺伝子座中への所望のベクター組込みの存在を確認することができる(Erlich et al., Science 252:1643−51,1991; Zimmer and Gruss, Nature 338:150,1989; Mouellic et al., Proc.Natl.Acad.Sci.(USA) 87:4712,1990; および Shesely et al., Proc.Natl.Acad.Sci.(USA) 88:4294,1991)。
【0324】
遺伝子トラップ法
ヒトSEP遺伝子を機能的に破壊するために、外来の核酸配列をヒトSEP遺伝子座中に挿入するのに利用可能なもう一つの方法は、遺伝子トラップ法である。この方法は、エクソンをmRNA中にスプライシングして、遺伝子トラップベクターコーディング配列を遺伝子中にランダム様式で挿入する、全ての哺乳動物細胞に存在する細胞機構を利用する。いったん挿入されると、遺伝子トラップベクターは、トラップされたヒトSEP遺伝子を機能的に破壊しうる突然変異を生じる。相同的組換えとは対照的に、突然変異誘発のためのこのシステムは、極めてランダムな突然変異を生じる。したがって、機能的に破壊されたヒトSEP遺伝子を含有する遺伝子修飾された細胞を得るためには、この特定の突然変異を含有する細胞を、種々の遺伝子のランダム突然変異を含有する細胞のプールから識別し且つ選択しなければならない。
【0325】
遺伝子トラップ用のシステムおよびベクターは、ネズミ細胞および他の細胞タイプを遺伝子修飾する場合の使用について記載されている(例えば、Allen et al., Nature 33:852−55, 1988; Bellen et al., Genes Dev. 3:1288−1300, 1989; Bier et al., Genes Dev. 3:1273−1287, 1989; Bonnerot et al., J. Virol. 66:4982−91, 1992; Brenner et al., Proc. Natl. Acad. Sci. USA 86:5517−21, 1989; Chang et al., Virology 193:737−47, 1993; Friedrich and Soriano, Methods Enzymol. 225:681−701, 1993; Friedrich and Soriano, Genes Dev. 5:1513−23, 1991; Goff, Methods Enzymol. 152:469−81, 1987; Gossler et al., Science 244:463−65, 1989; Hope, Develop. 113:399−408, 1991; Kerr et al., Cold Spring Harb. Symp. Quant. Biol. 2:767−776, 1989; Reddy et al., J. Virol. 65:1507−1515, 1991; Reddy et al., Proc. Natl. Acad. Sci. U.S.A. 89:6721−25, 1992; Skarnes et al., Genes Dev. 6:903−918, 1992; von Melchner and Ruley, J. Virol. 63:3227−3233, 1989; および Yoshida et al, Transgen. Res. 4:277−87, 1995 を参照されたい)。
【0326】
プロモータートラップ(5’トラップ)ベクターは、5’〜3’の順で、スプライスアクセプター配列の後にエクソンを含有するが、これは、典型的に、翻訳開始コドンおよび読み取り枠(ORF)および/または内部リボソームエントリー部位を特徴とする。概して、これらプロモータートラップベクターは、プロモーターも、機能的に連結したスプライスドナー配列も含有しない。したがって、宿主細胞の細胞性ゲノム中への組込み後、そのプロモータートラップベクター配列は、上流の遺伝子の通常のスプライシングを遮断し、末端エクソンとして作用する。ベクターコーディング配列の発現は、適当な読み枠中の破壊された遺伝子のイントロン中へのベクター組込みに依存する。このような場合、細胞性スプライシング機構は、ベクターコーディング配列の上流のトラップされた遺伝子からエクソンをスプライシングする(Zambrowicz et al., WO99/50426号)。
【0327】
上記のプロモータートラップベクターと類似の作用を生じる別の方法は、プロモータートラップベクターのスプライスアクセプターと翻訳開始コドンまたはポリアデニル化配列との間の領域中に存在するまたはそれ以外の場合、その領域中に遺伝子操作される停止コドンの nested セットを包含するベクターである。コーディング配列は、独立リボソームエントリー部位(IRES)を含有するように遺伝子操作することもできるので、そのコーディング配列は、宿主細胞ゲノム中の組込み部位とはほとんど無関係に発現されるであろう。典型的には、必然的ではなく、IRESは、停止コドンの nested セットと連結して用いられる。
【0328】
別のタイプの遺伝子トラップスキームは、3’遺伝子トラップベクターを用いる。このタイプのベクターは、操作上の組合せで、プロモーター領域を含有するが、これは、隣接するコーディング配列、そのコーディング配列、およびコーディング配列エクソンの3’末端を規定するスプライスドナー配列の発現を媒介する。宿主細胞ゲノム中への組込み後、ベクタープロモーターによって発現される転写物は、組み込まれた遺伝子トラップベクター配列の下流に位置するトラップされた遺伝子からスプライスアクセプター配列へとスプライシングされる。したがって、ベクターの組込みは、3’遺伝子トラップカセットのコーディング配列、および末端エクソンおよびそのポリアデニル化シグナルを含めたいずれかの下流細胞性エクソンを含む融合転写物の発現を引き起こす。このようなベクターが遺伝子中に組み込まれる場合、細胞性スプライシング機構は、トラップされた遺伝子の3’エクソンの上流のベクターコーディング配列をスプライシングする。このようなベクターの一つの利点は、3’遺伝子トラップベクターの発現が、遺伝子トラップカセット中のプロモーターによって作動されるので、宿主細胞中で通常発現される遺伝子中への組込みを必要としないということである(Zambrowicz et al., WO99/50426号)。3’遺伝子トラップベクター中に包含されてよい転写プロモーターおよびエンハンサーの例には、ターゲッティングベクターに関して上に論及されたものが含まれる。
【0329】
プロモーターまたは3’遺伝子トラップベクターの構造成分として用いられるウイルスベクター主鎖は、標的細胞のゲノム中に挿入されうる広範囲のベクターより選択されてよい。適当な主鎖ベクターには、単純ヘルペスウイルスベクター、アデノウイルスベクター、アデノ関連ウイルスベクター、レトロウイルスベクター、レンチウイルスベクター、仮性狂犬病ウイルス、α−ヘルペスウイルスベクター等が含まれるが、これらに制限されるわけではない。ウイルスベクター、特に、非複製性細胞を修飾するのに適したウイルスベクター、および外因性ポリヌクレオチド配列の発現と連結したこのようなベクターの使用方法についての詳細な概説は、Viral Vectors: Gene Therapy and Neuroscience Applications, Eds. Caplitt and Loewy, Academic Press, San Diego, 1995 に見出されうる。
【0330】
おそらくは、遺伝子トラップ法にはレトロウイルスベクターが用いられる。これらベクターは、米国特許第5,449,614号に記載されたようなレトロウイルスパッケージング細胞系と連結して用いることができる。非ネズミ哺乳動物細胞を遺伝子修飾の標的細胞として用いる場合、両種性または汎親和性のパッケージング細胞系を用いて、適当なベクターをパッケージすることができる(Ory et al., Pro. Natl. Acad. Sci., USA 93:11400−11406,1996)。現在記載されている3’遺伝子トラップベクターを生じるのに適応させうる代表的なレトロウイルスベクターは、例えば、米国特許第5,521,076号に記載されている。
【0331】
遺伝子トラップ用ベクターは、相同的組換えに用いられるターゲッティングベクターに関して上に論及された正のマーカー遺伝子の一つまたはそれを越えるものを含有してよい。ターゲッティングベクターでのそれらの使用と同様に、これら正のマーカーは、遺伝子トラップ用ベクター中において、細胞ゲノム中にベクターを組み込まれた細胞を識別し且つ選択するのに用いられる。このマーカー遺伝子は、独立リボソームエントリー部位(IRES)を含有するように遺伝子操作されてよいので、そのマーカーは、標的細胞ゲノム中にベクターが組み込まれた位置とはほとんど無関係に発現されるであろう。
【0332】
遺伝子トラップベクターが、感染した宿主細胞のゲノム中にかなりランダムに組み込まれると仮定すると、破壊されたヒトSEP遺伝子を有する遺伝子修飾された細胞は、ランダムなベクター組込みが行われた細胞の集団から識別されなければならない。好ましくは、その細胞集団における遺伝子修飾は、その集団が、それら細胞のゲノム中で見出される本質的にあらゆる遺伝子中で突然変異を示して、破壊されたヒトSEP遺伝子を含む細胞がその集団から識別されることを可能にするように充分なランダムさおよび頻度を有する(Zambrowicz et al., WO99/50426号; Sands et al., WO98/14614号を参照されたい)。
【0333】
破壊されたヒトSEP遺伝子を含有する個々の突然変異細胞系は、突然変異した細胞集団において、例えば、ヒトSEP遺伝子配列中の突然変異を確認するのに逆転写およびPCR(RT−PCR)を用いて識別される。この方法は、クローンをプールすることによって能率的にすることができる。例えば、破壊されたヒトSEP遺伝子を含有する個々のクローンを見出すには、遺伝子トラップベクター中に固定された一つのプライマーおよびヒトSEP遺伝子配列中に位置する別のプライマーを用いてRT−PCRを行う。正のRT−PCR結果は、そのベクター配列がヒトSEP遺伝子転写物中にエンコードされていることを示し、ヒトSEP遺伝子が遺伝子トラップ組込みイベントによって破壊されたことが示される(例えば、Sands et al., WO98/14614号を参照されたい)。
【0334】
時間的、空間的および誘導性の遺伝子破壊
内因性ヒトSEP遺伝子の機能的破壊は、特定の発生段階または細胞周期段階で(時間的破壊)または特定の細胞タイプで(空間的破壊)生じることがありうる。ヒトSEP遺伝子破壊は、ある種の条件が存在する場合、誘導性でもありうる。Cre−Lox系のようなリコンビナーゼ切除系は、特定の発生段階で、特定の組織または細胞タイプで、または特定の環境条件下でヒトSEP遺伝子を活性化させるまたは失活させるのに用いることができる。概して、Cre−Lox技法を利用する方法は、Torres and Kuhn, Laboratory Protocols for Conditional Gene Targeting, Oxford University Press, 1997 によって記載のように行われる。Cre−Lox系について記載されたのと類似した方法も、FLP−FRT系を利用して用いることができる。相同的組換えまたはウイルス挿入によって条件付きで遺伝子を破壊するリコンビナーゼ切除系の使用に関する更に別の指針は、例えば、米国特許第5,626,159号、米国特許第5,527,695号、米国特許第5,434,066号、WO98/29533号、Orban et al., Proc. Natl. Acad. Sci. USA 89:6861−65, 1992; O’Gormann et al., Science 251:1351−55, 1991; Sauer et al., Nucleic Acids Research 17:147−61, 1989; Barinaga, Science 265:26−28, 1994; および Akagi et al., Nucleic Acids Res. 25:1766−73, 1997 に与えられる。一つより多いリコンビナーゼ系を、動物細胞を遺伝子修飾に用いることができる。
【0335】
Cre−Lox系のようなリコンビナーゼ系を用いて、時間的、空間的または誘導性の様式でヒトSEP遺伝子を破壊するのに相同的組換えを用いる場合、ヒトSEP遺伝子コーディング領域の一部分を、loxP部位に隣接したヒトSEP遺伝子コーディング領域を含むターゲッティング構築物によって置き換える。この遺伝子修飾を有する動物細胞は、機能的なloxPに隣接したヒトSEP遺伝子を含有する。ヒトSEP遺伝子破壊の時間的、空間的または誘導性の側面は、所望の空間的に調節された、時間的に調節された、または誘導性のプロモーターそれぞれの制御下において動物細胞中で発現される、追加の導入遺伝子、すなわち、Creリコンビナーゼ導入遺伝子の発現パターンによってもたらされる。Creリコンビナーゼは、組換えのためのloxP部位を標的とする。したがって、Cre発現が活性化されると、loxP部位で組換えが行われて、挟まれたヒトSEP遺伝子コーディング配列が切除され、ヒトSEP遺伝子の機能的破壊が生じる(Rajewski et al., J. Clin. Invest. 98:600−03, 1996; St.−Onge et al., Nucleic Acids Res. 24:3875−77, 1996; Agah et al., J. Clin. Invest. 100:169−79, 1997; Brocard et al., Proc. Natl. Acad. Sci. USA 94:14559−63, 1997; Feil et al., Proc. Natl. Acad. Sci. USA 93:10887−90, 1996; および Kuehn et al., Science 269:1427−29, 1995)。
【0336】
Creリコンビナーゼ導入遺伝子およびloxPに隣接したヒトSEP遺伝子を両方とも含有する細胞は、標準的なトランスジェニック技術によって生じることができる。ヒトSEP遺伝子を時間的、空間的または条件付きで破壊するためのリコンビナーゼ系特異的プロモーターの使用に関する更に別の指針は、例えば、Sauer, Meth. Enz. 225:890−900, 1993, Gu et al., Science 265:103−06, 1994, Araki et al., J. Biochem. 122:977−82, 1997, Dymecki, Proc. Natl. Acad. Sci. 93:6191−96, 1996、および Meyers et al., Nature Genetics 18:136−41, 1998 に見出される。
【0337】
ヒトSEP遺伝子の誘導性破壊は、テトラサイクリン応答性バイナリー系を用いることによって達成することもできる(Gossen and Bujard, Proc. Natl. Acad. Sci. USA 89:5547−51, 1992)。この系は、内因性ヒトSEP遺伝子調節要素、およびテトラサイクリンで制御可能なリプレッサー(TetR)を発現する導入遺伝子中に、Tetプロモーターを導入するように細胞を遺伝子修飾することを含む。このような細胞では、テトラサイクリンの投与は、TetRを活性化させ、順次、これがヒトSEP遺伝子発現を阻害し、したがって、ヒトSEP遺伝子を機能的に破壊する(St.−Onge et al., Nucleic Acids Res. 24:3875−77,1996,米国特許第5,922,927号)。
【0338】
ヒトSEP遺伝子の時間的、空間的および誘導性の破壊のための上記の系は、例えば、WO98/29533号に記載のように遺伝子修飾の方法として遺伝子トラップ法を用いる場合に用いることもできる。
【0339】
遺伝子修飾された動物細胞を生じること
遺伝子修飾のための上記の方法は、実質的には動物に由来する体細胞または幹細胞のいずれのタイプでも、ヒトSEP遺伝子を機能的に破壊するのに用いることができる。本発明の遺伝子修飾された動物細胞には、ヒト細胞を含めた哺乳動物細胞、および鳥類細胞が含まれるが、これらに制限されるわけではない。これら細胞は、培養に適応された、腫瘍発生性のまたは形質転換された細胞系のようないずれかの動物細胞系を遺伝子修飾することに由来してよいし、またはそれらは、所望のヒトSEP遺伝子修飾を有する遺伝子修飾された非ヒト動物から単離されてよい。
【0340】
これら細胞は、破壊されたヒトSEP遺伝子についてヘテロ接合性であってよいしまたはホモ接合性であってよい。ヒトSEP遺伝子破壊についてホモ接合性である細胞(ヒトSEP−/−)を得るために、両方の対立遺伝子の直接的な逐次的ターゲッティングを行うことができる。この方法は、正の選択可能マーカーを再循環することによって容易にすることができる。このスキームにより、正の選択可能マーカーをエンコードしているヌクレオチド配列は、Cre−LoxP系を用いた一つの対立遺伝子の破壊後に除去される。したがって、同様のベクターは、次の回のターゲッティングにおいて、第二のヒトSEP遺伝子対立遺伝子を破壊するのに用いることができる(Abuin and Bradley, Mol. Cell. Biol. 16:1851−56, 1996; Sedivy et al., T. I. G. 15:88−90, 1999; Cruz et al., Proc. Natl. Acad. Sci. (USA) 88:7170−74, 1991; Mortensen et al., Proc. Natl. Acad. Sci. (USA) 88:7036−40, 1991; te Riele et al., Nature (London) 348:649−651, 1990)。
【0341】
ヒトSEP−/−であるES細胞を得るための別の戦略は、ヒトSEP遺伝子破壊にヘテロ接合性である細胞(ヒトSEP+/−)の集団からの細胞のホモジナイゼーションである。この方法は、選択可能薬物耐性マーカーを発現するヒトSEP+/−標的クローンを、極めて高い薬物濃度に対して選択するスキームを用いるが、この選択は、薬物耐性マーカーをエンコードしている配列の二つのコピーを発現する、したがって、ヒトSEP遺伝子破壊にホモ接合性である細胞に有利である(Mortensen et al., Mol. Cell. Biol. 12:2391−95, 1992)。
【0342】
所望の細胞または細胞系の遺伝子修飾後、ヒトSEP遺伝子座は、標準的なPCRによるPCR分析または当該技術分野において知られているサザンブロッティング法によって修飾部位として確かめることができる(例えば、米国特許第4,683,202号;および Erlich et al., Science 252:1643,1991 を参照されたい)。ヒトSEP遺伝子の機能的破壊の更に別の立証は、ヒトSEP遺伝子メッセンジャーRNA(mRNA)レベルおよび/またはヒトSEPポリペプチドレベルが、正常にヒトSEP遺伝子を発現する細胞中で減少するかどうかで行うこともできる。ヒトSEP遺伝子mRNAレベルの尺度は、逆転写酵素に媒介されるポリメラーゼ連鎖反応(RT−PCR)、ノーザンブロット分析または in situ ハイブリダイゼーションを用いることによって得ることができる。細胞によって生産されるヒトSEPポリペプチドの定量化は、例えば、当該技術分野において知られている標準的な免疫検定法によって行うことができる。このような免疫検定には、ラジオイムノアッセイ、ELISA(酵素結合イムノソルベント検定)、“サンドイッチ”免疫検定、イムノラジオメトリックアッセイ、ゲル拡散沈降反応、免疫拡散検定、in situ 免疫検定(例えば、金コロイド、酵素または放射性同位体の標識を用いた)、ウェスタンブロット、2次元ゲル分析、沈降反応、免疫蛍光検定、プロテインA検定、および免疫電気泳動検定のような技術を用いた競合的および非競合的検定システムが含まれるが、これらに制限されるわけではない。
【0343】
好ましい遺伝子修飾された動物細胞は、胚性幹(ES)細胞およびES様細胞である。これら細胞は、マウス(Evans et al., Nature 129:154−156, 1981; Martin, Proc. Natl. Acad. Sci. USA, 78:7634−7638, 1981)、ブタおよびヒツジ(Notanianni et al., J. Reprod. Fert. Suppl., 43:255−260, 1991; Campbell et al., Nature 380:64−68, 1996)、およびヒトを含めた霊長類(Thomson et al., 米国特許第5,843,780号,Thomson et al., Science 282:1145−1147, 1995; および Thomson et al., Proc. Natl. Acad. Sci. USA 92:7844−7848, 1995)などのいろいろな種の着床前の胚および胚盤胞に由来する。
【0344】
これらのタイプの細胞は、多能性である。すなわち、適当な条件下において、それらは、3種類全ての胚葉、すなわち、外胚葉、中胚葉および内胚葉に由来するいろいろな細胞タイプに分化する。培養条件に依り、ES細胞の試料は、幹細胞として無制限に培養されて、単一試料内でいろいろ異なった細胞タイプに分化させることができるし、またはマクロファージ様細胞、ニューロン細胞、心筋細胞、脂肪細胞、平滑筋細胞、内皮細胞、骨格筋細胞、角化細胞、および好酸球、マスト細胞、赤芽球前駆細胞または巨核球などの造血細胞のような特定の細胞タイプに分化するように支配されることができる。支配された分化は、例えば、Keller et al., Curr. Opin. Cell Biol. 7:862−69, 1995, Li et al., Curr. Biol. 8:971, 1998, Klug et al., J. Clin. Invest. 98:216−24,1 996, Lieschke et al., Exp. Hematol. 23:328−34, 1995, Yamane et al., Blood 90:3516−23, 1997, および Hirashima et al., Blood 93:1253−63, 1999 に更に記載されるように、その培養条件において特異的増殖因子またはマトリックス成分を含むことによって達せられる。
【0345】
遺伝子修飾に用いられる具体的な胚性幹細胞系は重要ではないが、典型的なネズミES細胞系には、AB−1(McMahon and Bradley, Cell 62:1073−85, 1990)、E14(Hooper et al., Nature 326:292−95, 1987)、D3(Doetschmann et al., J. Embryol. Exp. Morph. 87:27−45, 1985)、CCE(Robertson et al., Nature 323:445−48, 1986)、RW4(Genome Systems, St. Louis, MO)およびDBA/11acJ(Roach et al., Exp. Cell Res. 221:520−25, 1995)が含まれる。
【0346】
ポリペプチドの製造
本発明によれば、本発明のポリペプチドの製造は、例えば、本発明の一つまたはそれを越えるポリヌクレオチドで形質転換された微生物発現宿主を慣用的な栄養発酵培地中で培養することによって行うことができる。適当な培地の選択は、発現宿主の選択に基づいておよび/または発現構築物の調節必要条件に基づいてよい。このような培地は、当業者に周知である。所望ならば、この培地は、潜在的に混入している他の微生物よりも形質転換された発現宿主に有利な追加の成分を含有してよい。
【0347】
したがって、本発明は、更に、ヒトSEP活性を有するポリペプチドを製造する方法であって、(a)配列番号:1または配列番号:5に示されるヌクレオチド配列またはその誘導体、ホモログ、変異体またはフラグメントで宿主細胞を形質転換し;そして(b)その形質転換された宿主細胞を、このポリペプチドの発現に適した条件下で培養する工程を含む方法を提供する。
【0348】
本発明は、更に、ヒトSEP活性を有するポリペプチドを製造する方法であって、(a)配列番号:1または配列番号:5に示されるヌクレオチド配列またはその誘導体、ホモログ、変異体またはフラグメントで形質転換された宿主細胞を、このポリペプチドの発現に適した条件下で培養し;そして(b)このポリペプチドを宿主細胞培養物から回収する工程を含む方法に関する。
【0349】
本発明は、更に、ヒトSEP活性を有するポリペプチドを製造する方法であって、(a)配列番号:1または配列番号:5に示されるヌクレオチド配列またはその誘導体、ホモログ、変異体またはフラグメントで宿主細胞を形質転換し;(b)この形質転換された宿主細胞を、このポリペプチドの発現に適した条件下で培養し;そして(c)このポリペプチドを宿主細胞培養物から回収する工程を含む方法に関する。
【0350】
リボザイム
リボザイムは、RNAの特異的切断を触媒することができる酵素的RNA分子である。リボザイム作用機作は、相補的な標的RNAへのリボザイム分子の配列特異的ハイブリダイゼーションに続く内ヌクレオチド結合分解性の切断(endonucleolytic cleavage)を含む。本発明の範囲内にあるのは、ヒトSEP RNA配列の内ヌクレオチド結合分解性の切断を特異的に且つ効率よく触媒するよう設計されたハンマーヘッドモチーフリボザイム分子である。
【0351】
いずれか可能なRNA標的中の特異的リボザイム切断部位は、次の配列、GUA、GUUおよびGUCが含まれるリボザイム切断部位について標的分子を走査することによって最初に識別される。いったん識別されると、この切断部位を含有する標的遺伝子の領域に該当する15〜20リボヌクレオチドの短いRNA配列を、オリゴヌクレオチド配列を機能不能にすることがありうる二次構造特徴について評価することができる。候補標的の適合性も、リボヌクレアーゼ保護検定を用いて、相補的オリゴヌクレオチドとのハイブリダイゼーションについての接近容易性を調べることによって評価することができる。
【0352】
本発明のアンチセンスRNAおよびDNA両方の分子およびリボザイムは、RNA分子の合成について当該技術分野において知られているいずれかの方法によって製造することができる。これらには、固相ホスホルアミダイト化学合成のような、オリゴヌクレオチドを化学合成する技法が含まれる。或いは、RNA分子は、アンチセンスRNA分子をエンコードしているDNA配列の in vitro または in vivo 転写によって生じることができる。このようなDNA配列は、T7またはSP6のような適当なRNAポリメラーゼプロモーターと一緒にいろいろなベクター中に包含させることができる。或いは、アンチセンスRNAを構成的にまたは誘導的に合成するアンチセンスcDNAを、細胞系、細胞または組織中に導入することができる。
【0353】
検出
ヒトSEPポリヌクレオチドコーディング配列の存在は、配列番号:1または配列番号:5に示される配列のプローブ、一部分またはフラグメントを用いたDNA−DNAまたはDNA−RNAハイブリダイゼーションまたは増幅によって検出することができる。核酸増幅に基づく検定は、ヒトSEP DNAまたはRNAを含有する形質転換体を検出するための、ヒトSEPコーディング配列に基づくオリゴヌクレオチドまたはオリゴマーの使用を含む。本明細書中で用いられる“オリゴヌクレオチド”または“オリゴマー”は、少なくとも約10ヌクレオチドおよび約60ヌクレオチド程度の、好ましくは、好ましくは、約15〜30ヌクレオチド、そしてより好ましくは、プローブまたはアンプリマー(amplimer)として用いることができる約20〜25ヌクレオチドの核酸配列を意味してよい。好ましくは、オリゴヌクレオチドは、配列番号:1または配列番号:5に示されるヌクレオチド配列の3’領域に由来する。
【0354】
タンパク質に特異的な多クローン性抗体かまたは単クローン性抗体を用いることによるような、ヒトSEPポリペプチドの発現を検出するおよび測定する種々のプロトコールは、当該技術分野において知られている。例には、酵素結合イムノソルベント検定(ELISA)、ラジオイムノアッセイ(RIA)および蛍光活性化セルソーティング(FACS)が含まれる。ヒトSEPポリペプチド上の二つの非干渉性エピトープに反応性の単クローン性抗体を用いる単クローン性二部位免疫検定(two−site, monoclonal−based immunoassay)が好適であるが、競合的結合検定を用いてよい。これらおよび他の検定は、特に、Hampton R et al.(1990, Serological Methods, A Laboratory Manual, APS Press, St Paul, MN, USA)および Maddox DE et al.(1983, J. Exp. Med., 158:1211)に記載されている。
【0355】
いろいろな標識および接合技術は、当業者に知られており、種々の核酸およびアミノ酸検定で用いることができる。ヒトSEPポリヌクレオチド配列を検出するための標識ハイブリダイゼーションまたはPCRプローブを生じる手段には、標識ヌクレオチドを用いるオリゴラベリング、ニックトランスレーション、エンドラベリングまたはPCR増幅が含まれる。或いは、ヒトSEPコーディング配列またはそのいずれか一部分を、mRNAプローブの製造のためのベクター中にクローン化してよい。このようなベクターは、当該技術分野において知られているし、市販されており、そしてT7、T3またはSP6のような適当なRNAポリメラーゼおよび標識ヌクレオチドの付加によって in vitro でRNAプローブを合成するのに用いることができる。
【0356】
Pharmacia Biotech(Piscataway, NJ, USA)、Promega(Madison, WI, USA)および US Biochemical Corporation(Cleaveland, OH, USA)のような多数の会社は、これら手順のための市販のキットおよびプロトコールを供給している。適当なレポーター分子または標識には、放射性核種、酵素、蛍光剤、化学発光剤または発色剤、並びに基質、補助因子、阻害剤、磁性粒子等が含まれる。このような標識の使用を教示する特許には、US−A−3817837号;US−A−3850752号;US−A−3939350号;US−A−3996345号;US−A−4277437号;US−A−4275149号;およびUS−A−4366241号が含まれる。更に、組換え免疫グロブリンを、US−A−4816567号に示されるように生じることができる。
【0357】
特定の分子の発現を定量する更に別の方法には、ヌクレオチドを放射性標識すること(Melby PC et al., 1993, J. Immunol. Methods, Vol 159,pp.235−244)またはビオチニル化すること(Duplaa C et al., 1993, Annal Biochem., Vol 229, p.36)、対照核酸の共増幅、および実験結果を補間する標準曲線が含まれる。多重試料の定量化は、ELISAフォーマットで検定を実施することによって迅速化することができるが、この場合、目的のオリゴマーは、いろいろな希釈度で与えられ、分光測光または熱量測定応答が迅速な定量化を生じる。
【0358】
マーカー遺伝子発現の存在/不存在は、目的の遺伝子も存在するということを示唆するが、その存在および発現は、確かめられるべきである。例えば、ヒトSEPコーディング配列をマーカー遺伝子配列内に挿入する場合、ヒトSEPコーディング領域を含有する組換え細胞は、マーカー遺伝子機能の不存在によって識別することができる。或いは、マーカー遺伝子は、単一プロモーターの制御下にあるヒトSEPコーディング配列と一緒にタンデムに置かれることができる。誘導または選択に応答したマーカー遺伝子の発現は、通常、ヒトSEPの発現も示す。
【0359】
或いは、ヒトSEPのコーディング配列を含有し且つヒトSEPコーディング領域を発現する宿主細胞は、当業者に知られている種々の手順によって識別することができる。これら手順には、核酸またはタンパク質の検出および/または定量化のためのメンブラン、溶液またはチップを基剤とする技術を含めた、DNA−DNAまたはDNA−RNAハイブリダイゼーションおよびタンパク質バイオアッセイまたは免疫検定技術が含まれるが、これらに制限されるわけではない。
【0360】
抗体
本発明のアミノ酸配列は、標準的な技法の使用によるように、そのアミノ酸配列に対する抗体を生じるのに用いることもできる。
【0361】
当該技術分野において周知の手順は、ヒトSEPポリペプチドへの抗体の産生に用いることができる。このような抗体には、多クローン性、単クローン性、キメラ、単鎖、FabフラグメントおよびFab発現ライブラリーによって生じるフラグメントが含まれるが、これらに制限されるわけではない。中和抗体、すなわち、ヒトSEPポリペプチドの生物学的活性を阻害する抗体は、診断薬および治療薬に特に好適である。
【0362】
抗体の産生には、ヤギ、ウサギ、ラット、マウス等を含めた種々の宿主を、免疫原性を保持する阻害剤またはそのいずれか一部分、変異体、ホモログ、フラグメントまたは誘導体またはオリゴペプチドの注射によって免疫感作することができる。宿主の種に依り、種々のアジュバントを用いて免疫学的応答を増加させることができる。このようなアジュバントには、フロイント、水酸化アルミニウムのようなミネラルゲル、およびリゾレシチン、プルロニックポリオール、ポリアニオン、ペプチド、オイルエマルジョン、キーホールリンペットヘモシアニンおよびジニトロフェノールのような界面活性物質が含まれるが、これらに制限されるわけではない。BCG(カルメット・ゲラン桿菌(Bacilli Calmette−Guerin))およびコリネバクテリウム・パルヴム(Corynebacterium parvum)は、用いることができる潜在的に有用なヒトアジュバントである。
【0363】
アミノ酸配列への単クローン性抗体は、培養中の連続的継代細胞系によって抗体分子を産生させるいずれかの技術を用いて製造することもできる。これらには、Koehler and Milstein によって最初に記載されたハイブリドーマ技術(1975, Nature, Vol 256,pp.495−497)、ヒトB細胞ハイブリドーマ技術(Kosbor et al.,(1983), Immunol. Today, Vol 4,p.72; Cote et al.,(1983), Proceedings of the National Academy of Sciences (USA), Vol 80,pp.2026−2030)およびEBVハイブリドーマ技術(Cole et al.,(1985), Monoclonal Antibodies and Cancer Therapy, Alan R Liss Inc., pp.77−96)が含まれるが、これらに制限されるわけではない。更に、“キメラ抗体”の産生のために開発された技術である、適当な抗原特異性および生物学的活性を有する分子を得るためのヒト抗体遺伝子へのマウス抗体遺伝子のスプライシングを用いることができる(Morrison et al.,(1984), Proceedings of the National Academy of Sciences (USA), Vol 81, pp.6851−6855; Neuberger et al.,(1984), Nature, Vol 312, pp.604−608; Takeda et al., (1985), Nature, Vol 314, pp.452−454)。或いは、単鎖抗体の産生について記載された技術(US−A−4946779号)は、阻害剤特異的単鎖抗体を生じるのに適応することができる。
【0364】
抗体は、リンパ球集団において in vivo 産生を引き起こすことによって、または Orlandi et al.(1989, Proceedings of the National Academy of Sciences (USA), Vol 86, pp.3833−3837)および Winter G and Milstein C(1991; Nature, Vol 349, pp.293−299)に開示されたように、極めて特異的な結合性試薬の組換え免疫グロブリンライブラリーまたはパネルをスクリーニングすることによって生じることもできる。
【0365】
ヒトSEPへの特異的結合部位を含有する抗体フラグメントを生じることもできる。例えば、このようなフラグメントには、抗体分子のペプシン消化によって生じることができるF(ab’)2フラグメント、およびこのF(ab’)2フラグメントのジスルフィド架橋を還元させることによって生じることができるFabフラグメントが含まれるが、これらに制限されるわけではない。或いは、Fab発現ライブラリーを、所望の特異性での単クローン性Fabフラグメントの迅速且つ容易な識別を可能にするように構築することができる(Huse WD et al.,(1989), Science, Vol 256, pp.1275−1281)。
【0366】
別の技術は、例えば、ファージが、そのコート表面上でscFvフラグメントをいろいろな相補性決定領域(CDR)とともに発現する場合のファージディスプレイライブラリーをスクリーニングすることを含む。この技術は、当該技術分野において周知である。
【0367】
ヒトSEP特異的抗体は、ヒトSEPポリペプチドの発現に関連した状態および疾患の診断に有用である。確定された特異性を有する多クローン性抗体かまたは単クローン性抗体を用いる競合的結合検定またはイムノラジオメトリックアッセイの種々のプロトコールは、当該技術分野において周知である。このような免疫検定は、典型的に、ヒトSEPポリペプチドとその特異的抗体(または類似したヒトSEP結合性分子)との間の複合体の形成、および複合体形成の測定を含む。特異的ヒトSEPタンパク質上の二つの非干渉性エピトープに反応性の単クローン性抗体を用いる単クローン性二部位免疫検定は好適であるが、競合的結合検定を用いてもよい。これら検定は、Maddox DE et al.(1983, Journal of Experimental Medicine, Vol 158, p.1211)に記載されている。
【0368】
抗ヒトSEP抗体は、異常なペプチドシグナリングを伴う障害、またはヒトSEPの異常な発現を特徴とする他の障害または疾患の診断に有用である。ヒトSEPの診断検定には、ヒト体液、細胞、組織、またはこのような組織の切片または抽出物中でヒトSEPポリペプチドを検出するために抗体および標識を利用する方法が含まれる。本発明のポリペプチドおよび抗体は、修飾してまたは修飾することなく用いることができる。しばしば、これらポリペプチドおよび抗体は、レポーター分子とそれらを共有結合によってかまたは非共有結合によって連結することにより標識されるであろう。いろいろなレポーター分子が当業者に知られている。
【0369】
抗体は、生物試料中に存在する本発明のポリペプチドを、(a)本発明の抗体を提供し;(b)生物試料をこの抗体と一緒に、抗体−抗原複合体を形成させる条件下でインキュベートし;そして(c)この抗体を含む抗体−抗原複合体が形成されるかどうか確認することを含む方法によって検出する方法で用いることができる。
【0370】
これら状況に依って、適当な試料には、精巣または脳のような摘出組織、またはこのような組織に由来する腫瘍性新生物が含まれうる。
本発明の抗体は、固体支持体に結合されてよいし、および/または適当な試薬、対照、取扱い説明書等と一緒に、適当な容器中のキットにパッケージされていてよい。
【0371】
検定/識別方法
本発明は、更に、(ヒト細胞のような)細胞中のヒトSEPの存在を検出する検定方法であって、(a)このような細胞からの(全RNAのような)RNAについて、配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異から決定されるようなヒトSEPに特異的である1対のPCRプライマーを用いて逆転写酵素−ポリメラーゼ連鎖反応(RT−PCR)を行い;そして(b)適当なサイズのPCRフラグメントの出現を、アガロースゲル電気泳動などによって検定することを含む方法に関する。
【0372】
本発明は、更に、ヒトSEPの活性および/またはその発現に(阻害するまたはそれ以外には修飾するなどの)影響を与える試剤(化合物、それを含む他の物質または組成物など)を識別する方法であって、ヒトSEPまたはそれをコードするヌクレオチド配列をその試剤と接触させた後、ヒトSEPの活性および/またはその発現を測定することを含む方法に関する。
【0373】
本発明は、更に、ヒトSEPの活性および/またはその発現に(選択的に阻害するまたはそれ以外には選択的に修飾するなどの)選択的に影響を与える試剤(化合物、それを含む他の物質または組成物など)を識別する方法であって、ヒトSEPまたはそれをコードするヌクレオチド配列をその試剤と接触させた後、ヒトSEPの活性および/またはその発現を測定することを含む方法に関する。
【0374】
本発明は、更に、ヒトSEPの活性および/またはその発現に(阻害するまたはそれ以外には修飾するなどの)影響を与える試剤(化合物、それを含む他の物質または組成物など)を識別する方法であって、ヒトSEPの活性および/またはその発現を、(a)配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含む組換えDNAを包含している細胞系、または(b)ヒトSEPを天然に選択的に発現する細胞集団または細胞系中において、その試剤の存在下でまたはその試剤を添加後に測定することを含む方法に関する。好ましくは、ヒトSEPの活性は、上記の検定方法によって決定される。
【0375】
本発明は、更に、ヒトSEPの活性および/またはその発現に(選択的に阻害するまたはそれ以外には選択的に修飾するなどの)選択的に影響を与える試剤(化合物、それを含む他の物質または組成物など)を識別する方法であって、ヒトSEPの活性および/またはその発現を、(a)配列番号:1または配列番号:5に示されるDNA配列またはその対立遺伝子変異を含む組換えDNAを包含している細胞系、または(b)ヒトSEPを天然に選択的に発現する細胞集団または細胞系中において、その試剤の存在下でまたはその試剤を添加後に測定することを含む方法に関する。好ましくは、ヒトSEPの活性は、上記の検定方法によって決定される。
【0376】
本発明は、更に、ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)活性またはそれ(その誘導体、ホモログ、変異体またはフラグメントを含めた)をコードするヌクレオチド配列の発現のモジュレーション(好ましくは、特異的モジュレーション)について試剤をスクリーニングする方法であって、(a)候補試剤を提供し;(b)ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列とその候補試剤とを、適当な条件下でモジュレーションさせるのに充分な時間混合し;そして(c)その候補試剤がヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)活性またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列の発現をモジュレートするかどうか確かめるために、その候補試剤によるヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列のモジュレーションを検出する工程を含む方法に関する。
【0377】
本発明は、更に、ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(その誘導体、ホモログ、変異体またはフラグメントを含めた)をコードするヌクレオチド配列との特異的結合親和性について試剤をスクリーニングする方法であって、(a)候補試剤を提供し;(b)ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列とその候補試剤とを、適当な条件下で結合させるのに充分な時間混合し;そして(c)その候補試剤がヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列に結合するかどうか確かめるために、ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列への候補試剤の結合を検出する工程を含む方法に関する。
【0378】
本発明は、更に、ヒトSEPをモジュレートすることができる試剤を識別する方法であって、(a)その試剤を、ヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列と接触させ;(b)工程(a)の混合物を生物活性ペプチドと一緒に、その生物活性ペプチドのタンパク質分解に適した条件下でインキュベートし;(c)生物活性ペプチドタンパク質分解の量を測定し;そして(d)工程(c)の生物活性ペプチドタンパク質分解の量と、その試剤を含むことなくインキュベートされたヒトSEP(またはその誘導体、ホモログ、変異体またはフラグメント)またはそれ(またはその誘導体、ホモログ、変異体またはフラグメント)をコードするヌクレオチド配列について得られる生物活性ペプチドタンパク質分解の量とを比較し、それによって、その試剤が生物活性ペプチドタンパク質分解に(阻害するまたは選択的に阻害するなどの)影響を与えるかどうか確認する工程を含む方法に関する。
【0379】
したがって、本発明の一定の態様において、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体、および/またはヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体を発現する細胞系は、エンドペプチダーゼ活性のモジュレーターとして作用する抗体、ペプチド、または有機または無機分子のような他の試剤について、またはそれらの発現についてスクリーニングし、それによって、生物活性ペプチドレベルをモジュレートすることができる治療薬を識別するのに用いることができる。例えば、ヒトSEPの活性を中和することができる抗ヒトSEP抗体は、生物活性ペプチドのヒトSEPタンパク質分解を阻害し、それによって、それらのレベルを増加させるのに用いることができる。或いは、組換え発現されたヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体、またはヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体を発現する細胞系を用いる組合せ化学によって作られるペプチドライブラリーまたは有機ライブラリーのスクリーニングは、生物活性ペプチドのヒトSEPによるタンパク質分解をモジュレートすること(例えば、阻害することまたは選択的に阻害すること)によって機能する治療薬の識別に有用でありうる。合成化合物、天然物、および他の潜在的に生物学的に活性な物質源は、当業者にとって常套的であると考えられる多数の方法でスクリーニングすることができる。例えば、ヒトSEPのN末端領域をエンコードしているヌクレオチド配列は、細胞系中で発現させることができるが、これは、ヒトSEP活性のアゴニストかまたはアンタゴニストであるアロステリックモジュレーターをスクリーニングするのに用いることができる。或いは、ヒトSEPの保存触媒ドメインをエンコードしているヌクレオチド配列を、細胞系中で発現させて、生物活性ペプチドタンパク質分解の阻害剤または選択的阻害剤についてスクリーニングするのに用いることができる。
【0380】
ヒトSEP活性または生物活性ペプチドタンパク質分解を妨げる試験薬の能力は、ヒトSEPレベルまたは生物活性ペプチドレベルを測定することによって決定することができる。
【0381】
したがって、本発明は、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体の生物活性ペプチドタンパク質分解活性をモジュレートすることができる化合物を識別する方法であって、(a)その化合物を、ヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体と接触させ;(b)工程(a)の混合物を生物活性ペプチドと一緒に、その生物活性ペプチドのタンパク質分解に適した条件下でインキュベートし;(c)生物活性ペプチドタンパク質分解の量を測定し;そして(d)工程(c)の生物活性ペプチドタンパク質分解の量と、その化合物を含むことなくインキュベートされたヒトSEPまたはその変異体、ホモログ、フラグメントまたは誘導体について得られる生物活性ペプチドタンパク質分解の量とを比較し、それによって、その化合物が生物活性ペプチドタンパク質分解を刺激するまたは阻害するかどうか決定する工程を含む方法に関する。この方法の一つの態様において、フラグメントは、ヒトSEPのN末端領域からであってよく、ヒトSEPのアロステリックモジュレーターを識別する方法を提供する。本発明のもう一つの態様において、このフラグメントは、ヒトSEPのカルボキシ末端領域からであってよく、生物活性ペプチドタンパク質分解の阻害剤または選択阻害剤を識別する方法を提供する。
【0382】
これら生物活性ペプチドは、完全長であってよいしまたはそのフラグメントであってよく、組換えによって、または好ましくは、合成によって生じることができる。好ましくは、これら生物活性ペプチドは、ヒトSEPによってモジュレートされる(好ましくは、タンパク質分解/加水分解によって切断される)ことができる低分子量合成ペプチドである。より好ましくは、これら合成ペプチドを標識する(好ましくは、蛍光標識、より好ましくは、本明細書中に記載のFRET検定で用いることができるような分子内消光性蛍光原性色素で蛍光標識する)。
【0383】
ヒトSEPは、生物活性ペプチド活性を調節することおよび/または生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解に関与しうるので、上記の“生物活性ペプチド(類)”(および同種のもの)への言及は、これら言及が必要な変更を加えて解釈するためにある場合について、適宜、“生物学的に不活性なペプチド(類)”(および同種のもの)への言及を意味するとみなすこともできる。例えば、ヒトSEP活性の阻害が、増加したレベルの生物活性ペプチド(類)をもたらすかもしれない場合、このような阻害は、更に、または代わりに、増加したレベルの生物学的に不活性なペプチド(類)をもたらし、それによって、それらの“活性型”のペプチド(類)の減少したレベルをもたらすかもしれない。
【0384】
ヒトSEPポリペプチド、その免疫原性フラグメントまたはそのオリゴペプチドは、種々の薬物スクリーニング技術のいずれにおいても治療的化合物をスクリーニングするのに用いることができる。このような試験で用いられるポリペプチドは、溶液中でフリーであってよいし、固体支持体に固着されていてよいし、細胞表面上にあってもよいし、または細胞内に位置していてよい。活性の消滅またはヒトSEPポリペプチドと試験される試剤との間の結合性複合体の形成は、測定することができる。
【0385】
したがって、本発明は、ヒトSEPまたはその発現、またはその一部分またはその変異体、ホモログ、フラグメントまたは誘導体のモジュレーション(好ましくは、特異的結合親和性または阻害のような特異的モジュレーション)について一つまたは複数の化合物をスクリーニングする方法であって、一つまたは複数の化合物を提供し;ヒトSEPまたはそれをコードするヌクレオチド配列またはその一部分またはその変異体、ホモログ、フラグメントまたは誘導体と、一つまたは複数の化合物各々とを、適当な条件下でモジュレーションさせるのに充分な時間混合し;そして例えば、(i)複数の化合物各々へのヒトSEP、またはその一部分またはその変異体、ホモログ、フラグメントまたは誘導体の結合を検出し、それによって、ヒトSEPまたはそれをコードするヌクレオチド配列をモジュレートする一つまたは複数の化合物を識別すること;または(ii)複数の化合物各々によるヒトSEP、またはその一部分またはその変異体、ホモログ、フラグメントまたは誘導体の阻害を検出し、それによって、ヒトSEPまたはそれをコードするヌクレオチド配列をモジュレートする(阻害する)一つまたは複数の化合物を識別することを含む方法に関する。このような検定において、これら複数の化合物は、当業者に知られている組合せ化学技術によって生じることができる。
【0386】
薬物スクリーニングのためのもう一つの技法は、ヒトSEPポリペプチドへの適当な結合親和性を有する化合物の高処理スクリーニング(HTS)に提供され、1984年9月13日公開の Geysen, WO84/03564号に詳細に記載された方法に基づいている。要約すると、多数の異なる低分子量ペプチド試験化合物を、プラスチックピンまたは何か他の表面のような固体支持体上で合成する。これらペプチド試験化合物を、ヒトSEPフラグメントと反応させ、洗浄する。次に、結合したヒトSEPを、当該技術分野において周知の方法を適当に適応することなどによって検出する。精製されたヒトSEPは、上述の薬物スクリーニング技術で用いるためにプレート上に直接的にコーティングすることもできる。或いは、非中和抗体を、そのペプチドを捕捉し且つそれを固体支持体上に固定するために用いることができる。
【0387】
本発明は、更に、ヒトSEPを結合することができる中和抗体が、ヒトSEPを結合することについて試験化合物と特異的に競合する競合的薬物スクリーニング検定の使用を包含する。この方式では、これら抗体は、一つまたはそれを越える抗原決定基をヒトSEPと共有するいずれかのペプチドの存在を検出するのに用いることができる。
【0388】
本発明の検定方法は、高処理スクリーニング(HTS)であってよい。この点で、WO84/03564号の教示は、本発明のヒトSEPに適応することができる。
【0389】
US−A−5738985号の教示は、本発明の検定方法に適応することができる。
試剤
本発明は、更に、本発明の検定方法および識別方法によって識別される一つまたはそれを越える試剤を提供する。
【0390】
本発明の試剤は、例えば、有機化合物または無機化合物でありうる。この試剤は、例えば、配列番号:1または配列番号:5に示される配列の全部または一部分についてアンチセンスであるヌクレオチド配列でありうる。好ましくは、この試剤は、SEP活性のモジュレーター、より好ましくは、SEP阻害剤(SEPi)または選択的SEPiであろう。
【0391】
SEPiは、SEPの酵素活性を阻害する、すなわち、それが基質ペプチド、ポリペプチドまたはタンパク質を(タンパク質分解によって)切断するのを妨げる化合物である。
【0392】
本発明は、更に、薬剤として用いるための本発明の試剤(またはその薬学的に許容しうる塩またはその薬学的に許容しうる溶媒和化合物さえも)または前述のいずれかを含有する医薬組成物を提供する。
【0393】
本発明は、更に、泌尿生殖器系、心臓血管系、神経系および内分泌系のいずれか一つまたはそれを越えるものにおける、ヒトSEP活性に(阻害する、選択的に阻害する、モジュレートするまたは拮抗するなどの)影響を与える試剤の使用に関する。
【0394】
診断薬
本発明は、更に、ヒトSEPポリヌクレオチド配列の検出のための診断用組成物を提供する。この診断用組成物は、配列番号:1または配列番号:5に示される配列またはその変異体、ホモログ、フラグメントまたは誘導体、または配列番号:1または配列番号:5に示されるヌクレオチド配列またはその対立遺伝子変異の全部または一部分にハイブリッド形成することができる配列を含んでいてよい。
【0395】
疾患の診断のための基準を提供するには、ヒトSEPポリペプチド発現からの正常値または標準値を決定すべきである。これは、動物かまたはヒトである正常対象から得られる体液または細胞抽出物(例えば、精巣から)と、ヒトSEPポリペプチドへの抗体とを、当該技術分野において周知である複合体形成に適した条件下で混合することによって達せされる。標準的な複合体形成の量は、既知量の抗体が既知濃度の精製ヒトSEPポリペプチドと混合されている陽性対照の希釈列にそれを比較することによって定量することができる。次に、正常な試料から得られる標準値を、ヒトSEPポリペプチド発現に関係がある障害または疾患に潜在的に罹患している対象からの試料により得られる値と比較することができる。標準値と対象値との間の偏差は、その疾患状態の存在を確定する。
【0396】
ヒトSEPポリヌクレオチドまたはそのいずれか一部分は、診断用化合物および/または治療的化合物の基準を提供することができる。診断目的には、ヒトSEPポリヌクレオチド配列を用いて、ヒトSEP活性が関連していることがありうる状態、障害または疾患における遺伝子発現を検出し且つ定量することができる。
【0397】
ヒトSEPをエンコードしているポリヌクレオチド配列は、ヒトSEPの発現に起因する疾患の診断に用いることができる。例えば、ヒトSEPをエンコードしているポリヌクレオチド配列は、ヒトSEP発現の異常を検出するために、血清、滑液または腫瘍生検のような、生検または剖検からの組織または体液のハイブリダイゼーション検定またはPCR検定で用いることができる。このような定性的または定量的方法の形態には、サザンまたはノーザン分析、ドットブロットまたは他のメンブランを基剤とする技術;PCR技術;ディップスティック、ピンまたはチップ技術;およびELISAまたは他の多重試料フォーマット技術が含まれうる。これら技術は全て、当該技術分野において周知であり、実際上、多数の市販の診断用キットの基準である。
【0398】
このような検定は、具体的な治療処置計画の効力を評価するために調整されてよいし、動物実験、臨床試験、または個々の患者の処置を監視する場合に用いることができる。疾患の診断用の基準を提供するためには、ヒトSEP発現についての正常または標準のプロフィールを決定すべきである。これは、動物かまたはヒトである正常対象から得られる体液または細胞抽出物と、ヒトSEPまたはその一部分とを、ハイブリダイゼーションまたは増幅に適した条件下で混合することによって達せされる。標準的なハイブリダイゼーションは、正常対象について得られる値と、既知量の精製ヒトSEPが用いられている同様の実験で行われる陽性対照の希釈列とを比較することによって定量することができる。正常な試料から得られる標準値は、ヒトSEPコーディング配列の発現に関係がある障害または疾患に潜在的に罹患している対象からの試料により得られる値と比較することができる。標準値と対象値との間の偏差は、その疾患状態の存在を確定する。疾患が確定された場合、既存の治療薬を投与し、そして処置プロフィールまたは値を生じることができる。最終的には、その検定を一定の基準で繰り返して、それら値が正常または標準のパターンに向かって進行するまたは復帰するかどうか評価することができる。成功した処置プロフィールは、数日間または数ヶ月間にわたる処置の効力を示すのに用いることができる。
【0399】
本発明は、更に、例えば、疾患状態におけるヒトSEPレベルを診断用に検出し且つ定量するのに用いることができる抗ヒトSEP抗体を生じるための、ヒトSEPポリペプチド、またはその変異体、ホモログ、フラグメントまたは誘導体の使用に関する。
【0400】
本発明は、更に、正対照として用いることができる精製されたヒトSEPおよび抗ヒトSEP抗体を含む、細胞および組織中のヒトSEPの検出のための診断用検定およびキットに関する。このような抗体は、ヒトSEPタンパク質の発現、またはその欠失体、変異体、ホモログ、フラグメントまたは誘導体の発現に関係があるいずれかの疾患状態または状態を検出するための、溶液、メンブランまたは組織を基剤とする技術で用いることができる。
【0401】
プローブ
本発明のもう一つの側面は、ヒトSEPコーディング領域または対立遺伝子などの密接に関係した分子をエンコードしている、ゲノム配列を含めたポリヌクレオチド配列を検出することができる核酸ハイブリダイゼーションまたはPCRプローブの規定である。プローブの特異性、すなわち、それが高度に保存された、保存されたまたは非保存の領域またはドメインに由来するかどうか、およびハイブリダイゼーションまたは増幅の(高、中または低)ストリンジェンシーは、そのプローブが、天然に存在するヒトSEPコーディング配列または関係のある配列だけを識別するかどうか決定するであろう。関係のある核酸配列の検出のためのプローブは、3’領域のようなヒトSEPファミリーメンバーの保存されたまたは高度に保存されたヌクレオチド領域から選択され、しかもこのようなプローブは、縮重プローブのプールで用いることができる。同一ヌクレオチド配列、または最大の特異性が望まれる場所の検出ために、核酸プローブは、非保存ヌクレオチド領域またはヒトSEPポリヌクレオチドの独特の領域から選択される。本明細書中で用いられる“非保存ヌクレオチド領域”という用語は、本明細書中に開示されるヒトSEPコーディング配列に独特であり、既知のSEPのような関係のあるファミリーメンバーに存在しないヌクレオチド領域を意味する。
【0402】
PCRは、US−A−4683195号、US−A−4800195号およびUS−A−4965188号に記載のように、ヒトSEP配列に基づくオリゴヌクレオチドについて更に別の使用を提供する。このようなオリゴマーは、概して、化学合成されるが、それらは、酵素的に生じてよいしまたは組換え体源から製造されてよい。オリゴマーは、概して、二つのヌクレオチド配列、すなわち、特定の遺伝子または状態の識別に最適にされた条件下で用いられるセンス配向(5’→3’)のものおよびアンチセンス配向(3’←5’)のものを含む。同じ二つのオリゴマー、すなわち、nested セットのオリゴマー、またはオリゴマーの縮重プールさえも、密接に関係したDNAまたはRNA配列の検出および/または定量化のために、低いストリンジェント条件下で用いることができる。
【0403】
ヒトSEPの核酸配列は、内因性ゲノム配列をマッピングするために、前に記載されたようなハイブリダイゼーションプローブを生じるのに用いることもできる。この配列は、周知の技法を用いて、特定の染色体にまたはその染色体の特異的領域にマッピングすることができる。これらには、染色体拡大(chromosomal spread)への in situ ハイブリダイゼーション(Verma et al.(1988) Human Chromosomes: A Manual of Basic Techniques, Pergamon Press, New York City, USA)、フローソーティド染色体調製(flow−sorted chromosomal preparations)、または酵母人工染色体(YACs)、細菌人工染色体(BACs)、細菌PI構築または単一染色体cDNAライブラリーのような人工染色体構築が含まれる。
【0404】
染色体標品の in situ ハイブリダイゼーション、および確定された染色体マーカーを用いる連鎖分析のような物理的マッピング技術は、遺伝子地図を拡張する場合に非常に貴重である。遺伝子地図の例は、Science(1995; 270:410f および 1994; 265:1981f)に見出されうる。しばしば、特定のヒト染色体の数またはアームが知られていないとしても、別の哺乳動物種の染色体上の遺伝子の配置が、関連したマーカーを示すことがありうる。新しい配列は、物理的マッピングによって、染色体アームまたはその一部分に割り当てることができる。これは、ポジショナルクローニングまたは他の遺伝子発見技術を用いて疾患遺伝子について探索している研究者に貴重な情報を提供する。毛細管拡張性運動失調(AT)などの疾患または症候群が、特定のゲノム領域への遺伝子連鎖によって大まかに位置決定されると、例えばATが11q22−23(Gatti et al,(1988), Nature, 336:577−580)、その領域へのいずれかの配列マッピングは、更なる研究のための関連遺伝子または調節遺伝子を呈するだろう。本発明のヌクレオチド配列は、正常個体、保持個体または罹患した個体の間で、転座、逆位等による染色体位置の相違を検出するのに用いることもできる。
【0405】
医薬
本発明は、更に、ヒトSEP活性のための処置を必要としている個体を処置するための医薬組成物であって、この活性に(阻害するまたは選択的に阻害するなどの)影響を与える試剤の治療的有効量および薬学的に許容しうる担体、希釈剤または賦形剤を含む組成物を提供する。
【0406】
したがって、本発明は、更に、本発明の試剤(本発明のヌクレオチド配列の発現パターンまたはその発現産物の活性をモジュレートすることができる試剤および/または本発明による検定によって識別される試剤)を含む医薬組成物を包含する。この点で、具体的にはヒト療法について、本発明の試剤は単独で投与することができるにもかかわらず、それらは、概して、予定の投与経路および標準的な医薬慣例に関して選択される医薬担体、賦形剤または希釈剤との混合物で投与されるであろう。
【0407】
例として、本発明の医薬組成物中では、本発明の試剤を、いずれか適当な1種類または複数の結合剤、1種類または複数の滑沢剤、1種類または複数の懸濁化剤、1種類または複数のコーティング剤、または1種類または複数の可溶化剤と混合してよい。
【0408】
概して、本発明の試剤の治療的に有効な1日の経口または静脈内用量は、0.01〜50mg/kg(処置される対象の体重)、好ましくは、0.01〜20mg/kg、より好ましくは、0.1〜20mg/kgの範囲であると考えられる。本発明の試剤は、静脈内注入によって、0.001〜10mg/kg/時の範囲であると考えられる用量で投与されてもよい。
【0409】
したがって、本発明は、ヒトSEP活性のための処置を必要としている個体を処置する方法であって、この個体に有効量の本発明の医薬組成物を投与することを含む方法を提供する。
【0410】
典型的には、医師が、個々の患者に最も適している実際用量を決定するであろうが、それは、具体的な患者の年齢、体重、性別および応答により異なるであろう。上の投薬量は、平均的な場合を代表するものである。当然ながら、より高いまたはより低い投薬量範囲が望ましい個々の場合がありうるし、そのようなものは本発明の範囲内である。
【0411】
適当な場合、これら医薬組成物は、吸入によって;坐剤または膣坐剤の形で;局所には、ローション剤、液剤、クリーム剤、軟膏剤または散布剤の形で;皮膚パッチの使用によって;経口には、デンプンまたはラクトースのような賦形剤を含有する錠剤の形で;または単独でかまたは賦形剤との混合物でのカプセル剤または小卵剤で;または着香剤または着色剤を含有するエリキシル剤、液剤または懸濁剤の形で投与することができるし、またはそれらは、非経口によって、例えば、空洞内、静脈内、筋肉内または皮下に注射することができる。非経口投与には、これら組成物は、他の物質、例えば、その溶液を血液と等張にさせる充分な塩類または単糖類を含有してよい滅菌水性液剤の形で最もよく用いることができる。口腔または舌下投与には、これら組成物は、慣用法で製剤化することができる錠剤または口中錠の形で投与してよい。
【0412】
対象(患者など)への経口、非経口、口腔および舌下投与について、本発明の試剤の1日投薬レベルは、典型的には、10〜500mg(1回または分割用量で)であってよい。したがって、および例として、錠剤またはカプセル剤は、適宜、単回で、または一度に2個またはそれを越えて投与するのに、5〜100mgの活性成分を含有してよい。本発明の試剤を徐放性製剤中で投与することも可能である。
【0413】
ある用途には、概して、ヒトの場合、本発明の試剤の経口投与が好ましい経路であり、最も好都合であり、いくつかの場合には、空洞内(i.c.)投与に関連するような他の投与経路に関連した欠点を回避することができる。レシピエントが、嚥下障害または経口投与後の薬物吸収の欠陥を患っている状況では、薬物を非経口投与してよい。
【0414】
獣医学的使用について、本発明の試剤は、典型的に、通常の獣医学慣例にしたがって適当に許容しうる製剤として投与され、そして獣医外科医が、具体的な動物に最も適当である投薬計画および投与経路を決定するであろう。しかしながら、ヒト処置の場合と同様、獣医学的処置のために試剤を単独で投与することは可能でありうる。
【0415】
典型的に、これら医薬組成物は、ヒトまたは動物使用のためであってよく、いずれか1種類またはそれを越える薬学的に許容しうる希釈剤、担体または賦形剤を含むであろう。医薬担体、賦形剤または希釈剤の選択肢は、予定の投与経路および標準的な医薬慣例に関して選択することができる。上に示されたように、これら医薬組成物は、担体、賦形剤または希釈剤として、またはそれに加えて、いずれか適当な1種類または複数の結合剤、1種類または複数の滑沢剤、1種類または複数の懸濁化剤、1種類または複数のコーティング剤、または1種類または複数の可溶化剤を含んでよい。
【0416】
本発明のいくつかの態様において、これら医薬組成物は、本発明の検定によってスクリーニングされた試剤;配列表または図に示される配列であって、その誘導体、フラグメント、ホモログまたは変異体を含めたもの、または配列番号:1または配列番号:5に示されるヌクレオチド配列にハイブリッド形成することができる配列のいずれか一つと相互作用することができる試剤の内の一つまたはそれを越えるものを含むであろう。
【0417】
本発明の範囲内に含まれるのは、ヒトSEP mRNAを不安定にするように機能するまたはヒトSEPの翻訳を阻害するオリゴヌクレオチド配列、アンチセンスRNAおよびDNA分子、およびリボザイムである。このようなヌクレオチド配列は、生物活性ペプチドのレベルを増加させることが好ましいと考えられる状態で用いることができる。
【0418】
ヒトSEPアンチセンス分子は、例えば、増加したヒトSEP活性に関係した種々の異常な状態の予防および/または処置のための基準を提供することができる。
【0419】
ヒトSEP核酸アンチセンス分子は、生物活性ペプチドレベルを上昇させることが好ましいと考えられる状態においてヒトSEPの活性を阻止するのに用いることができる。
【0420】
レトロウイルス、アデノウイルス、ヘルペスまたはワクシニアウイルスに由来するまたは種々の細菌プラスミドに由来する発現ベクターは、標的細胞集団への組換えヒトSEPセンスまたはアンチセンス分子の送達に用いることができる。当業者に周知である方法を用いて、ヒトSEPを含有する組換えベクターを構築することができる。或いは、組換えヒトSEPを、リポソームで標的細胞に送達することができる。
【0421】
完全長cDNA配列および/またはその調節成分は、研究者が遺伝子機能のセンス(Youssoufian H and H F Lodish,(1993), Mol. Cell Biol., 13:98−104)またはアンチセンス(Eguchi et al,(1991), Annual Rev. Biochem., 60:631−652)研究においてヒトSEPを手段として用いることを可能にする。ゲノムDNAから得られるcDNAまたは制御配列から設計されるオリゴヌクレオチドは、in vitro または in vivo で発現を阻害するのに用いることができる。このような技法は、現在、当該技術分野において周知であり、センスまたはアンチセンスオリゴヌクレオチドまたはより大きいフラグメントを、コーディング領域または制御領域に沿ったいろいろな位置から設計することができる。適当なオリゴヌクレオチドは、20ヌクレオチドの長さでありうるが、これを用いて、ヒトSEP配列または密接に関係した分子をヒトライブラリーから単離することができる。
【0422】
更に、ヒトSEP発現は、エンドペプチダーゼ活性を阻止することによって生物活性ペプチドレベルを増加させることが好ましいと考えられる状態において、高レベルのヒトSEPフラグメントを発現する発現ベクターで細胞または組織をトランスフェクションすることによってモジュレートすることができる。このような構築物は、翻訳できないセンスまたはアンチセンス配列を含む細胞を溢れさせることがありうる。DNA中への組込みが不存在の場合でも、このようなベクターは、そのベクターの全コピーが内因性ヌクレアーゼによって無能力にされるまで、RNA分子を転写し続けることがありうる。このような一過性発現は、非複製性ベクターについては1ヶ月またはそれを越える間、および適当な複製要素がそのベクター系の一部分である場合はなお一層長い間持続することがありうる。
【0423】
ヒトSEPは、生物活性ペプチド活性を調節することおよび/または生物学的に不活性なペプチドのそれらの活性型へのタンパク質分解に関与しうるので、上記の“生物活性ペプチド(類)”(および同種のもの)への言及は、これら言及が必要な変更を加えて解釈するためにある場合について、適宜、“生物学的に不活性なペプチド(類)”(および同種のもの)への言及を意味するとみなすこともできる。例えば、ヒトSEP活性の阻害が、増加したレベルの生物活性ペプチド(類)をもたらすかもしれない場合、このような阻害は、更に、または代わりに、増加したレベルの生物学的に不活性なペプチド(類)をもたらし、それによって、それらの“活性型”のペプチド(類)の減少したレベルをもたらすかもしれない。
【0424】
遺伝子発現の修飾は、プロモーター、エンハンサーおよびイントロンのような、ヒトSEP遺伝子の制御領域へのアンチセンス配列を設計することによって得ることができる。
【0425】
転写開始部位、例えば、リーダー配列の−10〜+10の領域に由来するオリゴヌクレオチドが好適である。アンチセンスRNAおよびDNA分子は、転写物がリボソームに結合するのを妨げることによってmRNAの翻訳を阻止するように設計することもできる。同様に、阻害は、“三重らせん”塩基対合としても知られる Hogeboom 塩基対合法を用いて行うことができる。三重らせん対合は、ポリメラーゼ、転写因子または調節分子の結合のために充分に開く二重らせんの能力に影響する。
【0426】
したがって、本発明は、本発明の試剤(またはその薬学的に許容しうる塩またはその薬学的に許容しうる溶媒和化合物さえも)を薬学的に許容しうる希釈剤、賦形剤または担体と一緒に含む医薬組成物を提供する。
【0427】
この医薬組成物は、獣医学的(すなわち、動物)使用またはヒト使用のためでありうる。
したがって、本発明は、更に、ヒトSEPタンパク質(アンチセンス核酸配列を含めた)の阻害剤またはアンタゴニストの有効量を、薬学的に許容しうる希釈剤、担体または賦形剤(それらの組合せを含めた)との混合物で含む医薬組成物に関する。
【0428】
本発明は、また更に、医薬組成物であって、ヒトSEPポリヌクレオチド配列、ヒトSEPアンチセンス分子、ヒトSEPポリペプチド、タンパク質、ペプチド、または阻害剤、選択的阻害剤、アンタゴニスト(抗体を含めた)またはアゴニストのようなヒトSEP活性の有機モジュレーターの全部または一部分を単独で、または安定化用化合物のような少なくとも1種類の他の試剤との組合せで含んでよく、しかも生理食塩水、緩衝化生理食塩水、デキストロースおよび水が含まれるがこれに制限されないいずれかの滅菌の生体適合性医薬担体中で投与されてよい医薬組成物に関する。
【0429】
医薬組合せ
本発明の医薬組成物は、サイクリックGMPの増強剤またはエンハンサー(ホスホジエステラーゼ5型阻害剤、例えば、Sildenafil、または酸化窒素ドナー、または酸化窒素前駆体、例えば、L−アルギニナーゼなど)および/または中枢作用性製剤(例えば、アポモルフィンまたはメラノタンII(melanotan II)のようなドーパミンレセプターアゴニストまたはメラノコルチン(melanocortin)レセプターアゴニスト)などの1種類またはそれを越える他の薬学的活性剤と組み合わせて用いてよい。アポモルフィンの製剤としての使用についての教示は、US−A−5945117号に見出されうる。その具体的な文書において、アポモルフィンは舌下に送達される。
【0430】
更に、または代わりに、本発明の医薬組成物は、1種類またはそれを越える中性エンドペプチダーゼ(NEP)阻害剤(NEPi)、1種類またはそれを越えるPDE5阻害剤(PDE5i)(例えば、シルデナフィル(sildenafil)(Pfizer)、バルデナフィル(vardenafil)(Bayer BA38−9456)およびIC351(Cialis, Icos Lilly))、1種類またはそれを越えるNPYレセプターアンタゴニスト、1種類またはそれを越えるPDE2型阻害剤、1種類またはそれを越える酸化窒素(NO)ドナー(例えば、NMI−921)、1種類またはそれを越えるドーパミンレセプターアゴニスト(例えば、アポモルフィン、Uprima、Ixsene)、1種類またはそれを越えるメラノコルチンレセプターアゴニスト(例えば、Melanotan IIまたはPT14)、1種類またはそれを越えるカリウムチャンネルオープナー(例えば、KATPチャンネルオープナー(例えば、ミノキシジル、ニコランジル(nicorandil))および/またはカルシウム活性化カリウムチャンネルオープナー(例えば、BMS−204352))、1種類またはそれを越えるα1−アドレノセプターアンタゴニスト(例えば、フェントラミン、Vasofem、Vasomax)、1種類またはそれを越えるVIPレセプターアゴニストまたはVIP類似体(例えば、Ro−125−1533)またはVIPフラグメント、1種類またはそれを越えるα−アドレノセプターアンタゴニストとVIPの組合せ(例えば、Invicorp、Aviptadil)、1種類またはそれを越えるα2−アドレノセプターアンタゴニスト(例えば、ヨヒンビン)、1種類またはそれを越えるエストロゲン、エストロゲンおよびメドロキシプロゲステロンまたは酢酸メドロキシプロゲステロン(MPA)、またはエストロゲンおよびメチルテストステロンホルモン置換療法薬(例えば、HRT、特に、Premarin、Cenestin、Oestrofeminal、Equin、Estrace、Estrofem、Elleste、Solo、Estring、Eastraderm、Eastraderm TTS、Eastraderm Matrix、Dermestril、Premphase、Prempro、Prempak、Premique、Estratest、Estratest HS、Tibolone)、1種類またはそれを越えるテストステロン置換薬(DHEA(デヒドロアンドロステンジオン)、テストステロン(Tostrelle)またはテストステロンインプラント(Organon)を含めた)、1種類またはそれを越えるテストステロン/エストラジオール薬、1種類またはそれを越えるエストロゲンアゴニスト(例えば、Lasofoxifene)、1種類またはそれを越えるセロトニンレセプターアゴニストまたはアンタゴニスト(例えば、5HT1A、5HT2C、5HT2Aおよび5HT3レセプターアゴニストおよびアンタゴニスト;WO00/28993号に記載の)、1種類またはそれを越えるプロスタノイドレセプターアゴニスト(例えば、Muse、アルプロスタジル、ミソプロストール)、1種類またはそれを越えるプリン作動性レセプターアゴニスト(特に、P2Y2およびP2Y4)、または1種類またはそれを越える抗うつ薬(例えば、ビュープロピオン(Wellbutrin)、ミラタザピン(mirratazapine)、ネファゾドン(nefazodone))と組み合わせて用いてよい。
【0431】
好ましくは、上記のこのような組合せで用いられる本発明のこの医薬組成物は、SEPiである。本発明の好ましい組合せは、SEPi+NEPiおよびSEPi+PDE5i、具体的には、SEPi+ Sildenafil である。
【0432】
一般的な方法の参照
概して、本明細書中に述べられる技術は、当該技術分野において周知であるが、具体的には、Sambrook et al., Molecular Cloning, A Laboratory Manual (1989) および Ausubel et al., Short Protocols in Molecular Biology (1990) 4th Ed, John Wiley & Sons, Inc. を参照してよい。PCRは、US−A−4683195号、US−A−4800195号およびUS−A−4965188号に記載されている。
【0433】
寄託
次の試料は、ブダペスト条約にしたがって、承認された受託者 The National Collections of Industrial, Food and Marine Bacteria(NCIMB)at 23 St.Machar Drive, Aberdeen, Scotland, AB24 3RY, United Kingdom に、2001年6月29日に寄託された。
【0434】
NCIMB番号NCIMB41110は、E.coli MSSE82である。
寄託者は、Pfizer Limited, Ramsgate Road, Sandwich, Kent, CT13 9NJ, United Kingdom であった。
【0435】
当業者は、上述のE.coli クローン(NCIMB41110)を、アンピシリンを含有する Luria Broth 中で容易に成長させ、そのクローンのプラスミドDNAを、Sambrook, et al.,eds.(1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, NY, USA に記載のアルカリ溶解法を用いて単離しうる。次に、Sanger et al.(Proceedings of the National Academy of Science (USA), (Dec. 1977), 74(12):5463−5467)によって記載され且つ蛍光検出について Applied Biosystems, Foster City, CA, USA(Applied Biosystems 製造者の参考文献を参照されたい)によって変更されたようなジデオキシターミネーション法を用いて、そのDNAを配列決定し且つヒトSEPを識別しうる。
【0436】
受託番号NCIMB41110として寄託された上述の寄託生物物質を言及する場合に本明細書中で用いられる一つまたは複数の“細胞”という用語は、一つまたは複数の“微生物”または“細菌”という均等な用語と同じ意味である。
【0437】
本発明は、更に、その寄託物から誘導可能なおよび/または発現可能な配列およびそれを含む態様を包含する。本発明は、更に、その寄託物から誘導可能なおよび/または発現可能な部分配列およびそれを含む態様を包含するが、ここにおいて、それら部分配列は、活性ポリペプチド(活性酵素部位)をコードする。本発明は、更に、その寄託物から誘導可能なおよび/または発現可能な配列を含むタンパク質およびそれを含む態様を包含する。本発明は、更に、その寄託物から誘導可能なおよび/または発現可能な部分配列を含むタンパク質およびそれを含む態様を包含するが、ここにおいて、それら部分配列は、活性ポリペプチド(活性酵素部位)をコードする。
【0438】
実施例部分、図面および配列表への序論
本発明を、ここで、単に例として、添付の図面および配列表に関して記載する。
【0439】
【実施例】
実施例部分
実施例1−ヒトSEPの同定
データベースマイニング
ヒトSEPの新規な遺伝子は、プローブとしてネプリリシンタンパク質およびBLASTアルゴリズムを用いてヒト発現配列タグ(ESTs)のデータベースをマイニングすることによって発見した。次に、ESTヒット(データベース=Incyte GoldTM;遺伝子id.=241161)を集合させて、コーディング配列の大きいフラグメントが予想される隣接した配列にした。これは、ネプリリシンタンパク質配列との相同性(60%同一性)によって触媒ドメインに該当する。PCRクローニングのためのプローブは、新規な遺伝子について予想されるコーディング配列のこの領域を用いて設計した。次に、ヒトゲノムデータベースからの未完成の配列を更にマイニングすることで、5個の予想されるエクソンを識別し、これらは、欠けているN末端領域中の同じ新規な遺伝子に属すると仮定された。これは、後に、ヒト精巣ライブラリーから得られる完全長クローンの配列決定後に確認した(下を参照されたい)。
【0440】
新規なヒトSEP配列には、3’UTR、および二つの活性触媒部位の一つを含有するヒトSEPの高度に保存されたC末端領域中のコーディング配列の一部分が含まれる。この新規なヒトSEPは、37アミノ酸のインサートを含有すると考えられる。
【0441】
完全長ヒトSEP cDNAの単離
オリゴヌクレオチド(5’−ctgtcttgatggattggatg−3’)は、5’−RACE(5’cDNA末端の迅速増幅)PCRを用いて、cDNAライブラリーからより長いヒトSEP cDNAを増幅させることができるように隣接した発現配列タグ(ESTs)の上述の集合からの部分ヒトSEP cDNA配列を用いて設計した。
【0442】
次に、12アレイの96ウェルフォーマットヒト Rapid−ScreenTMcDNAライブラリーのパネルを、5’−RACE PCRによってスクリーニングした。ヒトSEPに該当するcDNAを、脳、肝、胎盤、小腸および精巣に由来するライブラリー中で識別した。
【0443】
これらcDNAには、完全長であるものがなかったので、精巣からのそれより長いが部分長のcDNAの内の一つの配列から設計されたプライマー(5’−gtccttggcagtcgaattctcc−3’)を用いてライブラリーのパネルについて更に5’−RACEを行った。これは、単離され且つ両末端から配列決定された精巣ライブラリー中のより長い(約3.0kb)推定上の完全長cDNAクローンを識別した。この完全長ヒトSEPクローンをMSSE82と称し(そしてNCIMBに受託番号NCIMB41110として寄託し)、この完全長クローンを、Genbank 受託番号#AF067196を有するpCMV6−XL4ベクター中にクローン化した。
【0444】
実施例2−ヒトSEP mRNAの組織分布
多重組織メッセンジャーRNAブロットを、ヒトSEPについてプローブした。SEP mRNAは、精巣試料中で検出されたが、他の組織では検出されなかった。
【0445】
完全なヒトSEPコーディング配列に該当するDNAのフラグメントを、PCRにより、SEPクローンMSSE82を鋳型として用いて増幅させた。そのフラグメントを、メガプライムキット(Amersham PLC, UK)を用いて32P dCTPで放射性標識した。その放射性標識されたフラグメントをハイブリダイゼーションプローブとして、いろいろなヒト組織および細胞系の選択(76)から、mRNAを含有する多重組織mRNAアレイ(ドットブロット)(Clontech, USA より)をスクリーニングするのに用いた。ハイブリダイゼーションおよび洗浄後、そのブロットにオートラジオグラフィーを施した。精巣からはシグナルを検出したが、他の組織からは検出されなかった。
【0446】
実施例3−組換えSEP酵素の製造
チャイニーズハムスター卵巣(CHO)細胞の培養物を、リポフェクタミン(lipofectamine)試薬プロトコール(Invitrogen Ltd, Paisley, UK)に記載のリポフェクタミン法を用いて、プラスミドMSSE82でトランスフェクションする。トランスフェクション後24時間または48時間に、細胞培地を採取し、そして3000gで5分間の遠心分離によって細胞破片を除去する。次に、その培地を、50mM HEPES pH7.4/10%グリセロールに対して、“スライド・ア・ライサー(slide a lyser)”(Pierce and Warner, Chester UK より)を用いて4℃で一晩透析する。次に、透析された試料をアリコートで凍結させ、液体窒素下で貯蔵する。
【0447】
実施例4−SEPペプチダーゼ活性の検定
SEP検定
背景
SEP検定は、NEPと一緒の使用について、Carvalho et al. によって開発されたFRET検定に基づく(Carvalho et al., Annal.Biochem. 237,pp.167−173(1996))。このSEP FRET検定は、蛍光原性ドナー/アクセプター色素の新規な組合せ、具体的には、ローダミングリーン(Molecular Probes,Inc.)およびQSY7(Molecular Probes,Inc.)を代用することを除いて、同一ではないが類似した分子内消光蛍光原性ペプチド基質を利用する。
【0448】
SEPのエンドペプチダーゼ活性は、合成ペプチド基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2をタンパク質分解するその能力をモニターすることによって測定する。
【0449】
この検定に選択される二つの発蛍光団(蛍光原性色素)は、オーバーラップする発光および吸収スペクトルを有し、したがって、エネルギー移動に適している。ローダミングリーンは、ドナーとして作用し、485nmで励起した場合、535nmで発光(蛍光)を生じ、順次、QSY7を励起する(FRETが起こっている)。そのQSY7は蛍光的に不活性しているので、535nmより上で発光を生じないし、したがって、シグナルは認められない(ローダミングリーン発光が消光している)。
【0450】
このペプチド基質のArg−Valペプチド結合におけるSEPによる切断(選択的加水分解)時に、ローダミングリーンおよびQSY7部分は別々に移動するので、485nmでの励起では、エネルギー移動はもはや生じることができない。結果として、蛍光の増加は、ローダミングリーンについて535nmで認められる。
【0451】
合成ペプチド基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH 2 の製造
実験:
ペプチド組み立てを、0.25mmol FMOC−PAL−PEG−PS樹脂上で、固相ペプチド合成プロトコールにより、製造者に供給された(Applied Biosystems, Foster City, CA, USA)9−フルオレニルメトキシカルボニル(FMOC)基剤合成サイクルへの変更を用いて完成した。本発明者が変更したサイクルは、20%ピペリジン/N−メチルピロリジノン(NMP)での2x5分間処理でアミノ末端を脱保護し;その効率を、301nmでのUV吸光度により、UV吸光度検出器を介する小アリコートの脱保護溶液の通過によって監視する。別々のカートリッジ中で、入ってくるアミノ酸を、N,N−ジメチルホルムアミド(DMF)中に溶解した各0.9当量の2−(1H−ベンゾトリアゾール−1−イル)−1,1,3,3テトラメチルウロニウムヘキサフルオロリン酸(HBTU)/1−ヒドロキシベンゾトリアゾール(HOBt)で活性化する。2当量のジイソプロピルエチルアミン(DIEA)を加える。同時に、樹脂を続いてNMPで洗浄して、脱保護副生成物を除去する。洗浄液を樹脂から排液させ、そして活性化したアミノ酸エステルを樹脂に移し、アミノ末端にカップリングさせるように20分間撹拌する。残留するカップリング溶液を排液し、樹脂を再度NMPで洗浄する。ペプチド均一性を確実にするために、NMP中の0.4M無水酢酸/0.04M HOBt溶液および12mmol DIEAを樹脂に加えて、いずれの潜在的な未反応部位もアセチル化する。最後に、樹脂をNMPで洗浄し、排液した後、1:1のジクロロメタン/2,2,2−トリフルオロエタノール混合物で洗浄し、排液する。これは、ペプチド合成の一つのサイクルの典型である。完成した合成用樹脂を、Reagent K(King,D.S. et al., (1990), Int.J.Pep.Prot.Res., 32,pp.255−66)を用いて切断し且つ脱保護して、251mg(100%)の粗製ペプチドCP1、エレクトロスプレー質量分析(ERMS)(m/z計算値(calc.)=977.21(MH+ 平均),obs.=977.47)を与える。
【0452】
QSY−7のシステインへの連結:
50mg(51μmol)の粗製CP1を、45mg(52.4μmol)のQSY−7マレイミドを含有する10%DIEA/DMFの溶液中に溶解させた。10分後、その反応を、HPLC−MS分析によって不完全であると判定し、更に30mg(30.7μmol)の粗製ペプチドを加えた。更に30分後、HPLC−MSにより、その反応は完了していると判定し、出発試薬は全て消費した。生成物を、C18分取用HPLCクロマトグラフィーによって単離し、マトリックス支援レーザー脱離イオン化質量分析法(MALDI−MS)によって所望の生成物分子量を示す画分をプールし、凍結乾燥させて、73.7mg(50%)の紫色粉末、CP2、ESMS(m/z calc.=1797.86(MH+ 一同位体),obs.=1797.86)とした。
【0453】
ビス(トリフルオロアセチル)ローダミングリーンのアミノ末端への連結:
73.7mg(41μmol)のCP2を、35mg(52.8μmol)のローダミングリーンカルボン酸,トリフルオロアセトアミド,スクシンイミジルエステル(5(6)−CR 110TFA,SE)*混合異性体*を含有する2%DIEA/DMF溶液中に溶解させた。2時間後、HPLC−MS分析により、その反応は完了していると判定した。生成物を、C4分取用HPLCクロマトグラフィーによって単離し、所望の生成物分子量(MALDI−MS)を示す画分をプールし、凍結乾燥させて、71.4mg(74%)の紫色粉末CP3、ESMS(m/z calc.=2345.92(MH+ 一同位体),obs.=2345.47)とした。
【0454】
ローダミングリーンからのトリフルオロアセチル保護基の除去:
71.4mg(30.4μmol)のCP3を、10mlの4:1のCH3CN/H2O中に溶解させた。これに、200mg(1886μmol)のNa2CO3を加えた。16時間ボルテックスした後、上澄みを不溶性物質からデカントした。反応容器を1mlのDMSOですすぎ洗浄し;これを上澄みと一緒にし、そして生成物を、C4分取用HPLCクロマトグラフィーによって単離した。生成物分子量(MALDI−MS)を示す画分を一緒にし、凍結乾燥させて、64mg(98%)の紫色粉末CP4、ESMS(m/z calc.=2155.54(MH+ 平均),obs.=2155.27)とした。CP4は、所望の合成ペプチド基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2である。
【0455】
物質:
試薬は全て、入手可能な最高の商用純度のものを購入し、そして更に精製することなく用いた。ペプチド合成のための試薬は全て、次のものを除いて、Applied Biosystems, Foster City, CA, USA から購入した。QSYTM−7マレイミド(カタログ番号Q−10257)およびローダミングリーンカルボン酸,トリフルオロアセトアミド,スクシンイミジルエステル(5(6)−CR 110TFA,SE)*混合異性体*(カタログ番号R−6112)は、Molecular Probes,Inc., OR, USA から購入した;FMOC−PAL−PEG−PSは、Perseptive Biosystems, MA, USA(カタログ番号GEN913384)から購入した;FMOC−B−アラニンおよびFMOC−d−フェニルアラニンは、Novabiochem, CA, USA から購入した;FMOC−Arg(Pbf)−OHは、AnaSpec,Inc., CA, USA から購入した;2,2,2−トリフルオロエタノールは、Aldrich, WI,USA から購入した。炭酸ナトリウムは、Fisher, PA, USA から購入した。
【0456】
分取用HPLCクロマトグラフィーは、Vydac(CA, USA)C18(カタログ番号218TP1022)またはC4(カタログ番号214TP1022)カラム上において、10ml/分の流速で、0%〜80%の直線勾配(A=5%CH3CN/0.1%TFA/94.9%H2O,B=100%CH3CN)で30分間にわたって溶離して行って、30秒の時間画分を集めた。分析用HPLC−MSは、Waters(MA, USA)2690 HPLCインレットおよび Waters 996フォトダイオードアレイ検出器と連結された Micromass(Manchester, UK)LCT質量分析計(外部校正される標準に基づく質量)を用いて、Vydac C4(カタログ番号214TP5415)カラム上における0%〜80%の直線勾配(A=5%CH3CN/0.1%TFA/94.9%H2O,B=100%CH3CN)で1ml/分の流速で30分間にわたるクロマトグラフィーを行って実施した。デコンボリューション分子量は、多重荷電実測イオンから、Micromass 変換ソフトウェアを用いて計算した。MALDI−MSは、Perseptive Biosystems Voyager−DEリニア型質量分析計において、αシアノ4−ヒドロキシケイヒ酸マトリックス(Hewlett Packard, CA, USA)を用いて得て、報告した質量は外部校正に基づく。
【0457】
操作(化学構造を含む):
CP4(=合成ペプチド基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSYTM−7)−βAla−NH2)を、鍵中間体CP3を固相ペプチド合成スキーム中に包含させることによって合成する。
【0458】
スキーム1:
【0459】
【化1】
要約すると、FMOC−PAL−PEG樹脂を、収率および時間の効率について最適化される固相ペプチド合成プロトコールを用いて作り上げる。これらサイクル(上記に充分な詳細)は、2回のFMOC脱保護、洗浄、HBTUで活性化したアミノ酸の1回のカップリング、洗浄、キャッピング、そして最後に、初めはNMPで、次に1:1のトリフルオロエタノール/ジクロロメタンでの洗浄を包含する。これら洗浄は、樹脂二次構造を弛緩させるのを助けて、次のサイクル中に次の入ってくるアミノ酸の完全な脱保護および有効なカップリングを可能にする。
【0460】
CP2を、スキーム2にしたがって合成する(上記に充分な詳細):
【0461】
【化2】
このQSY−7タグの包含後、スキーム3にしたがって、二番目の発蛍光団であるローダミングリーンを、ビストリフルオロアセチル保護された色素として加える:
【0462】
【化3】
最後に、トリフルオロアセチル基を、Na2CO3での処理によって除去して、所望の基質CP4を与える:
【0463】
【化4】
検定
検定用の試薬は、最初に、次のように調製する:
基質溶液は、基質ローダミングリーン−Gly−Gly−dPhe−Leu−Arg−Arg−Val−Cys(QSY7)−βAla−NH2を50mM HEPES緩衝液pH7.4(Sigma, UK)中に2μMの濃度で再懸濁させた後、25mlにつき1個のEDTA不含プロテアーゼ阻害剤混合物錠剤(Roche Diagnostics, UK)を加えることによって調製する。
【0464】
上記のSEP酵素のアリコートを融解させた後、50mM HEPES、pH7.4中に、その50μlが、検定中に約30%の基質を生成物に変換するのに充分な酵素を含有するように、各々の酵素バッチに特異的な所定の因子によって希釈させる。
【0465】
4mlのDMSO+96mlの50mM HEPES pH7.4を含んで成る4%DMSOを調製する。
生成物溶液は、500μlの基質溶液を、250μlの酵素溶液+250μlの4%DMSO溶液に加え、そして37℃で16時間インキュベートすることによって調製する。
【0466】
検定を次のように設定する:
黒色96ウェル微量滴定プレート中において、100μlの基質溶液を50μlの4%DMSO溶液に加える。同様の非特異的バックグラウンドブランクも設定するが、ここにおいて、この50μlの4%DMSO溶液は、更に、40μMホスホルアミドンを含有する。50μlの酵素溶液をその検定およびブランクに加え、その96ウェルプレートをBMGギャラクシー蛍光リーダー中に入れて、Biolise ソフトウェアパッケージで操作する(BMG Lab technologies, Offenberg, Germany)。
【0467】
そのプレートを、蛍光リーダー中において37℃で1時間インキュベートし、蛍光測定値を3分毎に得る(励起(Ex)485nm/発光(Em)535nm)。SEPのタンパク質分解活性は、試料の蛍光の増加速度から非特異的バックグラウンドブランクの蛍光単位の増加速度を差し引いたものに相当する。4回の成功した示数についてそのソフトウェアによって計算される最大速度測定値(MaxV)を、この計算に用いる。
【0468】
同一微量滴定プレート上のウェル中の200μlの生成物から得られる蛍光測定値を用いる。必要ならば、この値を、SEP検定の60分の時点から測定された蛍光単位と一緒に用いて、1時間のインキュベーション時間中にタンパク質分解される基質の百分率(%)を計算する、または測定された蛍光増加速度を、タンパク質分解された基質ng/分/ml(酵素)のような他の有用な単位に変換する。
【0469】
この検定を用いて、Butterworths によって公表された Athel Cornish Bowden, 1979 による Fundamentals of Enzyme Kinetics に記載の標準的な原理にしたがって、VmaxおよびKmのような酵素反応速度論パラメーターを計算する。
【0470】
SEP阻害剤の阻害パラメーターを決定するためのSEP検定の使用
SEP阻害剤(例えば、ホスホルアミドン)ののIC50を決定するために、多重SEP検定を、上記のように、50μlのDMSO溶液(阻害剤の10mM100%DMSO原液の4%DMSO/50mM HEPES pH7.4を用いる適当な希釈によって作られる)中に含まれる一定範囲の試験濃度の阻害剤で行う。適当な標準グラフフィッティング計算機プログラムを用いて、S字形用量反応曲線を、対数阻害剤濃度に対するMaxV(または阻害%または活性%)のプロットに適合させる。IC50は、50%の最大阻害を引き起こす阻害剤濃度として計算する。典型的には、ある与えられたIC50決定値について、半対数単位増加量が異なる一定用量範囲の少なくとも10種類の阻害剤濃度を用いる。
【0471】
この検定を用いて、例えば、Butterworths によって公表された Athel Cornish Bowden, 1979 による Fundamentals of Enzyme Kinetics に記載の標準的な酵素学原理にしたがって、阻害のKiおよびモード(すなわち、この阻害が競合的、混合、非競合的であるかどうか等)を決定する。
【0472】
実施例5−性的興奮の動物モデル
本研究において、本発明者は、男性および女性の性的興奮の生理学についての強壮な再現可能モデルを開発した。このモデルは、麻酔されたウサギを用い、Laser Doppler 技法を用いて空洞内血圧および性器血流を監視し、同時に、心臓血管パラメーターを常套的に記録する。本発明者は、試験薬の不存在下および存在下における骨盤神経刺激またはVIPの注入によって引き起こされる陰茎中の空洞内血圧および膣(および陰核さえも)血流の僅かな変化を測定することができる。
【0473】
本発明者は、この動物モデルが、臨床データに直接的に反映すると考えている。したがって、このモデルを用いて、空洞内血圧の増加による陰茎勃起の増進および膣または陰核血流増進を測定するなどの、MEDおよびFSADの予防および/または処置のための候補薬を研究することができる。
【0474】
男性および女性の性的興奮に関与する潜在的物質としてVIPおよび他の神経ペプチドを識別すること
血管作用性腸管ペプチド(VIP)として知られる前性的(pro−sexual)神経ペプチドを分解するSEPの能力を、例えば、ラジオイムノアッセイ(RIA)であって、Peninsula Laboratories, CA, USA から商業的に入手できるVIP RIAなどを利用することによって測定する。
【0475】
SEP酵素試料、典型的には、5〜100μlの組換えSEP(上記の方法によって製造される)を、VIPペプチド試料、典型的には、1〜10ngと一緒に、50mM HEPES,pH7.4のような緩衝液中において37℃で5時間インキュベートする。これと同一であるが10μMホスホルアミドンも含有する負の対照を設定し、同一に処理する。インキュベーション時間後、試料および負の対照双方に残っているVIPの量を、製造者の取扱説明書によりRIAを用いて決定する。負の対照に対する試料中のVIP量の減少は、SEPのVIPタンパク質分解活性の尺度である。この検定を用いて、例えば、Butterworths によって公表された Athel Cornish Bowden, 1979 による Fundamentals of Enzyme Kinetics に記載の標準的な原理にしたがって、VmaxおよびKmのような酵素反応速度論パラメーターを決定する。
【0476】
実施例6−SEP阻害剤についての動物試験法
女性性的機能不全動物モデル
麻酔プロトコール
雌ニュージーランドウサギ(〜2.5kg)に、Medetomidine(Domitor(登録商標))0.5ml/kg 筋肉内(i.m.)および Ketamine(Vetalar(登録商標))0.25ml/kg 筋肉内(i.m.)の組合せを前投与し、同時に、フェイスマスクによる吸入酸素を維持する。これらウサギを、ベンチレーターに連結された PortexTMカフなし気管内チューブ3IDを用いて気管切開し、そして30〜40呼吸/分の換気速度において、18〜20mlのおよその一回呼吸量および10cmH2Oの最大気道圧で維持する。次に、麻酔薬を Isoflurane に切り替え、2l/分でのO2で換気を続ける。右耳辺縁静脈に、23Gまたは24Gカテーテルを用いてカニューレ挿入し、乳酸加リンガー液を0.5ml/分で灌流させる。このウサギを、侵襲性手術中は3% Isoflurane で維持し、維持麻酔には2%に降下させる。
【0477】
血管のカニューレ挿入
ウサギの左鼠けい部を剃毛し、垂直切開を大腿に沿って約5cmの長さで行う。大腿静脈を露出させ、分離後、薬物および化合物の注入用にPVCカーテル(17G;Portex Limited, Hythe, Kent, UK)をカニューレ挿入する。カニューレ挿入を大腿動脈について繰り返し、カテーテルを10cmの深さまで挿入して、カテーテルが腹大動脈に確実に達するようにする。この動脈カテーテルを Gould システムに連結して、血圧を記録する。血液ガス分析のための試料も、この動脈カテーテルによって採取する。収縮期および拡張期血圧を測定し、そして式[(拡張期x2+収縮期)÷3]を用いて平均動脈血圧を計算する。心拍数は、脈波型酸素飽和度計および Po−ne−mah データ捕捉ソフトウェアシステム(Ponemah Physiology Platform, Gould Instrument Systems,Inc., OH, USA)を用いて測定する。
【0478】
骨盤神経の刺激
腹部正中切開を腹腔中に行う。この切開は、恥骨直上約5cmの長さである。脂肪および筋肉を大まかに切除して、体腔の下に走る下腹神経を露出させる。恥骨の上にある大腿静脈および動脈を損傷させないために、恥骨壁の側弯曲に近い状態を保つことが不可欠である。坐骨神経および骨盤神経は、より深部にあり、ウサギの背側に更に切開後に見出される。坐骨神経がいったん識別されると、骨盤神経は容易に見出される。骨盤神経という用語は、大まかに用いられており;これについての解剖学書では、これら神経を充分に詳細に定義することができない。しかしながら、この神経の刺激は、膣および陰核の血流の増加および骨盤領域の神経支配を引き起こす。この骨盤神経を周囲組織から分離し、Harvard 双極刺激電極をその神経のまわりに置く。この神経を、ある程度の引っ張りを与えるように僅かに持ち上げた後、電極を適所に確保する。約1mlの軽パラフィン油をその神経および電極のまわりに置く。これは、神経への保護潤滑剤として作用し且つ電極の血液混入を防止する。電極を Grass S88 Stimulator につなぐ。骨盤神経を、次のパラメーター、すなわち、5V、0.5msパルス幅、10秒の刺激持続および2〜16Hzの周波数範囲、を用いて刺激する。再現性応答は、神経を15〜20分毎に刺激した場合に得られる。
【0479】
周波数応答曲線を、亜最大下応答として用いる最適周波数を決定するために、各実験の開始時に決定し、通常は4Hzである。試験される1種類または複数の化合物を、大腿静脈により、Harvard 22注入ポンプを用いて注入して、連続15分刺激サイクルを可能にする。
【0480】
Laser Doppler 探針の配置
腹部正中切開を骨盤の尾側末端に行って、骨盤部位を露出させる。結合組織を除去して、陰核膜を露出させ、その壁が小血管から確実に離れているようにする。外部膣壁も、結合組織を全て除去することによって露出させる。一つの Laser Doppler フロー探針を膣内に3cm挿入するので、探針シャフトの半分はまだ見えている。第二探針は、外部陰核壁直上にあるように配置する。次に、これら探針の位置を、シグナルが得られるまで調整する。第二探針を外部膣壁上の血管表面直上に置く。両方の探針を適所にクランプで固定する。
【0481】
膣および陰核の血流を、Po−ne−mah データ捕捉ソフトウェア(Ponemah Physiology Platform, Gould Instrument Systems,Inc.)を用いて Flowmeter から直接的に数値としてか、または Gould チャートレコーダートレースから間接的に記録する。校正は実験開始時に設定する(0〜125ml/分/100g組織)。
【0482】
血管作用性腸管ペプチド(VIP)の注入
注入されるVIP(Bachem, H−3775)の用量は、2.0、6.0、20.0、60.0μg/kg 静脈内(i.v.)であり、0.5ml容量の生理食塩水中で注入する。VIPは、三方タップによって大腿静脈中に500μl/分で注入する Harvard 22ポンプを用いて注入する。VIP注入後、カテーテルをヘパリン加生理食塩水(Hepsaline)で洗浄するので、カテーテル中にはVIPが残っていない。
【0483】
VIP注入を用いた実験には、再現性応答を得られるように最初の感作性用量反応曲線(2〜60μg/kg)のが必要である。Hepsaline(50UI/ml)の最初の注入は、負の対照として作用するように注入する。
【0484】
阻害剤の注入
SEP阻害剤およびビヒクル対照は、VIPと同速度で注入する。SEP阻害剤は、VIP用量反応曲線の前の30分間放置し、骨盤神経刺激の前の15分間放置する。
【0485】
データは、平均性器(膣/陰核)血流±平均の標準誤差(s.e.m.)として表す。有意の変化は、スチューデントt検定を用いて確認する。
男性性的機能不全動物モデル
ウサギ麻酔法
雄ニュージーランドウサギ(〜2.5kg)に、Medetomidine(Domitor(登録商標))0.5ml/kg 筋肉内(i.m.)および Ketamine(Vetalar(登録商標))0.25ml/kg 筋肉内(i.m.)の組合せを前投与し、同時に、フェイスマスクによる吸入酸素を維持する。これらウサギを、ベンチレーターに連結された PortexTMカフなし気管内チューブ3IDを用いて気管切開し、そして30〜40呼吸/分の換気速度において、18〜20mlのおよその一回呼吸量および10cmH2Oの最大気道圧で維持する。次に、麻酔薬を Isoflurane に切り替え、2l/分でのO2で換気を続ける。右耳辺縁静脈に、23Gまたは24Gカテーテルを用いてカニューレ挿入し、乳酸加リンガー液を0.5ml/分で灌流させる。このウサギを、侵襲性手術中は3% Isoflurane で維持し、維持麻酔には2%に降下させる。
【0486】
血管のカニューレ挿入
ウサギの左鼠けい部を剃毛し、垂直切開を大腿に沿って約5cmの長さで行う。大腿静脈を露出させ、分離後、薬物および化合物の注入用にPVCカーテル(17G;Portex Limited)をカニューレ挿入する。或いは、または更に、左頸静脈を露出させ、分離後、薬物および化合物の注入用にPVCカーテル(17G;Portex Limited)をカニューレ挿入する。カニューレ挿入を大腿動脈について繰り返し、カテーテルを10cmの深さまで挿入して、カテーテルが腹大動脈に確実に達するようにする。この動脈カテーテルを Gould システムに連結して、血圧を記録する。血液ガス分析のための試料も、この動脈カテーテルによって採取する。収縮期および拡張期血圧を測定し、そして式[(拡張期x2+収縮期)÷3]を用いて平均動脈血圧を計算する。心拍数は、脈波型酸素飽和度計および Po−ne−mah データ捕捉ソフトウェアシステム(Ponemah Physiology Platform, Gould Instrument Systems, Inc.)を用いて測定する。
【0487】
骨盤神経の刺激
腹部正中切開を腹腔中に行う。この切開は、恥骨直上約5cmの長さである。脂肪および筋肉を大まかに切除して、体腔の下に走る下腹神経を露出させる。恥骨の上にある大腿静脈および動脈を損傷させないために、恥骨壁の側弯曲に近い状態を保つことが不可欠である。坐骨神経および骨盤神経は、より深部にあり、ウサギの背側に更に切開後に見出される。坐骨神経がいったん識別されると、骨盤神経は容易に見出される。骨盤神経という用語は、大まかに用いられており;これについての解剖学書では、これら神経を充分に詳細に定義することができない。しかしながら、この神経の刺激は、空洞内血圧および空洞血流の増加および骨盤領域の神経支配を引き起こす。この骨盤神経を周囲組織から分離し、Harvard 双極刺激電極をその神経のまわりに置く。この神経を、ある程度の引っ張りを与えるように僅かに持ち上げた後、電極を適所に確保する。約1mlの軽パラフィン油をその神経および電極のまわりに置く。これは、神経への保護潤滑剤として作用し且つ電極の血液混入を防止する。電極を Grass S88 Stimulator につなぐ。骨盤神経を、次のパラメーター、すなわち、5V、0.5msパルス幅、16Hzの周波数で20秒の刺激持続を用いて刺激する。再現性応答は、神経を15〜20分毎に刺激した場合に得られる。
【0488】
上のパラメーターを用いた数回の刺激を行って、平均対照応答を決定する。試験される1種類または複数の化合物を、頸静脈により、Harvard 22注入ポンプを用いて注入して、連続15分刺激サイクルを可能にする。陰茎のまわりの皮膚および結合組織を除去して、陰茎を露出させる。カテーテルセット(Insyte−W,Becton−Dickinson 20 Gauge 1.1x48mm,Becton−Dickinson)を、白膜を介して左海綿体腔中に挿入し、針を除去して、軟質カテーテルを残す。このカテーテルを、圧力変換器(Ohmeda 5299−04)によって Gould システムに連結して、空洞内血圧を記録する。空洞内血圧がいったん決定されたら、そのカテーテルを、Vetbond(組織用接着剤,3M)を用いて適所で密封する。心拍数は、脈波型酸素飽和度計および Po−ne−mah データ捕捉ソフトウェアシステム(Ponemah Physiology Platform, Gould Instrument Systems,Inc.)を用いて測定する。
【0489】
空洞内血流は、Po−ne−mah データ捕捉ソフトウェア(Ponemah Physiology Platform, Gould Instrument Systems,Inc.)を用いて Flowmeter から直接的に数値としてかまたは Gould チャートレコーダートレースから間接的に記録する。校正は実験開始時に設定する(0〜125ml/分/100g組織)。
【0490】
阻害剤の注入
SEP阻害剤およびビヒクル対照は、0.1ml/秒の速度で注入する。SEP阻害剤は、骨盤神経刺激の前の15分間放置する。
【0491】
データは、平均空洞内血圧±s.e.m.として表す。有意の変化は、スチューデントt検定を用いて確認する。
【0492】
【配列表】
【0493】
【表3】
【0494】
【表4】
【0495】
【表5】
配列番号:1は、ヒトSEPをコードしているヌクレオチド配列(cDNA)を示す。
【0496】
配列番号:2は、+1読み取り枠中のcDNA配列の翻訳から予想されるヒトSEPタンパク質を示す。
配列番号:3および4は、ヒトSEPをコードしているヌクレオチド配列(cDNA)の同定で用いられるオリゴヌクレオチドプライマー配列を示す。
【0497】
配列番号:5は、5’および3’部分ベクター配列(強調されている)を含めた、ヒトSEPをコードしているヌクレオチド配列(cDNA)を示す。
参考文献
Argiolas, A. et al (1995), Neuromodulation of penile erection. Prog Neurobiol. 47:235−255.
Benet, A. E. et al (1994), Male erectile dysfunction assessment and treatment options. Comp. Ther. 20:669−673.
Boolel, M. et al (1996). Sildenafil, a novel effective oral therapy for male erectile dysfunction. Br. J. of Urology 78:257−261.
Carter AJ. et al (1998). Effect of the selective phosphodiesterase type 5 inhibitor sildenafil on erectile dysfuntion in the anesthetized dog. J. Urol. 160:242−6.
Chiou, W. F. et al (1998). Relaxation of corpus cavernosum and raised intracavernous pressure by berberine in rabbit. Br. J. Pharmacol. 125:1677−1684.
Jeremy, J. Y. et al (1997). Effects of sildenafil,a type−5 cGMP phosphodiesterase inhibitor,and papaverine on cyclic GMP and cyclic AMP levels in the rabbit corpus cavernosum in vitro. Br.J.Urology 79:958−963.
Lerner, S. E. et al (1993). A review of erectile dysfunction: new insights and more questions. J. Urology 149:1246−1255.
Melman, A. & Gingell, J. C. (1999). The epidemiology and pathophysiology of erectile dysfunction. J. Urology 161:5−11.
Montague, D. et al (1996). Clinical guidelines panel on erectile dysfunction: Summary report on the treatment of organic erectile dysfunction. J. Urology 156:2007−2011.
Naylor, A. M. (1998). Endogenous neurotransmitters mediating penile erection. Br. J. Urology 81:424−431.
NIH Consensus Development Panel on Impotence (1993). NIH Consensus Conference Impotence. J.A.M.A. 270:83.
Omote M. (1999). Pharmacological profiles of sildenafil (VIAGRA) in the treatment of erectile dysfuntion: efficacy and drug interaction with nitrate. Nippon Yakurigaku Zasshi. 114:213−8.
Taub. H. C. et al (1993). Relationship between contracion and relaxation in human and rabbit corpus cavernosum. Urology 42:698−704.
Traish AM, et al (1999). Effects of castration and androgen replacement on erectile function in a rabbit model. Endocrinology. 140:1861−8.
【図面の簡単な説明】
【図1】
図1は、ヒトSEP cDNA配列の読み取り枠(ORF)の分析を示す。
【図2】
図2は、blastpアルゴリズムからのペアワイズアラインメントによるヒトSEPの最も密接に関係したヒトタンパク質に対しての比較を示す。
【図3】
図3は、blastp(タンパク質)およびfasta(コーディングヌクレオチド)アルゴリズムからのペアワイズアラインメントによるSEPについてのヒト、ラットおよびマウス配列の比較を示す。
【図4】
図4は、触媒ドメインを示すヒトSEPおよび関係したヒトタンパク質の多重アラインメントを示す。
【図5】
図5は、触媒ドメインを示すヒト、ラットおよびマウスSEPタンパク質の多重アラインメントを示す。
【図6】
図6は、触媒ドメインを示すヒト、ラットおよびマウスSEPコーディング配列の多重アラインメントを示す。
【図7】
図7は、全SEP様タンパク質の多重アラインメントに由来する放射状樹として表される、Neighbour−Joining Distance 法による系統分析を示す。
【図8】
図8は、多重アラインメントの触媒ドメイン領域に由来する放射状樹として表される、Neighbour−Joining Distance 法による系統分析を示す。
Claims (15)
- 単離されたおよび/または精製されたポリヌクレオチドであって、
(a)配列番号:2に示されるポリペプチドをエンコードしているポリヌクレオチド;
(b)配列番号:1または配列番号:5のヌクレオチド配列を含むポリヌクレオチド;
(c)NCIMB41110中に含有されるDNAによって発現されたポリペプチドをエンコードしているポリヌクレオチド;
(d)(a)〜(c)のいずれか一つのポリヌクレオチドに少なくとも83%の同一性を有するヌクレオチド配列を含むポリヌクレオチド;
(e)(a)〜(d)のいずれか一つのポリヌクレオチドにハイブリッド形成することができるヌクレオチド配列を含むポリヌクレオチド;
(f)(a)〜(e)のいずれか一つのポリヌクレオチドの相補鎖;または
(g)(a)〜(f)のいずれか一つのポリヌクレオチドのポリヌクレオチドフラグメント
の内の一つまたはそれを越えるものを含む上記ポリヌクレオチド。 - ヒト可溶性分泌エンドペプチダーゼ(ヒトSEP)をエンコードする請求項1に記載のポリヌクレオチド。
- ポリペプチドまたはそのフラグメントを製造する方法であって、請求項1または請求項2に記載のポリヌクレオチドを含むベクターで形質転換されたまたはトランスフェクションされた宿主細胞を、該ポリペプチドまたはそのフラグメントの発現に充分な条件下の培地中で培養することを含む上記方法。
- SEP活性を有するポリペプチドであって、
(a)配列番号:1または配列番号:5のポリヌクレオチド配列から翻訳される推定のアミノ酸配列を有するポリペプチドおよびその変異体、フラグメント、ホモログ、類似体および誘導体;
(b)配列番号:2のポリペプチドおよびその変異体、フラグメント、ホモログ、類似体および誘導体;
(c)NCIMB41110のcDNAによってエンコードされたポリペプチドおよびその変異体、フラグメント、ホモログ、類似体および誘導体;または
(d)ポリペプチドであって、(i)配列番号:1または配列番号:5のポリヌクレオチドによってエンコードされたポリペプチド、(ii)配列番号:2のポリペプチド、または(iii)NCIMB41110のcDNAによってエンコードされたポリペプチドに少なくとも78%の同一性を有するもの
の内の一つまたはそれを越えるものを含む上記ポリペプチド。 - 請求項4に記載のポリペプチドに対する抗体。
- 請求項4に記載のポリペプチドを阻害するまたは選択的に阻害する化合物。
- 医薬組成物であって、請求項5に記載の抗体または請求項6に記載の化合物および1種類またはそれを越える薬学的に許容しうる担体、希釈剤または賦形剤を含む上記医薬組成物。
- 製剤として用いるための請求項5に記載の抗体、請求項6に記載の化合物または請求項7に記載の組成物。
- 性的機能不全、特に、男性勃起機能不全(MED)または女性性的機能不全(FSD)の予防および/または処置のための薬剤の製造における請求項5に記載の抗体または請求項6に記載の化合物の使用。
- 前記女性性的機能不全(FSD)が女性性的興奮障害(FSAD)である請求項9に記載の使用。
- 患者の性的機能不全、特に、男性勃起機能不全(MED)または女性性的機能不全(FSD)の予防および/または処置の方法であって、該患者に治療的有効量の請求項5に記載の抗体または請求項6に記載の化合物を投与することを含む上記方法。
- 前記女性性的機能不全(FSD)が女性性的興奮障害(FSAD)である請求項11に記載の方法。
- 請求項4に記載のポリペプチドを過剰発現する、過少発現するまたはその標的挿入または欠失を示すように ex vivo または in vivo で遺伝子操作された細胞。
- 請求項13に記載の細胞を含む非ヒト動物。
- 請求項4に記載のポリペプチドを生じることができる受託番号NCIMB41110として寄託された細胞およびそれに由来しうる変異体および突然変異体。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB0017387.2A GB0017387D0 (en) | 2000-07-14 | 2000-07-14 | Novel enzyme |
| PCT/IB2001/001263 WO2002006492A1 (en) | 2000-07-14 | 2001-07-16 | A novel human soluble secreted endopeptidase (sep) for the treatment of sexual dysunfction |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004504032A true JP2004504032A (ja) | 2004-02-12 |
| JP2004504032A5 JP2004504032A5 (ja) | 2005-02-24 |
Family
ID=9895717
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002512384A Pending JP2004504032A (ja) | 2000-07-14 | 2001-07-16 | 性的機能不全の処置用の新規なヒト可溶性分泌エンドペプチダーゼ(sep) |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US6878529B2 (ja) |
| EP (1) | EP1303619A1 (ja) |
| JP (1) | JP2004504032A (ja) |
| AU (1) | AU2001269371A1 (ja) |
| CA (1) | CA2415557A1 (ja) |
| GB (1) | GB0017387D0 (ja) |
| MX (1) | MXPA03000426A (ja) |
| WO (1) | WO2002006492A1 (ja) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020086405A1 (en) * | 2000-09-25 | 2002-07-04 | Inmaculada Silos-Santiago | 56638, a novel human neprilysin protease and uses thereof |
| ATE406438T1 (de) * | 1999-11-19 | 2008-09-15 | Solvay Pharm Bv | Menschliches homolog aus der familie der metalloproteasen |
| US6650943B1 (en) | 2000-04-07 | 2003-11-18 | Advanced Bionics Corporation | Fully implantable neurostimulator for cavernous nerve stimulation as a therapy for erectile dysfunction and other sexual dysfunction |
| GB0017387D0 (en) * | 2000-07-14 | 2000-08-30 | Pfizer Ltd | Novel enzyme |
| US6991916B2 (en) * | 2000-07-14 | 2006-01-31 | Pfizer Inc. | Compounds for the treatment of sexual dysfunction |
| US20020091129A1 (en) * | 2000-11-20 | 2002-07-11 | Mitradev Boolell | Treatment of premature ejaculation |
| US6885895B1 (en) * | 2001-04-26 | 2005-04-26 | Advanced Bionics Corporation | Methods and systems for electrical and/or drug stimulation as a therapy for erectile dysfunction |
| BR0209855A (pt) * | 2001-05-18 | 2004-06-15 | Solvay Pharm Gmbh | Uso de compostos com atividade inibidora de nep/mp combinada na preparação de medicamentos |
| US7262184B2 (en) | 2003-09-26 | 2007-08-28 | Solvay Pharmaceuticals Gmbh | Amidomethyl-substituted 1-(carboxyalkyl) cyclopentyl-carbonylamino-benzazepine-N-acetic acid compounds, process and intermediate products for their preparation and pharmaceutical compositions containing them |
| US7427611B2 (en) | 2003-09-26 | 2008-09-23 | Solvay Pharmaceuticals Gmbh | Amidomethyl-substituted 1-(carboxyalkyl)-cyclopentyl-carbonylamino-benzazepine-N-acetic acid compounds, process and intermediate products for their preparation and pharmaceutical compositions containing them |
| US7452875B2 (en) | 2003-09-26 | 2008-11-18 | Solvay Pharmaceuticals Gmbh | Amidomethyl-substituted 1-(carboxyalkyl) cyclopentyl-carbonylamino-benzazepine-N-acetic acid compounds, process and intermediate products for their preparation and pharmaceutical compositions containing them |
| WO2005112939A1 (en) * | 2004-05-14 | 2005-12-01 | Solvay Pharmaceuticals Gmbh | Medicaments containing dually acting inhibitors of neutral endopeptidase and of human soluble endopeptidase for the treatment of sexual dysfunction |
| US20050267072A1 (en) * | 2004-05-14 | 2005-12-01 | Solvay Pharmaceuticals Gmbh | Pharmaceutical compositions containing dually acting inhibitors of neutral endopeptidase for the treatment of sexual dysfunction |
| US20050267124A1 (en) * | 2004-05-14 | 2005-12-01 | Solvay Pharmaceuticals Gmbh | Pharmaceutical compositions comprising NEP-inhibitors, inhibitors of the endogenous producing system and PDEV inhibiitors |
| US20080199065A1 (en) * | 2004-05-17 | 2008-08-21 | Christopher Paul Swain | Method, System and Device for In-Vivo Biopsy |
| AU2008227875B2 (en) | 2007-03-19 | 2014-06-12 | Insuline Medical Ltd. | Drug delivery device |
| US8622991B2 (en) | 2007-03-19 | 2014-01-07 | Insuline Medical Ltd. | Method and device for drug delivery |
| US9220837B2 (en) | 2007-03-19 | 2015-12-29 | Insuline Medical Ltd. | Method and device for drug delivery |
| EP2231229A1 (en) | 2007-12-18 | 2010-09-29 | Insuline Medical Ltd. | Drug delivery device with sensor for closed-loop operation |
| RU2532893C2 (ru) | 2008-11-07 | 2014-11-10 | Инсьюлин Медикал Лтд. | Устройство и способ доставки лекарственных средств |
| EP2432454B1 (en) | 2009-05-19 | 2017-03-01 | Neuroderm Ltd | Compositions for continuous administration of dopa decarboxylase inhibitors |
| DK3326615T3 (da) | 2010-11-15 | 2020-03-09 | Neuroderm Ltd | Kontinuerlig indgivelse af l-dopa-, dopa- decarboxylase-inhibitorer, catechol-o-methyltransferaseinhibitorer og sammensætninger til samme |
| WO2013025261A2 (en) * | 2011-04-06 | 2013-02-21 | Georgia Tech Research Corporation | Fluorogenic peptide probes and assays |
| US9375202B2 (en) | 2012-05-04 | 2016-06-28 | Given Imaging Ltd. | Device and method for in vivo cytology acquisition |
| CA2875446A1 (en) | 2012-06-05 | 2013-12-12 | Neuroderm Ltd. | Compositions comprising apomorphine and organic acids and uses thereof |
| BR112016021034A8 (pt) | 2014-03-13 | 2021-06-29 | Neuroderm Ltd | composição farmacêutica, uso da mesma e kit |
| US10258585B2 (en) | 2014-03-13 | 2019-04-16 | Neuroderm, Ltd. | DOPA decarboxylase inhibitor compositions |
| CN112546453B (zh) * | 2020-10-15 | 2022-11-29 | 西安蓝极医疗电子科技有限公司 | 基于激光照射治疗男性勃起功能障碍的发光体组件及装置 |
| US11844754B2 (en) | 2020-11-17 | 2023-12-19 | Neuroderm, Ltd. | Methods for treatment of Parkinson's disease |
| US11331293B1 (en) | 2020-11-17 | 2022-05-17 | Neuroderm, Ltd. | Method for treatment of Parkinson's disease |
| US11213502B1 (en) | 2020-11-17 | 2022-01-04 | Neuroderm, Ltd. | Method for treatment of parkinson's disease |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2777291B1 (fr) | 1998-04-08 | 2000-07-07 | Inst Nat Sante Rech Med | Nouvelle metalloprotease membranaire nep ii et son utilisation pour le criblage d'inhibiteurs utiles en therapie |
| CA2260376A1 (en) | 1999-02-11 | 2000-08-11 | Universite De Montreal | New metalloproteases of the neprilysin family |
| EP1069188A1 (en) | 1999-07-15 | 2001-01-17 | Sanofi-Synthelabo | Three neprilysin-like membrane metallopeptidases |
| GB0017387D0 (en) * | 2000-07-14 | 2000-08-30 | Pfizer Ltd | Novel enzyme |
-
2000
- 2000-07-14 GB GBGB0017387.2A patent/GB0017387D0/en not_active Ceased
-
2001
- 2001-07-13 US US09/905,846 patent/US6878529B2/en not_active Expired - Fee Related
- 2001-07-16 EP EP01947731A patent/EP1303619A1/en not_active Withdrawn
- 2001-07-16 WO PCT/IB2001/001263 patent/WO2002006492A1/en not_active Application Discontinuation
- 2001-07-16 MX MXPA03000426A patent/MXPA03000426A/es unknown
- 2001-07-16 AU AU2001269371A patent/AU2001269371A1/en not_active Abandoned
- 2001-07-16 CA CA002415557A patent/CA2415557A1/en not_active Abandoned
- 2001-07-16 JP JP2002512384A patent/JP2004504032A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US20020102707A1 (en) | 2002-08-01 |
| US6878529B2 (en) | 2005-04-12 |
| AU2001269371A1 (en) | 2002-01-30 |
| GB0017387D0 (en) | 2000-08-30 |
| EP1303619A1 (en) | 2003-04-23 |
| CA2415557A1 (en) | 2002-01-24 |
| MXPA03000426A (es) | 2003-06-24 |
| WO2002006492A1 (en) | 2002-01-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6878529B2 (en) | Compounds for the treatment of sexual dysfunction | |
| US6991916B2 (en) | Compounds for the treatment of sexual dysfunction | |
| JP2004501637A (ja) | 新規プロテアーゼ | |
| US20040014131A1 (en) | Assay methods | |
| EP1554382B1 (en) | Gpr54 knock-out mammals and screening methods using them | |
| US9049849B2 (en) | Screening methods for compounds useful for treating pancreatic dysfunction | |
| US20010039037A1 (en) | Novel polypeptide | |
| EP1090989A1 (en) | Human g-protein-coupled receptor | |
| US6692936B1 (en) | Nucleic acid encoding a C5A anaphylatoxin receptor | |
| ES2291177T3 (es) | Polipeptido de tipo receptor acoplado a proteina g. | |
| US6780611B1 (en) | Polynucleotide encoding neuromedin U receptor | |
| WO2004048565A1 (ja) | アポトーシス関連蛋白質およびその用途 | |
| WO2004084930A1 (en) | Use of saposin-related proteins for preventing and treating obesity, diabetes and/or metabolic syndrome | |
| EP1090925A1 (en) | Human G-protein coupled receptor | |
| EP1090926A1 (en) | Human G-protein coupled receptor | |
| JP4451158B2 (ja) | 転写制御シスエレメント及びそれに特異的に結合する転写調節因子並びにそれらの用途 | |
| WO2001000799A1 (fr) | Nouvelle proteine et son adn | |
| EP1096008A2 (en) | Human G protein-coupled receptor, PFI-014 | |
| EP1094075A1 (en) | Human G-protein coupled receptor | |
| US20020064825A1 (en) | Novel polypeptide | |
| EP1094109A2 (en) | Human G protein-coupled receptor, PFI-010 | |
| EP1158002A1 (en) | Human G-protein coupled receptor | |
| WO2004078208A1 (ja) | MIP-3α抑制薬の医薬用途および脳・神経細胞保護剤のスクリーニング方法 | |
| JP2005506042A (ja) | 細胞トランスポーターをコードするポリヌクレオチド、およびその使用方法 | |
| JP2005507948A (ja) | エネルギー恒常性の調節に関与するエンドフィリン相同性タンパク質 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20050422 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20050927 |