JP2004123729A - ラタノプロストを有効成分とする澄明な点眼液 - Google Patents
ラタノプロストを有効成分とする澄明な点眼液 Download PDFInfo
- Publication number
- JP2004123729A JP2004123729A JP2003314865A JP2003314865A JP2004123729A JP 2004123729 A JP2004123729 A JP 2004123729A JP 2003314865 A JP2003314865 A JP 2003314865A JP 2003314865 A JP2003314865 A JP 2003314865A JP 2004123729 A JP2004123729 A JP 2004123729A
- Authority
- JP
- Japan
- Prior art keywords
- latanoprost
- bak
- solution
- benzalkonium chloride
- base
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- GGXICVAJURFBLW-CEYXHVGTSA-N latanoprost Chemical compound CC(C)OC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1CC[C@@H](O)CCC1=CC=CC=C1 GGXICVAJURFBLW-CEYXHVGTSA-N 0.000 title claims abstract description 55
- 229960001160 latanoprost Drugs 0.000 title claims abstract description 53
- 239000004615 ingredient Substances 0.000 title abstract 3
- 239000006210 lotion Substances 0.000 title abstract 3
- 235000002911 Salvia sclarea Nutrition 0.000 title 1
- 244000182022 Salvia sclarea Species 0.000 title 1
- 229960000686 benzalkonium chloride Drugs 0.000 claims abstract description 15
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 claims abstract description 15
- 239000004094 surface-active agent Substances 0.000 claims abstract description 15
- 238000002156 mixing Methods 0.000 claims abstract description 14
- 239000000203 mixture Substances 0.000 claims description 43
- 238000009472 formulation Methods 0.000 claims description 24
- 239000002997 ophthalmic solution Substances 0.000 claims description 21
- 239000012929 tonicity agent Substances 0.000 claims description 21
- 229940054534 ophthalmic solution Drugs 0.000 claims description 20
- 125000000217 alkyl group Chemical group 0.000 claims description 13
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 claims description 12
- 125000004432 carbon atom Chemical group C* 0.000 claims description 9
- PEDCQBHIVMGVHV-UHFFFAOYSA-N glycerol group Chemical group OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims description 8
- 239000003755 preservative agent Substances 0.000 claims description 8
- 230000002335 preservative effect Effects 0.000 claims description 8
- 239000002202 Polyethylene glycol Substances 0.000 claims description 6
- 239000004359 castor oil Substances 0.000 claims description 6
- 235000019438 castor oil Nutrition 0.000 claims description 6
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 claims description 6
- 229920001223 polyethylene glycol Polymers 0.000 claims description 6
- -1 polyoxyethylene Polymers 0.000 claims description 6
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 claims description 6
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 claims description 6
- 229920000053 polysorbate 80 Polymers 0.000 claims description 6
- 229940068968 polysorbate 80 Drugs 0.000 claims description 6
- 229920002685 Polyoxyl 35CastorOil Polymers 0.000 claims description 5
- 239000004480 active ingredient Substances 0.000 claims description 5
- 238000000034 method Methods 0.000 claims description 5
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 claims description 4
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 4
- 229930195725 Mannitol Natural products 0.000 claims description 4
- 229920003171 Poly (ethylene oxide) Polymers 0.000 claims description 4
- 229930006000 Sucrose Natural products 0.000 claims description 4
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 claims description 4
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 claims description 4
- 150000001875 compounds Chemical class 0.000 claims description 4
- 235000011187 glycerol Nutrition 0.000 claims description 4
- 239000000594 mannitol Substances 0.000 claims description 4
- 235000010355 mannitol Nutrition 0.000 claims description 4
- 239000005720 sucrose Substances 0.000 claims description 4
- RFVNOJDQRGSOEL-UHFFFAOYSA-N 2-hydroxyethyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCO RFVNOJDQRGSOEL-UHFFFAOYSA-N 0.000 claims description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 3
- 239000003795 chemical substances by application Substances 0.000 abstract description 6
- 208000010412 Glaucoma Diseases 0.000 abstract description 3
- 239000003814 drug Substances 0.000 abstract description 3
- 229940124597 therapeutic agent Drugs 0.000 abstract description 2
- 239000007951 isotonicity adjuster Substances 0.000 abstract 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 50
- 239000002585 base Substances 0.000 description 42
- 239000000243 solution Substances 0.000 description 38
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 36
- 239000008213 purified water Substances 0.000 description 31
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 24
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 15
- 235000019799 monosodium phosphate Nutrition 0.000 description 15
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 15
- 238000010438 heat treatment Methods 0.000 description 14
- 239000011780 sodium chloride Substances 0.000 description 12
- 229940110775 latanoprost ophthalmic solution Drugs 0.000 description 10
- 150000003839 salts Chemical class 0.000 description 9
- 239000011521 glass Substances 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 230000000052 comparative effect Effects 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 239000000654 additive Substances 0.000 description 5
- 241000894006 Bacteria Species 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 239000003889 eye drop Substances 0.000 description 4
- 229940012356 eye drops Drugs 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L sodium carbonate Substances [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- 239000008215 water for injection Substances 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 230000002421 anti-septic effect Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 208000028006 Corneal injury Diseases 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 229910021538 borax Inorganic materials 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 150000001805 chlorine compounds Chemical class 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 229910001629 magnesium chloride Inorganic materials 0.000 description 2
- TZBAVQKIEKDGFH-UHFFFAOYSA-N n-[2-(diethylamino)ethyl]-1-benzothiophene-2-carboxamide;hydrochloride Chemical compound [Cl-].C1=CC=C2SC(C(=O)NCC[NH+](CC)CC)=CC2=C1 TZBAVQKIEKDGFH-UHFFFAOYSA-N 0.000 description 2
- 239000003002 pH adjusting agent Substances 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- 238000004321 preservation Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000005185 salting out Methods 0.000 description 2
- 239000001632 sodium acetate Substances 0.000 description 2
- 235000017281 sodium acetate Nutrition 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 2
- 235000011083 sodium citrates Nutrition 0.000 description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 description 2
- 239000001488 sodium phosphate Substances 0.000 description 2
- 235000011008 sodium phosphates Nutrition 0.000 description 2
- 235000010339 sodium tetraborate Nutrition 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 239000002562 thickening agent Substances 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- BSVBQGMMJUBVOD-UHFFFAOYSA-N trisodium borate Chemical compound [Na+].[Na+].[Na+].[O-]B([O-])[O-] BSVBQGMMJUBVOD-UHFFFAOYSA-N 0.000 description 2
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 2
- 229940002639 xalatan Drugs 0.000 description 2
- HMUNWXXNJPVALC-UHFFFAOYSA-N 1-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]piperazin-1-yl]-2-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)N1CCN(CC1)C(CN1CC2=C(CC1)NN=N2)=O HMUNWXXNJPVALC-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- VZSRBBMJRBPUNF-UHFFFAOYSA-N 2-(2,3-dihydro-1H-inden-2-ylamino)-N-[3-oxo-3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propyl]pyrimidine-5-carboxamide Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C(=O)NCCC(N1CC2=C(CC1)NN=N2)=O VZSRBBMJRBPUNF-UHFFFAOYSA-N 0.000 description 1
- LDXJRKWFNNFDSA-UHFFFAOYSA-N 2-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)-1-[4-[2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidin-5-yl]piperazin-1-yl]ethanone Chemical compound C1CN(CC2=NNN=C21)CC(=O)N3CCN(CC3)C4=CN=C(N=C4)NCC5=CC(=CC=C5)OC(F)(F)F LDXJRKWFNNFDSA-UHFFFAOYSA-N 0.000 description 1
- YLZOPXRUQYQQID-UHFFFAOYSA-N 3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)-1-[4-[2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidin-5-yl]piperazin-1-yl]propan-1-one Chemical compound N1N=NC=2CN(CCC=21)CCC(=O)N1CCN(CC1)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F YLZOPXRUQYQQID-UHFFFAOYSA-N 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- NIPNSKYNPDTRPC-UHFFFAOYSA-N N-[2-oxo-2-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(CNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 NIPNSKYNPDTRPC-UHFFFAOYSA-N 0.000 description 1
- AFCARXCZXQIEQB-UHFFFAOYSA-N N-[3-oxo-3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(CCNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 AFCARXCZXQIEQB-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229920002565 Polyethylene Glycol 400 Polymers 0.000 description 1
- 229920002675 Polyoxyl Polymers 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 102000000471 Prostaglandin F receptors Human genes 0.000 description 1
- 108050008995 Prostaglandin F receptors Proteins 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 210000001742 aqueous humor Anatomy 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 239000002526 disodium citrate Substances 0.000 description 1
- 235000019262 disodium citrate Nutrition 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- CEYULKASIQJZGP-UHFFFAOYSA-L disodium;2-(carboxymethyl)-2-hydroxybutanedioate Chemical compound [Na+].[Na+].[O-]C(=O)CC(O)(C(=O)O)CC([O-])=O CEYULKASIQJZGP-UHFFFAOYSA-L 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- IXCSERBJSXMMFS-UHFFFAOYSA-N hcl hcl Chemical compound Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 230000004410 intraocular pressure Effects 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 1
- 235000019796 monopotassium phosphate Nutrition 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- 239000006174 pH buffer Substances 0.000 description 1
- JLFNLZLINWHATN-UHFFFAOYSA-N pentaethylene glycol Chemical compound OCCOCCOCCOCCOCCO JLFNLZLINWHATN-UHFFFAOYSA-N 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- PJNZPQUBCPKICU-UHFFFAOYSA-N phosphoric acid;potassium Chemical compound [K].OP(O)(O)=O PJNZPQUBCPKICU-UHFFFAOYSA-N 0.000 description 1
- 229920002503 polyoxyethylene-polyoxypropylene Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 150000003180 prostaglandins Chemical class 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- WUUHFRRPHJEEKV-UHFFFAOYSA-N tripotassium borate Chemical compound [K+].[K+].[K+].[O-]B([O-])[O-] WUUHFRRPHJEEKV-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
【課題】ラタノプロスト点眼液のより優れた処方を提供する。
【解決手段】ラタノプロストを有効成分とし、防腐剤として塩化ベンザルコニウムを配合した点眼液において、下記1)〜3)から選択される少なくとも一つの手段により、配合変化による白濁が防止された澄明な点眼液を提供する。1)界面活性剤を配合する手段、2)塩化ベンザルコニウムとして式[C6H5CH2N(CH3)2R]Cl(式中Rは炭素数12のアルキル基である)で表される塩化ベンザルコニウムを用いる手段、および3)等張化剤として非イオン性等張化剤を配合する手段。
【選択図】なし
【解決手段】ラタノプロストを有効成分とし、防腐剤として塩化ベンザルコニウムを配合した点眼液において、下記1)〜3)から選択される少なくとも一つの手段により、配合変化による白濁が防止された澄明な点眼液を提供する。1)界面活性剤を配合する手段、2)塩化ベンザルコニウムとして式[C6H5CH2N(CH3)2R]Cl(式中Rは炭素数12のアルキル基である)で表される塩化ベンザルコニウムを用いる手段、および3)等張化剤として非イオン性等張化剤を配合する手段。
【選択図】なし
Description
本発明は、緑内障治療剤として有用なラタノプロストを有効成分とする澄明性且つ安定な点眼液に関するものである。
ラタノプロストは、化学名イソプロピル−(Z)−7[(1R,2R,3R,5S)3,5−ジヒドロキシ−2−[(3R)−3−ヒドロキシ−5−フェニルペンチル]シクロペンチル]−5−ヘプタノエートで表される、プロスタグランジン系の緑内障治療薬である。ラタノプロストは選択的FP受容体アゴニストであり、房水の流出を促進させることにより眼圧を下降させる(例えば、特許文献1参照)。ラタノプロストの投与経路は点眼投与であり、0.005%ラタノプロスト含有点眼液(商品名:キサラタン点眼液)が市販されている。
特許第2721414号公報
本発明は、ラタノプロスト点眼液のより優れた処方を提供することを目的とするものである。
点眼液の防腐剤としては、効果等の観点から塩化ベンザルコニウム(以下BAKと略記する)が最も汎用されている。しかしBAKは優れた防腐力を有する反面、高い濃度で使用すると角膜障害を引き起こす可能性がある。従って、BAKを点眼液に配合する際には、なるべく濃度を低減させることが望ましい。
ここでいうBAKとは、[C6H5CH2N(CH3)2R]Clで表される化学構造を有し、そのアルキル基(Rで示されている)がC8H17〜C18H37であるものの混合物を意味する。
日・米・欧の薬局方には次のように定義されている。
日本薬局方:[C6H5CH2N(CH3)2R]Clで示され、RはC8H17〜C18H37で、主としてC12H25及びC14H29からなる。
アメリカ薬局方: [C6H5CH2N(CH3)2R]Clの塩化アルキルベンジルジメチルアンモニウムの混合物で、RはC8H17より長鎖の全てまたはいくつかのアルキル基の混合を表し、大部分はC12H25、C14H29およびC16H33で構成される。
ヨーロッパ薬局方:塩化アルキルベンジルジメチルアンモニウムの混合物で、アルキル基はC8からC18の鎖長を有する。
一方、点眼液には、通常等張性を保つために添加物(等張化剤)が配合されているが、その代表的なものは塩化ナトリウム等のアルカリ金属塩や塩化マグネシウム等のアルカリ土類金属塩の無機塩類である。
さらに、点眼液においては、通常pHの変動を防ぐための添加物(緩衝剤)が配合されているが、その代表的なものは、リン酸ナトリウム、ホウ酸ナトリウム等の無機塩類や酢酸ナトリウム、クエン酸ナトリウム、炭酸ナトリウム等の有機塩類である。
市販のラタノプロスト点眼液には、これらの等張化剤や緩衝剤が配合されている。
そこで、本発明者らは、これらの汎用添加物を配合したラタノプロスト点眼液を調製し種々の検討をした。
その結果、驚くべきことに、BAKを0.015%以上の濃度にすると白濁は生じないが、0.01%以下の濃度にすると白濁が生じることが判明した。これは、疎水性の高いラタノプロストとBAKが複合体を形成し、添加物である塩類の塩析効果によってラタノプロスト−BAK複合体が析出するためと考えられるが、BAKの濃度を0.01%以下の濃度にしたとき初めて析出が起きることは驚くべき発見である。実際に市販されているラタノプロスト点眼液(商品名:キサラタン点眼液)ではBAKが0.02%配合されているので、白濁という問題は生じない。しかし、前述のようにBAKは優れた防腐剤ではあるものの高い濃度で使用すると角膜障害を引き起こす可能性がある。従って、BAKを点眼液に配合する際には、なるべく濃度を低減させることが望ましい。
本発明者らは、まず白濁を防止するための添加物を種々検討した結果、界面活性剤を配合すると白濁を防止できることを見出した。
また、BAKの種類に注目して鋭意研究を行った結果、アルキル基の炭素数が8〜18の混合物を用いるのではなく、炭素数12のBAKを用いると白濁を防止できることを見出した。
さらに、等張化剤として塩類を用いることが白濁の原因の一因ではないかと考え、等張化剤の種類に注目して鋭意研究を行った。その結果、等張化剤として非イオン性の等張化剤を用いると白濁を防止できることを見出した。
すなわち、本発明は、ラタノプロストを有効成分とし、防腐剤として塩化ベンザルコニウムを配合した点眼液において、下記1)〜3)から選択される少なくとも一つの手段により、配合変化による白濁が防止された澄明な点眼液が得られることを見出した。
1)界面活性剤を配合する手段
2)塩化ベンザルコニウムとして、式
[C6H5CH2N(CH3)2R]Cl
(式中Rは炭素数12のアルキル基である)
で表される塩化ベンザルコニウムを用いる手段
3)等張化剤として非イオン性等張化剤を配合する手段
2)塩化ベンザルコニウムとして、式
[C6H5CH2N(CH3)2R]Cl
(式中Rは炭素数12のアルキル基である)
で表される塩化ベンザルコニウムを用いる手段
3)等張化剤として非イオン性等張化剤を配合する手段
上記3つの手段は、夫々単独で用いてもよく、それらを組み合わせて用いてもよい。
本発明における点眼液の有効成分であるラタノプロストの濃度は0.001〜0.01%(W/V)が好ましく、特に0.005%(W/V)が好ましい。
本発明における第一の手段は、界面活性剤を配合することにある。界面活性剤を配合すると、等張化剤の種類やBAKの種類に関係なく、白濁を防止した澄明なラタノプロスト点眼液を得ることができる。
界面活性剤の例としては、ポリソルベート80、ポリエキシエチレン硬化ヒマシ油60、ポリオキシル35ヒマシ油、モノステアリン酸ポリエチレングリコール、マクロゴール4000、レシチン、ショ糖エステル、ポリオキシエチレンアルキルエーテル、ステアリン酸ポリオキシル、ポリオキシエチレンポリオキシプロピレングリコール等が挙げられるが、好ましくは、ポリソルベート80、ポリエキシエチレン硬化ヒマシ油60、ポリオキシル35ヒマシ油である。界面活性剤の濃度は、0.001〜0.5%が好ましい。
本発明における第二の手段は、防腐剤として式[C6H5CH2N(CH3)2R]Cl(式中Rは炭素数12のアルキル基である)で表される塩化ベンザルコニウムを用いることである。ここでいうアルキル基の炭素数が12の塩化ベンザルコニウム(以下BAK−C12と略記する)とは、[C6H5CH2N(CH3)2R]Clで表される化学構造を有し、そのアルキル基(式中Rで示されている)がC12H25であるものを示す。
BAK−C12を防腐剤として用いることにより、等張化剤の種類に関係なく、白濁を防止した澄明なラタノプロスト点眼液を得ることができる。
BAK−C12は市販のものを使用できる。BAK−C12の濃度は、0.01%(W/V)以下が好ましい。BAK濃度が低すぎると十分な防腐力が得られないので、より好ましいBAK濃度範囲は0.003〜0.01%(W/V)である。
本発明における第三の手段は、等張化剤として非イオン性等張化剤を配合することである。非イオン性等張化剤を用いることにより、BAKの種類に関係なく、白濁を防止した澄明なラタノプロスト点眼液を得ることができる。非イオン性等張化剤を用いると、点眼液中の塩類の総量を減らすことができる結果、塩析効果の影響が減少し、白濁が抑制される。
非イオン性等張化剤としては、通常点眼液に用いられているものならば良く、具体的にはグリセリン、マンニトール、ポリエチレングリコール、プロピレングリコール、トレハロース、シュークロース等が挙げられる。非イオン性等張化剤の濃度は、物質ごとに等張化できる濃度に設定すればよい。
本発明の点眼液の調製には、必要に応じてpH緩衝剤、pH調整剤、可溶化剤、増粘剤等を加えることができる。pH緩衝剤としては、リン酸ナトリウム、リン酸二水素ナトリウム、リン酸水素二ナトリウム、リン酸カリウム、リン酸二水素カリウム、リン酸水素二カリウム等のリン酸塩;ホウ酸ナトリウム、ホウ酸カリウム等のホウ酸塩;クエン酸ナトリウム、クエン酸二ナトリウム等のクエン酸塩;酢酸ナトリウム、酢酸カリウム等の酢酸塩、炭酸ナトリウム、炭酸水素ナトリウム等の炭酸塩等が挙げられる。pH調整剤としては、塩酸、クエン酸、リン酸、酢酸、水酸化ナトリウム、水酸化カリウム等を挙げることができる。可溶化剤としては、ポリソルベート80、ポリエキシエチレン硬化ヒマシ油60、マクロゴール4000等が挙げられる。増粘剤としては、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、ポリビニルアルコール、カルボキシビニルポリマー、ポリビニルピロリドン等が挙げられる。
また、手段1および2には等張化剤として塩化ナトリウム、塩化カリウム、塩化カルシウム、塩化マグネシウム等の塩類を加えることができる。
本発明点眼液のpHは3〜8、特に4〜7とするのが好ましい。
本発明の点眼液は汎用されている方法によって調製することができる。
界面活性剤を配合することにより、BAKの濃度を低くしても澄明なラタノプロスト点眼液を提供することができる。
また、BAK−C12を防腐剤として用いることにより、BAKの濃度を低くしても澄明なラタノプロスト点眼液を提供することができる。
さらに、非イオン性等張化剤を配合することにより、BAKの濃度を低くしても澄明なラタノプロスト点眼液を提供することができる。
手段1)による実施例
実施例1−1
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、ポリソルベート80 0.01g、塩化ベンザルコニウム0.01gを精製水約90mLに溶解し、pHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、基剤にラタノプロストを溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例1−1
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、ポリソルベート80 0.01g、塩化ベンザルコニウム0.01gを精製水約90mLに溶解し、pHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、基剤にラタノプロストを溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例1−2
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、ポリオキシエチレン硬化ヒマシ油60 0.01g、塩化ベンザルコニウム0.01gを精製水約90mLに溶解し、pHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、基剤にラタノプロストを溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、ポリオキシエチレン硬化ヒマシ油60 0.01g、塩化ベンザルコニウム0.01gを精製水約90mLに溶解し、pHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、基剤にラタノプロストを溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例1−3
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、ポリオキシル35ヒマシ油0.01g、塩化ベンザルコニウム0.01gを精製水約90mLに溶解し、pHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、基剤にラタノプロストを溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、ポリオキシル35ヒマシ油0.01g、塩化ベンザルコニウム0.01gを精製水約90mLに溶解し、pHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、基剤にラタノプロストを溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
手段2)による実施例
実施例2−1
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、BAK−C120.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例2−1
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、BAK−C120.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例2−2
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、BAK−C120.005gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
結晶リン酸二水素ナトリウム0.2g、塩化ナトリウム0.8g、BAK−C120.005gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
手段3)による実施例
実施例3−1
結晶リン酸二水素ナトリウム0.2g、濃グリセリン2.3g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例3−1
結晶リン酸二水素ナトリウム0.2g、濃グリセリン2.3g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例3−2
結晶リン酸二水素ナトリウム0.2g、マンニトール4.5g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
結晶リン酸二水素ナトリウム0.2g、マンニトール4.5g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例3−3
結晶リン酸二水素ナトリウム0.2g、PEG400 8.0g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
結晶リン酸二水素ナトリウム0.2g、PEG400 8.0g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例3−4
結晶リン酸二水素ナトリウム0.2g、プロピレングリコール2.0g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
結晶リン酸二水素ナトリウム0.2g、プロピレングリコール2.0g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実施例3−5
結晶リン酸二水素ナトリウム0.2g、トレハロース9.0g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
結晶リン酸二水素ナトリウム0.2g、トレハロース9.0g、BAK0.01gを精製水約90mLに溶解し、1N水酸化ナトリウム水溶液でpHを6.7に調整し、精製水の追加で全量100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。
実験1 ラタノプロストの残存率の測定及び外観の観察
1)比較処方1〜4を次のようにして調製した。
1)比較処方1〜4を次のようにして調製した。
100mLガラスビーカー中に精製水約90mLを入れた。この精製水に結晶リン酸二水素ナトリウム0.2gと塩化ナトリウム0.9gを溶解させ、1N水酸化ナトリウム水溶液を用いてpHを6.7に調整し、精製水の追加で全量を100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、全体を約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。この溶液に注射用水を加えて全量を100mLに調整した。このラタノプロスト溶液をガラス試験管に正確に10mLとり、1%BAK(前記化学構造式中のアルキル基Rの炭素数が12、14および16であるものの混合物)溶液を50、 100、150または200μL添加し、混和した。これらの処方を表1に示す。
2)処方1〜3を次のようにして調製した。
100mLガラスビーカー中に精製水約90mLを入れた。この精製水に結晶リン酸二水素ナトリウム0.2gおよび塩化ナトリウム0.9gおよび界面活性剤を表2に示した濃度になるように溶解させ、水酸化ナトリウム水溶液あるいは希塩酸を用いてpHを6.7に調整し、精製水の追加で全量を100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、全体を約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。この溶液に注射用水を加えて全量を100mLに調整した。このラタノプロスト溶液をガラス試験管に正確に10mLとり、1%BAK(前記化学構造式中のアルキル基Rの炭素数が12、14および16であるものの混合物)溶液を100μL投入し、混和した。これらの処方を表2に示す。
3)処方4〜5を次のようにして調製した。
100mLガラスビーカー中に精製水約90mLを入れた。この精製水に結晶リン酸二水素ナトリウム0.2gと塩化ナトリウム0.9gを溶解させ、1N水酸化ナトリウム水溶液を用いてpHを6.7に調整し、精製水の追加で全量を100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、全体を約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。この溶液に注射用水を加えて全量を100mLに調整した。このラタノプロスト溶液をガラス試験管に正確に10mLとり、1%BAK−C12溶液を50および100μL添加し、混和した。これらの処方を表3に示す。
4)処方6〜10を次のようにして調製した。
100mLガラスビーカー中に精製水約90mLを入れた。この精製水に結晶リン酸二水素ナトリウム0.2gと非イオン性等張化剤を表4に示した濃度になるように溶解させ、水酸化ナトリウム水溶液あるいは希塩酸を用いてpHを6.7に調整し、精製水の追加で全量を100mLとし、基剤を得た。ラタノプロスト5mgに基剤100mLを加え、全体を約80℃の水浴中で加温しながら撹拌し、ラタノプロストを基剤に溶解させた。この溶液を室温に戻した後pHが6.7であることを確認した。この溶液に注射用水を加えて全量を100mLに調整した。このラタノプロスト溶液をガラス試験管に正確に10mLとり、1%BAK(前記化学構造式中のアルキル基Rの炭素数が12、14および16であるものの混合物)溶液を100μL投入し、混和した。これらの処方を表4に示す。
5)以上のようにして調製した各調製液の外観観察を行い、それぞれ1mLずつを25mLメスフラスコに正確にサンプリングした。残りの液それぞれ9mLずつを0.22μmフィルターを用いてろ過した。
<結果>
表5に比較処方1〜4の外観観察および残存率測定の結果を示す。ラタノプロストにBAKを0.02%または0.015%配合した比較処方1および2では、外観は無色透明で残存率も96.8〜99.4%であり配合変化は起こらなかった。しかし、BAK0.01%または0.005%配合した比較処方3および4は、白濁し、残存率も減少して配合変化が起こった。
表5に比較処方1〜4の外観観察および残存率測定の結果を示す。ラタノプロストにBAKを0.02%または0.015%配合した比較処方1および2では、外観は無色透明で残存率も96.8〜99.4%であり配合変化は起こらなかった。しかし、BAK0.01%または0.005%配合した比較処方3および4は、白濁し、残存率も減少して配合変化が起こった。
表6に処方1〜3(手段1)の外観観察および残存率測定の結果を示す。比較処方3および4では、白濁が見られ、残存率も低減しているのに対し、界面活性剤を配合した処方1〜3では、白濁は見られず、残存率も97.2〜99.8%と高い値を保っていた。この結果から、界面活性剤を配合すると、ラタノプロストとBAKの配合変化を防止し、安定且つ澄明な点眼液が得られることが分かる。
表7に処方4および5(手段2)の外観観察および残存率測定の結果を示す。BAKを用いた比較処方3および4では、白濁が見られ、残存率も低減しているのに対し、BAKに替えてBAK−C12を配合した処方4および5では、白濁は見られず、残存率も97.3〜98.2%であり、配合変化は起こらなかった。この結果から、BAKに替えてBAK−C12を配合するとこれがラタノプロストとの配合変化を防止し、安定且つ澄明な点眼液が得られることが分かる。
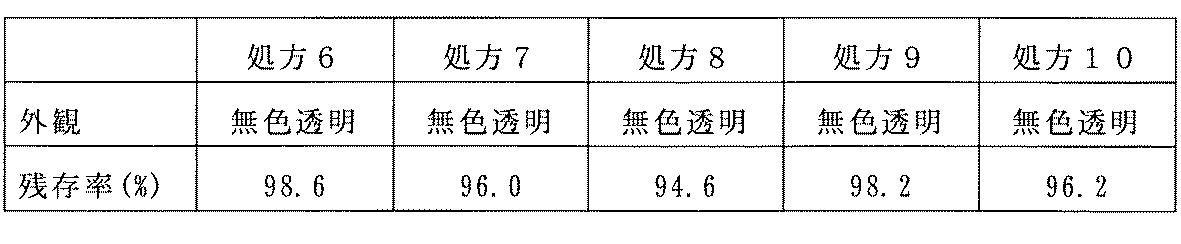
表8に処方6〜10(手段3)の外観観察および残存率測定の結果を示す。等張化剤として塩化ナトリウムを用いた比較処方3および4では、白濁が見られ、残存率も低減しているのに対し、塩化ナトリウムに替えて非イオン性等張化剤を用いた処方6〜10では、白濁は見られず、残存率も94.6〜98.6%あり、配合変化は起こらなかった。この結果から、等張化剤として非イオン性のものを配合するとラタノプロストとBAKの配合変化を防止し、安定且つ澄明な点眼液が得られることが分かる。
実験2 保存効力試験
上記実施例1−1、2−1および3−1について保存効力試験を行った。保存効力試験は、第十三改正日本薬局方の保存効力試験法に準拠して行った。
上記実施例1−1、2−1および3−1について保存効力試験を行った。保存効力試験は、第十三改正日本薬局方の保存効力試験法に準拠して行った。
Claims (8)
- ラタノプロストを有効成分とし、防腐剤として塩化ベンザルコニウムを配合した点眼液において、下記1)〜3)から選択される少なくとも一つの手段により、配合変化による白濁が防止された澄明な点眼液。
1)界面活性剤を配合する手段
2)塩化ベンザルコニウムとして、式
[C6H5CH2N(CH3)2R]Cl
(式中Rは炭素数12のアルキル基である)
で表される塩化ベンザルコニウムを用いる手段
3)非イオン性等張化剤を配合する手段 - ラタノプロストの濃度が0.001〜0.01%(W/V)で、塩化ベンザルコニウムの濃度が0.003〜0.01%(W/V)である請求項1記載の点眼液。
- 界面活性剤が、ポリソルベート80、ポリエキシエチレン硬化ヒマシ油60、ポリオキシル35ヒマシ油またはモノステアリン酸ポリエチレングリコールである請求項1記載の点眼液。
- 非イオン性等張化剤が、グリセリン、マンニトール、ポリエチレングリコール、プロピレングリコール、トレハロースまたはシュークロースである請求項1記載の点眼液。
- ラタノプロストを有効成分とし、防腐剤として塩化ベンザルコニウムを配合した点眼液において、下記1)〜3)から選択される少なくとも一つの手段により、配合変化による白濁を防止する方法。
1)界面活性剤を配合する手段
2)塩化ベンザルコニウムとして、式
[C6H5CH2N(CH3)2R]Cl
(式中Rは炭素数12のアルキル基である)
で表される塩化ベンザルコニウムを用いる手段
3)非イオン性等張化剤を配合する手段 - ラタノプロストの濃度が0.001〜0.01%(W/V)で、塩化ベンザルコニウムの濃度が0.003〜0.01%(W/V)である請求項5記載の白濁防止法。
- 界面活性剤が、ポリソルベート80、ポリエキシエチレン硬化ヒマシ油60、ポリオキシル35ヒマシ油またはモノステアリン酸ポリエチレングリコールである請求項5記載の白濁防止法。
- 非イオン性等張化剤が、グリセリン、マンニトール、ポリエチレングリコール、プロピレングリコール、トレハロースまたはシュークロースである請求項5記載の白濁防止法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003314865A JP2004123729A (ja) | 2002-09-09 | 2003-09-08 | ラタノプロストを有効成分とする澄明な点眼液 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002263039 | 2002-09-09 | ||
| JP2002263035 | 2002-09-09 | ||
| JP2002263030 | 2002-09-09 | ||
| JP2003314865A JP2004123729A (ja) | 2002-09-09 | 2003-09-08 | ラタノプロストを有効成分とする澄明な点眼液 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008331735A Division JP5171606B2 (ja) | 2002-09-09 | 2008-12-26 | ラタノプロストを有効成分とする澄明な点眼液 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2004123729A true JP2004123729A (ja) | 2004-04-22 |
Family
ID=32303627
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003314865A Pending JP2004123729A (ja) | 2002-09-09 | 2003-09-08 | ラタノプロストを有効成分とする澄明な点眼液 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2004123729A (ja) |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008247828A (ja) * | 2007-03-30 | 2008-10-16 | Wakamoto Pharmaceut Co Ltd | ラタノプロストを含有する水性医薬組成物。 |
| JP2009040749A (ja) * | 2007-08-10 | 2009-02-26 | Kaken Pharmaceut Co Ltd | ラタノプロスト点眼剤 |
| JP2009535342A (ja) * | 2006-04-26 | 2009-10-01 | アーシエックス, インコーポレイテッド | 眼瞼腫脹の予防および処置のための組成物 |
| JP2013189450A (ja) * | 2007-02-07 | 2013-09-26 | Teika Seiyaku Kk | ラタノプロスト含有点眼液組成物 |
| JP5327809B2 (ja) * | 2007-08-29 | 2013-10-30 | わかもと製薬株式会社 | ラタノプロスト含有水性医薬組成物 |
| WO2014119643A1 (ja) * | 2013-01-31 | 2014-08-07 | 千寿製薬株式会社 | 澄明な水性液剤 |
| JP2022120120A (ja) * | 2022-06-13 | 2022-08-17 | 東亜薬品株式会社 | 眼科用水性組成物及びプロスタグランジンF2α誘導体の含量の低下を抑制する方法 |
-
2003
- 2003-09-08 JP JP2003314865A patent/JP2004123729A/ja active Pending
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009535342A (ja) * | 2006-04-26 | 2009-10-01 | アーシエックス, インコーポレイテッド | 眼瞼腫脹の予防および処置のための組成物 |
| US8685439B2 (en) | 2006-04-26 | 2014-04-01 | Aciex Therapeutics, Inc. | Method for the treatment and prevention of eyelid swelling |
| JP2013189450A (ja) * | 2007-02-07 | 2013-09-26 | Teika Seiyaku Kk | ラタノプロスト含有点眼液組成物 |
| JP2008247828A (ja) * | 2007-03-30 | 2008-10-16 | Wakamoto Pharmaceut Co Ltd | ラタノプロストを含有する水性医薬組成物。 |
| JP2009040749A (ja) * | 2007-08-10 | 2009-02-26 | Kaken Pharmaceut Co Ltd | ラタノプロスト点眼剤 |
| US9456980B2 (en) | 2007-08-29 | 2016-10-04 | Wakamoto Pharmaceutical Co., Ltd. | Latanoprost-containing aqueous pharmaceutical composition |
| JP5327809B2 (ja) * | 2007-08-29 | 2013-10-30 | わかもと製薬株式会社 | ラタノプロスト含有水性医薬組成物 |
| WO2014119643A1 (ja) * | 2013-01-31 | 2014-08-07 | 千寿製薬株式会社 | 澄明な水性液剤 |
| JP5753958B2 (ja) * | 2013-01-31 | 2015-07-22 | 千寿製薬株式会社 | 澄明な水性液剤 |
| US9968679B2 (en) | 2013-01-31 | 2018-05-15 | Senju Pharmaceutical Co., Ltd. | Clear aqueous solution |
| RU2662067C2 (ru) * | 2013-01-31 | 2018-07-23 | Сэндзю Фармасьютикал Ко., Лтд. | Прозрачный водный раствор |
| US10709786B2 (en) | 2013-01-31 | 2020-07-14 | Senju Pharmaceutical Co., Ltd. | Clear aqueous solution |
| JP2022120120A (ja) * | 2022-06-13 | 2022-08-17 | 東亜薬品株式会社 | 眼科用水性組成物及びプロスタグランジンF2α誘導体の含量の低下を抑制する方法 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5171606B2 (ja) | ラタノプロストを有効成分とする澄明な点眼液 | |
| US20110118348A1 (en) | Methods of stabilizing latanoprost in an aqueous solution | |
| JP2013056948A (ja) | 安定なプロスタグランジン含有組成物 | |
| CN102014920A (zh) | 滴眼剂制剂及其应用 | |
| JP5593345B2 (ja) | イソプロピルウノプロストンの分解抑制方法 | |
| JP2004123729A (ja) | ラタノプロストを有効成分とする澄明な点眼液 | |
| US20120263803A1 (en) | Aqueous ophthalmic composition | |
| JP4314429B2 (ja) | ラタノプロストを有効成分とする安定な点眼液 | |
| JP2005263792A (ja) | 澄明なラタノプロスト点眼液 | |
| JP2009256281A (ja) | イソプロピルウノプロストン含有点眼剤組成物 | |
| CN101278936B (zh) | 含有效成分拉坦前列素的澄明滴眼剂 | |
| JP2007063265A (ja) | 熱的に不安定な薬物の分解抑制方法 | |
| WO2005079809A1 (ja) | 澄明なラタノプロスト点眼液 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050315 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20081104 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090428 |