【0001】
【発明の属する技術分野】
本発明は、3次元光造形やホログラフィー、平版印刷用版材、カラープルーフ、フォトレジスト及びカラーフィルター等の画像記録材料や、インク、塗料、及び接着剤等に用いられる、光または熱硬化性組成物に関し、特に、コンピュータ等のデジタル信号から各種レーザを用いて直接製版できる、いわゆるダイレクト製版可能なネガ型平版印刷原版の記録材料として好適に用いられる光または熱硬化性組成物に関する。
【0002】
【従来の技術】
近年におけるレーザの発展は目ざましく、特に、波長300nm〜1200nmの紫外光、可視光、赤外光を放射する固体レーザ及び半導体レーザ、ガスレーザは高出力かつ小型のものが容易に入手できるようになっており、これらのレーザは、平版印刷におけるコンピュータ等のデジタルデータから直接製版する際の記録光源として、非常に有用である。これら各種レーザ光に感応する記録材料については種々研究がなされており、感光波長760nm以上の赤外線レーザ対応のポジ型記録材料(特許文献1参照)、酸触媒架橋型のネガ型記録材料(特許文献2参照)等が知られている。また、300nm〜700nmの紫外光または可視光レーザ対応型のラジカル重合型ネガ型記録材料(特許文献3、4参照)等も知られている。
【0003】
通常、光または熱重合型のネガ型画像記録材料は、光又は熱によりラジカルを発生する化合物と、重合性化合物とを含有し、光又は熱により発生したラジカルを開始剤として該重合性化合物の重合反応を生起させ、露光部の記録層を硬化させて画像部を形成する記録方式を利用している。
【0004】
このようなネガ型の画像記録材料においては、耐刷性向上の目的で、露光・現像工程後に加熱処理(以下、適宜「バーニング処理」と称する)を行うことが一般的である。これは、露光において重合しきれなかった未反応の重合性化合物に、再び高温の熱を加えることにより硬化反応を促進させ、より強固な画像部を形成しようするものである。しかし、従来の重合性化合物では、このような高温の加熱処理によって未反応の分子が昇華してしまい、画像部がダメージを受けるため、十分な耐刷性向上の効果を得ることができなかった。
【0005】
一方、感度向上の目的からも種々の記録材料が提案されている。例えば、化学増幅型感材(特許文献5参照)や、エチレン性不飽和化合物の重合を利用した感材(特許文献6参照)など、光や熱に対する反応性に優れる成分を含有するものが知られている。しかし、このような記録材料は、白灯下での取り扱いや環境温度の変化により所望されない反応が生起したり、また、空気中の酸素による重合阻害が生じるなど、保存安定性に劣るといった懸念があった。
そのような問題を解決するために、特定の環構造にエチレン性不飽和結合を有する重合性化合物を用いた記録材料(特許文献7参照)が提案されている。この記録材料に用いられている重合性化合物は1分子中に複数の重合性基を有するため、感度に優れ、しかも、保存安定性にも優れるものの、未反応の化合物が記録材料の膜中に存在すると、経時的に膜表面に滲出したり、温度環境によっては膜内を移動して形成された皮膜の強度低下をまねき、耐刷性を劣化させるという問題を有している。この傾向は、特にバーニング処理行ったときに著しく、膜強度向上のための処理により、かえって画像部の耐刷性を低下させるという欠点があった。
【0006】
【特許文献1】
米国特許第4708925号明細書
【特許文献2】
特開平8−276558号公報
【特許文献3】
米国特許2850445号明細書
【特許文献4】
特公昭44−20189号公報
【特許文献5】
特開平11−65105号公報
【特許文献6】
特開2000−89455公報
【特許文献7】
特開平8−160615号公報
【0007】
【発明が解決しようとする課題】
上記従来の技術の欠点を考慮してなされた本発明の目的は、感度、保存安定性、耐刷性、および現像性に優れ、特に、バーニング処理を行うことで著しく耐刷性が向上するネガ型平版印刷版原版の画像記録材料として有用な、光または熱硬化性組成物を提供することにある。
【0008】
【課題を解決するための手段】
本発明者らは、鋭意検討の結果、光または熱硬化性組成物中の重合性化合物として、特定の構造骨格とエチレン性不飽和基とを有する重合性化合物を用いることで、上記目的が達成されることを見出し、本発明を解決するに至った。
即ち、本発明の光または熱硬化性組成物は、(A)エチレン性不飽和結合を少なくとも1つ有し、且つ、少なくとも1つ以上のアミド構造により構成された環構造を2つ以上有する重合性化合物(以下、適宜「特定重合性化合物」と称する)と、
(B)光または熱によりラジカルを生成する化合物(以下、適宜「ラジカル開始剤」と称する)と、
を有することを特徴とする。
【0009】
なお、本発明においては、請求項1に係る環構造のうち少なくとも1つが、2つ以上のアミド構造から構成されたものが好ましい。
また、請求項1に係る環構造のうち少なくとも1つは、4〜10員環であるものが好ましく、そのような環構造としては、下記式(A−1)〜(A−12)から選択される構造がより好ましい。中でも、本発明において最も好ましい環構造としては、イソシアヌル酸骨格(A−12)が挙げられる。
【0010】
【化1】
【0011】
また、本発明においては、請求項1に係るエチレン性不飽和結合が、該環構造に結合したものが好ましく、さらに、環構造1つにつき、エチレン性不飽和結合が2つ以上結合した構造であるものが好ましい。
【0012】
また、本発明においては、請求項1に係る2つ以上の環構造が、連結基を介して結合されたものが好ましい。
【0013】
本発明の作用は明確ではないが、係る特定重合性化合物は、その分子内にラジカル反応性の高いエチレン性不飽和結合を有するため、露光時のエネルギー付与により該特定重合性化合物間で高密度且つ強固な架橋構造が速やかに形成される。したがって、このような特定重合性化合物を記録材料として用いた平版印刷版原版は、高感度、且つ、優れた耐刷性が実現されるものと考えられる。
さらに、本発明に係る特定重合性化合物は、その分子量が比較的大きいという特徴と、アミド構造を含んでなる環構造による凝集性を有する。すなわち、経時においても、該重合性化合物が膜内を移動して膜表面に滲出したりして、皮膜の強度を低下させるといった問題もなく、保存安定性に優れるとともに、バーニング処理によっても、該未反応の重合性化合物が昇華することなく、膜中にとどまってバーニング処理の熱により重合、硬化反応が促進される。その結果、より強固な画像部が得られ、さらなる耐刷性の向上効果が得られる。
また、一般的には、このように高分子量の重合性化合物を用いると、現像性が低下するといった懸念もあるが、本発明に係る特定重合性化合物は、上記環構造を構成するアミド基に起因する親水性の作用により、非画像部の除去性にも優れるものと推測される。
【0014】
【発明の実施の形態】
本発明の光または熱硬化性組成物は、(A)エチレン性不飽和結合を少なくとも1つ有し、且つ、少なくとも1つ以上のアミド構造により構成された環構造を2つ以上有する重合性化合物(特定重合性化合物)と、(B)光または熱によりラジカルを生成する化合物(ラジカル開始剤)と、を含有することを特徴とする。さらに、本発明の光または熱硬化性組成物は、所定の波長の光を吸収し熱に変換する機能を有する(C)増感色素と、皮膜特性向上の目的で(D)バインダーポリマーと、を含有することができる。
以下、本発明の光または熱硬化性組成物に使用しうる各化合物について順次説明する。
【0015】
〔(A)特定重合性化合物〕
本発明に用いられる特定重合性化合物とは、エチレン性不飽和結合を少なくとも1つ有し、且つ、少なくとも1つ以上のアミド構造により構成された環構造(以下、適宜「特定環構造」と称する)を2つ以上有する重合性化合物を指す。このような特定重合性化合物は、光または熱により発生したラジカルを開始剤として重合硬化反応を生起する。
【0016】
(少なくとも1つ以上のアミド構造により構成された環構造)
本発明に係る特定環構造とは、環構造を構成する原子団として少なくとも1つ以上のアミド構造を有するものであれば特に限定はないが、中でも、2つ以上のアミド構造から構成されたものが好ましく、3つ以上のアミド構造から構成されたものが強度の点でより好ましい。
【0017】
本発明に係る特定環構造を構成するアミド構造としては、下記一般式(I)で表されるものが好ましい。
【0018】
【化2】
【0019】
式(I)中、Rは、後述するエチレン性不飽和結合性基により置換されているか、あるいは、水素原子または有機基を表す。
Rで表される有機基としては、それぞれ置換基を有してもよいアルキル基、アルケニル基、アルキニル基、アリール基、ヘテロ環基が好ましい。
そのようなアルキル基としては炭素原子数が1から20までの直鎖状、分岐状、および環状のアルキル基を挙げることができ、その具体例としては、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基、ウンデシル基、ドデシル基、トリデシル基、ヘキサデシル基、オクタデシル基、エイコシル基、イソプロピル基、イソブチル基、s−ブチル基、t−ブチル基、イソペンチル基、ネオペンチル基、1−メチルブチル基、イソヘキシル基、2−エチルヘキシル基、2−メチルヘキシル基、シクロヘキシル基、シクロペンチル基、2−ノルボルニル基を挙げることができる。これらの中では、炭素原子数1から12までの直鎖状、炭素原子数3から12までの分岐状、ならびに炭素原子数5から10までの環状のアルキル基がより好ましい。
【0020】
置換アルキル基の置換基としては、水素原子を除く一価の非金属原子団からなる基が用いられ、好ましい例としては、ハロゲン原子(−F、−Br、−Cl、−I)、ヒドロキシル基、アルコキシ基、アリーロキシ基、メルカプト基、アルキルチオ基、アリールチオ基、アルキルジチオ基、アリールジチオ基、アミノ基、N−アルキルアミノ基、N,N−ジアルキルアミノ基、N−アリールアミノ基、N,N−ジアリールアミノ基、N−アルキル−N−アリールアミノ基、アシルオキシ基、カルバモイルオキシ基、N−アルキルカルバモイルオキシ基、N−アリールカルバモイルオキシ基、N,N−ジアルキルカルバモイルオキシ基、N,N−ジアリールカルバモイルオキシ基、N−アルキル−N−アリールカルバモイルオキシ基、アルキルスルホキシ基、アリールスルホキシ基、アシルチオ基、アシルアミノ基、N−アルキルアシルアミノ基、N−アリールアシルアミノ基、ウレイド基、N’−アルキルウレイド基、N’,N’−ジアルキルウレイド基、N’−アリールウレイド基、N’,N’−ジアリールウレイド基、N’−アルキル−N’−アリールウレイド基、N−アルキルウレイド基、N−アリールウレイド基、N’−アルキル−N−アルキルウレイド基、N’−アルキル−N−アリールウレイド基、N’,N’−ジアルキル−N−アルキルウレイド基、N’,N’−ジアルキル−N−アリールウレイド基、N’−アリール−N−アルキルウレイド基、N’−アリール−N−アリールウレイド基、N’,N’−ジアリール−N−アルキルウレイド基、N’,N’−ジアリール−N−アリールウレイド基、N’−アルキル−N’−アリール−N−アルキルウレイド基、N’−アルキル−N’−アリール−N−アリールウレイド基、アルコキシカルボニルアミノ基、アリーロキシカルボニルアミノ基、N−アルキル−N−アルコキシカルボニルアミノ基、N−アルキル−N−アリーロキシカルボニルアミノ基、N−アリール−N−アルコキシカルボニルアミノ基、N−アリール−N−アリーロキシカルボニルアミノ基、ホルミル基、アシル基、カルボキシル基、アルコキシカルボニル基、アリーロキシカルボニル基、カルバモイル基、N−アルキルカルバモイル基、N,N−ジアルキルカルバモイル基、N−アリールカルバモイル基、N,N−ジアリールカルバモイル基、N−アルキル−N−アリールカルバモイル基、アルキルスルフィニル基、アリールスルフィニル基、アルキルスルホニル基、
【0021】
アリールスルホニル基、スルホ基(−SO3H)およびその共役塩基基(スルホナト基と称す)、アルコキシスルホニル基、アリーロキシスルホニル基、スルフィナモイル基、N−アルキルスルフィナモイル基、N,N−ジアルキルスルフィイナモイル基、N−アリールスルフィナモイル基、N,N−ジアリールスルフィナモイル基、N−アルキル−N−アリールスルフィナモイル基、スルファモイル基、N−アルキルスルファモイル基、N,N−ジアルキルスルファモイル基、N−アリールスルファモイル基、N,N−ジアリールスルファモイル基、N−アルキル−N−アリールスルファモイル基、ホスホノ基(−PO3H2)およびその共役塩基基(ホスホナト基と称す)、ジアルキルホスホノ基(−PO3(alkyl)2)「alkyl=アルキル基、以下同」、ジアリールホスホノ基(−PO3(aryl)2)「aryl=アリール基、以下同」、アルキルアリールホスホノ基(−PO3(alkyl)(aryl))、モノアルキルホスホノ基(−PO3(alkyl))およびその共役塩基基(アルキルホスホナト基と称す)、モノアリールホスホノ基(−PO3H(aryl))およびその共役塩基基(アリールホスホナト基と称す)、ホスホノオキシ基(−OPO3H2)およびその共役塩基基(ホスホナトオキシ基と称す)、ジアルキルホスホノオキシ基(−OPO3H(alkyl)2)、ジアリールホスホノオキシ基(−OPO3(aryl)2)、アルキルアリールホスホノオキシ基(−OPO3(alkyl)(aryl))、モノアルキルホスホノオキシ基(−OPO3H(alkyl))およびその共役塩基基(アルキルホスホナトオキシ基と称す)、モノアリールホスホノオキシ基(−OPO3H(aryl))およびその共役塩基基(アリールホスホナトオキシ基と称す)、シアノ基、ニトロ基、アリール基、アルケニル基、アルキニル基、ヘテロ環基、シリル基等が挙げられる。
【0022】
これらの置換基におけるアルキル基の具体例としては、前述のアルキル基が挙げられ、上記置換基におけるアリール基の具体例としては、フェニル基、ビフェニル基、ナフチル基、トリル基、キシリル基、メシチル基、クメニル基、クロロフェニル基、ブロモフェニル基、クロロメチルフェニル基、ヒドロキシフェニル基、メトキシフェニル基、エトキシフェニル基、フェノキシフェニル基、アセトキシフェニル基、ベンゾイロキシフェニル基、メチルチオフェニル基、フェニルチオフェニル基、メチルアミノフェニル基、ジメチルアミノフェニル基、アセチルアミノフェニル基、カルボキシフェニル基、メトキシカルボニルフェニル基、エトキシフェニルカルボニル基、フェノキシカルボニルフェニル基、N−フェニルカルバモイルフェニル基、シアノフェニル基、スルホフェニル基、スルホナトフェニル基、ホスホノフェニル基、ホスホナトフェニル基等を挙げることができる。
【0023】
また、アルケニル基の例としては、ビニル基、1−プロペニル基、1−ブテニル基、シンナミル基、2−クロロ−1−エテニル基、等が挙げられ、アルキニル基の例としては、エチニル基、1−プロピニル基、1−ブチニル基、トリメチルシリルエチニル基等が挙げられる。
アシル基(R01CO−)のR01としては、水素原子、ならびに上記のアルキル基、アリール基を挙げることができる。これらの置換基の内、さらにより好ましいものとしてはハロゲン原子(−F、−Br、−Cl、−I)、アルコキシ基、アリーロキシ基、アルキルチオ基、アリールチオ基、N−アルキルアミノ基、N,N−ジアルキルアミノ基、アシルオキシ基、N−アルキルカルバモイルオキシ基、N−アリールカルバモイルオキシ基、アシルアミノ基、ホルミル基、アシル基、カルボキシル基、アルコキシカルボニル基、アリーロキシカルボニル基、カルバモイル基、N−アルキルカルバモイル基、N,N−ジアルキルカルバモイル基、N−アリールカルバモイル基、N−アルキル−N−アリールカルバモイル基、スルホ基、スルホナト基、スルファモイル基、N−アルキルスルファモイル基、N,N−ジアルキルスルファモイル基、N−アリールスルファモイル基、N−アルキル−N−アリールスルファモイル基、ホスホノ基、ホスホナト基、ジアルキルホスホノ基、ジアリールホスホノ基、モノアルキルホスホノ基、アルキルホスホナト基、モノアリールホスホノ基、アリールホスホナト基、ホスホノオキシ基、ホスホナトオキシ基、アリール基、アルケニル基が挙げられる。
ヘテロ環基としてはピリジル基、ピペリジニル基等が挙げられる。シリル基としてはトリメチルシリル基等が挙げられる。
【0024】
一方、置換アルキル基におけるアルキレン基としては前述の炭素数1から20までのアルキル基上の水素原子のいずれか1つを除し、2価の有機残基としたものを挙げることができ、好ましくは炭素原子数1から12までの直鎖状、炭素原子数3から12までの分岐状ならびに炭素原子数5から10までの環状のアルキレン基を挙げることができる。このような置換基とアルキレン基を組み合わせることで得られる置換アルキル基の、好ましい具体例としては、クロロメチル基、ブロモメチル基、2−クロロエチル基、トリフルオロメチル基、メトキシメチル基、イソプロポキシメチル基、ブトキシメチル基、s−ブトキシブチル基、メトキシエトキシエチル基、アリルオキシメチル基、フェノキシメチル基、メチルチオメチル基、トリルチオメチル基、ピリジルメチル基、テトラメチルピペリジニルメチル基、N−アセチルテトラメチルピペリジニルメチル基、トリメチルシリルメチル基、メトキシエチル基、エチルアミノエチル基、ジエチルアミノプロピル基、モルホリノプロピル基、アセチルオキシメチル基、ベンゾイルオキシメチル基、N−シクロヘキシルカルバモイルオキシエチル基、N−フェニルカルバモイルオキシエチル基、アセチルアミノエチル基、N−メチルベンゾイルアミノプロピル基、2−オキソエチル基、2−オキソプロピル基、カルボキシプロピル基、メトキシカルボニルエチル基、アリルオキシカルボニルブチル基、クロロフェノキシカルボニルメチル基、カルバモイルメチル基、N−メチルカルバモイルエチル基、N,N−ジプロピルカルバモイルメチル基、N−(メトキシフェニル)カルバモイルエチル基、N−メチル−N−(スルホフェニル)カルバモイルメチル基、スルホブチル基、スルホナトブチル基、スルファモイルブチル基、N−エチルスルファモイルメチル基、N,N−ジプロピルスルファモイルプロピル基、N−トリルスルファモイルプロピル基、N−メチル−N−(ホスホノフェニル)スルファモイルオクチル基、ホスホノブチル基、ホスホナトヘキシル基、ジエチルホスホノブチル基、ジフェニルホスホノプロピル基、メチルホスホノブチル基、メチルホスホナトブチル基、トリルホスホノヘキシル基、トリルホスホナトヘキシル基、ホスホノオキシプロピル基、ホスホナトオキシブチル基、ベンジル基、フェネチル基、α−メチルベンジル基、1−メチル−1−フェニルエチル基、p−メチルベンジル基、シンナミル基、アリル基、1−プロペニルメチル基、2−ブテニル基、2−メチルアリル基、2−メチルプロペニルメチル基、2−プロピニル基、2−ブチニル基、3−ブチニル基等を挙げることができる。
【0025】
アリール基としては、1個から3個のベンゼン環が縮合環を形成したもの、ベンゼン環と5員不飽和環が縮合環を形成したものを挙げることができ、具体例としては、フェニル基、ナフチル基、アントリル基、フェナントリル基、インデニル基、アセナフテニル基、フルオレニル基を挙げることができ、これらのなかでは、フェニル基、ナフチル基がより好ましい。
置換アリール基としては、前述のアリール基の環形成炭素原子上に置換基として、水素原子を除く一価の非金属原子団からなる基を有するものが用いられる。好ましい置換基の例としては前述のアルキル基、置換アルキル基、ならびに、先に置換アルキル基における置換基として示したものを挙げることができる。
【0026】
このような、置換アリール基の好ましい具体例としては、ビフェニル基、トリル基、キシリル基、メシチル基、クメニル基、クロロフェニル基、ブロモフェニル基、フルオロフェニル基、クロロメチルフェニル基、トリフルオロメチルフェニル基、ヒドロキシフェニル基、メトキシフェニル基、メトキシエトキシフェニル基、アリルオキシフェニル基、フェノキシフェニル基、メチルチオフェニル基、トリルチオフェニル基、エチルアミノフェニル基、ジエチルアミノフェニル基、モルホリノフェニル基、アセチルオキシフェニル基、ベンゾイルオキシフェニル基、N−シクロヘキシルカルバモイルオキシフェニル基、N−フェニルカルバモイルオキシフェニル基、アセチルアミノフェニル基、N−メチルベンゾイルアミノフェニル基、カルボキシフェニル基、メトキシカルボニルフェニル基、アリルオキシカルボニルフェニル基、クロロフェノキシカルボニルフェニル基、カルバモイルフェニル基、N−メチルカルバモイルフェニル基、N,N−ジプロピルカルバモイルフェニル基、N−(メトキシフェニル)カルバモイルフェニル基、N−メチル−N−(スルホフェニル)カルバモイルフェニル基、スルホフェニル基、スルホナトフェニル基、スルファモイルフェニル基、N−エチルスルファモイルフェニル基、N,N−ジプロピルスルファモイルフェニル基、N−トリルスルファモイルフェニル基、N−メチル−N−(ホスホノフェニル)スルファモイルフェニル基、ホスホノフェニル基、ホスホナトフェニル基、ジエチルホスホノフェニル基、ジフェニルホスホノフェニル基、メチルホスホノフェニル基、メチルホスホナトフェニル基、トリルホスホノフェニル基、トリルホスホナトフェニル基、アリルフェニル基、1−プロペニルメチルフェニル基、2−ブテニルフェニル基、2−メチルアリルフェニル基、2−メチルプロペニルフェニル基、2−プロピニルフェニル基、2−ブチニルフェニル基、3−ブチニルフェニル基等を挙げることができる。
【0027】
アルケニル基、置換アルケニル基、アルキニル基、ならびに置換アルキニル基(−C(R02)=C(R03)(R04)、ならびに−C≡C(R05))としては、R02、R03、R04、R05が一価の非金属原子団からなる基のものが使用できる。好ましいR02、R03、R04、R05の例としては、水素原子、ハロゲン原子、アルキル基、置換アルキル基、アリール基ならびに置換アリール基を挙げることができる。これらの具体例としては、前述の例として示したものを挙げることができる。R02、R03、R04、R05のより好ましい基としては、水素原子、ハロゲン原子ならびに炭素原子数1から10までの直鎖状、分岐状、環状のアルキル基を挙げることができる。
【0028】
このようなアルケニル基、置換アルケニル基、アルキニル基、置換アルキニル基の好ましい具体例としては、ビニル基、1−プロペニル基、1−ブテニル基、1−ペンテニル基、1−ヘキセニル基、1−オクテニル基、1−メチル−1−プロペニル基、2−メチル−1−プロペニル基、2−メチル−1−ブテニル基、2−フェニル−1−エテニル基、2−クロロ−1−エテニル基、エチニル基、1−プロピニル基、1−ブチニル基、フェニルエチニル基を挙げることができる。
ヘテロ環基としては、置換アルキル基の置換基として例示したピリジル基等が挙げられる。
【0029】
本発明に係る特定環構造は、上記のアミド構造以外に他の原子を含んで構成されてもよい。好ましい他の原子としては、炭素、窒素、酸素、硫黄などが挙げられる。環構造に炭素原子が含まれる場合、その置換基として水素原子のほかに、ハロゲン原子、ヒドロキシル基、カルボキシル基、スルホナト基、ニトロ基、シアノ基、アミド基、アミノ基、アルキル基、アルケニル基、アルキニル基、アリール基、置換オキシ基、置換スルホニル基、置換カルボニル基、置換スルフィニル基、スルホ基、ホスホノ基、ホスホナト基、シリル基、ヘテロ環基を有してもよい。
また、窒素原子上には、水素原子のほかに、アルキル基、アルケニル基、アルキニル基、アリール基、ヘテロ環基を有してもよい。そのようなアルキル基、アルケニル基、アルキニル基、アリール基、ヘテロ環基としては、前述したものが挙げられる。
【0030】
上記置換オキシ基(R06O−)としては、R06が水素原子を除く一価の非金属原子団からなる基であるものを用いることができる。好ましい置換オキシ基としては、アルコキシ基、アリーロキシ基、アシルオキシ基、カルバモイルオキシ基、N−アルキルカルバモイルオキシ基、N−アリールカルバモイルオキシ基、N,N−ジアルキルカルバモイルオキシ基、N,N−ジアリールカルバモイルオキシ基、N−アルキル−N−アリールカルバモイルオキシ基、アルキルスルホキシ基、アリールスルホキシ基、ホスホノオキシ基、ホスホナトオキシ基を挙げることができる。これらにおけるアルキル基、ならびにアリール基としては前述のアルキル基、置換アルキル基ならびに、アリール基、置換アリール基として示したものを挙げることができる。また、アシルオキシ基におけるアシル基(R07CO−)としては、R07が、先の例として挙げたアルキル基、置換アルキル基、アリール基ならびに置換アリール基のものを挙げることができる。これらの置換基の中では、アルコキシ基、アリーロキシ基、アシルオキシ基、アリールスルホキシ基がより好ましい。好ましい置換オキシ基の具体例としては、メトキシ基、エトキシ基、プロピルオキシ基、イソプロピルオキシ基、ブチルオキシ基、ペンチルオキシ基、ヘキシルオキシ基、ドデシルオキシ基、ベンジルオキシ基、アリルオキシ基、フェネチルオキシ基、カルボキシエチルオキシ基、メトキシカルボニルエチルオキシ基、エトキシカルボニルエチルオキシ基、メトキシエトキシ基、フェノキシエトキシ基、メトキシエトキシエトキシ基、エトキシエトキシエトキシ基、モルホリノエトキシ基、モルホリノプロピルオキシ基、アリロキシエトキシエトキシ基、フェノキシ基、トリルオキシ基、キシリルオキシ基、メシチルオキシ基、メシチルオキシ基、クメニルオキシ基、メトキシフェニルオキシ基、エトキシフェニルオキシ基、クロロフェニルオキシ基、ブロモフェニルオキシ基、アセチルオキシ基、ベンゾイルオキシ基、ナフチルオキシ基、フェニルスルホニルオキシ基、ホスホノオキシ基、ホスホナトオキシ基等が挙げられる。
【0031】
アミド基も含む置換アミノ基(R08NH−、(R09)(R010)N−)としては、R08、R09、R010が水素原子を除く一価の非金属原子団からなる基のものを使用できる。なおR09とR010とは結合して環を形成してもよい。置換アミノ基の好ましい例としては、N−アルキルアミノ基、N,N−ジアルキルアミノ基、N−アリールアミノ基、N,N−ジアリールアミノ基、N−アルキル−N−アリールアミノ基、アシルアミノ基、N−アルキルアシルアミノ基、N−アリールアシルアミノ基、ウレイド基、N’−アルキルウレイド基、N’,N’−ジアルキルウレイド基、N’−アリールウレイド基、N’,N’−ジアリールウレイド基、N’−アルキル−N’−アリールウレイド基、N−アルキルウレイド基、N−アリールウレイド基、N’−アルキル−N−アルキルウレイド基、N’−アルキル−N−アリールウレイド基、N’,N’−ジアルキル−N−アルキルウレイド基、N’−アルキル−N’−アリールウレイド基、N’,N’−ジアルキル−N−アルキルウレイド基、N’,N’−ジアルキル−N’−アリールウレイド基、N’−アリール−N−アルキルウレイド基、N’−アリール−N−アリールウレイド基、N’,N’−ジアリール−N−アルキルウレイド基、N’,N’−ジアリール−N−アリールウレイド基、N’−アルキル−N’−アリール−N−アルキルウレイド基、N’−アルキル−N’−アリール−N−アリールウレイド基、アルコキシカルボニルアミノ基、アリーロキシカルボニルアミノ基、N−アルキル−N−アルコキシカルボニルアミノ基、N−アルキル−N−アリーロキシカルボニルアミノ基、N−アリール−N−アルコキシカルボニルアミノ基、N−アリール−N−アリーロキシカルボニルアミノ基が挙げられる。これらにおけるアルキル基、アリール基としては前述のアルキル基、置換アルキル基、ならびにアリール基、置換アリール基として示したものを挙げることができ、アシルアミノ基、N−アルキルアシルアミノ基、N−アリールアシルアミノ基おけるアシル基(R07CO−)のR07は前述のとおりである。これらの内、より好ましいものとしては、N−アルキルアミノ基、N,N−ジアルキルアミノ基、N−アリールアミノ基、アシルアミノ基が挙げられる。好ましい置換アミノ基の具体例としては、メチルアミノ基、エチルアミノ基、ジエチルアミノ基、モルホリノ基、ピペリジノ基、ピロリジノ基、フェニルアミノ基、ベンゾイルアミノ基、アセチルアミノ基等が挙げられる。
【0032】
置換スルホニル基(R011−SO2−)としては、R011が一価の非金属原子団からなる基のものを使用できる。より好ましい例としては、アルキルスルホニル基、アリールスルホニル基を挙げることができる。これらにおけるアルキル基、アリール基としては前述のアルキル基、置換アルキル基、ならびにアリール基、置換アリール基として示したものを挙げることができる。このような、置換スルホニル基の具体例としては、ブチルスルホニル基、フェニルスルホニル基、クロロフェニルスルホニル基等が挙げられる。
【0033】
スルホナト基(−SO3−)は前述のとおり、スルホ基(−SO3H)の共役塩基陰イオン基を意味し、通常は対陽イオンとともに使用されるのが好ましい。このような対陽イオンとしては、一般に知られるもの、すなわち、種々のオニウム類(アンモニウム類、スルホニウム類、ホスホニウム類、ヨードニウム類、アジニウム類等)、ならびに金属イオン類(Na+、K+、Ca2+、Zn2+等)が挙げられる。
【0034】
置換カルボニル基(R013−CO−)としては、R013が一価の非金属原子団からなる基のものを使用できる。置換カルボニル基の好ましい例としては、ホルミル基、アシル基、カルボキシル基、アルコキシカルボニル基、アリーロキシカルボニル基、カルバモイル基、N−アルキルカルバモイル基、N,N−ジアルキルカルバモイル基、N−アリールカルバモイル基、N,N−ジアリールカルバモイル基、N−アルキル−N’−アリールカルバモイル基が挙げられる。これらにおけるアルキル基、アリール基としては前述のアルキル基、置換アルキル基、ならびにアリール基、置換アリール基として示したものを挙げることができる。これらの内、より好ましい置換カルボニル基としては、ホルミル基、アシル基、カルボキシル基、アルコキシカルボニル基、アリーロキシカルボニル基、カルバモイル基、N−アルキルカルバモイル基、N,N−ジアルキルカルバモイル基、N−アリールカルバモイル基が挙げられ、さらにより好ましいものとしては、ホルミル基、アシル基、アルコキシカルボニル基ならびにアリーロキシカルボニル基が挙げられる。好ましい置換カルボニル基の具体例としては、ホルミル基、アセチル基、ベンゾイル基、カルボキシル基、メトキシカルボニル基、エトキシカルボニル基、アリルオキシカルボニル基、ジメチルアミノフェニルエテニルカルボニル基、メトキシカルボニルメトキシカルボニル基、N−メチルカルバモイル基、N−フェニルカルバモイル基、N,N−ジエチルカルバモイル基、モルホリノカルボニル基等が挙げられる。
【0035】
置換スルフィニル基(R014−SO−)としてはR014が一価の非金属原子団からなる基のものを使用できる。好ましい例としては、アルキルスルフィニル基、アリールスルフィニル基、スルフィナモイル基、N−アルキルスルフィナモイル基、N,N−ジアルキルスルフィナモイル基、N−アリールスルフィナモイル基、N,N−ジアリールスルフィナモイル基、N−アルキル−N−アリールスルフィナモイル基が挙げられる。これらにおけるアルキル基、アリール基としては前述のアルキル基、置換アルキル基、ならびにアリール基、置換アリール基として示したものを挙げることができる。これらの内、より好ましい例としてはアルキルスルフィニル基、アリールスルフィニル基が挙げられる。このような置換スルフィニル基の具体例としては、ヘキシルスルフィニル基、ベンジルスルフィニル基、トリルスルフィニル基等が挙げられる。
【0036】
置換ホスホノ基とはホスホノ基上の水酸基の一つもしくは二つが他の有機オキソ基によって置換されたものを意味し、好ましい例としては、前述のジアルキルホスホノ基、ジアリールホスホノ基、アルキルアリールホスホノ基、モノアルキルホスホノ基、モノアリールホスホノ基が挙げられる。これらの中ではジアルキルホスホノ基、ならびにジアリールホスホノ基がより好ましい。このような具体例としては、ジエチルホスホノ基、ジブチルホスホノ基、ジフェニルホスホノ基等が挙げられる。
【0037】
ホスホナト基(−PO3H2−、−PO3H−)とは前述のとおり、ホスホノ基(−PO3H2)の、酸第一解離もしくは、酸第二解離に由来する共役塩基陰イオン基を意味する。通常は対陽イオンと共に使用されるのが好ましい。このような対陽イオンとしては、一般に知られるもの、すなわち、種々のオニウム類(アンモニウム類、スルホニウム類、ホスホニウム類、ヨードニウム類、アジニウム類、等)、ならびに金属イオン類(Na+、K+、Ca2+、Zn2+等)が挙げられる。
【0038】
置換ホスホナト基とは前述の置換ホスホノ基の内、水酸基を一つ有機オキソ基に置換したものの共役塩基陰イオン基であり、具体例としては、前述のモノアルキルホスホノ基(−PO3H(alkyl))、モノアリールホスホノ基(−PO3H(aryl))の共役塩基が挙げられる。
【0039】
以上のようなアミド構造を少なくとも1つ有する、本発明に係る特定環構造としては、4〜10員環であるものが好ましく、5〜6員環であることがより好ましい。そのような環構造の具体例としては、下記(A−1)〜(A−12)に示すものが挙げられる。なかでも、アミド構造を2つ以上含んでなる(A−9)〜(A−12)で表されるものが膜強度の点で好ましく、(A−10)または(A−12)で表されるものが皮膜強度・現像性のバランスの点で特に好ましく、最も好ましいものは(A−12)である。
【0040】
【化3】
【0041】
本発明に係る特定重合性化合物は、その分子内に、上記特定環構造を2つ以上有する。そのような2つ以上の特定環構造は、同一のものであっても、互いに異なるものであってもよい。
また、そのような2つ以上の環構造は、お互いが直接結合して一つの化合物を構成していてもよいが、多価の連結基、より好ましくは多価の有機連結基を介して結合していることがより好ましい。有機連結基は、実質的に非金属原子からなる多価の有機基であり、主として、炭素原子、窒素原子、酸素原子、水素原子、硫黄原子等から構成されるものである。
より具体的な連結基としては、特に限定されるものではないが、例えば、下記の構造単位を単独或いは複数組み合わせて構成されるものを挙げることができる。その分子量としては、12〜3000であることが好ましく、12〜2000であることがより好ましく、12〜1000であることが特に好ましい。
【0042】
【化4】
【0043】
上記の多価の連結基は置換基を有してもよい。多価の連結基の置換基としては、特に限定されるものではないが、例えば、前述のハロゲン原子、ヒドロキシル基、カルボキシル基、スルホナト基、ニトロ基、シアノ基、アミド基、アミノ基、アルキル基、アルケニル基、アルキニル基、アリール基、置換オキシ基、置換スルホニル基、置換カルボニル基、置換スルフィニル基、スルホ基、ホスホノ基、ホスホナト基、シリル基、ヘテロ環基が挙げられる。
【0044】
(エチレン性不飽和結合)
本発明に係る特定重合性化合物は、上記特定環構造を2つ以上と、少なくとも1つ以上のエチレン性不飽和結合を有する。本発明においては、このようなエチレン性不飽和結合を特定重合性化合物内のどの部位に有していてもよいが、好ましくは、特定環構造を構成するアミド構造、即ち、前記一般式(I)におけるRの末端置換基として導入されるか、或いは、特定環構造を構成するアミド構造以外の他の原子の末端置換基として導入されることが好ましい。さらに、上記特定環構造1つにつき、2つ以上のエチレン性不飽和結合を有することが好ましい。
本発明に用いられるエチレン性不飽和結合としては、下記一般式(II)〜(IV)で表されるものが好ましい。
【0045】
【化5】
【0046】
一般式(II)において、R1は水素原子または1価の有機基を表し、好ましくは、水素原子または置換基を有してもよいアルキル基などが挙げられ、中でも、水素原子、メチル基がラジカル反応性が高いことから好ましい。
R2、R3は、それぞれ独立に、水素原子、ハロゲン原子、アミノ基、カルボキシル基、アルコキシカルボニル基、スルホ基、ニトロ基、シアノ基、または1価の有機基を表し、1価の有機基としては、置換基を有してもよいアルキル基、置換基を有してもよいアリール基、置換基を有してもよいアルコキシ基、置換基を有してもよいアリールオキシ基、置換基を有してもよいアルキルアミノ基、置換基を有してもよいアリールアミノ基、置換基を有してもよいアルキルスルホニル基、置換基を有してもよいアリールスルホニル基などが挙げられる。中でも、水素原子、カルボキシル基、アルコキシカルボニル基、置換基を有してもよいアルキル基、置換基を有してもよいアリール基がラジカル反応性が高いことから好ましい。
【0047】
Y1は、酸素原子、硫黄原子、または、−NR12−を表す。ここで、R12は、水素原子、または1価の有機基を表し、好ましくは、水素原子、置換基を有してもよいアルキル基などが挙げられ、中でも、水素原子、メチル基、エチル基、イソプロピル基がラジカル反応性が高いことから好ましい。
【0048】
ここで、上記R1〜R3およびR12において導入しうる各置換基としては、アルキル基、アルケニル基、アルキニル基、アリール基、アルコキシ基、アリーロキシ基、ハロゲン原子、アミノ基、アルキルアミノ基、アリールアミノ基、カルボキシル基、アルコキシカルボニル基、スルホ基、ニトロ基、シアノ基、アミド基、アルキルスルホニル基、アリールスルホニル基などが挙げられる。
【0049】
一般式(III)において、R4〜R8はそれぞれ独立に、水素原子、ハロゲン原子、アミノ基、ジアルキルアミノ基、カルボキシル基、アルコキシカルボニル基、スルホ基、ニトロ基、シアノ基、または1価の有機基を表し、1価の有機基としては、置換基を有してもよいアルキル基、置換基を有してもよいアリール基、置換基を有してもよいアルコキシ基、置換基を有してもよいアリールオキシ基、置換基を有してもよいアルキルアミノ基、置換基を有してもよいアリールアミノ基、置換基を有してもよいアルキルスルホニル基、置換基を有してもよいアリールスルホニル基などが挙げらる。中でも、水素原子、カルボキシル基、アルコキシカルボニル基、置換基を有してもよいアルキル基、置換基を有してもよいアリール基が好ましい。導入しうる置換基としては、一般式(II)で挙げたものと同様のものが挙げられる。
Y2は、酸素原子、硫黄原子、または−NR12−を表す。R12は、一般式(II)におけるものと同様である。
【0050】
一般式(IV)において、R9は、水素原子または一価の有機基を表し、好ましくは、水素原子、置換基を有してもよいアルキル基などが挙げられ、中でも、水素原子、メチル基がラジカル反応性が高いことから好ましい。
R10、R11は、それぞれ独立に、水素原子、ハロゲン原子、アミノ基、ジアルキルアミノ基、カルボキシル基、アルコキシカルボニル基、スルホ基、ニトロ基、シアノ基、または1価の有機基を表し、1価の有機基としては、置換基を有してもよいアルキル基、置換基を有してもよいアリール基、置換基を有してもよいアルコキシ基、置換基を有してもよいアリールオキシ基、置換基を有してもよいアルキルアミノ基、置換基を有してもよいアリールアミノ基、置換基を有してもよいアルキルスルホニル基、置換基を有してもよいアリールスルホニル基などが挙げられる。中でも、水素原子、カルボキシル基、アルコキシカルボニル基、置換基を有してもよいアルキル基、置換基を有してもよいアリール基がラジカル反応性が高いことから好ましい。
ここで、導入しうる置換基としては、一般式(II)で挙げたものと同様のものが挙げられる。
Y3は、酸素原子、硫黄原子、−NR12−、または置換基を有してもよいフェニレン基を表す。R12は、一般式(II)におけるものと同様である。
【0051】
このようなエチレン性不飽和結合の中でも、一般式(II)で表されるものが感度の点で好ましい。
【0052】
ここで、本発明に係る特定重合性化合物の具体例(M−1)〜(M−47)を挙げるが、本発明はこれらに限定されるものではない。なお、具体例(M−1)〜(M−47)の構造中の記号A1〜A22は、具体例(M−1)〜(M−47)の後にひき続き例示するA1〜A22の構造が結合されることを意味する。
【0053】
【化6】
【0054】
【化7】
【0055】
【化8】
【0056】
【化9】
【0057】
【化10】
【0058】
【化11】
【0059】
【化12】
【0060】
【化13】
【0061】
【化14】
【0062】
【化15】
【0063】
次に、本発明に係る特定重合性化合物の代表的な合成例を示すが、本発明はこれらに限定されるものではない。
(化合物M−7の合成)
1000mlの三口フラスコに、ビス(2−アクリロイロキシエチル)−2−ヒドロキシエチルイソシアヌル酸93g、トリエチルアミン26g、p−メトキシフェノール0.05gを入れ、アセトン300mlを加え溶解した。氷浴で冷却しながら、グルタル酸ジクロリド20gを1時間かけて滴下した。滴下終了後、氷浴を外した。さらに6時間反応させた後に、反応混液を水1.5Lに投入した。析出した結晶をろ過により取り出し、化合物(M−7)を、65g得た。
化合物(M−7)であることは、H−NMR、質量スペクトル、IRスペクトルにより確認した。
【0064】
(化合物M−28の合成)
1000mlの三口フラスコに、ビス(2−アクリロイロキシエチル)−2−ヒドロキシエチルイソシアヌル酸78g、トリエチルアミン21g、p−メトキシフェノール0.05gを入れ、THF400mlを加え溶解した。氷浴で冷却しながら、1,3−ベンゼンジスルフォニルジクロリド28gのTHF100ml溶液を1.5時間かけて滴下した。滴下終了後、氷浴を外した。さらに6時間反応させた後に、反応混液を水2Lに投入した。酢酸エチル1Lで抽出し、有機層を飽和炭酸水素水溶液、飽和食塩水で順次洗浄した。有機層を硫酸マグネシウムで乾燥し、ろ過した後に、溶媒を減圧留去し、化合物(M−28)を、74g得た。化合物(M−28)であることは、H−NMR、質量スペクトル、IRスペクトルにより確認した。
【0065】
(化合物M−22の合成)
1000mlの三口フラスコに、ビス(2−アクリロイロキシエチル)−2−ヒドロキシエチルイソシアヌル酸43g、トリエチルアミン12g、p−メトキシフェノール0.05gを入れ、アセトン400mlを加え溶解した。氷浴で冷却しながら、ジグリコールクロリド9gを20分かけて滴下した。滴下終了後、氷浴を外した。さらに6時間反応させた後に、反応混液を水1Lに投入した。酢酸エチル1Lで抽出し、有機層を飽和炭酸水素水溶液、飽和食塩水で順次洗浄した。有機層を硫酸マグネシウムで乾燥し、ろ過した後に、溶媒を減圧留去し、化合物(M−22)を、15g得た。化合物(M−22)であることは、H−NMR、質量スペクトル、IRスペクトルにより確認した。
【0066】
本発明に係る特定重合性化合物の分子量は、好ましくは400以上であり、さらに好ましくは600〜3,000の範囲である。400を下回ると皮膜強度の向上効果が不足し、平版印刷版原版の記録材料として使用した場合に、画像強度が不足する傾向にあるため好ましくない。また、3,000を超えると現像性が低下する。
本発明に係る特定重合性化合物は、単独で用いても2種以上を併用して用いてもよい。
【0067】
本発明の光又は熱硬化性組成物には、前記特定重合性化合物の他、本発明の効果を損なわない範囲において、他の公知の重合性化合物を併用することができる。その場合は、他の重合性化合物の含有量が、重合性化合物全体の80質量%以下であることが好ましく、さらに60質量%以下であることが好ましい。
【0068】
このような重合性化合物としては、少なくとも一個のエチレン性不飽和二重結合を有する付加重合性化合物であることが好ましく、末端エチレン性不飽和結合を少なくとも1個、より好ましくは2個以上有する化合物から選ばれることが好ましい。このような化合物群は当該産業分野において広く知られるものであり、本発明においてはこれらを特に限定無く用いることができる。これらは、例えば、モノマー、プレポリマー、すなわち2量体、3量体及びオリゴマー、又はそれらの混合物ならびにそれらの共重合体などの化学的形態を持つものを包含する。
【0069】
モノマー及びその共重合体の例としては、不飽和カルボン酸(例えば、アクリル酸、メタクリル酸、イタコン酸、クロトン酸、イソクロトン酸、マレイン酸など)や、そのエステル類、アミド類があげられ、好ましくは、不飽和カルボン酸と脂肪族多価アルコール化合物とのエステル、不飽和カルボン酸と脂肪族多価アミン化合物とのアミド類が用いられる。また、ヒドロキシル基や、アミノ基、メルカプト基等の求核性置換基を有する不飽和カルボン酸エステル、アミド類と単官能もしくは多官能イソシアナート類、エポキシ類との付加反応物、単官能もしくは、多官能のカルボン酸との脱水縮合反応物等も好適に使用される。
【0070】
また、イソシアナート基や、エポキシ基、等の親電子性置換基を有する、不飽和カルボン酸エステル、アミド類と単官能もしくは多官能のアルコール類、アミン類、チオール類との付加反応物、ハロゲン基や、トシルオキシ基、等の脱離性置換基を有する、不飽和カルボン酸エステル、アミド類と単官能もしくは多官能のアルコール類、アミン類、チオール類との置換反応物も好適である。また、別の例として、上記の不飽和カルボン酸の代わりに、不飽和ホスホン酸、スチレン、ビニルエーテル等に置き換えた化合物群を使用することも可能である。
【0071】
前記特定重合性化合物およびその他の重合性化合物について、どのような構造のものを用いるか、単独で使用するか、添加量はどうかといった、使用方法の詳細は、最終的な光または熱硬化性樹脂の性能設計にあわせて任意に設定できる。例えば、本発明の光または熱硬化性樹脂を平版印刷版原版の記録材料として用いる場合には、次のような観点から選択される。
感度の点では、1分子あたりの不飽和基含有量が多い構造が好ましく、多くの場合、2官能以上が好ましい。また、画像部すなわち硬化膜の強度を高くするためには、3官能以上のものがよく、さらに、異なる官能数・異なる重合性基を有する化合物(例えば、アクリル酸エステル系化合物、メタクリル酸エステル化合物、スチレン系化合物等)を組み合わせて用いることで感度と膜強度の両方を調節する方法も有効である。一方、大きな分子量の化合物や疎水性の高い化合物は、感度や膜強度に優れる反面、現像スピードや現像液中での析出といった点で好ましくない場合もある。
【0072】
また、記録材料中の他の成分(例えば後述する、バインダーポリマー、ラジカル開始剤、着色剤等)との相溶性、分散性に対しても、上述の重合性化合物の選択・使用法は重要な要因であり、例えば低純度の重合性化合物の使用や、2種以上の重合性化合物の併用によって、相溶性を向上させうることがある。支持体、オーバーコート層等との密着性を向上せしめる目的で特定の構造を選択することもあり得る。
【0073】
画像記録層中の重合性化合物の配合比に関しては、多いほうが感度的に有利であるが、多すぎる場合には、好ましくない相分離が生じたり、画像記録層の粘着性による製造工程上の問題(例えば、記録層成分の転写、粘着に由来する製造不良)や、現像液からの析出が生じる等の問題が生じうる。
さらに、酸素に対する重合阻害の大小、解像度、かぶり性、屈折率変化等の観点からも、適切な構造、配合、添加量を任意に選択することができ、さらに、場合によっては下塗り、上塗りといった層構成或いは塗布方法なども選択することができる。
これらの観点から、記録材料全組成物中の重合性化合物の含有量は、5〜80質量%が好ましく、20〜75質量%がより好ましい。
【0074】
〔(B)光または熱によりラジカルを生成する化合物〕
本発明の光または熱硬化性組成物には、光または熱によりラジカルを生成する化合物(ラジカル開始剤)を含有する。ラジカル開始剤とは、光および/または熱のエネルギーによってラジカルを発生し、前述の(A)特定重合性化合物、さらには、所望により併用される前記公知の重合性化合物など、の重合を開始、促進させる化合物を指す。また、本発明に係る(A)特定重合性化合物は、それ自体が高分子化合物であり、皮膜形成性を有するため、ラジカル開始剤のみを添加することで優れた光または熱硬化性組成物となる。
本発明において、好ましいラジカル開始剤としては、(a)芳香族ケトン類、(b)オニウム塩化合物、(c)有機過酸化物、(d)チオ化合物、(e)ヘキサアリールビイミダゾール化合物、(f)ケトオキシムエステル化合物、(g)ボレート化合物、(h)アジニウム化合物、(i)メタロセン化合物、(j)活性エステル化合物、(k)炭素ハロゲン結合を有する化合物等が挙げられる。以下に、上記(a)〜(k)の具体例を挙げるが、本発明はこれらに限定されるものではない。
【0075】
(a)芳香族ケトン類
本発明に用いられるラジカル開始剤として好ましい(a)芳香族ケトン類としては、「RADIATION CURING IN POLYMER SCIENCE AND TECHNOLOGY」J.P.Fouassier,J.F.Rabek(1993),p77−117記載のベンゾフェノン骨格あるいはチオキサントン骨格を有する化合物が挙げられる。例えば、
【0076】
【化16】
【0077】
が挙げられる。中でも、特に好ましい(a)芳香族ケトン類の例としては、特公昭47−6416記載のα−チオベンゾフェノン化合物、特公昭47−3981記載のベンゾインエーテル化合物、例えば、下記化合物が挙げられる。
【0078】
【化17】
【0079】
特公昭47−22326記載のα−置換ベンゾイン化合物、例えば、下記化合物が挙げられる。
【0080】
【化18】
【0081】
特公昭47−23664記載のベンゾイン誘導体、特開昭57−30704記載のアロイルホスホン酸エステル、特公昭60−26483記載のジアルコキシベンゾフェノン、例えば、下記化合物が挙げられる。
【0082】
【化19】
【0083】
特公昭60−26403、特開昭62−81345記載のベンゾインエーテル類、例えば、下記化合物が挙げられる。
【0084】
【化20】
【0085】
特公平1−34242、米国特許第4,318,791号、ヨーロッパ特許0284561A1号記載のα−アミノベンゾフェノン類、例えば、下記化合物が挙げられる。
【0086】
【化21】
【0087】
特開平2−211452記載のp−ジ(ジメチルアミノベンゾイル)ベンゼン、例えば、下記化合物が挙げられる。
【0088】
【化22】
【0089】
特開昭61−194062記載のチオ置換芳香族ケトン、例えば、下記化合物が挙げられる。
【0090】
【化23】
【0091】
特公平2−9597記載のアシルホスフィンスルフィド、例えば、下記化合物が挙げられる。
【0092】
【化24】
【0093】
特公平2−9596記載のアシルホスフィン、例えば、下記化合物が挙げられる。
【0094】
【化25】
【0095】
また、特公昭63−61950記載のチオキサントン類、特公昭59−42864記載のクマリン類等を挙げることもできる。
【0096】
(b)オニウム塩化合物
本発明に用いられるラジカル開始剤として好ましい(b)オニウム塩化合物としては、下記一般式(1)〜(3)で表される化合物が挙げられる。
【0097】
【化26】
【0098】
式(1)中、Ar1とAr2は、それぞれ独立に、置換基を有していても良い炭素原子数20個以下のアリール基を示す。このアリール基が置換基を有する場合の好ましい置換基としては、ハロゲン原子、ニトロ基、炭素原子数12個以下のアルキル基、炭素原子数12個以下のアルコキシ基、または炭素原子数12個以下のアリールオキシ基が挙げられる。(Z2)−はハロゲンイオン、過塩素酸イオン、カルボン酸イオン、テトラフルオロボレートイオン、ヘキサフルオロホスフェートイオン、およびスルホン酸イオンからなる群より選択される対イオンを表し、好ましくは、過塩素酸イオン、ヘキサフルオロフォスフェートイオン、およびアリールスルホン酸イオンである。
【0099】
式(2)中、Ar3は、置換基を有していても良い炭素原子数20個以下のアリール基を示す。好ましい置換基としては、ハロゲン原子、ニトロ基、炭素原子数12個以下のアルキル基、炭素原子数12個以下のアルコキシ基、炭素原子数12個以下のアリールオキシ基、炭素原子数12個以下のアルキルアミノ基、炭素原子数12個以下のジアルキルアミノ基、炭素原子数12個以下のアリールアミノ基または、炭素原子数12個以下のジアリールアミノ基が挙げられる。(Z3)−は(Z2)−と同義の対イオンを表す。
【0100】
式(3)中、R23、R24及びR25は、それぞれ同じでも異なっていても良く、置換基を有していても良い炭素原子数20個以下の炭化水素基を示す。好ましい置換基としては、ハロゲン原子、ニトロ基、炭素原子数12個以下のアルキル基、炭素原子数12個以下のアルコキシ基、または炭素原子数12個以下のアリールオキシ基が挙げられる。(Z4)−は(Z2)−と同義の対イオンを表す。
【0101】
本発明において、好適に用いることのできるオニウム塩の具体例としては、本願出願人が先に提案した特願平11−310623号明細書の段落番号[0030]〜[0033]に記載されたものや特願2000−160323号明細書の段落番号[0015]〜[0046]に記載されたものを挙げることができる。
【0102】
本発明において用いられるオニウム塩は、極大吸収波長が400nm以下であることが好ましく、さらに360nm以下であることが好ましい。このように吸収波長を紫外線領域にすることにより、平版印刷版原版の取り扱いを白灯下で実施することができる。
【0103】
(c)有機過酸化物
本発明に用いられるラジカル開始剤として好ましい(c)有機過酸化物としては、分子中に酸素−酸素結合を1個以上有する有機化合物のほとんど全てが含まれるが、その例としては、メチルエチルケトンパーオキサイド、シクロヘキサノンパーオキサイド、3,3,5−トリメチルシクロヘキサノンパーオキサイド、メチルシクロヘキサノンパーオキサイド、アセチルアセトンパーオキサイド、1,1−ビス(ターシャリイブチルパーオキシ)−3,3,5−トリメチルシクロヘキサン、1,1−ビス(ターシャリイブチルパーオキシ)シクロヘキサン、2,2−ビス(ターシャリイブチルパーオキシ)ブタン、ターシャリイブチルハイドロパーオキサイド、クメンハイドロパーオキサイド、ジイソプロピルベンゼンハイドロパーオキサイド、パラメタンハイドロパーオキサイド、2,5−ジメチルヘキサン−2,5−ジハイドロパーオキサイド、1,1,3,3−テトラメチルブチルハイドロパーオキサイド、ジターシャリイブチルパーオキサイド、ターシャリイブチルクミルパーオキサイド、ジクミルパーオキサイド、ビス(ターシャリイブチルパーオキシイソプロピル)ベンゼン、2,5−ジメチル−2,5−ジ(ターシャリイブチルパーオキシ)ヘキサン、2,5−キサノイルパーオキサイド、過酸化こはく酸、過酸化ベンゾイル、2,4−ジクロロベンゾイルパーオキサイド、メタ−トルオイルパーオキサイド、ジイソプロピルパーオキシジカーボネート、ジ−2−エチルヘキシルパーオキシジカーボネート、ジ−2−エトキシエチルパーオキシジカーボネート、ジメトキシイソプロピルパーオキシカーボネート、ジ(3−メチル−3−メトキシブチル)パーオキシジカーボネート、ターシャリイブチルパーオキシアセテート、ターシャリイブチルパーオキシピバレート、ターシャリイブチルパーオキシネオデカノエート、ターシャリイブチルパーオキシオクタノエート、ターシャリイブチルパーオキシ−3,5,5−トリメチルヘキサノエート、ターシャリイブチルパーオキシラウレート、ターシャリーカーボネート、3,3′4,4′−テトラ−(t−ブチルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(t−アミルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(t−ヘキシルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(t−オクチルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(クミルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(p−イソプロピルクミルパーオキシカルボニル)ベンゾフェノン、カルボニルジ(t−ブチルパーオキシ二水素二フタレート)、カルボニルジ(t−ヘキシルパーオキシ二水素二フタレート)等がある。
【0104】
中でも、3,3′4,4′−テトラ−(t−ブチルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(t−アミルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(t−ヘキシルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(t−オクチルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(クミルパーオキシカルボニル)ベンゾフェノン、3,3′4,4′−テトラ−(p−イソプロピルクミルパーオキシカルボニル)ベンゾフェノン、ジ−t−ブチルジパーオキシイソフタレートなどの過酸化エステル系が好ましい。
【0105】
(d)チオ化合物
本発明で用いられるラジカル開始剤として好ましい(d)チオ化合物としては、下記一般式(4)で示される構造を有する化合物が挙げられる。
【0106】
【化27】
【0107】
(ここで、R26はアルキル基、アリール基または置換アリール基を示し、R27は水素原子またはアルキル基を示す。また、R26とR27は、互いに結合して酸素、硫黄および窒素原子から選ばれたヘテロ原子を含んでもよい5員ないし7員環を形成するのに必要な非金属原子群を示す。)
上記一般式(4)におけるアルキル基としては炭素原子数1〜4個のものが好ましい。またアリール基としてはフェニル、ナフチルのような炭素原子数6〜10個のものが好ましく、置換アリール基としては、上記のようなアリール基に塩素原子のようなハロゲン原子、メチル基のようなアルキル基、メトシキ基、エトキシ基のようなアルコキシ基で置換されたものが含まれる。R27は、好ましくは炭素原子数1〜4個のアルキル基である。一般式(4)で示されるチオ化合物の具体例としては、下記に示すような化合物が挙げられる。
【0108】
【化28】
【0109】
(e)ヘキサアリールビイミダゾール化合物
本発明に用いられるラジカル開始剤として好ましい(e)ヘキサアリールビイミダゾール化合物としては、特公昭45−37377号、特公昭44−86516号記載のロフィンダイマー類、例えば2,2′−ビス(o−クロロフェニル)−4,4′,5,5′−テトラフェニルビイミダゾール、2,2′−ビス(o−ブロモフェニル)−4,4′,5,5′−テトラフェニルビイミダゾール、2,2′−ビス(o,p−ジクロロフェニル)−4,4′,5,5′−テトラフェニルビイミダゾール、2,2′−ビス(o−クロロフェニル)−4,4′,5,5′−テトラ(m−メトキシフェニル)ビイミダゾール、2,2′−ビス(o,o′−ジクロロフェニル)−4,4′,5,5′−テトラフェニルビイミダゾール、2,2′−ビス(o−ニトロフェニル)−4,4′,5,5′−テトラフェニルビイミダゾール、2,2′−ビス(o−メチルフェニル)−4,4′,5,5′−テトラフェニルビイミダゾール、2,2′−ビス(o−トリフルオロフェニル)−4,4′,5,5′−テトラフェニルビイミダゾール等が挙げられる。
【0110】
(f)ケトオキシムエステル化合物
本発明に用いられるラジカル開始剤として好ましい(f)ケトオキシムエステル化合物としては、3−ベンゾイロキシイミノブタン−2−オン、3−アセトキシイミノブタン−2−オン、3−プロピオニルオキシイミノブタン−2−オン、2−アセトキシイミノペンタン−3−オン、2−アセトキシイミノ−1−フェニルプロパン−1−オン、2−ベンゾイロキシイミノ−1−フェニルプロパン−1−オン、3−p−トルエンスルホニルオキシイミノブタン−2−オン、2−エトキシカルボニルオキシイミノ−1−フェニルプロパン−1−オン等が挙げられる。
【0111】
(g)ボレート化合物
本発明に用いられるラジカル開始剤として好ましい(g)ボレート化合物の例としては、下記一般式(5)で表される化合物を挙げることができる。
【0112】
【化29】
【0113】
(ここで、R28、R29、R30およびR31は互いに同一でも異なっていてもよく、各々置換もしくは非置換のアルキル基、置換もしくは非置換のアリール基、置換もしくは非置換のアルケニル基、置換もしくは非置換のアルキニル基、又は置換もしくは非置換の複素環基を示し、R28、R29、R30およびR31はその2個以上の基が結合して環状構造を形成してもよい。ただし、R28、R29、R30およびR31のうち、少なくとも1つは置換もしくは非置換のアルキル基である。(Z5)+はアルカリ金属カチオンまたは第4級アンモニウムカチオンを示す。)
上記R28〜R31のアルキル基としては、直鎖、分枝、環状のものが含まれ、炭素原子数1〜18のものが好ましい。具体的にはメチル、エチル、プロピル、イソプロピル、ブチル、ペンチル、ヘキシル、オクチル、ステアリル、シクロブチル、シクロペンチル、シクロヘキシルなどが含まれる。また置換アルキル基としては、上記のようなアルキル基に、ハロゲン原子(例えば−Cl、−Brなど)、シアノ基、ニトロ基、アリール基(好ましくはフェニル基)、ヒドロキシ基、−COOR32(ここでR32は水素原子、炭素数1〜14のアルキル基、又はアリール基を示す)、−OCOR33又は−OR34(ここでR33、R34は炭素数1〜14のアルキル基、又はアリール基を示す)、及び下記式で表されるものを置換基として有するものが含まれる。
【0114】
【化30】
【0115】
(ここでR35、R36は独立して水素原子、炭素数1〜14のアルキル基、又はアリール基を示す)
上記R28〜R31のアリール基としては、フェニル基、ナフチル基などの1〜3環のアリール基が含まれ、置換アリール基としては、上記のようなアリール基に前述の置換アルキル基の置換基又は、炭素数1〜14のアルキル基を有するものが含まれる。上記R28〜R31のアルケニル基としては、炭素数2〜18の直鎖、分枝、環状のものが含まれ。置換アルケニル基の置換基としては、前記の置換アルキル基の置換基として挙げたものが含まれる。上記R28〜R31のアルキニル基としては、炭素数2〜28の直鎖又は分枝のものが含まれ、置換アルキニル基の置換基としては、前記置換アルキル基の置換基として挙げたものが含まれる。また、上記R28〜R31の複素環基としてはN、SおよびOの少なくとも1つを含む5員環以上、好ましくは5〜7員環の複素環基が挙げられ、この複素環基には縮合環が含まれていてもよい。更に置換基として前述の置換アリール基の置換基として挙げたものを有していてもよい。一般式(5)で示される化合物例としては具体的には米国特許3,567,453号、同4,343,891号、ヨーロッパ特許109,772号、同109,773号に記載されている化合物および以下に示すものが挙げられる。
【0116】
【化31】
【0117】
(h)アジニウム化合物
本発明に用いられるラジカル開始剤として好ましい(h)アジニウム塩化合物としては、特開昭63−138345号、特開昭63−142345号、特開昭63−142346号、特開昭63−143537号ならびに特公昭46−42363号記載のN−O結合を有する化合物群をあげることができる。
【0118】
(i)メタロセン化合物
本発明に用いられるラジカル開始剤として好ましい(i)メタロセン化合物としては、特開昭59−152396号、特開昭61−151197号、特開昭63−41484号、特開平2−249号、特開平2−4705号記載のチタノセン化合物ならびに、特開平1−304453号、特開平1−152109号記載の鉄−アレーン錯体をあげることができる。
【0119】
上記チタノセン化合物の具体例としては、ジ−シクロペンタジエニル−Ti−ジ−クロライド、ジ−シクロペンタジエニル−Ti−ビス−フェニル、ジ−シクロペンタジエニル−Ti−ビス−2,3,4,5,6−ペンタフルオロフェニ−1−イル、ジ−シクロペンタジエニル−Ti−ビス−2,3,5,6−テトラフルオロフェニ−1−イル、ジ−シクロペンタジエニル−Ti−ビス−2,4,6−トリフルオロフェニ−1−イル、ジ−シクロペンタジエニル−Ti−2,6−ジフルオロフェニ−1−イル、ジ−シクロペンタジエニル−Ti−ビス−2,4−ジフルオロフェニ−1−イル、ジ−メチルシクロペンタジエニル−Ti−ビス−2,3,4,5,6−ペンタフルオロフェニ−1−イル、ジ−メチルシクロペンタジエニル−Ti−ビス−2,3,5,6−テトラフルオロフェニ−1−イル、ジ−メチルシクロペンタジエニル−Ti−ビス−2,4−ジフルオロフェニ−1−イル、ビス(シクロペンタジエニル)−ビス(2,6−ジフルオロ−3−(ピリ−1−イル)フェニル)チタニウムビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(メチルスルホンアミド)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(N−ブチルビアロイル−アミノ)フェニル〕チタン、
【0120】
ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(N−ブチル−(4−クロロベンゾイル)アミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(N−ベンジル−2,2−ジメチルペンタノイルアミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(N−(2−エチルヘキシル)−4−トリル−スルホニル)アミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(N−(3−オキサヘプチル)ベンゾイルアミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(N−(3,6−ジオキサデシル)ベンゾイルアミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(トリフルオロメチルスルホニル)アミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(トリフルオロアセチルアミノ)フェニル〕チタン、
【0121】
ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(2−クロロベンゾイル)アミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(4−クロロベンゾイル)アミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(N−(3,6−ジオキサデシル)−2,2−ジメチルペンタノイルアミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(N−(3,7−ジメチル−7−メトキシオクチル)ベンゾイルアミノ)フェニル〕チタン、ビス(シクロペンタジエニル)ビス〔2,6−ジフルオロ−3−(N−シクロヘキシルベンゾイルアミノ)フェニル〕チタン、等を挙げることができる。
【0122】
(j)活性エステル化合物
本発明に用いられるラジカル開始剤として好ましい(j)活性エステル化合物としては、特公昭62−6223記載のイミドスルホネート化合物、特公昭63−14340号、特開昭59−174831号記載の活性スルホネート類をあげることができる。
【0123】
(k)炭素ハロゲン結合を有する化合物
本発明に用いられるラジカル開始剤として好ましい(k)炭素ハロゲン結合を有する化合物としては、下記一般式(6)から(12)のものを挙げることができる。
【0124】
【化32】
【0125】
(式中、X2はハロゲン原子をし、Y1は−C(X2)3、−NH2、−NHR38、−NR38、−OR38を表わす。ここでR38はアルキル基、置換アルキル基、アリール基、置換アリール基を表わす。またR37は−C(X2)3、アルキル基、置換アルキル基、アリール基、置換アリール基、置換アルケニル基、を表わす。)
【0126】
【化33】
【0127】
(ただし、R39は、アルキル基、置換アルキル基、アルケニル基、置換アルケニル基、アリール基、置換アリール基、ハロゲン原子、アルコキシ基、置換アルコキシル基、ニトロ基又はシアノ基であり、X3はハロゲン原子であり、nは1〜3の整数である。)
【0128】
【化34】
【0129】
(ただし、R40は、アリール基又は置換アリール基であり、R41は、以下に示す基又はハロゲンであり、Z6は−C(=O)−、−C(=S)−又は−SO2−であり、X3はハロゲン原子であり、mは1又は2である。)
【0130】
【化35】
【0131】
(R42、R43はアルキル基、置換アルキル基、アルケニル基、置換アルケニル基、アリール基又は置換アリール基であり、R44は一般式(6)中のR38と同じである。)
【0132】
【化36】
【0133】
(ただし、式中、R45は置換されていてもよいアリール基又は複素環式基であり、R46は炭素原子1〜3個を有するトリハロアルキル基又はトリハロアルケニル基であり、pは1、2又は3である。)
【0134】
【化37】
【0135】
(式(10)は、トリハロゲノメチル基を有するカルボニルメチレン複素環式化合物を表す。L7は水素原子又は式:CO−(R47)q(C(X4)3)rの置換基であり、Q2はイオウ、セレン又は酸素原子、ジアルキルメチレン基、アルケン−1,2−イレン基、1,2−フェニレン基又はN−R基であり、M4は置換又は非置換のアルキレン基又はアルケニレン基であるか、又は1,2−アリーレン基であり、R48はアルキル基、アラルキル基又はアルコキシアルキル基であり、R47は炭素環式又は複素環式の2価の芳香族基であり、X4は塩素、臭素またはヨウ素原子であり、q=0及びr=1であるか又はq=1及びr=1又は2である。)
【0136】
【化38】
【0137】
(式(11)は、4−ハロゲノ−5−(ハロゲノメチル−フェニル)−オキサゾール誘導体を表す。X5はハロゲン原子であり、tは1〜3の整数であり、sは1〜4の整数であり、R49は水素原子又はCH3−tX5 t基であり、R50はs価の置換されていてもよい不飽和有機基である。)
【0138】
【化39】
【0139】
(式(12)は、2−(ハロゲノメチル−フェニル)−4−ハロゲノ−オキサゾール誘導体を表す。X6はハロゲン原子であり、vは1〜3の整数であり、uは1〜4の整数であり、R51は水素原子又はCH3−vX6 v基であり、R52はu価の置換されていてもよい不飽和有機基である。)
【0140】
このような炭素−ハロゲン結合を有する化合物の具体例としては、たとえば、若林ら著、Bull.Chem.Soc.Japan,42、2924(1969)記載の化合物、たとえば、2−フェニル4,6−ビス(トリクロルメチル)−S−トリアジン、2−(p−クロルフェニル)−4,6−ビス(トリクロルメチル)−S−トリアジン、2−(p−トリル)−4,6−ビス(トリクロルメチル)−S−トリアジン、2−(p−メトキシフェニル)−4,6−ビス(トリクロルメチル)−S−トリアジン、2−(2′,4′−ジクロルフェニル)−4,6−ビス(トリクロルメチル)−S−トリアジン、2,4,6−トリス(トリクロルメチル)−S−トリアジン、2−メチル−4,6−ビス(トリクロルメチル)−S−トリアジン、2−n−ノニル−4,6−ビス(トリクロルメチル)−S−トリアジン、2−(α,α,β−トリクロルエチル)−4,6−ビス(トリクロルメチル)−S−トリアジン等が挙げられる。その他、英国特許1388492号明細書記載の化合物、たとえば、2−スチリル−4,6−ビス(トリクロルメチル)−S−トリアジン、2−(p−メチルスチリル)−4,6−ビス(トリクロルメチル)−S−トリアジン、2−(p−メトキシスチリル)−4,6−ビス(トリクロルメチル)−S−トリアジン、2−(p−メトキシスチリル)−4−アミノ−6−トリクロルメチル−S−トリアジン等、特開昭53−133428号記載の化合物、たとえば、2−(4−メトキシ−ナフト−1−イル)−4,6−ビス−トリクロルメチル−S−トリアジン、2−(4−エトキシ−ナフト−1−イル)−4,6−ビス−トリクロルメチル−S−トリアジン、2−〔4−(2−エトキシエチル)−ナフト−1−イル〕−4,6−ビス−トリクロルメチル−S−トリアジン、2−(4,7−ジメトキシ−ナフト−1−イル)−4,6−ビス−トリクロルメチル−S−トリアジン)、2−(アセナフト−5−イル)−4,6−ビス−トリクロルメチル−S−トリアジン等、独国特許3337024号明細書記載の化合物、例えば、下記化合物等を挙げることができる。
【0141】
【化40】
【0142】
また、F.C.Schaefer等によるJ.Org.Chem.29、1527(1964)記載の化合物、たとえば2−メチル−4,6−ビス(トリブロムメチル)−S−トリアジン、2,4,6−トリス(トリブロムメチル)−S−トリアジン、2,4,6−トリス(ジブロムメチル)−S−トリアジン、2−アミノ−4−メチル−6−トリブロムメチル−S−トリアジン、2−メトキシ−4−メチル−6−トリクロルメチル−S−トリアジン等を挙げることができる。さらに特開昭62−58241号記載の、例えば、下記化合物等を挙げることができる。
【0143】
【化41】
【0144】
更に特開平5−281728号記載の、例えば、下記化合物等を挙げることができる。
【0145】
【化42】
【0146】
あるいはさらにM.P.Hutt、E.F.ElslagerおよびL.M.Herbel著「Journalof Heterocyclic chemistry」第7巻(No.3)、第511頁以降(1970年)に記載されている合成方法に準じて、当業者が容易に合成することができる次のような化合物群、例えば、下記化合物等を挙げることができる。
【0147】
【化43】
【0148】
(l)アゾ系化合物
本発明に用いられるラジカル開始剤として好ましい(i)アゾ系化合物としては、2,2’−アゾビスイソブチロニトリル、2,2’−アゾビスプロピオニトリル、1,1’−アゾビス(シクロヘキサン−1−カルボニトリル)、2,2’−アゾビス(2−メチルブチロニトリル)、2,2’−アゾビス(2,4−ジメチルバレロニトリル)、2,2’−アゾビス(4−メトキシ−2,4−ジメチルバレロニトリル)、4,4’−アゾビス(4−シアノ吉草酸)、2,2’−アゾビスイソ酪酸ジメチル、2,2’−アゾビス(2−メチルプロピオンアミドオキシム)、2,2’−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]、2,2’−アゾビス{2−メチル−N−[1,1−ビス(ヒドロキシメチル)−2−ヒドロキシエチル]プロピオンアミド}、2,2’−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]、2,2’−アゾビス(N−ブチル−2−メチルプロピオンアミド)、2,2’−アゾビス(N−シクロヘキシル−2−メチルプロピオンアミド)、2,2’−アゾビス[N−(2−プロペニル)−2−メチルプロピオンアミド]、2,2’−アゾビス(2,4,4−トリメチルペンタン)等を挙げることができる。
【0149】
本発明におけるラジカル開始剤のさらにより好ましい例としては、上述の(a)芳香族ケトン類、(b)オニウム塩化合物、(c)有機過酸化物、(e)ヘキサアリールビイミダゾール化合物、(i)メタロセン化合物、(k)炭素ハロゲン結合を有する化合物、を挙げることができ、さらに最も好ましい例としては、芳香族ヨードニウム塩、芳香族スルホニウム塩、チタノセン化合物、一般式(6)であらわされるトリハロメチル−S−トリアジン化合物を挙げることができる。
【0150】
これらのラジカル開始剤は、光または熱硬化性組成物の全固形分に対し、0.1〜50質量%、好ましくは、0.5〜30質量%、特に好ましくは5〜20質量%の割合で光または熱硬化性組成物中に添加することができる。
本発明におけるラジカル開始剤は単独もしくは2種以上の併用によって好適に用いられる。
【0151】
〔(C)増感色素〕
本発明の光または熱硬化性組成物には、所定の波長の光を吸収する増感色素を添加することが好ましい。この増感色素が吸収し得る波長の露光により上記ラジカル開始剤のラジカル発生反応や、それによる上記特定重合性化合物の重合反応が促進されるものである。このような増感色素としては、公知の分光増感色素または光を吸収して光ラジカル開始剤と相互作用する染料あるいは顔料が挙げられる。この増感色素の吸収する光の波長により、本発明の光または熱硬化性組成物は、紫外線から可視光線および赤外線まで種々の波長に感応する組成物となる。
【0152】
<分光増感色素あるいは染料>
本発明に用いられる増感色素として好ましい分光増感色素または染料は、多核芳香族類(例えば、ピレン、ペリレン、トリフェニレン)、キサンテン類(例えば、フルオレッセイン、エオシン、エリスロシン、ローダミンB、ローズベンガル)、シアニン類(例えば、チアカルボシアニン、オキサカルボシアニン)、メロシアニン類(例えば、メロシアニン、カルボメロシアニン)、チアジン類(例えば、チオニン、メチレンブルー、トルイジンブルー)、アクリジン類(例えば、アクリジンオレンジ、クロロフラビン、アクリフラビン)、フタロシアニン類(例えば、フタロシアニン、メタルフタロシアニン)、ポルフィリン類(例えば、テトラフェニルポルフィリン、中心金属置換ポルフィリン)、クロロフィル類(例えば、クロロフィル、クロロフィリン、中心金属置換クロロフィル)、金属錯体、アントラキノン類、例えば(アントラキノン)、スクアリウム類、例えば(スクアリウム)、例えば、下記化合物等が挙げられる。
【0153】
【化44】
【0154】
より好ましい分光増感色素又は染料の例としては特公平37−13034号記載のスチリル系色素、例えば、
【0155】
【化45】
【0156】
特開昭62−143044号記載の陽イオン染料、例えば、
【0157】
【化46】
【0158】
特公昭59−24147号記載のキノキサリニウム塩、例えば、
【0159】
【化47】
【0160】
特開昭64−33104号記載の新メチレンブルー化合物、例えば、
【0161】
【化48】
【0162】
特開昭64−56767号記載のアントラキノン類、例えば、
【0163】
【化49】
【0164】
特開平2−1714号記載のベンゾキサンテン染料、特開平2−226148号及び特開平2−226149号記載のアクリジン類、例えば、
【0165】
【化50】
【0166】
特公昭40−28499号記載のピリリウム塩類、例えば、
【0167】
【化51】
【0168】
特公昭46−42363号記載のシアニン類、例えば、
【0169】
【化52】
【0170】
特開平2−63053号記載のベンゾフラン色素、例えば、
【0171】
【化53】
【0172】
特開平2−85858号、特開平2−216154号の共役ケトン色素、例えば、
【0173】
【化54】
【0174】
特開昭57−10605号記載の色素、特公平2−30321号記載のアゾシンナミリデン誘導体、例えば、
【0175】
【化55】
【0176】
特開平1−287105号記載のシアニン系色素、例えば、
【0177】
【化56】
【0178】
特開昭62−31844号、特開昭62−31848号、特開昭62−143043号記載のキサンテン系色素、例えば、
【0179】
【化57】
【0180】
特公昭59−28325号記載のアミノスチリルケトン、例えば、
【0181】
【化58】
【0182】
特開平2−179643号記載の以下の一般式(13)〜(15)で表わされる色素、
【0183】
【化59】
【0184】
(式中、A3は、酸素原子、イオウ原子、セレン原子、テルル原子、アルキル又はアリール置換された窒素原子またはジアルキル置換された炭素原子を表し、Y2は、水素原子、アルキル基、置換アルキル基、アリール基、置換アリール基、アラルキル基、アシル基、または置換アルコキシカルボニル基を表し、R53、R54は、水素原子、炭素数1〜18のアルキル基、もしくは置換基として、−OR55、−(CH2CH2O)w−R55、ハロゲン原子(F、Cl、Br、I)、及び下記式で表される基を有する炭素数1〜18の置換アルキル基(但し、R55は水素原子又は炭素数1〜10のアルキル基を表し、B1は、ジアルキルアミノ基、水酸基、アシルオキシ基、ハロゲン原子、ニトロ基を表す。wは0〜4の整数を表す。)
【0185】
【化60】
【0186】
特開平2−244050号記載の以下の一般式(16)で表されるメロシアニン色素、
【0187】
【化61】
【0188】
(式中、R56およびR57は各々独立して水素原子、アルキル基、置換アルキル基、アルコキシカルボニル基、アリール基、置換アリール基またはアラルキル基を表わす。A4は、酸素原子、イオウ原子、セレン原子、テルル原子、アルキルないしはアリール置換された窒素原子、またはジアルキル置換された炭素原子を表わす。X7は含窒素ヘテロ五員環を形成するのに必要な非金属原子群を表わす。Y3は置換フェニル基、無置換ないし置換された多核芳香環、または無置換ないしは置換されたヘテロ芳香環を表わす。Z7は水素原子、アルキル基、置換アルキル基、アリール基、置換アリール基、アラルキル基、アルコキシ基、アルキルチオ基、アリールチオ基、置換アミノ基、アシル基、またはアルコキシカルボニル基を表しし、Y3と互いに結合して環を形成していてもよい。好ましい具体例としては、下記化合物)
【0189】
【化62】
【0190】
特公昭59−28326号記載の以下の一般式(17)で表されるメロシアニン色素、
【0191】
【化63】
【0192】
(式中、R58およびR59はそれぞれ水素原子、アルキル基、置換アルキル基、アリール基、置換アリール基またはアラルキル基を表わし、それらは互いに等しくても異ってもよい。X8はハメット(Hammett)のシグマ(σ)値が−0.9から+0.5までの範囲内の置換基を表す)
【0193】
特開昭59−89303号記載の以下の一般式(18)で表されるメロシアニン色素、
【0194】
【化64】
【0195】
〔(式中R60およびR61は各々独立して水素原子、アルキル基、置換アルキル基、アリール基、置換アリール基またはアラルキル基を表わす。X9はハメット(Hammett)のシグマ(σ)値が−0.9から+0.5までの範囲内の置換基を表わす。Y4は水素原子、アルキル基、置換アルキル基、アリール基、置換アリール基、アラルキル基、アシル基またはアルコキシカルボニル基を表す)好ましい具体例としては、下記に示す化合物が挙げられる〕
【0196】
【化65】
【0197】
特願平6−269047号記載の以下の一般式(19)で表されるメロシアニン色素、
【0198】
【化66】
【0199】
〔(式中、R62、R63、R64、R65、R70、R71、R72、R73はそれぞれ独立して、水素原子、ハロゲン原子、アルキル基、置換アルキル基、アリール基、置換アリール基、ヒドロキシル基、置換オキシ基、メルカプト基、置換チオ基、アミノ基、置換アミノ基、置換カルボニル基、スルホ基、スルホナト基、置換スルフィニル基、置換スルホニル基、ホスフォノ基、置換ホスフォノ基、ホスフォナト基、置換ホスフォナト基、シアノ基、ニトロ基を表すか、もしくは、R62とR63、R63とR64、R64とR65、R70とR71、R71とR72、R72とR73が互いに結合して脂肪族又は芳香族環を形成していても良く、R66は水素原子、アルキル基、置換アルキル基、アリール基、又は置換アリール基を表し、R67は置換、又は無置換のアルケニルアルキル基、又は置換もしくは無置換のアルキニルアルキル基を表し、R68、R69はそれぞれ独立して、水素原子、ハロゲン原子、アルキル基、置換アルキル基、アリール基、置換アリール基、置換カルボニル基を表す)好ましい具体例としては、下記で示す化合物が挙げられる〕
【0200】
【化67】
【0201】
特願平7−164583号記載の以下の一般式(20)で表されるベンゾピラン系色素、
【0202】
【化68】
【0203】
(式中、R74〜R77は互いに独立して、水素原子、ハロゲン原子、アルキル基、アリール基、水酸基、アルコキシ基又はアミノ基を表す。またR74〜R77はそれらが各々結合できる炭素原子と共に非金属原子から成る環を形成していても良い。R78は水素原子、アルキル基、アリール基、ヘテロ芳香族基、シアノ基、アルコキシ基、カルボキシ基又はアルケニル基を表す。R79はR78で表される基または−Z7−R78であり、Z7はカルボニル基、スルホニル基、スルフィニル基またはアリーレンジカルボニル基を表す。またR78及びR79は共に非金属原子から成る環を形成しても良い。A5はO原子、S原子、NHまたは置換基を有するN原子を表す。B2はO原子、または=C(G7)(G8)の基を表す。G7、G8は同一でも異なっていても良く、水素原子、シアノ基、アルコキシカルボニル基、アリールオキシカルボニル基、アシル基、アリールカルボニル基、アルキルチオ基、アリールチオ基、アルキルスルホニル基、アリールスルホニル基、又はフルオロスルホニル基を表す。但し、G7、G8は同時に水素原子となることはない。またG7及びG8は炭素原子と共に非金属原子からなる環を形成していても良い。)等を挙げることができる。
【0204】
その他、増感色素として特に以下の赤外線吸収剤(染料或いは顔料)も好適に使用される。好ましい前記染料としては、例えば、特開昭58−125246号、特開昭59−84356号、特開昭59−202829号、特開昭60−78787号公報等に記載されているシアニン染料、英国特許434,875号明細書記載のシアニン染料等を挙げることができる。
【0205】
また、米国特許第5,156,938号明細書に記載の近赤外吸収増感剤も好適に用いられ、さらに、米国特許第3,881,924号明細書に記載の置換されたアリールベンゾ(チオ)ピリリウム塩、特開昭57−142645号(米国特許第4,327,169号)公報に記載のトリメチンチアピリリウム塩、特開昭58−181051号、同58−220143号、同59−41363号、同59−84248号、同59−84249号、同59−146063号、同59−146061号公報に記載のピリリウム系化合物、特開昭59−216146号公報に記載のシアニン色素、米国特許第4,283,475号明細書に記載のペンタメチンチオピリリウム塩等や、特公平5−13514号、同5−19702号公報に記載されているピリリウム化合物も好ましく用いられる。
【0206】
また、米国特許第4,756,993号明細書中に式(I)、(II)として記載されている近赤外吸収染料、EP916513A2号明細書に記載のフタロシアニン系染料も好ましい染料として挙げることができる。
【0207】
さらに、特願平10−79912号公報に記載のアニオン性赤外線吸収剤も、好適に使用することができる。アニオン性赤外線吸収剤とは、実質的に赤外線を吸収する色素の母核にカチオン構造がなく、アニオン構造を有するものを示す。例えば、(イ)アニオン性金属錯体、(ロ)アニオン性カーボンブラック、(ハ)アニオン性フタロシアニン、さらに(ニ)下記一般式(21)で表される化合物などが挙げられる。これらのアニオン性赤外線吸収剤の対カチオンは、プロトンを含む一価の陽イオン、あるいは多価の陽イオンである。
【0208】
【化69】
【0209】
ここで、(イ)アニオン性金属錯体とは、実質的に光を吸収する錯体部の中心金属および配位子全体でアニオンとなるものを示す。
【0210】
(ロ)アニオン性カーボンブラックは、置換基としてスルホン酸、カルボン酸、ホスホン酸基等のアニオン基が結合しているカーボンブラックが挙げられる。これらの基をカーボンブラックに導入するには、カーボンブラック便覧第三版(カーボンブラック協会編、1995年4月5日、カーボンブラック協会発行)第12頁に記載されるように、所定の酸でカーボンブラックを酸化する等の手段をとればよい。
【0211】
(ハ)アニオン性フタロシアニンは、フタロシアニン骨格に、置換基として、先に(ロ)の説明において挙げたアニオン基が結合し、全体としてアニオンとなっているものを示す。
【0212】
次に、前記(ニ)一般式(21)で表される化合物、について、詳細に説明する。前記一般式(21)中、G9はアニオン性置換基を表し、G10は中性の置換基を表す。(X10)+は、プロトンを含む1〜m価のカチオンを表し、mは1ないし6の整数を表す。M5は共役鎖を表し、この共役鎖M5は置換基や環構造を有していてもよい。共役鎖M5は、下記式で表すことができる。
【0213】
【化70】
【0214】
式中、R80、R81、R82はそれぞれ独立に、水素原子、ハロゲン原子、シアノ基、アルキル基、アリール基、アルケニル基、アルキニル基、カルボニル基、チオ基、スルホニル基、スルフィニル基、オキシ基、アミノ基を表し、これらは互いに連結して環構造を形成していてもよい。nは、1〜8の整数を表す。
【0215】
前記一般式(21)で表されるアニオン性赤外線吸収剤のうち、以下のIRA−1〜IRA−5のものが、好ましく用いられる。
【0216】
【化71】
【0217】
また、以下のIRC−1〜IRC−44に示すカチオン性赤外線吸収剤も好ましく使用できる。
【0218】
【化72】
【0219】
【化73】
【0220】
【化74】
【0221】
【化75】
【0222】
【化76】
【0223】
【化77】
【0224】
【化78】
【0225】
【化79】
【0226】
【化80】
【0227】
前記構造式中、T−は、1価の対アニオンを表し、好ましくは、ハロゲンアニオン(F−,Cl−、Br−、I−)、ルイス酸アニオン(BF4−、PF6−、SbCl6−、ClO4−)、アルキルスルホン酸アニオン、アリールスルホン酸アニオンである。
【0228】
前記アルキルスルホン酸のアルキルとは、炭素原子数が1から20までの直鎖状、分岐状、又は環状のアルキル基を意味し、具体的には、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基、ウンデシル基、ドデシル基、トリデシル基、ヘキサデシル基、オクタデシル基、エイコシル基、イソプロピル基、イソブチル基、s−ブチル基、t−ブチル基、イソペンチル基、ネオペンチル基、1−メチルブチル基、イソヘキシル基、2−エチルヘキシル基、2−メチルヘキシル基、シクロヘキシル基、シクロペンチル基、2−ノルボルニル基を挙げることができる。これらの中では、炭素原子数1から12までの直鎖状、炭素原子数3から12までの分岐状、ならびに炭素原子数5から10までの環状のアルキル基がより好ましい。
【0229】
また前記アリールスルホン酸のアリールとは、1個のベンゼン環からなるもの、2又は3個のベンゼン環が縮合環を形成したもの、ベンゼン環と5員不飽和環が縮合環を形成したものを表し、具体例としては、フェニル基、ナフチル基、アントリル基、フェナントリル基、インデニル基、アセナブテニル基、フルオレニル基、を挙げることができ、これらの中でも、フェニル基、ナフチル基がより好ましい。
【0230】
また、以下のIRN−1〜IRN−9に示す非イオン性赤外線吸収剤も好ましく使用できる。
【0231】
【化81】
【0232】
【化82】
【0233】
【化83】
【0234】
前記例示化合物中、特に好ましいアニオン性赤外線吸収剤としてはIRA−1が、カチオン性赤外線吸収剤としてはIRC−7、IRC−30、IRC−40、およびIRC−42が、非イオン性赤外線吸収剤としてはIRN−9が挙げられる。
【0235】
<顔料>
本発明において使用される顔料としては、市販の顔料及びカラーインデックス(C.I.)便覧、「最新顔料便覧」(日本顔料技術協会編、1977年刊)、「最新顔料応用技術」(CMC出版、1986年刊)、「印刷インキ技術」CMC出版、1984年刊)に記載されている顔料が利用できる。
【0236】
顔料の種類としては、黒色顔料、黄色顔料、オレンジ色顔料、褐色顔料、赤色顔料、紫色顔料、青色顔料、緑色顔料、蛍光顔料、金属粉顔料、その他、ポリマー結合色素が挙げられる。具体的には、不溶性アゾ顔料、アゾレーキ顔料、縮合アゾ顔料、キレートアゾ顔料、フタロシアニン系顔料、アントラキノン系顔料、ペリレン及びペリノン系顔料、チオインジゴ系顔料、キナクリドン系顔料、ジオキサジン系顔料、イソインドリノン系顔料、キノフタロン系顔料、染付けレーキ顔料、アジン顔料、ニトロソ顔料、ニトロ顔料、天然顔料、蛍光顔料、無機顔料、カーボンブラック等が使用できる。これらの顔料のうち好ましいものはカーボンブラックである。
【0237】
これら顔料は表面処理をせずに用いてもよく、表面処理を施して用いてもよい。表面処理の方法には、樹脂やワックスを表面コートする方法、界面活性剤を付着させる方法、反応性物質(例えば、シランカップリング剤、エポキシ化合物、ポリイソシアネート等)を顔料表面に結合させる方法等が考えられる。上記の表面処理方法は、「金属石鹸の性質と応用」(幸書房)、「印刷インキ技術」(CMC出版、1984年刊)及び「最新顔料応用技術」(CMC出版、1986年刊)に記載されている。
【0238】
顔料の粒径は0.01μm〜10μmの範囲にあることが好ましく、0.05μm〜1μmの範囲にあることがさらに好ましく、特に0.1μm〜1μmの範囲にあることが好ましい。顔料の粒径が0.01μm未満のときは分散物の画像記録層塗布液中での安定性の点で好ましくなく、また、10μmを越えると画像記録層の均一性の点で好ましくない。
【0239】
顔料を分散する方法としては、インク製造やトナー製造等に用いられる公知の分散技術が使用できる。分散機としては、超音波分散器、サンドミル、アトライター、パールミル、スーパーミル、ボールミル、インペラー、デスパーザー、KDミル、コロイドミル、ダイナトロン、3本ロールミル、加圧ニーダー等が挙げられる。詳細は、「最新顔料応用技術」(CMC出版、1986年刊)に記載されている。
【0240】
なお、本発明の光または熱硬化性組成物の硬化反応を促進するために添加される増感色素は組成物中に他の成分とともに直接添加してもよいが、これに隣接する別の層を設けて、そこへ添加しても同様の効果を得ることができる。
特に、本発明の光または熱硬化性組成物を後述する平版印刷版原版のネガ型画像記録層に使用する場合、該画像記録層の同一の層に添加してもよいし、別の層を設け、そこへ添加してもよいが、ネガ型画像記録材料を作成した際に、記録層の波長300nm〜1200nmの範囲における吸収極大での光学濃度が、0.1〜3.0の間にあることが好ましい。この範囲をはずれた場合、感度が低くなる傾向がある。光学濃度は前記増感色素の添加量と記録層の厚みとにより決定されるため、所定の光学濃度は両者の条件を制御することにより得られる。記録層の光学濃度は常法により測定することができる。測定方法としては、例えば、透明、或いは白色の支持体上に、乾燥後の塗布量が平版印刷版として必要な範囲において適宜決定された厚みの記録層を形成し、透過型の光学濃度計で測定する方法、アルミニウム等の反射性の支持体上に記録層を形成し、反射濃度を測定する方法等が挙げられる。
【0241】
〔(D)バインダーポリマー〕
本発明の光または熱硬化性組成物においては、皮膜特性向上などの目的で、必要に応じて、(D)バインダーポリマーを使用することができる。バインダーポリマーとしては線状有機ポリマーを用いることが好ましい。このような「線状有機ポリマー」としては、公知のものを任意に使用できる。好ましくは水現像あるいは弱アルカリ水現像を可能とするために、水あるいは弱アルカリ水に可溶性又は膨潤性である線状有機ポリマーが選択される。線状有機ポリマーは、画像記録材料の皮膜形成剤としてだけでなく、水、弱アルカリ水あるいは有機溶剤現像剤としての用途に応じて選択使用される。例えば、水可溶性有機ポリマーを用いると水現像が可能になる。このような線状有機ポリマーとしては、側鎖にカルボン酸基を有するラジカル重合体、例えば特開昭59−44615号、特公昭54−34327号、特公昭58−12577号、特公昭54−25957号、特開昭54−92723号、特開昭59−53836号、特開昭59−71048号に記載されているもの、すなわち、メタクリル酸共重合体、アクリル酸共重合体、イタコン酸共重合体、クロトン酸共重合体、マレイン酸共重合体、部分エステル化マレイン酸共重合体等がある。また同様に側鎖にカルボン酸基を有する酸性セルロース誘導体がある。この他に水酸基を有する重合体に環状酸無水物を付加させたものなどが有用である。
【0242】
特にこれらの中で、ベンジル基又はアリル基と、カルボキシル基を側鎖に有する(メタ)アクリル樹脂及び特開2000−187322号公報に記載されている側鎖に二重結合を有するアルカリ可溶性樹脂が、膜強度、感度、現像性のバランスに優れており、好適である。
【0243】
また、特公平7−12004号、特公平7−120041号、特公平7−120042号、特公平8−12424号、特開昭63−287944号、特開昭63−287947号、特開平1−271741号、特願平10−116232号等に記載される酸基を含有するウレタン系バインダーポリマーは、非常に、強度に優れるので、耐刷性・低露光適性の点で有利である。
【0244】
さらにこの他に水溶性線状有機ポリマーとして、ポリビニルピロリドンやポリエチレンオキサイド等が有用である。また硬化皮膜の強度を上げるためにアルコール可溶性ナイロンや2,2−ビス−(4−ヒドロキシフェニル)−プロパンとエピクロロヒドリンのポリエーテル等も有用である。
【0245】
本発明で使用されるポリマーの重量平均分子量については好ましくは5000以上であり、さらに好ましくは1万〜30万の範囲であり、数平均分子量については好ましくは1000以上であり、さらに好ましくは2000〜25万の範囲である。多分散度(重量平均分子量/数平均分子量)は1以上が好ましく、さらに好ましくは1.1〜10の範囲である。
これらのポリマーは、ランダムポリマー、ブロックポリマー、グラフトポリマー等いずれでもよいが、ランダムポリマーであることが好ましい。
【0246】
本発明で使用されるポリマーは従来公知の方法により合成できる。合成する際に用いられる溶媒としては、例えば、テトラヒドロフラン、エチレンジクロリド、シクロヘキサノン、メチルエチルケトン、アセトン、メタノール、エタノール、エチレングリコールモノメチルエーテル、エチレングリコールモノエチルエーテル、2−メトキシエチルアセテート、ジエチレングリコールジメチルエーテル、1−メトキシ−2−プロパノール、1−メトキシ−2−プロピルアセテート、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、トルエン、酢酸エチル、乳酸メチル、乳酸エチル、ジメチルスルホキシド、水等が挙げられる。これらの溶媒は単独で又は2種以上混合して用いられる。
本発明で使用されるポリマーを合成する際に用いられるラジカル重合開始剤としては、アゾ系開始剤、過酸化物開始剤等公知の化合物が使用できる。
【0247】
本発明で使用されるバインダーポリマーは単独で用いても混合して用いてもよい。本発明の光または熱硬化性組成物を平版印刷版原版の記録材料として用いる場合には、これらバインダーポリマーを添加量は、画像記録材料全固形分に対し20〜95質量%、好ましくは30〜90質量%の割合で添加される。添加量が20質量%未満の場合は、画像形成した際、画像部の強度向上効果が充分に得られない。また添加量が95質量%を越える場合は、画像形成されない。またラジカル重合可能なエチレン性不飽和二重結合を有する化合物と線状有機ポリマーは、質量比で1/9〜7/3の範囲とするのが好ましい。
以上のようにして得られた本発明の光または熱硬化性組成物は、感度、保存安定性、耐刷性、および現像性に優れ、特に、バーニング処理を行うことで著しく耐刷性が向上するネガ型平版印刷版原版の記録材料として好適に用いられる。
【0248】
〔平版印刷版原版への応用〕
本発明の光または熱硬化性組成物を、平版印刷版原版の記録材料として用いる際は、上記光または熱硬化性組成物を溶媒に溶かして、適当な支持体上に塗布することにより製造することができる。また、目的に応じて、後述する種々の添加剤、保護層、樹脂中間層、バックコート層なども同様にして形成することができる。
【0249】
本発明の光または熱硬化性組成物には、可視光域に大きな吸収を持つ染料を画像の着色剤として使用することができる。具体的には、オイルイエロー#101、オイルイエロー#103、オイルピンク#312、オイルグリーンBG、オイルブルーBOS、オイルブルー#603、オイルブラックBY、オイルブラックBS、オイルブラックT−505(以上オリエント化学工業(株)製)、ビクトリアピュアブルー、クリスタルバイオレット(CI42555)、メチルバイオレット(CI42535)、エチルバイオレット、ローダミンB(CI145170B)、マラカイトグリーン(CI42000)、メチレンブルー(CI52015)等、及び特開昭62−293247号に記載されている染料を挙げることができる。また、フタロシアニン系顔料、アゾ系顔料、カーボンブラック、酸化チタンなどの顔料も好適に用いることができる。
【0250】
これらの着色剤は、画像形成後、画像部と非画像部の区別がつきやすいので、添加する方が好ましい。なお、添加量は、記録層塗布液全固形分に対し、0.01〜10質量%の割合である。
【0251】
また、本発明においては、光または熱硬化性組成物の調製中あるいは保存中において重合性化合物の不要な熱重合を阻止するために少量の熱重合防止剤を添加することが望ましい。適当な熱重合防止剤としてはハイドロキノン、p−メトキシフェノール、ジ−t−ブチル−p−クレゾール、ピロガロール、t−ブチルカテコール、ベンゾキノン、4,4′−チオビス(3−メチル−6−t−ブチルフェノール)、2,2′−メチレンビス(4−メチル−6−t−ブチルフェノール)、N−ニトロソ−N−フェニルヒドロキシルアミンアルミニウム塩等が挙げられる。熱重合防止剤の添加量は、全組成物の質量に対して約0.01質量%〜約5質量%が好ましい。また必要に応じて、酸素による重合阻害を防止するためにベヘン酸やベヘン酸アミドのような高級脂肪酸誘導体等を添加して、塗布後の乾燥の過程で記録層の表面に偏在させてもよい。高級脂肪酸誘導体の添加量は、全組成物の約0.1質量%〜約10質量%が好ましい。
【0252】
また、本発明の光または熱硬化性組成物は、主として平版印刷版原版の記録層を形成するために用いられるが、そのような記録層の現像条件に対する処理の安定性を広げるため、特開昭62−251740号や特開平3−208514号に記載されているような非イオン界面活性剤、特開昭59−121044号、特開平4−13149号に記載されているような両性界面活性剤を添加することができる。
【0253】
非イオン界面活性剤の具体例としては、ソルビタントリステアレート、ソルビタンモノパルミテート、ソルビタントリオレート、ステアリン酸モノグリセリド、ポリオキシエチレンノニルフェニルエーテル等が挙げられる。
【0254】
両性界面活性剤の具体例としては、アルキルジ(アミノエチル)グリシン、アルキルポリアミノエチルグリシン塩酸塩、2−アルキル−N−カルボキシエチル−N−ヒドロキシエチルイミダゾリニウムベタイン、N−テトラデシル−N,N−ベタイン型(例えば、商品名アモーゲンK、第一工業(株)製)等が挙げられる。
上記非イオン界面活性剤及び両性界面活性剤の記録層塗布液中に占める割合は、0.05〜15質量%が好ましく、より好ましくは0.1〜5質量%である。
【0255】
さらに、本発明に係る記録層塗布液中には、必要に応じ、塗膜の柔軟性等を付与するために可塑剤が加えられる。例えば、ポリエチレングリコール、クエン酸トリブチル、フタル酸ジエチル、フタル酸ジブチル、フタル酸ジヘキシル、フタル酸ジオクチル、リン酸トリクレジル、リン酸トリブチル、リン酸トリオクチル、オレイン酸テトラヒドロフルフリル等が用いられる。
【0256】
本発明の光または熱硬化性組成物を使用して平版印刷版原版を製造するには、通常、光または熱硬化性組成物の構成成分を塗布液に必要な各成分とともにを溶媒に溶かして、適当な支持体上に塗布すればよい。ここで使用する溶媒としては、エチレンジクロライド、シクロヘキサノン、メチルエチルケトン、メタノール、エタノール、プロパノール、エチレングリコールモノメチルエーテル、1−メトキシ−2−プロパノール、2−メトキシエチルアセテート、1−メトキシ−2−プロピルアセテート、ジメトキシエタン、乳酸メチル、乳酸エチル、N,N−ジメチルアセトアミド、N,N−ジメチルホルムアミド、テトラメチルウレア、N−メチルピロリドン、ジメチルスルホキシド、スルホラン、γ−ブチロラクトン、トルエン、水等を挙げることができるがこれに限定されるものではない。これらの溶媒は単独又は混合して使用される。溶媒中の上記成分(添加剤を含む全固形分)の濃度は、好ましくは1〜50質量%である。
【0257】
また塗布、乾燥後に得られる支持体上の記録層の塗布量(固形分)は、用途によって異なるが、平版印刷版原版についていえば一般的に0.5〜5.0g/m2が好ましい。塗布量が少なくなるにつれて、見かけの感度は大になるが、記録層の皮膜特性は低下する。
塗布する方法としては、種々の方法を用いることができるが、例えば、バーコーター塗布、回転塗布、スプレー塗布、カーテン塗布、ディップ塗布、エアーナイフ塗布、ブレード塗布、ロール塗布等を挙げることができる。
【0258】
本発明に係る記録層塗布液には、塗布性を良化するための界面活性剤、例えば、特開昭62−170950号に記載されているようなフッ素系界面活性剤を添加することができる。好ましい添加量は、全記録層の材料固形分中0.01〜1質量%、さらに好ましくは0.05〜0.5質量%である。
【0259】
(支持体)
本発明の光または熱硬化性組成物を用いて平版印刷版原版を形成する場合に使用される支持体としては、寸度的に安定な板状物であれば特に制限はなく、例えば、紙、プラスチック(例えば、ポリエチレン、ポリプロピレン、ポリスチレン等)がラミネートされた紙、金属板(例えば、アルミニウム、亜鉛、銅等)、プラスチックフィルム(例えば、二酢酸セルロース、三酢酸セルロース、プロピオン酸セルロース、酪酸セルロース、酢酸酪酸セルロース、硝酸セルロース、ポリエチレンテレフタレート、ポリエチレン、ポリスチレン、ポリプロピレン、ポリカーボネート、ポリビニルアセタール等)等が挙げられる。これらは、樹脂フィルムや金属板などの単一成分のシートであっても、2以上の材料の積層体であってもよく、例えば、上記のごとき金属がラミネート、若しくは蒸着された紙やプラスチックフィルム、異種のプラスチックフィルム同志の積層シート等が含まれる。
【0260】
前記支持体としては、ポリエステルフィルム又はアルミニウム板が好ましく、その中でも寸法安定性がよく、比較的安価であるアルミニウム板は特に好ましい。好適なアルミニウム板は、純アルミニウム板及びアルミニウムを主成分とし、微量の異元素を含む合金板であり、更にアルミニウムがラミネート若しくは蒸着されたプラスチックフィルムでもよい。アルミニウム合金に含まれる異元素には、ケイ素、鉄、マンガン、銅、マグネシウム、クロム、亜鉛、ビスマス、ニッケル、チタン等がある。合金中の異元素の含有量は高々10質量%以下である。本発明において特に好適なアルミニウムは、純アルミニウムであるが、完全に純粋なアルミニウムは精錬技術上製造が困難であるので、僅かに異元素を含有するものでもよい。このように本発明に適用されるアルミニウム板は、その組成が特定されるものではなく、従来より公知公用の素材のアルミニウム板を適宜に利用することができる。
前記アルミニウム板の厚みは、およそ0.1〜0.6mm程度、好ましくは0.15〜0.4mm、特に好ましくは0.2〜0.3mmである。
【0261】
アルミニウム板を粗面化するに先立ち、所望により、表面の圧延油を除去するための例えば界面活性剤、有機溶剤又はアルカリ性水溶液等による脱脂処理が行われる。
アルミニウム板の表面の粗面化処理は、種々の方法により行われるが、例えば、機械的に粗面化する方法、電気化学的に表面を溶解粗面化する方法及び化学的に表面を選択溶解させる方法により行われる。機械的方法としては、ボール研磨法、ブラシ研磨法、ブラスト研磨法、バフ研磨法等の公知の方法を用いることができる。また、電気化学的な粗面化法としては塩酸又は硝酸電解液中で交流又は直流により行う方法がある。また、特開昭54−63902号公報に開示されているように両者を組み合わせた方法も利用することができる。
【0262】
このように粗面化されたアルミニウム板は、所望により、アルカリエッチング処理、中和処理を経て、表面の保水性や耐摩耗性を高めるために陽極酸化処理を施すことができる。アルミニウム板の陽極酸化処理に用いられる電解質としては、多孔質酸化皮膜を形成する種々の電解質の使用が可能で、一般的には硫酸、リン酸、蓚酸、クロム酸或いはそれらの混酸が用いられる。それらの電解質の濃度は電解質の種類によって適宜決められる。
【0263】
陽極酸化の処理条件は、用いる電解質により種々変わるので一概に特定し得ないが、一般的には電解質の濃度が1〜80質量%溶液、液温は5〜70℃、電流密度5〜60A/dm2、電圧1〜100V、電解時間10秒〜5分の範囲であれば適当である。
陽極酸化皮膜の量は1.0g/m2以上が好適であるが、より好ましくは2.0〜6.0g/m2の範囲である。陽極酸化被膜が1.0g/m2未満であると耐刷性が不十分であったり、平版印刷版の非画像部に傷が付き易くなって、印刷時に傷の部分にインキが付着するいわゆる「傷汚れ」が生じ易くなる。
尚、このような陽極酸化処理は平板印刷版の支持体の印刷に用いる面に施されるが、電気力線の裏回りにより、裏面にも0.01〜3g/m2の陽極酸化被膜が形成されるのが一般的である。
【0264】
支持体表面の親水化処理は、上記陽極酸化処理の後に施されるものであり、従来より知られている処理法が用いられる。このような親水化処理としては、米国特許第2,714,066号、同第3,181,461号、第3,280,734号及び第3,902,734号公報に開示されているようなアルカリ金属珪酸塩(例えば、珪酸ナトリウム水溶液)法がある。この方法においては、支持体が珪酸ナトリウム水溶液で浸漬処理されるか、又は電解処理される。他に特公昭36−22063号公報に開示されているフッ化ジルコン酸カリウム及び米国特許第3,276,868号、同第4,153,461号、同第4,689,272号公報に開示されているようなポリビニルホスホン酸で処理する方法等が用いられる。
これらの中で、本発明において特に好ましい親水化処理は珪酸塩処理である。珪酸塩処理について、以下に説明する。
【0265】
上述の如き処理を施したアルミニウム板の陽極酸化皮膜を、アルカリ金属珪酸塩が0.1〜30質量%、好ましくは0.5〜10質量%であり、25℃でのpHが10〜13である水溶液に、例えば15〜80℃で0.5〜120秒浸漬する。アルカリ金属珪酸塩水溶液のpHが10より低いと液はゲル化し13.0より高いと酸化皮膜が溶解されてしまう。本発明に用いられるアルカリ金属珪酸塩としては、珪酸ナトリウム、珪酸カリウム、珪酸リチウムなどが使用される。アルカリ金属珪酸塩水溶液のpHを高くするために使用される水酸化物としては水酸化ナトリウム、水酸化カリウム、水酸化リチウムなどがある。なお、上記の処理液にアルカリ土類金属塩もしくは第IVB族金属塩を配合してもよい。アルカリ土類金属塩としては、硝酸カルシウム、硝酸ストロンチウム、硝酸マグネシウム、硝酸バリウムのような硝酸塩や、硫酸塩、塩酸塩、燐酸塩、酢酸塩、蓚酸塩、ホウ酸塩などの水溶性の塩が挙げられる。第IVB族金属塩として、四塩化チタン、三塩化チタン、フッ化チタンカリウム、蓚酸チタンカリウム、硫酸チタン、四ヨウ化チタン、塩化酸化ジルコニウム、二酸化ジルコニウム、オキシ塩化ジルコニウム、四塩化ジルコニウムなどを挙げることができる。アルカリ土類金属塩もしくは、第IVB族金属塩は単独又は2以上組み合わせて使用することができる。これらの金属塩の好ましい範囲は0.01〜10質量%であり、更に好ましい範囲は0.05〜5.0質量%である。
珪酸塩処理により、アルミニウム板表面上の親水性が一層改善されるため、印刷の際、インクが非画像部に付着しにくくなり、汚れ性能が向上する。
【0266】
(バックコート層)
支持体の裏面には、必要に応じてバックコートが設けられる。かかるバックコートとしては、特開平5−45885号公報記載の有機高分子化合物及び特開平6−35174号公報記載の有機又は無機金属化合物を加水分解及び重縮合させて得られる金属酸化物からなる被覆層が好ましく用いられる。
これらの被覆層のうち、Si(OCH3)4、Si(OC2H5)4、Si(OC3H7)4、Si(OC4H9)4などの珪素のアルコキシ化合物が安価で入手し易く、それから与られる金属酸化物の被覆層が耐現像性に優れており特に好ましい。
【0267】
(保護層)
一般的な平版印刷版原版においては、通常、露光を大気中で行うため、記録層の上に、さらに保護層を設けることができる。この様な保護層に望まれる特性としては、酸素等の低分子化合物の透過性が低く、露光に用いる光の透過性が良好で、記録層との密着性に優れ、かつ、露光後の現像工程で容易に除去できることであり、ポリビニルアルコール、ポリビニルピロリドン、酸性セルロース類、ゼラチン、アラビアゴム、ポリアクリル酸などのような比較的結晶性に優れた水溶性高分子化合物を用いることが一般的である。
一方、本発明の光または熱硬化性組成物は、酸素などの重合阻害による画像形成性の低下を抑制し得るという利点を有するため、必ずしもこのような保護層を備えなくてもよいが、さらに外部からの酸素遮断性を高め、画像形成性、特に、画像強度を高める目的で上記保護層を備えてもよい。
【0268】
(露光、現像および印刷)
上述された支持体表面に、本発明の光または熱硬化性組成物を記録層として形成した平版印刷版原版は、赤外線レーザで記録することができる。また、紫外線ランプやサーマルヘッドによる熱的な記録も可能である。本発明においては、波長760nmから1200nmの赤外線を放射する固体レーザ及び半導体レーザにより画像露光されることが好ましい。
【0269】
赤外線レーザにより露光した後、本発明の光または熱硬化性組成物は、好ましくは、水又はアルカリ性水溶液にて現像される。
【0270】
現像液として、アルカリ性水溶液を用いる場合、本発明の光または熱硬化性組成物の現像液及び補充液としては、従来公知のアルカリ性水溶液が使用できる。例えば、ケイ酸ナトリウム、同カリウム、第3リン酸ナトリウム、同カリウム、同アンモニウム、第2リン酸ナトリウム、同カリウム、同アンモニウム、炭酸ナトリウム、同カリウム、同アンモニウム、炭酸水素ナトリウム、同カリウム、同アンモニウム、ほう酸ナトリウム、同カリウム、同アンモニウム、水酸化ナトリウム、同アンモニウム、同カリウム及び同リチウム等の無機アルカリ塩が挙げられる。また、モノメチルアミン、ジメチルアミン、トリメチルアミン、モノエチルアミン、ジエチルアミン、トリエチルアミン、モノイソプロピルアミン、ジイソプロピルアミン、トリイソプロピルアミン、n−ブチルアミン、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、モノイソプロパノールアミン、ジイソプロパノールアミン、エチレンイミン、エチレンジアミン、ピリジン等の有機アルカリ剤も用いられる。
これらのアルカリ剤は単独又は2種以上を組み合わせて用いられる。
【0271】
さらに、自動現像機を用いて現像する場合には、現像液と同じもの又は、現像液よりもアルカリ強度の高い水溶液(補充液)を現像液に加えることによって、長時間現像タンク中の現像液を交換することなく、多量の平版印刷版原版を処理できることが知られている。本発明においてもこの補充方式が好ましく適用される。
【0272】
現像液及び補充液には現像性の促進や抑制、現像カスの分散及び印刷版画像部の親インキ性を高める目的で必要に応じて種々の界面活性剤や有機溶剤等を添加できる。好ましい界面活性剤としては、アニオン系、カチオン系、ノニオン系及び両性界面活性剤が挙げられる。好ましい有機溶剤としてはベンジルアルコール等が挙げられる。また、ポリエチレングリコール若しくはその誘導体、又はポリプロピレングリコール若しくはその誘導体等の添加も好ましい。また、アラビット、ソルビット、マンニット等の非還元糖を添加することもできる。
【0273】
さらに、現像液及び補充液には必要に応じて、ハイドロキノン、レゾルシン、亜硫酸又は亜硫酸水素酸のナトリウム塩及びカリウム塩等の無機塩系還元剤、さらに有機カルボン酸、消泡剤、硬水軟化剤を加えることもできる。
【0274】
以上記述した現像液及び補充液を用いて現像処理された印刷版は、水洗水、界面活性剤等を含有するリンス液、アラビアガムや澱粉誘導体を含む不感脂化液で後処理される。本発明の光または熱硬化性組成物を印刷用版材として使用する場合の後処理としては、これらの処理を種々組み合わせて用いることができる。
【0275】
近年、製版・印刷業界では製版作業の合理化及び標準化のため、印刷用版材用の自動現像機が広く用いられている。この自動現像機は、一般に現像部と後処理部からなり、印刷用版材を搬送する装置と各処理液槽とスプレー装置とからなり、露光済みの印刷版を水平に搬送しながら、ポンプで汲み上げた各処理液をスプレーノズルから吹き付けて現像処理するものである。また、最近は処理液が満たされた処理液槽中に液中ガイドロール等によって印刷用版材を浸漬搬送させて処理する方法も知られている。このような自動処理においては、各処理液に処理量や稼働時間等に応じて補充液を補充しながら処理することができる。また、電気伝導度をセンサーにて感知し、自動的に補充することもできる。
また、実質的に未使用の処理液で処理するいわゆる使い捨て処理方式も適用できる。
【0276】
以上のようにして得られた平版印刷版は所望により不感脂化ガムを塗布したのち、印刷工程に供することができるが、より一層の高耐刷力の平版印刷版としたい場合にはバーニング処理が施される。
平版印刷版をバーニングする場合には、バーニング前に特公昭61−2518号、同55−28062号、特開昭62−31859号、同61−159655号の各公報に記載されているような整面液で処理することが好ましい。
【0277】
その方法としては、該整面液を浸み込ませたスポンジや脱脂綿にて、平版印刷版上に塗布するか、整面液を満たしたバット中に印刷版を浸漬して塗布する方法や、自動コーターによる塗布等が適用される。また、塗布した後でスキージ又はスキージローラーで、その塗布量を均一にすることは、より好ましい結果を与える。
整面液の塗布量は一般に0.03〜0.8g/m2(乾燥質量)が適当である。
整面液が塗布された平版印刷版は必要であれば乾燥された後、バーニングプロセッサー(例えば、富士写真フイルム(株)より販売されているバーニングプロセッサー:BP−1300)等で高温に加熱される。この場合の加熱温度及び時間は、画像を形成している成分の種類にもよるが、180〜300℃の範囲で1〜20分の範囲が好ましい。
【0278】
バーニング処理された平版印刷版は、必要に応じて適宜、水洗、ガム引き等の従来行なわれている処理を施こすことができるが、水溶性高分子化合物等を含有する整面液が使用された場合にはガム引きなどのいわゆる不感脂化処理を省略することができる。
【0279】
このような処理によって、本発明の光または熱硬化性組成物より得られた平版印刷版はオフセット印刷機等にかけられ、多数枚の印刷に用いられる。
【0280】
【実施例】
以下、実施例により本発明を詳細に説明するが、本発明はこれらに限定されるものではない。なお、本願実施例においては、本発明の光または熱硬化性組成物を記録材料として用いた平版印刷版についての評価を行い、その評価を本発明の光または熱硬化性組成物の評価とする。
【0281】
〔実施例1〜6、比較例1、2〕
(支持体の作成)
99.5%以上のアルミニウムと、Fe 0.30%、Si 0.10%、Ti0.02%、Cu 0.013%を含むJIS A1050合金の溶湯を清浄化処理を施し、鋳造した。清浄化処理には、溶湯中の水素などの不要なガスを除去するために脱ガス処理し、セラミックチューブフィルタ処理をおこなった。鋳造法はDC鋳造法で行った。凝固した板厚500mmの鋳塊を表面から10mm面削し、金属間化合物が粗大化してしまわないように550℃で10時間均質化処理を行った。
次いで、400℃で熱間圧延し、連続焼鈍炉中で500℃60秒中間焼鈍した後、冷間圧延を行って、板圧0.30mmのアルミニウム圧延板とした。圧延ロールの粗さを制御することにより、冷間圧延後の中心線平均表面粗さRaを0.2μmに制御した。その後、平面性を向上させるためにテンションレベラーにかけた。
【0282】
次に平版印刷版支持体とするための表面処理を行った。
まず、アルミニウム板表面の圧延油を除去するため10%アルミン酸ソーダ水溶液で50℃30秒間脱脂処理を行い、30%硫酸水溶液で50℃30秒間中和、スマット除去処理を行った。
次いで支持体と記録層の密着性を良好にし、かつ非画像部に保水性を与えるため、支持体の表面を粗面化する、いわゆる、砂目立て処理を行った。1%の硝酸と0.5%の硝酸アルミを含有する水溶液を45℃に保ち、アルミウェブを水溶液中に流しながら、間接給電セルにより電流密度20A/dm2、デューティー比1:1の交番波形でアノード側電気量240C/dm2を与えることで電解砂目立てを行った。その後10%アルミン酸ソーダ水溶液で50℃30秒間エッチング処理を行い、30%硫酸水溶液で50℃30秒間中和、スマット除去処理を行った。
【0283】
さらに耐摩耗性、耐薬品性、保水性を向上させるために、陽極酸化によって支持体に酸化皮膜を形成させた。電解質として硫酸20%水溶液を35℃で用い、アルミウェブを電解質中に通搬しながら、間接給電セルにより14A/dm2の直流で電解処理を行うことで2.5g/m2の陽極酸化皮膜を作成した。
【0284】
(記録層の形成)
下記組成の記録層塗布液1を調製し、上記のようにして得られたアルミニウム支持体にワイヤーバーを用いて塗布し、温風式乾燥装置にて115℃で45秒間乾燥して記録層を形成し、平版印刷版原版を得た。乾燥後の被覆量は1.2〜1.3g/m2の範囲内であった。
<記録層塗布液1>
・重合性化合物:(表1に記載の化合物) 1.0g
・バインダーポリマー:(表1に記載の化合物) 1.0g
・赤外線吸収剤「IR−1」:(以下に示す構造) 0.15g
・ラジカル開始剤「S−1」:(以下に示す構造) 0.35g
・ビクトリアピュアブルーのナフタレンスルホン酸塩 0.04g
・フッ素系界面活性剤 0.01g
(メガファックF−176、大日本インキ化学工業(株)製)
・メチルエチルケトン 9.0g
・メタノール 10.0g
・1−メトキシ−2−プロパノール 8.0g
【0285】
なお、実施例に用いた重合性化合物は、前記例示した本発明に係る特定重合性化合物であり、また、比較例に用いた重合性化合物(U−1)〜(U−3)は、以下に示す構造の、本発明の範囲外の重合性化合物である。
【0286】
【化84】
【0287】
次に、本発明の実施例および比較例で用いたバインダーポリマー(P−1)〜(P−3)の構造を示す。
【0288】
【化85】
【0289】
次に、本発明の実施例および比較例で用いた赤外線吸収剤(IR−1)〜(IR−3)の構造を示す。
【0290】
【化86】
【0291】
次に、本発明の実施例および比較例で用いたラジカル開始剤(S−1)〜(S−4)の構造を示す。
【0292】
【化87】
【0293】
(露光)
得られたネガ型平版印刷版原版を、水冷式40W赤外線半導体レーザを搭載したCreo社製Trendsetter 3244VFSにて、出力9W、外面ドラム回転数210rpm、版面エネルギー100mJ/cm2、解像度2400dpiの条件で露光した。
【0294】
(現像処理)
露光後、富士写真フイルム(株)製自動現像機スタブロン900Nを用い現像処理した。現像液は、仕込み液、補充液ともに富士写真フイルム(株)製DV−2の1:4水希釈液を用いた。現像浴の温度は30℃とした。また、フィニッシャーは、富士写真フイルム(株)製FN−6の1:1水希釈液(pH=10.8)を用いた。
【0295】
〔耐刷性、非画像部の汚れ性および保存安定性の評価〕
得られた平版印刷版を、次に、小森コーポレーション(株)製のリスロン印刷機で、大日本インキ化学工業社製のDIC−GEOS(N)墨のインキを用いて印刷した。この際、どれだけの枚数が充分なインキ濃度を保って印刷できるかを目視にて測定し、耐刷性および非画像部の汚れ性を評価した。
また、得られた平版印刷版原版を、それぞれ60℃で3日間保存、及び、45℃、湿度75%RHで3日間保存して強制経時させた後、同様の印刷を行い、耐刷性、非画像部の汚れ性を評価した。結果を表1に併記する。
【0296】
【表1】
【0297】
表1に明らかなように、本発明に係る特定重合性化合物を用いた実施例1〜6の平版印刷版は、本発明の範囲外の重合性化合物を用いた比較例1、2の平版印刷版に比べ、耐刷性に優れ、非画像部の汚れもみられなかった。また、高温高湿度環境下で保存した後も、耐刷性、非画像部の汚れ性が低下せず、保存安定性に優れていることがわかった。
【0298】
〔実施例7〜16、比較例3、4〕
(下塗り層の形成)
実施例1〜6と同様のアルミニウム支持体に、下記組成の下塗り液をワイヤーバーにて塗布し、温風式乾燥装置を用いて90℃で30秒間乾燥した。乾燥後の被覆量は10mg/m2であった。
【0299】
【0300】
(記録層の形成)
次に、下記組成の記録層塗布液2を調整し、上記の下塗り済みのアルミニウム板にワイヤーバーを用いて塗布し、温風式乾燥装置にて115℃で45秒間乾燥してネガ型平版印刷版原版を得た。乾燥後の被覆量は1.3g/m2であった。なお、これらの平版印刷版原版の記録層の赤外線領域での吸収極大における反射濃度を測定したところ、いずれも0.6〜1.2の間にあった。
【0301】
<記録層塗布液2>
・重合性化合物:(表2に記載の化合物) 1.0g
・バインダーポリマー:「P−3」 1.0g
・赤外線吸収剤「IR−1」 0.10g
・ラジカル発生剤「S−1」 0.35g
・ビクトリアピュアブルーのナフタレンスルホン酸塩 0.04g
・フッ素系界面活性剤 0.01g
(メガファックF−176、大日本インキ化学工業(株)製)
・メチルエチルケトン 9.0g
・メタノール 10.0g
・1−メトキシ−2−プロパノール 8.0g
【0302】
(露光)
得られたネガ型平版印刷版原版を、実施例1〜6と同様にして赤外線レーザ露光および現像処理を行い、平版印刷版を得た。
【0303】
〔バーニング処理後の耐刷性の評価〕
得られた平版印刷版を、実施例1〜6と同様にして印刷を行い、耐刷性を評価した。
続いて、得られた平版印刷版の版面を富士写真フイルム(株)製のバーニング整面液BC−3で拭いた後、約240℃で7分間、バーニング処理を行った。その後、水洗し、富士写真フイルム(株)製ガムGU−7を水で体積を2倍に希釈した液で版面を処理した。
その後、上記と同様にして印刷を行い、バーニング処理後の耐刷性を評価した。結果を表2に併記する。
【0304】
【表2】
【0305】
表2に明らかなように、本発明に係る特定重合性化合物を用いた実施例7〜16の平版印刷版は、本発明の範囲外の重合性化合物を用いた比較例3、4の平版印刷版に比べ、耐刷性に優れることが確認された。さらに、バーニング処理を行うことで、実施例7〜16の平版印刷版原版は耐刷性が著しく向上した。これは、露光により重合しきれなかった未反応の重合性化合物が、バーニング処理によって昇華することなく重合・硬化反応を生起したものと推測される。
【0306】
〔実施例17〜25、比較例5〕
(支持体の作成)
厚さ0.30mmのアルミニウム版をナイロンブラシと400メッシュのパミストンの水懸濁波とを用いその表面を砂目立てした後、水でよく洗浄した。10質量%水酸化ナトリウム水溶液に70℃で60秒間浸漬してエッチングした後、流水で水洗後、20質量%硝酸で中和洗浄し、次いで水洗した。これをVA=12.7Vの条件下で正弦波の交番波形電流を用いて1質量%硝酸水溶液中で160クーロン/dm2の陽極時電気量で電解粗面化処理を行った。その表面粗さを測定したところ、0.6μm(Ra表示)であった。引き続いて30質量%の硫酸水溶液中に浸漬し55℃で2分間デスマットした後、20質量%硫酸水溶液中、電流密度2A/dm2において、陽極酸化被膜の厚さが2.7g/m2になるように、2分間陽極酸化処理した。
【0307】
(下塗り層の形成)
下記の手順によりSG法の液状組成物(ゾル液)を調整した。
<ゾル液組成物>
・メタノール 130g
・水 20g
・85質量%リン酸 16g
・テトラエトキシシラン 50g
・3−メタクリロキシプロピルトリメトキシシラン 60g
上記ゾル液組成物を混合し、撹拌した。約5分で発熱が認められた。60分間反応させた後、内容物を別の容器へ移し、メタノール3000gを加えることにより、ゾル液を得た。
このゾル液をメタノール/エチレングリコール=9/1(質量比)で希釈して、基板上のSiの量が30mg/m2となるように塗布し、100℃1分間乾燥させ、下塗り層を形成した。
【0308】
(記録層の形成)
このように処理されたアルミニウム支持体上に、下記組成の記録層塗布液3を上記の下塗り済みのアルミニウム支持体にワイヤーバーを用いて塗布し、温風式乾燥装置にて115℃で45秒間乾燥して平版印刷版原版を得た。乾燥後の被覆量は1.2〜1.3g/m2の範囲内であった。
【0309】
<記録層塗布液3>
・重合性化合物:(表3に記載の化合物) 0.8g
・バインダーポリマー:「P−3」 1.2g
・赤外線吸収剤:「IR−1」 0.09g
・ラジカル開始剤:「S−2」 0.40g
・ビクトリアピュアブルーのナフタレンスルホン酸 0.04g
・フッ素系界面活性剤 0.01g
(メガファックF−176,大日本インキ化学工業(株)製)
・メチルエチルケトン 9.0g
・メタノール 10.0g
・p−メトキシフェノール 0.001g
・1−メトキシ−2−プロパノール 8.0g
【0310】
〔感度および耐刷性の評価〕
得られた平版印刷版原版を、水冷式40W赤外線半導体レーザを搭載したクレオ社製トレンドセッター3244VFSを用いて、解像度2400dpiの条件で出力して露光した。この際、露光パワー(W)と外面ドラム回転数を変化させることにより版面エネルギーを変化させて露光した。
続いて、実施例1〜6と同様の方法で現像処理を行い、平版印刷版を得た。さらに実施例1〜6と同様の方法で印刷を行い、感度および耐刷性を評価した。結果を表3に併記する。
【0311】
【表3】
【0312】
表3に明らかなように、本発明に係る特定重合性化合物を用いた実施例17〜25の平版印刷版は、本発明の範囲外の重合性化合物を用いた比較例5の平版印刷版に比べ、それぞれの露光量において優れた耐刷性が得られ、また、低露光であっても、著しい耐刷性の低下はみられず、感度にも優れることが確認された。
【0313】
〔実施例26〜29、比較例6〕
(記録層の形成)
実施例7〜16と同様の下塗りを施した支持体上に、下記組成の記録層塗布液4をワイヤーバーを用いて塗布し、温風式乾燥装置にて115℃で45秒間乾燥した。さらに、下記オーバーコート層塗布液をスライドホッパーを用いて塗布し、温風式乾燥装置にて120℃で75秒間乾燥して平版印刷版原版を得た。尚、画像記録層の塗布量は2.0g/m2であり、オーバーコート層の塗布量は2.3g/m2であった。
【0314】
<オーバーコート層用塗布液>
・ポリビニルアルコール 2.5g
(ケン化度98.5モル%、重合度500)
・ポリビニルピロリドン 0.5g
(K30、東京化成工業(株)製 分子量4万)
・非イオン性界面活性剤 0.05g
(EMAREX NP−10 日本エマルジョン社(株)製)
・イオン交換水 96.95g
【0315】
(露光・現像)
得られたネガ型平版印刷版原版を、実施例1〜6と同様にして、赤外線レーザ露光および現像処理を行い、平版印刷版を得た。
【0316】
〔耐刷性、非画像部の汚れ性および保存安定性の評価〕
得られた平版印刷版を、実施例1〜6と同様にして印刷を行い、実施例1〜6と同様の方法で耐刷性、非画像部の汚れ性および保存安定性を評価した。結果を表4に併記する。
【0317】
【表4】
【0318】
表4から明らかなように、記録層表面にオーバーコート層を設けた場合であっても、本発明に係る特定重合性化合物を用いた実施例26〜29の平版印刷版は、本発明の範囲外の重合性化合物を用いた比較例6の平版印刷版に比べ、耐刷性に優れ、非画像部の汚れもみられなかった。また、高温高湿度環境下で保存した後も、耐刷性、非画像部の汚れ性が低下せず、保存安定性に優れていることがわかった。
【0319】
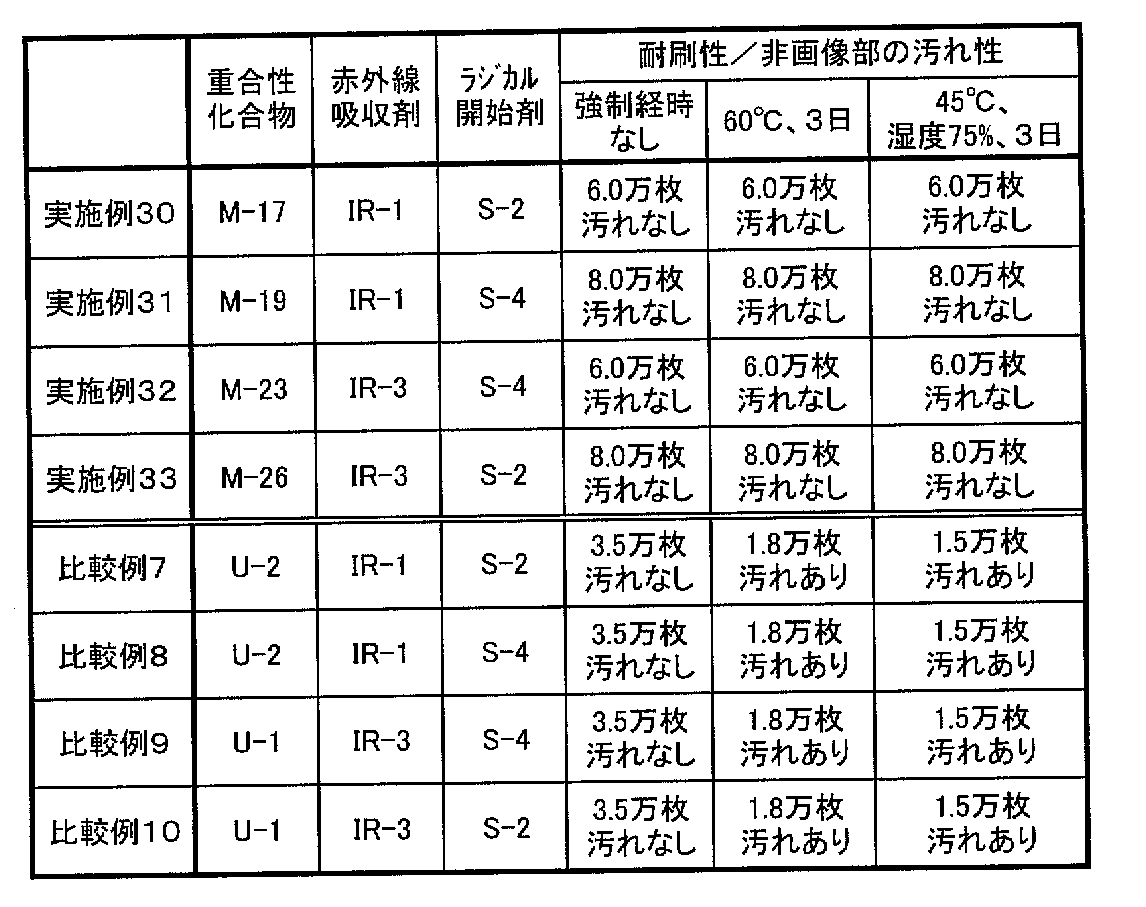
〔実施例30〜33、比較例7〜10〕
実施例1〜6で用いた支持体に、印刷版非画像部としての親水性を確保するため、シリケート処理を行った。処理は3号珪酸ソーダ1.5%水溶液を70℃に保ちアルミウェブの接触時間が15秒となるよう通搬し、さらに水洗した。Siの付着量は10mg/m2であった。以上により作成した支持体のRa(中心線表面粗さ)は0.25μmであった。
【0320】
(記録層の形成)
このように処理されたアルミニウム支持体上に、下記組成の記録層塗布液5をワイヤーバーを用いて塗布し、温風式乾燥装置にて115℃で45秒間乾燥して平版印刷版原版を得た。乾燥後の被覆量は1.2〜1.3g/m2の範囲内であった。次いで、実施例26〜29と同様にして、オーバーコート層を塗布した。
【0321】
<記録層塗布液5>
・重合性化合物:(表5に記載の化合物) 1.0g
・バインダーポリマー:「P−3」 1.0g
・赤外線吸収剤:(表5に記載の化合物) 0.08g
・ラジカル開始剤:(表5に記載の化合物) 0.30g
・ビクトリアピュアブルーのナフタレンスルホン酸 0.04g
・フッ素系界面活性剤 0.01g
(メガファックF−176,大日本インキ化学工業(株)製)
・メチルエチルケトン 9.0g
・メタノール 10.0g
・p−メトキシフェノール 0.001g
・1−メトキシ−2−プロパノール 8.0g
【0322】
得られたネガ型平版印刷版原版を、現像液を下記のものに変えた以外は実施例1〜6と同様にして、赤外線レーザ露光および現像処理を行った。
<現像液>
・水酸化カリウム 3g
・炭酸水素カリウム 1g
・炭酸カリウム 2g
・亜硫酸ナトリウム 1g
・ポリエチレングリコールモノナフチルエーテル 150g
・ジブチルナフタレンスルホン酸ナトリウム塩 50g
・エチレンジアミン4酢酸4ナトリウム塩 8g
・水 785g
【0323】
〔耐刷性、非画像部の汚れ性および保存安定性の評価〕
得られた平版印刷版を、実施例1〜6と同様の方法で印刷を行い、さらに実施例1〜6同様の方法で耐刷性、非画像部の汚れ性および保存安定性の評価を行った。結果を表5に併記する。
【0324】
【表5】
【0325】
表5に明らかなように、本発明に係る特定重合性化合物を用いた実施例30〜33の平版印刷版は、本発明の範囲外の重合性化合物を用いた比較例7〜10の平版印刷版に比べ、耐刷性に優れ、非画像部の汚れもみられなかった。また、高温高湿度環境下で保存した後も、耐刷性、非画像部の汚れ性が低下せず、保存安定性に優れていることがわかった。
以上、本実施例によれば、本発明の光または熱硬化性組成物は、平版印刷版原版の記録材料として有用であることがわかった。
【0326】
【発明の効果】
本発明によれば、感度、保存安定性、耐刷性、および現像性に優れ、特に、バーニング処理を行うことで著しく耐刷性が向上するネガ型平版印刷版原版の画像記録材料として有用な、光または熱硬化性組成物を得ることができる。[0001]
BACKGROUND OF THE INVENTION
The present invention is a photo or thermosetting composition used for image recording materials such as three-dimensional stereolithography, holography, planographic printing plates, color proofs, photoresists and color filters, inks, paints, and adhesives. In particular, the present invention relates to a light or thermosetting composition that can be directly made from a digital signal of a computer or the like using various lasers, and is preferably used as a recording material for a so-called negative lithographic printing original plate that can be directly made.
[0002]
[Prior art]
The development of lasers in recent years has been remarkable, and in particular, solid-state lasers, semiconductor lasers, and gas lasers that emit ultraviolet light, visible light, and infrared light having a wavelength of 300 nm to 1200 nm can be easily obtained with high output and small size. These lasers are very useful as recording light sources when directly making a plate from digital data of a computer or the like in lithographic printing. Various studies have been made on recording materials sensitive to these various laser beams. Positive recording materials compatible with infrared lasers having a photosensitive wavelength of 760 nm or more (see Patent Document 1), acid-catalyst-crosslinked negative recording materials (Patent Documents) 2) is known. Also known are radical polymerization negative recording materials compatible with ultraviolet light or visible light laser of 300 nm to 700 nm (see Patent Documents 3 and 4).
[0003]
Usually, a light or heat-polymerizable negative image recording material contains a compound that generates radicals by light or heat and a polymerizable compound, and the radicals generated by light or heat are used as initiators for the polymerizable compound. A recording method is used in which an image portion is formed by causing a polymerization reaction and curing a recording layer in an exposed portion.
[0004]
In such a negative image recording material, for the purpose of improving printing durability, it is common to perform a heat treatment (hereinafter referred to as “burning treatment” as appropriate) after the exposure / development process. This is intended to promote a curing reaction by applying high-temperature heat again to an unreacted polymerizable compound that could not be polymerized by exposure, thereby forming a stronger image portion. However, in the conventional polymerizable compound, unreacted molecules are sublimated by such high-temperature heat treatment, and the image portion is damaged, so that it is not possible to obtain a sufficient effect of improving printing durability. .
[0005]
On the other hand, various recording materials have been proposed for the purpose of improving sensitivity. For example, a material containing a component excellent in reactivity to light and heat, such as a chemically amplified photosensitive material (see Patent Document 5) and a photosensitive material using polymerization of an ethylenically unsaturated compound (see Patent Document 6) is known. It has been. However, there is a concern that such a recording material is inferior in storage stability, such as undesired reactions occurring due to handling under white light or changes in environmental temperature, and polymerization inhibition due to oxygen in the air occurs. there were.
In order to solve such a problem, a recording material using a polymerizable compound having an ethylenically unsaturated bond in a specific ring structure (see Patent Document 7) has been proposed. Since the polymerizable compound used in this recording material has a plurality of polymerizable groups in one molecule, it has excellent sensitivity and storage stability, but unreacted compound is present in the recording material film. If present, it has a problem that it exudes to the surface of the film over time, or depending on the temperature environment, the strength of the film formed by moving in the film is lowered, and the printing durability is deteriorated. This tendency is remarkable particularly when the burning process is performed, and there is a drawback that the printing durability of the image area is lowered by the process for improving the film strength.
[0006]
[Patent Document 1]
U.S. Pat. No. 4,708,925
[Patent Document 2]
JP-A-8-276558
[Patent Document 3]
U.S. Pat. No. 2,850,445
[Patent Document 4]
Japanese Patent Publication No. 44-20189
[Patent Document 5]
Japanese Patent Laid-Open No. 11-65105
[Patent Document 6]
JP 2000-89455 A
[Patent Document 7]
JP-A-8-160615
[0007]
[Problems to be solved by the invention]
The object of the present invention, which has been made in consideration of the above-mentioned drawbacks of the prior art, is a negative that is excellent in sensitivity, storage stability, printing durability, and developability, and in particular, the printing durability is significantly improved by performing a burning treatment. An object of the present invention is to provide a light or thermosetting composition useful as an image recording material for a lithographic printing plate precursor.
[0008]
[Means for Solving the Problems]
As a result of intensive studies, the present inventors have achieved the above object by using a polymerizable compound having a specific structural skeleton and an ethylenically unsaturated group as the polymerizable compound in the light or thermosetting composition. And the present invention has been solved.
That is, the photo- or thermosetting composition of the present invention is (A) a polymer having at least one ethylenically unsaturated bond and at least two ring structures composed of at least one amide structure. A functional compound (hereinafter referred to as “specific polymerizable compound” as appropriate),
(B) a compound that generates radicals by light or heat (hereinafter referred to as “radical initiator” as appropriate);
It is characterized by having.
[0009]
In the present invention, it is preferable that at least one of the ring structures according to claim 1 is composed of two or more amide structures.
In addition, at least one of the ring structures according to claim 1 is preferably a 4- to 10-membered ring, and such a ring structure is selected from the following formulas (A-1) to (A-12): The structure is more preferred. Among these, the most preferable ring structure in the present invention is an isocyanuric acid skeleton (A-12).
[0010]
[Chemical 1]
Further, in the present invention, it is preferable that the ethylenically unsaturated bond according to claim 1 is bonded to the ring structure. Further, each ring structure has a structure in which two or more ethylenically unsaturated bonds are bonded. Some are preferred.
[0012]
In the present invention, it is preferable that two or more ring structures according to claim 1 are bonded through a linking group.
[0013]
Although the action of the present invention is not clear, such a specific polymerizable compound has an ethylenically unsaturated bond having a high radical reactivity in its molecule, so that a high density is obtained between the specific polymerizable compounds by applying energy during exposure. In addition, a strong cross-linked structure is quickly formed. Therefore, it is considered that a lithographic printing plate precursor using such a specific polymerizable compound as a recording material can realize high sensitivity and excellent printing durability.
Furthermore, the specific polymerizable compound according to the present invention has a feature that its molecular weight is relatively large and aggregability due to a ring structure including an amide structure. That is, even over time, there is no problem that the polymerizable compound moves in the film and exudes to the surface of the film, thereby reducing the strength of the film, and is excellent in storage stability, and also by a burning treatment, The unreacted polymerizable compound stays in the film without sublimation, and the polymerization and curing reaction is accelerated by the heat of the burning treatment. As a result, a stronger image portion can be obtained, and a further improvement effect of printing durability can be obtained.
In general, when such a high molecular weight polymerizable compound is used, there is a concern that developability is lowered. However, the specific polymerizable compound according to the present invention has an amide group constituting the ring structure. It is presumed that the non-image area is excellent in removability due to the resulting hydrophilic action.
[0014]
DETAILED DESCRIPTION OF THE INVENTION
The photo or thermosetting composition of the present invention is (A) a polymerizable compound having at least one ethylenically unsaturated bond and having at least two ring structures composed of at least one amide structure. (Specific polymerizable compound) and (B) a compound that generates radicals by light or heat (radical initiator). Furthermore, the light or thermosetting composition of the present invention comprises (C) a sensitizing dye having a function of absorbing light of a predetermined wavelength and converting it into heat, and (D) a binder polymer for the purpose of improving film properties, Can be contained.
Hereafter, each compound which can be used for the light or thermosetting composition of this invention is demonstrated one by one.
[0015]
[(A) Specific polymerizable compound]
The specific polymerizable compound used in the present invention is a ring structure having at least one ethylenically unsaturated bond and composed of at least one amide structure (hereinafter referred to as “specific ring structure” as appropriate). ) Is a polymerizable compound having two or more. Such a specific polymerizable compound causes a polymerization and curing reaction using a radical generated by light or heat as an initiator.
[0016]
(Ring structure composed of at least one amide structure)
The specific ring structure according to the present invention is not particularly limited as long as it has at least one or more amide structures as an atomic group constituting the ring structure, but among them, those composed of two or more amide structures Are preferable, and those composed of three or more amide structures are more preferable in terms of strength.
[0017]
As the amide structure constituting the specific ring structure according to the present invention, those represented by the following general formula (I) are preferable.
[0018]
[Chemical 2]

In the formula (I), R is substituted by an ethylenically unsaturated bond group described later, or represents a hydrogen atom or an organic group.
The organic group represented by R is preferably an alkyl group, an alkenyl group, an alkynyl group, an aryl group or a heterocyclic group, each of which may have a substituent.
Examples of such an alkyl group include linear, branched, and cyclic alkyl groups having 1 to 20 carbon atoms, and specific examples thereof include a methyl group, an ethyl group, a propyl group, and a butyl group. Group, pentyl group, hexyl group, heptyl group, octyl group, nonyl group, decyl group, undecyl group, dodecyl group, tridecyl group, hexadecyl group, octadecyl group, eicosyl group, isopropyl group, isobutyl group, s-butyl group, t Examples include -butyl group, isopentyl group, neopentyl group, 1-methylbutyl group, isohexyl group, 2-ethylhexyl group, 2-methylhexyl group, cyclohexyl group, cyclopentyl group, and 2-norbornyl group. Of these, linear alkyl groups having 1 to 12 carbon atoms, branched alkyl groups having 3 to 12 carbon atoms, and cyclic alkyl groups having 5 to 10 carbon atoms are more preferable.
[0020]
As the substituent of the substituted alkyl group, a group composed of a monovalent non-metallic atomic group excluding a hydrogen atom is used. Preferred examples include a halogen atom (—F, —Br, —Cl, —I), a hydroxyl group. , Alkoxy group, aryloxy group, mercapto group, alkylthio group, arylthio group, alkyldithio group, aryldithio group, amino group, N-alkylamino group, N, N-dialkylamino group, N-arylamino group, N, N -Diarylamino group, N-alkyl-N-arylamino group, acyloxy group, carbamoyloxy group, N-alkylcarbamoyloxy group, N-arylcarbamoyloxy group, N, N-dialkylcarbamoyloxy group, N, N-diaryl Carbamoyloxy group, N-alkyl-N-arylcarbamoyloxy group, alkyl Rufoxy group, arylsulfoxy group, acylthio group, acylamino group, N-alkylacylamino group, N-arylacylamino group, ureido group, N′-alkylureido group, N ′, N′-dialkylureido group, N ′ -Arylureido group, N ', N'-diarylureido group, N'-alkyl-N'-arylureido group, N-alkylureido group, N-arylureido group, N'-alkyl-N-alkylureido group, N′-alkyl-N-arylureido group, N ′, N′-dialkyl-N-alkylureido group, N ′, N′-dialkyl-N-arylureido group, N′-aryl-N-alkylureido group, N′-aryl-N-arylureido group, N ′, N′-diaryl-N-alkylureido group, N ′, N′-diary Ru-N-arylureido group, N′-alkyl-N′-aryl-N-alkylureido group, N′-alkyl-N′-aryl-N-arylureido group, alkoxycarbonylamino group, aryloxycarbonylamino group N-alkyl-N-alkoxycarbonylamino group, N-alkyl-N-aryloxycarbonylamino group, N-aryl-N-alkoxycarbonylamino group, N-aryl-N-aryloxycarbonylamino group, formyl group, Acyl group, carboxyl group, alkoxycarbonyl group, aryloxycarbonyl group, carbamoyl group, N-alkylcarbamoyl group, N, N-dialkylcarbamoyl group, N-arylcarbamoyl group, N, N-diarylcarbamoyl group, N-alkyl- N-arylcarbamoyl group Alkylsulfinyl group, arylsulfinyl group, alkylsulfonyl group,
[0021]
Arylsulfonyl group, sulfo group (-SO3H) and its conjugate base group (referred to as sulfonate group), alkoxysulfonyl group, aryloxysulfonyl group, sulfinamoyl group, N-alkylsulfinamoyl group, N, N-dialkylsulfinamoyl group, N-arylsulfina Moyl group, N, N-diarylsulfinamoyl group, N-alkyl-N-arylsulfinamoyl group, sulfamoyl group, N-alkylsulfamoyl group, N, N-dialkylsulfamoyl group, N-arylsulfuric group Famoyl group, N, N-diarylsulfamoyl group, N-alkyl-N-arylsulfamoyl group, phosphono group (—PO3H2) And its conjugate base group (referred to as phosphonate group), dialkylphosphono group (—PO3(Alkyl)2) “Alkyl = alkyl group, hereinafter the same”, diarylphosphono group (—PO3(Aryl)2) “Aryl = aryl group, the same shall apply hereinafter”, alkylarylphosphono group (—PO3(Alkyl) (aryl)), monoalkylphosphono group (—PO3(Alkyl)) and its conjugate base group (referred to as alkylphosphonate group), monoarylphosphono group (—PO3H (aryl)) and its conjugate base group (referred to as arylphosphonate group), phosphonooxy group (—OPO3H2) And conjugated base groups thereof (referred to as phosphonatoxy groups), dialkylphosphonooxy groups (—OPO)3H (alkyl)2), Diarylphosphonooxy group (-OPO3(Aryl)2), An alkylarylphosphonooxy group (—OPO3(Alkyl) (aryl)), monoalkylphosphonooxy group (—OPO3H (alkyl)) and its conjugate base group (referred to as alkylphosphonatoxy group), monoarylphosphonooxy group (—OPO)3H (aryl)) and its conjugate base group (referred to as arylphosphonatoxy group), cyano group, nitro group, aryl group, alkenyl group, alkynyl group, heterocyclic group, silyl group and the like.
[0022]
Specific examples of the alkyl group in these substituents include the aforementioned alkyl groups, and specific examples of the aryl group in the above substituents include a phenyl group, a biphenyl group, a naphthyl group, a tolyl group, a xylyl group, and a mesityl group. , Cumenyl group, chlorophenyl group, bromophenyl group, chloromethylphenyl group, hydroxyphenyl group, methoxyphenyl group, ethoxyphenyl group, phenoxyphenyl group, acetoxyphenyl group, benzoyloxyphenyl group, methylthiophenyl group, phenylthiophenyl group , Methylaminophenyl group, dimethylaminophenyl group, acetylaminophenyl group, carboxyphenyl group, methoxycarbonylphenyl group, ethoxyphenylcarbonyl group, phenoxycarbonylphenyl group, N-phenylcarbamoylpheny Group, cyanophenyl group, sulfophenyl group, sulfonatophenyl group, phosphonophenyl group, and a phosphate Hona preparative phenyl group.
[0023]
Examples of alkenyl groups include vinyl, 1-propenyl, 1-butenyl, cinnamyl, 2-chloro-1-ethenyl, etc. Examples of alkynyl include ethynyl, 1 -Propynyl group, 1-butynyl group, trimethylsilylethynyl group and the like.
Acyl group (R01CO-) R01Examples thereof include a hydrogen atom, and the above alkyl group and aryl group. Among these substituents, more preferred are a halogen atom (—F, —Br, —Cl, —I), an alkoxy group, an aryloxy group, an alkylthio group, an arylthio group, an N-alkylamino group, N, N. -Dialkylamino group, acyloxy group, N-alkylcarbamoyloxy group, N-arylcarbamoyloxy group, acylamino group, formyl group, acyl group, carboxyl group, alkoxycarbonyl group, aryloxycarbonyl group, carbamoyl group, N-alkylcarbamoyl group Group, N, N-dialkylcarbamoyl group, N-arylcarbamoyl group, N-alkyl-N-arylcarbamoyl group, sulfo group, sulfonate group, sulfamoyl group, N-alkylsulfamoyl group, N, N-dialkylsulfa group Moyl group, N-arylsulfur Amoyl group, N-alkyl-N-arylsulfamoyl group, phosphono group, phosphonato group, dialkylphosphono group, diarylphosphono group, monoalkylphosphono group, alkylphosphonato group, monoarylphosphono group, arylphospho Examples thereof include a nato group, a phosphonooxy group, a phosphonatooxy group, an aryl group, and an alkenyl group.
Examples of the heterocyclic group include a pyridyl group and a piperidinyl group. Examples of the silyl group include a trimethylsilyl group.
[0024]
On the other hand, examples of the alkylene group in the substituted alkyl group include divalent organic residues obtained by removing any one of the hydrogen atoms on the alkyl group having 1 to 20 carbon atoms. Can include linear alkylene groups having 1 to 12 carbon atoms, branched chains having 3 to 12 carbon atoms, and cyclic alkylene groups having 5 to 10 carbon atoms. Preferable specific examples of the substituted alkyl group obtained by combining such a substituent and an alkylene group include a chloromethyl group, a bromomethyl group, a 2-chloroethyl group, a trifluoromethyl group, a methoxymethyl group, and an isopropoxymethyl group. , Butoxymethyl group, s-butoxybutyl group, methoxyethoxyethyl group, allyloxymethyl group, phenoxymethyl group, methylthiomethyl group, tolylthiomethyl group, pyridylmethyl group, tetramethylpiperidinylmethyl group, N-acetyltetra Methylpiperidinylmethyl group, trimethylsilylmethyl group, methoxyethyl group, ethylaminoethyl group, diethylaminopropyl group, morpholinopropyl group, acetyloxymethyl group, benzoyloxymethyl group, N-cyclohexylcarbamoyloxyethyl Group, N-phenylcarbamoyloxyethyl group, acetylaminoethyl group, N-methylbenzoylaminopropyl group, 2-oxoethyl group, 2-oxopropyl group, carboxypropyl group, methoxycarbonylethyl group, allyloxycarbonylbutyl group, chloro Phenoxycarbonylmethyl group, carbamoylmethyl group, N-methylcarbamoylethyl group, N, N-dipropylcarbamoylmethyl group, N- (methoxyphenyl) carbamoylethyl group, N-methyl-N- (sulfophenyl) carbamoylmethyl group, Sulfobutyl group, sulfonatobutyl group, sulfamoylbutyl group, N-ethylsulfamoylmethyl group, N, N-dipropylsulfamoylpropyl group, N-tolylsulfamoylpropyl group, N-methyl-N- (phosphonov Nyl) sulfamoyloctyl group, phosphonobutyl group, phosphonatohexyl group, diethylphosphonobutyl group, diphenylphosphonopropyl group, methylphosphonobutyl group, methylphosphonatobutyl group, tolylphosphonohexyl group, tolylphosphonatohexyl Group, phosphonooxypropyl group, phosphonatoxybutyl group, benzyl group, phenethyl group, α-methylbenzyl group, 1-methyl-1-phenylethyl group, p-methylbenzyl group, cinnamyl group, allyl group, 1- Examples thereof include a propenylmethyl group, a 2-butenyl group, a 2-methylallyl group, a 2-methylpropenylmethyl group, a 2-propynyl group, a 2-butynyl group, and a 3-butynyl group.
[0025]
Examples of the aryl group include those in which 1 to 3 benzene rings form a condensed ring, and those in which a benzene ring and a 5-membered unsaturated ring form a condensed ring. Specific examples include a phenyl group, A naphthyl group, an anthryl group, a phenanthryl group, an indenyl group, an acenaphthenyl group, and a fluorenyl group can be exemplified, and among these, a phenyl group and a naphthyl group are more preferable.
As the substituted aryl group, those having a group consisting of a monovalent non-metallic atomic group excluding a hydrogen atom as a substituent on the ring-forming carbon atom of the aforementioned aryl group are used. Examples of preferred substituents include the alkyl groups, substituted alkyl groups, and those previously shown as substituents in the substituted alkyl group.
[0026]
Preferred examples of such a substituted aryl group include biphenyl group, tolyl group, xylyl group, mesityl group, cumenyl group, chlorophenyl group, bromophenyl group, fluorophenyl group, chloromethylphenyl group, trifluoromethylphenyl group. Hydroxyphenyl group, methoxyphenyl group, methoxyethoxyphenyl group, allyloxyphenyl group, phenoxyphenyl group, methylthiophenyl group, tolylthiophenyl group, ethylaminophenyl group, diethylaminophenyl group, morpholinophenyl group, acetyloxyphenyl group, Benzoyloxyphenyl group, N-cyclohexylcarbamoyloxyphenyl group, N-phenylcarbamoyloxyphenyl group, acetylaminophenyl group, N-methylbenzoylaminophenyl group, cal Xiphenyl group, methoxycarbonylphenyl group, allyloxycarbonylphenyl group, chlorophenoxycarbonylphenyl group, carbamoylphenyl group, N-methylcarbamoylphenyl group, N, N-dipropylcarbamoylphenyl group, N- (methoxyphenyl) carbamoylphenyl group N-methyl-N- (sulfophenyl) carbamoylphenyl group, sulfophenyl group, sulfonatophenyl group, sulfamoylphenyl group, N-ethylsulfamoylphenyl group, N, N-dipropylsulfamoylphenyl group, N-tolylsulfamoylphenyl group, N-methyl-N- (phosphonophenyl) sulfamoylphenyl group, phosphonophenyl group, phosphonatophenyl group, diethylphosphonophenyl group, diphenylphosphonophenyl Methylphosphonophenyl group, methylphosphonatophenyl group, tolylphosphonophenyl group, tolylphosphonophenyl group, allylphenyl group, 1-propenylmethylphenyl group, 2-butenylphenyl group, 2-methylallylphenyl group, A 2-methylpropenylphenyl group, a 2-propynylphenyl group, a 2-butynylphenyl group, a 3-butynylphenyl group, and the like can be given.
[0027]
An alkenyl group, a substituted alkenyl group, an alkynyl group, and a substituted alkynyl group (—C (R02) = C (R03) (R04), And -C≡C (R05)) As R02, R03, R04, R05Can be a group consisting of a monovalent nonmetallic atomic group. Preferred R02, R03, R04, R05Examples of these include a hydrogen atom, a halogen atom, an alkyl group, a substituted alkyl group, an aryl group, and a substituted aryl group. Specific examples thereof include those shown as the above examples. R02, R03, R04, R05As more preferred groups, there can be mentioned a hydrogen atom, a halogen atom and a linear, branched or cyclic alkyl group having 1 to 10 carbon atoms.
[0028]
Preferable specific examples of such alkenyl group, substituted alkenyl group, alkynyl group and substituted alkynyl group include vinyl group, 1-propenyl group, 1-butenyl group, 1-pentenyl group, 1-hexenyl group and 1-octenyl group. 1-methyl-1-propenyl group, 2-methyl-1-propenyl group, 2-methyl-1-butenyl group, 2-phenyl-1-ethenyl group, 2-chloro-1-ethenyl group, ethynyl group, 1 -A propynyl group, 1-butynyl group, and phenylethynyl group can be mentioned.
Examples of the heterocyclic group include the pyridyl group exemplified as the substituent of the substituted alkyl group.
[0029]
The specific ring structure according to the present invention may include other atoms in addition to the above amide structure. Preferred other atoms include carbon, nitrogen, oxygen, sulfur and the like. When the ring structure contains a carbon atom, in addition to a hydrogen atom as a substituent, a halogen atom, a hydroxyl group, a carboxyl group, a sulfonate group, a nitro group, a cyano group, an amide group, an amino group, an alkyl group, an alkenyl group, It may have an alkynyl group, an aryl group, a substituted oxy group, a substituted sulfonyl group, a substituted carbonyl group, a substituted sulfinyl group, a sulfo group, a phosphono group, a phosphonato group, a silyl group, or a heterocyclic group.
In addition to the hydrogen atom, the nitrogen atom may have an alkyl group, an alkenyl group, an alkynyl group, an aryl group, or a heterocyclic group. Examples of the alkyl group, alkenyl group, alkynyl group, aryl group, and heterocyclic group include those described above.
[0030]
The substituted oxy group (R06As O-), R06In which is a group composed of a monovalent non-metallic atomic group excluding a hydrogen atom. Preferred substituted oxy groups include alkoxy groups, aryloxy groups, acyloxy groups, carbamoyloxy groups, N-alkylcarbamoyloxy groups, N-arylcarbamoyloxy groups, N, N-dialkylcarbamoyloxy groups, N, N-diarylcarbamoyloxy groups. Groups, N-alkyl-N-arylcarbamoyloxy groups, alkylsulfoxy groups, arylsulfoxy groups, phosphonooxy groups, and phosphonatoxy groups. Examples of the alkyl group and aryl group in these include the alkyl groups, substituted alkyl groups, aryl groups, and substituted aryl groups described above. In addition, an acyl group (R07CO-) is R07However, the alkyl group, the substituted alkyl group, the aryl group, and the substituted aryl group mentioned as the previous examples can be exemplified. Among these substituents, an alkoxy group, an aryloxy group, an acyloxy group, and an arylsulfoxy group are more preferable. Specific examples of preferred substituted oxy groups include methoxy, ethoxy, propyloxy, isopropyloxy, butyloxy, pentyloxy, hexyloxy, dodecyloxy, benzyloxy, allyloxy, phenethyloxy, Carboxyethyloxy group, methoxycarbonylethyloxy group, ethoxycarbonylethyloxy group, methoxyethoxy group, phenoxyethoxy group, methoxyethoxyethoxy group, ethoxyethoxyethoxy group, morpholinoethoxy group, morpholinopropyloxy group, allyloxyethoxyethoxy group, Phenoxy group, tolyloxy group, xylyloxy group, mesityloxy group, mesityloxy group, cumenyloxy group, methoxyphenyloxy group, ethoxyphenyloxy group, chlorophenyl Alkoxy group, bromophenyl group, acetyloxy group, benzoyloxy group, naphthyloxy group, a phenylsulfonyloxy group, a phosphonooxy group, phosphonatoxy group, and the like.
[0031]
Substituted amino groups (R08NH-, (R09) (R010) N-) includes R08, R09, R010May be a group consisting of a monovalent nonmetallic atomic group excluding a hydrogen atom. R09And R010And may combine to form a ring. Preferred examples of the substituted amino group include an N-alkylamino group, an N, N-dialkylamino group, an N-arylamino group, an N, N-diarylamino group, an N-alkyl-N-arylamino group, an acylamino group, N-alkylacylamino group, N-arylacylamino group, ureido group, N′-alkylureido group, N ′, N′-dialkylureido group, N′-arylureido group, N ′, N′-diarylureido group N′-alkyl-N′-arylureido group, N-alkylureido group, N-arylureido group, N′-alkyl-N-alkylureido group, N′-alkyl-N-arylureido group, N ′, N′-dialkyl-N-alkylureido group, N′-alkyl-N′-arylureido group, N ′, N′-dialkyl-N-al Luureido group, N ′, N′-dialkyl-N′-arylureido group, N′-aryl-N-alkylureido group, N′-aryl-N-arylureido group, N ′, N′-diaryl-N— Alkylureido group, N ′, N′-diaryl-N-arylureido group, N′-alkyl-N′-aryl-N-alkylureido group, N′-alkyl-N′-aryl-N-arylureido group, Alkoxycarbonylamino group, aryloxycarbonylamino group, N-alkyl-N-alkoxycarbonylamino group, N-alkyl-N-aryloxycarbonylamino group, N-aryl-N-alkoxycarbonylamino group, N-aryl-N -An aryloxycarbonylamino group is mentioned. Examples of the alkyl group and aryl group in these include the alkyl groups, substituted alkyl groups, and aryl groups and substituted aryl groups described above, such as acylamino group, N-alkylacylamino group, and N-arylacylamino. Acyl group (R07CO-) R07Is as described above. Of these, more preferred are an N-alkylamino group, an N, N-dialkylamino group, an N-arylamino group, and an acylamino group. Specific examples of preferred substituted amino groups include methylamino group, ethylamino group, diethylamino group, morpholino group, piperidino group, pyrrolidino group, phenylamino group, benzoylamino group, acetylamino group and the like.
[0032]
Substituted sulfonyl group (R011-SO2-) As R011Can be a group consisting of a monovalent non-metallic atomic group. More preferable examples include an alkylsulfonyl group and an arylsulfonyl group. Examples of the alkyl group and aryl group in these include those described above as the alkyl group, substituted alkyl group, aryl group, and substituted aryl group. Specific examples of such a substituted sulfonyl group include a butylsulfonyl group, a phenylsulfonyl group, a chlorophenylsulfonyl group, and the like.
[0033]
Sulfonato group (-SO3As described above,-) represents a sulfo group (-SO3H) means a conjugated base anionic group, usually preferably used together with a counter cation. Such counter cations include those generally known, that is, various oniums (ammoniums, sulfoniums, phosphoniums, iodoniums, aziniums, etc.), and metal ions (Na+, K+, Ca2+, Zn2+Etc.).
[0034]
Substituted carbonyl group (R013-CO-) includes R013Can be a group consisting of a monovalent non-metallic atomic group. Preferred examples of the substituted carbonyl group include formyl group, acyl group, carboxyl group, alkoxycarbonyl group, aryloxycarbonyl group, carbamoyl group, N-alkylcarbamoyl group, N, N-dialkylcarbamoyl group, N-arylcarbamoyl group, N, N-diarylcarbamoyl group, N-alkyl-N′-arylcarbamoyl group may be mentioned. Examples of the alkyl group and aryl group in these include those described above as the alkyl group, substituted alkyl group, aryl group, and substituted aryl group. Among these, more preferred substituted carbonyl groups include formyl, acyl, carboxyl, alkoxycarbonyl, aryloxycarbonyl, carbamoyl, N-alkylcarbamoyl, N, N-dialkylcarbamoyl, N-ary. A rucarbamoyl group can be mentioned, and even more preferred are a formyl group, an acyl group, an alkoxycarbonyl group and an aryloxycarbonyl group. Specific examples of preferred substituted carbonyl groups include formyl group, acetyl group, benzoyl group, carboxyl group, methoxycarbonyl group, ethoxycarbonyl group, allyloxycarbonyl group, dimethylaminophenylethenylcarbonyl group, methoxycarbonylmethoxycarbonyl group, N -Methylcarbamoyl group, N-phenylcarbamoyl group, N, N-diethylcarbamoyl group, morpholinocarbonyl group and the like.
[0035]
Substituted sulfinyl group (R014-SO-) is R014Can be a group consisting of a monovalent non-metallic atomic group. Preferable examples include alkylsulfinyl group, arylsulfinyl group, sulfinamoyl group, N-alkylsulfinamoyl group, N, N-dialkylsulfinamoyl group, N-arylsulfinamoyl group, N, N-diarylsulfinamoyl. Group, N-alkyl-N-arylsulfinamoyl group. Examples of the alkyl group and aryl group in these include those described above as the alkyl group, substituted alkyl group, aryl group, and substituted aryl group. Of these, more preferred examples include an alkylsulfinyl group and an arylsulfinyl group. Specific examples of such a substituted sulfinyl group include a hexylsulfinyl group, a benzylsulfinyl group, and a tolylsulfinyl group.
[0036]
The substituted phosphono group means a group in which one or two hydroxyl groups on the phosphono group are substituted with other organic oxo groups, and preferred examples thereof include the above-mentioned dialkylphosphono group, diarylphosphono group, alkylarylphospho group. Group, monoalkylphosphono group and monoarylphosphono group. Of these, dialkylphosphono groups and diarylphosphono groups are more preferred. Specific examples thereof include a diethyl phosphono group, a dibutyl phosphono group, a diphenyl phosphono group, and the like.
[0037]
Phosphonato group (-PO3H2-, -PO3H-) is, as described above, a phosphono group (—PO3H2), A conjugate base anion group derived from acid first dissociation or acid second dissociation. Usually, it is preferable to use it with a counter cation. Such counter cations include those generally known, that is, various oniums (ammoniums, sulfoniums, phosphoniums, iodoniums, aziniums, etc.), and metal ions (Na+, K+, Ca2+, Zn2+Etc.).
[0038]
The substituted phosphonato group is a conjugated base anion group obtained by substituting one organic oxo group in the above-mentioned substituted phosphono group. As a specific example, the monoalkylphosphono group (—PO3H (alkyl)), monoarylphosphono group (—PO3H (aryl)) conjugate base.
[0039]
The specific ring structure according to the present invention having at least one amide structure as described above is preferably a 4- to 10-membered ring, more preferably a 5- to 6-membered ring. Specific examples of such a ring structure include those shown in the following (A-1) to (A-12). Among these, those represented by (A-9) to (A-12) comprising two or more amide structures are preferable in terms of film strength, and represented by (A-10) or (A-12). Is particularly preferable from the viewpoint of the balance between film strength and developability, and (A-12) is the most preferable.
[0040]
[Chemical 3]
[0041]
The specific polymerizable compound according to the present invention has two or more of the specific ring structures in the molecule. Such two or more specific ring structures may be the same or different.
In addition, two or more such ring structures may be directly bonded to each other to form one compound, but are bonded via a polyvalent linking group, more preferably a polyvalent organic linking group. More preferably. The organic linking group is a polyvalent organic group substantially composed of a nonmetallic atom, and is mainly composed of a carbon atom, a nitrogen atom, an oxygen atom, a hydrogen atom, a sulfur atom, or the like.
More specific linking groups are not particularly limited, and examples thereof include those constituted by combining the following structural units singly or in combination. The molecular weight is preferably 12 to 3000, more preferably 12 to 2000, and particularly preferably 12 to 1000.
[0042]
[Formula 4]
[0043]
The above polyvalent linking group may have a substituent. The substituent of the polyvalent linking group is not particularly limited. For example, the halogen atom, hydroxyl group, carboxyl group, sulfonate group, nitro group, cyano group, amide group, amino group, alkyl group described above are used. Alkenyl group, alkynyl group, aryl group, substituted oxy group, substituted sulfonyl group, substituted carbonyl group, substituted sulfinyl group, sulfo group, phosphono group, phosphonato group, silyl group, and heterocyclic group.
[0044]
(Ethylenically unsaturated bond)
The specific polymerizable compound according to the present invention has two or more specific ring structures and at least one ethylenically unsaturated bond. In the present invention, such an ethylenically unsaturated bond may be present at any site in the specific polymerizable compound, but preferably an amide structure constituting the specific ring structure, that is, the general formula (I It is preferably introduced as a terminal substituent of R in R) or as a terminal substituent of an atom other than the amide structure constituting the specific ring structure. Furthermore, it is preferable to have two or more ethylenically unsaturated bonds per one of the specific ring structures.
As the ethylenically unsaturated bond used in the present invention, those represented by the following general formulas (II) to (IV) are preferable.
[0045]
[Chemical formula 5]
[0046]
In general formula (II), R1Represents a hydrogen atom or a monovalent organic group, preferably a hydrogen atom or an alkyl group which may have a substituent. Among them, a hydrogen atom or a methyl group is preferable because of high radical reactivity.
R2, R3Each independently represents a hydrogen atom, a halogen atom, an amino group, a carboxyl group, an alkoxycarbonyl group, a sulfo group, a nitro group, a cyano group, or a monovalent organic group, and the monovalent organic group includes a substituent. An alkyl group that may have a substituent, an aryl group that may have a substituent, an alkoxy group that may have a substituent, an aryloxy group that may have a substituent, and a substituent Examples thereof include a good alkylamino group, an arylamino group which may have a substituent, an alkylsulfonyl group which may have a substituent, and an arylsulfonyl group which may have a substituent. Among these, a hydrogen atom, a carboxyl group, an alkoxycarbonyl group, an alkyl group which may have a substituent, and an aryl group which may have a substituent are preferable because of high radical reactivity.
[0047]
Y1Is an oxygen atom, a sulfur atom, or -NR12-Represents. Where R12Represents a hydrogen atom or a monovalent organic group, preferably a hydrogen atom or an alkyl group which may have a substituent, among which a hydrogen atom, a methyl group, an ethyl group or an isopropyl group is a radical. It is preferable because of its high reactivity.
[0048]
Where R1~ R3And R12Examples of the substituents that can be introduced in are alkyl group, alkenyl group, alkynyl group, aryl group, alkoxy group, aryloxy group, halogen atom, amino group, alkylamino group, arylamino group, carboxyl group, alkoxycarbonyl group, sulfo group. Group, nitro group, cyano group, amide group, alkylsulfonyl group, arylsulfonyl group and the like.
[0049]
In the general formula (III), R4~ R8Each independently represents a hydrogen atom, a halogen atom, an amino group, a dialkylamino group, a carboxyl group, an alkoxycarbonyl group, a sulfo group, a nitro group, a cyano group, or a monovalent organic group, An alkyl group that may have a substituent, an aryl group that may have a substituent, an alkoxy group that may have a substituent, an aryloxy group that may have a substituent, and a substituent. And an alkylamino group which may have a substituent, an arylamino group which may have a substituent, an alkylsulfonyl group which may have a substituent, and an arylsulfonyl group which may have a substituent. Among these, a hydrogen atom, a carboxyl group, an alkoxycarbonyl group, an alkyl group that may have a substituent, and an aryl group that may have a substituent are preferable. Examples of the substituent that can be introduced include the same substituents as those described in formula (II).
Y2Is an oxygen atom, a sulfur atom, or -NR12-Represents. R12Is the same as in general formula (II).
[0050]
In general formula (IV), R9Represents a hydrogen atom or a monovalent organic group, preferably a hydrogen atom, an alkyl group which may have a substituent, etc. Among them, a hydrogen atom or a methyl group is preferable because of high radical reactivity. .
R10, R11Each independently represents a hydrogen atom, a halogen atom, an amino group, a dialkylamino group, a carboxyl group, an alkoxycarbonyl group, a sulfo group, a nitro group, a cyano group, or a monovalent organic group. Represents an alkyl group which may have a substituent, an aryl group which may have a substituent, an alkoxy group which may have a substituent, an aryloxy group which may have a substituent, and a substituent. Examples thereof include an alkylamino group which may have, an arylamino group which may have a substituent, an alkylsulfonyl group which may have a substituent, and an arylsulfonyl group which may have a substituent. Among these, a hydrogen atom, a carboxyl group, an alkoxycarbonyl group, an alkyl group which may have a substituent, and an aryl group which may have a substituent are preferable because of high radical reactivity.
Here, examples of the substituent that can be introduced include the same substituents as those described in the general formula (II).
Y3Is an oxygen atom, a sulfur atom, -NR12-Represents a phenylene group which may have a substituent. R12Is the same as in general formula (II).
[0051]
Among such ethylenically unsaturated bonds, those represented by the general formula (II) are preferable in terms of sensitivity.
[0052]
Here, specific examples (M-1) to (M-47) of the specific polymerizable compound according to the present invention will be given, but the present invention is not limited to these. In addition, the symbol A in the structure of the specific examples (M-1) to (M-47)1~ A22Is A which is exemplified after the specific examples (M-1) to (M-47).1~ A22Means that the structures of
[0053]
[Chemical 6]
[0054]
[Chemical 7]
[0055]
[Chemical 8]
[0056]
[Chemical 9]
[0057]
Embedded image
[0058]
Embedded image
[0059]
Embedded image
[0060]
Embedded image
[0061]
Embedded image
[0062]
Embedded image
[0063]
Next, typical synthesis examples of the specific polymerizable compound according to the present invention will be shown, but the present invention is not limited thereto.
(Synthesis of Compound M-7)
In a 1000 ml three-necked flask, 93 g of bis (2-acryloyloxyethyl) -2-hydroxyethylisocyanuric acid, 26 g of triethylamine, and 0.05 g of p-methoxyphenol were added and dissolved by adding 300 ml of acetone. While cooling in an ice bath, 20 g of glutaric dichloride was added dropwise over 1 hour. After completion of the dropping, the ice bath was removed. After a further 6 hours of reaction, the reaction mixture was poured into 1.5 L of water. The precipitated crystals were taken out by filtration to obtain 65 g of compound (M-7).
It was confirmed by H-NMR, mass spectrum, and IR spectrum that it was the compound (M-7).
[0064]
(Synthesis of Compound M-28)
In a 1000 ml three-necked flask, 78 g of bis (2-acryloyloxyethyl) -2-hydroxyethylisocyanuric acid, 21 g of triethylamine and 0.05 g of p-methoxyphenol were added, and 400 ml of THF was added and dissolved. While cooling in an ice bath, a solution of 28 g of 1,3-benzenedisulfonyl dichloride in 100 ml of THF was added dropwise over 1.5 hours. After completion of the dropping, the ice bath was removed. After a further 6 hours of reaction, the reaction mixture was poured into 2 L of water. Extraction was performed with 1 L of ethyl acetate, and the organic layer was washed successively with a saturated aqueous bicarbonate solution and saturated brine. The organic layer was dried over magnesium sulfate and filtered, and then the solvent was distilled off under reduced pressure to obtain 74 g of compound (M-28). It was confirmed by H-NMR, mass spectrum, and IR spectrum that it was the compound (M-28).
[0065]
(Synthesis of Compound M-22)
In a 1000 ml three-necked flask, 43 g of bis (2-acryloyloxyethyl) -2-hydroxyethylisocyanuric acid, 12 g of triethylamine and 0.05 g of p-methoxyphenol were added, and 400 ml of acetone was added and dissolved. While cooling in an ice bath, 9 g of diglycol chloride was added dropwise over 20 minutes. After completion of the dropping, the ice bath was removed. After a further 6 hours of reaction, the reaction mixture was poured into 1 L of water. Extraction was performed with 1 L of ethyl acetate, and the organic layer was washed successively with a saturated aqueous bicarbonate solution and saturated brine. The organic layer was dried over magnesium sulfate and filtered, and then the solvent was distilled off under reduced pressure to obtain 15 g of compound (M-22). It was confirmed by H-NMR, mass spectrum, and IR spectrum that it was the compound (M-22).
[0066]
The molecular weight of the specific polymerizable compound according to the present invention is preferably 400 or more, and more preferably in the range of 600 to 3,000. If it is less than 400, the effect of improving the film strength is insufficient, and when used as a recording material for a lithographic printing plate precursor, the image strength tends to be insufficient. On the other hand, if it exceeds 3,000, the developability deteriorates.
The specific polymerizable compound according to the present invention may be used alone or in combination of two or more.
[0067]
In the light or thermosetting composition of the present invention, in addition to the specific polymerizable compound, other known polymerizable compounds can be used in combination as long as the effects of the present invention are not impaired. In that case, the content of the other polymerizable compound is preferably 80% by mass or less, more preferably 60% by mass or less of the entire polymerizable compound.
[0068]
Such a polymerizable compound is preferably an addition polymerizable compound having at least one ethylenically unsaturated double bond, and a compound having at least one terminal ethylenically unsaturated bond, more preferably two or more. Is preferably selected from. Such a compound group is widely known in the industrial field, and can be used without any particular limitation in the present invention. These include, for example, those having chemical forms such as monomers, prepolymers, that is, dimers, trimers and oligomers, or mixtures thereof and copolymers thereof.
[0069]
Examples of monomers and copolymers thereof include unsaturated carboxylic acids (for example, acrylic acid, methacrylic acid, itaconic acid, crotonic acid, isocrotonic acid, maleic acid, etc.), and esters and amides thereof. In this case, an ester of an unsaturated carboxylic acid and an aliphatic polyhydric alcohol compound, or an amide of an unsaturated carboxylic acid and an aliphatic polyvalent amine compound is used. In addition, unsaturated carboxylic acid ester having a nucleophilic substituent such as hydroxyl group, amino group, mercapto group, amide and monofunctional or polyfunctional isocyanate, addition reaction product of epoxy, monofunctional or A dehydration condensation reaction product with a polyfunctional carboxylic acid is also preferably used.
[0070]
In addition, an unsaturated carboxylic acid ester having an electrophilic substituent such as an isocyanate group or an epoxy group, an addition reaction product of an amide with a monofunctional or polyfunctional alcohol, amine or thiol, halogen A substituted reaction product of an unsaturated carboxylic acid ester or amide with a monofunctional or polyfunctional alcohol, amine or thiol having a leaving group such as a group or a tosyloxy group is also suitable. As another example, it is also possible to use a group of compounds substituted with unsaturated phosphonic acid, styrene, vinyl ether or the like instead of the unsaturated carboxylic acid.
[0071]
For the specific polymerizable compound and other polymerizable compounds, details of how to use such as what kind of structure is used, whether it is used alone, or how much is added, is the final photo or thermosetting resin It can be set arbitrarily according to the performance design. For example, when the light or thermosetting resin of the present invention is used as a recording material for a lithographic printing plate precursor, it is selected from the following viewpoints.
From the viewpoint of sensitivity, a structure having a high unsaturated group content per molecule is preferable, and in many cases, a bifunctional or higher functionality is preferable. Further, in order to increase the strength of the image area, that is, the cured film, those having three or more functionalities are preferable, and compounds having different functional numbers and different polymerizable groups (for example, acrylic ester compounds, methacrylic ester compounds). It is also effective to adjust both sensitivity and film strength by using a combination of styrene compounds and the like. On the other hand, a compound having a large molecular weight or a compound having high hydrophobicity is excellent in sensitivity and film strength, but is not preferable in terms of development speed and precipitation in a developer.
[0072]
In addition, the selection and use method of the above-mentioned polymerizable compound is also important for compatibility and dispersibility with other components in the recording material (for example, binder polymer, radical initiator, colorant, etc. described later). For example, compatibility may be improved by using a low-purity polymerizable compound or using two or more polymerizable compounds in combination. A specific structure may be selected for the purpose of improving the adhesion to a support, an overcoat layer or the like.
[0073]
As for the compounding ratio of the polymerizable compound in the image recording layer, a larger amount is more advantageous in terms of sensitivity, but if it is too much, an undesirable phase separation occurs or a problem in the manufacturing process due to the adhesiveness of the image recording layer. Problems (such as defective production due to transfer and adhesion of recording layer components) and precipitation from the developer may occur.
Furthermore, from the viewpoints of polymerization inhibition with respect to oxygen, resolution, fogging property, refractive index change, etc., an appropriate structure, blending, and addition amount can be arbitrarily selected. A configuration or a coating method can also be selected.
From these viewpoints, the content of the polymerizable compound in the entire recording material composition is preferably 5 to 80% by mass, and more preferably 20 to 75% by mass.
[0074]
[(B) Compound that generates radicals by light or heat]
The light or thermosetting composition of the present invention contains a compound (radical initiator) that generates radicals by light or heat. The radical initiator generates radicals by light and / or heat energy, and initiates polymerization of the above-mentioned (A) specific polymerizable compound, and further, the known polymerizable compound used in combination as desired. Refers to the compound to be promoted. In addition, since the specific polymerizable compound (A) according to the present invention is a polymer compound itself and has a film-forming property, an excellent light or thermosetting composition can be obtained by adding only a radical initiator. Become.
In the present invention, preferred radical initiators include (a) aromatic ketones, (b) onium salt compounds, (c) organic peroxides, (d) thio compounds, (e) hexaarylbiimidazole compounds, f) Ketoxime ester compounds, (g) borate compounds, (h) azinium compounds, (i) metallocene compounds, (j) active ester compounds, (k) compounds having a carbon halogen bond, and the like. Specific examples of the above (a) to (k) are given below, but the present invention is not limited to these.
[0075]
(A) Aromatic ketones
(A) Aromatic ketones preferred as the radical initiator used in the present invention include “RADIATION CURING IN POLYMER SCIENCE AND TECHNOLOGY” P. Fouassier, J. et al. F. Examples include compounds having a benzophenone skeleton or a thioxanthone skeleton described in Rabek (1993), p77-117. For example,
[0076]
Embedded image
[0077]
Is mentioned. Among them, examples of particularly preferred (a) aromatic ketones include α-thiobenzophenone compounds described in JP-B-47-6416, benzoin ether compounds described in JP-B-47-3981, for example, the following compounds.
[0078]
Embedded image
[0079]
Examples of the α-substituted benzoin compounds described in JP-B-47-22326 include the following compounds.
[0080]
Embedded image
[0081]
Examples thereof include benzoin derivatives described in JP-B-47-23664, aroylphosphonic acid esters described in JP-A-57-30704, dialkoxybenzophenones described in JP-B-60-26483, for example, the following compounds.
[0082]
Embedded image
[0083]
Examples of the benzoin ethers described in JP-B-60-26403 and JP-A-62-181345 include the following compounds.
[0084]
Embedded image
[0085]
Examples of the α-aminobenzophenones described in JP-B-1-34242, US Pat. No. 4,318,791, and European Patent 0284561A1, such as the following compounds.
[0086]
Embedded image
[0087]
P-Di (dimethylaminobenzoyl) benzene described in JP-A-2-211452, for example, the following compounds may be mentioned.
[0088]
Embedded image
[0089]
Examples of the thio-substituted aromatic ketone described in JP-A-61-194062 include the following compounds.
[0090]
Embedded image
[0091]
The acylphosphine sulfide described in JP-B-2-9597, for example, the following compounds may be mentioned.
[0092]
Embedded image
[0093]
Examples of the acylphosphine described in JP-B-2-9596 include the following compounds.
[0094]
Embedded image
[0095]
Further, thioxanthones described in JP-B-63-61950, coumarins described in JP-B-59-42864, and the like can also be mentioned.
[0096]
(B) Onium salt compounds
Preferred examples of the onium salt compound (b) as a radical initiator used in the present invention include compounds represented by the following general formulas (1) to (3).
[0097]
Embedded image
[0098]
In formula (1), Ar1And Ar2Each independently represents an aryl group having 20 or less carbon atoms, which may have a substituent. Preferred substituents when this aryl group has a substituent include a halogen atom, a nitro group, an alkyl group having 12 or less carbon atoms, an alkoxy group having 12 or less carbon atoms, or a group having 12 or less carbon atoms. An aryloxy group is mentioned. (Z2)−Represents a counter ion selected from the group consisting of halogen ion, perchlorate ion, carboxylate ion, tetrafluoroborate ion, hexafluorophosphate ion, and sulfonate ion, preferably perchlorate ion, hexafluorophosphine Fate ions and aryl sulfonate ions.
[0099]
In formula (2), Ar3Represents an aryl group having 20 or less carbon atoms which may have a substituent. Preferred examples of the substituent include a halogen atom, a nitro group, an alkyl group having 12 or less carbon atoms, an alkoxy group having 12 or less carbon atoms, an aryloxy group having 12 or less carbon atoms, and 12 or less carbon atoms. Examples thereof include an alkylamino group, a dialkylamino group having 12 or less carbon atoms, an arylamino group having 12 or less carbon atoms, or a diarylamino group having 12 or less carbon atoms. (Z3)−Is (Z2)−Represents a counter ion having the same meaning as.
[0100]
In formula (3), R23, R24And R25These may be the same or different and each represents a hydrocarbon group having 20 or less carbon atoms which may have a substituent. Preferable substituents include a halogen atom, a nitro group, an alkyl group having 12 or less carbon atoms, an alkoxy group having 12 or less carbon atoms, or an aryloxy group having 12 or less carbon atoms. (Z4)−Is (Z2)−Represents a counter ion having the same meaning as.
[0101]
Specific examples of onium salts that can be suitably used in the present invention include those described in paragraphs [0030] to [0033] of Japanese Patent Application No. 11-310623 previously proposed by the present applicant. And those described in paragraphs [0015] to [0046] of Japanese Patent Application No. 2000-160323.
[0102]
The onium salt used in the present invention preferably has a maximum absorption wavelength of 400 nm or less, and more preferably 360 nm or less. By making the absorption wavelength in the ultraviolet region in this way, the lithographic printing plate precursor can be handled under white light.
[0103]
(C) Organic peroxide
The organic peroxide (c) that is preferable as the radical initiator used in the present invention includes almost all organic compounds having one or more oxygen-oxygen bonds in the molecule. Examples thereof include methyl ethyl ketone peroxide. , Cyclohexanone peroxide, 3,3,5-trimethylcyclohexanone peroxide, methylcyclohexanone peroxide, acetylacetone peroxide, 1,1-bis (tertiarybutylperoxy) -3,3,5-trimethylcyclohexane, 1,1 -Bis (tertiary butyl peroxy) cyclohexane, 2,2-bis (tertiary butyl peroxy) butane, tertiary butyl hydroperoxide, cumene hydroperoxide, diisopropylbenzene hydroperoxide , Parameter hydroperoxide, 2,5-dimethylhexane-2,5-dihydroperoxide, 1,1,3,3-tetramethylbutyl hydroperoxide, ditertiary butyl peroxide, tertiary butyl cumyl peroxide , Dicumyl peroxide, bis (tertiarybutylperoxyisopropyl) benzene, 2,5-dimethyl-2,5-di (tertiarybutylperoxy) hexane, 2,5-xanoyl peroxide, peroxysuccinic acid Benzoyl peroxide, 2,4-dichlorobenzoyl peroxide, meta-toluoyl peroxide, diisopropyl peroxydicarbonate, di-2-ethylhexyl peroxydicarbonate, di-2-ethoxyethyl peroxydicarbonate, dimethyl ester Xyisopropyl peroxycarbonate, di (3-methyl-3-methoxybutyl) peroxydicarbonate, tertiary butyl peroxyacetate, tertiary butyl peroxypivalate, tertiary butyl peroxyneodecanoate, tertiary butyl Peroxyoctanoate, tertiary butyl peroxy-3,5,5-trimethylhexanoate, tertiary butyl peroxylaurate, tertiary carbonate, 3,3'4,4'-tetra- (t-butyl Peroxycarbonyl) benzophenone, 3,3′4,4′-tetra- (t-amylperoxycarbonyl) benzophenone, 3,3′4,4′-tetra- (t-hexylperoxycarbonyl) benzophenone, 3, 3'4,4'-tetra- (t -Octylperoxycarbonyl) benzophenone, 3,3'4,4'-tetra- (cumylperoxycarbonyl) benzophenone, 3,3'4,4'-tetra- (p-isopropylcumylperoxycarbonyl) benzophenone, carbonyl Examples include di (t-butylperoxydihydrogen diphthalate) and carbonyldi (t-hexylperoxydihydrogen diphthalate).
[0104]
Among them, 3,3'4,4'-tetra- (t-butylperoxycarbonyl) benzophenone, 3,3'4,4'-tetra- (t-amylperoxycarbonyl) benzophenone, 3,3'4 4'-tetra- (t-hexylperoxycarbonyl) benzophenone, 3,3'4,4'-tetra- (t-octylperoxycarbonyl) benzophenone, 3,3'4,4'-tetra- (cumylper) Peroxyesters such as (oxycarbonyl) benzophenone, 3,3'4,4'-tetra- (p-isopropylcumylperoxycarbonyl) benzophenone, di-t-butyldiperoxyisophthalate are preferred.
[0105]
(D) Thio compound
Preferred examples of the (d) thio compound as a radical initiator used in the present invention include compounds having a structure represented by the following general formula (4).
[0106]
Embedded image
[0107]
(Where R26Represents an alkyl group, an aryl group or a substituted aryl group, and R27Represents a hydrogen atom or an alkyl group. R26And R27Represents a group of nonmetallic atoms necessary to form a 5- to 7-membered ring which may be bonded to each other and contain a heteroatom selected from oxygen, sulfur and nitrogen atoms. )
As an alkyl group in the said General formula (4), a C1-C4 thing is preferable. As the aryl group, those having 6 to 10 carbon atoms such as phenyl and naphthyl are preferable, and as the substituted aryl group, a halogen atom such as a chlorine atom and an alkyl such as a methyl group as described above. And those substituted with an alkoxy group such as a group, a methoxy group, and an ethoxy group. R27Is preferably an alkyl group having 1 to 4 carbon atoms. Specific examples of the thio compound represented by the general formula (4) include the following compounds.
[0108]
Embedded image
[0109]
(E) Hexaarylbiimidazole compound
Preferred (e) hexaarylbiimidazole compounds as radical initiators for use in the present invention include lophine dimers described in JP-B Nos. 45-37377 and 44-86516, such as 2,2′-bis (o- Chlorophenyl) -4,4 ', 5,5'-tetraphenylbiimidazole, 2,2'-bis (o-bromophenyl) -4,4', 5,5'-tetraphenylbiimidazole, 2,2 ' -Bis (o, p-dichlorophenyl) -4,4 ', 5,5'-tetraphenylbiimidazole, 2,2'-bis (o-chlorophenyl) -4,4', 5,5'-tetra (m -Methoxyphenyl) biimidazole, 2,2'-bis (o, o'-dichlorophenyl) -4,4 ', 5,5'-tetraphenylbiimidazole, 2,2'-bis (o Nitrophenyl) -4,4 ', 5,5'-tetraphenylbiimidazole, 2,2'-bis (o-methylphenyl) -4,4', 5,5'-tetraphenylbiimidazole, 2,2 Examples include '-bis (o-trifluorophenyl) -4,4', 5,5'-tetraphenylbiimidazole.
[0110]
(F) Ketoxime ester compounds
Preferred (f) ketoxime ester compounds as radical initiators used in the present invention include 3-benzoyloxyiminobutan-2-one, 3-acetoxyiminobutan-2-one, and 3-propionyloxyiminobutane-2. -One, 2-acetoxyiminopentane-3-one, 2-acetoxyimino-1-phenylpropan-1-one, 2-benzoyloxyimino-1-phenylpropan-1-one, 3-p-toluenesulfonyloxy Iminobutan-2-one, 2-ethoxycarbonyloxyimino-1-phenylpropan-1-one, and the like.
[0111]
(G) Borate compound
Examples of the (g) borate compound preferable as the radical initiator used in the present invention include compounds represented by the following general formula (5).
[0112]
Embedded image
[0113]
(Where R28, R29, R30And R31May be the same as or different from each other, and each may be a substituted or unsubstituted alkyl group, a substituted or unsubstituted aryl group, a substituted or unsubstituted alkenyl group, a substituted or unsubstituted alkynyl group, or a substituted or unsubstituted complex. Represents a cyclic group, R28, R29, R30And R31The two or more groups may combine to form a cyclic structure. However, R28, R29, R30And R31Of these, at least one is a substituted or unsubstituted alkyl group. (Z5)+Represents an alkali metal cation or a quaternary ammonium cation. )
R above28~ R31Examples of the alkyl group include linear, branched, and cyclic groups, and those having 1 to 18 carbon atoms are preferable. Specifically, methyl, ethyl, propyl, isopropyl, butyl, pentyl, hexyl, octyl, stearyl, cyclobutyl, cyclopentyl, cyclohexyl and the like are included. The substituted alkyl group includes an alkyl group as described above, a halogen atom (for example, —Cl, —Br, etc.), a cyano group, a nitro group, an aryl group (preferably a phenyl group), a hydroxy group, —COOR.32(Where R32Represents a hydrogen atom, an alkyl group having 1 to 14 carbon atoms, or an aryl group), -OCOR33Or -OR34(Where R33, R34Represents an alkyl group having 1 to 14 carbon atoms or an aryl group), and those having a substituent represented by the following formula.
[0114]
Embedded image
[0115]
(Where R35, R36Independently represents a hydrogen atom, an alkyl group having 1 to 14 carbon atoms, or an aryl group)
R above28~ R31Examples of the aryl group include 1 to 3 ring aryl groups such as a phenyl group and a naphthyl group. As the substituted aryl group, the aryl group as described above may be substituted with the above-described substituted alkyl group or with 1 carbon atom. Those having ˜14 alkyl groups are included. R above28~ R31Examples of the alkenyl group include linear, branched and cyclic groups having 2 to 18 carbon atoms. Examples of the substituent of the substituted alkenyl group include those exemplified as the substituent of the substituted alkyl group. R above28~ R31Examples of the alkynyl group include linear or branched groups having 2 to 28 carbon atoms, and examples of the substituent of the substituted alkynyl group include those exemplified as the substituent of the substituted alkyl group. In addition, the above R28~ R31Examples of the heterocyclic group include a 5- or more-membered heterocyclic group containing at least one of N, S and O, preferably a 5- to 7-membered heterocyclic group, and this heterocyclic group includes a condensed ring. Also good. Furthermore, you may have what was mentioned as a substituent of the above-mentioned substituted aryl group as a substituent. Specific examples of the compound represented by the general formula (5) are described in US Pat. Nos. 3,567,453 and 4,343,891, European Patents 109,772 and 109,773. Examples include compounds and those shown below.
[0116]
Embedded image
[0117]
(H) Azinium compounds
Preferred (h) azinium salt compounds as radical initiators used in the present invention include JP-A 63-138345, JP-A 63-142345, JP-A 63-142346, and JP-A 63-143537. In addition, a compound group having an N—O bond described in JP-B-46-42363 can be given.
[0118]
(I) Metallocene compound
Preferred (i) metallocene compounds as radical initiators used in the present invention are disclosed in JP 59-152396, JP 61-151197, JP 63-41484, JP 2-249, Examples thereof include titanocene compounds described in Kaihei 2-4705, and iron-arene complexes described in JP-A-1-304453 and JP-A-1-152109.
[0119]
Specific examples of the titanocene compound include di-cyclopentadienyl-Ti-di-chloride, di-cyclopentadienyl-Ti-bis-phenyl, and di-cyclopentadienyl-Ti-bis-2,3. 4,5,6-pentafluorophen-1-yl, di-cyclopentadienyl-Ti-bis-2,3,5,6-tetrafluorophen-1-yl, di-cyclopentadienyl-Ti- Bis-2,4,6-trifluorophen-1-yl, di-cyclopentadienyl-Ti-2,6-difluorophen-1-yl, di-cyclopentadienyl-Ti-bis-2,4 -Difluorophen-1-yl, di-methylcyclopentadienyl-Ti-bis-2,3,4,5,6-pentafluorophen-1-yl, di-methylcyclopentadienyl-Ti- -2,3,5,6-tetrafluorophen-1-yl, di-methylcyclopentadienyl-Ti-bis-2,4-difluorophen-1-yl, bis (cyclopentadienyl) -bis (2,6-difluoro-3- (pyridin-1-yl) phenyl) titanium bis (cyclopentadienyl) bis [2,6-difluoro-3- (methylsulfonamido) phenyl] titanium, bis (cyclopentadi Enyl) bis [2,6-difluoro-3- (N-butylbialoyl-amino) phenyl] titanium,
[0120]
Bis (cyclopentadienyl) bis [2,6-difluoro-3- (N-butyl- (4-chlorobenzoyl) amino) phenyl] titanium, bis (cyclopentadienyl) bis [2,6-difluoro-3 -(N-benzyl-2,2-dimethylpentanoylamino) phenyl] titanium, bis (cyclopentadienyl) bis [2,6-difluoro-3- (N- (2-ethylhexyl) -4-tolyl-sulfonyl] ) Amino) phenyl] titanium, bis (cyclopentadienyl) bis [2,6-difluoro-3- (N- (3-oxaheptyl) benzoylamino) phenyl] titanium, bis (cyclopentadienyl) bis [2 , 6-Difluoro-3- (N- (3,6-dioxadecyl) benzoylamino) phenyl] titanium, bis (cyclopentadienyl) bi [2,6-difluoro-3- (trifluoromethylsulfonyl) amino) phenyl] titanium, bis (cyclopentadienyl) bis [2,6-difluoro-3- (trifluoroacetyl) phenyl] titanium,
[0121]
Bis (cyclopentadienyl) bis [2,6-difluoro-3- (2-chlorobenzoyl) amino) phenyl] titanium, bis (cyclopentadienyl) bis [2,6-difluoro-3- (4-chloro Benzoyl) amino) phenyl] titanium, bis (cyclopentadienyl) bis [2,6-difluoro-3- (N- (3,6-dioxadecyl) -2,2-dimethylpentanoylamino) phenyl] titanium, bis (Cyclopentadienyl) bis [2,6-difluoro-3- (N- (3,7-dimethyl-7-methoxyoctyl) benzoylamino) phenyl] titanium, bis (cyclopentadienyl) bis [2,6 -Difluoro-3- (N-cyclohexylbenzoylamino) phenyl] titanium and the like.
[0122]
(J) Active ester compound
Preferred (j) active ester compounds as radical initiators used in the present invention include imide sulfonate compounds described in JP-B-62-2223, active sulfonates described in JP-B-63-14340, and JP-A-59-174831. I can give you.
[0123]
(K) Compound having carbon halogen bond
Examples of the compound (k) having a carbon halogen bond that is preferable as the radical initiator used in the present invention include those represented by the following general formulas (6) to (12).
[0124]
Embedded image
[0125]
(Where X2Is a halogen atom, Y1Is -C (X2)3, -NH2, -NHR38, -NR38, -OR38Represents. Where R38Represents an alkyl group, a substituted alkyl group, an aryl group, or a substituted aryl group. Also R37Is -C (X2)3Represents an alkyl group, a substituted alkyl group, an aryl group, a substituted aryl group, or a substituted alkenyl group. )
[0126]
Embedded image
[0127]
(However, R39Is an alkyl group, substituted alkyl group, alkenyl group, substituted alkenyl group, aryl group, substituted aryl group, halogen atom, alkoxy group, substituted alkoxyl group, nitro group or cyano group, and X3Is a halogen atom, and n is an integer of 1 to 3. )
[0128]
Embedded image
[0129]
(However, R40Is an aryl group or a substituted aryl group, R41Is a group or halogen shown below, Z6Is —C (═O) —, —C (═S) — or —SO.2-And X3Is a halogen atom, and m is 1 or 2. )
[0130]
Embedded image
[0131]
(R42, R43Is an alkyl group, a substituted alkyl group, an alkenyl group, a substituted alkenyl group, an aryl group or a substituted aryl group, and R44Is R in the general formula (6)38Is the same. )
[0132]
Embedded image
[0133]
(However, in the formula, R45Is an optionally substituted aryl or heterocyclic group, R46Is a trihaloalkyl group or trihaloalkenyl group having 1 to 3 carbon atoms, and p is 1, 2 or 3. )
[0134]
Embedded image
[0135]
(Formula (10) represents a carbonylmethylene heterocyclic compound having a trihalogenomethyl group. L7Is a hydrogen atom or the formula: CO- (R47) Q (C (X4)3) R substituent, Q2Is a sulfur, selenium or oxygen atom, a dialkylmethylene group, an alkene-1,2-ylene group, a 1,2-phenylene group or an N—R group;4Is a substituted or unsubstituted alkylene group or alkenylene group, or a 1,2-arylene group, R48Is an alkyl group, an aralkyl group or an alkoxyalkyl group, and R47Is a carbocyclic or heterocyclic divalent aromatic group, X4Is a chlorine, bromine or iodine atom, q = 0 and r = 1, or q = 1 and r = 1 or 2. )
[0136]
Embedded image
[0137]
(Formula (11) represents a 4-halogeno-5- (halogenomethyl-phenyl) -oxazole derivative. X5Is a halogen atom, t is an integer of 1-3, s is an integer of 1-4, R49Is a hydrogen atom or CH3-tX5 tR and R50Is an s-valent unsaturated organic group which may be substituted. )
[0138]
Embedded image
[0139]
(Formula (12) represents a 2- (halogenomethyl-phenyl) -4-halogeno-oxazole derivative. X6Is a halogen atom, v is an integer of 1-3, u is an integer of 1-4, R51Is a hydrogen atom or CH3-vX6 vR and R52Is an u-valent unsaturated organic group which may be substituted. )
[0140]
Specific examples of such a compound having a carbon-halogen bond include those described in Wakabayashi et al., Bull. Chem. Soc. Japan, 42, 2924 (1969), such as 2-phenyl 4,6-bis (trichloromethyl) -S-triazine, 2- (p-chlorophenyl) -4,6-bis (trichloromethyl)- S-triazine, 2- (p-tolyl) -4,6-bis (trichloromethyl) -S-triazine, 2- (p-methoxyphenyl) -4,6-bis (trichloromethyl) -S-triazine, 2 -(2 ', 4'-dichlorophenyl) -4,6-bis (trichloromethyl) -S-triazine, 2,4,6-tris (trichloromethyl) -S-triazine, 2-methyl-4,6 -Bis (trichloromethyl) -S-triazine, 2-n-nonyl-4,6-bis (trichloromethyl) -S-triazine, 2- (α, α, β-trichloroethyl) -4,6 Bis (trichloromethyl) -S- triazine. In addition, compounds described in British Patent 1388492, for example, 2-styryl-4,6-bis (trichloromethyl) -S-triazine, 2- (p-methylstyryl) -4,6-bis (trichloromethyl) -S-triazine, 2- (p-methoxystyryl) -4,6-bis (trichloromethyl) -S-triazine, 2- (p-methoxystyryl) -4-amino-6-trichloromethyl-S-triazine, etc. And compounds described in JP-A-53-133428, such as 2- (4-methoxy-naphth-1-yl) -4,6-bis-trichloromethyl-S-triazine, 2- (4-ethoxy-naphtho) 1-yl) -4,6-bis-trichloromethyl-S-triazine, 2- [4- (2-ethoxyethyl) -naphth-1-yl] -4,6-bis-trick Rumethyl-S-triazine, 2- (4,7-dimethoxy-naphth-1-yl) -4,6-bis-trichloromethyl-S-triazine), 2- (acenaphtho-5-yl) -4,6- Examples include compounds described in German Patent No. 3333724, such as bis-trichloromethyl-S-triazine, and the like.
[0141]
Embedded image
[0142]
F.F. C. J. Schaefer et al. Org. Chem. 29, 1527 (1964), such as 2-methyl-4,6-bis (tribromomethyl) -S-triazine, 2,4,6-tris (tribromomethyl) -S-triazine, 2,4 , 6-tris (dibromomethyl) -S-triazine, 2-amino-4-methyl-6-tribromomethyl-S-triazine, 2-methoxy-4-methyl-6-trichloromethyl-S-triazine, etc. Can do. Furthermore, for example, the following compounds described in JP-A-62-258241 can be exemplified.
[0143]
Embedded image
[0144]
Furthermore, for example, the following compounds described in JP-A-5-281728 can be mentioned.
[0145]
Embedded image
[0146]
Or even more P. Hutt, E .; F. Elslager and L.L. M.M. The following compounds that can be easily synthesized by those skilled in the art according to the synthesis methods described in Herbel, “Journalof Heterocyclic Chemistry”, Volume 7 (No. 3), pages 511 et seq. (1970) Examples of the group include the following compounds.
[0147]
Embedded image
[0148]
(L) Azo compounds
Preferred (i) azo compounds as radical initiators used in the present invention include 2,2′-azobisisobutyronitrile, 2,2′-azobispropionitrile, 1,1′-azobis (cyclohexane). -1-carbonitrile), 2,2′-azobis (2-methylbutyronitrile), 2,2′-azobis (2,4-dimethylvaleronitrile), 2,2′-azobis (4-methoxy-2) , 4-dimethylvaleronitrile), 4,4′-azobis (4-cyanovaleric acid), dimethyl 2,2′-azobisisobutyrate, 2,2′-azobis (2-methylpropionamidooxime), 2,2 ′ -Azobis [2- (2-imidazolin-2-yl) propane], 2,2'-azobis {2-methyl-N- [1,1-bis (hydroxymethyl) -2-hydroxyethyl ] Propionamide}, 2,2′-azobis [2-methyl-N- (2-hydroxyethyl) propionamide], 2,2′-azobis (N-butyl-2-methylpropionamide), 2,2 ′ -Azobis (N-cyclohexyl-2-methylpropionamide), 2,2'-azobis [N- (2-propenyl) -2-methylpropionamide], 2,2'-azobis (2,4,4-trimethyl) Pentane) and the like.
[0149]
Still more preferred examples of the radical initiator in the present invention include the above-mentioned (a) aromatic ketones, (b) onium salt compounds, (c) organic peroxides, (e) hexaarylbiimidazole compounds, (i) ) Metallocene compounds, (k) compounds having a carbon halogen bond, and the most preferred examples include aromatic iodonium salts, aromatic sulfonium salts, titanocene compounds, and trihalomethyl represented by the general formula (6) -S-triazine compounds can be mentioned.
[0150]
These radical initiators are in a proportion of 0.1 to 50% by weight, preferably 0.5 to 30% by weight, particularly preferably 5 to 20% by weight, based on the total solid content of the light or thermosetting composition. Can be added to the light or thermosetting composition.
The radical initiator in the present invention is preferably used alone or in combination of two or more.
[0151]
[(C) Sensitizing dye]
It is preferable to add a sensitizing dye that absorbs light of a predetermined wavelength to the light or thermosetting composition of the present invention. Exposure to a wavelength that can be absorbed by the sensitizing dye promotes the radical generation reaction of the radical initiator and the polymerization reaction of the specific polymerizable compound. Examples of such sensitizing dyes include known spectral sensitizing dyes or dyes or pigments that absorb light and interact with a photo radical initiator. Depending on the wavelength of light absorbed by the sensitizing dye, the light or thermosetting composition of the present invention becomes a composition sensitive to various wavelengths from ultraviolet rays to visible rays and infrared rays.
[0152]
<Spectral sensitizing dye or dye>
Spectral sensitizing dyes or dyes preferred as sensitizing dyes for use in the present invention include polynuclear aromatics (eg, pyrene, perylene, triphenylene), xanthenes (eg, fluorescein, eosin, erythrosine, rhodamine B, rose bengal). ), Cyanines (eg, thiacarbocyanine, oxacarbocyanine), merocyanines (eg, merocyanine, carbomerocyanine), thiazines (eg, thionine, methylene blue, toluidine blue), acridines (eg, acridine orange, chloroflavin) , Acriflavine), phthalocyanines (eg, phthalocyanine, metal phthalocyanine), porphyrins (eg, tetraphenylporphyrin, central metal-substituted porphyrin), chlorophylls (eg, chlorophyll) , Chlorophyllin, center metal-substituted chlorophyll), metal complexes, anthraquinones, such as (anthraquinone), squaryliums, for example (squarylium), for example, the following compounds.
[0153]
Embedded image
[0154]
Examples of more preferable spectral sensitizing dyes or dyes are styryl dyes described in JP-B-37-13034, for example,
[0155]
Embedded image
[0156]
Cationic dyes described in JP-A-62-143044, such as
[0157]
Embedded image
[0158]
Quinoxalinium salts described in JP-B-59-24147, for example,
[0159]
Embedded image
[0160]
New methylene blue compounds described in JP-A No. 64-33104, for example,
[0161]
Embedded image
[0162]
Anthraquinones described in JP-A No. 64-56767, for example,
[0163]
Embedded image
[0164]
Benzoxanthene dyes described in JP-A-2-17114, acridines described in JP-A-2-226148 and JP-A-2-226149, for example,
[0165]
Embedded image
[0166]
Pyrylium salts described in Japanese Patent Publication No. 40-28499, for example,
[0167]
Embedded image
[0168]
Cyanines described in JP-B-46-42363, for example,
[0169]
Embedded image
[0170]
Benzofuran dyes described in JP-A-2-63053, for example,
[0171]
Embedded image
[0172]
Conjugated ketone dyes disclosed in JP-A-2-85858 and JP-A-2-216154, for example,
[0173]
Embedded image
[0174]
A dye described in JP-A No. 57-10605, an azocinnamylidene derivative described in JP-B-2-30321, for example,
[0175]
Embedded image
[0176]
Cyanine dyes described in JP-A-1-287105, for example,
[0177]
Embedded image
[0178]
Xanthene dyes described in JP-A-62-31844, JP-A-62-31848, JP-A-62-143043, for example,
[0179]
Embedded image
[0180]
Aminostyryl ketone described in JP-B-59-28325, for example,
[0181]
Embedded image
[0182]
Dyes represented by the following general formulas (13) to (15) described in JP-A-2-179634;
[0183]
Embedded image
[0184]
(Where A3Represents an oxygen atom, a sulfur atom, a selenium atom, a tellurium atom, an alkyl or aryl substituted nitrogen atom or a dialkyl substituted carbon atom;2Represents a hydrogen atom, an alkyl group, a substituted alkyl group, an aryl group, a substituted aryl group, an aralkyl group, an acyl group, or a substituted alkoxycarbonyl group;53, R54Is a hydrogen atom, an alkyl group having 1 to 18 carbon atoms, or —OR as a substituent.55,-(CH2CH2O)w-R55, A halogen atom (F, Cl, Br, I), and a substituted alkyl group having 1 to 18 carbon atoms having a group represented by the following formula (where R55Represents a hydrogen atom or an alkyl group having 1 to 10 carbon atoms;1Represents a dialkylamino group, a hydroxyl group, an acyloxy group, a halogen atom, or a nitro group. w represents an integer of 0 to 4; )
[0185]
Embedded image
[0186]
Merocyanine dyes represented by the following general formula (16) described in JP-A-2-244050,
[0187]
Embedded image
[0188]
(Wherein R56And R57Each independently represents a hydrogen atom, an alkyl group, a substituted alkyl group, an alkoxycarbonyl group, an aryl group, a substituted aryl group or an aralkyl group. A4Represents an oxygen atom, a sulfur atom, a selenium atom, a tellurium atom, an alkyl or aryl-substituted nitrogen atom, or a dialkyl-substituted carbon atom. X7Represents a group of nonmetallic atoms necessary to form a nitrogen-containing hetero five-membered ring. Y3Represents a substituted phenyl group, an unsubstituted or substituted polynuclear aromatic ring, or an unsubstituted or substituted heteroaromatic ring. Z7Represents a hydrogen atom, an alkyl group, a substituted alkyl group, an aryl group, a substituted aryl group, an aralkyl group, an alkoxy group, an alkylthio group, an arylthio group, a substituted amino group, an acyl group, or an alkoxycarbonyl group;3And may be bonded to each other to form a ring. Preferred specific examples include the following compounds)
[0189]
Embedded image
[0190]
Merocyanine dyes represented by the following general formula (17) described in JP-B-59-28326,
[0191]
Embedded image
[0192]
(Wherein R58And R59Each represents a hydrogen atom, an alkyl group, a substituted alkyl group, an aryl group, a substituted aryl group or an aralkyl group, which may be the same or different from each other. X8Represents a substituent having a Hammett sigma (σ) value in the range of −0.9 to +0.5)
[0193]
A merocyanine dye represented by the following general formula (18) described in JP-A-59-89303,
[0194]
Embedded image
[0195]
[(R in the formula60And R61Each independently represents a hydrogen atom, an alkyl group, a substituted alkyl group, an aryl group, a substituted aryl group or an aralkyl group. X9Represents a substituent having a Hammett's sigma (σ) value in the range of −0.9 to +0.5. Y4Represents a hydrogen atom, an alkyl group, a substituted alkyl group, an aryl group, a substituted aryl group, an aralkyl group, an acyl group or an alkoxycarbonyl group. Preferred examples include the following compounds:
[0196]
Embedded image
[0197]
A merocyanine dye represented by the following general formula (19) described in Japanese Patent Application No. 6-269047;
[0198]
Embedded image
[0199]
[(In the formula, R62, R63, R64, R65, R70, R71, R72, R73Are each independently a hydrogen atom, halogen atom, alkyl group, substituted alkyl group, aryl group, substituted aryl group, hydroxyl group, substituted oxy group, mercapto group, substituted thio group, amino group, substituted amino group, substituted carbonyl group , Sulfo group, sulfonate group, substituted sulfinyl group, substituted sulfonyl group, phosphono group, substituted phosphono group, phosphonate group, substituted phosphonate group, cyano group, nitro group, or R62And R63, R63And R64, R64And R65, R70And R71, R71And R72, R72And R73May be bonded to each other to form an aliphatic or aromatic ring, and R66Represents a hydrogen atom, an alkyl group, a substituted alkyl group, an aryl group, or a substituted aryl group, and R67Represents a substituted or unsubstituted alkenylalkyl group, or a substituted or unsubstituted alkynylalkyl group, R68, R69Each independently represents a hydrogen atom, a halogen atom, an alkyl group, a substituted alkyl group, an aryl group, a substituted aryl group, or a substituted carbonyl group). Preferred specific examples include the following compounds:
[0200]
Embedded image
[0201]
A benzopyran dye represented by the following general formula (20) described in Japanese Patent Application No. 7-164583;
[0202]
Embedded image
[0203]
(Wherein R74~ R77Independently denote a hydrogen atom, a halogen atom, an alkyl group, an aryl group, a hydroxyl group, an alkoxy group or an amino group. Also R74~ R77May form a ring composed of nonmetallic atoms together with carbon atoms to which they can be bonded. R78Represents a hydrogen atom, an alkyl group, an aryl group, a heteroaromatic group, a cyano group, an alkoxy group, a carboxy group or an alkenyl group. R79Is R78Or a group represented by -Z7-R78And Z7Represents a carbonyl group, a sulfonyl group, a sulfinyl group or an arylene carbonyl group. Also R78And R79Both may form a ring composed of nonmetallic atoms. A5Represents an O atom, an S atom, NH or an N atom having a substituent. B2Is an O atom or = C (G7) (G8) Group. G7, G8May be the same or different and each represents a hydrogen atom, a cyano group, an alkoxycarbonyl group, an aryloxycarbonyl group, an acyl group, an arylcarbonyl group, an alkylthio group, an arylthio group, an alkylsulfonyl group, an arylsulfonyl group, or a fluorosulfonyl group. Represent. However, G7, G8Do not become hydrogen atoms at the same time. G7And G8May form a ring composed of a nonmetallic atom together with a carbon atom. And the like.
[0204]
In addition, the following infrared absorbers (dyes or pigments) are also preferably used as sensitizing dyes. Preferred examples of the dye include cyanine dyes described in JP-A-58-125246, JP-A-59-84356, JP-A-59-202829, JP-A-60-78787, and the like. Examples include cyanine dyes described in Japanese Patent No. 434,875.
[0205]
Further, near infrared absorption sensitizers described in US Pat. No. 5,156,938 are also preferably used, and further substituted aryl benzoates described in US Pat. No. 3,881,924 are also used. (Thio) pyrylium salt, trimethine thiapyrylium salt described in JP-A-57-142645 (US Pat. No. 4,327,169), JP-A 58-181051, 58-220143, 59 -41363, 59-84248, 59-84249, 59-146063, 59-146061, pyranyl compounds described in JP-A-59-216146, cyanine dyes described in US The pentamethine thiopyrylium salt described in Japanese Patent No. 4,283,475, and the like described in Japanese Patent Publication Nos. 5-13514 and 5-19702 That pyrylium compounds are also preferably used.
[0206]
In addition, the near-infrared absorbing dyes described as formulas (I) and (II) in US Pat. No. 4,756,993 and the phthalocyanine dyes described in EP 916513A2 are also preferable dyes. Can do.
[0207]
Furthermore, the anionic infrared absorber described in Japanese Patent Application No. 10-79912 can also be suitably used. An anionic infrared absorbing agent refers to an anionic infrared absorbing agent having an anionic structure without a cationic structure in the mother nucleus of a dye that substantially absorbs infrared rays. Examples include (a) anionic metal complexes, (b) anionic carbon black, (c) anionic phthalocyanine, and (d) compounds represented by the following general formula (21). The counter cation of these anionic infrared absorbers is a monovalent cation containing a proton or a polyvalent cation.
[0208]
Embedded image
[0209]
Here, (a) an anionic metal complex refers to an anion that is an anion of the central metal and the entire ligand of the complex part that substantially absorbs light.
[0210]
(B) Examples of the anionic carbon black include carbon black to which anionic groups such as sulfonic acid, carboxylic acid, and phosphonic acid groups are bonded as substituents. In order to introduce these groups into carbon black, as described in Carbon Black Handbook 3rd Edition (Edited by Carbon Black Association, April 5, 1995, published by Carbon Black Association), page 12, What is necessary is just to take means, such as oxidizing carbon black.
[0211]
(C) Anionic phthalocyanine refers to a phthalocyanine skeleton having the anion group previously mentioned in the description of (b) as a substituent bonded to form an anion as a whole.
[0212]
Next, (d) the compound represented by the general formula (21) will be described in detail. In the general formula (21), G9Represents an anionic substituent and G10Represents a neutral substituent. (X10)+Represents a 1 to m-valent cation containing a proton, and m represents an integer of 1 to 6. M5Represents a conjugated chain, and this conjugated chain M5May have a substituent or a ring structure. Conjugated chain M5Can be represented by the following formula.
[0213]
Embedded image
[0214]
Where R80, R81, R82Each independently represents a hydrogen atom, halogen atom, cyano group, alkyl group, aryl group, alkenyl group, alkynyl group, carbonyl group, thio group, sulfonyl group, sulfinyl group, oxy group, amino group, which are linked to each other. Thus, a ring structure may be formed. n represents an integer of 1 to 8.
[0215]
Of the anionic infrared absorbers represented by the general formula (21), those of the following IRA-1 to IRA-5 are preferably used.
[0216]
Embedded image
[0217]
Moreover, the cationic infrared absorber shown to the following IRC-1-IRC-44 can also be used preferably.
[0218]
Embedded image
[0219]
Embedded image
[0220]
Embedded image
[0221]
Embedded image
[0222]
Embedded image
[0223]
Embedded image
[0224]
Embedded image
[0225]
Embedded image
[0226]
Embedded image
[0227]
In the structural formula, T−Represents a monovalent counter anion, preferably a halogen anion (F-, Cl-, Br-, I-), a Lewis acid anion (BF4-, PF6-, SbCl6-, ClO4-), An alkyl sulfonate anion, and an aryl sulfonate anion.
[0228]
The alkyl of the alkyl sulfonic acid means a linear, branched or cyclic alkyl group having 1 to 20 carbon atoms, specifically, a methyl group, an ethyl group, a propyl group, a butyl group. , Pentyl, hexyl, heptyl, octyl, nonyl, decyl, undecyl, dodecyl, tridecyl, hexadecyl, octadecyl, eicosyl, isopropyl, isobutyl, s-butyl, t- A butyl group, isopentyl group, neopentyl group, 1-methylbutyl group, isohexyl group, 2-ethylhexyl group, 2-methylhexyl group, cyclohexyl group, cyclopentyl group, and 2-norbornyl group can be exemplified. Of these, linear alkyl groups having 1 to 12 carbon atoms, branched alkyl groups having 3 to 12 carbon atoms, and cyclic alkyl groups having 5 to 10 carbon atoms are more preferable.
[0229]
The aryl of the aryl sulfonic acid includes one consisting of one benzene ring, two or three benzene rings forming a condensed ring, and one having a benzene ring and a 5-membered unsaturated ring forming a condensed ring. Specific examples thereof include a phenyl group, a naphthyl group, an anthryl group, a phenanthryl group, an indenyl group, an acenabutenyl group, and a fluorenyl group. Among these, a phenyl group and a naphthyl group are more preferable.
[0230]
Moreover, the nonionic infrared absorber shown to the following IRN-1-IRN-9 can also be used preferably.
[0231]
Embedded image
[0232]
Embedded image
[0233]
Embedded image
[0234]
Among the exemplified compounds, IRA-1 is a particularly preferable anionic infrared absorber, and IRC-7, IRC-30, IRC-40, and IRC-42 are nonionic infrared absorbers as cationic infrared absorbers. As IRN-9.
[0235]
<Pigment>
Examples of the pigment used in the present invention include commercially available pigments and color index (CI) manual, “Latest Pigment Handbook” (edited by Japan Pigment Technology Association, published in 1977), “Latest Pigment Application Technology” (CMC Publishing, 1986), “Printing Ink Technology”, CMC Publishing, 1984) can be used.
[0236]
Examples of the pigment include black pigments, yellow pigments, orange pigments, brown pigments, red pigments, purple pigments, blue pigments, green pigments, fluorescent pigments, metal powder pigments, and other polymer-bonded dyes. Specifically, insoluble azo pigments, azo lake pigments, condensed azo pigments, chelate azo pigments, phthalocyanine pigments, anthraquinone pigments, perylene and perinone pigments, thioindigo pigments, quinacridone pigments, dioxazine pigments, isoindolinone pigments In addition, quinophthalone pigments, dyed lake pigments, azine pigments, nitroso pigments, nitro pigments, natural pigments, fluorescent pigments, inorganic pigments, carbon black, and the like can be used. Among these pigments, carbon black is preferable.
[0237]
These pigments may be used without surface treatment, or may be used after surface treatment. The surface treatment method includes a method of surface coating with a resin or wax, a method of attaching a surfactant, a method of bonding a reactive substance (eg, silane coupling agent, epoxy compound, polyisocyanate, etc.) to the pigment surface, etc. Can be considered. The above-mentioned surface treatment methods are described in “Characteristics and Applications of Metal Soap” (Shobobo), “Printing Ink Technology” (CMC Publishing, 1984) and “Latest Pigment Application Technology” (CMC Publishing, 1986). Yes.
[0238]
The particle size of the pigment is preferably in the range of 0.01 μm to 10 μm, more preferably in the range of 0.05 μm to 1 μm, and particularly preferably in the range of 0.1 μm to 1 μm. When the particle diameter of the pigment is less than 0.01 μm, it is not preferable from the viewpoint of stability of the dispersion in the image recording layer coating solution, and when it exceeds 10 μm, it is not preferable from the viewpoint of uniformity of the image recording layer.
[0239]
As a method for dispersing the pigment, a known dispersion technique used in ink production, toner production, or the like can be used. Examples of the disperser include an ultrasonic disperser, a sand mill, an attritor, a pearl mill, a super mill, a ball mill, an impeller, a disperser, a KD mill, a colloid mill, a dynatron, a three-roll mill, and a pressure kneader. Details are described in "Latest Pigment Applied Technology" (CMC Publishing, 1986).
[0240]
Note that the sensitizing dye added to accelerate the curing reaction of the light or thermosetting composition of the present invention may be added directly to the composition together with other components, but another layer adjacent thereto. The same effect can be obtained even if it is provided and added thereto.
In particular, when the photo or thermosetting composition of the present invention is used in a negative image recording layer of a lithographic printing plate precursor described later, it may be added to the same layer of the image recording layer, or another layer may be added. However, when a negative type image recording material is prepared, the optical density at the absorption maximum in the wavelength range of 300 nm to 1200 nm of the recording layer is between 0.1 and 3.0. Preferably there is. When this range is deviated, the sensitivity tends to be low. Since the optical density is determined by the addition amount of the sensitizing dye and the thickness of the recording layer, the predetermined optical density can be obtained by controlling both conditions. The optical density of the recording layer can be measured by a conventional method. As a measuring method, for example, on a transparent or white support, a recording layer having a thickness appropriately determined in a range where the coating amount after drying is necessary as a lithographic printing plate is formed, and a transmission optical densitometer is used. Examples thereof include a measuring method, a method of forming a recording layer on a reflective support such as aluminum, and measuring a reflection density.
[0241]
[(D) Binder polymer]
In the light or thermosetting composition of the present invention, (D) a binder polymer can be used as needed for the purpose of improving film properties. It is preferable to use a linear organic polymer as the binder polymer. As such a “linear organic polymer”, a known one can be arbitrarily used. Preferably, a linear organic polymer that is soluble or swellable in water or weak alkaline water is selected to enable water development or weak alkaline water development. The linear organic polymer is selected and used not only as a film-forming agent for an image recording material but also according to its use as water, weak alkaline water or an organic solvent developer. For example, when a water-soluble organic polymer is used, water development is possible. Examples of such linear organic polymers include radical polymers having a carboxylic acid group in the side chain, such as JP-A-59-44615, JP-B-54-34327, JP-B-58-12777, and JP-B-54-25957. , JP 54-92723, JP 59-53836, JP 59-71048, ie, methacrylic acid copolymer, acrylic acid copolymer, itaconic acid copolymer. Examples thereof include a polymer, a crotonic acid copolymer, a maleic acid copolymer, and a partially esterified maleic acid copolymer. Similarly, there is an acidic cellulose derivative having a carboxylic acid group in the side chain. In addition, those obtained by adding a cyclic acid anhydride to a polymer having a hydroxyl group are useful.
[0242]
Among these, a (meth) acrylic resin having a benzyl group or an allyl group and a carboxyl group in the side chain and an alkali-soluble resin having a double bond in the side chain described in JP-A No. 2000-187322 are particularly mentioned. It is excellent in the balance of film strength, sensitivity and developability, and is suitable.
[0243]
In addition, Japanese Patent Publication No. 7-2004, Japanese Patent Publication No. 7-120041, Japanese Patent Publication No. 7-120042, Japanese Patent Publication No. 8-12424, Japanese Patent Laid-Open No. 63-287944, Japanese Patent Laid-Open No. 63-287947, Japanese Patent Laid-Open No. Urethane-based binder polymers containing acid groups described in Japanese Patent No. 271741 and Japanese Patent Application No. 10-116232 are very excellent in strength, and are advantageous in terms of printing durability and suitability for low exposure.
[0244]
In addition, polyvinyl pyrrolidone, polyethylene oxide, and the like are useful as the water-soluble linear organic polymer. In order to increase the strength of the cured film, alcohol-soluble nylon, polyether of 2,2-bis- (4-hydroxyphenyl) -propane and epichlorohydrin, and the like are also useful.
[0245]
The weight average molecular weight of the polymer used in the present invention is preferably 5000 or more, more preferably in the range of 10,000 to 300,000, and the number average molecular weight is preferably 1000 or more, more preferably 2000 to 2000 The range is 250,000. The polydispersity (weight average molecular weight / number average molecular weight) is preferably 1 or more, and more preferably 1.1 to 10.
These polymers may be random polymers, block polymers, graft polymers or the like, but are preferably random polymers.
[0246]
The polymer used in the present invention can be synthesized by a conventionally known method. Examples of the solvent used in the synthesis include tetrahydrofuran, ethylene dichloride, cyclohexanone, methyl ethyl ketone, acetone, methanol, ethanol, ethylene glycol monomethyl ether, ethylene glycol monoethyl ether, 2-methoxyethyl acetate, diethylene glycol dimethyl ether, 1-methoxy. Examples include 2-propanol, 1-methoxy-2-propyl acetate, N, N-dimethylformamide, N, N-dimethylacetamide, toluene, ethyl acetate, methyl lactate, ethyl lactate, dimethyl sulfoxide, and water. These solvents are used alone or in combination of two or more.
As the radical polymerization initiator used for synthesizing the polymer used in the present invention, known compounds such as azo initiators and peroxide initiators can be used.
[0247]
The binder polymer used in the present invention may be used alone or in combination. When the light or thermosetting composition of the present invention is used as a recording material for a lithographic printing plate precursor, the amount of these binder polymers added is 20 to 95% by mass, preferably 30 to 30%, based on the total solid content of the image recording material. 90% by mass is added. When the addition amount is less than 20% by mass, the effect of improving the strength of the image portion cannot be sufficiently obtained when an image is formed. If the amount added exceeds 95% by mass, no image is formed. Moreover, it is preferable that the compound which has an ethylenically unsaturated double bond which can be radically polymerized, and a linear organic polymer shall be 1 / 9-7 / 3 by mass ratio.
The light or thermosetting composition of the present invention obtained as described above is excellent in sensitivity, storage stability, printing durability, and developability. Particularly, the printing durability is remarkably improved by performing a burning treatment. It is suitably used as a recording material for a negative lithographic printing plate precursor.
[0248]
[Application to lithographic printing plate precursor]
When the light or thermosetting composition of the present invention is used as a recording material for a lithographic printing plate precursor, it is produced by dissolving the light or thermosetting composition in a solvent and applying the solution on a suitable support. be able to. Depending on the purpose, various additives, a protective layer, a resin intermediate layer, a backcoat layer, and the like described later can be formed in the same manner.
[0249]
In the light or thermosetting composition of the present invention, a dye having a large absorption in the visible light region can be used as an image colorant. Specifically, Oil Yellow # 101, Oil Yellow # 103, Oil Pink # 312, Oil Green BG, Oil Blue BOS, Oil Blue # 603, Oil Black BY, Oil Black BS, Oil Black T-505 (orientated chemistry) Manufactured by Kogyo Co., Ltd.), Victoria Pure Blue, Crystal Violet (CI42555), Methyl Violet (CI42535), Ethyl Violet, Rhodamine B (CI145170B), Malachite Green (CI42000), Methylene Blue (CI522015), etc., and JP-A-62-2 And dyes described in No. 293247. In addition, pigments such as phthalocyanine pigments, azo pigments, carbon black, and titanium oxide can also be suitably used.
[0250]
These colorants are preferably added since it is easy to distinguish an image area from a non-image area after image formation. The added amount is 0.01 to 10% by mass with respect to the total solid content of the recording layer coating solution.
[0251]
Further, in the present invention, it is desirable to add a small amount of a thermal polymerization inhibitor in order to prevent unnecessary thermal polymerization of the polymerizable compound during the preparation or storage of the light or thermosetting composition. Suitable thermal polymerization inhibitors include hydroquinone, p-methoxyphenol, di-t-butyl-p-cresol, pyrogallol, t-butylcatechol, benzoquinone, 4,4'-thiobis (3-methyl-6-t-butylphenol ), 2,2'-methylenebis (4-methyl-6-t-butylphenol), N-nitroso-N-phenylhydroxylamine aluminum salt and the like. The addition amount of the thermal polymerization inhibitor is preferably about 0.01% by mass to about 5% by mass with respect to the mass of the entire composition. If necessary, higher fatty acid derivatives such as behenic acid and behenic acid amide may be added to prevent polymerization inhibition due to oxygen and may be unevenly distributed on the surface of the recording layer in the course of drying after coating. . The amount of the higher fatty acid derivative added is preferably about 0.1% by mass to about 10% by mass of the total composition.
[0252]
The photo- or thermosetting composition of the present invention is mainly used for forming a recording layer of a lithographic printing plate precursor. Nonionic surfactants as described in JP-A-62-251740 and JP-A-3-208514, amphoteric surfactants as described in JP-A-59-121044 and JP-A-4-13149 Can be added.
[0253]
Specific examples of the nonionic surfactant include sorbitan tristearate, sorbitan monopalmitate, sorbitan trioleate, stearic acid monoglyceride, polyoxyethylene nonylphenyl ether and the like.
[0254]
Specific examples of amphoteric surfactants include alkyldi (aminoethyl) glycine, alkylpolyaminoethylglycine hydrochloride, 2-alkyl-N-carboxyethyl-N-hydroxyethylimidazolinium betaine, N-tetradecyl-N, N- Examples include betaine type (for example, trade name Amorgen K, manufactured by Dai-ichi Kogyo Co., Ltd.).
The proportion of the nonionic surfactant and the amphoteric surfactant in the recording layer coating solution is preferably 0.05 to 15% by mass, more preferably 0.1 to 5% by mass.
[0255]
Furthermore, a plasticizer is added to the recording layer coating solution according to the present invention as needed to impart flexibility and the like of the coating film. For example, polyethylene glycol, tributyl citrate, diethyl phthalate, dibutyl phthalate, dihexyl phthalate, dioctyl phthalate, tricresyl phosphate, tributyl phosphate, trioctyl phosphate, tetrahydrofurfuryl oleate and the like are used.
[0256]
In order to produce a lithographic printing plate precursor using the light or thermosetting composition of the present invention, the components of the light or thermosetting composition are usually dissolved in a solvent together with the components necessary for the coating solution. What is necessary is just to apply | coat on a suitable support body. Solvents used here include ethylene dichloride, cyclohexanone, methyl ethyl ketone, methanol, ethanol, propanol, ethylene glycol monomethyl ether, 1-methoxy-2-propanol, 2-methoxyethyl acetate, 1-methoxy-2-propyl acetate, dimethoxy Examples include ethane, methyl lactate, ethyl lactate, N, N-dimethylacetamide, N, N-dimethylformamide, tetramethylurea, N-methylpyrrolidone, dimethyl sulfoxide, sulfolane, γ-butyrolactone, toluene, water and the like. It is not limited to this. These solvents are used alone or in combination. The concentration of the above components (total solid content including additives) in the solvent is preferably 1 to 50% by mass.
[0257]
The coating amount (solid content) of the recording layer on the support obtained after coating and drying varies depending on the use, but generally speaking, it is 0.5 to 5.0 g / m for a lithographic printing plate precursor.2Is preferred. As the coating amount decreases, the apparent sensitivity increases, but the film properties of the recording layer decrease.
Various methods can be used as the coating method, and examples thereof include bar coater coating, spin coating, spray coating, curtain coating, dip coating, air knife coating, blade coating, and roll coating.
[0258]
In the recording layer coating liquid according to the present invention, a surfactant for improving the coating property, for example, a fluorosurfactant described in JP-A-62-170950 can be added. . A preferable addition amount is 0.01 to 1% by mass, more preferably 0.05 to 0.5% by mass, based on the material solid content of the entire recording layer.
[0259]
(Support)
The support used when forming a lithographic printing plate precursor using the light or thermosetting composition of the present invention is not particularly limited as long as it is a dimensionally stable plate-like material. , Paper laminated with plastic (eg, polyethylene, polypropylene, polystyrene, etc.), metal plate (eg, aluminum, zinc, copper, etc.), plastic film (eg, cellulose diacetate, cellulose triacetate, cellulose propionate, cellulose butyrate) Cellulose acetate butyrate, cellulose nitrate, polyethylene terephthalate, polyethylene, polystyrene, polypropylene, polycarbonate, polyvinyl acetal, etc.). These may be a single component sheet such as a resin film or a metal plate, or may be a laminate of two or more materials. For example, a paper or plastic film on which a metal as described above is laminated or vapor-deposited. And laminated sheets of different plastic films.
[0260]
As the support, a polyester film or an aluminum plate is preferable, and among them, an aluminum plate that has good dimensional stability and is relatively inexpensive is particularly preferable. A suitable aluminum plate is a pure aluminum plate or an alloy plate containing aluminum as a main component and containing a trace amount of different elements, and may be a plastic film on which aluminum is laminated or vapor-deposited. Examples of foreign elements contained in the aluminum alloy include silicon, iron, manganese, copper, magnesium, chromium, zinc, bismuth, nickel, and titanium. The content of foreign elements in the alloy is at most 10% by mass. Particularly suitable aluminum in the present invention is pure aluminum, but completely pure aluminum is difficult to produce in the refining technique, and may contain slightly different elements. Thus, the composition of the aluminum plate applied to the present invention is not specified, and an aluminum plate made of a publicly known material can be appropriately used.
The aluminum plate has a thickness of about 0.1 to 0.6 mm, preferably 0.15 to 0.4 mm, and particularly preferably 0.2 to 0.3 mm.
[0261]
Prior to roughening the aluminum plate, a degreasing treatment with, for example, a surfactant, an organic solvent or an alkaline aqueous solution for removing rolling oil on the surface is performed as desired.
The surface roughening treatment of the aluminum plate is performed by various methods. For example, a method of mechanically roughening, a method of electrochemically dissolving and roughening a surface, and a method of selectively dissolving a surface chemically. This is done by the method of As the mechanical method, a known method such as a ball polishing method, a brush polishing method, a blast polishing method, or a buff polishing method can be used. Further, as an electrochemical surface roughening method, there is a method of performing alternating current or direct current in hydrochloric acid or nitric acid electrolyte. Further, as disclosed in JP-A-54-63902, a method in which both are combined can also be used.
[0262]
The aluminum plate roughened in this way can be subjected to an anodizing treatment to enhance the water retention and wear resistance of the surface through an alkali etching treatment and a neutralization treatment, if desired. As the electrolyte used for the anodizing treatment of the aluminum plate, various electrolytes that form a porous oxide film can be used. In general, sulfuric acid, phosphoric acid, oxalic acid, chromic acid, or a mixed acid thereof is used. The concentration of these electrolytes is appropriately determined depending on the type of electrolyte.
[0263]
The treatment conditions for anodization vary depending on the electrolyte used, and thus cannot be specified in general. However, in general, the electrolyte concentration is 1 to 80% by mass solution, the liquid temperature is 5 to 70 ° C., and the current density is 5 to 60 A / day. dm2A voltage of 1 to 100 V and an electrolysis time of 10 seconds to 5 minutes are suitable.
The amount of anodized film is 1.0 g / m2Although the above is suitable, More preferably, it is 2.0-6.0 g / m.2Range. Anodized film of 1.0 g / m2If it is less than that, the printing durability is insufficient, or the non-image part of the lithographic printing plate is likely to be scratched, and so-called “scratch stain” in which ink adheres to the scratched part during printing is likely to occur.
Such anodizing treatment is applied to the surface used for printing on the support of the lithographic printing plate. However, due to the back of the lines of electric force, 0.01 to 3 g / m on the back surface.2In general, an anodic oxide coating is formed.
[0264]
The hydrophilic treatment of the support surface is performed after the anodizing treatment, and conventionally known treatment methods are used. Such hydrophilization treatment is disclosed in US Pat. Nos. 2,714,066, 3,181,461, 3,280,734 and 3,902,734. There are various alkali metal silicate methods (for example, sodium silicate aqueous solution). In this method, the support is immersed in an aqueous sodium silicate solution or electrolytically treated. In addition, disclosed in Japanese Patent Publication No. 36-22063 is potassium fluoride zirconate and U.S. Pat. Nos. 3,276,868, 4,153,461, and 4,689,272. A method of treating with polyvinylphosphonic acid as described above is used.
Among these, a particularly preferred hydrophilic treatment in the present invention is a silicate treatment. The silicate treatment will be described below.
[0265]
The anodized film of the aluminum plate subjected to the treatment as described above has an alkali metal silicate content of 0.1 to 30% by mass, preferably 0.5 to 10% by mass, and a pH at 25 ° C. of 10 to 13. It is immersed in a certain aqueous solution at, for example, 15 to 80 ° C. for 0.5 to 120 seconds. If the pH of the alkali metal silicate aqueous solution is lower than 10, the solution will gel, and if it is higher than 13.0, the oxide film will be dissolved. Examples of the alkali metal silicate used in the present invention include sodium silicate, potassium silicate, and lithium silicate. Examples of the hydroxide used to increase the pH of the alkali metal silicate aqueous solution include sodium hydroxide, potassium hydroxide, and lithium hydroxide. In addition, you may mix | blend alkaline-earth metal salt or Group IVB metal salt with said process liquid. Alkaline earth metal salts include nitrates such as calcium nitrate, strontium nitrate, magnesium nitrate, and barium nitrate, and water-soluble salts such as sulfate, hydrochloride, phosphate, acetate, oxalate, and borate. Can be mentioned. Examples of Group IVB metal salts include titanium tetrachloride, titanium trichloride, potassium titanium fluoride, potassium potassium oxalate, titanium sulfate, titanium tetraiodide, zirconium chloride, zirconium dioxide, zirconium oxychloride, zirconium tetrachloride, etc. Can do. Alkaline earth metal salts or Group IVB metal salts can be used alone or in combination of two or more. A preferable range of these metal salts is 0.01 to 10% by mass, and a more preferable range is 0.05 to 5.0% by mass.
Since the hydrophilicity on the surface of the aluminum plate is further improved by the silicate treatment, the ink hardly adheres to the non-image area during printing, and the stain performance is improved.
[0266]
(Back coat layer)
A back coat is provided on the back surface of the support as necessary. As such a backcoat, a coating comprising a metal oxide obtained by hydrolysis and polycondensation of an organic polymer compound described in JP-A-5-45885 and an organic or inorganic metal compound described in JP-A-6-35174 A layer is preferably used.
Of these coating layers, Si (OCH3)4, Si (OC2H5)4, Si (OC3H7)4, Si (OC4H9)4A silicon alkoxy compound such as silicon is inexpensive and readily available, and a metal oxide coating layer provided therefrom is particularly preferred because of its excellent development resistance.
[0267]
(Protective layer)
In general lithographic printing plate precursors, since exposure is usually performed in the air, a protective layer can be further provided on the recording layer. The properties desired for such a protective layer include low permeability of low molecular compounds such as oxygen, good light transmission for exposure, excellent adhesion to the recording layer, and development after exposure. It is easy to remove in the process, and it is common to use water-soluble polymer compounds having relatively excellent crystallinity such as polyvinyl alcohol, polyvinyl pyrrolidone, acidic celluloses, gelatin, gum arabic, and polyacrylic acid. is there.
On the other hand, since the light or thermosetting composition of the present invention has an advantage that it can suppress a decrease in image forming property due to polymerization inhibition of oxygen or the like, it does not necessarily include such a protective layer. The protective layer may be provided for the purpose of enhancing oxygen barrier properties from the outside and enhancing image forming properties, particularly image strength.
[0268]
(Exposure, development and printing)
A lithographic printing plate precursor in which the light or thermosetting composition of the present invention is formed as a recording layer on the support surface described above can be recorded with an infrared laser. Thermal recording with an ultraviolet lamp or a thermal head is also possible. In the present invention, image exposure is preferably performed by a solid-state laser and a semiconductor laser that emit infrared rays having a wavelength of 760 nm to 1200 nm.
[0269]
After exposure with an infrared laser, the light or thermosetting composition of the present invention is preferably developed with water or an aqueous alkaline solution.
[0270]
When an alkaline aqueous solution is used as the developer, a conventionally known alkaline aqueous solution can be used as the developer or replenisher for the light or thermosetting composition of the present invention. For example, sodium silicate, potassium, tribasic sodium phosphate, potassium, ammonium, dibasic sodium phosphate, potassium, ammonium, sodium carbonate, potassium, ammonium, sodium bicarbonate, potassium, Examples include inorganic alkali salts such as ammonium, sodium borate, potassium, ammonium, sodium hydroxide, ammonium, potassium, and lithium. Moreover, monomethylamine, dimethylamine, trimethylamine, monoethylamine, diethylamine, triethylamine, monoisopropylamine, diisopropylamine, triisopropylamine, n-butylamine, monoethanolamine, diethanolamine, triethanolamine, monoisopropanolamine, diisopropanolamine, Organic alkali agents such as ethyleneimine, ethylenediamine, and pyridine are also used.
These alkali agents are used alone or in combination of two or more.
[0271]
Furthermore, when developing using an automatic developing machine, the developer in the developing tank for a long time is added to the developer by adding an aqueous solution (replenisher) that is the same as the developer or higher in alkali strength than the developer. It is known that a large amount of a lithographic printing plate precursor can be processed without replacing the plate. This replenishment method is also preferably applied in the present invention.
[0272]
Various surfactants, organic solvents, and the like can be added to the developer and the replenisher as necessary for the purpose of promoting and suppressing developability, dispersing development residue, and improving the ink affinity of the printing plate image area. Preferred surfactants include anionic, cationic, nonionic and amphoteric surfactants. Preferred organic solvents include benzyl alcohol. Moreover, addition of polyethylene glycol or a derivative thereof, or polypropylene glycol or a derivative thereof is also preferable. In addition, non-reducing sugars such as arabit, sorbit and mannitol can be added.
[0273]
In addition, the developer and replenisher may contain inorganic quinone reducing agents such as hydroquinone, resorcin, sodium sulfite or sodium bisulfite, and organic carboxylic acids, antifoaming agents, and hard water softeners as necessary. It can also be added.
[0274]
The printing plate developed using the developer and replenisher described above is post-treated with a desensitizing solution containing washing water, a rinsing solution containing a surfactant and the like, gum arabic and starch derivatives. In the case of using the light or thermosetting composition of the present invention as a printing plate material, these treatments can be used in various combinations.
[0275]
In recent years, automatic developing machines for printing plate materials have been widely used in the plate making and printing industries in order to rationalize and standardize plate making operations. This automatic developing machine is generally composed of a developing unit and a post-processing unit, and includes an apparatus for conveying a printing plate material, processing liquid tanks and a spray device. Each processing liquid pumped up is sprayed from a spray nozzle for development processing. In addition, recently, a method is also known in which a printing plate material is immersed and conveyed in a processing liquid tank filled with a processing liquid by a submerged guide roll or the like. In such automatic processing, each processing solution can be processed while being supplemented with a replenisher according to the processing amount, operating time, and the like. In addition, the electrical conductivity can be detected by a sensor and replenished automatically.
In addition, a so-called disposable processing method in which processing is performed with a substantially unused processing solution can also be applied.
[0276]
The lithographic printing plate obtained as described above can be subjected to a printing process after applying a desensitized gum if desired. However, if a lithographic printing plate having a higher printing durability is desired, a burning treatment is performed. Is given.
In the case of burning a lithographic printing plate, before burning, an adjustment as described in JP-B-61-2518, JP-A-55-28062, JP-A-62-31859, JP-A-61-159655 is used. It is preferable to treat with a surface liquid.
[0277]
As its method, with a sponge or absorbent cotton soaked with the surface-adjusting liquid, it is applied onto a lithographic printing plate, or a method in which the printing plate is immersed and applied in a vat filled with the surface-adjusting liquid, Application by an automatic coater is applied. Further, it is more preferable to make the coating amount uniform with a squeegee or a squeegee roller after coating.
The coating amount of the surface conditioning liquid is generally 0.03 to 0.8 g / m.2(Dry mass) is appropriate.
The lithographic printing plate coated with the surface-adjusting liquid is dried if necessary, and then heated to a high temperature with a burning processor (for example, burning processor BP-1300 sold by Fuji Photo Film Co., Ltd.). . In this case, the heating temperature and time are in the range of 180 to 300 ° C. and preferably in the range of 1 to 20 minutes, although depending on the type of components forming the image.
[0278]
The burned lithographic printing plate can be subjected to conventional treatments such as washing and gumming as needed, but a surface-conditioning solution containing a water-soluble polymer compound or the like is used. In such a case, a so-called desensitizing treatment such as gumming can be omitted.
[0279]
By such treatment, the lithographic printing plate obtained from the light or thermosetting composition of the present invention is applied to an offset printing machine or the like and used for printing a large number of sheets.
[0280]
【Example】
EXAMPLES Hereinafter, although an Example demonstrates this invention in detail, this invention is not limited to these. In the examples of the present application, the lithographic printing plate using the light or thermosetting composition of the present invention as a recording material is evaluated, and the evaluation is the evaluation of the light or thermosetting composition of the present invention. .
[0281]
[Examples 1 to 6, Comparative Examples 1 and 2]
(Create support)
A molten metal of JIS A1050 alloy containing 99.5% or more of aluminum and Fe 0.30%, Si 0.10%, Ti 0.02%, and Cu 0.013% was subjected to cleaning treatment and cast. In the cleaning process, a degassing process was performed to remove unnecessary gases such as hydrogen in the molten metal, and a ceramic tube filter process was performed. The casting method was a DC casting method. The solidified 500 mm thick ingot was chamfered 10 mm from the surface and homogenized at 550 ° C. for 10 hours so that the intermetallic compound would not become coarse.
Next, after hot rolling at 400 ° C. and intermediate annealing at 500 ° C. for 60 seconds in a continuous annealing furnace, cold rolling was performed to obtain an aluminum rolled plate having a plate pressure of 0.30 mm. By controlling the roughness of the rolling roll, the centerline average surface roughness Ra after cold rolling was controlled to 0.2 μm. Then, it applied to the tension leveler in order to improve planarity.
[0282]
Next, the surface treatment for making a lithographic printing plate support was performed.
First, in order to remove the rolling oil on the surface of the aluminum plate, degreasing treatment was carried out with a 10% sodium aluminate aqueous solution at 50 ° C. for 30 seconds, and neutralization and smut removal treatment were carried out with a 30% sulfuric acid aqueous solution at 50 ° C. for 30 seconds.
Next, in order to improve the adhesion between the support and the recording layer and to provide water retention to the non-image area, a so-called graining treatment was performed to roughen the surface of the support. An aqueous solution containing 1% nitric acid and 0.5% aluminum nitrate is kept at 45 ° C., and the current density is 20 A / dm by an indirect power feeding cell while flowing the aluminum web into the aqueous solution.2, Anode side electricity quantity 240C / dm with alternating waveform with duty ratio 1: 12Electrolytic graining was performed by giving Thereafter, etching treatment was performed with a 10% sodium aluminate aqueous solution at 50 ° C. for 30 seconds, and neutralization and smut removal treatment were performed with a 30% sulfuric acid aqueous solution at 50 ° C. for 30 seconds.
[0283]
Furthermore, in order to improve wear resistance, chemical resistance and water retention, an oxide film was formed on the support by anodic oxidation. A 20% sulfuric acid aqueous solution was used as an electrolyte at 35 ° C., and an aluminum web was carried into the electrolyte while an indirect power supply cell was used to provide 14 A / dm.22.5 g / m by electrolytic treatment with direct current2An anodic oxide film was prepared.
[0284]
(Formation of recording layer)
A recording layer coating solution 1 having the following composition was prepared, applied to the aluminum support obtained as described above using a wire bar, and dried at 115 ° C. for 45 seconds in a hot air drying apparatus to form a recording layer. The lithographic printing plate precursor was obtained. The coating amount after drying is 1.2 to 1.3 g / m2It was in the range.
<Recording layer coating solution 1>
-Polymerizable compound: (compounds listed in Table 1) 1.0 g
-Binder polymer: (compounds listed in Table 1) 1.0 g
Infrared absorber “IR-1”: (structure shown below) 0.15 g
-Radical initiator “S-1”: (structure shown below) 0.35 g
・ Victoria Pure Blue Naphthalenesulfonate 0.04g
・ Fluorosurfactant 0.01 g
(Megafuck F-176, manufactured by Dainippon Ink & Chemicals, Inc.)
・ Methyl ethyl ketone 9.0g 9.0g
・ Methanol: 10.0 g
1-Methoxy-2-propanol 8.0 g
[0285]
In addition, the polymeric compound used for the Example is the specific polymeric compound which concerns on this invention illustrated above, Moreover, the polymeric compounds (U-1)-(U-3) used for the comparative example are the following. It is a polymerizable compound having the structure shown below and outside the scope of the present invention.
[0286]
Embedded image
[0287]
Next, the structures of binder polymers (P-1) to (P-3) used in Examples and Comparative Examples of the present invention are shown.
[0288]
Embedded image
[0289]
Next, the structures of the infrared absorbers (IR-1) to (IR-3) used in Examples and Comparative Examples of the present invention are shown.
[0290]
[Chemical Formula 86]
[0291]
Next, the structures of the radical initiators (S-1) to (S-4) used in Examples and Comparative Examples of the present invention are shown.
[0292]
Embedded image
[0293]
(exposure)
The obtained negative lithographic printing plate precursor was output by a Creo Trendsetter 3244VFS equipped with a water-cooled 40 W infrared semiconductor laser, output 9 W, outer drum rotation speed 210 rpm, plate energy 100 mJ / cm.2The exposure was performed under the condition of a resolution of 2400 dpi.
[0294]
(Development processing)
After the exposure, the film was developed using an automatic processor Stablon 900N manufactured by Fuji Photo Film Co., Ltd. As the developer, a 1: 4 water diluted solution of DV-2 manufactured by Fuji Photo Film Co., Ltd. was used for both the feed solution and the replenisher solution. The temperature of the developing bath was 30 ° C. As the finisher, a 1: 1 water dilution (pH = 10.8) of FN-6 manufactured by Fuji Photo Film Co., Ltd. was used.
[0295]
[Evaluation of printing durability, stain resistance of non-image area and storage stability]
The resulting lithographic printing plate was then printed with a Lithrone printing machine manufactured by Komori Corporation using DIC-GEOS (N) black ink manufactured by Dainippon Ink & Chemicals, Inc. At this time, the number of sheets that can be printed while maintaining a sufficient ink density was measured by visual observation, and the printing durability and the stain resistance of the non-image area were evaluated.
The obtained lithographic printing plate precursor was stored for 3 days at 60 ° C. and stored for 3 days at 45 ° C. and humidity 75% RH, followed by forced aging. The dirtiness of the non-image area was evaluated. The results are also shown in Table 1.
[0296]
[Table 1]
[0297]
As is apparent from Table 1, the planographic printing plates of Examples 1 to 6 using the specific polymerizable compound according to the present invention are the planographic printing plates of Comparative Examples 1 and 2 using the polymerizable compound outside the scope of the present invention. Compared to the plate, the printing durability was excellent, and the non-image area was not stained. In addition, it was found that after storage in a high-temperature and high-humidity environment, the printing durability and stain resistance of the non-image area did not deteriorate, and the storage stability was excellent.
[0298]
[Examples 7 to 16, Comparative Examples 3 and 4]
(Formation of undercoat layer)
An undercoat liquid having the following composition was applied to the same aluminum support as in Examples 1 to 6 with a wire bar, and dried at 90 ° C. for 30 seconds using a hot air dryer. The coating amount after drying is 10 mg / m2Met.
[0299]
[0300]
(Formation of recording layer)
Next, the recording layer coating solution 2 having the following composition was prepared, applied to the above-mentioned undercoated aluminum plate using a wire bar, and dried at 115 ° C. for 45 seconds with a hot air drying apparatus, and then negative lithographic printing I got the original version. The coating amount after drying is 1.3 g / m2Met. When the reflection density at the absorption maximum in the infrared region of the recording layer of these planographic printing plate precursors was measured, all were between 0.6 and 1.2.
[0301]
<Recording layer coating solution 2>
-Polymerizable compounds: (compounds listed in Table 2) 1.0 g
-Binder polymer: “P-3” 1.0 g
・ Infrared absorber “IR-1” 0.10 g
・ Radical generator “S-1”: 0.35 g
・ Victoria Pure Blue Naphthalenesulfonate 0.04g
・ Fluorosurfactant 0.01 g
(Megafuck F-176, manufactured by Dainippon Ink & Chemicals, Inc.)
・ Methyl ethyl ketone 9.0g 9.0g
・ Methanol: 10.0 g
1-Methoxy-2-propanol 8.0 g
[0302]
(exposure)
The obtained negative lithographic printing plate precursor was subjected to infrared laser exposure and development in the same manner as in Examples 1 to 6 to obtain a lithographic printing plate.
[0303]
[Evaluation of printing durability after burning]
The obtained lithographic printing plate was printed in the same manner as in Examples 1 to 6, and printing durability was evaluated.
Subsequently, the plate surface of the obtained lithographic printing plate was wiped with a burning surface-adjusting solution BC-3 manufactured by Fuji Photo Film Co., Ltd., and then subjected to a burning treatment at about 240 ° C. for 7 minutes. Then, it washed with water and processed the plate surface with the liquid which diluted the volume GU-7 made from Fuji Photo Film Co., Ltd. with water twice.
Thereafter, printing was performed in the same manner as described above, and printing durability after the burning treatment was evaluated. The results are also shown in Table 2.
[0304]
[Table 2]
[0305]
As is apparent from Table 2, the planographic printing plates of Examples 7 to 16 using the specific polymerizable compound according to the present invention are the planographic printing plates of Comparative Examples 3 and 4 using the polymerizable compound outside the scope of the present invention. It was confirmed that the printing durability was superior to that of the plate. Furthermore, the printing durability of the planographic printing plate precursors of Examples 7 to 16 was remarkably improved by performing the burning treatment. This is presumed that the unreacted polymerizable compound that could not be polymerized by exposure caused a polymerization / curing reaction without sublimation by the burning treatment.
[0306]
[Examples 17 to 25, Comparative Example 5]
(Create support)
The surface of an aluminum plate having a thickness of 0.30 mm was grained using a nylon brush and a water suspension wave of 400 mesh Pamiston, and then thoroughly washed with water. After etching by dipping in a 10% by mass aqueous sodium hydroxide solution at 70 ° C. for 60 seconds, washed with running water, neutralized and washed with 20% by mass nitric acid, and then washed with water. This was 160 coulomb / dm in a 1% by weight nitric acid aqueous solution using a sinusoidal alternating waveform current under the condition of VA = 12.7V.2Electrolytic surface roughening treatment was performed with the amount of electricity at the time of anode. The surface roughness measured was 0.6 μm (Ra indication). Subsequently, after being immersed in a 30% by mass sulfuric acid aqueous solution and desmutted at 55 ° C. for 2 minutes, the current density was 2 A / dm in a 20% by mass sulfuric acid aqueous solution.2The thickness of the anodized film is 2.7 g / m2Then, anodization was performed for 2 minutes.
[0307]
(Formation of undercoat layer)
The SG method liquid composition (sol solution) was prepared by the following procedure.
<Sol solution composition>
・ Methanol: 130g
・ Water water 20g
・ 85% by mass phosphoric acid 16g
Tetraethoxysilane 50 g 50g
・ 3-Methacryloxypropyltrimethoxysilane 60g
The sol composition was mixed and stirred. An exotherm was observed in about 5 minutes. After reacting for 60 minutes, the contents were transferred to another container, and 3000 g of methanol was added to obtain a sol solution.
This sol solution was diluted with methanol / ethylene glycol = 9/1 (mass ratio), and the amount of Si on the substrate was 30 mg / m.2And then dried at 100 ° C. for 1 minute to form an undercoat layer.
[0308]
(Formation of recording layer)
The recording layer coating solution 3 having the following composition was applied to the above-mentioned undercoated aluminum support using a wire bar on the thus treated aluminum support, and heated at 115 ° C. for 45 seconds using a hot air dryer. The lithographic printing plate precursor was obtained by drying. The coating amount after drying is 1.2 to 1.3 g / m2It was in the range.
[0309]
<Recording layer coating solution 3>
-Polymerizable compounds: (compounds listed in Table 3) 0.8 g
・ Binder polymer: “P-3” 1.2 g
Infrared absorber: “IR-1” 0.09 g
-Radical initiator: “S-2” 0.40 g
・ Victoria Pure Blue Naphthalenesulfonic Acid 0.04g
・ Fluorosurfactant 0.01 g
(Megafuck F-176, manufactured by Dainippon Ink & Chemicals, Inc.)
・ Methyl ethyl ketone 9.0g 9.0g
・ Methanol: 10.0 g
・ P-Methoxyphenol 0.001g
1-Methoxy-2-propanol 8.0 g
[0310]
[Evaluation of sensitivity and printing durability]
The resulting lithographic printing plate precursor was output and exposed under the condition of a resolution of 2400 dpi using a Creo Trendsetter 3244VFS equipped with a water-cooled 40 W infrared semiconductor laser. At this time, exposure was performed by changing the plate surface energy by changing the exposure power (W) and the outer drum rotation speed.
Subsequently, development processing was performed in the same manner as in Examples 1 to 6 to obtain a lithographic printing plate. Furthermore, printing was performed in the same manner as in Examples 1 to 6, and the sensitivity and printing durability were evaluated. The results are also shown in Table 3.
[0311]
[Table 3]
[0312]
As is apparent from Table 3, the planographic printing plates of Examples 17 to 25 using the specific polymerizable compound according to the present invention were changed to the planographic printing plate of Comparative Example 5 using a polymerizable compound outside the scope of the present invention. In comparison, it was confirmed that excellent printing durability was obtained at each exposure amount, and that even if the exposure was low, no significant reduction in printing durability was observed and the sensitivity was excellent.
[0313]
[Examples 26 to 29, Comparative Example 6]
(Formation of recording layer)
A recording layer coating solution 4 having the following composition was coated on a support coated with the same undercoat as in Examples 7 to 16 using a wire bar, and dried at 115 ° C. for 45 seconds with a hot air dryer. Furthermore, the following overcoat layer coating solution was applied using a slide hopper and dried at 120 ° C. for 75 seconds with a hot air drying apparatus to obtain a lithographic printing plate precursor. The coating amount of the image recording layer is 2.0 g / m.2The coating amount of the overcoat layer is 2.3 g / m2Met.
[0314]
<Coating liquid for overcoat layer>
・ Polyvinyl alcohol 2.5g
(Saponification degree 98.5 mol%, polymerization degree 500)
-Polyvinylpyrrolidone 0.5g 0.5g
(K30, manufactured by Tokyo Chemical Industry Co., Ltd., molecular weight 40,000)
・ Nonionic surfactant: 0.05 g
(EMAREX NP-10, manufactured by Nippon Emulsion Co., Ltd.)
・ Ion-exchanged water 96.95g
[0315]
(Exposure / Development)
The obtained negative lithographic printing plate precursor was subjected to infrared laser exposure and development in the same manner as in Examples 1 to 6 to obtain a lithographic printing plate.
[0316]
[Evaluation of printing durability, stain resistance of non-image area and storage stability]
The obtained lithographic printing plate was printed in the same manner as in Examples 1 to 6, and printing durability, stain resistance of non-image areas, and storage stability were evaluated in the same manner as in Examples 1 to 6. The results are also shown in Table 4.
[0317]
[Table 4]
[0318]
As is clear from Table 4, the planographic printing plates of Examples 26 to 29 using the specific polymerizable compound according to the present invention are within the scope of the present invention even when an overcoat layer is provided on the surface of the recording layer. Compared to the lithographic printing plate of Comparative Example 6 using the other polymerizable compound, the printing durability was excellent and the non-image area was not stained. In addition, it was found that after storage in a high-temperature and high-humidity environment, the printing durability and stain resistance of the non-image area did not deteriorate, and the storage stability was excellent.
[0319]
[Examples 30 to 33, Comparative Examples 7 to 10]
The support used in Examples 1 to 6 was subjected to a silicate treatment in order to ensure hydrophilicity as a printing plate non-image part. In the treatment, a 1.5% aqueous solution of sodium silicate 3 was kept at 70 ° C. so that the contact time of the aluminum web was 15 seconds, and further washed with water. The amount of Si deposited is 10 mg / m2Met. Ra (center line surface roughness) of the support prepared as described above was 0.25 μm.
[0320]
(Formation of recording layer)
The recording layer coating solution 5 having the following composition is coated on the aluminum support thus treated using a wire bar, and dried at 115 ° C. for 45 seconds in a hot air drying apparatus to obtain a lithographic printing plate precursor. It was. The coating amount after drying is 1.2 to 1.3 g / m2It was in the range. Next, an overcoat layer was applied in the same manner as in Examples 26 to 29.
[0321]
<Recording layer coating solution 5>
-Polymerizable compounds: (compounds listed in Table 5) 1.0 g
-Binder polymer: “P-3” 1.0 g
Infrared absorber: (compounds listed in Table 5) 0.08g
-Radical initiator: (compounds listed in Table 5) 0.30 g
・ Victoria Pure Blue Naphthalenesulfonic Acid 0.04g
・ Fluorosurfactant 0.01 g
(Megafuck F-176, manufactured by Dainippon Ink & Chemicals, Inc.)
・ Methyl ethyl ketone 9.0g 9.0g
・ Methanol: 10.0 g
・ P-Methoxyphenol 0.001g
1-Methoxy-2-propanol 8.0 g
[0322]
The obtained negative lithographic printing plate precursor was subjected to infrared laser exposure and development treatment in the same manner as in Examples 1 to 6 except that the developer was changed to the following.
<Developer>
• Potassium hydroxide 3g 3g
・ Potassium hydrogen carbonate 1g
Potassium carbonate 2g 2g
・ Sodium sulfite 1 g of g
・ Polyethylene glycol mononaphthyl ether 150 g
・ Dibutyl naphthalene sulfonic acid sodium salt 50 g
・ Ethylenediaminetetraacetic acid tetrasodium salt 8g
Water water 785g 785g
[0323]
[Evaluation of printing durability, stain resistance of non-image area and storage stability]
The obtained lithographic printing plate was printed in the same manner as in Examples 1 to 6, and further evaluated for printing durability, stain resistance of non-image areas, and storage stability in the same manner as in Examples 1 to 6. It was. The results are also shown in Table 5.
[0324]
[Table 5]
[0325]
As is apparent from Table 5, the planographic printing plates of Examples 30 to 33 using the specific polymerizable compound according to the present invention are the planographic printing plates of Comparative Examples 7 to 10 using the polymerizable compound outside the scope of the present invention. Compared to the plate, the printing durability was excellent, and the non-image area was not stained. In addition, it was found that after storage in a high-temperature and high-humidity environment, the printing durability and stain resistance of the non-image area did not deteriorate, and the storage stability was excellent.
As mentioned above, according to the present Example, it turned out that the light or thermosetting composition of this invention is useful as a recording material of a lithographic printing plate precursor.
[0326]
【The invention's effect】
According to the present invention, it is excellent in sensitivity, storage stability, printing durability, and developability, and is particularly useful as an image recording material for a negative lithographic printing plate precursor whose printing durability is remarkably improved by performing a burning treatment. A light or thermosetting composition can be obtained.
