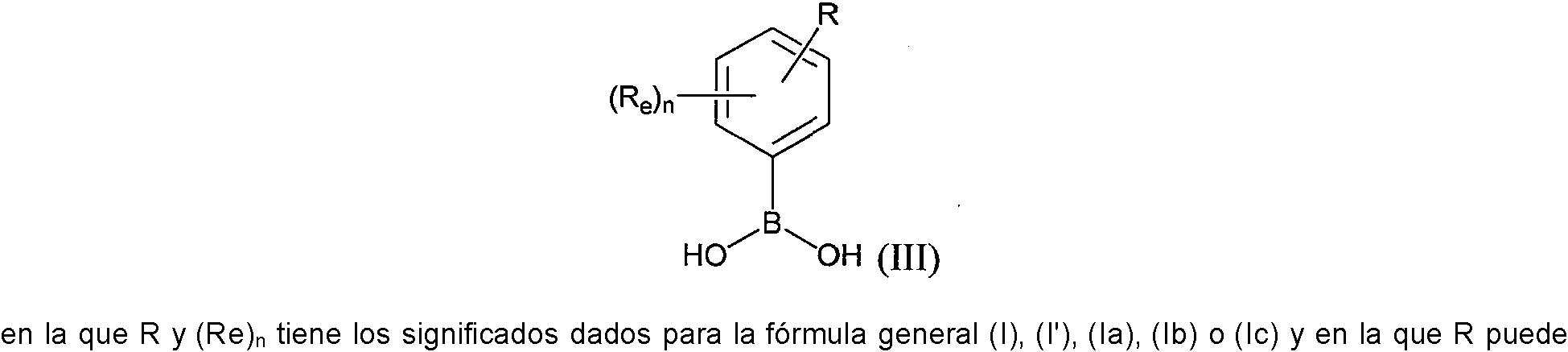
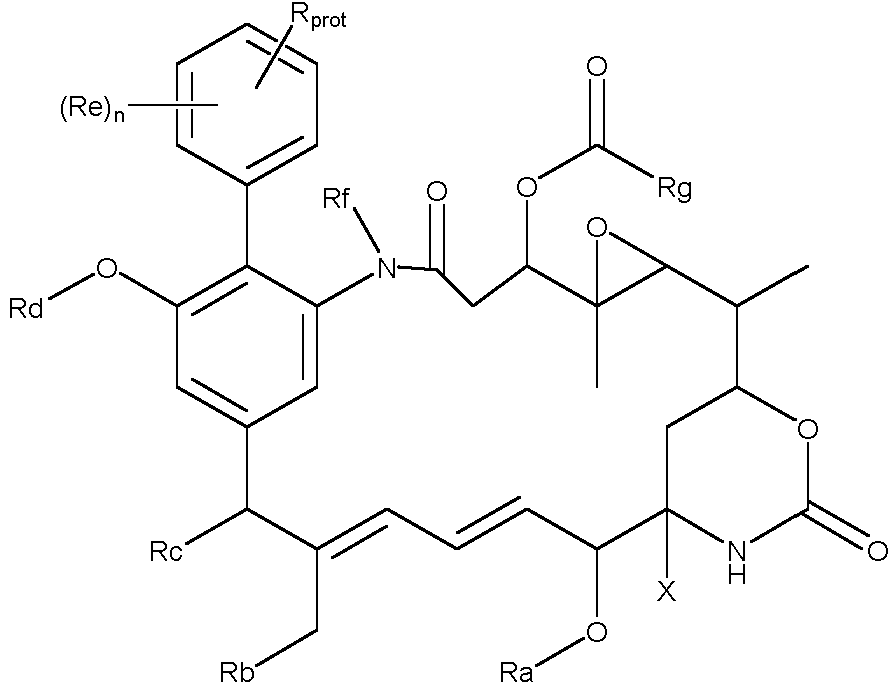
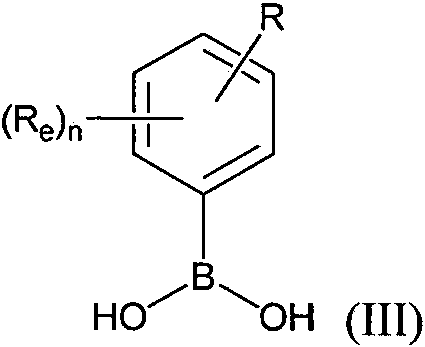
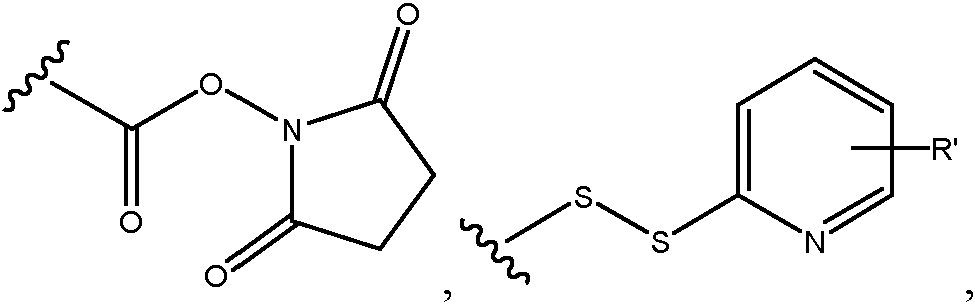
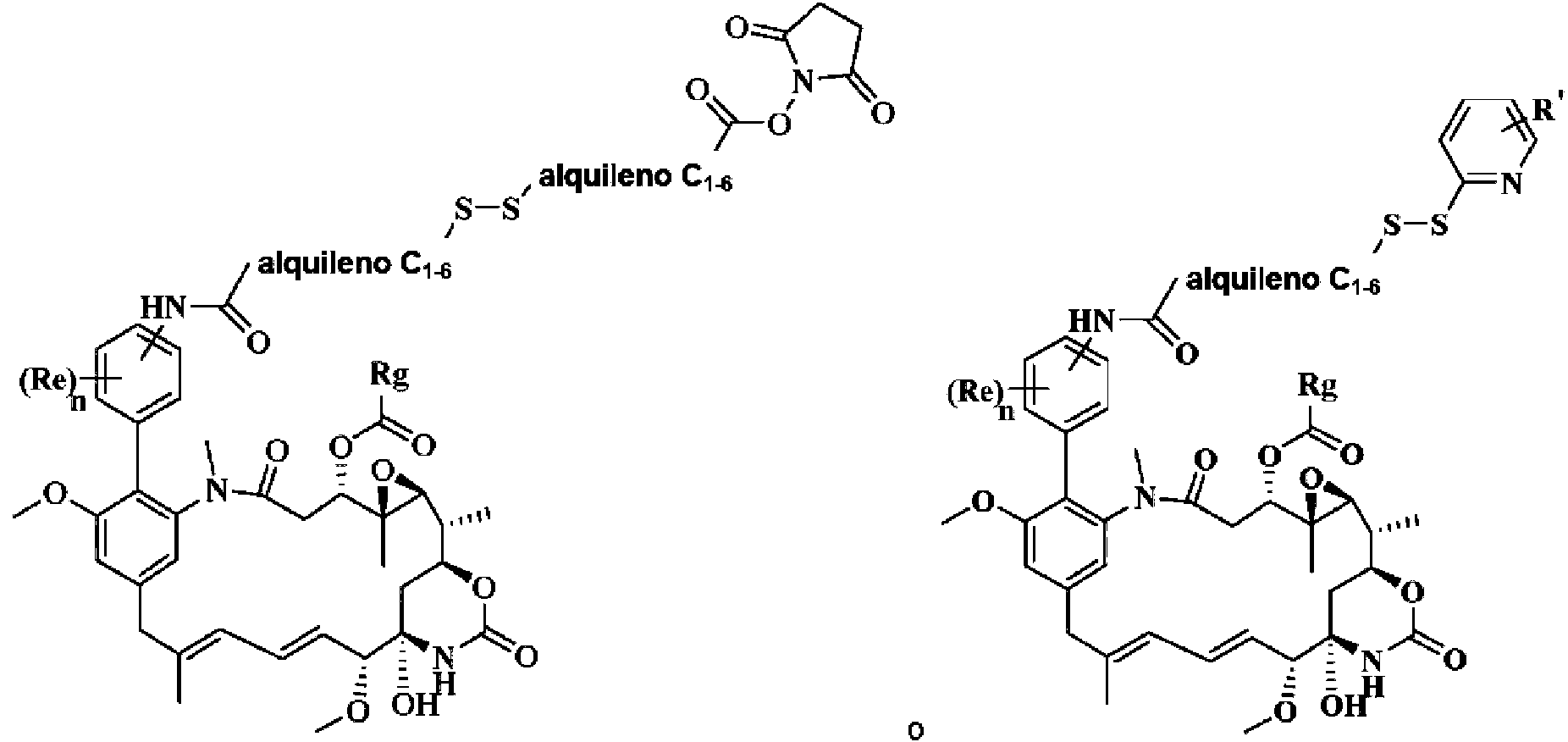
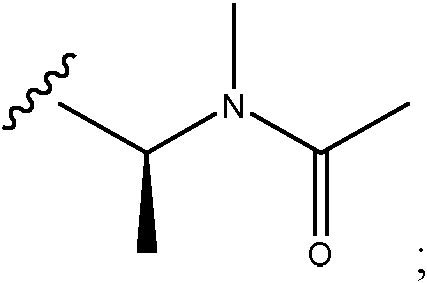
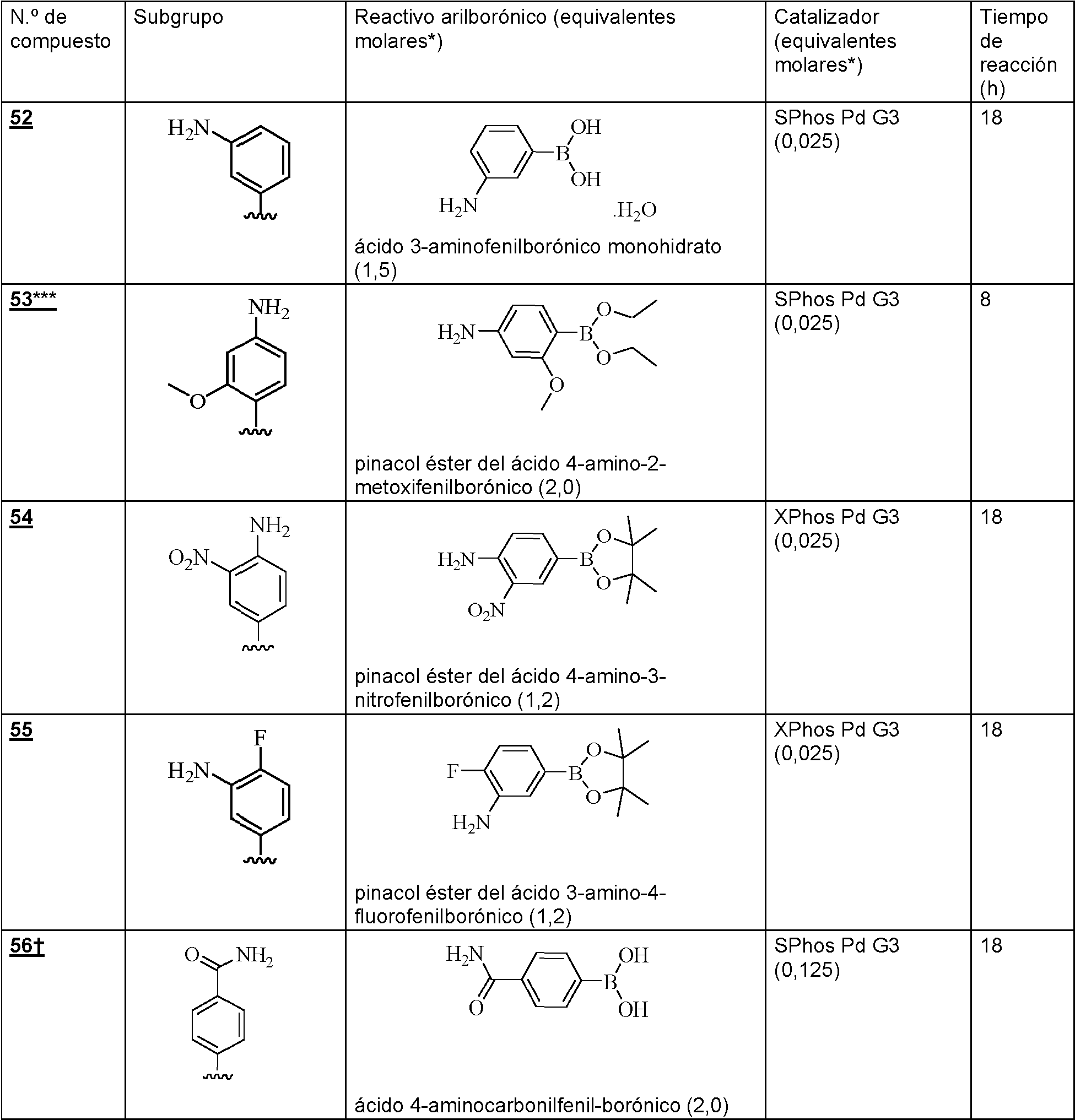
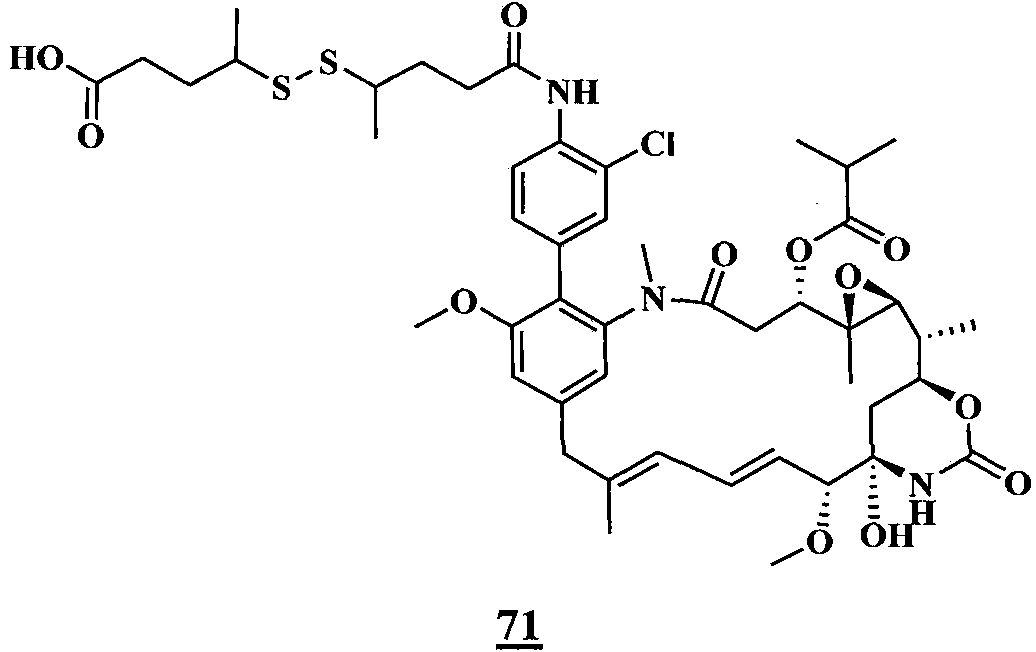
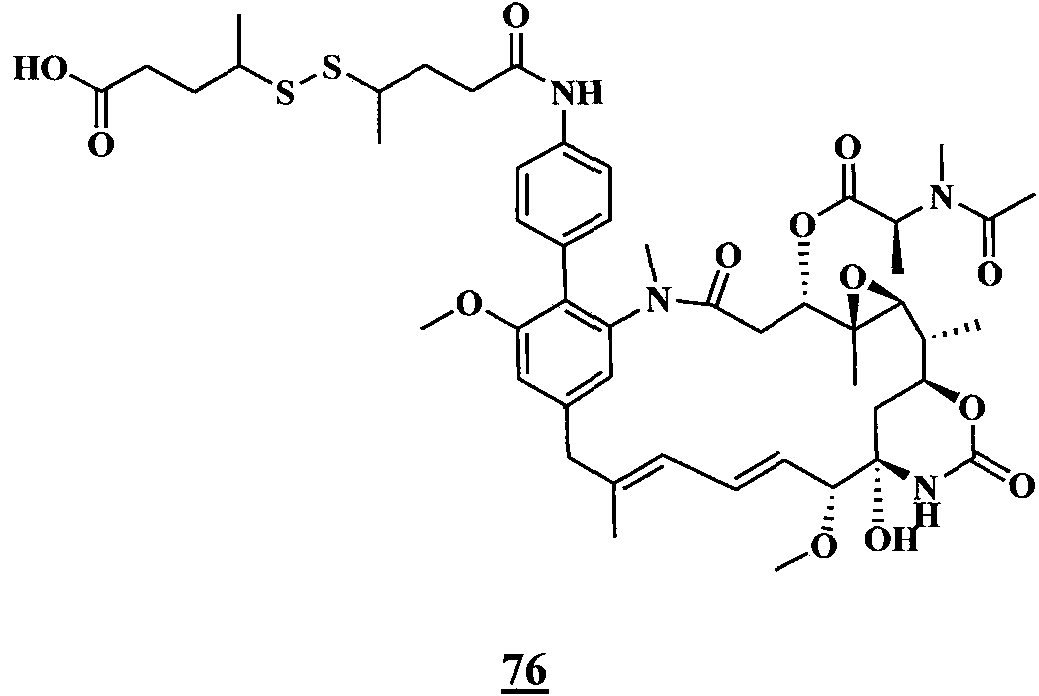
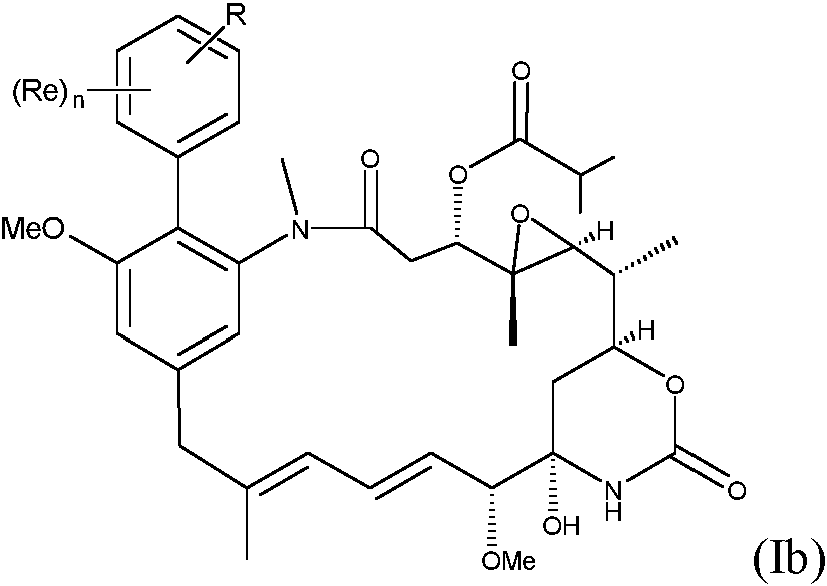
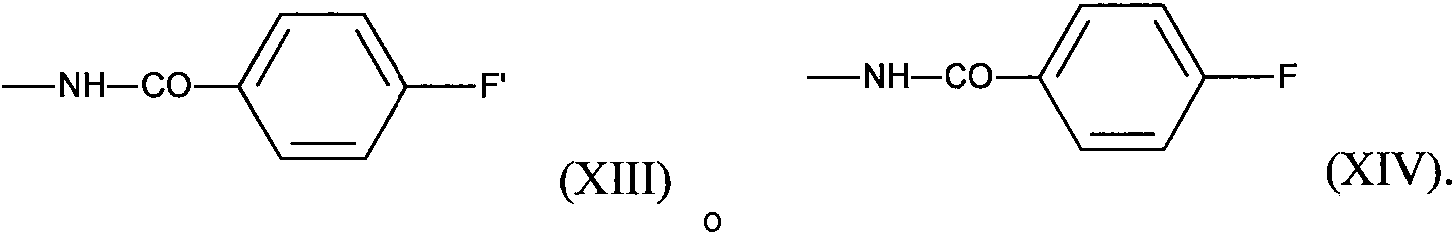ES2882016T3 - Nuevos agentes citotóxicos y conjugados de los mismos - Google Patents
Nuevos agentes citotóxicos y conjugados de los mismos Download PDFInfo
- Publication number
- ES2882016T3 ES2882016T3 ES17771552T ES17771552T ES2882016T3 ES 2882016 T3 ES2882016 T3 ES 2882016T3 ES 17771552 T ES17771552 T ES 17771552T ES 17771552 T ES17771552 T ES 17771552T ES 2882016 T3 ES2882016 T3 ES 2882016T3
- Authority
- ES
- Spain
- Prior art keywords
- group
- compound
- alkyl
- reagent
- linker
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000002254 cytotoxic agent Substances 0.000 title description 5
- 229940127089 cytotoxic agent Drugs 0.000 title description 5
- 231100000599 cytotoxic agent Toxicity 0.000 title description 5
- 150000001875 compounds Chemical class 0.000 claims abstract description 254
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims abstract description 62
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 51
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 50
- -1 hydrogen atoms halogen Chemical class 0.000 claims abstract description 49
- 150000003839 salts Chemical class 0.000 claims abstract description 35
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims abstract description 31
- 239000001257 hydrogen Substances 0.000 claims abstract description 29
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 29
- 125000003118 aryl group Chemical group 0.000 claims abstract description 24
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims abstract description 21
- 125000005843 halogen group Chemical group 0.000 claims abstract description 17
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 15
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 13
- 125000000547 substituted alkyl group Chemical group 0.000 claims abstract description 12
- 150000001413 amino acids Chemical class 0.000 claims abstract description 11
- 125000000753 cycloalkyl group Chemical group 0.000 claims abstract description 11
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 9
- 125000003342 alkenyl group Chemical group 0.000 claims abstract description 8
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 8
- 125000000304 alkynyl group Chemical group 0.000 claims abstract description 7
- 125000003282 alkyl amino group Chemical group 0.000 claims abstract description 5
- 125000004663 dialkyl amino group Chemical group 0.000 claims abstract description 5
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims abstract description 5
- 239000003153 chemical reaction reagent Substances 0.000 claims description 208
- QTBSBXVTEAMEQO-UHFFFAOYSA-N acetic acid Substances CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 134
- 125000005647 linker group Chemical group 0.000 claims description 100
- 108091008324 binding proteins Proteins 0.000 claims description 81
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 70
- 238000006243 chemical reaction Methods 0.000 claims description 69
- 230000001268 conjugating effect Effects 0.000 claims description 57
- 238000000034 method Methods 0.000 claims description 51
- 229920001223 polyethylene glycol Polymers 0.000 claims description 44
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 claims description 40
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 36
- 238000002360 preparation method Methods 0.000 claims description 34
- 230000008569 process Effects 0.000 claims description 31
- 239000003814 drug Substances 0.000 claims description 27
- 125000000524 functional group Chemical group 0.000 claims description 26
- 239000003054 catalyst Substances 0.000 claims description 21
- 125000002947 alkylene group Chemical group 0.000 claims description 20
- 229910052763 palladium Inorganic materials 0.000 claims description 15
- 239000012038 nucleophile Substances 0.000 claims description 14
- 229910052717 sulfur Inorganic materials 0.000 claims description 13
- 125000004434 sulfur atom Chemical group 0.000 claims description 13
- 125000006239 protecting group Chemical group 0.000 claims description 12
- 125000003107 substituted aryl group Chemical group 0.000 claims description 12
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims description 11
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims description 11
- 125000002228 disulfide group Chemical group 0.000 claims description 10
- 239000002202 Polyethylene glycol Substances 0.000 claims description 9
- 229910052760 oxygen Inorganic materials 0.000 claims description 9
- 239000008194 pharmaceutical composition Substances 0.000 claims description 9
- 230000009467 reduction Effects 0.000 claims description 9
- 108060003951 Immunoglobulin Proteins 0.000 claims description 8
- 235000001014 amino acid Nutrition 0.000 claims description 8
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 8
- 102000018358 immunoglobulin Human genes 0.000 claims description 8
- 239000001301 oxygen Substances 0.000 claims description 8
- 229940124597 therapeutic agent Drugs 0.000 claims description 8
- 239000000427 antigen Substances 0.000 claims description 7
- 102000036639 antigens Human genes 0.000 claims description 7
- 108091007433 antigens Proteins 0.000 claims description 7
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 6
- 125000002252 acyl group Chemical group 0.000 claims description 6
- 150000001543 aryl boronic acids Chemical group 0.000 claims description 6
- 239000012634 fragment Substances 0.000 claims description 6
- 229920002704 polyhistidine Polymers 0.000 claims description 6
- 108091005804 Peptidases Proteins 0.000 claims description 5
- 125000004450 alkenylene group Chemical group 0.000 claims description 5
- 125000002883 imidazolyl group Chemical group 0.000 claims description 5
- 239000003550 marker Substances 0.000 claims description 5
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical group C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 claims description 5
- 238000002560 therapeutic procedure Methods 0.000 claims description 5
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 5
- VEGGTWZUZGZKHY-GJZGRUSLSA-N (2s)-2-[[(2s)-2-amino-3-methylbutanoyl]amino]-5-(carbamoylamino)-n-[4-(hydroxymethyl)phenyl]pentanamide Chemical compound NC(=O)NCCC[C@H](NC(=O)[C@@H](N)C(C)C)C(=O)NC1=CC=C(CO)C=C1 VEGGTWZUZGZKHY-GJZGRUSLSA-N 0.000 claims description 4
- 239000004365 Protease Substances 0.000 claims description 4
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 claims description 4
- 150000001371 alpha-amino acids Chemical class 0.000 claims description 4
- 235000008206 alpha-amino acids Nutrition 0.000 claims description 4
- 125000003827 glycol group Chemical group 0.000 claims description 4
- 125000001151 peptidyl group Chemical group 0.000 claims description 4
- 229910052723 transition metal Inorganic materials 0.000 claims description 4
- 150000003624 transition metals Chemical class 0.000 claims description 4
- AGGWFDNPHKLBBV-YUMQZZPRSA-N (2s)-2-[[(2s)-2-amino-3-methylbutanoyl]amino]-5-(carbamoylamino)pentanoic acid Chemical group CC(C)[C@H](N)C(=O)N[C@H](C(O)=O)CCCNC(N)=O AGGWFDNPHKLBBV-YUMQZZPRSA-N 0.000 claims description 3
- HSRXSKHRSXRCFC-WDSKDSINSA-N Val-Ala Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(O)=O HSRXSKHRSXRCFC-WDSKDSINSA-N 0.000 claims description 3
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 3
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 claims description 3
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims description 3
- 125000005982 diphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 3
- 230000007515 enzymatic degradation Effects 0.000 claims description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 3
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims description 3
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 claims description 3
- 125000005002 aryl methyl group Chemical group 0.000 claims description 2
- 125000005620 boronic acid group Chemical group 0.000 claims description 2
- 229910052702 rhenium Inorganic materials 0.000 claims description 2
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 claims description 2
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 2
- 102000023732 binding proteins Human genes 0.000 claims 10
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 abstract description 21
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 abstract description 12
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 abstract description 8
- 229910052736 halogen Inorganic materials 0.000 abstract description 6
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 abstract description 5
- 125000003161 (C1-C6) alkylene group Chemical group 0.000 abstract description 4
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 abstract description 2
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 150
- 239000000562 conjugate Substances 0.000 description 134
- 239000000243 solution Substances 0.000 description 116
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 88
- 239000000872 buffer Substances 0.000 description 76
- 102000014914 Carrier Proteins Human genes 0.000 description 71
- 239000007787 solid Substances 0.000 description 66
- 230000021615 conjugation Effects 0.000 description 59
- 239000011541 reaction mixture Substances 0.000 description 59
- 238000005160 1H NMR spectroscopy Methods 0.000 description 55
- 229940049595 antibody-drug conjugate Drugs 0.000 description 54
- 238000003786 synthesis reaction Methods 0.000 description 54
- 230000015572 biosynthetic process Effects 0.000 description 53
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 51
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 44
- 239000000611 antibody drug conjugate Substances 0.000 description 39
- 210000004027 cell Anatomy 0.000 description 39
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 36
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 36
- 239000000203 mixture Substances 0.000 description 36
- 239000012071 phase Substances 0.000 description 35
- 102000004169 proteins and genes Human genes 0.000 description 34
- 108090000623 proteins and genes Proteins 0.000 description 34
- 235000018102 proteins Nutrition 0.000 description 33
- 230000002441 reversible effect Effects 0.000 description 29
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 27
- 108090000765 processed proteins & peptides Proteins 0.000 description 27
- 238000004440 column chromatography Methods 0.000 description 26
- 206010028980 Neoplasm Diseases 0.000 description 25
- WYURNTSHIVDZCO-UHFFFAOYSA-N tetrahydrofuran Substances C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 25
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 20
- 229910052801 chlorine Inorganic materials 0.000 description 20
- 230000002829 reductive effect Effects 0.000 description 20
- 229920000642 polymer Polymers 0.000 description 19
- 239000002253 acid Substances 0.000 description 18
- 229910052786 argon Inorganic materials 0.000 description 18
- 239000000460 chlorine Substances 0.000 description 18
- 125000004093 cyano group Chemical group *C#N 0.000 description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 17
- 229940079593 drug Drugs 0.000 description 17
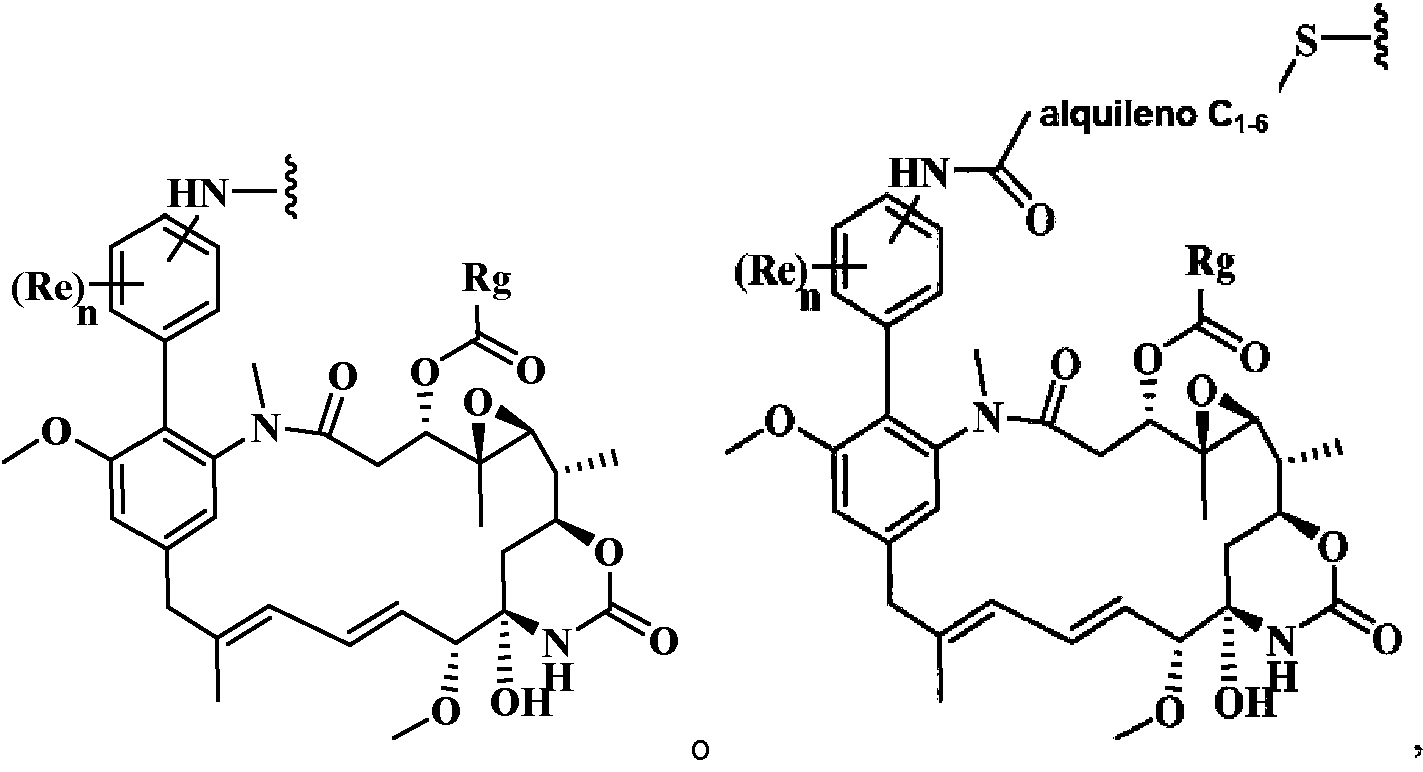
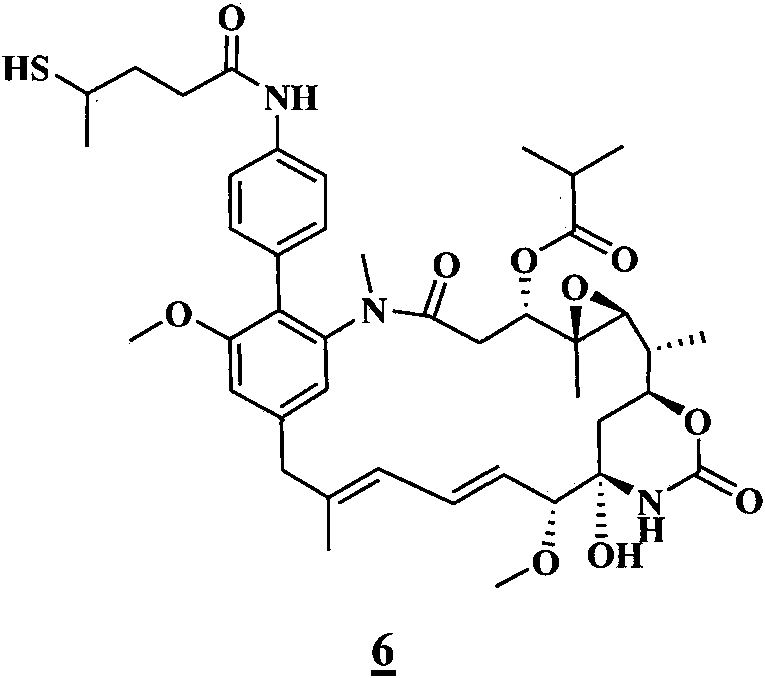
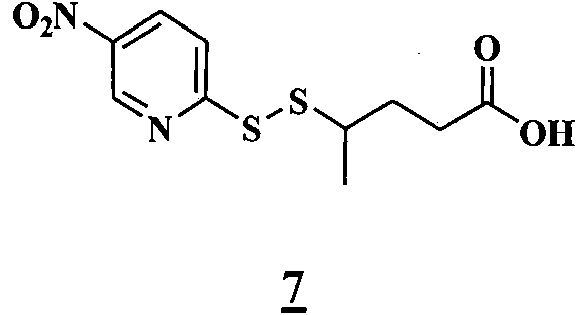
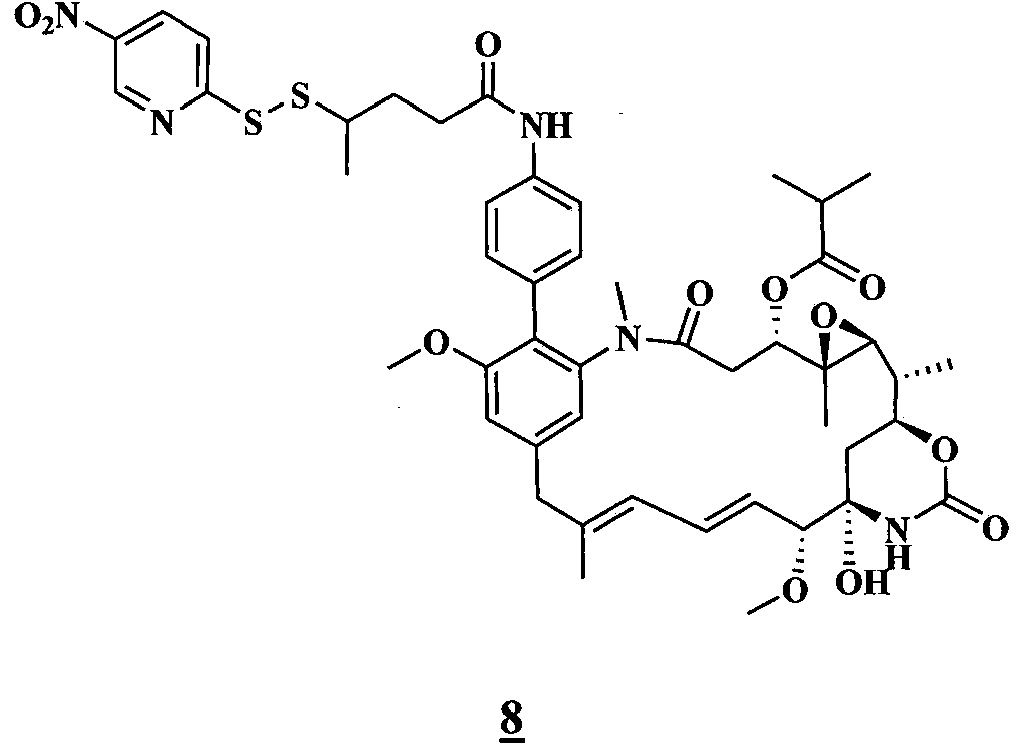
- 0 C[C@@](C(O[C@@](CC(N(C)C(C1Cl)C=C(CC(C)=CC=C[C@]([C@@](C2)(*3)O)OC)C=C1OC)=O)[C@]1(C)O[C@]1[C@](C)C2OC3=O)=O)N(C)C(CCS)=O Chemical compound C[C@@](C(O[C@@](CC(N(C)C(C1Cl)C=C(CC(C)=CC=C[C@]([C@@](C2)(*3)O)OC)C=C1OC)=O)[C@]1(C)O[C@]1[C@](C)C2OC3=O)=O)N(C)C(CCS)=O 0.000 description 16
- 101000936922 Homo sapiens Sarcoplasmic/endoplasmic reticulum calcium ATPase 2 Proteins 0.000 description 16
- 102100027732 Sarcoplasmic/endoplasmic reticulum calcium ATPase 2 Human genes 0.000 description 16
- 230000001472 cytotoxic effect Effects 0.000 description 16
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 16
- 239000001488 sodium phosphate Substances 0.000 description 16
- 229910000162 sodium phosphate Inorganic materials 0.000 description 16
- 238000003756 stirring Methods 0.000 description 16
- 238000011282 treatment Methods 0.000 description 16
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 16
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 15
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 15
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 15
- 238000012512 characterization method Methods 0.000 description 15
- 231100000433 cytotoxic Toxicity 0.000 description 15
- 229910052731 fluorine Inorganic materials 0.000 description 15
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 14
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 14
- 239000012044 organic layer Substances 0.000 description 14
- 239000011780 sodium chloride Substances 0.000 description 14
- 229960000575 trastuzumab Drugs 0.000 description 14
- 239000003960 organic solvent Substances 0.000 description 13
- 239000011734 sodium Substances 0.000 description 13
- 239000002904 solvent Substances 0.000 description 13
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 13
- 102100034741 Cyclin-dependent kinase 20 Human genes 0.000 description 12
- 239000007821 HATU Substances 0.000 description 12
- 101500014379 Lymnaea stagnalis Ovulation hormone Proteins 0.000 description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 239000011737 fluorine Substances 0.000 description 12
- YSUIQYOGTINQIN-UZFYAQMZSA-N 2-amino-9-[(1S,6R,8R,9S,10R,15R,17R,18R)-8-(6-aminopurin-9-yl)-9,18-difluoro-3,12-dihydroxy-3,12-bis(sulfanylidene)-2,4,7,11,13,16-hexaoxa-3lambda5,12lambda5-diphosphatricyclo[13.2.1.06,10]octadecan-17-yl]-1H-purin-6-one Chemical compound NC1=NC2=C(N=CN2[C@@H]2O[C@@H]3COP(S)(=O)O[C@@H]4[C@@H](COP(S)(=O)O[C@@H]2[C@@H]3F)O[C@H]([C@H]4F)N2C=NC3=C2N=CN=C3N)C(=O)N1 YSUIQYOGTINQIN-UZFYAQMZSA-N 0.000 description 11
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 11
- 125000003277 amino group Chemical group 0.000 description 11
- 239000003125 aqueous solvent Substances 0.000 description 11
- 239000012267 brine Substances 0.000 description 11
- 201000011510 cancer Diseases 0.000 description 11
- 238000004108 freeze drying Methods 0.000 description 11
- 229910052757 nitrogen Inorganic materials 0.000 description 11
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 11
- VNFWTIYUKDMAOP-UHFFFAOYSA-N sphos Chemical group COC1=CC=CC(OC)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 VNFWTIYUKDMAOP-UHFFFAOYSA-N 0.000 description 11
- 125000001424 substituent group Chemical group 0.000 description 11
- 238000006069 Suzuki reaction reaction Methods 0.000 description 10
- 239000010410 layer Substances 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- 229920000858 Cyclodextrin Polymers 0.000 description 9
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 9
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-diisopropylethylamine Substances CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 9
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 125000004429 atom Chemical group 0.000 description 9
- 230000015556 catabolic process Effects 0.000 description 9
- 238000006731 degradation reaction Methods 0.000 description 9
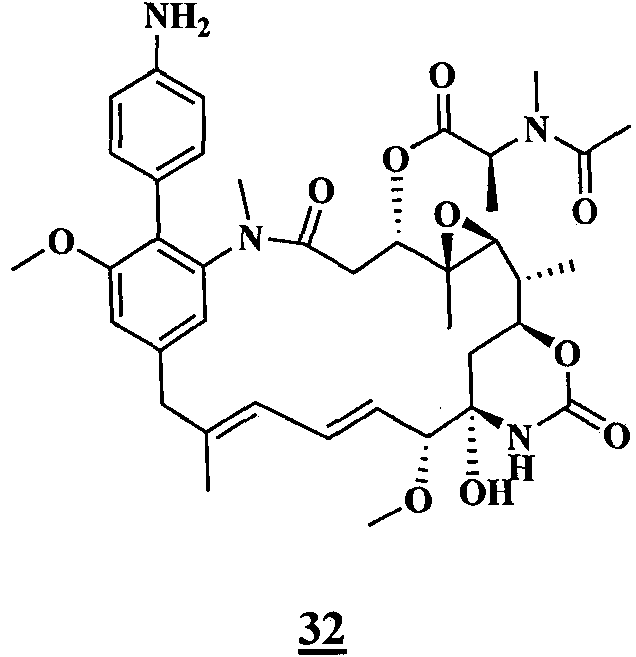
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 238000010926 purge Methods 0.000 description 9
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 8
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 8
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 8
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 8
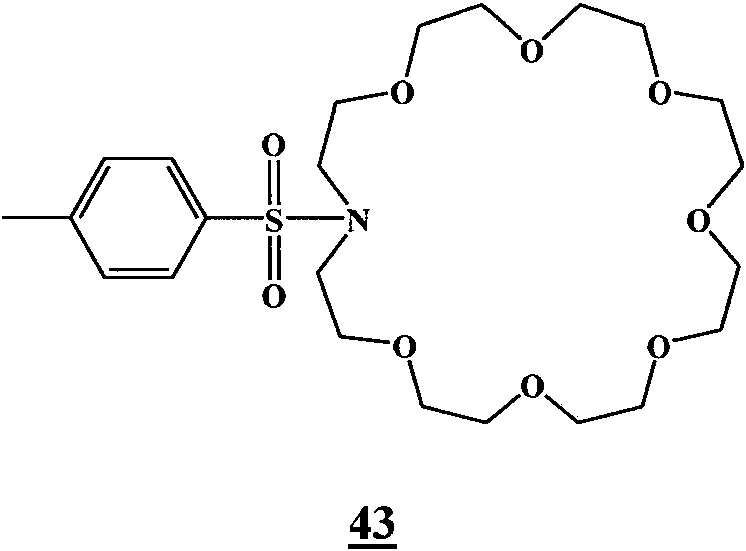
- 150000003983 crown ethers Chemical class 0.000 description 8
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 8
- 235000019253 formic acid Nutrition 0.000 description 8
- 150000002431 hydrogen Chemical group 0.000 description 8
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 8
- 210000002966 serum Anatomy 0.000 description 8
- 241000894007 species Species 0.000 description 8
- 150000003573 thiols Chemical class 0.000 description 8
- 230000035899 viability Effects 0.000 description 8
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 7
- 241001465754 Metazoa Species 0.000 description 7
- 241000699666 Mus <mouse, genus> Species 0.000 description 7
- 229940024606 amino acid Drugs 0.000 description 7
- 230000001363 autoimmune Effects 0.000 description 7
- 238000000338 in vitro Methods 0.000 description 7
- 239000000543 intermediate Substances 0.000 description 7
- 239000012528 membrane Substances 0.000 description 7
- 125000004433 nitrogen atom Chemical group N* 0.000 description 7
- 230000000269 nucleophilic effect Effects 0.000 description 7
- 125000004430 oxygen atom Chemical group O* 0.000 description 7
- 230000004962 physiological condition Effects 0.000 description 7
- 102000004196 processed proteins & peptides Human genes 0.000 description 7
- 238000006722 reduction reaction Methods 0.000 description 7
- 210000004881 tumor cell Anatomy 0.000 description 7
- NEAFWRKPYYJETG-UHFFFAOYSA-N 4-sulfanylpentanoic acid Chemical compound CC(S)CCC(O)=O NEAFWRKPYYJETG-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 6
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 6
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 6
- 239000004472 Lysine Substances 0.000 description 6
- 229930126263 Maytansine Natural products 0.000 description 6
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- 150000007513 acids Chemical class 0.000 description 6
- 125000005529 alkyleneoxy group Chemical group 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000004587 chromatography analysis Methods 0.000 description 6
- 229940125898 compound 5 Drugs 0.000 description 6
- 150000002148 esters Chemical class 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 229920001515 polyalkylene glycol Polymers 0.000 description 6
- 230000002062 proliferating effect Effects 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 5
- HUWSZNZAROKDRZ-RRLWZMAJSA-N (3r,4r)-3-azaniumyl-5-[[(2s,3r)-1-[(2s)-2,3-dicarboxypyrrolidin-1-yl]-3-methyl-1-oxopentan-2-yl]amino]-5-oxo-4-sulfanylpentane-1-sulfonate Chemical compound OS(=O)(=O)CC[C@@H](N)[C@@H](S)C(=O)N[C@@H]([C@H](C)CC)C(=O)N1CCC(C(O)=O)[C@H]1C(O)=O HUWSZNZAROKDRZ-RRLWZMAJSA-N 0.000 description 5
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 5
- 208000023275 Autoimmune disease Diseases 0.000 description 5
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 5
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 5
- PZBFGYYEXUXCOF-UHFFFAOYSA-N TCEP Chemical compound OC(=O)CCP(CCC(O)=O)CCC(O)=O PZBFGYYEXUXCOF-UHFFFAOYSA-N 0.000 description 5
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 5
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 5
- 229960000455 brentuximab vedotin Drugs 0.000 description 5
- 239000003638 chemical reducing agent Substances 0.000 description 5
- 229940126142 compound 16 Drugs 0.000 description 5
- 230000008878 coupling Effects 0.000 description 5
- 238000010168 coupling process Methods 0.000 description 5
- 238000005859 coupling reaction Methods 0.000 description 5
- 239000007857 degradation product Substances 0.000 description 5
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 5
- 150000002367 halogens Chemical class 0.000 description 5
- 238000004128 high performance liquid chromatography Methods 0.000 description 5
- 230000014759 maintenance of location Effects 0.000 description 5
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 5
- 229910052938 sodium sulfate Inorganic materials 0.000 description 5
- 235000011152 sodium sulphate Nutrition 0.000 description 5
- 229960001612 trastuzumab emtansine Drugs 0.000 description 5
- QWPXBEHQFHACTK-KZVYIGENSA-N (10e,12e)-86-chloro-12,14,4-trihydroxy-85,14-dimethoxy-33,2,7,10-tetramethyl-15,16-dihydro-14h-7-aza-1(6,4)-oxazina-3(2,3)-oxirana-8(1,3)-benzenacyclotetradecaphane-10,12-dien-6-one Chemical compound CN1C(=O)CC(O)C2(C)OC2C(C)C(OC(=O)N2)CC2(O)C(OC)\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 QWPXBEHQFHACTK-KZVYIGENSA-N 0.000 description 4
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 4
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 4
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 4
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 4
- WWTBZEKOSBFBEM-SPWPXUSOSA-N (2s)-2-[[2-benzyl-3-[hydroxy-[(1r)-2-phenyl-1-(phenylmethoxycarbonylamino)ethyl]phosphoryl]propanoyl]amino]-3-(1h-indol-3-yl)propanoic acid Chemical compound N([C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)O)C(=O)C(CP(O)(=O)[C@H](CC=1C=CC=CC=1)NC(=O)OCC=1C=CC=CC=1)CC1=CC=CC=C1 WWTBZEKOSBFBEM-SPWPXUSOSA-N 0.000 description 4
- STBLNCCBQMHSRC-BATDWUPUSA-N (2s)-n-[(3s,4s)-5-acetyl-7-cyano-4-methyl-1-[(2-methylnaphthalen-1-yl)methyl]-2-oxo-3,4-dihydro-1,5-benzodiazepin-3-yl]-2-(methylamino)propanamide Chemical compound O=C1[C@@H](NC(=O)[C@H](C)NC)[C@H](C)N(C(C)=O)C2=CC(C#N)=CC=C2N1CC1=C(C)C=CC2=CC=CC=C12 STBLNCCBQMHSRC-BATDWUPUSA-N 0.000 description 4
- FNHHVPPSBFQMEL-KQHDFZBMSA-N (3S)-5-N-[(1S,5R)-3-hydroxy-6-bicyclo[3.1.0]hexanyl]-7-N,3-dimethyl-3-phenyl-2H-1-benzofuran-5,7-dicarboxamide Chemical compound CNC(=O)c1cc(cc2c1OC[C@@]2(C)c1ccccc1)C(=O)NC1[C@H]2CC(O)C[C@@H]12 FNHHVPPSBFQMEL-KQHDFZBMSA-N 0.000 description 4
- IWZSHWBGHQBIML-ZGGLMWTQSA-N (3S,8S,10R,13S,14S,17S)-17-isoquinolin-7-yl-N,N,10,13-tetramethyl-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-amine Chemical compound CN(C)[C@H]1CC[C@]2(C)C3CC[C@@]4(C)[C@@H](CC[C@@H]4c4ccc5ccncc5c4)[C@@H]3CC=C2C1 IWZSHWBGHQBIML-ZGGLMWTQSA-N 0.000 description 4
- FPIRBHDGWMWJEP-UHFFFAOYSA-N 1-hydroxy-7-azabenzotriazole Chemical compound C1=CN=C2N(O)N=NC2=C1 FPIRBHDGWMWJEP-UHFFFAOYSA-N 0.000 description 4
- VVJKKWFAADXIJK-UHFFFAOYSA-N Allylamine Chemical compound NCC=C VVJKKWFAADXIJK-UHFFFAOYSA-N 0.000 description 4
- OJRUSAPKCPIVBY-KQYNXXCUSA-N C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N Chemical compound C1=NC2=C(N=C(N=C2N1[C@H]3[C@@H]([C@@H]([C@H](O3)COP(=O)(CP(=O)(O)O)O)O)O)I)N OJRUSAPKCPIVBY-KQYNXXCUSA-N 0.000 description 4
- KCBAMQOKOLXLOX-BSZYMOERSA-N CC1=C(SC=N1)C2=CC=C(C=C2)[C@H](C)NC(=O)[C@@H]3C[C@H](CN3C(=O)[C@H](C(C)(C)C)NC(=O)CCCCCCCCCCNCCCONC(=O)C4=C(C(=C(C=C4)F)F)NC5=C(C=C(C=C5)I)F)O Chemical compound CC1=C(SC=N1)C2=CC=C(C=C2)[C@H](C)NC(=O)[C@@H]3C[C@H](CN3C(=O)[C@H](C(C)(C)C)NC(=O)CCCCCCCCCCNCCCONC(=O)C4=C(C(=C(C=C4)F)F)NC5=C(C=C(C=C5)I)F)O KCBAMQOKOLXLOX-BSZYMOERSA-N 0.000 description 4
- BQXUPNKLZNSUMC-YUQWMIPFSA-N CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 Chemical compound CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 BQXUPNKLZNSUMC-YUQWMIPFSA-N 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- 208000035473 Communicable disease Diseases 0.000 description 4
- 229940126657 Compound 17 Drugs 0.000 description 4
- 229940126639 Compound 33 Drugs 0.000 description 4
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 4
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 4
- QWPXBEHQFHACTK-UHFFFAOYSA-N Maytansinol Natural products CN1C(=O)CC(O)C2(C)OC2C(C)C(OC(=O)N2)CC2(O)C(OC)C=CC=C(C)CC2=CC(OC)=C(Cl)C1=C2 QWPXBEHQFHACTK-UHFFFAOYSA-N 0.000 description 4
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 4
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 4
- OPFJDXRVMFKJJO-ZHHKINOHSA-N N-{[3-(2-benzamido-4-methyl-1,3-thiazol-5-yl)-pyrazol-5-yl]carbonyl}-G-dR-G-dD-dD-dD-NH2 Chemical compound S1C(C=2NN=C(C=2)C(=O)NCC(=O)N[C@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(N)=O)=C(C)N=C1NC(=O)C1=CC=CC=C1 OPFJDXRVMFKJJO-ZHHKINOHSA-N 0.000 description 4
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 4
- PNUZDKCDAWUEGK-CYZMBNFOSA-N Sitafloxacin Chemical compound C([C@H]1N)N(C=2C(=C3C(C(C(C(O)=O)=CN3[C@H]3[C@H](C3)F)=O)=CC=2F)Cl)CC11CC1 PNUZDKCDAWUEGK-CYZMBNFOSA-N 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- SPXSEZMVRJLHQG-XMMPIXPASA-N [(2R)-1-[[4-[(3-phenylmethoxyphenoxy)methyl]phenyl]methyl]pyrrolidin-2-yl]methanol Chemical compound C(C1=CC=CC=C1)OC=1C=C(OCC2=CC=C(CN3[C@H](CCC3)CO)C=C2)C=CC=1 SPXSEZMVRJLHQG-XMMPIXPASA-N 0.000 description 4
- 230000003213 activating effect Effects 0.000 description 4
- 125000002877 alkyl aryl group Chemical group 0.000 description 4
- 125000005037 alkyl phenyl group Chemical group 0.000 description 4
- 238000007112 amidation reaction Methods 0.000 description 4
- 239000003242 anti bacterial agent Substances 0.000 description 4
- 229940088710 antibiotic agent Drugs 0.000 description 4
- 239000012300 argon atmosphere Substances 0.000 description 4
- 229940009098 aspartate Drugs 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 239000012230 colorless oil Substances 0.000 description 4
- 229940125773 compound 10 Drugs 0.000 description 4
- 229940125797 compound 12 Drugs 0.000 description 4
- 229940126543 compound 14 Drugs 0.000 description 4
- 229940125758 compound 15 Drugs 0.000 description 4
- 229940126086 compound 21 Drugs 0.000 description 4
- 229940126208 compound 22 Drugs 0.000 description 4
- 229940125833 compound 23 Drugs 0.000 description 4
- 229940126214 compound 3 Drugs 0.000 description 4
- 229940125878 compound 36 Drugs 0.000 description 4
- 229940127573 compound 38 Drugs 0.000 description 4
- 229940127271 compound 49 Drugs 0.000 description 4
- 239000012468 concentrated sample Substances 0.000 description 4
- 238000012258 culturing Methods 0.000 description 4
- 235000018417 cysteine Nutrition 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 230000002255 enzymatic effect Effects 0.000 description 4
- 229930195712 glutamate Natural products 0.000 description 4
- 229940049906 glutamate Drugs 0.000 description 4
- 238000010438 heat treatment Methods 0.000 description 4
- 230000007062 hydrolysis Effects 0.000 description 4
- 238000006460 hydrolysis reaction Methods 0.000 description 4
- 230000003301 hydrolyzing effect Effects 0.000 description 4
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 4
- 125000000468 ketone group Chemical group 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 230000002503 metabolic effect Effects 0.000 description 4
- PIDFDZJZLOTZTM-KHVQSSSXSA-N ombitasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)NC1=CC=C([C@H]2N([C@@H](CC2)C=2C=CC(NC(=O)[C@H]3N(CCC3)C(=O)[C@@H](NC(=O)OC)C(C)C)=CC=2)C=2C=CC(=CC=2)C(C)(C)C)C=C1 PIDFDZJZLOTZTM-KHVQSSSXSA-N 0.000 description 4
- 230000003389 potentiating effect Effects 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 239000011550 stock solution Substances 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 4
- 235000019798 tripotassium phosphate Nutrition 0.000 description 4
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 4
- IUSARDYWEPUTPN-OZBXUNDUSA-N (2r)-n-[(2s,3r)-4-[[(4s)-6-(2,2-dimethylpropyl)spiro[3,4-dihydropyrano[2,3-b]pyridine-2,1'-cyclobutane]-4-yl]amino]-3-hydroxy-1-[3-(1,3-thiazol-2-yl)phenyl]butan-2-yl]-2-methoxypropanamide Chemical compound C([C@H](NC(=O)[C@@H](C)OC)[C@H](O)CN[C@@H]1C2=CC(CC(C)(C)C)=CN=C2OC2(CCC2)C1)C(C=1)=CC=CC=1C1=NC=CS1 IUSARDYWEPUTPN-OZBXUNDUSA-N 0.000 description 3
- YJLIKUSWRSEPSM-WGQQHEPDSA-N (2r,3r,4s,5r)-2-[6-amino-8-[(4-phenylphenyl)methylamino]purin-9-yl]-5-(hydroxymethyl)oxolane-3,4-diol Chemical compound C=1C=C(C=2C=CC=CC=2)C=CC=1CNC1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O YJLIKUSWRSEPSM-WGQQHEPDSA-N 0.000 description 3
- UMRUUWFGLGNQLI-QFIPXVFZSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-6-[(2-methylpropan-2-yl)oxycarbonylamino]hexanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CCCCNC(=O)OC(C)(C)C)C(O)=O)C3=CC=CC=C3C2=C1 UMRUUWFGLGNQLI-QFIPXVFZSA-N 0.000 description 3
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 3
- YQOLEILXOBUDMU-KRWDZBQOSA-N (4R)-5-[(6-bromo-3-methyl-2-pyrrolidin-1-ylquinoline-4-carbonyl)amino]-4-(2-chlorophenyl)pentanoic acid Chemical compound CC1=C(C2=C(C=CC(=C2)Br)N=C1N3CCCC3)C(=O)NC[C@H](CCC(=O)O)C4=CC=CC=C4Cl YQOLEILXOBUDMU-KRWDZBQOSA-N 0.000 description 3
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 3
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 3
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 3
- TWBPWBPGNQWFSJ-UHFFFAOYSA-N 2-phenylaniline Chemical group NC1=CC=CC=C1C1=CC=CC=C1 TWBPWBPGNQWFSJ-UHFFFAOYSA-N 0.000 description 3
- BGAJNPLDJJBRHK-UHFFFAOYSA-N 3-[2-[5-(3-chloro-4-propan-2-yloxyphenyl)-1,3,4-thiadiazol-2-yl]-3-methyl-6,7-dihydro-4h-pyrazolo[4,3-c]pyridin-5-yl]propanoic acid Chemical compound C1=C(Cl)C(OC(C)C)=CC=C1C1=NN=C(N2C(=C3CN(CCC(O)=O)CCC3=N2)C)S1 BGAJNPLDJJBRHK-UHFFFAOYSA-N 0.000 description 3
- DQAZPZIYEOGZAF-UHFFFAOYSA-N 4-ethyl-n-[4-(3-ethynylanilino)-7-methoxyquinazolin-6-yl]piperazine-1-carboxamide Chemical compound C1CN(CC)CCN1C(=O)NC(C(=CC1=NC=N2)OC)=CC1=C2NC1=CC=CC(C#C)=C1 DQAZPZIYEOGZAF-UHFFFAOYSA-N 0.000 description 3
- XFJBGINZIMNZBW-CRAIPNDOSA-N 5-chloro-2-[4-[(1r,2s)-2-[2-(5-methylsulfonylpyridin-2-yl)oxyethyl]cyclopropyl]piperidin-1-yl]pyrimidine Chemical compound N1=CC(S(=O)(=O)C)=CC=C1OCC[C@H]1[C@@H](C2CCN(CC2)C=2N=CC(Cl)=CN=2)C1 XFJBGINZIMNZBW-CRAIPNDOSA-N 0.000 description 3
- RSIWALKZYXPAGW-NSHDSACASA-N 6-(3-fluorophenyl)-3-methyl-7-[(1s)-1-(7h-purin-6-ylamino)ethyl]-[1,3]thiazolo[3,2-a]pyrimidin-5-one Chemical compound C=1([C@@H](NC=2C=3N=CNC=3N=CN=2)C)N=C2SC=C(C)N2C(=O)C=1C1=CC=CC(F)=C1 RSIWALKZYXPAGW-NSHDSACASA-N 0.000 description 3
- 108090000371 Esterases Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 3
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 3
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 3
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 3
- 238000006957 Michael reaction Methods 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical class ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 125000003172 aldehyde group Chemical group 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 3
- 150000005347 biaryls Chemical group 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 239000004305 biphenyl Substances 0.000 description 3
- 150000001720 carbohydrates Chemical class 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 3
- 230000003833 cell viability Effects 0.000 description 3
- 125000001309 chloro group Chemical group Cl* 0.000 description 3
- 238000003776 cleavage reaction Methods 0.000 description 3
- 229940125810 compound 20 Drugs 0.000 description 3
- 229940125961 compound 24 Drugs 0.000 description 3
- 229940125807 compound 37 Drugs 0.000 description 3
- 229940125844 compound 46 Drugs 0.000 description 3
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 3
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 3
- BJXYHBKEQFQVES-NWDGAFQWSA-N enpatoran Chemical compound N[C@H]1CN(C[C@H](C1)C(F)(F)F)C1=C2C=CC=NC2=C(C=C1)C#N BJXYHBKEQFQVES-NWDGAFQWSA-N 0.000 description 3
- 125000004185 ester group Chemical group 0.000 description 3
- GWNFQAKCJYEJEW-UHFFFAOYSA-N ethyl 3-[8-[[4-methyl-5-[(3-methyl-4-oxophthalazin-1-yl)methyl]-1,2,4-triazol-3-yl]sulfanyl]octanoylamino]benzoate Chemical compound CCOC(=O)C1=CC(NC(=O)CCCCCCCSC2=NN=C(CC3=NN(C)C(=O)C4=CC=CC=C34)N2C)=CC=C1 GWNFQAKCJYEJEW-UHFFFAOYSA-N 0.000 description 3
- 125000001153 fluoro group Chemical group F* 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- JAXFJECJQZDFJS-XHEPKHHKSA-N gtpl8555 Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)N[C@H](B1O[C@@]2(C)[C@H]3C[C@H](C3(C)C)C[C@H]2O1)CCC1=CC=C(F)C=C1 JAXFJECJQZDFJS-XHEPKHHKSA-N 0.000 description 3
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 3
- OAKJQQAXSVQMHS-UHFFFAOYSA-N hydrazine group Chemical group NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 3
- 150000002576 ketones Chemical class 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 239000012299 nitrogen atmosphere Substances 0.000 description 3
- MUJIDPITZJWBSW-UHFFFAOYSA-N palladium(2+) Chemical compound [Pd+2] MUJIDPITZJWBSW-UHFFFAOYSA-N 0.000 description 3
- 238000007911 parenteral administration Methods 0.000 description 3
- 238000002953 preparative HPLC Methods 0.000 description 3
- 235000019419 proteases Nutrition 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 230000007017 scission Effects 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- 239000003039 volatile agent Substances 0.000 description 3
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 2
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 2
- OZFAFGSSMRRTDW-UHFFFAOYSA-N (2,4-dichlorophenyl) benzenesulfonate Chemical compound ClC1=CC(Cl)=CC=C1OS(=O)(=O)C1=CC=CC=C1 OZFAFGSSMRRTDW-UHFFFAOYSA-N 0.000 description 2
- VIJSPAIQWVPKQZ-BLECARSGSA-N (2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-acetamido-5-(diaminomethylideneamino)pentanoyl]amino]-4-methylpentanoyl]amino]-4,4-dimethylpentanoyl]amino]-4-methylpentanoyl]amino]propanoyl]amino]-5-(diaminomethylideneamino)pentanoic acid Chemical compound NC(=N)NCCC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(C)=O VIJSPAIQWVPKQZ-BLECARSGSA-N 0.000 description 2
- UDQTXCHQKHIQMH-KYGLGHNPSA-N (3ar,5s,6s,7r,7ar)-5-(difluoromethyl)-2-(ethylamino)-5,6,7,7a-tetrahydro-3ah-pyrano[3,2-d][1,3]thiazole-6,7-diol Chemical compound S1C(NCC)=N[C@H]2[C@@H]1O[C@H](C(F)F)[C@@H](O)[C@@H]2O UDQTXCHQKHIQMH-KYGLGHNPSA-N 0.000 description 2
- STPKWKPURVSAJF-LJEWAXOPSA-N (4r,5r)-5-[4-[[4-(1-aza-4-azoniabicyclo[2.2.2]octan-4-ylmethyl)phenyl]methoxy]phenyl]-3,3-dibutyl-7-(dimethylamino)-1,1-dioxo-4,5-dihydro-2h-1$l^{6}-benzothiepin-4-ol Chemical compound O[C@H]1C(CCCC)(CCCC)CS(=O)(=O)C2=CC=C(N(C)C)C=C2[C@H]1C(C=C1)=CC=C1OCC(C=C1)=CC=C1C[N+]1(CC2)CCN2CC1 STPKWKPURVSAJF-LJEWAXOPSA-N 0.000 description 2
- KKHFRAFPESRGGD-UHFFFAOYSA-N 1,3-dimethyl-7-[3-(n-methylanilino)propyl]purine-2,6-dione Chemical compound C1=NC=2N(C)C(=O)N(C)C(=O)C=2N1CCCN(C)C1=CC=CC=C1 KKHFRAFPESRGGD-UHFFFAOYSA-N 0.000 description 2
- MHSLDASSAFCCDO-UHFFFAOYSA-N 1-(5-tert-butyl-2-methylpyrazol-3-yl)-3-(4-pyridin-4-yloxyphenyl)urea Chemical compound CN1N=C(C(C)(C)C)C=C1NC(=O)NC(C=C1)=CC=C1OC1=CC=NC=C1 MHSLDASSAFCCDO-UHFFFAOYSA-N 0.000 description 2
- ZSKXYSCQDWAUCM-UHFFFAOYSA-N 1-(chloromethyl)-2-dodecylbenzene Chemical compound CCCCCCCCCCCCC1=CC=CC=C1CCl ZSKXYSCQDWAUCM-UHFFFAOYSA-N 0.000 description 2
- GPAAEZIXSQCCES-UHFFFAOYSA-N 1-methoxy-2-(2-methoxyethoxymethoxymethoxy)ethane Chemical compound COCCOCOCOCCOC GPAAEZIXSQCCES-UHFFFAOYSA-N 0.000 description 2
- PYRKKGOKRMZEIT-UHFFFAOYSA-N 2-[6-(2-cyclopropylethoxy)-9-(2-hydroxy-2-methylpropyl)-1h-phenanthro[9,10-d]imidazol-2-yl]-5-fluorobenzene-1,3-dicarbonitrile Chemical compound C1=C2C3=CC(CC(C)(O)C)=CC=C3C=3NC(C=4C(=CC(F)=CC=4C#N)C#N)=NC=3C2=CC=C1OCCC1CC1 PYRKKGOKRMZEIT-UHFFFAOYSA-N 0.000 description 2
- VVCMGAUPZIKYTH-VGHSCWAPSA-N 2-acetyloxybenzoic acid;[(2s,3r)-4-(dimethylamino)-3-methyl-1,2-diphenylbutan-2-yl] propanoate;1,3,7-trimethylpurine-2,6-dione Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O.CN1C(=O)N(C)C(=O)C2=C1N=CN2C.C([C@](OC(=O)CC)([C@H](C)CN(C)C)C=1C=CC=CC=1)C1=CC=CC=C1 VVCMGAUPZIKYTH-VGHSCWAPSA-N 0.000 description 2
- YOETUEMZNOLGDB-UHFFFAOYSA-N 2-methylpropyl carbonochloridate Chemical compound CC(C)COC(Cl)=O YOETUEMZNOLGDB-UHFFFAOYSA-N 0.000 description 2
- MGADZUXDNSDTHW-UHFFFAOYSA-N 2H-pyran Chemical compound C1OC=CC=C1 MGADZUXDNSDTHW-UHFFFAOYSA-N 0.000 description 2
- HGOBHXGITKMPPL-UHFFFAOYSA-N 4-[3-(4-methylphenyl)sulfonyl-2-[(4-methylphenyl)sulfonylmethyl]propanoyl]benzoic acid Chemical compound C1=CC(C)=CC=C1S(=O)(=O)CC(C(=O)C=1C=CC(=CC=1)C(O)=O)CS(=O)(=O)C1=CC=C(C)C=C1 HGOBHXGITKMPPL-UHFFFAOYSA-N 0.000 description 2
- SYIFSIGCMOMQRB-UHFFFAOYSA-N 4-methyl-4-sulfanylpentanoic acid Chemical compound CC(C)(S)CCC(O)=O SYIFSIGCMOMQRB-UHFFFAOYSA-N 0.000 description 2
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 2
- ROUFCTKIILEETD-UHFFFAOYSA-N 5-nitro-2-[(5-nitropyridin-2-yl)disulfanyl]pyridine Chemical compound N1=CC([N+](=O)[O-])=CC=C1SSC1=CC=C([N+]([O-])=O)C=N1 ROUFCTKIILEETD-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- 229940122361 Bisphosphonate Drugs 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 2
- 229940127007 Compound 39 Drugs 0.000 description 2
- 108010092160 Dactinomycin Proteins 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- 239000012591 Dulbecco’s Phosphate Buffered Saline Substances 0.000 description 2
- RRSNDVCODIMOFX-MPKOGUQCSA-N Fc1c(Cl)cccc1[C@H]1[C@@H](NC2(CCCCC2)[C@@]11C(=O)Nc2cc(Cl)ccc12)C(=O)Nc1ccc(cc1)C(=O)NCCCCCc1cccc2C(=O)N(Cc12)C1CCC(=O)NC1=O Chemical compound Fc1c(Cl)cccc1[C@H]1[C@@H](NC2(CCCCC2)[C@@]11C(=O)Nc2cc(Cl)ccc12)C(=O)Nc1ccc(cc1)C(=O)NCCCCCc1cccc2C(=O)N(Cc12)C1CCC(=O)NC1=O RRSNDVCODIMOFX-MPKOGUQCSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- 229920001710 Polyorthoester Polymers 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 2
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 2
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 2
- 238000003514 Retro-Michael reaction Methods 0.000 description 2
- XYONNSVDNIRXKZ-UHFFFAOYSA-N S-methyl methanethiosulfonate Chemical compound CSS(C)(=O)=O XYONNSVDNIRXKZ-UHFFFAOYSA-N 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- 238000006161 Suzuki-Miyaura coupling reaction Methods 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 2
- PVNFMCBFDPTNQI-UIBOPQHZSA-N [(1S,2R,5S,6S,16E,18E,20R,21S)-11-chloro-21-hydroxy-12,20-dimethoxy-2,5,9,16-tetramethyl-8,23-dioxo-4,24-dioxa-9,22-diazatetracyclo[19.3.1.110,14.03,5]hexacosa-10,12,14(26),16,18-pentaen-6-yl] acetate [(1S,2R,5S,6S,16E,18E,20R,21S)-11-chloro-21-hydroxy-12,20-dimethoxy-2,5,9,16-tetramethyl-8,23-dioxo-4,24-dioxa-9,22-diazatetracyclo[19.3.1.110,14.03,5]hexacosa-10,12,14(26),16,18-pentaen-6-yl] 3-methylbutanoate [(1S,2R,5S,6S,16E,18E,20R,21S)-11-chloro-21-hydroxy-12,20-dimethoxy-2,5,9,16-tetramethyl-8,23-dioxo-4,24-dioxa-9,22-diazatetracyclo[19.3.1.110,14.03,5]hexacosa-10,12,14(26),16,18-pentaen-6-yl] 2-methylpropanoate [(1S,2R,5S,6S,16E,18E,20R,21S)-11-chloro-21-hydroxy-12,20-dimethoxy-2,5,9,16-tetramethyl-8,23-dioxo-4,24-dioxa-9,22-diazatetracyclo[19.3.1.110,14.03,5]hexacosa-10,12,14(26),16,18-pentaen-6-yl] propanoate Chemical class CO[C@@H]1\C=C\C=C(C)\Cc2cc(OC)c(Cl)c(c2)N(C)C(=O)C[C@H](OC(C)=O)[C@]2(C)OC2[C@H](C)[C@@H]2C[C@@]1(O)NC(=O)O2.CCC(=O)O[C@H]1CC(=O)N(C)c2cc(C\C(C)=C\C=C\[C@@H](OC)[C@@]3(O)C[C@H](OC(=O)N3)[C@@H](C)C3O[C@@]13C)cc(OC)c2Cl.CO[C@@H]1\C=C\C=C(C)\Cc2cc(OC)c(Cl)c(c2)N(C)C(=O)C[C@H](OC(=O)C(C)C)[C@]2(C)OC2[C@H](C)[C@@H]2C[C@@]1(O)NC(=O)O2.CO[C@@H]1\C=C\C=C(C)\Cc2cc(OC)c(Cl)c(c2)N(C)C(=O)C[C@H](OC(=O)CC(C)C)[C@]2(C)OC2[C@H](C)[C@@H]2C[C@@]1(O)NC(=O)O2 PVNFMCBFDPTNQI-UIBOPQHZSA-N 0.000 description 2
- PSLUFJFHTBIXMW-WYEYVKMPSA-N [(3r,4ar,5s,6s,6as,10s,10ar,10bs)-3-ethenyl-10,10b-dihydroxy-3,4a,7,7,10a-pentamethyl-1-oxo-6-(2-pyridin-2-ylethylcarbamoyloxy)-5,6,6a,8,9,10-hexahydro-2h-benzo[f]chromen-5-yl] acetate Chemical compound O([C@@H]1[C@@H]([C@]2(O[C@](C)(CC(=O)[C@]2(O)[C@@]2(C)[C@@H](O)CCC(C)(C)[C@@H]21)C=C)C)OC(=O)C)C(=O)NCCC1=CC=CC=N1 PSLUFJFHTBIXMW-WYEYVKMPSA-N 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 238000005804 alkylation reaction Methods 0.000 description 2
- IYABWNGZIDDRAK-UHFFFAOYSA-N allene Chemical group C=C=C IYABWNGZIDDRAK-UHFFFAOYSA-N 0.000 description 2
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 150000003862 amino acid derivatives Chemical class 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 239000012431 aqueous reaction media Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 150000001500 aryl chlorides Chemical group 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 235000010290 biphenyl Nutrition 0.000 description 2
- 150000004663 bisphosphonates Chemical class 0.000 description 2
- 229920001400 block copolymer Polymers 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Chemical compound BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 238000006555 catalytic reaction Methods 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 229940125936 compound 42 Drugs 0.000 description 2
- 229940097362 cyclodextrins Drugs 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 238000010612 desalination reaction Methods 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 125000006575 electron-withdrawing group Chemical group 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- CHPZKNULDCNCBW-UHFFFAOYSA-N gallium nitrate Chemical compound [Ga+3].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O CHPZKNULDCNCBW-UHFFFAOYSA-N 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 150000007857 hydrazones Chemical class 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 239000012280 lithium aluminium hydride Substances 0.000 description 2
- 238000004020 luminiscence type Methods 0.000 description 2
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 108010082117 matrigel Proteins 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- NSPJNIDYTSSIIY-UHFFFAOYSA-N methoxy(methoxymethoxy)methane Chemical compound COCOCOC NSPJNIDYTSSIIY-UHFFFAOYSA-N 0.000 description 2
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 229950002142 minretumomab Drugs 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- 239000011574 phosphorus Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920001308 poly(aminoacid) Polymers 0.000 description 2
- 229920000728 polyester Polymers 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 229920006324 polyoxymethylene Polymers 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- NROKBHXJSPEDAR-UHFFFAOYSA-M potassium fluoride Chemical compound [F-].[K+] NROKBHXJSPEDAR-UHFFFAOYSA-M 0.000 description 2
- 229910000160 potassium phosphate Inorganic materials 0.000 description 2
- 235000011009 potassium phosphates Nutrition 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 230000002028 premature Effects 0.000 description 2
- 230000006920 protein precipitation Effects 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 239000012521 purified sample Substances 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 125000006413 ring segment Chemical group 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 125000006850 spacer group Chemical group 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- PVYJZLYGTZKPJE-UHFFFAOYSA-N streptonigrin Chemical compound C=1C=C2C(=O)C(OC)=C(N)C(=O)C2=NC=1C(C=1N)=NC(C(O)=O)=C(C)C=1C1=CC=C(OC)C(OC)=C1O PVYJZLYGTZKPJE-UHFFFAOYSA-N 0.000 description 2
- KZNICNPSHKQLFF-UHFFFAOYSA-N succinimide Chemical group O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 125000003944 tolyl group Chemical group 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 2
- 229920003169 water-soluble polymer Polymers 0.000 description 2
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- DVOOXRTYGGLORL-VKHMYHEASA-N (2r)-2-(methylamino)-3-sulfanylpropanoic acid Chemical compound CN[C@@H](CS)C(O)=O DVOOXRTYGGLORL-VKHMYHEASA-N 0.000 description 1
- GCTFTMWXZFLTRR-GFCCVEGCSA-N (2r)-2-amino-n-[3-(difluoromethoxy)-4-(1,3-oxazol-5-yl)phenyl]-4-methylpentanamide Chemical compound FC(F)OC1=CC(NC(=O)[C@H](N)CC(C)C)=CC=C1C1=CN=CO1 GCTFTMWXZFLTRR-GFCCVEGCSA-N 0.000 description 1
- ALBODLTZUXKBGZ-JUUVMNCLSA-N (2s)-2-amino-3-phenylpropanoic acid;(2s)-2,6-diaminohexanoic acid Chemical compound NCCCC[C@H](N)C(O)=O.OC(=O)[C@@H](N)CC1=CC=CC=C1 ALBODLTZUXKBGZ-JUUVMNCLSA-N 0.000 description 1
- OIOAKXPMBIZAHL-LURJTMIESA-N (2s)-2-azaniumyl-5-[(2-methylpropan-2-yl)oxy]-5-oxopentanoate Chemical compound CC(C)(C)OC(=O)CC[C@H](N)C(O)=O OIOAKXPMBIZAHL-LURJTMIESA-N 0.000 description 1
- CGMTUJFWROPELF-YPAAEMCBSA-N (3E,5S)-5-[(2S)-butan-2-yl]-3-(1-hydroxyethylidene)pyrrolidine-2,4-dione Chemical compound CC[C@H](C)[C@@H]1NC(=O)\C(=C(/C)O)C1=O CGMTUJFWROPELF-YPAAEMCBSA-N 0.000 description 1
- JXVAMODRWBNUSF-KZQKBALLSA-N (7s,9r,10r)-7-[(2r,4s,5s,6s)-5-[[(2s,4as,5as,7s,9s,9ar,10ar)-2,9-dimethyl-3-oxo-4,4a,5a,6,7,9,9a,10a-octahydrodipyrano[4,2-a:4',3'-e][1,4]dioxin-7-yl]oxy]-4-(dimethylamino)-6-methyloxan-2-yl]oxy-10-[(2s,4s,5s,6s)-4-(dimethylamino)-5-hydroxy-6-methyloxan-2 Chemical compound O([C@@H]1C2=C(O)C=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C2[C@@H](O[C@@H]2O[C@@H](C)[C@@H](O[C@@H]3O[C@@H](C)[C@H]4O[C@@H]5O[C@@H](C)C(=O)C[C@@H]5O[C@H]4C3)[C@H](C2)N(C)C)C[C@]1(O)CC)[C@H]1C[C@H](N(C)C)[C@H](O)[C@H](C)O1 JXVAMODRWBNUSF-KZQKBALLSA-N 0.000 description 1
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- UVNPEUJXKZFWSJ-LMTQTHQJSA-N (R)-N-[(4S)-8-[6-amino-5-[(3,3-difluoro-2-oxo-1H-pyrrolo[2,3-b]pyridin-4-yl)sulfanyl]pyrazin-2-yl]-2-oxa-8-azaspiro[4.5]decan-4-yl]-2-methylpropane-2-sulfinamide Chemical compound CC(C)(C)[S@@](=O)N[C@@H]1COCC11CCN(CC1)c1cnc(Sc2ccnc3NC(=O)C(F)(F)c23)c(N)n1 UVNPEUJXKZFWSJ-LMTQTHQJSA-N 0.000 description 1
- AGNGYMCLFWQVGX-AGFFZDDWSA-N (e)-1-[(2s)-2-amino-2-carboxyethoxy]-2-diazonioethenolate Chemical compound OC(=O)[C@@H](N)CO\C([O-])=C\[N+]#N AGNGYMCLFWQVGX-AGFFZDDWSA-N 0.000 description 1
- ICGQLNMKJVHCIR-UHFFFAOYSA-N 1,3,2-dioxazetidin-4-one Chemical class O=C1ONO1 ICGQLNMKJVHCIR-UHFFFAOYSA-N 0.000 description 1
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 1
- YPFDHNVEDLHUCE-UHFFFAOYSA-N 1,3-propanediol Substances OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 1
- HNSDLXPSAYFUHK-UHFFFAOYSA-N 1,4-bis(2-ethylhexyl) sulfosuccinate Chemical compound CCCCC(CC)COC(=O)CC(S(O)(=O)=O)C(=O)OCC(CC)CCCC HNSDLXPSAYFUHK-UHFFFAOYSA-N 0.000 description 1
- RNHDAKUGFHSZEV-UHFFFAOYSA-N 1,4-dioxane;hydrate Chemical compound O.C1COCCO1 RNHDAKUGFHSZEV-UHFFFAOYSA-N 0.000 description 1
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- YQTCQNIPQMJNTI-UHFFFAOYSA-N 2,2-dimethylpropan-1-one Chemical group CC(C)(C)[C]=O YQTCQNIPQMJNTI-UHFFFAOYSA-N 0.000 description 1
- ZIZXHPCBPDNLDD-UHFFFAOYSA-N 2-[2-[2-[2-[2-[2-(4-methylphenyl)sulfonyloxyethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethyl 4-methylbenzenesulfonate Chemical compound C1=CC(C)=CC=C1S(=O)(=O)OCCOCCOCCOCCOCCOCCOS(=O)(=O)C1=CC=C(C)C=C1 ZIZXHPCBPDNLDD-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- WEZDRVHTDXTVLT-GJZGRUSLSA-N 2-[[(2s)-2-[[(2s)-2-[(2-aminoacetyl)amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]acetic acid Chemical compound OC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)CN)CC1=CC=CC=C1 WEZDRVHTDXTVLT-GJZGRUSLSA-N 0.000 description 1
- FMKGJQHNYMWDFJ-CVEARBPZSA-N 2-[[4-(2,2-difluoropropoxy)pyrimidin-5-yl]methylamino]-4-[[(1R,4S)-4-hydroxy-3,3-dimethylcyclohexyl]amino]pyrimidine-5-carbonitrile Chemical compound FC(COC1=NC=NC=C1CNC1=NC=C(C(=N1)N[C@H]1CC([C@H](CC1)O)(C)C)C#N)(C)F FMKGJQHNYMWDFJ-CVEARBPZSA-N 0.000 description 1
- QCXJFISCRQIYID-IAEPZHFASA-N 2-amino-1-n-[(3s,6s,7r,10s,16s)-3-[(2s)-butan-2-yl]-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-10-propan-2-yl-8-oxa-1,4,11,14-tetrazabicyclo[14.3.0]nonadecan-6-yl]-4,6-dimethyl-3-oxo-9-n-[(3s,6s,7r,10s,16s)-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-3,10-di(propa Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N=C2C(C(=O)N[C@@H]3C(=O)N[C@H](C(N4CCC[C@H]4C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]3C)=O)[C@@H](C)CC)=C(N)C(=O)C(C)=C2O2)C2=C(C)C=C1 QCXJFISCRQIYID-IAEPZHFASA-N 0.000 description 1
- BEXOYZKPTUJSCZ-UHFFFAOYSA-N 2-chloro-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)aniline Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=C(N)C(Cl)=C1 BEXOYZKPTUJSCZ-UHFFFAOYSA-N 0.000 description 1
- VHSHLMUCYSAUQU-UHFFFAOYSA-N 2-hydroxypropyl methacrylate Chemical compound CC(O)COC(=O)C(C)=C VHSHLMUCYSAUQU-UHFFFAOYSA-N 0.000 description 1
- BMIBJCFFZPYJHF-UHFFFAOYSA-N 2-methoxy-5-methyl-3-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridine Chemical compound COC1=NC=C(C)C=C1B1OC(C)(C)C(C)(C)O1 BMIBJCFFZPYJHF-UHFFFAOYSA-N 0.000 description 1
- LFOIDLOIBZFWDO-UHFFFAOYSA-N 2-methoxy-6-[6-methoxy-4-[(3-phenylmethoxyphenyl)methoxy]-1-benzofuran-2-yl]imidazo[2,1-b][1,3,4]thiadiazole Chemical compound N1=C2SC(OC)=NN2C=C1C(OC1=CC(OC)=C2)=CC1=C2OCC(C=1)=CC=CC=1OCC1=CC=CC=C1 LFOIDLOIBZFWDO-UHFFFAOYSA-N 0.000 description 1
- 238000005084 2D-nuclear magnetic resonance Methods 0.000 description 1
- ZJSQZQMVXKZAGW-UHFFFAOYSA-N 2H-benzotriazol-4-ol hydrate Chemical compound O.OC1=CC=CC2=C1N=NN2 ZJSQZQMVXKZAGW-UHFFFAOYSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- PYSRRFNXTXNWCD-UHFFFAOYSA-N 3-(2-phenylethenyl)furan-2,5-dione Chemical compound O=C1OC(=O)C(C=CC=2C=CC=CC=2)=C1 PYSRRFNXTXNWCD-UHFFFAOYSA-N 0.000 description 1
- PWMYMKOUNYTVQN-UHFFFAOYSA-N 3-(8,8-diethyl-2-aza-8-germaspiro[4.5]decan-2-yl)-n,n-dimethylpropan-1-amine Chemical compound C1C[Ge](CC)(CC)CCC11CN(CCCN(C)C)CC1 PWMYMKOUNYTVQN-UHFFFAOYSA-N 0.000 description 1
- PBVAJRFEEOIAGW-UHFFFAOYSA-N 3-[bis(2-carboxyethyl)phosphanyl]propanoic acid;hydrochloride Chemical compound Cl.OC(=O)CCP(CCC(O)=O)CCC(O)=O PBVAJRFEEOIAGW-UHFFFAOYSA-N 0.000 description 1
- YKQXROMICPMQBZ-UHFFFAOYSA-N 3-chloro-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)aniline Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=C(N)C=C1Cl YKQXROMICPMQBZ-UHFFFAOYSA-N 0.000 description 1
- DKIDEFUBRARXTE-UHFFFAOYSA-N 3-mercaptopropanoic acid Chemical compound OC(=O)CCS DKIDEFUBRARXTE-UHFFFAOYSA-N 0.000 description 1
- ATVJXMYDOSMEPO-UHFFFAOYSA-N 3-prop-2-enoxyprop-1-ene Chemical compound C=CCOCC=C ATVJXMYDOSMEPO-UHFFFAOYSA-N 0.000 description 1
- ZANPJXNYBVVNSD-UHFFFAOYSA-N 4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)aniline Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=C(N)C=C1 ZANPJXNYBVVNSD-UHFFFAOYSA-N 0.000 description 1
- WYFCZWSWFGJODV-MIANJLSGSA-N 4-[[(1s)-2-[(e)-3-[3-chloro-2-fluoro-6-(tetrazol-1-yl)phenyl]prop-2-enoyl]-5-(4-methyl-2-oxopiperazin-1-yl)-3,4-dihydro-1h-isoquinoline-1-carbonyl]amino]benzoic acid Chemical compound O=C1CN(C)CCN1C1=CC=CC2=C1CCN(C(=O)\C=C\C=1C(=CC=C(Cl)C=1F)N1N=NN=C1)[C@@H]2C(=O)NC1=CC=C(C(O)=O)C=C1 WYFCZWSWFGJODV-MIANJLSGSA-N 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- DTRIDVOOPAQEEL-UHFFFAOYSA-N 4-sulfanylbutanoic acid Chemical compound OC(=O)CCCS DTRIDVOOPAQEEL-UHFFFAOYSA-N 0.000 description 1
- LGZKGOGODCLQHG-CYBMUJFWSA-N 5-[(2r)-2-hydroxy-2-(3,4,5-trimethoxyphenyl)ethyl]-2-methoxyphenol Chemical compound C1=C(O)C(OC)=CC=C1C[C@@H](O)C1=CC(OC)=C(OC)C(OC)=C1 LGZKGOGODCLQHG-CYBMUJFWSA-N 0.000 description 1
- WOJKKJKETHYEAC-UHFFFAOYSA-N 6-Maleimidocaproic acid Chemical compound OC(=O)CCCCCN1C(=O)C=CC1=O WOJKKJKETHYEAC-UHFFFAOYSA-N 0.000 description 1
- 229960005538 6-diazo-5-oxo-L-norleucine Drugs 0.000 description 1
- YCWQAMGASJSUIP-YFKPBYRVSA-N 6-diazo-5-oxo-L-norleucine Chemical compound OC(=O)[C@@H](N)CCC(=O)C=[N+]=[N-] YCWQAMGASJSUIP-YFKPBYRVSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- HCCNBKFJYUWLEX-UHFFFAOYSA-N 7-(6-methoxypyridin-3-yl)-1-(2-propoxyethyl)-3-(pyrazin-2-ylmethylamino)pyrido[3,4-b]pyrazin-2-one Chemical compound O=C1N(CCOCCC)C2=CC(C=3C=NC(OC)=CC=3)=NC=C2N=C1NCC1=CN=CC=N1 HCCNBKFJYUWLEX-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- HDZZVAMISRMYHH-UHFFFAOYSA-N 9beta-Ribofuranosyl-7-deazaadenin Natural products C1=CC=2C(N)=NC=NC=2N1C1OC(CO)C(O)C1O HDZZVAMISRMYHH-UHFFFAOYSA-N 0.000 description 1
- 230000002407 ATP formation Effects 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- CEIZFXOZIQNICU-UHFFFAOYSA-N Alternaria alternata Crofton-weed toxin Natural products CCC(C)C1NC(=O)C(C(C)=O)=C1O CEIZFXOZIQNICU-UHFFFAOYSA-N 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 125000006847 BOC protecting group Chemical group 0.000 description 1
- VGGGPCQERPFHOB-MCIONIFRSA-N Bestatin Chemical compound CC(C)C[C@H](C(O)=O)NC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 VGGGPCQERPFHOB-MCIONIFRSA-N 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 241000195940 Bryophyta Species 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- JQUCWIWWWKZNCS-LESHARBVSA-N C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F Chemical compound C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F JQUCWIWWWKZNCS-LESHARBVSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N C1CCCCC1 Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 1
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 1
- ZJCVXJNNMAXCLF-CAQNNZPWSA-N CC(C)C(O[C@@H](CC(N(C)c1c(-c2cc(C(O)=O)ccc2)c(OC)cc(C/C(/C)=C/C=C/[C@H]([C@@](C2)(N3)O)OC)c1)=O)C(C)(C)[C@@H](C)[C@H](C)[C@H]2OC3=O)=O Chemical compound CC(C)C(O[C@@H](CC(N(C)c1c(-c2cc(C(O)=O)ccc2)c(OC)cc(C/C(/C)=C/C=C/[C@H]([C@@](C2)(N3)O)OC)c1)=O)C(C)(C)[C@@H](C)[C@H](C)[C@H]2OC3=O)=O ZJCVXJNNMAXCLF-CAQNNZPWSA-N 0.000 description 1
- FUONMUACVAGUGU-OBQIPGSJSA-N CC(C)C(O[C@@H](CC(N(C)c1cc(C/C(/C)=C/C=C/[C@H]([C@@H](C2)[N]3(C)C)OC)cc(OC)c1-c(cc1Cl)ccc1NC(CCC(C)(C)S)=O)=O)[C@]1(C)O[C@H]1[C@H](C)[C@H]2OC3=O)=O Chemical compound CC(C)C(O[C@@H](CC(N(C)c1cc(C/C(/C)=C/C=C/[C@H]([C@@H](C2)[N]3(C)C)OC)cc(OC)c1-c(cc1Cl)ccc1NC(CCC(C)(C)S)=O)=O)[C@]1(C)O[C@H]1[C@H](C)[C@H]2OC3=O)=O FUONMUACVAGUGU-OBQIPGSJSA-N 0.000 description 1
- OPQNCARIZFLNLF-MGPRVXNSSA-N CC(C)C(O[C@@H](CC(N(C)c1cc(C/C(/C)=C/C=C/[C@H]([C@@](C2)(N3)O)OC)cc(OC)c1Cl)=O)[C@]1(C)OC1[C@H](C)C2OC3=O)=O Chemical compound CC(C)C(O[C@@H](CC(N(C)c1cc(C/C(/C)=C/C=C/[C@H]([C@@](C2)(N3)O)OC)cc(OC)c1Cl)=O)[C@]1(C)OC1[C@H](C)C2OC3=O)=O OPQNCARIZFLNLF-MGPRVXNSSA-N 0.000 description 1
- OWBIBDONLXEDTH-DAEVLTMZSA-N CC(C)[C@@H](C(N[C@@H](CCCNC(N)=O)C(Nc1ccc(COC(N)=O)cc1)=O)=O)NC(CCC(C)OCCC(C)NC=O)=O Chemical compound CC(C)[C@@H](C(N[C@@H](CCCNC(N)=O)C(Nc1ccc(COC(N)=O)cc1)=O)=O)NC(CCC(C)OCCC(C)NC=O)=O OWBIBDONLXEDTH-DAEVLTMZSA-N 0.000 description 1
- PYDATAKVLFHLEV-UHFFFAOYSA-N CCC(C)(CC)CCNC(CCC(C)SSCCC(C(C)(CC)CC)=O)=O Chemical compound CCC(C)(CC)CCNC(CCC(C)SSCCC(C(C)(CC)CC)=O)=O PYDATAKVLFHLEV-UHFFFAOYSA-N 0.000 description 1
- IHTNBPXRXIDFDR-UHFFFAOYSA-N CCCCCN1CCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCC1 Chemical compound CCCCCN1CCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCC1 IHTNBPXRXIDFDR-UHFFFAOYSA-N 0.000 description 1
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical group NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- AKFJBRHWYYWBST-LJAQVGFWSA-N Cc(cc1)ccc1S(CC(CS(c1ccc(C)cc1)(=O)=O)C(c(cc1)ccc1C(N[C@@H](CCC(O)=O)C(NCCOC)=O)=O)=O)(=O)=O Chemical compound Cc(cc1)ccc1S(CC(CS(c1ccc(C)cc1)(=O)=O)C(c(cc1)ccc1C(N[C@@H](CCC(O)=O)C(NCCOC)=O)=O)=O)(=O)=O AKFJBRHWYYWBST-LJAQVGFWSA-N 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 229930188224 Cryptophycin Natural products 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N D-alpha-Ala Natural products CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-RXMQYKEDSA-N D-lysine Chemical compound NCCCC[C@@H](N)C(O)=O KDXKERNSBIXSRK-RXMQYKEDSA-N 0.000 description 1
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 1
- WEAHRLBPCANXCN-UHFFFAOYSA-N Daunomycin Natural products CCC1(O)CC(OC2CC(N)C(O)C(C)O2)c3cc4C(=O)c5c(OC)cccc5C(=O)c4c(O)c3C1 WEAHRLBPCANXCN-UHFFFAOYSA-N 0.000 description 1
- 108010002156 Depsipeptides Proteins 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- AUGQEEXBDZWUJY-ZLJUKNTDSA-N Diacetoxyscirpenol Chemical compound C([C@]12[C@]3(C)[C@H](OC(C)=O)[C@@H](O)[C@H]1O[C@@H]1C=C(C)CC[C@@]13COC(=O)C)O2 AUGQEEXBDZWUJY-ZLJUKNTDSA-N 0.000 description 1
- AUGQEEXBDZWUJY-UHFFFAOYSA-N Diacetoxyscirpenol Natural products CC(=O)OCC12CCC(C)=CC1OC1C(O)C(OC(C)=O)C2(C)C11CO1 AUGQEEXBDZWUJY-UHFFFAOYSA-N 0.000 description 1
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- BUZMZDDKFCSKOT-CIUDSAMLSA-N Glu-Glu-Glu Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O BUZMZDDKFCSKOT-CIUDSAMLSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010009504 Gly-Phe-Leu-Gly Proteins 0.000 description 1
- 229920002527 Glycogen Polymers 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 208000017891 HER2 positive breast carcinoma Diseases 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 1
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 1
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 1
- 208000005016 Intestinal Neoplasms Diseases 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- QNAYBMKLOCPYGJ-UWTATZPHSA-N L-Alanine Natural products C[C@@H](N)C(O)=O QNAYBMKLOCPYGJ-UWTATZPHSA-N 0.000 description 1
- FFEARJCKVFRZRR-UHFFFAOYSA-N L-Methionine Natural products CSCCC(N)C(O)=O FFEARJCKVFRZRR-UHFFFAOYSA-N 0.000 description 1
- FADYJNXDPBKVCA-UHFFFAOYSA-N L-Phenylalanyl-L-lysin Natural products NCCCCC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FADYJNXDPBKVCA-UHFFFAOYSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 229930195722 L-methionine Natural products 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000002146 L01XE16 - Crizotinib Substances 0.000 description 1
- 239000002177 L01XE27 - Ibrutinib Substances 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 229920001491 Lentinan Polymers 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 241000549168 Maytenus Species 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- VFKZTMPDYBFSTM-KVTDHHQDSA-N Mitobronitol Chemical compound BrC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-KVTDHHQDSA-N 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- NUGPIZCTELGDOS-QHCPKHFHSA-N N-[(1S)-3-[4-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)piperidin-1-yl]-1-pyridin-3-ylpropyl]cyclopentanecarboxamide Chemical compound C(C)(C)C1=NN=C(N1C1CCN(CC1)CC[C@@H](C=1C=NC=CC=1)NC(=O)C1CCCC1)C NUGPIZCTELGDOS-QHCPKHFHSA-N 0.000 description 1
- LVDRREOUMKACNJ-BKMJKUGQSA-N N-[(2R,3S)-2-(4-chlorophenyl)-1-(1,4-dimethyl-2-oxoquinolin-7-yl)-6-oxopiperidin-3-yl]-2-methylpropane-1-sulfonamide Chemical compound CC(C)CS(=O)(=O)N[C@H]1CCC(=O)N([C@@H]1c1ccc(Cl)cc1)c1ccc2c(C)cc(=O)n(C)c2c1 LVDRREOUMKACNJ-BKMJKUGQSA-N 0.000 description 1
- GDFAOVXKHJXLEI-VKHMYHEASA-N N-methyl-L-alanine Chemical compound C[NH2+][C@@H](C)C([O-])=O GDFAOVXKHJXLEI-VKHMYHEASA-N 0.000 description 1
- 238000011785 NMRI mouse Methods 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- QOVYHDHLFPKQQG-NDEPHWFRSA-N N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O Chemical compound N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O QOVYHDHLFPKQQG-NDEPHWFRSA-N 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- SYNHCENRCUAUNM-UHFFFAOYSA-N Nitrogen mustard N-oxide hydrochloride Chemical group Cl.ClCC[N+]([O-])(C)CCCl SYNHCENRCUAUNM-UHFFFAOYSA-N 0.000 description 1
- KGTDRFCXGRULNK-UHFFFAOYSA-N Nogalamycin Natural products COC1C(OC)(C)C(OC)C(C)OC1OC1C2=C(O)C(C(=O)C3=C(O)C=C4C5(C)OC(C(C(C5O)N(C)C)O)OC4=C3C3=O)=C3C=C2C(C(=O)OC)C(C)(O)C1 KGTDRFCXGRULNK-UHFFFAOYSA-N 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 229930187135 Olivomycin Natural products 0.000 description 1
- 235000019502 Orange oil Nutrition 0.000 description 1
- 101710160107 Outer membrane protein A Proteins 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 241000604373 Ovatus Species 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- VREZDOWOLGNDPW-ALTGWBOUSA-N Pancratistatin Chemical compound C1=C2[C@H]3[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O)[C@@H]3NC(=O)C2=C(O)C2=C1OCO2 VREZDOWOLGNDPW-ALTGWBOUSA-N 0.000 description 1
- VREZDOWOLGNDPW-MYVCAWNPSA-N Pancratistatin Natural products O=C1N[C@H]2[C@H](O)[C@H](O)[C@H](O)[C@H](O)[C@@H]2c2c1c(O)c1OCOc1c2 VREZDOWOLGNDPW-MYVCAWNPSA-N 0.000 description 1
- 108010057150 Peplomycin Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 102000000447 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Human genes 0.000 description 1
- 108010055817 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Proteins 0.000 description 1
- RFCVXVPWSPOMFJ-STQMWFEESA-N Phe-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](N)CC1=CC=CC=C1 RFCVXVPWSPOMFJ-STQMWFEESA-N 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 229930182556 Polyacetal Natural products 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 108010020346 Polyglutamic Acid Proteins 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 102100024924 Protein kinase C alpha type Human genes 0.000 description 1
- 101710109947 Protein kinase C alpha type Proteins 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- OWPCHSCAPHNHAV-UHFFFAOYSA-N Rhizoxin Natural products C1C(O)C2(C)OC2C=CC(C)C(OC(=O)C2)CC2CC2OC2C(=O)OC1C(C)C(OC)C(C)=CC=CC(C)=CC1=COC(C)=N1 OWPCHSCAPHNHAV-UHFFFAOYSA-N 0.000 description 1
- NSFWWJIQIKBZMJ-YKNYLIOZSA-N Roridin A Chemical compound C([C@]12[C@]3(C)[C@H]4C[C@H]1O[C@@H]1C=C(C)CC[C@@]13COC(=O)[C@@H](O)[C@H](C)CCO[C@H](\C=C\C=C/C(=O)O4)[C@H](O)C)O2 NSFWWJIQIKBZMJ-YKNYLIOZSA-N 0.000 description 1
- 229910006074 SO2NH2 Inorganic materials 0.000 description 1
- 229910004298 SiO 2 Inorganic materials 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 229920000147 Styrene maleic anhydride Polymers 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- 239000012505 Superdex™ Substances 0.000 description 1
- CGMTUJFWROPELF-UHFFFAOYSA-N Tenuazonic acid Natural products CCC(C)C1NC(=O)C(=C(C)/O)C1=O CGMTUJFWROPELF-UHFFFAOYSA-N 0.000 description 1
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 229910021626 Tin(II) chloride Inorganic materials 0.000 description 1
- 108060008539 Transglutaminase Proteins 0.000 description 1
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 1
- UMILHIMHKXVDGH-UHFFFAOYSA-N Triethylene glycol diglycidyl ether Chemical compound C1OC1COCCOCCOCCOCC1CO1 UMILHIMHKXVDGH-UHFFFAOYSA-N 0.000 description 1
- 206010050283 Tumour ulceration Diseases 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 102000009524 Vascular Endothelial Growth Factor A Human genes 0.000 description 1
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- QIKVYJOCQXXRSJ-PKDLRSQSSA-N [(1s)-2-[[(1e)-1-[(1s,2r,3r)-3-acetyloxy-2-hydroxy-5-azabicyclo[3.1.0]hexan-4-ylidene]-2-[[(z)-1-hydroxy-3-oxobut-1-en-2-yl]amino]-2-oxoethyl]amino]-1-[(2s)-2-methyloxiran-2-yl]-2-oxoethyl] 3-methoxy-5-methylnaphthalene-1-carboxylate Chemical compound C[C@@]1([C@@H](C(=O)N\C(C(=O)N\C(=C/O)C(C)=O)=C/2N3C[C@H]3[C@@H](O)[C@@H]\2OC(C)=O)OC(=O)C=2C=C(C=C3C(C)=CC=CC3=2)OC)CO1 QIKVYJOCQXXRSJ-PKDLRSQSSA-N 0.000 description 1
- IFJUINDAXYAPTO-UUBSBJJBSA-N [(8r,9s,13s,14s,17s)-17-[2-[4-[4-[bis(2-chloroethyl)amino]phenyl]butanoyloxy]acetyl]oxy-13-methyl-6,7,8,9,11,12,14,15,16,17-decahydrocyclopenta[a]phenanthren-3-yl] benzoate Chemical compound C([C@@H]1[C@@H](C2=CC=3)CC[C@]4([C@H]1CC[C@@H]4OC(=O)COC(=O)CCCC=1C=CC(=CC=1)N(CCCl)CCCl)C)CC2=CC=3OC(=O)C1=CC=CC=C1 IFJUINDAXYAPTO-UUBSBJJBSA-N 0.000 description 1
- XZSRRNFBEIOBDA-CFNBKWCHSA-N [2-[(2s,4s)-4-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-2,5,12-trihydroxy-7-methoxy-6,11-dioxo-3,4-dihydro-1h-tetracen-2-yl]-2-oxoethyl] 2,2-diethoxyacetate Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC(OC)=C4C(=O)C=3C(O)=C21)(O)C(=O)COC(=O)C(OCC)OCC)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 XZSRRNFBEIOBDA-CFNBKWCHSA-N 0.000 description 1
- UBVOLHQIEQVXGM-UHFFFAOYSA-N [4-[(2-methylpropan-2-yl)oxycarbonylamino]phenyl]boronic acid Chemical compound CC(C)(C)OC(=O)NC1=CC=C(B(O)O)C=C1 UBVOLHQIEQVXGM-UHFFFAOYSA-N 0.000 description 1
- USMYACISHVPTHK-PXLJZGITSA-N [4-[[(2s)-5-(carbamoylamino)-2-[[(2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)-3-methylbutanoyl]amino]pentanoyl]amino]phenyl]methyl (4-nitrophenyl) carbonate Chemical compound O=C([C@H](CCCNC(N)=O)NC(=O)[C@@H](NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)C(C)C)NC(C=C1)=CC=C1COC(=O)OC1=CC=C([N+]([O-])=O)C=C1 USMYACISHVPTHK-PXLJZGITSA-N 0.000 description 1
- 229950005186 abagovomab Drugs 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 125000004036 acetal group Chemical group 0.000 description 1
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N acetaldehyde dimethyl acetal Natural products COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 229960004308 acetylcysteine Drugs 0.000 description 1
- 229930183665 actinomycin Natural products 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 229950009084 adecatumumab Drugs 0.000 description 1
- 229960003767 alanine Drugs 0.000 description 1
- HAXFWIACAGNFHA-UHFFFAOYSA-N aldrithiol Chemical group C=1C=CC=NC=1SSC1=CC=CC=N1 HAXFWIACAGNFHA-UHFFFAOYSA-N 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 125000002355 alkine group Chemical group 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- HFHDHCJBZVLPGP-RWMJIURBSA-N alpha-cyclodextrin Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO HFHDHCJBZVLPGP-RWMJIURBSA-N 0.000 description 1
- 229950009106 altumomab Drugs 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 229950001537 amatuximab Drugs 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 230000000719 anti-leukaemic effect Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000002927 anti-mitotic effect Effects 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 229940045687 antimetabolites folic acid analogs Drugs 0.000 description 1
- 229940045713 antineoplastic alkylating drug ethylene imines Drugs 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000012062 aqueous buffer Substances 0.000 description 1
- 150000008209 arabinosides Chemical class 0.000 description 1
- 229950005725 arcitumomab Drugs 0.000 description 1
- 150000001502 aryl halides Chemical class 0.000 description 1
- 108010044540 auristatin Proteins 0.000 description 1
- 150000001540 azides Chemical class 0.000 description 1
- 150000001541 aziridines Chemical class 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 229950007843 bavituximab Drugs 0.000 description 1
- 229950003269 bectumomab Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 238000007068 beta-elimination reaction Methods 0.000 description 1
- 201000011281 bladder sarcoma Diseases 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical class N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- 201000008275 breast carcinoma Diseases 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 229960005520 bryostatin Drugs 0.000 description 1
- MJQUEDHRCUIRLF-TVIXENOKSA-N bryostatin 1 Chemical compound C([C@@H]1CC(/[C@@H]([C@@](C(C)(C)/C=C/2)(O)O1)OC(=O)/C=C/C=C/CCC)=C\C(=O)OC)[C@H]([C@@H](C)O)OC(=O)C[C@H](O)C[C@@H](O1)C[C@H](OC(C)=O)C(C)(C)[C@]1(O)C[C@@H]1C\C(=C\C(=O)OC)C[C@H]\2O1 MJQUEDHRCUIRLF-TVIXENOKSA-N 0.000 description 1
- MUIWQCKLQMOUAT-AKUNNTHJSA-N bryostatin 20 Natural products COC(=O)C=C1C[C@@]2(C)C[C@]3(O)O[C@](C)(C[C@@H](O)CC(=O)O[C@](C)(C[C@@]4(C)O[C@](O)(CC5=CC(=O)O[C@]45C)C(C)(C)C=C[C@@](C)(C1)O2)[C@@H](C)O)C[C@H](OC(=O)C(C)(C)C)C3(C)C MUIWQCKLQMOUAT-AKUNNTHJSA-N 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 108700002839 cactinomycin Proteins 0.000 description 1
- 229950009908 cactinomycin Drugs 0.000 description 1
- 229940088954 camptosar Drugs 0.000 description 1
- 229940127093 camptothecin Drugs 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical class OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- XREUEWVEMYWFFA-CSKJXFQVSA-N carminomycin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=C(O)C=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XREUEWVEMYWFFA-CSKJXFQVSA-N 0.000 description 1
- 229930188550 carminomycin Natural products 0.000 description 1
- XREUEWVEMYWFFA-UHFFFAOYSA-N carminomycin I Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=C(O)C=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XREUEWVEMYWFFA-UHFFFAOYSA-N 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 229950001725 carubicin Drugs 0.000 description 1
- 108010047060 carzinophilin Proteins 0.000 description 1
- 229960000419 catumaxomab Drugs 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 238000003570 cell viability assay Methods 0.000 description 1
- 238000012054 celltiter-glo Methods 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 150000001804 chlorine Chemical class 0.000 description 1
- ZYVSOIYQKUDENJ-WKSBCEQHSA-N chromomycin A3 Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@@H]1OC(C)=O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@@H](O)[C@H](O[C@@H]3O[C@@H](C)[C@H](OC(C)=O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@@H]1C[C@@H](O)[C@@H](OC)[C@@H](C)O1 ZYVSOIYQKUDENJ-WKSBCEQHSA-N 0.000 description 1
- 229950006647 cixutumumab Drugs 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- LGZKGOGODCLQHG-UHFFFAOYSA-N combretastatin Natural products C1=C(O)C(OC)=CC=C1CC(O)C1=CC(OC)=C(OC)C(OC)=C1 LGZKGOGODCLQHG-UHFFFAOYSA-N 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 229940125877 compound 31 Drugs 0.000 description 1
- 229940126545 compound 53 Drugs 0.000 description 1
- 229940127113 compound 57 Drugs 0.000 description 1
- 229940125900 compound 59 Drugs 0.000 description 1
- 229950007276 conatumumab Drugs 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 150000001879 copper Chemical class 0.000 description 1
- KTEIFNKAUNYNJU-GFCCVEGCSA-N crizotinib Chemical compound O([C@H](C)C=1C(=C(F)C=CC=1Cl)Cl)C(C(=NC=1)N)=CC=1C(=C1)C=NN1C1CCNCC1 KTEIFNKAUNYNJU-GFCCVEGCSA-N 0.000 description 1
- 229960005061 crizotinib Drugs 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 150000001945 cysteines Chemical class 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229950007409 dacetuzumab Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 229960002482 dalotuzumab Drugs 0.000 description 1
- 229960002204 daratumumab Drugs 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 230000022811 deglycosylation Effects 0.000 description 1
- 229950003913 detorubicin Drugs 0.000 description 1
- 229950008962 detumomab Drugs 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- 150000001993 dienes Chemical class 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- BGRWYRAHAFMIBJ-UHFFFAOYSA-N diisopropylcarbodiimide Natural products CC(C)NC(=O)NC(C)C BGRWYRAHAFMIBJ-UHFFFAOYSA-N 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229940042396 direct acting antivirals thiosemicarbazones Drugs 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 1
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- AMRJKAQTDDKMCE-UHFFFAOYSA-N dolastatin Chemical compound CC(C)C(N(C)C)C(=O)NC(C(C)C)C(=O)N(C)C(C(C)C)C(OC)CC(=O)N1CCCC1C(OC)C(C)C(=O)NC(C=1SC=CN=1)CC1=CC=CC=C1 AMRJKAQTDDKMCE-UHFFFAOYSA-N 0.000 description 1
- 229930188854 dolastatin Natural products 0.000 description 1
- 229950009964 drozitumab Drugs 0.000 description 1
- 229960005501 duocarmycin Drugs 0.000 description 1
- VQNATVDKACXKTF-XELLLNAOSA-N duocarmycin Chemical compound COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C([C@@]64C[C@@H]6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-XELLLNAOSA-N 0.000 description 1
- 229930184221 duocarmycin Natural products 0.000 description 1
- 229950011453 dusigitumab Drugs 0.000 description 1
- 229950000006 ecromeximab Drugs 0.000 description 1
- FSIRXIHZBIXHKT-MHTVFEQDSA-N edatrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CC(CC)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FSIRXIHZBIXHKT-MHTVFEQDSA-N 0.000 description 1
- 229950006700 edatrexate Drugs 0.000 description 1
- VLCYCQAOQCDTCN-UHFFFAOYSA-N eflornithine Chemical compound NCCCC(N)(C(F)F)C(O)=O VLCYCQAOQCDTCN-UHFFFAOYSA-N 0.000 description 1
- 239000012039 electrophile Substances 0.000 description 1
- 229960004137 elotuzumab Drugs 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 229950010640 ensituximab Drugs 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- WXCXUHSOUPDCQV-UHFFFAOYSA-N enzalutamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1N1C(C)(C)C(=O)N(C=2C=C(C(C#N)=CC=2)C(F)(F)F)C1=S WXCXUHSOUPDCQV-UHFFFAOYSA-N 0.000 description 1
- 229960004671 enzalutamide Drugs 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- 229930013356 epothilone Natural products 0.000 description 1
- 150000003883 epothilone derivatives Chemical class 0.000 description 1
- 229960001433 erlotinib Drugs 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 229950008579 ertumaxomab Drugs 0.000 description 1
- 229950009569 etaracizumab Drugs 0.000 description 1
- DQJJMWZRDSGUJP-UHFFFAOYSA-N ethenoxyethene;furan-2,5-dione Chemical compound C=COC=C.O=C1OC(=O)C=C1 DQJJMWZRDSGUJP-UHFFFAOYSA-N 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- DNJIEGIFACGWOD-UHFFFAOYSA-N ethyl mercaptane Natural products CCS DNJIEGIFACGWOD-UHFFFAOYSA-N 0.000 description 1
- 229960005237 etoglucid Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 229950009929 farletuzumab Drugs 0.000 description 1
- 229950002846 ficlatuzumab Drugs 0.000 description 1
- 229950008085 figitumumab Drugs 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 229950010320 flanvotumab Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 150000002224 folic acids Chemical class 0.000 description 1
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 238000007306 functionalization reaction Methods 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 229950002140 futuximab Drugs 0.000 description 1
- 229940044658 gallium nitrate Drugs 0.000 description 1
- 229950004896 ganitumab Drugs 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 229960000578 gemtuzumab Drugs 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 229950002026 girentuximab Drugs 0.000 description 1
- 229950000918 glembatumumab Drugs 0.000 description 1
- 229930182478 glucoside Natural products 0.000 description 1
- 229940096919 glycogen Drugs 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 125000001188 haloalkyl group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- OMHHHNURFLVQBM-UHFFFAOYSA-N hydroxy(isocyanato)carbamic acid Chemical compound OC(=O)N(O)N=C=O OMHHHNURFLVQBM-UHFFFAOYSA-N 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- CBOIHMRHGLHBPB-UHFFFAOYSA-N hydroxymethyl Chemical compound O[CH2] CBOIHMRHGLHBPB-UHFFFAOYSA-N 0.000 description 1
- 229940015872 ibandronate Drugs 0.000 description 1
- 229960001507 ibrutinib Drugs 0.000 description 1
- XYFPWWZEPKGCCK-GOSISDBHSA-N ibrutinib Chemical compound C1=2C(N)=NC=NC=2N([C@H]2CN(CCC2)C(=O)C=C)N=C1C(C=C1)=CC=C1OC1=CC=CC=C1 XYFPWWZEPKGCCK-GOSISDBHSA-N 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 229950002200 igovomab Drugs 0.000 description 1
- 229950005646 imgatuzumab Drugs 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 229940030980 inova Drugs 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 201000002313 intestinal cancer Diseases 0.000 description 1
- 229950001014 intetumumab Drugs 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 229960005386 ipilimumab Drugs 0.000 description 1
- 229950010939 iratumumab Drugs 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- SZQUEWJRBJDHSM-UHFFFAOYSA-N iron(3+);trinitrate;nonahydrate Chemical compound O.O.O.O.O.O.O.O.O.[Fe+3].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O SZQUEWJRBJDHSM-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 238000010829 isocratic elution Methods 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 229950000518 labetuzumab Drugs 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical class CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 229940115286 lentinan Drugs 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 229950002884 lexatumumab Drugs 0.000 description 1
- 229950002950 lintuzumab Drugs 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 239000012669 liquid formulation Substances 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- YROQEQPFUCPDCP-UHFFFAOYSA-N losoxantrone Chemical compound OCCNCCN1N=C2C3=CC=CC(O)=C3C(=O)C3=C2C1=CC=C3NCCNCCO YROQEQPFUCPDCP-UHFFFAOYSA-N 0.000 description 1
- 229950008745 losoxantrone Drugs 0.000 description 1
- 229950004563 lucatumumab Drugs 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 230000002132 lysosomal effect Effects 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 229950001474 maitansine Drugs 0.000 description 1
- 229950001869 mapatumumab Drugs 0.000 description 1
- 229950008001 matuzumab Drugs 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 229960004452 methionine Drugs 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- GDOPTJXRTPNYNR-UHFFFAOYSA-N methyl-cyclopentane Natural products CC1CCCC1 GDOPTJXRTPNYNR-UHFFFAOYSA-N 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 229950003734 milatuzumab Drugs 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 229960005485 mitobronitol Drugs 0.000 description 1
- MXWHMTNPTTVWDM-NXOFHUPFSA-N mitoguazone Chemical compound NC(N)=N\N=C(/C)\C=N\N=C(N)N MXWHMTNPTTVWDM-NXOFHUPFSA-N 0.000 description 1
- 229960003539 mitoguazone Drugs 0.000 description 1
- VFKZTMPDYBFSTM-GUCUJZIJSA-N mitolactol Chemical compound BrC[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-GUCUJZIJSA-N 0.000 description 1
- 229950010913 mitolactol Drugs 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- 229950003063 mitumomab Drugs 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000000302 molecular modelling Methods 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- VMFMUJZRXZXYAH-UHFFFAOYSA-N n-[5-[[5-chloro-4-[2-[2-(dimethylamino)-2-oxoacetyl]anilino]pyrimidin-2-yl]amino]-4-methoxy-2-(4-methylpiperazin-1-yl)phenyl]prop-2-enamide Chemical compound C=CC(=O)NC=1C=C(NC=2N=C(NC=3C(=CC=CC=3)C(=O)C(=O)N(C)C)C(Cl)=CN=2)C(OC)=CC=1N1CCN(C)CC1 VMFMUJZRXZXYAH-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 229950008353 narnatumab Drugs 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 229960000513 necitumumab Drugs 0.000 description 1
- QZGIWPZCWHMVQL-UIYAJPBUSA-N neocarzinostatin chromophore Chemical compound O1[C@H](C)[C@H](O)[C@H](O)[C@@H](NC)[C@H]1O[C@@H]1C/2=C/C#C[C@H]3O[C@@]3([C@@H]3OC(=O)OC3)C#CC\2=C[C@H]1OC(=O)C1=C(O)C=CC2=C(C)C=C(OC)C=C12 QZGIWPZCWHMVQL-UIYAJPBUSA-N 0.000 description 1
- 229940117969 neopentyl glycol Drugs 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 229950010203 nimotuzumab Drugs 0.000 description 1
- KGTDRFCXGRULNK-JYOBTZKQSA-N nogalamycin Chemical compound CO[C@@H]1[C@@](OC)(C)[C@@H](OC)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=C(O)C=C4[C@@]5(C)O[C@H]([C@H]([C@@H]([C@H]5O)N(C)C)O)OC4=C3C3=O)=C3C=C2[C@@H](C(=O)OC)[C@@](C)(O)C1 KGTDRFCXGRULNK-JYOBTZKQSA-N 0.000 description 1
- 229950009266 nogalamycin Drugs 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 229960003347 obinutuzumab Drugs 0.000 description 1
- 229950009090 ocaratuzumab Drugs 0.000 description 1
- 229960002450 ofatumumab Drugs 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 229950008516 olaratumab Drugs 0.000 description 1
- CZDBNBLGZNWKMC-MWQNXGTOSA-N olivomycin Chemical class O([C@@H]1C[C@@H](O[C@H](C)[C@@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1)O[C@H]1O[C@@H](C)[C@H](O)[C@@H](OC2O[C@@H](C)[C@H](O)[C@@H](O)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@H](O)[C@H](OC)[C@H](C)O1 CZDBNBLGZNWKMC-MWQNXGTOSA-N 0.000 description 1
- 229950000846 onartuzumab Drugs 0.000 description 1
- 239000010502 orange oil Substances 0.000 description 1
- 229950007283 oregovomab Drugs 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 150000002905 orthoesters Chemical class 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 150000002923 oximes Chemical class 0.000 description 1
- 150000002924 oxiranes Chemical class 0.000 description 1
- 239000003002 pH adjusting agent Substances 0.000 description 1
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical group [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- VREZDOWOLGNDPW-UHFFFAOYSA-N pancratistatine Natural products C1=C2C3C(O)C(O)C(O)C(O)C3NC(=O)C2=C(O)C2=C1OCO2 VREZDOWOLGNDPW-UHFFFAOYSA-N 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- 229950004260 parsatuzumab Drugs 0.000 description 1
- 229950010966 patritumab Drugs 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- 229960005570 pemtumomab Drugs 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- QIMGFXOHTOXMQP-GFAGFCTOSA-N peplomycin Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCCN[C@@H](C)C=1C=CC=CC=1)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C QIMGFXOHTOXMQP-GFAGFCTOSA-N 0.000 description 1
- 229950003180 peplomycin Drugs 0.000 description 1
- 229960002087 pertuzumab Drugs 0.000 description 1
- 108010073101 phenylalanylleucine Proteins 0.000 description 1
- NMHMNPHRMNGLLB-UHFFFAOYSA-N phloretic acid Chemical compound OC(=O)CCC1=CC=C(O)C=C1 NMHMNPHRMNGLLB-UHFFFAOYSA-N 0.000 description 1
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 1
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 1
- 229940126620 pintumomab Drugs 0.000 description 1
- 229960000952 pipobroman Drugs 0.000 description 1
- NJBFOOCLYDNZJN-UHFFFAOYSA-N pipobroman Chemical compound BrCCC(=O)N1CCN(C(=O)CCBr)CC1 NJBFOOCLYDNZJN-UHFFFAOYSA-N 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 150000003057 platinum Chemical class 0.000 description 1
- 229920000765 poly(2-oxazolines) Polymers 0.000 description 1
- 229920000233 poly(alkylene oxides) Polymers 0.000 description 1
- 239000002745 poly(ortho ester) Substances 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920002643 polyglutamic acid Polymers 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 229920000166 polytrimethylene carbonate Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 235000011181 potassium carbonates Nutrition 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 239000011698 potassium fluoride Substances 0.000 description 1
- 235000003270 potassium fluoride Nutrition 0.000 description 1
- 235000011118 potassium hydroxide Nutrition 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 229950009904 pritumumab Drugs 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 239000001990 protein-drug conjugate Substances 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- DNXIASIHZYFFRO-UHFFFAOYSA-N pyrazoline Chemical compound C1CN=NC1 DNXIASIHZYFFRO-UHFFFAOYSA-N 0.000 description 1
- NIFIFKQPDTWWGU-UHFFFAOYSA-N pyrite Chemical compound [Fe+2].[S-][S-] NIFIFKQPDTWWGU-UHFFFAOYSA-N 0.000 description 1
- 229910052683 pyrite Inorganic materials 0.000 description 1
- 239000011028 pyrite Substances 0.000 description 1
- DVUZQONFTJKFPV-UHFFFAOYSA-N pyrrole-2,5-dithione Chemical class S=C1NC(=S)C=C1 DVUZQONFTJKFPV-UHFFFAOYSA-N 0.000 description 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 229950011613 racotumomab Drugs 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 229950011639 radretumab Drugs 0.000 description 1
- 229960002633 ramucirumab Drugs 0.000 description 1
- 229920005604 random copolymer Polymers 0.000 description 1
- BMKDZUISNHGIBY-UHFFFAOYSA-N razoxane Chemical compound C1C(=O)NC(=O)CN1C(C)CN1CC(=O)NC(=O)C1 BMKDZUISNHGIBY-UHFFFAOYSA-N 0.000 description 1
- 229960000460 razoxane Drugs 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 238000006268 reductive amination reaction Methods 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- OWPCHSCAPHNHAV-LMONGJCWSA-N rhizoxin Chemical compound C/C([C@H](OC)[C@@H](C)[C@@H]1C[C@H](O)[C@]2(C)O[C@@H]2/C=C/[C@@H](C)[C@]2([H])OC(=O)C[C@@](C2)(C[C@@H]2O[C@H]2C(=O)O1)[H])=C\C=C\C(\C)=C\C1=COC(C)=N1 OWPCHSCAPHNHAV-LMONGJCWSA-N 0.000 description 1
- 229950003238 rilotumumab Drugs 0.000 description 1
- 229950004892 rodorubicin Drugs 0.000 description 1
- IMUQLZLGWJSVMV-UOBFQKKOSA-N roridin A Natural products CC(O)C1OCCC(C)C(O)C(=O)OCC2CC(=CC3OC4CC(OC(=O)C=C/C=C/1)C(C)(C23)C45CO5)C IMUQLZLGWJSVMV-UOBFQKKOSA-N 0.000 description 1
- 238000001896 rotating frame Overhauser effect spectroscopy Methods 0.000 description 1
- VHXNKPBCCMUMSW-FQEVSTJZSA-N rubitecan Chemical compound C1=CC([N+]([O-])=O)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VHXNKPBCCMUMSW-FQEVSTJZSA-N 0.000 description 1
- 230000002000 scavenging effect Effects 0.000 description 1
- 150000007659 semicarbazones Chemical class 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 239000012064 sodium phosphate buffer Substances 0.000 description 1
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 239000011877 solvent mixture Substances 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 229950006315 spirogermanium Drugs 0.000 description 1
- ICXJVZHDZFXYQC-UHFFFAOYSA-N spongistatin 1 Natural products OC1C(O2)(O)CC(O)C(C)C2CCCC=CC(O2)CC(O)CC2(O2)CC(OC)CC2CC(=O)C(C)C(OC(C)=O)C(C)C(=C)CC(O2)CC(C)(O)CC2(O2)CC(OC(C)=O)CC2CC(=O)OC2C(O)C(CC(=C)CC(O)C=CC(Cl)=C)OC1C2C ICXJVZHDZFXYQC-UHFFFAOYSA-N 0.000 description 1
- 235000011150 stannous chloride Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 238000005556 structure-activity relationship Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 125000001174 sulfone group Chemical group 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 231100000057 systemic toxicity Toxicity 0.000 description 1
- 229950001289 tenatumomab Drugs 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 229950010259 teprotumumab Drugs 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- VYCVAPFXSOAOCL-ROUUACIJSA-N tert-butyl n-[(2s)-1-[[(2s)-5-(carbamoylamino)-1-[4-(hydroxymethyl)anilino]-1-oxopentan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]carbamate Chemical compound CC(C)(C)OC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=O)C(=O)NC1=CC=C(CO)C=C1 VYCVAPFXSOAOCL-ROUUACIJSA-N 0.000 description 1
- 150000003527 tetrahydropyrans Chemical group 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 150000003584 thiosemicarbazones Chemical class 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 229950004742 tigatuzumab Drugs 0.000 description 1
- AXZWODMDQAVCJE-UHFFFAOYSA-L tin(II) chloride (anhydrous) Chemical compound [Cl-].[Cl-].[Sn+2] AXZWODMDQAVCJE-UHFFFAOYSA-L 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 102000003601 transglutaminase Human genes 0.000 description 1
- 125000004665 trialkylsilyl group Chemical group 0.000 description 1
- PXSOHRWMIRDKMP-UHFFFAOYSA-N triaziquone Chemical compound O=C1C(N2CC2)=C(N2CC2)C(=O)C=C1N1CC1 PXSOHRWMIRDKMP-UHFFFAOYSA-N 0.000 description 1
- 229960004560 triaziquone Drugs 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- TUQOTMZNTHZOKS-UHFFFAOYSA-N tributylphosphine Chemical compound CCCCP(CCCC)CCCC TUQOTMZNTHZOKS-UHFFFAOYSA-N 0.000 description 1
- 229930013292 trichothecene Natural products 0.000 description 1
- 150000003327 trichothecene derivatives Chemical class 0.000 description 1
- HDZZVAMISRMYHH-LITAXDCLSA-N tubercidin Chemical compound C1=CC=2C(N)=NC=NC=2N1[C@@H]1O[C@@H](CO)[C@H](O)[C@H]1O HDZZVAMISRMYHH-LITAXDCLSA-N 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 229950009811 ubenimex Drugs 0.000 description 1
- 229950004593 ublituximab Drugs 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 229950000815 veltuzumab Drugs 0.000 description 1
- GPXBXXGIAQBQNI-UHFFFAOYSA-N vemurafenib Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(=CN=C3NC=2)C=2C=CC(Cl)=CC=2)=C1F GPXBXXGIAQBQNI-UHFFFAOYSA-N 0.000 description 1
- 229960003862 vemurafenib Drugs 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 229950006959 vorsetuzumab Drugs 0.000 description 1
- 229950003511 votumumab Drugs 0.000 description 1
- 238000010792 warming Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229940053867 xeloda Drugs 0.000 description 1
- 229950008250 zalutumumab Drugs 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229950009268 zinostatin Drugs 0.000 description 1
- 229960000641 zorubicin Drugs 0.000 description 1
- FBTUMDXHSRTGRV-ALTNURHMSA-N zorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 FBTUMDXHSRTGRV-ALTNURHMSA-N 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/12—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains three hetero rings
- C07D498/18—Bridged systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/537—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines spiro-condensed or forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68033—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a maytansine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6903—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being semi-solid, e.g. an ointment, a gel, a hydrogel or a solidifying gel
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Cell Biology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Catalysts (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
Un compuesto de fórmula general I o una sal del mismo: **(Ver fórmula)** en la que: R representa un grupo seleccionado entre -Y-OH, -Y-SH, -Y-S(O)2NH-Rx, -Y-NHS(O)2-Rx, -Y-CO2H, -Y-C(O)NH- Rx, -Y-NHC(O)-Rx, -Y-NHRy o -Y-S(O)2NH2, en los que o Y no está presente o Y representa un alquileno C1-6; Rx representa un alquilo C1-6 que está sustituido con -OH, -SH, -NH2 o -CO2H; Ry representa un átomo de hidrógeno o un grupo alquilo C1-4; X representa OH; Ra representa un grupo alquilo C1-4; Rb representa hidrógeno; Rc representa hidrógeno o metoxi; Rd representa un grupo alquilo C1-4; cada Re representa independientemente un átomo de halógeno, un grupo CF3, un grupo alquilo C1-4, un grupo alcoxi C1-4, un grupo -CN o un grupo -NO2; n es 0, 1 o 2; Rf representa un grupo alquilo C1-4; Rg representa un átomo de hidrógeno o un grupo alquilo, cicloalquilo, alquenilo, alquinilo, arilo o heteroarilo opcionalmente sustituido y en donde cuando Rg es un grupo alquilo opcionalmente sustituido, dicho grupo alquilo puede estar opcionalmente sustituido por: i) uno o más átomos de halógeno y/o grupos hidroxilo, alcoxi, amino, alquilamino o dialquilamino, en los que el resto alquilo tiene de 1 a 4 átomos de carbono; ii) uno o más aminoácidos; iii) un grupo N(Ri)(Rii), en el que R' representa hidrógeno o un grupo alquilo C1-4y en el que Rii representa un grupo alquilo C1-4, un grupo -C(O)-alquilo C1-6, un grupo -C(O)-alquenilo C2-6o un grupo -C(O)-cicloalquilo C3-6, en donde dicho grupo cicloalquilo C3-6 puede estar sin sustituir o sustituido con hasta 2 grupos metilo.
Description
DESCRIPCIÓN
Nuevos agentes citotóxicos y conjugados de los mismos
Campo de la invención
Esta invención se refiere a nuevos agentes citotóxicos, nuevos conjugados, en particular conjugados anticuerpofármaco e intermedios para elaborar los conjugados, incluyendo nuevos reactivos de conjugación. También se refiere a nuevos procesos para la elaboración de agentes citotóxicos.
Antecedentes de la invención
En los últimos años se ha dedicado mucha investigación a la conjugación de agentes terapéuticos como cargas útiles para péptidos y proteínas para una amplia gama de aplicaciones. La proteína o el péptido en sí mismo puede tener propiedades terapéuticas y/o ser una proteína de unión. Además, se ha usado la conjugación a polímeros para mejorar las propiedades de determinados agentes terapéuticos. Por ejemplo, los polímeros sintéticos, solubles en agua, en particular polialquilenglicoles, se usan ampliamente para conjugar péptidos o proteínas terapaéuticamente activos. Se ha demostrado que estos conjugados terapéuticos alteran las farmacocinéticas de manera favorables prolongando el tiempo de circulación y disminuyendo las tasas de aclaramiento, disminuyendo la toxicidad sistémica y, en varios casos, mostrando aumento de la eficacia clínica. El proceso de conjugar covalentemente polietilenglicol, PEG, a proteínas y otras cargas útiles normalmente se conoce como "PEGilación".
Las proteínas de unión (es decir proteínas o péptidos capaces de unirse a un compañero de unión en un objetivo), en particular anticuerpos o fragmentos de anticuerpo, se usan con frecuencia en los conjugados. Por ejemplo, se pueden conjugar con agentes citotóxicos y fármacos quimioterapéuticos para producir conjugados anticuerpo-fármaco (ADC), permitiendo la administración dirigida de dichos agentes a tejidos o estructuras específicos, por ejemplo tipos de células o factores de crecimiento particulares, minimizando el impacto en tejidos sanos normales y reduciendo de manera significativa los efectos secundarios asociados con los tratamientos de quimioterapia. Dichos conjugados tienen amplias aplicaciones terapéuticas potenciales en diversas áreas de enfermedades, en particular en el cáncer.
Kupchan et al., J. Am. Chem. Soc., 94, 1354 (1972) aisló por primera vez la maitansina de la corteza del arbusto africano Maytenus ovatus, donde se señaló por sus propiedades contra la leucemia. Se descubrió que los maitansinoides, tales como maitansinol y los ésteres C-3 del maitansinol son producidos por microbios (US 4.151.042), musgos (Sakai et al, J. Nat. Prod., 51 (5), 845-850, 1988) y también podrían generarse por rutan sintéticas (Kupchan et al., J. Med. Chem., 21, 31-37, 1978, Higashide et al., Nature 270, 721-722, 1977). La maitansina y el maitansinol tienen las estructuras:
El documento US 4.190.580 describe un método de síntesis de maitansinoides, mientras que el documento US 4.260.608 identifica una variedad de compuestos derivados de la maitansina con actividades antimicrobianas y antitumorales potentes como resultado de sus efectos antimitóticos sobre las células. El documento US 4.260.608 divulga derivados de la maitansina con un grupo alquilo opcionalmente sustituido en la posición R3. Desde entonces se han llevado a cabo numerosos estudios de relación estructura-actividad para determinar otras estructuras de maitansinoides potentes. Kawai et al., Chem. Pharm. Bull. 32 (9), 3441-3451 (1984) publicaron diversas estructuras que se modificaron en la posición C3 del maitansinol, que mostraron potentes efectos antitumorales in vivo. Los documentos EP 0004466, US 4.137.230 y WO 2012/061590 describen nuevos maitansinoides. Se describen varias modificaciones de maitansinoides en el documento US 2009/258870, Taft et al, Chem. Eur. J. 2012, 18, 880-886 y Harmrolfs et al, Beilstein J. Org. Chem. 2014, 10, 535-543.
Los maitansinoides bien conocidos incluyen aquellos conocidos como DM1 y DM4 como se describen en los documentos US 5.208.020 y WO2004/103272. Estos tienen las estructuras:
Las ansamitocinas son un subgrupo de maitansinoides, cuya síntesis se describe por Taft et al, ChemBioChem 2008, 9, 1057-1060. El documento EP 2103618 A1 divulga derivados de ansomitocina, composiciones farmacéuticas que comprenden los mismos, métodos para la producción de los derivados de ansamitocina y su uso para el tratamiento del cáncer. Una ansamitocina bien conocida es AP-3, que tiene la estructura:
Posteriormente, los maitansinoides y los ésteres de maitansinoides se usaron como carga útil citotóxica dentro de un contexto ADC en el documento EP 0425235 y se han usado de manera amplia desde entonces, véase, por ejemplo Liu et al, Proc. Natl. Acad. Sci. USA, 93, 8618-8623 (1996) y Kieda et al, Clin. Cancer Res., 15 (12), 2009. Widdison et al, J. Med. Chem. 49, 4392-4408 (2006) describió las cargas útiles de los maitansinoides DM1 y DM4 enlazados a tiol. Estas cargas útiles se conjugaron mediante un proceso de dos etapas en las que primero se hizo reaccionar un enlazador que contenía tiol con restos de lisina dentro del anticuerpo, seguido de conjugación de las cargas útiles que contenían tiol al enlazador mediante intercambio de disulfuro. Un medio alternativo para producir ADC por este proceso de dos etapas es mediante el uso de un enlazador heterobifuncional de trans-4-(maleimidilmetil)ciclohexan-1-carboxilato de succinimidilo (SMCC), el cual tiene un grupo succinimida en un extremo para reacciona con los restos de lisina dentro del anticuerpo y un grupo maleimida en el otro extremo para reaccionar con el grupo tiol del maitansinoide. El producto farmacéutico Kadcyla® disponible en el mercado es un ejemplo de un ADC producido usando un enlazador SMCC con una carga útil de maitansinoide DM1. Kadcyla® es en la actualidad uno de los ADC principales en la clínica y se usa para el tratamiento de cáncer de mama HER2 positivo.
El documento WO 2014/064424 describe ADC basados en maitansinas usando una tecnología específica diferente para unir el fármaco al anticuerpo. Se dan a modo de ejemplos conjugados derivados del reactivo AHX-DM1 disponible en el mercado de Levena (Concords) y tiene la estructura:
Todavía existe la necesidad de nuevas moléculas citotóxicas potentes que se pueden usar en un contexto ADC. Estas cargas útiles deben conjugarse de forma eficaz con un anticuerpo usando una tecnología de conjugación que permite que se generen ADC más estables. También existe la necesidad de ADC que muestran mayor eficacia o potencia en modelos celulares o animales relevantes de cánceres o, como alternativa, muestran un nivel similar de eficacia/potencia pero una cantidad reducida de toxicidad no específica dentro de la célula o el sujeto de ensayo.
Los presentes inventores han encontrado ahora que determinados compuestos maitansinoides nuevos poseen actividad citotóxica mejorada y son particularmente adecuados para su inclusión en conjugados con proteínas de unión. Los maitansinoides además tienen estabilidad mejorada en comparación con los compuestos comparadores. Los presentes inventores también encontraron un nuevo método de síntesis que posibilita la preparación eficaz de estos compuestos nuevos así como un método nuevo y mejorado de síntesis de otros maitansinoides.
Sumario de la invención
La invención proporciona un compuesto de fórmula general (I) o una sal del mismo:
en la que:
R representa un grupo seleccionado entre -Y-OH, -Y-SH, -Y-S(O)2NH-Rx, -Y-NHS(O)2-Rx, -Y-CO2H, -Y-C(O)NH-Rx, -Y-NHC(O)-Rx, -Y-NHRy o -Y-S(O)2NH2,
en los que o Y no está presente o Y representa un alquileno C-i-a;
Rx representa un alquilo Ci-a que está sustituido con -OH, -SH, -NH2 o -CO2H;
Ry representa un átomo de hidrógeno o un grupo alquilo C1-4;
X representa OH;
Ra representa un grupo alquilo C1-4;
Rb representa hidrógeno;
Rc representa hidrógeno o metoxi;
Rd representa un grupo alquilo C1-4;
cada Re representa independientemente un átomo de halógeno, un grupo CF3, un grupo alquilo C1-4, un grupo alcoxi C1-4, un grupo -CN o un grupo -NO2; n es 0, 1 o 2;
Rf representa un grupo alquilo C1-4;
Rg representa un átomo de hidrógeno o un grupo alquilo, cicloalquilo, alquenilo, alquinilo, arilo o heteroarilo opcionalmente sustituido y
en donde cuando Rg es un grupo alquilo opcionalmente sustituido, dicho grupo alquilo puede estar opcionalmente sustituido por:
i) uno o más átomos de halógeno y/o grupos hidroxilo, alcoxi, amino, alquilamino o dialquilamino, en los que el resto alquilo tiene de 1 a 4 átomos de carbono;
ii) uno o más aminoácidos;
iii) un grupo N(Ri)(Rii, en el que Ri representa hidrógeno o un grupo alquilo C1-4 y en el que Rii representa un grupo alquilo C1-4, un grupo -C(O)-alquilo C1-a, un grupo -C(O)-alquenilo C2-ao un grupo -C(O)-cicloalquilo C3-a, en donde dicho grupo cicloalquilo C3-a puede estar sin sustituir o sustituido con hasta 2 grupos metilo.
La presente invención también proporciona nuevos: conjugados; reactivos de conjugación; composiciones farmacéuticas; procesos para la preparación de los compuestos de fórmula I e intermedios útiles para preparar un compuesto de fórmula I, como se especifica en las reivindicaciones adjuntas. Además, la presente invención proporciona los nuevos compuestos y conjugados para su uso en terapia, como se especifica en las reivindicaciones adjuntas.
La presente divulgación también proporciona un compuesto de fórmula general (I') o una sal del mismo:
en la que R representa un grupo -Y-OH, -Y-O-Rx, -Y-SH, -Y-S-Rx, -Y-CO2H, -Y-CO-Rx, -Y-NHRy, -Y-NRy-NHRz o -Y-CRy=NOH, en el que o Y no está presente o Y representa un grupo alquileno C1-6 o alquilenoxi C1-6, cualquiera de los cuales puede estar interrumpido por un átomo de oxígeno, Rx representa un grupo alquilo C1-4 sustituido por -OH, -SH, -NHRy o -CO2H y cada uno de Ry y Rz representa independientemente un átomo de hidrógeno o un grupo alquilo C1-4; X representa OH, Oalquilo C1-4, SH, alquilo S1.4 o CN; Ra representa un átomo de hidrógeno o un grupo alquilo C1-4; Rb representa hidrógeno, OH, alcoxi C1-4 o alquilo C1-4C(O)O-; Rc representa hidrógeno, OH, alcoxi C1-4 o alquilo C1-4C(O)O-; Rd representa un átomo de hidrógeno o un grupo alquilo C1-4; cada Re representa independientemente un átomo de halógeno, un grupo CF3 o un grupo alquilo C1-4 o un grupo alcoxi C1-4 y n es 0, 1, 2, 3 o 4; Rf representa un átomo de hidrógeno o un grupo alquilo C1-4 y Rg representa un átomo de hidrógeno o un grupo alquilo, cicloalquilo, alquenilo, alquinilo, arilo o heteroarilo opcionalmente sustituido.
La presente divulgación proporciona también un conjugado que comprende un compuesto de fórmula general (I) o (I') o una sal del mismo enlazado a una proteína de unión mediante un enlazador, estando dicho enlazador conectado a dicho compuesto a través del grupo R de fórmula general (I) o (I').
La presente divulgación también proporciona un reactivo de conjugación que comprende un compuesto de fórmula general (I) o (I') o una sal del mismo unido a través de un enlazador a al menos un grupo funcional capaz de reaccionar con una proteína de unión, estando dicho enlazador conectado a dicho compuesto a través del grupo R de fórmula general (I) o (I').
La presente divulgación proporciona también una composición farmacéutica que comprende un compuesto o un conjugado de acuerdo con la presente divulgación, junto con un vehículo farmacéuticamente aceptable y opcionalmente junto con otro agente terapéutico. También se proporciona un método para tratar un paciente que necesita tratamiento para una enfermedad o trastorno proliferativo, autoinmunitario o infeccioso que comprende administrar una cantidad farmacéuticamente eficaz de un compuesto, conjugado o composición de acuerdo con la presente divulgación al paciente. También se proporciona un compuesto, conjugado o composición de acuerdo con la presente divulgación para su uso en terapia, en particular para su uso en el tratamiento de una enfermedad o trastorno proliferativo, autoinmunitario o infeccioso. Además, se puede usar un compuesto o conjugado de acuerdo con la presente divulgación para la elaboración de un medicamento para su uso en el tratamiento de una enfermedad o trastorno proliferativo, autoinmunitario o infeccioso.
La presente divulgación proporciona también un proceso para la preparación de los compuestos de acuerdo con la presente divulgación y nuevos intermedios útiles para preparar los compuestos de acuerdo con la presente divulgación.
Descripción detallada
Los compuestos
Los compuestos de la presente divulgación son de fórmula general (I). Los compuestos de la presente divulgación son una clase nueva de compuestos que contienen bifenilo que tienen actividad biológica inesperada. Los compuestos de la presente divulgación también son útiles en la producción de nuevos conjugados anticuerpo-fármaco y reactivos de conjugación.
En algunas realizaciones de la presente divulgación los compuestos son de fórmula (I'). En los compuestos de la presente divulgación, preferentemente cualquier grupo Ry o Rz presente en R es un grupo metilo o, en especial, un átomo de hidrógeno. En una realización preferida, Y no está presente. Si Y está presente, esta es preferentemente un grupo alquileno C1-4 o alquilenoxi C1-4, el cual puede estar interrumpido por un átomo de oxígeno, como en, por ejemplo,
-CH2-O-CH2-. Un grupo alquileno puede ser, por ejemplo, un grupo metileno, etileno o n-propileno, mientras que un grupo alquilenoxi puede ser, por ejemplo, un grupo metilenoxi, etilenoxi o n-propilenoxi. En algunas realizaciones de la presente divulgación R es -Y-OH, -Y-SH, -Y-S(O)2NH-Rx, -Y-NHS(O)2-Rx, -Y-CO2H, -Y-C(O)NH-Rx, -Y-NHC(O)-Rx, -Y-NHRy o -Y-S(O)2NH2, en donde Y no está presente o Y representa un grupo alquileno C1-6 y en donde Rx representa un grupo alquilo C1-6 que está sustituido con -OH, -SH, -NH2 o CO2H. En algunas realizaciones preferidas de la presente divulgación, R es Y-NHC(O)-Rx, más preferentemente R es Y-NHC(O)-Rx en el que Y está ausente, aún más preferentemente R es Y-NHC(O)-Rx en el que Y está ausente y Rx representa alquilo C1-6 sustituido con -SH. En algunas realizaciones preferidas de la presente divulgación, R es -OH, -NH2, -SH, -CONH2, -SO2NH2, -CO2H, CH2OH o -NHC(O)-alquilen C1-6-SH, en particular -NH2 o -NH-C(O)-alquilen C1-6-SH y especialmente -NH-C(O)-alquilen C1-6-SH. Cuando R es -NH-C(O)-alquilo C ^en donde dicho alquilo está sustituido con -SH (es decir -NH(C(O)-alquilen C1-6 -SH), el resto alquilo C1-6puede ser de cadena lineal o ramificada y, por ejemplo, R pueden incluir los siguientes:
En algunas realizaciones de la presente divulgación, R es un grupo -OH, -NH2, -CONH2 o -CO2H o un grupo alquileno C1-4, en especial un grupo metileno, etileno o n-propileno, sustituido por un grupo -OH, -NH2, -CONH2 o -CO2H. El grupo R puede estar en cualquier posición del anillo fenilo. El grupo R está preferentemente en la posición 3 o 4 del anillo fenilo (es decir con respecto a la posición del anillo fenilo que forma un enlace con el anillo fenilo que forma parte de la estructura principal del maitansinoide)
Cuando está presente, cada Re representa independientemente un átomo de halógeno, un grupo alquilo C1-6, alquenilo C2-6, alquinilo C2-6 o alcoxi C1-6 opcionalmente sustituido, cada uno de los cuales puede estar opcionalmente interrumpido por un átomo de oxígeno, un grupo fenilo o heteroarilo C5-10 opcionalmente sustituido, -OH, -CO2Rv, -C(O)NRvRw, -NRvC(O)Rw, NRvRw, _-SRv, -S(O)-Rv, S(O)2-Rv, -S(O)2NRvRw, un grupo -CN o un grupo -NO2. En algunas realizaciones de la presente divulgación, Re o está ausente o, cuando está presente, cada Re representa independientemente un átomo de halógeno, un grupo CF3, un grupo alquilo C1-4, un grupo alcoxi C1-4, un grupo -CN o un grupo -NO2. En algunas realizaciones de la presente divulgación, cualquier grupo Re presente se selecciona independientemente entre el grupo que consiste en un átomo de halógeno, un grupo metoxi, un grupo -CN o un grupo -NO2. En algunas realizaciones preferidas de la presente divulgación, cualquier grupo Re presente se selecciona entre el grupo que consiste en cloro, flúor, un grupo metoxi, un grupo -CN y un grupo -NO2. En algunas realizaciones preferidas de la presente divulgación, cualquier grupo Re presente preferentemente es un átomo de halógeno, por ejemplo un átomo de cloro, bromo o flúor o un grupo metilo o metoxi. Preferentemente n es 0, 1 o 2, en especial 0 o 1, en especial 0. Cuando está presente, el o cada grupo Re puede estar en cualquier posición del grupo fenilo distinta de la posición en la que el anillo fenilo está sustituido por el grupo R.
Preferentemente X representa OH. Preferentemente Ra representa alquilo C1-4, en especial metilo. Preferentemente Rb representa hidrógeno. Preferentemente Rc representa hidrógeno o metoxi, más preferentemente hidrógeno. Preferentemente Rd representa alquilo C1-4, en especial metilo. Preferentemente Re representa cloro o hidrógeno, en especial cloro. Preferentemente Rf representa alquilo C1-4, en especial metilo.
No se cree que la naturaleza del sustituyente Rg sea crucial para la presente divulgación, en la bibliografía se ha indicado una amplia gama de sustituyentes en esta posición en el núcleo de maitansina. Cualquier grupo alquilo, alquenilo o alquinilo tiene preferentemente hasta 10, por ejemplo hasta 6, átomos de carbono. Un grupo cicloalquilo preferentemente tiene 5, 6 o 7 átomos de carbono en el anillo y puede, por ejemplo, estar sustituido con uno o más grupos alquilo C1-4. Un grupo arilo preferentemente es un grupo fenilo. Un grupo heteroarilo puede, por ejemplo tener 5, 6 o 7 átomos en el anillo incluyendo al menos un átomo O, S y/o N. Este puede ser, por ejemplo, un grupo tiofeno, pirrol, pirrolidona, oxazol, tiazol, imidazol, pirazol, pirazolina, isoxazol, triazol, pirano, piridina, piperidina, dioxano, morfolina, piridazina, pirimidina, pirazina o piperazina. Los sustituyentes opcionales que pueden estar presentes en un grupo arilo o heteroarilo Rg incluyen átomos de halógeno y grupos alquilo, haloalquilo, hidroxi, amino, alquilamino,
dialquilamino y alcoxi, en los que cualquier resto alquilo tiene de 1 a 4 átomos de carbono. Un grupo alquilo Rg puede, por ejemplo, estar sustituido por uno o más átomos de halógeno y/o grupos hidroxi, alcoxi, amino, alquilamino o dialquilamino, en los que cualquier resto alquilo tiene de 1 a 4 átomos de carbono. Un grupo alquilo Rg también puede estar sustituido por uno o más aminoácidos, por ejemplo N-metilalanina o N-metilcisteína. En algunas realizaciones de la presente divulgación donde Rg es un grupo alquilo sustituido, el grupo -C(O)-Rg puede ser un derivado de aminoácido. Por ejemplo, un grupo alquilo Rg puede estar sustituido con un grupo N(Ri)(Rii), en el que Ri representa hidrógeno o un grupo alquilo C1-4 y en el que R'' representa un grupo alquilo C1-4, un grupo -C(O)-C-i_6, un grupo alquenilo -C(O)-C2-6 o un grupo cicloalquilo -C(O)-C3-6 en el que dicho grupo cicloalquilo C3-6 puede estar sin sustituir o sustituido con hasta 2 grupos metilo. En algunas realizaciones preferidas de la presente divulgación Rg representa alquilo C1-4 que está sin sustituir o sustituido con N(Ri)(Rii); Ri representa un grupo alquilo C1-4 y Rii representa un grupo -C(O)-alquilo C1-6. Los ejemplos de dichos grupos Rg incluyen
En algunas realizaciones de la presente divulgación donde Rg es un grupo alquilo sustituido, además de estar sustituido por un grupo N(Ri)(Rii) como se ha analizado anteriormente, el grupo alquilo puede estar opcionalmente sustituido con un sustituyente seleccionado entre el grupo que consiste en -OH, -SH, -SMe, un carbociclo C6-10 aromático que está opcionalmente sustituido con hidroxilo y un heterociclo C5-10 aromático. Como se ha analizado anteriormente, el grupo -C(O)-Rg puede ser un derivado de aminoácido. Por ejemplo, el grupo -C(O)-Rg puede comprender un resto de aminoácido, por ejemplo, tal como L-alanina o L-metionina.
En algunas realizaciones preferidas de la presente divulgación, Rg representa un grupo alquilo C1-6 sustituido o, en especial, sin sustituir, por ejemplo metilo, etilo, propilo, isopropilo, butilo, isobutilo, pentilo, hexilo o un grupo fenilo opcionalmente sustituido. Más preferentemente Rg representa alquilo C1-4, en especial isopropilo.
En algunas realizaciones preferidas de la presente divulgación, Ra representa alquilo C1-4; Rb representa hidrógeno; Rc representa hidrógeno o metoxi; Rd representa alquilo C1-4; Re está ausente o cuando está presente representa flúor, cloro, metoxi, -CN o -NO2; n = 0 o 1; Rf representa alquilo C1-4 y Rg representa alquilo C1-4.
En algunas realizaciones preferidas de la presente divulgación, Ra representa alquilo C1-4; Rb representa hidrógeno; Rc representa hidrógeno o metoxi; Rd representa alquilo C1-4; Re está ausente o, cuando está presente representa cloro; Rf representa alquilo C1-4 y Rg representa alquilo C1-4.
Preferentemente el compuesto es un compuesto de fórmula (I') o una sal del mismo:
en la que R representa un grupo -Y-OH, -Y-O-Rx, -Y-SH, -Y-S-Rx, -Y-CO2H, -Y-C(O)-Rx, -Y-NHRy, -Y-NRy-NHRz o -Y-CRy=NOH, en el que o Y no está presente o Y representa un grupo alquileno C1-6 o alquilenoxi C1-6, cualquiera de los cuales puede estar interrumpido por un átomo de oxígeno, Rx representa un grupo alquilo C1-4 sustituido por -OH, -SH, -NHRy o -CO2H y cada uno de Ry y Rz representa independientemente un átomo de hidrógeno o un grupo alquilo C1-4; X representa OH, Oalquilo C1-4, SH, alquilo S1.4 o CN; Ra representa un átomo de hidrógeno o un grupo alquilo C1-4; Rb representa hidrógeno, OH, alcoxi C1-4 o alquilo C1-4C(O)O-; Rc representa hidrógeno, OH, alcoxi C1-4 o alquilo C1-4C(O)O-; Rd representa un átomo de hidrógeno o un grupo alquilo C1-4; cada Re representa independientemente un átomo de halógeno, un grupo CF3 o un grupo alquilo C1-4 o un grupo alcoxi C1-4 y n es 0, 1, 2, 3 o 4; Rf representa un átomo de hidrógeno o un grupo alquilo C1-4 y Rg representa un átomo de hidrógeno o un grupo alquilo, cicloalquilo, alquenilo, alquinilo, arilo o heteroarilo opcionalmente sustituido.
Preferentemente, el compuesto de la presente divulgación es un compuesto de fórmula general (Ia) o una sal del mismo:
en la que R, X, n y Ra-Rg tienen los significados y significados preferidos indicados anteriormente, por ejemplo, para el compuesto de fórmula (I) o fórmula (I'). El compuesto de fórmula (Ia) también se puede representar como sigue:
Más preferentemente, el compuesto de la presente divulgación es un compuesto de fórmula general (Ib) o una sal del mismo:
en la que R, Re y n tienen los significados y significados preferidos indicados anteriormente, por ejemplo, para el compuesto de fórmula (I) o fórmula (I').
En algunas realizaciones de la presente divulgación, el compuesto es un compuesto de fórmula (Ib) en la que n es 0 o 1; Re cuando está presente, es cloro, flúor, metoxi, -CN o -NO2 y R es -NH2 o -NH-C(O)-alquilen C1-6-SH o una sal del mismo.
En algunas realizaciones de la presente divulgación, el compuesto es un compuesto de fórmula (Ic)
en el cual Rg es
n es 0 o 1; Re cuando está presente, es cloro, flúor, metoxi, -CN o -NO2 y R es -NH2 o -NH-C(O)-alquilen C1-6-SH o una sal del mismo.
Los compuestos de fórmula (I) (y (I'), (Ia), (Ib) y (Ic)) pueden formar sales. Las sales adecuadas de acuerdo con la presente divulgación incluyen aquellas formadas con ácidos orgánicos o inorgánicos. En particular, las sales adecuadas formadas con ácidos incluyen aquellas formadas con ácidos minerales, ácidos carboxílicos orgánicos fuertes, tales como ácidos alcanocarboxílicos de 1 a 4 átomos de carbono que están sin sustituir o sustituidos, por ejemplo, con halógeno, tales como ácidos dicarboxílicos saturados o insaturados, tales como ácidos hidroxicarboxílicos, tales como aminoácidos o con ácidos organosulfónicos, tales como ácidos alquil o arilsulfónicos (C1-C4) que están sin sustituir o sustituidos, por ejemplo, con halógeno. Las sales de adición de ácido farmacéuticamente aceptables incluyen aquellas formadas a partir de los ácidos clorhídrico, bromhídrico, sulfúrico, nítrico, cítrico, tartárico, acético, fosfórico, láctico, pirúvico, trifluoroacético, succínico, perclórico, fumárico, maleico, glicólico, láctico, salicílico, oxaloacético, metanosulfónico, etanosulfónico, p-toluenosulfónico, fórmico, benzoico, malónico, naftaleno-2-sulfónico, bencenosulfónico, isetiónico, ascórbico, málico, ftálico, aspártico y glutámico, lisina y arginina. Los compuestos de fórmula (I) (y (I'), (Ia), (Ib) y (Ic)) y las sales de los mismos pueden existir también en forma de solvatos, por ejemplo hidratos.
Los compuestos de la presente divulgación contienen quirales (centros asimétricos). Los estereoisómeros individuales (enantiómeros y diaestereoisómeros) están dentro del alcance de la presente divulgación. Los compuestos de la presente divulgación también pueden existir como atropisómeros, que son estereoisómeros que aparecen debido a la rotación impedida alrededor de un enlace sencillo (por ejemplo un enlace biarilo). En algunos casos la barrera para la interconversión entre atropisómeros puede ser lo suficientemente alta de modo que los atropisómeros individuales son estables y se pueden aislar. Por consiguiente, los atropisómeros individuales también están dentro del alcance de la presente divulgación. En algunas circunstancias, los compuestos pueden existir en formas tautoméricas y dichas formas tautoméricas de los compuestos también están abarcadas por la presente divulgación.
Las cargas útiles de la presente divulgación se pueden formar en conjugados y, como tales, estos se deben considerar como productos intermedios útiles para la preparación de los conjugados. Su estructura permite la conexión con un enlazador en la posición C-19 position (véase Higashide et al 1977, supra, para nomenclatura). Se sabe que las cargas útiles de maitansinoides que están conectadas a enlazadores a través de un enlace éster a la posición C-3 están sujetas a escisión/hidrólisis por esterasas o eliminación beta. Se sabe que las esterasas residen en la sangre y ambos mecanismos de hidrólisis pueden dar como resultado la liberación prematura de la carga útil de maitansinoide antes de que haya entrado en la célula, lo que puede provocar toxicidades no específicas y/o reducir la potencia del fármaco antitumoral. Sin embargo, los presentes inventores entienden que la presencia de un sustituyente éster C-3 en un maitansinoide está asociado con una potencia mejorada. Aunque cuando la conjugación es a través de la posición C-19 la eliminación beta y/o la hidrólisis por esterasas aún son posibles, la carga útil y por lo tanto la ADC aún retendrán la actividad y, a diferencia de las cargas útiles conjugadas en C-3, no sufrirán liberación prematura después de estas reacciones. Además, los presentes inventores han realizado experimentos comparativos de estabilidad en suero in vitro que, sorprendentemente, indican que un compuesto comparador que es adecuado para la conjugación a través de un sustituyente éster C-3, es menos estable que un compuesto que es adecuado para la conjugación a través de la posición C-19 pero que también contiene aún un sustituyente éster C-3. Por lo tanto, los compuestos de la presente divulgación, así como los conjugados que incorporan esos compuestos, se considera que poseen buenas propiedades de estabilidad.
Aspectos del proceso
Una característica clave de los compuestos de la presente divulgación es que el grupo fenilo presente en la estructura principal de la maitansina portan otro grupo fenilo sustituido con un grupo R y este grupo R se puede usar para conjugar el compuesto a una proteína de unión. La estructura principal de la maitansina contiene un grupo fenilo que porta un átomo de cloro. Los inventores han descubierto un método nuevo que desplaza este átomo de cloro para producir los compuestos que contienen fenilo de la presente divulgación. Por consiguiente, la presente divulgación proporciona también un proceso para la preparación de un compuesto de la presente divulgación que comprende hacer reaccionar un compuesto de fórmula general:
en la que X, Ra-Rd, Rf y Rg tienen los significados y significados preferidos dados anteriormente para el compuesto de fórmula (I), (I'), (la), (Ib) o (Ic), con un reactivo aril-organometálico en el que el resto arilo es un grupo fenilo que está sustituido con (Re)n y R o una versión protegida de R y en el que R y (Re)n tienen los significados dados para la fórmula general (I), (I'), (Ia), (lb) o (Ic), llevándose a cabo la reacción en presencia de un catalizador de metal de transición.
El reactivo aril-organometálico puede ser, por ejemplo, un reactivo de aril cinc, aril estaño, aril magnesio o aril silicio. Más preferentemente, el reactivo aril-organometálico es un reactivo arilborónico; en especial un ácido aril borónico de fórmula general
estar presente en una forma protegida.
El catalizador de metal de transición puede ser, por ejemplo, un derivado de cobre, níquel o, en especial, paladio y el metal está normalmente en el estado de oxidación I o II. El metal está presente junto con un ligando bidentado o, en especial, monodentado. Este ligando puede, por ejemplo, basarse en nitrógeno o, en especial, fósforo. Un catalizador especialmente preferido es metanosulfonato de (2-diciclohexilfosfino-2',6'-dimetoxibifenil)[(2-(2-amino-1,1-bifenil)paladio (II), disponible en el mercado como Sphos Pd G3 de Sigma Aldrich.
Normalmente la reacción se llevará a cabo en presencia de un disolvente, por ejemplo un disolvente de éter tal como THF, 2-metil-THF, 1,4-dioxano, éter ferc-butil metílico o dimetoxietano, un hidrocarburo tal como tolueno o un alcohol tal como n-butanol. Se prefiere el uso de THF. Habitualmente son adecuadas las condiciones básicas. La reacción se realiza generalmente a temperatura ambiente o temperatura elevada. La temperatura de reacción puede ser por ejemplo de 20 a 120 °C, por ejemplo de 30 a 100 °C, especialmente de 40-60 °C.
Preferentemente el compuesto de fórmula (II) tiene la fórmula:
en la que Ra, Rb, Rc, Rd, Rf, Rg y X son como se han definido anteriormente, por ejemplo como para el compuesto de fórmula (I), (I'), (Ia), (Ib) o (Ic) o
Se entenderá que en los reactivos aril-organometálicos, en especial los reactivos de fórmula (III) (y (IIIa), (IIIb), (IIIc) y (IIId), analizados a continuación), el grupo R puede estar presente en forma protegida. Los grupos adecuados para proteger un grupo carboxi incluyen metilo, etilo, t-butilo, bencilo, p-metoxibencilo, 9-fluorenilmetilo, trimetilsililo, tbutildimetilsililo y difenilmetilo. Los grupos adecuados para proteger un grupo amino incluyen t-butoxicarbonilo (BOC), tritilo, benciloxicarbonilo, 9-fluorenilmetoxicarbonilo, formilo, trimetilsililo y t-butildimetilsililo (TBDMS), se pueden usar ftalimida y succinimidas y grupos análogos para proteger un grupo hidrazina o hidroxilamina. Los grupos adecuados para proteger un grupo hidroxi incluyen grupos sililo que incluyen grupos trialquilsililo C1-6, tales como trimetilsililo, trietilsililo, tbutildifenilsililo y t-butildimetilsililo; grupos acilo que incluyen grupos alcanoílo C1-6, tales como formilo, acetilo y pivaloílo y grupos acilo aromáticos tales como benzoílo; grupos arilmetilo tales como bencilo, p-metoxibencilo, 9-fluorenilmetilo y difenilmetilo; grupos acetal tales como tetrahidropirano (THP); éteres tales como éter alílico y t-Bu éter; éter metoximetílico (MOM) y éter 2-metoxietoximetílico (MEM). Se pueden encontrar numerosos ejemplos de grupos protectores adecuados en, por ejemplo, "Greene's Protective Groups in Organic Synthesis", Wiley-Blackwell, 2014.
Donde el reactivo aril-organometálico contiene un grupo R en forma protegida, el producto inmediato del proceso de la presente divulgación será un compuesto de fórmula (I), (I'), (Ia), (Ib) o (Ic) o una sal del mismo, en la que el grupo R también está presente en esa forma protegida, es decir:
Estos compuestos protegidos se convierten en el correspondiente compuesto de fórmula general (I), (I'), (la), (Ib) o (Ic) o una sal del mismo, mediante eliminación del grupo protector y como tales, los compuestos protegidos son útiles como productos intermedios para la preparación de los compuestos de fórmula general (I), (I'), (Ia), (Ib) o (Ic) o una sal de los mismos. Estos compuestos protegidos, que se espera que tengan en sí mismos actividad biológica, son nuevos y forman un aspecto más de la presente divulgación. En especial se prefieren los compuestos en los que el grupo protector es uno de los mencionados anteriormente.
En algunas realizaciones preferidas de la presente divulgación, el proceso comprende hacer reaccionar un compuesto de fórmula (II) con un reactivo de aril-boro en la que el resto arilo es un grupo fenilo sustituido con (Re)n y con R o una versión protegida de R, en la que R y (Re)n tiene los significados dados para la fórmula general (I), (I'), (Ia), (Ib) o (Ic), en presencia de un catalizador de paladio. Las reacciones catalizadas con paladio entre reactivos arilborónicos y haluros de arilo a menudo se denominan en la técnica reacciones de Suzuki, acoplamientos de Suzuki, reacciones de Suzuki-Miyaura o acoplamientos de Suzuki-Miyaura. Donde el proceso comprende una reacción de Suzuki, en algunas
realizaciones de la presente divulgación, el reactivo arilborónico es un ácido aril borónico, un éster aril-boronato o una sal de trifluoroborato de arilo. Preferentemente el reactivo arilborónico o es un ácido aril borónico, por ejemplo de fórmula (III)
o un éster de aril-boronato, por ejemplo un pinacol éster de fórmula (IIIa), un 1,3-propanodiol éster de fórmula (IIIb), un neopentilglicol éster de fórmula (IIIc) o un éster N-metiliminodiacético de fórmula (INd):
en la que R y (Re)n tiene los significados dados para la fórmula general (I), (I'), (Ia), (Ib) o (Ic) y en la que R puede estar presente en forma protegida; en especial un ácido aril borónico de fórmula general
en la que R y (Re)n tiene los significados dados para la fórmula general (I), (I'), (Ia), (Ib) o (Ic) y en la que R puede estar presente en una forma protegida. Donde los grupos R y/o Re presentes en los reactivos arilborónicos pueden formar sales (por ejemplo, en el caso de un reactivo arilborónico que contiene un grupo R que es -NH2), se pueden usar las formas de sal adecuadas de los reactivos (tal como la sal clorhidrato en el caso donde R es -NH2).
Donde el proceso comprende llevar a cabo una reacción de Suzuki (es decir un acoplamiento que implica un reactivo arilborónico y el uso de un catalizador de paladio), la reacción se realiza habitualmente en presencia de una base adecuada, tal como una base potásica inorgánica, por ejemplo fosfato potásico, carbonato potásico, hidróxido potásico o fluoruro potásico. Preferentemente, la reacción se realiza en presencia de fosfato potásico.
Los catalizadores de paladio adecuados para las reacciones de Suzuki implican un compuesto de fórmula (III) y el reactivo arilborónico apropiado incluye aquellos basados en ligandos de fosfina estéricamente impedidos que contienen grupos ciclohexilo, tales como metanosulfonato de (2-diciclohexilfosfino-2',6'-dimetoxibifenil)[(2-(2'-amino-1,1'-bifenil)paladio (II), disponible en el mercado como SPhos Pd G3 de Sigma Aldrich, como se ha mencionado anteriormente y metanosulfonato de (2-diciclohexilfosfino-2',4',6-triisopropiM,1-bifenil)[2-(2-amino-1,1-bifenil)]paladio (II), disponible en el mercado como XPhos Pd G3 de Sigma Aldrich o una mezcla de los dos. Otros ejemplos incluyen los catalizadores vendidos por Sigma Aldrich con los nombres comerciales de SPhos Pd G4 y XPhos Pd G4. Las estructuras de estos catalizadores se proporcionan a continuación:
Un ejemplo más de un catalizador adecuado es acetato de paladio (II) junto con el ligando de XPhos (2-diciclohexilfosfino-2',4',6'-triisopropilbifenilo), que de nuevo están disponibles en Sigma Aldrich.
Donde el proceso comprende llevar a cabo una reacción de Suzuki (es decir un acoplamiento que implica un reactivo arilborónico y el uso de un catalizador de paladio), la reacción puede, por ejemplo, llevarse a cabo a temperatura elevada (a una temperatura por ejemplo en el intervalo de desde 30 hasta 100 °C o de 40-60 °C) o, más preferentemente, a temperatura ambiente (por ejemplo a una temperatura en el intervalo de desde 15 hasta 40 °C, dependiendo de las condiciones ambientales locales).
Donde el proceso comprende llevar a cabo una reacción de Suzuki (es decir un acoplamiento que implica un reactivo arilborónico y el uso de un catalizador de paladio), la reacción se realiza habitualmente en presencia de agua. Se ha encontrado que la adición de agua facilita y acelera la reacción. Por consiguiente, en realizaciones preferidas de la presente divulgación, el proceso comprende hacer reaccionar un compuesto de fórmula (II) con un reactivo de arilboro en la que el resto arilo es un grupo fenilo sustituido con (Re)n y con R o una versión protegida de R, en la que R y (Re)n tiene los significados dados para la fórmula general (I), (I'), (Ia), (Ib) o (Ic), en presencia de un catalizador de paladio y en presencia de agua, por ejemplo, se usa un sistema disolvente acuoso. Los ejemplos de sistemas disolventes adecuados incluyen sistemas disolventes de éter: agua, tales como THF:agua, 2-metil THF:agua, éter dietílico:agua, éter diisopropílico:agua, éter ferc-butil metílico:agua, dimetoxietano:agua y 1,4-dioxano:agua. Otros ejemplos incluyen sistemas disolventes de alcohol:agua, tales como sistemas de n-butanol:agua y tolueno:agua. En algunas realizaciones preferidas de la presente divulgación, el sistema disolvente es THF:agua, por ejemplo en una relación de volumen de 5:1 a 20:1, en especial de aproximadamente 10:1.
También se ha encontrado que la reacción catalizada por paladio entre el reactivo arilborónico y el compuesto de fórmula (II) avanza particularmente bien en ausencia o ausencia sustancial de oxígeno. Habitualmente, las reacciones se realizan en atmósfera inerte, tal como argón o nitrógeno, después de purgar el aire del sistema. Se pueden llevar a cabo múltiples ciclos de purgado-rellenado para minimizar los niveles de oxígeno presentes en el sistema. Por lo tanto, en algunas realizaciones preferidas de la presente divulgación, la reacción de Suzuki se lleva a cabo en ausencia o ausencia sustancial de oxígeno.
Se ha encontrado que la reacción de Suzuki trabaja particularmente bien en presencia de agua y en ausencia sustancial de oxígeno. Por lo tanto, en algunas realizaciones preferidas de la presente divulgación, el reactivo arilorganometálico es un ácido aril-borónico o un éster de aril-boronato y la reacción se realiza en presencia de un catalizador de paladio, en presencia de agua y en ausencia o ausencia sustancial de oxígeno.
El proceso de la presente divulgación inesperadamente proporciona acceso a una amplia variedad de motivos de
biarilo que comprenden diversas funcionalidades y proporciona también acceso directo a determinados compuestos de fórmula (I), (I'), (la), (Ib) y (Ic) con un alto rendimiento. El uso con éxito de condiciones suaves para preparar los compuestos de la presente divulgación es particularmente sorprendente a la vista de la reactividad percibida del resto de cloruro de arilo rico en electrones estéricamente impedidos en el compuesto de fórmula (II) y a la vista del complejo y la estructura química susceptible del compuesto maitansinoide. La eficacia del proceso de la presente divulgación es sorprendente, en particular porque se podría esperar que el uso de un catalizador de paladio diera como resultado la degradación de la porción dieno y/o epóxido de la estructura principal del maitansinoide. Esto de hecho no sucede.
Se apreciará que, después de la etapa de acoplamiento del biarilo, el compuesto resultante se puede someter a otra transformación química. Por ejemplo, como se ha descrito anteriormente, donde el reactivo aril-organometálico contiene un grupo R en la forma protegida, el producto inmediato del proceso estará también en la forma protegida y se puede someter a una etapa de desprotección en la que el grupo protector se elimina. Como otro ejemplo, donde el producto de la etapa de acoplamiento del biarilo es un compuesto de fórmula (I), (I'), (Ia), (Ib) o (Ic), este se puede convertir en otro compuesto de fórmula (I), (I'), (Ia), (Ib) o (Ic) por una transformación química posterior (por ejemplo, un compuesto en que R es -NH2 se puede convertir en un compuesto en el que R es -NH-C(O)-alquil C1-6-SH o un compuesto en el que R es -CH2OH se puede convertir por oxidación en un compuesto en el que R es -CO2H). Como un ejemplo más, los compuestos de fórmula (I), (I'), (Ia), (Ib) o (Ic) son útiles para producir agentes de conjugación y conjugados y el proceso también puede comprender una o más etapas en las que el compuesto de fórmula (I), (I'), (Ia), (Ib) o (Ic) se convierte en un reactivo de conjugación de la presente divulgación o en un conjugado de la presente divulgación.
Conjugados y reactivos de conjugación
Los conjugados y los reactivos de la presente divulgación contienen un enlazador que, a través del grupo R de la fórmula (I), (I'), (Ia), (Ib) o (Ic), conecta el compuesto de fórmula (I), (I'), (Ia), (Ib) o (Ic) o una sal del mismo, denominado en el presente documento carga útil o fármaco D, a la proteína de unión en los conjugados de la presente divulgación o a la agrupación funcional en los reactivos de conjugación de la presente divulgación. Los conjugados y reactivos se pueden representar de forma esquemática por:
D~enlazador~F' o
D~enlazador~F
respectivamente, donde D es el fármaco y F es la agrupación funcional del reactivo, que en la reacción con una proteína de unión da lugar a la agrupación F' que incluye la proteína de unión presente en el conjugado.
Mientras que en algunas realizaciones de la presente divulgación, el enlazador puede ser un enlace, por ejemplo en el caso de los conjugados, que comprende un compuesto de fórmula (I), (I'), (Ia), (Ib) o (Ic) que contiene un grupo R colgante que puede actuar como un espaciador entre la estructura maitansinoide principal y la proteína de unión, en otras realizaciones preferidas de la presente divulgación, el enlazador es distinto de un enlace, por ejemplo, el enlazador comprende un grupo que actúa como un espaciador entre el fármaco y la proteína de unión o entre el fármaco y el grupo funcional del reactivo que reacciona con la proteína de unión.
En algunas realizaciones preferidas de la presente divulgación, el conjugado comprende un compuesto de fórmula (I').
Los compuestos de la presente divulgación se pueden convertir en conjugados, en particular conjugados de anticuerpo fármaco (ADC) mediante unión del compuesto a través del grupo R a una proteína de unión apropiada (por ejemplo, anticuerpo, fragmento de anticuerpo y similares) usando químicas de enlace conocidas en la técnica. Las químicas de unión a modo de ejemplo incluyen aquellas basadas en maleimidas o N-hidroxisuccinimidas como se divulga en los documentos WO 2004/060965 y Wo 2013/090590 respectivamente y aquellas divulgadas en el documento WO2014/064424A1.
Como se usa en el presente documento, el término "proteína de unión" pretende incluir tanto proteínas de unión como péptidos y, excepto donde el contexto requiera otra cosa de forma específica, se debe entender que incluye tanto péptidos como proteínas. Las proteínas de unión que se pueden usar en los conjugados de la presente divulgación incluyen cualquier proteína, polipéptido o péptido que pueda servir como un agente de unión para un patrón o una diana de unión. La diana puede ser, por ejemplo, un microorganismo, un virus o una célula, por ejemplo, una célula cancerosa o inmunológica. La proteína de unión por tanto actúa para dirigir los compuestos de la presente divulgación, la carga útil en un conjugado de acuerdo con la presente divulgación, a la diana particular. Los ejemplos de dichas proteínas de unión incluyen anticuerpos de longitud completa, fragmentos de anticuerpos, armazones proteicos de inmunoglobulina (Ig) y no Ig/miméticos de anticuerpos obtenidos mediante técnicas de ingeniería genética de proteínas racional o combinatoria, y lectinas. Las proteínas de unión más comunes usadas en los conjugados de proteínafármaco son los anticuerpos y cualquier referencia a una proteína de unión debería, excepto donde el contexto requiera específicamente lo contrario, entenderse que incluye una referencia específica a un anticuerpo.
Como se usa en el presente documento, "anticuerpo" significa una molécula de inmunoglobulina que reconoce y se une específicamente a un antígeno diana, tal como una proteína, polipéptido, péptido, hidrato de carbono,
polinucleótido, lípido o una combinación de los mismos a través de al menos un sitio de reconocimiento de antígeno dentro de la región variable de la molécula de inmunoglobulina. El término "anticuerpo" incluye anticuerpos policlonales, anticuerpos monoclonales, anticuerpos multiespecíficos tales como anticuerpos biespecíficos, anticuerpos quiméricos, anticuerpos humanizados, anticuerpos humanos, proteínas de fusión que comprenden una porción de determinación de antígeno de un anticuerpo y cualquier otra molécula de inmunoglobulina modificada que comprende un sitio de reconocimiento de antígeno siempre que los anticuerpos exhiban la actividad biológica deseada. Un anticuerpo puede incluir cualquiera de las cinco clases principales de inmunoglobulinas: IgA, IgD, IgE, IgG e IgM o subclases (isotipos) de las mismas (por ejemplo, IgGl, IgG2, IgG3, IgG4, IgAl e IgA2), basándose en la identidad de sus dominios constantes de cadena pesada, citados como alfa, delta, épsilon, gamma y mu, respectivamente. Las diferentes clases de inmunoglobulinas tienen diferentes y bien conocidas estructuras de subunidad y configuraciones tridimensionales. En una realización de la presente divulgación, el anticuerpo es IgGI o IgG4.
Además, excepto donde el contexto requiera lo contrario, el término "anticuerpo" debería entenderse que abarca anticuerpos de longitud completa y fragmentos de anticuerpo que comprenden una región de unión a antígeno dl anticuerpo de longitud completa. Los fragmentos de anticuerpo pueden ser, por ejemplo, Fab, Fab', F(ab')2, scFv, Fv, diacuerpos, minicuerpos o anticuerpos multiespecíficos formados a partir de fragmentos de anticuerpos, por ejemplo minicuerpos compuestos de diferentes permutaciones de fragmentos scFv o diacuerpos y, opcionalmente, fragmentos Fc o dominios Ch, tales como proteínas de fusión scFv-Fc, scFv-Fc-scFv, Fab-scFv, (Fab'ScFv)2, scDiacuerpos, scDiacuerpo-Fc, scDiacuerpo-CH3, scFv-Ch3 y SCFV-Ch2-Ch3. Un fragmento de anticuerpo se puede producir por escisión enzimática, técnicas sintéticas o recombinantes.
Una proteína de unión puede servir como un agente de unión para un receptor, antígeno u otro resto en la superficie de una diana, por ejemplo, una célula o un virus asociado con una enfermedad proliferativa, autoinmune o infecciosa. Por ejemplo, la proteína de unión puede ser un anticuerpo que se une específicamente a un antígeno de superficie celular en una célula cancerosa. Se conocen métodos de identificación y validación de antígenos de superficie celular para que los anticuerpos se dirijan a las células cancerosas, por ejemplo en Carter P, et al., Endocr. Relat. Cancer.
2004 Dec; 11 (4): 659-87 y varios conjugados anticuerpo-fármaco para tratar el cáncer se encuentran actualmente en desarrollo clínico. Los ejemplos de anticuerpos disponibles para el tratamiento de cáncer y marcadores tumorales de cánceres específicos, también se conocen bien en la técnica y se pueden usar. Como alternativa, la diana puede ser una célula inmunológica, por ejemplo, una célula que es responsable de la producción de anticuerpos autoinmunitarios o un linfocito activado que está asociado con una enfermedad autoinmune. En otras realizaciones de la presente divulgación, la diana puede ser un microorganismo o un virus asociado con una infección o enfermedad microbiana y vírica.
Un ejemplo de un anticuerpo útil en los conjugados de la presente divulgación es un anticuerpo anti-CD30, por ejemplo un anticuerpo quimérico monoclonal cAC10, por ejemplo brentuximab. Un ejemplo más de un anticuerpo útil en los conjugados de la presente divulgación es un anticuerpo anti-HER2, por ejemplo trastuzumab.
Un reactivo de conjugación de acuerdo con la presente divulgación comprende un compuesto de acuerdo con la presente divulgación unido a través del grupo R mediante un enlazador a un grupo funcional F capaz de reaccionar con una proteína de unión.
Como se ha mencionado anteriormente, se puede usar cualquier clase de reacción de conjugación conocida para formar los conjugados de la presente divulgación. Por ejemplo, la reacción se puede llevar a cabo usando los métodos conocidos de unión de tiol, conjugación de amina o química clic. Por ejemplo, el reactivo puede contener un grupo maleimida, un grupo N-hidroxisuccinimida, un grupo de química clic, por ejemplo un grupo azida o alquino, un grupo amina, un grupo carboxilo o un grupo éster activo. Otros enfoques posibles incluyen el uso de proteínas de unión que han sido modificadas por ingeniería genética con un aminoácido específicamente para conjugación, tales como cisteínas modificadas genéticamente o aminoácidos no presentes en la naturaleza y conjugación enzimática a través de una reacción enzimática específica tal como con transglutaminasa. La conjugación enzimática también se puede conseguir usando una enzima Sortasa que puede, por ejemplo, conjugar restos de enlazador-fármaco a la secuencia LPXTG que se ha modificado genéticamente en la proteína de unión. El sitio de reacción en la proteína de unión puede ser de naturaleza tanto nucleófila como electrófila. Los sitios de conjugación comunes están en los restos de aminoácido de lisina o cisteína o los restos de carbohidrato. Como alternativa, la conjugación puede ocurrir en un marcador de polihistidina que se ha unido a la proteína de unión.
Preferentemente el reactivo de conjugación comprende un grupo funcional capaz de reaccionar con al menos un electrófilo o, en especial, nucleófilo, presente en la proteína de unión y, por lo tanto, de unirse químicamente a la misma. Como tal, el reactivo de conjugación habitualmente incluye al menos un grupo saliente que se pierde en la reacción con un nucleófilo. El reactivo de conjugación puede, por ejemplo, incluir dos o más grupos salientes y preferentemente el reactivo de conjugación de acuerdo con la presente divulgación es capaz de reaccionar con dos nucleófilos. Si están presentes dos o más grupos salientes, estos pueden ser iguales o diferentes. Como alternativa, un reactivo de conjugación puede contener un grupo sencillo que es químicamente equivalente a dos grupos salientes y cuyo grupo sencillo es capaz de reaccionar con dos nucleófilos.
Los grupos nucleófilos incluyen átomos de azufre y grupos amina y los grupos nucleófilos en las proteínas de unión
son proporcionados, por ejemplo, por restos de cisteína, lisina o histidina. En una realización preferida de la presente divulgación, un grupo nucleófilo es un átomo de azufre presente en un resto de cisteína presente en la proteína de unión. Dichas estructuras se pueden obtener por reducción de un enlace disulfuro presente en la proteína de unión. En otra realización de la presente divulgación, un grupo nucleófilo puede ser un grupo imidazol presente en un resto de histidina presente en un marcador de polihistidina unido a la proteína de unión.
Un grupo de reactivos se base en las bis-halo- o bis-tio-maleimidas y derivados de las mismas como se describe en Smith et al., J. Am. Chem. Soc,. 2010, 132, 1960-1965 y Schumacher et al., Bioconj. Chem., 2011,22, 132-136. Estos reactivos contienen la agrupación funcional:
en la que cada L es un grupo saliente. El átomo de nitrógeno del anillo de maleimida está conectado al grupo de unión. De forma similar, las maleimidas que contienen un único grupo saliente L:
se puede usar. De nuevo, el átomo de nitrógeno del anillo de maleimida está conectado al grupo de unión.
Además, las maleimidas que carecen de grupo saliente:
se puede usar. De nuevo, el átomo de nitrógeno del anillo de maleimida está conectado al grupo de unión. Por ejemplo, loa reactivos basados en maleimida se pueden hacer reaccionar con un resto de tiol presente en una proteína de unión, por ejemplo, después de la reducción de un enlace disulfuro que puede estar presente en la proteína de unión. Otro grupo de reactivos son los descritos en el documento WO2011/73391. Un ejemplo de estos reactivos comprende la agrupación funcional:
en la que cada L es un grupo saliente.
Otro grupo funcional de reactivos de conjugación son aquellos basados en grupos acilo activados tales como ésteres de N-hidroxisuccinimida, es decir que contienen un grupo funcional que tiene la fórmula:
o una sal del mismo.
Los grupos funcionales de este tipo se pueden usar para conjugar con proteínas de unión mediante, por ejemplo, una reacción de amidación con un grupo amina nucleófilo presente en la proteína de unión.
Otro ejemplo de reactivos de conjugación son aquellos que contienen un grupo disulfuro piridilo
en el que R' o está ausente o representa un grupo aceptor de electrones, tal como un grupo -NO2. Los grupos funcionales de este tipo se pueden usar para conjugar con proteínas de unión mediante, por ejemplo, reacción con restos de tiol presentes en las proteínas de unión (por ejemplo, resultantes de la reducción de un puente disulfuro en la proteína de unión), que dan como resultado un conjugado que a su vez contiene un enlace disulfuro.
En una realización especialmente preferida de la presente divulgación, el reactivo de conjugación contiene la agrupación funcional F:
en la que W representa un grupo aceptor de electrones, por ejemplo un grupo ceto, un grupo éster -O-CO- o un grupo sulfona -SO2-; cada uno de A y B representa independientemente una cadena alquileno o alquenileno C1-5 y o cada L representa de manera independiente un grupo saliente o ambos Ls juntos representan un grupo saliente. Cuando los reactivos que contienen dichos grupos reaccionan con proteínas, un primer grupo saliente L se pierde para formar in situ un reactivo de conjugación que contiene una agrupación funcional de fórmula:
en la que m es de 0 a 4, que reacciona con un primer nucleófilo. El segundo grupo saliente L se pierde después y tiene lugar una reacción con un segundo nucleófilo. Como alternativa a usar un reactivo que contiene la agrupación funcional (V) como material de partida, se pueden usar reactivos que contienen la agrupación funcional (VI), ya que las agrupaciones funcionales (V) y (VI) son equivalentes químicos entre sí.
Estos reactivos de conjugación de la presente divulgación son del tipo general divulgado en los documentos WO 2005/007197 y WO 2010/100430. Dichos reactivos se pueden usar, por ejemplo, para seleccionar como diana dos átomos de azufre obtenidos por reducción de un enlace disulfuro o grupos imidazol presentes en los restos de histidina presentes en un marcador de polihistidina.
Un grupo saliente L puede, por ejemplo, ser -SP, -OP, -SO2P, -OSO2P, -N+PR13R14, halógeno u -O0, en el que P representa un átomo de hidrógeno o un grupo alquilo (preferentemente alquilo C1-6), arilo (preferentemente fenilo) o alquil-arilo (preferentemente alquilfenilo C1-6) o es un grupo que incluye una porción -(CH2CH2O)q en la que q es un número de seis o más y cada uno de R13 y R14 representa independientemente un átomo de hidrógeno, un grupo alquilo C1-4o un grupo P y 0 representa un grupo arilo sustituido, en especial fenilo, que contiene al menos un
sustituyente, por ejemplo -CN, -CF3, -NO2, -CO2Raa, -COH, -CH2OH, -CORaa, -ORaa, -OCORaa, -OCO2Raa, -SRaa, -SORaa, -SO2Raa, -NHCORaa, -NRaa2, CORaa, -NHCO2Raa, -NPCO2Raa, -NO, -NHOH, -NRaa OH, -CH=N-NHCORaa, -CH=N-NRaaCORaa, -N+Raa3, -N+HRaa2, -N+H2Raa, halógeno, especialmente cloro o, en especial, flúor, -CECRaa, -CH=CRaa2 y -CH=CHRaa, en la que cada Raa representa un átomo de hidrógeno o un grupo alquilo (preferentemente alquilo C1-6), arilo (preferentemente fenilo) o alquil-arilo (preferentemente alquil-fenilo Ci-a). Se prefiere la presencia de sustituyentes captadores de electrones.
Los reactivos de conjugación en los que P representa un grupo que incluye una porción -(CH2CH2O)q en la que q es un número de seis o más se describen en el documento WO 2016/059377 y los reactivos que incluyen dichos grupos salientes forman una realización preferida de la presente divulgación. Dichos reactivos pueden incluir, por ejemplo, -(CH2CH2O)q-R1 donde R1 es un grupo de protección terminal. R1 puede ser, por ejemplo, un átomo de hidrógeno, un grupo alquilo, en especial un grupo alquilo C1-4, en particular un grupo metilo o un grupo arilo opcionalmente sustituido, por ejemplo un grupo fenilo opcionalmente sustituido, por ejemplo un grupo tolilo. Como alternativa, el grupo de protección terminal incluye un grupo funcional tal como un grupo carboxilo o un grupo amina. Dichos grupos de protección terminar pueden, por ejemplo, tener la fórmula -CH2CH2CO2H o -CH2CH2NH2 y se pueden preparar por funcionalización de la unidad terminal de una cadena (CH2CH2O)q. Como alternativa, en vez de estar terminado por un grupo protector terminal, el grupo -(CH2CH2O)q puede tener dos puntos de unión en el reactivo de conjugación tal que químicamente el equivalente de dos grupos salientes está presente, capaz de reaccionar con dos nucleófilos.
La porción -(CH2CH2O)q del grupo saliente está basado en PEG, polietilenglicol. El PEG puede ser de cadena lineal o ramificado y se puede derivatizar o funcionalizar de cualquier modo. q es un número de 6 o más, por ejemplo 6, 7, 8, 9 o 10 o más. Por ejemplo, q puede ser de 6 a 9. No hay un límite superior particular para q. q puede ser, por ejemplo, 150 o menos, por ejemplo 120 o menos, por ejemplo 100 o menos. Por ejemplo q puede ser de 6 o 7 a 150, por ejemplo de 6 o 7 a 120.
Un grupo saliente L especialmente preferido presente en un nuevo reactivo de conjugación de acuerdo con la presente divulgación es -SP o -SO2P, en especial -SO2P. Dentro de este grupo, una realización preferida de la presente divulgación es donde P representa un grupo fenilo o, en especial, un grupo tolilo. Otra realización preferida de la presente divulgación es donde P representa un grupo que incluye una porción -(CH2CH2O)q, en especial una en la que q tiene uno de los valores mencionados anteriormente, en especial 7. Los grupos salientes L especialmente preferidos son -SO2-(CH2CH2O)q-H y -SO2-(CH2CH2O)q-Me, en especial -SO2-(CH2CH2O)y-H y -SO2-(CH2CH2O)y-Me. A lo largo de esta memoria descriptiva, cualquier referencia a un grupo saliente L se debe entender que incluye una referencia específica a estos grupos preferidos, en especial -SO2-(CH2CH2O)q-H y -SO2-(CH2CH2O)q-Me y en especial -SO2-(CH2CH2O)y-H y -SO2-(CH2CH2O)7-Me.
Preferentemente W representa un grupo ceto. Preferentemente cada uno de A y B representa -CH2- y m es 0.
Los reactivos de fórmula V y VI anteriores forman conjugados que incluyen la agrupación F':
en la que W representa un grupo aceptor de electrones o un grupo obtenido por reducción de un grupo aceptor de electrones y Pr representa la proteína de unión unida a A y B a través de los nucleófilos Nu. El producto inmediato del proceso de conjugación (como se describe con más detalle a continuación) es un conjugado que contiene un grupo aceptor de electrones W. Sin embargo, el proceso de conjugación es reversible en condiciones adecuadas. Esto puede ser deseable para algunas aplicaciones, por ejemplo, donde se necesita la liberación rápida de la proteína de unión, pero para otras aplicaciones, puede no ser deseable la liberación rápida de la proteína de unión. Por lo tanto, puede ser deseable estabilizar los conjugados mediante reducción del resto aceptor de electrones para dar un resto que previene la liberación de la proteína de unión. Por consiguiente, el proceso de conjugación puede comprender una etapa adicional opcional de reducir el grupo aceptor de electrones en el conjugado. El uso de un borohidruro, por ejemplo borohidruro sódico, cianoborohidruro sódico, borohidruro potásico o triacetoxiborohidruro sódico, como agente reductor es particularmente preferido. Otros agentes de reducción que se pueden usar incluyen, por ejemplo, cloruro de estaño (lI), alcóxidos tales como alcóxido de aluminio e hidruro de litio y aluminio.
Por lo tanto, por ejemplo, un resto W que contiene un grupo ceto se puede reducir hasta un resto que contiene un grupo CH(o H); se puede obtener un grupo éter CH.ORaa por la reacción de un grupo hidroxi con un agente de eterificación; se puede obtener un grupo éster CH.O.C(O)Raa mediante la reacción de un grupo hidroxi con un agente de acilación; se puede preparar un grupo amina CH.NH2, CH.NHRaa o CH.NRaa2 a partir de una cetona por aminación reductora o se puede formar una amida CH.NHC(O)Raa o CH.N(C(O)Raa)2 por acilación de una amina. Se puede reducir una sulfona hasta un sulfóxido, sulfuro o tiol éter.
Preferentemente las agrupaciones F' y F tienen la fórmula:
en especial
En las fórmulas anteriores, los grupos salientes preferidos son como se han descrito anteriormente. Preferentemente cada Nu es un átomo de azufre.
Otro grupo preferido de reactivos de conjugación contiene el agolpamiento funcional:
~W-CR15R15'-CR15L.L' (VIII)
en el que W tiene el significado y los significados preferidos facilitados anteriormente y uno de dos: cada R15 representa un átomo de hidrógeno o un grupo alquilo C1-4, R15' representa un átomo de hidrógeno y cada L y L' representa independientemente un grupo saliente o ambos L y L' juntos representan un grupo saliente o cada R15 representa un átomo de hidrógeno o un grupo alquilo C1-4, L representa un grupo saliente y R15' y L' juntos representan un enlace.
Otro grupo de reactivos de conjugación incluyen el agrupamiento funcional F:
~W-(CH=CH)p-(CH2)2-L (IX)
o
~W-(CH=CH)p-CH=CH2 (X)
en los que W tiene el significado y los significados preferidos facilitados anteriormente y p representa 0 o un número entero de 1 a 4, preferentemente 0. Un reactivo especialmente preferido de este tipo incluye el agrupamiento funcional: ~NH-CO-Ar'-CO-(CH2)2-L (IXa)
o
~NH-CO-Ar'-CO-CH=CH2 (Xa)
en los que Ar' representa un grupo arilo opcionalmente sustituido, en especial fenilo.
En todos los casos, los significados preferidos para los grupos salientes L son como se han mencionado anteriormente. Los reactivos de conjugación de acuerdo con la presente divulgación pueden contener más de un agrupamiento funcional para reacción con una proteína de unión. Por ejemplo, un reactivo puede contener un agrupamiento funcional, preferentemente de fórmula (V) o (VI), en un extremo de la molécula y uno o más agrupamientos funcionales adicionales, en cualquier lugar de la molécula. Dichas estructuras se describen en, por ejemplo, Belcheva et al, J.
Biomater. Sci Polymer Edn. 9 (3), 207-226 y son útiles en la síntesis de los conjugados que contienen múltiples proteínas de unión y/o múltiples cargas útiles.
Los reactivos de conjugación nuevos de la presente divulgación se pueden preparar por métodos análogos a métodos conocidos. Es una característica común de todos los grupos R posibles en la fórmula (I) que se puedan hacer reaccionar con facilidad con un grupo complementario en un enlazador. Por lo tanto, por ejemplo, un grupo hidroxilo o tiol se puede hacer reaccionar con un grupo ácido o un enlazador para formar un enlace éster; un grupo amino se puede hacer reaccionar con un grupo ácido (incluyendo un grupo ácido activado tal como DCC) para formar un enlace amida; un grupo carboxilo puede hacerse reaccionar con un grupo amina para formar un enlace amida, si se desea activando primero el grupo carboxilo; una hidrazina se puede hacer reaccionar con un aldehído o cetona para formar una hidrazona o con un ácido carboxílico para formar una hidrazida, si se desea activando primero el grupo carboxilo; un grupo oxiamina se puede hacer reaccionar con un aldehído o cetona para formar una oxima.
Los reactivos de conjugación de acuerdo con la presente divulgación se pueden hacer reaccionar con una proteína de unión para formar un conjugado de acuerdo con la presente divulgación y dicha reacción forma otro aspecto más de la presente divulgación. Por lo tanto, un reactivo de conjugación que incluye una agrupación funcional adecuada, en especial la agrupación funcional V o VI, se hace reaccionar con una proteína de unión, en particular con un anticuerpo o fragmento de anticuerpo, para formar un conjugado, en especial uno que incluye la agrupación (VII).
Una característica principal del uso de los reactivos de conjugación (V) o (VI) es que un grupo saliente de a-metileno y un doble enlace se conjugan de forma cruzada pon una función aceptora de electrones que sirve como un resto activador de Michael. Si el grupo saliente es propenso a la eliminación en el reactivo de función cruzada en lugar de al desplazamiento directo y el grupo acepto de electrones es un resto activador adecuado para la reacción de Michael, entonces la bisalquilación intramolecular secuencial puede ocurrir por reacciones consecutivas de Michael y retro Michael. En los reactivos que contienen la agrupación funcional (V), un grupo saliente sirve para enmascarar un doble enlace conjugado latente que no está expuesto hasta después de que haya ocurrido la primera alquilación para dar un reactivo que incluye la agrupación funcional (VI) y la bis-alquilación resulta de las reacciones secuenciales e interactivas de Michael y retro-Michael. Los agentes de alquilación de funcionalidad cruzada pueden contener múltiples enlaces conjugados al doble enlace o entre el grupo saliente y el grupo aceptor de electrones.
Donde la unión a la proteína de unión es a través de dos átomos de azufre derivados de un enlace disulfuro en la proteína, el proceso puede realizarse reduciendo el enlace disulfuro después de lo cual el producto reducido se hace reaccionar con el reactivo de acuerdo con la presente divulgación. Preferentemente el enlace disulfuro se reduce y cualquier exceso de agente reductor se elimina, por ejemplo, por intercambio de solución tamponadora, antes de introducir el reactivo de conjugación. El enlace de disulfuro se puede reducir, por ejemplo, con ditiotreitol, mercaptoetanol o tris-carboxietilfosfina usando métodos convencionales.
En el caso de agentes de conjugación que comprenden un grupo de fórmula (V) o (VI) por ejemplo, las reacciones de conjugación se pueden llevar a cabo en condiciones similares a los procesos de conjugación conocidos, incluyendo las condiciones divulgadas en los documentos WO 2005/007197, WO 2009/047500, WO 2014/064423 y WO 2014/064424.
Donde las conjugaciones se llevan a cabo usando un reactivo de conjugación que tiene un éster de N-hidroxisuccinimida, por ejemplo, por reacción de amidación con un grupo amina nucleófilo presente en la proteína de unión, las reacciones de conjugación también se pueden llevar a cabo en condiciones similares a los procesos de conjugación conocidos, incluyendo las condiciones divulgadas en, por ejemplo, Widdison et al, J. Med. Chem., 2006, 49 (14), págs. 4392-4408, el documento WO2004/103272, el documento WO2012/061590 o el documento WO2013/090590. De forma similar, para las químicas de enlace de maleimida, se pueden usar las condiciones tales como las divulgadas en los documentos WO2004/010957 o WO2004/060965.
El proceso se puede realizar, por ejemplo, en un disolvente o mezcla disolvente en la que todos los reactivos son solubles. Por ejemplo, se puede permitir que la proteína de unión reaccione directamente con el reactivo de conjugación polimérico en un medio de reacción acuoso. Este medio de reacción también puede estar tamponado, dependiendo de las necesidades de PH del nucleófilo. El pH óptimo para la reacción normalmente será de al menos 4,5, habitualmente de entre aproximadamente 5,0 y aproximadamente 8,5, preferentemente de aproximadamente 6,0 a 7,5. Las condiciones de reacción óptimas dependerán por supuesto de los reactivos específicos empleados.
Las temperaturas de reacción de entre 3-40 °C son normalmente adecuadas cuando se usa un medio de reacción acuoso. Las reacciones realizadas en medios orgánicos (por ejemplo THF, acetato de etilo, acetona, acetonitrilo, DMF, DMA) habitualmente se realizan a temperaturas hasta temperatura ambiente. En una realización preferida de la presente divulgación, la reacción se realiza en tampón acuoso que puede contener una proporción de disolvente orgánico, por ejemplo hasta el 50 % en volumen de disolvente orgánico, habitualmente del 5 al 20 % en volumen de disolvente orgánico.
La proteína de unión se puede conjugar de manera eficaz usando un equivalente estequiométrico o un exceso ligero de reactivo de conjugación. Sin embargo, también es posible realizar la reacción de conjugación con un exceso
estequiométrico de reactivo de conjugación y esto puede ser deseable para algunas proteínas o si se desean conjugados que contienen una relación promedio más alta de fármaco a anticuerpo (DAR más alto). El reactivo en exceso se puede eliminar con facilidad, por ejemplo por cromatografía de intercambio iónico o HPLC, durante la posterior purificación del conjugado.
Por supuesto, es posible para más de un reactivo de conjugación conjugarse con una proteína de unión, donde la proteína contiene suficientes puntos de unión adecuados. Por ejemplo, en una proteína de unión que contiene dos enlaces disulfuro diferentes o en una proteína de unión que contiene un enlace disulfuro y también porta un marcador de polihistidina, es posible conjugar dos moléculas de reactivo por molécula de proteína de unión usando un reactivo de conjugación de fórmula (V) o (VI) y dichos conjugados forman parte de la presente divulgación.
Enlazador
El enlazador que conecta la carga útil, a través del grupo R de fórmula general (I), (I'), (Ia), (Ib) o (Ic) a la proteína de unión en un conjugado de acuerdo con la presente divulgación o la agrupación funcional capaz de reaccionar con una proteína de unión en un reactivo de conjugación de acuerdo con la presente divulgación puede contener cualquier grupo deseado, por ejemplo, cualquiera de los grupos convencionales normalmente encontrados en este campo.
Subsección enlazador (i).
En una realización de la presente divulgación, el enlazador entre la carga útil y la agrupación de fórmula F'/F y en particular la porción del enlazador inmediatamente adyacente a la agrupación de fórmula F'/F en los conjugados o reactivos de las fórmulas (V), (VI), (VII), (VIII), (IX) y (X), puede incluir un grupo alquileno (preferentemente un grupo alquileno C1-10) o un grupo arilo o heteroarilo opcionalmente sustituido, cualquiera de los cuales puede estar terminado o interrumpido por uno o más átomos de oxígeno, átomos de azufre, grupos -NRaa (en los que Raa representa un átomo de hidrógeno o un grupo alquilo (preferentemente alquilo C1-6), arilo (preferentemente fenilo) o alquil-arilo (preferentemente alquil-fenilo C1-6)), grupos ceto, grupos -O-CO-, grupos -CO-O-, -O-CO-O, -O-CO-NRaa-, -NR-CO-O-, -CO-NRaa y/o grupos -NRaa.CO-. Los grupos arilo adecuados incluyen grupos fenilo y naftilo, mientras que los grupos heteroarilo adecuados incluyen piridina, pirrol, furano, pirano, imidazol, pirazol, oxazol, piridazina, pirimidina y purina. En especial se prefieren los grupos arilo como la porción del enlazador inmediatamente adyacente al grupo F/F', en especial los grupos fenilo. Más en especial se prefieren los grupos heteroarilo como la porción del enlazador inmediatamente adyacente al grupo F/F', por ejemplo uno de los mencionados anteriormente.
El grupo arilo o heteroarilo puede ser adyacente a otra porción del grupo enlazador que es, o que contiene, un grupo -NRaa.CO- o -CO.NRaa, por ejemplo un grupo -NH.CO- o -CO.NH-. En este caso y en cualquier otro a lo largo de esta memoria descriptiva, donde está presente un grupo Raa, este es preferentemente un alquilo C1-4, en especial un grupo metilo o, en especial, un átomo de hidrógeno.
Los sustituyentes que pueden estar presentes en un arilo opcionalmente sustituido, en especial un grupo fenilo o heteroarilo incluyen por ejemplo uno o más del mismo o de diferentes sustituyentes seleccionados entre alquilo (preferentemente alquilo C1-4, en especial metilo, opcionalmente sustituido con OH o CO2H), -CF3, -NRaa2, -CN, -NO2, -CO2Raa, -COH, -CH2OH, -CORaa, -ORaa, -OCORaa, -OCO2Raa, -SRaa, -SORaa, -SO2Raa, -NHCORaa, -NRaaCORaa, -NHCO2Raa, -NRaa.CO2Raa, -NO, -NHOH, -NRaa.OH, -CH=N-NHCORaa, -CH=N-NRaa.CORaa, -N+Raa3, -N+H3, -N*HRaa2, -N+H2Raa, halógeno, por ejemplo flúor o cloro, -CECRaa, -CH=CRaa2 y -CH=CHRaa, en los que cada Raa representa independientemente un átomo de hidrógeno o un grupo alquilo (preferentemente alquilo C1-6), arilo (preferentemente fenilo), o alquil-arilo (preferentemente alquil-fenilo C1-6). Es especialmente preferida la presencia de sustituyentes aceptores de electrones. Los sustituyentes preferidos incluyen por ejemplo CN, NO2, -ORaa, -OCORaa, -SRaa, -NHCORaa, -NHOH y -NRaa.CORaa.
Preferentemente el enlazador incluye uno de los grupos anteriores adyacente a la agrupación F'/F. En especial se prefieren los conjugados y los reactivos de conjugación que incluyen la agrupación:
o, en especial:
También son adecuados los conjugados y reactivos de conjugación de las fórmulas: -CO-NH-Het-F', -CO-NH-Het-F, -NH-CO-Het-F' y -NH-CO-Het-F, en las que Het representa un grupo heteroarilo, por ejemplo uno de los mencionados anteriormente.
Cualquiera de las estructuras anteriores puede estar adyacente a cualquiera de las estructuras mencionadas en las subsecciones (ii) y (iii) a continuación.
En todas las fórmulas anteriores, en especial las fórmulas (XI), (XII), (XIII) y (XIV), preferentemente F' tiene la fórmula (VII), por ejemplo (VIIa), (VIIb) o (VIIc) anteriores y preferentemente F tiene la fórmula (V) o (VI), por ejemplo (Va), (Vb), (Via) o (VIb) anteriores.
Subsección enlazador (ii).
En una realización de la presente divulgación, el enlazador puede contener un grupo degradable, es decir, puede contener un grupo que se rompe en condiciones fisiológicas, separando la carga útil de la proteína a la que está, o estará, unida. Como alternativa, puede ser un enlazador que no es escindible en condiciones fisiológicas. Donde un enlazador se rompe en condiciones fisiológicas, este es preferentemente escindible en condiciones intracelulares. Donde la diana es intracelular, preferentemente el enlazador es sustancialmente insensible a las condiciones extracelulares (es decir de modo que el suministro en la diana intracelular de una dosis suficiente del agente terapéutico no se prohíba).
Donde el enlazador contiene un grupo degradable, este es normalmente sensible a las condiciones hidrolíticas, por ejemplo, puede ser un grupo que se degrada a determinados valores de pH (por ejemplo, condiciones ácidas). Las condiciones hidrolíticas/ácidas se pueden encontrar, por ejemplo, en los endosomas lo lisosomas. Los ejemplos de grupos susceptible a hidrólisis en condiciones ácidas incluyen hidrazonas, semicarbazonas, tiosemicarbazonas, amidas cis-aconíticas, ortoésteres y cetales. Los ejemplos de grupos susceptibles a condiciones hidrolíticas incluyen:
y
En una realización preferida de la presente divulgación, el enlazador incluye
Por ejemplo, puede incluir:
El enlazador también puede ser susceptible a degradación en condiciones reductoras. Por ejemplo, puede contener un grupo disulfuro que es escindible en exposición a agentes reductores biológicos, tales como tioles. Los ejemplos de grupos disulfuro incluyen:
en la que cada uno de R, R', R" y R'" es independientemente hidrógeno o alquilo C1-4. En una realización preferida de la presente divulgación, el enlazador incluye
Por ejemplo, puede incluir
o
El enlazador también puede contener un grupo que es susceptible a degradación enzimática, por ejemplo puede ser susceptible a escisión por una proteasa (por ejemplo, una proteasa lisosómica o endosómica) o una peptidasa. En una realización especialmente preferida de la presente divulgación, una porción del enlazador contiene un grupo peptidilo que comprende al menos uno, por ejemplo al menos dos, al menos tres, al menos cuatro o al menos cinco restos de aminoácido, específicamente aminoácidos alfa de origen natural. Por ejemplo, la porción del enlazador que contiene la secuencia Phe-Leu, Gly-Phe-Leu-Gly, Val-Ala, Val-Cit, Phe-Lys o Glu-Glu-Glu y la presencia de un grupo peptidilo Val-Cit se prefiere. Los enlazadores que contienen la secuencia Val-Cit-PAB, como se analiza más adelante, son especialmente preferidos.
Un ejemplo particularmente referido de un grupo susceptible a degradación enzimática es:
en donde AA representa una secuencia de aminoácido específica de proteasa, tal como una de las mencionadas anteriormente, en especial Val-Cit. En otras palabras, en una realización preferida de la presente divulgación, el enlazador incluye:
Por ejemplo, puede incluir
En algunas realizaciones preferidas de la presente divulgación, la porción PAB del enlazador (es decir porción benciloxicarbonilo) puede estar directamente unida al grupo R del resto de fármaco (por ejemplo, al residuo de un grupo -NH2 formando así un resto carbamato, en el caso en donde R es -NH2 en los compuestos de fórmula (I), (I'), (Ia), (Ib) o (Ic) y el nitrógeno del grupo Val puede estar conectado al resto del enlazador.
Como se ha analizado anteriormente, en algunas realizaciones de la presente divulgación el compuesto de fórmula (I), (I'), (Ia), (Ib) o (Ic) puede contener un grupo R de fórmula -NH-C(O)-alquilen C1-6-SH. Cuando se incorpora en un conjugado o un reactivo de conjugación de la presente divulgación, esto se puede lograr mediante el uso de un enlace disulfuro, por ejemplo:
En dichos casos, la porción de enlazador del conjugado o reactivo de conjugación se puede considerar que contiene un grupo -S-alquileno C1-6, que se puede escindir por reducción del enlace disulfuro para liberar el compuesto de fórmula (I) que contiene el grupo R de fórmula -NH-C(O)-alquilen C1-6-SH. Por ejemplo, en algunas realizaciones de la presente divulgación el enlazador comprende un grupo -S-alquileno C1-6 seleccionado entre los siguientes:
y
Los conjugados de este tipo pueden, por ejemplo, sintetizarse a partir de un compuesto de fórmula (I), (I'), (Ia), (Ib) o (Ic) en las que el grupo R es un grupo -NH2, por ejemplo, por una reacción de amidación con un ácido carboxílico o derivado de ácido carboxílico adecuado. Como resultado, se puede considerar que el grupo enlazador contiene un grupo:
por ejemplo un grupo enlazador que contiene un grupo disulfuro que es escindible con exposición a agentes reductores biológicos, como se ha descrito anteriormente.
Los conjugados de la presente divulgación comprenden una proteína de unión conjugada con el fármaco D a través del residuo del grupo R (por ejemplo, a través de un grupo -NH- en el caso de un compuesto de fórmula (I) en el que R es -NH2 o a través de un grupo -NHC(O)alquilen C1-6-S-, en el caso de un compuesto de fórmula (I) en el que R es -NHC(O)alquilen C1.6-SH).
El enlazador puede portar una única carga útil D o más de un grupo D. Los múltiples grupos D se pueden incorporar mediante el uso de un enlazador ramificado, el cual puede incorporar, por ejemplo, un aspartato o glutamato o un resto similar. Esto introduce un elemento ramificado de fórmula:
donde b es 1,2, 3 o 4, siendo b=1 aspartato y siendo b=2 glutamato y representando b=3 una realización preferida de la presente divulgación. Cada uno de los restos acilo en la fórmula anterior se puede acoplar a un grupo D. El grupo ramificado anterior puede incorporar un grupo -CO.CH2-, es decir:
Si se desea, el aspartato o glutamato o resto similar puede estar acoplado a otros aspartato y/o glutamato y/o restos similares, por ejemplo:
etcétera.
De manera similar, los aminoácidos lisina, serina, treonina, cisteína, arginina o tirosina o restos similares (por ejemplo, lisina o serina) se pueden introducir para formar un grupo ramificado, es decir:
en el que b es 4 para lisina y
en el que b es 1 para serina.
Subsección enlazador (iii).
El enlazador de los reactivos y conjugados de la presente divulgación puede, si se desea, contener un oligómero o polímero (denominados en conjunto en el presente documento "polímero" por conveniencia). Un polímero puede, por ejemplo, ser un polialquilen glicol, una polivinilpirrolidona, un poliacrilato, por ejemplo poliacriloil morfolina, un polimetacrilato, una polioxazolina, un alcohol polivinílico, una poliacrilamida o una polimetacrilamida, por ejemplo policarboximetacrilamida o un copolímero HPMA. Además, el polímero puede ser un polímero que es susceptible de degradación enzimática o hidrolítica. Dichos polímeros, por ejemplo, incluyen poliésteres, poliacetales, poli(orto ésteres), policarbonatos, poli(imino carbonatos) y poliamidas, tales como poli(aminoácidos). Un polímero puede ser un homopolímero, copolímero aleatorio o copolímero definido estructuralmente tal como un copolímero de bloque, por ejemplo, puede ser un copolímero de bloque derivado de dos o más óxidos de alquileno o de poli(óxido de alquileno) y o bien un poliéster, poliacetal, poli(orto éster) o un poli(aminoácido). Los polímeros polifuncionales que se pueden usar incluyen copolímeros de diviniléter-anhídrido maleico y estireno-anhídrido maleico.
También se pueden usar polímeros de origen natural, por ejemplo polisacáridos tales como quitina, dextrano, dextrina, quitosano, almidón, celulosa, glucógeno, poli(ácido sialílico), ácido hialurónico y derivados de los mismos. También se pueden usar polímeros tales como ácido poliglutámico, así como polímeros híbridos derivados de monómeros naturales tales como sacáridos o aminoácidos y monómeros sintéticos tales como óxido de etileno o ácido metacrílico.
Un polímero es preferentemente un polímero sintético, soluble en agua, en particular, polialquilen glicol. Si el polímero es un polialquilen glicol, este es preferentemente uno que contiene unidades C2 y/o C3 y es, especialmente, un polietilenglicol. Un polímero, en particular un polialquilen glicol, puede contener una única cadena lineal o puede tener morfología ramificada compuesto por varias cadenas ya sean cortas o largas. Se pueden usar polialquilen glicoles sustituidos o protegidos en el extremo, por ejemplo, metoxipolietilenglicol.
Opcionalmente, un polímero puede estar derivatizado o funcionalizado en cualquier modo que se desee. Los grupos reactivos pueden estar unidos en el extremo o grupo terminal del polímero o a lo largo de la cadena del polímero a través de enlazadores colgantes.
Si PEG está presente en el enlazador, el número óptimo de unidades ~(CH2-CH2-O-)~ presentes en el enlazador de los conjugados y reactivos de la presente divulgación dependerá, por supuesto, de la aplicación pretendida. Para algunas aplicaciones, se pueden usar PEG de alto peso molecular, por ejemplo el peso molecular promedio en número puede ser de hasta aproximadamente 75.000, por ejemplo hasta 50.000, 40.000 o 30.000 g/mol. Por ejemplo, el peso molecular promedio en número puede estar en el intervalo de 500 a aproximadamente 75.000 g/mol. Sin embargo, se pueden preferir porciones de PEG más pequeñas para algunas aplicaciones. Por ejemplo una porción PEG del enlazador puede tener un peso molecular de hasta 3.000 g/mol. Sin embargo, los grupos p Eg que contienen tan solo 2 unidades de repetición, por ejemplo de 2 a 50 unidades de repetición, son útiles para algunas aplicaciones. Las porciones que contienen PEG con 2, 3, 4, 5, 6, 7, 8, 9 o 10 unidades de repetición o 12, 20, 24, 36, 40 o 48 unidades de repetición, pueden, por ejemplo, estar presentes en el enlazador.
El documento WO 2016/063006 describe reactivos y conjugados que tiene enlazadores que contienen PEG de una estructura particular y reactivos y conjugados que incluyen dichos enlazadores de una realización preferida de la presente divulgación.
En dichos reactivos y conjugados, hay una porción PEG que es o que incluye una cadena colgante de PEG que tiene un grupo extremo terminal de fórmula -CH2CH2ORr en la que Rr representa un átomo de hidrógeno, un grupo alquilo, por ejemplo un grupo alquilo C1-4, especialmente un grupo metilo o un grupo arilo opcionalmente sustituido, especialmente un grupo fenilo, especialmente un grupo fenilo no sustituido.
Los conjugados de este tipo se pueden representar de forma esquemática con la fórmula:
en la que D representa la nueva carga útil de la presente divulgación, F' representa la proteína de unión y PEG representa la cadena de polietilenglicol colgante que tiene un grupo extremo terminal de fórmula -CH2CH2ORr.
Los reactivos de este tipo se pueden representar de forma esquemática con la fórmula:
en la que D representa la carga útil de la presente divulgación, F representa la agrupación funcional capaz de reaccionar con una proteína de unión un PEG representa la cadena de polietilenglicol colgante que tiene un grupo extremo terminal de fórmula -CH2CH2ORr. La agrupación funcional F es preferentemente capaz de reaccionar con dos nucleófilos presentes en una proteína o péptido como se ha explicado anteriormente y es preferentemente de fórmula (V), (VI) o (VIII), en especial (V) o (VI).
En una realización preferida de la presente divulgación, todo el PEG en la porción PEG del enlazador está presente en la cadena colgante de PEG. En otra realización de la presente divulgación, PEG también puede estar presente en la cadena principal del conjugado o reactivo.
Como con la porción total de PEG, el tamaño de la cadena colgante de PEG dependerá de la aplicación pretendida. Por ejemplo, dicha cadena colgante de PEG puede tener un peso molecular de hasta 3.000 g/mol. Sin embargo, oligómeros muy pequeños, que consisten en cadenas de PEG discretas con, por ejemplo, que contienen tan solo 2 unidades de repetición, por ejemplo de 2 a 50 unidades de repetición, son útiles para algunas aplicaciones y están presentes como dicha cadena p Eg en una realización preferida de la presente divulgación. La cadena colgante de PEG pude ser de cadena lineal o ramificada. Las cadenas de PEG, por ejemplo, cadenas de cadena lineal o ramificadas, con 12, 20, 24, 36, 40 o 48 unidades de repetición, se pueden usar.
Los conjugados y reactivos en los que el enlazador incluye al menos dos unidades ~(CH2-CH2-O-)~ dentro de un anillo también están contempladas. Por ejemplo, el anillo puede estar unido a través de un átomo de unión sencillo dentro del anillo al resto del enlazador o el anillo puede estar unido a través de dos o más átomos de unión dentro del anillo al resto del enlazador en un único punto.
Los conjugados de este tipo se pueden representar de forma esquemática con la fórmula:
en la que D representa la carga útil de la presente divulgación, F' representa la proteína o el péptido unido al resto del conjugado a través de una porción de unión de proteína o péptido al enlazador y
representa un anillo que incluye al menos dos unidades etilenglicol, ~(CH2-CH2-O-)~.
Los reactivos de este tipo se pueden representar de forma esquemática con la fórmula:
en la que D representa la carga útil de la presente divulgación, F representa una agrupación funcional capaz de unirse a una proteína o péptido y
representa un anillo que incluye al menos dos unidades etilenglicol, ~(CH2-CH2-O-)~. La agrupación funcional F es capaz de reaccionar con una proteína o péptido como se explica con más detalle a continuación.
Los átomos de unión pueden ser, por ejemplo, átomos de nitrógeno, carbono, fósforo o silicio, en especial átomos de nitrógeno y/o carbono y los átomos presentes en el punto de unión al resto del enlazador pueden, por ejemplo, ser átomos de nitrógeno o carbono.
Los siguientes son dibujos esquemáticos de formas posibles de unión del anillo al resto del enlazador en los conjugados o reactivos de la presente divulgación, representando T un átomo de unión en el anillo y representando PEG al menos dos unidades ~(CH2-CH2-O-)~:
Los ejemplos específicos de anillos adecuados incluyen los siguientes, donde el símbolo ~ indica un punto de incorporación del anillo en el enlazador:
Preferentemente el anillo está unido al resto del enlazador en un único punto y lo más preferente el anillo está unido a través de un único átomo de unión en el anillo al resto del enlazador en un único punto.
El anillo puede constar por ejemplo de unidades ~(CH2-CH2-O-)x~ en las que x es al menos 2, preferentemente de 2 a 20. Como alternativa, el anillo puede contener unidades ~(CH2-CH2-O-)x~ en las que x es al menos 2, preferentemente de 2 a 50, especialmente de 2 a 20, pero también puede incluir uno o más átomos adicionales como se ha mencionado anteriormente o puede estar derivatizado de alguna otra manera. Los anillos que contienen PEG con 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 o 20 unidades de repetición o 24, 36, 40 o 48 unidades de repetición, por ejemplo, se pueden usar.
Los conjugados y reactivos se pueden sintetizar fácilmente a partir de éteres corona. Los éteres corona son oligómeros cíclicos de etilenglicol y se conocen muchos éteres de corona diferentes, algunos de los cuales consisten por completo en unidades de etilenglicol y algunos de los cuales contienen átomos adicionales en el anillo. Por ejemplo, los éteres aza-corona contienen un átomo de nitrógeno, mientras que los éteres diaza-corona contienen dos átomos de nitrógeno. Muchos éteres corona están disponibles en el mercado y esos proporcionan puntos de partida convenientes para la síntesis de los conjugados y reactivos de acuerdo con la presente divulgación. Se conocen éteres corona que portan grupos funcionales a través de los cuales se pueden hacer reaccionar con otros compuestos, por ejemplo se conocen éteres corona que portan grupos carboxi, hidroxi, amino o aldehído, así como éteres corona condensados a un anillo de benceno que opcionalmente portan un grupo funcional tal como un grupo carboxi, hidroxi, amino, isocianato, nitro o aldehído.
Los éteres corona habituales que se pueden incorporar en los conjugados y reactivos de acuerdo con la presente divulgación incluyen las estructuras mostradas a continuación.
Estas pueden estar unidad a la cadena principal del enlazador de los conjugados y reactivos de la presente divulgación por reacción a través de átomos, especialmente átomos de nitrógeno, presentes en el anillo o a través de grupos, por ejemplo grupos hidroxi, amino, carboxi, aldehído, isocianato o nitro, presentes en una cadena lateral. Los enlaces habituales se muestran a continuación:
También se contemplan conjugados y reactivos en los que el enlazador incluye una ciclodextrina. Por ejemplo, las ciclodextrinas pueden ser una a-ciclodextrina, p-ciclodextrina o Y-ciclodextrina. En los conjugados que comprenden una ciclodextrina, la ciclodextrina puede, por ejemplo, estar unida al resto del enlazador a través de la posición 3 o 6 , por ejemplo, a través de una ciclodextrina funcionalizada con amino. En algunas realizaciones de la presente divulgación de conjugados y reactivos de este tipo, las ciclodextrinas pueden ser monocíclicas. En algunas realizaciones de la presente divulgación de conjugados y reactivos de este tipo, la ciclodextrina puede estar presente como un grupo colgante que está unido a la cadena principal del enlazador.
En algunas realizaciones de la presente divulgación, el reactivo de conjugación puede estar representado esquemáticamente por la fórmula
y/o el conjugado puede estar representado esquemáticamente por la fórmula
en la que D representa la carga útil de la presente divulgación, por ejemplo un grupo de fórmula:
en el que Rg es -C(CH3)2 o
n es 0 o 1; Re o está ausente o, cuando está presente, es cloro, flúor, metoxi, -CN o -NO2;
representa un grupo que incluye un resto el cual, cuando está presente en un conjugado de la presente divulgación, facilita la degradación del conjugado en condiciones fisiológicas, tales como un grupo -Ala-Val- o -PAB-Cit-Val- en el caso donde D está conjugado a través de un grupo -NH- o un grupo que contiene azufre que está covalentemente unido a otro átomo de azufre presente en el conjugado (es decir dando como resultado un resto disulfuro -S-S-presente en el conjugado), tal como un grupo que contiene un resto -S-alquileno C-i^en el caso donde D está conjugado a través de un grupo -NH-C(O)-alquilen C1-6-S-;
F representa la agrupación funcional capaz de reaccionar con una proteína de unión, tal como
en las que R' o está ausente o representa un grupo aceptor de electrones, tal como un grupo -NO2 o F representa
y F' representa la proteína o péptido unido al resto del conjugado a través del resto del grupo funcional.
Por ejemplo, los reactivos de conjugación de este tipo pueden tener la estructura:
en el que Rg es -C(CH3)2 o
n es 0 o 1; Re o está ausente o, cuando está presente, es cloro, flúor, metoxi, -CN o -NO2 y R' o está ausente o representa un grupo aceptor de electrones, tal como un grupo -NO2 y los conjugados pueden tener la estructura correspondiente resultante de la reacción de la porción de unión de la proteína o péptido del enlazador con la proteína o péptido.
En algunas realizaciones de la presente divulgación, el reactivo de conjugación puede estar representado esquemáticamente por la fórmula
y/o el conjugado puede estar representado esquemáticamente por la fórmula
en la que D representa la carga útil de la presente divulgación, por ejemplo un grupo de fórmula:
en el que Rg es -C(CH3)2 o
n es 0 o 1; Re o está ausente o, cuando está presente, es cloro, flúor, metoxi, -CN o -NO2;
representa un grupo que incluye un resto el cual, cuando está presente en un conjugado de la presente divulgación, facilita la degradación del conjugado en condiciones fisiológicas, tal como un grupo -Ala-Val- o -PAB-Cit-Val- en el caso donde D está conjugado a través de un grupo -NH- o un grupo que contiene azufre que está covalentemente unido a otro átomo de azufre presente en el conjugado (es decir dando como resultado un resto disulfuro -S-S-presente en el conjugado), tal como un grupo que contiene un resto -S-alquileno C-i^en el caso donde D está conjugado a través de un grupo -NH-C(O)-alquilen C1-6-S-;
PEG representa un grupo que contiene polietilenglicol y
F representa la agrupación funcional capaz de reaccionar con una proteína de unión, tal como
en las que R' o está ausente o representa un grupo aceptor de electrones, tal como un grupo -NO2 o F representa
y F' representa la proteína o péptido unido al resto del conjugado a través del resto del grupo funcional.
Por ejemplo, los reactivos de conjugación de este tipo pueden tener la estructura:
en el que Rg es -C(CH3)2 o
n es 0 o 1; Re o está ausente o, cuando está presente, es cloro, flúor, metoxi, -CN o -NO2;
y los conjugados pueden tener la estructura correspondiente resultante de la reacción de la porción de unión de la proteína o péptido del enlazador con la proteína o péptido.
En algunas realizaciones de la presente divulgación, el reactivo de conjugación puede estar representado esquemáticamente por la fórmula:
y/o el conjugado puede estar representado esquemáticamente por la fórmula
en la que D representa la carga útil de la presente divulgación, por ejemplo un grupo de fórmula:
en el que Rg es -C(CH3)2 o
n es 0 o 1; Re o está ausente o, cuando está presente, es cloro, flúor, metoxi, -CN o -NO2
representa un grupo que incluye un resto el cual, cuando está presente en un conjugado de la presente divulgación, facilita la degradación del conjugado en condiciones fisiológicas, tal como un grupo -Ala-Val- o -PAB-Cit-Val- en el caso donde D está conjugado a través de un grupo -NH- o un grupo que contiene azufre que está covalentemente unido a otro 'tomo de azufre presente en el conjugado (es decir dando como resultado un resto disulfuro -S-S- presente en el conjugado), tal como un grupo que contiene un resto -S-alquileno Ci-6en el caso donde D está conjugado a través de un grupo -NH-C(O)-alquilen C1-6-S-;
representa un grupo que contiene un resto ramificado, tal como un resto Glu, Asp, Lys, Ser, Thr, Cys, Arg, Tyr o similar; PEG representa una cadena colgante de polietilenglicol que tiene un grupo extremo terminal de fórmula -CH2CH2ORr, en donde Rr representa un átomo de hidrógeno, un grupo alquilo, por ejemplo un grupo alquilo C1-4, especialmente un grupo metilo o un grupo arilo opcionalmente sustituido, especialmente un grupo fenilo, especialmente un grupo fenilo sin sustituir;
F representa la agrupación funcional capaz de reaccionar con una proteína de unión, tal como
en las que R' o está ausente o representa un grupo aceptor de electrones, tal como un grupo -NO2 o F representa
y F' representa la proteína o péptido unido al resto del conjugado a través del resto del grupo funcional.
Por ejemplo, los reactivos de conjugación de este tipo pueden tener la estructura:
en el que Rg es -C(CH3)2 o
n es 0 o 1; Re o está ausente o, cuando está presente, es cloro, flúor, metoxi, -CN o -NO2; y los conjugados pueden tener la estructura correspondiente resultante de la reacción de la porción de unión de la proteína o péptido del enlazador con la proteína o péptido.
En algunas realizaciones de la presente divulgación, el reactivo de conjugación puede estar representado esquemáticamente por la fórmula
y/o el conjugado puede estar representado esquemáticamente por la fórmula
en la que D representa la carga útil de la presente invención, por ejemplo un grupo de fórmula:
en el que Rg es -C(CH3)2 o
n es 0 o 1; Re cuando está presente, es cloro, flúor, metoxi, -CN o -NO2;
representa un grupo que incluye un resto el cual, cuando está presente en un conjugado de la presente divulgación, facilita la degradación del conjugado en condiciones fisiológicas, tal como un grupo -Ala-Val- o -PAB-Cit-Val- en el caso donde D está conjugado a través de un grupo -NH- o un grupo que contiene azufre que está covalentemente unido a otro 'tomo de azufre presente en el conjugado (es decir dando como resultado un resto disulfuro -S-S- presente en el conjugado), tal como un grupo que contiene un resto -S-alquileno Ci-6en el caso donde D está conjugado a través de un grupo -NH-C(O)-alquilen C1-6-S-;
representa un grupo que contiene un resto ramificado, tal como un resto Glu, Asp, Lys, Ser, Thr, Cys, Arg, Tyr o similar;
representa un anillo que incluye al menos dos unidades etilenglicol, ~(CH2-CH2-O-)~; F representa la agrupación funcional capaz de reaccionar con una proteína de unión, tal como
en las que R' o está ausente o representa un grupo aceptor de electrones, tal como un grupo -NO2 o F representa
y F' representa la proteína o péptido unido al resto del conjugado a través del resto del grupo funcional.
Por ejemplo, los reactivos de conjugación de este tipo pueden tener la estructura:
en el que Rg es -C(CH3)2 o
n es 0 o 1; Re o está ausente o, cuando está presente, es cloro, flúor, metoxi, -CN o -NO2; y los conjugados pueden tener la estructura correspondiente resultante de la reacción de la porción de unión de la proteína o péptido del enlazador con la proteína o péptido.
Los compuestos de la presente divulgación también incluyen los siguientes, que se pueden producir mediante procesos análogos a los descritos anteriormente, por ejemplo mediante acoplamiento de Suzuki usando el compuesto maitansinoide de cloruro arilo y el reactivo arilborónico apropiados y, opcionalmente, mediante reacción posterior (por ejemplo, por desprotección y/o amidación) para producir los compuestos de fórmula (I):
en donde Sub es
Donde se producen atropisómeros aislables, por ejemplo debido a rotación impedida alrededor del enlace biarilo debido a la presencia de ciertos sustituyentes orto en el anillo de fenilo del grupo Sub, la presente divulgación también incluye esos atropisómeros individuales. Por ejemplo, donde Sub es
el compuesto de la presente divulgación puede ser:
Los compuestos de la presente divulgación también incluyen los compuestos ejemplo descritos a continuación.
Los conjugados de la presente divulgación también incluyen aquellos que incorporan los anteriores compuestos de fórmula (I).
Composiciones farmacéuticas y utilidad médica
Los compuestos y conjugados de acuerdo con la presente divulgación se pueden formular en una composición farmacéutica junto con un vehículo farmacéuticamente aceptable, opcionalmente junto con otro agente terapéutico para su uso en terapia, específicamente, para su uso como un medicamento para el tratamiento de una enfermedad proliferativa, autoinmune o infecciosa. Un método para tratar a un paciente comprende administrar una cantidad farmacéuticamente eficaz de dicho compuesto, conjugado o composición a un paciente que lo necesita. El paciente puede ser un animal, específicamente un mamífero y más específicamente un ser humano. Las condiciones a modo de ejemplo para las que la presente divulgación encuentra utilidad incluyen, por ejemplo, un cáncer, por ejemplo una leucemia, que incluye linfoma no de Hodgkin, leucemia mielógena aguda, mieloma múltiple, leucemias linfocíticas y leucemia mielógena crónica; cáncer gástrico; cáncer de mama; cáncer de ovario; cáncer de hígado; cáncer intestinal; cáncer de colon; cáncer renal, por ejemplo carcinoma de células renales; cáncer de pulmón, por ejemplo cáncer microcítico de pulmón; melanoma; cáncer de vejiga y sarcomas.
Las composiciones farmacéuticas a modo de ejemplo incluyen aquellas en forma de una suspensión acuosa u oleaginosa estéril para administración parenteral. La administración parenteral incluye inyección subcutánea, intravenosa, intramuscular, intraperitoneal e intratecal y técnicas de infusión. Algunas formulaciones adecuadas para administración parenteral (por ejemplo, por inyección), incluyen líquidos estériles, acuosos o no acuosos, isotónicos, libre de pirógenos, (por ejemplo, soluciones, suspensiones). Dichos líquidos pueden contener además otros ingredientes farmacéuticamente aceptables, tales como antioxidantes, tampones, conservantes, estabilizantes, bacteriostáticos, agentes de suspensión, agentes espesantes y solutos que hacen a la formulación isotónica con respecto a la sangre (u otro líquido corporal pertinente) del receptor deseado. Los vehículos a modo de ejemplo para las formulaciones líquidas incluyen solución salina, solución salina tamponada, dextrosa, agua, glicerol, etanol o una combinación de los mismos. Las formulaciones opcionalmente pueden comprender además sustancias auxiliares farmacéuticamente aceptables, tales como agentes de ajuste del pH y tamponantes, agentes de ajuste de la tonicidad, estabilizantes, agentes humectantes y similares o una combinación de los mismos.
Los compuestos, conjugados y composiciones de la presente divulgación pueden, si se desea, usarse en combinación con otro agente terapéutico, por ejemplo otro agente contra el cáncer, por ejemplo, agentes alquilantes, alquil sulfonatos, aziridinas, etileniminas y metilamelaminas, acetogeninas, una auristatina, camptotecina, briostatina, calistatina, CC-1065, criptoficinas, dolastatina, duocarmicina, eleuterobina, pancratistatina, una sarcodictina, espongistatina, mostazas nitrogenadas, antibióticos, antibióticos de enediína, dinemicina, bisfosfonatos, esperamicina, cromóforos de antibióticos de enediína relacionados como cromoproteína, aclacinomisinas, actinomicina, autramicina, azaserina, bleomicinas, cactinomicina, carabicina, carminomicina, carzinofilina, cromomicinas, dactinomicina, daunorrubicina, detorrubicina, 6-diazo-5-oxo-L-norleucina, doxorrubicina, epirrubicina, esorrubicina, idarrubicina, marcelomicina, mitomicinas, ácido micofenólico, nogalamicina, olivomicinas, peplomicina, potfiromicina, puromicina, quelamicina, rodorrubicina, estreptonigrina, estreptozocina, tubercidina, ubenimex, zinostatina, zorrubicina; antimetabolitos, erlotinib, vemurafenib, crizotinib, sorafenib, ibrutinib, enzalutamida, análogos de ácido fólico, análogos de purina, andrógenos, anti-suprarrenales, reabastecedor de ácido fólico tal como ácido frolínico, aceglatona, glucósido de aldofosfamida, ácido aminolevulínico, eniluracilo, amsacrina, bestrabucilo, bisantreno, edatraxato, defofamina, demecolcina, diazicuona, elfornitina, acetato de eliptinio, una epotilona, etoglúcido, nitrato de galio, hidroxiurea, lentinano, lonidainina, maitansinoides, mitoguazona, mitoxantrona, mopidanmol, nitraerina, pentostatina, fenamet, pirarrubicina, losoxantrona, ácido podofílico 2-etilhidrazida, procarbazina, complejo de polisacárido PSK® (JHS Natural Products, Eugene, Oregón), razoxano; rizoxina; sizofirano; espirogermanio; ácido tenuazónico; triazicuona; 2,2',2"-triclorotrietilamina; tricotecenos (especialmente toxina T-2, verracurina A, roridina A y anguidina); uretano; vindesina; dacarbazina; manomustina; mitobronitol; mitolactol; pipobromano; gacitosina; arabinósido ("Ara
C"); ciclofosfamida; tiotepa; taxoides, clorambucilo; gemcitabina; 6-tioguanina; mercaptopurina; metotrexato; análogos de platino, vinblastina; platino; etopósido (VP-16); ifosfamida; mitoxantrona; vincristina; vinorrelbina; novantrona; tenipósido; edatrexato; daunomicina; aminopterina; xeloda; ibandronato; irinotecán (Camptosar, CPT-11), inhibidor de topoisomerasa RFS 2000; difluorometilornitina; retinoides; capecitabina; combretastatina; leucovorina; oxaliplatino; inhibidores de PKC-alfa, Raf, H-Ras, EGFR y VEGF-A que reducen la proliferación celular; y sales farmacéuticamente aceptables, ácidos o derivados de los mismos o una combinación de los mismos.
Los compuestos, conjugados y composiciones de la presente divulgación también se pueden usar en combinación con un anticuerpo adicional, por ejemplo, abagovomab, adecatumumab, afutuzumab, alemtuzumab, altumomab, amatuximab, anatumomab, arcitumomab, bavituximab, bectumomab, bevacizumab, bivatuzumab, blinatumomab, brentuximab, cantuzumab, catumaxomab, cetuximab, citatuzumab, cixutumumab, clivatuzumab, conatumumab, daratumumab, drozitumab, duligotumab, dusigitumab, detumomab, dacetuzumab, dalotuzumab, ecromeximab, elotuzumab, ensituximab, ertumaxomab, etaracizumab, farletuzumab, ficlatuzumab, figitumumab, flanvotumab, futuximab, ganitumab, gemtuzumab, girentuximab, glembatumumab, ibritumomab, igovomab, imgatuzumab, indatuximab, inotuzumab, intetumumab, ipilimumab, iratumumab, labetuzumab, lexatumumab, lintuzumab, lorvotuzumab, lucatumumab, mapatumumab, matuzumab, milatuzumab, minretumomab, mitumomab, moxetumomab, narnatumab, naptumomab, necitumumab, nimotuzumab, nofetumomabn, ocaratuzumab, ofatumumab, olaratumab, onartuzumab, oportuzumab, oregovomab, panitumumab, parsatuzumab, patritumab, pemtumomab, pertuzumab, pintumomab, pritumumab, racotumomab, ramucirumab, radretumab, rilotumumab, rituximab, robatumumab, satumomab, sibrotuzumab, siltuximab, simtuzumab, solitomab, tacatuzumab, taplitumomab, tenatumomab, teprotumumab, tigatuzumab, tositumomab, trastuzumab, tucotuzumab, ublituximab, veltuzumab, vorsetuzumab, votumumab, zalutumumab, CC49, 3F8 o una combinación de los mismos.
Los compuestos, conjugados y composiciones de la presente divulgación se pueden usar en tratamiento junto con terapia de radiación.
En algunas realizaciones preferidas de la divulgación, el compuesto, conjugado, reactivo de conjugación, composición, método de tratamiento, proceso o intermedio es como se define en las cláusulas numeradas a continuación:
1. Un compuesto de fórmula general (I) o una sal del mismo:
en la que R representa un grupo -Y-OH, -Y-O-Rx, -Y-SH, -Y-S-Rx, -Y-CO2H, -Y-CO-Rx, -Y-NHRy, -Y-NRy-NHRz o -Y-CRy=NOH, en el que o Y no está presente o Y representa un grupo alquileno C1-6 o alquilenoxi C1-6, cualquiera de los cuales puede estar interrumpido por un átomo de oxígeno, Rx representa un grupo alquilo C1-4 sustituido por -OH, -SH, -NHRy o -CO2H y cada uno de Ry y Rz representa independientemente un átomo de hidrógeno o un grupo alquilo C1-4; X representa OH, Oalquilo C1-4, SH, alquilo S1-4 o CN; Ra representa un átomo de hidrógeno o un grupo alquilo C1-4; Rb representa hidrógeno, OH, alcoxi C1-4 o alquilo C1-4C(O)O-; Rc representa hidrógeno, OH, alcoxi C1-4 o alquilo C1-4C(O)O-; Rd representa un átomo de hidrógeno o un grupo alquilo C1-4; cada Re representa independientemente un átomo de halógeno, un grupo CF3 o un grupo alquilo C1-4 o un grupo alcoxi C1-4 y n es 0, 1,2, 3 o 4; Rf representa un átomo de hidrógeno o un grupo alquilo C1-4 y Rg representa un átomo de hidrógeno o un grupo alquilo, cicloalquilo, alquenilo, alquinilo, arilo o heteroarilo opcionalmente sustituido.
2. Un compuesto como se define en la cláusula 1, en el que Y no está presente o en el que Y representa un grupo alquileno C1-4 o alquilenoxi C1-4, el cual puede estar interrumpido por un átomo de oxígeno.
3. Un compuesto como se define en la cláusula 1 o la cláusula 2, en el que R es un grupo -OH, -NH2, -CONH2 o -CO2H o un grupo alquileno C^sustituido con un grupo -OH, -NH2, -CONH2 o -CO2H.
4. Un compuesto como se define en una cualquiera de las cláusulas anteriores, en el que R está en la posición 3 o 4 de anillo fenilo.
5. Un compuesto como se define en una cualquiera de las cláusulas anteriores, en el que cualquier grupo Re presente es un átomo de halógeno o un grupo metilo o metoxi.
6. Un compuesto como se define en una cualquiera de las cláusulas anteriores, en el que n es 0, 1 o 2.
7. Un compuesto como se define en una cualquiera de las cláusulas anteriores, en el que X representa OH. 8. Un compuesto como se define en una cualquiera de las cláusulas anteriores, en el que Ra representa alquilo C1-4; Rb representa hidrógeno; Rc representa hidrógeno o metoxi; Rd representa alquilo C1-4; Re representa cloro o hidrógeno; Rf representa alquilo C1-4 y Rg representa alquilo C1-4.
9. Un compuesto como se define en una cualquiera de las cláusulas anteriores, que es un compuesto de fórmula general (Ia) o una sal del mismo:
10. Un compuesto como se define en la cláusula 9, que es un compuesto de fórmula general (Ib) o una sal del mismo:
11. Un conjugado que comprende un compuesto como se define en una cualquiera de las cláusulas anteriores unido a una proteína de unión a través de un enlazador, estando dicho enlazador conectado a dicho compuestos a través del grupo R de la fórmula general I.
12. Un conjugado como se define en la cláusula 11, en el que la proteína de unión es un anticuerpo de longitud completa o un fragmento de anticuerpo que comprende una región de unión a antígeno del anticuerpo de longitud completa.
13. Un conjugado como se define en la cláusula 11, en el que la proteína de unión es IgG1 o IgG4 o un fragmento de IgG1 o IgG4.
14. Un conjugado como se define en una cualquiera de las cláusulas 11 a 13, que incluye una porción:
en la que W representa un grupo aceptor de electrones o un grupo obtenido por reducción de un grupo aceptor de electrones, cada uno de A y B representa de manera independiente una cadena alquileno o alquenileno C1-5 y Pr representa dicha proteína de unión unida a A y B a través de nucleófilos Nu; o incluye una porción:
~W'-(CH=CH)p-(CH2)2-Nu-Pr
en la que W representa un grupo aceptor de electrones o un grupo obtenido por reducción de un grupo aceptor de electrones, p es 0 o un número entero de 1 a 4 y Pr representa dicha proteína de unión unida al resto de la molécula a través de un nucleófilo Nu.
15. Un conjugado como se define en la cláusula 14, que incluye una porción:
0 que incluye una porción:
~NH-CO-Ar'-CO-(CH2)2-Nu-Pr
en la que Ar' representa un grupo arilo opcionalmente sustituido.
16. Un conjugado como se define en una cualquiera de las cláusulas 11 a 15, en el que cada Nu representa un átomo de azufre presente en un resto de cisteína en la proteína de unión Pr o en el que cada Nu representa un grupo imidazol presente en un marcador de polihistidina unido a la proteína de unión.
17. Un conjugado como se define en una cualquiera de las cláusulas 11 a 16, en el que el enlazador incluye una cadena de polietilenglicol colgante que tiene un grupo extremo terminal de fórmula -CH2CH2ORr en la que Rr representa un átomo de hidrógeno, un grupo alquilo o un grupo arilo opcionalmente sustituido.
18. Un conjugado como se define en una cualquiera de las cláusulas 11 a 17, en el que el enlazador incluye un grupo peptidilo que comprende al menos dos aminoácidos alfa de origen natural.
19. Un conjugado como se define en la cláusula 18, en el que el enlazador incluye la secuencia Val-Cit-PAB. 20. Un reactivo de conjugación que comprende un compuesto como se define en una cualquiera de las cláusulas 1 a 10 , unido a través de un enlazador a al menos un grupo funcional capaz de reaccionar con una proteína de unión, estando dicho enlazador conectado a dicho compuestos a través del grupo R de la fórmula general I. 21. Un reactivo de conjugación como se define en la cláusula 20, en el cual dicho grupo funcional tiene la fórmula:
en el cual W representa un grupo aceptor de electrones; cada uno de A y B representa independientemente una cadena alquileno o alquenileno C1-5 y o bien cada L representa independientemente un grupo saliente o bien ambos Ls juntos representan un grupo saliente o
en el que W y A tienen los significados dados anteriormente, L representa un grupo saliente y m es de 0 a 4 o
~W-(CH=CH)p-(CH2)2-L o ~W-(CH=CH)p-CH=CH2
en los que W representa un grupo aceptor de electrones, p representa 0 o un número entero de 1 a 4 y L representa un grupo saliente.
22. Un reactivo de conjugación como se define en la cláusula 21, en el cual dicho grupo funcional tiene la fórmula:
o
~NH-CO-Ar'-CO-(CH2)2-L
o
~NH-CO-Ar'-CO-CH=CH2
en la que Ar' representa un grupo arilo opcionalmente sustituido.
23. Un reactivo de conjugación como se define en una cualquiera de las cláusulas 20 a 22, en las que el o cada grupo saliente incluye una porción -(CH2CH2O)q en la que q es un número de seis o más.
24. Un reactivo de conjugación como se define en una cualquiera de las cláusulas 20 a 23, en el que el enlazador incluye una característica como se define en una cualquiera de las cláusulas 17 a 19.
25. Una composición farmacéutica que comprende un compuesto como se define en una cualquiera de las cláusulas 1 a 10 o un conjugado como se define en una cualquiera de las cláusulas 11 a 19, junto con un vehículo, opcionalmente junto con otro agente terapéutico.
26. Un método para tratar a un paciente que necesita tratamiento para una enfermedad o trastorno proliferativo, autoinmune o infeccioso, que comprende administrar una cantidad farmacéuticamente eficaz de un compuesto como se define en una cualquiera de las cláusulas 1 a 10 , un conjugado como se define en una cualquiera de las cláusulas 11 a 19 o una composición farmacéutica como se define en la cláusula 25, al paciente.
27. Un compuesto como se define en una cualquiera de las cláusulas 1 a 10 o un conjugado como se define en una cualquiera de las cláusulas 11 a 19 para su uso en terapia.
28. Un proceso para la preparación de un compuesto de fórmula general I o una sal del mismo como se define en una cualquiera de las cláusulas 1 a 10 , que comprende hacer reaccionar compuesto de fórmula:
en la que X, Ra-Rd, Rf y Rg tienen los significados dados para la fórmula general I, con un reactivo arilorganometálico en el que el resto arilo es un grupo fenilo sustituido con (Re)n y con R o una versión protegida de R, en la cual R y (Re)n tienen los significados dados para la fórmula general I, llevándose a cabo la reacción en presencia de un catalizador de metal de transición.
29. Un proceso como se define en la cláusula 28, en la que el reactivo aril-organometálico es un ácido borónico de fórmula general
o una versión protegida del mismo y la reacción se lleva a cabo en presencia de un catalizador de paladio.
30. Un intermedio útil para preparar un compuesto de fórmula general I o una sal del mismo como se define en una cualquiera de las cláusulas 1 a 10 , que tiene la fórmula general
Breve descripción de los dibujos
Las figuras 1 y 2 muestran los resultados del Ejemplo 2, que muestran gráficos del % de viabilidad celular frente a la concentración del compuesto para el compuesto 3 y para DM1 en ensayos in vitro frente a la línea celular Karpas-299 de linfoma de linfocitos T humana CD30 positiva y a la línea celular tumoral SK-BR-3 HER2 positiva.
La Figura 3 muestra los resultados del estudio de xenoinjerto de ratón descrito en el Ejemplo 16, que muestra un gráfico del volumen tumoral medio ± error estándar a lo largo del tiempo después de la administración a ratones de vehículo, de conjugado 29 de la presente divulgación o de Kadcyla®.
La Figura 4 muestra los resultados del estudio de suero de ratón del Ejemplo 38, que muestra gráficos de iones
relacionados con fármaco a lo largo del tiempo de los compuestos 26 y 78, y que demuestra que después de 7 días a 37 °C se produce una degradación significativa del compuesto 78 en suero de ratón, mientras que no se observaron productos de degradación comparables del compuesto 26.
Ejemplos
Los siguientes ejemplos ilustran la invención.
Métodos generales:
Los espectros de RMN 1H se registraron usando un instrumento de RMN apropiado (por ejemplo, un instrumento de RMN Varian Inova de 500 MHz). Las purezas cromatográficas se determinaron usando LC/MS (por ejemplo, en un sistema de LC/MS Agilent 1200 Series).
Ejemplo 1 (fuera de las reivindicaciones): Preparación de 4-(N-Boc amino)fenil-AP3, 3
El compuesto 1 ácido 4-(N-Boc amino)fenil borónico (18,7 mg) se añadió a AP32 sólido (32,6 mg), con fosfato potásico tribásico (32,7 mg) y el catalizador de paladio Sphos Pd G3 (1 mg) disponible en el mercado de Sigma-Aldrich. Los sólidos se purgaron con Ar 3x y se añadió THF seco (150 j l) a la mezcla. Después se burbujeó Ar a través de la mezcla de reacción durante 60 s, el recipiente de reacción se cerró herméticamente y se calentó a 40 °C durante 2 h, punto en el que la reacción se consideró completa según LC/MS. Después la mezcla de reacción se filtró a través de un lecho pequeño de SiO2, se lavó con Et2O y se concentró. La mezcla se purificó después por HPLC preparativa (columna Gemini 150 x 30 mm) (5^-95 % de ACN en H2O, conteniendo cada una AcOH al 0,05 %) y las fracciones deseadas se liofilizaron para proporcionar 3 en forma de un sólido cristalino de color blanco (14,3 mg, 35 % de rendimiento). RMN 1H (500 MHz, CLOROFORMO-d) 8 = 7,41 (d, J = 7,3 Hz, 2H), 7,06 (d, J = 8 ,8 Hz, 2H), 6 ,88 (dd, J = 1,5, 10,7 Hz, 2H), 6,58-6,46 (m, 2H), 6,27-6,18 (m, 2H), 5,49 (dd, J = 9,0, 15,4 Hz, 1H), 4,85 (dd, J = 2,9, 12,2 Hz, 1H), 4,36-4,28 (m, 1H), 3,83 (s, 3H), 3,61-3,52 (m, 2H), 3,39 (s, 3H), 3,28 (d, J = 13,2 Hz, 1H), 3,09-2,95 (m, 3H), 2,70 2,68 (m, 3H), 2,65 (quint., J = 7,0 Hz, 1H), 2,25 (dd, J = 2,9, 13,7 Hz, 1H), 1,77 (s, 3H), 1,70 (d, J = 13,2 Hz, 1H), 1,55 (s, 9H), 1,33 (d, J = 6,3 Hz, 3 H), 1,28 (d, J = 7,3 Hz, 3 H), 1,22 (d, J = 6 ,8 Hz, 3 H), 0,96 (s, 3 H); LC/MS: tiempo de retención 3,49 min (columna de HPLC analítica Merck Chromolith RP-18e (monolítica, 50 x 2 mm); método de HPLC analítica: volumen de inyección 5 jl; caudal 1 ml/min; 5^-95 % de acetonitrilo en agua durante 5 min; Detector de matriz de diodos Agilent a A = 254 o 220 nm; temperatura ambiente), (ES+) calc. para C43H58N3O11: [M+H] 792; encontrada 792.
El grupo protector BOC se puede eliminar del compuesto 3 para producir el compuesto correspondiente que contiene un grupo amina libre. Este compuesto después se puede, a su vez, conjugar mediante el grupo amina usando métodos
conocidos para producir un conjugado, específicamente, un conjugado anticuerpo-fármaco.
Ejemplo 2 : Ensayo de fuerza in vitro del compuesto 3 en las líneas celulares Karpas-299 y SK-BR-3
La pérdida de viabilidad de las células tumorales después del tratamiento con fármacos citotóxicos o ADC in vitro se puede medir cultivando líneas celulares en presencia de concentraciones en aumento de fármacos o ADC y cuantificando la pérdida de proliferación o actividad metabólica usando el reactivo de luminiscencia CellTiter-Glo® (Promega). El protocolo describe la siembra de células, el tratamiento farmacológico y la determinación de la viabilidad celular en referencia a células no tratadas basándose en la síntesis de ATP, que está directamente relacionada con la cantidad de células presentes en el pocillo.
La línea celular Karpas-299 de linfoma de linfocitos T humana CD30 positiva, se obtuvo gracias al Dr. Abraham Karpas de la Universidad de Cambridge. Las células se cultivaron en medio RPMI complementado con suero bovino fetal al 10%, 100 U/ml de penicilina y 100|jg/ml de estreptomicina. En placas de 96 pocillos de pared blanca y fondo transparente, se sembraron células Karpas 299 a 2.500 células por pocillo (50 jl/pocillo) y se incubaron durante 24 h a 37 °C y con CO2 al 5 %.
La línea celular tumoral SK-BR-3 HER2 positiva (ATCC-HTB-30), se cultivó en medio 5A de McCoy complementado con suero bovino fetal al 10%, 100 U/ml de penicilina y 100 jg/m l de estreptomicina. Las células SK-BR-3 se separaron, se sembraron a 5.000 células por pocillo (100 jl/pocillo) en placas de 96 pocillos de pared blanca y fondo transparente recubiertas con poli-D-lisina y se incubaron durante 24 h a 37 °C y con CO2 al 5 %.
Se prepararon diluciones en serie de compuestos por triplicado usando como diluyente el medio de cultivo celular relevante. Las células Karpas-299 CD30 positivas se trataron con 50 j l de compuestos a una concentración de ensayo 2X. El medio de las placas de ensayo s K-BR-3 se retiró y se reemplazó por 100 j l de compuestos diluidos en serie a una concentración de ensayo 1X. Las concentraciones de ensayo se especifican en la Tabla 1. Después, las células se incubaron con los compuestos (volumen total 100 jl/pocillo), a 37 °C y con CO2 al 5 % durante 96 h más.
Tabla 1
Línea celular Compuesto Intervalo de
concentración
Karpas-299 3 200 nM - 20 fM
SK-BR-3 3 50 nM - 640 fM
Al final de la incubación, la viabilidad celular se midió usando el reactivo de luminiscencia CellTiter-Glo®, como se describe en las instrucciones del fabricante. Los datos se analizaron posteriormente usando un modelo de regresión no lineal de cuatro parámetros.
La viabilidad se expresó como % de células sin tratar y se calculó usando la siguiente fórmula:
% Viabilidad — 100 x ^ u m n^ s^ c e n c ^a M u e s tr a ~ ^ u m n^ s^ c e n c â Sin control celular
L u m in i s c e n c i a S in ^ra ^a r ~ L u /^ . in is c G n c it t^ ín control celular
El % de viabilidad (eje Y) se representó gráficamente frente al logaritmo de la concentración de fármaco en nM (eje X) para extrapolar los valores de CI50 de todos los compuestos.
Los resultados se muestran en la Tabla 2 y en las Figuras 1 y 2. En ambas líneas celulares, el compuesto 3 tiene mayor fuerza que el control DM1.
Tabla 2
Ejemplo 3: P rep a ra c ión de l co m p u e s to m a ita n s in o id e 4.
El reactivo arilborónico, ácido 4-aminofenilborónico (215 mg), fosfato de tripotasio ( 668 mg), el catalizador SPhos Pd G3 (15,4 mg) y AP3 (500 mg) se añadieron de manera secuencial a un recipiente de reacción purgado con argón. Después el recipiente se cerró herméticamente y los sólidos se purgaron con argón (4 x ciclos de evacuación/purga). THF (6 ml) y agua (0.6 ml), que se había desoxigenado rigurosamente purgando con argón, se añadieron después y la mezcla de reacción se agitó a temperatura ambiente durante 18 h. Después, la mezcla de reacción se diluyó con acetato de etilo (60 ml) y se lavó con salmuera (20 ml). Las capas se separaron y la capa orgánica se concentró a presión reducida. El residuo se purificó después por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v) y las fracciones deseadas se liofilizaron para dar el compuesto 4 en forma de un sólido de color blanco (449 mg). RMN 1H (500 MHz; CDCla) 56,90 (d, J = 8,1 Hz, 2H), 6,84 (d, J = 10,1 Hz, 2H), 6,69 (d, J =8 ,6 Hz, 2H), 6,48 (dd, J = 15,4, 11,0 Hz, 1H), 6,24 (s, 1H), 6,18 (d, J = 11,0 Hz, 1H), 5,49-5,44 (m, 1H), 4,84 (dd, J = 11,9, 2,8 Hz, 1H), 4,32-4,27 (m, 1H), 3,82 (s, 3H), 3,55 (d, J = 13,0 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,25 (d, J = 13,0 Hz, 1H), 3,06 (s, 1H), 3,00 (d, J = 9,9 Hz, 1H), 2,97-2,94 (m, 1H), 2,68 (s, 3H), 2,64-2,61 (m, 1H), 2,23 (dd, J = 13,8, 2,7 Hz, 1H), 1,74 (s, 3H), 1,68 (d, J= 13,6 Hz, 1H), 1,52-1,47 (m, 1H), 1,30 (d, J = 6,5 Hz, 3H), 1,26 (d, J = 7,2 Hz, 3H), 1,25-1,23 (m, 1H), 1,20 (d, J = 6,5 Hz, 3H), 0,93 (s, 3H). LC/MS: (ES+) [M+H]+ (692, 100 %).
Ejemplo 4: Preparación del compuesto maitansinoide 5.
El compuesto 5 se sintetizó de manera análoga a la del compuesto 4 del ejemplo 3. Brevemente, pinacol éster del ácido 4-amino-3-clorofenilborónico (100 mg), fosfato de tripotasio (674 mg), SPhos Pd G3 (15,2 mg) y AP3 (500 mg) se añadieron secuencialmente a un recipiente de reacción purgado con argón. Después el recipiente se cerró herméticamente y los sólidos se purgaron con argón (4 x ciclos de evacuación/purga). THF (6 ml) y agua (0.6 ml), que se había desoxigenado rigurosamente purgando con argón, se añadieron después y la mezcla de reacción se agitó a temperatura ambiente durante 5 h. Después, la mezcla de reacción se diluyó con acetato de etilo (60 ml) y se lavó con salmuera (20 ml). Las capas se separaron y la capa orgánica se concentró a presión reducida. El residuo se purificó después por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v) y las fracciones deseadas se liofilizaron para dar el compuesto 5 en forma de un sólido de color blanco (80 mg). RMN 1H (500 MHz; CDCla) 57,05 (s, 1H), 6,85 (d, J = 11,4 Hz, 2H), 6,77 (s, 2H), 6,48 (dd, J = 15,4, 11,2 Hz, 1H), 6,24 (s, 1H), 6,18 (d, J = 11,2 Hz, 1H), 5,46 (dd, J = 15,4, 9,0 Hz, 1H), 4,84 (dd, J = 11,8, 2,8 Hz, 1H), 4,32-4,27 (m, 1H), 4,11 (d, J = 0,6 Hz, 2H), 3,83 (s, 3H), 3,55 (d, J = 13,0 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,25 (d, J = 13,0 Hz, 1H), 3,02-2,99 (m, J = 7,8 Hz, 2H), 2,93 (dd, J = 13,7, 12,2 Hz, 1H), 2,72 (s, 3H), 2,65-2,60 (m, 1H), 2,24-2,21 (m, 1H), 1,74 (s, 3H), 1,68 (d, J = 13,3 Hz, 1H), 1,53-1,47 (m, 1H), 1,30 (d, J = 6,4 Hz, 3H), 1,30-1,27 (m, 1H), 1,26 (d, J = 7,2 Hz, 3H), 1,20 (d, J = 6,7 Hz, 3H), 0,93 (s, 3H). LC/MS: (ES+) [M+H]+ (726, 100 %).
Ejemplo 5: Preparación del compuesto maitansinoide 6.
Etapa 1: Síntesis del compuesto 7.
A una solución de 2,2'-ditiobis(5-nitropiridina) (930 mg) y ácido 4-mercapto-pentanoico (197 mg) en THF:DMF (8 ml, 1:1 v/v) se le añadió piridina (150 j l) y la solución se agitó a temperatura ambiente durante 15 h. Después, la mezcla de reacción se diluyó con acetato de etilo (50 ml) y se lavó con salmuera (20 ml). La capa orgánica se separó, se secó sobre sulfato sódico, se filtró y se concentró al vacío. El residuo se purificó después por cromatografía de fase normal eluyendo con hexano:acetato de etilo (100:0 v/v a 60:40 v/v). El disolvente se eliminó al vacío para dar el compuesto 7 en forma de un sólido de color amarillo claro (194 mg). RMN 1H (500 MHz; CDCh) 59,26 (d, J = 2,1 Hz, 1H), 8,39 (dd, J = 8 ,8 , 2,1 Hz, 1H), 7,89 (d, J = 8 ,8 Hz, 1H), 3,13-3,06 (m, 1H), 2,64-2,53 (m, 2H), 2,04-1,89 (m, 2H), 1,37 (d, J = 6 ,8 Hz, 3H). LC/MS: (ES+) [M+H]+ (289, 100 %).
Etapa 2: Síntesis del compuesto 8.
A una solución en agitación del compuesto 4 (237 mg), el compuesto 7 (102 mg) y HATU (405 mg) en DMF (8 ml) a 0 °C se le añadió lentamente W,A/-diisopropiletilamina (DIPEA, 240 jl). La mezcla de reacción se dejó calentar a temperatura ambiente y se agitó durante 16 h. La solución se diluyó con agua (20 ml) y salmuera (20 ml) y la mezcla resultante se extrajo con acetato de etilo (50 ml). La capa orgánica se separó y se concentró al vacío. El residuo se disolvió en DMF (8 ml) y se purificó por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se liofilizaron para dar el compuesto 8 en forma de un sólido de color amarillo claro (253 mg). RMN 1H
(500 MHz; CDCI3) 59,27 (d, J = 2,2 Hz, 1H), 8,40 (dt, J = 8,8, 2,9 Hz, 1H), 7,95-7,93 (m, 1H), 7,56-7,54 (m, 2H), 7,47 7,45 (m, 1H), 7,10 (dd, J = 7,6, 0,4 Hz, 2H), 6,89 (d, J = 7,7 Hz, 2H), 6,54-6,48 (m, 1H), 6,24 (d, J = 0,4 Hz, 1H), 6,21 (d, J = 11,1 Hz, 1H), 5,49 (dd, J = 15,2, 9,1 Hz, 1H), 4,85 (dd, J = 12,0, 2,8 Hz, 1H), 4,34-4,29 (m, 1H), 3,84 (s, 3H), 3,59 (d, J = 13,0 Hz, 1H), 3,54 (d, J = 9,0 Hz, 1H), 3,39 (s, 3H), 3,29 (d, J = 12,9 Hz, 1H), 3,22-3,17 (m, 1H), 3,04-2,97 (m, 3H), 2,69 (d, J = 2,8 Hz, 3H), 2,67-2,56 (m, 3H), 2,27-2,24 (m, 1H), 2,12-2,07 (m, 2H), 1,77 (s, 3H), 1,70 (d, J = 13,0 Hz, 1H), 1,55-1,48 (m, 1H), 1,42-1,41 (m, 3H), 1,32 (d, J = 6,4 Hz, 3H), 1,27-1,26 (m, 1H), 1,28 (d, J = 7,2 Hz, 3H), 1,22 (d, J = 6,7 Hz, 3H), 0,96 (s, 3H). LC/MS: (ES+) [M+H]+ (962, 100 %).
Etapa 3: Síntesis del compuesto 6.
A una solución del compuesto 8 (22 mg) y clorhidrato de tris(2-carboxietil)fosfina (TCEP.HCl, 67 mg) en acetonitrilo:agua (1,8 ml, 5:4 v/v) se le añadió lentamente solución saturada de hidrogenocarbonato sódico (1,2 ml) hasta que se consiguió un pH de 7-8. Después, la mezcla de reacción se agitó a temperatura ambiente durante 2 h antes de concentrar la solución al vacío y el residuo se disolvió en acetonitrilo (50 ml). La solución en acetonitrilo se lavó después con salmuera (20 ml), las capas se separaron y la capa orgánica se concentró al vacío. El residuo se purificó después por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v) y las fracciones deseadas se liofilizaron para dar el compuesto 6 en forma de un sólido de color blanco (14 mg). RMN 1H (500 MHz; CDCh) 57,58 7,57 (m, 1H), 7,51-7,47 (m, 1H), 7,09 (d, J = 8,2 Hz, 2H), 6,89 (d, J = 9,0 Hz, 2H), 6,51 (dd, J = 15,4, 11,1 Hz, 1H), 6,24 (s, 1H), 6,22-6,20 (m, 1H), 5,49 (dd, J = 15,3, 9,0 Hz, 1H), 4,85 (dd, J = 12,0, 2,8 Hz, 1H), 4,34-4,29 (m, 1H), 3,83 (s, 3H), 3,58 (d, J = 12,9 Hz, 1H), 3,54 (d, J = 8,9 Hz, 1H), 3,39 (s, 3H), 3,28 (d, J = 12,8 Hz, 1H), 3,07-2,96 (m, 4H), 2,69 (s, 3H), 2,66-2,62 (m, 1H), 2,61-2,53 (m, 2H), 2,27-2,24 (m, 1H), 2,19-2,13 (m, 1H), 1,86-1,80 (m, 1H), 1,77 (s, 3H), 1,70 (d, J = 13,5 Hz, 1H), 1,54-1,48 (m, 2H), 1,43 (d, J = 6,7 Hz, 3H), 1,32 (d, J = 6,3 Hz, 3H), 1,28 (d, J = 7,2 Hz, 3H), 1,27-1,26 (m, 1H), 1,22 (d, J = 6,7 Hz, 3H), 0,96 (s, 3H). LC/MS: (ES+) [M+H]+ (808, 100 %).
Ejemplo 6 : Preparación del compuesto maitansinoide 9.
Etapa 1: Síntesis del compuesto 10.
El compuesto 10 se sintetizó de manera análoga a la del compuesto 7 del ejemplo 5 usando ácido 4-mercapto-4-metilpentanoico en lugar de ácido 4-mercapto-pentanoico. El compuesto 10 se aisló en forma de un sólido de color amarillo claro. LC/MS: (ES+) [M+H]+ (303, 100 %).
E tapa 2: S ín te s is de l co m p u e s to 11
El compuesto 11 se sintetizó de manera análoga a la del compuesto 8 del ejemplo 5 usando el compuesto 10 en lugar del compuesto 7. El compuesto 11 se aisló en forma de un sólido de color amarillo claro. RMN 1H (500 MHz; CDCh) 5 9,35-9,24 (m, 1H), 8,44-8,36 (m, 1H), 7,88 (dd, J= 46,8, 8,7 Hz, 1H), 7,54-7,44 (m, 2H), 7,35-7,34 (m, 1H), 7,09-7,07 (m, 1H), 6,87-6,86 (m, 2H), 6,51-6,46 (m, 1H), 6,26 (s, 1H), 6,20-6,17 (m, 1H), 5,47 (dd, J = 15,6, 9,1 Hz, 1H), 4,85 4,82 (m, 1H), 4,32-4,27 (m, 1H), 3,82 (s, 3H), 3,58-3,55 (m, 1H), 3,52 (d, J = 8,9 Hz, 1H), 3,37 (s, 3H), 3,28-3,25 (m, 1H), 3,16-3,12 (m, 1H), 3,03-2,94 (m, 3H), 2,67 (s, 3H), 2,66-2,60 (m, 1H), 2,56-2,53 (m, 2H), 2,25-2,22 (m, 1H), 2,15 2,07 (m, 2H), 1,75 (s, 3H), 1,69-1,66 (m, 1H), 1,52-1,48 (m, 1H), 1,37 (s, 6 H), 1,30 (d, J = 6,3 Hz, 3H), 1,26 (d, J = 7,1 Hz, 3H), 1,25-1,24 (m, 1H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+(976, 100%).
Etapa 3: Síntesis del compuesto 9.
El compuesto 9 se sintetizó de manera análoga a la del compuesto 6 del ejemplo 5 usando el compuesto 11 en lugar del compuesto 8. El compuesto 9 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh) RMN 1H (500 MHz; CDCla) 57,56-7,54 (m, 2H), 7,34 (s, 1H), 7,08-7,07 (m, 2H), 6 ,86 (d, J = 9,8 Hz, 2H), 6,51-6,46 (m, 1H), 6,21-6,18 (m, 2H), 5,49-5,44 (m, 1H), 4,85-4,82 (m, 1H), 4,32-4,27 (m, 1H), 3,81 (s, 3H), 3,56 (d, J = 12,7 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,26 (d, J = 13,6 Hz, 1H), 3,01-2,94 (m, 3H), 2,67 (s, 3H), 2,64-2,61 (m, 1H), 2,59-2,56 (m, 2H), 2,25-2,22 (m, 1H), 2,04-2,01 (m, 2H), 1,75 (s, 3H), 1,69-1,67 (m, 1H), 1,52-1,48 (m, 1H), 1,43 (s, 6 H), 1,30 (d, J = 6,3 Hz, 3H), 1,26 (d, J = 7,1 Hz, 3H), 1,25-1,23 (m, 1H), 1,20 (d, J= 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (822, 100 %).
Ejemplo 7: Preparación del compuesto maitansinoide 12.
E tapa 1: S ín te s is de l co m p u e s to 13.
A una solución en agitación de 2,2'-ditiobis(5-nitropiridina) (682 mg) y 4-metilmorfolina (NMM, 600 |jl) en THF (10 ml) se le añadió lentamente una solución de ácido 4-mercaptobutírico (222 mg) en acetato de etilo (2 ml) y la solución combinada se agitó a temperatura ambiente durante 1 h. Después, la mezcla de reacción se diluyó con solución saturada de hidrogenocarbonato sódico (10 ml), agua (10 ml) y acetato de etilo (30 ml). La capa orgánica se separó y se lavó con solución saturada de hidrogenocarbonato sódico (20 ml). Las capas acuosas se combinaron y se acidificaron con HCl 1 M (70 ml) antes de extraer con acetato de etilo (2 x 50 ml). Las capas orgánicas combinadas se secaron después sobre sulfato sódico, se filtraron y se concentraron al vacío. El residuo se purificó por cromatografía de fase normal eluyendo con hexano (ácido acético al 0,5 %):acetato de etilo (100:0 v/v a 60:40 v/v). El disolvente se eliminó al vacío para dar el compuesto 13 en forma de un sólido de color amarillo claro (82 mg). RMN 1H (500 MHz, CDCla) 5 9,28 (s, 1H), 8,40 (dd, J = 8 ,8 , 2,6 Hz, 1H), 7,87 (d, J = 8 ,8 Hz, 1H), 2,91 (t, J = 7,1 Hz, 2H), 2,54 (t, J = 7,1 Hz, 2H), 2,05 (quintuplete, J = 7,1 Hz, 2H). LC/MS: (ES+) [M+H]+ (275, 100 %).
Etapa 2: Síntesis del compuesto 14.
El compuesto 14 se sintetizó de manera análoga a la del compuesto 8 del ejemplo 5 usando el compuesto 13 en lugar del compuesto 7. El compuesto 14 se aisló en forma de un sólido de color amarillo claro. RMN 1H (500 MHz; CDCla) 5 9,30 (d, J = 2,2 Hz, 1H), 8,43 (dd, J = 8 ,8 , 2,5 Hz, 1H), 7,92 (d, J = 9,0 Hz, 1H), 7,57-7,54 (m, 1H), 7,44-7,41 (m, 1H), 7,11-7,08 (m, 2H), 6,90-6,88 (m, 2H), 6,53-6,48 (m, 1H), 6,23-6,19 (m, 2H), 5,52-5,47 (m, 1H), 4,86-4,83 (m, 1H), 4,34 4,29 (m, 1H), 3,84 (s, 3H), 3,59 (d, J = 13,1 Hz, 1H), 3,54 (d, J = 9,0 Hz, 1H), 3,39 (s, 3H), 3,29 (d, J = 12,7 Hz, 1H), 3,04-2,97 (m, 5H), 2,69 (s, 3H), 2,67-2,62 (m, 1H), 2,58-2,55 (m, 2H), 2,27-2,24 (m, 1H), 2,21-2,15 (m, 2H), 1,77 (s, 3H), 1,70 (ddd, J = 13,0, 1,4, 0,6 Hz, 1H), 1,54-1,50 (m, 1H), 1,32 (d, J = 6,4 Hz, 3H), 1,28 (d, J = 11,2 Hz, 4H), 1,27 1,26 (m, 1H), 1,22 (d, J = 6,7 Hz, 3H), 0,96 (s, 3H). LC/MS: (ES+) [M+H]+ (948, 100 %).
Etapa 3: Síntesis del compuesto 12.
El compuesto 12 se sintetizó de manera análoga a la del compuesto 6 del ejemplo 5 usando el compuesto 14 en lugar del compuesto 8. El compuesto 12 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh) 57,56 7,54 (m, 1H), 7,49 (d, J = 3,9 Hz, 1H), 7,08-7,07 (m, 2H), 6 ,86 (d, J = 8 ,8 Hz, 2H), 6,49 (dd, J = 15,3, 11,0 Hz, 1H), 6,21-6,18 (m, 2H), 5,47 (dd, J = 15,3, 9,0 Hz, 1H), 4,84-4,81 (m, 1H), 4,32-4,27 (m, 1H), 3,81 (s, 3H), 3,56 (d, J = 13,0 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,28-3,25 (m, 1H), 3,04-2,95 (m, 3H), 2,67 (s, 3H), 2,65-2,61 (m, 2H), 2,53 (t, J = 7,2 Hz, 2H), 2,26-2,22 (m, 1H), 2,07-2,02 (m, 2H), 1,75 (s, 3H), 1,69 (d, J = 0,4 Hz, 1H), 1,54-1,48 (m, 1H), 1,38 (t, J = 8,0 Hz, 1H), 1,30 (d, J = 6,3 Hz, 3H), 1,26 (d, J = 7,2 Hz, 3H), 1,25-1,24 (m, 1H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (794, 100 %).
Ejemplo 8: Preparación del compuesto maitansinoide 15.
Etapa 1: Síntesis del compuesto 16.
A una solución en agitación de ácido 3-mercapto-propiónico (0,41 ml) en agua (15 ml) a 0 °C se le añadió una solución de metanotiolsulfonato de S-metilo (0,49 ml) en etanol (7,5 ml). La mezcla de reacción se dejó calentar a temperatura ambiente y se agitó durante 18 h antes de concentrar al vacío. Se añadió solución saturada de hidrogenocarbonato sódico (8 ml) al resto hasta que se obtuvo un pH de 7-8 y la mezcla resultante se extrajo después con diclorometano (2 x 10 ml). Las capas se separaron y la capa acuosa se acidificó con solución 0,1 M de HCl (12 ml) y después solución 1 M de HCl (6 ml) para conseguir un pH de solución de 2-3. Después, la capa acuosa se extrajo con acetato de etilo (2 x 40 ml). Las capas orgánicas se separaron y se combinaron, se secaron sobre sulfato sódico, se filtraron y se concentraron al vacío para dar el compuesto 16 en forma de un sólido de color blanco (0,71 g). RMN 1H (500 MHz; CDCla) 52,94 (t, J = 6 ,8 Hz, 2H), 2,83 (d, J = 6 ,8 Hz, 2H), 2,42 (s, 3H). LC/MS: (ES+) [M+H]+ (152, 100 %).
Etapa 2: Síntesis del compuesto 17.
El compuesto 17 se sintetizó de manera análoga a la del compuesto 8 del ejemplo 5 usando el compuesto 16 en lugar del compuesto 7. El compuesto 17 se aisló en forma de un sólido de color blanco. LC/MS: (ES+) [M+H]+ (826, 100 %).
Etapa 3: Síntesis del compuesto 15.
El compuesto 15 se sintetizó de manera análoga a la del compuesto 6 del ejemplo 5 usando el compuesto 17 en lugar del compuesto 8. El compuesto 15 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCla) 57,63 (s, 1H), 7,57-7,55 (m, 1H), 7,09-7,07 (m, 2H), 6,87 (d, J = 8,2 Hz, 2H), 6,49 (dd, J = 15,3, 11,1 Hz, 1H), 6,22-6,18 (m, 2H), 5,47 (dd, J = 15,3, 9,1 Hz, 1H), 4,85-4,82 (m, 1H), 432-4,27 (m, 1H), 3,82 (s, 3H), 3,57 (d, J = 13,0 Hz, 1H), 3,52 (d, J = 8,9 Hz, 1H), 3,37 (s, 3H), 3,26 (d, J = 12,7 Hz, 1H), 3,04-2,95 (m, 3H), 2,90 (c, J = 7,4 Hz, 2H), 2,70 (dd, J =
8,7, 4,5 Hz, 2H), 2,67 (s, 3H), 2,64-2,60 (m, 1H), 2,24 (dd, J = 13,9, 2,6 Hz, 1H), 1,75 (s, 3H), 1,72 (d, J = 8,5 Hz, 1H), 1,70-1,66 (m, 1H), 1,54-1,48 (m, 1H), 1,30 (d, J = 6,4 Hz, 3H), 1,26 (d, J = 7,2 Hz, 3H), 1,24-1,23 (m, 1H), 1,20 (d, J = 6 ,8 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (780, 100 %).
Ejemplo 9: Preparación del compuesto maitansinoide 18.
Etapa 1: Síntesis del compuesto 19.
A una solución de ácido 4-mercapto-pentanoico (0,97 g) en etanol:agua (10 ml, 1:1 v/v) se le añadió metanotiolsulfonato de S-metilo (0,72 ml) y la mezcla de reacción se agitó en atmósfera de argón a temperatura ambiente durante 22 h. El etanol se eliminó a presión reducida antes de diluir la solución de reacción con salmuera (10 ml) y se extrajo con acetato de etilo (3 x 15 ml). Las capas orgánicas combinadas se lavaron después con salmuera (15 ml), la capa orgánica se separó, se secó sobre sulfato sódico, se filtró y se concentró al vacío para dar el compuesto 19 en forma de un aceite de color amarillo (0,9 g). RMN 1H (300 MHz; CDCh): 59,09 (s, 1H), 2,89 (m, 1H), 2,52 (t, J = 7,6 Hz, 2H), 2,41 (s, 3H), 2,03-1,85 (m, 2H), 1,35 (d, J = 6 ,8 Hz, 3H).
Etapa 2: Síntesis del compuesto 20.
A una solución del compuesto 19 (33 mg) en THF anhidro (2 ml) a 0 °C en atmósfera de argón se le añadió cloroformiato de isobutilo (25 j l ) y NMM (50 jl). Después de agitar durante 20 min a 0 °C, se añadió lentamente una solución del compuesto 5 (42 mg) en THF anhidro (4 ml) a la mezcla de reacción, que se dejó calentar a temperatura ambiente y se agitó durante otras 16 h. Una solución del compuesto 19 (33 mg) y cloroformiato de isobutilo (25 j l ) en
THF anhidro (1 ml), que se había agitado en atmósfera de argón a temperatura ambiente durante 1 h, se añadió después a la mezcla de reacción. La solución de reacción se agitó después durante 24 h antes de eliminar el disolvente al vacío y el residuo se purificó por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,05% y tampón B (v/v): acetonitrilo:ácido acético al 0,05 % (80:20 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 20 en forma de un sólido de color blanco (20 mg). RMN 1H (500 MHz; CDCh): 58,42 (s, 1H), 7,70 (s, 1H), 7,12 (s, 1H), 7,04 (d, J = 7,0 Hz, 1H), 6 ,88 (s, 1H), 6,85 (s, 1H), 6,48 (dd, J = 15,4, 11,1 Hz, 1H), 6,21-6,17 (m, 2H), 5,47 (dd, J = 15,5, 8,9 Hz, 1H), 4,83 (dd, J = 11,9, 2,3 Hz, 1H), 4,30 (t, J = 10,8 Hz, 1H), 3,82 (s, 3H), 3,56 (d, J = 13,0 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,27 (d, J = 12,4 Hz, 2H), 3,00 (d, J = 9,5 Hz, 2H), 2,94-2,89 (m, 3H), 2,73 (s, 3H), 2,64 (dc, J = 21,7, 7,3 Hz, 3H), 2,43 (d, J = 3,6 Hz, 1H), 2,23-2,21 (m, 1H), 2,17-2,15 (m, 1H), 2,06 (dd, J = 13,1, 7,4 Hz, 1H), 1,75 (s, 3H), 1,67 (d, J = 13,7 Hz, 1H), 1,50 (d, J = 6 ,6 Hz, 3H), 1,40 (d, J = 6,7 Hz, 1H), 1,31 (d, J = 6,2 Hz, 3H), 1,26 (c, J = 8,2 Hz, 5H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (888 , 100 %).
Etapa 3: Síntesis del compuesto 18.
El compuesto 18 se sintetizó de manera análoga a la del compuesto 6 del ejemplo 5 usando el compuesto 20 en lugar del compuesto 8. RMN 1H (500 MHz; CDCla): 58,41 (s, 1H), 7,70 (s, 1H), 7,12 (s, 1H), 7,04 (d, J = 6 ,8 Hz, 1H), 6 ,88 (s, 1H), 6,85 (s, 1H), 6,48 (dd, J = 15,2, 11,2 Hz, 1H), 6,21-6,17 (m, 2H), 5,47 (dd, J = 15,4, 9,0 Hz, 1H), 4,84-4,80 (m, 1H), 4,30 (t, J = 11,0 Hz, 1H), 3,82 (s, 3H), 3,56 (d, J = 12,8 Hz, 1H), 3,52 (d, J = 8,9 Hz, 1H), 3,37 (s, 3H), 3,27 (d, J = 12,7 Hz, 1H), 2,99 (t, J = 8,4 Hz, 1H), 2,92 (t, J = 12,8 Hz, 1H), 2,73 (s, 3H), 2,67-2,59 (m, 2H), 2,22 (d, J = 13,9 Hz, 1H), 2,08-2,04 (m, 1H), 1,75 (s, 3H), 1,67 (d, J = 14,3 Hz, 2H), 1,50 (d, J = 6 ,6 Hz, 3H), 1,36 (d, J = 6 ,8 Hz, 2H), 1,30 (t, J = 6 ,6 Hz, 6 H), 1,20 (d, J = 6 ,6 Hz, 3H), 0,94 (s, 3H), 0,88 (dd, J = 11,6, 5,5 Hz, 3H). LC/MS: (ES+) [M+H]+ (842, 100 %).
Ejemplo 10: Preparación del compuesto maitansinoide 21.
Etapa 1: Síntesis del compuesto 22.
El compuesto 22 se sintetizó de manera análoga a la del compuesto 8 del ejemplo 5 usando el compuesto 5 en lugar
del compuesto 4 y usando el compuesto 10 en lugar del compuesto 7. El compuesto 22 se aisló en forma de un sólido de color blanco. LC/MS: (ES+) [M+H]+ (1010, 100 %).
Etapa 2: Síntesis del compuesto 21..
El compuesto 21. se sintetizó de manera análoga a la del compuesto 6 del ejemplo 5 usando el compuesto 22 en lugar del compuesto 8. El compuesto 21 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh) S 8,44 8,42 (m, 1H), 7,69 (d, J = 0,3 Hz, 1H), 7,12 (d, J = 06 Hz, 1H), 7,06-7,04 (m, 1H), 6 ,86 (d, J = 11,8 Hz, 2H), 6,51-6,45 (m, 1H), 6,22-6,17 (m, 2H), 5,47 (dd, J = 15,4, 9,0 Hz, 1H), 4,84-4,82 (m, 1H), 4,84-4,82 (m, 1H), 432-4,27 (m, 1H), 3,82 (s, 3H), 3,56 (d, J = 13,0 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,27 (d, J = 12,7 Hz, 1H), 3,00 (d, J = 9,5 Hz, 2H), 2,92 (t, J = 12,9 Hz, 1H), 2,72 (s, 3H), 2,66-2,60 (m, 3H), 2,24-2,21 (m, 1H), 2,04 (dd, J = 9,2, 6 ,8 Hz, 2H), 1,75 (s, 3H), 1,67 (d, J = 11,3 Hz, 1H), 1,54-1,48 (m, 1H), 1,44 (s, 6 H), 1,31 (d, J = 6,3 Hz, 3H), 1,25 (s, 3H), 1,25-1,23 (m, 1H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (856, 100 %).
Ejemplo 11: Preparación del compuesto maitansinoide 23.
Etapa 1: Síntesis del compuesto 24.
A una solución en agitación del compuesto 5 (50 mg), el compuesto 16 (29 mg) y HATU (79 mg) en DMF (1,5 ml) a 0 °C se le añadió lentamente DIPEA (50 (jl). La mezcla de reacción se dejó calentar a temperatura ambiente y se agitó durante 14 h. Se añadieron más cantidades del compuesto 16 (47 mg) en DMF (500 jl), HATU (129 mg)y DlpEA (100 j l) y la mezcla de reacción se agitó a temperatura ambiente durante otras 6 h. La mezcla de reacción se purificó después directamente por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 24 en forma de un sólido de color blanco (15 mg). LC/MS: (ES+) [M+H]+ (860, 100 %).
Etapa 2: Síntesis del compuesto 23.
El compuesto 23 se sintetizó de manera análoga a la del compuesto 6 del ejemplo 5 usando el compuesto 24 en lugar del compuesto 8. El compuesto 23 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh) RMN 1H
(500 MHz; CDCI3) 58,45-8,43 (m, 1H), 7,75 (s, 1H), 7,13 (s, 1H), 7,06 (d, J = 8,2 Hz, 1H), 6,88-6,85 (m, 2H), 6,48 (dd, J = 15,4, 11,0 Hz, 1H), 6,21-6,17 (m, 2H), 5,47 (dd, J = 15,5, 9,0 Hz, 1H), 4,83 (dd, J = 11,8, 2,9 Hz, 1H), 4,32-4,27 (m, 1H), 3,82 (s, 3H), 3,56 (d, J = 12,9 Hz, 1H), 3,52 (d, J = 8,9 Hz, 1H), 3,37 (s, 3H), 3,27 (d, J = 12,8 Hz, 1H), 3,02 2,99 (m, 2H), 2,94-2,90 (m, 3H), 2,78 (t, J = 6,5 Hz, 2H), 2,73 (s, 3H), 2,65-2,60 (m, 1H), 2,23 (dd, J = 13,7, 2,8 Hz, 1H), 1,74 (s, 3H), 1,67 (d, J = 13,1 Hz, 1H), 1,53-1,47 (m, 1H), 1,31 (d, J = 6,3 Hz, 3H), 1,26 (d, J = 7,2 Hz, 3H), 1,25 1,23 (m, 1H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (814, 100%).
Ejemplo 12: Preparación del reactivo de conjugación 25 que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 26.
Una mezcla del compuesto 8 (17 mg) y ácido 4-mercapto-pentanoico (10 mg) en DMF (2 ml) se agitó a temperatura ambiente durante 16 h. Después, la mezcla de reacción se diluyó con acetato de etilo (20 ml) y se lavó con salmuera (10 ml). La capa orgánica se separó y se concentró al vacío antes de disolver el residuo en DMF ( 6 ml) y se purificó por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 26 en forma de un sólido de color blanquecino (23 mg). RMN 1H (500 MHz; CDCl3) 5 8,17 (s, 1H), 7,59-7,58 (m, 2H), 7,06-7,05 (m, 2H), 6 ,86 (s, 2H), 6,48 (dd, J = 15,3, 11,1 Hz, 1H), 6,41 (s, 1H), 6,18 (d, J = 10,9 Hz, 1H), 5,47 (dd, J = 15,4, 8,9 Hz, 1H), 4,79 (d, J = 12,0 Hz, 1H), 4,29 (t, J = 11,3 Hz, 1H), 3,81 (s, 3H), 3,56 (d, J = 13,0 Hz, 1H), 3,52 (d, J = 8,9 Hz, 1H), 3,37 (s, 3H), 3,26 (d, J = 12,9 Hz, 1H), 2,96 (d, J = 9,2 Hz, 2H), 2,90 2,84 (m, 2H), 2,66 (d, J = 3,7 Hz, 3H), 2,62 (dd, J = 14,0, 7,0 Hz, 2H), 2,55-2,40 (m, 4H), 2,32-2,25 (m, 1H), 2,07-1,95 (m, 3H), 1,79 (t, J = 6,9 Hz, 1H), 1,74 (s, 3H), 1,68-1,65 (m, 1H), 1,53-1,46 (m, 1H), 1,34 (d, J = 6,4 Hz, 3H), 1,27 (d, J = 6 ,6 Hz, 6 H), 1,24 (d, J = 7,2 Hz, 3H), 1,24-1,23 (m, 1H), 1,19 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (940, 100 %).
Etapa 2: Síntesis del reactivo 25.
Una mezcla del compuesto 26 (23 mg), clorhidrato de W-(3-dimetilaminopropil)-W'-etilcarbodiimida (EDC.HCl, 12 mg) y W-hidroxisuccinimida (5 mg) en diclorometano anhidro (2 ml) se agitó a temperatura ambiente durante 4 h. Después, la mezcla de reacción se concentró al vacío y el residuo se disolvió en DMSO (5 ml) antes de purificar por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para
dar el reactivo 25 en forma de un sólido de color blanco (25 mg). RMN 1H (500 MHz; CDCI3) 57,75-7,69 (m, 1H), 7,58 7,54 (m, 2H), 7,08-7,06 (m, 2H), 6,87-6,85 (m, 2H), 6,48 (dd, J = 15,4, 11,0 Hz, 1H), 5,47 (dd, J = 15,4, 9,0 Hz, 1H), 4,84-4,81 (m, 1H), 4,32-4,27 (m, 1H), 3,81 (s, 3H), 3,56 (d, J = 13,0 Hz, 1H), 3,52 (d, J = 8,9 Hz, 1H), 3,37 (s, 3H), 3,26 (d, J = 13,0 Hz, 1H), 3,01-2,84 (m, 6 H), 2,82 (d, J = 1,0 Hz, 3H), 2,80-2,73 (m, 2H), 2,67 (s, 3H), 2,64-2,60 (m, 1H), 2.53- 2,50 (m, 2H), 2,25-2,21 (m, 1H), 2,15-2,11 (m, 1H), 2,06-1,96 (m, 3H), 1,75 (s, 3H), 1,68 (d, J = 13,5 Hz, 1H), 1.53- 1,47 (m, 1H), 1,37 (d, J = 6 ,8 Hz, 3H), 1,34-1,30 (m, 6 H), 1,26 (d, J = 7,2 Hz, 3H), 1,24-1,23 (m, 1H), 1,20 (d, J = 6 ,8 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (1037, 100 %).
Ejemplo 13: Preparación del reactivo de conjugación 2Z que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 28.
El compuesto 28 se sintetizó de manera análoga a la del compuesto 26 del ejemplo 12 usando ácido 4-mercapto-4-metil-pentanoico en lugar de ácido 4-mercapto-pentanoico. El compuesto 28 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CD3OD) 57,63-7,62 (m, 2H), 6,96 (s, 1H), 6,71-6,66 (m, 1H), 6,29-6,27 (m, 1H), 5,58-5,53 (m, 1H), 4,76-4,73 (m, 1H), 4,26-4,22 (m, 1H), 3,83 (s, 3H), 3,63-3,60 (m, 2H), 3,39 (s, 3H), 3,36 (m, 1H), 3,07-3,02 (m, 1H), 2,99-2,94 (m, 1H), 2,89-2,87 (m, 1H), 2,79-2,74 (m, 1H), 2,70 (s, 3H), 2,63-2,54 (m, 2H), 2,40-2,37 (m, 2H), 2,27-2,24 (m, 1H), 2,06-1,90 (m, 5H), 1,80 (s, 3H), 1,65-1,54 (m, 3H), 1,36 (d, J = 6 ,8 Hz, 3H), 1,29-1,27 (d, 13H), 1,22 (d, J = 6,7 Hz, 3H), 1,02 (s, 3H). LC/MS: (ES+) [M+H]+ (954, 100 %).
Etapa 2: Síntesis del reactivo 2Z.
El reactivo 2Z se sintetizó de una manera análoga a la del reactivo 25 del ejemplo 12 usando el compuesto 28 en lugar del compuesto 26. El reactivo 2Z se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh) 57,89 (d, J = 4,9 Hz, 1H), 7,58-7,56 (m, 2H), 7,07 (d, 8,1 Hz, 2H), 6 ,86 (d, J = 6,4 Hz, 2H), 6,48 (dd, J = 15,3, 11,1 Hz, 1H), 6,23 (s, 1H), 6,18 (d, J = 10,9 Hz, 1H), 5,47 (dd, J = 15,4, 9,0 Hz, 1H), 4,84-4,81 (m, 1H), 432-4,27 (m, 1H), 3,81 (s, 3H), 3,56 (d, J = 12,9 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,26 (d, J = 12,8 Hz, 1H), 3,06 (s, 1H), 3,00-2,94 (m, 2H), 2,87-2,83 (m, 6 H), 2,77-2,71 (m, 2H), 2,66 (s, 3H), 2,64-2,60 (m, 1H), 2,55-2,48 (m, 2H), 2,24 (d, J = 13,4 Hz, 1H), 2,09-1,96 (m, 4H), 1,75 (s, 3H), 1,68 (d, J = 13,5 Hz, 1H), 1,54-1,46 (m, 1H), 1,34 (d, J = 6,7 Hz, 3H), 1,30-1,28 (m, 9H), 1,25-1,24 (m, 1H), 1,26 (d, J = 7,2 Hz, 3H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (1051, 100 %).
Ejemplo 14: Conjugación de los 25 y 27 con Trastuzumab para producir los conjugados anticuerpo-fármaco (ADC) 29 y 30, respectivamente.
Los reactivos de conjugación 25 y 27 se conjugaron con Trastuzumab, produciendo los ADC 29 y 30, respectivamente. Brevemente, los reactivos se disolvieron en DMSO para dar soluciones madre 10 mM. A una solución de Trastuzumab en 100 mM de tampón fosfato sódico, cloruro sódico 100 mM, pH 8,0 se le añadió propilenglicol (40 % v/v) y la solución se mezcló suavemente para dar una concentración de anticuerpo final de 4,8 mg/ml. Los reactivos de conjugación (13 equiv. por mAb) se añadieron después a las soluciones de anticuerpo y las mezclas de reacción se mezclaron suavemente y se incubaron a 24 °C durante 3 h. Después se añadió carbón activado en polvo (70 % p/p de mAb) a las soluciones de reacción que se agitó suavemente durante 30 min a temperatura ambiente para eliminar las especies relacionadas con el fármaco sin reaccionar. Las mezclas de reacción se mezclaron después (membrana PES de 0,22 |jm) y la muestra purificada intercambió con tampón en ácido succínico 10 mM, trehalosa al 6 % p/v, Tween 20 0 ,01 % v/v, pH 5,5 usando columnas de desalación PD-10.
Los DAR de los conjugados se determinaron por espectrometría de masas después de desglucosilación de las muestras usando PNGasa F. Las DAR promedio de los conjugados se calcularon a partir de las intensidades máximas relativas de las especies DAR individuales. Se determinaron asignaciones de DAR de 3,3 y 2,8 para los conjugados de anticuerpo fármaco 29 y 30, respectivamente.
Ejemplo 15: Ensayo de fuerza in vitro de los compuestos en líneas celulares SK-BR-3.
La pérdida de viabilidad de las células tumorales después del tratamiento con los compuestos de la invención, se sometió a ensayo cultivando líneas celulares SK-BR-3 en presencia de concentraciones en aumento de los compuestos de la invención y cuantificando la pérdida de proliferación o de actividad metabólica como se describe en el Ejemplo 2. Los valores de CI50 promedio de los compuestos de la invención se muestran en la Tabla 3 y las concentraciones de ensayo se especifican en la Tabla 4. También se proporciona el valor de CI50 de un compuesto comparador 31.:
de Chem. Eur. J. 2012, 18, 880-886.
Tabla 3
Tabla 4
Línea Intervalo de
celular Compuesto concentración
SK-BR-3 4 nM - 2,6 pM
SK-BR-3 6 nM - 0,2 pM
SK-BR-3 18 nM - 2,6 pM
SK-BR-3 31 (comparador) 1000 nM - 457 pM
Los compuestos de la invención, que contienen un resto bifenilo, tienen valores de CI50 inesperadamente más bajos con respecto a la inhibición de la proliferación de células SK-BR-3, que un compuesto comparador que contiene alilamina.
Ejemplo 16: Estudio de xenoinjerto de ratón JIMT-1 que compara el conjugado de trastuzumab-fármaco 29 con Kadcyla® (comparativo).
El conjugado 29 se preparó como se describe en el Ejemplo 14. Para la inoculación celular, se usaron ratonas lampiñas sanas NMRI (RjOrl:NMRI-Foxn1nu/Foxn1nu) de 6 semanas de vida al llegar.
Los tumores se indujeron mediante inyección subcutánea en el costado derecho de 5x106 células JIMT-1 (carcinoma de mama) en 200 pl de suspensión celular en PBS. Se añadió Matrigel (40 pl de Matrigel por 200 pl de suspensión celular) poco antes de la inoculación de las células tumorales. Los tumores se midieron dos veces por semana con calibradores y el volumen se calculó usando la fórmula:
Volumen tumoral (mm3) = ---------- -— ------
Cuando los volúmenes tumorales alcanzaron un volumen tumoral medio de aproximadamente 134 mm3, los animales se distribuyeron al azar en grupos de ocho ratones y se inició el tratamiento (día 0). Todas las sustancias de prueba se inyectaron a través de la vena de la cola (bolo iv). Se administró una sola dosis de 30 mg/kg de ADC en 10 ml/kg y se usó PBS para el grupo tratado con vehículo.
La viabilidad y el comportamiento de los ratones se registraron todos los días. Los pesos corporales se midieron dos veces por semana. Los animales se sacrificaron cuando se alcanzó un criterio de valoración humanitario (por ejemplo, peso tumoral calculado de > 10 % del peso corporal y/o volumen tumoral > 2000 mm3, pérdida de peso corporal del animal de > 20 % en comparación con el peso corporal en la distribución del grupo, ulceración de tumores, ausencia de movilidad, signos generales de dolor), o en una fecha de finalización del estudio predeterminada.
Los volúmenes tumorales medios ± error estándar el día 0 y el día 14 después del tratamiento se representan en la Figura 3. Los resultados muestran que para los animales tratados con vehículo, el volumen del tumor se duplicó aproximadamente entre el día 0 y el día 14 (135 frente a 268 mm3). Para los animales tratados con conjugado 29, (dosis de 30 mg/kg), el día 14, el volumen tumoral se redujo a casi la mitad del valor registrado el día 0 (134 frente a 73 mm3), mientras que el producto clínico Kadcyla® mostró un aumento en el volumen tumoral durante el mismo período de tiempo (134 frente a 165 mm3). Todos los compuestos fueron bien tolerados.
Ejemplo 17: Preparación del compuesto maitansinoide 32.
El compuesto 32 se sintetizó de manera análoga a la del compuesto 4 del ejemplo 3. Brevemente, pinacol éster del ácido 4-aminofenilborónico (16 mg), fosfato de tripotasio (33 mg), SPhos Pd G3 ( 6 mg) y maitansina (disponible en Toronto Research Chemicals, 25 mg) se añadieron secuencialmente a un recipiente de reacción purgado con argón. Después el recipiente se cerró herméticamente y los sólidos se purgaron con argón (4 x ciclos de evacuación/purga). THF (600 pl) y agua (60 pl), que se había desoxigenado rigurosamente purgando con argón, se añadieron después y la mezcla de reacción se agitó a temperatura ambiente durante 17 h. Después, la mezcla de reacción se diluyó con acetato de etilo (20 ml) y se lavó con salmuera (10 ml). Las capas se separaron y la capa orgánica se concentró a presión reducida. El residuo se purificó después por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v) y las fracciones deseadas se liofilizaron para dar el compuesto 32 en forma de un sólido de color blanco (17,3 mg). RMN 1H (500 MHz; CDCla) 56,90 (d, J = 7,9 Hz, 2H), 6,82 (s, 1H), 6,72-6,66 (m, 3H), 666 (s, 1H), 6,46 (dd, J = 15,4, 11,2 Hz, 1H), 6,23 (s, 1H), 5,70 (dd, J = 15,3, 9,0 Hz, 1H), 5,35-5,31 (m, 1H), 4,82 (dd, J = 12,0, 2,7 Hz, 1H), 432-4,28
(m, 1H), 3,81 (s, 3H), 3,68 (d, J = 12,8 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,42-3,41 (m, 1H), 3,37 (s, 3H), 3,15 (d, J = 12,7 Hz, 1H), 3,10-3,03 (m, 2H), 2,81 (s, 3H), 2,68 (s, 3H), 2,26 (dd, J = 14,3, 2,6 Hz, 1H), 2,07 (s, 3H), 1,68 (s, 3H), 1,65 (d, J = 13,7 Hz, 1H), 1,54-1,48 (m, 1H), 1,32-1,30 (m, 6H), 1,26 (d, J = 13,0 Hz, 1H), 0,92 (s, 3H). LC/MS: (ES+) [M+H]+ (749, 100 %).
Ejemplo 18: Preparación del compuesto maitansinoide 33.
Etapa 1: Síntesis del compuesto 34.
El compuesto 34 se sintetizó de manera análoga a la del compuesto 8 del ejemplo 5 usando el compuesto 32 en lugar del compuesto 4. El compuesto 34 se aisló en forma de un sólido de color amarillo claro. LC/MS: (ES+) [M+H]+ (1019, 100 %).
Etapa 2: Síntesis del compuesto 33.
El compuesto 33 se sintetizó de manera análoga a la del compuesto 6 del ejemplo 5 usando el compuesto 34 en lugar del compuesto 8. El compuesto 33 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh) 57,56 7,53 (m, 2H), 7,28 (dc, J = 3,1, 1,0 Hz, 1H), 7,07-7,05 (m, 2H), 6,83 (s, 1H), 6,72-6,69 (m, 1H), 6,67 (d, J = 0,3 Hz, 1H), 6,48-6,42 (m, 1H), 6,21 (s, 1H), 5,71-5,66 (m, 1H), 5,35-5,31 (m, 1H), 4,82-4,79 (m, 1H), 4,31-4,27 (m, 1H), 3,80 (s, 3H), 3,69 (d, J = 12,7 Hz, 1H), 3,51 (d, J = 9,0 Hz, 1H), 3,40-3,39 (m, 1H), 3,36 (s, 3H), 3,17-3,14 (m, 1H), 3,07 (d, J = 9,8 Hz, 1H), 3,03-2,98 (m, 2H), 2,80 (s, 3H), 2,65 (s, 3H), 2,57-2,52 (m, 2H), 2,26-2,23 (m, 1H), 2,17-2,11 (m, 1H), 2,06 (s, 3H), 1,82-1,75 (m, 1H), 1,68 (s, 3H), 1,64-1,61 (m, 1H), 1,46-1,44 (m, 1H), 1,41-1,40 (m, 3H), 1,31-1,29 (m, 6H), 1,26-1,23 (m, 1H), 0,91 (s, 3H). LC/MS: (ES+) [M+H]+ (865, 100 %).
Ejemplo 19: Preparación del reactivo de conjugación 35 que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 36.
Una solución de ácido 4-[2,2-bis[(p-tolilsulfonil)-metil]acetil]benzoico (1,0 g, Nature Protocols, 2006, 1(54), 2241-2252) se añadió a hidrato de W-hidroxibenzotriazol (306 mg) en THF anhidro (10 ml) en atmósfera de nitrógeno. La solución resultante se enfrió a 0 °C y se añadió diisopropilcarbodiimida (310 j l) gota a gota. La mezcla de reacción se agitó durante 20 min a 0 °C antes de calentarse a temperatura ambiente. Se añadió más THF (10 ml) a la mezcla de reacción después de 1 h. Después de 18 h, el precipitado formado se filtró y se lavó con THF frío (2 x 5 ml) antes de secarlo al vacío. El sólido se agitó con metanol (10 ml) durante 1 h a temperatura ambiente, se recogió por filtración y se lavó secuencialmente con metanol (2 x 5 ml) y éter dietílico (5 ml). Después, el sólido se secó al vacío para dar el compuesto 36 en forma de un sólido de color blanco (1,1 g). LC/MS: (ES+) [M+H]+ (618, 100%).
Etapa 2: Síntesis del compuesto 37.
A una suspensión en agitación de 5-terc-butil éster del ácido L-glutámico (198 mg) en DMF anhidra (20 ml) en atmósfera de nitrógeno se le añadió NMM (107 jl). La mezcla de reacción se enfrió a 0 °C antes de añadir el compuesto 36 (603 mg). La suspensión resultante se agitó a 0 °C durante 1 h, tras lo cual la mezcla de reacción se
dejó calentar a temperatura ambiente. Después de 19 h, la solución resultante se concentró al vacío y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:acetonitrilo al 5 %:ácido fórmico al 0,1 % y tampón B (v/v): acetonitrilo:ácido fórmico al 0,1 % (100:0 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío y el disolvente acuoso se eliminó por liofilización para dar el compuesto 37 en forma de un sólido de color blanco (198 mg). RMN 1H (400 MHz, CDCla) 87,98 (1H, d), 7,86 (2H), 7,71-7,65 (6H, m), 7,36 (4H, d), 4,68 (1H, ddd), 4,34 (1H, c), 3,62 (2H, ddd), 3,50 (2H, ddd), 2,69 (1H ddd), 2,55-2,45 (1H, m), 2,48 (6H, s), 2,34-2,16 (2H, m), 1,46 (9H, s). LC/MS: (ES+) [2M+H]+(1371, 70 %), [2M+H-fBu]+ (1315, 70 %), [M+H-fBu]+ (630, 100 %).
Etapa 3: Síntesis del compuesto 38.
El compuesto 37 (50 mg) y hexafluorofosfato de (benzotriazol-1-iloxi)tris-(dimetilamino)fosfonio (BOP) (40 mg) se disolvieron en DMF anhidra (3 ml), se enfriaron a 0 °C y se añadieron a una solución de NH2-PEG(24u)-OMe (99 mg) y NMM (10 |jl) en DMF anhidra (2 ml). La mezcla de reacción se agitó a 0 °C y después de 4 h, se añadieron cantidades adicionales de BOP (10 mg) y NMM (2,5 j l ) a la mezcla de reacción que se agitó durante otros 15 min antes de almacenarla a -20 °C durante 18 h. Después, la mezcla de reacción se concentró al vacío y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:acetonitrilo al 5 %:ácido fórmico al 0,1 % y tampón B (v/v): acetonitrilo:ácido fórmico al 0,1 % (100:0 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío el disolvente acuoso se eliminó por liofilización para dar bis-tolilsulfonil-propanoil-benzamida-L-Glu-[OfBu]-[PEG(24u)-OMe] en forma de un aceite incoloro (128 mg). LC/MS: (ES+) [M+H]+ (1757 Da, 100%), [M+2H]2+ (879, 100%). Bis-tolilsulfonil-propanoil-benzamida-L-Glu-[OtBu]-[PEG(24u)-OMe] (126,5 mg) se disolvió en ácido fórmico (2,5 ml) y se agitó en atmósfera de nitrógeno a temperatura ambiente. Después de 20 h, la mezcla de reacción se concentró al vacío y se secó a alto vacío durante 18 h para dar el compuesto 38 en forma de un aceite incoloro (122 mg, rendimiento cuantitativo supuesto). LC/MS: (ES+) [M+H]+ (1700, 100 %).
Etapa 4: Síntesis del compuesto 39-
A una solución del compuesto 4 (50 mg), Fmoc-Val-Cit-PAB-PNP (Levena Biopharma, 85 mg) y 1 -hidroxi-7-azabenzotriazol (HOAt) (11,5 mg) en DMF (3 ml), enfriada a 0 °C, se le añadió DIPeA (40 jl). La mezcla de reacción se dejó calentar a temperatura ambiente y se agitó durante 19 h. Se añadió más HOAt (14 mg) y la mezcla se agitó a temperatura ambiente durante 9 h antes de almacenar a -20 °C durante 72 h. Después se añadió más HOAt (18 mg) y la mezcla se agitó a temperatura ambiente durante 6 h. La mezcla de reacción se purificó después directamente por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (100:0 v/v a 0:100 v/v). Las fracciones de producto se
combinaron y se concentraron a presión reducida y la solución acuosa se extrajo con acetato de etilo (100 ml). Las capas se separaron y la capa orgánica se lavó con salmuera. La capa de acetato de etilo se separó después, se secó sobre sulfato sódico, se filtró y se concentró al vacío. El producto se purificó otra vez por cromatografía de fase normal eluyendo con diclorometano:metanol (100:0 v/v a 85:15 v/v). El disolvente se eliminó al vacío para dar el compuesto 39 en forma de un sólido de color blanco (44 mg). RMN 1H (500 MHz,CDaOD) 8 ppm 0,83-1,03 (m, 14H), 1,12-1,34 (m, 17H), 1,46-1,67 (m, 7H), 1,79 (s, 6H), 1,92 (s a, 2H), 2,03-2,14 (m, 2H), 2,24 (d, J = 14,17 Hz, 2H), 2,69 (s, 4 H), 2,76 (dt, J = 13,92, 6,72 Hz, 2H), 2,87 (d, J = 9,77 Hz, 2H), 2,99-3,16 (m, 3H), 3,16-3,24 (m, 2H), 3,37 (d, J = 6,35 Hz, 8H), 3,57-3,63 (m, 3H), 3,82 (s, 4 H), 3,98 (d, J = 7,33 Hz, 1H), 4,17-4,27 (m, 3H), 4,34-4,46 (m, 3H), 4,50-4,61 (m, 1H), 4,74 (d, J = 9,77 Hz, 2H), 5,15 (s, 3 H), 5,55 (dd, J = 15,14, 8,79 Hz, 1H), 6,27 (d, J = 10,75 Hz, 1H), 6,67 (dd, J = 15,63, 11,23 Hz, 1H), 6,95 (s, 1 H), 7,04-7,15 (m, 4H), 7,27-7,43 (m, 3H), 7,49 (d, J = 7,82 Hz, 5H), 7,61 (d, J = 8,3, 3H), 7,67 (t, J = 8,3, 3H), 7,80 (d, J = 7,33 Hz, 3H). LC/MS: (ES+) [M+H]+ (1320, 100 %).
Etapa 5: Síntesis del compuesto 40.
A una solución del compuesto 39 (52 mg) en metanol anhidro (2 ml) en atmósfera de argón se le añadió dietilamina (250 |jl) y la mezcla se agitó a temperatura ambiente durante 1 h. Después se añadió más dietilamina (250 j l) y la mezcla se agitó a temperatura ambiente durante otras 2 h. Después, la mezcla de reacción se concentró a presión reducida y se purificó por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 40 en forma de un sólido de color blanco (25 mg). RMN 1H (500 MHz; DMSO-d6) 510,23 (s, 1H), 9,80 (s, 1H), 8,69 (d, J = 7,5 Hz, 1H), 8,10 (s, 3H), 7,63 (d, J = 8,5 Hz, 2H), 7,48 (d, J = 8,2 Hz, 2H), 7,39 (d, J = 8,5 Hz, 2H), 7,13 (s, 1H), 7,08 (d, J = 8,0 Hz, 1H), 6,87 (s, 1H), 6,81 (s, 1H), 6,62 (dd, J = 15,2, 11,3 Hz, 1H), 6,22 (d, J= 11,0 Hz, 1H), 6,08 (s, 1H), 5,89-5,86 (m, 1H), 5,43 (dd, J = 15,2, 8,9 Hz, 1H), 5,11 (s, 2H), 4,59-4,52 (m, 2H), 4,11 (t, J = 11,2 Hz, 1H), 3,76 (s, 3H), 3,68-3,66 (m, J = 5,3 Hz, 1H), 3,54-3,51 (m, J = 7,7 Hz, 2H), 3,25 (s, 3H), 3,06-3,05 (m, 1H), 2,98-2,97 (m, 1H), 2,85 (t, J = 13,1 Hz, 1H), 2,70 (d, J = 9,7 Hz, 1H), 2,66 2,63 (m, 1H), 2,22 (d, J = 12,4 Hz, 1H), 2,09 (c, J = 6,7 Hz, 1H), 1,76-1,73 (m, 1H), 1,69 (s, 3H), 1,66-1,62 (m, 1H), 1,51-1,38 (m, 4H), 1,15-1,13 (m, 5H), 1,10 (d, J = 6,7 Hz, 3H), 0,97-0,94 (m, 9H). LC/MS: (ES+) [M+H]+(1098, 100 %).
Etapa 6: Síntesis del reactivo 35.
A una solución del compuesto 38 (25,3 mg) en DMF anhidra (400 j l) enfriada a 0 °C se le añadió HATU (5,7 mg). Después de agitar durante 25 min, se añadió NMM (1,5 j l ) y la solución se agitó durante 15 min antes de dejarla calentar a temperatura ambiente y agitar durante otros 10 min. A una solución separada del compuesto 40 (15 mg) en DMF anhidra (300 j l) se le añadió NMM (1,5 j l) y la solución se agitó durante 10 min a temperatura ambiente. Después las soluciones se combinaron y se añadieron más HATU (5,7 mg) y NMM (0,8 j l ) a la mezcla de reacción. Después de agitar durante 1 h a temperatura ambiente, la mezcla de reacción se concentró al vacío y se purificó por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (95:5 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío y el disolvente acuoso se eliminó por liofilización para dar el reactivo 35 en forma de un sólido incoloro (27,2 mg). LC/MS: (ES+) [M+2Na]2+ (1412 Da, 40 %), [M+H+Na]2+ (1401, 50 %), [M+2H+Na]3+ (935, 80 %), [M-H2O+3H]3+ (921, 100 %).
Ejemplo 20: Preparación del reactivo de conjugación 41. que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 42.
A una solución en agitación de dietanolamina (2,5 g) y trietilamina (6,05 g) en diclorometano (15 ml) se le añadió lentamente una solución de cloruro de tosilo (3,8 g) en diclorometano (15 ml) a temperatura ambiente. Después de 2 h, se añadió agua (25 ml) a la mezcla de reacción y el producto se extrajo con diclorometano (5 x 30 ml). Los extractos orgánicos combinados se secaron sobre sulfato de magnesio, la solución se filtró después y los volátiles se eliminaron al vacío para producir el compuesto 42 en forma de un sólido de color blanco (4,7 g). RMN 1H (400 MHz, CDCla) 57,68 (d, J = 8,3 Hz, 2H), 7,30 (d, J = 8,3 Hz, 2H), 3,84 (t, J = 5,0 Hz, 4H), 3,56 (s, 2H), 3,24 (t, J = 5,0 Hz, 4H), 2,41 (s, 3H). LC/MS: (ES+) [M+Na]+ (282, 95 %), [M+H]+ (260, 100 %).
Etapa 2: Síntesis del compuesto 43.
Una solución del compuesto 42 (176 mg) en THF anhidro (2 ml) se añadió gota a gota durante un periodo de 1 h a una solución de hidruro sódico (80 mg, 60 % dispersión en aceite mineral) en THF anhidro (8 ml) a temperatura ambiente. Después de agitar durante 1 h, se añadió una solución de di-p-toluenosulfonato de hexaetilenglicol (400 mg) en THF anhidro (2 ml) durante un periodo de 2 h y la mezcla de reacción se agitó a temperatura ambiente durante 72 h. Se añadió agua (30 ml) y el THF se eliminó al vacío. La solución acuosa se extrajo con cloroformo (4 x 25 ml), las fases orgánicas se combinaron y se secaron sobre sulfato de magnesio antes de filtrar la solución y se concentraron al vacío. El residuo se purificó después por cromatografía de fase inversa en columna C-18 eluyendo con tampón A
(v/v): agua:acetonitrilo al 5 %:ácido trifluoroacético al 0,05 % y tampón B (v/v):acetonitrilo:ácido trifluoroacético al 0,05 % (100:0 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío y el disolvente acuoso se eliminó por liofilización para dar el compuesto 43 en forma de un aceite incoloro (78 mg). RMN 1H (400 MHz, CDCh) 57,68 (d, J = 8,3 Hz, 2H), 7,26 (d, J = 8,3 Hz, 4H), 3,67-358 (m, 24H), 3,58-3,53 (m, 4H), 3,38 (t, J = 6,0 Hz, 4H), 2,40 (s, 3H). LC/MS: (ES+) [M+Na]+ (528, 80 %), [M+H]+ (506, 50 %).
Etapa 3: Síntesis del compuesto 44-
A una solución del compuesto 43 (78 mg) en THF anhidro (6 ml) se le añadió hidruro de litio y aluminio (1,13 ml, solución 1 M en THF) y la solución se calentó a reflujo durante 16 h antes de enfriar la mezcla de reacción a 0 °C e inactivarla mediante la adición gota a gota de agua. La suspensión se filtró y el precipitado se lavó con cloroformo:etanol (9:1 v/v, 5 x 6 ml). El filtrado y los lavados se combinaron y se concentraron al vacío para dar el compuesto 44 en forma de un aceite incoloro (50 mg). LC/MS: (ES+) [M+Na]+ (374, 70 %), [M+H]+ (352, 100 %).
Etapa 4: Síntesis del compuesto 45-
A una solución de Fmoc-Glu(OfBu)-OH (78 mg) en DMF anhidra (500 j l ) a 0 °C se le añadió HATU (108 mg) y NMM (34 j l) y la mezcla se agitó a 0 °C durante 10 min. A esto se le añadió una solución del compuesto 44 (44 mg) en DMF anhidra (500 j l) y la mezcla se agitó a 0 °C en atmósfera de argón durante 15 min. Después, la mezcla de reacción se concentró al vacío y el residuo se disolvió en DMF anhidra (500 jl). Se añadió piperidina (70 j l ) y la solución se agitó durante 90 min a temperatura ambiente. La solución de reacción se concentró al vacío y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:acetonitrilo al 5 %:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (100:0 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío y el disolvente acuoso se eliminó por liofilización para dar el compuesto 45 en forma de un aceite de color naranja (44 mg). LC/MS: (ES+) [M+H]+ (537, 45 %).
Etapa 5: Síntesis del compuesto 46
A una solución de ácido 4-[2,2-bis[(p-tolilsulfonil)-metil]acetil]benzoico (37,5 mg) en DMF anhidra (500 |jl) a 0 °C se le añadió HATU (65 mg) y n Mm (20 j l ) y la mezcla se agitó a 0 °C durante 10 min. A esto se le añadió una solución del compuesto 45 (44,3 mg) en DMF anhidra (500 j l ) y la mezcla se agitó a 0 °C en atmósfera de argón durante 1 h. Después, la mezcla de reacción se concentró al vacío, el residuo se disolvió en DMF (1 ml) y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (60:40 v/v a 0:100 v/v). El disolvente se eliminó por liofilización para dar bis-tolilsulfonil-propanoil-benzamida-L-Glu-(OfBu)-aza-24-corona-8 en forma de un sólido de color blanco (28,5 mg). LC/MS: (ES+) [M+Na]+ (1041, 20%), [M+H]+ (1019, 5%). A una solución de bis-tolilsulfonilpropanoil-benzamida-L-Glu-(OfBu)-aza-24-corona-8 (26,5 mg) en diclorometano anhidro (1 ml) se le añadió ácido trifluoroacético (500 j l) y la solución se agitó a temperatura ambiente en atmósfera de argón durante 1 h. Los volátiles se eliminaron al vacío para dar el compuesto 46 en forma de un sólido de color blanco (rendimiento cuantitativo supuesto). LC/MS: (ES+) [M+Na]+ (985, 35 %), [M+H]+ (963, 30 %).
Etapa 6: Síntesis del reactivo 41.
A una solución del compuesto 46 (10,5 mg) en DMF (300 j l) enfriada a 0 °C se le añadió HATU (4 mg). Después de agitar durante 20 min, se añadió NMM (1 j l ) y la solución de reacción se agitó durante otros 30 min a 0 °C. A una solución separada del compuesto 40 (10 mg) en DMF (200 j l) enfriada a 0 °C se le añadió NMM (1 j l ) y la solución se agitó durante 40 min. Las soluciones se combinaron después antes de añadir cantidades adicionales de HATU (4 mg) y NMM (1 j l ) y la mezcla de reacción se dejó calentar a temperatura ambiente y se agitó durante 3,25 h. Después, la solución de reacción se concentró al vacío y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (70:30 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío y el disolvente acuoso se eliminó por liofilización para dar el reactivo 41 en forma de un sólido de color blanco (8,2 mg). LC/MS: (ES+) [M+2Na]2+ (1043, 30 %), [M+Na+H]2+ (1033, 60 %), [M+2H]2+ (1021, 100 %), [M+3H]3+ (682, 30 %).
Ejemplo 21: Preparación del reactivo de conjugación 4Z que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 48.
A una solución en agitación del compuesto 4 (50 mg), Fmoc-Val-Ala-OH (Creagen, 67 mg) and HATU (85 mg) en DMF anhidra (2 ml) a 0 °C se le añadió DIPEA (50 |jl). La solución se dejó calentar a temperatura ambiente y se agitó durante 16 h. La mezcla de reacción se purificó después directamente por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v) y las fracciones deseadas se liofilizaron para dar el compuesto 48 en forma de un sólido de color blanco (57 mg). LC/MS: (ES+) [M+H]+ (1084, 100 %).
Etapa 2: Síntesis del compuesto 49.
A una solución en agitación del compuesto 48 (30 mg) en diclorometano (2 ml) se le añadió dietilamina (140 j l) y la mezcla de reacción se agitó a temperatura ambiente durante 16 h antes de concentrar la solución al vacío. El residuo se disolvió en DMF (5 ml) y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 49 en forma de un sólido de color blanco (20 mg). LC/MS: (ES+) [M+H]+ (862, 100 %).
Etapa 3: Síntesis del reactivo 47.
A una solución del compuesto 38 (15,6 mg), el compuesto 49 (8 mg) y HATU (6,6 mg) en DMF (2 ml) a 0 °C se le añadió NMM (30 j l) y la mezcla se agitó a 0 °C durante 90 min. La mezcla de reacción se purificó después directamente por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el reactivo 47 en forma de un sólido de color blanco (15 mg). RMN 1H (500 MHz; DMSO-d6) 59,99 (s, 0,5H), 9,92 (s, 0.5H), 8,73 (dd, J = 7,2, 5,1 Hz, 1H), 8,40-8,39 (m, 0.5H), 8,25 (d, J = 6,5 Hz, 0.5H), 8,05-8,01 (m, 1H), 7,97-7,87 (m, 2H), 7,67-7,51 (m, 6H), 7,46-7,44 (m, 3H), 7,13-7,09 (m, 2H), 6,86 (s, 1H), 6,81 (s, 1H), 6,65-6,60 (m, 1H), 6,52 (s, 1H), 6,23-6,21 (m, 1H), 5,87 (s, 1H), 5,42 (dd, J = 15,2, 8,9 Hz, 1H), 4,59-4,57 (m,
1H), 4,46-4,39 (m, 2H), 4,27-4,17 (m, 1H), 4,13-4,09 (m, 1H), 4,01-3,98 (m, 1H), 3,84-3,80 (m, 2H), 3,75-3,71 (m, 6H), 3,51 (s, 96H), 3,44-3,42 (m, 5H), 3,38-3,36 (m, 1H), 3,25 (d, J = 4,0 Hz, 6H), 2,89-2,83 (m, 1H), 2,70 (d, J = 9,4 Hz, 1H), 2,46 (s, 6H), 2,40-2,22 (m, 4H), 2,08-1,90 (m, 3H), 1,69 (s, 3H), 1,51-1,45 (m, 2H), 1,40-1,38 (m, 1H), 1,33-1,31 (m, 4H), 1,14 (d, J = 7,1 Hz, 6H), 1,10 (d, J = 6,6 Hz, 4H), 0,93 (s, 3H), 0,90-0,84 (m, 6H). LC/MS: (ES+) [M+2H]2+ (1272, 30 %), [M+3H]3+ (848, 100 %).
Ejemplo 22: Preparación del reactivo de conjugación 50 que comprende una carga útil citotóxica maitansinoide.
A una suspensión en agitación de amino-PEG(2u)-ácido (50 mg) y A/-hidroxisuccinimida éster del ácido 6-maleimidohexanoico (60 mg) en DMF anhidra (2 ml) se le añadió DIPEA (80 |jl) y la mezcla de reacción se agitó a temperatura ambiente durante 2 h. La mezcla se purificó después directamente por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 51 en forma de un sólido de color blanco (43 mg). RMN 1H (500 MHz; DMSO-d6) 57,83-7,80 (m, 1H), 7,02 (s, 2H), 3,61 (t, J = 6,4 Hz, 3H), 3,41-3,36 (m, 6H), 3,34-3,33 (m, 1H), 3,18 (c, J = 5,8 Hz, 3H), 2,45 (t, J = 6,3 Hz, 2H), 2,05 (t, J = 7,4 Hz, 2H), 1,48 (dt, J = 14,9, 7,4 Hz, 4H), 1,23-1,13 (m, 2H). LC/MS: (ES+) [M+H]+ (371, 100 %).
Etapa 2: Síntesis del reactivo 50.
A una solución del compuesto 40 (12 mg), el compuesto 51 (5,6 mg) y HATU (8,2 mg) en DMF (1,5 ml) enfriada a 0 °C se le añadió NMM (20 j l ) y la mezcla se agitó a 0 °C durante 2,5 h. La mezcla de reacción se purificó después directamente por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el reactivo 50 en forma de un sólido de color blanco (12 mg). RMN 1H (500 MHz; DMSO-d6) 510,06 (s, 1H), 9,79-9,78 (m, 1H), 8,18 (d, J = 7,3 Hz, 1H), 7,91 (d, J = 8,8 Hz, 1H), 7,82-7,80 (m, 1H), 7,63 (d, J = 8,5 Hz, 2H), 7,47 (d, J = 8,5 Hz, 2H), 7,37 (d, J = 8,5 Hz, 2H), 7,13 (s, 1H), 7,08 (d, J = 8,0 Hz, 2H), 7,00 (s, 2H), 6,86 (s, 1H), 6,80 (s, 1H), 6,62 (dd, J = 15,3, 11,2 Hz, 1H), 6,21 (d, J = 11,1 Hz, 1H), 6,04-6,01 (m, 1H), 5,87 (s, 1H), 5,45-5,40 (m, 3H), 5,10 (s, 2H), 4,59-4,56 (m, 1H), 4,41-4,37 (m, 1H), 4,25-4,22 (m, 1H), 4,13-4,09 (m, 1H), 3,76 (s, 3H), 3,63-3,59 (m, 2H), 3,54-3,50 (m, 2H), 3,48-3,46 (m, 4H), 3,38-3,36 (m, 4H), 3,25 (s, 3H), 3,17 (c, J = 5,8 Hz, 2H), 3,04-2,92 (m, 2H), 2,88-2,83 (m, 1H), 2,70 (d, J = 9,7 Hz, 1H), 2,67-2,61 (m, 1H), 2,47-2,45 (m, 1H), 2,41-2,36 (m, 1H), 2,23 (dd, J = 13,0, 0,8 Hz, 1H), 2,04 (t, J = 7,4 Hz, 2H), 2,01-1,94 (m, 1H), 1,73-1,65 (m, 5H), 1,63-1,58 (m, 1H), 1,51-1,42 (m, 7H), 1,40-1,35 (m, 2H), 1,20-1,12 (m, 8H), 1,10 (d, J = 6,6 Hz, 3H), 0,94 (s, 3H), 0,87 (d, J = 6,7 Hz, 3H), 0,83 (d, J = 6,8 Hz, 3H). LC/MS: (ES+) [M+H]+ (1449, 100 %).
Ejemplo 23: Preparación de una serie de compuestos maitansinoides.
Se preparó una serie de compuestos maitansinoides de fórmula general (XV) usando un procedimiento análogo al descrito en el ejemplo 3, sustituyendo el ácido 4-aminofenilborónico con una serie de reactivos arilborónicos para producir los compuestos 52, 53, 54, 55, 56 (fuera de las reivindicaciones), 5Z, 58, 59, 60, 61, 62, 63 y 64 (fuera de las
reivindicaciones). Las estructuras de compuesto y las modificaciones al protocolo sintético descritas en el ejemplo 3, se muestran en la tabla 5.
Tabla 5
continuación
continuación
Datos de caracterización para el compuesto 52 RMN 1H (500 MHz; CDCI3) 57,21-7,15 (m, 1H), 6,85 (d, J = 2,2 Hz,
2H), 6,68-6,65 (m, 1H), 6,51-6,45 (m, 3H), 6,22-6,17 (m, 2H), 5,49-5,44 (m, 1H), 4,84-4,81 (m, 1H), 4,31-4,27 (m, 1H), 3,82 (s, 3H), 3,57-3,50 (m, 2H), 3,37 (s, 3H), 3,29-3,24 (m, 1H), 3,02-2,90 (m, 3H), 2,73 (s, 3H), 2,69-2,61 (m, 1H), 2,27-2,22 (m, 1H), 1,75 (s, 3H), 1,69-1,66 (m, 1H), 1,50-1,48 (m, 1H), 1,30 (d, J = 6,3 Hz, 3H), 1,26 (d, J = 7,1 Hz, 3H), I , 24-1,23 (m, 1H), 1,20 (d, J = 6,7 Hz, 3H), 0,93 (s, 3H). LC/MS: (ES+) [M+H]+ (692, 100 %).
Datos de caracterización para el compuesto 53: LC/MS: (ES+) [M+H]+ (722, 100 %).
Datos de caracterización para el compuesto 54: RMN 1H (500 MHz; CDCh) 57,98 (s, 1H), 7,08 (dd, J = 8,5, 1,5 Hz,
1H), 6,89 (s, 1H), 6,86 (s, 1H), 6,82 (d, J = 8,6 Hz, 1H), 6,48 (dd, J = 15,4, 11,0 Hz, 1H), 6,21-6,16 (m, 4H), 5,47 (dd,
J = 15,4, 9,0 Hz, 1H), 4,84 (dd, J = 11,9, 2,8 Hz, 1H), 4,30 (t, J = 10,6 Hz, 1H), 3,84 (s, 3H), 3,57 (d, J = 12,9 Hz, 1H),
3.52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,27 (d, J = 13,0 Hz, 1H), 3,00 (d, J = 9,7 Hz, 1H), 2,94 (t, J = 12,9 Hz, 1H), 2,74
(s, 3H), 2,63 (dt, J = 13,9, 6,9 Hz, 1H), 2,25 (dd, J = 13,8, 2,7 Hz, 1H), 1,75 (s, 3H), 1,67 (d, J = 13,5 Hz, 1H), 1,53
1,47 (m, 1H), 1,30 (d, J = 6,3 Hz, 3H), 1,26 (d, J = 7,1 Hz, 3H), 1,25-1,24 (m, 1H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (737, 100 %).
Datos de caracterización para el compuesto 55: RMN 1H (300 MHz; CDCh) 56,99 (dd, J = 10,9, 8,4 Hz, 1H), 6,85 (d,
J = 2,7 Hz, 2H), 6,54-6,47 (m, 2H), 6,44-6,39 (m, 1H), 6,21-6,16 (m, 2H), 5,47 (dd, J = 15,4, 9,1 Hz, 1H), 4,83 (dd, J =
I I , 9, 2,9 Hz, 1H), 4,33-4,25 (m, 1H), 3,82 (s, 3H), 3,73 (s, 2H), 3,58-3,50 (m, 2H), 3,37 (s, 3H), 3,25 (d, J = 13,1 Hz, 1H), 3,02-2,86 (m, 2H), 2,73 (s, 3H), 2,67-2,58 (m, 1H), 2,22 (dd, J = 13,8, 2,7 Hz, 1H), 1,74 (s, 3H), 1,67 (d, J =
13.7 Hz, 1H), 1,53-1,46 (m, 1H), 1,30 (d, J = 6,2 Hz, 3H), 1,26 (d, J = 7,0 Hz, 3H), 1,25-1,23 (m, 1H), 1,20 (d, J =
6.7 Hz, 3H), 0,93 (s, 3H). LC/MS: (ES+) [2M+H]+ (1420, 100 %), [M+H]+ (710, 70 %).
Datos de caracterización para el compuesto 56 (fuera de las reivindicaciones): RMN 1H (500 MHz; CDCh) 57,83 (d, J
= 8,3 Hz, 2H), 7,23-7,21 (m, 2H), 6,89 (d, J = 10,0 Hz, 2H), 6,49 (dd, J = 15,5, 11,0 Hz, 1H), 6,21-6,19 (m, 2H), 5,48
(dd, J = 15,5, 9,1 Hz, 1H), 4,84 (dd, J = 11,9, 2,9 Hz, 1H), 4,32-4,27 (m, 1H), 3,82 (s, 3H), 3,58 (d, J = 12,7 Hz, 1H),
3.52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,30-3,27 (m, 1H), 3,02-2,94 (m, 2H), 2,66 (s, 3H), 2,64-2,60 (m, 1H), 2,25 (dd,
J = 13,6, 2,8 Hz, 1H), 1,76 (s, 3H), 1,69-1,67 (m, 1H), 1,53-1,48 (m, 1H), 1,31 (d, J = 6,4 Hz, 3H), 1,26 (d, J = 7,2 Hz,
4H), 1,25-1,24 (m, 1H), 1,20 (d, J = 6,8 Hz, 3H), 0,95 (s, 3H). LC/MS: (ES+) [M+H]+ (720, 100 %).
Datos de caracterización para el compuesto 57: RMN 1H (500 MHz; CDCh) 57,94 (d, J = 8,7 Hz, 2H), 6,89 (d, J =
9,0 Hz, 2H), 6,48 (dd, J = 15,3, 11,0 Hz, 1H), 6,21-6,18 (m, 2H), 5,47 (dd, J = 15,3, 9,0 Hz, 1H), 4,85 (s, 2H), 4,82 (dd,
J = 11,9, 2,9 Hz, 1H), 4,31-4,27 (m, 1H), 3,81 (s, 3H), 3,57 (d, J = 12,8 Hz, 1H), 3,52 (d, J = 8,9 Hz, 1H), 3,37 (s, 3H),
3,28 (d, J = 12,7 Hz, 1H), 3,01-2,91 (m, 2H), 2,67 (s, 3H), 2,65-2,59 (m, 1H), 2,23 (dd, J = 13,8, 2,8 Hz, 1H), 1,75 (s,
3H), 1,66 (dd, J = 13,7, 1,5 Hz, 1H), 1,52-1,47 (m, 1H), 1,30 (d, J = 6,3 Hz, 3H), 1,25 (d, J = 7,2 Hz, 3H), 1,25-1,23 (m,
1H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (756, 100 %).
Datos de caracterización para el compuesto 58: RMN 1H (500 MHz; CDCh) 56,96 (d, J = 7,9 Hz, 2H), 6,86 (d, J =
10,4 Hz, 2H), 6,81 (d, J = 8,6 Hz, 2H), 6,49 (dd, J = 15,4, 11,1 Hz, 1H), 6,24 (s, 1H), 6,19 (d, J = 11,1 Hz, 1H), 5,47
(dd, J = 15,5, 9,0 Hz, 1H), 4,83 (dd, J = 11,9, 2,8 Hz, 1H), 4,32-4,28 (m, 1H), 3,82 (s, 3H), 3,56 (d, J = 13,0 Hz, 1H),
3.52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,26 (d, J = 12,8 Hz, 1H), 3,02-2,96 (m, 2H), 2,67 (s, 3H), 2,64-2,60 (m, 1H), 2,27
(dd, J = 13,6, 2,3 Hz, 1H), 1,75 (s, 3H), 1,68 (d, J = 13,5 Hz, 1H), 1,53-1,48 (m, 1H), 1,30 (d, J = 6,3 Hz, 3H), 1,26 (d,
J = 7,2 Hz, 3H), 1,25-1,24 (m, 1H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (693, 100 %).
Datos de caracterización para el compuesto 59: RMN 1H (300 MHz; CDCh) 57,22 (d, J = 7,9 Hz, 1H), 6,86 (s, 2H),
6,83-6,80 (m, 1H), 6,70 (d, J = 7,6 Hz, 1H), 6,62 (s, 1H), 6,48 (dd, J = 15,3, 11,0 Hz, 1H), 6,39 (s, 1H), 6,19 (d, J = 10.7 Hz, 1H), 5,51 (dd, J = 15,3, 9,0 Hz, 1H), 4,86 (dd, J = 11,9, 2,5 Hz, 1H), 4,44-4,36 (m, 1H), 3,82 (s, 3H), 3,56 (d, J = 13,0 Hz, 1H), 3,49 (d, J = 9,0 Hz, 1H), 3,36 (s, 3H), 3,24 (d, J = 13,1 Hz, 1H), 3,00 (d, J = 9,6 Hz, 1H), 2,91 (t, J = 13.0 Hz, 1H), 2,65 (s, 2H), 2,63-2,58 (m, 1H), 2,41-2,35 (m, 1H), 1,74 (s, 3H), 1,71-1,65 (m, 1H), 1,57-1,45 (m, 1H), 1,31 (d, J = 6,3 Hz, 3H), 1,28-1,27 (m, 1H), 1,23 (d, J = 7,1 Hz, 3H), 1,19 (d, J = 6,7 Hz, 3H), 0,95 (s, 3H). LC/MS: (ES+) [M+H]+ (693, 100 %).
Datos de caracterización para el compuesto 60: RMN 1H (300 MHz; CDCh) 57,39 (d, J = 8,0 Hz, 2H), 7,11 (d, J = 7,8 Hz, 2H), 6,88 (d, J = 4,2 Hz, 2H), 6,49 (dd, J = 15,4, 10,9 Hz, 1H), 6,22-6,17 (m, 2H), 5,47 (dd, J = 15,3, 9,2 Hz, 1H), 4,82 (dd, J = 12,0, 3,0 Hz, 1H), 4,73 (s, 2H), 4,33-4,26 (m, 1H), 3,82 (s, 3H), 3,57 (d, J = 12,9 Hz, 1H), 3,53-3,50 (m, 1H), 3,37 (s, 3H), 3,27 (d, J = 13,3 Hz, 1H), 3,03-2,91 (m, 3H), 2,67 (s, 3H), 2,67-2,58 (m, 1H), 2,23 (dd, J = 13,8, 3.0 Hz, 1H), 1,75 (d, J = 5,5 Hz, 3H), 1,70-1,65 (m, 1H), 1,55-1,46 (m, 1H), 1,31 (d, J = 6,3 Hz, 3H), 1,26-1,24 (m, 1H), 1,26 (d, J = 7,2 Hz, 3H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (707, 100 %).
Datos de caracterización para el compuesto 61: RMN 1H (300 MHz; CDCh) 57,40-7,30 (m, 2H), 7,13 (s, 1H), 7,07 7,04 (m, 1H), 6,88 (d, J = 6,2 Hz, 2H), 6,49 (dd, J = 15,4, 11,0 Hz, 1H), 6,21-6,17 (m, 2H), 5,47 (dd, J = 15,2, 9,0 Hz, 1H), 4,84-4,80 (m, 1H), 4,70 (s, 2H), 4,33-4,25 (m, 1H), 3,82 (s, 3H), 3,57 (d, J = 12,7 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,27 (d, J = 12,6 Hz, 1H), 3,04-2,91 (m, 3H), 2,66 (s, 3H), 2,63-2,58 (m, 1H), 2,28-2,22 (m, 1H), 1,86-1,82 (m, 1H), 1,75 (s, 3H), 1,70-1,65 (m, 1H), 1,52-1,47 (m, 1H), 1,30 (d, J = 6,2 Hz, 3H), 1,27-1,24 (m, 1H), 1,26 (d, J = 7.0 Hz, 3H), 1,20 (d, J = 6,7 Hz, 3H), 0,95 (s, 3H). LC/MS: (ES+) [M+H]+ (707, 100 %).
Datos de caracterización para el compuesto 62: RMN 1H (500 MHz; CDCh) 57,11 (s, 1H), 7,00 (d, J = 8,4 Hz, 1H), 6,89-6,85 (m, J = 10,7 Hz, 3H), 6,48 (dd, J = 15,4, 11,0 Hz, 1H), 6,23 (s, 1H), 6,18 (d, J = 11,0 Hz, 1H), 6,09 (s, 1H), 5,47 (dd, J = 15,4, 9,0 Hz, 1H), 4,83 (dd, J = 11,9, 2,9 Hz, 1H), 4,32-4,27 (m, 1H), 3,83 (s, 3H), 3,56 (d, J = 12,9 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,26 (d, J = 12,9 Hz, 1H), 3,11 (d, J = 2,0 Hz, 1H), 3,00 (d, J = 9,7 Hz, 1H), 2,94 (dd, J = 13,7, 12,1 Hz, 1H), 2,71 (s, 3H), 2,65-2,59 (m, 1H), 2,24 (dd, J = 13,8, 2,7 Hz, 1H), 1,74 (s, 3H), 1,67 (d, J = 13,5 Hz, 1H), 1,52-1,46 (m, 1H), 1,30 (d, J = 6,4 Hz, 3H), 1,26 (d, J = 7,2 Hz, 3H), 1,27-1,25 (m, 1H), 1,20 (d, J = 6.7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (727, 100 %).
Datos de caracterización para el compuesto 63: RMN 1H (500 MHz; CDCh) 5 7,05 (d, J = 8,3 Hz, 0,33H), 6,98 (d, 0.66H, J = 2,4 Hz, 0,66H), 6,94-6,91 (m, 1H), 6,89-6,85 (m, 2.33H), 6,79 (d, J = 8,3 Hz, 0.66H), 6,51-6,44 (m, 1H), 6,23-6,15 (m, 2H), 5,50-5,41 (m, 1H), 4,84 (dd, J = 11,9, 3,0 Hz, 0.66H), 4,74 (dd, J = 12,1, 3,1 Hz, 0.33H), 4,32-4,23 (m, 1H), 3,94-3,92 (m, 2H), 3,88 (s, 2H), 3,84 (s, 1H), 3,59-3,50 (m, 2H), 3,37 (s, 2H), 3,36 (s, 1H), 3,31-3,25 (m, 1H), 3,02-2,78 (m, 4H), 2,69 (s, 2H), 2,65-2,60 (m, 1H), 2,27-2,23 (m, 0.66H), 2,14-2,11 (m, 0.33H), 1,77 (s, 1H), 1,74 (s, 2H), 1,70-1,62 (m, 1H), 1,52-1,46 (m, 1H), 1,32-1,25 (m, 7H), 1,21-1,19 (m, 3H), 0,95 (s, 2H), 0,90 (s, 1H). LC/MS: (ES+) [M+H]+ (717, 100%).
Datos de caracterización para el compuesto 64 (fuera de las reivindicaciones): RMN 1H (500 MHz; CDCh) 57,30 (d, J = 2,4 Hz, 0.2H), 7,24 (d, J = 2,4 Hz, 0.8H), 6,94 (d, J = 8,1 Hz, 0.2H), 6,90 (s, 0.8H), 6,83-6,79 (m, 2H), 6,74 (s, 1H), 6,71 (d, J = 8,2 Hz, 1H), 6,51-6,46 (m, 1H), 6,22-6,15 (m, 2H), 5,49-5,41 (m, 1H), 4,86 (dd, J = 11,8, 2,7 Hz, 0.8H), 4,68-4,65 (m, 0.2H), 4,33-4,24 (m, 1H), 3,85-3,81 (m, 2H), 3,76-3,73 (m, 3H), 3,68-3,66 (m, 3H), 3,59-3,49 (m, 2H), 3,37-3,36 (m, 3H), 3,28-3,22 (m, 1H), 3,11-3,02 (m, 2.4H), 2,93 (s, 0.6H), 2,91-2,85 (m, 0.6H), 2,70 (s, 2.4H), 2,67 2,60 (m, 1H), 2,29-2,26 (m, 0.8H), 1,80 (s, 0.6H), 1,78-1,74 (m, 0.2H), 1,73 (s, 2.4H), 1,72-1,63 (m, 1H), 1,54-1,46 (m, 1H), 1,32-1,30 (m, 3H), 1,28-1,24 (m, 4H), 1,21-1,18 (m, 3H), 0,97 (s, 2.4H), 0,91 (s, 0.6H). LC/MS: (ES+) [M+H]+ (750, 100 %).
Ejemplo 24: Preparación del compuesto maitansinoide 65.
El compuesto 61 (36 mg), nitrato de hierro (III) nonahidrato (13 mg), TEMPO (4,8 mg), cloruro potásico (6,2 mg) y 1,2dicloroetano (2 ml) se añadieron secuencialmente a un recipiente de reacción y la mezcla se agitó en atmósfera de oxígeno durante 5 días. Después, la mezcla de reacción se concentró al vacío, el residuo se disolvió en DMF (10 ml) y después se purificó por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 65 en forma de un sólido de color blanco (4,5 mg). RMN 1H (500 MHz; CD3OD) 58,01 (d, J = 7,4 Hz, 1H), 7,82-7,80 (m, 1H), 7,53-7,50 (m, 1H), 7,42-7,39 (m, 1H), 7,17 (s, 1H), 6,99 (s, 1H), 6,72-6,67 (m, 1H), 6,30 (d, J = 11,0 Hz, 1H), 5,59-5,51 (m, 1H), 4,75 (d, J = 11,7 Hz, 1H), 4,27-4,22 (m, 1H), 3,85 (s, 3H), 3,65-3,61 (m, 3H), 3,39 (s, 3H), 3,11-3,06 (m, 1H), 2,88 (d, J = 9,4 Hz, 1H), 2,80-2,74 (m, 1H), 2,67 (s, 3H), 2,32-2,29 (m, 1H), 1,81 (s, 3H), 1,66-1,57 (m, 3H), 1,31-1,27 (m, 7H), 1,23 (d, J = 6,5 Hz, 3H), 1,04 (s, 3H). LC/MS: (ES+) [M+H]+ (721, 100 %).
Ejemplo 25: Preparación del reactivo de conjugación 66 que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 67.
A una solución en agitación del compuesto 58 (328 mg), Boc-Val-Cit-PAB (BroadPharm, 688 mg) y tri-n-butilfosfina (700 |jl) en DMF (15 ml) a 0 °C se le añadió lentamente azodicarboxilato de diisopropilo (560 jl). La mezcla se dejó calentar gradualmente a temperatura ambiente y se agitó durante 2,5 h. La mezcla de reacción se purificó después directamente por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 67 en forma de un sólido de color amarillo claro (92 mg). LC/MS: (ES+) [M+H]+ (1154, 100%).
Etapa 2: Síntesis del compuesto 68.
Una solución del compuesto 67 (92 mg) en ácido fórmico (2 ml) se agitó a temperatura ambiente durante 80 min. Después, la mezcla de reacción se concentró al vacío, el residuo se disolvió en DMF (5 ml) y después se purificó por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 68 en forma de un sólido de color blanco (47 mg). LC/MS: (ES+) [M+H]+ (1054, 100 %).
Etapa 3: Síntesis del reactivo 66.
El reactivo 66 se sintetizó de una manera análoga a la del reactivo 47 del ejemplo 21 (Etapa 3) usando el compuesto 68 en lugar del compuesto 49- El reactivo 66 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; DMSO-da) 510,02 (s, 1H), 8,76 (d, J = 7,8 Hz, 0.5H), 8,16-8,14 (m, 0.5H), 8,05-8,02 (m, 1H), 7,92-7,79 (m, 2H), 7,69-7,61 (m, 2H), 7,57-7,51 (m, 5H), 7,47-7,43 (m, 4H), 7,41-7,31 (m, 2H), 7,12 (d, J = 0,4 Hz, 1H), 7,09-7,08 (m, 2H), 7,00 (d, J = 8,8 Hz, 2H), 6,86 (s, 1H), 6,81 (s, 1H), 6,65-6,60 (m, 0.5H), 6,53 (s, 0.5H), 6,23-6,20 (m, 0.5H), 5,99-5,97 (m, 0.5H), 5,89-5,87 (m, 1H), 5,45-5,40 (m, 3H), 5,06-5,00 (m, 1H), 4,59-4,53 (m, 0.5H), 4,44-4,39 (m, 1H), 4,27-4,24 (m, 0.5H), 4,14-4,07 (m, 0.5H), 4,02-3,97 (m, 0.5H), 3,86-3,80 (m, 1H), 3,76 (s, 3H), 3,74-3,71 (m, 1.5H), 3,68-3,63 (m, 0.5H), 3,51 (s, 96H), 3,46-3,42 (m, 5H), 3,25 (d, J = 4,4 Hz, 7H), 3,05-2,94 (m, 1.5H), 2,90-2,85 (m, 0.5H), 2,72-2,70 (m, 1H), 2,66-2,63 (m, 2H), 2,46 (s, 6H), 2,40-2,37 (m, 2H), 2,34-2,27 (m, 2H), 2,20-2,17 (m, 1H), 2,05-1,91 (m, 2H), 1,72-1,68 (m, 4H), 1,62-1,59 (m, 0.5H), 1,52-1,35 (m, 4.5H), 1,14 (d, J = 6,9 Hz, 6H), 1,10 (d, J = 6,6 Hz, 3H), 0,94 (s, 3H), 0,88 (d, J = 6,5 Hz, 3H), 0,84 (d, J = 6,7 Hz, 4H). LC/MS: (ES+) [M+2H]2+ (1368, 20 %), [M+3H]3+ (912, 70 %), [M+4H]4+ (684, 100 %).
Ejemplo 26: Preparación del reactivo de conjugación 69 que comprende una carga útil citotóxica maitansinoide.
El reactivo 69 se sintetizó de una manera análoga a la del reactivo 66 del ejemplo 25 usando el compuesto 62 en lugar del compuesto 58 (step 1). El reactivo 69 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh) 5 9,15 (s, 0.5H), 7,96-7,88 (m, 2.5H), 7,80-7,72 (m, 1H), 7,75-7,66 (m, 8H), 7,47-7,44 (m, 1H), 737-7,32 (m, 7H), 7,17 (s, 1H), 6,97 (d, J = 8,4 Hz, 1H), 6,89 (d, J = 8,1 Hz, 1H), 6,85 (d, J = 4,7 Hz, 2H), 6,48 (dd, J = 15,3, 11,0 Hz, 0.5H), 6,25-6,17 (m, 1.5H), 5,97-5,86 (m, 0.5H), 5,50-5,45 (m, 0.5H), 5,11-5,00 (m, 4H), 4,81 (dd, J = 11,6, 1,9 Hz, 1H), 4,67
4,65 (m, 0.5H), 4,56-4,55 (m, 0.5H), 4,38-4,20 (m, 2H), 3,81 (s, 3H), 3,63 (s, 96H), 3,57-3,52 (m, 12H), 3,37 (d, J = 5,5 Hz, 6H), 3,27-3,20 (m, 3H), 2,94 (dd, J = 27,1, 11,3 Hz, 2H), 2,69 (s, 3H), 2,65-2,61 (m, 1H), 2,47 (s, 6H), 2,41 2,34 (m, 1.5H), 2,22-2,13 (m, 2.5H), 1,98-1,95 (m, 1H), 1,83-1,79 (m, 3H), 1,74 (s, 3H), 1,66 (d, J = 13,5 Hz, 1H), 1,58 1,48 (m, 2H), 1,29 (d, J = 6,1 Hz, 3H), 1,25 (d, J = 7,1 Hz, 4H), 1,19 (d, J = 6,7 Hz, 3H), 1,00 (t, J = 6,4 Hz, 5H), 0,93 (s, 3H). LC/MS: (ES+) [M+2H]2+ (1385, 15 %), [M+3H]3+ (923, 75 %), [M+4H]4+ (693, 100 %).
Ejemplo 27: Preparación del reactivo de conjugación 70 que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 71.
Una solución del compuesto 18 (18 mg) y el compuesto 7 (19 mg) en DMF anhidra (1 ml) se agitó en atmósfera de argón a temperatura ambiente durante 18 h. La solución de reacción después se diluyó con agua (1 ml) y se purificó por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,05 % y tampón B (v/v): acetonitrilo:ácido acético al 0,05 % (70:30 v/v a 10:90 v/v). Las fracciones deseadas se combinaron, se concentraron al vacío y se liofilizaron para dar el compuesto 71 en forma de un sólido de color blanco (12 mg). RMN 1H (500 MHz; CDCh): 58,41 (s, 1H), 7,70 (s, 1H), 7,12 (s, 1H), 7,04 (d, J = 7,3 Hz, 1H), 6,87 (dd, J = 10,8, 5,9 Hz, 2H), 6,48 (dd, J = 15,2, 10,9 Hz, 1H), 6,31 (s, 1H), 6,19 (dd, J = 11,0, 0,5 Hz, 1H), 5,47 (dd, J = 15,4, 8,8 Hz, 1H), 4,84-4,81 (m, 1H), 4,32-4,28 (m, 1H), 3,82 (d, J = 5,0 Hz, 3H), 3,56 (d, J = 12,7 Hz, 1H), 3,52 (d, J = 9,0 Hz, 1H), 3,37 (s, 3H), 3,28-3,21 (m, 2H), 3,00 (dd, J = 10,0, 4,8 Hz, 1H), 2,91 (t, J = 13,0 Hz, 1H), 2,73 (d, J = 8,7 Hz, 3H), 2,67-2,56 (m, 4H), 2,44 (d, J = 8,5 Hz, 1H), 2,23 (dd, J = 13,8, 3,1 Hz, 1H), 2,16 (dt, J = 12,7, 6,6 Hz, 1H), 2,03 (ddt, J = 25,3, 12,2, 6,5 Hz, 4H), 1,50 (d, J = 6,7 Hz, 3H), 1,45 (d, J = 6,7 Hz, 3H), 1,36 (dt, J = 6,9, 3,6 Hz, 1H), 1,31 (c, J = 6,1 Hz, 5H), 1,25 (dt, J = 7,5, 4,1 Hz, 4H), 1,20 (d, J = 6,7 Hz, 3H), 0,93 (s, 3H). LC/MS: (ES+) [M+H]+ (974, 100 %), [M+Na]+ (996, 45 %)
Etapa 2: Síntesis del reactivo 70.
Una mezcla del compuesto 71 (11 mg), EDC.HCl (15 mg) y W-hidroxisuccinimida (10 mg) en diclorometano anhidro (3 ml) se agitó en atmósfera de argón a temperatura ambiente durante 72 h. Después, la mezcla de reacción se concentró al vacío y el residuo se disolvió en diclorometano:acetonitrilo (2 ml, 1:1 v/v) antes de purificar por cromatografía de fase normal eluyendo con diclorometano:acetonitrilo (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y el disolvente se eliminó al vacío para dar el reactivo 70 en forma de un sólido de color blanco (12 mg). RMN 1H (500 MHz; CDCla): 58,41 (d, J = 7,5 Hz, 1H), 7,79-7,70 (m, 1H), 7,12 (s, 1H), 7,06-7,04 (m, 1H), 6,86 (d, J = 11,8 Hz, 2H), 6,48 (dd, J = 15,4, 11,0 Hz, 1H), 6,19 (d, J = 14,5 Hz, 2H), 5,49-5,45 (m, 1H), 4,83 (dd, J = 11,7, 2,6 Hz, 1H), 4,30 (t, J = 11,2 Hz, 1H), 3,81 (s, 3H), 3,56 (d, J = 12,8 Hz, 1H), 3,52 (d, J = 8,8 Hz, 1H), 3,37 (s, 3H), 3,27 (d, J = 12,5 Hz,
2H), 3,00 (d, J = 9,8 Hz, 2H), 2,93 (dd, J = 13,0, 4,8 Hz, 2H), 2,87-2,79 (m, 7H), 2,72 (d, J = 3,3 Hz, 3H), 2,62 (tt, J = 13,4, 6,5 Hz, 3H), 2,23 (d, J = 14,2 Hz, 1H), 2,07 (dddd, J = 31,6, 23,4, 16,2, 7,7 Hz, 4H), 1,74 (s, 3H), 1,67 (d, J = 13,6 Hz, 1H), 1,50 (d, J = 6,7 Hz, 1H), 1,47 (d, J = 6,7 Hz, 1H), 1,37 (dd, J = 6,8, 1,7 Hz, 2H), 1,34 (d, J = 6,9 Hz, 2H), 1,31 (d, J = 6,3 Hz, 3H), 1,26 (c, J = 8,3 Hz, 5H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: (ES+) [M+H]+ (1071, 100 %), [M+Na]+ (1093, 80 %).
Ejemplo 28: Preparación de reactivo de conjugación 72 que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 73.
A una solución de Fmoc-Lys(Boc)-OH (470 mg) en DMF anhidra (5 ml) a 0 °C se le añadió HATU (1,4 g). A esto se le añadió una solución de NH2-pEG(24u)-OMe (1 g) y NMM (340 j l) en DMF anhidra (5 ml) a 0 °C antes de dejar calentar la solución a temperatura ambiente y se agitó durante 1 h. Después, la mezcla de reacción se concentró al vacío y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (95:5 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío y el disolvente acuoso se eliminó por liofilización para dar Fmoc-Lys(Boc)-[PEG(24u)-OMe]. LC/MS: (ES+) [M+Na]+ (1560, 100 %), [M+H]+ (1539, 80 %). A una solución del Fmoc-Lys(Boc)-[PEG(24u)-OMe] en DMF (10 ml) se le añadió piperidina (0,9 ml) y la solución se agitó durante 10 min a temperatura ambiente. La solución de reacción se concentró al vacío y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (95:5 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío y el disolvente acuoso se eliminó por liofilización para dar el compuesto 73 en forma de un sólido de color blanco (1 g). LC/MS: (ES+) [M+H]+ (1316, 10 %), [M+2H-Boc]2+ (609, 100 %).
Etapa 2: Síntesis del compuesto 74.
A una solución del compuesto 36 (420 mg) en DMF anhidra (2 ml) se le añadió una solución del compuesto 73 (1 g) y NMM (92 |jl) en DMF anhidra (3 ml). Después de agitar durante 2,5 a temperatura ambiente, la mezcla de reacción se concentró al vacío y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (95:5 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío y el disolvente acuoso se eliminó por liofilización para dar bis-tolilsulfonilpropanoil-benzamida-L-Lys-[Boc]-[PEG(24u)-OMe] en forma de un sólido de color blanco (0,84 g). LC/MS: (ES+) [M+2H-Boc]2+ (850, 95 %). Después se disolvió bis-tolilsulfonil-propanoil-benzamida-L-Lys-[Boc]-[PEG(24u)-OMe] (0,84 g) en ácido fórmico (3 ml) y la solución se agitó a temperatura ambiente durante 3 h. Los volátiles se eliminaron al vacío y el residuo se lavó con tolueno (3 x 6 ml) antes de secar el residuo al vacío y se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (95:5 v/v a 0:100 v/v). El disolvente orgánico se eliminó al vacío y el disolvente acuoso se eliminó por liofilización para dar el compuesto 74 en forma de un sólido de color blanco (0,59 g). LC/MS: (ES+) [M+H]+ (1699, 5 %), [M+2H]2+ (850, 100 %).
Etapa 3: Síntesis del reactivo 72.
A una solución del compuesto 74 (52 mg) en DMF anhidra (0,9 ml) se le añadió el reactivo 25 (21 mg) seguido de NMM (9 j l ) y la mezcla se agitó a temperatura ambiente. Se añadieron cantidades adicionales de NMM (2 x 9 j l) después de 2 y 4 h y después, tras 6 h, la solución de reacción se almacenó a -20 °C durante otras 16 h. Después, la solución de reacción se concentró al vacío, el residuo se disolvió en acetonitrilo (400 j l) y después se purificó por cromatografía de fase inversa en columna C-18, eluyendo con tampón A (v/v): agua:ácido trifluoroacético al 0,05 % y tampón B (v/v): acetonitrilo:ácido trifluoroacético al 0,05 % (70:30 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el reactivo 72 en forma de un sólido de color blanco (17 mg). MS: (ES+) [M+2Na]2+ (1333, 10 %), [M+3H]3+ (874, 100 %), [M+4H]4+ (656, 30 %).
Ejemplo 29: Preparación del reactivo de conjugación 75 que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 76.
Una mezcla del compuesto 34 (40 mg) y ácido 4-mercapto-pentanoico (27 mg) en DMF (5 ml) se agitó a temperatura ambiente durante 16 h. La mezcla de reacción se purificó después directamente por cromatografía de fase inversa en columna C-18 eluyendo con tampón A (v/v): agua:ácido acético al 0,1 % y tampón B (v/v): acetonitrilo:ácido acético al 0,1 % (100:0 v/v a 0:100 v/v). Las fracciones deseadas se combinaron y se liofilizaron para dar el compuesto 76 en forma de un sólido de color blanco (36 mg). LC/MS: (ES+) [M+H]+ (998, 100 %), [M+2H]2+ (499, 20 %).
Etapa 2: Síntesis del reactivo 75.
El reactivo 75 se sintetizó de una manera análoga a la del reactivo 25 del ejemplo 12 usando el compuesto 76 en lugar del compuesto 26. El reactivo 75 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh) 57,76 7,70 (m, 1H), 7,58-7,56 (m, 2H), 7,08-7,06 (m, 2H), 6,84 (d, J = 0,4 Hz, 1H), 6,72-6,68 (m, 2H), 6,46 (dd, J = 15,3, 11,3 Hz, 1H), 6,25 (s, 1H), 5,72-5,67 (m, 1H), 5,36-5,32 (m, 1H), 4,82-4,79 (m, 1H), 4,30 (td, J = 11,2, 1,4 Hz, 1H), 3,81 (s, 3H), 3,70 (d, J = 12,9 Hz, 1H), 3,52 (d, J = 9,1 Hz, 1H), 3,37 (s, 3H), 3,18-3,15 (m, 1H), 3,09-3,02 (m, 2H), 2,96-2,73 (m, 6H), 2,66 (s, 3H), 2,54-2,51 (m, 2H), 2,28-2,24 (m, 1H), 2,15-1,95 (m, 6H), 1,69 (s, 3H), 1,66 (d, J = 0,4 Hz, 1H), 1,53-1,47 (m, 1H), 1,37 (d, J = 6,7 Hz, 3H), 1,34-1,25 (m, 13H), 0,92 (s, 3H). LC/MS: (ES+) [M+H]+(1094, 100 %).
Ejemplo 30: Preparación del reactivo de conjugación 77 (comparador) que comprende una carga útil citotóxica maitansinoide.
Etapa 1: Síntesis del compuesto 78.
El compuesto 78 se sintetizó de manera análoga a la del compuesto 71 del ejemplo 27 usando N2'-desacetil-N2'-(4-mercapto-1-oxopentil)-maitansina (disponible en BOC Sciences) en lugar del compuesto 18. El compuesto 78 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh): 56,83 (s, 1H), 6,69-6,67 (m, 1H), 6,42 (ddd, J = 14,9, 11,3, 3,4 Hz, 1H), 6,32 (d, J = 6,4 Hz, 1H), 5,69-5,62 (m, 1H), 4,92-4,86 (m, 1H), 4,32 (quintuplete, J = 9,8 Hz, 1H), 3,99 (s, 3H), 3,62 (ddd, J = 20,7, 13,1, 7,4 Hz, 1H), 3,48 (td, J = 10,4, 4,2 Hz, 1H), 3,35 (d, J = 2,8 Hz, 3H), 3,21 (s, 3H), 3,17-3,12 (m, 1H), 3,01-2,95 (m, 2H), 2,91 (dd, J = 13,8, 8,8 Hz, 2H), 2,84 (td, J = 14,1,6,7 Hz, 2H), 2,67-2,60 (m, 2H), 2,55-2,36 (m, 4H), 2,20 (dd, J = 14,4, 2,6 Hz, 1H), 1,95 (td, J = 13,2, 6,9 Hz, 2H), 1,81 (dt, J = 20,0, 5,7 Hz, 2H), 1,73 (dd, J = 19,2, 14,2 Hz, 1H), 1,65 (s, 3H), 1,48-1,45 (m, 2H), 1,39 (dd, J = 12,6, 6,9 Hz, 2H), 1,34 (dd, J = 9,0, 7,0 Hz, 2H), 1,32-1,25 (m, 12H), 0,82 (dd, J = 11,9, 5,7 Hz, 3H). LC/MS: (ES+) [M-H2O+H]+ (880, 100 %), [M+H]+ (898, 15 %), [M+Na]+ (920, 60 %).
Etapa 2: Síntesis del reactivo 77.
El reactivo 77 se sintetizó de una manera análoga a la del reactivo 25 del ejemplo 12 usando el compuesto 78 en lugar del compuesto 26. El reactivo 77 se aisló en forma de un sólido de color blanco. RMN 1H (500 MHz; CDCh): 56,86 6,83 (m, 1H), 6,75 (t, J = 8,8 Hz, 1H), 6,64 (d, J = 4,8 Hz, 1H), 6,43 (dd, J = 15,3, 11,2 Hz, 1H), 6,20 (s, 1H), 5,67 (ddd, J = 15,0, 9,4, 5,2 Hz, 1H), 5,42 (c, J = 6,7 Hz, 1H), 4,78 (dd, J = 12,0, 2,7 Hz, 1H), 4,27 (t, J = 11,3 Hz, 1H), 3,98 (s, 3H), 3,65 (d, J = 12,7 Hz, 1H), 3,50 (d, J = 9,0 Hz, 1H), 3,35 (s, 3H), 3,22 (s, 3H), 3,13 (t, J = 10,2 Hz, 1H), 3,04 (d, J = 9,7 Hz, 1H), 2,85 (d, J = 3,4 Hz, 9H), 2,72 (t, J = 6,9 Hz, 2H), 2,61 (t, J = 13,2 Hz, 1H), 2,55-2,49 (m, 1H), 2,46-2,35 (m, 1H), 2,17 (dd, J = 14,3, 2,4 Hz, 1H), 2,04-1,83 (m, 4H), 1,64 (s, 3H), 1,57 (d, J = 13,6 Hz, 1H), 1,51 (s, 2H), 1,48 1,44 (m, 1H), 1,30-1,23 (m, 14H), 0,80 (s, 3H). LC/MS: (ES+) [M-H2O+H]+ (977, 100 %), [M+H]+ (995, 15%), [M+Na]+ (1017, 55 %).
Ejemplo 31: Preparación del compuesto maitansinoide 79.
El compuesto 79, que se sintetizó como una mezcla de atropisómeros, se preparó de una manera similar a la del compuesto 4 del ejemplo 3. Brevemente, pinacol éster del ácido 4-amino-2-clorofenilborónico (66 mg), fosfato de tripotasio (148 mg), SPhos Pd G3 (13,6 mg) y AP3 (100 mg) se añadieron secuencialmente a un recipiente de reacción purgado con argón. Después el recipiente se cerró herméticamente y los sólidos se purgaron con argón (4 x ciclos de evacuación/purga). THF (1,2 ml) y agua (120 jl), que se había desoxigenado rigurosamente purgando con argón, se añadieron después y la mezcla de reacción se agitó a temperatura ambiente durante 12 h. El análisis de la mezcla de reacción en bruto por LC/MS identificó dos máximos con la masa molecular esperada para el compuesto 79. Los dos picos resueltos a los 2,81 y 3,00 min se corresponden con las dos especies de atropisómeros. En adelante, los atropisómeros que eluyen a los 2,81 y 3,00 min se denominarán compuestos 80 y 81, respectivamente.
La separación de los atropisómeros se consiguió por HPLC preparativa de fase inversa. En primer lugar, la mezcla de reacción en bruto se diluyó con acetato de etilo (40 ml) y después se lavó con salmuera (20 ml). La capa orgánica se separó y se concentró al vacío y el residuo se disolvió en DMF (4 ml). Los atropisómeros 80 y 81 se separaron por HPLC preparativa de fase inversa usando una columna Luna C18(2) (250 mm L x 50 mm ID, 5 |jm) eluyendo con tampón A (v/v): agua:ácido acético al 0,05 % y tampón B (v/v): acetonitrilo:ácido acético al 0,05 % (90:10 v/v a 10:90 v/v, 35 min, temperatura ambiente). Las fracciones correspondientes a los dos atropisómeros (como se confirmó por LC/MS) se separaron y se liofilizaron para dar los compuestos 80 y 81 en forma de sólidos de color blanco. Cada compuesto se purificó después otra vez por cromatografía de fase normal eluyendo con diclorometano:acetona (100:0 v/v a 50:50 v/v) para dar el compuesto 80 (15 mg) y el compuesto 81 (10 mg) en forma de sólidos de color blanco. Los cromatogramas de la HPLC de los compuestos 80 y 81 después de la purificación en fase normal indican que ambos compuestos consiguieron una pureza >96 % por área máxima.
La estabilidad de los atropisómeros se investigó calentando soluciones de los compuestos 80 y 81 en DMSO a 50 °C durante 1 h. Después de calentar durante 1 h, los compuestos se analizaron por HPLC y no se observaron cambios de los cromatogramas de la HPLC de las muestras precalentadas, lo que indica que ambos atropisómeros son estables y no se interconvierten a la temperatura elevada indicada.
Datos de caracterización para el compuesto 80: RMN 1H (500 MHz; CDCh) ó 6,92 (d, J = 8,2 Hz, 1H), 6,84 (s, 2H), 6,73 (d, J = 2,1 Hz, 1H), 6,57 (dd, J = 8,2, 2,2 Hz, 1H), 6,51-6,45 (m, 1H), 6,21 (s, 1H), 6,18-6,16 (m, 1H), 5,47-5,42 (m, 1H), 4,76-4,74 (m, 1H), 4,30-4,25 (m, 1H), 3,81 (s, 3H), 3,55 (d, J = 12,6 Hz, 1H), 3,51 (d, J = 8,8 Hz, 1H), 3,36 (s, 3H), 3,28 (d, J = 12,6 Hz, 1H), 3,01 (s, 1H), 2,94 (s, 3H), 2,87 (t, J = 13,3 Hz, 1H), 2,64-2,59 (m, 1H), 2,19-2,15 (m, 1H), 1,77 (s, 3H), 1,66-1,63 (m, 1H), 1,50-1,45 (m, 1H), 1,29-1,24 (m, 6H), 1,19 (d, J = 6,7 Hz, 3H), 0,87 (s, 3H). LC/MS: tiempo de retención 2,81 min (columna Acquity UPLC BEH C18 1,7 jm , 2,1 x 50 mm, eluyendo con agua (ácido acético al 0,05 %):acetonitrilo (ácido acético al 0,05 %) (95:5 v/v a 5:95 v/v), 5 min de gradiente, 0,6 ml/min, temperatura ambiente), (ES+) [M+H]+ (726, 100 %).
Datos de caracterización para el compuesto 81_: RMN 1H (500 MHz; CDCh) ó 6,89 (s, 1H), 6,84 (s, 1H), 6,77 (d, J = 2,1 Hz, 1H), 6,67 (d, J = 8,2 Hz, 1H), 6,57 (dd, J = 8,2, 2,1 Hz, 1H), 6,51-6,46 (m, 1H), 6,27 (s, 1H), 6,19 (d, J = 11,1 Hz, 1H), 5,47 (dd, J = 15,3, 9,0 Hz, 1H), 4,84-4,82 (m, 1H), 4,32-4,27 (m, 1H), 3,84 (s, 3H), 3,58 (d, J = 13,1 Hz, 1H), 3,52 (d, J = 8,9 Hz, 1H), 3,37 (s, 3H), 3,26 (d, J = 13,1 Hz, 1H), 3,02-2,91 (m, 2H), 2,72 (s, 3H), 2,67-2,58 (m, 1H), 2,23 2,21 (m, 1H), 1,74 (s, 3H), 1,68 (d, J = 13,2 Hz, 1H), 1,53-1,47 (m, 2H), 1,30 (d, J = 6,3 Hz, 3H), 1,28-1,24 (m, 4H), 1,20 (d, J = 6,7 Hz, 3H), 0,94 (s, 3H). LC/MS: tiempo de retención 3,00 min, (ES+) [M+H]+ (726, 100%).
La invención incluye los atropisómeros individuales del compuesto de fórmula 79. Por ejemplo, incluye el atropisómero que tiene un tiempo de retención de 2,81 minutos cuando se analizó por LC/MS en las condiciones indicadas anteriormente en el ejemplo 31 y también incluye el atropisómero que tiene un tiempo de retención de 3,00 minutos cuando se analizó por LC/MS en las condiciones indicadas anteriormente en el ejemplo 31.
Usando una combinación de espectroscopia RMN 2D (ROESY) y estudios de modelado molecular, se propone que los compuestos 80 y 81 tienen las estructuras siguientes:
Ejemplo 32: Ensayo de fuerza in vitro de los compuestos en líneas celulares SK-BR-3.
La pérdida de viabilidad de las células tumorales después del tratamiento con los compuestos de la invención, se sometió a ensayo cultivando líneas celulares SK-BR-3 en presencia de concentraciones en aumento de los compuestos de la invención y cuantificando la pérdida de proliferación o de actividad metabólica como se describe en el Ejemplo 2. Los valores de CI50 promedio de los compuestos de la invención se muestran en la Tabla 6 y las concentraciones de ensayo se especifican en la Tabla 7.
Tabla 6
Tabla 7
Línea Compuesto Intervalo de
celular concentración
SK-BR-3 9 200 nM -91 pM
SK-BR-3 12 200 nM -91 pM
SK-BR-3 15 200 nM -91 pM
SK-BR-3 21 200 nM -2 ,6 pM
SK-BR-3 23 200 nM -2 ,6 pM
SK-BR-3 32 500 nM -6 ,4 pM
SK-BR-3 53 300 nM -137 pM
SK-BR-3 54 800 nM -0 ,4 pM
SK-BR-3 55 800 nM -0 ,4 pM
SK-BR-3 56 (fuera de las
reivindicaciones) 1000 nM -61 pM
SK-BR-3 57 500 nM -6 ,4 pM
SK-BR-3 58 100 nM -6,1 pM
SK-BR-3 59 1000 nM -3,6 pM
SK-BR-3 60 700 nM -0 ,9 pM
SK-BR-3 61 1000 nM -3,6 pM
SK-BR-3 62 100 nM -1,3 pM
SK-BR-3 63 800 nM -2 ,9 pM
SK-BR-3 64 (fuera de las
reivindicaciones) 200 nM -12 pM
SK-BR-3 80 200 nM -12 pM
SK-BR-3 81 100 nM -1,3 pM
SK-BR-3 31 (comparador) 1000 nM -457 pM
Estos datos muestran que los compuestos de la invención, que contienen un resto bifenilo, tienen valores de CI50 inesperadamente más bajos que los del comparador que contiene alilamina.
Ejemplo 33: Conjugación de los reactivos 35, 47, 69 y 72 con Trastuzumab para producir los conjugados anticuerpo fármaco (ADC) 82, 83, 84 y 85 respectivamente, con Da r 4.
Los reactivos de conjugación 35, 47, 69 y 72 se conjugaron con Trastuzumab produciendo los ADC 82, 83, 84 y 85 usando métodos análogos a los descritos en los documentos WO2014064423 y WO2014064424.
Brevemente, Trastuzumab (5-7,4 mg/ ml en fosfato sódico 20 mM, NaCl 150 mM, EDTA 20 mM pH 7,5) se calentó a 40 °C en un bloque de calentamiento durante 15 min. Se añadió una solución 5 mM de TCEP (6 equiv. por mAb) a la
solución de mAb, se mezcló suavemente y se incubó a 40 °C durante 1 h antes de dejarlo enfriar a 22 °C.
Para las conjugaciones usando los reactivos 35, 47 y 69, la solución de mAb reducida se diluyó después a 4,4 mg/ ml con fosfato sódico 20 mM, NaCl 150 mM, EDTA 20 mM, pH 7,5. Los reactivos de conjugación 35, 47 y 69 se disolvieron en DMF para dar soluciones 1,5 mM. El reactivo de conjugación (5,6 equiv. por mAb) se añadió a las soluciones de mAb para dar concentraciones finales de anticuerpo de 4,0 mg/ml. Para la conjugación usando el reactivo 72, el reactivo se disolvió en propilenglicol:DMF (3:1 v/v) para dar una solución 0,75 mM. El reactivo 72 (5,6 equiv. por Ab) se añadió después a la solución de mAb para dar una concentración final de anticuerpo de 4,0 mg/ml.
Cada solución de reacción de conjugación se mezcló después suavemente y se incubó a 22 °C durante 18-21 h. Las soluciones de reacción en bruto se mezclaron después con volúmenes iguales de fosfato sódico 50 mM, NaCl 4 M, pH 7 y las soluciones resultantes se cargaron en una columna ToyoPearl Fenil-650S HIC equilibrada con fosfato sódico 50 mM, NaCl 2 M, pH 7. Cada ADC se eluyó de la columna con un gradiente de fosfato sódico 50 mM, pH 7 (isopropanol al 20 %). Las fracciones que contenía DAR 4 ADC se agruparon y se concentraron. La muestra concentrada se intercambió con tampón en PBS, pH 7,1-7,5 y se filtró de forma estéril (membranas PVDA de 0,22 pm). Las asignaciones DAR se basaron en los ratios de absorción A248/A280. El DAR promedio de los ADC 82, 83, 84 y 85 se calculó a partir de las áreas máximas relativas de las especies DAR individuales seguid de análisis HIC a 280 nm.
Ejemplo 34: Conjugación del reactivo 41 a Brentuximab para producir el conjugado anticuerpo fármaco (ADC) 86 con DAR 4.
El reactivo de conjugación 41 se conjugó con Brentuximab produciendo el ADC 86 usando un método similar al descrito en el ejemplo 33. Brevemente, Brentuximab (8,5 mg/ ml en fosfato sódico 20 mM, NaCl 150 mM, EDTA 20 mM, pH 7,5) se calentó a 40 °C en un bloque de calentamiento durante 15 min. Se añadió TCEP (6 equiv. por mAb) a la solución de mAb, se mezcló suavemente y se incubó a 40 °C durante 1 h antes de dejarlo enfriar a 22 °C. El reactivo de conjugación 41 se disolvió en DMF para dar una solución 1,6 mM. La solución de mAb reducida se diluyó hasta 6,7 mg/ml con fosfato sódico 20 mM, NaCl 150 mM, EDTA 20 mM, pH 7,5) seguido de la adición de propilenglicol, dando como resultado una concentración de solución final de mAb reducida de 4,4 mg/ml. El conjugado de reacción (6 equiv. por mAb) se añadió a la solución de mAb para dar una concentración final de anticuerpo de 4 mg/ml. La solución de reacción se mezcló suavemente y se incubó a 22 °C durante 24 h. Después de este tiempo, la solución de reacción se trató con W-acetil-L-cisteína 50 mM (20 equiv. sobre reactivo) a 22 °C durante 30 min. La solución de reacción en bruto se mezcló después con un volumen igual de fosfato sódico 50 mM, NaCl 4 M, pH 7 y la solución resultante se cargó sobre una columna ToyoPearl Fenil-650S HIC equilibrada con fosfato sódico 50 mM, NaCl 2 M, pH 7. El ADC se eluyó de la columna con un gradiente de fosfato sódico 50 mM, pH 7 (isopropanol al 20 %). Las fracciones que contenían DAR 4 ADC se agruparon y se concentraron (Vivaspin 20, membrana PES de 10 kDa). La muestra concentrada se intercambió con tampón en DPBS, pH 7,1-7,5 y se filtró de forma estéril (membrana PVDF de 0,22 pm). El ADC se volvió a purificar usando una columna de hidroxipatita Foresight CHT equilibrada con fosfato sódico 10 mM, pH 6,7. El ADC se eluyó de la columna con un gradiente de fosfato sódico 10 mM, NaCl 2 M, pH 6,7. Las fracciones que contenían ADC se agruparon y se concentraron (Vivaspin 20, membrana PES de 30 kDa) y la muestra concentrada se intercambió con tampón en DPBS, pH 7,1-7,5 y se filtró de forma estéril (membrana PVDA de 0,22 pm). El DAR del conjugado se determinó usando el método descrito en el ejemplo 33.
Ejemplo 35: Conjugación del reactivo 50 a Trastuzumab para producir el conjugado anticuerpo fármaco (ADC) 87.
El reactivo de conjugación 50 se conjugó a Trastuzumab, produciendo el ADC 87. Brevemente, el reactivo 50 se disolvió en DMSO para dar una solución madre 10 mM. Trastuzumab en tampón HEPES 100 mM, EDTA 1 mM, pH 7,0 (concentración de mAb 5 mg/ml), se redujo con TCEP (2,2 equiv. por mAb) a 37 °C durante 2 h. La solución de mAb reducida se dejó enfriar a 25 °C y después se diluyó con DMSO (10 % v/v). El reactivo de conjugación 50 (10 equiv. por mAb) se añadió después a la solución de mAb reducida y la mezcla de reacción se mezcló suavemente y se incubó a 25 °C durante 30 min. El exceso de reactivo 50 se inactivó incubando la solución de reacción con W-acetil cisteína (10 equiv. por mAb) a 25 °C durante 30 min. Después se añadió carbón activad en polvo (70 % p/p de mAb) a la solución de reacción que se agitó suavemente durante 30 min a temperatura ambiente para eliminar las especies de fármaco sin reaccionar. La mezcla de reacción se filtró después (membrana PES de 0,22 pm) y la muestra purificada se intercambió con tampón en ácido succínico 10 mM, trehalosa al 6 % p/v, Tween 20 0,01 % v/v, pH 5,5 usando columnas de desalación PD-10. Se asignó un DAR promedio de 4 al conjugado 87 usando el método descrito en el ejemplo 33.
Ejemplo 36: Conjugación de los reactivos 70, 75 y 77 (comparador) a Trastuzumab para producir los conjugados de anticuerpo fármaco (ADC) 88, 89 y 90 (comparador), respectivamente.
Los reactivos de conjugación 70, 75 y 77 (comparador) se conjugaron con Trastuzumab proporcionando los ADC 88, 89 y 90 (comparador), respectivamente, usando el protocolo general de conjugación siguiente. Brevemente, los reactivos se disolvieron en DMF para dar soluciones madre 1,8-4,0 mM. A una solución de Trastuzumab en fosfato sódico 20 mM, NaCl 150 mM, EDTA 20 mM, pH 7,5 se le añadió solución madre de reactivo (5-20 equiv. por mAb, bien en una única adición o en múltiples alícuotas a lo largo del periodo de incubación) para dar una concentración final de anticuerpo de 3,0-4,0 mg/ml (que contiene DMF 10 % v/v). Las soluciones de reacción se incubaron a 22 °C
durante 1-4 h.
Los ADC 88 y 89 se purificaron por cromatografía SEC preparativa usando una columna HiLoad 16/600 Superdex 200 pg y elución isocrática usando PBS (isopropanol al 15 %) como eluyente. El ADC 90 (comparador) se purificó usando una columna de hidroxipatita Foresight c Ht equilibrada con fosfato sódico 10 mM, pH 6,7 y el ADC se eluyó de la columna con un gradiente de fosfato sódico 10 mM, cloruro sódico 2 M, pH 6,7.
Después de la cromatografía en columna, las fracciones que contenían el ADC deseado se agruparon y se concentraron. Las muestras concentradas se intercambiaron con tampón en PBS y se filtraron de forma estéril. Las asignaciones DAR se calcularon a partir de las intensidades máximas relativas de las especies DAR individuales después de espectrometría de masas. Se calcularon DAR promedio de 2,0, 3,2 y 3,1 para los ADC 88, 89 y 90 (comparador), respectivamente.
Ejemplo 37: Análisis de los ADC mediante ensayo de viabilidad celular in vitro.
La pérdida de viabilidad de células tumorales después del tratamiento con ADC que incorporan maitansinoides de la invención, se sometió a ensayó cultivando líneas celulares en presencia de concentraciones en aumento de los ADC y cuantificando la pérdida de proliferación o de actividad metabólica como se describe en el Ejemplo 2. Los valores de CI 50 promedio de los ADC que incorporan los maitansinoides de la invención, se muestran en la Tabla 8 y las concentraciones de ensayo se especifican en la Tabla 9.
Tabla 8
(
(
(
(
(
(
(
(
(
Tabla 9
Línea st . Intervalo de
celular C _ompue o . ., r concentración
SK-BR-3 29 2 nM - 3,2 pM
SK-BR-3 30 10 nM - 0,6 pM
SK-BR-3 82 10 nM -4 ,6 pM
SK-BR-3 83 20 nM -1,2 pM
SK-BR-3 84 10 nM - 0,6 pM
SK-BR-3 85 50 nM -22,9 pM
Karpas-299 86 50 nM - 0,18 pM
SK-BR-3 87 1000 nM -3,6 pM
SK-BR-3 88 10 nM - 0,6 pM
SK-BR-3 89 10 nM - 0,6 pM
Los valores de CI50 obtenidos muestran que los ADC que incorporan los nuevos maitansinoides de la invención, tienen fuertes propiedades de destrucción celular in vitro.
Ejemplo 38: Estabilidad de los compuestos 26 y 78 (comparador) en suero de ratón.
Soluciones de los compuestos 26 y 78 (comparador) en una mezcla 50/50 v/v de DMF:solución tampón (fosfato de sodio 20 mM, cloruro de sodio 150 mM, EDTA 20 mM, pH 7,5) (0,5 mg/ml) se diluyeron a 0,05 mg/ml en suero de ratón (contenido de suero del 90 % (v/v)). Una parte alícuota de cada muestra correspondiente al punto temporal '0' se congeló inmediatamente a -80 °C, mientras que la muestra restante se incubó a 37 °C durante 7 d. Se tomaron partes alícuotas adicionales después de 4 y 7 d y se congelaron a -80 °C. Antes del análisis, las muestras se sacaron del congelador y las especies relacionadas con maitansinoides se extrajeron del suero mediante precipitación de proteínas. La precipitación de proteínas se realizó añadiendo acetonitrilo (75 % v/v) a cada parte alícuota por punto temporal, y después de mezclar suavemente, se dejó que las mezclas reposaran a 4 °C durante 2 h. Después, la proteína precipitada se separó por centrifugación (1400 xg, 30 min, 4 °C) y el sobrenadante que contenía la especie
extraída relacionada con maitansinoide, se analizó mediante EM-CL-Orbitrap (espectrometría de masas con cromatografía líquida usando Orbitrap).
Análisis de EM de fase inversa con Orbitrap. Las muestras se diluyeron adicionalmente con agua dando como resultado una solución de acetonitrilo al 15% v/v. A continuación, se inyectó una parte alícuota (2,5 j l ) de cada solución en un sistema de EM con nanocromatografía líquida, que consistía en un Dionex ULTIMATE 3000 UPLC equipado con una columna PepMap C18 (0,075 x 150 mm), acoplado en línea a un instrumento de EM-Orbitrap que funcionaba en modo ES positivo a una resolución de 75K usando masa de bloqueo. El tampón A consistía en agua al 100 % y el tampón B en acetonitrilo al 100 %, conteniendo ambos ácido fórmico al 0,1 %, y se realizó un gradiente de B del 15 al 80 % a un caudal de 0,3 jl/m in durante 60 min. El análisis de los datos se realizó manualmente analizando los posibles productos de degradación usando una herramienta informática Thermo Xcalibur Qual Browser.
La Figura 4a muestra que después de 4 y 7 días a 37 °C en suero de ratón, se producía una degradación significativa del compuesto 78 (comparador), con picos correspondientes a los productos de degradación A y B detectables mediante análisis de e M de fase inversa con Orbitrap. La cantidad de producto de degradación B en particular, aumentaba del día 4 al día 7. En cambio, en la Figura 4b, después de 7 días de incubación, no se observaron productos de degradación equivalentes a A y B (denominados C y D a continuación) para el compuesto 26. Estos datos son consistentes con que el compuesto 26 tiene una estabilidad mejorada frente al compuesto 78 (comparador). A continuación se muestran las estructuras del compuesto 78 y los fragmentos A y B.
Las estructuras del compuesto 26 y los fragmentos C yd D se muestran a continuación.
Claims (1)
- REIVINDICACIONES1. Un compuesto de fórmula general I o una sal del mismo:en la que:R representa un grupo seleccionado entre -Y-OH, -Y-SH, -Y-S(O)2NH-Rx, -Y-NHS(O)2-Rx, -Y-CO2H, -Y-C(O)NH-Rx, -Y-NHC(O)-Rx, -Y-NHRy o -Y-S(O)2NH2,en los que o Y no está presente o Y representa un alquileno C-i-a;Rx representa un alquilo Ci-a que está sustituido con -OH, -SH, -NH2 o -CO2H; Ry representa un átomo de hidrógeno o un grupo alquilo C1-4;X representa OH;Ra representa un grupo alquilo C1-4;Rb representa hidrógeno;Rc representa hidrógeno o metoxi;Rd representa un grupo alquilo C1-4;cada Re representa independientemente un átomo de halógeno, un grupo CF3, un grupo alquilo C1-4, un grupo alcoxi C1.4, un grupo -CN o un grupo -NO2;n es 0, 1 o 2;Rf representa un grupo alquilo C1-4;Rg representa un átomo de hidrógeno o un grupo alquilo, cicloalquilo, alquenilo, alquinilo, arilo o heteroarilo opcionalmente sustituido yen donde cuando Rg es un grupo alquilo opcionalmente sustituido, dicho grupo alquilo puede estar opcionalmente sustituido por:i) uno o más átomos de halógeno y/o grupos hidroxilo, alcoxi, amino, alquilamino o dialquilamino, en los que el resto alquilo tiene de 1 a 4 átomos de carbono;ii) uno o más aminoácidos;iii) un grupo N(Ri)(Rii), en el que R' representa hidrógeno o un grupo alquilo C-My en el que Rii representa un grupo alquilo C1-4, un grupo -C(O)-alquilo C-ua, un grupo -C(O)-alquenilo C2-ao un grupo -C(O)-cicloalquilo C3-a, en donde dicho grupo cicloalquilo C3-a puede estar sin sustituir o sustituido con hasta 2 grupos metilo.2. Un compuesto como se reivindica en la reivindicación 1, en donde R representa un grupo seleccionado entre -Y-SH, -Y-S(O)2NH-Rx, -Y-NHS(O)2-Rx, -Y-C(O)NH-Rx, -Y-NHC(O)-Rx, o -Y-S(O)2NH2, en donde Rx es como se define en la reivindicación 1.3. Un compuesto como se reivindicación en las reivindicaciones 1 o 2, en donde R representa -Y-NHC(O)-Rx, en donde Rx es como se define en la reivindicación 1.4. Un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en donde Rd es metilo.5. Un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en donde cualquier grupo Re presente se selecciona entre el grupo que consiste en un átomo de halógeno, un grupo metoxi, un grupo -CN o un grupo -NO2. a. Un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde cualquier grupo Re presente es uno seleccionado entre un átomo de halógeno, un grupo metilo o un grupo metoxi.7. Un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a a, en donde Rg representa alquilo C1-4 que está sin sustituir o sustituido con N(Ri)(Rii) y en donde Ri representa un grupo alquilo C ^ y Rii representa un grupo -C(O)-alquilo C1-a.8. Un compuesto de acuerdo con una cualquiera de las reivindicaciones anteriores, que es un compuesto de la fórmula general la o una sal del mismo:por ejemplo un compuesto de fórmula general Ib o una sal del mismo:en donde cada uno de R, Re y n son como se definen en la reivindicación 1.9. Un conjugado que comprende un compuesto como se reivindica en una cualquiera de las reivindicaciones precedentes unido a una proteína de unión a través deun enlazador, estando dicho enlazador conectado a dicho compuesto a través del grupo R de la fórmula general I; en donde:i) el enlazador incluye:a) el grupo -S-alquileno C1-6-; y/ob) un grupo peptidilo que comprende al menos dos alfa aminoácidos de origen natural (por ejemplo, en donde el enlazador incluye la secuencia Val-Cit-PAB o Val-Ala) y/o un grupo disulfuro yii) la proteína de unión es un anticuerpo de longitud completa o un fragmento de anticuerpo que comprende una región de unión a antígeno de anticuerpo de longitud completa, en donde dicho anticuerpo es una inmunoglobulina (por ejemplo la proteína de unión es IgG1 o IgG4 o un fragmento de IgG1 o IgG4).10. Un conjugado de acuerdo con la reivindicación 9, que incluye una porción:en la que W representa un grupo aceptor de electrones o un grupo obtenido por reducción de un grupo aceptor de electrones, cada uno de A y B representa de manera independiente una cadena alquileno o alquenileno C1-5 y Pr representa dicha proteína de unión unida a A y B a través de nucleófilos Nu;o incluye una porción:~W'-(CH=CH)p-(CH2)2-Nu-Pren la que W representa un grupo aceptor de electrones o un grupo obtenido por reducción de un grupo aceptor de electrones, p es 0 o un número entero de 1 a 4 y Pr representa dicha proteína de unión unida al resto de la molécula a través de un nucleófilo Nu,por ejemplo, el conjugado incluye las porciones:o~NH-CO-Ar'-CO-(CH2)2-Nu-Pren la cual Ar' representa un grupo arilo opcionalmente sustituido y/oen el que cada Nu representa un átomo de azufre presente en un resto de cisteína en la proteína de unión Pr o en el que cada Nu representa un grupo imidazol presente en un marcador de polihistidina unido a la proteína de unión.11. Un conjugado de acuerdo con una cualquiera de las reivindicaciones 9 o 10, en el cuali) el enlazador incluye una cadena de polietilenglicol colgante que tiene un grupo extremo terminal de fórmula -CH2CH2OR1" en el cual Rr representa un átomo de hidrógeno, un grupo alquilo o un grupo arilo y/oal menos dos unidades ~(CH2-CH2-O-)~ con un anillo oii) el enlazador incluye un grupo susceptible de degradación enzimática de fórmula:en el cual AA representa una secuencia de aminoácido específica de proteasa (por ejemplo, AA representa Val-Cit).12. Un reactivo de conjugación que comprende un compuesto como se reivindica en una cualquiera de las reivindicaciones 1 a 8, unido a través de un enlazador a al menos un grupo funcional capaz de reaccionar con una proteína de unión, estando dicho enlazador conectado a dicho compuesto a través del grupo R de la fórmula general I;en donde:i) la proteína de uniones un anticuerpo de longitud completa o un fragmento de anticuerpo que comprende una región de unión a antígeno del anticuerpo de longitud completa, en donde dicho anticuerpo es una inmunoglobulina (por ejemplo la proteína de unión es IgG1 o IgG4 o un fragmento de IgG1 o IgG4) yii) el enlazador incluye un grupo peptidilo que comprende al menos dos alfa aminoácidos de origen natural (por ejemplo, en donde el enlazador incluye la secuencia Val-Cit-PAB o Val-Ala) y/o un grupo disulfuro.y en donde opcionalmente:i) el reactivo de conjugación incluye una porcióno una sal del mismo oii) el reactivo de conjugación incluye una porción:oiii) el grupo funcional del reactivo de conjugación tiene la fórmula:en el cual W representa un grupo aceptor de electrones; cada uno de A y B representa independientemente una cadena alquileno o alquenileno C1-5 y o bien cada L representa independientemente un grupo saliente o bien ambos Ls juntos representan un grupo saliente oen el que W y A tienen los significados dados anteriormente, L representa un grupo saliente y m es de 0 a 4 o ~W-(CH=CH)p-(CH2)2-Lo~W-(CH=CH)p-CH=CH2en los que W representa un grupo aceptor de electrones, p representa 0 o un número entero de 1 a 4 y L representa un grupo saliente;(por ejemplo el grupo funcional del reactivo de conjugación tiene la fórmula:oo~NH-CO-Ar'-CO-(CH2)2-Lo~NH-CO-Ar'-CO-CH=CH2en las que Ar' representa un grupo arilo opcionalmente sustituido) y en las que opcionalmente,el o cada grupo saliente incluye una porción -(CH2CH2O)q en la que q es un número de seis o más.13. Un conjugado de reacción como se reivindica en la reivindicación 12, en el cual el enlazador incluye una característica como se define en la reivindicación 11.14. Una composición farmacéutica que comprende un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 8 o un conjugado de acuerdo con una cualquiera de las reivindicaciones 9 a 11, junto con un vehículo, opcionalmente junto con otro agente terapéutico.15. Un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 8 o un conjugado de acuerdo con una cualquiera de las reivindicaciones 9 a 11 para su uso en terapia.16. Un proceso para la preparación de un compuesto de fórmula general I o una sal del mismo de acuerdo con una cualquiera de las reivindicaciones 1 a 8, que comprende hacer reaccionar compuesto de fórmula:en la que X, Ra-Rd, Rf y Rg tienen los significados dados para la fórmula general I, con un reactivo aril-organometálico en el que el resto arilo es un grupo fenilo sustituido con (Re)n y con R o una versión protegida de R, en la cual R y (Re)n tienen los significados dados para la fórmula general I, llevándose a cabo la reacción en presencia de un catalizador de metal de transición and en donde,opcionalmente, el reactivo aril-organometálico es un ácido arilborónico o un éster de aril boronato y en la cual la reacción se lleva a cabo en presencia de un catalizador de paladio en presencia de agua y en ausencia o ausencia sustancial de oxígeno, (por ejemplo, el reactivo aril-organometálico es un ácido borónico de fórmula general:o una versión protegida del mismo y la reacción se realiza en presencia de un catalizador de paladio).17. Un intermedio útil para preparar un compuesto de fórmula general I o una sal del mismo de acuerdo con una cualquiera de las reivindicaciones 1 a 8, que tiene la fórmula generalen la que X, n y Ra-Rg tienen los significados dados para la fórmula general I de la reivindicación 1 y Rprot es el grupo R de fórmula general I que porta un grupo protector o una sal del mismo; en donde R incluye un grupo -OH o -SH y el grupo protector es un grupo sililo, un grupo acilo o un grupo arilmetilo; R incluye un grupo -CO2H y el grupo protector es metilo, etilo, f-butilo, bencilo, p-metoxibencilo, 9-fluorenilmetilo, trimetilsililo, t-butildimetilsililo o difenilmetilo o R incluye un grupo -NHR', -NHR" o -NHR'” y el grupo protector es f-butoxicarbonilo, tritilo, benciloxicarbonilo, 9-fluorenilmetoxicarbonilo, formilo, trimetilsililo o f-butildimetilsililo.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB1615725.7A GB201615725D0 (en) | 2016-09-15 | 2016-09-15 | Novel cytotoxic agents and conjugates thereof |
| PCT/GB2017/052731 WO2018051109A1 (en) | 2016-09-15 | 2017-09-15 | Novel cytotoxic agents and conjugates thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2882016T3 true ES2882016T3 (es) | 2021-11-30 |
Family
ID=57288675
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES17771552T Active ES2882016T3 (es) | 2016-09-15 | 2017-09-15 | Nuevos agentes citotóxicos y conjugados de los mismos |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US10654873B2 (es) |
| EP (1) | EP3512856B1 (es) |
| JP (1) | JP7076433B2 (es) |
| CN (1) | CN109790178B (es) |
| ES (1) | ES2882016T3 (es) |
| GB (1) | GB201615725D0 (es) |
| WO (1) | WO2018051109A1 (es) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20230146507A1 (en) * | 2020-03-23 | 2023-05-11 | Helmholtz-Zentrum für Infektionsforschung GmbH | N-phenyl-3-mercaptopropanamide derivatives as metallo-beta-lactamase inhibitors for the treatment of bacterial infections |
| CN111620806B (zh) * | 2020-06-12 | 2021-05-11 | 常州瑞明药业有限公司 | 一种氨氯地平中间体的制备方法 |
| CN111635418A (zh) * | 2020-06-17 | 2020-09-08 | 山东大学 | 一种美登木素衍生物及其合成方法和应用 |
| EP4044113A1 (en) * | 2021-02-12 | 2022-08-17 | Koninklijke Philips N.V. | Image sequence analysis |
| CA3226570A1 (en) * | 2021-07-23 | 2023-01-26 | Igor SHERMAN | Alpha-fetoprotein bioconjugates for disease treatment |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4137230A (en) | 1977-11-14 | 1979-01-30 | Takeda Chemical Industries, Ltd. | Method for the production of maytansinoids |
| GR63147B (en) | 1978-03-24 | 1979-09-24 | Takeda Chemical Industries Ltd | Preparation process of demethyl maytansinoids |
| JPS5566585A (en) | 1978-11-14 | 1980-05-20 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| CA2026147C (en) | 1989-10-25 | 2006-02-07 | Ravi J. Chari | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US6441163B1 (en) | 2001-05-31 | 2002-08-27 | Immunogen, Inc. | Methods for preparation of cytotoxic conjugates of maytansinoids and cell binding agents |
| KR101025143B1 (ko) | 2002-12-31 | 2011-04-01 | 넥타르 테라퓨틱스 | 가수분해상으로 안정한 말레이미드-종결 중합체 |
| AU2004240541B2 (en) | 2003-05-20 | 2009-08-20 | Immunogen, Inc. | Improved cytotoxic agents comprising new maytansinoids |
| GB0316294D0 (en) | 2003-07-11 | 2003-08-13 | Polytherics Ltd | Conjugated biological molecules and their preparation |
| EP2103618A1 (en) * | 2008-03-20 | 2009-09-23 | Leibniz Universität Hannover | Novel ansamitocin derivatives |
| WO2010100430A1 (en) | 2009-03-04 | 2010-09-10 | Polytherics Limited | Conjugated proteins and peptides |
| EP2486023A4 (en) | 2009-10-06 | 2014-05-07 | Immunogen Inc | EFFICIENT CONJUGATES AND HYDROPHILIC BINDER |
| US20110149960A1 (en) | 2009-12-17 | 2011-06-23 | Media Patents, S.L. | Method and apparatus for filtering multicast packets |
| CN103269712B (zh) | 2010-11-03 | 2016-09-21 | 伊缪诺金公司 | 包含新型安丝菌素衍生物的细胞毒性剂 |
| CN103313990B (zh) | 2010-11-17 | 2016-07-20 | 基因泰克公司 | 丙氨酰美登醇抗体偶联物 |
| WO2013090590A1 (en) | 2011-12-13 | 2013-06-20 | Immunogen, Inc. | Use of n-hydroxysuccinimide to improve conjugate stability |
| NO2789793T3 (es) * | 2012-10-24 | 2018-01-27 | ||
| CN103254213B (zh) | 2012-12-21 | 2015-02-25 | 百奥泰生物科技(广州)有限公司 | 类美登素酯的制备方法及用于所述方法的组合物 |
| EP3016980B1 (en) | 2013-07-05 | 2020-05-06 | Formation Biologics Inc. | Egfr antibody conjugates |
| CN103483357B (zh) * | 2013-10-12 | 2015-11-18 | 齐鲁制药有限公司 | 一种抗体-美登素偶联物的中间体新晶型及其制备方法 |
| WO2016059377A1 (en) | 2014-10-14 | 2016-04-21 | Polytherics Limited | Process for the conjugation of a peptide or protein with a reagent comprising a leaving group including a portion of peg |
| EP3220956B1 (en) | 2014-10-24 | 2023-08-09 | Abzena (UK) Limited | Conjugates and conjugating reagents |
-
2016
- 2016-09-15 GB GBGB1615725.7A patent/GB201615725D0/en not_active Ceased
-
2017
- 2017-09-15 US US16/332,797 patent/US10654873B2/en active Active
- 2017-09-15 WO PCT/GB2017/052731 patent/WO2018051109A1/en not_active Ceased
- 2017-09-15 ES ES17771552T patent/ES2882016T3/es active Active
- 2017-09-15 JP JP2019514273A patent/JP7076433B2/ja active Active
- 2017-09-15 CN CN201780059402.0A patent/CN109790178B/zh active Active
- 2017-09-15 EP EP17771552.1A patent/EP3512856B1/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP7076433B2 (ja) | 2022-05-27 |
| EP3512856B1 (en) | 2021-03-24 |
| CN109790178A (zh) | 2019-05-21 |
| JP2020500148A (ja) | 2020-01-09 |
| GB201615725D0 (en) | 2016-11-02 |
| US20190202839A1 (en) | 2019-07-04 |
| US10654873B2 (en) | 2020-05-19 |
| EP3512856A1 (en) | 2019-07-24 |
| CN109790178B (zh) | 2022-05-03 |
| WO2018051109A1 (en) | 2018-03-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2882016T3 (es) | Nuevos agentes citotóxicos y conjugados de los mismos | |
| AU2019455069B2 (en) | A conjugate of a cytotoxic agent to a cell binding molecule with branched linkers | |
| JP2025093934A (ja) | 共役連結体、該連結体を含有する細胞結合分子-薬物共役体、並びに該共役体及び連結体の使用及び製造方法 | |
| JP5905559B2 (ja) | 新規cc−1065類似体およびその複合体 | |
| KR101413955B1 (ko) | 아지리디닐-에포틸론 화합물 | |
| JP2024541058A (ja) | 抗体の特異的共役 | |
| JP2021506883A (ja) | ピロロベンゾジアゼピン抗体結合体 | |
| JP2021506743A (ja) | 生物活性分子コンジュゲート、その調製法及び使用 | |
| WO2015106599A1 (en) | Conjugates and compositions for drug delivery | |
| WO2014197854A1 (en) | Novel linkers for antibody-drug conjugates and related compounds, compositions, and methods of use | |
| CA2989269A1 (en) | Hydrophilic linkers for conjugation of a cytotoxic agent or chromophore molecule to a cell-binding molecule | |
| CA3108168A1 (en) | Conjugates of cell-binding molecules with cytotoxic agents | |
| JP7235929B1 (ja) | ヘミアスタリン誘導体を含む抗体薬物複合体 | |
| KR20250150111A (ko) | 캄프토테신 유도체 및 이의 접합체, 이의 제조 방법 및 의학적 용도 | |
| TW202506105A (zh) | 連接子-藥物分子及抗體藥物偶聯物、其製備方法和應用 | |
| WO2021206160A1 (ja) | 抗体薬物複合体 | |
| WO2016197946A1 (zh) | 抗体药物偶联物、中间体、制备方法、药物组合物及应用 | |
| CN117430660A (zh) | 奥瑞他汀f类似物及其抗体药物偶联物与应用 | |
| KR20250038769A (ko) | 면역조절제 퓨린 유래 화합물, 이의 접합체 및 이의 사용 방법 | |
| US20250382317A1 (en) | N-substituted indole derivatives and conjugates for the treatment of cancer | |
| WO2025077572A1 (zh) | 一种用于前药给药系统的可裂解连接体化合物及其制备和应用 | |
| WO2025174248A1 (en) | Trans-cyclooctenes with "or gate" release | |
| NZ744940B2 (en) | Conjugation linkers, antibody-drug conjugates thereof, and methods of synthesis and use of such conjugates | |
| HK1126114A (en) | Tlr agonists |