ES2816640T3 - Evento de maíz DP-004114-3 y métodos para la detección del mismo - Google Patents
Evento de maíz DP-004114-3 y métodos para la detección del mismo Download PDFInfo
- Publication number
- ES2816640T3 ES2816640T3 ES13715578T ES13715578T ES2816640T3 ES 2816640 T3 ES2816640 T3 ES 2816640T3 ES 13715578 T ES13715578 T ES 13715578T ES 13715578 T ES13715578 T ES 13715578T ES 2816640 T3 ES2816640 T3 ES 2816640T3
- Authority
- ES
- Spain
- Prior art keywords
- dna
- maize
- event
- sequence
- plant
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8241—Phenotypically and genetically modified plants via recombinant DNA technology
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6888—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for detection or identification of organisms
- C12Q1/6895—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for detection or identification of organisms for plants, fungi or algae
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8241—Phenotypically and genetically modified plants via recombinant DNA technology
- C12N15/8261—Phenotypically and genetically modified plants via recombinant DNA technology with agronomic (input) traits, e.g. crop yield
- C12N15/8271—Phenotypically and genetically modified plants via recombinant DNA technology with agronomic (input) traits, e.g. crop yield for stress resistance, e.g. heavy metal resistance
- C12N15/8279—Phenotypically and genetically modified plants via recombinant DNA technology with agronomic (input) traits, e.g. crop yield for stress resistance, e.g. heavy metal resistance for biotic stress resistance, pathogen resistance, disease resistance
- C12N15/8286—Phenotypically and genetically modified plants via recombinant DNA technology with agronomic (input) traits, e.g. crop yield for stress resistance, e.g. heavy metal resistance for biotic stress resistance, pathogen resistance, disease resistance for insect resistance
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A40/00—Adaptation technologies in agriculture, forestry, livestock or agroalimentary production
- Y02A40/10—Adaptation technologies in agriculture, forestry, livestock or agroalimentary production in agriculture
- Y02A40/146—Genetically Modified [GMO] plants, e.g. transgenic plants
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Analytical Chemistry (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Cell Biology (AREA)
- Immunology (AREA)
- Botany (AREA)
- Insects & Arthropods (AREA)
- Pest Control & Pesticides (AREA)
- Mycology (AREA)
- Breeding Of Plants And Reproduction By Means Of Culturing (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Physiology (AREA)
- Developmental Biology & Embryology (AREA)
- Environmental Sciences (AREA)
- Crystallography & Structural Chemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Medicinal Chemistry (AREA)
Abstract
Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Description
DESCRIPCIÓN
Evento de maíz DP-004114-3 y métodos para la detección del mismo
REFERENCIA AL LISTADO DE SECUENCIAS ENVIADO ELECTRÓNICAMENTE
La copia oficial del listado de secuencias se remite electrónicamente mediante EFS-Web como un listado de secuencias en formato ASCII con un archivo denominado "5251_PCT_sequence_listing.txt", creado el 8 de marzo de 2013 y que tiene un tamaño de 51 kilobytes y se presenta concurrentemente con la memoria descriptiva. El listado de secuencias contenido en este documento en formato ASCII forma parte de la memoria descriptiva.
Campo de la invención
Las realizaciones de la presente invención se refieren al campo de la biología molecular vegetal, específicamente, divulga construcciones de ADN para conferir resistencia a insectos a una planta. Las realizaciones de la invención se refieren más específicamente a ensayos para detectar la presencia del evento de maíz resistente a insectos DP-004114-3 en una muestra y a composiciones del mismo.
Antecedentes de la invención
La presente divulgación se refiere a la planta de maíz (Zea mays) resistente a insectos DP-004114-3, también denominada "línea de maíz DP-004114-3", "evento de maíz DP-004114-3", y "maíz 4114" y a la construcción de expresión de ADN vegetal de la planta de maíz DP-004114-3 y a la detección del transgén/región flanqueante de inserción en la planta de maíz DP-004114-3 y la descendencia de la misma. El documento WO2011/084621 se refiere al evento de maíz DP-004114-3 y a métodos de detección del mismo.
El maíz es un cultivo importante y es una fuente de alimento primaria en muchas áreas del mundo. El daño causado por plagas de insectos es un factor importante en la pérdida mundial de cultivos de maíz, a pesar del uso de medidas protectoras, tales como plaguicidas químicos. En vista de esto, se ha introducido por ingeniería genética resistencia a insectos en cultivos tales como maíz para controlar el daño por insectos y para reducir la necesidad de plaguicidas químicos tradicionales. Un grupo de genes que se ha utilizado para la producción de cultivos transgénicos resistentes a insectos es el grupo de delta-endotoxina de Bacillus thuringiensis (Bt). Las delta-endotoxinas se han expresado con éxito en plantas de cultivo, tales como algodón, patatas, arroz, girasol, así como maíz y han mostrado que proporcionan un control excelente frente a plagas de insectos. (Perlak, F.J et al. (1990) Bio/Technology 8:939-943; Perlak, F.J. et al. (1993) Plant Mol. Biol. 22:313-321; Fujimoto, H. et al. (1993) Bio/Technology 11:1151-1155; Tu et al. (2000) Nature Biotechnology 18:1101-1104; Publicación PCT WO 01/13731; y Bing, J.W. et al. (2000) Efficacy of Cry1F Transgenic Maize, 14th Biennial International Plant Resistance to Insects Workshop, Fort Collins, CO).
Se sabe que la expresión de genes exógenos en plantas está influenciada por su ubicación en el genoma de la planta, quizá debido a la estructura de la cromatina (por ejemplo, heterocromatina) o a la proximidad de elementos reguladores transcripcionales (por ejemplo, potenciadores) próximos al sitio de integración (Weising et al. (1988) Ann. Rev. Genet.
22:421-477). Al mismo tiempo, la presencia del transgén en diferentes ubicaciones en el genoma influenciará de diferentes maneras al fenotipo general de la planta. Por este motivo, normalmente es necesario detectar sistemáticamente un gran número de eventos para identificar un evento caracterizado por la expresión óptima de un gen de interés introducido. Por ejemplo, en plantas y otros organismos se ha observado que puede haber una gran variación en los niveles de expresión de un gen introducido entre diferentes eventos. También puede haber diferentes en los patrones de expresión espacial o temporal, por ejemplo, diferencias en la expresión relativa de un transgén en diversos tejidos vegetales, que pueden no corresponder a los patrones esperados de los elementos reguladores transcripcionales en la construcción génica introducida. Por este motivo, es común producir de cientos a miles de diferentes eventos y detectar sistemáticamente estos eventos para detectar un solo evento que tiene los niveles y patrones de expresión deseados del transgén para fines comerciales. Un evento que tiene niveles o patrones deseados de expresión del transgén es útil para introgresar el transgén en otros fondos genéticos mediante cruzamiento sexual usando métodos de fitomejoramiento convencionales. La descendencia de dichos cruces mantiene las características de expresión del transgén del transformante original. Esta estrategia se usa para asegurar una expresión génica fiable en diversas variedades que están adaptadas a las condiciones de crecimiento locales.
Sería ventajoso ser capaz de detectar la presencia de un evento particular para determinar si la descendencia de un cruzamiento sexual contiene un transgén de interés. Además, sería útil un método para detectar un evento particular para cumplir con las regulaciones que requieren la aprobación y el marcaje precomercial de alimentos provenientes de plantas de cultivo recombinantes, por ejemplo o para su uso en el monitoreo ambiental, el monitoreo de rasgos en cultivos en el campo o el monitoreo de productos procedentes de la cosecha de un cultivo, así como para su uso para garantizar el cumplimiento de las partes sometidas a términos regulatorios o contractuales.
Es posible detectar la presencia de un transgén mediante cualquier método de detección de ácido nucleico incluyendo, pero sin limitación, la reacción en cadena de la polimerasa (PCR) o hibridación de ADN usando sondas de ácidos nucleicos. Estos métodos de detección se centran generalmente en elementos genéticos de uso frecuente, tales como
promotores, terminadores, genes marcadores, etc., debido a que para muchas construcciones de ADN, la región codificante es intercambiable. Como resultado, dichos métodos pueden no ser útiles para discriminar entre diferentes eventos, particularmente aquellos producidos usando la misma construcción de ADN o construcciones muy similares, a menos que se conozca la secuencia de ADN del ADN flanqueante adyacente al ADN heterólogo insertado. Por ejemplo, se describe un ensayo PCR específico de evento en la Patente de los Estados Unidos n.° 6.395.485 para la detección del evento de élite GAT-ZM1. Por consiguiente, sería deseable tener un método sencillo y discriminatorio para la identificación del evento DP-004114-3.
Sumario de la invención
La invención proporciona un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
La invención también proporciona un método para detectar el amplicón de la invención en una muestra biológica procedente de una planta, tejido o semilla del evento de maíz DP-004114-3, en donde dicha planta comprende una secuencia de nucleótidos que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa de la misma, en donde dicha secuencia de nucleótidos es detectable en dicha muestra usando un método de amplificación de ácidos nucleicos o un método de hibridación de ácidos nucleicos, en donde se ha depositado una muestra representativa de dicho evento de maíz DP004114-3 en la Colección Americana de Cultivos Tipo (ATCC) con el n.° de registro PTA-11506.
Además, la invención proporciona un método para determinar la cigosidad del ADN de una planta de maíz que comprende el evento de maíz DP-004114-3 en una muestra biológica que comprende: (a) poner en contacto dicha muestra con un par de cebadores seleccionado entre el grupo que consiste en las SEQ ID NO: 29 y 30, de tal forma que (1) cuando se usa en una reacción de amplificación de ácido nucleico que comprende ADN del evento de maíz DP-004114-3, dicha reacción produce un primer amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo, que es diagnóstico para el evento de maíz DP-004114-3 y (2) cuando se usa en una reacción de amplificación de ácido nucleico que comprende ADN genómico de maíz distinto de ADN de DP-004114-3, dicha reacción produce un segundo amplicón que es diagnóstico para el ADN genómico de maíz distinto de ADN de DP-004114-3; (b) llevar a cabo una reacción de amplificación de ácido nucleico; y (c) detectar los amplicones producidos de este modo, en donde la detección de la presencia de ambos amplicones indica que dicha muestra es heterocigota para el ADN del evento de maíz DP-004114-3, en donde la detección únicamente del primer amplicón indica que dicha muestra es homocigota para el ADN del evento de maíz DP-004114-3.
La invención también proporciona un par de cebadores polinucleotídicos que comprenden un primer cebador polinucleotídico y un segundo cebador polinucleotídico 20, en donde el primer cebador polinucleotídico comprende la secuencia de nucleótidos de la SEQ ID NO: 29 y el complemento de la misma; y el segundo cebador polinucleotídico comprende la secuencia de nucleótidos de la s Eq ID NO: 30 y el complemento de la misma, que funcionan juntas en presencia de un molde de ADN de DP-004114-3 en una muestra para producir un amplicón diagnóstico para el evento DP-004114-3.
La invención proporciona además un kit para detectar ácidos nucleicos que son únicos para el evento DP-004114-3 que comprende un par de cebadores que comprende en las SEQ ID NO: 29 y 30 y los complementos de las mismas, que funcionan como un par de cebadores en un método de detección de ácidos nucleicos y que tras la amplificación de o la hibridación con una secuencia de ácido nucleico diana en una muestra seguida de la detección del amplicón o la hibridación con la secuencia diana, son diagnósticos para la presencia de secuencias de ácido nucleico únicas para el evento DP-004114-3 en la muestra.
En el presente documento también se describen métodos para producir y seleccionar una planta de cultivo monocotiledónea resistente a insectos. Más específicamente, se describe una construcción de ADN que cuando se expresa en células vegetales y plantas, confiere resistencia a los insectos. Se describe una construcción de ADN que puede introducirse y replicarse en una célula hospedadora, que cuando se expresa en células vegetales y plantas, confiere resistencia a insectos a las células vegetales y plantas. El evento de maíz DP-004114-3 se produjo mediante transformación mediada por Agrobacterium con el plásmido PHP27118. Este evento contiene los casetes génicos crylF, cry34Ab1, cry35Ab1 y pat, que confieren resistencia a ciertas plagas de lepidópteros y coleópteros, así como tolerancia a la fosfinotricina.
Específicamente, el primer casete contiene una versión truncada del gen cry lF de Bacillus thuringiensis var. aizawai. La inserción del gen cry1F confiere resistencia al daño por plagas de lepidópteros. La proteína Cry1F (SEQ ID NO: 1) está formada por 605 aminoácidos y tiene un peso molecular de aproximadamente 68 kDa. La expresión del gen cry1F está controlada por el promotor de poliubiquitina de maíz (Christensen et al. (1992) Plant Mol. Biol. 118(4):675-89), que proporciona expresión constitutiva de la proteína Cry1F en maíz. Esta región también incluye la región 5' no traducida (UTR) y el intrón asociado con el promotor de poliubiquitina nativo. El terminador para el gen cry1F es la señal de adición de poli(A) del marco abierto de lectura 25 (ORF 25) del plásmido Ti de Agrobacterium tumefaciens pTi15955 (Barker et al. (1983) Plant Mol. Biol. 2:335-350).
El segundo casete contiene el gen cry34Ab1 aislado de Bacillus thuringiensis cepa PS149B1 (Patentes de los Estados Unidos n.° 6.127.180; 6.624.145 y 6.340.593). La proteína Cry34Ab1 (SEQ ID NO: 2) tiene 123 aminoácidos de longitud y tiene un peso molecular de aproximadamente 14 kDa. La expresión del gen cry34Ab1 se controla por una segunda copia del promotor de poliubiquitina de maíz con 5' UTR e intrón (Christensen et al., 1992, anteriormente citado). El terminador para el gen cry34Ab1 es el terminador pinII (Keil et al. (1986) Nucleic Acids Res. 14:5641-5650; An et al. (1989) Plant Cell 1:115-22).
El tercer casete génico contiene el gen cry35Ab1, también aislado de Bacillus thuringiensis cepa PS149B1 (Patentes de los Estados Unidos n.° 6.083.499; 6.548.291 y 6.340.593). La proteína Cry35Ab1 (SEQ ID NO: 3) tiene una longitud de 383 aminoácidos y un peso molecular de aproximadamente 44 kDa. La expresión simultánea de las proteínas Cry34Ab1 y Cry35Ab1 en la planta confiere resistencia a los insectos coleópteros. La expresión del gen cry35Ab1 está controlada por la secuencia de promotor y líder de peroxidasa de Triticum aestivum (trigo) (Hertig et al. (1991) Plant Mol. Biol. 16:171-174). El terminador para el gen cry35Ab1 es una segunda copia del terminador pinII (Keil et al., 1986, anteriormente citado; An et al., 1989, anteriormente citado).
El casete cuarto y final contiene una versión del gen de fosfinotricina acetiltransferasa de Streptomyces viridochromogenes (pat) que se ha optimizado para su expresión en maíz. El gen pat expresa la enzima fosfinotricina acetiltransferasa (PAT) que confiere tolerancia a la fosfinotricina. La proteína PAT (SEQ ID NO: 4) tiene 183 aminoácidos de longitud y tiene un peso molecular de aproximadamente 21 kDa. La expresión del gen pat está controlada por las regiones promotoras y terminadoras del transcrito de 35S de CaMV (Franck et al. (1980) Cell 21:285-294; Odell et al. (1985) Nature 313:810-812; Pietrzak, et al. (1986) Nucleic Acids Res. 14(14):5857-5868). También se describen plantas que contienen las construcciones de ADN.
En el presente documento también se describen composiciones y métodos para identificar una nueva planta de maíz denominada DP-004114-3. Los métodos se basan en cebadores o sondas que reconocen específicamente la secuencia 5' y/o 3' flanqueante de DP-004114-3. Las moléculas de ADN pueden comprender secuencias cebadoras que cuando se utilizan en una reacción PCR, producirán amplicones únicos para el evento transgénico DP-004114-3. En el presente documento también se describen plantas y semillas de maíz que comprenden estas moléculas. Además, los kits pueden utilizar estas secuencias cebadoras para la identificación del evento DP-004114-3.
Un aspecto adicional se refiere a la secuencia flanqueante específica de DP-004114-3 descrita en el presente documento, que puede usarse para desarrollar métodos de identificación específicos para DP-004114-3 en muestras biológicas. Más particularmente, un aspecto se refiere a las regiones flanqueantes 5' y/o 3' de DP-004114-3 que pueden usarse para el desarrollo de cebadores y sondas específicos. Un aspecto adicional se refiere a métodos de identificación para la presencia de DP-004114-3 en muestras biológicas basándose en el uso de dichos cebadores o sondas específicos.
En el presente documento se describen métodos para detectar la presencia de ADN correspondiente al evento de maíz DP-004114-3 en una muestra. Dichos métodos comprenden: (a) poner en contacto la muestra que comprende ADN con un conjunto de cebadores de ADN, que cuando se usan en una reacción de amplificación de ácidos nucleicos con ADN genómico extraído del evento de maíz DP-004114-3 produce un amplicón que es diagnóstico para el evento de maíz DP-004114-3; (b) llevar a cabo una reacción de amplificación de ácido nucleico, produciendo de este modo el amplicón; y (c) detectar el amplicón.
De acuerdo con otro aspecto, los métodos para detectar la presencia de una molécula de ADN correspondiente al evento DP-004114-3 en una muestra, comprendiendo dichos métodos: (a) poner en contacto la muestra que comprende ADN extraído de una planta de maíz con una molécula de sonda de ADN que hibrida en condiciones rigurosas con ADN extraído del evento de maíz DP-004114-3 y no hibrida en condiciones rigurosas con un ADN de planta de maíz de control; (b) someter a la muestra y a la sonda a condiciones de hibridación rigurosas; y (c) detectar la hibridación de la sonda al ADN. Más específicamente, un método para detectar la presencia de una molécula de ADN correspondiente al evento DP-004114-3 en una muestra, consistiendo dichos métodos en (a) poner en contacto la muestra que comprende ADN extraído de una planta de maíz con una molécula de sonda de ADN que consiste en secuencias que son únicas para el evento, por ejemplo, secuencias de unión, en donde dicha molécula sonda de ADN hibrida en condiciones rigurosas con ADN extraído del evento de maíz DP-004114-3 y no hibrida en condiciones rigurosas con un ADN de planta de maíz de control; (b) someter a la muestra y a la sonda a condiciones de hibridación rigurosas; y (c) detectar la hibridación de la sonda al ADN.
Además, en el presente documento se describen un kit y métodos para identificar el evento DP-004114-3 en una muestra biológica que detectan una región específica de DP-004114-3.
Las moléculas de ADN pueden comprender al menos una secuencia de unión de DP-004114-3; en donde una secuencia de unión abarca la unión entre el ADN heterólogo insertado en el genoma y el ADN de la célula de maíz que flanquea al sitio de inserción, es decir, ADN flanqueante y es diagnóstica del evento DP-004114-3.
Los métodos para producir una planta de maíz resistente a insectos pueden comprender las etapas de: (a) cruzar
sexualmente una primera línea precursora de maíz que comprende los casetes de expresión descritos en el presente documento, lo que confiere resistencia a insectos y una segunda línea de maíz precursora que carece de resistencia a insectos, produciendo de este modo una pluralidad de plantas descendientes; y (b) seleccionar una planta descendiente que es resistencia a los insectos. Dichos métodos pueden comprender opcionalmente la etapa adicional de retrocruzar la planta descendiente con la secunda línea de maíz precursora para producir una planta de maíz genéticamente pura que es resistente a los insectos.
Un método para producir una planta de maíz que es resistente a los insectos puede comprender transformar una célula de maíz con la construcción de ADN PHP27118, cultivar la célula de maíz transformada hasta obtener una planta de maíz, seleccionar la planta de maíz que muestra resistencia a insectos y cultivar adicionalmente la planta de maíz hasta obtener una planta de maíz fértil. La planta de maíz fértil puede autopolinizarse o cruzarse con variedades de maíz compatibles para producir descendencia resistente a insectos.
Otro aspecto se refiere además a un kit de detección de ADN para identificar el evento de maíz DP-004114-3 en muestras biológicas. El kit comprende un primer cebador que reconoce específicamente la región flanqueante 5' o 3' de DP-004114-3 y un segundo cebador que reconoce específicamente una secuencia en el ADN exógeno de DP-004114-3 o en el ADN flanqueante, para su uso en un protocolo de identificación PCR. Un aspecto adicional se refiere a un kit para identificar el evento DP-004114-3 en muestras biológicas, comprendiendo dicho kit una sonda específica que tiene una secuencia que corresponde o que es complementaria a, una secuencia que tiene entre un 80 % y un 100 % de identidad de secuencia con una región específica del evento DP-004114-3. La secuencia de la sonda corresponde a una región específica que comprende parte de la región flanqueante 5' o 3' del evento DP-004114-3.
Los métodos y kits pueden usarse para diferentes fines, tales como, pero sin limitación, los siguientes: para identificar el evento DP-004114-3 en plantas, material vegetal o en productos tales como, pero sin limitación, alimentos o productos alimentarios (frescos o procesados) que comprenden o proceden de material vegetal; adicionalmente o como alternativa, los métodos y kits pueden usarse para identificar material vegetal transgénico a fin de diferenciar entre material transgénico y no transgénico; adicionalmente o como alternativa, los métodos y kits pueden usarse para determinar la calidad del material vegetal que comprende el evento de maíz DP-004114-3. Los kits también pueden contener los reactivos y materiales necesarios para llevar a cabo el método de detección.
En el presente documento también se describe una planta de maíz DP-004114-3 o sus partes, incluyendo, pero sin limitación, polen, óvulos, células vegetativas, los núcleos de células de polen y los núcleos de los óvulos de la planta de maíz DP-004114-3 y la descendencia procedente de la misma. En el presente documento también se describen la planta de maíz y la semilla de DP-004114-3 a partir de las que las moléculas de cebador de ADN proporcionan un producto de amplicón específico.
Los anteriores y otros aspectos de la invención serán más evidentes a partir de la siguiente descripción detallada y los dibujos adjuntos.
Breve descripción de los dibujos
FIG. 1. Diagrama esquemático del plásmido PHP27118 con elementos genéticos indicados y sitios de enzima de restricción Hind III. El tamaño del plásmido es de 54910 pb.
FIG. 2. Diagrama esquemático del ADN-T que indica los genes crylF, cry34Ab1, cry35Ab1 y pat (flechas) junto con sus elementos reguladores respectivos. Se indican los sitios de la enzima de restricción Hind III en el a DN-T. El tamaño del ADN-T es de 11978 pb.
FIG. 3. Diagrama esquemático de la transformación y el desarrollo de DP-004114-3.
FIG. 4. Efectos en el desarrollo de larvas de gusano de la raíz del maíz occidental (WCRW) en el ensayo de plántulas subletales que emplea plántulas híbridas de maíz en el mismo origen genético: maíz DP-004114-3 con una isolínea como control negativo. Los resultados se basan en tres replicados. Los perfiles gráficos muestran el porcentaje de larvas en cada una de las tres fases a los 17 días después de la eclosión del huevo. Un desplazamiento hacia la fase 3 indica una reducción en la eficacia.
FIG. 5. Representación esquemática de las regiones de borde del inserto y genómicas secuenciadas en el maíz 4114. El diagrama indica los fragmentos de la PCR generados a partir de ADN genómico de maíz 4114 que se clonaron y secuenciaron: fragmentos A a F. La línea discontinua vertical representa las uniones del borde genómico/inserto. Los fragmentos G y H representan las regiones del borde genómico 5' y 3', respectivamente. La figura no está representada a escala.
Descripción detallada
Las siguientes definiciones y métodos se proporcionan para definir mejor la presente invención y para guiar a los expertos habituales en la materia en la práctica de la presente invención. A menos que se indique otra cosa, los
términos han de interpretarse de acuerdo con el uso convencional por los expertos habituales en la técnica relevante. También pueden encontrarse definiciones de términos comunes en biología molecular en Rieger et al., Glossary of Genetics: Classical and Molecular, 5.a edición, Springer-Verlag; Nueva York, 1991; y Lewin, Genes V, Oxford University Press: Nueva York, 1994. Se usa la nomenclatura para las bases de ADN como se expone en el 37 CFR §1.822.
La siguiente tabla expone las abreviaturas usadas a lo largo de este documento y en particular, en la sección de ejemplos.
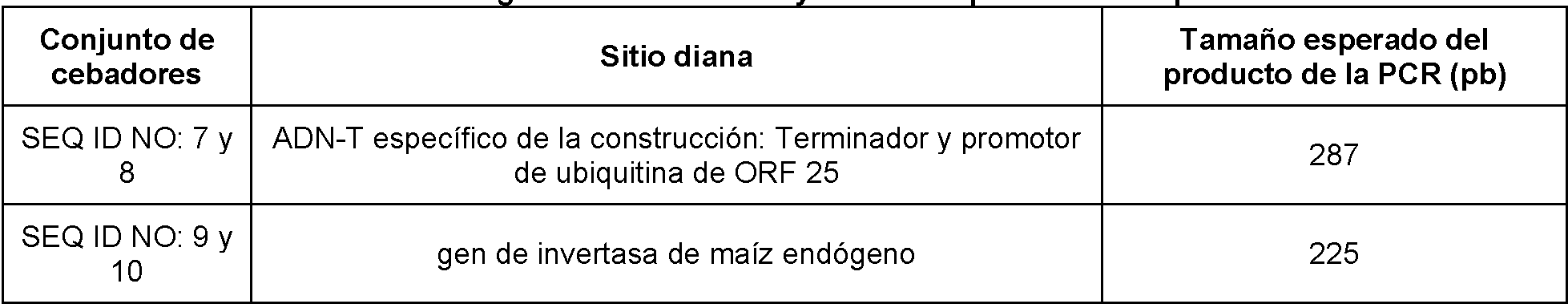
Tabla de abreviaturas
Las composiciones de la presente divulgación incluyen semillas depositadas como el depósito de patente n.° PTA-11506 y plantas, células vegetales y semillas derivadas de las mismas. Los solicitantes han efectuado un depósito de al menos 2500 semillas del evento de maíz DP-004114-3 en la Colección Americana de Cultivos Tipo (ATCC), Manassas, VA 20110-2209 EE. UU., el 24 de noviembre de 2010 y a los depósitos se les asignó el n.° de depósito PTA-11506. Estos depósitos se mantendrán bajo los términos del Tratado de Budapest sobre el Reconocimiento Internacional del Depósito de Microorganismos para los fines de Procedimiento de Patentes. Estos depósitos se efectuaron simplemente por comodidad para los expertos en la materia y no como admisión de que sea necesario un depósito, según lo dispuesto en el 35 U.S.C. §112. Las semillas depositadas en la ATCC el 24 de noviembre de 2010 se tomaron del depósito mantenido por Pioneer Hi-Bred International, Inc., 7250 NW 62nd Avenue, Johnston, lowa 50131-1000. Se encontrará disponible el acceso a este depósito durante el periodo durante el que esté pendiente la solicitud para el Comisionado de Patentes y Marcas y para las personas que el Comisionado considere con derecho previa solicitud. Tras la autorización de cualquiera de las reivindicaciones en la solicitud, los solicitantes pondrán a disposición del público, según lo dispuesto en el 37 C.F.R. § 1.808, una o más muestras del depósito de al menos 2500 semillas de maíz híbrido en la Colección Americana de Cultivos Tipo (ATCC), 10801 University Boulevard, Manassas, VA 20110-2209. Este depósito de semillas del evento de maíz d P-004114-3 se mantendrá en el repositorio
de la ATCC, que es un depósito público, durante un periodo de 30 años o de 5 años después de la solicitud más reciente o durante el periodo de vigencia de la patente, lo que tenga mayor duración y se repondrá en caso de que quede indisponible durante dicho periodo.
Como se usa en el presente documento, la expresión "que comprende" significa "incluyendo, pero sin limitación".
Como se usa en el presente documento, el término "maíz" significa Zea mays e incluye todas las variedades de la planta que pueden cruzarse con el maíz, incluyendo las especies de maíz silvestres.
Como se usa en el presente documento, la expresión "específico de DP-004114-3" se refiere a una secuencia de nucleótidos que es adecuada para identificar de manera discriminatoria el evento DP-004114-3 en plantas, material vegetal o en productos, tales como, pero sin limitación, alimentos o productos alimentarios (frescos o procesados) que comprenden o proceden de material vegetal.
Como se usa en el presente documento, las expresiones "resistente a insectos" y "que afecta a plagas de insectos" se refiere a efectuar cambios en la alimentación, el crecimiento y/o el comportamiento de los insectos en cualquier etapa del desarrollo, incluyendo, pero sin limitación: eliminar el insecto; retardar el crecimiento; prevenir la capacidad reproductiva; inhibir la alimentación; y similares.
Como se usa en el presente documento, las expresiones "actividad plaguicida" y "actividad insecticida" se usan como sinónimos para hacer referencia a la actividad de un organismo o una sustancia (tal como, por ejemplo, una proteína) que puede medirse mediante numerosos parámetros que incluyen, pero sin limitación, mortalidad de la plaga, pérdida de peso de la plaga, atracción de plagas, repelencia de plagas y otros cambios de comportamiento y físicos de una plaga después de que se alimente y/o se exponga al organismo o la sustancia durante un espacio de tiempo adecuado. Por ejemplo, las "proteínas plaguicidas" son proteínas que muestran actividad plaguicida por sí mismas o en combinación con otras proteínas.
"Secuencia codificante" se refiere a una secuencia de nucleótidos que codifica una secuencia de aminoácidos específica. Como se usa en el presente documento, los términos "codificante" y "codificado", cuando se usan en el contexto de un ácido nucleico específico, quieren decir que el ácido nucleico comprende la información necesaria para guiar la traducción de la secuencia de nucleótidos en una proteína específica. La información mediante la que se codifica una proteína se especifica mediante el uso de codones. Un ácido nucleico que codifica una proteína puede comprender secuencias no traducidas (por ejemplo, intrones) en las regiones traducidas del ácido nucleico o pueden carecer de dichas secuencias no traducidas intermedias (por ejemplo, como en el ADNc).
"Gen" se refiere a un fragmento de ácido nucleico que expresa una proteína específica, incluyendo secuencias reguladoras que preceden (secuencias 5' no codificantes) y siguen (secuencias 3' no codificantes) a la secuencia codificante. "Gen nativo" se refiere a un gen tal como se encuentra en la naturaleza con sus propias secuencias reguladoras. "Gen quimérico" se refiere a cualquier gen que no es un gen nativo, que comprende secuencias reguladoras y codificantes que no se encuentran juntas en la naturaleza. Por consiguiente, un gen quimérico puede comprender secuencias reguladoras y secuencias codificantes que proceden de diferentes fuentes o secuencias reguladoras y secuencias codificantes procedentes de la misma fuente, pero dispuestas de una manera diferente a la que se encuentra en la naturaleza. "Gen endógeno" se refiere a un gen nativo en su ubicación natural en el genoma de un organismo. "Exógeno" se refiere a un material no encontrado normalmente en la ubicación de interés. Por tanto, el "ADN exógeno" puede comprender tanto ADN recombinante como ADN reorganizado recién introducido de la planta. Un gen "exógeno" se refiere a un gen no encontrado normalmente en el organismo hospedador, pero que se introduce en el organismo hospedador por transferencia génica. Los genes exógenos pueden comprender genes nativos insertados en un organismo no nativo o genes quiméricos. Un "transgén" es un gen que se ha introducido en el genoma mediante un procedimiento de transformación. El sitio en el genoma de una planta donde se ha insertado un ADN recombinante puede denominarse "sitio de inserción" o "sitio diana".
Como se usa en el presente documento, "inserto de ADN" se refiere al ADN heterólogo en los casetes de expresión usados para transformar el material vegetal, mientras que puede existir "ADN flanqueante" o bien de ADN genómico naturalmente presente en un organismo, tal como una planta o ADN exógeno (heterólogo) introducido mediante el proceso de transformación, que es extraño respecto de la molécula de ADN insertada adicional, por ejemplo, fragmentos asociados con el evento de transformación. Una "región flanqueante" o "secuencia flanqueante", como se usa en el presente documento, se refiere a una secuencia de al menos 20 pb, preferentemente al menos 50 pb y hasta 5000 pb, que se ubica o bien inmediatamente cadena arriba de y contigua a o inmediatamente cadena debajo de y contigua a la molécula de ADN exógeno insertada original. Los procedimientos de transformación que dan lugar a la integración aleatoria del ADN exógeno darán como resultado transformantes que contienen diferentes regiones flanqueantes características y únicas para cada transformante. Cuando se introduce ADN recombinante en una planta mediante cruzamiento tradicional, normalmente no se cambiarán sus regiones flanqueantes. Los transformantes también contienen uniones únicas entre un trozo de ADN heterólogo insertado y ADN genómico o dos (2) trozos de ADN genómico o dos (2) trozos de ADN heterólogo. Una "unión" es un punto donde se unen dos (2) fragmentos de ADN específicos. Por ejemplo, se forma una unión donde el ADN insertado se une al ADN flanqueante. También existe un punto de unión en un organismo transformado donde dos (2) fragmentos de ADN se unen de un modo que está
modificado con respecto al encontrado en el organismo nativo. "ADN de unión" se refiere a ADN que comprende un punto de unión. Dos secuencias de unión expuestas en la presente divulgación son el punto de unión entre el ADN genómico de maíz y el extremo 5' del inserto como se expone en la SEQ ID NO: 27 y el punto de unión entre el extremo 3' del inserto y el ADN genómico de maíz, como se expone en la SEQ ID NO: 28.
Como se usa en el presente documento, "heterólogo", en referencia a un ácido nucleico, es un ácido nucleico originario de una especie exógena o, en caso de ser de la misma especie, está sustancialmente modificado con respecto a su forma nativa en cuanto a su composición y/o locus genómico mediante intervención humana deliberada. Por ejemplo, un promotor unido operativamente a una secuencia de nucleótidos heteróloga puede proceder de una especie diferente a aquella de la que se obtuvo la secuencia de nucleótidos o, en caso de ser de la misma especie, el promotor no se encuentra unido operativamente de manera natural a la secuencia de nucleótidos. Una proteína heteróloga puede tener como origen una especie exógena o, en caso de ser de la misma especie, está sustancialmente modificada con respecto a su forma original mediante intervención humana deliberada.
"Secuencias reguladoras" se refiere a secuencias de nucleótidos ubicadas cadena arriba (secuencias 5' no codificantes), dentro o cadena abajo (secuencias 3' no codificantes) de una secuencia codificante y que influyen en la transcripción, el procesamiento o la estabilidad del ARN o la traducción de la secuencia codificante asociada. Las secuencias reguladoras pueden incluir promotores, secuencias líder de traducción, intrones y secuencias de reconocimiento de poliadenilación.
"Promotor" se refiere a una secuencia de nucleótidos capaz de controlar la expresión de una secuencia codificante o un ARN funcional. En general, una secuencia codificante está ubicada en 3' respecto de una secuencia promotora. La secuencia promotora consiste en elementos cadena arriba proximales y más distales, citándose los anteriores elementos como potenciadores. Por consiguiente, un "potenciador" es una secuencia de nucleótidos que puede estimular la actividad promotora y puede ser un elemento innato del promotor o un elemento heterólogo insertado para potenciar el nivel o la especificidad de tejido de un promotor. Los promotores pueden proceder por completo de un gen nativo o estar compuestos de diferentes elementos procedentes de diferentes promotores encontrados en la naturaleza o incluso comprender segmentos de nucleótidos sintéticos. Los expertos en la materia entienden que los diferentes promotores pueden dirigir la expresión de un gen en diferentes tejidos o tipos celulares o en diferentes estadios de desarrollo o en respuesta a diferentes condiciones ambientales. Los promotores que provocan la expresión de un fragmento de ácido nucleico en la mayoría de tipos celulares durante la mayoría del tiempo se citan comúnmente como "promotores constitutivos". Se están descubriendo continuamente nuevos promotores de diversos tipos útiles en células vegetales; pueden encontrarse numerosos ejemplos en la compilación de Okamuro y Goldberg (1989) Biochemistry of Plants 15:1-82. Se reconoce además que ya que en la mayoría de los casos los límites exactos de las secuencias reguladoras no se han definido completamente, algunos fragmentos de ácido nucleico de diferentes longitudes pueden tener una actividad promotora idéntica.
La "secuencia líder de la traducción" se refiere a una secuencia de nucleótidos ubicada entre la secuencia promotora de un gen y la secuencia codificante. La secuencia líder de traducción se encuentra presente en el ARNm completamente procesado cadena arriba de la secuencia de inicio de la traducción. La secuencia líder de la traducción puede afectar a numeroso parámetros que incluyen, el procesamiento del transcrito primario en ARNm, la estabilidad del ARNm y/o la eficiencia de la traducción. Se han descrito ejemplos de secuencias líder de la traducción (Turner y Foster (1995) Mol. Biotechnol. 3:225-236).
Las "secuencias 3' no codificantes" se refieren a secuencias de nucleótidos ubicadas cadena debajo de una secuencia codificante e incluyen secuencias de reconocimiento de la poliadenilación y otras secuencias que codifican señales reguladoras capaces de afectar al procesamiento del ARNm o la expresión génica. La señal de poliadenilación normalmente se caracteriza por que afecta a la adición de tramos de ácido poliadenílico al extremo 3' del precursor de ARNm. El uso de diferentes secuencias 3' no codificantes se ejemplifica por Ingelbrecht et al. (1989) Plant Cell 1:671-680.
Una "proteína" o un "polipéptido" es una cadena de aminoácidos dispuesta en un orden específico determinado por la secuencia codificante en un polinucleótido que codifica el polipéptido.
Una construcción de ADN es un conjunto de moléculas de ADN ligadas entre sí que proporciona uno o más casetes de expresión. La construcción de ADN puede ser un plásmido que tiene capacidad de autorreplicación en una célula bacteriana y contiene diversos sitios de restricción de enzima endonucleasa que son útiles para introducir moléculas de ADN que proporcionan elementos genéticos funcionales, es decir, promotores, intrones, líderes, secuencias codificantes, regiones de terminación 3', entre otros; o una construcción de ADN puede ser un conjunto lineal de moléculas de ADN, tales como un casete de expresión. El casete de expresión contenido en una construcción de ADN comprende los elementos genéticos necesarios para proporcionar la transcripción de un ARN mensajero. El casete de expresión puede diseñarse para su expresión en células procariotas o eucariotas. Los casetes de expresión pueden diseñarse para su expresión en células vegetales.
Las moléculas de ADN pueden proporcionarse en casetes de expresión para su expresión en un organismo de interés. El casete incluirá secuencias reguladoras 5' y 3' unidas operativamente a una secuencia codificante. "Unido
operativamente" significa que las secuencias de ácido nucleico que se están uniendo son contiguas y, cuando es necesario unir dos regiones codificantes de proteína, contiguas y en el mismo marco de lectura. Unido operativamente pretende indicar un enlace funcional entre un promotor y una segunda secuencia, en donde la secuencia promotora inicia y media la transcripción de la secuencia de ADN correspondiente a la segunda secuencia. El casete puede contener además al menos un gen adicional que se va a cotransformar en el organismo. Como alternativa, los genes adicionales pueden proporcionarse en múltiples casetes de expresión o múltiples construcciones de ADN.
El casete de expresión incluirá en la dirección de la transcripción de 5' a 3': un región de inicio de la transcripción y la traducción, una región codificante y una región de terminación de la traducción funcional en el organismo que sirve como hospedador. La región de inicio de la transcripción (es decir, el promotor) puede ser nativa o análoga o exógena o heteróloga para el organismo hospedador. Además, el promotor puede ser la secuencia natural o como alternativa, una secuencia sintética. Los casetes de expresión pueden contener además secuencias líder 5' en la construcción del casete de expresión. Dichas secuencias líder pueden actuar potenciando la traducción.
Ha de entenderse que, como se usa en el presente documento, el término "transgénico" incluye cualquier célula, línea celular, callo, tejido, parte de planta o planta, cuyo genotipo se ha alterado mediante la presencia de un ácido nucleico heterólogo que incluye aquellos transgénicos alterados inicialmente de este modo, así como aquellos creados mediante cruzamientos sexuales o propagación asexual a partir del transgénico inicial. El término "transgénico", como se usa en el presente documento, no abarca la alteración del genoma (cromosómica o extracromosómica) mediante métodos de fitomejoramiento convencionales o por eventos de origen natural, tales como fertilización cruzada aleatoria, infección vírica no recombinante, transformación bacteriana no recombinante, transposición no recombinante o mutación espontánea.
Un "evento" transgénico se produce mediante la transformación de células vegetales con una o más construcciones de ADN heterólogas, incluyendo un casete de expresión de ácido nucleico que comprende un transgén de interés, la regeneración de una población de plantas resultante de la inserción del transgén en el genoma de la planta y la selección de una planta particular caracterizada por la inserción en una ubicación particular del genoma. Un evento se caracteriza fenotípicamente por la expresión del transgén. A nivel genético, un evento forma parte del acervo genético de una planta. El término "evento" también se refiere a la descendencia producida por un cruzamiento sexual exógamo entre el transformante y otra variedad que incluye el ADN heterólogo. Incluso después del retrocruzamiento repetido con un precursor recurrente, el ADN insertado y el ADN flanqueado del precursor transformado está presente en la descendencia del cruce en la misma ubicación cromosómica. El término "evento" también se refiere a ADN del transformante original que comprende el ADN insertado y la secuencia flanqueante inmediatamente adyacente al ADN insertado que podría esperarse que se transfiera a una descendencia que recibe el ADN insertado que incluye el transgén de interés como resultado de un cruzamiento sexual de una línea precursora que incluye el ADN insertado (por ejemplo, el transformante original y la descendencia resultante de la autopolinización) y una línea precursora que no contiene el ADN insertado.
Puede criarse una planta de maíz DP-004114-3 resistente a insectos cruzando en primer lugar una planta de maíz precursora que comprende una planta de maíz cultivada a partir de la planta de maíz DP-004114-3 transgénica y la descendencia de la misma procedente de la transformación con los casetes de expresión descritos en el presente documento que confieren resistencia a insectos y una segunda planta de maíz precursora que carece de resistencia a insectos, produciendo de este modo una pluralidad de primeras plantas descendientes; y después seleccionando una primera planta descendiente que es resistente a los insectos; y autopolinizar la primera planta descendiente, produciendo de este modo una pluralidad de segundas plantas descendientes; y después seleccionar entre las segundas plantas descendientes una planta resistente a insectos. Estas etapas pueden incluir además el retrocruzamiento de la primera planta descendiente resistente a insectos o la segunda planta descendiente resistente a insectos con la segunda planta de maíz precursora o una tercera planta de maíz precursora, produciendo de este modo una planta de maíz que es resistente a los insectos.
Como se usa en el presente documento, el término "planta" incluye la referencia a plantas enteras, órganos de plantas (por ejemplo, hojas, tallos, raíces, etc.), semillas, células vegetales y la descendencia de las mismas. Las partes de plantas transgénicas pueden comprender, por ejemplo, células vegetales, protoplastos, tejidos, callo, embriones, así como flores, tallos, frutos, hojas y raíces procedentes de plantas transgénicas o su descendencia previamente transformadas con una molécula de ADN descrita en el presente documento y que por tanto constan, al menos en parte, de células transgénicas, también se describen en el presente documento.
Como se usa en el presente documento, la expresión "célula vegetal" incluye, sin limitación, semillas, cultivos en suspensión, embriones, regiones meristemáticas, tejido de callo, hojas, raíces, brotes, gametofitos, esporofitos, polen y micrósporas. La clase de plantas que puede usarse en los métodos descritos en el presente documento es generalmente tan amplia como la clase de plantas superiores susceptibles a las técnicas de transformación, incluyendo plantas tanto monocotiledóneas como dicotiledóneas.
"Transformación" se refiere a la transferencia de un fragmento de ácido nucleico en el genoma de un organismo hospedador, que da como resultado herencia genéticamente estable. Los organismos hospedadores que contienen los fragmentos de ácido nucleico transformados se denominan organismos "transgénicos". Los ejemplos de métodos
de transformación de plantas incluyen transformación mediada por Agrobacterium (De Blaere et al. (1987) Meth. Enzymol. 143:277) y la tecnología acelerada por partículas o de "pistola génica" (Klein et al. (1987) Nature (Londres) 327:70-73; Patente de los Estados Unidos n.° 4.945.050). Los métodos de transformación adicionales se divulgan más adelante.
Por tanto, pueden incorporarse polinucleótidos aislados en construcciones recombinantes, normalmente construcciones de ADN, que tienen la capacidad de introducirse y replicarse en una célula hospedadora. Dicha construcción puede ser un vector que incluye un sistema de replicación y secuencias que tienen la capacidad de transcribir y traducir una secuencia codificante de polipéptido en una célula hospedadora determinada. Se ha descrito una serie de vectores adecuados para la transfección estable de células vegetales o para el establecimiento de plantas transgénicas en, por ejemplo, Pouwels et al., (1985; Sup. 1987) Cloning Vectors: A Laboratory Manual, Weissbach y Weissbach (1989) Methods for Plant Molecular Biology, (Academic Press, Nueva York); y Flevin et al., (1990) Plant Molecular Biology Manual, (Kluwer Academic Publishers). Normalmente, los vectores de expresión en plantas incluyen, por ejemplo, uno o más genes vegetales clonados bajo el control transcripcional de secuencias reguladoras 5' y 3' y un marcador de selección dominante. Dichos vectores de expresión en plantas también pueden contener una región reguladora del promotor (por ejemplo, una región reguladora que controla la expresión inducible o constitutiva, regulada ambientalmente o por el desarrollo o específica de células o tejidos), un sitio de inicio de la transcripción, un sitio de unión al ribosoma, una señal de procesamiento de ARN, un sitio de terminación de la transcripción y/o una señal de poliadenilación.
También ha de entenderse que pueden cruzarse dos plantas transgénicas diferentes para producir descendencia que contiene dos genes exógenos segregantes añadidos de manera independiente. La autopolinización de la descendencia adecuada puede producir plantas que son homocigotas para ambos genes exógenos añadidos. También se contemplan el retrocruzamiento con una planta precursora y el cruzamiento exogámico con una planta no transgénica, así como la propagación vegetativa. Pueden encontrarse descripciones de otros métodos de fitomejoramiento que se usan comúnmente para diferentes rasgos y cultivos en una de varias referencias, por ejemplo, Fehr, en Breeding Methods for Cultivar Development, Wilcos J. ed., American Society of Agronomy, Madison Wis. (1987).
Una "sonda" es un ácido nucleico aislado al que se une un marcador detectable o una molécula indicadora convencional, por ejemplo, un isótopo radiactivo, ligando, agente quimioluminiscente o enzima. Dicha sonda puede ser complementaria a una hebra de un ácido nucleico diana para una hebra de ADN aislado del evento de maíz DP-004114-3, ya proceda de una planta de maíz o de una muestra que incluye ADN del evento. Las sondas pueden incluir no solo ácidos desoxirribonucleicos o ribonucleicos, sino también poliaminas y otros materiales de sonda que se unen específicamente a una secuencia de ADN y pueden usarse para detectar la presencia de dicha secuencia de ADN diana.
Los "cebadores" son ácidos nucleicos aislados que se hibridan a una hebra de ADN diana complementaria mediante hibridación de ácido nucleico para formar un híbrido entre el cebador y la hebra de ADN diana, y después extenderse a lo largo de la hebra de a Dn diana mediante una polimerasa, por ejemplo, una ADN polimerasa. Los pares de cebadores pueden referirse a su uso para la amplificación de una secuencia de ácido nucleico diana, por ejemplo, mediante la PCR u otros métodos de amplificación de ácidos nucleicos convencionales. La "PCR" o "reacción en cadena de la polimerasa" es una técnica usada para la amplificación de segmentos de ADN específicos (véanse, las Patentes de los Estados Unidos n.° 4.683.195 y 4.800.159).
Las sondas y cebadores tienen una longitud de nucleótidos suficiente para unirse a la secuencia de ADN diana específicamente en las condiciones de hibridación o las condiciones de reacción determinadas por el operario. Esta longitud puede ser cualquier longitud que sea lo suficientemente larga para ser útil en un método de detección elegido. En general, se usan 11 nucleótidos de longitud o más, 18 nucleótidos de longitud o más y 22 nucleótidos de longitud o más. Dichas sondas y cebadores se hibridan específicamente a una secuencia diana en condiciones de hibridación de alta rigurosidad. Las sondas y cebadores pueden tener una similitud de secuencia de ADN completa de nucleótidos contiguos con la secuencia diana, aunque pueden diseñarse mediante métodos convencionales sondas que difieren respecto de la secuencia de ADN diana y que conservan la capacidad para hibridar con las secuencias de ADN diana. Las sondas pueden usarse como cebadores, pero generalmente se diseñan para que se unan al ADN o ARN diana y no se usan en un proceso de amplificación.
Pueden usarse cebadores específicos para amplificar un fragmento de integración para producir un amplicón que puede usarse como "sonda específica" para identificar el evento DP-004114-3 en muestras biológicas. Cuando la sonda se hibrida con los ácidos nucleicos de una muestra biológica en condiciones que permiten la unión de la sonda a la muestra, esta unión puede detectarse y de este puede obtenerse una indicación de la presencia del evento DP-004114-3 en la muestra biológica. Se ha descrito en la técnica dicha identificación de una sonda unida. La sonda específica puede ser una secuencia que, en condiciones optimizadas, se hibrida específicamente con una región en la región flanqueante 5' o 3' del evento y también comprende una parte del ADN exógeno contiguo con la misma. La sonda específica puede comprender una secuencia al menos un 80 %, entre un 80 y un 85 %, entre un 85 y un 90 %, entre un 90 y un 95 % y entre un 95 y un 100 % idéntica (o complementaria) a una región específica del evento.
Se describen métodos para preparar y usar las sondas y cebadores, por ejemplo, en Sambrook et al., Molecular Cloning: A Laboratory Manual, 2.a ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. 1989 (en lo sucesivo, "Sambrook et al., 1989"); Ausubel et al. eds., Current Protocols in Molecular Biology, , Greene Publishing y Wiley-Interscience, Nueva York, 1995 (con actualizaciones periódicas) (en lo sucesivo, "Ausubel et al., 1995"); e Innis et al., PCR Protocols: A Guide to Methods and Applications, Academic Press: San Diego, 1990. Los pares de cebadores de la PCR pueden proceder de una secuencia conocida, por ejemplo, usando programas informáticos pensados para dicho fin, tales como la herramienta de análisis de cebadores de la PCR en Vector NTI, versión 6 (Informax Inc., Bethesda MD); PrimerSelect (DNASTAR Inc., Madison, WI); y Primer (Versión 0.5©, 1991, Whitehead Institute for Biomedical Research, Cambridge, Mass.). Además, puede explorarse visualmente la secuencia e identificarse manualmente los cebadores usando guías conocidas por un experto en la materia.
Un "kit", como se usa en el presente documento, se refiere a un conjunto de reactivos con el fin de llevar a cabo el método descrito en el presente documento, más particularmente, la identificación del evento DP-004114-3 en muestras biológicas. El kit descrito en el presente documento puede usarse y sus componentes pueden ajustarse específicamente, con una finalidad de control de calidad (por ejemplo, pureza de lotes de semillas), detección del evento DP-004114-3 en material vegetal o material que comprende o procede de material vegetal, tal como, pero sin limitación, alimentos o productos alimentarios. "Material vegetal", como se usa en el presente documento, se refiere a un material que se obtiene o procede de una planta.
Los cebadores y sondas basados en las secuencias de ADN flanqueante y del inserto divulgadas en el presente documento pueden usarse para confirmar (y, en caso necesario corregir) las secuencias divulgadas mediante métodos convencionales, por ejemplo, volviendo a clonar y secuenciar dichas secuencias. Las sondas y cebadores de ácidos nucleicos pueden hibridar en condiciones rigurosas a una secuencia de ADN diana. Puede usarse cualquier método de hibridación o amplificación de ácidos nucleicos convencional para identificar la presencia de ADN de un evento transgénico en una muestra. Las moléculas de ácido nucleico o los fragmentos de las mismas tienen la capacidad de hibridar específicamente con otras moléculas de ácido nucleico en ciertas circunstancias. Como se usa en el presente documento, se dice que dos moléculas de ácido nucleico son capaces de hibridar específicamente entre sí en caso de que las dos moléculas sean capaces de formar una estructura de ácido nucleico bicatenaria antiparalela.
Se dice que una molécula de ácido nucleico es el "complemento" de otra molécula de ácido nucleico en caso de que muestre complementariedad completa. Como se usa en el presente documento, se dice que las moléculas muestran "complementariedad completa" cuando cada nucleótido de una de las moléculas es complementario a un nucleótido de la otra. Se dice que dos moléculas son "mínimamente complementarias" si pueden hibridar entre sí con suficiente estabilidad para permitir que queden hibridadas entre sí al menos en condiciones de "baja rigurosidad" convencionales. De manera similar, se dice que las moléculas son "complementarias" si pueden hibridar entre sí con suficiente estabilidad para permitir que permanezcan hibridadas entre sí en condiciones de "alta rigurosidad" convencionales. Las condiciones de rigurosidad convencionales se describen por Sambrook et al., 1989 y por Haymes et al., En: Nucleic Acid Hybridization, a Practical Approach, IRL Press, Washington, D.C. (1985). Las desviaciones respecto de la complementariedad completa son por tanto permisibles, en tanto que dichas desviaciones no impidan por completo la capacidad de las moléculas para formar una estructura bicatenaria. Para que una molécula de ácido nucleico sirva como cebador o sonda, solo es necesario que sea lo suficientemente complementaria en secuencia para que tenga la capacidad de formar una estructura bicatenaria estable en las concentraciones particulares de disolvente y sal empleadas.
En las reacciones de hibridación, la especificidad es normalmente la función de los lavados después de la hibridación, siendo factores críticos la fuerza iónica y la temperatura de la solución de lavado final. El punto térmico de fusión (Tm) es la temperatura (en condiciones de fuerza iónica y pH definidas) a la cual hibrida un 50 % de la secuencia diana complementaria con una sonda perfectamente coincidente. Para los híbridos de ADN-ADN, puede calcularse de manera aproximada la Tm mediante la ecuación de Meinkoth y Wahl (1984) Anal. Biochem. 138:267-284: Tm = 81,5 °C 16,6 (log M) 0,41 (%GC) - 0,61 (% form) - 500/l; donde M es la molaridad de los cationes monovalentes, % GC es el porcentaje de nucleótidos de guanosina y citosina en el ADN, % form es el porcentaje de formamida en la solución de hibridación y L es la longitud del híbrido en pares de bases. La Tm se reduce en aproximadamente 1 °C por cada 1 % de emparejamiento erróneo; por lo tanto, la Tm, la hibridación y/o las condiciones de lavado pueden ajustarse para hibridar con secuencias de la identidad deseada. Por ejemplo, en caso de que se pretenda obtener secuencias con > 90 % de identidad, la Tm puede reducirse en aproximadamente 10 °C. En general, las condiciones rigurosas se seleccionan para que sean aproximadamente 5 °C inferiores a la Tm para la secuencia específica y es complementaria en condiciones de fuerza iónica y pH definidas. Sin embargo, las condiciones altamente rigurosas pueden utilizar una hibridación y/o lavado a 1, 2, 3 o 4 °C menos que la Tm; las condiciones moderadamente rigurosas pueden utilizar una hibridación y/o lavado a 6, 7, 8, 9 o 10 °C menos que la Tm; las condiciones de baja rigurosidad pueden utilizar una hibridación y/o lavado a 11, 12, 13, 14, 15 o 20 °C menos que la Tm.
Usando la ecuación, las composiciones de hibridación y lavado y la Tm deseada, los expertos habituales en la materia entenderán que se describen inherentemente variaciones en la rigurosidad de las soluciones de hibridación y/o lavado. En caso de que el grado de emparejamiento erróneo dé como resultado una Tm de menos de 45 °C (solución acuosa) o 32 °C (solución de formamida), se prefiere aumentar la concentración de SSC, de tal forma que puede usarse una mayor temperatura. Puede encontrarse una extensa guía de hibridación de ácidos nucleicos en Tijssen (1993)
Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes, Parte I, Capítulo 2 (Elsevier, Nueva York); y Ausubel et al., eds. (1995) y Sambrook et al. (1989).
Como se usa en el presente documento, una secuencia sustancialmente homóloga es una molécula de ácido nucleico que hibridará específicamente con el complemento de la molécula de ácido nucleico con la que se está comparando en condiciones de alta rigurosidad. Los expertos en la materia conocen condiciones de rigurosidad adecuadas que promueven la hibridación de ADN, por ejemplo, cloruro de sodio/citrato de sodio 6X (SSC) a aproximadamente 45 °C, seguido de un lavado de SSC 2X a 50 °C o pueden encontrarse en Ausubel et al. (1995), 6.3.1-6.3.6. Normalmente, las condiciones rigurosas serán aquellas en las que la concentración salina es menor de aproximadamente 1,5 M de ion Na, típicamente una concentración de ion Na (u otras sales) de aproximadamente 0,01 a 1,0 M a pH de 7,0 a 8,3 y la temperatura es de al menos aproximadamente 30 °C para sondas cortas (por ejemplo, de 10 a 50 nucleótidos) y al menos aproximadamente 60 °C para sondas largas (por ejemplo, más de 50 nucleótidos). También pueden lograrse condiciones rigurosas con la adición de un agente desestabilizante, tal como formamida. Las condiciones de baja rigurosidad ejemplares incluyen hibridación con una solución tampón de formamida del 30 al 35 %, NaCl 1 M, SDS al 1 % (dodecilsulfato de sodio) a 37 °C y un lavado en SSC de 1X a 2X (SSC 20X = NaCl 3,0 M/citrato trisódico 0,3 M) a de 50 a 55 °C. Las condiciones de rigurosidad moderada ejemplares incluyen hibridación en formamida del 40 al 45 %, NaCl 1 M, SDS al 1 % a 37 °C y un lavado en SSC de 0,5X a 1X a de 55 a 60 °C. Las condiciones de alta rigurosidad ejemplares incluyen hibridación en formamida al 50 %, NaCl 1 M, SDS al 1 % a 37 °C y un lavado en SDS 0,1X a de 60 a 65 °C. Un ácido nucleico puede hibridar específicamente con una o más de las moléculas de ácido nucleico únicas para el evento DP-004114-3 o los complementos de los mismos o fragmentos de cualquiera de ellas en condiciones moderadamente rigurosas.
Se conocen bien en la técnica procedimientos de alineación de secuencias para la comparación. Por tanto, puede lograrse la determinación del porcentaje de identidad entre dos secuencias cualesquiera usando un algoritmo matemático. Los ejemplos no limitantes de dichos algoritmos matemáticos son el algoritmo de Myers y Miller (1988) CABIOS 4:11-17; el algoritmo de homología local de Smith et al. (1981) Adv. Appl. Math. 2:482; el algoritmo de alineamiento de homología de Needleman y Wunsch (1970) J. Mol. Biol. 48:443-453; el método de búsqueda de similitud de Pearson y Lipman (1988) Proc. Natl. Acad. Sci. 85:2444-2448; el algoritmo de Karlin y Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2264, modificado como en Karlin y Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877.
Pueden utilizarse implementaciones computarizadas de estos algoritmos matemáticos para la comparación de secuencias para determinar la identidad de secuencia. Dichas implementaciones incluyen, pero sin limitación: CLUSTAL en el programa PC/Gene (disponible de Intelligenetics, Mountain View, California); el programa ALIGN (Versión 2.0); el programa ALIGN PLUS (versión 3.0, copyright 1997); y GAP, BESTFIT, BLAST, FASTA y TFASTA en el paquete informático de Wisconsin Genetics, versión 10 (disponible de Accelrys, 9685 Scranton Road, San Diego, CA 92121, EE. UU.). Pueden efectuarse alineamientos usando estos programas usando los parámetros por defecto.
El programa CLUSTAL está bien descrito por Higgins y Sharp, Gene 73: 237-244 (1988); Higgins y Sharp, CABIOS 5: 151-153 (1989); Corpet, et al., Nucleic Acids Research 16: 10881-90 (1988); Huang, et al., Computer Applications in the Biosciences 8: 155-65 (1992) y Pearson, et al., Methods in Molecular Biology 24: 307-331 (1994). Los programas ALIGN y ALIGN PLUS están basados en el algoritmo de Myers y Miller (1988), anteriormente citado. Los programas BLAST de Altschul et al. (1990) J. Mol. Biol. 215:403 se basan en el algoritmo de Karlin y Altschul (1990), anteriormente citado. La familia BLAST de programas que pueden usarse para búsquedas de similitud en bases de datos incluye: BLASTN para secuencias de consulta de nucleótidos frente a secuencias de bases de datos de nucleótidos; BLASTX para secuencias de consulta de nucleótidos frente a bases de datos de proteínas; BLASTP para secuencias de consulta de proteínas frente a bases de datos de proteínas; TBLASTN para secuencias de consulta de proteínas frente a secuencias de bases de datos de nucleótidos; y TBLASTX para secuencias de consulta de nucleótidos frente a secuencias de bases de datos de nucleótidos. Véase, Ausubel, et al., (1995). El alineamiento también puede llevarse a cabo manualmente mediante inspección visual.
Para obtener alineaciones con huecos con fines de comparación, puede utilizarse Gapped BLAST (en BLAST 2.0) como se describe en Altschul et al. (1997) Nucleic Acids Res. 25:3389. Como alternativa, puede usarse PSI-BLAST (en BLAST 2.0) para realizar una búsqueda iterada que detecta relaciones distantes entre moléculas. Véase Altschul et al. (1997) anteriormente citado. Cuando se utiliza BLAST, Gapped BLAST o PSI-BAST, pueden usarse los parámetros por defecto de los respectivos programas (por ejemplo, BLASTN para secuencias de nucleótidos, BLASTX para proteínas).
Como se usa en el presente documento, "identidad de secuencia" o "identidad", en el contexto de dos secuencias de ácido nucleico o polipéptido hace referencia a los restos en las dos secuencias que son iguales cuando se alinean para máxima correspondencia a lo largo de una ventana de comparación especificada. Cuando se usa el porcentaje de identidad de secuencia en referencia a proteínas, se reconoce que las posiciones que restos que no son idénticas normalmente difieren por sustituciones de aminoácidos conservativas, donde se sustituyen los restos de aminoácido por otros restos de aminoácido con propiedades similares (por ejemplo, carga o hidrofobia) y por lo tanto, no cambian las propiedades funcionales de la molécula. Cuando las secuencias difieren en sustituciones conservativas, puede ajustarse por exceso el porcentaje de identidad de secuencia para corregir la naturaleza conservativa de la sustitución.
Se dice que las secuencias que difieren por dichas sustituciones conservativas tienen "similitud de secuencia" o "similitud". Los medios para hacer este ajuste son bien conocidos por los expertos en la materia. Normalmente, esto implica puntuar una sustitución conservativa como un emparejamiento erróneo parcial en lugar de completo, aumentando de este modo el porcentaje de identidad de secuencia. Por tanto, por ejemplo, cuando a un aminoácido idéntico se le da una puntuación de 1 y a una sustitución no conservativa se le da una puntuación de cero, a una sustitución conservativa se le da una puntuación entre cero y 1. La puntuación de las sustituciones conservativas se calcula, por ejemplo, como se implementa en el programa p C/GENE (Intelligenetics, Mountain View, California).
Como se usa en el presente documento, el "porcentaje de identidad de secuencia" significa el valor determinado al comparar dos secuencias alineadas de manera óptima a lo largo de una ventana de comparación, en donde la porción de la secuencia de polinucleótido en la ventana de comparación puede comprender adiciones o eliminaciones (es decir, huecos), en comparación con la secuencia de referencia (que no comprende adiciones o eliminaciones) para un alineamiento óptimo de las dos secuencias. El porcentaje se calcula determinando el número de posiciones en las cuales se encuentra la base de ácido nucleico o el resto de aminoácido idénticos en ambas secuencias para producir el número de posiciones emparejadas, dividiendo el número de posiciones coincidentes entre el número total de posiciones en la ventana de comparación y multiplicando el resultado por 100 para producir el porcentaje de identidad de secuencia.
En referencia a la amplificación de una secuencia de ácido nucleico (por ejemplo, mediante la PCR) usando un par de cebadores de amplificación particular, las "condiciones rigurosas" son condiciones que permiten que el par de cebadores se hibride únicamente con la secuencia de ácido nucleico diana a la que se uniría un cebador que tenga la secuencia de tipo silvestre correspondiente (o su complemento) y preferentemente para producir un producto de amplificación único, el amplicón, en una reacción de amplificación térmica de ADN.
La expresión "específico para (una secuencia diana)" indica que una sonda o cebador hibrida en condiciones de hibridación rigurosas solo con la secuencia diana en una muestra que comprende la secuencia diana.
Como se usa en el presente documento, "ADN amplificado" o "amplicón" se refiere al producto de amplificación de ácido nucleico de una secuencia de ácido nucleico diana que forma parte de un molde de ácido nucleico. Por ejemplo, para determinar si una planta de maíz resultante de un cruzamiento sexual contiene ADN genómico del evento transgénico procedente de la planta de maíz descrita en el presente documento, El ADN extraído de la muestra de tejido de la planta de maíz puede someterse a un método de amplificación de ácido nucleico usando un par de cebadores de ADN que incluye un primer cebador procedente de la secuencia flanqueante adyacente al sitio de inserción del ADN heterólogo insertado y un segundo cebador procedente del ADN heterólogo insertado para producir un amplicón que es diagnóstico para la presencia del ADN del evento. Como alternativa, el segundo cebador puede proceder de la secuencia flanqueante. El amplicón tiene una longitud y una secuencia que también es diagnóstica para el evento. El amplicón puede tener una longitud en el intervalo desde la longitud combinada de los pares de cebadores más un par de bases de nucleótidos hasta cualquier longitud del amplicón que puede producirse mediante un protocolo de amplificación de ADN. Como alternativa, los pares de cebadores pueden proceder de la secuencia flanqueante en ambos lados del ADN insertado a fin de producir un amplicón que incluye la secuencia de nucleótidos del inserto completa de la construcción de expresión PHP27118, así como la secuencia que flanquea el inserto transgénico. Puede ubicarse un miembro de un par de cebadores procedente de la secuencia flanqueante a una distancia de la secuencia de ADN insertada, pudiendo variar esta distancia desde un par de bases de nucleótidos hasta los límites de la reacción de amplificación o aproximadamente 20.000 pb. El uso del término "amplicón" excluye específicamente dímeros de cebador que pueden formarse en la reacción de amplificación térmica de ADN.
La amplificación de ácido nucleico puede lograrse mediante cualquiera de los diversos métodos de amplificación de ácido nucleico conocidos en la técnica, incluyendo la PCR. Se conocen en la técnica diversos métodos de amplificación y se describen, entre otros, en las Patentes de los Estados Unidos n.° 4.683.195 y 4.683.202 y en Innis et al., (1990) anteriormente citado. Se han desarrollado métodos de amplificación por la PCR para amplificar hasta 22 Kb de ADN genómico y hasta 42 Kb de ADN de bacteriófago (Cheng et al., Proc. Natl. Acad. Sci. USA 91:5695-5699, 1994). Pueden usarse estos métodos, así como otros métodos conocidos en la técnica de amplificación de ADN en la práctica de las realizaciones de la presente invención. Ha de entenderse que puede ser necesario ajustar una serie de parámetros en un protocolo de PCR específico a las condiciones de laboratorio específicas y pueden modificarse ligeramente y aun así permitir la recogida de resultados similares. Estos ajustes serán evidentes para un experto en la materia.
El amplicón producido mediante estos métodos puede detectarse mediante diversas técnicas, incluyendo, pero sin limitación, Genetic Bit Analysis (Nikiforov, et al. Nucleic Acid Res. 22:4167-4175, 1994) donde se diseña un oligonucleótido de ADN que solapa tanto con la secuencia de ADN flanqueante adyacente como con la secuencia de ADN insertada. El oligonucleótido se inmoviliza en los pocillos de una placa de micropocillos. Después de la PCR de la región de interés (usando un cebador en la secuencia insertada y uno en la secuencia flanqueante adyacente), puede hibridarse un producto de la PCR monocatenario al oligonucleótido inmovilizado y servir como molde para una reacción de extensión de una base usando una ADN polimerasa y ddNTP marcados específicos para la siguiente base esperada. La lectura puede estar basada en fluorescencia o en ELISA. Una señal indica la presencia del inserto/secuencia flanqueante debido a la amplificación exitosa, la hibridación y la extensión de una sola base.
Otro método de detección es la técnica de pirosecuenciación descrita por Winge (2000) Innov. Pharma. Tech. 00:18-24. En este método, se diseña un oligonucleótido que solapa con la unión del ADN adyacente y el ADN del inserto. El oligonucleótido se hibrida a un producto de la PCR monocatenario de la región de interés (un cebador en la secuencia insertada y uno en la secuencia flanqueante) y se incuba en presencia de una ADN polimerasa, ATP, sulfurilasa, luciferasa, apirasa, adenosina 5' fosfosulfato y luciferina. Los dNTP se añaden individualmente y la incorporación da como resultado una señal de luz que se mide. Una señal de luz indica la presencia del inserto del transgén/secuencia flanqueante debido a la exitosa amplificación, hibridación y extensión de una sola o de múltiples bases.
La polarización de fluorescencia como se describe por Chen et al., (1999) Genome Res. 9:492-498 es también un método que puede usarse para detectar un amplicón descrito en el presente documento. Usando este método, se diseña un oligonucleótido que solapa la unión del ADN flanqueado e insertado. El oligonucleótido se hibrida con un producto de la PCR monocatenario procedente de la región de interés (un cebador en el ADN insertado y uno en la secuencia de ADN flanqueante) y se incuba en presencia de una ADN polimerasa y un ddNTP marcado fluorescentemente. La extensión de una sola base da como resultado la incorporación del ddNTP. La incorporación puede medirse como un cambio en la polimerización usando un fluorómetro. Un cambio en la polarización indica la presencia del inserto del transgén/secuencia flanqueante debido a la exitosa amplificación, la hibridación y la extensión de una sola base.
Taqman® (PE Applied Biosystems, Foster City, Calif ) se describe como un método para detectar y cuantificar la presencia de una secuencia de ADN y se explica completamente en las instrucciones proporcionadas por el fabricante. En resumen, se diseña una sonda oligonucleotídica FRET que solapa con la unión del ADN flanqueante y del inserto. La sonda de FRET y los cebadores de la PCR (un cebador en la secuencia de ADN del inserto y uno en la secuencia genómica flanqueante) se ciclan en presencia de una polimerasa termoestable y dNTP. La hibridación de la sonda de FRET da como resultado la escisión y liberación del resto fluorescente lejos del resto de inactivación en la sonda de FRET. Una señal fluorescente indica la presencia de la secuencia flanqueante/inserto de transgén debido a una amplificación e hibridación exitosas.
Se han descrito sondas moleculares para su uso en la detección de secuencia, como se describe en Tyangi et al. (1996) Nature Biotech. 14:303-308. En resumen, se diseña una sonda oligonucleotídica FRET que solapa con la unión del ADN flanqueante y del inserto. La estructura única de la sonda de FRET da como resultado que contenga estructura secundaria que mantiene los restos fluorescentes e inactivantes muy próximos. La sonda de FRET y los cebadores de la PCR (un cebador en la secuencia de ADN del inserto y uno en la secuencia flanqueante) se ciclan en presencia de una polimerasa termoestable y dNTP. Después de la amplificación exitosa mediante la PCR, la hibridación de la sonda de FRET a la secuencia diana da como resultado la eliminación de la estructura secundaria de la sonda y la separación espacial de los restos fluorescente y de inactivación. Se obtiene como resultado una señal fluorescente. Una señal fluorescente indica la presencia de la secuencia flanqueante/inserto de transgén debido a una amplificación e hibridación exitosas.
Una reacción de hibridación que usa una sonda específica para una secuencia hallada en el amplicón es otro método más usado para detectar el amplicón producido mediante una reacción PCR.
El evento de maíz DP-004114-3 es eficaz contra plagas de insectos que incluyen insectos seleccionados entre los órdenes de los coleópteros, dípteros, himenópteros, lepidópteros, malófagos, homópteros, hemípteros, ortópteros, tisanópteros, dermápteros, isópteros, anopluros, sifonápteros, tricópteros, etc., en particular, coleópteros y lepidópteros.
Los Insectos del orden de los lepidópteros incluyen, pero sin limitación, gusanos cogolleros, gusanos cortadores, falsos medidores y heliotinas de la familia Noctuidae: Agrotis Ípsilon Hufnagel (gusano cortador negro); A. orthogonia Morrison (gusano cortador occidental); A. segetum Denis y Schiffermüller (polilla del nabo); A. subterranea Fabricius (gusano gris); Alabama argillacea Hübner (gusano de la hoja del maíz); Anticarsia gemmatalis Hübner (oruga de las leguminosas); Athetis mindara Barnes y McDunnough (gusano cortador rugoso); Earias insulana Boisduval (oruga espinosa del algodonero); E. vittella Fabricius (gusano moteado); Egira (Xylomyges) curialis Grote (oruga de los cítricos); Euxoa messoria Harris (gusano cortador); Helicoverpa armigera Hübner (oruga del tomate); H. zea Boddie (gusano elotero); Heliothis virescens Fabricius (oruga del tabaco); Hypena scabra Fabricius (gusano del trébol); Hyponeuma taltula Schaus; Mamestra configurata Walker (gusano de las crucíferas); M. brassicae Linnaeus (polilla de la col); Melanchra picta Harris (oruga cebra); Mocis latipes Guenée (gusano medidor); Pseudaletia unipuncta Haworth (defoliadora del maíz); Pseudoplusia includens Walker (falso medidor de la soja); Richia albicosta Smith (Gusano cortador de la alubia occidental); Spodoptera frugiperda JE Smith (gusano cogollero); S. exigua Hübner (gusano cogollero de la remolacha); S. litura Fabricius (gusano del tabaco); Trichoplusia ni Hübner (medidor de la col); barrenadores, gusanos tejedores, gusanos de las coníferas y esqueletizantes de las familias Pyralidae y Crambidae, tales como Achroia grisella Fabricius (polilla de la cera); Amyelois transitella Walker (gusano anaranjado); Anagasta kuehniella Zeller (polilla de la harina mediterránea); Cadra cautella Walker (polilla de la almendra); Chilo partellus Swinhoe (barrenador moteado del tallo); C. suppressalis Walker (barrenador del arroz); C. terrenellus Pagenstecher (barrenador de la caña de azúcar); Corcyra cephalonica Stainton (polilla del arroz); Crambus caliginosellus Clemens (gusano tejedor del maíz); C. teterrellus Zincken (gusano tejedor del pasto varilla); Cnaphalocrocis medinalis Guenée
(enrollador de la hoja del arroz); Desmia funeralis Hübner (enrollador de la vid); Diaphania hyalinata Linnaeus (gusano del melón); D. nitidalis Stoll (oruga de la calabaza); Diatraea flavipennella Box; D. grandiosella Dyar (barrenador del maíz occidental del sur), D. saccharalis Fabricius (barrenador de la caña de azúcar); Elasmopalpus lignosellus Zeller (barrenador del tallo del maíz); Eoreuma loftini Dyar (barrenador del arroz mexicano); Ephestia elutella Hübner (polilla del tabaco (cacao)); Galleria mellonella Linnaeus (polilla de la cera); Hedylepta accepta Butler (enrollador de la hoja de la caña de azúcar); Herpetogramma licarsisalis Walker (gusano tejedor); Homoeosoma electellum Hulst (polilla del girasol); Loxostege sticticalis Linnaeus (gusano tejedor de la remolacha); Maruca testulalis Geyer (barrenador de la vaina de la alubia); Orthaga thyrisalis Walker (polilla del árbol del té); Ostrinia nubilalis Hübner (barrenador del maíz europeo); Plodia interpunctella Hübner (polilla de la harina india); Scirpophaga incertulas Walker (barrenador amarillo del tallo); Udea rubigalis Guenée (anudador de la hoja del apio); y enrolladores de las hojas, gusanos de los brotes, gusanos de las semillas y gusanos de los frutos de la familia Tortricidae Acleris gloverana Walsingham (polilla de los frutales occidental); A. variana Fernald (polilla de los frutales oriental); Adoxophyes orana Fischer von Rosslerstamm (capua de los frutales); Archips spp. incluyendo A. argyrospila Walker (enrollador de la hoja de los frutales) y A. rosana Linnaeus (enrollador de la hoja europeo); Argyrotaenia spp.; Bonagota salubricola Meyrick (enrolladora de las hojas brasileña); Choristoneura spp.; Cochylis hospes Walsingham (polilla bandeada del girasol); Cydia latiferreana Walsingham (polilla del castaño); C. pomonella Linnaeus (polilla de la manzana); Endopiza viteana Clemens (polilla del grano de la uva); Eupoecilia ambiguella Hübner (polilla de la viña); Grapholita molesta Busck (polilla de la fruta oriental); Lobesia botrana Denis & Schiffermüller (polilla de la vid europea); Platynota flavedana Clemens (rosquilla variegada); P. stultana Walsingham (rosquilla omnívora); Spilonota ocellana Denis & Schiffermüller (piral roja de los brotes); y Suleima helianthana Riley (polilla del brote del girasol).
Otras plagas agronómicas del orden de los lepidópteros incluyen, pero sin limitación, Alsophila pometaria Harris (gusano del cancro); Anarsia lineatella Zeller (barrenador del melocotonero); Anisota senatoria J.E. Smith (oruga rayada naranja del roble); Antheraea pernyi Guérin-Méneville (polilla del roble chino); Bombyx mori Linnaeus (gusano de la seda); Bucculatrix thurberiella Busck (perforador de la hoja del melocotonero); Colias eurytheme Boisduval (oruga de la alfalfa); Datana integerrima Grote & Robinson (oruga de la nuez); Dendrolimus sibiricus Tschetwerikov (polilla de la seda siberiana), Ennomos subsignaria Hübner (oruga del olmo); Erannis tiliaria Harris (áncora del tilo); Erechthias flavistriata Walsingham (polilla del brote de la caña de azúcar); Euproctis chrysorrhoea Linnaeus (polilla marrón); Harrisina americana Guérin-Méneville (esqueletizador de la vid); Heliothis subflexa Guenée; Hemileuca oliviae Cockrell (oruga del rango); Hyphantria cunea Drury (gusano de tela de araña); Keiferia lycopersicella Walsingham (minador del tomate); Lambdina fiscellaria fiscellaria Hulst (barrenador del abeto oriental); L. fiscellaria lugubrosa Hulst (barrenador del abeto occidental); Leucoma salicis Linnaeus (polilla satín); Lymantria dispar Linnaeus (polilla parda); Malacosoma spp.; Manduca quinquemaculata Haworth (gusano cornudo del tomate); M. sexta Haworth (gusano cornudo del tabaco); Operophtera brumata Linnaeus (polilla invernal); Orgyia spp.; Paleacrita vernata Peck (gusano del cancro primaveral); Papilio cresphontes Cramer (mariposa cometa gigante); Phryganidia californica Packard (gusano del roble californiano); Phyllocnistis citrella Stainton (barrenador de la hoja de los cítricos); Phyllonorycter blancardella Fabricius (minador en elipses); Pieris brassicae Linnaeus (mariposa blanca gigante); P. rapae Linnaeus (mariposa blanca pequeña); P. napi Linnaeus (mariposa blanca y verde); Platyptilia carduidactyla Riley (polilla de la alcachofa); Plutella xylostella Linnaeus (polilla de dorso de diamante); Pectinophora gossypiella Saunders (gusano rosado); Pontia protodice Boisduval & Leconte (gusano de la col del sur); Sabulodes aegrotata Guenée (falsa medidora omnívora); Schizura concinna J.E. Smith (oruga de joroba roja); Sitotroga cerealella Olivier (polilla del grano); Telchin licus Drury (barrenador gigante de la caña de azúcar); Thaumetopoea pityocampa Schiffermüller (oruga procesionaria del pino); Tineola bisselliella Hummel (polilla de la ropa); Tuta absoluta Meyrick (minador de la hoja del tomate) e Yponomeuta padella Linnaeus (arañuelo del ciruelo).
Resultan interesantes las larvas y adultos del orden de los coleópteros, incluyendo gorgojos de las familias Anthribidae, Bruchidae y Curculionidae incluyendo, pero sin limitación: Anthonomus grandis Boheman (gorgojo del algodón); Cylindrocopturus adspersus LeConte (gorgojo del tallo del girasol); Diaprepes abbreviatus Linnaeus (picudo de la raíz); Hypera punctata Fabricius (gorgojo del trébol); Lissorhoptrus oryzophilus Kuschel (gorgojo de agua del arroz); Metamasius hemipterus hemipterus Linnaeus (gorgojo rayado de la caña de azúcar); M. hemipterus sericeus Olivier (gorgojo de la caña de azúcar); Sitophilus granarius Linnaeus (gorgojo del grano); S. oryzae Linnaeus (gorgojo del arroz); Smicronyx fulvus LeConte (gorgojo rojo de la semilla del girasol); S. sordidus LeConte (gorgojo gris de la semilla del girasol); Sphenophorus maidis Chittenden (chinche del maíz); S. livis Vaurie (gorgojo de la caña de azúcar); Rhabdoscelus obscurus Boisduval (gorgojo de la caña de azúcar de Nueva Guinea); escarabajos pulga, escarabajos del pepino, gusanos de la raíz, gusanos de las hojas, gusanos de la patata y minadores de las hojas de la familia Chrysomelidae incluyendo, pero sin limitación: Chaetocnema ectypa Horn (escarabajo pulga del maíz del desierto); C. pulicaria Melsheimer (escarabajo pulga del maíz); Colaspis brunnea Fabricius (colaspis de la uva); Diabrotica barberi Smith & Lawrence (gusano de la raíz del maíz del norte); D. undecimpunctata howardi Barber (gusano de la raíz del maíz del sur); D. virgifera virgifera LeConte (gusano de la raíz del maíz occidental); Leptinotarsa decemlineata Say (escarabajo de la patata de colorado); Oulema melanopus Linnaeus (escarabajo de las hojas de los cereales); Phyllotreta cruciferae Goeze (escarabajo pulga del maíz); Zygogramma exclamationis Fabricius (escarabajo del girasol); escarabajos de la familia Coccinellidae incluyendo, pero sin limitación: Epilachna varivestis Mulsant (escarabajo de la alubia mexicano); chafer y otros escarabajos de la familia Scarabaeidae incluyendo, pero sin limitación: Antitrogus parvulus Britton (larva de la caña de Childers); Cyclocephala borealis Arrow (escarabajo enmascarado del norte); C. immaculata Olivier (escarabajo enmascarado del sur); Dermolepida albohirtum Waterhouse (larva de la caña de lomo gris); Euetheola humilis rugiceps LeConte (escarabajo de la caña de azúcar);
Lepidiota frenchi Blackburn (larva de la caña francesa); Tomarus gibbosus De Geer (escarabajo de la zanahoria); T. subtropicus Blatchley (larva de la caña de azúcar); Phyllophaga crinita Burmeister (gusano blanco); P. latifrons LeConte (escarabajo de junio); Popillia japonica Newman (escarabajo japonés); Rhizotrogus majalis Razoumowsky (escarabajo europeo); escarabajos de alfombra de la familia Dermestidae; gusanos de alambre de la familia Elateridae, Eleodes spp., Melanotus spp. incluyendo M. communis Gyllenhal (gusano de alambre); Conoderus spp.; Limonius spp.; Agriotes spp.; Ctenicera spp.; Aeolus spp.; escarabajos de la corteza de la familia Scolytidae; escarabajos de la familia Tenebrionidae; escarabajos de la familia Cerambycidae, tales como, pero sin limitación, Migdolus fryanus Westwood (escarabajo de la caña); y escarabajos de la familia Buprestidae incluyendo, pero sin limitación, Aphanisticus cochinchinae seminulum Obenberger (escarabajo bupresto minador).
Son interesantes los ejemplares adultos e inmaduros del orden Diptera, incluyendo minadores de las hojas Agromyza parvicornis Loew (mosca minadora del maíz); mosquitas que incluyen, pero sin limitación: Contarinia sorghicola Coquillett (mosquito del sorgo); Mayetiola destructor Say (mosca de Hessian); Neolasioptera murtfeldtiana Felt, (mosquito de la semilla del girasol); Sitodiplosis mosellana Géhin (mosquito del trigo); moscas de la fruta (Tephritidae), Oscinella frit Linnaeus (moscas de la fruta); gusanos que incluyen, pero sin limitación: Delia spp. incluyendo Delia platura Meigen (gusano del maíz); D. coarctata Fallen (mosca del trigo); Fannia canicularis Linnaeus, F. femoralis Stein (moscas menores); Meromyza americana Fitch (gusano del tallo del trigo); Musca domestica Linnaeus (mosca doméstica); Stomoxys calcitrans Linnaeus (moscas de establo)); moscas de la cara, moscas de los cuernos, moscardas, Chrysomya spp.; Phormia spp.; y otras plagas de moscas muscoides, tábanos Tabanus spp.; moscardones Gastrophilus spp.; Oestrus spp.; larvas del ganado Hypoderma spp.; moscas de los ciervos Chrysops spp.; Melophagus ovinus Linnaeus (keds); y otras Brachycera, mosquitos Aedes spp.; Anopheles spp.; Culex spp.; moscas negras Prosimulium spp.; Simulium spp.; mosquitos mordedores, moscas de la arena, esciáridos y otras Nematocera.
Se incluyen como insectos de interés aquellos del orden de los hemípteros, tales como, pero sin limitación, las siguientes familias: Adelgidae, Aleyrodidae, Aphididae, Asterolecaniidae, Cercopidae, Cicadellidae, Cicadidae, Cixiidae, Coccidae, Coreidae, Dactylopiidae, Delphacidae, Diaspididae, Eriococcidae, Flatidae, Fulgoridae, Issidae, Lygaeidae, Margarodidae, Membracidae, Miridae, Ortheziidae, Pentatomidae, Phoenicococcidae, Phylloxeridae, Pseudococcidae, Psyllidae, Pyrrhocoridae y Tingidae.
Los miembros agronómicamente importantes del orden de los hemípteros incluyen además, pero sin limitación: Acrosternum hilare Say (chinche verde); Acyrthisiphon pisum Harris (pulgón del guisante); Adelges spp. (adélgidos); Adelphocoris rapidus Say (chinche rápida de plantas); Anasa tristis De Geer (chinche de la calabaza); Aphis craccivora Koch (pulgón del caupí); A. fabae Scopoli (pulgón negro de la alubia); A. gossypii Glover (pulgón del algodón, pulgón del melón); A. maidiradicis Forbes (pulgón de la raíz del maíz); A. pomi De Geer (pulgón del manzano); A. spiraecola Patch (pulgón de la spirea); Aulacaspis tegalensis Zehntner (escama de la caña de azúcar); Aulacorthum solani Kaltenbach (pulgón estriado de la patata); Bemisia tabaci Gennadius (mosca blanca del tabaco, mosca blanca del boniato); B. argentifolii Bellows & Perring (mosca blanca de alas plateadas); Blissus leucopterus leucopterus Say (chinche); Blostomatidae spp.; Brevicoryne brassicae Linnaeus (pulgón de la col); Cacopsylla pyricola Foerster (mieleta del peral); Calocoris norvegicus Gmelin (chinche de la cápside de la patata); Chaetosiphon fragaefolii Cockerell (pulgón de la fresa); Cimicidae spp.; Coreidae spp.; Corythuca gossypii Fabricius (chinche de encaje); Cyrtopeltis modesta Distant (chinche del tomate); C. notatus Distant (chicharrita); Deois flavopicta Stál (chinche); Dialeurodes citri Ashmead (mosca blanca de los cítricos); Diaphnocoris chlorionis Say (chinche de la acacia de las tres espinas); Diuraphis noxia Kurdjumov/Mordvilko (pulgón del trigo ruso); Duplachionaspis divergens Green (escama armada); Dysaphis plantaginea Paaserini (pulgón rosado del manzano); Dysdercus suturellus Herrich-Schaffer (tinte del algodón); Dysmicoccus boninsis Kuwana (chinche harinosa gris de la caña de azúcar); Empoasca fabae Harris (saltahojas de la patata); Eriosoma lanigerum Hausmann (pulgón lanígero del manzano); Erythroneoura spp. (saltahojas de la vid); Eumetopina flavipes Muir (saltaplantas de la caña de azúcar); Eurygaster spp.; Euschistus servus Say (chinche hedionda parda); E. variolarius Palisot de Beauvois (chinche hedionda de una mancha); Graptostethus spp. (complejo de chinches de semillas); y Hyalopterus pruniGeoffroy (pulgón harinoso de la ciruela); Icerya purchasi Maskell (cochinilla acanalada); Labopidicola allii Knight (chinche de la planta de la cebolla); Laodelphax striatellus Fallen (saltahojas menor pardo); Leptoglossus corculus Say (chinche del piñón); Leptodictya tabida Herrich-Schaeffer (chinche de encaje); Lipaphis erysimi Kaltenbach (pulgón del nabo); Lygocoris pabulinus Linnaeus (cápsido verde común); Lygus lineolaris Palisot de Beauvois (chinche lygus); L. Hesperus Knight (chinche lygus occidental); L. pratensis Linnaeus (chinche del páramo común); L. rugulipennis Poppius (chinche lygus europea); Macrosiphum euphorbiae Thomas (pulgón de la patata); Macrolestes quadrilineatus Forbes (saltahojas del áster); Magicicada septendecim Linnaeus (chicharra periódica); Mahanarva fimbriolata Stál (chinche salivosa); M. posticata Stál (cigarrita de la caña de azúcar); Melanaphis sacchari Zehntner (pulgón de la caña de azúcar); Melanaspis glomerata Green (escama negra); Metopolophium dirrhodum Walker (pulgón rosado de los cereales); Myzus persicae Sulzer (pulgón del melocotón-patata, pulgón verde del melocotonero); Nasonovia ribisnigri Mosley (pulgón de la lechuga); Nephotettix cinticeps Uhler (saltahojas verde); N. nigropictus Stál (saltahojas del arroz); Nezara viridula Linnaeus (chinche hedionda verde del sur); Nilaparvata lugens Stál (saltaplantas pardo); Nysius ericae Schilling (falsa chinche); Nysius raphanus Howard (falsa chinche); Oebalus pugnax Fabricius (chinche hedionda del arroz); Oncopeltus fasciatus Dallas (gran chinche del algodoncillo); Orthops campestris Linnaeus; Pemphigus spp. (pulgones de las raíces y pulgones de las agallas); Peregrinus maidis Ashmead (saltaplantas del maíz); Perkinsiella saccharicida Kirkaldy (saltahojas de la caña de azúcar); Phylloxera devastatrix Pergande (phylloxera del pecán); Planococcus citri Risso (pulgón harinoso de
los cítricos); Plesiocoris rugicollis Fallen (cápsido de la manzana); Poecilocapsus lineatus Fabricius (chinche de plantas de cuatro rayas); Pseudatomoscelis seriatus Reuter (saltona del algodón); Pseudococcus spp. (otros del complejo de pulgones harinosos); Pulvinaria elongata Newstead (escama del ficus); Pyrilla perpusilla Walker (saltahojas de la caña de azúcar); Pyrrhocoridae spp.; Quadraspidiotus perniciosus Comstock (cochinilla de san José); Reduviidae spp.; Rhopalosiphum maidis Fitch (pulgón de la hoja del maíz); R. padi Linnaeus (pulgón de la avena); Saccharicoccus sacchari Cockerell (chinche harinosa rosada de la caña de azúcar); Scaptocoris castanea Perty (chinche hedionda parda de las raíces); Schizaphis graminum Rondani (chinche verde); Sipha flava Forbes (pulgón amarillo de la caña de azúcar); Sitobion avenae Fabricius (pulgón del grano inglés); Sogatella furcifera Horvath (saltaplantas de dorso blanco); Sogatodes oryzicola Muir (saltahojas del arroz); Spanagonicus albofasciatus Reuter (pulga saltona negra); Therioaphis maculata Buckton (pulgón moteado de la alfalfa); Tinidae spp.; Toxoptera aurantii Boyer de Fonscolombe (pulgón negro de los cítricos); y T. citricida Kirkaldy (pulgón pardo de los cítricos); Trialeurodes abutiloneus (mosca blanca de alas bandeadas) y T. vaporariorum Westwood (mosca blanca del invernadero); Trioza diospyri Ashmead (mieleta del caqui); y Typhlocyba pomaria McAtee (saltahojas blanco del manzano).
También se incluyen los adultos y las larvas del orden Acari (ácaros) tales como Aceria tosichella Keifer (ácaro rizado del trigo); Panonychus ulmi Koch (araña roja europea); Petrobia latens Müller (ácaro pardo del trigo); Steneotarsonemus bancrofti Michael (ácaro del tallo de la caña de azúcar); arañuelas y arañas rojas de la familia Tetranychidae, Oligonychus grypus Baker & Pritchard, O. indicus Hirst (ácaro de la hoja de la caña de azúcar), O. pratensis Banks (ácaro de la hierba de Banks), O. stickneyi McGregor (arañuela de la caña de azúcar); Tetranychus urticae Koch (arañuela de dos puntos); T. mcdanieli McGregor (arañuela de McDaniel); T. cinnabarinus Boisduval (arañuela carmín); T. turkestani Ugarov & Nikolski (arañuela de la fresa), ácaros planos de la familia Tenuipalpidae, Brevipalpus lewisi McGregor (ácaro plano de los cítricos); ácaros de la roya de la familia Eriophyidae y otros ácaros que se alimentan de hojas importantes en la salud humana y animal, es decir, ácaros del polvo de la familia Epidermoptidae, ácaros de los folículos de la familia Demodicidae, ácaros del grano de la familia Glycyphagidae, garrapatas y otras Ixodidae. Ixodes scapularis Say (garrapata del ciervo); I. holocyclus Neumann (garrapata paralizante australiana); Dermacentor variabilis Say (garrapata común americana); Amblyomma americanum Linnaeus (garrapata solitaria); y ácaros de la sarna de las familias Psoroptidae, Pyemotidae y Sarcoptidae.
Son interesantes las plagas de insectos del orden Thysanura, tales como Lepisma saccharina Linnaeus (pececillo de plata); Thermobia domestica Packard (insecto de fuego).
Las plagas de artrópodos adicionales abarcadas incluyen: arañas del orden Araneae tales como Loxosceles reclusa Gertsch & Mulaik (araña reclusa parda); y Latrodectus mactans Fabricius (araña viuda negra); y ciempiés del orden Scutigeromorpha tales como Scutigera coleoptrata Linnaeus (ciempiés doméstico). Además, son interesantes las plagas de insectos del orden de los isópteros, incluyendo aquellos del familia Termitidae, tales como, pero sin limitación, Cornitermes cumulans Kollar, Cylindrotermesnordenskioeldi Holmgren y Pseudacanthotermes militaris Hagen (termita de la caña de azúcar); así como de la familia Rhinotermitidae incluyendo, pero sin limitación, Heterotermes tenuis Hagen. También son de interés los insectos del orden de los tisanópteros, incluyendo, pero sin limitación, trips, tales como Stenchaetothrips minutus van Deventer (trips de la caña de azúcar).
Las realizaciones de la presente invención se definen adicionalmente en los siguientes ejemplos. Ha de entenderse que estos ejemplos se proporcionan únicamente a modo ilustrativo.
Ejemplos
Ejemplo 1. Transformación de maíz mediante transformación con Agrobacterium y regeneración de plantas transgénicas que contienen los genes Cry1F, Cry34Ab1, Cry35Ab1 (Cry34/35Ab1) y Pat
El maíz 4114 se produjo mediante transformación mediada por Agrobacterium con el plásmido PHP27118. Este evento contiene los casetes génicos cry1F, cry34Ab1, cry35Ab1 y pat, que confieren resistencia a ciertas plagas de lepidópteros y coleópteros.
Específicamente, el primer casete contiene una versión truncada del gen cry1F de Bt var. aizawai. La inserción del gen cry1F confiere resistencia al daño por plagas de lepidópteros, incluyendo ECB y FAW. La proteína Cry1F (SEQ ID NO: 1) está formada por 605 aminoácidos y tiene un peso molecular de aproximadamente 68 kDa. La expresión del gen cry1F está controlada por el promotor de poliubiquitina de maíz (Christensen et al., 1992, anteriormente citado), que proporciona expresión constitutiva de la proteína Cry1F en maíz. Esta región también incluye la 5' UTR y el intrón asociado con el promotor de poliubiquitina nativo. El terminador para el gen cry1F es la señal de adición de poli(A) del marco abierto de lectura 25 (ORF 25) del plásmido Ti de Agrobacterium tumefaciens (A. tumefaciens) pTi15955 (Barker et al., 1983, supra).
El segundo casete contiene el gen cry34Ab1 aislado de Bt cepa PS149B1 (Patentes de los Estados Unidos n.° 6.127.180; 6.624.145 y 6.340.593). La proteína Cry34Ab1 (SEQ ID NO: 2) tiene 123 aminoácidos de longitud y tiene un peso molecular de aproximadamente 14 kDa. La expresión del gen cry34Ab1 se controla por una segunda copia del promotor de poliubiquitina de maíz con 5' UTR e intrón (Christensen et al., 1992, anteriormente citado). El terminador para el gen cry34Ab1 es el terminador pinII (Keil et al., 1986, anteriormente citado; An et al., 1989,
anteriormente citado).
El tercer casete génico contiene el gen cry35Ab1, también aislado de Bt cepa PS149B1 (Patentes de los Estados Unidos n.° 6.083.499; 6.548.291 y 6.340.593). La proteína Cry35Ab1 (SEQ ID NO: 3) tiene una longitud de 383 aminoácidos y un peso molecular de aproximadamente 44 kDa. La expresión simultánea de las proteínas Cry34Ab1 y Cry35Ab1 en la planta confiere resistencia a los insectos coleópteros, incluyendo la WCRW. La expresión del gen cry35Ab1 está controlada por la secuencia de promotor y líder de peroxidasa de Triticum aestivum (trigo) (Hertig et al.
1991, anteriormente citado). El terminador para el gen cry35Ab1 es una segunda copia del terminador pinII (Keil et al.
1986, anteriormente citado; An et al. 1989, anteriormente citado).
El casete cuarto y final contiene una versión de pat de Streptomyces viridochromogenes que se ha optimizado para su expresión en maíz. El gen pat expresa PAT, que confiere tolerancia a la fosfinotricina (glufosinato-amonio). La proteína PAT (SEQ ID NO: 4) tiene 183 aminoácidos de longitud y tiene un peso molecular de aproximadamente 21 kDa. La expresión del gen pat está controlada por las regiones promotoras y terminadoras del transcrito de 35S de CaMV (Franck et al., 1980, anteriormente citado; Odell et al., 1985, anteriormente citado; Pietrzak, et al., 1986, anteriormente citado). También se proporcionan plantas que contienen las construcciones de ADN. Una descripción de los elementos genéticos en el ADN-T de PHP27118 (expuesto en la SEQ ID NO: 5) y sus fuentes se describen adicionalmente en la tabla 1.
T l 1: El m n n i n l r i n ADN-T l l mi PHP2711
continuación
Se extrajeron en condiciones asépticas embriones inmaduros de maíz (Zea mays L.) de la cariópside en desarrollo nueve a once días después de la polinización y se inocularon con A. tumefaciens cepa LBA4404 que contenía el plásmido PHP27118 (figura 1), esencialmente como se describe en Zhao (Patente de los Estados Unidos n.° 5.981.840). La región de ADN-T de PHP27118 se muestra en la figura 2. Después de tres a seis días de cultivo conjunto del embrión y el Agrobacterium en medio de cultivo sólido sin selección, se transfirieron los embriones a un medio sin selección con herbicida pero que contenía carbenicilina. Después de tres a cinco días en este medio, se transfirieron los embriones a medio de selección que era estimulante para la embriogénesis somática del maíz y que contenía bialafos para la selección de células que expresan el transgén pat. El medio también contenía carbenicilina para eliminar cualquier Agrobacterium restante. Después de seis a ocho semanas en el medio de selección, se identificaron callos sanos en crecimiento que demostraron resistencia al bialafos. Los supuestos callos transgénicos se regeneraron posteriormente para producir plántulas de T0.
Se tomaron muestras de las plántulas de T0 para su análisis por la PCR para verificar la presencia y el número de copias de los genes crylF, cry35Ab1, cry34Abl y/o pat insertados. Se confirmó que el evento de maíz DP-004114-3 contenía una sola copia del ADN-T (véanse los ejemplos 2 y 3). Además de este análisis, se analizaron las plántulas de T0 respecto de la presencia de ciertas secuencias de la cadena principal del vector binario de Agrobacterium mediante la PCR (datos no mostrados). Se seleccionaron las plantas en las que se determinó que tenían una sola copia para los genes insertados y negativas para las secuencias de la cadena principal de Agrobacterium para su propagación adicional en el invernadero. Se sometió a estas plantas de T0 seleccionadas a una detección sistemática de eficacia de rasgos y de expresión de proteínas llevando a cabo numerosos bioensayos (véase el ejemplo 5). Las plantas de T0 que cumplían todos los criterios pasaron a la siguiente fase y se cruzaron con líneas endógamas para producir simiente para las pruebas posteriores. En la figura 3 se muestra una vista general de la transformación y el desarrollo del evento.
Ejemplo 2. Caracterización del evento de maíz DP-004114-3
Se aisló ADN genómico de tejido foliar de simiente de ensayo de maíz 4114 y una sustancia de control (simiente de un maíz no modificado genéticamente con un acervo genético representativo del acervo genético del evento) y se sometió a amplificación mediante PCR cualitativa usando un par de cebadores específicos para la construcción. Los productos de la PCR se separaron en un gel de agarosa para confirmar la presencia de la construcción insertada en el ADN genómico aislado de la simiente de ensayo y la ausencia de la construcción insertada en el ADN genómico aislado de la simiente de control. Se usó un patrón de referencia (escala para ADN de baja masa; Invitrogen Corporation, n.° de catálogo 10380-012) para determinar el tamaño del producto de la PCR. Se evaluó la fiabilidad del método PCR específico para la construcción repitiendo tres veces el experimento. Se evaluó la sensibilidad de la amplificación por la PCR mediante diversas diluciones del ADN genómico del maíz 4114.
Se recogieron muestras foliares de ensayo y control (etapa foliar V5-V7) de plantas cultivadas en la Estación Experimental de DuPont (Wilmington, DE) a partir de semillas obtenidas de Pioneer Hi-Bred (Johnston, IA). Se llevaron a cabo extracciones de ADN genómico de los tejidos foliares de ensayo y de control usando un protocolo de extracción de urea convencional.
El ADN genómico se cuantificó usando el espectrofotómetro NanoDrop 1000 usando el programa informático ND-1000 V3.6 (ThermoScientific, Wilmington, DE) y el reactivo Quant-iT PicoGreen® (Invitrogen, Carslbad, CA). Las muestras de ADN se visualizaron en un gel de agarosa para confirmar los valores de cuantificación y para determinar la calidad del ADN.
Las muestras de ADN genómico aisladas del tejido foliar del maíz 4114 y las muestras de control se sometieron a amplificación por la PCR (Roche High Fidelity PCR Master Kit, Roche, n.° de catálogo 12140314001) utilizando un par de cebadores específicos para la construcción (SEQ ID NO: 7 y 8) que abarcan el terminador del ORF 25 de maíz y el promotor de ubiquitina (véase la figura 2) y permite la identificación única del ADN-T insertado en el maíz 4114. Un segundo par de cebadores (SEQ ID NO: 9 y 10) se usó para amplificar el gen de invertasa endógeno de maíz (n.° de referencia de GenBank AF171874.1) como control positivo para la amplificación por la PCR. El sitio diana de la PCR y el tamaño del producto de la PCR esperado para cada cebador se muestran en la tabla 2. Los reactivos de la PCR y las condiciones de reacción se muestran en la tabla 3. En este estudio, se usaron 50 ng de ADN genómico foliar en todas las reacciones PCR.
T l 2: i i i n ADN n mi l P R m ñ r l r l P R
Tabla 3: Reactivos condiciones de reacción de la PCR
Un producto de la PCR con un tamaño de aproximadamente 300 pb amplificado mediante el conjunto de cebadores específicos para la construcción (SEQ ID NO: 7 y 8) se observa en las reacciones de la PCR usando el plásmido PHP27118 (10 ng) como molde y todas las muestras de ADN de maíz 4114, pero en ausencia de todas las muestras de maíz de control y el control sin molde. Este experimento se repitió tres veces y se obtuvieron resultados similares.
Los resultados observados para los extractos de ADN de cinco plantas de maíz 4114 y cinco plantas de maíz de control correspondieron estrechamente con el tamaño del producto de la PCR esperado (287 pb) para las muestras que contenían ADN genómico de maíz 4114. Se observó un producto de la PCR con un tamaño de aproximadamente 220 pb para las muestras tanto de maíz 4114 como de maíz de control después de la reacción PCR con el conjunto de cebadores (SEQ ID NO: 9 y 10) para la detección del gen de invertasa de maíz endógeno. Estos resultados corresponden estrechamente con el tamaño esperado del producto de la PCR (225 pb) para las muestras de ADN genómico que contienen el gen de invertasa endógeno de maíz. La banda diana endógena no se observó en el control sin molde.
Para evaluar la sensibilidad de la amplificación mediante la PCR, se diluyeron diversas concentraciones de una sola muestra de ADN de maíz 4114 en ADN de control no modificado genéticamente, dando como resultado cantidades de ADN de maíz 4114 en el intervalo de 500 fg, 5 pg, 10 pg, 50 pg, 100 pg, 500 pg, 5 ng y 50 ng (la cantidad total de ADN genómico en todas las muestras de la PCR fue de 50 ng). Cada dilución se sometió a amplificación PCR como se efectuó anteriormente. Basándose en este análisis, se determinó que el límite de detección (LDD) era de aproximadamente 100 pg de ADN de maíz 4114 en 50 ng de ADN total o un 0,2 % de ADN de maíz 4114.
En conclusión, el análisis por PCR cualitativa utilizando un conjunto de cebadores específico para la construcción para el maíz 4114 confirmó que las plantas de ensayo contenían el ADN-T insertado del plásmido PHP27118, como resulta evidente por la presencia de la banda diana específica para la construcción en todas las muestras de planta de ensayo analizadas y la ausencia en las plantas de control no modificadas genéticamente. Este resultado fue reproducible. Las plantas de ensayo y de control contenían el gen endógeno de invertasa de maíz. La sensibilidad del análisis en las condiciones descritas es de aproximadamente 100 pg de ADN genómico de maíz 4114 en 50 ng de ADN genómico total o un 0,2 % de ADN genómico de maíz 4114.
Ejemplo 3. Análisis de transferencia de Southern de maíz DP-004114-3 para determinar la integridad y el número de copias
Se usó análisis de transferencia de Southern para confirmar la integridad y el número de copias del ADN-T insertado de PHP27118 y para confirmar la presencia de los casetes génicos de crylF, cry34Ab1, cry35Ab1 y pat en el maíz 4114.
Se seleccionaron cinco plantas individuales de la generación T1 del maíz 4114 para su análisis por transferencia de Southern. Se recogió material foliar joven de las plantas de maíz 4114 (ensayo) y de maíz no transgénicas (control) y se colocó inmediatamente sobre nieve carbónica. Las muestras congeladas se liofilizaron y se extrajo el ADN genómico de los tejidos de ensayo y de control usando un método de extracción con CTAB.
Después de las digestiones con enzima de restricción como se detallan más adelante, se separaron los fragmentos de ADN en geles de agarosa, se despurinizaron, se desnaturalizaron y se neutralizaron in situ y se transfirieron a una membrana de nylon en tampón SSC 20X usando el método descrito para el TURBOBLOTTEr ™ Rapid Downward Transfer System (Schleicher y Schuell). Después de la transferencia a la membrana, el ADN se unió a la membrana mediante reticulación con luz ultravioleta.
Integridad
Se seleccionó la enzima de restricción Hind III para el análisis por transferencia de Southern de la integridad, ya que hay tres sitios ubicados en el ADN-T (figura 2). Se digirieron aproximadamente 1-3 pg de ADN genómico con Hind III y se separaron por tamaños en un gel de agarosa. Como control positivo, se añadieron aproximadamente 15 pg de plásmido que contenía el ADN-T de PHP27118 en una muestra de ADN vegetal de control, se digirió y se incluyó en el gel de agarosa. También se incluyó un control negativo para verificar la hibridación de fondo dela sonda al genoma de maíz.
Para la hibridación, se usaron cuatro sondas homólogas para los genes crylF, cry34Ab1, cry35Ab1 y pat en el ADN-T de PHP27118 (para los elementos génicos, véase la figura 2) para confirmar la presencia de los genes. Para desarrollar las sondas, se generaron fragmentos homólogos a los genes crylF, cry34Ab1, cry35Ab1 y pat mediante la PCR a partir del plásmido que contenía el ADN-T de PHP27118, se separaron por tamaños en un gel de agarosa y se purificaron usando un kit de extracción de gel QIAquick® (Qiagen). Posteriormente se generaron todas las sondas de ADN a partir de los fragmentos usando el sistema de marcado de ADN Rediprime™ II (Amersham) que lleva a cabo el marcaje prima aleatorio con [32P]dCTP.
Las sondas marcadas se hibridaron con el ADN diana en las membranas de nylon para la detección de los fragmentos específicos usando la solución de hibridación MiracleHyb® esencialmente como se describe por el fabricante (Stratagene). Los lavados después de la hibridación se llevaron a cabo en condiciones de alta rigurosidad. Las transferencias se expusieron a una película de rayos X a -80 °C durante uno o más puntos de tiempo para detectar los fragmentos de hibridación.
Debido a que se conocen los sitios de la enzima Hind III en el ADN-T, se determinaron los tamaños esperados de la
banda para cada una de las sondas (tabla 4, figura 2). Para una copia intacta del ADN-T, se esperaba que la sonda para cry lF hibridase con un fragmento de 3891 pb. Se esperaba que las sondas para los genes cry34Ab1, cry35Ab1 y pat se hibridasen a un fragmento de 7769 pb. Los fragmentos de las muestras de ensayo que coinciden con los tamaños esperados, así como coincidentes con las bandas en la muestra de control de plásmido, pueden confirmar la integridad del ADN-T insertado y la presencia de cada gen.
Los resultados del análisis de transferencia de Southern con Hind III y las sondas para los genes crylF, cry34Ab1, cry35Ab1 y pat confirmó los tamaños de fragmento esperados y, por lo tanto, confirmaron que el a DN-T se insertó intacto en cada uno de los eventos y que estaba presente cada uno de los genes.
Se observó una banda de aproximadamente 4 kb con la sonda para crylF, lo que es coherente con el tamaño de fragmento esperado. Se observó un fragmento similar de aproximadamente 4 kb en el carril de control positivo de plásmido, que se supuso que era la banda esperada de 3891 pb. Basándose en la migración equivalente de la banda de hibridación en los eventos para la banda en el control positivo de plásmido, se confirmó que la porción del ADN-T que contenía cry lF se había insertado intacta en el maíz 4114.
En la hibridación con la sonda para cry34Ab1, se observó una banda de aproximadamente 8 kb en el evento y también en el control positivo del plásmido. Se supuso que la branda de hibridación en el carril de control positivo de plásmido era la banda esperada de 7769 pb. Debido a que la banda de hibridación en el evento había migrado de manera equivalente con esta banda, se confirmó que esta porción del ADN-T que contenía cry34Ab1 se había insertado intacta.
De manera similar, las hibridaciones con cry35Ab1 y pat se hibridaron con el mismo fragmento de 7769 pb en la planta y el control positivo de plásmido, como se esperaba. Estos resultados confirmaron que la porción del ADN-T que contenía los genes cry35Ab1 y pat se había insertado intacta.
Este análisis por transferencia de Southern confirma que el maíz 4114 contiene una copia intacta del ADN-T de PHP27118 que contiene los genes crylF, cry34Ab1, cry35Ab1 y pat.
Tabla 4: Sumario de los fragmentos de hibridación esperados y observados en las transferencias de h rn r l ADN m íz 4114 i ri n Hin III
Número de copias
Se usaron las sondas para cry lF y pat en las hibridaciones por transferencia de Southern para evaluar el número de copias de las inserciones en maíz 4114.
Se seleccionó la enzima de restricción Bcl I para el análisis por transferencia de Southern del número de copias, ya que hay un solo sitio ubicado en el ADN-T (figura 2). Aproximadamente 3 |jg de ADN genómico de plantas individuales de la generación T1 del evento 4114 se digirieron con Bcl I y se separaron por tamaños en un gel de agarosa. Se añadió un plásmido que contenía el ADN-T de PHP27118 en una muestra de ADN vegetal de control, se digirió y se incluyó en el gel de agarosa para que sirviese como control positivo de hibridación. También se incluyó ADN de maíz de control negativo para verificar la hibridación de fondo de la sonda al genoma de maíz. Se incluyó el marcador de peso molecular de ADN VII, marcado con digoxigenina (DIG) (Roche, Indianápolis, IN), en las transferencias de Bcl I como patrón de tamaño para los fragmentos de hibridación.
Las sondas para los genes cry lF y pat también se marcaron mediante una reacción PCR que incorpora un nucleótido marcado con digoxigenina (DIG), [DIG-11]-dUTP, en el fragmento. El marcaje mediante la PCR de los fragmentos aislados se llevó a cabo de acuerdo con los procedimientos proporcionados en el kit de síntesis de la sonda de DIG para la PCR (Roche).
Las sondas marcadas con DIG se hibridaron con las transferencias de Southern de Bcl I de la generación T1 del evento 4114. Las sondas se hibridaron con el ADN diana para la detección de los fragmentos específicos usando la
solución DIG Easy Hyb (Roche) esencialmente como se describe por el fabricante. Los lavados después de la hibridación se llevaron a cabo en condiciones de alta rigurosidad. Las sondas marcadas con DIG hibridadas a los fragmentos unidos se detectaron usando el sistema para detección de ácido nucleico quimioluminiscente CDP-Star (Roche). Las transferencias se expusieron a una película de rayos X a temperatura ambiente durante uno o más puntos de tiempo para detectar los fragmentos de hibridación. Las membranas se despojaron de sonda hibridada siguiendo las recomendaciones del fabricante antes de la hibridación con sondas adicionales.
La enzima de restricción Bcl I, que tiene un solo sitio de restricción en el ADN-T (figura 2), se seleccionó para confirmar la presencia de una sola inserción de ADN-T de PHP27118 en el maíz 4114. El sitio para Bcl I está ubicado en el pb 2546 del ADN-T (figura 2) y proporcionará fragmentos de más de aproximadamente 2500 pb y 9400 pb para un solo ADN-T insertado. La hibridación con la sonda de pat podría indicar el número de copias de este elemento hallado en el evento basándose en el número de bandas de hibridación (por ejemplo, una banda de hibridación indica una copia del elemento). La sonda para pat podría hibridar con el fragmento de más de 9400 pb. Debido a que el sitio de la enzima de restricción Bcl I se encuentra en el gen crylF, se espera que la sonda para cry lF se hibride a ambos fragmentos y dé como resultado dos bandas para una sola inserción de ADN-T (figura 2).
Los resultados del análisis de transferencia de Southern con Bcl I y las sondas para los genes cry lF y pat para el maíz 4114 se resumen en la tabla 5.
Tabla 5: Sumario de los fragmentos de hibridación esperados y observados en transferencias de Southern ara di estiones con Bcl I de maíz 4114
Los resultados del análisis de transferencia de Southern del maíz 4114 con digestión con Bcl I y la sonda para cry lF mostró dos bandas como se esperaba, una banda de más de 8,6 kb y una segunda banda de aproximadamente 3,1 kb. Se esperan dos bandas para una sola inserción debido a la ubicación del sitio de Bcl I en el gen crylF, por lo que estos resultados indican que hay una sola copia de cry lF en el maíz 4114. Los resultados del análisis de transferencia de Southern del maíz 4114 con digestión con Bcl I y la sonda para pat mostraron una sola banda de más de 8,6 kb que coincidía con el tamaño de la banda de crylF de mayor tamaño, como se esperaba. Estos resultados indican que también hay una sola inserción del gen pat en el evento de maíz 4114.
Ya que los genes cry34Ab1 y cry35Ab1 están ubicados en el mismo fragmento que el gen pat y parte del gen crylF y entre los genes crylF y pat en el ADN-T, por extensión esto también demuestra que es probable que este evento contenga una sola copia de cada uno de estos genes.
Ejemplo 4. Caracterización por secuenciación del inserto y las regiones de borde genómico del evento de maíz DP-004114-3
La secuencia del inserto y de las regiones de borde genómico se determinaron para confirmar la integridad del ADN insertado y para caracterizar la secuencia genómica que flanquea el sitio de inserción presente en el maíz 4114. En total, se confirmaron 16.752 pb de la secuencia genómica de maíz 4114, que comprende 2.422 pb de la secuencia de borde genómico 5', 2.405 pb de la secuencia de borde genómico 3' y 11.925 pb de ADN-T insertado de PHP27118. Se observó que el ADN-T insertado en el maíz 4114 tenía una eliminación de 29 pb en el extremo del borde derecho (RB) y una eliminación de 24 pb en el extremo del borde izquierdo (LB). Toda la demás secuencia se encuentra intacta y es idéntica a la del plásmido PHP27118. Se verificó que las regiones del borde genómico 5' y 3' del maíz 4114 eran procedentes de maíz mediante amplificación por la PCR y secuenciación de las regiones de borde genómico de plantas tanto de maíz 4114 como de maíz de control.
Se obtuvo simiente que contenía el evento DP-004114-3 de una generación T1S2 de maíz 4114. Se obtuvo simiente de control de una línea de maíz que tiene un acervo genético similar al del maíz 4114 pero que no contiene los casetes génicos de cry1F, cry34Ab1, cry35Ab1 y pat. Todas las semillas se obtuvieron de Pioneer Hi-Bred International, Inc. (Johnston, IA). Se usaron la escala de ADN de bajo peso molecular (Invitrogen Corp., Carlsbad, CA) y la escala de ADN de alto peso molecular (Invitrogen Corp.) para la electroforesis en gel para estimar los tamaños de fragmento de ADN en geles de agarosa.
Se sembraron la simiente de maíz 4114 y la simiente de control en cámaras de crecimiento en la estación experimental de DuPont (Wilmington, DE) para producir los tejidos vegetales usados para este estudio. Se sembró una semilla por maceta y la maceta se identificó de manera única. Todas las plantas se cultivaron con luz, temperatura y agua reguladas para un crecimiento saludable de la planta. Se recogieron muestras foliares de las plantas de maíz de control y 4114. Para cada planta individual, se recogió material foliar en una bolsa premarcada, se colocó sobre nieve carbónica y después se transfirió a un congelador a temperatura extremadamente baja (<-55 °C) después de la recogida. Todas las muestras se mantuvieron congeladas hasta el procesado de los tejidos.
Confirmación del genotipo mediante análisis PCR específico de evento
Se tomó una muestra foliar de todas las plantas de ensayo y de control para un análisis PCR específico para eventos. Se extrajo ADN de cada muestra foliar usando el kit para la PCR de plantas Extract-N-Amp™ siguiendo el procedimiento descrito (Sigma-Aldrich, St. Louis, MO) para el análisis por PCR en tiempo real.
La PCR en tiempo real se llevó a cabo en cada muestra de ADN usando un sistema de detección de secuencia ABI PRISM® 7500HT (Applied Biosystems, Inc., Foster City, CA). Se diseñaron conjuntos de sondas TaqMan® (Applied Biosystems, Inc.) y cebadores (Integrated DNA Technologies, Coralville, IA) para detectar una secuencia diana de maíz 4114. Además, se usó un segundo conjunto de sonda TaqMan® y cebador para un gen endógeno de maíz de referencia para confirmar la presencia de ADN amplificable en cada reacción. El análisis consistió en la determinación por PCR en tiempo real de las llamadas positivas/negativas cualitativas. El ADN extraído se evaluó usando la mezcla maestra para PCR universal TaqMan®, No AmpErase® UNG (Applied Biosystems, Inc.).
La determinación positiva o negativa para el maíz 4114 se basó en la comparación del CT (ciclo umbral) de la PCR diana específica para el evento con la de la diana de referencia endógena de maíz. En caso de que dianas de la PCR del evento y endógenas se amplificasen por encima del CT umbral, la planta se marcó como positiva para dicho evento. En caso de que se amplificase la diana endógena y no la diana del evento, la planta se puntuó como negativa. En caso de que no se amplificase ninguna de las dianas para una muestra particular, se determinó que era una muestra de ADN de mala calidad o un ensayo fallido y se repitió el ensayo.
Todas las plantas de maíz 4114 fueron positivas para la PCR específica del evento y las proteínas PAT, Cry1F y Cry34Ab1, mientras que todas las plantas de maíz de control fueron negativas. Los resultados se resumen en la tabla 6.
Tabla 6. Sumario del análisis PCR específico para el evento y la expresión de las proteínas CrylF, Cry34Ab1
PAT en lantas^ de maíz 4114 de maíz de control
Secuenciación de ADN
Los fragmentos de ADN se clonaron y enviaron para su secuenciación al servicio de secuenciación de Pioneer Crop Genetics Research (Wilmington, DE). Se usó el programa informático Sequencher™ de Gene Codes Corporation (Ann Arbor, Michigan) para ensamblar las secuencias. La anotación de secuencias se llevó a cabo usando Vector NTI 9.1.0 (Invitrogen Corp) comparando las secuencias de inserto de ADN-T generadas a partir del maíz 4114 con las secuencias de la región de ADN-T del plásmido PHP27118 (usadas para la transformación para producir maíz 4114).
La región de ADN-T del plásmido PHP27118, usada para crear maíz 4114, se secuenció y comparó con la secuencia de ADN-T insertada en el maíz 4114.
Se usó la secuencia de la región de ADN-T del plásmido PHP27118 para diseñar pares de cebadores para caracterizar el ADN-T insertado en el maíz 4114. Se generaron seis productos de la PCR solapantes usando ADN genómico de cuatro plantas de maíz 4114 diferentes como molde. Estos productos de la PCR se clonaron y secuenciaron.
Secuenciación de las regiones de borde genómico flanqueante 5' y 3'
La caracterización de secuencia preliminar de las regiones de borde genómico flanqueantes 5' y 3' se llevaron a cabo usando varias rondas de PCR inversa, (Silver y Keerikatte (1989) J. Virol. 63: 1924; Ochman et al. (1988) Genetics 120:621-623; Triglia et al., (1988) Nucl. Acids Res. 16:8186) con cebadores anclados en varias regiones del ADN-T insertado. La información de secuencia obtenida de la PCR inversa se sometió a análisis BLASTn y se mostró que coincidían con el clon BAC de maíz AC211214 de la base de datos de nucleótidos GenBank del NCBI (National Center for Biotechnology Information). Esta secuencia se usó posteriormente para diseñar cebadores que abarcaban las uniones de inserto/genómicas 5' y 3' en el maíz 4114. Los productos de la PCR generados a partir de cuatro plantas de maíz 4114 se clonaron y secuenciaron para verificar las uniones del inserto/genómicas 5' y 3' y las regiones del borde genómico.
Además, para demostrar que las regiones de borde genómico 5' y 3' eran procedentes de maíz, se llevó a cabo la PCR en plantas de maíz 4114 y de maíz de control en las regiones genómicas. Cada fragmento de la PCR se secuenció directamente para verificar su identidad de origen de maíz.
Se usó la información de secuencia de ADN-T del plásmido PHP27118 para diseñar cebadores para verificar la secuencia insertada en el maíz 4114 (tablas 7 y 8).
Tabla 7. Cebadores de la PCR usados para caracterizar las regiones de borde genómico y de ADN-T insertadas en el maíz 4114
T l : n i i i n l r r l r i n P R.
continuación
Para caracterizar el ADN-T insertado en maíz 4114, se diseñaron cebadores para la PCR para amplificar el inserto de ADN-T en seis productos de la PCR separados solapantes, como se indica en la tabla 7: fragmentos A a F (Posiciones indicadas en la figura 5). Como cabía esperar, se generaron los productos de la PCR predichos solo a partir de muestras de ADN genómico de maíz 4114 y no estaban presentes en las muestras de maíz de control. Se clonaron y secuenciaron los seis productos de la PCR. Cuando se comparó la secuencia del ADN-T insertado en maíz 4114 con la región de ADN-T del plásmido PHP27118 usado para crear el maíz 4114, se determinó que había una eliminación de 29 pb en el extremo RB y una eliminación de 24 pb en el extremo LB. Las eliminaciones en los extremos RB y LB normalmente suceden en la transformación mediada por Agrobacterium (Kim et al. (2007) Plant J. 51:779-791). Toda la demás secuencia se encuentra intacta y es idéntica a la del plásmido PHP27118. La secuencia de la inserción se presenta en la SEQ ID NO: 27.
Para verificar la secuencia adicional del borde genómico 5', se llevó a cabo la PCR con un cebador directo (SEQ ID NO: 11) en la región del borde genómico 5' y un cebador inverso (SEQ ID NO: 12) en el ADN-T insertado. El fragmento de la PCR resultante A de 2.511 pb de las muestras de ADN genómico de maíz 4114 se clonó y se secuenció (figura 3). Los 2.422 pb de la secuencia de la región del borde genómico 5' se expone en los nucleótidos 1-2.422 de la SEQ ID NO: 27.
Para verificar la secuencia adicional del borde genómico 3', se llevó a cabo la PCR con un cebador directo (SEQ ID NO: 21) en el ADN-T insertado y un cebador inverso (SEQ ID NO: 22) en la región del borde genómico 3'. El fragmento
de la PCR resultante F de 2.612 pb de las muestras de ADN genómico de maíz 4114 se clonó y se secuenció (figura 3). Los 2.405 pb de la secuencia de la región del borde genómico 3' se expone en los nucleótidos 14.348 a 16.752 de la SEQ ID NO: 27.
En total, se confirmaron 16.752 pb de secuencia del ADN genómico de maíz 4114: 2.422 pb de la secuencia del borde genómico 5', 2.405 pb de la secuencia de borde genómico 3' y 11.925 pb que comprenden el ADN-T insertado.
Para demostrar que las secuencias del borde genómico flanqueantes 5' y 3' son procedentes de maíz, se llevó a cabo la PCR en las regiones de borde genómico 5' y 3' (el par de cebadores expuesto en las SEQ ID NO: 23 y 24 y el par de cebadores expuesto en las SEQ ID NO: 25 y 26, respectivamente) en las muestras de ADN genómico de maíz 4114 y las muestras de maíz de control. Se generaron el fragmento G de la PCR (257 pb para la región genómica 5') y el fragmento G de la PCR (283 pb para la región genómica 3') esperados a partir tanto de maíz 4114 como de maíz de control. Estos productos de la PCR se clonaron y secuenciaron y los productos correspondientes del maíz 4114 y del maíz de control son idénticos, confirmando de este modo que las secuencias son genómicamente procedentes de maíz.
Ejemplo 5. Eficacia en insectos del evento de maíz DP-004114-3
Se generaron datos de eficacia acerca del maíz 4114. Las pruebas de campo compararon maíz 4114 en dos fondos genéticos con un control negativo (isolínea) en los mismos fondos genéticos. Las pruebas de eficacia incluyeron: daño foliar por primera generación de ECB (ECB1) y daño en el tallo por ECB de segunda generación (ECB2) en cuatro ubicaciones, daño en la raíz por WCRW en tres ubicaciones y daño foliar por FAW en una ubicación. En cada ubicación, se plantaron parcelas de una sola hilera en un bloque completo aleatorizado con tres replicados (20 granos/parcela x 12 entradas x 3 replicados = 1 experimento/ubicación). Se tomaron muestras de tejido de todas las plantas después de la emergencia para confirmar la presencia del evento mediante PCR específica para el evento. Se cortó cualquier negativo y cada parcela se redujo hasta un objetivo de 10-15 plantas espaciadas uniformemente por parcela.
Para los ensayos que caracterizan el daño por ECB1, cada planta se infestó manualmente con aproximadamente 100 larvas neonatas de ECB 3 veces (300 larvas en total) a lo largo de aproximadamente una semana comenzando en aproximadamente la etapa de crecimiento V5. Aproximadamente tres semanas después de la última infestación con éxito, se efectuaron valoraciones del daño foliar (basándose en una escala de valoración visual 9 -1, donde 9 indica ausencia de daño y 1 indica daño máximo) en 8 plantas consecutivas por parcela (total de 24 plantas por fondo genético, por entrada) y se calcularon las medias para cada tratamiento. Los resultados de la alimentación foliar de ECB de primera generación en maíz 4114 se muestran en la tabla 9.
Tabla 9. Eficacia del maíz DP-004114-3 contra larvas de ECB de primera generación Ubicació Línea de maíz a del daño por ECB1LF ± Error estándar
ab
4114 9,0 ± 0,05 A
York, NE 1507x59122 9,0 ± 0,08 A
ontrol negativo 4,4 ± 0,09 B
4114 9,0 ± 0,00 A
Johnston, 1507x59122 9,0 ± 0,00 A
ontrol negativo 4,5 ± 0,08 B
4114 9,0 ± 0,02 A
4114 9,0 ± 0,00 A
ontrol negativo 5,5 ± 0,17 B
aLas valoraciones del daño en plantas individuales se determinaron usando la siguiente escala visual.
9. Ausencia de daño foliar visible o una pequeña cantidad de lesión de tipo punción o fino agujero en unas pocas hojas.
8. Pequeña cantidad de lesiones de tipo agujero en unas pocas hojas.
7. Lesión de tipo agujero común en varias hojas.
6. Varias hojas con lesiones de tipo agujero y alargadas (Lesiones <1,27 cm (0,5") de longitud).
5. Varias hojas con lesiones alargadas (lesiones de 1,27 cm (0,5") a 2,54 cm (1,0") de longitud).
4. Varias hojas con lesiones alargadas (lesiones > 2,54 cm (1,0") de longitud).
3. Lesiones largas (> 2,54 cm (1,0")) comunes en aproximadamente la mitad de las hojas.
2. Lesiones largas (> 2,54 cm (1,0")) comunes en aproximadamente dos tercios de las hojas.
1. La mayoría de las hojas con lesiones largas.
bEn una ubicación, las medias con la misma letra no son significativamente diferentes (prueba de LSD protegida de Fisher, P > 0,05).___________________________________________________________________________________
Para los ensayos que caracterizan el daño por ECB2, se infestaron de nuevo manualmente las mismas plantas infestadas anteriormente con ECB1 posteriormente en la temporada de crecimiento con aproximadamente 100 larvas neonatas de ECB (300 larvas en total) por planta 3 veces a lo largo de aproximadamente una semana comenzando en la etapa de crecimiento R1, cuando aproximadamente un 50 % de las plantas estaban dispersando polen. Aproximadamente a los 50-60 días después de la última infestación, se dividieron los tallos de 8 plantas consecutivas por parcela (total de 24 plantas por fondo genético por entrada) desde la parte superior del 4.° entrenudo por encima de la mazorca primaria hasta la base de la planta. Después se midió en centímetros la longitud total de los túneles en el tallo por ECB (ECBXCM) y se registraron para cada planta. Los túneles de 1 cm o menos se consideraron agujeros de entrada (la larva no era capaz de establecerse en el tallo) y no se incluyeron en los cm totales de túneles. Se calcularon las medias (cm totales de túneles) para cada tratamiento. Los resultados de alimentación del tallo por ECB2 para el maíz 4114 se muestran en la tabla 10.
Tabla 10. Eficacia del maíz DP-004114-3 contra larvas de ECB de se unda eneración
También se investigó el daño radicular causado por WCRW. Se infestaron manualmente plantas aproximadamente en la fase de crecimiento V2 con aproximadamente 500 huevos de WCRW aplicados al suelo a cada lado de la planta (~1.000 huevos/planta en total). Además, se plantaron las parcelas en campos que tenían altas probabilidades de contener una infestación natural de WCRW. Las raíces de las plantas se evaluaron aproximadamente en la etapa de crecimiento R2. Se retiraron cinco plantas consecutivas por parcela (45 plantas por fondo genético en total, por entrada) de la parcela y se lavaron con agua a presión. El daño en la raíz se valoró usando la escala de lesión nodular de 0-3 (CRWNIS) (Oleson, et al. (2005) J. Econ. Entomol. 98 (1): 1-8) y se calcularon las medias para cada tratamiento. Las valoraciones medias del daño radicular a causa de la alimentación del WCRW se muestran en la tabla 11.
Tabla 11. Eficacia del maíz DP-004114-3 contra larvas de WCR
Para la prueba de eficacia del FAW, se infestaron manualmente plantas individuales con aproximadamente 75 neonatos aproximadamente en la etapa de crecimiento V5. Se valoró el daño en las hojas en 8 plantas consecutivas
por parcela (un total de 24 plantas por fondo genético, por entrada) (FAWL basada en una escala de valoración visual 9-1, donde 9 indica ausencia de daño y 1 indica daño máximo) aproximadamente dos semanas después de la última inoculación con éxito) y se calcularon las medias para cada tratamiento. Las valoraciones medias del daño que caracterizan la alimentación foliar del FAW en DP-004114-3 se muestran en la tabla 12.
Tabla 12. Eficacia del maíz DP-004114-3 contra larvas de FAW
Además de los estudios de eficacia en campo, el maíz 4114 se evaluó en el ensayo de laboratorio de plántula subletal (SSA) (Publicación de los Estados Unidos n.° 2006/0104904). El SSA permitió comparar la eficacia del maíz 4114 con un control no protegido (isolínea próxima) sin los efectos de confusión del ambiente de campo. La técnica de SSA implica exponer a una población de WCRW neonato a plántulas de maíz que contienen uno de los eventos de maíz 4114 o plántulas de maíz no transgénicas (control negativo). Las larvas fueron expuestas durante un periodo de 17 días desde la fecha de eclosión inicial del huevo. La unidad experimental para el SSA fue un solo recipiente de plástico con unas dimensiones de 23 x 30 x 10 cm (Pactiv Corp., Lake Forest, IL). Las entradas se dispusieron en un bloque completo aleatorizado con 3 replicados por entrada. Para cada entrada, La configuración del s Sa implicó colocar 115 granos en cada recipiente con 225 ml de una solución fungicida de tiofanato-metilo al 1 % y 1000 ml de medio de crecimiento de plantas Metro-Mix 200 (Scotts-Sierra Horticultural Products Company, Marysville, OH). Inmediatamente después de añadir la Metro-Mix, Se infestó con los huevos de WCRW sobre la superficie de cada recipiente a una tasa de 1.000 huevos por recipiente. Los huevos de WCRW se preincubaron a 25 °C, de tal forma que se temporizó para que la eclosión inicial del huevo se produjese 5-7 días del establecimiento del recipiente. Los recipientes infestados se mantuvieron en una cámara ambiental ajustada a 25 °C, humedad relativa del 65 % y un ciclo de luz:oscuridad de 14:10. Las larvas se extrajeron de los recipientes 17 días después de la eclosión de los huevos usando un sistema de embudo Burlese. Se seleccionó una muestra secundaria aleatoria de 30 larvas por recipiente y se midieron sus cápsulas de cabeza en un microscopio de disección para categorizar cada una en 1 de 3 etapas. Los datos recogidos incluyen la edad estructural de la población larval determinada a partir del número de larvas en cada una de las tres potenciales etapas. Se representaron los histogramas que presentaban gráficamente la distribución de edad de las larvas para cada entrada y se compararon visualmente, como se muestra en la figura 4.
El espectro de plagas para el maíz 4114 se proporciona en la tabla 13.
Tabla 13. Plagas de insectos que se controlan o suprimen por maíz DP-004114-3 que expresa Cry1F, Cr 34Ab1 Cr 35Ab1
continuación
Ejemplo 6. Expresión y concentración de proteínas
Generación de material vegetal
Se cultivó maíz 4114 de la generación PHNAR x BC3F3 en cinco ubicaciones en los Estados Unidos y Canadá. Cada sitio empleó un diseño de bloque completo aleatorizado que contenía cuatro bloques, con cada bloque separado por una distancia amortiguadora de al menos 36 pulgadas (0,9 m). Cada entrada se plantó en parcelas de 2 filas bordeadas a cada lado por 1 fila de simiente de borde.
Recogida y procesado de tejido foliar
Se recogió una muestra de tejido foliar en cada bloque en la etapa V9. Todas las muestras se recogieron de plantas sanas seleccionadas imparcialmente representativas de cada evento. Cada muestra foliar se obtuvo seleccionando la hoja más joven que había emergido al menos 8 pulgadas (20 cm, tejido visible) desde la espira. En caso de que esta hoja estuviese dañada o no estuviese sana, se tomó una muestra de la siguiente hoja por debajo. Se podó (cortó) la hoja de la planta a aproximadamente 8 pulgadas (20 cm) desde la punta de la hoja. La muestra foliar (incluyendo el nervio central) se cortó en trozos de <1 pulgada (2,5 cm) y se colocaron en un vial para muestras de 50 ml. Después, se colocaron las muestras sobre nieve carbónica hasta que se transfirieron a un congelador (<-10 °C). Las muestras se enviaron congeladas y se almacenaron a <-10 °C tras su llegada. Todas las muestras de tejido se liofilizaron, al vacío, hasta sequedad. Las muestras foliares liofilizadas se homogeneizaron finamente para prepararlas para el análisis. Las muestras se almacenaron congeladas entre las etapas de procesado.
Determinaciones de la concentración de proteínas
Las concentraciones de las proteínas Cry1F, Cry34Ab1, Cry35Ab1 y PAT se determinaron usando métodos de ELISA cuantitativo específicos.
Extracción de proteínas
Se pesaron alícuotas de muestras de tejido foliar procesado en tubos de 1,2 ml con un peso diana de 10 mg. Cada muestra analizada respecto de las concentraciones de proteína Cry1F, Cry34Ab1, Cry35Ab1 y PAT se extrajo en 0,6 ml de PBST enfriado (suero salino tamponado con fosfato más Tween-20). Después de la centrifugación, se retiraron los sobrenadantes, se diluyeron y se analizaron.
Determinación de la concentración de proteína de Cry1F, Cry34Ab1 y PAT
Los kits de ELISA para Cry1F, Cry34Ab1 y PAT empleados se obtuvieron de EnviroLogix, Inc. (Portland, ME) y el kit de ELISA para Cry35Ab1 empleado se obtuvo de Acadia BioScience, LLC (Portland, ME). El método ELISA para cada una de estas cuatro proteínas utilizó un formato en "sándwich" secuencial para determinar la concentración de la proteína en extractos de muestra. Se incubaron patrones (analizados en pocillos triplicados) y extractos de muestra diluida (analizados en pocillos duplicados) en una placa prerrecubierta con un anticuerpo específico para una sola proteína seleccionada entre Cry1F, Cry34Ab1, Cry35Ab1 o PAT. Después de la incubación, se lavaron de la placa las sustancias no unidas. Un anticuerpo específico diferente para la respectiva proteína seleccionada, conjugado a la enzima peroxidasa de rábano picante (HRP), se añadió a la placa y se incubó. Posteriormente, se lavaron las sustancias no unidas de la placa dejando la proteína unida "en sándwich" entre el anticuerpo recubierto sobre la placa y el conjugado de anticuerpo-HRP. La detección del complejo de anticuerpo unido-proteína se logró mediante la adición de sustrato, que generó un producto coloreado en presencia de HRP. La reacción se detuvo con una solución
ácida y se determinó la densidad óptica (DO) de cada pocilio usando un lector de placas. Se usó una media de los resultados de pocillos duplicados para determinar la concentración de la proteína Cry1F, Cry34Ab1, Cry35Ab1 o PAT en ng/mg de peso seco de la muestra.
Cálculos para determinar las concentraciones de proteína
Se usó el programa informático SoftMax® Pro para llevar a cabo los cálculos necesarios para convertir los valores de DO obtenidos del lector de placas en concentraciones de proteína.
1. Curva patrón
Se incluyó una curva patrón en cada placa de ELISA. La ecuación para la curva patrón se generó mediante el programa informático, que usó un ajuste cuadrático para relacionar los valores medios de DO obtenidos de los patrones con la respectiva concentración patrón (ng/ml). La ecuación de regresión cuadrática se aplicó del siguiente modo:
y = Cx2 Bx A
donde x = concentración patrón conocida e y = valor de absorbancia medio respectivo (DO).
2. Concentración de la muestra
La interpolación de la concentración de la muestra (ng/ml) se logró resolviendo para x la ecuación anterior usando valores para A, B y C determinados mediante la curva patrón.
—B + J b 2 — 4C(A — DO de la muestra) Concentración de la muestra (ng /m l) = --------- - -----------------—---------------------------
Por ejemplo, Parámetros de la curva: A = 0,0476, B = 0,4556, C = -0,01910 y DO de la muestra = 1,438
-0,4556 + j0 ,45562 -4(-0,01910)(0,0476 - 1,438)
Concentración de la muestra
2 (^ 0 j 0191ú j 3,6 ng /m l Los valores de concentración de la muestra se ajustaron para el factor de dilución expresado como 1:N Concentración ajustada = Concentración de muestra x Factor de dilución por ejemplo, Concentración de muestra = 3,6 ng/ml y Factor de dilución = 1:10
Concentración ajustada = 3,6 ng/ml x 10 = 36 ng/ml
Los valores de concentración de la muestra ajustados se convirtieron de ng/ml a ng/mg de peso de la muestra del siguiente modo:
ng/mg de peso de la muestra = ng/ml x Volumen de extracción (ml)/Peso de la muestra (mg) por ejemplo, Concentración = 36 ng/ml, Volumen de extracción = 0,60 ml y Peso de la muestra = 10,0 mg ng/mg de peso de la muestra = 36 ng/mg x 0,60 ml/10,0 mg = 2,2 ng/mg
3. Límite inferior de cuantificación (LIDC)
El LIDC, en ng/mg de peso de la muestra, se calculó del siguiente modo:
LIDQ reportable del ensayo
x
Volumen de extracción
LIDC =
------— - -------- --------
-
-----
L—
-----------------------------------
Peso diana de la muestra
por ejemplo para PAT en hojas: LIDC del ensayo reportable = 2,3 ng/ml, volumen de extracción = 0,6 ml y peso diana de la muestra = 10 mg
2,3 ng /m l
x
0,6 ml
LIDC = 0,14ng/mg de peso de la muestra
10
mg
Resultados
Las proteínas CrylF, Cry34Ab1, Cry35Ab1 y PAT se detectaron en tejido foliar de V9 de maíz 4114 a las concentraciones expuestas en la tabla 14 a continuación.
T l 14: n n r i n r ín n m íz 4114
Ejemplo 7: Un sistema de identificación específico de evento para maíz DP-004114-3
Se diseñó el sistema específico de evento para maíz DP-004114-3 en la unión 5' entre el inserto DP-004114-3 y la región genómica de maíz. El cebador directo (08-O-2677, SEQ ID NO: 29) está situado dentro del ADN genómico de maíz, el cebador inverso (08-O-2678, SEQ ID NO: 30) está situado dentro del ADN insertado y el sitio de unión de la sonda (08-QP74, SEQ ID NO: 31) abarca la transición entre el inserto DP-004114-3 y el ADN genómico de maíz (tabla 15). Las concentraciones óptimas de cebador y sonda se seleccionaron basándose en la eficiencia de la PCR y la capacidad para cuantificar los extremos bajos (0,08 % de GM) y altos (5 % de GM) del intervalo dinámico (tabla 16).
Tabla 16: Mezcla maestra para el sistema PCR específico para el evento DP-004114-3
P Concentrroductos químicos Concentración ación
finalf pl/reacción Applied Biosystems TaqMan Universal PCR Master
2x 1x 10,0 Mix, No AmpErase UNG
08-0-2677 10 jiM 500 nM 1,0 08-0-2678 10 jM 900 nM 1,8 08-QP74 10 jM 200 nM 0,4 Agua estéril 1,8 Volumen total 15,0
f La reacción PCR total es de 20 j l (15 j l de mezcla maestra y 5 j l de molde de ADN genómico).
_____________________________ Tabla 17: Parámetros de reacción y ciclado____________________________ Formato: 15 |jl de mezcla maestra 5 |jl de molde de ADN genómico = 20 |jl por reacción
Equipo: Termociclador en tiempo real Applied Biosystems ViiA7
Programa Programa informático ViiA 7 RUO versión 1.1
informático:
Material plástico: Placas de reacción ópticas de 96 pocillos MicroAmp® (Applied Biosystems, Inc.); Placas de reacción óptica transparentes de 384 pocillos PRISM™ (Applied Biosystems, Inc.); y película adhesiva óptica MicroAmp™ (Applied Biosystems, Inc.)
Tabla 18: Parámetros de ciclado
Etapa Estadio Temp. Tiemp Recogida de
o datos Ciclos
El formato del ensayo usó una curva patrón que tenía cuatro puntos de referencia, cada una por triplicado. Los patrones se produjeron preparando una solución de 40 ng/jl de ADN genómico total de maíz con 10 % de ADN de maíz DP-004114-3 seguido de diluciones seriadas en tampón TE 0,1x que contenía 10 ng/jl de ADN de esperma de salmón. Los controles negativos (NTC) se midieron por triplicado para cada sistema para verificar la pureza de los reactivos. Cada muestra (desconocida) se analizó a razón de 200 ng de ADN genómico de maíz por reacción en triplicados (seis reacciones por muestra en total para ambos sistemas PCR). Posteriormente se calculó el contenido relativo de ADN de maíz DP-004114-3 a ADN de maíz total determinando la media de los números de copias basándose en las curvas patrón (regresión lineal del valor de ciclo umbral (Ct ) frente al log [número de copias]) y calculando las proporciones del número de copias de maíz DP-004114-3/número de copias totales de genomas de maíz haploides.
Este sistema de PCR cuantitativa específica de evento para la detección del ADN de maíz DP-004114-3 se desarrolló, optimizó y validó en un sistema para PCR en tiempo real ViiA 7™ de Applied Biosystems. El método también puede aplicarse en una plataforma diferente pero, con una optimización y adaptación mínimas.
El método de PCR en tiempo real específico para el evento descrito en el presente documento puede aplicarse para determinar el contenido relativo de ADN de maíz DP-004114-3 en el ADN genómico de maíz total. El método funciona de manera lineal con un nivel aceptable de exactitud y precisión a lo largo del intervalo completo, de un 0,08 % a un 5,0 % de contenido de DP-004114-3. El método se desarrolló y validó con ADN genómico extraído de semillas de maíz. Sin embargo, puede aplicarse el ensayo a cualquier matriz de la que pueda purificarse ADN genómico con suficiente cantidad y calidad.
Ejemplo 8: Método de detección PCR basado en gel para el evento de maíz DP-004114-3
Este protocolo describe un ensayo de PCR basado en gel cualitativo para detectar la presencia de ADN de maíz DP-004114-3. El método de detección PCR se usa junto con un método de extracción de ADN que proporciona ADN de suficiente calidad y cantidad.
Se desarrolló un sistema PCR para maíz DP-004114-3 usando cebadores para amplificar la unión del borde 5' entre el ADN genómico de maíz y el inserto de DP-004114-3. El cebador directo se ubica en la región genómica de maíz y el cebador inverso se ubica en el inserto del transgén.
Cebador directo (11-0-4127) (SEQ ID NO: 33): 5'- GGA CCC TGT TCA CAA CAC AGG GCT C-3' Cebador inverso (11-0-4128) (SEQ ID NO: 34): 5'- GGC CGA AGC TTC GGT CCG G-3'
Secuencia del amplicón (se subrayan los sitios de unión al cebador) (SEQ ID NO: 35): qqaccctqttcacaacacaqqqctctqqctttqqaqcctctcqtttqtaqcacttqcacqtaqttacccqqaccqaaqcttcaacac aqatctqataqtttaaacqctcttcaactqqaaqaqcqqttacccqqaccqaaqcttcqqcc
Equipos y materiales usados:
Reactivos, tampones y soluciones:
Procedimientos
Los reactivos se mezclaron exhaustivamente antes de su uso. Se preparó una mezcla de reacción que consistía en todos los componentes de la reacción PCR, excepto para el ADN molde, en cantidad suficiente para llevar a cabo todas las reacciones. Los reactivos y la mezcla maestra se mantuvieron sobre hielo.
Preparación de la mezcla maestra para el sistema PCR:
Claims (8)
1. Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
2. Un método para detectar el amplicón de la reivindicación 1 en una muestra biológica procedente de una planta, tejido o semilla del evento de maíz DP-004114-3, en donde dicha planta comprende una secuencia de nucleótidos que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa de la misma, en donde dicha secuencia de nucleótidos es detectable en dicha muestra usando un método de amplificación de ácidos nucleicos o un método de hibridación de ácidos nucleicos, en donde se ha depositado una muestra representativa de dicho evento de maíz DP004114-3 en la Colección Americana de Cultivos Tipo (ATCC) con el n.° de registro PTA-11506.
3. El método de la reivindicación 2, en donde dicha muestra biológica comprende una planta, tejido o semilla del evento de maíz transgénico DP-004114-3.
4. El método de la reivindicación 3, en donde dicha muestra biológica es una muestra de ADN extraída de una planta de maíz transgénico del evento DP-004114-3 y en donde dicha muestra de ADN comprende la secuencia de nucleótidos de SEQ ID NO: 32 o el complemento de la misma.
5. El método de la reivindicación 2, en donde dicha muestra biológica se selecciona entre el grupo que consiste en harina de maíz, maíz molido, jarabe de maíz, aceite de maíz, almidón de maíz y cereales producidos total o parcialmente para que contengan subproductos de maíz.
6. Un método para determinar la cigosidad del ADN de una planta de maíz que comprende el evento de maíz DP-004114-3 en una muestra biológica que comprende:
(a) poner en contacto dicha muestra con un par de cebadores seleccionado entre el grupo que consiste en las SEQ ID No : 29 y 30, de tal forma que
(1) cuando se usa en una reacción de amplificación de ácido nucleico que comprende ADN del evento de maíz DP-004114-3, dicha reacción produce un primer amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo, que es diagnóstico para el evento de maíz DP-004114-3 y
(2) cuando se usa en una reacción de amplificación de ácido nucleico que comprende ADN genómico de maíz distinto de ADN de DP-004114-3, dicha reacción produce un segundo amplicón que es diagnóstico para el ADN genómico de maíz distinto de ADN de DP-004114-3;
(b) llevar a cabo una reacción de amplificación de ácido nucleico; y
(c) detectar los amplicones producidos de este modo, en donde la detección de la presencia de ambos amplicones indica que dicha muestra es heterocigota para el ADN del evento de maíz DP-004114-3, en donde la detección únicamente del primer amplicón indica que dicha muestra es homocigota para el ADN del evento de maíz DP-004114-3.
7. Un par de cebadores polinucleotídicos que comprenden un primer cebador polinucleotídico y un segundo cebador polinucleotídico 20, en donde el primer cebador polinucleotídico comprende la secuencia de nucleótidos de la SEQ ID NO: 29 y el complemento de la misma; y el segundo cebador polinucleotídico comprende la secuencia de nucleótidos de la s Eq ID NO: 30 y el complemento de la misma, que funcionan juntas en presencia de un molde de ADN de DP-004114-3 en una muestra para producir un amplicón diagnóstico para el evento DP-004114-3.
8. Un kit para detectar ácidos nucleicos que son únicos para el evento DP-004114-3 que comprende un par de cebadores que comprende en las SEQ ID NO: 29 y 30 y los complementos de las mismas, que funcionan como un par de cebadores en un método de detección de ácidos nucleicos y que tras la amplificación de o la hibridación con una secuencia de ácido nucleico diana en una muestra seguida de la detección del amplicón o la hibridación con la secuencia diana, son diagnósticos para la presencia de secuencias de ácido nucleico únicas para el evento DP-004114-3 en la muestra.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261617990P | 2012-04-24 | 2012-04-24 | |
| PCT/US2013/034374 WO2013149018A1 (en) | 2012-03-30 | 2013-03-28 | Maize event dp-004114-3 and methods for detection thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2816640T3 true ES2816640T3 (es) | 2021-04-05 |
Family
ID=48083682
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES13715578T Active ES2816640T3 (es) | 2012-04-24 | 2013-03-28 | Evento de maíz DP-004114-3 y métodos para la detección del mismo |
Country Status (14)
| Country | Link |
|---|---|
| US (4) | US9725772B2 (es) |
| EP (1) | EP2831243B1 (es) |
| CN (2) | CN104411828A (es) |
| AR (2) | AR090558A1 (es) |
| BR (1) | BR112014026728B1 (es) |
| CA (1) | CA2871557C (es) |
| EA (1) | EA034330B1 (es) |
| ES (1) | ES2816640T3 (es) |
| HU (1) | HUE050690T2 (es) |
| MX (1) | MX373192B (es) |
| PL (1) | PL2831243T3 (es) |
| UA (1) | UA116982C2 (es) |
| WO (1) | WO2013149018A1 (es) |
| ZA (1) | ZA201407686B (es) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102892284B (zh) * | 2009-12-17 | 2016-03-23 | 先锋国际良种公司 | 玉米事件dp-004114-3及其检测方法 |
| AR090558A1 (es) * | 2012-04-24 | 2014-11-19 | Pioneer Hi Bred Int | Evento de maiz dp-004114-3 y metodos para su deteccion |
| US20230220407A1 (en) * | 2012-04-24 | 2023-07-13 | Pioneer Hi-Bred International, Inc. | Maize event dp-004114-3 and methods for detection thereof |
| CN105779610B (zh) * | 2015-08-06 | 2019-01-18 | 中国农业科学院生物技术研究所 | 转基因抗虫玉米hgk60外源插入片段的旁侧序列及其检测方法 |
| BR112023001798A2 (pt) * | 2020-07-31 | 2023-02-23 | Inari Agriculture Tech Inc | Célula de planta de milho transgênico, parte de planta de milho transgênico, planta de milho transgênico, método para obter uma população a granel de sementes endogâmicas, método de obtenção de semente de milho híbrido, molécula de dna, produto de planta de milho transgênico processado, amostra biológica, molécula de ácido nucleico adaptada para detecção de dna genômico, método de detecção de uma célula de planta de milho, método de excisão do lócus transgênico inir12 do genoma da célula de planta de milho, método de modificação de uma célula de planta de milho transgênico, método de produção de células de plantas de milho transgênico compreendendo um lócus transgênico inir12, calo de planta de milho transgênico, semente de planta de milho transgênico, método de uso da célula de planta de milho, método de coleta de dados de análise de ácidos nucleicos, método de reprodução de plantas |
| CN112831584B (zh) * | 2021-01-27 | 2023-06-06 | 隆平生物技术(海南)有限公司 | 转基因玉米事件lp007-2及其检测方法 |
| CN113354721B (zh) * | 2021-06-18 | 2022-08-05 | 山东省农业科学院 | 一种调控玉米籽粒胚发育的基因Emb1637的应用 |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4945050A (en) | 1984-11-13 | 1990-07-31 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4800159A (en) | 1986-02-07 | 1989-01-24 | Cetus Corporation | Process for amplifying, detecting, and/or cloning nucleic acid sequences |
| US6083499A (en) | 1996-04-19 | 2000-07-04 | Mycogen Corporation | Pesticidal toxins |
| US5981840A (en) | 1997-01-24 | 1999-11-09 | Pioneer Hi-Bred International, Inc. | Methods for agrobacterium-mediated transformation |
| JP4647099B2 (ja) | 1998-10-23 | 2011-03-09 | マイコジェン コーポレーション | 約15kDaおよび約45kDaの殺虫性タンパク質をコードする、植物において最も効果的に発現するポリヌクレオチド |
| AR025349A1 (es) | 1999-08-23 | 2002-11-20 | Mycogen Corp | Metodos para controlar las plagas del gusano gris |
| US6395485B1 (en) | 2000-01-11 | 2002-05-28 | Aventis Cropscience N.V. | Methods and kits for identifying elite event GAT-ZM1 in biological samples |
| BRPI0410027B1 (pt) | 2003-05-02 | 2020-11-03 | Dow Agrosciences Llc | molécula de dna isolada, kit e método para identificação do evento tc1507, construto de dna, método para aumentar a resistência de uma planta a insetos, método de detecção da presença do evento tc1507, sequência de junção de dna isolado, método de screening de sementes, método para a produção de uma planta, método para a detecção da presença da inserção do evento tc1507, kit de detecção de dna |
| EP1794308B1 (en) | 2004-09-29 | 2013-08-28 | Pioneer-Hi-Bred International, Inc. | Corn event das-59122-7 and methods for detection thereof |
| EP1812577A1 (en) | 2004-11-12 | 2007-08-01 | Pioneer-Hi-Bred International, Inc. | Method of evaluating plant protection |
| UA98770C2 (ru) * | 2006-05-26 | 2012-06-25 | Монсанто Текнолоджи, Ллс | Растение кукурузы и семена, которые соответствуют трансгенному случаю mon89034, и способы его обнаружения и применения |
| MX2008015435A (es) * | 2006-06-03 | 2008-12-12 | Syngenta Participations Ag | Evento de maiz mir 162. |
| CN101641443A (zh) * | 2006-10-30 | 2010-02-03 | 先锋高级育种国际公司 | 玉米事件dp-098140-6,鉴定和/或检测其的组合物和方法 |
| US20100022390A1 (en) | 2006-12-22 | 2010-01-28 | Pioneer Hi-Bred International, Inc. | Resistance management strategy |
| MX2010007415A (es) | 2008-01-10 | 2010-08-16 | Pioneer Hi Bred Int | Nuevo gen de bacillus thuringiensis con actividad contra coleopteros. |
| US8273535B2 (en) | 2008-02-08 | 2012-09-25 | Dow Agrosciences, Llc | Methods for detection of corn event DAS-59132 |
| WO2011075595A1 (en) * | 2009-12-17 | 2011-06-23 | Pioneer Hi-Bred International, Inc. | Maize event dp-043a47-3 and methods for detection thereof |
| CN102892284B (zh) * | 2009-12-17 | 2016-03-23 | 先锋国际良种公司 | 玉米事件dp-004114-3及其检测方法 |
| AR090558A1 (es) * | 2012-04-24 | 2014-11-19 | Pioneer Hi Bred Int | Evento de maiz dp-004114-3 y metodos para su deteccion |
-
2013
- 2013-03-27 AR ARP130101044A patent/AR090558A1/es active IP Right Grant
- 2013-03-28 BR BR112014026728-6A patent/BR112014026728B1/pt active IP Right Grant
- 2013-03-28 EP EP13715578.4A patent/EP2831243B1/en active Active
- 2013-03-28 EA EA201491810A patent/EA034330B1/ru unknown
- 2013-03-28 ES ES13715578T patent/ES2816640T3/es active Active
- 2013-03-28 CN CN201380028463.2A patent/CN104411828A/zh active Pending
- 2013-03-28 PL PL13715578T patent/PL2831243T3/pl unknown
- 2013-03-28 CA CA2871557A patent/CA2871557C/en active Active
- 2013-03-28 HU HUE13715578A patent/HUE050690T2/hu unknown
- 2013-03-28 CN CN201811462556.7A patent/CN109468314B/zh active Active
- 2013-03-28 MX MX2014012894A patent/MX373192B/es active IP Right Grant
- 2013-03-28 UA UAA201411674A patent/UA116982C2/uk unknown
- 2013-03-28 WO PCT/US2013/034374 patent/WO2013149018A1/en not_active Ceased
- 2013-03-29 US US13/853,413 patent/US9725772B2/en active Active
-
2014
- 2014-10-22 ZA ZA2014/07686A patent/ZA201407686B/en unknown
-
2017
- 2017-07-12 US US15/648,112 patent/US10407688B2/en active Active
-
2019
- 2019-07-19 US US16/516,341 patent/US20190338300A1/en not_active Abandoned
-
2020
- 2020-08-19 US US16/997,530 patent/US20200385749A1/en not_active Abandoned
-
2022
- 2022-11-11 AR ARP220103108A patent/AR127650A2/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| EP2831243B1 (en) | 2020-07-01 |
| UA116982C2 (uk) | 2018-06-11 |
| US20170369953A1 (en) | 2017-12-28 |
| ZA201407686B (en) | 2015-10-28 |
| CA2871557A1 (en) | 2013-10-03 |
| MX373192B (es) | 2020-05-07 |
| AR090558A1 (es) | 2014-11-19 |
| US20190338300A1 (en) | 2019-11-07 |
| WO2013149018A1 (en) | 2013-10-03 |
| BR112014026728B1 (pt) | 2022-02-22 |
| US10407688B2 (en) | 2019-09-10 |
| CA2871557C (en) | 2022-09-13 |
| CN109468314B (zh) | 2022-06-24 |
| US20200385749A1 (en) | 2020-12-10 |
| EA201491810A1 (ru) | 2015-03-31 |
| MX2014012894A (es) | 2015-10-15 |
| EP2831243A1 (en) | 2015-02-04 |
| HUE050690T2 (hu) | 2020-12-28 |
| US9725772B2 (en) | 2017-08-08 |
| PL2831243T3 (pl) | 2021-01-25 |
| CN104411828A (zh) | 2015-03-11 |
| AR127650A2 (es) | 2024-02-14 |
| CN109468314A (zh) | 2019-03-15 |
| BR112014026728A2 (pt) | 2017-07-11 |
| EA034330B1 (ru) | 2020-01-29 |
| US20130283483A1 (en) | 2013-10-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20240417817A1 (en) | Maize event dp-004114-3 and methods for detection thereof | |
| US20110154526A1 (en) | Maize event DP-043A47-3 and methods for detection thereof | |
| US20110154525A1 (en) | Maize event DP-040416-8 and methods for detection thereof | |
| US20110154524A1 (en) | Maize event DP-032316-8 and methods for detection thereof | |
| US20190071689A1 (en) | Maize event dp-033121-3 and methods for detection thereof | |
| US20200385749A1 (en) | Maize event dp-004114-3 and methods for detection thereof | |
| CN102317461A (zh) | 通过杂交种子生产期间的操纵进行的混合庇护区部署 | |
| US20230220407A1 (en) | Maize event dp-004114-3 and methods for detection thereof | |
| WO2021000219A1 (en) | Biotic stress tolerant plants and methods | |
| BR112012014665B1 (pt) | Constructo de dna, método para obtenção de uma planta transformada, molécula de ácido nucleico isolada, amplicon, métodos de produção de sementes de milho híbridas, para produzir uma planta de milho resistente às pestes lepidoptera, para a produção de uma planta de milho resistente ao menos ao crisomelídeo do milho, de detecção da presença de uma molécula de ácido nucleico, de detecção da presença do dna e kit para detectar ácidos nucleicos |