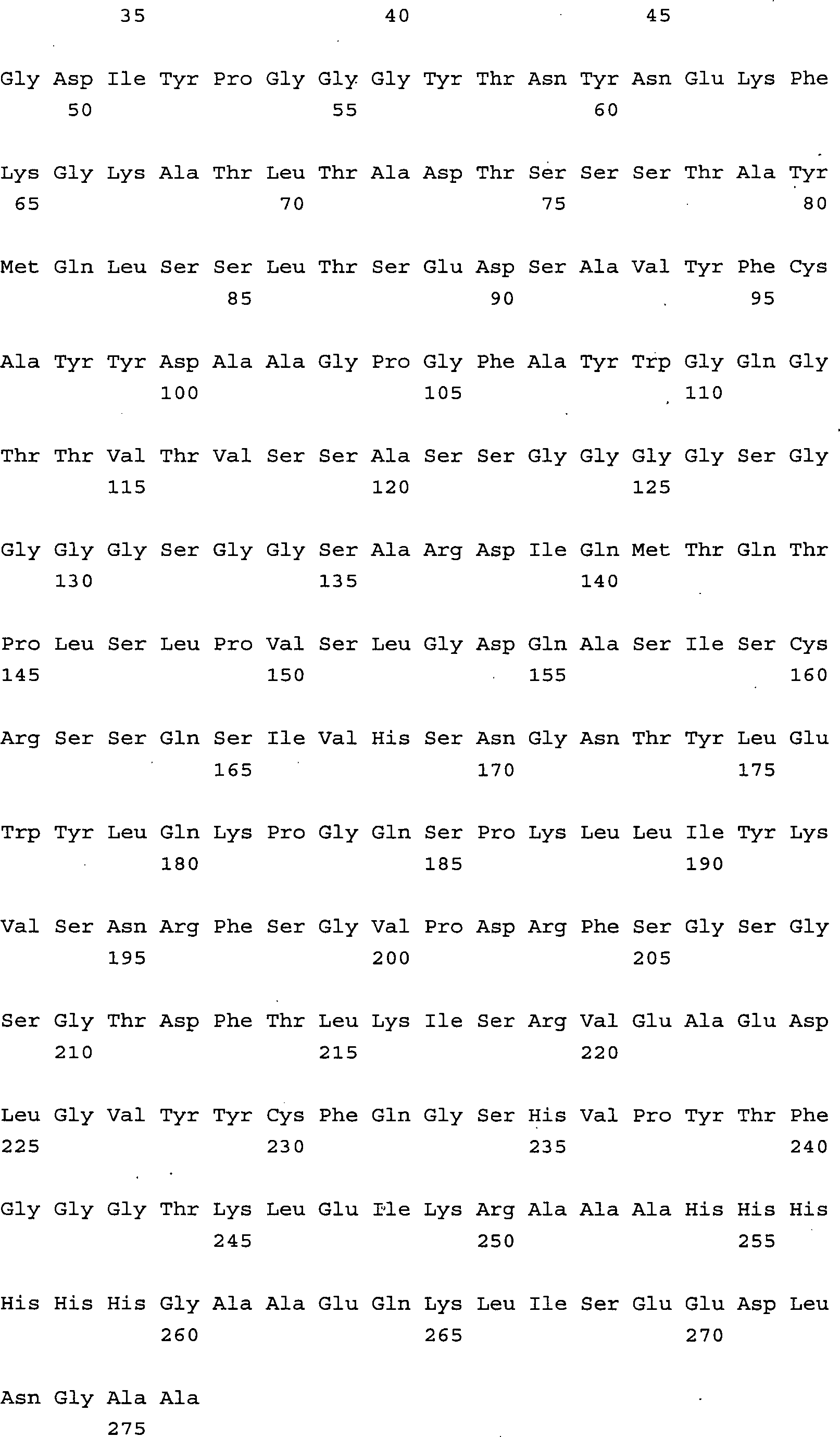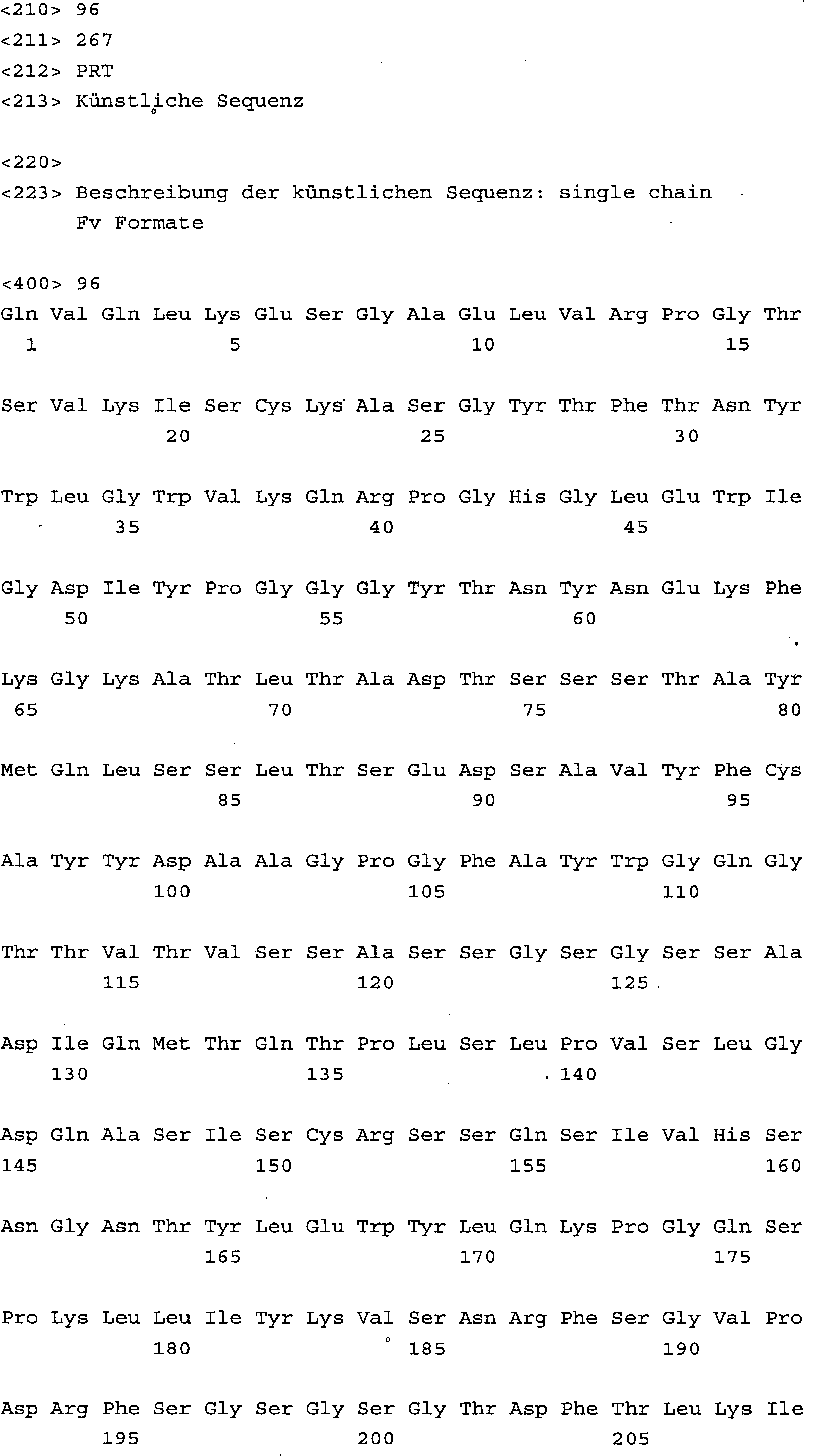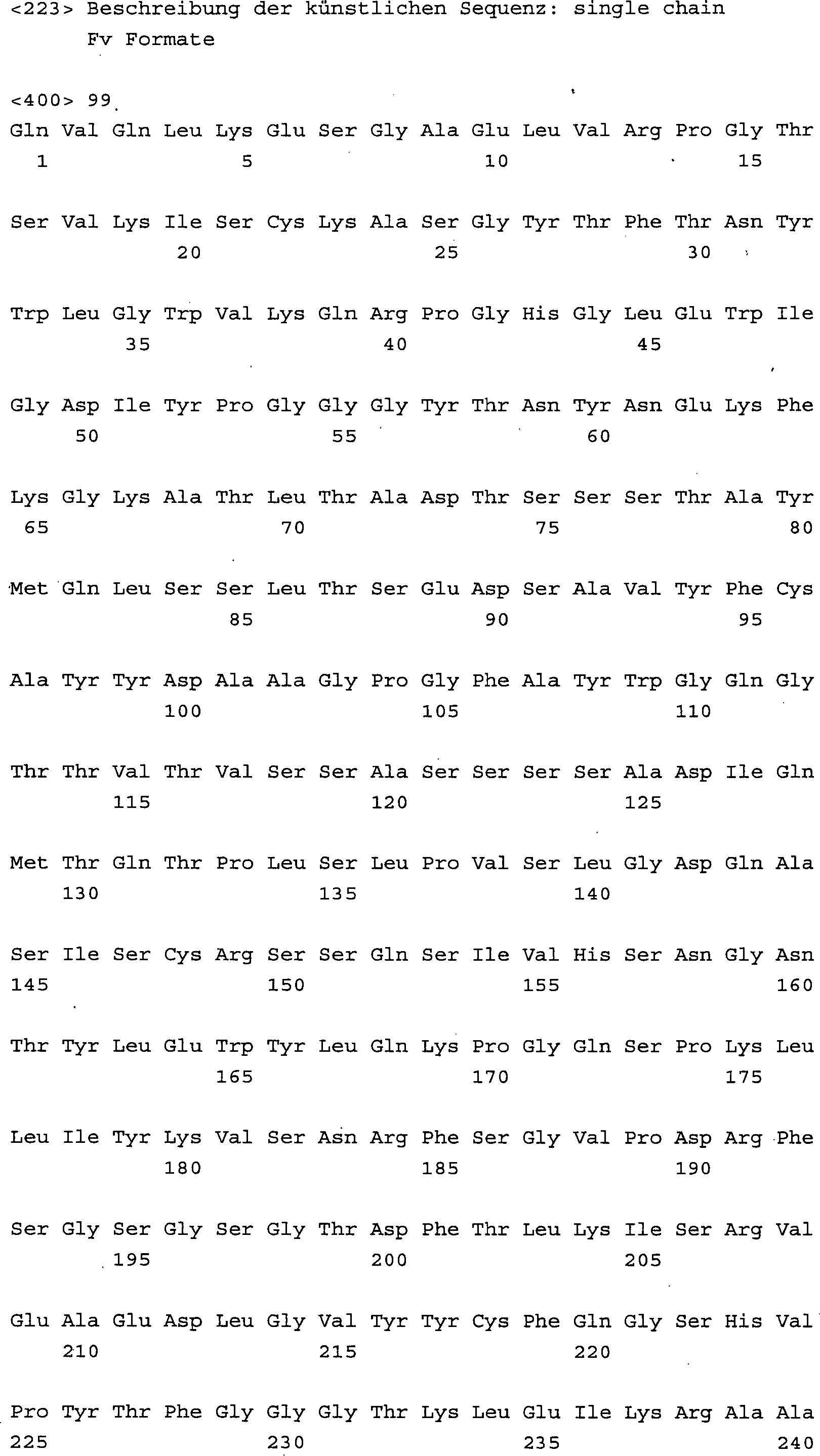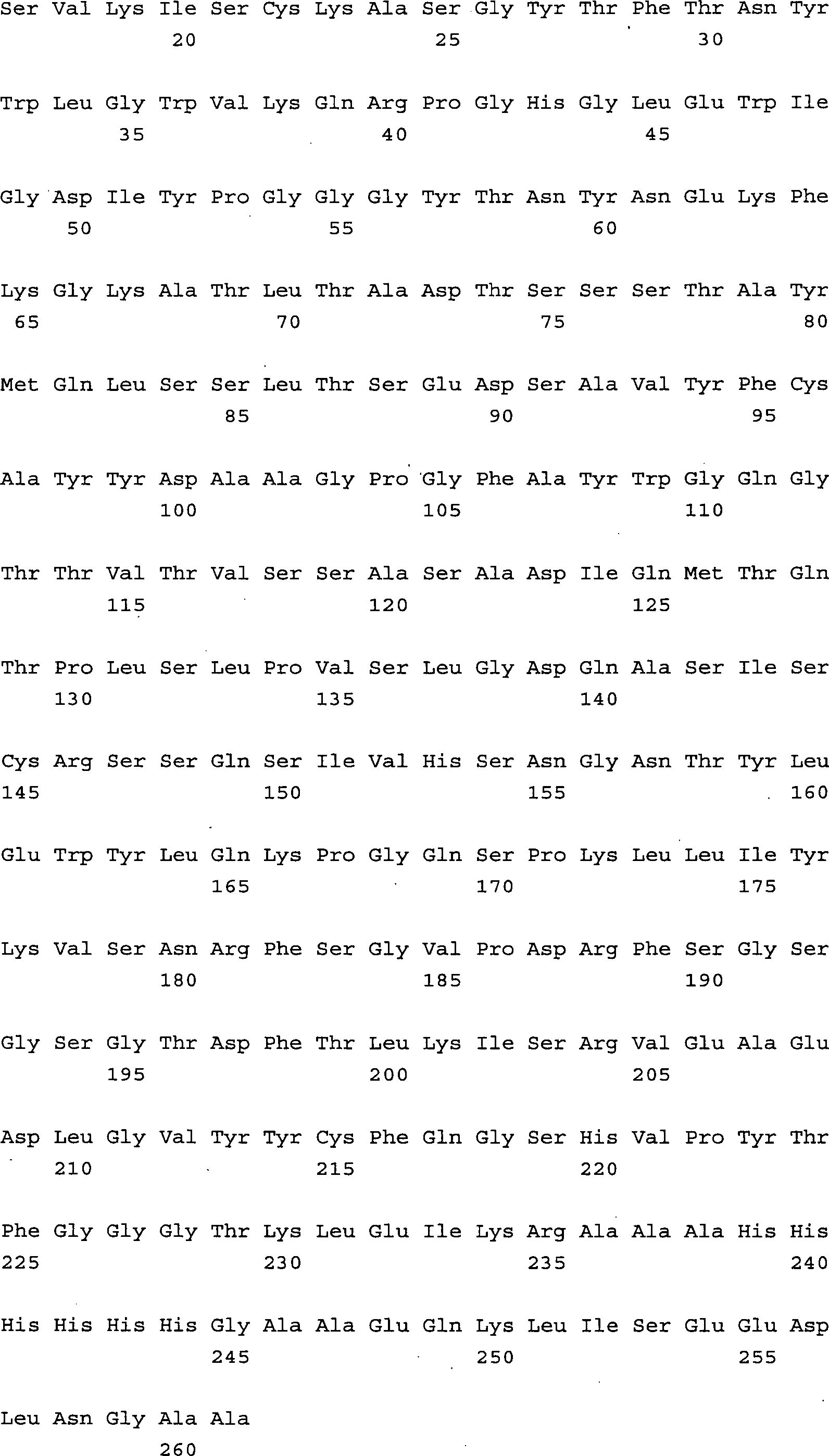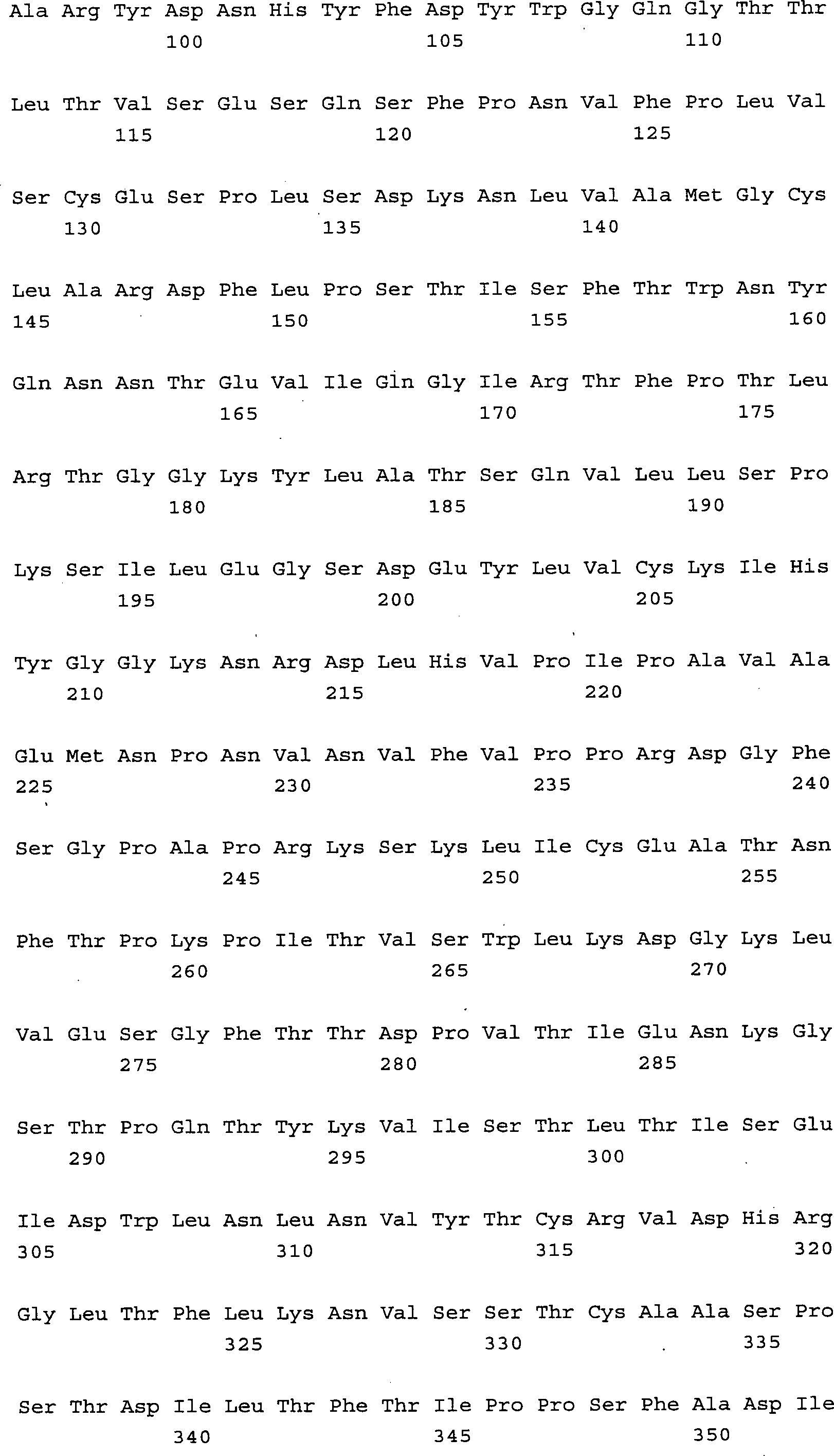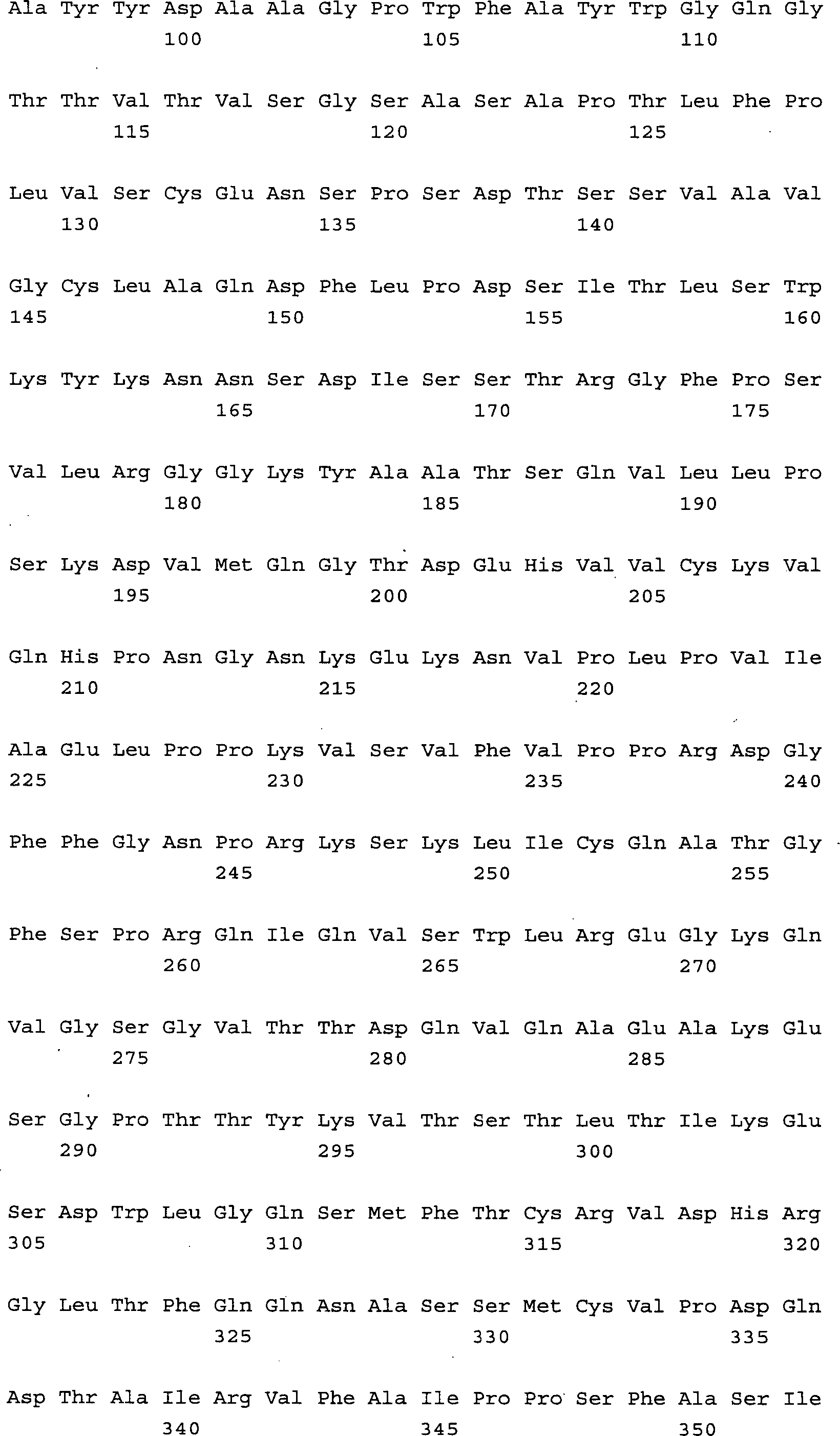-
Die Erfindung betrifft Erkennungsmoleküle, die
gegen Tumore gerichtet sind und zur Diagnose und Therapie von Tumorerkrankungen
verwendet werden können.
-
Tumor- oder Krebserkrankungen sind
Geschwulsterkrankungen, die eine örtlich umschriebene Zunahme
des Gewebevolumens beschreiben. Im weiteren Sinne ist jede lokalisierte
Anschwellung durch Ödeme, akute
und/oder chronische Entzündungen,
eine aneurysmatische Erweiterung oder auch eine entzündlich bedingte
Organschwellung ein Tumor. Im engeren Sinne werden vor allem gewebliche
Neubildungen wie Gewächse,
Blastome und/oder Neoplasien in Form eines spontanen, verschiedenartig
enthemmten, autonomen und irreversiblen Überschußwachstums von körpereigenem
Gewebe, das in der Regel mit unterschiedlich ausgeprägtem Verlust
spezifischer Zellen und Gewebefunktionen verbunden ist, als Tumorerkrankungen
verstanden. Es ist möglich,
Tumore nach ihrem biologischen Verhalten, aber auch nach einer histogenetischen
Systematik bzw. nach klinischen oder pathologischen Befunden zu
systematisieren.
-
Insbesondere im klinischen Bereich
kann es erforderlich sein, Tumore möglichst frühzeitig und auch selektiv zu
erkennen, da eine frühzeitige
Erkennung und die dann folgende Behandlung bzw. Entfernung sicherstellt,
daß die
Geschwulst erfolgreich behandelt werden kann, ohne daß die befallenen
Organstrukturen bzw. Genabschnitte deformiert werden, wobei weiterhin
verhindert werden kann, daß sich
Metastasen ausbilden. Auch bei den Folgeuntersuchungen nach einer
Krebsbehandlung müssen
kleinste Metastasen frühzeitig detektiert
werden, um die weitere Nachbehandlung zu optimieren. Für weite
Bereiche der Arbeitsmedizin ist es außerdem notwendig, zu bestimmen,
ob ein Gewebe oder ein Organ eine potentielle Krebsanfälligkeit
zeigt, ohne daß das
Organ bzw. das Gewebe bereits selbst entartet bzw. transformiert
ist.
-
Die älteste und zugleich einfachste
und zum Teil auch noch heute mit Erfolg angewendete Methode, einen
Tumor zu erkennen, ist das Tasten und Schauen. So ist z.B. das Mammakarzinom
bzw. das Prostatakarzinom als Knoten ertastbar. Hinweise auf Hautkrebs
sind durch auffällige
Muttermale durch den Arzt oder den Patienten selbst optisch zu detektieren.
Andere optische Verfahren sind beispielsweise die bildgebenden Methoden.
Hier werden mit Hilfe von Apparaten Bilder vom Körper aufgenommen, auf denen
ein Tumor erkennbar ist. Zu diesen Methoden zählen zum Beispiel Röntgenbestrahlung
wie auch die Computer-Tomographie
(CT). Bei diesen Verfahren wird der Körper mit energiereicher Strahlung
durchleuchtet, wobei die entarteten Gewebestrukturen aufgrund der
veränderten
Durchlässigkeit
für diese
Strahlung im Vergleich zum gesunden Gewebe erkennbar sind. Häufig werden
bei diesen Methoden Kontrastmittel verwendet, die in entsprechende
Regionen gespritzt werden und die Absorption erhöhen. Außerdem ist die Krebsdiagnose
mittels Ultraschall sowie durch die Verwendung radioaktiv markierter
Antikörper
möglich,
wobei die tumortypischen Antigene an die zu untersuchenden Organe
binden und so die Tumore innerhalb des bildgebenden Verfahrens erkennbar
machen. Neben den bildgebenden Methoden sind Laboruntersuchungen
ein weiteres wichtiges Mittel zur Krebsfrüherkennung. Dabei werden Proben
von Urin, Blut oder auch Gewebeproben auf Abnormitäten untersucht.
Dies kann beispielsweise eine veränderte Zusammensetzung dieser
Proben sein, aber auch das Auftreten von Substanzen, die normalerweise
nicht oder nur in geringen Mengen vorkommen. Diese Substanzen werden
allgemein als Tumormarker bezeichnet. Sie werden entweder vom Tumorgewebe
selbst produziert oder als Reaktion des Körpers auf den Tumor gebildet.
Als Tumormarker werden neben Substanzen auch zelluläre Veränderungen
bezeichnet, deren qualitative oder quantitative Analyse eine Aussage über das
Vorliegen, den Verlauf oder eine Prognose von bösartigen Erkrankungen ermöglicht.
Tumormarker sind meist physiologisch vorkommende bzw. modifizierte
Substanzen, die gegenüber
physiologischen Bedingungen oder der normalen genotypischen/phänotypischen
Ausprägung
im Urin, Serum oder anderen Körperflüssigkeiten
in erhöhter
oder erniedrigter Konzentration oder in oder auf Tumorzellen nachweisbar
sind, wobei diese Substanzen vom Tumorgewebe synthetisiert und/oder
sezerniert und folgend durch Tumorzerfall freigesetzt oder als Reaktion
des Organismus auf einen Tumor gebildet werden. Es ist eine Vielzahl
von Tumormarkern beschrieben worden, deren Einsatz insbesondere
beim Dickdarmkrebs, Brustkrebs, Eierstockkrebs, Prostata- und Hodenkrebs
und beim kleinzelligen Lungenkarzinom als sinnvoll gilt. Zu diesen
Krebsmarkern gehört
beispielsweise das CEA, CA 15-3, CA 125, Alpha-Fetoprotein, HCG,
das prostataspezifische Antigen, die neuronspezifische Enolase,
CA 19-9 und SCC.
-
Die genannten Marker zeigen durch
eine Erhöhung
im Serum oder in Geweben oder durch ihr Vorhandensein als modifizierte
Proteine, Lipide und/oder Kohlenhydrate zum einen beispielsweise
(i) entzündliche
Erkrankungen, Darmpolypen, Virusentzündungen aber insbesondere auch
(ii) Zirrhosen, Entartungen, Tumore und Metastasen an. Ein Großteil dieser
Marker besteht aus Molekülen,
die Protein- als auch Kohlenhydratstrukturen, ggf. Lipide umfassen.
Je geringer der Proteinanteil und demgemäß je größer der Kohlenhydrat- oder
Lipidanteil dieser Marker ist, um so schwieriger können diese
beispielsweise mit Erkennungsmolekülen, wie z.B. Antikörpern, detektiert
werden. Bisher wurden durch Immunisierung von Mäusen mit Hilfe der Hybridom-Technologie
verschiedene Antikörper
gegen Kohlenhydratstrukturen hergestellt.
-
Die Krebsdiagnostik mit Erkennungsmolekülen weist
mehrere Nachteile auf. So können
bestimmte Tumormarker auch bei nichtkanzerogenen Krankheiten auftreten,
wodurch die eingesetzten Erkennungsmoleküle eine positive Reaktion anzeigen;
weiterhin bedeutet eine Nichtinteraktion der Erkennungsmoleküle nicht, daß keine
Tumorkrankheit vorhanden ist. Ein weiterer Nachteil ist, daß die bekannten
Erkennungssubstanzen in der Regel unspezifisch sind. Das bedeutet,
daß ein
positiver Nachweis nur in seltenen Fällen auf eine bestimmte Art
der Tumorerkrankung weist. Ein weiterer, ganz entscheidender Nachteil
der bekannten Erkennungsmoleküle
ist außerdem,
daß sie
nur bedingt zur Verlaufskontrolle der Entwicklung von Tumoren, beispielsweise
nach einer Operation, verwendet werden können. Das heißt, die
bekannten Tumormarker können in
der Regel nicht zur Früherkennung
oder zur Nachbehandlung, insbesondere nicht zur Prophylaxe eingesetzt werden.
-
Neben diesen allgemeinen Nachteilen
treten bei Erkennungsmolekülen,
die gegen Kohlenhydratstrukturen gerichtet sind, spezielle Nachteile
auf. Die Immunisierung mit Kohlenhydratantigenen führt meist
nur zu einer primären
IgM-Antwort bzw.
die Immunantwort bleibt vollständig
aus, da viele Kohlenhydratstrukturen auch Autoantigene sind. Weil
Kohlenhydrate T-Cell-unabhängige
Antigene sind, die nicht in der Lage sind, einen Klassenswitch und
die damit verbundene Reifung durch somatische Mutationen hervorzurufen,
bleibt die Antikörperantwort
meist auf die IgM-Klasse beschränkt.
Aufgrund der generell schwachen Wechselwirkung und der notwendigen
Multivalenz ist es deshalb schwierig, Antikörper mit hoher Affinität herzustellen.
Ein Problem bei Antikörpern gegen
Kohlenhydratstrukturen sind nicht nur die geringe Affinität, sondern
auch die Spezifität.
Besonders gegen kurze nichtgeladene Kohlenhydratstrukturen ist es äußerst schwierig,
spezifische Antikörper
herzustellen, wobei eine gewisse Spezifität in vielen Fällen auch
nur dann erreicht wird, wenn die Kohlenhydratstruktur auf einem
bestimmten Träger
lokalisiert ist. So erkennt beispielsweise der Antikörper JAA/F11,
der gegen Galβ1→3GalNAc
gerichtet ist, nicht nur dieses Antigen selbst, sondern auch GIcNAcβ1→6Galβ1→3-(GlcNAcβ1→6)GalNAc
sowie, wenn auch mit geringerer Avidität, Galβ1-3GlcNAc. Auch die neueren
Möglichkeiten
der Gewinnung von Erkennungsmolekülen durch verschiedene Formen
der kombinatorischen Techniken, wie beispielsweise der Phagendisplay-Technologie,
lösen die
genannten Nachteile nicht. Auch hier bleibt das Problem der schwachen
Erkennungsmolekül-Kohlenhydrat-Interaktion.
Zu berücksichtigen
ist hierbei insbesondere, daß die
durch Immunisierung meistgewonnenen primären IgM-Antikörper für den therapeutischen
Einsatz zu groß sind.
Ein weiterer Nachteil der bekannten Erkennungsmoleküle gegen Tumormarker
ist der, dass sie den Tumor erst erkennbar machen, wenn dieser eine
kritische Größe bereits erreicht
hat. Das heißt,
frühe Stadien
des Tumorwachstums können
mit den bekannten Erkennungsmolekülen, die gegen Tumormarker
gerichtet sind, nicht bestimmt werden.
-
Ein weiterer Nachteil der bekannten
Erkennungssubstanzen ist, daß sie
nicht "funktional" eingesetzt werden
können.
Funktional bedeutet, daß die
Erkennungsmoleküle
nicht nur so an die Tumormarker binden, daß diese detektiert werden,
sondern daß sie
somit über
Marker mit der Tumorzelle Wechselwirken, daß die Tumorzelle in ihrem Wachstum
beeinträchtigt
wird. Es ist möglich,
daß die
Erkennungsmoleküle
mit bestimmten Tumormarkern, die beispielsweise auf Tumorzelloberflächen immobilisiert
sind, so spezifisch interagieren, daß der durch die Tumormarker
charakterisierte Tumor therapeutisch behandelt wird. Diese funktional
aktiven Erkennungsmoleküle
sind zum einen in der Lage, tumorzellenassoziierten Tumormarker
zu detektieren und gleichzeitig durch ihre Bindung an diese tumorspezifische
Struktur die Tumorzelle an einem weiteren Wachstum oder an einer
Ausbildung von Metastasen zu hindern. Die bekannten Erkennungsmoleküle sind
nachteilhafterweise in nur wenigen Fällen in der Lage, das Tumorwachstum
zu beeinflussen. In der Regel müssen
daher zusätzlich
Substanzen, die das Tumorwachstum einschränken bzw. inhibieren, an den
Antikörper
gekoppelt werden, so daß dieser
die „Fähre" dieser Substanz
ist, aber nicht das Agens der Behandlung.
-
Aufgabe der Erfindung ist es daher,
Erkennungsmoleküle
bereitzustellen, mit denen zum einen Tumore einfach, sicher und
effizient detektiert werden können,
und die weiterhin in der Prophylaxe, Therapie und/oder Nachbehandlung
von Tumoren eingesetzt werden können.
-
Die Erfindung löst dieses technische Problem
durch die Bereitstellung von Erkennungsmolekülen umfassend eine Aminosäuresequenz,
die die Aminosäuresequenz
SEQ ID Nr. 1 und die Aminosäuresequenz SEQ
ID Nr. 2 oder 3 und die Aminosäuresequenz
SEQ ID Nr. 4, 5 oder 6 enthält,
wobei die Erkennungsmoleküle
das Antigen Core-1 spezifisch binden.
-
Die Definitionen der Begriffe, die
im folgenden gemacht werden, treffen mutatis mutandis auf zuvor
gemachte, diese und die nachfolgenden Ausführungen zu.
-
Unter dem Begriff Erkennungsmolekül versteht
man erfindungsgemäß ein Molekül, das,
insbesondere unter stringenten Bedingungen, die Kohlenhydratstruktur
Core-1 spezifisch bindet.
-
Unter Core-1 versteht man erfindungsgemäß die Kohlenhydratstruktur
Galβ1-3GalNAc,
die als α-Anomer
(Galβ1-3GalNAcα) oder β-Anomer (Galβ1-3GalNAcβ) vorliegen
kann. Bevorzugt ist hier die α-anomere Variante.
Die erfindungsgemäßen Erkennungsmoleküle können aber
auch nur das alpha-Anomer Galβ1-3GalNAcα oder beide
Anomere Galβ1-3GalNAcα und Galβ1-3GalNAcβ in gleicher
Weise binden.
-
Unter einer spezifischen Bindung
gegen Core-1 versteht man erfindungsgemäß eine Bindung, die nur Core-1,
bevorzugt das α-Anomer, erkennt oder
die Core-1 und Core-2 (Galβ1-3(GlcNAcβ1-6)GalNAca) erkennt.
Die Erkennungsmoleküle
zeigen dabei keine Kreuzreaktivität mit anderen Derivaten und
Anomeren dieser Kohlenhydratstrukturen wie sie in Beispiel 7 aufgeführt sind.
Die erfindungsgemäßen Erkennungsmoleküle interagieren
nicht mit Galα1-3GalNAcα, Galα1-3GalNAcβ, GalNAcα, Neu5Acα2-3Galβ1-3GalNAcα, Galβ1-3 (Neu5Acα2-6)GalNAcα, GlcNAcβ1-2Galβ1-3GalNRcα, GlcNAca1-3Galβ1-3GalNAcα, GalNAcα1-3Galβ und 3'-O-Su-Galβ1-3GalNAcα unter den
in Beispiel 7 beschriebenen Bedingungen. Die Bestimmung erfolgt
dabei insbesondere über
Spezifitätstests
mit definierten synthetischen Kohlenhydratstrukturen.
-
In einer bevorzugten Ausführungsform
umfasst ein erfindungsgemäßes Erkennungsmolekül, das das Antigen
Core-1 spezifisch bindet:
- a) eine erste Aminosäuresequenz,
die die Aminosäuresequenz
SEQ ID Nr . 1 und die Aminosäuresequenz SEQ
ID Nr . 2 oder 3 und die Aminosäuresequenz
SEQ ID Nr. 4 oder 5 oder 6 enthält;
und
- b) eine zweite Aminosäuresequenz,
die die Aminosäuresequenz
SEQ ID Nr. 7 oder 8 oder 9 und die Aminosäuresequenz SEQ ID Nr. 10 oder
11 und die Aminosäuresequenz
SEQ ID Nr. 12 oder 13 enthält.
-
Die erste und zweite Aminosäuresequenz
können
dabei auf einem oder mehreren, dort bevorzugt zwei, Polypeptiden
vorkommen.
-
Die erfindungsgemäßen Core-1 bindenden Erkennungsmoleküle sind
dadurch charakterisiert, dass sie ein definiertes Set von einzelnen
Aminosäuresequenzen
beinhalten. Die Aminosäuresequenz
dieser Erkennungsmoleküle
enthält
ein oder zwei Tripletts definierter Sequenzen. Diese Sequenzen stellen
die Bindungsdomänen
dar und definieren die Spezifität
des Erkennungsmoleküls.
Das 1-Triplett-Erkennungsmolekül enthält die Aminosäuresequenz
SEQ ID NO. 1, die Aminosäuresequenz
SEQ ID NO. 2 oder 3 und die Aminosäuresequenz SEQ ID NO. 4 oder
5 oder 6. Core-1-spezifische Erkennungsmoleküle, die durch zwei Tripletts definiert
sind, enthalten für
das erste Triplett die Aminosäuresequenz
SEQ ID NO. 1, die Aminosäuresequenz SEQ
ID NO. 2 oder 3 und die Aminosäuresequenz
SEQ ID NO. 4 oder 5 oder 6 und für
das zweite Triplett die Aminosäuresequenz
SEQ ID NO. 7 oder 8 oder 9, die Aminosäuresequenz SEQ ID NO. 10 oder
11 und die Aminosäuresequenz
SEQ ID NO. 12 oder 13. Dabei können
das erste und zweite Triplett entweder auf einer oder mehreren Polypeptidketten
vorkommen, die im letzteren Fall gemeinsam das bindende Erkennungsmolekül bilden.
Im Weiteren werden diese Tripletts im Sinne der Erfindung als Triplettsequenz
1 für die
erste umfasste Aminosäuresequenz
und als Triplettsequenz 2 für
die zweite umfasste Aminosäuresequenz,
siehe Definition a) und b) der obigen Beschreibung, bezeichnet.
Das Erkennungsmolekül
kann erfindungsgemäß ein Antikörper sein,
insbesondere ein muriner, chimärer
oder humaner IgG oder IgM, eine scFv-Struktur oder eine andere.
-
Eine weitere Ausführungsform der Erfindung betrifft
Erkennungsmoleküle,
bei denen mindestens eine Aminosäuresequenz
der SEQ ID NO. 1 bis 13 durch Mutation, Deletion und/oder Insertion
verändert
ist, wobei jedoch die Eigenschaft der Bindungsspezifität gegen
Core-1 weiter besteht. Dies dient vorteilhafterweise der Verbesserung
der Erkennungsmoleküle,
beispielsweise in Bezug auf Affinität, Löslichkeit und/oder Produzierbarkeit.
-
In einer bevorzugten Ausführungsform
erfolgt die Modifikation eines Erkennungsmoleküls durch eine oder mehrere
Mutationen in einer oder mehreren Aminosäuresequenzen ausgewählt aus
SEQ ID NO. 1 bis 13, wobei einzelne Aminosäuren durch Aminosäuren mit
analogen physikochemischen Eigenschaften ersetzt werden, die die
3-dimensionale Struktur der Bindungsdomäne des Erkennungsmoleküls mit Vorteil
nicht grundlegend verändern,
so dass die Core-1 Spezifität
des Erkennungsmoleküls
erhalten bleibt. Aminosäuren mit
analogen physikochemischen Eigenschaften im Sinne der Erfindung
können
in 6 verschiedene Gruppen zusammengefaßt werden und sind in Tabelle
1 dargestellt. Tabelle
1: Aminosäuren
mit analogen physikochemischen Eigenschaften unberücksichtigt
der molekularen Größe. Eigenschaft
oder Aminosäure
| funktionelle
Gruppe | |
| aliphatisch | Glycin |
| | Alanin |
| | Valin |
| | Leucin |
| | Isoleucin |
| Hydroxy-Gruppe | Serin |
| | Threonin |
| Carboxy-Gruppe | Asparaginsäure |
| | Glutaminsäure |
| Amid-Gruppe | Asparagin |
| | Glutamin |
| Amino-Gruppe | Lysin |
| | Arginin |
| aromatisch | Phenylalanin |
| | Tyrosin |
| | Tryptophan |
-
In einer weiter bevorzugten Ausführungsform
der erfindungsgemäßen Erkennungsmoleküle, die
Core-1 spezifisch binden, ist mindestens eine Aminosäuresequenz
der Aminosäuresequenzen
SEQ ID NO. 1, 2, 3, 7, 8 und/oder 9 durch kanonische Strukturvarianten
bzw. äquivalente
Strukturen mit den Aminosäuresequenzen
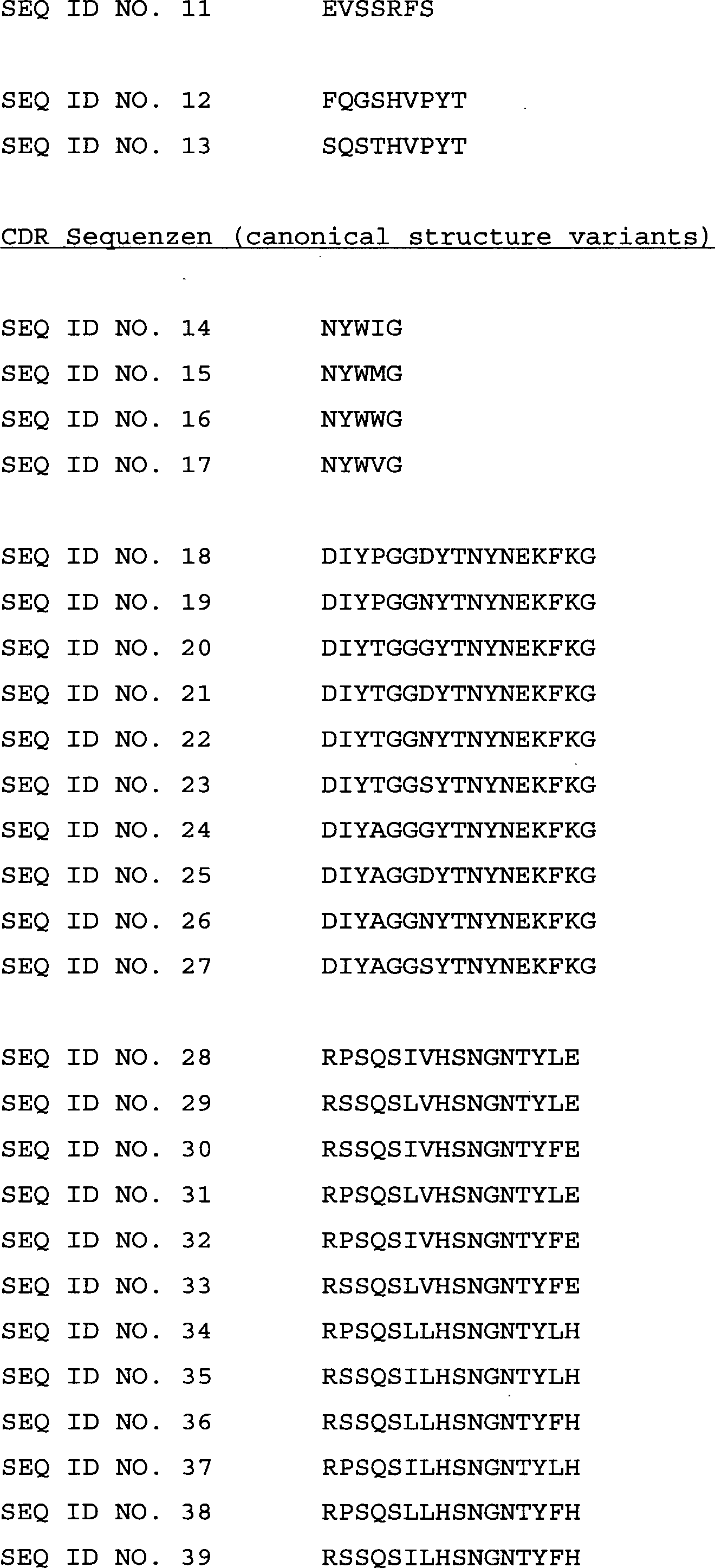
SEQ ID NO. 14 bis 45 ersetzt, wobei die, SEQ ID NO. 1 durch eine
Sequenz der Sequenzen SEQ ID NO. 14 bis 17 (CDRH1), die SEQ ID NO.
2 oder 3 durch eine Sequenz der Sequenzen SEQ ID NO. 18 bis 27 (CDRH2)
und die SEQ ID NO. 7 oder 8 oder 9 durch eine Sequenz der Sequenzen
SEQ ID NO. 28 bis 45 (CDRL1) ersetzt ist.
-
Der generelle Zusammenhang zwischen
einer Aminosäuresequenz
und der Tertiärstruktur
der von diesen Sequenzen gebildeten Loops ist dem Fachmann bekannt
und wurde ausführlich
untersucht [Rooman et al., 1989; Martin, Thornton, 1996]. Ein spezielles
Beispiel stellen die Immunglobuline dar. Durch Analyse der Loop-Konformationen
der hypervariablen Regionen (complementarity determining regions,
CDRs) in der leichten und der schweren Kette von Antikörpermolekülen wurden
sogenannte kanonische Klassen definiert [Chothia, Lesk, 1987; Chothia
et al., 1986, 1989, 1992; Wu, Cygler, 1993]. Auf dieser Grundlage
wurden die kanonischen Strukturvarianten SEQ ID NO. 14 bis 45 der
SEQ ID NO 1, 2, 3, 7, 8 und 9 abgeleitet.
-
Die Aminosäuresequenzen SEQ ID NO. 1 bis
13 oder deren Modifikationen in einem Core-1 spezifischen Erkennungsmolekül im Sinne
der Erfindung bilden räumliche
Strukturen aus, beispielsweise so genannte Loops, die dadurch gekennzeichnet
sind, dass sie eine definierbare Tertiärstruktur und/oder Quartärstruktur besitzen.
Die Bindungsregion eines Erkennungsmoleküls mit dem Core-1 Antigen wird
von Aminosäureresten gebildet,
die von bis zu sechs variablen Loops an der Oberfläche des
Moleküls
bereitgestellt werden, und die spezifisch mit Core-1 interagieren.
-
In einer weiteren Ausführungsform
der Erfindung werden Erkennungsmoleküle, die Core-1 spezifisch binden,
bereitgestellt, bei denen mindestens eine Sequenz der Sequenzen
des Tripletts weggelassen wird, die nicht unmittelbar an der Interaktion
mit dem Core-1 Antigen beteiligt ist.
-
In einer weiteren Ausführungsform
umfassen die Erkennungsmoleküle
mindestens eine der Aminosäuresequenzen
der SEQ ID NO. 1 bis 13 oder deren oben beschriebene Varianten doppelt
oder mehrfach, wobei diese Dopplungen auch als Varianten der gleichen
Aminosäuresequenz
vorkommen können.
Alle die in diesem Abschnitt beschriebenen Erkennungsmoleküle erkennen
vorteilhafterweise das Antigen Core-1 spezifisch. Im folgenden werden
auch diese Erkennungsmoleküle,
die streng genommen aufgrund des Weglassens oder Vervielfältigen von
Sequenzen keine Triplettsequenzen tragen, trotzdem als Triplettsequenz
1 oder Triplettsequenz 2 bezeichnet, um die Anschaulichkeit zu vereinfachen.
-
In einer weiteren Ausführungsform,
umfassen die erfindungsgemäßen Erkennungsmoleküle, die
das Core-1 Antigen spezifisch binden, Aminosäuresequenzen, die eine Homologie
von mindestens 60%, vorzugsweise 70%, bevorzugt 806, ganz besonders
bevorzugt 90% gegenüber
den Sequenzen SEQ ID NO. 1 bis 13 aufweisen.
-
Die Erkennungsmoleküle im Sinne
der Erfindung können
weiterhin Gerüstsequenzen
umfassen, die die umfassenden Aminosäuresequenzen Aminosäuresequenz
SEQ ID NO. 1 und die Aminosäuresequenz SEQ
ID NO. 2 oder 3 und die Aminosäuresequenz
SEQ ID Nr. 4 oder 5 oder 6, oder deren oben beschriebene Varianten,
voneinander trennen, und Gerüstsequenzen,
die die Aminosäuresequenzen
SEQ ID Nr. 7 oder 8 oder 9 und die Aminosäuresequenz SEQ ID Nr. 10 oder
11 und die Aminosäuresequenz
SEQ ID Nr. 12 oder 13 , oder deren oben beschriebene Varianten,
voneinander trennen. Die erste und zweite Aminosäuresequenz können dabei
auf einem oder mehreren, bevorzugt zwei, Polypeptidketten vorkommen.
Diese Gerüstsequenzen
werden im Sinne der Erfindung als Spacer oder Frameworksequenzen
bezeichnet und können
unterschiedliche Längen
und Sequenzen haben. Dabei sind ebenfalls solche Erkennungsmoleküle ausdrücklich mit eingeschlossen,
bei denen nicht alle Aminosäuresequenzen
der SEQ ID Nr. 1 bis 13 oder deren oben beschriebenen Varianten
durch Spacer getrennt werden. Darüber hinaus haben die Erkennungsmoleküle vorzugsweise
weitere flankierende Aminosäuresequenzen,
die im Sinne der Erfindung auch als Gerüstsequenzen bezeichnet werden.
-
Die Gerüstsequenzen haben insbesondere
die Aufgabe, die beschriebenen Aminosäuresequenzen, die für die Core-1
spezifische Bindung der Erkennungsmoleküle verantwortlich beziehungsweise
beteiligt sind, in eine geeignete Anordnung und räumliche
Struktur zu bringen, damit die Bindung an das Core-1 erfolgen kann.
Es kann vorgesehen sein, dass die Aminosäuresequenzen SEQ ID NO. 1 bis
NO. 13 ohne mindestens eine zusätzliche
Aminosäuresequenz
als Gerüstsequenz
das Core-1 Antigen im Sinne der Erfindung nicht spezifisch binden
können.
-
Darüber hinaus können die
Gerüstsequenzen
den Erkennungsmolekülen
z.B. die notwendige biologische und chemische Stabilität geben,
damit die räumliche
Struktur effektiv aufgebaut und für die Funktion und Anwendung
in einer geeigneten funktionellen Form, die die Core-1 Bindung beinhaltet,
erhalten werden kann.
-
In einer bevorzugten Ausführungsform
werden die Triplettsequenzen in bestehende Proteine durch Austausch
von Aminosäuresequenzen
und/oder durch Hinzufügung
eingefügt,
wobei die bestehenden Proteinsequenzen als Gerüstsequenzen im Sinne der Erfindung
dienen, beziehungsweise Gerüstsequenzen
aus geeigneten Proteinen entnommen sind. Dabei können diese Gerüstsequenzen
beispielsweise durch Mutationen, Deletionen oder Insertionen verändert werden.
Hierbei bedient man sich dem Fachmann an sich bekannter Methoden
der Molekularbiologie, Biochemie und Protein-Engineering. Bevorzugte
Proteine hierfür
sind Proteine der Immunglobulin-Superfamilie, Protease-Inhibitoren, Lektine,
Helix-Bündel-Proteine
und Lipocaline, wie sie z.B. offenbart sind in: Nygren und Uhlen,
1997; Nuttall SD et al., 1999 und Skerra, 2000.
-
In einer weiter bevorzugten Ausführungsform
sind die Gerüstsequenzen
Antikörpergerüstsequenzen aus
einer oder verschiedenen Spezies oder Aminosäuresequenzen, die die Consensussequenz
der Gerüstsequenzen
muriner, humaner und/oder Antikörper
anderer Säuger
nachahmen. Eine Consensussequenz ist eine idealisierte Sequenz,
in der repräsentativ
an jeder Position die am meisten vorkommende Aminosäure steht,
wenn viele existierende Sequenzen, beispielsweise aus Antikörper-Datenbanken, miteinander
verglichen werden. Dabei sind die hier bevorzugten Erkennungsmoleküle dadurch
gekennzeichnet, dass die Gerüstsequenzen
für die
erste Triplettsequenz 1 umfassend die Aminosäuresequenz SEQ ID NO. 1, die
Aminosäuresequenz
SEQ ID NO. 2 oder 3 und die Aminosäuresequenz SEQ ID NO. 4 oder
5 oder 6, oder deren oben beschriebene Varianten, Antikörpergerüstsequenzen
der variablen schweren Kette VH, die in der Literatur auch als Framework-Sequenzen
bezeichnet werden, sind und die Gerüstsequenzen für die Triplettsequenz
2 umfassend die Aminosäuresequenz
SEQ ID NO. 7 oder 8 oder 9, die Rminosäuresequenz SEQ ID NO. 10 oder
11 und die Aminosäuresequenz
SEQ ID NO. 12 oder 13 , oder deren oben beschrieben Varianten, Antikörpergerüstsequenzen
der variablen leichten Kette VL sind.
-
Bevorzugt sind weiterhin Antikörpergerüstsequenzen
von Antikörpern
aus Säugetieren,
besonders bevorzugt sind Antikörpergerüstsequenzen
humanen und/oder murinen Ursprungs. Die Gerüstsequenzen können dabei
aus Antikörpergerüstsequenzen
verschiedener Spezies kombiniert werden. Diese Antikörpergerüstsequenzen
sind dem Fachmann bekannt und in verschiedenen Datenbanken zugänglich wie
der Kabat-Datenbank (immuno.bme.nwu.edu) oder der Datenbank des
National Center for Biotechnology Information (www.ncbi.nlm.nih.gov).
Ebenfalls können
diese Antikörpergerüststrukturen
durch weitere Aminosäuren
verlängert, und/oder
durch eine oder mehrere Mutationen, z.B. Deletionen und/oder Insertionen,
verändert
werden, wobei die spezifische Bindung an Core-1 erhalten bleibt.
-
Werden in einer bevorzugten Variante
der Erfindung die Triplettsequenzen mit Antikörpergerüstsequenzen kombiniert, stellt
das Erkennungsmolekül
eine variable Kette eines Antikörpers
oder eine davon abgeleitete Struktur dar.
-
Besonders bevorzugte Antikörpergerüstsequenzen
als Gerüstsequenzen
im Sinne der Erfindung sind für
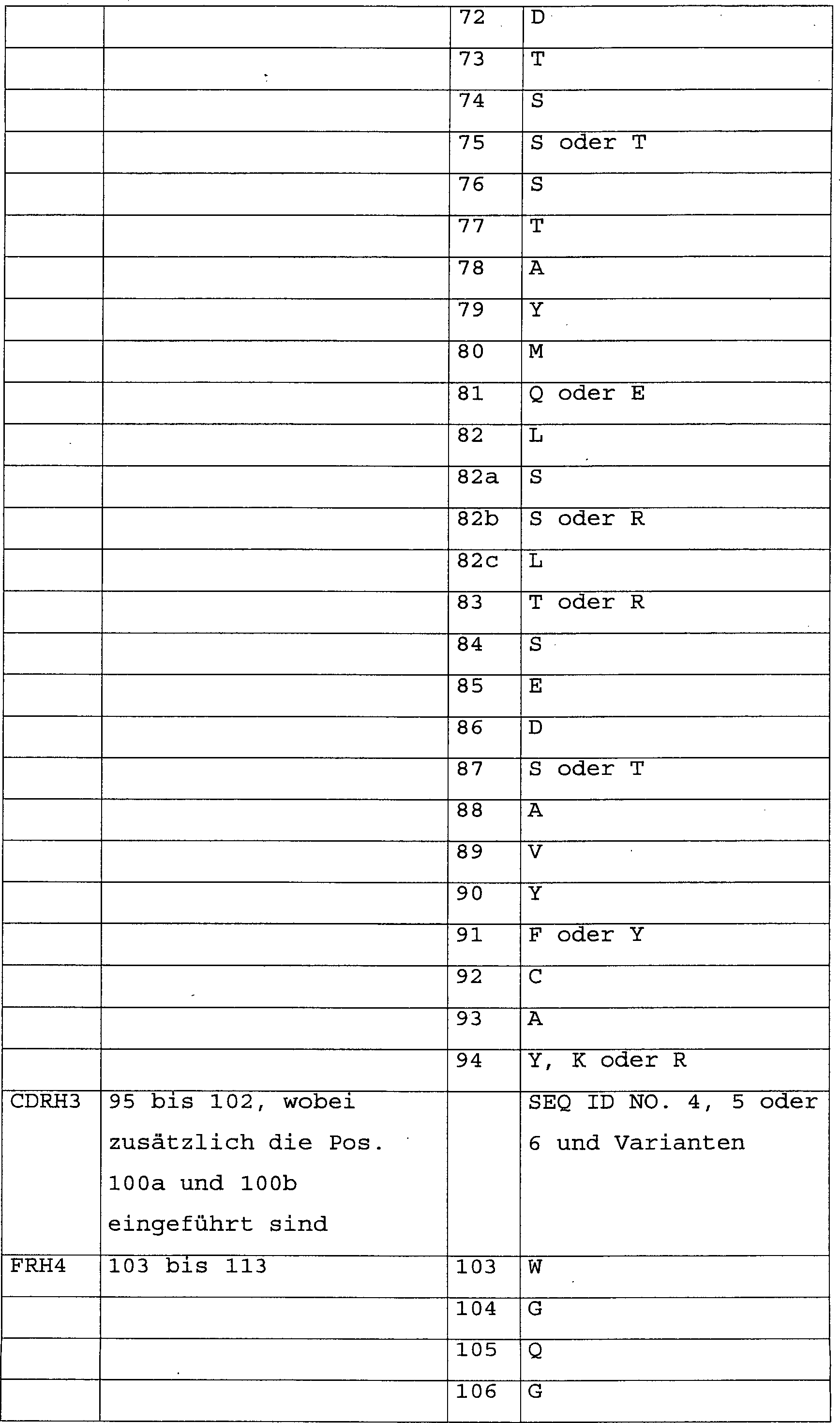
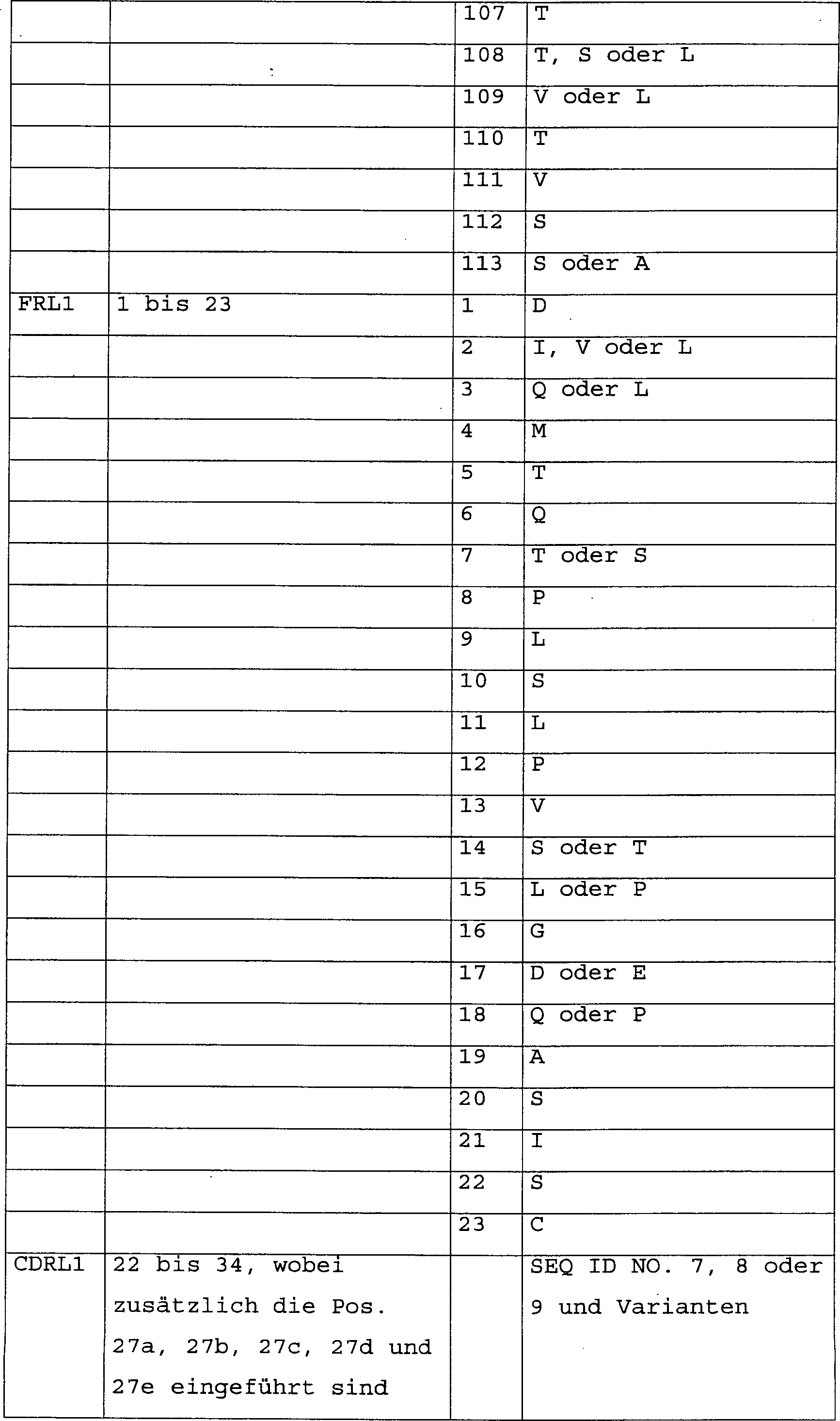
die variable schwere Kette die Aminosäuresequenzen entsprechend FRH1,
FRH2, FRH3 und FHR4 in Tabelle 2 und für die variable leichte Kette
die Aminosäuresequenzen
entsprechend FRL1, FRL2, FRL3 und FRL4 in Tabelle 2, wobei die Aminosäuresequenzen
der Triplettsequenzen 1 und 2 mit den SEQ ID NO. 1 bis 13. den entsprechenden
CDR-Regionen der Antikörper
entsprechen. Dabei setzen sich die variable schwere (VH) bzw. leichte
(VL) Antikörperkette
wie folgt zusammen: die VH: FRH1-CDRH1-FRH2-CDRH2-FRH3-CDRH3-FRH4 und die VL: FRL1-CDRL1-FRL2-CDRL2-FRL3-CDRL3-FRL4. Tabelle
2 erläutert
die Positionen im Detail. Die Positionen der einzelnen Aminosäuren bzw.
Aminosäuresequenzen
entsprechen der Nummerierung von Aminosäuren in Antikörpermolekülen nach
Kabat.
-
-
-
-
-
-
-
Die Aminosäuresequenzen SEQ ID NO. 46
bis 79 entsprechen Aminosäuresequenzen
mit bevorzugten Gerüstsequenzen
für die
variable schwere Kette. Die Aminosäuresequenzen SEQ ID NO. 80 bis
94 entsprechen Aminosäuresequenzen
mit bevorzugten Gerüstsequenzen
für die
variable leichte Kette.
-
Die zu verwendenden Techniken und
Methoden zur Herstellung dieser Sequenzen sind dem Fachmann bekannt,
ebenso ist der Fachmann in der Lage, geeignete Gerüstsequenzen
und/oder Mutationen auszuwählen.
-
Im Sinne der Erfindung können die
Core-1 spezifischen Erkennungsmoleküle in verschiedenen Formaten
vorliegen. Die grundlegende Struktur des Erkennungsmoleküls sind
eine oder mehrere Polypeptidketten, die oben beschriebenen erfindungsgemäßen Triplettsequenz
1 oder Triplettsequenzen 1 und 2 und Gerüstsequenzen umfassen. Beispielsweise
sind die Aminosäuresequenz
der variablen schweren Kette mit den Gerüstsequenzen und den Triplettsequenzen
1 und die Aminosäuresequenz
der variablen leichten Kette mit den Gerüstsequenzen und den Triplettsequenzen
2 nicht-kovalent oder kovalent miteinander verknüpft, und können auf einer oder mehreren
Polypeptidketten liegen. Mehrere Polypeptidketten können kovalent,
beispielsweise durch Disulfidbrücken,
oder nicht-kovalent verbunden als Erkennungsmolekül vorliegen.
-
Zu den unterschiedlichen erfindungsgemäßen Formaten
der Erkennungsmoleküle
gehören
insbesondere die Verknüpfung
der Triplettsequenzen mit Aminosäuresequenzen,
die über
die oben beschriebenen Gerüstsequenzen
hinausgehen. In einer bevorzugten Variante umfassen daher erfindungsgemäße Erkennungsmoleküle neben
den Triplettsequenzen und den Gerüstsequenzen weitere Zusatzsequenzen.
Zusatzsequenzen sind insbesondere Aminosäuresequenzen, die primär nicht
der räumlichen
Anordnung der Triplettsequenzen wie in Form der, Gerüstsequenzen
dienen, diese jedoch vorteilhaft durch sekundäre oder tertiäre Wechselwirkungen
beeinflussen können.
Beispielsweise stabilisieren Zusatzsequenzen in Form von konstanten
Domänen
eines Antikörpers
den Antikörper
und bewirken eine Dimerisierung, wodurch es zu einer verbesserten Bindung
des Antikörpers
kommt, oder beispielsweise bewirkt eine Fusion eines scFv mit einer
Domäne
eines Bakteriophagenhüllproteins
eine Aktivitätssteigerung
der scFv-Bindung,
wie sie z.B. in Jensen KB et al., 2002 offenbart ist.
-
In einer bevorzugten Ausführungsform
umfassen die Erkennungsmoleküle
Aminosäuresequenzen
mit Gerüstsequenzen
auf Antikörperbasis
und neben den Triplettsequenzen weitere Zusatzsequenzen. Die Zusatzsequenzen
haben insbesondere mindestens eine der folgenden Aufgaben:
- a) Verknüpfung
einer Triplettsequenz mit ihren entsprechend geeigneten Gerüstsequenzen
mit mindestens einer weiteren Triplettsequenz mit ihren entsprechend
geeigneten Gerüstsequenzen,
um beispielsweise eine Bindungsfähigkeit
zu erzeugen oder zu verbessern;
- b) der Stabilisierung der Domänen, beispielsweise durch einen
Linker zwischen zwei Proteindomänen
oder Aminosäuresequenzen,
die mit anderen der gleichen oder einer zweiten Kette in Wechselwirkung
treten;
- c) Effektorfunktionen für
immunologische Aufgaben, beispielsweise durch Fusion mit Fc-Teil
von Antikörpern,
Chemokinen, Cytokinen, Wachstumsfaktoren oder Teilen davon, oder
Antikörpern
mit einer anderen Spezifität
oder Fragmenten davon, zur Rekrutierung von Zellen des Immunsystems,
beispielsweise Makrophagen, oder Teilen des Komplementsystems;
- d) Fusion mit Tags, beispielsweise Multimerisierungssequenzen – zum Beispiel μ-tail-Sequenz
aus IgM oder Assoziationsdomäne
aus p53 oder MBL – zur
Multimerisierung der Core-1 bindenden Anteile für eine multivalente Bindung
oder zur Rufreinigung der Erkennungsmoleküle, beispielsweise His-Tag
oder zum Nachweis, beispielsweise myc-Tag oder zur Markierung oder
Chelatisierung von Erkennungsmolekülen, beispielsweise durch Lysin-reiche
Sequenzen.
-
Geeignete Strukturen sind dem Fachmann
bekannt oder durch logische Schlussfolgerung aus dem Stand der Technik
abzuleiten.
-
Dabei weiter bevorzugte Ausführungsformen
sind erfindungsgemäße Erkennungsmoleküle, die
folgende Formate umfassen: single chain Antikörperfragment (scFv), Fv-Fragment,
Fab-Fragment, F(ab)2-Fragment, Multibody (Dia-, Tria-, Tetrabody),
Immunglobulin der Isotypen IgG, IgM, IgA, IgE, IgD oder deren Subklassen,
beispielsweise IgGl, oder von Immunglobulinen abgeleitete Erkennungsmoleküle, die
mindestens eine konstante Domäne
umfassen.
-
In einer bevorzugten Ausführungsform
sind die erfindungsgemäßen Erkennungsmoleküle aus einer schweren
und einer leichten Polypeptidkette zusammengesetzt, wobei die Aminosäuresequenzen
der schweren und leichten Kette jeweils eine der oben beschriebenen
Triplettstrukturen umfassen, die die CDR Regionen des Antikörpers darstellen,
die entsprechenden Antikörpergerüstsequenzen,
die die Frameworksequenzen der Antikörper darstellen, und Zusatzsequenzen,
die mindestens eine der konstanten Domänen des Antikörperisotyps
umfassen. Die beiden Ketten können
miteinander kovalente Bindungen eingehen. Die konstanten Regionen
und variablen Regionen können
dabei Sequenzen von Antikörpern
aus einer oder verschiedenen Spezies enthalten. Es können Teile
von konstanten Domänen
oder ganze konstante Domänen
deletiert oder mutiert sein, beispielsweise um die Effektorfunktion
der Zusatzsequenzen zu verändern, beispielsweise
die Bindung an Fc-Rezeptoren zu verhindern oder zu verbessern. In
einer bevorzugten Ausführungsform
ist das Erkennungsmolekül
ein muriner, chimärisierter,
humanisierter, partiell humaner oder humaner Antikörper oder Antikörperfragment.
Die Chimärisierung
erfolgt beispielsweise durch Verknüpfung der variablen Antikörperdomänen mit
konstanten Antikörperdomänen oder
Fragmenten der konstanten Domäne
von Antikörpern
verschiedener Spezies. Bevorzugt sind Sequenzen der konstanten Domänen humaner
Antikörper.
-
Die Antikörpergerüstsequenzen können so
gewählt
werden, dass die Sequenzen weitestgehend homolog zu humanen Antikörpersequenzen
sind. Die Wahl für
den Speziesursprung der Gerüstsequenzen
hängt auch
von der Anwendung ab. So werden für eine therapeutische Anwendung
in bestimmten Bereichen möglichst
große
Anteile an humanen Gerüstsequenzen
bevorzugt, vor allem dann, wenn eine human anti-Maus Antikörperantwort
(HAMA) vermieden werden soll. In anderen therapeutischen Bereichen
ist ein Xenoanteil vorteilhaft, da er das Immunsystem in einer zusätzlichen
Weise stimuliert. Eine Kombination beider ist in einigen Fällen besonders
geeignet, vor allem dann, wenn in einer Erstimmunisierung ein Xenoanteil
vorteilhaft und bei späteren
Anwendungen ein spezieskonformer und damit humaner Anteil vorteilhaft
ist.
-
Bevorzugt ist eine Homologie zu humanen
Consensussequenzen, wobei für
die variable schwere Kette die HuHI und für die variable leichte Kette
die HuKII bevorzugt wird. Besonders bevorzugt ist eine Homologie zu
humanen Keimbahnsequenzen, die dem Fachmann bekannt sind und zum
Beispiel über
die V BASE Datenbank (www.mrc-cpe.cam.ac.uk) zugänglich sind.
-
Die zu verwendenden Techniken und
Methoden zur Herstellung dieser Sequenzen sind dem Fachmann bekannt,
ebenso ist der Fachmann in der Lage, geeignete humane Sequenzen
auszuwählen und/oder möglicherweise
notwendige Mutationen der Sequenzen durchzuführen.
-
In einer weiteren Ausführungsform
sind zusätzlich
die Triplettsequenzen, die im allgemeinen den Bindungs-Loops (CDR-Regionen) entsprechen
und die bevorzugt starke Homologien zu den entsprechenden Sequenzbereichen
in der humanen Keimbahnsequenz haben, diesen schrittweise durch
einfache Mutationen angeglichen, ohne die spezifische Bindung an
Core-1 zu beeinträchtigen.
Erkennungsmoleküle
mit diesen Sequenzen werden hier als partiell humane Antikörper oder
Antikörperfragmente
bezeichnet. Bevorzugte humanisierte Sequenzen stellen z.B. die Sequenzen
SEQ ID NO. 56 bis 79 bzw. SEQ ID NO. 85 bis 94 dar.
-
In einer weiteren bevorzugten Ausführungsform
werden bestimmte Aminosäuren
der Antikörpergerüstsequenzen
einer Spezies durch andere ausgetauscht, um normalerweise weniger
immunogene Regionen zu generieren. Dies beinhaltet dem Fachmann
an sich bekannte Technologien, beispielsweise Technologien der Humanisierung,
beispielsweise CDR-Grafting, Resurfacing, Chain-Shuffling mit Mutationen
und Deimmunisierung durch Mutation oder Deletion von humanen MHC
Epitopen.
-
In einer bevorzugten Ausführungsform
handelt es sich um ein vom IgM abgeleitetes Erkennungsmolekül mit den
entsprechenden konstanten Domänen
eines IgM, bevorzugt humanen Sequenzen. Im Sinne der Erfindnung
setzten sich Immunglobuline aus der schweren Kette und der leichten
Kette eines Antikörpers
zusammen, wobei bevorzugt 2 leichte und 2 schwere Ketten eine Einheit
darstellen. Immunglobuline des IgM Typs bestehen meist aus 5 solchen
Einheiten, die zusätzlich
zu Disulfidbrücken
durch die J-Kette miteinander verknüpft sind.
-
In einer besonders bevorzugten Ausführungsform
ist die J-Kette nicht vorhanden, wobei es ebenfalls zur Multimerisierung
der Untereinheiten kommt, wobei hier hexa- und pentamere Strukturen
vorliegen können.
-
In einer bevorzugten Ausführungsform
der Erkennungsmoleküle
handelt es sich um Single chain Antikörperfragmente umfassend eine
Triplettstruktur 1 mit entsprechenden oben beschriebenen Antikörpergerüstsequenzen,
die die CDR Regionen des Antikörpers
und Frameworksequenzen der variablen Domäne der schweren Kette von Antikörpern darstellen,
und eine Triplettstruktur 2 mit den entsprechenden oben beschriebenen
Antikörpergerüstsequenzen,
die die CDR Regionen des Antikörpers
und Frameworksequenzen der variablen Domäne der leichten Kette von Antikörpern darstellen,
die kovalent miteinander in Form eines Fusionsproteins verknüpft sind.
Hierbei sind die Sequenzen direkt oder durch einen Linker miteinander
verknüpft.
Bevorzugt sind hier scFv Formate ohne Linker oder mit einem Linker
von 1 bis 9 Aminosäuren
Länge.
Diese scFv Antikörper
bilden multimere Strukturen (beispielsweise Dia-, Tria-, Tetrabodies),
die im Sinne der Erfindung auch als Multibodies bezeichnet werden
und zeigen aufgrund der Multivalenz höhere Avidität zum Core-1 Antigen. Es wurden
Core-1 spezifische Erkennungsmoleküle im scFv Format mit verschiedenen
Linkerlängen konstruiert
(SEQ ID NO. 95 bis 106) und ihre Bindungscharakteristik im ELISA
untersucht. Eine schrittweise Linkerverkürzung führte zu einer Erhöhung der
Bindung an Asialoglykophorin, einem Core-1 tragenden Glykoprotein,
wie in 3 dargestellt.
Die besten Bindungseigenschaften zeigten hierbei die Varianten mit
der SEQ ID NO. 104 und 105. Diese multivalenten Konstrukte im Dia/Triabody
Format sind besonders bevorzugte Ausführungsformen der Erfindung
und sind aufgrund verbesserter pharmakokinetischer Eigenschaften
für die
Tumortherapie von Vorteil.
-
In einer weiter bevorzugten Ausführungsform
sind die Erkennungsmoleküle
fusioniert, chemisch gekoppelt, kovalent oder nicht-kovalent assoziiert
mit (i) Immunglobulindomänen
verschiedener Spezies, (ii) Enzymmolekülen, (iii) Interaktionsdomänen, (iv)
Signalsequenzen, (v) Fluoreszenzfarbstoffen, (vi) Toxinen, (vii) katalytischen
Antikörpern,
(viii) einem oder mehreren Antikörpern
oder Antikörperfragmenten
mit anderer Spezifität,
(ix) zytolytischen Komponenten, (x) Immunmodulatoren, (xi) Immuneffektoren,
(xii) MHC-Klasse 2 oder Klasse II Antigenen, (xiii) Chelatoren zur
radioaktiven Markierung, (xiv) Radioisotopen, (xv) Liposomen, (xvi) Transmembrandomänen, (xvii)
Viren und/oder Zellen. Außerdem
können
die Erkennungsmoleküle
insbesondere mit einem Tag fusioniert sein, die die Detektion des – Erkennungsmoleküls und deren
Aufreinigung ermöglichen,
wie zum Beispiel ein Myc-Tag oder ein His-Tag. Technologien zur
Herstellung dieser Konstrukte sind dem Fachmann bekannt, ebenso
ist der Fachmann in der Lage, geeignete Sequenzen und Komponenten auszuwählen und
mit den erfindungsgemäßen Erkennungsmolekülen in geeigneter
Weise zu verbinden.
-
In einer weiteren bevorzugten Ausführungsform
sind die beschriebenen Erkennungsmoleküle auf Antikörper- oder
Antikörperfragment-Basis
mit Peptiden oder Proteinen, die nicht von Immunglobulinen abgeleitet sind,
fusioniert. Beispielsweise wird die Multimerisierungsdomäne eines
Nicht-Immunglobulinmoleküls mit einem
scFv fusioniert, insbesondere das C-terminale Ende der alpha-Kette
des C4 Bindungsproteins, wie es bei Tonye Libyh M. et al., 1997
beschrieben ist, und somit ein multivalentes Erkennungsmolekül konstruiert.
-
In einer weiteren Ausführungsform
wird ein scFv mit einer Transmembrandomäne eines Nicht-Immunglobulinmoleküls fusioniert,
beispielsweise mit der Transmembrandomäne des c-erb B2, des h-PDGFR,
des humanen Transferrinrezeptors oder des humanen Asialoglykoprotein-Rezeptors
(Liao et al., 2000), und somit die Expression von Bindungsmolekülen auf
der Oberfläche
von Zellen ermöglicht.
-
Eine weitere bevorzugte Ausführungsform
der Erfindung umfasst erfindungsgemäße Erkennungsmoleküle, die
weiterhin Aminosäuresequenzen
umfassen, die spezifisch an Makrophagen oder andere Immuneffektorzellen
binden. Beispielsweise umfassen die erfindungsgemäßen Erkennungsmoleküle weiterhin
eine Antikörperbindungsstelle
gegen CD64, wodurch es in Form eines bispezifischen Antikörpers beziehungsweise Antikörperfragments
(Diabodies) zur Bindung von Makrophagen an Core-1 positive Tumorzellen
kommt, was zu deren Bekämpfung
und/oder Zerstörung
führt.
-
Eine bevorzugte Ausführungsform
der Erfindung betrifft radioaktiv markierte Core-1 spezifische Erkennungsmoleküle. Eine
bevorzugte Form sind Erkennungsmoleküle auf der Basis von Antikörpern oder
Antikörperfragmenten.
Eine weitere bevorzugte Ausführungsform
sind radioaktiv markierte erfindungsgemäße Erkennungsmoleküle im Single
chain Format (einschließlich
als Dia-, Tria-, Tetrabodies). Weitere bevorzugte Formen sind radioaktiv
markierte Single chain Antikörperfragmente
und ganze Immunglobuline, beispielsweise erfindungsgemäße Chimäre oder
humanisierte IgG oder IgM Antikörper
oder humanisierte Antikörperfragmente. Die
Erfindung ist selbstverständlich
nicht auf diese Antikörper,
die radioaktive Markierung und diese Formate der Antikörper beschränkt.
-
Antikörperfragmente wie die bevorzugten
multivalenten scFv Fragmente insbesondere ohne oder mit sehr kurzem
Linker bieten gegenüber
intakten monoklonalen Antikörpern
einen Vorteil für
das Targeting von soliden Tumoren. Bei intakten Antikörpern, die
in Biodistributionsstudien eine spezifische Anreicherung im Tumorareal
zeigen, fällt
bei genauer Untersuchung des Tumors eine inhomogene Antikörperverteilung
mit vornehmlicher Anreicherung im Randbereich auf. Zentral gelegene
Tumoranteile werden aufgrund von Tumornekrosen, inhomogener Rntigenverteilung
sowie einem erhöhten
interstitiellen Gewebedruck mit diesen Antikörperkonstrukten nicht erreicht.
Kleinere Antikörperfragmente
zeigen dagegen eine schnelle Tumormarkierung, dringen tiefer in
den Tumor ein und werden gleichzeitig relativ schnell aus der Blutbahn
entfernt. Die Dissoziationskonstante von monovalenten Antikörperfragmenten
wie Fabs oder scFv ist allerdings oftmals zu niedrig, was in einer
kurzen Verweildauer an den Tumorzellen resultiert. Deshalb bieten
multivalente Antikörperkonstrukte
wie Multibodies (Diabodies, Tria/Tetrabodies), F(ab')2 und
andere Minibodies (multivalente Antikörperkonstrukte bestehend aus
der Bindungsdomäne
und einer Multimerisierungssequenz, beispielsweise scFv und CH3
Domäne
eines IgG) in der Tumortherapie viele Vorteile. Multivalenten Konstrukte
im Dia/Triabody Format sind bevorzugte Ausführungsformen der Erfindung
und sind aufgrund verbesserter pharmakokinetischer Eigenschaften
für die
Tumortherapie von Vorteil und wurden zur Verwendung in der Tumortherapie
weiter entwickelt. Sie können
als Vehikel für
die spezifische Anreicherung von zum Beispiel zytotoxischen Substanzen
wie Chemotherapeutika oder Radionuklide im Tumor verwendet werden.
Durch geeignete Radionuklidwahl können Tumorzellen über eine
Distanz von mehreren Zelldurchmessern abgetötet werden, wodurch auch Antigen-negative
Tumorzellen in einem Tumorareal erfasst und die schlechte Penetration
der Antikörper
in solide Tumoren zumindest teilweise ausgeglichen werden können.
-
Eine besonders bevorzugte Ausführungsform
der Erfindung sind radioaktiv-markierten Multibodies – insbesondere
wie unter Beispiel 9 näher
ausgeführt
-, die besonders vorteilhafte pharmakokinetischen Eigenschaften
vereinen mit einer in der Kombination gegenüber ganzen Immunglobulinen
und scFv verbesserten Tumorretention, Tumorpenetration, Serumhalbwertszeit
und Serum zu Tumor-Verteilungsverhältnis. Weitere Vorteile sind
die hohe Avidität
und die bakterielle Expression, die es erlaubt, kostengünstig diese
Erkennungsmoleküle
herzustellen. Damit eignet sich dieses besondere Format der erfindungsgemäßen Erkennungsmoleküle vorteilhafterweise
bevorzugt für
die Behandlung von kleinen Primärtumoren,
Metastasen und minimal residual Erkrankungen.
-
Eine bevorzugte Ausführungsform
der Erfindung sind nicht radioaktiv markierte Erkennungsmoleküle. Eine
bevorzugte Form hierbei sind Erkennungsmoleküle auf der Basis von Antikörpern oder
Antikörperfragmenten.
-
Eine besonders bevorzugte Ausführungsform
sind Chimäre
und humanisierte Immunglobuline auf der Basis von IgM Molekülen zur
Inhibition der Lebermetastasierung und zur Bekämpfung residualer Tumorzellen.
-
Weitere bevorzugte Ausführungsformen
sind toxin- oder Zytostatika-gekoppelte erfindungsgemäße chimärisierte
oder humanisierte IgG und IgM basierte Erkennungsmoleküle und im
Besonderen Multibodies (Dia- Tria-, Tetrabodies) mit besonders vorteilhaften
pharmakokinetischen Eigenschaften wie oben ausgeführt.
-
Eine weitere bevorzugte Ausführungsform
sind Liposomen, die beispielsweise mit Toxinen oder Zytostatika
beladen sind, und die auf ihrer Oberfläche erfindungsgemäße Erkennungsmoleküle tragen.
-
Der Fachmann ist in der Lage, geeignete
Radioisotope, Toxine und Zytostatika auszuwählen. Geeignete Techniken,
Verfahren, Dosierungen und Formulierungen sind dem Fachmann bekannt.
-
Eine weitere bevorzugte Ausführungsform
der Erfindung sind Effektorzellen des Immunsystems, auf deren Oberfläche erfindungsgemäße Erkennungsmoleküle gebunden
sind, die die Effektorzellen zu Core-1 tragenden Tumorzellen dirigieren/adressieren
und dadurch deren Bekämpfung
und/oder Zerstören
vermitteln. Bevorzugte Effektorzellen sind Makrophagen, dendritische
Zellen und NK-Zellen, die aus dem Patienten gewonnen werden und
ex vivo mit den Erkennungsmolekülen
gekoppelt werden. Weiter bevorzugt sind Zelllinien dieser Zelltypen.
Die Kopplung erfolgt beispielsweise durch bispezifische Erkennungsmoleküle, die
neben den Core-1 spezifischen Anteilen weiterhin Aminosäuren umfassen,
die eine Bindung an die Effektorzellen vermitteln. Beispielsweise
sind dies bispezifische Antikörper,
Komplementanteile oder konstante Domänen von Antikörpern.
-
Eine weiter bevorzugte Ausführungsform
sind hierbei Makrophagen aus dem Patienten, die nach Gewinnung mit
einem bispezifischen Antikörper
beispielsweise in Form ganzer Antikörper, bevorzugt chemisch gekoppelter
Fab-Fragmente oder weiter bevorzugt Diabodies, die zum einen CD64
erkennen und zum anderen erfindungsgemäß Core-1 spezifisch sind. Diese
Makrophagen, die über
die CD64 Spezifität
die bispezifischen Erkennungsmoleküle tragen, werden dem Patienten
in einer geeigneten Formulierung wieder zugeführt, um den Core-1 positiven
Tumor zu bekämpfen.
Die hierzu verwendeten Techniken und die geeigneten Verfahren, Dosierungen
und Formulierungen sind dem Fachmann bekannt. Eine weiter bevorzugte
Ausführungsform sind
Makrophagen aus dem Patienten, die nach Gewinnung mit einem erfindungsgemäßen Core-1
spezifischen Antikörper
oder Antiköperfragment,
die den konstanten Teil eines Antikörpers umfassen, der an Makrophagen über die
an sich bekannten Fc-Rezeptoren bindet. Dabei können die Erkennungsmoleküle entweder als
ganze Antikörper,
bevorzugt chimäre
oder humanisierte IgG oder IgM, oder als Antikörperfragment, beispielsweise
scFv, Fab oder Multibodies in Form eines Fusionsproteins oder chemisch
gekoppelt mit dem dem Fachmann bekannten Teil der konstanten Domäne von Antikörpern, an
die Makrophagen binden. Diese die Erkennungsmoleküle tragenden
Makrophagen werden dem Patienten in einer geeigneten Formulierung
wieder zugeführt,
um den Core-1 positiven Tumor zu bekämpfen. Die hierzu verwendeten
Techniken und die geeigneten Verfahren, Dosierungen und Formulierungen
sind dem Fachmann bekannt.
-
Eine weiter bevorzugte Ausführungsform
sind Zelllinien oder Zellen aus dem Körper wie die oben beschriebenen
Effektorzellen, die mit Molekülen
transfiziert werden, die erfindungsgemäße Core-1 spezifische Erkennungsmoleküle und weiterhin
Elemente umfassen, die eine Expression und eine Verankerung in der Membran
bewirken, beispielsweise transmembrane Domäne, und die Aktivierung der
Effektorzellen bei Kontakt mit einer Core-1 tragenden Tumorzelle
vermitteln. Die entsprechenden Elemente sind dem Fachmann bekannt.
Beispielsweise wird eine dendritische Zelllinie mit einem Vektor
transfiziert, der ein Erkennungsmolekül umfasst, das ein erfindungsgemäßes scFv
oder Multibody und eine Transmembrandomäne und eine aktivierende Domäne umfasst.
In einem anderen Beispiel werden dazu Makrophagen viral transfiziert.
Diese die Erkennungsmoleküle
tragenden Effektorzellen werden einem Patienten in einer geeigneten
Formulierung zugeführt
um den Core-1 positiven Tumor zu bekämpfen. Die hierzu verwendeten
Techniken und die geeigneten Verfahren, Dosierungen und Formulierungen
sind dem Fachmann bekannt.
-
Die Erfindung betrifft auch Nukleinsäuremoleküle, die
ein oder mehrere genetische Sequenzen umfassen, die mindestens eines
der oben beschriebenen erfindungsgemäßen Erkennungsmoleküle und/oder
Konstrukte kodieren. Aufgrund des degenerierten genetischen Codes
können
diese Nukleinsäuremoleküle sehr unterschiedliche
Sequenzen haben. Die Wahl der Codons ist ebenfalls von der Zelle
abhängig,
die für
die Herstellung des Erkennungsmoleküls verwendet wird, da in unterschiedlichen
Zellen aus unterschiedlichen Organismen häufig unterschiedliche Codons
bevorzugt werden und die Expressionsrate stark beeinflusst werden kann,
beispielsweise sind die in eukaryontischen Genen bevorzugt verwendeten
Codons AGA und AGG für Arginin
in Bakterien nur selten vertreten. Hier treten die Codons CGC und
CGU deutlich häufiger
auf. Das erfindungsgemäße Nukleinsäuremolekül ist in
bevorzugten Ausführungsformen
eine genomische DNA, eine cDNR und/oder eine RNA. Die Kriterien
zur Wahl geeigneter Codons und die Herstellung eines geeigneten
Nukleinsäuremoleküls sind
dem Fachmann bekannt.
-
Weiterhin betrifft die Erfindung
Vektoren zur Expression der Erkennungsmoleküle insbesondere in Zellen.
Unter einem Vektor versteht man im Sinne der Erfindung ein erfindungsgemäßes Nukleinsäuremolekül, das zur
Expression des Erkennungsmoleküls
dient und das eine Nukleinsäuresequenz,
die ein oder mehrere genetische Sequenzen umfasst, die mindestens
eines der oben beschriebenen Erkennungsmoleküle kodieren, und insbesondere
mindestens einen Promotor umfasst, der die Expression des Erkennungsmoleküls bewirkt.
Vektoren können
dabei selbstverständlich
weitere Elemente umfassen, die dem Fachmann bekannt sind und die
beispielsweise der Vermehrung von Vektoren zur Herstellung in geeigneten
Zellen und zur Klonierung dienen. Die Nukleinsäuresequenzen können auf
einem oder mehreren Vektoren vorliegen, beispielsweise wird in einer
bevorzugten Ausführungsform
die schwere Kette eines erfindungsgemäßen Immunglobulins durch einen
und die leichte Kette durch einen anderen Vektor kodiert. In einer
weiteren bevorzugten Ausführungsform der
Erfindung sind die variable Domäne
der leichten Kette und die variable Domäne der schweren Kette auf dem
gleichen Vektor unter einem Promotor als Fusionsprotein kodiert.
Außerdem
können
im Sinne der Erfindung Nukleinsäuresequenzen,
die Teile eines Erkennungsmoleküls
kodieren, durch unterschiedliche dem Fachmann bekannte Promotoren
exprimiert werden. In einer weiteren Ausführungsform können die
unterschiedlichen Nukleinsäuresequenzen
auf einem gemeinsamen Vektor liegen. Dabei kann jede Sequenz durch einen
eigenen, gleichen oder unterschiedlichen, Promotor exprimiert werden
oder die Sequenzen können
in einem bicistronischen Vektor unter einem Promotor vorliegen.
Bevorzugt werden durch die unterschiedlichen Promotoren unterschiedliche
Expressionsraten der Teile der Erkennungsmoleküle erreicht, die eine Bildung des
gesamten Erkennungsmoleküls
gegenüber
einer gleichen Expressionsrate der verschiedenen Teile verbessert.
Weiterhin bevorzugt werden Promotoren verwendet, die induzierbar
sind, um eine Expression des Erkennungsmoleküls zu verbessern. Besonders
bevorzugt umfassen die Vektoren weiterhin andere dem Fachmann bekannte
regulatorische Elemente, beispielsweise Enhancer, die die Expression
des Erkennungsmoleküls
oder Teile davon verstärken,
beispielsweise der CMV Enhancer oder Immunglobulin-Enhancer-Sequenzen. Bevorzugt
umfassen die Nukleinsäuremoleküle und Vektoren
zusätzlich
Nukleinsäuresequenzen,
die als Signalsequenzen zur Sekretion des Erkennungsmoleküls oder
Teilen davon dienen, die dem Fachmann an sich bekannt sind, beispielsweise
PelB, OmpR oder MalE für
prokaryontische Zellsysteme bzw. das Signalpeptid des T-Zellrezeptors,
der Immunglobulinketten, des t-PA oder EPO für eukaryontische Zellsysteme
[Boel et al., 2000; Herrera et al., 2000]. Dies erleichtert vorteilhafterweise
die Reinigung und/oder verbessert die Ausbeute der Erkennungsmoleküle. Die
Verfahren zur Herstellung der oben beschriebenen Nukleinsäuren und Vektoren,
geeigneter Promotoren, Enhancer und Vektorkonstrukte sowie die Kriterien
zu deren Wahl sind dem Fachmann bekannt und werden in den Beispielen
näher erläutert.
-
In einer besonderen Ausführungsform
der Erfindung umfasst der erfindungsgemäße Vektor weiterhin Nukleinsäuresequenzen,
die für
virale Proteine kodieren. Als eine besondere Form eines Vektors
wird dabei der Virus selbst bezeichnet, dessen genetisches Material
eine Nukleinsäuresequenz
umfasst, die für
ein erfindungsgemäßes Erkennungsmolekül kodiert.
In einer bevorzugten Form ist das Erkennungsmolekül ein Fusionsprotein
mit einem Virushüllprotein
oder Teilen davon, das es ermöglicht,
dass nicht nur das genetische Material die Nukleinsäuresequenz
des Erkennungsmoleküls
umfasst, sondern auch das Erkennungsmolekül selbst auf der Oberfläche des
Virus bindungsaktiv vorliegt, beispielsweise ein erfindungsgemäßes scFv
Erkennungsmolekül
als Fusionsprotein mit einem Hüllprotein
von für
gentherapeutische Anwendungen geeigneten Adenoviren, Poxviren oder
Vacciniaviren. Dies vermittelt die Adressierung des Virus zu einer
Core-1 exprimierenden Tumorzelle, wodurch es. zur Expression des
Erkennungsmoleküls
in der Tumorzelle kommt. Dies kann zur Expression des Erkennungsmoleküls in vivo
im Organismus oder in vitro in der Zellkultur verwendet werden.
Bevorzugt werden dabei bekannte Systeme verwendet, die einen Helfervirus
zur Replikation verwenden, um beispielsweise die Sicherheit eines
diesen Vektor umfassenden gentherapeutischen Verfahrens zu gewährleisten.
Die Verfahren zur Herstellung der beschriebenen viralen Vektoren,
zur Infektion und Expression der Erkennungsmoleküle sind dem Fachmann bekannt.
-
In einer weiteren besonderen Ausführungsform
umfasst der erfindungsgemäße Vektor
ein Fusionsprotein aus einem erfindungsgemäßen Erkennungsmolekül und einem
Protein oder Peptid, das spezifisch an ein Virus bindet. Die gewonnenen
Erkennungsmoleküle
können
so mit Vorteil zur Adressierung des Virus an eine Core-1 exprimierende
Zelle verwendet werden. So kann z.B. der Transfer des genetischen
Materials über Infektionen
vermittelt werden, wodurch es ermöglicht wird, spezifische Moleküle, die
durch das genetische Material des Virus kodiert werden, in den Zellen
in vivo im Organismus in Form einer Gentherapie oder in vitro in der
Zellkultur zu exprimieren.
-
Weiterhin betrifft die Erfindung
ein Verfahren zur Gewinnung der Erkennungsmoleküle umfassend das Einbringen
von ein, oder mehreren erfindungsgemäßen Vektoren, die ein oder
mehrere erfindungsgemäße Nukleinsäuremoleküle enthalten,
in eine geeignete Wirtszelle, die Kultivierung dieser Wirtszelle
unter geeigneten Bedingungen und die Bereitstellung von ein oder
mehreren Erkennungsmolekülen
aus den Zellen oder dem Kulturmedium. Unter dem Begriff „Einbringen
von Vektoren" versteht
man im Sinne der Erfindung dem Fachmann an sich bekannte Technologien
mit denen der Vektor in eine Wirtszelle gebracht wird, beispielsweise
Elektroporation, Transfektion unter Verwendung kationischer Lipide
oder Infektion und dort transient oder stabil verbleibt. Unter dem
Begriff „Bereitstellung
von einem oder mehreren Erkennungsmolekülen" versteht man im Sinne der Erfindung
dem Fachmann an sich bekannte Technologien mit denen die während des
Kultivierungsprozesses exprimierten Erkennungsmoleküle aus dem
Kulturüberstand
und/oder Zellen gewonnen werden, beispielsweise unterschiedliche
proteinchemische Reinigungsschritte beispielsweise Fraktionierung, Konzentrierung,
Fällungen,
und/oder Chromatographie. Die in dem Verfahren zu verwendenden Techniken und
Methoden sind dem Fachmann bekannt, ebenso ist der Fachmann in der
Lage, geeignete Wirtszellen und Kultivierungsbedingungen sowie Methoden
zur Bereitstellung aus den Zellen und/oder dem Kulturüberstand auszuwählen. Hierbei
wählt der
Fachmann beispielsweise, wie bereits oben ausgeführt, Nukleinsäuresequenzen
mit geeigneten Codons und Promotorsequenzen abgestimmt auf die Wirtszelle,
um eine möglichst
starke Expression von aktiven Erkennungsmolekülen zu gewinnen. In einer bevorzugten
Ausführungsform
verwendet. der Fachmann beispielsweise affinitätschromatographische Schritte,
beispielsweise Chromatographie an Protein A oder Protein G oder
Protein L oder beipielsweise Metallionen-Affinitätschromatographie über einen zusätzlich eingefügten His-Tag.
In den Beispielen ist dies beispielhaft näher ausgeführt.
-
Der Begriff "Gewinnung" umfasst neben den zuvor explizit genannten
Schritten auch zusätzliche Schritte,
wie etwa Vorbehandlungen des Ausgangsstoffes oder Weiterbehandlungen
des Endproduktes. Vorbehandlungsverfahren sind an sich dem Fachmann
bekannt. Weiterbehandlungsverfahren umfassen neben den oben beschrieben
Bereitstellungsverfahren beispielsweise auch die endgültige Zusammensetzungen und/oder
Formulierung des mit dem Herstellungsverfahren gewonnenen Erkennungsmoleküls in geeigneten Verwendungs-
und/oder Darreichungsformen. Die Art der Verwendungs- oder Darreichungsform,
z.B. Lösung, Lyophilisat
oder Tablette, hängt
hierbei von der beabsichtigten Verwendung ab. Dem Fachmann ist hierbei
bekannt, welche Darreichungsform sich für welchen Verwendungszweck
eignet. Je nach Darreichungsform kann das durch das erfindungsgemäße Verfahren
hergestellte Erkennungsmolekül
zusammen mit Hilfs-, Träger- oder
weiteren Wirkstoffen vorliegen. Hilfsstoffe sind hierbei vorzugsweise
Adjuvantien, weitere Wirkstoffe, vorzugsweise immunstimulatorische
Moleküle,
wie Interleukine. Das mit dem erfindungsgemäßen Verfahren hergestellte
Erkennungsmolekül
kann auch in Weiterbehandlungsschritten chemisch modifiziert werden.
Vorzugsweise wird das Erkennungsmolekül hierbei mit einem oder mehreren
weiteren Molekülen
in geeigneter Weise, d.h. durch chemische oder physikalische Interaktion,
verbunden. Als weitere Moleküle
im Sinne der Erfindung dienen bevorzugt anderen Proteine oder Peptide,
die mit dem durch das erfindungsgemäße Verfahren hergestellten
Erkennungsmolekül kovalent
oder nicht-kovalent verknüpft
werden, beispielsweise um bispezifische Erkennungsmoleküle herzustellen,
indem ein erfindungsgemäßes Erkennungsmolekül, das spezifisch
das Core-1 Antigen erkennt, mit einem zweiten Molekül verknüpft wird,
das beispielsweise eine Immuneffektorzelle (beispielsweise Makrophage,
NK-Zellen, Dendritische Zellen) spezifisch bindet oder beispielsweise
eine Verknüpfung
mit Interleukinen (beispielsweise IL-2, IL-7, IL-12, IL-15), Chemokinen
oder Wachstumsfaktoren, wodurch über
die Wirkung dieser Moleküle über die
Bindung des erfindungsgemäßen Erkennungsmoleküls Immuneffektoren
an die Core-1 positiven Tumorzellen dirigiert werden und diese beispielsweise
bekämpfen und/oder
zerstören.
Diese weiteren Moleküle
oder Teile davon können
wie bereits weiter oben beschrieben auch Teil des Erkennungsmoleküls selbst
sein und werden in diesem Fall nicht über die hier beschriebenen chemischen
oder physikalischen Methoden nach der Expression des Erkennungsmoleküls verknüpft. Unter „Immuneffektoren" versteht man im
Sinne der Erfindung solche Komponenten der Erfindung die direkt
oder indirekt eine Bekämpfung
und/oder Zerstörung
von Core-1 positiven Tumorzellen bewirken können, beispielsweise Immuneffektorzellen,
wie beispielsweise Makrophagen, NK-Zellen, Dendritische Zellen,
oder Effektormoleküle,
wie beispielsweise Proteine oder Peptide des Komplementsystems.
Als weitere Moleküle
im Rahmen des erfindungsgemäßen Verfahrens
sind besonders Substanzen geeignet, die eine therapeutische oder diagnostische
Wirkung entfalten, beispielsweise Radioisotope oder Toxine. Diese
Substanzen werden über
an sich bekannte Verfahren mit den Erkennungsmolekülen verknüpft, beispielsweise
werden Radioisotope entweder direkt eingelagert (beispielsweise
Iod) oder über
einen kovalent gekoppelten Chelator (beispielsweise Yttrium, Indium,
Bismut) gebunden. Die Schritte des Weiterbehandlungsverfahrens sind
dem Fachmann bekannt.
-
Die zur Expression der Erkennungsmoleküle erfindungsgemäß verwendeten
Zellen können
prokaryontische oder eukaryontische Zellen sein, beispielsweise
Bakterien-, Hefe- (bevorzugt S.cerevisiae oder P.pastoris), Insekten-
(D.melanogaster), Pflanzen-, Säugerzellen
(bevorzugt Hamster-, Maus- oder humane Zelllinien) oder Organismen
wie transgene Tiere und Pflanzen. Vorzugsweise werden zur Expression
der erfindungsgemäßen Erkennungsmoleküle in einem
prokaryontischen System E.coli und zur Expression in einem eukaryontischen
System die Säugerzelllinien
NSO, SP2/0, CHO-K1, CHOdhfr-, COS-1, COS-7, HEK293, K562, Namalwa
oder Percy 6 verwendet.
-
Weiterhin betrifft die vorliegende
Erfindung Wirtszellen, die durch das oben beschriebene Verfahren hergestellt
wurden und mit Hilfe derer erfindungsgemäße Erkennungsmoleküle hergestellt
werden können. Selbstverständlich können die
Wirtszellen Teil eines Klons sein oder ihn selber darstellen. Die
Erfindung betrifft auch Organismen, die erfindungsgemäße Wirtszellen
umfassen. Die zu verwendenden Techniken und Methoden zur Herstellung
dieser Organismen sind dem Fachmann bekannt.
-
Die Erfindung betrifft weiterhin
Zusammensetzungen für
therapeutische, prophylaktische oder diagnostische Zwecke umfassend
mindestens ein erfindungsgemäßes Erkennungsmolekül in einer
geeigneten, insbesondere einer pharmazeutisch geeigneten Form oder
Zusammensetzung. Die pharmazeutische Zusammensetzung umfaßt insbesondere
zusätzliche
Stoffe und Substanzen, beispielsweise medizinische und/oder pharmazeutisch-technische
Hilfsstoffe. Im Sinne der Erfindung gelten als Arzneimittel sowohl
solche pharmazeutischen Zusammensetzungen, die für therapeutische und prophylaktische
Zwecke verwendet werden, als auch solche pharmazeutischen Zusammensetzungen,
die in vivo als Diagnostikum eingesetzt werden. In einer weiteren
bevorzugten Ausführungsform
handelt es sich um Zusammensetzungen für die ex vivo Diagnostik die zusätzliche
Stoffe und Substanzen enthalten können. Diese Ausführungsform
ist unter der Beschreibung für die
Diagnostika näher
ausgeführt.
-
„Arzneimittel oder pharmazeutische
Zusammensetzungen",
die vorliegend synonym verwendet werden, sind erfindungsgemäß Stoffe
und Zubereitungen aus Stoffen, die dazu bestimmt sind, durch Anwendung am
oder im menschlichen Körper
Krankheiten, Leiden, Körperschäden oder
krankhafte Beschwerden zu heilen, zu lindern oder zu verhüten. Medizinische
Hilfsstoffe sind erfindungsgemäß solche
Stoffe, die zur Produktion als aktive Ingredienzien von Arzneimitteln
eingesetzt werden. Pharmazeutisch-technische Hilfsstoffe dienen
der geeigneten Formulierung des Arzneimittels oder der pharmazeutischen
Zusammensetzung und können
sogar, sofern sie nur während
des Herstellungsverfahrens benötigt
werden, anschließend
entfernt werden oder können
als pharmazeutisch verträgliche
Träger
Teil der pharmazeutischen Zusammensetzung sein. Beispiele für pharmazeutisch
verträgliche
Träger
sind nachstehend aufgeführt.
Die Arzneimittelformulierung oder Formulierung der pharmazeutischen
Zusammensetzung erfolgt gegebenenfalls in Kombination mit einem pharmazeutisch
verträglichen
Träger
und/oder Verdünnungsmittel.
Beispiele für
geeignete pharmazeutisch verträgliche
Träger
sind dem Fachmann bekannt und umfassen z.B. Phosphat-gepufferte
Kochsalzlösungen, Wasser,
Emulsionen wie z.B. Öl/Wasser-Emulsionen,
verschiedene Arten von Detergenzien, sterile Lösungen, etc. Arzneimittel oder
pharmazeutische Zusammensetzungen, die solche Träger umfassen, können mittels
bekannter konventioneller Methoden formuliert werden. Diese Arzneimittel
oder pharmazeutischen Zusammensetzungen können einem Individuum in einer
geeigneten Dosis verabreicht werden, z.B. in einem Bereich von 1 μg bis 10
g an Erkennungsmolekülen
pro Tag und Patient Bevorzugt werden dabei Dosen von 1 mg bis 1
g. Die Verabreichung kann auf verschiedenen Wegen erfolgen, beispielsweise
intravenös,
intraperitoneal, intrarektal, intragastrointestinal, intranodal,
intramuskulär,
lokal, beispielsweise in den Tumor, aber auch subkutan, intradermal
oder auf der Haut oder über
die Schleimhäute.
Die Verabreichung von Nukleinsäuren
kann auch in Form von Gen-Therapie geschehen, beispielsweise über weiter
oben beschriebene virale Vektoren. Die Art der Dosierung und des
Verabreichungsweges kann vom behandelnden Arzt entsprechend den
klinischen Faktoren bestimmt werden. Es ist dem Fachmann bekannt,
dass die Art der Dosierung von verschiedenen Faktoren abhängig ist,
wie z.B. der Größe, der
Körperoberfläche, dem
Alter, dem Geschlecht oder der allgemeinen Gesundheit des Patienten,
aber auch von dem speziellen Mittel, welches verabreicht wird, der
Dauer und Art der Verabreichung und von anderen Medikamenten, die
möglicherweise
parallel verabreicht werden.
-
Die pharmazeutischen Zusammensetzungen
oder das Arzneimittel umfasst insbesondere eine pharmakologische
Substanz, die ein oder mehrere erfindungsgemäße Erkennungsmoleküle oder/und
diese kodierende Nukleinsäuremoleküle in einer
geeigneten Lösung
oder Verabreichungsform enthält.
Diese können
entweder alleine mit den entsprechenden unter Arzneimitteln oder
pharmazeutischen Zusammensetzungen beschriebenen Hilfsstoffen oder
in Kombination mit einem oder mehreren Adjuvantien, beispielsweise
QS-21, GPI-0100 oder andere Saponine, Wasser-Öl Emulsionen wie beispielsweise
Montanide Adjuvantien, Polylysin, Polyargininverbindungen, DNA-Verbindungen
wie beispielsweise CpG, Detox, bakterielle Vakzine wie beispielsweise
Thyphusvakzine oder BCG-Vakzine, und/oder einem anderen geeigneten
Stoff zur Wirkungsverstärkung
verabreicht werden; vorzugsweise immunstimulatorische Moleküle, wie
Interleukine, beispielsweise IL-2, IL-12, IL-4 und/oder Wachstumsfaktoren,
beispielsweise GM-CSF. Diese werden in bekannten Methoden mit den
erfindungsgemäßen Erkennungsmolekülen gemischt
und in einer geeigneten Formulierung und Dosierung verabreicht.
Formulierungen, Dosierungen und geeignete Komponenten sind dem Fachmann
bekannt.
-
Die pharmazeutische Zusammensetzung
oder das Arzneimittel kann selbstverständlich auch eine Kombination
von 2 oder mehreren der erfindungsgemäßen pharmazeutischen Zusammensetzungen
oder Arzneimittel sein, sowie eine Kombination mit anderen Arzneimitteln,
Tumorvakzinen oder Tumorbehandlungen, wie beispielsweise Antikörpertherapien,
Chemotherapien oder Radiotherapien, die auf eine geeignete weise zeitlich
gemeinsam oder getrennt verabreicht beziehungsweise angewandt werden.
Herstellung der Arzneimittel oder pharmazeutischen Zusammensetzungen
erfolgt nach an sich bekannten Methoden.
-
Die Arzneimittel oder pharmazeutischen
Zusammensetzungen können
insbesondere zur Behandlung von Core-1 positiven Tumorerkrankungen
eingesetzt werden, wie beispielsweise Mammakarzinome, Zervikalkarzinome,
Ovarialkarzinome, Colonkarzinome, Gastrointestinalkarzinome, Pankreaskarzinome,
Lungenkarzinome, Prostatakarzinome. Zu diesen Tumorerkrankungen
können
auch Core-1 und/oder Core-2 positive Tumorerkrankungen gehören. Die
Behandlung geht beispielsweise gegen Primärtumoren, minimal residuale Tumorerkrankungen,
Relapses und/oder Metastasen. Die Behandlung der Tumoren kann auch
als adjunvante Behandlung erfolgen. Die Verwendung der Arzneimittel
kann auch zur Prophylaxe von Core-1 positiven Tumorerkrankungen
erfolgen. Die prophylaktische Anwendung zielt beispielsweise auf
eine Prophylaxe des Tumors sowie von Metastasen. Die Tumormittel
werden in einer geeigneten Form nach bekannten Methoden verabreicht.
Eine bevorzugte Variante ist die Injektion beziehungsweise Verabreichung
der Arzneimittel intravenös, lokal
in Körperkavitäten, beispielsweise
intraperitoneal, intrarektal, intragastrointestinal, lokal beispielsweise direkt
in, den Tumor, Organe oder Lymphgefäße (intranodal), aber auch
subkutan, intradermal oder auf der Haut, intramuskulär. Verabreichungsarten
können
bevorzugterweise auch kombiniert werden, wobei sie an verschiedenen
Behandlungstagen oder an einem Behandlungstag verabreicht werden
können.
Dabei können erfindungsgemäß auch 2
oder mehrere der erfindungsgemäßen Arzneimittel
oder pharmazeutischen Zusammensetzungen kombiniert werden oder eine
oder mehrere erfindungsgemäße Arzneimittel
mit ein oder mehreren Arzneimitteln oder Tumorbehandlungen, wie
beispielsweise Antikörpertherapien,
Chemotherapien oder Radiotherapien, die zeitlich gemeinsam oder
getrennt verabreicht beziehungsweise angewandt werden.
-
Die vorliegende Erfindung betrifft
auch ein Verfahren zur Herstellung eines Arzneimittels oder einer pharmazeutischen
Zusammensetzung umfassend die Schritte der Herstellung von Erkennungsmolekülen und weiterhin
umfassend den Schritt der Formulierung der erfindungsgemäßen Erkennungsmoleküle in pharmazeutisch
verträglicher
Form. Die hierfür
bevorzugten erfindungsgemäßen Erkennungsmoleküle sind
weiter oben als Ausführungsformen
zur Behandlung von Tumorerkrankungen und Prophylaxe, sowie weiter
unten unter in vivo Diagnostika näher beschrieben.
-
Die erfindungsgemäßen Erkennungsmoleküle und durch
das erfindungsgemäße Verfahren
hergestellten Stoffe und Zusammensetzungen können demgemäß bevorzugt zur Prophylaxe,
Diagnose, Verlaufskontrolle und/oder Behandlung von Tumorerkrankungen
verwendet werden. Die Verwendung der Erkennungsmoleküle, der
Vektoren und/oder des Arzneimittels oder der pharmazeutischen Zusammensetzung
zur Prophylaxe und/oder Behandlung von Krebserkrankungen, einschließlich Tumoren
und Metastasen ist weiterhin bevorzugt.
-
In einer bevorzugten Ausführungsform
ist die Krebserkrankung oder der Tumor, die/der behandelt oder verhindert
wird, ausgewählt
aus der Gruppe von Krebserkrankungen oder Tumorerkrankungen des
Hals-Nasen-Ohren-Bereichs, der Lunge, des Mediastinums, des Gastrointestinaltraktes,
des Urogenitalsystems, des gynäkologischen
Systems, der Brust, des endokrinen Systems, der Haut, Knochen- und
Weichteilsarkomen, Mesotheliomen, Melanomen, Neoplasmen des zentralen
Nervensystems, Krebserkrankungen oder Tumorerkrankungen im Kindesalter,
Lymphomen, Leukämien,
paraneoplastischen Syndromen, Metastasen ohne bekannten Primärtumor (CUP-Syndrom), peritonealen
Karzinomastosen, Immunsuppressionbezogenen Malignitäten und/oder
Tumor-Metastasen.
-
Insbesondere kann es sich bei den
Tumoren um folgende Krebsarten handeln: Adenokarzinom der Brust,
der Prostata und des Dickdarms; alle Formen von Lungenkrebs, der
von den Bronchien ausgeht; Knochenmarkkrebs, das Melanom, das Hepatom,
das Neuroblastom; das Papillom; das Apudom, das Choristom, das Branchiom;
das maligne Karzinoid-Syndrom; die Karzinoid-Herzerkrankung; das Karzinom (z.B. Walker-Karzinom,
Basalzellen-Karzinom, basosquamöses
Karzinom, Brown-Pearce-Karzinom,
duktales Karzinom, Ehrlich-Tumor, in situ-Karzinom, Krebs-2-Karzinom,
Merkel-Zellen-Karzinom, Schleimkrebs, nichtkleinzelliges Bronchialkarzinom,
Haferzellen-Karzinom, papilläres
Karzinom, szirrhöses
Karzinom, bronchioloalveoläres
Karzinom, Bronchiai-Karzinom, Plattenepithelkarzinom und Transitionalzell-Karzinom);
histiocytische Funktionsstörung;
Leukämie
(z.B. in Zusammenhang mit B-Zellen-Leukämie, Gemischt-Zellen-Leukämie, Nullzellen-Leukämie, T-Zellen-Leukämie, chronische
T-Zellen-Leukämie, HTLV-II-assoziierte
Leukämie,
akut lymphozytische Leukämie,
chronisch-lymphozythische Leukämie,
Mastzell-Leukämie und
myeloische Leukämie);
maligne Histiocytose, Hodgkin-Krankheit, non-Hodgkin-Lymphom, solitärer Plasmazelltumor;
Reticuloendotheliose, Chondroblastom; Chondrom, Chondrosarkom; Fibrom;
Fibrosarkom; Riesenzell-Tumore;
Histiocytom; Lipom; Liposarkom; Leukosarkom; Mesotheliom; Myxom;
Myxosarkom; Osteom; Osteosarkom; Ewing-Sarkom; Synoviom; Adenofribrom; Adenolymphom;
Karzinosarkom, Chordom, Craniopharyngiom, Dysgerminom, Hamartom;
Mesenchymom; Mesonephrom, Myosarkom, Ameloblastom, Cementom; Odontom;
Teratom; Thymom, Chorioblastom; Adenokarzinom, Adenoma Cholangiom;
Cholesteatom; Cylindrom; Cystadenocarcinom, Cystadenom; Granulosazelltumor;
Gynadroblastom; Hidradenom; Inselzelltumor; Leydig-Zelltumor; Papillom;
Sertoli-Zell-Tumor,
Thekazelltumor, Leiomyom; Leiomyosarkom; Myoblastom; Myom; Myosarkom;
Rhabdomyom; Rhabdomyosarkom; Ependynom; Ganglioneurom, Gliom; Medulloblastom,
Meningiom; Neurilemmom; Neuroblastom; Neuroepitheliom, Neurofibrom,
Neurom, Paragangliom, nicht-chromaffines Paragangliom, Angiokeratom,
angiolymphoide Hyperplasie mit Eosinophilie; sclerosierendes Angiom;
Angiomatose; Glomangiom; Hemangioendotheliom; Hemangiom; Hemangiopericytom,
Hemangiosarkom; Lymphangiom, Lymphangiomyom, Lymphangiosarkom; Pinealom;
Cystosarkom phyllodes; Hemangiosarkom; Lymphangiosarkom; Myxosarkom,
Ovarialkarzinom; Sarkom (z.B. Ewing-Sarkom, experimentell, Kaposi-Sarkom
und Mastzell-Sarkom); Neoplasmen (z.B. Knochen-Neoplasmen, Brust-Neoplasmen, Neoplasmen
des Verdauungssystems, colorektale Neoplasmen, Leber-Neoplasmen,
Pankreas-Neoplasmen, Hirnanhang-Neoplasmen, Hoden-Neoplasmen, Orbita-Neoplasmen,
Neoplasmen des Kopfes und Halses, des Zentralnervensystems, Neoplasmen
des Hörorgans,
des Beckens, des Atmungstrakts und des Urogenitaltrakts); Neurofibromatose
und zervikale Plattenepitheldysplasie.
-
In einer weiter bevorzugten Ausführungsform
ist die Krebserkrankung oder der Tumor, die/der behandelt oder verhindert
wird, ausgewählt
aus der Gruppe von Krebserkrankungen oder Tumorerkrankungen, die Zellen
umfassen, die das Core-1 in der erfindungsgemäßen Definition umfassen, ausgewählt aus
der Gruppe: Tumoren des Hals-Nasen-Ohren-Bereichs umfassend Tumoren der inneren
Nase, der Nasennebenhöhlen, des
Nasopharynx, der Lippen, der Mundhöhle, des Oropharynx, des Larynx,
des Hypopharynx, des Ohres, der Speicheldrüsen und Paragangliome, Tumoren
der Lunge umfassend nicht-kleinzellige Bronchialkarzinome, kleinzellige
Bronchialkarzinome, Tumoren des Mediastinums, Tumoren des Gastrointestinaltraktes
umfassend Tumoren des Ösophagus,
des Magens, des Pankreas, der Leber, der Gallenblase und der Gallenwege,
des Dünndarms,
Kolon- und Rektumkarzinome und Analkarzinome, Urogenitaltumoren
umfassend Tumoren der Nieren, der Harnleiter, der Blase, der Prostata,
der Harnröhre,
des Penis und der Hoden, gynäkologische
Tumoren umfassend Tumoren des Zervix, der Vagina, der Vulva, Korpuskarzinom,
maligne Trophoblastenerkrankung, Ovarialkarzinom, Tumoren des Eileiters
(Tuba Faloppii), Tumoren der Bauchhöhle, Mammakarzinome, Tumoren
endokriner Organe umfassend Tumoren der Schilddrüse, der Nebenschilddrüse, der
Nebennierenrinde, endokrine Pankreastumoren, Karzinoidtumoren und
Karzinoidsyndrom, multiple endokrine Neoplasien, Knochen- und Weichteilsarkome,
Mesotheliome, Hauttumoren, Melanome umfassend kutane und intraokulare Melanome,
Tumoren des zentralen Nervensystems, Tumoren im Kindesalter umfassend
Retinoblastom, Wilms Tumor, Neurofibromatose, Neuroblastom, Ewing-Sarkom
Tumorfamilie, Rhabdomyosarkom, Lymphome umfassend Non-Hodgkin-Lymphome,
kutane T-Zell-Lymphome, primäre
Lymphome des zentralen Nervensystems, Morbus Hodgkin, Leukämien umfassend
akute Leukämien,
chronische myeloische und lymphatische Leukämien, Plasmazell-Neoplasmen,
myelodysplastische Syndrome, paraneoplastische Syndrome, Metastasen
ohne bekannten Primärtumor
(CUP-Syndrom), peritoneale Karzinomastose, Immunsuppression-bezogene
Malignität
umfassend AIDS-bezogene Malignitäten
wie Kaposi-Sarkom,
AIDS-assoziierte Lymphome, AIDS-assoziierte Lymphome des zentralen
Nervensystems, AIDS-assoziierter Morbus Hodgkin und AIDS-assoziierter
anogenitale Tumoren, Transplantationsbezogene Malignitäten, metastasierte
Tumoren umfassend Gehirnmetastasen, Lungenmetastasen, Lebernetastasen,
Knochenmetastasen, pleurale und perikardiale Metastasen und maligne
Aszites.
-
In einer weiter bevorzugten Ausführungsform
ist die Krebserkrankung oder der Tumor, die/der behandelt oder verhindert
wird, ausgewählt
aus der Gruppe umfassend Krebserkrankungen oder Tumorerkrankungen
der Mammakarzinome, der Gastrointestinaltumore, einschließlich Kolonkarzinome,
Magenkarzinome, Pankreaskarzinome, Dickdarmkrebs, Dünndarmkrebs,
der Ovarialkarzinome, der Zervikalkarzinome, Lungenkrebs, Prostatakrebs,
Nierenzellkarzinome und/oder Lebermetastasen.
-
Die erfindungsgemäßen Erkennungsmoleküle können bei
der Behandlung oder Prophylaxe von Tumorerkrankungen direkt eingesetzt
werden oder mit zusätzlichen
Effektorstrukturen gekoppelt werden. Unter „Effektorstrukturen" versteht man erfindungsgemäß solche
chemischen oder biochemischen Verbindnungen, Moleküle oder
Atome, die direkt oder indirekt eine Abtötung oder Schädigung,
einschließlich
beispielsweise Wachstumsverlangsamung oder Wachstumsinhibition von
Tumorzellen bewirken. Hierzu gehören
beispielsweise Radioisotope, Toxine, Cytostatika und andere Effektormoleküle wie beispielsweise
Cytokine und Chemokine oder andere Strukturen, die selbst Effektoren
darstellen oder an die Effektormoleküle gekoppelt werden, beispielsweise
mit Toxinen oder Cytostatika beladene Liposomen, die erfindungsgemäße Erkennungsmoleküle tragen.
Beim letzteren Beispiel der Liposomen sind insbesondere auch solche
Effektorstrukturen gemeint, die neben dem Erkennungsmolekül für die Tumorspezifität auch solche
Moleküle
tragen, die für
eine Aufnahme der Effektorstrukturen oder Teile davon in die Zellen
verantwortlich sind, wie beispielsweise Antikörper gegen Rezeptoren, die
eine Rezeptor-vermittelte Endozytose bewirken. Vorzugsweise umfassen
die Erkennungsmoleküle
in diesen Fällen
eine Transmembrandomäne,
die ihnen eine Insertion in die Liposomenmembran erlaubt oder in
einer anderen bevorzugten Ausführungsform
werden die Erkennungsmoleküle
chemisch auf die Liposomenoberfläche
gekoppelt. Die hierfür
verwendeten Techniken sind dem Fachmann bekannt, einschließlich der
Herstellung der Liposomen. Auch die Verbindung der Erkennungsmoleküle mit den anderen
Effektorstrukturen erfolgt nach an sich bekannten Methoden. Die
Kopplungen können
dabei wie bereits oben ausgeführt
beispielsweise direkt durch kovalente oder nicht-kovalente Beladung
erfolgen, durch chemische Kopplung, wobei ein zusätzliches
chemisches oder biologisches Molekül notwendig sein kann, beispielsweise
ein Chelator oder ein Linker, oder in Form von Fusionsproteinen
oder -peptiden durch Fusion. Eingesetzt werden die Erkennungsmoleküle bei der
Behandlung von Tumorerkrankungen mit Core-1 tragenden Tumoren, und/oder
für eine
Untergruppe an erfindungsgemäßen Erkennungsmolekülen, die
weiter oben über ihre
Spezifität
für Core-1
und Core-2 beschrieben sind, Core-2 und/oder Core-1 tragenden Tumorzellen
oder zur Prophylaxe, die beispielsweise die Ausbildung von primären Tumoren
oder Metastasen verhindert. Bevorzugtes Ziel ist dabei die Behandlung
der minimalen residualen Erkrankung und von Metastasen. Eine weitere bevorzugte
Anwendung ist dabei die Inhibition der Lebermetastasierung von Core-1
und/oder Core-2 positiven Tumorzellen. Die erfindungsgemäßen Erkennungsmoleküle werden
dabei in einer geeigneten Formulierung einmalig oder wiederholt
in geeigneten zeitlichen Abständen
und Dosen verabreicht.
-
Im Folgenden und davor versteht man
im Sinne der Erfindung unter dem Core-1 Antigen auch Core-1 und/oder
Core-2 und unter Core-1 positiven Zellen oder Tumorzellen und/oder
-geweben auch Core-1 und/oder Core-2 positive Zellen oder Tumorzellen
und/oder -gewebe.
-
In einer bevorzugten Ausführungsform
werden die erfindungsgemäßen oben
beschriebenen radioaktiven Erkennungsmoleküle mit einer Applikation von
nicht markierten erfindungsgemäßen Core-1
spezifischen Erkennungsmolekülen
kombiniert. Dies dient der Verbesserung des Hintergrundes und damit
einer spezifischeren Bindung an den Tumor, indem potentielle Core-1
tragende Moleküle
im Blut abgesättigt
werden. Bevorzugt werden dabei IgM abgleitete Erkennungsmoleküle verwendet,
beispielsweise der in den Beispielen beschriebene cIgM oder die
humanisierte Form davon, da diese vor allem an Core-1 Antigen im
Blut binden und damit den Hintergrund und die Serumbelastung mit
Radioaktivität
erniedrigen und das relative Tumortargeting erhöhen, während aufgrund der Größe der Moleküle ein Eindringen
in Gewebe und Tumoren limitiert ist. Die hierfür verwendeten Verfahren und
Technologien sind dem Fachmann bekannt, ebenfalls kann der Fachmann eine
geeignete Dosis, Formulierungen, Applikationsroute und Zeitpunkt
der Gabe der nicht-markierten Erkennungsmoleküle erstellen.
-
Bevorzugt ist weiterhin die Verwendung
von viralen Vektoren zur gentherapeutischen Anwendung, bei der insbesondere
die Oberfläche
der Viren erfindungsgemäße Erkennungsmoleküle tragen.
-
Die Erfindung betrifft weiterhin
Verfahren unter Verwendung der erfindungsgemäßen Erkennungsmoleküle, die
es erlauben, aus einem großen
Pool unterschiedlicher Moleküle
Core-1 tragende Moleküle
zu identifizieren und/oder zu gewinnen, die für eine Anwendung in der Tumorbehandlung,
Tumorprophylaxe und Tumordiagnose vorteilhaft verwendet werden können. Unter
Core- 1 tragenden
Molekülen
versteht man erfindungsgemäß Moleküle, die
Core-1 und/oder Core-2 Strukturen tragen und spezifisch von den
erfindungsgemäßen Erkennungsmolekülen gebunden
werden. Erfindungsgemäß sind Core-1
tragende Moleküle
Glykoproteine, Glykopeptide und/oder Glykolipide sowie auch Zellen
oder andere Trägersubstanzen,
wie beispielsweise Viren, Bakterien, Teile von Zellen, wie beispielsweise
Exosomen oder Zelllysate, oder Liposomen, die ein oder mehrere Core-1
Strukturen enthalten. Die Core-1 tragenden Moleküle können aus Zellen oder Zelllinien, aus
Kulturüberständen, aus
Tumorgewebe, Tumorzellen oder Körperflüssigkeiten,
wie Blut, Blutserum, Lymphe, Urin, Spinalflüssigkeit oder Sperma angereichert
oder isoliert werden.
-
Die zuvor eingeführten Definitionen der Begriffe
sind für
die Begriffe in den nachfolgend beschriebenen Verfahren mutatis
mutandis anwendbar.
-
Core-1 tragende Moleküle werden
in einem erfindungsgemäßen Verfahren
durch Bindung an die oben beschriebenen erfindungsgemäßen Core-1
spezifischen Erkennungsmoleküle
identifiziert und/oder isoliert und gewonnen. Nach dem erfindungsgemäßen Verfahren
können
die oben beschriebenen Core-1 tragenden Moleküle aus Körperflüssigkeiten oder aus Überständen von
Zellkulturen durch eine Affinitätschromatographie gewonnen
werden. Dabei können
weitere Reinigungs- und/oder Konzentrierungsschritte nach an sich
bekannten Methoden mit einem oder mehreren Affinitätschromatographieschritten
kombiniert werden. Ebenso können tumorassoziierte
Core-1 tragende Moleküle
aus Tumorzellen, Tumorgeweben oder Tumorzelllinien gewonnen werden,
indem ein geeigneter Schritt nach an sich bekannten Methoden vorgeschaltet
wird, der es erlaubt, die zellassoziierten Core-1 tragenden Moleküle für die Affinitätsreinigung
zugänglich
zu machen, beispielsweise durch Solubilisierung mit geeigneten Detergenzien
oder durch Abspaltung durch Proteolyse oder durch Zelllyse.
-
In einem weiteren erfindungsgemäßen Verfahren
werden Core-1 tragende Moleküle
oder Zellen aus Geweben gewonnen. Hierzu wird das Gewebe nach an
sich bekannten Methoden aufgeschlossen, um die Core-1 tragenden
Moleküle
oder Zellen zugänglich
zu machen, beispielsweise durch proteolytische oder mechanische
Methoden. Dem Fachmann sind diese Verfahren bekannt.
-
Wie oben ausgeführt werden auch Core-1 positive
Zellen oder Zelllinien unter Verwendung der Core-1 spezifischen
Erkennungsmoleküle
isoliert oder angereichert und von solchen Zellen, die keine oder
geringe Mengen an Core-1 Strukturen tragen, getrennt. Unter dem
Begriff "Isolierung
oder Anreicherung der Zellen" sind
alle Maßnahmen
zur Separierung von Zellen zu verstehen, die durch das Tragen von
Core-1 Strukturen einen Komplex mit den erfindungsgemäßen Erkennungsmolekülen gebildet
haben. Dem Fachmann sind diese Verfahren bekannt. Vorzugsweise wird
hierfür
die FACS oder die MACS Methode eingesetzt. Beispielsweise erfolgt
die Anreicherung durch Bindung von erfindungsgemäßen Erkennungsmolekülen an die
Core-1 Struktur auf der Zelloberfläche und anschließender Selektion
der so markierten Zellen durch Bindung an Trägermaterialien, die spezifisch
mit dem Erkennungsmolekül
interagieren, beispielsweise anti-Maus IgM Antikörper gekoppelt an Magnetbeads
(MACS-Sortierung). Außerdem
können
die Core-1 spezifischen Erkennungsmoleküle selbst kovalent an einen
Träger
gekoppelt sein. Ein weiteres Beispiel ist die Gewinnung mit Hilfe
eines FRCS-Sorters, der Zellen, die die Erkennungsmoleküle tragen,
die fluoreszenzmarkiert wurden, sortiert. Beide Methoden sind dem
Fachmann bekannt. Diese so angereicherten Core-1 positiven Zellen
können
für die
Herstellung von Vakzinen verwendet werden, beispielsweise zur Beladung
von Dendritischen Zellen oder direkt als Tumorzelllysat in einer
Vakzinen Zusammensetzung. Die vorhergehende Anreicherung von Core-1
positiven Zellen soll zu einer höheren
Tumorspezifität
der Vakzinierung führen.
Dem Fachmann sind diese Verfahren bekannt.
-
Die vorliegende Erfindung betrifft
weiterhin Verfahren zur Herstellung eines Diagnostikums umfassend die
Schritte des erfindungsgemäßen Verfahrens
zur Herstellung der erfindungsgemäßen Core-1 spezifischen Erkennungsmoleküle und weiterhin
umfassend den Schritt der Formulierung der Erkennungsmoleküle in einer diagnostisch
verwendbaren Form Unter dem Begriff "Diagnostikum" sind erfindungsgemäß Stoffe und Zubereitungen
aus Stoffen definiert, die dazu bestimmt sind, durch Anwendung am
oder im menschlichen Körper oder
Teilen davon Krankheiten, Leiden, Körperschäden oder krankhafte Beschwerden
zu erkennen. Als Teile des menschlichen Körpers sind vorzugsweise Körperflüssigkeiten,
wie Blut, Blutserum, Lymphe, Urin, Spinalflüssigkeit oder Sperma, oder
Gewebebiopsien oder -proben zu verstehen.
-
Die Formulierung des Diagnostikums
umfasst vorzugsweise die Modifikation der hergestellten Erkennungsmoleküle mit Substanzen,
die einen Nachweis des Antigens Core-1, in bestimmten Ausführungsformen, die
von der Feinspezifität
des erfindungsgemäßen Erkennungsmoleküls abhängen, definitionsgemäß auch das
Antigen Core-2, erlauben. Geeignete Substanzen sind im Stand der
Technik bekannt. Ausgehend von der Wahl der Substanz ist der Fachmann
in der Lage, geeignete Maßnahmen
zur Formulierung des Diagnostikums einzusetzen.
-
Für
die Diagnostik können
erfindungsgemäß auch Substanzen
nach an sich bekannten Methoden an die Erkennungsmoleküle gekoppelt
werden, die einen Nachweis der Core-1 Antigene und/oder deren Trägermoleküle und/oder
-zellen erleichtern, beispielsweise durch Biotinylierung, Fluoreszenzmarkierung,
radioaktive Markierung oder Enzymkopplung der Erkennungsmoleküle.
-
In einem weiteren Verfahren zur Tumordiagnostik
und Prognose werden erfindungsgemäße Erkennungsmoleküle verwendet,
die Core-1 Antigene und/oder deren Trägermoleküle im Serum von Menschen erkennen.
Die Bestimmung erfolgt bevorzugt qualitativ, quantitativ und/oder
in zeitlich relativen Quantitäten
nach an sich bekannten Methoden. Die gleichen Verfahren werden erfindungsgemäß auch zur
Verlaufskontrolle von Tumorerkrankungen und zur Kontrolle von Behandlungsverläufen einschließlich des
Monitorings von Immunantworten und zur Kontrolle und Dosierung von
Tumorbehandlungen eingesetzt. Die in den Verfahren verwendeten Methoden
sind an sich bekannt, beispielsweise ELISA, Westerblot, FACS (Fluoreszenzaktivierte Zellsortierung),
MACS (Magnetvermittelte Zellsortierung), ADCC (Antikörpervermittelte
Zellzytotoxizität),
CDC (Komplement vermittelte Zytotoxizität), Immuncytochemie und Immunhistochemie.
-
In den bevorzugten erfindungsgemäßen Verfahren
zur Tumordiagnostik und Prognose werden erfindungsgemäße Core-1
spezifische Erkennungsmoleküle
in an sich bekannten Verfahren eingesetzt, um das Antigen Core-1
im Serum oder in Gewebspräparaten
nachzuweisen. Dabei wird das Antigen Core-1 auf Trägermolekülen, in
Immunkomplexen auf Trägermolekülen vorliegendes
Core-1 und/oder auf Zellen gebundenes Core-1 nachgewiesen und das
Vorhandensein des Core-1 Antigens und/oder der Core-1 tragenden
Moleküle qualitativ,
quantitativ und/oder in relativen Quantitäten nach an sich bekannten
Methoden bestimmt. Die gleichen Verfahren werden erfin dungsgemäß auch zur
Verlaufskontrolle von Tumorerkrankungen und zur Kontrolle von Behandlungsverläufen eingesetzt.
Die in den Verfahren verwendeten Methoden sind an sich bekannt, beispielsweise
ELISA, Western-Blot, FACS (Fluoreszenzaktivierte Zellsortierung),
MACS (Magnetvermittelte Zellsortierung), ADCC (Antikörpervermittelte
Zellzytotoxizität),
CDC (Komplement vermittelte Zytotoxizität), Immuncytochemie und Immunhistochemie.
-
Eine bevorzugte Ausführungsform
ist ein Gewebsschnelltest, bei dem in einem immunhistologischen Verfahren
die Gewebsproben mit fluoreszenzmarkierten erfindungsgemäßen Erkennungsmolekülen gefärbt werden.
In einem weiter bevorzugten Verfahren wird das erfindungsgemäße Erkennungsmolekül, bevorzugt ein
Antikörper
des Isotyps IgM, mit einem weiteren Antikörper, der spezifisch das Antigen
MUC1 erkennt, bevorzugt Isotyp Igel, kombiniert. Der Vorteil dabei
ist, dass beispielsweise für
die Diagnostik von gastrointestinalen Karzinomen (z.B. Colorektale
Karzinome und Magenkarzinome) diese in einem frühen Stadium erkannt und gleichzeitig
eine Prognose bezüglich
des Krankheitsverlaufes und/oder der Lebermetastasierungsgefahr gegeben
werden kann, wobei ein höheres
Niveau an Core-1 Antigen eine schlechtere Verlaufsprognose und eine
um das mehrfach höhere
Wahrscheinlichkeit der Lebermetastasierung bedeutet. In einer weiter
bevorzugten Ausführungsform
sind die Antikörper
und Erkennungsmoleküle
direkt mit unterschiedlichen Fluoreszenzfarbstoffen, beispielsweise
Cy3 und Cy5 oder Cy3 und FITC, markiert. In einer Ausführungsform,
in der eine Signalverstärkung
vorteilhaft ist, werden die Antikörper und/oder Erkennungsmoleküle durch
markierte sekundäre
Antikörper
oder das Biotin-Streptavidin verstärkt. Dabei ist es vorteilhaft,
unterschiedliche Isotypen und/oder Speziessequenzen im konstanten
Teil der Antikörper
zu verwenden. Die hierbei verwendeten Technologien und Methoden, beispielsweise
der Markierung und der Immunhistologie, sowohl die Wahl der geeigneten
Formate der Erkennungsmoleküle
sind dem Fachmann bekannt. Das beschriebene diagnostische Verfahren
ist nicht auf gastrointestinale Tumoren beschränkt, sondern anwendbar für alle das
Antigen Core-1 tragende Tumorerkrankungen.
-
In einer weiter bevorzugten Ausführungsform
wird ein serologischer Test durchgeführt, bei dem als Verfahren
ein Sandwich-ELISA verwendet wird. Dieser besteht aus einem Fängerantikörper, der
Trägermoleküle des Core-1
Antigens aus dem Serum an eine feste Phase bindet, und einem Nachweisantikörper, hierunter
fallen erfindungsgemäß auch andere
erfindungsgemäße Erkennungsmoleküle, die
das Core-1 Antigen erkennen. Damit kann unterschieden werden, welches
Trägermolekül das Core-1
trägt.
In einer bevorzugten Form kann damit auf den Ursprung des Primärtumors
Rückschlüsse gezogen
werden. Als Fängerantikörper können verschiedene
Antikörper
dienen, die Glykoproteine erkennen, die O-Glykosylierungen tragen.
Eine bevorzugte Ausführungsform
verwendet Antikörper
gegen das epitheliale Muzin MUCl als Fängerantikörper, das häufig ein Träger des Core-1 im Tumorfall
ist. In einer weiteren Ausführungsfom
werden alle Antigene im Blut bestimmt, die das Core-1 Antigen tragen.
Dies ist dadurch möglich,
dass das Core-1 Antigen in der Regel in mehreren Kopien pro Trägermolekül vorkommt.
Hierbei wird erfindungsgemäß ein erfindungsgemäßes Core-1 spezifisches
Erkennungsmolekül
als Fängerantikörper verwendet
und ein markiertes erfindungsgemäßes Core-1
spezifisches Erkennungsmolekül
als Nachweisantikörper,
wobei die Erkennungsmoleküle
keine Antikörper
sein müssen.
In einer bevorzugten Ausführungsform
wird ein IgM als Erkennungsmolekül
mindestens als Fänger-
oder Nachweisantikörper
verwendet. In einer weiter bevorzugten Ausführungsform wird der Nachweisantikörper mit
Biotin markiert und das System über
Streptavidin in Kombination mit einem geeigneten Nachweisverfahren
nachgewiesen. Ein geeignetes Nachweisverfahren sind beispiellweise
POD Markierungen oder Fluoreszenzmarkierungen des Streptavidins.
-
In einer weiter bevorzugten Ausführungsform
der Erfindung werden für
einen serologischen Tumortest die Bestimmung des Core-1 Antigens,
wie zuvor beschrieben, mit der Bestimmung anderer serologischer
Tumormarker kombiniert, beispielsweise PSA, CEA oder AFP. Eine hierbei
bevorzugte Ausführungsform
ist die Bestimmung des MUC1 und des Core-1 Antigens. In einer bevorzugten
Ausführungsform
wird hierbei das MUC1 mit Hilfe eines MUC1 spezifischen Antikörpers aus
dem Serum an eine feste Phase immobilisiert und mit einem zweiten
anti-MUC1 spezifischen Antikörper,
bevorzugt solche, die die DTR-Region in einer glykosylierten Form
verbessert erkennen, als Nachweisantikörper nachgewiesen und das Core-1
Antigen auf dem mit Hilfe eines anti-MUC1 Fängerantikörpers immobilisierten MUC1
mit einem erfindungsgemäßen Erkennungsmolekül nachgewiesen.
Dieser diagnostische Test verbindet eine Früherkennung mit einer prognostischen Aussage über den
Krankheitsverlauf und/oder der Lebermetastasierungswahrscheinlichkeit.
Die hierbei verwendeten Technologien, beispielsweise der Markierung
und der Serologie, einschließlich
der Nachweismethoden, sind dem Fachmann bekannt. Die beschriebenen
diagnostischen Verfahren sind nicht auf gastrointestinale Tumoren
beschränkt,
sondern anwendbar für
alle das Antigen Core-1 tragende Tumoren. Die beschriebenen serologischen
Tests dienen der Diagnose, des Monitorings des Verlaufs der Tumorerkrankung
und der Prognose von Core-1 Antigen-positiven Tumoren.
-
In einem weiteren erfindungsgemäßen Verfahren
werden die erfindungsgemäßen Core-1-spezifischen
Erkennungsmoleküle
zu einer in vivo Diagnostik verwendet. Hierfür werden die Erkennungsmoleküle mit geeigneten
an sich bekannten Verfahren markiert und somit für an sich bekannte bildgebende
Verfahren am Menschen zugänglich
gemacht, beispielsweise Radioimmundiagnostik, PET-Scan Verfahren
oder Immunofluoreszenzendoskopie, beispielweise durch Kopplung und/oder
Beladung mit entsprechenden Molekülen, beispielsweise radioaktiven
Isotope, beispielsweise das Indium, oder Fluoreszenzfarbstoffe,
beispielsweise dem Cy3, Cy2, Cy5 oder FITC. In einer bevorzugten
Ausführungsform
werden erfindungsgemäße Multibodies
mit einem geeigneten Chelator (beispielsweise DOTA oder DTPA) kovalent
gekoppelt und mit Indium-111 beladen und zur in vivo Diagnostik
eingesetzt. Diese werden in einer bevorzugten Ausführungsform
intravenös
in einer für
das Individuum geeigneten Dosis verabreicht und die Lokalisation
des Core-1 Antigens und eines potentiellen Tumors nach an sich bekannten
Verfahren gemessen. Die hierfür
verwendeten Verfahren und Technologien, einschließlich der
bildgebenden Verfahren, sind dem Fachmann bekannt, ebenfalls kann
der Fachmann eine geeignete Dosis und Formulierungen erstellen.
-
In einer weiteren bevorzugten Ausführungsform
werden Immunglobuline, bevorzugt IgM und IgG, wie oben beschrieben
und in den Beispielen näher
ausgeführt,
radioaktiv-markiert, beispielsweise mit Indium-111, und lokal in
den Tumor oder in den Tumor versorgende oder entsorgende Blutgefäße gegeben.
Dies dient in einer Ausführungsform
zur Bestimmung der Größe des Tumors
und in einer weiteren Ausführungsform
der Bestimmung befallener Lymphknoten. Die hierfür verwendeten Verfahren und
Technologien sind dem Fachmann bekannt, ebenfalls kann der Fachmann
eine geeignete Dosis und Formulierungen erstellen.
-
In einer weiteren Ausführungsform
werden die erfindungsgemäßen radioaktiv-markierten
Erkennungsmoleküle
auch über
andere Applikationsrouten verabreicht. Dabei bevorzugte Routen sind intraperitoneal,
intranodal oder intrarectal bzw. intragastrointestinal. Intraperitoneal
ist dabei besonders vorteilhaft zur Bestimmung von Tumoren, die über das
Peritoneum zugänglich
sind und/oder in dieses metastasieren, beispielsweise Ovarialkarzimome
und bestimmte gastrointestinale Karzinome. Intrarectale bzw. intragastrointestinale Verabreichung
ist vorteilhaft für
bestimmte gastrointestinale Tumoren und deren Lokalisation und Größenbestimmung.
Intranodal kann in bestimmten Fällen
dafür verwendet
werden einzelne Lymphknoten direkt zu infiltrieren.
-
In einer bevorzugten Ausführungsform
werden die erfindungsgemäßen oben
beschriebenen radioaktiven Erkennungsmoleküle für in vivo Diagnostika mit einer
Applikation von nicht markierten erfindungsgemäßen Core-1 spezifischen Erkennungsmolekülen kombiniert.
Dies dient der Verbesserung des Hintergrundes. Bevorzugt werden
dabei IgM abgeleitete Erkennungsmoleküle verwendet, da diese vor
allem an Core-1 Antigen im Blut binden und damit den Hintergrund
deutlich erniedrigen, während
aufgrund der Größe der Moleküle ein Eindringen
in Gewebe und Tumoren limitiert ist. Die hierfür verwendeten Verfahren und
Technologien sind dem Fachmann bekannt, ebenfalls kann der Fachmann
eine geeignete Dosis, Formulierungen, Applikationsroute und Zeitpunkt
der Gabe der nicht-markierten Erkennungsmoleküle erstellen.
-
In einer weiteren bevorzugten Ausführungsform
werden erfindungsgemäße Erkennungsmoleküle, bevorzugt
Immunglobuline, Multibodies oder Antikörperfragmente, weiter bevorzugt
IgM, IgG und Multibodies, mit einem Fluoreszenzfarbstoff markiert
und in vivo verabreicht. Bevorzugte Applikationsrouten sind hierbei
intrarectal, intragastrointestinal, intraperitoneal, intravenös und in
zuführende
oder abführende
Blutgefäße. Eine besonders
bevorzugte Ausführungsform
dient der Lokalisation gastrointestinaler Karzinome, die durch eine Fluoreszenz endoskopie
nach Applikation der fluoreszenzmarkierten Erkennungsmoleküle durchgeführt wird. In
einer weiter bevorzugten Ausführungsform
wird ein erfindungsgemäßes Erkennungsmolekül mit mindestens einem
Antikörper
gegen ein weiteres Tumorantigen kombiniert, bevorzugt anti-MUC1
Antikörper.
Bevorzugt werden dabei unterschiedliche Fluoreszenzfarbstoffe verwendet,
die eine Unterscheidung der Erkennungsmoleküle und Antikörper erlauben,
womit eine prognostische Aussage mit einer Früherkennung und einer größeren Anzahl
an Fällen
kombiniert wird. Bevorzugte Fluoreszenzfarbstoffe sind solche mit
geringer Hintergrundfluoreszenz, die dem Fachmann bekannt sind.
Die hierfür
verwendeten Verfahren und Technologien, einschließlich der
bildgebenden Verfahren, beispielsweise der Fluoreszenz-Endoskopie, sind
dem Fachmann bekannt, ebenfalls kann der Fachmann eine geeignete
Dosis, Formulierungen, Applikationsroute und Zeitpunkt der Gabe
der nicht-markierten Erkennungsmoleküle erstellen.
-
Die Erfindung weist mehrere Vorteile
auf: Die erfindungsgemäßen Core-1
spezifischen Erkennungsmoleküle
erkennen Karzinomarten spezifisch, wodurch sie mit Vorteil bei vielen
Tumorpatienten verschiedener Indikation zu einer Diagnose und/oder
Therapie verwendet werden können.
Darüber
hinaus binden die Erkennungsmoleküle vorteilhafterweise praktisch
nicht auf normalen Geweben. Dies ist gegenüber den bekannten Tumormarkern
ein besonderer Vorteil und eine herausragende Eigenschaft der erfindungsgemäßen Erkennungsmoleküle. Vorteilhaft
ist weiterhin, daß die
Erkennungsmoleküle
das Core-1 Antigen Träger-unabhängig erkennen.
Ein besonderer Vorteil der erfindungsgemäßen Erkennungsmoleküle ist die
hohe Spezifität
für das Tumorgewebe.
Dies ist insbesondere in der hohen Spezifität für definite Kohlenhydrat-Antigene
begründet.
Bei einer unspezifischen Erkennung anderer Kohlenhydratstrukturen
würde sich
nämlich
die Gefahr der unspezifischen Erkennung von Nicht-Tumorgewebe erhöhen. Weiterhin
weisen die erfindungsgemäßen Erkennungsmoleküle eine
hohe Affinität
auf. Hierdurch ist insbesondere die Möglichkeit gegeben, geringervalente
Fragmente zu konstruieren, wie IgG und Multibodies. Die Möglichkeit
dieser verschiedenen Formate ist vorteilhaft für die Entwicklung von Therapeutika.
Die Core-1 und/oder Core-2 Struktur an der Zelloberfläche erhöht die Wahrscheinlichkeit
der Ausbildung von Metastasen, beispielsweise von Lebermetastasen;
durch die Blockierung der Core-1 und/oder Core-2 Struktur mit Erkennungsmolekülen wird
die Metastasenbildung reduziert bzw. inhibiert.
-
Im folgenden soll die Erfindung anhand
von Beispielen näher
erläutert
werden, ohne auf diese Beispiele beschränkt zu sein.
-
Beispiele
-
1. Herstellung von Core-1
spezifischen Multibodies mit kurzen Linkern
-
Multibodies mit den Sequenzen SEQ
ID NO. 96 bis 106 wurden durch Verkürzung oder Deletion des Linkers
zwischen der VH und der VL des
single chain Antikörpers
mit der Sequenz SEQ ID NO. 95 gebildet (1a). Hierfür wurden die VH und
die VL mit spezifischen Primern so amplifiziert,
daß 22
Nukleotide am 3'-Ende der VH und am 5'-Ende der VL einen
komplementären
Bereich ausbilden (1b,
PCR I und PCR II), und anschließend
die beiden PCR-Fragmente nach Aufreinigung in einer SOE-PCR miteinander
verknüpft (1b, PCR III) . Zum Schluß wurde
das PCR-Fragment über
NcoI/NotI in einen prokaryontischen Expressionsvektor kloniert.
Dieser Vektor enthält
den lacZ Promotor, eine Ribosomenbindungsstelle (RBS), das M13 origin,
die pelB Signalsequenz zur Sekretion ins Periplasma, ein Ampicillin-Resistenzgen
und eine Klonierungskassette, um an das C-terminale Ende des scFv
mit ein Hexa-Histidin-Tag zur effizienten Aufreinigung und ein c-myc-Tag
zu koppeln (2).
-
2. Bakterielle Expression
und Aufreinigung der Core-1 spezifischen Multibodies
-
Die Antikörperfragmente aus Beispiel
1 wurden in Escherichia coli exprimiert und aufgereinigt. Hierfür wurde
das entsprechende Plasmid durch Elektroporation in elektrokompetente
E.coli transformiert und über Nacht
in 2xTY Medium (10 g Hefeextrakt, 16 g Trypton, 5 g NaCl per L)
mit 100 μg/mL
Ampicillin kultiviert. Diese Kultur wurde 1:100 mit 2xTY Medium,
dem 100 g/ml Ampicillin und 0,5% Glukose zugesetzt wurde, verdünnt und
bei 37°C
inkubiert, bis eine OD600nm von ca. 0,6
erreicht war. Dann wurde der Kultur zur Induktion 1 mM IPTG zugesetzt
und diese bei 25°C
weitere 5 h inkubiert. Die Bakterien wurden durch Zentrifugation
bei 4000xg für
20 min geerntet, das Zellpellet in TES Puffer (30 mM Tris-HCl, pH
8.0, 20% Saccharose, 1 mM EDTA) resuspendiert und 20 min auf Eis
inkubiert. Anschließend
wurden 5 mM MgSO4 zugefügt und die Suspension für weitere
20 min auf Eis inkubiert. Durch Zentrifugation bei 4000xg für 60 min
wurde dann die Periplasmafraktion gewonnen und über Nacht bei 4°C gegen Bindungspuffer
(50 mM Phosphatpuffer, pH 8.0, 300 mM NaCl, 10 mM Imidazol) dialysiert.
Die in der Periplasmafraktion enthaltenen Antikörperfragmente wurden unter Verwendung
des C-terminalen His-Tags durch Metallionen-Affinitäts-chromatographie (HiTrap
Chelating HP, Amersham Pharmacia Biotech) aufgereinigt. Dafür wurde
die dialysierte Fraktion auf die vorher mit Bindungspuffer äquilibrierte
Säule gegeben
und mit Waschpuffer (50 mM Phosphatpuffer, pH 8.0, 300 mM NaCl,
30 mM Imidazol) die nicht bindenden Proteine von der Säule gewaschen.
Anschließend
wurden die Antikörperfragmente
mit Elutionspuffer (50 mM Phosphatpuffer, pH 8.0, 300 mM NaCl, 300
mM Imidazol) eluiert. Dieses Aufreinigungsprotokoll wurde für alle Core-1
spezifischen Antikörperfragmente
mit Hexa-Histidin-Tag
verwendet, beispielsweise den humanisierten single chain Antikörpern aus
Beispiel 6.
-
3. Analyse der Core-1
spezifischen Multibodies im scFv Format mit unterschiedlicher Linkerlänge im ELISA
-
Multibodies mit den Aminosäuresequenzen
SEQ ID NO. 95, 96, 97, 98, 99, 100, 101, 103, 104 und 105 wurden
wie oben beschrieben in E.coli exprimiert und die Periplasmafraktionen
gewonnen. Als Antigen für den
ELISA Test wurde Asialoglykophorin (Sigma), ein Core-1 tragendes
Glykoprotein, eingesetzt. Aus der Stammlösungen (lmg in lml Bi-dest.
H2O), die portioniert bei –20°C aufbewahrt
werden, wurde eine Verdünnung
von 5 μg/ml
in PBS hergestellt. Davon wurden 50 μl/well in eine Mikrotiterplatte
(NUNCLON-TC Microwell 96 F) pipettiert und die Testplatte über Nacht
bei 4°C
inkubiert. Am nächsten
Tag wurde die Testplatte mit PBS/0,2% Tween 3x gewaschen. Anschließend wurden
mit 2% BSA in PBS unspezifische Bindungsstellen blockiert und 50 μl der jeweiligen
mit PBS/1% BSA in verschiedenen Verdünnungsschritten verdünnten Fraktionen
aufgetragen und 2 h bei 37°C
inkubiert. Nach drei Waschschritten mit PBS/0,2% Tween wurden zum Nachweis
der spezifisch gebundenen Antikörperkonstrukte
als Zweit-Antikörper Peroxidase-gekoppelter
anti-His Tag-Antikörper
eingesetzt. Zum Nachweis des gebundenen sekundären Antikörpers erfolgte eine Farbreaktion
mit TMB (3,3',5,5'-Tetramethylbenzidine). Nach 15 Minuten
wurde die Reaktion durch Zugabe von 2,5N H2SO4 abgestoppt. Die Messung erfolgte mit einem
Mikrotiterplattenphotometer mit Filter 450nm im Dual-mode gegen
einen Referenzfilter 630nm. Das Ergebnis ist in 3 dargestellt. Eine schrittweise Linkerverkürzung führt zu einer
Erhöhung
der Bindung an Asialoglykophorin. Die besten Bindungseigenschaften
zeigen die Varianten mit der SEQ ID NO. 104 und 105. Diese multivalenten
Konstrukte im Dia/Triabody Format sind bevorzugte Ausführungsformen
der Erfindung und sind aufgrund verbesserter pharmakokinetischer
Eigenschaften für
die Tumortherapie von Vorteil.
-
4. Klonierung der Vektoren
zur Expression chimärer
Core-1 spezifischer IgG und IgM Antikörper
-
Das NcoI/XhoI DNA Fragment aus dem
scFv Vektor, das für
die VH kodiert (4), wurde in den NcoI/SalI geschnittenen
BS-Leader Vektor
kloniert. Der BS-Leader Vektor enthält eine Klonierungskassette
zur Einführung
der T-Zellrezeptor Signalpeptidsequenz an das 5'-Ende sowie einer Splice-Donor-Sequenz an das 3'-Ende der Sequenzen
der variablen Domänen
(4). Die VL-Sequenz
des entsprechenden Antikörpers wurde
mit spezifischen Primern zur Einführung der NcoI-Schnittstelle
am 5'-Ende und der
NheI-Schnittstelle am 3'-Ende
in der PCR unter Verwendung der scFv Sequenz als Templat amplifiziert
und nach NcoI/NheI Verdau in den gleich verdauten BS-Leader Vektor
kloniert. Danach wurde jeweils das HindIII/BamHI Fragment aus dem
BS-Leader Vektor in den entsprechenden eukaryontischen Expressionsvektor
kloniert. Diese Vektoren (pEFpuroCγlVH,
pEFpuroCμVH und pEFneoCκVL)
enthalten den EF-1α-Promotor
und den HCMV-Enhancer, das SV40-origin, das BGH-Polyadenylierungssignal, das Puromycin-Resistenzgen
im Vektor für
die schwere Kette und das Neomycin-Resistenzgen oder das Dehydrofolatreduktase-Gen
im Vektor für
die leichte Kette sowie die genomischen Sequenzen der humanen konstanten γ1 Region
oder μ Region
für die
schwere Kette bzw. der humanen konstanten κ Region für die leichte Kette (Primer
zur Amplifizierung aus genomischer humaner DNA und Vektorkarte siehe 4).
-
5. Eukaryontische Expression
Core-1 spezifischer chimärer
IgG und IgM Antikörper
in CHO Zellen und deren Aufreinigung
-
Zur Expression der chimären Antikörper cIgG-Karo4
bestehend aus den Sequenzen SEQ ID NO. 111 und 113 und cIgM-Karo4
bestehend aus den Sequenzen SEQ ID NO. 112 und 113 wurden CHOdhfr-
Zellen (ATCC-Nr. CRL-9096) mit einem Gemisch der Vektoren für die schwere
und die leichte Kette (1:3) durch Elektroporation (106 Zellen/ml,
500 V, 50 μs)
cotransfiziert und in Selektionsmedium (CHO-S-SFM II Medium (Life Technologies),
HT Supplement (Biochrom), 400 μg/ml
G418, 5 μg/ml
Puromycin) 2 Wochen kultiviert. Nach Einzelzellklonierung in einer
96-Loch-Platte wurden die Überstände im ELISA
(Asialoglykophorin als Antigen, anti human Fcγ1- POD gekoppelt bzw. anti human
Fc5μ- POD
gekoppelt (Dianova) als Sekundärantikörper) getestet
und der Klon mit der höchsten
Antikörperproduktionsrate
selektioniert (ca. 0,5 μg/106 Zellen/24 h).
-
Zur Antikörperproduktion wurden die stabil
transfizierten, den chimären
IgG bzw. IgM sekretierenden CHO Zellen in Spinnerflaschen in CHO-S-SFM
II Medium, ergänzt
durch HT Supplement, kultiviert, bis eine Zelldichte von ca. 1 × 106 Zellen/ml erreicht war. Nach Abtrennung
der Zellen vom Zellkulturüberstand
durch Zentrifugation (400xg, 15 min) wurde der Chimäre Antikörper unter
Verwendung einer Protein A – Säule (HiTrap
rProtein A FF, Amersham Pharmacia Biotech) für den chimären IgG bzw. einer anti human
Fc5μ- Antikörper Affinitätssäule auf
gereinigt. Die durch pH-Sprung eluierte gereinigte Antikörperfraktion
wurde unter Verwendung von Centriprep-Zentrifugenröhrchen (cut
off 50 kDa, Millipore) in PBS umgepuffert und aufkonzentriert.
-
6. Angleichung der Sequenz
der Core-1 spezifischen Antikörpersequenzen
an humaae Keimbahnsequenzen
-
Für
die Angleichung der Core-1 bindenden Antikörpersequenzen an humane Sequenzen
wurde in der Datenbank humaner Keimbahnsequenzen nach homologen
Sequenzen gesucht und unter Verwendung der humanen Consensus-Sequenzen
und den Erkenntnissen der kanonischen Struktur humaner Antikörper wurden
humanisierte Core-1-bindende Sequenzen entwickelt. Für die variable
schwere Kette diente die humane Keimbahnsequenz VH1-46 als Vorlage,
für die
variable leichte Kette die Sequenz A18.
-
Die humanisierten VH bzw.
VL Sequenzen SEQ ID NO. 56 bis 79 bzw. 85
bis 94 wurden mit Hilfe der gene assembly PCR (singleoverlap extension
PCR) hergestellt. Die PCR Reaktion erfolgte nach folgendem Schema:
erste Denaturierung 94°C
für 2min,
dann 30 Zyklen Denaturierung bei 94°C für 45 sec, Annealing bei 55°C für 45 sec
und Elongation bei 73°C
für 1,5
min und am Ende einen Elongationsschritt bei 73°C für 7 min.
-
Die so hergestellten VH und
VL Ketten wurden mit den Enzymen NcoI und
XhoI bzw. NotI und XhoI geschnitten und zur Seqeunzierung in einen
Klonierungsvektor (pLitmus 28 bzw. pBluescript KS) kloniert. Die richtigen
VH und VL Ketten
wurden anschließend
erneut amplifiziert, um am 3'-Ende
der VH und am 5'-Ende der VL eine
BbsI Schnittstelle einzufügen,
um darüber
die VH und die VL mit
nur einem Alanin als Linker zu verknüpfen. Nach der Ligation wurden
die kompletten scFv (die Ligationsprodukte) unter Verwendung der
flankierenden Primer amplifiziert und in einen bakteriellen Expressionsvektor
kloniert.
-
7. Spezifitätsanalyse
der Core-1 spezifischen Erkennungsmoleküle im ELISA
-
Als Antigene wurden verschiedene
Kohlenhydrat-PAA-Konjugate (Synthesome) und Glykoproteine verwendet:
Asialoglykophorin (AGP), Glykophorin (GP) und Asialofetuine (Sigma);
die PAA (Poly[N-(2-hydroxyethyl) Rcrylamid)-Konjugate: Galβ1-3GalNAcα1-OC3H6NH-PAA und Galβ1-3GalNRcα1-p-OC6H4NH-PAA als Core-1
(alpha-Anomer) Konjugate mit unterschiedlichen Linkerlängen, Galβ1-3GalNAcβ1-OC3H6NH-PAA als beta-Anomer
des Core-1, Galα1-3GalNAcα1-OC3H6NH-PAA und Galα1-3GalNAcβ1-OC3H6NH-PAA als weitere Stereoanomere
des Core-1, die Core-2 Struktur Galβ1-3(GlcNAcβ1-6)GalNAcα1-OC3H6NH-PAA und die Derivate GalNAcα1-OC3H6NH-PAA, Neu5Acα2-3Galβ1-3GalNAcα1-OC3H6NH-PAA, Galβ1-3(Neu5Acα2-6)GalNAcα1-OC3H6NH-PAA, GlcNAcβ1-2Galβ1-3GalNAcα1-OC3H6NH-PAA, GlcNAca1-3Galβ1-3GalNAcα1-OC3H6NH-PAA, GalNAcα1-3Galβ1-OC3H6NH-PAA und 3'-O-Su-Galβ1-3GalNAcα1-OC3H6NH-PAA.
-
Aus den jeweiligen Stammlösungen (1
mg in 1 ml Bi-dest.H2O) , die portioniert
bei -20°C
aufbewahrt werden, wurde eine Verdünnung von 5 μg/ml in PBS
hergestellt. Davon wurden 50 μl/well
in eine Mikrotiterplatte (NUNCLON-TC Microwell 96 F) pipettiert
und die Testplatte 1 h bei 37°C
und über
Nacht bei 4°C
inkubiert. Am nächsten
Tag wurde die Testplatte mit PBS/0,2% Tween 3× gewaschen. Anschließend wurden
mit 2% BSA in PBS unspezifische Bindungsstellen blockiert und 50 μl des ersten
Antikörpers
aufgetragen (chimärer
IgG bzw. IgM: gereinigt 0,1 μg/ml
in PBS/0,1% BSA oder unverdünnter
Kulturüberstand
produzierender CHOdhfr-Zellen; Multibodies: 10 μg/ml in PBS/0,1% BSA). Nach
drei Waschschritten mit PBS/0,2% Tween wurden zum Nachweis der spezifisch
gebundenen Antikörperkonstrukte
die entsprechenden Zweit-Antikörper, Peroxidase-gekoppelt,
eingesetzt (ein anti-Maus
bzw. anti-human Fcyl bzw. μ -Antikörper für die ganzen
Antikörper,
ein anti-His Tag-Antikörper
für Multibodies).
Zum Nachweis des gebundenen sekundären Antikörpers erfolgte eine Farbreaktion
mit TMB (3,3',5,5'- Tetramethylbenzidine).
Nach 15 Minuten wurde die Reaktion durch Zugabe von 2,5N HZSO4 abgestoppt.
Die Messung erfolgte mit einem Mikrotiterplattenphotometer mit Filter
450nm im Dual-mode gegen einen Referenzfilter 630nm.
-
Repräsentative Ergebnisse sind in
den 5 und 6 dargestellt. In 5 sind zwei Erkennungsmoleküle mit variierenden
Loop-Sequenzen im IgM-Format verglichen. Die Antikörperkonstrukte
mIgM-Karo2 (SEQ ID NO. 107 und SEQ ID NO. 109) und mIgM-Karo4 (SEQ
ID NO. 108 und SEQ ID NO. 110) binden hochspezifisch an das Antigen
Core-1, bevorzugt an das alpha-Anomer
Galβ1-3GalNAcα und schwächer an
das beta-Anomer Galβ1-3GalNAcβ. Die erfindungsgemäßen Erkennungsmoleküle können auch
nur das alpha-Anomer Galβ1-3GalNAcα oder beide
Anomere Galβ1-3GalNAcα und Galβ1-3GalNAcβ in gleicher
Weise binden. Zusätzlich
bindet mIgM-Karo4 die Core-2 Struktur Galβ1-3(GlcNAcβ1-6)GalNAcα. Alle anderen getesteten Kohlenhydratstrukturen,
auch strukturell stark verwandte Strukturen werden durch die hier
beanspruchten Bindungsproteine nicht erkannt. Als Core-1 tragendes
Glykoprotein zeigt AGP ein starkes Signal mit beiden Varianten,
wobei das ebenfalls Core-1 tragende Glykoprotein Asialofetuin deutlich
stärker
mit der Karo2-Variante reagiert, was sehr wahrscheinlich mit der
unterschiedlichen Core-1 Dichte in beiden Proteinen zusammenhängt. 6 zeigt das Spezifitätsmuster
der beispielhaft ausgewählten
humanisierten Erkennungsmoleküle
Karo11 (SEQ ID NO. 56 und SEQ ID NO. 90), Karo21 (SEQ ID NO. 59
und SEQ ID NO. 90) und Karo38 (SEQ ID NO. 69 und SEQ ID NO. 90)
mit variierenden Gerüstsequenzen
im scFv-Format mit einer Aminosäure
als Linker. Auch hier zeigt sich das gleiche Spezifitätsmuster,
wie in der Definition der Core-1 spezifischen Bindung im Sinne der
Erfindung beschrieben (siehe oben).
-
Die spezifische Bindung der verschiedenen
bevorzugten Formate und Kombinationen im ELISA, beispielhaft an
AGP, GP und/oder Galβ1-3GalNAcα1-OC3H6NH-PAA, ist in
den 7a bis e dargestellt.
-
8. Immunhistologische
und immunzytologische Färbungen
-
Für
die immunhistologischen Färbungen
wurden Gefrierschnitte entsprechender Gewebeproben luftgetrocknet
und mit 10% Formaldehyd in PBS 15 min fixiert. Zur Reduktion der
endogenen Peroxidase-Aktivität wurden
die Schnitte mit 3% Wasserstoffperoxid in PBS behandelt und nach
Blockierung unspezifischer Bindungsstellen mit präabsorbiertem
Kaninchenserum an Neuraminidase-behandelten Erythrozyten mit einem Core-1
spezifischen Primärantikörper inkubiert.
Anschließend
wurden die Präparate
mit einem entsprechenden Sekundärantikörper (anti-Maus
bzw. anti-human IgG oder IgM, POD gekoppelt) inkubiert. Die Farbreaktion erfolgte
unter Verwendung des Peroxidase-Substrats Diaminobenzidin und die
Gegenfärbung
mit Hämatoxylin.
-
Das beispielhafte erfindungsgemäße Erkennungsmolekül mIgM-Karo4 reagiert nur
mit sehr wenigen Strukturen im Normalgewebe. Diese befinden sich
aber in für
einen Antikörper
nicht zugänglichen
Bereichen (Tabelle 3). Tabelle
3: Reaktion von humanem Normalgewebe mit dem Core-1 spezifischen
Antikörper
mIgM-Karo4
| Gewebetyp | Reaktivität |
| Epidermis – Basalmembran | negativ |
| Magen | |
| Foveola
Epithelium | negativ |
| Fundusdrüsen | negativ |
| Korpusdrüsen | negativ |
| Colon
Mucosa | negativ |
| Milz | |
| Trabeculae
lienis | negativ |
| Retikularzellen | negativ |
| Lymphozyten | negativ |
| Endothelium | negativ |
| Prostata | negativ |
| Leber | |
| Hepatozyten | negativ |
| Kupffer-Zellen | negativ |
| Gallenwege | negativ |
| Lymphknoten | |
| Lymphozyten | negativ |
| Retikularzellen | negativ |
| Gallenblase | negativ |
| Nebenniere | |
| Nebennierenrinde | negativ |
| Nebennierenmark | negativ |
| Blase | negativ |
| Herz | negativ |
| Bauchspeicheldrüse | |
| Drüsengänge | positiv |
| Azini | negativ |
| Langerhans'sche Inseln | negativ |
-
Die beanspruchten Erkennungsmoleküle reagieren
positiv mit einer Vielzahl von Karzinomen. Die Daten in Tabelle
4 zeigen, dass die Core-1 spezifischen Erkennungsmoleküle einen
großen
Prozentsatz an Tumorpatienten einer Indikation erkennen, der von
Indikation zu Indikation unterschiedlich ist. Tabelle
4: Reaktion von humanem Tumorgewebe mit dem Core-1 spezifischen
Antikörper
mIgM-Karo4
| Gewebetyp | Reaktivität |
| Colonkarzinom | |
| primäres Karzinom | 31/52 |
| Lebermetastasen | 20/22 |
| Lungenkarzinom | |
| Großzelliges | 3/8 |
| Bronchoalveolar | 1/1 |
| Adenokarzinom | 6/6 |
| Blasenkarzinom | 5/9 |
| Magenkarzinom | |
| Intestinaler
Typ | 8/8 |
| Diffuseer
Typ | 3/3 |
| Prostatakarzinom | 9/9 |
| Mammakarzinom | |
| Intraductal/ductal | 8/10 |
| Schwach
differenziert | 2/5 |
| Muzinöses | 1/1 |
| Schilddrüsenkarzinom | 0/10 |
| Nierenkarzinom | |
| Klarzelliges | 4/9 |
| Transitionalzelliges | 2/5 |
| Zervikalkarzinom | 1/2 |
| Ovarialkarzinom | |
| Adenokarzinom | 2/2 |
| Endometrioide | 2/2 |
| Teratom | 2/2 |
| Glioblastom | 0/3 |
-
Für
die Entwicklung eines Maus-Tumormodells wurden verschiedene Xenotransplantate
untersucht. Bei den Xenotransplantaten handelt es sich um humanes
Kolonkarzinomgewebe, das auf Nacktmäusen mehrfach passagiert wurde. 8 zeigt beispielhaft eine
immunhistochemische Färbung
eines Xenotransplantat-Präparats
mit dem Core-1 spezifischen Antikörper cIgG-Karo4.
-
Für
die immunzytologischen Färbungen
wurde die Immunfluoreszenz eingesetzt. Dafür wurden die entsprechenden Zellen
auf Objektträger
angetrocknet und mit 5% Formaldehyd 10 min fixiert. Nach Blockierung
unspezifischer Bindungsstellen mit BSA (1% in PBS) wurden die Zellen
mit dem Primärantikörper inkubiert.
Anschließend
wurde 3 mal mit PBS gewaschen und mit dem entsprechenden fluoreszenz-markierten
Sekundärantikörper (anti-Maus
oder anti-human IgG bzw. IgM für
ganze Antikörper;
anti-Myc-Tag oder anti-His-Tag Antikörper für die single chain Antikörperfragmente)
inkubiert. Nach mehrmaligem Waschen mit PBS wurden die Zellen in
Mowiol eingebettet.
-
Es wurden verschiedene Zelllinien
mit Core-1 spezifischen Erkennungsmolekülen in der Immunfluoreszenz
getestet. Eine Reihe von Tumorzelllinien und auch einigen Leukämie-Zelllinien
reagieren positiv (Tab. 5 und 9).
-
Tabelle
5: Reaktivität
verschiedener Zelllinien mit den Core-1 spezifischen Antikörpern mIgM-Karo1
bzw. mIgM-Karo4
-
9 zeigt
beispielhaft eine Fluoreszenzmarkierung von KG-1 Zellen, einer akuten
myeloischen Leukämie-Zelllinie,
mit verschiedenen Antikörperkonstrukten,
einem murinen IgM und zwei scFv-Antikörpern mit unterschiedlicher
Linkerlänge
(SEQ ID NO. 95 mit 18 Aminosäuren
und SEQ ID NO. 104 mit einer Aminosäure als Linker). Alle drei
Konstrukte zeigen eine spezifische Färbung der Tumorzelllinie, wobei
das monovalente Antikörperfragment
SEQ ID NO. 95 das schwächste
Signal zeigt.
-
9. Chelatisierung und
radioaktive Markierung von Antikörpers
und Antikörperfragmenten
-
Durch Konjugation wurde an den Antikörper cIgG-Karo4
bzw. den Multibody mit der Sequenz SEQ ID NO. 104 ein Chelator kovalent
gebunden, der die Bindung eines Radiometalls ermöglicht. Als Chelatoren kamen
die kommerziellen Produkte der Firma Macrocyclics (Dallas, USA),
p-isothiocyanatobenzyldiethylenetriaminepentaacetic acid (p-SCN-Bz-DTPA)
und pisothiocyanatobenzyl -1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid
(p-SCN-Bz-DOTA) zum Einsatz. Beide Chelatoren eignen sich zur Kopplung
an Antikörper
zu deren Radioaktivmarkierung [Brechbiel et al., 1986; Kozak et
al., 1989; Stimmel et al., 1995].
-
Die Konjugation erfolgte durch Reaktion
der Isothiocyanatgruppe des Chelators mit einer freien ε-Aminogruppe der Aminosäure Lysin
am Antikörper.
Es entsteht eine kovalente N-C-Bindung zwischen Chelator und Antikörper.
-
Der gereinigte Antikörper bzw.
das gereinigte Antikörperfragment
muß zunächst in
Kopplungspuffer pH 8,7 umgepuffert werden. Hierzu wurde eine Ultrafiltration
in einer Filtrationshülse
(Centriprep YM50 (Amicon)) durchgeführt. Dies erfolgte durch mehrmalige
Verdünnung
mit 10-fachem Volumen und Filtration durch eine Membran mit definierter
Porengröße durch
Zentrifugation. Dadurch wurde PBS durch den alkalischen Kopplungspuffer
(0,05 M Natrium-Carbonat, 0,15 M Natriumchlorid, pH 8,7) ersetzt.
-
Die Chelatisierung wurde mit den
bifunktionellen Chelatoren p-SCN-Bz-DTPA-
bzw. p-SCN-Bz-DOTA durchgeführt.
Zur Chelatisierungsreaktion wurden Protein (1-10 mg/ml) in Kopplungspuffer
und eine Lösung des
Chelators von 1 mg/ml in 2% DMSO/Wasser so gemischt, dass ein molarer Überschuß des Chelators
gewährleistet
war. Es folgte eine Inkubation der Mischung von 1h bei 37°C. Anschließend wurde
nicht gebundener Chelator durch Ultrafiltration im gleichen Gefäß (Centriprep
YM50 (Amicon)) abgetrennt und wie oben beschrieben in den zur Radioaktivmarkierung
notwendigen Beladungspuffer auf pH 4,2 umgepuffert (0,15 M Natriumacetat,
0,15 M Natriumclorid, pH 4,2). Die Proteinkonzentration während und
nach diesem Schritt wurde wieder auf 1-10mg/ml mit Hilfe einer UV-Messung
bei 280nm eingestellt.
-
Es waren Bedingungen für die Chelatisierungsreaktion
zu finden, die eine Radiomarkierung des Antikörpers erlauben, ohne dessen
Bioaktivität
wesentlich zu mindern.
-
Der chelatisierte Antikörper wurde
mit einem Radiometall beladen, wodurch der Radio-Antikörper erzeugt
wurde. Zur Beladung wurden die Isotope 111Indium
und 90Yttrium verwendet. Beide haben chemisch
und physikochemisch vergleichbare Eigenschaften und werden durch
den Chelator als dreiwertige Ionen gebunden (111In3+, 90Y3+).
Der mit 111Indium markierte Antikörper ist
ein γ-Strahler
und wird in der Klinik zur individuellen Dosisfindung für den Patienten
verwendet, während 90Yttrium ein β-Strahler ist, der therapeutisch
zum Einsatz kommt. Die Halbwertzeiten betragen für 111In
67 Stunden und für 90Y 64 Stunden.
-
Zur Beladung wurde 111Indiumchlorid
der Firma NEN (Perkin Elmer, Belgien) verwendet. Die Lieferung des
Radiometalls erfolgt in salzsaurer Lösung. Diese 111InCl3 Lösung
wurde zunächst
kurzzeitig auf eine HCl-Konzentration von 1M gebracht. Anschließend wurde
mit 0,05M HCl auf eine spezifische Aktivität von 80-320 mCi/ml verdünnt und
davon ein Aliquot zum Einbau in den chelatisierten Antikörper verwendet,
wobei das zugegebene Volumen HCl-saurer 111InCl3-Lösung
gleich dem Volumen der vorgelegten Antikörperlösung im Kopplungspuffer pH
4,2 sein sollte, um die pH-Stabilität zu gewährleisten. Inkubationsdauer
war 1h bei 37°C mit
gelegentlichem vorsichtigem Mischen.
-
Im Anschluß daran wurde der Filtereinsatz
wieder in die Filtrationshülse
eingesetzt und wie oben beschrieben in Phosphatpuffer pH 7,2 mit
physiologischem Gehalt an Kochsalz umgepuffert. Dabei erfolgte eine Trennung
von hochmolekularem radioaktiv markiertem Antikörper und ungebundenem 111InCl3. Die Quantifizierung
des Einbaus von 111In in den chelatisierten
Antikörper
erfolgte dünnschichtchromatographisch.
Die Einbaurate des Radiometalls lag bei 70-99% der eingesetzten
Radioaktivität.
-
10. Nachweis des Core-1
positiven, sekretorischen MUC1 im Sandwich-ELISA
-
Core-1 positives, sekretorisches
MUC1 kann im Sandwich-ELISA nachgewiesen werden. Dabei dient ein
MUC1 spezifischer Antikörper
als Fänger-Antikörper von
MUCl und ein Core-1 spezifischer Antikörper zum Nachweis des Core-1
Antigens. Ein dritter Enzym- oder Fluoreszenz-gekoppelter Antikörper muss
zur Detektion des Zweitantikörpers
eingesetzt werden.
-
Als Beispiel wurden die Überstände zweier
Tumorzelllinien analysiert (K562 und T47D). Die Ergebnisse sind
in Tabelle 6 dargestellt. 105 Zellen pro
ml Zellkulturmedium wurden ausgesät, 4 Tage ohne Mediumwechsel
kultiviert, anschließend
ein Aliquot abgenommen und der Zellkulturüberstand durch Zentrifugation vom
Zellpellet getrennt. 50 μl
dieser Überstände wurden
unverdünnt
im ELISA eingesetzt. Der anti-MUC1-anti-Core-1-Sandwich-ELISA
wurde durchgeführt,
indem die Mikrotiterplatte mit dem Fänger-Antikörper (1 μg/ml) in PBS über Nacht
bei 4 °C
beschichtet wurde. – Es
wurden drei verschiedenen Konzentrationen des Antikörpers für die Beschichtung
getestet (1 μg/ml,
2 μg/ml
und 4 μg/ml).
Die Beschichtung mit 1 μg/ml
erwies sich im Sandwich ELISA als am empfindlichsten. – Anschließend wurden
die beschichteten Platten zweimal mit PBS gewaschen und 1,5 h in
5% BSA, 0,05% Tween 20 in PBS bei Raumtemperatur blockiert. Der
Blockierungspuffer wurde entfernt, die Platten erneut einmal mit
0,1% Tween 20 in PBS (Waschpuffer) gewaschen, die Proben dazugegeben
und 1,5 h bei Raumtemperatur inkubiert. Als Negativkontrollen wurden
das Zellkulturmedium oder 2% BSA in Waschpuffer (Verdünnungspuffer
für Zweitantikörper) verwendet.
Eine Positivkontrolle stand nicht zur Verfügung. Nach dreimaligem Waschen
erfolgte die Neuraminidase Behandlung in den dafür vorgesehenen Wells. Zu diesem
Zweck wurde die Neuraminidase-Lösung
(DADE Behring, Deutschland) in Immidazolpuffer (0,68 g Immidazol
, 0,19 g CaCl2 und 0,4 g NaCl in 100 ml
H2O, pH 6,8) 1:5 verdünnt und 50 μl/well 30 min bei 37°C inkubiert.
Als Kontrolle wurde der Imidazolpuffer ohne Neuraminidase-Lösung in
einem entsprechenden Well inkubiert. Anschließend wurden die Wells dreimal
gewaschen und der mIgM-Karo4
Antikörper
zum Nachweis des Core-1 Antigens in einer 1:500 Verdünnung in
2% BSA in Waschpuffer dazugegeben und eine weitere Stunde bei Raumtemperatur
inkubiert. Nach erneutem dreimaligen Waschen folgte die Zugabe eines
Peroxidasegekoppelten anti Maus IgM(μ) Antikörpers (Dianova) 1:5000 verdünnt in 2%
BSA in Waschpuffer und eine Inkubation von 1 h bei Raumtemperatur.
Abschließend
wurden die Platten zweimal in Waschpuffer und einmal in PBS gewaschen.
Die Färbereaktion
erfolgte in 25 mM Zitronensäure,
Phosphatpuffer pH 5,0 mit 0,04% H2O2 und 0,4 mg/ml o-Phenylendiamin (Sigma)
im Dunkeln bei Raumtemperatur. Die Farbreaktion wurde durch Zugabe
von 2,5 N Schwefelsäure
(Endkonzentration 0,07 N) gestoppt und im ELISA-Reader bei 492 nm
mit einem Referenzfilter von 620 nm vermessen.
-
Tabelle
6: Analyse von Core-1 positivem MUC1 in Kulturüberständen zweier Zelllinien mit
und ohne Neuraminidase Behandlung im Sandwich ELISA
-
Legende zu den Abbildungen
-
1a:
Sequenzen der Linker in den verschiedenen Multibody single chain
Antikörperfragmenten.
-
1b:
Klonierungsschema zur Herstellung von single chain Antikörperfragmenten
mit unterschiedlicher Linkerlänge.
-
2: Vektor
zur Klonierung und bakteriellen Expression von single chain Antikörperfragmenten.
-
3: Analyse
von Multibodies im scFv Format mit unterschiedlicher Linkerlänge im ELISA.
-
Multibodies mit den Aminosäuresequenzen
SEQ ID NO. 95, 96, 97, 98, 99, 100, 101, 103, 104 und 105 wurden
wie oben beschrieben in E.coli exprimiert und die Periplasmafraktionen
gewonnen. Als Antigen für den
ELISA Test wurde Asialoglykophorin, ein Core-1 tragendes Glykoprotein,
eingesetzt. Eine schrittweise Linkerverkürzung führt zu einer Erhöhung der
Bindung an Asialoglykophorin. Die besten Bindungseigenschaften zeigen
die Varianten mit der SEQ ID NO. 104 und 105. Diese multivalenten
Konstrukte im Dia/Triabody Format sind bevorzugte Ausführungsformen
der Erfindung.
-
4:
Vektorsystem zur Klonierung und eukaryontischen Expression von chimären Antikörpern im IgG1
oder IgM-Format.
-
5 und 6: Spezifitätsanalyse
im ELISA.
-
Als Antigene wurden verschiedene
Glykoproteine und Kohlenhydrat-PAA-Konjugate verwendet. Asialoglykophorin
[1]; Glykophorin [2]; Asialofetuine [3]; Galβ1-3GalNAcα1-OC3H6NH-PAA [4]; Galβ1-3GalNAcα1-p-OC6H4NH-PAA [5]; Galα1-3Ga1NAcα1-OC3H6NH-PAA
[6]; Galβ1-3GalNAcβ1-OC3H6NH-PAA [7]; Galα1-3GalNAcβ1-OC3H6NH-PAA [8]; Galβ1-3 (GlcNAcβ1-6) GalNAcα1-OC3H6NH-PAA [9]; GalNAcα1-OC3H6NH-PAA [10]; Neu5Acα2-3Galβ1-3GalNAcα1-OC3H6NH-PAA [11]; Galβ1-3 (Neu5Acα2-6)GalNAcα1-OC3H6NH-PAA [12]; GlcNAcβ1-2Galβ1-3GalNAcα1-OC3H6NH-PAA [13]; GlcNAcal-3Galβ1-3GalNAcα1-OC3H6NH-PAA [14]; GalNAcα1-3Galβ1-OC3H6NH-PAA [15]; und 3'-O-Su-Galβ1-3GalNAcα1-OC3H6NH-PAA [16]. Als
Kontrolle wurde BSA [17] verwendet. In 5 wurden zwei Antikörper im IgM-Format mit unterschiedlicher
CDR-Sequenz-Zusammensetzung eingesetzt. 6 zeigt das Spezifitätsmuster von drei humanisierten
Erkennungsmolekülen
im scFv-Format mit variierenden Gerüstsequnzen.
-
7:
Spezifische Bindung verschiedener bevorzugter Formate und Kombinationen
erfindungsgemäßer Erkennungsmoleküle im ELISA,
beispielhaft an den. Antigenen AGP, GP und/oder Core-1-PAA (Galβ1-3GalNAcα1-OC3H6NH-PAA).
-
8:
Immunhistochemische Färbung
von Xenotransplantat-Präparaten.
-
Humanes Colonkarzinomgewebe wurde
auf Nacktmäuse
transplantiert und nach Erreichen einer bestimmten Größe passagiert.
Das Tumorgewebe wurde eingebettet und geschnitten und für immunhistochemische
Färbungen
eingesetzt. In a) wurde das Gewebes mit cIgG-Karo4 als Primärantikörper und
einem anti-human Fcγ Antikörper – POD gekoppelt
als Sekundärantikörper markiert.
Die braune Färbung
kennzeichnet die Core-1-positiven Strukturen.
-
9:
Fluoreszenzmarkierung von Zellen der Tumorzelllinie KG-1 mit verschiedenen
Core-1 spezifischen Erkennungsmolekülen.
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
SEQUENZPROTOKOLL
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-