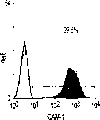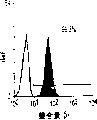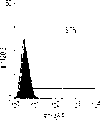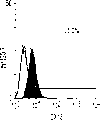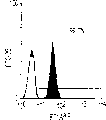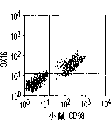CN1461341A - 肝祖先细胞克隆生长的方法 - Google Patents
肝祖先细胞克隆生长的方法 Download PDFInfo
- Publication number
- CN1461341A CN1461341A CN00820051A CN00820051A CN1461341A CN 1461341 A CN1461341 A CN 1461341A CN 00820051 A CN00820051 A CN 00820051A CN 00820051 A CN00820051 A CN 00820051A CN 1461341 A CN1461341 A CN 1461341A
- Authority
- CN
- China
- Prior art keywords
- cell
- progenitor cells
- hepatic progenitor
- liver
- offspring
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0607—Non-embryonic pluripotent stem cells, e.g. MASC
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/067—Hepatocytes
- C12N5/0672—Stem cells; Progenitor cells; Precursor cells; Oval cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2500/00—Specific components of cell culture medium
- C12N2500/05—Inorganic components
- C12N2500/10—Metals; Metal chelators
- C12N2500/20—Transition metals
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2500/00—Specific components of cell culture medium
- C12N2500/05—Inorganic components
- C12N2500/10—Metals; Metal chelators
- C12N2500/20—Transition metals
- C12N2500/24—Iron; Fe chelators; Transferrin
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2500/00—Specific components of cell culture medium
- C12N2500/05—Inorganic components
- C12N2500/10—Metals; Metal chelators
- C12N2500/20—Transition metals
- C12N2500/24—Iron; Fe chelators; Transferrin
- C12N2500/25—Insulin-transferrin; Insulin-transferrin-selenium
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2500/00—Specific components of cell culture medium
- C12N2500/30—Organic components
- C12N2500/36—Lipids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2500/00—Specific components of cell culture medium
- C12N2500/30—Organic components
- C12N2500/38—Vitamins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2500/00—Specific components of cell culture medium
- C12N2500/90—Serum-free medium, which may still contain naturally-sourced components
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/10—Growth factors
- C12N2501/11—Epidermal growth factor [EGF]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/30—Hormones
- C12N2501/33—Insulin
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/30—Hormones
- C12N2501/38—Hormones with nuclear receptors
- C12N2501/39—Steroid hormones
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2502/00—Coculture with; Conditioned medium produced by
- C12N2502/13—Coculture with; Conditioned medium produced by connective tissue cells; generic mesenchyme cells, e.g. so-called "embryonic fibroblasts"
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biomedical Technology (AREA)
- Wood Science & Technology (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Developmental Biology & Embryology (AREA)
- Gastroenterology & Hepatology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
开发了一种繁殖哺乳动物内胚层来源的祖先细胞如它们的肝祖先细胞、它们的后代或其混合物的方法,所述方法包括在培养基中在胚胎哺乳动物滋养细胞层上培养哺乳动物祖先细胞、它们的后代或其混合物。培养基可以补充一种或多种激素和其它生长剂。这些激素和其它生长剂可以包括胰岛素、地塞米松、转铁蛋白、烟酰胺、血清白蛋白、β-巯基乙醇、游离脂肪酸、CuSO4和H2SeO3。培养基也可以包括抗生素。重要地是,培养基不包括血清。本发明包括诱导祖先细胞分化为它们的成体结局的方法,如肝祖先细胞分别通过添加或除去表皮生长因子分化为肝细胞或胆细胞。产生哺乳动物祖先细胞的方法是有用的,其中这些祖先细胞可以随后在一个或多个如下方法中使用:生长和分化因子的鉴定,毒理研究、药物开发、抗菌剂研究或制备体外器官如生物人造肝脏。
Description
1.技术领域
本发明涉及哺乳动物肝祖先细胞克隆生长的新颖条件,包括多潜能细胞、干细胞和其它早期肝祖先细胞。尤其是,本发明涉及在协同培养中使用合成培养基和滋养细胞繁殖肝祖先细胞的方法。而且,本发明涉及用作滋养细胞且能够维持肝祖先细胞生长的细胞。
2.背景技术
在哺乳动物组织中识别多潜能祖细胞群对于临床和商业目的都是重要的,对理解发育过程和组织内环境平衡也是重要的。祖细胞群是基因治疗、细胞移植和生物人工器官组织工程的理想靶标(Millar,A.D.1992 Nature 357,455;Langer,R.和Vacanti,J.P.1993 Science260,920;Gage,F.H.1998 Nature 392,18)。
从对造血干细胞(Spangrude等人.1988 Science 241,58)、神经干细胞(Davis,A.A.,和Temple,S.1994 Nature 372,263;Stemple,D.L.,和Anderson,D.J.1992 Cell 71,973)和表皮干细胞(Jones,P.H.,和Watt,F.M.1993 Cell 73,713)的研究中,很容易地看到存在组织特异的、“决定的”干细胞或具有高度生长潜能和/或多种潜能的祖细胞,它们每一个都已经采用该组织适用的特定方法被克隆地识别。这些祖细胞被认为是负责正常的造血、神经和表皮组织内环境平衡和严重创伤后再生反应的细胞(Hall,P.A.,和Watt,F.M.1989 Development106,619)。
尽管肝脏通常是静止的组织不需快速的更新,但哺乳动物的成年肝脏在广泛的肝毒性损伤或部分肝切除后,具有巨大的恢复能力(Fishback,F.C.1929 Arch.Pathol.7,955);(Higgins,G.M.,和Anderson,R.M.1931 Arch.Pathol.12,186)。最近通过连续的移植实验检测得到的来自小鼠的数据已被阐明,提示成年实质细胞具有几乎无限的生长潜能(Overturf等人,1997 Am.J.Pathol.151,1273);(Rhim,J.A.等人,1994 Science 263,1149)。这些实验利用限制该能力的不均一肝细胞群来证实在成年实质细胞、成年实质细胞亚群和/或非实质细胞(即祖细胞)中观察到的生长潜能。此外,研究显示没有胆管上皮分化的证据,因为所用的宿主是白蛋白-尿激酶转基因的,或在另外的情况下是酪氨酸分解酶缺陷的;两种类型的宿主都具备选择肝细胞系的条件。因此,该实验不能检测双能细胞群。
数个组织学研究确定来自妊娠中期胚胎的早期肝细胞具有分化成胆管上皮以及成熟肝细胞的发育性双向潜能(Shiojiri,N.1997Microscopy Res.Tech.39,328-35)。肝脏发育始于腹侧前肠内胚层,在内胚层上皮与发生心脏的中胚层接触后即刻开始(Douarin,N.M.1975 Medical Biol.53,427);(Houssaint,E.1980 CellDiffer.9,269)。在小鼠,肝脏定型发生在第8胚胎日(E)。最初阶段的肝脏发育以在内胚层诱导血清白蛋白和甲胎蛋白mRNAs而显现,且在形态学改变之前(Gualdi,R.等人,1996 Genes Dev.10,1670)。在小鼠妊娠期的E9.5天,特化的细胞在那时增殖并以索状方式穿入原始横隔的间叶组织中,形成肝原基。尽管肝脏体积在那时显著地增加,但体积增加主要地是由于造血细胞,该细胞在小鼠E10天转移至胎肝(Houssaint,E.1981 Cell Differ.10,243),并影响肝细胞使之显示成极其扭曲和不规则的形状(Luzzatto,A.C.1981 Cell TissueRes.215,133)。有趣的是,最近来自基因定向突变小鼠的数据显示,许多基因的损伤在E12至E15期间引起致死性肝衰竭、凋亡和/或实质细胞坏死(Gunes,C.等人,1998 EMBO J.17,2846;Hilberg,F.等人,1993Nature 365,1791;Motoyama,J.等人,1997 Mech.Dev.66,27;Schmidt,C.等人,1995 Nature 373,699)。特别地,应激活化的级联(Ganiatsas,S.等人,1998.Proc.Natl.Acad.Sci.USA 95,6881;Nishina,H.等人,1999Development 126,505)或抗凋亡级联(Beg,A.等人,1995 Nature376,167;Li,Q.等人,1999 Science 284,321;Tanaka,M.等人,1999.Immunity 10,421)之一部分的基因破坏可以引起严重的肝发育损害,没有造血作用,尽管有广泛的失活基因表达。不清楚是否肝细胞对发育应激刺激固有地敏感,或是特定的胎肝微环境本身引起这种破坏性作用(Doi,T.S.等人,1999.Proc.Natl.Acad.Sci.USA 96,2994)。另一方面,成年肝脏的基本结构有赖于最初围绕门静脉的胆管上皮柱的出现(Shiojiri,N.1997 Microscopy Res.Tech.39,328)。免疫组织化学上,肝内胆管上皮细胞分化的第一个信号是表达胆管特异的细胞角蛋白(CK)。CK蛋白,即上皮细胞的胞浆中间丝(IF)蛋白,是由多基因家族编码的并以组织和分化特异的方式表达(Moll,R.等人,1982Cell 31,11)。CK19是最显著的胆管标记物之一,因为成年肝细胞完全不表达CK19,而成年胆管上皮细胞表达此蛋白。只有CK8和CK18从早期肝细胞到成年肝细胞均表达(Moll,R.等人,1982 Cell 31,11)。在大鼠发育的E15.5天,相对于小鼠的E14天,胆管前体细胞被CK18和CK8抗体均重染,一些胆管前体细胞表达CK19。随着发育的进程,成熟的胆管逐渐表达CK19外还表达CK7,并丧失白蛋白的表达(Shiojiri,N.等人,1991 Cancer Res.51,2611)。尽管早至E13天的大鼠肝细胞被认为是同质的群体,但仍然要看是否所有的早期肝细胞可以分化成胆管上皮细胞系,以及它们的结局是任何确定的。确定性种系标记研究,如采用逆转录酶病毒载体者,还没有对肝细胞进行,而且对于确定任何双能肝祖先细胞所必需的纯系生长条件尚未确定。
对于纯系生长分析,一个主要障碍是造血细胞的过度生长,这妨碍了观察肝细胞离体扩张的能力。因此,必须使用一个肝细胞群富集步骤。尽管能够在胎肝中分离造血细胞的表面标记物已经被详细研究(Dzierzak,E.等人,1998 Immunol.Today 19,228-36),但用于肝祖先细胞者仍然缺少详细说明,因为该研究仍处于初期阶段(Sigal,S.等人,1994 Hepatology 19,999)。因此,通常用于成体肝细胞的离体增殖条件可引起其去分化,并丧失组织特异的功能如表达白蛋白(Block,G.D.等人,1996 J.Cell Biol.132,1133)。只有在没有血清且有限定的激素、生长因子和/或某些细胞外基质成分的混合物存在的情况下培养的肝细胞中,合成组织特异的mRNAs和转录后完全调节组织特异基因的能力发生一些改善(Jefferson,D.M.等人,1984,Mol.Cell.Biol.4,1929;Enat R,等人,1984,81,1411)。但是,增殖的胎肝细胞在体内仍然表达这些血清蛋白。。在本领域还不清楚的是如何在体外维持和培养肝祖先细胞。对于鉴定维持肝祖先细胞离体扩张的条件而言,这是一个未满足的需要。同样地,对于体外集落形成分析(CFA),这也是一个未满足的需要,其中CFA用于定义刚刚从肝组织分离的肝祖先的集落生长潜能;克隆生长被定义为接种到培养物中的单细胞产生子细胞群的能力,这些子细胞群克隆自接种的细胞。其它人已经对集落生长进行了描述(Block,G.D.等人J.Cell Biol.1996,132,1133),包括在肝培养物中以高细胞浓度接种的紧密生长在一起的细胞的集合体;然而,在这些现有研究中描述的细胞集落不能进行传代培养,因此,按照此处的定义,它们不可克隆,只有有限的用途。
其它人已经对体外培养肝细胞做了一些尝试。Naughton等人的美国专利5,510,254请求保护依赖于生物相容性的但不是活的物质的三维框架的肝细胞培养。对于不需要人工构架的肝细胞培养条件,以及提供肝祖先细胞将被扩充且培养的条件,这是一个未满足的需要。此外,存在对于具有如下能力的克隆肝祖先的未满足的需要需要:双潜能分化能力,这是产生胆和肝细胞谱系的能力,和除了其它用途之外,用作生物人造肝脏组分的适用性,用于肝毒素试验和药物开发的适用性。
Naughton等人的美国专利5,559,022请求保护与黄色曙红(EosinY)结合的肝补充细胞,其中黄色曙红是用来对“补充细胞”进行特征描述的染色剂,但没有使用用于肝细胞的建立良好的标记物,也没有提供用于克隆扩张的方法,也没有提供用来分离活肝补充细胞的标记物。存在对于如下方法的未满足的需要,即教导如何分离且培养具有肝祖先所必需的许多特征的细胞的方法,这些特征包括至少一种特异性标记物的表达,和分化为肝细胞或胆细胞的潜能。也存在对于肝祖先克隆生长方法的未满足的需要。克隆生长是必需的,作为一个清楚且精确的多潜能肝祖先细胞的辨别和鉴定特征。
Ponting的美国专利5,405,772请求保护一种用于细胞生长的培养基。专利5,405,772需要使用3-30μg/ml胆固醇,5-30μg/ml核苷,和或者使用2-100μg/cm2 IV型胶原蛋白或者0.5-100μg/cm2纤维连接蛋白。存在对于对肝祖先细胞生长特异且最优的培养基的需求。
Kuri-Harcuch等人的美国专利4,914,032请求保护一种培养肝细胞的方法。与本发明相反,专利4,914,032或者没有教导肝祖先的培养,或者没有教导肝细胞的克隆生长条件。同样地,Kuri-Harcuch等人的美国专利5,030,105请求保护通过处理肝细胞培养物评价试剂的方法。存在对于克隆生长条件的未满足的需要,以便于可以用确定的细胞群来试验且用于肝祖先细胞的培养方法。
Naughton等人的美国专利5,858,721请求保护基质细胞的转染。然而,专利5,858,721受到需要生物相容性的且非生活物质的框架的限制。相反,在本发明中存在对于不需要合成的网状结构的生长条件的未填充的需求。
本发明者认识到,培养成熟肝细胞如肝细胞,而非更有用的肝祖先细胞,是不完全的。他们仔细地确定了肝祖先细胞的分离参数和纯系生长需要的条件。祖细胞和选择、培养祖细胞的方法有许多用途,包括在治疗肝衰竭患者的医疗实践中的应用、在毒物评价中的应用和在药物评价中的应用。
Reid等人的美国专利5,576,207和5,789,246教导了对滋养细胞和含有激素的合成培养基的需求。这些现有研究都主张使用胚胎肝基质细胞,组合使用确定的胞外基质基层,和一种不含血清的、含激素的合成培养基,作为扩张肝祖先的条件。然而,所用的合成培养基比本发明所用的培养基复杂的多;细胞被铺平板于纯化的基质基层(IV型胶原蛋白和层粘连蛋白)上,而此处它们被直接铺平板于滋养细胞(该滋养细胞提供所述基质)上;且胚胎基质细胞被作为胚胎肝脏的原始培养物制备,不是作为细胞系建立。通过使用胚胎基质细胞系,滋养细胞由一个更加简单的、更加实用的且更易于重现的支持这些细胞的方式而提供。而且,可以合理地假设,STO滋养细胞将不会严格地仅支持肝祖先细胞,而是可以用于多个组织类型的祖先细胞。现有专利中,肝祖先细胞培养物是以高细胞浓度接种的,且它们的扩张以集落形成被观察到,这意味着细胞的集合被诱导以繁殖,而不是细胞的克隆。
3.发明概述
本发明涉及一种增殖祖先细胞、它们的后代或其混合物的方法。尤其是,本发明涉及一种增殖内胚层来源的祖先细胞、它们的后代或其混合物的方法。这些细胞来源于内胚层组织。然后这些内胚层来源的祖先细胞、它们的后代或其混合物在培养基中的含滋养细胞的层上培养。这些祖先细胞、它们的后代或其混合物可以是脊椎动物细胞。这些祖先细胞、它们的后代或其混合物可以表达细胞间粘附分子(ICAM)或ICAM-1阳性和经典的组织相容性抗原(MHC)I类抗原阴性的表现型。经典的MHC I类抗原也称作MHC Ia类抗原。
本发明也涉及一种培养肝干细胞和其它祖先细胞的方法,使用了一种不含血清的、含激素的合成培养基和滋养细胞。而且,本发明涉及一种培养祖先细胞的后代,或祖先细胞和祖先细胞后代的组合的方法。优选地,祖先细胞是肝祖先细胞。同样地,本发明涉及一种用特定培养条件克隆肝多潜能细胞的方法。优选地,本发明涉及一种克隆肝多潜能祖先细胞的方法。肝多潜能祖先细胞可以来源于任何无脊椎动物或脊椎动物种类,更优选地来自哺乳动物。甚至更优选地,肝多潜能祖先细胞来源于人、灵长类动物、猪、狗、大鼠、兔子或小鼠。最优选地,多潜能祖先细胞来源于人。本发明教导了肝祖先细胞和它们的后代的离体扩张所需要的特定培养条件。本发明也教导了用胚胎滋养细胞,如STO小鼠胚胎细胞,作为肝祖先细胞的滋养细胞。滋养细胞是与本发明所教导的新颖的不含血清的、含激素的合成培养基(HDM)组合使用的。该组合可以使发明人从E15大鼠肝脏建立各种大鼠胎儿肝细胞系,而不会发生这些细胞的恶性转化。
而且,本发明涉及克隆滋养细胞的方法,所述滋养细胞可以维持肝祖先细胞和它们的后代的繁殖。
本发明也涉及特定细胞系,当用作滋养细胞时,所述细胞系可以支持肝祖先细胞生长。
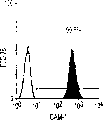
本发明还涉及克隆肝祖先细胞的方法。本发明教导了,使用肝细胞系和HDM-STO协同培养系统开发体外集落形成分析(CFA),以定义新鲜分离的肝祖先细胞的克隆生长潜能。当CFA与特定抗原轮廓纯化的细胞结合时,它揭示出双潜能肝祖先细胞。例如,来自E13大鼠肝脏且具有高生长潜能的祖先细胞,在小鼠中相当于E11.5,与经典MHC I类(RT1A1)-,OX18(pan-MHC I类)dull和细胞间粘附分子1(ICAM-1)+具有相同的表型。
本发明还涉及能维持克隆肝细胞生长的培养基。该培养基的特色是具有好几种特定激素和养分,且不存在血清。
仍然进一步,本发明涉及在含有滋养细胞生物合成产物的培养基中培养肝祖先细胞。
本发明进一步涉及诱导肝细胞分化的方法,包括肝细胞和胆细胞表现型的产生。表皮生长因子(EGF)在本发明中被教导,不仅影响祖先细胞集落的生长,而且影响它们作为肝细胞或作为胆上皮细胞的命运。
4.附图简述
图1A-1C是来自15天胚胎大鼠肝脏的肝细胞系的特征。
图2A-2F是在滋养细胞上的集落形成试验。
图3A-3X是成体肝细胞的各种肝细胞系上,大鼠细胞表面抗原的表达。
图4A1-4D4描绘了E13胚胎大鼠肝脏的表现型分析。
图5A-5D是在没有和存在EGF的情况下,肝细胞集落的特征。
图6A-6B描绘了在RT1A1-肝细胞上诱导CK19的表达。
图7是在STO5滋养细胞上肝细胞集落形成的图解说明。
5.优选实施方案的详细说明
本发明是一种繁殖方法和干细胞的用途。多种组织是祖先细胞的适当来源,包括外胚层、中胚层和内胚层来源的组织。外胚层组织可以包括皮肤组织、脑组织和其它神经组织。中胚层组织可以包括肌肉、血液和造血系统。内胚层组织可以包括与肠道、胃、胰腺,甲状腺和消化系统相关的腺体。尤其是,本发明是一种肝干细胞和其它肝祖先细胞的繁殖方法。该方法涉及将分离的肝干细胞和/或肝祖先细胞和/或它们的后代的群暴露于能维持克隆生长的生长条件下,也就是,以非常低的细胞浓度生长。在一个优选实施方案中,该方法涉及使用一种不含血清的、含激素的合成培养基来支持肝祖先细胞在滋养细胞层上的增殖。滋养细胞的功能是多方面的,包括提供养分、提供附着面和将肝祖先细胞的存活、生长和/或分化所必需的一些生长因子和胞外基质成分分泌到培养基中。在另一个优选实施方案中,该方法涉及选择能维持肝干细胞和肝祖先细胞生长的细胞。滋养细胞可以来自爬行动物、鸟、甲壳动物、鱼、环节动物、软体动物、线虫、昆虫或哺乳动物,优选来自人。优选地,滋养细胞来自胚胎组织。而且优选地,滋养细胞来自胚胎组织。而且优选地,滋养细胞可以来自胚胎肝组织。另外,滋养细胞可以被遗传修饰。仍然在一个更加优选的实施方案中,该方法涉及克隆那些最优地维持肝细胞的滋养细胞。
任何分离肝干细胞和肝祖先细胞的方法是可以接受的,包括通过基于亲和力的相互作用,如亲和淘选、结合补体的免疫手术法,通过流式细胞仪,通过离心淘析,通过差速离心等等。分离的肝干细胞和祖先细胞有能力表达一些或全部表现型标记物(经典的MHC I-类,ICAM-1+,OX18dull,甲胎蛋白+,或白蛋白+)。本发明的另一个实施方案是肝祖先细胞在集落中表现的生长模式的特征在于堆积的细胞形成为集合、集落或簇。
本发明的一个优选实施方案是,肝细胞可以选择性地在不含血清的、含激素的合成培养基(HDM)中生长。
HDM组合物包括一种营养培养基,包括但不限于,Dulbecco改良Eagle培养基和Ham F12的混合物,该混合物中加入了如下成分:高达大约40ng/ml EGF,高达大约5-10μg/ml胰岛素,高达大约10-6M地塞米松或其它糖皮质激素,高达大约10μg/ml铁饱和的转铁蛋白,高达大约5×10-2M烟酰胺,高达大约2%牛血清白蛋白,高达大约5×10-4M2-巯基乙醇或等效的还原剂,高达大约8μeq/l游离脂肪酸,高达大约2×10-2M谷氨酰胺,高达大约1×10-6M CuSO4,高达大约3×10-8MH2SeO3,以及任选的抗生素。抗生素可以包括青霉素、链霉素、庆大霉素和其它本领域的普通抗生素,以及它们的组合。本技术领域的熟练技术人员将了解到,其它营养培养基,如Ham F-10,培养基199,或包括MCDB 151和MCDB 302在内的MCDB系列中的一种,在最小量测试后可以被用来取代DMEM/F12。细胞扩张的最低条件是在不存在任何激素的情况下使用滋养细胞;上述列出的最关键的激素要求是糖皮质激素、胰岛素、转铁蛋白和EGF,构成用于祖先细胞扩张的严格的激素促分裂原。可以添加其它激素因子,且它们可以具有次生生长效应,但不能取代上述列出的关键要求。同样地,在激素组成中作一些变化也在本发明的范围内,如本技术领域的普通技术人员可以完成的变化。
优选的范围包括10-50ng/ml EGF,2-10μg/ml胰岛素,5×10-7M-5×10-6M地塞米松(9α-氟-16α-甲基-脱氢皮质甾醇),5-20μg/ml铁饱和转铁蛋白,2-8×10-3M烟酰胺,0.05-0.5%血清白蛋白,2-8×10-5M2-巯基乙醇,5-10μeq游离脂肪酸混合物,1-3×10-3M谷氨酰胺,0.5-2×10-6M CuSO4,1-5×i0-8M H2SeO3,1-5μm棕榈酸,0.1-0.4μm棕榈油酸,0.5-1.2μm硬脂酸,0.5-2μm油酸,1-5μm亚油酸,和0.2-0.8μm亚麻酸。
本发明的不含血清的、含激素的合成培养基适合于肝细胞的克隆生长。该HDM含有一种基础培养基,所述基础培养基可以是多种选项中的任一种,如Dulbecco改良Eagle培养基(DME),Ham F12,RPMI 1640,Williams E培养基,等等。一个优选的实施方案是Dulbecco改良Eagle培养基和Ham F12的1∶1混合物(DMEM/F12,例如来自GIBCO/BRL,GrandIsland,NY)。基础培养基含有优选浓度为10ng/ml的表皮生长因子EGF(例如来自Collaborative Biomedical Products),优选浓度为5μg/ml的胰岛素(例如来自Sigma),10-6M地塞米松(例如来自Sigma),10μg/ml铁饱和转铁蛋白(Sigma),4.4×10-3M烟酰胺(例如来自Sigma),0.2%血清白蛋白(例如来自Sigma),5×10-5M 2-巯基乙醇(例如来自Sigma),7.6μeq/l游离脂肪酸混合物(2.4μM棕榈酸,0.21μM棕榈油酸,0.88μM硬脂酸,1μM油酸,2.7μM亚油酸,和0.43μM亚麻酸),2×10-3M谷氨酰胺(例如来自GIBCO/BRL),1×10-6MCuSO4,3×10-8M H2SeO3,和抗生素。滋养细胞分泌的生长因子包括但不限于,胰岛素样生长因子(IGF),白细胞介素(IL)-6家族,肝细胞生长因子(HGF)和成纤维细胞生长因子(FGF),它们可以被加入到培养基中来增强滋养效应,但是当上述生长因子单独加入或以各种组合加入时还没有发现取代滋养效应,这意味着滋养细胞在产生其它仍然未鉴定出的信号,这些信号是单独需要的或与这些生长因子的组合是需要的。
本发明的仍然又一个实施方案是,肝祖先细胞是从单祖先细胞繁殖的,也就是说,这些细胞是克隆的。在集落中培养细胞不一定等于克隆生长,所述克隆生长被隐含或明确地定义为来源于单细胞的细胞繁殖。本技术领域已知的几种克隆方法中的任一种是合适的,包括将祖先细胞稀释为每孔细胞培养板孔中一个细胞,或更少,该方法被称作有限稀释。类似地可以用克隆环克隆祖先细胞,是通过选择性切除,通过在微粒上稀释培养物,通过用流式细胞仪进行单细胞分选,通过用微量移液管或光学镊子挑选个体细胞,以及通过琼脂进行的。
本发明的仍然又一个实施方案是,许多克隆的祖先细胞是可以有丝分裂的。优选地,祖先细胞能有丝分裂至少一个周期,甚至更优选地祖先细胞能分裂至少10个周期。
本发明的仍然又一个实施方案是,肝祖先细胞和它们的后代是在用滋养细胞的代谢产物和生物合成产物补充的培养基中繁殖的。补充可以采取条件培养基的形式,即,先用活滋养细胞温育的培养基。优选地,补充可以采取从滋养细胞条件培养基中分离出下述因子的形式,所述因子包括维持且增强肝祖先细胞和它们的后代生长的蛋白质、肽、脂质、糖类和代谢调节剂。蛋白质可以包括胞外基质的可溶和不可溶成分和生长因子,包括表皮生长因子和胰岛素样生长因子。
进一步优选地,肝细胞可以选择性地在使用了滋养细胞层的培养基中培养,在该培养基中那些滋养细胞是胚胎细胞或成体细胞或其它合适的细胞。在一个实施方案中,滋养细胞是基质细胞或成纤维细胞。成纤维细胞或其它合适的细胞可以被基因修饰,例如通过转染。优选地,成纤维细胞或其它合适的细胞,可以是人、非人灵长类动物、猪、狗、兔子、大鼠或小鼠中胚层细胞,且其它哺乳动物和鸟类中胚层细胞也是合适的。而且,成纤维细胞可以被克隆且选择支持肝祖先细胞的能力。
本发明的一个优选实施方案是,分离的肝祖先细胞可以通过选择性应用或者不存在表皮生长因子(EGF)或其它分化信号被定型为肝细胞或胆细胞谱系。
本发明的一个仍然更优选的实施方案是,分离的干细胞和其它肝祖先细胞可以被用作生物人造肝脏的成分,所述生物人造肝脏可以被用作体外肝脏辅助装置。本发明的一个仍然更优选的实施方案是,含有分离的肝祖先细胞和它们的后代的生物人造肝脏可以被用来支持患有肝功能失常或衰竭的病人的生命。6.实施例
下述实施例是本发明的例证性说明,但本发明绝不限于这些特定实施例。本技术领域的普通技术人员在这些实施例中将发现完成本发明的方法。本技术领域的普通技术人员将认识到大量落入本发明范围的可选实施方案。
6.1肝干细胞和肝祖先细胞的制备和分析
大鼠。从Charles River Breeding Laboratory(Wilmington,MA)获得怀孕的Fisher 344大鼠。为同步妊娠,动物在下午放在一起,观察到栓子的早晨被指定为0天。雄性Fisher 344大鼠(200-250g)被用于成体肝细胞来源。
建立肝细胞系。制备妊娠15天的胎肝。通过用0.05%胰蛋白酶和0.5mM EDTA或10单位/ml嗜热菌蛋白酶(Sigma,St.Louis,MO)和100单位/ml脱氧核糖核酸酶I(Sigma)在37℃孵育肝脏获得了单细胞悬液。细胞铺在Ficoll-paque(Pharmacia Biotech,Uppsala,Sweden)上,以450g进行梯度密度离心15min。将底部组分的细胞接种进组织培养皿中,对th1120-3和rter6或rhe14321,培养皿分别用17mg/ml IV型胶原蛋白(Collaborative Biomedical Products,Bedford,MA)或12μg/ml层粘连蛋白(Collaborative Biomedical Products)被覆。无血清激素限定培养基,HDM,是Dulbecco改良Eagle培养基和Ham F12(DMEM/F12,GIBCO/BRL,Grand Island,NY)的1∶1混合物,其中添加了20ng/ml EGF(Collaborative Biomedical Products)、5μg/ml胰岛素(Sigma)、10-7M地塞米松(Sigma)、10μg/ml铁饱和的转铁蛋白(Sigma)、4.4×10-3M烟酰胺、0.2%牛血清白蛋白(Sigma)、5×10-5M 2-巯基乙醇(Sigma)、7.6μeq/l游离脂肪酸、2×10-3M谷氨酰胺(GIBCO/BRL)、1×10-6M CuSO4、3×10-8M H2SeO3和抗生素。给出的每个浓度是培养基中的终浓度。培养4周后,胰蛋白酶消化的细胞在滋养层上培养,滋养细胞是丝裂霉素C处理的STO小鼠胚胎成纤维细胞系(American Type Culture Collection,Rockville MD)。Th1120-3、rter6和rhel4321是从胎肝细胞的三个独立标本中克隆的并用HDM保存在STO滋养细胞上。在细胞系建立后,所有细胞培养物的EGF浓度减至10ng/ml。
细胞粘附试验。用0.3至10μg/ml的纤维连接蛋白(Collaborative Biomedical Products)、层粘连蛋白和IV型胶原包被的96孔微滴板(Corning,Cambridge,MA)评价细胞与其的粘附。通过200g 15min的Percoll(Pharmacia Biotech)梯度密度离心移除STO细胞后,3×104的肝细胞系、th1120-3、rter6和rhel4321在每孔内用HDM培养10小时。冲洗两次移除飘浮细胞后,添加含有四唑盐WST-1(Boehringer Mannheim,Indianapolis,IN)的新鲜培养基以检测变化的粘附细胞的数量。4小时后,根据生产厂商的方案测定吸光率。
STO亚系。来自ATCC的100个亲代STO细胞,在100mm培养皿中,用含10%热灭活胎牛血清、2×10-3M谷氨酰胺、5×10-5M 2-巯基乙醇和抗生素补充的DMEM/F12,培养7天。选择4个亚克隆以根据细胞形态和生长速度进一步鉴定。尽管在4个亚克隆中进行了rter6的CFA,其中之一,STO6,在丝裂霉素C处理后不再与培养板附着。用Dr.J.M.Adama,The Walter and Eliza Hall Institute of MedicalResearch惠赠的pEF-Hlx-MClneo或pEF-MClneo转染一个亚克隆STO5。用DOSPER脂质体转染试剂(Boehringer Mannheim)在Nde I位点向细胞内导入线性质粒。G418选择后,分离6个克隆。三个克隆的每一个都用CFA分析。
集落的免疫组化染色。培养板在甲醇-丙酮(1∶1)中室温固定2min,冲洗并用含20%山羊血清(GIBCO/BRL)的Hanks平衡盐溶液(HBSS)4℃阻断。对甲胎蛋白和白蛋白的双免疫组化,培养板用抗大鼠白蛋白抗体(ICN Biomedicals,Costa Mesa,CA)孵育,接着用得克萨斯红结合的抗兔IgG(Vector laboratories,Burlingame,CA)和FITC结合的抗大鼠甲胎蛋白多克隆抗体(NordicImmunology,Tilburg,Netherlands)孵育。为双标记白蛋白和CK19,抗CK19单克隆抗体(Amersham,Buckinghamshire,England)和FITC结合的抗小鼠IgG(Caltag,Burlingame,CA)被用来代替抗甲胎蛋白抗体。
E13胎肝的游离。胎肝被切碎,置入冰冷的含10mM HEPES、0.8mMMgSO4和1mM EGTA(pH7.4)的无Ca++HBSS中。肝脏用0.2%IV型胶原酶(Sigma)和16.5单位/ml嗜热菌蛋白酶(Sigma)的HBSS溶液粉碎,HBSS用10mM HEPES、0.8mM MgSO4和1mM CaCl2制备。在37℃孵育10min后,细胞悬液用0.025%胰蛋白酶和2.5mM EDTA(Sigma)消化10min。然后,通过添加1mg/ml胰蛋白酶抑制剂(Sigma)抑制胰蛋白酶。最终,用200单位/ml脱氧核糖核酸酶I(Sigma)处理细胞。在所有实验中,每个肝脏获得了3-5×105个细胞。
成体肝细胞的分离。进行两步肝灌注法分离肝细胞。灌注后,以50g离心细胞1min两次以浓缩大的实质细胞。用台盼蓝排除法检测细胞活力>90%。
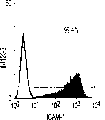
流式细胞仪分析。细胞在FACScan(Becton-Dickinson,MountainView,CA)上分析,并用Moflow流式细胞仪(Cytomation,FortCollins,CO)分类。来自E13胎肝的细胞悬液用含20%山羊血清(GIBCO/BRL)和1%硬骨鱼明胶(Sigma)的HBSS在冰上孵育,以防止非特异的抗体结合。冲洗后,细胞用FITC结合的抗大鼠RT1Aa,b,l抗体B5(Pharmingen,San Diego,CA)和PE结合的抗大鼠ICAM-1抗体1A29(Pharmingen)重悬浮。在一些实验中,细胞用生物素化抗大鼠单态MHC I类抗体OX18(Pharmingen)染色,然后用抗生物素蛋白链菌素-红670(GIBCO/BRL)第二次染色以进行三重染色。所有染色都用冰冷的含10mM HEPES、0.8mM MgSO4、0.2mM EGTA和0.2%BSA(pH7.4)的无Ca++HBSS进行。建立的三个肝细胞系被胰蛋白酶化,并通过Percoll密度梯度离心分馏以去除滋养细胞。大鼠肝癌细胞系FTO-2B和大鼠肝上皮细胞系WB-F344以及成体肝细胞被染色,以与胎肝细胞系比较。细胞系分别由Dr.R.E.K.Fournier,Fred Hutchinson CancerResearch Center,Seattle,WA和Dr.M.-S.Tsao,University of NorthCarolina,Chapel Hill,NC惠赠。细胞用FITC结合的B5、OX18,PE结合的1A29或抗FITC结合的大鼠整合素β1抗体Ha2/5(Pharmingen)阻断和染色。FITC结合的抗小鼠IgG被用于OX18。三个胎肝细胞系的细胞悬液用生物素化抗小鼠CD98染色,随后用抗生物素蛋白链菌素-红670以及抗大鼠单克隆抗体(moAb)二次染色以圈定出小鼠细胞群。
各种抗原以不同的相对数量由细胞进行表达。在实际应用中,特定抗原的表达水平可以是零表达、低水平表达、对于许多抗原来说的正常或常规的表达水平以及高表达水平。在该用法中,术语“低”可以与弱或微弱交换使用。也可以对表达水平进行更详细的描述,但这四个表达水平可以满足许多目的。应该清楚,抗原表达的测量,例如通过流式细胞仪,提供了一个连续范围的抗原表达测定值。
肝细胞系、分选的细胞和成体肝细胞的CFA。肝细胞系以每9.6cm2500细胞分三份铺于丝裂霉素C处理的STO滋养细胞层上,使用与维持每个细胞系相同的HDM。在铺板之前,细胞被胰蛋白酶消化,并通过Percoll密度梯度离心分馏以去除滋养细胞。培养物孵育10至14天,每隔一天换一次培养基。然后进行甲胎蛋白和白蛋白的双重免疫荧光染色。通过集落形态,P或F型,以及甲胎蛋白和白蛋白的表达分析集落,每孔100个集落。用Diff-Quick(Baxter,McGaw Park,IL)染色集落以计算每孔的集落数。在初步分选的细胞和成体肝细胞的CFA中,铺置的细胞数量按所描述的进行改变。作为另一个较小的修改,培养时间延长到14至17天之间,且地塞米松的浓度增至10-6M。所有其它的步骤如上进行。在成体肝细胞的CFA中,少量肝细胞块没有在制备后从细胞悬液中去除。因此,可能从细胞块中产生不确定数量的集落。对分选细胞上胆管分化的CFA,在存在或缺少EGF的每个培养物中,在第5天进行集落的白蛋白和CK19双重免疫荧光染色。在培养的第5天,超过一个CK19+细胞的任何集落被计算为CK19+集落。在第10和15天,含有多簇两个CK19+细胞或一簇超过三个CK19+细胞的集落被计算为CK19+集落。每孔大约计算100个集落。每个点代表来自三重染色培养物的均数±标准差。
6.2用激素限定培养基使用小鼠胚胎细胞滋养层产生和鉴定大鼠胎肝细胞系
尝试对大鼠E15肝细胞进行单纯长期培养以观察胎肝细胞能够体外维持和扩张产生后代的时间。经过梯度密度离心取出造血单核细胞后,胎肝细胞在被覆IV型胶原或层粘连蛋白的培养皿中用HDM培养(见实施例6.1)。细胞良好地存活4周以上。但在IV型胶原或层粘连蛋白被覆的新培养皿上继代培养并不能继续扩张。当丝裂霉素C处理的STO胚胎小鼠成纤维细胞系被用作继代培养的滋养层时,可生长出许多细胞集落。从4个独立的实验中最终建立了几个稳定的肝细胞系。
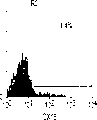
在克隆细胞系之前,在连续生长的细胞群中进行甲胎蛋白和白蛋白的免疫组织化学分析。两种蛋白,甲胎蛋白和白蛋白被用作标记物来证实这些细胞群来自肝细胞系。有形成细胞团趋势的细胞群,称为P-集落,具有强烈表达的甲胎蛋白和白蛋白,而另一个集落则产生扁平的单层,称为F-集落,甲胎蛋白表达减少,不表达白蛋白。胚胎小鼠成纤维细胞,STO,未显示对两种抗体的任何反应性。为了进一步分析,根据P型或F型集落的形态学标准从不同的实验中选择出三个克隆肝细胞系。Rhe14321(图1a)主要由成堆的小细胞组成,P型集落,而th1120-3(图1c)则仅形成扁平单层的F型集落。Rter6(图1b)是这两种类型的中间表现型。有趣的是,rter6的不均一性在经过扁平集落的三轮连续克隆后仍然可观察到。为了观察来自rhe14321和rter6中单个细胞的集落的不均一性,细胞在STO成纤维细胞上,以每9.6cm2(6孔板的一个孔)500个细胞的密度培养10至14天。然后根据其形态学和甲胎蛋白和白蛋白的表达来确定集落的特性。图2a、图2b、图2c、图2d、图2e和图2f显示了结果。在细胞系rhe14321(图2b)和rter6(图2c)中以及克隆前的初始细胞群中(图2a),几乎所有的P型集落强烈地表达甲胎蛋白,而F型集落细胞则不表达。而且,甲胎蛋白和白蛋白的强烈表达仅在P型集落中观察到。克隆肝细胞系的形态学差异与P型集落的百分比相关(图2b和图2c)。在rter6和rhe14321的CFA中P型集落的百分比分别为33.3%(±8.6%SD)和65.7%(±4.0%SD)。计数每孔的总集落数目以计算纯系生长的效率(集落效率)。rter6和rhe14321的效率分别为45.7%(±1.3%SD)和36.4%(±1.1%SD)。th1120-3细胞沿着其外侧缘互相紧密贴附,使制备单细胞悬液很困难。但是,th1120-3细胞并不产生堆积的集落。
下一步,检测每种细胞系粘附细胞外基质(ECM)特定成分的偏嗜,因为小鼠肝细胞与这些ECM蛋白如层粘连蛋白、IV型胶原和纤维连接蛋白的粘附在不同发育期中是改变的。而IV型胶原在th1120-3(图1c)的贴附中是最有效的,类似于在成体肝细胞中的发现,而对rter6(图1b)和rhe14321(图1a)的效果次之。层粘连蛋白对于rth14321的贴附是最有效的支持物(图1a)。这种偏嗜类似于小鼠胎肝细胞的原代培养。总之,甲胎蛋白和白蛋白在P型集落中的保守表达,以及rth14321与层粘连蛋白的优先粘附,表明产生P型集落的细胞群与肝脏祖细胞更确实地相关。
6.3为集落形成实验分离STO亚克隆:肝脏祖细胞实验
为了形成CFA系统以鉴定具有高度生长潜能的双能肝脏祖细胞,培养系统必须能够在克隆接种密度下支持细胞扩张,并保留重要的原始肝脏功能。白蛋白和甲胎蛋白是早期肝脏发育的最显著标记物中的两个。P型集落的优化培养条件应该是最佳的,因为P型,但不是F型集落在纯系扩张过程中维持甲胎蛋白和白蛋白的表达。因此,就其支持rter6的P型集落对STO亚克隆进行了比较。这些克隆中的一个,STO5,较任何其他亚系和亲代细胞系更支持P型集落形成(图2d)。Rhe14321的CFA也证实了STO5较亲代STO是更有效的滋养层(图2e)。小鼠H1x基因产物,在来自E10.5的内衬消化道的间充质细胞中表达,对胎肝细胞扩张是重要的。尽管H1x基因的mRNA表达在所有STO亚克隆中被分析,但在亚克隆间其表达没有显著的差异(数据未显示)。而且,在STO5中,小鼠H1x的稳定转染体并不引起集落形成实验的改善(图2f)。但是转染体中的一个克隆被用来进行进一步实验,因为该转染体在相对高的代数时,更稳定地持久维持STO5的原始形态学。
6.4采用表面抗原标记物和集落形成实验从E13胎肝中鉴定肝脏祖细胞
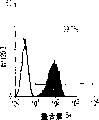
肝细胞生成和大量的血细胞生成可同时存在于胎肝中。到目前为止,血细胞生成祖细胞的抗原性全貌已经被广泛的分析,而对于早期肝脏祖细胞的研究仍然处于起步阶段。肝脏细胞的抗原性全貌可采用在本研究中建立的三种肝细胞系来进行分析,它们是成体肝癌细胞系(FTO-2B),来自成年大鼠肝脏的上皮细胞系(WB-F344),和新鲜分离的成体肝细胞。与FTO-2B,WB-F344和成体细胞相比,最不成熟的胎肝细胞系,rhe14321的表达图谱是非常独特的,因为它没有经典的MHC I类(RT1A1)的表达(图3a-3x)。细胞系th1120-3(图3i-31)在RT1A1,OX18(pan-MHC I类)和ICAM-1的表达图谱上类似于rhe14321(图3a-3d),而rter6(图3e-3h)则具有非常高的RT1A1和OX18的表达(图3)。另外,来自一个不同实验中的另一个细胞系,与rhe14321具有相同的形态学,也是RT1A1-,OX18dull,和ICAM-1+。整合素b1的表达在所有细胞系中是相似的,而RT1Aa,b,l和ICAM-1的表达图谱在它们中则是独特的。成体肝细胞的抗原性全貌是RT1A1+,OX18+和ICAM-1+。因此,在成年大鼠中,所有的骨髓细胞除了成熟的红细胞外都强烈的表达MHCI类分子,胎肝细胞群可根据MHC I类的表达从造血细胞群中分离出来。来自大鼠E13肝脏的细胞悬液用抗RT1A1和ICAM-1抗体进行染色。图4a显示了RT1A1和ICAM-1的双色染色图谱。为了确定哪个组分中含有肝细胞群,5个组分通过荧光活化的细胞分选进行分离,然后通过CFA选择纯系生长潜能。图4b代表了经过分选后5个组分重新分选的结果。肝细胞集落,通过白蛋白和甲胎蛋白的表达来确定,在形态学上也是可以区分的,可以对每孔中肝细胞集落的数目进行计数。大多数肝细胞集落可在圈定RT1A1dull和ICAM-1+(表1,图4b圈定2)中被检测出来,P型集落的频率为75.6%(±4.9%SD)。圈定1显示了更少数目的集落,其他的片段含有可忽略数目的具有集落形成能力的细胞。在圈定1和2中,甲胎蛋白和白蛋白两者的表达可在所有肝细胞集落中被证实。来自圈定2细胞的一些集落较其他的更大。为了详细研究肝细胞上MHC I类的表达,用RT1A1,ICAM-1,和OX18的三色染色进行侧向散射(SSC)作为另一个参数来进行细胞分级分离。侧向散射(SSC),细胞粒度的反射图,是一个从造血细胞中分离肝细胞的有用参数,因为胎肝细胞在早至妊娠E11时就含有脂滴(Luzzatto,1981)。图4c 示圈定2含有最多数目的集落形成细胞。基于SSC圈定R2,对应于圈定2的种群明显显示为RT1A1-和OX18dull表现型(图4c和图4d)。CFA证实了R4较圈定2能够吸附更多的集落形成细胞(表1)。这些结果表明来自E13大鼠肝脏的RT1A1-,OX18dull,和ICAM-1+种群是产生甲胎蛋白+和白蛋白+集落的肝细胞。对于rhe14321细胞发现了相同的抗原性全貌(图3)。
表1.根据RT1A和ICAM-1的表达来自分选的E13胎肝中肝细胞集落的频率
| 圈定12345 | 接种的细胞(每孔) 肝细胞集落(每孔) 集落形成的效率(%)1000 8.7±4.0 0.87500 136.3±46 275000 10.0±7.9 0.135000 6.3±0.6 0.135000 5.0±1.0 0.10 |
| R3 | 1000 7.0±2.6 0.70 |
| R4 | 500 269.3±9.8 54 |
在含有STO5h1x上的形成集落的培养物表明来自E13胎肝的每个组分的细胞数目。肝细胞集落的数目是从三重染色的培养物中建立的(均数±SD)。集落形成效率表示了接种进行培养,在经16天培养后形成可被分析的集落的细胞的百分比。
6.5 E13肝细胞和成体肝细胞的不同生长需求
从E13肝脏中分选出来的肝细胞的生长需求采用已确定的STO5滋养层和HDM进行研究。EGF很长时间被认为是一个成体肝细胞的有效生长因子。因此,要研究EGF对分选的肝细胞的集落形成的效果。RT1A1-OX18dull,ICAM-1+肝细胞的集落大小在缺乏EGF时变得更大,而成体肝细胞仅在EGF存在的情况下能生成集落(图6c)。而且,来自成体肝细胞的集落形态学是经典的F型,而所有的RT1A1-肝细胞不需要EGF就可产生P型的集落。但是,在缺少EGF的情况下集落效率略有下降(图6a)。有趣的是,缺少EGF的培养条件主要支持两种类型的P-集落,P1和P2。尽管在培养的第12天,大多数集落是P2类型,但准确区分两种类型是很困难的,因为它们中的一些集落并没有经典的如图6a所示的形态学特征。这些结果表明胎肝细胞和成体肝细胞在生长需求以及RT1A1(图3和4)的表达和集落形态学上具有本质上的不同。
培养3周后,当生长看上去达到最大程度时,评价RT1A1-,OX18和ICAM-1的表达。如在图5b至5d中所示,RT1A1的表达并未被诱导,而OX18的表达则减少。ICAM-1的水平没有改变。而且,单个集落的平均细胞数可从回收的细胞数目,大鼠肝细胞的百分比和集落效率进行计算。估计的细胞数可达3至4×103(表2)。这表明在这种培养条件下单个细胞形成的集落平均可分裂大约11-12次。
表2.在单个肝细胞集落中计算的细胞数接种的 接种密度 培养 回收的细 大鼠细胞 集落效率 单个集落中细胞数 (细胞/厘 时间 胞数 的百分比 (%) 的平均细胞
米2) (天) (%) 数目500 18 18 1.5×106 58 41 4.2×1034000 51 21 6.0×106 90 44 3.1×1034000 51 20 4.0×106 69 21 3.3×103
在图4c中从R4中分选的细胞培养在60mm或100mm培养皿中的STO5h1x滋养层细胞上。在培养细胞指定时期后,回收细胞并计数总细胞数目。根据大鼠ICAM-1和小鼠CD98的表达从流式细胞仪分析中计算大鼠细胞的百分比。集落效率表明了接种培养能形成集落的细胞的百分比。来自三重染色培养物的数据(均数)是从平行进行的试验中获得。
在单个集落中细胞的平均数目=(回收的细胞数×大鼠细胞百分比/100)/接种细胞数×集落效率/100)
6.6 RT1AI-肝脏祖细胞中双能性的证据
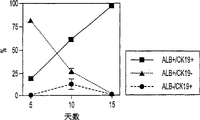
在大鼠E13妊娠中,肝细胞被认为是双能的祖细胞,可产生成熟的肝细胞和胆管上皮细胞。但是,在本发明的发现之前,还没有直接的证据证明这两种转归是否来自单个细胞。为了确定是否RT1A1-OX18dull ICAM-1+胎肝细胞可在这种培养系统中分化成为胆系细胞,这些集落用抗CK19作为胆管上皮细胞的特定标记物进行染色。CK19在大鼠胎肝的15.5天后表达在胆管上皮祖细胞上,此时在细胞上白蛋白的表达消失了。分选的RT1A1-ICAM-1+细胞在存在或缺少EGF的情况下进行培养,它们的命运在培养5天后用CK19和白蛋白的表达进行监测。第一个5天后,在用EGF处理的培养物中CK19+集落消失了,而少量含有CK19+细胞的集落出现在缺少EGF的培养物中。尽管CK19表达的强度很微弱,CK19+细胞显示了白蛋白的表达降低。在培养的第10天,一些集落明显仅表达CK19或白蛋白,其他则有双重阳性表达。在单个集落中CK19+和白蛋白+细胞的图谱是相反的。双重阳性集落和CK19单阳性集落的数目在缺少EGF时仍然是更高的(图7a)。在EGF存在时,许多集落在第10天仅含有白蛋白+细胞(图7b)。最后,在缺少EGF的第15天时,双重阳性集落的百分比达到近100%(图7a)。总之,在培养过程中EGF极大程度地抑制了CK19+集落的出现(图7b)。这些结果表明来自E13胎肝的RT1A1-,OX18dull和ICAM-1+细胞可朝向胆系细胞分化,其转归在体外受EGF影响(图8)。
6.7.可以维持肝干细胞和肝祖先细胞克隆生长的滋养细胞的分离和克隆的方案
将来自猪、小猎兔犬、兔子、小鼠或猴子的新鲜胚胎组织或冷冻组织(如肝脏、肺、肾、肌肉、肠)在无钙的磷酸缓冲盐溶液(PBS)中切碎。在用PBS清洗几次后,用磁力搅拌器搅拌的同时用0.25%胰蛋白酶温育细胞悬液,于37℃10分钟,或室温60分钟。通过使悬液通过筛眼过滤悬液来除去剩余的细胞块。然后用基础培养基(如Eagle’s MEM)在组织培养皿上培养细胞,其中基础培养基补充有血清(如10%胎牛血清)和多种生长补充剂中的任意种(如2mM谷氨酰胺,丙酮酸钠和MEM非必需氨基酸)。塑料基层和含血清培养基是一般的条件,该条件允许作为支持细胞(“滋养细胞”)候补者的细胞群的扩充,其中所述细胞群最普通的是来源于中胚层(如基质细胞),且该条件提供支持另一细胞类型(如祖先细胞)的存活、生长和/或功能的因子。当滋养细胞铺满或几乎铺满时,用0.05%胰蛋白酶传代培养滋养细胞。在几轮传代培养后,制备作为冷冻原种的扩张的细胞,且就这样储存直至使用。滋养细胞的另一种来源可以是商购的滋养细胞或滋养细胞系的原始培养物。在任何情况下,下述标准是鉴定适当的滋养细胞所需要的:
滋养细胞支持
1)带有表型标记物的肝祖先细胞的克隆生长,其中表型标记为经典的MHC I类抗原阴性,ICAM-1阳性,和/或非经典的MHC I类抗原微弱阳性;
2)带有表型标记物的有后代的肝祖先细胞的克隆生长,其中表型标记为经典的MHC I类抗原阴性,ICAM-1阳性,非经典的MHC I类抗原微弱阳性,甲胎蛋白阳性,白蛋白阳性或CK19阳性;或
3)诱导分化成肝谱系和胆谱系,这是定义双潜能肝祖先细胞所必需的。
在本领域,经典的MHC I类抗原也已知为MHC Ia类抗原。非经典的MHC I类抗原也已知为MHC Ib类抗原。在不同种属中MHC抗原具有不同的名称:例如在大鼠中为RT1,在小鼠中为H-2,在人中为HLA。
下面描述如上所述的分析:
肝祖先细胞的克隆生长条件
将肝祖先细胞以500细胞/9.6cm2铺平板于生长停滞的滋养细胞上,即经过处理以防止增殖的滋养细胞。滋养细胞的生长停滞是通过用丝裂霉素C对其进行处理或通过照射(根据细胞类型为3000-5000拉德)实现的。用不含血清的HDM饲养生长停滞的滋养细胞和祖先细胞。作为一个例子,用于啮齿动物细胞的HDM是Dulbecco改良Eagle培养基和Ham F12的1∶1混合物,该混合物中添加了10ng/ml EGF,5μg/ml胰岛素,10-6M地塞米松,10μg/ml铁饱和转铁蛋白,4.4×10-3M烟酰胺,0.2%牛血清白蛋白,5×10-5M 2-巯基乙醇,7.6μeq/l游离脂肪酸,2×10-3M谷氨酰胺,1×10-6M CuSO4,3×10-8M H2SeO3和抗生素。用培养基将培养物培养10-14天,培养基每隔一天换一次。然后进行甲胎蛋白、白蛋白和/或CK19的双重免疫荧光染色,以鉴定后代的命运。通过甲胎蛋白和白蛋白的表达分析100个集落。而且,集落形态,P或F型,可用于鉴定相关后代。
滋养细胞和肝祖先细胞的理想结合是那些来源于相同种属的滋养细胞和肝祖先细胞的结合。优选地,滋养细胞来自与该肝祖先细胞来源相同的组织和种属。然而,来自一个种类的滋养细胞和来自另一种类的祖先细胞的混合是可能的。例如,甚至啮齿动物滋养细胞可用于人肝祖先细胞。可溶和不可溶的因子(它们可以是种属特异性的和/或组织特异性的)有助于肝干细胞或肝祖先细胞的克隆生长。这些因子的来源是:
1)来自最佳种属和组织的培养的滋养细胞的条件培养基。滋养细胞可以是任何细胞类型,不仅仅是基质细胞。
2)当关键因子已知时,可以分别通过导入用于转录或转染的互补DNA或mRNA至任何细胞中产生生物活性滋养细胞群,互补DNA或mRNA用于合成对肝祖先细胞具有活性的来源于最佳滋养细胞的相关分子(信号)。
3)如果关键因子已知,也可以通过用那些信号分子补充培养基来完全取代滋养细胞,不管它们是蛋白质、肽、糖类、脂类、糖肽、糖蛋白、脂蛋白、糖脂,还是这些成分的组合,它们组成对肝祖先细胞具有活性的来源于最佳滋养细胞的信号。
对上述实施例的描述仅是为了例证的目,目的不在于限定本发明的范围或实施方案。没有特定描述的其它实施方案对于本技术领域的普通技术人员是显而易见的。这样的其它实施方案仍然被认为落入本发明的范围和精神之内。因此,本发明仅受所附权利要求的适当限定。
此处所引用的所有专利和公开文献均完整引用于此作为参考。
权利要求书
(按照条约第19条的修改)
1.一种繁殖内胚层来源的祖先细胞、它们的后代或其混合物的方法,所述方法包括在存在培养基的情况下在含有滋养细胞的层上培养内胚层来源的祖先细胞、它们的后代或其混合物,其中祖先细胞、它们的后代、或其混合物表达细胞间粘附分子抗原,不表达经典的主要组织相容性抗原。
2.如权利要求1的方法,其中所述祖先细胞、它们的后代或其混合物包括脊椎动物细胞。
3.如权利要求2的方法,其中所述祖先细胞、它们的后代或其混合物包括人细胞、非人灵长类动物细胞、猪细胞、狗细胞、兔子细胞、大鼠细胞、小鼠细胞或它们的组合。
4.如权利要求3的方法,其中所述祖先细胞、它们的后代或其混合物包括肝脏、肺、肠、胰腺、甲状腺、性腺祖先或它们的组合。
5.如权利要求4的方法,其中所述祖先细胞、它们的后代或其混合物来源于肝脏。
6.如权利要求1的方法,其中所述培养基包括一种基础培养基。
7.如权利要求6的方法,其中所述基础培养基包括Dulbecco改良Eagle培养基和Ham F12。
8.如权利要求1的方法,其中所述培养基包括至少一种激素。
9.如权利要求8的方法,其中所述激素是胰岛素。
10.如权利要求8的方法,其中所述培养基进一步包括一种糖皮质激素。
11.如权利要求8的方法,其中所述糖皮质激素是地塞米松。
12.如权利要求1的方法,其中所述培养基进一步包括铁饱和转铁蛋白。
13.如权利要求1的方法,其中所述培养基进一步包括烟酰胺。
14.如权利要求1的方法,其中所述培养基进一步包括血清白蛋白。
15.如权利要求1的方法,其中所述培养基进一步包括至少一种还原剂。
16.如权利要求15的方法,其中所述还原剂是β-巯基乙醇。
17.如权利要求1的方法,其中所述培养基包括至少一种脂质补充剂。
18.如权利要求17的方法,其中所述脂质补充剂包括一种游离脂肪酸。
19.如权利要求17的方法,其中所述游离脂肪酸混合物包括棕榈酸,棕榈油酸,硬脂酸,油酸,亚油酸,亚麻酸或它们的组合。
20.如权利要求1的方法,其中所述培养基包括谷氨酰胺。
21.如权利要求1的方法,其中所述培养基进一步包括微量元素。
22.如权利要求21的方法,其中所述微量元素包括CuSO4。
23.如权利要求21的方法,其中所述微量元素包括H2SeO3。
24.如权利要求1的方法,其中所述培养基包括一种抗氧化剂。
25.如权利要求24的方法,其中所述抗氧化剂包括H2SeO3。
26.如权利要求1的方法,其中所述培养基进一步包括抗生素。
27.如权利要求1的方法,其中所述培养基进一步包括表皮生长因子。
28.如权利要求1的方法,其中所述滋养细胞具有包括至少一种脊椎动物组织的来源。
29.如权利要求28的方法,其中所述脊椎动物包括胚胎。
30.如权利要求29的方法,其中所述脊椎动物包括人、非人灵长类动物、猪、狗、兔子、大鼠、小鼠或它们的组合。
31.如权利要求1的方法,其中所述滋养细胞是克隆的。
32.如权利要求31的方法,其中所述克隆是STO5。
33.如权利要求1的方法,其中所述滋养细胞包括基质细胞。
34.如权利要求1的方法,其中所述滋养细胞包括成纤维细胞。
35.如权利要求1的方法,其中所述肝祖先细胞表达MHC Ib dull,表达OX18 dull,表达甲胎蛋白,表达白蛋白,表达细胞角蛋白-19,或它们的组合。
36.如权利要求1的方法,其中所述ICAM是ICAM-1。
37.如权利要求1的方法,其中所述肝细胞后代表达MHC Ib dull,表达ICAM,表达OX18 dull,表达甲胎蛋白,表达白蛋白,表达细胞角蛋白-19,或它们的组合。
38.如权利要求37的方法,其中所述ICAM是ICAM-1。
39.如权利要求1的方法,其中所述肝祖先细胞、它们的后代、或其组合作为堆积集落生长。
40.如权利要求1的方法,其中所述方法进一步包括克隆肝祖先细胞。
41.如权利要求40的方法,其中所述克隆使用了稀释的细胞数量、克隆托、琼脂糖中的生长、珠子上的生长、流式细胞仪或它们的组合。
42.如权利要求1的方法,其中所述肝祖先细胞经受至少一次有丝分裂形式的细胞分裂。
43.如权利要求42的方法,其中所述肝祖先细胞经受至少十次有丝分裂形式的细胞分裂。
44.如权利要求1的方法,其中所述肝祖先细胞产生具有独立命运的子细胞。
45.如权利要求44的方法,其中所述子细胞分化为胆细胞。
46.如权利要求44的方法,其中所述子细胞分化为肝细胞。
47.一种鉴定肝生长因子的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供一种怀疑包括至少一种肝生长因子的样品,将祖先细胞、它们的后代、或其混合物和该样品混合,且观察对肝祖先细胞生长的刺激作用。
48.一种鉴定肝分化因子的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供一种怀疑包括至少一种肝分化因子的样品,将祖先细胞、它们的后代、或其混合物和该样品混合,且观察肝祖先细胞的分化。
49.一种鉴定肝毒素的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供一种怀疑包括至少一种肝毒素的样品,将祖先细胞、它们的后代、或其混合物和该样品混合,且观察肝祖先细胞的死亡情况。
50.一种开发药物的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供一种怀疑能够影响肝祖先细胞,新陈代谢的药物,将祖先细胞、它们的后代、或其混合物和该样品混合,且观察肝祖先细胞的新陈代谢上的变化。
51.一种鉴定新颖抗菌剂的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供至少一种怀疑具有抗菌作用的试剂,将祖先细胞、它们的后代、或其混合物和该试剂混合,且观察肝祖先细胞在生长上的变化。
52.一种制备体外肝脏的方法,所述方法包括提供肝祖先细胞、它们的后代或其组合,在生物反应器中培养所述肝祖先细胞、它们的后代或其组合直到得到足够的细胞群,有效地作为体外肝脏发挥作用。
53.一种繁殖肝祖先、它们的后代或其组合的方法,所述方法包括:
(a)提供至少一个肝祖先细胞,其表达细胞间粘附分子抗原,不表达主要组织相容性抗原;和
(b)在含有至少一种滋养细胞生物合成产物的培养基中培养肝祖先细胞。
54.如权利要求53的方法,其中所述培养基进一步包括糖皮质激素、胰岛素、表皮生长因子、烟酰胺或它们的组合。
55.如权利要求53的方法,其中所述滋养细胞生物合成产物包括肽、糖肽、脂肽、脂质、糖脂、糖类、蛋白、糖蛋白、脂蛋白或它们的组合,其中生物合成产物增强了肝祖先细胞的繁殖或分化。
56.如权利要求53的方法,其中所述滋养细胞生物合成产物包括胰岛素样生长因子、白细胞介素-6家族生长因子、肝细胞生长因子、成纤维细胞生长因子、胞外基质或它们的组合,其中生物合成产物生物合成产物增强了肝祖先细胞的繁殖或分化。
57.如权利要求53的方法,其中所述至少一种肝祖先细胞包括至少一种来自人、非人灵长类动物、猪、狗、兔子、大鼠或小鼠的细胞。
58.如权利要求53的方法,其中所述方法进一步包括克隆至少一个肝祖先细胞。
59.如权利要求53的方法,其中所述方法进一步加入了生长因子。
60.如权利要求59的方法,其中所述方法进一步加入了分化因子以产生肝细胞、胆细胞或它们的组合。
61.如权利要求1的方法,其中所述培养基是不含血清的。
62.一种繁殖内胚层来源的祖先细胞、它们的后代或其混合物的方法,所述方法包括在存在不含血清的培养基的情况下在含有滋养细胞的层上培养内胚层来源的祖先细胞、它们的后代或其混合物。
63.如权利要求62的方法,其中所述祖先细胞、它们的后代或其混合物包括肝脏、肺、肠、胰腺、甲状腺、性腺祖先或它们的组合。
64.如权利要求62的方法,其中所述基础培养基包括Dulbecco改良Eagle培养基和Ham F12。
65.如权利要求62的方法,其中所述培养基包括至少一种激素。
66.如权利要求65的方法,其中所述激素是胰岛素、糖皮质激素、转铁蛋白、表皮生长因子或它们的组合。
67.如权利要求62的方法,其中所述滋养细胞具有包括至少一种脊椎动物组织的来源。
68.如权利要求67的方法,其中所述脊椎动物包括人、非人灵长类动物、猪、狗、兔子、大鼠、小鼠或它们的组合。
69.如权利要求62的方法,其中所述滋养细胞是克隆的。
70.如权利要求62的方法,其中所述滋养细胞包括基质细胞。
71.如权利要求62的方法,其中所述肝祖先细胞表达细胞间粘附分子(ICAM)抗原,不表达主要组织相容性抗原(MHC)Ia类抗原,表达MHC Ib dull类,表达OX18 dull,表达甲胎蛋白,表达白蛋白,表达细胞角蛋白-19,或它们的组合。
72.如权利要求71的方法,其中所述ICAM是ICAM-1。
73.如权利要求62的方法,其中所述肝后代细胞不表达MHC Ia类,表达MHC Ib dull类,表达ICAM,表达OX18 dull,表达甲胎蛋白,表达白蛋白,表达细胞角蛋白-19,或它们的组合。
74.如权利要求73的方法,其中所述ICAM是ICAM-1。
75.如权利要求62的方法,其中所述方法进一步包括克隆肝祖先细胞。
76.如权利要求75的方法,其中所述肝祖先细胞经受至少一次有丝分裂形式的细胞分裂。
77.如权利要求75的方法,其中所述肝祖先细胞经受至少十次有丝分裂形式的细胞分裂。
78.如权利要求75的方法,其中所述肝祖先细胞产生具有独立命运的子细胞。
79.如权利要求78的方法,其中所述子细胞分化为胆细胞。
80.如权利要求78的方法,其中所述子细胞分化为肝细胞。
Claims (60)
1.一种繁殖内胚层来源的祖先细胞、它们的后代或其混合物的方法,所述方法包括在存在培养基的情况下在含有滋养细胞的层上培养内胚层来源的祖先细胞、它们的后代或其混合物。
2.如权利要求1的方法,其中所述祖先细胞、它们的后代或其混合物包括脊椎动物细胞。
3.如权利要求2的方法,其中所述祖先细胞、它们的后代或其混合物包括人细胞、非人灵长类动物细胞、猪细胞、狗细胞、兔子细胞、大鼠细胞、小鼠细胞或它们的组合。
4.如权利要求3的方法,其中所述祖先细胞、它们的后代或其混合物包括肝脏、肺、肠、胰腺、甲状腺、性腺祖先或它们的组合。
5.如权利要求4的方法,其中所述祖先细胞、它们的后代或其混合物来源于肝脏。
6.如权利要求1的方法,其中所述培养基包括一种基础培养基。
7.如权利要求6的方法,其中所述基础培养基包括Dulbecco改良Eagle培养基和Ham F12。
8.如权利要求1的方法,其中所述培养基包括至少一种激素。
9.如权利要求8的方法,其中所述激素是胰岛素。
10.如权利要求8的方法,其中所述培养基进一步包括一种糖皮质激素。
11.如权利要求8的方法,其中所述糖皮质激素是地塞米松。
12.如权利要求1的方法,其中所述培养基进一步包括铁饱和转铁蛋白。
13.如权利要求1的方法,其中所述培养基进一步包括烟酰胺。
14.如权利要求1的方法,其中所述培养基进一步包括血清白蛋白。
15.如权利要求1的方法,其中所述培养基进一步包括至少一种还原剂。
16.如权利要求15的方法,其中所述还原剂是β-巯基乙醇。
17.如权利要求1的方法,其中所述培养基包括至少一种脂质补充剂。
18.如权利要求17的方法,其中所述脂质补充剂包括一种游离脂肪酸。
19.如权利要求17的方法,其中所述游离脂肪酸混合物包括棕榈酸,棕榈油酸,硬脂酸,油酸,亚油酸,亚麻酸或它们的组合。
20.如权利要求1的方法,其中所述培养基包括谷氨酰胺。
21.如权利要求1的方法,其中所述培养基进一步包括微量元素。
22.如权利要求21的方法,其中所述微量元素包括CuSO4。
23.如权利要求21的方法,其中所述微量元素包括H2SeO3。
24.如权利要求1的方法,其中所述培养基包括一种抗氧化剂。
25.如权利要求24的方法,其中所述抗氧化剂包括H2SeO3。
26.如权利要求1的方法,其中所述培养基进一步包括抗生素。
27.如权利要求1的方法,其中所述培养基进一步包括表皮生长因子。
28.如权利要求1的方法,其中所述滋养细胞具有包括至少一种脊椎动物组织的来源。
29.如权利要求28的方法,其中所述脊椎动物包括胚胎。
30.如权利要求29的方法,其中所述脊椎动物包括人、非人灵长类动物、猪、狗、兔子、大鼠、小鼠或它们的组合。
31.如权利要求1的方法,其中所述滋养细胞是克隆的。
32.如权利要求31的方法,其中所述克隆是STO5。
33.如权利要求1的方法,其中所述滋养细胞包括基质细胞。
34.如权利要求1的方法,其中所述滋养细胞包括成纤维细胞。
35.如权利要求1的方法,其中所述肝祖先细胞表达细胞间粘附分子(ICAM)抗原,不表达主要组织相容性抗原(MHC)Ia类抗原,表达MHC Ib dull,表达OX18 dull,表达甲胎蛋白,表达白蛋白,表达细胞角蛋白-19,或它们的组合。
36.如权利要求35的方法,其中所述ICAM是ICAM-1。
37.如权利要求1的方法,其中所述肝细胞后代不表达MHC Ia类,表达MHC Ib类,表达ICAM,表达OX18 dull,表达甲胎蛋白,表达白蛋白,表达细胞角蛋白-19,或它们的组合。
38.如权利要求37的方法,其中所述ICAM是ICAM-1。
39.如权利要求1的方法,其中所述肝祖先细胞、它们的后代、或其组合作为堆积集落生长。
40.如权利要求1的方法,其中所述方法进一步包括克隆肝祖先细胞。
41.如权利要求40的方法,其中所述克隆使用了稀释的细胞数量、克隆托、琼脂糖中的生长、珠子上的生长、流式细胞仪或它们的组合。
42.如权利要求1的方法,其中所述肝祖先细胞经受至少一次有丝分裂形式的细胞分裂。
43.如权利要求42的方法,其中所述肝祖先细胞经受至少十次有丝分裂形式的细胞分裂。
44.如权利要求1的方法,其中所述肝祖先细胞产生具有独立命运的子细胞。
45.如权利要求44的方法,其中所述子细胞分化为胆细胞。
46.如权利要求44的方法,其中所述子细胞分化为肝细胞。
47.一种鉴定肝生长因子的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供一种怀疑包括至少一种肝生长因子的样品,将祖先细胞、它们的后代、或其混合物和该样品混合,且观察对肝祖先细胞生长的刺激作用。
48.一种鉴定肝分化因子的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供一种怀疑包括至少一种肝分化因子的样品,将祖先细胞、它们的后代、或其混合物和该样品混合,且观察肝祖先细胞的分化。
49.一种鉴定肝毒素的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供一种怀疑包括至少一种肝毒素的样品,将祖先细胞、它们的后代、或其混合物和该样品混合,且观察肝祖先细胞的死亡情况。
50.一种开发药物的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供一种怀疑能够影响肝祖先细胞,新陈代谢的药物,将祖先细胞、它们的后代、或其混合物和该样品混合,且观察肝祖先细胞的新陈代谢上的变化。
51.一种鉴定新颖抗菌剂的方法,所述方法包括提供肝祖先细胞、它们的后代或其混合物和提供至少一种怀疑具有抗菌作用的试剂,将祖先细胞、它们的后代、或其混合物和该试剂混合,且观察肝祖先细胞在生长上的变化。
52.一种制备体外肝脏的方法,所述方法包括提供肝祖先细胞、它们的后代或其组合,在生物反应器中培养所述肝祖先细胞、它们的后代或其组合直到得到足够的细胞群,有效地作为体外肝脏发挥作用。
53.一种繁殖肝祖先、它们的后代或其组合的方法,所述方法包括:
(a)提供至少一个肝祖先细胞
(b)在含有至少一种滋养细胞生物合成产物的培养基中培养肝祖先细胞。
54.如权利要求53的方法,其中所述培养基进一步包括糖皮质激素、胰岛素、表皮生长因子、烟酰胺或组合。
55.如权利要求53的方法,其中所述滋养细胞生物合成产物包括肽、糖肽、脂肽、脂质、糖脂、糖类、蛋白、糖蛋白、脂蛋白或它们的组合,其中生物合成产物增强了肝祖先细胞的繁殖或分化。
56.如权利要求53的方法,其中所述滋养细胞生物合成产物包括胰岛素样生长因子、白细胞介素-6家族生长因子、肝细胞生长因子、成纤维细胞生长因子、胞外基质或它们的组合,其中生物合成产物生物合成产物增强了肝祖先细胞的繁殖或分化。
57.如权利要求53的方法,其中所述至少一种肝祖先细胞包括至少一种来自人、非人灵长类动物、猪、狗、兔子、大鼠或小鼠的细胞。
58.如权利要求53的方法,其中所述方法进一步包括克隆至少一个肝祖先细胞。
59.如权利要求53的方法,其中所述方法进一步加入了生长因子。
60.如权利要求59的方法,其中所述方法进一步加入了分化因子以产生肝细胞、胆细胞或它们的组合。
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/US2000/027428 WO2002029012A1 (en) | 2000-10-03 | 2000-10-03 | Processes for clonal growth of hepatic progenitor cells |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1461341A true CN1461341A (zh) | 2003-12-10 |
Family
ID=21741846
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN00820051A Pending CN1461341A (zh) | 2000-10-03 | 2000-10-03 | 肝祖先细胞克隆生长的方法 |
Country Status (9)
| Country | Link |
|---|---|
| EP (1) | EP1325111A1 (zh) |
| JP (1) | JP2004510434A (zh) |
| KR (1) | KR100887623B1 (zh) |
| CN (1) | CN1461341A (zh) |
| AU (2) | AU7753500A (zh) |
| CA (1) | CA2424779C (zh) |
| HK (1) | HK1054570A1 (zh) |
| IL (1) | IL155387A0 (zh) |
| WO (1) | WO2002029012A1 (zh) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101701219A (zh) * | 2009-11-06 | 2010-05-05 | 哈尔滨医科大学 | 编码兔肝细胞生长因子的cDNA及其表达载体和应用 |
| CN101275121B (zh) * | 2007-03-26 | 2011-05-11 | 芦银雪 | 体外培养扩增的人肝脏祖先细胞及其制备方法 |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003523166A (ja) | 1998-09-29 | 2003-08-05 | ガミダ セル リミテッド | 幹細胞および前駆細胞の増殖と分化を制御する方法 |
| US20020187133A1 (en) | 1999-10-01 | 2002-12-12 | Hiroshi Kubota | Methods of isolating bipotent hepatic progenitor cells |
| ES2328466T3 (es) | 2001-03-27 | 2009-11-13 | Vertex Pharmaceuticals Incorporated | Composiciones y metodos utiles para la infeccion por hcv. |
| IL152904A0 (en) * | 2002-01-24 | 2003-06-24 | Gamida Cell Ltd | Utilization of retinoid and vitamin d receptor antagonists for expansion of renewable stem cell populations |
| CN104630129A (zh) * | 2002-03-15 | 2015-05-20 | 北卡罗来纳大学查伯山分校 | 原肝干细胞和近肝干细胞 |
| AU2003304106C1 (en) * | 2002-05-17 | 2010-10-28 | Mount Sinai School Of Medicine Of New York University | Mesoderm and definitive endoderm cell populations |
| US20060003446A1 (en) | 2002-05-17 | 2006-01-05 | Gordon Keller | Mesoderm and definitive endoderm cell populations |
| DE10338531A1 (de) | 2003-08-19 | 2005-04-07 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Verfahren zur Reklonierung von Produktionszellen |
| US8669109B2 (en) | 2003-08-19 | 2014-03-11 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Methods of producing proteins in Chinese hamster ovary (CHO) cells |
| US7332336B2 (en) | 2003-08-19 | 2008-02-19 | Effector Cell Institute, Inc. | Methods for inducing differentiation of pluripotent cells |
| US20060040386A1 (en) * | 2004-01-14 | 2006-02-23 | Suchitra Holgersson | Human hepatic progenitor cells and methods of use thereof |
| CN1914313A (zh) * | 2004-02-13 | 2007-02-14 | 旭科技玻璃股份有限公司 | 胚胎干细胞用喂食细胞培育培养基及喂食细胞 |
| US8874380B2 (en) | 2010-12-09 | 2014-10-28 | Rutgers, The State University Of New Jersey | Method of overcoming therapeutic limitations of nonuniform distribution of radiopharmaceuticals and chemotherapy drugs |
| US20080199441A1 (en) * | 2006-11-09 | 2008-08-21 | Tony Peled | Use of ex-vivo cultured hematopoietic cells for treatment of peripheral vascular diseases |
| WO2009013254A1 (en) | 2007-07-20 | 2009-01-29 | Cellartis Ab | A novel population of hepatocytes derived via definitive endoderm (de-hep) from human blastocysts stem cells |
| JP6232638B2 (ja) * | 2013-06-24 | 2017-11-22 | 国立研究開発法人医薬基盤・健康・栄養研究所 | 肝前駆細胞増殖用培地 |
| CN104630130A (zh) * | 2014-12-05 | 2015-05-20 | 新乡医学院 | 一种大鼠肝细胞分离方法 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4914032A (en) * | 1985-06-06 | 1990-04-03 | Centro De Investigation Y Estudios Avanzados Del Instituto Politecnico Nacional | Process for the long-term surviving culture of hepatocytes |
| EP0597964A4 (en) * | 1991-08-07 | 1994-11-30 | Einstein Coll Med | PROLIFERATION OF HEPATOCYTE PRECURSORS. |
| DE69434637T2 (de) * | 1993-11-19 | 2006-09-21 | Albert Einstein College Of Medicine Of Yeshivauniversity, A Division Of Yeshiva | Hepatoblasten und verfahren zu ihrer isolierung |
| CA2146735C (en) * | 1994-04-11 | 2007-02-20 | Chise Tateno | Liver parenchymal cells having clonal growth ability, method for obtaining same, method for subculturing same, and subculturing system of primary hepatocytes |
| JP3266766B2 (ja) * | 1994-08-23 | 2002-03-18 | 科学技術振興事業団 | ローン性増殖能を有する肝実質細胞とその取得方法、並びにその継代培養方法 |
| CA2877233A1 (en) * | 1999-01-19 | 2000-07-27 | Lola M. Reid | Human liver progenitors |
| AU2000278582B2 (en) * | 2000-10-03 | 2007-08-30 | University Of North Carolina At Chapel Hill | Methods of isolating bipotent hepatic progenitor cells |
-
2000
- 2000-10-03 AU AU7753500A patent/AU7753500A/xx active Pending
- 2000-10-03 CN CN00820051A patent/CN1461341A/zh active Pending
- 2000-10-03 AU AU2000277535A patent/AU2000277535B2/en not_active Ceased
- 2000-10-03 KR KR1020037004803A patent/KR100887623B1/ko not_active IP Right Cessation
- 2000-10-03 EP EP00967317A patent/EP1325111A1/en not_active Ceased
- 2000-10-03 CA CA2424779A patent/CA2424779C/en not_active Expired - Fee Related
- 2000-10-03 IL IL15538700A patent/IL155387A0/xx unknown
- 2000-10-03 JP JP2002532583A patent/JP2004510434A/ja active Pending
- 2000-10-03 WO PCT/US2000/027428 patent/WO2002029012A1/en active IP Right Grant
-
2003
- 2003-09-19 HK HK03106718.5A patent/HK1054570A1/zh unknown
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101275121B (zh) * | 2007-03-26 | 2011-05-11 | 芦银雪 | 体外培养扩增的人肝脏祖先细胞及其制备方法 |
| CN101701219A (zh) * | 2009-11-06 | 2010-05-05 | 哈尔滨医科大学 | 编码兔肝细胞生长因子的cDNA及其表达载体和应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1325111A1 (en) | 2003-07-09 |
| WO2002029012A1 (en) | 2002-04-11 |
| KR100887623B1 (ko) | 2009-03-11 |
| HK1054570A1 (zh) | 2003-12-05 |
| KR20040047732A (ko) | 2004-06-05 |
| JP2004510434A (ja) | 2004-04-08 |
| CA2424779C (en) | 2016-08-23 |
| AU7753500A (en) | 2002-04-15 |
| CA2424779A1 (en) | 2002-04-11 |
| IL155387A0 (en) | 2003-11-23 |
| AU2000277535B2 (en) | 2007-03-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1461341A (zh) | 肝祖先细胞克隆生长的方法 | |
| CN1742082A (zh) | 原肝干细胞和近肝干细胞 | |
| US20090053758A1 (en) | Processes for clonal growth of hepatic progenitor cells | |
| CN1665920A (zh) | 肝移植细胞、测定及其应用 | |
| US10093895B2 (en) | Hepatic stellate cell precursors and methods of isolating same | |
| CN1326354A (zh) | 无限增殖的人角质细胞系 | |
| AU2000277535A1 (en) | Processes for clonal growth of hepatic progenitor cells | |
| CN1258589C (zh) | 分离双能肝祖细胞的方法 | |
| US20030175255A1 (en) | Methods of isolating bipotent hepatic progenitor cells | |
| Charbord et al. | Phenotypic and functional characterization of human marrow vascular stromal cells | |
| KR100845471B1 (ko) | 간 전구세포의 클론 증식방법 | |
| KR20070030936A (ko) | 간 전구세포의 클론 증식방법 | |
| AU2007202994A1 (en) | Processes for clonal growth of hepatic progenitor cells | |
| Qiao | The role of bone marrow derived stromal populations in lymphohematopoietic differentiation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C12 | Rejection of a patent application after its publication | ||
| RJ01 | Rejection of invention patent application after publication |
Open date: 20031210 |