CN111479926A - 具有两个表达盒的猿猴腺病毒载体 - Google Patents
具有两个表达盒的猿猴腺病毒载体 Download PDFInfo
- Publication number
- CN111479926A CN111479926A CN201880081337.6A CN201880081337A CN111479926A CN 111479926 A CN111479926 A CN 111479926A CN 201880081337 A CN201880081337 A CN 201880081337A CN 111479926 A CN111479926 A CN 111479926A
- Authority
- CN
- China
- Prior art keywords
- vector
- adenovirus vector
- expression cassette
- simian
- simian adenovirus
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000013598 vector Substances 0.000 title claims abstract description 270
- 241000990167 unclassified Simian adenoviruses Species 0.000 title claims abstract description 53
- 108700019146 Transgenes Proteins 0.000 claims abstract description 93
- 241000701161 unidentified adenovirus Species 0.000 claims abstract description 45
- 230000010076 replication Effects 0.000 claims abstract description 18
- 108020004705 Codon Proteins 0.000 claims description 27
- 238000000034 method Methods 0.000 claims description 20
- 150000007523 nucleic acids Chemical group 0.000 claims description 20
- 230000001105 regulatory effect Effects 0.000 claims description 20
- 239000000203 mixture Substances 0.000 claims description 18
- 229960005486 vaccine Drugs 0.000 claims description 17
- 201000010099 disease Diseases 0.000 claims description 16
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 16
- 241001217856 Chimpanzee adenovirus Species 0.000 claims description 14
- 230000028993 immune response Effects 0.000 claims description 14
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 13
- 230000001124 posttranscriptional effect Effects 0.000 claims description 11
- 108020004999 messenger RNA Proteins 0.000 claims description 10
- 238000011282 treatment Methods 0.000 claims description 8
- 230000001939 inductive effect Effects 0.000 claims description 7
- 239000003814 drug Substances 0.000 claims description 6
- 208000006454 hepatitis Diseases 0.000 claims description 6
- 231100000283 hepatitis Toxicity 0.000 claims description 6
- 230000002265 prevention Effects 0.000 claims description 6
- 241000283923 Marmota monax Species 0.000 claims description 5
- 210000004962 mammalian cell Anatomy 0.000 claims description 3
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 2
- 210000004027 cell Anatomy 0.000 description 147
- 241000725643 Respiratory syncytial virus Species 0.000 description 84
- 108090000623 proteins and genes Proteins 0.000 description 69
- 239000000427 antigen Substances 0.000 description 58
- 108091007433 antigens Proteins 0.000 description 58
- 102000036639 antigens Human genes 0.000 description 58
- 208000015181 infectious disease Diseases 0.000 description 55
- 241000700605 Viruses Species 0.000 description 50
- 239000002245 particle Substances 0.000 description 32
- 241000701022 Cytomegalovirus Species 0.000 description 31
- 230000009977 dual effect Effects 0.000 description 30
- 102000004169 proteins and genes Human genes 0.000 description 30
- 230000003612 virological effect Effects 0.000 description 30
- 206010037742 Rabies Diseases 0.000 description 23
- 238000003780 insertion Methods 0.000 description 21
- 230000037431 insertion Effects 0.000 description 21
- 108090000765 processed proteins & peptides Proteins 0.000 description 21
- 102000004196 processed proteins & peptides Human genes 0.000 description 19
- 239000002157 polynucleotide Substances 0.000 description 18
- 229920001184 polypeptide Polymers 0.000 description 18
- 230000004044 response Effects 0.000 description 16
- 238000002474 experimental method Methods 0.000 description 15
- 241000701646 Kappapapillomavirus 2 Species 0.000 description 14
- 241000282577 Pan troglodytes Species 0.000 description 14
- 238000001262 western blot Methods 0.000 description 14
- 108090000288 Glycoproteins Proteins 0.000 description 12
- 102000003886 Glycoproteins Human genes 0.000 description 12
- 241001529936 Murinae Species 0.000 description 12
- 241000699670 Mus sp. Species 0.000 description 12
- 241000283690 Bos taurus Species 0.000 description 11
- 125000003275 alpha amino acid group Chemical group 0.000 description 11
- 230000004927 fusion Effects 0.000 description 11
- 230000003472 neutralizing effect Effects 0.000 description 11
- 108091033319 polynucleotide Proteins 0.000 description 11
- 102000040430 polynucleotide Human genes 0.000 description 11
- 101150039699 M2-1 gene Proteins 0.000 description 10
- 239000000835 fiber Substances 0.000 description 10
- 230000036039 immunity Effects 0.000 description 10
- 238000013518 transcription Methods 0.000 description 10
- 230000035897 transcription Effects 0.000 description 10
- 241000598171 Human adenovirus sp. Species 0.000 description 9
- 241000282405 Pongo abelii Species 0.000 description 9
- 230000005847 immunogenicity Effects 0.000 description 9
- 108020004414 DNA Proteins 0.000 description 8
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 8
- 241000701806 Human papillomavirus Species 0.000 description 8
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 8
- 241000282576 Pan paniscus Species 0.000 description 8
- 101710185720 Putative ethidium bromide resistance protein Proteins 0.000 description 8
- 239000003623 enhancer Substances 0.000 description 8
- 230000002163 immunogen Effects 0.000 description 8
- 238000013519 translation Methods 0.000 description 8
- 238000002255 vaccination Methods 0.000 description 8
- 101710141454 Nucleoprotein Proteins 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 239000002773 nucleotide Substances 0.000 description 7
- 125000003729 nucleotide group Chemical group 0.000 description 7
- 108010068327 4-hydroxyphenylpyruvate dioxygenase Proteins 0.000 description 6
- 241001631646 Papillomaviridae Species 0.000 description 6
- 210000001744 T-lymphocyte Anatomy 0.000 description 6
- 239000002671 adjuvant Substances 0.000 description 6
- 210000000234 capsid Anatomy 0.000 description 6
- 239000000284 extract Substances 0.000 description 6
- 239000012634 fragment Substances 0.000 description 6
- 108020001507 fusion proteins Proteins 0.000 description 6
- 102000037865 fusion proteins Human genes 0.000 description 6
- 102000039446 nucleic acids Human genes 0.000 description 6
- 108020004707 nucleic acids Proteins 0.000 description 6
- 238000010561 standard procedure Methods 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- 210000003501 vero cell Anatomy 0.000 description 6
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 5
- CXURGFRDGROIKG-UHFFFAOYSA-N 3,3-bis(chloromethyl)oxetane Chemical compound ClCC1(CCl)COC1 CXURGFRDGROIKG-UHFFFAOYSA-N 0.000 description 5
- 230000004543 DNA replication Effects 0.000 description 5
- 241000282412 Homo Species 0.000 description 5
- 101710125507 Integrase/recombinase Proteins 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 5
- 108090001074 Nucleocapsid Proteins Proteins 0.000 description 5
- 239000004098 Tetracycline Substances 0.000 description 5
- 230000001086 cytosolic effect Effects 0.000 description 5
- 230000037430 deletion Effects 0.000 description 5
- 238000012217 deletion Methods 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 244000052769 pathogen Species 0.000 description 5
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 229930101283 tetracycline Natural products 0.000 description 5
- 229960002180 tetracycline Drugs 0.000 description 5
- 235000019364 tetracycline Nutrition 0.000 description 5
- 150000003522 tetracyclines Chemical class 0.000 description 5
- 230000013715 transcription antitermination Effects 0.000 description 5
- 230000029812 viral genome replication Effects 0.000 description 5
- 102000030782 GTP binding Human genes 0.000 description 4
- 108091000058 GTP-Binding Proteins 0.000 description 4
- 101710085938 Matrix protein Proteins 0.000 description 4
- 101710127721 Membrane protein Proteins 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 241000282579 Pan Species 0.000 description 4
- 206010061603 Respiratory syncytial virus infection Diseases 0.000 description 4
- 230000005867 T cell response Effects 0.000 description 4
- 108020005202 Viral DNA Proteins 0.000 description 4
- 150000001413 amino acids Chemical group 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 210000003719 b-lymphocyte Anatomy 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 238000001415 gene therapy Methods 0.000 description 4
- 230000002458 infectious effect Effects 0.000 description 4
- 210000004072 lung Anatomy 0.000 description 4
- 238000005457 optimization Methods 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- 230000009261 transgenic effect Effects 0.000 description 4
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 241000991587 Enterovirus C Species 0.000 description 3
- 101710145505 Fiber protein Proteins 0.000 description 3
- 108091006027 G proteins Proteins 0.000 description 3
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 3
- 241000282575 Gorilla Species 0.000 description 3
- 108060003393 Granulin Proteins 0.000 description 3
- 241000288906 Primates Species 0.000 description 3
- 208000035415 Reinfection Diseases 0.000 description 3
- 241001068295 Replication defective viruses Species 0.000 description 3
- 108700008625 Reporter Genes Proteins 0.000 description 3
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 3
- 230000002238 attenuated effect Effects 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 239000013592 cell lysate Substances 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 210000005260 human cell Anatomy 0.000 description 3
- 230000003053 immunization Effects 0.000 description 3
- 238000002649 immunization Methods 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 230000003362 replicative effect Effects 0.000 description 3
- 230000000241 respiratory effect Effects 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 210000004988 splenocyte Anatomy 0.000 description 3
- 229940036185 synagis Drugs 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 239000013603 viral vector Substances 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 2
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 241000725303 Human immunodeficiency virus Species 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 101100187215 Mus musculus Nmu gene Proteins 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 108091092724 Noncoding DNA Proteins 0.000 description 2
- 108010061100 Nucleoproteins Proteins 0.000 description 2
- 102000011931 Nucleoproteins Human genes 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 206010033799 Paralysis Diseases 0.000 description 2
- 102000011755 Phosphoglycerate Kinase Human genes 0.000 description 2
- 241000282569 Pongo Species 0.000 description 2
- 230000004570 RNA-binding Effects 0.000 description 2
- 241000711798 Rabies lyssavirus Species 0.000 description 2
- 208000004756 Respiratory Insufficiency Diseases 0.000 description 2
- 206010038678 Respiratory depression Diseases 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 101710198474 Spike protein Proteins 0.000 description 2
- 101001099217 Thermotoga maritima (strain ATCC 43589 / DSM 3109 / JCM 10099 / NBRC 100826 / MSB8) Triosephosphate isomerase Proteins 0.000 description 2
- 108700009124 Transcription Initiation Site Proteins 0.000 description 2
- 108010067390 Viral Proteins Proteins 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 238000012411 cloning technique Methods 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 230000009260 cross reactivity Effects 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 241001493065 dsRNA viruses Species 0.000 description 2
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000003832 immune regulation Effects 0.000 description 2
- 238000012744 immunostaining Methods 0.000 description 2
- 229960001438 immunostimulant agent Drugs 0.000 description 2
- 239000003022 immunostimulating agent Substances 0.000 description 2
- 230000003308 immunostimulating effect Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000010255 intramuscular injection Methods 0.000 description 2
- 239000007927 intramuscular injection Substances 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 238000006386 neutralization reaction Methods 0.000 description 2
- 230000001717 pathogenic effect Effects 0.000 description 2
- 230000007255 peripheral T cell response Effects 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 238000003752 polymerase chain reaction Methods 0.000 description 2
- 230000001323 posttranslational effect Effects 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 210000002345 respiratory system Anatomy 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000012250 transgenic expression Methods 0.000 description 2
- 230000017613 viral reproduction Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 102000008482 12E7 Antigen Human genes 0.000 description 1
- 108010020567 12E7 Antigen Proteins 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 206010002515 Animal bite Diseases 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 108090000565 Capsid Proteins Proteins 0.000 description 1
- 102100023321 Ceruloplasmin Human genes 0.000 description 1
- 241000282994 Cervidae Species 0.000 description 1
- 241000288673 Chiroptera Species 0.000 description 1
- 108091062157 Cis-regulatory element Proteins 0.000 description 1
- 108700010070 Codon Usage Proteins 0.000 description 1
- 206010010071 Coma Diseases 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 201000006306 Cor pulmonale Diseases 0.000 description 1
- 241000450599 DNA viruses Species 0.000 description 1
- 101100118093 Drosophila melanogaster eEF1alpha2 gene Proteins 0.000 description 1
- 101150029662 E1 gene Proteins 0.000 description 1
- 101150005585 E3 gene Proteins 0.000 description 1
- 206010014950 Eosinophilia Diseases 0.000 description 1
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 241000282324 Felis Species 0.000 description 1
- 101710160621 Fusion glycoprotein F0 Proteins 0.000 description 1
- 101000834253 Gallus gallus Actin, cytoplasmic 1 Proteins 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 102100021519 Hemoglobin subunit beta Human genes 0.000 description 1
- 108091005904 Hemoglobin subunit beta Proteins 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 241001135569 Human adenovirus 5 Species 0.000 description 1
- 241000711920 Human orthopneumovirus Species 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 206010022998 Irritability Diseases 0.000 description 1
- 101710084021 Large envelope protein Proteins 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 241000711828 Lyssavirus Species 0.000 description 1
- 101150103632 M2-2 gene Proteins 0.000 description 1
- 241000282553 Macaca Species 0.000 description 1
- 108700011259 MicroRNAs Proteins 0.000 description 1
- 101000574441 Mus musculus Alkaline phosphatase, germ cell type Proteins 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 108700001237 Nucleic Acid-Based Vaccines Proteins 0.000 description 1
- 108091005461 Nucleic proteins Chemical group 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 208000009608 Papillomavirus Infections Diseases 0.000 description 1
- 208000037581 Persistent Infection Diseases 0.000 description 1
- 206010034912 Phobia Diseases 0.000 description 1
- 101710093543 Probable non-specific lipid-transfer protein Proteins 0.000 description 1
- 229940096437 Protein S Drugs 0.000 description 1
- 101710188314 Protein V Proteins 0.000 description 1
- 101000584831 Pseudoalteromonas phage PM2 Protein P6 Proteins 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 229940124679 RSV vaccine Drugs 0.000 description 1
- 101900083372 Rabies virus Glycoprotein Proteins 0.000 description 1
- 241000711931 Rhabdoviridae Species 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 206010039424 Salivary hypersecretion Diseases 0.000 description 1
- 240000005499 Sasa Species 0.000 description 1
- 208000008630 Sialorrhea Diseases 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 108010022394 Threonine synthase Proteins 0.000 description 1
- 108090000848 Ubiquitin Proteins 0.000 description 1
- 102000044159 Ubiquitin Human genes 0.000 description 1
- 206010046306 Upper respiratory tract infection Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 108700005077 Viral Genes Proteins 0.000 description 1
- 241001492404 Woodchuck hepatitis virus Species 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000000240 adjuvant effect Effects 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 230000002924 anti-infective effect Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 108010088716 attachment protein G Proteins 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 206010006475 bronchopulmonary dysplasia Diseases 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000012830 cancer therapeutic Substances 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000007969 cellular immunity Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 208000004209 confusion Diseases 0.000 description 1
- 210000004087 cornea Anatomy 0.000 description 1
- 210000005220 cytoplasmic tail Anatomy 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 102000004419 dihydrofolate reductase Human genes 0.000 description 1
- 206010013395 disorientation Diseases 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- 230000009395 genetic defect Effects 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000028996 humoral immune response Effects 0.000 description 1
- 230000004727 humoral immunity Effects 0.000 description 1
- 230000008348 humoral response Effects 0.000 description 1
- 208000013403 hyperactivity Diseases 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000000899 immune system response Effects 0.000 description 1
- 230000009851 immunogenic response Effects 0.000 description 1
- 229940027941 immunoglobulin g Drugs 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000003071 memory t lymphocyte Anatomy 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 210000002241 neurite Anatomy 0.000 description 1
- 230000002276 neurotropic effect Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 231100000862 numbness Toxicity 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 229960000402 palivizumab Drugs 0.000 description 1
- 208000003154 papilloma Diseases 0.000 description 1
- 208000035824 paresthesia Diseases 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 208000019899 phobic disease Diseases 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 230000002516 postimmunization Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 229940021993 prophylactic vaccine Drugs 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 108010054624 red fluorescent protein Proteins 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 208000002491 severe combined immunodeficiency Diseases 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 229940021747 therapeutic vaccine Drugs 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 239000012646 vaccine adjuvant Substances 0.000 description 1
- 229940124931 vaccine adjuvant Drugs 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 244000052613 viral pathogen Species 0.000 description 1
- 230000001018 virulence Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/235—Adenoviridae
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
- A61K2039/5256—Virus expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/53—DNA (RNA) vaccination
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10334—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10341—Use of virus, viral particle or viral elements as a vector
- C12N2710/10342—Use of virus, viral particle or viral elements as a vector virus or viral particle as vehicle, e.g. encapsulating small organic molecule
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10341—Use of virus, viral particle or viral elements as a vector
- C12N2710/10343—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16111—Cytomegalovirus, e.g. human herpesvirus 5
- C12N2710/16121—Viruses as such, e.g. new isolates, mutants or their genomic sequences
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/18011—Paramyxoviridae
- C12N2760/18511—Pneumovirus, e.g. human respiratory syncytial virus
- C12N2760/18534—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/20011—Rhabdoviridae
- C12N2760/20111—Lyssavirus, e.g. rabies virus
- C12N2760/20134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/48—Vector systems having a special element relevant for transcription regulating transport or export of RNA, e.g. RRE, PRE, WPRE, CTE
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Genetics & Genomics (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Biomedical Technology (AREA)
- Virology (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Biochemistry (AREA)
- Mycology (AREA)
- Animal Behavior & Ethology (AREA)
- Biophysics (AREA)
- Plant Pathology (AREA)
- Molecular Biology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Breeding Of Plants And Reproduction By Means Of Culturing (AREA)
- Information Retrieval, Db Structures And Fs Structures Therefor (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
猿猴腺病毒载体,其包含两个表达盒,其中每个表达盒都包含转基因和启动子,且其中第一表达盒被插入所述猿猴腺病毒载体的E1区域中,且第二表达盒被插入所述腺病毒载体的与载体复制相容的区域中。
Description
序列表
本申请含有已经以ASCII形式电子提交且在此以其整体通过引用并入的序列表。所述ASCII拷贝,在2018年10月11日创建,命名为VU66441A_WO_SL.txt,且大小为178,926字节。
发明领域
本发明处于重组腺病毒载体的领域中。本发明涉及包含两个表达盒的腺病毒载体。具体而言,本发明涉及猿猴腺病毒,诸如黑猩猩(chimp)腺病毒,其包含两个表达盒。
发明背景
重组腺病毒可用于基因疗法中且可用作疫苗。
由于它们的大转基因容量和在各种靶标组织中实现高度有效基因转移的能力,人腺病毒已被广泛用于基因转移应用。
然而,大多数人暴露于人腺病毒并发展对人腺病毒的免疫力。因此,需要有效地将分子递送至靶标并使预先存在的对人腺病毒血清型的免疫力的影响最小化的载体。猿猴腺病毒在这方面是有效的;它们与人病毒足够密切相关,以有效地诱导对递送的外源性抗原的免疫力,人对所述递送的外源性抗原几乎没有预先存在的免疫力或没有预先存在的免疫力。因此,基于猿猴腺病毒的病毒载体可以提供人来源的腺病毒载体用于开发基于核酸的疫苗的用途的替代方案。
复制缺陷的腺病毒将其基因组递送至细胞的内部,并且因为它们不复制,所以不扩增转基因有效载荷。通常,E1基因被包含选择的启动子和对应于一个或多个目标基因的核酸序列的转基因盒替换,产生复制缺陷的重组病毒。
在本领域中需要改进的重组腺病毒。
发明概述
本发明涉及猿猴腺病毒载体,其包含两个表达盒。具体而言,本发明涉及猿猴腺病毒,诸如黑猩猩(chimp)腺病毒,其包含两个表达盒。合适的黑猩猩腺病毒的实例包括ChAd155和ChAd83。
本发明的腺病毒载体可用作免疫原性组合物的组分,其用于诱导受试者中的免疫应答,其在治疗中的使用方法和制造方法。
术语“载体”是指含有或携带遗传物质且可以用于将外源基因引入生物体的试剂(诸如质粒或病毒)。本发明的腺病毒载体源自非人猿猴腺病毒,也称为“猿猴腺病毒”。优选地,本发明的猿猴腺病毒载体是猿猴腺病毒。
本发明的腺病毒载体中的每个表达盒包含转基因和启动子。“转基因”是编码目标多肽的核酸序列,其与侧接所述转基因的载体序列异源。核酸编码序列以允许宿主细胞中的转基因转录、翻译和/或表达的方式可操作连接至调节组分。“启动子”是允许RNA聚合酶的结合并指导基因的转录的核苷酸序列。通常,启动子位于靠近转录起始位点的基因的非编码区域中。
在本发明的腺病毒载体中,所述第一表达盒被插入病毒的E1区域中,且所述第二表达盒被插入腺病毒载体的第二区域中。
在本发明的包含两个表达盒的猿猴腺病毒载体中,所述第一表达盒被插入猿猴腺病毒载体的E1区域中,且所述第二表达盒被插入腺病毒载体的与载体复制相容的区域中。如果腺病毒载体基因组的区域的破坏不会影响腺病毒载体复制的能力,则认为该区域“与载体复制相容”。
优选地,在本发明的腺病毒载体中,所述第一表达盒被插入病毒的E1区域中,且所述第二表达盒被插入腺病毒载体的E3、HE1或HE2区域中。如本领域中众所周知的,E3基因在转导的早期表达,以准备宿主细胞用于病毒复制。E3参与免疫调节。术语“HE1”用于描述位于L5和E4的终止密码子之间的位点。术语“HE2”已用于定义位于ITR的末端和E4 mRNA的帽位点之间的位点。
例如,在ChAd155腺病毒载体中:
• HE1 ChAd155: 在SEQ ID NO:1的bp 34611和34612之间的插入位点。
• HE2 ChAd155: 在SEQ ID NO:1的bp 37662和37663之间的插入位点。
在另一个实例中,在ChAd83腺病毒载体中:
• HE1 ChAd83: 在SEQ ID NO:2的bp 33535和33536之间的插入位点。
• HE2 ChAd83: 在SEQ ID NO:2的bp 36387和36388之间的插入位点。
当第一表达盒被插入腺病毒载体的E1区域中时,天然E1区域被缺失。为了增加载体的克隆容量,可以从腺病毒载体除去天然E3区域。在其中第二表达盒被插入E3区域中的本发明的实施方案中,或在其中第二表达盒不被插入E3区域中的实施方案中,可以从腺病毒载体缺失天然E3区域。HE1或HE2位点中的插入不需要缺失载体骨架的任何特定序列。
优选地,第二表达盒被插入腺病毒载体的HE1或HE2区域中。最优选地,第二表达盒被插入腺病毒载体的HE2区域中。在一个实施方案中,从腺病毒载体缺失天然E3区域以增加载体的克隆容量,并且第二表达盒被插入腺病毒载体的HE1或HE2区域中。
在本发明的实施方案中,所述腺病毒载体的第一表达盒可以包含人CMV启动子或增强的人CMV启动子,和/或所述第二表达盒可以包含人CMV启动子或增强的人CMV启动子。
在一个优选实施方案中,所述第一和第二表达盒包含不同的启动子。例如,在一个实施方案中,所述第一表达盒可以包含人CMV启动子,且所述第二表达盒可以包含增强的人CMV启动子(反之亦然)。
在本发明的一个方面,提供了本发明的腺病毒载体,其中所述第一表达盒被插入病毒的E1区域中,且所述第二表达盒被插入腺病毒载体的与载体复制相容的区域中,其中所述第一和第二表达盒中的至少一个包含增强的CMV启动子。在一些实施方案中,所述增强的hCMV启动子可以包括与SEQ ID NO:6具有至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或更多序列同一性的核酸序列。在一些实施方案中,所述启动子包含SEQ ID NO:6的核酸序列或由其组成。
本发明的腺病毒载体源自猿猴腺病毒载体,例如,源自黑猩猩(黑猩猩(Pan troglodytes)),倭黑猩猩(倭黑猩猩(Pan paniscus)),大猩猩(大猩猩(Gorilla gorilla))和猩猩(苏门答腊猩猩(Pongo abelii)和婆罗洲猩猩(Pongo pygnaeus))。黑猩猩腺病毒包括,但不限于AdY25、ChAd3、ChAd19、ChAd25.2、ChAd26、ChAd27、ChAd29、ChAd30、ChAd31、ChAd32、ChAd33、ChAd34、ChAd35、ChAd37、ChAd38、ChAd39、ChAd40、ChAd63、ChAd83、ChAd155、ChAd15、SadV41、sAd4310A、sAd4312、SAdV31、SAdV-A1337、ChAdOx1、ChAdOx2和ChAd157。优选地,本发明的猿猴腺病毒载体是ChAd83或ChAd155腺病毒载体,最优选ChAd155腺病毒载体。
优选地,本发明的腺病毒载体在人受试者中具有小于30%、优选小于10%的血清阳性率,且最优选在人受试者中没有血清阳性率。
在一个优选实施方案中,本发明的猿猴腺病毒载体能够感染哺乳动物细胞。
在一个实施方案中,本发明的腺病毒载体的第一表达盒和第二表达盒包含来自呼吸道合胞病毒(RSV)的转基因。例如,在一个实施方案中,所述表达盒之一包含RSV F抗原,且另一表达盒包含RSV M和N抗原。在此类实施方案中,所述载体优选编码RSV F0ΔTM抗原(缺失跨膜和细胞质区域的融合(F)蛋白)以及RSV M2-1(转录抗终止)和N(核衣壳)抗原。
本发明还提供了包含猿猴腺病毒载体和药学上可接受的赋形剂的组合物。
此外,本发明提供了猿猴腺病毒载体或包含这种腺病毒载体的组合物,其用作药物、疫苗和/或用于治疗或预防疾病。
本发明还提供了诱导受试者中的免疫应答的方法,其包括将所述猿猴腺病毒载体或组合物施用于所述受试者。
附图描述
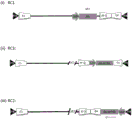
图1:具有单一表达盒的猿猴腺病毒构建体。反向末端重复区(ITR)侧接3'和5'末端;E1是早期基因1;CMV是巨细胞病毒启动子;CASI是CASI启动子;RG是模型抗原,WPRE是土拨鼠肝炎转录后调节元件,∆E3表示早期基因3被缺失;纤突表示编码纤突蛋白的腺病毒基因,且E4是早期基因4。
三种不同的猿猴腺病毒载体显示于图1中。通过插入转基因表达盒替代腺病毒基因组的E3区域(“RC1”)来构建图1(i)的载体(顶部小图),通过将转基因表达盒插入HE1区域中,即,在纤突基因和E4区域的终止密码子之间(“RC3”)来形成图1(ii)的载体(中间小图),并且通过将转基因表达盒插入HE2区域中,即在ITR的末端和E4 mRNA的帽区域之间(“RC2”)来制备图1(iii)的载体(底部小图)。
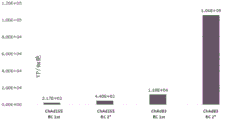
图2A:具有插入E3和HE2位点中的转基因盒的ChAd155和ChAd83(图1的RC1和RC2载体)在原代人细胞系中的产生。
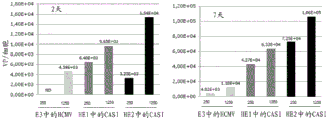
图2B:在感染后两天和七天,具有插入E3、HE1和HE2中的转基因盒的ChAd83(图1的RC1、RC2和RC3载体)在人MRC5细胞系中的产生。以250和1250的感染复数感染细胞。
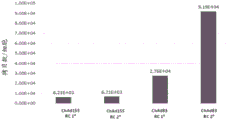
图3A:图1的RC1和RC2载体(ChAd155和ChAd83)在人原代细胞系中的总病毒基因组拷贝数。
图3B:在感染后两天和七天,图1的ChAd83载体的RC1、RC2和RC3版本在人MRC5细胞系中的总病毒基因组拷贝数。以250和1250的感染复数感染细胞。
图4:图1的ChAd155 RC1和RC2以及ChAd83 RC1和RC2载体在鼠细胞系(图4(a),顶部小图)和非人灵长类细胞系(图4(b),底部小图)中的总病毒基因组拷贝数。以50和250的感染复数感染细胞。
图5:表达模型狂犬病糖蛋白(RG)转基因的ChAd155 RC1和RC2载体在鼠细胞系中的表达水平的比较,其由在感染后两天和五天的western印迹所证明(图5(a),顶部小图)。表达模型狂犬病糖蛋白(RG)转基因的ChAd155 RC1和RC2载体与ChAd83 RC1和RC2载体在鼠细胞系中的表达水平的比较,其由感染后两天和五天的western印迹所证明(图5(b),底部小图)。以50、250和1250的感染复数感染细胞。
图5(c):表达模型狂犬病糖蛋白(RG)转基因的ChAd83 RC1、RC2和RC3载体在人MRC5细胞系中的表达水平的比较,其由在感染后两天和七天的western印迹所证明。以250和1250的感染复数感染细胞。
图6:具有单个表达盒的另一猿猴腺病毒构建体。反向末端重复区(ITR)侧接3’和5’末端;人CMV (hCMV)是巨细胞病毒启动子;FΔTM (F0DTM)和N.M2-1是RSV抗原;2A是自切割连接序列;∆E4表示早期基因4被缺失;纤突表示编码纤突蛋白的腺病毒基因。在图6的载体中,插入转基因表达盒代替腺病毒基因组的E1区域。
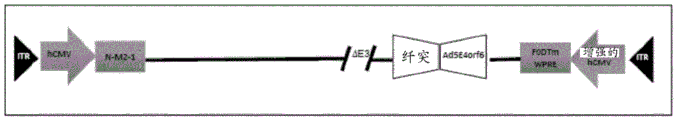
图7:具有双重表达盒的根据本发明的猿猴腺病毒构建体。反向末端重复区(ITR)侧接3'和5'末端;人CMV (hCMV)是巨细胞病毒启动子;增强的hCMV是增强的巨细胞病毒启动子;N-M2-1和FΔTM (F0DTM)是RSV抗原;WPRE是土拨鼠肝炎转录后调节元件;∆E3表示早期基因3被缺失;纤突表示编码纤突蛋白的腺病毒基因;且Ad5E4orf6是在早期基因4(E4)区域中的替代物。
图7的载体通过如下构建:插入第一转基因表达盒代替腺病毒基因组的E1区域,且在HE2区域中,即在右ITR的下游,插入第二转基因表达盒。
图8:通过感染后48小时和96小时,在非还原条件下western印迹证明的,MRC5细胞系中表达F0∆TM转基因的载体的表达水平的比较。以500和1250的感染复数感染细胞。
图9:通过感染后48小时,在还原条件下western印迹证明的,MRC5细胞系中表达NM2-1转基因的载体的表达水平的比较。以250和1250的感染复数感染细胞。
图10:来自表达RSV抗原F0∆TM (F∆Tm)的ChAd155载体的免疫原性的比较。在用5x108个病毒颗粒的剂量接种疫苗后4周和8周收集数据。
图11:来自表达M2 RSV抗原的ChAd155载体的免疫原性的比较。在用107或106个病毒颗粒的剂量接种疫苗后3周收集数据。
图12A和12B:举例说明来自实施例9的实验的结果,以研究来自ChAd155载体的肺T细胞应答。图12A显示CD4+应答,且图12B显示CD8+应答。
图13A和13B:显示来自实施例9的实验的结果,以研究来自ChAd155载体的外周T细胞应答。图13A显示PBMC CD4+应答,且图13B显示PBMC CD8+应答。
图14A和14B:还显示来自实施例9的结果。图14A显示RSV中和Ab滴度,且图14B举例说明第90天的nAb与第0天的nAb的比率。
图15A、15B和15C:显示实施例10的免疫原性实验的结果。
图16A和16B:使用实施例11中的载体在HeLa细胞中的表达获得的Western印迹。
图17:举例说明实施例12的CRPV实验的结果。
图18:显示实施例13的HPV双重盒载体表征的结果。
序列的注释
SEQ ID NO:1 – 编码野生型ChAd155的多核苷酸序列
SEQ ID NO:2 – 编码野生型ChAd83的多核苷酸序列
SEQ ID NO:3 – 编码CASI启动子的多核苷酸序列
SEQ ID NO:4 – 编码ChAd155/RSV的多核苷酸序列
SEQ ID NO:5 – RSV F0∆TM-N-M2-1氨基酸序列
SEQ ID NO:6 – 编码增强的hCMV启动子的多核苷酸序列
SEQ ID NO:7 – 编码hCMV NM2 bgh聚A盒的多核苷酸序列
SEQ ID NO:8 – NM2氨基酸(蛋白)序列
SEQ ID NO:9 – 编码hCMV F0 WPRE bgh聚A盒的多核苷酸序列
SEQ ID NO:10 – F0氨基酸(蛋白)序列
SEQ ID NO:11 – 柔性接头的氨基酸序列
SEQ ID NO:12 – 柔性接头的氨基酸序列。
发明详述
腺病毒
腺病毒是具有近似36 kb的线性双链DNA基因组的无包膜二十面体病毒。腺病毒可以转导几种哺乳动物物种的许多细胞类型,包括分裂中和非分裂中细胞两者,而不整合至宿主细胞的基因组中。由于它们证明的安全性、在各种靶标组织中实现高度有效基因转移的能力以及大的转基因容量,它们已被广泛用于基因转移应用。人腺病毒载体目前用于基因疗法和疫苗中,但具有在先前暴露于普通人腺病毒后预先存在的免疫力的全世界高度流行的缺点。
腺病毒具有拥有二十面体衣壳的特征性形态,所述二十面体衣壳包含三种主要蛋白:六邻体(II)、五邻体基质(III)和有节纤突(IV),连同许多其他次要蛋白VI、VIII、IX、IIIa和IVa2。所述六邻体占所述衣壳的结构组分的大部分,所述衣壳由240个三聚的六邻体壳粒和12个五邻体基质组成。所述六邻体具有三个保守双桶(barrel),并且顶部具有三个塔(tower),每个塔含有来自每个亚基的环,所述亚基形成衣壳的大部分。六邻体的基质在腺病毒血清型之间是高度保守的,而表面环是可变的。五邻体是另一种腺病毒衣壳蛋白;其形成纤突所附接的五聚的基质。三聚的纤突蛋白从在衣壳的12个顶点中的每一个处的五邻体基质伸出且是有节的杆状结构。所述纤突蛋白的主要作用是经由节区域与细胞受体的相互作用而将病毒衣壳与细胞表面拴系。纤突的柔性轴以及节区域中的变异是不同腺病毒血清型特征性的。
腺病毒基因组已被充分地表征。线性、双链DNA与高度碱性蛋白VII和小肽pX (也称为mu)缔合。另一种蛋白V与该DNA-蛋白复合物一起包装,并经由蛋白VI提供与衣壳的结构连接。就类似地定位的特定开放阅读框(例如每种病毒的E1A、E1B、E2A、E2B、E3、E4、L1、L2、L3、L4和L5基因的位置)而言,在腺病毒基因组的整体组构中存在一般保守性。腺病毒基因组的每个末端包含被称为反向末端重复区(ITR)的序列,其是病毒复制所必需的。腺病毒基因组的5' 末端含有包装和复制所必需的5' 顺式元件;即,5' ITR序列(其可以作为复制起点发挥功能)和天然5' 包装增强子结构域(其含有包装线性腺病毒基因组所必需的序列和E1启动子的增强子元件)。腺病毒基因组的3'末端包括包装和衣壳化所必需的3' 顺式元件(包括ITR)。该病毒也包含病毒编码的蛋白酶,其是加工产生感染性病毒粒子所需的结构蛋白中的一些所必需的。
基于在宿主细胞转导后表达病毒基因的顺序,描述了腺病毒基因组的结构。更具体地,根据转录在DNA复制开始之前还是之后发生,将所述病毒基因称为早期(E)或晚期(L)基因。在转导的早期阶段中,表达腺病毒的E1A、E1B、E2A、E2B、E3和E4基因以制备用于病毒复制的宿主细胞。E1基因被认为是主开关,其充当转录活化剂,并参与早期和晚期基因转录两者。E2参与DNA复制;E3参与免疫调节,且E4调节病毒mRNA代谢。在感染的晚期阶段期间,编码病毒颗粒的结构组分的晚期基因L1-L5的表达被活化。晚期基因从主要晚期启动子(MLP)转录,并进行选择性剪接。
HE1和HE2位点被鉴定为转基因的潜在插入位点,因为在这些特定点中的插入并不中断黑猩猩腺病毒(诸如C型或E型黑猩猩腺病毒,例如ChAd155和ChAd83)的编码序列或重要调节序列。HE1和HE2位点可以通过在任何黑猩猩腺病毒中的序列比对来鉴定。因此,ChAd基因组的HE1和HE2位点中的表达盒的克隆并不影响病毒复制周期。
腺病毒复制
在历史上,腺病毒疫苗开发已经集中于缺陷的、非复制型载体。通过缺失对于复制必需的E1区域基因,使得它们复制缺陷。通常,非必需的E3区域基因也被缺失,以便为外源转基因腾出空间。然后插入包含在外源启动子的控制下的转基因的表达盒。然后在E1-互补细胞中产生这些复制缺陷的病毒。
术语“复制缺陷的”或“不能复制的”腺病毒是指这样的腺病毒,其不能复制,因为其已经被工程改造以至少包含功能缺失(或“功能丧失”突变),即在不将基因完全除去的情况下损害该基因的功能的缺失或突变,例如人工终止密码子的引入,活性位点或相互作用结构域的缺失或突变,基因的调节序列的突变或缺失等,或编码对于病毒复制必需的基因产物的基因的完全除去,诸如选自E1A、E1B、E2A、E2B、E3和E4 (诸如E3 ORF1、E3 ORF2、E3ORF3、E3 ORF4、E3 ORF5、E3 ORF6、E3 ORF7、E3 ORF8、E3 ORF9、E4 ORF7、E4 ORF6、E4 ORF4、E4 ORF3、E4 ORF2和/或E4 ORF1)的腺病毒基因中的一个或多个的完全除去。合适地,E1和任选地E3和/或E4被缺失。如果缺失,当确定相对于另一个序列的百分比同一性时,合适地将在比对中不考虑前面提及的缺失的基因区域。
本发明的载体
基于非人猿猴腺病毒的病毒载体代表将人来源的载体用于基因疗法和基因疫苗的替代方案。从非人猿猴分离的某些腺病毒与从人分离的腺病毒密切相关,如它们在人来源的细胞中的有效繁殖所证明。由于人几乎不发展或不发展对猿猴腺病毒的免疫力,因此它们有望为人腺病毒使用提供改进的替代方案。
“低血清阳性率”可以意指具有与人腺病毒5 (Ad5)相比降低的预先存在的中和抗体水平。类似地或可替代地,“低血清阳性率”可以意指小于约30%血清阳性率、小于约20%血清阳性率、小于约15%血清阳性率、小于约10%血清阳性率、小于约5%血清阳性率、小于约4%血清阳性率、小于约3%血清阳性率、小于约2%血清阳性率、小于约1%血清阳性率或无可检测的血清阳性率。使用如Hum. Gene Ther. (2004) 15:293中所述的方法,可以将血清阳性率测量为具有临床相关的中和滴度(定义为50%中和滴度>200)的个体的百分比。
本发明的腺病毒载体源自非人猿猴腺病毒,也称为“猿猴腺病毒”。许多腺病毒已分离自非人猿猴,诸如黑猩猩、倭黑猩猩、猕猴、猩猩和大猩猩。源自这些腺病毒的载体可以诱导针对由这些载体编码的转基因的强烈免疫应答。基于非人猿猴腺病毒的载体的某些优点包括在人靶标群体中相对缺乏针对这些腺病毒的交叉中和抗体,因此其使用克服了预先存在的对人腺病毒的免疫力。例如,一些猿猴腺病毒不具有与预先存在的人中和抗体的交叉反应性,并且某些黑猩猩腺病毒与预先存在的人中和抗体的交叉反应仅存在于2%的靶标群体中,相比之下,在某些候选人腺病毒载体的情况下为35% (Sci. Transl. Med. (2012)4:1)。
本发明的腺病毒载体源自猿猴腺病毒,例如,源自黑猩猩(黑猩猩(Pan troglodytes)),倭黑猩猩(倭黑猩猩(Pan paniscus)),大猩猩(大猩猩(Gorilla gorilla))和猩猩(苏门答腊猩猩(Pongo abelii)和婆罗洲猩猩(Pongo pygnaeus))。它们包括来自组B、组C、组D、组E和组G的腺病毒。黑猩猩腺病毒包括,但不限于AdY25、ChAd3、ChAd19、ChAd25.2、ChAd26、ChAd27、ChAd29、ChAd30、ChAd31、ChAd32、ChAd33、ChAd34、ChAd35、ChAd37、ChAd38、ChAd39、ChAd40、ChAd63、ChAd83、ChAd155、ChAd15、SadV41和ChAd157 ChAd3、ChAd19、ChAd25.2、ChAd26、ChAd27、ChAd29、ChAd30、ChAd31、ChAd32、ChAd33、ChAd34、ChAd35、ChAd37、ChAd38、ChAd39、ChAd40、ChAd63、ChAd83、ChAd155、ChAd15、SadV41、sAd4310A、sAd4312、SAdV31、SAdV-A1337、ChAdOx1、ChAdOx2和ChAd157。或者,腺病毒载体可以源自从倭黑猩猩分离的非人猿猴腺病毒,诸如PanAd1、PanAd2、PanAd3、Pan 5、Pan 6、Pan 7 (也称为C7)和Pan 9。载体可以全部或部分地包括编码非人腺病毒的纤突、五邻体或六邻体的核苷酸。
在本发明的腺病毒载体的一个实施方案中,所述腺病毒载体在人受试者中具有小于30%、小于20%、小于10%或小于5%的血清阳性率,优选地在人受试者中没有血清阳性率,且更优选地在先前未与黑猩猩腺病毒载体接触的人受试者中没有血清阳性率。
在本发明的腺病毒载体的实施方案中,所述腺病毒DNA能够进入哺乳动物靶标细胞,即其为感染性的。本发明的感染性重组腺病毒载体可以用作预防性或治疗性疫苗且用于基因疗法。因此,在一个实施方案中,所述重组腺病毒载体包含用于递送至靶标细胞中的内源性分子。所述靶标细胞是哺乳动物细胞,例如牛细胞、犬细胞、山羊细胞、鹿细胞、黑猩猩细胞、翼手目细胞、马细胞、猫细胞、人细胞、狼细胞、绵羊细胞、猪细胞、啮齿动物细胞、熊细胞或狐狸细胞。用于递送至靶标细胞中的内源性分子是表达盒。
在本发明的一个实施方案中,所述载体包含左ITR区域,缺失的E1区域,然后缺失的E3区域,以及任选地,额外增强子元件;这些随后为纤突区域、E4区域和右ITR。在向右和向左方向发生翻译。在该实施方案中,所述第一表达盒被插入缺失的E1区域中,且所述第二表达盒被插入缺失的E3区域中。在一个进一步实施方案中,所述两个表达盒的启动子是CMV启动子。在又一个进一步实施方案中,所述增强子元件是乙型肝炎翻译后调节元件(HPRE)或土拨鼠肝炎翻译后调节元件(WPRE)。
在本发明的一个实施方案中,所述载体包含左和右ITR区域;缺失的E1区域;至少部分缺失的E3区域;纤突区域;E4区域;两个表达盒,各自包含:启动子和至少一个目标抗原和,任选地,一个或多个增强子元件。将所述第一表达盒插入缺失的E1区域中,且将所述第二表达盒插入HE1位点处,即,在纤突基因的终止密码子和E4区域之间(“HE1位点”)。ChAd155 HE1插入位点在野生型ChAd155序列的bp 34611和34612之间。ChAd83 HE1插入位点在野生型ChAd83序列的bp 33535和33536之间。在向右和向左方向发生翻译。在一个进一步实施方案中,所述启动子是CMV启动子。在一个优选实施方案中,一个启动子是CMV启动子,且另一个是eCMV启动子。在又一个进一步实施方案中,所述增强子元件是HPRE或WPRE。
在一个进一步实施方案中,所述载体包含左和右ITR区域;缺失的E1区域;至少部分缺失的E3区域;纤突区域;E4区域;两个表达盒,各自包含:启动子,至少一个目标抗原和,任选地,一个或多个增强子元件。所述第一表达盒被插入缺失的E1区域中,且所述第二表达盒被插入HE2位点处,即,在左ITR的末端和E4 mRNA的帽位点之间(“HE2位点”)。ChAd155HE2插入位点在野生型ChAd155序列的bp 37662和37663之间。ChAd83 HE2插入位点在野生型ChAd83序列的bp 36387和36388之间。在向右和向左方向发生翻译。在一个进一步实施方案中,所述启动子是CMV启动子。在一个优选实施方案中,一个启动子是CMV启动子,且另一个是eCMV启动子。在又一个进一步实施方案中,所述增强子元件是HPRE或WPRE(所述增强子元件增加转基因的表达)。
所述HE1和HE2位点被鉴定为转基因的插入位点,因为在这些特定点中的插入并不中断ChAd155和ChAd83的编码序列或调节序列。因此,将表达盒插入ChAd基因组的HE1或HE2位点并不影响病毒复制周期。
在本发明的一个实施方案中,所述载体是腺病毒载体的功能性或免疫原性衍生物。“腺病毒载体的衍生物”意指载体的修饰形式,例如,所述载体的一个或多个核苷酸被缺失、插入、修饰或取代。
调节元件
调节元件,即,表达控制序列,包括适当的转录起始、终止、启动子和增强子序列;有效的RNA加工信号诸如剪接和聚腺苷酸化(聚A)信号,包括兔β-珠蛋白聚A;四环素可调节系统、微RNA、转录后调节元件(例如WPRE、土拨鼠肝炎病毒的转录后调节元件);稳定细胞质mRNA的序列;增强翻译效率的序列(例如,Kozak共有序列);增强蛋白稳定性的序列;和当期望时,增强编码的产物的分泌的序列。
“启动子”是允许RNA聚合酶的结合并指导基因的转录的核苷酸序列。通常,启动子位于靠近转录起始位点的基因的非编码区域中。在转录的起始中发挥功能的启动子内的序列元件经常通过共有核苷酸序列表征。启动子的实例包括但不限于来自细菌、酵母、植物、病毒和哺乳动物(包括猿猴和人)的启动子。大量表达控制序列(包括内部的、天然的、组成型的、诱导型的和/或组织特异性的启动子)是本领域中已知的,并且可以被利用。
本发明的启动子通常将是异源启动子。本发明的启动子可以是组成型的。
启动子的实例包括但不限于来自细菌、酵母、植物、病毒和哺乳动物(包括人)的启动子。
启动子的实例包括但不限于,TBG启动子、逆转录病毒劳斯肉瘤病毒LTR启动子(任选地与增强子一起)、巨细胞病毒(CMV)启动子(任选地与CMV增强子一起,参见,例如,Boshart等人, Cell, 41:521-530 (1985))、CASI启动子、SV40启动子、二氢叶酸还原酶启动子、β-肌动蛋白启动子、磷酸甘油激酶(PGK)启动子和EF1a启动子(Invitrogen)。
合适的启动子包括巨细胞病毒(CMV)启动子和CASI启动子。所述CMV启动子是强烈且普遍活性的。其具有在许多组织类型中驱动高水平的转基因表达的能力,并且是本领域中众所周知的。所述CMV启动子可以在有或没有CMV增强子的情况下用于本发明的载体中。
所述CASI启动子是合成启动子,其被描述为CMV增强子、鸡β-肌动蛋白启动子和侧接泛素(UBC)增强子的剪接供体和剪接受体的组合(US 8865881)。
在一些实施方案中,所述CASI启动子可以包括与SEQ ID NO:3具有至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或更多序列同一性的核酸序列。在一些实施方案中,所述启动子包含SEQ ID NO:3的核酸序列或由其组成。
在一些实施方案中,所述增强的hCMV启动子可以包括与SEQ ID NO:6具有至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或更多序列同一性的核酸序列。在一些实施方案中,所述启动子包含SEQ ID NO:6的核酸序列或由其组成。
任选地,携带编码治疗上有用的或免疫原性的产物的转基因的载体还可以包括选择标记或报道基因。所述报道基因可以选自本领域中已知的那些。合适的报道基因包括,但不限于,增强的绿色荧光蛋白、红色荧光蛋白、荧光素酶和分泌的胚胎碱性磷酸酶(seAP),其可以包括编码遗传霉素、潮霉素或嘌呤霉素抗性的序列,以及其他。此类选择报道物或标记基因(其可以位于或不位于待包装至病毒颗粒中的病毒基因组之外)可以用于发出质粒在细菌细胞中的存在的信号,诸如氨苄青霉素抗性。所述载体的其他组分可以包括复制起点。
如本文所用的“转录后调节元件”是这样的DNA序列,其在转录时增强通过本发明的病毒载体递送的一种或多种转基因或其片段的表达。转录后调节元件包括但不限于乙型肝炎病毒转录后调节元件(HPRE)和土拨鼠肝炎转录后调节元件(WPRE)。WPRE是三部分顺式作用元件,其已被证明增强由某些(但不是全部)启动子驱动的转基因表达。
在本发明的实施方案中,ChAd155载体可以包含启动子、增强子和报道基因中的一种或多种。例如,本发明的载体可以包含ChAd155-增强的hCMV-SeAP、ChAd155-CASI-seAP和ChAd155-hCMV-seAP(其任选地具有四环素开/关转录控制),以及ChAd155–CMV-hFerL-chEF1-seAP(其具有四环素开/关转录控制)。
在本发明的实施方案中,ChAd83载体可以包含启动子、增强子和报道基因中的一种或多种。例如,本发明的载体可以包含ChAd155-增强的hCMV SeAP、ChAd83增强的hCMVSeAP、ChAd155-CASI-seAP和ChAd83-hCMV-seAP(其任选地具有四环素开/关转录控制),以及ChAd83 –CMV-hFerL-chEF1-seAP(其具有四环素开/关转录控制)。
使用本文提供的技术,结合本领域技术人员已知的技术,生成本发明的载体。此类技术包括cDNA的常规克隆技术(诸如在教科书中描述的那些)、腺病毒基因组的重叠寡核苷酸序列的使用、聚合酶链式反应、和提供期望的核苷酸序列的任何合适方法。
转基因
“转基因”是编码目标多肽的核酸序列,其与侧接所述转基因的载体序列异源。核酸编码序列以允许宿主细胞中的转基因转录、翻译和/或表达的方式可操作连接至调节组分。在本发明的实施方案中,所述载体以治疗或预防水平表达转基因。转基因多肽的“功能衍生物”是多肽的修饰形式,例如,其中一个或多个氨基酸被缺失、插入、修饰或取代。
所述转基因可用于预防或治疗,例如,作为用于诱导免疫应答的疫苗,以通过校正或替换缺陷或缺失的基因来校正遗传缺陷,或作为癌症治疗剂。如本文所用,免疫应答的诱导是指蛋白诱导针对该蛋白的T细胞和/或体液抗体免疫应答的能力。
由转基因引发的免疫应答可以是抗原特异性B细胞应答,其产生中和抗体。引发的免疫应答可以是抗原特异性T细胞应答,其可以是全身性应答和/或局部应答。抗原特异性T细胞应答可以包括CD4+ T细胞应答,诸如涉及表达细胞因子(例如干扰素γ(IFNγ)、肿瘤坏死因子α(TNFα)和/或白介素2(IL2))的CD4+ T细胞的应答。可替代地或另外地,所述抗原特异性T细胞应答包括CD8+ T细胞应答,诸如涉及表达细胞因子(例如IFNγ、TNFα和/或IL2)的CD8+ T细胞的应答。
转基因序列的组成将取决于将向其中放置所得载体的用途。在一个实施方案中,所述转基因是编码在生物学和医学中有用的产物的序列,诸如预防性转基因、治疗性转基因或免疫原性转基因,例如蛋白或RNA。蛋白转基因包括抗原。本发明的抗原性转基因诱导针对引起疾病的生物体的免疫原性应答。
本发明的转基因包括,但不限于,狂犬病病毒抗原,例如,狂犬病糖蛋白(RG),呼吸道合胞病毒(RSV)抗原,人免疫缺陷病毒(HIV)抗原或其片段。
作为遗传密码中的冗余的结果,多肽可以由各种不同的核酸序列编码。编码偏向于与其他相比更多地使用一些同义密码子(即编码相同氨基酸的密码子)。“密码子优化的”意指在不改变氨基酸序列的情况下对重组核酸的密码子组成进行修饰。密码子优化已用于通过使用生物体特异性的密码子使用频率来提高不同生物体中的mRNA表达。
除了密码子偏爱之外,且与密码子偏爱无关,比其他更频繁地使用一些同义密码子对。此密码子对偏爱意味着一些密码子对被代表过多,而其他被代表不足。密码子对去优化已被用于减少病毒毒力。例如,已报道,与野生型脊髓灰质炎病毒相比,经修饰以含有代表不足的密码子对的脊髓灰质炎病毒证明降低的翻译效率并且被减毒(Science (2008)320:1784)。通过密码子对去优化工程改造合成的减毒病毒可以产生编码与野生型相同的氨基酸序列、但使用同义密码子的不同成对排列的病毒。通过密码子对去优化减毒的病毒生成与野生型相比减少最多达1000倍的噬斑,产生更少的病毒颗粒,并且需要多达约100倍的病毒颗粒来形成噬斑。
相反,经修饰以含有在人基因组中过度代表的密码子对的脊髓灰质炎病毒以类似于野生型RNA的方式起作用,并且生成大小与野生型RNA相同的噬斑(Coleman等人 (2008)Science 320:1784)。发生这种情况,尽管存在以下事实:具有过度代表的密码子对的病毒含有与具有不足代表的密码子对的病毒类似数目的突变,并且证明与野生型相比增强的翻译。该观察表明,会预期密码子对优化的构建体以类似于其非密码子对优化的对应物的方式起作用,并且不会期望其提供功能优势。不希望受理论束缚,这可能是因为自然进化已经优化密码子配对。
本发明的构建体可以包含密码子优化的核酸序列。可替代地或另外地,本发明的载体包含转基因或其免疫原性衍生物或片段的密码子优化的序列。本发明的构建体可以包含密码子对优化的核酸序列。可替代地或另外地,本发明的载体包含转基因或其免疫原性衍生物或片段的密码子对优化的序列或由其组成。
呼吸道合胞病毒(RSV)转基因
在一个实施方案中,本发明提供了包含两个表达盒的重组猿猴来源的腺病毒载体在治疗或预防RSV感染中的用途,其中每个表达盒都包含源自人呼吸道合胞病毒(RSV)的免疫原性转基因。在一个实施方案中,本发明的重组猿猴来源的腺病毒载体在所述表达盒之一中包含RSV F抗原,且在另一表达盒中包含另一RSV病毒抗原。合适的抗原在下面进一步讨论。在一个实施方案中,重组猿猴来源的腺病毒载体在第二表达盒中包含RSV M和N抗原。在此类实施方案中,所述载体优选地编码RSV F0ΔTM抗原(缺失跨膜区和细胞质区的融合(F)蛋白)和RSV M2-1(转录抗终止)和N(核衣壳)抗原。
RSV的感染并不赋予完全的保护性免疫力。婴儿期的感染随后为症状性RSV再感染,其在整个成年期继续。这些再感染通常未被诊断,因为它们通常呈现为常见的急性上呼吸道感染。然而,在更脆弱的人(例如,免疫受损的成人或老年人)中,再感染也可导致严重的疾病。免疫系统的两个分支(体液和细胞免疫)均参与免于严重疾病的保护[Guvenel AK,Chiu C和Openshaw PJ. Current concepts and progress in RSV vaccinedevelopment. Expert Rev Vaccines. 2014; 13(3): 333-44.]。
体液免疫应答能够中和病毒并抑制病毒复制,由此在针对下呼吸道RSV感染和严重疾病的保护中发挥主要作用[Piedra PA, Jewell AM, Cron SG, 等人, Correlates ofimmunity to respiratory syncytial virus (RSV) associated-hospitalization:establishment of minimum protective threshold levels of serum neutralizingantibodies. Vaccine. 2003; 21(24): 3479-82.]。预防性给予的免疫球蛋白G (IgG)RSV-中和单克隆抗体(Synagis)的形式的被动免疫已显示在具有支气管肺发育不良或潜在心肺疾病的早产婴儿和新生儿中在一定程度上预防RSV疾病[Cardenas S, Auais A和Piedimonte G. Palivizumab in the prophylaxis of respiratory syncytial virusinfection. Expert Rev Anti Infect Ther. 2005; 3(5): 719-26]。
T细胞也参与RSV疾病的控制。已经在具有低CD8 T细胞计数的患者中描述了致死性RSV感染,如在严重联合免疫缺陷、骨髓和肺移植受体的情况下[Hertz,1989]。新生儿的RSV感染的致死性病例的组织病理学显示肺部浸润物中存在相对少量的CD8 T细胞[Welliver TP, Garofalo RP, Hosakote Y, 等人, Severe human lower respiratorytract illness caused by respiratory syncytial virus and influenza virus ischaracterized by the absence of pulmonary cytotoxic lymphocyte responses. JInfect Dis. 2007. 195(8): 1126-36.]。此外,产生干扰素-γ(IFN-γ)的CD8 T细胞的存在已经与RSV的动物模型中的Th2应答减少和嗜酸性粒细胞减少相关[Castilow EM和VargaSM. Overcoming T cell-mediated immunopathology to achieve safe RSVvaccination. Future Virol. 2008; 3(5): 445-454; Stevens WW, Sun J, CastilloJP, 等人, Pulmonary eosinophilia is attenuated by early responding CD8(+)memory T cells in a murine model of RSV vaccine-enhanced disease.Viral Immunol. 2009; 22(4): 243-51]。
可用作免疫原以免疫人或非人动物的RSV的合适的抗原可以选自:融合蛋白(F)、附着蛋白(G)、基质蛋白(M2)和核蛋白(N)。术语“F蛋白”或“融合蛋白”或“F蛋白多肽”或“融合蛋白多肽”是指具有RSV融合蛋白多肽的氨基酸序列的全部或部分的多肽或蛋白。类似地,术语“G蛋白”或“G蛋白多肽”是指具有RSV附着蛋白多肽的氨基酸序列的全部或部分的多肽或蛋白。术语“M蛋白”或“基质蛋白”或“M蛋白多肽”是指具有RSV基质蛋白的氨基酸序列的全部或部分的多肽或蛋白,且可以包括M2-1 (其可以在本文中书写为M2.1)和M2-2基因产物中的任一种或两种。同样地,术语“N蛋白”或“核衣壳蛋白”或“N蛋白多肽”是指具有RSV核蛋白的氨基酸序列的全部或部分的多肽或蛋白。
主要基于G糖蛋白的抗原性的差异,已经描述了两组人RSV毒株,A和B组。迄今为止已经分离了许多RSV毒株,其中任何在本文公开的免疫原性组合的抗原的背景下都是合适的。由GenBank和/或EMBL登录号指示的示例性毒株可以见于美国公开的申请号2010/0203071 (WO2008114149),其通过引用并入本文,用于公开适合用于本发明中的RSV F和G蛋白的核酸和多肽序列的目的。在一个实施方案中,所述RSV F蛋白可以是RSV F蛋白的胞外结构域(F0ΔTM)。
示例性的M和N蛋白核酸和蛋白序列可以见于,例如,美国公开的申请号2014/0141042 (WO2012/089833),其并入本文,用于公开适合用于本发明中的RSV M和N蛋白的核酸和多肽序列的目的。
合适地,为了在本发明中一起使用,转基因核酸编码RSV F抗原和RSV M和N抗原。更具体地,所述核酸编码RSV F0ΔTM抗原(缺失跨膜和细胞质区域的融合(F)蛋白)和RSVM2-1(转录抗终止)和N(核衣壳)抗原。
缺失跨膜和细胞质区域的融合(F)蛋白(F0ΔTM)
RSV F蛋白是主要的表面抗原并且介导病毒与靶标细胞的融合。F蛋白是在RSV亚组和毒株中高度保守的抗原。F蛋白是中和抗体(包括预防性RSV中和单克隆抗体Synagis)的靶标。跨膜区域和细胞质尾部的缺失允许F0ΔTM蛋白的分泌。识别F蛋白的这种可溶形式的中和抗体,包括Synagis,在体外抑制RSV感染性[Magro M, Andreu D, Gómez-Puertas P, 等人, Neutralization of human respiratory syncytial virus infectivity byantibodies and low-molecular-weight compounds targeted against the fusionglycoprotein. J Virol. 2010; 84(16): 7970-82]。
核衣壳(N)蛋白
N蛋白是内部(未暴露的)抗原,在RSV毒株之间高度保守,并且已知是许多T细胞表位的来源。N蛋白对于RSV基因组的复制和转录是必需的。N蛋白的主要功能是为了RNA转录、复制和包装的目的而包装病毒基因组并保护其免受核糖核酸酶的影响。
转录抗终止(M2-1)蛋白
M2-1蛋白是转录抗终止因子,其对于全长信使RNA (mRNA)的有效合成以及多顺反子通读mRNA(其为非区段负链RNA病毒特征性的)的合成是重要的。M2-1是内部(未暴露的)抗原,其在RSV毒株之间高度保守,并且已知是许多T细胞表位的来源。
N-M2-1融合蛋白
编码接头的多核苷酸位于编码RSV N抗原或其片段的多核苷酸和编码RSV M2.1抗原或其片段的多核苷酸之间。因此,在某些优选实例中,表达盒含有编码融合的RSV病毒蛋白N-接头-M2.1的转基因。优选的是,所述接头是柔性接头,优选包含根据SEQ ID NO:11 (Gly-Gly-Gly-Ser-Gly-Gly-Gly)或SEQ ID NO:12 (Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly)的氨基酸序列的柔性接头。
乳头瘤(PV)转基因
在一个实施方案中,本发明提供了包含两个表达盒的重组猿猴来源的腺病毒载体在治疗或预防乳头瘤病毒诱导的疾病中的用途,其中每个表达盒都包含源自乳头瘤病毒(PV)的免疫原性转基因。合适地,本发明的重组猿猴来源的腺病毒载体包含所述表达盒之一中的修饰的乳头瘤病毒E1抗原和另一表达盒中的修饰的乳头瘤病毒E2抗原。
人乳头瘤病毒(HPV)是小DNA病毒,其感染粘膜和/或皮肤(cutaneous skin)并引起多种疾病病况,包括宫颈赘生物、宫颈癌和其他肛殖癌。已知超过40种类型的HPV感染人的肛殖道,并且约15种高风险HPV基因型与人宫颈癌因果相关。大多数宫颈上皮的HPV感染在两年时段内是亚临床的(subclinal),并且是自解决的。然而,高风险HPV类型的持续感染可以引起病变并进展为侵袭性癌症。
可用作免疫原的HPV的合适抗原描述于WO2018060288中,并且尤其包括HPV E1和E2蛋白。
狂犬病(RG)转基因
狂犬病病毒是弹状病毒科中的一种有包膜的、单链RNA病毒。狂犬病病毒属的成员引起狂犬病,并且具有所有已知的人病毒病原体中最高的死亡率。狂犬病经由受感染哺乳动物的唾液传播。一种嗜神经性病毒,其进入其宿主的神经系统,引起几乎总是致命的脑脊髓炎。目前,全世界每年存在约60,000例狂犬病死亡,主要由亚洲和非洲的发展中国家的狗咬伤以及北美的野生动物和蝙蝠引起。
狂犬病以狂怒或麻痹的形式呈现。潜伏期在约五天和几年之间变化,但通常在约20和90天之间。临床疾病最经常始于不适、厌食、疲劳、头痛和发烧的前驱抱怨,随后为在暴露部位处的疼痛或麻木(parathesia)。焦虑、烦乱或易怒在该时段期间可能是明显的,随后是过度活跃、迷失方向、癫痫、恐水病、唾液分泌过多,和最终麻痹、昏迷和死亡。
狂犬病抗原可以源自狂犬病病毒糖蛋白(RG)。例如,狂犬病糖蛋白可以用作模型抗原。
腺病毒载体的递送
在一些实施方案中,本发明的重组腺病毒载体通过表皮施用、皮内施用、肌肉内注射、腹膜内注射、静脉内注射、经鼻施用、经口施用、直肠施用、皮下注射、经皮施用或阴道内施用,而施用于受试者。
在本发明的一个实施方案中,所述载体可以肌肉内(IM)施用,即,直接注射入肌肉。肌肉血管形成良好,并且摄取通常快速。
佐剂
建立对特定病原体的强烈且持久的免疫力的方法包括向疫苗中添加佐剂。“佐剂”意指增强、刺激、活化、加强或调节针对组合物的活性成分的免疫应答的试剂。佐剂作用可以在细胞或体液水平或两者上发生。佐剂刺激免疫系统针对实际抗原的应答,但本身没有免疫作用。可替代地或另外地,本发明的佐剂化组合物可以包含一种或多种免疫刺激剂。“免疫刺激剂”意指无论是与抗原一起施用还是分开施用均诱导受试者的免疫应答的总体暂时性增加的试剂。
本发明的组合物可以与或不与佐剂一起施用。可替代地或另外地,所述组合物可以包含一种或多种佐剂(例如疫苗佐剂)或与一种或多种佐剂(例如疫苗佐剂)结合施用,具体而言,所述组合物包含免疫学有效量的本发明的编码转基因的载体。
使用方法
提供了用于在有此需要的受试者中诱导针对由病原体引起的疾病的免疫应答的方法,其包括施用免疫有效量的如本文所公开的构建体或组合物的步骤。在一些实施方案中,提供了本文公开的构建体或组合物用于在有此需要的受试者中诱导针对转基因抗原的免疫应答的用途。本发明的载体可以应用于预防、治疗或改善由于感染导致的疾病。
本发明的方法包括本发明的载体在医学中的用途。它们包括本发明的载体用于治疗由病原体引起的疾病的用途。本发明的载体可用于制备用于治疗由病原体引起的疾病的药物。本发明的载体可用于制备用于预防或治疗疾病、例如由呼吸道合胞病毒(RSV)引起的疾病的药物。
用腺病毒载体的有效免疫取决于腺病毒载体骨架的内在免疫调节能力。免疫学效力较低的腺病毒诱导较少的抗原表达。有效的免疫还取决于启动子驱动强烈且持续的转基因表达的能力。例如,由巨细胞病毒立即早期(CMV-IE)启动子驱动的腺病毒载体并不维持长期的转基因表达,因为它们诱导抑制表达的细胞因子。
“受试者”意欲为脊椎动物,诸如哺乳动物,例如人或兽医哺乳动物。在一些实施方案中,所述受试者是人。
通用
使用本文提供的技术和序列,结合本领域技术人员已知的技术,生成本发明的载体。此类技术包括cDNA的常规克隆技术(诸如在教科书中描述的那些)、腺病毒基因组的重叠寡核苷酸序列的使用、聚合酶链式反应、和提供期望的核苷酸序列的任何合适方法。
除非另有解释,否则本文使用的所有技术和科学术语具有与本公开所属领域普通技术人员通常理解的相同的含义。单数形式“一个/种(a)”、“一个/种(an)”和“该/所述”包括复数对象,除非上下文另有清楚指出。类似地,词语“或”意欲包括“和”,除非上下文另有清楚指示。术语“多个/种”是指两个/种或更多个/种。此外,关于物质的浓度或水平(诸如溶液组分浓度或其比率)和反应条件(诸如温度、压力和循环时间)给出的数值限值,意欲是近似的。本文使用的术语“约”意指量±10%。
现在将借助于以下非限制性实施例进一步描述本发明。
实施例
实施例1:用单一表达盒构建黑猩猩腺病毒
使用标准程序从健康黑猩猩分离野生型黑猩猩腺病毒类型155 (ChAd155) (WO 2016/198621)和类型83 (ChAd83) (WO 2010/086189),并如Sci Transl Med (2012) 4:1和WO2010/086189中所述进行构建。
在实施例1中,通过插入单一转基因表达盒各自构建ChAd155和ChAd 83载体。表达盒组分使用经典的人CMV启动子或CASI启动子,作为模型抗原的狂犬病糖蛋白和任选地WPRE增强子。针对转基因盒测试三个不同的插入位点:
(i)用转基因盒替换E3区域,
(ii)将转基因盒插入纤突和E4区域之间(位点HE1),和
(iii)将转基因盒插入右ITR的下游(位点HE2)。
这些插入位点的该编号对应于图1的举例说明,其中:
(i)顶部小图举例说明RC1载体,其中转基因盒替换E3区域,
(ii)中间小图举例说明RC3载体,其中将转基因盒插入在纤突基因的终止密码子和E4区域之间(位点HE1),且
(iii)底部小图举例说明RC2载体,其中将转基因盒插入右ITR的下游(位点HE2)。
在实施例1中显示的载体中,E1区域在所有构型中都保持完整。
通过同源重组技术将转基因插入SEQ ID NO:1和SEQ ID NO:2的以下位置中:
HE1 ChAd155:在SEQ ID NO:1的bp 34611和34612之间的插入位点;
HE2 ChAd155:在SEQ ID NO:1的bp 37662和37663之间的插入位点;
HE1 ChAd83:在SEQ ID NO:2的bp 33535和33536之间的插入位点;
HE2 ChAd83:在SEQ ID NO:2的bp 36387和36388之间的插入位点。
当将转基因盒插入HE1位点时,ChAd155无法复制。然而,将转基因盒插入ChAd83的HE1位点产生可行的载体。
实施例2:实施例1的载体的病毒产生、载体滴度和表达
为了鉴定其中评估载体复制的动物模型,在各种动物来源的细胞中评价实施例1的C型腺病毒ChAd155 RC2和E型腺病毒ChAd83 RC2载体的复制能力,其通过载体滴度和基因组拷贝数测量。结果显示于表1中。
表1. 实施例1的RC2 ChAd155和RC2 ChAd83的复制和表达
如表1中所示,人MRC5细胞和猪PK15细胞产生ChAd155和ChAd83两者的高载体滴度和高基因组拷贝数。鼠NMuLi和非人灵长类Vero细胞也产生RC ChAd155,但程度低于人或猪细胞。RC ChAd83在鼠NMuLi细胞中以及(令人惊讶地)在非人灵长类Vero细胞中无法良好生长。
人MRC5、小鼠NMuLi和非人灵长类Vero细胞支持RC ChAd155的表达,直至第7天。人MRC5细胞支持RC ChAd83的表达,直至第7天,如同在小鼠NMuLi和非人灵长类Vero细胞中一样,但程度低于人细胞。
病毒产生
图2A显示由以ChAd155或ChAd83(其各自包含实施例1的RC1或RC2载体构建体)感染的人原代MRC5细胞产生的病毒的量。感染后7天收获细胞,并且在三个冷冻-解冻循环后获得的细胞裂解物中评估载体滴度。通过用针对相应启动子区域设计的引物的定量PCR (QPCR)分析来测量载体滴度。感染复数(moi)为每个细胞1250个病毒颗粒。在条形上方,病毒产量以病毒颗粒数/细胞(vp/细胞)指示。
人MRC5细胞支持包含RC1 (2.17 x 103 vp/细胞)或RC2 (4.40 x 103 vp/细胞)的ChAd155的产生,并且还支持包含RC1 (1.18 x 104 vp/细胞)或RC2 (1.06 x 105 vp/细胞)的ChAd83的产生。如图2A中所示,ChAd83以比ChAd155更高的水平产生;包含RC2的ChAd83载体是四种病毒/载体组合中最稳健的。
图2B显示由以包含实施例1的RC1、RC2或RC3载体构建体的ChAd83感染的人原代MRC5细胞产生的病毒的量。感染后2天和7天收获细胞。如同图2A,通过用针对相应启动子区域设计的引物的定量PCR (QPCR)分析来测量载体滴度。感染复数(moi)为每个细胞250或1250个病毒颗粒。在条形上方,病毒产量以病毒颗粒数/细胞(vp/细胞)指示。
人MRC5细胞支持包含RC1、RC2或RC3的ChAd83的产生。如图2B中所示,RC2和RC3ChAd83载体的病毒产量高于RC1载体。ChAd83 RC2 HE2载体的病毒产量也高于RC3 HE1载体。
载体基因组拷贝数
感染后,载体在细胞中复制,并且载体基因组拷贝数可以通过QPCR测量。甚至在不完全允许病毒复制和繁殖的细胞中也可以发生载体DNA复制。载体DNA的QPCR提供了在感染细胞内的载体复制的量度,其与病毒完成复制周期并作为成熟病毒后代释放的能力无关。因此,可以在不允许ChAd病毒复制或繁殖的动物物种、组织类型和细胞类型中定量载体复制。
与载体滴度平行地测量载体基因组拷贝数,并且结果显示于图3A和图3B中。
关于图2A中显示的病毒产量,人MRC5细胞用ChAd155或ChAd83(其各自包含实施例1的RC1或RC2载体构建体)感染。感染后7天收获细胞,提取总DNA,通过QPCR定量病毒基因组,并且结果表示为每个细胞的载体基因组拷贝。所述感染复数(moi)是每个细胞250个病毒颗粒,并且每个细胞的病毒颗粒数目在表示每个细胞的病毒基因组拷贝数的条形上方指示。所述拷贝数与转基因表达的水平成正比。
如图3A中所示,通过ChAd155的RC1 (6.21 x 103 vp/细胞)和RC2 (6.71 x 103vp/细胞)的病毒DNA复制的量是相似的。ChAd83比ChAd155产生更多的RC1 (2.76 x 104vp/细胞)和RC2 (9.19 x 104 vp/细胞)病毒DNA。通过ChAd83 RC2观察到最高水平的病毒DNA复制。
关于图2B中显示的病毒产量,人MRC5细胞用包含实施例1的RC1、RC2或RC3载体构建体的ChAd83感染。感染后2天和7天收获细胞,提取总DNA,通过QPCR定量病毒基因组,并且结果表示为每个细胞的载体基因组拷贝。所述感染复数(moi)是每个细胞250或1250个病毒颗粒,并且每个细胞的病毒颗粒数目在表示每个细胞的病毒基因组拷贝数的条形上方指示。所述拷贝数与转基因表达的水平成正比。
如图3B中所示,RC2和RC3 ChAd83载体的病毒DNA复制的量高于RC1载体。RC2和RC3ChAd83载体之间存在相当的病毒DNA复制。
实施例3:实施例1的载体的腺病毒基因组拷贝数
在源自小鼠和非人灵长类两者的细胞培养物中评估具有实施例1的构建体的能够复制的腺病毒载体的效率,其表示为每个细胞的载体拷贝数。
图4(a)显示在单层中生长并用ChAd155 RC1、ChAd155 RC2、ChAd83 RC1或ChAd83RC2以每个细胞250个病毒颗粒的感染复数感染的鼠肝NMuLi细胞中生长的能够复制的载体的基因组拷贝数。在感染后五天提取总DNA,并通过使用与载体的启动子区域退火的引物的QPCR测量载体复制。
表示为每个细胞的载体拷贝数的结果显示于图4(a)中。ChAd155在NMuLi细胞中以高效扩增RC1和RC2载体两者。ChAd155在近似相同的程度上复制RC1 (1.73 x 104)和RC2(1.92 x 104)载体。在复制RC1和RC2载体中,ChAd83没有ChAd155那么有效。ChAd83在鼠细胞中仅以少量复制载体DNA。RC1载体以每个细胞5.47 x 102个拷贝的水平复制,且RC2载体以每个细胞6.74 x 102个拷贝的水平复制。
非人灵长类Vero细胞也以单层生长,并且被ChAd155 RC1、ChAd155 RC2、ChAd83RC1或ChAd83 RC2感染(图4(b))。使用两种不同的感染复数:每个细胞50和250个病毒颗粒。在感染后五天提取总DNA,并通过使用与载体的启动子区域退火的引物的QPCR测量载体复制。
表示为每个细胞的载体拷贝数的结果显示于图4(b)中。Vero灵长类细胞系对于ChAd155 RC1(在50的moi下为每个细胞3.71 x 103个拷贝,并且在250的moi下为每个细胞4.93 x 104个拷贝)和ChAd155 RC2(在50的moi下为每个细胞8.15 x 103个拷贝,并且在250的moi下为每个细胞7.05 x 104个拷贝)是容许的。Vero灵长类细胞系对于ChAd83 RC1或ChAd83 RC2的容许性差(如果有的话)。在50的moi下,没有检测到从Vero细胞表达ChAd83RC1或ChAd83 RC2载体。在250的moi下,ChAd83以每个细胞1.13 x 102个拷贝的水平复制RC1载体,且以每个细胞1.29 x 103个拷贝的水平复制RC2载体。
实施例4:实施例1的载体的来自鼠和非人灵长类细胞的转基因表达
进行Western印迹分析以比较鼠NMuLi细胞中ChAd155 RC1和ChAd155 RC2的转基因表达的水平(图5(a))。用ChAd155 RC1或ChAd155 RC2以每个细胞50、250或1250个病毒颗粒的感染复数感染细胞。在感染后2天和5天收获细胞,使用标准方法制备提取物,并将等量的总细胞提取物上样至SDS-PAGE凝胶上。在电泳分离后,将蛋白转移至硝酸纤维素膜上,然后将其用市售的针对狂犬病糖蛋白转基因的单克隆抗体进行探测。
图5(a)证明ChAd155 RC1和ChAd155 RC2两者均在鼠NMuLi细胞中表达转基因。在感染后2天和5天两者均观察到表达,由约51 kDa的条带指示,其对应于狂犬病糖蛋白(RG)的预期分子量。在感染后2天和5天两者,ChAd155 RC2载体产生比ChAd155 RC1载体更高水平的转基因表达。
然后进行Western印迹分析以比较鼠NMuLi细胞中ChAd155 RC1、ChAd155 RC2、ChAd83 RC1和ChAd83 RC2的转基因表达的水平(图5(b))。用ChAd155 RC1、ChAd155 RC2、ChAd83 RC1或ChAd83 RC2以每个细胞50、250或1250个病毒颗粒(对于ChAd83 RC1为250和1250)的感染复数感染细胞。处理细胞用于western印迹。在感染后2天和7天收获细胞,使用标准方法制备提取物,并将等量的提取物上样至SDS-PAGE凝胶上。在电泳分离后,将蛋白转移至硝酸纤维素膜上,然后将其用市售的针对狂犬病糖蛋白转基因的单克隆抗体进行探测。
图5(b)证明ChAd155 RC1、ChAd155 RC2、ChAd83 RC1和ChAd83 RC2在鼠NMuLi细胞中表达转基因。在感染后2天和5天两者均观察到表达,由约51 kDa的条带指示,其对应于狂犬病糖蛋白(RG)的预期分子量。ChAd155证明比ChAd83更有效的转基因表达。在感染后2天,甚至在50 vp/细胞的低复数,也观察到ChAd155 RC2的稳健的转基因表达,而在较高moi首先观察到ChAd155 RC1的稳健的转基因表达。而且,在ChAd155和ChAd83病毒血清型两者中,RC2证明比RC1更有效的转基因表达。在每次直接比较中,RC2比RC1更稳健地表达。
进行Western印迹分析以比较MRC5细胞中ChAd83 RC1、RC2和RC3的转基因表达的水平(图5(c))。用ChAd83 RC1、RC2或RC3以每个细胞250或1250个病毒颗粒的感染复数感染细胞。在感染后2天和7天收获细胞,使用标准方法制备提取物,并将等量的总细胞提取物上样至SDS-PAGE凝胶上。在电泳分离后,将蛋白转移至硝酸纤维素膜上,然后将其用市售的针对狂犬病糖蛋白转基因的单克隆抗体进行探测。
图5(c)证明ChAd83 RC1、RC2和RC3全部都在MRC5细胞中表达转基因。在感染后2天和7天两者均观察到表达,由约51 kDa的条带指示,其对应于狂犬病糖蛋白(RG)的预期分子量。在感染后2天和7天两者,ChAd83 RC2载体产生比ChAd83 RC1和RC3载体更高水平的转基因表达。在第7天,对于RC1和RC3载体没有检测到狂犬病糖蛋白。
实施例5: 具有单个表达盒的替代黑猩猩腺病毒的构建
如实施例1中,使用标准程序从健康黑猩猩分离的野生型黑猩猩腺病毒类型155(ChAd155) (WO 2016/198621)被构建为复制缺陷的病毒,如Sci Transl Med (2012) 4:1和WO 2010/086189中所述。
在实施例5中,通过插入单个转基因表达盒来构建ChAd155。该表达盒包含经典人CMV (hCMV)启动子、F0ΔTM、N和M2-1 RSV抗原,以及任选地WPRE增强子。该载体显示于图6中。将表达盒插入腺病毒的E1区域中(在E1区域已被缺失之后)。
图6中显示的ChAd155包含编码RSVF0ΔTM、M2-1和N抗原的全部的转基因,其中在RSVF0ΔTM抗原和复合RSV N.M2-1抗原之间包括自切割位点(“2A”),其中在RSV M2-1和N抗原之间包括柔性接头。
实施例5的ChAd155 RSV载体包含SEQ ID NO:4的多核苷酸并编码SEQ ID NO:5的多肽。
实施例6: 具有双重表达盒的黑猩猩腺病毒的构建
再次,使用标准程序从健康黑猩猩分离的野生型黑猩猩腺病毒类型155 (ChAd155)(WO 2016/198621)被构建为复制缺陷的病毒,如Sci Transl Med (2012) 4:1和WO 2010/086189中所述。
通过将两个转基因表达盒插入腺病毒中的两个不同位置中来构建实施例6的ChAd155:
(1) 第一表达盒组分包含经典的人CMV (hCMV)启动子和N.M2-1 RSV复合抗原。将该第一表达盒插入腺病毒的E1区域中(在E1区域已被缺失之后)。
(2) 第二表达盒包含增强的经典人CMV(增强的hCMV)启动子、F0ΔTM RSV抗原和WPRE增强子。将该第一表达盒插入腺病毒的HE2区域中(在HE2区域已被缺失之后)。
该包含双重表达盒的载体显示于图7中。
在图7的构建体中,Ad5E4orf6已被取代至早期基因4 (E4)区域中。所述取代是增加HEK 293细胞中的生产率必需的。
实施例7:来自实施例6的双重表达盒的转基因表达
进行Western印迹分析以将MRC5细胞中的实施例6的ChAd155载体(图中标记为“双重”或“双重盒”)中的转基因表达水平与以下中的转基因表达水平进行比较:
(i) 包含单个F表达盒的载体(ChAd155-F0ΔTM,标记为“F0ΔTm”),
(ii) 包含单个NM2表达盒的载体(ChAd155-NM2,标记为“NM2-1”),和
(iii) 实施例5的包含含有F和N.M2-1 RSV抗原的单个表达盒的载体(ChAd155-F0ΔTM.NM2,也标记为“RSV”)。
western印迹分析显示于图8和图9中。
如图8中所示,用ChAd155-F0ΔTM、ChAd155-F0ΔTM.NM2 (“RSV”)或实施例6的ChAd155双重盒以每个细胞500个病毒颗粒的感染复数感染细胞。另外,用ChAd155-F0ΔTM.NM2 (“RSV”)以每个细胞500或1250个病毒颗粒的感染复数感染细胞。在感染后48小时和96小时收获细胞,使用标准方法制备提取物,并将等量的总细胞提取物上样至SDS-PAGE凝胶上。
图8显示,ChAd155双重盒在MRC5细胞中提供了与ChAd155F0ΔTM相当且比ChAd155-FΔTM.NM2更高的F抗原的表达水平。
如图9中所示,用ChAd155-NM2、ChAd155-F0ΔTM.NM2 (“RSV”)或实施例6的ChAd155双重盒以每个细胞250和1250个病毒颗粒的感染复数感染细胞。在感染后48小时收获细胞,使用标准方法制备提取物,并将等量的总细胞提取物上样至SDS-PAGE凝胶上。
在图9中,ChAd155双重盒在MRC5细胞中提供了与ChAd155-NM2单一载体至少相当且比ChAd155-FΔTM.NM2 (“RSV”)更高的NM2-1表达水平。
实施例8:实施例6的双重表达盒的免疫原性
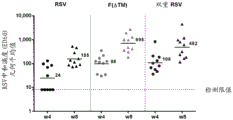
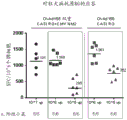
在CD1远交小鼠(每组10只)中评估实施例6的双重表达盒的免疫原性。通过将5x108个病毒颗粒肌肉内注射至小鼠中来进行实验。在免疫后4和8周通过测量RSV中和滴度来测量B-细胞应答。每个点代表单个小鼠中的应答,并且线对应于每个剂量组的平均值。该分析的结果显示于图10中。
图10显示,ChAd155双重盒提供了与ChAd155F0ΔTM相当且比由ChAd155-F0ΔTM.NM2 (“RSV”)产生的B-细胞应答更高的B-细胞应答。
还在BALB/c近交小鼠(每组48只、11只或8只)中评估实施例6的双重表达盒的免疫原性。通过肌肉内注射107或106个病毒颗粒来进行实验。免疫后3周通过使用在BALB/c小鼠中作图的M2肽T细胞表位的离体IFN-γ酶联免疫斑点(ELISpot)测量T-细胞应答。结果显示于图11中,表示为每百万个脾细胞的IFN-γ斑点形成细胞数(SFC)。每个点代表单个小鼠中的应答,并且线对应于每个剂量组的平均值。在x轴上显示以病毒颗粒的数目计的注射剂量。结果显示于图11中。
图11显示,ChAd155双重盒提供了比由单一盒ChAd155-F0ΔTM.NM2 (“三重RSV”,其结果从历史数据获得)产生的T-细胞应答更高的T-细胞应答。对于106 vp剂量,应答的该差异更大。
图11涉及“#阳性小鼠”,即对疫苗应答的小鼠的数目。
实施例9: 实施例6的双重表达盒在母牛中的免疫原性
研究设计在下表2中详述:
| <u>组</u> | <u>母牛数</u> | <u>疫苗</u> | <u>途径</u> | <u>剂量</u> | <u>免疫</u> | <u>研究结束</u> |
| Gp1 | 4 | ChAd155 单一RSV | 肌肉内(IM) | 1x10<sup>11</sup> | D0 | D90 |
| Gp2 | 4 | ChAd155双重RSV | 肌肉内(IM) | 1x10<sup>11</sup> | D0 | D90 |
| Gp3 | 4 | 盐水 | 肌肉内(IM) | N/A | D0 | D90 |
“ChAd155单一RSV”是实施例5的ChAd155,且“ChAd155双重RSV”是实施例6的ChAd155。
研究中纳入总共12只成年母牛。母牛年龄范围为2.7岁至7.8岁,且具有4.8岁的平均范围。
在将它们纳入研究之前,将母牛通过ELISA针对牛RSV (BRSV)抗体进行预筛选。这允许建立具有相似分布和平均BRSV Ab滴度的研究组(以便不偏重任何组)。
在接种疫苗前(D-5或D0)和接种疫苗后(D7、10、14、28、60、90)从母牛收集样品。在该研究中,在第0天(D0),将母牛用两种疫苗之一的1x10^11个病毒颗粒或用盐水接种疫苗。
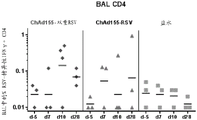
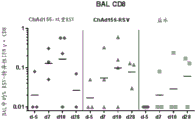
在接种疫苗后的第-5、7、10或28天进行支气管肺泡灌洗(BAL),以分离母牛的肺中的T细胞。然后使用细胞内细胞因子染色(ICS)检测用疫苗中编码的RSV抗原(以肽合并物的形式)刺激后的CD4+和CD8+ T细胞的IFN-γ细胞因子产生(即IFNɣ ICS用于检测动物中的肺T细胞应答)。该实验的结果显示于图12A和12B中。从该实验可以得出结论,ChAd155-双重RSV诱导支气管肺泡灌洗物(BAL)中的一致的RSV-特异性CD4+和CD8+应答。
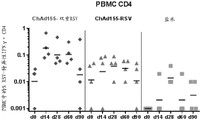
还在接种疫苗后第0、14、28、60和90天从母牛取血液样品,以便使用细胞内细胞因子染色(ICS)检测外周血单核细胞(PBMC)的RSV-特异性CD4+和CD+应答的IFN-γ细胞因子产生(即IFNɣ ICS用于检测外周T细胞应答)。该实验的结果显示于图13A和13B中。基于这些结果,可以得出结论,ChAd155-双重RSV一致地扩增PBMC中的预先存在的RSV-特异性CD4+和CD8+应答。
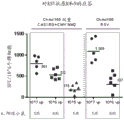
血液样品还用于检测血清中的RSV的中和抗体(nAbs)(即检测到外周体液应答)。该实验的结果显示于图14A和14B中。这些结果显示,ChAd155-双重RSV加强血清中的RSVnAb,其在接种疫苗后3个月维持在高于基线的水平。
实施例10: 编码狂犬病G和RSV NM2蛋白的ChAd155双重的免疫原性
该实验中构建的使用的三种不同的ChAd155载体:
• 编码狂犬病G (RG)和RSV NM2蛋白两者的ChAd155(在该实施例中称为“ChAd155双重”,和ChAd155双重hCMV NM 2-1 – CASI RG WPRE);
• 仅编码狂犬病G (RG)蛋白的ChAd155(在该实施例中称为“ChAd155 RG”,和ChAd155(∆E4)CASI RG WPRE);和
• 图6中显示的ChAd155载体,即具有编码RSV F0ΔTM、M2-1和N抗原的全部的转基因的载体(称为“ChAd155 RSV”)。
将三种不同剂量的ChAd155双重腺病毒施用于小鼠:最高剂量的107个病毒颗粒,和中等剂量的106个病毒颗粒和最低剂量的105个病毒颗粒。
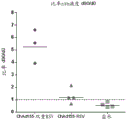
将两种不同剂量的ChAd155 RG和ChAd155 RSV载体施用于小鼠。对于ChAd155RSV,这是较高剂量的107个疫苗颗粒,和较低剂量的106个疫苗颗粒。对于ChAd155 RG,这是较高剂量的106个疫苗颗粒,和较低剂量的105个疫苗颗粒。3周后处死小鼠,并通过IFNγELISpot测试脾细胞的对疫苗编码的抗原的T细胞应答。
该实验的结果显示于图15A、15B和15C中。从图15A、15B和15C可以看出,ChAd155双重RG-NM2载体显示与单独编码RG和NM2抗原各自的载体总体相当的免疫应答。
图15C比较用于所有三种不同载体的通用106 vp剂量下对所有编码的抗原的累积应答。狂犬病G蛋白被列出两次(G1和G2),因为重叠肽的两种合并物用于覆盖该蛋白的整个序列。
因此,将两种抗原置于同一载体中仍产生相当的免疫应答,同时允许在同一载体中提供不同病原体的抗原。
实施例11: 编码狂犬病G和RSV NM2蛋白的ChAd155双重在HeLa细胞中的表达
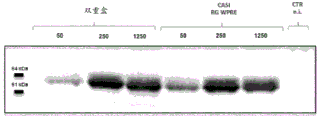
在实施例11的实验中,用实施例10中使用的纯化的“ChAd155双重”、“ChAd155 RG”和“ChAd155 RSV”感染HeLa细胞。
在该实验中使用50、250和1250的感染复数(MOI)。
为了获得图16A中显示的Western印迹(在还原条件下获得),感染后48小时收获细胞裂解物。NM2-1的估计大小为65 kDa。图16A显示ChAd155双重盒和ChAd155 NM2-1的相当的表达水平。另外,ChAd155双重盒的NM2-1表达水平高于ChAd155 RSV载体。
为了获得图16B中显示的Western印迹,在感染后48小时收获上清液。狂犬病糖蛋白的估计大小为57.6 kDa。图16B显示ChAd155双重和ChAd155 RG腺病毒的相当的表达水平。
此外,还使用四种不同的载体收集感染性数据。通过六邻体免疫染色法在附着的Procell 92细胞中评估纯化病毒的感染性。结果在下表3中给出(vp = 病毒颗粒,ifu = 感染单位,且R是这两个数字之间的比率)。感染性结果表明所有载体都具有相似的感染性。此外,由于所有R值都低于300,所以所有载体的感染性都被认为在可接受的范围内。
表 3:
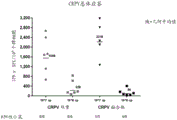
实施例12:编码CRPV E2和E1蛋白的ChAd155双重的免疫原性
在该实验中构建两种不同的ChAd155载体:
• 编码第一表达盒中的修饰的CRPV E2蛋白和第二表达盒中的修饰的CRPV E1蛋白的ChAd155(称为“CRPV双重”);和
• 编码单个表达盒中的修饰的CRPV E2和E1蛋白的融合体的ChAd155(称为“CRPV融合体”)
向小鼠施用两种不同剂量的两种腺病毒载体:较高剂量的107个病毒颗粒,和较低剂量的106个病毒颗粒。该实验的结果显示于图17中。图17是接种疫苗后3周对脾细胞进行的IFNγ ELISpot。对结果进行统计分析,并且来自不同载体的应答之间的差异不被认为是统计学显著的。然而,如从图17可以看出,与CRPV融合载体相比,ChAd155 CRPV双重载体在最低剂量下的应答小鼠的频率增加(对于106剂量的CRPV双重载体,6/6阳性应答小鼠,但对于106剂量的CRPV融合载体,只有4/6阳性应答小鼠。
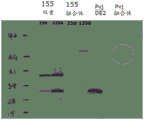
实施例13:编码CRPV E2和E1蛋白的ChAd155双重的表达
在实施例13中还使用实施例12中使用的两种不同的ChAd155载体。
该实验中使用250和1250的感染复数(MOI)。感染后48小时收获细胞裂解物。修饰的E1蛋白的估计大小为48 kDa,修饰的E2蛋白为35 kDa,且包含修饰的E1和E2蛋白两者的融合蛋白为88 kDa。
图18显示Western印迹(在还原条件下获得),其举例说明CRPV双重载体的修饰的E1和E2蛋白的表达比CRPV融合载体更好。图18中显示的“Pvj”列是使用的对照。
此外,使用两种不同的载体收集感染性数据。通过六邻体免疫染色法在附着的Procell 92细胞中评估纯化病毒的感染性。结果在下表4中给出(vp = 病毒颗粒,ifu = 感染单位,且R是这两个数字之间的比率)。感染性结果表明两种载体具有相似的感染性。此外,由于所有R值都低于300,所以所有载体的感染性都被认为在可接受的范围内。
表4:
序列描述
SEQ ID NO: 1 编码野生型ChAd155的多核苷酸序列
SEQ ID NO: 2 编码野生型ChAd83的多核苷酸序列
SEQ ID NO: 3 编码CASI启动子的多核苷酸序列
SEQ ID NO: 4 编码ChAd155/RSV的多核苷酸序列
SEQ ID NO: 5 RSV F0∆TM-N-M2-1氨基酸序列
SEQ ID NO: 6 编码增强的hCMV启动子的多核苷酸序列
SEQ ID NO: 7 编码hCMV NM2 bgh聚A盒的多核苷酸序列
CMV启动子序列:粗体
转基因序列NM2:斜体
bgh聚A 聚A信号:斜体+下划线
SEQ ID NO: 8 NM2蛋白序列
SEQ ID NO: 9 编码hCMV F0 WPRE bgh聚A盒的多核苷酸序列
增强的CMV启动子序列:粗体
转基因序列F0:斜体
WPRE序列:下划线的粗体
bgh聚A聚A信号
:
斜体+下划线
SEQ ID NO: 10 F0蛋白序列
SEQ ID NO: 11 柔性接头的氨基酸序列
SEQ ID NO: 12 柔性接头的氨基酸序列
Claims (22)
1.猿猴腺病毒载体,其包含两个表达盒,其中每个表达盒都包含转基因和启动子,且其中第一表达盒被插入所述猿猴腺病毒载体的E1区域中,且第二表达盒被插入所述腺病毒载体的与载体复制相容的区域中。
2.猿猴腺病毒载体,其包含两个表达盒,其中每个表达盒都包含转基因和启动子,且其中第一表达盒被插入所述猿猴腺病毒载体的E1区域中,且第二表达盒被插入所述猿猴腺病毒载体的E3区域中,在所述猿猴腺病毒载体的L5和E4的终止密码子之间(“HE1”区域)或所述猿猴腺病毒载体的ITR的末端和E4 mRNA的帽位点之间(“HE2”区域)。
3.权利要求2的猿猴腺病毒载体,其中所述第二表达盒被插入所述猿猴腺病毒载体的E3区域中。
4.权利要求2的猿猴腺病毒载体,其中所述第二表达盒被插入所述猿猴腺病毒载体的HE1区域中。
5.权利要求2的猿猴腺病毒载体,其中所述第二表达盒被插入所述猿猴腺病毒载体的HE2区域中。
6.任一前述权利要求的猿猴腺病毒载体,其中所述载体是黑猩猩腺病毒载体。
7.任一前述权利要求的猿猴腺病毒载体,其中所述载体是腺病毒。
8.权利要求7的猿猴腺病毒载体,其中所述载体是ChAd155。
9.权利要求7的猿猴腺病毒载体,其中所述载体是ChAd83。
10.任一前述权利要求的猿猴腺病毒载体,其中所述第一表达盒包含人CMV启动子或增强的人CMV启动子。
11.任一前述权利要求的猿猴腺病毒载体,其中所述第二表达盒包含人CMV启动子或增强的人CMV启动子。
12.权利要求10或11的猿猴腺病毒载体,其中所述增强的hCMV启动子具有与SEQ IDNO:6具有至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%序列同一性的核酸序列。
13.权利要求10至12中任一项的猿猴腺病毒载体,其中,所述启动子包含SEQ ID NO:6的核酸序列或由其组成。
14.任一前述权利要求的猿猴腺病毒载体,其中所述第一表达盒和第二表达盒包含不同的启动子。
15.任一前述权利要求的猿猴腺病毒载体,其中所述腺病毒载体能够感染哺乳动物细胞。
16.任一前述权利要求的猿猴腺病毒载体,其中所述第一表达盒和/或第二表达盒进一步包含转录后调节元件。
17.权利要求16的猿猴腺病毒载体,其中所述转录后调节元件是土拨鼠肝炎转录后调节元件。
18.组合物,其包含任一前述权利要求的猿猴腺病毒载体和药学上可接受的赋形剂。
19.根据任一前述权利要求所述的猿猴腺病毒载体或组合物,其用作药物。
20.根据任一前述权利要求所述的猿猴腺病毒载体或组合物,其用作疫苗。
21.根据任一前述权利要求所述的猿猴腺病毒载体或组合物,其用于治疗或预防疾病。
22.诱导受试者中的免疫应答的方法,其包括将根据任一前述权利要求所述的猿猴腺病毒载体或组合物施用于所述受试者。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762572944P | 2017-10-16 | 2017-10-16 | |
| US62/572944 | 2017-10-16 | ||
| PCT/EP2018/078210 WO2019076880A1 (en) | 2017-10-16 | 2018-10-16 | SIMIENS ADENOVIRAL VECTORS COMPRISING TWO EXPRESSION CASSETTES |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN111479926A true CN111479926A (zh) | 2020-07-31 |
Family
ID=63896161
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201880081337.6A Pending CN111479926A (zh) | 2017-10-16 | 2018-10-16 | 具有两个表达盒的猿猴腺病毒载体 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US20200299651A1 (zh) |
| EP (1) | EP3697918A1 (zh) |
| JP (1) | JP2021500880A (zh) |
| CN (1) | CN111479926A (zh) |
| AR (1) | AR114989A1 (zh) |
| BR (1) | BR112020007413A2 (zh) |
| CA (1) | CA3084346A1 (zh) |
| MX (1) | MX2020003746A (zh) |
| WO (1) | WO2019076880A1 (zh) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220047277A (ko) | 2019-07-16 | 2022-04-15 | 길리애드 사이언시즈, 인코포레이티드 | Hiv 백신, 및 이의 제조 및 사용 방법 |
| MX2022003658A (es) | 2019-09-30 | 2022-04-25 | Gilead Sciences Inc | Vacunas contra el virus de la hepatitis b (vhb) y metodos para tratar el vhb. |
| WO2024015741A1 (en) | 2022-07-12 | 2024-01-18 | Gilead Sciences, Inc. | Hiv immunogenic polypeptides and vaccines and uses thereof |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040136963A1 (en) * | 2001-06-22 | 2004-07-15 | The Trustees Of The University Of Pennsylvania | Simian adenovirus vectors and methods of use |
| CN1965086A (zh) * | 2004-04-28 | 2007-05-16 | 宾夕法尼亚州立大学托管会 | 多价病毒载体和产生它的系统 |
| WO2017017049A1 (en) * | 2015-07-27 | 2017-02-02 | Glaxosmithkline Biologicals S.A. | Novel adenovirus |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010522540A (ja) | 2007-03-21 | 2010-07-08 | アイディー バイオメディカル コーポレイション オブ ケベック | キメラ抗原 |
| CA2738654C (en) | 2008-09-27 | 2019-02-26 | Witricity Corporation | Wireless energy transfer systems |
| BRPI1008018A2 (pt) | 2009-02-02 | 2016-03-15 | Okairos Ag | ácidos nucleicos de adenovírus símio e sequências de aminoácidos, vetores contendo os mesmos e uso dos mesmos |
| WO2012021730A2 (en) * | 2010-08-11 | 2012-02-16 | Genvec, Inc. | Respiratory syncytial virus (rsv) vaccine |
| WO2012089231A1 (en) | 2010-12-30 | 2012-07-05 | Okairòs Ag | Paramyxovirus vaccines |
| CN103492574B (zh) | 2011-02-22 | 2015-12-09 | 加州理工学院 | 使用腺相关病毒(aav)载体递送蛋白 |
| WO2013052859A2 (en) * | 2011-10-05 | 2013-04-11 | Genvec, Inc. | Adenoviral vector-based respiratory syncytial virus (rsv) vaccine |
| US11571472B2 (en) * | 2014-06-13 | 2023-02-07 | Glaxosmithkline Biologicals Sa | Immunogenic combinations |
| AU2016275619B2 (en) | 2015-06-12 | 2019-09-19 | Glaxosmithkline Biologicals Sa | Adenovirus polynucleotides and polypeptides |
| US11466292B2 (en) | 2016-09-29 | 2022-10-11 | Glaxosmithkline Biologicals Sa | Compositions and methods of treatment |
-
2018
- 2018-10-16 US US16/756,377 patent/US20200299651A1/en not_active Abandoned
- 2018-10-16 MX MX2020003746A patent/MX2020003746A/es unknown
- 2018-10-16 CN CN201880081337.6A patent/CN111479926A/zh active Pending
- 2018-10-16 WO PCT/EP2018/078210 patent/WO2019076880A1/en unknown
- 2018-10-16 AR ARP180103001A patent/AR114989A1/es unknown
- 2018-10-16 BR BR112020007413-6A patent/BR112020007413A2/pt not_active IP Right Cessation
- 2018-10-16 EP EP18789094.2A patent/EP3697918A1/en active Pending
- 2018-10-16 CA CA3084346A patent/CA3084346A1/en not_active Abandoned
- 2018-10-16 JP JP2020521360A patent/JP2021500880A/ja not_active Ceased
-
2023
- 2023-08-21 US US18/453,078 patent/US20240093161A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040136963A1 (en) * | 2001-06-22 | 2004-07-15 | The Trustees Of The University Of Pennsylvania | Simian adenovirus vectors and methods of use |
| CN1965086A (zh) * | 2004-04-28 | 2007-05-16 | 宾夕法尼亚州立大学托管会 | 多价病毒载体和产生它的系统 |
| WO2017017049A1 (en) * | 2015-07-27 | 2017-02-02 | Glaxosmithkline Biologicals S.A. | Novel adenovirus |
Non-Patent Citations (2)
| Title |
|---|
| D. L. LI等: "Modified recombinant adenoviruses increase porcine circovirus 2 capsid protein expression and induce enhanced immune responses in mice" * |
| JULIANA C. SMALL等: "Construction and Characterization of E1- and E3-Deleted Adenovirus Vectors Expressing Two Antigens from Two Separate Expression Cassettes" * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2019076880A1 (en) | 2019-04-25 |
| EP3697918A1 (en) | 2020-08-26 |
| US20240093161A1 (en) | 2024-03-21 |
| MX2020003746A (es) | 2020-11-06 |
| JP2021500880A (ja) | 2021-01-14 |
| US20200299651A1 (en) | 2020-09-24 |
| BR112020007413A2 (pt) | 2020-12-08 |
| AR114989A1 (es) | 2020-11-18 |
| CA3084346A1 (en) | 2019-04-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN112618707B (zh) | 一种SARS-CoV-2冠状病毒疫苗及其制备方法 | |
| JP6230527B2 (ja) | サルアデノウイルス及び雑種アデノウイルスベクター | |
| US11254711B2 (en) | Adenovirus polynucleotides and polypeptides | |
| EP3551644B1 (en) | Chimpanzee adenovirus constructs with lyssavirus antigens | |
| US20240093161A1 (en) | Simian adenoviral vectors with two expression cassettes | |
| US11859199B2 (en) | Adenoviral vectors with two expression cassettes encoding RSV antigenic proteins or fragments thereof | |
| US11268108B2 (en) | Replication competent adenoviral vectors | |
| AU2020244533A1 (en) | Recombinant RSV with silent mutations, vaccines, and methods related thereto | |
| JP5675789B2 (ja) | 免疫接種のための発現ベクターとしての水疱性口内炎ウイルスの異なる複数の抗原型 | |
| US20220364115A1 (en) | Enhanced promoter | |
| EA039001B1 (ru) | Аденовирусные полинуклеотиды и полипептиды |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20200731 |