CN110799210A - 选择性消耗抗原特异性抗体的融合蛋白 - Google Patents
选择性消耗抗原特异性抗体的融合蛋白 Download PDFInfo
- Publication number
- CN110799210A CN110799210A CN201780084570.5A CN201780084570A CN110799210A CN 110799210 A CN110799210 A CN 110799210A CN 201780084570 A CN201780084570 A CN 201780084570A CN 110799210 A CN110799210 A CN 110799210A
- Authority
- CN
- China
- Prior art keywords
- seldeg
- seq
- antigen
- fragment
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000000427 antigen Substances 0.000 title claims abstract description 295
- 108091007433 antigens Proteins 0.000 title claims abstract description 291
- 102000036639 antigens Human genes 0.000 title claims abstract description 291
- 102000037865 fusion proteins Human genes 0.000 title claims abstract description 38
- 108020001507 fusion proteins Proteins 0.000 title claims abstract description 38
- 210000004027 cell Anatomy 0.000 claims abstract description 113
- 230000000890 antigenic effect Effects 0.000 claims abstract description 92
- 230000008685 targeting Effects 0.000 claims abstract description 91
- 108010001857 Cell Surface Receptors Proteins 0.000 claims abstract description 59
- 238000000034 method Methods 0.000 claims abstract description 49
- 230000007935 neutral effect Effects 0.000 claims abstract description 16
- 230000000779 depleting effect Effects 0.000 claims abstract description 4
- 108090000623 proteins and genes Proteins 0.000 claims description 186
- 235000018102 proteins Nutrition 0.000 claims description 181
- 102000004169 proteins and genes Human genes 0.000 claims description 181
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 claims description 128
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 claims description 125
- 230000027455 binding Effects 0.000 claims description 105
- 239000012634 fragment Substances 0.000 claims description 89
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 claims description 88
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 claims description 88
- 108060003951 Immunoglobulin Proteins 0.000 claims description 62
- 102000018358 immunoglobulin Human genes 0.000 claims description 62
- 102000000844 Cell Surface Receptors Human genes 0.000 claims description 58
- 102000007238 Transferrin Receptors Human genes 0.000 claims description 37
- 108010033576 Transferrin Receptors Proteins 0.000 claims description 36
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 claims description 31
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 claims description 30
- 230000000295 complement effect Effects 0.000 claims description 29
- 108010073807 IgG Receptors Proteins 0.000 claims description 28
- 102000009490 IgG Receptors Human genes 0.000 claims description 28
- 239000000833 heterodimer Substances 0.000 claims description 28
- 206010028980 Neoplasm Diseases 0.000 claims description 24
- 210000001519 tissue Anatomy 0.000 claims description 23
- 108010088751 Albumins Proteins 0.000 claims description 22
- 102000009027 Albumins Human genes 0.000 claims description 22
- 239000003814 drug Substances 0.000 claims description 16
- 210000001163 endosome Anatomy 0.000 claims description 16
- 108010003723 Single-Domain Antibodies Proteins 0.000 claims description 13
- 210000004899 c-terminal region Anatomy 0.000 claims description 13
- 238000003384 imaging method Methods 0.000 claims description 11
- 229940124597 therapeutic agent Drugs 0.000 claims description 11
- 150000001413 amino acids Chemical group 0.000 claims description 10
- 230000002411 adverse Effects 0.000 claims description 9
- 238000010494 dissociation reaction Methods 0.000 claims description 8
- 230000005593 dissociations Effects 0.000 claims description 8
- 230000002829 reductive effect Effects 0.000 claims description 8
- 230000015556 catabolic process Effects 0.000 claims description 7
- 238000006731 degradation reaction Methods 0.000 claims description 7
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims description 6
- 239000011575 calcium Substances 0.000 claims description 6
- 229910052791 calcium Inorganic materials 0.000 claims description 6
- 230000001419 dependent effect Effects 0.000 claims description 6
- 108020001580 protein domains Proteins 0.000 claims description 6
- 238000006243 chemical reaction Methods 0.000 claims description 5
- 208000023275 Autoimmune disease Diseases 0.000 claims description 4
- 230000007246 mechanism Effects 0.000 claims description 4
- 210000000056 organ Anatomy 0.000 claims description 4
- 108010055170 Synaptotagmin I Proteins 0.000 claims description 3
- 230000008569 process Effects 0.000 claims description 3
- 235000004252 protein component Nutrition 0.000 claims description 3
- 239000002872 contrast media Substances 0.000 claims description 2
- 230000003278 mimic effect Effects 0.000 claims 6
- 102000001317 Synaptotagmin I Human genes 0.000 claims 1
- 102000006240 membrane receptors Human genes 0.000 abstract 1
- 230000035772 mutation Effects 0.000 description 136
- 108091028043 Nucleic acid sequence Proteins 0.000 description 38
- 102000005962 receptors Human genes 0.000 description 33
- 108020003175 receptors Proteins 0.000 description 33
- 102100023302 Myelin-oligodendrocyte glycoprotein Human genes 0.000 description 31
- 239000004475 Arginine Substances 0.000 description 30
- 108010000123 Myelin-Oligodendrocyte Glycoprotein Proteins 0.000 description 30
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 30
- 229960000575 trastuzumab Drugs 0.000 description 29
- 230000015572 biosynthetic process Effects 0.000 description 28
- 125000003275 alpha amino acid group Chemical group 0.000 description 27
- 241000699670 Mus sp. Species 0.000 description 26
- 108091033319 polynucleotide Proteins 0.000 description 25
- 102000040430 polynucleotide Human genes 0.000 description 25
- 239000002157 polynucleotide Substances 0.000 description 25
- 125000000539 amino acid group Chemical group 0.000 description 23
- 108090000765 processed proteins & peptides Proteins 0.000 description 23
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 22
- 239000002953 phosphate buffered saline Substances 0.000 description 22
- 230000004927 fusion Effects 0.000 description 21
- 102000018697 Membrane Proteins Human genes 0.000 description 19
- 108010052285 Membrane Proteins Proteins 0.000 description 19
- 230000000694 effects Effects 0.000 description 17
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 15
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 15
- 210000004369 blood Anatomy 0.000 description 15
- 239000008280 blood Substances 0.000 description 15
- 102000009109 Fc receptors Human genes 0.000 description 14
- 108010087819 Fc receptors Proteins 0.000 description 14
- 241000699666 Mus <mouse, genus> Species 0.000 description 13
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 13
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 12
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 12
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 12
- 210000003712 lysosome Anatomy 0.000 description 12
- 230000001868 lysosomic effect Effects 0.000 description 12
- 102000004196 processed proteins & peptides Human genes 0.000 description 12
- 238000002347 injection Methods 0.000 description 11
- 239000007924 injection Substances 0.000 description 11
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 10
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 10
- 235000001014 amino acid Nutrition 0.000 description 10
- 238000010586 diagram Methods 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 230000001965 increasing effect Effects 0.000 description 10
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 9
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 9
- 229940024606 amino acid Drugs 0.000 description 9
- 238000001727 in vivo Methods 0.000 description 9
- 238000002600 positron emission tomography Methods 0.000 description 9
- 230000028993 immune response Effects 0.000 description 8
- 230000003993 interaction Effects 0.000 description 8
- 229960002087 pertuzumab Drugs 0.000 description 8
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 7
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 7
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 7
- 239000012636 effector Substances 0.000 description 7
- 230000001404 mediated effect Effects 0.000 description 7
- 230000009467 reduction Effects 0.000 description 7
- 102000014914 Carrier Proteins Human genes 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 6
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 6
- 241000282412 Homo Species 0.000 description 6
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 6
- 101150070676 SYT1 gene Proteins 0.000 description 6
- 230000002378 acidificating effect Effects 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 108091008324 binding proteins Proteins 0.000 description 6
- 239000000539 dimer Substances 0.000 description 6
- 230000037361 pathway Effects 0.000 description 6
- 238000002823 phage display Methods 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 5
- 108020004414 DNA Proteins 0.000 description 5
- 150000001720 carbohydrates Chemical class 0.000 description 5
- 235000014633 carbohydrates Nutrition 0.000 description 5
- 238000002059 diagnostic imaging Methods 0.000 description 5
- 230000002708 enhancing effect Effects 0.000 description 5
- 230000013595 glycosylation Effects 0.000 description 5
- 238000006206 glycosylation reaction Methods 0.000 description 5
- 102000003137 synaptotagmin Human genes 0.000 description 5
- 108060008004 synaptotagmin Proteins 0.000 description 5
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 4
- 108010021468 Fc gamma receptor IIA Proteins 0.000 description 4
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 4
- 229920002684 Sepharose Polymers 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 230000035508 accumulation Effects 0.000 description 4
- 238000009825 accumulation Methods 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 210000002889 endothelial cell Anatomy 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 238000001000 micrograph Methods 0.000 description 4
- 230000002688 persistence Effects 0.000 description 4
- 238000002818 protein evolution Methods 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 238000010561 standard procedure Methods 0.000 description 4
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 4
- 238000007492 two-way ANOVA Methods 0.000 description 4
- 102000012002 Aquaporin 4 Human genes 0.000 description 3
- 108010036280 Aquaporin 4 Proteins 0.000 description 3
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 description 3
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 3
- 206010052779 Transplant rejections Diseases 0.000 description 3
- 238000002591 computed tomography Methods 0.000 description 3
- 239000012228 culture supernatant Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000000684 flow cytometry Methods 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 239000000710 homodimer Substances 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 108010068617 neonatal Fc receptor Proteins 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 150000007523 nucleic acids Chemical class 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- UUDAMDVQRQNNHZ-UHFFFAOYSA-N (S)-AMPA Chemical compound CC=1ONC(=O)C=1CC(N)C(O)=O UUDAMDVQRQNNHZ-UHFFFAOYSA-N 0.000 description 2
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- 206010012735 Diarrhoea Diseases 0.000 description 2
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 2
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 2
- 102000018899 Glutamate Receptors Human genes 0.000 description 2
- 108010027915 Glutamate Receptors Proteins 0.000 description 2
- 239000000854 Human Growth Hormone Substances 0.000 description 2
- 102000003839 Human Proteins Human genes 0.000 description 2
- 108090000144 Human Proteins Proteins 0.000 description 2
- 108010001831 LDL receptors Proteins 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 108010031099 Mannose Receptor Proteins 0.000 description 2
- HOKKHZGPKSLGJE-GSVOUGTGSA-N N-Methyl-D-aspartic acid Chemical compound CN[C@@H](C(O)=O)CC(O)=O HOKKHZGPKSLGJE-GSVOUGTGSA-N 0.000 description 2
- 208000001388 Opportunistic Infections Diseases 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 102100036417 Synaptotagmin-1 Human genes 0.000 description 2
- 108091008874 T cell receptors Proteins 0.000 description 2
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 2
- 102000011923 Thyrotropin Human genes 0.000 description 2
- 108010061174 Thyrotropin Proteins 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 238000004820 blood count Methods 0.000 description 2
- 230000007012 clinical effect Effects 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- PQYUGUXEJHLOIL-UHFFFAOYSA-N diethoxysilyl triethyl silicate Chemical compound C(C)O[SiH](O[Si](OCC)(OCC)OCC)OCC PQYUGUXEJHLOIL-UHFFFAOYSA-N 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 210000001723 extracellular space Anatomy 0.000 description 2
- -1 glutathione Amino acid Chemical class 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000028709 inflammatory response Effects 0.000 description 2
- 238000002743 insertional mutagenesis Methods 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000002132 lysosomal effect Effects 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 238000007726 management method Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- 230000008684 selective degradation Effects 0.000 description 2
- 238000001542 size-exclusion chromatography Methods 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 229940126622 therapeutic monoclonal antibody Drugs 0.000 description 2
- 210000000115 thoracic cavity Anatomy 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- KISWVXRQTGLFGD-UHFFFAOYSA-N 2-[[2-[[6-amino-2-[[2-[[2-[[5-amino-2-[[2-[[1-[2-[[6-amino-2-[(2,5-diamino-5-oxopentanoyl)amino]hexanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxypropanoyl]amino]-5-oxopentanoyl]amino]-5-(diaminomethylideneamino)p Chemical compound C1CCN(C(=O)C(CCCN=C(N)N)NC(=O)C(CCCCN)NC(=O)C(N)CCC(N)=O)C1C(=O)NC(CO)C(=O)NC(CCC(N)=O)C(=O)NC(CCCN=C(N)N)C(=O)NC(CO)C(=O)NC(CCCCN)C(=O)NC(C(=O)NC(CC(C)C)C(O)=O)CC1=CC=C(O)C=C1 KISWVXRQTGLFGD-UHFFFAOYSA-N 0.000 description 1
- ORJCWNHUOREFAT-UHFFFAOYSA-N 7,8-dimethylquinoxalino[2,3-f][1,10]phenanthroline Chemical compound C1=CC=C2N=C(C=3C(=NC=C(C=3C)C)C=3C4=CC=CN=3)C4=NC2=C1 ORJCWNHUOREFAT-UHFFFAOYSA-N 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- 206010000060 Abdominal distension Diseases 0.000 description 1
- 206010067484 Adverse reaction Diseases 0.000 description 1
- 208000008190 Agammaglobulinemia Diseases 0.000 description 1
- 108090000672 Annexin A5 Proteins 0.000 description 1
- 102000004121 Annexin A5 Human genes 0.000 description 1
- 101600129809 Aplysia californica Synaptotagmin-1 (isoform 2) Proteins 0.000 description 1
- 102000010637 Aquaporins Human genes 0.000 description 1
- 108010063290 Aquaporins Proteins 0.000 description 1
- 102000005427 Asialoglycoprotein Receptor Human genes 0.000 description 1
- 208000030767 Autoimmune encephalitis Diseases 0.000 description 1
- 108091008875 B cell receptors Proteins 0.000 description 1
- 102100030802 Beta-2-glycoprotein 1 Human genes 0.000 description 1
- 101710180007 Beta-2-glycoprotein 1 Proteins 0.000 description 1
- 208000019838 Blood disease Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 102000002110 C2 domains Human genes 0.000 description 1
- 108050009459 C2 domains Proteins 0.000 description 1
- 102100032937 CD40 ligand Human genes 0.000 description 1
- 101710104159 Chaperonin GroEL Proteins 0.000 description 1
- 108010009685 Cholinergic Receptors Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 208000031973 Conjunctivitis infective Diseases 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 101710088194 Dehydrogenase Proteins 0.000 description 1
- 108010045579 Desmoglein 1 Proteins 0.000 description 1
- 102000007577 Desmoglein 3 Human genes 0.000 description 1
- 108010032035 Desmoglein 3 Proteins 0.000 description 1
- 102100034579 Desmoglein-1 Human genes 0.000 description 1
- 102100036966 Dipeptidyl aminopeptidase-like protein 6 Human genes 0.000 description 1
- 101710092625 Dipeptidyl aminopeptidase-like protein 6 Proteins 0.000 description 1
- 101800001467 Envelope glycoprotein E2 Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 101000759376 Escherichia phage Mu Tail sheath protein Proteins 0.000 description 1
- 206010017533 Fungal infection Diseases 0.000 description 1
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 1
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 1
- 102000005915 GABA Receptors Human genes 0.000 description 1
- 108010005551 GABA Receptors Proteins 0.000 description 1
- 108010063919 Glucagon Receptors Proteins 0.000 description 1
- 102100040890 Glucagon receptor Human genes 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 102000011714 Glycine Receptors Human genes 0.000 description 1
- 108010076533 Glycine Receptors Proteins 0.000 description 1
- 208000017891 HER2 positive breast carcinoma Diseases 0.000 description 1
- 108010033040 Histones Proteins 0.000 description 1
- 101000806663 Homo sapiens Aquaporin-4 Proteins 0.000 description 1
- 101000868215 Homo sapiens CD40 ligand Proteins 0.000 description 1
- 101000777314 Homo sapiens Choline kinase alpha Proteins 0.000 description 1
- 101000777313 Homo sapiens Choline/ethanolamine kinase Proteins 0.000 description 1
- 101000851181 Homo sapiens Epidermal growth factor receptor Proteins 0.000 description 1
- 101001013648 Homo sapiens Methionine synthase Proteins 0.000 description 1
- 101000766306 Homo sapiens Serotransferrin Proteins 0.000 description 1
- 101000835093 Homo sapiens Transferrin receptor protein 1 Proteins 0.000 description 1
- 101001138544 Homo sapiens UMP-CMP kinase Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 206010020983 Hypogammaglobulinaemia Diseases 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 108010001127 Insulin Receptor Proteins 0.000 description 1
- 102000003746 Insulin Receptor Human genes 0.000 description 1
- 108010036012 Iodide peroxidase Proteins 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 102000000853 LDL receptors Human genes 0.000 description 1
- 102100024640 Low-density lipoprotein receptor Human genes 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 102000047918 Myelin Basic Human genes 0.000 description 1
- 102000006386 Myelin Proteins Human genes 0.000 description 1
- 108010083674 Myelin Proteins Proteins 0.000 description 1
- 101710107068 Myelin basic protein Proteins 0.000 description 1
- 102100032977 Myelin-associated oligodendrocyte basic protein Human genes 0.000 description 1
- 101710091862 Myelin-associated oligodendrocyte basic protein Proteins 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 102000007999 Nuclear Proteins Human genes 0.000 description 1
- 108010089610 Nuclear Proteins Proteins 0.000 description 1
- 108020005497 Nuclear hormone receptor Proteins 0.000 description 1
- 102000007399 Nuclear hormone receptor Human genes 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 208000005141 Otitis Diseases 0.000 description 1
- 102000007079 Peptide Fragments Human genes 0.000 description 1
- 108010033276 Peptide Fragments Proteins 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 108010010974 Proteolipids Proteins 0.000 description 1
- 102000016202 Proteolipids Human genes 0.000 description 1
- LCTONWCANYUPML-UHFFFAOYSA-M Pyruvate Chemical compound CC(=O)C([O-])=O LCTONWCANYUPML-UHFFFAOYSA-M 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 238000011579 SCID mouse model Methods 0.000 description 1
- 102000042773 Small Nucleolar RNA Human genes 0.000 description 1
- 108020003224 Small Nucleolar RNA Proteins 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- 101800001271 Surface protein Proteins 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 108010034949 Thyroglobulin Proteins 0.000 description 1
- 102000009843 Thyroglobulin Human genes 0.000 description 1
- 102100027188 Thyroid peroxidase Human genes 0.000 description 1
- 102100028601 Transaldolase Human genes 0.000 description 1
- 108020004530 Transaldolase Proteins 0.000 description 1
- 102000005937 Tropomyosin Human genes 0.000 description 1
- 108010030743 Tropomyosin Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 206010053614 Type III immune complex mediated reaction Diseases 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- 102000003734 Voltage-Gated Potassium Channels Human genes 0.000 description 1
- 108090000013 Voltage-Gated Potassium Channels Proteins 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 102000004248 Zinc Transporter 8 Human genes 0.000 description 1
- 108090000702 Zinc Transporter 8 Proteins 0.000 description 1
- 102000034337 acetylcholine receptors Human genes 0.000 description 1
- 102000005421 acetyltransferase Human genes 0.000 description 1
- 108020002494 acetyltransferase Proteins 0.000 description 1
- 201000001028 acute contagious conjunctivitis Diseases 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 230000006838 adverse reaction Effects 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 230000002924 anti-infective effect Effects 0.000 description 1
- 208000037908 antibody-mediated disorder Diseases 0.000 description 1
- 108010006523 asialoglycoprotein receptor Proteins 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000005784 autoimmunity Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 238000005460 biophysical method Methods 0.000 description 1
- 208000024330 bloating Diseases 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 230000033077 cellular process Effects 0.000 description 1
- 238000012412 chemical coupling Methods 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 238000001297 coherence probe microscopy Methods 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 208000019258 ear infection Diseases 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 102000005525 fibrillarin Human genes 0.000 description 1
- 108020002231 fibrillarin Proteins 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 108010042430 galactose receptor Proteins 0.000 description 1
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 1
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 108010013113 glutamyl carboxylase Proteins 0.000 description 1
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Natural products OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 210000003780 hair follicle Anatomy 0.000 description 1
- 208000014951 hematologic disease Diseases 0.000 description 1
- 208000018706 hematopoietic system disease Diseases 0.000 description 1
- 108010064060 high density lipoprotein receptors Proteins 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 102000057121 human AQP4 Human genes 0.000 description 1
- 239000012216 imaging agent Substances 0.000 description 1
- 150000003949 imides Chemical class 0.000 description 1
- 230000016178 immune complex formation Effects 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000017555 immunoglobulin mediated immune response Effects 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000009878 intermolecular interaction Effects 0.000 description 1
- 230000007154 intracellular accumulation Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 150000002605 large molecules Chemical class 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 238000000302 molecular modelling Methods 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 230000009437 off-target effect Effects 0.000 description 1
- 230000001151 other effect Effects 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 230000018883 protein targeting Effects 0.000 description 1
- XNSAINXGIQZQOO-SRVKXCTJSA-N protirelin Chemical compound NC(=O)[C@@H]1CCCN1C(=O)[C@@H](NC(=O)[C@H]1NC(=O)CC1)CC1=CN=CN1 XNSAINXGIQZQOO-SRVKXCTJSA-N 0.000 description 1
- 238000002708 random mutagenesis Methods 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 229920002477 rna polymer Polymers 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 201000009890 sinusitis Diseases 0.000 description 1
- 206010040872 skin infection Diseases 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 229960002175 thyroglobulin Drugs 0.000 description 1
- 210000001685 thyroid gland Anatomy 0.000 description 1
- 239000005495 thyroid hormone Substances 0.000 description 1
- 229940036555 thyroid hormone Drugs 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 208000016261 weight loss Diseases 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/71—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2881—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against CD71
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
- A61K2039/6056—Antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
- A61K2039/6081—Albumin; Keyhole limpet haemocyanin [KLH]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/10—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody
- A61K51/1027—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody against receptors, cell-surface antigens or cell-surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/569—Single domain, e.g. dAb, sdAb, VHH, VNAR or nanobody®
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/71—Decreased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/72—Increased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Gastroenterology & Hepatology (AREA)
- Cell Biology (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Oncology (AREA)
- Optics & Photonics (AREA)
- Physics & Mathematics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
Abstract
本发明包括称为“Seldeg”的融合蛋白,其包括在近中性pH下特异性结合细胞表面受体或其他细胞表面分子的靶向组分,和与靶向组分直接或间接融合的抗原组分。抗原组分被配置为特异性结合靶抗原特异性抗体。本发明还包括通过给予患者具有配置成特异性结合靶抗原特异性抗体的抗原组分的Seldeg来从患者中消耗靶抗原特异性抗体的方法。
Description
技术领域
本发明涉及工程化蛋白,更具体地涉及选择性消耗体内靶抗原特异性抗体的融合蛋白(“Seldeg”)。
背景技术
抗体是存在于人体以及哺乳动物体内的血液和其他体液中的Y形蛋白质。抗体是人体免疫系统的重要组成部分。它们通过识别称为抗原的外来靶标的独特部分起作用。抗体能够通过其两个抗原结合位点选择性地识别并触发对抗原的免疫应答。每个抗原结合位点位于抗体Y形的两个尖端的端。靶抗原可以结合一个或两个抗原结合位点。抗体Y形的基底称为Fc片段。当抗体与其靶标结合时,Fc区可通过抗体效应功能引起靶标清除。这种反应可包括破坏抗原的细胞过程。在某些自身免疫疾病和其它疾病中,可以产生靶向体内自身抗原的致病抗体,从而导致发病。抗体可以是两种物理形式中的任一种,即从细胞分泌并在血浆中游离的可溶形式,或者是附着于B细胞外膜的膜结合形式。分泌的抗体在涉及自身反应性抗体的疾病中引起病变。它们还可以促进移植排斥或消除基于蛋白质的治疗剂。
由于它们能够特异性结合靶分子,抗体可用于治疗癌症和自身免疫等疾病。它们还可用于在全身成像期间检测肿瘤,例如使用正电子发射断层扫描(PET)中的放射性标记抗体。然而,它们相对长的体内持久性可导致非肿瘤组织中的高背景,导致肿瘤成像的不良对比度和不期望的脱靶效应。
发明内容
本公开包括融合蛋白,在本文中称为“Seldeg”,其配置为允许选择性清除抗原特异性抗体。Seldeg包括被配置成特异性结合细胞表面受体或其他细胞表面分子的靶向组分,和配置成特异性结合抗原特异性抗体或其变体的抗原组分。
Seldeg的靶向组分包括蛋白质或蛋白质片段,其被配置为特异性结合细胞表面受体或其他细胞表面分子。Seldeg的抗原组分包括一个分子的抗原或抗原片段或抗原模拟物,其被配置为特异性结合靶抗原特异性抗体。抗原组分与靶向组分直接或间接融合。
本公开内容还包括消耗患者体内靶抗原特异性抗体的方法,该方法通过给予患者足以从患者的循环或靶组织中去除至少50%的靶抗原特异性抗体的量的Seldeg。
上述Seldeg和方法可以进一步包括以下细节,除非明确相互排斥,否则它们可以彼此组合:
i)靶向组分可以在近中性pH下与细胞表面受体或细胞表面分子结合,解离常数小于10μM;
ii)近中性pH可以大于6.8且小于7.5;
iii)Seldeg可以包含至少第一靶向组分和第二靶向组分,其中第一靶向组分的蛋白质或蛋白质片段被配置为与第二靶向组分的蛋白质或蛋白质片段结合不同的细胞表面受体或不同的细胞表面分子;
iv)靶向组分可包括两个免疫球蛋白Fc片段的异二聚体,其中异二聚体的一个免疫球蛋白Fc片段与抗原组分融合,而另一个免疫球蛋白Fc片段可以不与抗原组分融合;
v)免疫球蛋白Fc片段可以具有与Fcγ受体显著降低的结合或没有可检测的结合;
vi)免疫球蛋白Fc片段可以衍生自不结合Fcγ受体或补体的免疫球蛋白类或同种型;
vii)免疫球蛋白Fc片段可以被配置成与Fcγ受体和补体结合;
viii)至少一个免疫球蛋白Fc片段可经修饰以在近中性的pH下对FcRn的结合亲和力高于未修饰的免疫球蛋白Fc片段;
ix)抗原组分可以与免疫球蛋白Fc片段的铰链-CH2-CH3结构域的N-端或C-端的一个免疫球蛋白Fc片段融合;
x)免疫球蛋白Fc片段可以被修饰为对Fcγ受体和/或补体(C1q)没有结合亲和力,或者对Fcγ受体和/或补体(C1q)的结合亲和力低于未修饰的免疫球蛋白Fc片段;
xi)靶向组分可包括被配置为特异性结合细胞表面受体或细胞表面分子的一个或多个抗体可变区或其片段;
xii)抗体可变区或其片段可包括至少一种纳米抗体;
xiii)纳米抗体可以是纳米抗体多聚体,其中一个纳米抗体与抗原组分融合并且纳米抗体多聚体中的所有其他纳米抗体可以不融合;
xiv)靶向组分可以被配置成在包含Seldeg和细胞表面受体或细胞表面分子的复合物进入内体后从细胞表面受体或细胞表面分子解离;
xv)抗原组分可以融合至靶向组分上的N端位置或C端位置;
xvi)抗原组分可以融合至靶向组分上的非端位置;
xvii)抗原组分可以通过化学反应、通过接头或在形成单一组合的抗原组分-靶向组分融合蛋白的过程中与靶向组分融合;
xviii)靶向组分可以是被配置为特异性结合FcRn的一种或多种白蛋白分子、白蛋白片段或突变的白蛋白变体;
xix)靶向组分可包括被配置成与运铁蛋白受体结合的一个或多个抗体可变结构域或纳米抗体;
xx)靶向组分可包括被配置成与运铁蛋白受体结合的一个或多个蛋白质分子或蛋白质结构域;
xxi)靶向组分可包括被配置成与磷脂酰丝氨酸结合的一个或多个蛋白质分子或蛋白质结构域;
xxii)靶向蛋白质组分可包括被配置成结合磷脂酰丝氨酸的一个或多个抗体可变结构域或纳米抗体;
xxiii)一个或多个蛋白质分子或蛋白质结构域可以被配置成通过钙依赖性机制结合磷脂酰丝氨酸;
xxiv)靶向组分可包括突触结合蛋白1的C2A结构域;
xxv)Seldeg可包括至少第一抗原组分和第二抗原组分,其中一个分子的第一抗原组分的抗原、抗原片段或抗原模拟物不同于一个分子的第二抗原组分的抗原、抗原片段或抗原模拟物;
xxvi)Seldeg可以包括至少第一抗原组分和第二抗原组分,其中一个分子的第一抗原组分的抗原、抗原片段或抗原模拟物与一个分子的第二抗原组分的抗原、抗原片段或抗原模拟物相同;
xxvii)该方法可包括在给予后5小时内给予足够量的Seldeg以从患者的循环或靶组织中除去至少50%的靶抗原特异性抗体;
xxviii)该方法可包括给予Seldeg,所述Seldeg具有靶向组分,靶向组分包含被配置为在近中性pH下以小于10μM的解离常数结合细胞表面受体或其他细胞表面分子的蛋白质或蛋白质片段;
xxix)给予的Seldeg的量可以是至少与待消耗的靶抗原特异性抗体的量等摩尔的量;
xxx)该方法可包括以足以在给予后2小时内从患者的循环或靶组织中除去至少90%的靶抗原特异性抗体的量给予Seldeg;
xxxi)Seldeg可以以足以在给予后1小时内从患者的循环或靶组织中除去至少50%的靶抗原特异性抗体的量给予;
xxxii)每当50%的患者预期在循环或靶组织中再生阈值量的靶抗原特异性抗体时,可以重新给予Seldeg;
xxxiii)Seldeg可以去除循环或靶抗原特异性抗体靶向的组织中小于10%的非靶抗体;
xxxiv)Seldeg可以去除不会对患者产生临床不利影响的患者的循环或靶组织中的一定量的非靶抗体;
xxxv)Seldeg可以去除循环或靶抗原特异性抗体靶向的组织中小于1%的非靶抗体;
xxxvi)Seldeg可通过表达细胞表面受体或细胞表面分子的细胞引起靶抗原特异性抗体的降解;
xxxvii)Seldeg可以给予患有自身免疫疾病的患者,并且靶抗原特异性抗体可以特异性结合自身抗原;
xxxviii)Seldeg可以给予接受移植器官的患者,并且靶抗原特异性抗体可以特异性结合移植器官上的抗原;
xxxix)可以给予Seldeg以增加肿瘤成像期间的对比度,并且靶抗原特异性抗体可以特异性结合肿瘤抗原;
x1)Seldeg可以给予已接受生物制剂的患者,并且靶抗原特异性抗体可以是生物制剂;
xli)如果患者具有对治疗剂特异的抗体,并且Seldeg被配置为靶向对治疗剂特异的抗体,Seldeg可以在递送治疗剂之前给予患者;
xlii)可以给予Seldeg以提供PET图像造影剂;
xliii)靶抗原特异性抗体可以是抗MOG抗体;
xliv)靶抗原特异性抗体可以是抗-HER2抗体;
xlv)Seldeg可包括具有以下至少一种的氨基酸序列的蛋白质:SEQ ID NO:2,SEQID NO:4,SEQ ID NO:6,SEQ ID NO:8,SEQ ID NO:10,SEQ ID NO:12,SEQ ID NO:14,SEQ IDNO:16,SEQ ID NO:18,SEQ ID NO:20,SEQ ID NO:22,SEQ ID NO:24,SEQ ID NO:26,SEQ IDNO:28,SEQ ID NO:30,SEQ ID NO:32,或SEQ ID NO:34,或其同源物;
xlvi)Seldeg可包括具有以下氨基酸序列的蛋白质的异二聚体:SEQ ID NO:2加SEQ ID NO:6,SEQ ID NO:4加SEQ ID NO:6,SEQ ID NO:8加SEQ ID NO:10,SEQ ID NO:12加SEQ ID NO:14,SEQ ID NO:16加SEQ ID NO:18加SEQ ID NO:20,SEQ ID NO:20加SEQ IDNO:22加SEQ ID NO:24,SEQ ID NO:26加SEQ ID NO:28,SEQ ID NO:30加SEQ ID NO:6,SEQID NO:32加SEQ ID NO:6,或SEQ ID NO:34加SEQ ID NO:6,或其同源物。
附图说明
为了更完整地理解本发明及其特征和优点,现在结合附图参考以下描述,这些附图未按比例绘制,其中相同的数字表示相同的特征,并且其中:
图1是选择的细胞事件的示意图,其导致在Seldeg存在下抗原特异性抗体的降解;
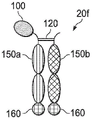
图2A是Seldeg的示意图,其包括与Fc片段的N端位置融合的抗原;
图2B是Seldeg的示意图,其包括与Fc片段的C端位置融合的抗原;
图2C是Seldeg的示意图,其包括与Fc片段的非端位置融合的抗原;
图2D是Seldeg的示意图,其包括与结合细胞表面受体或细胞表面分子的蛋白质或蛋白质片段的端位置融合的抗原;
图2E是Seldeg的示意图,其包括与结合细胞表面受体或细胞表面分子的蛋白质或蛋白质片段的非端位置融合的抗原;
图2F是Seldeg的示意图,其包括与Fc片段的N端位置融合的抗原和与融合至Fc片段的C端的细胞表面蛋白或细胞表面受体结合的蛋白质或蛋白质片段;
图2G是Seldeg的示意图,其包括与Fc片段的C-端位置融合的抗原和与融合至Fc片段的N-端的细胞表面蛋白或细胞表面受体结合的蛋白质或蛋白质片段;
图2H是Seldeg的示意图,其包括与结合细胞表面蛋白或细胞表面受体的抗体的C-端位置融合的抗原;
图2I是Seldeg的示意图,其包括与Fc片段的C-端位置融合的抗原和与融合至Fc片段的N-端的细胞表面蛋白或细胞表面受体结合的scFv片段;
图2J是Seldeg的示意图,其包括与Fc片段的N端位置融合的抗原和与融合至Fc片段的C端的细胞表面蛋白或细胞表面受体结合的scFv片段;
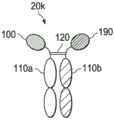
图2K是Seldeg的示意图,其包括与Fc片段的N端位置融合的两种不同抗原;
图2L是Seldeg的示意图,其包括融合至Fc片段的N端位置的两种不同抗原和与融合至Fc片段的C端的细胞表面蛋白或细胞表面受体结合的蛋白质或蛋白质片段;
图2M是Seldeg的示意图,其包括与Fc片段的N端位置融合的两个抗原分子;
图2N是Seldeg的示意图,其包括融合至Fc片段的N端位置的两个抗原分子和与融合至Fc片段的C端的细胞表面蛋白或细胞表面受体结合的蛋白质或蛋白质片段;
图3A是两种示例性的FcRn靶向Seldeg,人表皮生长因子受体2Seldeg(“HER2-Seldeg”)和髓鞘少突胶质细胞糖蛋白Seldeg(“MOG-Seldeg”)的示意图;
图3B显示了在pH 6.0和7.4,示例性的FcRn靶向Seldeg与FcRn的结合增加;
图3C显示了在4℃(30天)和37℃(5天)孵育后,两种示例性的FcRn靶向Seldeg的HPLC分析,以评估它们的储存稳定性;
图3D显示了报告示例性的标准化全身计数与时间的关系图,显示了示例性的FcRn靶向Seldeg对抗原特异性抗体的清除;
图3E显示了报告示例性的标准化血液和身体计数与时间的额外图表,显示了示例性的FcRn靶向Seldeg对抗原特异性抗体的清除;
图3F显示了报告示例性的标准化血液和全身计数与时间的额外图表,显示了示例性的FcRn靶向Seldeg对抗原特异性抗体的清除;
图4A在左上图中显示了称为MOG-Seldeg-PS的示例性Seldeg的示意图,其包含与与磷脂酰丝氨酸(PS)结合的靶向蛋白(突触结合蛋白1的C2A结构域,Syt1)融合的抗原;图4A的右上图显示了MOG-Seldeg-PS的重组蛋白MOG-Seldeg-PS(DN)的示例性SDS-PAGE凝胶(还原和非还原条件),其具有显著降低与PS结合的突变和没有连接抗原(MOG)的Fc-Syt1;图4A在下图中显示了在右上图4A中显示的MOG-Seldeg-PS,MOG-Seldeg-PS(DN)和Fc-Syt1的重组蛋白的示例性HPLC图谱;
图4B显示了报告示例性的标准化血液和全身计数与时间的额外图表,显示了示例性PS靶向的Seldeg对抗原特异性抗体的清除;
图5A显示了报告示例性数据的图表,其显示了在示例性靶向FcRn的Seldeg和对照蛋白质存在下细胞中抗原特异性抗体的积累;
图5B是在靶抗原特异性抗体存在下示例性靶向FcRn的Seldeg和对照蛋白的示例性系列显微图像,其中代表性内体的显微图像被裁剪、放大并呈现在右上角插图中;
图5C是在靶抗原特异性抗体存在下的示例性靶向FcRn的Seldeg和对照蛋白的另一系列示例性显微图像,其中代表性内体的显微图像被裁剪、放大并呈现在右上角插图中;
图6A是在靶抗原特异性抗体存在下的示例性靶向FcRn的Seldeg和对照蛋白的另一系列示例性显微图像,其中代表性溶酶体的显微图像被裁剪、放大并呈现在右上角插图中;
图6B是在不识别Seldeg靶向的抗原的抗原特异性抗体存在下的示例性靶向FcRn的Seldeg的另一系列示例性显微图像,其中代表性溶酶体的显微图像被裁剪、放大并呈现于右上角插图中;
图7显示了报告示例性数据的图表,其显示了在示例性PS靶向Seldeg和对照蛋白存在下细胞中抗原特异性抗体的积累;
图8是示例性Seldeg的示意图,其包括与结合转铁蛋白受体(TfR)的靶向蛋白(抗体)融合的抗原;显示了重组蛋白的HPLC图谱,包括不连接抗原(MOG)的靶向蛋白(抗体)的分析;
图9是报告示例性数据的图,其显示在示例性靶向TfR的Seldeg和对照蛋白的存在下细胞中抗原特异性抗体的积累;
图10A是在递送放射性标记的HER2特异性抗体和用示例性靶向FcRn的Seldeg、对照蛋白或载剂对照处理后小鼠肿瘤的示例性系列的正电子发射断层摄影(PET)分析。
图10B显示了报告在递送放射性标记的HER2特异性抗体和用示例性靶向FcRn的Seldeg、对照蛋白或载剂对照处理后肿瘤携带小鼠的肿瘤:胸部区域的对比度量的图表。
发明详述
本公开涉及工程化蛋白质,更具体地涉及Seldeg,其是被配置为选择性地靶向抗原特异性抗体以从体内消耗的融合蛋白。Seldeg通过与抗原特异性抗体结合并将它们引导至含有降解酶的晚期内体或溶酶体而引起靶向的抗原特异性抗体的选择性降解。Seldeg是融合蛋白或分子,其至少包括靶向组分和抗原组分。靶向组分包括蛋白质或蛋白质片段或其他分子,其被配置为结合细胞表面受体或其他细胞表面分子。抗原组分包括被靶向的抗原特异性抗体识别的一个分子的抗原、抗原片段或抗原模拟物。
在抗原特异性抗体与抗原组分结合后,形成包含Seldeg和抗原特异性抗体的复合物。该复合物还配置成与细胞表面受体或其他细胞表面分子结合,允许细胞内化包括Seldeg、抗原特异性抗体和靶向的细胞表面受体或其他细胞表面分子的复合物(参见图1)。由于酸性pH,低钙浓度和/或区分内体环境与细胞外环境的其他条件,靶向的细胞表面受体或细胞表面分子可在进入内体时从复合物解离。内体内化和溶酶体进入导致复合物的选择性降解。
如本文所用的术语“抗原特异性抗体”是指结合特定抗原、抗原片段或抗原模拟物的抗体。
如本文所用的术语“抗原片段”是指可被抗原特异性抗体识别的抗原的一部分。
如本文所用的术语“抗原模拟物”是指具有与抗原特异性抗体识别的抗原部分相同的总体形状和性质的蛋白质、蛋白质片段、肽或其他分子。
如本文所用的术语“细胞表面分子”是指暴露在细胞质膜上的蛋白质或其他生物分子(例如磷脂,碳水化合物)。
Seldeg可以包括融合至IgG抗体的Fc片段(本文也称为“免疫球蛋白Fc片段”)的抗原,FcRn特异性纳米抗体-抗原融合分子,通过其可变区融合至抗原的结合FcRn的FcRn特异性抗体,白蛋白-抗原融合蛋白,PS结合蛋白,TfR特异性抗体,或被配置为结合细胞表面受体或技术人员通过阅读本发明可鉴定的其他细胞表面分子的其他蛋白质、蛋白质片段或其他分子。
本文描述的Seldeg的实例包括靶向组分,其被配置为结合细胞表面分子,例如人FcRn、暴露的磷脂酰丝氨酸(PS)或转铁蛋白受体(TfR),在近中性pH下具有小于10μM的亲和力(解离常数)。
FcRn和TfR是蛋白质,PS是磷脂,它们可以在表面和体内多种不同细胞类型中发现。本发明不限于靶向这些受体或细胞表面分子,并且可以设想许多其他靶标,例如低密度脂蛋白受体,高密度脂蛋白受体,去唾液酸糖蛋白受体,抑制性Fcγ受体,T细胞受体,B细胞受体,G蛋白偶联受体,胰岛素受体,胰高血糖素受体,半乳糖受体,甘露糖受体,VEGF受体,甘露糖受体等本领域技术人员可以识别的靶标。其他靶标可以在例如以下出版物或数据库中鉴定:细胞表面受体蛋白质图谱(Bausch-Fluck,D.,Hofmann,A.,Bock,T.,Frei,A.P.,Cerciello,F.,Jacobs,A.,Moest,H.,Omasits,U.,Gundry,R.L.,Yoon,C.,Schiess,R.,Schmidt,A.,Mirkowska,P.,A.,Van Eyk,J.E.,Bourquin,J-P.,Aebersold,R.,Boheler,K.R.,Zandstra,P.,Wollscheid,B.(2015)质谱衍生的细胞表面蛋白质图谱.PLoSOne 10:e0121314),以及人类蛋白质图谱(https://www.proteinatlas.org/ humanproteome/secretome)。
靶向组分可以在近中性pH下结合细胞表面受体或其他细胞表面分子,亲和力(解离常数)小于10μM。
因此,Seldeg的靶向组分可包括任何类型的分子,其被配置为特异性结合细胞表面受体或其他细胞表面分子。此类分子可包括蛋白质,蛋白质片段,多核苷酸如核糖核酸或脱氧核糖核酸,多肽,多糖,脂质,氨基酸,肽,糖和/或技术人员通过阅读本发明可鉴定的其他小分子或大分子和/或聚合物。例如,Seldeg的靶向组分可包括作为细胞受体的配体的多核苷酸。
Seldeg可以包括至少第一靶向组分和第二靶向组分,其中第一靶向组分的蛋白质或蛋白质片段被配置为与第二靶向组分的蛋白质或蛋白质片段结合不同的细胞表面受体或不同的细胞表面分子。
如图1所示,Seldeg 20可以可逆地结合细胞表面受体或细胞10表面上的其他分子30。存在于细胞外空间50中的靶抗原特异性抗体40可以可逆地结合Seldeg 20。结合通常发生在近中性的pH下,例如pH大于6.8且小于7.5,因为这是细胞外空间50的典型pH。非靶抗体60不结合Seldeg 20,或以如此低的亲和力结合以致于任何结合都是非特异性的。具有连接的Seldeg 20和靶抗原特异性抗体40的细胞表面受体或分子30经途径A通过受体介导的摄取进入内体70而被内化到细胞10中。受体或其他分子可再循环回到细胞表面。相应地,经途径B,具有连接的Seldeg 20和靶抗原特异性抗体40的受体或分子30循环回到细胞10的表面。然后靶抗原特异性抗体40可以释放并且从Seldeg 20重新连接到相同或其他Seldeg,或者可以仍然连接。类似地,Seldeg 20可以从受体或分子30释放并且可以重新连接到相同或其他细胞表面受体或分子。对于一些Seldeg,由于该区室中的酸性pH或低Ca2+浓度,Seldeg20和抗体40的复合物可以在早期或晚期内体中与受体或其他分子30解离(途径C)。相应地,在途径D中,受体或细胞表面分子可以再循环回到细胞表面,而与抗体40结合的Seldeg 20进入溶酶体并在途径E中被降解成片段80。对于一些Seldeg,在内化到细胞10后的一些时间点上,具有连接的Seldeg 20和靶抗原特异性抗体40的受体或分子30在途径F中进入晚期内体/溶酶体,其中至少靶抗原特异性抗体40被降解成片段80。如果Seldeg 20将受体或分子30交联成二聚体或更高级的聚集体,预期这种进入溶酶体增加。
通过这种选择性消耗机制,Seldeg靶向抗原特异性抗体并使其选择性地从体内消耗,而不会对非靶特异性抗体的水平产生不利影响。
具体说,如本文所述的Seldeg可以靶向抗原特异性抗体并使其选择性地从体内消耗,而不会由于非靶特异性抗体的消耗而在患者中产生不利的临床效果。这种不利的临床效果包括例如,免疫抑制及其症状,例如红眼病,支气管炎,耳部感染,鼻窦感染,感冒,腹泻,肺炎,酵母感染,脑膜炎,皮肤感染和其他机会性感染,特别是通常通过抗体介导的免疫反应来控制的机会性感染;和血液疾病,例如低血小板计数或贫血,以及低丙种球蛋白血症及其症状,例如腹痛,腹胀,恶心,呕吐,腹泻或体重减轻。
通常,本发明的Seldeg被配置为通过靶向组分在近中性pH下特异性结合细胞表面受体/分子,并且还通过直接或间接地融合至靶向组分的抗原组分在近中性pH下特异性结合抗原特异性抗体。如本文所用的术语“特异性结合”是指靶向组分与细胞表面受体/分子之间或抗原组分与抗原特异性抗体之间可检测的选择性分子间相互作用。例如,为了特异性结合,抗原需要显示与被靶向的抗体的可检测的相互作用,而不显示与其他抗体的可检测的相互作用。用于检测特异性结合的技术是本领域已知的,例如ELISA,表面等离子共振分析和技术人员可识别的其他方法。
因此,Seldeg允许患者循环中的至少一部分抗原特异性抗体内化到表达靶向的细胞表面受体或靶向的其他细胞表面分子的细胞中,然后在细胞内降解。
本发明的Seldeg可以通过在每个Seldeg中包含每种类型的抗原、抗原片段或抗原模拟物的一个拷贝(在本文中称为“一个分子”)来避免免疫应答,其与插入突变相结合以减少或消除预期会降低抗体交联和潜在炎性免疫复合物的形成的Fcγ受体结合和/或补体结合。具体说,至少99%的Seldeg,至少99.5%的Seldeg,或至少99.9%的Seldeg可以在近中性pH下每个Seldeg仅含有一个拷贝的抗原、抗原片段或抗原模拟物。根据本发明的其他Seldeg可含有多于一个的抗原、抗原片段或抗原模拟物分子。由每个Seldeg分子含有一个抗原分子的Seldeg结合的抗体的二价性质可导致每个抗体两个Seldeg分子的复合物,其通过靶受体二聚化预期增加Seldeg-抗体复合物的溶酶体递送的效率。
Seldeg可包括至少第一抗原组分和第二抗原组分,其中一个分子的第一抗原组分的抗原、抗原片段或抗原模拟物不同于一个分子的第二抗原组分的抗原、抗原片段或抗原模拟物。因此,包含至少第一抗原组分和第二抗原组分的Seldeg允许清除多于一种特异性的抗原特异性抗体。
Seldeg可包括至少第一抗原组分和第二抗原组分,其中一个分子的第一抗原组分的抗原、抗原片段或抗原模拟物与一个分子的第二抗原组分的抗原、抗原片段或抗原模拟物相同。
因此,Seldeg可包括,例如,与靶向组分的C-端和/或N-端融合的一种或多种抗原组分,其中一个分子的各个抗原组分的抗原、抗原片段、抗原模拟物可以相同或不同。
此外,Seldeg可含有人或人源化蛋白质或蛋白质片段,以避免或降低当给予人时对Seldeg的免疫反应的可能性。抗原组分的抗原、抗原片段或抗原模拟物优选是人蛋白质或蛋白质片段,用于将Seldeg给予人。靶向组分也优选是人蛋白质或蛋白质片段,例如人抗体片段或人白蛋白或白蛋白片段,或人源化抗体或人源化抗体片段,用于将Seldeg给予人。如果开发用于非人动物的Seldeg,则可以使用衍生自或工程化以与该动物免疫相容的蛋白质或蛋白质片段。
图2A是Seldeg 20a的活性的示意图,其包括与具有IgG 110的Fc片段的靶向组分融合的抗原100。如本领域技术人员所理解的,IgG的Fc片段是抗体Y形的所有下基底,即巯基桥连的铰链区和CH2和CH3结构域。Seldeg的Fc片段可以不具有铰链区,或铰链区不具有巯基桥。Fc片段110允许Seldeg 20a在表达FcRn的细胞上结合FcRn分子。在图2A所示的实施例中,抗原100可以在铰链-CH2-CH3 120的N-端与Fc片段110a融合。当抗原100与Fc片段110a融合并且所得抗原-Fc片段与另一个缺乏抗原的Fc片段110b二聚化时,使用“旋钮进孔”策略(例如,参见Moore,G.L.,Bautista,C.,Pong,E.,Nguyen,D.H.,Jacinto,J.,Eivazi,A.,Muchhal,U.S.,Karki,S.,Chu,S.Y.,Lazar,G.A.,2011)。新的双特异性抗体形式能够同时产生不同靶抗原的二价和单价共同接合(co-engagement)。制备了MAb 3,546-557),一种异二聚体Seldeg分子20a。Seldeg 20a具有Fc片段,其具有抗原100的单体展示,其避免形成可导致炎症和其他不利影响的多聚体免疫复合物。虽然可以在某些情况下产生并使用仅含有与Fc片段110a融合的抗原100的Seldeg,但由于Fc片段倾向于二聚化,通常会产生二聚体。为了避免其中两个Fc片段110a都具有融合抗原100的Fc片段二聚体,其可以导致多聚体免疫复合物的形成,Seldeg被设计为具有“旋钮进孔”突变和/或静电转向突变(例如,参见Gunasekaran,K.,Pentony,M.,Shen,M.,Garrett,L.,Forte,C.,Woodward,A.,Ng,S.B.,Born,T.,Retter,M.,Manchulenko,K.,Sweet,H.,Foltz,I.N.,Wittekind,M.,Yan,W.(2010)通过静电转向效应增强抗体Fc异二聚体形成:应用于双特异性分子和单价IgG(Enhancing antibody Fc heterodimer formation through electrostatic steeringeffects:applications to bispecific molecules and monovalent IgG).J Biol Chem285,19637-19646),以促进异二聚体的形成,所以只有一个Fc融合了一个抗原。其他方法也可用于产生异二聚体,例如在抗原-Fc融合体的C-端和第二Fc片段的N-端之间插入(G4S)13接头肽(例如,参见Zhou,L.,Wang,H-Y.,Tong,S.,Okamoto,C.T.,Shen,W-C.,Zaro,J.L.(2016)单链Fc-二聚体-人生长激素融合蛋白用于改善药物递送(Single chain Fc-dimer-human growth hormone fusion protein for improved drug delivery).Biomaterials,117,24-31)。在实施例10中描述了几种Seldeg实例的DNA和蛋白质序列,其包括旋钮进孔突变,静电转向突变和/或精氨酸突变或其他降低Fcγ受体和补体结合的突变。
旋钮进孔突变的其他实例包括:Y349T/T394F:S364H/F405A和Y349T/F405F:S364H/T394F(例如,参见Moore,G.L.,Bautista,C.,Pong,E.,Nguyen,D.H.,Jacinto,J.,Eivazi,A.,Muchhal,U.S.,Karki,S.,Chu,S.Y.,Lazar,G.A.(2011)一种新的双特异性抗体形式能够同时产生不同靶抗原的二价和单价共同接合(A novel bispecific antibodyformat enables simultaneous bivalent and monovalent co-engagement of distincttarget antigens).MAbs 3,546-557),T366W:T366S:L368A/Y407V(例如,参见Atwell,S.,Ridgway,J.B.B.,Wells,J.A.,Carter,P(1997)使用噬菌体展示文库重建同源二聚体的结构域界面的稳定的异二聚体(Stable heterodimers from remodeling the domaininterface of a homodimer using a phage display library).J.Mol.Biol.,270,26-35)以及本领域技术人员可鉴定的其他突变。如本领域技术人员所理解的,这些示例性旋钮进孔突变的残基编号是指EU抗体编号系统。
静电转向突变的其他实例包括:E356K/D399K:K392D/K409D和K409D/K370D:D357K/D399K(例如,参见Gunasekaran,K.,Pentony,M.,Shen,M.,Garrett,L.,Forte,C.,Woodward,A.,Ng,S.B.,Born,T.,Retter,M.,Manchulenko,K.,Sweet,H.,Foltz,I.N.,Wittekind,M.,Yan,W.(2010).通过静电转向效应增强抗体Fc异二聚体形成:应用于双特异性分子和单价IgG(Enhancing antibody Fc heterodimer formation throughelectrostatic steering effects:applications to bispecific molecules andmonovalent IgG).J Biol Chem 285,19637-19646.)以及本领域技术人员可鉴定的其他突变。如本领域技术人员所理解的,这些示例性静电转向突变的残基编号是指EU抗体编号系统。
精氨酸突变或降低与Fcγ受体和补体(C1q)的结合的其他突变的其他实例包括:G236R/L328R(例如,参见Horton,H.M.,Bernett,M.J.,Pong,E.,Peipp,M.,Karki,S.,Chu,S.Y.,Richards,J.O.,Vostiar,I.,Joyce,P.F.,Repp,R.,Desjarlais,J.R.,Zhukosky,E.(2010)Fc-工程化抗CD19单克隆抗体对淋巴瘤和白血病的有效体外和体内活性(Potent invitro and in vivo activity of an Fc-engineered anti-CD19 monoclonal antibodyagainst lymphoma and leukemia).Cancer Res.,68,8049-8057;Moore,G.L.,Bautista,C.,Pong,E.,Nguyen,D.H.,Jacinto,J.,Eivazi,A.,Muchhal,U.S.,Karki,S.,Chu,S.Y.,Lazar,G.A.(2011)。新的双特异性抗体形式能够同时产生不同靶抗原的二价和单价共同接合。MAbs 3,546-557),N297A或N297Q(例如,参见Tao,M-H.,Morrison,S.L.(1989)非糖基化嵌合小鼠-人IgG的研究:碳水化合物在结构和效应功能中的作用介导人IgG恒定区(Studies of aglycosylated chimeric mouse-human IgG:role of carbohydrate inthe structure and effector functions mediated bu the human IgG constantregion).J.Immunol.,143,2595-2601;Lux,A.,Yu,X.,Scanlan,C.N.,Nimmerjahn,F.(2013)免疫复合物大小和糖基化对IgG与人FcγR结合的影响(Impact of immune complexsize and glycosylation on IgG binding to human FcγRs).J.Immunol.,190,4315-4323),D265A(例如,参见Lux,A.,Yu,X.,Scanlan,C.N.,Nimmerjahn,F.(2013)免疫复合物大小和糖基化对IgG与人FcγR结合的影响(Impact of immune complex size andglycosylation on IgG binding to human FcγRs).J.Immunol.,190,4315-4323;Clynes,R.A.,Towers,T.L.,Presta,L.G.,Ravetch,J.V.(2000)抑制性Fc受体调节体内对肿瘤靶标的细胞毒性(Inhibitory Fc receptors modulate in vivo cytotoxicityagainst tumor targets).Nat.Med.6,443-446),L234A/L235A(例如,参见Wines,B.D.,Powell,M.S.,Parren,P.W.H.I.,Barnes,N.,Hogarth,P.M.(2000)IgG Fc含有不同的Fc受体(FcR)结合位点:白细胞受体FcγRI和FcγRIIa与Fc区域结合,不同于新生儿FcR和蛋白A识别的区域(The IgG Fc contains distinct Fc receptor(FcR)binding sites:theleukocyte receptors FcγRI and FcγRIIa bind to a region in the Fc distinctfrom that recognized by neonatal FcR and protein A).J.Immunol.,164,5313-5318),和L234A/L235A/P329G(例如,参见Schlothauer,T.,Herter,S.,Koller,C.F.,Grau-Richards,S.,Steinhart,V.,Spick,C.,Kubbies,M.,Klein,C.,Umana,P.,Mossner,E.(2016)新型人IgG1和IgG4 Fc工程化抗体,具有完全消除的效应功能(Novel humanIgG1and IgG4 Fc-engineered antibodies with completely abolished effectorfunctions).PEDS,29,457-466),以及本领域技术人员可鉴定的其他突变。如本领域技术人员所理解的,这些示例性精氨酸突变或降低与Fcγ受体和补体(C1q)的结合的其他突变的残基编号是指EU抗体编号系统。
可以使用消除FcγR和/或靶向FcγR和补体结合位点的位置处或附近的残基的补体结合的其他突变。IgG的Fc区上的这些位点已经定位(例如,参见Jefferis,R.,Lund,J.(2002)用于FcγR的人IgG-Fc上的相互作用位点:当前模型(Interaction sites on humanIgG-Fc for FcγR:current models).Immunol.Letts.,82,57-65;Duncan,A.R.,Winter,G.(1988)IgG上C1q的结合位点(The binding site for C1q on IgG).Nature,332,738-740;Idusogie,E.E.,Presta,L.G.,Gazzano-Santoro,H.,Totpal,K.,Wong,P.Y.,Ultsch,M.,Meng,G.,Mulkerrin,M.G.(2000)在利妥昔单抗上定位C1q结合位点,利妥昔单抗是具有人IgG1Fc的嵌合人抗体(Mapping of the C1q binding site on rituxan,a chimerichuman antibody with a human IgG1 Fc).J.Immunol.,164,4178-4184;Hogarth,P.M.,Anania,J.,Wines,B.D.(2014)人和非人灵长类动物的FcγR及其与IgG的相互作用:对炎症诱导,抗感染和使用治疗性单克隆抗体的影响(The FcγR of humans and non-humanprimates and their interaction with IgG:implications for induction ofinflammation,resistance to infection and the use of therapeutic monoclonalantibodies).Curr.Top.Microbiol.Immunol.,382,321-352)。
Seldeg可包括衍生自不与Fcγ受体或补体如人IgG2或人IgG4结合或具有非常弱结合的免疫球蛋白类或同种型的Fc片段。
对于诸如诊断成像的一些应用,Seldeg可包括具有Fcγ受体和/或补体的结合位点的Fc片段以增加针对Seldeg中存在的抗原的炎症反应。
与未修饰的Fc片段相比,可修饰Fc片段110以在近中性的pH下显著增加对FcRn的结合亲和力。例如,通过表面等离子共振或其他生物物理方法测定,在大于6.8且小于7.5的pH下,Fc片段110和FcRn之间的解离常数可小于10μM。然而,在酸性内体pH(约6.0)下与未修饰的Fc片段相比,Fc片段110可以具有与相似或增加的对FcRn的亲和力,或者其可以经修饰以在内体pH下与未修饰的Fc片段相比对FcRn具有低得多或可忽略的结合亲和力。在近中性pH的这种结合亲和力的增加允许每个Seldeg使其结合的靶抗原特异性抗体有效内化并被转运到表达FcRn的细胞中的晚期内体或溶酶体中。可以通过插入突变来实现Fc片段对FcRn的增强的结合亲和力。与近中性pH相反,天然存在的IgG在酸性pH水平下对FcRn具有显著更高的结合亲和力。该性质对于在表达FcRn的细胞内回收和转运IgG是必需的。相反,例如,在pH 7.4下对FcRn的结合亲和力的增加导致受体介导的细胞内化和溶酶体递送。
还可以修饰Fc片段110以消除或显著降低对Fcγ受体和补体(C1q)的结合亲和力。该修饰防止由多聚体免疫复合物的形成引起的炎症反应。例如,如实施例10中所述,Fc区可以是突变的(G236R/L328R;EU编号)(例如,参见Moore,G.L.,Bautista,C.,Pong,E.,Nguyen,D.H.,Jacinto,J.,Eivazi,A.,Muchhal,U.S.,Karki,S.,Chu,S.Y.,Lazar,G.A.(2011)。新的双特异性抗体形式能够同时产生不同靶抗原的二价和单价共同接合。MAbs 3,546-557)(EU编号),在本文中也称为“精氨酸突变”,因此它们不结合Fcγ受体。在实施例10中,这些突变对应于Fc-Syt1的残基22和114(参见SEQ ID NO:10)以及MOG-Seldeg-PS的残基114和236(参见SEQ ID NO:8)。显着降低或消除与Fcγ受体和补体结合的突变的其他实例包括:N297A或N297Q(EU编号;例如,参见Tao,M-H.,Morrison,S.L.(1989)非糖基化嵌合小鼠-人IgG的研究:碳水化合物在由人IgG恒定区介导的结构和效应子功能中的作用(Studies of aglycosylated chimeric mouse-human IgG:role of carbohydrate inthe structure and effector functions mediated by the human IgG constantregion).J.Immunol.,143,2595-2601;Lux,A.,Yu,X.,Scanlan,C.N.,Nimmerjahn,F.(2013)免疫复合物大小和糖基化对IgG与人FcγR结合的影响(Impact of immune complexsize and glycosylation on IgG binding to human FcγRs).J.Immunol.,190,4315-4323),D265A(例如,参见Lux,A.,Yu,X.,Scanlan,C.N.,Nimmerjahn,F.(2013)免疫复合物大小和糖基化对IgG与人FcγR结合的影响(Impact of immune complex size andglycosylation on IgG binding to human FcγRs).J.Immunol.,190,4315-4323;Clynes,R.A.,Towers,T.L.,Presta,L.G.,Ravetch,J.V.(2000)抑制性Fc受体调节体内对肿瘤靶标的细胞毒性(Inhibitory Fc receptors modulate in vivo cytotoxicityagainst tumor targets).Nat.Med.6,443-446),L234A/L235A(例如,参见Wines,B.D.,Powell,M.S.,Parren,P.W.H.I.,Barnes,N.,Hogarth,P.M.(2000)IgG Fc含有不同的Fc受体(FcR)结合位点:白细胞受体FcγRI和FcγRIIa与Fc区域结合,不同于新生儿FcR和蛋白A识别的区域(The IgG Fc contains distinct Fc receptor(FcR)binding sites:theleukocyte receptors FcγRI and FcγRIIa bind to a region in the Fc distinctfrom that recognized by neonatal FcR and protein A).J.Immunol.,164,5313-5318),L234A/L235A/P329G(例如,参见Schlothauer,T.,Herter,S.,Koller,C.F.,Grau-Richards,S.,Steinhart,V.,Spick,C.,Kubbies,M.,Klein,C.,Umana,P.,Mossner,E.(2016)新型人IgG1和IgG4 Fc工程化抗体,具有完全消除的效应功能(Novel human IgG1and IgG4 Fc-engineered antibodies with completely abolished effectorfunctions).PEDS,29,457-466),(EU 编号)以及本领域技术人员可鉴定的其他突变。优选对Fcγ受体的结合亲和力降低至少10倍。
如图2B所示,在Seldeg 20b中,抗原100可以在另一个端位置连接到Fc片段110a,或者如图2C所示,在Seldeg 20c中,抗原100可以连接在非端位置。任何不阻止特异性FcRn结合的位置都是合适的。这些位置包括与FcRn相互作用位点足够远的氨基酸残基(包括CH2-CH3结构域界面处的残基252-256,309-311,433-436(EU编号)以便不直接或空间阻断FcRn结合,如技术人员可以识别的那样)。
抗原100可以以任何合适的方式与Fc片段110融合,包括通过化学反应连接,通过接头连接,或在单一组合的抗原-Fc片段蛋白形成期间。可以使用的化学偶联的实例是:胺-胺(NHS酯),巯基-巯基(马来酰亚胺),胺-巯基(NHS酯/马来酰亚胺),巯基-碳水化合物(马来酰亚胺/酰肼)),或通过具有所需化学反应性的非天然氨基酸连接。可以在重组产生Fc片段和/或抗原期间插入这种非天然氨基酸。聚乙二醇(PEG)间隔物也可以插入化学偶联的蛋白质、蛋白质片段或其他分子之间。可能的接头包括甘氨酸-丝氨酸接头肽的重复,或其他更刚性的接头肽,其在抗原-Fc融合的重组表达质粒中编码。连接化学,连接位点和肽的选择可以通过分子建模来指导,并且可以设计为最小化靶向细胞表面分子的蛋白质/蛋白质片段或抗原的结合活性的损失,如技术人员所理解的。
图2D是Seldeg 20d的示意图,其中抗原100连接于抗体可变区130。抗体可变区130特异性结合细胞表面受体或细胞表面分子。抗体可变区130可以是完整的可变区或其片段,只要它可以特异性结合细胞表面受体或细胞表面分子即可。抗体可变区130可以包括抗体的非可变区的部分,其被配置为结合细胞表面受体或细胞表面分子。例如,抗体可变区130可以是单结构域抗体(sdAb)或骆驼科动物来源的VHH结构域(通常也称为纳米抗体)。这些可变区具有免疫球蛋白结构域的整体折叠,包含两个反平行的β-折叠,并且还可以包括来自免疫球蛋白超家族的其他成员的结构域,例如T细胞受体可变结构域,抗体的恒定区结构域或共同受体的结构域,CD4,以及本领域技术人员可识别的其他结构域。抗体可变区130可以作为单体存在,如图2D中所示,或作为多聚体存在。例如,如果抗体可变区130作为纳米抗体存在,则可以在第一纳米抗体的C端和第二纳米抗体的N端之间用诸如GSSGGSGGGGS的接头肽工程化以形成二聚体,从而增加靶标受体/分子的结合亲合力。如果抗体可变区130是纳米抗体或另一种经工程化以形成多聚体的蛋白质,则可以在Seldeg形成期间包括不含抗原100的变体,使得多聚体仅含有一个拷贝的抗原100,正如上文对于含有Fc片段的Seldeg所述。抗体可变区还可以包括通过肽接头与轻链可变(VL)结构域连接以形成scFv片段的重链可变(VH)结构域的异二聚体。用于连接VH和VL结构域的接头序列是本领域技术人员熟知的,包括连接VH结构域的C端和VL结构域的N端的GGGGSGGGGSGGGGS[(G4S)3]序列。在一些实施方式中,VL结构域的C端可以用相似的接头序列连接到VH结构域的N端。可以使用噬菌体展示,酵母展示或其他抗体展示方法从scFv文库中分离结合细胞表面受体或其他细胞表面分子的scFv。Seldeg的靶向蛋白组分还可以包括抗体的Fab片段,其可以使用噬菌体展示,酵母展示等从Fab片段文库中分离。对于纳米抗体,scFv和Fab片段,通过随机突变互补决定区(CDR)中的残基,或通过使用易错聚合酶链反应,以产生突变的纳米抗体或可变结构域的文库,可以增加与细胞表面受体或细胞表面分子结合的亲和力。将靶向的示例性CDR残基是轻链可变结构域的CDR3(残基89-97;Kabat编号)和重链可变结构域的CDR3(残基95-102;Kabat编号)中的那些。这些文库可以在噬菌体或酵母上展示,并且使用本领域技术人员已知的方法选择更高亲和力的变体。
尽管图2D示出了抗体可变区130的端位置处的抗原100,但是它可以替代地位于非端位置。抗原100可以以任何合适的方式与抗体可变区110融合,包括通过化学反应连接,通过接头连接,或在单个组合的抗原-抗体可变区融合蛋白的形成期间。
Seldeg还可以含有与靶向组分融合的抗原组分,其包括除抗体或抗体片段之外的蛋白质,条件是该蛋白质被配置为结合细胞表面受体或其他细胞表面分子。例如,如图2E所示,Seldeg 20e包括与能够结合FcRn的白蛋白或白蛋白片段140融合的抗原100。可以突变或修饰白蛋白或白蛋白片段,使其以增加的亲和力与FcRn结合。例如,可以使用易错PCR将突变插入(人血清)白蛋白的FcRn结合结构域(DIII)中,然后在酵母或噬菌体上展示突变的白蛋白变体文库,并选择更高亲和力的变体。或者,可以通过突变白蛋白:FcRn界面处或附近的残基并选择或筛选具有增加的结合亲和力的白蛋白变体来产生更高亲和力的变体。尽管图2E示出了在白蛋白或白蛋白片段140的非端位置处的抗原100,但是它可以替代地位于端位置。抗原100可以以任何合适的方式与白蛋白或白蛋白片段140融合,包括通过化学反应连接,通过接头连接,或在单一组合的抗原-FcRn结合蛋白形成期间。
图2F是示例性Seldeg 20f的示意图,其包括连接于Fc片段150的N-端的抗原100。在图2F所示的实例中,结合细胞表面受体或细胞表面分子的蛋白质或蛋白质片段160连接于Fc片段150a的C端。例如,蛋白质或蛋白质片段可以是与磷脂酰丝氨酸(PS)结合的突触结合蛋白的C2A结构域。可以改造Fc片段150以更高的亲和力结合FcRn,并且可以使其突变,使得其以非常低的或不可检测的结合亲和力结合Fcγ受体和补体。为了避免具有融合抗原100的两个Fc片段150a的Fc片段同型二聚体,其可以导致多聚体免疫复合物的形成,如图2F中所示的Seldeg被设计为具有旋钮进孔突变和/或静电转向突变,以促进异二聚体形成,因此只有一个Fc具有一个Fc抗原。在图2F中,Fc片段150a和150b都具有与细胞表面蛋白或与其融合的其他细胞表面分子结合的蛋白质或蛋白质片段;或者,可以仅存在一种这样的蛋白质或蛋白质片段。在图2G所示的示例性Seldeg中,抗原100和结合细胞表面受体或细胞表面分子的蛋白质或蛋白质片段160分别与Fc片段150a和150b的C-和N-端融合,得到Seldeg20g。
图2H是示例性Seldeg 20h的示意图,其包括与结合细胞表面蛋白或细胞表面分子的抗体170的C端连接的抗原100。可以改造抗体中的Fc片段(Fc)以更高的亲和力结合FcRn,并且可以使其突变,使得其以非常低的或不可检测的结合亲和力结合Fcγ受体和补体。为了避免其中两个Fc片段都具有融合抗原100的抗体同源二聚体,其可以导致多聚体免疫复合物的形成,如图2H所示的Seldeg被设计为具有旋钮进孔突变和/或静电转向突变,以促进异二聚体的形成,因此每个抗体分子只有一个抗体重链连接有抗原100。抗体的两个Fab片段可以结合相同的细胞表面蛋白或其他细胞表面分子;或者,它们可以结合两种或更多种不同的细胞表面蛋白质或分子。
图2I是示例性Seldeg 20i的示意图,其包括与结合细胞表面蛋白质或细胞表面分子的scFv(180)-Fc融合体的C-端连接的抗原100。可以改造抗体中的Fc片段(Fc)以更高的亲和力结合FcRn,并且可以使其突变,使得其以非常低的或不可检测的结合亲和力结合Fcγ受体和补体。为了避免其中两个Fc片段都具有融合抗原100的抗体同源二聚体,其可以导致多聚体免疫复合物的形成,如图2I所示的Seldeg被设计为具有旋钮进孔突变和/或静电转向突变,以促进异二聚体的形成,因此每个分子只有一个抗体重链-scFv连接有抗原100。抗体的两个scFv片段可以结合相同的细胞表面蛋白或其他细胞表面分子;或者,它们可以结合两种或更多种不同的细胞表面蛋白质或分子。
图2J是示例性Seldeg 20j的示意图,其包括与结合细胞表面蛋白质或细胞表面分子的Fc-scFv(180)融合体的N-端连接的抗原100。可以改造抗体中的Fc片段(Fc)以更高的亲和力结合FcRn,并且可以使其突变,使得其以非常低的或不可检测的结合亲和力结合Fcγ受体和补体。为了避免其中两个Fc片段都具有融合抗原100的抗体同源二聚体,其可以导致多聚体免疫复合物的形成,如图2I所示的Seldeg被设计为具有旋钮进孔突变和/或静电转向突变,以促进异二聚体的形成,因此每个分子只有一个抗体重链-scFv连接有抗原100。抗体的两个scFv片段可以结合相同的细胞表面蛋白或其他细胞表面分子;或者,它们可以结合两种或更多种不同的细胞表面蛋白质或分子。
如图2K所示,在示例性Seldeg 20k中,两个抗原组分(100,190)可以连接至靶向组分,例如在N端或其他位置的Fc片段110a和Fc片段110b,以产生可以清除具有不同特异性的抗原特异性抗体的Seldeg。如图2K所示的Seldeg设计有旋钮进孔突变和/或静电转向突变以促进异二聚体形成,因此在每个Seldeg分子中存在每种类型的抗原分子(100,190)。
图2L是示例性Seldeg 20l的示意图,其包括连接于Fc片段150的N-端的抗原100和抗原190。在图2L所示的示例性实施方式中,结合细胞表面受体或细胞表面分子的蛋白质或蛋白质片段160连接于Fc片段150a和150b的C端。如图2L所示的Seldeg设计有旋钮进孔突变和/或静电转向突变以促进异二聚体形成,因此在每个Seldeg分子中存在每种类型的抗原分子(100,190)。在图2L中,Fc片段150a和150b都具有结合细胞表面蛋白或与其融合的其他细胞表面分子的蛋白质或蛋白质片段;但在其他实施方式中,仅存在一种这样的蛋白质或蛋白质片段。
如图2M所示,在示例性Seldeg 20m中,相同抗原(100)的两个分子可以在N端或其他位置连接至Fc片段200以产生示例性Seldeg 20m。该示例性Seldeg是同源二聚体,其含有增强与FcRn结合的突变,并且不包含旋钮进孔和/或静电转向突变。
图2N是示例性Seldeg 20n的示意图,其包括与Fc片段210的N端连接的两个相同抗原分子(100)。在图2N所示的示例性实施方式中,结合细胞表面受体或细胞表面分子的蛋白质或蛋白质片段160连接于Fc片段210的C端。该示例性Seldeg是同源二聚体,并且不含有旋钮进孔和/或静电转向突变。在图2N中,同源二聚体Fc片段200具有与与两条多肽链融合的其他细胞表面分子或细胞表面蛋白结合的蛋白质或蛋白质片段,但在其他实施方式中,可仅存在一种这样的蛋白质或蛋白质片段。
对于靶向FcRn的Seldeg,类似的原理可以应用于能够结合FcRn的其他蛋白质。另外,靶向FcRn的Seldeg或其形成方法可能受FcRn结合蛋白的性质影响。尽管白蛋白倾向于不形成二聚体或其他多聚体,但是其他FcRn结合蛋白可以,在这种情况下,最终的Seldeg可以以含有抗体片段的那些形式形成,使得每个Seldeg仅含有一个抗原拷贝。在图2A,2B,2C,2F,2G,2H,2I,2J,2K,2L所示的实施例中,Seldeg具有两个抗体Fc片段,它们经工程化具有旋钮进孔突变和/或静电转向突变以促进异二聚体的形成,所述异二聚体包含与一个Fc片段连接的一个抗原和一个未连接抗原的Fc片段。可以进一步改造Fc片段以在近中性pH以更高的亲和力结合FcRn(图2A,2B,2C,2K,2M),或者与一种或多种蛋白质、scFv片段、Fab片段或靶向一种或多种细胞表面受体或分子的其他分子连接(图2F,2G,2H,2I,2J,2L,2N)。还可以改造图2F,2G,2H,2I,2J,2L,2N中所示的实施例中的Fc片段以更高的亲和力结合FcRn,使得它们靶向FcRn和一种或多种细胞表面受体或分子。
白蛋白在酸性pH下比在中性pH下与FcRn结合更强。然而,还可以修饰白蛋白以改变其在近中性或内体pH下的结合亲和力,以促进靶抗原特异性抗体的降解和Seldeg的再循环。类似地,抗体可变区FcRn结合蛋白可以特异于该蛋白的方式受pH影响,但它们仍可被修饰以改变其在近中性或内体pH下的结合亲和力以促进靶抗原特异性抗体的降解。使用噬菌体展示,酵母展示或其他具有技术水平的人所熟知的技术,这些FcRn结合蛋白可以从免疫球蛋白可变结构域,scFv(VH:VL异二聚体,其中VH和VL结构域通过接头肽如GGGGSGGGGSGGGGS彼此连接)或Fab片段的文库中分离。这些文库可以衍生自天然存在的抗体可变基因,或者可以使用产生“半合成”文库的方法产生,其中使用随机化的寡核苷酸序列产生互补决定区(CDR)。通过例如使用易错PCR然后使用噬菌体展示或酵母展示选择在CDR中插入随机突变,可以实现其亲和力的进一步增加。将靶向的示例性CDR残基是轻链可变结构域的CDR3(残基89-97;Kabat编号)和重链可变结构域的CDR3(残基95-102;Kabat编号)中的那些。类似的方法可用于分离与其他细胞表面受体/分子结合的基于抗体的蛋白质或基于支架的蛋白质。
Seldeg可以包括任何靶向组分,其被配置为特异性结合细胞表面上的受体或其他分子(图2D,2E,2F,2G,2H,2I,2J,2L或2N)。靶向组分直接或间接(例如,通过接头)融合至具有每种类型的抗原,抗原片段或抗原模拟物的一个分子的抗原组分,以减少抗体介导的交联。如本文所用的术语“抗原类型”是指结合特定抗体的抗原。因此,Seldeg可以包括多于一种的抗原类型,其中每个Seldeg仅具有每种抗原类型的一种分子。如果靶向蛋白含有免疫球蛋白衍生的Fc片段,则可以突变Fc区,使其不与Fcγ受体和补体结合,或以显著降低的水平结合至Fcγ受体和补体。Seldeg的几种不同的可能配置如图2A-N所示;这些仅作为示例示出并且不是限制性的,因为本领域技术人员也可以设想多种其他配置。
Seldeg可包括与Fcγ受体和补体结合的Fc片段。当需要针对Seldeg中的抗原的免疫应答时(例如,在肿瘤成像中),在特定应用领域的背景下可能需要Fcγ和补体结合位点的存在。在这种应用中,可优选配置为结合Fcγ受体和补体的Seldeg。例如,包括缺乏工程化突变(例如精氨酸突变)以对本文所述的Fcγ受体和/或补体(C1q)具有降低的结合亲和力或没有结合亲和力的Fc片段的Seldeg,可以配置为引发这种免疫应答。包括具有本领域技术人员已知的突变以增加与Fcγ受体和/或补体(C1q)的结合的Fc片段的Seldeg也可以被配置为引发这种免疫应答。此类Seldeg还可以配置成每个Seldeg包含一个以上相同类型的抗原分子(图2K,2L,2M或2N)以增强免疫复合物的形成。
例如,Seldeg可具有靶向结构域或抗体片段(例如Fab片段或scFv片段)的数量的变化,其范围为1-3个靶向结构域或抗体片段(图2)。这些靶向结构域或抗体片段可以与免疫球蛋白Fc片段连接,而在其他情况下,靶向结构域或抗体片段可以彼此连接;抗原和抗体片段可以以不同的方向与Fc片段或彼此融合(图2);Seldeg可包括在融合蛋白,结构域或片段之间长度和组成不同的接头序列,例如IEGRMD,GGGGS或该接头的2-3次重复;可以使用抗原模拟物如小分子或肽;Seldeg中的Fc片段可以被突变,使得它对Fcγ受体,补体具有显著降低的结合亲和力和对结合FcRn的亲和力增加;Seldeg的Fc片段可具有突变,例如旋钮进孔和/或静电转向突变,从而形成抗原连接的和非抗原连接的Fc片段或含有两种不同的抗原的异二聚体。
Seldeg可包括以下抗原:包括与自身免疫疾病(包括自身免疫性脑炎)相关的蛋白质、糖蛋白和核酸,髓鞘少突胶质细胞糖蛋白(MOG),髓鞘碱性蛋白,蛋白脂质蛋白,髓鞘相关糖蛋白,髓鞘相关少突胶质细胞碱性蛋白,转醛酶,乙酰胆碱受体,肌肉特异性激酶,低密度脂蛋白受体相关蛋白4,胰岛素,胰岛抗原2,谷氨酸脱羧酶65,锌转运蛋白8,瓜氨酸化抗原,氨基甲酰化抗原,胶原蛋白,软骨gp39,gp130-RAPS,65kDa热休克蛋白,纤维蛋白(fibrillarin),小核蛋白(snoRNP),水通道蛋白4,甲状腺刺激因子受体,核抗原,DNA,组蛋白,糖蛋白gp70,核糖体,丙酮酸脱氢酶脱氢尿苷酰乙酰转移酶,毛囊抗原,人原肌球蛋白异构体5,N-甲基-D-天冬氨酸(NMDA)受体,α-氨基-3-羟基-5-甲基-4-异噁唑丙酸(AMPA)受体,GABAA和GABAB受体,甘氨酸受体,二肽基肽酶样蛋白6(DPPX),谷氨酸受体(GluR5),电压门控钾通道,Hu,甲状腺过氧化物酶,甲状腺球蛋白,甲状腺刺激素(TSH)受体,甲状腺激素T3和T4,桥粒芯糖蛋白1和3,以及其他技术人员可识别的抗原。以下抗原是与肿瘤相关并且可以在Seldeg中掺入以在诊断成像期间清除肿瘤特异性抗体的抗原的实例:HER2,前列腺特异性膜抗原(PSMA),前列腺干细胞相关抗原(PSCA),c-Met,EpCAM,癌胚抗原(CEA)。其他抗原包括患者具有特异性抗体的治疗剂,或移植接受体中抗体识别的移植抗原。此外,可以产生抗原的分子模拟物(合成的,蛋白质片段等),并且这些也可以用于产生Seldeg。上述抗原是实例,并且不限于本领域技术人员在阅读本公开后可鉴定的其他类型的可能抗原。
在本文所述的一些实施例中,Seldeg可以是融合蛋白的异二聚体,其包含以下氨基酸序列:SEQ ID NO:2加SEQ ID NO:6,SEQ ID NO:4加SEQ ID NO:6,SEQ ID NO:8加SEQID NO:10,SEQ ID NO:12加SEQ ID NO:14,SEQ ID NO:16加SEQ ID NO:18加抗体轻链SEQID NO:20,SEQ ID NO:22加SEQ ID NO:24加抗体轻链SEQ ID NO:20,SEQ ID NO:26加SEQID NO:28,SEQ ID NO:30加SEQ ID NO:6,SEQ ID NO:32加SEQ ID NO:6,或SEQ ID NO:34加SEQ ID NO:6,或其同源物。
Seldeg可以是包含与以下具有至少50%相同性的氨基酸序列的融合蛋白:SEQ IDNO:2,SEQ ID NO:4,SEQ ID NO:6,SEQ ID NO:8,SEQ ID NO:10,SEQ ID NO:12,SEQ ID NO:14,SEQ ID NO:16,SEQ ID NO:18,SEQ ID NO:20,SEQ ID NO:22,SEQ ID NO:24,SEQ IDNO:26,SEQ ID NO:28,SEQ ID NO:30,SEQ ID NO:32,或SEQ ID NO:34。
如本文所用,在两个核酸或多肽序列的上下文中的“序列相同性”或“相同性”指的是当在指定的比较窗口上对齐以获得最大对应性时两个序列中的核苷酸碱基或残基是相同的。当使用序列相同性或相似性的百分比指代蛋白质时,认识到不相同的残基位置通常因保守氨基酸取代而不同,其中氨基酸残基被具有相似理化性质的氨基酸残基的功能等同残基取代,因此不会改变分子的功能特性。
本文使用的功能等同的氨基酸残基通常是指具有与原始氨基酸基本相似的理化和立体化学特征的其他氨基酸残基。理化性质包括水溶性(疏水性或亲水性),介电和电化学性质,生理pH,侧链的部分电荷(正、负或中性)和本领域技术人员可识别的其他性质。立体化学特征包括氨基酸的空间和构象排列及其手性。例如,在本公开的意义上,谷氨酸被认为是天冬氨酸的功能等同残基。酪氨酸和色氨酸被认为是苯丙氨酸的功能等同残基。精氨酸和赖氨酸被认为是组氨酸的功能等同残基。
本领域技术人员将理解,序列之间的相似性通常通过包括以下步骤的过程来测量:将两个多肽或多核苷酸序列比对以形成比对序列,然后检测匹配的字符(即,两个比对的序列之间相似或相同的字符)的数量,并计算每个多肽或多核苷酸序列中的匹配的字符的总数除以比对的总字符数,包括缺口。相似性结果表示为相同性的百分比。
如本文所用,“序列相同性百分比”意指通过在比较窗口上比较两个最佳比对序列而确定的值,其中比较窗口中多核苷酸序列的部分与参考序列(不含添加或缺失)相比可包含添加或缺失(即缺口)以最佳比对所述两种序列。该百分比如下计算:通过测定两个序列中出现相同核酸碱基或氨基酸残基的位置数产生匹配位置数,将该匹配位置数除以比较窗口中位置的总数,得到的结果乘以100产生序列相同性百分比。
如本文所用,“参考序列”是用作序列比较基础的确定序列。参考序列可以是指定序列的子集或全部;例如,作为全长蛋白质或蛋白质片段的区段。参考序列可以是,例如,在例如GenBank和UniProt等数据库中可识别的序列,以及本领域技术人员可识别的其他序列。
如本领域技术人员所理解的,可以使用数学算法来确定任何两个序列之间的百分比相同性。合适的数学算法的计算机实施手段可用于比较序列来确定序列相同性。这类实施手段包括但不限于:CLUSTAL,ALIGN,GAP,BESTFIT,BLAST,FASTA,以及技术人员可识别的其他实施手段。
例如,根据本公开的Seldeg可具有与SEQ ID NO:2,SEQ ID NO:4,SEQ ID NO:6,或SEQ ID NO:8,或SEQ ID NO:10,或SEQ ID NO:12,或SEQ ID NO:14,或SEQ ID NO:16,或SEQID NO:18,SEQ ID NO:20,SEQ ID NO:22,SEQ ID NO:24,SEQ ID NO:26,SEQ ID NO:28,SEQID NO:30,SEQ ID NO:32,或SEQ ID NO:34相比至少50%,优选至少80%,更优选至少90%,最优选至少95%的序列相同性的氨基酸序列。
Seldeg靶向的抗原特异性抗体可以是存在于患者体内的自身抗体,与治疗剂结合的抗体,识别移植的抗体和用于诊断成像的修饰的(例如放射性标记的)抗体或片段/工程化形式,以及本领域技术人员可以识别的其他抗体。
如下面的实施例所示,Seldeg能够选择性地消除对其融合抗原具有特异性的靶抗原特异性抗体,例如靶抗原特异性抗体HER2特异性曲妥珠单抗或帕妥珠单抗(“TZB”或“PZB”)和MOG特异性抗体(“8-18C5”)。如下面的实施例所示,Seldeg能够选择性地消耗靶抗原特异性抗体,而不会对总IgG水平产生负面影响或引起不良免疫反应。这些发现与其他方法形成对比,其他方法通过使用FcRn抑制剂或破坏B细胞的抗体,治疗导致总IgG的消耗。这些方法对非靶向特异性或B细胞功能的抗体产生不利影响,因为它们缺乏Seldeg提供的选择性。
基于这种独特的选择性,Seldeg平台具有许多应用,因为Seldeg可能与许多其他靶向蛋白和抗原一起产生。此类应用的实例包括治疗自身免疫性疾病,在移植前或移植期间治疗抗体介导的排斥,增加肿瘤全身成像期间的对比度(例如,肿瘤抗原PSMA,EpCAM和CEA可用作抗原以发展另外的Seldeg),例如,如果观察到不良反应,则在给予后消耗特定生物制剂的体浓度,去除抗体以清除在递送治疗剂之前识别治疗剂的抗体。
Seldeg可以能够将它们递送至在细胞表面上表达靶向的受体或其他分子的细胞的任何方式给予,例如通过注射,特别是静脉内,皮下或肌内注射,或注射到需要消耗的抗原特异性抗体靶向的组织中。Seldeg也可以在经遗传工程改造以包含编码Seldeg的表达构建体的细胞中表达。具体说,可以通过引入编码Seldeg蛋白的表达构建体来对细胞进行基因工程改造,所述Seldeg蛋白包括允许原位从工程细胞分泌Seldeg的蛋白质或肽。例如,可以使用与嵌合抗原受体(CAR)T细胞疗法所述类似的方法,用编码Seldeg的表达构建体转染患者来源的细胞,并将转染的细胞递送回患者体内。表达构建体将包含本领域技术人员已知的表达载体,并且可以例如包含编码MOG Seldeg(SEQ ID NO:1和5)的基因,其具有分泌前导肽,例如衍生自连接于成熟MOG Seldeg(SEQ ID NO:1)和Fc(SEQ ID NO:5)的编码序列的5'端的免疫球蛋白基因的那些。
Seldeg可以以不阻断每个靶向受体/细胞表面分子的量给予,允许细胞表面受体/分子的正常功能。使用的Seldeg的剂量可以与针对清除靶向的抗体的量相似,这将取决于例如抗体介导的疾病的特异性,或者Seldeg是否用于改善诊断成像中的对比度。预期使用的Seldeg的量小于靶向的受体类型的总数,因此靶向的受体的正常功能不会受到不利影响。此外,Seldeg可以设计成使它们不与细胞表面受体或细胞表面分子的天然配体竞争结合,例如,通过使用在不与IgG结合位点重叠的位点结合FcRn的纳米抗体(VHH)(例如,参见Andersen,J.T.,Gonzalez-Pajuelo,M.,Foss,S.,Landsverk,O.J.B.,Pinto,D.,Szyroki,A.,de Haard,H.J.,Saunders,M.,Vanlandshoot,P.,Sandlie,I.(2012)选择靶向人类新生儿受体的纳米抗体(Selection of nanobodies that target human neonatalreceptor).Sci.Rep.,3,1118)。此外,Seldeg可以去除循环中或待消耗的抗原特异性抗体靶向的组织中的非靶向抗体的少于10%,少于5%,少于1%或少于0.1%。在Seldeg治疗期间和之后保留非靶向抗体在正常免疫功能和避免感染以及本文所述的其他效果中可能是重要的。
可以每天,每周或每当50%的患者预期在循环中或在靶向的抗原特异性抗体识别的组织中再生阈值量的靶向的抗原特异性抗体时给予Seldeg。靶向的抗原特异性抗体的水平可以通过使用酶联免疫吸附测定(ELISA)来分析血清样品来确定。或者,可以使用本领域技术人员公知的其他方法。
在具有抗体介导的排斥风险的移植患者中,可以在移植之前或之后给予Seldeg。如果靶抗原特异性抗体在循环中或在靶抗原特异性抗体识别的组织中达到阈值量的靶抗原特异性抗体,则可以给予紧急剂量的Seldeg。靶向的抗原特异性抗体的水平可以通过使用酶联免疫吸附测定(ELISA)来分析血清样品来确定。或者,可以使用本领域技术人员公知的其他方法。
在具有对治疗剂(例如基于蛋白质的治疗剂)特异性的抗体的患者中,可以在递送治疗剂之前给予Seldeg以消耗这些抗体。如果它们在先前递送期间引发免疫应答,或者如果患者中存在对治疗剂特异的预先存在的抗体,预期这将克服与快速抗体介导的治疗剂清除相关的问题。可以使用许多不同的方法检测对基于蛋白质的治疗剂特异的预先存在的或诱导的抗体(例如,参见Xue,L.,Clements-Egan,A.,Amaravadi,L.,Birchler,M.,Gorovits,B.,Liang,M.,Myler,H.,Purushothama,S.,Manning,M.S.,Sung,C.(2017)在生物治疗开发期间评估和管理预先存在的药物反应性抗体的建议(Recommendations forthe assessment and management of pre-existing drug-reactive antibodies duringbiotherapeutic development).AAPS,19,1576-1586)。
在诊断/治疗诊断成像中,预期放射性标记的成像抗体的递送之后将进行一段时间以允许肿瘤定位。随后,Seldeg可用于从脱靶位点(例如循环)清除放射性标记的抗体,从而改善对比度。例如,该方法可包括以下步骤:首先,向患者注射与肿瘤抗原结合的放射性标记(或其他标记)的抗体。第二步,在允许放射性标记的抗体与肿瘤结合的一段时间(例如16-24小时)之后,以与注射剂量的显像剂相当的摩尔量注射Seldeg。在清除期(例如4-24小时)之后,使用正电子发射断层扫描或其他全身成像模态对患者成像。
Seldeg可以足以在给予后1小时,2小时,5小时,24小时或48小时或更长时间消耗循环中或靶抗原特异性抗体识别的组织中靶抗原特异性抗体浓度的至少50%,至少80%或至少90%的量给予。Seldeg在体内的持久性将决定其消耗抗原特异性抗体的活性有多长。可以设计Seldeg通过它们靶向的细胞表面受体或细胞表面分子的行为而具有不同的体内半衰期。Seldeg对该细胞表面受体或细胞表面分子的亲和力也可以使用本领域技术人员已知的诱变和方法进行修饰,以产生在循环和/或组织中具有不同持久性的Seldeg。具体说,Seldeg可以以与待消耗的抗原特异性抗体的量至少近似等摩尔的量给予。Seldeg可以以与靶抗原特异性抗体的摩尔比为例如约1:1,2:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1或更高摩尔比的量给予。具体说,例如,其中Seldeg靶向给予患者的抗体(例如抗MOG或抗HER2抗体等),Seldeg可以以与给予的靶抗原特异性抗体的摩尔比为例如约1:1,2:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1或更高的摩尔比的剂量给予。
实施例
提供下列实施例以进一步说明本发明的具体实施方式。所述实施例无意完整并详细地公开或描述本发明的每个方面,也不应按上述方式理解。除非另有说明,否则在这些实施例中始终使用细胞系和组合物的名称。
实施例1-表达和纯化与FcRn结合的Seldeg
靶向细胞上的FcRn的Seldeg含有作为与二聚人IgG1衍生的Fc片段连接的单体的重组抗原(图3A),其具有突变以消除与人FcγR的相互作用并增强近中性的pH下Seldeg Fc片段与FcRn的结合亲和力。通过在CH3结构域中插入“旋钮进孔”突变来实现这两种Seldeg的异二聚体形成。
产生示例性HER2-Seldeg(SEQ ID NO:3,4,5和6)的表达构建体如下制备:为表达具有与工程化Fc片段(SEQ ID NO:3)融合的HER2的多肽链,使用标准分子生物学技术从HER2过表达的乳腺癌细胞系(BT-474)中分离编码HER2前导肽和细胞外结构域(由630个残基组成的ECD)的基因。使用重叠延伸的剪接,通过IEGRMD接头肽将该基因与编码人IgG1衍生的Fc片段的基因的铰链区的N端融合。使用标准方法将消除与FcγRs(G236R/L328R;EU编号)的结合,增强与FcRn(MST-HN;M252Y/S254T/T256E/H433K/N434F;EU编号)的结合和产生“旋钮进孔”(Y349T/T394F;EU编号)的突变插入Fc片段基因中。在与轻链恒定区中的半胱氨酸桥接的铰链区中的半胱氨酸(C220;EU编号)也突变为丝氨酸。产生具有FcRn增强突变,消除FcγR结合的突变和没有融合抗原的Fc片段基因,具有互补的旋钮进孔突变(S364H/F405A;EU编号)(SEQ ID NO:5)。用Gibco Expi293TM表达系统试剂盒(Life Technologies)瞬时转染后,在HEK-293F(Life Technologies)细胞中表达重组蛋白。使用阴离子交换柱(SOURCE-15Q,GE Healthcare)在pH 8.0和线性盐梯度(0-0.5M NaCl)从培养物上清液中纯化HER2-Seldeg。或者,可以使用蛋白A-Sepharose和标准方法纯化HER2-Seldeg。从柱(离子交换或蛋白A-Sepharose)洗脱后,将HER2-Seldeg用磷酸盐缓冲盐水(PBS)透析。在用于实验之前,使用PBS(Lonza)中的尺寸排阻色谱(SEC)(GE Healthcare)进一步纯化HER2-Seldeg。使用类似方法制备用于其他Seldeg的表达质粒,并且在转染的HEK-293F细胞中表达重组蛋白。没有FcRn增强突变的Seldeg(例如MOG-Seldeg-PS;MOG-Seldeg-TfR;SEQ IDNO:7,8,9,10,11,12,13以及14,15,16,17,18,19,和20)用蛋白G-Sepharose纯化。
产生靶向对两种抗原特异的抗体的Seldeg:(1)HER2-Seldeg;和(2)MOG-Seldeg。抗原HER2是用于治疗的明确定义的靶标,并且还用于HER2特异性抗体的过表达HER2的肿瘤的诊断成像,例如曲妥珠单抗(TZB)或帕妥珠单抗(PZB)。抗原MOG在多发性硬化(MS)动物模型和人类MS中被自身反应性抗体识别。
HER2-Seldeg和MOG-Seldeg在中性pH和酸性pH下对FcRn保持显著更高的结合亲和力,不同于包含与Fc片段融合的HER2或MOG以产生HER2-Seldeg和MOG-Seldeg的类似构建体的重组融合蛋白(分别为“HER2-WT”和“MOG-WT”),除了它们缺乏在近中性pH下增加结合亲和力的FcRn增强的MST-HN突变(M252Y,S254T,T256E,H433K,N434F;EU编号)(图3B)。使用BIAcore T200(GE Healthcare)进行表面等离子体共振实验以分析重组蛋白与FcRn的相互作用。以10μl/分钟的流速,在PBS(pH 6.0或7.4)加0.01%v/v吐温-20中,在固定的FcRn(在CM5传感器芯片上以~600RU偶联)上注射100nM MOG/HER2-Seldeg或MOG/HER2-WT来分析Seldeg/WT与重组小鼠FcRn的结合。在每次注射和解离阶段后,使用0.15M NaCl,0.1M碳酸氢钠,pH8.5再生流动池。对数据进行零调整并减去背景(通过仅在偶联反应期间与缓冲剂偶联的流动池注射获得背景)。
使用以下方法鉴定增加FcRn的突变,例如MST-HN:在Fc片段基因中随机突变已知对FcRn结合必需的氨基酸(例如253、435)附近的残基,并且在噬菌体上展示突变的Fc片段文库。使用噬菌体展示技术选择对FcRn具有增加的结合亲和力的Fc片段(Ghetie,V.,Popov,S.,Borvak,J.,Radu,C.,Matesoi,D.,Medesan,C.,Ober,R.J.,Ward,E.S.(1997)通过随机诱变增加IgG片段的血清持久性(Increasing the serum persistence of an IgGfragment by random mutagenesis),Nature Biotech.,15,637-640;Dall’Acqua,W.F.,Woods,R.M.,Ward,E.S.,Palaszynski,S.R.,Patel,N.K.,Brrewah,Y.A.,Wu,H.,Kiener,P.A.,Langermann,S.(2001)增加人IgG1对新生儿受体的亲和力:生物学因素(Increasingthe affinity of a human IgG1 for the neonatal receptor:biologicalconsequences),J.Immunol.,169,5171-5180)。或者,这些残基可以突变为每一个可能的其他氨基酸和使用诸如ELISA或表面等离子体共振结合分析的方法鉴定的对FcRn的更高的亲和力的Fc片段。
尺寸排阻分析表明,当在4℃孵育30天或在37℃孵育5天后,包含Seldeg的重组蛋白在磷酸盐缓冲盐水中孵育后不形成聚集体(图3C)。
实施例2-靶向FcRn的Seldeg在转基因表达人FcγR的小鼠(huFcγR小鼠)中消耗靶抗原特异性抗体的能力
为了确定Seldeg消耗靶抗原特异性抗体的能力,用15μg放射性标记的(125I-标记的)MOG特异性抗体8-18C5注射转基因表达人FcγR的小鼠(huFcγR小鼠;Smith,P.,DiLillo,D.J.,Bournazos,S.,Li,F.,Ravetch,J.V.(2012).小鼠模型重现人Fcγ受体结构和功能多样性(Mouse model recapitulating human Fcγreceptor structural andfunctional diversity).Proc.Natl.Acad.Sci.USA 109,6181-6186.http://dx.doi.org/10.1073/pnas.1203954109)。在huFcγR小鼠注射8-18C5后24小时,通过注射给予125μg或31μg的MOG-Seldeg或对照。在图3D中,“MOG-Seldeg-高”对应于125μg剂量,“MOG-Seldeg-低”对应于31μg剂量。对照是磷酸盐缓冲盐水(“PBS”)和未修饰的MOG-Fc融合蛋白(“MOG-WT”)。MOG-WT是与MOG-Seldeg类似的构建体,除了它缺乏在近中性pH下增加结合亲和力的增强FcRn增强的MST-HN突变。
为了产生图3D的数据,在指定的时间采集放射性标记的8-18C5的全身计数。紧接在Seldeg或对照递送之前8-18C5给予后24小时获得的每分钟计数(“CPM”)视作每只小鼠100%,并且此后获得的全身CPM标准化至该时间点。误差条表示标准偏差,并且使用具有Tukey多重比较的双因素ANOVA确定统计学显著性差异,p<0.05且n=6只小鼠/组。
125μg和31μg的MOG-Seldeg的剂量比500μg MST-HN Abdeg的剂量低约2至8倍(以摩尔计),所述Abdeg已经显示全面消除小鼠中的IgG水平。使用这种较低剂量的MOG-Seldeg以尽可能减少通过与Seldeg竞争FcRn结合对融合的抗原非特异性的IgG的影响。与8-18C5靶抗原特异性抗体相比,125μg或31μg的剂量分别代表约16倍和4倍摩尔过量。
图3D提供了放射性标记的8-18C5(靶抗原特异性抗体)的标准化全身计数与时间的关系图。给予MOG-Seldeg导致标准化全身计数中8-18C5的快速的剂量依赖性降低(图3D),这证明了MOG-Seldeg从体内选择性消耗8-18C5的能力。相反,注射缺乏FcRn增强的MST-HN突变的对照MOG-WT对8-18C5抗体消除没有影响。这证明了MST-HN突变在pH6.0-7.4下赋予对FcRn的高结合亲和力的重要性。
实施例3-靶向FcRn的Seldeg的特异性及其诱导血液和全身中靶抗原特异性抗体水平显著降低的能力
为了分析Seldeg的特异性及其对具有不同抗原识别特性的抗体的影响,在HER2-Seldeg和MOG-Seldeg存在下研究了HER2特异性抗体TZB的行为(图3E)。为了产生图3E的数据,huFcγR小鼠静脉内注射15μg放射性标记的(125I标记的)TZB,随后注射4倍摩尔过量的HER2-Seldeg,或作为抗原特异性的对照,MOG-Seldeg。另外的对照是磷酸盐缓冲盐水(“PBS”),Abdeg和包含融合至Fc片段以产生与HER2-Seldeg类似的构建物的重组融合蛋白(“HER2-WT”),除了其缺乏在近中性pH下增加结合亲和力的FcRn-增强MST-HN突变。与Seldeg形成对比,“Abdeg”是人IgG1衍生的抗体,其具有非选择性消耗抗体的MST-HN突变。这些蛋白质被称为Abdeg,因为它们是通常导致IgG降解的抗体。
为了产生图3E的数据,将小鼠放血并在指定的时间进行血液和全身计数。在紧接Seldeg或对照递送之前TZB给予后24小时获得的每分钟计数(“CPM”)对于每只小鼠视作100%,并且此后获得的血液和全身的CPM标准化至该时间点。误差条表示标准偏差,并且使用具有Tukey多重比较的双因素ANOVA确定统计学显著性差异,p<0.05且n=6只小鼠/组。
图3E提供了放射性标记的TZB(靶抗原特异性抗体)的标准化血液和全身计数与时间的图。给予HER2-Seldeg导致TZB的标准化全身计数显著降低,血液和全身计数均显示,这表明HER2-Seldeg选择性地从体内消耗TZB的能力。相反,对照蛋白质表现出与PBS对照观察到的相似的行为(图3E)。
实施例4-靶向FcRn的Seldeg快速消耗靶抗原特异性抗体的能力
给小鼠静脉内给予放射性标记的(125I)TZB(15μg),24小时后静脉内递送HER2-Seldeg(51μg;超过TZB 4倍摩尔过量)。另外的对照是磷酸盐缓冲盐水(“PBS”)和Abdeg(60μg)。
为了产生图3F的数据,将小鼠放血并在指定的时间进行血液和全身计数。在紧接Seldeg或对照递送之前TZB给予后24小时获得的每分钟计数(“CPM”)对于每只小鼠视作100%,并且此后获得的血液和全身的CPM标准化至该时间点。误差条表示标准偏差,并且使用具有Tukey多重比较的双因素ANOVA确定统计学显著性差异,p<0.05且n=5-6只小鼠/组。
图3F提供了放射性标记的TZB(靶抗原特异性抗体)的标准化血液和全身计数与时间的图。给予HER2-Seldeg导致TZB的标准化全身计数和血液计数的快速降低,这证明了HER2-Seldeg从体内快速消耗TZB的能力。值得注意的是,在Seldeg给予后两小时内TZB的血液计数降低至接近背景水平(图3F),进一步支持HER2-Seldeg从血液中快速消耗靶抗原特异性抗体的能力。相反,在60μg/小鼠的剂量下,Abdeg的递送导致与PBS对照观察到的相似的行为(图3F)。
实施例5-靶向细胞表面上暴露的磷脂酰丝氨酸(PS)的Seldeg的活性
我们还研究了Seldeg选择性消除huFcγR小鼠中对MOG特异性的抗体的能力,其中靶向蛋白是突触结合蛋白1(Syt1)的C2结构域。Syt1与细胞上暴露的PS结合,因此Seldeg被设计为MOG-Seldeg-PS并且示意性地显示(图4A)。还产生了由于存在“DN”突变(D173N,D179N,D231N,D233N和D239N)而不与PS结合的MOG-Seldeg-PS(DN)。使用蛋白G-Sepharose和标准方法从转染的HEK 293F细胞的培养物上清液中纯化MOG Seldeg PS和MOG SeldegPS(DN)。通过将旋钮进孔和静电转向突变插入Fc区来实现异二聚体形成,并且尺寸排阻分析表明重组蛋白表现良好(图4A)。
为了产生图4B中所示的数据,给小鼠静脉内注射放射性标记的(125I)嵌合8-18C5(人恒定/小鼠可变结构域;MOG特异性;15-20μg)和24小时后静脉内递送磷酸盐缓冲盐水(PBS),40μg MOG-Seldeg-PS或作为对照的34μgFc-Syt1(未连接MOG)或40μg MOG-Seldeg-PS(DN)。在指定的时间测定放射性水平。紧接在MOG-Seldeg-PS或对照递送之前获得的全身CPM或血液CPM水平被视为100%,并且获得的所有后续CPM针对这些CPM水平进行标准化。误差条表示平均值的标准误差(SEM),MOG-Seldeg-PS处理组和对照组(Fc-Syt1,MOG-Seldeg-PS(DN)和PBS)之间的统计学显著性差异由*表示(p<0.05,双向ANOVA与Tukey的多重比较;n=5-6只小鼠/组)。
给予MOG-Seldeg-PS导致血液和全身计数中8-18C5的标准化全身计数显著降低,这证明了MOG-Seldeg-PS选择性消耗体内8-18C5的能力。相比之下,对照蛋白Fc-Syt1表现出与PBS对照相似的行为,尽管MOG-Seldeg-PS(DN)诱导8-18C5的减少(由于残留与PS的结合),但效果却显著低于MOG-Seldeg-PS(图4B)。
实施例6-靶向FcRn的Seldeg有效地将靶抗原特异性抗体内化到内体中并通过递送至溶酶体引起降解的能力
为了确定Seldeg在细胞水平上的活性机制,进行流式细胞术和荧光显微镜检查以分析Seldeg对靶抗原特异性抗体TZB、PZB和8-18C5的内化和积累的影响。首先,用人FcRn-GFP表达构建体转染人内皮细胞(HMEC-1),使其突变,使其结合特性类似于小鼠FcRn。
Seldeg有效地将结合的靶抗原特异性抗体内化到细胞内的内体中,并且在孵育8小时后,将靶抗原特异性抗体递送至溶酶体。
图5A是平均荧光强度(“MFI”)的图,图5B和图5C是在靶抗原特异性抗体存在下Seldeg活性的显微图像,其中代表性内体的显微图像被裁剪,放大并呈现在右上角的插图中。图5A显示分别在Alexa 647-标记的TZB和HER2-Seldeg以及Alexa 647-标记的8-18C5和MOG-Seldeg的存在下更大的MFI。这个更大的MFI表明HER2-和MOG-Seldeg分别与TZB和8-18C5的共孵育(在图5A,5B和5C中,分别是400nM Seldeg或WT对照加100nM抗原特异性抗体;30分钟脉冲,无追踪或60分钟追踪,标记的30’P或30’P 60’C)导致更高水平的TZB和8-18C5进入细胞。当在HER2-Seldeg存在下使用HER2特异性抗体帕妥珠单抗(PZB)代替TZB时获得了类似的结果(图5A)。此外,在60分钟追踪期间,细胞保留大部分的每种靶抗原特异性抗体。相反,在阴性对照HER2-WT(对TZB或PZB选择性)和MOG-WT(对8-18C5选择性)的存在下,细胞内靶抗原特异性抗体的积累显著较低。
图5B和C显示抗原特异性抗体在细胞中积累并且在Seldeg存在下与内体中的FcRn相关联。为了产生图5B的显微图像,HMEC-1细胞用100nM Alexa 647标记的TZB(HER2特异性)与400nM Alexa 555标记的HER2-Seldeg或HER2-WT(如所示)复合物脉冲30分钟,洗涤,立即固定或洗涤,在培养基中追踪60分钟,然后固定。使用荧光显微镜对固定的细胞进行成像。使用相同的方法产生图5C中的数据,除了使用100nM Alexa 647-标记的8-18C5(MOG特异性)与400nM Alexa 555标记的MOG-Seldeg或MOG-WT复合物。每个显微图像中的条为5μm,并且每个显微图像插图中的条为0.25μm。图5B和5C中显示的数据表明,与存在对照(WT)蛋白质相比,在存在与FcRn结合的Seldeg的情况下,抗原特异性抗体在表达FcRn的细胞中累积至显著更高的水平。
图6A显示了在靶抗原特异性抗体存在下Seldeg活性的显微图像,其中代表性溶酶体的显微图像被裁剪、放大并呈现在右上角插图中。对于图6A,HMEC-1细胞用Alexa 555标记的葡聚糖预脉冲2小时并洗涤,然后用100nM Alexa 647标记的8-18C5(MOG特异性)和400nM MOG-Seldeg或MOG-WT(如所示)的复合物脉冲30分钟,然后追踪8小时,然后洗涤,固定并成像。为了产生图6B的显微图像,将HMEC-1细胞用Alexa 555标记的葡聚糖预脉冲2小时并洗涤,然后用100nM Alexa 647标记的TZB或8-18C5抗体和400nM MOG-Seldeg或HER2-Seldeg(如所示)的复合物脉冲30分钟,然后进行8小时追逐,然后洗涤,固定并成像。对于每个叠加图像(如右栏所示),GFP,Alexa 555和Alexa 647分别是伪色的绿色,红色和蓝色。每个显微图像中的条为5μm,并且每个显微图像插图中的条为0.25μm。值得注意的是,图6B显示细胞分别在MOG-Seldeg或HER2-Seldeg存在下不在溶酶体中积累TZB和8-18C5,这表明它们的作用的抗原特异性。
实施例7-靶向磷脂酰丝氨酸的Seldeg有效地将靶抗原特异性抗体内化到细胞中的能力
图7显示MOG-Seldeg-PS有效地将MOG特异性抗体(嵌合8-18C5)内化到内皮细胞和巨噬细胞中,并且摄取依赖于PS结合。将暴露PS的内皮细胞(2H11)或巨噬细胞(RAW264.7)与混合20nM MOG-Seldeg-PS,MOG-Seldeg-PS(DN)或Fc-Syt1(没有MOG)的10nM Alexa 647标记的嵌合8-18C5一起孵育2小时。通过流式细胞术确定Alexa 647标记的嵌合8-18C5(通过使用本领域技术人员熟知的方法将小鼠抗体8-18C5的可变结构域与人IgG1,Cκ的恒定区融合而制备)的平均荧光强度(MFI),一式三份样品。
该示例性PS结合Seldeg是钙依赖性的,因此在钙浓度低得多的内体中解离。并非所有PS靶向的Seldeg预期是钙依赖性的,但是一些是这样,例如包含膜联蛋白V的那些将具有这种性质,如技术人员所理解的那样。此外,几种抗体可与β-2糖蛋白1结合,而β-2糖蛋白1又可与PS结合。
实施例8-靶向转铁蛋白受体的Seldeg有效地将靶抗原特异性抗体内化到表达人转铁蛋白受体的细胞中的能力
已经产生了包含与靶向转铁蛋白受体(MOG-Seldeg-TfR)的抗体融合的抗原(MOG)的Seldeg,并且在图8中示意性地显示。MOG-Seldeg-TfR和对照抗体,Ab-TfR(不存在MOG)使用蛋白G-Sepharaose和标准方法从转染的HEK-293F细胞的培养物上清液中纯化。MOG-Seldeg-TfR有效地将MOG特异性抗体(嵌合8-18C5)内化到内皮细胞(HMEC-1)中,摄取取决于Seldeg中MOG的存在(图9)。将表达人TfR的HMEC-1细胞与混合200nM MOG-Seldeg-TfR或TfR特异性抗体(Ab-TfR;无MOG)的50nM Alexa 647标记的嵌合8-18C5(特异于MOG)一起孵育30分钟,然后洗涤,没有追踪(30'P),或追踪30分钟后洗涤和追踪60分钟(30'P,60'C)。通过流式细胞术测定一式三份样品的Alexa 647-标记的8-18C5的平均荧光强度(MFI)(图9)。
实施例9-Seldeg在使用放射性标记的抗体的肿瘤的正电子发射断层扫描分析期间靶向FcRn以清除背景的能力
将雌性BALB/c SCID小鼠在乳腺脂肪垫中植入HER2阳性乳腺癌细胞系HCC1954(0.5×106个细胞/小鼠;细胞在注射前悬浮于RPM1-1640/Matrigel中)。6-7天后,给小鼠注射124-I标记的TZB(60μg/小鼠),并在22小时后使用正电子发射断层扫描(PET)进行分析。给小鼠注射摩尔当量的HER2-Seldeg(51μg/小鼠),或作为对照,注射MOG-Seldeg(31μg/小鼠)或PBS载剂(n=3只小鼠/组)。在注射Seldeg或PBS后4小时使用PET分析小鼠。使用Siemens Inveon PET计算机断层扫描(CT)多模态系统进行小鼠成像。
为了产生图10A中所示的数据,在注射124-I标记的TZB后22小时(‘22h’)和注射HER2-Seldeg,MOG-Seldeg或PBS后4.5-5小时('4.5小时清除')进行小鼠成像。PET和CT图像在AMIDE软件包中共同注册。图10B提供了注射124-I标记的TZB后22小时以及注射HER2-Seldeg,MOG-Seldeg或PBS后4小时放射性标记强度的对比度量的图。为了确定对比度量,在胸部区域(背景)和肿瘤中鉴定了两个感兴趣的区域。绘制肿瘤中的平均强度与胸部区域中的平均强度的比率的平均值(n=3只小鼠/组)。误差条指出标准误差。显示了用HER2-Seldeg与MOG-Seldeg或PBS处理的小鼠之间的统计学显著性差异(p<0.05)。数据显示HER2-Seldeg的递送降低了小鼠胸部区域的背景。
实施例10-具有突变(例如旋钮进孔突变、精氨酸突变和静电转向突变)的示例性Seldeg和对照及其变体的DNA和蛋白质序列
表1显示了编码本文所述的示例性蛋白质的多核苷酸的DNA序列,表2显示了由表1中所示的多核苷酸编码的示例性蛋白质的氨基酸序列,其中SEQ ID NO:1的DNA序列编码SEQ ID NO:2的蛋白质,SEQ ID NO:3的DNA序列编码SEQ ID NO:4的蛋白质,SEQ ID NO:5的DNA序列编码SEQ ID NO:6的蛋白质,SEQ ID NO:7的DNA序列编码SEQ ID NO:8的蛋白质,SEQ ID NO:9的DNA序列编码SEQ ID NO:10的蛋白质,SEQ ID NO:11的DNA序列编码SEQ IDNO:12的蛋白质,SEQ ID NO:13的DNA序列编码SEQ ID NO:14的蛋白质,SEQ ID NO:15的DNA序列编码SEQ ID NO:16的蛋白质,SEQ ID NO:17的DNA序列编码SEQ ID NO:18的蛋白质,SEQ ID NO:19的DNA序列编码SEQ ID NO:20的蛋白质,SEQ ID NO:21的DNA序列编码SEQ IDNO:22的蛋白质,SEQ ID NO:23的DNA序列编码SEQ ID NO:24的蛋白质,SEQ ID NO:25的DNA序列编码SEQ ID NO:26的蛋白质,SEQ ID NO:27的DNA序列编码SEQ ID NO:28的蛋白质,SEQ ID NO:29的DNA序列编码SEQ ID NO:30的蛋白质,SEQ ID NO:31的DNA序列编码SEQ IDNO:32的蛋白质,SEQ ID NO:33的DNA序列编码SEQ ID NO:34的蛋白质。
表1:编码示例性蛋白质的多核苷酸的DNA序列
表2:示例性蛋白质的氨基酸序列
SEQ ID NO:1的DNA序列是编码示例性MOG-Seldeg融合蛋白(SEQ ID NO:2)的多核苷酸,其具有增加FcRn结合的突变,旋钮进孔突变和精氨酸突变。分别为SEQ ID NO:1和2的MOG的示例性DNA和氨基酸序列是小鼠来源的。
具体说,SEQ ID NO:2的示例性MOG-Seldeg的氨基酸序列形成融合蛋白,其从N端到C端具有小鼠(m)MOG的残基1-117,残基118-122处的第一接头,残基123-138处的免疫球蛋白铰链(人IgG1衍生的),残基139-248处的免疫球蛋白CH2结构域(人IgG1衍生的),残基249-355处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:2的示例性MOG-Seldeg具有残基160,162,164,341和342处增加FcRn结合的突变,残基144和236处的精氨酸突变以及残基257和302处的“旋钮进孔”突变。通常与免疫球蛋白轻链配对的半胱氨酸残基(128)突变成丝氨酸。SEQ ID NO:2中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:3的DNA序列是编码示例性HER2-Seldeg融合蛋白(SEQ ID NO:4)的多核苷酸,其具有增加FcRn结合的突变,旋钮进孔突变和精氨酸突变。
具体说,SEQ ID NO:4的示例性HER2-Seldeg的氨基酸序列形成融合蛋白,其从N端到C端具有HER2的残基1-630,残基631-636处的第一接头,残基637-650处的免疫球蛋白铰链(人IgG1衍生的),残基651-760处的免疫球蛋白CH2结构域(人IgG1衍生的),残基761-867处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:4的示例性HER2-Seldeg具有残基672,674,676,853和854处增加FcRn结合的突变,残基656和748处的精氨酸突变以及残基769和814处的“旋钮进孔”突变。通常与免疫球蛋白轻链配对的半胱氨酸残基(640)突变成丝氨酸。SEQ ID NO:4中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:5的DNA序列是编码示例性Fc片段(SEQ ID NO:6)的多核苷酸,其具有增加FcRn结合的突变,旋钮进孔突变和精氨酸突变。例如,SEQ ID NO:6的融合蛋白被配置用于与MOG-Seldeg(SEQ ID NO:2)或HER2-Seldeg(SEQ ID NO:4)融合体形成异二聚体。
具体说,SEQ ID NO:6的示例性Fc片段的氨基酸序列从N端到C端具有残基1-16处的免疫球蛋白铰链(人IgG1衍生的),残基17-126处的免疫球蛋白CH2结构域(人IgG1衍生的),残基127-233处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:6的示例性Fc片段具有残基38,40,42,219和220处增加FcRn结合的突变,残基22和114处的精氨酸突变以及残基150和191处的“旋钮进孔”突变。通常与免疫球蛋白轻链配对的半胱氨酸残基(6)突变成丝氨酸。SEQ ID NO:6中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:7的DNA序列是编码具有旋钮进孔突变和精氨酸突变的示例性MOG-Seldeg-PS融合体的多核苷酸,并且编码的融合蛋白的相应氨基酸序列是SEQ ID NO:8。
具体说,SEQ ID NO:8的示例性MOG-Seldeg-PS融合体的氨基酸序列从N端到C端具有mMOG的残基1-117,残基118-122处的第一接头,残基123-138处的免疫球蛋白铰链(人IgG1衍生的),残基139-248处的免疫球蛋白CH2结构域(人IgG1衍生的),残基249-355处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:8的示例性MOG-Seldeg-PS在残基144和236处具有精氨酸突变,并且在残基257和302处具有“旋钮进孔”突变。与免疫球蛋白轻链配对的半胱氨酸残基(128)突变成丝氨酸。突触结合蛋白(Syt1)的C2A PS结合结构域的残基141-266(显示为残基361-486)通过GGGGS接头肽(残基356-360)与CH3结构域的C-端融合。SEQ ID NO:8中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:9的DNA序列是编码具有旋钮进孔突变和精氨酸突变的示例性Fc-Syt1融合体(SEQ ID NO:10)的多核苷酸,其被配置用于与MOG-Seldeg-PS(SEQ ID NO:8)形成异二聚体。
具体说,SEQ ID NO:10的示例性Fc-Syt1融合体的氨基酸序列从N端到C端具有残基1-16处的免疫球蛋白铰链(人IgG1衍生的),残基17-126处的免疫球蛋白CH2结构域(人IgG1衍生的),残基126-233处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:10的示例性Fc-Syt1融合蛋白在残基22和114处具有精氨酸突变,并且在残基150和191处具有“旋钮进孔”突变。通常与免疫球蛋白轻链配对的半胱氨酸残基(6)突变成丝氨酸。突触结合蛋白(Syt1)的C2A PS结合结构域的残基141-266(显示为残基239-364)通过GGGGS接头肽(残基234-238)与CH3结构域的C-端融合。SEQ ID NO:10中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:11的DNA序列是编码示例性MOG-Seldeg-PS融合体(SEQ ID NO:12)的多核苷酸,其具有旋钮进孔突变、静电转向突变和精氨酸突变。
具体说,SEQ ID NO:12的示例性MOG-Seldeg-PS融合体的氨基酸序列从N端到C端具有mMOG的残基1-117,残基118-122处的第一接头,残基123-138处的免疫球蛋白铰链(人IgG1衍生的),残基139-248处的免疫球蛋白CH2结构域(人IgG1衍生的),残基249-355处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:12的示例性MOG-Seldeg-PS在残基144和236处具有精氨酸突变,在残基300和317处具有静电转向突变,并且在残基257和302处具有“旋钮进孔”突变。与免疫球蛋白轻链配对的半胱氨酸残基(128)突变成丝氨酸。突触结合蛋白(Syt1)的C2A PS结合结构域的残基141-266(显示为残基361-486)通过GGGS接头肽(残基356-360)与CH3结构域的C-端融合。SEQ ID NO:12中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:13的DNA序列是编码具有旋钮进孔突变、静电转向突变和精氨酸突变的示例性Fc-Syt1融合体(SEQ ID NO:14)的多核苷酸,其被配置例如用于与MOG-Seldeg-PS(SEQ ID NO:12)形成异二聚体。
具体说,SEQ ID NO:14的示例性Fc-Syt1融合蛋白的氨基酸序列从N端到C端具有残基1-16处的免疫球蛋白铰链(人IgG1衍生的),残基17-126处的免疫球蛋白CH2结构域(人IgG1衍生的),残基127-233处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:14的示例性MOG-Seldeg-PS在残基22和114处具有精氨酸突变,在残基143和185处具有静电转向突变,并且在残基150和191处具有“旋钮进孔”突变。与免疫球蛋白轻链配对的半胱氨酸残基(6)突变成丝氨酸。突触结合蛋白(Syt1)的C2APS结合结构域的残基141-266(显示为残基239-364)通过GGGGS接头肽(残基234-238)与CH3结构域的C-端融合。SEQ ID NO:14中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:15的DNA序列是编码示例性MOG-Seldeg-TfR融合蛋白(SEQ ID NO:16)的多核苷酸,其包含具有旋钮进孔突变的TfR-特异性抗体重链。
具体说,SEQ ID NO:16的示例性TfR特异性抗体重链-MOG融合体(MOG-Seldeg-TfR)的氨基酸序列从N端到C端具有残基1-116处的TfR特异性VH结构域,残基117-213处的免疫球蛋白CH1结构域(人IgG1衍生的),残基214-229处的免疫球蛋白铰链(人IgG1衍生的),残基230-339处的免疫球蛋白CH2结构域(人IgG1衍生的),残基240-446处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:16的示例性TfR特异性抗体重链在残基348和393处具有“旋钮进孔”突变。mMOG的残基1-117(显示为残基452-568)通过GGGGS接头肽(残基447-451)与CH3结构域的C端融合。SEQ ID NO:16中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:17的DNA序列是编码示例性TfR特异性抗体重链的多核苷酸。具有旋钮进孔突变的编码的融合蛋白(SEQ ID NO:18)被配置为例如与MOG-Seldeg-TfR融合体(SEQID NO:16)形成异二聚体。
具体说,用于与TfR特异性重链-MOG融合体(SEQ ID NO:16)形成异二聚体的SEQID NO:18的示例性TfR特异性抗体重链的氨基酸序列从N端到C端具有残基1-116处的TfR特异性VH结构域,残基117-213处的免疫球蛋白CH1结构域(人IgG1衍生的),残基214-229处的免疫球蛋白铰链(人IgG1衍生的),残基230-339处的免疫球蛋白CH2结构域(人IgG1衍生的),残基340-446处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:18的示例性TfR特异性抗体重链在残基363和404处具有”旋钮进孔”突变。SEQ ID NO:18中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:19的DNA序列是编码TfR特异性抗体(SEQ ID NO:20)的示例性轻链的多核苷酸,并且被配置为例如与MOG-Seldeg-TfR融合体(SEQ ID NO:16)和TfR特异性抗体重链(SEQ ID NO:18)形成异二聚体。
具体说,SEQ ID NO:20的示例性TfR-特异性抗体轻链的氨基酸序列从N端到C端具有残基1-107处的TfR-特异性VL结构域,和残基108-213处的免疫球蛋白CL结构域(人Cκ)。SEQ ID NO:20中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:21的DNA序列是编码示例性MOG-Seldeg-TfR融合蛋白(SEQ ID NO:22)的多核苷酸,其包含具有精氨酸突变和旋钮进孔突变的TfR-特异性抗体重链。
具体说,SEQ ID NO:22的示例性TfR特异性抗体重链-MOG融合体(MOG-Seldeg-TfR)的氨基酸序列从N端到C端具有残基1-116处的TfR特异性VH结构域,残基117-213处的免疫球蛋白CH1结构域(人IgG1衍生的),残基214-229处的免疫球蛋白铰链(人IgG1衍生的),残基230-339处的免疫球蛋白CH2结构域(人IgG1衍生的),残基340-446处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:22的示例性TfR特异性抗体重链在残基235和327处具有精氨酸突变,并且在残基348和393处具有“旋钮进孔”突变。mMOG的残基1-117(显示为残基452-568)通过GGGGS接头肽(残基447-451)与CH3结构域的C端融合。SEQ ID NO:22中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:23的DNA序列是编码具有精氨酸突变和旋钮进孔突变的示例性TfR特异性抗体重链(SEQ ID NO:24)的多核苷酸,例如被配置用于与MOG-Seldeg-TfR融合体(SEQID NO:22)形成异二聚体。
具体说,SEQ ID NO:24的示例性TfR特异性抗体重链的氨基酸序列从N端到C端具有残基1-116处的TfR特异性VH结构域,残基117-213处的免疫球蛋白CH1结构域(人IgG1衍生的),残基214-229处的免疫球蛋白铰链(人IgG1衍生的),残基230-339处的免疫球蛋白CH2结构域(人IgG1衍生的),残基340-446处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQID NO:24的TfR特异性抗体重链在残基235和327处具有精氨酸突变,并且在残基363和404处具有“旋钮进孔”突变。SEQ ID NO:24中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:25的DNA序列是编码示例性HER2-Seldeg融合蛋白(SEQ ID NO:26)的多核苷酸,其具有增加FcRn结合的突变和旋钮进孔突变。
具体说,SEQ ID NO:26的示例性变体HER2-Seldeg的氨基酸序列形成融合蛋白,其从N端到C端具有HER2的残基1-630,残基631-636处的第一接头,残基637-650处的免疫球蛋白铰链(人IgG1衍生的),残基651-760处的免疫球蛋白CH2结构域(人IgG1衍生的),残基761-867处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:26的HER2-Seldeg具有残基672,674,676,853和854处增加FcRn结合的突变,以及残基769和814处的“旋钮进孔”突变。通常与免疫球蛋白轻链配对的半胱氨酸残基(640)突变成丝氨酸。SEQ ID NO:26中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:27的DNA序列是编码具有增加FcRn结合的突变和旋钮进孔突变的示例性Fc片段(SEQ ID NO:28)的多核苷酸,并且被配置用于例如与HER2-Seldeg(SEQ ID NO:26)形成异二聚体。
具体说,SEQ ID NO:28的示例性变体Fc片段的氨基酸序列从N端到C端具有残基1-16处的免疫球蛋白铰链(人IgG1衍生的),残基17-126处的免疫球蛋白CH2结构域(人IgG1衍生的),残基127-233处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:28的变体Fc片段具有残基38,40,42,219和220处增加FcRn结合的突变,以及残基150和191处的”旋钮进孔”突变。通常与免疫球蛋白轻链配对的半胱氨酸残基(6)突变成丝氨酸。SEQ ID NO:28中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:29的DNA序列是编码示例性前列腺特异性膜抗原(PSMA)-Seldeg融合蛋白(SEQ ID NO:30)的多核苷酸,其具有增加FcRn结合的突变、旋钮进孔突变和精氨酸突变。该融合蛋白将例如,与示例性Fc片段(SEQ ID NO:6)形成异二聚体。
具体说,SEQ ID NO:30的示例性变体PSMA-Seldeg的氨基酸序列形成融合蛋白,其从N端到C端具有残基1-16处的免疫球蛋白铰链(人IgG1衍生的),残基17-126处的免疫球蛋白CH2结构域(人IgG1衍生的),残基127-233处的免疫球蛋白CH3结构域(人IgG1衍生的),其在C-末端通过残基234-238处的接头与PSMA的细胞外结构域(残基239-945)融合。SEQ IDNO:30的变体PSMA-Seldeg具有在残基38,40,42,219和220处增加FcRn结合的突变,残基22和114处的精氨酸突变以及残基135和180处的“旋钮进孔”突变。通常与免疫球蛋白轻链配对的半胱氨酸残基(6)突变成丝氨酸。SEQ ID NO:30中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:31的DNA序列是编码示例性GAD65-Seldeg融合蛋白(SEQ ID NO:32)的多核苷酸,其具有增加FcRn结合的突变,旋钮进孔突变和精氨酸突变。该融合蛋白将例如,与示例性Fc片段(SEQ ID NO:6)形成异二聚体。
具体说,SEQ ID NO:32的示例性变体GAD65-Seldeg的氨基酸序列形成融合蛋白,其从N端到C端具有人谷氨酸羧化酶65(GAD65)的残基1-585,残基586-590处的第一接头,残基591-606处的免疫球蛋白铰链(人IgG1衍生的),残基607-716处的免疫球蛋白CH2结构域(人IgG1衍生的),残基717-823处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:32的变体GAD65-Seldeg具有在残基628,630,632,809和810处增加FcRn结合的突变,残基612和704处的精氨酸突变以及残基725和770处的“旋钮进孔”突变。通常与免疫球蛋白轻链配对的半胱氨酸残基(596)突变成丝氨酸。SEQ ID NO:32中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
SEQ ID NO:33的DNA序列是编码示例性水通道蛋白4-Seldeg融合蛋白(SEQ IDNO:34)的多核苷酸,其具有增加FcRn结合的突变,旋钮进孔突变和精氨酸突变。该融合蛋白将例如,与示例性Fc片段(SEQ ID NO:6)形成异二聚体。
具体说,SEQ ID NO:34的示例性变体水通道蛋白4(AQP4)-Seldeg的氨基酸序列形成融合蛋白,其从N端到C端具有人水通道蛋白4的残基1-323,残基324-328处的第一接头,残基329-344处的免疫球蛋白铰链(人IgG1衍生的),残基345-454处的免疫球蛋白CH2结构域(人IgG1衍生的),残基455-561处的免疫球蛋白CH3结构域(人IgG1衍生的)。SEQ ID NO:34的变体AQP4-Seldeg具有在残基366,368,370,547,548处增加FcRn结合的突变,残基350和442处的精氨酸突变以及残基463和508处的“旋钮进孔”突变。通常与免疫球蛋白轻链配对的半胱氨酸残基(334)突变成丝氨酸。SEQ ID NO:34中提到的氨基酸残基编号是蛋白质序列的编号,并不是指EU编号惯例。
以上公开的主题应被认为是说明性的,而非限制性的,并且所附权利要求旨在覆盖所有落入本公开的真正精神和范围内的这样的修改、改进和其它实施方式。因此,在法律允许的最大程度上,本公开的范围将由所附权利要求及其等同形式的可允许的最宽泛解释来确定,并且不应受前述详细描述的限制或约束。
在本说明书和权利要求书中所用的单数形式“一个”、“一种”和“该”包括多个指示物,除非上下文中有明显的表示。除非内容另有明确规定,否则术语“多个”包括两个或更多个指示物。除非另外定义,否则,本文中所使用的所有技术和科学术语都具有本公开所属领域普通技术人员通常所理解的含义。
Claims (48)
1.一种Seldeg,包含:
靶向组分,具有配置成特异性结合细胞表面受体或细胞表面分子的蛋白质或蛋白质片段;和
抗原组分,具有被配置为特异性结合靶抗原特异性抗体或其变体的一个分子的抗原、抗原片段或抗原模拟物;
其中靶向组分与抗原组分直接或间接融合。
2.如权利要求1所述的Seldeg,其中,所述靶向组分在近中性pH下以解离常数小于10μM与细胞表面受体或细胞表面分子结合。
3.如权利要求2所述的Seldeg,其中,近中性pH大于6.8且小于7.5。
4.如权利要求1所述的Seldeg,其包含至少第一靶向组分和第二靶向组分,其中第一靶向组分的蛋白质或蛋白质片段被配置为与第二靶向组分的蛋白质或蛋白质片段结合不同的细胞表面受体或不同的细胞表面分子。
5.如权利要求1所述的Seldeg,其中,所述靶向蛋白组分包括两个免疫球蛋白Fc片段的异二聚体,其中异二聚体的一个免疫球蛋白Fc片段与抗原组分融合,而另一个免疫球蛋白Fc片段不与抗原组分融合。
6.如权利要求5所述的Seldeg,其中,所述免疫球蛋白Fc片段与Fcγ受体具有显著降低的结合或没有可检测的结合。
7.如权利要求5所述的Seldeg,其中,所述免疫球蛋白Fc片段可以衍生自不结合Fcγ受体或补体的免疫球蛋白类或同种型。
8.如权利要求5所述的Seldeg,其中,所述免疫球蛋白Fc片段被配置为结合Fcγ受体和补体。
9.如权利要求5所述的Seldeg,其中,至少一个免疫球蛋白Fc片段经修饰以在近中性的pH下对FcRn的结合亲和力高于未修饰的Fc片段。
10.如权利要求5所述的Seldeg,其中,所述抗原组分与免疫球蛋白Fc片段的铰链-CH2-CH3结构域的N-端或C-端的一个免疫球蛋白Fc片段融合。
11.如权利要求5所述的Seldeg,其中,所述免疫球蛋白Fc片段经修饰以对Fcγ受体和/或补体(C1q)没有结合亲和力,或者对Fcγ受体和/或补体(C1q)的结合亲和力低于未修饰的免疫球蛋白Fc片段。
12.如权利要求1所述的Seldeg,其中,所述靶向组分包括被配置为特异性结合细胞表面受体或细胞表面分子的一个或多个抗体可变区或其片段。
13.如权利要求12所述的Seldeg,其中,所述抗体可变区或其片段包括至少一个纳米抗体。
14.如权利要求13所述的Seldeg,其中,所述纳米抗体是纳米抗体多聚体,其中一个纳米抗体与所述抗原组分融合,而所述纳米抗体多聚体中的所有其他纳米抗体不与所述抗原组分融合。
15.如权利要求1所述的Seldeg,其中,所述靶向组分配置成在包含Seldeg和细胞表面受体或细胞表面分子的复合物进入内体后从细胞表面受体或细胞表面分子解离。
16.如权利要求1所述的Seldeg,其中,所述抗原组分融合至靶向组分上的N端位置或C端位置。
17.如权利要求1所述的Seldeg,其中,所述抗原组分融合至靶向组分上的非端位置。
18.如权利要求1所述的Seldeg,其中,所述抗原组分通过化学反应、通过接头或在形成单一组合的抗原组分-靶向组分融合蛋白的过程中与靶向组分融合。
19.如权利要求1所述的Seldeg,其中,所述靶向组分包括配置为特异性结合FcRn的一种或多种白蛋白分子、白蛋白片段或突变的白蛋白变体。
20.如权利要求1所述的Seldeg,其中,所述靶向组分包括配置成与运铁蛋白受体结合的一个或多个抗体可变结构域或纳米抗体。
21.如权利要求1所述的Seldeg,其中,所述靶向组分包括配置成与运铁蛋白受体结合的一个或多个蛋白质分子或蛋白质结构域。
22.如权利要求1所述的Seldeg,其中,所述靶向组分包括配置成与磷脂酰丝氨酸结合的一个或多个蛋白质分子或蛋白质结构域。
23.如权利要求1所述的Seldeg,其中,所述靶向组分包括配置成与磷脂酰丝氨酸结合的一个或多个抗体可变结构域或纳米抗体。
24.如权利要求22所述的Seldeg,其中,所述一个或多个蛋白质分子或蛋白质结构域被配置成通过钙依赖性机制结合磷脂酰丝氨酸。
25.如权利要求22所述的Seldeg,其中,所述靶向组分包括突触结合蛋白1的C2A结构域。
26.如权利要求1所述的Seldeg,包括至少第一抗原组分和第二抗原组分,其中一个分子的第一抗原组分的抗原、抗原片段或抗原模拟物不同于一个分子的第二抗原组分的抗原、抗原片段或抗原模拟物。
27.如权利要求1所述的Seldeg,包括至少第一抗原组分和第二抗原组分,其中一个分子的第一抗原组分的抗原、抗原片段或抗原模拟物与一个分子的第二抗原组分的抗原、抗原片段或抗原模拟物相同。
28.一种从患者中消耗靶抗原特异性抗体的方法,所述方法包括:
给予患者足以从患者的循环或靶组织中除去至少50%的靶抗原特异性抗体的量的Seldeg,
其中Seldeg包括
靶向组分,具有配置成特异性结合细胞表面受体或细胞表面分子的蛋白质或蛋白质片段;和
抗原组分,具有被配置为特异性结合靶抗原特异性抗体或其变体的一个分子的抗原、抗原片段或抗原模拟物;
其中靶向蛋白组分与抗原组分直接或间接融合。
29.如权利要求28所述的方法,其中,所述方法包括以足以在给予后5小时内从患者的循环或靶组织中除去至少50%的靶抗原特异性抗体的量给予Seldeg。
30.如权利要求28所述的方法,其中,所述蛋白质或蛋白质片段被配置成在近中性pH下以小于10μM的解离常数结合所述细胞表面受体或其他细胞表面分子。
31.如权利要求28所述的方法,其中,足量的Seldeg是至少与待消耗的靶抗原特异性抗体的量等摩尔的量。
32.如权利要求28所述的方法,所述方法包括以足以在给予后2小时内从患者的循环或靶组织中除去至少90%的靶抗原特异性抗体的量给予Seldeg。
33.如权利要求28所述的方法,所述方法包括以足以在给予后1小时内从患者的循环或靶组织中除去至少50%的靶抗原特异性抗体的量给予Seldeg。
34.如权利要求28所述的方法,所述方法还包括每当预期50%的患者在靶组织的循环中再生阈值量的靶抗原特异性抗体时再次给予Seldeg。
35.如权利要求28所述的方法,其中,所述Seldeg从循环或靶抗原特异性抗体靶向的组织中去除小于10%的非靶抗体。
36.如权利要求28所述的方法,其中,所述Seldeg去除不会对患者产生临床不利影响的患者的循环或靶组织中的一定量的非靶抗体。
37.如权利要求28所述的方法,其中,所述Seldeg从循环或靶抗原特异性抗体靶向的组织中去除小于1%的非靶抗体。
38.如权利要求28所述的方法,其中,所述Seldeg通过表达细胞表面受体或细胞表面分子的细胞引起靶抗原特异性抗体的降解。
39.如权利要求28所述的方法,其中,所述Seldeg给予患有自身免疫疾病的患者,并且靶抗原特异性抗体特异性结合自身抗原。
40.如权利要求28所述的方法,其中,所述Seldeg给予接受移植器官的患者,并且靶抗原特异性抗体特异性结合所述移植器官上的抗原。
41.如权利要求28所述的方法,其中,给予Seldeg以在肿瘤成像期间增加对比度,并且靶抗原特异性抗体特异性结合肿瘤抗原。
42.如权利要求28所述的方法,其中,所述Seldeg给予已接受生物制剂的患者并且靶抗原特异性抗体是所述生物制剂。
43.如权利要求28所述的方法,其中,如果所述患者具有对所述治疗剂特异的抗体,则在递送治疗剂之前给予Seldeg,所述Seldeg被配置成靶向对所述治疗剂特异的抗体。
44.如权利要求28所述的方法,其中,给予Seldeg以提供PET图像造影剂。
45.如权利要求1所述的Seldeg,其中,所述靶抗原特异性抗体是抗MOG抗体。
46.如权利要求1所述的Seldeg,其中,所述靶抗原特异性抗体是抗HER2抗体。
47.如权利要求1所述的Seldeg,包括具有以下至少一种的氨基酸序列的蛋白质:SEQID NO:2,SEQ ID NO:4,SEQ ID NO:6,SEQ ID NO:8,SEQ ID NO:10,SEQ ID NO:12,SEQ IDNO:14,SEQ ID NO:16,SEQ ID NO:18,SEQ ID NO:20,SEQ ID NO:22,SEQ ID NO:24,SEQ IDNO:26,SEQ ID NO:28,SEQ ID NO:30,SEQ ID NO:32,或SEQ ID NO:34,或其同源物。
48.如权利要求1所述的Seldeg,包括具有以下氨基酸序列的蛋白质的异二聚体:i)SEQID NO:2加SEQ ID NO:6,ii)SEQ ID NO:4加SEQ ID NO:6,iii)SEQ ID NO:8加SEQ ID NO:10,iv)SEQ ID NO:12加SEQ ID NO:14,v)SEQ ID NO:16加SEQ ID NO:18加SEQ ID NO:20,vi)SEQ ID NO:20加SEQ ID NO:22加SEQ ID NO:24,vii)SEQ ID NO:26加SEQ ID NO:28,viii)SEQ ID NO:30加SEQ ID NO:6,ix)SEQ ID NO:32加SEQ ID NO:6,或x)SEQ ID NO:34加SEQ ID NO:6,或其同源物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662429367P | 2016-12-02 | 2016-12-02 | |
| US62/429,367 | 2016-12-02 | ||
| PCT/US2017/064186 WO2018102668A1 (en) | 2016-12-02 | 2017-12-01 | Fusion proteins for selectively depleting antigen-specific antibodies |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN110799210A true CN110799210A (zh) | 2020-02-14 |
Family
ID=62242041
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780084570.5A Pending CN110799210A (zh) | 2016-12-02 | 2017-12-01 | 选择性消耗抗原特异性抗体的融合蛋白 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US11459396B2 (zh) |
| EP (1) | EP3548073A4 (zh) |
| JP (2) | JP7295799B2 (zh) |
| CN (1) | CN110799210A (zh) |
| AU (1) | AU2017366674B2 (zh) |
| CA (1) | CA3045797A1 (zh) |
| WO (1) | WO2018102668A1 (zh) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3570894A4 (en) * | 2017-01-17 | 2021-04-07 | The Texas A&M University System | ENDOLYSOSOMAL TARGETING CONJUGATES FOR BETTER LOAD MOLECULES DISTRIBUTION TO ENDOLYSOSOMAL COMPARTMENT OF TARGET CELLS |
| US11986536B2 (en) | 2019-03-23 | 2024-05-21 | Ablevia Biotech Gmbh | Compound for the sequestration of undesirable antibodies in a patient |
| EP3715374A1 (en) | 2019-03-23 | 2020-09-30 | Ablevia biotech GmbH | Compound for the sequestration of undesirable antibodies in a patient |
| EP3715376A1 (en) | 2019-03-23 | 2020-09-30 | Ablevia biotech GmbH | Compound for the prevention or treatment of myasthenia gravis |
| EP3715375A1 (en) | 2019-03-23 | 2020-09-30 | Ablevia biotech GmbH | Compound for the prevention or treatment of pre-eclampsia |
| EP4216990A1 (en) | 2020-09-23 | 2023-08-02 | Ablevia biotech GmbH | Compound for the sequestration of undesirable antibodies in a patient |
| BR112023005216A2 (pt) | 2020-09-23 | 2023-04-25 | Ablevia Biotech Gmbh | Composto para aumentar a eficácia de terapia de reposição do fator viii |
| TW202228784A (zh) | 2020-09-23 | 2022-08-01 | 奧地利商艾柏力維亞生技有限公司 | 用以於一患者中螯合非預期的抗peg抗體的化合物 |
| BR112023005257A2 (pt) | 2020-09-23 | 2023-04-25 | Ablevia Biotech Gmbh | Composto para a prevenção ou tratamento de condições mediadas por autoanticorpos |
| WO2022063892A1 (en) | 2020-09-23 | 2022-03-31 | Ablevia Biotech Gmbh | Compound for increasing efficacy of viral vectors |
| EP4217401A1 (en) | 2020-09-24 | 2023-08-02 | Ablevia biotech GmbH | Compound for the prevention or treatment of myasthenia gravis |
| WO2023180502A1 (en) | 2022-03-24 | 2023-09-28 | Ablevia Biotech Gmbh | Compound for increasing efficacy of oncolytic viruses |
| EP4508074A1 (en) | 2022-04-13 | 2025-02-19 | Ose Immunotherapeutics | New class of molecules for selective clearance of antibody |
| WO2024092033A1 (en) * | 2022-10-26 | 2024-05-02 | Amgen Inc. | Multispecific molecules for clearance of immunoglobulins in the treatment of autoantibody-induced diseases |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002016414A2 (en) * | 2000-08-22 | 2002-02-28 | Micromet Ag | Composition for the elimination of autoreactive b-cells |
| US20060235208A1 (en) * | 2002-09-27 | 2006-10-19 | Xencor, Inc. | Fc variants with optimized properties |
| JP2012503007A (ja) * | 2008-09-17 | 2012-02-02 | ゼンコア インコーポレイテッド | IgE媒介性疾患を治療するための新規組成物および方法 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2002236499A8 (en) * | 2000-11-30 | 2009-12-03 | Uab Research Foundation | Receptor-mediated uptake of peptides that bind the human transferrin receptor |
| WO2005077981A2 (en) * | 2003-12-22 | 2005-08-25 | Xencor, Inc. | Fc POLYPEPTIDES WITH NOVEL Fc LIGAND BINDING SITES |
| EP1896503B1 (en) | 2005-05-31 | 2014-10-29 | Board of Regents, The University of Texas System | IgG1 ANTIBODIES WITH MUTATED Fc PORTION FOR INCREASED BINDING TO FcRn RECEPTOR AND USES TEHEREOF |
| ES2608835T3 (es) * | 2011-04-13 | 2017-04-17 | Bristol-Myers Squibb Company | Proteínas de fusión Fc que comprenden nuevos enlazadores o disposiciones |
| RU2650784C2 (ru) * | 2011-05-05 | 2018-04-17 | Альбумедикс А/С | Варианты альбумина |
| PL3087095T3 (pl) * | 2013-12-24 | 2020-03-31 | Argenx Bvba | Antagoniści fcrn i sposoby stosowania |
| US20160060358A1 (en) | 2014-08-28 | 2016-03-03 | California Institute Of Technology | Induction of antigen-specific tolerance |
| US20170334962A1 (en) * | 2016-05-19 | 2017-11-23 | Texas A&M University System | FcRn-TARGETED ANTIGEN FUSION PROTEINS |
-
2017
- 2017-12-01 US US16/465,975 patent/US11459396B2/en active Active
- 2017-12-01 AU AU2017366674A patent/AU2017366674B2/en active Active
- 2017-12-01 CN CN201780084570.5A patent/CN110799210A/zh active Pending
- 2017-12-01 WO PCT/US2017/064186 patent/WO2018102668A1/en unknown
- 2017-12-01 JP JP2019529975A patent/JP7295799B2/ja active Active
- 2017-12-01 CA CA3045797A patent/CA3045797A1/en active Pending
- 2017-12-01 EP EP17876621.8A patent/EP3548073A4/en active Pending
-
2022
- 2022-09-08 US US17/930,545 patent/US20230087965A1/en active Pending
-
2023
- 2023-06-09 JP JP2023095266A patent/JP2023113894A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002016414A2 (en) * | 2000-08-22 | 2002-02-28 | Micromet Ag | Composition for the elimination of autoreactive b-cells |
| US20060235208A1 (en) * | 2002-09-27 | 2006-10-19 | Xencor, Inc. | Fc variants with optimized properties |
| JP2012503007A (ja) * | 2008-09-17 | 2012-02-02 | ゼンコア インコーポレイテッド | IgE媒介性疾患を治療するための新規組成物および方法 |
Non-Patent Citations (1)
| Title |
|---|
| HA JH等: "Immunoglobulin Fc Heterodimer Platform Technology: From Design to Applications in Therapeutic Antibodies and Proteins" * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3548073A4 (en) | 2020-07-22 |
| CA3045797A1 (en) | 2018-06-07 |
| US11459396B2 (en) | 2022-10-04 |
| US20230087965A1 (en) | 2023-03-23 |
| EP3548073A1 (en) | 2019-10-09 |
| JP2023113894A (ja) | 2023-08-16 |
| JP7295799B2 (ja) | 2023-06-21 |
| US20200031948A1 (en) | 2020-01-30 |
| JP2020500885A (ja) | 2020-01-16 |
| WO2018102668A1 (en) | 2018-06-07 |
| AU2017366674B2 (en) | 2025-01-02 |
| AU2017366674A1 (en) | 2019-06-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230087965A1 (en) | Fusion proteins for selectively depleting antigen-specific antibodies | |
| JP7591917B2 (ja) | Sirp-アルファドメインまたはそのバリアントを有する構築物 | |
| KR102562519B1 (ko) | IL-15/IL-15Rα FC-융합 단백질 및 PD-1 항체 단편을 포함하는 이중특이성 이종이량체 융합 단백질 | |
| JP2022185021A (ja) | 多価多重特異性ox40結合融合タンパク質 | |
| EP3242891B1 (en) | Monomeric fc domains | |
| JP7065766B2 (ja) | 改変j鎖を有する結合分子 | |
| US20160009824A1 (en) | Tetravalent bispecific antibodies | |
| JP2020500885A5 (zh) | ||
| JP2010528588A (ja) | 一本鎖FC(ScFc)領域、それを含む結合ポリペプチド、およびそれに関連する方法 | |
| EP4303231A1 (en) | Bispecific antibody | |
| WO2022121941A1 (zh) | 抗人msln的抗体及其用途 | |
| JP2024538050A (ja) | メソテリン結合タンパク質及びその使用 | |
| JP2023159379A (ja) | Pd-1とvegfを標的とした四価二重特異性抗体、その製造方法および用途 | |
| CA3193273A1 (en) | Methods and compositions to treat autoimmune diseases and cancer | |
| US20230046416A1 (en) | Chemically Induced Association and Dissociation of Therapeutic FC Compositions and Chemically Induced Dimerization of T Cell Engager with Human Serum Albumin | |
| KR20240052030A (ko) | 높은 열 안정성 및 감쇠된 효과기 기능을 갖는 fc 변이체 | |
| CN118119402A (zh) | 工程化抗her2双特异性蛋白 | |
| WO2024184287A1 (en) | Combination therapy of an anti-egfrviii/anti-cd3 antibody and an tumor-targeted 4-1bb agonist | |
| CN118541393A (zh) | 间皮素结合蛋白及其用途 | |
| TW202411257A (zh) | 包含taci多肽的融合蛋白及其用途 | |
| WO2024263558A1 (en) | Dual transporters and methods of use | |
| JP2022525261A (ja) | ビスタ結合抗体およびその使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20200214 |