CN109072186B - 利用前列腺素e2进行肌肉再生的组合物和方法 - Google Patents
利用前列腺素e2进行肌肉再生的组合物和方法 Download PDFInfo
- Publication number
- CN109072186B CN109072186B CN201780014836.9A CN201780014836A CN109072186B CN 109072186 B CN109072186 B CN 109072186B CN 201780014836 A CN201780014836 A CN 201780014836A CN 109072186 B CN109072186 B CN 109072186B
- Authority
- CN
- China
- Prior art keywords
- muscle
- pge2
- cells
- compound
- subject
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- XEYBRNLFEZDVAW-ARSRFYASSA-N dinoprostone Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=O XEYBRNLFEZDVAW-ARSRFYASSA-N 0.000 title claims abstract description 255
- 229960002986 dinoprostone Drugs 0.000 title claims abstract description 231
- XEYBRNLFEZDVAW-UHFFFAOYSA-N prostaglandin E2 Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CC=CCCCC(O)=O XEYBRNLFEZDVAW-UHFFFAOYSA-N 0.000 title claims abstract description 231
- 238000000034 method Methods 0.000 title abstract description 131
- 239000000203 mixture Substances 0.000 title abstract description 34
- 230000009756 muscle regeneration Effects 0.000 title description 25
- 150000001875 compounds Chemical class 0.000 claims abstract description 243
- 210000003205 muscle Anatomy 0.000 claims abstract description 163
- 208000014674 injury Diseases 0.000 claims abstract description 121
- 208000027418 Wounds and injury Diseases 0.000 claims abstract description 79
- 208000021642 Muscular disease Diseases 0.000 claims abstract description 18
- 210000001665 muscle stem cell Anatomy 0.000 claims description 145
- 210000004027 cell Anatomy 0.000 claims description 138
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 84
- 201000010099 disease Diseases 0.000 claims description 57
- 230000015556 catabolic process Effects 0.000 claims description 47
- 230000001154 acute effect Effects 0.000 claims description 45
- 230000008733 trauma Effects 0.000 claims description 45
- 230000035755 proliferation Effects 0.000 claims description 33
- 206010013801 Duchenne Muscular Dystrophy Diseases 0.000 claims description 31
- 206010006895 Cachexia Diseases 0.000 claims description 28
- 210000001057 smooth muscle myoblast Anatomy 0.000 claims description 28
- 201000006938 muscular dystrophy Diseases 0.000 claims description 24
- 210000002027 skeletal muscle Anatomy 0.000 claims description 24
- 210000000130 stem cell Anatomy 0.000 claims description 22
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 claims description 20
- 201000009338 distal myopathy Diseases 0.000 claims description 20
- 230000003472 neutralizing effect Effects 0.000 claims description 19
- 208000029549 Muscle injury Diseases 0.000 claims description 18
- 206010028417 myasthenia gravis Diseases 0.000 claims description 18
- 230000007423 decrease Effects 0.000 claims description 17
- 239000003814 drug Substances 0.000 claims description 17
- 201000003728 Centronuclear myopathy Diseases 0.000 claims description 16
- 201000009623 Myopathy Diseases 0.000 claims description 16
- 208000032978 Structural Congenital Myopathies Diseases 0.000 claims description 16
- 239000003937 drug carrier Substances 0.000 claims description 16
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 14
- 108010051913 15-hydroxyprostaglandin dehydrogenase Proteins 0.000 claims description 13
- 102100030489 15-hydroxyprostaglandin dehydrogenase [NAD(+)] Human genes 0.000 claims description 12
- 239000003112 inhibitor Substances 0.000 claims description 12
- 208000030507 AIDS Diseases 0.000 claims description 11
- 201000006935 Becker muscular dystrophy Diseases 0.000 claims description 11
- 230000003274 myotonic effect Effects 0.000 claims description 11
- 206010019280 Heart failures Diseases 0.000 claims description 10
- 201000009342 Limb-girdle muscular dystrophy Diseases 0.000 claims description 10
- 201000002169 Mitochondrial myopathy Diseases 0.000 claims description 10
- 231100000569 acute exposure Toxicity 0.000 claims description 10
- 201000001981 dermatomyositis Diseases 0.000 claims description 10
- 208000023692 inborn mitochondrial myopathy Diseases 0.000 claims description 10
- 238000007918 intramuscular administration Methods 0.000 claims description 10
- 208000029308 periodic paralysis Diseases 0.000 claims description 10
- 208000005987 polymyositis Diseases 0.000 claims description 10
- 208000001076 sarcopenia Diseases 0.000 claims description 10
- 206010007559 Cardiac failure congestive Diseases 0.000 claims description 9
- 206010039020 Rhabdomyolysis Diseases 0.000 claims description 9
- 208000026137 Soft tissue injury Diseases 0.000 claims description 9
- 206010046543 Urinary incontinence Diseases 0.000 claims description 9
- 238000007912 intraperitoneal administration Methods 0.000 claims description 9
- 230000035882 stress Effects 0.000 claims description 9
- 238000001361 intraarterial administration Methods 0.000 claims description 8
- 238000001990 intravenous administration Methods 0.000 claims description 8
- 238000007920 subcutaneous administration Methods 0.000 claims description 8
- 230000001684 chronic effect Effects 0.000 claims description 6
- 239000007927 intramuscular injection Substances 0.000 claims description 6
- 238000010255 intramuscular injection Methods 0.000 claims description 6
- 241000489861 Maximus Species 0.000 claims description 5
- 208000026214 Skeletal muscle atrophy Diseases 0.000 claims description 5
- 230000025185 skeletal muscle atrophy Effects 0.000 claims description 5
- 210000001015 abdomen Anatomy 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 4
- 230000001114 myogenic effect Effects 0.000 claims description 4
- 210000003314 quadriceps muscle Anatomy 0.000 claims description 4
- 208000002320 spinal muscular atrophy Diseases 0.000 claims description 4
- 210000003813 thumb Anatomy 0.000 claims description 4
- 206010052428 Wound Diseases 0.000 claims description 3
- 230000002068 genetic effect Effects 0.000 claims description 3
- 210000003692 ilium Anatomy 0.000 claims description 3
- 230000001815 facial effect Effects 0.000 claims description 2
- 210000004237 neck muscle Anatomy 0.000 claims description 2
- 210000002976 pectoralis muscle Anatomy 0.000 claims description 2
- 210000001139 rectus abdominis Anatomy 0.000 claims description 2
- 210000003811 finger Anatomy 0.000 claims 2
- 210000000663 muscle cell Anatomy 0.000 abstract description 232
- 230000006378 damage Effects 0.000 abstract description 75
- 150000003166 prostaglandin E2 derivatives Chemical class 0.000 abstract description 21
- -1 prostaglandin E2 (PGE 2) compound Chemical class 0.000 abstract description 18
- 230000001172 regenerating effect Effects 0.000 abstract description 8
- 206010028289 Muscle atrophy Diseases 0.000 abstract description 7
- 201000000585 muscular atrophy Diseases 0.000 abstract description 7
- 230000011664 signaling Effects 0.000 abstract description 6
- 208000029578 Muscle disease Diseases 0.000 abstract description 4
- 230000020763 muscle atrophy Effects 0.000 abstract description 3
- 208000002720 Malnutrition Diseases 0.000 abstract description 2
- 230000001071 malnutrition Effects 0.000 abstract description 2
- 235000000824 malnutrition Nutrition 0.000 abstract description 2
- 208000015380 nutritional deficiency disease Diseases 0.000 abstract description 2
- 230000002062 proliferating effect Effects 0.000 abstract 1
- 241000699670 Mus sp. Species 0.000 description 91
- 238000011282 treatment Methods 0.000 description 63
- 102000008866 Prostaglandin E receptors Human genes 0.000 description 38
- 108010088540 Prostaglandin E receptors Proteins 0.000 description 38
- 239000003981 vehicle Substances 0.000 description 38
- 210000001087 myotubule Anatomy 0.000 description 37
- 230000037444 atrophy Effects 0.000 description 35
- 206010003694 Atrophy Diseases 0.000 description 33
- 238000002474 experimental method Methods 0.000 description 30
- 229940002612 prodrug Drugs 0.000 description 30
- 239000000651 prodrug Substances 0.000 description 30
- 229940044601 receptor agonist Drugs 0.000 description 28
- 239000000018 receptor agonist Substances 0.000 description 28
- 208000035475 disorder Diseases 0.000 description 27
- 230000005764 inhibitory process Effects 0.000 description 27
- 210000000107 myocyte Anatomy 0.000 description 26
- QAOBBBBDJSWHMU-WMBBNPMCSA-N 16,16-dimethylprostaglandin E2 Chemical compound CCCCC(C)(C)[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=O QAOBBBBDJSWHMU-WMBBNPMCSA-N 0.000 description 24
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 24
- 102100024450 Prostaglandin E2 receptor EP4 subtype Human genes 0.000 description 24
- 239000005090 green fluorescent protein Substances 0.000 description 24
- 239000000017 hydrogel Substances 0.000 description 23
- 230000001965 increasing effect Effects 0.000 description 23
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 22
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 22
- 102100027187 Solute carrier organic anion transporter family member 2A1 Human genes 0.000 description 22
- 238000011069 regeneration method Methods 0.000 description 22
- 239000007924 injection Substances 0.000 description 21
- 238000002347 injection Methods 0.000 description 21
- 230000008929 regeneration Effects 0.000 description 21
- 238000002054 transplantation Methods 0.000 description 21
- 210000003098 myoblast Anatomy 0.000 description 19
- 101710095536 Solute carrier organic anion transporter family member 2A1 Proteins 0.000 description 18
- 238000012258 culturing Methods 0.000 description 18
- 210000004263 induced pluripotent stem cell Anatomy 0.000 description 18
- 230000032683 aging Effects 0.000 description 17
- 238000004458 analytical method Methods 0.000 description 17
- 210000001671 embryonic stem cell Anatomy 0.000 description 17
- 238000012360 testing method Methods 0.000 description 17
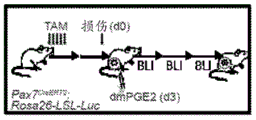
- 101100351033 Mus musculus Pax7 gene Proteins 0.000 description 16
- 230000000694 effects Effects 0.000 description 16
- 238000003556 assay Methods 0.000 description 15
- 239000002552 dosage form Substances 0.000 description 15
- 150000002500 ions Chemical class 0.000 description 15
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 14
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 14
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 14
- 239000002953 phosphate buffered saline Substances 0.000 description 14
- 239000000126 substance Substances 0.000 description 14
- 239000002340 cardiotoxin Substances 0.000 description 13
- 231100000677 cardiotoxin Toxicity 0.000 description 13
- 230000002441 reversible effect Effects 0.000 description 13
- 239000000523 sample Substances 0.000 description 13
- 101000783356 Naja sputatrix Cytotoxin Proteins 0.000 description 12
- 210000004413 cardiac myocyte Anatomy 0.000 description 12
- 239000000835 fiber Substances 0.000 description 12
- 238000002513 implantation Methods 0.000 description 12
- 210000002363 skeletal muscle cell Anatomy 0.000 description 12
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 12
- 241000699666 Mus <mouse, genus> Species 0.000 description 11
- 101150109738 Ptger4 gene Proteins 0.000 description 11
- 230000000735 allogeneic effect Effects 0.000 description 11
- 238000001727 in vivo Methods 0.000 description 11
- 238000005259 measurement Methods 0.000 description 11
- 239000002609 medium Substances 0.000 description 11
- 108090000623 proteins and genes Proteins 0.000 description 11
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 10
- 241000282376 Panthera tigris Species 0.000 description 10
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 10
- 210000003141 lower extremity Anatomy 0.000 description 10
- 230000004936 stimulating effect Effects 0.000 description 10
- 210000001519 tissue Anatomy 0.000 description 10
- 239000002435 venom Substances 0.000 description 10
- 231100000611 venom Toxicity 0.000 description 10
- 210000001048 venom Anatomy 0.000 description 10
- 230000004220 muscle function Effects 0.000 description 9
- 150000003180 prostaglandins Chemical class 0.000 description 9
- 239000013598 vector Substances 0.000 description 9
- 101100447432 Danio rerio gapdh-2 gene Proteins 0.000 description 8
- 101150112014 Gapdh gene Proteins 0.000 description 8
- 108060001084 Luciferase Proteins 0.000 description 8
- 239000005089 Luciferase Substances 0.000 description 8
- 230000029918 bioluminescence Effects 0.000 description 8
- 238000005415 bioluminescence Methods 0.000 description 8
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 8
- 230000001052 transient effect Effects 0.000 description 8
- PXGPLTODNUVGFL-BRIYLRKRSA-N (E,Z)-(1R,2R,3R,5S)-7-(3,5-Dihydroxy-2-((3S)-(3-hydroxy-1-octenyl))cyclopentyl)-5-heptenoic acid Chemical compound CCCCC[C@H](O)C=C[C@H]1[C@H](O)C[C@H](O)[C@@H]1CC=CCCCC(O)=O PXGPLTODNUVGFL-BRIYLRKRSA-N 0.000 description 7
- 101000601661 Homo sapiens Paired box protein Pax-7 Proteins 0.000 description 7
- 101150058514 PTGES gene Proteins 0.000 description 7
- 102100037503 Paired box protein Pax-7 Human genes 0.000 description 7
- 238000011529 RT qPCR Methods 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 7
- 238000000540 analysis of variance Methods 0.000 description 7
- 238000004422 calculation algorithm Methods 0.000 description 7
- 238000004113 cell culture Methods 0.000 description 7
- 230000036461 convulsion Effects 0.000 description 7
- 230000002354 daily effect Effects 0.000 description 7
- 230000007547 defect Effects 0.000 description 7
- 208000007345 glycogen storage disease Diseases 0.000 description 7
- 238000003384 imaging method Methods 0.000 description 7
- 229910052757 nitrogen Inorganic materials 0.000 description 7
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 7
- 102000004169 proteins and genes Human genes 0.000 description 7
- 230000004044 response Effects 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 208000024891 symptom Diseases 0.000 description 7
- 229960001603 tamoxifen Drugs 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 238000002287 time-lapse microscopy Methods 0.000 description 7
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- 102100022745 Laminin subunit alpha-2 Human genes 0.000 description 6
- 241001293415 Mannheimia Species 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 201000006815 congenital muscular dystrophy Diseases 0.000 description 6
- 230000000593 degrading effect Effects 0.000 description 6
- 229940088598 enzyme Drugs 0.000 description 6
- 238000009472 formulation Methods 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 230000001737 promoting effect Effects 0.000 description 6
- 230000008439 repair process Effects 0.000 description 6
- 235000002639 sodium chloride Nutrition 0.000 description 6
- 238000001179 sorption measurement Methods 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 5
- 206010061218 Inflammation Diseases 0.000 description 5
- 108090000748 Prostaglandin-E Synthases Proteins 0.000 description 5
- 102000004226 Prostaglandin-E Synthases Human genes 0.000 description 5
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 5
- 238000011088 calibration curve Methods 0.000 description 5
- 230000003915 cell function Effects 0.000 description 5
- 230000004663 cell proliferation Effects 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 229960000905 indomethacin Drugs 0.000 description 5
- 230000004054 inflammatory process Effects 0.000 description 5
- 238000002955 isolation Methods 0.000 description 5
- 210000002414 leg Anatomy 0.000 description 5
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 5
- 238000007427 paired t-test Methods 0.000 description 5
- 239000008194 pharmaceutical composition Substances 0.000 description 5
- 239000012071 phase Substances 0.000 description 5
- 229920001184 polypeptide Polymers 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 102000005962 receptors Human genes 0.000 description 5
- 108020003175 receptors Proteins 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 229940124597 therapeutic agent Drugs 0.000 description 5
- 230000001256 tonic effect Effects 0.000 description 5
- 238000011830 transgenic mouse model Methods 0.000 description 5
- 108090000672 Annexin A5 Proteins 0.000 description 4
- 102000004121 Annexin A5 Human genes 0.000 description 4
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- 206010010356 Congenital anomaly Diseases 0.000 description 4
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 4
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 101150024938 HPGD gene Proteins 0.000 description 4
- 102100029100 Hematopoietic prostaglandin D synthase Human genes 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 101000988802 Homo sapiens Hematopoietic prostaglandin D synthase Proteins 0.000 description 4
- 229930195725 Mannitol Natural products 0.000 description 4
- 241000699660 Mus musculus Species 0.000 description 4
- 108090000459 Prostaglandin-endoperoxide synthases Proteins 0.000 description 4
- 102000004005 Prostaglandin-endoperoxide synthases Human genes 0.000 description 4
- 101150058615 Ptger1 gene Proteins 0.000 description 4
- 229920002125 Sokalan® Polymers 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 238000010171 animal model Methods 0.000 description 4
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 description 4
- 239000011324 bead Substances 0.000 description 4
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 230000034994 death Effects 0.000 description 4
- 230000007812 deficiency Effects 0.000 description 4
- 238000000605 extraction Methods 0.000 description 4
- 210000003414 extremity Anatomy 0.000 description 4
- 229920000159 gelatin Polymers 0.000 description 4
- 235000019322 gelatine Nutrition 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 238000001294 liquid chromatography-tandem mass spectrometry Methods 0.000 description 4
- 238000012423 maintenance Methods 0.000 description 4
- 239000000594 mannitol Substances 0.000 description 4
- 235000010355 mannitol Nutrition 0.000 description 4
- 238000004949 mass spectrometry Methods 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 230000005012 migration Effects 0.000 description 4
- 238000013508 migration Methods 0.000 description 4
- 210000004940 nucleus Anatomy 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 230000000750 progressive effect Effects 0.000 description 4
- BHMBVRSPMRCCGG-OUTUXVNYSA-N prostaglandin D2 Chemical compound CCCCC[C@H](O)\C=C\[C@@H]1[C@@H](C\C=C/CCCC(O)=O)[C@@H](O)CC1=O BHMBVRSPMRCCGG-OUTUXVNYSA-N 0.000 description 4
- BHMBVRSPMRCCGG-UHFFFAOYSA-N prostaglandine D2 Natural products CCCCCC(O)C=CC1C(CC=CCCCC(O)=O)C(O)CC1=O BHMBVRSPMRCCGG-UHFFFAOYSA-N 0.000 description 4
- 238000011002 quantification Methods 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 150000003384 small molecules Chemical class 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- CUJMXIQZWPZMNQ-XYYGWQPLSA-N 13,14-dihydro-15-oxo-prostaglandin E2 Chemical compound CCCCCC(=O)CC[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=O CUJMXIQZWPZMNQ-XYYGWQPLSA-N 0.000 description 3
- YRTJDWROBKPZNV-UHFFFAOYSA-N 15-Oxoprostaglandin E2 Natural products CCCCCC(=O)C=CC1C(O)CC(=O)C1CC=CCCCC(O)=O YRTJDWROBKPZNV-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 108700028369 Alleles Proteins 0.000 description 3
- 238000011740 C57BL/6 mouse Methods 0.000 description 3
- 229920002307 Dextran Polymers 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- 241000713666 Lentivirus Species 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 208000010428 Muscle Weakness Diseases 0.000 description 3
- 206010028347 Muscle twitching Diseases 0.000 description 3
- 206010028372 Muscular weakness Diseases 0.000 description 3
- 102000004364 Myogenin Human genes 0.000 description 3
- 108010056785 Myogenin Proteins 0.000 description 3
- 101150115210 PTGER2 gene Proteins 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- 230000003213 activating effect Effects 0.000 description 3
- 230000009692 acute damage Effects 0.000 description 3
- 239000000556 agonist Substances 0.000 description 3
- 239000005557 antagonist Substances 0.000 description 3
- 230000006907 apoptotic process Effects 0.000 description 3
- 230000000747 cardiac effect Effects 0.000 description 3
- 239000006143 cell culture medium Substances 0.000 description 3
- 238000001516 cell proliferation assay Methods 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 238000012937 correction Methods 0.000 description 3
- 238000007405 data analysis Methods 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 239000012091 fetal bovine serum Substances 0.000 description 3
- 238000001502 gel electrophoresis Methods 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 230000003394 haemopoietic effect Effects 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 230000001771 impaired effect Effects 0.000 description 3
- 230000002757 inflammatory effect Effects 0.000 description 3
- 230000003902 lesion Effects 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 150000007523 nucleic acids Chemical class 0.000 description 3
- 239000002773 nucleotide Substances 0.000 description 3
- 125000003729 nucleotide group Chemical group 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 230000002035 prolonged effect Effects 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 239000011550 stock solution Substances 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 230000009261 transgenic effect Effects 0.000 description 3
- 230000032258 transport Effects 0.000 description 3
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 2
- IGAZHQIYONOHQN-UHFFFAOYSA-N Alexa Fluor 555 Chemical compound C=12C=CC(=N)C(S(O)(=O)=O)=C2OC2=C(S(O)(=O)=O)C(N)=CC=C2C=1C1=CC=C(C(O)=O)C=C1C(O)=O IGAZHQIYONOHQN-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 208000010392 Bone Fractures Diseases 0.000 description 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 2
- IVOMOUWHDPKRLL-KQYNXXCUSA-N Cyclic adenosine monophosphate Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-KQYNXXCUSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 2
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 2
- 206010017076 Fracture Diseases 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 2
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 2
- 101000836225 Homo sapiens Solute carrier organic anion transporter family member 2A1 Proteins 0.000 description 2
- 238000009015 Human TaqMan MicroRNA Assay kit Methods 0.000 description 2
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 2
- 102000005604 Myosin Heavy Chains Human genes 0.000 description 2
- 108010084498 Myosin Heavy Chains Proteins 0.000 description 2
- 238000011789 NOD SCID mouse Methods 0.000 description 2
- 241000272115 Notechis scutatus Species 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 108091006791 SLCO2A1 Proteins 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- IVOMOUWHDPKRLL-UHFFFAOYSA-N UNPD107823 Natural products O1C2COP(O)(=O)OC2C(O)C1N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-UHFFFAOYSA-N 0.000 description 2
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- 150000001413 amino acids Chemical group 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 239000012491 analyte Substances 0.000 description 2
- 239000003146 anticoagulant agent Substances 0.000 description 2
- 229940114079 arachidonic acid Drugs 0.000 description 2
- 235000021342 arachidonic acid Nutrition 0.000 description 2
- 239000005441 aurora Substances 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 239000007975 buffered saline Substances 0.000 description 2
- 229950008654 butaprost Drugs 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 230000032823 cell division Effects 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 239000002131 composite material Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- CVSVTCORWBXHQV-UHFFFAOYSA-N creatine Chemical compound NC(=[NH2+])N(C)CC([O-])=O CVSVTCORWBXHQV-UHFFFAOYSA-N 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- 229940095074 cyclic amp Drugs 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 125000004431 deuterium atom Chemical group 0.000 description 2
- 235000005911 diet Nutrition 0.000 description 2
- 230000037213 diet Effects 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 238000000265 homogenisation Methods 0.000 description 2
- 239000011539 homogenization buffer Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 201000008319 inclusion body myositis Diseases 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 239000007928 intraperitoneal injection Substances 0.000 description 2
- 229960002725 isoflurane Drugs 0.000 description 2
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 238000002826 magnetic-activated cell sorting Methods 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- XRISENIKJUKIHD-LHQZMKCDSA-N methyl 7-[(1r,2r,3r)-3-hydroxy-2-[(e,4r)-4-hydroxy-4-(1-propylcyclobutyl)but-1-enyl]-5-oxocyclopentyl]heptanoate Chemical compound CCCC1([C@H](O)C\C=C\[C@@H]2[C@H](C(=O)C[C@H]2O)CCCCCCC(=O)OC)CCC1 XRISENIKJUKIHD-LHQZMKCDSA-N 0.000 description 2
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 2
- 239000008108 microcrystalline cellulose Substances 0.000 description 2
- 229940016286 microcrystalline cellulose Drugs 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 210000005036 nerve Anatomy 0.000 description 2
- 208000018360 neuromuscular disease Diseases 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 235000019198 oils Nutrition 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 230000002980 postoperative effect Effects 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 238000004445 quantitative analysis Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000000284 resting effect Effects 0.000 description 2
- 238000003757 reverse transcription PCR Methods 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 210000002460 smooth muscle Anatomy 0.000 description 2
- 239000003998 snake venom Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 239000012086 standard solution Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 230000036977 tonic contraction Effects 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- 239000012224 working solution Substances 0.000 description 2
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- MGOGKPMIZGEGOZ-REOHCLBHSA-N (2s)-2-amino-3-hydroxypropanamide Chemical compound OC[C@H](N)C(N)=O MGOGKPMIZGEGOZ-REOHCLBHSA-N 0.000 description 1
- UCTWMZQNUQWSLP-VIFPVBQESA-N (R)-adrenaline Chemical compound CNC[C@H](O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-VIFPVBQESA-N 0.000 description 1
- 229930182837 (R)-adrenaline Natural products 0.000 description 1
- MXDQOCKVVLKVJS-QKIVIXBWSA-N (z)-7-[(1r,2r,3r)-3-methoxy-2-[(e,3s)-3-methoxyoct-1-enyl]-5-oxocyclopentyl]hept-5-enoic acid Chemical compound CCCCC[C@H](OC)\C=C\[C@H]1[C@H](OC)CC(=O)[C@@H]1C\C=C/CCCC(O)=O MXDQOCKVVLKVJS-QKIVIXBWSA-N 0.000 description 1
- XXTBGKDWFYXGDZ-KJCKJCAZSA-N (z)-7-[(1r,2r,3r,5r)-5-chloro-3-hydroxy-2-[(e,4s)-4-hydroxy-4-(1-prop-2-enylcyclobutyl)but-1-enyl]cyclopentyl]hept-5-enoic acid Chemical compound C([C@H](O)C1(CC=C)CCC1)\C=C\[C@H]1[C@H](O)C[C@@H](Cl)[C@@H]1C\C=C/CCCC(O)=O XXTBGKDWFYXGDZ-KJCKJCAZSA-N 0.000 description 1
- LLVVDFDWPQHXBA-QEJIITRLSA-N 11-Deoxy-16,16-dimethyl-PGE2 Chemical compound CCCCC(C)(C)[C@H](O)\C=C\[C@H]1CCC(=O)[C@@H]1C\C=C/CCCC(O)=O LLVVDFDWPQHXBA-QEJIITRLSA-N 0.000 description 1
- WTJYDBMHYPQFNJ-ZUVVJKHESA-N 19R-Hydroxy-PGE2 Chemical compound C[C@@H](O)CCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=O WTJYDBMHYPQFNJ-ZUVVJKHESA-N 0.000 description 1
- BVGVPUMSPSNRRQ-CNOJNPITSA-N 2-[3-[(1r,2s,3r)-3-hydroxy-2-[(e,3s)-3-hydroxy-5-[2-(methoxymethyl)phenyl]pent-1-enyl]-5-oxocyclopentyl]sulfanylpropylsulfanyl]acetic acid Chemical compound COCC1=CC=CC=C1CC[C@H](O)\C=C\[C@@H]1[C@@H](SCCCSCC(O)=O)C(=O)C[C@H]1O BVGVPUMSPSNRRQ-CNOJNPITSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- JVTIXNMXDLQEJE-UHFFFAOYSA-N 2-decanoyloxypropyl decanoate 2-octanoyloxypropyl octanoate Chemical compound C(CCCCCCC)(=O)OCC(C)OC(CCCCCCC)=O.C(=O)(CCCCCCCCC)OCC(C)OC(=O)CCCCCCCCC JVTIXNMXDLQEJE-UHFFFAOYSA-N 0.000 description 1
- LUTDLYPHDVQSHT-UHFFFAOYSA-N 2-hydroxycyclopentan-1-one Chemical group OC1CCCC1=O LUTDLYPHDVQSHT-UHFFFAOYSA-N 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- MTDIMKNAJUQTIO-UHFFFAOYSA-N 4-[4-cyano-2-[2-(4-fluoronaphthalen-1-yl)propanoylamino]phenyl]butanoic acid Chemical compound C=1C=C(F)C2=CC=CC=C2C=1C(C)C(=O)NC1=CC(C#N)=CC=C1CCCC(O)=O MTDIMKNAJUQTIO-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-M 4-hydroxybenzoate Chemical compound OC1=CC=C(C([O-])=O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-M 0.000 description 1
- JWYPJSNXPZTEHL-UHFFFAOYSA-N 5-(3-hydroxy-4-phenylbut-1-enyl)-1-[6-(2h-tetrazol-5-yl)hexyl]pyrrolidin-2-one Chemical compound C1CC(=O)N(CCCCCCC=2NN=NN=2)C1C=CC(O)CC1=CC=CC=C1 JWYPJSNXPZTEHL-UHFFFAOYSA-N 0.000 description 1
- VKEJXDXJUFQESA-DLMPNJEASA-N 9-Deoxy-9-methylene-PGE2 Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=C)[C@@H]1C\C=C/CCCC(O)=O VKEJXDXJUFQESA-DLMPNJEASA-N 0.000 description 1
- 102100024643 ATP-binding cassette sub-family D member 1 Human genes 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 235000006491 Acacia senegal Nutrition 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 201000011452 Adrenoleukodystrophy Diseases 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- 208000007195 Andersen Syndrome Diseases 0.000 description 1
- 201000006060 Andersen-Tawil syndrome Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 208000006304 Bethlem myopathy Diseases 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- 239000004255 Butylated hydroxyanisole Substances 0.000 description 1
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 206010058892 Carnitine deficiency Diseases 0.000 description 1
- 206010050215 Carnitine palmitoyltransferase deficiency Diseases 0.000 description 1
- 201000006868 Charcot-Marie-Tooth disease type 3 Diseases 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 208000000094 Chronic Pain Diseases 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 102000029816 Collagenase Human genes 0.000 description 1
- 108060005980 Collagenase Proteins 0.000 description 1
- 208000029323 Congenital myotonia Diseases 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 208000012514 Cumulative Trauma disease Diseases 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 101710088194 Dehydrogenase Proteins 0.000 description 1
- 208000016192 Demyelinating disease Diseases 0.000 description 1
- 108700043208 Dimauro disease Proteins 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 208000028771 Facial injury Diseases 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 1
- 239000001828 Gelatine Substances 0.000 description 1
- 206010064571 Gene mutation Diseases 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 208000032008 Glycogen storage disease due to glycogen debranching enzyme deficiency Diseases 0.000 description 1
- 206010053185 Glycogen storage disease type II Diseases 0.000 description 1
- 206010053250 Glycogen storage disease type III Diseases 0.000 description 1
- 208000035895 Guillain-Barré syndrome Diseases 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 208000011092 Hand injury Diseases 0.000 description 1
- 208000006411 Hereditary Sensory and Motor Neuropathy Diseases 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 1
- 101001023021 Homo sapiens LIM domain-binding protein 3 Proteins 0.000 description 1
- 206010020850 Hyperthyroidism Diseases 0.000 description 1
- 238000012404 In vitro experiment Methods 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100022338 Integrin alpha-M Human genes 0.000 description 1
- ZSBXGIUJOOQZMP-UHFFFAOYSA-N Isomatrine Natural products C1CCC2CN3C(=O)CCCC3C3C2N1CCC3 ZSBXGIUJOOQZMP-UHFFFAOYSA-N 0.000 description 1
- YQEZLKZALYSWHR-UHFFFAOYSA-N Ketamine Chemical compound C=1C=CC=C(Cl)C=1C1(NC)CCCCC1=O YQEZLKZALYSWHR-UHFFFAOYSA-N 0.000 description 1
- 102100035112 LIM domain-binding protein 3 Human genes 0.000 description 1
- 208000034693 Laceration Diseases 0.000 description 1
- 206010024453 Ligament sprain Diseases 0.000 description 1
- 102000003960 Ligases Human genes 0.000 description 1
- 108090000364 Ligases Proteins 0.000 description 1
- 206010061225 Limb injury Diseases 0.000 description 1
- 102100030417 Matrilysin Human genes 0.000 description 1
- 108090000855 Matrilysin Proteins 0.000 description 1
- NLSTZAFFNDSJGQ-UHFFFAOYSA-N Matrin Natural products O=C1CCCN2CC3CCNC4CCCC(C34)C12 NLSTZAFFNDSJGQ-UHFFFAOYSA-N 0.000 description 1
- 108010049137 Member 1 Subfamily D ATP Binding Cassette Transporter Proteins 0.000 description 1
- 208000001145 Metabolic Syndrome Diseases 0.000 description 1
- 206010049567 Miller Fisher syndrome Diseases 0.000 description 1
- 208000026072 Motor neurone disease Diseases 0.000 description 1
- 206010049565 Muscle fatigue Diseases 0.000 description 1
- 206010073713 Musculoskeletal injury Diseases 0.000 description 1
- 206010028470 Mycoplasma infections Diseases 0.000 description 1
- 102100026784 Myelin proteolipid protein Human genes 0.000 description 1
- 208000004304 Myofibromatosis Diseases 0.000 description 1
- 206010061533 Myotonia Diseases 0.000 description 1
- 208000010316 Myotonia congenita Diseases 0.000 description 1
- 208000012905 Myotonic disease Diseases 0.000 description 1
- 206010068871 Myotonic dystrophy Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 201000009110 Oculopharyngeal muscular dystrophy Diseases 0.000 description 1
- 101150053131 PTGER3 gene Proteins 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 241000287118 Parus Species 0.000 description 1
- 208000013234 Pearson syndrome Diseases 0.000 description 1
- 208000017493 Pelizaeus-Merzbacher disease Diseases 0.000 description 1
- 102000010292 Peptide Elongation Factor 1 Human genes 0.000 description 1
- 108010077524 Peptide Elongation Factor 1 Proteins 0.000 description 1
- 108700010203 Phosphoglycerate Kinase 1 Deficiency Proteins 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 102100024616 Platelet endothelial cell adhesion molecule Human genes 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 102100024448 Prostaglandin E2 receptor EP2 subtype Human genes 0.000 description 1
- 229940122829 Prostaglandin E2 receptor agonist Drugs 0.000 description 1
- 102100038277 Prostaglandin G/H synthase 1 Human genes 0.000 description 1
- 108050003243 Prostaglandin G/H synthase 1 Proteins 0.000 description 1
- 102100038280 Prostaglandin G/H synthase 2 Human genes 0.000 description 1
- 108050003267 Prostaglandin G/H synthase 2 Proteins 0.000 description 1
- 102000015433 Prostaglandin Receptors Human genes 0.000 description 1
- 108010050183 Prostaglandin Receptors Proteins 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- FBQUXLIJKPWCAO-AZIFJQEOSA-N Rivenprost Chemical compound COCC1=CC=CC(C[C@H](O)\C=C\[C@@H]2[C@H](C(=O)C[C@H]2O)CCSCCCC(=O)OC)=C1 FBQUXLIJKPWCAO-AZIFJQEOSA-N 0.000 description 1
- 108091006172 SLC21 Proteins 0.000 description 1
- WINXNKPZLFISPD-UHFFFAOYSA-M Saccharin sodium Chemical compound [Na+].C1=CC=C2C(=O)[N-]S(=O)(=O)C2=C1 WINXNKPZLFISPD-UHFFFAOYSA-M 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 208000010040 Sprains and Strains Diseases 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 208000037114 Symptom Flare Up Diseases 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 208000026723 Urinary tract disease Diseases 0.000 description 1
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 238000002679 ablation Methods 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 125000000218 acetic acid group Chemical group C(C)(=O)* 0.000 description 1
- 210000001361 achilles tendon Anatomy 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 101150063416 add gene Proteins 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 239000010775 animal oil Substances 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 229940127090 anticoagulant agent Drugs 0.000 description 1
- 229940053195 antiepileptics hydantoin derivative Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 229960004676 antithrombotic agent Drugs 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 210000000270 basal cell Anatomy 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 229920002988 biodegradable polymer Polymers 0.000 description 1
- 239000004621 biodegradable polymer Substances 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000001217 buttock Anatomy 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 1
- 229940043253 butylated hydroxyanisole Drugs 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 1
- 238000010805 cDNA synthesis kit Methods 0.000 description 1
- 210000000459 calcaneus Anatomy 0.000 description 1
- 239000000378 calcium silicate Substances 0.000 description 1
- 229910052918 calcium silicate Inorganic materials 0.000 description 1
- 229960003340 calcium silicate Drugs 0.000 description 1
- 235000012241 calcium silicate Nutrition 0.000 description 1
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 description 1
- 244000309466 calf Species 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229960001631 carbomer Drugs 0.000 description 1
- 229940085237 carbomer-980 Drugs 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000001925 catabolic effect Effects 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000010001 cellular homeostasis Effects 0.000 description 1
- 230000004700 cellular uptake Effects 0.000 description 1
- 239000003610 charcoal Substances 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 238000013375 chromatographic separation Methods 0.000 description 1
- 208000020832 chronic kidney disease Diseases 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 230000007012 clinical effect Effects 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 229960002424 collagenase Drugs 0.000 description 1
- 210000004953 colonic tissue Anatomy 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 208000011425 congenital myotonic dystrophy Diseases 0.000 description 1
- 239000012059 conventional drug carrier Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 229960003624 creatine Drugs 0.000 description 1
- 239000006046 creatine Substances 0.000 description 1
- 238000007821 culture assay Methods 0.000 description 1
- AJEHNBIPLQJTNU-UHFFFAOYSA-N cyanomethyl acetate Chemical compound CC(=O)OCC#N AJEHNBIPLQJTNU-UHFFFAOYSA-N 0.000 description 1
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 1
- 150000001940 cyclopentanes Chemical class 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 210000000852 deltoid muscle Anatomy 0.000 description 1
- 230000002638 denervation Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 208000016097 disease of metabolism Diseases 0.000 description 1
- 108010007093 dispase Proteins 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 229910001651 emery Inorganic materials 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- 201000000523 end stage renal failure Diseases 0.000 description 1
- 208000030172 endocrine system disease Diseases 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 229940079360 enema for constipation Drugs 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 229960003559 enprostil Drugs 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 229960005139 epinephrine Drugs 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229960001617 ethyl hydroxybenzoate Drugs 0.000 description 1
- NUVBSKCKDOMJSU-UHFFFAOYSA-N ethylparaben Chemical compound CCOC(=O)C1=CC=C(O)C=C1 NUVBSKCKDOMJSU-UHFFFAOYSA-N 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 230000003352 fibrogenic effect Effects 0.000 description 1
- 238000013100 final test Methods 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 238000005558 fluorometry Methods 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 210000002683 foot Anatomy 0.000 description 1
- 230000002431 foraging effect Effects 0.000 description 1
- 210000000245 forearm Anatomy 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 230000009746 freeze damage Effects 0.000 description 1
- 239000012520 frozen sample Substances 0.000 description 1
- 229940014259 gelatin Drugs 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 235000001727 glucose Nutrition 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 201000004502 glycogen storage disease II Diseases 0.000 description 1
- 201000004543 glycogen storage disease III Diseases 0.000 description 1
- 201000009339 glycogen storage disease VII Diseases 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 210000001255 hallux Anatomy 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 238000011134 hematopoietic stem cell transplantation Methods 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 150000001469 hydantoins Chemical class 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 230000002584 immunomodulator Effects 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000000415 inactivating effect Effects 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 201000011489 infantile myofibromatosis Diseases 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 239000003983 inhalation anesthetic agent Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 238000010813 internal standard method Methods 0.000 description 1
- 239000007925 intracardiac injection Substances 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 230000010189 intracellular transport Effects 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 229960003299 ketamine Drugs 0.000 description 1
- 210000003127 knee Anatomy 0.000 description 1
- 238000011813 knockout mouse model Methods 0.000 description 1
- 208000021601 lentivirus infection Diseases 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 238000001972 liquid chromatography-electrospray ionisation mass spectrometry Methods 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 238000000622 liquid--liquid extraction Methods 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- PTOJVMZPWPAXER-VFJVYMGBSA-N methyl 7-[(1r,2r,3r)-3-hydroxy-2-[(e,3r)-3-hydroxy-4-phenoxybut-1-enyl]-5-oxocyclopentyl]hepta-4,5-dienoate Chemical compound O[C@@H]1CC(=O)[C@H](CC=C=CCCC(=O)OC)[C@H]1\C=C\[C@@H](O)COC1=CC=CC=C1 PTOJVMZPWPAXER-VFJVYMGBSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 239000004570 mortar (masonry) Substances 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 208000005264 motor neuron disease Diseases 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 230000004118 muscle contraction Effects 0.000 description 1
- 230000003387 muscular Effects 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- 201000009340 myotonic dystrophy type 1 Diseases 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- GYCKQBWUSACYIF-UHFFFAOYSA-N o-hydroxybenzoic acid ethyl ester Natural products CCOC(=O)C1=CC=CC=C1O GYCKQBWUSACYIF-UHFFFAOYSA-N 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 230000037081 physical activity Effects 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 239000011505 plaster Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 210000001778 pluripotent stem cell Anatomy 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 238000012809 post-inoculation Methods 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- WGCXTGBZBFBQPP-UHFFFAOYSA-N prostaglandin E2 methyl ester Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CC=CCCCC(=O)OC WGCXTGBZBFBQPP-UHFFFAOYSA-N 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000003762 quantitative reverse transcription PCR Methods 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000015355 regulation of circadian sleep/wake cycle, sleep Effects 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 230000024977 response to activity Effects 0.000 description 1
- 102220013334 rs368367224 Human genes 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 201000000306 sarcoidosis Diseases 0.000 description 1
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 1
- 210000003497 sciatic nerve Anatomy 0.000 description 1
- 230000011218 segmentation Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002832 shoulder Anatomy 0.000 description 1
- 210000000419 skeletal muscle satellite cell Anatomy 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 238000011476 stem cell transplantation Methods 0.000 description 1
- UQZVCDCIMBLVNR-TWYODKAFSA-N sulprostone Chemical compound O[C@@H]1CC(=O)[C@H](C\C=C/CCCC(=O)NS(=O)(=O)C)[C@H]1\C=C\[C@@H](O)COC1=CC=CC=C1 UQZVCDCIMBLVNR-TWYODKAFSA-N 0.000 description 1
- 229960003400 sulprostone Drugs 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 208000016505 systemic primary carnitine deficiency disease Diseases 0.000 description 1
- 238000012353 t test Methods 0.000 description 1
- 238000004885 tandem mass spectrometry Methods 0.000 description 1
- 210000002435 tendon Anatomy 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 210000003371 toe Anatomy 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 238000004724 ultra fast liquid chromatography Methods 0.000 description 1
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 208000014001 urinary system disease Diseases 0.000 description 1
- 239000005526 vasoconstrictor agent Substances 0.000 description 1
- 230000024883 vasodilation Effects 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 238000011816 wild-type C57Bl6 mouse Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/557—Eicosanoids, e.g. leukotrienes or prostaglandins
- A61K31/5575—Eicosanoids, e.g. leukotrienes or prostaglandins having a cyclopentane, e.g. prostaglandin E2, prostaglandin F2-alpha
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/34—Muscles; Smooth muscle cells; Heart; Cardiac stem cells; Myoblasts; Myocytes; Cardiomyocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/02—Peptides of undefined number of amino acids; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/06—Anabolic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0657—Cardiomyocytes; Heart cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0658—Skeletal muscle cells, e.g. myocytes, myotubes, myoblasts
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0658—Skeletal muscle cells, e.g. myocytes, myotubes, myoblasts
- C12N5/0659—Satellite cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0661—Smooth muscle cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/02—Compounds of the arachidonic acid pathway, e.g. prostaglandins, leukotrienes
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biomedical Technology (AREA)
- Zoology (AREA)
- Biotechnology (AREA)
- Cell Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Genetics & Genomics (AREA)
- Wood Science & Technology (AREA)
- Epidemiology (AREA)
- Rheumatology (AREA)
- Cardiology (AREA)
- Developmental Biology & Embryology (AREA)
- Immunology (AREA)
- Neurology (AREA)
- Biochemistry (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- Virology (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Hospice & Palliative Care (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Urology & Nephrology (AREA)
- Neurosurgery (AREA)
- Hematology (AREA)
Abstract
本文提供了通过将肌细胞暴露于前列腺素E2(PGE2)化合物或激活PGE2信号传导的化合物而增殖肌细胞的组合物、方法和试剂盒。还提供了通过给予单独的PGE2化合物或与分离的肌细胞组合的PGE2化合物而用于在患有肌肉萎缩、营养不良和/或损伤的受试者中再生肌肉的方法。可以预防性地给予与分离的肌细胞组合的PGE2化合物来预防肌肉疾病或病症。
Description
相关申请的交叉引用
本申请要求于2016年3月4日递交的第62/303,979号美国临时申请和2016年6月9日递交的第62/348,116号美国临时申请的优先权,其公开的内容为了所有目的在此通过引用全部并入本文中。
在联邦资助的研发下作出的发明权利的声明
本发明是在国立卫生研究院(the National Institutes of Health)第AG020961号政府支持基金下进行的。政府享有本发明的某些权利。
发明背景
在骨骼肌中,衰老引起进行性损伤再生以及肌肉质量、力量和功能的丧失。肌肉功能的丧失是一个主要的公共健康问题,其常常在不断增加的老龄人群中引起严重的运动能力丧失和生活质量受损。肌肉功能下降的一个主要决定因素是衰老过程中急性损伤或创伤后,骨骼肌干细胞(MuSC)再生肌肉的能力受损。还需要加强由于例如,术后固定不动或停用、癌性和HIV性恶病质、肌肉营养不良、急性损伤以及衰老而经历创伤、损伤和/或萎缩肌肉的肌肉再生。常驻型MuSC很少,但其在整个成年期对肌肉(例如骨骼肌、平滑肌和心肌)的维持和修复是至关重要的。随着衰老,功能性干细胞的数目减少,因而增加提升MuSC数目和功能的需要增强。
前列腺素E2(PGE2),也称为地诺前列酮(dinoprostone),已被用于不同的临床环境中,包括诱导女人分娩和增强造血干细胞移植。PGE2可用作抗凝剂和抗血栓形成剂。PGE2作为脂质介质可以缓解炎症的作用也广为人知。COX-1和/或COX-2的抑制剂——非甾体抗炎药(NSAID),主要是经PGE2生物合成通过抑制前列腺素而抑制炎症。
PGE2通过环氧合酶(COX)和前列腺素E合成酶由花生四烯酸合成。PGE2的水平受PGE2降解酶——15-羟基前列腺素脱氢酶(15-PGDH)的生理调控。15-PGDH催化PGE2 15-OH失活转化为15-酮基。
本领域仍然需要用于再生或复原有需要的受试者中创伤、受损、功能异常和/或萎缩的肌肉的有效疗法。本发明满足该需要且还提供了优势。
发明概述
在本发明的一个方面,本文提供了刺激分离的肌肉干细胞群增殖的方法。所述方法包括用选自以下的化合物培养分离的肌细胞群:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物、以及以上的组合。
在本发明的第二个方面,本文提供了组合物,其包含分离的肌细胞群和选自以下的化合物:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物、以及以上的组合。
在本发明的第三方面,本文提供了试剂盒,其包含组合物和说明书,所述组合物包含分离的肌细胞群和选自以下的化合物:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物、以及以上的组合。
在第四个方面,本文提供了用于在患有与肌肉创伤、损伤或萎缩相关的病症或疾病的受试者中再生肌细胞群的方法。所述方法包括给予所述受试者治疗有效量的化合物和药学可接受的载体来增加所述受试者的肌细胞群和/或增强所述受试者的肌肉功能,所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物、以及以上的组合。
在第五个方面,本文提供了用于在有需要的受试者中预防或治疗与肌肉创伤、损伤或萎缩相关的病症或疾病的方法。所述方法包括给予所述受试者以下物质来预防或治疗所述与肌肉创伤、损伤或萎缩相关的病症或疾病:(i)治疗有效量的化合物和药学可接受的载体,所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物、以及以上的组合,以及(ii)分离的肌细胞群。
本发明的其他目的、特征和优势通过以下详细描述和附图对于本领域技术人员是显而易见的。
附图简要说明
图1A-1H显示在体外短暂PGE2处理促进年轻MuSC增殖。图1A:通过ELISA测定的年轻胫骨前肌(TA)肌肉损伤(虎蛇毒素(notexin),NTX)后的PGE2水平;对照为未受损伤的对侧TA;(n=4只小鼠/时间点)。图IB:通过RT-qPCR测定的虎蛇毒素损伤后MuSC的PGE2合成酶(Ptges2和Ptges)的表达,(n=3只小鼠/时间点)。图1C:用媒介物(-)或PGE2(10ng/ml)处理24小时后,接着在水凝胶上培养至第7天(急性处理)MuSC数目增加;(n=12只小鼠,于4个独立的实验中)。图ID:在EP4拮抗剂(ONO-AE3-208,1μM)不存在或存在下用媒介物(-)或PGE2(10ng/ml)短暂处理24小时后MuSC数目增加;(n=9只小鼠,在3个独立的实验中测定)。图1E-1G:无EP4的MuSC增殖。EP4f/f(无)MuSC用编码GFP荧光素酶的慢病毒载体转导,并用编码Cre(+Cre)或无Cre(-Cre;空载体)的慢病毒载体处理以删除EP4等位基因。随后,用媒介物(-)或PGE2(10ng/ml)处理MuSC 24小时,并在水凝胶上培养3天。图IE:描述无EP4的MuSC分析的示意图。图IF:无EP4的MuSC数目;(n=6只小鼠,于2个独立的实验中)。图1G:代表性图。比例尺=40μm;GFP,绿色;mCherry,红色。图1H:每两天用媒介物(-)或PGE2(10ng/ml)处理的活性炭吸附处理培养基中培养7天后,水凝胶上的MuSC数目;(n=3只小鼠,具有3个技术重复)。*P<0.0 5,**P<0.001,***P<0.0005,****P<0.0001。对于多重比较,利用采用Bonferroni校正的ANOVA检验(图1A、1B、1D和1F);成对t-检验(图1C);曼-惠特尼检验(图1H)。均值+s.e.m,n.s.,不显著的。
图2A-2J显示衰老MuSC对PGE2的异常反应。图2A:通过ELISA测定的衰老TA损伤(虎蛇毒素,NTX)后的PGE2水平;对照为未受损伤的对侧TA;(n=4只小鼠/时间点)。图2B:通过ELISA测定的未受损伤的幼龄(n=7只小鼠)和老龄(n=5只小鼠)小鼠TA的PGE2水平。图2C:显示PGE2通过降解酶15-PGDH分解代谢为其失活的PGE代谢物——13,14-二羟基-15-酮PGE2(PGEM)的示意图。图2D:通过质谱定量的PGEM水平;(n=4只小鼠/年龄组)。图2E:PGE2降解酶15-PGDH(Hpgd)的表达;(n=3只小鼠,采用2个技术重复)。图2F:用媒介物(-)、PGE2(10ng/ml)或15-PGDH抑制剂SW033291(1μΜ;SW)急性处理24小时后第7天测定的衰老MuSC数目增加;(n=15只小鼠,于5个独立的实验中)。图2G:每两天用媒介物(-)或PGE2(10ng/ml)处理的活性炭吸附处理培养基中培养7天后,水凝胶上的衰老MuSC数目;(n=3只小鼠,具有3个技术重复)。图2H:描述PGE2对MuSC影响的示意图。PGE2通过EP4受体/cAMP(环状AMP)信号传导通路起作用来促进增殖。在衰老MuSC中,通过PGT(前列腺素转运蛋白)的胞内转运后,PGE2分解代谢通过15-PGDH介导为失活形式——PGEM。图2I:微孔板中对照(左图)和用PGE2急性处理后(右图)的衰老MuSC的克隆通过延时显微镜检查追踪48小时的轨迹。通过不同的颜色显示原始细胞和其每一个新生后代的轨迹。图2J:通过延时显微镜检查追踪的克隆中对照(左图,n=32个克隆)和用PGE2急性处理后(右图,n=45个克隆)的衰老MuSC活细胞计数(数目)变化。在所有时间点每代(G1-G6)中活细胞的比例显示为标准化为100个单一MuSC起始群的细胞数目。活细胞计数的百分比增加为4.0%(对照)和5.4%(PGE2-处理)(上图)。通过延时显微镜检查追踪的克隆中对照(左图)和用PGE2急性处理后(右图)的衰老MuSC死细胞计数(数目)变化。在所有时间点每代(G1-G6)中死细胞的比例显示为标准化为100个单一MuSC的起始群的细胞数目。死细胞计数的百分比增加为1.0%(对照)和0.1%(PGE2-处理)(下图)。*P<0.05,**P<0.001,***P<0.0005。对于多重比较,利用采用Bonferroni校正的ANOVA检验(图2A和2F);曼-惠特尼检验(图2B、2D、2E和2G)。均值±s.e.m.,n.s.,不显著的。
图3A-3D显示在体内急性PGE2处理促进MuSC移植和再生。图3A:用媒介物(-)或PGE2急性处理后,培养的分离自转基因小鼠的GFP/luc标记的年轻MuSC(250个细胞)的移植,如图1C中所描述。移植示意图(上图)。非侵入性生物发光成像(BLI)信号测量为各TA的辐射度;(n=5只小鼠/条件)(下图)。图3B:移植培养的用Cre(+Cre)或无Cre(-Cre;空载体)处理的GFP/luc标记的EP4f/f MuSC(1,000个细胞),以删除EP4等位基因。用编码GFP/荧光素酶的慢病毒载体转导EP4f/f MuSC,用于BLI。移植示意图(上图)。移植后(n=5只小鼠/条件(下图))的BLI信号。图3C:与媒介物(-)或dmPGE2共同注射的新鲜分选的GFP/luc标记的年轻MuSC(250个细胞)的移植。移植示意图(上图)。移植后的BLI信号;(对于媒介物和dmPGE2处理,分别为n=4和n=5只小鼠)。图3D:与媒介物(-)或dmPGE2共同注射的GFP/luc标记的衰老MuSC(250个细胞)的移植;(n=3只小鼠/条件)(下图)。用编码GFP/荧光素酶的慢病毒载体转导衰老MuSC,用于BLI。移植示意图(上图)。移植后的BLI信号,表示为平均辐射度(ps-1cm-2sr-1)。每种条件的代表性BLI图。比例尺=5mm(图3A-3D)。数据代表两个独立的实验。*P<0.05,**P<0.001,和***P<0.0005。对于组比较,采用ANOVA检验,且通过费歇尔检验确定终点的显著性差异。均值+s.e.m。
图4A-4P显示肌内注射单独的PGE2促进MuSC扩增,改善再生和增加力量。年轻的(图4A-4D):心脏毒素(CTX)损伤后48小时,用媒介物(-)或dmPGE2注射幼龄小鼠的TA肌肉;(n=3只小鼠/条件)。图4A:实验程序的示意图(上图)。心脏毒素损伤后14天染色的代表性TA横截面(下图),其中核(DAPI;蓝色)、层粘连蛋白(绿色)和PAX7(红色)。箭头指示PAX7+MuSC。比例尺=40μm。图4B:通过免疫荧光测定的来自幼龄小鼠的TA横截面中表达PAX7的卫星细胞/100根纤维的内源MuSC增加。图4C:使用用于肌纤维分析的Baxter算法定量媒介物(-,开放的白色条)和dmPGE2(填充的蓝色条)处理的年轻TA的肌纤维横截面面积(CSA)。图4D:小(<1,000μm2CSA)和大(>1,000μm2CSA)肌纤维的分布。(图4E-4G)通过Pax7-荧光素酶测定的内源MuSC增加。用三苯氧胺(TAM)经腹膜内处理Pax7CreERT2;Rosa26-LSL-Luc小鼠,3天后TA经过心脏毒素(CTX)损伤、注射媒介物(-)或dmPGE2,并通过BLI监测;(n=3只小鼠/条件)。图4E:实验程序的示意图。图4F:BLI(n=3只小鼠/条件)。图4G:代表性BLI图。比例尺=5mm。衰老的(图4H-4K):在体内心脏毒素(CTX)损伤后48小时用媒介物(-)或dmPGE2处理对老龄小鼠的TA进行治疗;(n=3只小鼠/条件)。图4H:实验程序的示意图(上图)。心脏毒素损伤后14天染色的代表性TA横截面(下图),其中核(DAPI;蓝色)、层粘连蛋白(绿色)和PAX7(红色)。箭头指示PAX7+肌肉干细胞。比例尺=40μm。图4I:图4B中所示老龄小鼠的内源MuSC增加。图4J:图4C所示衰老TA的肌纤维横截面面积(CSA)。图4:图4D所示衰老TA的CSA分布。(图4L-4P)下坡式跑步机跑步后在老龄小鼠体内测量的肌肉收缩力的力增加。使小鼠经过2周连续的20°下坡式跑步机跑步,并在第5周测定力。在第1周期间,老龄小鼠的中间和侧面腓肠肌(GA)注射媒介物(-)或dmPGE2。媒介物(-)处理或dmPGE2处理分别采用n=10或8个生物重复,其中每个具有5个技术重复。图4L:实验示意图。代表性颤搐力(图4M)和强直收缩力(图4N)。通过将力标准化为生理横截面面积(PCSA)来计算比肌肉颤搐力(图4O)和比肌肉强直收缩力(图4P)。成对t检验(图4B、4D、4I和4K);对于组比较采用ANOVA检验,且通过费歇尔检验确定终点的显著性差异(图4F);曼-惠特尼检验(图4O和4P)。*P<0.05,**P<0.001和****P<0.0001。均值+s.e.m。
图5A-5K显示PGE2促进MuSC扩增。图5A:相比对侧未受损伤的对照,通过ELISA测定的低温损伤后第3天幼龄小鼠后肢肌肉的胫骨前肌(TA)的PGE2水平;(n=4只小鼠/时间点/条件)。图5B:用PGE2(10ng/ml)或媒介物(-)处理24小时(d0-d1)后的1小时期间,用EdU(红色)标记且染色成肌素(绿色)的分裂的肌肉干细胞(MuSC)的代表性图。比例尺代表40μm。图5C:用EDU标记的分裂的MuSC的百分比,如(b)中所示;(n=6只小鼠,具有3个技术重复,于两个独立的实验中)。图5D:用媒介物(-)或所示剂量的PGE2(1-200ng/ml)处理后,通过代谢活力检测VisionBlue测量的增殖增加;(n=6只小鼠,具有3个技术重复,于两个独立的实验中)。图5E:用媒介物(-)或PGE2处理24小时后MuSC的前列腺素受体(Ptger 1-4)的表达;(n=3只小鼠,具有2个技术重复)。图5F:相对于未处理对照(-),PGE2处理1小时后MuSC的cAMP水平增加;(n=6只小鼠,具有3个技术重复,于2个独立的实验中测定)。图5G-5H:用媒介物(-)或PGE2处理24小时后MuSC的Pax7(图5G)和成肌素(图5H)的表达;(n=3只小鼠,具有2个技术重复)。图5I-5J:用编码GFP/荧光素酶的慢病毒载体转导EP4f/f MuSC,并用编码Cre(+Cre)或无Cre(-Cre;空载体)的慢病毒载体进行处理来删除EP4等位基因。柱状图显示了+CreMuSC(图5I)和GFP/Luc+MuSC(图5J)的百分比。图5K:在每两天补充媒介物(-)或PGE2(10ng/ml)的包含活性炭吸附处理胎牛血清的成肌细胞培养基中培养7天后,水凝胶上的MuSC的代表性图。比例尺代表40μm。*P<0.05,**P<0.001,***P<0.0005。成对t检验(图5A、5E、5G和5H);曼-惠特尼检验(图5C)。均值+s.e.m。n.s.,不显著的。
图6A-6C显示了年轻和衰老肌肉的质谱分析检测前列腺素和PGE2代谢物。图6A:分析的前列腺素(PGE2、PGF2α和PGD2)和PGE2代谢物(15-酮PGE2和13,14-二氢-15-酮PGE2)的化学结构、化学式、精确分子量和分子量。所有复合标准品均添加了内标PGF2α-D9和PGE2-D9。图6B:通过稀释储备溶液至0.1ng/ml至500ng/ml的终浓度来制备液相色谱-电喷雾离子阱-串联质谱(LC-ESI-MS/MS)分析的校准标准品。给出了每个标准品的标准曲线方程式和相关系数。图6C:代表性色谱图。单独的峰显示分析的前列腺素及其代谢物的极好的色谱分辨率。Cps,计数/秒。
图7A-7G显示衰老MuSC响应PGE2处理而增加增殖和细胞存活。图7A-7C:对于年轻和衰老MuSC,通过qRT-PCR测量的mRNA水平以Gapdh标准化;(n=3只小鼠,具有2个技术重复)。图7A:Slco2al基因编码的前列腺素转运蛋白(PGT)。图7B:PGE2合成酶,Ptges和Ptges2。图7C:基因Ptger1-4编码的EP1-4受体。图7D:用媒介物(-)处理或PGE2处理24小时后MuSC的Pax7mRNA水平;(n=3只小鼠,具有2个技术重复)。图7E:用媒介物(-;上图)或PGE2(下图)急性处理后通过延时显微镜检查追踪的单个衰老MuSC克隆。对于每个克隆,显示了48小时定时拍摄轨迹后得到的活细胞(开放柱)和死细胞(黑色柱)数目。图7F:通过延时显微镜检查评估追踪媒介物(-)或短暂PGE2处理的活的衰老MuSC在48小时时间段的增殖曲线。图7G:衰老MuSC凋亡膜联蛋白V+的流式细胞术分析,用媒介物(-)或PGE2处理24小时后且在水凝胶上生长7天后进行分析;(n=9只小鼠,于3个独立的实验中)。以α=0.05水平的曼-惠特尼检验(图7A-7D)和成对t检验(图7G)。均值+s.e.m。n.s.,不显著的。
图8A-8B显示用于肌肉横截面面积的肌纤维分析的Baxter算法。图8A:心脏毒素(CTX)损伤后48小时用媒介物(-)或PGE2在体内治疗的幼龄小鼠的胫骨前肌肌纤维的代表性横截面图。图显示染色,其中层粘连蛋白(绿色)和DAPI(蓝色)。图8B:通过用于肌纤维分析的Baxter算法分析来自图8A的相应分割图,以测定损伤后第14天肌纤维(下图)横切面的横切面面积(CSA)。比例尺代表40μm。
图9A-9G显示删除MuSC中的PGE2受体EP4降低损伤后骨骼肌的再生和力量。用三苯氧胺处理的Pax7特异性EP4条件性敲除小鼠(Pax7CreERT2;EP4fl/fl)在虎蛇毒素损伤后6天(图9C-9D)、21天(图9B和9E)和14天(图9F和9G)测定的胫骨前肌(TA);(n=3只小鼠/条件)。图9A:实验示意图。图9B:来自损伤后的对照或EP4KO小鼠的分选的MuSC(α7+CD34+lin-)中Ptger4(EP4受体)的表达。图9C:代表性TA横切面。DAPI,蓝色;胚胎肌球蛋白重链(eMyHC),红色。比例尺=40μm。图9D:eMyHC纤维的百分比。图9E:对照和Pax7特异性EP4敲除TA的肌纤维横切面面积(CSA)。虎蛇毒素损伤后第14天的肌肉颤搐力(图9F)和(图9G)肌肉强直收缩力。曼-惠特尼检验(图9B、9C、9F和9G);对于组比较,ANOVA检验;且通过费歇尔检验每个二进数(bin)的显著性差异(图9E)。*P<0.05,***P<0.0005,和****P<0.0001。均值+s.e.m。
图10A-10C显示在再生的较早时间点,肌肉中内源性PGE2信号传导的阻断减少再生和力量。在心脏毒素损伤后,用媒介物(-)或NSAID(吲哚美辛)注射胫骨前肌(TA)后,通过非侵入性生物发光成像(BLI)测定的三苯氧胺(TAM)处理的Pax7CreERT2;Rosa26-LSL-Luc小鼠的内源MuSC;(n=3只小鼠/条件)。图10A:实验方案。图10Β:BLI;(n=3只小鼠/条件)。图10C:虎蛇毒素损伤后第14天的肌肉颤搐力(对于媒介物处理,n=8;对于NSAID处理,n=10)。采用ANOVA检验进行组比较,且通过费歇尔检验终点的显著性差异(图10B)。曼-惠特尼检验(图10C)。*P<0.05,**P<0.001,***P<0.0005,和****P<0.0001。均值+s.e.m。
发明详述
I.前言
本发明部分是基于发现前列腺素E2(PGE2)能够改善肌细胞增殖和功能。可将PGE2单独或与分离的肌细胞组合用于修复由于损伤、萎缩或疾病而造成的肌肉损害。事实上,施用后,PGE2-处理的肌细胞显示增加的肌肉再生和改善的肌肉功能。由此,本文提供了新的治疗方法、组合物和试剂盒来促进肌肉再生和创伤、损伤或萎缩肌肉的恢复。
II.概述
实施本发明利用分子生物学领域的常规技术。公开在本发明中使用的一般方法的基础文本包括Sambrook and Russell,Molecular Cloning,A Laboratory Manual(3rded.2001);Kriegier,Gene Transfer and Expression:A Laboratory Manual(1990);和Current Protocols in Molecular Biology(Ausubel et al.,eds.,1994))。
对于核酸,大小以千碱基(kb)、碱基对(bp)或核苷酸(nt)示出。单链DNA和/或RNA的大小可以以核苷酸给出。这些为来自琼脂糖或丙烯酰胺凝胶电泳、来自测序的核酸或来自发表的DNA序列的估算值。对于蛋白质,大小以千道尔顿(kDa)或氨基酸残基数目示出。蛋白质大小为来自凝胶电泳、来自测序的蛋白质、来自推导的氨基酸序列或来自发表的蛋白质序列的估算值。
不可商购获得的寡核苷酸可以化学合成,例如,根据由Beaucage and Caruthers,Tetrahedron Lett.22:1859-1862(1981)首次描述的固相亚磷酰胺三酯方法,使用如VanDevanter et.al.,Nucleic Acids Res.12:6159-6168(1984)中所描述的自动化合成仪。寡核苷酸的纯化使用任何本领域认可的策略进行,例如如Pearson and Reanier,J.Chrom.255:137-149(1983)中所述的非变性丙烯酰胺凝胶电泳或阴离子交换高效液相色谱(HPLC)。
III.定义
如本文中所用的,以下术语具有其归属的含义,除非另有说明。
如本文中所用的术语“一个”、“一种”或“所述”不仅包括具有一个/种成员的方面,还包括具有多于一个/种成员的方面。例如,单数形式“一个”、“一种”和“所述”包括复数指示物,除非上下文明确指示相反。因此,例如,提及“一个细胞”包括多个这样的细胞,且提及“所述试剂”包括提及一种或多种本领域技术人员已知的试剂,等等。
术语“前列腺素E2”或“PGE2”是指可以通过花生四烯酸经环氧合酶(COX)和最终的前列腺素E合成酶(PGE5)合成的前列腺素。PGE2在包括血管舒张、炎症和调节睡/醒循环在内的多种生物功能中起作用。
术语“前列腺素E2受体激动剂”或“PGE2受体激动剂”是指能够结合并激活任何PGE2受体,从而刺激PGE2信号传导通路的化合物、小分子、多肽、生物产品等。
术语“减弱PGE2分解代谢的化合物”是指能够减少或降低PGE2分解的化合物、小分子、多肽、生物产品等。
术语“中和PGE2抑制的化合物”是指能够阻断或阻碍PGE2合成、活性、分泌、功能等的抑制剂的化合物、小分子、多肽、生物产品等。
术语“衍生物”在化合物的上下文中,包括但不限于给定化合物的酰胺、醚、酯、氨基、羧基、乙酰基和/或醇衍生物。
术语“胚胎干细胞来源的肌细胞”或“ESC来源的肌细胞”是指来源于胚胎干细胞或由胚胎干细胞分化的肌细胞。
术语“诱导的多能干细胞来源的肌细胞”或“iPSC来源的肌细胞”是指来源于诱导的多能干细胞或由诱导的多能干细胞分化的肌细胞。
术语“分离的”在细胞的上下文中,是指至少部分从来源组织(例如,肌肉组织)中与其天然共存的其他细胞类型或其他细胞物质分离和/或纯化的目标单细胞或目标细胞群。当其至少约60%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%,且在某些情况下,至少约99%不含非肌细胞的细胞时,肌细胞群为“分离的”。可以通过任何合适的方法,例如,通过荧光激活的细胞分选来测量纯度。
术语“自体的”是指来源于其随后被重新引入个体的同一个体的任何物质(例如,细胞)。
术语“同种异体的”是指来源于与引入物质的个体相同物种的不同动物的任何物质(例如,细胞)。当一个或多个位点的基因不相同时,认为两个或更多个个体是彼此同种异体的。在一些方面,来自相同物种的个体的同种异体的物质可能是在遗传上足够不同而不能在抗原上相互作用。
术语“治疗”或“处理”是指以下中的任意一项:改善一种或多种疾病症状;在其出现前阻止此类症状的显现;减慢或完全阻止疾病进展(其可以通过复发期之间较长的时间段、减慢或阻止症状恶化等显示);增强缓解期的开始;减慢疾病的进行性-慢性期造成的不可逆损伤(第一阶段和第二阶段);延迟所述进行性阶段的开始;或以上的任意组合。
术语“给予/给药/施用”是指可用于使递送诸如本文中描述的化合物和细胞的试剂或组合物至预期生物作用位点成为可能的方法。这些方法包括但不限于,肠胃外给药(例如,静脉内、皮下、腹膜内、肌内、动脉内、血管内、心内、鞘内、鼻内、皮内、玻璃体内等)、穿粘膜注射、经口给药、以栓剂给药,以及局部给药。本领域技术人员知道用于给予治疗有效量的本文中描述的化合物和/或细胞来预防或减轻一种或多种与疾病或病症相关的症状的其他方法。
术语“治疗有效量”或“治疗有效剂量”或“有效量”是指足以产生有益或所需临床效应的化合物、治疗剂(例如,细胞)和/或药物的量。治疗有效量或剂量可以基于每名患者独特的因素,包括但不限于患者年龄、体型、疾病类型或程度、疾病阶段、再生细胞的给药途径、所使用的补充疗法的类型或范围、进行中的疾病过程、以及所需的治疗类型(例如,侵入性的相比常规的治疗)。可由细胞培养和动物模型初步估计本文所述的药物化合物或组合物的治疗有效量。例如,细胞培养方法中测定的IC50值可用作动物模型的起始点,而动物模型中测定的IC50值可用于探寻人体中的治疗有效剂量。
术语“药学可接受的载体”是指不对生物体造成明显刺激且不消除所给予化合物的生物活性和特性的载体或稀释剂。
术语“受试者”、“个体”和“患者”在本文中可互换使用,是指脊椎动物,优选哺乳动物,更优选人。哺乳动物包括但不限于小鼠、大鼠、类人猿、人、家畜、运动动物和宠物。
术语“急性暴露”在化合物给药的上下文中,是指将化合物暂时或短暂施用于受试者,例如,人类受试者或细胞。在一些实施方案中,急性暴露包括在处理过程中或在延长的时间段内化合物的单次施用。
术语“间歇暴露”在化合物给药的上下文中,是指将化合重复施用于受试者,例如,人类受试者或细胞,其中施用之间间隔所需的时间段。
术语“急性方案”在化合物给药的上下文中,是指将化合物暂时或短暂施用于受试者,例如人类受试者,或者是指将化合物重复施用于受试者,例如人类受试者,其中施用之间间隔所需的时间段(例如,1天)。在一些实施方案中,急性方案包括在治疗过程中或在延长的时间段内将化合物急性暴露(例如,单次剂量)于受试者。在其他实施方案中,急性方案包括将化合物间歇暴露(例如,重复的剂量)于受试者,其中每次暴露之间间隔所需的时间段。
术语“连续暴露”在化合物给药的上下文中,是指将化合物在延长的时间段内重复地、长期地施用于受试者,例如,人类受试者或细胞。
术语“慢性方案”在化合物给药的上下文中,是指将化合物在延长的时间段内重复地、长期地施用于受试者,例如人类受试者,使得化合物的量或水平在选定的时间段内基本稳定。在一些实施方案中,慢性方案包括将受试者在延长的时间段内连续暴露于化合物。
IV.实施方案的详细描述
在一方面,本文提供了通过用化合物培养分离的肌细胞群而用于刺激分离的肌细胞群增殖、扩增和/或移植的方法,所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物、以及以上的组合。在一些实施方案中,所分离的肌细胞群为基本上纯化的或纯化的(例如,与非肌细胞或非目标的其他细胞分离)。在一些情况下,所分离的肌细胞群包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的组合。在特定的实施方案中,所分离的肌细胞群包括肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的组合。
所分离的肌细胞群可以获自受试者。在其他实施方案中,所分离的肌细胞来自细胞系,例如原代细胞系。在一些情况下,所述受试者患有与肌肉创伤、损伤或萎缩相关的病症或疾病。所述与肌肉创伤、损伤或萎缩相关的病症或疾病可以选自:急性肌肉损伤、撕伤或外伤、手部软组织损伤、Duchenne型肌营养不良(DMD)、Becker型肌营养不良、肢带型肌营养不良、肌萎缩侧索硬化(ALS)、远端型肌营养不良(DO)、遗传性肌病、强直性肌营养不良(MDD)、线粒体性肌病、肌管性肌病(MM)、重症肌无力(MG)、充血性心力衰竭、周期性麻痹、多肌炎、横纹肌溶解、皮肌炎、癌性恶病质、AIDS性恶病质、心源性恶病质、压力诱导的尿失禁、以及肌少症。
在一些实施方案中,所述PGE2衍生物包括16,16-二甲基前列腺素E2。在其他实施方案中,所述减弱PGE2分解代谢的化合物包括这样的化合物、中和肽或中和抗体,其失活或阻断15-羟基前列腺素脱氢酶(15-PGDH),或者失活或阻断前列腺素转运蛋白(PTG或SLCO2A1,其转运细胞内的PGE2以被15-PGDH分解代谢)。
在一些实施方案中,用所述化合物培养所述分离的肌细胞群的步骤包括将所述分离的肌细胞群急性地、间歇地或连续地暴露于所述化合物。可以以急性方式将所述分离的细胞暴露于所述化合物一次。在其他情况下,可以在多于一个时间点将所述分离的细胞暴露于所述化合物,这样在暴露之间间隔时间段。在其他情况下,可以将所述分离的细胞连续暴露于所述化合物,这样与所述细胞直接接触的化合物水平不低于预选的量。
在特定的实施方案中,本文提供了用于促进受试者肌细胞移植的方法。所述方法包括用有效量的化合物培养或接触分离的肌细胞群来促进所述受试者中所述肌细胞的移植,以及将所述培养或接触的肌细胞给予所述受试者,其中所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。
在另一方面,本文提供了包含分离的肌细胞群和化合物的组合物,其中所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物,以上的类似物、以及以上的组合。在一些实施方案中,所述分离的肌细胞群包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的组合。在一些情况下,所述分离的肌细胞群包括肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的组合。所述组合物还可包含药学可接受的载体。
在又一方面,本文提供了试剂盒,其包含本文公开的任一种组合物以及说明书。
在另一方面,本文提供了在患有与肌肉创伤、损伤或萎缩相关的病症或疾病的受试者中再生肌细胞群的方法。所述方法包括给予所述受试者治疗有效量的化合物和药学可接受的载体来增加所述受试者的肌细胞群和/或增强所述受试者的肌肉功能,其中所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。
在相关方面,本文提供了在患有与肌肉创伤、损伤或萎缩相关的病症或疾病的受试者中刺激肌细胞群增殖和/或扩增的方法。所述方法包括给予所述受试者治疗有效量的化合物和药学可接受的载体来增加所述受试者的肌细胞群和/或增强所述受试者的肌肉功能,其中所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物、,和以上的组合。
在一些实施方案中,所述肌细胞群包括内源性肌细胞群。在其他实施方案中,所述肌细胞群包括已给予(例如,注射或移植)所述受试者的分离的肌细胞群。在其他实施方案中,所述肌细胞群包括已给予所述受试者的内源性肌细胞群和分离的肌细胞群。
在一些实施方案中,所述与肌肉创伤、损伤或萎缩相关的病症或疾病选自:急性肌肉损伤或外伤、手部软组织损伤、Duchenne型肌营养不良(DMD)、Becker型肌营养不良、肢带型肌营养不良、肌萎缩侧索硬化(ALS)、远端型肌营养不良(DD)、遗传性肌病、强直性肌营养不良(MDD)、线粒体性肌病、肌管性肌病(MM)、重症肌无力(MG)、充血性心力衰竭、周期性麻痹、多肌炎、横纹肌溶解、皮肌炎、癌性恶病质、AIDS性恶病质、心源性恶病质、压力诱导的尿失禁、以及肌少症。
在一些实施方案中,所述肌细胞群包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的组合。在一些情况下,所述肌细胞群包括肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的组合。
在一些实施方案中,所述PGE2衍生物包括16,16-二甲基前列腺素E2。
在一些实施方案中,所述减弱PGE2分解代谢的化合物包括失活或阻断15-羟基前列腺素脱氢酶(15-PGDH)或者失活或阻断前列腺素转运蛋白(PTG或SLCO2A1)的化合物、中和肽或中和抗体。
在一些实施方案中,给予所述化合物的步骤包括经口、腹膜内、肌内、动脉内、皮内、皮下、静脉内,或心内给药。在一些情况下,所述化合物根据急性方案给药。在某些情况下,所述急性方案包括将所述受试者急性地暴露(例如,单次剂量)于所述化合物。在其他情况下,所述急性方案包括将所述受试者间歇地暴露(例如,重复的剂量)于所述化合物。作为一个非限制性的实例,急性PGE2方案可以包括在所需时间段内(例如,在2、3、4、5、6或7天的过程中)PGE2的一系列间歇(例如,每天)剂量。
在其他实施方案中,所述给予步骤还包括将分离的肌细胞群给予所述受试者。所述分离的肌细胞群可以为所述受试者自体的。所述分离的肌细胞群可以为所述受试者同种异体的。在一些情况下,所述分离的肌细胞群为基本上纯化的或纯化的。在其他情况下,在给予所述受试者之前用所述化合物培养所述分离的肌细胞群。用所述化合物培养所述分离的肌细胞群的步骤可以包括将所述分离的肌细胞群急性地、间歇地或连续地暴露于所述化合物。给予所述分离的肌细胞群可以包括将所述细胞注射或移植至所述受试者。所述分离的肌细胞群和所述化合物可以同时给予所述受试者。可选地,所述分离的肌细胞群和所述化合物可以依次给予所述受试者。
在另一方面,本文提供了预防或治疗有需要的受试者中与肌肉创伤、损伤或萎缩相关的病症或疾病的方法。所述方法包括给予所述受试者以下物质来预防或治疗与肌肉创伤、损伤或萎缩相关的病症或疾病:(i)治疗有效量的化合物和药学可接受的载体,所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合,以及(ii)分离的肌细胞群。
在相关方面,本文提供了通过给予所述受试者以下物质来在患有与肌肉创伤、损伤或萎缩相关的病症或疾病的受试者中刺激肌细胞群增殖和/或扩增的方法:(i)选自以下的治疗有效量的化合物和药学可接受的载体:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合,以及(ii)分离的肌细胞群。在一些实施方案中,所述肌细胞群包括内源性肌细胞群。在其他实施方案中,所述肌细胞群包括已给予(例如,注射或移植)所述受试者的分离的肌细胞群。在其他实施方案中,所述肌细胞群包括内源性肌细胞群和已给予所述受试者的分离的肌细胞群。在某些实施方案中,所述治疗有效量的化合物包括这样的量,其足以增加所述受试者的内源性肌细胞群和/或增加已给予所述受试者的分离的肌细胞群和/或增强所述受试者的肌肉功能。
在一些实施方案中,所述PGE2衍生物包括16,16-二甲基前列腺素E2。在一些情况下,所述减弱PGE2分解代谢的化合物包括失活或阻断15-羟基前列腺素脱氢酶(15-PGDH)或者失活或阻断前列腺素转运蛋白(PTG或SLCO2A1)的化合物、中和肽或中和抗体。
在一些实施方案中,所述肌细胞群包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的组合。在一些情况下,所述肌细胞群包括肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的组合。所述分离的肌细胞群可以为基本纯化的或纯化的。
在一些实施方案中,所述分离的肌细胞群在给予所述受试者之前用所述化合物培养。在一些情况下,用所述化合物培养所述分离的肌细胞群包括将所述肌细胞群急性地、间歇地或连续地暴露于所述分离的所述化合物。
在一些实施方案中,所述分离的肌细胞群为所述受试者自体的。在其他实施方案中,所述分离的肌细胞群为所述受试者同种异体的。
所述化合物的给予可以为经口、腹膜内、肌内、动脉内、皮内、皮下、静脉内或心内给药。在一些情况下,根据急性方案给予所述化合物。在某些情况下,所述急性方案包括将所述化合物急性地暴露(例如,单次剂量)于所述受试者。在其他情况下,所述急性方案包括将所述化合物间歇地暴露于(例如,重复的剂量)所述受试者。作为一个非限制性实例,急性PGE2方案可以包括在所需的时间段内(例如,在2、3、4、5、6或7天的过程中)PGE2的一系列间歇(例如,每天)剂量。给予所述分离的肌细胞群可以包括将所述细胞注射或移植至所述受试者。所述化合物和所述分离的肌细胞群可以同时给予所述受试者。任选地,所述化合物和所述分离的肌细胞群可以依次给予所述受试者。
在一些实施方案中,所述受试者疑似患有与肌肉创伤、损伤或萎缩相关的病症或疾病,或者处于与肌肉创伤、损伤或萎缩相关的病症或疾病的风险。在一些情况下,所述与肌肉创伤、损伤或萎缩相关的病症或疾病选自:急性肌肉损伤或外伤、手部软组织损伤、Duchenne型肌营养不良(DMD)、Becker型肌营养不良、肢带型肌营养不良、肌萎缩侧索硬化(ALS)、远端型肌营养不良(DD)、遗传性肌病、强直性肌营养不良(MOD)、线粒体性肌病、肌管性肌病(MM)、重症肌无力(MG)、充血性心力衰竭、周期性麻痹、多肌炎、横纹肌溶解、皮肌炎、癌性恶病质、AIDS性恶病质、心源性恶病质、压力诱导的尿失禁、以及肌少症。
A.刺激肌细胞增殖或移植的方法
本文提供了用于刺激或促进分离的肌细胞增殖和/或移植的体外或离体方法。所述方法包括用以下物质培养或接触分离的肌细胞群:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,或以上的组合。可以将所述化合物加入用于维持或增殖所述细胞的任何培养基。
所述化合物可以为能够模拟、激活或刺激PGE2信号转导的任何小分子、前药、生物产品等。在一些情况下,所述化合物为PGE2(即地诺前列酮)、合成的PGE2衍生物(例如,16,16-二甲基前列腺素E2;dmPGE2)、合成的PGE2类似物、合成的PGE2变体,或肌肉特异性的PGE2变体。在其他情况下,所述化合物为PGE2前药,如在暴露至肌肉细胞或与肌细胞极为接近时能够分解代谢为具药学活性的PGE2药物的PGE2前药。在其他情况下,所述化合物可以为包括PGE2受体1、PGE2受体2、PGE2受体3和PGE2受体4在内的PGE2受体中的任一种的激动剂。所述激动剂可以特异性结合或激活一种或多种PGE2受体。在一些情况下,所述化合物可以为减弱、阻碍、抑制或降低PGE2分解代谢的化合物,如失活或阻断能够降解或分解代谢PGE2的酶(如15-羟基-前列腺素脱氢酶(15-PGDH))的化合物或中和(阻断)抗体。在其他情况下,所述化合物阻断、阻止或对抗对PGE2和/或PGE2合成、活性和/或分泌的抑制。
在一些实施方案中,本文描述的化合物可以引发肌细胞的增殖,包括静止期肌细胞。所述分离的肌细胞群可以为纯的或基本上纯的肌细胞群,这样所述肌细胞的至少约90%为单一类型的肌细胞。在其他实施方案中,所述群为肌细胞的混合物,其中不到约90%的细胞为同一细胞类型。在一些情况下,所述肌细胞包括从受试者收获的骨骼肌细胞、平滑肌细胞和/心肌细胞。在其他情况下,所述肌细胞由胚胎干细胞产生或分化,例如,人胚胎干细胞或诱导的多能干细胞,例如,人的诱导的多能干细胞。在其他方面,所述肌细胞为去分化的肌细胞。在一些实施方案中,所述分离的肌细胞群包括肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的组合。例如,所述分离的肌细胞可以为纯的或基本上纯的肌肉干细群胞。可选地,所述分离的肌细胞可以为纯的或基本上纯的卫星细胞群。在其他情况下,所述分离的肌细胞可以为肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维或以上的任意组合的异源混合物。这样,所述混合物可以包含肌肉干细胞和卫星细胞,以及任选地,肌细胞。
在一些实施方案中,所述肌细胞或所述诱导的多能干细胞来源于患有与肌肉创伤、损伤或萎缩相关的病症或疾病的受试者。在一些实施方案中,所述与肌肉创伤、损伤或萎缩相关的病症或疾病为急性肌肉损伤、撕伤或外伤、手部软组织损伤、Duchenne型肌营养不良(DMD)、Becker型肌营养不良、肢带型肌营养不良、肌萎缩侧索硬化(ALS)、远端型肌营养不良(DD)、遗传性肌病、强直性肌营养不良(MDD)、线粒体性肌病、肌管性肌病(MM)、重症肌无力(MG)、充血性心力衰竭、周期性麻痹、多肌炎、横纹肌溶解、皮肌炎、癌性恶病质、AIDS性恶病质、心源性恶病质、压力诱导的尿失禁、肌少症,或以上的任意组合。
在特定的实施方案中,提供了在受试者中促进肌细胞移植的离体方法。所述方法包括用有效量的化合物培养或接触分离的肌细胞群来促进受试者肌细胞的移植,其中所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。所述方法还包括将所培养或接触的肌细胞给予所述受试者。在一些情况下,所述分离的肌细胞群为所述受试者自体的。在其他情况下,所述分离的肌细胞群为所述受试者同种异体的。在一些实施方案中,所述受试者为人。在一些实施方案中,所述受试者患有与肌肉创伤、损伤或萎缩相关的病症或疾病。在一些实施方案中,所述方法还包括给予所述受试者治疗有效量的化合物和药学可接受的载体,其中所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。可以在将所培养或接触的肌细胞给予所述受试者之前、同时和/或之后,将所述化合物给予所述受试者。在一些情况下,所述分离的肌细胞群用与给予所述受试者相同的化合物培养或接触。在其他情况下,所述分离的肌细胞群用与给予所述受试者不同的化合物培养或接触。
所述肌细胞可以获自身体的任何肌肉,包括但不限于胸肌复合肌、背阔肌、大圆肌和肩胛下肌、肱桡肌、二头肌、肱肌、旋前方肌、旋前圆肌、桡侧腕屈肌、尺侧腕屈肌、指浅屈肌、指深屈肌、拇短屈肌、拇对掌肌、拇收肌、拇短屈肌、髂腰肌、腰大肌、腹直肌、股直肌、臀大肌、臀中肌、内侧腘绳肌、腓肠肌、外侧腘绳肌、股四头肌、长收肌、短收肌、大收肌、内侧腓肠肌、外侧腓肠肌、比目鱼肌、胫骨后肌、胫骨前肌、趾长屈肌、趾短屈肌、拇长屈肌、姆长伸肌、手部肌肉、手臂肌肉、足部肌肉、腿部肌肉、胸部肌肉、腹部肌肉、背部肌肉、臀部肌肉、肩部肌肉、头部和颈部肌肉等。
在一些实施方案中,从特定肌肉获取所述肌细胞,根据本文公开的方法进行扩增,然后移植回相同的肌肉,或者可选地,移植至不同的肌肉。在一些情况下,所述肌细胞的来源和所述移植部位为受试者的同一肌肉。在其他情况下,所述肌细胞的来源和所述移植部位为受试者的不同肌肉。在其他情况下,所述肌细胞的来源和所述移植部位为来自不同受试者的相同类型的肌肉。在其他情况下,所述肌细胞的来源和所述移植部位为来自不同受试者的不同类型的肌肉。
可以用本文公开的化合物急性地、间歇地或连续地培养分离的肌细胞。在一些实施方案中,将所述细胞暴露于单剂量的所述化合物一段时间。在其他实施方案中,将所述细胞暴露于至少两倍或更多倍剂量的所述化合物,这样给药之间间隔一段时间,例如一天、两天、一周或更久。在一些实施方案中,将所述细胞长期或连续暴露于所述化合物,例如,在一段持续时间内不改变化合物浓度或不改变对细胞的影响。
B.在受试者中再生受损伤肌细胞的方法
本文提供的方法可用于受试者(如人受试者)的肌肉再生或复原。肌肉再生包括从肌肉干细胞、卫星细胞、肌肉祖细胞,和以上的任意组合形成新的肌肉纤维。所述方法还可用于增强或增加肌肉修复和/或维持。
可以将本发明的PGE2化合物给予经历肌肉退化或萎缩的受试者。肌肉萎缩可以包括肌肉质量和/或力量的损失,其可以影响受试者的任何肌肉。在一些情况下,需要本文提供的组合物、方法和试剂盒的受试者由于例如年龄、不活动、损伤、患病和以上的任意组合而显示或经历肌肉损失。
在一些实施方案中,化合物可以激活肌细胞增殖、分化和/或肌细胞的融合。在一些情况下,使所述肌肉组织再生。在其他情况下,使肌肉功能(例如肌肉质量、肌肉力量和/或肌肉收缩)修复或增强。在一些情况下,肌肉无力和萎缩得到改善。
所述受损伤的肌肉可以为身体的任何肌肉,包括但不限于胸肌、背阔肌、大圆肌和肩胛下肌、肱桡肌、二头肌、肱肌、旋前方肌、旋前圆肌、桡侧腕屈肌、尺侧腕屈肌、指浅屈肌、指深屈肌、拇短屈肌、拇对掌肌、拇收肌、拇短屈肌、髂腰肌、腰肌、腹直肌、股直肌、臀大肌、臀中肌、内侧腘绳肌、腓肠肌、外侧腘绳肌、股四头肌、长收肌、短收肌、大收肌、内侧腓肠肌、外侧腓肠肌、比目鱼肌、胫骨后肌、胫骨前肌、趾长屈肌、趾短屈肌、拇长屈肌、姆长伸肌、手部肌肉、手臂肌肉、足部肌肉、腿部肌肉、胸部肌肉、腹部肌肉、背部肌肉、臀部肌肉、肩部肌肉、头部和颈部肌肉、面部肌肉、眼咽肌肉等。
需要肌肉再生的受试者可能具有肌肉骨骼损伤(例如骨折、拉伤、扭伤、急性损伤、使用过度损伤等)、创伤后四肢或面部损伤、运动损伤、老年人骨折、手部软组织损伤、肌肉萎缩(例如,肌肉量减少)、Duchenne型肌营养不良(DMD)、Becker型肌营养不良、福山型先天性肌营养不良(FCMD)、肢带型肌营养不良(LGMD)、先天性肌营养不良、面肩肱型肌营养不良(FHMD)、强直性肌营养不良、眼咽型肌营养不良、远端型肌营养不良、埃德型(Emery-Dreifuss)肌营养不良、先天性肌强直、肌紧张性营养不良、其他肌营养不良、肌肉萎缩症,如由于癌症、终末期肾病(ESRD)、获得性免疫缺陷综合症(AIDS)或慢性阻塞性肺病(COPD)造成的恶病质、术后肌无力、创伤后肌无力、肌少症、不活动(例如,肌肉停用或不动)、尿道括约肌缺陷、尿道括约肌缺陷、神经肌肉疾病等。
神经肌肉疾病的非限制性实例包括但不限于酸性麦芽糖酶缺乏症、肌萎缩侧索硬化、Andersen-Tawil综合征、Becker型肌营养不良、Becker型先天性肌强直、Bethlem肌病、延髓性肌肉萎缩、肉碱缺乏症、肉碱棕榈酰基转移酶缺乏症、中央轴空病、中央核肌病、Charcot-Marie-Tooth病、先天性肌营养不良、先天性肌无力综合征、先天性肌强直性营养不良、Cori病、脱支酶缺乏、Dejerine-Sottas病、皮肌炎、远端型肌营养不良、Duchenne型肌营养不良、营养不良性肌强直、埃德型肌营养不良、内分泌性肌病、Eulenberg病、面肩肱型肌营养不良、胫骨远端肌病、弗里德希氏(Friedreich)共济失调、福山型(Fukuyuma)先天性肌营养不良、10型糖原贮积症、11型糖原贮积症、2型糖原贮积症、3型糖原贮积症、5型糖原贮积症、7型糖原贮积症、9型糖原贮积症、Gowers-Laing远端型肌病、遗传性包涵体肌炎、甲亢性肌病、甲减性肌病、包涵体肌炎、遗传性肌病、整合素缺陷性先天性肌营养不良、脊髓性肌萎缩、脊髓性肌萎缩、乳酸脱氢酶缺乏症、Lambert-Eaton肌无力综合征、McArdel病、merosin缺陷性先天性肌营养不良、肌肉代谢性疾病、线粒体性肌病、Miyoshi远端型肌病、运动神经元疾病、肌-眼-脑病、重症肌无力、肌腺苷酸脱氨酶缺乏症、肌纤维性肌病、肌磷酸化酶缺乏症、先天性肌强直、强直性肌营养不良、肌管性肌病、线状体肌病、Nonaka远端型肌病、眼咽型肌营养不良、先天性副肌强直、Pearson综合征、周期性麻痹、磷酸果糖激酶缺乏症、磷酸甘油酸激酶缺乏症、磷酸甘油酸变位酶缺乏症、磷酸酶缺乏症、多肌炎、庞培氏(Pompe)病、进行性眼外肌瘫痪、脊髓性肌肉萎缩、Ullrich先天性肌营养不良、Welander远端型肌病、ZASP相关肌病等。
肌肉萎缩(例如,肌肉消耗)可能由以下原因造成或与以下原因相关,例如,正常衰老(例如,肌少症)、遗传异常(例如,突变或单核苷酸多态性)、营养不良、循环不良、丧失荷尔蒙支持、由于缺少锻炼(例如,卧床、肢体石膏固定等)造成的肌肉停用、衰老、损伤激活肌肉的神经、脊髓灰质炎、肌萎缩侧索硬化(ALS或路格里克氏病)、心力衰竭、肝病、糖尿病、肥胖、代谢综合征、脱髓鞘疾病(例如,多发性硬化、Charcot-Marie-Tooth病、Pelizaeus-Merzbacher病、脑脊髓炎、视神经脊髓炎、肾上腺脑白质营养不良和格林-巴利综合征)、去神经、疲劳、锻炼诱导的肌肉疲劳、虚弱、神经肌肉疾病、无力、慢性痛等。
在一些方面,本文提供了在有需要的受试者中再生肌肉的方法,其通过给予所述受试者治疗有效量的化合物和药学可接受的载体在所述受试者中增加肌细胞群和/或增强肌肉功能,其中所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。所述受试者中的肌细胞群可以包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的任意组合。另外,所述受试者中的肌细胞可以为肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的任意组合。可以通过以下途径将所述化合物给予所述受试者:经口、腹膜内、肌内、动脉内、皮内、皮下、静脉内或心内给药。在一些情况下,将所述化合物直接给予所述功能异常的、损伤的、创伤的和/或萎缩的肌肉。可以根据急性方案(例如,单次或间歇给药)或长期方案(例如,连续给药)给予所述化合物。
在一些实施方案中,所述受试者还被给予所述受试者自体的或同种异体的分离(或分离并纯化)的肌细胞群。可以通过本领域技术人员已知的任何方法分离和/或纯化所述细胞。所述细胞可以为同源的或异源的肌细胞群。
在一些实施方案中,在将细胞给予所述受试者之前通过用所述PGE2化合物培养所述细胞来刺激所述细胞增殖。可以在体外培养期间将所述化合物急性地、间歇地或连续地暴露于所述细胞。在一些情况下,在用所述PGE2化合物培养后,所述肌细胞群增加了至少约1%、至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约200%、至少约500%、至少约1000%,或更多。
为了再生或修复所述受试者的肌肉,将本发明的化合物和所述分离的肌细胞同时给予所述受试者。在一些实施方案中,将所述化合物和所述培养的肌细胞同时给予所述受试者。在其他实施方案中,将所述化合物和所述分离的肌细胞依次给予所述受试者。在其他实施方案中,将所述化合物和所述培养的肌细胞依次给予所述受试者。
本文中描述的方法可以用于将肌肉纤维的数目增加至少约1%、至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约200%、至少约500%、至少约1000%或更多。在一些实施方案中,所述方法可以增加创伤的、损伤的、萎缩的或退化的肌肉的生长。
C.影响肌肉的病症或疾病的预防或治疗方法
本文中提供的方法可用于在有需要的受试者中预防或治疗与肌肉创伤、损伤或萎缩相关的病症或疾病。所述方法可以为可能会经历肌肉创伤、损伤或萎缩的受试者提供预防性治疗。在一些实施方案中,所述受试者可能患有具有可能影响肌肉的第二症状的病症或疾病。在其他实施方案中,所述受试者已接受手术或治疗干预来治疗所述肌肉病症或疾病,并且将本文公开的方法用于预防或抑制再现或复发。在一些实施方案中,所述受试者患有本文描述的任一种影响肌肉的病症或疾病。
如本文中所用的,术语“处理/治疗”包括在疾病症状发作之前和/或在所述病症或疾病的临床表现或其他显现之后给予合适形式的化合物和/或细胞,来减轻疾病严重性、停止疾病进展或消除疾病。术语“预防/防止”疾病包括延长或延迟所述病症或疾病的症状发作,优选在对所述病症或疾病具有增加的敏感性的受试者中。
所述方法包括给予所述受试者以下物质来预防或治疗所述与肌肉创伤、损伤或萎缩相关的病症或疾病:(i)治疗有效量的化合物和药学可接受的载体,其中所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合,以及(ii)分离的肌细胞群。所述肌细胞可以为所述受试者自体的或同种异体的。
所述化合物可以通过以下途径给药:经口、腹膜内、肌内、动脉内、皮内、皮下、静脉内或通过心内注射。可以根据急性方案(例如,单次或间歇给药)或慢性方案(例如,连续给药)给予所述化合物。可以通过注射或移植给予所述分离的肌细胞。在一些实施方案中,所述化合物和所述细胞被一起或同时给药。在其他实施方案中,所述化合物和所述细胞被依次给药。在一些情况下,所述化合物在所述细胞之前给药。在其他情况下,所述细胞在所述化合物之前给药。
在注射或移植至所述受试者之前,所述分离的肌细胞可以为基本上纯化的或纯化的。也可在施用之前,在培养中扩增或刺激所述细胞以增殖。如本文所描述的,可以用本发明的化合物培养分离的肌细胞,包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞、肌肉干细胞、卫星细胞、成肌细胞、肌细胞、肌管、肌纤维,和以上的任意组合。通过将所述化合物急性地、间歇地或连续地暴露于所述细胞,所述肌细胞增殖且数目增加。可以将扩增的细胞移植至经历肌肉创伤、损伤或萎缩的受试者。
D.前列腺素E2(PGE2)化合物
在一些实施方案中,本发明的化合物选自:PGE2、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。在一些情况下,减弱PGE2分解代谢的化合物可以为化合物、中和肽或中和抗体,其失活或阻断15-羟基前列腺素脱氢酶(15-PGDH)或者失活或阻断前列腺素转运蛋白(其转运细胞内的PGE2被15-PGDH分解代谢)。所述前列腺素转运蛋白也称为2310021C19Rik、MATR1、Matrin F/Q、OATP2A1、PGT、PHOAR2、SLC21A2、可溶性载体有机阴离子转运蛋白家族成员2A1和SLCO2A1。
所述PGE2受体激动剂可以为小分子化合物,其为特异性结合PGE2受体等的激活性抗体。在一些实施方案中,所述化合物为PGE2衍生物或类似物。在一些实施方案中,所述化合物为PGE2前药。例如,在给药或肌肉再生的部位,或在将所述前药暴露至肌细胞时,PGE2前药可以分解代谢为具药学活性的PGE2药物。
在特定的实施方案中,所述化合物为PGE2衍生物或类似物,其包含对PGE2的一个或多个修饰,所述修饰增加其稳定性、活性、耐降解能力、转运至肌细胞(例如,促进细胞摄取),和/或停留在肌细胞中(例如,摄取后减少从肌细胞的分泌)。
非限制性地,PGE2衍生物和类似物的实例包括2,2-二氟-16-苯氧基-PGE2化合物、2-去羧基-2-羟甲基-16-氟-PGE2化合物、2-去羧基-2-羟甲基-11-二氧-PGE2化合物、19(R)-羟基PGE2、16,16-二甲基PGE2、16,16-二甲基PGE2对(对乙酰氨基苯甲酰氨基)苯酯、11-脱氧-16,16-二甲基PGE2、9-脱氧-9-亚甲基-16,16-二甲基PGE2、9-脱氧-9-亚甲基PGE2、布他前列素(butaprost)、硫前列酮、恩前列素(enprostil)、PGE2丝氨醇酰胺、PGE2甲酯、16-苯基四去甲(tetranor)PGE2、5-反式PGE2、15(S)-15-甲基PGE2,和15(R)-15-甲基PGE2。其他PGE2衍生物和类似物例如,在第5,409,911号美国专利中列出。
PGE2衍生物和类似物的其他非限制性实例包括Zhao et al.(Bioorganic&Medicinal Chemistry Letters,17:6572-5(2007))中描述的更稳定的PGE2类似物——PGE2的乙内酰脲衍生物,其中羟基环戊酮环被杂环取代,且未饱和的α-烯基链被苯乙基链取代;Ungrin et al.(Mol.Pharmacol.,59:1446-56(2001))中描述的PGE2类似物;Tanamiet al.(Bioorg.Med.Chem.Lett.,8:1507-10(1998))中描述的PGE2的13-脱氢衍生物;以及第8,546,603号和第8,158,676号美国专利中描述的取代的环戊烷。
在一些实施方案中,所述化合物为PGE2受体,例如,EP1受体、EP2受体、EP3受体和EP4受体的激动剂。PGE2受体激动剂的非限制性实例包括ONO-D1-004、ONO-AE1-259、ONO-AE-248、ONO-AE1-329、ONO-4819CD(Ono Pliarmaceiitical Co.,Japan)、L-902688(CaymanChemical)、CAY10598(Cayman Chemical),和CP-533536(Pfizer)。其他的PGE2受体激动剂例如,在第6,410,591号;第6,610,719号;第6,747,037号;第7,696,235号;第7,662,839号;第7,652,063号;第7622,475号;和第7,608,637号美国专利中有描述。
E.分离的肌细胞
本发明的肌细胞(肌源性细胞)包括但不限于肌肉干细胞、骨骼肌干细胞、平滑肌干细胞、心肌干细胞、肌肉卫星细胞、肌源性的祖细胞、肌源性的细胞、肌细胞、成肌细胞、肌管、有丝分裂后的肌管、多核的肌纤维和有丝分裂后的肌肉纤维。在一些实施方案中,所述分离的肌细胞包括肌肉干细胞。在其他实施方案中,所述分离的肌细胞包括肌肉卫星细胞。所述肌细胞可以来源于干细胞,如骨髓来源的干细胞,或者多能干细胞,如胚胎干细胞或诱导的多能干细胞。在一些实施方案中,所述分离的肌细胞包括去分化的肌细胞。在其他实施方案中,所述肌细胞经遗传改造,以在一些情况下纠正疾病相关的基因突变。
卫星细胞是可以定植于肌肉组织内的小单核祖细胞。这些细胞可被诱导增殖和分化为肌细胞,且在一些情况下融合至肌纤维。在肌肉创伤或损伤期间,静止期卫星细胞(例如,当时未分化或经历细胞分裂的卫星细胞)和肌肉干细胞可以被激活而增殖,和/或迁出肌肉干细胞微环境(niche)。所述卫星细胞和肌肉干细胞也可分化为肌细胞、成肌细胞或其他肌细胞类型。
从胚胎干细胞生成肌细胞的方法和方案例如,在Hwang et al.,PLoS One,2013,8(8):e72023;和Darabi et al.,Cell Stem Cell,2012,10(5):610-9中有描述。从诱导的多能干细胞生成肌细胞的方法和方案例如,在Darabi et al..Cell Stem Cell,2012,10(5):610-9;Tan et al.,PLoS One,2011;和Mizuno et al.,FASEB J.,2010,24(7):2245-2253中有描述。
在一些实施方案中,通过活检肌肉获得肌细胞,所述肌肉如来自个体的成熟或成体肌肉,例如,四头肌、臀大肌、二头肌、三头肌或任何肌肉。所述肌肉可以为骨骼肌、平滑肌或心肌。分离平滑肌干细胞的方法的详细描述可以例如,在第8,747,838号美国专利和第20070224167号美国专利申请公开中找到。从肌肉组织分离目标肌细胞如肌肉干细胞或卫星细胞的方法例如,在Blanco-Bose et al.,Exp.Cell Res.,2001,26592:212-220中有详细描述。
纯化目标肌细胞群如肌肉干细胞、肌肉卫星细胞、肌细胞、成肌细胞、肌管和/或肌纤维的方法,包括选择、分离或富集具有表达于目标肌细胞的细胞表面的特异性细胞表面标志物或特异性多肽的细胞。可用的细胞表面标志物描述于例如,Fukada et al.,Front.Physiol,2013,4:317。可以实施细胞分选方法将目标肌细胞与其他细胞类型隔离或分离,如流式细胞术,例如,荧光活化的细胞分选(FACS);磁珠细胞分离,例如,磁活化的细胞分选(MACS),和其他基于抗体的细胞分选方法。
所述分离的目标肌细胞群可以使用基于培养的常规方法扩增或繁殖。培养肌细胞的方法可以在例如,第5,324,656号美国专利中找到。在一些情况下,在支架或诸如水凝胶的凝胶上培养所述细胞。
F.施用方法
可以在受试者的损伤部位或其附近局部施用本发明的化合物,或全身施用本发明的化合物。在一些实施方案中,可以通过以下方式施用所述化合物,例如,腹膜内、肌内、动脉内、经口、静脉内、颅内、鞘内、脊柱内、病变内、鼻内、皮下、脑室内、局部和/或通过吸入。可以与目标肌细胞同时或依序施用所述化合物。当所述化合物与所述细胞同时施用时,所述化合物和细胞可以在同一组合物中施用。当分开施用时,所述化合物可以在药学可接受的载体中提供。在一些实施方案中,在给予所述细胞之前或之后施用所述化合物。
在一些实施方案中,所述化合物根据急性方案给药。在某些情况下,所述化合物被一次性给予所述受试者。在其他情况下,所述化合物在一个时间点施用,且在第二个时间点再次施用。在其他情况下,所述化合物以间歇剂量在较短时间段内(例如,2天、3天、4天、5天、6天、1周、2周、3周、4周、1个月或更久)重复给予所述受试者(例如,每天一次或两次)。在一些情况下,化合物施用之间的时间为约1天、2天、3天、4天、5天、6天、1周、2周、3周、4周、1个月或更久。在其他实施方案中,根据慢性方案,在所需的时间段内连续或长期地给予所述化合物。例如,可以给予所述化合物,使得所述化合物的量或水平在所选的时间段内基本稳定。
可以通过本领域通常使用的方法来实现所述分离的肌细胞至受试者的施用。在一些实施方案中,通过移植或注射如肌内注射进行施用。引入的细胞数目需要考虑诸多因素,如性别、年龄、体重、疾病或病症的类型、病症的阶段、所述细胞群中所需细胞的百分比(例如,细胞群的纯度),以及产生预期结果所需要的细胞数目。通常,出于治疗目的施用细胞时,所述细胞以药学有效剂量给予。“药学有效量”或“药学有效剂量”是指足以产生所需的生理效应的量,或能够实现预期结果的量,特别是对于治疗所述病症或疾病,包括减少或消除所述病症或疾病的一种或多种症状或临床表现。药学有效剂量也适用于本文描述的与所述细胞组合使用的治疗化合物。
细胞可以一次注射施用或通过在足以产生治疗效应的指定时间段内连续注射施用。当治疗涉及连续注射时,可以注射不同的肌细胞群。药学可接受的载体,如下文中进一步描述的,可用于将所述细胞注射至所述受试者。这些通常包括,例如,缓冲盐水(例如,磷酸盐缓冲盐水)、或未添加的基础细胞培养基、或本领域已知的培养基。
可以用本发明的化合物和/或细胞直接注射任何数量的身体肌肉,如,例如,二头肌;三头肌;肱桡肌;肱肌(臂前肌);浅层隔室(compartment)屈腕肌;三角肌;腘绳肌的股二头肌、股薄肌、半腱肌和半膜肌;四头肌的股直肌、股外侧肌、股内侧肌和股中间肌;小腿的腓肠肌(外侧和中间)、胫骨前肌和比目鱼肌;胸部的胸大肌和胸小肌;上背部的背阔肌;菱形肌(大肌和小肌);横跨颈部、肩部和背部的斜方肌;腹部的腹直肌;以及臀部的臀大肌、臀中肌和臀小肌。
G.药物组合物
本发明的化合物和细胞的药物组合物可以包含药学可接受的载体。在某些方面,药学可接受的载体部分由所施用的具体组合物以及由施用所述组合物的具体方法确定。相应地,存在多种适合的本发明的药物组合物制剂(参见,例如,雷明登氏药学全书,第18版,Mack Publishing Co.,Eastern,PA(1990))。
如本文中所用的,“药学可接受的载体”包括本领域普通技术人员在配制药物组合物中已知的任何标准的药学可接受的载体。因此,细胞或化合物本身作为药学可接受的盐或作为缀合物存在,可以制备成药学上可接受的稀释剂中的制剂;例如,盐水、磷酸盐缓冲盐水(PBS)、乙醇水溶液,或葡萄糖、甘露醇、葡聚糖、丙二醇、油(例如,植物油、动物油、合成油等)、微晶纤维素、羧甲基纤维素、羟丙基甲基纤维素、硬脂酸镁、磷酸钙、明胶、聚山梨酯80等的溶液,或作为适当赋形剂中的固体制剂。
所述药物组合物通常还包含一种或多种缓冲剂(例如,中性缓冲盐水或磷酸盐缓冲盐水)、碳水化合物(例如,葡萄糖、甘露糖、蔗糖或葡聚糖)、甘露醇、蛋白质、多肽或氨基酸如甘氨酸、抗氧化剂(例如,抗坏血酸、偏亚硫酸氢钠、丁基化羟基甲苯、丁基化羟基苯甲醚等)、抑菌剂、螯合剂如EDTA或谷胱甘肽、使得制剂与受体血液等渗、低渗或弱高渗的溶质、混悬剂、增稠剂、防腐剂、调味剂、甜味剂和着色化合物,视情况而定。
本发明的药物组合物以与剂量剂型相容的方式施用,并且这样的量将是治疗有效的。施用的量取决于多种因素,包括例如,年龄、体重、身体活动和个体饮食、待治疗的病症或疾病,以及所述病症或疾病的阶段或严重性。在某些实施方案中,剂量的大小还可通过伴随在特定个体中施用治疗剂的任何不良副作用的存在、性质和程度来确定。
然而,应当理解,任何特定患者的具体剂量水平和给药频率可能存在差异,并且取决于多种因素,包括所采用具体化合物的活性、代谢稳定性和该化合物的作用时间长度、年龄、体重、遗传特征、总体健康状况、性别、饮食、给药方式和时间、排泄率、药物组合、具体病症的严重程度以及宿主正在接受的治疗。
在某些实施方案中,所述化合物的剂量可以采用固体、半固体、冻干粉形式或液体剂量的形式,如,例如,片剂、丸剂、小球、胶囊、粉剂、溶液、混悬剂、乳剂、栓剂、保留灌肠剂、霜剂、软膏剂、洗剂、凝胶剂、气雾剂、泡沫剂等,优选以适于简单施用精确剂量的单位剂型。
如本文中所用的,术语“单位剂型”是指适合作为人和其他哺乳动物的单一剂量的物理上离散的单位,每个单位含有预定量的治疗剂,经计算能够产生所需的起效、耐受性和/或治疗效果,并与合适的药物赋形剂(例如,安瓿)联合使用。另外,可以制备更为浓缩的剂型,然后可以由其制备更多的稀释单位剂型。因此,更为浓缩的剂型包含基本上超过,例如至少1、2、3、4、5、6、7、8、9、10倍或更多倍的治疗化合物的量。
制备这种剂型的方法是本领域技术人员已知的(参见,例如,雷明登氏药学全书,同上)。所述剂型通常包含常规药物载体或赋形剂,且可以另外包含其他药剂、载体、佐剂、稀释剂、组织渗透增强剂、增溶剂等。适当的赋形剂可以通过本领域熟知的方法(参见,例如雷明登氏药学全书,同上)适应具体的剂型和给药途径。
合适的赋形剂的实例包括但不限于,乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯树胶、磷酸钙、藻酸盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、盐水、糖浆、甲基纤维素、乙基纤维素、羟丙基甲基纤维素和聚丙烯酸如卡波姆(Carbopols),例如,卡波姆941、卡波姆980、卡波姆981等。剂型可另外包含润滑剂如滑石、硬脂酸镁和矿物油;湿润剂;乳化剂;混悬剂;防腐剂如甲基-羟基-苯甲酸盐、乙基-羟基-苯甲酸盐和丙基-羟基-苯甲酸盐(即,对羟基苯甲酸盐);pH调节剂如无机酸和有机酸及碱;增甜剂;和调味剂。所述剂量形型还可包含可生物降解的聚合物小珠、葡聚糖和环糊精包合复合物。
对于经口给药,所述治疗有效剂量可以为以下形式:片剂、胶囊、乳剂、混悬剂、溶液、糖浆、喷雾剂、锭剂、粉剂和缓释剂。用于经口给药的合适的赋形剂包括药物级别的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、明胶、蔗糖、碳酸镁等。
所述治疗有效剂量还可以冻干形式提供。这样的剂型可包含缓冲剂,例如,碳酸氢盐,用于在给药前复溶,或者缓冲剂可以包含在冻干剂型中,用于与例如水复溶。所述冻干剂型还可包含合适的血管收缩剂,例如肾上腺素。所述冻干剂型可以在注射器内提供,任选地与用于复溶的缓冲剂组合包装,使得所复溶的剂型可以立即施用于个体。
H.试剂盒
本文中描述的组合物的其他实施方案为试剂盒,其包含分离的肌细胞群和选自以下的化合物:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物(例如,15-羟基前列腺素脱氢酶(15-PGDH)抑制剂或前列腺素转运蛋白(PTG或SLCO2A1)抑制剂)、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。所述试剂盒通常包含容器,其可以由诸如玻璃或塑料的多种材料制成,并且可以包括例如瓶子、小瓶、注射器和试管。所述试剂盒通常带有标签,并且标签包括任何书写或记录的材料,其可以为电子的或计算机可读的形式,提供使用试剂盒内件的说明或其他信息。
V.实施例
以下所提供的实施例仅用于说明而非限制所要求保护的发明内容。
实施例1:急性前列腺素E2递送增加老龄小鼠的骨骼肌再生和力量
本实施例说明了PGE2信号传导在再生期间是肌肉干细胞功能所必需的。
老龄者罹患进行性骨骼肌萎缩和再生失败,这降低了活动性和生活质量1,2。对肌肉再生至关重要的是成年肌肉干细胞(MuSC),其在整个生命期间定植于肌肉组织中,以准备响应损伤并修复骨骼肌3-8。在衰老过程中,具有功能的MuSC比例显著降低,阻碍了肌肉再生9-13。到目前为止,还没有以MuSC为靶标的治疗剂用于临床来对抗该再生下降。本发明中,我们鉴定了一种天然的免疫调节剂——前列腺素E2(PGE2),作为肌肉再生必需的MuSC功能的有效调节剂。我们发现PGE2受体——EP4,是体外MuSC增殖和小鼠体内移植所必需的。在老龄小鼠的MuSC中,PGE2通路被异常调节,这是由于细胞固有的分子缺陷——增加的前列腺素降解酶(15-PGDH)使PGE2失活。通过将MuSC短暂急性暴露于稳定的耐降解性PGE2——16,16-二甲基PGE2(dmPGE2)中,同时将MuSC移植至损伤的肌肉中,可克服该缺陷。明显地,单次肌内注射单独的dmPGE2足以加速再生,这通过损伤后内源MuSC数目和肌纤维尺寸的较早增加可以得到证实。此外,老龄小鼠的肌肉力量产生能力增加,其响应于锻炼诱导的再生和急性dmPGE2治疗方案。我们的发现给出了一种新的治疗指示,即PGE2可作为肌肉再生和力量的有效诱导剂。
为了对抗肌肉再生潜能的下降,我们寻找了以MuSC为靶标的治疗剂,也即卫星细胞,一类致力于肌肉再生的干细胞群3-8。因为短暂炎症性和纤维生脂反应在肌肉再生中起着至关重要的作用14-17,我们试图鉴定由损伤诱导的炎症调节物,其能够克服衰老相关的MuSC功能下降。我们的转录组数据库分析揭示PGE2的Ptger4受体(严重炎症期间的一种天然和有效的脂质调节剂18)在新鲜分离的MuSC上以高水平表达。在肌肉组织溶解产物中,通过虎蛇毒素注射或冷冻损伤的标准损伤范例,我们在幼龄(2-4个月)小鼠肌肉损伤后3天检测到PGE2水平急剧增加(图1A和图5A),以及其合成酶——Ptges和Piges2的随之上调(图IB)。该早期瞬时时间窗口符合有充分文件记录的损伤后MuSC扩增动力学和炎性细胞因子积累8,15,16。为了确定PGE2处理是否增强MuSC行为,我们通过FACS从幼龄小鼠(2-4个月)6的后肢肌肉纯化了MuSC,并将其接种至水凝胶上,采用12kpa的刚度以维持干细胞功能19。我们发现PGE2(10ng/ml)使由EDU掺入测定的细胞分裂(图1B-1D)增加,且1周后,急性暴露于PGE21天诱导了MuSC数目相对于对照增加了6倍(图1C)。
已知PGE2通过4种G-蛋白偶联受体(Ptger1-4;EP1-4)18,20进行传导信号,但MuSC中这些受体的表达先前未被描述。对不同受体(Ptger1-4)的转录水平分析揭示了PGE2处理MuSC后上调的仅有受体Ptger1和Ptger4(图5E)。PGE2刺激的MuSC具有升高的胞内cAMP18,20,证实了PGE2通过EP4传导信号来促进增殖和干细胞转录状态(图5F-5H)。在EP4拮抗剂——ONO-AE3-208的存在下,PGE2的增殖诱导被钝化(图1D)。然而,PGE2对EP4的特异性最明显地显示于cre-介导的条件性消融后缺少受体的MuSC中(图1E-1G和图5I-5J)。确实,即使在富含生长因子的培养基存在下,这些无EP4的MuSC也不能增殖。最后,我们发现通过暴露于含有活性炭吸附处理的血清的培养基中MuSC生长被阻止21,而加入PGE2后发生分裂(图1H和图5K)。因此,PGE2/EP4是MuSC增殖所必需的且足以使MuSC增殖。
我们试图确定PGE2是否能够改善先前针对衰老MuSC报导的肌肉再生缺陷9-13。与幼龄小鼠肌肉(2-4个月)相反,衰老肌肉(18-20个月)的虎蛇毒素损伤未引起PGE2合成的增加。相反,损伤后衰老肌肉中的稳态PGE2水平保持不变(图2A),且显著高于年轻肢胫骨前肌(TA)肌肉(图2B)。我们假设由于分解代谢缺陷,衰老肌肉的PGE2可能是功能异常的。确实,在我们通过质谱法分析年轻和衰老TA肌肉组织中存在的PGE2时,发现衰老肌肉组织中失活形式的13,14-二氢-15-酮PGE2(PGEM)的相对量显著增加(图2C-2D和图6A-6C)。这已证实是由于在将PGE2转化为其失活形式的初始步骤中,编码PGE2降解酶(15-PGDH)的mRNA水平具有相应的7倍增加(图2E)。相反地,前列腺素转运蛋白(PGT)、PGE2合成酶和EP4受体的相对水平在年轻和衰老的MuSC之间无差异(图7A-7C)。另外,当将衰老MuSC暴露于1天脉冲(pulse)的PGE2或15-PGDH的抑制剂(SW033291)22时,15-PGDH的作用被克服,且观察到增殖和Pax7表达维持的特性增加(图2F和图7D)。与年轻MuSC相似,衰老MuSC在含有活性炭吸附处理的血清的培养基中不能增殖,但单独添加PGE2即可恢复(图2G)。我们推测在衰老MuSC中,PGE2通路调节异常,这是由于细胞固有的分子缺陷——升高的15-PGDH,其在培养中可通过急性暴露于PGE2或SW来克服(图2H)。
因为衰老MuSC为异源的10,我们试图确定PGE2在单细胞水平上的影响。克隆分析可以揭示作为整体的群体分析所掩盖的差异。相应地,我们在短暂(1天)暴露于PGE2的单一衰老MuSC和未处理对照MuSC的水凝胶“微孔”中进行了长期延时显微镜检查。收集了48小时时间段内的数据,然后使用我们先前描述的用于细胞追踪和谱系重建的Baxter算法10,19,23进行分析。我们观察到响应于PGE2的积累细胞数目显著增加,对于最强的克隆体,跨越了6个代次(图2I-2J)。PGE2处理后每个克隆的细胞数目显著增加,这是由于增殖的显著增加(图2I-2J和图7E-7F),其伴随着细胞死亡的大幅减少(图2J和图7E-7G)。这些协同效应造成了观察到的响应于PGE2的衰老MuSC数目增加。
为了测试以PGE2短暂处理年轻MuSC是否增加再生,我们将所培养的PGE2处理的MuSC移植至小鼠损伤的后肢肌肉中。为了以定量方式监测体内再生随时间的动态,我们了利用了我们以前开发的用于监测移植后MuSC功能6,10,19的灵敏且定量的生物发光成像(BLI)分析。从表达了GFP和荧光素酶的幼龄转基因小鼠(2-4个月)(GFP/Luc小鼠)中分离出MuSC,暴露于急性PGE2处理1天,第7天收获并移植。将相等数目的dmPGE2处理和对照MuSC(250个细胞)移植至幼龄(2-4个月)NOD-SCID小鼠的损伤后肢。在用PGE2急性处理后,通过BLI测定年轻MuSC再生能力增加了一个数量级(图3A)。相反地,在移植了4倍多数量的培养的因条件性清除而缺少EP4受体的MuSC后(图3B),最初检测到的BLI信号逐渐下降至低于显著性阈值的水平(图3B)。
此外,当在肌肉干细胞特异性缺失EP4(Pax7CreERT2;ΕΡ4fl/fl)的小鼠模型中进行虎蛇毒素损伤时(图9A-9B),肌肉再生受损,这可通过胚胎肌球蛋白重链(eMHC)阳性纤维增加的数目观察到(图9C-9D)。这伴随着在再生时间点最后(第21天)评估的Pax7CreERT2;EP4fl /fl组中小鼠纤维横切面面积的减小(图9E)。在损伤后第14天还检测到力量输出(强直)的显著减少(图9F-9G)。因此,PGE2通过EP4受体的信号传导是MuSC体内再生所必需的。
为了测试直接注射PGE2而未经培养是否能够有效促进体内再生,我们共同注射了PGE2和新鲜分离的MuSC。对于所有随后的体内注射实验,我们使用经修饰的更稳定形式的PGE2——16,16-二甲基PGE2(dmPGE2)24。我们假设对于衰老MuSC实验,经修饰的15-PGDH对抗性dmPGE2的递送特别重要,因为在衰老MuSC中15-PGDH显著升高(图2E)24。使用dmPGE2,我们观察到相对于对照,年轻和衰老的MuSC移植显著增加,其响应于虎蛇毒素损伤(一种被广泛接受的干细胞功能的严格测试)而进一步增加(图3C-3D)。因此,dmPGE2与MuSC细胞群的一起递送足以促进再生。
我们假定单独PGE2的递送能够刺激肌肉再生。为了检测这一假设,以心脏毒素对幼龄小鼠的肌肉制造损伤,并在3天后将大剂量的dmPGE2注射至幼龄小鼠的后肢肌肉。损伤后14天,我们在基膜下和肌纤维顶部的经典卫星细胞微环境处观察到内源表达PAX7的MuSC有所增加(60±15%)(图4A-4B),然而dmPGE2在无损伤时没有影响。此外,在较早的时间点,肌纤维的分布趋向于较大的尺寸,其以用于肌纤维分析的Baxter算法得到的横切面面积来评估,表明PGE2可使再生加速(图4C-4D和图8A-8B)。另外,我们通过荧光素酶表达,采用转基因小鼠模型——Pax7CreERT2;Rosa26-LSL-Luc,追踪了对内源MuSC的损伤和dmPGE2的响应(图4E)。BLI数据与组织学数据一致(图4F-4G)。
我们检测了注射吲哚美辛(一种非甾体抗炎剂(NSAID)和减少PGE2合成的COX2抑制剂)对肌肉再生的影响。在心脏毒素损伤后3天,在将吲哚美辛注射至相同Pax7CreERT2;Rosa26-LSL-Luc小鼠模型的后肢肌肉后,我们观察到荧光素酶活性的显著降低,表明肌肉干细胞活化和再生的损伤(图10A-10B)。相比在损伤后第14天评估的对照组,注射吲哚美辛至心脏毒素损伤的肌肉还引起颤搐力的显著损失(图10C)。在老龄小鼠中,在单次dmPGE2注射后,在损伤后14天我们还检测到内源MuSC数目的大幅增加(24±2%)(图4H-4I)和肌纤维尺寸的随之增加(图4J-4K)。因此,仅暴露于dmPGE2影响内源修复的程度和时间过程。
作为最后的测试,我们测定了通过下坡式跑步机运动诱导的天然损伤后,dmPGE2增强的再生是否能够引起肌肉力量的增加。在该情形下,通过在20度下降的下坡式跑步机上每天10分钟的跑步来造成损伤25。在第一周期间,治疗组中的老龄小鼠连续跑了5天,且每天在锻炼后注射dmPGE2。在第二周期间,治疗组中的老龄小鼠连续跑了5天,但未接受另外的治疗(图4L)。比较了dmPGE2治疗和未治疗腓肠肌小鼠肌肉(GA)的比颤搐力和强直收缩力,发现二者均显著增加(图4M-4P)。因此,在锻炼诱导的损伤同时急性暴露于dmPGE2可以使衰老肌肉力量显著增加。
我们发现了骨骼肌再生中PGE2的新的指示作用。PGE2对骨骼肌影响的先前研究已表明其可改变组织培养中的增殖、融合、蛋白质降解和成肌细胞的分化26-30。因此,这些研究不同于我们的研究,因为成肌细胞是已丧失了干细胞功能的祖细胞。卫星细胞(MuSC)对发展和再生至关重要3-8,31,且通过跑步或其他高强度锻炼,其在幼龄和老龄小鼠以及人体中的数目增加15,32-36。已报导非甾体抗炎剂能够减弱锻炼诱导的MuSC增加15,32-36。我们的数据提供了新的证据,表明有效肌肉再生的炎症早期瞬态波的有利效应15部分是由于PGE2及其受体EP4,其对MuSC增殖和移植而言是必需且足够的。对于造血、肝和结肠组织,递送15-PGDH抑制剂——SW033291(最近被发现能够增强再生)22。明显地,PGE2及其类似物数十年来已被安全地应用于人类患者,例如用于诱导分娩37,和促进造血干细胞抑制38,这为其临床应用于损伤后肌肉修复进行了准备。总之,我们的发现显示急性PGE2方案足以快速和强效地增强锻炼诱导的损伤的再生,并克服衰老相关的限制,使得力量增加。
参考文献
1 Di Monaco,M.,Vailero,F.,Di Monaco,R.&Tappero,R.Prevalence ofsarcopenia and its association with osteoporosis in 313older women followinga hip fracture.Archives of Gerontology and Geriatrics 52,71-74(2010).
2 Ruiz,J.R.et al.Association between muscular strength and mortalityin men:prospective cohort study.Bmj 337,a439,doi:10.1136/bmj.a439 (2008).
3 Chakkalakal,J.V.,Jones,K.M.,Basson,M.A.&Brack,A.S.The aged nichedisrupts muscle stem cell quiescence.Nature 490,355-360,doi:10.1038/nature11438(2012).
4 Mauro,A.Satellite cell of skeletal muscle fibers.J Biophys BiocnemCytol 9,493-495(1961).
5 Montarras,D.et al.Direct isolation of satellite cells for skeletalmuscle regeneration.Science 309,2064-2067,doi:10.1126/science.1114758(2005).
6 Sacco,A.,Doyonnas,R.,Kraft,P.,Vitorovic,S.&Blau,H.M.Self-renewaland expansion of single transplanted muscle stem cells.Nature 456,502-506,doi:10.1038/nature07384(2008).
7 Kuang,S.,Gillespie,M.A.&Rudnicki,M.A.Niche regulation of musclesatellite cell self-renewal and differentiation.Cell stem cell 2,22-31,doi:10.1016/j.stem.2007.12.012(2008).
8 Shi,X.&Garry,D.J.Muscle stem cells in development,regeneration,anddisease.Genes&development 20,1692-1708,doi:10.1101/gad.1419406(2006).
9 Bernet,J.D.et al.p38 MAPK signaling underlies a cell-autonomousloss of stem cell self-renewal in skeletal muscle of aged mice.Naturemedicine 20,265-271,doi:10.1038/nm.3465(2014).
10 Cosgrove,B.D.et al.Rejuvenation of the muscle stem cell populationrestores strength to injured aged muscles.Nature medicine 20,255-264,doi:10.1038/nm.3464(2014).
11 Price,F.D.et al.Inhibiton of JAK-STAT signaling stimulates adultsatellite cell function.Nature medicine 20,1174-1181,doi:10.1038/nm.3655(2014).
12 Sousa-Victor,P.et al.Geriatric muscle stem cells switch reversiblequiescence into senescence.Nature 506,316-321,doi:10.1038/nature13013(2014).
13 Tierney,M.T.et al.STAT3 signaling controls satellite cellexpansion and skeletal repair.Nature medicine 20,1182-1186,doi:10.1038/nm.3656(2014).
14 Arnold,L.et al.Inflammatory monocytes recruited after skeletalmuscle injury switch into antiinflammatory macrophages to supportmyogenesis.The Journal of experimental medicine 204,1057-1069,doi:10.1084/jem.20070075(2007).
15 Chazaud,B.Inflammation during skeletal muscle regeneration andtissue remodeling:application to exercise-induced muscle damagemanagement.Immunol Cell Biol 94,140-145,doi:10.1038/icb.2015.97(2016).
16 Joe,A.W.et al.Muscle injury activates resident fibro/adipogenicprogenitors that facilitate myogenesis.Nature cell biology 12,153-163,doi:10.1038/ncb2015(2010).
17 Tidball,J.G.Mechanisms of muscle injury,repair,andregeneration.Compr Physiol 1,2029-2062,doi:10.1002/cphy.c100092(2011).
18 Ricciotti,E.&FitzGeraid,G.A.Prostaglandins andInflammation.Arteriosclerosis,Thrombosis,and Vascular Biology 31,986-1000(2011).
19 Gilbert,P,M.et al.Substrate elasticity regulates skeletal musclestem cell self-renewal in culture.Science 329,1078-1081,doi:10.1126/science.1191035(2010).
20 Korotkova,M.&Lundberg,I.E.The skeletal muscle arachidonic acidcascade in health and inflammatory disease.Nature reviews.Rheumatology 10,295-303,doi:10.1038/nrrheum.2014.2(2014).
21 Smethurst,M.&Williams,D.C.Levels of prostaglandin E andprostaglandin F in samples of commercial serum used for tissueculture.Prostaglandins 13,719-722(1977).
22 Zhang,Y.et al.Inhibition of the prostaglandin-degrading enzyme 15-PGDH potentiates tissue regeneration.Science 348,aaa2340(2015).
23 Magnusson,K,E.,Jalden,J.,Gilbert,P.M.&Blau,H.M.Global linking ofcell tracks using the Viterbi algorithm.IEEE transactions on medical imaging34,911-929,doi:10.1109/TMI.2014.2370951(2015).
24 Ohno,H.,Morikawa,Y.&Hirata,F.Studies on 15-hydroxyprostaglandindehydrogenase with various prostaglandin analogues.Journal of biochemistry84,1485-1494(1978).
25 Sacco,A.et al.Short telomeres and stem cell exhaustion modelDuchenne muscular dystrophy in mdx/mTR mice.Cell 143,1059-1071,doi:10.1016/j.cell.2010.11.039(2010).
26 Baracos,V.,Rodemann,H.P.,Dinarello,C.A.&Goldberg,A.L.Stimulationof muscle protein degradation and prostaglandin E2 release by leukocyticpyrogen(interleukin-1).Amechanism for the increased degradation of muscleproteins during fever.The New England journal of medicine 308,553-558,doi:10.1056/NEJM198303103081002 (1983).
27 Beaulieu,D.et al.Abnormal prostaglandin E2 production blocksmyogenic differentiation in myotonic dystrophy.Neurobiology of disease 45,122-129,doi:10.1016/j.nbd.2011.06.014(2012).
28 Mo,C,Romero-Suarez,S.,Bonewald,L.,Johnson,M.&Brotto,M.Prostaglandin E2:from clinical applications to its potential role in bone-muscle crosstalk and myogenic differentiation.Recent patents on biotechnology6,223-229(2012).
29 Mo,C.et al.Prostaglandin E2 promotes proliferation of skeletalmuscle myoblasts via EP4 receptor activation.Cell cycle 14,1507-1516,doi:10.1080/15384101.2015.1026520(2015).
30 Rodemann,H.P.&Goldberg,A.L.Arachidonic acid,prostaglandin E2 andF2 alpha influence rates of protein turnover in skeletal and cardiac muscle.JBiol Chem 257,1632-1638(1982).
31 Pawlikowski,B.,Pulliam,C,Betta,N.D.,Kardon,G.&Oiwin,B.B.Pervasivesatellite cell contribution to uninjured adult muscle fibers.Skeletal muscle5,42,doi:10.1186/s13395-015-0067-1(2015).
32 Crameri,R.M.et al.Changes in satellite cells in human skeletalmuscle after a single bout of high intensity exercise.The Journal ofphysiology 558,333-340,doi:10.1113/jphysiol.2004.061846(2004).
33 Darr,K,C.&Schultz,E.Exercise-induced satellite cell activation ingrowing and mature skeletal muscle.Journal of applied physiology 63,1816-1821(1987).
34 Dreyer,H,C,Blanco,C.E.,Sattler,F.R.,Schroeder,E.T.&Wiswell,R.A.Satellite cell numbers in young and older men 24hours after eccentricexercise.Muscle&nerve 33,242-253,doi:10.1002/mus.20461(2006).
35 Mackey,A.L.et al.The influence of and-inflammatory medication onexercise-induced myogenic precursor cell responses in humans.Journal ofapplied physiology 103,425-431,doi:10.1152/japplphysiol.00157.2007(2007).
36 Paulsen,G.,Mikkelsen,U.R.,Raastad,T.&Peake,J.M.Leucocytes,cytokines and satellite cells:what role do they play in muscle damage andregeneration following eccentric exercise?Exercise immunology review 18,42-97(2012).
37 Thomas,J.,Fairclough,A.,Kavanagh,J.&Kelly,A.J.Vaginalprostaglandin(PGE2and PGF2α)for induction of labour at term.The Cochranedatabase of systematic reviews 6,CD003101,doi:10.1002/14651858.CD003101.pub3(2014).
38 North,T.E,et al.Prostaglandin E2regulates vertebratehaematopoietic stem cell homeostasis.Nature 447,1007-1011(2007).
方法
小鼠
我们进行的所有实验和方案均遵守斯坦福大学和实验动物护理管理小组(APLAC)的制度指导。我们从美国国家老龄化研究所(NIA)获得了野生型老龄C57BL/6(18-20个月)小鼠以用于衰老肌肉研究,而幼龄野生型C57BL/6小鼠获自Jackson实验室。按先前所述产生双转基因GFP/luc小鼠1。简言之,FVB品系保持了表达受普遍存在的受Actb启动子调控的萤火虫荧光素酶(luc)转基因小鼠。C57BL/6品系保持了表达受普遍存在的受UBC启动子调控的绿色荧光蛋白(GFP)的转基因小鼠。我们将来自GFP/luc的细胞用于NOD-SCID(JacksonLaboratory)受体小鼠的同种异体移植实验。EP4flox/flox小鼠由K.Andreasson(StanfordUniversity)2友情赠与。双转基因Pax7CreERT2;Rosa26-LSL-Luc通过将获自Jackson实验室的Pax7CreERT2小鼠(保存编号017763)3和获自Jackson实验室的Rosa26-LSL-Luc(保存编号005125)4杂交而产生。我们通过合适的基于PCR的策略验证了这些基因型。来自转基因品系的所有小鼠均为幼龄。对于所有品系,幼龄小鼠为2-4个月的年龄,且老龄小鼠为18-20个月的年龄。这些研究中使用的所有小鼠均为雌性。
肌肉干细胞分离
我们按先前所述1,5,6分离和富集肌肉干细胞。简言之,温和的胶原酶消化和通过MAC离解器切割使得众多的单纤维被离解,接着进行分散酶消化来从其微环境释放出单核细胞。随后,使用磁珠柱(Miltenyi)来减少细胞混合物中表达造血谱系和非肌细胞(CD45-/CD11b-/CD31-)。剩下的细胞混合物接着进行FACS分析来分选出共表达CD34和α7-整合素标志物的MuSC。我们使用FlowJo v10.0生成和分析流式细胞散点图。对于每次分选,我们将来自至少3只独立的供体雌性小鼠的MuSC(每只~5,000个)合并在一起。
肌肉干细胞移植
按先前所述1,5,6,我们在FACS分离之后或在从细胞培养物收集之后立即将250个MuSC(图3a、3c和3d)或1,000个MuSC(图3b)直接移植至受体小鼠的胫骨前肌(TA)肌肉。对于年轻MuSC研究,我们将来自GFP/luc小鼠(2-4个月的年龄)的细胞移植至后肢受辐照的NOD-SCID小鼠。对于衰老MuSC研究,按先前所述5,我们移植了来自老龄C57BL/6小鼠(18-20个月,NIH)的细胞,在移植前,该细胞在培养的第2天用luc-IRES-GFP慢病毒(GFP/luc病毒)转导24小时(详细信息参见下文“肌肉干细胞培养、处理和慢病毒感染”部分)。在移植肌肉干细胞之前,我们通过腹膜内注射氯胺酮(2.4mg/只小鼠)麻醉NOD-SCID受体小鼠。然后我们以单次剂量的18Gy辐照后肢,身体的其余部位用铅夹具屏蔽。我们在辐照2天内进行移植。
按照所述(媒介物或PGE2处理的10ng/ml)的方法处理培养细胞,并从在37℃下以溶于PBS中的0.5%胰蛋白酶孵育2分钟的水凝胶培养物中收集细胞,并采用血球计计数。我们将细胞以所需的细胞浓度重悬于0.1%的明胶/PBS中,然后以10μl的量肌内注射至TA肌肉来进行移植(250个MuSC/TA)。对于新鲜MuSC移植,我们将分选的细胞与13nmol的16,16-二甲基前列腺素E2(dmPGE2)(Tocris,目录号4027)或媒介物对照(PBS)共同注射。我们通过移植至相同小鼠对侧腿的TA肌肉比较了来自不同条件的细胞。移植后一个月,我们注射了10μl的虎蛇毒素(10μgml-1;Latoxan,法国)来损伤受体肌肉和在体内激活MuSC。移植后8周,将小鼠安乐死并采集TA用于分析。
生物发光成像
按先前所述1,5,6,我们使用Xenogen-100系统进行生物发光成像(BLI)。简言之,我们使用异氟烷吸入将小鼠麻醉,并通过腹膜内注射120μL D-荧光素(0.1mmol kg-1,复溶于PBS中;Caliper LifeSciences)。在荧光素注射后5分钟,我们使用60秒的曝光,以F-停止=1.0获取BLI。记录数码图像并使用Living Image软件(Caliper LifeSciences)进行分析。我们采用位于每只后肢上的一致目标区(ROI)进行分析图像来计算生物发光信号。我们以104的辐射度(p s-1cm-2sr-1)值来计算生物发光信号,以确定移植阈值。该104的辐射度阈值约等于先前报告的p/s的总流量阈值。该BLI阈值对应于一根或多根GFP+肌纤维的组织学检测1,5,6。我们在移植后每周进行BLI成像。
肌肉损伤
我们采用了在肌内注射10μl的虎蛇毒素(10μg ml-1;Latoxan)或心脏毒素(10μΜ;Latoxan)至TA肌肉的损伤模式。对于低温损伤,在TA肌肉的皮肤制造切口,并将在液氮中冷冻过的铜探针施用至TA肌肉,维持3次间隔10秒,以使肌肉在每次施用冷冻探针之间可以解冻。当有指示时,在损伤后48小时,将16,16-二甲基前列腺素E2(dmPGE2)(13nmol,Tocris,目录号4027)或媒介物对照(PBS)注射至TA肌肉。将对侧TA用作内部对照。我们在损伤后14天采集组织用于分析。
对于Pax7CreERT2;Rosa26-LSL-Luc小鼠实验,我们利用5次连续的每日腹膜内注射他莫昔芬来激活Pax7启动子控制下的荧光素酶表达来治疗小鼠。在最后一次他莫昔芬注射后1周,对小鼠肌内注射10μl的心脏毒素(10μΜ;Latoxan),我们将这一天指定为测定的第0天。3天后,将13nmol dmPGE2(13nmol)或媒介物对照(PBS)注射至TA肌肉。将对侧TA用作内部对照。在损伤后第3天、第7天、第10天和第14天测定生物发光。
组织的组织学
我们按照先前所述5,6,采集和制备了受体TA肌肉组织以用于组织学分析。我们以抗层粘连蛋白(Miliipore,克隆A5,目录号05-206,1:200)和抗-PAX7(Santa CrazBiotechnology,目录号sc-81648,1:50)第一抗体孵育横切面,接着以AlexaFluor第二抗体(Jackson ImmunoResearch Laboratories,1:200)孵育。我们以DAPI(Invitrogen)将核对染。我们利用配有Plan NeoFluar 10x/0.30NA或20x/0.75NA物镜(Carl Zeiss)和ORCA-ER数码相机(Hamamatsu Photonics)的AxioPlan2落射式荧光显微镜(Carl ZeissMicroimaging),通过SlideBook(3i)软件控制,来获取图像。使用Adobe Photoshop对图像进行了裁剪,并对来自相同实验的所有图进行一致的对比度调整。复合图使用AdobeIllustrator生成。我们使用MetaMorph图像分析软件(Molecular Devices)分析了PAX7阳性细胞的数目,采用能够鉴定纤维的用于肌纤维分析的Baxter算法分析了纤维面积,并将图中的纤维分割以分析每根纤维的面积。对于PAX7的定量,我们检测了TA上跨越至少2mm深度的连续切面。对于纤维面积,对如上的每只小鼠捕获了至少10个视场的层粘连蛋白染色的肌纤维横切面,包含超过400根肌纤维。数据分析是盲化的。进行图像获取和评分的研究者不知道所分析样品组的处理条件。
水凝胶制作
我们从按先前所述6合成的PEG前体制备了聚乙二醇(PEG)水凝胶。简言之,我们通过使用已发表的可获得12-kPa(杨氏模量)刚度的水凝胶的配方来制备了水凝胶,其厚度为1mm,这是在培养物中培养MuSC和保持干细胞生命的最优条件6。按先前所述6,我们制备了12-kPa的水凝胶微孔阵列以用于克隆增殖实验。我们切割和粘贴所有水凝胶来覆盖12孔或24孔培养板的表面。
肌肉干细胞培养、处理和慢病毒感染
分离后,我们将MuSC重悬于包含DMEM/F10(50:50)、15%FBS、2.5ng ml-1纤维母细胞生长因子-2(FGF-2,也称为bFGF)和1%盘尼西林-链霉素的肌源性细胞培养基中。我们以500个细胞/cm2表面积的密度接种MuSC悬液。我们将细胞培养物保持在37℃和5%CO2下,并每天更换培养基。对于PGE2、15-PGDH抑制剂和EP4受体拮抗剂处理的研究,在首个24小时,我们向在胶原包被盘上培养的MuSC中加入1-200ng/ml的前列腺素E2(Cayman Chemical)(除非在图例中有明确说明,10ng/ml是使用的标准浓度),和/或1μΜEP4拮抗剂(ONO-AE3-208,Cayman Chemical),或1μΜ15-PGDH抑制剂(SW033291,Cayman Chemical)。然后将细胞进行胰蛋白酶化,并将细胞重新接种到水凝胶上,额外再培养6天。所有处理均与其溶剂(DMSO)媒介物对照进行比较。对于吸附处理的血清测定,我们将分离的MuSC重悬于包含DMEM/F10(50:50)、15%活性炭吸附处理的FBS(Gibco,目录号12676011)、2.5ng ml-1bFGF和1%盘尼西林-链霉素的培养基中。当图片中有注释时,我们向吸附处理的血清细胞培养基中额外添加了1.5μg/ml胰岛素(Sigma,10516)和0.25μΜ地塞米松(Sigma,D8893)。这些实验中MuSC培养于水凝胶上,且在每次更换培养基(每两天)时向培养物中添加媒介物(DMSO)或10ng/ml的PGE2(Cayman Chemical)。7天后测定增殖(见下面)。
我们在培养1周后进行所有MuSC培养测定和移植,除非另有说明。如前所述3,对于衰老MuSC的移植研究,我们用编码延长因子-1α启动子驱动的luc-IRES-GFP的慢病毒(GFP/luc病毒)感染培养的MuSC 24小时。对于EP4f/f MuSC研究,我们按上述(肌肉干细胞分离)分离了MuSC,并以GFP/luc病毒感染所有细胞,并将其中的一部分用编码pLM-CMV-R-Cre的慢病毒(mCherry/Cre病毒)共感染24小时。pLM-CMV-R-Cre由Michel Sadelain赠与(Addgene质粒编号27546)7。我们将衰老MuSC(250个细胞)或EP4f/f MuSCs(1,000个细胞)移植至幼龄(2-4个月)NOD-SCID受体小鼠的经18-gy辐照的TA。对于体外增殖测定,注射后将ΕΡ4f/fMuSC接种于水凝胶上,并用媒介物(DMSO)或10ng/mlPGE2处理24小时,并在3天后测定增殖。在注射后48小时,使用倒置荧光显微镜(Carl Zeiss Microimaging),测定细胞的GFP和/或mCherry表达。MuSC是通过FACS从小鼠中新鲜分离的,并培养最长1周的时间,因此未对支原体感染进行评估。
增殖分析
为了分析增殖,我们采用了3种不同的分析(血球计、VisionBlue和EdU)。对于每一种,我们以500个细胞/cm2表面积的密度将MuSC接种于平的水凝胶(血球计和VisionBlue)或胶原包被的板上(EdU测定)。对于血球计细胞数计数,我们通过在37℃下以溶于PBS中的0.5%胰蛋白酶孵育5分钟,在所示的时间点采集细胞,并使用血球计对其进行至少3次的定量测定。另外,我们使用VisionBlue Quick细胞活力荧光测定试剂盒(BioVision,目录号K303)作为培养细胞生长的读取值。简言之,我们将MuSC与10%VisionBlue在培养基中孵育3小时,并在荧光板读取仪(Infinite M1000PRO,Tecan)上测量在Ex=530-570nm,Em=590-620nm处的荧光强度。我们使用Click-iT EdU Alexa Fluor 555成像试剂盒(LifeTechnologies)测定增殖。简言之,我们用EdU(20μΜ)孵育活细胞1小时,然后固定,并根据厂商指导对核染色,并利用抗成肌素(Santa Cruz,目录号sc576,1:250)来测定分化。我们利用DAPI(Invitrogen)复染核。我们利用配置有Plan NeoFluar 10x/0.30NA或20x/0.75NA物镜(Carl Zeiss)和ORCA-ER数码相机(Hamamatsu Photonics)的AxioPlan2落射式荧光显微镜(Carl Zeiss Microimaging),通过SlideBook(3i)软件控制,来获取图像。我们使用MetaMorph图像分析软件(Molecular Devices)对EdU阳性细胞进行定量。数据分析是盲化的,其中进行细胞评分的研究者不知道所分析样品组的处理条件。
克隆肌肉干细胞增殖和命运分析
按先前所述5,6,我们通过延时显微镜测定了克隆肌肉干细胞的增殖。简言之,我们用PGE2(Cayman Chemical)或媒介物(DMSO)处理分离的衰老MuSC 24小时。在水凝胶上生长5天后,将细胞以500个细胞/cm2表面积的密度重新接种于具有600μm直径的水凝胶微孔中。对于延时显微镜检查,我们监测了从12小时开始(第0天)至接种后2天的具有单细胞的那些孔中的细胞增殖,并使用具有自定义环境控制室和电动平台的PALM/AxioObserver Z1系统(Carl Zeiss MicroImaging),以10×放大倍数,每3分钟记录图像。我们在采集时间间隔之间每隔一天更换培养基。我们采用用于细胞追踪和谱系重建的Baxter算法分析了时间推移图顺序,以鉴定和追踪单细胞并生成谱系树5,6,8-10。
基于相衬边界和运动性的维持或丧失,以时间推移顺序区分了活细胞和死细胞。我们发现这两种条件下的增殖(分裂)和死亡速率随时间而改变。因此,我们分别估计了第1个和第2个24小时间隔的速率。使用6中描述的方程式来估计值,且列于表1中。我们给出了p24和p48这两个间隔的增殖速率以及相应的死亡速率d24和d48。例如,在处理条件下,第二个24小时间隔期间的增殖速率为5.38%/小时。表1(如下)显示了两种条件下的增殖速率和死亡速率在第一个时间间隔内类似,而实验最后细胞数目的差异是由于第二个时间间隔期间分裂速率和死亡速率的差异导致的。两个时间间隔内模拟的细胞计数通过下式给出:
其中c0为起始时的细胞数。图7F给出了模拟曲线对真实细胞计数的作图。表1.估计的每小时增殖速率和死亡率。
| p24 | p48 | d24 | d48 | |
| DMSO | 0.0488 | 0.0403 | 0.0045 | 0.0112 |
| E2 | 0.0475 | 0.0538 | 0.0067 | 0.0012 |
数据分析是盲化的。进行图像采集和评分的研究者不知道所分析样品组的处理条件。
定量RT-PCR
我们使用RNeasy微量试剂盒(Qiagen)从MuSC分离了RNA。对于肌肉样本,我们将组织在液氮中速冻,使用研钵和研杵将组织均质化,然后使用注射器和针研磨,接着使用Trizol(Invitrogen)分离RNA。我们使用SensiFASTTM cDNA合成试剂盒(Bioline)从来自每个样本的总mRNA反转录了cDNA。我们使用SYBR Green PC Master Mix(AppliedBiosystems)或TaqMan Assays(Applied Biosystems),在ABI 7900HT实时PCR系统(Applied Biosvstems)中,对cDNA进行RT-PCR。样本循环条件为:95℃ 10min,然后在95℃15s和60℃ 1min的条件下进行40个循环。为了定量相对转录水平,我们使用2-ΔΔCt来比较处理和未处理样本,并将结果以相对于Gapdh来表示。对于SYBR Green qRT-PCR,我们使用了以下引物序列:Gapdh,正向5'-TTCACCACCATGGAGAAGGC-3'(SEQ ID NO:1),反向5'-CCCTTTTGGCTCCACCCT-3'(SEQ ID NO:2);Hpgd,正向5'-TCCAGTGTGATGTGGCTGAC-3'(SEQ IDNO:3),反向5'-ATTGTTCACGCCTGCATTGT-3'(SEQ ID NO:4);Ptges,正向5'-GCTGTCATCACAGGCCAGA-3'(SEQ ID NO:5),反向5'-CTCCACATCTGGGTCACTCC-3'(SEQ ID NO:6);Ptges2,正向5'-CTCCTACAGGAAAGTGCCCA-3'(SEQ ID NO:7),反向5'-ACCAGGTAGGTCTTGAGGGC-3'(SEQ ID NO:8);Ptger1,正向5'-GTGGTGTCGTGCATCTGCT-3'(SEQID NO:9),反向,5'-CCGCTGCAGGGAGTTAGAGT-3'(SEQ ID NO:10),和Ptger2,正向5'-ACCTTCGCCATATGCTCCTT-3'(SEQ ID NO:11),反向5'-GGACCGGTGGCCTAAGTATG-3'(SEQ IDNO:12)。根据厂商说明书,利用TaqMan Universal PCR Master Mix reagent试剂盒(Applied Biosystems),使用TaqMan Assays(Applied Biosystems)定量测定样本中的Pax7、成肌素、Slco2al(PGT)、Ptger3和Ptger4。转录水平以相对于Gapdh水平来表示。对于SYBR Green qPCR,使用Gapdh qPCR来标准化输入的cDNA样本。对于Taqman qPCR,多重qPCR使得靶标信号(FAM)能够通过其内部的Gapdh信号(VIC)单独地被标准化。
PGE2 ELISA
收获肌肉,并用含有吲哚美辛(5.6μg/ml)的冰冷的PBS冲洗,并在液氮中速冻。将冷冻的样本在液氮中研成粉末。将粉末转移至装有500μl裂解缓冲液(50mM Tris-HCl pH7.5、150mM NaCl、4mM CaCl、1.5%Triton X-100、蛋白酶抑制剂和微菌球核酸酶)的Eppendorf管中,然后使用组织匀浆器均质化。使用PGE2 ELISA试剂盒(R&D Systems,目录号KGE004B)测量上清液的PGE2水平,并以相对于通过BCA测定(BioRad)的总蛋白质来表示,为ng PGE2。每个样本测定两个重复,且在两个独立实验的每个样本中分别测定。
cAMP活性测定
用DMSO(媒介物)或PGE2(10ng/ml)处理MuSC 1小时,并根据厂商优化的cAMP-Glo测定方案(Promega)测量环状AMP水平。每个样本测定三个重复且在两个独立的实验中测定。
流式细胞术
我们测定了膜联蛋白V作为在最初的媒介物(DMSO)或PGE2(10ng/ml)急性(24小时)处理后于水凝胶上培养7天后MuSC凋亡的读取值。我们使用FITC膜联蛋白V凋亡检测试剂盒(Biolegend,目录号640914),根据厂商的方案进行分析。我们在FACS LSR II细胞计数器上使用共享FACS设备中的FACSDiva软件(BD Biosciences)分析细胞的膜联蛋白V,该设备是使用NIH S10共享仪器基金(S1GRR027431-01)购买的。
质谱分析
分析物:
所有前列腺素标准品——PGF2α;PGE2;PGD2;15-酮PGE2;13,14-二氢15-酮PGE2;PGE2-D4;和PGF2α-D9——均购自Cayman Chemical。对于PGE2-D4内标,3和4位置以总共4个氘原子进行标记。对于PGF2α-D9,17、18、19和20位置总共9个氘原子进行标记。
校准曲线绘制:
分析物原液(5mg/mL)用DMSO制备。用乙腈/水(1:1v/v)连续稀释这些原液来获得一系列的标准工作溶液,用于绘制校准曲线。通过以下方式绘制校准曲线:将10μL的每种标准工作溶液加入到200μL的均质化缓冲剂(丙酮/水1:1v/v;0.005%BHT来防止氧化)中,然后加入10μL内标溶液(PGF2α-D9和PGE2-D4每种3000ng/mL)。校准曲线使用每组样本重新绘制。校准曲线范围:对于PGE2和13,14-二氢15-酮PGE2为0.05ng/mL至500ng/mL;对于PGD2和PGF2α为0.1ng/mL至500ng/mL;且对于15-酮PGE2为0.025ng/mL至500ng/mL。
提取方案:
提取方案选自Prasain et al.11并进行修改,包含了丙酮蛋白质沉淀,然后进行2个步骤的液液萃取;其中后一步骤提高了LC-MS/MS的灵敏度。采用丁羟甲苯(BHT)和氮气(N2)下的蒸发来防止氧化。
收获固体组织,称重,并使用液氮速冻。将肌肉组织与均质化珠子和200μL均质化缓冲液共置于聚丙烯管中,并在FastPrep 24均质器(MPBiomedicals)中以6m/s的速度处理40秒。均质化后,将10μL内标溶液(3000ng/mL)加入到组织匀浆中,然后超声处理并震荡10分钟。离心样本并将上清液转移至干净的离心管中。向样本中加入200μL己烷,然后震荡15分钟,接着离心。将样本在-80℃下冷冻40分钟。从冷冻的下面水层倒出己烷层并丢弃。融化后,向底部水层加入25μL 1N的甲酸,并将样本涡旋振荡。对于第二次提取,往水相加入200μL氯仿。将样本摇晃15分钟以确保完全提取。通过离心分层。将下面的氯仿层转移至新的eppendorf管,并在氮气下,于40℃蒸发至干燥。将干燥的残留物于100μL乙腈/10mM乙酸铵中复溶(2:8v/v),并通过LC-MS/MS进行分析。
LC-MS/MS:
由于许多前列腺素是具有相同分子量的位置异构体且具有相似的片段化特征,因此色谱分离至关重要。针对每种分析物仔细挑选了两个SRM离子峰(transition)——一个是定量离子峰(quantifier)和另一个是定性离子峰(qualifier)。独特的定性物离子强度比率和保留时间对于鉴定靶标分析物至关重要。所有分析均通过负电喷射LC-MS/MS,采用LC-20ADXR超快速液相色谱仪和8030三极串联四极杆质谱仪(Shimadzu)进行。HPLC条件为:Acquity UPLC BEH C18 2.1x100mm,1.7μm粒径填充柱,在50℃下操作,流速为0.25mL/min。流动相由以下物质组成:A:0.1%醋酸水溶液,和B:0.1%醋酸乙腈溶液。洗脱程序:最初采用35%B保持5分钟,然后采用35%-40%的梯度3分钟,接着40%-95%3分钟;总运行时间为14分钟。注射体积为20μL。采用此HPLC条件,我们实现了目标分析物的基线分离。
使用选择反应监测(SRM)进行定量分析。质量离子峰如下:PGD2:m/z 351.10→m/z315.15(定量离子峰)和m/z 351.10→m/z 233.05(定性离子峰);PGE2:m/z 351.10→m/z271.25(定量离子峰)和m/z 351.10→m/z 315.20(定性离子峰);PGF2α:m/z 353.10→m/z309.20(定量离子峰)和m/z 353.10→m/z 193.20(定性离子峰);15酮-PGE2:m/z 349.30→m/z 331.20(定量离子峰)和m/z 349.30→m/z 113.00(定性离子峰);13,14-二氢15-酮PGE2:m/z 351.20→m/z 333.30(定量离子峰)和m/z 351.20→m/z 113.05(定性离子峰);PGE2-D4:m/z 355.40→m/z 275.20;和PGF2α-D9:m/z 362.20→m/z 318.30。停留时间为20-30ms。
使用LabSolutions LCMS(Shimadzu)进行定量分析。采用内标法进行定量:将PGE2-D4用作PGE2、15-酮PGE2和13,14-二氢15-酮PGE2定量的内标。PGF2α-D9为PGD2和PGF2定量的内标。采用1/X2的权重因子,校准曲线在浓度范围内为线性的(R>0.99),其中X为浓度。反算的标准浓度偏差为标称值的±15%,且定量下限(LLOQ)为±20%。
体内肌肉力量测量
使老龄小鼠(18个月)在下坡式跑步机上跑步,持续连续2周。在第1周期间,小鼠每天跑步,持续5天,且在第6天和第7天休息。在第1周期间,在每次跑步机跑步后2小时,对每只小鼠的两条腿的每块(侧面中间的)腓肠肌(GA)肌肉注射一个剂量的PBS(媒介物对照)或13nM的dmPGE2(实验组)。在第2周期间,小鼠仅进行5天的跑步机跑步。使用Exer3/6(Columbus Instruments)进行跑步机跑步。小鼠在20度下坡式跑步机上跑步10分钟,开始速度为7米/min。3min后,将速度以1米/min增加至14米/min的最终速度。选择10分钟跑步时间,因为在独立的对照老龄小鼠组中,在12分钟的中值时间时观察到了力竭,其定义为尽管进行电刺激小鼠仍不能保持在跑步机上跑步。在第5周,根据先前发表的方案5,对GA肌肉进行力量测量。简言之,对于每只小鼠,通过制造切口来暴露GA。我们切断跟骨保留完整的跟腱,并使用薄金属钩将腱-骨复合物连接至300C-LR力传感器(Aurora Scientific)上。通过用盐水(0.9%氯化钠)溶液定期加湿使肌肉和肌腱保持湿润。通过金属钳将下肢固定于膝盖下面,而不干扰至腿部的血流供应。在整个力量测量过程中,小鼠处于吸入麻醉剂(2%异氟烷)的状态,并通过加热灯来维持体温。在所有测量中,我们在预先确定的超大刺激电压下使用0.1-ms脉冲。采用递送2mA恒定电流(矩形脉冲宽度0.1ms)的双极电刺激袖(cuff)经由近端坐骨神经来刺激GA肌肉。对于颤搐力测量,以单次0.1-ms脉冲刺激GA肌肉,且对于强直收缩力测量,以连续150Hz的0.3s脉冲进行刺激。我们对每块肌肉进行了5次颤搐力测量,然后进行了5次强直收缩力测量,在每次测量之间恢复2-3分钟,每组n=5只小鼠。使用PCI-6251采集卡(National Instruments)收集数据,并在Matlab中分析。我们通过根据肌肉生理横切面面积(PCSA)对力测量值进行标准化来计算比力值,其在对照和实验PGE2处理组(表2)间之间是相似的。根据以下方程式12计算PCSA(测量为mm2):
PCSA(mm2)=[质量(g)×Cosθ]÷[(ρ(g/mm3)×纤维长度(mm)],
其中θ为纤维的羽状角,且ρ为肌肉密度(0.001056g/mm3)。
统计分析
我们在至少3个独立的实验中进行了细胞培养实验,其中在每个独立实验中合并了3个生物学重复。总体而言,我们在至少两个独立的实验中进行了MuSC移植实验,其中每个条件总共至少3-5个移植物。实验采用成对t检验,其中对照样本来自相同的体外实验或来自体内对侧肢体肌肉。采用非参数曼-惠特尼检验来确定未处理(-)相对于处理(PGE或dmPGE2)组之间的显著性差异,α=0.05。使用ANOVA或多重t检验来进行多重比较,采用Bonferroni校正或采用Fisher’s检验来确定显著性水平,如附图说明中所示。除非另有说明,数据显示为均值±s.e.m。
方法参考文献:
1 Sacco,A.,Doyonnas,R.,Kraft,P.,Vitorovic,S.&Blau,H.M.Self-renewaland expansion of single transplanted muscle stem cells.Nature 456,502-506,doi:10.1038/nature07384(2008).
2 Schneider,A.et al.Generation of a conditional allele of the mouseprostaglandin EP4receptor.Genesis 40,7-14,doi:10.1002/gene.20048(2004).
3 Murphy,M,M.,Lawson,J.A.,Mathew,S.J.,Hutcheson,D.A.&Kardon,G.Statellite cells,connective tissue fibroblasts and their interactions arecrucial for muscle regeneration.Development 138,3625-3637,doi:10.1242/dev.064162(2011).
4 Safran,M.et al.Mouse reporter strain for noninvasive bioluminescent imaging of cells that have undergone Cre-mediatedrecombination.Molecular imaging 2,297-302(2003).
5 Cosgrove,B.D.et al.Rejuvenation of the muscle stem cell populationrestores strength to injured aged muscles.Nature medicine 20,255-264,doi:10.1038/nm.3464(2014).
6 Gilbert,P.M.et al.Substrate elasticity regulates skeletal musclestem cell self-renewal in culture.Science 329,1078-1081,doi:10.1126/science.1191035(2010).
7 Papapetrou,E.P.et al.Genomic safe harbors permit high beta-globintransgene expression in thalassemia induced pluripotent stem cells.Naturebiotechnology 29,73-78,doi:10.1038/nbt.1717(2011).
8 Chenouard,N.et al.Objective comparison of particle trackingmethods.Nature methods 11,281-289,doi:10.1038/nmeth.2808(2014).
9 Magnusson,K.E.,Jalden,J.,Gilbert,P.M.&Blau,H.M.Global linking ofcell tracks using the Viterbi algorithm.IEEE transactions on medical imaging34,911-929,doi:10.1109/TMI.2014.2370951(2015).
10 Maska,M.et al.A benchmark for comparison of cell trackingalgorithms.Bioinformatics 30,1609-1617,doi:10.1093/bioinformatics/btu080(2014).
11 Prasain,J.K.,Hoang,H.D.,Edmonds,J.W.&Miller,M.A.Prostaglandinextraction and analysis in Caenorhabditis elegans.Journal of visualizedexperiments:JoVE,doi:10.3791/50447(2013).
12 Burkholder,T.J.,Fingado,B.,Baron,S.&Lieber,R.L.Relationshipbetween muscle fiber types and sizes and muscle architectural properties inthe mouse hindlimb.J Morphol 221,177-190,doi:10.1002/jmor.1052210207(1994).
表2.锻炼后5周衰老腓肠肌的生理横切面面积(PCSA)。
实施例2:前列腺素E2(PGE2)注射后肌肉力量增加
本实施例显示了注射PGE2的老龄小鼠腓肠肌肌肉的比颤搐力增加。使老龄小鼠(18个月大)每天进行跑步机跑步直至力竭,为期10天。使用Exer3/6(ColumbusInstalments)进行跑步机跑步。小鼠在20度下坡式跑步机上跑步,起始速度为10米/分钟。3分钟后,速度以1米/分钟增加至最终20米/分钟的速度。力竭定义为尽管进行电刺激动物仍不能保持在跑步机上跑步。每次跑步机跑步后2h,每只小鼠的两侧腓肠肌肌肉均注射PBS(对照组)或3nM PGE2(实验组)。使用300C-LR力量传感器(Aurora Scientific),采用预先确定的超大刺激强度下单次0.1ms脉冲,在最后一次跑步机跑步后4周来进行力测量。
图4M-4N提供了单侧腓肠肌肌肉的代表性原始肌肉力量轨迹中。通过PCI-6251采集卡(National Instruments)记录肌肉力量和同步脉冲,并使用Matlab进行分析。图4O-4P显示了通过利用肌肉生理横断面积将力测量值标准化来计算比肌肉力值。比颤搐力值(kN/m2)通过盒须图示出,其显示最小值、最大值和中值。每块肌肉进行5次重复测量。对照组,N=4,PGE2注射组,n=5。**表示通过双尾曼-惠特尼检验的统计显著性值p<0.005。
VI.示例性实施方案
根据当前公开的主题提供的示例性的实施方案包括但不限于,权利要求和以下实施方案:
1.刺激分离的肌细胞群增殖的方法,所述方法包括:
用化合物培养所述分离的肌细胞群,所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。
2.如实施方案1的所述的方法,其中所述分离的肌细胞群为纯化的。
3.如实施方案1或2所述的方法,其中所述分离的肌细胞群包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的组合。
4.如实施方案1-3中任一实施方案所述的方法,其中所述分离的肌细胞群包括肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的组合。
5.如实施方案1-4中任一实施方案所述的方法,其中所述分离的肌细胞群获自受试者。
6.如实施方案5所述的方法,其中所述受试者患有与肌肉创伤、损伤或萎缩相关的病症或疾病。
7.如实施方案6所述的方法,其中所述与肌肉创伤、损伤或萎缩相关的病症或疾病选自:急性肌肉损伤或外伤、软组织手部损伤、Duchenne型肌营养不良(DMD)、Becker型肌营养不良、肢带型肌营养不良、肌萎缩侧索硬化(ALS)、远端型肌营养不良(DD)、遗传性肌病、强直性肌营养不良(MDD)、线粒体性肌病、肌管性肌病(MM)、重症肌无力(MG)、充血性心力衰竭、周期性麻痹、多肌炎、横纹肌溶解、皮肌炎、癌性恶病质、AIDS性恶病质、心源性恶病质、压力诱导的尿失禁和肌少症。
8.如实施方案1-7中任一实施方案所述的方法,其中所述PGE2衍生物包括16,16-二甲基前列腺素E2。
9.如实施方案1-7中任一实施方案所述的方法,其中所述减弱PGE2分解代谢的化合物包括失活或阻断15-羟基前列腺素脱氢酶(15-PGDH)或者失活或阻断前列腺素转运蛋白(PTG或SLCO2A1)的化合物、中和肽或中和抗体。
10.如实施方案1-9中任一实施方案所述的方法,其中以所述化合物培养所述分离的肌细胞群包括将所述化合物急性地、间歇地或连续地暴露于所述分离的肌细胞群。
11.促进受试者的肌细胞移植的方法,所述方法包括:
以有效量的化合物培养分离的肌细胞群来促进所述受试者的所述肌细胞的移植,以及将所述培养的肌细胞给予所述受试者,所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。
12.如实施方案11所述的方法,其中所述分离的肌细胞群为纯化的。
13.如实施方案11或12所述的方法,其中所述分离的肌细胞群包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的组合。
14.如实施方案11-13中任一实施方案所述的方法,其中所述分离的肌细胞群包括肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的组合。
15.如实施方案11-14中任一实施方案所述的方法,其中所述分离的肌细胞群为所述受试者自体的。
16.如实施方案11-14中任一实施方案所述的方法,其中所述分离的肌细胞群为所述受试者同种异体的。
17.如实施方案11-16中任一实施方案所述的方法,其中所述受试者患有与肌肉创伤、损伤或萎缩相关的病症或疾病。
18.如实施方案17所述的方法,其中所述与肌肉创伤、损伤或萎缩相关的病症或疾病选自:急性肌肉损伤或外伤、手部软组织损伤、Duchenne型肌营养不良(DMD)、Becker型肌营养不良、肢带型肌营养不良、肌萎缩侧索硬化(ALS)、远端型肌营养不良(DD)、遗传性肌病、强直性肌营养不良(MDD)、线粒体性肌病、线粒体性肌病(MM)、重症肌无力(MG)、充血性心力衰竭、周期性麻痹、多肌炎、横纹肌溶解、皮肌炎、癌性恶病质、AIDS性恶病质、心源性恶病质、压力诱导的尿失禁和肌少症。
19.如实施方案11-18中任一实施方案所述的方法,其中所述PGE2衍生物包括16,16-二甲基前列腺素E2。
20.如实施方案11-18中任一实施方案所述的方法,其中所述减弱PGE2分解代谢的化合物包括失活或阻断15-羟基前列腺素脱氢酶(15-PGDH)或者失活或阻断前列腺素转运蛋白(PTG或SLCO2A1)的化合物、中和肽或中和抗体。
21.如实施方案11-20中任一实施方案所述的方法,其中以所述化合物培养所述分离的肌细胞群包括将所述化合物急性地、间歇地或连续地暴露于所述分离的肌细胞群。
22.组合物,其包含分离的肌细胞群和化合物,所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。
23.如实施方案22所述的组合物,其中所述分离的肌细胞群包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的组合。
24.如实施方案22或23所述的组合物,其中所述分离的肌细胞群包括肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的组合。
25.如实施方案22-24中任一实施方案所述的组合物,其还包含药学可接受的载体。
26.试剂盒,其包含如实施方案22-25中任一项所述的组合物和说明书。
27.用于在患有与肌肉创伤、损伤或萎缩相关的病症或疾病的受试者中再生肌细胞群的方法,所述方法包括:
给予所述受试者治疗有效量的化合物和药学可接受的载体来增加所述受试者的肌细胞群和/或增强肌肉功能,所述化合物选自前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合。
28.如实施方案27所述的方法,其中所述与肌肉创伤、损伤或萎缩相关的病症或疾病选自:急性肌肉损伤或外伤、手部软组织损伤、Duchenne型肌营养不良(DMD)、Becker型肌营养不良、肢带型肌营养不良、肌萎缩侧索硬化(ALS)、远端型肌营养不良(DD)、遗传性肌病、强直性肌营养不良(MDD)、线粒体性肌病、线粒体性肌病(MM)、重症肌无力(MG)、充血性心力衰竭、周期性麻痹、多肌炎、横纹肌溶解、皮肌炎、癌性恶病质、AIDS性恶病质、心源性恶病质、压力诱导的尿失禁和肌少症。
29.如实施方案27或28所述的方法,其中所述肌细胞群包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的组合。
30.如实施方案27-29中任一实施方案所述的方法,其中所述肌细胞群包括肌肉干细胞、卫星细胞、肌细胞、成肌细胞、肌管、肌纤维,或以上的组合。
31.如实施方案27-30中任一实施方案所述的方法,其中所述PGE2衍生物包括16,16-二甲基前列腺素E2。
32.如实施方案27-30中任一实施方案所述的方法,其中所述减弱PGE2分解代谢的化合物包括失活或阻断15-羟基前列腺素脱氢酶(15-PGDH)或者失活或阻断前列腺素转运蛋白(PTG或SLCO2A1)的化合物、中和肽或中和抗体。
33.如实施方案27-32中任一实施方案所述的方法,其中给予所述化合物包括经口、腹膜内、肌内、动脉内、皮内、皮下、静脉内或心内施用。
34.如实施方案27-33中任一实施方案所述的方法,其中所述化合物根据急性方案施用。
35.如实施方案27-34中任一实施方案所述的方法,其中给予还包括将分离的肌细胞群给予所述受试者。
36.如实施方案35所述的方法,其中所述分离的肌细胞群为所述受试者自体的。
37.如实施方案35所述的方法,其中所述分离的肌细胞群为所述受试者同种异体的。
38.如实施方案35-37中任一实施方案所述的方法,其中所述分离的肌细胞群为纯化的。
39.如实施方案35-38中任一实施方案所述的方法,其中所述分离的肌细胞群在给予所述受试者之前用所述化合物培养。
40.如实施方案39所述的方法,其中所述分离的肌细胞群用所述化合物培养包括将所述化合物急性地、间歇地或连续地暴露于所述分离的肌细胞群。
41.如实施方案35-40中任一实施方案所述的方法,其中给予所述分离的肌细胞群包括将所述细胞注射或移植至所述受试者。
42.如实施方案35-41中任一项所述的方法,其中将所述分离的肌细胞群和所述化合物同时给予所述受试者。
43.如实施方案35-41中任一项所述的方法,其中将所述分离的肌细胞群和所述化合物依次给予所述受试者。
44.在有需要的受试者中预防或治疗与肌肉创伤、损伤或萎缩相关的病症或疾病的方法,所述方法包括:
将以下物质给予所述受试者来预防或治疗所述与肌肉创伤、损伤或萎缩相关的病症或疾病:(i)治疗有效量的化合物和药学可接受的载体,所述化合物选自:前列腺素E2(PGE2)、PGE2前药、PGE2受体激动剂、减弱PGE2分解代谢的化合物、中和PGE2抑制的化合物、以上的衍生物、以上的类似物,和以上的组合,以及(ii)分离的肌细胞群。
45.如实施方案44所述的方法,其中所述PGE2衍生物包括16,16-二甲基前列腺素E2。
46.如实施方案44所述的方法,其中所述减弱PGE2分解代谢的化合物包括:失活或阻断15-羟基-前列腺素脱氢酶(15-PGDH)或者失活或阻断前列腺素转运蛋白(PTG或SLCO2A1)的化合物、中和肽或中和抗体。
47.如实施方案44-46中任一实施方案所述的方法,其中所述分离的肌细胞群包括骨骼肌细胞、平滑肌细胞、心肌细胞、胚胎干细胞来源的肌细胞、诱导的多能干细胞来源的肌细胞、去分化的肌细胞,或以上的组合。
48.如实施方案44-47中任一实施方案所述的方法,其中所述分离的肌细胞群包括肌肉干细胞、卫星细胞、成肌细胞、肌细胞、肌管、肌纤维,或以上的组合。
49.如实施方案44-48中任一实施方案所述的方法,其中所述分离的肌细胞群为纯化的。
50.如实施方案44-49中任一实施方案所述的方法,其中所述分离的肌细胞群在给予所述受试者之前用所述化合物培养。
51.如实施方案50所述的方法,其中用所述化合物培养所述分离的肌细胞群包括将所述化合物急性地、间歇地或连续地暴露于所述分离的肌细胞群。
52.如实施方案44-51中任一实施方案所述的方法,其中所述分离的肌细胞群为所述受试者自体的。
53.如实施方案44-51中任一实施方案所述的方法,其中所述分离的肌细胞群为所述受试者同种异体的。
54.如实施方案44-53中任一实施方案所述的方法,其中给予所述化合物包括经口、腹膜内、肌内、动脉内、皮内、皮下、静脉内或心内施用。
55.如实施方案44-54中任一实施方案所述的方法,其中所述化合物根据急性方案施用。
56.如实施方案44-55中任一实施方案所述的方法,其中给予所述分离的肌细胞群包括将所述细胞注射或移植至所述受试者。
57.如实施方案44-56中任一实施方案所述的方法,其中将所述化合物和所述分离的肌细胞群同时给予所述受试者。
58.如实施方案44-56中任一实施方案所述的方法,其中将所述化合物和所述分离的肌细胞群依次给予所述受试者。
59.如实施方案44-58中任一实施方案所述的方法,其中所述受试者疑似患有与肌肉创伤、损伤或萎缩相关的病症或疾病,或者处于发展与肌肉创伤、损伤或萎缩相关的病症或疾病的风险。
60.如实施方案44-59中任一实施方案所述的方法,其中所述与肌肉创伤、损伤或萎缩相关的病症或疾病选自:急性肌肉损伤或外伤、手部软组织损伤、Duchenne型肌营养不良(DMD)、Becker型肌营养不良、肢带型肌营养不良、肌萎缩侧索硬化(ALS)、远端型肌营养不良(DD)、遗传性肌病、强直性肌营养不良(MDD)、线粒体性肌病、肌管性肌病(MM)、重症肌无力(MG)、充血性心力衰竭、周期性麻痹、多肌炎、横纹肌溶解、皮肌炎、癌性恶病质、AIDS性恶病质、心源性恶病质、压力诱导的尿失禁和肌少症。
尽管为了清楚理解的目的,以说明和实例方式对上述发明进行了一些详细的描述,本领域技术人员将理解的是,可以在所附权利要求的范围内作出一些改变和修饰。另外,本文中提供的每篇参考文献均通过引用整体并入本文中,其程度等同于就像每篇参考文献通过引入分别并入本文中。
非正式序列表
Gapdh,正向
5'-TTCACCACCATGGAGAAGGC-3'(SEQ ID NO:1)
Gapdh,反向
5'-CCCTTTTGGCTCCACCCT-3'(SEQ ID NO:2)
Hpgd,正向
5'-TCCAGTGTGATGTGGCTGAC-3'(SEQ ID NO:3)
Hpgd,反向
5'-ATTGTTCACGCCTGCATTGT-3'(SEQ ID NO:4)
Ptges,正向
5'-GCTGTCATCACAGGCCAGA-3'(SEQ ID NO:5)
Ptges,反向
5'-CTCCACATCTGGGTCACTCC-3'(SEQ ID NO:6)
Ptges2,正向
5'-CTCCTACAGGAAAGTGCCCA-3'(SEQ ID NO:7)
Ptges2,反向
5'-ACCAGGTAGGTCTTGAGGGC-3'(SEQ ID NO:8)
Ptger1,正向
5'GTGGTGTCGTGCATCTGCT-3'(SEQ ID NO:9)
Ptger1,反向
5'CCGCTGCAGGGAGTTAGAGT-3'(SEQ ID NO:10)
Ptger2,正向
5'-ACCTTCGCCATATGCTCCTT-3'(SEQ ID NO:11)
Ptger2,反向
5'-GGACCGGTGGCCTAAGTATG-3'(SEQ ID NO:12)
Claims (16)
1.减弱前列腺素E2(PGE2)分解代谢的化合物在制备用于在有需要的受试者中治疗骨骼肌创伤的药物中的用途,其中所述减弱PGE2分解代谢的化合物是15-羟基前列腺素脱氢酶(15-PGDH)抑制剂。
2.减弱PGE2分解代谢的化合物在制备用于在有需要的受试者中治疗骨骼肌损伤的药物中的用途,其中所述减弱PGE2分解代谢的化合物是15-PGDH抑制剂。
3.减弱PGE2分解代谢的化合物在制备用于在有需要的受试者中治疗骨骼肌萎缩的药物中的用途,其中所述减弱PGE2分解代谢的化合物是15-PGDH抑制剂。
4.如权利要求1-3任一项所述的用途,其中所述药物用于通过经口、腹膜内、肌内、动脉内、皮内、皮下、静脉内或心内给药给予所述有需要的受试者。
5.如权利要求1-3任一项所述的用途,其中所述药物用于通过急性暴露、间歇暴露、慢性暴露或连续暴露给予所述有需要的受试者。
6.如权利要求1-3任一项所述的用途,其中所述骨骼肌创伤、骨骼肌损伤或骨骼肌萎缩是选自以下的一种或多种或者由选自以下的的一种或多种导致:急性肌肉损伤或外伤、手部软组织损伤、Duchenne型肌营养不良、Becker型肌营养不良、肢带型肌营养不良、肌萎缩侧索硬化、远端型肌营养不良、强直性肌营养不良、线粒体性肌病、肌管性肌病、重症肌无力、充血性心力衰竭、周期性麻痹、多肌炎、横纹肌溶解、皮肌炎、癌性恶病质、AIDS性恶病质、心源性恶病质、压力诱导的尿失禁、肌少症、Charcot-Marie-Tooth病、以及面肩肱型肌营养不良。
7.如权利要求1-3任一项所述的用途,其中所述骨骼肌创伤、骨骼肌损伤或骨骼肌萎缩是遗传性肌病或由遗传性肌病导致。
8.如权利要求1-3任一项所述的用途,其中所述化合物诱导肌肉干细胞群的增殖。
9.如权利要求8所述的用途,其中所述肌肉干细胞群包括:肌源性细胞、卫星细胞、肌肉祖细胞、或以上的组合。
10.如权利要求4所述的用途,其中所述药物通过肌内给药施用,肌内给药包括肌内注射至选自以下的肌肉:胸肌复合肌、背阔肌、大圆肌、肩胛下肌、肱桡肌、二头肌、肱肌、旋前方肌、旋前圆肌、桡侧腕屈肌、尺侧腕屈肌、指浅屈肌、指深屈肌、拇短屈肌、拇对掌肌、拇收肌、髂腰肌、腰大肌、腹直肌、股直肌、臀大肌、臀中肌、内侧腘绳肌、腓肠肌、外侧腘绳肌、股四头肌、长收肌、短收肌、大收肌、比目鱼肌、胫骨后肌、胫骨前肌、趾长屈肌、趾短屈肌、拇长屈肌、以及姆长伸肌。
11.如权利要求4所述的用途,其中所述药物通过肌内给药施用,肌内给药包括肌内注射至选自以下的肌肉:手部肌肉、手臂肌肉、足部肌肉、腿部肌肉、胸部肌肉、腹部肌肉、背部肌肉、臀部肌肉、肩部肌肉、头部肌肉、以及颈部肌肉。
12.如权利要求10所述的用途,其中所述腓肠肌为内侧腓肠肌、或外侧腓肠肌。
13.如权利要求1-3任一项所述的用途,其中所述减弱PGE2分解代谢的化合物包括失活或阻断15-羟基前列腺素脱氢酶(15-PGDH)的化合物、中和肽或中和抗体。
14.如权利要求1-3任一项所述的用途,其中所述药物通过经口给药施用。
15.如权利要求1-3任一项所述的用途,其中所述药物还包含药学上可接受的载体。
16.如权利要求1-3任一项所述的用途,其中所述骨骼肌创伤、骨骼肌损伤或骨骼肌萎缩是脊髓性肌肉萎缩、或者由脊髓性肌肉萎缩导致。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202310631766.9A CN116716241A (zh) | 2016-03-04 | 2017-03-03 | 利用前列腺素e2进行肌肉再生的组合物和方法 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662303979P | 2016-03-04 | 2016-03-04 | |
| US62/303,979 | 2016-03-04 | ||
| US201662348116P | 2016-06-09 | 2016-06-09 | |
| US62/348,116 | 2016-06-09 | ||
| PCT/US2017/020650 WO2017152044A1 (en) | 2016-03-04 | 2017-03-03 | Compositions and methods for muscle regeneration using prostaglandin e2 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202310631766.9A Division CN116716241A (zh) | 2016-03-04 | 2017-03-03 | 利用前列腺素e2进行肌肉再生的组合物和方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN109072186A CN109072186A (zh) | 2018-12-21 |
| CN109072186B true CN109072186B (zh) | 2023-06-23 |
Family
ID=59743257
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202310631766.9A Pending CN116716241A (zh) | 2016-03-04 | 2017-03-03 | 利用前列腺素e2进行肌肉再生的组合物和方法 |
| CN201780014836.9A Active CN109072186B (zh) | 2016-03-04 | 2017-03-03 | 利用前列腺素e2进行肌肉再生的组合物和方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202310631766.9A Pending CN116716241A (zh) | 2016-03-04 | 2017-03-03 | 利用前列腺素e2进行肌肉再生的组合物和方法 |
Country Status (8)
| Country | Link |
|---|---|
| EP (1) | EP3423067A4 (zh) |
| JP (2) | JP2019513010A (zh) |
| KR (2) | KR102387896B1 (zh) |
| CN (2) | CN116716241A (zh) |
| AU (2) | AU2017225999B2 (zh) |
| BR (1) | BR112018017228A2 (zh) |
| CA (1) | CA3014667A1 (zh) |
| WO (1) | WO2017152044A1 (zh) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9918994B2 (en) | 2016-03-04 | 2018-03-20 | The Board Of Trustees Of The Leland Stanford Junior University | Compositions and methods for muscle regeneration using prostaglandin E2 |
| EP3548035A4 (en) | 2016-11-30 | 2020-07-22 | Case Western Reserve University | COMBINATIONS OF 15 PGDH INHIBITORS WITH CORTICOSTEROIDS AND / OR TNF INHIBITORS AND USES THEREOF |
| WO2018145080A1 (en) | 2017-02-06 | 2018-08-09 | Case Western Reserve University | Compositions and methods of modulating short-chain dehydrogenase activity |
| EP3606520A4 (en) * | 2017-04-07 | 2021-01-06 | Case Western Reserve University | SHORT CHAIN DEHYDROGENASE ACTIVITY INHIBITORS FOR THE TREATMENT OF CORONARY DISORDERS |
| CN111212648A (zh) * | 2017-06-09 | 2020-05-29 | 莱兰斯坦福初级大学评议会 | 用于预防或治疗肌肉疾患的组合物和方法 |
| BR112021023952A2 (pt) * | 2019-06-11 | 2022-01-18 | Univ Leland Stanford Junior | Métodos de rejuvenescimento de tecido envelhecido pela inibição de 15-hidroxiprostaglandina desidrogenase (15-pgdh) |
| KR20220079563A (ko) * | 2019-09-16 | 2022-06-13 | 인스티튜트 오브 주올로지, 차이니즈 아카데미 오브 사이언스 | 조직 재생을 위한 방법 및 조성물 |
| EP4232026A1 (en) * | 2020-10-23 | 2023-08-30 | The Board of Trustees of the Leland Stanford Junior University | Elevation of mitochondrial biogenesis and function by inhibition of prostaglandin degrading enzyme 15-pgdh |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3927213A (en) * | 1973-07-10 | 1975-12-16 | American Home Prod | Prostaglandin E{HD 2 {B and derivatives for reducing the side effects of anti-inflammatory agents |
| US5143842A (en) | 1988-11-01 | 1992-09-01 | The University Of Colorado Foundation, Inc. | Media for normal human muscle satellite cells |
| US5409911A (en) | 1992-09-11 | 1995-04-25 | Merck & Co., Inc. | Prostaglandin analog for treating osteoporosis |
| US5833978A (en) * | 1995-03-16 | 1998-11-10 | Universite Laval | Method of in vitro preconditioning healthy donor's myoblasts before transplantation thereof in compatible patients suffering of recessive myopathies like muscular dystrophy, for improving transplantation success |
| US6841573B2 (en) * | 2002-11-27 | 2005-01-11 | Molecular Nutrition | Use of arachidonic acid as a method of increasing skeletal muscle mass |
| EP1981523A2 (en) | 2006-02-09 | 2008-10-22 | Schering Corporation | Novel hcv inhibitor combinations and methods |
| AU2007230902B2 (en) * | 2006-03-24 | 2013-03-14 | Children's Medical Center Corporation | Method to modulate hematopoietic stem cell growth |
| AU2008331597B2 (en) | 2007-11-29 | 2013-11-28 | Allergan, Inc. | Substituted cyclopentanes having prostaglandin activity |
| US8871752B2 (en) * | 2008-02-19 | 2014-10-28 | Sucampo Ag | Method for modulating stem cell growth |
| WO2009125877A1 (ja) | 2008-04-11 | 2009-10-15 | 学校法人慶應義塾 | 平滑筋幹細胞の単離方法 |
| WO2012064920A1 (en) * | 2010-11-11 | 2012-05-18 | University Of Miami | Methods, compositions, cells, and kits for treating ischemic injury |
| WO2015065716A1 (en) * | 2013-10-15 | 2015-05-07 | Case Western Reserve University | Compositions and methods of modulating short-chain dehydrogenase activity |
| JP6203820B2 (ja) * | 2012-04-16 | 2017-09-27 | ケース ウエスタン リザーブ ユニバーシティ | 15−pgdh活性を調節する組成物および方法 |
| US20130331389A1 (en) | 2012-06-11 | 2013-12-12 | National Cheng Kung University | Methods and Compositions for Cardiomyocyte Replenishment by Endogenous and Progenitor Stem Cells |
-
2017
- 2017-03-03 AU AU2017225999A patent/AU2017225999B2/en active Active
- 2017-03-03 KR KR1020187028393A patent/KR102387896B1/ko active IP Right Grant
- 2017-03-03 WO PCT/US2017/020650 patent/WO2017152044A1/en active Application Filing
- 2017-03-03 EP EP17760893.2A patent/EP3423067A4/en active Pending
- 2017-03-03 CN CN202310631766.9A patent/CN116716241A/zh active Pending
- 2017-03-03 CA CA3014667A patent/CA3014667A1/en active Pending
- 2017-03-03 BR BR112018017228A patent/BR112018017228A2/pt active Search and Examination
- 2017-03-03 JP JP2018546415A patent/JP2019513010A/ja active Pending
- 2017-03-03 KR KR1020227012174A patent/KR102481354B1/ko active IP Right Grant
- 2017-03-03 CN CN201780014836.9A patent/CN109072186B/zh active Active
-
2022
- 2022-06-01 JP JP2022089405A patent/JP2022116259A/ja active Pending
- 2022-11-10 AU AU2022268368A patent/AU2022268368A1/en active Pending
Non-Patent Citations (1)
| Title |
|---|
| Inhibition of prostaglandin-degrading enzyme 15-PGDH rejuvenates aged muscle mass and strength;A.R.PALLA等;《science》;20201210;第371卷(第6528期);全文 * |
Also Published As
| Publication number | Publication date |
|---|---|
| KR102387896B1 (ko) | 2022-04-15 |
| KR102481354B1 (ko) | 2022-12-23 |
| AU2022268368A1 (en) | 2022-12-15 |
| JP2019513010A (ja) | 2019-05-23 |
| AU2017225999B2 (en) | 2022-08-18 |
| WO2017152044A1 (en) | 2017-09-08 |
| KR20180129804A (ko) | 2018-12-05 |
| CN109072186A (zh) | 2018-12-21 |
| CA3014667A1 (en) | 2017-09-08 |
| EP3423067A1 (en) | 2019-01-09 |
| AU2017225999A1 (en) | 2018-08-30 |
| KR20220049615A (ko) | 2022-04-21 |
| EP3423067A4 (en) | 2019-09-04 |
| JP2022116259A (ja) | 2022-08-09 |
| CN116716241A (zh) | 2023-09-08 |
| BR112018017228A2 (pt) | 2019-02-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN109072186B (zh) | 利用前列腺素e2进行肌肉再生的组合物和方法 | |
| Arthur et al. | The effect of physiological stimuli on sarcopenia; impact of Notch and Wnt signaling on impaired aged skeletal muscle repair | |
| Sakuma et al. | Molecular mechanism of sarcopenia and cachexia: recent research advances | |
| US11969433B2 (en) | Compositions and methods for muscle regeneration using prostaglandin E2 | |
| Gayraud-Morel et al. | Skeletal muscle as a paradigm for regenerative biology and medicine | |
| Yuan et al. | Exercise‐induced α‐ketoglutaric acid stimulates muscle hypertrophy and fat loss through OXGR1‐dependent adrenal activation | |
| WO2018227138A1 (en) | Compositions and methods for preventing or treating muscle conditions | |
| Huo et al. | Contribution of muscle satellite cells to sarcopenia | |
| AU2012308097B2 (en) | Treatment of bone diseases | |
| Turchi et al. | Butyrate prevents visceral adipose tissue inflammation and metabolic alterations in a Friedreich’s ataxia mouse model | |
| US11382872B2 (en) | LSD1 inhibitors as skeletal muscle hypertrophy inducers | |
| Haynie | Role of sex differences on cancer cachexia progression and fibrosis during cancer cachexia development | |
| JP2019156718A (ja) | 筋変性抑制剤及びその使用方法 | |
| Yuan et al. | α-ketoglutaric acid stimulates muscle hypertrophy and fat loss through OXGR1-dependent adrenal activation | |
| Pemmari | Macrophage and Chondrocyte Phenotypes in Inflammation | |
| Meirlevede et al. | Adult stem cell characterization from the medial gastrocnemius and the semitendinosus muscle in early development of cerebral palsy pathology | |
| JP2024020797A (ja) | 筋萎縮の治療剤 | |
| JPH04234819A (ja) | 脳の老化及び中枢神経系の機能不足状態の予防及び治療のためのデルマタン硫酸の使用 | |
| WO2013038740A1 (ja) | 筋肥大を促進する物質又は因子のスクリーニング方法 | |
| Bennett | Skeletal muscle regeneration and the role of Sirtuin 1 | |
| Hindi | Signaling mechanisms in regenerative myogenesis. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 40001925 Country of ref document: HK |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant |