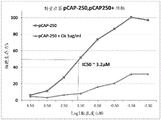
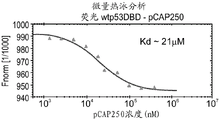
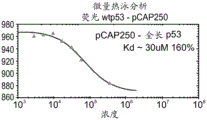
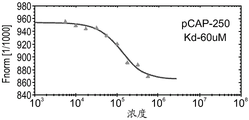
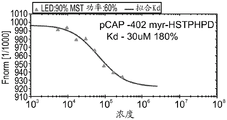
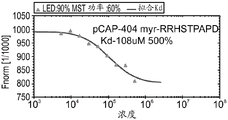
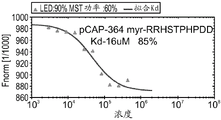
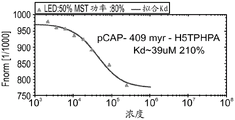
CN108884137B - 肽及其在治疗与突变型p53相关的疾病、病症或病况中的用途 - Google Patents
肽及其在治疗与突变型p53相关的疾病、病症或病况中的用途 Download PDFInfo
- Publication number
- CN108884137B CN108884137B CN201780022355.2A CN201780022355A CN108884137B CN 108884137 B CN108884137 B CN 108884137B CN 201780022355 A CN201780022355 A CN 201780022355A CN 108884137 B CN108884137 B CN 108884137B
- Authority
- CN
- China
- Prior art keywords
- peptide
- dbd
- mutant
- cancer
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 307
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 title claims abstract description 230
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 title description 53
- 102000004196 processed proteins & peptides Human genes 0.000 title description 53
- 201000010099 disease Diseases 0.000 title description 32
- 208000035475 disorder Diseases 0.000 title description 21
- 230000004568 DNA-binding Effects 0.000 claims abstract description 22
- 150000001413 amino acids Chemical class 0.000 claims description 154
- 206010028980 Neoplasm Diseases 0.000 claims description 69
- 201000011510 cancer Diseases 0.000 claims description 41
- 230000003993 interaction Effects 0.000 claims description 38
- 238000011282 treatment Methods 0.000 claims description 12
- 206010033128 Ovarian cancer Diseases 0.000 claims description 10
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 10
- 229960004316 cisplatin Drugs 0.000 claims description 10
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 claims description 10
- 238000011518 platinum-based chemotherapy Methods 0.000 claims description 8
- 238000007920 subcutaneous administration Methods 0.000 claims description 8
- 230000000149 penetrating effect Effects 0.000 claims description 7
- 239000003814 drug Substances 0.000 claims description 5
- 238000001802 infusion Methods 0.000 claims description 5
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 4
- 201000005202 lung cancer Diseases 0.000 claims description 4
- 208000020816 lung neoplasm Diseases 0.000 claims description 4
- 206010006187 Breast cancer Diseases 0.000 claims description 3
- 208000026310 Breast neoplasm Diseases 0.000 claims description 3
- 206010009944 Colon cancer Diseases 0.000 claims description 3
- 208000029742 colonic neoplasm Diseases 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 abstract description 36
- 235000001014 amino acid Nutrition 0.000 description 156
- 229940024606 amino acid Drugs 0.000 description 156
- 210000004027 cell Anatomy 0.000 description 96
- 230000007420 reactivation Effects 0.000 description 65
- 238000000034 method Methods 0.000 description 45
- 230000000694 effects Effects 0.000 description 44
- 108090000623 proteins and genes Proteins 0.000 description 43
- -1 Small molecule compounds Chemical class 0.000 description 35
- 230000027455 binding Effects 0.000 description 34
- 239000000203 mixture Substances 0.000 description 30
- 102000004169 proteins and genes Human genes 0.000 description 30
- 235000018102 proteins Nutrition 0.000 description 29
- 229910052757 nitrogen Inorganic materials 0.000 description 24
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 21
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 21
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 17
- 238000005481 NMR spectroscopy Methods 0.000 description 17
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 16
- 230000035772 mutation Effects 0.000 description 16
- 150000004665 fatty acids Chemical group 0.000 description 13
- 230000006870 function Effects 0.000 description 13
- 235000014113 dietary fatty acids Nutrition 0.000 description 12
- 229930195729 fatty acid Natural products 0.000 description 12
- 239000000194 fatty acid Substances 0.000 description 12
- 150000002632 lipids Chemical group 0.000 description 12
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 11
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 11
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 11
- 241000699670 Mus sp. Species 0.000 description 11
- 230000014509 gene expression Effects 0.000 description 11
- 108020004414 DNA Proteins 0.000 description 10
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 10
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 10
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- 239000013078 crystal Substances 0.000 description 10
- 238000001228 spectrum Methods 0.000 description 10
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 9
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 9
- 244000172533 Viola sororia Species 0.000 description 9
- 150000001875 compounds Chemical class 0.000 description 9
- 238000001727 in vivo Methods 0.000 description 9
- 230000004048 modification Effects 0.000 description 9
- 238000012986 modification Methods 0.000 description 9
- 230000035899 viability Effects 0.000 description 9
- 108700028369 Alleles Proteins 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- 238000003556 assay Methods 0.000 description 8
- 230000003833 cell viability Effects 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 8
- 201000005787 hematologic cancer Diseases 0.000 description 8
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 8
- 230000002209 hydrophobic effect Effects 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 239000002773 nucleotide Substances 0.000 description 7
- 125000003729 nucleotide group Chemical group 0.000 description 7
- 238000013207 serial dilution Methods 0.000 description 7
- 238000010186 staining Methods 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- 238000004461 1H-15N HSQC Methods 0.000 description 6
- FUOOLUPWFVMBKG-UHFFFAOYSA-N 2-Aminoisobutyric acid Chemical compound CC(C)(N)C(O)=O FUOOLUPWFVMBKG-UHFFFAOYSA-N 0.000 description 6
- 201000009030 Carcinoma Diseases 0.000 description 6
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 description 6
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 description 6
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 6
- 238000012565 NMR experiment Methods 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 230000006907 apoptotic process Effects 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 6
- 230000000875 corresponding effect Effects 0.000 description 6
- 238000001114 immunoprecipitation Methods 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 6
- 230000036961 partial effect Effects 0.000 description 6
- 230000035515 penetration Effects 0.000 description 6
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical group [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 108091033409 CRISPR Proteins 0.000 description 5
- 102000012199 E3 ubiquitin-protein ligase Mdm2 Human genes 0.000 description 5
- 108050002772 E3 ubiquitin-protein ligase Mdm2 Proteins 0.000 description 5
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 5
- 108060001084 Luciferase Proteins 0.000 description 5
- 239000005089 Luciferase Substances 0.000 description 5
- 206010025323 Lymphomas Diseases 0.000 description 5
- 238000007792 addition Methods 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- NIHSNFSFDGHHRG-SDNWHVSQSA-N n-[2-[(e)-2-(4-methoxyphenyl)ethenyl]quinazolin-4-yl]-n',n'-dimethylpropane-1,3-diamine Chemical compound C1=CC(OC)=CC=C1\C=C\C1=NC(NCCCN(C)C)=C(C=CC=C2)C2=N1 NIHSNFSFDGHHRG-SDNWHVSQSA-N 0.000 description 5
- 150000003839 salts Chemical group 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 150000003431 steroids Chemical group 0.000 description 5
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 4
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 4
- 108010050904 Interferons Proteins 0.000 description 4
- 102000014150 Interferons Human genes 0.000 description 4
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 4
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 4
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 4
- 108700008625 Reporter Genes Proteins 0.000 description 4
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Chemical compound CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 235000004279 alanine Nutrition 0.000 description 4
- 230000001093 anti-cancer Effects 0.000 description 4
- 239000002246 antineoplastic agent Substances 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 230000002708 enhancing effect Effects 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N glycerol Substances OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 4
- 229910052739 hydrogen Inorganic materials 0.000 description 4
- 238000011503 in vivo imaging Methods 0.000 description 4
- 230000001965 increasing effect Effects 0.000 description 4
- 229940079322 interferon Drugs 0.000 description 4
- 238000007912 intraperitoneal administration Methods 0.000 description 4
- 239000003094 microcapsule Substances 0.000 description 4
- 230000000144 pharmacologic effect Effects 0.000 description 4
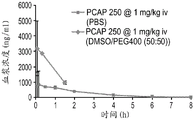
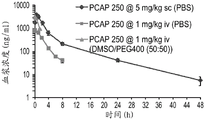
- 230000036470 plasma concentration Effects 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 230000002441 reversible effect Effects 0.000 description 4
- 239000011734 sodium Substances 0.000 description 4
- 229910052708 sodium Inorganic materials 0.000 description 4
- 235000000346 sugar Nutrition 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 210000004881 tumor cell Anatomy 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- RFBVBRVVOPAAFS-UHFFFAOYSA-N 2,2-bis(hydroxymethyl)-1-azabicyclo[2.2.2]octan-3-one Chemical compound C1CC2CCN1C(CO)(CO)C2=O RFBVBRVVOPAAFS-UHFFFAOYSA-N 0.000 description 3
- HVCOBJNICQPDBP-UHFFFAOYSA-N 3-[3-[3,5-dihydroxy-6-methyl-4-(3,4,5-trihydroxy-6-methyloxan-2-yl)oxyoxan-2-yl]oxydecanoyloxy]decanoic acid;hydrate Chemical compound O.OC1C(OC(CC(=O)OC(CCCCCCC)CC(O)=O)CCCCCCC)OC(C)C(O)C1OC1C(O)C(O)C(O)C(C)O1 HVCOBJNICQPDBP-UHFFFAOYSA-N 0.000 description 3
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 3
- 238000010354 CRISPR gene editing Methods 0.000 description 3
- 150000008574 D-amino acids Chemical class 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 229930186217 Glycolipid Natural products 0.000 description 3
- 208000017604 Hodgkin disease Diseases 0.000 description 3
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 3
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 108700025716 Tumor Suppressor Genes Proteins 0.000 description 3
- 102000044209 Tumor Suppressor Genes Human genes 0.000 description 3
- 102100040403 Tumor necrosis factor receptor superfamily member 6 Human genes 0.000 description 3
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 3
- 125000000539 amino acid group Chemical group 0.000 description 3
- 229940034982 antineoplastic agent Drugs 0.000 description 3
- 230000004888 barrier function Effects 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 210000000170 cell membrane Anatomy 0.000 description 3
- 238000002512 chemotherapy Methods 0.000 description 3
- 238000013270 controlled release Methods 0.000 description 3
- 238000004925 denaturation Methods 0.000 description 3
- 230000036425 denaturation Effects 0.000 description 3
- 229950006137 dexfosfoserine Drugs 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 230000002489 hematologic effect Effects 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 230000002601 intratumoral effect Effects 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 208000032839 leukemia Diseases 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 230000001394 metastastic effect Effects 0.000 description 3
- 206010061289 metastatic neoplasm Diseases 0.000 description 3
- 238000010369 molecular cloning Methods 0.000 description 3
- 201000005962 mycosis fungoides Diseases 0.000 description 3
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 3
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 3
- 150000003904 phospholipids Chemical class 0.000 description 3
- BZQFBWGGLXLEPQ-REOHCLBHSA-N phosphoserine Chemical compound OC(=O)[C@@H](N)COP(O)(O)=O BZQFBWGGLXLEPQ-REOHCLBHSA-N 0.000 description 3
- 229910052697 platinum Inorganic materials 0.000 description 3
- 229920001983 poloxamer Polymers 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 230000000861 pro-apoptotic effect Effects 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 230000001737 promoting effect Effects 0.000 description 3
- 238000003757 reverse transcription PCR Methods 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 238000001089 thermophoresis Methods 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- 230000005748 tumor development Effects 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- KDQAABAKXDWYSZ-PNYVAJAMSA-N vinblastine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 KDQAABAKXDWYSZ-PNYVAJAMSA-N 0.000 description 3
- 229960004982 vinblastine sulfate Drugs 0.000 description 3
- 238000012447 xenograft mouse model Methods 0.000 description 3
- YXEWPGYLMHXLPS-UHFFFAOYSA-N (2,5-dioxopyrrol-1-yl)methyl propanoate Chemical compound CCC(=O)OCN1C(=O)C=CC1=O YXEWPGYLMHXLPS-UHFFFAOYSA-N 0.000 description 2
- WPWJFABXGZAMQI-SFHVURJKSA-N (2s)-2-(hexadecanoylamino)-4-sulfanylbutanoic acid Chemical compound CCCCCCCCCCCCCCCC(=O)N[C@H](C(O)=O)CCS WPWJFABXGZAMQI-SFHVURJKSA-N 0.000 description 2
- AFSHUZFNMVJNKX-LLWMBOQKSA-N 1,2-dioleoyl-sn-glycerol Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](CO)OC(=O)CCCCCCC\C=C/CCCCCCCC AFSHUZFNMVJNKX-LLWMBOQKSA-N 0.000 description 2
- BLCJBICVQSYOIF-UHFFFAOYSA-N 2,2-diaminobutanoic acid Chemical compound CCC(N)(N)C(O)=O BLCJBICVQSYOIF-UHFFFAOYSA-N 0.000 description 2
- OYIFNHCXNCRBQI-UHFFFAOYSA-N 2-aminoadipic acid Chemical compound OC(=O)C(N)CCCC(O)=O OYIFNHCXNCRBQI-UHFFFAOYSA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- XIIQDZOQBSLDBF-UHFFFAOYSA-N 4-[1,3-di(hexadecanoyloxy)propan-2-yloxy]-4-oxobutanoic acid Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(OC(=O)CCC(O)=O)COC(=O)CCCCCCCCCCCCCCC XIIQDZOQBSLDBF-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 2
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 2
- 206010000871 Acute monocytic leukaemia Diseases 0.000 description 2
- 108090000672 Annexin A5 Proteins 0.000 description 2
- 102000004121 Annexin A5 Human genes 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 241000972773 Aulopiformes Species 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- 101100285688 Caenorhabditis elegans hrg-7 gene Proteins 0.000 description 2
- 102000011727 Caspases Human genes 0.000 description 2
- 108010076667 Caspases Proteins 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- MWWSFMDVAYGXBV-RUELKSSGSA-N Doxorubicin hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-RUELKSSGSA-N 0.000 description 2
- 208000031448 Genomic Instability Diseases 0.000 description 2
- 208000021309 Germ cell tumor Diseases 0.000 description 2
- 102100031181 Glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 2
- 102100040018 Interferon alpha-2 Human genes 0.000 description 2
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 2
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 2
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 2
- 206010050017 Lung cancer metastatic Diseases 0.000 description 2
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 239000004907 Macro-emulsion Substances 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 108010006519 Molecular Chaperones Proteins 0.000 description 2
- 208000035489 Monocytic Acute Leukemia Diseases 0.000 description 2
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 description 2
- KYRVNWMVYQXFEU-UHFFFAOYSA-N Nocodazole Chemical compound C1=C2NC(NC(=O)OC)=NC2=CC=C1C(=O)C1=CC=CS1 KYRVNWMVYQXFEU-UHFFFAOYSA-N 0.000 description 2
- BZQFBWGGLXLEPQ-UHFFFAOYSA-N O-phosphoryl-L-serine Natural products OC(=O)C(N)COP(O)(O)=O BZQFBWGGLXLEPQ-UHFFFAOYSA-N 0.000 description 2
- 108700020796 Oncogene Proteins 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- 108010067902 Peptide Library Proteins 0.000 description 2
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 206010039491 Sarcoma Diseases 0.000 description 2
- 229920000147 Styrene maleic anhydride Polymers 0.000 description 2
- 108091027544 Subgenomic mRNA Proteins 0.000 description 2
- 208000003721 Triple Negative Breast Neoplasms Diseases 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- 239000013504 Triton X-100 Substances 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 125000002252 acyl group Chemical group 0.000 description 2
- 150000007824 aliphatic compounds Chemical class 0.000 description 2
- 230000009435 amidation Effects 0.000 description 2
- 238000007112 amidation reaction Methods 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- RWZYAGGXGHYGMB-UHFFFAOYSA-N anthranilic acid Chemical compound NC1=CC=CC=C1C(O)=O RWZYAGGXGHYGMB-UHFFFAOYSA-N 0.000 description 2
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical group CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 150000001491 aromatic compounds Chemical class 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- PZOHOALJQOFNTB-UHFFFAOYSA-M brequinar sodium Chemical compound [Na+].N1=C2C=CC(F)=CC2=C(C([O-])=O)C(C)=C1C(C=C1)=CC=C1C1=CC=CC=C1F PZOHOALJQOFNTB-UHFFFAOYSA-M 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 238000000423 cell based assay Methods 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 238000003570 cell viability assay Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 235000012000 cholesterol Nutrition 0.000 description 2
- 239000000562 conjugate Substances 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 230000008034 disappearance Effects 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 229960002918 doxorubicin hydrochloride Drugs 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 239000005038 ethylene vinyl acetate Substances 0.000 description 2
- 208000021045 exocrine pancreatic carcinoma Diseases 0.000 description 2
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 2
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 2
- 150000002339 glycosphingolipids Chemical class 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical group CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 201000001441 melanoma Diseases 0.000 description 2
- 102000006240 membrane receptors Human genes 0.000 description 2
- 108020004084 membrane receptors Proteins 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- 229950002137 mitocarcin Drugs 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 125000001419 myristoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 239000002105 nanoparticle Substances 0.000 description 2
- 229950006344 nocodazole Drugs 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 150000007523 nucleic acids Chemical group 0.000 description 2
- 231100000590 oncogenic Toxicity 0.000 description 2
- 230000002246 oncogenic effect Effects 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 108700025694 p53 Genes Proteins 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 201000002530 pancreatic endocrine carcinoma Diseases 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 239000000816 peptidomimetic Substances 0.000 description 2
- 238000002823 phage display Methods 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 2
- 229920000724 poly(L-arginine) polymer Polymers 0.000 description 2
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 2
- 108010011110 polyarginine Proteins 0.000 description 2
- 229920000728 polyester Polymers 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 230000023603 positive regulation of transcription initiation, DNA-dependent Effects 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 230000008521 reorganization Effects 0.000 description 2
- 102200106179 rs28934573 Human genes 0.000 description 2
- 102200104868 rs587781525 Human genes 0.000 description 2
- 235000019515 salmon Nutrition 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 230000009758 senescence Effects 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 201000008261 skin carcinoma Diseases 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 150000003408 sphingolipids Chemical class 0.000 description 2
- 125000003696 stearoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 230000002195 synergetic effect Effects 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- 238000011191 terminal modification Methods 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- NOYPYLRCIDNJJB-UHFFFAOYSA-N trimetrexate Chemical compound COC1=C(OC)C(OC)=CC(NCC=2C(=C3C(N)=NC(N)=NC3=CC=2)C)=C1 NOYPYLRCIDNJJB-UHFFFAOYSA-N 0.000 description 2
- 229960001099 trimetrexate Drugs 0.000 description 2
- 208000022679 triple-negative breast carcinoma Diseases 0.000 description 2
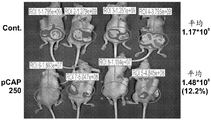
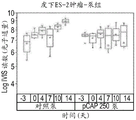
- 230000004614 tumor growth Effects 0.000 description 2
- SPDZFJLQFWSJGA-UHFFFAOYSA-N uredepa Chemical compound C1CN1P(=O)(NC(=O)OCC)N1CC1 SPDZFJLQFWSJGA-UHFFFAOYSA-N 0.000 description 2
- 229950006929 uredepa Drugs 0.000 description 2
- 231100000747 viability assay Toxicity 0.000 description 2
- 238000003026 viability measurement method Methods 0.000 description 2
- 239000011782 vitamin Substances 0.000 description 2
- 229940088594 vitamin Drugs 0.000 description 2
- 229930003231 vitamin Natural products 0.000 description 2
- 235000013343 vitamin Nutrition 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- WWUZIQQURGPMPG-UHFFFAOYSA-N (-)-D-erythro-Sphingosine Natural products CCCCCCCCCCCCCC=CC(O)C(N)CO WWUZIQQURGPMPG-UHFFFAOYSA-N 0.000 description 1
- HZSBSRAVNBUZRA-RQDPQJJXSA-J (1r,2r)-cyclohexane-1,2-diamine;tetrachloroplatinum(2+) Chemical compound Cl[Pt+2](Cl)(Cl)Cl.N[C@@H]1CCCC[C@H]1N HZSBSRAVNBUZRA-RQDPQJJXSA-J 0.000 description 1
- FROLUYNBHPUZQU-IIZJPUEISA-N (2R,3R,4S,5R)-2-(hydroxymethyl)-6-[3-[3-[(3R,4S,5R,6R)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxypropoxy]propoxy]oxane-3,4,5-triol Chemical compound OC[C@H]1OC(OCCCOCCCOC2O[C@H](CO)[C@H](O)[C@H](O)[C@H]2O)[C@H](O)[C@@H](O)[C@H]1O FROLUYNBHPUZQU-IIZJPUEISA-N 0.000 description 1
- YXQOVXILWFIANY-SECBINFHSA-N (2r)-2-amino-2-cyclohexylpropanoic acid Chemical compound OC(=O)[C@@](N)(C)C1CCCCC1 YXQOVXILWFIANY-SECBINFHSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- OPCHFPHZPIURNA-MFERNQICSA-N (2s)-2,5-bis(3-aminopropylamino)-n-[2-(dioctadecylamino)acetyl]pentanamide Chemical compound CCCCCCCCCCCCCCCCCCN(CC(=O)NC(=O)[C@H](CCCNCCCN)NCCCN)CCCCCCCCCCCCCCCCCC OPCHFPHZPIURNA-MFERNQICSA-N 0.000 description 1
- IYKLZBIWFXPUCS-VIFPVBQESA-N (2s)-2-(naphthalen-1-ylamino)propanoic acid Chemical compound C1=CC=C2C(N[C@@H](C)C(O)=O)=CC=CC2=C1 IYKLZBIWFXPUCS-VIFPVBQESA-N 0.000 description 1
- NAALWFYYHHJEFQ-ZASNTINBSA-N (2s,5r,6r)-6-[[(2r)-2-[[6-[4-[bis(2-hydroxyethyl)sulfamoyl]phenyl]-2-oxo-1h-pyridine-3-carbonyl]amino]-2-(4-hydroxyphenyl)acetyl]amino]-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid Chemical compound N([C@@H](C(=O)N[C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C=1C=CC(O)=CC=1)C(=O)C(C(N1)=O)=CC=C1C1=CC=C(S(=O)(=O)N(CCO)CCO)C=C1 NAALWFYYHHJEFQ-ZASNTINBSA-N 0.000 description 1
- SWXOGPJRIDTIRL-DOUNNPEJSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s)-1-amino-3-(1h-indol-3-yl)-1-oxopropan-2-yl]-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5,8,11,14,17-pent Chemical compound C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 SWXOGPJRIDTIRL-DOUNNPEJSA-N 0.000 description 1
- OMJKFYKNWZZKTK-POHAHGRESA-N (5z)-5-(dimethylaminohydrazinylidene)imidazole-4-carboxamide Chemical compound CN(C)N\N=C1/N=CN=C1C(N)=O OMJKFYKNWZZKTK-POHAHGRESA-N 0.000 description 1
- MWWSFMDVAYGXBV-FGBSZODSSA-N (7s,9s)-7-[(2r,4s,5r,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydron;chloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-FGBSZODSSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Chemical group CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- BWKMGYQJPOAASG-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinoline-3-carboxylic acid Chemical compound C1=CC=C2CNC(C(=O)O)CC2=C1 BWKMGYQJPOAASG-UHFFFAOYSA-N 0.000 description 1
- PORPENFLTBBHSG-MGBGTMOVSA-N 1,2-dihexadecanoyl-sn-glycerol-3-phosphate Chemical group CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(O)=O)OC(=O)CCCCCCCCCCCCCCC PORPENFLTBBHSG-MGBGTMOVSA-N 0.000 description 1
- SNKAWJBJQDLSFF-NVKMUCNASA-N 1,2-dioleoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC SNKAWJBJQDLSFF-NVKMUCNASA-N 0.000 description 1
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 1
- FONKWHRXTPJODV-DNQXCXABSA-N 1,3-bis[2-[(8s)-8-(chloromethyl)-4-hydroxy-1-methyl-7,8-dihydro-3h-pyrrolo[3,2-e]indole-6-carbonyl]-1h-indol-5-yl]urea Chemical compound C1([C@H](CCl)CN2C(=O)C=3NC4=CC=C(C=C4C=3)NC(=O)NC=3C=C4C=C(NC4=CC=3)C(=O)N3C4=CC(O)=C5NC=C(C5=C4[C@H](CCl)C3)C)=C2C=C(O)C2=C1C(C)=CN2 FONKWHRXTPJODV-DNQXCXABSA-N 0.000 description 1
- ZKFNOUUKULVDOB-UHFFFAOYSA-N 1-amino-1-phenylmethyl phosphonic acid Chemical compound OP(=O)(O)C(N)C1=CC=CC=C1 ZKFNOUUKULVDOB-UHFFFAOYSA-N 0.000 description 1
- GPVGDGBVGWUGAL-UHFFFAOYSA-N 1-cyclohexyl-1-nitrosourea Chemical compound NC(=O)N(N=O)C1CCCCC1 GPVGDGBVGWUGAL-UHFFFAOYSA-N 0.000 description 1
- CNQCTSLNJJVSAU-UHFFFAOYSA-N 132937-89-4 Chemical compound O.Cl.Cl.Cl.Cl.OCCNCCN1N=C2C3=CC=CC(O)=C3C(=O)C3=C2C1=CC=C3NCCNCCO.OCCNCCN1N=C2C3=CC=CC(O)=C3C(=O)C3=C2C1=CC=C3NCCNCCO CNQCTSLNJJVSAU-UHFFFAOYSA-N 0.000 description 1
- OOMDVERDMZLRFX-UHFFFAOYSA-N 2,2-bis(aminomethyl)propane-1,3-diol;cyclobutane-1,1-dicarboxylic acid;platinum Chemical compound [Pt].NCC(CN)(CO)CO.OC(=O)C1(C(O)=O)CCC1 OOMDVERDMZLRFX-UHFFFAOYSA-N 0.000 description 1
- KSXTUUUQYQYKCR-LQDDAWAPSA-M 2,3-bis[[(z)-octadec-9-enoyl]oxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCC(=O)OCC(C[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC KSXTUUUQYQYKCR-LQDDAWAPSA-M 0.000 description 1
- WALUVDCNGPQPOD-UHFFFAOYSA-M 2,3-di(tetradecoxy)propyl-(2-hydroxyethyl)-dimethylazanium;bromide Chemical compound [Br-].CCCCCCCCCCCCCCOCC(C[N+](C)(C)CCO)OCCCCCCCCCCCCCC WALUVDCNGPQPOD-UHFFFAOYSA-M 0.000 description 1
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 1
- MIJDSYMOBYNHOT-UHFFFAOYSA-N 2-(ethylamino)ethanol Chemical compound CCNCCO MIJDSYMOBYNHOT-UHFFFAOYSA-N 0.000 description 1
- HEFYHDKCEOTPPW-UHFFFAOYSA-N 2-(octylamino)acetic acid Chemical compound CCCCCCCCNCC(O)=O HEFYHDKCEOTPPW-UHFFFAOYSA-N 0.000 description 1
- QCXJFISCRQIYID-IAEPZHFASA-N 2-amino-1-n-[(3s,6s,7r,10s,16s)-3-[(2s)-butan-2-yl]-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-10-propan-2-yl-8-oxa-1,4,11,14-tetrazabicyclo[14.3.0]nonadecan-6-yl]-4,6-dimethyl-3-oxo-9-n-[(3s,6s,7r,10s,16s)-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-3,10-di(propa Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N=C2C(C(=O)N[C@@H]3C(=O)N[C@H](C(N4CCC[C@H]4C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]3C)=O)[C@@H](C)CC)=C(N)C(=O)C(C)=C2O2)C2=C(C)C=C1 QCXJFISCRQIYID-IAEPZHFASA-N 0.000 description 1
- DSWLRNLRVBAVFC-UHFFFAOYSA-N 2-methylsulfinyl-1-pyridin-2-ylethanone Chemical compound CS(=O)CC(=O)C1=CC=CC=N1 DSWLRNLRVBAVFC-UHFFFAOYSA-N 0.000 description 1
- RZCJYMOBWVJQGV-UHFFFAOYSA-N 2-naphthyloxyacetic acid Chemical compound C1=CC=CC2=CC(OCC(=O)O)=CC=C21 RZCJYMOBWVJQGV-UHFFFAOYSA-N 0.000 description 1
- YZEUHQHUFTYLPH-UHFFFAOYSA-N 2-nitroimidazole Chemical compound [O-][N+](=O)C1=NC=CN1 YZEUHQHUFTYLPH-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Chemical group CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- HDBQZGJWHMCXIL-UHFFFAOYSA-N 3,7-dihydropurine-2-thione Chemical compound SC1=NC=C2NC=NC2=N1 HDBQZGJWHMCXIL-UHFFFAOYSA-N 0.000 description 1
- AZKSAVLVSZKNRD-UHFFFAOYSA-M 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide Chemical compound [Br-].S1C(C)=C(C)N=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 AZKSAVLVSZKNRD-UHFFFAOYSA-M 0.000 description 1
- GTJXPMSTODOYNP-BTKVJIOYSA-N 3-[(e)-1-[4-[2-(dimethylamino)ethoxy]phenyl]-2-phenylbut-1-enyl]phenol;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 GTJXPMSTODOYNP-BTKVJIOYSA-N 0.000 description 1
- UZFPOOOQHWICKY-UHFFFAOYSA-N 3-[13-[1-[1-[8,12-bis(2-carboxyethyl)-17-(1-hydroxyethyl)-3,7,13,18-tetramethyl-21,24-dihydroporphyrin-2-yl]ethoxy]ethyl]-18-(2-carboxyethyl)-8-(1-hydroxyethyl)-3,7,12,17-tetramethyl-22,23-dihydroporphyrin-2-yl]propanoic acid Chemical compound N1C(C=C2C(=C(CCC(O)=O)C(C=C3C(=C(C)C(C=C4N5)=N3)CCC(O)=O)=N2)C)=C(C)C(C(C)O)=C1C=C5C(C)=C4C(C)OC(C)C1=C(N2)C=C(N3)C(C)=C(C(O)C)C3=CC(C(C)=C3CCC(O)=O)=NC3=CC(C(CCC(O)=O)=C3C)=NC3=CC2=C1C UZFPOOOQHWICKY-UHFFFAOYSA-N 0.000 description 1
- WUIABRMSWOKTOF-OYALTWQYSA-N 3-[[2-[2-[2-[[(2s,3r)-2-[[(2s,3s,4r)-4-[[(2s,3r)-2-[[6-amino-2-[(1s)-3-amino-1-[[(2s)-2,3-diamino-3-oxopropyl]amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2r,3s,4s,5r,6r)-4-carbamoyloxy-3,5-dihydroxy-6-(hydroxymethyl)ox Chemical compound OS([O-])(=O)=O.N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C WUIABRMSWOKTOF-OYALTWQYSA-N 0.000 description 1
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- ZKARERKEBVSZCX-VMDDUYISSA-M 4-methylbenzenesulfonate;trimethyl-[4-[(1e,3e,5e)-6-phenylhexa-1,3,5-trienyl]phenyl]azanium Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1.C1=CC([N+](C)(C)C)=CC=C1\C=C\C=C\C=C\C1=CC=CC=C1 ZKARERKEBVSZCX-VMDDUYISSA-M 0.000 description 1
- PXLPCZJACKUXGP-UHFFFAOYSA-N 5-(3,4-dichlorophenyl)-6-ethylpyrimidine-2,4-diamine Chemical compound CCC1=NC(N)=NC(N)=C1C1=CC=C(Cl)C(Cl)=C1 PXLPCZJACKUXGP-UHFFFAOYSA-N 0.000 description 1
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- WOVKYSAHUYNSMH-RRKCRQDMSA-N 5-bromodeoxyuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(Br)=C1 WOVKYSAHUYNSMH-RRKCRQDMSA-N 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- KABRXLINDSPGDF-UHFFFAOYSA-N 7-bromoisoquinoline Chemical compound C1=CN=CC2=CC(Br)=CC=C21 KABRXLINDSPGDF-UHFFFAOYSA-N 0.000 description 1
- LPDLEICKXUVJHW-QJILNLRNSA-N 78nz2pmp25 Chemical compound OS(O)(=O)=O.O([C@]12[C@H](OC(C)=O)[C@]3(CC)C=CCN4CC[C@@]5([C@H]34)[C@H]1N(C)C1=C5C=C(C(=C1)OC)[C@]1(C(=O)OC)C3=C(C4=CC=CC=C4N3)CCN3C[C@H](C1)C[C@@](C3)(O)CC)C(=O)N(CCCl)C2=O LPDLEICKXUVJHW-QJILNLRNSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Chemical group CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 230000005730 ADP ribosylation Effects 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 102000010565 Apoptosis Regulatory Proteins Human genes 0.000 description 1
- 108010063104 Apoptosis Regulatory Proteins Proteins 0.000 description 1
- 101100295091 Arabidopsis thaliana NUDT14 gene Proteins 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 206010060971 Astrocytoma malignant Diseases 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 101150068685 BTG2 gene Proteins 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 241000143476 Bidens Species 0.000 description 1
- 206010004593 Bile duct cancer Diseases 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 206010006143 Brain stem glioma Diseases 0.000 description 1
- 244000056139 Brassica cretica Species 0.000 description 1
- 235000003351 Brassica cretica Nutrition 0.000 description 1
- 235000003343 Brassica rupestris Nutrition 0.000 description 1
- 206010055113 Breast cancer metastatic Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 206010007275 Carcinoid tumour Diseases 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- URYAFVKLYSEINW-UHFFFAOYSA-N Chlorfenethol Chemical compound C=1C=C(Cl)C=CC=1C(O)(C)C1=CC=C(Cl)C=C1 URYAFVKLYSEINW-UHFFFAOYSA-N 0.000 description 1
- 108010077544 Chromatin Proteins 0.000 description 1
- PPASFTRHCXASPY-UHFFFAOYSA-N Cl.Cl.NCCCNc1ccc2c3c(nn2CCNCCO)c4c(O)ccc(O)c4C(=O)c13 Chemical compound Cl.Cl.NCCCNc1ccc2c3c(nn2CCNCCO)c4c(O)ccc(O)c4C(=O)c13 PPASFTRHCXASPY-UHFFFAOYSA-N 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 206010055114 Colon cancer metastatic Diseases 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- XZMCDFZZKTWFGF-UHFFFAOYSA-N Cyanamide Chemical compound NC#N XZMCDFZZKTWFGF-UHFFFAOYSA-N 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- AEMOLEFTQBMNLQ-AQKNRBDQSA-N D-glucopyranuronic acid Chemical compound OC1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-AQKNRBDQSA-N 0.000 description 1
- XULFJDKZVHTRLG-JDVCJPALSA-N DOSPA trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F.CCCCCCCC\C=C/CCCCCCCCOCC(C[N+](C)(C)CCNC(=O)C(CCCNCCCN)NCCCN)OCCCCCCCC\C=C/CCCCCCCC XULFJDKZVHTRLG-JDVCJPALSA-N 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 108010013198 Daptomycin Proteins 0.000 description 1
- ZQZFYGIXNQKOAV-OCEACIFDSA-N Droloxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 ZQZFYGIXNQKOAV-OCEACIFDSA-N 0.000 description 1
- 108700006830 Drosophila Antp Proteins 0.000 description 1
- 101100136092 Drosophila melanogaster peng gene Proteins 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 206010014967 Ependymoma Diseases 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 208000022072 Gallbladder Neoplasms Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 1
- 229920002683 Glycosaminoglycan Polymers 0.000 description 1
- 108020005004 Guide RNA Proteins 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 108010033040 Histones Proteins 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- LCWXJXMHJVIJFK-UHFFFAOYSA-N Hydroxylysine Natural products NCC(O)CC(N)CC(O)=O LCWXJXMHJVIJFK-UHFFFAOYSA-N 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- 238000012695 Interfacial polymerization Methods 0.000 description 1
- 108010078049 Interferon alpha-2 Proteins 0.000 description 1
- 108010079944 Interferon-alpha2b Proteins 0.000 description 1
- 206010061252 Intraocular melanoma Diseases 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- OGNSCSPNOLGXSM-VKHMYHEASA-N L-2,4-diaminobutyric acid Chemical compound NCC[C@H](N)C(O)=O OGNSCSPNOLGXSM-VKHMYHEASA-N 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- 150000008575 L-amino acids Chemical class 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 1
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 206010023825 Laryngeal cancer Diseases 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 206010064912 Malignant transformation Diseases 0.000 description 1
- 229930126263 Maytansine Natural products 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 208000002030 Merkel cell carcinoma Diseases 0.000 description 1
- 206010063569 Metastatic squamous cell carcinoma Diseases 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 208000003445 Mouth Neoplasms Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 1
- 208000014767 Myeloproliferative disease Diseases 0.000 description 1
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 1
- NPKISZUVEBESJI-AWEZNQCLSA-N N-benzoyl-L-phenylalanine Chemical compound C([C@@H](C(=O)O)NC(=O)C=1C=CC=CC=1)C1=CC=CC=C1 NPKISZUVEBESJI-AWEZNQCLSA-N 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- LYPFDBRUNKHDGX-SOGSVHMOSA-N N1C2=CC=C1\C(=C1\C=CC(=N1)\C(=C1\C=C/C(/N1)=C(/C1=N/C(/CC1)=C2/C1=CC(O)=CC=C1)C1=CC(O)=CC=C1)\C1=CC(O)=CC=C1)C1=CC(O)=CC=C1 Chemical compound N1C2=CC=C1\C(=C1\C=CC(=N1)\C(=C1\C=C/C(/N1)=C(/C1=N/C(/CC1)=C2/C1=CC(O)=CC=C1)C1=CC(O)=CC=C1)\C1=CC(O)=CC=C1)C1=CC(O)=CC=C1 LYPFDBRUNKHDGX-SOGSVHMOSA-N 0.000 description 1
- RBPOYGUQBCQHCW-UHFFFAOYSA-N NCCN.I.I.I.I Chemical compound NCCN.I.I.I.I RBPOYGUQBCQHCW-UHFFFAOYSA-N 0.000 description 1
- SHVCEINPHADNMU-UHFFFAOYSA-N NCCNCCN.I.I.I.I Chemical compound NCCNCCN.I.I.I.I SHVCEINPHADNMU-UHFFFAOYSA-N 0.000 description 1
- UZJCEIKVMCLANK-UHFFFAOYSA-N NCCNCCN.I.I.I.I.I.I Chemical compound NCCNCCN.I.I.I.I.I.I UZJCEIKVMCLANK-UHFFFAOYSA-N 0.000 description 1
- NPKISZUVEBESJI-UHFFFAOYSA-N Nalpha-benzoyl-L-phenylalanine Natural products C=1C=CC=CC=1C(=O)NC(C(=O)O)CC1=CC=CC=C1 NPKISZUVEBESJI-UHFFFAOYSA-N 0.000 description 1
- 208000002454 Nasopharyngeal Carcinoma Diseases 0.000 description 1
- 206010061306 Nasopharyngeal cancer Diseases 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 206010029266 Neuroendocrine carcinoma of the skin Diseases 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- FOQXBQHXOQYZSM-UHFFFAOYSA-N OC1=NC2=CC=CC=C2C=C1.[P] Chemical compound OC1=NC2=CC=CC=C2C=C1.[P] FOQXBQHXOQYZSM-UHFFFAOYSA-N 0.000 description 1
- REYJJPSVUYRZGE-UHFFFAOYSA-N Octadecylamine Chemical compound CCCCCCCCCCCCCCCCCCN REYJJPSVUYRZGE-UHFFFAOYSA-N 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 239000005642 Oleic acid Chemical group 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Chemical group CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 102000043276 Oncogene Human genes 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 208000007571 Ovarian Epithelial Carcinoma Diseases 0.000 description 1
- 206010033268 Ovarian low malignant potential tumour Diseases 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 208000000821 Parathyroid Neoplasms Diseases 0.000 description 1
- 108010043958 Peptoids Proteins 0.000 description 1
- 208000007641 Pinealoma Diseases 0.000 description 1
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 1
- 201000007552 Pituitary carcinoma Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 208000007452 Plasmacytoma Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 239000005828 Pyrimethanil Substances 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 108091027981 Response element Proteins 0.000 description 1
- DREPOWITHQLFOD-UHFFFAOYSA-N S(=O)(=O)(O)NC(N(C1=CC=CC=C1)Cl)=O Chemical compound S(=O)(=O)(O)NC(N(C1=CC=CC=C1)Cl)=O DREPOWITHQLFOD-UHFFFAOYSA-N 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 206010061934 Salivary gland cancer Diseases 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 208000009359 Sezary Syndrome Diseases 0.000 description 1
- 208000021388 Sezary disease Diseases 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 206010054184 Small intestine carcinoma Diseases 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 239000005665 Spiromesifen Substances 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 238000012288 TUNEL assay Methods 0.000 description 1
- 101710192266 Tegument protein VP22 Proteins 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testosterone Natural products O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- IWEQQRMGNVVKQW-OQKDUQJOSA-N Toremifene citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 IWEQQRMGNVVKQW-OQKDUQJOSA-N 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 108010050144 Triptorelin Pamoate Proteins 0.000 description 1
- 239000007984 Tris EDTA buffer Substances 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 108010078814 Tumor Suppressor Protein p53 Proteins 0.000 description 1
- 108010040002 Tumor Suppressor Proteins Proteins 0.000 description 1
- 102000001742 Tumor Suppressor Proteins Human genes 0.000 description 1
- 208000006593 Urologic Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 201000005969 Uveal melanoma Diseases 0.000 description 1
- QYKIQEUNHZKYBP-UHFFFAOYSA-N Vinyl ether Chemical compound C=COC=C QYKIQEUNHZKYBP-UHFFFAOYSA-N 0.000 description 1
- 235000005811 Viola adunca Nutrition 0.000 description 1
- 240000009038 Viola odorata Species 0.000 description 1
- 235000013487 Viola odorata Nutrition 0.000 description 1
- 235000002254 Viola papilionacea Nutrition 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- OLLSDNUHBJHKJS-XKORHJEPSA-N [(2s,3s,4r,6s)-6-[(2r,3s,4r,5r,6r)-6-[[(4r,5s,6s,7r,9r,11e,13e,15r,16r)-4-acetyloxy-16-ethyl-15-[[(2r,3r,4r,5r,6r)-5-hydroxy-3,4-dimethoxy-6-methyloxan-2-yl]oxymethyl]-5,9,13-trimethyl-2,10-dioxo-7-(2-oxoethyl)-1-oxacyclohexadeca-11,13-dien-6-yl]oxy]-4-(d Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O.O([C@@H]1[C@@H](C)O[C@H]([C@@H]([C@H]1N(C)C)O)O[C@@H]1[C@@H](C)[C@H](OC(C)=O)CC(=O)O[C@@H]([C@H](/C=C(\C)/C=C/C(=O)[C@H](C)C[C@@H]1CC=O)CO[C@H]1[C@@H]([C@H](OC)[C@H](O)[C@@H](C)O1)OC)CC)[C@H]1C[C@@](C)(O)[C@@H](OC(=O)CC(C)C)[C@H](C)O1 OLLSDNUHBJHKJS-XKORHJEPSA-N 0.000 description 1
- KMLCRELJHYKIIL-UHFFFAOYSA-N [1-(azanidylmethyl)cyclohexyl]methylazanide;platinum(2+);sulfuric acid Chemical compound [Pt+2].OS(O)(=O)=O.[NH-]CC1(C[NH-])CCCCC1 KMLCRELJHYKIIL-UHFFFAOYSA-N 0.000 description 1
- ATBOMIWRCZXYSZ-XZBBILGWSA-N [1-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-3-hexadecanoyloxypropan-2-yl] (9e,12e)-octadeca-9,12-dienoate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC ATBOMIWRCZXYSZ-XZBBILGWSA-N 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- XLLNINGEDIOQGQ-UHFFFAOYSA-N [acetyloxy(hydroxy)phosphoryl] acetate Chemical compound CC(=O)OP(O)(=O)OC(C)=O XLLNINGEDIOQGQ-UHFFFAOYSA-N 0.000 description 1
- 238000010317 ablation therapy Methods 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- RUGAHXUZHWYHNG-NLGNTGLNSA-N acetic acid;(4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]-19-[[(2r)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5, Chemical compound CC(O)=O.CC(O)=O.CC(O)=O.CC(O)=O.CC(O)=O.C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1.C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 RUGAHXUZHWYHNG-NLGNTGLNSA-N 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- QAWIHIJWNYOLBE-OKKQSCSOSA-N acivicin Chemical compound OC(=O)[C@@H](N)[C@@H]1CC(Cl)=NO1 QAWIHIJWNYOLBE-OKKQSCSOSA-N 0.000 description 1
- 229950008427 acivicin Drugs 0.000 description 1
- USZYSDMBJDPRIF-SVEJIMAYSA-N aclacinomycin A Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@H]1C)O[C@H]1[C@H](C[C@@H](O[C@H]1C)O[C@H]1C[C@]([C@@H](C2=CC=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)C(=O)OC)(O)CC)N(C)C)[C@H]1CCC(=O)[C@H](C)O1 USZYSDMBJDPRIF-SVEJIMAYSA-N 0.000 description 1
- 229960004176 aclarubicin Drugs 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 101150063416 add gene Proteins 0.000 description 1
- 208000020990 adrenal cortex carcinoma Diseases 0.000 description 1
- 208000007128 adrenocortical carcinoma Diseases 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000012867 alanine scanning Methods 0.000 description 1
- 229960005310 aldesleukin Drugs 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 201000007538 anal carcinoma Diseases 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000002841 anti-cancer assay Methods 0.000 description 1
- 229940124650 anti-cancer therapies Drugs 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 238000011319 anticancer therapy Methods 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- XZNUGFQTQHRASN-XQENGBIVSA-N apramycin Chemical compound O([C@H]1O[C@@H]2[C@H](O)[C@@H]([C@H](O[C@H]2C[C@H]1N)O[C@@H]1[C@@H]([C@@H](O)[C@H](N)[C@@H](CO)O1)O)NC)[C@@H]1[C@@H](N)C[C@@H](N)[C@H](O)[C@H]1O XZNUGFQTQHRASN-XQENGBIVSA-N 0.000 description 1
- 229950006334 apramycin Drugs 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- 229940114079 arachidonic acid Drugs 0.000 description 1
- 235000021342 arachidonic acid Nutrition 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000011717 athymic nude mouse Methods 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- KLNFSAOEKUDMFA-UHFFFAOYSA-N azanide;2-hydroxyacetic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OCC(O)=O KLNFSAOEKUDMFA-UHFFFAOYSA-N 0.000 description 1
- HRXVDDOKERXBEY-UHFFFAOYSA-N azatepa Chemical compound C1CN1P(=O)(N1CC1)N(CC)C1=NN=CS1 HRXVDDOKERXBEY-UHFFFAOYSA-N 0.000 description 1
- 229950002182 azatepa Drugs 0.000 description 1
- 230000037429 base substitution Effects 0.000 description 1
- XFILPEOLDIKJHX-QYZOEREBSA-N batimastat Chemical compound C([C@@H](C(=O)NC)NC(=O)[C@H](CC(C)C)[C@H](CSC=1SC=CC=1)C(=O)NO)C1=CC=CC=C1 XFILPEOLDIKJHX-QYZOEREBSA-N 0.000 description 1
- 229950001858 batimastat Drugs 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 125000003910 behenoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- MMIMIFULGMZVPO-UHFFFAOYSA-N benzyl 3-bromo-2,6-dinitro-5-phenylmethoxybenzoate Chemical compound [O-][N+](=O)C1=C(C(=O)OCC=2C=CC=CC=2)C([N+](=O)[O-])=C(Br)C=C1OCC1=CC=CC=C1 MMIMIFULGMZVPO-UHFFFAOYSA-N 0.000 description 1
- 102000005936 beta-Galactosidase Human genes 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 238000005415 bioluminescence Methods 0.000 description 1
- 230000029918 bioluminescence Effects 0.000 description 1
- 238000010352 biotechnological method Methods 0.000 description 1
- QKSKPIVNLNLAAV-UHFFFAOYSA-N bis(2-chloroethyl) sulfide Chemical compound ClCCSCCCl QKSKPIVNLNLAAV-UHFFFAOYSA-N 0.000 description 1
- 229950008548 bisantrene Drugs 0.000 description 1
- 229950006844 bizelesin Drugs 0.000 description 1
- 201000001531 bladder carcinoma Diseases 0.000 description 1
- 229960004395 bleomycin sulfate Drugs 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 208000012172 borderline epithelial tumor of ovary Diseases 0.000 description 1
- 238000002725 brachytherapy Methods 0.000 description 1
- 208000030224 brain astrocytoma Diseases 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 210000001217 buttock Anatomy 0.000 description 1
- 125000004063 butyryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 108700002839 cactinomycin Proteins 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- YZBQHRLRFGPBSL-RXMQYKEDSA-N carbapenem Chemical compound C1C=CN2C(=O)C[C@H]21 YZBQHRLRFGPBSL-RXMQYKEDSA-N 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Chemical group 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 208000002458 carcinoid tumor Diseases 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 230000025084 cell cycle arrest Effects 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 230000004637 cellular stress Effects 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 102000005352 centromere protein F Human genes 0.000 description 1
- 108010031377 centromere protein F Proteins 0.000 description 1
- 229940106189 ceramide Drugs 0.000 description 1
- 150000001783 ceramides Chemical class 0.000 description 1
- 201000007335 cerebellar astrocytoma Diseases 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- SOYKEARSMXGVTM-UHFFFAOYSA-N chlorphenamine Chemical compound C=1C=CC=NC=1C(CCN(C)C)C1=CC=C(Cl)C=C1 SOYKEARSMXGVTM-UHFFFAOYSA-N 0.000 description 1
- 229960003291 chlorphenamine Drugs 0.000 description 1
- 150000001840 cholesterol esters Chemical class 0.000 description 1
- 150000001841 cholesterols Chemical class 0.000 description 1
- 210000003483 chromatin Anatomy 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000005354 coacervation Methods 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- DMSZORWOGDLWGN-UHFFFAOYSA-N ctk1a3526 Chemical compound NP(N)(N)=O DMSZORWOGDLWGN-UHFFFAOYSA-N 0.000 description 1
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 description 1
- 208000017763 cutaneous neuroendocrine carcinoma Diseases 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- DOAKLVKFURWEDJ-QCMAZARJSA-N daptomycin Chemical compound C([C@H]1C(=O)O[C@H](C)[C@@H](C(NCC(=O)N[C@@H](CCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@H](CO)C(=O)N[C@H](C(=O)N1)[C@H](C)CC(O)=O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](CC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)CCCCCCCCC)C(=O)C1=CC=CC=C1N DOAKLVKFURWEDJ-QCMAZARJSA-N 0.000 description 1
- 229960005484 daptomycin Drugs 0.000 description 1
- 229960003109 daunorubicin hydrochloride Drugs 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 125000003074 decanoyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 229960003603 decitabine Drugs 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 239000007857 degradation product Substances 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-M deoxycholate Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC([O-])=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-M 0.000 description 1
- 229940009976 deoxycholate Drugs 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- UMGXUWVIJIQANV-UHFFFAOYSA-M didecyl(dimethyl)azanium;bromide Chemical compound [Br-].CCCCCCCCCC[N+](C)(C)CCCCCCCCCC UMGXUWVIJIQANV-UHFFFAOYSA-M 0.000 description 1
- 238000002050 diffraction method Methods 0.000 description 1
- 239000013024 dilution buffer Substances 0.000 description 1
- PSLWZOIUBRXAQW-UHFFFAOYSA-M dimethyl(dioctadecyl)azanium;bromide Chemical compound [Br-].CCCCCCCCCCCCCCCCCC[N+](C)(C)CCCCCCCCCCCCCCCCCC PSLWZOIUBRXAQW-UHFFFAOYSA-M 0.000 description 1
- MWRBNPKJOOWZPW-CLFAGFIQSA-N dioleoyl phosphatidylethanolamine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(COP(O)(=O)OCCN)OC(=O)CCCCCCC\C=C/CCCCCCCC MWRBNPKJOOWZPW-CLFAGFIQSA-N 0.000 description 1
- MKYNHKOAYQRSBD-UHFFFAOYSA-N dioxouranium;nitric acid Chemical compound O=[U]=O.O[N+]([O-])=O.O[N+]([O-])=O MKYNHKOAYQRSBD-UHFFFAOYSA-N 0.000 description 1
- ZGSPNIOCEDOHGS-UHFFFAOYSA-L disodium [3-[2,3-di(octadeca-9,12-dienoyloxy)propoxy-oxidophosphoryl]oxy-2-hydroxypropyl] 2,3-di(octadeca-9,12-dienoyloxy)propyl phosphate Chemical compound [Na+].[Na+].CCCCCC=CCC=CCCCCCCCC(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COP([O-])(=O)OCC(O)COP([O-])(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COC(=O)CCCCCCCC=CCC=CCCCCC ZGSPNIOCEDOHGS-UHFFFAOYSA-L 0.000 description 1
- CZLKTMHQYXYHOO-QTNFYWBSSA-L disodium;(2s)-2-[(2-phosphonatoacetyl)amino]butanedioic acid Chemical compound [Na+].[Na+].OC(=O)C[C@@H](C(O)=O)NC(=O)CP([O-])([O-])=O CZLKTMHQYXYHOO-QTNFYWBSSA-L 0.000 description 1
- SVJSWELRJWVPQD-KJWOGLQMSA-L disodium;(2s)-2-[[4-[2-[(6r)-2-amino-4-oxo-5,6,7,8-tetrahydro-1h-pyrido[2,3-d]pyrimidin-6-yl]ethyl]benzoyl]amino]pentanedioate Chemical compound [Na+].[Na+].C([C@@H]1CC=2C(=O)N=C(NC=2NC1)N)CC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 SVJSWELRJWVPQD-KJWOGLQMSA-L 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229950004203 droloxifene Drugs 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- MGQRRMONVLMKJL-KWJIQSIXSA-N elsamitrucin Chemical compound O1[C@H](C)[C@H](O)[C@H](OC)[C@@H](N)[C@H]1O[C@@H]1[C@](O)(C)[C@@H](O)[C@@H](C)O[C@H]1OC1=CC=CC2=C(O)C(C(O3)=O)=C4C5=C3C=CC(C)=C5C(=O)OC4=C12 MGQRRMONVLMKJL-KWJIQSIXSA-N 0.000 description 1
- 229950002339 elsamitrucin Drugs 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- WHWZLSFABNNENI-UHFFFAOYSA-N epinastine Chemical compound C1C2=CC=CC=C2C2CN=C(N)N2C2=CC=CC=C21 WHWZLSFABNNENI-UHFFFAOYSA-N 0.000 description 1
- 229960003449 epinastine Drugs 0.000 description 1
- 229960003265 epirubicin hydrochloride Drugs 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- IIUMCNJTGSMNRO-VVSKJQCTSA-L estramustine sodium phosphate Chemical compound [Na+].[Na+].ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)OP([O-])([O-])=O)[C@@H]4[C@@H]3CCC2=C1 IIUMCNJTGSMNRO-VVSKJQCTSA-L 0.000 description 1
- WCDWBPCFGJXFJZ-UHFFFAOYSA-N etanidazole Chemical compound OCCNC(=O)CN1C=CN=C1[N+]([O-])=O WCDWBPCFGJXFJZ-UHFFFAOYSA-N 0.000 description 1
- 229950006566 etanidazole Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- LIQODXNTTZAGID-OCBXBXKTSA-N etoposide phosphate Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 LIQODXNTTZAGID-OCBXBXKTSA-N 0.000 description 1
- 229960000752 etoposide phosphate Drugs 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 201000008819 extrahepatic bile duct carcinoma Diseases 0.000 description 1
- 208000024519 eye neoplasm Diseases 0.000 description 1
- 229950011548 fadrozole Drugs 0.000 description 1
- NMUSYJAQQFHJEW-ARQDHWQXSA-N fazarabine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-ARQDHWQXSA-N 0.000 description 1
- 229950005096 fazarabine Drugs 0.000 description 1
- 229960004887 ferric hydroxide Drugs 0.000 description 1
- 229960000961 floxuridine Drugs 0.000 description 1
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 238000010230 functional analysis Methods 0.000 description 1
- IQECZGDVZMVJSH-UHFFFAOYSA-N furan 1H-pyrazole Chemical compound O1C=CC=C1.N1N=CC=C1 IQECZGDVZMVJSH-UHFFFAOYSA-N 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- 229960005144 gemcitabine hydrochloride Drugs 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 201000007116 gestational trophoblastic neoplasm Diseases 0.000 description 1
- 229940097042 glucuronate Drugs 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 125000000268 heptanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000005570 heteronuclear single quantum coherence Methods 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- 125000003104 hexanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 235000011167 hydrochloric acid Nutrition 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- QJHBJHUKURJDLG-UHFFFAOYSA-N hydroxy-L-lysine Natural products NCCCCC(NO)C(O)=O QJHBJHUKURJDLG-UHFFFAOYSA-N 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 201000006866 hypopharynx cancer Diseases 0.000 description 1
- 230000002267 hypothalamic effect Effects 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 229960001176 idarubicin hydrochloride Drugs 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 210000001822 immobilized cell Anatomy 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000006882 induction of apoptosis Effects 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000000185 intracerebroventricular administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 229950010897 iproplatin Drugs 0.000 description 1
- 229960000779 irinotecan hydrochloride Drugs 0.000 description 1
- GURKHSYORGJETM-WAQYZQTGSA-N irinotecan hydrochloride (anhydrous) Chemical compound Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 GURKHSYORGJETM-WAQYZQTGSA-N 0.000 description 1
- IEECXTSVVFWGSE-UHFFFAOYSA-M iron(3+);oxygen(2-);hydroxide Chemical compound [OH-].[O-2].[Fe+3] IEECXTSVVFWGSE-UHFFFAOYSA-M 0.000 description 1
- RGXCTRIQQODGIZ-UHFFFAOYSA-O isodesmosine Chemical compound OC(=O)C(N)CCCC[N+]1=CC(CCC(N)C(O)=O)=CC(CCC(N)C(O)=O)=C1CCCC(N)C(O)=O RGXCTRIQQODGIZ-UHFFFAOYSA-O 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Chemical group CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- 108010021336 lanreotide Proteins 0.000 description 1
- 229960001739 lanreotide acetate Drugs 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 201000004962 larynx cancer Diseases 0.000 description 1
- 125000000400 lauroyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 125000002463 lignoceryl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005647 linker group Chemical group 0.000 description 1
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 150000002689 maleic acids Chemical class 0.000 description 1
- 230000036212 malign transformation Effects 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 208000006178 malignant mesothelioma Diseases 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 125000000628 margaroyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- QZIQJVCYUQZDIR-UHFFFAOYSA-N mechlorethamine hydrochloride Chemical compound Cl.ClCCN(C)CCCl QZIQJVCYUQZDIR-UHFFFAOYSA-N 0.000 description 1
- 229960002868 mechlorethamine hydrochloride Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- 229960003846 melengestrol acetate Drugs 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- KPQJSSLKKBKWEW-RKDOVGOJSA-N methanesulfonic acid;5-nitro-2-[(2r)-1-[2-[[(2r)-2-(5-nitro-1,3-dioxobenzo[de]isoquinolin-2-yl)propyl]amino]ethylamino]propan-2-yl]benzo[de]isoquinoline-1,3-dione Chemical compound CS(O)(=O)=O.CS(O)(=O)=O.[O-][N+](=O)C1=CC(C(N([C@@H](CNCCNC[C@@H](C)N2C(C=3C=C(C=C4C=CC=C(C=34)C2=O)[N+]([O-])=O)=O)C)C2=O)=O)=C3C2=CC=CC3=C1 KPQJSSLKKBKWEW-RKDOVGOJSA-N 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- BKBBTCORRZMASO-ZOWNYOTGSA-M methotrexate monosodium Chemical compound [Na+].C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C([O-])=O)C=C1 BKBBTCORRZMASO-ZOWNYOTGSA-M 0.000 description 1
- 229960003058 methotrexate sodium Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- QTFKTBRIGWJQQL-UHFFFAOYSA-N meturedepa Chemical compound C1C(C)(C)N1P(=O)(NC(=O)OCC)N1CC1(C)C QTFKTBRIGWJQQL-UHFFFAOYSA-N 0.000 description 1
- 229950009847 meturedepa Drugs 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- ZAHQPTJLOCWVPG-UHFFFAOYSA-N mitoxantrone dihydrochloride Chemical compound Cl.Cl.O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO ZAHQPTJLOCWVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004169 mitoxantrone hydrochloride Drugs 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 235000010460 mustard Nutrition 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- 208000025113 myeloid leukemia Diseases 0.000 description 1
- 230000007498 myristoylation Effects 0.000 description 1
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 1
- IVDYILJMWVOXRG-UHFFFAOYSA-N n,n-diethylethanamine;propane Chemical compound CCC.CCN(CC)CC IVDYILJMWVOXRG-UHFFFAOYSA-N 0.000 description 1
- DDBRXOJCLVGHLX-UHFFFAOYSA-N n,n-dimethylmethanamine;propane Chemical compound CCC.CN(C)C DDBRXOJCLVGHLX-UHFFFAOYSA-N 0.000 description 1
- ZUHZZVMEUAUWHY-UHFFFAOYSA-N n,n-dimethylpropan-1-amine Chemical compound CCCN(C)C ZUHZZVMEUAUWHY-UHFFFAOYSA-N 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Chemical group CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- NKFHKYQGZDAKMX-PPRKPIOESA-N n-[(e)-1-[(2s,4s)-4-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-2,5,12-trihydroxy-7-methoxy-6,11-dioxo-3,4-dihydro-1h-tetracen-2-yl]ethylideneamino]benzamide;hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 NKFHKYQGZDAKMX-PPRKPIOESA-N 0.000 description 1
- NJSMWLQOCQIOPE-OCHFTUDZSA-N n-[(e)-[10-[(e)-(4,5-dihydro-1h-imidazol-2-ylhydrazinylidene)methyl]anthracen-9-yl]methylideneamino]-4,5-dihydro-1h-imidazol-2-amine Chemical compound N1CCN=C1N\N=C\C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1\C=N\NC1=NCCN1 NJSMWLQOCQIOPE-OCHFTUDZSA-N 0.000 description 1
- BRZOTEHEMOQUOY-UHFFFAOYSA-N n-[bis(aziridin-1-yl)phosphoryl]benzamide Chemical compound C=1C=CC=CC=1C(=O)NP(=O)(N1CC1)N1CC1 BRZOTEHEMOQUOY-UHFFFAOYSA-N 0.000 description 1
- DVCWHHPODMXDAM-UHFFFAOYSA-N n-ethylethanamine;propane Chemical compound CCC.CCNCC DVCWHHPODMXDAM-UHFFFAOYSA-N 0.000 description 1
- 239000002088 nanocapsule Substances 0.000 description 1
- 201000007425 nasal cavity carcinoma Diseases 0.000 description 1
- 201000011216 nasopharynx carcinoma Diseases 0.000 description 1
- 102000004212 necdin Human genes 0.000 description 1
- 108090000771 necdin Proteins 0.000 description 1
- 229950007221 nedaplatin Drugs 0.000 description 1
- 210000001020 neural plate Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 102000045246 noggin Human genes 0.000 description 1
- 108700007229 noggin Proteins 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 231100001143 noxa Toxicity 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 238000011580 nude mouse model Methods 0.000 description 1
- 238000011903 nutritional therapy Methods 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical group CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Chemical group CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 125000002801 octanoyl group Chemical group C(CCCCCCC)(=O)* 0.000 description 1
- 201000008106 ocular cancer Diseases 0.000 description 1
- 201000002575 ocular melanoma Diseases 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical group CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 235000021313 oleic acid Nutrition 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 229950008017 ormaplatin Drugs 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 208000020668 oropharyngeal carcinoma Diseases 0.000 description 1
- 201000006958 oropharynx cancer Diseases 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 229950000370 oxisuran Drugs 0.000 description 1
- 125000001312 palmitoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 210000003695 paranasal sinus Anatomy 0.000 description 1
- 208000022775 paranasal sinus carcinoma Diseases 0.000 description 1
- 201000003913 parathyroid carcinoma Diseases 0.000 description 1
- 208000017954 parathyroid gland carcinoma Diseases 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- 108010043655 penetratin Proteins 0.000 description 1
- MCYTYTUNNNZWOK-LCLOTLQISA-N penetratin Chemical compound C([C@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(N)=O)C1=CC=CC=C1 MCYTYTUNNNZWOK-LCLOTLQISA-N 0.000 description 1
- 208000030940 penile carcinoma Diseases 0.000 description 1
- 201000008174 penis carcinoma Diseases 0.000 description 1
- VOKSWYLNZZRQPF-GDIGMMSISA-N pentazocine Chemical compound C1C2=CC=C(O)C=C2[C@@]2(C)[C@@H](C)[C@@H]1N(CC=C(C)C)CC2 VOKSWYLNZZRQPF-GDIGMMSISA-N 0.000 description 1
- 229960005301 pentazocine Drugs 0.000 description 1
- 239000000863 peptide conjugate Substances 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 208000028591 pheochromocytoma Diseases 0.000 description 1
- 125000001095 phosphatidyl group Chemical group 0.000 description 1
- 150000003905 phosphatidylinositols Chemical class 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- USRGIUJOYOXOQJ-GBXIJSLDSA-N phosphothreonine Chemical compound OP(=O)(O)O[C@H](C)[C@H](N)C(O)=O USRGIUJOYOXOQJ-GBXIJSLDSA-N 0.000 description 1
- 238000002428 photodynamic therapy Methods 0.000 description 1
- 238000001126 phototherapy Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229950005566 picoplatin Drugs 0.000 description 1
- IIMIOEBMYPRQGU-UHFFFAOYSA-L picoplatin Chemical compound N.[Cl-].[Cl-].[Pt+2].CC1=CC=CC=N1 IIMIOEBMYPRQGU-UHFFFAOYSA-L 0.000 description 1
- 208000024724 pineal body neoplasm Diseases 0.000 description 1
- 201000004123 pineal gland cancer Diseases 0.000 description 1
- NJBFOOCLYDNZJN-UHFFFAOYSA-N pipobroman Chemical compound BrCCC(=O)N1CCN(C(=O)CCBr)CC1 NJBFOOCLYDNZJN-UHFFFAOYSA-N 0.000 description 1
- 229960000952 pipobroman Drugs 0.000 description 1
- NUKCGLDCWQXYOQ-UHFFFAOYSA-N piposulfan Chemical compound CS(=O)(=O)OCCC(=O)N1CCN(C(=O)CCOS(C)(=O)=O)CC1 NUKCGLDCWQXYOQ-UHFFFAOYSA-N 0.000 description 1
- 229950001100 piposulfan Drugs 0.000 description 1
- 208000011866 pituitary adenocarcinoma Diseases 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229920001308 poly(aminoacid) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229960004293 porfimer sodium Drugs 0.000 description 1
- 150000004032 porphyrins Chemical class 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- FASDKYOPVNHBLU-ZETCQYMHSA-N pramipexole Chemical compound C1[C@@H](NCCC)CCC2=C1SC(N)=N2 FASDKYOPVNHBLU-ZETCQYMHSA-N 0.000 description 1
- 229960003089 pramipexole Drugs 0.000 description 1
- 230000013823 prenylation Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 229960001586 procarbazine hydrochloride Drugs 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 201000001514 prostate carcinoma Diseases 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 238000002331 protein detection Methods 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- MKSVFGKWZLUTTO-FZFAUISWSA-N puromycin dihydrochloride Chemical compound Cl.Cl.C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO MKSVFGKWZLUTTO-FZFAUISWSA-N 0.000 description 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 238000002673 radiosurgery Methods 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 208000020615 rectal carcinoma Diseases 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- 102200101620 rs104894442 Human genes 0.000 description 1
- 102200106293 rs1057519982 Human genes 0.000 description 1
- 102200106085 rs1057519991 Human genes 0.000 description 1
- 102200108678 rs1057520000 Human genes 0.000 description 1
- 102200104166 rs11540652 Human genes 0.000 description 1
- 102200069225 rs121434640 Human genes 0.000 description 1
- 102200104161 rs121912651 Human genes 0.000 description 1
- 102200104859 rs121912660 Human genes 0.000 description 1
- 102200104359 rs1555525012 Human genes 0.000 description 1
- 102200068968 rs200188353 Human genes 0.000 description 1
- 102200059506 rs281875236 Human genes 0.000 description 1
- 102200104154 rs28934571 Human genes 0.000 description 1
- 102200104847 rs28934574 Human genes 0.000 description 1
- 102200102887 rs28934578 Human genes 0.000 description 1
- 102220028074 rs375790538 Human genes 0.000 description 1
- 102200038489 rs397514581 Human genes 0.000 description 1
- 102200106582 rs530941076 Human genes 0.000 description 1
- 102220024291 rs59851104 Human genes 0.000 description 1
- 102200050211 rs606231264 Human genes 0.000 description 1
- 102200089545 rs662 Human genes 0.000 description 1
- 102200016737 rs72552294 Human genes 0.000 description 1
- 102200034073 rs78464826 Human genes 0.000 description 1
- 102200102859 rs786202962 Human genes 0.000 description 1
- 102220251555 rs930365498 Human genes 0.000 description 1
- 201000003804 salivary gland carcinoma Diseases 0.000 description 1
- 229960005399 satraplatin Drugs 0.000 description 1
- 190014017285 satraplatin Chemical compound 0.000 description 1
- 238000007790 scraping Methods 0.000 description 1
- 238000007423 screening assay Methods 0.000 description 1
- 229960003440 semustine Drugs 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- VBSPHZOBAOWFCL-UHFFFAOYSA-N setastine Chemical compound C=1C=CC=CC=1C(C=1C=CC(Cl)=CC=1)(C)OCCN1CCCCCC1 VBSPHZOBAOWFCL-UHFFFAOYSA-N 0.000 description 1
- 229950003911 setastine Drugs 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- UIIMBOGNXHQVGW-UHFFFAOYSA-M sodium bicarbonate Substances [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 239000012064 sodium phosphate buffer Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 229950009641 sparsomycin Drugs 0.000 description 1
- XKLZIVIOZDNKEQ-CLQLPEFOSA-N sparsomycin Chemical compound CSC[S@](=O)C[C@H](CO)NC(=O)\C=C\C1=C(C)NC(=O)NC1=O XKLZIVIOZDNKEQ-CLQLPEFOSA-N 0.000 description 1
- XKLZIVIOZDNKEQ-UHFFFAOYSA-N sparsomycin Natural products CSCS(=O)CC(CO)NC(=O)C=CC1=C(C)NC(=O)NC1=O XKLZIVIOZDNKEQ-UHFFFAOYSA-N 0.000 description 1
- 241000894007 species Species 0.000 description 1
- WWUZIQQURGPMPG-KRWOKUGFSA-N sphingosine Chemical compound CCCCCCCCCCCCC\C=C\[C@@H](O)[C@@H](N)CO WWUZIQQURGPMPG-KRWOKUGFSA-N 0.000 description 1
- GOLXNESZZPUPJE-UHFFFAOYSA-N spiromesifen Chemical compound CC1=CC(C)=CC(C)=C1C(C(O1)=O)=C(OC(=O)CC(C)(C)C)C11CCCC1 GOLXNESZZPUPJE-UHFFFAOYSA-N 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 239000008117 stearic acid Chemical group 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- URLYINUFLXOMHP-HTVVRFAVSA-N tcn-p Chemical compound C=12C3=NC=NC=1N(C)N=C(N)C2=CN3[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O URLYINUFLXOMHP-HTVVRFAVSA-N 0.000 description 1
- 229960001674 tegafur Drugs 0.000 description 1
- WFWLQNSHRPWKFK-ZCFIWIBFSA-N tegafur Chemical compound O=C1NC(=O)C(F)=CN1[C@@H]1OCCC1 WFWLQNSHRPWKFK-ZCFIWIBFSA-N 0.000 description 1
- 229960002197 temoporfin Drugs 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 208000008732 thymoma Diseases 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 229960003723 tiazofurine Drugs 0.000 description 1
- FVRDYQYEVDDKCR-DBRKOABJSA-N tiazofurine Chemical compound NC(=O)C1=CSC([C@H]2[C@@H]([C@H](O)[C@@H](CO)O2)O)=N1 FVRDYQYEVDDKCR-DBRKOABJSA-N 0.000 description 1
- MNRILEROXIRVNJ-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=NC=N[C]21 MNRILEROXIRVNJ-UHFFFAOYSA-N 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 229950002376 tirapazamine Drugs 0.000 description 1
- QVMPZNRFXAKISM-UHFFFAOYSA-N tirapazamine Chemical compound C1=CC=C2[N+]([O-])=NC(=N)N(O)C2=C1 QVMPZNRFXAKISM-UHFFFAOYSA-N 0.000 description 1
- 235000010384 tocopherol Nutrition 0.000 description 1
- 229960001295 tocopherol Drugs 0.000 description 1
- 229930003799 tocopherol Natural products 0.000 description 1
- 239000011732 tocopherol Substances 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 229960002190 topotecan hydrochloride Drugs 0.000 description 1
- 229960004167 toremifene citrate Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 108091006106 transcriptional activators Proteins 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- VXKHXGOKWPXYNA-PGBVPBMZSA-N triptorelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 VXKHXGOKWPXYNA-PGBVPBMZSA-N 0.000 description 1
- 229960004824 triptorelin Drugs 0.000 description 1
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 1
- 230000005760 tumorsuppression Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000010798 ubiquitination Methods 0.000 description 1
- 230000034512 ubiquitination Effects 0.000 description 1
- 230000004222 uncontrolled growth Effects 0.000 description 1
- 125000000297 undecanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 229960001055 uracil mustard Drugs 0.000 description 1
- 208000010570 urinary bladder carcinoma Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 206010046885 vaginal cancer Diseases 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 125000003774 valeryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 229960002730 vapreotide Drugs 0.000 description 1
- 108700029852 vapreotide Proteins 0.000 description 1
- ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N verteporfin Chemical compound C=1C([C@@]2([C@H](C(=O)OC)C(=CC=C22)C(=O)OC)C)=NC2=CC(C(=C2C=C)C)=NC2=CC(C(=C2CCC(O)=O)C)=NC2=CC2=NC=1C(C)=C2CCC(=O)OC ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N 0.000 description 1
- 229960003895 verteporfin Drugs 0.000 description 1
- AQTQHPDCURKLKT-JKDPCDLQSA-N vincristine sulfate Chemical compound OS(O)(=O)=O.C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 AQTQHPDCURKLKT-JKDPCDLQSA-N 0.000 description 1
- 229960002110 vincristine sulfate Drugs 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- 229960005212 vindesine sulfate Drugs 0.000 description 1
- BCXOZISMDZTYHW-IFQBWSDRSA-N vinepidine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@H](C2)CC)N2CCC2=C1NC1=CC=CC=C21 BCXOZISMDZTYHW-IFQBWSDRSA-N 0.000 description 1
- 229960002166 vinorelbine tartrate Drugs 0.000 description 1
- GBABOYUKABKIAF-IWWDSPBFSA-N vinorelbinetartrate Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC(C23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-IWWDSPBFSA-N 0.000 description 1
- 229960000834 vinyl ether Drugs 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 229960001771 vorozole Drugs 0.000 description 1
- XLMPPFTZALNBFS-INIZCTEOSA-N vorozole Chemical compound C1([C@@H](C2=CC=C3N=NN(C3=C2)C)N2N=CN=C2)=CC=C(Cl)C=C1 XLMPPFTZALNBFS-INIZCTEOSA-N 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- 238000001363 water suppression through gradient tailored excitation Methods 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- DVPVGSLIUJPOCJ-XXRQFBABSA-N x1j761618a Chemical compound OS(O)(=O)=O.OS(O)(=O)=O.OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(=O)CN(C)C)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(=O)CN(C)C)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 DVPVGSLIUJPOCJ-XXRQFBABSA-N 0.000 description 1
- 229950003017 zeniplatin Drugs 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4746—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used p53
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Dermatology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
本发明提供了一种分离肽。所述肽包含在空间和构型上排列为允许所述肽与p53的DNA结合结构域(DBD)通过DBD的至少一个残基相互作用的氨基酸序列,其中通过所述至少一个残基,pCAP 250(SEQ ID NO:1)结合所述DBD,其中所述肽至少部分地将突变型p53蛋白再活化,条件是所述肽不是SEQ ID NO:9‑382。
Description
发明领域和背景
本发明,在其一些实施方案中,涉及肽及其在治疗与突变型p53相关的疾病、病症或病况中的用途。
癌症是发达国家中的主要死亡原因,且随着人口的平均年龄持续上升,诊断病例数和经济影响也随之上升。癌症不是单一疾病,而是特征在于异常细胞的失控生长和扩散的一组超过200种疾病。癌症是高度异质性的疾病,并且甚至在具有相同类型和等级的癌症的患者之间,也具有肿瘤细胞表面标记物的表达和分布的主要分子差异。此外,随着癌症进展,细胞突变倾向于积累,进一步增加肿瘤异质性。大多数肿瘤细胞表现出基因组不稳定性,以及癌基因的增加表达和肿瘤抑制基因的失活。
p53基因被认为是最重要的肿瘤抑制基因,其充当针对癌症发展的主要屏障。p53蛋白响应于各种类型的细胞应激,且触发细胞周期停滞、凋亡或衰老。这通过携带p53 DNA结合基序的特异性靶标基因的转录反式激活而实现。得到广泛赞同的是,p53途径在几乎所有人类癌症中受损。p53的突变被视为恶性转化过程中的关键步骤,且超过50%的癌症病例在其p53基因中携带突变。这些突变中的大多数是靶向p53的DNA-结合核心结构域(DBD)的错义点突变,从而终止p53与其靶标位点的特异性DNA结合。这些突变阻止p53依赖性转录,且因此阻止p53介导的肿瘤抑制。不同类型的人肿瘤中的p53突变的异常高频率使得p53在参与肿瘤发育的基因之中是独特的,使得突变的p53 (Mut-p53)成为用于新型癌症疗法的有吸引力的靶标。
结构研究已经揭示,p53的DBD中的肿瘤来源的错义突变产生共同效果:DBD折叠在生理温度下的不稳定(Joerger, A.C., M.D. Allen和A.R. Fersht, Crystal structure of a superstable mutant of human p53 core domain. Insights into the mechanism of rescuing oncogenic mutations. J Biol Chem, 2004. 279(2): p. 1291-6)。这种不稳定可以是可逆的,因为一些突变型可以在降低的温度下恢复至野生型构象且结合DNA。因此,p53的大多数突变使p53蛋白折叠不稳定,导致在生理温度下的部分变性。
突变型p53蛋白在肿瘤细胞中以高水平积累,主要由于它们无法上调p53的自身破坏物Mdm2的表达。此外,许多活化p53的应激信号(如缺氧、基因组不稳定和癌基因表达)在癌细胞中得到组成型诱导。因此,预期Mut-p53的再活化发挥主要的抗肿瘤作用。此外,已经在小鼠模型中显示,p53功能的恢复在正常组织中被良好耐受,且不产生可见的毒性作用(Ventura, A., 等人, Restoration of p53 function leads to tumour regression invivo. Nature, 2007. 445(7128): p. 661-5)。
结构研究显示,错误折叠的程度在突变型间不同;然而,没有明确的替代折叠,反而有部分变性。这表明,逆转p53突变对折叠影响的“小分子”方法可适用于宽范围的突变型形式。来自结构研究的另一个重要预测是,根据质量作用定律,预期结合至所述蛋白的正确折叠部分的配体将使得平衡朝向天然折叠移动。
p53构象领域中尝试了一些校正方法。Friedler和同事提供了构象稳定肽的原理论证(Friedler, A., 等人, A peptide that binds and stabilizes p53 core domain: chaperone strategy for rescue of oncogenic mutants. Proc. Natl. Acad. Sci.USA, 2002. 99(2): p. 937-42)。基于p53 DBD和ASPP之间的复合物的晶体结构设计了九残基肽CDB3 (Samuels-Lev, Y., 等人, ASPP proteins specifically stimulate theapoptotic function of p53. Mol. Cell, 2001. 8(4): p. 781-94)。该肽显示结合Mut-p53且充当分子伴侣,将平衡朝向野生型构象移动,如对PAb1620增加的反应性所示。然而,CDB3的生物效果(Issaeva, N., 等人, Rescue of mutants of the tumor suppressorp53 in cancer cells by a designed peptide. Proc. Natl. Acad. Sci. USA, 2003.100(23): p. 13303-7)仅仅是部分的,因为Mut-p53/CDB3复合物的构象处于野生型和突变型之间的中间状态。
已经使用基于蛋白或基于细胞的测定法鉴定出靶向Mut-p53的小分子化合物(Peng, Y., 等人, Rescue of mutant p53 transcription function by ellipticine.Oncogene, 2003. 22(29): p. 4478-87)。通过筛选保护分离的p53 DBD免于热变性的分子,鉴定了CP-31398,如通过蛋白加热后PAb1620反应性的维持所评价的(Foster, B.A.,等人, Pharmacological rescue of mutant p53 conformation and function.Science, 1999. 286(5449): p. 2507-10)。CP-31398的作用机制仍不清楚。NMR研究未能检测到CP-31398与p53 DBD的任何结合(Rippin, T.M., 等人, Characterization of the p53-rescue drug CP-31398 in vitro and in living cells. Oncogene, 2002. 21(14): p. 2119-29)。CP-31398以p53依赖和非依赖的方式影响基因表达且诱导细胞死亡。因此,看来CP-3138具有p53以外的其他细胞靶标,这可能是其细胞毒性的原因。
通过使用基于细胞的筛选测定法,发现了在活癌细胞中挽救p53功能的另外两种小分子PRIMA-1和MIRA-1。PRIMA-1和MIRA-1具有类似的活性概况(Bykov, V.J., 等人,Reactivation of mutant p53 and induction of apoptosis in human tumor cells bymaleimide analogs. J Biol Chem, 2005. 280(34): p. 30384-91),但结构上无关。PRIMA-1是一种前体药物,其转换为结合突变型p53,但也结合其它分子的活性化合物(CellDeath Dis.2015 Jun 18;6:e1794. doi: 10.1038/cddis.2015.143.),并且它的一些作用似乎独立于突变型p53状态(BMC Cancer. 2015 Oct 13;15:684. doi: 10.1186/s12885-015-1667-1.)。
本发明的一些实施方案的发明人在先前已经描述了噬菌体展示用于选择mutp53-再活化肽的应用(WO2015/019318)。噬菌体肽展示文库具有比化学文库高得多的复杂度。选择过程是基于肽与固定化靶标的结合,洗脱并扩增,并最终通过测序鉴定,从而能够在短时间内筛选大量的分子。将不同的选择策略组合以选择来自不同肽文库的先导物(leads),并且深度测序所选的集合。显示先导肽在体外和活细胞中赋予mutp53野生型p53样活性,并且导致在几种异种移植模型中携带mutp53的肿瘤的消退。
发明概述
根据本发明的一些实施方案的一个方面,提供了分离肽,其包含在空间和构型上排列为允许所述肽与p53的DNA结合结构域(DBD)通过DBD的至少一个残基相互作用的氨基酸序列,其中通过所述至少一个残基,pCAP 250 (SEQ ID NO: 1)结合所述DBD,其中所述肽至少部分地将突变型p53蛋白再活化,条件是所述肽不是SEQ ID NO: 59-382。
根据本发明的一些实施方案,所述相互作用是经由DBD的螺旋-2和L1。
根据本发明的一些实施方案,所述相互作用影响DBD的螺旋-2和/或L1的结构稳定性,如通过NMR测定的。
根据本发明的一些实施方案,所述至少一个残基选自L1的H115、G117和p53的Y126和V274和G279和R280。
根据本发明的一些实施方案,所述相互作用是通过所述氨基酸序列的至少一个氨基酸。
根据本发明的一些实施方案,所述相互作用是通过所述氨基酸序列的至少两个氨基酸。
根据本发明的一些实施方案,所述相互作用是通过所述氨基酸序列的至少三个氨基酸。
根据本发明的一些实施方案,所述相互作用是通过所述氨基酸序列的至少四个氨基酸。
根据本发明的一些实施方案,所述肽包含以下氨基酸序列:
X1-X2-X3-X4-X5-X6 (SEQ ID NO: 53)
其中,
X1和X5是带正电荷的氨基酸;
X2选自Ser、Thr、Asn、Gln、Pro、Ala和Gly;
X3是任何氨基酸;
X4和X6选自α甲基氨基酸和β断裂子氨基酸。
根据本发明的一些实施方案,所述肽包含以下氨基酸序列:
X1-X2-X3-X4-X5-X6 (SEQ ID NO: 54)
其中,
X1和X5选自His、Arg和Lys;
X2选自Ser、Thr、Asn、Gln、Pro、Ala和Gly;
X3、X4、X6是任何氨基酸。
根据本发明的一些实施方案,所述带正电荷的氨基酸选自His、二氨基丁酸(Dab)、Arg和Lys。
根据本发明的一些实施方案,X3是D-氨基酸。
根据本发明的一些实施方案,X3是磷酸化的氨基酸。
根据本发明的一些实施方案,X3是不可磷酸化的氨基酸。
根据本发明的一些实施方案,X3是非氢键结合的氨基酸。
根据本发明的一些实施方案,X3选自极性不带电氨基酸和疏水氨基酸。
根据本发明的一些实施方案,X2是Ser。
根据本发明的一些实施方案,X4是α甲基氨基酸且X6是丙氨酸。
根据本发明的一些实施方案,所述分离肽具有氨基酸序列HSAPHP (SEQ ID NO:49)或HSEPHP (SEQ ID NO: 50)。
根据本发明的一些实施方案,所述分离肽包含连接至所述氨基酸序列C-端的至少一个另外的氨基酸(X7)。
根据本发明的一些实施方案,所述至少一个另外的氨基酸是带负电荷的氨基酸。
根据本发明的一些实施方案,所述至少一个另外的氨基酸选自Asp、Glu、Gly、Ala和Ser。
根据本发明的一些实施方案,所述至少一个另外的氨基酸包含两个另外的氨基酸(X7-X8)且其中X8选自His、Dab、Asp和Glu。
根据本发明的一些实施方案,所述分离肽包含连接至所述氨基酸序列N-端的至少一个另外的氨基酸。
根据本发明的一些实施方案,所述分离肽包含连接至所述氨基酸序列N-端的至少两个另外的氨基酸。
根据本发明的一些实施方案,所述连接至所述氨基酸序列N-端的至少一个另外的氨基酸是Arg。
根据本发明的一些实施方案,所述分离肽进一步包含细胞穿透部分。
根据本发明的一些实施方案,所述细胞穿透部分连接至所述肽的N-端。
根据本发明的一些实施方案,所述细胞穿透部分选自脂肪酸部分、蛋白质部分及其组合。
根据本发明的一些实施方案,所述脂肪酸部分包含肉豆蔻酰脂肪酸且所述蛋白质部分包含至少一个带正电荷的氨基酸。
根据本发明的一些实施方案,所述分离肽长度不长于20个氨基酸。
根据本发明的一些实施方案,所述肽至少部分地将突变型p53蛋白的构象改变为野生型(WT) p53蛋白的构象。
根据本发明的一些实施方案,所述肽至少部分地改变突变型p53蛋白的构象,使得所述突变型p53蛋白被针对野生型p53蛋白的单克隆抗体识别。
根据本发明的一些实施方案,所述突变型p53蛋白不被针对野生型p53蛋白的单克隆抗体识别。
根据本发明的一些实施方案,所述突变型p53蛋白在结合所述肽后,被针对野生型p53蛋白的单克隆抗体识别。
根据本发明的一些实施方案,所述单克隆抗体是Ab1620。
根据本发明的一些实施方案,所述肽至少部分地将突变型p53蛋白的活性恢复至野生型p53蛋白的活性。
根据本发明的一些实施方案,所述活性是降低表达突变型p53蛋白的细胞的生存力。
根据本发明的一些实施方案,所述活性是促进表达突变型p53蛋白的细胞的凋亡。
根据本发明的一些实施方案,所述活性是结合表达突变型p53蛋白的细胞中的p53共有DNA结合元件。
根据本发明的一些实施方案,所述共有DNA结合元件包含SEQ ID NO: 55和56所示的核酸序列。
根据本发明的一些实施方案,所述结合导致内源性p53靶标基因的至少部分活化。
根据本发明的一些实施方案,所述内源性靶标基因选自p21、MDM2和PUMA。
根据本发明的一些实施方案,所述突变型p53蛋白与野生型p53蛋白的构象不同。
根据本发明的一些实施方案,所述分离肽如SEQ ID NO: 429或448所示。
根据本发明的一些实施方案,所述分离肽如SEQ ID NO: 429、448、446、449或462所示。
根据本发明的一些实施方案,所述分离肽选自SEQ ID NO: 8和412-464。
根据本发明的一些实施方案,所述分离肽不是SEQ ID NO: 59-382中所示的任何肽。
根据本发明的一些实施方案的一个方面,提供了治疗与突变型p53蛋白相关的疾病、病症或病况的方法,其包括向有此需要的对象施用治疗有效量的如本文描述的分离肽,从而治疗所述疾病、病症或病况。
根据本发明的一些实施方案,所述方法进一步包括向所述对象施用治疗有效量的基于铂的化学疗法。
根据本发明的一些实施方案的一个方面,提供了治疗与突变型p53蛋白相关的疾病、病症或病况的方法,其包括向有此需要的对象施用治疗有效量的基于铂的化学疗法和包含氨基酸序列的分离肽,所述氨基酸序列具有的空间和构型允许所述肽与p53的DNA结合结构域(DBD)以如pCAP 250 (SEQ ID NO: 1)结合DBD的相同方式进行结合,其中所述肽至少部分地将突变型p53再活化,从而治疗所述疾病、病症或病况。
根据本发明的一些实施方案的一个方面,提供了治疗与突变型p53蛋白相关的疾病、病症或病况的方法,其包括向有此需要的对象施用治疗有效量的包含氨基酸序列的分离肽,所述氨基酸序列具有的空间和构型允许所述肽与p53的DNA结合结构域(DBD)以如pCAP 250 (SEQ ID NO: 1)结合DBD的相同方式进行结合,其中所述肽至少部分地将突变型p53再活化,且其中所述治疗有效量为每天0.01-0.3 mg/kg,从而治疗所述疾病、病症或病况。
根据本发明的一些实施方案,所述肽是如本文所述的肽。
根据本发明的一些实施方案,所述肽是pCAP 250 (SEQ ID NO: 1)。
根据本发明的一些实施方案,所述施用包括皮下施用。
根据本发明的一些实施方案,所述施用包括连续输注。
根据本发明的一些实施方案,所述疾病是癌症。
除非另有说明,本文使用的全部技术和/或科学术语具有如本发明所属领域中普通技术人员通常理解的相同含义。下文描述了示例性的方法和/或材料,但与本文所述的那些相似或等同的方法和材料可以被用于实践或测试本发明的实施方案。在冲突的情况下,以本专利说明书(包括定义)为准。另外,所述材料、方法和实例仅为说明性的且不意图是必然限制性的。
附图简述
本文参考附图,以仅示例的方式描述了本发明的一些实施方案。对于现在详细附图的具体参考,要强调的是所显示的具体内容是以示例的方式,且为了本发明的实施方案的说明性讨论的目的。对此,连同附图的说明将使得可以如何执行本发明的实施方案对于本领域技术人员显而易见。
在图中:
图1是单独或连同顺铂的pCAP-250 (SEQ ID NO: 1)在ES2卵巢癌细胞的生存力测定中的剂量应答。在96孔板中以3000个细胞/孔培养细胞。将pCAP-250的系列稀释物单独或与1µg/ml的顺铂一起添加,并且将板在37℃另外温育48h。随后将培养基移除,并通过使用在甲醇/PBS (1:5, v/v)中的结晶紫(0.05%)将细胞染色10分钟,随后使用PBS洗涤3次,来测定细胞生存力。向每孔添加10%乙酸,进行10分钟。在595 nm测定OD。使用1 µg/ml处理的ES2细胞的生存力为39%。估计pCAP-250的IC50为3.2µM并且与顺铂组合的pCAP-250的IC50估计为1.9µM,表明两种化合物之间的协同效应。
图2是显示pCAP-250 (SEQ ID NO: 1)和不同衍生物(SEQ ID NOs: 2-19)在ES2卵巢癌细胞的生存力测定中,以及对于如MST测定的对p53 DBD的结合的作用的柱状图。将表达内源mp53S241F的ES2 Con细胞,和其中使用CRISPR/Cas9将p53稳定敲除以控制对mutp53的特异性的ES2 KO细胞(ES2 p53KO),以3000个细胞/孔培养在96孔板中。以8 µg/ml的浓度添加指示的肽,并且将板在37℃另外温育48h。随后将培养基移除,并通过使用在甲醇/PBS(1:5, v/v)中的结晶紫(0.05%)将细胞染色10分钟,随后使用PBS洗涤3次,来测定细胞生存力。向每孔添加10%乙酸,进行10分钟,在595 nm测定OD。特定肽对ES2 Con相比ES KO的作用的差异,指示肽对mutp53表达的特异性。其中氨基酸(例如丝氨酸和组氨酸)被取代为丙氨酸的数种肽衍生物显示出对ES2 Con细胞的减少的作用,指示这些氨基酸对肽功效的重要性。
图3A-I和图3K是荧光标记的WTp53DBD (图3A)或全长p53 (图3B)与指示的肽(SEQID NO: 1、4、9)的结合的微量热泳(MST)分析的图。所述根据生产商的说明进行;制备各指示肽(图3A-pCAP-250) (图3A、F、H、I、K pCAP402、pCAP 404、pCAP409和pCAP 364)的10个系列稀释物;向每个肽样品添加标记的蛋白并加载至毛细管。使用不同浓度的肽分析样品的荧光wtp53DBD在温度梯度下的运动。MST分析结果以从生产商数据分析软件获得的曲线来呈现。
图4A-D显示多种施用模式的药代动力学。图4A:1 mg/kg iv施用后的pCAP-250的血浆浓度相对于时间概况(平均值±SD, n=3)。图4B:连续皮下施用7天后的pCAP-250的血浆浓度相对于时间概况(平均值±SD, n=3)。图4C:1 mg/kg iv施用后的pCAP-250的血浆浓度相对于时间概况(平均值±SD, n=3)。图4D:1 mg/kg皮下施用后的pCAP-250的血浆浓度相对于时间概况(平均值±SD, n=3)。
图5A-D:pCAP-250肽在小鼠异种移植模型中的体内效果。
将表达荧光素酶的2*105个ES2细胞注射至裸小鼠臀部。测量生物发光。注射后12天,将小鼠随机分配至4个组,并每周三次肿瘤内注射2种对照肽(pCAPs 76和12;每种肽5 μg)的混合物或pCAP-250 (10 μg)。可选地,向小鼠移植Alzet微型泵,其含有在PBS中0.8 mg对照肽或在PBS中0.8 mg pCAP-250。图5A,在实验终止时(第21天),对照组小鼠和肿瘤内pCAP-250治疗的小鼠的活体成像。图5B,在实验终止时(第14天),对照组小鼠和Alzet微型泵pCAP-250治疗的小鼠的活体成像。图5C,对照小鼠和有效的pCAP-250组:显示作为时间的函数的肿瘤中荧光素酶读数的箱线图;显示了在治疗开始之前(至第0天)和之后的平均值(水平线),标准差(盒),最高和最低读数。IVIS系统的背景阈值检测水平为约5x106个光子。图5D,对照小鼠和有效的pCAP-250组:显示作为时间的函数的肿瘤中荧光素酶读数的箱线图;显示了在治疗开始之前(至第0天)和之后的平均值(水平线),标准差(盒),最高和最低读数。IVIS系统的背景阈值检测水平为约5x106个光子。
图6A-C显示HSTPHPD肽序列在P53 DNA结合结构域(DBD)的表面上的可选预测的肽结合位置。DBD以青色卡通图像显示,且预测的肽以洋红色棒显示。图6A:DBD肽复合物的概览。图6B:DBD-肽结合交界面的更近的检查。图6C:DBD (链B)和预测的肽结合位置(链A)之间的非键相互作用的详细的原子列表。
图7显示一式三份的p53再活化肽的剂量应答效果。SW489细胞系包含p53突变型p53R273H。在96孔板中以3000个细胞/孔培养细胞。添加不同肽的系列稀释物并且将板在37℃另外温育72h。随后将培养基移除,并通过使用在甲醇/PBS (1:5, v/v)中的结晶紫(0.05%)将细胞染色10分钟,随后使用PBS洗涤3次,来测定细胞生存力。向每孔添加10%乙酸,进行10分钟。在595 nm测定OD。将结果归一化至未处理细胞100%生存力。
图8显示了一式三份的p53再活化肽的剂量应答效果。ES2细胞系包含p53突变型S241F。在96孔板中以3000个细胞/孔培养细胞。添加不同肽的系列稀释物并且将板在37℃另外温育48h。随后将培养基移除,并通过使用在甲醇/PBS (1:5, v/v)中的结晶紫(0.05%)将细胞染色10分钟,随后使用PBS洗涤3次,来测定细胞生存力。向每孔添加10%乙酸,进行10分钟。在595 nm测定OD。将结果归一化至未处理细胞100%生存力。
图9显示在293 K处获得的野生型p53核心结构域(DBD)的1H-15N HSQC谱,由Wong等人产生的DBD (SEQ ID NO: 44的94-312)谱和残基分配以黑色显示[Wong, K.B., 等人,Hot-spot mutants of p53 core domain evince characteristic local structuralchanges. Proc Natl Acad Sci U S A, 1999. 96(15): p. 8438-42]。对游离DBD (94-296)和对DBD-pCAP 250复合物产生的NMR谱分别以蓝色和红色显示。中等(C277和R280)和强烈的峰变化(G117)的实例分别以洋红色和棕色突出显示。H115和Y126的峰区域以黄色突出显示。
图10显示对于由于pCAP 250 (SEQ ID NO: 1)与DBD结合而导致的1H-15N HSQC谱变化,DBD结构的作图。DBD结构以卡通图像显示且DNA为黄色。来自Wong等人(同上)的分析的未分配的残基为绿色,且涉及在添加pCAP 250后峰变化的残基为洋红色。
图11A-B显示了H115、G117和Y126的结构重组。DBD结构以卡通图像显示且DNA为黄色。H115、G117和Y126显示为绿色棒,且L1环为洋红色。图11A和11B分别呈现了由NMR (pdb码2FEJ)解析的前两种最佳能量的DBD构象。
图12显示了在293 K获得的野生型p53 DBD-肽复合物的1H-15N HSQC谱。对DBD-pCAP 250和对DBD-pCAP 615 (SEQ ID NO: 465)蛋白肽复合物产生的NMR谱分别以红色和绿色显示。H115和Y126的峰以圆形突出显示。
图13显示了在293 K获得的野生型p53 DBD和DBD-pCAP 553 (SEQ ID NO: 429)-复合物的1H-15N HSQC谱。对游离DBD和对DBD-pCAP 553蛋白肽复合物产生的NMR谱分别以蓝色和红色显示。特异性地出现在pCAP 553肽版本中的强烈未分配的峰以绿色椭圆形突出显示。在DBD-pCAP 553复合物中变得更加致密且圆的峰的几个实例以棕色椭圆形突出显示。
图14显示DBD-pCAP 250复合物的前两种预测的肽结合模型。DBD结构以卡通图像显示且DNA为黄色。H115、G117和Y126显示为绿色棒,且L1环为洋红色。DBD-pCAP 250复合物的前两种预测的肽结合模型为青色。
发明详述
本发明,在其一些实施方案中,涉及肽及其在治疗与突变型p53相关的疾病、病症或病况中的用途。
在详细解释本发明的至少一个实施方案之前,应当理解本发明不一定将其应用限制于以下说明中所示或通过实施例示例的细节。本发明能够具有其它实施方案或能够以各种方式实践或实施。
本发明的一些实施方案的发明人在先前已经描述了噬菌体展示用于选择mutp53-再活化肽的应用(WO2015/019318,其通过引用以其整体并入本文)。显示包括pCAP 250(SEQ ID NO: 1)的先导肽在体外和活细胞中赋予mutp53野生型p53样活性,并且导致在几种异种移植模型中携带mutp53的肿瘤的消退。
在将本发明变成实践时,本发明人已经发现pCAP 250结合p53的DNA结合结构域(DBD)。使用丙氨酸扫描的结构/功能分析揭示了pCAP 250结合DBD的共有序列。
NMR实验结果提供了pCAP 250及其肽变体明确结合p53蛋白的野生型DBD的进一步证据。这些结果支持了使用微量热泳(MST)分析(图3A-I和图3K)的关于pCAP 250与DBD结合的发现。NMR结果进一步指示pCAP 250及其肽变体的结合诱导DBD中的结构变化,其直接影响了DBD-DNA结合界面区(即螺旋-2和L1环结构基序,其对于DBD结合DNA的能力至关重要)的完整性和稳定性。pCAP 250及其肽变体的结合进一步影响了螺旋2和L1环结构基序周围的另外的残基,在DBD表面产生相对大且明确受影响斑块(patch)。
这些发现允许设计新型肽,所述肽与p53的DBD共享相同的相互作用,且能够至少部分地使突变型p53再活化,被赋予抗癌活性的此类肽显示于实施例5中。
因此,根据本发明的一个方面,提供了分离肽,所述肽包含在空间和构型上排列为允许所述肽与p53的DNA结合结构域(DBD)通过DBD的至少一个残基相互作用的氨基酸序列,其中通过所述相同的至少一个残基,pCAP 250 (SEQ ID NO: 1)结合所述DBD,其中所述肽至少部分地将突变型p53再活化。
根据具体的实施方案,所述肽不是WO2015/019318的SEQ ID NO: 1-338,368-382(即本文的SEQ ID NO: 59-382)。
根据具体的实施方案,所述肽不是WO2015/019318 (通过引用以其整体并入本文)中教导的具有使突变型p53再活化的活性的任何肽。
如本文所用的术语“分离的”是指至少部分地与自然环境(例如与身体或从肽文库)分开。
如本文所用的术语“p53”也被称为“TP53”,是指编码EC 2.7.1.37的蛋白产物的基因序列,其通常作为转录因子起作用,调节细胞周期,因此在其野生型形式下作为肿瘤抑制基因起作用。根据具体的实施方案,p53是人p53。
如本文所用,术语“野生型p53”、“wt p53”和“WT p53”可互换地使用并且涉及野生型p53蛋白,具有野生型p53蛋白的构象且因此具有野生型p53蛋白的活性。在一些实施方案中,野生型p53可以通过特异性单克隆抗体鉴定。在某些实施方案中,所述单克隆抗体是Ab1620。
所述蛋白的结构数据可以得自PDBeRCSB。
关于蛋白的术语“构象”涉及蛋白在空间中的结构排列(折叠)。
如本文所用,术语“突变型p53”、“Mut-p53”、“突变的p53”和“p53突变型”可互换地使用且涉及突变的p53蛋白,其不能有效地在靶标细胞中起作用。在一些实施方案中,突变型p53不能结合其靶标位点。在一些实施方案中,突变型p53在DNA结合结构域(DBD)区域突变。在一些实施方案中,突变型p53错误折叠成失活构象。在一些示例性实施方案中,突变型p53是温度敏感型(ts)突变型p53R249S (R249S p53)、热点全长突变型p53 Mut-p53 R175H(R175H p53)或任何其他突变型p53蛋白。在一些实施方案中,通过特异性单克隆抗体鉴定突变型p53,所述抗体能够识别p53的错误折叠构象(由p53的突变诱导)。在一些实施方案中,突变型p53通过特异性单克隆抗体鉴定。在某些实施方案中,所述单克隆抗体是Ab420。
在某些实施方案中,突变型p53蛋白包含选自以下的突变:R175H、V143A、R249S、R273H、R280K、P309S、P151S、P151H、C176S、C176F、H179L、Q192R、R213Q、Y220C、Y220D、R245S、R282W、D281G、S241F、C242R、R248Q、R248W、D281G、R273C和V274F。每种可能代表本发明的一个单独的实施方案。
如本文所述的术语“再活化肽”、“突变型p53再活化肽”或“所述肽”可以互换地使用并且涉及能够至少部分地使突变型p53恢复活性的肽。如本文所用的短语“再活化突变型p53蛋白”是指这样的肽,在其与突变型p53蛋白相互作用后,增加了所述突变型p53蛋白的至少一种活性,其中所述活性是野生型p53蛋白的活性。例如,在与本发明提供的肽相互作用后,突变型p53蛋白可以以野生型p53蛋白在相似情况下的相似方式,直接或间接地增加促凋亡蛋白(诸如半胱天冬酶)在癌细胞中的表达;或在体内抑制肿瘤,如可以使用疾病的异种移植小鼠模型测定的。
不受到理论的制约,这表明所述再活化肽在DBD结合突变型p53并且热力学地稳定野生型p53蛋白折叠并且因此恢复肿瘤抑制功能。
在一些实施方案中,所述再活化肽可以通过影响突变型p53的构象,再活化突变型p53,以呈现与天然的野生型p53更相似或相同的构象。在一些实施方案中,所述再活化肽可以再活化突变型p53以恢复突变型p53与靶标DNA中的野生型p53结合位点的结合。在一些实施方案中,所述再活化肽可以恢复突变型p53的生化性质。在一些实施方案中,所述再活化肽可以诱导突变型p53蛋白以展示癌细胞的p53-选择性抑制。在一些实施方案中,所述再活化肽可以再活化突变型p53,以使其具有与野生型p53相似(即,在突变型p53和野生型p53之间±, 10%、20%、30%的差异)或相同的结构性质、生化性质、生理性质和/或功能性质,诸如本文描述的结合/结构测定(例如MST和NMR)所确定的。
在一些实施方案中,所述再活化肽是具有3-30个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有7-30个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有12-30个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有3-25个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有7-25个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有12-25个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有3-22个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有7-22个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有12-22个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有7-9个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有6-9个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有7-10个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是具有6-10个氨基酸的长度的肽。在一些实施方案中,所述再活化肽是长度为9-10个氨基酸的肽。在一些实施方案中,所述再活化肽是长度为8-10个氨基酸的肽。在一些实施方案中,所述再活化肽是长度为6-9个氨基酸的肽。在一些实施方案中,所述再活化肽是长度为6-8个氨基酸的肽。在一些实施方案中,所述再活化肽是长度为6-7个氨基酸的肽。在一些实施方案中,所述再活化肽是长度为7-8个氨基酸的肽。在一些实施方案中,所述再活化肽是长度为7-9个氨基酸的肽。在一些实施方案中,所述再活化肽是长度为5-20个氨基酸的肽。在一些实施方案中,所述再活化肽是长度为6-15个氨基酸的肽。在一些实施方案中,所述再活化肽是长度为7或12个氨基酸的肽。
如在本文中可互换使用的术语“能够至少部分地再活化突变型p53蛋白”或“至少部分地再活化突变型p53蛋白”是指这样的肽,其中当所述肽与突变型p53蛋白结合后,突变型p53蛋白获得或增加了与野生型p53蛋白相应活性相似的活性。
如本文所用的p53的“DNA结合结构域”或“DBD”是指p53的结合靶蛋白中p53应答元件的结构域(例如共有DNA结合元件包含SEQ ID NO: 44所示的氨基酸序列或由其组成),其通常归于人p53 (全长p53 GenBank: BAC16799.1,SEQ ID NO: 44)的残基94-292、91-292、94-293、94-296、91-296、91-293、94-312或92-312。根据具体的实施方案,所述DBD是突变的p53的。
如提及的,所述肽包含在空间和构型上排列为允许所述肽与p53的DBD通过至少一个DBD的残基相互作用的氨基酸序列,其中pCAP 250 (SEQ ID NO: 1)通过所述至少一个残基与DBD结合。
因此,根据本发明的一些实施方案的再活化肽通常与p53的DBD结构域结合,使得所述肽的反应基团定位于足够接近DBD中相应的反应基团(通常为氨基酸残基的侧链),从而允许在DBD中存在有效浓度的所述肽,并且另外地,所述肽的反应基团以适当的方向定位,以允许重叠和因此允许强化学相互作用和低解离。根据本发明的一些实施方案的再活化肽因此通常包括已知参与相互作用的结构元件,并且还可以具有其构象灵活性的限制,从而避免影响或减弱其与p53的DBD结合的构象变化。
根据一些实施方案,所述相互作用是经由所述DBD的螺旋-2和L1。
通常,螺旋-2定位于氨基酸276-289之间,且L1位于氨基酸112-124之间。
根据一些实施方案,所述相互作用影响所述DBD的螺旋-2和/或L1的结构稳定性,如通过NMR测定的。
根据一些实施方案,DBD中介导与所述肽相互作用的至少一个残基选自:p53的L1的H115、G117和p53的Y126和V274和G279和R280 (野生型或突变型,其中氨基酸差异通常是不显著影响氨基酸编号的单一氨基酸)。但是,技术人员将知晓如何找到相应的氨基酸(就突变型p53中的组成和位置而言)。
根据一些实施方案,所述肽与DBD的相互作用是非共价的,例如水介导的氢键结合相互作用。
根据一些实施方案,所述相互作用是通过所述氨基酸序列的至少一个氨基酸。
根据一些实施方案,所述相互作用是通过所述氨基酸序列的至少两个氨基酸。
根据一些实施方案,所述相互作用是通过所述氨基酸序列的至少三个氨基酸。
根据一些实施方案,所述相互作用是通过所述氨基酸序列的至少四个氨基酸。
根据具体的实施方案,所述相互作用是与人p53的氨基酸Trp146和/或Gln144。这种相互作用可能经由pCAP 250的Ser或类似结构的其类似物,如下文进一步描述的。
根据具体的实施方案,所述相互作用是与人p53的氨基酸Tyr126、Asn128和/或Asp268。
根据另一个具体的实施方案,所述相互作用是与人p53的氨基酸Lys101,经由pCAP250的Asp10或类似结构的其类似物,如下文进一步描述的。
根据另一个具体的实施方案,所述相互作用是与人p53的氨基酸Thr102,经由pCAP250的Asp10或类似结构的其类似物,如下文进一步描述的。
根据另一个具体的实施方案,所述相互作用是与人p53的氨基酸Phe113,经由pCAP250的Thr6或类似结构的其类似物,如下文进一步描述的。
根据另一个具体的实施方案,所述相互作用是与人p53的氨基酸Trp146,经由pCAP250的Ser5或类似结构的其类似物,如下文进一步描述的。
根据另一个具体的实施方案,所述相互作用是与人p53的氨基酸Ser5,经由pCAP250的Thr6或类似结构的其类似物,如下文进一步描述的。
根据另一个具体的实施方案,所述相互作用是与人p53的氨基酸His8,经由pCAP250的Thr6或类似结构的其类似物,如下文进一步描述的。
根据另一个具体的实施方案,所述相互作用是与人p53的氨基酸Gly112,经由pCAP250的Ser5或类似结构的其类似物,如下文进一步描述的。
根据另一个具体的实施方案,所述相互作用是与人p53的氨基酸Gly112,经由pCAP250的Thr6或类似结构的其类似物,如下文进一步描述的。
另外提出的用于在p53 DBD表面上的相互作用的位置在图6A-C列出,其被认为是说明书的一部分,其中每种可能代表了一个独立的实施方案。
另外提出的用于在p53 DBD表面上的相互作用的位置在图9-14列出,其被认为是说明书的一部分,其中每种可能代表了一个独立的实施方案。
阐明在所述肽或在所述DBD中对相互作用非常重要的氨基酸的方法是本领域熟知的并且包括,但不限于晶体学,以及使用基于计算机的算法,例如AnchorDock (Ben ShimonStructure.2015 May 5;23(5):929-40),虚拟晶体学计算器V.2.等。
根据具体的实施方案,所述肽包含共有基序。
如本文使用的术语“共有基序”是指连续或不连续的至少3个氨基酸、4、5或6个氨基酸的氨基酸序列。根据具体的实施方案,所述共有基序是6个连续氨基酸的长度。
根据具体的实施方案,所述肽包含以下氨基酸序列:
X1-X2-X3-X4-X5-X6 (SEQ ID NO: 53)
其中,
X1和X5是带正电荷氨基酸;
X2选自Ser、Thr、Asn、Gln、Pro、Ala和Gly;
X3是任何氨基酸;
X4和X6选自α甲基氨基酸和β断裂子氨基酸。
根据具体的实施方案,所述肽包含以下氨基酸序列:
X1-X2-X3-X4-X5-X6 (SEQ ID NO: 54)
其中,
X1和X5选自His、Arg和Lys;
X2选自Ser、Thr、Asn、Gln、Pro、Ala和Gly;
X3、X4、X6是任何氨基酸。
如本文所用的“带正电荷氨基酸”是可以在生理pH下带正电(即质子化)的氨基酸。
根据一个实施方案,所述带正电荷氨基酸选自His、二氨基丁酸(Dab)、Arg和Lys。
根据具体的实施方案,X3是D-氨基酸。
根据具体的实施方案,X3是磷酸化的(例如磷酸丝氨酸)或其仿磷酸化物(例如Glu或Asp)。
根据具体的实施方案,X3是不可磷酸化的氨基酸(例如Val)。
根据具体的实施方案,X3是非氢键结合的氨基酸(例如Ala)。
根据具体的实施方案,X3选自极性不带电荷氨基酸(例如Ser)和疏水氨基酸(例如Ile)。
根据具体的实施方案,X2是Ser。
根据具体的实施方案,X4和X6选自Ser、Thr、Pro、Ala和Gly。
根据具体的实施方案,X4是α甲基氨基酸或β断裂子,例如Pro、Aib或Ala。
根据具体的实施方案,X4是α甲基氨基酸。
根据具体的实施方案,X6是Ala。
根据具体的实施方案,所述肽具有氨基酸序列HSAPHP (SEQ ID NO: 46)。
根据具体的实施方案,所述肽包含连接至所述氨基酸序列C-端的至少一个另外的氨基酸(X7)。
根据具体的实施方案,所述至少一个另外的氨基酸是带负电荷的氨基酸(即在生理pH下通常带负电(即去质子化)的氨基酸)或小氨基酸(例如Gly、Ala、Val)。
根据具体的实施方案,所述至少一个另外的氨基酸选自Asp、Glu、Gly、Ala和Ser。
根据具体的实施方案,所述至少一个带负电荷的氨基酸是Asp。
根据具体的实施方案,所述至少一个另外的氨基酸包含两个另外的氨基酸(X7-X8)且其中所述X8选自His、Dab、Asp和Glu。
根据具体的实施方案,所述至少一个带负电荷的氨基酸是Asp或两个连续Asp残基。
根据具体的实施方案,所述肽包含连接至所述氨基酸序列N-端的至少一个另外的氨基酸。
根据具体的实施方案,所述肽包含连接至所述氨基酸序列N-端的至少两个另外的氨基酸。
根据具体的实施方案,连接至所述氨基酸序列N-端的至少一个另外的氨基酸是Arg或两个连续的Arg残基。
所述肽与DBD的结合可以使用本领域已知的任何方法确定,诸如竞争测定,其中使用可溶性DBD作为竞争剂。
如本文所用的术语“重组或合成肽”是指通过本领域已知的标准生物技术方法产生的肽,诸如在细菌中表达或固相肽合成(SPPS)。
根据具体的实施方案,所述肽进一步包含细胞穿透部分,其可以连接至所述肽的N-端、所述肽的C-端或所述肽的两个末端。应当理解,这个部分还可以不经由其末端结合至肽主体,只要其不干扰所述肽与DBD的结合。应当理解,这个部分是异源部分,其不以相同方式(即,在位置或化学方面)结合天然的肽。
如本文使用的术语“穿透性”是指试剂或物质穿透、弥散或分散通过屏障、膜或皮肤层的能力。“细胞穿透性”或“细胞穿透”部分是指能够促进或增强分子通过膜穿透的本领域已知的任何分子。
如本文所用的短语“穿透性增强部分”是指增强任何连接的肽跨越细胞膜的转位的试剂。
可以使用本领域中已知的主动或被动促进或增加组合物至细胞内的穿透性的任何部分,用于与根据本发明的肽核心缀合。非限制性的实例包括:疏水部分诸如脂肪酸、类固醇和大体积芳族或脂肪族化合物;可以具有细胞膜受体或载体的部分,诸如类固醇、维生素和糖、天然(例如带正电荷的氨基酸,例如Lys或Arg)和非天然氨基酸和蛋白部分,例如转运肽,也被称为“细胞穿透肽”或CPP、多聚精氨酸或多聚赖氨酸、其组合,或抗体。根据一些实施方案,所述蛋白质部分是CPP。根据一些实施方案,所述蛋白质部分是多精氨酸。根据一些实施方案,所述疏水部分是脂质部分或氨基酸部分。根据本发明的一些实施方案,所述细胞穿透部分是蛋白部分和基于脂质部分的组合(例如,一个来自肽的N端且另一个来自肽的C端)。
细胞穿透肽(CPP)是短肽(≤40个氨基酸),具有获得进入几乎任何细胞内部的能力。它们高度阳离子性并且通常富含精氨酸和赖氨酸氨基酸。事实上,本发明人已经使用带正电荷的氨基酸(在任一肽末端)或多聚阳离子氨基酸(至少2个,例如2-12个)多聚-Arg来赋予所述肽细胞穿透性。它们具有将各种共价和非共价缀合的负荷,诸如蛋白质、寡核苷酸和甚至200nm的脂质体携带进入细胞的优越性质。因此,根据另外的示例性实施方案,CPP可以用于将肽转运至细胞内部。
TAT (来自HIV-1的转录激活因子)、pAntp (也称为穿透素(penetratin),果蝇触角足基因同源结构域转录因子)和VP22 (来自单纯性疱疹病毒)是CPP的实例,其可以以无毒且有效的方式进入细胞并且可适合用于本发明的一些实施方案。产生CPP-负荷缀合物和使用此类缀合物感染细胞的方案可以见于,例如L Theodore等人[The Journal ofNeuroscience, (1995) 15(11): 7158-7167], Fawell S, 等人[Proc Natl Acad SciUSA, (1994) 91:664–668],和Jing Bian等人[Circulation Research (2007) 100:1626-1633]。
然而,本公开并不限于此,且可以使用任何合适的穿透剂,如本领域技术人员已知的。
当本发明的肽连接至细胞穿透肽时,可以理解为全长肽不大于50个氨基酸、不大于40个氨基酸、不大于35氨基酸、不大于30氨基酸、不大于25氨基酸、不大于22氨基酸、不大于20氨基酸、不大于15氨基酸、不大于12氨基酸、不大于10氨基酸、不大于9个氨基酸、不大于8氨基酸,或不大于7氨基酸。
非蛋白质的细胞穿透部分的非限制实例包括:疏水部分诸如脂质、脂肪酸、类固醇和大体积芳族或脂肪族化合物;可以具有细胞膜受体或载体的部分,诸如类固醇、维生素和糖,纳米颗粒和脂质体。
如本文所用的术语“脂肪酸部分”是指脂肪酸的部分,其展示与相应的完整脂肪酸来源分子相似的具体的化学和药理学特征的组。该术语进一步是指包含脂肪(羧)酸的酰基组分的任何分子种类和/或分子片段。
根据本发明的穿透性增强部分优选经由直接键合或经由接头共价连接至所述肽序列,以形成肽缀合物。所述穿透性增强部分可以直接或通过间隔物连接至所述肽部分的任何位置,优选连接至肽的氨基末端。根据某些实施方案,所述穿透性增强部分是脂肪酸。
根据本发明的疏水部分可以优选包含脂质部分或氨基酸部分。根据具体的实施方案,所述疏水部分选自:磷脂类、类固醇类、鞘氨醇、神经酰胺类、辛基-甘氨酸、2-环己基丙氨酸、苯甲酰基苯丙氨酸、丙酰基(C3);丁酰基(C4);戊酰基(C5);己酰基(C6);庚酰基(C7);辛酰基(C8);壬酰基(C9);癸酰基(C10);十一烷酰基(C11);月桂酰基(C12);十三烷酰基(C13);肉豆蔻酰基(C14);十五烷酰基(C15);棕榈酰基(C16);phtanoyl ((CH3)4);十七烷酰基(C17);硬脂酰基(C18);十九烷酰基(C19);花生酰基(arachidoyl) (C20);二十一烷酰基(heniecosanoyl) (C21);山萮酰基(C22);二十三烷酰基(trucisanoyl) (C23);和二十四烷酰基(lignoceroyl) (C24);其中所述疏水部分以酰胺键、巯基、胺、醇、酚基或碳-碳键连接至所述嵌合多肽。
根据本发明可以使用的脂类部分的其它实例为:Lipofectamine、Transfectace、Transfectam、Cytofectin、DMRIE、DLRIE、GAP-DLRIE、DOTAP、DOPE、DMEAP、DODMP、DOPC、DDAB、DOSPA、EDLPC、EDMPC、DPH、TMADPH、CTAB、赖氨酰-PE、DC-Cho、-丙氨酰胆固醇;DCGS、DPPES、DCPE、DMAP、DMPE、DOGS、DOHME、DPEPC、普兰尼克(Pluronic)、Tween、BRIJ、缩醛磷脂、磷脂酰乙醇胺,磷脂酰胆碱、甘油-3-乙基磷脂酰胆碱、二甲基铵丙烷、三甲基铵丙烷、二乙基铵丙烷、三乙基铵丙烷、二甲基双十八烷基溴化铵、鞘脂类,鞘磷脂、溶血脂(lysolipid)、糖脂(glycolipid)、硫苷脂(sulfatide)、鞘糖脂、胆固醇、胆固醇酯、胆固醇盐、油、N-琥珀酰基二油酰基磷脂酰乙醇胺、1,2-二油酰基-sn-甘油、1,3-二棕榈酰基-2-琥珀酰基甘油、1,2-二棕榈酰基-sn-3-琥珀酰基甘油、1-十六烷基-2-棕榈酰基甘油基磷脂酰乙醇胺、棕榈酰基高半胱氨酸、N,N'-双(十二烷基氨基羰基亚甲基)-N,N'-双((-N,N,N-三甲基铵乙基-氨基羰基亚甲基)乙二胺四碘化物;N,N''-双(十六烷基氨基羰基亚甲基)-N,N',N''-三((-N,N,N-三甲基铵-乙基氨基羰基亚甲基二亚乙基三胺六碘化物;N,N'-双(十二烷基氨基羰基亚甲基)-N,N''-双((-N,N,N-三甲基铵乙基氨基羰基亚甲基)亚环己基-1,4-二胺四碘化物;1,7,7-四-((-N,N,N,N-四甲基铵乙基氨基-羰基亚甲基)-3-十六烷基氨基羰基-亚甲基-1,3,7-三氮杂庚烷七碘化物;N,N,N',N'-四((-N,N,N-三甲基铵-乙基氨基羰基亚甲基)-N'-(1,2-二油酰基甘油基-3-磷酰乙醇氨基羰基亚甲基)二亚乙基三胺四碘化物;二油酰基磷脂酰乙醇胺、脂肪酸、溶血脂、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰甘油、磷脂酰肌醇、鞘脂、糖脂、糖脂(glucolipid)、硫苷脂、鞘糖脂、磷脂酸、棕榈酸、硬脂酸、花生四烯酸、油酸、携带聚合物的脂质、携带磺化糖的脂质、胆固醇,生育酚半琥珀酸酯、具有醚连接的脂肪酸的脂质、具有酯连接的脂肪酸的脂质、聚合脂质,磷酸二乙酰酯、硬脂胺、心磷脂、具有6-8个碳长度的脂肪酸的磷脂、具有不对称酰基链的磷脂、6-(5-胆甾烯(cholesten)-3b-基氧基)-1-硫代-b-D-吡喃半乳糖苷、二半乳糖基二甘油酯、6-(5-胆甾烯-3b-基氧基)己基-6-氨基-6-脱氧-1-硫代-b-D-吡喃半乳糖苷、6-(5-胆甾烯-3b-基氧基)己基-6-氨基-6-脱氧-1-硫代-a-D-吡喃甘露糖苷、12-(((7'-二乙基氨基-香豆素-3-基)羰基)甲基氨基)-十八烷酸;N-[12-(((7'-二乙基氨基香豆素-3-基)羰基)甲基-氨基)十八烷酰基]-2-氨基棕榈酸;胆甾醇)4'-三甲基-铵基)丁酸酯;N-琥珀酰基二油酰基-磷脂酰乙醇胺;1,2-二油酰基-sn-甘油;1,2-二棕榈酰基-sn-3-琥珀酰基-甘油;1,3-二棕榈酰基-2-琥珀酰基甘油、1-十六烷基-2-棕榈酰基甘油基-磷酸乙醇胺和棕榈酰基高半胱氨酸。
术语“多肽”和“肽”在本文中可互换使用,是指氨基酸残基的聚合物。所述术语适用于其中一个或多个氨基酸残基是相应天然存在的氨基酸的人工化学类似物的氨基酸聚合物,以及适用于天然存在的氨基酸聚合物。
如本文使用的术语“肽”涵盖天然肽(降解产物、合成的合成肽或重组肽)和拟肽(通常为合成的合成肽),以及类肽和半肽,它们是肽类似物,可以具有例如使肽在体内时更稳定或更能够穿透至细胞内的修饰。这样的修饰包括,但不限于N端修饰,C端修饰,肽键修饰,主链修饰和残基修饰。制备拟肽化合物是方法是本领域熟知的,并且例如在Quantitative Drug Design, C.A. Ramsden Gd., Chapter 17.2, F. Choplin PergamonPress (1992)中指出,其通过引入并入本文,如同完全在本文中阐述。下文提供了这方面的进一步的细节。
所述肽内的肽键(-CO-NH-)可以被取代,例如,通过N-甲基化酰胺键(-N(CH3)-CO-)、酯键(-C(=O)-O-)、酮亚甲基键(-CO-CH2-)、亚磺酰基亚甲基键(-S(=O)-CH2-)、α-氮杂键(-NH-N(R)-CO-),其中R是任何烷基(例如,甲基)、胺键(-CH2-NH-)、硫键(-CH2-S-)、亚乙基键(-CH2-CH2-)、羟亚乙基键(-CH(OH)-CH2-)、硫代酰胺键(-CS-NH-)、烯族双键(-CH=CH-)、氟化烯族双键(-CF=CH-)、逆酰胺键(-NH-CO-)、肽衍生物(-N(R)-CH2-CO-),其中R是“正常”侧链,天然地存在于碳原子上。
这些修饰可以发生在肽链的任何键上并且甚至可以同时在几个(2-3)键上发生。
“保守取代”是指一种类型中的氨基酸被相同类型中的氨基酸取代,其中类型通过共同的物理-化学氨基酸侧链性质和自然界中发现的同源蛋白中的高取代频率来定义,如例如通过标准Dayhoff频率交换矩阵或BLOSUM矩阵来确定。已经归类出氨基酸侧链的六个一般类型且包括:I类(Cys);II类(Ser、Thr、Pro、Ala、Gly);III类(Asn、Asp、Gin、Glu);IV类(His、Arg、Lys);V类(He、Leu、Val、Met);和VI类(Phe、Tyr、Trp)。例如,用Asp取代另一III类残基诸如Asn、Gin或Glu是保守取代。
其它分类包括带正电氨基酸(Arg、His、Lys)、带负电氨基酸(Asp、Glu)、极性不带电(Ser、Thr、Asn、Gln)、疏水侧链(Ala、Val、Ile、Leu、Met、Phe、Tyr、Trp)。
“非保守取代”是指一种类型中的氨基酸被来自另一种类型的氨基酸取代;例如,Ala (II类残基)被III类残基(诸如Asp、Asn、Glu或Gin)取代。
天然芳族氨基酸Trp、Tyr和Phe可以被非天然芳族氨基酸诸如1,2,3,4-四氢异喹啉-3-羧酸(Tic)、萘基丙氨酸、Phe的环-甲基化衍生物、Phe的卤代衍生物或O-甲基-Tyr取代。其它合成选项列于下文表2中。
本发明的一些实施方案的肽还可以包括一种或多种经修饰的氨基酸或一种或多种非氨基酸单体(例如脂肪酸、复合碳水化合物等)。
术语“(一种或多种)氨基酸”被理解为包括20种天然存在的氨基酸;这些氨基酸在体内通常翻译后修饰,包括例如羟基脯氨酸、磷酸丝氨酸和磷酸苏氨酸;和其它非天然氨基酸包括,但不限于2-氨基己二酸、羟基赖氨酸、异锁链赖氨素、正缬氨酸、正亮氨酸和鸟氨酸。此外,术语“氨基酸”包括D-和L-氨基酸两者。
下文的表1和表2列出了天然存在的氨基酸(表1)和非常规氨基酸或经修饰的氨基酸(例如合成的,表2),其可以用于本发明的一些实施方案中。
表1
| 氨基酸 | 三字母缩写 | 单字母符号 |
| 丙氨酸 | Ala | A |
| 精氨酸 | Arg | R |
| 天冬酰胺 | Asn | N |
| 天冬氨酸 | Asp | D |
| 半胱氨酸 | Cys | C |
| 谷氨酰胺 | Gln | Q |
| 谷氨酸 | Glu | E |
| 甘氨酸 | Gly | G |
| 组氨酸 | His | H |
| 异亮氨酸 | Ile | I |
| 亮氨酸 | Leu | L |
| 赖氨酸 | Lys | K |
| 甲硫氨酸 | Met | M |
| 苯丙氨酸 | Phe | F |
| 脯氨酸 | Pro | P |
| 丝氨酸 | Ser | S |
| 苏氨酸 | Thr | T |
| 色氨酸 | Trp | W |
| 酪氨酸 | Tyr | Y |
| 缬氨酸 | Val | V |
| 如上的任何氨基酸 | Xaa | X |
表2
本发明的一些实施方案的肽优选以线性形式使用,尽管将理解,在环化没有严重干扰肽特征的情况下,也可以使用肽的环状形式。
为了改善生物利用度,所述肽可以包含至少一个D氨基酸(例如2-7个、2-6个、2-5个、2-4个、2-3个)。根据具体的实施方案,所述肽中的全部氨基酸都是D氨基酸。
在一些实施方案中,所述肽是化学修饰的。
“化学修饰的”是指通过天然过程或通过本领域众所周知的化学修饰技术修饰的氨基酸。在许多已知的修饰中,典型但不排他的实例包括:乙酰化、酰化、酰胺化、ADP-核糖基化、糖基化、糖胺多糖化、GPI锚形成、脂质或脂质衍生物的共价连接、甲基化、肉豆蔻酰化(myristlyation)、聚乙二醇化、异戊二烯化、磷酸化、泛素化或任何类似过程(参见例如,SEQ ID NO: 2、17-19)。
根据具体的实施方案,所述肽可以包含C端酰胺化。
还可选地或另外地,所述肽可以缀合至非蛋白、非毒性部分,诸如但不限于聚乙二醇(PEG)、聚乙烯吡咯烷酮(PVP)、聚(苯乙烯共马来酸酐)(SMA),和二乙烯醚和马来酸酐共聚物(DIVEMA)。
应理解,本发明的肽还可以利用展示出期望活性(例如p53突变型的再活化)的肽同源物,在本文中也称作功能等同物,借以根据本领域已知的方法(诸如本文所述的)确定肽同源物的活性。此类同源物可以是例如,与SEQ ID NO: 53或54或1至少80%、至少81%、至少82%、至少83%、至少84%、至少5%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同(只要其不是WO2015/019318中公开的肽(例如SEQ ID NO: 286-321))。
根据具体的实施方案,所述肽包含氨基酸序列或如SEQ ID NO: 8、412-464中所示。
根据具体的实施方案,所述肽选自以下序列:SEQ ID NO: 429、448、449、446和462。
在某些实施方案中,所述肽至少部分地将突变型p53蛋白的构象改变为野生型(WT) p53蛋白的构象。
本领域已知,仅特异性识别野生型p53蛋白的抗体。此类抗体在确定某些p53蛋白(野生型或突变型)是否维持了野生型的功能p53蛋白的构象中高度有用。因此,在某些实施方案中,所述肽至少部分地改变突变型p53蛋白的构象,使得所述突变型p53蛋白被专门针对野生型p53蛋白或针对保持野生型p53蛋白构象的p53蛋白的单克隆抗体识别。在某些实施方案中,所述单克隆抗体是Ab1620。
应当理解,因为p53从两个等位基因表达,细胞内p53总含量可以为野生型(wt/wt)、野生型和突变型p53的混合物(wt/mut),或仅突变型p53 (当两个等位基因均突变(mut/mut),或一个等位基因缺失(mut/-)时)。在癌症中,情况通常是wt/mut、mut/mut或mut/-。因为p53作为四聚体起作用,突变型p53蛋白可以使可存在于癌细胞中的野生型p53蛋白的活性被废除。因此,本发明提供的肽特别可用于治疗其中野生型p53蛋白的水平增加没有产生结果的癌症。
在某些实施方案中,所述肽至少部分地将突变型p53蛋白的活性恢复为野生型p53蛋白的活性的至少一种。
如本文所用的术语“减少”是指在相同测定条件下,与对照(例如使用对照媒介物处理或完全没有处理的相同细胞/动物系统)相比,使特定表型在统计上显著地下降至少约10%、20%、30%、40%、50%、60%、70%、75%、80%、95%或甚至100%。
如本文所用的术语“增加”或“改善”是指在相同测定条件下,与对照(例如使用对照媒介物处理或完全没有处理的相同细胞/动物系统)相比,使特定表型在统计上显著地增加至少约10%、20%、30%、40%、50%、60%、70%、75%、80%、95%或甚至100%。
如本文所用的术语“表达突变型p53蛋白的细胞”是指从至少一个等位基因表达突变型p53蛋白的细胞。在某些实施方案中,术语“表达突变型p53蛋白的细胞”与“癌细胞”是可互换的。
术语“促凋亡基因”是指直接(例如某些半胱天冬酶)或间接(例如,作为信号转导级联的以部分)参与凋亡的一个基因,或大量基因。
在某些实施方案中,所述活性是降低表达突变型p53蛋白的细胞的生存力。在某些实施方案中,所述活性是促进表达突变型p53蛋白的细胞的凋亡。在某些实施方案中,所述活性是活化表达所述突变型p53蛋白的细胞的促凋亡基因。在某些实施方案中,所述促凋亡基因选自CD95、Bax、DR4、DR5、PUMA、NOXA、Bid、53AIP1和PERP。每种可能代表本发明的一个单独的实施方案。
在某些实施方案中,所述活性是结合表达突变型p53蛋白的细胞中的p53共有DNA结合元件。在某些实施方案中,所述共有DNA结合元件包含SEQ ID NO: 55和56中所示的核酸序列或由其组成。
监测通过本发明的任何肽诱导的细胞变化的方法是本领域已知的并且包括例如,MTT测试,其是基于活细胞将黄色的盐MTT (3-(4,5-二甲基噻唑基-2)-2,5-二苯基四唑溴)(Sigma, Aldrich St Louis, MO, USA)还原为蓝紫色不可溶甲臜沉淀物的选择能力;BrDu测定[Cell Proliferation ELISA BrdU比色试剂盒(Roche, Mannheim, Germany];TUNEL测定[Roche, Mannheim, Germany];Annexin V测定[ApoAlert® Annexin V ApoptosisKit (Clontech Laboratories, Inc., CA, USA)];衰老相关的β-半乳糖苷酶测定(DimriGP, Lee X,等人1995. A biomarker that identifies senescent human cells inculture and in aging skin in vivo. Proc Natl Acad Sci U S A 92:9363-9367);以及多种RNA和蛋白检测方法(其检测表达和/或活性水平),其进一步在下文中描述。
在某些实施方案中,所述结合导致内源性p53靶标基因的至少部分活化。在某些实施方案中,所述内源性靶标基因选自p21、MDM2和PUMA。每种可能代表本发明的一个单独的实施方案。
在某些实施方案中,所述突变型p53蛋白与野生型p53蛋白的构象不同。在某些实施方案中,所述突变型p53蛋白与野生型p53蛋白相比至少部分失活。
在某些实施方案中,所述突变型p53蛋白不被针对野生型p53蛋白的单克隆抗体识别。在某些实施方案中,所述突变型p53蛋白在结合所述肽后,被针对野生型p53蛋白的单克隆抗体识别。在某些实施方案中,所述单克隆抗体是Ab1620。
在一些实施方案中,所述再活化肽可以将突变型p53再活化至具有与野生型p53蛋白相似或相同的结构性质、生化性质、生理性质和/或功能性质。
根据一些实施方案,提供了突变型p53再活化肽,其中所述肽长度为约3-25个氨基酸。在一些实施方案中,所述突变型p53再活化肽长度为约4-15个氨基酸。在一些实施方案中,所述突变型p53再活化肽长度为约7-12个氨基酸。在一些实施方案中,所述突变型p53再活化肽长度为7个氨基酸。在一些实施方案中,所述突变型p53再活化肽长度为12个氨基酸。每种可能代表本发明的一个单独的实施方案。
在本申请全文中描述了其它肽长度。每种可能代表本发明的一个单独的实施方案。
根据一些实施方案,突变型p53再活化肽可以影响突变型p53,使其可以反式活化在其启动子上具有野生型p53结合元件的报道基因(诸如荧光素酶)。在一些实施方案中,报道基因的反式活化可以在体外(例如在试管或孔中)或在体内,在具有报道基因构建体的细胞内进行。
根据一些实施方案,突变型p53再活化肽可以结合至突变型p53的DNA结合结构域(DBD)。在一些实施方案中,突变型p53在其DNA结合结构域(DBD)中带有突变。
如本文使用的术语“药物组合物”是指包含至少一种药物活性成分的任何组合物。
如本文使用的术语“与突变型p53蛋白相关”是指由突变型p53蛋白引起的,或其进展涉及突变型p53蛋白在细胞或器官中的存在的任何疾病、病症或病况。
应当理解,因为p53从两个等位基因表达,细胞内p53总含量可以为野生型(wt/wt)、野生型和突变型p53的混合物(wt/mut),或仅突变型p53 (当两个等位基因均突变(mut/mut),或一个等位基因缺失(mut/-)时)。在癌症中,情况通常是wt/mut、mut/mut或mut/-。因为p53作为四聚体起作用,突变型p53蛋白使确实存在于癌细胞中的野生型p53蛋白的活性被废除。因此,本发明提供的肽特别可用于治疗癌症。值得注意的是,细胞可以具有多于2个p53等位基因,其中至少一个是突变型p53。
如本文使用的术语“治疗有效量”是指含有根据本发明的肽的组合物的量,所述量足以降低、减少和/或抑制个体内的疾病、病症或病况。
根据本发明的一个方面,提供了治疗与突变型p53蛋白相关的疾病、病症或病况的方法,其包括向有此需要的对象施用治疗有效量的如本文所述的分离肽(例如SEQ ID NO:8、412-464),从而治疗所述疾病、病症或病况。
根据本发明的一个方面,提供了治疗与突变型p53蛋白相关的疾病、病症或病况的方法,其包括向有此需要的对象施用治疗有效量的包含氨基酸序列的分离肽,所述氨基酸序列具有的空间和构型上允许所述肽与p53的DNA结合结构域(DBD)以如pCAP 250 (SEQ IDNO: 1)结合DBD的相同方式进行结合,其中所述肽至少部分地将突变型p53蛋白再活化,且其中所述治疗有效量是每天0.01-0.3 mg/kg或每天0.01-0.2 mg/kg (例如每天0.01-0.35mg/kg、每天0.01-0.35 mg/kg、每天0.01-0.15 mg/kg、每天0.01-0.1 mg/kg、每天0.01-0.095 mg/kg、每天0.01-0.09 mg/kg、每天0.01-0.085 mg/kg、每天0.01-0.08 mg/kg、每天0.01-0.075 mg/kg、每天0.01-0.07 mg/kg、每天0.01-0.065 mg/kg、每天0.01-0.06 mg/kg、每天0.01-0.055 mg/kg、每天0.01-0.05 mg/kg、每天0.01-0.45 mg/kg、每天0.01-0.04mg/kg、每天0.01-0.035 mg/kg、每天0.01-0.03 mg/kg),从而治疗所述疾病、病症或病况。
如本文提及的,术语“治疗疾病”或“治疗病况”涉及施用包括至少一种药剂的组合物,其有效缓解与疾病相关的症状,减轻所述疾病的严重性或治愈所述疾病,或防止对象中发生所述疾病。施用可以包括任何施用途径。在一些实施方案中,所述疾病是由突变型p53在细胞、组织、器官、体内等中的存在引起或涉及突变型p53在细胞、组织、器官、体内等中的存在的疾病。在一些实施方案中,所述疾病是癌症。在一些实施方案中,所述癌症选自乳腺癌、结肠癌、卵巢癌和肺癌。
在一些实施方案中,所述癌症是转移性癌症。
在一些实施方案中,所述癌症是转移性乳腺癌、转移性结肠癌、转移性卵巢癌或转移性肺癌。
每种可能代表本发明的一个单独的实施方案。在一些实施方案中,所述对象是哺乳动物,诸如人。在一些实施方案中,所述对象是哺乳动物。在一些实施方案中,所述对象是非哺乳动物。在一些实施方案中,所述对象被诊断患有所述疾病、病况或病症。
在一些实施方案中,癌症是肾上腺皮质癌、肛门癌、膀胱癌、脑肿瘤、脑干神经胶质瘤、脑肿瘤、小脑星形细胞瘤、脑星形细胞瘤、室管膜瘤、成神经管细胞瘤、幕上原始神经外胚层、松果体瘤、下丘脑胶质瘤、乳腺癌、类癌瘤、癌、宫颈癌、结肠癌、子宫内膜癌、食道癌、肝外胆管癌、尤因家族肿瘤(pnet)、颅外生殖细胞肿瘤、眼癌、眼内黑色素瘤、胆囊癌、胃癌、生殖细胞瘤、性腺外,妊娠滋养细胞肿瘤、头颈癌、下咽癌、胰岛细胞癌、喉癌、白血病、急性淋巴细胞,白血病、口腔癌、肝癌、肺癌、小细胞,淋巴瘤、AIDS相关,淋巴瘤、中枢神经系统(原发),淋巴瘤、皮肤T细胞,淋巴瘤、霍奇金氏病、非霍奇金氏病、恶性间皮瘤、黑色素瘤、梅克尔细胞癌、转移性鳞状细胞癌、多发性骨髓瘤、浆细胞瘤、蕈样肉芽肿病、骨髓增生异常综合征、骨髓增生性病症、鼻咽癌、神经母细胞瘤、口咽癌、骨肉瘤、卵巢上皮癌、卵巢生殖细胞肿瘤、卵巢低恶性潜能肿瘤、胰腺癌、外分泌,胰腺癌、胰岛细胞癌、副鼻窦和鼻腔癌、甲状旁腺癌、阴茎癌、嗜铬细胞瘤癌、垂体癌、浆细胞肿瘤、前列腺癌、横纹肌肉瘤、直肠癌、肾细胞癌、唾液腺癌、塞扎里综合征、皮肤癌、皮肤T细胞淋巴瘤、皮肤癌、卡波西肉瘤、皮肤癌、黑色素瘤、小肠癌、软组织肉瘤、软组织肉瘤、睾丸癌、胸腺瘤、恶性,甲状腺癌、尿道癌、子宫癌、肉瘤、儿童期的罕见癌症、阴道癌、外阴癌或维尔姆斯氏瘤。
在一些实施方案中,所述癌症是肺癌。
在一些实施方案中,所述癌症是卵巢癌。
在一些实施方案中,所述癌症是三阴性乳腺癌。
在一些实施方案中,所述癌症是转移性肺癌。
在一些实施方案中,所述癌症是转移性卵巢癌。
在一些实施方案中,所述癌症是转移性三阴性乳腺癌。
在一些实施方案中,癌症是非实体瘤诸如血癌。在另一个实施方案中,非实体瘤或血癌是白血病或淋巴瘤。在另一个实施方案中,非实体瘤或血癌是急性淋巴细胞白血病(ALL)。在另一个实施方案中,非实体瘤或血癌是急性骨髓性白血病(AML)。在另一个实施方案中,非实体瘤或血癌是慢性淋巴细胞白血病(CLL)。在另一个实施方案中,非实体瘤或血癌是小淋巴细胞淋巴瘤(SLL)。在另一个实施方案中,非实体瘤或血癌是慢性骨髓性白血病(CML)。在另一个实施方案中,非实体瘤或血癌是急性单核细胞白血病(AMOL)。在另一个实施方案中,非实体瘤或血癌是霍奇金氏淋巴瘤(四种亚型中任一种)。在另一个实施方案中,非实体瘤或血癌是非霍奇金氏淋巴瘤(亚型中任一种)。在另一个实施方案中,非实体瘤或血癌是骨髓性白血病。
对于在本发明的方法中的应用,可以使用一种或多种药学上可接受的载体、稳定剂或赋形剂(媒介物),以常规方式配制所述再活化肽,以形成药物组合物,如本领域中已知的,特别是关于蛋白活性剂。载体在与组合物的其他成分相容且对其受体无害的意义上是“可接受的”。合适的载体通常包括生理盐水或乙醇多元醇诸如甘油或丙二醇。
所述再活化肽可以配制为中性或盐形式。药学上可接受的盐包括酸加成盐(与游离氨基形成),并且其是与无机酸诸如盐酸或磷酸,或此类有机酸诸如乙酸、草酸、酒石酸和马来酸形成。与游离羧基形成的盐也可以衍生自无机碱诸如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁,和有机碱诸如异丙胺、三甲胺、2-乙基氨基乙醇、组氨酸和普鲁卡因。
所述组合物可以合适地配制用于静脉内、肌内、皮下或腹膜内施用,且方便地包含所述再活化肽的无菌水溶液,其优选与受体的血液等渗。此类制剂通常通过以下制备:将固体活性成分溶解于含有生理上相容的物质诸如氯化钠、甘氨酸等且具有与生理条件相容的缓冲pH的水中以产生水溶液,且使得所述溶液无菌。这些可以制备于单位剂量或多剂量容器(例如,密封的安瓿或小瓶)中。
所述组合物可以并入稳定剂,诸如例如聚乙二醇、蛋白、糖类(例如海藻糖)、氨基酸、无机酸及其混合物。稳定剂在水溶液中以适当的浓度和pH使用。将该水溶液的pH调整至5.0-9.0的范围内,优选6-8的范围内。在配制再活化肽中,可以使用抗吸附剂。其他合适的赋形剂可以通常包括抗氧化剂诸如抗坏血酸。
所述组合物可以配制为控释制剂,其可以通过使用聚合物来复合或吸附蛋白而实现。用于控释制剂的适当聚合物包括例如聚酯、聚氨基酸、聚乙烯,吡咯烷酮、乙烯乙酸乙烯酯和甲基纤维素。用于控释的另一种可能方法是将再活化肽并入聚合物材料(诸如聚酯、聚氨基酸、水凝胶、聚(乳酸)或乙烯乙酸乙烯酯共聚物)的颗粒中。或者,代替将这些试剂并入聚合颗粒中,可将这些材料捕获到微胶囊中,例如分别通过凝聚技术或通过界面聚合制备的微胶囊,例如羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊,或捕获到胶体药物递送系统、例如脂质体、白蛋白微球、微乳剂、纳米颗粒和纳米胶囊中或大乳剂(macroemulsions)中。
在一些实施方案中,本发明的再活化肽可以配制于经口或口服组合物中,并且在一些实施方案中,包含液体溶液、乳液、悬浮液等。在一些实施方案中,适合用于制备此类组合物的药学上可接受的载体是本领域中熟知的。在一些实施方案中,液体口服组合物包含约0.001%至约0.9%的再活化肽,或在另一个实施方案中,约0.01%至约10%的再活化肽。
在一些实施方案中,用于在本发明的方法中使用的组合物包含溶液或乳液,其在一些实施方案中是包含安全和有效量的再活化肽和任选其他化合物的水溶液或乳液,其意欲用于局部鼻内施用。
在一些实施方案中,本发明的可注射溶液配制于水溶液中。在一个实施方案中,本发明的可注射溶液配制于生理上相容的缓冲液诸如Hank氏溶液、林格氏溶液或生理盐缓冲液中。在一些实施方案中,对于经粘膜施用,在制剂中使用适于待渗透的屏障的渗透剂。此类渗透剂是本领域中通常已知的。
在一个实施方案中,本文所述的制剂配制用于肠胃外施用,例如通过推注注射或连续输注。在一些实施方案中,用于注射的制剂以单位剂量形式呈现,例如安瓿中或多剂量容器中,并且任选地具有添加的防腐剂。在一些实施方案中,组合物是油性或水性媒介物中的悬浮液、溶液或乳液,且含有配制剂诸如悬浮剂、稳定剂和/或分散剂。
本发明的再活化肽可以通过任何合适的施用途径进行施用,所述施用途径选自口服、局部、经皮或肠胃外施用。根据一些实施方案,所述施用途径是经由选自真皮、阴道、直肠、吸入、鼻内、经眼、经耳和经颊的局部应用。根据一些实施方案,所述施用途径是经由肠胃外注射。在各个实施方案中,施用步骤通过选自以下的肠胃外途径实施:静脉内、肌内、皮下、皮内、腹膜内、动脉内、脑内、脑室内、骨内和鞘内。例如,所述再活化肽可以全身施用,例如,通过肠胃外途径,诸如,腹膜内(i.p.)、静脉内(i.v.)、皮下或肌内途径。本发明的再活化肽和/或任何任选的额外药剂可以全身施用,例如,通过鼻内施用。本发明的再活化肽和/或任何任选的额外药剂可以全身施用,例如,通过口服施用,通过使用能够为蛋白提供口服生物利用度的特定组合物或制剂。本发明的再活化肽和/或任何任选的额外药剂可以局部施用。
根据具体的实施方案,施用包括皮下施用。
可选或另外地,根据具体的实施方案,施用包括连续输注。
因此,所述再活化肽(例如SEQ ID NO: 1、8或412-464或429、448、449、446、462)还可以通过慢释递送系统、泵和用于连续输注的其它已知递送系统以例如以下剂量递送:例如每天0.01-0.3 mg/kg、每天0.01-0.15 mg/kg、每天0.01-0.1 mg/kg、每天0.01-0.095mg/kg、每天0.01-0.09 mg/kg、每天0.01-0.085 mg/kg、每天0.01-0.08 mg/kg、每天0.01-0.075 mg/kg、每天0.01-0.07 mg/kg、每天0.01-0.065 mg/kg、每天0.01-0.06 mg/kg、每天0.01-0.055 mg/kg、每天0.01-0.05 mg/kg、每天0.01-0.45 mg/kg、每天0.01-0.04 mg/kg、每天0.01-0.035 mg/kg、每天0.01-0.03 mg/kg)。可以改变给药方案以基于其药代动力学提供特定再活化肽的循环水平。因此,计算剂量,从而维持治疗剂的期望的循环水平。
通常,通过再活化肽的活性和对象的状况以及待治疗的对象的体重或表面积确定有效剂量。还通过伴随在具体对象中施用再活化肽的任何不良副作用的存在、性质和程度来确定剂量大小和给药方案。
在一些实施方案中,提供用于治疗或预防p53相关病况的药剂盒。在一些实施方案中,所述药剂盒包含容器(例如小瓶),其包含在合适的缓冲液中的Mut-p53再活化肽,和用于施用所述再活化肽的使用说明。
提出,当与黄金标准治疗(例如抗癌疗法)组合时,可以提高使用本发明的肽的治疗的功效。因此,可以单独或与用于此类病症的其它既定的或实验性治疗方案组合使用所述肽,用于治疗与p53相关的疾病或病症(如上文所述)。可理解,使用另外的治疗方法或组合物的治疗具有显著降低此类治疗的有效临床剂量的潜力,从而降低所述治疗的通常为破坏性的副作用和高成本。
适合与本发明的一些实施方案的肽或编码其的多核苷酸组合的治疗癌症的治疗方案包括,但不限于化学疗法、放疗、光疗和光动力疗法、手术、营养疗法、消融疗法、放疗和化学疗法的组合、近距离放射治疗、质子束疗法、免疫疗法、细胞疗法和光子束放射外科疗法。根据具体的实施方案,所述化学疗法是基于铂的。
抗癌药物
可以与本发明的化合物共施用的抗癌药物包括但不限于:阿西维辛;阿柔比星;盐酸阿考达唑;阿克罗宁;阿霉素;阿多来新;阿地白介素;六甲蜜胺;安波霉素;醋酸阿美蒽醌;氨鲁米特;安吖啶;阿那曲唑;氨茴霉素;天冬酰胺酶;曲林菌素;阿扎胞苷;阿扎替派;阿佐霉素;巴马司他;苯佐替哌;比卡鲁胺;盐酸比生群;二甲磺酸双奈法德(BisnafideDimesylate);比折来新;硫酸博来霉素;布列奎钠(Brequinar Sodium);溴匹立明;白消安;放线菌素C;卡普睾酮;卡醋胺;卡贝替姆;卡铂;卡莫司汀;盐酸卡柔比星;卡折来新;西地芬戈;苯丁酸氮芥;西罗里霉素;顺铂;克拉屈滨;甲磺酸克立那托;环磷酰胺;阿糖胞苷;达卡巴嗪;更生霉素;盐酸柔红霉素;地西他滨;右奥马铂;地扎胍宁;甲磺酸地扎胍宁;地吖醌;多西他赛;阿霉素;盐酸阿霉素;屈洛昔芬;柠檬酸屈洛昔芬;丙酸甲雄烷酮;达佐霉素;依达曲沙;盐酸艾佛鸟氨酸;依沙芦星;恩络铂;恩普氨酯;依匹哌啶;盐酸表阿霉素;厄布洛唑;盐酸依索比星;雌莫司汀;雌莫司汀磷酸钠;依他硝唑;依托泊苷;磷酸依托泊苷;氯苯乙嘧胺(Etoprine);盐酸法倔唑;法扎拉滨;维甲酰酚胺;氟尿苷;磷酸氟达拉滨;氟尿嘧啶;氟环胞苷;磷喹酮;福司曲星钠;吉西他滨;盐酸吉西他滨;羟基脲;盐酸伊达比星;异环磷酰胺;依莫佛新;干扰素α-2a;干扰素α-2b;干扰素α-n1;干扰素α-n3;干扰素β-Ia;干扰素γ-Ib;异丙铂;盐酸伊立替康;醋酸兰瑞肽;来曲唑;醋酸亮丙瑞林;盐酸利阿唑;洛美曲索钠;环己亚硝脲;盐酸洛索蒽醌;马索罗酚;美登素;盐酸氮芥;醋酸甲地孕酮;醋酸美仑孕酮;美法仑;美诺立尔;巯嘌呤;甲氨蝶呤;甲氨蝶呤钠;氯苯氨啶;美妥替哌(Meturedepa);米汀度胺;米托卡星(mitocarcin);丝裂红素;丝林霉素;丝裂马菌素;丝裂霉素;丝裂帕菌素;米托坦;盐酸米托蒽醌;霉酚酸;诺考达唑(Nocodazole);诺加霉素;奥马铂;奥昔舒仑(Oxisuran);紫杉醇;培加帕酶;培利霉素;戊氮芥;硫酸培洛霉素;培磷酰胺;哌泊溴烷;哌泊舒凡;盐酸吡罗蒽醌;普卡霉素;普洛美坦;卟吩姆钠;紫菜霉素;松龙苯芥;盐酸丙卡巴肼;嘌呤霉素;盐酸嘌呤霉素;吡唑呋喃菌素;利波腺苷;吡鲁米特;沙芬戈;盐酸沙芬戈;司莫司汀;辛曲秦;司泊索非钠(Sparfosate Sodium);稀疏霉素(Sparsomycin);盐酸锗螺胺;螺旋氮芥;螺铂;链黑霉素;链脲佐菌素;磺氯苯脲;他利霉素;紫杉醇;替可加兰钠(Tecogalan Sodium);替加氟;盐酸替洛蒽醌;替莫泊芬;替尼泊苷;替罗昔隆;睾内酯;硫咪嘌呤;硫鸟嘌呤;噻替哌;噻唑呋林(Tiazofuirin);替拉扎明;盐酸拓扑替康;柠檬酸托瑞米芬;醋酸曲托龙;磷酸曲西瑞宾;三甲曲沙(Trimetrexate);三甲曲沙葡糖醛酯;曲普瑞林;盐酸妥布氯唑;尿嘧啶氮芥;乌瑞替哌(Uredepa);伐普肽;维替泊芬;硫酸长春碱;硫酸长春新碱;长春地辛;硫酸长春地辛;硫酸长春匹定;硫酸长春甘酯;硫酸长春罗辛;酒石酸长春瑞滨;硫酸长春罗定;硫酸长春利定;伏氯唑;折尼铂;净司他丁;盐酸佐柔比星。另外的抗肿瘤药包括在Antineoplastic Agents,第52章(Paul Calabresi and Bruce A. Chabner)中公开的那些,和在Goodman and Gilman's “The Pharmacological Basis ofTherapeutics”, Eighth Edition, 1990, McGraw-Hill, Inc. (Health ProfessionsDivision)中公开的那些。
根据本发明的另一个方面,提供了治疗与突变型p53蛋白相关的疾病、病症或病况的方法,其包括向有此需要的对象施用治疗有效量的基于铂的化学疗法和包含氨基酸序列的分离肽,所述氨基酸序列具有的空间和构型允许所述肽与p53的DNA结合结构域(DBD)以如pCAP 250 (SEQ ID NO: 1)结合所述DBD的相同方式进行结合(例如SEQ ID NO: 1、8、412-464、429、448、449、446、462),其中所述肽至少部分地将突变型p53蛋白再活化,从而治疗所述疾病、病症或病况。
基于铂的化学疗法的具体实例包括但不限于顺铂(首先被开发的),卡铂(第二代基于铂的抗肿瘤药),奥沙利铂、赛特铂、吡铂、奈达铂、三核铂(Triplatin)、Lipoplatin(顺铂的脂质体版本)。
用于实现如本文所述的组合治疗(例如所述肽连同基于铂的化学疗法)的试剂盒和物品或产品也在本文预期中。
应理解,包含选自59-382的氨基酸序列的肽也可以在上述方法中实施。
如本文使用,术语“约”是指±10%。
术语“包含”、“包括”、“具有”和它们的同源词是指“包括但不限于”。
术语“由……组成”是指“包括且限于”。
术语“基本上由……组成”是指所述组合物、方法或结构可以包括另外的成分、步骤和/或部分,但只有所述另外的成分、步骤和/或部分不实质上改变要求保护的组合物、方法或结构的基本和新颖的特征的情况。
除非上下文另有明确说明,如本文使用的单数形式“一个/种”和“所述”包括复数引用物。例如,术语“化合物”或“至少一种化合物”可以包括多种化合物,包括其混合物。
贯穿本申请,本发明的各种实施方案可以以范围形式呈现。应当理解,以范围形式的描述仅仅为了便利和简洁,而不应当被解释为对本发明的范围的严格限定。因此,范围的描述应当被理解为已经具体公开了所有可能的子范围以及在该范围内的单一数值。例如,范围的描述诸如1至6应当被理解为具有具体公开的子范围诸如1至3,1至4,1至5,2至4,2至6,3至6等,以及在该范围内的单独数值,例如1、2、3、4、5和6。不论范围的幅度如何都适用。
在本文指定的任何数值范围,均意为包括在指定范围内的任何引用的数字(分数或整数)。短语第一指定数和第二指定数“之间的范围”,和“范围从”第一指定数“到”第二指定数,在本文中可互换使用,并且意为包括第一指定数和第二指定数以及在其间的全部分数和整数。
如本文使用的术语“方法”是指用于完成给出的任务的方式、手段、技术和程序,包括但不限于化学、药理学、生物学、生物化学和医学领域实践者已知的,或容易从已知的方式、手段、技术和程序发展的那些方式、手段、技术和程序。
如本文使用的,术语“治疗”包括终止、基本上抑制、减缓或反转病况的进程,基本上缓解病况的临床或审美症状或基本上预防病况的临床或审美症状的出现。
当参考具体的序列表时,这样的参考应当被理解为还涵盖基本对应于其互补序列的序列,同时包括较少的序列变异,其例如由测序错误、克隆错误或引起碱基取代、碱基缺失或碱基添加的其它变化而导致,前提是此类变异的频率小于50个核苷酸中1个,可选地,小于100个核苷酸中1个,可选地,小于200个核苷酸中1个,可选地,小于500个核苷酸中1个,可选地,小于1000个核苷酸中1个,可选地,小于5,000个核苷酸中1个,可选地,小于10,000个核苷酸中1个。
应理解,出于清楚的目的而在分开的实施方案的上下文中描述的本发明的某些特征,也可以提供在单一实施方案的组合中。反之,出于简洁的目的而在单一实施方案的上下文中描述的本发明的各种特征,也可以被分开提供,或提供在任何合适的亚组合中,或合适地,提供在本发明的任何其它描述的实施方案中。各种实施方案的上下文中描述的特定特征不被认为是那些实施方案的关键特征,除非所述实施方案没有那些要素则无法操作。
如上文描述的以及如下文权利要求书部分要求保护的本发明的各种实施方案和方面在以下实施例中得到实验支持。
实施例
现参考以下实例,其与上文的说明一起以非限制性的方式阐明本发明。
通常,本文使用的术语和在本发明中利用的实验室程序包括分子、生化、微生物和重组DNA技术。这些技术在文献中得到透彻解释。参见例如,“Molecular Cloning: Alaboratory Manual” Sambrook等人, (1989); “Current Protocols in MolecularBiology” Volumes I-III Ausubel, R. M., ed. (1994); Ausubel等人, “CurrentProtocols in Molecular Biology”, John Wiley和Sons, Baltimore, Maryland(1989); Perbal, “A Practical Guide to Molecular Cloning”等人, John Wiley &Sons, New York (1988); Watson等人, “Recombinant DNA”, Scientific AmericanBooks, New York; Birren等人(eds) “Genome Analysis: A Laboratory ManualSeries”, Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); 如在以下中所述的方法:美国专利号4,666,828; 4,683,202; 4,801,531; 5,192,659和5,272,057;“Cell Biology: A Laboratory Handbook”, Volumes I-III Cellis, J. E.,ed. (1994); “Current Protocols in Immunology”等人Volumes I-III Coligan J. E.,ed. (1994); Stites 等人 (eds), “Basic and Clinical Immunology”(第8版),Appleton & Lange, Norwalk, CT (1994); Mishell和Shiigi (eds), “SelectedMethods in Cellular Immunology”, W. H. Freeman and Co., New York (1980); 可获得的免疫测定被广泛描述于专利和科学文献中,参见例如,美国专利号3,791,932; 3,839,153; 3,850,752; 3,850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771和5,281,521; “Oligonucleotide Synthesis” Gait, M. J., ed. (1984); “Nucleic AcidHybridization” Hames, B. D.,和Higgins S. J., eds. (1985); “Transcription andTranslation” Hames, B. D.,和Higgins S. J., Eds. (1984); “Animal Cell Culture”Freshney, R. I., ed. (1986); “Immobilized Cells and Enzymes” IRL Press,(1986); “A Practical Guide to Molecular Cloning” Perbal, B., (1984) 和”Methods in Enzymology” Vol. 1-317, Academic Press; “PCR Protocols: A Guide ToMethods And Applications”, Academic Press, San Diego, CA (1990); Marshak等人,“Strategies for Protein Purification and Characterization - A LaboratoryCourse Manual” CSHL Press (1996); 其全部通过引用并入,如同完全在本文中阐述。本文全文提供了其它的一般参考文件。相信在其中的程序是本领域熟知的并且为了方便读者而提供。在其中所含的全部信息通过引用并入本文。
实验程序
结晶紫生存力测定
在96孔板中以2500-4000个细胞/孔培养细胞。添加不同肽的系列稀释物,并且将板在37℃另外温育48h。随后将培养基移除,并通过使用在甲醇/PBS (1:5, v/v)中的结晶紫(0.05%)将细胞染色10分钟,随后使用PBS洗涤3次,来测定细胞生存力。向每孔添加10%乙酸,进行10分钟。在595 nm测定OD。
ChIP分析
在室温下,使用甲醛(1%终浓度)交联细胞10分钟。使用0.25M甘氨酸中和甲醛5分钟。使用10ml冰冷的PBS洗涤细胞两次,并通过刮落收集。最终,将细胞重悬于0.3ml的裂解缓冲液(1% SDS、10mM EDTA、50mM Tris-HCl、pH 8.1,蛋白酶抑制剂混合物),并且在超声浴中超声处理6分钟,随后在冰上离心10分钟以产生200-500bp片段。收集上清液并且在ChIP稀释缓冲液(1% Triton X-100、2 mM EDTA、150 mM NaCl、20 mM Tris-HCl,pH 8.1)中稀释10次,随后在4℃,使用具有2μg剪切的鲑鱼精DNA和10μg BSA的40μl预阻断蛋白A-琼脂糖进行免疫清除2小时。在4℃下,使用特异性αp53或αRNApolII多克隆抗体,进行免疫沉淀过夜。在免疫沉淀后,添加40 μl蛋白A-琼脂糖并进一步温育另外1小时。依次在TSE I (0.1%SDS、1% Triton X-100、2 mM EDTA、20 mM Tris-HCl、pH 8.1,150 mM NaCl)、TSE II (500mM NaCl)和缓冲液III (0.25 M LiCl、1% NP-40、1%脱氧胆酸盐、1 mM EDTA、10 mM Tris-HCl,pH 8.1)中洗涤沉淀物。使用TE缓冲液将沉淀物洗涤三次并使用1% SDS,0.1 M NaHCO3萃取两次。合并洗出液并且在65℃加热过夜以逆转甲醛交联。使用QIAquick Spin Kit(Qiagen, CA)纯化DNA片段。一式三份执行免疫沉淀反应。以单独的珠子充当非特异性对照。通过定量RT-PCR评估来自克隆的ChIP产物中的活性和抑制性组蛋白标记的定量分析。为了将免疫沉淀反应(IP)的功效归一化,使用necdin启动子区域和5'区域的特异性引物完成染色质IP的归一化。
CRISPR p53敲除
质粒#42230,含有TP53外显子3单向导RNA (sgRNA),来自Addgene。根据生产商的方案,使用jetPEI试剂(Polyplus)转染ES2细胞。在48小时后,在96孔板中接种细胞作为单细胞克隆。扩增单细胞克隆并且使用DO-1抗-p53抗体,通过蛋白质印记分析检验它们的p53状态。
sgRNA序列:
F:5'-CACCGCCATTGTTCAATATCGTCCG-3' (SEQ ID NO:47)
R:5'-AACCGGACGATATTGAACAATGG-3' (SEQ ID NO:48)。
肽的临床前测试
将2x105-106个细胞皮下注射至小鼠(6周龄无胸腺裸鼠)的各个股骨。在这些实验中采用的全部细胞系稳定表达荧光素酶报道基因,以能够通过活体成像监控肿瘤生长。4-18天后,当肿瘤达到可视大小,将小鼠随机分配至几个组:对照组,使用任一单个对照肽处理,和使用有效肽(任一单个肽)处理的组。通过一周三次在40μl PBS中10μg肽/肿瘤的瘤内注射,或通过Alzet微型泵0.8mg进行两周来施用肽。使用IVIS2000系统,通过活体成像测量随时间的肿瘤生长。将暴露时间校准至20秒。在8分钟内获得16张图像,并且对每个肿瘤获取峰发光值。实验进行至肿瘤达到1cm3的最大允许大小,在此时将小鼠处死并且将肿瘤取出,测量并称重。
RT-PCR
根据制造商的方案,使用Macherey-Nagel NucleoSpin RNA II试剂盒,从细胞沉淀物获得RNA。使用Bio-RT 2000 (Bio-Lab)和随机六聚体引物,对0.4-1 µg的等分试样进行反转录。使用SYBR Green FastMix ROX (Quanta)在ABI 7300仪器(AppliedBiosystems)上执行QRT-PCR。RT-PCR引物(全部引物序列以5'至3'呈现):
引物列表
| 基因 | 正向引物/(SEQ ID NO:20-31) | 反向引物/(SEQ ID NO:32-43) |
| p53 | CCCAAGCAATGGATGATTTGA | GGCATTCTGGGAGCTTCATCT |
| p21 | GGCAGACCAGCATGACAGATT | GCGGATTAGGGCTTCCTCTT |
| PUMA | GACCTCAACGCACAGTACGAG | AGGAGTCCCATGATGAGATTGT |
| MDM2 | AGGCAAATGTGCAATACCAACA | GGTTACAGCACCATCAGTAGGTACAG |
| CD95 | ACTGTGACCCTTGCACCAAAT | GCCACCCCAAGTTAGATCTGG |
| Btg2 | AGGCACTCACAGAGCACTACAAAC | GCCCTTGGACGGCTTTTC |
| GAPDH | ACCCACTCCTCCACCTTTGA | CTGTTGCTGTAGCCAAATTCGT |
| p21 (ChIP) | GTGGCTCTGATTGGCTTTCTG | CTTGGGCTGCCTGTTTTCAG |
| PUMA (ChIP) | GCGAGACTGTGGCCTTGTGTC | ACTTTGTGGACCCTGGAACG |
| MDM2 (ChIP) | GGTTGACTCAGCTTTTCCTCTTG | TATTTAAACCATGCATTTTCC |
| CD95 (ChIP) | GGATAATTAGACGTACGTGGGC | GGACAATTGACAAAATCAGTATC |
| GAPDH (ChIP) | GTATTCCCCCAGGTTTACAT | AGGAGTGAGTGGAAGACAGAA |
NMR
用1L NMR缓冲液(含有52.5mM NaCl和2.625mM DTT,pH 7.2的157.5mM磷酸钠缓冲液)透析纯化的15N标记的p53核心结构域1ml 40μM (aa 94-296) 48小时,替换缓冲液并使用1L NMR缓冲液透析样品另外24-48小时(总共72小时)。对0.5 ml样品进行高分辨NMR。在魏茨曼科学研究所(Weizmann Institute of Science)进行NMR分析。
在293 K,记录15N-p53自身,以及当如与指定的肽复合时的二维1H-15N异核单量子相干(HSQC)谱。在装配有5 mm反式检测三重共振CryoProbe(TCI)的Bruker AVIII-800NMR谱仪上获得谱。使用WATERGATE序列实现溶剂抑制。
实施例1:pCAP-250与顺铂协同降低ES2卵巢癌细胞的生存力
在96孔板中以3000个细胞/孔培养ES2细胞。将pCAP-250的系列稀释物单独或与1µg/ml顺铂一起添加,并将板在37℃另外温育48h。随后将培养基移除,并通过使用在甲醇/PBS (1:5, v/v)中的结晶紫(0.05%)将细胞染色10分钟,随后使用PBS洗涤3次,来测定细胞生存力。向每孔添加10%乙酸,进行10分钟。在595 nm测定OD。使用1µg/ml处理的ES2细胞的生存力为39%。估计pCAP-250的IC50为3.2µM并且与顺铂组合的pCAP-250的IC50估计为1.9µM,表明两种化合物之间的协同效应。
图1显示了实验的结果。明显地,癌症细胞的生存力在pCAP 250存在下显著降低。通过pCAP 250与基于铂的化学疗法的组合治疗,观察到协同作用。
实施例2:pCAP-250和不同衍生物的活性的表征
将表达内源mp53S241F的ES2 Con细胞,和其中使用CRISPR/Cas9将p53稳定敲除以控制对mutp53的特异性的ES2 KO细胞(ES2 p53KO),以3000个细胞/孔培养在96孔板中。以8µg/ml的浓度添加指示的肽,并且将板在37℃另外温育48h。随后将培养基移除,并通过使用在甲醇/PBS (1:5, v/v)中的结晶紫(0.05%)将细胞染色10分钟,随后使用PBS洗涤3次,来测定细胞生存力。向每孔添加10%乙酸,进行10分钟。在595 nm测定OD。
图2显示了特定肽对ES2 Con相比ES KO的作用的差异,指示肽对mutp53表达的特异性。其中氨基酸(例如丝氨酸和组氨酸)被取代为丙氨酸的数种肽衍生物显示出对ES2Con细胞的减少的作用,指示这些氨基酸对肽功效的重要性。
在如下文所述的亲和结合测定进一步强化了所述结果。
实施例3:pCAP 250结合p53 DBD
图3A-I和图3K显示了荧光标记的WTp53DBD和pCAP-250的结合的微量热泳分析。根据生产商说明执行实验;制备pCAP-250的10个系列稀释物,向每个肽样品添加标记的蛋白并加载至毛细管。使用不同浓度的pCAP-250,分析样品的荧光wtp53DBD在温度梯度下的运动。微量热泳分析结果以从生产商数据分析软件获得的曲线来呈现。
实施例4:药代动力学研究-pCAP 250施用模式和血浆中半衰期
图4A-D的结果显示当静脉内施用时,pCAP 250 (SEQ ID NO:1)具有0.8-1.8小时的血浆半衰期。结果进一步显示当皮下施用时,pCAP 250具有3-8小时的血浆半衰期。
实施例5:pCAP-250肽在小鼠异种移植模型中的体内效果
图5A-D显示当以0.4mg/kg的剂量一周3次瘤内注射施用时,pCAP 250 (SEQ IDNO: 1)对卵巢癌异种移植模型中的ES2细胞的肿瘤发育具有显著效果。进一步显示当以每天2.3mg/kg的剂量,通过Alzet微型泵皮下施用时,pCAP 250对卵巢癌异种移植模型中的ES2细胞的肿瘤发育具有显著效果。
实施例6:由体外细胞生存力测定确定的pCAP 250肽变体的抗癌症活性
表3
| SEQ ID NO: | pCAP编号 | 肽序列 |
| 412 | 483 | myr-RRHSTPHPGE |
| 413 | 485 | myr-RRHSTPHPSE |
| 414 | 488 | myr-RRHSTPHPAD |
| 415 | 489 | myr-RRHSTPHPAE |
| 416 | 504 | myr-RRHSSPHPD |
| 417 | 505 | myr-RRHSVPHPD |
| 418 | 507 | myr-RRHSCPHPD |
| 419 | 513 | myr-RRHSePHPD |
| 420 | 514 | myr-RRHStPHPD |
| 421 | 515 | myr-RRHSsPHPD |
| 422 | 516 | myr-RRHSvPHPD |
| 423 | 518 | myr-RR(L-DAB)STPHPD |
| 424 | 519 | myr-RRHSTP(L-DAB)PD |
| 425 | 530 | myr-RRHSTPHPDD-ch3 |
| 426 | 541 | myr-RRHSTPHAD |
| 427 | 551 | myr-RRHSKPHPD |
| 428 | 552 | myr-RRHSSP(L-DAB)PD |
| 429 | 553 | myr-RRHSvP(L-DAB)PD |
| 430 | 554 | myr-RRHSTP(L-DAB)AD |
| 431 | 590 | myr-RRHSsP(L-DAB)PD |
| 432 | 594 | myr-RRHSKPHPDD-NH2 |
| 433 | 595 | myr-RR(L-DAB)STP(L-DAB)PD |
| 434 | 596 | myr-RRHSKP(L-DAB)PD |
| 435 | 597 | myr-RR(L-DAB)SKPHPD |
| 436 | 598 | myr-RR(L-DAB)SKP(L-DAB)PD |
| 437 | 599 | myr-RRHSKPHAD |
| 438 | 600 | myr-RRHSKPHASE |
| 439 | 601 | myr-RRHSKPHPSE |
| 440 | 602 | myr-RR(L-DAB)SsP(L-DAB)PD |
| 441 | 603 | myr-RR(L-DAB)SvP(L-DAB)PD |
| 442 | 606 | myr-RRHSTPHASE |
| 443 | 607 | myr-RRHSkPHPD |
| 444 | 608 | myr-RRHS(L-DAB)PHPD |
| 445 | 609 | myr-RRHS(L-DAB)PHAD |
| 446 | 610 | myr-RRHSEP(L-DAB)PD |
| 447 | 611 | myr-RR(L-DAB)SEPHPD |
| 448 | 622 | myr-RRHSvP(L-DAB)PD-NH2 |
| 449 | 624 | myr-RRHST(Aib)HAD |
| 450 | 630 | myr-RRHSTPHPDIEGR |
| 451 | 632 | myr-RRHSTPHPDIEGRGWQRPSSW |
| 452 | 633 | myr-RR(L-DAB)SEP(L-DAB)PD |
| 453 | 634 | myr-RRHSEP(L-DAB)PD-NH2 |
| 454 | 635 | myr-RR(L-DAB)SEPHPD |
| 455 | 636 | myr-RRHS(PSER)P(L-DAB)PD |
| 456 | 637 | myr-RRHS(pser)P(L-DAB)PD |
| 457 | 638 | myr-RRHS(PSER)P(L-DAB)PD-NH2 |
| 458 | 639 | myr-RRHSKP(L-DAB)PD |
| 459 | 640 | myr-RR(L-DAB)SKPHPD |
| 460 | 642 | myr-RRHSTPHPAH |
| 461 | 643 | myr-RRHSTPHPA(L-DAB) |
| 462 | 644 | myr-RRHSTPHPDH |
| 463 | 645 | myr-RRHSvP(L-DAB)PDH |
| 464 | 646 | myr-RRHSTPHADH |
表3:53种pCAP-250肽变体的列表。myr代表肉豆蔻酰基,大写字母和小写字母分别代表L-型和D-型氨基酸。L-DAB代表L-型二氨基丁酸。PSER和pser分别代表L-型和D-型磷酸丝氨酸。AIB代表氨基异丁酸。
在对两个细胞系的抗肿瘤测定中测试肽。如图7-8所示,指示的肽被赋予抗癌活性,如细胞生存力(结晶紫生存力测定)所确定的。
实施例7:pCAP-250-DBD复合物及其肽变体的NMR实验。
执行NMR实验(1H-15N HSQC谱)以评价由pCAP-250肽(PCAP-250)与p53 DBD结合所诱导的结构效果。因为先前产生了对WT DBD (SEQ ID NO: 44的94-312)的残基峰分配[Wong 等人 同上],使用WT DBD (94-296, SEQ ID NO: 44)进行NMR实验,保持如Wong等人[同上]所述相同的条件。
图9显示了由Wong等人(同上)获得的NMR峰分配,连同对游离DBD和DBD-pCAP 250复合物获得的NMR峰图谱。从图9可以看出,总体上,成功再现了Wong等人(同上)的图谱,尽管在两个DBD构建体的C-端长度上存在差异(296相对312)。在游离DBD和DBD-pCAP 250的图谱之间观察到不同强度的许多峰变化,包括一些未分配峰的消失和出现,因此清晰地提供了pCAP 250与WT DBD结合的指示。这些变化在DBD结构上的作图提供了关于被pCAP 250结合所影响的三维结构区的清晰图像。这个区域主要涉及DBD-DNA交界面基序的螺旋-2和L1环,并且其进一步延伸至蛋白的中心区域中(参见图10中的洋红色)。C277和R280是位于螺旋-2的残基的中等峰移动的实例,而对于位于L1环的G117上观察到最剧烈的峰移动(参见图9中的洋红色和棕色圆圈)。
有趣的是,最初由Wong等人(同上)观察到的H115和Y126的相对低强度的峰没有在游离DBD上观察到,但是在添加pCAP 250肽后确实出现(参见图10中黄色圆圈)。在峰分配中的如此显著的差异可以被视为由pCAP 250诱导的最主要的峰变化。初始峰的低强度和峰从游离DBD谱的消失指示这些残基位于蛋白质的低稳定性结构区域,其可以采用超过一种优势稳定构象,并且因此对蛋白条件中的小变化高度敏感。实际上,在比较通过NME解析的DBD结构的前两种低能量构象(pdb码2FEJ)时,H115和Y126显示了剧烈的结构重组。值得注意的是,H115和Y126的三维组织紧密接近G117,并且可以直接影响G117,并且这三个残基一同与L1环的结构完整性高度相关(参见图11A-B)。在肽添加后的H115和Y126峰的出现通过使用不同pCAP 250肽变体pCAP-615 (RRHSTP{DAB}PD),SEQ ID NO: 465的额外NMR实验而进一步确认(参见图12)。
在具有突变型p53R273H的基于SW-480细胞的测定中,发现pCAP-553 (myr-RRHSvP(L-DAB)PD, v代表D-型缬氨酸, SEQ ID NO: 429) pCAP 250肽变体比P-250的效果强2倍(参见图7)。NMR分析指示pCAP-553 (P553)倾向于以改善的亲和力结合DBD。这主要反映在与游离DBD比较,对DBD-pCAP 553复合物产生的NMR峰图谱上的7个不同的新的且非常强烈未分配的峰的出现。另外地,对DBD-pCAP 553复合物获得的峰的形状倾向于更加统一和圆,指示P553肽的结合改善了DBD的结构稳定性(参见图13)。
NMR实验结果提供了pCAP 250及其肽变体明确结合p53蛋白的野生型DBD的证据。这些结果支持了使用MST方法(图3A-I和图3K)的关于pCAP 250与DBD结合的发现。NMR结果进一步指示pCAP 250及其肽变体的结合诱导DBD中的结构变化,其直接影响了DBD-DNA结合界面区(即螺旋-2和L1环结构基序,其对于DBD结合DNA的能力至关重要)的完整性和稳定性。pCAP 250及其肽变体的结合进一步影响了螺旋2和L1环结构基序周围的另外的残基,在DBD表面产生了相对大而明确受影响斑块。
尽管已经结合其具体实施方案描述了本发明,但是很明显许多可选方案、修改和变化对本领域技术人员将是显而易见的。因此,旨在涵盖落入所附权利要求书的精神和宽范围中的全部此类可选方案、修改和变化。
在本说明书中提及的全部出版物、专利和专利申请以其整体通过引用并入说明书,以如同每个单独的出版物、专利或专利申请被具体或单独指出通过引用并入本文的相同程度。另外,在本申请中的任何参考的引用或鉴定不应当被理解为承认该参考可用作本发明的现有技术。在使用章节标题的范围内,不应当将其解释为必然限定性的。
Claims (12)
1.一种分离肽,其选自SEQ ID NOs: 426、427、429、430、431和446,其中所述肽与p53的DNA结合结构域DBD通过所述DBD的至少一个残基相互作用,其中所述肽至少部分地将突变型p53蛋白再活化,且其中所述相互作用经由所述DBD的螺旋-2和L1。
2.权利要求1的分离肽,其中通过NMR测定的,所述相互作用影响所述DBD的螺旋-2和/或L1的结构稳定性。
3.权利要求1的分离肽,其中所述至少一个残基选自L1的H115、G117和所述p53的Y126和V274和G279和R280。
4.权利要求1的分离肽,其中所述相互作用是通过所述DBD的至少一个氨基酸、通过所述DBD的至少两个氨基酸、通过所述DBD的至少三个氨基酸或通过所述DBD的至少四个氨基酸。
5.权利要求1-4中任一项的分离肽,其进一步包含细胞穿透部分。
6.权利要求1的分离肽,其中所述分离肽如SEQ ID NO: 429所示。
7.权利要求1-4中任一项的分离肽在制备用于治疗与突变型p53相关的癌症的药物中的用途。
8.根据权利要求7的用途,其中所述癌症选自乳腺癌、结肠癌、卵巢癌和肺癌。
9.根据权利要求7的用途,其中经由选自连续输注和皮下施用的施用途径向有此需要的对象施用治疗有效量的所述分离肽。
10.根据权利要求9的用途,其中所述治疗有效量为每天0.01-0.3 mg/kg。
11.根据权利要求7的用途,其中所述治疗进一步包括施用治疗有效量的基于铂的化学疗法。
12.根据权利要求11的用途,其中所述基于铂的化学疗法包括顺铂。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662291003P | 2016-02-04 | 2016-02-04 | |
| US62/291,003 | 2016-02-04 | ||
| PCT/IL2017/050132 WO2017134671A1 (en) | 2016-02-04 | 2017-02-03 | Peptides and use of same in the treatment of diseases, disorders or conditions associated with a mutant p53 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN108884137A CN108884137A (zh) | 2018-11-23 |
| CN108884137B true CN108884137B (zh) | 2022-04-05 |
Family
ID=58108701
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780022355.2A Active CN108884137B (zh) | 2016-02-04 | 2017-02-03 | 肽及其在治疗与突变型p53相关的疾病、病症或病况中的用途 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US11230578B2 (zh) |
| EP (1) | EP3411390A1 (zh) |
| JP (2) | JP7072508B2 (zh) |
| CN (1) | CN108884137B (zh) |
| AU (1) | AU2017214733B2 (zh) |
| CA (1) | CA3012302A1 (zh) |
| RU (1) | RU2762089C2 (zh) |
| WO (1) | WO2017134671A1 (zh) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6554099B2 (ja) | 2013-08-07 | 2019-07-31 | イェダ リサーチ アンド ディベロップメント カンパニー リミテッドYeda Research And Development Co.Ltd. | p53変異体を再活性化することの可能なペプチド |
| WO2017134671A1 (en) | 2016-02-04 | 2017-08-10 | Yeda Research And Development Co. Ltd. | Peptides and use of same in the treatment of diseases, disorders or conditions associated with a mutant p53 |
| US20220251159A1 (en) * | 2016-02-04 | 2022-08-11 | Yeda Research And Development Co., Ltd | Peptides and use of same in the treatment of diseases, disroders or conditions associated with a mutant p53 |
| EP4121441A1 (en) | 2020-03-16 | 2023-01-25 | Yeda Research and Development Co. Ltd | Peptide analogs and use of same in treating diseases, disorders or conditions associated with a mutant p53 protein |
| CN112578106B (zh) * | 2020-04-13 | 2022-04-22 | 南京大学 | 一种纳米孔道单分子蛋白质测序仪 |
| CN112921032A (zh) * | 2020-12-29 | 2021-06-08 | 苏州中科先进技术研究院有限公司 | 一种引物对、探针、试剂盒及其使用方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1329493A (zh) * | 1998-12-02 | 2002-01-02 | 辉瑞产品公司 | 恢复p53家族蛋白质的构象稳定性的方法和组合物 |
| WO2013036208A1 (en) * | 2011-09-09 | 2013-03-14 | Agency For Science, Technology And Research | P53 activating peptides |
| WO2015019318A1 (en) * | 2013-08-07 | 2015-02-12 | Yeda Research And Development Co. Ltd. | Peptides capable of reactivating p53 mutants |
Family Cites Families (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL154600B (nl) | 1971-02-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen. |
| NL154598B (nl) | 1970-11-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van laagmoleculire verbindingen en van eiwitten die deze verbindingen specifiek kunnen binden, alsmede testverpakking. |
| NL154599B (nl) | 1970-12-28 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van specifiek bindende eiwitten en hun corresponderende bindbare stoffen, alsmede testverpakking. |
| US3901654A (en) | 1971-06-21 | 1975-08-26 | Biological Developments | Receptor assays of biologically active compounds employing biologically specific receptors |
| US3853987A (en) | 1971-09-01 | 1974-12-10 | W Dreyer | Immunological reagent and radioimmuno assay |
| US3867517A (en) | 1971-12-21 | 1975-02-18 | Abbott Lab | Direct radioimmunoassay for antigens and their antibodies |
| NL171930C (nl) | 1972-05-11 | 1983-06-01 | Akzo Nv | Werkwijze voor het aantonen en bepalen van haptenen, alsmede testverpakkingen. |
| US3850578A (en) | 1973-03-12 | 1974-11-26 | H Mcconnell | Process for assaying for biologically active molecules |
| US3935074A (en) | 1973-12-17 | 1976-01-27 | Syva Company | Antibody steric hindrance immunoassay with two antibodies |
| US3996345A (en) | 1974-08-12 | 1976-12-07 | Syva Company | Fluorescence quenching with immunological pairs in immunoassays |
| US4034074A (en) | 1974-09-19 | 1977-07-05 | The Board Of Trustees Of Leland Stanford Junior University | Universal reagent 2-site immunoradiometric assay using labelled anti (IgG) |
| US3984533A (en) | 1975-11-13 | 1976-10-05 | General Electric Company | Electrophoretic method of detecting antigen-antibody reaction |
| US4098876A (en) | 1976-10-26 | 1978-07-04 | Corning Glass Works | Reverse sandwich immunoassay |
| US4879219A (en) | 1980-09-19 | 1989-11-07 | General Hospital Corporation | Immunoassay utilizing monoclonal high affinity IgM antibodies |
| US5011771A (en) | 1984-04-12 | 1991-04-30 | The General Hospital Corporation | Multiepitopic immunometric assay |
| US4666828A (en) | 1984-08-15 | 1987-05-19 | The General Hospital Corporation | Test for Huntington's disease |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4801531A (en) | 1985-04-17 | 1989-01-31 | Biotechnology Research Partners, Ltd. | Apo AI/CIII genomic polymorphisms predictive of atherosclerosis |
| US5272057A (en) | 1988-10-14 | 1993-12-21 | Georgetown University | Method of detecting a predisposition to cancer by the use of restriction fragment length polymorphism of the gene for human poly (ADP-ribose) polymerase |
| US5192659A (en) | 1989-08-25 | 1993-03-09 | Genetype Ag | Intron sequence analysis method for detection of adjacent and remote locus alleles as haplotypes |
| US5294605A (en) * | 1990-07-19 | 1994-03-15 | The Scripps Research Institute | Amphiphilic peptide compositions and analogues thereof |
| US5614393A (en) | 1991-10-10 | 1997-03-25 | Rhone-Poulenc Agrochimie | Production of γ-linolenic acid by a Δ6-desaturase |
| US5281521A (en) | 1992-07-20 | 1994-01-25 | The Trustees Of The University Of Pennsylvania | Modified avidin-biotin technique |
| US5969120A (en) | 1993-09-03 | 1999-10-19 | Research Development Foundation | Mutants of the RB and P53 genes |
| US6184205B1 (en) * | 1994-07-22 | 2001-02-06 | University Of North Carolina At Chapel Hill | GRB2 SH3 binding peptides and methods of isolating and using same |
| US6169073B1 (en) | 1995-02-16 | 2001-01-02 | Bayer Corporation | Peptides and peptidomimetics with structural similarity to human p53 that activate p53 function |
| US5711376A (en) | 1995-12-07 | 1998-01-27 | Marathon Oil Company | Hydraulic fracturing process |
| US5877282A (en) * | 1996-09-20 | 1999-03-02 | Bristol-Myers Squibb Company | Peptide inhibitors of nuclear protein translocation having nuclear localization sequences and methods of use thereof |
| CA2289960A1 (en) | 1997-05-15 | 1998-11-19 | Kyowa Hakko Kogyo Co., Ltd. | Peptides having a cyclic structure and restoring the activities of p53 protein to mutant p53 protein |
| US20030224379A1 (en) | 2000-01-21 | 2003-12-04 | Tang Y. Tom | Novel nucleic acids and polypeptides |
| US6979446B2 (en) | 2001-01-26 | 2005-12-27 | Inhibitex, Inc. | Monoclonal antibodies to the ClfA protein and method of use in treating or preventing infections |
| EP1472276A4 (en) | 2001-02-28 | 2007-05-09 | Keith M Skubitz | PEPTIDES OF SMALL SIZE CAPACITY TO MODULATE THE FUNCTION OF THE MEMBERS OF THE FAMILY OF CD66 (CEACAM) |
| AU2003205830A1 (en) | 2002-01-23 | 2003-09-02 | Mohamed Raafat El-Gewely | Molecular libraries |
| US7361747B2 (en) | 2003-05-22 | 2008-04-22 | The University Of Hong Kong | Isolation and characterization of the precursor virus of human SARS virus: SARS-associated corona virus-like virus |
| EP1957045A2 (en) | 2005-03-14 | 2008-08-20 | Board of Regents, The University of Texas System | Bioactive fus1 peptides and nanoprticle-polypeptide complexes |
| GB0514538D0 (en) * | 2005-07-14 | 2005-08-24 | Ludwig Inst Cancer Res | Variant polypeptide and screening assay |
| WO2009112075A1 (en) | 2008-03-13 | 2009-09-17 | Universita' Degli Studi Di Trieste | Peptides and aptamers thereof as specific modulators of mutant p53 function |
| US8287845B2 (en) | 2008-12-18 | 2012-10-16 | E I Du Pont De Nemours And Company | Hair-binding peptides |
| CN101805738B (zh) * | 2009-11-12 | 2012-03-21 | 昆明理工大学 | 早老综合征所致ALT肿瘤的特有p53突变蛋白-p53N236S及其应用 |
| EP2771349B1 (en) | 2011-09-16 | 2020-02-26 | Iogenetics, LLC. | Bioinformatic processes for determination of peptide binding |
| WO2017134671A1 (en) | 2016-02-04 | 2017-08-10 | Yeda Research And Development Co. Ltd. | Peptides and use of same in the treatment of diseases, disorders or conditions associated with a mutant p53 |
-
2017
- 2017-02-03 WO PCT/IL2017/050132 patent/WO2017134671A1/en active Application Filing
- 2017-02-03 CN CN201780022355.2A patent/CN108884137B/zh active Active
- 2017-02-03 US US16/074,086 patent/US11230578B2/en active Active
- 2017-02-03 CA CA3012302A patent/CA3012302A1/en active Pending
- 2017-02-03 AU AU2017214733A patent/AU2017214733B2/en active Active
- 2017-02-03 JP JP2018540383A patent/JP7072508B2/ja active Active
- 2017-02-03 RU RU2018131120A patent/RU2762089C2/ru active
- 2017-02-03 EP EP17706901.0A patent/EP3411390A1/en not_active Withdrawn
-
2022
- 2022-05-10 JP JP2022077818A patent/JP2022112518A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1329493A (zh) * | 1998-12-02 | 2002-01-02 | 辉瑞产品公司 | 恢复p53家族蛋白质的构象稳定性的方法和组合物 |
| WO2013036208A1 (en) * | 2011-09-09 | 2013-03-14 | Agency For Science, Technology And Research | P53 activating peptides |
| WO2015019318A1 (en) * | 2013-08-07 | 2015-02-12 | Yeda Research And Development Co. Ltd. | Peptides capable of reactivating p53 mutants |
Non-Patent Citations (3)
| Title |
|---|
| "A small peptide derived from p53 linker region can resume the apoptotic activity of p53 by sequestering iASPP with p53";Shi Qiu et al.;《Cancer Letters》;20151231;第356卷;第910-917页 * |
| "An All-D Amino Acid Peptide Model of R1(IV)531-543 from Type IV Collagen Binds the α3β1 Integrin and Mediates Tumor Cell Adhesion, Spreading, and Motility";Changfen Li et al.;《Biochemistry》;19971231;第36卷(第49期);第15404-15410页 * |
| "残基突变对P53-DNA结合域肽段构象影响的分子动力学模拟";许朝莹 等;《物理化学学报》;20120418;第28卷(第7期);第1665-1675页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2022112518A (ja) | 2022-08-02 |
| WO2017134671A1 (en) | 2017-08-10 |
| EP3411390A1 (en) | 2018-12-12 |
| RU2018131120A3 (zh) | 2020-06-25 |
| AU2017214733A1 (en) | 2018-09-06 |
| JP2019512004A (ja) | 2019-05-09 |
| CA3012302A1 (en) | 2017-08-10 |
| RU2018131120A (ru) | 2020-03-05 |
| JP7072508B2 (ja) | 2022-05-20 |
| US11230578B2 (en) | 2022-01-25 |
| CN108884137A (zh) | 2018-11-23 |
| AU2017214733B2 (en) | 2022-09-29 |
| RU2762089C2 (ru) | 2021-12-15 |
| US20190048053A1 (en) | 2019-02-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN108884137B (zh) | 肽及其在治疗与突变型p53相关的疾病、病症或病况中的用途 | |
| ES2795982T3 (es) | Péptidos capaces de reactivar mutantes de p53 | |
| EP2951196B1 (en) | Cell penetrating peptides for intracellular delivery of molecules | |
| ES2687987T3 (es) | Péptidos que penetran en las células para la administración intracelular de moléculas | |
| US10188699B2 (en) | CAPCNA peptide therapeutics for cancer | |
| KR20160013058A (ko) | 암의 치료를 위한 방법 및 조성물 | |
| CN111655277B (zh) | Atf5肽变体及其用途 | |
| WO2016130966A1 (en) | Compositions and methods for regulating blood pressure | |
| US9314497B2 (en) | E2F as a target of hormone refractory prostate cancer | |
| JP5700409B2 (ja) | Hsp90を標的にした新規抗がんキメラペプチド | |
| US9683025B2 (en) | Methods and compositions for treating cancer and inflammatory diseases | |
| US10316077B2 (en) | Cell-penetrating ATF5 polypeptides and uses thereof | |
| EP3265108A1 (en) | Peptides and compositions comprising same and uses thereof in the treatment of diseases | |
| US20190030126A1 (en) | Inhibitors of the Interaction BCL-2 L10 / IP3 Receptors | |
| US20220251159A1 (en) | Peptides and use of same in the treatment of diseases, disroders or conditions associated with a mutant p53 | |
| EP4121441A1 (en) | Peptide analogs and use of same in treating diseases, disorders or conditions associated with a mutant p53 protein |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |