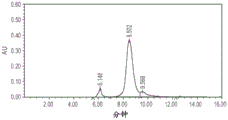
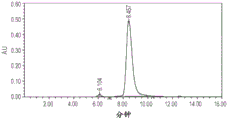
CN107337728B - 脂蛋白复合物及其制备和用途 - Google Patents
脂蛋白复合物及其制备和用途 Download PDFInfo
- Publication number
- CN107337728B CN107337728B CN201710493059.2A CN201710493059A CN107337728B CN 107337728 B CN107337728 B CN 107337728B CN 201710493059 A CN201710493059 A CN 201710493059A CN 107337728 B CN107337728 B CN 107337728B
- Authority
- CN
- China
- Prior art keywords
- apoa
- population
- lipid
- lipoprotein
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 102000004895 Lipoproteins Human genes 0.000 title claims abstract description 390
- 108090001030 Lipoproteins Proteins 0.000 title claims abstract description 389
- 238000002360 preparation method Methods 0.000 title description 16
- 238000000034 method Methods 0.000 claims abstract description 254
- 102000007592 Apolipoproteins Human genes 0.000 claims abstract description 178
- 108010071619 Apolipoproteins Proteins 0.000 claims abstract description 178
- 238000011282 treatment Methods 0.000 claims abstract description 26
- 238000004519 manufacturing process Methods 0.000 claims abstract description 23
- 150000002632 lipids Chemical class 0.000 claims description 375
- 108090000623 proteins and genes Proteins 0.000 claims description 231
- 102000004169 proteins and genes Human genes 0.000 claims description 212
- 235000018102 proteins Nutrition 0.000 claims description 210
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 claims description 189
- 239000002245 particle Substances 0.000 claims description 189
- 239000000203 mixture Substances 0.000 claims description 154
- 150000003904 phospholipids Chemical class 0.000 claims description 140
- 235000012000 cholesterol Nutrition 0.000 claims description 87
- 235000004252 protein component Nutrition 0.000 claims description 51
- 108010059886 Apolipoprotein A-I Proteins 0.000 claims description 46
- 102000005666 Apolipoprotein A-I Human genes 0.000 claims description 46
- 238000005227 gel permeation chromatography Methods 0.000 claims description 45
- 239000000725 suspension Substances 0.000 claims description 45
- 150000001413 amino acids Chemical class 0.000 claims description 44
- RWKUXQNLWDTSLO-GWQJGLRPSA-N N-hexadecanoylsphingosine-1-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)N[C@@H](COP([O-])(=O)OCC[N+](C)(C)C)[C@H](O)\C=C\CCCCCCCCCCCCC RWKUXQNLWDTSLO-GWQJGLRPSA-N 0.000 claims description 34
- 230000007704 transition Effects 0.000 claims description 34
- 230000007935 neutral effect Effects 0.000 claims description 31
- 125000002252 acyl group Chemical group 0.000 claims description 29
- 239000003814 drug Substances 0.000 claims description 27
- 239000002158 endotoxin Substances 0.000 claims description 25
- 239000008194 pharmaceutical composition Substances 0.000 claims description 24
- 101000733802 Homo sapiens Apolipoprotein A-I Proteins 0.000 claims description 23
- 235000001014 amino acid Nutrition 0.000 claims description 22
- 239000003599 detergent Substances 0.000 claims description 18
- 238000002296 dynamic light scattering Methods 0.000 claims description 18
- PEDCQBHIVMGVHV-UHFFFAOYSA-N glycerol Substances OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims description 16
- 208000032928 Dyslipidaemia Diseases 0.000 claims description 13
- 208000017170 Lipid metabolism disease Diseases 0.000 claims description 13
- 150000003839 salts Chemical class 0.000 claims description 12
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 claims description 10
- ATBOMIWRCZXYSZ-XZBBILGWSA-N [1-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-3-hexadecanoyloxypropan-2-yl] (9e,12e)-octadeca-9,12-dienoate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC ATBOMIWRCZXYSZ-XZBBILGWSA-N 0.000 claims description 9
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 claims description 6
- 238000001816 cooling Methods 0.000 claims description 6
- 229930182817 methionine Natural products 0.000 claims description 6
- 239000003085 diluting agent Substances 0.000 claims description 5
- 239000002552 dosage form Substances 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 4
- 150000002978 peroxides Chemical class 0.000 claims description 4
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 4
- 238000010438 heat treatment Methods 0.000 claims 2
- 239000003125 aqueous solvent Substances 0.000 claims 1
- 238000000746 purification Methods 0.000 abstract description 35
- 238000005382 thermal cycling Methods 0.000 abstract description 31
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 12
- 238000003259 recombinant expression Methods 0.000 abstract description 9
- 201000010099 disease Diseases 0.000 abstract description 7
- 230000002265 prevention Effects 0.000 abstract description 6
- 208000035475 disorder Diseases 0.000 abstract description 5
- 230000001258 dyslipidemic effect Effects 0.000 abstract 1
- 210000004027 cell Anatomy 0.000 description 188
- 108010010234 HDL Lipoproteins Proteins 0.000 description 122
- 102000015779 HDL Lipoproteins Human genes 0.000 description 122
- 239000000306 component Substances 0.000 description 76
- 239000000243 solution Substances 0.000 description 71
- 108090000765 processed proteins & peptides Proteins 0.000 description 50
- 210000002381 plasma Anatomy 0.000 description 43
- 230000000694 effects Effects 0.000 description 37
- 238000009472 formulation Methods 0.000 description 37
- 239000011159 matrix material Substances 0.000 description 37
- 239000000047 product Substances 0.000 description 35
- 102000019758 lipid binding proteins Human genes 0.000 description 33
- 239000000872 buffer Substances 0.000 description 32
- 230000002441 reversible effect Effects 0.000 description 30
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 27
- 238000005349 anion exchange Methods 0.000 description 27
- 208000024172 Cardiovascular disease Diseases 0.000 description 25
- 230000001965 increasing effect Effects 0.000 description 25
- 230000002829 reductive effect Effects 0.000 description 25
- 201000001320 Atherosclerosis Diseases 0.000 description 24
- 108020004414 DNA Proteins 0.000 description 24
- -1 apoA-IV Proteins 0.000 description 24
- 229940079593 drug Drugs 0.000 description 24
- 210000002966 serum Anatomy 0.000 description 24
- 210000004185 liver Anatomy 0.000 description 23
- 230000015572 biosynthetic process Effects 0.000 description 22
- 230000014509 gene expression Effects 0.000 description 22
- 230000001225 therapeutic effect Effects 0.000 description 22
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 21
- 108010007622 LDL Lipoproteins Proteins 0.000 description 21
- 102000007330 LDL Lipoproteins Human genes 0.000 description 21
- 239000002609 medium Substances 0.000 description 21
- 230000003647 oxidation Effects 0.000 description 21
- 238000007254 oxidation reaction Methods 0.000 description 21
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 19
- 229940099352 cholate Drugs 0.000 description 19
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 19
- 238000002347 injection Methods 0.000 description 19
- 239000007924 injection Substances 0.000 description 19
- 102000004196 processed proteins & peptides Human genes 0.000 description 18
- 101710129138 ATP synthase subunit 9, mitochondrial Proteins 0.000 description 17
- 101710168506 ATP synthase subunit C, plastid Proteins 0.000 description 17
- 101710114069 ATP synthase subunit c Proteins 0.000 description 17
- 101710197943 ATP synthase subunit c, chloroplastic Proteins 0.000 description 17
- 101710187091 ATP synthase subunit c, sodium ion specific Proteins 0.000 description 17
- 210000004962 mammalian cell Anatomy 0.000 description 17
- 230000008569 process Effects 0.000 description 17
- 230000004141 reverse cholesterol transport Effects 0.000 description 17
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 16
- 241000700605 Viruses Species 0.000 description 16
- 108091016323 lipid binding proteins Proteins 0.000 description 16
- 230000009918 complex formation Effects 0.000 description 15
- 208000029078 coronary artery disease Diseases 0.000 description 15
- 238000009826 distribution Methods 0.000 description 15
- 238000000265 homogenisation Methods 0.000 description 15
- 238000001802 infusion Methods 0.000 description 15
- 239000002904 solvent Substances 0.000 description 15
- 150000003626 triacylglycerols Chemical class 0.000 description 15
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 14
- 150000004665 fatty acids Chemical class 0.000 description 14
- 239000000706 filtrate Substances 0.000 description 14
- 238000004128 high performance liquid chromatography Methods 0.000 description 14
- 125000003473 lipid group Chemical group 0.000 description 14
- 239000003960 organic solvent Substances 0.000 description 14
- 229920006395 saturated elastomer Polymers 0.000 description 14
- 239000013598 vector Substances 0.000 description 14
- 230000008901 benefit Effects 0.000 description 13
- 235000013601 eggs Nutrition 0.000 description 13
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical group CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 13
- 230000002209 hydrophobic effect Effects 0.000 description 13
- 239000000843 powder Substances 0.000 description 13
- 239000011347 resin Substances 0.000 description 13
- 239000000523 sample Substances 0.000 description 13
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 12
- 108010062497 VLDL Lipoproteins Proteins 0.000 description 12
- 239000006185 dispersion Substances 0.000 description 12
- 238000004108 freeze drying Methods 0.000 description 12
- 239000012528 membrane Substances 0.000 description 12
- 239000000693 micelle Substances 0.000 description 12
- 239000008363 phosphate buffer Substances 0.000 description 12
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 12
- 229920005989 resin Polymers 0.000 description 12
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 12
- 230000032258 transport Effects 0.000 description 12
- 108010008184 Aryldialkylphosphatase Proteins 0.000 description 11
- 102000006996 Aryldialkylphosphatase Human genes 0.000 description 11
- 241001465754 Metazoa Species 0.000 description 11
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 11
- 239000013604 expression vector Substances 0.000 description 11
- 229960003512 nicotinic acid Drugs 0.000 description 11
- 239000011664 nicotinic acid Substances 0.000 description 11
- 235000001968 nicotinic acid Nutrition 0.000 description 11
- 239000012460 protein solution Substances 0.000 description 11
- PORPENFLTBBHSG-MGBGTMOVSA-N 1,2-dihexadecanoyl-sn-glycerol-3-phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(O)=O)OC(=O)CCCCCCCCCCCCCCC PORPENFLTBBHSG-MGBGTMOVSA-N 0.000 description 10
- 241000283973 Oryctolagus cuniculus Species 0.000 description 10
- 108010076504 Protein Sorting Signals Proteins 0.000 description 10
- 239000013543 active substance Substances 0.000 description 10
- 238000004113 cell culture Methods 0.000 description 10
- 238000004587 chromatography analysis Methods 0.000 description 10
- 238000001914 filtration Methods 0.000 description 10
- 239000002502 liposome Substances 0.000 description 10
- 102000039446 nucleic acids Human genes 0.000 description 10
- 108020004707 nucleic acids Proteins 0.000 description 10
- 150000007523 nucleic acids Chemical class 0.000 description 10
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 9
- 108010087614 Apolipoprotein A-II Proteins 0.000 description 9
- 102000009081 Apolipoprotein A-II Human genes 0.000 description 9
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 9
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 108090000340 Transaminases Proteins 0.000 description 9
- 230000027455 binding Effects 0.000 description 9
- 230000008859 change Effects 0.000 description 9
- 150000001840 cholesterol esters Chemical class 0.000 description 9
- 238000010668 complexation reaction Methods 0.000 description 9
- 235000014113 dietary fatty acids Nutrition 0.000 description 9
- 239000000194 fatty acid Substances 0.000 description 9
- 229930195729 fatty acid Natural products 0.000 description 9
- 239000000499 gel Substances 0.000 description 9
- 239000010410 layer Substances 0.000 description 9
- 229940067606 lecithin Drugs 0.000 description 9
- 239000000787 lecithin Substances 0.000 description 9
- 235000010445 lecithin Nutrition 0.000 description 9
- 230000003902 lesion Effects 0.000 description 9
- 230000007246 mechanism Effects 0.000 description 9
- 229920001184 polypeptide Polymers 0.000 description 9
- 102100029470 Apolipoprotein E Human genes 0.000 description 8
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 8
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 8
- 229930006000 Sucrose Natural products 0.000 description 8
- 229960000583 acetic acid Drugs 0.000 description 8
- 125000004432 carbon atom Chemical group C* 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 8
- 239000000356 contaminant Substances 0.000 description 8
- 239000011261 inert gas Substances 0.000 description 8
- 229910052757 nitrogen Inorganic materials 0.000 description 8
- 239000002773 nucleotide Substances 0.000 description 8
- 125000003729 nucleotide group Chemical group 0.000 description 8
- 239000001488 sodium phosphate Substances 0.000 description 8
- 229910000162 sodium phosphate Inorganic materials 0.000 description 8
- 235000011008 sodium phosphates Nutrition 0.000 description 8
- 239000005720 sucrose Substances 0.000 description 8
- 238000002560 therapeutic procedure Methods 0.000 description 8
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 8
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 8
- 101710095339 Apolipoprotein E Proteins 0.000 description 7
- 108010061846 Cholesterol Ester Transfer Proteins Proteins 0.000 description 7
- 102000012336 Cholesterol Ester Transfer Proteins Human genes 0.000 description 7
- 241000196324 Embryophyta Species 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 208000035150 Hypercholesterolemia Diseases 0.000 description 7
- 108010029485 Protein Isoforms Proteins 0.000 description 7
- 102000001708 Protein Isoforms Human genes 0.000 description 7
- 239000007864 aqueous solution Substances 0.000 description 7
- 229910052786 argon Inorganic materials 0.000 description 7
- 239000003613 bile acid Substances 0.000 description 7
- 229930183167 cerebroside Natural products 0.000 description 7
- 239000002131 composite material Substances 0.000 description 7
- 229940088598 enzyme Drugs 0.000 description 7
- 229940125753 fibrate Drugs 0.000 description 7
- 150000002270 gangliosides Chemical class 0.000 description 7
- 230000036571 hydration Effects 0.000 description 7
- 238000006703 hydration reaction Methods 0.000 description 7
- 238000000338 in vitro Methods 0.000 description 7
- 238000001990 intravenous administration Methods 0.000 description 7
- 238000011068 loading method Methods 0.000 description 7
- 125000001312 palmitoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 7
- 239000011148 porous material Substances 0.000 description 7
- 230000009467 reduction Effects 0.000 description 7
- 239000006228 supernatant Substances 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 6
- ZXWQZGROTQMXME-WXUJBLQXSA-N 2-hydroxy-n-[(e,2s,3r)-3-hydroxy-1-[(2r,3r,4s,5r,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoctadec-4-en-2-yl]tetracosanamide Chemical class CCCCCCCCCCCCCCCCCCCCCCC(O)C(=O)N[C@H]([C@H](O)\C=C\CCCCCCCCCCCCC)CO[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O ZXWQZGROTQMXME-WXUJBLQXSA-N 0.000 description 6
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 6
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 6
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 6
- 229930195725 Mannitol Natural products 0.000 description 6
- 239000011324 bead Substances 0.000 description 6
- 150000001784 cerebrosides Chemical class 0.000 description 6
- 238000012512 characterization method Methods 0.000 description 6
- 238000001502 gel electrophoresis Methods 0.000 description 6
- 239000001307 helium Substances 0.000 description 6
- 229910052734 helium Inorganic materials 0.000 description 6
- SWQJXJOGLNCZEY-UHFFFAOYSA-N helium atom Chemical compound [He] SWQJXJOGLNCZEY-UHFFFAOYSA-N 0.000 description 6
- 230000028993 immune response Effects 0.000 description 6
- 230000001976 improved effect Effects 0.000 description 6
- 238000002955 isolation Methods 0.000 description 6
- 239000000594 mannitol Substances 0.000 description 6
- 235000010355 mannitol Nutrition 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 150000003905 phosphatidylinositols Chemical class 0.000 description 6
- 229950004354 phosphorylcholine Drugs 0.000 description 6
- 230000010076 replication Effects 0.000 description 6
- 239000013557 residual solvent Substances 0.000 description 6
- 230000028327 secretion Effects 0.000 description 6
- 239000000758 substrate Substances 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- CITHEXJVPOWHKC-UUWRZZSWSA-N 1,2-di-O-myristoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCC CITHEXJVPOWHKC-UUWRZZSWSA-N 0.000 description 5
- BIABMEZBCHDPBV-MPQUPPDSSA-N 1,2-palmitoyl-sn-glycero-3-phospho-(1'-sn-glycerol) Chemical class CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@@H](O)CO)OC(=O)CCCCCCCCCCCCCCC BIABMEZBCHDPBV-MPQUPPDSSA-N 0.000 description 5
- CFWRDBDJAOHXSH-SECBINFHSA-N 2-azaniumylethyl [(2r)-2,3-diacetyloxypropyl] phosphate Chemical compound CC(=O)OC[C@@H](OC(C)=O)COP(O)(=O)OCCN CFWRDBDJAOHXSH-SECBINFHSA-N 0.000 description 5
- 101150037123 APOE gene Proteins 0.000 description 5
- 208000037260 Atherosclerotic Plaque Diseases 0.000 description 5
- 101100216294 Danio rerio apoeb gene Proteins 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 5
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 5
- 108010023302 HDL Cholesterol Proteins 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 102000003929 Transaminases Human genes 0.000 description 5
- 235000003704 aspartic acid Nutrition 0.000 description 5
- 230000009286 beneficial effect Effects 0.000 description 5
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 239000000539 dimer Substances 0.000 description 5
- 229960003724 dimyristoylphosphatidylcholine Drugs 0.000 description 5
- 229960005160 dimyristoylphosphatidylglycerol Drugs 0.000 description 5
- BPHQZTVXXXJVHI-AJQTZOPKSA-N ditetradecanoyl phosphatidylglycerol Chemical compound CCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@@H](O)CO)OC(=O)CCCCCCCCCCCCC BPHQZTVXXXJVHI-AJQTZOPKSA-N 0.000 description 5
- 239000003480 eluent Substances 0.000 description 5
- 239000007789 gas Substances 0.000 description 5
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 5
- 239000004615 ingredient Substances 0.000 description 5
- 239000003112 inhibitor Substances 0.000 description 5
- 230000000977 initiatory effect Effects 0.000 description 5
- 210000003734 kidney Anatomy 0.000 description 5
- 239000008176 lyophilized powder Substances 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 230000004060 metabolic process Effects 0.000 description 5
- 230000037230 mobility Effects 0.000 description 5
- 230000036470 plasma concentration Effects 0.000 description 5
- 238000000926 separation method Methods 0.000 description 5
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 5
- LDWIWSHBGAIIMV-ODZMYOIVSA-M sodium;[(2r)-2,3-di(hexadecanoyloxy)propyl] 2,3-dihydroxypropyl phosphate Chemical compound [Na+].CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC(O)CO)OC(=O)CCCCCCCCCCCCCCC LDWIWSHBGAIIMV-ODZMYOIVSA-M 0.000 description 5
- 238000000527 sonication Methods 0.000 description 5
- 238000003860 storage Methods 0.000 description 5
- 238000006467 substitution reaction Methods 0.000 description 5
- 230000004083 survival effect Effects 0.000 description 5
- 230000014616 translation Effects 0.000 description 5
- 238000000108 ultra-filtration Methods 0.000 description 5
- 238000011100 viral filtration Methods 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 4
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 4
- KILNVBDSWZSGLL-KXQOOQHDSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCC KILNVBDSWZSGLL-KXQOOQHDSA-N 0.000 description 4
- LRYZPFWEZHSTHD-HEFFAWAOSA-O 2-[[(e,2s,3r)-2-formamido-3-hydroxyoctadec-4-enoxy]-hydroxyphosphoryl]oxyethyl-trimethylazanium Chemical class CCCCCCCCCCCCC\C=C\[C@@H](O)[C@@H](NC=O)COP(O)(=O)OCC[N+](C)(C)C LRYZPFWEZHSTHD-HEFFAWAOSA-O 0.000 description 4
- 208000004476 Acute Coronary Syndrome Diseases 0.000 description 4
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 4
- 101150094024 Apod gene Proteins 0.000 description 4
- 101150104773 Apoh gene Proteins 0.000 description 4
- 239000005531 Flufenacet Substances 0.000 description 4
- 108090000144 Human Proteins Proteins 0.000 description 4
- 102000003839 Human Proteins Human genes 0.000 description 4
- 208000031226 Hyperlipidaemia Diseases 0.000 description 4
- 206010067125 Liver injury Diseases 0.000 description 4
- 241000714177 Murine leukemia virus Species 0.000 description 4
- 101100440173 Mus musculus Clu gene Proteins 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 108010080283 Pre-beta High-Density Lipoproteins Proteins 0.000 description 4
- 239000012564 Q sepharose fast flow resin Substances 0.000 description 4
- 241000700159 Rattus Species 0.000 description 4
- YASAKCUCGLMORW-UHFFFAOYSA-N Rosiglitazone Chemical compound C=1C=CC=NC=1N(C)CCOC(C=C1)=CC=C1CC1SC(=O)NC1=O YASAKCUCGLMORW-UHFFFAOYSA-N 0.000 description 4
- 241000701033 Simian cytomegalovirus Species 0.000 description 4
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 4
- 101100049199 Xenopus laevis vegt-a gene Proteins 0.000 description 4
- 239000001099 ammonium carbonate Substances 0.000 description 4
- 235000012501 ammonium carbonate Nutrition 0.000 description 4
- 238000010171 animal model Methods 0.000 description 4
- 239000003011 anion exchange membrane Substances 0.000 description 4
- 239000012062 aqueous buffer Substances 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 230000003143 atherosclerotic effect Effects 0.000 description 4
- 210000000941 bile Anatomy 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 229910052799 carbon Inorganic materials 0.000 description 4
- 239000012504 chromatography matrix Substances 0.000 description 4
- MYSWGUAQZAJSOK-UHFFFAOYSA-N ciprofloxacin Chemical compound C12=CC(N3CCNCC3)=C(F)C=C2C(=O)C(C(=O)O)=CN1C1CC1 MYSWGUAQZAJSOK-UHFFFAOYSA-N 0.000 description 4
- 230000000536 complexating effect Effects 0.000 description 4
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 4
- 238000004925 denaturation Methods 0.000 description 4
- 230000036425 denaturation Effects 0.000 description 4
- 238000000502 dialysis Methods 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 239000006167 equilibration buffer Substances 0.000 description 4
- IANUJLZYFUDJIH-UHFFFAOYSA-N flufenacet Chemical compound C=1C=C(F)C=CC=1N(C(C)C)C(=O)COC1=NN=C(C(F)(F)F)S1 IANUJLZYFUDJIH-UHFFFAOYSA-N 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 238000002523 gelfiltration Methods 0.000 description 4
- 125000005456 glyceride group Chemical group 0.000 description 4
- 239000001963 growth medium Substances 0.000 description 4
- 108010064060 high density lipoprotein receptors Proteins 0.000 description 4
- 102000054823 high-density lipoprotein particle receptor activity proteins Human genes 0.000 description 4
- 230000006698 induction Effects 0.000 description 4
- 210000000936 intestine Anatomy 0.000 description 4
- 229960003174 lansoprazole Drugs 0.000 description 4
- MJIHNNLFOKEZEW-UHFFFAOYSA-N lansoprazole Chemical compound CC1=C(OCC(F)(F)F)C=CN=C1CS(=O)C1=NC2=CC=CC=C2N1 MJIHNNLFOKEZEW-UHFFFAOYSA-N 0.000 description 4
- 229920006008 lipopolysaccharide Polymers 0.000 description 4
- 230000003908 liver function Effects 0.000 description 4
- HYAFETHFCAUJAY-UHFFFAOYSA-N pioglitazone Chemical compound N1=CC(CC)=CC=C1CCOC(C=C1)=CC=C1CC1C(=O)NC(=O)S1 HYAFETHFCAUJAY-UHFFFAOYSA-N 0.000 description 4
- 108091033319 polynucleotide Proteins 0.000 description 4
- 239000002157 polynucleotide Substances 0.000 description 4
- 102000040430 polynucleotide Human genes 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 230000001681 protective effect Effects 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- 238000004007 reversed phase HPLC Methods 0.000 description 4
- 238000012163 sequencing technique Methods 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 102000014898 transaminase activity proteins Human genes 0.000 description 4
- 238000010361 transduction Methods 0.000 description 4
- 230000026683 transduction Effects 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- 238000013519 translation Methods 0.000 description 4
- ZGGHKIMDNBDHJB-NRFPMOEYSA-M (3R,5S)-fluvastatin sodium Chemical compound [Na+].C12=CC=CC=C2N(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)=C1C1=CC=C(F)C=C1 ZGGHKIMDNBDHJB-NRFPMOEYSA-M 0.000 description 3
- NRJAVPSFFCBXDT-HUESYALOSA-N 1,2-distearoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCCCC NRJAVPSFFCBXDT-HUESYALOSA-N 0.000 description 3
- BPIUIOXAFBGMNB-UHFFFAOYSA-N 1-hexoxyhexane Chemical compound CCCCCCOCCCCCC BPIUIOXAFBGMNB-UHFFFAOYSA-N 0.000 description 3
- RFVFQQWKPSOBED-PSXMRANNSA-N 1-myristoyl-2-palmitoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)O[C@@H](COP([O-])(=O)OCC[N+](C)(C)C)COC(=O)CCCCCCCCCCCCC RFVFQQWKPSOBED-PSXMRANNSA-N 0.000 description 3
- IJFVSSZAOYLHEE-UHFFFAOYSA-N 2,3-di(dodecanoyloxy)propyl 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCCCCCCCCC(=O)OCC(COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCC IJFVSSZAOYLHEE-UHFFFAOYSA-N 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- 241000282472 Canis lupus familiaris Species 0.000 description 3
- 208000032064 Chronic Limb-Threatening Ischemia Diseases 0.000 description 3
- 108010004103 Chylomicrons Proteins 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 3
- ACTIUHUUMQJHFO-UHFFFAOYSA-N Coenzym Q10 Natural products COC1=C(OC)C(=O)C(CC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)C)=C(C)C1=O ACTIUHUUMQJHFO-UHFFFAOYSA-N 0.000 description 3
- 241000699802 Cricetulus griseus Species 0.000 description 3
- 241000282326 Felis catus Species 0.000 description 3
- 229930186217 Glycolipid Natural products 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- 206010022562 Intermittent claudication Diseases 0.000 description 3
- 208000032382 Ischaemic stroke Diseases 0.000 description 3
- 239000000232 Lipid Bilayer Substances 0.000 description 3
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 3
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 3
- SXZWBNWTCVLZJN-NMIJJABPSA-N N-tricosanoylsphing-4-enine-1-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCCCCCCC(=O)N[C@@H](COP([O-])(=O)OCC[N+](C)(C)C)[C@H](O)\C=C\CCCCCCCCCCCCC SXZWBNWTCVLZJN-NMIJJABPSA-N 0.000 description 3
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 3
- FVJZSBGHRPJMMA-IOLBBIBUSA-N PG(18:0/18:0) Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@@H](O)CO)OC(=O)CCCCCCCCCCCCCCCCC FVJZSBGHRPJMMA-IOLBBIBUSA-N 0.000 description 3
- 206010034576 Peripheral ischaemia Diseases 0.000 description 3
- 206010035226 Plasma cell myeloma Diseases 0.000 description 3
- 101100379247 Salmo trutta apoa1 gene Proteins 0.000 description 3
- 208000034189 Sclerosis Diseases 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 208000032109 Transient ischaemic attack Diseases 0.000 description 3
- 206010045261 Type IIa hyperlipidaemia Diseases 0.000 description 3
- 108010069201 VLDL Cholesterol Proteins 0.000 description 3
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 3
- JLPULHDHAOZNQI-JLOPVYAASA-N [(2r)-3-hexadecanoyloxy-2-[(9e,12e)-octadeca-9,12-dienoyl]oxypropyl] 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC JLPULHDHAOZNQI-JLOPVYAASA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 150000001298 alcohols Chemical class 0.000 description 3
- 238000005571 anion exchange chromatography Methods 0.000 description 3
- 239000003146 anticoagulant agent Substances 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 230000001746 atrial effect Effects 0.000 description 3
- 229920000080 bile acid sequestrant Polymers 0.000 description 3
- 210000004556 brain Anatomy 0.000 description 3
- 229960001058 bupropion Drugs 0.000 description 3
- SNPPWIUOZRMYNY-UHFFFAOYSA-N bupropion Chemical compound CC(C)(C)NC(C)C(=O)C1=CC=CC(Cl)=C1 SNPPWIUOZRMYNY-UHFFFAOYSA-N 0.000 description 3
- 238000007707 calorimetry Methods 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 235000017471 coenzyme Q10 Nutrition 0.000 description 3
- ACTIUHUUMQJHFO-UPTCCGCDSA-N coenzyme Q10 Chemical compound COC1=C(OC)C(=O)C(C\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CCC=C(C)C)=C(C)C1=O ACTIUHUUMQJHFO-UPTCCGCDSA-N 0.000 description 3
- 238000004440 column chromatography Methods 0.000 description 3
- LHCZDUCPSRJDJT-UHFFFAOYSA-N dilauroyl phosphatidylglycerol Chemical compound CCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCCCCCC LHCZDUCPSRJDJT-UHFFFAOYSA-N 0.000 description 3
- MWRBNPKJOOWZPW-CLFAGFIQSA-N dioleoyl phosphatidylethanolamine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(COP(O)(=O)OCCN)OC(=O)CCCCCCC\C=C/CCCCCCCC MWRBNPKJOOWZPW-CLFAGFIQSA-N 0.000 description 3
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 3
- 230000008030 elimination Effects 0.000 description 3
- 238000003379 elimination reaction Methods 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000005886 esterification reaction Methods 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 230000008020 evaporation Effects 0.000 description 3
- 229960003765 fluvastatin Drugs 0.000 description 3
- 238000005194 fractionation Methods 0.000 description 3
- 239000012362 glacial acetic acid Substances 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 229930182470 glycoside Natural products 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 231100000234 hepatic damage Toxicity 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 238000010348 incorporation Methods 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 208000021156 intermittent vascular claudication Diseases 0.000 description 3
- 238000002608 intravascular ultrasound Methods 0.000 description 3
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 3
- 229960004768 irinotecan Drugs 0.000 description 3
- 230000003907 kidney function Effects 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 230000008818 liver damage Effects 0.000 description 3
- 229960004844 lovastatin Drugs 0.000 description 3
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 3
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 3
- 238000002595 magnetic resonance imaging Methods 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 235000013336 milk Nutrition 0.000 description 3
- 239000008267 milk Substances 0.000 description 3
- 210000004080 milk Anatomy 0.000 description 3
- 201000000050 myeloid neoplasm Diseases 0.000 description 3
- 208000010125 myocardial infarction Diseases 0.000 description 3
- 235000015097 nutrients Nutrition 0.000 description 3
- 239000003791 organic solvent mixture Substances 0.000 description 3
- 210000001672 ovary Anatomy 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 239000002953 phosphate buffered saline Substances 0.000 description 3
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 3
- 238000001556 precipitation Methods 0.000 description 3
- 108010038649 preproapolipoprotein A-I Proteins 0.000 description 3
- 230000004224 protection Effects 0.000 description 3
- 230000017854 proteolysis Effects 0.000 description 3
- 238000003753 real-time PCR Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 208000037803 restenosis Diseases 0.000 description 3
- 230000001177 retroviral effect Effects 0.000 description 3
- 238000012552 review Methods 0.000 description 3
- 239000012679 serum free medium Substances 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000011877 solvent mixture Substances 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 201000010875 transient cerebral ischemia Diseases 0.000 description 3
- 238000011269 treatment regimen Methods 0.000 description 3
- 235000013311 vegetables Nutrition 0.000 description 3
- 230000035899 viability Effects 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- 229940088594 vitamin Drugs 0.000 description 3
- 229930003231 vitamin Natural products 0.000 description 3
- 235000013343 vitamin Nutrition 0.000 description 3
- 239000011782 vitamin Substances 0.000 description 3
- 239000008096 xylene Substances 0.000 description 3
- 229960001360 zolmitriptan Drugs 0.000 description 3
- ULSDMUVEXKOYBU-ZDUSSCGKSA-N zolmitriptan Chemical compound C1=C2C(CCN(C)C)=CNC2=CC=C1C[C@H]1COC(=O)N1 ULSDMUVEXKOYBU-ZDUSSCGKSA-N 0.000 description 3
- AHOUBRCZNHFOSL-YOEHRIQHSA-N (+)-Casbol Chemical compound C1=CC(F)=CC=C1[C@H]1[C@H](COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-YOEHRIQHSA-N 0.000 description 2
- XMAYWYJOQHXEEK-OZXSUGGESA-N (2R,4S)-ketoconazole Chemical compound C1CN(C(=O)C)CCN1C(C=C1)=CC=C1OC[C@@H]1O[C@@](CN2C=NC=C2)(C=2C(=CC(Cl)=CC=2)Cl)OC1 XMAYWYJOQHXEEK-OZXSUGGESA-N 0.000 description 2
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 2
- WKJDWDLHIOUPPL-JSOSNVBQSA-N (2s)-2-amino-3-({[(2r)-2,3-bis(tetradecanoyloxy)propoxy](hydroxy)phosphoryl}oxy)propanoic acid Chemical compound CCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCC WKJDWDLHIOUPPL-JSOSNVBQSA-N 0.000 description 2
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 2
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 2
- SLKDGVPOSSLUAI-PGUFJCEWSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphoethanolamine zwitterion Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OCCN)OC(=O)CCCCCCCCCCCCCCC SLKDGVPOSSLUAI-PGUFJCEWSA-N 0.000 description 2
- OZSITQMWYBNPMW-GDLZYMKVSA-N 1,2-ditetradecanoyl-sn-glycerol-3-phosphate Chemical compound CCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(O)=O)OC(=O)CCCCCCCCCCCCC OZSITQMWYBNPMW-GDLZYMKVSA-N 0.000 description 2
- OZOMQRBLCMDCEG-CHHVJCJISA-N 1-[(z)-[5-(4-nitrophenyl)furan-2-yl]methylideneamino]imidazolidine-2,4-dione Chemical compound C1=CC([N+](=O)[O-])=CC=C1C(O1)=CC=C1\C=N/N1C(=O)NC(=O)C1 OZOMQRBLCMDCEG-CHHVJCJISA-N 0.000 description 2
- PZNPLUBHRSSFHT-RRHRGVEJSA-N 1-hexadecanoyl-2-octadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[C@@H](COP([O-])(=O)OCC[N+](C)(C)C)COC(=O)CCCCCCCCCCCCCCC PZNPLUBHRSSFHT-RRHRGVEJSA-N 0.000 description 2
- VHVPQPYKVGDNFY-DFMJLFEVSA-N 2-[(2r)-butan-2-yl]-4-[4-[4-[4-[[(2r,4s)-2-(2,4-dichlorophenyl)-2-(1,2,4-triazol-1-ylmethyl)-1,3-dioxolan-4-yl]methoxy]phenyl]piperazin-1-yl]phenyl]-1,2,4-triazol-3-one Chemical compound O=C1N([C@H](C)CC)N=CN1C1=CC=C(N2CCN(CC2)C=2C=CC(OC[C@@H]3O[C@](CN4N=CN=C4)(OC3)C=3C(=CC(Cl)=CC=3)Cl)=CC=2)C=C1 VHVPQPYKVGDNFY-DFMJLFEVSA-N 0.000 description 2
- NEZDNQCXEZDCBI-UHFFFAOYSA-N 2-azaniumylethyl 2,3-di(tetradecanoyloxy)propyl phosphate Chemical compound CCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCCN)OC(=O)CCCCCCCCCCCCC NEZDNQCXEZDCBI-UHFFFAOYSA-N 0.000 description 2
- AZSNMRSAGSSBNP-UHFFFAOYSA-N 22,23-dihydroavermectin B1a Natural products C1CC(C)C(C(C)CC)OC21OC(CC=C(C)C(OC1OC(C)C(OC3OC(C)C(O)C(OC)C3)C(OC)C1)C(C)C=CC=C1C3(C(C(=O)O4)C=C(C)C(O)C3OC1)O)CC4C2 AZSNMRSAGSSBNP-UHFFFAOYSA-N 0.000 description 2
- HVCOBJNICQPDBP-UHFFFAOYSA-N 3-[3-[3,5-dihydroxy-6-methyl-4-(3,4,5-trihydroxy-6-methyloxan-2-yl)oxyoxan-2-yl]oxydecanoyloxy]decanoic acid;hydrate Chemical compound O.OC1C(OC(CC(=O)OC(CCCCCCC)CC(O)=O)CCCCCCC)OC(C)C(O)C1OC1C(O)C(O)C(O)C(C)O1 HVCOBJNICQPDBP-UHFFFAOYSA-N 0.000 description 2
- SPBDXSGPUHCETR-JFUDTMANSA-N 8883yp2r6d Chemical compound O1[C@@H](C)[C@H](O)[C@@H](OC)C[C@@H]1O[C@@H]1[C@@H](OC)C[C@H](O[C@@H]2C(=C/C[C@@H]3C[C@@H](C[C@@]4(O[C@@H]([C@@H](C)CC4)C(C)C)O3)OC(=O)[C@@H]3C=C(C)[C@@H](O)[C@H]4OC\C([C@@]34O)=C/C=C/[C@@H]2C)/C)O[C@H]1C.C1C[C@H](C)[C@@H]([C@@H](C)CC)O[C@@]21O[C@H](C\C=C(C)\[C@@H](O[C@@H]1O[C@@H](C)[C@H](O[C@@H]3O[C@@H](C)[C@H](O)[C@@H](OC)C3)[C@@H](OC)C1)[C@@H](C)\C=C\C=C/1[C@]3([C@H](C(=O)O4)C=C(C)[C@@H](O)[C@H]3OC\1)O)C[C@H]4C2 SPBDXSGPUHCETR-JFUDTMANSA-N 0.000 description 2
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 2
- APKFDSVGJQXUKY-KKGHZKTASA-N Amphotericin-B Natural products O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1C=CC=CC=CC=CC=CC=CC=C[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-KKGHZKTASA-N 0.000 description 2
- 206010002383 Angina Pectoris Diseases 0.000 description 2
- 200000000007 Arterial disease Diseases 0.000 description 2
- 206010003210 Arteriosclerosis Diseases 0.000 description 2
- 206010003211 Arteriosclerosis coronary artery Diseases 0.000 description 2
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 description 2
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 description 2
- 241000972773 Aulopiformes Species 0.000 description 2
- 239000005528 B01AC05 - Ticlopidine Substances 0.000 description 2
- KPYSYYIEGFHWSV-UHFFFAOYSA-N Baclofen Chemical compound OC(=O)CC(CN)C1=CC=C(Cl)C=C1 KPYSYYIEGFHWSV-UHFFFAOYSA-N 0.000 description 2
- XPCFTKFZXHTYIP-PMACEKPBSA-N Benazepril Chemical compound C([C@@H](C(=O)OCC)N[C@@H]1C(N(CC(O)=O)C2=CC=CC=C2CC1)=O)CC1=CC=CC=C1 XPCFTKFZXHTYIP-PMACEKPBSA-N 0.000 description 2
- VOVIALXJUBGFJZ-KWVAZRHASA-N Budesonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@H]3OC(CCC)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O VOVIALXJUBGFJZ-KWVAZRHASA-N 0.000 description 2
- 239000004072 C09CA03 - Valsartan Substances 0.000 description 2
- 102000053028 CD36 Antigens Human genes 0.000 description 2
- 108010057973 CSL-111 Proteins 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- 229920001268 Cholestyramine Polymers 0.000 description 2
- 208000017667 Chronic Disease Diseases 0.000 description 2
- 102000003780 Clusterin Human genes 0.000 description 2
- 108090000197 Clusterin Proteins 0.000 description 2
- 101100007328 Cocos nucifera COS-1 gene Proteins 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 2
- 108010036949 Cyclosporine Proteins 0.000 description 2
- 150000008574 D-amino acids Chemical class 0.000 description 2
- FMGSKLZLMKYGDP-UHFFFAOYSA-N Dehydroepiandrosterone Natural products C1C(O)CCC2(C)C3CCC(C)(C(CC4)=O)C4C3CC=C21 FMGSKLZLMKYGDP-UHFFFAOYSA-N 0.000 description 2
- LTMHDMANZUZIPE-AMTYYWEZSA-N Digoxin Natural products O([C@H]1[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@](C)([C@H](O)C4)[C@H](C4=CC(=O)OC4)CC5)CC3)CC2)C[C@@H]1O)[C@H]1O[C@H](C)[C@@H](O[C@H]2O[C@@H](C)[C@H](O)[C@@H](O)C2)[C@@H](O)C1 LTMHDMANZUZIPE-AMTYYWEZSA-N 0.000 description 2
- KLFKZIQAIPDJCW-HTIIIDOHSA-N Dipalmitoylphosphatidylserine Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCC KLFKZIQAIPDJCW-HTIIIDOHSA-N 0.000 description 2
- XPOQHMRABVBWPR-UHFFFAOYSA-N Efavirenz Natural products O1C(=O)NC2=CC=C(Cl)C=C2C1(C(F)(F)F)C#CC1CC1 XPOQHMRABVBWPR-UHFFFAOYSA-N 0.000 description 2
- 206010056474 Erythrosis Diseases 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 108091029865 Exogenous DNA Proteins 0.000 description 2
- 108010049003 Fibrinogen Proteins 0.000 description 2
- 102000008946 Fibrinogen Human genes 0.000 description 2
- UGJMXCAKCUNAIE-UHFFFAOYSA-N Gabapentin Chemical compound OC(=O)CC1(CN)CCCCC1 UGJMXCAKCUNAIE-UHFFFAOYSA-N 0.000 description 2
- 241000287828 Gallus gallus Species 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 235000010469 Glycine max Nutrition 0.000 description 2
- 244000060234 Gmelina philippensis Species 0.000 description 2
- 206010061996 Heart valve stenosis Diseases 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 108010001831 LDL receptors Proteins 0.000 description 2
- 102000000853 LDL receptors Human genes 0.000 description 2
- 108010007859 Lisinopril Proteins 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 108091028043 Nucleic acid sequence Proteins 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- 235000021314 Palmitic acid Nutrition 0.000 description 2
- AHOUBRCZNHFOSL-UHFFFAOYSA-N Paroxetine hydrochloride Natural products C1=CC(F)=CC=C1C1C(COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-UHFFFAOYSA-N 0.000 description 2
- 241000287127 Passeridae Species 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 208000018262 Peripheral vascular disease Diseases 0.000 description 2
- 239000004695 Polyether sulfone Substances 0.000 description 2
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 2
- 101800000571 Proapolipoprotein A-I Proteins 0.000 description 2
- 102400000658 Proapolipoprotein A-I Human genes 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 108091005487 SCARB1 Proteins 0.000 description 2
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- 102000001494 Sterol O-Acyltransferase Human genes 0.000 description 2
- 108010054082 Sterol O-acyltransferase Proteins 0.000 description 2
- 208000006011 Stroke Diseases 0.000 description 2
- CYQFCXCEBYINGO-UHFFFAOYSA-N THC Natural products C1=C(C)CCC2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3C21 CYQFCXCEBYINGO-UHFFFAOYSA-N 0.000 description 2
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 description 2
- DRHKJLXJIQTDTD-OAHLLOKOSA-N Tamsulosine Chemical compound CCOC1=CC=CC=C1OCCN[C@H](C)CC1=CC=C(OC)C(S(N)(=O)=O)=C1 DRHKJLXJIQTDTD-OAHLLOKOSA-N 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- 108090000190 Thrombin Proteins 0.000 description 2
- KJADKKWYZYXHBB-XBWDGYHZSA-N Topiramic acid Chemical compound C1O[C@@]2(COS(N)(=O)=O)OC(C)(C)O[C@H]2[C@@H]2OC(C)(C)O[C@@H]21 KJADKKWYZYXHBB-XBWDGYHZSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 241000711975 Vesicular stomatitis virus Species 0.000 description 2
- 229930003316 Vitamin D Natural products 0.000 description 2
- 229930003427 Vitamin E Natural products 0.000 description 2
- 229930003448 Vitamin K Natural products 0.000 description 2
- OGQICQVSFDPSEI-UHFFFAOYSA-N Zorac Chemical compound N1=CC(C(=O)OCC)=CC=C1C#CC1=CC=C(SCCC2(C)C)C2=C1 OGQICQVSFDPSEI-UHFFFAOYSA-N 0.000 description 2
- DSNRWDQKZIEDDB-GCMPNPAFSA-N [(2r)-3-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-2-[(z)-octadec-9-enoyl]oxypropyl] (z)-octadec-9-enoate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C/CCCCCCCC DSNRWDQKZIEDDB-GCMPNPAFSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 229960002669 albendazole Drugs 0.000 description 2
- HXHWSAZORRCQMX-UHFFFAOYSA-N albendazole Chemical compound CCCSC1=CC=C2NC(NC(=O)OC)=NC2=C1 HXHWSAZORRCQMX-UHFFFAOYSA-N 0.000 description 2
- NDAUXUAQIAJITI-UHFFFAOYSA-N albuterol Chemical compound CC(C)(C)NCC(O)C1=CC=C(O)C(CO)=C1 NDAUXUAQIAJITI-UHFFFAOYSA-N 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 229960005260 amiodarone Drugs 0.000 description 2
- 229940025084 amphetamine Drugs 0.000 description 2
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 2
- 229960003942 amphotericin b Drugs 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 238000002399 angioplasty Methods 0.000 description 2
- 230000000879 anti-atherosclerotic effect Effects 0.000 description 2
- 229940127219 anticoagulant drug Drugs 0.000 description 2
- 239000003524 antilipemic agent Substances 0.000 description 2
- 239000002249 anxiolytic agent Substances 0.000 description 2
- 239000012736 aqueous medium Substances 0.000 description 2
- 238000000149 argon plasma sintering Methods 0.000 description 2
- 238000003491 array Methods 0.000 description 2
- 208000011775 arteriosclerosis disease Diseases 0.000 description 2
- 229960005370 atorvastatin Drugs 0.000 description 2
- KUCQYCKVKVOKAY-CTYIDZIISA-N atovaquone Chemical compound C1([C@H]2CC[C@@H](CC2)C2=C(C(C3=CC=CC=C3C2=O)=O)O)=CC=C(Cl)C=C1 KUCQYCKVKVOKAY-CTYIDZIISA-N 0.000 description 2
- 229960003159 atovaquone Drugs 0.000 description 2
- 229960000794 baclofen Drugs 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 229960004530 benazepril Drugs 0.000 description 2
- MAFMQEKGGFWBAB-UHFFFAOYSA-N benzonatate Chemical compound CCCCNC1=CC=C(C(=O)OCCOCCOCCOCCOCCOCCOCCOCCOCCOC)C=C1 MAFMQEKGGFWBAB-UHFFFAOYSA-N 0.000 description 2
- 229960003789 benzonatate Drugs 0.000 description 2
- 229960002537 betamethasone Drugs 0.000 description 2
- UREBDLICKHMUKA-DVTGEIKXSA-N betamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-DVTGEIKXSA-N 0.000 description 2
- 229960004436 budesonide Drugs 0.000 description 2
- BTANRVKWQNVYAZ-UHFFFAOYSA-N butan-2-ol Chemical compound CCC(C)O BTANRVKWQNVYAZ-UHFFFAOYSA-N 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- YKPUWZUDDOIDPM-SOFGYWHQSA-N capsaicin Chemical compound COC1=CC(CNC(=O)CCCC\C=C\C(C)C)=CC=C1O YKPUWZUDDOIDPM-SOFGYWHQSA-N 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 235000013330 chicken meat Nutrition 0.000 description 2
- 230000001906 cholesterol absorption Effects 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 229960001265 ciclosporin Drugs 0.000 description 2
- 229960001380 cimetidine Drugs 0.000 description 2
- CCGSUNCLSOWKJO-UHFFFAOYSA-N cimetidine Chemical compound N#CNC(=N/C)\NCCSCC1=NC=N[C]1C CCGSUNCLSOWKJO-UHFFFAOYSA-N 0.000 description 2
- 229960003405 ciprofloxacin Drugs 0.000 description 2
- 229940110767 coenzyme Q10 Drugs 0.000 description 2
- 239000012141 concentrate Substances 0.000 description 2
- 230000003750 conditioning effect Effects 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 229960003572 cyclobenzaprine Drugs 0.000 description 2
- JURKNVYFZMSNLP-UHFFFAOYSA-N cyclobenzaprine Chemical compound C1=CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 JURKNVYFZMSNLP-UHFFFAOYSA-N 0.000 description 2
- 229930182912 cyclosporin Natural products 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- POZRVZJJTULAOH-LHZXLZLDSA-N danazol Chemical compound C1[C@]2(C)[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=CC2=C1C=NO2 POZRVZJJTULAOH-LHZXLZLDSA-N 0.000 description 2
- 229960000766 danazol Drugs 0.000 description 2
- 229960001987 dantrolene Drugs 0.000 description 2
- FMGSKLZLMKYGDP-USOAJAOKSA-N dehydroepiandrosterone Chemical compound C1[C@@H](O)CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC=C21 FMGSKLZLMKYGDP-USOAJAOKSA-N 0.000 description 2
- CYQFCXCEBYINGO-IAGOWNOFSA-N delta1-THC Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 CYQFCXCEBYINGO-IAGOWNOFSA-N 0.000 description 2
- 238000003936 denaturing gel electrophoresis Methods 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- LTMHDMANZUZIPE-PUGKRICDSA-N digoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LTMHDMANZUZIPE-PUGKRICDSA-N 0.000 description 2
- 229960005156 digoxin Drugs 0.000 description 2
- LTMHDMANZUZIPE-UHFFFAOYSA-N digoxine Natural products C1C(O)C(O)C(C)OC1OC1C(C)OC(OC2C(OC(OC3CC4C(C5C(C6(CCC(C6(C)C(O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)CC2O)C)CC1O LTMHDMANZUZIPE-UHFFFAOYSA-N 0.000 description 2
- HESHRHUZIWVEAJ-JGRZULCMSA-N dihydroergotamine Chemical compound C([C@H]1C(=O)N2CCC[C@H]2[C@]2(O)O[C@@](C(N21)=O)(C)NC(=O)[C@H]1CN([C@H]2[C@@H](C3=CC=CC4=NC=C([C]34)C2)C1)C)C1=CC=CC=C1 HESHRHUZIWVEAJ-JGRZULCMSA-N 0.000 description 2
- 229960004704 dihydroergotamine Drugs 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- ADEBPBSSDYVVLD-UHFFFAOYSA-N donepezil Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2CC1CC(CC1)CCN1CC1=CC=CC=C1 ADEBPBSSDYVVLD-UHFFFAOYSA-N 0.000 description 2
- 229960004242 dronabinol Drugs 0.000 description 2
- XPOQHMRABVBWPR-ZDUSSCGKSA-N efavirenz Chemical compound C([C@]1(C2=CC(Cl)=CC=C2NC(=O)O1)C(F)(F)F)#CC1CC1 XPOQHMRABVBWPR-ZDUSSCGKSA-N 0.000 description 2
- 229960003804 efavirenz Drugs 0.000 description 2
- 230000002526 effect on cardiovascular system Effects 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 238000005538 encapsulation Methods 0.000 description 2
- 238000006911 enzymatic reaction Methods 0.000 description 2
- 238000011067 equilibration Methods 0.000 description 2
- 210000003743 erythrocyte Anatomy 0.000 description 2
- 230000032050 esterification Effects 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 229940012952 fibrinogen Drugs 0.000 description 2
- SYTBZMRGLBWNTM-UHFFFAOYSA-N flurbiprofen Chemical compound FC1=CC(C(C(O)=O)C)=CC=C1C1=CC=CC=C1 SYTBZMRGLBWNTM-UHFFFAOYSA-N 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 208000020694 gallbladder disease Diseases 0.000 description 2
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 2
- 238000001641 gel filtration chromatography Methods 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 229960004580 glibenclamide Drugs 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- ZNNLBTZKUZBEKO-UHFFFAOYSA-N glyburide Chemical compound COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZNNLBTZKUZBEKO-UHFFFAOYSA-N 0.000 description 2
- 210000002216 heart Anatomy 0.000 description 2
- 231100000304 hepatotoxicity Toxicity 0.000 description 2
- 239000012456 homogeneous solution Substances 0.000 description 2
- 230000000887 hydrating effect Effects 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 229960001680 ibuprofen Drugs 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 238000003018 immunoassay Methods 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 239000007972 injectable composition Substances 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 2
- 238000010829 isocratic elution Methods 0.000 description 2
- MOYKHGMNXAOIAT-JGWLITMVSA-N isosorbide dinitrate Chemical compound [O-][N+](=O)O[C@H]1CO[C@@H]2[C@H](O[N+](=O)[O-])CO[C@@H]21 MOYKHGMNXAOIAT-JGWLITMVSA-N 0.000 description 2
- 229960000201 isosorbide dinitrate Drugs 0.000 description 2
- 239000007951 isotonicity adjuster Substances 0.000 description 2
- 229960004130 itraconazole Drugs 0.000 description 2
- 229960002418 ivermectin Drugs 0.000 description 2
- 229960004125 ketoconazole Drugs 0.000 description 2
- 229960004752 ketorolac Drugs 0.000 description 2
- OZWKMVRBQXNZKK-UHFFFAOYSA-N ketorolac Chemical compound OC(=O)C1CCN2C1=CC=C2C(=O)C1=CC=CC=C1 OZWKMVRBQXNZKK-UHFFFAOYSA-N 0.000 description 2
- 229960001848 lamotrigine Drugs 0.000 description 2
- PYZRQGJRPPTADH-UHFFFAOYSA-N lamotrigine Chemical compound NC1=NC(N)=NN=C1C1=CC=CC(Cl)=C1Cl PYZRQGJRPPTADH-UHFFFAOYSA-N 0.000 description 2
- 229960000681 leflunomide Drugs 0.000 description 2
- VHOGYURTWQBHIL-UHFFFAOYSA-N leflunomide Chemical compound O1N=CC(C(=O)NC=2C=CC(=CC=2)C(F)(F)F)=C1C VHOGYURTWQBHIL-UHFFFAOYSA-N 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000004576 lipid-binding Effects 0.000 description 2
- 230000029226 lipidation Effects 0.000 description 2
- 108010022197 lipoprotein cholesterol Proteins 0.000 description 2
- RLAWWYSOJDYHDC-BZSNNMDCSA-N lisinopril Chemical compound C([C@H](N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(O)=O)C(O)=O)CC1=CC=CC=C1 RLAWWYSOJDYHDC-BZSNNMDCSA-N 0.000 description 2
- 229960002394 lisinopril Drugs 0.000 description 2
- RDOIQAHITMMDAJ-UHFFFAOYSA-N loperamide Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(C(=O)N(C)C)CCN(CC1)CCC1(O)C1=CC=C(Cl)C=C1 RDOIQAHITMMDAJ-UHFFFAOYSA-N 0.000 description 2
- 229960001571 loperamide Drugs 0.000 description 2
- 229960005375 lutein Drugs 0.000 description 2
- 235000012680 lutein Nutrition 0.000 description 2
- KBPHJBAIARWVSC-RGZFRNHPSA-N lutein Chemical compound C([C@H](O)CC=1C)C(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\[C@H]1C(C)=C[C@H](O)CC1(C)C KBPHJBAIARWVSC-RGZFRNHPSA-N 0.000 description 2
- 239000001656 lutein Substances 0.000 description 2
- ORAKUVXRZWMARG-WZLJTJAWSA-N lutein Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2C(=CC(O)CC2(C)C)C ORAKUVXRZWMARG-WZLJTJAWSA-N 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 238000001906 matrix-assisted laser desorption--ionisation mass spectrometry Methods 0.000 description 2
- 238000010297 mechanical methods and process Methods 0.000 description 2
- 229960004616 medroxyprogesterone Drugs 0.000 description 2
- FRQMUZJSZHZSGN-HBNHAYAOSA-N medroxyprogesterone Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](O)(C(C)=O)CC[C@H]21 FRQMUZJSZHZSGN-HBNHAYAOSA-N 0.000 description 2
- 238000005374 membrane filtration Methods 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 229940035363 muscle relaxants Drugs 0.000 description 2
- 239000003158 myorelaxant agent Substances 0.000 description 2
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 229960002739 oxaprozin Drugs 0.000 description 2
- OFPXSFXSNFPTHF-UHFFFAOYSA-N oxaprozin Chemical compound O1C(CCC(=O)O)=NC(C=2C=CC=CC=2)=C1C1=CC=CC=C1 OFPXSFXSNFPTHF-UHFFFAOYSA-N 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 238000012856 packing Methods 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 229960002296 paroxetine Drugs 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- VOKSWYLNZZRQPF-GDIGMMSISA-N pentazocine Chemical compound C1C2=CC=C(O)C=C2[C@@]2(C)[C@@H](C)[C@@H]1N(CC=C(C)C)CC2 VOKSWYLNZZRQPF-GDIGMMSISA-N 0.000 description 2
- 229960005301 pentazocine Drugs 0.000 description 2
- 238000012510 peptide mapping method Methods 0.000 description 2
- 239000000816 peptidomimetic Substances 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 210000001322 periplasm Anatomy 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 2
- 229940068065 phytosterols Drugs 0.000 description 2
- 229960005095 pioglitazone Drugs 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 230000008488 polyadenylation Effects 0.000 description 2
- 229920006393 polyether sulfone Polymers 0.000 description 2
- 102000054765 polymorphisms of proteins Human genes 0.000 description 2
- 229960002847 prasterone Drugs 0.000 description 2
- 229960002965 pravastatin Drugs 0.000 description 2
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 229960005205 prednisolone Drugs 0.000 description 2
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 2
- FYPMFJGVHOHGLL-UHFFFAOYSA-N probucol Chemical compound C=1C(C(C)(C)C)=C(O)C(C(C)(C)C)=CC=1SC(C)(C)SC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 FYPMFJGVHOHGLL-UHFFFAOYSA-N 0.000 description 2
- 229960003912 probucol Drugs 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- 108010030416 proteoliposomes Proteins 0.000 description 2
- 229960004157 rabeprazole Drugs 0.000 description 2
- YREYEVIYCVEVJK-UHFFFAOYSA-N rabeprazole Chemical compound COCCCOC1=CC=NC(CS(=O)C=2NC3=CC=CC=C3N=2)=C1C YREYEVIYCVEVJK-UHFFFAOYSA-N 0.000 description 2
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 2
- 229960004622 raloxifene Drugs 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- 230000007115 recruitment Effects 0.000 description 2
- 239000013074 reference sample Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229960001487 rimexolone Drugs 0.000 description 2
- QTTRZHGPGKRAFB-OOKHYKNYSA-N rimexolone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CC)(C)[C@@]1(C)C[C@@H]2O QTTRZHGPGKRAFB-OOKHYKNYSA-N 0.000 description 2
- 229960000425 rizatriptan Drugs 0.000 description 2
- TXHZXHICDBAVJW-UHFFFAOYSA-N rizatriptan Chemical compound C=1[C]2C(CCN(C)C)=CN=C2C=CC=1CN1C=NC=N1 TXHZXHICDBAVJW-UHFFFAOYSA-N 0.000 description 2
- 229960004586 rosiglitazone Drugs 0.000 description 2
- 229960002052 salbutamol Drugs 0.000 description 2
- 235000019515 salmon Nutrition 0.000 description 2
- QWAXKHKRTORLEM-UGJKXSETSA-N saquinavir Chemical compound C([C@@H]([C@H](O)CN1C[C@H]2CCCC[C@H]2C[C@H]1C(=O)NC(C)(C)C)NC(=O)[C@H](CC(N)=O)NC(=O)C=1N=C2C=CC=CC2=CC=1)C1=CC=CC=C1 QWAXKHKRTORLEM-UGJKXSETSA-N 0.000 description 2
- 229960001852 saquinavir Drugs 0.000 description 2
- 238000013341 scale-up Methods 0.000 description 2
- 229960002073 sertraline Drugs 0.000 description 2
- VGKDLMBJGBXTGI-SJCJKPOMSA-N sertraline Chemical compound C1([C@@H]2CC[C@@H](C3=CC=CC=C32)NC)=CC=C(Cl)C(Cl)=C1 VGKDLMBJGBXTGI-SJCJKPOMSA-N 0.000 description 2
- UNAANXDKBXWMLN-UHFFFAOYSA-N sibutramine Chemical compound C=1C=C(Cl)C=CC=1C1(C(N(C)C)CC(C)C)CCC1 UNAANXDKBXWMLN-UHFFFAOYSA-N 0.000 description 2
- 229960004425 sibutramine Drugs 0.000 description 2
- DEIYFTQMQPDXOT-UHFFFAOYSA-N sildenafil citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.CCCC1=NN(C)C(C(N2)=O)=C1N=C2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(C)CC1 DEIYFTQMQPDXOT-UHFFFAOYSA-N 0.000 description 2
- 229960002639 sildenafil citrate Drugs 0.000 description 2
- 229960002855 simvastatin Drugs 0.000 description 2
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 238000001179 sorption measurement Methods 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 239000012798 spherical particle Substances 0.000 description 2
- 229960002256 spironolactone Drugs 0.000 description 2
- LXMSZDCAJNLERA-ZHYRCANASA-N spironolactone Chemical compound C([C@@H]1[C@]2(C)CC[C@@H]3[C@@]4(C)CCC(=O)C=C4C[C@H]([C@@H]13)SC(=O)C)C[C@@]21CCC(=O)O1 LXMSZDCAJNLERA-ZHYRCANASA-N 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 238000012289 standard assay Methods 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 229960003708 sumatriptan Drugs 0.000 description 2
- KQKPFRSPSRPDEB-UHFFFAOYSA-N sumatriptan Chemical compound CNS(=O)(=O)CC1=CC=C2NC=C(CCN(C)C)C2=C1 KQKPFRSPSRPDEB-UHFFFAOYSA-N 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 229960001685 tacrine Drugs 0.000 description 2
- YLJREFDVOIBQDA-UHFFFAOYSA-N tacrine Chemical compound C1=CC=C2C(N)=C(CCCC3)C3=NC2=C1 YLJREFDVOIBQDA-UHFFFAOYSA-N 0.000 description 2
- 229960001967 tacrolimus Drugs 0.000 description 2
- QJJXYPPXXYFBGM-SHYZHZOCSA-N tacrolimus Natural products CO[C@H]1C[C@H](CC[C@@H]1O)C=C(C)[C@H]2OC(=O)[C@H]3CCCCN3C(=O)C(=O)[C@@]4(O)O[C@@H]([C@H](C[C@H]4C)OC)[C@@H](C[C@H](C)CC(=C[C@@H](CC=C)C(=O)C[C@H](O)[C@H]2C)C)OC QJJXYPPXXYFBGM-SHYZHZOCSA-N 0.000 description 2
- 229960001603 tamoxifen Drugs 0.000 description 2
- 229960002613 tamsulosin Drugs 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- 229960000565 tazarotene Drugs 0.000 description 2
- RMMXLENWKUUMAY-UHFFFAOYSA-N telmisartan Chemical compound CCCC1=NC2=C(C)C=C(C=3N(C4=CC=CC=C4N=3)C)C=C2N1CC(C=C1)=CC=C1C1=CC=CC=C1C(O)=O RMMXLENWKUUMAY-UHFFFAOYSA-N 0.000 description 2
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 2
- 229960001278 teniposide Drugs 0.000 description 2
- 229960001693 terazosin Drugs 0.000 description 2
- VCKUSRYTPJJLNI-UHFFFAOYSA-N terazosin Chemical compound N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(CC1)CCN1C(=O)C1CCCO1 VCKUSRYTPJJLNI-UHFFFAOYSA-N 0.000 description 2
- 229960002722 terbinafine Drugs 0.000 description 2
- DOMXUEMWDBAQBQ-WEVVVXLNSA-N terbinafine Chemical compound C1=CC=C2C(CN(C\C=C\C#CC(C)(C)C)C)=CC=CC2=C1 DOMXUEMWDBAQBQ-WEVVVXLNSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 229960004072 thrombin Drugs 0.000 description 2
- PHWBOXQYWZNQIN-UHFFFAOYSA-N ticlopidine Chemical compound ClC1=CC=CC=C1CN1CC(C=CS2)=C2CC1 PHWBOXQYWZNQIN-UHFFFAOYSA-N 0.000 description 2
- 229960005001 ticlopidine Drugs 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 229960000488 tizanidine Drugs 0.000 description 2
- XFYDIVBRZNQMJC-UHFFFAOYSA-N tizanidine Chemical compound ClC=1C=CC2=NSN=C2C=1NC1=NCCN1 XFYDIVBRZNQMJC-UHFFFAOYSA-N 0.000 description 2
- 229960004394 topiramate Drugs 0.000 description 2
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 2
- 229960000303 topotecan Drugs 0.000 description 2
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 2
- 229960005026 toremifene Drugs 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 231100000167 toxic agent Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 229960004380 tramadol Drugs 0.000 description 2
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 2
- KBPHJBAIARWVSC-XQIHNALSSA-N trans-lutein Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CC(O)CC1(C)C)C=CC=C(/C)C=CC2C(=CC(O)CC2(C)C)C KBPHJBAIARWVSC-XQIHNALSSA-N 0.000 description 2
- GXPHKUHSUJUWKP-UHFFFAOYSA-N troglitazone Chemical compound C1CC=2C(C)=C(O)C(C)=C(C)C=2OC1(C)COC(C=C1)=CC=C1CC1SC(=O)NC1=O GXPHKUHSUJUWKP-UHFFFAOYSA-N 0.000 description 2
- 229960001641 troglitazone Drugs 0.000 description 2
- GXPHKUHSUJUWKP-NTKDMRAZSA-N troglitazone Natural products C([C@@]1(OC=2C(C)=C(C(=C(C)C=2CC1)O)C)C)OC(C=C1)=CC=C1C[C@H]1SC(=O)NC1=O GXPHKUHSUJUWKP-NTKDMRAZSA-N 0.000 description 2
- WVPSKSLAZQPAKQ-CDMJZVDBSA-N trovafloxacin Chemical compound C([C@H]1[C@@H]([C@H]1C1)N)N1C(C(=CC=1C(=O)C(C(O)=O)=C2)F)=NC=1N2C1=CC=C(F)C=C1F WVPSKSLAZQPAKQ-CDMJZVDBSA-N 0.000 description 2
- 229960000497 trovafloxacin Drugs 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- 150000004670 unsaturated fatty acids Chemical group 0.000 description 2
- 229960004699 valsartan Drugs 0.000 description 2
- SJSNUMAYCRRIOM-QFIPXVFZSA-N valsartan Chemical compound C1=CC(CN(C(=O)CCCC)[C@@H](C(C)C)C(O)=O)=CC=C1C1=CC=CC=C1C1=NN=N[N]1 SJSNUMAYCRRIOM-QFIPXVFZSA-N 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- PNVNVHUZROJLTJ-UHFFFAOYSA-N venlafaxine Chemical compound C1=CC(OC)=CC=C1C(CN(C)C)C1(O)CCCCC1 PNVNVHUZROJLTJ-UHFFFAOYSA-N 0.000 description 2
- 229960004688 venlafaxine Drugs 0.000 description 2
- 108010002139 very low density lipoprotein triglyceride Proteins 0.000 description 2
- 229960005318 vigabatrin Drugs 0.000 description 2
- PJDFLNIOAUIZSL-UHFFFAOYSA-N vigabatrin Chemical compound C=CC(N)CCC(O)=O PJDFLNIOAUIZSL-UHFFFAOYSA-N 0.000 description 2
- 230000029812 viral genome replication Effects 0.000 description 2
- 235000019166 vitamin D Nutrition 0.000 description 2
- 239000011710 vitamin D Substances 0.000 description 2
- 150000003710 vitamin D derivatives Chemical class 0.000 description 2
- 235000019165 vitamin E Nutrition 0.000 description 2
- 229940046009 vitamin E Drugs 0.000 description 2
- 239000011709 vitamin E Substances 0.000 description 2
- 235000019168 vitamin K Nutrition 0.000 description 2
- 239000011712 vitamin K Substances 0.000 description 2
- 150000003721 vitamin K derivatives Chemical class 0.000 description 2
- 229940045997 vitamin a Drugs 0.000 description 2
- 229940046008 vitamin d Drugs 0.000 description 2
- 229940046010 vitamin k Drugs 0.000 description 2
- FJHBOVDFOQMZRV-XQIHNALSSA-N xanthophyll Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CC(O)CC1(C)C)C=CC=C(/C)C=CC2C=C(C)C(O)CC2(C)C FJHBOVDFOQMZRV-XQIHNALSSA-N 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- OILXMJHPFNGGTO-UHFFFAOYSA-N (22E)-(24xi)-24-methylcholesta-5,22-dien-3beta-ol Natural products C1C=C2CC(O)CCC2(C)C2C1C1CCC(C(C)C=CC(C)C(C)C)C1(C)CC2 OILXMJHPFNGGTO-UHFFFAOYSA-N 0.000 description 1
- RQOCXCFLRBRBCS-UHFFFAOYSA-N (22E)-cholesta-5,7,22-trien-3beta-ol Natural products C1C(O)CCC2(C)C(CCC3(C(C(C)C=CCC(C)C)CCC33)C)C3=CC=C21 RQOCXCFLRBRBCS-UHFFFAOYSA-N 0.000 description 1
- JSPNNZKWADNWHI-PNANGNLXSA-N (2r)-2-hydroxy-n-[(2s,3r,4e,8e)-3-hydroxy-9-methyl-1-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoctadeca-4,8-dien-2-yl]heptadecanamide Chemical compound CCCCCCCCCCCCCCC[C@@H](O)C(=O)N[C@H]([C@H](O)\C=C\CC\C=C(/C)CCCCCCCCC)CO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O JSPNNZKWADNWHI-PNANGNLXSA-N 0.000 description 1
- ASWBNKHCZGQVJV-UHFFFAOYSA-N (3-hexadecanoyloxy-2-hydroxypropyl) 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(O)COP([O-])(=O)OCC[N+](C)(C)C ASWBNKHCZGQVJV-UHFFFAOYSA-N 0.000 description 1
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- UBCHPRBFMUDMNC-UHFFFAOYSA-N 1-(1-adamantyl)ethanamine Chemical compound C1C(C2)CC3CC2CC1(C(N)C)C3 UBCHPRBFMUDMNC-UHFFFAOYSA-N 0.000 description 1
- WEJDYJKJPUPMLH-UHFFFAOYSA-N 1-(4-chlorophenyl)-2-methylpropan-2-amine;hydrochloride Chemical compound Cl.CC(C)(N)CC1=CC=C(Cl)C=C1 WEJDYJKJPUPMLH-UHFFFAOYSA-N 0.000 description 1
- RYCNUMLMNKHWPZ-SNVBAGLBSA-N 1-acetyl-sn-glycero-3-phosphocholine Chemical compound CC(=O)OC[C@@H](O)COP([O-])(=O)OCC[N+](C)(C)C RYCNUMLMNKHWPZ-SNVBAGLBSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- VTAKZNRDSPNOAU-UHFFFAOYSA-M 2-(chloromethyl)oxirane;hydron;prop-2-en-1-amine;n-prop-2-enyldecan-1-amine;trimethyl-[6-(prop-2-enylamino)hexyl]azanium;dichloride Chemical compound Cl.[Cl-].NCC=C.ClCC1CO1.CCCCCCCCCCNCC=C.C[N+](C)(C)CCCCCCNCC=C VTAKZNRDSPNOAU-UHFFFAOYSA-M 0.000 description 1
- TYDSIOSLHQWFOU-UHFFFAOYSA-N 2-cyclohexylidenecyclohexan-1-one Chemical compound O=C1CCCCC1=C1CCCCC1 TYDSIOSLHQWFOU-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 108020005029 5' Flanking Region Proteins 0.000 description 1
- OQMZNAMGEHIHNN-UHFFFAOYSA-N 7-Dehydrostigmasterol Natural products C1C(O)CCC2(C)C(CCC3(C(C(C)C=CC(CC)C(C)C)CCC33)C)C3=CC=C21 OQMZNAMGEHIHNN-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 101150094949 APRT gene Proteins 0.000 description 1
- 108010006533 ATP-Binding Cassette Transporters Proteins 0.000 description 1
- 102000005416 ATP-Binding Cassette Transporters Human genes 0.000 description 1
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 1
- 102100029457 Adenine phosphoribosyltransferase Human genes 0.000 description 1
- 108010024223 Adenine phosphoribosyltransferase Proteins 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 102100036475 Alanine aminotransferase 1 Human genes 0.000 description 1
- 108010082126 Alanine transaminase Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 241000272525 Anas platyrhynchos Species 0.000 description 1
- 206010002388 Angina unstable Diseases 0.000 description 1
- 241000252073 Anguilliformes Species 0.000 description 1
- 101150102415 Apob gene Proteins 0.000 description 1
- 102100037320 Apolipoprotein A-IV Human genes 0.000 description 1
- 108010076807 Apolipoprotein C-I Proteins 0.000 description 1
- 102100036451 Apolipoprotein C-I Human genes 0.000 description 1
- 102000018616 Apolipoproteins B Human genes 0.000 description 1
- 108010027006 Apolipoproteins B Proteins 0.000 description 1
- 108010025628 Apolipoproteins E Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 206010062542 Arterial insufficiency Diseases 0.000 description 1
- 208000000412 Avitaminosis Diseases 0.000 description 1
- 239000005552 B01AC04 - Clopidogrel Substances 0.000 description 1
- 102000006734 Beta-Globulins Human genes 0.000 description 1
- 108010087504 Beta-Globulins Proteins 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 230000005653 Brownian motion process Effects 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 239000002947 C09CA04 - Irbesartan Substances 0.000 description 1
- 239000002053 C09CA06 - Candesartan Substances 0.000 description 1
- 239000005537 C09CA07 - Telmisartan Substances 0.000 description 1
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- ZKLPARSLTMPFCP-UHFFFAOYSA-N Cetirizine Chemical compound C1CN(CCOCC(=O)O)CCN1C(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 ZKLPARSLTMPFCP-UHFFFAOYSA-N 0.000 description 1
- 229940123239 Cholesterol synthesis inhibitor Drugs 0.000 description 1
- 239000004380 Cholic acid Substances 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 108010032608 Cohn fraction IV Proteins 0.000 description 1
- 229920002905 Colesevelam Polymers 0.000 description 1
- 229920002911 Colestipol Polymers 0.000 description 1
- 241000252095 Congridae Species 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- 229930105110 Cyclosporin A Natural products 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 229920002271 DEAE-Sepharose Polymers 0.000 description 1
- GUBGYTABKSRVRQ-WFVLMXAXSA-N DEAE-cellulose Chemical compound OC1C(O)C(O)C(CO)O[C@H]1O[C@@H]1C(CO)OC(O)C(O)C1O GUBGYTABKSRVRQ-WFVLMXAXSA-N 0.000 description 1
- 101150074155 DHFR gene Proteins 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 238000007399 DNA isolation Methods 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- IIUZTXTZRGLYTI-UHFFFAOYSA-N Dihydrogriseofulvin Natural products COC1CC(=O)CC(C)C11C(=O)C(C(OC)=CC(OC)=C2Cl)=C2O1 IIUZTXTZRGLYTI-UHFFFAOYSA-N 0.000 description 1
- 108090000204 Dipeptidase 1 Proteins 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- 108010016695 ETC216 Proteins 0.000 description 1
- 206010014476 Elevated cholesterol Diseases 0.000 description 1
- 206010014486 Elevated triglycerides Diseases 0.000 description 1
- 208000037487 Endotoxemia Diseases 0.000 description 1
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 208000010228 Erectile Dysfunction Diseases 0.000 description 1
- DNVPQKQSNYMLRS-NXVQYWJNSA-N Ergosterol Natural products CC(C)[C@@H](C)C=C[C@H](C)[C@H]1CC[C@H]2C3=CC=C4C[C@@H](O)CC[C@]4(C)[C@@H]3CC[C@]12C DNVPQKQSNYMLRS-NXVQYWJNSA-N 0.000 description 1
- 101001065501 Escherichia phage MS2 Lysis protein Proteins 0.000 description 1
- 108090000371 Esterases Proteins 0.000 description 1
- 102000008857 Ferritin Human genes 0.000 description 1
- 108050000784 Ferritin Proteins 0.000 description 1
- 238000008416 Ferritin Methods 0.000 description 1
- XWLUWCNOOVRFPX-UHFFFAOYSA-N Fosphenytoin Chemical compound O=C1N(COP(O)(=O)O)C(=O)NC1(C=1C=CC=CC=1)C1=CC=CC=C1 XWLUWCNOOVRFPX-UHFFFAOYSA-N 0.000 description 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 1
- HEMJJKBWTPKOJG-UHFFFAOYSA-N Gemfibrozil Chemical compound CC1=CC=C(C)C(OCCCC(C)(C)C(O)=O)=C1 HEMJJKBWTPKOJG-UHFFFAOYSA-N 0.000 description 1
- 108700007698 Genetic Terminator Regions Proteins 0.000 description 1
- FAEKWTJYAYMJKF-QHCPKHFHSA-N GlucoNorm Chemical compound C1=C(C(O)=O)C(OCC)=CC(CC(=O)N[C@@H](CC(C)C)C=2C(=CC=CC=2)N2CCCCC2)=C1 FAEKWTJYAYMJKF-QHCPKHFHSA-N 0.000 description 1
- 208000002705 Glucose Intolerance Diseases 0.000 description 1
- 206010018429 Glucose tolerance impaired Diseases 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- UXWOXTQWVMFRSE-UHFFFAOYSA-N Griseoviridin Natural products O=C1OC(C)CC=C(C(NCC=CC=CC(O)CC(O)C2)=O)SCC1NC(=O)C1=COC2=N1 UXWOXTQWVMFRSE-UHFFFAOYSA-N 0.000 description 1
- 108010021075 HDL2 Lipoproteins Proteins 0.000 description 1
- FOHHNHSLJDZUGQ-VWLOTQADSA-N Halofantrine Chemical compound FC(F)(F)C1=CC=C2C([C@@H](O)CCN(CCCC)CCCC)=CC3=C(Cl)C=C(Cl)C=C3C2=C1 FOHHNHSLJDZUGQ-VWLOTQADSA-N 0.000 description 1
- 208000032456 Hemorrhagic Shock Diseases 0.000 description 1
- 206010019851 Hepatotoxicity Diseases 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 229940122236 Histamine receptor antagonist Drugs 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000990566 Homo sapiens HEAT repeat-containing protein 6 Proteins 0.000 description 1
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 1
- 101000801684 Homo sapiens Phospholipid-transporting ATPase ABCA1 Proteins 0.000 description 1
- 208000030673 Homozygous familial hypercholesterolemia Diseases 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 1
- 208000010152 Huntington disease-like 3 Diseases 0.000 description 1
- 102000004286 Hydroxymethylglutaryl CoA Reductases Human genes 0.000 description 1
- 108090000895 Hydroxymethylglutaryl CoA Reductases Proteins 0.000 description 1
- 208000037147 Hypercalcaemia Diseases 0.000 description 1
- 208000000563 Hyperlipoproteinemia Type II Diseases 0.000 description 1
- 206010021024 Hypolipidaemia Diseases 0.000 description 1
- 108010091358 Hypoxanthine Phosphoribosyltransferase Proteins 0.000 description 1
- 102100029098 Hypoxanthine-guanine phosphoribosyltransferase Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- SHGAZHPCJJPHSC-NUEINMDLSA-N Isotretinoin Chemical compound OC(=O)C=C(C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-NUEINMDLSA-N 0.000 description 1
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 1
- 150000008575 L-amino acids Chemical class 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- XUIIKFGFIJCVMT-LBPRGKRZSA-N L-thyroxine Chemical compound IC1=CC(C[C@H]([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-LBPRGKRZSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 239000012480 LAL reagent Substances 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 241000239218 Limulus Species 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- 102100024640 Low-density lipoprotein receptor Human genes 0.000 description 1
- UPYKUZBSLRQECL-UKMVMLAPSA-N Lycopene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1C(=C)CCCC1(C)C)C=CC=C(/C)C=CC2C(=C)CCCC2(C)C UPYKUZBSLRQECL-UKMVMLAPSA-N 0.000 description 1
- JEVVKJMRZMXFBT-XWDZUXABSA-N Lycophyll Natural products OC/C(=C/CC/C(=C\C=C\C(=C/C=C/C(=C\C=C\C=C(/C=C/C=C(\C=C\C=C(/CC/C=C(/CO)\C)\C)/C)\C)/C)\C)/C)/C JEVVKJMRZMXFBT-XWDZUXABSA-N 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 241000282567 Macaca fascicularis Species 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 241000422980 Marietta Species 0.000 description 1
- 241000282346 Meles meles Species 0.000 description 1
- 108090000157 Metallothionein Proteins 0.000 description 1
- 102000007474 Multiprotein Complexes Human genes 0.000 description 1
- 108010085220 Multiprotein Complexes Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- LKQLRGMMMAHREN-YJFXYUILSA-N N-stearoylsphingosine-1-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)N[C@@H](COP([O-])(=O)OCC[N+](C)(C)C)[C@H](O)\C=C\CCCCCCCCCCCCC LKQLRGMMMAHREN-YJFXYUILSA-N 0.000 description 1
- DDUHZTYCFQRHIY-UHFFFAOYSA-N Negwer: 6874 Natural products COC1=CC(=O)CC(C)C11C(=O)C(C(OC)=CC(OC)=C2Cl)=C2O1 DDUHZTYCFQRHIY-UHFFFAOYSA-N 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 108091006006 PEGylated Proteins Proteins 0.000 description 1
- 241000282520 Papio Species 0.000 description 1
- 241001504519 Papio ursinus Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 102000014190 Phosphatidylcholine-sterol O-acyltransferase Human genes 0.000 description 1
- 108010011964 Phosphatidylcholine-sterol O-acyltransferase Proteins 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 241001505332 Polyomavirus sp. Species 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108020005067 RNA Splice Sites Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 206010062237 Renal impairment Diseases 0.000 description 1
- 108020005091 Replication Origin Proteins 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- FIMXSEMBHGTNKT-UHFFFAOYSA-N Scopine Natural products CN1C2CC(O)CC1C1C2O1 FIMXSEMBHGTNKT-UHFFFAOYSA-N 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 206010040070 Septic Shock Diseases 0.000 description 1
- 206010049771 Shock haemorrhagic Diseases 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 229930182558 Sterol Natural products 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 208000001435 Thromboembolism Diseases 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 241000287433 Turdus Species 0.000 description 1
- 208000007814 Unstable Angina Diseases 0.000 description 1
- 206010047627 Vitamin deficiencies Diseases 0.000 description 1
- YEEZWCHGZNKEEK-UHFFFAOYSA-N Zafirlukast Chemical compound COC1=CC(C(=O)NS(=O)(=O)C=2C(=CC=CC=2)C)=CC=C1CC(C1=C2)=CN(C)C1=CC=C2NC(=O)OC1CCCC1 YEEZWCHGZNKEEK-UHFFFAOYSA-N 0.000 description 1
- YVPOVOVZCOOSBQ-AXHZAXLDSA-N [(1s,3r,7s,8s,8ar)-8-[2-[(2r,4r)-4-hydroxy-6-oxooxan-2-yl]ethyl]-3,7-dimethyl-1,2,3,7,8,8a-hexahydronaphthalen-1-yl] (2s)-2-methylbutanoate;pyridine-3-carboxylic acid Chemical compound OC(=O)C1=CC=CN=C1.C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 YVPOVOVZCOOSBQ-AXHZAXLDSA-N 0.000 description 1
- LEBBDRXHHNYZIA-LDUWYPJVSA-N [(2s,3r,4s,5r,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl] n-[(z)-1,3-dihydroxyoctadec-4-en-2-yl]carbamate Chemical compound CCCCCCCCCCCCC\C=C/C(O)C(CO)NC(=O)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O LEBBDRXHHNYZIA-LDUWYPJVSA-N 0.000 description 1
- ZWBTYMGEBZUQTK-PVLSIAFMSA-N [(7S,9E,11S,12R,13S,14R,15R,16R,17S,18S,19E,21Z)-2,15,17,32-tetrahydroxy-11-methoxy-3,7,12,14,16,18,22-heptamethyl-1'-(2-methylpropyl)-6,23-dioxospiro[8,33-dioxa-24,27,29-triazapentacyclo[23.6.1.14,7.05,31.026,30]tritriaconta-1(32),2,4,9,19,21,24,26,30-nonaene-28,4'-piperidine]-13-yl] acetate Chemical compound CO[C@H]1\C=C\O[C@@]2(C)Oc3c(C2=O)c2c4NC5(CCN(CC(C)C)CC5)N=c4c(=NC(=O)\C(C)=C/C=C/[C@H](C)[C@H](O)[C@@H](C)[C@@H](O)[C@@H](C)[C@H](OC(C)=O)[C@@H]1C)c(O)c2c(O)c3C ZWBTYMGEBZUQTK-PVLSIAFMSA-N 0.000 description 1
- 238000002679 ablation Methods 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 108091005646 acetylated proteins Proteins 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 108091005647 acylated proteins Proteins 0.000 description 1
- 210000004100 adrenal gland Anatomy 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 239000010441 alabaster Substances 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 102000015395 alpha 1-Antitrypsin Human genes 0.000 description 1
- 108010050122 alpha 1-Antitrypsin Proteins 0.000 description 1
- 229940024142 alpha 1-antitrypsin Drugs 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 108091005598 amidated proteins Proteins 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- HTIQEAQVCYTUBX-UHFFFAOYSA-N amlodipine Chemical compound CCOC(=O)C1=C(COCCN)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1Cl HTIQEAQVCYTUBX-UHFFFAOYSA-N 0.000 description 1
- 229960000528 amlodipine Drugs 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 239000003957 anion exchange resin Substances 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 230000000507 anthelmentic effect Effects 0.000 description 1
- 229940124339 anthelmintic agent Drugs 0.000 description 1
- 239000000921 anthelmintic agent Substances 0.000 description 1
- 230000003288 anthiarrhythmic effect Effects 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000003178 anti-diabetic effect Effects 0.000 description 1
- 230000003556 anti-epileptic effect Effects 0.000 description 1
- 230000001315 anti-hyperlipaemic effect Effects 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000001022 anti-muscarinic effect Effects 0.000 description 1
- 229940124605 anti-osteoporosis drug Drugs 0.000 description 1
- 230000000648 anti-parkinson Effects 0.000 description 1
- 230000000842 anti-protozoal effect Effects 0.000 description 1
- 239000003416 antiarrhythmic agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 229960003965 antiepileptics Drugs 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 239000002255 antigout agent Substances 0.000 description 1
- 229960002708 antigout preparations Drugs 0.000 description 1
- 239000002220 antihypertensive agent Substances 0.000 description 1
- 229940030600 antihypertensive agent Drugs 0.000 description 1
- 239000003430 antimalarial agent Substances 0.000 description 1
- 229940033495 antimalarials Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 229940125684 antimigraine agent Drugs 0.000 description 1
- 239000002282 antimigraine agent Substances 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000000939 antiparkinson agent Substances 0.000 description 1
- 229940127218 antiplatelet drug Drugs 0.000 description 1
- 229940036589 antiprotozoals Drugs 0.000 description 1
- 229960004676 antithrombotic agent Drugs 0.000 description 1
- 239000003200 antithyroid agent Substances 0.000 description 1
- 229940043671 antithyroid preparations Drugs 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 229940121357 antivirals Drugs 0.000 description 1
- 230000000949 anxiolytic effect Effects 0.000 description 1
- 229940005530 anxiolytics Drugs 0.000 description 1
- 108010073614 apolipoprotein A-IV Proteins 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 208000037741 atherosclerosis susceptibility Diseases 0.000 description 1
- 229960004099 azithromycin Drugs 0.000 description 1
- MQTOSJVFKKJCRP-BICOPXKESA-N azithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)N(C)C[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 MQTOSJVFKKJCRP-BICOPXKESA-N 0.000 description 1
- 229940092705 beclomethasone Drugs 0.000 description 1
- NBMKJKDGKREAPL-DVTGEIKXSA-N beclomethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(Cl)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O NBMKJKDGKREAPL-DVTGEIKXSA-N 0.000 description 1
- 239000002876 beta blocker Substances 0.000 description 1
- 229940097320 beta blocking agent Drugs 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 230000031200 bile acid secretion Effects 0.000 description 1
- 239000003833 bile salt Substances 0.000 description 1
- 229940093761 bile salts Drugs 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 1
- 239000012503 blood component Substances 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 238000005537 brownian motion Methods 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- ABJKWBDEJIDSJZ-UHFFFAOYSA-N butenafine Chemical compound C=1C=CC2=CC=CC=C2C=1CN(C)CC1=CC=C(C(C)(C)C)C=C1 ABJKWBDEJIDSJZ-UHFFFAOYSA-N 0.000 description 1
- 229960002962 butenafine Drugs 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 230000002308 calcification Effects 0.000 description 1
- 229960002882 calcipotriol Drugs 0.000 description 1
- LWQQLNNNIPYSNX-UROSTWAQSA-N calcipotriol Chemical compound C1([C@H](O)/C=C/[C@@H](C)[C@@H]2[C@]3(CCCC(/[C@@H]3CC2)=C\C=C\2C([C@@H](O)C[C@H](O)C/2)=C)C)CC1 LWQQLNNNIPYSNX-UROSTWAQSA-N 0.000 description 1
- 229960005084 calcitriol Drugs 0.000 description 1
- GMRQFYUYWCNGIN-NKMMMXOESA-N calcitriol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@@H](CCCC(C)(C)O)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C GMRQFYUYWCNGIN-NKMMMXOESA-N 0.000 description 1
- 235000020964 calcitriol Nutrition 0.000 description 1
- 239000011612 calcitriol Substances 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 229940127093 camptothecin Drugs 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 229960000932 candesartan Drugs 0.000 description 1
- SGZAIDDFHDDFJU-UHFFFAOYSA-N candesartan Chemical compound CCOC1=NC2=CC=CC(C(O)=O)=C2N1CC(C=C1)=CC=C1C1=CC=CC=C1C1=NN=N[N]1 SGZAIDDFHDDFJU-UHFFFAOYSA-N 0.000 description 1
- 229960002504 capsaicin Drugs 0.000 description 1
- 235000017663 capsaicin Nutrition 0.000 description 1
- FFGPTBGBLSHEPO-UHFFFAOYSA-N carbamazepine Chemical compound C1=CC2=CC=CC=C2N(C(=O)N)C2=CC=CC=C21 FFGPTBGBLSHEPO-UHFFFAOYSA-N 0.000 description 1
- 229960000623 carbamazepine Drugs 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 150000001746 carotenes Chemical class 0.000 description 1
- 235000005473 carotenes Nutrition 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 125000001549 ceramide group Chemical group 0.000 description 1
- RIZIAUKTHDLMQX-UHFFFAOYSA-N cerebroside D Natural products CCCCCCCCCCCCCCCCC(O)C(=O)NC(C(O)C=CCCC=C(C)CCCCCCCCC)COC1OC(CO)C(O)C(O)C1O RIZIAUKTHDLMQX-UHFFFAOYSA-N 0.000 description 1
- 229960005110 cerivastatin Drugs 0.000 description 1
- SEERZIQQUAZTOL-ANMDKAQQSA-N cerivastatin Chemical compound COCC1=C(C(C)C)N=C(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC(O)=O)=C1C1=CC=C(F)C=C1 SEERZIQQUAZTOL-ANMDKAQQSA-N 0.000 description 1
- 229960001803 cetirizine Drugs 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- SOYKEARSMXGVTM-UHFFFAOYSA-N chlorphenamine Chemical compound C=1C=CC=NC=1C(CCN(C)C)C1=CC=C(Cl)C=C1 SOYKEARSMXGVTM-UHFFFAOYSA-N 0.000 description 1
- 229960003291 chlorphenamine Drugs 0.000 description 1
- 239000003354 cholesterol ester transfer protein inhibitor Substances 0.000 description 1
- 150000001841 cholesterols Chemical class 0.000 description 1
- 235000019416 cholic acid Nutrition 0.000 description 1
- 229960002471 cholic acid Drugs 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 229960004588 cilostazol Drugs 0.000 description 1
- RRGUKTPIGVIEKM-UHFFFAOYSA-N cilostazol Chemical compound C=1C=C2NC(=O)CCC2=CC=1OCCCCC1=NN=NN1C1CCCCC1 RRGUKTPIGVIEKM-UHFFFAOYSA-N 0.000 description 1
- 229960001214 clofibrate Drugs 0.000 description 1
- KNHUKKLJHYUCFP-UHFFFAOYSA-N clofibrate Chemical compound CCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 KNHUKKLJHYUCFP-UHFFFAOYSA-N 0.000 description 1
- 229960003009 clopidogrel Drugs 0.000 description 1
- GKTWGGQPFAXNFI-HNNXBMFYSA-N clopidogrel Chemical compound C1([C@H](N2CC=3C=CSC=3CC2)C(=O)OC)=CC=CC=C1Cl GKTWGGQPFAXNFI-HNNXBMFYSA-N 0.000 description 1
- FDJOLVPMNUYSCM-UVKKECPRSA-L cobalt(3+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2,7, Chemical compound [Co+3].N#[C-].C1([C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP([O-])(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)[N-]\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O FDJOLVPMNUYSCM-UVKKECPRSA-L 0.000 description 1
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 1
- 230000001149 cognitive effect Effects 0.000 description 1
- 229960000674 colesevelam hydrochloride Drugs 0.000 description 1
- 229960002577 colestipol hydrochloride Drugs 0.000 description 1
- KILNVBDSWZSGLL-UHFFFAOYSA-N colfosceril palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCC KILNVBDSWZSGLL-UHFFFAOYSA-N 0.000 description 1
- 238000012777 commercial manufacturing Methods 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 208000026758 coronary atherosclerosis Diseases 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- 238000005138 cryopreservation Methods 0.000 description 1
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 1
- 108091006028 deamidated proteins Proteins 0.000 description 1
- 230000006240 deamidation Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 238000006298 dechlorination reaction Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000005238 degreasing Methods 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 239000003405 delayed action preparation Substances 0.000 description 1
- 229940009976 deoxycholate Drugs 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 1
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000001784 detoxification Methods 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- SOYKEARSMXGVTM-HNNXBMFYSA-N dexchlorpheniramine Chemical compound C1([C@H](CCN(C)C)C=2N=CC=CC=2)=CC=C(Cl)C=C1 SOYKEARSMXGVTM-HNNXBMFYSA-N 0.000 description 1
- 229960001882 dexchlorpheniramine Drugs 0.000 description 1
- 238000011026 diafiltration Methods 0.000 description 1
- 229960001259 diclofenac Drugs 0.000 description 1
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- 235000015872 dietary supplement Nutrition 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- WLOHNSSYAXHWNR-NXPDYKKBSA-N dirithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H]2O[C@H](COCCOC)N[C@H]([C@@H]2C)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 WLOHNSSYAXHWNR-NXPDYKKBSA-N 0.000 description 1
- 229960004100 dirithromycin Drugs 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000002934 diuretic Substances 0.000 description 1
- 229940030606 diuretics Drugs 0.000 description 1
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 1
- 229960003530 donepezil Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000001205 effect on erythrocytes Effects 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 108010072542 endotoxin binding proteins Proteins 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- DNVPQKQSNYMLRS-SOWFXMKYSA-N ergosterol Chemical compound C1[C@@H](O)CC[C@]2(C)[C@H](CC[C@]3([C@H]([C@H](C)/C=C/[C@@H](C)C(C)C)CC[C@H]33)C)C3=CC=C21 DNVPQKQSNYMLRS-SOWFXMKYSA-N 0.000 description 1
- 235000004626 essential fatty acids Nutrition 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- 238000009164 estrogen replacement therapy Methods 0.000 description 1
- CIKWKGFPFXJVGW-UHFFFAOYSA-N ethacridine Chemical compound C1=C(N)C=CC2=C(N)C3=CC(OCC)=CC=C3N=C21 CIKWKGFPFXJVGW-UHFFFAOYSA-N 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 229960005293 etodolac Drugs 0.000 description 1
- XFBVBWWRPKNWHW-UHFFFAOYSA-N etodolac Chemical compound C1COC(CC)(CC(O)=O)C2=N[C]3C(CC)=CC=CC3=C21 XFBVBWWRPKNWHW-UHFFFAOYSA-N 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- OLNTVTPDXPETLC-XPWALMASSA-N ezetimibe Chemical compound N1([C@@H]([C@H](C1=O)CC[C@H](O)C=1C=CC(F)=CC=1)C=1C=CC(O)=CC=1)C1=CC=C(F)C=C1 OLNTVTPDXPETLC-XPWALMASSA-N 0.000 description 1
- 229960000815 ezetimibe Drugs 0.000 description 1
- 201000001386 familial hypercholesterolemia Diseases 0.000 description 1
- XUFQPHANEAPEMJ-UHFFFAOYSA-N famotidine Chemical compound NC(N)=NC1=NC(CSCCC(N)=NS(N)(=O)=O)=CS1 XUFQPHANEAPEMJ-UHFFFAOYSA-N 0.000 description 1
- 229960001596 famotidine Drugs 0.000 description 1
- 230000002550 fecal effect Effects 0.000 description 1
- YMTINGFKWWXKFG-UHFFFAOYSA-N fenofibrate Chemical compound C1=CC(OC(C)(C)C(=O)OC(C)C)=CC=C1C(=O)C1=CC=C(Cl)C=C1 YMTINGFKWWXKFG-UHFFFAOYSA-N 0.000 description 1
- 229960002297 fenofibrate Drugs 0.000 description 1
- 229960002428 fentanyl Drugs 0.000 description 1
- IVLVTNPOHDFFCJ-UHFFFAOYSA-N fentanyl citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 IVLVTNPOHDFFCJ-UHFFFAOYSA-N 0.000 description 1
- RWTNPBWLLIMQHL-UHFFFAOYSA-N fexofenadine Chemical compound C1=CC(C(C)(C(O)=O)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 RWTNPBWLLIMQHL-UHFFFAOYSA-N 0.000 description 1
- 229960003592 fexofenadine Drugs 0.000 description 1
- 230000020764 fibrinolysis Effects 0.000 description 1
- 230000003480 fibrinolytic effect Effects 0.000 description 1
- 239000013020 final formulation Substances 0.000 description 1
- DBEPLOCGEIEOCV-WSBQPABSSA-N finasteride Chemical compound N([C@@H]1CC2)C(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](C(=O)NC(C)(C)C)[C@@]2(C)CC1 DBEPLOCGEIEOCV-WSBQPABSSA-N 0.000 description 1
- 229960004039 finasteride Drugs 0.000 description 1
- 229960004884 fluconazole Drugs 0.000 description 1
- RFHAOTPXVQNOHP-UHFFFAOYSA-N fluconazole Chemical compound C1=NC=NN1CC(C=1C(=CC(F)=CC=1)F)(O)CN1C=NC=N1 RFHAOTPXVQNOHP-UHFFFAOYSA-N 0.000 description 1
- 229960002390 flurbiprofen Drugs 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 229960000693 fosphenytoin Drugs 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 229960002284 frovatriptan Drugs 0.000 description 1
- SIBNYOSJIXCDRI-SECBINFHSA-N frovatriptan Chemical compound C1=C(C(N)=O)[CH]C2=C(C[C@H](NC)CC3)C3=NC2=C1 SIBNYOSJIXCDRI-SECBINFHSA-N 0.000 description 1
- 238000002825 functional assay Methods 0.000 description 1
- 229960001625 furazolidone Drugs 0.000 description 1
- PLHJDBGFXBMTGZ-WEVVVXLNSA-N furazolidone Chemical compound O1C([N+](=O)[O-])=CC=C1\C=N\N1C(=O)OCC1 PLHJDBGFXBMTGZ-WEVVVXLNSA-N 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 229960002870 gabapentin Drugs 0.000 description 1
- 108010074605 gamma-Globulins Proteins 0.000 description 1
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000004083 gastrointestinal agent Substances 0.000 description 1
- 229940125695 gastrointestinal agent Drugs 0.000 description 1
- 229960003627 gemfibrozil Drugs 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- WIGIZIANZCJQQY-RUCARUNLSA-N glimepiride Chemical compound O=C1C(CC)=C(C)CN1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)N[C@@H]2CC[C@@H](C)CC2)C=C1 WIGIZIANZCJQQY-RUCARUNLSA-N 0.000 description 1
- 229960004346 glimepiride Drugs 0.000 description 1
- ZJJXGWJIGJFDTL-UHFFFAOYSA-N glipizide Chemical compound C1=NC(C)=CN=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZJJXGWJIGJFDTL-UHFFFAOYSA-N 0.000 description 1
- 229960001381 glipizide Drugs 0.000 description 1
- 150000002314 glycerols Chemical class 0.000 description 1
- 150000002327 glycerophospholipids Chemical class 0.000 description 1
- 150000002339 glycosphingolipids Chemical class 0.000 description 1
- 239000003163 gonadal steroid hormone Substances 0.000 description 1
- DDUHZTYCFQRHIY-RBHXEPJQSA-N griseofulvin Chemical compound COC1=CC(=O)C[C@@H](C)[C@@]11C(=O)C(C(OC)=CC(OC)=C2Cl)=C2O1 DDUHZTYCFQRHIY-RBHXEPJQSA-N 0.000 description 1
- 229960002867 griseofulvin Drugs 0.000 description 1
- 229960003242 halofantrine Drugs 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 230000010247 heart contraction Effects 0.000 description 1
- 231100000753 hepatic injury Toxicity 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 230000007686 hepatotoxicity Effects 0.000 description 1
- NIDYWHLDTIVRJT-UJPOAAIJSA-N heptyl-β-d-glucopyranoside Chemical compound CCCCCCCO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O NIDYWHLDTIVRJT-UJPOAAIJSA-N 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 239000000710 homodimer Substances 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 230000000148 hypercalcaemia Effects 0.000 description 1
- 208000030915 hypercalcemia disease Diseases 0.000 description 1
- 230000000260 hypercholesteremic effect Effects 0.000 description 1
- 239000003326 hypnotic agent Substances 0.000 description 1
- 230000000147 hypnotic effect Effects 0.000 description 1
- 208000026621 hypolipoproteinemia Diseases 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 201000001881 impotence Diseases 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 239000004434 industrial solvent Substances 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 239000002054 inoculum Substances 0.000 description 1
- 239000004041 inotropic agent Substances 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 201000004332 intermediate coronary syndrome Diseases 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229960002198 irbesartan Drugs 0.000 description 1
- YCPOHTHPUREGFM-UHFFFAOYSA-N irbesartan Chemical compound O=C1N(CC=2C=CC(=CC=2)C=2C(=CC=CC=2)C=2[N]N=NN=2)C(CCCC)=NC21CCCC2 YCPOHTHPUREGFM-UHFFFAOYSA-N 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 229960005280 isotretinoin Drugs 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- 239000003410 keratolytic agent Substances 0.000 description 1
- 230000005977 kidney dysfunction Effects 0.000 description 1
- 231100000636 lethal dose Toxicity 0.000 description 1
- 239000003199 leukotriene receptor blocking agent Substances 0.000 description 1
- 229950008325 levothyroxine Drugs 0.000 description 1
- 125000005647 linker group Chemical group 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 231100000845 liver adenoma Toxicity 0.000 description 1
- 210000005229 liver cell Anatomy 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 230000005976 liver dysfunction Effects 0.000 description 1
- 230000007056 liver toxicity Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 229960003088 loratadine Drugs 0.000 description 1
- JCCNYMKQOSZNPW-UHFFFAOYSA-N loratadine Chemical compound C1CN(C(=O)OCC)CCC1=C1C2=NC=CC=C2CCC2=CC(Cl)=CC=C21 JCCNYMKQOSZNPW-UHFFFAOYSA-N 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 229960004999 lycopene Drugs 0.000 description 1
- 235000012661 lycopene Nutrition 0.000 description 1
- OAIJSZIZWZSQBC-GYZMGTAESA-N lycopene Chemical compound CC(C)=CCC\C(C)=C\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C=C(/C)CCC=C(C)C OAIJSZIZWZSQBC-GYZMGTAESA-N 0.000 description 1
- 239000001751 lycopene Substances 0.000 description 1
- 239000003120 macrolide antibiotic agent Substances 0.000 description 1
- 229940041033 macrolides Drugs 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 230000001483 mobilizing effect Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 102000035118 modified proteins Human genes 0.000 description 1
- 108091005573 modified proteins Proteins 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 235000021281 monounsaturated fatty acids Nutrition 0.000 description 1
- 239000003149 muscarinic antagonist Substances 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- GACQNVJDWUAPFY-UHFFFAOYSA-N n'-[2-[2-(2-aminoethylamino)ethylamino]ethyl]ethane-1,2-diamine;hydrochloride Chemical compound Cl.NCCNCCNCCNCCN GACQNVJDWUAPFY-UHFFFAOYSA-N 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 239000012454 non-polar solvent Substances 0.000 description 1
- 231100000956 nontoxicity Toxicity 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 239000002417 nutraceutical Substances 0.000 description 1
- 235000021436 nutraceutical agent Nutrition 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- HEGSGKPQLMEBJL-RKQHYHRCSA-N octyl beta-D-glucopyranoside Chemical compound CCCCCCCCO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HEGSGKPQLMEBJL-RKQHYHRCSA-N 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 235000021313 oleic acid Nutrition 0.000 description 1
- 239000000014 opioid analgesic Substances 0.000 description 1
- 229940005483 opioid analgesics Drugs 0.000 description 1
- 229940126701 oral medication Drugs 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000036542 oxidative stress Effects 0.000 description 1
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000002572 peristaltic effect Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000008055 phosphate buffer solution Substances 0.000 description 1
- 229940025511 phospholipid / protein Drugs 0.000 description 1
- 150000003014 phosphoric acid esters Chemical class 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229940096701 plain lipid modifying drug hmg coa reductase inhibitors Drugs 0.000 description 1
- 230000007505 plaque formation Effects 0.000 description 1
- 239000000106 platelet aggregation inhibitor Substances 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920005644 polyethylene terephthalate glycol copolymer Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 235000020777 polyunsaturated fatty acids Nutrition 0.000 description 1
- 231100000683 possible toxicity Toxicity 0.000 description 1
- 238000012809 post-inoculation Methods 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 150000003180 prostaglandins Chemical class 0.000 description 1
- 230000009979 protective mechanism Effects 0.000 description 1
- 230000020978 protein processing Effects 0.000 description 1
- KWGRBVOPPLSCSI-WCBMZHEXSA-N pseudoephedrine Chemical compound CN[C@@H](C)[C@@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WCBMZHEXSA-N 0.000 description 1
- 229960003908 pseudoephedrine Drugs 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 238000011897 real-time detection Methods 0.000 description 1
- 210000003370 receptor cell Anatomy 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 229960002354 repaglinide Drugs 0.000 description 1
- QEVHRUUCFGRFIF-MDEJGZGSSA-N reserpine Chemical compound O([C@H]1[C@@H]([C@H]([C@H]2C[C@@H]3C4=C(C5=CC=C(OC)C=C5N4)CCN3C[C@H]2C1)C(=O)OC)OC)C(=O)C1=CC(OC)=C(OC)C(OC)=C1 QEVHRUUCFGRFIF-MDEJGZGSSA-N 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 229960000885 rifabutin Drugs 0.000 description 1
- WDZCUPBHRAEYDL-GZAUEHORSA-N rifapentine Chemical compound O([C@](C1=O)(C)O/C=C/[C@@H]([C@H]([C@@H](OC(C)=O)[C@H](C)[C@H](O)[C@H](C)[C@@H](O)[C@@H](C)\C=C\C=C(C)/C(=O)NC=2C(O)=C3C(O)=C4C)C)OC)C4=C1C3=C(O)C=2\C=N\N(CC1)CCN1C1CCCC1 WDZCUPBHRAEYDL-GZAUEHORSA-N 0.000 description 1
- 229960002599 rifapentine Drugs 0.000 description 1
- 229960000888 rimantadine Drugs 0.000 description 1
- 229960000371 rofecoxib Drugs 0.000 description 1
- RZJQGNCSTQAWON-UHFFFAOYSA-N rofecoxib Chemical compound C1=CC(S(=O)(=O)C)=CC=C1C1=C(C=2C=CC=CC=2)C(=O)OC1 RZJQGNCSTQAWON-UHFFFAOYSA-N 0.000 description 1
- 239000013017 sartobind Substances 0.000 description 1
- 235000003441 saturated fatty acids Nutrition 0.000 description 1
- 102000014452 scavenger receptors Human genes 0.000 description 1
- 108010078070 scavenger receptors Proteins 0.000 description 1
- FIMXSEMBHGTNKT-RZVDLVGDSA-N scopine Chemical compound C([C@@H]1N2C)[C@H](O)C[C@@H]2[C@@H]2[C@H]1O2 FIMXSEMBHGTNKT-RZVDLVGDSA-N 0.000 description 1
- 230000009291 secondary effect Effects 0.000 description 1
- 229940125723 sedative agent Drugs 0.000 description 1
- 239000000932 sedative agent Substances 0.000 description 1
- 238000004062 sedimentation Methods 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000036303 septic shock Effects 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 150000003408 sphingolipids Chemical class 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 150000003432 sterols Chemical class 0.000 description 1
- 235000003702 sterols Nutrition 0.000 description 1
- 239000000021 stimulant Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 229960005187 telmisartan Drugs 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 231100001274 therapeutic index Toxicity 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- PBJUNZJWGZTSKL-MRXNPFEDSA-N tiagabine Chemical compound C1=CSC(C(=CCCN2C[C@@H](CCC2)C(O)=O)C2=C(C=CS2)C)=C1C PBJUNZJWGZTSKL-MRXNPFEDSA-N 0.000 description 1
- 229960001918 tiagabine Drugs 0.000 description 1
- 231100000816 toxic dose Toxicity 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- ZCIHMQAPACOQHT-ZGMPDRQDSA-N trans-isorenieratene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/c1c(C)ccc(C)c1C)C=CC=C(/C)C=Cc2c(C)ccc(C)c2C ZCIHMQAPACOQHT-ZGMPDRQDSA-N 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- 125000000430 tryptophan group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C2=C([H])C([H])=C([H])C([H])=C12 0.000 description 1
- 229960004747 ubidecarenone Drugs 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 235000021122 unsaturated fatty acids Nutrition 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 210000003501 vero cell Anatomy 0.000 description 1
- ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N verteporfin Chemical compound C=1C([C@@]2([C@H](C(=O)OC)C(=CC=C22)C(=O)OC)C)=NC2=CC(C(=C2C=C)C)=NC2=CC(C(=C2CCC(O)=O)C)=NC2=CC2=NC=1C(C)=C2CCC(=O)OC ZQFGRJWRSLZCSQ-ZSFNYQMMSA-N 0.000 description 1
- 229960003895 verteporfin Drugs 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 239000012905 visible particle Substances 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 239000011720 vitamin B Substances 0.000 description 1
- 235000005282 vitamin D3 Nutrition 0.000 description 1
- 239000011647 vitamin D3 Substances 0.000 description 1
- QYSXJUFSXHHAJI-YRZJJWOYSA-N vitamin D3 Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C\C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-YRZJJWOYSA-N 0.000 description 1
- 229940046001 vitamin b complex Drugs 0.000 description 1
- 229940021056 vitamin d3 Drugs 0.000 description 1
- 239000000341 volatile oil Substances 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 229960004764 zafirlukast Drugs 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/775—Apolipopeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/04—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length on carriers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/04—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length on carriers
- C07K1/042—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length on carriers characterised by the nature of the carrier
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/29—Coated or structually defined flake, particle, cell, strand, strand portion, rod, filament, macroscopic fiber or mass thereof
- Y10T428/2982—Particulate matter [e.g., sphere, flake, etc.]
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Immunology (AREA)
- Analytical Chemistry (AREA)
- Toxicology (AREA)
- Marine Sciences & Fisheries (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
本公开涉及脂蛋白复合物和脂蛋白群体以及它们在治疗和/或者预防血脂异常疾病、障碍和/或者病症中的用途。本公开还涉及使用基于热循环的方法进行载脂蛋白的重组表达、载脂蛋白的纯化以及脂蛋白复合物的产生。
Description
本发明是基于申请日为2012年2月6日,申请号为“201280015257.3”(国际申请号为PCT/US2012/024020),发明名称为“脂蛋白复合物及其制备和用途”的专利申请的分案申请。
1.相关申请的交叉引用
本申请依据35U.S.C.§119(e)要求2011年2月7日提交的临时申请61/440,371、2011年3月14日提交的临时申请61/452,630以及2011年5月17日提交的临时申请61/487,263的益处,将所有这些申请的全部内容通过引用的方式并入本申请。
2.技术领域
本公开提供了脂蛋白复合物、包含所述复合物的药物组合物、产生并纯化用于所述复合物的载脂蛋白的方法、制备所述复合物的方法以及使用所述复合物治疗或者预防心血管疾病、与其相关的障碍和/或者病症的方法。
3.背景技术
3.1.综述
循环的胆固醇经由血液中转运脂质的、脂质与蛋白质组成的血浆脂蛋白复合物颗粒运送。血浆中循环的脂蛋白颗粒具有以下四种主要类别并且均包括在脂肪转运系统中:乳糜微粒、极低密度脂蛋白(VLDL)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)。乳糜微粒构成了肠内脂肪吸收的短寿命产物。VLDL尤其是LDL负责将胆固醇由肝(胆固醇在肝中合成或由饮食来源获得)递送至肝外的组织,包括动脉壁。相反,HDL介导胆固醇的逆转运(RCT),胆固醇脂质的去除,具体地,由肝外组织至肝,胆固醇在肝中储存、分解代谢、消除或再循环。HDL在炎症、转运氧化的脂质和白细胞介素中也起有益作用。
脂蛋白颗粒具有包含胆固醇(通常为胆固醇酯的形式)和甘油三酯的疏水核。该核为包含磷脂、未酯化的胆固醇和载脂蛋白的表层所围绕。载脂蛋白介导脂质转运,并且载脂蛋白中的一部分可与脂质代谢中涉及的酶相互作用。已经鉴别了至少十种载脂蛋白,其包括:ApoA-I、ApoA-II、ApoA-IV、ApoA-V、ApoB、ApoC-I、ApoC-II、ApoC-III、ApoD、ApoE、ApoJ和ApoH。还发现其它蛋白质如LCAT(卵磷脂:胆固醇酰基转移酶)、CETP(胆固醇脂转移蛋白)、PLTP(磷脂转移蛋白)和PON(对氧磷酶)也与脂蛋白有关。
心血管疾病,如冠心病、冠状动脉疾病和动脉粥样硬化在极大程度上与血清中升高的胆固醇浓度有关。例如,动脉粥样硬化是一种缓慢进展型疾病,其经由动脉壁内胆固醇的蓄积而表征。令人信服的证据支持以下理论:在动脉粥样硬化病变中沉积的脂质主要来自于血浆LDL;因此,LDL已被普遍地认为是“有害的”胆固醇,相反,HDL血清浓度与冠心病成反比。事实上,HDL的较高血清浓度被认为是负向的风险因素。据假设,较高浓度的血浆HDL不仅保护性地对抗冠状动脉疾病,而且实际上可以诱导动脉粥样硬化斑块的消退(参见,例如,Badimon et al.,1992,Circulation 86(Suppl.III):86-94;Dansky and Fisher,1999,Circulation 100:1762-63;Tangirala et al.,1999,Circulation 100(17):1816-22;Fan et al.,1999,Atherosclerosis 147(1):139-45;Deckert et al.,1999,Circulation 100(11):1230-35;Boisvert et al.,1999,Arterioscler.Thromb.Vasc.Biol.19(3):525-30;Benoit et al.,1999,Circulation 99(1):105-10;Holvoet et al.,1998,J.Clin.Invest.102(2):379-85;Duverger et al.,1996,Circulation 94(4):713-17;Miyazaki et al.,1995,Arterioscler.Thromb.Vasc.Biol.15(11):1882-88;Mezdouret al.,1995,Atherosclerosis 113(2):237-46;Liu et al.,1994,J.Lipid Res.35(12):2263-67;Plump et al.,1994,Proc.Nat.Acad.Sci.USA 91(20):9607-11;Paszty et al.,1994,J.Clin.Invest.94(2):899-903;She et al,1992,Chin.Med.J.(Engl).105(5):369-73;Rubin et al.,1991,Nature 353(6341):265-67;She et al.,1990,Ann.NYAcad.Sci.598:339-51;Ran,1989,Chung Hua Ping Li Hsueh Tsa Chih(还翻译为:Zhonghua Bing Li Xue Za Zhi)18(4):257-61;Quezado et al.,1995,J.Pharmacol.Exp.Ther.272(2):604-11;Duverger et al.,1996,Arterioscler.Thromb.Vasc.Biol.16(12):1424-29;Kopfler et al.,1994,Circulation;90(3):1319-27;Milleret al.,1985,Nature 314(6006):109-11;Ha et al.,1992,Biochim.Biophys.Acta 1125(2):223-29;Beitz et al.,1992,Prostaglandins Leukot.Essent.Fatty Acids 47(2):149-52)。作为结论,HDL已被普遍认为是“有利的”胆固醇(参见,例如,Zhang,et al.,2003Circulation 108:661-663)。
HDL的“保护性”作用在大量研究中得以证实(例如,Miller et al.,1977,Lancet1(8019):965-68;Whayne et al.,1981,Atherosclerosis 39:411-19)。在这些研究中,LDL升高的浓度似乎与增加的心血管风险相关,而较高的HDL浓度好像具有心血管保护作用。体内研究已经进一步证明了HDL的保护作用,其显示注入兔中的HDL可以阻碍胆固醇诱发的动脉病变的形成(Badimon et al.,1989,Lab.Invest.60:455-61)和/或者可以诱导所述动脉病变消退(Badimon et al.,1990,J.Clin.Invest.85:1234-41)。
3.2.胆固醇逆转运、HDL和载脂蛋白A-I
胆固醇逆转运(RCT)通路起消除来自肝外大部分组织的胆固醇的作用并且对于维持机体内大部分细胞的结构和功能至关重要。RCT主要由以下三个步骤组成:(a)胆固醇外流,即,胆固醇最初由不同的外周细胞池的去除;(b)经由卵磷脂:胆固醇酰基转移酶(LCAT)的作用进行的胆固醇酯化,从而防止外流的胆固醇再次进入细胞中;以及(c)将HDL-胆固醇和胆固醇酯摄取至肝细胞进行水解,然后进行再循环、贮存、在胆汁中分泌或代谢成胆酸。
LCAT(RCT中的关键酶)由肝产生并在与HDL成分缔合的血浆中进行循环。LCAT将源自细胞的胆固醇转化为胆固醇酯,所述胆固醇酯在指定去除的HDL中被隔离(参见Jonas2000,Biochim.Biophys.Acta 1529(1-3):245-56)。胆固醇酯转移蛋白(CETP)与磷脂转移蛋白(PLTP)致力于循环的HDL群的进一步改造。CETP将LCAT生成的胆固醇酯运至其它的脂蛋白,特别是包括ApoB的脂蛋白,如VLDL和LDL。PLTP向HDL供应卵磷脂。HDL甘油三酯通过细胞外的肝甘油三酯脂肪酶进行代谢,并且脂蛋白胆固醇通过肝经由几种机制而除去。
HDL颗粒的功能特征主要通过它们的主要载脂蛋白组分如ApoA-I和ApoA-II而确定。还观察到与HDL缔合的微量ApoC-I、ApoC-II、ApoC-III、ApoD、ApoA-IV、ApoE、ApoJ。HDL根据RCT代谢级联或通路过程的重构状态而以多种不同的尺寸以及上述成分的不同混合物存在。
每个HDL颗粒通常包含至少1个分子的,并且通常包括2至4个分子的ApoA-I。如Prof.Gerd Assmann所描述的,HDL颗粒也可以只包括ApoE(γ-LpE颗粒),其还被认为负责胆固醇外流(参见,例如,von Eckardstein et al.,1994,Curr Opin Lipidol.5(6):404-16)。ApoA-I作为前原载脂蛋白A-I(preproapolipoprotein A-I)由肝和小肠合成,并作为原载脂蛋白A-I(proapolipoprotein A-I)(原ApoA-I(proApoA-I))分泌且快速地发生裂解从而产生血浆形式的ApoA-I,其是一种243个氨基酸的单多肽链(Brewer et al.,1978,Biochem.Biophys.Res.Commun.80:623-30)。在实验中直接注射入血流的前原ApoA-I也可以裂解为血浆形式的ApoA-I(Klon et al.,2000,Biophys.J.79(3):1679-85;Segrest etal.,2000,Curr.Opin.Lipidol.11(2):105-15;Segrest et al.,1999,J.Biol.Chem.274(45):31755-58)。
ApoA-I包含由连接体部分(经常为脯氨酸)间隔开的6至8个不同的22个氨基酸的α-螺旋或者功能性重复。该重复单元以两亲的螺旋形构型存在(Segrest et al.,1974,FEBS Lett.38:247-53)并赋予ApoA-I的主要生物学活性,即,脂质结合和卵磷脂胆固醇酰基转移酶(LCAT)活化。
ApoA-I与脂质形成以下三种类型的稳定复合物:称为前-β-1HDL的、贫脂质的小复合物;称为前-β-2HDL的、包含极性脂质(磷脂和胆固醇)的平盘状颗粒;以及称为球状或成熟HDL(HDL3和HDL2)的、包含极性和非极性脂质的球状颗粒。循环群中的大部分HDL包含ApoA-I和ApoA-II(“AI/AII-HDL成分”)。然而,只包含ApoA-I的HDL成分(“AI-HDL成分”)在RCT中表现更有效。一些流行病学研究证明了Apo-AI-HDL成分抗动脉粥样硬化的假设(Parra et al.,1992,Arterioscler.Thromb.12:701-07;Decossin et al.,1997,Eur.J.Clin.Invest.27:299-307)。
HDL颗粒由几种具有不同尺寸、脂质组成和载脂蛋白组成的颗粒群制成。可以根据它们的性能而进行分离,所述性能包括其水合密度、载脂蛋白组成和荷电特征。例如,前-β-HDL成分的特征为具有比成熟α-HDL少的表面电荷。由于这种电荷差异,而使得前-β-HDL和成熟α-HDL在琼脂糖凝胶中具有不同的电泳迁移率(David et al.,1994,J.Biol.Chem.269(12):8959-8965)。
前-β-HDL与成熟α-HDL的代谢也不同。前-β-HDL具有以下两种代谢归宿:由血浆除去以及通过肾代谢或者是重构成优先通过肝降解的中等尺寸HDL(Lee et al.,2004,J.Lipid Res.45(4):716-728)。
尽管由细胞表面转移胆固醇的机制(即,胆固醇外流)是未知的,但是仍认为贫脂质的复合物,前-β-1HDL是从RCT中涉及的外周组织转移的胆固醇的优选受体(参见Davidson et al.,1994,J.Biol.Chem.269:22975-82;Bielicki et al.,1992,J.LipidRes.33:1699-1709;Rothblat et al.,1992,J.Lipid Res.33:1091-97;and Kawano etal.,1993,Biochemistry 32:5025-28;Kawano et al.,1997,Biochemistry 36:9816-25)。在胆固醇由细胞表面募集的这种过程中,前-β-1HDL快速地转化为前-β-2HDL。PLTP可以增加前-β-2HDL盘(disc)形成的速率,但缺少表明PLTP在RCT中的作用的数据。LCAT优先与盘状的小(前-β)HDL和球状的(即成熟)HDL反应,而将卵磷脂或其它磷脂的2-酰基转移至胆固醇的游离羟基残基以形成胆固醇酯(保留在HDL中)和溶血卵磷脂。LCAT反应需要ApoA-I作为活化剂;即,ApoA-I是LCAT的天然辅因子。在HDL中隔离的胆固醇至其酯的转化防止了胆固醇重新进入细胞中,且净结果为胆固醇由细胞除去。
ApoAI-HDL成分(即,包括ApoA-I而无ApoA-II)中成熟HDL颗粒中的胆固醇酯经由肝除去并比源自包含ApoA-I和ApoA-II的HDL(A1/AII-HDL成分)的那些更有效地加工入胆汁中。这可部分地归因于ApoAI-HDL与肝细胞膜的更有效的结合。已经假定存在HDL受体,并且已将B类I型清除剂受体(SR-BI)鉴别为HDL受体(Acton et al.,1996,Science 271:518-20;Xu et al.,1997,Lipid Res.38:1289-98)。SR-BI在生成类固醇的组织(如,肾上腺)及肝中最大量表达(Landschulz et al.,1996,J.Clin.Invest.98:984-95;Rigotti et al.,1996,J.Biol.Chem.271:33545-49)。对于HDL受体的综述,参见Broutin et al.,1988,Anal.Biol.Chem.46:16-23。
经由ATP-结合盒转运子AI的最初脂化对于血浆HDL的形成以及对于前-β-HDL颗粒的胆固醇外流能力而言是至关重要的(Lee and Parks,2005,Curr.Opin.Lipidol.16(1):19-25)。根据这些作者,这种最初的脂化使得前-β-HDL更有效地起胆固醇受体的作用并且防止了ApoA-I与预存在的血浆HDL颗粒快速缔合,从而得到前-β-HDL颗粒更强的胆固醇外流能力。
CETP还可在RCT中起重要作用。CETP活性或其受体VLDL和LDL的变化在HDL群的“重构”中起重要作用。例如,在CETP不存在下,HDL变成不可清除的大颗粒。(对于RCT和HDL的综述,参见Fielding and Fielding,1995,J.Lipid Res.36:211-28;Barrans et al.,1996,Biochem.Biophys.Acta 1300:73-85;Hirano et al.,1997,Arterioscler.Thromb.Vasc.Biol.17(6):1053-59)。
HDL也在其它脂质和非极性分子的逆转运以及解毒作用中起重要作用,即,将脂质由细胞、器官和组织转运至肝进行分解代谢和排泄。此类脂质包括鞘磷脂(SM)、氧化的脂质和溶血磷脂酰胆碱。例如,Robins和Fasulo(1997,J.Clin.Invest.99:380-84)已经证明了HDL刺激植物甾醇经由肝转运入胆汁分泌物中。
HDL的主要组分ApoA-I可以与SM于体外缔合。当使用牛脑SM(BBSM)对ApoA-I进行体外重构(reconstituted)时,在临近BBSM相变温度的温度28℃产生最大的重构率(Swaney,1983,J.Biol.Chem.258(2),1254-59)。在BBSM:ApoA-I比值为7.5:1或更低(wt/wt)时,形成了一种重构的均质HDL颗粒,每个颗粒包含三分子ApoA-I并且具有360:1的BBSM:ApoA-I摩尔比。该HDL颗粒在电子显微镜下为盘状的复合物,其类似于通过在磷脂/蛋白质升高的比值下将ApoA-I与磷脂酰胆碱进行重组而获得的复合物。然而,BBSM:ApoA-I比值为15:1(wt/wt)时,形成了具有较高磷脂:蛋白质摩尔比(535:1)的、较大直径的盘状复合物。这些复合物与使用磷脂酰胆碱形成的ApoA-I复合物相比,明显更大、更稳定并且对于变性更具抵抗力。
初期胆固醇受体(前-β-HDL以及γ-迁移ApoE包含脂蛋白)中鞘磷脂(SM)增多,表明SM可以增强这些颗粒促进胆固醇外流的能力(Dass and Jessup,2000,J.Pharm.Pharmacol.52:731-61;Huang et al.,1994,Proc.Natl.Acad.Sci.USA 91:1834-38;Fielding and Fielding 1995,J.Lipid Res.36:211-28)。
3.3.HDL和ApoA-I的保护机制
近来对于HDL保护机制的研究焦点在于载脂蛋白A-I(ApoA-I),即HDL的主要组分。较高血浆浓度的ApoA-I与冠状病变的缺失或减少有关(Maciejko et al.,1983,N.Engl.J.Med.309:385-89;Sedlis et al.,1986,Circulation 73:978-84)。
在实验动物中注入ApoA-I或HDL可产生显著的生物化学变化,以及降低动脉粥样硬化病变的程度及严重性。在Maciejko和Mao(1982,Arteriosclerosis 2:407a)、Badimon等人(1989,Lab.Invest.60:455-61;1989,J.Clin.Invest.85:1234-41)的最初报告之后,发现通过注入HDL(d=l.063-1.325g/ml)可显著地降低喂食胆固醇的兔中动脉粥样硬化病变的程度(降低45%)以及降低其胆固醇酯含量(降低58.5%)。他们还发现注入HDL使确定的病变出现接近50%的消退。Esper等人(1987,Arteriosclerosis 7:523a)已经证明,注入HDL可以显著地改变患有遗传性高胆固醇血症的、Watanabe兔的血浆脂蛋白组成,所述遗传性高胆固醇血症可发展成早期的动脉病变。在这些兔中,注入HDL可使保护性HDL与导致动脉粥样硬化的LDL之间的比值超过两倍。
通过ApoA-I在体外发挥溶纤维蛋白活性的观察结果进一步强调了HDL在动物模型中预防动脉疾病的潜力(Saku et al.,1985,Thromb.Res.39:1-8)。Ronneberger(1987,XthInt.Congr.Pharmacol.,Sydney,990)证明ApoA-I可以增加Beagle犬与Cynomologous猴的血纤蛋白溶解。发现在体外的人血浆中具有类似的活性。Ronneberger能够证实在经ApoA-I治疗的动物中,脂质沉积和动脉斑块形成的减少。
体外研究表明,ApoA-I与卵磷脂的复合物可以促进游离的胆固醇由培养的动脉平滑肌细胞外流(Stein et al.,1975,Biochem.Biophys.Acta,380:106-18)。HDL通过这种机制还可以减少这些细胞的增殖(Yoshida et al.,1984,Exp.Mol Pathol.41:258-66)。
也已证明使用包括ApoA-I或ApoA-II模拟肽的HDL灌注疗法通过ABC1转运子而调节血浆HDL浓度,从而产生了治疗心血管疾病的效力(参见,例如,Brewer et al.,2004,Arterioscler.Thromb.Vasc.Biol.24:1755-1760)。
已经分离出ApoA-I的两种天然形成的人多态性,其中精氨酸残基被半胱氨酸取代。在载脂蛋白A-I米兰(ApoA-IM)中,这种取代出现在残基173,而在载脂蛋白A-I巴黎(ApoA-Ip)中,这种取代出现在残基151(Franceschini et al.,1980,J.Clin.Invest.66:892-900;Weisgraber et al.,1983,J.Biol.Chem.258:2508-13;Bruckert et al.,1997,Atherosclerosis 128:121-28;Daum et al.,1999,J.Mol.Med.77:614-22;Klon et al.,2000,Biophys.J.79(3):1679-85)。还已经分离了另外的ApoA-I的天然形成的人多态性,其中亮氨酸在144位被精氨酸取代。该多态性已经称为载脂蛋白A-I Zaragoza(ApoA-IZ)且与严重的α低脂蛋白血症和高密度脂蛋白(HDL)胆固醇逆转运的增强作用相关(Recalde etal.,2001,Atherosclerosis 154(3):613-623;Fiddyment et al.,2011,ProteinExpr.Purif.80(1):110-116)。
包含ApoA-IM或ApoA-Ip的二硫化物连接的同源二聚体的重构HDL颗粒与包含野生型ApoA-I的重构HDL颗粒相比,其清除二肉豆蔻酰磷脂酰胆碱(DMPC)乳状液的能力及其促进胆固醇外流的能力相似(Calabresi et al.,1997b,Biochemistry 36:12428-33;Franceschini et al.,1999,Arterioscler.Thromb.Vasc.Biol.19:1257-62;Daum etal.,1999,J.Mol.Med.77:614-22)。在两种突变体中,杂合的个体降低了HDL的浓度,但是自相矛盾地是,其也降低了动脉粥样硬化的风险(Franceschini et al.,1980,J.Clin.Invest.66:892-900;Weisgraber et al.,1983,J.Biol.Chem.258:2508-13;Bruckert et al.,1997,Atherosclerosis 128:121-28)。尽管包含任一变体的重构HDL颗粒与包含野生型ApoA-I的重构HDL颗粒相比时具有降低的效力,但是其能够活化LCAT(Calabresi et al.,1997,Biochem.Biophys.Res.Commun.232:345-49;Daum et al.,1999,J.Mol.Med.77:614-22)。
ApoA-IM突变体作为常染色体显性性状遗传;并且已经鉴别了该家族内的八代载体(Gualandri et al.,1984,Am.J.Hum.Genet.37:1083-97)。单个ApoA-IM载体状态的特征为显著降低的HDL-胆固醇浓度。尽管单个载体显著降低HDL胆固醇浓度,但是其并未明显地表现出任何增加的动脉疾病风险。事实上,通过研究系谱档案(genealogical records)发现这些受试者受到“保护”而使其免于动脉粥样硬化(Sirtori et al.,2001,Circulation,103:1949-1954;Roma et al.,1993,J.Clin.Invest.91(4):1445-520)。
ApoA-IM在突变体载体中的、可能的保护作用机制似乎与ApoA-IM突变体的结构修饰有关,而在该结构中,缺失了一个α-螺旋并且增加了暴露的疏水性残基(Franceschiniet al.,1985,J.Biol.Chem.260:1632-35)。多个α-螺旋紧密结构的缺失使该分子的柔韧性增加,而所述分子与正常的ApoA-I相比,更易于与脂质缔合。此外,脂蛋白复合物对变性更敏感,从而表明在突变体中,也可以改善脂质的递送。
Bielicki等人(1997,Arterioscler.Thromb.Vasc.Biol.17(9):1637-43)已经证明ApoA-IM与野生型ApoA-I相比,具有募集膜胆固醇的有限能力。此外,由ApoA-IM与膜脂质缔合而形成的初生HDL主要是7.4nm的颗粒,而不是由野生型ApoA-I形成的、较大的9nm和11nm的复合物。这些观察结果表明,在ApoA-I基本序列中Arg173→Cys173的取代干扰了细胞胆固醇募集和初生HDL组装的正常过程。该突变明显与从细胞除去胆固醇的降低的效力有关。因此,其抗动脉粥样硬化的性质可能与RCT无关。
归因于Arg173→Cys173取代的、最显著的结构变化是ApoA-IM的二聚作用(Bielickiet al.,1997,Arterioscler.Thromb.Vasc.Biol.17(9):1637-43)。ApoA-IM可以与自身形成同源二聚体而与ApoA-II形成异源二聚体。对于包含载脂蛋白混合物的血液成分的研究表明,循环中二聚体和复合物的存在是造成载脂蛋白消除半衰期延长的原因。已在突变体载体的临床研究中观察到此类消除半衰期的延长(Gregg et al.,1988,NATO ARW onHuman Apolipoprotein Mutants:From Gene Structure to Phenotypic Expression,Limone S G)。其它研究表明,ApoA-IM二聚体(ApoA-IM/ApoA-IM)在体外的HDL颗粒互变中起抑制因子的作用(Franceschini et al.,1990,J.Biol.Chem.265:12224-31)。
3.4.目前用于血脂异常及相关病症的治疗
血脂异常障碍是与升高的血清胆固醇和甘油三酯浓度以及较低的血清HDL:LDL比值相关的疾病,并且其包括高脂血症(特别是高胆固醇血症)、冠心病、冠状动脉疾病、血管和血管周围疾病、以及诸如动脉粥样硬化的心血管疾病。也可以包括与动脉粥样硬化相关的综合征,比如由动脉机能不全引起的短暂性脑缺血发作或者间歇性跛行。目前具有大量可用于降低与血脂异常障碍相关的、高血清胆固醇和甘油三酯的治疗。但是,鉴于疗效、副作用和患病人群,而使得每种治疗具有各自的缺点和限制。
胆汁酸结合树脂是一类中断胆汁酸由肠至肝的再循环的药物,如消胆胺(QuestranBristol-Myers Squibb)和盐酸考来替泊(Upjohn公司)以及盐酸考来维仑(Daiichi-Sankyo公司)。当口服时,这些带正电荷的树脂在肠中与带负电荷的胆汁酸结合。由于所述树脂不能由肠吸收,因此它们携带着胆汁酸一起排出。但是,此类树脂的使用充其量只能将血清胆固醇浓度降低约20%,而且其与以下的胃肠副作用有关,该副作用包括便秘和一些维生素缺乏症。此外,由于所述树脂也可以结合其它的药物,因而必需在所述树脂摄入前至少一个小时或者摄入之后四至六小时才能服用其它的口服药物,从而使得心脏病患者的用药方案复杂化。
他汀类药物(statins)是降胆固醇药物,其通过抑制胆固醇生物合成通路中所涉及的关键酶,即HMGCoA还原酶而阻断胆固醇的合成。他汀类药物有时可结合胆汁酸结合树脂使用,所述他汀类药物的例子如洛伐他汀辛伐他汀普伐他汀氟伐他汀和阿伐他汀他汀类药物显著降低血清胆固醇和血清LDL的浓度,并且延缓冠状动脉粥样硬化的进程。然而,血清HDL胆固醇的浓度仅中等地增加。LDL作用减弱的机制可能涉及VLDL浓度的降低以及LDL受体细胞表达的诱导,而其造成了产量减少和/或LDL分解代谢增强。包括肝和肾功能障碍的副作用与这些药物的使用有关(The Physicians Desk Reference,56th Ed.,2002,Medical Economics)。
烟酸(尼克酸)是一种水溶性的维生素B-复合物,其作为食物添加物和抗高血脂药使用。烟酸减少了VLDL的形成并且在降低LDL方面是有效的。在一些情况中,烟酸与胆汁酸结合树脂结合使用。当烟酸以足够的剂量使用时,可以增加HDL,但是当以这样高的剂量使用时,其有效性受到严重副作用的限制。是一种延长释放的烟酸形式,其与纯烟酸相比产生更少的副作用。烟酸/洛伐他汀是一种含有烟酸和洛伐他汀的制剂,其联合了每种药物的益处。
贝特类药物(Fibrates)是一类降脂质药物,其用于治疗各种形式的高脂血症(即,血清甘油三酯升高),所述高脂血症也可以与高胆固醇血症有关。贝特类药物似乎减少了VLDL成分并且适当地增加了HDL,但是,这些药物对于血清胆固醇的作用却是可变的。在美国,贝特类药物如氯贝丁酯非诺贝特和苯扎贝特已被批准作为降血脂药使用,但仍未获得批准用作高胆固醇血症药物。例如,氯贝丁酯是一种降血脂药,其(经由未知的机制)通过减少VLDL成分而起降低血清甘油三酯的作用。尽管在某些患者亚群中可以降低血清胆固醇,但是其对于药物的生物化学反应是可变的,并且不可能总是预知哪名患者将获得有利的结果。未表现出预防冠心病的疗效。化学和药理学相关的药物吉非贝齐是一种脂质调节剂,其中等地降低血清甘油三酯和VLDL胆固醇,并中等增加HDL胆固醇-HDL2和HDL3亚成分以及ApoA-I和A-II(即,AI/AMT-HDL成分)。但是,该脂质应答是不均匀的(heterogeneous),特别是在不同的患者群体中。此外,尽管在无冠心病史或无现存冠心病症状的、40-55岁之间的男性患者中观察到了冠心病的预防作用,但是还不清楚将这些结果以何种程度外推至其它的患者群体(如,妇女、老年人和较年轻的男性)。事实上,在患有确定的冠心病的患者中并未观察到疗效。严重的副作用与贝特类药物的使用有关,而所述副作用包括毒性作用,如恶性肿瘤(特别是胃肠癌)、胆囊疾病以及非冠状死亡发生几率的增加。
对于绝经后妇女中的中度的高胆固醇血症,可考虑口服雌激素替代疗法。然而,HDL的增加可能伴有甘油三酯的升高。当然,雌激素治疗受限于具体的患者群体(绝经后妇女)并且与严重的副作用有关,而所述副作用包括诱发恶性肿瘤、胆囊疾病、血栓栓塞性疾病、肝腺瘤、血压升高、葡萄糖耐受不良以及高钙血症。
HDL以及与磷脂复合的、重组形式的ApoA-I可用作非极性或两亲性分子的吸收剂/清除剂,所述非极性或两亲性分子如胆固醇及衍生物(氧甾醇、氧化的甾醇、植物甾醇等)、胆固醇酯、磷脂及衍生物(氧化的磷脂)、甘油三酯、氧化产物和脂多糖(LPS)(参见,如,Casas et al.,1995,J.Surg.Res.Nov59(5):544-52)。HDL还可以用作TNF-α及其它淋巴因子的清除剂。HDL还可以用作人血清对氧磷酶的载体,所述人血清对氧磷酶如PON-1、-2、-3。对氧磷酶是一种与HDL缔合的酯酶,其对于保护细胞组分对抗氧化是重要的。LDL的氧化在氧化应激过程中产生,其似乎与动脉粥样硬化的形成有直接关联(Aviram,2000,FreeRadic.Res.33Suppl:S85-97)。对氧磷酶似乎在动脉粥样硬化和心血管疾病的易受性方面起重要作用(Aviram,1999,Mol.Med.Today 5(9):381-86)。人血清对氧磷酶(PON-1)与高密度脂蛋白(HDL)结合。其活性与动脉粥样硬化呈负相关。PON-1水解有机磷酸酯并且可以通过抑制HDL和低密度脂蛋白(LDL)的氧化而保护免受动脉粥样硬化(Aviram,1999,Mol.Med.Today 5(9):381-86)。实验研究表明,这种保护作用与PON-1水解氧化的脂蛋白中的特异性脂质过氧化物的能力有关。保持或促进PON-1活性的干预可有助于延缓动脉粥样硬化与冠心病的发作。
HDL进一步具有抗血栓药和纤维蛋白原还原剂的作用以及作为失血性休克药物的作用(Cockerill et al.,WO 01/13939,2001年3月1日公布)。HDL,特别是ApoA-I,其已被证明促进败血症产生的脂多糖交换为包含ApoA-I的脂质颗粒,从而功能性地中和所述脂多糖(Wright et al.,WO9534289,1995年12月21日公布;Wright et al.,1999年7月27日发行的美国专利5,928,624;1999年8月3日发行的美国专利5,932,536)。
存在众多可用于体外制备脂蛋白复合物的方法。美国专利6,287,590和6,455,088公开了如下的方法:将载脂蛋白和脂质溶液在有机溶剂(或者溶剂混合物)中共冷冻干燥并且在冷冻干燥粉末的水合过程中形成荷电的脂蛋白复合物。脂蛋白复合物也可通过洗涤剂透析法来形成;例如,将脂质、脂蛋白和诸如胆酸盐的洗涤剂的混合物进行透析并重构形成复合物(参见,例如Jonas et al.,1986,Methods Enzymol.128:553-82)。美国公布文本2004/0067873的实施例1公开了胆酸盐分散法,其中将脂质分散体与胆酸盐在用于形成为胶束的条件下混合,并且再将这些胶束与载脂蛋白溶液一起孵育以形成复合物。最终,例如通过透析、超滤或者在亲和性珠子或者树脂上吸附将有毒的胆酸盐除去。美国专利6,306,433公开了通过使得蛋白和脂质的流体混合物进行高压匀浆化来形成脂蛋白复合物。然而,对于高剪切力敏感的蛋白可能在暴露至高压匀浆时丧失活性。
因此,目前可用的制备方法导致起始物质的浪费诸如蛋白降解,和/或者需要所得产物的纯化诸如除去毒性剂,且因此是效率低且开支大的。此外,脂蛋白复合物的制备可为不均一的,其含有尺寸和组成可变的复合物的混合物。参见例如美国专利5,876,968。因此,需要开发用于产生脂蛋白复合物的有效且获得更均质的复合物(优选具有高纯度)的新的方法。所述方法可允许更经济的大规模生产,而产生具有较低的污染物所导致的副作用风险的更均质的药用产物。
此外,然而考虑到产物的低的总产率以及在重组表达的蛋白培养中出现的蛋白降解,ApoA-I、ApoA-IM、ApoA-IP和其它变体以及重组的HDL目前受到大量的治疗性给药所需的载脂蛋白以及蛋白生产成本的限制(参见,例如Mallory et al.,1987,J.Biol.Chem.262(9):4241-4247;Schmidt et al.,1997,Protein Expression&Purification 10:226-236)。早期临床试验已经表明用于治疗心血管疾病的每次输注所给予的蛋白剂量范围为1.5-4g。完全治疗所需的输注次数是未知的(参见,例如Eriksson et al.,1999,Circulation 100(6):594-98;Carlson,1995,Nutr.Metab.Cardiovasc.Dis.5:85-91;Nanjee et al.,2000,Arterioscler.Thromb.Vasc.Biol.20(9):2148-55;Nanjee et al.,1999,Arterioscler.Thromb.Vasc.Biol.19(4):979-89;Nanjee et al.,1996,Arterioscler.Thromb.Vasc.Biol.16(9):1203-14)。
重组人ApoA-I已经在异源性宿主中表达,然而成熟蛋白的产率不足以用于大规模治疗应用,特别是当与进一步降低产率且产生不纯产物的纯化方法结合时。
Weinberg et al.,1988,J.Lipid Research 29:819-824描述了通过反相高效液相色谱由人血浆纯化的载脂蛋白A-I、A-II和A-IV以及它们的亚型的分离。
WO 2009/025754描述了α-1-抗胰蛋白酶和ApoA-I由人血浆的蛋白分离和纯化。
Hunter et al.,2009,Biotechnol.Prog.25(2):446-453描述了大肠杆菌中进行重组表达的ApoA-I米兰突变体的大规模纯化。
Caparon et al.,2009,Biotechnol.And Bioeng.105(2):239-249描述了ApoA-I米兰由大肠杆菌宿主的表达和纯化,所述大肠杆菌宿主经遗传性工程化以删除两个宿主细胞蛋白以降低这些蛋白在纯化的载脂蛋白产物中的水平。
美国专利6,090,921描述了使用阴离子交换色谱法将ApoA-I或者载脂蛋白E(ApoE)由含有ApoA-I和ApoE的人血浆成分纯化。
Brewer et al.,1986,Meth.Enzymol.128:223-246描述了使用色谱技术进行载脂蛋白由人血液的分离和表征。
Weisweiler et al.,1987,Clinica Chimica Acta 169:249-254描述了使用快速-蛋白液相色谱法进行ApoA-I和ApoA-II由人HDL的分离。
deSilva et al.,1990,J.Biol.Chem.265(24):14292-14297描述了通过免疫亲和色谱法和反相高效液相色谱法进行载脂蛋白J的纯化。
目前正在开发脂蛋白和脂蛋白复合物用于临床应用,其中临床研究使用不同的基于脂蛋白的试剂,其确立了脂蛋白疗法的可行性(Tardif,2010,Journal of ClinicalLipidology 4:399–404)。一个研究评价了自体同源的去脂的HDL(Waksman et al.,2010,JAm.Coll.Cardiol.55:2727-2735)。另外的研究评价了ETC-216,其为重组ApoA-IM和棕榈酰基-油酰基-PC(POPC)的复合物(Nissen et al.,2003,JAMA 290:2292-2300)。CSL-111为由与大豆磷脂酰胆碱(SBPC)络合的血浆纯化的重建的人ApoA-I(Tardif et al.,2007,JAMA297:1675-1682)。目前的探索药物已经显示出降低动脉粥样硬化斑块的效能,但是该作用伴随有次级效应,诸如转氨酶增加以及ApoA-I抗体的形成(Nanjee et al.,1999,Arterioscler.Vasc.Throm.Biol.19:979-89;Nissen et al.,2003,JAMA 290:2292-2300;Spieker et al.,2002,Circulation 105:1399-1402;Nieuwdorp et al.,2004,Diabetologia 51:1081-4;Drew et al.,2009,Circulation 119,2103-11;Shaw et al.,2008,Circ.Res.103:1084-91;Tardiff et al.,2007,JAMA 297:1675-1682;Waksman,2008,Circulation 118:S 371;Cho,美国专利7,273,849B2,2007年9月25日出版)。例如,ERASE临床试验(Tardiff et al.,2007,JAMA 297:1675-1682)采用两个剂量的CSL-111:40mg/kg和80mg/kg的ApoA-I。80mg/kg剂量组由于肝毒性(已知为严重的转氨酶升高)而需要终止。甚至在40mg/kg剂量组中,若干患者经历了转氨酶升高。
因此,存在对于更有效地降低血清胆固醇、增加HDL血清水平、预防和/或者治疗血脂异常和/或者与血脂异常相关的疾病、病症和/或者障碍的更安全的药物的需要。本领域存在对于不与肝毒性相关且优选仅诱导甘油三酯、LDL-甘油三酯或者VLDL-甘油三酯的最少量(或者无)的增加的脂蛋白制剂,以及对于可用于可靠地制备这些脂蛋白的商业规模的制剂的稳固生产方法的需要。
4.发明内容
本公开提供了特别适用于治疗和/或者预防血脂异常和与血脂异常相关的疾病、障碍和/或者病症的包含蛋白部分(例如载脂蛋白部分)和脂质部分的脂蛋白复合物和脂蛋白复合物群体。本公开还发现了本申请所述的具有更高纯度和/或者均质性和/或者包含特定比例的脂质和蛋白的复合物群体具有增强的动员胆固醇以及降低副作用风险的能力。
所述脂蛋白复合物包含蛋白部分(例如载脂蛋白部分)和脂质部分(例如磷脂部分)。所述蛋白部分包含一种或者多种当存在于脂蛋白复合物中时能够动员胆固醇的脂质-结合蛋白,诸如载脂蛋白、肽或者载脂蛋白肽类似物或者模拟物。所述载脂蛋白和载脂蛋白肽的非限制性实例包括前原载脂蛋白、前原ApoA I、原ApoA-I、ApoA-I、前原ApoA-II、原ApoA-II、ApoA-II、前原ApoA-IV、原ApoA-IV、ApoA-IV、ApoA-V、前原ApoE、原ApoE(proApoE)、ApoE、前原ApoA-IM、原ApoA-IM、ApoA-IM、前原ApoA-IP、原ApoA-IP、ApoA-IP、前原ApoA-IZ、原ApoA-IZ和ApoA-IZ。所述一种或者多种载脂蛋白可为单体、二聚体或者三聚体或者它们的混合物的形式。在一个具体的实施方案中,所述载脂蛋白部分基本上由ApoA-I构成,最优选地为单一同等型。脂蛋白复合物中的ApoA-I可具有与相应于SEQ ID NO:1的氨基酸25-267的蛋白至少90%或者至少95%的序列同一性。任选地,ApoA-I进一步包含在相应于SEQ ID NO:1的全长ApoA-I氨基酸25的位置(以及成熟蛋白的位置1)上的门冬氨酸。优选地,至少75%、至少80%、至少85%、至少90%或者至少95%的ApoA-I为经恰当工程化的成熟蛋白(即,缺失信号和前肽序列)且为未被氧化、被脱去酰胺和/或者被截短的。
本公开还提供了经工程化以表达ApoA-I的哺乳动物宿主细胞、包含ApoA-I的细胞培养物以及产生成熟的生物学活性ApoA-I的方法。已经发现,工程化哺乳动物宿主细胞以表达大量的成熟ApoA-I是可能的,所述成熟ApoA-I基本上不含不成熟的ApoA-I(原ApoA-I)以及经蛋白酶降解所产生的截短形式的ApoA-I。这些结果是令人意料不到的。首先,预期的是,用于蛋白加工的宿主细胞机制(machinery)被异源性蛋白如ApoA-I的过表达所压制,这导致未加工的不成熟蛋白的产生。第二,使得分泌至培养基中的ApoA-I被蛋白酶降解,而仅在培养基中观察到低水平的截短的ApoA-I。哺乳动物宿主细胞、细胞培养物和产生ApoA-I的方法特别适于以商业上相关的数量产生用于治疗应用中的成熟蛋白。
将本申请提供的哺乳动物宿主细胞工程化以表达优选包含氨基酸序列(或者由氨基酸序列组成)的蛋白,所述氨基酸序列具有与SEQ ID NO:1的位置25-267至少95%、至少96%、至少97%、至少98%、至少99%或者100%的同一性。所述蛋白优选在相应于SEQ IDNO:1的位置25的位置上具有门冬氨酸残基。所述哺乳动物宿主细胞可任选地进一步分泌所述蛋白。在一些情况下,由哺乳动物宿主细胞表达和/或者分泌的蛋白可进一步包含18个氨基酸的信号序列(MKAAVLTLAVLFLTGSQA,SEQ ID NO:2)和/或者6个氨基酸的前肽序列(RHFWQQ,SEQ ID NO:3)。在一些情况下,将所述宿主细胞工程化以表达包含氨基酸序列的蛋白,所述氨基酸序列具有与SEQ ID NO:1至少95%、至少96%、至少97%、至少98%、至少99%或者100%的同一性。
所述宿主细胞可来自任何哺乳动物细胞系,包括但不限于中国仓鼠卵巢(例如CHO-K1或者CHO-S)、VERO、BHK、BHK 570、HeLa、COS-1、COS-7、MDCK、293、3T3、PC12和W138,或者来自骨髓瘤细胞或者细胞系(例如鼠类骨髓瘤细胞或者细胞系)。
所述哺乳动物宿主细胞可进一步含有编码ApoA-I蛋白的核酸的多个副本,所述ApoA-I蛋白为例如包含SEQ ID NO:1的位置25-267或者由SEQ ID NO:1的位置25-267组成的蛋白。例如,所述哺乳动物宿主细胞可含有至少约5、6、7、8或者更多的核酸副本,且至多约10、11、12、13或者14个核酸副本。所述核酸可进一步可操作地连接至启动子,所述启动子能够在哺乳动物宿主细胞中高水平地表达所述蛋白,例如,猿猴巨细胞病毒启动子或者更具体为早期猿猴巨细胞病毒启动子。
所述哺乳动物宿主细胞优选能够在培养物中产生至少约0.5、1、2或者3g/L ApoA-I和/或者至多约20g/L ApoA-I,例如至多4、5、6、7、8、9、10、12或者15g/L ApoA-I。所述培养物可为任意规格的,范围为约150mL至约500L、1000L、2000L、5000L、10,000L、25,000L或者50,000L或者更大。在不同的实施方案中,所述培养物体积的范围可为10L至50L、50L至100L、100L至150L、150L至200L、200L至300L、300L至500L、500L至1000L、1000L至1500L、1500L至2000L、2000L至3000L、3000L至5000L、5000L至7500L、7500L至10,000L、10,000L至20,000L、20,000L至40,000L、30,000L至50,000L。在一些情况下,所述培养物为大规格培养物,诸如15L、20L、25L、30L、50L、100L、200L、300L、500L、1000L、5000L、10,000L、15,000L、20,000L、25,000L、至多50,000L或者更大。
本公开的哺乳动物宿主细胞可在培养物中生长。因此,本公开进一步提供了哺乳动物细胞培养物,其包含如上所述或者在如下段落6.1.2中所述的多个哺乳动物宿主细胞。所述细胞培养物可包括一种或者多种以下特征:(a)所述培养物(其任选地为至少10升、至少20升、至少30升、至少50升、至少100升、300L、500L、1000L、5000L、10,000L、15,000L、20,000L、25,000L、至多50,000L的大规格分批培养物,或者为至少10升、至少20升、至少30升、至少50升、至少100升、300L、500L、1000L、5000L或者至多10,000L的连续培养物)包含至少约0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0g/L或者更多的成熟ApoA-I蛋白,该ApoA-I蛋白包含相应于SEQ ID NO:1的氨基酸25-267的氨基酸序列或者由该氨基酸序列组成;(b)在所述培养基中的至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或者至少99%的蛋白为缺失信号序列的ApoA-I蛋白;(c)在所述培养基中的至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或者至少99%的蛋白为缺失信号序列和前肽序列的成熟ApoA-I蛋白;以及(d)至少75%、至少80%、至少85%、至少90%、至少95%的成熟ApoA-I未被截短、氧化或者被脱去酰胺。
本公开还提供了产生成熟的生物学活性ApoA-I的方法。一般而言,所述方法包括在表达和分泌ApoA-I的条件下培养如上所述或者在如下段落6.1.2中所述的任意哺乳动物宿主细胞。所述方法可进一步包括以下步骤:由培养的哺乳动物宿主细胞的上清液回收,并任选地纯化所述成熟的生物学活性ApoA-I(诸如通过在如下段落6.1.3和段落6.1.4公开的方法)。
通过如上所述的方法获得的或者可获得的ApoA-I可进一步与脂质复合以形成本申请所述的脂蛋白复合物,和/或者可以治疗有效量掺入至药物组合物中。所述药物组合物优选为磷酸盐缓冲溶液,其也含有蔗糖和/或者甘露醇作为赋形剂。
已经进一步发现,通过使用色谱法和滤过步骤的新的组合来纯化ApoA-I,可产生大量的纯的ApoA-I,其含有如下水平的宿主细胞蛋白、宿主细胞DNA、内毒素和截短形式的所述蛋白,所述水平足够低以至于产生一种或者多种属性,包括降低的副作用风险以及低毒性或者无毒性,这使得所述蛋白特别适用于治疗用途。优选地,由本申请所述的方法纯化的ApoA-I在哺乳动物细胞中重组性产生且分泌至生长培养基中。因此,本公开涉及纯化ApoA-I的方法,其包括以下步骤:(a)使含有ApoA-I的溶液与阴离子交换基质在使得ApoA-I不能与所述基质结合的条件下接触;(b)经具有足以除去病毒或者病毒颗粒的孔径的膜将步骤(a)获得的含有ApoA-I的溶液滤过;(c)在使得ApoA-I与基质结合的条件下使得步骤(b)获得的滤液经过第一反相色谱柱;(d)使用增加浓度的有机溶剂梯度由所述第一反相色谱基质洗脱出第一含有ApoA-I的反相洗脱液;(e)在使得ApoA-I与基质结合的条件下使得步骤(d)的第一ApoA-I的反相洗脱液经过第二反相色谱柱;以及(f)使用增加浓度的有机溶剂梯度由所述第二反相色谱基质洗脱出第二含有ApoA-I的反相洗脱液。所进行的步骤的顺序不是关键的,例如,在示例性实施方案中,经膜滤过以除去病毒或者病毒颗粒的步骤在上述步骤(f)之后进行,而不是在步骤(a)之后进行。
本申请还提供了由本申请所述的纯化方法获得的或者可获得的基本纯的ApoA-I产物,其中ApoA-I的浓度为至少10g/L。所述由本申请所述的纯化方法产生的基本纯的ApoA-I产物优选包含小于约10pg的宿主细胞DNA/mg ApoA-I、小于约100ng的宿主细胞蛋白/mg ApoA-I和/或者小于0.1EU的内毒素/mg ApoA-I。所述ApoA-I产物可为至少95%纯的、至少96%纯的、至少97%纯的、至少98%纯的或者至少99%纯的。
此外,所述基本纯的ApoA-I产物可掺入至本申请所述的包含ApoA-I的任何药物组合物和/或者脂蛋白复合物。
所述脂质部分通常包含一种或者多种磷脂,所述磷脂可为中性的、荷负电的、荷正电的或者它们的组合。所述磷脂上的脂肪酸链在长度上优选含有12-26或者16-26个碳且可在饱和程度上为饱和至单不饱和。示例性磷脂包括小烷基链磷脂、蛋磷脂酰胆碱、大豆磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二肉豆蔻酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱、1-肉豆蔻酰-2-棕榈酰磷脂酰胆碱、1-棕榈酰-2-肉豆蔻酰磷脂酰胆碱、1-棕榈酰-2-硬脂酰磷脂酰胆碱、1-硬脂酰-2-棕榈酰磷脂酰胆碱、二油酰磷脂酰胆碱、二油酰磷脂酰乙醇胺、二月桂酰磷脂酰甘油磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰甘油、二磷脂酰甘油诸如二肉豆蔻酰磷脂酰甘油、二棕榈酰磷脂酰甘油、二硬脂酰磷脂酰甘油、二油酰磷脂酰甘油、二肉豆蔻酰磷脂酸、二棕榈酰磷脂酸、二肉豆蔻酰磷脂酰乙醇胺、二棕榈酰磷脂酰乙醇胺、二肉豆蔻酰磷脂酰丝氨酸、二棕榈酰磷脂酰丝氨酸、脑磷脂酰丝氨酸、脑鞘磷脂、蛋鞘磷脂、乳鞘磷脂、棕榈酰鞘磷脂、植物鞘磷脂、二棕榈酰鞘磷脂、二硬脂酰鞘磷脂、二棕榈酰磷脂酰甘油盐、磷脂酸、半乳糖脑苷脂、神经节苷酯、脑苷脂、二月桂基磷脂酰胆碱、(1,3)-D-甘露糖基-(1,3)甘油二酯、氨基苯基糖苷、3-胆固醇基-6'-(糖基硫基)己基醚糖脂以及胆固醇及其衍生物。包含SM和棕榈酰鞘磷脂的磷脂部分可任选地包含少量的任意类型的脂质,包括但不限于溶血磷脂质、除了棕榈酰鞘磷脂之外的鞘磷脂、半乳糖脑苷脂、神经节苷酯、脑苷脂、甘油酯、甘油三酯以及胆固醇及其衍生物。
最优选地,所述脂质部分含有至少一种中性磷脂以及任选地一种或者多种负电荷磷脂。在包含中性和负电荷磷脂的脂蛋白复合物中,所述中性和负电荷磷脂可含有具有相同或者不同数目的碳以及相同或者不同程度的饱和度的脂肪酸链。在一些情况下,所述中性和负电荷磷脂将具有相同的酰基末端,例如C16:0,或者棕榈酰、酰基链。
当所述复合物的脂质成分包含中性和负电荷磷脂或者由中性和负电荷磷脂组成时,所述中性与负电荷磷脂的重量-重量(wt:wt)比优选为范围为约99:1至约90:10、更优选约99:1至约95:5且最优选约98:2至约96:4的wt:wt比。在一个实施方案中,所述一种或多种中性磷脂和一种或多种负电荷磷脂以约97:3的一种或多种中性磷脂与一种或多种负电荷磷脂的重量-重量(wt:wt)比存在。
所述中性磷脂可为天然的或者合成的。优选地,所述磷脂为鞘磷脂(“SM”),诸如棕榈酰鞘磷脂、植物鞘磷脂、二植物鞘磷脂、磷酸鞘脂或者糖鞘脂,其任选地含有具有16-26个碳原子的链长的饱和或者单-不饱和的脂肪酸。SM可来自任何来源。例如,所述SM可由乳、蛋、脑获得或者合成性制备。在一个具体的实施方案中,所述SM由鸡蛋获得(“蛋SM”)。在另一个具体实施方案中,所述SM为棕榈酰鞘磷脂。
在生理学pH带有至少部分负电荷的任何磷脂可用作负电荷磷脂。非限制性实例包括荷负电的形式,例如磷脂酰肌醇、磷脂酰丝氨酸、磷脂酰甘油和磷脂酸的盐。在一个具体的实施方案中,所述负电荷磷脂为1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)]或者DPPG、磷脂酰甘油。优选的盐包括钾盐和钠盐。
用于制备本公开复合物的磷脂优选为至少95%纯的且更优选为至少99%纯的,和/或者具有在4meq O/kg、更优选在3meq O/kg(例如在2meq O/kg)的氧化水平。氧和脂肪酸的主要初始反应产物为过氧化氢。使用碘量滴定法,可以通过测定过氧化物在样品中的存在来测量氧化水平。
本公开的脂蛋白复合物优选具有载脂蛋白与脂质的比,该比导致更完全和更均质的复合物形成,如下在实施例中显示。所述脂蛋白复合物的特征在于范围为1:80-1:120、1:100-1:115或者1:105-1:110的载脂蛋白部分:脂质部分摩尔比,其中所述载脂蛋白在ApoA-I等价物中表达。在一个具体的实施方案中,所述载脂蛋白部分:脂质部分的摩尔比为1:80-1:90(例如1:82、1:85或者1:87)、1:90-1:100(例如1:95或者1:98)、1:100-1:110(例如1:105或者1:108)。
在一些具体的实施方案中,特别是蛋SM用作中性脂质的那些,所述载脂蛋白部分:脂质部分的重量比的范围为约1:2.7至约1:3(例如1:2.7)。
本公开的脂蛋白复合物也可用作递送疏水性、亲脂性或者非极性活性剂的载体。对于所述应用,所述脂质部分可进一步包含一种或者多种疏水性、亲脂性或者非极性活性剂,或者所述脂蛋白复合物可载入有一种或者多种疏水性、亲脂性或者非极性活性剂,所述活性剂包括但不限于脂肪酸、药物、核酸、维生素和/或者营养素。活性剂的具体实例描述于段落6.2中。
本公开还提供了脂蛋白复合物群体。典型地:
·所述群体含有多个脂蛋白复合物,其各自包含蛋白部分和脂质部分;
·所述蛋白部分含有如上所述和在段落6.1或者6.5.3中所述的脂蛋白或者脂蛋白类似物;最优选地,蛋白部分包含脂蛋白(例如ApoA-I蛋白)或者基本上由脂蛋白(例如ApoA-I蛋白)构成,所述脂蛋白由段落6.1.2所述的方法获得或者可获得,和/或者由段落6.1.4所述的方法纯化;
·所述脂质部分含有如上所述和在段落6.2或者6.5.2中所述的脂质;
·所述脂蛋白复合物优选由在段落6.5.4中所述的热循环方法产生。
申请人已经发现了若干特征,这些特征被认为在单独或者组合时有助于脂蛋白复合物群体的效能和安全性特性。这些特征包括:
·群体中的复合物大小的均一性,其主要范围为4nm至15nm(例如5nm至12nm、6nm至15nm或者8nm至10nm);
·用于制备复合物的载脂蛋白的纯度(例如,缺乏被氧化的、被脱去酰胺的、被截短的和/或者不成熟形式的载脂蛋白和/或者缺乏内毒素和/或者缺乏除了一种或者多种载脂蛋白之外的蛋白(诸如宿主细胞蛋白),和/或者通常存在于重组生产中的宿主细胞DNA);
·群体中复合物本身的纯度(特征在于缺乏污染物,诸如用于制备复合物的溶剂或者洗涤剂;缺乏氧化的脂质;缺乏被脱去酰胺的、氧化的或者截短的蛋白;和/或者降低量的或者缺乏非复合的载脂蛋白和/或者脂质)。
在这些特征中,认为复合物的均一性以及复合物中成熟的、未修饰的载脂蛋白的普及能够增加效能。载脂蛋白、脂质和复合物的纯度降低了副作用的风险,所述副作用诸如由肝酶(例如转氨酶)增加所表现出的肝损伤。此外,发明人已经可以通过导致大部分载脂蛋白掺入复合物中的方法制备脂蛋白复合物群体,并且非复合的载脂蛋白的量的降低也是有益的,这是因为其降低了可由给予异源性蛋白所引起的受试者中免疫源应答的风险。
因此,本公开提供了脂蛋白复合物群体,其特征在于以下特征中的一种或者多种或者全部:
(a)所述群体中至少75wt%、至少80wt%、至少85wt%、至少90wt%或者至少95wt%的脂蛋白(通常为ApoA-I)为成熟形式;
(b)所述群体中不超过25wt%、不超过20wt%、不超过15wt%、不超过10wt%或者不超过5wt%的脂蛋白(通常为ApoA-I)为不成熟形式;
(c)所述群体含有不超过100皮克宿主细胞DNA/毫克脂蛋白(通常为ApoA-I)、不超过50皮克宿主细胞DNA/毫克脂蛋白(通常为ApoA-I)、不超过25皮克宿主细胞DNA/毫克脂蛋白(通常为ApoA-I)、不超过10皮克宿主细胞DNA/毫克脂蛋白(通常为ApoA-I)或者不超过5皮克宿主细胞DNA/毫克脂蛋白(通常为ApoA-I);
(d)所述群体含有不超过500纳克宿主细胞蛋白/毫克脂蛋白(通常为ApoA-I)、不超过200纳克宿主细胞蛋白/毫克脂蛋白(通常为ApoA-I)、不超过100纳克宿主细胞蛋白/毫克脂蛋白(通常为ApoA-I)、不超过50纳克宿主细胞蛋白/毫克脂蛋白(通常为ApoA-I)或者不超过20纳克宿主细胞蛋白/毫克脂蛋白(通常为ApoA-I);
(e)所述群体中不超过25wt%、不超过20wt%、不超过15wt%、不超过10wt%或者不超过5wt%的脂蛋白(通常为ApoA-I)为截短形式;
(f)所述脂蛋白成分包含成熟ApoA-I或者由成熟ApoA-I构成,且所述群体中的所述ApoA-I中的不超过20%、不超过15%、不超过10%、不超过5%、不超过3%、不超过2%或者不超过1%的蛋氨酸112和蛋氨酸148各自被氧化;
(g)如经凝胶渗透色谱法(“GPC”)或者动态光散射(“DLS”)所测量,至少80%、至少85%、至少90%或者至少95%的脂蛋白复合物为具有以下粒度的颗粒形式:4nm至15nm,例如6nm至15nm或者8nm至12nm,更优选5nm至12nm;
(i)所述群体含有不超过1EU内毒素/毫克脂蛋白(通常为ApoA-I)、不超过0.5EU内毒素/毫克脂蛋白(通常为ApoA-I)、不超过0.3EU内毒素/毫克脂蛋白(通常为ApoA-I)或者不超过0.1EU内毒素/毫克脂蛋白(通常为ApoA-I);
(j)所述群体中的脂蛋白(通常为ApoA-I)中的不超过15%、不超过10%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的氨基酸被脱去酰胺;
(k)所述复合物中的脂质部分中的不超过15wt%、不超过10wt%、不超过5wt%、不超过2wt%或者0wt%的脂质为胆固醇;
(l)所述群体含有不超过200ppm、100ppm、50ppm的非水溶剂;
(m)所述群体不含有任何洗涤剂(例如胆酸盐);
(n)如经凝胶渗透色谱法中群体在单峰中的百分数所测量,所述群体可为至少80%、至少85%、至少90%、至少95%、至少97%、至少98%或者至少99%均质的;
(o)所述群体在组合物中,在所述组合物中,至少80%、至少85%、至少90%、至少95%或者至少97%的蛋白为复合形式;
(p)所述群体中不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的脂质被氧化;以及
(q)所述群体中不超过15%、不超过10%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的蛋氨酸和/或者色氨酸残基被氧化。
在一些具体的实施方案中,所述群体具有选自以下各组的特征:
组I:上述特征(a)、(b)和(e);
组II:上述特征(c)、(d)和(i);
组III:上述特征(f)、(j)、(e)、(p)和(q);
组IV:上述特征(g)、(n)和(o);
组V:上述特征(l)和(m);和
组VI:上述特征(k)。
在某些方面,所述群体的特征在于独立选自组I和组IV各自的一种或者两种特征;任选地,所述群体的特征在于独立选自组I和组IV各自的三种特征。所述群体的另外的特征在于独立选自组II和/或者组III各自的一种、两种或者三种特征。所述群体的进一步特征在于独立选自组V的一种或者两种特征和/或者独立选自组VI的一种特征。
某些脂质和蛋白成分可形成多种不同的但均质的脂蛋白复合物。因此,本公开还提供了包含两种、三种或者四种脂蛋白复合物群体的组合物,所述脂蛋白复合物包含不同量的载脂蛋白分子(例如两个、三个或者四个ApoA-I分子或者ApoA-I等价物)。在示例性实施方案中,组合物包含两种脂蛋白复合物群体,其分别为包含每个脂蛋白复合物具有2个ApoA-I分子或者ApoA-I等价物的脂蛋白复合物的第一群体,包含每个脂蛋白复合物具有3或者4个ApoA-I分子或者ApoA-I等价物的脂蛋白复合物的第二群体,以及任选地包含每个脂蛋白复合物具有4或者3个ApoA-I分子或者ApoA-I等价物的脂蛋白复合物的第三群体。
包含两种或者更多种脂蛋白复合物群体的组合物优选具有低水平的非复合的脂蛋白和/或者脂质。因此,组合物中优选不超过15%、不超过12%、不超过10%、不超过9%、不超过8%、不超过7%、不超过6%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的脂质为非复合形式和/或者组合物中不超过15%、不超过12%、不超过10%、不超过9%、不超过8%、不超过7%、不超过6%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的脂蛋白为非复合形式。
本公开提供了用于制备脂蛋白复合物的方法。所述方法特别基于这样的发现:使得含有非复合的脂质以及脂质-结合蛋白或者肽的混悬液经历热循环条件会导致脂蛋白复合物的形成,其具有相对于其它方法有利的结果,在所述其它方法中通过将成分在固定温度孵育来产生脂蛋白复合物。
本公开提供了用于制备脂蛋白复合物的热循环方法,诸如在段落6.5.1至6.5.4中所述。典型地,所述方法包括使得包含脂质颗粒(“脂质成分”)和脂质-结合蛋白或者肽(“蛋白成分”)的混悬液进行多个热循环,直到大部分蛋白成分掺入至脂蛋白复合物中。所述方法通常使得所述混悬液在第一较高温度范围内的温度以及第二较低温度范围内的温度之间的温度进行循环,直到形成脂蛋白复合物。所述热循环方法的所述高和低温度范围是基于脂蛋白复合物的脂质和蛋白成分的相转变温度。可选择地,当所述脂质成分不显示确定的或者离散的相转变时(这可在使用具有不饱和的脂肪酸链的磷脂或者磷脂混合物时发生),所述热循环的高和低温度范围的差别为至少约20℃,至多约40℃或者更大。例如,在一些实施方案中,所述低和高温度范围的差别为20℃-30℃、20℃-40℃、20℃-50℃、30℃-40℃、30℃-50℃、25℃-45℃、35℃-55℃。
对于脂质,所述相转变包括由已知为凝胶状态的紧密填充的有序的结构变化为已知为流体状态的松散填充的较无序的结构。脂蛋白复合物通常在本领域中通过以下方法来形成:将脂质颗粒和载脂蛋白在接近使用的具体脂质或者脂质混合物的转变温度进行孵育。所述脂质成分的相转变温度(其可由量热法确定)+/-12℃,更优选地+/-10℃表示本公开方法中的“低”温度范围。在某些实施方案中,所述低温度范围为所述脂质成分的相转变温度的+/-3℃、+/-5℃或者+/-8℃。在一个具体实施方案中,所述低温度范围为所述脂质成分的相转变温度的不小于-5℃或者不小于-10℃至+5℃。
对于蛋白,所述相转变温度涉及由三级结构变化为二级结构。所述蛋白成分的相转变温度+/-12℃,更优选+/-10℃表示本公开的方法中的“高”温度范围。在一些具体的实施方案中,所述高温度范围为所述蛋白成分的相转变温度的+/-3℃、+/-5℃或者+/-8℃。在一个具体实施方案中,所述低温度范围为所述蛋白成分的相转变温度的-10℃至不超过+5℃、不超过+10℃或者不超过+15℃。
所述起始混悬液(即并未进行热循环的混悬液)的脂质成分优选包含脂质颗粒,例如主要包含不与脂质-结合蛋白复合的脂质。所述脂质成分的组成通常描述于如下段落6.5.2。
所述起始混悬液的蛋白成分优选含有这样的脂质-结合肽和/或者蛋白,所述脂质-结合肽和/或者蛋白不与脂质复合,或者以与在预期复合物中的蛋白/肽与脂质的比相比大至少5-倍(例如至少5-倍、至少10-倍或者至少20-倍)的蛋白/肽与脂质的比与脂质组合。所述蛋白成分的组成通常描述于如下段落6.1和段落6.5.3。优选根据在段落6.1.2中所述的方法制备所述蛋白成分和/或者根据在段落6.1.3或者6.1.4中所述的方法纯化所述蛋白成分。
在本公开的方法中,将含有所述蛋白成分和脂质成分的混悬液通常在高温度范围和低温度范围之间(优选起始于在高温度范围中的温度)进行热循环,直到形成脂蛋白复合物。使用适当量的脂质和蛋白成分(例如如在美国专利公开2006-0217312A1中所述,将其内容通过引用的方式并入本申请),在若干循环之后可实现所述脂质和蛋白成分的基本完全复合。适于热循环方法的对于蛋白和脂质化学计量的进一步详述描述于段落6.5.4中。
由所述方法产生的复合物通常为超分子集合体,其形态为胶束、小泡、球状或者盘状颗粒,其中所述蛋白成分与所述脂质成分在具体的化学计量范围进行物理结合,其具有均匀的粒度分布。本公开的方法有利地导致所述在起始混悬液中的脂质和/或者蛋白基本上完全复合,这获得基本上不含游离脂质和/或者游离蛋白的组合物,如通过分离方法诸如色谱法所观察。因此,本公开的方法可在不存在纯化步骤的情况下进行。
在起始混悬液中的脂质成分通常为颗粒形式。优选的是所述颗粒的粒度主要为至少45nm、至少50nm、至少55nm或者至少60nm,其粒度范围为至多65nm、至多70nm、至多75nm、至多80nm、至多100nm、至多120nm、至多150nm、至多200nm、至多250nm、至多300nm、至多500nm,例如,45nm至100nm或者45nm至250nm,更优选50nm至90nm,且最优选55nm至75nm。在优选的实施方案中,所述脂质颗粒主要包含蛋-鞘磷脂且粒度为55nm至75nm。在另外优选的实施方案中,所述脂质颗粒主要包含一种或者多种合成鞘磷脂(例如棕榈酰鞘磷脂或者植物鞘磷脂)且粒度为175nm至250nm。在另外优选的实施方案中,所述脂质颗粒主要包含一种或者多种合成脂质(例如棕榈酰鞘磷脂或者植物鞘磷脂)且粒度为250nm至1000nm。在另外优选的实施方案中,所述脂质颗粒主要包含一种或者多种合成脂质(例如棕榈酰鞘磷脂或者植物鞘磷脂)且粒度为1000nm至4000nm。本申请所指的粒度为经动态光散射确定的ζ(Z)平均粒度。高压匀浆例如微流化(microfluidization)有利地产生具有适当粒度的脂质颗粒。用于形成颗粒的其它方法披露于如下段落6.5.2中,且可用作匀浆化的替代方法。如果所述方法产生不在优选的粒度范围内的颗粒,则所述颗粒可进行粒度滤过以获得具有适当粒度的颗粒。
本申请所述的制备脂蛋白复合物的方法有利地产生其粒度分布为均匀的复合物,这避免了对于粒度分级的需要。此外,本公开的方法导致将起始的蛋白基本上完全掺入(例如至少95%、至少96%、至少97%、至少98%或者至少99%)至脂蛋白颗粒中。因此,本公开提供了包含脂蛋白复合物的组合物,且其中在所述组合物中的至少95%、至少96%、至少97%、至少98%或者至少99%的脂质-结合蛋白与脂质复合,例如使用凝胶渗透色谱法所确定。在一些具体的实施方案中,本公开提供了包含脂蛋白复合物的组合物,所述脂蛋白复合物具有以下的ζ平均粒度:4nm至20nm,例如4nm至20nm、4nm至15nm、4nm至12nm、5nm至15nm、5nm至12nm、5nm至10nm、5nm至20nm、6nm至15nm或者8nm至12nm,且其中所述组合物中的至少95%、至少96%、至少97%、至少98%或者至少99%的脂质-结合蛋白与脂质复合,例如使用凝胶渗透色谱法所确定。根据本申请所述的方法使脂质颗粒与脂蛋白进行热循环通常导致具有以下粒度的脂蛋白颗粒群体:4nm至15nm,例如6nm至15nm、5nm至12nm或者8nm至12nm。进行热循环的所述脂质颗粒的粒度的范围可为50nm至250nm。在优选的实施方案中,所述脂质颗粒主要包含蛋-鞘磷脂且粒度为55至75nm。在另外优选的实施方案中,所述脂质颗粒主要包含一种或者多种合成鞘磷脂(例如植物鞘磷脂)且粒度为175nm至250nm。
在制备脂蛋白复合物的方法中的一个或者多个步骤可在惰性气体下进行。实施该步骤可降低或者防止载脂蛋白和/或者脂质的氧化,由此降低副作用诸如肝损伤的风险。适当的惰性气体包括氮气、氦气和氩气。
通过如上所述的方法获得的或者可获得的脂蛋白复合物特别适于治疗用途,这是因为在形成复合物后不需要进一步的纯化步骤。
本公开还提供了脂蛋白复合物群体和药物组合物,所述药物组合物包含本申请所述的脂蛋白复合物或者其群体,且可任选地包含一种或者多种药用载体、赋形剂和/或者稀释剂。在一些实施方案中,将所述药物组合物以适于给药的单位剂量进行包装。例如,在一些实施方案中,所述组合物包含在密封瓶中包装的单位剂量的干燥(例如低压冻干)的脂蛋白复合物。所述组合物适于用水、生理溶液(诸如盐水)或者缓冲剂重建,且经注射给药。所述组合物可任选地包含一种或者多种抗结块剂和/或者抗团聚剂以便于所述荷电复合物的重建,或者可包含设计用于调节所述重建混悬液的pH、渗透度和/或者盐度的一种或者多种缓冲剂、等渗剂(例如蔗糖和/或者甘露醇)、糖或者盐(例如氯化钠)。如上所述的脂蛋白复合物群体和/或者药物组合物可在使得氧化最小化的条件下制备,由此降低由氧化产物所引起的副作用诸如肝损伤的风险。例如,药物组合物可在惰性气体诸如氮气、氦气或者氩气下制备。
对于商业应用,有用的是进行脂蛋白复合物和药物组合物的大规格的制备。因此,本公开还提供了包含脂蛋白复合物的至少1L、2L、5L或者10L且至多15L、20L、30L、50L或者更大的制剂(例如5L至30L、10L至15L或者30L至50L的制剂),其量足以实现脂质-结合蛋白的以下浓度:至少约3mg/mL、至少约4mg/mL或者至少约5mg/mL,且至多约10mg/mL、约15mg/mL或者约20mg/mL,优选范围为约8mg/mL至约12mg/mL,最优选约8mg/mL。在一个具体的实施方案中,所述制剂具有15L至25L的体积且含有约100g至约250g的ApoA-I。在另外的具体实施方案中,所述制剂具有30L至50L的体积且含有约240g至约780g的ApoA-I。
本申请所述的脂蛋白复合物用于治疗动物最优选人类中的血脂异常障碍。所述病症包括但不限于高脂血症且特别是高胆固醇血症(包括杂合的和纯合的家族性高胆固醇血症),以及心血管疾病诸如动脉粥样硬化(包括治疗和预防动脉粥样硬化)和动脉粥样硬化的众多临床表现诸如中风、缺血性中风(ischemic stroke)、短暂性缺血发作、心肌梗塞、急性冠脉综合征(acute coronary syndrome)、心绞痛、间歇性跛行、严重肢体缺血(criticallimb ischemia)、心瓣狭窄(valve stenosis)和房脉瓣硬化(atrial valve sclerosis);再狭窄(例如预防或者治疗动脉粥样硬化斑块,其作为医学操作诸如气囊血管成形术的结果发展);以及其它病症诸如内毒素血症,其通常导致感染性休克。
已经发现,本申请所述的脂蛋白复合物和组合物当以低于迄今为止所研究的其它脂蛋白复合物所使用的剂量的剂量给药时影响和/或者促进胆固醇外流。参见例如Spiekeret al.,2002,Circulation 105:1399-1402(使用80mg/kg的剂量);Nissen et al.,2003,JAMA 290:2292-2300(使用15mg/kg或者40mg/kg的剂量);Tardif et al.,2007JAMA 297:1675-1682(使用40mg/kg至80mg/kg的剂量),使用范围为15mg/kg至80mg/kg的剂量。此外,已经发现本申请所述的脂蛋白复合物具有减少的副作用。如下在实施例中所显示,已经发现本公开的脂蛋白复合物在低至2mg/kg的剂量有效地动员胆固醇,相反地先前给予人类患者的脂蛋白复合物不显著地提升甘油三酯、VLDL和肝酶诸如转氨酶的水平(c.f.,Nanjeeet al.,1999,Arterioscler.Vasc.Throm.Biol.19:979-89)。此外,在具有正常肝和/或者肾功能的正常受试者中,即使当剂量增至约15mg/kg(缺乏甘油三酯升高)或者高达45mg/kg(缺乏转氨酶增加)时也观察到减少的副作用。因此,本公开复合物的在给药时不产生副作用的能力优选在具有正常肝功能、正常肾功能或者正常肝功能和正常肾功能的个体中进行评估。
在不被理论所束缚的情况下,发明人将本公开脂蛋白复合物的益处归因于相比于先前治疗而言复合物的更均匀的粒度分布以及损伤的蛋白和/或者脂质(例如氧化的蛋白、被脱去酰胺的蛋白以及氧化的脂质)的降低的量。进一步认为包含负电荷磷脂的所述脂质部分将使得本申请所述的复合物和组合物相比于常规脂蛋白复合物而言具有改善的治疗性质。在小盘状前-βHDL颗粒(其在肾中降解)和大盘状和/或者球状HDL(其被肝识别,在所述肝中,它们的胆固醇被储存、再循环、代谢(作为胆汁酸)或者清除(在胆汁中))之间的关键差异中的一种是颗粒的电荷。相比于荷负电的大盘状和/或者球状HDL颗粒而言,所述小盘状前-βHDL颗粒具有较小的表面负电荷。认为较大的负电荷是引起所述颗粒被肝识别且因此避免所述颗粒被肾分解代谢的因素中的一种。此外,已经显示肾不能容易地吸收荷电颗粒(参见Hacker et al.,2009,Pharmacology:Principles and Practice,183)。因此,部分由于存在荷电磷脂,认为本申请所述的荷负电的脂蛋白复合物和组合物相比于常规脂蛋白复合物而言在循环中停留更长,或者电荷将以电荷依赖性方式影响所述脂蛋白的半衰期。预期的是,它们的较长的循环(停留)时间以及所述复合物与存在的HDL的凝聚和融合的比率和/或者程度的降低(作为荷负电的结果)的结合将促进胆固醇动员(通过给予所述复合物更多的蓄积胆固醇的时间)和酯化(通过提供更多的LCAT催化酯化反应的时间)。所述电荷也可增加胆固醇捕获和/或者除去的比率,由此促进更大量的胆固醇的除去。因此,预期的是本申请所述的荷负电的脂蛋白复合物和组合物将提供优于常规脂蛋白疗法的治疗益处,这是因为需要给予的复合物和/或者组合物较少,且通常在较少地给予时,副作用降低。
因此,本申请提供的方法通常包括向受试者给予治疗有效量的本申请所述的脂蛋白复合物、脂蛋白复合物的群体或者药物组合物以治疗或者预防血脂异常障碍。所述脂蛋白复合物每次注射可以以下剂量来给予:范围为约0.25mg/kg ApoA-I等价物至约45mg/kg,例如约0.5mg/kg至约30mg/kg或者约1mg/kg ApoA-I等价物至最多约15mg/kg ApoA-I等价物。通过选择使得甘油三酯、VLDL-胆固醇和/或者VLDL-甘油三酯水平增加最小化的剂量,所述剂量可进一步针对待治疗的个体来制定。在一些具体的实施方案中,所述剂量为约3mg/kg、约6mg/kg或者约12mg/kg。
所述方法进一步包括以如下间隔来给予所述脂蛋白复合物:间隔范围为5至14天,或者6至12天,诸如一周或者两周。所述方法可进一步包括以如上所述的任意间隔且优选为一周的间隔给予所述脂蛋白复合物4、5、6、7、8、9、10、11、12或者至多52次。例如,在一个实施方案中,给予所述脂蛋白复合物六次,在每次给药之间的间隔为1周。对于慢性病症,可进行多于52次给药。任选地,所述方法可由初始诱导期来开始,其中更频繁地给予所述脂蛋白复合物。
复合物和/或者其药物组合物可经肠胃外给药,例如静脉内给药。静脉内给药可作为历时范围为约1至约24小时或者约1至4小时、约0.5至2小时或者约1小时的时间的输注来完成。
如下实施例显示在以30mg/kg和45mg/kg的剂量给药后甘油三酯水平少量增加,这可解释为由高程度的胆固醇动员所导致的VLDL和LDL的增加。可在治疗过程中控制这些参数,这是因为它们可在医院实验室中使用标准脂质表盘来进行常规测量。基于如下实施例,可实现剂量选择以使得甘油三酯和VLDL-胆固醇和VLDL-甘油三酯水平的增加最小化,这取决于患者对药物的反应,其允许个体化类型药物。
所述复合物和/或者组合物可单独给药(作为单一疗法),或者可选择地,它们可与用于治疗和/或者预防血脂异常和/或者与其相关的病症、疾病和/或者障碍的其它治疗剂一起给药。可与本申请所述的荷负电的脂蛋白复合物和组合物一起给药的所述治疗剂的非限制性实例包括胆汁酸结合树脂、HMG CoA还原酶抑制剂(他汀类药物)、烟酸、树脂、胆固醇吸收抑制剂、血小板聚集抑制剂、贝特类药物、抗凝血剂、CETP抑制剂(例如安塞曲匹和达塞曲匹)和/或者PCSKG抗体或者配体。
5.附图说明
图1:人前原-载脂蛋白A-I的氨基酸序列(SEQ ID NO:1;GenBank登记号AAB59514.1)。粗体字体的氨基酸1-18相应于ApoA-I的信号序列,且下划线标记的氨基酸19-24相应于前肽序列。信号序列和前肽序列均在细胞中断开以产生全长成熟人ApoA-I(氨基酸25-267)。
图2:在表达ApoA-I的重组S-CHO细胞的12天加料分批培养物中的ApoA-I滴定。通过由第0代向第43代的连续传代将细胞连续培养。在第4、8、14、19、25、21、36和43代通过反相HPLC来监测ApoA-I产生。ApoA-I在培养基中的量在1259mg/L至1400mg/L变化。
图3A-3B:图3A显示在表达ApoA-I的重组S-CHO细胞的200L 13天培养物中的存活细胞密度。在第9天观察到存活细胞密度的最大值33.20x105个细胞/mL,存活率为92.5%。图3B显示在13天培养中ApoA-I在培养基中的浓度。在第12天观察到ApoA-I在培养基中的浓度的最大值,约为2mg/mL。
图4:通过本申请所述的方法纯化的ApoA-I的SDS聚丙烯酰胺凝胶。左侧泳道显示分子量标记。右侧泳道显示具有约28kD的分子量的纯化的ApoA-I。
图5A-5D:蛋白:脂质重量比为1:2.5(式A;图5A)、1:2.7(式B;图5B)、1:3.1(式C;图5C)的原ApoA-I/SM复合物的HPLC色谱图以及蛋白:脂质重量比为1:2.7(式D;图5D)的原ApoA-I/SM/DPPC复合物的HPLC色谱图。
图6A-6D:分别在10、20、30和60分钟的式D的脂蛋白复合物的HPLC色谱图。
图7A-7D:分别在10、20、30和50分钟的式B的脂蛋白复合物的HPLC色谱图。
图8A-8D:分别在20、40、60和120分钟的式F的脂蛋白复合物的HPLC色谱图。
图9:随时间推移前-βHDL复合物的形成的图表,其示例说明了具有1:2.7的脂蛋白:总磷脂的wt:wt比的脂蛋白复合物的形成,包括原ApoA-I和SM(式B);原ApoA-I、SM、DPPC和DPPG,其中SM:DPPC:DPPG wt:wt比为48:48:4(式F);以及原ApoA-I、SM、DPPC和DPPG,其中SM:DPPC:DPPG wt:wt比为73:23:4(式G)。
图10A-10D:式E、H、I和J各自的HPLC色谱图。
图11:制备脂蛋白复合物的示例性方法的示意图。
图12:针对非商业规格热循环运行所使用的示例性热循环装置。
图13A-13E:具有增加数目的热循环的SM/DPPG/ApoA-I蛋白复合物的凝胶渗透色谱。使所述成分在57℃和37℃之间进行热循环,在每个温度进行5分钟,总计30分钟(图13A)、60分钟(图13B)、120分钟(图13C)、180分钟(图13D)或者210分钟(图13E)。
图14:SM/ApoA-I复合物的凝胶渗透色谱。
图15:N-棕榈酰-4-羟基二氢鞘氨醇-1-磷酸胆碱(植物SM或者植物鞘磷脂的一种形式)/DPPG/ApoA-I复合物的凝胶渗透色谱。
图16:合成棕榈酰SM/DPPG/ApoA-I复合物的凝胶渗透色谱。
图17:植物鞘磷脂/DPPG/ApoA-I复合物的凝胶渗透色谱。
图18:SM/DPPC/DPPG/ApoA-I肽复合物的凝胶渗透色谱。
图19A-19D:使用Malvern Instruments Zetasizer(Malvern Instruments Inc.)通过动态光散射系统表征脂质颗粒。在图19A中,所述Z平均值为84.49nm(“84nm颗粒”);在图19B中,所述Z平均值为76.76nm(“77nm颗粒”);在图19C中,所述Z平均值为66.21nm(“66nm颗粒”);以及在图19D中,所述Z平均值为59.50nm(“60nm颗粒”)。
图20A-20D:具有84nm(图20A)、77nm(图20B)、66nm(图20C)和60nm(图20D)的脂质颗粒的复合物在五次热循环后的凝胶渗透色谱图。
图21A-21B:用450nm(图21A)和40nm(图21B)的脂质颗粒开始的复合物在六次热循环后的凝胶渗透色谱图。
图22:用65nm的脂质颗粒开始的复合物在六次热循环后的凝胶渗透色谱,其中第一循环起始于37℃的“低温度”。
图23:制备包含脂蛋白复合物的药物组合物的示例性实施方案的示意图,其包括将经本公开方法产生的脂蛋白复合物配制为商业上有效的药物组合物。
图24:在输注式B和式H的脂蛋白复合物后血浆VLDL-总胆固醇水平的增加。以5mg/kg的剂量将式H(■)和式B(▼)的脂蛋白复合物输注至禁食的兔子。减去三组的范围为0.03至0.3g/L的基线值以确定血浆VLDL-总胆固醇水平的增加。
图25:在输注式B和式H的脂蛋白复合物后血浆甘油三酯水平的增加。以5mg/kg的剂量将式H(■)和式B(▲)的脂蛋白复合物输注至禁食的兔子。减去三组的范围为0.31至0.71g/L的基线值以确定血浆甘油三酯水平的增加。
图26A-26D:相比于稀释剂(■),在兔子中输注5mg/kg或者20mg/kg以及20mg/kg的ApoA-I/蛋SM复合物(●,▲)或者ApoA-I/合成SM复合物(◆,▼)后血浆总胆固醇(图26A)、甘油三酯(图26B)、磷脂(图26C)和ApoA-I(图26D)的增加。对于不同血浆脂质所测量的基线值的范围如下:对于血浆胆固醇,0.28至0.4g/L;对于血浆甘油三酯,0.23至0.29g/L;且对于血浆磷脂,0.45至0.61g/L。
图27A-27C:相比于稀释剂(■),在兔子中输注5mg/kg ApoA-I/蛋SM复合物(●)以及ApoA-I/合成SM复合物(◆)后血浆HDL-总胆固醇(图27A)、LDL-总胆固醇(图27B)和VLDL-总胆固醇(图27C)的增加。基线值的范围如下:对于血浆HDL–总胆固醇,0.20至0.31g/L;对于血浆LDL-总胆固醇,0.06至0.09g/L;以及对于血浆VLDL-总胆固醇,0.007至0.011g/L。
6.具体实施方式
本公开提供了脂蛋白复合物、其群体以及制备所述脂蛋白复合物的方法。所述复合物以及其群体和组合物(例如药物组合物)用于治疗和/或者预防血脂异常和/或者与血脂异常相关的疾病、障碍和/或者病症。如在发明内容章节中所讨论的,所述脂蛋白复合物包含优选已确定重量或者摩尔比的两个主要部分,即载脂蛋白部分和磷脂部分,且优选包含特定量的中性磷脂以及任选的一种或者多种负电荷磷脂。
6.1.蛋白部分
本公开提供了包含蛋白部分的脂蛋白复合物。本公开进一步提供了制备脂蛋白复合物的方法。所述脂蛋白复合物的蛋白成分对于本发明方法的成功而言不是关键的。事实上,任何提供治疗和/或预防益处的脂质-结合蛋白诸如载脂蛋白和/或其衍生物或类似物均可包括在该复合物中。此外,由于在与脂质缔合时可活化LCAT或者形成盘状颗粒而“模拟”载脂蛋白(例如ApoA-I)活性的任何α-螺旋肽或肽类似物或任何其它类型的分子可包含在脂蛋白复合物中,并且涵盖在术语“脂质-结合蛋白”内。
6.1.1.脂质结合蛋白
本公开进一步提供了纯化重组产生的蛋白的方法,所述重组产生的蛋白例如用于制备脂蛋白复合物。所述重组产生的蛋白最适当地为载脂蛋白。适当的蛋白包括载脂蛋白ApoA-I、ApoA-II、ApoA-IV、ApoA-V和ApoE;优选为成熟形式。脂质-结合蛋白也包括前述载脂蛋白的活性多晶型、同等型、变体和突变体以及截短形式,其中最常见的为载脂蛋白A-I米兰(ApoA-IM)、载脂蛋白A-I巴黎(ApoA-IP)和载脂蛋白A-I萨拉戈萨(ApoA-IZ)。含有半胱氨酸残基的载脂蛋白突变体也是已知的,且也可使用(参见例如美国公开2003/0181372)。载脂蛋白可以是单体或二聚体形式,而所述二聚体可以为同源二聚体或异源二聚体。例如,可使用ApoA-I(Duverger et al.,1996,Arterioscler.Thromb.Vasc.Biol.16(12):1424-29)、ApoA-IM(Franceschini et al.,1985,J.Biol.Chem.260:1632-35)、ApoA-IP(Daum et al.,1999,J.Mol.Med.77:614-22)、ApoA-II(Shelness et al.,1985,J.Biol.Chem.260(14):8637-46;Shelness et al.,1984,J.Biol.Chem.259(15):9929-35)、ApoA-IV(Duverger etal.,1991,Euro.J.Biochem.201(2):373-83)、ApoE(McLean et al.,1983,J.Biol.Chem.258(14):8993-9000)、ApoJ和ApoH的同源二聚体和异源二聚体(在可行的情况下)。所述载脂蛋白可以包括与促进其分离的元件(比如His标签)或经设计用于其它目的的其它元件相应的残基,只要当该载脂蛋白包含在复合物中时能够保留一些生物活性即可。
如本领域所公知的,所述载脂蛋白可以由动物来源进行纯化(特别是由人类来源)或者进行重组生产,参见例如Chung et al.,1980,J.Lipid Res.21(3):284-91;Cheung etal.,1987,J.Lipid Res.28(8):913-29。也参见美国专利5,059,528、5,128,318、6,617,134;美国公开20002/0156007、2004/0067873、2004/0077541和2004/0266660;以及PCT公开WO/2008/104890和WO/2007/023476。纯化的其它方法也是可能的,例如如下在章节6.1.3和6.1.4中所述。
适合作为载脂蛋白用于本申请所述的复合物及组合物中的、与载脂蛋白相应的肽和肽类似物以及模拟ApoA-I、ApoA-IM、ApoA-II、ApoA-IV和Apo-E活性的激动剂的非限制性实例在以下文献中公开:美国专利6,004,925、6,037,323和6,046,166(授予Dasseux etal.)、美国专利5,840,688(授予Tso)、美国公开2004/0266671、2004/0254120、2003/0171277和2003/0045460(Fogelman的)、美国公开2003/0087819(Bielicki的)以及PCT公开WO/2010/093918(Dasseux et al.的),将它们的内容通过引用的方式并入本申请。这些肽和肽类似物可包括L-氨基酸或者D-氨基酸或者L-和D-氨基酸的混合物。它们也可包括一种或者多种非肽或酰胺键,诸如一种或多种公知的肽/酰胺等排物。可以使用本领域已知的任何肽合成技术来合成或制备所述“肽和/或肽模拟物”载脂蛋白,所述肽合成技术包括,如美国专利6,004,925、6,037,323和6,046,166中描述的技术。
所述复合物可包括单一类型的脂质-结合蛋白,或者两种或者更多种不同的脂质-结合蛋白的混合物,其可以源自相同或不同的物种。尽管不必需,但是所述脂蛋白复合物仍优选包含源自受治疗动物物种的脂质-结合蛋白或者氨基酸序列与受治疗动物物种相对应的脂质-结合蛋白,以避免诱导对治疗的免疫应答。因此,对于人类患者的治疗,人源的脂质-结合蛋白优选用于本公开的复合物中。肽模拟物载脂蛋白的使用也可降低或避免产生免疫应答。
在某些优选的实施方案中,所述脂质-结合蛋白为具有与成熟人ApoA-I蛋白至少95%序列同一性的氨基酸序列的蛋白,例如具有相应于SEQ ID NO:1的位置25-267的氨基酸序列的蛋白。在某些实施方案中,所述成熟人ApoA-I蛋白具有与SEQ ID NO:1的位置25-267至少96%、至少97%、至少98%或者至少99%序列同一性的氨基酸序列。在一些实施方案中,所述成熟人ApoA-I蛋白具有在位置1(即相应于SEQ ID NO:1的位置25的位置)上具有门冬氨酸的氨基酸序列。在一个具体的实施方案中,所述成熟人ApoA-I蛋白具有相应于SEQID NO:1的位置25-267的氨基酸序列。在一个优选的实施方案中,所述ApoA-I蛋白在哺乳动物宿主细胞最优选为中国仓鼠卵巢(“CHO”)细胞中重组产生,如在下述小章节中所述。
6.1.2.载脂蛋白的重组表达
本公开提供了用于产生脂质结合蛋白诸如ApoA-I的重组表达方法,以及相关的核酸、哺乳动物宿主细胞、细胞培养物。如本申请所述,可将所得的重组脂质结合蛋白纯化和/或者掺入脂蛋白复合物。
一般而言,对于重组产生,将编码脂质-结合蛋白或者肽的多核苷酸序列插入适当的表达媒介物中,所述媒介物即为含有所插入的编码序列的转录和翻译所必需元件的载体,或者在RNA病毒载体的情况下,其为复制和翻译所必需的元件。所述表达载体可衍生自病毒诸如腺病毒、腺伴随病毒、疱疹病毒、逆转录病毒或者慢病毒。然后将表达媒介物转染至适当靶标细胞,该细胞表达蛋白或者肽。适当的宿主细胞包括但不限于细菌类、哺乳动物或者昆虫宿主细胞系统,包括杆状病毒系统(参见例如Luckow et al.,Bio/Technology,6,47(1988))以及确立的细胞系诸如293、COS-7、C127、3T3、CHO、HeLa、BHK等。取决于所使用的表达系统,然后将所表达的肽通过本领域熟知的操作分离。重组蛋白和肽产生的方法为本领域熟知的(参见,例如Sambrook et al.,1989,Molecular Cloning A LaboratoryManual,Cold Spring Harbor Laboratory,N.Y.;以及Ausubel et al.,1989,CurrentProtocols in Molecular Biology,Greene Publishing Associates and WileyInterscience,N.Y.,将其各自的内容通过引用的方式并入本申请)。
当ApoA-I为脂质结合蛋白时,ApoA-I蛋白由编码ApoA-I的重组核苷酸序列表达。在一些实施方案中,编码ApoA-I的核苷酸序列来自人类。人ApoA-I核苷酸序列的非限制性实例披露于美国专利5,876,968;5,643,757;和5,990,081以及WO 96/37608;将其各自的内容通过引用的方式并入本申请。在某些实施方案中,所述核苷酸序列编码成熟ApoA-I蛋白的氨基酸序列,其优选可操作地连接至用于从宿主细胞分泌ApoA-I的信号序列(例如SEQID NO:1的氨基酸1-18)和/或者前蛋白序列(例如SEQ ID NO:1的氨基酸19-25)。适用于定向分泌ApoA-I的其它信号序列可对于ApoA-I例如人白蛋白信号肽或者人IL-2信号肽是异源性的,或者对于ApoA-I是同源性的。
优选地,所述核苷酸序列编码成熟人ApoA-I多肽,例如具有与相应于SEQ ID NO:1的位置25-267的氨基酸序列至少95%、至少96%、至少97%、至少98%或者至少99%相同的氨基酸序列的多肽,任选地其中所述氨基酸序列在位置25包含门冬氨酸。在优选的实施方案中,所述核苷酸序列编码具有SEQ ID NO:1的氨基酸序列的多肽。所述核苷酸序列也可编码具有与人ApoA-I蛋白的氨基酸序列至少95%、至少96%、至少97%、至少98%或者至少99%相同的氨基酸序列的多肽,所述人ApoA-I蛋白的氨基酸序列阐述于GenBank登记号NP_000030、AAB59514、P02647、CAA30377、AAA51746或者AAH05380.1中的一种,其任选地在相应于成熟人ApoA-I蛋白的第一氨基酸的位置包含门冬氨酸。
所述ApoA-I编码多核苷酸可为针对在重组宿主细胞中表达所优化的密码子。优选的宿主细胞为哺乳动物宿主细胞,包括但不限于中国仓鼠卵巢细胞(例如CHO-K1;ATCCNo.CCL 61;CHO-S(GIBCO Life Technologies Inc.,Rockville,MD,目录#11619012))、VERO细胞、BHK(ATCC No.CRL 1632)、BHK 570(ATCC No.CRL 10314)、HeLa细胞、COS-1(ATCCNo.CRL 1650)、COS-7(ATCC No.CRL 1651)、MDCK细胞、293细胞(ATCC No.CRL 1573;Grahamet al.,J.Gen.Virol.36:59-72,1977)、3T3细胞、骨髓瘤细胞(特别是鼠类)、PC12细胞和W138细胞。在某些实施方案中,所述哺乳动物细胞诸如CHO-S细胞(InvitrogenTM,CarlsbadCA)适于在无血清培养基中生长。另外适当的细胞系为本领域已知的且获自公共储藏室诸如American Type Culture Collection,Manassas,Va。
对于ApoA-I的重组表达,编码ApoA-I的多核苷酸可操作地连接至一个或者多个控制序列例如启动子或者终止子,其调节ApoA-I在感兴趣的宿主细胞中的表达。所述一个或者多个控制序列可对于ApoA-I-编码序列而言是天然的或者外源的,且也对于其中表达ApoA-I的宿主细胞而言是天然的或者外源的。控制序列包括但不限于启动子、核糖体结合位点、先导序列、多腺苷酸化序列、前肽序列、信号肽序列和转录终止子。在一些实施方案中,所述控制序列包括启动子、核糖体结合位点以及转录和翻译终止信号。所述控制序列也可包括用于引入特定限制位点的目的的一种或者多种衔接物,这促进所述控制序列与编码ApoA-I的核苷酸序列的编码区的连接。
驱动ApoA-I的重组表达的启动子可为构成性启动子、调节性启动子或者诱导性启动子。适当的启动子序列可获自编码细胞外或者细胞内多肽的基因,其对于宿主细胞而言是内源性或者异源性的。用于具有可变长度的启动子的分离、鉴别和处理的方法可在本领域中获得或者可从本领域容易地修改。参见例如Nevoigt et al.(2006)Appl.Environ.Microbiol.72:5266-5273,将其内容通过引用的方式并入本申请。
一种或者多种控制序列可衍生自病毒来源。例如,在某些方面,启动子衍生自多瘤或者腺病毒主要后期启动子。在其它方面,所述启动子衍生自猿猴病毒40(SV40),其可作为还含有SV40病毒复制起始区的片段来获得(Fiers et al.,1978,Nature,273:113-120)或者来自巨细胞病毒例如猿猴巨细胞病毒立即早期启动子(参见美国专利4,956,288)。其它适当的启动子包括来自金属硫蛋白基因的那些(参见美国专利4,579,821和4,601,978)。
本申请还提供了重组ApoA-I表达载体。重组表达载体可为可通过重组DNA技术来处理以便于异源性ApoA-I在重组宿主细胞中的表达的任何载体,例如质粒或者病毒。可将所述表达载体整合至重组宿主细胞的染色体中且其包含一种或者多种可操作地连接至一种或者多种用于产生ApoA-I的控制序列的异源性基因。在其它实施方案中,所述表达载体为染色体外复制的DNA分子,例如线性或者闭合的环状质粒,发现其具有低拷贝数(例如约1至约10个拷贝/基因组当量)或者高拷贝数(例如多于约10个拷贝/基因组当量)。在多个实施方案中,所述表达载体包括可选标记,诸如使得包含所述载体的重组宿主有机体具有抗菌素抗性(例如氨苄西林、卡那霉素、氯霉素或者四环素抗药性)的基因。在具体的方面,所述DNA构成物、载体和多核苷酸适于ApoA-I在哺乳动物细胞中的表达。用于ApoA-I在哺乳动物细胞中的表达的载体可包含与宿主细胞系统相容的复制起始区、启动子以及任何必需的核糖体结合位点、RNA剪接位点、多腺苷酸化位点和转录终止子序列。在某些方面,所述复制起始区对于宿主细胞是异源性的,例如其为病毒来源(例如SV40、Polyoma、Adeno、VSV、BPV)。在其它方面,复制起始区通过宿主细胞染色体复制机制来提供。
用于将外源DNA引入至哺乳动物宿主细胞中的方法、试剂和工具为本领域已知的且包括但不限于磷酸钙-介导的转染(Wigler et al.,1978,Cell 14:725;Corsaro etal.,1981,Somatic Cell Genetics 7:603;Graham et al.,1973,Virology 52:456)、电穿孔(Neumann et al.,1982,EMBO J.1:841-5)、DEAE-葡聚糖介导的转染(Ausubel et al.(eds.),Short Protocols in Molecular Biology,3rd Edition(John Wiley&Sons1995))和脂质体介导的转染(Hawley-Nelson et al.,1993,Focus 15:73;Ciccarone etal.,1993,Focus 15:80)。
对于高产率的生产,ApoA-I的稳定表达是优选的。例如,在将外源DNA引入至宿主细胞之后,所述宿主细胞可在富集培养基中生长1-2天,然后将其更换至选择性培养基中。并非使用含有病毒复制起始区的表达载体,宿主细胞可使用具有包含ApoA-I-编码序列的核苷酸序列的载体进行转化,其通过适当的表达控制元件和可选标记来控制。所述载体中的可选标记赋予对选择的抗性且允许细胞稳定地将载体整合至它们的染色体中且生长以形成集落(foci),所述集落继而可被克隆且扩大至细胞系中。可使用众多选择系统,包括但不限于可分别在tk-、hgprt-或者aprt-细胞中采用的单纯疱疹病毒胸苷激酶(Wigler etal.,1977,Cell 11:223)、次黄嘌呤鸟嘌呤磷酸核糖转移酶(Szybalska&Szybalski,1962,Proc.Natl.Acad.Sci.USA 48:2026)和腺嘌呤磷酸核糖转移酶(Lowy et al.,1980,Cell22:817)基因。同样地,抗代谢药物抗性可用作选择基础,其通过使用例如,dhfr,其赋予对甲氨蝶呤的抗性(Wigler et al.,1980,Natl.Acad.Sci.USA 77:3567;O’Hare et al.,1981,Proc.Natl.Acad.Sci.USA 78:1527);gpt,其赋予对麦考酚酸的抗性(Mulligan&Berg,1981,Proc.Natl.Acad.Sci.USA 78:2072);neo,其赋予对氨基糖苷G-418的抗性(Colberre-Garapin et al.,1981,J.Mol.Biol.150:1);和/或者hyg,其赋予对潮霉素的抗性(Santerre et al.,1984,Gene 30:147)。
稳定的高产率的表达也可通过使用整合至宿主细胞基因组的逆转录病毒载体来实现(参见,例如美国专利公开2008/0286779和2004/0235173)。可选择地,ApoA-I的稳定的高产率的表达可通过基因激活方法来实现,其引起在所选的哺乳动物细胞的基因组DNA中的内源性ApoA-I基因的激活表达且将其扩增,例如在WO 1994/012650中所述。增加ApoA-I基因(含有ApoA-I编码序列和一种或者多种控制元件)的拷贝数可促进ApoA-I的高产率表达。优选地,其中表达ApoA-I的哺乳动物宿主细胞具有至少2、至少3、至少4或者至少5的ApoA-I基因拷贝指数。在一些具体的实施方案中,其中表达ApoA-I的哺乳动物宿主细胞具有至少6、至少7、至少8、至少9或者至少10的ApoA-I基因拷贝指数。
在某些实施方案中,所述哺乳动物细胞适于产生至少0.5g/L、至少1g/L、至少1.5g/L、至少2g/L、至少2.5g/L、至少3g/L、至少3.5g/L且任选地至多4g/L、至多4.5g/L、至多5g/L、至多5.5g/L或者至多6g/L的量的ApoA-I。所述哺乳动物宿主细胞优选能够在培养物中产生至少约0.5、1、2或者3g/L的ApoA-I和/或者在培养物中产生至多约20g/L的ApoA-I,例如在培养物中产生至多4、5、6、7、8、9、10、12或者15g/L的ApoA-I。
在某些实施方案中,所述哺乳动物细胞适于在无血清培养基中生长。在这些实施方案中,所述ApoA-I由所述细胞分泌。在其它实施方案中,所述ApoA-I不由所述细胞分泌。
本申请提供的哺乳动物宿主细胞可用于产生ApoA-I。一般而言,所述方法包括在表达ApoA-I的条件下培养本申请所述的哺乳动物宿主细胞。此外,所述方法可包括由所述哺乳动物细胞培养物的上清液回收且任选纯化成熟ApoA-I。
所述培养条件(包括培养基、温度、pH)可适合待培养的哺乳动物宿主细胞以及所选的培养方式(摇瓶、生物反应器、滚瓶等)。哺乳动物细胞可以在大规模分批培养物、连续培养物或者半连续培养物中生长。
本申请还提供了哺乳动物细胞培养物,其包含多个本申请所述的ApoA-I-产生的哺乳动物宿主细胞。在一些实施方案中,所述哺乳动物细胞培养物包括至少0.5g/L、至少1g/L、至少1.5g/L、至少2g/L、至少2.5g/L、至少3g/L、至少3.5g/L且任选地至多4g/L、至多4.5g/L、至多5g/L、至多5.5g/L或者至多6g/L的ApoA-I。所述培养物可为任何规模,其范围为约150mL至约500mL、1L、10L、15L、50L、100L、200L、250L、300L、350L、400L、500L、750L、1000L、1500L、2000L、2500L、3000L、5000L、7500L、10000L、15000L、20000L、25000L、50000L或者更大。在一些情况下,所述培养物为大规模培养物,诸如15L、20L、25L、30L、50L、100L、200L、300L、500L、1000L、5000L、10000L、15000L、20000L、25000L、至多50000L或者更大。
6.1.3.载脂蛋白的纯化
本公开涉及获得高度纯化的载脂蛋白的方法,其用于制备本申请所述的脂蛋白复合物及其组合物。所述方法可应用于任何载脂蛋白,包括但不限于ApoA-I、-II、-III或者–IV;ApoB48和ApoB100;ApoC-I、-II、-III或者–IV;ApoD;ApoE、ApoH;ApoJ。更具体地,本公开涉及获得高度纯化的ApoA-I的方法。在一些实施方案中,所述ApoA-I为具有选自(但不限于)下述序列的人蛋白:在Genbank登记号NP_000030、AAB59514、P02647、CAA30377、AAA51746和AAH05380.1中阐述的序列。在某些实施方案中,所述ApoA-I为如上在段落6.1.2中所述的人蛋白。在其它实施方案中,本公开的方法可用于纯化由非人动物(参见,例如美国公开2004/0077541)例如,牛、马、羊、猴、狒狒、山羊、兔、狗、刺猬、獾、小鼠、大鼠、猫、豚鼠、仑鼠、鸭、鸡、鲑鱼和鳗鱼获得的ApoA-I(Brouillette et al.,2001,Biochim.Biophys.Acta.1531:4-46;Yu et al.,1991,Cell Struct.Funct.16(4):347-55;Chen and Albers,1983,Biochim Biophys Acta.753(1):40-6;Luo et al.,1989,J LipidRes.30(11):1735-46;Blaton et al.,1977,Biochemistry 16:2157-63;Sparrow et al.,1995,J Lipid Res.36(3):485-95;Beaubatie et al.,1986,J.Lipid Res.27:140-49;Januzzi et al.,1992,Genomics 14(4):1081-8;Goulinet and Chapman,1993,J.LipidRes.34(6):943-59;Collet et al.,1997,J Lipid Res.38(4):634-44;以及Frank andMarcel,2000,J.Lipid Res.41(6):853-72)。
可通过本申请披露的方法纯化的ApoA-I蛋白的实例包括但不限于前原载脂蛋白形式的ApoA-I、原形式和成熟形式的ApoA-I,以及活化的多晶型、同等型、变体和突变体以及截短形式,例如ApoA-IM、ApoA-IZ和ApoA-IP。ApoA-IM为ApoA-I的R173C分子变体(参见,例如Parolini et al.,2003,J Biol Chem.278(7):4740-6;Calabresi et al.,1999,Biochemistry 38:16307-14;以及Calabresi et al.,1997,Biochemistry 36:12428-33)。ApoA-IP为ApoA-I的R151C分子变体(参见,例如Daum et al.,1999,J Mol Med.77(8):614-22)。ApoA-IZ为ApoA-I的L144R分子变体(参见Recalde et al.,2001,Atherosclerosis154(3):613-623;Fiddyment et al.,2011,Protein Expr.Purif.80(1):110-116)。含有半胱氨酸残基的载脂蛋白A-I突变体也是已知的,并且也可通过本申请所述的方法纯化(参见,例如美国公开2003/0181372)。用于本申请所述的方法的ApoA-I可为单体、同源二聚体或异源二聚体。例如,可制备的原-ApoA-I和成熟ApoA-I的同源二聚体和异源二聚体包括ApoA-I(Duverger et al.,1996,Arterioscler Thromb Vasc Biol.16(12):1424-29)、ApoA-IM(Franceschini et al.,1985,J Biol Chem.260:1632-35)和ApoA-IP(Daum et al.,1999,J Mol Med.77:614-22)等。
本申请所述的纯化方法可以适于本领域从业者的任何规模来进行。
在某些方面,可通过本申请所述的方法纯化的ApoA-I蛋白具有与SEQ ID NO:1的氨基酸25-267至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或者至少100%相同的氨基酸序列。
载脂蛋白可来自任何来源,包括血液血浆或者原核细胞或者真核细胞的重组表达。在一些具体的实施方案中,所述载脂蛋白为ApoA-I,例如人ApoA-I。在某些方面,所述ApoA-I在原核或者真核宿主细胞的细胞质或者周质中表达。在这些实施方案中,在纯化ApoA-I前,将所述细胞破裂以将ApoA-I释放至上清液。细胞破裂方法为本领域熟知的。使细胞破裂的示例性方法包括但不限于酶方法、声裂法、洗涤剂方法和机械法。在某些优选的方面,ApoA-I在哺乳动物细胞优选CHO细胞中表达,且分泌至生长培养基。在这些实施方案中,ApoA-I由澄清的无细胞培养基纯化。应该理解的是,尽管所述纯化方法在本申请中与人ApoA-I结合来更详细地描述,但是本领域技术人员能够使得所述纯化条件适于其它载脂蛋白以及非人ApoA-I;ApoA-I或者其它载脂蛋白的多晶型、同等型、变体和突变体以及截短形式,这取决于可由本领域技术人员容易确定的特定蛋白特征(例如分子量、等电点、斯托克斯半径、疏水性、多聚体状态等)。
当ApoA-I由血浆制备时,其可通过任何已知的方法包括但不限于冷分级分离方法由血浆分离,诸如描述于Cohn et al.,1946,J.Am.Chem.Soc.68:459-475(“Cohn方法”)或者Oncley et al.,1949,J.Am.Chem.Soc.71:541-550(“Cohn-Oncley方法”)。用于由血浆分离载脂蛋白的其它方法包括Cohn和Cohn-Oncley方法的变化形式,诸如Kistler-Nitschmann方法(参见Nitschmann et al.,1954,Helv.Chim.Acta 37:866-873;Kistleret al.,1962,Vox Sang.7:414-424)。
在这些实施方案中,载脂蛋白通过由血浆用冷的醇例如乙醇进行沉淀来获得。用于血浆的冷分级分离的其它醇包括C1-C6直链或者支链醇,诸如甲醇、正丙醇、异丙醇、正丁醇、仲丁醇、异丁醇和叔丁醇。在多个实施方案中,除了醇之外的降低蛋白溶解性的试剂可用于由血浆来沉淀载脂蛋白。所述试剂包括但不限于乙醚(ether)、硫酸铵、7-乙氧基吖啶-3,9-二胺(雷佛奴尔)和聚乙二醇。沉淀的蛋白可通过本领域任何已知的方法由上清液分离,所述方法包括但不限于沉积、离心和滤过。
ApoA-I可由含有蛋白的血浆的任何部分回收。在一些实施方案中,ApoA-I由人血浆的血清部分回收,其中纤维蛋白原的量通过用约8%(w/w)的乙醇沉淀而降低。在其它实施方案中,载脂蛋白由人血浆的血清部分回收,其中其它血清蛋白(例如β-球蛋白和γ-球蛋白)的浓度已经通过用约25%(w/w)的乙醇沉淀而降低。在其它实施方案中,载脂蛋白作为由人血清的沉淀物来回收,其通过将乙醇浓度增加至约38%至约42%(w/w)而获得。在一个具体的实施方案中,载脂蛋白作为由人血清的沉淀物来回收,其通过将乙醇浓度增加至约40%(w/w)而获得(Cohn部分IV)。沉淀的ApoA-I可通过本领域任何已知的方法包括但不限于离心和滤过由血清部分回收。
在一些实施方案中,血浆部分(载脂蛋白由该部分回收)的温度足够低以防止蛋白变性。在这些实施方案中,ApoA-I部分的温度的范围为约-10℃至约0℃,诸如约-8℃至约-2℃。在多个实施方案中,血浆部分(ApoA-I由该部分回收)的pH的范围防止蛋白变性。在这些实施方案中,含有ApoA-I的部分的pH范围为约5至约7,诸如约5.5至约6.5。
6.1.4.改善的脂蛋白纯化方法
申请人已经进一步发现产生成熟、完整且基本上不含污染物的脂蛋白的改善的纯化方法,其如下描述且在实施例中示例说明。本申请所述的纯化方法可以适于本领域从业者的任何规模来进行。
所述方法可应用于任何载脂蛋白,包括但不限于ApoA-I、-II、-III或者–IV;ApoB48和ApoB100;ApoC-I、-II、-III或者–IV;ApoD;ApoE、ApoH;ApoJ。更具体地,本公开涉及获得高度纯化的ApoA-I的方法。在一些实施方案中,所述ApoA-I为具有选自(但不限于)下述序列的人蛋白:在Genbank登记号NP_000030、AAB59514、P02647、CAA30377、AAA51746和AAH05380.1中阐述的序列。在某些实施方案中,所述ApoA-I为如上在段落6.1.2中所述的人蛋白。在其它实施方案中,本公开的方法可用于纯化由非人动物(参见,例如美国公开2004/0077541)例如,牛、马、羊、猴、狒狒、山羊、兔、狗、刺猬、獾、小鼠、大鼠、猫、豚鼠、仑鼠、鸭、鸡、鲑鱼和鳗鱼获得的ApoA-I(Brouillette et al.,2001,Biochim Biophys Acta.1531:4-46;Yu et al.,1991,Cell Struct Funct.16(4):347-55;Chen and Albers,1983,Biochim Biophys Acta.753(1):40-6;Luo et al.,1989,J Lipid Res.30(11):1735-46;Blaton et al.,1977,Biochemistry 16:2157-63;Sparrow et al.,1995,J Lipid Res.36(3):485-95;Beaubatie et al.,1986,J Lipid Res.27:140-49;Januzzi et al.,1992,Genomics 14(4):1081-8;Goulinet and Chapman,1993,J Lipid Res.34(6):943-59;Collet et al.,1997,J Lipid Res.38(4):634-44;以及Frank and Marcel,2000,J LipidRes.41(6):853-72)。
可通过本申请披露的方法纯化的ApoA-I蛋白的实例包括但不限于前原载脂蛋白形式的ApoA-I、原形式和成熟形式的ApoA-I,以及活化的多晶型、同等型、变体和突变体以及截短形式,例如ApoA-IM、ApoA-IZ和ApoA-IP。含有半胱氨酸残基的载脂蛋白A-I突变体也是已知的,并且也可通过本申请所述的方法纯化(参见,例如美国公开2003/0181372)。用于本申请所述的方法的ApoA-I可为单体、同源二聚体或异源二聚体。例如,可制备的原-ApoA-I和成熟ApoA-I的同源二聚体和异源二聚体包括ApoA-I(Duverger et al.,1996,Arterioscler Thromb Vasc Biol.16(12):1424-29)、ApoA-IM(Franceschini et al.,1985,J Biol Chem.260:1632-35)和ApoA-IP(Daum et al.,1999,J Mol Med.77:614-22)等。
在某些方面,可通过本申请所述的方法纯化的ApoA-I蛋白具有与SEQ ID NO:1的氨基酸25-267至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或者至少100%相同的氨基酸序列。
载脂蛋白可来自任何来源,包括血液血浆或者原核细胞或者真核细胞的重组表达。在一些具体的实施方案中,所述载脂蛋白为ApoA-I,例如人ApoA-I。在某些方面,所述ApoA-I在原核或者真核宿主细胞的细胞质或者周质中表达。在这些实施方案中,在纯化ApoA-I前,将所述细胞破裂以将ApoA-I释放至上清液。细胞破裂方法为本领域熟知的。使细胞破裂的示例性方法包括但不限于酶方法、声裂法、洗涤剂方法和机械法。在某些优选的方面,ApoA-I在哺乳动物细胞优选CHO细胞中表达,且分泌至生长培养基。在这些实施方案中,ApoA-I由澄清的无细胞培养基纯化。应该理解的是,尽管所述纯化方法在本申请中与人ApoA-I结合来更详细地描述,但是本领域技术人员能够使得所述纯化条件适于其它载脂蛋白以及非人ApoA-I;ApoA-I或者其它载脂蛋白的多晶型、同等型、变体和突变体以及截短形式,这取决于可由本领域技术人员容易确定的特定蛋白特征(例如分子量、等电点、斯托克斯半径、疏水性、多聚体状态等)。
一般而言,所述纯化方法包括以下步骤:(a)在使得ApoA-I不与基质结合的条件下使得含有ApoA-I的溶液与阴离子交换基质接触;(b)经具有足以除去病毒或者病毒颗粒的孔径的膜将步骤(a)获得的含有ApoA-I的溶液滤过;(c)在使得ApoA-I与基质结合的条件下使得步骤(b)获得的滤液经过第一反相色谱柱;(d)使用增加浓度的有机溶剂梯度由第一反相色谱基质洗脱出第一含有ApoA-I的反相洗脱液;(e)在使得ApoA-I与基质结合的条件下使得步骤(d)获得的第一ApoA-I的反相洗脱液经过第二反相色谱柱;以及(f)使用增加浓度的有机溶剂梯度由第二反相色谱基质洗脱出第二含有ApoA-I的反相洗脱液。所述步骤所进行的顺序不是关键的。对于本领域技术人员显而易见的是,所述步骤的顺序的众多排列是可能的,其中一些如下描述。
在某些方面,调整所述含有ApoA-I的溶液,之后使其与步骤(a)的阴离子交换基质接触。进行调整以调节所述蛋白溶液的pH,以使得其处于其中ApoA-I不与步骤(a)的阴离子交换基质结合的范围内(即所述蛋白不具有净负电荷且步骤(a)以阴性方式进行)。在这些方面,含有ApoA-I的溶液的pH为约5至约7,优选约5.0至约5.6。在具体的方面,所述pH为约5.1至约5.5。在其它方面,所述pH为约5.3。可通过加入适当的酸(例如盐酸)或者碱(例如氢氧化钠)来进行pH的调节,直到获得预期范围内的pH。在一些实施方案中,将含有ApoA-I的溶液滤过以移去细胞和细胞碎片,之后进行调整步骤。在其它实施方案中,当不存在调整步骤时,在进行步骤(a)之前,任选地将含有ApoA-I的溶液滤过,以移去细胞和细胞碎片。
在一些实施方案中,使得含有ApoA-I的溶液与阴离子交换基质接触的步骤(a)通过使蛋白溶液经过色谱柱来进行。在这些实施方案中,所述柱装填的底料高度为约10cm至约50cm,优选约10cm至约30cm,且更优选约20cm。在某些方面,所述柱装载有包含约10g至约50g诸如约10g至约30g、诸如约25g至约35g的ApoA-I/L的蛋白溶液。在一些具体的实施方案中,所述柱装载有包含至多约32g的ApoA-I/L的蛋白溶液。在其它实施方案中,步骤(a)以分批方式进行,即,将阴离子交换基质加入至烧瓶中的蛋白溶液中,混合充足的时间以将污染物与基质结合,然后例如通过滤过或者离心将基质物质由蛋白溶液分离。在某些实施方案中,将所述蛋白溶液滤过以除去溶液中的颗粒,之后使其与阴离子交换基质接触。
本申请所述的方法的步骤(a)中所用的阴离子交换基质可为本领域已知的任何阴离子交换基质。适当的阴离子交换基质包括但不限于Q-Sepharose FF、Q-Spherosil、DEAE-Sepharose FF、Q-Cellulose、DEAE-Cellulose和Q-Spherodex。在一个具体的实施方案中,所述阴离子交换基质为Q-Sepharose FF(GE Healthcare)。在某些方面,在使得步骤(a)的蛋白溶液与阴离子交换基质接触之前,将所述基质在具有如上讨论的使得ApoA-I不与所述基质结合的优选的范围内pH的缓冲剂中平衡。用于在步骤(a)之前平衡阴离子交换基质且用于进行步骤(a)的缓冲剂对于技术人员是已知的。在一些具体的实施方案中,所述缓冲剂为TAMP A(20mM磷酸钠,pH 5.3)。
在多个实施方案中,步骤(a)用于针对除了ApoA-I之外的蛋白(例如宿主细胞蛋白)、宿主细胞DNA和内毒素纯化ApoA-I,所述除了ApoA-I之外的蛋白(例如宿主细胞蛋白)、宿主细胞DNA和内毒素结合至阴离子交换基质且由此与ApoA-I分离,ApoA-I在如上所述的pH和盐条件下不与基质结合。在某些方面,由阴离子交换步骤回收在起始溶液中的至少75%、至少80%、至少85%或者至少90%或者更大的量的ApoA-I。
在多个实施方案中,所述纯化方法包括步骤(b),其中使用滤器将步骤(a)的ApoA-I溶液滤过,所述滤器具有足以捕获病毒和病毒颗粒的孔径。任选地,经膜滤过以除去病毒或者病毒颗粒的步骤(b)在如上步骤(f)后进行,而不是在步骤(a)后进行。在某些方面,在病毒滤过步骤(b)之前通过加入氢氧化钠或者其它适当的碱来调节来自阴离子交换基质的洗脱液的pH。将步骤(a)的含有ApoA-I的溶液调节为约7.8至约8.2的pH。在具体的方面,将含有ApoA-I的溶液调节为约8.0的pH。步骤(b)中使用的滤器可为具有用于捕获病毒的适当孔径例如约15nm至约75nm的孔径的任何滤器。在一些具体的实施方案中,所述滤器的孔径为约20nm(例如Planova 20N,Asahi Kasei Medical)。技术人员应该认识到蛋白溶液经过病毒滤器的流速由所述溶液的性质(例如其粘性、颗粒的浓度等)来确定。对于病毒滤过的典型流速为约12.5L/h/m2,然而,所述流速可被调节更高或者更低以保持1巴或者更低的滤器压力。步骤(b)的滤液含有ApoA-I。在某些方面,ApoA-I由病毒滤过步骤的回收率为步骤(a)的阴离子交换洗脱液中的ApoA-I量的至少80%、至少85%、至少90%、至少95%或者至少98%或者更大。
在一些具体的实施方案中,本申请所述的纯化方法包括步骤(b)之后的步骤(c),其中在允许载脂蛋白A-I与基质结合的缓冲剂和盐条件下使得步骤(b)的滤液经过第一反相色谱柱。在这些实施方案中,使用增加浓度的有机溶剂的梯度将所述ApoA-I针对宿主细胞DNA、宿主细胞蛋白、内毒素和截短形式进行纯化。反相色谱法可使用本领域已知的多种基质进行,所述基质包括但不限于硅胶、聚苯乙烯或者交联琼脂糖基培养基(在所述培养基上接枝C4-C18疏水性配体)。用于本申请所述的方法中的可商购得到的疏水性基质包括但不限于Butyl Sepharose-FF、Octyl Sepharose-FF、Dianon HP20ss、C18 Hypersil和Source 30RPC。在一些具体的实施方案中,步骤(c)中使用的基质为Source 30RPC(GEHealthcare)。在某些方面,所述反相色谱柱具有约10cm至约50cm诸如约10cm至约30cm的底料高度。在具体的方面,所述反相色谱柱具有约25cm的底料高度。
在一些实施方案中,将病毒滤过步骤(b)的ApoA-I滤液以每升约1至约20g ApoA-I诸如约1.5g至约5g ApoA-I且更优选约2.5g至约3.5g ApoA-I的浓度载入至反相柱上。在具体的方面,将步骤(b)的ApoA-I滤液以约3.4g ApoA-I/L的浓度载入至反相柱上。可用于在载入ApoA-I之前平衡所述反相柱且保证所述蛋白在载入后将结合至所述柱上的缓冲条件将对于本领域技术人员而言是可容易确定的。优选地,所述柱平衡缓冲剂为强的缓冲剂,其可将柱pH降低至约9.5。在某些实施方案中,所述平衡缓冲剂为TAMP D(20mM碳酸铵)。优选地,在平衡后,将步骤(b)的含有ApoA-I的滤液(pH为约8.0)以约0.5cm至约5.0cm/分钟诸如约2.0cm至约4.0cm/分钟的流速载入至柱上。在一个具体的实施方案中,将含有ApoA-I滤液以约2.8cm/分钟的流速载入至柱上。
在步骤(c)中将ApoA-I结合至反相基质后,通过暴露于增加浓度的有机溶剂在缓冲剂中的梯度诸如约35%至约50%乙腈在TAMP D缓冲剂中的梯度将蛋白在步骤(d)中洗脱出。在某些方面,历时约60至约90分钟诸如约70分钟或者更优选约80分钟的时间内约35%至约50%乙腈的线性梯度可用于将ApoA-I由所述柱洗脱出。在某些方面,在线性梯度之后进行使用50%乙腈的约10分钟的等度洗脱。用于将ApoA-I由所述反相柱洗脱出的确切条件将对于本领域技术人员是可容易确定的。在多个实施方案中,柱负载中的约60%诸如约65%、约70%、约75%或者约80%或者更多的ApoA-I存在于步骤(d)的柱洗脱液中。
在某些方面,本申请所述的纯化方法进一步包括在步骤(d)后的步骤(e),其中使得步骤(d)的载脂蛋白A-I反相洗脱液经过第二反相色谱柱以进一步由全长蛋白中除去DNA、宿主细胞蛋白和截短形式的ApoA-I。优选地,在允许所述载脂蛋白A-I结合至基质的条件下将步骤(d)的反相洗脱液载入至第二反相柱上。用于步骤(e)的反相基质可为与步骤(d)所用的相同类型的基质或者不同类型的基质。在一些具体的实施方案中,步骤(e)中所用的反相基质为C18硅胶基质诸如Daisogel SP-300-BIO C18基质(10μm;DaisoCo.,Ltd.)。可用于在载入ApoA-I之前平衡所述C18柱且保证所述蛋白在载入后将结合至所述柱上的缓冲条件将对于本领域技术人员而言是可容易确定的。优选地,所述柱平衡缓冲剂为强缓冲剂,其可将柱pH降低至约9.5。在某些实施方案中,所述平衡缓冲剂为TAMP E(100mM碳酸铵)。在多个实施方案中,在本申请所述的纯化方法的步骤(e)中所用的反相柱具有约10cm至约50cm诸如约10cm至约30cm的底料高度。在一些具体的实施方案中,步骤(e)中所用的反相柱具有约25cm的底料高度。
在多个实施方案中,将步骤(d)的ApoA-I洗脱液以每升约0.5g至约30g ApoA-I诸如约1g至约10g ApoA-I且更优选约4g至约5g ApoA-I的浓度载入至C18反相柱上。在一些具体的实施方案中,将步骤(d)的ApoA-I洗脱液以约4.7g ApoA-I/L的浓度载入至C18柱上。优选地,在平衡后,将步骤(d)的含有ApoA-I的洗脱液以约0.5cm至约5.0cm/分钟诸如约1.0cm至约3.0cm/分钟的流速载入至柱上。在一个具体的实施方案中,将含有ApoA-I的滤液以约2.1cm/分钟的流速载入至柱上。
在ApoA-I结合至步骤(e)的反相基质中后,使用增加浓度的有机溶剂在缓冲剂中的梯度诸如约40%至约50%乙腈在TAMP E缓冲剂中的梯度将蛋白在步骤(f)洗脱出。在某些方面,历时约40至约80分钟诸如约50分钟、约60分钟或者约70分钟的时间内约40%至约50%乙腈的线性梯度用于将ApoA-I由所述柱洗脱出。在一些具体的实施方案中,历时约60分钟的时间内约40%至约50%乙腈在TAMP E缓冲剂中的线性梯度用于将ApoA-I由所述反相基质洗脱出。在某些方面,线性梯度之后进行使用50%乙腈的约15分钟的等度洗脱。用于将ApoA-I由所述反相柱洗脱出的确切条件将对于本领域技术人员而言是容易确定的。在多个实施方案中,在柱负载中的约60%诸如约65%、约70%、约75%或者约80%或者更多的ApoA-I在步骤(f)的柱洗脱液中回收。
在某些实施方案中,将有机溶剂由本申请所述方法的步骤(f)获得的含有ApoA-I的洗脱液除去。溶剂除去可通过本领域已知的任何方法来完成,包括但不限于将步骤(f)获得的含有ApoA-I的洗脱液浓缩并将所述浓缩液渗滤至含水缓冲剂中。在某些实施方案中,将步骤(f)的洗脱液浓缩约2-倍、约2.5-倍、约3-倍、约3.5-倍、约4-倍、约4.5-倍或者约5-倍(相比于步骤(f)的反相柱中洗脱液的体积)。在一个具体的实施方案中,将洗脱液浓缩约2.5-倍,然后经约10、15或者20体积,优选15体积的适当含水缓冲剂渗滤。适当的含水缓冲剂为本领域已知的。特别优选的缓冲剂为TAMP C(3mM磷酸钠,pH 8.0)。
在一些实施方案中,色谱柱的顺序是可颠倒的。
任选地,在浓缩和缓冲剂交换后,将含水ApoA-I溶液进一步经阴离子交换色谱法以阴性模式(即在其中ApoA-I不结合至阴离子交换基质的条件下)纯化,以除去残留的DNA和其它荷负电的污染物诸如宿主细胞蛋白(步骤(g))。在一些实施方案中,所述阴离子交换步骤以分批模式进行。在其它实施方案中,所述阴离子交换步骤经柱色谱法进行。用于分批模式或者柱色谱法中的适当的阴离子交换基质包括但不限于Q Sepharose-FF或者如上在步骤(a)中所讨论的任何阴离子交换基质。在具体的方面,所述阴离子交换步骤通过以下方法实施:使得ApoA-I溶液经过阴离子交换膜诸如具有大的表面积和强的阳离子电荷的膜,例如Sartobind Q或者Mustang Q。优选地,使用Mustang Q阴离子交换膜(Pall LifeSciences)来进行所述阴离子交换步骤。在某些方面,将所述含水ApoA-I溶液的pH降低至约5.5、约6.0或者约6.5,之后使用任何适当的酸进行该阴离子交换步骤。在具体的方面,使用稀磷酸将所述含水ApoA-I溶液的pH降低至约6.0。在优选的实施方案中,使得所述ApoA-I溶液以约12.5L/m2/h经过Mustang Q柱。
在一些实施方案中,将所述阴离子交换膜滤液浓缩并任选地渗滤,以将溶剂变换为适于储存或者进一步加工所述ApoA-I的溶剂,所述加工诸如与在如下段落6.5.1中所述的脂质复合和/或者如以下段落6.6中所述配制在药物组合物中。用于储存或者进一步加工ApoA-I的适当的缓冲剂对于本领域技术人员而言是容易确定的。在一些具体的实施方案中,将所述纯化的ApoA-I交换至TAMP C缓冲剂中。任何超滤膜可用于该步骤中,条件是所述膜具有低于全长成熟ApoA-I的分子量的分子量截止值以使得其允许缓冲剂经过而不允许蛋白经过。在一些具体的实施方案中,使用10,000额定分子量截止值的聚醚砜膜(例如Filtron Omega系列)。优选地,在超滤后所述溶液中的ApoA-I浓度为至少10g/L、至少12g/L、至少15g/L、至少20g/L、至少25g/L、至少30g/L、至少35g/L、至少40g/L、至少45g/L或者至少50g/L。
6.1.5.载脂蛋白产物
本公开还提供了基本纯的成熟全长载脂蛋白。本申请使用的术语“基本纯的”是指至少95%纯的蛋白。在某些实施方案中,所述基本纯的蛋白为至少96%纯的、至少97%纯的、至少98%纯的、至少99%纯的、至少99.5%纯的、至少99.9%纯的或者100%纯的。在某些方面,使用光源对照白色背景进行视觉观察时,由本申请所述的纯化方法产生的基本纯的载脂蛋白产物为不含可见颗粒的澄清至略微乳色溶液。在多个实施方案中,由如上在段落6.1.4中所述的方法获得或者可获得的基本纯的载脂蛋白包括少量或者检测不到的量的一种或者多种宿主细胞DNA、除了载脂蛋白之外的蛋白(例如宿主细胞蛋白)、内毒素、残留的溶剂以及低生物负载(即在样品上或者样品中的少量的微生物),如下进一步详述。载脂蛋白产物的纯度可由本领域已知的任何方法来确定,包括但不限于N-末端Edman序列测定、MALDI-MS、凝胶电泳、HPLC和/或者免疫测定。
在多个实施方案中,由本申请所述的方法获得的基本纯的载脂蛋白为具有约28.1千道尔顿的质量的全长成熟人ApoA-I。该产物中的ApoA-I的质量可由本领域已知的任何方法来确定,包括但不限于MALDI-MS。在多个实施方案中,产物中至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或者至少99%的ApoA-I蛋白为成熟全长ApoA-I(例如包含SEQ ID NO:1的氨基酸25-267的ApoA-I)。在某些方面,所述基本纯的ApoA-I产物含有约15wt%或者更低、约10wt%或者更低、约5wt%或者更低、约4wt%或者更低、约3wt%或者更低、约2wt%或者更低或者约1wt%或者更低的N-末端延长的ApoA-I同等型(例如原ApoA-I)。本领域技术人员应该认识到,产物中任何N-末端延长的ApoA-I将在给药后在血液中快速地转化为成熟ApoA-I。在多个实施方案中,所述ApoA-I产物含有约25wt%或者更低、约20wt%或者更低、约15wt%或者更低、约10wt%或者更低、约5wt%或者更低、约4wt%或者更低、约3wt%或者更低、约2wt%或者更低、约1wt%或者更低、约0.75wt%或者更低、约0.5wt%或者更低、约0.25wt%或者更低或者约0.1wt%或者更低的截短形式的ApoA-I。截短的或者延长的ApoA-I的量可通过例如N-末端Edman序列测定和/或者MALDI-MS和/或者运行和扫描SDS-PAGE凝胶来确定,以确定纯化的ApoA-I谱带面积(如果存在)的强度与所有谱带的总强度的比例。在多个实施方案中,所述ApoA-I产物含有约20wt%或者更低、约10wt%或者更低、约5wt%或者更低、约4wt%或者更低、约3wt%或者更低、约2wt%或者更低、约1wt%或者更低、约0.75wt%或者更低、约0.5wt%或者更低、约0.25wt%或者更低或者约0.1wt%或者更低的氧化形式的ApoA-I,特别是在位置Met112和/或者Met148氧化的ApoA-I。
在某些实施方案中,由本申请所述的方法产生的基本纯的载脂蛋白包含以小于约100ppm(例如ng/mg)诸如小于约75ppm、小于约50ppm、小于约40ppm、小于约30ppm、小于约20ppm或者小于约10ppm的量存在的宿主细胞蛋白。在一些具体的实施方案中,所述基本纯的载脂蛋白产物包含小于约20ppm的宿主细胞蛋白。更优选地,所述载脂蛋白产物包含小于约10ppm的宿主细胞蛋白。载脂蛋白样品中的宿主细胞蛋白的存在和量可由本领域已知的任何方法来确定。当载脂蛋白在例如哺乳动物细胞中重组产生时,可商购得到的ELISA试剂盒(例如Kit F015,来自Cygnus Technologies)可用于检测和定量宿主细胞蛋白水平。
在某些方面,如本申请所述纯化的基本纯的载脂蛋白产物包含以小于约50pg/mg的载脂蛋白诸如小于约40pg/mg、小于约30pg/mg、小于约20pg/mg、小于约10pg/mg或者小于约5pg/mg的载脂蛋白的量存在的宿主细胞DNA。在优选的实施方案中,基本纯的载脂蛋白产物包含小于约10pg的宿主细胞蛋白/mg的载脂蛋白。宿主细胞DNA在载脂蛋白样品中的存在和量可由本领域已知的任何方法来确定,包括实时-PCR或者使用抗-SSB抗体(GlycotypeBiotechnology)的具有单链结合蛋白的复合物的检测,优选通过定量PCR。
在某些实施方案中,由本申请所述的方法产生的基本纯的载脂蛋白产物包含小于约0.5EU/mg的载脂蛋白诸如小于约0.4EU/mg、小于约0.3EU/mg、小于约0.2EU/mg或者小于约0.1EU/mg的载脂蛋白的量的内毒素。优选地,本申请所述的基本纯的载脂蛋白产物包含小于约0.1EU的内毒素/mg的载脂蛋白。内毒素的检测和定量可由本领域已知的任何方法来实现,例如使用针对革兰氏阴性细菌内毒素(Cambrex;敏感性0.125EU/mL)的鲎阿米巴样细胞溶解物(Limulus Amebocyte Lysate,LAL)定性测试。
本申请所述的基本纯的载脂蛋白产物具有低生物负载。术语“生物负载”是指产物中的需氧菌、厌氧菌、酵母以及霉菌的水平。在多个实施方案中,如本申请所述纯化的基本纯的载脂蛋白产物的生物负载为小于约1CFU/mL。生物负载测试可根据任何已知方法来进行,例如根据European Pharmacopoeia Chapter 2.6.12.B,2.6.1以及USB Chapter 61统一方法。
本申请所述的基本纯的载脂蛋白产物包含少量的残留溶剂。在一些具体的实施方案中,残留溶剂以针对10mg/L的载脂蛋白而言小于约50ppm、小于约45ppm、小于约40ppm、小于约35ppm、小于约30ppm、小于约25ppm、小于约20ppm、小于约15ppm或者小于约10ppm的量存在。优选地,残留溶剂以针对10mg/L的载脂蛋白而言小于约41ppm的量存在。残留溶剂的量可由本领域已知的任何方法来测定,包括但不限于GC-MS和HPLC。
优选地,所述载脂蛋白为ApoA-I(例如包含SEQ ID NO:1的氨基酸25-267的ApoA-I)。在一些实施方案中,所述成熟人ApoA-I蛋白具有在位置1(即,相应于SEQ ID NO:1的位置25的位置)具有门冬氨酸的氨基酸序列。
6.2.脂质部分
本公开的脂蛋白复合物和组合物包含脂质部分。所述脂质部分包含一种或者多种脂质。在多个实施方案中,一种或者多种脂质可为饱和和/或者不饱和的,以及天然或者合成的脂质。所述脂质部分优选包含至少一种磷脂。
可存在于脂质部分中的适当的脂质包括但不限于小烷基链磷脂、蛋磷脂酰胆碱、大豆磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二肉豆蔻酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱、1-肉豆蔻酰-2-棕榈酰磷脂酰胆碱、1-棕榈酰-2-肉豆蔻酰磷脂酰胆碱、1-棕榈酰-2-硬脂酰磷脂酰胆碱、1-硬脂酰-2-棕榈酰磷脂酰胆碱、二油酰磷脂酰胆碱、二油酰磷脂酰乙醇胺、二月桂酰磷脂酰甘油磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰甘油、二磷脂酰甘油诸如二肉豆蔻酰磷脂酰甘油、二棕榈酰磷脂酰甘油、二硬脂酰磷脂酰甘油、二油酰磷脂酰甘油、二肉豆蔻酰磷脂酸、二棕榈酰磷脂酸、二肉豆蔻酰磷脂酰乙醇胺、二棕榈酰磷脂酰乙醇胺、二肉豆蔻酰磷脂酰丝氨酸、二棕榈酰磷脂酰丝氨酸、脑磷脂酰丝氨酸、脑鞘磷脂、棕榈酰鞘磷脂、二棕榈酰鞘磷脂、蛋鞘磷脂、乳鞘磷脂、植物鞘磷脂、二硬脂酰鞘磷脂、二棕榈酰磷脂酰甘油盐、磷脂酸、半乳糖脑苷脂、神经节苷酯、脑苷脂、二月桂基磷脂酰胆碱、(1,3)-D-甘露糖基-(1,3)甘油二酯、氨基苯基糖苷、3-胆固醇基-6'-(糖基硫基)己基醚糖脂以及胆固醇及其衍生物。合成的脂质诸如合成的棕榈酰鞘磷脂或者N-棕榈酰-4-羟基二氢鞘氨醇-1-磷酸胆碱(植物鞘磷脂形式)可用于使得脂质氧化最小化。包含棕榈酰鞘磷脂的磷脂部分可任选地包括少量的任何类型的脂质,包括但不限于溶血磷脂质、除了棕榈酰鞘磷脂之外的鞘磷脂、半乳糖脑苷脂、神经节苷酯、脑苷脂、甘油酯、甘油三酯和胆固醇及其衍生物。
在优选的实施方案中,所述脂质部分包含两种类型的磷脂:鞘磷脂(SM)和负电荷磷脂。SM为“中性”磷脂,是在生理pH条件下净电荷约为零的磷脂。使用的SM的特性并不是成功的关键所在。因此,如本申请所用,“SM”的表达不仅包括衍生自或者源自天然来源的鞘磷脂,而且包括与天然形成的SM一样的、不受LCAT水解影响的天然形成的SM的类似物和衍生物。SM是一种结构极类似于卵磷脂的磷脂,但是其与卵磷脂不一致之处在于其不具有甘油骨架,并由此而不具有结合酰基链的酯键。相反,SM具有神经酰胺骨架,在该骨架中酰胺键与酰基链连接。SM并不是LCAT的底物,并且其通常不能被LCAT水解。但是,SM可以起LCAT抑制剂的作用或者可以通过稀释底物磷脂的浓度而降低LCAT的活性。由于SM不被水解,因此其在循环中可滞留更长的时间。预期这种特征可使本申请所述的荷负电的脂蛋白复合物具有更长的药理作用(胆固醇的流动)持续时间,并且其与不包括SM的载脂蛋白复合物相比,能够获取更多的脂质,尤其是胆固醇。这种作用可以使包括SM的脂蛋白复合物与不包括SM的脂蛋白复合物相比,治疗所需的次数更少或者剂量更低。
事实上,SM可以源自任何来源。例如,SM可以由牛奶、蛋或脑获得。还可以使用SM类似物或衍生物。有用的SM类似物和衍生物的非限制性实例包括但不限于棕榈酰鞘磷脂、N-棕榈酰-4-羟基二氢鞘氨醇-1-磷酸胆碱(一种形式的植物鞘磷脂)、棕榈酰鞘磷脂、硬脂酰鞘磷脂、D-赤藓糖-N-16:0-鞘磷脂及其二氢异构体、D-赤藓糖-N-16:0-二氢-鞘磷脂。可使用合成的SM诸如合成的棕榈酰鞘磷脂或者N-棕榈酰-4-羟基二氢鞘氨醇-1-磷酸胆碱(植物鞘磷脂),以产生更均质的复合物以及更少的污染物和/或者氧化产物(相比于动物来源的鞘脂)。
示例性鞘磷脂,即棕榈酰鞘磷脂和植物鞘磷脂如下显示。
可以人工地使由天然来源分离的鞘磷脂富含一种特殊的饱和或不饱和酰基链。例如,乳鞘磷脂(Avanti Phospholipid,Alabaster,Ala.)的特征为具有饱和的长酰基链(即,具有20个或更多个碳原子的酰基链)。相反,蛋鞘磷脂的特征为具有饱和的短酰基链(即,具有少于20个碳原子的酰基链)。例如,虽然只有大约20%的乳鞘磷脂包括C16:0(16个碳,饱和的)酰基链,但是却有约80%的蛋鞘磷脂包括C16:0酰基链。可以通过使用溶剂萃取来使乳鞘磷脂的组成富含与蛋鞘磷脂具可比性的酰基链组分,反之亦然。
为使SM具有特定的酰基链,其可以是半合成的。例如,首先可将乳鞘磷脂从乳品纯化,然后可将一种特定的酰基链如C16:0酰基链裂解并替换为另一酰基链。SM也可以完全通过例如大规模合成来进行合成。参见,例如Dong et al.,美国专利5,220,043,标题为Synthesis of D-erythro-sphingomyelins,issued Jun.15,1993;Weis,1999,Chem.Phys.Lipids102(1-2):3-12。
可以选择性地改变构成半合成或合成SM的酰基链的长度和饱和度。所述酰基链可以是饱和或不饱和的,并且可以含有约6至约24个碳原子。每条链可以含有相同数目的碳原子,或者可选地,每条链可以含有不同数目的碳原子。在一些实施方案中,半合成或合成的SM包含混合的酰基链,以使其中的一条链为饱和的而另一条链为不饱和的。在具有这样混合的酰基链的SM中,该链的长度可以相同或不同。在其它实施方案中,半合成或合成SM的酰基链可均为饱和或不饱和的。此外,该链可以含有相同或不同数目的碳原子。在一些实施方案中,构成半合成或合成SM的酰基链是相同的。在一个具体的实施方案中,该链与天然形成的脂肪酸的酰基链一致,所述天然形成的脂肪酸的例子如油酸、棕榈酸或硬脂酸。在另外的实施方案中,使用具有饱和或者不饱和官能链的SM。在另一个具体的实施方案中,这两种酰基链均为饱和的并且均含有6至24个碳原子。以下的表1提供了可以包含在半合成和合成SM中的、存在于通常形成的脂肪酸中的酰基链的非限制性实例:
在优选的实施方案中,所述SM为棕榈酰SM诸如合成的棕榈酰SM,其具有C16:0酰基链,或者其为蛋SM,其包含作为主要成分的棕榈酰SM。
在一个具体的实施方案中,使用官能化的SM诸如植物鞘磷脂。
所述脂质部分优选包含负电荷磷脂。本申请使用的“负电荷磷脂”为在生理pH条件下具有负的净电荷的磷脂。所述负电荷磷脂可包含单一类型的负电荷磷脂,或者两种或者更多种不同的荷负电的磷脂的混合物。在一些实施方案中,所述荷电磷脂为荷负电的甘油磷脂。所述一种或者多种荷电磷脂的特性并不是成功的关键所在。适当的负电荷磷脂的具体实例包括但不限于1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)]、磷脂酰甘油、磷脂酰肌醇、磷脂酰丝氨酸和磷脂酸。在一些实施方案中,所述负电荷磷脂包含一种或者多种磷脂酰肌醇、磷脂酰丝氨酸、磷脂酰甘油和/或者磷脂酸。在一个具体的实施方案中,所述负电荷磷脂由1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)]或者DPPG构成。
与SM一样,负电荷磷脂可以由天然来源获得或者通过化学合成制备。如上文与SM相关的讨论一样,在采用合成的负电荷磷脂的实施方案中,可以选择性地改变酰基链的特性。在本申请描述的荷电脂蛋白复合物的一些实施方案中,该负电荷磷脂上的两种酰基链是相同的。在一些实施方案中,SM以及负电荷磷脂上的酰基链全部相同。在特定的实施方案中,所述一种或者多种负电荷磷脂和/或SM均具有C16:0或C16:1酰基链。在特定的实施方案中,所述SM的脂肪酸部分主要为C16:1棕榈酰。在一个特定的实施方案中,所述一种或者多种荷电的磷脂和/或SM的酰基链与棕榈酸的酰基链一致。
使用的磷脂优选为至少95%纯的和/或者具有降低水平的氧化剂。由天然来源获得的脂质优选具有较少的多不饱和脂肪酸部分和/或者不易于氧化的脂肪酸部分。样品的氧化水平可使用碘量法来确定,其提供了过氧化值,表示为每千克样品的分离的碘的毫当量数,缩写为meq O/kg。参见例如Gray,J.I.,Measurement of Lipid Oxidation:AReview,Journal of the American Oil Chemists Society,Vol.55,p.539-545(1978);Heaton,F.W.and Uri N.,Improved Iodometric Methods for the Determination ofLipid Peroxides,Journal of the Science of food and Agriculture,vol 9.P,781-786(1958)。优选地,所述氧化水平或者过氧化物水平是低的,例如小于5meq O/kg、小于4meq O/kg、小于3meq O/kg或者小于2meq O/kg。
包含SM和棕榈酰鞘磷脂的脂质部分可任选地包含少量的额外的脂质。实际上,可使用任何类型的脂质,包括但不限于溶血磷脂质、半乳糖脑苷脂、神经节苷酯、脑苷脂、甘油酯、甘油三酯和胆固醇及其衍生物。
当包括在内时,所述任选的脂质通常包含小于约15wt%的脂质部分,尽管在一些情况下可包含更任选的脂质。在一些实施方案中,任选的脂质为小于约10wt%、小于约5wt%或者小于约2wt%。在一些实施方案中,所述脂质部分不包含任选的脂质。
在一个具体的实施方案中,所述磷脂部分含有重量比(SM:负电荷磷脂)范围为90:10至99:1、更优选范围为95:5至98:2的蛋SM、棕榈酰SM或者植物鞘磷脂以及DPPG。在一个实施方案中,所述重量比为97:3。
本公开的脂蛋白复合物也可用作载体来递送疏水性、亲脂性或者非极性活性剂以用于各种治疗或者诊断应用。对于所述应用,所述脂质部分可进一步包含一种或者多种疏水性、亲脂性或者非极性活性剂,包括但不限于脂肪酸、药物、核酸、维生素和/或者营养素。适当的疏水性、亲脂性或者非极性活性剂并不限于治疗类别,且可为例如镇痛药、抗炎剂、驱虫药、抗心律不齐药、抗菌剂、抗病毒剂、抗凝血剂、抗抑郁药、抗糖尿病药、抗癫痫剂、抗真菌剂、抗痛风药、抗高血压剂、抗疟药、抗偏头痛药、抗毒蕈碱剂、抗肿瘤药、勃起机能障碍改善剂、免疫抑制剂、抗原虫剂、抗甲状腺剂、抗焦虑剂、镇静药、安眠药、神经镇静药、β-阻滞剂、心脏收缩药(cardiac inotropic agents)、皮质类固醇(corticosteroids)、利尿剂、抗帕金森综合征剂、胃肠药、组胺受体拮抗剂、角质层分离剂、脂质调节剂、抗心绞痛药、cox-2抑制剂、白三烯抑制剂、大环内酯类、肌肉松弛药(muscle relaxants)、营养剂、核酸(例如小干扰RNA)、阿片样物质镇痛药、蛋白酶抑制剂、性激素类、兴奋药、肌肉松弛药、抗骨质疏松药(anti-osteoporosis agents)、减肥药、认知增强药、抗尿失禁药、营养油、抗良性前列腺肥大药、必需脂肪酸、非必需脂肪酸以及它们的混合物。
适当的疏水性、亲脂性或者非极性活性剂的具体的非限制性实例为:阿昔曲丁(acetretin)、阿苯达唑(albendazole)、沙丁胺醇(albuterol)、氨鲁米特(aminoglutethimide)、胺碘酮(amiodarone)、氨氯地平(amlodipine)、安非他命(amphetamine)、两性霉素B(amphotericin B)、阿托伐他汀(atorvastatin)、阿托伐醌(atovaquone)、阿奇霉素(azithromycin)、巴氯芬(baclofen)、倍氯米松(beclomethasone)、贝那普利(benezepril)、苯佐那酯(benzonatate)、倍他米松(betamethasone)、比卡鲁胺(bicalutanide)、布地奈德(budesonide)、安非他酮(bupropion)、白消安(busulfan)、布替萘芬(butenafine)、骨化二醇(calcifediol)、卡泊三烯(calcipotriene)、骨化三醇(calcitriol)、喜树碱(camptothecin)、坎地沙坦(candesartan)、辣椒碱(capsaicin)、卡马西平(carbamezepine)、胡萝卜素类(carotenes)、塞来考昔(celecoxib)、西立伐他汀(cerivastatin)、西替利嗪(cetirizine)、氯苯那敏(chlorpheniramine)、胆钙化甾醇(cholecalciferol)、西洛他唑(cilostazol)、西咪替丁(cimetidine)、桂利嗪(cinnarizine)、环丙沙星(ciprofloxacin)、西沙必利(cisapride)、克拉霉素(clarithromycin)、氯马斯汀(clemastine)、氯米芬(clomiphene)、氯米帕明(clomipramine)、氯吡格雷(clopidogrel)、可待因(codeine)、辅酶Q10(coenzyme Q10)、环苯扎林(cyclobenzaprine)、环孢菌素(cyclosporin)、达那唑(danazol)、丹曲林(dantrolene)、右氯苯那敏(dexchlorpheniramine)、双氯芬酸(diclofenac)、双香豆素(dicoumarol)、地高辛(digoxin)、脱氢表雄酮(dehydroepiandrosterone)、二氢麦角胺(dihydroergotamine)、双氢速甾醇(dihydrotachysterol)、地红霉素(dirithromycin)、多奈哌齐(donezepil)、依法韦仑(efavirenz)、头孢他定(eposartan)、麦角钙化醇(ergocalciferol)、麦角胺(ergotamine)、必需脂肪酸来源(essential fatty acid sources)、依托度酸(etodolac)、依托泊苷(etoposide)、法莫替丁(famotidine)、非诺贝特(fenofibrate)、芬太尼(fentanyl)、非索非那定(fexofenadine)、非那雄胺(finasteride)、氟康唑(fluconazole)、氟比洛芬(flurbiprofen)、氟伐他汀(fluvastatin)、磷苯妥英(fosphenytoin)、夫罗曲普坦(frovatriptan)、呋喃唑酮(furazolidone)、加巴喷丁(gabapentin)、吉非贝齐(gemfibrozil)、格列本脲(glibenclamide)、格列吡嗪(glipizide)、格列本脲(glyburide)、格列美脲(glimepiride)、灰黄霉素(griseofulvin)、卤泛群(halofantrine)、布洛芬(ibuprofen)、厄贝沙坦(irbesartan)、伊立替康(irinotecan)、硝酸异山梨酯(isosorbide dinitrate)、异维A酸(isotretinoin)、伊曲康唑(itraconazole)、伊维菌素(ivermectin)、酮康唑(ketoconazole)、酮咯酸(ketorolac)、拉莫三嗪(lamotrigine)、兰索拉唑(lansoprazole)、来氟米特(leflunomide)、赖诺普利(lisinopril)、洛哌丁胺(loperamide)、氯雷他定(loratadine)、洛伐他汀(lovastatin)、L-甲状腺素(L-thryroxine)、叶黄素(lutein)、番茄红素(lycopene)、甲羟孕酮(medroxyprogesterone)、米非司酮(mifepristone)、甲氟喹(mefloquine)、醋酸甲地孕酮(megestrol acetate)、美沙酮(methadone)、甲氧沙林(methoxsalen)、甲硝唑(metronidazole)、咪康唑(miconazole)、咪达唑仑(midazolam)、米格列醇(miglitol)、米诺地尔(minoxidil)、米托蒽醌(mitoxantrone)、孟鲁司特(montelukast)、萘丁美酮(nabumetone)、纳布啡(nalbuphine)、那拉曲坦(naratriptan)、奈芬纳韦(nelfinavir)、硝苯地平(nifedipine)、尼索地平(nilsolidipine)、尼鲁米特(nilutanide)、呋喃妥因(nitrofurantoin)、尼扎替丁(nizatidine)、奥美拉唑(omeprazole)、奥普瑞白介素(oprevelkin)、甾二醇(oestradiol)、奥沙普秦(oxaprozin)、紫杉醇(paclitaxel)、旁卡西醇(paracalcitol)、帕罗西汀(paroxetine)、喷他佐辛(pentazocine)、吡格列酮(pioglitazone)、pizofetin、普伐他汀(pravastatin)、泼尼松龙(prednisolone)、普罗布考(probucol)、黄体酮(progesterone)、伪麻黄碱(pseudoephedrine)、吡斯的明(pyridostigmine)、雷贝拉唑(rabeprazole)、雷洛昔芬(raloxifene)、罗非考昔(rofecoxib)、瑞格列奈(repaglinide)、利福布汀(rifabutine)、利福喷汀(rifapentine)、利美索龙(rimexolone)、利托那韦(ritanovir)、利扎曲普坦(rizatriptan)、罗格列酮(rosiglitazone)、沙奎那韦(saquinavir)、舍曲林(sertraline)、西布曲明(sibutramine)、枸橼酸西地那非(sildenafil citrate)、辛伐他汀(simvastatin)、西罗莫司(sirolimus)、螺内酯(spironolactone)、舒马普坦(sumatriptan)、他克林(tacrine)、他克莫司(tacrolimus)、他莫昔芬(tamoxifen)、坦洛新(tamsulosin)、塔革雷汀(targretin)、他扎罗汀(tazarotene)、替米沙坦(telmisartan)、替尼泊苷(teniposide)、特比萘芬(terbinafine)、特拉唑嗪(terazosin)、四氢大麻酚(tetrahydrocannabinol)、噻加宾(tiagabine)、噻氯匹定(ticlopidine)、tirofibran、替扎尼定(tizanidine)、托吡酯(topiramate)、托泊替康(topotecan)、托瑞米芬(toremifene)、曲马多(tramadol)、维A酸(tretinoin)、曲格列酮(troglitazone)、曲伐沙星(trovafloxacin)、泛癸利酮(ubidecarenone)、缬沙坦(valsartan)、文拉法辛(venlafaxine)、维替泊芬(verteporfin)、氨己烯酸(vigabatrin)、维生素A(vitamin A)、维生素D(vitamin D)、维生素E(vitamin E)、维生素K(vitamin K)、扎鲁司特(zafirlukast)、齐留通(zileuton)、佐米曲坦(zolmitriptan)、唑吡坦(zolpidem)和佐匹克隆(zopiclone)。也可使用上面所列的试剂的盐、异构体和衍生物,以及它们的混合物。
6.3.脂蛋白复合物
本公开提供了包含蛋白部分和脂质部分的脂蛋白复合物,其各自的组成已经如上分别在章节6.1和6.2中描述。
一般而言,所述蛋白部分包含一种或者多种提供治疗和/或者预防益处的脂质-结合蛋白诸如载脂蛋白和/或者其衍生物或者类似物。所述复合物可包含单一类型的脂质-结合蛋白,或者可衍生自相同或者不同种类的两种或者更多种不同的脂质-结合蛋白的混合物。适当的脂质-结合蛋白如上在段落6.1中描述。尽管不必需,但是所述脂蛋白复合物将优选包含衍生自待治疗的动物物种的脂质-结合蛋白或者相应于待治疗的动物物种的氨基酸序列的脂质-结合蛋白,以避免产生对治疗免疫应答的诱导作用。因此,对于治疗人类患者,人源的脂质-结合蛋白优选用于本公开的复合物。肽模拟载脂蛋白的使用也可降低或者避免免疫应答。
认为具有高纯度(例如成熟且未被截短、未氧化、未被脱去酰胺的,未污染有内毒素和/或者未污染有其它蛋白或者核酸)的载脂蛋白增强了治疗效能和/或者增强脂蛋白复合物的安全性。因此,所述蛋白部分可包含至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%成熟的全长ApoA-I,其任选具有不超过25%、不超过20%、不超过15%、不超过10%、不超过5%或者约0%的氧化的蛋氨酸-112或者蛋氨酸-148和/或者不超过15%、不超过10%、不超过5%或者约0%的脱胺的氨基酸。所述载脂蛋白可根据本申请所述的任何方法来纯化。任选地,所述载脂蛋白可如在段落6.1.4中所述来制备。
在一个具体的实施方案中,所述蛋白部分包含ApoA-I或者基本上由ApoA-I构成,例如,所述ApoA-I为基本纯的成熟的全长ApoA-I,如上在段落6.1.5中所述。
所述脂质部分包含一种或者多种脂质,其可为饱和的、不饱和的、天然和合成的脂质和/或者磷脂。适当的脂质包括但不限于小烷基链磷脂、蛋磷脂酰胆碱、大豆磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二肉豆蔻酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱、1-肉豆蔻酰-2-棕榈酰磷脂酰胆碱、1-棕榈酰-2-肉豆蔻酰磷脂酰胆碱、1-棕榈酰-2-硬脂酰磷脂酰胆碱、1-硬脂酰-2-棕榈酰磷脂酰胆碱、二油酰磷脂酰胆碱、二油酰磷脂酰乙醇胺、二月桂酰磷脂酰甘油磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰甘油、二磷脂酰甘油诸如二肉豆蔻酰磷脂酰甘油、二棕榈酰磷脂酰甘油、二硬脂酰磷脂酰甘油、二油酰磷脂酰甘油、二肉豆蔻酰磷脂酸、二棕榈酰磷脂酸、二肉豆蔻酰磷脂酰乙醇胺、二棕榈酰磷脂酰乙醇胺、二肉豆蔻酰磷脂酰丝氨酸、二棕榈酰磷脂酰丝氨酸、脑磷脂酰丝氨酸、脑鞘磷脂、二棕榈酰鞘磷脂、二硬脂酰鞘磷脂、二棕榈酰磷脂酰甘油盐、磷脂酸、半乳糖脑苷脂、神经节苷酯、脑苷脂、二月桂基磷脂酰胆碱、(1,3)-D-甘露糖基-(l,3)甘油二酯、氨基苯基糖苷、3-胆固醇基-6'-(糖基硫基)己基醚糖脂以及胆固醇及其衍生物。包含SM和棕榈酰鞘磷脂的磷脂部分可任选地包含少量的任何类型的脂质,包括但不限于溶血磷脂质、除了棕榈酰鞘磷脂之外的鞘磷脂、半乳糖脑苷脂、神经节苷酯、脑苷脂、甘油酯、甘油三酯和胆固醇及其衍生物。合成的脂质为优选的,诸如合成的棕榈酰鞘磷脂或者N-棕榈酰-4-羟基二氢鞘氨醇-1-磷酸胆碱(植物鞘磷脂)。上面在段落6.2中描述了其它脂质。优选地,脂蛋白复合物包含鞘磷脂。
任选地,本公开的脂蛋白复合物可负载有用于多种治疗或者诊断应用的疏水性、亲脂性或者非极性活性剂,包括但不限于脂肪酸、药物、核酸、维生素和/或者营养素。适当的试剂如上描述于段落6.2中。
所述脂蛋白复合物可使用本申请所述的任何方法来制备。优选地,所述复合物如在段落6.5.1-6.5.4中所述的来制备。
本申请所述的荷负电的脂蛋白复合物中脂质部分与蛋白部分的摩尔比可以改变,并且除了其它因素之外,该摩尔比取决于构成所述蛋白部分的载脂蛋白的特性、构成所述脂质部分的荷电磷脂的特性和数量以及荷电脂蛋白复合物的期望尺寸。由于认为载脂蛋白(诸如ApoA-I)的生物活性受构成载脂蛋白的两亲性螺旋介导,因此可方便地使用ApoA-I蛋白质当量来表示脂质:载脂蛋白摩尔比的载脂蛋白部分。一般公认ApoA-I含有6-10个两亲性螺旋,并且其取决于用来计算螺旋的方法。可以ApoA-I当量来表示其它的载脂蛋白,根据它们含有的两亲性螺旋数目。例如,可将通常以二硫桥键二聚体存在的ApoA-IM表示为2当量的ApoA-I,原因是每分子ApoA-IM含有的两亲性螺旋是每分子ApoA-I的两倍。相反,可将含有一个两亲性螺旋的肽载脂蛋白表示为1/10-1/6当量的ApoA-I,原因是其每分子含有的两亲性螺旋是每分子ApoA-I的1/10-1/6。一般而言,脂蛋白复合物(此处定义为“Ri”)中脂质:ApoA-I当量的摩尔比范围为约105:1至110:1。在一些实施方案中,Ri约为108:1。对于磷脂,使用约为650-800的MW可以获得重量比。
在一些实施方案中,脂质:ApoA-I等价物的摩尔比(“RSM”)的范围为约80:1至约110:1,例如约80:1至约100:1。在一个具体的实例中,脂蛋白复合物的RSM可为约82:1。
可以使用任何本领域已知的、可检测的标记物对构成荷电脂蛋白复合物的各种载脂蛋白和/或磷脂分子进行标记,所述标记物包括稳定的同位素(如,13C、15N、2H等)、放射性同位素(如,14C、3H、125I等)、荧光团、化学发光物或酶标记物。
在优选的实施方案中,所述脂蛋白复合物为荷负电的脂蛋白复合物,其包含蛋白部分和脂质部分,所述蛋白部分优选为成熟的全长ApoA-I,且所述脂质部分包含中性磷脂、鞘磷脂(SM)和负电荷磷脂。
已经发现,构成脂蛋白复合物的脂质部分的SM和负电荷磷脂的组成以及相对量影响构成所述复合物的组合物的均质性和稳定性。如在实施例章节所示例说明,相比于类似的组合物(其中除了SM之外,脂质部分包含DPPC)而言,脂质部分包含SM和负电荷磷脂的构成复合物的组合物为更均质的且更稳定的。
因此,含有SM和荷负电的脂质的本公开的复合物优选在不存在卵磷脂的情况下形成以改善它们的均质性和稳定性。一旦形成均质的含有SM和荷负电的脂质的复合物,可掺入另外的脂质诸如卵磷脂。
当包括在内时,任选的脂质将通常构成小于约15%的脂质部分,尽管在一些情况下可包括更任选的脂质。在一些实施方案中,任选的脂质为小于约10%、小于约5%或者小于约2%wt%。在一些实施方案中,荷负电的脂蛋白复合物的脂质部分不包含任选的脂质。
在一个具体的实施方案中,所述磷脂部分含有重量比范围为90:10至99:1、更优选范围为95:5至98:2例如97:3(SM:负电荷磷脂)的蛋SM、棕榈酰SM或者植物SM以及DPPG。
一些载脂蛋白在体内从一种脂蛋白复合物交换至另一种(对于载脂蛋白ApoA-I而言,这是真实存在的)。在所述交换的过程中,所述载脂蛋白通常携带一种或者多种磷脂分子。由于这种性质,预期的是,本申请所述的荷负电的脂蛋白复合物将负电荷磷脂“接种”于内源性HDL,由此将它们转化为对肾消除更具抗性的α颗粒。因此,预期的是,给予本申请所述的荷负电的脂蛋白复合物和组合物将增加HDL的血清水平和/或者改变内源性HDL半衰期以及内源性HDL代谢作用。预期的是这将导致胆固醇代谢的改变和逆转脂质转运。
如在实施例章节所示例说明,相比于具有其它重量:重量比的类似的组合物而言,ApoA-I:SM和DPPG磷脂的重量比为约1:2.7的构成复合物的组合物为更均质的且更稳定的。因此,本公开提供了脂蛋白组合物,其中所述蛋白:脂质重量比针对均质的复合物群体的形成进行优化。对于ApoA-I、SM和DPPG的复合物以及具有相似分子量组成的复合物而言,该重量:重量比的范围为1:2.6至1:3,且优选为1:2.7。在一些具体的实施方案中,ApoA-I蛋白部分与脂质部分的比的范围通常为约1:2.7至约1:3,其中1:2.7是优选的。这相应于ApoA-I蛋白与磷脂的摩尔比为约1:90至1:140。因此,本公开提供了复合物,其中所述蛋白与脂质的摩尔比为约1:90至约1:120、约1:100至约1:140或者约1:95至约1:125。具体地在处于该优选比时,所述ApoA-I蛋白部分以及SM和DPPG脂质部分形成基本上均质的复合物,其具有与天然HDL相同的粒度和电荷特征,如经柱色谱法和凝胶电泳所分别测定。
荷负电的脂蛋白复合物粒度可通过改变Ri来控制。也就是说,Ri越小,圆盘越小。例如,大的盘状圆盘一般具有的Ri的范围为约200:1至100:1,而小的盘状圆盘一般具有的Ri的范围为约100:1至30:1。
在一些具体实施方案中,所述荷负电的脂蛋白复合物为大的盘状圆盘,其含有2-4个ApoA-I等价物(例如2-4个ApoA-I分子、1-2个ApoA-IM二聚体分子或者12-40个单螺旋肽分子)、1个负电荷磷脂分子和400个SM分子。在其它具体实施方案中,所述荷负电的脂蛋白复合物为小的盘状圆盘,其含有2-4个ApoA-I等价物;1-10个、更优选3-6个负电荷磷脂分子;以及90-225个、更优选100-210个SM分子。
6.3.1.复合物和粒度的测量
脂蛋白复合物的组成以及它们的粒度和在制备所述脂蛋白复合物中所用的脂质颗粒的粒度可使用本领域已知的各种技术来确定。
溶液中的脂蛋白复合物的蛋白和脂质浓度可由本领域已知的任何方法来测量,包括但不限于蛋白和磷脂测定、色谱法诸如HPLC、凝胶过滤、GC,所述GC偶联有各种检测器包括质谱检测、UV或者二极管阵列、荧光、弹性光散射等。脂质和蛋白的完整性也可通过相同的色谱技术以及肽作图、SDS-PAGE凝胶电泳、ApoA-I的N-和C-末端序列测定以及用于确定脂质氧化的标准测定来确定。
脂蛋白复合物以及在制备所述脂蛋白复合物中所用的脂质颗粒的粒度范围如本申请所述。脂质粒度和/或者脂质和蛋白复合物粒度可使用本领域已知的方法来确定。示例性方法包括动态光散射和凝胶渗透色谱法。
动态光散射(DLS),也称为光子相关光谱学,其测量轰击在溶液中经布朗运动移动的颗粒的光束的波长位移。具体地,当被激光照明时所述移动的颗粒散射光以及所导致的所述散射光的强度波动可用于计算溶液中的球状粒度分布。参见,Zetasizer Nano SeriesUser Manual,MAN0317Issue 2.1(July 2004)。DLS确定了溶液中的颗粒的强度分布以及平均值,基于此,可计算颗粒体积和数目分布以及平均值。DLS技术可用于确定用于制备脂蛋白复合物的脂质颗粒的粒度以及脂蛋白复合物本身的粒度。适当的DLS仪器为ZetasizerNano by Malvern Instruments。
凝胶渗透色谱法(GPC)也可用于确定含有蛋白的复合物的粒度。基于分子大小,凝胶渗透色谱法将混合物中的成分分离。脂质-蛋白复合物的粒度可通过以下方法来确定:将复合物的洗脱特征与已知的标准或者参比样品的洗脱特征进行比较,通常通过与校正曲线比较。参比样品为可商购得到的且可包括蛋白和非蛋白标准品,诸如白蛋白、铁蛋白和维生素B12。Current Protocols in Molecular Biology(1998),Section IV,10.9.1-10.9.2。
用于制备本公开的脂蛋白复合物的脂质颗粒的粒度可为至少45nm、至少50nm、至少55nm、至少60nm,如经DLS(例如使用基于强度的测量)测量。此外,脂质颗粒的粒度可为至多65nm、至多70nm、至多80nm、至多90nm、至多100nm、至多120nm、至多150nm、至多200nm、至多250nm、至多300nm或者至多500nm,如经DLS测量。
本公开的脂蛋白复合物的粒度范围可为4nm至15nm、6nm至15nm、4nm至12nm、5to12nm、6nm至12nm、8nm至12nm或者8nm至10nm,如经本申请所述的技术测量。
6.4.脂蛋白复合物群体
本公开进一步提供了本申请所述的脂蛋白复合物群体。所述群体包含多个本申请所述的脂蛋白复合物,其各自包含蛋白部分和脂质部分,所述蛋白部分和脂质部分例如如本申请段落6.3中所述。申请人已经发现了认为单独地或者组合地对于脂蛋白复合物群体的效能和安全性特征起作用的若干特征。脂蛋白复合物群体可结合本申请所述的单独的或者组合的任何数目的特征。
首先,认为群体中的脂蛋白复合物的均一性(即群体中的一种或者多种离散的脂蛋白复合物的普及性,如经群体中的脂蛋白复合物的一个或者多个离散的峰所表示)以及成熟的未修饰的载脂蛋白的脂蛋白复合物的普及性增强了效能。因此,所述脂蛋白复合物的群体可包含蛋白部分以及脂质部分,所述蛋白部分包含载脂蛋白例如ApoA-I或者基本上由载脂蛋白例如ApoA-I构成,且其中所述群体为至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或者至少99%均质的,如经凝胶渗透色谱法的单峰中的群体百分数所测量。
在一些实施方案中,群体中的脂蛋白复合物的粒度的范围可为4nm至15nm,例如5nm至12nm、6nm至15nm或者8nm至10nm。
群体中的载脂蛋白例如ApoA-I可为成熟的优选全长(未截短的)ApoA-I,且所述群体可含有至少75wt%、至少80wt%、至少85wt%、至少90wt%、至少95wt%、至少96wt%、至少97wt%、至少98wt%、至少99wt%的成熟的优选全长(未截短的)ApoA-I。在一些实施方案中,所述群体包含不超过25wt%、不超过20wt%、不超过15wt%、不超过10wt%或者不超过5wt%的不成熟或者不完全加工的ApoA-I和/或者不超过20wt%、不超过15wt%、不超过10wt%或者不超过5wt%的截短的ApoA-I。
第二,复合物中的载脂蛋白和脂质的纯度以及脂蛋白复合物中的污染物的相对缺失,也称为脂蛋白复合物的纯度,被认为降低副作用诸如肝酶(例如转氨酶)增加所反映的肝损伤的风险。载脂蛋白的纯度可由氧化和/或者脱酰胺作用的相对缺失来测量。因此,在某些实施方案中,脂蛋白复合物群体可具有降低量的氧化的载脂蛋白,诸如不超过20%、不超过15%、不超过10%、不超过5%、不超过4%、不超过3%、不超过2%、不超过1%的氧化的蛋氨酸,具体为蛋氨酸-112或者蛋氨酸-148,或者不超过15%、不超过10%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的氧化的色氨酸。脂蛋白复合物群体也可具有降低的百分比的被脱去酰胺的氨基酸,例如不超过15%、不超过10%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的脱氨氨基酸。
还希望控制脂蛋白复合物中的脂质纯度。因此,在一些实施方案中,所述群体中不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的脂质被氧化。
复合物及其群体的纯度的另外的测量为由产生或者纯化载脂蛋白的方法或者制备所述脂蛋白复合物本身的方法所产生的污染物的减少或者缺失。因此,当所述载脂蛋白由宿主细胞例如哺乳动物宿主细胞纯化时,所述脂蛋白复合物群体优选不含宿主细胞DNA或者蛋白。在一些具体的实施方案中,所述群体含有不超过500纳克、不超过200纳克、不超过100纳克、不超过50纳克或者不超过20纳克的宿主细胞蛋白/毫克的脂蛋白,和/或者不超过100皮克、不超过50皮克、不超过25皮克、不超过10皮克或者不超过5皮克的宿主细胞DNA/毫克的脂蛋白,通常为ApoA-I。
可产生并且应避免的其它污染物为内毒素以及溶剂和洗涤剂,所述内毒素可存在于细胞培养物和血浆样品等中,且所述溶剂和洗涤剂可取决于用于制备和/或者纯化所述脂蛋白复合物的方法而存在。脂蛋白复合物群体可含有至多约1EU、约0.5EU、约0.3EU或者约0.1EU的内毒素/毫克的脂蛋白例如ApoA-I。脂蛋白复合物群体也可被限制为含有不超过200ppm、250ppm、100ppm的非水溶剂。在一个具体的实施方案中,所述群体不含有任何洗涤剂,例如胆酸盐。
此外,使用本申请公开的方法,将大多数载脂蛋白起始物质掺入至复合物中是可能的,从而限制存在于群体中的非复合的载脂蛋白的量。非复合的载脂蛋白的量的降低是有益的,这是因为其降低由于暴露至异源性蛋白所导致的免疫源应答的风险。所述脂蛋白复合物的群体可具有以下组成:其中至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或者100%的蛋白存在于脂蛋白复合物(即复合形式)中。任选地,所述脂蛋白复合物的群体可具有以下组成:其中至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或者100%的脂质存在于脂蛋白复合物中。
任选地,所述群体可包含这样的复合物,其中所述脂质部分包含占脂质重量不超过15%、不超过10%、不超过5%、不超过4%、不超过3%、不超过2%、不超过1%或者0%的胆固醇。
某些脂质和蛋白成分可形成多个不同的但均质的脂蛋白复合物。因此,本公开还提供了组合物,其包含两个、三个或者四个脂蛋白复合物群体,所述脂蛋白复合物包含不同量的载脂蛋白分子(例如两个、三个或者四个ApoA-I分子或者ApoA-I等价物)。在示例性实施方案中,组合物包含两个脂蛋白复合物群体,即分别为包含具有2个ApoA-I分子或者ApoA-I等价物/脂蛋白复合物的脂蛋白复合物的第一群体,包含具有3或者4个ApoA-I分子或者ApoA-I等价物/脂蛋白复合物的脂蛋白复合物的第二群体,以及任选的包含具有4或者3个ApoA-I分子或者ApoA-I等价物/脂蛋白复合物的脂蛋白复合物的第三群体。
包含两个或者更多个脂蛋白复合物群体的组合物优选具有低水平的非复合的脂蛋白和/或者脂质。因此,组合物中优选不超过15%、不超过12%、不超过10%、不超过9%、不超过8%、不超过7%、不超过6%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的脂质为非复合形式,和/或者组合物中不超过15%、不超过12%、不超过10%、不超过9%、不超过8%、不超过7%、不超过6%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的脂蛋白为非复合形式。
本申请还提供了特别用于商业应用的脂蛋白复合物或者其群体的大规模制备,诸如用于治疗目的的脂蛋白复合物的大规模制备。本申请涵盖的制剂包括脂蛋白复合物的群体,例如本申请所述的荷负电的脂蛋白复合物。
本申请提供了制剂,其脂蛋白复合物的体积、量和所得浓度适于按照商业规模制备组合物例如药物组合物和剂型。典型的制剂体积的范围为约5L至约50L,或者更多,例如,约10L至约40L、约15L至约35L、约15L至约30L、约20L至约40L、约20L至约30L、约25L至约45L、约25L至约35L。制剂体积可为约5L、约6L、约7L、约8L、约9L、约10L、约11L、约12L、约13L、约14L、约15L、约16L、约17L、约18L、约19L、约20L、约25L、约30L、约35L、约40L、约45L或者约50L。在一个优选的实施方案中,所述制剂具有约20L的体积。
制剂进一步含有脂蛋白复合物或者其群体,其量足以实现范围为约5mg/mL至多至约15mg/mL、5mg/mL至约10mg/mL、约10mg/mL至约15mg/mL或者约8mg/mL至约12mg/mL的载脂蛋白的载脂蛋白浓度。取决于制剂的体积,所述量的范围可为约25g至多至约350g,其表示为在制剂中载脂蛋白例如ApoA-I的量。在一个具体的实施方案中,所述制剂含有约8mg/mL的ApoA-I。
在一个具体的实施方案中,所述制剂具有15L至25L的体积且含有约100g至约250g的ApoA-I。在另外的具体实施方案中,所述制剂具有30L至50L的体积且含有约240g至约780g的ApoA-I。
6.5.制备脂蛋白复合物的方法
6.5.1.基于热循环的制备脂蛋白复合物的方法
已经发现,使用本申请所述的蛋白和脂质成分的热循环的方法可用于产生脂蛋白复合物且具有优于其它方法的优势。在本申请提供的热循环方法中,蛋白成分和脂质成分经历热循环,直到大部分蛋白成分(例如至少60%、至少70%、至少80%或者至少90%)与脂质成分复合,从而形成脂蛋白复合物。本领域技术人员应该认识到,该方法优于用于产生脂蛋白复合物的其它方法的优势包括:导致基本上均质的且纯的终产物的高复合效能,在所得的产物中存在极少的副产物至没有副产物(例如非复合的蛋白)或者制备杂质(例如洗涤剂或者表面活性剂、降解蛋白、氧化成分),从而避免对于高成本和高消耗的纯化步骤的需求。因此,所述方法是有效的且导致起始物质极少-至-无浪费。此外,所述方法易于扩大规模且具有低仪器消耗。不使用工业溶剂而进行这些方法的能力使得它们也是环境友好的。
优选地,为了使得蛋白和脂质成分的氧化最小化,复合物形成(包括脂质成分的均质化)的一个、多于一个或者所有步骤在惰性气体(例如氮气、氩气或者氦气)层下进行。
6.5.2.脂质成分
本公开的热循环方法可采用单独或者组合的多种脂质,包括饱和的、不饱和的、天然的和合成的脂质和/或者磷脂,如上在段落6.2中所述。
可使用产生脂质颗粒的任何方法制备脂质,用于与蛋白成分一起热循环,诸如多层脂囊(“MLV”)、小单层脂囊(“SUV”)、大单层脂囊(“LUV”)、胶束、分散体等。
用于产生脂质颗粒的一系列技术是已知的。已经使用各种规程产生脂质颗粒,形成不同类型的脂囊。优选的是在本公开热循环方法中使用的颗粒的粒度范围主要为45-80nm,最优选55nm至75nm。
高压匀浆例如微流化有利地产生具有适当粒度的颗粒。所述匀浆压力优选为至少1,000巴、至少1,200巴、至少1,400巴、至少1,600巴、至少1,800巴,且最优选至少2,000巴,例如至少2,200巴、至少2,400巴、至少2,600巴、至少2,800巴、至少3,000巴、至少3,200巴、至少3,400巴、至少3,600巴、至少3,800巴或者至少4,000巴。在一些具体的实施方案中,所述匀浆压力的范围为前述数值的任意一对之间,例如1,600至3,200巴;1,800至2,800巴;1,900至2,500巴;2,000至2,500巴;2,000至3,000巴;2,400至3,800巴;2,800至3,400巴等。1巴等于100kPa、1,000,000达因/平方厘米(巴)、0.987atm(大气压)、14.5038psi、29.53inHg和750.06托。
在一种适当的匀浆方法中,将脂质的乳液转移至Microfluidizer Model 110Y(Microfluidics Inc,Newton,Mass.)的填料容器中。将所述单元浸没在浴中以在匀浆过程中保持工艺温度(例如55℃、58℃、62℃等),且将其在使用前用惰性气体诸如氩气冲洗。启动后,使得所述乳液以连续的再循环和跨越相互作用顶部的压力梯度经过匀浆器,历时5-20分钟。在不存在蛋白成分的情况下所述脂质成分的匀浆防止所述蛋白成分被匀浆技术中使用的高剪切破坏。
也可适当使用其它方法,条件是可获得具有适当粒度的颗粒。例如,脂质通过含水溶液的水合可导致脂质的分散和多层脂囊(“MLV”)的自发形成。MLV为具有围绕中心含水核心的多个脂质双层的颗粒。这些类型的颗粒大于小单层脂囊(SUV)且直径可为350-400nm。MLV可通过以下方法来制备:将脂质在圆底烧瓶中在氯仿中溶解,并蒸发所述氯仿,直到所述脂质在烧瓶壁上形成薄层。加入所述含水溶液并使得所述脂质层再水化。在烧瓶旋动或者涡旋时形成脂囊。Deamer et al.,1983,in Liposomes(Ostro,Ed.),Marcel Dekker,Inc.New York(citing Bangham et al.,1965,J.Mol.Biol.13:238)。该方法也可用于产生单一片状脂囊。Johnson et al.,1971,Biochim.Biophys.Acta 233:820。
小单层脂囊(SUV)为具有封闭含水核心的单一脂质双层的颗粒。取决于用于产生SUV的方法,它们的粒度的直径范围为25-110nm。第一SUV通过以下方法制备:将在氯仿中的磷脂制剂在氮气下干燥,加入水层以产生毫摩尔范围的脂质浓度,并在45℃超声所述溶液至澄清。Deamer et al.,1983,in Liposomes(Ostro,Ed.),Marcel Dekker,Inc.New York。以该方式制备的SUV获得直径范围为25-50nm的颗粒。
制备SUV的另外的方法为将乙醇/脂质溶液快速注射至含水溶液以包囊。Deameret al.,1983,in Liposomes(Ostro,Ed.),Marcel Dekker,Inc.New York(citing Batzriet al.,1973,Biochim.Biophys.Acta 298:1015)。由该方法产生的SUV的粒度的直径范围为30-110nm。
SUV也可通过以下方法来制备:使得多层脂囊在20,000psi经过French Press达四次。所产生的SUV的粒度的直径范围为30-50nm。Deamer et al.,1983,in Liposomes(Ostro,Ed.),Marcel Dekker,Inc.New York(citing Barenholz et al.,1979,FEBSLetters 99:210)。
多层和单层磷脂脂囊也可通过将磷脂的含水制剂在高压经过小孔膜挤出来形成(Hope et al.,1996,Chemistry and Physics of Lipids,40:89-107)。
大单层脂囊与SUV类似,原因在于它们均为围绕所述中心含水核心的单一脂质双层,但LUV远大于SUV。取决于它们的组成部分以及用于制备它们的方法,LUV的粒度的直径范围为50-1000nm。Deamer et al.,1983,in Liposomes(Ostro,Ed.),Marcel Dekker,Inc.New York。通常使用以下三种方法中的一种来制备LUV:洗涤剂稀释、反相蒸发以及输注。
在洗涤剂稀释技术中,洗涤剂溶液诸如胆酸盐、脱氧胆酸盐、辛基葡糖苷、庚基葡糖苷和Triton X-100用于形成来自脂质制备的胶束。然后将所述溶液透析以除去所述洗涤剂。Deamer et al.,1983,in Liposomes(Ostro,Ed.),Marcel Dekker,Inc.New York。
所述反相蒸发技术将脂质在含水非极性溶液中溶解,形成倒置的胶束。将所述非极性溶剂蒸发并将所述胶束凝聚以形成LUV。该方法通常需要大量脂质。
所述输注方法将溶解在非极性溶液中的脂质注射至水溶液中以包囊。当所述非极性溶液蒸发时,在气体/液体界面上收集脂质。当气体鼓泡经过所述水溶液时,所述脂质片形成LUV和少层颗粒。将颗粒滤过以划分粒度。Deamer et al.,1983,in Liposomes(Ostro,Ed.),Marcel Dekker,Inc.New York(citing Deamer et al.,1976,Biochim.Biophys.Acta 443:629and Schieren et al.,1978,Biochim.Biophys.Acta542:137)。
可表征所得的脂质制剂的等分溶液以证实所述脂质颗粒适用于作为本申请公开的热循环方法中的脂质成分。脂质制剂的表征可使用本领域已知的任何方法来进行,包括但不限于尺寸排阻过滤、凝胶过滤、柱过滤、凝胶渗透色谱法以及非变性凝胶电泳。
6.5.3.蛋白成分
脂蛋白复合物的蛋白成分并不是本公开热循环方法成功的关键所在。事实上,提供治疗和/或预防益处的任何脂质-结合蛋白诸如载脂蛋白和/或其衍生物或类似物均可包括在该复合物中。此外,由于在与脂质缔合时可活化LCAT或形成盘状的颗粒而“模拟”载脂蛋白(诸如ApoA-I)活性的任何α螺旋肽或肽类似物或任何其它类型的分子可包括在脂蛋白复合物中,并且由此而包括在“脂质-结合蛋白”的定义内。可在热循环方法中使用的脂质-结合蛋白包括如上在段落6.1中所述的那些。所述脂质-结合蛋白可如上在段落6.1.2中所述重组产生。所述脂质-结合蛋白可通过本申请所述的任何方法纯化,包括如上在段落6.1.3或者段落6.1.4中所述的方法。
本领域熟知的是,所述蛋白成分可由动物来源(且具体地来自人来源)纯化,化学合成或者重组产生,参见例如Chung et al.,1980,J.Lipid Res.21(3):284-91;Cheung etal.,1987,J.Lipid Res.28(8):913-29。也参见美国专利5,059,528、5,128,318、6,617,134;美国公开20002/0156007、2004/0067873、2004/0077541和2004/0266660;以及PCT公开WO/2008/104890和WO/2007/023476。
所述蛋白成分可包含脂质,其中蛋白/肽与脂质的比为在预期复合物中的蛋白/肽与脂质的比的至少5-倍(例如至少5-倍、至少10-倍或者至少20-倍)。例如,为了产生其中预期的蛋白与脂质比为1:200(基于摩尔浓度)的脂蛋白复合物,所述蛋白成分中的蛋白可与脂质以例如1:10至1:20的比例混合,所述脂质通常为仅表示最终复合物中的脂质的少部分的脂质。并未暗示任何机制,当预期的复合物具有多于一种类型的脂质时,所述蛋白与少量的脂质的该“前-”复合是有用的,这允许在由热循环产生的脂蛋白复合物中以少量(例如在预期的脂蛋白复合物中,占总脂质的重量的10%或者更低、5%或者更低、3%或者更低、2%或者更低或者1%或者更低)存在的脂质的更均匀的分布。
6.5.4.由热循环产生脂蛋白复合物
所述方法通常使得包含脂质颗粒和脂质结合蛋白的混悬液在“高”温度范围和“低”温度范围之间进行热循环,直到形成脂蛋白复合物。
进行热循环的混悬液含有脂质成分和蛋白成分,其优选在高温度范围内的温度混合在一起以形成“起始”混悬液,然后使其进行热循环。
起始混悬液中的脂质和蛋白的最佳比例可由在待产生的最终脂蛋白复合物中的成分的预期化学计量来确定。本领域技术人员应该认识到,除了其它因素之外,脂质部分与蛋白部分的摩尔比将取决于蛋白成分中的蛋白和/或者肽的性质、脂质部分中的脂质的性质和量以及脂蛋白复合物的预期粒度。脂蛋白复合物中的适当的脂质与蛋白比可以使用本领域已知的任何数目的功能性测定来确定,所述功能性测定包括但不限于凝胶电泳迁移率测定、尺寸排阻色谱法、与HDL受体的相互作用、经由ATP-结合盒转运子(ABCA1)的识别、肝的摄取以及药物动力学/药效学。例如,可以使用凝胶电泳迁移率测定来确定复合物中脂质成分与蛋白成分的最佳比例。当本公开的方法所产生的复合物荷电(作为在脂质成分中包含磷脂的结果)时,应将所述复合物设计成类似于天然前-β-HDL或α-HDL颗粒的电泳迁移率。因此,在一些实施方案中,可将天然前-β-HDL或α-HDL颗粒用作确定复合物的迁移率的标准品。
在优选的实施方案中,最终复合物具有至少一种载脂蛋白或者载脂蛋白模拟物(最优选分别为成熟人ApoA-I或者ApoA-I肽)、至少一种中性脂质以及至少一种荷负电的脂质,诸如在PCT WO2006/100567中所述的那些,将其内容通过引用的方式并入本申请。
由于认为载脂蛋白(诸如ApoA-I)的生物活性受构成载脂蛋白的两亲性螺旋介导,因此可方便地使用ApoA-I蛋白当量来表示脂质:载脂蛋白摩尔比的载脂蛋白部分。一般公认ApoA-I含有6-10个两亲性螺旋,并且其取决于用来计算螺旋的方法。根据载脂蛋白含有的两亲性螺旋数目,可以ApoA-I当量来表示其它的载脂蛋白。例如,通常以二硫桥键二聚体存在的ApoA-IM可表示为2当量的ApoA-I,原因是每分子ApoA-IM含有的两亲性螺旋是每分子ApoA-I的两倍。相反,含有一个两亲性螺旋的肽载脂蛋白可以表示为1/10-1/6当量的ApoA-I,原因是其每分子含有的两亲性螺旋是每分子ApoA-I的1/10-1/6。
一般而言,脂蛋白复合物的脂质:ApoA-I当量摩尔比(本申请定义为“Ri”)的范围为约2:1至200:1。在一些实施方案中,所述Ri为约50:1至150:1,或者75:1至125:1、10:1至175:1。对于磷脂,可使用约650-800的MW获得重量比。
在某些实施方案中,所述成分的摩尔比为2-6(荷负电的脂质,例如DPPG):90-120(中性脂质,例如SM):1(ApoA-I等价物)。在一个具体的实施方案中,如在实施例1中所述,所述复合物包含以约108:1的脂质与蛋白摩尔比的DPPG、SM和ApoA-I,其中DPPG表示3wt%(+/-1%)的总脂质且SM表示97wt%(+/-5%)的脂质。
在开始热循环之前,起始混悬液中的脂质和蛋白成分的浓度的范围可为1至30mg/ml浓度的ApoA-I等价物以及1至100mg/ml浓度的脂质。在一些具体的实施方案中,蛋白成分的浓度选自1至30mg/ml、2至20mg/ml、5至20mg/ml、2至10mg/ml、5至15mg/ml、5至20mg/ml和10至20mg/ml,且脂质成分的浓度独立选自10至100mg/ml、10至75mg/ml、25至50mg/ml、10至75mg/ml、25至100mg/ml、25至75mg/ml和1至75mg/ml。
热循环方法的高和低温度范围是基于脂蛋白复合物的脂质和蛋白成分的相转变温度。可选择地,当脂质成分不显示限定的或者离散的相转变时,如可在使用具有不饱和脂肪酸链的磷脂或者磷脂混合物时所发生,热循环的高和低度范围的差异在于至少约20℃,至多至约40℃或者更大。例如,在一些实施方案中,所述高和低度范围的差异为20℃-30℃、20℃-40℃、20℃-50℃、30℃-40℃、30℃-50℃、25℃-45℃、35℃-55℃。
对于脂质,相转变包括由紧密填充的有序结构(已知为凝胶状态)向疏松填充的较无序结构(已知为流体状态)的变化。脂蛋白复合物通常在本领域中通过以下方法形成:将脂质颗粒和载脂蛋白在接近使用的具体脂质或者脂质混合物的转变温度的温度孵育。脂质成分的相转变温度(其可由量热法确定)+/-5℃-10℃表示在本公开的方法中的“低”温度范围。
对于蛋白,相转变温度包括由折叠的三维结构向二维结构的变化。对于脂质,相转变包括由紧密填充的有序结构(已知为凝胶状态)向疏松填充的较无序结构(已知为流体状态)的变化。脂蛋白复合物通常在本领域中通过以下方法形成:将脂质颗粒和载脂蛋白在接近使用的具体脂质或者脂质混合物的转变温度的温度孵育。
脂质成分的相转变温度(其可由量热法确定)+/-12℃、更优选+/-10℃表示在本公开的方法中的“低”温度范围。在某些实施方案中,所述低温度范围为脂质成分的相转变温度+/-3℃、+/-5℃或者+/-8℃。在一个具体实施方案中,所述低温度范围为所述脂质成分的相转变温度的不小于-5℃或者不小于-10℃至所述脂质成分的相转变温度的+5℃。
对于蛋白,相转变温度包括由三级结构向二级结构的变化。蛋白成分的相转变温度+/-12℃、更优选+/-10℃表示在本公开的方法中的“高”温度范围。在一些具体的实施方案中,所述高温度范围为蛋白成分的相转变温度+/-3℃、+/-5℃或者+/-8℃。在一个具体实施方案中,所述低温度范围为低于所述蛋白成分的相转变温度达10℃至高于所述蛋白成分的相转变温度达不超过5℃、不超过10℃或者不超过15℃。
使得起始混悬液在高温度和低温度之间、优选起始于高温度来进行热循环,直到将起始混悬液中至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或者至少99%的蛋白掺入至脂蛋白复合物中。使用适当的化学计量的脂质和蛋白成分,可在若干循环之后实现脂质和蛋白成分的基本上完全复合。循环的次数取决于蛋白和脂质成分、循环的持续时间,但通常基本上完全复合将需要5次或者更多次循环、10次或者更多次循环或者15次或者更多次循环(在高和低温度)。所述循环的范围通常为2分钟至60分钟。在一些具体的实施方案中,在每个温度,所述循环的范围为5至30分钟、10至20分钟、5至20分钟、2至45分钟或者5至45分钟。
由所述方法产生的复合物通常为超分子集合物,其形态为胶束、脂囊、球状或者盘状颗粒且具有均匀的粒度分布,其中所述蛋白成分以所述磷脂和蛋白之间的具体化学计量范围物理结合至所述磷脂。本方法有利地导致起始混悬液中的脂质和/或者蛋白的基本上完全复合,产生基本上不含脂质和/或者不含蛋白的组合物,如经分离方法诸如色谱法所观察。因此,本公开的方法可在不存在纯化步骤的情况下进行。
本公开的方法有利地产生粒度分布均匀的复合物,这避免了对于粒度分级的需求。
在本公开的一些实施方案中,所述脂蛋白复合物将含有多于一种类型的脂质,包含相对少量(例如小于10%、小于5%、小于3%或者小于1%的脂质成分)的一种或者多种脂质。为了优化分散,以少量使用的脂质可预先与蛋白成分共混,而不是掺入至脂质成分中的脂质颗粒。
可对所得的脂蛋白复合物的等分溶液进行表征以证实所述复合物具有预期的特征,例如所述蛋白成分基本上完全的(例如>90%、>95%、>97%或者>98%)掺入至所述脂质成分中。复合物的表征可使用本领域已知的任何方法来进行,包括但不限于尺寸排阻过滤、凝胶过滤、柱过滤、凝胶渗透色谱法以及非变性凝胶电泳。
本申请所述的脂蛋白复合物或者组合物的均质性和/或者稳定性可由本领域已知的任何方法来测量,所述方法包括但不限于色谱方法诸如凝胶过滤色谱法。例如,在一些实施方案中,单峰或者有限数目的峰可与稳定的复合物相关。所述复合物的稳定性可通过监测随时间推移新的峰的出现来确定。新的峰的出现为由于颗粒的不稳定性所导致的复合物的重组的征象。
优选地,为了使得蛋白和脂质成分的氧化最小化,所述热循环在惰性气体层(例如氮气、氩气或者氦气)下进行。
6.5.5.制备脂蛋白复合物的其它方法
可以将本申请所述的脂蛋白复合物(包括荷负电的脂蛋白复合物)制备成多种形式,其包括但不限于囊泡、脂质体、脂蛋白体、胶束和盘状的颗粒。除了如上所述的热循环方法之外,可以使用本领域技术人员公知的多种方法来制备所述脂蛋白复合物。可以使用大量可用于制备脂质体或脂蛋白体的技术。例如,载脂蛋白可以与合适的磷脂一起超声(使用超声浴或探针超声波仪)以形成复合物。可选择地,载脂蛋白例如ApoA-I可以与预成型的脂质囊泡组合以便自发形成脂蛋白复合物。还可以通过洗涤剂透析法或通过使用挤出装置或通过均化作用来形成荷电的脂蛋白复合物,所述洗涤剂透析法例如将载脂蛋白、荷电的磷脂和SM以及诸如胆酸盐的洗涤剂的混合物进行透析,以除去洗涤剂并重构形成荷负电的脂蛋白复合物(参见,例如Jonas et al.,1986,Methods in Enzymol.128:553-82)。
在一些实施方案中,复合物通过使用高压(例如约32000p.s.i.)进行均化达约40、约50或者约60分钟来制备。在一个具体的实施方案中,包含ApoA-I、SN和DPPG的复合物如下制备。将ApoA-I溶解于磷酸盐缓冲剂中,并在50℃与DPPG在磷酸盐缓冲剂中的分散液(使用高剪切混合器制备)一起孵育。然后将所述ApoA-I/DPPG混合物与SM的分散液混合,并在高于30,000p.s.i.的压力在30-50℃均化,直到复合物形成基本上完成,如经动态光散射或者凝胶渗透色谱法监测。
在一些实施方案中,通过美国公开2004/0067873的实施例1中描述的胆酸盐分散法来制备脂蛋白复合物,将其内容通过引用的方式并入本申请。简要地,将干燥的脂质在NaHCO3缓冲液中进行水合,然后进行涡旋和超声直至所有脂质分散。加入胆酸盐溶液,并将该混合物孵育30分钟,同时周期性进行涡旋和超声,直至该混合物变澄清,此时表明形成了脂质胆酸盐胶束。加入原ApoA-I的NaHCO3缓冲液,并将该溶液在约37℃-50℃孵育1小时。
可以通过本领域公知的方法除去胆酸盐。例如,可以通过透析、超滤而除去胆酸盐,或者通过吸附吸收至亲合珠(affinity bead)或树脂而除去胆酸盐分子。在一个实施方案中,将亲合珠,如BIO-(Bio-Rad实验室)加于荷负电的脂蛋白复合物与胆酸盐的制剂以吸附胆酸盐。在另一个实施方案中,将该制剂,比如脂蛋白复合物与胆酸盐的胶束制剂通过填装有亲合珠的柱子。
在一个具体的实施方案中,通过将该制剂装载于注射器内的BIO-上而由脂蛋白复合物制剂除去胆酸盐。然后使用隔膜密封该注射器并于4℃摇摆孵育过夜。使用前,通过将该溶液注射通过BIO-而除去胆酸盐,胆酸盐在BIO-中被所述珠吸附。
当具有类似于HDL,特别是类似于前-β-1或前-β-2HDL群中的HDL的尺寸与密度时,本申请所述的脂蛋白复合物诸如荷负电的脂蛋白复合物预期具有延长的循环半衰期。可以通过冷冻干燥来制备具有较长有效期的稳定制剂。在一些实施方案中,使用通常为本领域已知的共冷冻干燥法来制备ApoA-I-脂质复合物。简要地,共冷冻干燥步骤包括将ApoA-I和脂质的混合物一起溶解于有机溶剂或溶剂混合物中,或者将ApoA-I和脂质单独溶解后再把它们混合到一起。用于共冷冻干燥的溶剂或溶剂混合物的期望特征包括:(i)能够溶解疏水性脂质和两性蛋白质的介质相对极性,(ii)溶剂应属于根据FDA溶剂指导原则(联邦公报,第247号,62卷)的2或3类溶剂,以避免与残留的有机溶剂相关的潜在毒性,(iii)具有较低的沸点以确保冷冻干燥过程中更易除去溶剂,(iv)具有较高的熔点以便提供更快速的冷冻、更高的冷凝温度,以及由此更少的冷冻干燥器损耗。在一些实施方案中,使用了冰醋酸。还可以使用如甲醇、冰醋酸、二甲苯或环己烷的组合。
然后将ApoA-I-脂质溶液进行冷冻干燥以获得均质的粉末。可以对冷冻干燥的条件进行优化以获得溶剂的快速蒸发,并使冷冻干燥的载脂蛋白-脂质粉末中残留溶剂的量达到最少。冷冻干燥条件的选择可由本领域技术人员确定,并且其取决于溶剂的特性、容器的类型和尺寸、容纳的溶液、填装体积以及使用的冷冻干燥机的性能。
所述冷冻干燥的脂蛋白复合物可用于制备用于药物再配制的散装供应品(bulksupplies),或者制备可以重构以获得脂蛋白复合物的溶液或者混悬液的单独等分部分或剂量单位。对于重构,使用水溶液将冷冻干燥的粉末再水化为适当的体积(例如5mg多肽/ml,其便于静脉内注射)。在一些实施方案中,使用磷酸盐缓冲盐水或者生理盐水溶液将冷冻干燥的粉末再水化。可将所述混合物振摇或者涡旋以便于再水化。重构步骤可在等于或者大于复合物的脂质成分的相转变温度的温度进行。
在冷冻干燥的载脂蛋白-脂质粉末与具有合适pH和渗透压的水性介质进行水合后可自发形成ApoA-I-脂质复合物。在一些实施方案中,该水合介质含有稳定剂,选自但不限于蔗糖、海藻糖和甘油。在一些实施方案中,为了形成复合物,将该溶液加热超过脂质的转变温度几次。脂质与蛋白的比可为1:1至200:1(摩尔/摩尔),且优选3:1至2:1的脂质:蛋白(w/w),更优选2.7:1至2.1:1的脂质:蛋白(w/w),例如7:1的脂质:蛋白(w/w)。将粉末进行水合以获得最终的复合物浓度,其以蛋白当量表示为约5-30mg/ml。
在多个实施方案中,通过将多肽溶液的NH4CO3水溶液进行冷冻干燥而获得ApoA-I粉末。然后ApoA-I与脂质(例如鞘磷脂)的均匀溶液通过以下方法形成:将脂质粉末与ApoA-I粉末溶解于冰醋酸中。然后将该溶液进行冻干,并通过使所得的粉末与水性介质水合而形成类似于HDL的载脂蛋白-脂质复合物。
在一些实施方案中,可以通过将磷脂与蛋白溶液或混悬液进行共冷冻干燥而形成ApoA-I-脂质复合物。可以将ApoA-I和脂质(例如磷脂)于有机溶剂或有机溶剂混合物中的均匀溶液进行冻干,并且可以通过使冻干的粉末与水性缓冲液水合而自发形成ApoA-I-脂质复合物。用于该方法的有机溶剂和溶剂混合物的实例包括但不限于乙酸、乙酸/二甲苯混合物、乙酸/环己烷混合物以及甲醇/二甲苯混合物。
可对所得的重构制剂的等分溶液进行表征以证实所述复合物具有预期的粒度分布;例如,HDL的粒度分布。用于表征所述粒度的示例性方法为凝胶过滤色谱法。具有已知分子量和斯托克斯直径的一系列蛋白以及人HDL可用作用于定标所述柱的标准物。
在其它实施方案中,重组ApoA-I-脂质复合物通过将ApoA-I与脂质复合来制备,如在美国专利公开2006/0217312和国际公开WO 2006/100567(PCT/IB2006/000635)所披露,将其内容通过引用方式并入本申请。
美国专利6,004,925、6,037,323、6,046,166和6,287,590(将其内容通过引用方式并入本申请)公开了一种用于制备具有类似于HDL性质的荷负电的脂蛋白复合物的简单方法。这种方法包括载脂蛋白与脂质溶液在有机溶剂(或溶剂混合物)中的共冷冻干燥以及冷冻干燥的粉末在水合过程中形成荷负电的脂蛋白复合物,且该方法具有以下优势:(1)该方法需要很少的步骤;(2)该方法使用价格低廉的溶剂;(3)所包括的成分中的大部分或全部均被用来形成设计的复合物,因而避免了对于其它方法而言常见的起始材料的浪费;(4)形成了贮存期间很稳定的冻干复合物,因而使所得的复合物可以在即将使用前进行重构;(5)所得的复合物在形成后以及在使用前通常不必进行进一步的纯化;(6)避免了毒性化合物,包括诸如胆酸盐的洗涤剂;和(7)该制造方法易于工业化并且适用于GMP生产(即,在无内毒素的环境中)。
其它适当的方法描述于美国公开的申请2006/0217312和国际公开WO 2006/100567(PCT/IB 2006/000635),将其各自的内容通过引用的方式并入本申请。
优选地,为了使得蛋白和脂质成分的氧化最小化,复合物形成的一个、多于一个或者所有步骤在惰性气体(例如氮气、氩气或者氦气)层下进行。
可以通过本领域已知的任何方法来测量载脂蛋白-脂质颗粒溶液中的蛋白与脂质浓度,所述方法包括但不限于蛋白与磷脂测定以及色谱法,诸如HPLC、凝胶过滤、与各种检测器连接的GC,而所述检测器包括质谱、UV或二极管阵列、荧光、弹性光散射及其它。还可以通过相同的色谱技术以及肽作图、SDS-PAGE凝胶电泳、N-和C-末端的ApoA-I序列测定以及用于确定脂质氧化的标准测定来确定脂质与蛋白的完整性。
6.6.药物组合物
本公开所涵盖的药物组合物包括作为活性成分的荷负电的脂蛋白复合物,该复合物包含在药用的、适用于体内给药和递送的载体中。由于肽可以包含酸性和/或碱性的端链和/或侧链,因此肽模拟的载脂蛋白可以游离酸或碱的形式、或者以药用盐形式包括在该组合物中。还可以使用改性的蛋白,如酰胺化、酰化、乙酰化或聚乙二醇化的蛋白。任选地,所述药物组合物可包含加载有一种或者多种疏水性、亲脂性或者非极性活性剂的脂蛋白复合物,如上在段落6.2和6.3中所述。
可注射的组合物包括活性成分在水性或油性媒介物中的无菌混悬液、溶液或乳剂。该组合物还可包含多种配方成分,如助悬剂、稳定剂和/或分散剂。在一些实施方案中,可注射的组合物包含在磷酸盐缓冲盐水(10mM磷酸钠,80mg/mL蔗糖,pH 8.2)中的荷负电的脂蛋白复合物。用于注射的组合物可以单位剂量形式存在,如,在安瓿中或在多剂量的容器中,并且可包括添加的防腐剂。对于输注,组合物可在输液袋中进行供应,该输液袋由与荷负电的脂蛋白复合物相容的材料制成,如乙烯乙酸乙烯酯或本领域已知的任何其它相容的材料。
适当的剂型包含最终浓度为约5mg/mL至约15mg/mL的脂蛋白的荷负电的脂蛋白复合物。在一个具体的实施方案中,所述剂型包含最终浓度为约8mg/mL至约10mg/mL的载脂蛋白A-I、优选约8mg/mL的荷负电的脂蛋白复合物。
优选地,为了使得蛋白和脂质成分的氧化最小化,所述药物组合物在惰性气体(例如氮气、氩气或者氦气)层下配制和/或者填充。
6.7.治疗方法
事实上,本申请所述的脂蛋白复合物例如荷负电的脂蛋白复合物和组合物可以用于脂蛋白复合物的各种显示为有用的目的。脂蛋白复合物诸如荷负电的脂蛋白复合物有效地动员胆固醇,甚至在以显著低于目前可用的治疗方案所需的载脂蛋白的量的剂量给药(每2-5天给予20mg/kg至100mg/kg,1.4g至8g/平均身高的人类)时。
因此,本公开的复合物和组合物特别用于治疗或者预防心血管疾病、障碍和/或者相关病症。治疗或者预防受试者中的心血管疾病、障碍和/或者相关病症的方法通常包括向所述受试者给予低(<15mg/kg)剂量或者量的本申请所述的脂蛋白复合物或者药物组合物,其根据有效治疗或者预防具体适应症的治疗方案。
以足以或者有效提供治疗益处的量给予脂蛋白复合物。在治疗心血管疾病、障碍和/或者相关病症的情境下,可推断出治疗益处,条件是出现以下的一种或者多种:相比于基线而言胆固醇动员的增加、动脉粥样硬化斑块体积的降低、相比于基线水平而言游离胆固醇的高密度脂蛋白(HDL)部分的增加,而没有平均血浆甘油三酯浓度的增加或者肝转氨酶(或者丙氨酸氨基转移酶)水平的正常范围之上的增加。尽管希望完全治愈,但是完全治愈不是存在治疗益处所必需。
在一些实施方案中,所述脂蛋白复合物以每次注射约2mg/kg ApoA-I等价物至约12mg/kg ApoA-I等价物的剂量给予。在一些实施方案中,所述脂蛋白复合物以约3mg/kgApoA-I等价物的剂量给予。在一些实施方案中,所述脂蛋白复合物以约6mg/kg ApoA-I等价物的剂量给予。在一些实施方案中,所述脂蛋白复合物以约12mg/kg ApoA-I等价物的剂量给予。
待治疗的受试者为患有心血管疾病、障碍和/或者相关病症的个体。可使用本申请所述的脂蛋白复合物和组合物治疗或者预防的所述心血管疾病、障碍和/或者相关病症的非限制性实例包括外周血管性疾病、再狭窄、动脉粥样硬化以及动脉粥样硬化的众多临床表现诸如中风、缺血性中风、短暂性缺血发作、心肌梗塞、急性冠脉综合征、心绞痛、间歇性跛行、严重肢体缺血、心瓣狭窄和房脉瓣硬化。受试者可为具有急性冠脉综合征诸如心肌梗塞(具有或者不具有ST升高)或者不稳定心绞痛的先前发病的个体。所治疗的受试者可为任意动物例如哺乳动物,具体为人类。
在一个实施方案中,所述方法涵盖治疗或者预防心血管疾病的方法,包括以在给予后不改变患者的基线ApoA-I的量向受试者给予本申请所述的荷电的脂蛋白复合物或者组合物。
在其它实施方案中,所述方法涵盖治疗或者预防心血管疾病的方法,包括向受试者给予有效量的本申请所述的脂蛋白复合物(例如荷电的复合物)或者组合物,以便在给药约2小时后,获得比给药前基线(最初的)浓度高出约5mg/dL至100mg/dL的游离或复合的载脂蛋白血清浓度,和/或者在给药后约24小时后,获得比给药前基线(最初的)浓度高出约5mg/dL至20mg/dL的游离或复合的载脂蛋白血清浓度。
在另一个实施方案中,该方法包括治疗或预防心血管疾病的方法,其包括向受试者给予本申请所述的、有效量的脂蛋白复合物(例如荷电的复合物)或者组合物,以便在给药后至少一天内,获得比给药前最初的HDL-胆固醇成分高至少约10%的HDL-胆固醇成分的循环血浆浓度。
在另一个实施方案中,该方法包括治疗或预防心血管疾病的方法,其包括向受试者给予本申请所述的、有效量的脂蛋白复合物(例如荷电的复合物)或者组合物,以便在给药后的5分钟到1天之间,获得30至300mg/dL的HDL-胆固醇成分的循环血浆浓度。
在另一个实施方案中,该方法包括治疗或预防心血管疾病的方法,其包括向受试者给予本申请所述的、有效量的脂蛋白复合物(例如荷电的复合物)或者组合物,以便在给药后的5分钟到1天之间,获得30至300mg/dL的胆固醇酯的循环血浆浓度。
在另外的实施方案中,该方法包括治疗或预防心血管疾病的方法,其包括向受试者给予本申请所述的、有效量的脂蛋白复合物(例如荷电的复合物)或者组合物,以便在给药后至少一天内,获得比给药前的基线(最初的)浓度高至少约10%的增加的粪便胆固醇分泌。
本申请所述的脂蛋白复合物(包括荷负电的脂蛋白复合物)或者组合物可以单独使用或与用于治疗或预防前述病症的其它药物进行联合治疗。这样的治疗包括但不限于所包括药物的同时或依序给药。例如,在高胆固醇血症诸如家族性高胆固醇血症(纯合或者杂合)或动脉粥样硬化的治疗中,荷电的脂蛋白制剂可以与目前使用的任何一种或多种降低胆固醇的疗法一起施用;如胆汁酸树脂、烟酸、他汀类药物、胆固醇吸收抑制剂和/或贝特类药物。由于在胆固醇的合成和转运中,每种药物作用于不同的靶点,因而使得这样的联合方案可以产生特别有益的疗效,即,胆汁酸树脂影响胆固醇的再循环、乳糜微粒和LDL群;烟酸主要影响VLDL和LDL群;他汀类药物抑制胆固醇的合成,减少LDL群(并且也许增加LDL受体的表达);而本申请所述的脂蛋白复合物(包括荷负电的脂蛋白复合物)影响RCT,增加HDL并促进胆固醇外流。
在另外的实施方案中,本申请所述的脂蛋白复合物(包括荷负电的脂蛋白复合物)或者组合物可以结合贝特类药物使用以治疗或预防冠心病、冠状动脉疾病、心血管疾病、再狭窄、血管或外周血管疾病、动脉粥样硬化(包括治疗和预防动脉粥样硬化);如下描述了示例性制剂和治疗方案。
本申请所述的脂蛋白复合物(包括荷负电的脂蛋白复合物)或者组合物可以以增加小HDL成分的剂量给药,所述小HDL成分例如前-β、前-γ和前-β状HDL成分、αHDL成分、HDL3和/或HDL2成分。在一些实施方案中,该剂量可有效地实现如经由显像技术所测量的动脉粥样硬化斑块的减少,所述显像技术如磁共振成像(MRI)或血管内超声(IVUS)。IVUS追踪的参数包括但不限于粥样斑体积由基线改变的百分比以及粥样斑总体积的改变。MRI追踪的参数包括但不限于IVUS的那些参数以及斑块的脂质组成和钙化。
可以在最后的输注结束时,或在最后的输注后数周内,或在开始治疗后的3个月、6个月或1年内使用患者作为自身对照来测量斑块的消退(时间0比时间t)。
通过肠胃外的给药途径可实现最佳的给药,其包括静脉内注射(IV)、肌内注射(IM)、皮内注射、皮下注射(SC)以及腹膜内注射(IP)。在某些实施方案中,经由注样器、吸入器或导管进行给药。在一些实施方案中,该脂蛋白复合物例如荷负电的脂蛋白复合物以获得与通过肠胃外给药获得的循环血清浓度相等的循环血清浓度的量,通过注射、皮下植入泵或贮库制品进行给药。例如,该复合物还可吸收在支架或其它的装置中。
可以通过多种不同的治疗方案来实现给药。例如,可以在一天内定期地给药几次静脉内注射,其中累积的注射总体积不能达到每日毒性剂量。所述方法包括以6、7、8、9、10、11或者12天的间隔给药脂蛋白复合物。在一些实施方案中,所述脂蛋白复合物以一周的间隔给药。
所述方法可进一步包括以如上所述的任何间隔给予所述脂蛋白复合物4、5、6、7、8、9、10、11或者12次。例如,在一个实施方案中,给予脂蛋白复合物六次,在每次给药之间的间隔为1周。在一些实施方案中,给药可如下完成:给予一系列注射,然后停止注射达6个月至1年,然后再开始另外一系列的注射。然后可在每年或者每3-5年给予维持的系列注射。可历时一天(灌注以保持复合物的特定血浆水平)、若干天(例如历时8天的时间内四次注射)或者若干周(例如历时4周的时间内四次注射)完成所述系列注射,然后在六个月至一年后重新开始。对于慢性病症,可在发展基础上进行给药。任选地,所述方法可在诱导期后实施,当更频繁地给予脂蛋白复合物时。
在又一备选方案中,可以给药渐增的剂量,开始时以每次给药50-200mg之间的剂量给药约1至5次,随后每次给药时重复200mg和1g之间的剂量。根据患者的需求,其可以通过持续时间超过1小时的缓慢输注进行给药,通过1小时或更少时间的快速输注进行给药,或者通过一次快速推注给药。
可以使用细胞培养中的标准药物规程或者使用确定LD50(群体50%的致死剂量)和ED50(群体50%的治疗有效剂量)的实验动物来确定各种脂蛋白复合物的毒性和治疗效力。毒性与治疗作用之间的剂量比是治疗指标并且其可以表示为LD50/ED50比值。优选表现出更高治疗指数的脂蛋白复合物诸如荷负电的脂蛋白复合物。可跟踪的参数的非限制性实例包括肝功能转氨酶(不超过2×正常的基线水平)。其表明过多的胆固醇被运至肝并且不能同化如此大的量。由于胆固醇从红细胞的动员可使红细胞变脆或者影响红细胞的形状,因而还可监测对红细胞的作用。
患者可以在采取医疗措施之前接受数天至数周的治疗(如,预防性治疗)、或在采取医疗措施之中或之后接受数天至数周的治疗。所述给药可以与另一种有创疗法相伴或同时进行,所述有创疗法如血管成形术、颈动脉消融术、rotoblader或器官移植(如,心脏、肾、肝等)。
在某些实施方案中,将荷负电的脂蛋白复合物给药于胆固醇合成受他汀类药物或胆固醇合成抑制剂控制的患者。在其它实施方案中,将荷负电的脂蛋白复合物给药于接受结合树脂(例如,半合成树脂如消胆胺)或纤维(如植物纤维)治疗的患者,以捕获胆汁盐和胆固醇,从而增加胆汁酸的分泌并降低血胆固醇浓度。
6.8.其它用途
可以在体外检测中使用本申请所述的脂蛋白复合物例如荷负电的脂蛋白复合物和组合物来测量血清HDL,例如,出于诊断的目的。由于ApoA-I、ApoA-II和Apo肽与血清中的HDL组分缔合,因此荷负电的脂蛋白复合物可作为HDL群和前-β1以及前-β2HDL群的“标记物”使用。此外,该荷负电的脂蛋白复合物可作为在RCT中有效的HDL亚群的标记物使用。为此,可将荷负电的脂蛋白复合物加于患者的血清样品或与其混合,在合适的孵育时间后,可以通过检测引入的荷负电的脂蛋白复合物来分析HDL组分。这可通过使用标记的荷负电的脂蛋白复合物(如,放射性标记、荧光标记、酶标记、染料等)实现,或者通过使用对荷负电的脂蛋白复合物具有特异性的抗体(或抗体片段)的免疫测定实现。
可选择地,成像法(如,CAT扫描、MRI扫描)可以使用标记的荷负电的脂蛋白复合物以使循环系统显像或者监测RCT、或者使脂纹、动脉粥样硬化病变等地方蓄积的HDL显像,其中HDL在胆固醇外流中具有活性。
与某种原ApoA-1脂质复合物的制备和表征相关的实施例以及数据在美国专利公开2004/0067873中描述,将其内容通过引用的方式并入本申请。
在使用某种原ApoA-1脂质复合物的动物模型系统中获得的数据在美国专利公开2004/0067873中描述,将其内容通过引用的方式并入本申请。
7.实施例1:APOA-I表达系统的开发
7.1.人ApoA-I在中国仓鼠卵巢(CHO)细胞中的克隆和表达
7.1.1.ApoA-I表达载体的制备
前原ApoA-I基因序列由NCBI(P02647)获得且加入侧翼序列以便易于克隆和改善表达。合成了具有侧翼序列的编码前原ApoA-I的DNA并将其克隆至Bluescript KS+载体中。所述5′侧翼序列含有优化的Kozak翻译序列。将前原ApoA-I插入物由Bluescript KS+载体用Hind III和Bgl II限制酶切割。将该片段经凝胶纯化并连接至带有如下遗传成分的逆转录病毒表达载体:与莫洛尼小鼠肉瘤病毒5’LTR融合的人巨细胞病毒启动子、MoMuLV/SV包装区域、即早猿猴巨细胞病毒启动子、多克隆位点、MoMuLV的3’LTR以及细菌复制起始区和β-内酰胺酶基因。将所得结构的克隆经基因和侧翼区进行序列确定。根据与预测的DNA序列的一致性来选择最终的克隆(克隆#17)。然后使用共转染有用于水泡性口膜炎病毒包装糖蛋白的表达质粒的293GP细胞来制备用于转导的Retrovector。由共转染的细胞回收并浓缩的上清液用于如下在段落7.1.2中所述的CHO-S转导步骤。
7.1.2.用于表达ApoA-I的哺乳动物细胞系的产生
使用如上在段落7.1.1中所述的逆转录病毒载体使得适于在无血清培养基中生长的中国仓鼠卵巢细胞(CHO-S)进行三次转导(1X、2X和3X)。将收集的群体扩大以用于在每次转导后的深低温保藏并使得细胞样品进行基因拷贝分析。基因拷贝指数显示于如下表2中。针对在16-天加料分批测试(一式两份)中在125mL烧瓶中的生产率对3X转导的细胞系进行分析。结果显示于表3中。
*在进行产生2X细胞系之前将1X细胞系混合
**在进行产生3X细胞系之前将2X细胞系混合
表3
CHO-S-ApoA-I-R(3X)的加料分批生产率数据
*存活细胞密度
**由于收集误差未经d4细胞计数
7.1.3.表达ApoA-I的细胞系的稳定性
非GMP表征研究在CHO-S-ApoA-I-R(3X)克隆(17,其为产生ApoA-I的原始细胞库)上进行,以评估其在存活率、生长率、基因插入物的保存以及在长期培养过程中的一致的产物分泌方面的稳定性。
将细胞系由原始细胞库解冻并使用PF CHO LS培养基(HyClone,Logan UT)在125mL摇瓶中培养。通过由第0代至第43代的连续传代将细胞连续培养。在第4、8、14、19、25、31、36和43代,将细胞样品冷冻。在培养结束时,将来自所有代的细胞样品解冻并用于终末培养以比较在相同试验中不同代的细胞系的ApoA-I蛋白产生。在第12天使用反相HPLC分析测试来自每个样品的上清液以确定ApoA-I产生的水平。发现各个样品的ApoA-I浓度由1259mg/L变化至1400mg/L(图2)。
为了比较基因插入物的稳定性,将第0、4、14、25、36和43代的CHO细胞样品用于DNA分离。使用对基因组DNA的实时PCR来确定用于每个样品的遗传插入物的数目。如在表3中显示,根据在第0代至第43代之间的重叠的标准偏差,拷贝数的基于PCR的指数并非显著不同。发现ApoA-I的产生以及原始细胞库细胞系的基因拷贝指数值在所测试的43代中是稳定的。
表4
基因拷贝指数的稳定性
| 代 | 基因拷贝指数 | 标准偏差 |
| 0 | 7.87 | 0.25 |
| 4 | 7.80 | 0.27 |
| 14 | 7.80 | 0.27 |
| 25 | 7.97 | 0.25 |
| 36 | 7.90 | 0.17 |
| 43 | 8.20 | 0.27 |
7.2.ApoA-I的细胞生长和收集
7.2.1.接种物和200L生物反应器生产的规模放大
将一瓶稳定转染有来自原始细胞库的人ApoA-I基因的CHO-S细胞在37℃水浴中解冻并加入至含有35mL HyQ PF-CHO LS细胞培养基的单一的摇瓶(250mL)(Thermo FisherScientific)中。使用血细胞计数器确定的初始细胞计数为2.48x 105个细胞/mL且存活率为93.8%。然后将培养物置于在37℃在潮湿的5%CO2环境中保持的孵育箱中的轨道振荡器(90rpm)上。次代培养步骤将接种密度定标在约1.6x 105个细胞/mL。在烧瓶中第4天的细胞计数和存活率百分数分别为15.01x 105个细胞/mL以及93.9%。将250mL烧瓶培养物次代培养至1L烧瓶。来自1L烧瓶中的第3天平均存活的细胞计数为13.56x 105个细胞/mL且存活率为95.3%。将1L烧瓶培养物经次代培养至具有10L一次性Wave袋的Wave生物反应器系统20EH(GE Healthcare Bioscience Bioprocess Corp,Somerset,NJ),其初始培养体积和初始定标密度分别为1000mL和1.75x 105个细胞/mL。所述Wave生物反应器操作设定为37℃的孵育温度、15.0cpm的摇杆速度、10.9°的摇摆角度以及5.0%的CO2浓度且在具有0.25L/分钟的气体流速的通气条件下。在3天培养后,Wave袋中的存活细胞密度为10.73x105个细胞/mL,且加入新鲜的HyQ PF-CHO LS,使得培养基体积为5000mL。在另外的三天后,存活细胞密度为13.25x105个细胞/mL且将Wave袋的容积转移至30L生物反应器中。对于温度、pH、溶解氧、压力和振动率的30L生物反应器的操作设定点分别为37℃、pH 7.0、40%气体饱和度、1磅/平方英寸压力和50rpm振动率。
三天培养的30L生物反应器中的存活细胞密度为10.80x 105个细胞/mL,其足够以2.40x 105个细胞/mL的初始靶标密度接种于200L生物反应器中。转移30L的全部内容物且接种后重量、细胞密度和存活率分别为134.5Kg、2.37x 105个细胞/mL和90.9%。对于温度、pH、溶解氧、压力和振动率,200L生物反应器的操作设定点分别为37℃、pH 7.0、40%气体饱和度、1磅/平方英寸压力和35rpm振动率。在第3天,细胞密度为15.71x 105个细胞/mL,其足以将60L(v/v)的完全培养基(AGT CD CHO 5X,Invitrogen)和200mM L-谷氨酰胺(终浓度为10mM)溶液加入至生物反应器。在第8和12天,葡萄糖水平跌至低于5g/L,其促使加入3g/L的葡萄糖(20%)溶液。第9天的存活细胞密度最大值为33.20x 105个细胞/mL且存活率为92.5%。在第13天收集生物反应器中的细胞,且细胞存活率为78.5%。整个培养期间的培养物的细胞计数和存活率显示于图3A中且整个培养期间的培养基中的ApoA-I浓度显示于图3B中。
7.2.2.细胞的收集、分离和储存
通过使得生物反应器内容物先后经过双重Cuno(Rutherford,NJ,USA)60M02Maximizer滤器以及Millipore 0.22μm Opticap(Billercia,MA,USA),将来自生物反应器的培养基收集于200L袋中。然后将澄清的培养基储存在2-8℃直到开始分配操作。将澄清的培养基经Millipore 0.22μm滤器(Billerica,MA,USA)滤过并分配至2L无菌PETG瓶(ThermoFisher,Marietta,OH,USA)中,然后在-20℃冷冻直到释放以用于装运。
8.实施例2:APOA-I纯化系统的开发
8.1.材料和方法
表达、初始分离和预处理.
通过储存在环境温度将在实施例1中获得的ApoA-I澄清的细胞生长培养基(约1.8L)解冻。将解冻的培养基进行预处理以用于阴离子交换色谱法(用1M HCl降低pH 5.3±0.2)。
Apo A-I的纯化.
将以20cm的底料高度填充的Q-琼脂糖FF(GE Healthcare)阴离子交换柱用TAMP A缓冲剂(20mM磷酸钠,pH 5.3)平衡。当柱洗脱液的pH为约5.5时,判断平衡完成。将预处理的滤液载入至柱上(25-35g ApoA-I/L的阴离子交换树脂,流速为3.7cm/min)。将ApoA-I经柱(TAMP A流动相)洗涤,将其收集。
将来自阴离子交换柱的含有ApoA-I的流动相用1M NaOH调节pH为8.0±0.2。然后将溶液以约12.5L/h/m2的流速经0.2μm Planova 20N滤器(Asahi Kasei Medical)滤过以除去病毒和病毒颗粒。
当柱洗脱液达到pH 9.5时,将具有25cm的底料高度的Source 30反相色谱柱用TAMP D缓冲剂(20mM碳酸铵,pH 9.5)洗涤直到平衡。将来自病毒滤过步骤的含有ApoA-I的滤液以2.8cm/min的流速载入至柱上。将样品中的ApoA-I吸附到基质上并用35-50%乙腈在TAMP D缓冲剂中的梯度洗脱。
当柱洗脱液达到pH 9.5时,将以25cm的底料高度填充的反相硅胶C18柱(10μm)在TAMP E缓冲剂(100mM碳酸铵,pH 9.5)中洗涤直到平衡。然后将C18柱以4.7g ApoA-I/L基质加载。将吸附到柱基质上的ApoA-I以40-50%乙腈在TAMP E缓冲剂中的梯度洗脱。
通过如下将乙腈由C18柱洗脱的含有ApoA-I的级份除去:收集并将所述级份浓缩约2.5倍,然后将所述浓缩物经15体积的TAMP C缓冲剂(3mM磷酸钠,pH 8)渗滤。使用稀磷酸将渗滤的ApoA-I溶液的pH降低至约6.0,然后经过Mustang Q阴离子交换膜(Pall LifeSciences)以除去DNA和宿主细胞蛋白。将Mustang Q滤液经5体积的TAMP C缓冲剂渗滤。
然后使用具有10,000道尔顿的分子量筛截(molecular weight cutoff)的聚醚砜膜(Filtron Omega series)将渗滤的滤液进行最终的超滤,以使得所述膜保留28,000道尔顿的ApoA-I。所述蛋白溶液含有7.8-17g/L纯的ApoA-I,如通过扫描SDS-PAGE凝胶且测量纯的ApoA-I条带区域的密度与所有条带的总密度的比所确定。
8.2.结果
ApoA-I的表征.
经SDS-PAGE将ApoA-I产物的纯度测定为大于99%纯的,其具有低水平的DNA和宿主细胞蛋白,且无可检测量的截短的ApoA-I。参见图4。
9.实施例3:脂蛋白复合物成分的优化
9.1.载脂蛋白和磷脂成分的制备
原ApoA-I:
蛋白原ApoA-I以每100mL瓶含有约90mg蛋白的冻干品由UnitédeBiotechnologie,Institut Meurice,Hte Ecole Lucia De Brouckère,1Avenue EmileGryzon,B-1070Anderlecht,Belgium供应。批号为20060202。该蛋白使用前在约4℃保存。在冻干之前,原ApoA-I的浓度为3.225mg/mL,其中脲的含量为约0.011mg/mL。通过将约630mg的原ApoA-I溶解于25.6mL的乙酸/5%水中而制备原ApoA-I溶液。溶液的终浓度为25mg/mL。
ApoA-I:
ApoA-I如上在实施例1中所述来制备。
鞘磷脂:
来自蛋的鞘磷脂(NM-10)由日本的NOF公司,1-56,Oohama-Cho,Amagasaki-Shi,660-0095供应。批号为0502ES1。鞘磷脂使用前在约-20℃保存。鞘磷脂的纯度为99.1%。鞘磷脂溶液通过以下方法制备:将799.4mg纯化的鞘磷脂溶解于16mL的乙酸/5%水中以得到50mg/mL的终浓度。
磷脂酰甘油:
1,2-二棕榈酰-SN-甘油-3-磷脂酰甘油(phopsphatidyl glycerol)的钠盐(DPPG-Na,MG-6060LS)由日本的NOF公司,1-56,Oohama-Cho,Amagasaki-Shi,660-0095供应。批号为0309651L。DPPG-Na使用前在约-20℃保存。DPPG-Na的纯度为99.2%。DPPG-Na溶液通过以下方法制备:将49.1mg的DPPG-Na溶解于1mL的乙酸/5%水中,得到50mg/mL的终浓度。
磷脂酰胆碱:
二-棕榈酰磷脂酰胆碱(DPPC)由商购来源获得。
9.2.脂蛋白复合物的制备
制备如下脂蛋白复合物:
(a)中性脂蛋白复合物:
a.式A:原ApoA-I和SM,其中蛋白:磷脂重量比为1:2.5;
b.式B:原ApoA-I和SM,其中蛋白:磷脂重量比为1:2.7;
c.式C:原ApoA-I和SM,其中蛋白:磷脂重量比为1:3.1;
d.式D:原ApoA-I、SM和DPPC,其中脂蛋白wt:总磷脂wt比为1:2.7,SM:DPPC比为50:50;
e.式E:ApoA-I和SM,其中蛋白:磷脂重量比为1:2.7。
(b)荷负电的脂蛋白复合物:
a.式F:原ApoA-I、SM、DPPC和DPPG,其中脂蛋白wt:总磷脂wt比为1:2.7,SM:DPPC:DPPG wt:wt比为48:48:4;
b.式G:原ApoA-I、SM、DPPC和DPPG,其中脂蛋白wt:总磷脂wt比为1:2.7,SM:DPPC:DPPG wt:wt比为73:23:4;
c.式H:ApoAI、SM和DPPG,其中脂蛋白wt:总磷脂wt比为1:2.7,SM:DPPG wt:wt比为97:3;
d.式I:ApoAI、SM和DPPG,其中脂蛋白wt:总磷脂wt比为1:3.0,SM:DPPG wt:wt比为97:3;
e.式J:ApoAI、SM和DPPG,其中脂蛋白wt:总磷脂wt比为1:3.3,SM:DPPG wt:wt比为97:3。
9.3.脂蛋白复合物的配制率和均质性
通过将样品注射至HPLC系统来测试式A-J的脂蛋白复合物的配制,以检查脂蛋白复合物的粒度和分布。复合物经共-匀浆产生并在指定时间取样。
图5显示了包含不同的脂蛋白:SM wt:wt比的式A-C的中性脂蛋白复合物以及包含脂蛋白和中性磷脂比为1:2.7的式D的中性脂蛋白复合物(其中所述中性磷脂为50:50的SM:DPPC)的示例性HPLC色谱图。优选所述脂蛋白:SM wt:wt比为1:2.7。含有SM和DPPC混合物的式D显示出弱的复合物形成。
加入作为第二中性磷脂的磷脂酰胆碱导致缓慢且不完全的复合物形成。图6显示出式D的脂蛋白复合物在10、20、30和60分钟的HPLC色谱图。相反地,如在图7中显示,式B快速形成复合物。
向SM和DPPC加入负电荷磷脂、DPPG导致甚至更弱的复合物形成,如在图8中的式F的脂蛋白复合物在20、40、60和120分钟的HPLC色谱图中显示。
如在图9中显示,仅含有SM作为磷脂的蛋白与脂质重量比为1:2.7的脂蛋白复合物形成更强的前-B HDL复合物,且与具有相同的蛋白与脂质重量比但含有DPPC和/或者DPPG的脂蛋白复合物相比更快地形成。因此,仅包含SM作为中性脂质的脂蛋白复合物形成更均质的脂蛋白复合物,其相比于除了SM之外包含DPPC且加入或者不加入DPPG的复合物而言以更快的速率形成。
最后,相比于包含载脂蛋白:磷脂重量比为1:3.3的复合物以及未荷电的脂蛋白复合物而言,包含载脂蛋白:磷脂重量比为1:2.7-1:3的荷负电的脂蛋白复合物(其中磷脂部分含有97:3重量比的SM和DPPG)显示出优化的均质性且无游离脂质的峰。参见图10,显示出式E、H、I和J的HPLC色谱图。选择式B和H的脂蛋白复合物以用于在动物中进一步研究(实施例6),且基于动物研究的结果,选择式H的脂蛋白复合物以用于人类患者中的临床评估(实施例6和8)。
10.实施例4:使用基于热循环的方法形成脂蛋白复合物
10.1.用于制备ApoA-I/DPPG/鞘磷脂复合物的方法综述
蛋白浓度为1-30mg/ml、通常为5-20mg/ml的冷冻的ApoA-I在磷酸盐缓冲剂(pH 7-9)中的溶液通过在2-8℃解冻约24-96小时来制备并称重。将磷酸二氢钠和磷酸氢二钠加入至ApoA-I溶液中,获得在pH 7.4缓冲剂中的10mM的最终肽浓度。
DPPG溶液通过以下方法制备:将磷酸盐缓冲剂(10mM磷酸钠,pH 8.0)温热至50℃的目标。将DPPG粉末(NOF公司)在环境温度解冻至少1.5小时,然后称重并加入至缓冲剂容器中。然后使用ULTRA-高性能分散器(Works,Inc.)将DPPG在50℃的温度分散。分散后,将DPPG混悬液和ApoA-I溶液加热至57℃。将它们合并并在57℃在氮气下加热30分钟。将该前-复合物溶液冷却至室温。
将鞘磷脂(SM)粉末(NOF公司)在环境温度解冻,然后在玻璃池中称重。将磷酸盐磷酸盐缓冲剂(10mM磷酸钠,pH 8.0)加热至50℃,与SM粉末混合以获得SM浓度为220mg/ml。使用ULTRA-将SM粉末分散在混悬液中并将所述分散液冷却至4℃,然后经过匀浆器。经动态光散射(DLS)监测所述SM颗粒,其ζ(Z)平均粒度为55-70nm(使用强度测量)。这可通过例如使用Nano DeBee匀浆器在32000+/-3000巴来实现,其中入口温度为10-18℃且出口温度优选为30-40℃(且不超过59℃),导致所述颗粒具有58nm的Z-平均粒度。
对于复合,将所述ApoA-I/DPPG混合物和SM分散液分开温热至57℃。将温热的SM分散液加入至ApoA-I/DPPG混合物中,其中初始温度设定点为57℃。在搅拌混合后,将溶液冷却至37℃,然后使其经过一系列热循环(57℃-37℃)以形成ApoA-I/DPPG/SM复合物。持续进行该加热-冷却过程,其中在各温度之间的接触时间为5分钟-30分钟。重复该加热-冷却循环直到大部分蛋白成分掺入至脂蛋白复合物中。在热循环过程中的复合物的粒度和分布经凝胶渗透色谱法(GPC)监测。
ApoA-I/DPPG/SM复合物根据如上所述的方法来制备(且于图11示例说明)。所述ApoA-I蛋白具有相应于图1中描绘的序列的位置25-267的氨基酸序列。所述复合物含有97:3的重量比的鞘磷脂(SM)和1,2-二棕榈酰-sn-甘油-3--磷酸-(1'--外消旋-甘油)(二棕榈酰磷脂酰甘油或者DPPG)。ApoA-I蛋白与总脂质的比为1:2.7重量/重量(w/w),其相当于1:108的摩尔比。使用如图12中所述安置的热交换器将混合的脂质和蛋白成分在57℃-37℃之间循环,每个温度循环5分钟,所述热交换器在左侧包括Lauda Ecoline Star editionType 26LE水浴(样品在其中进行热循环)且在右侧包括壳&管热交换器(模型EF-C50-HE),其具有18-ml保持体积,由蠕动泵连接。
将180mg DPPG加入至2.82克10mM磷酸盐缓冲剂(pH 8.0)中。将所述混悬液在50℃用ULTRA-分散器分散10分钟。将22克SM粉末与78克10mM磷酸盐缓冲剂(pH8.0)混合。将所述混悬液在50℃用ULTRA-分散器分散20-40分钟。使用NanoBEE将SM匀浆化,获得60nm的平均粒度。使得DPPG、SM和蛋白达到57℃。在57℃将18mg(0.3ml)DPPG加入至在10mM磷酸盐缓冲剂(pH 7.4)中的214mg ApoA-I蛋白中。在57℃保持30分钟后,加入559mg SM颗粒(2.54ml)。然后使得该溶液进行热循环,形成复合物。
在热循环30分钟、60分钟、120分钟、180分钟和210分钟后显示ApoA-I/DPPG/SM复合物形成的凝胶渗透色谱法分别显示于图13A-13E中。随着循环时间的增加,产生更致密的复合物,如通过主要GPC峰的锐度增加所显示。相应于非复合的蛋白的峰也随着时间推移而消失。
10.2.ApoA-I/鞘磷脂复合物的形成
ApoA-I/SM复合物根据如上所述制备,但不使得ApoA-I与DPPG预先复合。所述蛋白成分为浓度为8.9mg/ml的5ml ApoA-I且所述脂质成分为已经混悬于10mM磷酸盐缓冲剂(pH8.0)中并均质形成60nm的脂质颗粒的0.5ml蛋鞘磷脂(220mg/ml)。使得所述蛋白和脂质成分在50℃以1:2.5wt:wt的比例混合。使用如在图12中所述的热循环装置使得所得混悬液进行热循环达18小时(108次循环且循环时间为10分钟)。凝胶渗透色谱法显示出形成的蛋白/脂质复合物为基本上均质的(参见图14的GPC色谱图)。
10.3.ApoA-I/DPPG/N-棕榈酰-4-羟基二氢鞘氨醇-1-磷酸胆碱(植物鞘磷脂)复合物的形成
ApoA-I/DPPG/植物鞘磷脂复合物根据如上所述的方法形成。将植物鞘磷脂颗粒均质为约183nm的粒度(经DLS测量)并加入至7.8g/L蛋白:DPPG混合物中,获得1:2.7的最终蛋白与脂质(SM和DPPG)比。使得含有N-棕榈酰-4-羟基二氢鞘氨醇-1-磷酸胆碱(植物-鞘磷脂)以及蛋白:DPPG成分的混悬液在37℃热循环六次,每次循环10分钟且在57℃热循环六次,每次循环10分钟,总计两小时。凝胶渗透色谱法显示出形成的蛋白/脂质复合物基本上为均质的(参见图15的GPC色谱图)。
10.4.ApoA-I/DPPG/合成的棕榈酰鞘磷脂的形成
ApoA-I/DPPG/合成的棕榈酰鞘磷脂复合物如下制备。使得合成的棕榈酰鞘磷脂(220mg/ml)在10mM磷酸盐缓冲剂(pH 7.4)中的8.8mL溶液混合直到达到3300nm的粒度。使得ApoA-I(945mg,14mg/ml)与0.03wt%DPPG(60mg/ml)混合并在50℃加热30分钟。使得合成的棕榈酰鞘磷脂微团与蛋白/DPPG复合物以1:2.7的载脂蛋白:磷脂重量比混合。使得蛋白和脂质的混悬液在37℃和57℃的热-冷循环(每十分钟交替一次)下进行热循环,总计达240分钟或者直到获得适当的粒度分布。在热循环过程中的复合物的粒度和分布经GPC监测。在络合后,浓度达到8.0mg ApoA-I/ml,然后将蔗糖(40mg/ml)和甘露醇(20mg/ml)加入至复合物中以用于等渗。将脂蛋白复合物经GPC测定且发现其为基本上均质的(参见图16的GPC色谱图)。
10.5.ApoA-I/DPPG/植物鞘磷脂的形成
ApoA-I/DPPG/植物鞘磷脂复合物如下制备。将植物鞘磷脂(220mg/ml)在10mM磷酸盐缓冲剂(pH 7.4)中的2.0mL溶液在50℃分散于ULTRA-中达40分钟直到获得990nm的粒度。使得ApoA-I(15.6mg,浓度为7.8mg/ml)与0.03wt%DPPG(60mg/ml)混合并在57℃加热30分钟。使得植物鞘磷脂溶液与蛋白/DPPG混合物以1:2.7的载脂蛋白:磷脂重量比混合。然后将蛋白和脂质的混悬液在37℃和57℃的热-冷循环(每十分钟交替一次)下进行热循环,总计达240分钟或者直到获得适当的粒度分布。将所述脂蛋白复合物的群体经GPC测量且发现其为约92.6%均质的(参见图17的GPC色谱图)。
10.6.具有ApoA-I肽的复合物的形成
ApoA-I肽、DPPG和鞘磷脂的复合物如上(参见段落10.1)所述产生,使用ApoA-I肽(H-Lys-Leu-Lys-Gln-Lys5-Leu-Ala-Glu-Leu-Leu10-Glu-Asn-Leu-Leu-Glu15-Arg-Phe-Leu-Asp-Leu20-Val-Inp22-OH;SEQ ID NO:4)溶液。所述磷脂成分由48.5:48.5:3的重量比的蛋鞘磷脂(SM)、1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(二棕榈酰磷脂酰胆碱,DPPC)和1,2–二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)](二棕榈酰磷脂酰基-甘油,DPPG)组成。肽与总磷脂复合物的比为1:2.5(w/w)。所述药物复合物为CER-522复合物在磷酸盐缓冲盐水(12mM磷酸钠,130mM氯化钠,pH 8.2)中的溶液。所述复合物通过以下方法形成:使得起始溶液在50℃和37℃之间进行热循环达两小时(流速为1ml/min)。
凝胶渗透色谱法显示出形成的蛋白/脂质复合物为基本上均质的,其中大部分蛋白已经掺入至脂蛋白复合物中(参见图18的GPC色谱图)。
10.7.脂质粒度以及热循环次数对复合物形成的影响
研究了脂质粒度以及热循环次数对粒度的影响。具有四种不同的起始脂质粒度(ζ平均值为85nm、77nm、66nm和60nm)的制剂(分别为图19A-19D)通过以下方法产生:使得SM溶液以单一路径经过NanoBEE。针对其ζ平均值分析每个路径。脂质粒度随着每个路径而减小且在达到预期粒度时收集所述脂质颗粒。在段落10.1的复合物形成方法中测试了四种不同的脂质粒度,进行五或七次循环,在37℃的每次循环3分钟且在57℃的每次循环10分钟。
当所述脂质成分与蛋白成分混合时,所得的混悬液为浑浊的。当复合物形成时,浑浊度降低,且所述溶液变得更透明。
五次循环后,由60nm脂质颗粒产生的复合物的混悬液为最透明的。GPC色谱图(图20A-20D)显示了所有样品的完全或者几乎完全的复合,如经主峰均质性所证实。当起始于66nm脂质颗粒时,在所得的脂蛋白复合物混悬液中经GPC未检测到非复合的蛋白,这表明在五次循环后所有蛋白与脂质复合,且所得的复合物为98%纯的。七次循环后,所有四个混悬液均变得更透明,这显示更大程度的复合。使用60nm脂质颗粒制备的混悬液似乎最澄清。
在分开的研究中,使用段落10.1所述的方法使得450nm和40nm的SM颗粒与ApoA-I和DPPG复合。使用450nm SM颗粒作为脂质成分将大部分(但并非全部)ApoA-I掺入至脂蛋白复合物中,如在图21A的GPC色谱图所显示(9.8分钟的峰)。使用40nm SM颗粒作为脂质成分将极小部分的ApoA-I掺入至脂蛋白复合物中,如在图21B的GPC色谱图所显示(9.551分钟的峰)。
10.8.起始温度对于复合物形成的作用
研究了起始热循环温度对复合物形成的作用。ApoA-I/DPPG/SM复合物如在段落10.1中所述产生,除了将所述脂质成分和蛋白成分温热至37℃(而不是57℃)并在37℃(而不是57℃)混合。所得的复合物的GPC色谱图显示于图22中。相比于热循环初始于57℃时,基本上较少的蛋白成分掺入至脂蛋白复合物中,如经相对大的蛋白峰(在9.455分钟洗脱出,图22)所证实。
10.9.使用热循环方法的脂蛋白复合物的商业生产
针对大规模的商业制造,本公开的方法可提升规模且任选地结合配制步骤。商业的实施方案描述于图23中。在该实施方案中,在热循环步骤后,将所述脂蛋白复合物稀释,与一种或者多种等渗剂(例如蔗糖和/或者甘露醇)混合,滤过,并等分至小瓶中。可将小瓶中的内容物冷冻干燥以延长所得制剂的贮存期限。
使用DaBEE2000将描述于段落10.1的ApoA-I/DPPG/SM复合物以20-L的规模产生。将该复合物用磷酸盐缓冲剂(pH 7-8)稀释并与蔗糖和甘露醇混合,获得含有磷酸盐缓冲剂(10mM pH 7.4)、8mg/ml ApoA-I、4%(w/w)蔗糖和2%(w/w)甘露醇的最终制剂。
10.10.由热循环制备的脂蛋白复合物与由共匀浆制备的脂蛋白复合物的比较
将由本申请所述的热循环方法制备的ApoA-I/DPPG/SM复合物与由脂质和蛋白成分的共匀浆制备的复合物进行比较。相比于由共匀浆制备的复合物而言,由热循环制备的复合物的纯度改善至97%,如经凝胶渗透色谱法所测量。使用SDS-PAGE,相比于由共匀浆的复合物而言,由热循环制备的复合物具有98%的增加的主带纯度,且存在较少截短的蛋白条带。
相比于共匀浆化,ApoA-I的氧化也通过热循环法降低。RP-HPLC(C18)显示,在共匀浆的复合物中在RT 0.93和0.99存在两个氧化峰,其在热循环法中不存在。肽图也显示,相比于由共匀浆产生的复合物而言,在由热循环产生的复合物中在ApoA-I蛋氨酸的Met 112和Met 148存在氧化降低。
数据汇总显示于如下表5中。
表5缩写:GPC=凝胶渗透色谱法,Rt=保留时间;NMT=不多于;SDS-PAGE=十二烷基硫酸钠聚丙烯酰胺凝胶电泳;HP-SEC=高性能-分子排阻色谱;RP-HPLC=反相-高效液相色谱;RRT=相对保留时间;RP-UPLC=反相-超高效液相色谱法;M112ox=ApoA-I残基112蛋氨酸氧化;M148ox=ApoA-I残基148蛋氨酸氧化.
10.11.惰性气体在制造方法中的用途
ApoA-I为灵敏的蛋白,其易感于化学不稳定性(例如氧化)。为了增强ApoA-I在含有ApoA-I/SM/DPPC的药物组合物的稳定性,在氮气(惰性气体)气氛下制备(包括热循环、填充和完成步骤)药物组合物。如下为对由共匀浆制备的ApoA-I/SM/DPPC复合物与由氮气下的热循环制备的ApoA-I/SM/DPPC复合物进行比较的研究结果。
实施例5:体外胆固醇外流研究
在Fu5AH大鼠肝细胞瘤细胞中研究ApoA-I-脂质复合物的生物活性,其测量ABCA1-介导的胆固醇外流。
Fu5AH大鼠肝细胞瘤细胞具有清除剂受体组B类型I(SRB1)的高表达,这促进细胞和成熟HDL之间的胆固醇的双向流动。该模型提供了针对HDL-介导的胆固醇外流活性的特定测定。所述测定使用Mweva et al.,2006,“Comparison of different cellular modelsmeasuring in vitro the whole human serum cholesterol efflux capacity,”Eur.J.Clin.Invest.36,552-559所述的方法来进行。将Fu5AH细胞用3H-胆固醇标记24小时。针对每个测试样品(30、20和10μg/ml的ApoA-I/DPPG/棕榈酰SM、ApoA-I/DPPG/蛋SM或者ApoA-I/DPPG/植物SM,用MEM稀释,所述MEM经25mM HEPES缓冲)以及对照样品(由人血浆(20μg/mL)纯化的ApoA-I、HDL3、2%人血清、单独培养基)制备用于外流的受体介质。将含有测试或者对照样品的受体培养基加入至细胞达4小时,并测量在外流介质和单层细胞中的胆固醇,以确定由Fu5AH细胞释放的胆固醇百分数。计算测试样品的生物活性且其表示为胆固醇外流相对于如上所述的式H的参比标准品(具有与测试样品中的脂蛋白复合物相同的浓度,其用作阳性试验对照)的百分数。结果显示于如下表7中,并证实所测试的脂蛋白复合物具有显著的生物活性,如经胆固醇外流测定所测量。
表7-在基于Fu5AH细胞的测定中的生物活性(通过诱导的胆固醇外流)
12.实施例6:兔子中式B和式H复合物的单一、低剂量给药的药效研究
正常兔子接受了以下的单一注射:(a)5mg/kg剂量的式B制剂(含有1:2.7的载脂蛋白:磷脂重量比的ApoA-I和SM的中性脂蛋白复合物);(b)5mg/kg剂量的式H制剂(含有1:2.7的载脂蛋白:磷脂重量比以及97:3的SM:DPPG重量比的ApoA-I、SM和DPPG的荷负电的脂蛋白复合物);或者(c)对照制剂,其含有用于脂蛋白复合物制剂的稀释剂。使用式B、式H和对照的每种来测试四只兔子。
VLDL总胆固醇和甘油三酯随时间推移的血浆水平显示于图24和25中。相比于用式B(ApoA-I和SM的脂蛋白复合物)处理的动物中的水平,在用式H(ApoA-I/DPPG/SM复合物)(b)处理的动物中的血浆VLDL总胆固醇水平增加较少且更快地返回至基线。针对甘油三酯水平观察到类似效果。该研究显示,相比于中性脂蛋白复合物而言,对于ApoA-I/DPPG/SM复合物,这些水平的暂时升高具有较短的持续时间。该结果与式H的脂蛋白复合物在人类受试者中的I期研究的结果(描述于如下实施例8)一致。
13.实施例7:蛋SM与合成的棕榈酰SM的比较药效研究
研究了静脉内注射至兔的载脂蛋白A-I(ApoA-I)/蛋SM和ApoA-I/合成的棕榈酰SM脂蛋白复合物的药效作用。在注射脂蛋白复合物后,测量了血浆脂质和脂蛋白水平的变化。
将ApoA-I/蛋SM或者ApoA-I/合成的SM脂蛋白复合物以5mg/kg或者20mg/kg的剂量以1mL/min的速率经静脉内输注至耳静脉来对兔给药。研究了4只动物/组。在给药前采集血浆样品,在输注结束后立即采集血浆样品,且在输注开始后的30分钟、45分钟、1小时、2小时、4小时、6小时、8小时、10小时和30小时采集血浆样品。然后针对总胆固醇、未酯化的胆固醇、磷脂和总甘油三酯使用商业酶试剂盒分析血浆样品。使用商业ELISA试剂盒在血浆样品中测定ApoA1。经GPC分析所述血浆样品以确定总胆固醇和未酯化胆固醇分布。对于5mg/kg剂量的处理,基于色谱图痕迹的曲线下总面积的百分数来定量所述结果。
图26A-26D显示了在用5mg/kg和20mg/kg的ApoA-I/蛋SM或者ApoA-I/合成的SM输注的兔中胆固醇、甘油三酯、磷脂和ApoA-I随时间推移的血浆水平。在给予的两种剂量的输注开始后30分钟内观察到快速且显著的胆固醇动员:在给予5mg/kg剂量后30分钟时观察到胆固醇动员峰,且在20mg/kg剂量观察到胆固醇动员的大幅增强。在测试的每个剂量,两种制剂均具有血浆甘油三酯、血浆磷脂和血浆重组人apoA-I的相似分布。
图27A-27C显示了血浆HDL-总胆固醇水平、血浆LDL-总胆固醇水平和血浆VLDL-总胆固醇水平。对于ApoA-I/蛋SM和ApoA-I/合成的SM,HDL-总胆固醇的增加是相似的(图27A)。血浆LDL-C和VLDL-C水平存在极少变化,且所述水平基本上不被注射每种制剂的脂蛋白复合物所改变(图27B-27C)。
该研究的结果显示ApoA-I/蛋SM和ApoA-I/合成的SM脂蛋白复合物具有相似的体内反应。
14.实施例8:ApoA-I/DPPG/SM复合物在健康血脂异常受试者中的I期研究
14.1.材料和方法
I期临床试验作为随机的、双盲的、安慰剂对照的、交叉的、单一升高剂量的研究在具有大于3.0的LDL/HDL比的健康志愿者中使用式H的脂蛋白复合物进行。该I期研究的目标是评估在作为单剂量给药时荷负电的脂蛋白复合物的安全性、耐受性、药代动力学以及药效学。研究了0.25、0.75、2.0、5.0、10.0、15.0、30.0和45.0mg/kg的逐渐升高的剂量。受试者经输注接受了已经通过蛋白和脂质成分的共匀浆制备的含有ApoA-I(如在实施例1中所述制备)、SM和DPPG(1:2.7的蛋白:脂质重量比且97%SM/3%DPPG(w/w)的脂质组成)的脂蛋白复合物的无菌溶液。所述无菌溶液为除了脂蛋白复合物之外还含有甘露醇和蔗糖(4%(w/w)蔗糖、2%(w/w)甘露醇)的10mM磷酸盐缓冲的溶液(pH 8.0)。
14.2.结果
如下汇总了来自该I期研究的临床发现。
总胆固醇:在每个时间点的平均血浆总胆固醇浓度如下显示于表8:
表8–在单一静脉内给药后的平均血浆总胆固醇浓度/时间
总胆固醇中的VLDL、LDL和HDL:总胆固醇中的VLDL、LDL和HDL随时间点和剂量的平均值汇总于如下表9-11:
表9-在单一静脉内给药后的总胆固醇中的平均VLDL
表10-在单一静脉内给药后的总胆固醇中的平均LDL
表11-在单一静脉内给药后的总胆固醇中的平均HDL
未酯化的(游离)胆固醇:在每个时间点的平均血浆游离(未酯化的)胆固醇浓度显示于如下表12:
表12-在单一静脉内给药后的平均血浆游离胆固醇浓度/时间
游离胆固醇中的VLDL、LDL和HDL:游离胆固醇中的VLDL、LDL和HDL随时间点和剂量的平均值显示于如下表13-15:
表13-在单一静脉内给药后的游离胆固醇中的平均VLDL
表14-在单一静脉内给药后的游离胆固醇中的平均LDL
表15-在单一静脉内给药后的游离胆固醇中的平均HDL
甘油三酯:在每个时间点的平均血浆甘油三酯浓度显示于如下表16:
表16-在单一静脉内给药后的平均血浆甘油三酯浓度/时间
ApoA-I:受试者的基线ApoA-I(mg/dL)随时间的变化显示于如下表17。将每个剂量的血浆ApoA-I的最大变化加为粗体。
表17-在单一静脉内给药后的平均血浆ApoA-I变化/时间
转氨酶:与毒性相关的肝丙氨酸氨基转移酶或者转氨酶水平的平均值显示于如下表18。丙氨酸氨基转移酶的正常范围为9-60IU/L。
表18-所选的丙氨酸氨基转移酶随处理和时间点的平均值汇总
不良事件:总计7名(22%)受试者具有不良事件。无受试者具有由研究者所认为的至少可能与研究药物相关的不良事件。似乎不存在不良事件发生的任何剂量相关的趋势。无受试者具有严重的不良事件,且无受试者由于不良事件而由所述研究退出。如下表19提供了体系统的不良事件的汇总:
14.3.结论
以0.25、0.75、2.0、5.0、10.0、15.0、30.0和45.0mg/kg的单一IV剂量给予包含式H的荷负电的脂蛋白复合物的无菌溶液的制剂的该I期研究得到以下结论。
在所有受试者中所有剂量的所述制剂均为很好耐受的,不良事件分布与使用安慰剂所观察的不良事件分布相似。所述复合物对于临床化学、血液学或者凝固参数的影响与安慰剂相比似乎没有差别。未观察到对ECG的不良作用。在单一剂量给予后未检测到对ApoA-I的抗体。
ApoA-I和鞘磷脂的血浆浓度随着剂量的增加而增加:对于至多10mg/kg的剂量而言在给药后24小时内ApoA-I水平返回至基线且对于高于10mg/kg的剂量而言在给药后72小时内ApoA-I水平返回至基线。对于至多5mg/kg的剂量而言在给药后24小时内鞘磷脂水平返回至基线,对于10-30mg/kg的剂量而言在给药后72小时内鞘磷脂水平返回至基线且对于给予45mg/kg剂量的受试者而言在给药后7天内鞘磷脂水平返回至基线。
胆固醇动员随着剂量增加而增强:在低至2.0mg/kg的剂量观察到游离胆固醇的HDL成分的动员(从基线平均增加23%)且其随剂量的增加而增强。甘油三酯水平瞬时增加至高于采用15mg/kg和15mg/kg以上的剂量的安慰剂所观察到的水平。
此外,给予复合物不显著提升肝转氨酶水平,且在所有情况下,所述水平很好地保持在正常范围内。这与CSL-111相反,CSL-111是与大豆磷脂酰胆碱复合的来自血浆的重组的纯化的人ApoA-I,其当以80mg/kg患者体重的剂量给予时,已经在一些患者中观察到将丙氨酸氨基-转移酶水平至多提升至正常上限的超过100-倍。Tardif et al.,2007,JAMA297:1675-1682。
因此,本公开的复合物的给药剂量可以低于针对模拟HDL的其它制剂所报道的剂量,且仍然实现脂质参数的临床上显著的改善而不具有有害副作用。
15.实施例9:在治疗具有急性冠脉综合征的患者中对APOA-I/SM/DPPG复合物的II期临床研究
在治疗心血管疾病中进行临床试验以进一步证实低剂量的式H的荷负电的脂蛋白复合物(ApoA-I、蛋-鞘磷脂(蛋-SM)和DPPG,载脂蛋白:磷脂重量比为1:2.7,蛋-SM与DPPG的重量比为97:3)的治疗益处。所述ApoA-I如上在实施例1中所述通过在CHO细胞中表达来制备,且复合物通过实施例4的热循环方法来产生。
表现有ACS症状的受试者符合该研究的筛选。在基线导管插入时,受试者需要对用于血管内超声(IVUS)的一个“靶标”动脉(其不受先前或者目前的PCI所影响)具有适当的IVUS评价,且靶标动脉的邻近4cm处应具有0和50%之间的直径狭窄(经视觉血管造影评估显示)、≥2.5mm的基准直径且不具有暗示血栓的充盈缺损。一旦基线IVUS已经通过IVUSCore Laboratory针对总体品质、适当靶标血管的存在以及技术因素的缺失(可妨碍IVUS成像的精确读取)来评价,所述受试者随机接受静脉内输注,历时一小时给予安慰剂或者复合物的三种剂量中的一种(3、6或者12mg/kg)。随机化受试者以每周间隔(即每7-11天)返回以进行五次额外的输注。在最后一次输注后一周(5-9天),撤回治疗结束试验。在最后一次输注后约3周(14-35天)进行随访IVUS。在最后一次输注后约6个月(+/-2周)进行随访,以采集用于抗-ApoA1抗体测试的样品且监测主要不良心脏事件(MACE)终末点。
主要终末点为通过三维IVUS评估的在靶标冠状动脉的30mm切片中的总斑块体积的额定变化。其它效力测量包括在靶标30mm切片中的斑块体积的变化百分数以及粥样斑体积的变化百分数、靶标30mm切片的总血管体积百分数,以及在解剖上同等的5mm切片(集中于具有基线最小斑块负荷的位点)的由基线至随访的斑块、管腔和总血管体积的变化,和在三维IVUS上的基线最大斑块负荷。斑块体积的变化百分数如下计算:将额定变化除以基线值,再乘以100。粥样斑(梗阻)体积百分数如下经计算机计算:将斑块体积除以弹性外膜(EEM)体积,然后乘以100。
16.具体实施方案、参考文献的引用
本公开的各个方面描述于如下编号的段落中所阐述的实施方案。
1.脂蛋白复合物,包含载脂蛋白部分和脂质部分,其中所述脂质部分基本上由95-99wt%的中性磷脂和1-5wt%的负电荷磷脂构成,其中所述载脂蛋白部分与磷脂部分的比在约1:2.7wt至约1:3wt的范围内。
2.实施方案1的脂蛋白复合物,其中所述载脂蛋白选自前原载脂蛋白、前原ApoA-I、原ApoA I、ApoA-I、前原ApoA-II、原ApoA II、ApoA II、前原ApoA-IV、原ApoA-IV、ApoA-IV、ApoA-V、前原ApoE、原ApoE、ApoE、前原ApoA I米兰、原ApoA-I米兰、ApoA-I米兰、前原ApoA-I巴黎、原ApoA-I巴黎和ApoA-I巴黎,以及它们的混合物。
3.实施方案2的脂蛋白复合物,其中所述载脂蛋白基本上由具有与相应于SEQ IDNO:1的氨基酸25-267的蛋白至少90%或者至少95%序列同一性的ApoA I构成。
4.实施方案3的脂蛋白复合物,其中所述载脂蛋白包含单体、二聚体和/或者四聚体。
5.实施方案1-4中任一项的脂蛋白复合物,其中所述载脂蛋白包含ApoA-I肽模拟物。
6.实施方案1-5中任一项的脂蛋白复合物,其中所述载脂蛋白部分与磷脂部分的重量比为1:2.7。
7.实施方案1-6中任一项的脂蛋白复合物,其中所述脂质:载脂蛋白摩尔比的范围为约1:105至约110,其中所述载脂蛋白值表示为ApoA-I等价物。
8.实施方案7的脂蛋白复合物,其中脂质:载脂蛋白摩尔比为1:108。
9.实施方案1-8中任一项的脂蛋白复合物,其中所述中性脂质为天然鞘磷脂或者合成鞘磷脂。
10.实施方案9的脂蛋白复合物,其中所述鞘磷脂为蛋-鞘磷脂。
11.实施方案9的脂蛋白复合物,其由至少95%纯的鞘磷脂制备。
12.实施方案1-11中任一项的脂蛋白复合物,其中所述脂质部分基本上由96-98wt%的中性磷脂和2-4wt%的负电荷磷脂构成。
13.实施方案12的脂蛋白复合物,其中所述脂质部分基本上由97wt%的中性磷脂和3wt%的负电荷磷脂构成。
14.实施方案13的脂蛋白复合物,其中所述负电荷磷脂包含磷脂酰甘油。
15.实施方案14的脂蛋白复合物,其中所述负电荷磷脂包含1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)](DPPG)的盐或者由1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)](DPPG)的盐组成。
16.实施方案15的脂蛋白复合物,其中所述盐为钠盐或者钾盐。
17.实施方案1-16中任一项的脂蛋白复合物,其中所述中性和/或者负电荷磷脂的酰基链各自彼此独立地选自含有12-26个、14-26个或者16-26个碳原子的饱和或者单不饱和烃。
18.实施方案17的脂蛋白复合物,其中所述中性和/或者负电荷磷脂的每个酰基链是相同的。
19.实施方案17的脂蛋白复合物,其中所述中性和/或者负电荷磷脂的每个酰基链是不同的。
20.实施方案17的脂蛋白复合物,其中所述中性和负电荷磷脂的酰基链含有相同数目的碳原子。
21.实施方案17的脂蛋白复合物,其中所述中性和负电荷磷脂的酰基链具有不同的饱和度。
22.实施方案17的脂蛋白复合物,其中所述中性和负电荷磷脂的酰基链含有16个碳原子。
23.实施方案1-22中任一项的脂蛋白复合物的群体。
24.脂蛋白复合物的群体,其各自包含脂质部分和基本上由载脂蛋白A-I(“ApoA-I”)构成的载脂蛋白部分,其中所述群体的特征在于以下特征中的一、二、三、四、五、六、七、八、九或者所有十种:
(a)所述群体中至少80wt%、至少85wt%、至少90wt%或者至少95wt%的ApoA-I为成熟形式;
(b)所述群体中不超过20wt%、不超过15wt%、不超过10wt%或者不超过5wt%的ApoA-I为不成熟形式;
(c)所述群体含有不超过100皮克、不超过50皮克、不超过25皮克、不超过10皮克或者不超过5皮克宿主细胞DNA/毫克的ApoA-I;
(d)所述群体含有不超过500纳克、不超过200纳克、不超过100纳克、不超过50纳克或者不超过20纳克宿主细胞蛋白/毫克的ApoA-I;
(e)所述群体中不超过20wt%、不超过15wt%、不超过10wt%或者不超过5wt%的ApoA-I为截短形式;
(f)所述群体中的所述ApoA-I的蛋氨酸112和蛋氨酸148各自的不超过20%、不超过15%、不超过10%、不超过5%、不超过3%、不超过2%或者不超过1%被氧化;
(g)至少80%、至少85%、至少90%或者至少90%的所述脂蛋白复合物为粒度为4nm至15nm或者6nm至15nm的颗粒形式,如经凝胶渗透色谱法(“GPC”)或者动态光散射(“DLS”)所测量;
(h)所述群体含有不超过1EU内毒素/毫克ApoA-I、不超过0.5EU内毒素/毫克ApoA-I、不超过0.3EU内毒素/毫克ApoA-I或者不超过0.1EU内毒素/毫克ApoA-I;以及
(i)所述群体中的所述ApoA-I中不超过10%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的氨基酸被脱去酰胺。
25.实施方案24的群体,其中所述复合物中的脂质部分中不超过15wt%、不超过10wt%、不超过5wt%或者不超过2wt%的脂质为胆固醇。
26.实施方案25的群体,其不含有胆固醇。
27.实施方案24-26中任一项的群体,其中至少85%、至少90%或者至少95%的蛋白为成熟ApoA-I蛋白。
28.实施方案27的群体,其中小于15%、小于10%或者小于10%的蛋白被氧化、被脱去酰胺和/或者被截短的。
29.实施方案24-28中任一项的群体,其中所述脂蛋白复合物为至少90%纯的、至少92.5%纯的、至少95%纯的、至少96%纯的、至少97%纯的或者至少98%纯的。
30.实施方案24-29中任一项的群体,其中所述脂蛋白复合物为至少80%均质的、至少85%均质的、至少90%均质的或者至少95%均质的,如由凝胶渗透色谱法中的单峰所反映。
31.实施方案30的群体,其中至少80%、至少85%、至少90%或者至少95%的脂蛋白复合物的粒度范围为4nm至12nm、6nm至12nm或者8nm至12nm,如经GPC或者DLS所测量。
32.实施方案24-31中任一项的群体,其中至少95%、至少96%、至少97%、至少98%或者至少99%的蛋白为复合物。
33.实施方案24-32中任一项的群体,其不含有胆酸盐。
34.实施方案24-33中任一项的群体,其不含有任何洗涤剂。
35.实施方案24-34中任一项的群体,其含有小于200ppm、小于100ppm或者小于50ppm的非水溶剂。
36.实施方案24-35中任一项的群体,其中所述ApoA-I为人ApoA-I蛋白。
37.实施方案24-36中任一项的群体,其中所述ApoA-I为重组ApoA-I。
38.实施方案24-37中任一项的群体,其中所述ApoA-I具有与相应于SEQ ID NO:1的氨基酸25-267的蛋白至少90%或者至少95%序列同一性的氨基酸序列。
39.实施方案24-38中任一项的群体,其中所述脂质部分基本上由95-99wt%中性磷脂和1-5wt%负电荷磷脂构成。
40.实施方案39的群体,其中所述脂质部分基本上由96-98wt%中性磷脂和2-4wt%负电荷磷脂构成。
41.实施方案24-40中任一项的群体,其中所述脂质部分基本上由97wt%中性磷脂和3wt%负电荷磷脂构成。
42.实施方案41的群体,其中所述中性脂质为天然鞘磷脂或者合成鞘磷脂,任选地其中所述脂质具有小于5meq O/kg、小于4meq O/kg、小于3meq O/kg或者小于2meq O/kg的过氧化值。
43.实施方案42的群体,其中所述鞘磷脂为蛋-鞘磷脂。
44.实施方案42的群体,其由至少95%纯的鞘磷脂制备。
45.实施方案41-44中任一项的群体,其中所述负电荷磷脂包含磷脂酰甘油。
46.实施方案45的群体,其中所述负电荷磷脂包含1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)](DPPG)的盐或者由1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)](DPPG)的盐组成。
47.实施方案46的群体,其中所述盐为钠盐或者钾盐。
48.实施方案24-47中任一项的群体,其中所述中性和/或者负电荷磷脂的酰基链各自彼此独立地选自含有12-26个、14-26个或者16-26个碳原子的饱和或者单-不饱和的烃。
49.实施方案48的群体,其中所述中性和/或者负电荷磷脂的每个酰基链是相同的。
50.实施方案48的群体,其中所述中性和/或者负电荷磷脂的每个酰基链是不同的。
51.实施方案48的群体,其中所述中性和负电荷磷脂的酰基链含有相同数目的碳原子。
52.实施方案48的群体,其中所述中性和负电荷磷脂的酰基链具有不同的饱和度。
53.实施方案48的群体,其中所述中性和负电荷磷脂的酰基链含有16个碳原子。
54.实施方案24-41中任一项的群体,其具有的载脂蛋白部分:脂质部分摩尔比的范围为1:80-120、1:85-1:110或者1:100-1:115,其中所述载脂蛋白值表示为ApoA-I等价物。
55.实施方案54的群体,其具有的载脂蛋白部分:脂质部分摩尔比的范围为1:80-1:90、1:90-1:100、1:100-1:110或者1:105-1:110,其中所述载脂蛋白值表示为ApoA-I等价物。
56.实施方案24-55中任一项的群体,其具有的载脂蛋白部分与磷脂部分的重量比的范围为1:2至约1:3。
57.实施方案24-40中任一项的群体,其中所述载脂蛋白部分与磷脂部分的重量比的范围为1:2.1-1:2.7。
58.实施方案57的群体,其中所述载脂蛋白部分与磷脂部分的重量比为1:2.7。
59.药物组合物,包含实施方案1-22中任一项的脂蛋白复合物或者实施方案23-58中任一项的脂蛋白复合物的群体以及一种或者多种药用载体、稀释剂和/或者赋形剂或者基本上由实施方案1-22中任一项的脂蛋白复合物或者实施方案23-58中任一项的脂蛋白复合物的群体以及一种或者多种药用载体、稀释剂和/或者赋形剂构成。
60.工程化以表达ApoA-I蛋白的哺乳动物宿主细胞,所述ApoA-I蛋白包含与SEQID NO:1的位置25-267具有至少95%的同一性的氨基酸序列。
61.实施方案60的哺乳动物宿主细胞,其中当在培养宿主细胞时所述蛋白分泌至培养基中。
62.实施方案60或者实施方案61的哺乳动物宿主细胞,其中所述蛋白进一步包含信号序列MKAAVLTLAVLFLTGSQA。
63.实施方案60-62中任一项的哺乳动物宿主细胞,其中所述蛋白进一步包含前肽序列RHFWQQ。
64.实施方案60-63中任一项的哺乳动物宿主细胞,其为中国仓鼠卵巢(CHO)、CHO-S、CHO-K1、VERO、BHK、BHK 570、HeLa、COS-1、COS-7、MDCK细胞、293、3T3、骨髓瘤、PC12和W138。
65.实施方案64的哺乳动物宿主细胞,其为CHO细胞。
66.实施方案65的哺乳动物宿主细胞,其为CHO-S细胞或者CHO-K1细胞。
67.实施方案60-66中任一项的哺乳动物宿主细胞,其能够在培养物中产生至少0.5、1、2、3或者4g/L的所述ApoA-I蛋白。
68.实施方案67的哺乳动物宿主细胞,其能够在培养物中产生至多4、5、6、7、8、9、10、12、15或者20g/L的所述ApoA-I蛋白。
69.实施方案67或者实施方案68的哺乳动物宿主细胞,其中所述培养物为大规模培养物。
70.实施方案69的哺乳动物宿主细胞,其中所述大规模培养物为至少15升、至少20升、至少25升或者至少30升。
71.实施方案70的哺乳动物宿主细胞,其中所述大规模培养物为约50升、约100升、约200升或者约300升。
72.实施方案60-71中任一项的哺乳动物宿主细胞,其包含至少约5拷贝的编码所述ApoA-I蛋白的核苷酸序列。
73.实施方案72的哺乳动物宿主细胞,其中每个核苷酸序列可操作地与启动子连接。
74.实施方案73的哺乳动物宿主细胞,其中所述启动子为巨细胞病毒启动子。
75.实施方案74的哺乳动物宿主细胞,其中所述启动子为即早猿猴巨细胞病毒启动子。
76.实施方案60-75中任一项的哺乳动物宿主细胞,其分泌成熟ApoA-I蛋白,所述成熟ApoA-I蛋白包含相应于SEQ ID NO:1的氨基酸25-267的氨基序列或者由相应于SEQ IDNO:1的氨基酸25-267的氨基序列构成。
77.哺乳动物细胞培养物,包含多个实施方案60-76中任一项的哺乳动物宿主细胞。
78.实施方案77的哺乳动物细胞培养物,其包含至少约0.5g/L的成熟ApoA-I蛋白,其包含相应于SEQ ID NO:1的氨基酸25-267的氨基序列或者由相应于SEQ ID NO:1的氨基酸25-267的氨基序列构成。
79.实施方案78的哺乳动物细胞培养物,其中至少80%、至少85%或者至少90%的所述成熟ApoA-I蛋白缺失信号序列。
80.实施方案78的哺乳动物细胞培养物,其中至少80%、至少85%或者至少90%的所述成熟ApoA-I蛋白缺失信号序列和前肽序列。
81.实施方案78-80中任一项的哺乳动物细胞培养物,其中至少80%、至少85%或者至少90%的所述成熟ApoA-I蛋白未被截短、氧化或者被脱去酰胺。
82.产生成熟的生物学活性ApoA-1蛋白的方法,包括在表达并分泌ApoA-I蛋白的条件下培养实施方案60-76中任一项的哺乳动物宿主细胞。
83.实施方案82的方法,进一步包括由所述培养的哺乳动物宿主细胞的上清液回收所述成熟的生物学活性ApoA-1蛋白。
84.实施方案82或者实施方案83的方法,进一步包括纯化ApoA-I蛋白。
85.药物组合物,包含治疗有效量的由实施方案84的方法获得的ApoA-I蛋白或者可由实施方案84的方法获得的ApoA-I蛋白。
86.实施方案85的药物组合物,其中所述ApoA-I蛋白与脂质复合。
87.用于在包含ApoA-I的药物组合物中最小化氧化产物的方法,包括在惰性气体下制造所述药物组合物。
88.实施方案87的方法,其中所述惰性气体为氮气、氦气或者氩气。
89.实施方案87或者实施方案88的方法,其中所述药物组合物为包含ApoA-I的脂蛋白复合物的药物组合物。
90.制备脂蛋白复合物的方法,包括:
(a)从第一温度范围内的温度至第二温度范围内的温度冷却包含脂质成分和蛋白成分的起始混悬液,
其中所述脂质成分基本上由脂质颗粒构成,且其中所述蛋白成分基本上由脂质-结合肽和/或者脂质-结合蛋白构成;
(b)从在所述第二温度范围内的温度至所述第一温度范围内的温度加热所述(a)的冷却的混悬液;
(c)从在所述第一温度范围内的温度至所述第二温度范围内的温度冷却所述(b)的加热的混悬液;以及
(d)重复步骤(b)和(c)至少一次,
由此形成脂蛋白复合物。
91.实施方案90的方法,其中步骤(c)包括重复步骤(a)和(b)直到至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%或者至少99%的所述脂质成分和/或者所述蛋白成分为复合物形式。
92.实施方案90或者实施方案91的方法,其中步骤(c)包括重复步骤(a)和(b)直到获得至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%或者至少99%均质性的脂蛋白复合物。
93.实施方案90-92中任一项的方法,其中步骤(d)包括重复步骤(b)和(c)至少三次、至少四次或者至少五次。
94.实施方案90-93中任一项的方法,其中步骤(c)包括重复步骤(b)和(c)至多六次、至多八次或者至多十次。
95.实施方案90-94中任一项的方法,其中在步骤(a)后,将所述混悬液保持在第二温度范围达至少1、至少2、至少3、至少4或者至少5分钟,之后进行所述加热步骤(b)。
96.实施方案90-95中任一项的方法,其中在步骤(a)后,将所述混悬液保持在第二温度范围达至多6、至多8、至多10、至多20分钟、至多30分钟或者至多1小时,之后进行所述加热步骤(b)。
97.实施方案90-96中任一项的方法,其中在步骤(b)后,将所述混悬液保持在第一温度范围达至少1、至少2、至少3、至少4或者至少5分钟,之后进行所述冷却步骤(c)。
98.实施方案90-97中任一项的方法,其中在步骤(b)后,将所述混悬液保持在第一温度范围达至多6、至多8、至多10、至多20分钟、至多30分钟或者至多1小时,之后进行所述冷却步骤(c)。
99.实施方案90-98中任一项的方法,其中不使所得的脂蛋白复合物进行离心。
100.实施方案90-99中任一项的方法,其中在步骤(a)的所述起始混悬液中,所述脂质成分和蛋白成分分别代表大部分脂质以及蛋白和肽。
101.实施方案90-100中任一项的方法,其中在步骤(a)的所述起始混悬液中,所述脂质成分代表至少60%、至少70%、至少80%或者至少90%的脂质。
102.实施方案90-101中任一项的方法,其中在步骤(a)的所述起始混悬液中,所述蛋白成分代表至少60%、至少70%、至少80%或者至少90%的蛋白和肽。
103.实施方案90-102中任一项的方法,其中在步骤(a)的所述起始混悬液中,在所述混悬液中的至多5%、至多10%、至多15%或者至多20%的脂质预先与所述蛋白成分复合。
104.实施方案90-103中任一项的方法,其中所述第一温度范围包括低于所述蛋白成分的转变温度不小于10℃且高于所述蛋白成分的转变温度不超过15、不超过10或者不超过5℃的温度。
105.实施方案90-104中任一项的方法,其中所述第二温度范围包括低于所述蛋白成分的转变温度不小于5或者不小于10℃且高于所述蛋白成分的转变温度不超过5℃的温度。
106.实施方案90-105中任一项的方法,其中所述第一温度范围的跨度不超过1℃、2℃、3℃、4℃、5℃、7℃或者10℃。
107.实施方案90-106中任一项的方法,其中所述第二温度范围的跨度不超过1℃、2℃、3℃、4℃、5℃、7℃或者10℃。
108.实施方案90-107中任一项的方法,进一步包括形成所述起始混悬液的步骤。
109.实施方案108的方法,其中形成所述混悬液包括使得各自在所述第一范围的温度预先加热的脂质颗粒的混悬液以及所述脂质-结合肽和/或者脂质-结合蛋白的溶液混合的步骤。
110.实施方案108的方法,其中形成所述混悬液包括使得各自在所述第一范围的温度预先加热的脂质颗粒群体和预先与脂质复合的所述脂质-结合肽和/或者脂质-结合蛋白混合。
111.实施方案110的方法,其中所述起始混悬液中的预先与脂质-结合肽和/或者脂质-结合蛋白复合的脂质占总脂质的不超过5%、不超过10%、不超过15%或者不超过20%。
112.实施方案109-111中任一项的方法,其中所述脂质溶液为均质的脂质溶液。
113.实施方案112的方法,进一步包括在所述混合步骤之前使用高压匀浆形成均质的脂质的溶液的步骤。
114.实施方案113的方法,其中所述高压匀浆处于高于1500巴、高于1800巴或者高于2000巴的压力。
115.实施方案114的方法,其中所述高压匀浆在1900-2500巴的压力进行。
116.实施方案90-115中任一项的方法,其中所述脂质成分基本上由脂质颗粒构成,所述脂质颗粒:
(i)具有至少45nm、至少50nm、至少55nm或者至少60nm的粒度,如经DLS所测量;以及
(ii)具有至多65nm、至多70nm、至多75nm、至多80nm、至多100nm、至多120nm、至多150nm、至多200nm、至多250nm、至多300nm、至多500nm的粒度,如经DLS所测量。
117.实施方案116的方法,所述脂质颗粒具有至多65nm、至多70nm、至多75nm或者至多80nm的粒度,如经DLS所测量。
118.实施方案116的方法,所述脂质颗粒具有至多100nm、至多120nm、至多150nm、至多200nm、至多250nm、至多300nm、至多500nm的粒度,如经DLS所测量。
119.实施方案90-116中任一项的方法,其中重复步骤(b)和(c)直到获得4nm至15nm、5nm至15nm、6nm至15nm或者8nm至15nm粒度的脂蛋白复合物。
120.实施方案90-116中任一项的方法,其中重复步骤(b)和(c)直到获得5nm至12nm、6nm至12nm或者8nm至12nm粒度的脂蛋白复合物。
121.实施方案90-120中任一项的方法,其中一个、多于一个或者所有步骤在惰性气体下进行。
122.实施方案121的方法,其中所述惰性气体为氮气。
123.实施方案90-122中任一项的方法,其中所述蛋白成分包含脂质-结合蛋白或者由脂质-结合蛋白组成。
124.实施方案123的方法,其中所述脂质-结合蛋白为ApoA-I、ApoA-II、ApoA-IV、ApoC-I、ApoC-II、ApoC-III、ApoE或者它们的混合物。
125.实施方案90-122中任一项的方法,其中所述蛋白成分包含脂质-结合肽或者由脂质-结合肽组成。
126.实施方案125的方法,其中所述脂质结合肽为ApoA-I、ApoA-II、ApoA-IV、ApoC-I、ApoC-II、ApoC-III、ApoE的类似物或者它们的混合物。
127.实施方案90-126中任一项的方法,其中所述脂质成分包含天然脂质、合成的脂质或者它们的混合物或者由天然脂质、合成的脂质或者它们的混合物组成。
128.实施方案127的方法,其中所述脂质成分包含以下物质或者由以下物质组成:醚磷脂、短链磷脂、胆固醇、胆固醇衍生物、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇、鞘脂质、磷脂酰甘油、神经节苷酯和/或者脑苷脂。
129.实施方案128的方法,其中所述脂质成分包含以下物质或者由以下物质组成:蛋磷脂酰胆碱、大豆磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二肉豆蔻酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱、1-肉豆蔻酰-2-棕榈酰磷脂酰胆碱、1-棕榈酰-2-肉豆蔻酰磷脂酰胆碱、1-棕榈酰-2-硬脂酰磷脂酰胆碱、1-硬脂酰-2-棕榈酰磷脂酰胆碱、二油酰磷脂酰胆碱、二油酰磷脂酰乙醇胺、二月桂酰磷脂酰甘油、二磷脂酰甘油、二肉豆蔻酰磷脂酰甘油、二棕榈酰磷脂酰甘油、二硬脂酰磷脂酰甘油、二油酰磷脂酰甘油、二肉豆蔻酰磷脂酸、二棕榈酰磷脂酸、二肉豆蔻酰磷脂酰乙醇胺、二棕榈酰磷脂酰乙醇胺、二肉豆蔻酰磷脂酰丝氨酸、二棕榈酰磷脂酰丝氨酸、鞘磷脂、二棕榈酰鞘磷脂、二硬脂酰鞘磷脂、二棕榈酰磷脂酰基甘油盐、磷脂酸、半乳糖脑苷脂、二月桂基磷脂酰胆碱、(1,3)-D-甘露糖基(1,3)甘油二酯、氨基苯基糖苷和/或者3-胆固醇基-6'-(糖基硫基)己基醚糖脂。
130.实施方案90-126中任一项的方法,其中所述脂质成分包含中性脂质。
131.实施方案130的方法,其中所述脂质成分主要为中性脂质。
132.实施方案130或者实施方案131的方法,其中所述中性脂质包含鞘磷脂。
133.实施方案132的方法,其中所述中性脂质主要为鞘磷脂。
134.实施方案132或者实施方案133的方法,其中所述鞘磷脂包含D-赤藓糖-鞘磷脂和/或者D-赤藓糖二氢鞘磷脂或者由D-赤藓糖-鞘磷脂和/或者D-赤藓糖二氢鞘磷脂构成。
135.实施方案130-135中任一项的方法,其中所述起始混悬液进一步包含负电荷磷脂。
136.实施方案135的方法,其中所述负电荷磷脂包含磷脂酰甘油或者由磷脂酰甘油构成。
137.实施方案136的方法,其中所述磷脂酰甘油具有C16:0酰基链。
138.实施方案136或者实施方案137的方法,其中所述磷脂酰甘油包含1,2-二棕榈酰-sn-甘油-3--磷酸-(1'--外消旋-甘油)的盐或者由1,2-二棕榈酰-sn-甘油-3--磷酸-(1'--外消旋-甘油)的盐构成。
139.实施方案138的方法,其中所述盐为钠盐。
140.实施方案90-139中任一项的方法,其中所述起始混悬液的脂质:蛋白摩尔比为约2:1至约200:1。
141.实施方案140的方法,其中所述起始混悬液的脂质:蛋白摩尔比为约10:1至约125:1。
142.实施方案140的方法,其中所述起始混悬液的脂质:蛋白摩尔比为约10:1至约150:1。
143.实施方案140的方法,其中所述起始混悬液的脂质:蛋白摩尔比为约75:1至125:1。
144.实施方案90-143中任一项的方法,其中所述起始混悬液含有范围为2-6(荷负电的脂质):90-120(中性脂质):1(脂质-结合肽、脂质结合蛋白或者它们的混合物)的摩尔比的荷负电的脂质、中性脂质和脂质-结合肽。
145.实施方案90-144中任一项的方法,其中所述第一温度范围为55℃至60℃。
146.实施方案90-145中任一项的方法,其中所述第二温度范围为35℃至40℃。
147.实施方案90-146中任一项的方法,其进一步包括将所得的脂蛋白复合物低压冻干的步骤。
148.实施方案147的方法,进一步包括在低压冻干前加入等渗剂的步骤。
149.药物组合物,包含脂蛋白复合物的群体,其中所述脂蛋白复合物:
(a)具有4nm至15nm、6nm至15nm、5至12nm或者8至10nm的粒度,如经GPC或者DLS所测量;以及
(b)为至少75%均质的、至少80%均质的、至少85%均质的、至少90%均质的、至少95%均质的、至少97%均质的、至少98%均质的或者至少99%均质的,如由凝胶渗透色谱法中的单峰所反映。
150.制备药物组合物的方法,包括:
(a)制备实施方案90-146中任一项的脂蛋白复合物的群体;和
(b)使得所述脂蛋白复合物的群体与一种或者多种药用赋形剂混合。
151.实施方案150的方法,其中所述药物组合物在惰性气体下制备。
152.实施方案151的方法,其中所述惰性气体为氮气、氦气或者氩气。
153.实施方案150-152中任一项的方法,进一步包括将药物组合物低压冻干的步骤。
154.实施方案150-152中任一项的方法,进一步包括将药物组合物等分为单独的单位剂量的步骤。
155.实施方案154的方法,进一步包括将单独的单位剂量低压冻干的步骤。
156.制备药物组合物的方法,包括将经实施方案147的方法或者实施方案153或者实施方案155的方法制备的低压冻干的脂蛋白复合物制剂重构。
157.实施方案156的方法,进一步包括使得重构的脂蛋白复合物与一种或者多种药用赋形剂混合。
158.实施方案156或者实施方案157的方法,进一步包括将药物组合物等分为单独的单位剂量的步骤。
159.经实施方案150或者实施方案156的方法制备的液体药物组合物。
160.经实施方案153的方法制备的低压冻干的药物组合物。
161.经实施方案158的方法制备的液体单位剂型。
162.液体单位剂型,包含治疗有效量的实施方案149的药物组合物。
163.经实施方案155的方法制备的无水单位剂型。
164.治疗血脂异常障碍的方法,包括向有此需要的受试者给予治疗有效量的:
(a)实施方案1-22中任一项的脂蛋白复合物;
(b)实施方案23-58中任一项的脂蛋白复合物的群体;
(c)实施方案59、149和159中任一项的药物组合物;
(d)经实施方案90-148中任一项的方法制备的治疗有效量的脂蛋白复合物;
(e)实施方案161或者实施方案162的单位剂型;
(f)在单一给药至多45mg/kg至健康志愿者之后不导致肝酶提升的脂蛋白复合物;
(g)在向人类受试者进行二、三、四、五或者六次给药后不导致肝酶提升的脂蛋白复合物;
(h)在向人类受试者以1mg/kg至20mg/kg的剂量单一给药后不导致肝酶提升的脂蛋白复合物;
(i)在向人类受试者以1mg/kg至20mg/kg的每次给药剂量进行二、三、四、五或者六次给药后不导致肝酶提升的脂蛋白复合物;
(j)在单一给药至多20mg/kg至健康志愿者之后不导致多于两倍的甘油三酯的增加的脂蛋白复合物;
(k)在向人类受试者进行二、三、四、五或者六次给药后不导致多于两倍的甘油三酯的增加的脂蛋白复合物;
(l)在向人类受试者以1mg/kg至20mg/kg的剂量单一给药后不导致多于两倍的甘油三酯的增加的脂蛋白复合物;或者
(m)在向人类受试者以1mg/kg至20mg/kg的每次给药剂量进行二、三、四、五或者六次给药后不导致多于两倍的甘油三酯的增加的脂蛋白复合物。
165.实施方案164的方法,进一步包括重复所述给药。
166.实施方案165的方法,其中所述给药以6天至12天的间隔重复。
167.实施方案166的方法,其中每周给药。
168.实施方案165-167中任一项的方法,其中历时一个月、五周、六周、两个月、三个月、六个月、一年、2年、3年或者更长的时间进行给药。
169.实施方案165-167中任一项的方法,其中进行给药一次、两次、三次、四次、五次、六次、七次、八次、九次、十次、十一次或者十二次。
170.实施方案164-169中任一项的方法,其中进行静脉内给药。
171.实施方案170的方法,其中经输注给药。
172.实施方案实施方案171的方法,其中历时一至四小时进行输注。
173.实施方案171的方法,其中历时至多24小时进行输注。
174.实施方案170-173中任一项的方法,其中脂蛋白复合物的量的范围为每次给药约0.25mg/kg ApoA-I等价物至约30mg/kg ApoA-I等价物。
175.实施方案174的方法,其中脂蛋白复合物的量的范围为每次给药约1mg/kgApoA-I等价物至约15mg/kg ApoA-I等价物。
176.实施方案175的方法,其中脂蛋白复合物的量的范围为每次给药约2mg/kgApoA-I等价物至约12mg/kg ApoA-I等价物。
177.实施方案176的方法,其中脂蛋白复合物的量为每次给药约3mg/kg ApoA-I等价物。
178.实施方案176的方法,其中脂蛋白复合物的量为每次给药约6mg/kg ApoA-I等价物。
179.实施方案176的方法,其中脂蛋白复合物的量为每次给药约12mg/kg ApoA-I等价物。
180.治疗血脂异常障碍的方法,包括:
(a)向受试者给予1mg/kg至12mg/kg的初始剂量的以下物质:
(i)实施方案1-22中任一项的脂蛋白复合物;
(ii)实施方案23-58中任一项的脂蛋白复合物的群体;
(iii)实施方案59、149和159中任一项的药物组合物;
(iv)经实施方案90-148中任一项的方法制备的治疗有效量的脂蛋白复合物;
(v)实施方案161或者实施方案162的单位剂型;
(vi)在单一给药至多45mg/kg至健康志愿者之后不导致肝酶提升的脂蛋白复合物;
(vii)在向人类受试者进行二、三、四、五或者六次给药后不导致肝酶提升的脂蛋白复合物;
(viii)在向人类受试者以1mg/kg至20mg/kg的剂量单一给药后不导致肝酶提升的脂蛋白复合物;
(ix)在向人类受试者以1mg/kg至20mg/kg的每次给药剂量进行二、三、四、五或者六次给药后不导致肝酶提升的脂蛋白复合物;
(x)在单一给药至多20mg/kg至健康志愿者之后不导致多于两倍的甘油三酯的增加的脂蛋白复合物;
(xi)在向人类受试者进行二、三、四、五或者六次给药后不导致多于两倍的甘油三酯的增加的脂蛋白复合物;
(xii)在向人类受试者以1mg/kg至20mg/kg的剂量单一给药后不导致多于两倍的甘油三酯的增加的脂蛋白复合物;或者
(xiii)在向人类受试者以1mg/kg至20mg/kg的每次给药剂量进行二、三、四、五或者六次给药后不导致多于两倍的甘油三酯的增加的脂蛋白复合物;
(b)在所述给药后4、8、12、24、48、72、168、336或者504小时确定所述受试者的甘油三酯、VLDL-胆固醇和/或者VLDL-甘油三酯是否提升至多于两倍;以及
(c)如果所述受试者的甘油三酯、VLDL-胆固醇和/或者VLDL-甘油三酯提升至给药前水平的多于两倍,则以较低剂量重复所述给药,且如果所述受试者的甘油三酯、VLDL-胆固醇和/或者VLDL-甘油三酯并未提升至给药前水平的多于两倍,则以相同或者更大的剂量重复所述给药。
181.实施方案165-180中任一项的方法,其中所述受试者具有高脂血症或者心血管疾病或者易发高脂血症或者心血管疾病。
182.实施方案181的方法,其中所述患者具有高脂血症或者易发高脂血症,且所述高脂血症为高胆固醇血症。
183.实施方案181的方法,其中所述患者具有心血管疾病或者易发心血管疾病,且其中所述心血管疾病为动脉粥样硬化、中风、心肌梗塞、急性冠脉综合征、心绞痛、间歇性跛行、严重肢体缺血、房脉瓣硬化或者再狭窄。
184.实施方案165-183中任一项的方法,进一步包括另外给予胆汁酸树脂、烟酸、抗炎剂、他汀类药物、贝特类、CETP抑制剂、血小板凝聚抑制剂、抗凝血剂、PCSK9激动剂和/或者胆固醇吸收抑制剂。
185.实施方案181的方法,进一步包括给予选自阿托伐他汀、罗苏伐他汀、普伐他汀或者洛伐他汀的他汀类药物。
186.实施方案181的方法,进一步包括给予贝特类非诺贝特。
187.实施方案181的方法,进一步包括给予胆固醇吸收抑制剂Zetia。
188.实施方案181的方法,进一步包括给予选自安塞曲匹和达塞曲匹的CETP抑制剂。
189.实施方案181的方法,进一步包括给予PCSK9抗体激动剂或者PCSK9配体激动剂。
190.实施方案181的方法,进一步包括给予胆固醇吸收抑制剂氯吡格雷硫酸氢盐。
191.实施方案181的方法,进一步包括给予抗凝血剂华法林。
192.实施方案181的方法,进一步包括给予抗炎剂阿司匹林。
193.组合物,包含一个、两个或者三个均质的脂蛋白复合物群体。
194.实施方案193的组合物,其中在至少一个均质的群体中的脂蛋白复合物具有实施方案1-22中任一项的复合物特征。
195.实施方案193或者实施方案194的组合物,其中所述群体中的至少一个、两个或者三个具有实施方案23-58中任一项的群体特征。
所有引用的参考文献均通过引用的方式将其内容并入本申请中以用于所有目的,就如同每个单独的公开、专利或专利申请都被具体地、单独地通过引用的方式将其内容并入本申请以用于所有目的。
对于本领域技术人员显而易见的是,可对本发明作出多种改进和变化而不脱离其实质和范围。所描述的特定实施方案仅通过举例的方式提供,并且本发明不单限于所附权利要求的术语,而且还可以覆盖此类权利要求具有的等价的全部范围。
序列表
<110> 塞勒尼斯医疗控股公司(CERENIS THERAPEUTICS HOLDING S.A.)
<120> 脂蛋白复合物及其制备和用途
<130> 376201-015WO (114437)
<140>
<141>
<150> 61/487,263
<151> 2011-05-17
<150> 61/452,630
<151> 2011-03-14
<150> 61/440,371
<151> 2011-02-07
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 267
<212> PRT
<213> 人
<400> 1
Met Lys Ala Ala Val Leu Thr Leu Ala Val Leu Phe Leu Thr Gly Ser
1 5 10 15
Gln Ala Arg His Phe Trp Gln Gln Asp Glu Pro Pro Gln Ser Pro Trp
20 25 30
Asp Arg Val Lys Asp Leu Ala Thr Val Tyr Val Asp Val Leu Lys Asp
35 40 45
Ser Gly Arg Asp Tyr Val Ser Gln Phe Glu Gly Ser Ala Leu Gly Lys
50 55 60
Gln Leu Asn Leu Lys Leu Leu Asp Asn Trp Asp Ser Val Thr Ser Thr
65 70 75 80
Phe Ser Lys Leu Arg Glu Gln Leu Gly Pro Val Thr Gln Glu Phe Trp
85 90 95
Asp Asn Leu Glu Lys Glu Thr Glu Gly Leu Arg Gln Glu Met Ser Lys
100 105 110
Asp Leu Glu Glu Val Lys Ala Lys Val Gln Pro Tyr Leu Asp Asp Phe
115 120 125
Gln Lys Lys Trp Gln Glu Glu Met Glu Leu Tyr Arg Gln Lys Val Glu
130 135 140
Pro Leu Arg Ala Glu Leu Gln Glu Gly Ala Arg Gln Lys Leu His Glu
145 150 155 160
Leu Gln Glu Lys Leu Ser Pro Leu Gly Glu Glu Met Arg Asp Arg Ala
165 170 175
Arg Ala His Val Asp Ala Leu Arg Thr His Leu Ala Pro Tyr Ser Asp
180 185 190
Glu Leu Arg Gln Arg Leu Ala Ala Arg Leu Glu Ala Leu Lys Glu Asn
195 200 205
Gly Gly Ala Arg Leu Ala Glu Tyr His Ala Lys Ala Thr Glu His Leu
210 215 220
Ser Thr Leu Ser Glu Lys Ala Lys Pro Ala Leu Glu Asp Leu Arg Gln
225 230 235 240
Gly Leu Leu Pro Val Leu Glu Ser Phe Lys Val Ser Phe Leu Ser Ala
245 250 255
Leu Glu Glu Tyr Thr Lys Lys Leu Asn Thr Gln
260 265
<210> 2
<211> 18
<212> PRT
<213> 人
<220>
<221> 信号
<222> (1)..(18)
<400> 2
Met Lys Ala Ala Val Leu Thr Leu Ala Val Leu Phe Leu Thr Gly Ser
1 5 10 15
Gln Ala
<210> 3
<211> 6
<212> PRT
<213> 人
<220>
<221> PROPEP
<222> (1)..(6)
<400> 3
Arg His Phe Trp Gln Gln
1 5
<210> 4
<211> 22
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注意="人工序列的描述: 合成多肽"
<220>
<221> MOD_RES
<222> (22)..(22)
<223> 哌啶-4-甲酸
<400> 4
Lys Leu Lys Gln Lys Leu Ala Glu Leu Leu Glu Asn Leu Leu Glu Arg
1 5 10 15
Phe Leu Asp Leu Val Xaa
20
Claims (43)
1.脂蛋白复合物的群体,其各自包含脂质部分和载脂蛋白部分,所述载脂蛋白部分包含载脂蛋白A-I (“ApoA-I”),其中根据经凝胶渗透色谱法的单峰所反映,所述脂蛋白复合物为至少95%均质的,其中所述脂蛋白复合物的群体通过以下方法产生,所述方法包括:
(a)将包含脂质成分和蛋白成分的起始混悬液从第一温度范围内的温度冷却至第二温度范围内的温度,其中:
(i)所述起始混悬液中的脂质:蛋白摩尔比为2:1至200:1;
(ii)所述起始混悬液中的脂质包含重量:重量比为99:1至95:5的中性磷脂和带负电荷的磷脂;
(iii)其中所述中性磷脂和带负电荷的磷脂的酰基链的长度为14-20个碳;和
(iv)所述第一温度范围包括不低于所述蛋白成分的相转变温度5℃至不高于所述蛋白成分的相转变温度5℃的温度,并且所述第二温度范围包括不低于所述脂质成分的相转变温度5℃至不高于所述脂质成分的相转变温度5℃的温度;
(b)将所述(a)的经冷却的混悬液从所述第二温度范围内的温度加热至所述第一温度范围内的温度;
(c)将所述(b)的经加热的混悬液从所述第一温度范围内的温度冷却至所述第二温度范围内的温度;和
(d)重复步骤(b)和(c),直至获得至少95%均质的脂蛋白复合物,从而形成脂蛋白复合物。
2.权利要求1所述的群体,其中所述脂质成分包含脂质颗粒,并且所述蛋白成分包含ApoA-I或ApoA-I和脂质,所述脂质的含量为以起始混悬液中的脂质总量的重量计不超过10%。
3.权利要求1或权利要求2所述的群体,其中所述脂蛋白复合物为至少97%均质,根据经凝胶渗透色谱法的单峰所反映。
4.权利要求1至3中任一项所述的群体,其中以群体中的ApoA-I的重量计至少98%是非截短的ApoA-I。
5. 权利要求1-4中任一项所述的群体,其中根据经凝胶渗透色谱法(“GPC”)或者动态光散射(“DLS”)所测量,至少95%的所述脂蛋白复合物为具有以下粒度的颗粒的形式:4 nm至15 nm、6 nm至15 nm、4 nm至12 nm、6 nm至12 nm或者8 nm至12 nm。
6. 权利要求1-5中任一项所述的群体,其中在所述群体中至少75 wt%、至少80 wt%、至少85 wt%、至少90 wt%或者至少95 wt%的ApoA-I为成熟形式。
7. 权利要求1-5中任一项所述的群体,其中在所述群体中不超过25 wt%、不超过20wt%、不超过15 wt%、不超过10 wt%或者不超过5 wt%的ApoA-I为不成熟形式。
8.权利要求1-7中任一项所述的群体,其中在所述群体中所述ApoA-I中的不超过10%、不超过5%、不超过3%、不超过2%或者不超过1%的蛋氨酸112和蛋氨酸148各自被氧化。
9.权利要求1-8中任一项所述的群体,其中在所述群体中所述ApoA-I的不超过15%、不超过10%、不超过5%、不超过4%、不超过3%、不超过2%或者不超过1%的氨基酸被脱去酰胺。
10. 权利要求1-9中任一项所述的群体,其中所述群体含有不超过1 EU内毒素/毫克ApoA-I、不超过0.5 EU内毒素/毫克ApoA-I、不超过0.3 EU内毒素/毫克ApoA-I或者不超过0.1 EU内毒素/毫克ApoA-I。
11.权利要求1-10中任一项所述的群体,其中所述群体含有不超过100皮克宿主细胞DNA/毫克ApoA-I、不超过50皮克宿主细胞DNA/毫克ApoA-I、不超过25皮克宿主细胞DNA/毫克ApoA-I、不超过10皮克宿主细胞DNA/毫克ApoA-I或者不超过5皮克宿主细胞DNA/毫克ApoA-I。
12.权利要求1-11中任一项所述的群体,其中所述群体含有不超过500纳克宿主细胞蛋白/毫克ApoA-I、不超过200纳克宿主细胞蛋白/毫克ApoA-I、不超过100纳克宿主细胞蛋白/毫克ApoA-I、不超过50纳克宿主细胞蛋白/毫克ApoA-I或者不超过20纳克宿主细胞蛋白/毫克ApoA-I。
13. 权利要求1-12中任一项所述的群体,其中所述群体包含不超过200 pm、不超过100ppm或不超过50 ppm的非含水溶剂和/或不包含任何洗涤剂。
14. 权利要求1-13中任一项所述的群体,其中在所述复合物的脂质部分中不超过15wt%、不超过10 wt%、不超过5 wt%或者不超过2 wt%的脂质为胆固醇。
15.权利要求1-14中任一项所述的群体,其中所述ApoA-I为人ApoA-I蛋白。
16.权利要求1-15中任一项所述的群体,其中所述ApoA-I为重组ApoA-I。
17.权利要求1-16中任一项所述的群体,其中所述中性磷脂包含鞘磷脂。
18. 权利要求1-17中任一项所述的群体,其中所述带负电荷的脂质包含1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)] (DPPG)或其盐。
19.权利要求1-18中任一项所述的群体,其中所述群体中带负电荷的脂质的组分与中性脂质和ApoA-I的摩尔比为2-6:90-120:1。
20. 权利要求1-19中任一项所述的群体,其中所述脂质部分包含96至98 wt%的中性磷脂和2至4 wt%的带负电荷的磷脂。
21. 权利要求20所述的群体,其中所述脂质部分包含97 wt%的中性磷脂和3 wt%的带负电荷的磷脂。
22.权利要求21所述的群体,其中所述中性磷脂为天然鞘磷脂或者合成鞘磷脂。
23. 权利要求22所述的群体,其中所述脂质具有小于5 meq O/kg、小于4 meq O/kg、小于3 meq O/kg或者小于2 meq O/kg的过氧化值。
24.权利要求22或权利要求23所述的群体,其中所述鞘磷脂为蛋-鞘磷脂。
25.权利要求21-24中任一项所述的群体,其中所述带负电荷的磷脂包括磷脂酰甘油。
26. 权利要求25所述的群体,其中所述带负电荷的磷脂包括1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)] (DPPG)的盐或者由1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)] (DPPG)的盐组成。
27.权利要求1-21中任一项所述的群体,其中所述第一温度范围为55℃至60℃。
28. 权利要求27所述的群体,其中所述中性磷脂包含鞘磷脂,所述带负电荷的磷脂包含1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)] (DPPG)或其盐,并且所述第二温度范围为35℃至40℃。
29.权利要求1-28中任一项所述的群体,其具有范围为1:2至1:3的载脂蛋白部分与磷脂部分的重量比。
30.权利要求29所述的群体,其具有范围为1:2.7的载脂蛋白部分与磷脂部分的重量比。
31. 脂蛋白复合物的群体,其各自包含脂质部分和载脂蛋白部分,所述载脂蛋白部分包含载脂蛋白A-I (“ApoA-I”),其中根据经凝胶渗透色谱法的单峰所反映,所述脂蛋白复合物为至少95%均质的,其中所述脂蛋白复合物的群体通过以下方法产生,所述方法包括:
(a)将包含脂质成分和蛋白成分的起始混悬液从第一温度范围内的温度冷却至第二温度范围内的温度,其中:
(i)所述起始混悬液中的脂质:蛋白摩尔比为2:1至200:1;
(ii)所述起始混悬液中的脂质包含重量:重量比为99:1至95:5的鞘磷脂和1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)] (DPPG)或其盐;和
(iii)所述第一温度范围为55℃至60℃并且所述第二温度范围为35℃至40℃;
(b)将所述(a)的经冷却的混悬液从所述第二温度范围内的温度加热至所述第一温度范围内的温度;
(c)将所述(b)的经加热的混悬液从所述第一温度范围内的温度冷却至所述第二温度范围内的温度;和
(d)重复步骤(b)和(c),直至获得至少95%均质的脂蛋白复合物,从而形成脂蛋白复合物。
32.权利要求31所述的群体,其具有范围为1:2至1:3的载脂蛋白部分与磷脂部分的重量比。
33.权利要求32所述的群体,其具有1:2.7的载脂蛋白部分与磷脂部分的重量比。
34.一种组合物,其包含根据权利要求1-33中任一项所述的群体。
35.一种组合物,其包含二个、三个或者四个根据权利要求1-33中任一项所述的群体。
36.权利要求34或35所述的组合物,其中所述组合物中的不超过5%、不超过4%、不超过3%、不超过2%、不超过1%的脂蛋白为非复合形式。
37.权利要求34-36中任一项所述的组合物,其中所述组合物中的不超过5%、不超过4%、不超过3%、不超过2%、不超过1%的脂质为非复合形式。
38.权利要求34-37中任一项所述的组合物,其包含第一群体,所述第一群体包含在每个脂蛋白复合物中具有2个ApoA-I分子或者ApoA-I等价物的脂蛋白复合物。
39.权利要求38所述的组合物,其包含第二群体,所述第二群体包含在每个脂蛋白复合物中具有3或4个ApoA-I分子或者ApoA-I等价物的脂蛋白复合物。
40.权利要求34-39中任一项所述的组合物,其还包含一种或者多种药学上可接受的载体、稀释剂和/或赋形剂。
41.药物组合物,其包含根据权利要求1-33中任一项所述的脂蛋白复合物的群体以及一种或者多种药学上可接受的载体、稀释剂和/或赋形剂,或者由根据权利要求1-33中任一项所述的脂蛋白复合物的群体以及一种或者多种药学上可接受的载体、稀释剂和/或赋形剂组成。
42.单位剂型,其包含治疗有效量的权利要求41所述的药物组合物。
43.根据权利要求1-33中任一项所述的脂蛋白复合物的群体或根据权利要求34-40中任一项所述的组合物在制备用于治疗血脂异常障碍的药物中的用途。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201710493059.2A CN107337728B (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161440371P | 2011-02-07 | 2011-02-07 | |
| US61/440,371 | 2011-02-07 | ||
| US201161452630P | 2011-03-14 | 2011-03-14 | |
| US61/452,630 | 2011-03-14 | ||
| US201161487263P | 2011-05-17 | 2011-05-17 | |
| US61/487,263 | 2011-05-17 | ||
| CN201710493059.2A CN107337728B (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
| PCT/US2012/024020 WO2012109162A1 (en) | 2011-02-07 | 2012-02-06 | Lipoprotein complexes and manufacturing and uses thereof |
| CN201280015257.3A CN103443123B (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201280015257.3A Division CN103443123B (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107337728A CN107337728A (zh) | 2017-11-10 |
| CN107337728B true CN107337728B (zh) | 2023-05-23 |
Family
ID=45592833
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201510711086.3A Pending CN105288589A (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
| CN201280015257.3A Active CN103443123B (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
| CN201510717344.9A Pending CN105294859A (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
| CN201710493059.2A Active CN107337728B (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
Family Applications Before (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201510711086.3A Pending CN105288589A (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
| CN201280015257.3A Active CN103443123B (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
| CN201510717344.9A Pending CN105294859A (zh) | 2011-02-07 | 2012-02-06 | 脂蛋白复合物及其制备和用途 |
Country Status (27)
| Country | Link |
|---|---|
| US (8) | US20120232005A1 (zh) |
| EP (4) | EP3466969B1 (zh) |
| JP (4) | JP6219170B2 (zh) |
| KR (1) | KR20140053848A (zh) |
| CN (4) | CN105288589A (zh) |
| AU (1) | AU2012214672B2 (zh) |
| CA (1) | CA2826158A1 (zh) |
| CY (2) | CY1121317T1 (zh) |
| DK (3) | DK2673296T3 (zh) |
| ES (2) | ES2716349T3 (zh) |
| HK (1) | HK1198834A1 (zh) |
| HR (2) | HRP20190072T1 (zh) |
| HU (2) | HUE042314T2 (zh) |
| IL (1) | IL227634B (zh) |
| IN (1) | IN2013DN07828A (zh) |
| LT (2) | LT2673296T (zh) |
| MX (2) | MX343907B (zh) |
| PH (1) | PH12016500191A1 (zh) |
| PL (2) | PL2673296T3 (zh) |
| PT (2) | PT2673296T (zh) |
| RS (2) | RS58243B1 (zh) |
| RU (2) | RU2627173C2 (zh) |
| SG (2) | SG10201801372YA (zh) |
| SI (2) | SI2673296T1 (zh) |
| TW (2) | TW201737935A (zh) |
| WO (1) | WO2012109162A1 (zh) |
| ZA (1) | ZA201305628B (zh) |
Families Citing this family (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8206750B2 (en) | 2005-03-24 | 2012-06-26 | Cerenis Therapeutics Holding S.A. | Charged lipoprotein complexes and their uses |
| WO2012000048A1 (en) | 2010-06-30 | 2012-01-05 | Csl Limited | A reconstituted high density lipoprotein formulation and production method thereof |
| CA2826158A1 (en) | 2011-02-07 | 2012-08-16 | Rose ACKERMANN | Lipoprotein complexes and manufacturing and uses thereof |
| US9125943B2 (en) | 2012-11-02 | 2015-09-08 | Csl Limited | Reconstituted HDL formulation |
| JP2016509068A (ja) * | 2013-02-28 | 2016-03-24 | エイジェンシー・フォー・サイエンス,テクノロジー・アンド・リサーチ | クロマチン欠損細胞培養採取物からの抗体のクロマトグラフィー精製 |
| CA2900902C (en) | 2013-03-15 | 2022-08-02 | Daniela Carmen Oniciu | Methods for the synthesis of sphingomyelins and dihydrosphingomyelins |
| US9708354B2 (en) | 2013-03-15 | 2017-07-18 | Cerenis Therapeutics Holding Sa | Methods for the synthesis of sphingomyelins and dihydrosphingomyelins |
| NZ631126A (en) | 2013-08-08 | 2018-06-29 | Csl Ltd | Contaminant removal method |
| EP2853259A1 (en) * | 2013-09-30 | 2015-04-01 | Université Pierre et Marie Curie (Paris 6) | Reconstituted high density lipoproteins composition and uses thereof |
| CN106488987A (zh) * | 2014-05-02 | 2017-03-08 | 塞勒尼斯医疗控股公司 | Hdl疗法标志物 |
| WO2016019333A1 (en) | 2014-07-31 | 2016-02-04 | Kinemed, Inc. | The effect of phospholipid composition of reconstituted hdl on its cholesterol efflux and anti-inflammatory properties |
| KR101671580B1 (ko) * | 2014-08-26 | 2016-11-02 | 영남대학교 산학협력단 | 미녹시딜 수용액 제조방법 |
| WO2016123365A1 (en) | 2015-01-30 | 2016-08-04 | The Regents Of The University Of Michigan | Liposomal particles comprising biological molecules and uses thereof |
| BR112017020491A2 (pt) * | 2015-03-25 | 2018-07-17 | The Regents Of The University Of Michigan | composições e métodos para distribuição de agentes de biomacromolécula. |
| US11642419B2 (en) * | 2015-03-25 | 2023-05-09 | The Regents Of The University Of Michigan | Compositions and methods for treating cardiovascular related disorders |
| EP3490579A1 (en) | 2016-07-27 | 2019-06-05 | Hartis-Pharma SA | Therapeutic combinations to treat red blood cell disorders |
| WO2018029505A1 (en) | 2016-08-11 | 2018-02-15 | Cerenis Therapeutics Holding Sa | Cer-001 therapy for treating familial primary hypoalphalipoproteinemia |
| US20190021674A1 (en) * | 2017-01-23 | 2019-01-24 | Hdl Therapeutics, Inc. | Methods for Treating Cholesterol-Related Diseases |
| ES2681124B1 (es) | 2017-03-08 | 2019-06-19 | Fund Imdea Alimentacion | Usos medicos de la apolipoproteina a y de activadores de la misma |
| TW201919712A (zh) * | 2017-08-10 | 2019-06-01 | 法商塞勒尼斯醫療控股公司 | 運送子(cargomers) |
| US20190046608A1 (en) | 2017-08-10 | 2019-02-14 | Cerenis Therapeutics Holding Sa | Apomers |
| SI3818078T1 (sl) * | 2018-07-03 | 2024-05-31 | Bristol-Myers Squibb Company | Postopki za proizvodnjo rekombinantnih proteinov |
| JP2020138941A (ja) * | 2019-02-28 | 2020-09-03 | 国立研究開発法人理化学研究所 | バイセル及びその利用 |
| CA3156906A1 (en) | 2019-11-20 | 2021-05-27 | Alkahest, Inc. | Blood plasma fractions for use in liver regeneration |
| US11484551B2 (en) | 2019-11-20 | 2022-11-01 | Alkahest, Inc. | Method of treating liver failure with plasma fraction IV-4 |
| IL297046A (en) | 2020-04-16 | 2022-12-01 | Abionyx Pharma Sa | Treatment of kidney disease using cer-001 |
| WO2021209808A1 (en) | 2020-04-16 | 2021-10-21 | Abionyx Pharma Sa | Cer-001 therapy for treating kidney disease |
| CA3177243A1 (en) | 2020-04-16 | 2021-10-21 | Abionyx Pharma Sa | Methods for treating acute conditions using lipid binding protein-based complexes |
| US20240000948A1 (en) | 2020-10-01 | 2024-01-04 | Abionyx Pharma Sa | Methods for treating eye diseases using lipid binding protein-based complexes |
| WO2022125878A1 (en) * | 2020-12-11 | 2022-06-16 | The Regents Of The University Of Michigan | Compositions and methods for preventing, attenuating, and treating medical conditions with shdl nanoparticles |
| WO2022150631A1 (en) * | 2021-01-08 | 2022-07-14 | Hdl Therapeutics, Inc | Systems and methods for reducing low attenuation plaque and/or plaque burden in patients |
| MX2023012223A (es) | 2021-04-15 | 2023-10-26 | Abionyx Pharma Sa | Uso de complejos a base de proteinas de union a lipidos en soluciones de conservacion de organos. |
| EP4340849A1 (en) * | 2021-05-19 | 2024-03-27 | Alkahest, Inc. | Blood plasma fractions for use in liver regeneration |
| US20230289963A1 (en) * | 2022-03-10 | 2023-09-14 | Cleerly, Inc. | Systems, devices, and methods for non-invasive image-based plaque analysis and risk determination |
| WO2023194798A1 (en) | 2022-04-06 | 2023-10-12 | Abionyx Pharma Sa | Methods for treating leukocytosis, endothelial dysfunction and carditis using lipid binding protein-based complexes |
| WO2023194797A1 (en) | 2022-04-06 | 2023-10-12 | Abionyx Pharma Sa | Methods for treating eye diseases using lipid binding protein-based complexes |
| WO2023237927A2 (en) | 2022-06-10 | 2023-12-14 | Abionyx Pharma Sa | Methods for treating hyperinflammatory conditions using lipid binding protein -based complexes |
| WO2023237935A2 (en) | 2022-06-10 | 2023-12-14 | Abionyx Pharma Sa | Methods for treating acute conditions using lipid binding protein-based complexes |
| WO2024003612A2 (en) | 2022-06-28 | 2024-01-04 | Abionyx Pharma Sa | Compounds and processes for the synthesis of sphingomyelins |
| KR20240009061A (ko) * | 2022-07-13 | 2024-01-22 | (재)씨젠의료재단 | 혈청 내 다중 아포지단백질의 직접정량 방법 |
| WO2024150064A1 (en) | 2023-01-13 | 2024-07-18 | Abionyx Pharma Sa | Lipid binding protein molecule therapy |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1486327A (zh) * | 2000-11-10 | 2004-03-31 | 普罗蒂奥制药公司 | 载脂蛋白类似物 |
| CN101170994A (zh) * | 2005-03-24 | 2008-04-30 | 科莱尼斯医疗公司 | 荷电的脂蛋白络合物及其用途 |
| CN101253195A (zh) * | 2005-08-26 | 2008-08-27 | 科莱尼斯医疗控股公司 | 用于在乳酸菌中制备载脂蛋白基因产物的组合物和方法 |
Family Cites Families (67)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4579821A (en) | 1981-11-23 | 1986-04-01 | University Patents, Inc. | Control of DNA sequence transcription |
| US4601978A (en) | 1982-11-24 | 1986-07-22 | The Regents Of The University Of California | Mammalian metallothionein promoter system |
| AU587989B2 (en) | 1984-10-16 | 1989-09-07 | Mitsubishi Chemical Corporation | DMA fragments, expression vectors, proteins, hosts, and process for production of the proteins |
| EP0209543A4 (en) | 1984-12-31 | 1989-07-11 | Internat Genetic Engineering I | FRAGMENTS OF HUMAN APOLIPOPROTEINS PEPTIDES, TYPE-SPECIFIC ANTIBODIES AND METHODS OF USE. |
| GB8625435D0 (en) | 1986-10-23 | 1986-11-26 | Erba Farmitalia | Human apolipoprotein ai |
| US5128318A (en) | 1987-05-20 | 1992-07-07 | The Rogosin Institute | Reconstituted HDL particles and uses thereof |
| GB8712540D0 (en) | 1987-05-28 | 1987-07-01 | Ucb Sa | Expression of human proapolipoprotein a-i |
| US4956288A (en) | 1988-04-22 | 1990-09-11 | Biogen, Inc. | Method for producing cells containing stably integrated foreign DNA at a high copy number, the cells produced by this method, and the use of these cells to produce the polypeptides coded for by the foreign DNA |
| IT1229996B (it) | 1989-04-20 | 1991-09-20 | Cesare Sirtori | Espressione di apolipoproteina ai e apolipoproteina ai-milano in lievito e composizioni farmaceutiche che contengono dette apolipoproteine. |
| US5220043A (en) | 1991-03-21 | 1993-06-15 | Ohio University | Synthesis of D-erythro-sphingomyelins |
| WO1993000443A1 (en) | 1991-06-26 | 1993-01-07 | Bio-Technology General Corp. | Purification of recombinant apolipoprotein e from bacteria |
| US5408038A (en) | 1991-10-09 | 1995-04-18 | The Scripps Research Institute | Nonnatural apolipoprotein B-100 peptides and apolipoprotein B-100-apolipoprotein A-I fusion peptides |
| SE9103701D0 (sv) * | 1991-12-13 | 1991-12-13 | Kabi Pharmacia Ab | Apolipoprotein |
| AU5457294A (en) | 1992-10-29 | 1994-05-24 | Board Of Regents, The University Of Texas System | Adenovirus-mediated ldl receptor gene transfer and targeting |
| TW402639B (en) | 1992-12-03 | 2000-08-21 | Transkaryotic Therapies Inc | Protein production and protein delivery |
| SE9203753D0 (sv) | 1992-12-11 | 1992-12-11 | Kabi Pharmacia Ab | Expression system for producing apolipoprotein ai-m |
| US5874075A (en) * | 1993-10-06 | 1999-02-23 | Amgen Inc. | Stable protein: phospholipid compositions and methods |
| US5643757A (en) | 1994-03-21 | 1997-07-01 | American Cyanamid Company | High yield production of human apolipoprotein A1 in E. coli. |
| US5840688A (en) | 1994-03-22 | 1998-11-24 | Research Corporation Technologies, Inc. | Eating suppressant peptides |
| IL109558A (en) | 1994-05-04 | 2004-08-31 | Yissum Res Dev Co | DNA structures Derived from the SV40 virus that include DNA sequences External |
| US5932536A (en) | 1994-06-14 | 1999-08-03 | The Rockefeller University | Compositions for neutralization of lipopolysaccharides |
| SE9500778D0 (sv) | 1995-03-03 | 1995-03-03 | Pharmacia Ab | Process for producing a protein |
| US6258596B1 (en) | 1995-05-22 | 2001-07-10 | Aventis Pharmaceuticals Products Inc. | Variants of apolipoprotein A-I |
| FR2734568B1 (fr) | 1995-05-22 | 1997-06-20 | Rhone Poulenc Rorer Sa | Nouveaux variants de l'apolipoproteine |
| SE9603068D0 (sv) | 1996-08-23 | 1996-08-23 | Pharmacia & Upjohn Ab | Process for purifying a protein |
| US6306433B1 (en) | 1997-08-12 | 2001-10-23 | Pharmacia Ab | Method of preparing pharmaceutical compositions |
| US6046166A (en) | 1997-09-29 | 2000-04-04 | Jean-Louis Dasseux | Apolipoprotein A-I agonists and their use to treat dyslipidemic disorders |
| US6037323A (en) | 1997-09-29 | 2000-03-14 | Jean-Louis Dasseux | Apolipoprotein A-I agonists and their use to treat dyslipidemic disorders |
| US6004925A (en) | 1997-09-29 | 1999-12-21 | J. L. Dasseux | Apolipoprotein A-I agonists and their use to treat dyslipidemic disorders |
| US6518412B1 (en) | 1997-09-29 | 2003-02-11 | Jean-Louis Dasseux | Gene therapy approaches to supply apolipoprotein A-I agonists and their use to treat dyslipidemic disorders |
| US6287590B1 (en) | 1997-10-02 | 2001-09-11 | Esperion Therapeutics, Inc. | Peptide/lipid complex formation by co-lyophilization |
| GB9919713D0 (en) | 1999-08-19 | 1999-10-20 | Queen Mary & Westfield College | New medical use of high density lipoprotein |
| PT1210411E (pt) | 1999-08-25 | 2006-12-29 | Immunex Corp | Composições e métodos para cultura celular melhorada |
| CA2413151C (en) | 2000-07-03 | 2012-11-27 | Gala Design, Inc. | Host cells containing multiple integrating vectors |
| AU2001271614B2 (en) | 2000-07-03 | 2007-05-31 | Catalent Pharma Solutions, Llc | Host cells containing multiple integrating vectors |
| US20040235173A1 (en) | 2000-07-03 | 2004-11-25 | Gala Design, Inc. | Production of host cells containing multiple integrating vectors by serial transduction |
| US20030224415A1 (en) | 2001-06-29 | 2003-12-04 | Gala Design, Inc. | Selection free growth of host cells containing multiple integrating vectors |
| KR100545945B1 (ko) | 2000-07-03 | 2006-01-25 | 갈라 디자인, 인크. | 발현 벡터 |
| US6664230B1 (en) | 2000-08-24 | 2003-12-16 | The Regents Of The University Of California | Orally administered peptides to ameliorate atherosclerosis |
| US7199102B2 (en) | 2000-08-24 | 2007-04-03 | The Regents Of The University Of California | Orally administered peptides synergize statin activity |
| US7148197B2 (en) | 2000-08-24 | 2006-12-12 | The Regents Of The University Of California | Orally administered small peptides synergize statin activity |
| US7144862B2 (en) | 2000-08-24 | 2006-12-05 | The Regents Of The University Of California | Orally administered peptides to ameliorate atherosclerosis |
| AU2567002A (en) | 2000-11-20 | 2002-05-27 | Univ Illinois | Membrane scaffold proteins |
| EE200300408A (et) | 2001-02-23 | 2003-12-15 | Immunex Corporation | Aktiivsete valkude saagise suurendamine |
| US7217785B2 (en) | 2001-05-09 | 2007-05-15 | The Regents Of The University Of California | Cysteine-containing peptides having antioxidant properties |
| ES2304452T3 (es) | 2001-08-20 | 2008-10-16 | Csl Behring Ag | Una hdl para el tratamiento de un ictus y de otras condiciones isquemicas. |
| US7223726B2 (en) | 2002-01-14 | 2007-05-29 | The Regents Of The University Of California | Apolipoprotein A-I mutant proteins having cysteine substitutions and polynucleotides encoding same |
| JP2006507223A (ja) | 2002-05-17 | 2006-03-02 | エスペリオン セラピューティクス,インコーポレイテッド | 脂質代謝異常疾患の治療方法 |
| AU2003254202A1 (en) | 2002-07-30 | 2004-02-16 | Esperion Therapeutics, Inc. | Methods of using non-human animal apoliprotein a-i protein |
| JP2006508126A (ja) * | 2002-11-06 | 2006-03-09 | アザヤ セラピューティクス インコーポレイティッド | 薬学的製剤のタンパク質安定化されたリポソーム製剤 |
| ES2715496T3 (es) * | 2003-07-03 | 2019-06-04 | Hdl Therapeutics Inc | Métodos y aparatos para crear derivados de partículas de HDL con un contenido reducido de lípidos |
| PE20050438A1 (es) | 2003-10-20 | 2005-06-14 | Esperion Therapeutics Inc | Formulas farmaceuticas, metodos y regimenes de dosificacion para el tratamiento y la prevencion de sindromes coronarios agudos |
| KR100560102B1 (ko) | 2004-06-25 | 2006-03-13 | 한국생명공학연구원 | 프로아포리포단백질 a-ⅰ 변이체와, 이를 포함하는고지혈증 또는 동맥경화증 예방 및 치료제 |
| KR101185609B1 (ko) * | 2004-07-16 | 2012-09-24 | 트러스티즈 오브 터프츠 칼리지 | 아포리포단백질 a1 미메틱 및 이의 용도 |
| WO2006012632A2 (en) | 2004-07-23 | 2006-02-02 | Xencor, Inc. | Apolipoprotein a-1 derivatives with altered immunogenicity |
| US8541236B2 (en) * | 2006-12-08 | 2013-09-24 | University Of Washington | Mutant apolipoprotein A-1 polypeptide with increased resistance to oxidation and reactive carbonyls |
| WO2008104890A2 (en) | 2007-02-28 | 2008-09-04 | Cerenis Therapeutics Holding Sa | Compositions and methods for producing apolipoprotein |
| US20110059549A1 (en) * | 2007-05-09 | 2011-03-10 | Coleman Matthew A | Methods and systems for producing nanolipoprotein particles |
| WO2009025754A2 (en) | 2007-08-17 | 2009-02-26 | Csl Behring Gmbh | Methods for purification of alpha-1-antitrypsin and apolipoprotein a-i |
| US9173890B2 (en) * | 2007-09-20 | 2015-11-03 | Abbott Cardiovascular Systems Inc. | Sustained release of Apo A-I mimetic peptides and methods of treatment |
| CN102177176B (zh) * | 2007-10-23 | 2014-05-07 | 克里夫兰临床基金会 | 氧化剂耐受性载脂蛋白a-1及模拟肽 |
| US20110293557A1 (en) | 2008-06-13 | 2011-12-01 | Proyecto De Biomedicina Cima, S.L. | Conjugates for the administration of biologically active compounds |
| RU2532222C2 (ru) * | 2009-02-16 | 2014-10-27 | Серенис Терапьютикс Холдинг С.А, | Миметики аполипопротеина а-i |
| US10525152B2 (en) * | 2009-10-09 | 2020-01-07 | Signablok, Inc. | Methods and compositions for targeted imaging |
| EP2526099B1 (en) | 2010-01-18 | 2016-03-30 | MSN Laboratories Limited | Improved process for the preparation of amide intermediates and their use thereof |
| CA2826158A1 (en) | 2011-02-07 | 2012-08-16 | Rose ACKERMANN | Lipoprotein complexes and manufacturing and uses thereof |
| US20140171365A1 (en) * | 2011-03-25 | 2014-06-19 | The Trustees Of Columbia University In The City Of New York | Pegylated human hdl particle and process for production thereof |
-
2012
- 2012-02-06 CA CA2826158A patent/CA2826158A1/en active Pending
- 2012-02-06 ES ES14150349T patent/ES2716349T3/es active Active
- 2012-02-06 CN CN201510711086.3A patent/CN105288589A/zh active Pending
- 2012-02-06 PL PL12703947T patent/PL2673296T3/pl unknown
- 2012-02-06 WO PCT/US2012/024020 patent/WO2012109162A1/en active Application Filing
- 2012-02-06 IN IN7828DEN2013 patent/IN2013DN07828A/en unknown
- 2012-02-06 PL PL14150349T patent/PL2767546T3/pl unknown
- 2012-02-06 DK DK12703947.7T patent/DK2673296T3/en active
- 2012-02-06 EP EP18195447.0A patent/EP3466969B1/en active Active
- 2012-02-06 SI SI201231514T patent/SI2673296T1/sl unknown
- 2012-02-06 RU RU2013139066A patent/RU2627173C2/ru not_active IP Right Cessation
- 2012-02-06 LT LTEP12703947.7T patent/LT2673296T/lt unknown
- 2012-02-06 SI SI201231508T patent/SI2767546T1/sl unknown
- 2012-02-06 RS RS20190073A patent/RS58243B1/sr unknown
- 2012-02-06 CN CN201280015257.3A patent/CN103443123B/zh active Active
- 2012-02-06 EP EP12703947.7A patent/EP2673296B1/en active Active
- 2012-02-06 PT PT12703947T patent/PT2673296T/pt unknown
- 2012-02-06 JP JP2013552722A patent/JP6219170B2/ja active Active
- 2012-02-06 RS RS20190093A patent/RS58275B1/sr unknown
- 2012-02-06 SG SG10201801372YA patent/SG10201801372YA/en unknown
- 2012-02-06 SG SG2013060512A patent/SG192693A1/en unknown
- 2012-02-06 EP EP14150349.0A patent/EP2767546B1/en active Active
- 2012-02-06 DK DK14150349.0T patent/DK2767546T3/en active
- 2012-02-06 US US13/367,237 patent/US20120232005A1/en not_active Abandoned
- 2012-02-06 KR KR1020137023430A patent/KR20140053848A/ko not_active Application Discontinuation
- 2012-02-06 MX MX2013009083A patent/MX343907B/es active IP Right Grant
- 2012-02-06 HU HUE12703947A patent/HUE042314T2/hu unknown
- 2012-02-06 PT PT14150349T patent/PT2767546T/pt unknown
- 2012-02-06 HU HUE14150349A patent/HUE041797T2/hu unknown
- 2012-02-06 EP EP24174300.4A patent/EP4400511A3/en active Pending
- 2012-02-06 CN CN201510717344.9A patent/CN105294859A/zh active Pending
- 2012-02-06 DK DK18195447.0T patent/DK3466969T3/da active
- 2012-02-06 ES ES12703947T patent/ES2717455T3/es active Active
- 2012-02-06 RU RU2017126088A patent/RU2017126088A/ru not_active Application Discontinuation
- 2012-02-06 CN CN201710493059.2A patent/CN107337728B/zh active Active
- 2012-02-06 LT LTEP14150349.0T patent/LT2767546T/lt unknown
- 2012-02-06 AU AU2012214672A patent/AU2012214672B2/en active Active
- 2012-02-07 TW TW106109180A patent/TW201737935A/zh unknown
- 2012-02-07 TW TW101103979A patent/TW201240671A/zh unknown
-
2013
- 2013-07-24 IL IL227634A patent/IL227634B/en active IP Right Grant
- 2013-07-24 ZA ZA2013/05628A patent/ZA201305628B/en unknown
- 2013-08-06 MX MX2016011834A patent/MX355159B/es unknown
- 2013-12-11 US US14/103,686 patent/US9187551B2/en active Active
-
2014
- 2014-07-17 US US14/334,519 patent/US10328119B2/en active Active
- 2014-12-08 HK HK14112302.2A patent/HK1198834A1/zh unknown
-
2015
- 2015-10-15 US US14/884,115 patent/US10322163B2/en active Active
-
2016
- 2016-01-27 PH PH12016500191A patent/PH12016500191A1/en unknown
-
2017
- 2017-09-27 JP JP2017186171A patent/JP6720126B2/ja active Active
-
2019
- 2019-01-10 HR HRP20190072TT patent/HRP20190072T1/hr unknown
- 2019-01-17 CY CY20191100061T patent/CY1121317T1/el unknown
- 2019-01-21 CY CY20191100078T patent/CY1121318T1/el unknown
- 2019-01-21 HR HRP20190138TT patent/HRP20190138T1/hr unknown
- 2019-04-29 US US16/397,944 patent/US11376309B2/en active Active
-
2020
- 2020-06-17 JP JP2020104518A patent/JP7009559B2/ja active Active
-
2022
- 2022-01-12 JP JP2022003351A patent/JP2022050603A/ja active Pending
- 2022-05-27 US US17/826,659 patent/US20220362336A1/en active Pending
-
2023
- 2023-08-04 US US18/365,367 patent/US11969456B2/en active Active
- 2023-08-04 US US18/365,328 patent/US11998587B2/en active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1486327A (zh) * | 2000-11-10 | 2004-03-31 | 普罗蒂奥制药公司 | 载脂蛋白类似物 |
| CN101170994A (zh) * | 2005-03-24 | 2008-04-30 | 科莱尼斯医疗公司 | 荷电的脂蛋白络合物及其用途 |
| CN101253195A (zh) * | 2005-08-26 | 2008-08-27 | 科莱尼斯医疗控股公司 | 用于在乳酸菌中制备载脂蛋白基因产物的组合物和方法 |
Non-Patent Citations (3)
| Title |
|---|
| "Expression and Purification of Recombinant Human Apolipoprotein A-I in Chinese Hamster Ovary Cells";Hartmut H.-J. Schmidt等;《PROTEIN EXPRESSION AND PURIFICATION》;19971231;第10卷;摘要,第226-227页 * |
| "Oxidation of methionine residues affects the structure and stability of apolipoprotein A-I in reconstituted high density lipoprotein particle";Alexander B.Sigalov等;《Chemistry and Physics of Lipids》;20011231;第113卷;摘要,第142-144页 * |
| 胡英等."生物药物制剂技术".《生物药物制剂技术》.化学工业出版社,2010,(第1版), * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107337728B (zh) | 脂蛋白复合物及其制备和用途 | |
| AU2018203258B2 (en) | Lipoprotein complexes and manufacturing and uses thereof | |
| NZ613524B2 (en) | Lipoprotein complexes and manufacturing and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| CB02 | Change of applicant information |
Address after: French Balma Applicant after: CERENIS THERAPEUTICS HOLDING S.A. Address before: France Lambero Applicant before: CERENIS THERAPEUTICS HOLDING S.A. |
|
| CB02 | Change of applicant information | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |