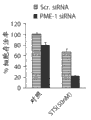CN103781514A - 联合疗法 - Google Patents
联合疗法 Download PDFInfo
- Publication number
- CN103781514A CN103781514A CN201280040838.2A CN201280040838A CN103781514A CN 103781514 A CN103781514 A CN 103781514A CN 201280040838 A CN201280040838 A CN 201280040838A CN 103781514 A CN103781514 A CN 103781514A
- Authority
- CN
- China
- Prior art keywords
- pme
- cell
- cancer
- alkyl
- carcinoma
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000002648 combination therapy Methods 0.000 title abstract 2
- 238000000034 method Methods 0.000 claims abstract description 43
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 25
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 13
- 101100353036 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) pme-1 gene Proteins 0.000 claims abstract description 11
- 206010070834 Sensitisation Diseases 0.000 claims abstract description 6
- 230000008313 sensitization Effects 0.000 claims abstract description 6
- 108020004459 Small interfering RNA Proteins 0.000 claims description 59
- 108091032973 (ribonucleotides)n+m Proteins 0.000 claims description 57
- 102000040650 (ribonucleotides)n+m Human genes 0.000 claims description 50
- 125000003729 nucleotide group Chemical group 0.000 claims description 29
- 150000001875 compounds Chemical class 0.000 claims description 27
- 239000002773 nucleotide Substances 0.000 claims description 24
- 238000011282 treatment Methods 0.000 claims description 23
- 239000003814 drug Substances 0.000 claims description 18
- 239000003795 chemical substances by application Substances 0.000 claims description 16
- 125000000217 alkyl group Chemical group 0.000 claims description 14
- 201000010099 disease Diseases 0.000 claims description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 13
- 108091034117 Oligonucleotide Proteins 0.000 claims description 12
- 125000003545 alkoxy group Chemical group 0.000 claims description 12
- 241001465754 Metazoa Species 0.000 claims description 9
- 239000007787 solid Substances 0.000 claims description 8
- 101100030375 Dictyostelium discoideum pho2a gene Proteins 0.000 claims description 7
- 230000003463 hyperproliferative effect Effects 0.000 claims description 7
- 201000009030 Carcinoma Diseases 0.000 claims description 6
- 102000053642 Catalytic RNA Human genes 0.000 claims description 6
- 108090000994 Catalytic RNA Proteins 0.000 claims description 6
- 108020005093 RNA Precursors Proteins 0.000 claims description 6
- 239000000074 antisense oligonucleotide Substances 0.000 claims description 6
- 238000012230 antisense oligonucleotides Methods 0.000 claims description 6
- 108091092562 ribozyme Proteins 0.000 claims description 6
- 108091027967 Small hairpin RNA Proteins 0.000 claims description 5
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 5
- 125000002768 hydroxyalkyl group Chemical group 0.000 claims description 5
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 4
- 206010006187 Breast cancer Diseases 0.000 claims description 4
- 208000026310 Breast neoplasm Diseases 0.000 claims description 4
- 206010007572 Cardiac hypertrophy Diseases 0.000 claims description 4
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 4
- 206010009944 Colon cancer Diseases 0.000 claims description 4
- 206010033128 Ovarian cancer Diseases 0.000 claims description 4
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 4
- 201000004681 Psoriasis Diseases 0.000 claims description 4
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 claims description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 4
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 4
- 125000003282 alkyl amino group Chemical group 0.000 claims description 4
- 201000008275 breast carcinoma Diseases 0.000 claims description 4
- 201000010881 cervical cancer Diseases 0.000 claims description 4
- 208000029742 colonic neoplasm Diseases 0.000 claims description 4
- 206010017758 gastric cancer Diseases 0.000 claims description 4
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 claims description 4
- 201000005787 hematologic cancer Diseases 0.000 claims description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 4
- 201000001514 prostate carcinoma Diseases 0.000 claims description 4
- 239000004055 small Interfering RNA Substances 0.000 claims description 4
- 201000011549 stomach cancer Diseases 0.000 claims description 4
- 208000030224 brain astrocytoma Diseases 0.000 claims description 3
- 208000024055 brain glioblastoma Diseases 0.000 claims description 3
- 201000011609 brain glioblastoma multiforme Diseases 0.000 claims description 3
- 201000007983 brain glioma Diseases 0.000 claims description 3
- 230000035755 proliferation Effects 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 2
- 102100037834 Protein phosphatase methylesterase 1 Human genes 0.000 claims 8
- 108010086028 protein phosphatase methylesterase-1 Proteins 0.000 claims 8
- 230000006907 apoptotic process Effects 0.000 abstract description 29
- 201000011510 cancer Diseases 0.000 abstract description 16
- 230000001939 inductive effect Effects 0.000 abstract description 8
- 230000030279 gene silencing Effects 0.000 abstract description 4
- 239000002246 antineoplastic agent Substances 0.000 abstract 1
- 229940127089 cytotoxic agent Drugs 0.000 abstract 1
- 150000003384 small molecules Chemical class 0.000 abstract 1
- 210000004027 cell Anatomy 0.000 description 107
- 208000011317 telomere syndrome Diseases 0.000 description 44
- 102200082402 rs751610198 Human genes 0.000 description 34
- 230000000694 effects Effects 0.000 description 33
- 238000001890 transfection Methods 0.000 description 33
- 208000005017 glioblastoma Diseases 0.000 description 30
- 230000001640 apoptogenic effect Effects 0.000 description 19
- 230000008569 process Effects 0.000 description 15
- 239000012634 fragment Substances 0.000 description 14
- 239000000126 substance Substances 0.000 description 14
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 13
- 230000014509 gene expression Effects 0.000 description 12
- 108090000623 proteins and genes Proteins 0.000 description 12
- 230000000692 anti-sense effect Effects 0.000 description 11
- -1 pi-allyl Chemical group 0.000 description 11
- 238000012545 processing Methods 0.000 description 11
- 239000000243 solution Substances 0.000 description 11
- 230000030833 cell death Effects 0.000 description 10
- 230000000670 limiting effect Effects 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- BMGQWWVMWDBQGC-IIFHNQTCSA-N midostaurin Chemical compound CN([C@H]1[C@H]([C@]2(C)O[C@@H](N3C4=CC=CC=C4C4=C5C(=O)NCC5=C5C6=CC=CC=C6N2C5=C43)C1)OC)C(=O)C1=CC=CC=C1 BMGQWWVMWDBQGC-IIFHNQTCSA-N 0.000 description 9
- 229950010895 midostaurin Drugs 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 238000004458 analytical method Methods 0.000 description 8
- 238000002474 experimental method Methods 0.000 description 8
- 239000003112 inhibitor Substances 0.000 description 8
- 230000004048 modification Effects 0.000 description 8
- 238000012986 modification Methods 0.000 description 8
- 235000018102 proteins Nutrition 0.000 description 8
- 102000004169 proteins and genes Human genes 0.000 description 8
- 238000001262 western blot Methods 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 7
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 7
- KOZFSFOOLUUIGY-SOLYNIJKSA-N K-252a Chemical compound C12=C3N4C5=CC=CC=C5C3=C3CNC(=O)C3=C2C2=CC=CC=C2N1[C@H]1C[C@@](C(=O)OC)(O)[C@]4(C)O1 KOZFSFOOLUUIGY-SOLYNIJKSA-N 0.000 description 7
- 108091081021 Sense strand Proteins 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 238000011262 co‐therapy Methods 0.000 description 7
- 239000000203 mixture Substances 0.000 description 7
- 150000003839 salts Chemical class 0.000 description 7
- 102000011727 Caspases Human genes 0.000 description 6
- 108010076667 Caspases Proteins 0.000 description 6
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 6
- 241001597008 Nomeidae Species 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical group CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 230000005540 biological transmission Effects 0.000 description 6
- 238000012054 celltiter-glo Methods 0.000 description 6
- 239000003085 diluting agent Substances 0.000 description 6
- 239000008103 glucose Substances 0.000 description 6
- 230000002401 inhibitory effect Effects 0.000 description 6
- 108020004999 messenger RNA Proteins 0.000 description 6
- QNDVLZJODHBUFM-WFXQOWMNSA-N okadaic acid Chemical compound C([C@H](O1)[C@H](C)/C=C/[C@H]2CC[C@@]3(CC[C@H]4O[C@@H](C([C@@H](O)[C@@H]4O3)=C)[C@@H](O)C[C@H](C)[C@@H]3[C@@H](CC[C@@]4(OCCCC4)O3)C)O2)C(C)=C[C@]21O[C@H](C[C@@](C)(O)C(O)=O)CC[C@H]2O QNDVLZJODHBUFM-WFXQOWMNSA-N 0.000 description 6
- VEFJHAYOIAAXEU-UHFFFAOYSA-N okadaic acid Natural products CC(CC(O)C1OC2CCC3(CCC(O3)C=CC(C)C4CC(=CC5(OC(CC(C)(O)C(=O)O)CCC5O)O4)C)OC2C(O)C1C)C6OC7(CCCCO7)CCC6C VEFJHAYOIAAXEU-UHFFFAOYSA-N 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 5
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 5
- 230000035519 G0 Phase Effects 0.000 description 5
- 230000010190 G1 phase Effects 0.000 description 5
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 5
- 239000012190 activator Substances 0.000 description 5
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 150000007523 nucleic acids Chemical group 0.000 description 5
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 5
- 238000011160 research Methods 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 229960004964 temozolomide Drugs 0.000 description 5
- PBCZSGKMGDDXIJ-HQCWYSJUSA-N 7-hydroxystaurosporine Chemical compound N([C@H](O)C1=C2C3=CC=CC=C3N3C2=C24)C(=O)C1=C2C1=CC=CC=C1N4[C@H]1C[C@@H](NC)[C@@H](OC)[C@]3(C)O1 PBCZSGKMGDDXIJ-HQCWYSJUSA-N 0.000 description 4
- PBCZSGKMGDDXIJ-UHFFFAOYSA-N 7beta-hydroxystaurosporine Natural products C12=C3N4C5=CC=CC=C5C3=C3C(O)NC(=O)C3=C2C2=CC=CC=C2N1C1CC(NC)C(OC)C4(C)O1 PBCZSGKMGDDXIJ-UHFFFAOYSA-N 0.000 description 4
- 108090000397 Caspase 3 Proteins 0.000 description 4
- 102100029855 Caspase-3 Human genes 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- UIARLYUEJFELEN-LROUJFHJSA-N LSM-1231 Chemical compound C12=C3N4C5=CC=CC=C5C3=C3C(=O)NCC3=C2C2=CC=CC=C2N1[C@]1(C)[C@](CO)(O)C[C@H]4O1 UIARLYUEJFELEN-LROUJFHJSA-N 0.000 description 4
- OTPNDVKVEAIXTI-UHFFFAOYSA-N LSM-1274 Chemical compound C12=C3C4=C5C=CC=C[C]5N3C(O3)CCC3N2C2=CC=C[CH]C2=C1C1=C4C(=O)NC1=O OTPNDVKVEAIXTI-UHFFFAOYSA-N 0.000 description 4
- KAJXOWFGKYKMMZ-UHFFFAOYSA-N LSM-3627 Chemical compound C12=C3C=CC=C[C]3NC2=C2NC3=CC=C[CH]C3=C2C2=C1C(=O)NC2=O KAJXOWFGKYKMMZ-UHFFFAOYSA-N 0.000 description 4
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 4
- MIFGOLAMNLSLGH-QOKNQOGYSA-N Z-Val-Ala-Asp(OMe)-CH2F Chemical compound COC(=O)C[C@@H](C(=O)CF)NC(=O)[C@H](C)NC(=O)[C@H](C(C)C)NC(=O)OCC1=CC=CC=C1 MIFGOLAMNLSLGH-QOKNQOGYSA-N 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 230000002354 daily effect Effects 0.000 description 4
- 238000013461 design Methods 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 230000002441 reversible effect Effects 0.000 description 4
- 230000035945 sensitivity Effects 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- 229940122454 Protein phosphatase 2A inhibitor Drugs 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- 230000022534 cell killing Effects 0.000 description 3
- 239000013000 chemical inhibitor Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 230000001332 colony forming effect Effects 0.000 description 3
- 230000008034 disappearance Effects 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 230000009977 dual effect Effects 0.000 description 3
- 238000004043 dyeing Methods 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- KKGQTZUTZRNORY-UHFFFAOYSA-N fingolimod Chemical compound CCCCCCCCC1=CC=C(CCC(N)(CO)CO)C=C1 KKGQTZUTZRNORY-UHFFFAOYSA-N 0.000 description 3
- 229960000556 fingolimod Drugs 0.000 description 3
- 238000012226 gene silencing method Methods 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 230000000968 intestinal effect Effects 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- LBWFXVZLPYTWQI-IPOVEDGCSA-N n-[2-(diethylamino)ethyl]-5-[(z)-(5-fluoro-2-oxo-1h-indol-3-ylidene)methyl]-2,4-dimethyl-1h-pyrrole-3-carboxamide;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C LBWFXVZLPYTWQI-IPOVEDGCSA-N 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 239000000651 prodrug Substances 0.000 description 3
- 229940002612 prodrug Drugs 0.000 description 3
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 229940034785 sutent Drugs 0.000 description 3
- 239000013638 trimer Substances 0.000 description 3
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 description 2
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 2
- WEEFNMFMNMASJY-UHFFFAOYSA-M 1,2-dimethoxy-12-methyl-[1,3]benzodioxolo[5,6-c]phenanthridin-12-ium;chloride Chemical compound [Cl-].C1=C2OCOC2=CC2=CC=C3C4=CC=C(OC)C(OC)=C4C=[N+](C)C3=C21 WEEFNMFMNMASJY-UHFFFAOYSA-M 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- PMYDPQQPEAYXKD-UHFFFAOYSA-N 3-hydroxy-n-naphthalen-2-ylnaphthalene-2-carboxamide Chemical compound C1=CC=CC2=CC(NC(=O)C3=CC4=CC=CC=C4C=C3O)=CC=C21 PMYDPQQPEAYXKD-UHFFFAOYSA-N 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- GNCMMKJNEMBGHM-UHFFFAOYSA-N Arcyriaflavin B Natural products C1=CC=C2C3=C(C(=O)NC4=O)C4=C4C5=CC=C(O)C=C5NC4=C3NC2=C1 GNCMMKJNEMBGHM-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 108090000567 Caspase 7 Proteins 0.000 description 2
- 102000047934 Caspase-3/7 Human genes 0.000 description 2
- 108700037887 Caspase-3/7 Proteins 0.000 description 2
- 102100038902 Caspase-7 Human genes 0.000 description 2
- 206010057248 Cell death Diseases 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 2
- 101710105402 Methylesterase 1 Proteins 0.000 description 2
- 108091093037 Peptide nucleic acid Proteins 0.000 description 2
- 108700019535 Phosphoprotein Phosphatases Proteins 0.000 description 2
- 102000045595 Phosphoprotein Phosphatases Human genes 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 2
- 239000005463 Tandutinib Substances 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 230000002421 anti-septic effect Effects 0.000 description 2
- 239000003125 aqueous solvent Substances 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 239000012830 cancer therapeutic Substances 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 238000006555 catalytic reaction Methods 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 230000000973 chemotherapeutic effect Effects 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- 239000006184 cosolvent Substances 0.000 description 2
- 238000005336 cracking Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 238000001378 electrochemiluminescence detection Methods 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 230000007515 enzymatic degradation Effects 0.000 description 2
- 230000003203 everyday effect Effects 0.000 description 2
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 229940088013 hycamtin Drugs 0.000 description 2
- 230000002779 inactivation Effects 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 description 2
- 229960004891 lapatinib Drugs 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 2
- 238000012856 packing Methods 0.000 description 2
- 230000002085 persistent effect Effects 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 229920002223 polystyrene Polymers 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 239000011655 sodium selenate Substances 0.000 description 2
- 235000018716 sodium selenate Nutrition 0.000 description 2
- 229960001881 sodium selenate Drugs 0.000 description 2
- 238000012916 structural analysis Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- UXXQOJXBIDBUAC-UHFFFAOYSA-N tandutinib Chemical compound COC1=CC2=C(N3CCN(CC3)C(=O)NC=3C=CC(OC(C)C)=CC=3)N=CN=C2C=C1OCCCN1CCCCC1 UXXQOJXBIDBUAC-UHFFFAOYSA-N 0.000 description 2
- 229950009893 tandutinib Drugs 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- ZMANZCXQSJIPKH-UHFFFAOYSA-N triethylamine Natural products CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 2
- 229960000241 vandetanib Drugs 0.000 description 2
- 239000013598 vector Substances 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- AOUOVFRSCMDPFA-QSDJMHMYSA-N (2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-amino-3-carboxypropanoyl]amino]-4-carboxybutanoyl]amino]-3-methylbutanoyl]amino]butanedioic acid Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC(O)=O AOUOVFRSCMDPFA-QSDJMHMYSA-N 0.000 description 1
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- AXRCEOKUDYDWLF-UHFFFAOYSA-N 3-(1-methyl-3-indolyl)-4-[1-[1-(2-pyridinylmethyl)-4-piperidinyl]-3-indolyl]pyrrole-2,5-dione Chemical compound C12=CC=CC=C2N(C)C=C1C(C(NC1=O)=O)=C1C(C1=CC=CC=C11)=CN1C(CC1)CCN1CC1=CC=CC=N1 AXRCEOKUDYDWLF-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-M 4-hydroxybenzoate Chemical compound OC1=CC=C(C([O-])=O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-M 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- ZGCSNRKSJLVANE-UHFFFAOYSA-N Aglycone-Rebeccamycin Natural products N1C2=C3NC4=C(Cl)C=CC=C4C3=C(C(=O)NC3=O)C3=C2C2=C1C(Cl)=CC=C2 ZGCSNRKSJLVANE-UHFFFAOYSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 108091026821 Artificial microRNA Proteins 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 1
- 108091006146 Channels Proteins 0.000 description 1
- 201000005262 Chondroma Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 108091033380 Coding strand Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 230000007067 DNA methylation Effects 0.000 description 1
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical class OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 108090000371 Esterases Proteins 0.000 description 1
- CTKXFMQHOOWWEB-UHFFFAOYSA-N Ethylene oxide/propylene oxide copolymer Chemical compound CCCOC(C)COCCO CTKXFMQHOOWWEB-UHFFFAOYSA-N 0.000 description 1
- 102000015212 Fas Ligand Protein Human genes 0.000 description 1
- 108010039471 Fas Ligand Protein Proteins 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 229920001503 Glucan Polymers 0.000 description 1
- 208000002927 Hamartoma Diseases 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 239000012098 Lipofectamine RNAiMAX Substances 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 108700011259 MicroRNAs Proteins 0.000 description 1
- 102000002568 Multienzyme Complexes Human genes 0.000 description 1
- 108010093369 Multienzyme Complexes Proteins 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- BDUHCSBCVGXTJM-IZLXSDGUSA-N Nutlin-3 Chemical compound CC(C)OC1=CC(OC)=CC=C1C1=N[C@H](C=2C=CC(Cl)=CC=2)[C@H](C=2C=CC(Cl)=CC=2)N1C(=O)N1CC(=O)NCC1 BDUHCSBCVGXTJM-IZLXSDGUSA-N 0.000 description 1
- GOQNKRPYPIQLQG-UHFFFAOYSA-N OP(O)(O)=S.OP(O)(O)=S Chemical compound OP(O)(O)=S.OP(O)(O)=S GOQNKRPYPIQLQG-UHFFFAOYSA-N 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 102000006478 Protein Phosphatase 2 Human genes 0.000 description 1
- 108010058956 Protein Phosphatase 2 Proteins 0.000 description 1
- 108010009341 Protein Serine-Threonine Kinases Proteins 0.000 description 1
- 102000009516 Protein Serine-Threonine Kinases Human genes 0.000 description 1
- 101710204571 Protein phosphatase PP2A regulatory subunit A Proteins 0.000 description 1
- QEHOIJJIZXRMAN-UHFFFAOYSA-N Rebeccamycin Natural products OC1C(O)C(OC)C(CO)OC1N1C2=C3NC4=C(Cl)C=CC=C4C3=C3C(=O)NC(=O)C3=C2C2=CC=CC(Cl)=C21 QEHOIJJIZXRMAN-UHFFFAOYSA-N 0.000 description 1
- 108050002653 Retinoblastoma protein Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 239000012722 SDS sample buffer Substances 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 241001138501 Salmonella enterica Species 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 108010017842 Telomerase Proteins 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 108010078814 Tumor Suppressor Protein p53 Proteins 0.000 description 1
- 102000015098 Tumor Suppressor Protein p53 Human genes 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- LUVOJBWJNHWVNG-UHFFFAOYSA-N [Na].[Na].[Na].OC(=O)CC(O)(C(O)=O)CC(O)=O Chemical compound [Na].[Na].[Na].OC(=O)CC(O)(C(O)=O)CC(O)=O LUVOJBWJNHWVNG-UHFFFAOYSA-N 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001447 alkali salts Chemical class 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 1
- 229920000180 alkyd Polymers 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000008485 antagonism Effects 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000000680 avirulence Effects 0.000 description 1
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 201000000053 blastoma Diseases 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000010307 cell transformation Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 230000002079 cooperative effect Effects 0.000 description 1
- 239000002577 cryoprotective agent Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 238000004163 cytometry Methods 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000017858 demethylation Effects 0.000 description 1
- 238000010520 demethylation reaction Methods 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 201000008184 embryoma Diseases 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 229950002189 enzastaurin Drugs 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 235000021323 fish oil Nutrition 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 231100000734 genotoxic potential Toxicity 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 150000002367 halogens Chemical group 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 210000002287 horizontal cell Anatomy 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- TWNIBLMWSKIRAT-VFUOTHLCSA-N levoglucosan Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@H]2CO[C@@H]1O2 TWNIBLMWSKIRAT-VFUOTHLCSA-N 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 230000013011 mating Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 125000001434 methanylylidene group Chemical group [H]C#[*] 0.000 description 1
- YACKEPLHDIMKIO-UHFFFAOYSA-L methylphosphonate(2-) Chemical compound CP([O-])([O-])=O YACKEPLHDIMKIO-UHFFFAOYSA-L 0.000 description 1
- 239000002679 microRNA Substances 0.000 description 1
- 210000000274 microglia Anatomy 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical compound NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229940044519 poloxamer 188 Drugs 0.000 description 1
- 229920001993 poloxamer 188 Polymers 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Substances [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Substances [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 1
- 239000001508 potassium citrate Substances 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000007420 reactivation Effects 0.000 description 1
- INSACQSBHKIWNS-QZQSLCQPSA-N rebeccamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](OC)[C@@H](CO)O[C@H]1N1C2=C3N=C4[C](Cl)C=CC=C4C3=C3C(=O)NC(=O)C3=C2C2=CC=CC(Cl)=C21 INSACQSBHKIWNS-QZQSLCQPSA-N 0.000 description 1
- 229960005567 rebeccamycin Drugs 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 150000003290 ribose derivatives Chemical class 0.000 description 1
- 125000000548 ribosyl group Chemical group C1([C@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 1
- 229920002477 rna polymer Polymers 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 238000003375 selectivity assay Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 239000013023 spike buffer Substances 0.000 description 1
- 230000003019 stabilising effect Effects 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 238000005728 strengthening Methods 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 239000001117 sulphuric acid Substances 0.000 description 1
- 235000011149 sulphuric acid Nutrition 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 208000037816 tissue injury Diseases 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 1
- 235000019263 trisodium citrate Nutrition 0.000 description 1
- 229940038773 trisodium citrate Drugs 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 150000004917 tyrosine kinase inhibitor derivatives Chemical class 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1137—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
- A61K31/5513—1,4-Benzodiazepines, e.g. diazepam or clozapine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/553—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having at least one nitrogen and one oxygen as ring hetero atoms, e.g. loxapine, staurosporine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1135—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against oncogenes or tumor suppressor genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/31—Combination therapy
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Genetics & Genomics (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Plant Pathology (AREA)
- Microbiology (AREA)
- Oncology (AREA)
- Virology (AREA)
- Dermatology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本发明基于一种发现,即沉默PME-1基因使癌细胞对某些小分子化学治疗剂诱导细胞凋亡的活性变得敏感。因此,本发明涉及一种单独的组合疗法、敏化方法和药用组合物。
Description
发明领域
本发明涉及癌症联合治疗的领域。
发明背景
癌症是一种困扰着全球的破坏性疾病。据估计有二分之一的男性和三分之一的女性在他们一生中都将患上某种形式的癌症。
有趣的是,近期已确定,不管不同癌症类型之间的表型变异性,有限数量遗传因子的微扰都足以诱导许多不同类型的人体细胞发生细胞转化(综述见Zhao
et al., Trends Mol Med, 2004, 10: 344 -350)。实验表明Ras和端粒酶(TERT)的激活,随同肿瘤抑制蛋白p53和成视网膜细胞瘤蛋白(Rb)的失活一起,能无限增殖(immortalize)多种人体细胞类型,其随后在响应蛋白磷酸酶2A
(PP2A)的抑制作用中可转化为致瘤状态(Mumby,
Cell, 2007, 130(1):21-24;Westermarck and Hahn, Trends Mol. Med., 2008,
14(4):152-160;Zhao et al.,Trends Mol Med, 2004, 10:
344-350)。因此,这些普通的遗传因素可被视为癌症发展的主调节因子(Zhao et al.,Trends Mol Med, 2004, 10:
344-350)。
PP2A是一种广泛存在的蛋白丝氨酸/苏氨酸磷酸酶(PSP),其发挥一种三聚体蛋白复合物的作用,该复合物由一个催化亚单位(PP2Ac或C)、一个支架亚单位(PR65或A)和其中一个可选择的调节B亚单位组成。如上所述,近期实验证据已充分确定,PP2A活性的抑制是人体细胞转化的先决条件(综述见Westermarck和Hahn, Trends Mol. Med., 2008, 14(4):152-160)。然而,很少有人知道关于体内调节PP2A复杂组成和/或活性的机制。识别PP2A抑制机理可能为开发新类别的重新激活PP2A肿瘤抑制活性的癌症治疗剂提供机遇。这种想法与针对通过小分子(如Nutlin-3)来重新激活P53的肿瘤抑制活性的癌症治疗方法(Vassilev
et al., Science, 2004, 303:844-48)类似。
蛋白磷酸酶甲酯酶1 (methylesterase 1) (PME-1)已被确定为是一种与癌症相关的PP2A-互作蛋白(interacting
protein) (Puustinen et al., Cancer Res., 2009, 69:2870-2877)。早期的生化研究已确定PME-1为一种蛋白质,其可通过其酶促用于催化PP2Ac亚单位上保存的亮氨酸309的脱甲基化所需要的甲基酯酶活性而抑制PP2A活性(Janssens
et al., Trends Biochem. Sci., 2008, 33:113-21)。PME-1抑制PP2A活性的另一种机制通过PME-1-PP2A复合体的结构分析提出,该结构分析证实PME-1直接与PP2Ac亚单位的催化裂隙结合(Xing et al., Cell, 2008, 133:154–163)。然而,PME-1的功能相关性或其在细胞信号调控中的作用并未得到确定。已报道PME-1表达与人胶质母细胞瘤(GBM)的进展、和与增殖,以及与病人GBM样本中的ERK
MAPK通路的活性有关。实验表明,通过siRNA的PME-1抑制作用抑制ERK通道活性和恶性肿瘤细胞的生长(Puustinen
et al., Cancer Res., 2009, 69:2870-2877)。然而,尽管其对恶性肿瘤细胞生长的抑制具有强有力的作用,但是PME-1的缺失不能诱导有效的细胞死亡(Puustinen et al., Cancer Res., 2009, 69:2870-2877)。
细胞杀伤和/或细胞凋亡是癌症治疗疗法的优选终点。另一方面,或者固有的或者获得性的耐药性是与目前所用化学疗法相关的主要问题。因此,虽然至少一些潜在的恶性肿瘤机制已被揭示,但是在过度增殖性疾病及特别是癌症的药物开发领域仍存在着需求。
发明简述
本发明基于在高增殖性细胞中在细胞凋亡水平上PME-1基因沉默和某些小分子化学药物的一种惊奇的、协同效应。
因此,在一方面,本发明提供一种作为药物的PME-1沉默和具有通式(I)的化学化合物的组合:
R’是H或烷基;
R’’是H或烷氧基;
R1和R2是H或一起形成氧代;
R3和R4独立地是H、OH或一起形成氧代;
R5、R6、R6’、R7和R8独立地选自H、烷基、烷氧基、羟基、羟基烷基、烷氧基羰基或单-和双烷基氨基;
X是CH2或O;和
n是0或1。
在另一方面,本发明提供一种小双链RNA (dsRNA)分子,其包含选自SEQ ID NO:s 3-5的核酸序列。
在另一方面,本发明提供一种包含上述组合或dsRNA的药用组合物。
在更进一步方面,本发明提供一种在需要此种敏化的人或动物患者中通过沉默PME-1基因使高增殖性细胞对化学治疗剂敏感的方法。
此外,本发明的一个方面提供一种在需要此种治疗的人或动物患者中治疗高增殖性疾病的方法,其通过给予至少一种类型的PME-1沉默剂和如上定义的式(I)化合物来实施。
在以上方面的某些实施方案中,所述PME-1沉默剂通过选自下列的药物获得,siRNA分子、DsiRNA分子、人工miRNA前体、shRNA分子、反义寡核苷酸、核糖酶、阻止PME-1功能趋向于PP2Ac的药物,及其任何组合。在进一步的实施方案中,所述PME-1沉默剂包含一种选自SEQ ID NO:s 1-39的核酸序列。
在以上方面的某些实施方案中,所治疗的高增殖性疾病选自牛皮癣、心肌肥大、良性肿瘤、实体癌和血液癌症。所述实体癌的非限定性实例包括头颈鳞状细胞癌、结肠癌、胃癌、乳腺癌、卵巢癌、前列腺癌、宫颈癌、脑癌、胶质瘤、星形细胞瘤和恶性胶质瘤。
本发明的其它特定的实施方案、目标、细节和优点在附属权利要求书、下列图示、详述的说明书和实施例中给出。
图示简述
在下文中,本发明将通过优选的实施方案并参照附图得到更详细的说明。
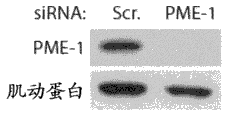
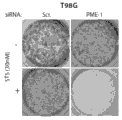
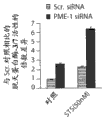
图1A是一种蛋白印迹,其表明人胶质母细胞瘤T98G细胞中杂乱dsRNA (Scr.)和PME-1特异性dsRNA
(PME-1)的PME-1沉默活性。
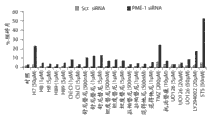
图1B显示T98G胶质母细胞瘤细胞中细胞凋亡的核碎片的量,其通过或者杂乱的或者PME-1特异性dsRNA转染48小时,然后用指定浓度的不同药物/化学抑制剂处理另外24小时所诱发。缩写:Chl Cl-氯化白屈菜赤碱,TMZ-替莫唑胺,STS-星形孢菌素。
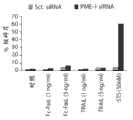
图1C显示T98G胶质母细胞瘤细胞中细胞凋亡的核碎片的量,其通过或者杂乱的或者PME-1特异性dsRNA转染48小时,然后用指定浓度的星形孢菌素(STS)或诱发细胞死亡的配体、重组FasL和TRAIL处理另外24小时所诱发。
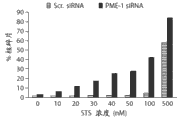
图1D显示与杂乱的dsRNA转染的细胞相比,随星形孢菌素浓度的增加,PME-1 dsRNA转染的T98G细胞的细胞凋亡中剂量依赖性的增加。
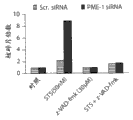
图1E和1F代表杂乱的或者PME-1 dsRNA转染并用指定浓度的星形孢菌素处理2日后,T98G和U118MG胶质母细胞瘤细胞分别的集落形成的(colonogenic potential)潜能。
图2A代表三种不同的PME-1 dsRNAs、PME-1.1 (SEQ ID NO:1)、PME-1.2 (SEQ ID NO: 2)和PME-1.3 (SEQ ID NO: 3)与星形孢菌素联合处理所诱导的细胞凋亡的核碎片。
图2B是一种蛋白印迹,其表明T98G细胞中杂乱dsRNA (Scr.)和三种不同的PME-1特异性dsRNA
(PME-1.1,即SEQ ID NO: 1,PME-1.2,即SEQ
ID NO: 2和PME-1.3,即SEQ
ID NO: 3)的PME-1沉默活性。
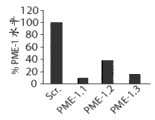
图2C是以上提及的蛋白印迹图像的密度分析,其显示与杂乱的siRNA转染的细胞相比,在用PME-1特异性dsRNAs (PME-1.1,即SEQ ID NO: 1,PME-1.2,即SEQ ID NO: 2和PME-1.3,即SEQ ID NO: 3)转染的T98G细胞中残留的PME-1水平。
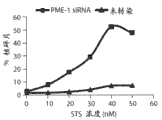
图2D显示与未转染的细胞相比,随星形孢菌素浓度的增加,PME-1 dsRNA转染的T98G细胞的细胞凋亡中剂量依赖性的增加。
图3A显示PME-1
dsRNA转染和星形孢菌素治疗对T98G细胞生存力的影响。
图3B显示PME-1
dsRNA转染和星形孢菌素处理对T98G细胞中活性细胞胱天蛋白酶-3和-7的水平的影响。
图3C显示泛-胱天蛋白酶(pan-caspase)抑制剂、Z-VAD-FMK治疗对PME-1 dsRNA和星形孢菌素介导的细胞凋亡的影响,以核碎片的量测定。
图4A显示用PP2A抑制剂、冈田软海绵酸预处理T98G细胞对PME-1
dsRNA和星形孢菌素介导的细胞凋亡的影响,以核碎片的量测定。
图4B代表dsRNA介导的不同PP2A B-亚单位共耗尽对PME-1特异性dsRNA和星形孢菌素介导的T98G细胞的细胞凋亡的影响,以核碎片的量测定。
图4C显示与杂乱的dsRNA转染的细胞相比,在星形孢菌素治疗中PME-1特异性或CIP2A特异性dsRNA所诱发的细胞凋亡潜能之间的比较。
图4D是一种蛋白印迹图像,其表明在人胶质母细胞瘤T98G细胞中杂乱dsRNA (Scr.)、PME-1特异性dsRNA
(PME-1)和CIP2A特异性dsRNA
(CIP2A)的PME-1和CIP2A的沉默活性。
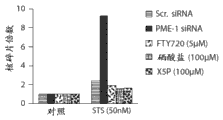
图4E显示使用特异性dsRNA (PME-1)和不同的化学活化剂PP2A、FTY720、硒酸盐或5-磷酸木酮糖(X5P),在PME-1耗尽的T98G细胞中星形孢菌素处理介导的细胞凋亡之间的比较。
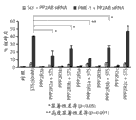
图5A显示用或者杂乱的或者PME-1特异性dsRNA转染48小时并用指定浓度的不同星形孢菌素类似物/衍生物处理另外24小时后,T98G胶质母细胞瘤细胞中细胞凋亡核碎片的量。
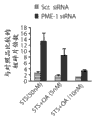
图5B代表用指定浓度的星形孢菌素类似物、PKC412和K252a处理2日后,杂乱的或PME-1特异性dsRNA转染的T98G胶质母细胞瘤细胞的集落形成的潜能。
图5C和5D代表用指定浓度的星形孢菌素(STS)、PKC412和K252a处理2日后,杂乱的或PME-1特异性dsRNA转染的U251MG和U87MG胶质母细胞瘤细胞各自的集落形成的潜能。
发明详述
本发明基于一个意外的发现,即沉默PME-1基因使癌细胞对某些小分子化学治疗剂诱导细胞凋亡的活性变得敏感。伴随PME-1基因的沉默和所述化疗药物的给药导致细胞凋亡水平的协同增加。因此,在一方面,本发明提供PME-1损耗和所述化疗药物的联合疗法。
PME-1基因沉默可以通过本领域已知的任何适合的方法来获得,包括但不限于RNA干扰(RNAi)。对于基于RNAi的基因沉默的最常用的方法是利用小干扰RNA
(siRNA)。
siRNA的原理在文献中被广泛提及。美国专利公布号2003/0143732、2003/0148507、2003/0175950、2003/0190635、2004/0019001、2005/0008617和2005/0043266中提及这些实例。siRNA双重分子包含反义区和有义链,其中所述反义链在编码一种mRNA序列的某种蛋白质中包含与目标区域互补的序列,而有义链包含与所述反义链互补的序列。因此,siRNA双重分子由两个核酸片段组装,其中一个片段包含反义链,而第二个片段包含所述siRNA分子的有义链。换言之,siRNA是小双链的RNAs (dsRNAs)。有义链和反义链可通过衔接分子(linker molecule)进行共价连接,所述衔接分子可以是多核苷酸连接序列或非核苷酸连接序列。反义链和有义链的长度可以变化,通常每个约19-21个核苷酸。在某些情况下,所述siRNA可以包括22、23或24个核苷酸。
基于RNAi的PME-1沉默的另一种方法是使用更长的,典型为25-35个nt的Dicer底物siRNAs
(DsiRNAs),其在某些情况下已被报道为比常规21-聚体siRNA更有效(Kim et al., Nat Biotechol, 2005, 23: 222 -226)。DsiRNAs通过Dicer在体内被加工成活性的siRNA。
在细胞中,形成活性的siRNA反义链并可识别靶mRNA的目标区域。这反过来导致靶RNA被RISC内切核酸酶复合物(RISC = RNA-诱导的沉默复合物)裂解,并通过RNA依赖性RNA聚合酶(RdRP)合成额外的RNA,RdRP可以激活Dicer并生成额外的siRNA双链体分子,从而扩增响应。
本文中所用的术语“dsRNA”是指siRNA和DsiRNAs
一般地,但不一定,dsRNA的反义链和有义链都包括少量的3’-末端突起(overhang),通常为1 -3个核苷酸。该3’突起可以包括一个或多个经修饰的核苷酸,如2’-O-甲基核糖核苷酸。反义的5’-末端一般是一个磷酸基(P)。具有末端磷酸基(P)的dsRNA双链体比起单反义链更容易进入细胞。在某些情况下,有义链的5’-末端或反义链和有义链两者都可以包含P基团。
通常,未修饰的RNA在生理条件下具有低的稳定性,原因是其被活细胞中存在的核糖核酸酶降解。如果将寡核苷酸外源性给予,那么非常需要根据已知的方法来修饰所述分子,从而增强其对抗化学和酶降解的稳定性。
体内外源性给予的核苷酸的修饰在本领域中已有广泛的描述(例如在US
2005/0255487中,结合到本文作为参考)。原则上,核苷酸的任何部分,即核糖,碱基和/或核苷酸间的(internucleotidic)磷酸二酯链都可以被修饰。例如,从核糖单位去除2’-OH基团得到2’-脱氧核糖核苷酸导致稳定性提高。此前公开的也有对该基团的其它修饰:核糖2’-OH基团被烷基、链烯基、烯丙基、烷氧基烷基、卤素、氨基、叠氮基或巯基替代。在该核糖单元上还可进行其它的修饰:可运用含有在核糖的2’-和4’-位置之间的亚甲基键的锁定的核酸(LNA)以创造更高的内在稳定性。
此外,例如可修饰核苷酸内的磷酸二酯键,以使得一或多个氧被硫、氨基、烷基或烷氧基替代。也可以修饰核苷酸中的碱基。
寡核苷酸优选地包含核糖的糖上一或多个2’-羟基的修饰,和/或在一或多个核苷酸内磷酸二酯键中的修饰,和/或在核糖的糖上的2’-和4’-位之间一或多个锁定的核酸(LNA)修饰。
特别优选的修饰是例如一或多个2’-OH基团被2’-脱氧基、2’-O-甲基、2’-卤素(例如氟)或2’-甲氧基乙基所替代。特别优选是其中某些核苷酸内的磷酸二酯键被修饰,例如被硫代磷酸酯(phosphorothioate)键替代的寡核苷酸。
在某些实施方案中,dsRNAs可以含有一或多种合成的或天然的核苷酸类似物,包括但不仅限于硫代磷酸酯、氨基磷酸酯、甲基膦酸酯、手性甲基膦酸酯和肽-核酸(PNA),只要dsRNAs保留其PME-1沉默能力即可。
应该强调的是,以上提及的修饰仅为非限定的实例。
关于RNAi的其中一个挑战是辨识相应的mRNA的有效dsRNA。应注意的是,带有不完全互补性的基因会被dsRNA非有意地下调,导致数据解释及潜在毒性的问题。然而,这可以通过用设计算法精心设计适合的dsRNA来部分解决。这些电脑程序用一套规则筛选出给定的目标序列,以发现带有低GC含量、缺失的内部重复序、富含A/U的5-末端和较高局部游离的键能的序列的延伸,这是增强dsRNA沉默作用的特征。
为了识别用于本发明的药物,通过使用市售和非市售的运算法设计几种不同的PME-1 siRNAs。为此目的,将PME-1的全长cDNA序列加载到siRNA的运算程序中(Eurofins MWG Operon’s Online Design Tool),而该独立程序由Cuia等开发(Biomedicine,
2004, 75: 67 -73)。另外,随后将生成siRNA序列的算法通过(trough)全基因组(genome wide) DNA序列排列(BLAST)进行筛选,以消除确实有脱靶(not free from off-targeting)的siRNA。换句话说,所有的那些具有与其它基因匹配而非与靶基因(PME-1)匹配的很短序列区域的siRNAs被认为对后期的利用非常重要。
然后将得到的siRNAs转染至不同的细胞系,并通过测定用PME-1特异性抗体处理siRNA后的PME-1蛋白的量,在蛋白水平上研究其降解mRNA的能力和进一步耗尽PME-1的翻译的能力(表1)。
表1. PME-1特异性siRNAs
适用于本发明各种实施方案中的更多的PME-1特异性siRNAs在US 2009/182134中已有公开并在表2中列出。
表2. 更多的PME-1特异性siRNAs
适合的dsRNAs包括具有与SEQ ID NO:s 1-36大于80%序列一致性,例如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或者甚至100%的序列一致性的那些序列,只要它们具有与参比dsRNAs相似的结合特性和PME-1沉默活性即可。
可根据本领域已知的方法,设计和合成更多的其它适用于本发明各个实施方案的PME-1特异性dsRNA。任何这样的分离的dsRNA必须与PME-1
cDNA序列充分互补,以实现沉默PME-1基因。
人工microRNA (miRNA)前体是另一类适用于调节RNAi的小RNAs。一般地,人工miRNA前体长度约21-25个核苷酸,并且它们可具有1-3个,一般为2个的悬垂的(overhanging) 3’核苷酸。PME-1沉默人工miRNA前体可通过本领域已知的方法设计和合成。
短-发夹状(Short-hairpin)
RNAs (shRNAs)仍是沉默PME-1的另一种途径。ShRNAs由以下组成:i) 一种短核苷酸序列,一般范围为19-29个核苷酸,其源于靶基因;ii) 回路,一般范围为4-23个核苷酸;和iii) 一个与初始靶序列逆向互补的短核苷酸序列,一般范围为19-29个核苷酸。PME-1沉默shRNAs可通过技术人员已知的方法设计和合成。PME-1特异性shRNAs的非限定性实例包括表3中列举的那些。
表3. PME-1特定shRNAs
PME-1沉默也可通过反义疗法获得,其中相对短(一般为13-25个核苷酸)的合成单链DNA或RNA寡核苷酸通过结合对应的mRNA而失活PME-1基因。反义寡核苷酸可以是未修饰的或经化学修饰的。在某些实施方案中,核糖2’-位上的氢被O-烷基,例如甲基代替。在进一步的实施方案中,反义寡核苷酸可包含一或多个合成或天然的核苷酸类似物,包括但不限于PNAs。
另外,PME-1沉默可通过裂解PME-1 mRNA的核糖酶获得。所述核酶技术在例如Li et al.的Adv.
Cancer Res., 2007, 96:103-43中有描述。
本文所用的术语“PME-1沉默”指完全或部分减少PME-1基因表达。在某些实施方案中,当将PME-1-特异性dsRNA、人工miRNA前体、shRNA、反义寡核苷酸、核酶,或其任何组合引入人或动物患者体内时,PME-1基因表达减少至少50%,或者至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。
在某些实施方案中,PME-1沉默可通过阻断或抑制PME-1和PP2A之间的相互作用得到,特别是PP2A的c-亚单位,由此阻止PME-1对PP2Ac至少50%,或至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的功能。这些阻断剂或抑制剂包括,但不限于重组或化学制备的修饰或未修饰的肽和部分肽以及非-肽分子,如小分子化学化合物。识别这些试剂的方法已在WO 2009/100173和US
2009/239244中公开。
适用于本发明的各个实施方案的化学化合物包括那些列于表4中的化合物及其任何立体异构体、盐、溶剂化物或前药。在一实施方案中,适合的化合物具有通式(I):
其中
R’是H或烷基;
R’’是H或烷氧基;
R1和R2是H或一起形成氧代;
R3和R4独立地是H或OH,或一起形成氧代;
R5、R6、R6’、R7和R8独立地选自H、烷基、烷氧基、羟基、羟基烷基、烷氧基羰基或单-和双烷基氨基;
X是CH2或O;和
n是0或1。
本文所用的词组“具有式”并非限定之意,可与一般使用的术语“包含”相同的方式使用。
上文提及的术语“烷基”包括直链和支链C1-6烷基二者,如甲基、乙基、丙基、丁基、戊基、己基等。在某些实施方案中,烷基是包含1-3个碳原子的C1-3烷基。
本文所用的术语“烷氧基”指直链和支链C1-6烷氧基二者,如甲氧基、乙氧基、丙氧基等。在某些实施方案中,烷氧基是包含1-3个碳原子的C1-3烷氧基。
本文所用的术语“羟基烷基”指被–OH取代的任何以上提及的C1-6烷基。
本文所用的术语“烷氧基羰基”指被–COOH取代的任何以上提及的C1-6烷氧基。
术语“氨基”指–NH2。
术语“单烷基氨基”包括被一个氨基取代的任何以上提及的烷基。
术语“二烷基氨基”指被二个氨基取代的任何以上提及的烷基。
本文所用的术语“立体异构体”是各分子的所有异构体的一种通用术语,其仅在其原子在空间中的取向不同。其包括对映体和具有一个以上的手性中心且彼此非镜像的化合物的异构体(非对映体)。
本文所用的术语“手性中心”或“不对称中心”指连接四个不同基团的碳原子。
术语“对映体”指在其镜像上不重叠并因此具有旋光性的分子,其中对映体沿一个方向的偏振光平面转动,而其镜像体沿相反方向的偏振光平面转动。
术语“外消旋的”指等份对映体的混合物并且不具旋光性。
可将任何所公开的化合物转化为药学上可接受的盐。所述药学上可接受的盐并不特别地限定,只要其无毒性即可。与无机或有机碱所成的盐的非限定性实例包括碱金属盐(例如钠盐、钾盐等)、碱土金属盐(例如钙盐、镁盐等)、铵盐、胺盐(例如三乙胺盐)等。酸加成盐的非限定性实例源于矿酸(例如盐酸、氢溴酸、氢碘酸、磷酸、硝酸、硫酸等)的盐,以及源于有机酸(例如酒石酸、乙酸、柠檬酸、苹果酸、乳酸、富马酸、马来酸、苯甲酸、二醇酸(glycol acid)、葡糖酸、琥珀酸等)的盐。
任何所公开的化合物都可用作以下提到的药用组合物的前药。本文所用的术语“前药”指给药后,例如通过代谢可在体内转化为活性药物的任何化合物。
具有式(I)的化合物的非限定性实例包括表4中所列的星形孢菌素(STS)、PKC412、K252a、UCN-01、CEP-701和SB-218078。
表4. 测定的星形孢菌素类似物/衍生物的实例。表中示出用PME-1特异性dsRNA转染和用指定浓度的不同星形孢菌素类似物/衍生物处理后,T98G胶质母细胞瘤细胞中细胞凋亡的核碎片的量(增强%)。
可将PME-1 dsRNAs和式(I)化合物伴随、同时或随后给药。
PME-1特异性dsRNAs的传递可以以两种主要的不同方式完成:1) 编码一种核酸序列的寡核苷酸的内源性转录,其中所述核酸序列位于表达构成物中或者2) 寡核苷酸的外源性传递。
对于内源性转录,可采用本领域已知的方法将PME-1特异性dsRNAs插入到适合的表达系统中。这样的表达系统的非限定性实例包括逆转录病毒载体、腺病毒载体、慢病毒载体、其它病毒载体、表达框(expression cassette)和质粒,例如包囊于聚乙二醇化免疫脂质体(PILs)中的那些,带有或不带有一或多种本领域已知的诱导型启动子。两条dsRNA带可表达在来自相同或不同启动子的单表达构成物中,或者所述两条dsRNA带可表达在分开的表达构成物中。
以上提及的表达系统也可用于传递PME-1沉默人工miRNA前体和shRNAs。
一般地,可在给予人或动物受试者(例如犬受试者)之前,将表达构成物配制成药用组合物。给药可通过本领域已知的任何适合的方法进行,包括全身性或局部传递。如本领域技术人员熟知的那样,制剂取决于预定的给药途径。例如,可将所述表达构成物在药学上可接受的载体或稀释剂中传递,或者可将其包埋入适当的缓慢释放的组合物中。在某些情况下,药用组合物可包含一或多种产生表达构成物的细胞。也可将细菌用于RNAi传递中。例如,重组工程的大肠杆菌可在体内传递和转移shRNAs之后进入哺乳动物细胞。相关途径将使用由例如肠沙门菌(Salmonella
enterica)衍生的微细胞。
对于外源性传递,一般将dsRNA分子与脂质体或脂质基载体、胆固醇轭合物或聚乙烯亚胺(PEI)复合。一种有前途的新途径是将dsRNAs与稳定的核酸脂质微粒(SNALPs)复合。带有或不带有所述复合的外源性传递的合适给药途径包括但不限于,如本领域技术人员已知的非肠道传递(例如静脉注射)、肠内传递(例如口服)、局部给药、表面给药(例如表皮或经皮)。由于手术移除肿瘤通常是主要的临床措施,因此可将dsRNAs直接给予到所切除的肿瘤空穴内。
式(I)的化学治疗剂可通过本领域已知的任何适合的途径给予人或动物受试者,包括但不限于对给予PME-1特异性dsRNAs所列的那些途径。
在本发明的联合疗法中,可将dsRNA分子和式(I)化合物配制成相同或不同的药用组合物。当使用不同的药用组合物时,可伴随、同时或随后给药。dsRNA分子和式(I)化合物的制剂和/或给药途径可彼此独立地选择。在某些实施方案中,药用组合物可包含一或多种不同的PME-1沉默dsRNAs和/或一或多种式(I)的化学治疗剂。
可将药用组合物在适用于给药的任何适当的药用载体中给药。可以以在人或动物患者中引起预防、缓解、防止或治愈高增殖性疾病(例如癌症)的任何方式给药。
为进行非肠道或局部给药,可将dsRNAs和/或式(I)化合物配制成例如溶液剂、混悬剂或乳剂。所述制剂按需要可包含水性或非水性溶剂、共溶剂、助溶剂、分散剂或湿润剂、悬浮剂和/或粘性剂。非水性溶剂的非限定性实例是丙二醇、聚乙二醇、植物油、鱼油和可注射用有机酯。水性载体包括例如水、水-醇溶液,包括盐水和缓冲溶媒胃肠外介质,包括氯化钠溶液、林格氏葡萄糖溶液、葡萄糖加氯化钠溶液、包含乳糖的林格氏溶液或者固定油。静脉内介质的非限定性实例包括液体和营养补充剂、电解质补充液,例如基于林格氏葡萄糖溶液等的那些介质。水性组合物可包含适当的缓冲剂,如磷酸钠和磷酸钾、枸橼酸盐、乙酸盐、碳酸盐或甘氨酸缓冲液,这取决于目标pH-范围。还可使用作为渗透压调节剂的氯化钠的用途。所述组合物还可包括其它赋形剂,如稳定剂或防腐剂。有用的稳定赋形剂包括表面活性剂(聚山梨醇酯20 & 80,泊洛沙姆407)、聚合物(聚乙二醇、聚维酮)、碳水化合物(蔗糖、甘露醇、葡萄糖、乳糖)、醇(山梨醇、甘油、丙二醇、乙二醇)、适合的蛋白质(白蛋白)、适合的氨基酸(甘氨酸、谷氨酸)、脂肪酸(乙醇胺)、抗氧剂(抗坏血酸、半胱氨酸等)、螯合剂(EDTA盐、组氨酸、天冬氨酸)或金属离子(Ca、Ni、Mg、Mn)。其中有用的防腐剂是苄醇、氯丁醇、苯扎氯铵和可能的对羟基苯甲酸酯。
口服给药的固体剂型包括但不限于胶囊剂、片剂、丸剂、锭剂、糖锭剂、散剂和颗粒剂。在这些固体剂型中,可将dsRNAs和/或式(I)化合物与至少一种惰性稀释剂(如蔗糖、乳糖或淀粉)混合。这些剂型如在通常的实践的那样,也可包含药用辅助物质,例如硬脂酸盐润滑剂或矫味剂。固体口服制剂还可用调节释放活性成分释放的肠溶衣或其它包衣材料制备。
口服给药的液体剂型的非限定性实例包括药学上可接受的乳剂、溶液剂、混悬剂、糖浆剂和酏剂,其包含本领域常用的惰性无毒稀释剂,如水和乙醇。这些组合物还可包含辅助剂,如湿润剂、缓冲剂、乳化剂、助悬剂、甜味剂和矫味剂。
药用组合物可以以按要求重新配制的浓缩形式或粉末形式提供。在冻干情况下,优选某些冷冻保护剂,包括聚合物(聚维酮、聚乙二醇、葡聚糖)、糖(蔗糖、葡萄糖、乳糖)、氨基酸(甘氨酸、精氨酸、谷氨酸)和白蛋白。如果将供重组的溶液加入到包装中,则包装中可由例如注射用无菌水或氯化钠溶液或右旋糖或葡萄糖溶液组成。
配制本发明药用制剂的途径和方法对于本领域技术人员是已知的,并可按其本身已知的方法制备,例如通过常规的混合、制粒、溶解、冻干或类似的过程制备。
本发明的联合疗法可用于治疗人或动物的高增殖性疾病,包括但不限于牛皮癣、心肌肥大、良性肿瘤(如腺癌、错构瘤和软骨瘤)、以及癌症,如头和颈的头颈鳞状细胞癌、结肠癌、胃癌、乳腺癌、卵巢癌、前列腺癌、宫颈癌、脑癌(如胶质瘤、星形细胞瘤和恶性胶质瘤)和血液癌症(如慢性和急性髓性白血病)。
本文所用的术语“治疗”或“处理”并不仅指完全治愈疾病,而且也指预防、减轻和缓解疾病或其相关症状。
DsRNAs和式(I)化合物组合的“有效量”意指改善肿瘤有害作用的最小量。本发明联合疗法的给药量和方案可通过治疗癌症相关疾病的临床领域的普通技术人员容易地确定。一般地,本发明联合疗法的剂量取决于下列考虑因素,例如:待治疗的患者的年龄、性别和一般健康状况;同时治疗的类型(如果有的话);治疗的频率和所要求的效果特性;组织损伤的程度;症状的持续时间;和由个体医生调节的其它可变因素。可将所要求的剂量给予一或多个应用中以获得所要求的结果。依据本发明实施方案的药用组合物可以以单位剂量形式提供。
在一实施方案中,可将dsRNAs可以约0.01 µg/kg-约10 mg/kg,或约1.0
µg/kg-10 mg/kg的剂量范围内的有效量给药。可将dsRNAs以单次日剂量给药,或者可将总的日剂量以分剂量,如每日2、3或4次给药。
在一实施方案中,可将式(I)化合物以约0.1 µg/kg-约300 mg/kg,或约1.0
µg/kg-约10 mg/kg的剂量范围内的有效量给药。可将式(I)化合物以单次日剂量给药,或者可将总的日剂量以分剂量,如每日2、3或4次给药。给药方案的选择可独立于dsRNAs的给药方案。
随着技术的进步,可以以多种方式应用本发明的概念,这对本领域技术人员而言将是显而易见的。本发明及其实施方案并不限定于以下所述的实施例,但可在权利要求书的范围内变化。
实施例
材料和方法
真核细胞培养和小干扰RNA (siRNA)转染:对于此研究,发明人使用T98G、U118MG、U251MG和U87MG人体胶质母细胞瘤细胞系。在37℃,5% CO2的湿润气氛下,将T98G和U251MG细胞在Eagle’s MEM中,U118MG在DMEM
(Sigma-Aldrich)中和U87MG在DMEM/F-12
(Gibco Products, Invitrogen)培养基中培养,所述培养基补充有10%热灭活FCS和青霉素(100单位/mL)-链霉素(100
Ag/mL)。根据制造商的使用说明书,用脂质转染胺试剂(Lipofectamine)
RNAiMAX试剂(Invitrogen)进行小干扰RNA (siRNA)的转染。转染运用所有实验中预定的转染方案进行,除CellTiter-glo和Caspase-glo实验之外,其中逆转染在96-孔培养板中进行。使用下列siRNA序列:
化学抑制剂和试药:小抑制剂筛选套装,其包含H-7、H-8、H-89、氯化白屈菜赤碱(Chl Cl)、舒尼替尼、坦度替尼、拉帕替尼、凡德他尼、PKC412和K252A,购自Biaffin GmbH & Co KG。盐酸托泊替康购自Selleck Chemicals。UO126、LY
294002、RO-31-8220、GÖ 6976 和SB
218078购自Calbiochem。星形孢菌素(STS)、CEP-701、UCN-01 从Sigma-Aldrich获得;替莫唑胺(TMZ)、Arcyriaflavin-A和K252c从Tocris
Bioscience获得;蝴蝶霉素(Rebeccamycin)从Enzo Life Sciences获得和恩扎啕林(Enzastaurin)得自LC
laboratories。泛-胱天蛋白酶抑制剂Z-VAD-FMK、PP2A抑制剂冈田软海绵酸和活化剂硒酸钠和5-磷酸木酮糖自Sigma-Aldrich公司获得。另一种PP2A活化剂FTY720购自Cayman
chemicals。人重组Fc-FasL融合蛋白和人重组异亮氨酸-拉链TRAIL (TRAIL)由John Eriksson教授(Åbo
Akademi University)赠送。所有这些化学物质均按供货商推荐用或者水或者DMSO重新构成。
蛋白质印迹法和抗体:将培养并处理的细胞溶于2X SDS样品缓冲液/电泳示踪缓冲剂(Laemmli Buffer)中,煮沸并用10%丙烯酰胺凝胶经SDS-PAGE溶解。蛋白被转移到PVDF膜上。将膜阻塞并用初级抗体所要求的稀释液和次级抗体的1:5000稀释液在5% Milk-PBS-Tween20中孵育必须的持续时间,然后通过增强化学发光(ECL)显影。抗-PME-1
(克隆H-226)和抗-CIP2A
(克隆 2G10-3B5)抗体(1:1000稀释液)
购自Santa Cruz Biotechnology。抗肌动蛋白(克隆AC-40)抗体(1:10,000稀释液)购自Sigma-Aldrich。蛋白印迹的密度分析采用MCID图像分析仪软件进行。
细胞活力测定:细胞存活率通过CellTiter-glo (CTG)测定法测定,该方法测定作为代谢活性和活细胞的一个指标的细胞ATP水平。CTG试剂盒购自Promega公司,并根据其推荐方法进行测定。测定在白色聚苯乙烯96孔板中进行(Nunc, Thermo
Fisher Scientific Inc.),发光性采用Perkin Elmer
Victor2微孔板读出仪测定。
胱天蛋白酶(Caspase)-3和-7活性分析:胱天蛋白酶-3和-7的活性通过以发光为基础的方法测定,该方法利用包含胱天蛋白酶-3和-7目标肽DEVD的底物,称为胱天蛋白酶-Glo
3/7试验(Promega Corp.)。根据制造商的使用说明书,试验在白色聚苯乙烯96孔板中进行(Nunc, Thermo Fisher Scientific Inc.),发光性采用Perkin Elmer Victor2微孔板读出仪测定。
通过sub-G0/G1期部分的估算的细胞凋亡测定法:将包含用碘化丙啶(Propidium iodide,PI)染色的碎片细胞核的sub-G0/G1期部分的百分比作为一种凋亡细胞的量度。将3.5-4 x 104个细胞接种于24孔板中,用siRNA转染48小时,然后用在新鲜介质中的指定浓度的试验化合物处理。处理24小时后,通过离心收集漂浮的和贴壁的细胞。将细胞沉淀物重新悬浮于400µl的包含40mM枸橼酸三钠(Tri-sodium citrate) (Merck)、0.3% Triton X-100 (Sigma-Aldrich)和50µg/mL碘化丙啶(Sigma-Aldrich)的PBS液的低渗PI缓冲液中,并在室温下避光培养10分钟。进行PI染色核的流式细胞计数分析,所记录的数据分别使用FACScan流式细胞仪和软件(Becton Dickinson)分析。
在使用泛-胱天蛋白酶抑制剂的实验中,将细胞保持在含有30µM Z-VAD-FMK的生长培养基中,从转染后18小时开始直到PI染色。对于用PP2A活性剂FTY720、硒酸钠和5-磷酸木酮糖处理,可从转染后24小时开始,将细胞在整个实验中保持在各自的药物中。转染24小时后,给予PP2A抑制剂、冈田软海绵酸处理24小时。
集落形成试验:使在6孔板中以极低密度(4-6 x 103)接种的细胞生长约7天,直至它们形成小集落。然后,根据供应商的使用说明书,用Lipofectamine RNAiMAX试剂(Invitrogen),将这些细胞用杂乱的或PME-1 siRNA进行转染。48小时后,用指定浓度的化学药物处理另48小时。室温下,将细胞集落用PBS冲洗,用3.7%甲醛固定,并用0.2%结晶紫溶液(于10%乙醇中制得)染色各15分钟。过量的染色剂通过用PBS反复洗涤除去。将接种板干燥,并用Olympus
SP-600UZ相机或Epson Perfection V700扫描仪拍照片,用ImageJ分析。
统计分析:两组数据均值之间的显著性差异水平使用未配对Student’s t-检验评估,假定样品均值间方差相等。所有p-值都是双尾的。将概率值p<0.05的参数描述为具有统计学上的显著意义,p<0.001为具有高度的显著性差异。
结果
为研究PME-1抑制作用对癌细胞存活的影响和对不同化学药物的敏感度的影响,首先,将人胶质母细胞瘤T98G细胞用PME-1
siRNA进行瞬间转染72小时,以有效降低PME-1蛋白水平(图1A)。将含有正常或降低水平的PME-1的T98G细胞(分别用SEQ ID NO:37中所示的杂乱siRNA或者SEQ
ID NO:1中所示的PME-1 siRNA转染的细胞)用不同的化学药物处理,所述化学药物包括丝氨酸-苏氨酸蛋白激酶的广泛特异性抑制剂(H7、H8、H89、氯化白屈菜赤碱、UO126、LY294002和星形孢菌素)、酪氨酸激酶抑制剂(舒尼替尼、坦度替尼、拉帕替尼和凡德他尼)、DNA拓扑异构酶I抑制剂(托泊替康)和DNA甲基化药物,替莫唑胺,该药物目前正用于多形性胶质母细胞瘤(GBM)的治疗。
将用siRNA转染48小时的T98G细胞用给定的药物处理24小时,随后将细胞溶解,并将其细胞核用低渗碘化丙啶缓冲液染色。通过流式细胞仪(FACS)分析溶胞产物的破碎细胞核的sub-G0/G1期分数的变化(图-1B)。细胞核的缩合和破碎是细胞凋亡的关键生化特征,而sub-G0/G1期分析已被广泛用于细胞凋亡的检测(FEBS Lett., 1986, 194(2):347-50; Cytometry, 1991, 12(4):323-329;Nature Protocols, 2006, 1:1458-1461)。使用这种技术,H7、舒尼替尼和LY294002在PME-1缺失的细胞中都表现出中等水平的细胞凋亡。化疗药物替莫唑胺在胶质母细胞瘤细胞中还能诱导中等水平的细胞死亡,但当与PME-1 siRNA联合使用时效果并不明显。所有受试药物中效果最突出的候选者是星形孢菌素(STS),其在PME-1耗尽的胶质母细胞瘤T98G细胞种能诱导非常高水平的细胞凋亡,而该STS浓度单独并不能诱导显著的核碎裂。发现PME-1耗尽的协同作用对STS具有特异性,原因是用大多数的化学化合物(图-1B)或者用诱发细胞死亡的配体、FasL (重组Fc-FasL融合蛋白)和TRAIL (图-1C)处理的细胞并未表现出同样的趋势。
此外,发现STS在以在杂乱siRNA转染的细胞中不能诱发细胞死亡的浓度下,在PME-1耗尽细胞中以剂量依赖的方式诱导细胞凋亡(图-1D)。然而,在浓度大于50 nM时,甚至在对照组(转染的杂乱siRNA) T98G细胞中,STS单独开始诱导细胞死亡。
然后通过集落形成试验,在T98G胶质母细胞瘤细胞和另一胶质母细胞瘤细胞系U118MG中测试这种联合疗法的效果。对于这种实验,使这些细胞在6孔培养板中生长直至形成小的集落,随后将其用杂乱或PME-1 siRNA转染48小时,接着用指定浓度的STS再处理另外48小时。将集落用甲醛固定,用结晶紫染色,并将图片用Image J.分析。在这两种细胞系中,或者PME-1耗尽或者STS处理单独都能适度地降低集落形成能力,而这两种治疗方法的组合则造成集落的几乎完全丧失(图-1E和1F)。
为排除SEQ ID NO:1中所示的PME-1 siRNA的序列特异性的脱靶效应的可能性,将三种不同的PME-1特异性siRNA序列(SEQ ID NO:s 1-3)转染至T98G细胞,STS处理后,分析细胞凋亡的核碎片(图-2A)。这些PME-1 siRNA的有效性通过蛋白印迹法(图-2B)测定,并根据β-肌动蛋白对谱带强度进行量化及标准化(图-2C)。所有的PME-1 siRNA序列都能将胶质母细胞瘤T98G细胞敏化为STS介导的细胞凋亡。为消除杂乱siRNA转染引起的任何可能的背景效应,将未转染的T98G细胞用增加浓度的STS处理,并将这些细胞中的细胞凋亡的核碎片与接受PME-1 siRNA和相同浓度的STS的细胞进行比较(图2D)。发明人观察到在STS浓度高于30nM时,STS单独使得有限数量的细胞死亡。在另一方面,PME-1下调的细胞对诱导细胞死亡的STS高度敏感,即使在本实验中使用的最低浓度下。
为研究在PME-1耗尽细胞中经STS诱导的细胞杀伤的特征,发明人首先通过Cell-titer-glo (CTG)测定法分析PME-1 siRNA和STS处理的这种双重组合对胶质母细胞瘤T98G细胞存活率的影响(图-3A)。该结果与sub-G0/G1期分析强烈相关,因为PME-1的耗尽降低小部分的细胞成活力,但当所述相同的细胞还受到STS处理时,细胞存活率急剧下降。细胞凋亡的另一个生化特征是效应器半胱氨酸-天门冬氨酸蛋白酶胱天蛋白酶-3和7的激活。发现单独的PME-1损耗能增加胱天蛋白酶-3/7的活性至少2倍,其与STS治疗联合可以上升而为胱天蛋白酶-3/7的6倍(图-3B),这提示胱天蛋白酶与细胞凋亡的诱导有关。为了进一步证明胱天蛋白酶的诱导作用,整个实验过程中,将接受PME-1siRNA和STS治疗的细胞用泛-胱天蛋白酶抑制剂Z-VAD-FMK处理,然后通过核碎片测定法分析细胞凋亡(图-3C)。发明人发现通过抑制胱天蛋白酶的活性,PME-1耗尽的细胞中STS介导的细胞凋亡完全逆转,这表明细胞凋亡完全依赖于胱天蛋白酶的诱导。
然后,发明人的重点是研究PME-1介导胶质母细胞瘤细胞对STS诱导的细胞凋亡的抵抗力背后的可能机制。由于PME-1的唯一确定的直接目标是PP2A,所以发明人利用一种PP2A的化学抑制剂,冈田软海绵酸(OA),推测它应该逆转PME-1抑制的效果,从而促进细胞的存活。实际上,胶质母细胞瘤T98G细胞在STS处理之前用OA先处理24小时,就足以解救PME-1 siRNA和STS以剂量依赖方式介导的细胞凋亡之中的细胞(图-4A)。这引导发明人进一步观察PP2A的作用,并发现可能有不同的PP2A三聚体复合物参与PME-1介导的细胞凋亡的作用中。由于PME-1促进某些PP2A的结合并阻止其它PP2A调节B-亚基的结合,因此发明人使用单独带有PME-1抑制作用的特殊B-亚基的siRNA介导的抑制作用来研究哪一个是PME-1介导作用所必需的。将九种不同的PP2A B-亚基siRNAs与PME-1 siRNA对胶质母细胞瘤T98G细胞进行共转染,接着经STS处理和细胞凋亡分析。正如所料,当抑制发生时,仅有少数几种PP2A B-亚基能逆转PME-1耗尽的细胞的细胞凋亡。代表性图-4B表明PPP2R2a、PPP2R3b、PPP2R5a或PPP2R5b B-亚基共耗尽的细胞能够明显逆转PME-1殆尽的细胞中STS介导的细胞凋亡。然而,或者PPP2R2c (图-4B)或者其它受试的B-亚基(数据未示出)的同时消耗不影响接受PME-1 siRNA和STS治疗的细胞的细胞凋亡。因此,发明人可以推断PME-1抑制作用通过重激活包含以上四个B亚基的PP2A三聚体而促进了STS介导的细胞凋亡。
为证实这些PP2A介导的细胞凋亡效果是否对PME-1有特异性或者是否与其它PP2A抑制/调节蛋白共享,发明人比较了CIP2A和PME-1耗尽在对STS治疗响应中它们使胶质母细胞瘤细胞对细胞凋亡敏感的能力。发明人发现CIP2A的下调增加细胞凋亡的程度极小,以致不能将其认定为PME-1耗尽细胞介导作用的协同作用(图-4C),这支持了这些作用对于PME-1下调具有特异性的观点。CIP2A和PME-1通过其各自的siRNAs的有效下调作用通过蛋白质印迹法证实(图-4D)。
随后,发明人还对三个近来鉴定的化学活化剂PP2A、FTY720、硒酸盐和5-磷酸木酮糖,测试了它们在响应STS治疗中促进细胞凋亡的能力。为便于PME-1 siRNA转染细胞和化学处理过的细胞之间的对比,发明人首先用Scr. siRNA转染T98G细胞,接着用化学物PP2A活化剂预处理6小时,然后用STS处理24小时,最后通过FACS进行sub-G0/G1期分析(图-4D)。这些化学物PP2A活化剂无一能够在STS治疗时敏化胶质母细胞瘤细胞的细胞凋亡。
所有上述结果突出了PME-1表达的向下调节的需求,以及随后所选择的PP2A复合物的激活以使胶质母细胞瘤细胞对STS介导的细胞凋亡敏感。
由于文献中已证明STS是激酶的一种广泛特异性抑制剂,因此其被认为在癌症化学治疗领域不具意义。但是,已知某些STS衍生物具有许多特异性并具有很少的副作用,并且目前在临床试验中用于治疗不同的疾病。因此,发明人在实验装置中,将STS用不同浓度的其衍生物替代,如PKC412、K252a、RO-31-8220、GÖ 6976、SB
218078、Arcyriaflavin A、K252c、蝴蝶霉素、恩扎啕林、UCN-01 或
CEP-701 (图-5A)。令人惊奇的是,发明人发现PKC-412、K252a、UCN-01和CEP-701能够在PME-1耗尽的胶质母细胞瘤细胞中以甚至高于STS本身的水平诱导细胞凋亡。SB 218078在较高浓度时可诱导适度水平的细胞凋亡。然而,RO-31-8220和其它测试的STS衍生物在这些细胞中都不具活性。所有这些药物在PME-1耗尽的T98G细胞中的对细胞凋亡的生化特性、结构和增强作用也列于表4中。
使用两种活性药物,PKC412和K252A在T98G细胞中进行的集落形成试验也证实了上述发现(图-5B)。为避免该细胞系特异性作用,发明人还在其它PME-1耗尽的胶质母细胞瘤细胞系U251MG和U87MG中,研究了细胞凋亡敏感药物(STS,PKC412和K252a)的效果。在所有研究的细胞系中,PME-1耗竭增强了STS、PKC412和K252a的细胞杀伤活性,尽管在所述各治疗组合的疗效中存在细胞类型依赖性差异(图-5C和5D)。
Claims (14)
2. 依据权利要求1的组合,其中所述PME-1沉默剂选自siRNA分子、DsiRNA分子、人工miRNA前体、shRNA分子、反义寡核苷酸、核糖酶以及阻止PME-1功能趋向于PP2Ac的药物。
3. 依据权利要求1的组合,其中所述PME-1沉默剂包含一种选自SEQ ID NO:s 1-39的核酸序列。
5. 依据权利要求1的组合,其用于治疗选自下列的高增殖性疾病:牛皮癣、心肌肥大、良性肿瘤、实体癌和血液癌症。
6. 依据权利要求5的组合,其中所述实体癌选自头颈鳞状细胞癌、结肠癌、胃癌、乳腺癌、卵巢癌、前列腺癌、宫颈癌、脑癌、胶质瘤、星形细胞瘤和恶性胶质瘤。
7. 包含选自SEQ ID NO:s 3-5的核酸序列的小双链RNA分子。
8. 一种药用组合物,其包含权利要求1-6中任一项的组合或依据权利要求7的小双链RNA,以及至少一种药学上可接受的载体。
9. 一种在需要此种敏化的人或动物患者中通过沉默PME-1基因使高增殖性细胞对化学治疗剂敏化的方法。
11. 依据权利要求10的方法,其中所述PME-1沉默剂选自siRNA分子、DsiRNA分子、人工miRNA前体、shRNA分子、反义寡核苷酸、核糖酶以及阻止PME-1功能趋向于PP2Ac的药物。
12. 依据权利要求10的方法,其中所述PME-1沉默剂包含一种选自SEQ ID NO:s 1-39的核酸序列。
13. 依据权利要求10的方法,其用于治疗选自下列的高增殖性疾病:牛皮癣、心肌肥大、良性肿瘤、实体癌和血液癌症。
14. 依据权利要求13的方法,其中所述实体癌选自头颈鳞状细胞癌、结肠癌、胃癌、乳腺癌、卵巢癌、前列腺癌、宫颈癌、脑癌、胶质瘤、星形细胞瘤和恶性胶质瘤。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161499750P | 2011-06-22 | 2011-06-22 | |
| FI20115640 | 2011-06-22 | ||
| US61/499750 | 2011-06-22 | ||
| FI20115640A FI20115640A0 (fi) | 2011-06-22 | 2011-06-22 | Yhdistelmähoito |
| PCT/FI2012/050618 WO2012175798A2 (en) | 2011-06-22 | 2012-06-15 | Combination therapy |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN103781514A true CN103781514A (zh) | 2014-05-07 |
Family
ID=44206849
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201280040838.2A Pending CN103781514A (zh) | 2011-06-22 | 2012-06-15 | 联合疗法 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US9476050B2 (zh) |
| EP (1) | EP2723450B1 (zh) |
| JP (1) | JP6001655B2 (zh) |
| CN (1) | CN103781514A (zh) |
| CA (1) | CA2839807A1 (zh) |
| DK (1) | DK2723450T3 (zh) |
| FI (1) | FI20115640A0 (zh) |
| WO (1) | WO2012175798A2 (zh) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2883356A1 (en) | 2012-08-30 | 2014-03-06 | Turun Yliopisto | Method of selecting individualized brain cancer therapy |
| US9663789B2 (en) * | 2013-04-26 | 2017-05-30 | Medical Diagnostic Laboratories, Llc | PME-1 as a biomarker to predict and diagnose endometrial and breast cancer and gene silencing of PME-1 to inhibit epithelial to mesenchymal transition |
| US11299528B2 (en) | 2014-03-11 | 2022-04-12 | D&D Pharmatech Inc. | Long acting TRAIL receptor agonists for treatment of autoimmune diseases |
| EA038551B1 (ru) | 2015-12-17 | 2021-09-14 | Дзе Джонс Хопкинс Юниверсити | Способ лечения или профилактики системного склероза |
| WO2017177148A1 (en) | 2016-04-07 | 2017-10-12 | The Johns Hopkins University | Compositions and methods for treating pancreatitis and pain with death receptor agonists |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6133437A (en) * | 1997-02-13 | 2000-10-17 | Apoptogen, Inc. | Modulation of IAPs for the treatment of proliferative diseases |
| US6214986B1 (en) * | 1998-10-07 | 2001-04-10 | Isis Pharmaceuticals, Inc. | Antisense modulation of bcl-x expression |
| US20070026394A1 (en) | 2000-02-11 | 2007-02-01 | Lawrence Blatt | Modulation of gene expression associated with inflammation proliferation and neurite outgrowth using nucleic acid based technologies |
| US20030190635A1 (en) | 2002-02-20 | 2003-10-09 | Mcswiggen James A. | RNA interference mediated treatment of Alzheimer's disease using short interfering RNA |
| US20040019001A1 (en) | 2002-02-20 | 2004-01-29 | Mcswiggen James A. | RNA interference mediated inhibition of protein typrosine phosphatase-1B (PTP-1B) gene expression using short interfering RNA |
| US20030175950A1 (en) | 2001-05-29 | 2003-09-18 | Mcswiggen James A. | RNA interference mediated inhibition of HIV gene expression using short interfering RNA |
| AU2003290083A1 (en) * | 2002-08-13 | 2004-03-11 | Cell Center Cologne Gmbh | Use of iap for the diagnosis and of iap-inhibitors for the treatment of hodgkin's lymphomas |
| CA2500468A1 (en) | 2002-09-28 | 2004-04-08 | Massachussets Institute Of Technology | Influenza therapeutic |
| US20040077084A1 (en) | 2002-10-17 | 2004-04-22 | Isis Pharmaceuticals Inc. | Antisense modulation of histone deacetylase 4 expression |
| US20040077083A1 (en) | 2002-10-17 | 2004-04-22 | Isis Pharmaceuticals Inc. | Antisense modulation of histone deacetylase 4 expression |
| US20090182134A1 (en) * | 2002-11-14 | 2009-07-16 | Dharmacon, Inc. | siRNA targeting phosphatases |
| PT2284266E (pt) | 2002-11-14 | 2013-12-17 | Thermo Fisher Scient Biosciences Inc | Siarn contra tp53 |
| EP2236619A3 (en) * | 2003-04-25 | 2011-12-14 | Dana-Farber Cancer Institute, Inc. | BCL2L12 polypeptide activators and inhibitors |
| US20050043266A1 (en) | 2003-07-25 | 2005-02-24 | Sumedha Jayasena | Short interfering RNA as an antiviral agent for hepatitis C |
| WO2005011598A2 (en) | 2003-07-31 | 2005-02-10 | University Of South Florida | Leukemia treatment method and composition |
| MX2007001155A (es) | 2004-07-29 | 2007-08-14 | Creabilis Therapeutics Spa | Uso de inhibidores de k-252a y de quinasa para la prevencion o el tratamiento de patologias asociadas con hmgb1. |
| US20080021198A1 (en) | 2005-10-12 | 2008-01-24 | Yigong Shi | Modulators of protein phosphatase 2A and PP2A methyl esterase |
| GB0612542D0 (en) * | 2006-06-23 | 2006-08-02 | Novartis Ag | Combinations comprising staurosporines |
| US20090274682A1 (en) | 2008-02-05 | 2009-11-05 | The Trustees Of Princeton University | Demethylation and inactivation of protein phosphatase 2a |
| CN102307475A (zh) | 2009-02-04 | 2012-01-04 | 彼帕科学公司 | 用与生长因子抑制剂组合的parp抑制剂治疗肺癌 |
-
2011
- 2011-06-22 FI FI20115640A patent/FI20115640A0/fi not_active Application Discontinuation
-
2012
- 2012-06-15 US US14/128,342 patent/US9476050B2/en not_active Expired - Fee Related
- 2012-06-15 CN CN201280040838.2A patent/CN103781514A/zh active Pending
- 2012-06-15 EP EP12767025.5A patent/EP2723450B1/en not_active Not-in-force
- 2012-06-15 JP JP2014516405A patent/JP6001655B2/ja not_active Expired - Fee Related
- 2012-06-15 CA CA2839807A patent/CA2839807A1/en not_active Abandoned
- 2012-06-15 WO PCT/FI2012/050618 patent/WO2012175798A2/en active Application Filing
- 2012-06-15 DK DK12767025.5T patent/DK2723450T3/en active
Non-Patent Citations (1)
| Title |
|---|
| P.PUUSTINEN ET AL: "PME-1 Protects Extracellular Signal-Regulated Kinase Pathway Activity from Protein Phosphatase 2A-Mediated Inactivation in Human Malignant Glioma", 《CANCER RESEARCH》 * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2723450B1 (en) | 2016-05-18 |
| JP6001655B2 (ja) | 2016-10-05 |
| US20140135377A1 (en) | 2014-05-15 |
| EP2723450A2 (en) | 2014-04-30 |
| WO2012175798A2 (en) | 2012-12-27 |
| CA2839807A1 (en) | 2012-12-27 |
| US9476050B2 (en) | 2016-10-25 |
| WO2012175798A3 (en) | 2013-04-11 |
| JP2014523426A (ja) | 2014-09-11 |
| FI20115640A0 (fi) | 2011-06-22 |
| DK2723450T3 (en) | 2016-07-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20200000787A1 (en) | Medicament for treatment of liver cancer | |
| CN102575254B (zh) | 利用不对称双链rna特异性抑制kras的方法和组合物 | |
| JP6060164B2 (ja) | 過剰増殖性疾患、好ましくはp53機能欠損の治療に用いるためのCIP2Aサイレンシング剤を含む併用薬剤 | |
| TWI752927B (zh) | 具高活性及減低脫靶之siRNA構造 | |
| CN103781514A (zh) | 联合疗法 | |
| US10094834B2 (en) | Method of selecting individualized brain cancer therapy | |
| JP6393682B2 (ja) | 併用療法iii |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20140507 |