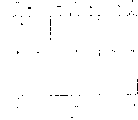CN100367548C - 新型碱性燃料电池 - Google Patents
新型碱性燃料电池 Download PDFInfo
- Publication number
- CN100367548C CN100367548C CNB018094007A CN01809400A CN100367548C CN 100367548 C CN100367548 C CN 100367548C CN B018094007 A CNB018094007 A CN B018094007A CN 01809400 A CN01809400 A CN 01809400A CN 100367548 C CN100367548 C CN 100367548C
- Authority
- CN
- China
- Prior art keywords
- fuel cell
- hydrogen
- anode
- alloy
- electrode
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M8/00—Fuel cells; Manufacture thereof
- H01M8/18—Regenerative fuel cells, e.g. redox flow batteries or secondary fuel cells
- H01M8/184—Regeneration by electrochemical means
- H01M8/186—Regeneration by electrochemical means by electrolytic decomposition of the electrolytic solution or the formed water product
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B60—VEHICLES IN GENERAL
- B60L—PROPULSION OF ELECTRICALLY-PROPELLED VEHICLES; SUPPLYING ELECTRIC POWER FOR AUXILIARY EQUIPMENT OF ELECTRICALLY-PROPELLED VEHICLES; ELECTRODYNAMIC BRAKE SYSTEMS FOR VEHICLES IN GENERAL; MAGNETIC SUSPENSION OR LEVITATION FOR VEHICLES; MONITORING OPERATING VARIABLES OF ELECTRICALLY-PROPELLED VEHICLES; ELECTRIC SAFETY DEVICES FOR ELECTRICALLY-PROPELLED VEHICLES
- B60L50/00—Electric propulsion with power supplied within the vehicle
- B60L50/50—Electric propulsion with power supplied within the vehicle using propulsion power supplied by batteries or fuel cells
- B60L50/70—Electric propulsion with power supplied within the vehicle using propulsion power supplied by batteries or fuel cells using power supplied by fuel cells
- B60L50/72—Constructional details of fuel cells specially adapted for electric vehicles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B60—VEHICLES IN GENERAL
- B60L—PROPULSION OF ELECTRICALLY-PROPELLED VEHICLES; SUPPLYING ELECTRIC POWER FOR AUXILIARY EQUIPMENT OF ELECTRICALLY-PROPELLED VEHICLES; ELECTRODYNAMIC BRAKE SYSTEMS FOR VEHICLES IN GENERAL; MAGNETIC SUSPENSION OR LEVITATION FOR VEHICLES; MONITORING OPERATING VARIABLES OF ELECTRICALLY-PROPELLED VEHICLES; ELECTRIC SAFETY DEVICES FOR ELECTRICALLY-PROPELLED VEHICLES
- B60L58/00—Methods or circuit arrangements for monitoring or controlling batteries or fuel cells, specially adapted for electric vehicles
- B60L58/30—Methods or circuit arrangements for monitoring or controlling batteries or fuel cells, specially adapted for electric vehicles for monitoring or controlling fuel cells
- B60L58/31—Methods or circuit arrangements for monitoring or controlling batteries or fuel cells, specially adapted for electric vehicles for monitoring or controlling fuel cells for starting of fuel cells
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B60—VEHICLES IN GENERAL
- B60L—PROPULSION OF ELECTRICALLY-PROPELLED VEHICLES; SUPPLYING ELECTRIC POWER FOR AUXILIARY EQUIPMENT OF ELECTRICALLY-PROPELLED VEHICLES; ELECTRODYNAMIC BRAKE SYSTEMS FOR VEHICLES IN GENERAL; MAGNETIC SUSPENSION OR LEVITATION FOR VEHICLES; MONITORING OPERATING VARIABLES OF ELECTRICALLY-PROPELLED VEHICLES; ELECTRIC SAFETY DEVICES FOR ELECTRICALLY-PROPELLED VEHICLES
- B60L7/00—Electrodynamic brake systems for vehicles in general
- B60L7/10—Dynamic electric regenerative braking
- B60L7/18—Controlling the braking effect
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B13/00—Oxygen; Ozone; Oxides or hydroxides in general
- C01B13/02—Preparation of oxygen
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B3/00—Hydrogen; Gaseous mixtures containing hydrogen; Separation of hydrogen from mixtures containing it; Purification of hydrogen
- C01B3/0005—Reversible uptake of hydrogen by an appropriate medium, i.e. based on physical or chemical sorption phenomena or on reversible chemical reactions, e.g. for hydrogen storage purposes ; Reversible gettering of hydrogen; Reversible uptake of hydrogen by electrodes
- C01B3/001—Reversible uptake of hydrogen by an appropriate medium, i.e. based on physical or chemical sorption phenomena or on reversible chemical reactions, e.g. for hydrogen storage purposes ; Reversible gettering of hydrogen; Reversible uptake of hydrogen by electrodes characterised by the uptaking medium; Treatment thereof
- C01B3/0031—Intermetallic compounds; Metal alloys; Treatment thereof
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/86—Inert electrodes with catalytic activity, e.g. for fuel cells
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/86—Inert electrodes with catalytic activity, e.g. for fuel cells
- H01M4/8605—Porous electrodes
- H01M4/8615—Bifunctional electrodes for rechargeable cells
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M8/00—Fuel cells; Manufacture thereof
- H01M8/08—Fuel cells with aqueous electrolytes
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B60—VEHICLES IN GENERAL
- B60L—PROPULSION OF ELECTRICALLY-PROPELLED VEHICLES; SUPPLYING ELECTRIC POWER FOR AUXILIARY EQUIPMENT OF ELECTRICALLY-PROPELLED VEHICLES; ELECTRODYNAMIC BRAKE SYSTEMS FOR VEHICLES IN GENERAL; MAGNETIC SUSPENSION OR LEVITATION FOR VEHICLES; MONITORING OPERATING VARIABLES OF ELECTRICALLY-PROPELLED VEHICLES; ELECTRIC SAFETY DEVICES FOR ELECTRICALLY-PROPELLED VEHICLES
- B60L2240/00—Control parameters of input or output; Target parameters
- B60L2240/10—Vehicle control parameters
- B60L2240/36—Temperature of vehicle components or parts
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/86—Inert electrodes with catalytic activity, e.g. for fuel cells
- H01M2004/8678—Inert electrodes with catalytic activity, e.g. for fuel cells characterised by the polarity
- H01M2004/8684—Negative electrodes
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/86—Inert electrodes with catalytic activity, e.g. for fuel cells
- H01M2004/8678—Inert electrodes with catalytic activity, e.g. for fuel cells characterised by the polarity
- H01M2004/8689—Positive electrodes
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M8/00—Fuel cells; Manufacture thereof
- H01M8/06—Combination of fuel cells with means for production of reactants or for treatment of residues
- H01M8/0606—Combination of fuel cells with means for production of reactants or for treatment of residues with means for production of gaseous reactants
- H01M8/065—Combination of fuel cells with means for production of reactants or for treatment of residues with means for production of gaseous reactants by dissolution of metals or alloys; by dehydriding metallic substances
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/30—Hydrogen technology
- Y02E60/32—Hydrogen storage
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/30—Hydrogen technology
- Y02E60/50—Fuel cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02T—CLIMATE CHANGE MITIGATION TECHNOLOGIES RELATED TO TRANSPORTATION
- Y02T90/00—Enabling technologies or technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02T90/40—Application of hydrogen technology to transportation, e.g. using fuel cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S420/00—Alloys or metallic compositions
- Y10S420/90—Hydrogen storage
Landscapes
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Sustainable Development (AREA)
- Sustainable Energy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Power Engineering (AREA)
- Mechanical Engineering (AREA)
- Transportation (AREA)
- Manufacturing & Machinery (AREA)
- Inorganic Chemistry (AREA)
- Combustion & Propulsion (AREA)
- Fuel Cell (AREA)
- Inert Electrodes (AREA)
Abstract
一种燃料电池(7),它具有立刻启动的能力和通过反向操作作为电解装置可以接受回收的能量,如再生制动的能量。立刻启动燃料电池(7)的效率增加和供电能力(更高的电压和电流)提高并显著地扩大操作温度范围到约-20到150℃。
Description
技术领域
本发明涉及燃料电池特别是Ovonic立刻启动碱性燃料电池。本燃料电池应用的电极解决了在现代燃料电池技术中存在的主要障碍,采用的材料不含昂贵的贵金属并可操作在环境温度下。特别是,本发明的立刻启动燃料电池所含的阳极是由氢存储材料构成。氢存储材料不仅储存氢,而且对从分子氢形成原子氢有优良的催化活性,还对以氢离子和羟离子生成水具有优良的催化活性。除了具有杰出的催化剂能力之外,该材料还对燃料电池的碱性电解液具有上等的耐腐蚀性。这些特点独特地允许本燃料电池可立刻启动,可用于很大的温度范围内(-20到150℃),和在反向操作成电解装置时可接受回收的能量,所以,消除对外部加热元件或电池组的需要。以这种方式,本发明者已经提供新一代的燃料电池,该电池纠正了从燃料电池诞生以来已经困扰该技术多年的问题。
背景技术
本申请第一次公开的燃料电池克服了广泛应用这种燃料电池的主要阻碍。即,本发明者已经解决了在现代燃料电池技术中存在的主要障碍,在其电极中采用的材料不含昂贵的贵金属。这些障碍包括:氢存储容量、必需的催化活性、离子的导电性、耐腐蚀性、和增加对不同气体毒化效应的阻力。此外,这些材料必须是低成本、不含贵金属,从而可以普遍地使用燃料电池。在燃料电池中的阳极具有固有的催化剂特性和氢存储容量(允许立刻启动),使用不含贵金属的活性材料。该燃料电池能立刻启动和能存储从如再生制动的过程中回收的能量。该材料是耐用和抗毒化的。通过已证明的低成本的生产技术,如现在应用在生产Ovonic Ni-MH蓄电池生产中的那些技术,很容易生产该电极。从阳极中去除了碳,在先有技术中碳倾向于被氧化成二氧化碳,所以有助于消除碳酸对燃料电池电解液的毒化。阳极的氢存储材料是足够致密以便阻断二氧化碳从氢燃料流进入到电解液,但允许氢气通过,作用如氢气泵。本燃料电池具有提高的效率和增加了供电能力(更高的电压和电流)并显著扩大操作温度的范围(从-20℃到150℃)。
本发明的燃料电池系统允许在能量生产/消费市场的所有领域广泛使用燃料电池,从而进一步促进氢为基础的经济结构的实现。Ovshinsky等人在1999年11月22日提交的、题目为“氢为基础的经济系统”的美国专利申请系统号No.09/444,810(′810申请)中公开了这种氢为基础的经济结构的基础设施,将该申请插入这里作为参考。通过已经克服了至今认为不能解决的化学、物理、电子和催化障碍的氢存储合金,依次使这种基础设施成为可能。这些合金全部描述在Ovshinsky等人在1999年11月6日提交的、题目为“使氢为基础的经济系统成为可能的高存储容量的合金”的共同待审的美国专利申请系列号No09/435,497(′497申请)中,将该申请插入这里代为参考。
随着世界人口的不断增加和世界经济的增长,二氧化碳的大气浓度使地球变暖造成气候变化。但是,全球的能量系统正不断减少使用富含碳的燃料,因为它的燃烧产生有害的气体。专家们说,到下个世纪末大气的二氧化碳含量可能是工业化时代以前的两倍,但是他们还说若不趋向用低碳燃料二氧化碳含量可能还要更高,对这种燃料已经探索了100多年。还有,矿物燃料造成污染并是国家之间战略军事斗争的起因。另外,波动的能量成本是世界范围内经济不稳定的根源。
在美国,据估计每单位经济生产量所形成的碳量,由于不断采用低碳燃料并结合提高能效率1950年以来已经减小了约一半。所以,能量系统的去碳化是最近20年以来该系统分析中所出现的单一最重要的因素。已经有人预言这种发展到21世纪末将产生无碳的能量系统。本发明是将这个时期缩短到数年左右的关键性的另一个成果。用接近的话说,氢气将用在汽车、卡车和工厂燃料电池中,就象它已经为轨道上的宇宙飞船提供动力一样。但是,由于解决了存储和基础设施问题(见′810和′497号申请),还将提供氢气作为通用的无碳燃料,以便满足所有燃料需要。
现在已经发生了明显的转变,目前都已认识到全球变暖和气候改变的问题并进行多种努力来解决它。因此,某些世界上最大的石油公司现在表明他们想帮助解决这些问题确实是令人鼓舞的。许多美国的公用事业公司许诺要拿出办法来减小他们的发电厂对大气造成的损害。杜邦,世界上最大的化学公司,甚至宣布他将自愿削减他的温室气体的排放,在十年减到1990年他们排放水平的35%。汽车工业是温室气体和其他污染物排放的主要肇事者(不管车辆专门减小了排放),现在已经实现了必需的转变,通过他们的电动和混合型车辆得到证明。
氢是“最终的燃料”。事实上认为它是未来的“特种”燃料。氢是宇宙中最丰富的元素(超过95%)。氢可以为我们的星球提供消耗不尽的干净能源,可以有各种方法生产出氢。应用课题发明人的发明,氢可以以固体状态储存和在卡车、火车、轮船、驳船等进行运输(见′810和′497号申请)。
燃料电池是能量转换装置,该装置直接将供给的气体的能量转换成电能。研究者已经积极研究燃料电池以便应用燃料电池的潜在的很高的能量产出效率。燃料电池的基本单元是有阳极、阴极、和合适的电解液的电池。燃料电池有许多可能的应用,如为运输的车辆提供动力、代替蒸汽透平和各种类型的供给电力的应用。尽管它们看起来简单,有许多问题妨碍燃料电池的广泛使用。
目前大多数燃料电池研究和开发部门都把精力集中在P.E.M(质子交换薄膜)燃料电池上。该P.E.M燃料电池有转换效率转低的缺点和许多其他的不足。例如,系统的电解液是酸性的。所以,只能用贵金属催化剂作为系统电极的活性材料。不幸的是,贵金属不仅昂贵,而且还对许多气体的毒化很敏感,特别是一氧化碳(CO)。还有由于P.E.M燃料电池的酸性特性,构造燃料电池的其余材料需要与这样的环境相容,这又增加了它的成本。质子交换薄膜本身是相当贵的,并且由于在温度低于80℃时它的低导电性,固有地限制了P.E.M燃料电池的动力性能和操作温度范围(在低温时PEM几乎不起作用,不象本发明的燃料电池)。还有薄膜对高温很敏感,在120℃时开始软化。薄膜的导电性依赖于水,在高温时水份干燥,从而使电池失效。因此,P.E.M燃料电池有许多缺点,这使它在工业/消费的使用中有关不合需要。
常规的碱性燃料电源比P.E.M燃料电池具有某些优点,它们有较高的操作效率,它们使用不太贵重的结构材料,和它们的不需要昂贵的薄膜。碱性电池在电解液中还有相对较高的离子导电性,因此它有相当高的供电能力。虽然常规的碱性燃料电池比P.E.M燃料电池对温度的敏感低,但常规的碱性燃料电池电极的铂活性材料在低温时变得效率极差。不幸的是,常规的碱性燃料电池还是有某些缺点。例如,常规的碱性燃料电池在两个电极中还是使用昂贵的贵金属催化剂,与在P.E.M燃料电池一样,它们对气体污染物的毒化很敏感。常规的碱性燃料电池还对由阳极碳基质氧化产生的或通过在电极上使用的燃料和空气中的杂质引入的CO2形成的碳酸很敏感。这种碳酸组分粘附在电解液/电极表面以而减小/消除了它们的活性。这里描述的发明从阳极根除了这个问题。
燃料电池象蓄电池一样通过电化学反应进行操作。但不象蓄电池将化学能储存在电池内,燃料电池通常以电池的外部供给反应剂。除电极失效外,只要供应燃料,最好是氢气和氧化剂,氧化剂一般是空气或氧气,并除去反应产物,电池就可连续操作。
燃料电池提供比内燃机或发电机系统更好的许多重要优点。这些优点包括相对较高的效率、环境清洁的操作特别是当采用氢作为燃料、高的可靠性、几乎没有运动部件、和安静的操作。燃料电池可能比其他常规的根据卡诺(Carnot)循环的动力源更加有效。
一般燃料电池的主要组件是用于氢氧化的阳极和用于氧还原的阴极,两电极都放在包含电解液(如碱性的电解溶液)的电池中。一般,反应剂如氢气和氧气分别通过多孔的阳极和阴极供给,并进入到表面上与电解液接触。阴极和阳极使用的特殊的材料是很重要的,因为它们对发生的反应必须为有效的催化剂。
在碱性燃料电池中,在阳极氢燃料和存在于电解液中的羟离子(OH-)之间发生反应,反应生成水和释放出电子:
H2+2OH-→2H2O+2e-.
在阴极,氧气、水和电子在阴极催化剂存在下发生反应,使氧还原并形成羟离子(OH-):
O2+2H2O+4e-→4OH-.
利用电子的流动为从外部连接在阳极和阴极的负荷提供电能。
应该注意到,要求碱性燃料电池的阴极催化剂比催化H+离子与OH-离子反应生成水要做得更多。开始时阳极必须催化和加速从H2形成H+和电子。这通过从分子氢分解成原子氢产生。整个反应可以看成为(式中M是催化剂):
M+H2→2MH→M+2H++2e-.
所以阳极催化剂必须不仅在电解液界面处有效地催化水的生成,而且还必须有效地将分子氢分解成离子氢。使用常规的阳极材料,分解的氢是不稳定的,如果不是在氧化反应中很快地使用它们那么氢原子可以很容易重新组合形成氢气。用本发明立刻启动的燃料电池的氢存储阳极材料,只要氢一产生就以氢化物的形式被捕获,然后当需要提供动力时使用它们。
除了在两个界面上有催化效率之外,催化材料必须耐碱性电解液的腐蚀。没有这样的抗腐蚀性,电极将很快毁于严酷的环境和电池将很快失效并毁坏。
一种先有技术的燃料电池阳极催化剂是铂。铂尽管有良好的催化特性,但并不适合在大范围的工业应用中作为燃料电池阳极的催化剂,因为它非常昂贵。还有,象铂这样的贵金属催化剂也不能承受通常氢燃料流中所含杂质的污染。这些杂质可以包括可能存在于氢燃料中的一氧化碳或包含在电解液中的杂质,如通常包含在未处理水中的杂质,包括钙、镁、铁和铜。
上述的污染物可以引起普通称为“毒化”的效应。在发生毒化的地方由必定包含在燃料电池中的毒化物质使材料的催化活性点变黑和失去活性。一旦催化活性点失去活性,它们就不再作为在阳极处有效的氢氧化反应的催化剂。由于可使用的催化活性点的总数被毒化显著地降低,所以阳极的催化效率减小。此外,催化活性减小造成阳极处的过电压增加,因此操作成本显著增加电池的效率更低。过电压是电极电势和它的平衡值之差,过电压的物理意义是克服电阻以便使电流通过阳极表面(电荷传送阻力)所需的电压。过电压代表不希望的能量损失,它增加燃料电池的操作成本。
在相关的文献中,美国专利4,623,597号(′597号申请)和它系统中的其他专利,将它们的公开内容插入这里作为参考,本发明者中一个,Stanford R.Ovshinsky,第一次描述了在电化学电池中用作负电极的无序多组分氢存储材料。在这个专利中,Ovshinsky描述可以怎样设计制造(即原子建造)无序材料来大大增加氢存储和可转换的特性。这样的无序材料是无定形的、微晶状的、中间范围有序的、和/或多晶体的(无大范围的组成有序),其中多晶体材料包括拓扑的、组成的、平移的、和位置的改性和无序。这些无序材料的活性材料的框架包括一个或几个元素的主基体和插入到这个主基体中的改性物。改性物提高所得材料的无序性,所以产生更大数目和范围的催化活性点和氢存储点。
′597号专利的无序电极材料是通过任意数目的技术由重量轻、便宜的元素组成。它保证形成的主要非平衡亚稳态相产生高能量和功率密度和低成本。得到的低成本、高能量密度无序材料允许电池用作二次电池最有利,但也可用作主电池。
′597号专利的材料其局部结构和化学有序的设计对获得所需的特性是极其重要的。通过将选择的改性元素插入到主基体来控制局部的化学有序因而局部的结构有序来产生所需的无序材料,从而达到′597号专利的阳极的改进特性。无序允许材料内的多种自由度,包括类型的和数量的两方面,这些自由度在常规材料中是不具备的。这些自由度极大地改变了材料的物理、结构、化学和电子环境。′597号专利的无序材料有所需的电子构形,该构形产生大量的活性点。存储点的特性和数目的设计独立于催化活性点。
多轨道的改性物,例如过渡元素,产生存储点数目更大的增加,这是由于存在不同的连接构形,从而获得能量密度的增加。改性技术特别提供非平衡材料,该材料具有变化的无序程度形成独特的连接构形、轨道重叠和连接点的范围。由于不同程序的轨道重叠和无序结构,在充电/放电周期或之间的静止时期内结构重排列的量明显降低形成长的使用周期和货架寿命。
′597号专利的改进电池包括电极材料,该材料具有设计制造的局部化学环境,设计该环境以便产生高的电化学充电和放电效率以及高的电荷输出。通过采用一种主基体,它可以是按照′597号专利用其他元素改性的,以便极大增加电-催化活性点和氢存储点密度,这样就使材料的局部化学环境的控制成为可能。
设计′597号专利的无序材料使其具有不寻常的电子构形,它是由改变组分原子和它们各个轨道的3维互相作用而产生的。无序来自原子的组成、位置和平移的关系。采用所选择的元素,通过它们与这些轨道的互相作用进一步改进无序以便产生所需的局部化学环境。
由这些构形产生的内部拓扑结构还允许原子和离子选择性扩散。在′597号专利中描述的发明使这些材料对特殊的用途比较理想,因为人们可以独立地控制催化活性和存储点的类型和数量。所有上述的特性使得材料不仅具有量上的差别,而且在质上产生变化,从而结构得到独特的新材料。
无序可以是形成在材料的整个主体或不同的区域内以组成或构形无序形式的原子特性。还可以通过在材料内造成各微观相引入无序,这是借助一相与另一相的关系模拟在原子水平上组成或构形的无序。例如,通过引入不同类型结晶相的微观区域,或通过引入一个或多个无定形相的区域,或通过除了结晶相区域之外引入无定形相区域,可以产生无序材料。在这些不同相之间的界面可以提供富有局部化学环境的表面,该局部化学环境为电化学的氢存储提供许多所需的点。
这些相同的原理可以应用到单一结构相中。例如,应用Ovshinsky在原子或微观级的无序原理将组成无序引入到材料中,可以用计划的方式从根本上改变该材料以便获得重要的改进和独特的结果。
直到目前为止除了Ovshinsky(在美国专利4,487,818号中,将它的内容插入这里作为参考)没有任何人已经应用原子建造工程的Ovshinsky原理来设计材料,使它在燃料电池技术中是独特的和极其先进的。特别是,对材料有一种要求,该材料能允许燃料电池操作在很宽的温度范围内,这样的燃料电池将可以在日常的消费应用中出现。对材料还有另一种要求,该材料能允许燃料电池反向运行可作为电解装置以便使用/储存回收的能量。最后该技术对材料还有一种要求,该材料通过提供燃料的内源允许燃料电池瞬时启动。所需材料的一种是不贵的氢存储阳极材料,它对分子氢分解和由氢离子和羟离子生成水具有高度的催化性,以及耐电解液的腐蚀、耐反应剂物流中污染物的毒化和能工作在很宽的温度范围内。还需一种与本发明的氢存储材料一起使用的非贵金属的金属催化剂材料,以便促进氢的分解和氢的氧化。
发明内容
本发明的目的是提供一种燃料电池,它具有立刻启动的能力和在反向操作作为电解装置时可以接受回收的能量如再生制动的能量。立刻启动的燃料电池效率提高和电力有效性增加(更高的电压和电流)以及显著地扩大操作的温度范围(-20到150℃)。该燃料电池采用有氢存储容量的阳极活性材料。阳极活性材料是一种氢存储合金,它对分子氢形成原子氢具有优良的催化活性,对由氢离子和羟离子合成水具有杰出的催化活性,以及对碱性燃料电池的碱性电解液有突出的耐腐蚀性。该阳极活性材料还是低成本的,不包含贵金属。该材料是耐用的和抗毒化的。通过已证明是低成本的生产技术很容易生产电极。阳极取消了在其中使用碳,这样有助于消除碳酸对燃料电池的毒化。
用于立刻启动燃料电池中的阳极活性氢存储合金可逆地吸收和释放氢并具有快速的氢化反应速率和很长的使用寿命。氢存储合金优选地是从稀土/混合稀土合金、锆合金、钛合金和它们的混合物或合金中选择。优选的氢存储合金包含分布在其颗粒整个氧化表面的加浓的催化剂镍区域。催化剂镍区域的直径为50-70埃,并大约在2-300埃范围内变化(优选的在50-100埃)。这样一种合金的例子具有下述的组分:
(基础合金)aCobMncFedSne:
式中基础合金包括0.1到60原子百分比的Ti、0.1到40原子百分比的Zr、0到60原子百分比的V、0.1到57原子百分比的Ni、和0到56原子百分比的Cr;b是0到7.5原子百分比;c是13到17原子百分比;d是0到3.5原子百分比;e是0到1.5原子百分比;和a+b+c+d+e=100原子百分比。
附图说明
图1是用于本发明燃料电池的燃料电极阳极的特殊示意说明图;
图2是本发明立刻启动碱性燃料电池的特殊示意说明图;
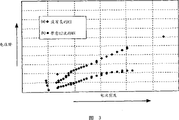
图3是使用氢存储活性材料的燃料电池的电势降(ΔV)对电流的曲线图,特别表示出在立刻启动模式下没有氢气流(曲线a)和在正常操作模式下氢气流动时(曲线b)的性能;和
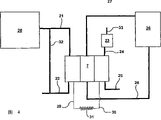
图4是装有本发明立刻启动碱性燃料电池的能量供应系统的特殊示意说明图。
具体实施方式
本发明总体上涉及立刻启动燃料电池和特别是涉及Ovonic立刻启动碱性燃料电池。该燃料电池有内在的氢储备(在存储的阳极内)用于立刻启动(在下面讨论),并有能力通过作为电解装置(在下面讨论)接受再生制动的能量。该燃料电池与先有技术的常规燃料电池比较效率提高和供电能力增加,同时明显地增加电池的操作温度范围(-20到150℃)。该燃料电池容易装配并具有采用已证明是低成本的生产技术的优点。
本发明还涉及燃料电极的阳极和阴极,以及装有本燃料电池的能量供应系统。燃料电池阳极包括具有固有的催化活性和氢存储容量的材料。阴极和阳极材料不包括任何贵金属,因此本来就是低成本的。阴极和阳极材料耐用且寿命长,并耐毒化。阳极不使用先有技术的碳基质。虽然下面详细讨论了本电极和描述它们在碱性燃料电池中的应用,但应该注意本发明的概念可以应用到其他类型的燃料电池。
图1是燃料电池存储阳极1的特殊示意说明图。阳极体包括疏水组分2(如聚四氟乙烯(PTFE)),氢存储阳极活性材料组分3。尽管图1表示疏水组分2和活性电极材料组分3是作为阳极1内分离的材料层,但它们也可紧密地混合成单一的材料。阳极1,也包括基质组分4,它起码作为电流收集器,但也可提供支承作用。下面将讨论这种基质组分。
阳极1有两个表面5,6。一个表面5在插入到燃料电池中时邻近反应剂(即:氢气和氧气)入口机构,而另一个表面6邻近水状的碱性电解液。如上所述,疏水组分(PTFE)2或者是阳极内的一层,或者是与阳极材料3紧密混合的。在任一种情况下,疏水材料(PTFE)的作用是作为水的阻挡层,防止水从燃料电池的水状碱性电解液中逃逸,而同时允许氢气从它的供应源通到电极材料。所以,阳极的一部分,表面6(和从表面略为向内的材料)是与电解液接触,其作用是氧化氢(提供电子),而阳极材料的其余部分(包括表面5)提供用于分子氢的分解和存储分解的氢用于稍后在表面6的氧化。
本发明的阳极活性材料3是氢存储材料和辅助的催化剂材料的复合物。优选的氢存储合金是不管氢的存储容量而能可逆地吸收和释放氢的氢存储合金,并有快速氢化反应速率、在电解液中良好的稳定性和使用寿命长等特性。应该注意,氢存储容量意味着该材料是以稳定的形式存储氢,是高于微量的某种非零量。优选的材料将能存储约0.1%重量的氢或更多。优选地该合金包括稀土/混合稀土合金、锆和/或钛合金或它们的混合物。阳极材料甚至可以这样成层,使氢输入表面5上的材料是由经过特殊设计对分子氢分解成原子氢有高度催化性的材料构成,同时设计在电解液界面上的表面6的材料对由氢和羟离子生成水有高度的催化性。
本发明者已经发现某些氢存储材料作为碱性燃料电池阳极材料是极其有用的。有用的氢存储合金对分子氢生成氢离子具有优良的催化活性,还对由氢离子和羟离子生成水具有优秀的催化活性。除了突出的催化能力之外,该材料还具有对燃料电池的碱性电解液突出的耐腐蚀性。在使用中,合金材料作为1)整个阳极的主体内分子氢的分解催化剂;2)水生成催化剂,在阳极的表面6处由氢和羟离子(从水状的碱性电解液来)生成水;3)内部氢存储的过渡层以便确保在表面6总是有氢离子的及时供应(这种能力在燃料电池启动和再生能量回收时都是有用的,下面将进行讨论)。
用作阳极材料的特殊合金是含有分布在整个氢化物界面上直径为50-70埃的加浓催化剂镍区域的合金,区域到区域的变化为2-300埃左右,优选地为50-100埃。由于这些镍区域,该材料表现出明显的催化作用和导电性。在′591号专利的合金中Ni区域的密度形成具有加浓的Ni表面的粉末颗粒。具有加浓Ni区域的最优选的合金是有下述组合的合金:
(基础合金)aCobMncFedSne
式中基础合金包括0.1到60原子百分比的Ti、0.1到40原子百分比的Zr、0到60原子百分比的V、0.1到57原子百分比的Ni、和0到56原子百分比的Cr;b是0到7.5原子百分比;c是13到17原子百分比;d是0到3.5原子百分比;e是0到1.5原子百分比;和a+b+c+d+e=100原子百分比。
基质组分4作用如导电体并也可作为支承机构。例如,如果将粉末状的导电材料,如镍、镍合金、铜、铜合金或碳混合成活性材料3,那么就将该材料作为导电材料,但它不能提供对电极材料本身任何的支承。
基质组分作为导电体和支承结构两者是优选的。通过将活性材料压缩到多孔金属基质中可以构成电极。通过增加电极的多孔金属基质的导电性可以增加电极的导电性。通常多孔金属基质包括但不局限于,网、格、冰铜(matte)、箔、泡沫、板和金属网。优选地用作电极的多孔金属基质是网、格、泡沫、或金属网。基质可由任何材料构成,它是导电性的并耐电解液的腐蚀或化学侵蚀。镍或镍合金是非常好的材料,但对高功率应用来说它可能会电阻太大。所以当需要高功率时,基质由铜、镀铜的镍、或铜镍合金构成,如在美国专利5,856,047号(Venkatesan等人)和5,851,698号(Reichman等人)提出的那样,它们的公开内容插入这里作为参考。如这里所用的,“铜”指的是纯铜或铜合金,和“镍”指的是纯镍或镍合金。使用铜构成电极的多孔金属基质具有几个重要的优点。铜是优良的导电体。所以用它作为基质材料减少了阳极的电阻。这也减小了燃料电池因内部消耗而浪费的功率,从而使燃料电池的输出功率增加。铜还是有延展性的金属。增加基质的可延展性允许基质更可靠地保持压缩到基质表面上的活性氢存储材料。这减小了在活性材料已经压缩到基质上之后烧结电极的需要,从而简化阳极制造过程和降低了成本。
阴极含有活性材料组分,该组分对分子氧分解成原子氧是催化剂,对由水和氧离子形成羟离子(OH-)也是催化剂,并耐电解液的腐蚀和抗毒化。在阴极的活性材料中,其主基体包括至少一个过渡金属元素,它通过结合入至少一个改性元素进行结构改性以便提高它的催化特性。这样的材料公开在1984年2月7日出版的Ovshinsky等人的美国专利4,430,391(′391)号中,它的公开内容插入这里作为参考。这样的催化剂体是以无序的非平衡材料为基础,该材料设计具有高密度的催化活性点、耐毒化和有长的操作寿命。改性元素,如La、Al、K、Cs、Na、Li、C和O结构上改造主基体的局部化学环境,主基体包括一个或几个如Mn、Co和Ni的过渡无素以便构成阴极的催化剂材料。这些低过电压的催化剂材料增加采用它们的燃料电池的操作效率。
阴极的构成和常规的使用铂催化剂的阴极相同,只是用上述的无贵金属催化剂代替铂。将无贵金属催化剂很细地分配和分散到整个多孔的碳冰铜状材料上。按照需要该材料可以有或者可以没有导电的基质,如果使用,基质可以是如上述的那样。
当本燃料电池作为电解装置反向运行时,在能量回收过程如再生制动中、水被电解成氢和氧。也就是说,当电动汽车在市内使用停和走的模式时,再生制动系统可以回收动能,并把它转换成电能。在这种模式,电动机颠倒它们的作用而变成发电机应用运动的动能发电。这造成电流脉冲,其数量为正常操作负荷的约10%。常规的燃料电池(碱性或PEM)不能接受这样的浪涌。这种能量的反馈将造成氢气和氧气很快的析出。这将使催化剂失去它们的完整性和粘着性,从而逐渐损害整个系统的性能。
在本发明的燃料电池中,这将不是个问题,因为氢存储阳极将吸收浪涌的电流,并用生产的氢充电。但是,氧气还原电极将析出氧气。虽然用Ovonic无贵金属催化剂电极将使问题减轻,但无论如何问题是存在的。可以采用解决这个问题的两个可替换的办法以便减轻这个问题。第一个解决办法是装设与阴极平行的第三电极,它将吸收电流浪涌,无伤害地析出氧。这个电极将需要大的表面面积,但不一定需要是多孔的。由于第三电极是析出氧气的电极,就不再忧虑在燃料电池氧气电极中碳冰铜的氧化。第二种选择方案是在阴极的电流收集器或基质的边缘或框架上装设Ovonic氧气析出催化剂涂层。这种催化剂当与用于氧气析出的无贵金属含碳基质比较时,将具有更有利的氧气过电压。因此当有电流浪涌时,氧气析出将优先发生在催化剂涂复的框架上,所以节省由于析出氧气而减损的氧气还原(阴极)电极。还可以设计制造氧气还原催化剂不是氧气析出催化剂。
应该注意本发明的阳极和阴极活性材料是非常抗毒化的。这是事实,因为这些材料增加的催化活性点数目不仅提高了催化剂活性,而且能使材料更加耐毒化,因为用本发明的材料,一定数量的催化活性点可以牺牲在毒化物质的效应里,而大量的没有毒化的点仍保持活性从而提高了所需的催化作用。还有某些毒素由于被连接到其他点而失去活性因此不会影响到活性点。
图2是结合入本发明电极1(“a”代表阳极和“c”代表阴极)的碱性燃料电池7的特殊示意说明图。燃料电池7包括三个通用段:1)阳极段,它包括阳极1a和氢气供应室8;2)电解液室11;和3)阴极段,它包括阴极1c和氧气(空气)供应室10。
在阳极段,氢气或含有氢气的气体混合物在压力下通过氢气入口12供应到氢气供应室8。然后氢气通过表面5a被吸收到阳极1a中。吸收的氢气被阳极活性材料催化分裂成原子氢,原子氢以氢化物的形式储存在氢存储材料中,接着在表面6a处最后与羟离子反应生成水。应该注意形成氢化物的热是帮助把燃料电池加热到它的最佳操作温度。供应的氢气中任何没有吸收的氢气和其他污染物气体或水蒸汽通过出口13放出。如果放出的气体中有足够的氢气保证回收的话可以使其循环使用。另外,如果需要可以用氢气为其他组分提供热源,如氢化物床氢气存储箱。
电解液室11保持(在这个特定例子中)水状的碱性电解液与阳极1a和阴极1c紧密接触。在先有技术中众所周知的碱性溶液,通常是氢氧化钾溶液。电解液提供在阳极1a的表面6a处与氢离子发生反应的羟离子,和在阴极1c的表面6c处与氧离子发生反应的水分子。该电解液是通过入口14和出口15穿过室11循环的(在另一个实施例中,电解液可以通过成胶质状有意使其不动)。如果需要,循环的电解液可以在外部加热或冷却,和如果需要可以调节电解液的浓度(如通过毛细效应等等)以补偿由电池生成的水和水通过电极蒸发而造成的任何损失。调节燃料电池电解液的系统在先有技术中是普通知道的,不需在这里进一步地描述。
在阴极段,通过氧气入口18将氧气、空气、或某些其他含氧气的气体混合物供应到氧气供应室10。然后氧气通过表面5c被吸收到阴极1c中。吸收的氧气被阴极活性材料催化分裂成离子氧,离子氧在表面6c处最终与水分子反应生成羟离子。在原料中任何没有被吸收的氧气和其他气体(如氮气、二氧化碳等)或在氧气供给中的水蒸汽通过出口19放出。
实例
进行实验来证明使用金属氢化物存储材料作为碱性燃料电池中阳极活性材料的基础概念。这个实验并不打算获得定量的数据而是表示材料的作用如预测的那样。为这个目的应用一套简单的实验室规模的装置。装配燃料电池,采用商业上有售的铂基空气电极和用MF139.12合金(标称组分的原子百分比为:9.0%Ti、5.0%V、26.2%Zr、38.0%Ni、3.5%Cr、15.6%Mn、0.8%Sn、1.5%Co、和0.4%Al)预先腐蚀的负电极(镍、金属网基质)。阳极和阴极由分隔器(无纺聚丙烯冰铜,表面用亲水材料接枝,密度30g/m2)分离,泡在KOH电解液中(30%重量的KOH、1.5%重量的LiOH的水状溶液),并最终放入到试验电池中。
在有和没有附加的氢气流进入阳极的两种情况下进行试验。首先用氢气对阳极(金属氢化物电极)充电并把空气供给阴极。一旦达到稳态的开路电势,采用电源迫使电池以固定的电流放电。采用标准的Hg/Hg0参考电极测量阳极和阴极的电池电势和半电池电势。在每种情况下一旦达到稳态电势,改变放电电流并重新继续测量。在很宽的范围内改变放电电流并重复该过程。
首先进行没有附加氢气流的这些测量,然后进行有附加氢气流的测量。对每个电流改变(ΔI)测量电势降(ΔV)或极化并将数值画成图。这种电势降是包含的全部极化因素的作用之和。通过保持大多数参数为常数,可以得到有和没有附加氢气流的电极性能的相对差。
图3表示电势降(ΔV)对电流的关系。即使没有氢气流(曲线a),氢化物电极能够保持明显的放电电流,因为它已经充电。在这个模式,燃料电池证明它的固有氢存储容量,所以形成立刻启动的燃料电池。当放电电流增加时极化增加,因为氢化物电极逐渐消耗尽氢。相反在氢气流动时(曲线b),极化较低,因为有连续的气态氢供应被变换成金属氢化物给燃料电池供能。极化值还会达到一个稳态值,这是因为电化学氢消耗的速率与气相中气态氢分解的速率相匹配(即正常的燃料电池操作模式)。
图4是装有本发明的碱性燃料电池7的能量供应系统的特殊示意说明图。能量供应系统还包括氢供应源20。该氢源可以是任何已知类型的,如氢化物床存储系统、压缩氢的存储容器、液态氢存储容器、或碳氢燃料重整装置。优选的氢源是金属氢化物存储系统。从氢源20来的氢气经过输入管线21输送到燃料电池7,和多余的气体经过输出管线22放空。一部分从输出管线22来的气体可以通过循环管线32再循环到输入管线21。能量供应系统还包括氧供应源,从经济的理由考虑它最好是空气。将空气抽入到管线33,然后可以使其通过二氧化碳洗涤器23。接着通过输入管线24将空气输送到燃料电池7。多余的空气和无用的气体通过输出管线25放空。因为这个气体流不包含有害气体,所以它可以直接放空到大气环境中。
能量供应系统还包括电解液循环系统。从输出管线28将来自燃料电池7的电解液排出并把它送到电解液调节装置26。如果需要,电解液调节装置26加热或冷却电解液和按照需要除去/加上水分。然后将调整过的电解液经过输入管线27送回到燃料电池7。
最后能量供应系统包括电引线29和30,它们将电从燃料电池7供给负荷31。负荷可以是任何需要电力的装置,特别打算应用于汽车的动力和驱动系统。
本燃料电池和装有它的能量供应系统特别适合这样的应用,在这些应用中需要立刻启动和能量回收,例如向车辆供电的系统。例如在消费者使用车辆时,有本发明的内在氢存储的燃料电池具有能从存储在它的电极中的氢立刻开始生产能量的优点。所以,没有等待从外部氢源供应氢气的滞后时间,另外,由于氢可以被吸收和存储在燃料电池的阳极材料中,也可以获得能量的回收。因此,可以进行的再生制动等活动,无需燃料电池外部的电池组,因为任何由反向运行燃料电池产生的氢将被存储在燃料电池的电极中。因此本质上应用本氢存储材料的燃料电池等价于与电池组结合的燃料电池。
这个说明书的附图、讨论、描述、和实例仅是为了说明本发明的特定实施例,而不是对它实践的限制。附录的权利要求书,包括所有等价条款,限定本发明的范畴。
Claims (22)
1.一种燃料电池,所述燃料电池有阳极,阳极包括:
气态氢源;
具有氢存储容量的阳极活性材料;
所述阳性活性材料有气态氢接触表面,电解液接触表面,以及设置在所述气态氢接触表面和所述电解液接触表面之间的所述阳极活性材料的主体;
用于将所述气态氢输送到所述阳性活性材料的所述气态氢接触表面的装置;
所述气态氢接触表面适合分解和吸收所述气态氢;所述阳极活性材料的所述主体适合存储所述吸收的氢;
所述电解液接触表面适合使所述存储的氢与电解溶液发生反应。
2.如权利要求1所述的燃料电池,其特征在于,所述阳极另外还包括基质组分,该组分提供导电性和机械支承两者,并包括导电的网、格、泡沫、冰铜、箔、板或金属网。
3.如权利要求1所述的燃料电池,其特征在于,所述氢存储容量为所述燃料电池提供瞬时启动能力。
4.如权利要求1所述的燃料电池,其特征在于,所述氢存储容量给所述燃料电池提供能力,以便通过反向运行作为电解装置接受回收能量。
5.如权利要求1所述的燃料电池,其特征在于,所述氢存储容量通过其氢化物的生成热给所述燃料电池提供热能。
6.如权利要求1所述的燃料电池,其特征在于,所述阳极活性材料是不包括贵金属催化剂的氢存储合金。
7.如权利要求6所述的燃料电池,其特征在于,所述阳极活性材料耐毒化。
8.如权利要求6所述的燃料电池,其特征在于,所述氢存储合金选自稀土/混合稀土合金、锆合金、钛合金和其合金的混合物。
9.如权利要求8所述的燃料电池,其特征在于,所述氢存储合金具有如下组合:
(基础合金)aCobMncFedSne
式中基础合金包括0.1到60原子百分比的Ti、0.1到40原子百分比的Zr、0到60原子百分比的V、0.1到57原子百分比的Ni、和0到56原子百分比的Cr;b是0到7.5原子百分比;c是13到17原子百分比;d是0到3.5原子百分比;e是0到1.5原子百分比;和a+b+c+d+e=100原子百分比。
10.如权利要求1所述的燃料电池,其特征在于,所述燃料电池还包括含有疏水组分的阳极。
11.如权利要求10所述的燃料电池,其特征在于,所述疏水组分是聚四氟乙烯(PTFE)。
12.如权利要求11所述的燃料电池,其特征在于,所述PTFE与所述氢存储合金紧密混合。
13.如权利要求11所述的燃料电池,其特征在于,所述PTFE是在所述阳极内的一层。
14.如权利要求1所述的燃料电池,其特征在于,所述阳极另外还包括一组分,该组分提供导电性和包括与所述氢存储材料紧密混合的导电粉末。
15.如权利要求14所述的燃料电池,其特征在于,所述导电粉末包括至少一种选自铜、铜合金、镍、镍合金和碳的材料。
16.如权利要求2所述的燃料电池,其特征在于,所述基质组分包括导电的网、格、泡沫、或金属网。
17.如权利要求16所述的燃料电池,其特征在于,所述网、格、泡沫、或金属网由镍或镍合金形成。
18.如权利要求16所述的燃料电池,其特征在于,所述网、格、泡沫、或金属网由铜、镀铜的镍或铜-镍合金形成。
19.如权利要求1所述的燃料电池,其特征在于,燃料电池还包括阴极,阴极包括:
a)用于防止水通过所述阴极的疏水组分;
b)提供机械支承和/或电流收集的基质组分;以及
c)阴极活性材料。
20.如权利要求19所述的燃料电池,其特征在于,所述阴极活性材料包括含有从Mn、Co和Ni中选择的一个或几个过渡元素的主基体,和至少一个选自La、Al、K、Cs、Na、Li、C和O的改性元素,改性元素使所述主基体的局部化学环境在结构上改性。
21.如权利要求19所述的燃料电池,其特征在于,所述阴极还包括在阴极的电流收集器或基质的边缘或框架上的氧析出催化剂涂层。
22.如权利要求19所述的燃料电池,其特征在于,所述燃料电池还包括第三氧析出电极,该电极与所述阴极平行,用于在能量回收期间吸收电流浪涌,从而析出氧。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/524,116 | 2000-03-13 | ||
| US09/524,116 US6447942B1 (en) | 2000-03-13 | 2000-03-13 | Alkaline fuel cell |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1429415A CN1429415A (zh) | 2003-07-09 |
| CN100367548C true CN100367548C (zh) | 2008-02-06 |
Family
ID=24087825
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB018094007A Expired - Fee Related CN100367548C (zh) | 2000-03-13 | 2001-03-13 | 新型碱性燃料电池 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US6447942B1 (zh) |
| EP (1) | EP1266415A4 (zh) |
| JP (1) | JP2003526890A (zh) |
| KR (1) | KR100476632B1 (zh) |
| CN (1) | CN100367548C (zh) |
| AU (1) | AU2001247377A1 (zh) |
| BR (1) | BR0109206A (zh) |
| CA (1) | CA2403213A1 (zh) |
| MX (1) | MXPA02009033A (zh) |
| TW (1) | TW531920B (zh) |
| WO (1) | WO2001069701A1 (zh) |
Families Citing this family (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6613471B2 (en) * | 2000-03-13 | 2003-09-02 | Energy Conversion Devices, Inc. | Active material for fuel cell anodes incorporating an additive for precharging/activation thereof |
| US20030207175A1 (en) * | 2000-03-13 | 2003-11-06 | Ovshinsky Stanford R. | Active material for electrochemical cell anodes incorporating an additive for precharging/activation thereof |
| US20030207156A1 (en) * | 2000-10-13 | 2003-11-06 | Ovshinsky Stanford R. | Very low emission hybrid electric vehicle incorporating an integrated propulsion system including a fuel cell and a high power nickel metal hydride battery pack |
| DE10065009B4 (de) * | 2000-12-23 | 2004-09-16 | Robert Bosch Gmbh | Brennstoffzelle |
| US6589686B2 (en) * | 2001-02-28 | 2003-07-08 | Ovonic Battery Company, Inc. | Method of fuel cell activation |
| US6605375B2 (en) * | 2001-02-28 | 2003-08-12 | Ovonic Battery Company, Inc. | Method of activating hydrogen storage alloy electrode |
| US7014953B2 (en) * | 2001-03-01 | 2006-03-21 | Texaco Ovoric Fuel Cell, Llc | Regenerative bipolar fuel cell |
| US6703156B2 (en) * | 2001-03-01 | 2004-03-09 | Texaco Ovonic Fuel Cell, Llc | Fuel cell cathode utilizing multiple redox couples |
| AU2003275103A1 (en) * | 2002-09-17 | 2004-04-08 | Diffusion Science, Inc. | Electrochemical generation, storage and reaction of hydrogen and oxygen using gas permeable catalyst-coated hollow microspheres |
| US20050118485A1 (en) * | 2002-11-22 | 2005-06-02 | Hazem Tawfik | Bipolar plate and electrolyte application |
| US7144648B2 (en) * | 2002-11-22 | 2006-12-05 | The Research Foundation Of State University Of New York | Bipolar plate |
| US20040229107A1 (en) * | 2003-05-14 | 2004-11-18 | Smedley Stuart I. | Combined fuel cell and battery |
| US6998184B2 (en) * | 2003-08-07 | 2006-02-14 | Texaco Ovonic Fuel Cell, Llc | Hybrid fuel cell |
| US7435492B2 (en) * | 2003-08-07 | 2008-10-14 | Ovonic Fuel Cell Company Llc | Hybrid fuel cell |
| US20050031921A1 (en) * | 2003-08-07 | 2005-02-10 | Ovshinsky Stanford R. | Hybrid fuel cell |
| US7008706B2 (en) * | 2003-08-07 | 2006-03-07 | Ovonic Fuel Cell Company Llc | Drive system incorporating a hybrid fuel cell |
| US20070014683A1 (en) * | 2003-09-30 | 2007-01-18 | General Electric Company | Hydrogen storage composition, and associated article and method |
| US7175826B2 (en) * | 2003-12-29 | 2007-02-13 | General Electric Company | Compositions and methods for hydrogen storage and recovery |
| NO325620B1 (no) * | 2003-10-21 | 2008-06-30 | Revolt Technology Ltd | Elektrode, fremgangsmate for fremstilling derav, metall/luft-brenselcelle og metallhydrid-battericelle |
| JP2005243583A (ja) * | 2004-02-27 | 2005-09-08 | Tama Tlo Kk | 燃料電池 |
| US7220501B2 (en) | 2004-03-10 | 2007-05-22 | General Motors Corporation | Integrated hybrid electrochemical device |
| US7282294B2 (en) * | 2004-07-02 | 2007-10-16 | General Electric Company | Hydrogen storage-based rechargeable fuel cell system and method |
| US8173010B2 (en) | 2005-05-19 | 2012-05-08 | Massachusetts Institute Of Technology | Method of dry reforming a reactant gas with intermetallic catalyst |
| DE102006002470A1 (de) * | 2005-09-08 | 2007-03-15 | Airbus Deutschland Gmbh | Brennstoffzellensystem zur Versorgung mit Trinkwasser und Sauerstoff |
| US20070141432A1 (en) * | 2005-12-21 | 2007-06-21 | General Electric Company | Third electrode frame structure and method related thereto |
| JP5081542B2 (ja) * | 2007-09-03 | 2012-11-28 | 本田技研工業株式会社 | 燃料電池システム及びその運転方法 |
| TWI407623B (zh) * | 2008-07-11 | 2013-09-01 | Hon Hai Prec Ind Co Ltd | 燃料電池組 |
| CN102800878B (zh) * | 2011-05-27 | 2015-04-22 | 中国地质大学(武汉) | 一种基于液态储氢材料的一体式直接燃料电池储能供能系统 |
| US9343735B2 (en) | 2014-04-14 | 2016-05-17 | Ovonic Battery Company, Inc. | Shared electrode hybrid battery-fuel cell system |
| EP3256616A4 (en) * | 2015-02-11 | 2018-10-17 | BASF Corporation | Hydrogen storage alloys |
| JP2018511141A (ja) * | 2015-02-11 | 2018-04-19 | ビーエーエスエフ コーポレーション | 水素吸蔵合金 |
| WO2016130621A1 (en) * | 2015-02-11 | 2016-08-18 | Basf Corporation | Hydrogen storage alloys |
| ITUA20162598A1 (it) * | 2016-04-14 | 2017-10-14 | Ne M E Sys Srl | Dispositivo elettrochimico ricaricabile per la produzione di energia elettrica |
| JP7152032B2 (ja) | 2017-04-19 | 2022-10-12 | ピーエイチ マター、エルエルシー | 電気化学電池及びその使用方法 |
| US11228051B2 (en) | 2017-04-19 | 2022-01-18 | Power To Hydrogen Llc | Electrochemical cell and method of using same |
| EP3529396A4 (en) | 2017-04-19 | 2020-10-14 | PH Matter, LLC | ELECTROCHEMICAL CELL AND ITS PROCESS FOR USE |
| KR102394626B1 (ko) * | 2017-11-30 | 2022-05-09 | 현대자동차주식회사 | 엔진의 이산화질소 배출량 예측 방법 |
| US11367914B2 (en) | 2020-11-06 | 2022-06-21 | ZAF Energy Systems, Incorporated | Pouched metal-air battery cells |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5470673A (en) * | 1991-03-01 | 1995-11-28 | University Of Essex | Electrochromic and electrocatalytic material |
| US5599640A (en) * | 1994-08-17 | 1997-02-04 | Korea Advanced Institute Of Science And Technology | Alkaline fuel cell |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS55121273A (en) * | 1979-03-12 | 1980-09-18 | Matsushita Electric Ind Co Ltd | Hydrogen fuel cell |
| DE3702138C2 (de) * | 1987-01-24 | 1994-10-13 | Varta Batterie | Elektrode mit Speichervermögen für Wasserstoff zur Durchführung von elektrochemischen und chemischen Reaktionen |
| JPH0821379B2 (ja) * | 1987-08-31 | 1996-03-04 | 松下電器産業株式会社 | 水素吸蔵電極 |
| US5662729A (en) * | 1994-10-04 | 1997-09-02 | Sanyo Electric Co., Ltd. | Shaped body of hydrogen absorbing alloy and container packed with hydrogen absorbing alloy |
| GB9507012D0 (en) * | 1995-04-05 | 1995-05-31 | Johnson Matthey Plc | Improved electrode |
| JP3336839B2 (ja) * | 1995-04-10 | 2002-10-21 | ダイキン工業株式会社 | 電池用撥水性付与剤および電池 |
| JP3236907B2 (ja) * | 1995-06-16 | 2001-12-10 | 三菱マテリアル株式会社 | 水素吸蔵合金膜複合体 |
| US6193929B1 (en) * | 1999-11-06 | 2001-02-27 | Energy Conversion Devices, Inc. | High storage capacity alloys enabling a hydrogen-based ecosystem |
-
2000
- 2000-03-13 US US09/524,116 patent/US6447942B1/en not_active Expired - Fee Related
-
2001
- 2001-03-12 TW TW090105660A patent/TW531920B/zh not_active IP Right Cessation
- 2001-03-13 AU AU2001247377A patent/AU2001247377A1/en not_active Abandoned
- 2001-03-13 KR KR10-2002-7012076A patent/KR100476632B1/ko not_active IP Right Cessation
- 2001-03-13 WO PCT/US2001/007864 patent/WO2001069701A1/en active IP Right Grant
- 2001-03-13 MX MXPA02009033A patent/MXPA02009033A/es not_active Application Discontinuation
- 2001-03-13 BR BR0109206-5A patent/BR0109206A/pt not_active Application Discontinuation
- 2001-03-13 JP JP2001567061A patent/JP2003526890A/ja active Pending
- 2001-03-13 EP EP01920306A patent/EP1266415A4/en not_active Withdrawn
- 2001-03-13 CA CA002403213A patent/CA2403213A1/en not_active Abandoned
- 2001-03-13 CN CNB018094007A patent/CN100367548C/zh not_active Expired - Fee Related
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5470673A (en) * | 1991-03-01 | 1995-11-28 | University Of Essex | Electrochromic and electrocatalytic material |
| US5599640A (en) * | 1994-08-17 | 1997-02-04 | Korea Advanced Institute Of Science And Technology | Alkaline fuel cell |
Also Published As
| Publication number | Publication date |
|---|---|
| KR100476632B1 (ko) | 2005-03-17 |
| CN1429415A (zh) | 2003-07-09 |
| US6447942B1 (en) | 2002-09-10 |
| CA2403213A1 (en) | 2001-09-20 |
| JP2003526890A (ja) | 2003-09-09 |
| WO2001069701A1 (en) | 2001-09-20 |
| EP1266415A4 (en) | 2010-01-06 |
| MXPA02009033A (es) | 2003-02-12 |
| TW531920B (en) | 2003-05-11 |
| BR0109206A (pt) | 2002-12-17 |
| AU2001247377A1 (en) | 2001-09-24 |
| EP1266415A1 (en) | 2002-12-18 |
| KR20020087078A (ko) | 2002-11-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN100367548C (zh) | 新型碱性燃料电池 | |
| US6492056B1 (en) | Catalytic hydrogen storage composite material and fuel cell employing same | |
| US6613471B2 (en) | Active material for fuel cell anodes incorporating an additive for precharging/activation thereof | |
| JP4658450B2 (ja) | 新規な燃料電池正極、並びにそれを用いた燃料電池 | |
| US6828057B2 (en) | Fuel cell with framed electrodes | |
| US20020029821A1 (en) | Atomically engineered hydrogen storage alloys having extended storage capacity at high pressures and high pressure hydrogen storage units containing variable amounts thereof | |
| US6703156B2 (en) | Fuel cell cathode utilizing multiple redox couples | |
| US6790551B2 (en) | Modified redox couple fuel cell cathodes and fuel cells employing same | |
| US6783891B2 (en) | Fuel cell cathode with redox couple | |
| Bacon et al. | Review Lecture-The development and practical application of fuel cells | |
| US7033699B2 (en) | Fuel cell cathodes and their fuel cells | |
| US6926986B2 (en) | Fuel cell with encapsulated electrodes | |
| US6933072B2 (en) | Parallel flow fuel cell | |
| Brito et al. | Electrochemical generators and the environment. Fuel Cells and metal/air batteries | |
| Akgerman | A basic model of hydrogen circulation in a proton exchange membrane (PEM) fuel cell |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20080206 Termination date: 20130313 |