COMPOSIÇÃO FARMACÊUTICA COMPREENDENDO EXTRATO DE CANNABIS, PRODUTO FARMACÊUTICO, PROCESSO DE PREPARAÇÃO DA DITA COMPOSIÇÃO
CAMPO DA INVENÇÃO
[001]. A presente invenção refere-se ao setor farmacêutico e revela uma composição farmacêutica que compreende extrato de Cannabis e outros componentes que oferecem uma significativa melhoria na biodisponibilidade do referido extrato.
[002]. Ainda, a presente invenção refere-se a um processo de preparação da referida composição e a um produto farmacêutico ou medicamento que compreende a referida composição indicada para tratamento de diversas doenças e distúrbios.
FUNDAMENTOS DA INVENÇÃO
[003]. A Cannabis sativa L. é uma planta que apresenta grande potencial terapêutico, devido às suas ações no sistema nervoso central. Outros nomes atribuídos aos produtos derivados da Cannabis sativa L. são marijuana, hashish, charas, bhang, ganja e sinsemila. Hashish (haxixe) e charas são os nomes dados à resina seca extraída das flores de plantas fêmeas, que apresenta maior porcentagem de compostos psicoativos (de 10 a 20%). Os termos ganja e sinsemila são utilizados para definir o material seco encontrado no topo das plantas fêmeas, contendo cerca de 5 a 8% de compostos psicoativos. Bhang e marijuana são preparações com menor conteúdo de substâncias psicoativas (2 a 5%), extraídas do restante da planta. O termo popular maconha é utilizado no Brasil para os preparados de folhas e flores secas da Cannabis sativa L., preparada como mistura para fumar (Honório et al., 2006; Rang et al., 2003).
[004]. Apesar das restrições legais na maior parte do mundo, o uso medicinal da Cannabis sativa L. e de seus derivados é permitido em alguns estados dos EUA e em alguns países como Canadá, Reino Unido, Holanda, Bélgica e Uruguai, para tratamento conjunto e alívio de sintomas relacionados ao tratamento de câncer, AIDS, esclerose múltipla, síndrome de Tourette e epilepsia. Em outros, países, como o Irã, Malásia, Arábia Saudita, Singapura e Emirados Árabes, o porte ou tráfico da planta é condenado com pena de morte (Drugs, 2003; Honório et al., 2006; dos Santos et al., 2015; American Herbal Pharmacopeia, 2014).
[005]. Alguns exemplos das aplicações terapêuticas dos produtos derivados de Cannabis sativa L. são: efeito analgésico, supressor da náusea e de outros efeitos colaterais da quimioterapia, controle de espasmos em pacientes portadores de esclerose múltipla, redução da pressão intraocular no tratamento de glaucoma, efeito broncodilatador, anticonvulsivante e miorrelaxante. Existem evidências não clínicas que demonstram o potencial antitumoral de produtos derivados da Cannabis sativa L. em diversos tipos de linhagens celulares tumorais, inclusive com efeito antimetastático e antiangiogênico (Honório et al., 2006; Brunton et al., 2010; Massi et al., 2004; Torres et al., 2011; Vaccani et al., 2005; Blázquez et al., 2004).
[006]. A potencialidade medicinal da Cannabis está ligada ao grande número de substâncias químicas (cerca de 489) já encontradas em amostras extraídas desta planta, incluindo compostos nitrogenados, aminoácidos, proteínas, enzimas, glicoproteínas, esteroides, terpenos, vitaminas, flavonoides, pigmentos, entre outros, sendo a principal classe a dos canabinóides ou fitocanabinoides. Com exceção dos canabinóides, pouco se sabe sobre as ações farmacológicas dos outros compostos presentes na Cannabis sativa L. Entretanto, acredita-se que alguns compostos (como, por exemplo, os terpenos) apresentam um amplo espectro de ação farmacológica, corroboradas por evidências provindas de estudos in vitro e in vivo que demonstram sua ação antioxidante, ansiolítica, anti-inflamatória, antibacteriana, antineoplásica e antimalárica (Honório et al., 2006; Costa 1972 apud Raymundo & Souza, 2007; Borgelt et al., 2013; Health Canada, 2013; Aggarwal, 2013; Izzo et al., 2009; Maa & Figi, 2014; Pamplona, 2014; Russo, 2007; Russo & McPartland, 2003).
[007]. Há ainda outras variedades pertencentes ao gênero Cannabis além da Cannabis sativa: Cannabis indica e Cannabis ruderalis (cânhamo) sendo usadas para fins medicinais e como droga psicoativa entre outras possibilidades.
[008]. Os três canabinóides mais importantes presentes na Cannabis são: os dois componentes psicoativos, Δ8 e Δ9 tetra-hidrocanabinol (Δ8 e Δ9 THC) e um componente não-psicoativo, o canabidiol (CBD). Outros canabinóides como Δ8 e Δ9 THC-a (ácido tetrahidrocanabinólico), CBD-A (ácido canabinólico), THCV (tetrahidrocanabivarina), CBDV (canabivarina), CBG (canabigerol) não têm sido extensivamente estudados, com uma literatura limitada descrevendo suas propriedades. Ademais, diversos autores acreditam que esses componentes, considerados menos importantes, são essenciais para o efeito Entourage (Costa, 2007; Hill et al., 2013; Sagredo et al., 2011; Maa & Figi, 2014; Russo, 2011; Szaflarski & Bebin, 2014; Williamson & Evans, 2000).
[009]. Preparações de Cannabis podem ser utilizadas por vias de administração distintas, cada uma com suas particularidades em relação à absorção e metabolismo dos compostos de interesse. Tradicionalmente, se utilizam preparados de Cannabis através da:
[0010]. (I) Via respiratória: A absorção ocorre através dos pulmões, utilizando material vegetal ou extratos, vaporizados, inalados ou na forma fumada;
[0011]. (II) Via oral: A absorção ocorre através do intestino, sofre efeito de primeira passagem e é comumente utilizado através de extratos hidro-alcoólicos vegetais ou extratos oleosos;
[0012]. (III) Via tópica: A absorção é feita através da aplicação de extratos da planta ou de cremes/pomadas diretamente na pele.
[0013]. A administração através de outras mucosas, que não as de vias orais ou respiratórias também é conhecida, mas menos utilizada. Atualmente, conhece-se um único produto no mercado farmacêutico que utiliza um spray para absorção dos compostos pela mucosa oral concomitante à absorção oral e outros produtos, não registrados no mercado farmacêutico, em forma de supositórios, absorvidos na mucosa retal. A administração por via intravenosa de canabinoides só é utilizada para investigação científica, não sendo uma via de uso médico amplamente estudada. Informações mais detalhadas sobre a farmacocinética tradicional de Cannabis podem ser encontradas em revisões sobre o tema (Groterhermen, 2004), enquanto informações sobre novas vias como a retal para supositórios (Brenneisen et al., 1996), trans-dermal (Stinchcomb et al., 2001) e sublingual (Guy and Flint, 2000) podem ser encontradas nas respectivas referências mencionadas. Cada uma destas vias administrativas apresenta características farmacocinéticas distintas.
[0014]. A administração através do pulmão é semelhante a uma administração intravenosa em bolus, devido ao início rápido de seu efeito (de segundos a minutos) ocasionado pela difusão passiva nos capilares alveolares. O efeito máximo ocorre após cerca de 30 minutos com duração de 2 a 3 horas.
[0015]. A administração oral de extratos medicinais à base de Cannabis ou mesmo de comprimidos contendo canabinóides isolados, apresenta absorção um pouco mais variável, dependendo do conteúdo gástrico e da quantidade que está sendo administrada. O início do efeito é mais lento, variando de 30 minutos a 2 horas, e mais longo, com duração de 5 a 8 horas.
[0016]. Poucas informações estão disponíveis na literatura sobre a farmacocinética de canabinóides administrados topicamente (Aggarwal, 2013). No entanto, existe o interesse em efeitos de ação local, como anti-inflamatório, antisséptico, analgésico e antioxidante.
[0017]. A absorção e o metabolismo dos canabinóides varia conforme a rota de administração, e a referência comparativa é a via inalatória, que se assemelha bastante à própria via de administração intravenosa. Há uma absorção muito rápida, em questão de minutos, seguida de uma queda abrupta, na mesma magnitude temporal (Wall et al., 1983; Ohlsson et al., 1980; Grotenhermen, 2004). A absorção oral gera uma absorção retardada, atingindo um máximo em forma de plateau após cerca de 2h de ingestão (Ohlsson et al., 1980; Wall et al., 1983; Grotenhermen, 2004).
[0018]. É ilustrada na Figura 1 uma curva de efeito do THC em 3 formas de administração: Intravenosa, inalatória e oral. Utilizou-se o conjunto de efeitos associados ao chamado "high”, como parâmetro de efeito de 0 a 10. (Estimado de figuras de Hollister et al, 1981 e Ohlsson et al., 1980) (Fonte: Journal of Cannabis Therapeutcis, Vol 3 (1), 2003).
[0019]. Conforme exemplificado na Figura 1, os efeitos subjetivos da Cannabis variam na mesma proporção entre as vias, sendo percebidos poucos minutos após a inalação, com efeito máximo em torno de 20-30 minutos quando administrado por esta via, desaparecendo completamente entre 3h e 4h após a inalação (Hollister et al., 1981; Chiang and Barnett, 1984). Efeitos somáticos, como aumento de frequência cardíaca e vermelhidão na conjuntiva ocular são observados logo após poucos minutos e podem durar cerca de 1h (Lindgren et al., 1981; Harder and Rietbrock, 1997). Após o uso oral, enquanto os efeitos subjetivos são percebidos após cerca de 90 minutos e tem seu máximo em forma de "plateau” (e não pico), entre 2h e 4h após a administração oral, reduzindo para níveis basais em torno de 6h (Wall et al., 1983; Hollister et al., 1981; Journal of Cannabis Therapeutics, 2003). O aumento de frequência cardíaca é mais transitório com o uso oral e, quando ocorre, frequentemente passa antes mesmo que os efeitos subjetivos sejam percebidos. Por esta via, a vermelhidão da conjuntiva dura entre 1h e 3h, mas é mais brando do que pela via inalatória (Ohlsson et al., 1980).
[0020]. A maioria das informações disponíveis sobre a farmacocinética da Cannabis estão relacionadas à farmacocinética do próprio Δ9-THC, mas sabe-se que, via de regra, os outros canabinóides mais estudos como o CBN e o CBD apresentam um perfil farmacocinético similar. Não há grandes diferenças farmacocinéticas entre homens e mulheres para estes compostos (Grotehnermen, 2004).
[0021]. Como poderá ser visto adiante, a presente invenção apresenta uma solução técnica a ser administrada por via oral que proporciona aumento significativo da biodisponibilidade de extrato de Cannabis não existente no estado da técnica aliando ainda diferenciais técnicos, vantagens econômicas, segurança e confiabilidade.
OBJETIVOS DA INVENÇÃO
[0022]. Assim, é um objetivo da presente invenção proporcionar uma composição farmacêutica que compreende extrato de Cannabis, sendo preferencialmente Cannabis sativa L.
[0023]. É outro dos objetivos da presente invenção proporcionar uma composição farmacêutica que aumente a biodisponibilidade do extrato de Cannabis sendo administrada oralmente.
[0024]. É ainda outro dos objetivos da presente invenção proporcionar uma composição farmacêutica que ofereça aumento da eficácia ou possibilidade da redução da dosagem e, consequentemente, redução de efeitos colaterais.
[0025]. Também, é outro dos objetivos da presente invenção proporcionar uma composição farmacêutica que ofereça maior proteção contra degradação do ativo pelos fluidos gástricos e redução da variabilidade interindividual.
[0026]. É outro dos objetivos da presente invenção proporcionar uma composição farmacêutica que compreende extrato de Cannabis que pode se apresentar em diversas formas como solução, emulsão e ainda em forma líquida de uso oral ou ainda cápsulas de gelatina mole ou dura.
SUMÁRIO DA INVENÇÃO
[0027]. A presente invenção atinge esses e outros objetivos por meio de uma composição farmacêutica particularmente indicada para ser administrada oralmente que compreende:
- - extrato de Cannabis em uma quantidade que varia de 1 % a 60%, em massa; e
- - veículo oleoso sendo óleo vegetal parcialmente hidrolisado ou mono, di e triglicerídeos de cadeia longa ou monolinoleato de glicerilo em uma quantidade que varia de 1% a 99%, em massa;
Sendo que todas as quantidades são relativas à massa total da composição e ainda opcionalmente sendo opcionalmente uma composição autoemulsificante.
[0028]. A presente invenção atinge esses e outros objetivos por meio de um processo de preparação da composição farmacêutica acima que compreende as seguintes etapas:
- a) Adiciona-se extrato de Cannabis a um veículo oleoso sendo óleo vegetal parcialmente hidrolisado ou mono, di e triglicerídeos de cadeia longa ou monolinoleato de glicerilo;
- b) Aquece-se a mistura do item a) a uma temperatura de cerca de 50°C sob agitação por cerca de 15 minutos;
- c) Opcionalmente, adiciona-se edulcorante e aromatizante sob agitação até atingir completa dissolução;
- d) Filtra-se a mistura de c).
[0029]. Ainda, a presente invenção atinge esses e outros objetivos por meio de um produto farmacêutico ou medicamento que compreende a composição farmacêutica acima sendo indicado para tratamento conjunto e alívio de sintomas relacionados ao tratamento de câncer, AIDS, esclerose múltipla, síndrome de Tourette e epilepsia, epilepsia refratária infantil, síndrome de Dravet, dor neuropática. bem como efeito analgésico, supressor da náusea e de outros efeitos colaterais da quimioterapia, controle de espasmos em pacientes portadores de esclerose múltipla, redução da pressão intraocular no tratamento de glaucoma, efeito broncodilatador, anticonvulsivante e miorrelaxante.
BREVE DESCRIÇÃO DOS DESENHOS
[0030]. A presente invenção será descrita com base nos desenhos aqui apensos, que ilustram:
[0031]. Figura 1 ilustra uma curva de efeito do THC em 3 formas de administração: Intravenosa, inalatória e oral como ensinamento do estado da técnica;
[0032]. Figura 2 ilustra as diferenças de geração do metabólito ativo 11 -OH-THC entre as vias de administração inalatória e oral como ensinamento do estado da técnica;
[0033]. Figura 3 ilustra o resultado da avaliação do perfil farmacocinético de uma composição controle administrada pela via intravenosa;
[0034]. Figura 4 ilustra o resultado da avaliação do perfil farmacocinético de uma primeira concretização preferida da presente invenção administrada pela via oral;
[0035]. Figura 5 ilustra o resultado da avaliação do perfil farmacocinético de uma segunda concretização preferida da presente invenção administrada pela via oral;
[0036]. Figura 6 ilustra o resultado da avaliação do perfil farmacocinético de uma primeira composição disponível atualmente no mercado administrada pela via oral;
[0037]. Figura 7 ilustra o resultado da avaliação do perfil farmacocinético de uma segunda composição disponível atualmente no mercado administrada pela via oral.
DESCRIÇÃO DETALHADA DA INVENÇÃO
[0038]. A presente invenção se refere a uma composição farmacêutica que compreende:
[0039]. - extrato de Cannabis, preferencialmente Cannabis sativa L.;
[0040]. - um veículo oleoso, sendo um óleo vegetal parcialmente hidrolisado ou mono, di e triglicerídeos de cadeia longa ou monolinoleato de glicerilo;
[0041]. - opcionalmente, um edulcorante.
[0042]. Opcionalmente, esta composição pode compreender outros componentes.
[0043]. O extrato de Cannabis é adicionado na composição farmacêutica objeto da presente invenção em uma quantidade que varia entre 1% e 60%, em massa, sendo preferencialmente, em uma quantidade que varia entre 5% e 30%, em massa, com base na massa total da presente invenção. Este extrato pode ser apresentado na forma de canabinóides semissintético ou sintético. Entende-se por extrato de Cannabis o extrato obtido por qualquer processo de extração conhecido para este fim tendo como matéria prima qualquer espécie do gênero Cannabis como Cannabis sativa, Cannabis indica e Cannabis ruderalis.
[0044]. Já o veículo oleoso é adicionado na composição farmacêutica objeto da presente invenção em uma quantidade que varia entre 1% e 99%, em massa, sendo, preferencialmente, em uma quantidade que varia entre 30% e 50%, em massa, com base na massa total da presente invenção. Preferencialmente, o veículo oleoso é óleo de milho parcialmente hidrolisado ou mono, di e triglicerídeos de cadeia longa ou monolinoleato de glicerilo. O óleo de milho parcialmente hidrolisado ou mono, di e triglicerídeos de cadeia longa ou monolinoleato de glicerilo apresentada superioridade em relação ao aumento da biodisponibilidade e a utilização do mesmo na formulação auto-emulsificante.
[0045]. Em concretizações alternativas, o edulcorante é adicionado na composição farmacêutica objeto da presente invenção em uma quantidade que varia entre 0,01% e 5,00%, em massa, sendo, preferencialmente, em uma quantidade que varia entre 0,01 % e 1,00%, em massa, com base na massa total da presente invenção. Preferencialmente, utiliza-se neotame, mas também pode ser aspartame, acesulfame, sacarina, ciclamato, sucrose, sucralose, manitol, sorbitol, glicerol, stevia.
[0046]. Ainda, a composição farmacêutica pode compreender outros componentes tais como:
- - flavorizante, sendo, preferencialmente, aroma de laranja;
- - emulsificante selecionado dentre óleo de rícino hidrogenado etoxilado, polyoxyethylene castor oil derivatives (derivados de óleo de rícino de polioxietileno), polyoxyl 40 hydrogenated castor oil (Óleo de rícino hidrogenado de polioxil 40), (Cremophor RH 40), polyoxyl 35 castor oil (Cremophor EL), polyoxyl 60 hydrogenated castor oil, polyoxyl 5 castor oil, polyoxyl 9 castor oil, polyoxyl 35 castor oil, polyoxyl 40 castor oil, polyoxylglycerides e seus derivados, polissorbatos e seus derivados, polaxamers e combinações entre estes;
- - co-emulsificante sendo selecionado dentre polietilenoglicol 400 (PEG 400), glicerol, etanol, propilenoglicol, 2-(2-etoxietoxi) etanol, polietilenoglicois e combinações entre estes.
[0047]. A composição farmacêutica objeto da presente invenção pode ser apresentada em diversas formas galênicas.
[0048]. A composição objeto da presente invenção é administrada oralmente. Logo, trata-se de uma administração oral de fitocanabinóides.
[0049]. Após a administração oral, os canabinóides são absorvidos lentamente e sujeitos ao metabolismo hepático de primeira passagem (metabolismo pré-sistêmico). No plasma, cerca de 95% a 99% da concentração inicial encontra-se ligada às proteínas plasmáticas. Somente cerca de 5% da concentração inicial está disponível para exercer efeitos farmacológicos, sendo que cerca de somente 1% atinge o cérebro.
[0050]. Os efeitos biológicos iniciam entre 1 e 2 horas após administração, com duração de aproximadamente 5-6 horas (Ohlsson et al., 1980; Timpone et al., 1997). A absorção oral é mais variável do que a absorção inalatória e a concentração plasmática máxima pode variar entre 2 e 4 horas, ocorrendo na forma de plateau. Algumas vezes os indivíduos podem demonstrar mais de um pico de concentração (Ohlsson et al., 1980, Hollister et al., 1981) e o uso de doses repetidas não gera uma concentração máxima superior a de uma única administração (Frytak et al. 1984).
[0051]. Espera-se que os canabinóides sejam parcialmente degradados pelo pH gástrico e na atividade metabólica dos intestinos (Harvey & Brown, 1991). Os canabinóides são sujeitos a um intenso metabolismo hepático de primeira passagem, fazendo com que uma fração considerável dos compostos sejam degradados antes de atingir o local de ação, principalmente o sistema nervoso central (SNC), que ainda considera a penetração da barreira hematoencefálica (BHE). A biodisponibilidade é bastante reduzida por este efeito, resultando em cerca de 6-7% na média, com alta variação interindividual (de 4 a 12%) tanto pro Δ9-THC quanto pro CBD (Ohlsson et al., 1980; Sporkert et al., 2001; Wall et al., 1986).
[0052]. Uma vez absorvido, o Δ9-THC é rapidamente removido do plasma, sendo 70% absorvido pelos tecidos altamente vascularizados e 30% convertido em metabólitos. O metabolismo hepático do Δ9-THC ocorre de forma rápida por hidroxilação, oxidação e conjugação, através das famílias CYP2C9 e CYP3A do citocromo P450. Essa via de degradação é responsável pela produção de uma maior proporção do metabólito ativo 11-OH-Δ9-THC, quando comparado com a administração pulmonar. A excreção de Δ9-THC ocorre dentro de dias a semanas, principalmente como metabólitos, dos quais aproximadamente 20% a 35% são encontrados na urina e 65% a 80% encontrados nas fezes. Apenas cerca de 5% são eliminados na forma inalterada. O tempo total de eliminação pode variar porque o Δ9-THC e seus metabólitos têm como principal local de armazenamento são os tecidos pouco vascularizados, como a gordura corporal. Os canabinóides conseguem atravessar a barreira placentária e passam para o leite materno, onde podem ser encontrados em grandes quantidades (Aggarwal, 2013; Dollery, 1999).
[0053]. O CDB também possui uma absorção variável após administração oral, com biodisponibilidade estimada em 6%, devido ao metabolismo de primeira passagem significativo. A distribuição do CBD é regida pela sua alta lipofilicidade e foi observado um elevado volume de distribuição (32 L/kg), com uma distribuição rápida no cérebro, tecido adiposo e outros órgãos. O CBD liga-se extensivamente às proteínas plasmáticas e aproximadamente 10% liga-se às hemácias circulantes. Devido à distribuição preferencial de CBD no tecido adiposo, existe a possibilidade de acumular-se CBD quando o mesmo é administrado de forma crônica, especialmente em pacientes com alta adiposidade. O metabolismo hepático do CBD ocorre por hidroxilação pelo citocromo P450, das famílias CYP3A (2/4) e CYP2C (8/9/19). O principal metabólito gerado por esse processo é o 7-OH-CBD. Cerca de 33% da eliminação ocorre pelas fezes e 16% pela urina, com 50% permanecendo nos tecidos por tempo superior a 1 dia, após uma única administração (Wall et al., 1986). O tempo de meia-vida do CBD em seres humanos foi estimado em 18-32 h e o clearance foi estimado entre 960 e1.560 ml/min após administração única, em usuários crônicos de Cannabis (Devinsky et al., 2014). O tempo de meia-vida longa favorece o uso do CBD como medicamento de uso crônico, de acordo com a necessidade de uso clínico para epilepsias refratárias.
[0054]. Um aspecto importante e frequentemente negligenciado é a produção do metabólito ativo 11-OH-THC a partir do Δ9-THC. Este metabólito também se liga fortemente às proteínas plasmáticas (Harvey, 1984), mas sua penetração no tecido cerebral é maior e mais rápida do que a do Δ9-THC (Perez-Reyes et al., 1976). O 11-OH-THC também se acumula em tecido adiposo e é no mínimo igualmente potente ao Δ9-THC do ponto de vista farmacológico, de maneira que contribui significativamente para os efeitos totais observados após a administração de Δ9-THC. Esta contribuição é particularmente significativa após a administração oral, que leva a uma maior produção do metabólito ativo (ver figura abaixo).
[0055]. A Figura 2 demonstra as diferenças de geração do metabólito ativo 11-OH-THC entre as vias de administração inalatória e oral.
[0056]. Em mulheres grávidas e lactantes, há de se destacar a distribuição de canabinóides envolvendo o feto e o leite materno. Os canabinóides se distribuem rapidamente pela placenta, e temos que a concentração plasmática destas moléculas no feto é equivalente à concentração plasmática da mãe após administração inalatória (Blackard and Tennes, 1984; Hutchings et al., 1989).
[0057]. Pela via de administração oral, a concentração de Δ9-THC em contato com o feto é cerca de 10 vezes menor do que a que ocorre pela via inalatória (Hutchings et al., 1989), e a concentração no sangue do cordão umbilical é cerca de 3 a 6 vezes inferior à concentração na mãe (Blackard and Tennes, 1984). Também é importante destacar que os metabólitos do Δ9-THC, particularmente o metabólito ativo 11-OH-THC, são muito menos eficientes em cruzar a barreira placentária (Bailey et al., 1987). De uma maneira geral, pode-se concluir que a via de administração oral é substancialmente mais segura do que a via inalatória, em relação à distribuição de canabinóides para o feto. A distribuição de Δ9-THC no leite materno é significativa, chegando a cerca de 0,2% do total administrado (ou seja, 20% do que chega ao cérebro da mãe) (Chao et al., 1976).
[0058]. Formulações de base lipídica
[0059]. Formulações de base lipídicas são constituídas de triglicerídeos de cadeia média ou longa, ou suas misturas, emulsificantes solúveis ou insolúveis em água e co-solventes. São aplicadas para promover aumento da biodisponibilidade de fármacos altamente lipofílicos que apresentam baixa biodisponibilidade. Em geral, podem promover um aumento da dissolução, da solubilidade e da permeabilidade de fármacos lipofílicos, além de promover redução do efluxo, promovido pela glicoproteína P e do metabolismo pré-sistêmico. Segundo Pouton et al., as formulações de base lipídica podem ser classificadas em 5 tipos de acordo com a composição e características da sua dispersão em água conforme mostrado na Tabela 1 abaixo:
[0060]. As formulações do tipo I forma dispersões grosseiras em água, enquanto que as formulações do tipo II, IIIA e IIIB formam emulsões, micro ou mini emulsões quando dispersas em água, sendo assim denominadas sistemas autoemulsificantes ou automicroemulsificantes de liberação de fármacos (Self emulsifying drug delivery system or Self microemulsifying drug delivery systems). As formulações do tipo V formam soluções micelares quando dispersas em água. Nas formulações dos tipos II a IV a digestão não é considerada crucial. A capacidade da fórmula farmacêutica de aumentar a miscibilidade dos compostos ativos nos fluidos gastrointestinais e reduzir a influência do processo de digestão na absorção, pode ter grande influência no aumento da biodisponibilidade, através do aumento da absorção pelos enterócitos.
[0061]. Outros fatores relevantes para o aumento da biodisponibilidade são as características dos veículos lipofílicos utilizados, e.g., tamanho e grau de saturação da cadeia lipídica. O metabolismo pré-sistêmico pode ser evitado através da absorção intestinal linfática. Lipídeos de cadeia longa são absorvidos no trato gastrointestinal pelos enterócitos e são re-esterificados a triglicerídeos no retículo endoplasmático e, subsequentemente, a lipoproteínas linfáticas que, devido ao seu tamanho, não são permeáveis ao endotélio vascular, porém, são absorvidos pelo endotélio linfático, mais permeável e descontínuo. Através desta via, estas lipoproteínas atingem diretamente a circulação sistêmica o que evita o metabolismo pré-sistêmico. Portanto, compostos bioativos ou fármacos que apresentam afinidade por estes lipídeos podem ter uma biodisponibilidade aumentada através da absorção linfática.
[0062]. Desta forma, formulações de base lipídica podem aumentar a biodisponibilidade dos canabinóides através de mecanismos distintos como proteção contra degradação gástrica, aumento da solubilidade nos líquidos intestinais, aumento da permeabilidade, redução do efluxo e promoção da absorção linfática. Estes mecanismos podem atuar concomitantemente e agir de forma sinérgica para o aumento da biodisponibilidade. Tendo isto em vista, as composições farmacêuticas objeto da presente invenção descritas a seguir foram desenvolvidas com o objetivo de aumento da biodisponibilidade de compostos canabinóides naturais, semissintéticos e sintéticos.
[0063]. Nesta primeira concretização preferida da presente invenção, o extrato de Cannabis, canabinóides semissintéticos ou sintéticos é dissolvido em mistura de triglicerídeos de cadeia longa parcialmente hidrolisados, proveniente do óleo de milho ou mono, di e triglicerídeos de cadeia longa ou monolinoleato de glicerilo.
[0064]. Este excipiente apresenta uma série de vantagens em relação aos óleos de cadeia média ou cadeia longa não hidrolisados, comumente utilizados como veículo em formulações contendo canabinóides. Dentre estas vantagens citamos como exemplo o aumento da miscibilidade dos canabinóides nos fluidos intestinais, a facilidade de digestão devido a presença de ácidos graxos livres e a absorção pela via linfática, fatores que contribuem para o aumento da biodisponibilidade dos canabinóides.
[0065]. Ainda, preferencialmente, são adicionados o edulcorante neotame e o flavorizante aroma de laranja.
[0066]. Preferencialmente, tais componentes estão presentes nesta primeira concretização preferida da presente invenção nas quantidades e proporções abaixo como mostrado na tabela 2:
[0067]. Tabela 2 - primeira concretização preferida
[0068]. Para obtenção da composição farmacêutica objeto da presente invenção, o extrato foi adicionado ao óleo de milho parcialmente hidrolisado e aquecido a 50 °C sob agitação por 15 min. Em seguida, foi adicionado o neotame sob agitação até completa dissolução, a última etapa é o processo de filtração.
[0069]. Em uma segunda concretização preferida, é desenvolvida uma formulação autoemulsificante contendo extrato padronizado de Cannabis sativa - CBD 100 mg/mL. Esta concretização se refere a uma mistura isotrópica contendo extrato padronizado de Cannabis sativa, utilizado em quantidade suficiente para obtenção de um teor de canabidiol (CBD) de 100 mg/mL na fórmula final. Para obtenção da dita concretização, foram utilizados os seguintes excipientes: óleo de milho parcialmente hidrolisado ou mono, di e triglicerídeos de cadeia longa ou monolinoleato de glicerilo - veículo; Polyoxyl 40 hydrogenated castor oil (Óleo de rícino hidrogenado de polioxil 40) -emulsificante; polietilenoglicol 400 (PEG 400) - coemulsificante; neotame -edulcorante e óleo essencial de laranja.
[0070]. Preferencialmente, tais componentes estão presentes nesta segunda concretização preferida da presente invenção nas quantidades e proporções abaixo como mostrado na tabela 3:
[0071]. Tabela 3 - segunda concretização preferida
[0072]. Para obtenção desta segunda concretização, o extrato de Cannabis é misturado ao óleo de milho e mantido em agitação à temperatura de 50°C. Após homogeneização a mistura é filtrada. Em seguida são adicionados Polyoxyl 40 hydrogenated castor oil (Óleo de rícino hidrogenado de polioxil 40), PEG 400, neotame e mantidos sob agitação a 50°C até obtenção de mistura homogênea. Em seguida, o produto é resfriado e adicionado o aroma de laranja.
[0073]. Testes
[0074]. Foram realizados testes para confirmação do resultado obtido com a composição objeto da presente invenção.
[0075]. Teste 01 - Perfil farmacocinético do canabidiol (CBD) a partir de extrato de Cannabis após administração oral das primeira e segunda concretizações preferidas.
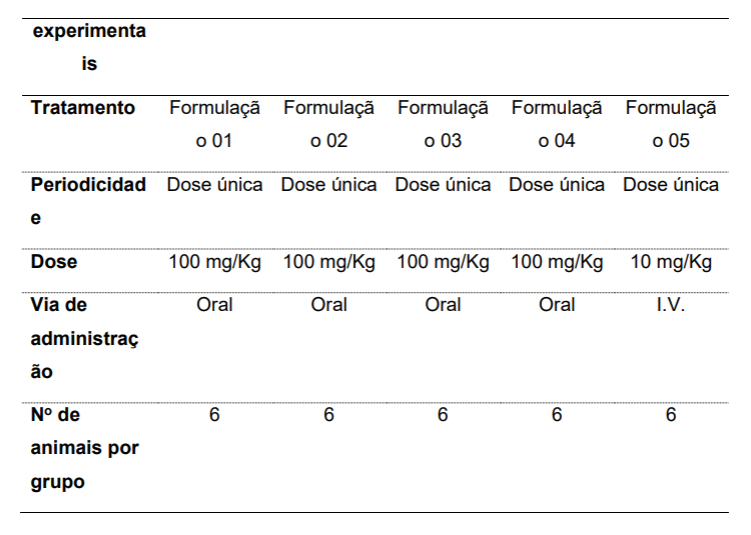
[0076]. O objetivo deste teste foi avaliar em caráter exploratório o perfil farmacocinético do Canabidiol (CBD) em camundongos tratados pela via oral ou intravenosa com diferentes formulações contendo extrato padronizado de Cannabis e determinar a sua biodisponibilidade absoluta. A dose administrada pela via oral foi de 100 mg/kg para todas as formulações avaliadas. A dose selecionada para administração intravenosa foi de 10 mg/kg. As vias de administração, oral e intravenosa, foram selecionadas baseadas no objetivo de determinar a biodisponibilidade absoluta do CBD contido nas diferentes formulações e compara-las entre si.
[0077]. Foram utilizados camundongos machos, saudáveis, da espécie Mus musculus e linhagem “CD1” (espécie roedora internacionalmente utilizada para avaliar o perfil farmacocinético de um composto candidato a fármaco), com idade entre 8 e 12 semanas, provenientes do Biotério de Criação do Centro de Inovação e Ensaios Pre-Clínicos - CIEnP. Os animais cujas matrizes foram adquiridas da empresa Charles River (EUA), são criados sob condições SPF “Specific Pathogen Free”.
[0078]. Os procedimentos experimentais seguiram as normas dos Princípios Éticos de Experimentação Animal adotadas pelo Conselho Nacional de Controle de Experimentação Animal (CONCEA). Os protocolos utilizados neste estudo foram revisados e aprovados pelo Comitê de Ética em Utilização Animal (CEUA) do CIEnP, sob os números 217/01 e adendo 001 e 264/00 e estão arquivados no CIEnP.
[0079]. Com o intuito de eliminar possíveis desvios que possam interferir na confiabilidade, rastreabilidade e na reprodutibilidade dos resultados do projeto, foram empregados os seguintes critérios:
[0080]. 1) O número de animais em cada grupo experimental foi determinado considerando a coleta máxima de sangue permitido por dia por animal (1-2% do volume circulante do animal) a fim de evitar qualquer alteração dos parâmetros farmacocinéticos;
[0081]. 2) Os animais foram distribuídos aleatoriamente nos diferentes grupos experimentais e foi levado em consideração a idade dos animais;
[0082]. 3) Nenhum dado foi excluído para cálculo dos resultados; as amostras em que não foi possível quantificar a Substância Teste ou, que apresentarem valor inferior ao Limite de Quantificação, foram consideradas igual a "zero”;
[0083]. 4) A determinação dos parâmetros farmacocinéticos foi realizada utilizando software internacionalmente reconhecido pelas agências reguladoras.
[0084]. A realização do presente protocolo consistiu no tratamento de camundongos machos da linhagem CD1 em dose única, pela via oral, com a dose de 100 mg/kg das primeira e segunda concretizações preferidas da presente invenção (fórmulas 1 e 2). Formulações similares às disponíveis comercialmente, contendo extrato de Cannabis diluído em triglicerídeos de cadeia média - TCM (fórmula 03) ou óleo de milho (fórmula 04) foram preparadas para fins comparativos seguindo as fórmulas descritas abaixo:
[0085]. Para determinação da biodisponibilidade absoluta, uma formulação hidrofílica foi preparada e a mesma foi administrada pela via endovenosa na concentração de 10 mg/mL (formulação 05):
[0087]. A composição acima foi preparada de acordo com as seguintes etapas:
[0088]. - O extrato de Cannabis foi misturado ao TCM e homogeneizado sob agitação a temperatura de 65°C. Em seguida a mistura foi resfriada e filtrada;
[0089]. - Em seguida foi adicionado óleo de rícino hidrogenado etoxilado e homogeneizado sob agitação a 65°C. Esta fração foi denominada fase oleosa;
[0090]. - Em recipiente separado, foi adicionado água ultrapura e sob agitação foram adicionados PEG 400 e Benzoato de sódio até completa dissolução. Esta fração foi denominada fase aquosa;
[0091]. - A fase oleosa foi aquecida a 65°C sob agitação;
[0092]. - A fase aquosa foi aquecida a 65°C sob agitação (200 rpm em agitador mecânico);
[0093]. - A fase oleosa foi vertida sob a fase aquosa e mantida sob agitação a 500 rpm durante 5 minutos;
[0094]. - A formulação foi homogeneizada em ultraturrax a 10.000 rpm durante 10 minutos;
[0095]. - Em seguida e formulação foi homogeneizada em HAP por 5 ciclos a 800 bar.
[0096]. A administração oral foi realizada por gavagem e a coleta de sangue de cada animal foi realizada pela veia mandibular nos dois primeiros pontos de coleta e, no terceiro ponto, a coleta foi realizada por punção cardíaca terminal. Os animais permaneceram em jejum por no máximo 4 horas antes do início do estudo e até duas horas após administração da Substância Teste. O sangue dos animais foi coletado após 0,25, 0,5, 1, 2, 4, e 6 horas da administração oral da Substância Teste.
[0097]. A administração intravenosa foi realizada através da veia lateral caudal e a coleta de sangue de cada animal, assim como descrito anteriormente, foi realizada pela veia mandibular nos dois primeiros pontos de coleta e, no terceiro ponto, a coleta foi realizada por punção cardíaca terminal. No caso de administração pela via intravenosa, não foi necessário realizar o período de jejum. O sangue dos animais foi coletado após 0,083, 0,25, 0,5, 1, 2 e 4 horas da administração da Substância Teste.
[0098]. Os parâmetros farmacocinéticos avaliados foram: AUC 0-6h e/ou, AUC 0-∞, Cmáx, Tmáx, T1/2, Vd, Cl, e biodisponibilidade absoluta. O cálculo da biodisponibilidade absoluta da Substância Teste foi realizado a partir da seguinte equação:
[0099]. F(%) = [(Dose Intravenosa x AUC oral)/ (Dose Oral x AUC Intravenosa)] x 100
[00100]. Os animais foram separados em 5 diferentes grupos levando-se em consideração a idade e a variação de peso entre os animais, sem exceder ± 20 % do peso médio. Após este processo os grupos experimentais descritos abaixo foram determinados aleatoriamente.
[00101]. Tabela 4. Representação dos grupos experimentais, tratamento, periodicidade, duração, dose, vias de administração, sexo, tempos de coleta e número de animais por tempo de coleta e por grupo experimental.
[00102]. A Figura 3 ilustra o resultado da avaliação do perfil farmacocinético da Substância formulação 05 administrada pela via intravenosa na dose de 10 mg/kg. Representação da média da concentração plasmática versus tempo (de 0,083 a 4 horas após administração pela via intravenosa). As barras representam o desvio padrão (SD) da média; n = 3 por ponto de coleta. A linha pontilhada indica o Limite de Quantificação do método analítico (LQ = 10 ng/mL).
[00103]. Já, a figura 4 ilustra o resultado da avaliação do perfil farmacocinético da formulação 01 administradas pela via oral. Perfil farmacocinético da formulação 01 após administração oral na dose de 100 mg/kg. Representação da média da concentração plasmática versus tempo (de 0,25 a 6 horas após administração pela via oral). As barras representam o desvio padrão (SD) da média; n = 3 por ponto de coleta. A linha pontilhada indica o Limite de Quantificação do método analítico (LQ = 10 ng/mL).
[00104]. A figura 5 ilustra o resultado da avaliação do perfil farmacocinético da formulação 02 administradas pela via oral. Perfil farmacocinético da formulação 02 após administração oral na dose de 100 mg/kg. Representação da média da concentração plasmática versus tempo (de 0,25 a 6 horas após administração pela via oral). As barras representam o desvio padrão (SD) da média; n = 3 por ponto de coleta. A linha pontilhada indica o Limite de Quantificação do método analítico (LQ = 10 ng/mL).
[00105]. A figura 6 ilustra o resultado da avaliação do perfil farmacocinético da formulação 03 administradas pela via oral. Perfil farmacocinético da formulação 03 após administração oral na dose de 100 mg/kg. Representação da média da concentração plasmática versus tempo (de 0,25 a 6 horas após administração pela via oral). As barras representam o desvio padrão (SD) da média; n = 3 por ponto de coleta. A linha pontilhada indica o Limite de Quantificação do método analítico (LQ = 10 ng/mL).
[00106]. A figura 7 ilustra o resultado da avaliação do perfil farmacocinético da formulação 04 administradas pela via oral. Perfil farmacocinético da formulação 04 após administração oral na dose de 100 mg/kg. Representação da média da concentração plasmática versus tempo (de 0,25 a 6 horas após administração pela via oral). As barras representam o desvio padrão (SD) da média; n = 3 por ponto de coleta. A linha pontilhada indica o Limite de Quantificação do método analítico (LQ = 10 ng/mL).
[00107]. Determinação dos parâmetros farmacocinéticos
[00108]. Na tabela abaixo estão descritos os parâmetros farmacocinéticos encontrados para a formulação 05 administrada pela via intravenosa (10 mg/kg) e para as formulações 01, 02, 03 e 04 administradas pela via oral (100 mg/kg).
[00109]. Tabela 5. Análise dos parâmetros farmacocinéticos determinados para as formulações 01 a 04, após administração oral (100 mg/kg), e da formulação 05 administrada pela via intravenosa (10 mg/kg).
[00110]. Ke = constante de eliminação; C0 = concentração no tempo 0; T1/2 = tempo de meia-vida; AUC = do inglês, Area Under de Curve; AUClast = do tempo 0 até o último tempo de coleta possível de quantificar a Substância Teste conforme método analítico validado; AUCinf = do tempo 0 até o infinito; VD = volume de distribuição; CL = clearance.
[00111]. De acordo com os resultados do teste acima apresentados, presente estudo demonstraram que a formulação 05 quando administrada pela via intravenosa, na dose de 10 mg/kg, apresentou concentração plasmática equivalente a 11,75 μg/mL 5 minutos após administração. Além disso, foi possível verificar um tempo de meia-vida de aproximadamente 1 hora, volume de distribuição e clearance de aproximadamente 3 L/kg e 44 mL/min/kg, respectivamente. Quando administrada pela via oral, na dose de 100 mg/kg, as diferentes formulações apresentaram perfil farmacocinético diferente.
[00112]. A formulação que apresentou maior exposição sistêmica foi formulação 02 (correspondente a segunda concretização preferida da presente invenção) com uma concentração máxima de aproximadamente 1,25 μg/mL.
[00113]. A formulação 01 (correspondente a primeira concretização preferida da presente invenção) apresentou a segunda maior exposição sistêmica máxima de aproximadamente 0,7 μg/mL.
[00114]. Já, as formulações 03 e 04, similar às disponíveis comercialmente, apresentaram exposição sistêmica 0,226 μg/mL e 0, 433 μg/mL.
[00115]. Estes resultados demonstram que a composição farmacêutica da presente invenção (aqui representada pelas formulações 01 e 02) promove um aumento na biodisponibilidade de canabinóides e, portanto, superioridade em relação às formulações disponíveis comercialmente.
[00116]. Tendo sido descrito um exemplo de uma concretização preferida da presente invenção, deve ser entendido que o escopo da presente invenção abrange outras variações possíveis do conceito inventivo descrito, sendo limitadas tão somente pelo teor das reivindicações apensas, aí incluídos os possíveis equivalentes.
[00117]. REFERÊNCIAS BIBLIOGRÁFICAS
[00118]. Seguem abaixo todas as referências bibliográficas mencionadas no decorrer do presente relatório:
[00119]. Aggarwal SK. Cannabinergic pain medicine: a concise clinical primer and survey of randomized-controlled trial results. Clin J Pain. 2013 Feb;29(2):162-71.
[00120]. American Herbal Pharmacopoeia Revision 2014. Cannabis inflorescence Cannabis spp. Standards of identity, analysis and quality control.
[00121]. ANVISA 2015. Canabidiol é reclassificado como substância controlada [Internet]. Brasília, 21 de janeiro de 2015, citado em 10/06/2015. Disponível em:http://portal.anvisa.gov.br/wps/content/anvisa+portal/anvisa/sala+de+imprensa/ menu+-+noticias+anos/2015/canabidiol+e+reclassificado+como+substancia+controlada
[00122]. Association of the British Pharmaceutical Industry (ABPI). Guidelines for phase 1 clinical trials (2002). Disponível em: http://www.abpi.org.uk/
[00123]. Brunton LL, Lazo JS e Parker LP. G & G. As bases farmacológicas da terapêutica. 10th ed. Porto Alegre: AMGH.; 2010. p. 558-559.
[00124]. Blázquez C, González-Feria L, Alvarez L, Haro A, Casanova ML, Guzmán M. Cannabinoids inhibit the vascular endothelial growth factor pathway in gliomas. Cancer Res. 2004 Aug 15;64(16):5617-23.
[00125]. Borgelt LM, Franson KL, Nussbaum AM, Wang GS. The pharmacologic and clinical effects of medical cannabis. Pharmacotherapy. 2013 Feb;33(2):195-209. doi: 10.1002/phar.1187.
[00126]. Chow SC. Design and Analysis of Bioavailability and Bioequivalence Studies (2009).
[00127]. Costa B. On the pharmacological properties of Delta9-tetrahydrocannabinol (THC). Chem Biodivers. 2007 Aug;4(8):1664-77.
[00128]. Cunha JM, Carlini EA, Pereira AE, Ramos OL, Pimentel C, Gagliardi R, Sanvito WL, Lander N, Mechoulam R. Chronic administration of cannabidiol to healthy volunteers and epileptic patients. Pharmacology. 1980;21(3):175-85.
[00129]. Dantas FG. Epilepsy and Marijuana - A Review. J Epilepsy Clin Neurophysiol 2005; 11(2):91-93.
[00130]. Devinsky O, Cilio MR, Cross H, Fernandez-Ruiz J, French J, Hill C, Katz R, Di Marzo V, Jutras-Aswad D, Notcutt WG, Martinez-Orgado J, Robson PJ, Rohrback BG, Thiele E, Whalley B, Friedman D. Cannabidiol: pharmacology and potential therapeutic role in epilepsy and other neuropsychiatric disorders. Epilepsia. 2014 Jun;55(6):791-802.
[00131]. dos Santos RG, Hallak JE, Leite JP, Zuardi AW, Crippa JA. Phytocannabinoids and epilepsy. J Clin Pharm Ther. 2015 Apr;40(2):135-43.
[00132]. Dollery C. Therapeutic Drugs: Elsevier Science Health Science Division; 1999. pp. C33-C35.
[00133]. Francischetti EA, Abreu VG. O Sistema Endocanabinoide: Nova Perspectiva no Controle de Fatores de Risco Cardiometabólico. Arq. Bras. Cardiol. 2006; 87: 548-558.
[00134]. Grotenhermen F1. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacokinet. 2003;42(4):327-60.
[00135]. Hazekamp A, Bastola K, Rashidi H, Bender J, Verpoorte R. Cannabis tea revisited: a systematic evaluation of the cannabinoid composition of cannabis tea. J Ethnopharmacol. 2007 Aug 15;113(1):85-90.
[00136]. Health Canada, 2013. Information for Health Care Professionals Cannabis (marihuana, marijuana) and the cannabinoids.
[00137]. Honório KM, Arroi A, da Silv ABF. Aspectos terapêuticos de compostos da planta Cannabis sativa. Quim. Nova, 2006; 29(2): 318-325.
[00138]. Hill TD, Cascio MG, Romano B, Duncan M, Pertwee RG, Williams CM, Whalley BJ, Hill AJ. Cannabidivarin-rich cannabis extracts are anticonvulsant in mouse and rat via a CB1 receptor-independent mechanism. Br J Pharmacol. 2013 Oct;170(3):679-92. doi: 10.1111/bph.12321.
[00139]. Izzo AA1, correlli F, Capasso R, Di Marzo V, Mechoulam R. Nonpsychotropic plant cannabinoids: new therapeutic opportunities from an ancient herb. Trends Pharmacol Sci. 2009 Oct;30(10):515-27.
[00140]. Kiepper A, Esher A. Regulation of marijuana by the Brazilian Senate: a public health issue. Cad. Saúde Pública, 2014 Rio de Janeiro, 30(8):1-3.
[00141]. Maa E, Figi P. The case for medical marijuana in epilepsy. Epilepsia. 2014 Jun;55(6):783-6.
[00142]. Massi P, Vaccani A, Ceruti S, Colombo A, Abbracchio MP, Parolaro D. Antitumor effects of cannabidiol, a nonpsychoactive cannabinoid, on human glioma cell lines. J Pharmacol Exp Ther. 2004 Mar;308(3):838-45. Epub 2003 Nov 14.
[00143]. Mechoulam R, Hanus L. A historical overview of chemical research on cannabinoids. Chem Phys Lipids. 2000 Nov;108(1-2):1-13.
[00144]. [No authors listed] Cannabis-based medicines--GW pharmaceuticals: high CBD, high THC, medicinal cannabis--GW pharmaceuticals, THC:CBD. Drugs R D. 2003;4(5):306-9.
[00145]. Pamplona, FA. Quais são e pra que servem os medicamentos à base de Cannabis? Cannabis-based medicine: what is it good for? Revista da Biologia (2014) 13(1): 28-35.
[00146]. Pertwee RG. Cannabinoid pharmacology: the first 66 years. Br J Pharmacol. 2006 Jan;147 Suppl 1:S163-71.
[00147]. R Development Core Team (2011). R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0.
[00148]. Rang HP, Dale M, Ritter JM & Moore PK. Farmacologia.2003, Elsevier. pp.639; 692-695.
[00149]. Raymundo PG, Souza PRK. Cannabis sativa l.: pros and cons of therapeutic use of drug abuse. Revista Brasileira de Ciências da Saúde 2007; 3(13):23-30.
[00150]. Resolução de Diretoria Colegiada (RDC) número 26, publicada pela Agencia Nacional de Vigilância Sanitária (ANVISA) em 13 de maio de 2014.
[00151]. Resolução de Diretoria Colegiada (RDC) número 9, publicada pela Agência Nacional de Vigilância Sanitária (ANVISA) em 20 de fevereiro de 2015.
[00152]. Russo EB, McPartland JM. Cannabis is more than simply delta(9)-tetrahydrocannabinol. Psychopharmacology (Berl). 2003 Feb;165(4):431-2.
[00153]. Russo E, Guy GW. A tale of two cannabinoids: the therapeutic rationale for combining tetrahydrocannabinol and cannabidiol. Med Hypotheses. 2006;66(2):234-46. Epub 2005 Oct 4.
[00154]. Russo EB. History of cannabis and its preparations in saga, science, and sobriquet. Chem Biodivers. 2007 Aug;4(8):1614-48.
[00155]. Russo EB. Taming THC: potential cannabis synergy and phytocannabinoid-terpenoid entourage effects. Br J Pharmacol. 2011 Aug; 163(7): 1344-1364.
[00156]. Sagredo O, Pazos MR, Satta V, Ramos JA, Pertwee RG, Fernández-Ruiz J. Neuroprotective effects of phytocannabinoid-based medicines in experimental models of Huntington's disease. J Neurosci Res. 2011 Sep;89(9):1509-18. doi: 10.1002/jnr.22682. Epub 2011 Jun 14.
[00157]. Stott CG, White L, Wright S, Wiilbraham D, Guy GW. A phase I study to assess the single and multiple dose pharmacokinetics of THC/CBD oromucosal spray. Eur J Clin Pharmacol. 2013; 69 (5): 1135-47.
[00158]. Szaflarski JP, Bebin EM. Cannabis, cannabidiol, and epilepsy--from receptors to clinical response. Epilepsy Behav. 2014 Dec;41:277-82. doi: 10.1016/j.yebeh.2014.08.135.
[00159]. Torres S, Lorente M, Rodríguez-Fornés F, Hernández-Tiedra S, Salazar M, García-Taboada E, Barcia J, Guzmán M, Velasco G. A combined preclinical therapy of cannabinoids and temozolomide against glioma. Mol Cancer Ther. 2011 Jan;10(1):90-103. doi: 10.1158/1535-7163.MCT-10-0688.
[00160]. U.S. Department of Health and Human Services, Public Health Service, FDA, Guidance for Industry, CGMP for Phase 1 Investigational Drugs. 2008 July.
[00161]. Vaccani A, Massi P, Colombo A, Rubino T, Parolaro D. Cannabidiol inhibits human glioma cell migration through a cannabinoid receptor-independent mechanism. Br J Pharmacol. 2005 Apr;144(8):1032-6.
[00162]. Zuardi AW. Cannabidiol: from an inactive cannabinoid to a drug with wide spectrum of action. Rev Bras Psiquiatr. 2008 Sep;30(3):271-80.
[00163]. Wall ME, Brine DR, Perez-Reys M. Metabolism of cannabinoids in man; in Braude and Szara. The pharmacology of marihuana. Raven Press, New York, 1976 (apud Cunha JM, Carlini EA, Pereira AE, Ramos OL, Pimentel C, Gagliardi R, Sanvioto WL, Lander N, Mechoulam R. Chronic Administration of Cannabidiol to Healthy Volunteers and Epiletic Patients. Pharmacology 1980; 21:175 -185).
[00164]. Williamson EM1, Evans FJ. Cannabinoids in clinical practice. Drugs. 2000 Dec;60(6):1303-14.