WO2015146537A1 - Gip上昇抑制剤の評価又は選択方法 - Google Patents
Gip上昇抑制剤の評価又は選択方法 Download PDFInfo
- Publication number
- WO2015146537A1 WO2015146537A1 PCT/JP2015/056603 JP2015056603W WO2015146537A1 WO 2015146537 A1 WO2015146537 A1 WO 2015146537A1 JP 2015056603 W JP2015056603 W JP 2015056603W WO 2015146537 A1 WO2015146537 A1 WO 2015146537A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- protein
- fabp4
- fabp5
- expression level
- gene
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/502—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects
- G01N33/5023—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects on expression patterns
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/92—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving lipids, e.g. cholesterol, lipoproteins, or their receptors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/10—Screening for compounds of potential therapeutic value involving cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/04—Endocrine or metabolic disorders
- G01N2800/042—Disorders of carbohydrate metabolism, e.g. diabetes, glucose metabolism
Definitions
- the present invention relates to a method for evaluating or selecting a GIP elevation inhibitor.
- GIP glycose-dependent insulotropic polypeptide
- K cells secretory cells
- GIP promotes insulin secretion from pancreatic ⁇ cells in a glucose-dependent manner and contributes to the regulation of blood glucose level.
- mice with artificially increased blood GIP concentrations are suppressed in lipid burning under high fat diet intake.
- GIP receptor-deficient mice suppress the accumulation of visceral fat and subcutaneous fat due to high-fat diet loading. From these findings, it is considered that postprandial GIP regulation is effective in preventing and improving obesity.
- GIP is known to have a gastric acid secretion inhibitory action and a gastric motility inhibitory action
- GIP elevation inhibition is effective in promoting postprandial digestion and improving stomach sag. Therefore, the development of a substance that suppresses the increase in GIP is desired, and accordingly, the development of a method that can rapidly evaluate the substance's ability to suppress the increase in GIP with high sensitivity is required.
- Patent Document 1 a method using the expression of CPT1 gene or CPT1 protein in cells or the activity of CPT1 protein as an index
- Patent Document 2 a method using expression as an index
- FABPs fatty acid-binding proteins
- Fatty acids have a wide variety of functions in cells such as energy sources and metabolic control signal molecules.
- FABPs play an important role in the functional expression of fatty acids by binding to insoluble fatty acids and enabling transport to various organs within the cell.
- FABP4 and FABP5 which are isoforms of FABPs, are highly homologous in amino acid sequence and steric structure and are co-expressed in adipocytes and macrophages (Non-Patent Documents 2 to 4). Functional analysis using knockout mice has been performed for FABP4 and FABP5 (Non-Patent Documents 2 to 15).
- FABP4 accounts for 1 to 3% of the cytoplasmic protein of adipocytes and is widely used as a differentiation marker for adipocytes (Non-patent Document 5).
- FABP4 in addition to its function as a molecular chaperone in adipocytes, it has been reported that it is involved in signal transduction by lipids and organelle responses, and in macrophages it is also involved in inflammatory reactions ( Non-patent documents 2, 6, 9).
- FABP5 has been suggested to be involved in the formation of psoriasis lesions in keratinocytes (Non-patent Document 7) and has been reported to be involved in the regulation of cytokine (IL-12p70), a key molecule of innate immune response, in the pancreas. (Non-patent document 8).
- Non-patent Document 11 a mouse in which FABP4 was knocked out was found to suppress a decrease in insulin sensitivity.
- a high-fat diet was given to FABP4 knockout mice, a decrease in insulin sensitivity was suppressed as compared to the wild type, but no effect on weight gain or fatty liver was observed (Non-Patent Documents 4 and 10). Since the expression of FABP5 is increased in the adipocytes of FABP4 knockout mice, it is considered that FABP5 works compensatory (Non-patent Documents 16 and 17).
- Non-patent Document 12 A tendency similar to that of the FABP4 knockout mouse is recognized in the FABP5 knockout mouse. Based on the results of single knockout mice, analysis was performed with FABP4 / 5 double knockout. When fed with a high fat diet, diet-induced obesity, insulin resistance, type 2 diabetes, It has been reported that the induction of fatty liver is suppressed (Non-Patent Documents 13, 14, and 15).
- Non-patent Document 18 When BMS309403, an inhibitor of FABP, was orally administered to model mice with type 2 diabetes or arteriosclerosis, improvement of the disease state was observed (Non-patent Document 18).
- the present invention includes the following steps (A) to (D): (A) contacting the test substance with a tissue or cell derived from a mammal capable of expressing the FABP4 gene or FABP5 gene, or the FABP4 protein or FABP5 protein; (B) a step of measuring the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in a tissue or cell derived from the mammal, (C) comparing the expression level or activity measured in (B) above with the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in the control group, (D) Based on the result of (C) above, a test substance that decreases the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein, Evalu
- the present invention also includes the following steps (A ′) to (D ′): (A ′) a step of administering a test substance to a non-human mammal; (B ′) a step of measuring the expression level of the FABP4 gene or FABP5 gene, the expression level of the FABP4 protein or FABP5 protein, or the activity of the FABP4 protein or FABP5 protein in the small intestine collected from the non-human mammal; (C ′) The expression level or activity measured in (B ′) above is determined based on the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or FABP4 in the small intestine collected from a non-human mammal of the control group Comparing the activity of the protein or FABP5 protein; (D ′) Based on the result of (C ′) above, a test substance that decreases the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein
- the present invention relates to a method for evaluating or selecting a GIP elevation inhibitor.
- the present inventors inhibit FABP4 / 5 that FABP4 and FABP5 (which may be collectively referred to as FABP4 / 5 in the present specification) are expressed in enterocytes that secrete GIP. It has been found that the GIP concentration in blood is lowered by the above, and therefore, a substance that inhibits FABP4 / 5 is useful as a GIP elevation inhibitor. From these findings, the present inventors have found that it is possible to evaluate or select a GIP elevation inhibitor using the inhibitory effect on the expression or activity of FABP4 / 5 as an index.
- the GIP increase inhibitory effect of various substances can be more easily and accurately evaluated, and an excellent GIP increase inhibitor can be selected.
- the GIP elevation inhibitor selected by the method of the present invention reduces, prevents or ameliorates the onset of obesity and the like, prevents weight gain or decreases body weight, or promotes post-meal digestion and improves stomach leaning. It is useful as an active ingredient.
- FABPs are expressed in the intestine
- FABP2 mainly expressed in the intestine
- FABP2 lipid metabolism in the intestine is thought to be played by FABP2.
- the GIP increase inhibitory action of various substances is evaluated using the FABP4 / 5 inhibitory action as an index, and a GIP increase inhibitor is selected based on the evaluation result.
- “suppression of GIP elevation” means that a diet containing lipids and carbohydrates, particularly a diet rich in lipids, especially a diet rich in triacylglycerol, is taken from K cells present in the small intestine. It means to suppress the increase of secreted GIP. That is, “GIP increase suppression” in this specification refers to suppressing GIP increase mainly occurring after meals.
- GIP increase inhibitory action suppresses GIP secretion by suppressing GIP secretion by suppressing GIP secretion from K cells, and reducing GIP concentration in blood. It is a concept that includes any GIP lowering action.
- expression of FABP4 / 5 refers to expression of FABP4 gene or FABP5 gene, or expression of FABP4 protein or FABP5 protein.
- activity of FABP4 / 5 refers to the activity of FABP4 protein or FABP5 protein.
- the evaluation or selection method of the GIP elevation inhibitor of the present invention can be performed in vitro or ex vivo, or in vivo.
- the method for evaluating or selecting the GIP elevation inhibitor of the present invention includes the following steps (A) to (D).
- D A step of evaluating or selecting a test substance that decreases the expression level or activity of FABP4 / 5 as a GIP increase inhibitor based on the result of (C).
- test substance used in the method of the present invention is not particularly limited as long as it is a substance desired to be used as a GIP elevation inhibitor.
- the test substance may be a naturally occurring substance, a substance artificially synthesized by a chemical or biological method, etc., and may be a compound, a composition or a mixture. Good.
- tissues or cells derived from mammals capable of expressing FABP4 / 5 used in the above step (A) include those from mammals expressing FABP4 gene or FABP5 gene, or FABP4 protein or FABP5 protein.
- Examples include detached tissues or cells, or cultures thereof.
- the isolated tissues or cells, or cultures thereof include small intestine tissues or cells such as duodenum and jejunum collected from mammals, fat tissues or cells, thymic epithelial tissues or cells, skin epithelial tissues or cells, and Examples thereof include small intestine primary cultured cells; small intestine cultured cells such as Caco-2 cells, IEC-6 cells, IEC-18 cells, STC-1 cells, and GLUTag cells; 3T3-L1 cells, and the like.
- examples of mammal-derived tissues or cells capable of expressing FABP4 / 5 used in the above step (A) include genetically so as to express the FABP4 gene or FABP5 gene, or the FABP4 protein or FABP5 protein.
- examples include modified mammalian tissues or cells, or cultures thereof.
- the genetically modified mammalian tissue or cell, and the culture thereof, for example, can be obtained by introducing a gene encoding FABP4 protein or FABP5 protein into any tissue or cell of a mammal. It can be produced by transforming to express FABP4 / 5 or to enhance the expression of FABP4 / 5.
- Examples of a method for introducing a gene into a cell include, but are not limited to, vector introduction by electroporation or lipofection.
- the mammal from which the tissue or cell capable of expressing FABP4 / 5 used in the method of the present invention is not particularly limited, and examples thereof include humans, mice, rats, hamsters, rabbits and the like.
- the contact between a mammal-derived tissue or cell capable of expressing FABP4 / 5 and a test substance is performed by, for example, adding the test substance to the culture solution in advance to a predetermined concentration, and then adding the tissue or cell to the culture solution. Or by adding a test substance at a predetermined concentration to the culture medium on which the tissue or cells are placed.
- the tissue or cells after contact are preferably cultured at room temperature (25 ° C.) to 37 ° C., usually for about 3 to 48 hours, preferably about 6 to 24 hours.
- the concentration at the time of seeding the tissue or cells in the culture solution is not particularly limited as long as the cells can grow.
- the addition concentration of the test substance is preferably 0.00001 to 10% by mass (dry residue), particularly preferably 0.0001 to 3% by mass (dry residue).
- a conventional medium can be used, and examples thereof include 10% FBS-containing Dulbecco's Modified Eagle's Medium. It is preferable to add growth additives such as serum, growth factors, insulin, and antibacterial agents to these media during cell passage and proliferation.
- the tissue or cells are collected, and the expression level of the FABP4 gene or FABP5 gene, the expression level of the FABP4 protein or FABP5 protein, or the activity of the FABP4 protein or FABP5 protein is measured.
- the level of gene expression is detected at the mRNA level, for example, total RNA is extracted from the cells, and the real-time RT-PCR method, RNase protection assay method, Northern blot analysis method, etc. are used. This can be performed by detecting and quantifying mRNA transcribed from the FABP4 / 5 gene.
- the expression level of the FABP4 / 5 protein can be measured by a conventional immunoassay method such as RIA method, EIA method, ELISA, bioassay method, Western blot, etc.
- Western blot is inexpensive and simple and desirable.
- the activity of the FABP4 / 5 protein can be measured by measuring the amount of binding substrate bound to the FABP4 / 5 protein.
- steps (C) to (D) expression of FABP4 / 5 in a tissue or cell derived from a mammal capable of expressing FABP4 / 5 contacted with a test substance (test group) measured in step (B) above
- the amount or activity is compared with the expression level or activity of FABP4 / 5 in the control group, and a test substance that can be used as a GIP elevation inhibitor is selected based on the comparison result.
- control group examples include mammal-derived tissues or cells capable of expressing the same FABP4 / 5 as in the test group, which were not contacted with the test substance.
- tissues or cells modified so that FABP4 / 5 is not expressed include siRNA-derived FABP4 / 5 knockdown cells, tissues or cells derived from FABP4 / 5 knockout mice. Measurement of the expression level or activity of FABP4 / 5 in the control group can be carried out in the same procedure as in the test group described in connection with the above step (B).
- the expression level or activity of FABP4 / 5 in the test group is compared with the expression level or activity of FABP4 / 5 in the control group.
- the test substance is evaluated as having a GIP increase inhibitory effect, and the test substance is selected as a GIP increase inhibitor.
- the expression level or activity in the test group is statistically significantly reduced relative to the expression level or activity in the control group, the test substance is evaluated as having a GIP increase inhibitory effect.
- the expression level or activity in the control group is 100%, the expression level or activity in the test group is 90% or less, preferably 80% or less, more preferably 60% or less.
- the test substance is evaluated to have a GIP increase inhibitory effect.
- a test substance evaluated as having a GIP elevation inhibitory effect is selected as a GIP elevation inhibitor.
- the method for evaluating or selecting the GIP elevation inhibitor of the present invention includes the following steps (A ′) to (D ′).
- a ′ a step of administering a test substance to a non-human mammal
- B ′ a step of measuring the expression level or activity of FABP4 / 5 in the small intestine collected from the non-human mammal
- C ′ a step of comparing the expression level or activity measured in (B ′) above with the expression level or activity of FABP4 / 5 in the small intestine collected from a non-human mammal of the control group
- D ′ A step of evaluating or selecting a test substance that decreases the expression level or activity of FABP4 / 5 as a GIP increase inhibitor based on the result of (C ′).
- the non-human mammal used in the above step (A ′) may be any kind of animal regardless of gender and age. Examples thereof include primates such as mice, rats, hamsters, guinea pigs, rabbits, cats, dogs, and monkeys, and rodents such as rats and mice are preferred from the viewpoint of easy availability and handling.
- Examples of the method for administering the test substance to the non-human mammal include oral administration, intragastrointestinal administration, intraperitoneal administration, intravascular administration, intradermal administration, and subcutaneous administration.
- the method of oral administration is preferable from the viewpoint of simplicity and minimal invasiveness.
- GIP is secreted from K cells of the duodenum and jejunum
- a method of directly refluxing to the duodenum or jejunum using cannulation or the like is also preferable.
- the dose of the test substance is 0.0004 mg / g body weight or more, preferably 0.04 to 2 mg / g body weight.
- the number of administrations may be single or may be divided into several times at intervals. Administration is preferably performed for each meal, more preferably between 60 minutes before meal and 60 minutes after meal.
- the expression level or activity of FABP4 / 5 in the small intestine of the non-human mammal administered with the test substance is measured.
- the measurement method may be an invasive method or a non-invasive method, and is not particularly limited.
- the small intestine is collected from the non-human mammal 1 to 360 minutes, preferably 5 to 120 minutes after administration of the test substance.
- the small intestine is collected under anesthesia or immediately after euthanasia, and the lower part of the stomach from the pylorus is collected.
- the expression level or activity of FABP4 / 5 in the collected cells is measured.
- step (C ′) to (D ′) the expression level or activity of FABP4 / 5 in the small intestine (test group) of the non-human mammal administered with the test substance obtained above was not administered. Compared with the expression level or activity of the small intestine (control group) collected from the same non-human mammal.
- the test substance is evaluated as having a GIP increase inhibitory effect, and the test substance is selected as a GIP increase inhibitor.
- test substances for example, the types of test substances that can be used, the measurement procedure of the expression level or activity of FABP4 / 5, the comparison procedure between the test group and the control group, the test substance evaluation or selection procedure, This is the same as the method performed in vitro or ex vivo.
- the selected substance may be subjected to further screening.
- a test substance evaluated or selected as having an inhibitory effect on the increase in GIP by the above method is obtained from a K cell by a secretory stimulation test using a cultured cell line of a mammalian small intestine K cell model or a single administration experiment using an experimental animal.
- a test substance evaluated or selected as having an inhibitory effect on the increase in GIP by the above method is obtained from a K cell by a secretory stimulation test using a cultured cell line of a mammalian small intestine K cell model or a single administration experiment using an experimental animal.
- the GIP elevation inhibitor selected by the present invention in the above procedure reduces GIP after meals, reduces the possibility of developing obesity, prevents or improves it, suppresses weight loss or increases in body weight, or promotes digestion Used as an active ingredient to improve stomach upset.
- the present invention provides a method for evaluating or selecting an appetite suppressant comprising the above steps (A) to (D) or (A ′) to (D ′).
- the present invention provides a method for evaluating or selecting an agent for preventing and / or improving obesity comprising the above steps (A) to (D) or (A ′) to (D ′).
- the present invention provides a method for evaluating or selecting a weight gain inhibitor comprising the steps (A) to (D) or (A ′) to (D ′).
- the present invention provides a method for evaluating or selecting a digestion promoting agent or a stomach sag ameliorating agent comprising the above steps (A) to (D) or (A ′) to (D ′).
- a test substance that decreases the expression level or activity of FABP4 / 5 is added to an appetite suppressant, obesity It is evaluated or selected as a prophylactic and / or ameliorating agent, a weight gain inhibitor, a digestion promoter or a stomach sag improving agent, respectively.
- compositions, production methods, uses or methods are further disclosed herein.
- present invention is not limited to these embodiments.
- ⁇ 2> The following steps (A) to (D): (A) contacting the test substance with a tissue or cell derived from a mammal capable of expressing the FABP4 gene or FABP5 gene, or the FABP4 protein or FABP5 protein; (B) a step of measuring the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in a tissue or cell derived from the mammal, (C) comparing the expression level or activity measured in (B) above with the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in the control group, (D) Based on the result of (C) above, a test substance that decreases the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein is used as
- ⁇ 4> The following steps (A) to (D): (A) contacting the test substance with a tissue or cell derived from a mammal capable of expressing the FABP4 gene or FABP5 gene, or the FABP4 protein or FABP5 protein; (B) a step of measuring the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in a tissue or cell derived from the mammal, (C) comparing the expression level or activity measured in (B) above with the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in the control group, (D) Based on the result of (C) above, a test substance that decreases the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein Evaluating
- ⁇ 5> The following steps (A) to (D): (A) contacting the test substance with a tissue or cell derived from a mammal capable of expressing the FABP4 gene or FABP5 gene, or the FABP4 protein or FABP5 protein; (B) a step of measuring the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in a tissue or cell derived from the mammal, (C) comparing the expression level or activity measured in (B) above with the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in the control group, (D) A test substance that decreases the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein based on the result of (C) above as a digestion
- ⁇ 6> The following steps (A) to (D): (A) contacting the test substance with a tissue or cell derived from a mammal capable of expressing the FABP4 gene or FABP5 gene, or the FABP4 protein or FABP5 protein; (B) a step of measuring the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in a tissue or cell derived from the mammal, (C) comparing the expression level or activity measured in (B) above with the expression level of FABP4 gene or FABP5 gene, the expression level of FABP4 protein or FABP5 protein, or the activity of FABP4 protein or FABP5 protein in the control group, (D) Based on the result of (C) above, a test substance that decreases the expression level of the FABP4 gene or FABP5 gene, the expression level of the FABP4 protein or FABP5 protein, or the activity of the FABP4 protein or FABP5 protein
- tissue or cell derived from a mammal capable of expressing the FABP4 gene or FABP5 gene, or the FABP4 protein or FABP5 protein is as follows: : (1) Small intestine tissue or cells collected from mammals, or cultures thereof; (2) Adipose tissue or cells collected from mammals, thymic epithelial tissue or cells, skin epithelial tissue or cells, or cultures thereof; (3) mammalian tissue or cells genetically modified to express the FABP4 gene or FABP5 gene, or the FABP4 protein or FABP5 protein, or a culture thereof; (4) small intestine primary cultured cells; or (5) Caco-2 cells, IEC-6 cells, IEC-18 cells, STC-1 cells, GLUTag cells, or 3T3-L1 cells.
- control group is preferably the following: (1) A mammal-derived tissue or cell capable of expressing the FABP4 gene or FABP5 gene, or FABP4 protein or FABP5 protein, which has not been contacted with the test substance; (2) a tissue or cell derived from a mammal that has no or almost no ability to express the FABP4 gene or the FABP5 gene, or the FABP4 protein or the FABP5 protein; (3) A tissue or cell derived from a mammal capable of expressing the FABP4 gene or FABP5 gene, or the FABP4 protein or FABP5 protein, modified so that the gene or protein is not expressed; or (4) the (2) Or (3) the tissue or cell contacted with the test substance.
- the test substance suppresses GIP elevation ⁇ 1>- ⁇ 8>
- the expression level or activity measured in (B) above is 90% or less, preferably 80% or less, more preferably 60% or less when the expression level or activity in the control group is 100%.
- the test substance is evaluated to have a GIP increase inhibitory effect, an appetite suppressive effect, an obesity prevention and / or improvement effect, a weight gain suppression effect, a digestion promoting effect, or a stomach sag improving effect, ⁇ 1>
- control group is preferably a small intestine collected from the non-human mammal that has not been administered a test substance.
- ⁇ 18> Preferably, when the expression level or activity measured in (B ′) is statistically significantly decreased with respect to the expression level or activity in the control group, the test substance increases GIP. Any one of ⁇ 11> to ⁇ 17>, which is evaluated as having an inhibitory effect, an appetite suppressive effect, an obesity prevention and / or improvement effect, a weight gain suppression effect, a digestion promoting effect, or a stomach sag improving effect. Method.
- the expression level or activity measured in (B ′) above is 90% or less, preferably 80% or less, more preferably 60% when the expression level or activity in the control group is 100%.
- the test substance is evaluated as having GIP increase inhibitory effect, appetite suppressive effect, obesity prevention and / or amelioration effect, weight gain inhibitory effect, digestion promoting effect, or stomach sag improving effect when ⁇ 11
- FABP4 / 5 inhibitor (FABP4 / 5 inhibitor)
- BMS309403 AstaTech, Inc.
- Compound2 J Lipid Res. 2011, 52, 646-656 was used as the FABP4 / 5 inhibitor.
- Example 1 Expression of FABP4 / 5 in intestinal cells (immunostaining)
- the duodenum collected from C57BL / 6J mice (male) (Claire Japan) was fixed with a 4% Paraformaldehyde solution, frozen sections were prepared, and immunostaining was performed. Double fluorescence staining was performed using antibodies in GIP and FABP5 to examine the expression of FABP5 in intestinal cells.
- T-4340 manufactured by Peninsula
- AF1476 manufactured by R & D systems
- Alexa Fluor 488 Donkey Anti-Rabbit IgG manufactured by Invitrogen
- Alexa Fluor 568 Dnkey Anti-goat IgG manufactured by Invitrogen
- the solution was fixed in 4% Paraformaldehyde solution at 4 ° C. for 10 minutes, washed with PBS, and then reacted with a primary antibody (100-fold blocking solution: 10% Donkey Serum in PBS) at room temperature for 3 hours.
- the secondary antibody 500-fold blocking solution was reacted at room temperature for 1 hour, washed with PBS, stained with Prolong Gold antigen with DAPI (manufactured by Invitrogen) and encapsulated, and observed under a microscope. (Use of 405 nm, 488 nm, and 568 nm lasers).
- Blood was collected by orbital venous plexus blood collection before lipid emulsion administration and at 10, 30, and 60 minutes after administration. The collected blood was centrifuged at 11,000 rpm and 4 ° C. for 10 minutes to prepare plasma. The blood GIP concentration and blood triglyceride (TG) concentration were measured using GIP ELISA kit (for rat / mouse) (Millipore) and Triglyceride E-Test Wako (Wako Pure Chemical Industries, Ltd.), respectively.
- GIP ELISA kit for rat / mouse
- Triglyceride E-Test Wako Waako Pure Chemical Industries, Ltd.
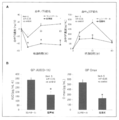
- FIG. 2 shows changes in blood TG concentration change ( ⁇ TG) and GIP concentration change ( ⁇ GIP) over time, and iAUC (0-1h) and Cmax in blood GIP concentration in mice after a single lipid emulsion administration.
- the increase in blood TG concentration and blood GIP concentration after lipid emulsion administration was statistically significantly reduced in the inhibitor-added group compared to the control group (FIG. 2A).
- iAUC and Cmax of blood GIP concentrations were also statistically significantly reduced in the inhibitor-added group compared to the control group (FIG. 2B).
- Example 3 FABP4 / 5 Inhibition Test on Small Intestine Primary Culture Cells After euthanizing 13- to 17-week-old C57BL / 6J mice by cervical dislocation under anesthesia, the upper small intestine (10 cm from immediately below the gastric pylorus) was removed and penetrated into ice-cooled L-15 medium (Sigma). . This was transferred into ice-cold PBS, fat and blood vessels adhering to the intestinal tract were carefully removed, the inside of the lumen was washed with ice-cold PBS, and the tissue was finely cut using a scalpel (small piece of 2 mm 2 or less) I made it.
- a scalpel small piece of 2 mm 2 or less
- Supernatant 1 the Collagenase solution was added in the same manner, and the mixture was incubated for 15 minutes, and the supernatant was recovered (Supernatant 2).
- Supernatant 1 and supernatant 2 were centrifuged at 100 rcf (about 800 rpm) for 3 minutes (room temperature). The supernatant was removed and suspended in 10 mL of DMEM. These were combined and centrifuged at 100 rcf for 3 minutes (room temperature).
- the supernatant was removed and suspended in 7 mL of DMEM (containing 10% FBS (Invitrogen), 1% Glutamax (Invitrogen), 1% penicillin / streptomycin (Invitrogen)). This was seeded in a 48 well plate coated with matrigel TM (BD Biosciences) (24 wells per animal) and incubated at 37 ° C., 5% CO 2 .
- DMEM containing 10% FBS (Invitrogen), 1% Glutamax (Invitrogen), 1% penicillin / streptomycin (Invitrogen)
- GIP secretion stimulation Small intestine primary cultured cells cultured for 24 hours were stimulated with stimulation medium (4.5 mM KCl, 138 mM NaCl, 4.2 mM NaHCO 3 , 1.2 mM NaH 2 PO 4 , 2.6 mM CaCl 2 , 1.2 mM MgCl 2 , 10 mM HEPES, NaOH (Adjusted to pH 7.4) once) and then incubated with stimulation medium alone or stimulation medium containing FABP4 / 5 inhibitor (10 or 25 ⁇ M).
- stimulation medium 4.5 mM KCl, 138 mM NaCl, 4.2 mM NaHCO 3 , 1.2 mM NaH 2 PO 4 , 2.6 mM CaCl 2 , 1.2 mM MgCl 2 , 10 mM HEPES, NaOH (Adjusted to pH 7.4) once
- stimulation medium alone (control), lipid micelle (PPM: stimulation medium + 500 ⁇ M Naurocholate, 200 ⁇ M oleic acid, 50 ⁇ M 2-monoolein), or PPM + FABP4 / 5 inhibitor (10 or 25 ⁇ M) was added and the medium was collected after 30 minutes.
- PPM stimulation medium + 500 ⁇ M Naurocholate, 200 ⁇ M oleic acid, 50 ⁇ M 2-monoolein
- PPM + FABP4 / 5 inhibitor 10 or 25 ⁇ M
- GIP GIP secretion rate
- the GIP secretion rate in the primary cultured cells of the small intestine stimulated with PPM is shown in FIG.
- PPM group the GIP secretion rate at 30 minutes after stimulation was statistically significantly increased as compared with the control group.
- PPM + inhibitor group an increase in GIP secretion rate was statistically significantly suppressed as compared to the PPM group.
- PPM stimulation + BMS309403 addition group the increase-dependent tendency of the increase in GIP secretion was recognized (FIG. 3A).
- Example 4 Screening of GIP elevation inhibitor based on FABP5 activity A GIP elevation inhibitor was screened based on FABP5 activity. The influence of the test substance on the FABP5 activity was examined by measuring FABP5 activity using the antagonistic binding of the test substance to the FABP5 protein.
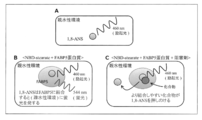
- the principle of the FABP5 activity measurement method used in this example is shown in FIG.
- 1-anilinonaphthalene-8-sulfonic acid (1,8-ANS) is a substance that has been reported to emit fluorescence by binding to FABP5 (Hum. Mol. Genet., 2014, 23 (24): 6495-6511).
- 1,8-ANS is a substance that emits fluorescence only in a hydrophobic environment, and does not emit fluorescence in a hydrophilic environment (FIG.
- test substance that suppresses the increase in fluorescence intensity by the above method is a substance that binds to FABP5 protein and inhibits its activity.
- E. coli-derived recombinant FABP5 was expressed by a conventional method and purified. Purified FABP5 protein, 1,8-ANS and test substance were added to a 96-well plate, allowed to stand at room temperature for 5 minutes, and then fluorescence intensity (excitation wavelength: 355 nm, fluorescence wavelength: 480 nm) was measured with a plate reader. It was measured.
- the FABP5 inhibitor Compound 2 having a GIP increase inhibitory action used in Example 3 and a fish oil which is an oil and fat having a GIP increase inhibitory action as shown in Reference Example 1 described later were used. The final concentration of the test substance in the evaluation system was 0.002% to 0.1% (w / v).
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Organic Chemistry (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Analytical Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Biophysics (AREA)
- Food Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- General Physics & Mathematics (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- General Engineering & Computer Science (AREA)
- Endocrinology (AREA)
- Toxicology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
以下の工程(A)~(D)を含む、GIP上昇抑制剤の評価又は選択方法:(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程。
Description
本発明は、GIP上昇抑制剤の評価又は選択方法に関する。
GIP(glucose-dependent insulinotropic polypeptide)は、脂質や糖質、アミノ酸を摂取することで、消化管上皮の分泌細胞(K細胞)より分泌されるインクレチンである。GIPは、グルコース依存的に膵臓β細胞からインスリン分泌を促進し、血糖値の調節に寄与する。近年、人為的に血中GIP濃度を高くしたマウスは、高脂肪食摂取下において脂質燃焼が抑制されることが報告されている。また、GIP受容体欠損マウスは高脂肪食負荷による内臓脂肪や皮下脂肪の蓄積が抑制されることが明らかになっている。これらの知見から、食後のGIP調節が肥満予防や改善に有効であると考えられる。さらにGIPは、胃酸分泌抑制作用や胃運動抑制作用を有することが知られていることから、GIPの上昇抑制は、食後の消化促進や胃もたれの改善に有効であると考えられる。したがって、GIPの上昇を抑制する物質の開発が望まれており、そのために、物質のGIPの上昇抑制能を高感度で迅速に評価することができる方法の開発が求められている。
従来のGIP上昇抑制剤の評価又は選択方法としては、細胞におけるCPT1遺伝子やCPT1蛋白質の発現、又はCPT1蛋白質の活性を指標とする方法(特許文献1)、FAT/CD36遺伝子又はFAT/CD36蛋白質の発現を指標とする方法(特許文献2)などが知られている。
FABPs(fatty acid-binding proteins)は、細胞内の脂肪酸結合蛋白質ファミリーであり、脂肪酸に高い結合性を有する14~15kDaのタンパク質である(非特許文献1、2)。脂肪酸はエネルギー源、代謝制御のシグナル分子など細胞内で多岐にわたる機能を有する。FABPsは、不溶性の脂肪酸に結合して細胞内の様々な器官への輸送を可能にすることにより、脂肪酸の機能発現に重要な役割を果たしている。
FABPsのアイソフォームであるFABP4とFABP5は、アミノ酸配列と立体構造の相同性が高く脂肪細胞とマクロファージに共発現している(非特許文献2~4)。FABP4とFABP5に関してノックアウトマウスを用いた機能解析が行われている(非特許文献2~15)。FABP4は、脂肪細胞の細胞質タンパク質の1~3%を占めており、脂肪細胞の分化マーカーとして広く利用されている(非特許文献5)。FABP4については、脂肪細胞においては分子シャペロンとしての機能以外に、脂質によるシグナル伝達や細胞小器官の応答にも関わっていること、またマクロファージにおいては炎症反応に関わっていることが報告されている(非特許文献2、6、9)。FABP5については、ケラチノサイトにおける乾癬の病変形成への関与が示唆され(非特許文献7)、また膵臓において自然免疫応答キー分子であるサイトカイン(IL-12p70)の制御に関与することが報告されている(非特許文献8)。
2型糖尿病モデルであるob/obマウスにおいてFABP4をノックアウトしたマウスはインスリン感受性低下の抑制が認められた(非特許文献11)。また、FABP4ノックアウトマウスに高脂肪食を与えると野生型と比較してインスリン感受性の低下は抑制されるが、体重増加や脂肪肝には影響が認められなかった(非特許文献4、10)。FABP4ノックアウトマウスの脂肪細胞ではFABP5の発現が上昇していることから、FABP5が代償的に働いていると考えられている(非特許文献16、17)。FABP5ノックアウトマウスでもFABP4ノックアウトマウスと同様の傾向が認められている(非特許文献12)。シングルノックアウトマウスでの結果を受けて、FABP4/5ダブルノックアウトでの解析が行われ、高脂肪食を与えた際に野生型と比較して、食事誘導性肥満、インスリン抵抗性、2型糖尿病、脂肪肝の惹起が抑制されたことが報告されている(非特許文献13、14、15)。
FABPの阻害剤であるBMS309403を2型糖尿病又は動脈硬化のモデルマウスに経口投与すると、病態の改善が認められた(非特許文献18)。食事誘導性肥満のマウスに対するFABP4/5阻害剤の投与は、血中のトリグリセリド値、遊離脂肪酸値の低減等、脂質異常症の改善をもたらした(非特許文献19)。
しかしながら、腸で主に発現しているFABPは、FABP2であり、そのため、腸における脂質代謝の役割はFABP2が果たしていると従来考えられていた。
特開2011-080804号公報
特開2011-080803号公報
Hum.Genomics,2011,5:170-191
Nat.Rev.Drug Discov.,2008,7:489-503
Proc.Natl.Acad.Sci.U.S.A,1986,83:3786-3790
Nat.Med.,2001,7:699-705
Biochim.Biophys.Acta.,1999,1441:106-116.
J.Biol.Chem.,2007,282:32424-32432.
J.Invest.Dermatol.,2011,131:604-612
Biochem.Biophys.Res.Commun.,2006,345:459-466
J.Biol.Chem.,2005,280:12888-12895
Science,1996,274:1377-1379
Endocrinology,2000,141:3388-3396
Diabetes,2003,52:300-307
Cell Metab.,2005,1:107-119
Diabetes,2006,55:1915-1922
Circulation,2004,110:1492-1498
Diabetes,2000,49:904-911
Am.J.Physiol.Endocrinol.Metab.,2006,290:E814-E823
Nature,2007,447:959-965
J.Lipid Res.,2011,52:646-656
本発明は、以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法を提供する。
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法を提供する。
また本発明は、以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法を提供する。
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法を提供する。
本発明は、GIP上昇抑制剤の評価又は選択方法に関する。
本発明者らは、GIPを分泌する腸細胞にFABP4及びFABP5(本明細書において、これらをまとめてFABP4/5とも称することがある)が発現していること、当該FABP4/5を阻害することによって血中GIP濃度が低下すること、したがってFABP4/5を阻害する物質がGIP上昇抑制剤として有用であることを見出した。これらの知見から、本発明者らは、FABP4/5の発現又は活性の抑制作用を指標として、GIP上昇抑制剤を評価又は選択することが可能であることを見出した。
本発明によれば、各種物質のGIP上昇抑制効果をより簡便かつ正確に評価することができ、優れたGIP上昇抑制剤を選択することが可能となる。また、本発明の方法により選択されたGIP上昇抑制剤は、肥満等の発症可能性の低下、予防若しくは改善、体重増加の予防若しくは体重の低下、又は食後の消化促進や胃もたれの改善をするための有効成分として有用である。
従来、腸にFABPsが発現していることは知られており、またマウス腸管組織切片の免疫染色により、FABP4が腸腺上皮細胞の細胞膜上に局在していることが知られていた([www.rndsystems.com/ihc_molecule_images.aspx?m=1416])。一方で従来、腸で主に発現しているFABPはFABP2であることが知られており、そのため腸における脂質代謝はFABP2が担っていると考えられていた。
しかしながら、本発明者らが腸管組織切片においてGIPとFABP5との共免疫染色を行ったところ、GIPのシグナルが検出される細胞において、FABP5の強いシグナルが認められた(図1)。この結果から、FABP4/5がともに腸上皮細胞に発現している蛋白質であることが明らかになった。また後述の実施例に示すように、FABP4/5を阻害することによってGIP濃度が低下したことから、FABP4/5がGIP分泌に関わっていることが判明した。したがって、FABP4/5を阻害する物質はGIP上昇抑制剤として有用であり、かつFABP4/5遺伝子の発現量、又はFABP4/5蛋白質の発現量や活性を測定することにより、各種物質のGIP上昇抑制効果を評価することができ、またGIP上昇抑制剤を選択することができる。
したがって、本発明においては、FABP4/5阻害作用を指標として、各種物質のGIP上昇抑制作用を評価し、又当該評価結果に基づいてGIP上昇抑制剤を選択する。本明細書において「GIP上昇抑制」とは、脂質及び糖質を含む食事、特に脂質を多く含む食事、そのなかでもトリアシルグリセロールを多く含む食事を摂取することにより、小腸に存在するK細胞から分泌されたGIPの上昇を抑制することをいう。すなわち、本明細書における「GIP上昇抑制」とは、主として食後に生じるGIP上昇を抑制することをいう。そして、本明細書における「GIP上昇抑制作用」は、K細胞からのGIP分泌を抑制することでGIP上昇を抑制するGIP分泌抑制作用、及び血中GIP濃度を低下させることによりGIP上昇を抑制するGIP低下作用のいずれをも含む概念である。
本明細書において「FABP4/5の発現」とは、FABP4遺伝子若しくはFABP5遺伝子の発現、又はFABP4蛋白質若しくはFABP5蛋白質の発現をいう。また本明細書において「FABP4/5の活性」とは、FABP4蛋白質若しくはFABP5蛋白質の活性をいう。
本発明のGIP上昇抑制剤の評価又は選択方法は、in vitro又はex vivoで行うことも、in vivoで行うこともできる。
in vitro又はex vivoで行う場合、本発明のGIP上昇抑制剤の評価又は選択方法は、以下の工程(A)~(D)を含む。
(A)FABP4/5を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4/5の発現量又は活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4/5の発現量又は活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4/5の発現量又は活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程。
(A)FABP4/5を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4/5の発現量又は活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4/5の発現量又は活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4/5の発現量又は活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程。
上記本発明の方法に使用される被験物質は、GIP上昇抑制剤として使用することを所望する物質であれば、特に制限されない。被験物質は、天然に存在する物質であっても、化学的又は生物学的方法等で人工的に合成した物質であってもよく、また化合物であっても、組成物若しくは混合物であってもよい。
上記工程(A)に用いられる、FABP4/5を発現可能な哺乳動物由来の組織又は細胞の例としては、FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現している、哺乳動物から単離された組織若しくは細胞、又はその培養物が挙げられる。当該単離された組織若しくは細胞、又はその培養物としては、哺乳動物から採取された十二指腸や空腸等の小腸組織又は細胞、脂肪組織又は細胞、胸腺上皮組織又は細胞、皮膚上皮組織又は細胞、及びそれらの培養物;小腸初代培養細胞;Caco-2細胞、IEC-6細胞、IEC-18細胞、STC-1細胞、GLUTag細胞等の小腸培養細胞;3T3-L1細胞、などが挙げられる。
あるいは、上記工程(A)に用いられる、FABP4/5を発現可能な哺乳動物由来の組織又は細胞の例としては、FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現するように遺伝的に改変された哺乳動物の組織若しくは細胞、又はその培養物が挙げられる。当該遺伝的に改変された哺乳動物の組織又は細胞、及びその培養物は、例えば、哺乳動物の任意の組織又は細胞にFABP4蛋白質又はFABP5蛋白質をコードする遺伝子を導入して、該組織又は細胞がFABP4/5を発現するように、あるいはFABP4/5の発現が強化されるように形質転換することによって作製することができる。遺伝子を細胞に導入する方法としては、エレクトロポレーションやリポフェクションなどによるベクター導入が挙げられるが、これらに限定されない。
本発明の方法で使用されるFABP4/5を発現可能な組織又は細胞が由来する哺乳動物としては、特に限定されないが、例えば、ヒト、マウス、ラット、ハムスター、ウサギ等が挙げられる。
上記FABP4/5を発現可能な哺乳動物由来の組織又は細胞と被験物質との接触は、例えば被験物質を所定の濃度になるように予め培養液中に添加した後、当該組織又は細胞を培養液に載置すること、あるいは、当該組織又は細胞が載置された培養液に、被験物質を所定の濃度になるように添加することにより行うことができる。接触後の組織又は細胞は、例えば室温(25℃)~37℃で通常3~48時間程度、好ましくは6~24時間程度培養するのが好ましい。
上記培養液に対する上記組織又は細胞の播種時の濃度は、細胞が増殖可能な濃度であれば特に限定されない。また、被験物質の添加濃度は、0.00001~10質量%(乾燥残分)とするのが好ましく、特に0.0001~3質量%(乾燥残分)とするのが好ましい。
上記組織又は細胞を培養する培地は、常用の培地を用いることができ、例えば10%FBS含有Dulbecco's Modified Eagle's Mediumなどが挙げられる。細胞継代、増殖時にはこれらの培地に、血清、増殖因子、インスリン等の増殖添加剤や抗菌剤等を添加することが好ましい。
次いで、工程(B)において、上記組織又は細胞を回収して、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する。遺伝子の発現量の測定は、mRNAレベルで検出する場合は、例えば細胞からtotal RNAを抽出して、リアルタイムRT-PCR法、RNA分解酵素プロテクションアッセイ法、あるいはノーザンブロット解析法等を利用して、FABP4/5遺伝子から転写されたmRNAを検出定量することにより行うことができる。
FABP4/5蛋白質の発現量の測定は、通常の免疫測定法、例えばRIA法、EIA法、ELISA、バイオアッセイ法、ウェスタンブロットなどにより行うことができるが、ウェスタンブロットが安価かつ簡便で望ましい。FABP4/5蛋白質の活性の測定は、FABP4/5蛋白質に対する結合基質の結合量を測定することなどにより行うことができる。
工程(C)~(D)においては、上記工程(B)で測定した、被験物質に接触させたFABP4/5を発現可能な哺乳動物由来の組織又は細胞(試験群)におけるFABP4/5の発現量又は活性を、対照群におけるFABP4/5の発現量又は活性と比較し、当該比較結果に基づいて、GIP上昇抑制剤として使用できる被験物質を選択する。
対照群としては、試験群と同じFABP4/5を発現可能な哺乳動物由来の組織又は細胞であって、被験物質に接触させなかったものが挙げられる。あるいは、対照群としては、生来的にFABP4/5の発現能がない又はほとんどない哺乳動物由来の組織又は細胞;試験群と同じ組織又は細胞を、FABP4/5が発現しないように改変したもの;さらにこれら組織又は細胞を被験物質に接触させたもの、などが挙げられる。FABP4/5が発現しないように改変した組織又は細胞としては、siRNAによるFABP4/5ノックダウン細胞、FABP4/5ノックアウトマウス由来の組織又は細胞などが挙げられる。対照群におけるFABP4/5の発現量又は活性の測定は、上記工程(B)に関して説明した試験群の場合と同様の手順で行うことができる。
次いで、試験群におけるFABP4/5の発現量又は活性と、対照群におけるFABP4/5の発現量又は活性とを比較する。試験群における発現量又は活性が対照群と比べて減少した場合、被験物質にはGIP上昇抑制効果があると評価し、該被験物質をGIP上昇抑制剤として選択する。例えば、対照群における発現量又は活性に対して、試験群における発現量又は活性が統計学的に有意に減少していた場合に、被験物質にはGIP上昇抑制効果があると評価する。別の例としては、対照群における発現量又は活性を100%としたときに、試験群における発現量又は活性が90%以下、好ましくは80%以下、より好ましくは60%以下である場合に、被験物質にはGIP上昇抑制効果があると評価する。GIP上昇抑制効果があると評価された被験物質は、GIP上昇抑制剤として選択される。
in vivoで行う場合、本発明のGIP上昇抑制剤の評価又は選択方法は、以下の工程(A')~(D')を含む。
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4/5の発現量又は活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4/5の発現量又は活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4/5の発現量又は活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程。
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4/5の発現量又は活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4/5の発現量又は活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4/5の発現量又は活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程。
上記工程(A')に用いられる非ヒト哺乳動物としては、性別、月齢を問わず、いかなる種類の動物でもよい。例えば、マウス、ラット、ハムスター、モルモット、ウサギ、ネコ、イヌ、及びサル等の霊長類を挙げることができるが、入手や取扱いが容易な点から、ラットやマウスなどのげっ歯類が好ましい。
上記非ヒト哺乳動物への被験物質の投与方法としては、例えば、経口投与、消化管内投与、腹腔内投与、血管内投与、皮内投与、皮下投与等が挙げられる。簡便さや低侵襲性の点からは経口投与する方法が好ましい。あるいは、GIPは十二指腸及び空腸のK細胞より分泌されることから、カニュレーション等を用い、十二指腸や空腸に直接還流させる方法も好ましい。
被験物質の投与量は、0.0004mg/g体重以上、好ましくは0.04~2mg/g体重である。投与回数は単回であっても、間隔をあけて数回に分けて投与してもよい。食餌毎の投与が好ましく、食前60分~食後60分の間に投与することがより好ましい。
次いで、工程(B')において、被験物質を投与した非ヒト哺乳動物の小腸におけるFABP4/5の発現量又は活性を測定する。測定の方法は、侵襲的方法でも非侵襲的方法でもよく、特に限定されない。
例えば、被験物質の投与1~360分後、好ましくは5~120分後に、上記非ヒト哺乳動物から小腸を採取する。小腸の採取は、麻酔下又は安楽死直後に開腹し、胃の幽門より下部を採取する。次いで、採取した細胞のFABP4/5の発現量又は活性を測定する。
工程(C')~(D')においては、上記で得られた被験物質を投与した非ヒト哺乳動物の小腸(試験群)におけるFABP4/5の発現量又は活性を、被験物質を投与しなかった同じ非ヒト哺乳動物から採取した小腸(対照群)の発現量又は活性と比較する。試験群における発現量又は活性が対照群と比べて減少した場合、被験物質にはGIP上昇抑制効果があると評価し、該被験物質をGIP上昇抑制剤として選択する。
本方法におけるその他の手法、例えば使用できる被験物質の種類、FABP4/5の発現量又は活性の測定手順、試験群と対照群との比較手順、被験物質の評価又は選択の手順は、上述したin vitro又はex vivoで行う方法の場合と同じである。
必要に応じて、選択された物質をさらなるスクリーニングにかけてもよい。例えば、上記方法でGIP上昇抑制効果があると評価又は選択された試験物質について、哺乳類小腸K細胞モデルの培養細胞株を用いた分泌刺激試験や実験動物を用いた単回投与実験によってK細胞からのGIP上昇抑制能を直接測定することにより、より強力なGIP上昇抑制作用を有する物質をさらに選別することができる。
以上の手順で本発明により選択されたGIP上昇抑制剤は、食後のGIPを減少させ、肥満の発症可能性の低下、予防若しくは改善のため、体重減少や体重の増加抑制のため、又は消化促進や胃もたれを改善するための有効成分として使用される。
したがって、別の一態様において、本発明は、上記工程(A)~(D)又は(A')~(D')を含む食欲抑制剤の評価又は選択方法を提供する。さらに別の一態様において、本発明は、上記工程(A)~(D)又は(A')~(D')を含む肥満予防及び/又は改善剤の評価又は選択方法を提供する。さらに別の一態様において、本発明は、上記工程(A)~(D)又は(A')~(D')を含む体重増加抑制剤の評価又は選択方法を提供する。なお別の一態様において、本発明は、上記工程(A)~(D)又は(A')~(D')を含む消化促進剤又は胃もたれ改善剤の評価又は選択方法を提供する。
これらの方法の工程(D)又は(D')では、工程(C)又は(C')の結果に基づいて、FABP4/5の発現量又は活性を減少させる被験物質を、食欲抑制剤、肥満予防及び/又は改善剤、体重増加抑制剤、あるいは消化促進剤又は胃もたれ改善剤として、それぞれ評価又は選択する。
これらの方法の工程(D)又は(D')では、工程(C)又は(C')の結果に基づいて、FABP4/5の発現量又は活性を減少させる被験物質を、食欲抑制剤、肥満予防及び/又は改善剤、体重増加抑制剤、あるいは消化促進剤又は胃もたれ改善剤として、それぞれ評価又は選択する。
本発明の例示的実施形態として、さらに以下の組成物、製造方法、用途あるいは方法を本明細書に開示する。ただし、本発明はこれらの実施形態に限定されない。
<1>以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法。
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法。
<2>以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、食欲抑制剤として評価又は選択する工程、
を含む、食欲抑制剤の評価又は選択方法。
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、食欲抑制剤として評価又は選択する工程、
を含む、食欲抑制剤の評価又は選択方法。
<3>以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、肥満予防及び/又は改善剤として評価又は選択する工程、
を含む、肥満予防及び/又は改善剤の評価又は選択方法。
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、肥満予防及び/又は改善剤として評価又は選択する工程、
を含む、肥満予防及び/又は改善剤の評価又は選択方法。
<4>以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、体重増加抑制剤として評価又は選択する工程、
を含む、体重増加抑制剤の評価又は選択方法。
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、体重増加抑制剤として評価又は選択する工程、
を含む、体重増加抑制剤の評価又は選択方法。
<5>以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、消化促進剤として評価又は選択する工程、
を含む、消化促進剤の評価又は選択方法。
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、消化促進剤として評価又は選択する工程、
を含む、消化促進剤の評価又は選択方法。
<6>以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、胃もたれ改善剤として評価又は選択する工程、
を含む、胃もたれ改善剤の評価又は選択方法。
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)上記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)上記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、胃もたれ改善剤として評価又は選択する工程、
を含む、胃もたれ改善剤の評価又は選択方法。
<7>好ましくは、上記FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞が以下である、<1>~<6>のいずれか1に記載の方法:
(1)哺乳動物から採取された小腸組織若しくは細胞、又はその培養物;
(2)哺乳動物から採取された脂肪組織若しくは細胞、胸腺上皮組織若しくは細胞、皮膚上皮組織若しくは細胞、又はその培養物;
(3)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現するように遺伝的に改変された哺乳動物の組織若しくは細胞、又はその培養物;
(4)小腸初代培養細胞;又は、
(5)Caco-2細胞、IEC-6細胞、IEC-18細胞、STC-1細胞、GLUTag細胞、又は3T3-L1細胞。
(1)哺乳動物から採取された小腸組織若しくは細胞、又はその培養物;
(2)哺乳動物から採取された脂肪組織若しくは細胞、胸腺上皮組織若しくは細胞、皮膚上皮組織若しくは細胞、又はその培養物;
(3)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現するように遺伝的に改変された哺乳動物の組織若しくは細胞、又はその培養物;
(4)小腸初代培養細胞;又は、
(5)Caco-2細胞、IEC-6細胞、IEC-18細胞、STC-1細胞、GLUTag細胞、又は3T3-L1細胞。
<8>好ましくは、上記対照群が以下である、<1>~<7>のいずれか1に記載の方法:
(1)上記FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞であって、上記被験物質に接触させなかったもの;
(2)生来的にFABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質の発現能がない又はほとんどない哺乳動物由来の組織又は細胞;
(3)上記FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞を、当該遺伝子又は蛋白質が発現しないように改変したもの;又は
(4)該(2)又は(3)の組織又は細胞を被験物質に接触させたもの。
(1)上記FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞であって、上記被験物質に接触させなかったもの;
(2)生来的にFABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質の発現能がない又はほとんどない哺乳動物由来の組織又は細胞;
(3)上記FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞を、当該遺伝子又は蛋白質が発現しないように改変したもの;又は
(4)該(2)又は(3)の組織又は細胞を被験物質に接触させたもの。
<9>好ましくは、上記(B)で測定した発現量又は活性が、上記対照群における発現量又は活性に対して統計学的に有意に減少していた場合に、上記被験物質はGIP上昇抑制効果、食欲抑制効果、肥満予防及び/又は改善効果、体重増加抑制効果、消化促進効果、あるいは胃もたれ改善効果があると評価される、<1>~<8>のいずれか1に記載の方法。
<10>好ましくは、上記(B)で測定した発現量又は活性が、上記対照群における発現量又は活性を100%としたときに90%以下、好ましくは80%以下、より好ましくは60%以下である場合に、上記被験物質はGIP上昇抑制効果、食欲抑制効果、肥満予防及び/又は改善効果、体重増加抑制効果、消化促進効果、あるいは胃もたれ改善効果があると評価される、<1>~<8>のいずれか1に記載の方法。
<11>以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法。
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法。
<12>以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、食欲抑制剤として評価又は選択する工程、
を含む、食欲抑制剤の評価又は選択方法。
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、食欲抑制剤として評価又は選択する工程、
を含む、食欲抑制剤の評価又は選択方法。
<13>以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、肥満予防及び/又は改善剤として評価又は選択する工程、
を含む、肥満予防及び/又は改善剤の評価又は選択方法。
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、肥満予防及び/又は改善剤として評価又は選択する工程、
を含む、肥満予防及び/又は改善剤の評価又は選択方法。
<14>以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、体重増加抑制剤として評価又は選択する工程、
を含む、体重増加抑制剤の評価又は選択方法。
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、体重増加抑制剤として評価又は選択する工程、
を含む、体重増加抑制剤の評価又は選択方法。
<15>以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、消化促進剤として評価又は選択する工程、
を含む、消化促進剤の評価又は選択方法。
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、消化促進剤として評価又は選択する工程、
を含む、消化促進剤の評価又は選択方法。
<16>以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、胃もたれ改善剤として評価又は選択する工程、
を含む、胃もたれ改善剤の評価又は選択方法。
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')上記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')上記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、胃もたれ改善剤として評価又は選択する工程、
を含む、胃もたれ改善剤の評価又は選択方法。
<17>好ましくは、上記対照群が被験物質を投与しなかった上記非ヒト哺乳動物から採取した小腸である、<11>~<16>のいずれか1に記載の方法。
<18>好ましくは、上記(B')で測定した発現量又は活性が、上記対照群における発現量又は活性に対して統計学的に有意に減少していた場合に、上記被験物質はGIP上昇抑制効果、食欲抑制効果、肥満予防及び/又は改善効果、体重増加抑制効果、消化促進効果、あるいは胃もたれ改善効果があると評価される、<11>~<17>のいずれか1に記載の方法。
<19>好ましくは、上記(B')で測定した発現量又は活性が、上記対照群における発現量又は活性を100%としたときに90%以下、好ましくは80%以下、より好ましくは60%以下である場合に、上記被験物質はGIP上昇抑制効果、食欲抑制効果、肥満予防及び/又は改善効果、体重増加抑制効果、消化促進効果、あるいは胃もたれ改善効果があると評価される、<11>~<17>のいずれか1に記載の方法。
以下、実施例を示し、本発明をより具体的に説明する。
(FABP4/5阻害剤)
以下の実施例では、FABP4/5阻害剤として、下記のBMS309403(AstaTech,Inc.)又はCompound2(J Lipid Res.2011,52,646-656)を用いた。
以下の実施例では、FABP4/5阻害剤として、下記のBMS309403(AstaTech,Inc.)又はCompound2(J Lipid Res.2011,52,646-656)を用いた。
実施例1 腸細胞におけるFABP4/5の発現
(免疫染色)
C57BL/6Jマウス(雄)(日本クレア)より採取した十二指腸を4%Paraformaldehyde水溶液で固定後、凍結切片を作製し、免疫染色を行った。GIP及びFABP5における抗体を用いて二重蛍光染色を行い、腸細胞におけるFABP5の発現を検討した。一次抗体として、GIPの抗体にはT-4340(Peninsula製)を用いた。また、FABP5の抗体にはAF1476(R&D systems製)を用いた。また二次抗体にはAlexa Fluor 488 Donkey Anti-Rabbit IgG(Invitrogen製)、Alexa Fluor 568 Dnkey Anti-goat IgG(Invitrogen製)を用いた。常法に従い、4%Paraformaldehyde水溶液において4℃にて10分間固定し、PBS洗浄後、一次抗体(100倍ブロッキング液:10%Donkey Serum in PBS)において室温で3時間反応させた。再度PBS洗浄した後、二次抗体(500倍ブロッキング液)を室温で1時間反応させ、PBS洗浄後、Prolong Gold antifade reagent with DAPI(Invitrogen製)にて核染色及び封入し、顕微鏡下で観察した(405nm、488nm、568nmのレーザー使用)。
(免疫染色)
C57BL/6Jマウス(雄)(日本クレア)より採取した十二指腸を4%Paraformaldehyde水溶液で固定後、凍結切片を作製し、免疫染色を行った。GIP及びFABP5における抗体を用いて二重蛍光染色を行い、腸細胞におけるFABP5の発現を検討した。一次抗体として、GIPの抗体にはT-4340(Peninsula製)を用いた。また、FABP5の抗体にはAF1476(R&D systems製)を用いた。また二次抗体にはAlexa Fluor 488 Donkey Anti-Rabbit IgG(Invitrogen製)、Alexa Fluor 568 Dnkey Anti-goat IgG(Invitrogen製)を用いた。常法に従い、4%Paraformaldehyde水溶液において4℃にて10分間固定し、PBS洗浄後、一次抗体(100倍ブロッキング液:10%Donkey Serum in PBS)において室温で3時間反応させた。再度PBS洗浄した後、二次抗体(500倍ブロッキング液)を室温で1時間反応させ、PBS洗浄後、Prolong Gold antifade reagent with DAPI(Invitrogen製)にて核染色及び封入し、顕微鏡下で観察した(405nm、488nm、568nmのレーザー使用)。
(結果)
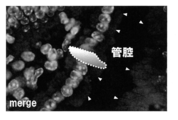
染色像を図1に示した。マウス小腸において、絨毛に存在する細胞の管腔側に連続的にFABP5の発現が認められた(矢印)。また、GIP陽性であるK細胞(白点線内)においてもFABP5の発現が認められた。なお、FABP4が腸腺上皮の細胞膜上に局在していることは既に知られている([www.rndsystems.com/ihc_molecule_images.aspx?m=1416])。したがって本実施例の結果から、FABP4/5がともに腸の上皮細胞で発現していることが明らかにされた。
染色像を図1に示した。マウス小腸において、絨毛に存在する細胞の管腔側に連続的にFABP5の発現が認められた(矢印)。また、GIP陽性であるK細胞(白点線内)においてもFABP5の発現が認められた。なお、FABP4が腸腺上皮の細胞膜上に局在していることは既に知られている([www.rndsystems.com/ihc_molecule_images.aspx?m=1416])。したがって本実施例の結果から、FABP4/5がともに腸の上皮細胞で発現していることが明らかにされた。
実施例2 FABP4/5阻害がGIP分泌に及ぼす影響
(マウス単回投与試験)
18時間絶食したマウス(C57BL/6J、雄性、9週齢、n=4-5、日本クレア)に、麻酔下にてFABP4/5阻害剤BMS309403(30mg/kg体重)を含む溶媒(10% 1-methyl-2-pyrrolione、5%cremophor、2%ethanol)、又は溶媒のみ(コントロール)を経口ゾンデにて胃内投与した。30分後、脂質乳剤(トリオレイン;2mg/g体重)を胃内投与した。採血は、脂質乳剤投与前、投与後10、30、及び60分において眼窩静脈叢採血により行った。採取した血液を11,000rpm、4℃で10分間遠心分離を行い、血漿を調製した。血中GIP濃度、血中トリグリセリド(TG)濃度については、それぞれGIP ELISAキット(ラット/マウス用)(ミリポア)及びトリグリセライドE-テストワコー(和光純薬工業)用いて測定した。
(マウス単回投与試験)
18時間絶食したマウス(C57BL/6J、雄性、9週齢、n=4-5、日本クレア)に、麻酔下にてFABP4/5阻害剤BMS309403(30mg/kg体重)を含む溶媒(10% 1-methyl-2-pyrrolione、5%cremophor、2%ethanol)、又は溶媒のみ(コントロール)を経口ゾンデにて胃内投与した。30分後、脂質乳剤(トリオレイン;2mg/g体重)を胃内投与した。採血は、脂質乳剤投与前、投与後10、30、及び60分において眼窩静脈叢採血により行った。採取した血液を11,000rpm、4℃で10分間遠心分離を行い、血漿を調製した。血中GIP濃度、血中トリグリセリド(TG)濃度については、それぞれGIP ELISAキット(ラット/マウス用)(ミリポア)及びトリグリセライドE-テストワコー(和光純薬工業)用いて測定した。
(結果)
脂質乳剤単回投与後のマウスにおける血中のTG濃度変化量(ΔTG)及びGIP濃度変化量(ΔGIP)の経時変化、ならびに血中GIP濃度のiAUC(0-1h)及びCmaxを図2に示す。脂質乳剤投与後における血中TG濃度及び血中GIP濃度の上昇は、コントロール群と比較して阻害剤添加群において統計学的に有意に低減した(図2A)。また、血中GIP濃度のiAUC及びCmaxもまた、コントロール群と比較して阻害剤添加群において統計学的に有意に低減した(図2B)。
脂質乳剤単回投与後のマウスにおける血中のTG濃度変化量(ΔTG)及びGIP濃度変化量(ΔGIP)の経時変化、ならびに血中GIP濃度のiAUC(0-1h)及びCmaxを図2に示す。脂質乳剤投与後における血中TG濃度及び血中GIP濃度の上昇は、コントロール群と比較して阻害剤添加群において統計学的に有意に低減した(図2A)。また、血中GIP濃度のiAUC及びCmaxもまた、コントロール群と比較して阻害剤添加群において統計学的に有意に低減した(図2B)。
実施例3 小腸初代培養細胞でのFABP4/5阻害試験
(小腸初代培養細胞の調製)
13~17週齢のC57BL/6Jマウスを麻酔下で頸椎脱臼により安楽死させた後、上部小腸(胃幽門直下から10cm)を摘出して、氷冷したL-15培地(Sigma)に浸透した。これを氷冷PBS中に移し、腸管に付着した脂肪及び血管等を丁寧に除去し、管腔内を氷冷PBSで洗浄した後、メスを用いて組織を微塵切り(2mm2以下の小片)にした。小片をPBSで3~4回洗浄した後、Collagenase XI(Sigma;0.4mg/mL)を溶解したDMEM(Sigma)を10mL添加し、10秒間激しく振とうしてから37℃で5分間インキュベートした。上清を除去した後、再びCollagenase溶液を10mL添加して10秒間激しく振とうし、37℃で5分間インキュベートした。その後、上清を除去し、再びCollagenase溶液を10mL添加して10秒間激しく振とうし、37℃で15分間インキュベートした。その間、5分ごとに10秒間の振とうを行った。インキュベート後に上清を回収し(上清1)、同様にCollagenase溶液を添加して15分間インキュベートし、上清を回収した(上清2)。上清1と上清2を100rcf(約800rpm)で3分間遠心した(室温)。上清を除去し、それぞれ10mLのDMEMに懸濁した後、これらを合わせて100rcfで3分間遠心した(室温)。上清を除去し、7mLのDMEM(10%FBS(Invitrogen)、1%Glutamax(Invitrogen)、1%penicilin/streptomycin(Invitrogen)含有)に懸濁した。これをmatrigelTM(BD Biosciences)でコートした48ウェルプレートに播種し(1匹辺り24ウェル)、37℃、5%CO2下でインキュベートした。
(小腸初代培養細胞の調製)
13~17週齢のC57BL/6Jマウスを麻酔下で頸椎脱臼により安楽死させた後、上部小腸(胃幽門直下から10cm)を摘出して、氷冷したL-15培地(Sigma)に浸透した。これを氷冷PBS中に移し、腸管に付着した脂肪及び血管等を丁寧に除去し、管腔内を氷冷PBSで洗浄した後、メスを用いて組織を微塵切り(2mm2以下の小片)にした。小片をPBSで3~4回洗浄した後、Collagenase XI(Sigma;0.4mg/mL)を溶解したDMEM(Sigma)を10mL添加し、10秒間激しく振とうしてから37℃で5分間インキュベートした。上清を除去した後、再びCollagenase溶液を10mL添加して10秒間激しく振とうし、37℃で5分間インキュベートした。その後、上清を除去し、再びCollagenase溶液を10mL添加して10秒間激しく振とうし、37℃で15分間インキュベートした。その間、5分ごとに10秒間の振とうを行った。インキュベート後に上清を回収し(上清1)、同様にCollagenase溶液を添加して15分間インキュベートし、上清を回収した(上清2)。上清1と上清2を100rcf(約800rpm)で3分間遠心した(室温)。上清を除去し、それぞれ10mLのDMEMに懸濁した後、これらを合わせて100rcfで3分間遠心した(室温)。上清を除去し、7mLのDMEM(10%FBS(Invitrogen)、1%Glutamax(Invitrogen)、1%penicilin/streptomycin(Invitrogen)含有)に懸濁した。これをmatrigelTM(BD Biosciences)でコートした48ウェルプレートに播種し(1匹辺り24ウェル)、37℃、5%CO2下でインキュベートした。
(GIP分泌刺激)
24時間培養した小腸初代培養細胞を刺激培地(4.5mM KCl、138mM NaCl、4.2mM NaHCO3、1.2mM NaH2PO4、2.6mM CaCl2、1.2mM MgCl2、10mM HEPES、NaOH(pH7.4に調整))で1回穏やかに洗浄した後、刺激培地のみ、又はFABP4/5阻害剤(10又は25μM)を含む刺激培地を添加してインキュベートした。30分後、刺激培地で1回穏やかに洗浄し、刺激培地のみ(コントロール)、脂質ミセル(PPM:刺激培地+500μMタウロコール酸Na、200μMオレイン酸、50μM 2-モノオレイン)、又はPPM+FABP4/5阻害剤(10又は25μM)を添加し、30分後に培地を回収した。FABP4/5阻害剤としては、BMS309403又はCompound2を用いた。
24時間培養した小腸初代培養細胞を刺激培地(4.5mM KCl、138mM NaCl、4.2mM NaHCO3、1.2mM NaH2PO4、2.6mM CaCl2、1.2mM MgCl2、10mM HEPES、NaOH(pH7.4に調整))で1回穏やかに洗浄した後、刺激培地のみ、又はFABP4/5阻害剤(10又は25μM)を含む刺激培地を添加してインキュベートした。30分後、刺激培地で1回穏やかに洗浄し、刺激培地のみ(コントロール)、脂質ミセル(PPM:刺激培地+500μMタウロコール酸Na、200μMオレイン酸、50μM 2-モノオレイン)、又はPPM+FABP4/5阻害剤(10又は25μM)を添加し、30分後に培地を回収した。FABP4/5阻害剤としては、BMS309403又はCompound2を用いた。
(GIP分泌率の測定)
回収した培地を、8,000rpm、4℃で5分間遠心して上清を得た(Secretion sample)。上清回収後のプレートにCell Lysis Buffer(0.5%(w/v)Sodium Deoxycholate monohydrate、1%(v/v)Igepal CA-630、50mmoL/L Tris-HCl(pH7.4)、150mmol/L NaCl、1 tablet EDTA-free protease inhibitor cocktail tablet(Roche))を添加し、凍結融解した後に細胞を回収した。これを12,000rpm、4℃で5分間遠心し、上清を得た(Lysis sample)。これらのサンプルについてGIP ELISAキット(ラット/マウス用)(ミリポア)を用いてGIPの定量を行い、GIP分泌率を求めた。GIP分泌率の算出方法を下記に示す。
回収した培地を、8,000rpm、4℃で5分間遠心して上清を得た(Secretion sample)。上清回収後のプレートにCell Lysis Buffer(0.5%(w/v)Sodium Deoxycholate monohydrate、1%(v/v)Igepal CA-630、50mmoL/L Tris-HCl(pH7.4)、150mmol/L NaCl、1 tablet EDTA-free protease inhibitor cocktail tablet(Roche))を添加し、凍結融解した後に細胞を回収した。これを12,000rpm、4℃で5分間遠心し、上清を得た(Lysis sample)。これらのサンプルについてGIP ELISAキット(ラット/マウス用)(ミリポア)を用いてGIPの定量を行い、GIP分泌率を求めた。GIP分泌率の算出方法を下記に示す。
(結果)
PPM刺激された小腸初代培養細胞におけるGIP分泌率を図3に示す。PPM刺激された細胞(PPM群)では、コントロール群と比較して、刺激後30分でのGIP分泌率が統計学的に有意に上昇した。一方、PPM刺激に加えてFABP4/5阻害剤を添加した細胞(PPM+阻害剤群)では、PPM群に対してGIP分泌率の上昇が統計学的に有意に抑制された。PPM刺激+BMS309403添加群では、用量依存的なGIP分泌の上昇抑制傾向が認められた(図3A)。
PPM刺激された小腸初代培養細胞におけるGIP分泌率を図3に示す。PPM刺激された細胞(PPM群)では、コントロール群と比較して、刺激後30分でのGIP分泌率が統計学的に有意に上昇した。一方、PPM刺激に加えてFABP4/5阻害剤を添加した細胞(PPM+阻害剤群)では、PPM群に対してGIP分泌率の上昇が統計学的に有意に抑制された。PPM刺激+BMS309403添加群では、用量依存的なGIP分泌の上昇抑制傾向が認められた(図3A)。
実施例4 FABP5活性に基づくGIP上昇抑制剤のスクリーニング
FABP5活性に基づいてGIP上昇抑制剤をスクリーニングした。試験物質のFABP5活性に及ぼす影響は、FABP5蛋白質への試験物質の拮抗的な結合を利用してFABP5活性を測定することにより調べた。本実施例で用いたFABP5活性測定法の原理を図4に示す。1-anilinonaphthalene-8-sulfonic acid(1,8-ANS)は、FABP5に結合することで蛍光を発することが報告されている物質である(Hum.Mol.Genet.,2014,23(24):6495-6511)。1,8-ANSは、疎水性環境下でのみ蛍光を発する物質であり、親水性環境下では蛍光を発しない(図4A)。一方、FABP5存在下では、1,8-ANSはFABP5との結合により分子周辺が疎水性環境となるため蛍光を発するようになる(図4B)。しかし、FABP5に対する結合定数がより小さい物質がさらに存在すると、その物質が1,8-ANSより優先的にFABP5に結合するため、1,8-ANSは蛍光を発しなくなる(図4C)。上記方法で蛍光強度の上昇を抑制した試験物質は、FABP5蛋白質と結合してその活性を阻害する物質である。
FABP5活性に基づいてGIP上昇抑制剤をスクリーニングした。試験物質のFABP5活性に及ぼす影響は、FABP5蛋白質への試験物質の拮抗的な結合を利用してFABP5活性を測定することにより調べた。本実施例で用いたFABP5活性測定法の原理を図4に示す。1-anilinonaphthalene-8-sulfonic acid(1,8-ANS)は、FABP5に結合することで蛍光を発することが報告されている物質である(Hum.Mol.Genet.,2014,23(24):6495-6511)。1,8-ANSは、疎水性環境下でのみ蛍光を発する物質であり、親水性環境下では蛍光を発しない(図4A)。一方、FABP5存在下では、1,8-ANSはFABP5との結合により分子周辺が疎水性環境となるため蛍光を発するようになる(図4B)。しかし、FABP5に対する結合定数がより小さい物質がさらに存在すると、その物質が1,8-ANSより優先的にFABP5に結合するため、1,8-ANSは蛍光を発しなくなる(図4C)。上記方法で蛍光強度の上昇を抑制した試験物質は、FABP5蛋白質と結合してその活性を阻害する物質である。
(試験物質によるFABP5阻害活性の測定)
大腸菌由来組換型FABP5を定法により発現させ、精製した。96穴プレートに、精製したFABP5蛋白質、1,8-ANS及び試験物質を添加し、室温にて5分間静置した後、プレートリーダーにて蛍光強度(励起波長:355nm、蛍光波長:480nm)を測定した。試験物質としては、実施例3で用いたGIP上昇抑制作用を有するFABP5阻害剤(Compound2)、及び後述の参考例1で示すようにGIP上昇抑制作用を有する油脂である魚油を用いた。評価系中の試験物質の最終濃度は0.002%~0.1%(w/v)とした。
大腸菌由来組換型FABP5を定法により発現させ、精製した。96穴プレートに、精製したFABP5蛋白質、1,8-ANS及び試験物質を添加し、室温にて5分間静置した後、プレートリーダーにて蛍光強度(励起波長:355nm、蛍光波長:480nm)を測定した。試験物質としては、実施例3で用いたGIP上昇抑制作用を有するFABP5阻害剤(Compound2)、及び後述の参考例1で示すようにGIP上昇抑制作用を有する油脂である魚油を用いた。評価系中の試験物質の最終濃度は0.002%~0.1%(w/v)とした。
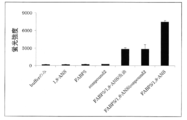
(結果)
評価結果を図5に示す。FABP5と1,8-ANSが共存することによりbufferのみ、又はFABP5や1,8-ANS単独と比較して有意な蛍光強度の上昇が認められた。この蛍光強度の上昇は、GIP上昇抑制作用を有するFABP5阻害剤の添加により統計学的に有意に抑制された(t-test、p<0.05)。また、GIP上昇抑制作用を有する油脂である魚油を添加した場合も、蛍光強度は統計学的に有意に低下した(t-test、p<0.05)。一方、GIP上昇抑制作用を有さない試験物質を添加した場合は、蛍光強度は低下しなかった(データ示さず)。これらの結果は、FABP5の活性を指標に、試験物質のGIP上昇抑制作用を評価することができることを示している。
評価結果を図5に示す。FABP5と1,8-ANSが共存することによりbufferのみ、又はFABP5や1,8-ANS単独と比較して有意な蛍光強度の上昇が認められた。この蛍光強度の上昇は、GIP上昇抑制作用を有するFABP5阻害剤の添加により統計学的に有意に抑制された(t-test、p<0.05)。また、GIP上昇抑制作用を有する油脂である魚油を添加した場合も、蛍光強度は統計学的に有意に低下した(t-test、p<0.05)。一方、GIP上昇抑制作用を有さない試験物質を添加した場合は、蛍光強度は低下しなかった(データ示さず)。これらの結果は、FABP5の活性を指標に、試験物質のGIP上昇抑制作用を評価することができることを示している。
参考例1 魚油のGIP上昇抑制作用
マウス単回食餌試験により、魚油のGIP上昇抑制作用を調べた。18時間絶食したマウス(C57BL/6J、雄性、8週齢、n=10、日本クレア)に、60分間、高脂肪食(HF)食(25%なたね油+5%パーム油)又は、魚油食(15.4%なたね油+5%パーム油+9.6%魚油(10%DHA))を粉末飼料として自由摂餌させた。自由摂餌前、摂餌後60、120、及び240分において各マウスの眼窩静脈叢から採血した。採取した血液を11,000rpm、4℃で10分間遠心分離を行い、血漿を調製し、GIP ELISAキット(ラット/マウス用)(ミリポア)を用いて血中GIP濃度を測定した。試験食摂餌後のマウスにおける血中GIP濃度変化量(ΔGIP)の経時変化、および血中GIP濃度のiAUC(0-4h)を図6A、Bに示す。血中GIP濃度の上昇は、HF食群と比較して魚油食群において統計学的に有意に低減した。
マウス単回食餌試験により、魚油のGIP上昇抑制作用を調べた。18時間絶食したマウス(C57BL/6J、雄性、8週齢、n=10、日本クレア)に、60分間、高脂肪食(HF)食(25%なたね油+5%パーム油)又は、魚油食(15.4%なたね油+5%パーム油+9.6%魚油(10%DHA))を粉末飼料として自由摂餌させた。自由摂餌前、摂餌後60、120、及び240分において各マウスの眼窩静脈叢から採血した。採取した血液を11,000rpm、4℃で10分間遠心分離を行い、血漿を調製し、GIP ELISAキット(ラット/マウス用)(ミリポア)を用いて血中GIP濃度を測定した。試験食摂餌後のマウスにおける血中GIP濃度変化量(ΔGIP)の経時変化、および血中GIP濃度のiAUC(0-4h)を図6A、Bに示す。血中GIP濃度の上昇は、HF食群と比較して魚油食群において統計学的に有意に低減した。
Claims (16)
- 以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)前記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)前記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法。 - 以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)前記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)前記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、食欲抑制剤として評価又は選択する工程、
を含む、食欲抑制剤の評価又は選択方法。 - 以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)前記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)前記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、肥満予防又は改善剤として評価又は選択する工程、
を含む、肥満予防又は改善剤の評価又は選択方法。 - 以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)前記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)前記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、体重増加抑制剤として評価又は選択する工程、
を含む、体重増加抑制剤の評価又は選択方法。 - 以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)前記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)前記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、消化促進剤として評価又は選択する工程、
を含む、消化促進剤の評価又は選択方法。 - 以下の工程(A)~(D):
(A)FABP4遺伝子若しくはFABP5遺伝子、又はFABP4蛋白質若しくはFABP5蛋白質を発現可能な哺乳動物由来の組織又は細胞に、被験物質を接触させる工程、
(B)該哺乳動物由来の組織又は細胞におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C)前記(B)で測定した発現量又は活性を、対照群におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D)前記(C)の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、胃もたれ改善剤として評価又は選択する工程、
を含む、胃もたれ改善剤の評価又は選択方法。 - 前記(B)で測定した発現量又は活性が、前記対照群における発現量又は活性に対して統計学的に有意に減少していた場合に、前記被験物質はGIP上昇抑制効果、食欲抑制効果、肥満予防及び/又は改善効果、体重増加抑制効果、消化促進効果、あるいは胃もたれ改善効果があると評価される、請求項1~6のいずれか1項記載の方法。
- 前記(B)で測定した発現量又は活性が、前記対照群における発現量又は活性を100%としたときに90%以下である場合に、前記被験物質はGIP上昇抑制効果、食欲抑制効果、肥満予防及び/又は改善効果、体重増加抑制効果、消化促進効果、あるいは胃もたれ改善効果があると評価される、請求項1~6のいずれか1項記載の方法。
- 以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')前記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')前記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、GIP上昇抑制剤として評価又は選択する工程、
を含む、GIP上昇抑制剤の評価又は選択方法。 - 以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')前記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')前記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、食欲抑制剤として評価又は選択する工程、
を含む、食欲抑制剤の評価又は選択方法。 - 以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')前記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')前記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、肥満予防又は改善剤として評価又は選択する工程、
を含む、肥満予防又は改善剤の評価又は選択方法。 - 以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')前記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')前記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、体重増加抑制剤として評価又は選択する工程、
を含む、体重増加抑制剤の評価又は選択方法。 - 以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')前記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')前記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、消化促進剤として評価又は選択する工程、
を含む、消化促進剤の評価又は選択方法。 - 以下の工程(A')~(D'):
(A')被験物質を非ヒト哺乳動物に投与する工程、
(B')該非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を測定する工程、
(C')前記(B')で測定した発現量又は活性を、対照群の非ヒト哺乳動物から採取した小腸におけるFABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性と比較する工程、
(D')前記(C')の結果に基づいて、FABP4遺伝子若しくはFABP5遺伝子の発現量、FABP4蛋白質若しくはFABP5蛋白質の発現量、又はFABP4蛋白質若しくはFABP5蛋白質の活性を減少させる被験物質を、胃もたれ改善剤として評価又は選択する工程、
を含む、胃もたれ改善剤の評価又は選択方法。 - 前記(B')で測定した発現量又は活性が、前記対照群における発現量又は活性に対して統計学的に有意に減少していた場合に、前記被験物質はGIP上昇抑制効果、食欲抑制効果、肥満予防及び/又は改善効果、体重増加抑制効果、消化促進効果、あるいは胃もたれ改善効果があると評価される、請求項9~14のいずれか1項記載の方法。
- 前記(B')で測定した発現量又は活性が、前記対照群における発現量又は活性を100%としたときに90%以下である場合に、前記被験物質はGIP上昇抑制効果、食欲抑制効果、肥満予防及び/又は改善効果、体重増加抑制効果、消化促進効果、あるいは胃もたれ改善効果があると評価される、請求項9~14のいずれか1項記載の方法。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US15/128,666 US10132795B2 (en) | 2014-03-24 | 2015-03-06 | Method for evaluating or selecting agent for suppressing GIP level elevation |
| EP15769760.8A EP3124966B1 (en) | 2014-03-24 | 2015-03-06 | Method for evaluating or selecting agent for suppressing gip level elevation |
| CN201580015560.7A CN106133519B (zh) | 2014-03-24 | 2015-03-06 | Gip上升抑制剂的评价或选择方法 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014-060341 | 2014-03-24 | ||
| JP2014060341 | 2014-03-24 | ||
| JP2015040187A JP6223376B2 (ja) | 2014-03-24 | 2015-03-02 | Gip上昇抑制剤の評価又は選択方法 |
| JP2015-040187 | 2015-03-02 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2015146537A1 true WO2015146537A1 (ja) | 2015-10-01 |
Family
ID=54195063
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2015/056603 WO2015146537A1 (ja) | 2014-03-24 | 2015-03-06 | Gip上昇抑制剤の評価又は選択方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US10132795B2 (ja) |
| EP (1) | EP3124966B1 (ja) |
| JP (1) | JP6223376B2 (ja) |
| CN (1) | CN106133519B (ja) |
| WO (1) | WO2015146537A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016214085A (ja) * | 2015-05-14 | 2016-12-22 | 花王株式会社 | 毛成長抑制剤の評価又は選択方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002524517A (ja) * | 1998-09-17 | 2002-08-06 | ブリストル−マイヤーズ スクイブ カンパニー | aP2阻害剤およびその組成物を用いる糖尿病の治療方法 |
| JP2004065194A (ja) * | 2002-08-09 | 2004-03-04 | Sumitomo Chem Co Ltd | 脂肪細胞関連因子の分析方法 |
| JP2011080803A (ja) * | 2009-10-05 | 2011-04-21 | Kao Corp | Gip上昇抑制剤の評価又は選択方法 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1998024464A1 (en) * | 1996-12-03 | 1998-06-11 | Trustees Of Boston University | Specific antagonists for glucose-dependent insulinotropic polypeptide (gip) |
| US7358254B2 (en) | 2001-07-13 | 2008-04-15 | Bristol-Myers Squibb Company | Method for treating atherosclerosis employing an aP2 inhibitor and combination |
| US6831102B2 (en) * | 2001-12-07 | 2004-12-14 | Bristol-Myers Squibb Company | Phenyl naphthol ligands for thyroid hormone receptor |
| PT2403605E (pt) | 2009-03-05 | 2015-08-05 | Harvard College | Composições contendo um anticorpo específico de ap2 ou um seu fragmento, para serem utilizadas no tratamento de diabetes, intolerância à glicose ou resistência à insulina induzida por obesidade |
| WO2011007864A1 (ja) | 2009-07-16 | 2011-01-20 | 花王株式会社 | 血中gip濃度上昇抑制剤 |
| JP5317919B2 (ja) | 2009-10-05 | 2013-10-16 | 花王株式会社 | Gip上昇抑制剤の評価又は選択方法 |
| US9056066B2 (en) | 2011-01-12 | 2015-06-16 | Kao Corporation | Agent for suppressing elevation of blood GIP level, agent for suppressing elevation of blood insulin level, agent for lowering blood triglyceride level after meal ingestion, and agent for suppressing elevation of blood glucose level |
| JP6026723B2 (ja) | 2011-02-22 | 2016-11-16 | 花王株式会社 | Gip上昇抑制剤 |
| JP2012171914A (ja) | 2011-02-22 | 2012-09-10 | Kao Corp | Gip上昇抑制剤 |
| CN102961388A (zh) | 2011-08-30 | 2013-03-13 | 三和淀粉工业株式会社 | 促进glp-1的分泌并且抑制gip的分泌的药剂 |
-
2015
- 2015-03-02 JP JP2015040187A patent/JP6223376B2/ja active Active
- 2015-03-06 EP EP15769760.8A patent/EP3124966B1/en active Active
- 2015-03-06 CN CN201580015560.7A patent/CN106133519B/zh not_active Expired - Fee Related
- 2015-03-06 WO PCT/JP2015/056603 patent/WO2015146537A1/ja active Application Filing
- 2015-03-06 US US15/128,666 patent/US10132795B2/en active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002524517A (ja) * | 1998-09-17 | 2002-08-06 | ブリストル−マイヤーズ スクイブ カンパニー | aP2阻害剤およびその組成物を用いる糖尿病の治療方法 |
| JP2004065194A (ja) * | 2002-08-09 | 2004-03-04 | Sumitomo Chem Co Ltd | 脂肪細胞関連因子の分析方法 |
| JP2011080803A (ja) * | 2009-10-05 | 2011-04-21 | Kao Corp | Gip上昇抑制剤の評価又は選択方法 |
Non-Patent Citations (8)
| Title |
|---|
| DIANE H. SONG ET AL.: "Glucose-Dependent Insulinotropic Polypeptide Enhances Adipocyte Development and Glucose Uptake in Part through Akt Activation", GASTROENTEROLOGY, vol. 3, no. 6, 13 December 2007 (2007-12-13), pages 1796 - 1805, XP022421688 * |
| FURUHASHI: "Fatty Acid-Binding Protein Family", JOURNAL OF JAPAN SOCIETY FOR THE STUDY OF OBESITY, vol. 19, no. 3, 25 December 2013 (2013-12-25), pages 167 - 174, XP008185862 * |
| HONG LAN ET AL.: "Small-molecule inhibitors of FABP4/5 ameliorate dyslipidemia but not insulin resistance in mice with diet-induced obesity", J. LIPID RES., vol. 2, no. 4, 5 April 2011 (2011-04-05), pages 646 - 656, XP055226912, ISSN: 0022-2275 * |
| K. B. COMERFORD ET AL.: "The Effects of Weight Loss on FABP4 and RBP4 in Obese Women with Metabolic Syndrome", HORM. METAB. RES., vol. 46, no. 3, 26 August 2013 (2013-08-26), pages 224 - 231, XP008184884 * |
| KIMITAKA SHIBUE ET AL.: "FABP5 is an essential modulator of fatty acid-induced GIP secretion in enteroendocrine K cells", DIABETOLOGIA, vol. 5 7, no. 1, September 2014 (2014-09-01), pages 766, XP055351043 * |
| MAS R.A.A.SYAMSUNARNO: "Fatty Acid Binding Protein-4 and -5 are Expressed in Intestinal Capillary Endothelial Cells and Regulate Lipid Absorption", CIRCULATION JOURNAL, vol. 78, no. supplement 1, 20 February 2014 (2014-02-20), pages 1737 * |
| RANDI UGLEHOLDT ET AL.: "Transgenic Rescue of Adipocyte Glucose-dependent Insulinotropic Polypeptide Receptor Expression Restores High Fat Diet-induced Body Weight Gain", J. BIOL. CHEM., vol. 6, no. 52, 28 December 2011 (2011-12-28), pages 44632 - 44645, XP055226918, ISSN: 0021-9258 * |
| SHIBUE ET AL.: "Shibosan Ketsugo Tanpaku 5 (FABP5) wa K Saibo ni Okeru Shibo Yudosei K Saibo ni Okeru Shibo Yudosei GIP Bunpi no Seigyo ni Kan'yo suru", DAI 29 KAI THE JAPANESE SOCIETY OF EXPERIMENTAL DIABETES AND OBESITY ON DIAGNOSIS OF DIABETES MELLITUS IN ANIMAL MODELS KOEN YOSHISHU, 19 February 2015 (2015-02-19), pages 48, XP008185736 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016214085A (ja) * | 2015-05-14 | 2016-12-22 | 花王株式会社 | 毛成長抑制剤の評価又は選択方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2015194481A (ja) | 2015-11-05 |
| EP3124966B1 (en) | 2020-04-29 |
| JP6223376B2 (ja) | 2017-11-01 |
| CN106133519A (zh) | 2016-11-16 |
| US20170227526A1 (en) | 2017-08-10 |
| US10132795B2 (en) | 2018-11-20 |
| EP3124966A4 (en) | 2017-09-27 |
| EP3124966A1 (en) | 2017-02-01 |
| CN106133519B (zh) | 2018-01-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Zadjali et al. | SOCS2 deletion protects against hepatic steatosis but worsens insulin resistance in high‐fat‐diet‐fed mice | |
| Yi et al. | Retracted: betatrophin: a hormone that controls pancreatic β cell proliferation | |
| Kosteli et al. | Weight loss and lipolysis promote a dynamic immune response in murine adipose tissue | |
| Hansotia et al. | Extrapancreatic incretin receptors modulate glucose homeostasis, body weight, and energy expenditure | |
| Kim et al. | Obesity-associated improvements in metabolic profile through expansion of adipose tissue | |
| Chandra et al. | Immunoglobulin-like domain containing receptor 1 mediates fat-stimulated cholecystokinin secretion | |
| Ström et al. | Attainment of brown adipocyte features in white adipocytes of hormone-sensitive lipase null mice | |
| Lee et al. | CREB/CRTC2 controls GLP‐1‐dependent regulation of glucose homeostasis | |
| WO2014144777A2 (en) | Lipids that increase insulin sensitivity and methods of using the same | |
| JP5109134B2 (ja) | 病態モデル実験動物、病態モデル実験動物の作出方法及び病態モデル実験動物の利用方法。 | |
| Arivazhagan et al. | Glycation and a spark of ALEs (advanced lipoxidation end products)–igniting RAGE/Diaphanous-1 and cardiometabolic disease | |
| JP6514282B2 (ja) | Gip上昇抑制剤の評価又は選択方法 | |
| JP6223376B2 (ja) | Gip上昇抑制剤の評価又は選択方法 | |
| Arivazhagan et al. | The RAGE/DIAPH1 axis: mediator of obesity and proposed biomarker of human cardiometabolic disease | |
| Majchrzak et al. | Adipocyte fatty acid binding protein (A-FABP) as a potential new therapeutic target for the treatment of obesity-associated cancers | |
| US8337835B2 (en) | Use of an endogenous ligand for peroxisome proliferator activated receptor alpha to treat liver disorders | |
| Wang et al. | High-fat diet-induced hyperinsulinemia promotes the development of prostate adenocarcinoma in prostate-specific Pten−/− mice | |
| Machida et al. | Pancreatic islet neuropeptide Y overexpression has minimal effect on islet morphology and β-cell adaptation to high-fat diet | |
| JP2015528000A (ja) | 代謝調節のための方法および組成物 | |
| Jia et al. | Expression of Kisspeptin-GnRH system is down-regulated in hypothalamic arcuate nucleus of male rats with high-fat diet | |
| JP5328595B2 (ja) | Gip上昇抑制剤の評価又は選択方法 | |
| Sakata et al. | The study of ghrelin secretion and acyl-modification using mice and ghrelinoma cell lines | |
| Al-Rashed et al. | ACSL1 Is a Key Regulator of Inflammatory and Macrophage Foaming Induced by Short-Term Palmitate Exposure or Acute High-Fat Feeding | |
| Valdez et al. | Persistent Inflammatory Lipotoxicity Impedes Pancreatic β-cell Function in Diet-Induced Obese Mice Despite Correction of Glucotoxicity | |
| van Dierendonck et al. | HILPDA uncouples lipid storage in adipose tissue macrophages from inflammation and metabolic dysregulation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 15769760 Country of ref document: EP Kind code of ref document: A1 |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 15128666 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| REEP | Request for entry into the european phase |
Ref document number: 2015769760 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2015769760 Country of ref document: EP |