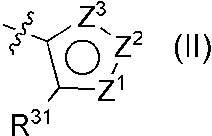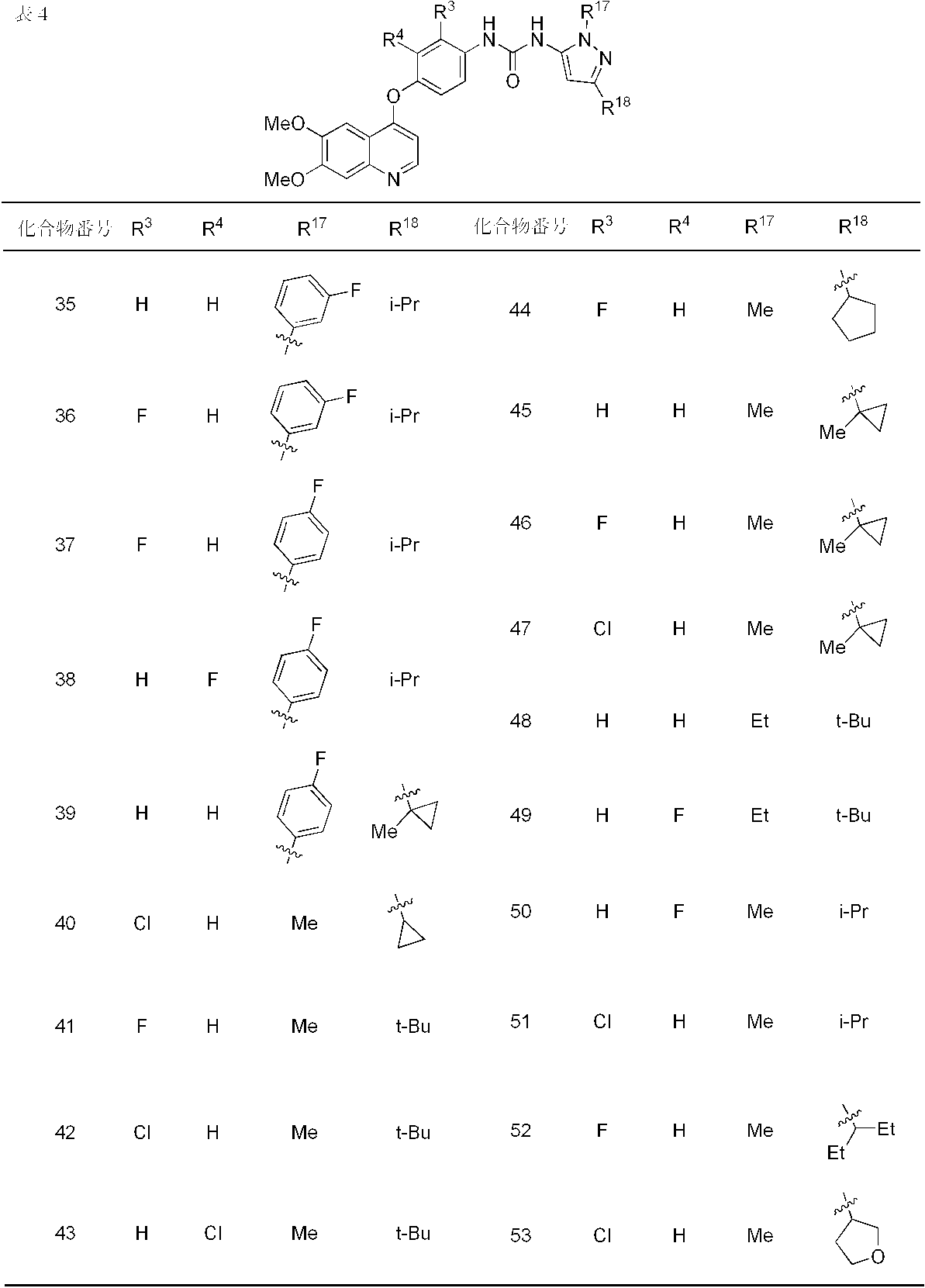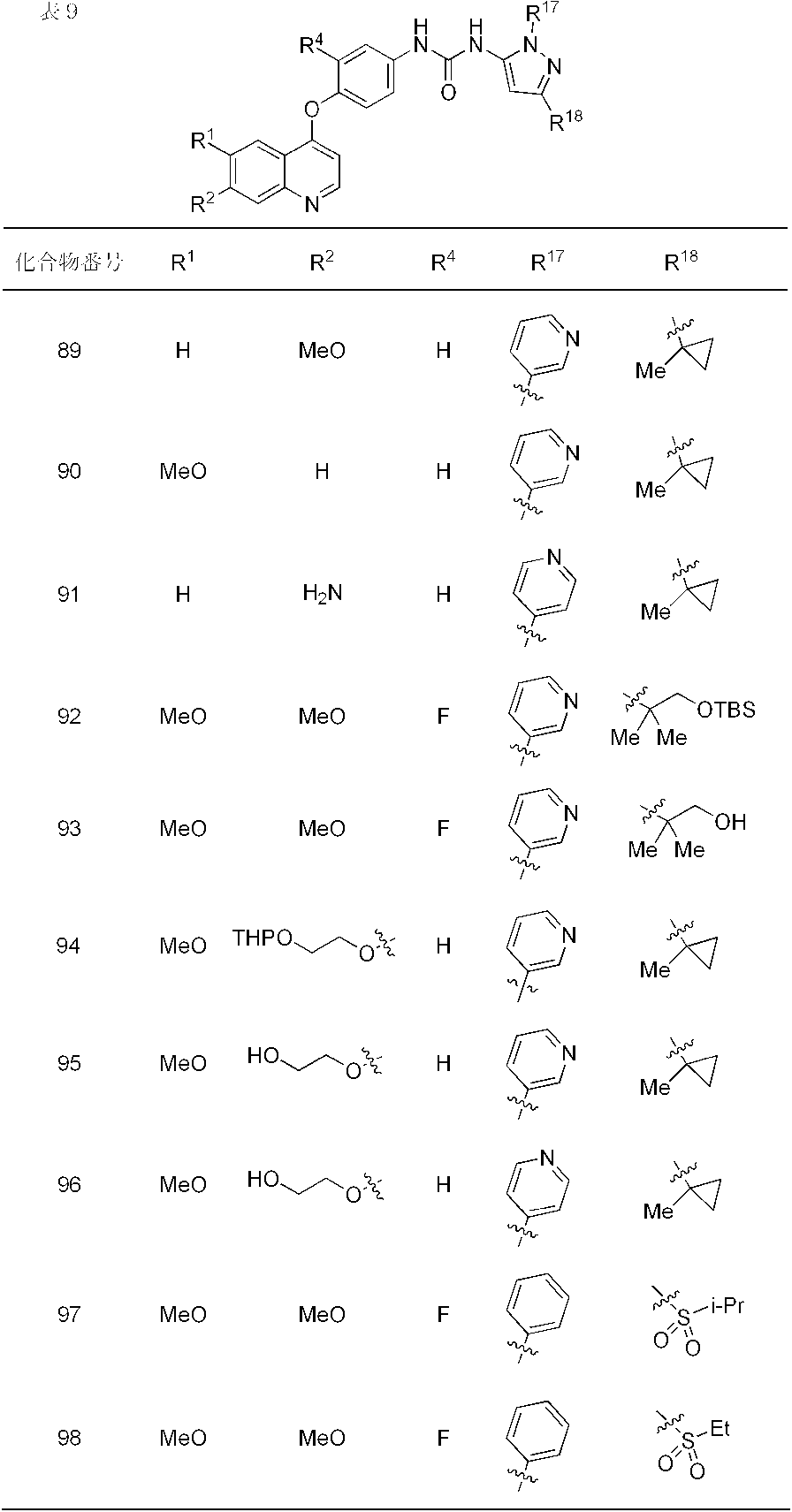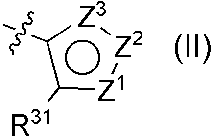WO2012008564A1 - 含窒素芳香族複素環誘導体 - Google Patents
含窒素芳香族複素環誘導体 Download PDFInfo
- Publication number
- WO2012008564A1 WO2012008564A1 PCT/JP2011/066186 JP2011066186W WO2012008564A1 WO 2012008564 A1 WO2012008564 A1 WO 2012008564A1 JP 2011066186 W JP2011066186 W JP 2011066186W WO 2012008564 A1 WO2012008564 A1 WO 2012008564A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- compound
- nitrogen
- pharmaceutically acceptable
- aromatic heterocyclic
- acceptable salt
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
Definitions
- the present invention relates to a nitrogen-containing aromatic heterocyclic derivative having an inhibitory action on fibroblast growth factor receptor (FGFR) ⁇ ⁇ ⁇ or a pharmaceutically acceptable salt thereof.
- FGFR fibroblast growth factor receptor
- FGFR is a receptor-type protein tyrosine kinase and is activated by the binding of its ligand, fibroblast growth factor (FGF). While FGF signals are responsible for many physiological functions such as angiogenesis and wound repair, FGFR is expressed in cells of many tissues and regulates cell phenotypes such as proliferation, differentiation, and survival. Therefore, FGF signal abnormality is thought to be involved in tumor growth by promoting the proliferation and survival of cancer cells. In mammals, FGFR is composed of four subtypes, FGFR1, FGFR2, FGFR3, and FGFR4 [Nature Reviews Cancer, Volume 10, pages 116-129 (2010)].
- FGF fibroblast growth factor
- FGF signal abnormalities are involved in cancer.
- about 10% of patients with estrogen receptor-positive breast cancer have FGFR1 amplification [Cancer Research, 57, 4360-4367 (1997)]
- FGFR2 is highly expressed in about 50% and is a poor prognostic factor
- endometrial cancer 12% of patients have FGFR2 somatic mutations, and the mutated cell line is highly sensitive to FGFR inhibitors [Proceedings of the National Academy of Science of the United States of America (Proc. Natl. Acad. Sci.
- FGFR inhibitors AZD2171 [Clin. Cancer Res., 13, 3051-3057 (2007)] and 4- [3-chloro-4- (cyclopropylaminocarbonyl) Aminophenoxy] -7-methoxy-6-quinolinecarboxamide (see Patent Document 8) showed antitumor activity in a human gastric cancer tumor model.
- PARP poly ADP-ribose polymerase
- FGFR inhibitors are used in various cancers (eg, stomach cancer, endometrial cancer, pituitary tumor, myeloproliferative disease, kidney cancer, bladder cancer, colon cancer, head and neck cancer, Skin cancer, non-Hodgkin lymphoma, brain tumor, breast cancer, ovarian cancer, multiple myeloma, osteosarcoma, etc.), viral infections, autoimmune diseases such as systemic lupus erythematosus, rheumatoid arthritis, hepatitis, kidney disease, etc. and / or Or it is considered useful as a preventive agent.
- cancers eg, stomach cancer, endometrial cancer, pituitary tumor, myeloproliferative disease, kidney cancer, bladder cancer, colon cancer, head and neck cancer, Skin cancer, non-Hodgkin lymphoma, brain tumor, breast cancer, ovarian cancer, multiple myeloma, osteosarcoma, etc.
- viral infections eg, autoimmune diseases such as
- kinase inhibitors containing quinoline derivatives having an aromatic heterocyclic urea structure are known (see Patent Documents 1 to 10). Also known are kinase inhibitors containing a quinoline derivative having a pyrazolourea structure (see Non-Patent Documents 1 to 3).
- An object of the present invention is to provide a nitrogen-containing aromatic heterocyclic derivative having a FGFR inhibitory action or a pharmaceutically acceptable salt thereof.
- the present invention relates to the following (1) to (32).
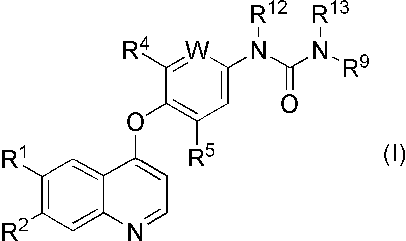
- R 1 and R 2 are the same or different and each represents a hydrogen atom, hydroxy, an optionally substituted lower alkylsulfonyloxy, an optionally substituted lower alkoxy, or —NR 20 R 21 (wherein R 20 and R 21 are the same or different and each represents a hydrogen atom or an optionally substituted lower alkyl), W represents CR 3 (wherein R 3 represents a hydrogen atom, lower alkoxy, or halogen), or a nitrogen atom, R 4 and R 5 are the same or different and each represents a hydrogen atom or halogen, R 9 represents an optionally substituted pyrazolyl, or an optionally substituted isoxazolyl, R 12 and R 13 are the same or different and each represents a hydrogen atom or lower alkyl]
- R 1A and R 2A are the same or different and each represents a hydrogen atom, hydroxy, an optionally substituted lower alkylsulfonyloxy, an optionally substituted lower alkoxy, or —NR 20A R 21A (wherein R 20A and R 21A are the same or different and each represents a hydrogen atom or an optionally substituted lower alkyl), W A represents CR 3A (wherein R 3A represents a hydrogen atom, lower alkoxy, or halogen) or a nitrogen atom; R 4A and R 5A are the same or different and each represents a hydrogen atom or halogen, R 9A represents substituted pyrazolyl (excluding 1-methyl-1H-pyrazol-5-yl and 1,3-dimethyl-1H-pyrazol-5-yl) or substituted isoxazolyl (substituent in the substituted isoxazolyl) Are the same or different and are optionally substituted lower alkyl having 2 or more carbon atoms), R 12
- R 9A is substituted pyrazolyl (excluding 1-methyl-1H-pyrazol-5-yl and 1,3-dimethyl-1H-pyrazol-5-yl) (7) to (9) Or a pharmaceutically acceptable salt thereof.
- R 9A is represented by formula (II)
- Z 1 is CR 28 (wherein R 28 is optionally substituted lower alkyl having 2 or more carbon atoms, lower alkyl sulfanyl, lower alkyl sulfinyl, lower alkyl sulfonyl, having a substituent.
- NR 29 (wherein R 29 represents lower alkyl having 2 or more carbon atoms), and Z 2 represents an oxygen atom, a nitrogen atom, or NR 27 (wherein R 27 represents a hydrogen atom, lower alkyl, or cycloalkyl), Z 3 is a nitrogen atom, NR 30 (wherein R 30 represents lower alkyl, aryl optionally having substituent (s), or aromatic heterocyclic group optionally having substituent (s)) or Represents CH, R 31 represents a hydrogen atom or lower alkyl, (1A) When Z 1 is CR 28 (wherein R 28 is as defined above), (1A-1) Z 2 is an oxygen atom and Z 3 is a nitrogen atom, (1A-2) Z 2 is a nitrogen atom and Z 3 is NR 30 (wherein R 30 is as defined above), (1A-3) Z 2 is NR 27 (wherein R 27 is as defined above), and Z 3 is a nitrogen atom, (2A) When Z 1 is NR 29 (wherein R 29 is as defined above
- Z 1 is CR 28A (wherein R 28A is as defined above), Z 2 is a nitrogen atom and Z 3 is NR 30A (wherein R 30A represents an aryl which may have a substituent or an aromatic heterocyclic group which may have a substituent)
- R 30A represents an aryl which may have a substituent or an aromatic heterocyclic group which may have a substituent
- the nitrogen-containing aromatic heterocyclic derivative or a pharmaceutically acceptable salt thereof according to any one of (11) to (13), wherein R 31 is a hydrogen atom.
- a medicament comprising the nitrogen-containing aromatic heterocyclic derivative or the pharmaceutically acceptable salt thereof according to any one of (7) to (15) as an active ingredient.
- An FGFR inhibitor comprising the nitrogen-containing aromatic heterocyclic derivative or the pharmaceutically acceptable salt thereof according to any one of (7) to (15) as an active ingredient.
- a therapeutic and / or prophylactic agent for a disease involving FGFR comprising as an active ingredient the nitrogen-containing aromatic heterocyclic derivative or the pharmaceutically acceptable salt thereof according to any one of (7) to (15) .
- An antitumor agent comprising the nitrogen-containing aromatic heterocyclic derivative or the pharmaceutically acceptable salt thereof according to any one of (7) to (15) as an active ingredient.
- a therapeutic and / or prophylactic agent for gastric cancer comprising the nitrogen-containing aromatic heterocyclic derivative or the pharmaceutically acceptable salt thereof according to any one of (7) to (15) as an active ingredient.
- a method for inhibiting FGFR comprising a step of administering an effective amount of the nitrogen-containing aromatic heterocyclic derivative or the pharmaceutically acceptable salt thereof according to any one of (7) to (15).
- Treatment of a disease involving FGFR comprising the step of administering an effective amount of the nitrogen-containing aromatic heterocyclic derivative or the pharmaceutically acceptable salt thereof according to any one of (7) to (15) and / or Or prevention methods.
- a method for treating and / or preventing cancer comprising a step of administering an effective amount of the nitrogen-containing aromatic heterocyclic derivative or the pharmaceutically acceptable salt thereof according to any one of (7) to (15).
- a method for treating and / or preventing gastric cancer comprising a step of administering an effective amount of the nitrogen-containing aromatic heterocyclic derivative or the pharmaceutically acceptable salt thereof according to any one of (7) to (15).
- diseases having an FGFR inhibitory action and the like and involving FGFR for example, stomach cancer, endometrial cancer, pituitary tumor, myeloproliferative disease, kidney cancer, bladder cancer, colon cancer
- Head and neck cancer skin cancer, non-Hodgkin lymphoma, brain tumor, breast cancer, ovarian cancer, multiple myeloma, osteosarcoma, virus infection, autoimmune diseases such as systemic lupus erythematosus, rheumatoid arthritis, hepatitis, kidney disease, etc.
- autoimmune diseases such as systemic lupus erythematosus, rheumatoid arthritis, hepatitis, kidney disease, etc.
- -Containing aromatic heterocyclic derivatives or pharmaceutically acceptable salts thereof which are useful for the treatment and / or prevention of.
- Lower alkyl and lower alkyl part of lower alkoxy, lower alkylsulfanyl, lower alkylsulfinyl, lower alkylsulfonyl and lower alkylsulfonyloxy include, for example, linear or branched alkyl having 1 to 10 carbon atoms, and more specifically Specific examples include methyl, ethyl, propyl, isopropyl, butyl, isobutyl, sec-butyl, tert-butyl, pentyl, isopentyl, neopentyl, hexyl, heptyl, octyl, nonyl, decyl and the like.
- Examples of the lower alkyl having 2 or more carbon atoms include linear or branched alkyl having 2 to 10 carbon atoms, and more specifically, ethyl, propyl, isopropyl, butyl, isobutyl, sec-butyl, tert-butyl. Pentyl, isopentyl, neopentyl, hexyl, heptyl, octyl, nonyl, decyl and the like.
- cycloalkyl examples include cycloalkyl having 3 to 8 carbon atoms, and more specifically, cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl, cyclooctyl and the like.
- aryl examples include aryl having 6 to 14 carbon atoms, and more specifically, phenyl, naphthyl, azulenyl, anthryl and the like.
- aliphatic heterocyclic group for example, a 5-membered or 6-membered monocyclic aliphatic heterocyclic group containing at least one atom selected from a nitrogen atom, an oxygen atom and a sulfur atom, and a 3- to 8-membered ring are condensed
- aromatic heterocyclic group for example, a 5-membered or 6-membered monocyclic aromatic heterocyclic group containing at least one atom selected from a nitrogen atom, an oxygen atom and a sulfur atom, and a 3- to 8-membered ring are condensed.
- Halogen means each atom of fluorine, chlorine, bromine and iodine.
- a lower alkyl which may have a substituent, a lower alkyl having 2 or more carbon atoms which may have a substituent, a lower alkoxy which may have a substituent, and a substituent;
- the substituents in the lower alkylsulfonyloxy which may be the same or different, for example, having 1 to 3 substituents, Halogen, hydroxy, sulfanyl, nitro, cyano, carboxy, carbamoyl, C 3-8 cycloalkyl, C 6-14 aryl, optionally substituted aliphatic heterocyclic group (having the substituent Examples of the substituent in the preferable aliphatic heterocyclic group include C 1-10 alkyl), aliphatic heterocyclic oxy, aromatic heterocyclic group, C 1-10 alkoxy, C 3-8 cycloalkoxy, C 6-14 aryloxy, C 7-16 aral
- the optionally substituted C 6-14 aryl [substituent of the C 6-14 aryl optionally having said substituent, for example, may have the substituent C 3 -8 cycloalkyl substituents (a) and the like]
- An aliphatic heterocyclic group, Aromatic heterocyclic group optionally having substituent (s) [As the substituent in the aromatic heterocyclic group optionally having substituent (s), for example, C 3 optionally having substituent (s)] -8 cycloalkyl substituents (a) and the like], C 1-10 alkoxy, C 3-8 cycloalkoxy, C 6-14 aryloxy, C 7-16 aralkyloxy, C 2-11 alkanoyloxy, C 7-15 aroyloxy, C 1-10 alkylsulfanyl, C 1-10 alkylsulfinyl, C 1-10 alkylsulfonyl,
- the optionally substituted C 6-14 aryl [substituent of the C 6-14 aryl optionally having said substituent, for example, may have the substituent C 3 -8 cycloalkyl substituents (a) and the like],
- An aliphatic heterocyclic group, Aromatic heterocyclic group optionally having substituent (s) [As the substituent in the aromatic heterocyclic group optionally having substituent (s), for example, C 3 optionally having substituent (s)] -8 cycloalkyl substituents (a) and the like], C 1-10 alkoxy, C 3-8 cycloalkoxy, C 6-14 aryloxy, C 7-16 aralkyloxy, C 2-11 alkanoyloxy, C 7-15 aroyloxy, C 1-10 alkylsulfanyl, C 1-10 alkylsulf
- C 1-10 alkyl as shown here and C 1-10 alkoxy, C 2-11 alkanoyloxy, C 1-10 alkylsulfanyl, C 1-10 alkylsulfonyl, C 2-11 alkanoyl, C 1-10 alkoxycarbonyl, C 1-10 alkylcarbamoyl, the C 1-10 alkyl moiety of the di- C 1-10 alkylcarbamoyl and tri C 1-10 alkyl silyloxy, for example the groups listed illustrative of the lower alkyl are exemplified.
- the two C 1-10 alkyls in the diC 1-10 alkylcarbamoyl may be the same or different.
- Three C 1-10 alkyl in birds C 1-10 alkylsilyloxy may be the same or different.
- the C 3-8 cycloalkyl and C 3-8 cycloalkyl moiety cycloalkoxy, e.g. groups listed illustrative of the cycloalkyl are exemplified.
- Examples of the aryl moiety of C 6-14 aryl and C 6-14 aryloxy, C 7-15 aroyl, C 7-15 aroyloxy and C 6-14 aryloxycarbonyl include the groups exemplified in the above aryl examples.
- Examples of the aryl moiety of C 7-16 aralkyloxy, C 7-16 aralkyl and C 7-16 aralkyloxycarbonyl include the groups exemplified in the above examples of aryl, and examples of the alkylene moiety include C 1-10 Examples thereof include alkylene, and more specifically, a group in which one hydrogen atom has been removed from the groups exemplified in the lower alkyl.
- Examples of the aliphatic heterocyclic group and the aliphatic heterocyclic group portion of the aliphatic heterocyclic oxy include the groups exemplified in the examples of the aliphatic heterocyclic group.
- the aromatic heterocyclic group has the same meaning as the aromatic heterocyclic group.
- Halogen is synonymous with the halogen.
- Pharmaceutically acceptable salts of compound (I) include, for example, pharmaceutically acceptable acid addition salts, metal salts, ammonium salts, organic amine addition salts, amino acid addition salts and the like.
- Examples of the pharmaceutically acceptable acid addition salt of compound (I) include inorganic acid salts such as hydrochloride, hydrobromide, nitrate, sulfate, phosphate, acetate, oxalate, and maleic acid.
- Organic salts such as salts, fumarate, citrate, benzoate, methanesulfonate, and the like
- pharmaceutically acceptable metal salts include, for example, alkali metal salts such as sodium salt and potassium salt , Alkaline earth metal salts such as magnesium salts and calcium salts, aluminum salts, zinc salts and the like.
- examples of pharmaceutically acceptable ammonium salts include salts such as ammonium and tetramethylammonium.
- Examples of acceptable organic amine addition salts include addition salts such as morpholine and piperidine.
- pharmaceutically acceptable amino acid addition salts include lysine, glycine, Ruaranin, aspartic acid, addition salts of glutamic acid and the like.
- intermediate (V-1) of compound (I-2) in which W is CR 3 (wherein R 3 has the same meaning as described above) is, for example, the following production method 1 Can be manufactured. Production method 1
- Process 1 Compound (IV) is obtained by reacting Compound (II) in a solvent, preferably in the presence of 1 to 100 equivalents of a base, at a temperature between ⁇ 10 ° C. and the boiling point of the solvent used for 5 minutes to 72 hours, Preferably, it can be produced by reacting with 1 to 100 equivalents of compound (III).
- Examples of the base include potassium carbonate, sodium carbonate, diisopropylethylamine, 2,6-lutidine and the like, and these can be used alone or in combination.
- Examples of the solvent include N-methylpyrrolidone (NMP), N, N-dimethylformamide (DMF), N, N-dimethylacetamide (DMA), dimethyl sulfoxide (DMSO), chlorobenzene and the like. Or it can mix and use.
- Compound (III) can be obtained, for example, as a commercial product.
- Compound (II) is, for example, WO97 / 017329, JP-A-11-158149, WO00 / 43366, WO01 / 47890, WO02 / 088110, WO03 / 000660, WO03 / 033472, WO2004 / 018430, WO2004 / 039782, US5773449A, Journal Of Medicinal Chemistry (J. Med. Chem.), 2005, 48 (5), 1359-1366, Journal of Medicinal Chemistry (J. Med. Chem.), 2006, 49 (8), 2440- It can be produced according to the method described in 2455 or the like.
- Compound (V-1) is obtained by adding Compound (IV) in a solvent in the presence of 0.1 to 100% by weight of metal catalyst, preferably 0.1 to 50% by weight of catalyst, based on Compound (IV).
- metal catalyst preferably 0.1 to 50% by weight of catalyst, based on Compound (IV).
- a temperature between 20 ° C. and the boiling point of the solvent used preferably at a temperature between 20 ° C. and the boiling point of the solvent used, in a hydrogen atmosphere under normal pressure or pressure, or from 1 equivalent to a large excess of a suitable amount It can be produced by treating for 5 minutes to 72 hours in the presence of a hydrogen source.
- an appropriate acid can be added to promote the reaction.
- the solvent include ethanol, methanol, ethyl acetate, THF, diethyl ether, water, acetonitrile and the like, and these can be used alone or in combination.
- the metal catalyst include palladium carbon, palladium alumina, palladium hydroxide, palladium hydroxide carbon, palladium chloride, and Wilkinson catalyst.
- Examples of the hydrogen source include formic acid, ammonium formate, sodium formate, and the like.
- Examples of the acid include hydrochloric acid, sulfuric acid, nitric acid, acetic acid, trifluoroacetic acid, trifluoromethanesulfonic acid and the like.
- Compound (V-1) is compound (IV) in a solvent at a temperature between ⁇ 10 ° C. and the boiling point of the solvent used, preferably at a temperature between 20 ° C. and the boiling point of the solvent used. It can also be produced by treating with 1 to 10 equivalents of a reducing agent, preferably for 1 to 10 equivalents relative to compound (IV) for a period of minutes to 72 hours.
- Process 3 Compound (V-1) is obtained by reacting Compound (II) in a solvent, preferably in the presence of 1 to 10 equivalents of a base relative to Compound (II), at a temperature between ⁇ 10 ° C. and the boiling point of the solvent used. It can also be produced by reacting with compound (VI) for 5 minutes to 72 hours, preferably 1 to 10 equivalents. At this time, 0.01 to 30 equivalents of an appropriate additive may be added.
- Examples of the solvent include DMF, DMA, DMSO, chloroform, acetone, methyl ethyl ketone, water and the like, and these can be used alone or in combination.
- Examples of the base include sodium hydroxide and sodium hydride.
- Examples of the additive include tetrabutylammonium bromide.
- Compound (VI) can be obtained, for example, as a commercial product.
- Production method 2 Among compounds (I), intermediate (V-2) of compound (I-3) in which W is a nitrogen atom is, for example, the method described in US20080312232 (especially scheme 10), WO2005 / 121125, or the like It can be manufactured according to.
- Production method 3 Compound (I) is obtained by using WO00 / 43366 or WO02 / using compound (V-1) obtained by production method 1 or compound (V-2) obtained by production method 2 [collectively referred to as compound (V)]. It can be produced in accordance with the method for producing a urea moiety described in 088110, or in accordance therewith.
- X 1 and X 2 are the same or different and each represents a chlorine atom, a bromine atom, an iodine atom, p-toluenesulfonyloxy, methanesulfonyloxy, or trifluoromethanesulfonyloxy
- X represents a halogen
- R 1 , R 2 , R 4 , R 5 , R 9 , R 12 , R 13 and W are as defined above
- R 12a and R 13a are the same or different and are lower in the definition of R 12 and R 13.
- R 12b among the definitions of R 12, represents a primary or secondary lower alkyl
- R 15 and R 16 represent a group obtained by removing one hydrogen atom from a carbon atom bonded to a nitrogen atom of R 12b together with an adjacent carbon atom
- R A and R B which may be the same or different, chlorine atom, bromine atom, or Represents a trichloromethyl oxy
- Process 1 Compound (I-6) is obtained by reacting Compound (V) with Compound (VII) in a solvent at a temperature between ⁇ 10 ° C. and the boiling point of the solvent used for 5 minutes to 72 hours, preferably 1 to 10 equivalents. It can be produced by reacting.
- Examples of the solvent include dichloromethane, chloroform, 1,2-dichloroethane, toluene, ethyl acetate, acetonitrile, diethyl ether, THF, 1,2-dimethoxyethane (DME), dioxane, NMP, DMF, DMA, pyridine and the like. These can be used alone or in combination.
- Compound (VII) can be obtained, for example, as a commercially available product, or can be obtained by a known method [for example, “4th edition Experimental Chemistry Course 20 Organic Synthesis II”, p.473, Maruzen (2001)] or in accordance with it. Or can be produced by the following production method A. Manufacturing method A
- Compound (VII) can be produced, for example, according to the method described in Synth. Commun., 1993, 23 (3), 335, or in accordance therewith. Specifically, compound (VII) is obtained by reacting compound (XV) in a solvent at a temperature between ⁇ 10 ° C. and the boiling point of the solvent used for 5 minutes to 72 hours, preferably 1 to 10 equivalents of diphenylphosphorus. It can be produced by reacting with acid azide (DPPA).
- DPPA acid azide
- pyrazole carboxylic acid (XV-1) is, for example, 1) "Experimental Chemistry Course” 5th Edition, Volume 16, Chapter 1 Synthesis Method of Carboxylic Acid (page 1-34), Maruzen, 2 ), Journal of Heterocyclic Chem. (J. Heterocyclic Chem.), 26 (5), 1389-1392 (1989), and the like.
- Imidazolecarboxylic acid (XV-2) is, for example, 1) Journal of Organic Chemistry (J. Org. Chem.), 1977, 42 (7), 1153-1159, 2) Heterocycles, 2006, 68 (6), 1149-1162, 3) Tetrahedron Lett., 35 (11), 1635-1638 (1994) and the like.
- Isoxazole carboxylic acid (XV-3) can be produced, for example, by the method described in US20100048545 and the like.
- Process 2 Compound (XII) is obtained by reacting Compound (V) in a solvent, preferably in the presence of 1 to 5 equivalents of a base, at a temperature between ⁇ 10 ° C.
- Examples of the solvent include NMP, DMF, DMA, benzene, toluene, hexane, ethyl acetate, THF, dioxane, diethyl ether, dichloromethane, chloroform and the like, and these can be used alone or in combination.
- Examples of the base include dimethylaminopyridine (DMAP), 1,4-diazabicyclo [2.2.2] octane (DABCO), triethylamine, diisopropylethylamine and the like.
- the reducing agent examples include lithium aluminum hydride, diisobutylalumino hydride (DIBAL), lithium borohydride and the like.
- Compound (VIII) and compound (IX-1) can be obtained, for example, as commercial products.
- the compound (XII) is obtained by converting the compound (V) into a reducing agent in a solvent, preferably in the presence of 1 to 10 equivalents, if necessary, for 5 minutes to 72 hours, preferably 1 to 10 equivalents, and preferably Can also be produced by reacting with 1 to 10 equivalents of compound (IX-2).
- Examples of the solvent include methanol, ethanol, dichloromethane, chloroform, 1,2-dichloroethane, toluene, ethyl acetate, acetonitrile, diethyl ether, THF, DME, dioxane, DMF, DMA, NMP, water, and the like. These can be used alone or in combination.
- Examples of the additive include hydrochloric acid, sulfuric acid, formic acid, acetic acid, trifluoroacetic acid, p-toluenesulfonic acid, tetraisopropoxytitanium and the like.
- Compound (IX-2) can be obtained, for example, as a commercial product.
- Process 3 Compound (I-5) can be produced using compound (XII) according to the method described in Step 1 or a modification thereof.
- Process 4 Compound (I) wherein R 12 is primary or secondary lower alkyl and R 13 is lower alkyl is preferably compound (I-5) in a solvent, preferably in the presence of 1 to 10 equivalents of a base.
- Examples of the base include potassium carbonate, potassium hydroxide, sodium hydroxide, sodium methoxide, potassium tert-butoxide, 1,8-diazabicyclo [5.4.0] -7-undecene (DBU), sodium hydride and the like.
- Examples of the solvent include DMF, DMA, NMP, benzene, toluene, hexane, ethyl acetate, DME, THF, dioxane, diethyl ether and the like, and these can be used alone or in combination.
- Compound (XIV) can be obtained, for example, as a commercial product.
- Process 5 Compound (I-4) is a compound in which Compound (V) is used in a solvent, preferably in the presence of 1 to 10 equivalents of a base, at a temperature between ⁇ 10 ° C. and the boiling point of the solvent used, preferably 0 ° C. After reacting with 1 to 10 equivalents of compound (X) for 5 minutes to 72 hours at a temperature between the boiling point of and -10 ° C in the presence of a base, preferably 1 to 10 equivalents of a base. Prepared by reacting with the compound (XI) at a temperature between the boiling point of the solvent used, preferably between 0 ° C. and the boiling point of the solvent used, for 5 minutes to 72 hours, preferably 1 to 10 equivalents. can do.
- Examples of the solvent include dichloromethane, chloroform, 1,2-dichloroethane, toluene, ethyl acetate, acetonitrile, diethyl ether, THF, DME, DMF, DMA, NMP, pyridine and the like, and these are used alone or in combination. be able to.
- Compound (X) can be obtained, for example, as a commercial product.
- Compound (XI) can be obtained, for example, as a commercial product, or can be produced according to WO1999 / 032106 or the method described in Step 2 of Production Method 3 above, or according thereto.
- Process 6 Compound (I) in which R 12 is lower alkyl can be produced using compound (I-4) and compound (XIII) according to the method described in Step 4 or a modification thereof.
- Compound (XIII) can be obtained, for example, as a commercial product.
- Process 7 Compound (I) in which at least one of R 12 and R 13 is lower alkyl is obtained by using the compound (I-6), compound (XIII) and / or compound (XIV) as described in the step 4, Or it can manufacture according to it.
- Compound (XIII) and compound (XIV) can be obtained, for example, as commercial products.
- the intermediates and target compounds in each of the above production methods are isolated and purified by separation and purification methods commonly used in organic synthetic chemistry, such as filtration, extraction, washing, drying, concentration, recrystallization, and various chromatography. be able to.
- the intermediate can be subjected to the next reaction without any particular purification.
- compounds (I) may have stereoisomers such as geometric isomers and optical isomers, tautomers and the like, but all possible isomers including these, and mixtures thereof Are used in or encompassed by the present invention. Also included in compound (I) are compounds in which one or more hydrogen atoms in compound (I) are replaced with deuterium atoms, and these and mixtures thereof are used in the present invention or Is included.
- compound (I) When it is desired to obtain a salt of compound (I), it may be purified as it is when compound (I) is obtained in a salt form, and when it is obtained in a free form, compound (I) is used as a suitable solvent. It may be isolated or purified by dissolving or suspending and forming a salt by adding an acid or a base.
- compound (I) or a pharmaceutically acceptable salt thereof may exist in the form of an adduct with water or various solvents, and these adducts are used in the present invention or are included in the present invention. Is included.
- Test Example 1 Measurement of enzyme inhibitory activity of human FGFR2 Assay buffer [100 mmol / L 4- (2-hydroxyethyl) -1-piperazine ethanesulfonic acid (HEPES), 10 mmol was added to a 384-well polypropylene plate (3657, Corning).
- HEPES (2-hydroxyethyl) -1-piperazine ethanesulfonic acid
- the termination buffer [100 mmol / LHEPES, 15 mmol / L ethylenediaminetetraacetic acid (EDTA), 0.022 vol% Brij-35, 0.17% Coating Reagent 3 [LabChip Coating Reagent 3, Caliper Life Sciences] and 7.2
- the enzyme reaction was stopped by adding 45 ⁇ L of% DMSO, pH 7.5].
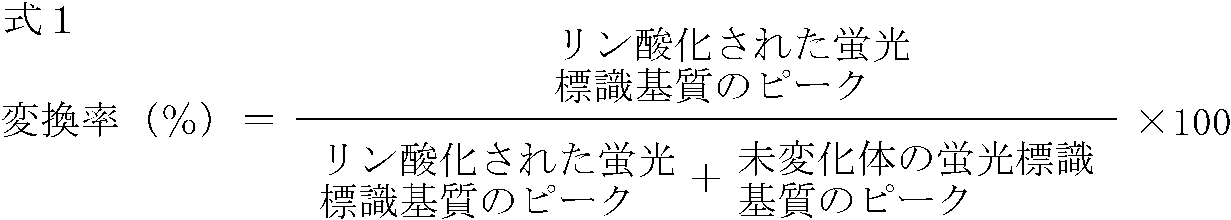
- the reaction solution is aspirated, and voltage and pressure are applied to the flow path, so that the fluorescently-labeled substrate phosphorylated by the enzyme reaction and unlabeled Variant fluorescently labeled substrates were separated by charge difference and the fluorescence intensity at 530 nm was measured for each when excited at 488 nm.
- the enzyme activity is calculated as the conversion rate under the conditions,
- the FGFR2 phosphorylation inhibition rate was evaluated by the following formula 2.
- the test substance concentration was changed in several stages, the inhibition rate of FGFR2 phosphorylation at each concentration was determined, and based on these, the FGFR2 phosphorylation 50% inhibition concentration (IC 50 ) of the test substance was calculated.
- IC 50 50% inhibition concentration
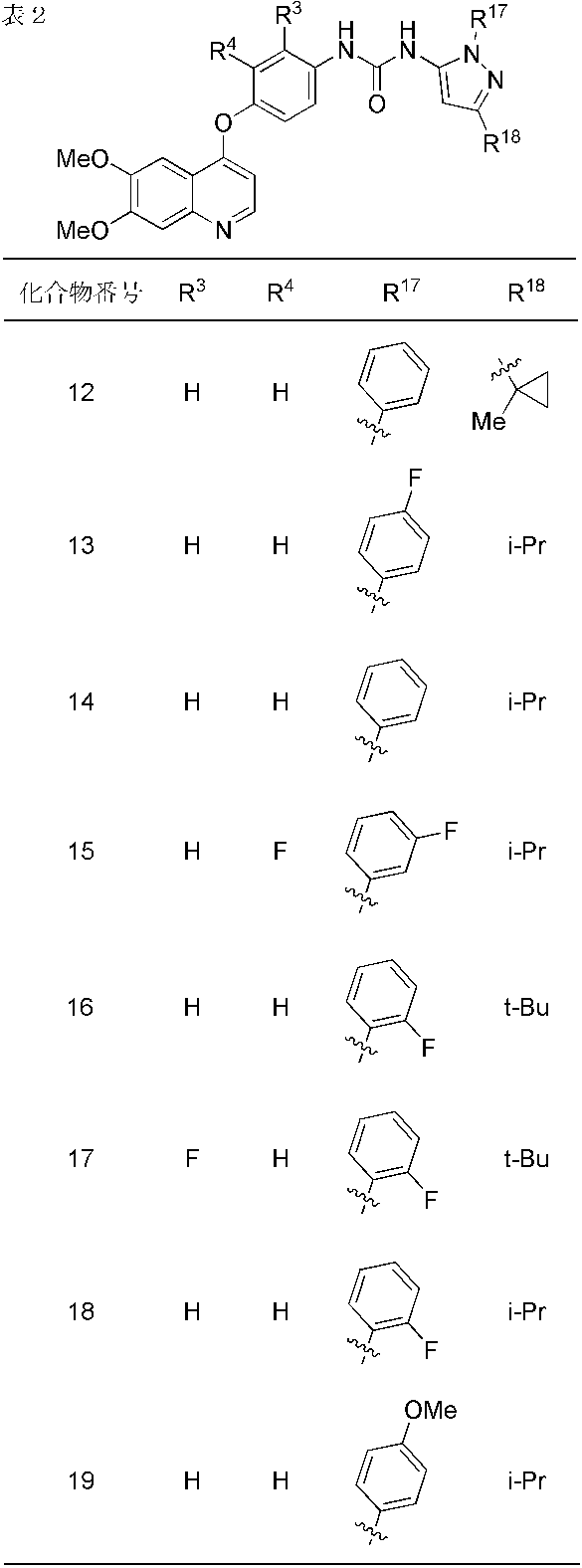
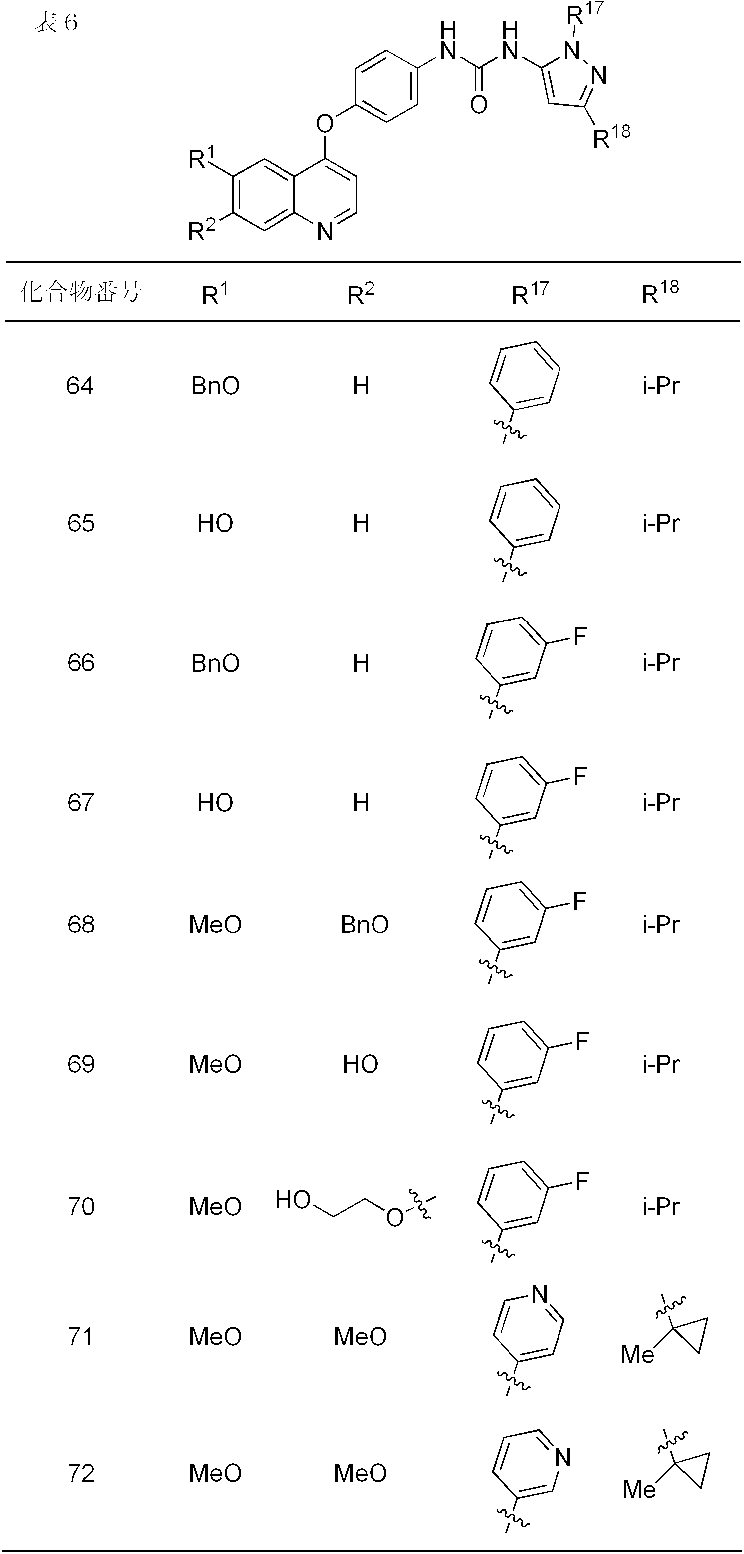
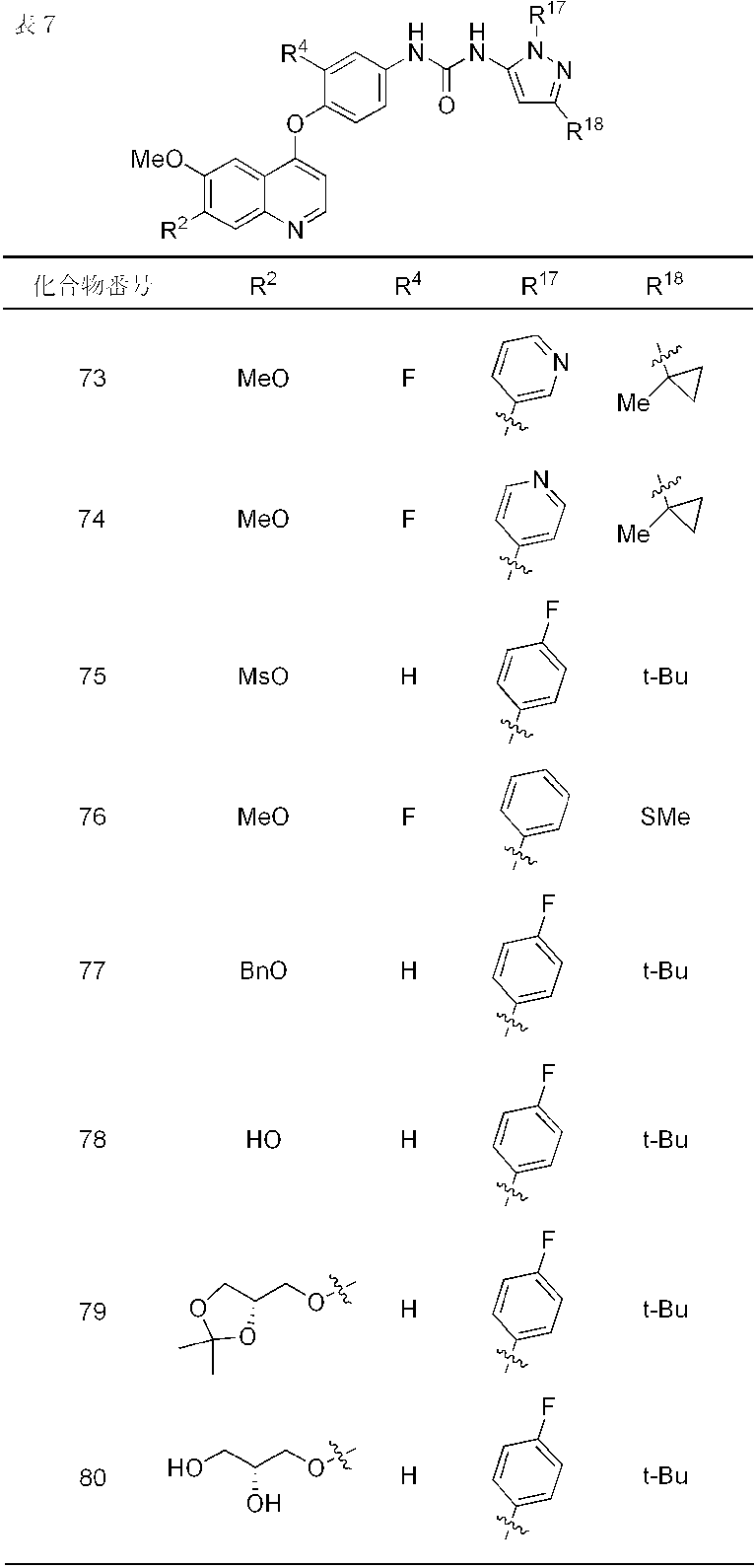
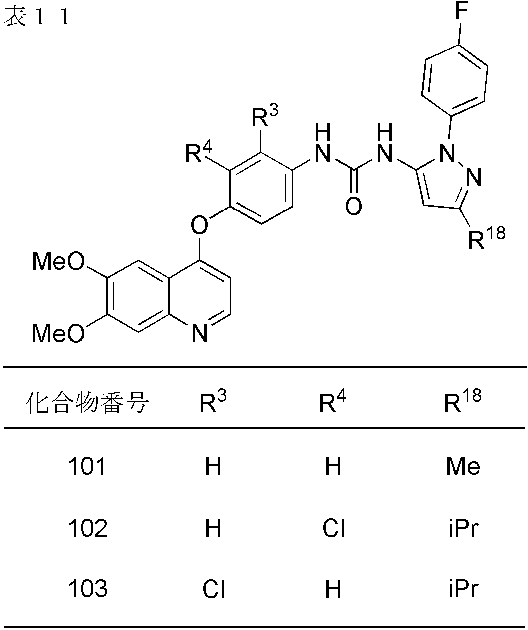
- compounds 1-19, 21-62, 65, 67, 70-76, 80, 82, 84, 86-91, 93 and 95-110 showed IC 50 values less than 100 nmol / L. From the results of the above test, it was confirmed that Compound (I) has FGFR2 phosphorylation inhibitory activity.
- Compound (I) or a pharmaceutically acceptable salt thereof inhibits FGFR, and diseases involving FGFR, such as various cancers (eg, stomach cancer, endometrial cancer, pituitary tumor, bone marrow proliferation, etc. Sex diseases, kidney cancer, bladder cancer, colon cancer, head and neck cancer, skin cancer, non-Hodgkin lymphoma, brain tumor, breast cancer, ovarian cancer, multiple myeloma, osteosarcoma, etc.), virus infection, systemic It is considered useful as a therapeutic and / or prophylactic agent for autoimmune diseases such as systemic lupus erythematosus, rheumatoid arthritis, hepatitis, renal diseases and the like.
- various cancers eg, stomach cancer, endometrial cancer, pituitary tumor, bone marrow proliferation, etc. Sex diseases, kidney cancer, bladder cancer, colon cancer, head and neck cancer, skin cancer, non-Hodgkin lymphoma, brain tumor, breast cancer, ova
- Compound (I) or a pharmaceutically acceptable salt thereof can be administered alone as it is, but it is usually desirable to provide it as various pharmaceutical preparations.
- the pharmaceutical preparation is used for animals or humans.
- the pharmaceutical preparation according to the present invention may contain compound (I) or a pharmaceutically acceptable salt thereof as an active ingredient alone or as a mixture with any other active ingredient for treatment.
- the pharmaceutical formulation is well known in the technical field of pharmaceutics by mixing the active ingredient with one or more pharmaceutically acceptable carriers (eg, diluents, solvents, excipients, etc.). Manufactured by any method.
- oral or parenteral such as intravenous administration.
- examples of the dosage form include tablets and injections.
- tablets suitable for oral administration can be produced using excipients such as lactose, disintegrants such as starch, lubricants such as magnesium stearate, binders such as hydroxypropylcellulose, and the like.
- an injection suitable for parenteral administration can be produced using a diluent or a solvent such as a salt solution, a glucose solution, or a mixed solution of a saline solution and a glucose solution.
- the dose and frequency of administration of compound (I) or a pharmaceutically acceptable salt thereof vary depending on the dosage form, patient age, body weight, nature or severity of symptoms to be treated, etc.
- the dose is 0.01 to 1000 mg, preferably 0.05 to 100 mg per adult, once to several times a day.
- parenteral administration such as intravenous administration
- 0.001 to 1000 mg preferably 0.01 to 100 mg per adult is administered once to several times a day.
- the dose and the number of doses vary depending on the various conditions described above.
- Process 2 5-Cyclopropyl-1-methyl-1H-pyrazole-3-carboxylic acid (Compound A4)
- the title compound A4 was obtained from the compound A3 obtained according to the step 1 according to the step 2 of Reference Example 1.
- Reference Example 3 Process 1 Ethyl 3-methyl-2,4-dioxohexanoate (Compound A5) Lithium hexamethyldisilazide (1 mol / L hexane solution, 12 mL) was added to diethyl ether (60 mL), brought to -78 ° C, and then pentane-3-one (1.0 g) in diethyl ether (15 mL). ) The solution was added. After stirring at ⁇ 78 ° C.
- Process 3 1,5-Diethyl-4-methyl-1H-pyrazole-3-carboxylic acid (Compound A7)
- the title compound A7 was obtained from the compound A6 obtained according to the step 2 according to the step 2 of Reference Example 1.
- Reference example 4 Process 1 5-[(3-Methoxyphenylamino) methylene] -2,2'-dimethyl- [1,3] dioxane-4,6-dione (Compound A8) 3-Methoxyaniline (1.23 g) and 5-methoxymethylene-2,2′-dimethyl- [1,3] dioxane-4,6-dione (1.90 g) were dissolved in 2-propanol (40 mL). Stir at 0 ° C. for 1 hour.
- Process 2 7-Methoxy-1H-quinolin-4-one (Compound A9) Compound A8 (1.22 g) and biphenyl (5.1 g) obtained according to Step 1 were suspended in diphenyl ether (15 mL) and stirred at 220 ° C. for 1.5 hours. After completion of the reaction, the resulting reaction mixture was purified by silica gel column chromatography using chloroform and methanol as developing solvents to obtain the title compound A9 (394 mg, 51% yield).
- Process 3 4-Chloro-7-methoxyquinoline (Compound A10) Compound A9 (394 mg) obtained according to Step 2 was suspended in diisopropylethylamine (3 mL), phosphorus oxychloride (1 mL) was added, and the mixture was stirred at 100 ° C. for 1 hr. Under ice-cooling, water was added to the resulting reaction mixture, and the aqueous layer was neutralized with aqueous sodium hydrogen carbonate solution and extracted with ethyl acetate. The organic layer was washed with water, dried over anhydrous sodium sulfate, and filtered.
- Process 4 4- (7-Methoxyquinolin-4-yloxy) aniline (Compound A11) Sodium hydride (165 mg) was dissolved in DMSO (25 mL) and 4-aminophenol (451 mg) was added. After stirring at room temperature for 10 minutes, a solution of compound A10 (400 mg) obtained in Step 3 in DMSO (4 mL) was added, and the mixture was stirred at 100 ° C. for 3 hours.
- the reaction was stopped by adding water, extracted with chloroform, and the organic layer was washed with 1 mol / L aqueous sodium hydroxide solution and saturated brine, dried over anhydrous sodium sulfate, filtered, and the filtrate was subjected to reduced pressure.
- the residue was purified by silica gel column chromatography using hexane and acetone as developing solvents, and further purified by slurry using acetonitrile to give the title compound A11 (381 mg, 69% yield).
- Process 2 1-Isopropyl-4-nitro-1H-pyrazole (Compound A13) Concentrated sulfuric acid (4 mL) was added to Compound A12 (1.1 g) obtained according to Step 1, then the mixture was brought to 0 ° C., and a mixed solution of nitric acid (2.4 mL) and concentrated sulfuric acid (0.8 mL) was added. After stirring at 80 ° C.
- Process 4 4- (6-Methoxyquinolin-4-yloxy) aniline (Compound A21) Sodium hydride (372 mg) was dissolved in DMSO (50 mL), 4-aminophenol (1.0 g) was added, and the mixture was stirred at room temperature for 10 min, and then compound A20 (900 mg) obtained in Step 3 in DMSO (900 mg) was added. 6 mL) solution was added and stirred at 100 ° C. for 3 hours.
- the reaction mixture obtained was neutralized by adding water and an aqueous sodium hydrogen carbonate solution, and extracted with ethyl acetate. The organic layer was washed with water, dried over anhydrous sodium sulfate, filtered, and filtered. The solvent was distilled off from the solution under reduced pressure, and the resulting residue was purified by silica gel column chromatography using hexane and ethyl acetate as eluents to give the title compound A22 (147 mg, yield 3 steps 10%). Obtained.
- Process 2 4- (6-Benzyloxyquinolin-4-yloxy) aniline (Compound A23) Sodium hydride (593 mg) was dissolved in DMSO (80 mL) and 4-aminophenol (1.6 g) was added. After stirring at room temperature for 10 minutes, Compound A22 (2.0 g) obtained in Step 1 was added, and the mixture was stirred at 100 ° C. overnight. Water was added to the obtained reaction mixture, and the mixture was extracted with chloroform. The organic layer was washed with 1 mol / L aqueous sodium hydroxide solution and saturated brine, dried over anhydrous sodium sulfate, filtered, and the filtrate was depressurized.
- the resulting reaction mixture was basified by adding to an aqueous sodium carbonate solution under ice-cooling, extracted with chloroform, the organic layer was washed with saturated brine, dried over anhydrous sodium sulfate, and filtered. The solvent was distilled off from the filtrate under reduced pressure, and the residue was purified by silica gel column chromatography using hexane and ethyl acetate as developing solvents to obtain the title compound A31 (92 mg, 83% yield).
- Reference Example 11 Process 1 Methyl 3-benzyloxy-2,2-dimethylpropanoate (Compound A32) After dissolving methyl 3-hydroxy-2,2-dimethylpropanoate (1.00 g) in THF (10 mL), sodium hydride (200 mg) was added in portions at 0 ° C, and the mixture was stirred at 0 ° C for 1 hour. , Benzyl bromide (1.94 g) was added and stirred at room temperature overnight.
- the organic layer was washed with 10% hydrochloric acid, saturated aqueous sodium hydrogen carbonate solution and saturated brine, dried over anhydrous sodium sulfate, filtered, and filtered.
- the solvent was distilled off under reduced pressure, and the resulting residue was purified by silica gel column chromatography using hexane and ethyl acetate as developing solvents, and the resulting crude product was used in the next reaction without further purification.
- the total amount of the crude product obtained by the above reaction was dissolved in methanol (3.5 mL), 10% hydrochloric acid (3.5 mL) was added, and the mixture was stirred at 80 ° C. for 6 hr.
- Process 4 3- (1-Benzyloxy-2-methylpropan-2-yl) -1-phenyl-1H-pyrazol-5-amine (Compound A35)
- Compound A34 (150 mg) obtained according to Step 3 was dissolved in ethanol (3 mL) and water (0.15 mL), phenylhydrazine (70.1 mg) and acetic acid (2.0 mg) were added, and the mixture was stirred at 90 ° C. overnight. After cooling the resulting reaction mixture to room temperature, water was added and extracted with ethyl acetate. The organic layer was dried over anhydrous sodium sulfate and filtered, and the solvent was distilled off from the filtrate under reduced pressure.
- Process 2 4- (4-Aminophenoxy) -N- (diphenylmethylene) quinolin-7-amine (Compound A37)
- Compound A36 600.0 mg obtained according to Step 1 was dissolved in DMSO (9.0 mL), 4-aminophenol (382.0 mg) and potassium carbonate (725.6 mg) were added, and microwave (Personal Chemistry, Emrys Optimizer) irradiation was performed. Under stirring at 200 ° C. for 15 minutes.
- the solvent was distilled off from the filtrate under reduced pressure, and the resulting residue was methanol (30 10% hydrochloric acid (30 mL) was added and heated to reflux for 4 hours. After cooling to room temperature, water was added to the resulting reaction mixture, extracted with ethyl acetate, the organic layer was dried over anhydrous sodium sulfate and filtered, and the solvent was distilled off from the filtrate under reduced pressure. The residue was purified by silica gel column chromatography using hexane and ethyl acetate as developing solvents to give the title compound A42 (2.39 g, two-step yield 63%).
- Process 2 4- ⁇ 6-Methoxy-7- [2- (tetrahydro-2H-pyran-2-yloxy) ethoxy] quinolin-4-yloxy ⁇ aniline (Compound A46) Sodium hydride (8 mg) was suspended in DMF (1.7 mL), compound A45 (50 mg) obtained in step 1 was added, and the mixture was stirred at 0 ° C. for 30 min, and further 2- (2-bromoethoxy) Tetrahydro-2H-pyran (29 ⁇ L) was added, and the mixture was stirred at room temperature overnight, and stirred at 50 ° C. for 2 hr. Water was added to the resulting reaction mixture, and the mixture was extracted with ethyl acetate.
- a crude product of tert-butyl 5-amino-3-isopropylthio-1-phenyl-1H-pyrazole-4-carboxylate was obtained according to Step 2 of Reference Example 10. . 6 mol / L hydrochloric acid (5 mL) was added to the obtained crude product, and the mixture was heated to reflux at 80 ° C. for 3 hours. After completion of the reaction, the reaction mixture obtained under ice-cooling was made basic by adding aqueous sodium carbonate solution, extracted with ethyl acetate, the organic layer was dried over anhydrous sodium sulfate, filtered, and the filtrate was subjected to reduced pressure.
- Process 2 5- (6,7-Dimethoxyquinolin-4-yloxy) pyridin-2-amine (Compound A52)
- Compound A51 (1.57 g) obtained according to Step 1, dibenzylideneacetone palladium (201 mg) and diphenyl-2-yldicyclohexylphosphine (182 mg) were added to lithium hexamethyldisilazide (1.0 mol / L THF solution, 6.5 mg). mL) was added and stirred at 65 ° C. for 2 hours.
- Reference Example 18 3-Chloro-4- (6,7-dimethoxyquinolin-4-yloxy) aniline (Compound A53) Add sodium hydride (60 wt%, 0.72 g) to DMSO (10 mL), stir at 50 ° C for 20 min, add 4-amino-2-chlorophenol hydrochloride (1.61 g), and stir at room temperature for 10 min did. 4-Chloro-6,7-dimethoxyquinoline (1.00 g) was added to the obtained reaction mixture, and the mixture was stirred overnight at 100 ° C.
- Reference Example 21 2,3-Dimethyl-4- (6,7-dimethoxyquinolin-4-yloxy) aniline (Compound A56) The title compound A56 (yield 55%) was obtained from 4-amino-2,3-dimethylphenol and 4-chloro-6,7-dimethoxyquinoline according to Reference Example 18.
- Reference Example 22 3,5-dichloro-4- (6,7-dimethoxyquinolin-4-yloxy) aniline (Compound A57)
- the title compound A57 (yield 21%) was obtained from 4-amino-3,5-dichlorophenol and 4-chloro-6,7-dimethoxyquinoline according to Reference Example 18.
- diseases having an FGFR inhibitory action and the like and involving FGFR for example, stomach cancer, endometrial cancer, pituitary tumor, myeloproliferative disease, kidney cancer, bladder cancer, colon cancer
- Head and neck cancer skin cancer, non-Hodgkin lymphoma, brain tumor, breast cancer, ovarian cancer, multiple myeloma, osteosarcoma, virus infection, autoimmune diseases such as systemic lupus erythematosus, rheumatoid arthritis, hepatitis, kidney disease, etc.
- autoimmune diseases such as systemic lupus erythematosus, rheumatoid arthritis, hepatitis, kidney disease, etc.
- -Containing aromatic heterocyclic derivatives or pharmaceutically acceptable salts thereof which are useful for the treatment and / or prevention of.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
式(I)[式中、R1およびR2は、同一または異なって、水素原子等を表し、Wは、CR3(式中、R3は、水素原子等を表す)等を表し、R4およびR5は、同一または異なって、水素原子等を表し、R9は置換基を有していてもよいピラゾリル等を表し、R12およびR13は、同一または異なって水素原子等を表す]で表される含窒素芳香族複素環誘導体(ただし、N-[2-クロロ-4-(6,7-ジメトキシ-4-キノリルオキシ)フェニル]-N'-(5-メチル-3-イソオキサゾリル)ウレアを除く)またはその薬学的に許容される塩、およびそれを有効成分として含有するFGFR阻害剤等を提供する。
Description
本発明は、繊維芽細胞増殖因子受容体 (FGFR) 阻害作用を有する含窒素芳香族複素環誘導体またはその薬学的に許容される塩等に関する。
FGFRは受容体型の蛋白質チロシンキナーゼであり、そのリガンドである繊維芽細胞増殖因子(Fibroblast growth factor;FGF)の結合によって活性化される。FGFシグナルは血管新生や創傷修復等の多くの生理学的機能を担っている一方で、FGFRは多くの組織の細胞に発現しており、増殖、分化、生存等の細胞の表現形を制御していることから、FGFシグナルの異常はがん細胞の増殖や生存を促進することにより腫瘍の成長に関与すると考えられる。哺乳類においては、FGFRは4つのサブタイプ、すなわちFGFR1、FGFR2、FGFR3およびFGFR4で構成されている[ネーチャー・レビューズ・キャンサー(Nature Reviews Cancer)、10巻、116~129頁 (2010年)]。
近年、FGFシグナルの制御異常が、がん(癌)に関与することが報告されている。例えば、エストロゲン受容体陽性乳がん患者の約10%にFGFR1の増幅があること[キャンサー・リサーチ(Cancer Res.)、57巻、4360~4367頁(1997年) ]、悪性の低分化型胃がん患者の約50%でFGFR2が高発現しており、予後不良因子であること[クリニカル・キャンサー・リサーチ(Clin. Cancer Res.)、13巻、3051~3057頁(2007年)]、子宮内膜がん患者の12%にFGFR2の体細胞変異が存在し、変異を有する細胞株はFGFR阻害薬に対して高い感受性を示すこと[プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンス・オブ・ザ・ユナイテッド・ステーツ・オブ・アメリカ(Proc. Natl. Acad. Sci. USA)、105巻、8713~8717頁(2008年)]、膀胱がん患者の約50%にFGFR3の活性化変異があること[ネーチャー・ジェネテックス(Nature Genetics)、23巻、18~19頁(1999年)]およびFGFR4のArg388アレルががん患者の予後や転移と相関すること等が報告されている[キャンサー・リサーチ(Cancer Res.)、62巻、840~847頁(2002年)]。
更に、FGFまたはFGFRの過剰発現や活性化型変異が多くのがん(例えば、下垂体腫瘍、骨髄増殖性疾患、腎がん、膀胱がん、大腸がん、頭頸部がん、皮膚がん、非ホジキンリンパ腫、脳腫瘍、乳がん、卵巣がん、多発性骨髄腫、骨肉腫等)で報告されている[エキスパート・オピニオン・オン・セラピューティック・ターゲッツ(Expert Opinion on Therapeutic Targets)、6巻、469~482頁(2002年)、ネーチャー(Nature)、411巻、355~365頁(2001年)]。
また、FGFR阻害剤であるAZD2171[クリニカル・キャンサー・リサーチ(Clin. Cancer Res.)、13巻、3051~3057頁(2007年)]および4-[3-クロロ-4-(シクロプロピルアミノカルボニル)アミノフェノキシ]-7-メトキシ-6-キノリンカルボキサミド (特許文献8参照) はヒト胃がん腫瘍モデルで抗腫瘍活性を示した。
さらに、FGFRを阻害するとその下流のシグナルが抑制され、それによりポリADPリボースポリメラーゼ(PARP)が切断されることが報告されており[ジャーナル・オブ・ヘパトロジー(Journal of Hepatology)、50巻、118~127頁(2009年)]、さらに、PARPの切断によりアポトーシスが誘導されることが報告されている[ザ・ジャーナル・オブ・バイオロジカル・ケミストリー(THE JOURNAL OF BIOLOGICAL CHEMISTRY), 273巻, 50号,33533-33539頁(1998年)]。そして、アポトーシスの誘導は、がん、ウイルス感染、全身性エリテマトーデス等の自己免疫疾患、関節リウマチ、肝炎、腎疾患等の治療につながると考えられている。[蛋白質核酸酵素, 38巻, 2号, 102-108頁(1993年), 蛋白質核酸酵素, 44巻, 10号,1477-1486頁(1999年)]
以上のことから、FGFR阻害剤は様々ながん(例えば、胃がん、子宮内膜がん、下垂体腫瘍、骨髄増殖性疾患、腎がん、膀胱がん、大腸がん、頭頸部がん、皮膚がん、非ホジキンリンパ腫、脳腫瘍、乳がん、卵巣がん、多発性骨髄腫、骨肉腫等)、ウイルス感染、全身性エリテマトーデス等の自己免疫疾患、関節リウマチ、肝炎、腎疾患等の治療および/または予防剤として有用であると考えられる。
さらに、FGFRを阻害するとその下流のシグナルが抑制され、それによりポリADPリボースポリメラーゼ(PARP)が切断されることが報告されており[ジャーナル・オブ・ヘパトロジー(Journal of Hepatology)、50巻、118~127頁(2009年)]、さらに、PARPの切断によりアポトーシスが誘導されることが報告されている[ザ・ジャーナル・オブ・バイオロジカル・ケミストリー(THE JOURNAL OF BIOLOGICAL CHEMISTRY), 273巻, 50号,33533-33539頁(1998年)]。そして、アポトーシスの誘導は、がん、ウイルス感染、全身性エリテマトーデス等の自己免疫疾患、関節リウマチ、肝炎、腎疾患等の治療につながると考えられている。[蛋白質核酸酵素, 38巻, 2号, 102-108頁(1993年), 蛋白質核酸酵素, 44巻, 10号,1477-1486頁(1999年)]
以上のことから、FGFR阻害剤は様々ながん(例えば、胃がん、子宮内膜がん、下垂体腫瘍、骨髄増殖性疾患、腎がん、膀胱がん、大腸がん、頭頸部がん、皮膚がん、非ホジキンリンパ腫、脳腫瘍、乳がん、卵巣がん、多発性骨髄腫、骨肉腫等)、ウイルス感染、全身性エリテマトーデス等の自己免疫疾患、関節リウマチ、肝炎、腎疾患等の治療および/または予防剤として有用であると考えられる。
一方、芳香族複素環ウレア構造を有するキノリン誘導体を含むキナーゼ阻害剤が知られている(特許文献1~10参照)。
また、ピラゾロウレア構造を有するキノリン誘導体を含むキナーゼ阻害剤が知られている(非特許文献1~3参照)。
また、ピラゾロウレア構造を有するキノリン誘導体を含むキナーゼ阻害剤が知られている(非特許文献1~3参照)。
アメリカン・アソシエーション・フォー・キャンサー・リサーチ(AACR) 2003年7月11-14日 「#36 アゾリル・キノリン-ウレア・デリバティブス:ア・ノーベル・シリーズ・オブ・ポテント・オーラリー・アクティブ・ブイイージーエフ・レセプター・チロシン・キナーゼ・インヒビターズ(Azolyl Quinoline-Urea Derivatives: A Novel Series of Potent Orally ActiveVEGF Receptor Tyrosine Kinase Inhibitors)」
「ジャーナル・オブ・メディシナル・ケミストリー(J. Med. Chem.)」、2010年、第53巻、p.357
「ジャーナル・オブ・アメリカン・ケミカル・ソサイエティ(J. Am. Chem. Soc.)」、2009年、第131巻、p.13286
本発明の目的は、FGFR阻害作用を有する含窒素芳香族複素環誘導体またはその薬学的に許容される塩等を提供することにある。
本発明は、以下の(1)~(32)に関する。
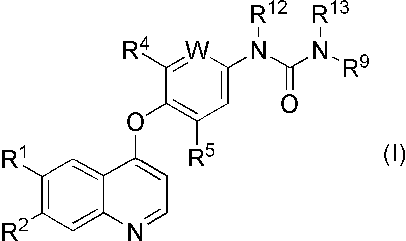
(1) 式(I)
(1) 式(I)
[式中、R1およびR2は、同一または異なって、水素原子、ヒドロキシ、置換基を有していてもよい低級アルキルスルホニルオキシ、置換基を有していてもよい低級アルコキシ、または-NR20R21(式中、R20およびR21は、同一または異なって、水素原子、または置換基を有していてもよい低級アルキルを表す)を表し、Wは、CR3(式中、R3は、水素原子、低級アルコキシ、またはハロゲンを表す)、または窒素原子を表し、
R4およびR5は、同一または異なって、水素原子、またはハロゲンを表し、
R9は、置換基を有していてもよいピラゾリル、または、置換基を有していてもよいイソオキサゾリルを表し、
R12およびR13は、同一または異なって、水素原子、または低級アルキルを表す]
で表される含窒素芳香族複素環誘導体(ただし、N-[2-クロロ-4-(6,7-ジメトキシ-4-キノリルオキシ)フェニル]-N’-(5-メチル-3-イソオキサゾリル)ウレアを除く)
またはその薬学的に許容される塩を有効成分として含有する繊維芽細胞増殖因子受容体(FGFR) 阻害剤。
(2) R5が水素原子である(1)記載のFGFR阻害剤。
(3) R1およびR2が、同一または異なって、置換基を有していてもよい低級アルコキシである(1)または(2)記載のFGFR阻害剤。
(4) WがCR3(式中、R3は、前記と同義である)である(1)~(3)のいずれかに記載のFGFR阻害剤。
(5) R9が、置換基を有していてもよいピラゾリルである(1)~(4)のいずれかに記載のFGFR阻害剤。
(6) R12およびR13が水素原子である(1)~(5)のいずれかに記載のFGFR阻害剤。
(7) 式(I-1)
R4およびR5は、同一または異なって、水素原子、またはハロゲンを表し、
R9は、置換基を有していてもよいピラゾリル、または、置換基を有していてもよいイソオキサゾリルを表し、
R12およびR13は、同一または異なって、水素原子、または低級アルキルを表す]
で表される含窒素芳香族複素環誘導体(ただし、N-[2-クロロ-4-(6,7-ジメトキシ-4-キノリルオキシ)フェニル]-N’-(5-メチル-3-イソオキサゾリル)ウレアを除く)
またはその薬学的に許容される塩を有効成分として含有する繊維芽細胞増殖因子受容体(FGFR) 阻害剤。
(2) R5が水素原子である(1)記載のFGFR阻害剤。
(3) R1およびR2が、同一または異なって、置換基を有していてもよい低級アルコキシである(1)または(2)記載のFGFR阻害剤。
(4) WがCR3(式中、R3は、前記と同義である)である(1)~(3)のいずれかに記載のFGFR阻害剤。
(5) R9が、置換基を有していてもよいピラゾリルである(1)~(4)のいずれかに記載のFGFR阻害剤。
(6) R12およびR13が水素原子である(1)~(5)のいずれかに記載のFGFR阻害剤。
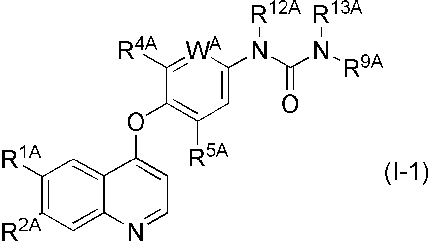
(7) 式(I-1)
[式中、R1AおよびR2Aは、同一または異なって、水素原子、ヒドロキシ、置換基を有していてもよい低級アルキルスルホニルオキシ、置換基を有していてもよい低級アルコキシ、または-NR20AR21A(式中、R20AおよびR21Aは、同一または異なって、水素原子、または置換基を有していてもよい低級アルキルを表す)を表し、
WAは、CR3A(式中R3Aは、水素原子、低級アルコキシ、またはハロゲンを表す)または窒素原子を表し、
R4AおよびR5Aは、同一または異なって、水素原子、またはハロゲンを表し、
R9Aは、置換ピラゾリル(ただし、1-メチル-1H-ピラゾール-5-イル、および1,3-ジメチル-1H-ピラゾール-5-イルは除く)、または、置換イソオキサゾリル(該置換イソオキサゾリルにおける置換基は、同一または異なって、置換基を有していてもよい炭素数2以上の低級アルキルである)を表し、
R12AおよびR13Aは、同一または異なって、水素原子、または低級アルキルを表す]で表される含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(8) R1AおよびR2Aが、同一または異なって、置換基を有していてもよい低級アルコキシである(7)記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(9) WAが、CR3A(式中、R3Aは、前記と同義である)である(7)または(8)記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(10) R9Aが、置換ピラゾリル(ただし、1-メチル-1H-ピラゾール-5-イル、および1,3-ジメチル-1H-ピラゾール-5-イルは除く)である(7)~(9)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(11) R9Aが、式(II)
WAは、CR3A(式中R3Aは、水素原子、低級アルコキシ、またはハロゲンを表す)または窒素原子を表し、
R4AおよびR5Aは、同一または異なって、水素原子、またはハロゲンを表し、
R9Aは、置換ピラゾリル(ただし、1-メチル-1H-ピラゾール-5-イル、および1,3-ジメチル-1H-ピラゾール-5-イルは除く)、または、置換イソオキサゾリル(該置換イソオキサゾリルにおける置換基は、同一または異なって、置換基を有していてもよい炭素数2以上の低級アルキルである)を表し、
R12AおよびR13Aは、同一または異なって、水素原子、または低級アルキルを表す]で表される含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(8) R1AおよびR2Aが、同一または異なって、置換基を有していてもよい低級アルコキシである(7)記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(9) WAが、CR3A(式中、R3Aは、前記と同義である)である(7)または(8)記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(10) R9Aが、置換ピラゾリル(ただし、1-メチル-1H-ピラゾール-5-イル、および1,3-ジメチル-1H-ピラゾール-5-イルは除く)である(7)~(9)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(11) R9Aが、式(II)
[式中、
Z1は、C-R28(式中、R28は、置換基を有していてもよい炭素数2以上の低級アルキル、低級アルキルスルファニル、低級アルキルスルフィニル、低級アルキルスルホニル、置換基を有していてもよいシクロアルキル、脂肪族複素環基を表す)、またはN-R29(式中、R29は、炭素数2以上の低級アルキルを表す)を表し、Z2は、酸素原子、窒素原子、またはN-R27(式中、R27は、水素原子、低級アルキル、またはシクロアルキルを表す)を表し、
Z3は、窒素原子、N-R30(式中、R30は、低級アルキル、置換基を有していてもよいアリール、または置換基を有していてもよい芳香族複素環基を表す)またはCHを表し、
R31は、水素原子、または低級アルキルを表し、
(1A) Z1がC-R28(式中、R28は、前記と同義である)であるとき、
(1A-1) Z2が酸素原子であり、Z3が窒素原子であるか、
(1A-2) Z2が窒素原子であり、Z3がN-R30(式中、R30は、前記と同義である)であるか、
(1A-3) Z2がN-R27(式中、R27は、前記と同義である)であり、Z3が窒素原子であるか、
(2A) Z1がN-R29(式中、R29は、前記と同義である)であるとき、
Z2が窒素原子であり、Z3がCHである]
で表される(7)~(9)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(12) Z1がC-R28A(式中、R28Aは、置換基を有していてもよい炭素数2以上の低級アルキルを表す)であり、Z2が窒素原子であり、Z3がN-R30(式中、R30は、前記と同義である)である(11)記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(13) Z1がC-R28A(式中、R28Aは、前記と同義である)であり、
Z2が窒素原子であり、Z3がN-R30A(式中、R30Aは、置換基を有していてもよいアリール、または置換基を有していてもよい芳香族複素環基を表す)である(11)記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(14) R31が水素原子である(11)~(13)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(15) R12AおよびR13Aが、水素原子である(7)~(14)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(16) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する医薬。
(17) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有するFGFR阻害剤。
(18) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有するFGFRが関与する疾患の治療および/または予防剤。
(19) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する抗腫瘍剤。
(20) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する胃癌の治療および/または予防剤。
(21) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含むFGFR阻害方法。
(22) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含むFGFRが関与する疾患の治療および/または予防方法。
(23) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含む癌の治療および/または予防方法。
(24) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含む胃癌の治療および/または予防方法。
(25) FGFR阻害剤の製造のための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
(26) FGFRが関与する疾患の治療および/または予防剤の製造のための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
(27) 抗腫瘍剤の製造のための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
(28) 胃癌の治療および/または予防剤の製造のための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
(29) FGFR阻害に使用するための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(30) FGFRが関与する疾患の治療および/または予防に使用するための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(31) 癌の治療および/または予防に使用するための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(32) 胃癌の治療および/または予防に使用するための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
Z1は、C-R28(式中、R28は、置換基を有していてもよい炭素数2以上の低級アルキル、低級アルキルスルファニル、低級アルキルスルフィニル、低級アルキルスルホニル、置換基を有していてもよいシクロアルキル、脂肪族複素環基を表す)、またはN-R29(式中、R29は、炭素数2以上の低級アルキルを表す)を表し、Z2は、酸素原子、窒素原子、またはN-R27(式中、R27は、水素原子、低級アルキル、またはシクロアルキルを表す)を表し、
Z3は、窒素原子、N-R30(式中、R30は、低級アルキル、置換基を有していてもよいアリール、または置換基を有していてもよい芳香族複素環基を表す)またはCHを表し、
R31は、水素原子、または低級アルキルを表し、
(1A) Z1がC-R28(式中、R28は、前記と同義である)であるとき、
(1A-1) Z2が酸素原子であり、Z3が窒素原子であるか、
(1A-2) Z2が窒素原子であり、Z3がN-R30(式中、R30は、前記と同義である)であるか、
(1A-3) Z2がN-R27(式中、R27は、前記と同義である)であり、Z3が窒素原子であるか、
(2A) Z1がN-R29(式中、R29は、前記と同義である)であるとき、
Z2が窒素原子であり、Z3がCHである]
で表される(7)~(9)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(12) Z1がC-R28A(式中、R28Aは、置換基を有していてもよい炭素数2以上の低級アルキルを表す)であり、Z2が窒素原子であり、Z3がN-R30(式中、R30は、前記と同義である)である(11)記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(13) Z1がC-R28A(式中、R28Aは、前記と同義である)であり、
Z2が窒素原子であり、Z3がN-R30A(式中、R30Aは、置換基を有していてもよいアリール、または置換基を有していてもよい芳香族複素環基を表す)である(11)記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(14) R31が水素原子である(11)~(13)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(15) R12AおよびR13Aが、水素原子である(7)~(14)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(16) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する医薬。
(17) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有するFGFR阻害剤。
(18) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有するFGFRが関与する疾患の治療および/または予防剤。
(19) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する抗腫瘍剤。
(20) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する胃癌の治療および/または予防剤。
(21) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含むFGFR阻害方法。
(22) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含むFGFRが関与する疾患の治療および/または予防方法。
(23) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含む癌の治療および/または予防方法。
(24) (7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含む胃癌の治療および/または予防方法。
(25) FGFR阻害剤の製造のための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
(26) FGFRが関与する疾患の治療および/または予防剤の製造のための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
(27) 抗腫瘍剤の製造のための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
(28) 胃癌の治療および/または予防剤の製造のための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
(29) FGFR阻害に使用するための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(30) FGFRが関与する疾患の治療および/または予防に使用するための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(31) 癌の治療および/または予防に使用するための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
(32) 胃癌の治療および/または予防に使用するための(7)~(15)のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
本発明により、例えば、FGFR阻害作用等を有し、FGFRが関与する疾患(例えば、胃がん、子宮内膜がん、下垂体腫瘍、骨髄増殖性疾患、腎がん、膀胱がん、大腸がん、頭頸部がん、皮膚がん、非ホジキンリンパ腫、脳腫瘍、乳がん、卵巣がん、多発性骨髄腫、骨肉腫、ウイルス感染、全身性エリテマトーデス等の自己免疫疾患、関節リウマチ、肝炎、腎疾患等)の治療および/または予防に有用な含窒素芳香族複素環誘導体またはその薬学的に許容される塩等が提供される。
以下、式(I)で表される化合物を化合物(I)という。他の式番号の化合物についても同様である。
式(I)および式(I-1)の各基の定義において、
低級アルキル、ならびに低級アルコキシ、低級アルキルスルファニル、低級アルキルスルフィニル、低級アルキルスルホニルおよび低級アルキルスルホニルオキシの低級アルキル部分としては、例えば直鎖または分岐状の炭素数1~10のアルキルが挙げられ、より具体的にはメチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、ペンチル、イソペンチル、ネオペンチル、ヘキシル、ヘプチル、オクチル、ノニル、デシル等が挙げられる。
式(I)および式(I-1)の各基の定義において、
低級アルキル、ならびに低級アルコキシ、低級アルキルスルファニル、低級アルキルスルフィニル、低級アルキルスルホニルおよび低級アルキルスルホニルオキシの低級アルキル部分としては、例えば直鎖または分岐状の炭素数1~10のアルキルが挙げられ、より具体的にはメチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、ペンチル、イソペンチル、ネオペンチル、ヘキシル、ヘプチル、オクチル、ノニル、デシル等が挙げられる。
炭素数2以上の低級アルキルとしては、例えば直鎖または分岐状の炭素数2~10のアルキルが挙げられ、より具体的にはエチル、プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、ペンチル、イソペンチル、ネオペンチル、ヘキシル、ヘプチル、オクチル、ノニル、デシル等が挙げられる。
シクロアルキルとしては、例えば、炭素数3~8のシクロアルキルが挙げられ、より具体的にはシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル等が挙げられる。
シクロアルキルとしては、例えば、炭素数3~8のシクロアルキルが挙げられ、より具体的にはシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル等が挙げられる。
アリールとしては、例えば炭素数6~14のアリールが挙げられ、より具体的にはフェニル、ナフチル、アズレニル、アントリル等が挙げられる。
脂肪族複素環基としては、例えば窒素原子、酸素原子および硫黄原子から選ばれる少なくとも1個の原子を含む5員または6員の単環性脂肪族複素環基、3~8員の環が縮合した二環または三環性で窒素原子、酸素原子および硫黄原子から選ばれる少なくとも1個の原子を含む縮環性脂肪族複素環基等が挙げられ、より具体的にはアジリジニル、アゼチジニル、ピロリジニル、ピペリジノ、ピペリジニル、アゼパニル、1,2,5,6-テトラヒドロピリジル、イミダゾリジニル、ピラゾリジニル、ピペラジニル、ホモピペラジニル、ピラゾリニル、オキシラニル、オキセタニル、テトラヒドロフラニル、テトラヒドロ-2H-ピラニル、5,6-ジヒドロ-2H-ピラニル、ジオキソラニル、ジオキサニル、オキサゾリジニル、モルホリノ、モルホリニル、チオキサゾリジニル、チオモルホリニル、2H-オキサゾリル、2H-チオキサゾリル、ジヒドロインドリル、ジヒドロイソインドリル、ジヒドロベンゾフラニル、ベンゾイミダゾリジニル、ジヒドロベンゾオキサゾリル、ジヒドロベンゾチオキサゾリル、ベンゾジオキソリニル、テトラヒドロキノリル、テトラヒドロイソキノリル、ジヒドロ-2H-クロマニル、ジヒドロ-1H-クロマニル、ジヒドロ-2H-チオクロマニル、ジヒドロ-1H-チオクロマニル、テトラヒドロキノキサリニル、テトラヒドロキナゾリニル、ジヒドロベンゾジオキシニル等が挙げられる。
脂肪族複素環基としては、例えば窒素原子、酸素原子および硫黄原子から選ばれる少なくとも1個の原子を含む5員または6員の単環性脂肪族複素環基、3~8員の環が縮合した二環または三環性で窒素原子、酸素原子および硫黄原子から選ばれる少なくとも1個の原子を含む縮環性脂肪族複素環基等が挙げられ、より具体的にはアジリジニル、アゼチジニル、ピロリジニル、ピペリジノ、ピペリジニル、アゼパニル、1,2,5,6-テトラヒドロピリジル、イミダゾリジニル、ピラゾリジニル、ピペラジニル、ホモピペラジニル、ピラゾリニル、オキシラニル、オキセタニル、テトラヒドロフラニル、テトラヒドロ-2H-ピラニル、5,6-ジヒドロ-2H-ピラニル、ジオキソラニル、ジオキサニル、オキサゾリジニル、モルホリノ、モルホリニル、チオキサゾリジニル、チオモルホリニル、2H-オキサゾリル、2H-チオキサゾリル、ジヒドロインドリル、ジヒドロイソインドリル、ジヒドロベンゾフラニル、ベンゾイミダゾリジニル、ジヒドロベンゾオキサゾリル、ジヒドロベンゾチオキサゾリル、ベンゾジオキソリニル、テトラヒドロキノリル、テトラヒドロイソキノリル、ジヒドロ-2H-クロマニル、ジヒドロ-1H-クロマニル、ジヒドロ-2H-チオクロマニル、ジヒドロ-1H-チオクロマニル、テトラヒドロキノキサリニル、テトラヒドロキナゾリニル、ジヒドロベンゾジオキシニル等が挙げられる。
芳香族複素環基としては、例えば窒素原子、酸素原子および硫黄原子から選ばれる少なくとも1個の原子を含む5員または6員の単環性芳香族複素環基、3~8員の環が縮合した二環または三環性で窒素原子、酸素原子および硫黄原子から選ばれる少なくとも1個の原子を含む縮環性芳香族複素環基等が挙げられ、より具体的にはフリル、チエニル、ピロリル、イミダゾリル、ピラゾリル、オキサゾリル、イソオキサゾリル、オキサジアゾリル、チアゾリル、イソチアゾリル、チアジアゾリル、トリアゾリル、テトラゾリル、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル、ベンゾフラニル、ベンゾチオフェニル、ベンゾオキサゾリル、ベンゾチアゾリル、イソインドリル、インドリル、インダゾリル、ベンゾイミダゾリル、ベンゾトリアゾリル、オキサゾロピリミジニル、チアゾロピリミジニル、ピロロピリジニル、ピロロピリミジニル、イミダゾピリジニル、プリニル、キノリニル、イソキノリニル、シンノリニル、フタラジニル、キナゾリニル、キノキサリニル、ナフチリジニル等が挙げられる。
ハロゲンは、フッ素、塩素、臭素、ヨウ素の各原子を意味する。
(i) 置換基を有していてもよい低級アルキル、置換基を有していてもよい炭素数2以上の低級アルキル、置換基を有していてもよい低級アルコキシ、および置換基を有していてもよい低級アルキルスルホニルオキシにおける置換基としては、同一または異なって、例えば置換数1~3の、
ハロゲン、ヒドロキシ、スルファニル、ニトロ、シアノ、カルボキシ、カルバモイル、C3-8シクロアルキル、C6-14アリール、置換基を有していてもよい脂肪族複素環基(該置換基を有していてもよい脂肪族複素環基における置換基としては、例えば、C1-10アルキル等が挙げられる)、脂肪族複素環オキシ、芳香族複素環基、
C1-10アルコキシ、C3-8シクロアルコキシ、C6-14アリールオキシ、C7-16アラルキルオキシ、C2-11アルカノイルオキシ、C7-15アロイルオキシ、
C1-10アルキルスルファニル、
-NRXRY(式中、RXおよびRYは同一または異なって、水素原子、C1-10アルキル、C3-8シクロアルキル、C6-14アリール、芳香族複素環基、C7-16アラルキル、C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニルまたはC7-16アラルキルオキシカルボニルを表す)、
C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニル、C6-14アリールオキシカルボニル、C1-10アルキルカルバモイル、ジC1-10アルキルカルバモイルおよびトリC1-10アルキルシリルオキシ
からなる群から選ばれる置換基が挙げられる。
(ii) 置換ピラゾリル、置換基を有していてもよいピラゾリル、置換基を有していてもよいイソオキサゾリル、置換基を有していてもよいアリール、および置換基を有していてもよい芳香族複素環基における置換基としては、同一または異なって、例えば置換数1~3の、
ハロゲン、ヒドロキシ、スルファニル、ニトロ、シアノ、カルボキシ、カルバモイル、置換基を有していてもよいC1-10アルキル[該置換基を有していてもよいC1-10アルキルにおける置換基としては、例えば、前記置換基を有していてもよい低級アルキル等における置換基(i)の例示で挙げた基等が挙げられる]、置換基を有していてもよいC3-8シクロアルキル[該置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)としては、例えば、前記置換基を有していてもよい低級アルキル等における置換基(i)の例示で挙げた基に加えC1-10アルキル、トリフルオロメチル等が挙げられる]、
置換基を有していてもよいC6-14アリール[該置換基を有していてもよいC6-14アリールにおける置換基としては、例えば、前記置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)等が挙げられる]、
脂肪族複素環基、
置換基を有していてもよい芳香族複素環基[該置換基を有していてもよい芳香族複素環基における置換基としては、例えば、前記置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)等が挙げられる]、
C1-10アルコキシ、C3-8シクロアルコキシ、C6-14アリールオキシ、C7-16アラルキルオキシ、C2-11アルカノイルオキシ、C7-15アロイルオキシ、
C1-10アルキルスルファニル、C1-10アルキルスルフィニル、C1-10アルキルスルホニル、
-NRX1RY1(式中、RX1およびRY1は同一または異なって、水素原子、C1-10アルキル、C3-8シクロアルキル、C6-14アリール、芳香族複素環基、C7-16アラルキル、C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニルまたはC7-16アラルキルオキシカルボニルを表す)、
C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニル、C6-14アリールオキシカルボニル、C1-10アルキルカルバモイルおよびジC1-10アルキルカルバモイル、
からなる群から選ばれる置換基が挙げられる。
(iii) 置換基を有していてもよいシクロアルキルにおける置換基としては、同一または異なって、例えば置換数1~3の、
オキソ、ハロゲン、ヒドロキシ、スルファニル、ニトロ、シアノ、カルボキシ、カルバモイル、置換基を有していてもよいC1-10アルキル[該置換基を有していてもよいC1-10アルキルにおける置換基としては、例えば、前記置換基を有していてもよい低級アルキル等における置換基(i)の例示で挙げた基等が挙げられる]、
置換基を有していてもよいC3-8シクロアルキル[該置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)としては、例えば、前記置換基を有していてもよい低級アルキル等における置換基(i)の例示で挙げた基に加えC1-10アルキル、トリフルオロメチル等が挙げられる]、
置換基を有していてもよいC6-14アリール[該置換基を有していてもよいC6-14アリールにおける置換基としては、例えば、前記置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)等が挙げられる]、
脂肪族複素環基、
置換基を有していてもよい芳香族複素環基[該置換基を有していてもよい芳香族複素環基における置換基としては、例えば、前記置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)等が挙げられる]、
C1-10アルコキシ、C3-8シクロアルコキシ、C6-14アリールオキシ、C7-16アラルキルオキシ、C2-11アルカノイルオキシ、C7-15アロイルオキシ、
C1-10アルキルスルファニル、C1-10アルキルスルフィニル、C1-10アルキルスルホニル、
-NRX2RY2(式中、RX2およびRY2は同一または異なって、水素原子、C1-10アルキル、C3-8シクロアルキル、C6-14アリール、芳香族複素環基、C7-16アラルキル、C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニルまたはC7-16アラルキルオキシカルボニルを表す)、
C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニル、C6-14アリールオキシカルボニル、C1-10アルキルカルバモイルおよびジC1-10アルキルカルバモイル、
からなる群から選ばれる置換基が挙げられる。
(i) 置換基を有していてもよい低級アルキル、置換基を有していてもよい炭素数2以上の低級アルキル、置換基を有していてもよい低級アルコキシ、および置換基を有していてもよい低級アルキルスルホニルオキシにおける置換基としては、同一または異なって、例えば置換数1~3の、
ハロゲン、ヒドロキシ、スルファニル、ニトロ、シアノ、カルボキシ、カルバモイル、C3-8シクロアルキル、C6-14アリール、置換基を有していてもよい脂肪族複素環基(該置換基を有していてもよい脂肪族複素環基における置換基としては、例えば、C1-10アルキル等が挙げられる)、脂肪族複素環オキシ、芳香族複素環基、
C1-10アルコキシ、C3-8シクロアルコキシ、C6-14アリールオキシ、C7-16アラルキルオキシ、C2-11アルカノイルオキシ、C7-15アロイルオキシ、
C1-10アルキルスルファニル、
-NRXRY(式中、RXおよびRYは同一または異なって、水素原子、C1-10アルキル、C3-8シクロアルキル、C6-14アリール、芳香族複素環基、C7-16アラルキル、C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニルまたはC7-16アラルキルオキシカルボニルを表す)、
C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニル、C6-14アリールオキシカルボニル、C1-10アルキルカルバモイル、ジC1-10アルキルカルバモイルおよびトリC1-10アルキルシリルオキシ
からなる群から選ばれる置換基が挙げられる。
(ii) 置換ピラゾリル、置換基を有していてもよいピラゾリル、置換基を有していてもよいイソオキサゾリル、置換基を有していてもよいアリール、および置換基を有していてもよい芳香族複素環基における置換基としては、同一または異なって、例えば置換数1~3の、
ハロゲン、ヒドロキシ、スルファニル、ニトロ、シアノ、カルボキシ、カルバモイル、置換基を有していてもよいC1-10アルキル[該置換基を有していてもよいC1-10アルキルにおける置換基としては、例えば、前記置換基を有していてもよい低級アルキル等における置換基(i)の例示で挙げた基等が挙げられる]、置換基を有していてもよいC3-8シクロアルキル[該置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)としては、例えば、前記置換基を有していてもよい低級アルキル等における置換基(i)の例示で挙げた基に加えC1-10アルキル、トリフルオロメチル等が挙げられる]、
置換基を有していてもよいC6-14アリール[該置換基を有していてもよいC6-14アリールにおける置換基としては、例えば、前記置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)等が挙げられる]、
脂肪族複素環基、
置換基を有していてもよい芳香族複素環基[該置換基を有していてもよい芳香族複素環基における置換基としては、例えば、前記置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)等が挙げられる]、
C1-10アルコキシ、C3-8シクロアルコキシ、C6-14アリールオキシ、C7-16アラルキルオキシ、C2-11アルカノイルオキシ、C7-15アロイルオキシ、
C1-10アルキルスルファニル、C1-10アルキルスルフィニル、C1-10アルキルスルホニル、
-NRX1RY1(式中、RX1およびRY1は同一または異なって、水素原子、C1-10アルキル、C3-8シクロアルキル、C6-14アリール、芳香族複素環基、C7-16アラルキル、C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニルまたはC7-16アラルキルオキシカルボニルを表す)、
C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニル、C6-14アリールオキシカルボニル、C1-10アルキルカルバモイルおよびジC1-10アルキルカルバモイル、
からなる群から選ばれる置換基が挙げられる。
(iii) 置換基を有していてもよいシクロアルキルにおける置換基としては、同一または異なって、例えば置換数1~3の、
オキソ、ハロゲン、ヒドロキシ、スルファニル、ニトロ、シアノ、カルボキシ、カルバモイル、置換基を有していてもよいC1-10アルキル[該置換基を有していてもよいC1-10アルキルにおける置換基としては、例えば、前記置換基を有していてもよい低級アルキル等における置換基(i)の例示で挙げた基等が挙げられる]、
置換基を有していてもよいC3-8シクロアルキル[該置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)としては、例えば、前記置換基を有していてもよい低級アルキル等における置換基(i)の例示で挙げた基に加えC1-10アルキル、トリフルオロメチル等が挙げられる]、
置換基を有していてもよいC6-14アリール[該置換基を有していてもよいC6-14アリールにおける置換基としては、例えば、前記置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)等が挙げられる]、
脂肪族複素環基、
置換基を有していてもよい芳香族複素環基[該置換基を有していてもよい芳香族複素環基における置換基としては、例えば、前記置換基を有していてもよいC3-8シクロアルキルにおける置換基(a)等が挙げられる]、
C1-10アルコキシ、C3-8シクロアルコキシ、C6-14アリールオキシ、C7-16アラルキルオキシ、C2-11アルカノイルオキシ、C7-15アロイルオキシ、
C1-10アルキルスルファニル、C1-10アルキルスルフィニル、C1-10アルキルスルホニル、
-NRX2RY2(式中、RX2およびRY2は同一または異なって、水素原子、C1-10アルキル、C3-8シクロアルキル、C6-14アリール、芳香族複素環基、C7-16アラルキル、C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニルまたはC7-16アラルキルオキシカルボニルを表す)、
C2-11アルカノイル、C7-15アロイル、C1-10アルコキシカルボニル、C6-14アリールオキシカルボニル、C1-10アルキルカルバモイルおよびジC1-10アルキルカルバモイル、
からなる群から選ばれる置換基が挙げられる。
ここで示したC1-10アルキルならびにC1-10アルコキシ、C2-11アルカノイルオキシ、C1-10アルキルスルファニル、C1-10アルキルスルホニル、C2-11アルカノイル、C1-10アルコキシカルボニル、C1-10アルキルカルバモイル、ジC1-10アルキルカルバモイルおよびトリC1-10アルキルシリルオキシのC1-10アルキル部分としては、例えば前記低級アルキルの例示で挙げた基が例示される。ジC1-10アルキルカルバモイルにおける2つのC1-10アルキルは同一でも異なっていてもよい。トリC1-10アルキルシリルオキシにおける3つのC1-10アルキルは同一でも異なっていてもよい。
C3-8シクロアルキルおよびC3-8シクロアルコキシのシクロアルキル部分としては、例えば前記シクロアルキルの例示で挙げた基が例示される。
C6-14アリールならびにC6-14アリールオキシ、C7-15アロイル、C7-15アロイルオキシおよびC6-14アリールオキシカルボニルのアリール部分としては、例えば前記アリールの例示で挙げた基が例示される。
C6-14アリールならびにC6-14アリールオキシ、C7-15アロイル、C7-15アロイルオキシおよびC6-14アリールオキシカルボニルのアリール部分としては、例えば前記アリールの例示で挙げた基が例示される。
C7-16アラルキルオキシ、C7-16アラルキルおよびC7-16アラルキルオキシカルボニルのアリール部分としては、例えば前記アリールの例示で挙げた基が例示され、アルキレン部分としては、例えばC1-10のアルキレンが挙げられ、より具体的には前記低級アルキルの例示で挙げた基から水素原子を1つ除いた基が挙げられる。
脂肪族複素環基および脂肪族複素環オキシの脂肪族複素環基部分としては、例えば前記脂肪族複素環基の例示で挙げた基が例示される。
脂肪族複素環基および脂肪族複素環オキシの脂肪族複素環基部分としては、例えば前記脂肪族複素環基の例示で挙げた基が例示される。
芳香族複素環基は、前記芳香族複素環基と同義である。
ハロゲンは、前記ハロゲンと同義である。
化合物(I)の薬学的に許容される塩は、例えば薬学的に許容される酸付加塩、金属塩、アンモニウム塩、有機アミン付加塩、アミノ酸付加塩等を包含する。化合物(I)の薬学的に許容される酸付加塩としては、例えば塩酸塩、臭化水素酸塩、硝酸塩、硫酸塩、リン酸塩等の無機酸塩、酢酸塩、シュウ酸塩、マレイン酸塩、フマル酸塩、クエン酸塩、安息香酸塩、メタンスルホン酸塩等の有機酸塩等が挙げられ、薬学的に許容される金属塩としては、例えばナトリウム塩、カリウム塩等のアルカリ金属塩、マグネシウム塩、カルシウム塩等のアルカリ土類金属塩、アルミニウム塩、亜鉛塩等が挙げられ、薬学的に許容されるアンモニウム塩としては、例えばアンモニウム、テトラメチルアンモニウム等の塩が挙げられ、薬学的に許容される有機アミン付加塩としては、例えばモルホリン、ピペリジン等の付加塩が挙げられ、薬学的に許容されるアミノ酸付加塩としては、例えばリジン、グリシン、フェニルアラニン、アスパラギン酸、グルタミン酸等の付加塩が挙げられる。
ハロゲンは、前記ハロゲンと同義である。
化合物(I)の薬学的に許容される塩は、例えば薬学的に許容される酸付加塩、金属塩、アンモニウム塩、有機アミン付加塩、アミノ酸付加塩等を包含する。化合物(I)の薬学的に許容される酸付加塩としては、例えば塩酸塩、臭化水素酸塩、硝酸塩、硫酸塩、リン酸塩等の無機酸塩、酢酸塩、シュウ酸塩、マレイン酸塩、フマル酸塩、クエン酸塩、安息香酸塩、メタンスルホン酸塩等の有機酸塩等が挙げられ、薬学的に許容される金属塩としては、例えばナトリウム塩、カリウム塩等のアルカリ金属塩、マグネシウム塩、カルシウム塩等のアルカリ土類金属塩、アルミニウム塩、亜鉛塩等が挙げられ、薬学的に許容されるアンモニウム塩としては、例えばアンモニウム、テトラメチルアンモニウム等の塩が挙げられ、薬学的に許容される有機アミン付加塩としては、例えばモルホリン、ピペリジン等の付加塩が挙げられ、薬学的に許容されるアミノ酸付加塩としては、例えばリジン、グリシン、フェニルアラニン、アスパラギン酸、グルタミン酸等の付加塩が挙げられる。
次に化合物(I)の製造法について説明する。
なお、以下に示す製造法において、定義した基が該製造法の条件下で変化するかまたは該製造法を実施するのに不適切な場合、有機合成化学で常用される保護基の導入および除去方法[例えば、プロテクティブ・グループス・イン・オーガニック・シンセシス第3版 (Protective Groups in Organic Synthesis, third edition)、グリーン(T.W.Greene)著、John Wiley & Sons Inc.(1999年)等に記載の方法]等を用いることにより、目的化合物を製造することができる。また、必要に応じて置換基導入等の反応工程の順序を変えることもできる。
なお、以下に示す製造法において、定義した基が該製造法の条件下で変化するかまたは該製造法を実施するのに不適切な場合、有機合成化学で常用される保護基の導入および除去方法[例えば、プロテクティブ・グループス・イン・オーガニック・シンセシス第3版 (Protective Groups in Organic Synthesis, third edition)、グリーン(T.W.Greene)著、John Wiley & Sons Inc.(1999年)等に記載の方法]等を用いることにより、目的化合物を製造することができる。また、必要に応じて置換基導入等の反応工程の順序を変えることもできる。
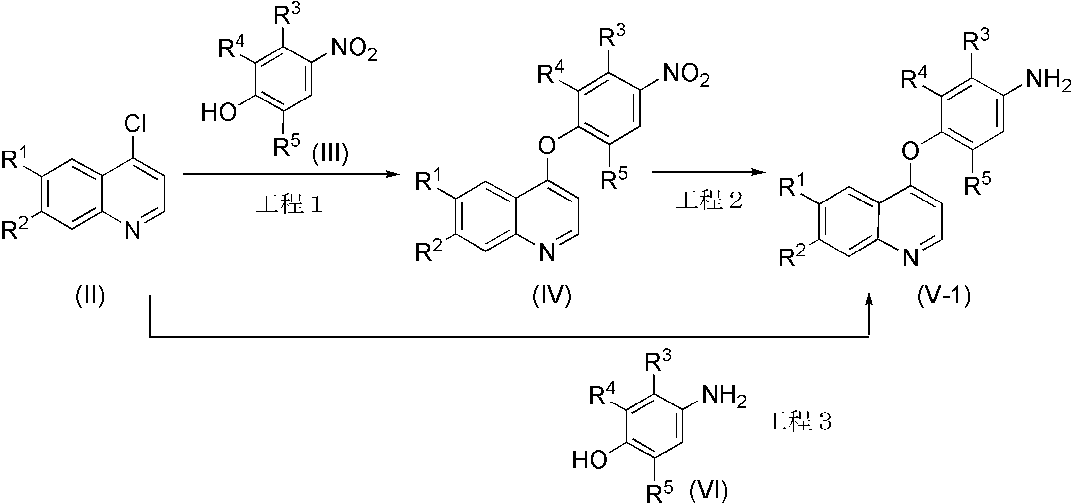
化合物(I)のうち、WがCR3(式中、R3は、前記と同義である)である化合物(I-2)の中間体(V-1)は、例えば、以下の製造法1により製造することができる。
製造法1
製造法1
(式中、R1、R2、R3、R4およびR5は、それぞれ前記と同義である)
工程1
化合物(IV)は、化合物(II)を、溶媒中、必要により好ましくは1~100当量の塩基の存在下、-10℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~100当量の化合物(III)と反応させることにより製造することができる。
工程1
化合物(IV)は、化合物(II)を、溶媒中、必要により好ましくは1~100当量の塩基の存在下、-10℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~100当量の化合物(III)と反応させることにより製造することができる。
塩基としては、例えば、炭酸カリウム、炭酸ナトリウム、ジイソプロピルエチルアミン、2,6-ルチジン等が挙げられ、これらを単独でまたは混合して用いることができる。
溶媒としては、例えば、N-メチルピロリドン(NMP)、N,N-ジメチルホルムアミド(DMF)、N,N-ジメチルアセトアミド(DMA)、ジメチルスルホキシド(DMSO)、クロロベンゼン等が挙げられ、これらを単独でまたは混合して用いることができる。
溶媒としては、例えば、N-メチルピロリドン(NMP)、N,N-ジメチルホルムアミド(DMF)、N,N-ジメチルアセトアミド(DMA)、ジメチルスルホキシド(DMSO)、クロロベンゼン等が挙げられ、これらを単独でまたは混合して用いることができる。
化合物(III)は、例えば、市販品として得ることができる。
化合物(II)は、例えば、WO97/017329、特開平11-158149、WO00/43366、WO01/47890、WO02/088110、WO03/000660、WO03/033472、WO2004/018430、WO2004/039782、US5773449A、ジャーナル・オブ・メディシナル・ケミストリー(J. Med. Chem.), 2005, 48(5), 1359-1366、ジャーナル・オブ・メディシナル・ケミストリー(J. Med. Chem.), 2006, 49(8), 2440-2455等に記載の方法、またはそれらに準じて製造することができる。
工程2
化合物(V-1)は、化合物(IV)を、溶媒中、化合物(IV)に対して0.1~100 重量%の金属触媒存在下、好ましくは、0.1~50 重量%の触媒存在下、-10℃と用いる溶媒の沸点との間の温度で、好ましくは20℃と用いる溶媒の沸点との間の温度で、常圧もしくは加圧下の水素雰囲気下で、または1当量~大過剰量の適当な水素源の存在下で、5分間~72時間処理することにより製造することができる。
化合物(II)は、例えば、WO97/017329、特開平11-158149、WO00/43366、WO01/47890、WO02/088110、WO03/000660、WO03/033472、WO2004/018430、WO2004/039782、US5773449A、ジャーナル・オブ・メディシナル・ケミストリー(J. Med. Chem.), 2005, 48(5), 1359-1366、ジャーナル・オブ・メディシナル・ケミストリー(J. Med. Chem.), 2006, 49(8), 2440-2455等に記載の方法、またはそれらに準じて製造することができる。
工程2
化合物(V-1)は、化合物(IV)を、溶媒中、化合物(IV)に対して0.1~100 重量%の金属触媒存在下、好ましくは、0.1~50 重量%の触媒存在下、-10℃と用いる溶媒の沸点との間の温度で、好ましくは20℃と用いる溶媒の沸点との間の温度で、常圧もしくは加圧下の水素雰囲気下で、または1当量~大過剰量の適当な水素源の存在下で、5分間~72時間処理することにより製造することができる。
このとき、0.01~30当量の適当な酸を加え、反応を促進させることもできる。
溶媒としては、例えば、エタノール、メタノール、酢酸エチル、THF、ジエチルエーテル、水、アセトニトリル等が挙げられ、これらを単独でまたは混合して用いることができる。
金属触媒としては、例えば、パラジウムカーボン、パラジウムアルミナ、水酸化パラジウム、水酸化パラジウムカーボン、塩化パラジウム、ウィルキンソン触媒等が挙げられる。
溶媒としては、例えば、エタノール、メタノール、酢酸エチル、THF、ジエチルエーテル、水、アセトニトリル等が挙げられ、これらを単独でまたは混合して用いることができる。
金属触媒としては、例えば、パラジウムカーボン、パラジウムアルミナ、水酸化パラジウム、水酸化パラジウムカーボン、塩化パラジウム、ウィルキンソン触媒等が挙げられる。
水素源としては、例えば、ギ酸、ギ酸アンモニウム、ギ酸ナトリウム等が挙げられる。
酸としては、例えば、塩酸、硫酸、硝酸、酢酸、トリフルオロ酢酸、トリフルオロメタンスルホン酸等が挙げられる。
また化合物(V-1)は、化合物(IV)を、溶媒中、-10℃と用いる溶媒の沸点との間の温度で、好ましくは20℃と用いる溶媒の沸点との間の温度で、5分間~72時間、化合物(IV)に対して好ましくは1~10当量の還元剤で処理することにより製造することもできる。
酸としては、例えば、塩酸、硫酸、硝酸、酢酸、トリフルオロ酢酸、トリフルオロメタンスルホン酸等が挙げられる。
また化合物(V-1)は、化合物(IV)を、溶媒中、-10℃と用いる溶媒の沸点との間の温度で、好ましくは20℃と用いる溶媒の沸点との間の温度で、5分間~72時間、化合物(IV)に対して好ましくは1~10当量の還元剤で処理することにより製造することもできる。
溶媒としては、例えば、エタノール、メタノール、酢酸エチル、THF、ジエチルエーテル、水、アセトニトリル等が挙げられ、これらを単独でまたは混合して用いることができる。
還元剤としては、例えば、亜ジチオン酸ナトリウム、スズ、二塩化スズ、鉄、亜鉛、水素化ホウ素ニッケル、水素化アルミニウムリチウム等が挙げられる。
工程3
化合物(V-1)は、化合物(II)を、溶媒中、化合物(II)に対して好ましくは1~10当量の塩基存在下、-10℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(VI)と反応させることで製造することもできる。このとき、0.01~30当量の適当な添加剤を加えてもよい。
還元剤としては、例えば、亜ジチオン酸ナトリウム、スズ、二塩化スズ、鉄、亜鉛、水素化ホウ素ニッケル、水素化アルミニウムリチウム等が挙げられる。
工程3
化合物(V-1)は、化合物(II)を、溶媒中、化合物(II)に対して好ましくは1~10当量の塩基存在下、-10℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(VI)と反応させることで製造することもできる。このとき、0.01~30当量の適当な添加剤を加えてもよい。
溶媒としては、例えば、DMF、DMA、DMSO、クロロホルム、アセトン、メチルエチルケトン、水等が挙げられ、これらを単独でまたは混合して用いることができる。
塩基としては、例えば、水酸化ナトリウム、水素化ナトリウム等が挙げられる。
添加剤としては、例えば、テトラブチルアンモニウムブロミド等が挙げられる。
化合物(VI) は、例えば、市販品として得ることができる。
製造法2
化合物(I)のうち、Wが窒素原子である化合物(I-3)の中間体(V-2)は、例えば、US20080312232(特にスキーム10)、WO2005/121125等に記載の方法、または、それらに準じて製造することができる。
塩基としては、例えば、水酸化ナトリウム、水素化ナトリウム等が挙げられる。
添加剤としては、例えば、テトラブチルアンモニウムブロミド等が挙げられる。
化合物(VI) は、例えば、市販品として得ることができる。
製造法2
化合物(I)のうち、Wが窒素原子である化合物(I-3)の中間体(V-2)は、例えば、US20080312232(特にスキーム10)、WO2005/121125等に記載の方法、または、それらに準じて製造することができる。
(式中、R1、R2、R4およびR5は、それぞれ前記と同義である)
製造法3
化合物(I)は、製造法1で得られる化合物(V-1)または製造法2で得られる化合物(V-2)[まとめて化合物(V)という]を用いて、WO00/43366またはWO02/088110に記載されているウレア部分の製造方法、またはそれらに準じて製造することができる。
製造法3
化合物(I)は、製造法1で得られる化合物(V-1)または製造法2で得られる化合物(V-2)[まとめて化合物(V)という]を用いて、WO00/43366またはWO02/088110に記載されているウレア部分の製造方法、またはそれらに準じて製造することができる。
具体的には、例えば、下記製造法、またはそれに準じて製造することができる。
(式中、X1およびX2は、同一または異なって塩素原子、臭素原子、ヨウ素原子、p-トルエンスルホニルオキシ、メタンスルホニルオキシ、またはトリフルオロメタンスルホニルオキシを表し、Xはハロゲンを表し、R1、R2、R4、R5、R9、R12、R13およびWは、それぞれ前記と同義であり、R12aおよびR13aは、同一または異なってR12およびR13の定義のうち低級アルキルを表し、R12bは、R12の定義のうち、1級または2級の低級アルキルを表し、R14は、R12の定義のうち、末端にメチレンを有する低級アルキルから該メチレンを除いた基または水素原子を表し、R15およびR16は、隣接する炭素原子と一緒になってR12bの窒素原子に結合している炭素原子から水素原子を一つ除いた基を表し、RAおよびRBは、同一または異なって、塩素原子、臭素原子、またはトリクロロメチルオキシを表す)
工程1
化合物(I-6)は、化合物(V)を、溶媒中、-10℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(VII)と反応させることにより製造することができる。
工程1
化合物(I-6)は、化合物(V)を、溶媒中、-10℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(VII)と反応させることにより製造することができる。
溶媒としては、例えばジクロロメタン、クロロホルム、1,2-ジクロロエタン、トルエン、酢酸エチル、アセトニトリル、ジエチルエーテル、THF、1,2-ジメトキシエタン(DME)、ジオキサン、NMP、DMF、DMA、ピリジン等が挙げられ、これらを単独でまたは混合して用いることができる。
化合物(VII)は、例えば、市販品として得ることができるか、公知の方法[例えば、「第4版実験化学講座20 有機合成II」、p.473、丸善(2001年)]もしくはそれに準じて得ることができるか、または、下記製造法Aにより製造することができる。
製造法A
化合物(VII)は、例えば、市販品として得ることができるか、公知の方法[例えば、「第4版実験化学講座20 有機合成II」、p.473、丸善(2001年)]もしくはそれに準じて得ることができるか、または、下記製造法Aにより製造することができる。
製造法A
(式中、R9は、前記と同義である)
化合物(VII)は、例えば、シンセティック・コミニュケーションズ(Synth. Commun.), 1993, 23(3), 335に記載の方法、またはそれに準じて製造することができる。
具体的には、化合物(VII)は、化合物(XV)を、溶媒中、-10℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量のジフェニルリン酸アジド(DPPA)と反応させることにより製造することができる。
化合物(VII)は、例えば、シンセティック・コミニュケーションズ(Synth. Commun.), 1993, 23(3), 335に記載の方法、またはそれに準じて製造することができる。
具体的には、化合物(VII)は、化合物(XV)を、溶媒中、-10℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量のジフェニルリン酸アジド(DPPA)と反応させることにより製造することができる。
溶媒としては、例えばトルエン、酢酸エチル、アセトニトリル、ジエチルエーテル、THF、DME、ジオキサン、NMP、DMF、DMA、ピリジン等が挙げられ、これらを単独でまたは混合して用いることができる。
化合物(XV)のうちピラゾールカルボン酸(XV-1)は、例えば1)「実験化学講座」第5版、第16巻、第1章 カルボン酸の合成法(1~34ページ)、丸善、2)、ジャーナル・オブ・ヘテロサイクリック・ケミストリー(J. Heterocyclic Chem.), 26(5),1389-1392 (1989)等に記載の方法等により製造することができる。イミダゾールカルボン酸(XV-2)は、例えば、1)ジャーナル・オブ・オーガニック・ケミストリー(J. Org. Chem.), 1977, 42(7), 1153-1159、2) ヘテロサイクルズ(Heterocycles), 2006, 68 (6), 1149-1162、3) テトラヘドロン・レターズ(Tetrahedron Lett.), 35(11), 1635-1638 (1994)等に記載の方法等により製造することができる。イソオキサゾールカルボン酸(XV-3)は、例えば、US20100048545等に記載の方法等により製造することができる。
工程2
化合物(XII)は、化合物(V)を、溶媒中、好ましくは1~5当量の塩基存在下、-10℃と用いる溶媒の沸点との間の温度で、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(VIII)、または好ましくは1~10当量の化合物(IX-1)と、5分間~72時間反応させた後、-10℃と用いる溶媒の沸点との間の温度で、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の還元剤で処理することにより製造することができる。
化合物(XV)のうちピラゾールカルボン酸(XV-1)は、例えば1)「実験化学講座」第5版、第16巻、第1章 カルボン酸の合成法(1~34ページ)、丸善、2)、ジャーナル・オブ・ヘテロサイクリック・ケミストリー(J. Heterocyclic Chem.), 26(5),1389-1392 (1989)等に記載の方法等により製造することができる。イミダゾールカルボン酸(XV-2)は、例えば、1)ジャーナル・オブ・オーガニック・ケミストリー(J. Org. Chem.), 1977, 42(7), 1153-1159、2) ヘテロサイクルズ(Heterocycles), 2006, 68 (6), 1149-1162、3) テトラヘドロン・レターズ(Tetrahedron Lett.), 35(11), 1635-1638 (1994)等に記載の方法等により製造することができる。イソオキサゾールカルボン酸(XV-3)は、例えば、US20100048545等に記載の方法等により製造することができる。
工程2
化合物(XII)は、化合物(V)を、溶媒中、好ましくは1~5当量の塩基存在下、-10℃と用いる溶媒の沸点との間の温度で、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(VIII)、または好ましくは1~10当量の化合物(IX-1)と、5分間~72時間反応させた後、-10℃と用いる溶媒の沸点との間の温度で、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の還元剤で処理することにより製造することができる。
溶媒としては、例えば、NMP、DMF、DMA、ベンゼン、トルエン、ヘキサン、酢酸エチル、THF、ジオキサン、ジエチルエーテル、ジクロロメタン、クロロホルム等が挙げられ、これらを単独でまたは混合して用いることができる。
塩基としては、例えば、ジメチルアミノピリジン(DMAP)、1,4-ジアザビシクロ[2.2.2]オクタン(DABCO)、トリエチルアミン、ジイソプロピルエチルアミン等が挙げられる。
塩基としては、例えば、ジメチルアミノピリジン(DMAP)、1,4-ジアザビシクロ[2.2.2]オクタン(DABCO)、トリエチルアミン、ジイソプロピルエチルアミン等が挙げられる。
還元剤としては、例えば、水素化リチウムアルミニウム、ジイソブチルアルミノハイドライド(DIBAL)、水素化ホウ素リチウム等が挙げられる。
化合物(VIII)、および化合物(IX-1)は、それぞれ、例えば、市販品として得ることができる。
また、化合物(XII)は、化合物(V)を、溶媒中、必要により好ましくは1~10当量の添加物の存在下、5分間~72時間、好ましくは1~10当量の還元剤、および好ましくは1~10当量の化合物(IX-2)と反応させることにより製造することもできる。
化合物(VIII)、および化合物(IX-1)は、それぞれ、例えば、市販品として得ることができる。
また、化合物(XII)は、化合物(V)を、溶媒中、必要により好ましくは1~10当量の添加物の存在下、5分間~72時間、好ましくは1~10当量の還元剤、および好ましくは1~10当量の化合物(IX-2)と反応させることにより製造することもできる。
溶媒としては、例えば、メタノール、エタノール、ジクロロメタン、クロロホルム、1,2-ジクロロエタン、トルエン、酢酸エチル、アセトニトリル、ジエチルエーテル、THF、DME、ジオキサン、DMF、DMA、NMP、水等が挙げられ、これらを単独でまたは混合して用いることができる。
添加物としては、例えば、塩酸、硫酸、ギ酸、酢酸、トリフルオロ酢酸、p-トルエンスルホン酸、テトライソプロポキシチタン等が挙げられる。
添加物としては、例えば、塩酸、硫酸、ギ酸、酢酸、トリフルオロ酢酸、p-トルエンスルホン酸、テトライソプロポキシチタン等が挙げられる。
還元剤としては、例えば、シアノ水素化ホウ素ナトリウム、水素化トリアセトキシホウ素ナトリウム、ピリジンボラン、2-ピコリンボラン等が挙げられる。
化合物(IX-2)は、例えば、市販品として得ることができる。
工程3
化合物(I-5)は、化合物(XII)を用いて、工程1に記載の方法、またはそれに準じて製造することができる。
工程4
R12が1級または2級の低級アルキルであり、R13が低級アルキルである化合物(I)は、化合物(I-5)を、溶媒中、好ましくは1~10当量の塩基存在下、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(XIV)と反応させることにより製造することができる。
化合物(IX-2)は、例えば、市販品として得ることができる。
工程3
化合物(I-5)は、化合物(XII)を用いて、工程1に記載の方法、またはそれに準じて製造することができる。
工程4
R12が1級または2級の低級アルキルであり、R13が低級アルキルである化合物(I)は、化合物(I-5)を、溶媒中、好ましくは1~10当量の塩基存在下、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(XIV)と反応させることにより製造することができる。
塩基としては、例えば炭酸カリウム、水酸化カリウム、水酸化ナトリウム、ナトリウムメトキシド、カリウムtert-ブトキシド、1,8-ジアザビシクロ[5.4.0]-7-ウンデセン(DBU)、水素化ナトリウム等が挙げられる。
溶媒としては、例えば、DMF、DMA、NMP、ベンゼン、トルエン、ヘキサン、酢酸エチル、DME、THF、ジオキサン、ジエチルエーテル等が挙げられ、これらを単独でまたは混合して用いることができる。
溶媒としては、例えば、DMF、DMA、NMP、ベンゼン、トルエン、ヘキサン、酢酸エチル、DME、THF、ジオキサン、ジエチルエーテル等が挙げられ、これらを単独でまたは混合して用いることができる。
化合物(XIV)は、例えば、市販品として得ることができる。
工程5
化合物(I-4)は、化合物(V)を、溶媒中、好ましくは1~10当量の塩基存在下、-10℃と用いる溶媒の沸点との間の温度で、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(X)と反応させた後、溶媒中、好ましくは1~10当量の塩基存在下、-10℃と用いる溶媒の沸点との間の温度で、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(XI)と反応させることにより製造することができる。
工程5
化合物(I-4)は、化合物(V)を、溶媒中、好ましくは1~10当量の塩基存在下、-10℃と用いる溶媒の沸点との間の温度で、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(X)と反応させた後、溶媒中、好ましくは1~10当量の塩基存在下、-10℃と用いる溶媒の沸点との間の温度で、好ましくは0℃と用いる溶媒の沸点との間の温度で、5分間~72時間、好ましくは1~10当量の化合物(XI)と反応させることにより製造することができる。
溶媒としては、例えばジクロロメタン、クロロホルム、1,2-ジクロロエタン、トルエン、酢酸エチル、アセトニトリル、ジエチルエーテル、THF、DME、DMF、DMA、NMP、ピリジン等が挙げられ、これらを単独でまたは混合して用いることができる。
化合物(X)は、例えば、市販品として得ることができる。
化合物(XI)は、例えば、市販品として得ることができるか、WO1999/032106もしくは上記製造法3の工程2に記載の方法、またはそれらに準じて製造することができる。
工程6
R12が低級アルキルである化合物(I)は、化合物(I-4)および化合物(XIII)を用いて、工程4に記載の方法、またはそれに準じて製造することができる。
化合物(X)は、例えば、市販品として得ることができる。
化合物(XI)は、例えば、市販品として得ることができるか、WO1999/032106もしくは上記製造法3の工程2に記載の方法、またはそれらに準じて製造することができる。
工程6
R12が低級アルキルである化合物(I)は、化合物(I-4)および化合物(XIII)を用いて、工程4に記載の方法、またはそれに準じて製造することができる。
化合物(XIII)は、例えば、市販品として得ることができる。
工程7
R12およびR13の少なくともどちらか一方が、低級アルキルである化合物(I)は、化合物(I-6)、化合物(XIII)および/または化合物(XIV)を用いて、工程4に記載の方法、またはそれに準じて製造することができる。
工程7
R12およびR13の少なくともどちらか一方が、低級アルキルである化合物(I)は、化合物(I-6)、化合物(XIII)および/または化合物(XIV)を用いて、工程4に記載の方法、またはそれに準じて製造することができる。
化合物(XIII)および化合物(XIV)は、それぞれ、例えば、市販品として得ることができる。
上記各製造法における中間体および目的化合物は、有機合成化学で常用される分離精製法、例えば、ろ過、抽出、洗浄、乾燥、濃縮、再結晶、各種クロマトグラフィー等に付して単離精製することができる。また、中間体においては特に精製することなく次の反応に供することも可能である。
上記各製造法における中間体および目的化合物は、有機合成化学で常用される分離精製法、例えば、ろ過、抽出、洗浄、乾燥、濃縮、再結晶、各種クロマトグラフィー等に付して単離精製することができる。また、中間体においては特に精製することなく次の反応に供することも可能である。
化合物(I)の中には、幾何異性体、光学異性体などの立体異性体、互変異性体などが存在し得るものもあるが、これらを含め、全ての可能な異性体およびそれらの混合物が本発明で使用されるか本発明に包含される。
化合物(I)の中に、化合物(I)中の1つまたはそれ以上の水素原子が重水素原子で置換された化合物も含まれ、これらおよびそれらの混合物が本発明で使用されるか本発明に包含される。
化合物(I)の中に、化合物(I)中の1つまたはそれ以上の水素原子が重水素原子で置換された化合物も含まれ、これらおよびそれらの混合物が本発明で使用されるか本発明に包含される。
化合物(I)の塩を取得したいとき、化合物(I)が塩の形で得られるときはそのまま精製すればよく、また、遊離の形で得られるときは、化合物(I)を適当な溶媒に溶解または懸濁し、酸または塩基を加えることにより塩を形成させて単離、精製すればよい。
また、化合物(I)またはその薬学的に許容される塩は、水または各種溶媒との付加物の形で存在することもあるが、これらの付加物も本発明で使用されるか本発明に包含される。
また、化合物(I)またはその薬学的に許容される塩は、水または各種溶媒との付加物の形で存在することもあるが、これらの付加物も本発明で使用されるか本発明に包含される。
化合物(I)の具体例を表1~表10に示す。ただし、本発明の化合物(I)はこれらに限定されるものではない。
表中、Meはメチルを表し、BnOはベンジルオキシを表し、Etはエチルを表し、i-Prはイソプロピルを表し、t-Buはtert-ブチルを表し、MsOはメタンスルホニルオキシを表し、THPOはテトラヒドロ-2H-ピラン-2-イルオキシを表し、TBSOはtert-ブチルジメチルシリルオキシを表す。
表中、Meはメチルを表し、BnOはベンジルオキシを表し、Etはエチルを表し、i-Prはイソプロピルを表し、t-Buはtert-ブチルを表し、MsOはメタンスルホニルオキシを表し、THPOはテトラヒドロ-2H-ピラン-2-イルオキシを表し、TBSOはtert-ブチルジメチルシリルオキシを表す。
次に、代表的な化合物(I)の薬理作用について試験例により具体的に説明する。
試験例1 ヒトFGFR2の酵素阻害活性の測定
384ウェルポリプロピレンプレート(3657、Corning)に、アッセイバッファー[100 mmol/L 4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES)、10 mmol/L 塩化マグネシウム、10 mmol/L 塩化マンガン、0.003 vol% Brij-35[BRIJ(登録商標) 35 Detergent,30%水溶液、Calbiochem社]、0.004 vol% Tween20[PlusOneTMTweenTM 20 (商品名)、Amershambiosciences社]および1 mmol/L ジチオスレイトール、pH 7.5]にて希釈したFGFR2(FGFR2, active、14-617、Millipore社)、蛍光標識基質(FL-Peptide 22、760366、Caliper Life Sciences社)、ATP(A7699、Sigma-Aldrich社)およびDMSOに溶解した被験物質を添加して、全量25 μLにて、28℃で240分間反応させた。FGFR2、蛍光標識基質、ATP およびDMSOの最終濃度は、それぞれ2 nmol/L、1.5 μmol/L、84 μmol/Lおよび1%とした。次に、このプレートにターミネーションバッファー[100 mmol/LHEPES、15 mmol/L エチレンジアミン四酢酸(EDTA)、0.022 vol% Brij-35、0.17% Coating Reagent 3 [LabChip Coating Reagent 3、Caliper Life Sciences社]および7.2% DMSO、pH 7.5]を45 μL添加して酵素反応を停止させた。次に、モビリティーシフトアッセイ装置(LabChipEZ Reader II、Caliper Life Sciences社)にて、反応溶液を吸引して、流路に電圧と圧力を掛けることで、酵素反応によりリン酸化された蛍光標識基質と未変化体の蛍光標識基質を電荷の差により分離し、それぞれについて488 nmで励起したときの530 nmの蛍光強度を測定した。酵素活性は、まず以下の式1に基づき、その条件下での変換率を算出し、
試験例1 ヒトFGFR2の酵素阻害活性の測定
384ウェルポリプロピレンプレート(3657、Corning)に、アッセイバッファー[100 mmol/L 4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES)、10 mmol/L 塩化マグネシウム、10 mmol/L 塩化マンガン、0.003 vol% Brij-35[BRIJ(登録商標) 35 Detergent,30%水溶液、Calbiochem社]、0.004 vol% Tween20[PlusOneTMTweenTM 20 (商品名)、Amershambiosciences社]および1 mmol/L ジチオスレイトール、pH 7.5]にて希釈したFGFR2(FGFR2, active、14-617、Millipore社)、蛍光標識基質(FL-Peptide 22、760366、Caliper Life Sciences社)、ATP(A7699、Sigma-Aldrich社)およびDMSOに溶解した被験物質を添加して、全量25 μLにて、28℃で240分間反応させた。FGFR2、蛍光標識基質、ATP およびDMSOの最終濃度は、それぞれ2 nmol/L、1.5 μmol/L、84 μmol/Lおよび1%とした。次に、このプレートにターミネーションバッファー[100 mmol/LHEPES、15 mmol/L エチレンジアミン四酢酸(EDTA)、0.022 vol% Brij-35、0.17% Coating Reagent 3 [LabChip Coating Reagent 3、Caliper Life Sciences社]および7.2% DMSO、pH 7.5]を45 μL添加して酵素反応を停止させた。次に、モビリティーシフトアッセイ装置(LabChipEZ Reader II、Caliper Life Sciences社)にて、反応溶液を吸引して、流路に電圧と圧力を掛けることで、酵素反応によりリン酸化された蛍光標識基質と未変化体の蛍光標識基質を電荷の差により分離し、それぞれについて488 nmで励起したときの530 nmの蛍光強度を測定した。酵素活性は、まず以下の式1に基づき、その条件下での変換率を算出し、
得られた変換率を元に、以下の式2によりFGFR2リン酸化阻害率を求めることにより評価した。
被験物質の濃度を数段階に変えて、それぞれの濃度におけるFGFR2リン酸化阻害率を求め、それらを元にして、被験物質のFGFR2リン酸化50%阻害濃度(IC50)を算出した。その結果、化合物1~19、21~62、65、67、70~76、80、82、84、86~91、93および95~110は、100 nmol/Lより小さなIC50値を示した。
上記試験の結果より、化合物(I)は、FGFR2リン酸化阻害活性を有することが確認された。従って、化合物(I)またはその薬学的に許容される塩はFGFRを阻害し、FGFRが関与する疾患、例えば、様々ながん(例えば、胃がん、子宮内膜がん、下垂体腫瘍、骨髄増殖性疾患、腎がん、膀胱がん、大腸がん、頭頸部がん、皮膚がん、非ホジキンリンパ腫、脳腫瘍、乳がん、卵巣がん、多発性骨髄腫、骨肉腫等)、ウイルス感染、全身性エリテマトーデス等の自己免疫疾患、関節リウマチ、肝炎、腎疾患等の治療および/または予防剤として有用であると考えられる。
上記試験の結果より、化合物(I)は、FGFR2リン酸化阻害活性を有することが確認された。従って、化合物(I)またはその薬学的に許容される塩はFGFRを阻害し、FGFRが関与する疾患、例えば、様々ながん(例えば、胃がん、子宮内膜がん、下垂体腫瘍、骨髄増殖性疾患、腎がん、膀胱がん、大腸がん、頭頸部がん、皮膚がん、非ホジキンリンパ腫、脳腫瘍、乳がん、卵巣がん、多発性骨髄腫、骨肉腫等)、ウイルス感染、全身性エリテマトーデス等の自己免疫疾患、関節リウマチ、肝炎、腎疾患等の治療および/または予防剤として有用であると考えられる。
化合物(I)またはその薬学的に許容される塩は、そのまま単独で投与することも可能であるが、通常各種の医薬製剤として提供するのが望ましい。また、その医薬製剤は、動物または人に使用されるものである。
本発明に係わる医薬製剤は、活性成分として化合物(I)またはその薬学的に許容される塩を単独で、または任意の他の治療のための有効成分との混合物として含有することができる。また、その医薬製剤は、活性成分を薬学的に許容される一種またはそれ以上の担体(例えば、希釈剤、溶剤、賦形剤等)と一緒に混合し、製剤学の技術分野においてよく知られている任意の方法により製造される。
本発明に係わる医薬製剤は、活性成分として化合物(I)またはその薬学的に許容される塩を単独で、または任意の他の治療のための有効成分との混合物として含有することができる。また、その医薬製剤は、活性成分を薬学的に許容される一種またはそれ以上の担体(例えば、希釈剤、溶剤、賦形剤等)と一緒に混合し、製剤学の技術分野においてよく知られている任意の方法により製造される。
投与経路としては、治療に際し最も効果的なものを使用するのが望ましく、経口または、例えば静脈内等の非経口を挙げることができる。
投与形態としては、例えば錠剤、注射剤等が挙げられる。
経口投与に適当な、例えば錠剤等は、乳糖等の賦形剤、澱粉等の崩壊剤、ステアリン酸マグネシウム等の滑沢剤、ヒドロキシプロピルセルロース等の結合剤等を用いて製造できる。
投与形態としては、例えば錠剤、注射剤等が挙げられる。
経口投与に適当な、例えば錠剤等は、乳糖等の賦形剤、澱粉等の崩壊剤、ステアリン酸マグネシウム等の滑沢剤、ヒドロキシプロピルセルロース等の結合剤等を用いて製造できる。
非経口投与に適当な、例えば注射剤等は、塩溶液、ブドウ糖溶液または塩水とブドウ糖溶液の混合液等の希釈剤または溶剤等を用いて製造できる。
化合物(I)またはその薬学的に許容される塩の投与量および投与回数は、投与形態、患者の年齢、体重、治療すべき症状の性質もしくは重篤度等により異なるが、通常経口の場合、成人一人あたり、0.01~1000 mg、好ましくは0.05~100 mgの範囲で、1日1回ないし数回投与する。静脈内投与等の非経口投与の場合、成人一人あたり0.001~1000 mg、好ましくは0.01~100 mgを1日1回ないし数回投与する。しかしながら、これら投与量および投与回数に関しては、前述の種々の条件により変動する。
化合物(I)またはその薬学的に許容される塩の投与量および投与回数は、投与形態、患者の年齢、体重、治療すべき症状の性質もしくは重篤度等により異なるが、通常経口の場合、成人一人あたり、0.01~1000 mg、好ましくは0.05~100 mgの範囲で、1日1回ないし数回投与する。静脈内投与等の非経口投与の場合、成人一人あたり0.001~1000 mg、好ましくは0.01~100 mgを1日1回ないし数回投与する。しかしながら、これら投与量および投与回数に関しては、前述の種々の条件により変動する。
以下、本発明を実施例および参考例によりさらに具体的に説明するが、本発明の範囲はこれらの実施例に限定されることはない。
なお、実施例および参考例で用いられるプロトン核磁気共鳴スペクトル(1H NMR)は、270 MHz、300 MHzまたは400 MHzで測定されたものであり、化合物および測定条件によって交換性プロトンが明瞭には観測されないことがある。なお、シグナルの多重度の表記としては通常用いられるものを用いるが、brとは見かけ上幅広いシグナルであることを表す。
なお、実施例および参考例で用いられるプロトン核磁気共鳴スペクトル(1H NMR)は、270 MHz、300 MHzまたは400 MHzで測定されたものであり、化合物および測定条件によって交換性プロトンが明瞭には観測されないことがある。なお、シグナルの多重度の表記としては通常用いられるものを用いるが、brとは見かけ上幅広いシグナルであることを表す。
また、各化合物の命名はケム・バイオ・ドロー・ウルトラ Ver. 11.0 (ケンブリッジソフト社) を用いて行った。
1-(5-tert-ブチル-1-メチル-1H-ピラゾール-3-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア (化合物1)
参考例1に従って得られる化合物A2(55 mg)をトルエン(3 mL)に溶解し、トリエチルアミン(36 mg)、ジフェニルホスホリルアジド(91 mg)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(70 mg)を加え、3時間加熱還流下撹拌した。得られた反応混合物に水を加えて反応を停止させ、クロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーにて精製し、標記化合物1(21 mg、収率19%)を得た。
ESI-MS: m/z 492[M-H]-,516[M+H]+
参考例1に従って得られる化合物A2(55 mg)をトルエン(3 mL)に溶解し、トリエチルアミン(36 mg)、ジフェニルホスホリルアジド(91 mg)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(70 mg)を加え、3時間加熱還流下撹拌した。得られた反応混合物に水を加えて反応を停止させ、クロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーにて精製し、標記化合物1(21 mg、収率19%)を得た。
ESI-MS: m/z 492[M-H]-,516[M+H]+
1-(5-tert-ブチル-1-メチル-1H-ピラゾール-3-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物2)
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよび参考例1に従って得られる化合物A2から実施例1に準じて標記化合物2 (収率71%) を得た。
ESI-MS: m/z 474[M-H]-,498[M+H]+
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよび参考例1に従って得られる化合物A2から実施例1に準じて標記化合物2 (収率71%) を得た。
ESI-MS: m/z 474[M-H]-,498[M+H]+
1-(5-シクロプロピル-1-メチル-1H-ピラゾール-3-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ]フェニルウレア (化合物3)
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよび参考例2に従って得られる化合物A4から実施例1に準じて標記化合物3 (収率25%) を得た。
ESI-MS: m/z 458[M-H]-, 482[M+H]+
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよび参考例2に従って得られる化合物A4から実施例1に準じて標記化合物3 (収率25%) を得た。
ESI-MS: m/z 458[M-H]-, 482[M+H]+
1-(1,5-ジエチル-4-メチル-1H-ピラゾール-3-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア (化合物4)
WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンおよび参考例3に従って得られる化合物A7から実施例1に準じて標記化合物4 (収率32%) を得た。
ESI-MS: m/z 494[M+H]+
WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンおよび参考例3に従って得られる化合物A7から実施例1に準じて標記化合物4 (収率32%) を得た。
ESI-MS: m/z 494[M+H]+
1-(5-tert-ブチル-1-メチル-1H-ピラゾール-3-イル)-3-[4-(7-メトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物5)
参考例4に従って得られる化合物A11、および参考例1に従って得られる化合物A2から実施例1に準じて標記化合物5 (収率58%) を得た。
ESI-MS: m/z 444[M-H]-
参考例4に従って得られる化合物A11、および参考例1に従って得られる化合物A2から実施例1に準じて標記化合物5 (収率58%) を得た。
ESI-MS: m/z 444[M-H]-
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-(1-イソプロピル-1H-ピラゾール-4-イル)ウレア (化合物6)
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(70 mg)を脱水クロロホルム(3 mL)に溶解し、室温でトリエチルアミン(0.3 mL)、およびトリホスゲン(70 mg)のクロロホルム(0.3 mL)溶液を加え、15分間撹拌した後、参考例5に従って得られる化合物A14(40 mg)を加え、室温で終夜撹拌した。得られた反応混合物に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製後、さらにヘキサンおよび酢酸エチルを展開溶媒とする分取薄層クロマトグラフィーで再精製し、最後に、アルミナカラムクロマトグラフィーを用いて精製し、標記化合物6(89 mg、収率85%)を得た。
ESI-MS: m/z 446[M-H]-,448[M+H]+
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(70 mg)を脱水クロロホルム(3 mL)に溶解し、室温でトリエチルアミン(0.3 mL)、およびトリホスゲン(70 mg)のクロロホルム(0.3 mL)溶液を加え、15分間撹拌した後、参考例5に従って得られる化合物A14(40 mg)を加え、室温で終夜撹拌した。得られた反応混合物に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製後、さらにヘキサンおよび酢酸エチルを展開溶媒とする分取薄層クロマトグラフィーで再精製し、最後に、アルミナカラムクロマトグラフィーを用いて精製し、標記化合物6(89 mg、収率85%)を得た。
ESI-MS: m/z 446[M-H]-,448[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]-3-(1-イソプロピル-1H-ピラゾール-4-イル)ウレア(化合物7)
Journal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンおよび参考例5に従って得られる化合物A14から実施例6に準じて標記化合物7(収率78%) を得た。
ESI-MS: m/z 464[M-H]-,466[M+H]+
Journal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンおよび参考例5に従って得られる化合物A14から実施例6に準じて標記化合物7(収率78%) を得た。
ESI-MS: m/z 464[M-H]-,466[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-(1-イソプロピル-1H-ピラゾール-4-イル)ウレア (化合物8)
WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンおよび参考例5に従って得られる化合物A14から実施例6に準じて標記化合物8(収率90%) を得た。
ESI-MS: m/z 464[M-H]-,466[M+H]+
WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンおよび参考例5に従って得られる化合物A14から実施例6に準じて標記化合物8(収率90%) を得た。
ESI-MS: m/z 464[M-H]-,466[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-クロロフェニル]-3-(1-イソプロピル-1H-ピラゾール-4-イル)ウレア(化合物9)
WO00/43366の製造例1に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-クロロアニリンおよび参考例5に従って得られる化合物A14から実施例6に準じて標記化合物9(収率89%)を得た。
ESI-MS: m/z 480[M-H]-,482[M+H]+
WO00/43366の製造例1に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-クロロアニリンおよび参考例5に従って得られる化合物A14から実施例6に準じて標記化合物9(収率89%)を得た。
ESI-MS: m/z 480[M-H]-,482[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-(5-イソプロピルイソオキサゾール-3-イル)ウレア (化合物10)
市販の5-イソプロピルイソオキサゾール-3-カルボン酸およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから実施例1に準じて標記化合物10(収率55%)を得た。
ESI-MS: m/z 471[M+H]+
市販の5-イソプロピルイソオキサゾール-3-カルボン酸およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから実施例1に準じて標記化合物10(収率55%)を得た。
ESI-MS: m/z 471[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-(5-イソプロピルイソオキサゾール-3-イル)ウレア (化合物11)
市販の5-イソプロピルイソオキサゾール-3-カルボン酸およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから実施例1に準じて標記化合物11(収率29%)を得た。
ESI-MS: m/z 465[M-H]-
市販の5-イソプロピルイソオキサゾール-3-カルボン酸およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから実施例1に準じて標記化合物11(収率29%)を得た。
ESI-MS: m/z 465[M-H]-
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-フェニル-1H-ピラゾール-5-イル]ウレア (化合物12)
参考例6に準じて得られる3-(1-メチルシクロプロピル)-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-1、149 mg)をクロロホルム(3 mL)に溶解し、トリエチルアミン(708 mg)を室温で加えた後に、トリホスゲン(104 mg)を加え、10分間撹拌後、WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(187 mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、標記化合物12(189 mg、収率56%)を得た。
ESI-MS: m/z 536[M+H]+
参考例6に準じて得られる3-(1-メチルシクロプロピル)-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-1、149 mg)をクロロホルム(3 mL)に溶解し、トリエチルアミン(708 mg)を室温で加えた後に、トリホスゲン(104 mg)を加え、10分間撹拌後、WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(187 mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、標記化合物12(189 mg、収率56%)を得た。
ESI-MS: m/z 536[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物13)
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物13(収率61%)を得た。
1H-NMR (CDCl3)δ: 8.43(1H,d, J = 5.4 Hz), 7.55 (1H, s), 7.41-7.45 (4H, m), 7.37 (1H, s), 7.32 (1H,brs),7.14 (2H, d, J = 9.0 Hz), 7.06 (2H, t, J = 8.5 Hz), 6.61 (1H, brs), 6.41(1H,d, J = 5.4 Hz), 6.39 (1H, s), 4.06 (3H, s), 4.03 (3H, s), 3.02 (1H, m),1.33(6H, d, J =7.1 Hz).
ESI-MS: m/z 542[M+H]+
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物13(収率61%)を得た。
1H-NMR (CDCl3)δ: 8.43(1H,d, J = 5.4 Hz), 7.55 (1H, s), 7.41-7.45 (4H, m), 7.37 (1H, s), 7.32 (1H,brs),7.14 (2H, d, J = 9.0 Hz), 7.06 (2H, t, J = 8.5 Hz), 6.61 (1H, brs), 6.41(1H,d, J = 5.4 Hz), 6.39 (1H, s), 4.06 (3H, s), 4.03 (3H, s), 3.02 (1H, m),1.33(6H, d, J =7.1 Hz).
ESI-MS: m/z 542[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-(3-イソプロピル-1-フェニル-1H-ピラゾール-5-イル)ウレア (化合物14)
参考例6に従って得られる化合物A17およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物14(収率60%)を得た。
1H-NMR (CDCl3)δ: 8.39(1H,d, J =5.1 Hz), 7.68 (1H, brs), 7.54 (1H, s), 7.22-7.42 (8H, m), 7.10 (2H,d, J= 9.0 Hz), 6.95 (1H, brs), 6.41 (1H, s), 6.39 (1H, d, J = 5.4 Hz), 4.04(3H,s), 4.00 (3H, s), 3.02 (1H, m), 1.32 (6H, d, J = 6.8 Hz).
ESI-MS: m/z 524[M+H]+
参考例6に従って得られる化合物A17およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物14(収率60%)を得た。
1H-NMR (CDCl3)δ: 8.39(1H,d, J =5.1 Hz), 7.68 (1H, brs), 7.54 (1H, s), 7.22-7.42 (8H, m), 7.10 (2H,d, J= 9.0 Hz), 6.95 (1H, brs), 6.41 (1H, s), 6.39 (1H, d, J = 5.4 Hz), 4.04(3H,s), 4.00 (3H, s), 3.02 (1H, m), 1.32 (6H, d, J = 6.8 Hz).
ESI-MS: m/z 524[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物15)
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物15(収率53%)を得た。
1H-NMR (CDCl3)δ: 8.38(1H,d, J = 5.4 Hz), 7.58 (1H, s), 7.55 (1H, dd, J = 2.2, 12.0 Hz), 7.06-7.26(8H,m), 6.88 (1H, brs), 6.44 (1H, s), 6.37 (1H, d, J = 5.1 Hz), 4.07 (3H, s),3.98(3H, s), 3.01 (1H, m), 1.32 (6H, d, J = 6.8 Hz).
ESI-MS: m/z 560[M+H]+
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物15(収率53%)を得た。
1H-NMR (CDCl3)δ: 8.38(1H,d, J = 5.4 Hz), 7.58 (1H, s), 7.55 (1H, dd, J = 2.2, 12.0 Hz), 7.06-7.26(8H,m), 6.88 (1H, brs), 6.44 (1H, s), 6.37 (1H, d, J = 5.1 Hz), 4.07 (3H, s),3.98(3H, s), 3.01 (1H, m), 1.32 (6H, d, J = 6.8 Hz).
ESI-MS: m/z 560[M+H]+
1-[3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア(化合物16)
参考例6に準じて得られる3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-4)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物16(収率49%)を得た。
1H-NMR (CDCl3)δ: 8.35(1H,d, J = 5.4 Hz), 8.23 (1H, brs), 7.55 (1H, s), 7.39-7.44 (3H, m), 7.28(1H,brs), 7.27 (1H, s), 7.13-7.18 (1H, m), 7.06-7.10 (3H, m), 6.85 (1H, t, J =9.5Hz), 6.48 (1H, s), 6.38 (1H, d, J = 5.4 Hz), 4.05 (3H, s), 3.98 (3H, s),1.35(9H, s).
ESI-MS: m/z 554[M-H]-,578[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-4)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物16(収率49%)を得た。
1H-NMR (CDCl3)δ: 8.35(1H,d, J = 5.4 Hz), 8.23 (1H, brs), 7.55 (1H, s), 7.39-7.44 (3H, m), 7.28(1H,brs), 7.27 (1H, s), 7.13-7.18 (1H, m), 7.06-7.10 (3H, m), 6.85 (1H, t, J =9.5Hz), 6.48 (1H, s), 6.38 (1H, d, J = 5.4 Hz), 4.05 (3H, s), 3.98 (3H, s),1.35(9H, s).
ESI-MS: m/z 554[M-H]-,578[M+H]+
1-[3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]ウレア (化合物17)
参考例6に準じて得られる3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-4)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物17(収率56%)を得た。
1H-NMR (CDCl3) δ: 8.43(1H,d, J = 5.4 Hz), 8.20 (1H, t, J = 9.0 Hz), 7.64 (1H, brs), 7.47-7.52 (2H,m),7.34 (1H, s), 7.25-7.30 (1H, m), 7.18 (1H, t, J = 7.8 Hz), 7.09 (1H,brs),6.99-7.06 (2H, m), 6.89 (1H, dd, J = 2.7, 11.2 Hz), 6.44-6.46 (2H, m),4.03(3H, s), 4.01 (3H, s), 1.37 (9H, s).
ESI-MS: m/z 572[M-H]-,596[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-4)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物17(収率56%)を得た。
1H-NMR (CDCl3) δ: 8.43(1H,d, J = 5.4 Hz), 8.20 (1H, t, J = 9.0 Hz), 7.64 (1H, brs), 7.47-7.52 (2H,m),7.34 (1H, s), 7.25-7.30 (1H, m), 7.18 (1H, t, J = 7.8 Hz), 7.09 (1H,brs),6.99-7.06 (2H, m), 6.89 (1H, dd, J = 2.7, 11.2 Hz), 6.44-6.46 (2H, m),4.03(3H, s), 4.01 (3H, s), 1.37 (9H, s).
ESI-MS: m/z 572[M-H]-,596[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-(2-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物18)
参考例6に準じて得られる1-(2-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-5)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物18(収率33%)を得た。
ESI-MS: m/z 540[M+H]+
参考例6に準じて得られる1-(2-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-5)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物18(収率33%)を得た。
ESI-MS: m/z 540[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[3-イソプロピル-1-(4-メトキシフェニル)-1H-ピラゾール-5-イル]ウレア (化合物19)
参考例6に準じて得られる3-イソプロピル-1-(4-メトキシフェニル)-1H-ピラゾール-5-アミン(化合物A17-6)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物19(収率41%)を得た。
1H-NMR (CDCl3) δ: 8.40(1H,d, J = 5.4 Hz), 7.55 (1H, s), 7.44 (2H, d, J = 9.0 Hz), 7.37 (1H, s), 7.31(2H,d, J = 8.8 Hz), 7.12 (2H, d, J = 9.0 Hz), 6.83 (4H, d, J = 9.0 Hz), 6.41(1H,d, J = 5.4 Hz), 6.38 (1H, s), 4.05 (3H, s), 4.02 (3H, s), 3.77 (3H,s),3.05-2.98 (1H, m), 1.32 (6H, d, J = 7.1 Hz).
ESI-MS: m/z 554[M+H]+
参考例6に準じて得られる3-イソプロピル-1-(4-メトキシフェニル)-1H-ピラゾール-5-アミン(化合物A17-6)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物19(収率41%)を得た。
1H-NMR (CDCl3) δ: 8.40(1H,d, J = 5.4 Hz), 7.55 (1H, s), 7.44 (2H, d, J = 9.0 Hz), 7.37 (1H, s), 7.31(2H,d, J = 8.8 Hz), 7.12 (2H, d, J = 9.0 Hz), 6.83 (4H, d, J = 9.0 Hz), 6.41(1H,d, J = 5.4 Hz), 6.38 (1H, s), 4.05 (3H, s), 4.02 (3H, s), 3.77 (3H,s),3.05-2.98 (1H, m), 1.32 (6H, d, J = 7.1 Hz).
ESI-MS: m/z 554[M+H]+
1-(3-tert-ブチル-1-フェニル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物20)
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-7)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物20(収率45%)を得た。
ESI-MS: m/z 536[M-H]-
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-7)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物20(収率45%)を得た。
ESI-MS: m/z 536[M-H]-
1-(3-tert-ブチル-1-フェニル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]ウレア (化合物21)
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物17-7)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物21(収率49%)を得た。
ESI-MS: m/z 554[M-H]-,556[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物17-7)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物21(収率49%)を得た。
ESI-MS: m/z 554[M-H]-,556[M+H]+
1-(3-tert-ブチル-1-フェニル-1H-ピラゾール-5-イル)-3-[3-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物22)
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-7)および参考例18に従って得られる化合物A53から、実施例12に準じて標記化合物22(収率64%)を得た。
ESI-MS: m/z 570[M-H]-,572[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-7)および参考例18に従って得られる化合物A53から、実施例12に準じて標記化合物22(収率64%)を得た。
ESI-MS: m/z 570[M-H]-,572[M+H]+
1-(3-tert-ブチル-1-フェニル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア (化合物23)
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-7)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物23(収率65%)を得た。
ESI-MS: m/z 554[M-H]-,556[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-7)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物23(収率65%)を得た。
ESI-MS: m/z 554[M-H]-,556[M+H]+
1-(3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]ウレア (化合物24)
参考例6に準じて得られる3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-アミン(化合物A17-8)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物24(収率57%)を得た。
ESI-MS: m/z 568[M-H]-, 570[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-アミン(化合物A17-8)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物24(収率57%)を得た。
ESI-MS: m/z 568[M-H]-, 570[M+H]+
1-(3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア (化合物25)
参考例6に準じて得られる3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-アミン(化合物A17-8)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物25(収率63%)を得た。
ESI-MS: m/z 568[M-H]-,570[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-アミン(化合物A17-8)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物25(収率63%)を得た。
ESI-MS: m/z 568[M-H]-,570[M+H]+
1-(3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-イル)-3-[2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物26)
参考例6に準じて得られる3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-アミン(化合物A17-8)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物26(収率54%)を得た。
ESI-MS: m/z 585[M-H]-,587[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-アミン(化合物A17-8)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物26(収率54%)を得た。
ESI-MS: m/z 585[M-H]-,587[M+H]+
1-(3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-イル)-3-[3-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物27)
参考例6に準じて得られる3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-アミン(化合物A17-8)および参考例18に従って得られる化合物A53から、実施例12に準じて標記化合物27(収率74%)を得た。
ESI-MS: m/z 585[M-H]-,587[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-p-トルイル-1H-ピラゾール-5-アミン(化合物A17-8)および参考例18に従って得られる化合物A53から、実施例12に準じて標記化合物27(収率74%)を得た。
ESI-MS: m/z 585[M-H]-,587[M+H]+
1-(3-tert-ブチル-1-フェニル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-メトキシフェニル]ウレア(化合物28)
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-7)および特開平11-158149の製造例5に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-メトキシアニリンから、実施例12に準じて標記化合物28(収率37%)を得た。
ESI-MS: m/z 566[M-H]-
参考例6に準じて得られる3-tert-ブチル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-7)および特開平11-158149の製造例5に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-メトキシアニリンから、実施例12に準じて標記化合物28(収率37%)を得た。
ESI-MS: m/z 566[M-H]-
1-[3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア (化合物29)
参考例6に準じて得られる3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-4)およびWO01/47890の製造例2に準じて得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物29(収率72%)を得た。
ESI-MS: m/z 572[M-H]-,596[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-4)およびWO01/47890の製造例2に準じて得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物29(収率72%)を得た。
ESI-MS: m/z 572[M-H]-,596[M+H]+
1-[3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物30)
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物30(収率58%)を得た。
ESI-MS: m/z 554[M-H]-,578[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物30(収率58%)を得た。
ESI-MS: m/z 554[M-H]-,578[M+H]+
1-[3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]ウレア (化合物31)
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物31(収率52%)を得た。
ESI-MS: m/z 572[M-H]-,596[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物31(収率52%)を得た。
ESI-MS: m/z 572[M-H]-,596[M+H]+
1-[3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア (化合物32)
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)およびWO01/47890の製造例2に準じて得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物32(収率56%)を得た。
ESI-MS: m/z 572[M-H]-,596[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)およびWO01/47890の製造例2に準じて得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物32(収率56%)を得た。
ESI-MS: m/z 572[M-H]-,596[M+H]+
1-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物33)
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物33(収率57%)を得た。
ESI-MS: m/z 554[M-H]-,578[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物33(収率57%)を得た。
ESI-MS: m/z 554[M-H]-,578[M+H]+
1-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア (化合物34)
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10)およびWO01/47890の製造例2に準じて得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物34(収率73%)を得た。
ESI-MS: m/z 572[M-H]-,596[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10)およびWO01/47890の製造例2に準じて得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物34(収率73%)を得た。
ESI-MS: m/z 572[M-H]-,596[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物35)
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物35(収率45%)を得た。
ESI-MS: m/z 540[M-H]-
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物35(収率45%)を得た。
ESI-MS: m/z 540[M-H]-
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]-3-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物36)
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物36(収率49%)を得た。
ESI-MS: m/z 558[M-H]-
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物36(収率49%)を得た。
ESI-MS: m/z 558[M-H]-
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]-3-[1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物37)
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物37 (収率57%)を得た。
ESI-MS: m/z 558[M-H]-
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物37 (収率57%)を得た。
ESI-MS: m/z 558[M-H]-
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-[1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物38)
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物38(収率66%)を得た。
ESI-MS: m/z 558[M-H]-
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物38(収率66%)を得た。
ESI-MS: m/z 558[M-H]-
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-(4-フルオロフェニル)-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-イル]ウレア (化合物39)
参考例6に準じて得られる1-(4-フルオロフェニル)-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-11)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物39(収率18%)を得た。
ESI-MS: m/z 552[M-H]-,576[M+H]+
参考例6に準じて得られる1-(4-フルオロフェニル)-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-11)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物39(収率18%)を得た。
ESI-MS: m/z 552[M-H]-,576[M+H]+
1-[2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-(3-シクロプロピル-1-メチル-1H-ピラゾール-5-イル)ウレア (化合物40)
参考例6に準じて得られる3-シクロプロピル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-12)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物40(収率58%)を得た。
ESI-MS: m/z 492[M-H]-,494[M+H]+
参考例6に準じて得られる3-シクロプロピル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-12)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物40(収率58%)を得た。
ESI-MS: m/z 492[M-H]-,494[M+H]+
1-(3-tert-ブチル-1-メチル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]ウレア (化合物41)
参考例6に準じて得られる3-tert-ブチル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-13)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物41(収率74%)を得た。
ESI-MS: m/z 492[M-H]-,494[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-13)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物41(収率74%)を得た。
ESI-MS: m/z 492[M-H]-,494[M+H]+
1-(3-tert-ブチル-1-メチル-1H-ピラゾール-5-イル)-3-[2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物42)
参考例6に準じて得られる3-tert-ブチル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-13)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物42(収率52%)を得た。
ESI-MS: m/z 510[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-13)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物42(収率52%)を得た。
ESI-MS: m/z 510[M+H]+
1-(3-tert-ブチル-1-メチル-1H-ピラゾール-5-イル)-3-[3-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物43)
参考例6に準じて得られる3-tert-ブチル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-13)および参考例18に従って得られる化合物A53から、実施例12に準じて標記化合物43(収率62%)を得た。
ESI-MS: m/z 508[M-H]-, 510[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-13)および参考例18に従って得られる化合物A53から、実施例12に準じて標記化合物43(収率62%)を得た。
ESI-MS: m/z 508[M-H]-, 510[M+H]+
1-(3-シクロペンチル-1-メチル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]ウレア (化合物44)
参考例6に準じて得られる3-シクロペンチル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-14)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物44(収率75%)を得た。
ESI-MS: m/z 504[M-H]-
参考例6に準じて得られる3-シクロペンチル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-14)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物44(収率75%)を得た。
ESI-MS: m/z 504[M-H]-
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-メチル-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-イル]ウレア (化合物45)
参考例6に準じて得られる1-メチル-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-15)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物45(収率52%)を得た。
ESI-MS: m/z 472[M-H]-
参考例6に準じて得られる1-メチル-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-15)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物45(収率52%)を得た。
ESI-MS: m/z 472[M-H]-
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]-3-[1-メチル-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-イル]ウレア (化合物46)
参考例6に準じて得られる1-メチル-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-15)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物46(収率73%)を得た。
ESI-MS: m/z 490[M-H]-,514[M+H]+
参考例6に準じて得られる1-メチル-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-15)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物46(収率73%)を得た。
ESI-MS: m/z 490[M-H]-,514[M+H]+
1-[2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-メチル-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-イル]ウレア (化合物47)
参考例6に準じて得られる1-メチル-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-15)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物47(収率47%)を得た。
ESI-MS: m/z 506[M-H]-
参考例6に準じて得られる1-メチル-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-15)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物47(収率47%)を得た。
ESI-MS: m/z 506[M-H]-
1-(3-tert-ブチル-1-エチル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物48)
参考例6に準じて得られる3-tert-ブチル-1-エチル-1H-ピラゾール-5-アミン(化合物A17-16)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物48(収率65%)を得た。
ESI-MS: m/z 488[M-H]-
参考例6に準じて得られる3-tert-ブチル-1-エチル-1H-ピラゾール-5-アミン(化合物A17-16)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物48(収率65%)を得た。
ESI-MS: m/z 488[M-H]-
1-(3-tert-ブチル-1-エチル-1H-ピラゾール-5-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア (化合物49)
参考例6に準じて得られる3-tert-ブチル-1-エチル-1H-ピラゾール-5-アミン(化合物A17-16)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物49(収率60%)を得た。
ESI-MS: m/z 506[M-H]-,508[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-エチル-1H-ピラゾール-5-アミン(化合物A17-16)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物49(収率60%)を得た。
ESI-MS: m/z 506[M-H]-,508[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-(3-イソプロピル-1-メチル-1H-ピラゾール-5-イル)ウレア (化合物50)
参考例6に準じて得られる3-イソプロピル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-17)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物50(収率63%)を得た。
ESI-MS: m/z 478[M-H]-,480[M+H]+
参考例6に準じて得られる3-イソプロピル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-17)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例12に準じて標記化合物50(収率63%)を得た。
ESI-MS: m/z 478[M-H]-,480[M+H]+
1-[2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-(3-イソプロピル-1-メチル-1H-ピラゾール-5-イル)ウレア (化合物51)
参考例6に準じて得られる3-イソプロピル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-17)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物51(収率49%)を得た。
ESI-MS: m/z 494[M-H]-,518[M+H]+
参考例6に準じて得られる3-イソプロピル-1-メチル-1H-ピラゾール-5-アミン(化合物A17-17)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物51(収率49%)を得た。
ESI-MS: m/z 494[M-H]-,518[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロフェニル]-3-[1-メチル-3-(ペンタン-3-イル)-1H-ピラゾール-5-イル]ウレア (化合物52)
参考例6に準じて得られる1-メチル-3-(ペンタン-3-イル)-1H-ピラゾール-5-アミン(化合物A17-18)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物52(収率66%)を得た。
ESI-MS: m/z 506[M-H]-,530[M+H]+
参考例6に準じて得られる1-メチル-3-(ペンタン-3-イル)-1H-ピラゾール-5-アミン(化合物A17-18)およびJournal of Medicinal Chemistry, 2005, 48(5), 1359-1366に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-2-フルオロアニリンから、実施例12に準じて標記化合物52(収率66%)を得た。
ESI-MS: m/z 506[M-H]-,530[M+H]+
1-[2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-メチル-3-(テトラヒドロフラン-3-イル)-1H-ピラゾール-5-イル]ウレア (化合物53)
参考例6に準じて得られる1-メチル-3-(テトラヒドロフラン-3-イル)-1H-ピラゾール-5-アミン(化合物A17-19)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物53(収率39%)を得た。
ESI-MS: m/z 522[M-H]-,546[M+H]+
参考例6に準じて得られる1-メチル-3-(テトラヒドロフラン-3-イル)-1H-ピラゾール-5-アミン(化合物A17-19)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物53(収率39%)を得た。
ESI-MS: m/z 522[M-H]-,546[M+H]+
1-[4-(6-メトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-フェニル-1H-ピラゾール-5-イル]ウレア (化合物54)
参考例6に準じて得られる3-(1-メチルシクロプロピル)-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-1)および参考例7に従って得られる化合物A21から、実施例12に準じて標記化合物54(収率90%)を得た。
ESI-MS: m/z 506[M+H]+
参考例6に準じて得られる3-(1-メチルシクロプロピル)-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-1)および参考例7に従って得られる化合物A21から、実施例12に準じて標記化合物54(収率90%)を得た。
ESI-MS: m/z 506[M+H]+
1-[3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6-メトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物55)
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)および参考例7に従って得られる化合物A21から、実施例12に準じて標記化合物55(収率23%)を得た。
ESI-MS: m/z 524[M-H]-,548[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)および参考例7に従って得られる化合物A21から、実施例12に準じて標記化合物55(収率23%)を得た。
ESI-MS: m/z 524[M-H]-,548[M+H]+
1-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6-メトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物56)
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10)および参考例7に従って得られる化合物A21から、実施例12に準じて標記化合物56(収率23%)を得た。
ESI-MS: m/z 524[M-H]-,548[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10)および参考例7に従って得られる化合物A21から、実施例12に準じて標記化合物56(収率23%)を得た。
ESI-MS: m/z 524[M-H]-,548[M+H]+
1-[3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(6-メトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物57)
参考例6に準じて得られる3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-4)および参考例7に従って得られる化合物A21から、実施例12に準じて標記化合物57(収率22%)を得た。
ESI-MS: m/z 524[M-H]-,548[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(2-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-4)および参考例7に従って得られる化合物A21から、実施例12に準じて標記化合物57(収率22%)を得た。
ESI-MS: m/z 524[M-H]-,548[M+H]+
1-[4-(7-メトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-フェニル-1H-ピラゾール-5-イル]ウレア (化合物58)
参考例6に準じて得られる3-(1-メチルシクロプロピル)-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-1)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物58(収率89%)を得た。
ESI-MS: m/z 506[M+H]+
参考例6に準じて得られる3-(1-メチルシクロプロピル)-1-フェニル-1H-ピラゾール-5-アミン(化合物A17-1)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物58(収率89%)を得た。
ESI-MS: m/z 506[M+H]+
1-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]-3-[4-(7-メトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物59)
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物59(収率94%)を得た。
1H-NMR (CDCl3) δ: 8.49(1H,d, J = 5.4 Hz), 8.23 (1H, d, J = 9.0 Hz), 7.91 (1H, s), 7.41 (2H, dd, J =9.6,2.6 Hz), 7.29 (1H, d, J = 2.4 Hz), 7.24-7.15 (4H, m), 7.12-7.08 (2H, m),6.90(1H, tt, J = 7.6, 2.6 Hz), 6.42 (1H, s), 6.37 (1H, d, J = 5.4 Hz), 3.92(3H,s), 2.99 (1H, td, J = 13.9, 7.0 Hz), 1.31 (6H, d, J = 7.1 Hz).
ESI-MS: m/z 510[M-H]-, 512[M+H]+
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物59(収率94%)を得た。
1H-NMR (CDCl3) δ: 8.49(1H,d, J = 5.4 Hz), 8.23 (1H, d, J = 9.0 Hz), 7.91 (1H, s), 7.41 (2H, dd, J =9.6,2.6 Hz), 7.29 (1H, d, J = 2.4 Hz), 7.24-7.15 (4H, m), 7.12-7.08 (2H, m),6.90(1H, tt, J = 7.6, 2.6 Hz), 6.42 (1H, s), 6.37 (1H, d, J = 5.4 Hz), 3.92(3H,s), 2.99 (1H, td, J = 13.9, 7.0 Hz), 1.31 (6H, d, J = 7.1 Hz).
ESI-MS: m/z 510[M-H]-, 512[M+H]+
1-[3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(7-メトキシキノリン-4-イルオキシ)フェニル]ウレア(化合物60)
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物60(収率58%)を得た。
ESI-MS: m/z 524[M-H]-
参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物60(収率58%)を得た。
ESI-MS: m/z 524[M-H]-
1-[1-(4-フルオロフェニル)-3-(1-メチルシクロプロピル)-1H-ピラソール-5-イル]-3-[4-(7-メトキシキノリン-4-イルオキシ)フェニル]ウレア(化合物61)
参考例6に準じて得られる1-(4-フルオロフェニル)-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-11)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物61(収率30%)を得た。
ESI-MS: m/z 522[M-H]-,546[M+H]+
参考例6に準じて得られる1-(4-フルオロフェニル)-3-(1-メチルシクロプロピル)-1H-ピラゾール-5-アミン(化合物A17-11)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物61(収率30%)を得た。
ESI-MS: m/z 522[M-H]-,546[M+H]+
1-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(7-メトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物62)
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物62(収率87%)を得た。
ESI-MS: m/z 524[M-H]-,526[M+H]+
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10)および参考例4に従って得られる化合物A11から、実施例12に準じて標記化合物62(収率87%)を得た。
ESI-MS: m/z 524[M-H]-,526[M+H]+
1-[4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)フェニル]-3-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物63)
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)およびWO03/033472の製造例1に従って得られる4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物63(収率99%)を得た。
ESI-MS: m/z 619[M+H]+
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3)およびWO03/033472の製造例1に従って得られる4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物63(収率99%)を得た。
ESI-MS: m/z 619[M+H]+
1-[4-(6-ベンジルオキシキノリン-4-イルオキシ)フェニル]-3-(3-イソプロピル-1-フェニル-1H-ピラゾール-5-イル)ウレア (化合物64)
参考例6に従って得られる化合物A17(130 mg) をクロロホルム(14 mL)に溶解し、室温でトリエチルアミン(460 mg)を加え、0℃でトリホスゲン(115 mg)を加え、30分間撹拌した後、参考例8に従って得られた化合物A23 (200 mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、さらに分取薄層クロマトグラフィーで精製することにより、標記化合物64(295 mg、収率89%)を得た。
参考例6に従って得られる化合物A17(130 mg) をクロロホルム(14 mL)に溶解し、室温でトリエチルアミン(460 mg)を加え、0℃でトリホスゲン(115 mg)を加え、30分間撹拌した後、参考例8に従って得られた化合物A23 (200 mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製し、さらに分取薄層クロマトグラフィーで精製することにより、標記化合物64(295 mg、収率89%)を得た。
1-[4-(6-ヒドロキシキノリン-4-イルオキシ)フェニル]-3-(3-イソプロピル-1-フェニル-1H-ピラゾール-5-イル)ウレア (化合物65)
実施例64に従って得られる化合物64 (273 mg)をトリフルオロ酢酸(1 mL)に溶解させ、メタンスルホン酸(0.1 mL)を加え、室温で2時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、クロロホルム、水および10%水酸化ナトリウム水溶液を加えpH 9とした。クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(クロロホルム:メタノール=10:1)で精製し、さらにアセトニトリルに懸濁後、不溶物をろ取して、標記化合物65(188 mg、収率82%)を得た。
1H-NMR (CD3OD) δ: 8.39(1H,d, J = 5.1 Hz), 7.86 (1H, d, J = 9.0 Hz), 7.59-7.47 (8H, m), 7.37 (1H, dd,J =9.1, 2.8 Hz), 7.15 (2H, dt, J = 9.8, 2.7 Hz), 6.54 (1H, d, J = 5.1 Hz),6.41(1H, s), 3.00-2.94 (1H, m), 1.31 (6H, d, J = 7.1 Hz).
ESI-MS: m/z 480[M+H]+
実施例64に従って得られる化合物64 (273 mg)をトリフルオロ酢酸(1 mL)に溶解させ、メタンスルホン酸(0.1 mL)を加え、室温で2時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、クロロホルム、水および10%水酸化ナトリウム水溶液を加えpH 9とした。クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(クロロホルム:メタノール=10:1)で精製し、さらにアセトニトリルに懸濁後、不溶物をろ取して、標記化合物65(188 mg、収率82%)を得た。
1H-NMR (CD3OD) δ: 8.39(1H,d, J = 5.1 Hz), 7.86 (1H, d, J = 9.0 Hz), 7.59-7.47 (8H, m), 7.37 (1H, dd,J =9.1, 2.8 Hz), 7.15 (2H, dt, J = 9.8, 2.7 Hz), 6.54 (1H, d, J = 5.1 Hz),6.41(1H, s), 3.00-2.94 (1H, m), 1.31 (6H, d, J = 7.1 Hz).
ESI-MS: m/z 480[M+H]+
1-[4-(6-ベンジルオキシキノリン-4-イルオキシ)フェニル]-3-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア(化合物66)
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3 、142 mg)をクロロホルム(14 mL)に溶解し、室温でトリエチルアミン(460 mg)を加え、0℃でトリホスゲン(115 mg)を加え、30分間撹拌した後、参考例8に従って得られた化合物A23 (200 mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:アセトン=92:8-34:66)で精製し、さらに分取薄層クロマトグラフィー(クロロホルム:メタノール=20:1)で精製することにより、標記化合物66(307 mg、収率89%)を得た。
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3 、142 mg)をクロロホルム(14 mL)に溶解し、室温でトリエチルアミン(460 mg)を加え、0℃でトリホスゲン(115 mg)を加え、30分間撹拌した後、参考例8に従って得られた化合物A23 (200 mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:アセトン=92:8-34:66)で精製し、さらに分取薄層クロマトグラフィー(クロロホルム:メタノール=20:1)で精製することにより、標記化合物66(307 mg、収率89%)を得た。
1-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]-3-[4-(6-ヒドロキシキノリン-4-イルオキシ)フェニル]ウレア (化合物67)
実施例66に従って得られた1-[4-(6-ベンジルオキシキノリン-4-イルオキシ)フェニル]-3-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア(化合物66)から、実施例65に準じて標記化合物67 (収率96%)を得た。
ESI-MS: m/z 498[M+H]+
実施例66に従って得られた1-[4-(6-ベンジルオキシキノリン-4-イルオキシ)フェニル]-3-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア(化合物66)から、実施例65に準じて標記化合物67 (収率96%)を得た。
ESI-MS: m/z 498[M+H]+
1-[4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)フェニル]-3-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア(化合物68)
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3、72 mg)をクロロホルム(2 mL)に溶解し、室温でトリエチルアミン(0.321 mL)を加え、0℃でトリホスゲン(60 mg)を加え、30分間撹拌後、WO03/033472の製造例1に従って得られる4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)アニリン(100mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノ-ル=100:0-96:4)で精製し、標記化合物68 (152 mg、収率82%)を得た。
参考例6に準じて得られる1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-3、72 mg)をクロロホルム(2 mL)に溶解し、室温でトリエチルアミン(0.321 mL)を加え、0℃でトリホスゲン(60 mg)を加え、30分間撹拌後、WO03/033472の製造例1に従って得られる4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)アニリン(100mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノ-ル=100:0-96:4)で精製し、標記化合物68 (152 mg、収率82%)を得た。
1-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]-3-[4-(7-ヒドロキシ-6-メトキシキノリン-4-イルオキシ)フェニル]ウレア(化合物69)
実施例68に従って得られた化合物68 (152 mg)をトリフルオロ酢酸(2 mL)に溶解し、メタンスルホン酸(0.2 mL)を加え、室温で2時間撹拌した。得られた反応混合物に、酢酸エチルおよび飽和炭酸水素ナトリウム水溶液を加え、酢酸エチルで抽出し、有機層を水および飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣に酢酸エチルを加え、析出した固体をろ取して標記化合物69(54 mg、収率41%)を得た。
実施例68に従って得られた化合物68 (152 mg)をトリフルオロ酢酸(2 mL)に溶解し、メタンスルホン酸(0.2 mL)を加え、室温で2時間撹拌した。得られた反応混合物に、酢酸エチルおよび飽和炭酸水素ナトリウム水溶液を加え、酢酸エチルで抽出し、有機層を水および飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣に酢酸エチルを加え、析出した固体をろ取して標記化合物69(54 mg、収率41%)を得た。
1-[1-(3-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]-3-{4-[7-(2-ヒドロキシエトキシ)-6-メトキシキノリン-4-イルオキシ]フェニル}ウレア (化合物70)
実施例69に従って得られる化合物69(66 mg)をDMF(2 mL)に溶解し、エチレンカーボネート(54 mg)および炭酸カリウム(124 mg)を加え、80℃で終夜加熱撹拌した。反応終了後、水を加え、酢酸エチルで抽出し、有機層を水および飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=50:1-20:1)で精製することにより標記化合物70(5.5 mg、収率8%)を得た。
1H-NMR (CD3OD) δ: 8.39(1H,d, J = 5.4 Hz), 7.90 (1H, s), 7.64-7.51 (4H, m), 7.39-7.33 (3H, m),7.25-7.16(3H, m), 6.50 (1H, d, J = 5.4 Hz), 6.41 (1H, s), 4.24 (2H, t, J = 4.8Hz), 4.01(3H, s), 3.99 (2H, d, J = 4.6 Hz), 3.01-2.94 (1H, m), 1.31 (6H, d, J =7.1 Hz).
ESI-MS: m/z 572[M+H]+
実施例69に従って得られる化合物69(66 mg)をDMF(2 mL)に溶解し、エチレンカーボネート(54 mg)および炭酸カリウム(124 mg)を加え、80℃で終夜加熱撹拌した。反応終了後、水を加え、酢酸エチルで抽出し、有機層を水および飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=50:1-20:1)で精製することにより標記化合物70(5.5 mg、収率8%)を得た。
1H-NMR (CD3OD) δ: 8.39(1H,d, J = 5.4 Hz), 7.90 (1H, s), 7.64-7.51 (4H, m), 7.39-7.33 (3H, m),7.25-7.16(3H, m), 6.50 (1H, d, J = 5.4 Hz), 6.41 (1H, s), 4.24 (2H, t, J = 4.8Hz), 4.01(3H, s), 3.99 (2H, d, J = 4.6 Hz), 3.01-2.94 (1H, m), 1.31 (6H, d, J =7.1 Hz).
ESI-MS: m/z 572[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-イル]ウレア (化合物71)
参考例9に従って得られる化合物A28(420 mg)をクロロホルム(15 mL)に溶解し、トリエチルアミン(1.91 mL)を室温で加えた。氷冷下トリホスゲン(348 mg)を加え、5分間撹拌した後、WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(527 mg)を加えた。室温で終夜撹拌した後、水を加えクロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、酢酸エチルおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、さらに、クロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで再精製し、次いでアセトニトリルを用いて再結晶し、最後にイソプロピルアルコールで再結晶することにより、標記化合物71(406 mg、収率42%)を得た。
1H-NMR (CDCl3) δ: 8.53(2H,d, J = 6.1 Hz), 8.46 (1H, d, J = 5.4 Hz), 8.05 (1H, s), 7.55-7.48 (5H, m),7.41(1H, s), 7.16-7.14 (2H, m), 6.43 (3H, t, J = 5.4 Hz), 4.05 (3H, s), 4.04(3H,s), 1.49 (3H, s), 1.06 (2H, dd, J = 6.3, 4.1 Hz), 0.81 (2H, dd, J = 6.3,4.1Hz).
ESI-MS: m/z 537[M+H]+
参考例9に従って得られる化合物A28(420 mg)をクロロホルム(15 mL)に溶解し、トリエチルアミン(1.91 mL)を室温で加えた。氷冷下トリホスゲン(348 mg)を加え、5分間撹拌した後、WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(527 mg)を加えた。室温で終夜撹拌した後、水を加えクロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、酢酸エチルおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、さらに、クロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで再精製し、次いでアセトニトリルを用いて再結晶し、最後にイソプロピルアルコールで再結晶することにより、標記化合物71(406 mg、収率42%)を得た。
1H-NMR (CDCl3) δ: 8.53(2H,d, J = 6.1 Hz), 8.46 (1H, d, J = 5.4 Hz), 8.05 (1H, s), 7.55-7.48 (5H, m),7.41(1H, s), 7.16-7.14 (2H, m), 6.43 (3H, t, J = 5.4 Hz), 4.05 (3H, s), 4.04(3H,s), 1.49 (3H, s), 1.06 (2H, dd, J = 6.3, 4.1 Hz), 0.81 (2H, dd, J = 6.3,4.1Hz).
ESI-MS: m/z 537[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-イル]ウレア (化合物72)
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A28-1)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例71に準じて標記化合物72 (収率66%)を得た。
1H-NMR (CDCl3) δ: 8.79(1H,d, J = 2.4 Hz), 8.44 (1H, d, J = 5.4 Hz), 8.40 (1H, t, J = 2.4 Hz), 7.95(1H,dd, J = 8.4, 1.6 Hz), 7.64 (1H, s), 7.53 (2H, s), 7.39 (4H, dt, J = 10.6,3.4Hz), 7.11 (2H, dd, J = 6.8, 2.2 Hz), 6.41 (2H, t, J = 2.6 Hz), 4.04 (6H,s),1.49 (3H, s), 1.05 (2H, dd, J = 6.2, 4.0 Hz), 0.80 (2H, dd, J = 6.3, 4.1Hz).
ESI-MS: m/z 537[M+H]+
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A28-1)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例71に準じて標記化合物72 (収率66%)を得た。
1H-NMR (CDCl3) δ: 8.79(1H,d, J = 2.4 Hz), 8.44 (1H, d, J = 5.4 Hz), 8.40 (1H, t, J = 2.4 Hz), 7.95(1H,dd, J = 8.4, 1.6 Hz), 7.64 (1H, s), 7.53 (2H, s), 7.39 (4H, dt, J = 10.6,3.4Hz), 7.11 (2H, dd, J = 6.8, 2.2 Hz), 6.41 (2H, t, J = 2.6 Hz), 4.04 (6H,s),1.49 (3H, s), 1.05 (2H, dd, J = 6.2, 4.0 Hz), 0.80 (2H, dd, J = 6.3, 4.1Hz).
ESI-MS: m/z 537[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-イル]ウレア (化合物73)
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A28-1)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例71に準じて標記化合物73 (収率49%)を得た。
1H-NMR (CDCl3) δ: 8.77(1H,d, J = 2.4 Hz), 8.44 (1H, d, J = 5.4 Hz), 8.37 (1H, d, J = 3.4 Hz), 7.94(2H,dd, J = 9.6, 7.9 Hz), 7.70 (1H, s), 7.55 (2H, dd, J = 11.6, 2.6 Hz), 7.38(2H,t, J = 6.5 Hz), 7.15 (1H, t, J = 8.7 Hz), 6.99 (1H, d, J = 7.1 Hz), 6.43(1H,s), 6.37 (1H, d, J = 5.4 Hz), 4.04 (6H, d, J = 6.3 Hz), 1.50 (3H, s), 1.06(2H,dd, J = 6.1, 4.1 Hz), 0.81 (2H, dd, J = 6.3, 4.1 Hz).
ESI-MS: m/z 555[M+H]+
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A28-1)およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例71に準じて標記化合物73 (収率49%)を得た。
1H-NMR (CDCl3) δ: 8.77(1H,d, J = 2.4 Hz), 8.44 (1H, d, J = 5.4 Hz), 8.37 (1H, d, J = 3.4 Hz), 7.94(2H,dd, J = 9.6, 7.9 Hz), 7.70 (1H, s), 7.55 (2H, dd, J = 11.6, 2.6 Hz), 7.38(2H,t, J = 6.5 Hz), 7.15 (1H, t, J = 8.7 Hz), 6.99 (1H, d, J = 7.1 Hz), 6.43(1H,s), 6.37 (1H, d, J = 5.4 Hz), 4.04 (6H, d, J = 6.3 Hz), 1.50 (3H, s), 1.06(2H,dd, J = 6.1, 4.1 Hz), 0.81 (2H, dd, J = 6.3, 4.1 Hz).
ESI-MS: m/z 555[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-イル]ウレア (化合物74)
参考例9に従って得られる化合物A28およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例71に準じて標記化合物74 (収率82%)を得た。
1H-NMR (CDCl3) δ: 8.64(1H,s), 8.49 (3H, dd, J = 13.7, 5.9 Hz), 7.64 (1H, dd, J = 12.1, 2.3 Hz), 7.58(1H,s), 7.52 (3H, td, J = 6.6, 3.7 Hz), 7.40 (1H, s), 7.17 (1H, ddd, J =29.7,12.1, 4.3 Hz), 6.44 (1H, s), 6.40 (1H, d, J = 5.4 Hz), 4.07 (3H, s), 4.04(3H,s), 1.49 (3H, s), 1.05 (2H, dd, J = 6.3, 4.1 Hz), 0.81 (2H, dd, J = 6.5,4.3Hz).
ESI-MS: m/z 553[M-H]-, 555[M+H]+
参考例9に従って得られる化合物A28およびWO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリンから、実施例71に準じて標記化合物74 (収率82%)を得た。
1H-NMR (CDCl3) δ: 8.64(1H,s), 8.49 (3H, dd, J = 13.7, 5.9 Hz), 7.64 (1H, dd, J = 12.1, 2.3 Hz), 7.58(1H,s), 7.52 (3H, td, J = 6.6, 3.7 Hz), 7.40 (1H, s), 7.17 (1H, ddd, J =29.7,12.1, 4.3 Hz), 6.44 (1H, s), 6.40 (1H, d, J = 5.4 Hz), 4.07 (3H, s), 4.04(3H,s), 1.49 (3H, s), 1.05 (2H, dd, J = 6.3, 4.1 Hz), 0.81 (2H, dd, J = 6.5,4.3Hz).
ESI-MS: m/z 553[M-H]-, 555[M+H]+
4-(4-{3-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]ウレイド}フェノキシ)-6-メトキシキノリン-7-イルメタンスルホナート (化合物75)
実施例78に従って得られる化合物78 (30 mg)をジクロロメタン(1.0 mL)に溶解し、0℃でトリエチルアミン(23.0 μL)およびメタンスルホニルクロリド(10.7 μL)を加え、室温で1時間撹拌した。反応終了後に水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、クロロホルム、ジイソプロピルエーテルおよびヘキサンの混合溶媒を用いてスラリー精製し、標記化合物75(16.2 mg、収率47%)を得た。
1H-NMR (CDCl3) δ: 8.48 (d,J= 5.6 Hz, 1H), 8.05 (s, 2H), 7.76 (s, 1H), 7.53-7.43 (m, 4H), 7.09-7.01 (m,4H),6.55 (d, J = 5.6 Hz, 1H), 6.39 (s, 1H), 4.08 (s, 3H), 3.32 (s, 3H), 1.33(s,9H).
ESI-MS: m/z 618[M-H]-
実施例78に従って得られる化合物78 (30 mg)をジクロロメタン(1.0 mL)に溶解し、0℃でトリエチルアミン(23.0 μL)およびメタンスルホニルクロリド(10.7 μL)を加え、室温で1時間撹拌した。反応終了後に水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、クロロホルム、ジイソプロピルエーテルおよびヘキサンの混合溶媒を用いてスラリー精製し、標記化合物75(16.2 mg、収率47%)を得た。
1H-NMR (CDCl3) δ: 8.48 (d,J= 5.6 Hz, 1H), 8.05 (s, 2H), 7.76 (s, 1H), 7.53-7.43 (m, 4H), 7.09-7.01 (m,4H),6.55 (d, J = 5.6 Hz, 1H), 6.39 (s, 1H), 4.08 (s, 3H), 3.32 (s, 3H), 1.33(s,9H).
ESI-MS: m/z 618[M-H]-
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-(3-メチルチオ-1-フェニル-1H-ピラゾール-5-イル)ウレア (化合物76)
参考例10に従って得られる化合物A31(39.2 mg)をクロロホルム(1 mL)に溶解し、トリエチルアミン(161 mg)を室温で加えた。0℃に冷却し、トリホスゲン(17.5 mg)を加え、10分間撹拌した後、WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(50mg)を加えた。室温に昇温して終夜撹拌した後、1時間加熱還流した。反応終了後、室温に冷却し、水を加えて、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製することにより、標記化合物76(21.1mg、収率24%)を得た。
1H-NMR (CDCl3, 300 MHz) δ:9.09-8.80(m, 1H), 8.33-8.27 (m, 1H), 7.85-7.63 (m, 1H), 7.57 (s, 1H), 7.54-7.51(s, 1H),7.28-7.16 (m, 3H), 7.16-7.01 (m, 5H), 6.58 (s, 1H), 6.33 (d, J = 5.5Hz, 1H),4.06 (s, 3H), 3.96 (s, 3H), 2.55-2.52 (m, 3H).
ESI-MS: m/z 544[M-H]-, 546[M+H]+
参考例10に従って得られる化合物A31(39.2 mg)をクロロホルム(1 mL)に溶解し、トリエチルアミン(161 mg)を室温で加えた。0℃に冷却し、トリホスゲン(17.5 mg)を加え、10分間撹拌した後、WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(50mg)を加えた。室温に昇温して終夜撹拌した後、1時間加熱還流した。反応終了後、室温に冷却し、水を加えて、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製することにより、標記化合物76(21.1mg、収率24%)を得た。
1H-NMR (CDCl3, 300 MHz) δ:9.09-8.80(m, 1H), 8.33-8.27 (m, 1H), 7.85-7.63 (m, 1H), 7.57 (s, 1H), 7.54-7.51(s, 1H),7.28-7.16 (m, 3H), 7.16-7.01 (m, 5H), 6.58 (s, 1H), 6.33 (d, J = 5.5Hz, 1H),4.06 (s, 3H), 3.96 (s, 3H), 2.55-2.52 (m, 3H).
ESI-MS: m/z 544[M-H]-, 546[M+H]+
1-[4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)フェニル]-3-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]ウレア(化合物77)
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10、1.00 g)をクロロホルム(40 mL)に溶解し、室温でトリエチルアミン(4.2 mL)を加え、0℃でトリホスゲン(762 mg)およびWO03/033472の製造例1に従って得られる4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)アニリン(1.45 g)を加え、室温で24時間撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、クロロホルムおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィで精製し、標記化合物77(1.52 g、収率62%)を得た。
参考例6に準じて得られる3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-10、1.00 g)をクロロホルム(40 mL)に溶解し、室温でトリエチルアミン(4.2 mL)を加え、0℃でトリホスゲン(762 mg)およびWO03/033472の製造例1に従って得られる4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)アニリン(1.45 g)を加え、室温で24時間撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、クロロホルムおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィで精製し、標記化合物77(1.52 g、収率62%)を得た。
1-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[4-(7-ヒドロキシ-6-メトキシキノリン-4-イルオキシ)フェニル]ウレア(化合物78)
実施例77に従って得られた化合物77 (1.48 g)をトリフルオロ酢酸(15 mL)に溶解し、0℃でメタンスルホン酸(1.5 mL)を加えて室温で1.5時間撹拌した。得られた反応混合物から減圧下で溶媒を留去し、残渣にクロロホルム、酢酸エチルおよび水を加えた後、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、クロロホルム、メタノールおよびジイソプロピルエーテルの混合溶液でスラリー精製することで、標記化合物78(812 mg、収率64%)を得た。
実施例77に従って得られた化合物77 (1.48 g)をトリフルオロ酢酸(15 mL)に溶解し、0℃でメタンスルホン酸(1.5 mL)を加えて室温で1.5時間撹拌した。得られた反応混合物から減圧下で溶媒を留去し、残渣にクロロホルム、酢酸エチルおよび水を加えた後、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、クロロホルム、メタノールおよびジイソプロピルエーテルの混合溶液でスラリー精製することで、標記化合物78(812 mg、収率64%)を得た。
(S)-1-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]-3-{4-[7-(2,2-ジメチル-1,3-ジオキソラン-4-イル)メトキシ-6-メトキシキノリン-4-イルオキシ]フェニル}ウレア(化合物79)
実施例78に従って得られた化合物78 (104 mg)をDMF(2.0 mL)に溶解し、-10℃で水素化ナトリウム(11.5 mg)を加え、-10℃で15分間撹拌した後、-10℃で(R)-(2,2-ジメチル-1,3-ジオキソラン-4-イル)メチル 4-メチルベンゼンスルホナート(109.7 mg)を加え、80℃で7時間撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、シリカゲルカラムクロマトグラフィ(クロロホルム:酢酸エチル= 1:1-1:4)で精製し、標記化合物79(23.4 mg、収率19%)を得た。
実施例78に従って得られた化合物78 (104 mg)をDMF(2.0 mL)に溶解し、-10℃で水素化ナトリウム(11.5 mg)を加え、-10℃で15分間撹拌した後、-10℃で(R)-(2,2-ジメチル-1,3-ジオキソラン-4-イル)メチル 4-メチルベンゼンスルホナート(109.7 mg)を加え、80℃で7時間撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、シリカゲルカラムクロマトグラフィ(クロロホルム:酢酸エチル= 1:1-1:4)で精製し、標記化合物79(23.4 mg、収率19%)を得た。
(R)-1-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]-3-{4-[7-(2,3-ジヒドロキシプロポキシ)-6-メトキシキノリン-4-イルオキシ]フェニル}ウレア(化合物80)
実施例79に従って得られる化合物79 (43.8 mg)を2 mol/L-塩化水素エタノール溶液(2.0 mL)に溶解し、50 ℃で1.5時間撹拌した。反応終了後、減圧下溶媒を留去し、クロロホルム、メタノール、酢酸エチルおよびヘキサンの混合溶媒を加えてスラリー精製した。さらに得られた固体にイソプロパノールおよびジイソプロピルエーテルの混合溶媒を加えてスラリー精製し、標記化合物80(17.8mg、収率44%)を得た。
1H-NMR (DMSO-d6) δ: 9.57(s,1H), 8.80 (d, J = 6.6 Hz, 1H), 8.69 (s, 1H), 7.76 (s, 1H), 7.67-7.56 (m,6H),7.40-7.32 (m, 5H), 6.85 (d, J = 7.0 Hz, 1H), 6.36 (s, 1H), 4.27 (dd, J =9.7,3.8 Hz, 1H), 4.17-3.91 (m, 7H), 1.29 (s, 9H).
ESI-MS: m/z 616[M+H]+
実施例79に従って得られる化合物79 (43.8 mg)を2 mol/L-塩化水素エタノール溶液(2.0 mL)に溶解し、50 ℃で1.5時間撹拌した。反応終了後、減圧下溶媒を留去し、クロロホルム、メタノール、酢酸エチルおよびヘキサンの混合溶媒を加えてスラリー精製した。さらに得られた固体にイソプロパノールおよびジイソプロピルエーテルの混合溶媒を加えてスラリー精製し、標記化合物80(17.8mg、収率44%)を得た。
1H-NMR (DMSO-d6) δ: 9.57(s,1H), 8.80 (d, J = 6.6 Hz, 1H), 8.69 (s, 1H), 7.76 (s, 1H), 7.67-7.56 (m,6H),7.40-7.32 (m, 5H), 6.85 (d, J = 7.0 Hz, 1H), 6.36 (s, 1H), 4.27 (dd, J =9.7,3.8 Hz, 1H), 4.17-3.91 (m, 7H), 1.29 (s, 9H).
ESI-MS: m/z 616[M+H]+
(R)-1-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]-3-{4-[7-(2,2-ジメチル-1,3-ジオキソラン-4-イル)メトキシ-6-メトキシキノリン-4-イルオキシ]フェニル}ウレア(化合物81)
実施例78に従って得られた化合物78 (50.0 mg)をDMF(1.0 mL)に溶解し、-10 ℃で水素化ナトリウム(5.5 mg)を加え、-10 ℃で10分間撹拌した後、-10 ℃で(S)-(2,2-ジメチル-1,3-ジオキソラン-4-イル)メチル 4-メチルベンゼンスルホナート(52.9 mg)を加え、80 ℃で16時間撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、シリカゲルカラムクロマトグラフィ(クロロホルム:酢酸エチル=1:1-1:4)で精製し、標記化合物81(6.0 mg、収率10%)を得た。
実施例78に従って得られた化合物78 (50.0 mg)をDMF(1.0 mL)に溶解し、-10 ℃で水素化ナトリウム(5.5 mg)を加え、-10 ℃で10分間撹拌した後、-10 ℃で(S)-(2,2-ジメチル-1,3-ジオキソラン-4-イル)メチル 4-メチルベンゼンスルホナート(52.9 mg)を加え、80 ℃で16時間撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、シリカゲルカラムクロマトグラフィ(クロロホルム:酢酸エチル=1:1-1:4)で精製し、標記化合物81(6.0 mg、収率10%)を得た。
(S)-1-[3-tert-ブチル-1-(4-フルオロフェニル)-1H-ピラゾール-5-イル]-3-{4-[7-(2,3-ジヒドロキシプロポキシ)-6-メトキシキノリン-4-イルオキシ]フェニル}ウレア (化合物82)
実施例81に従って得られる化合物81から、実施例80に準じて標記化合物82 (収率38%)を得た。
1H-NMR (DMSO-d6) δ: 9.51(s,1H), 8.80 (d, J = 6.6 Hz, 1H), 8.65 (s, 1H), 7.76 (s, 1H), 7.65-7.56 (m,6H),7.40-7.32 (m, 4H), 6.85 (d, J = 6.6 Hz, 1H), 4.27 (dd, J = 10.1, 3.8 Hz,1H),4.17-3.92 (m, 6H), 1.29 (s, 9H).
ESI-MS: m/z 614[M-H]-, 616[M+H]+
実施例81に従って得られる化合物81から、実施例80に準じて標記化合物82 (収率38%)を得た。
1H-NMR (DMSO-d6) δ: 9.51(s,1H), 8.80 (d, J = 6.6 Hz, 1H), 8.65 (s, 1H), 7.76 (s, 1H), 7.65-7.56 (m,6H),7.40-7.32 (m, 4H), 6.85 (d, J = 6.6 Hz, 1H), 4.27 (dd, J = 10.1, 3.8 Hz,1H),4.17-3.92 (m, 6H), 1.29 (s, 9H).
ESI-MS: m/z 614[M-H]-, 616[M+H]+
1-[3-(1-ベンジルオキシ-2-メチルプロパン-2-イル)-1-フェニル-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア(化合物83)
参考例11に従って得られる化合物A35(91.0 mg)をクロロホルム(2 mL)に溶解し、トリエチルアミン(184 mg)を室温で加えた。0 ℃に冷却し、トリホスゲン(38.5 mg)を加え、10分間撹拌した後、WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(81mg)を加えた。室温に昇温して終夜撹拌して反応終了後、水を加えて、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびアセトンを展開溶媒とする分取薄層クロマトグラフィーで精製することにより、標記化合物83(114 mg、収率67%)を得た。
1H-NMR (CDCl3, 270 MHz) δ:8.55-8.30(m, 2H), 7.57 (s, 1H), 7.51 (dd, J = 12.5, 2.6 Hz, 1H), 7.41-6.95 (m,14H),6.47 (s, 1H), 6.34 (d, J = 5.6 Hz, 1H), 4.53 (s, 2H), 4.06 (s, 3H), 3.98(s,3H), 3.55 (s, 2H), 1.38 (s, 6H).
ESI-MS: m/z 660[M-H]-, 662[M+H]+
参考例11に従って得られる化合物A35(91.0 mg)をクロロホルム(2 mL)に溶解し、トリエチルアミン(184 mg)を室温で加えた。0 ℃に冷却し、トリホスゲン(38.5 mg)を加え、10分間撹拌した後、WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(81mg)を加えた。室温に昇温して終夜撹拌して反応終了後、水を加えて、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびアセトンを展開溶媒とする分取薄層クロマトグラフィーで精製することにより、標記化合物83(114 mg、収率67%)を得た。
1H-NMR (CDCl3, 270 MHz) δ:8.55-8.30(m, 2H), 7.57 (s, 1H), 7.51 (dd, J = 12.5, 2.6 Hz, 1H), 7.41-6.95 (m,14H),6.47 (s, 1H), 6.34 (d, J = 5.6 Hz, 1H), 4.53 (s, 2H), 4.06 (s, 3H), 3.98(s,3H), 3.55 (s, 2H), 1.38 (s, 6H).
ESI-MS: m/z 660[M-H]-, 662[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-[3-(1-ヒドロキシ-2-メチルプロパン-2-イル)-1-フェニル-1H-ピラゾール-5-イル]ウレア (化合物84)
実施例83に従って得られた化合物83 (91 mg)にTHF(1.5 mL)および水酸化パラジウム(60 mg)を加え、水素雰囲気下、室温で2日間撹拌した。反応終了後、得られた反応混合物をセライト濾過し、ろ液から減圧下で溶媒を留去した後、得られた残渣を、クロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、さらに、クロロホルムおよびアセトンを展開溶媒とする分取薄層クロマトグラフィーで精製した。粗精製物をクロロホルムおよびメタノールの混合溶媒に溶解し、さらに、このものをヘキサンおよびジエチルエーテルの混合溶媒に滴下して、析出した固体をろ取して標記化合物84(20.4 mg、収率26%)を得た。
1H-NMR (CDCl3, 300 MHz) δ: 8.37 (d,J= 5.5 Hz, 1H), 8.26-8.14 (m, 1H), 7.60-7.51 (m, 2H), 7.46-7.09 (m, 9H), 6.48(s,1H), 6.40-6.33 (m, 1H), 4.07 (s, 3H), 4.01 (s, 3H), 3.65 (s, 2H), 1.33 (s,6H).
ESI-MS: m/z 570[M-H]-, 572[M+H]+
実施例83に従って得られた化合物83 (91 mg)にTHF(1.5 mL)および水酸化パラジウム(60 mg)を加え、水素雰囲気下、室温で2日間撹拌した。反応終了後、得られた反応混合物をセライト濾過し、ろ液から減圧下で溶媒を留去した後、得られた残渣を、クロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、さらに、クロロホルムおよびアセトンを展開溶媒とする分取薄層クロマトグラフィーで精製した。粗精製物をクロロホルムおよびメタノールの混合溶媒に溶解し、さらに、このものをヘキサンおよびジエチルエーテルの混合溶媒に滴下して、析出した固体をろ取して標記化合物84(20.4 mg、収率26%)を得た。
1H-NMR (CDCl3, 300 MHz) δ: 8.37 (d,J= 5.5 Hz, 1H), 8.26-8.14 (m, 1H), 7.60-7.51 (m, 2H), 7.46-7.09 (m, 9H), 6.48(s,1H), 6.40-6.33 (m, 1H), 4.07 (s, 3H), 4.01 (s, 3H), 3.65 (s, 2H), 1.33 (s,6H).
ESI-MS: m/z 570[M-H]-, 572[M+H]+
1-[3-(1-ベンジルオキシ-2-メチルプロパン-2-イル)-1-フェニル-1H-ピラゾール-5-イル]-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア(化合物85)
参考例11に従って得られる化合物A35(100.0 mg)をクロロホルム(2 mL)に溶解し、室温でトリエチルアミン(184 mg)を加え、0 ℃でトリホスゲン(38.5 mg)を加え、10分間撹拌した後、WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(77 mg)を加え、室温で終夜撹拌した。得られた反応混合物に、水を加え、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびアセトンを展開溶媒とする分取薄層クロマトグラフィーで精製し、標記化合物85(130 mg、収率78%)を得た。
参考例11に従って得られる化合物A35(100.0 mg)をクロロホルム(2 mL)に溶解し、室温でトリエチルアミン(184 mg)を加え、0 ℃でトリホスゲン(38.5 mg)を加え、10分間撹拌した後、WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(77 mg)を加え、室温で終夜撹拌した。得られた反応混合物に、水を加え、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびアセトンを展開溶媒とする分取薄層クロマトグラフィーで精製し、標記化合物85(130 mg、収率78%)を得た。
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-ヒドロキシ-2-メチルプロパン-2-イル)-1-フェニル-1H-ピラゾール-5-イル]ウレア (化合物86)
実施例85に従って得られる化合物85から、実施例84に準じて標記化合物86 (収率17%)を得た。
1H-NMR (CDCl3, 270 MHz) δ: 8.35 (d,J= 5.6 Hz, 1H), 8.30-8.19 (m, 1H), 7.54 (s, 1H), 7.51-7.15(m, 9H), 7.13-7.02(m,2H), 6.48 (s, 1H), 6.37 (d, J = 5.6 Hz, 1H), 4.04 (s, 3H), 3.99 (s, 3H),3.61(s, 2H), 1.30 (s, 6H).
ESI-MS: m/z 552[M-H]-, 554[M+H]+
実施例85に従って得られる化合物85から、実施例84に準じて標記化合物86 (収率17%)を得た。
1H-NMR (CDCl3, 270 MHz) δ: 8.35 (d,J= 5.6 Hz, 1H), 8.30-8.19 (m, 1H), 7.54 (s, 1H), 7.51-7.15(m, 9H), 7.13-7.02(m,2H), 6.48 (s, 1H), 6.37 (d, J = 5.6 Hz, 1H), 4.04 (s, 3H), 3.99 (s, 3H),3.61(s, 2H), 1.30 (s, 6H).
ESI-MS: m/z 552[M-H]-, 554[M+H]+
1-[4-(7-メトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-イル]ウレア (化合物87)
参考例9に従って得られる化合物A28 (40.0 mg)をクロロホルム(2.0 mL)に溶解し、0℃でトリエチルアミン(182 μL)、トリホスゲン(33.2 mg)および参考例4に従って得られる化合物A11(45.2 mg)を加えて室温で15時間撹拌した。混合物に、水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=19:1)で精製し、酢酸エチル、ジイソプロピルエーテルおよびヘキサンの混合溶媒を用いてスラリー精製することで、標記化合物87(24.1 mg、収率28%)を得た。
1H-NMR (CDCl3) δ: 8.54 (d,J= 5.5 Hz, 1H), 8.49-8.47 (m, 3H), 8.24 (d, J = 9.2 Hz, 1H), 7.62-7.38 (m,6H),7.23 (dd, J = 9.2, 2.6 Hz, 1H), 7.12 (d, J = 8.8 Hz, 2H), 6.43-6.40 (m,2H),3.95 (s, 3H), 1.46 (d, J = 6.2 Hz, 3H), 1.04 (dd, J = 6.2, 4.0 Hz, 2H),0.80(dd, J = 6.4, 4.2 Hz, 2H).
ESI-MS: m/z 507[M+H]+
参考例9に従って得られる化合物A28 (40.0 mg)をクロロホルム(2.0 mL)に溶解し、0℃でトリエチルアミン(182 μL)、トリホスゲン(33.2 mg)および参考例4に従って得られる化合物A11(45.2 mg)を加えて室温で15時間撹拌した。混合物に、水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=19:1)で精製し、酢酸エチル、ジイソプロピルエーテルおよびヘキサンの混合溶媒を用いてスラリー精製することで、標記化合物87(24.1 mg、収率28%)を得た。
1H-NMR (CDCl3) δ: 8.54 (d,J= 5.5 Hz, 1H), 8.49-8.47 (m, 3H), 8.24 (d, J = 9.2 Hz, 1H), 7.62-7.38 (m,6H),7.23 (dd, J = 9.2, 2.6 Hz, 1H), 7.12 (d, J = 8.8 Hz, 2H), 6.43-6.40 (m,2H),3.95 (s, 3H), 1.46 (d, J = 6.2 Hz, 3H), 1.04 (dd, J = 6.2, 4.0 Hz, 2H),0.80(dd, J = 6.4, 4.2 Hz, 2H).
ESI-MS: m/z 507[M+H]+
1-[4-(6-メトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-イル]ウレア (化合物88)
参考例9に従って得られる化合物A28および参考例7に従って得られる化合物A21から、実施例87に準じて標記化合物88 (収率61%)を得た。
1H-NMR (CDCl3) δ: 8.49 (d,J= 5.1 Hz, 3H), 8.38 (s, 1H), 7.98 (d, J = 9.2 Hz, 1H), 7.61-7.49 (m, 6H),7.41(dd, J = 9.2, 2.9 Hz, 1H), 7.14 (d, J = 8.8 Hz, 2H), 6.51 (d, J = 5.1 Hz,1H),6.40 (s, 1H), 3.97 (s, 3H), 1.48 (s, 3H), 1.04 (dd, J = 6.4, 4.2 Hz, 2H),0.80(dd, J = 6.4, 4.2 Hz, 2H).
ESI-MS: m/z 507[M+H]+
参考例9に従って得られる化合物A28および参考例7に従って得られる化合物A21から、実施例87に準じて標記化合物88 (収率61%)を得た。
1H-NMR (CDCl3) δ: 8.49 (d,J= 5.1 Hz, 3H), 8.38 (s, 1H), 7.98 (d, J = 9.2 Hz, 1H), 7.61-7.49 (m, 6H),7.41(dd, J = 9.2, 2.9 Hz, 1H), 7.14 (d, J = 8.8 Hz, 2H), 6.51 (d, J = 5.1 Hz,1H),6.40 (s, 1H), 3.97 (s, 3H), 1.48 (s, 3H), 1.04 (dd, J = 6.4, 4.2 Hz, 2H),0.80(dd, J = 6.4, 4.2 Hz, 2H).
ESI-MS: m/z 507[M+H]+
1-[4-(7-メトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-イル]ウレア (化合物89)
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A28-1)および参考例4に従って得られる化合物A11から、実施例87に準じて標記化合物89 (収率37%)を得た。
1H-NMR (CDCl3) δ: 8.75 (d,J= 2.2 Hz, 1H), 8.52 (d, J = 5.1 Hz, 1H), 8.33 (dd, J = 4.8, 1.5 Hz, 1H),8.21(d, J = 9.2 Hz, 1H), 8.01-7.91 (m, 3H), 7.41-7.32 (m, 4H), 7.20 (dd, J =9.2,2.2 Hz, 1H), 7.11-7.05 (m, 2H), 6.43 (s, 1H), 6.37 (d, J = 5.5 Hz, 1H),3.94(s, 3H), 1.48 (s, 3H), 1.04 (dd, J = 6.0, 4.2 Hz, 2H), 0.79 (dd, J = 6.4,4.2Hz, 2H).
ESI-MS: m/z 507[M+H]+
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A28-1)および参考例4に従って得られる化合物A11から、実施例87に準じて標記化合物89 (収率37%)を得た。
1H-NMR (CDCl3) δ: 8.75 (d,J= 2.2 Hz, 1H), 8.52 (d, J = 5.1 Hz, 1H), 8.33 (dd, J = 4.8, 1.5 Hz, 1H),8.21(d, J = 9.2 Hz, 1H), 8.01-7.91 (m, 3H), 7.41-7.32 (m, 4H), 7.20 (dd, J =9.2,2.2 Hz, 1H), 7.11-7.05 (m, 2H), 6.43 (s, 1H), 6.37 (d, J = 5.5 Hz, 1H),3.94(s, 3H), 1.48 (s, 3H), 1.04 (dd, J = 6.0, 4.2 Hz, 2H), 0.79 (dd, J = 6.4,4.2Hz, 2H).
ESI-MS: m/z 507[M+H]+
1-[4-(6-メトキシキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-イル]ウレア (化合物90)
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン (化合物A28-1) および参考例7に従って得られる化合物A21から、実施例87に準じて標記化合物90 (収率61%)を得た。
1H-NMR (CDCl3) δ: 8.73 (d,J= 2.2 Hz, 1H), 8.45 (d, J = 5.5 Hz, 1H), 8.35 (dd, J = 4.8, 1.1 Hz, 1H),8.20(s, 1H), 8.00 (s, 1H), 7.96-7.91 (m, 2H), 7.57 (d, J = 2.9 Hz, 1H),7.45-7.30(m, 4H), 7.12-7.05 (m, 2H), 6.47 (d, J = 5.1 Hz, 1H), 6.41 (s, 1H),3.96 (s,3H), 1.48 (s, 3H), 1.04 (dd, J = 6.2, 4.0 Hz, 2H), 0.78 (dd, J = 6.4,4.2 Hz,2H).
ESI-MS: m/z 507[M+H]+
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン (化合物A28-1) および参考例7に従って得られる化合物A21から、実施例87に準じて標記化合物90 (収率61%)を得た。
1H-NMR (CDCl3) δ: 8.73 (d,J= 2.2 Hz, 1H), 8.45 (d, J = 5.5 Hz, 1H), 8.35 (dd, J = 4.8, 1.1 Hz, 1H),8.20(s, 1H), 8.00 (s, 1H), 7.96-7.91 (m, 2H), 7.57 (d, J = 2.9 Hz, 1H),7.45-7.30(m, 4H), 7.12-7.05 (m, 2H), 6.47 (d, J = 5.1 Hz, 1H), 6.41 (s, 1H),3.96 (s,3H), 1.48 (s, 3H), 1.04 (dd, J = 6.2, 4.0 Hz, 2H), 0.78 (dd, J = 6.4,4.2 Hz,2H).
ESI-MS: m/z 507[M+H]+
1-[4-(7-アミノキノリン-4-イルオキシ)フェニル]-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-イル]ウレア (化合物91)
参考例12に従って得られる化合物A38(194.3 mg)をTHF(4.0 mL)に溶解し、1 mol/L塩酸(1.0 mL)を加えて50℃で1時間撹拌した。得られた反応混合物に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣にクロロホルム、酢酸エチルおよびヘキサンの混合溶媒を加えてスラリー精製をした。得られた粗生成物(113.7 mg)は、Waters社製カラム(XBridge Prep C18 5μm OBD)による分取高速液体クロマトグラフィー(0.05%トリフルオロ酢酸水溶液:メタノール=70:30-10:90)にて精製し、減圧下で溶媒を留去し、得られた残渣に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をTHF、ジイソプロピルエーテルおよびヘキサンの混合溶媒を用いてスラリー精製し、標記化合物91(64.8 mg、収率44%)を得た。
1H-NMR (DMSO-d6) δ: 9.23(s,1H), 8.71 (s, 1H), 8.66 (d, J = 6.6 Hz, 2H), 8.41 (d, J = 5.9 Hz, 1H), 8.00(d,J = 9.2 Hz, 1H), 7.65 (d, J = 6.6 Hz, 2H), 7.54 (d, J = 8.8 Hz, 2H), 7.17 (d,J= 8.8 Hz, 2H), 7.03 (dd, J = 9.2, 1.8 Hz, 1H), 6.93 (d, J = 2.2 Hz, 1H),6.29(s, 1H), 6.22 (d, J = 5.5 Hz, 1H), 6.06 (s, 2H), 1.43 (s, 3H), 0.96 (dd, J=6.0, 3.8 Hz, 2H), 0.78 (dd, J = 6.2, 4.0 Hz, 2H).
ESI-MS: m/z 492[M+H]+
参考例12に従って得られる化合物A38(194.3 mg)をTHF(4.0 mL)に溶解し、1 mol/L塩酸(1.0 mL)を加えて50℃で1時間撹拌した。得られた反応混合物に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣にクロロホルム、酢酸エチルおよびヘキサンの混合溶媒を加えてスラリー精製をした。得られた粗生成物(113.7 mg)は、Waters社製カラム(XBridge Prep C18 5μm OBD)による分取高速液体クロマトグラフィー(0.05%トリフルオロ酢酸水溶液:メタノール=70:30-10:90)にて精製し、減圧下で溶媒を留去し、得られた残渣に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した。ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をTHF、ジイソプロピルエーテルおよびヘキサンの混合溶媒を用いてスラリー精製し、標記化合物91(64.8 mg、収率44%)を得た。
1H-NMR (DMSO-d6) δ: 9.23(s,1H), 8.71 (s, 1H), 8.66 (d, J = 6.6 Hz, 2H), 8.41 (d, J = 5.9 Hz, 1H), 8.00(d,J = 9.2 Hz, 1H), 7.65 (d, J = 6.6 Hz, 2H), 7.54 (d, J = 8.8 Hz, 2H), 7.17 (d,J= 8.8 Hz, 2H), 7.03 (dd, J = 9.2, 1.8 Hz, 1H), 6.93 (d, J = 2.2 Hz, 1H),6.29(s, 1H), 6.22 (d, J = 5.5 Hz, 1H), 6.06 (s, 2H), 1.43 (s, 3H), 0.96 (dd, J=6.0, 3.8 Hz, 2H), 0.78 (dd, J = 6.2, 4.0 Hz, 2H).
ESI-MS: m/z 492[M+H]+
1-{3-[1-(tert-ブチルジメチルシリルオキシ)-2-メチルプロパン-2-イル]-1-(ピリジン-3-イル)-1H-ピラゾール-5-イル}-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]ウレア(化合物92)
参考例13に従って得られた渣、化合物A44 (235 mg)をクロロホルム(1 mL)に溶解し、室温でトリエチルアミン(320 mg)を加え、0℃でトリホスゲン(67.1 mg)を加え、10分間撹拌した後、WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(142mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、クロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、標記化合物92 (210 mg、収率68%)を得た。
参考例13に従って得られた渣、化合物A44 (235 mg)をクロロホルム(1 mL)に溶解し、室温でトリエチルアミン(320 mg)を加え、0℃でトリホスゲン(67.1 mg)を加え、10分間撹拌した後、WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(142mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、クロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、標記化合物92 (210 mg、収率68%)を得た。
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-[3-(1-ヒドロキシ-2-メチルプロパン-2-イル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-イル]ウレア (化合物93)
実施例92に従って得られる化合物92 (205 mg)をTHF(3 mL)に溶解し、1 mol/Lフッ化テトラブチルアンモニウム/THF溶液(1.8 mL)を加え、室温で終夜撹拌した。その後、トリフルオロ酢酸(4 mL)を加え、室温で3時間撹拌し、得られた反応混合物から減圧下で溶媒を留去した。得られた残渣に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去した。得られた残渣を、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、さらにクロロホルムおよびメタノールを展開溶媒とするNHシリカゲルカラムクロマトグラフィーで精製した。得られた粗生成物をクロロホルムおよびメタノールの混合溶媒に溶解し、この溶液をジエチルエーテルに滴下して析出した固体をろ取することにより標記化合物93(50.5 mg、収率30%)を得た。
1H-NMR (DMSO-d6, 300 MHz) δ: 9.37(brs,1H), 8.83-8.78 (m, 1H), 8.68 (brs, 1H), 8.60 (dd, J = 1.1, 5.9 Hz, 1H),8.46 (d,J = 5.1 Hz, 1H), 8.02-7.98 (m, 1H), 7.73-7.65 (m, 1H), 7.59 (dd, J =4.8, 8.1Hz, 1H), 7.52 (s, 1H), 7.40 (s, 1H), 7.36 (d, J = 8.8 Hz, 1H), 7.23(d, J = 8.4Hz, 1H), 6.43 (d, J = 5.1 Hz, 1H), 6.42 (s, 1H), 4.69-4.60 (m, 1H),3.95 (s,3H), 3.95 (s, 3H), 3.46 (d, J = 5.5 Hz, 2H), 1.24 (s, 6H).
ESI-MS: m/z 571[M-H]-, 573[M+H]+
実施例92に従って得られる化合物92 (205 mg)をTHF(3 mL)に溶解し、1 mol/Lフッ化テトラブチルアンモニウム/THF溶液(1.8 mL)を加え、室温で終夜撹拌した。その後、トリフルオロ酢酸(4 mL)を加え、室温で3時間撹拌し、得られた反応混合物から減圧下で溶媒を留去した。得られた残渣に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去した。得られた残渣を、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、さらにクロロホルムおよびメタノールを展開溶媒とするNHシリカゲルカラムクロマトグラフィーで精製した。得られた粗生成物をクロロホルムおよびメタノールの混合溶媒に溶解し、この溶液をジエチルエーテルに滴下して析出した固体をろ取することにより標記化合物93(50.5 mg、収率30%)を得た。
1H-NMR (DMSO-d6, 300 MHz) δ: 9.37(brs,1H), 8.83-8.78 (m, 1H), 8.68 (brs, 1H), 8.60 (dd, J = 1.1, 5.9 Hz, 1H),8.46 (d,J = 5.1 Hz, 1H), 8.02-7.98 (m, 1H), 7.73-7.65 (m, 1H), 7.59 (dd, J =4.8, 8.1Hz, 1H), 7.52 (s, 1H), 7.40 (s, 1H), 7.36 (d, J = 8.8 Hz, 1H), 7.23(d, J = 8.4Hz, 1H), 6.43 (d, J = 5.1 Hz, 1H), 6.42 (s, 1H), 4.69-4.60 (m, 1H),3.95 (s,3H), 3.95 (s, 3H), 3.46 (d, J = 5.5 Hz, 2H), 1.24 (s, 6H).
ESI-MS: m/z 571[M-H]-, 573[M+H]+
1-(4-{6-メトキシ-7-[2-(テトラヒドロ-2H-ピラン-2-イルオキシ)エトキシ]キノリン-4-イルオキシ}フェニル)-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-イル]ウレア(化合物94)
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A28-1、109 mg) をクロロホルム(8 mL)に溶解し、トリエチルアミン(0.494 mL)を室温で加え、0℃でトリホスゲン(90 mg)を加え、5分間撹拌後、さらに、参考例14で得られる化合物A46 (190 mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(酢酸エチル:メタノール=99:1-95:5)で精製し、標記化合物94 (253 mg、収率85%)を得た。
参考例9に準じて得られる3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A28-1、109 mg) をクロロホルム(8 mL)に溶解し、トリエチルアミン(0.494 mL)を室温で加え、0℃でトリホスゲン(90 mg)を加え、5分間撹拌後、さらに、参考例14で得られる化合物A46 (190 mg)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(酢酸エチル:メタノール=99:1-95:5)で精製し、標記化合物94 (253 mg、収率85%)を得た。
1-{4-[7-(2-ヒドロキシエトキシ)-6-メトキシキノリン-4-イルオキシ]フェニル}-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-3-イル)-1H-ピラゾール-5-イル]ウレア (化合物95)
実施例94に従って得られる化合物94 (187 mg)を酢酸(4 mL)、THF(2 mL)および水(1mL)の混合溶媒に溶解し、80℃で1時間撹拌した。得られた反応混合物から、減圧下で溶媒を留去し、クロロホルムで抽出後、有機層を飽和炭酸水素ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(クロロホルム:メタノール=97:3-92:8)で精製することにより、標記化合物95(99 mg、収率60%)を得た。
1H-NMR (CDCl3) δ: 8.73(1H,d, J = 2.6 Hz), 8.35-8.32 (3H, m), 8.19 (1H, s), 7.91 (1H, dq, J = 8.2,1.3Hz), 7.48 (1H, s), 7.36-7.28 (4H, m), 6.99 (2H, d, J = 8.8 Hz), 6.38 (1H,s),6.32 (1H, d, J = 5.5 Hz), 4.23 (2H, t, J = 4.4 Hz), 4.06 (2H, t, J = 4.2Hz),3.95 (3H, d, J = 14.7 Hz), 1.46 (3H, s), 1.02 (2H, dd, J = 6.2, 4.0 Hz),0.77(2H, dd, J = 6.4, 4.2 Hz).
ESI-MS: m/z 567[M+H]+
実施例94に従って得られる化合物94 (187 mg)を酢酸(4 mL)、THF(2 mL)および水(1mL)の混合溶媒に溶解し、80℃で1時間撹拌した。得られた反応混合物から、減圧下で溶媒を留去し、クロロホルムで抽出後、有機層を飽和炭酸水素ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(クロロホルム:メタノール=97:3-92:8)で精製することにより、標記化合物95(99 mg、収率60%)を得た。
1H-NMR (CDCl3) δ: 8.73(1H,d, J = 2.6 Hz), 8.35-8.32 (3H, m), 8.19 (1H, s), 7.91 (1H, dq, J = 8.2,1.3Hz), 7.48 (1H, s), 7.36-7.28 (4H, m), 6.99 (2H, d, J = 8.8 Hz), 6.38 (1H,s),6.32 (1H, d, J = 5.5 Hz), 4.23 (2H, t, J = 4.4 Hz), 4.06 (2H, t, J = 4.2Hz),3.95 (3H, d, J = 14.7 Hz), 1.46 (3H, s), 1.02 (2H, dd, J = 6.2, 4.0 Hz),0.77(2H, dd, J = 6.4, 4.2 Hz).
ESI-MS: m/z 567[M+H]+
1-{4-[7-(2-ヒドロキシエトキシ)-6-メトキシキノリン-4-イルオキシ]フェニル}-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-イル]ウレア (化合物96)
参考例9に従って得られる化合物A28 (16.6 mg)をクロロホルム(2 mL)に溶解し、トリエチルアミン(0.075 mL)を室温で加えた。氷冷下トリホスゲン(14 mg)を加え、5分間撹拌した後、参考例15に従って得られる化合物A48の粗生成物(31 mg)を加えた。室温で終夜撹拌後、水を加えクロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(クロロホルム:メタノール=97:3-90:10)で精製し、さらにアセトニトリルを加えて、撹拌した後、不溶物をろ取して除いた。ろ液から減圧下で溶媒を留去し、得られた残渣を逆相分取カラムクロマトグラフィー(Luna 5μ C18(2)150x4.6 mm, メタノール:0.05%トリフルオロ酢酸=1:1-1:9)で精製することにより、標記化合物96(収率10%)を得た。
1H-NMR (CDCl3, 270 MHz)δ:8.57 (d,J= 6.6 Hz, 3H), 8.19 (s, 2H), 7.94 (s, 1H), 7.70 (t, J = 8.2 Hz, 3H), 7.15 (d,J= 8.8 Hz, 2H), 6.74 (d, J = 6.6 Hz, 1H), 6.41 (s, 1H), 4.41 (t, J = 4.8Hz,2H), 4.03-4.13 (m, 5H), 3.39-3.41 (m, 2H), 1.48 (s, 3H), 1.07 (t, J = 3.1Hz,2H), 0.84 (t, J = 3.1 Hz, 2H).
ESI-MS: m/z 567[M+H]+
参考例9に従って得られる化合物A28 (16.6 mg)をクロロホルム(2 mL)に溶解し、トリエチルアミン(0.075 mL)を室温で加えた。氷冷下トリホスゲン(14 mg)を加え、5分間撹拌した後、参考例15に従って得られる化合物A48の粗生成物(31 mg)を加えた。室温で終夜撹拌後、水を加えクロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(クロロホルム:メタノール=97:3-90:10)で精製し、さらにアセトニトリルを加えて、撹拌した後、不溶物をろ取して除いた。ろ液から減圧下で溶媒を留去し、得られた残渣を逆相分取カラムクロマトグラフィー(Luna 5μ C18(2)150x4.6 mm, メタノール:0.05%トリフルオロ酢酸=1:1-1:9)で精製することにより、標記化合物96(収率10%)を得た。
1H-NMR (CDCl3, 270 MHz)δ:8.57 (d,J= 6.6 Hz, 3H), 8.19 (s, 2H), 7.94 (s, 1H), 7.70 (t, J = 8.2 Hz, 3H), 7.15 (d,J= 8.8 Hz, 2H), 6.74 (d, J = 6.6 Hz, 1H), 6.41 (s, 1H), 4.41 (t, J = 4.8Hz,2H), 4.03-4.13 (m, 5H), 3.39-3.41 (m, 2H), 1.48 (s, 3H), 1.07 (t, J = 3.1Hz,2H), 0.84 (t, J = 3.1 Hz, 2H).
ESI-MS: m/z 567[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-(3-イソプロピルスルホニル-1-フェニル-1H-ピラゾール-5-イル)ウレア (化合物97)
参考例16に従って得られる化合物A50(50 mg)をジクロロメタン(2 mL)に溶解し、0℃でトリエチルアミン(95.4 mg)およびトリホスゲン(37.3 mg)を加え、1時間撹拌した後、WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(49.4 mg)を加えた。室温に昇温して終夜撹拌した後、水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびアセトンを展開溶媒とする分取薄層クロマトグラフィーで精製した。得られた粗生成物をクロロホルムおよびメタノールの混合溶媒に溶解し、ヘキサンおよびジエチルエーテルの混合溶媒に滴下して析出した固体をろ取することにより標記化合物97(10.8 mg、収率11%)を得た。
1H-NMR (CDCl3, 270 MHz)δ:8.48 (d,J= 5.3 Hz, 1H), 7.61-7.50 (m, 7H), 7.39 (s, 1H), 7.20-7.13 (m, 2H), 7.11 (s,1H),6.42-6.37 (m, 1H), 4.06 (s, 3H), 4.06 (s, 3H), 3.43 (heptet, J = 6.9 Hz,1H),1.43 (d, J = 6.6 Hz, 6H).
ESI-MS: m/z 604[M-H]-, 606[M+H]+
参考例16に従って得られる化合物A50(50 mg)をジクロロメタン(2 mL)に溶解し、0℃でトリエチルアミン(95.4 mg)およびトリホスゲン(37.3 mg)を加え、1時間撹拌した後、WO01/47890の製造例2に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロアニリン(49.4 mg)を加えた。室温に昇温して終夜撹拌した後、水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびアセトンを展開溶媒とする分取薄層クロマトグラフィーで精製した。得られた粗生成物をクロロホルムおよびメタノールの混合溶媒に溶解し、ヘキサンおよびジエチルエーテルの混合溶媒に滴下して析出した固体をろ取することにより標記化合物97(10.8 mg、収率11%)を得た。
1H-NMR (CDCl3, 270 MHz)δ:8.48 (d,J= 5.3 Hz, 1H), 7.61-7.50 (m, 7H), 7.39 (s, 1H), 7.20-7.13 (m, 2H), 7.11 (s,1H),6.42-6.37 (m, 1H), 4.06 (s, 3H), 4.06 (s, 3H), 3.43 (heptet, J = 6.9 Hz,1H),1.43 (d, J = 6.6 Hz, 6H).
ESI-MS: m/z 604[M-H]-, 606[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)-3-フルオロフェニル]-3-[3-(エチルスルホニル)-1-フェニル-1H-ピラゾール-5-イル]ウレア(化合物98)
参考例16に準じて得られる3-エチルスルホニル-1-フェニル-1H-ピラゾール-5-アミン(化合物A50-1)から、実施例97に準じて標記化合物98 (収率9%)を得た。
1H-NMR (CDCl3, 300 MHz)δ:8.43 (d,J= 5.5 Hz, 1H), 7.60-7.47 (m, 7H), 7.39 (s, 1H), 7.21-7.13 (m, 2H), 7.11(s,1H), 6.41-6.36 (m, 1H), 4.06 (s, 3H), 4.05 (s, 3H), 3.32 (q, J = 7.3 Hz,2H),1.41 (t, J = 7.3 Hz, 3H).
ESI-MS: m/z 590[M-H]-, 592[M+H]+
参考例16に準じて得られる3-エチルスルホニル-1-フェニル-1H-ピラゾール-5-アミン(化合物A50-1)から、実施例97に準じて標記化合物98 (収率9%)を得た。
1H-NMR (CDCl3, 300 MHz)δ:8.43 (d,J= 5.5 Hz, 1H), 7.60-7.47 (m, 7H), 7.39 (s, 1H), 7.21-7.13 (m, 2H), 7.11(s,1H), 6.41-6.36 (m, 1H), 4.06 (s, 3H), 4.05 (s, 3H), 3.32 (q, J = 7.3 Hz,2H),1.41 (t, J = 7.3 Hz, 3H).
ESI-MS: m/z 590[M-H]-, 592[M+H]+
1-(5-tert-ブチル-1-メチル-1H-ピラゾール-3-イル)-3-[5-(6,7-ジメトキシキノリン-4-イルオキシ)ピリジン-2-イル]ウレア(化合物99)
参考例17に従って得られる化合物A52および参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物99(収率58%)を得た。
ESI-MS: m/z 475[M-H]-,499[M+H]+
参考例17に従って得られる化合物A52および参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物99(収率58%)を得た。
ESI-MS: m/z 475[M-H]-,499[M+H]+
1-[3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-イル]-3-[5-(6,7-ジメトキシキノリン-4-イルオキシ)ピリジン-2-イル]ウレア (化合物100)
参考例17に従って得られる化合物A52および参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)から、実施例6に準じて標記化合物100 (収率42%)を得た。
ESI-MS: m/z 555[M-H]-,579[M+H]+
参考例17に従って得られる化合物A52および参考例6に準じて得られる3-tert-ブチル-1-(3-フルオロフェニル)-1H-ピラゾール-5-アミン(化合物A17-9)から、実施例6に準じて標記化合物100 (収率42%)を得た。
ESI-MS: m/z 555[M-H]-,579[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-(4-フルオロフェニル)-3-メチル-1H-ピラゾール-5-イル]ウレア (化合物101)
1-(4-フルオロフェニル)-3-メチル-1H-ピラゾール-5-アミン(enamine社)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物101(収率54%)を得た。
1H-NMR (CDCl3, 300 MHz) δ: 8.43 (d,J= 5.1 Hz, 1H), 7.55 (s, 1H), 7.45-7.36 (m, 5H), 7.18-7.10 (m, 2H),7.10-7.02(m, 2H), 6.57 (s, 1H), 6.41 (d, J = 5.1 Hz, 1H), 6.34 (s, 1H), 4.05(s, 3H),4.02 (s, 3H), 2.35 (s, 3H).
ESI-MS: m/z 514[M+H]+
1-(4-フルオロフェニル)-3-メチル-1H-ピラゾール-5-アミン(enamine社)およびWO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物101(収率54%)を得た。
1H-NMR (CDCl3, 300 MHz) δ: 8.43 (d,J= 5.1 Hz, 1H), 7.55 (s, 1H), 7.45-7.36 (m, 5H), 7.18-7.10 (m, 2H),7.10-7.02(m, 2H), 6.57 (s, 1H), 6.41 (d, J = 5.1 Hz, 1H), 6.34 (s, 1H), 4.05(s, 3H),4.02 (s, 3H), 2.35 (s, 3H).
ESI-MS: m/z 514[M+H]+
1-[3-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物102)
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)および参考例18に従って得られる化合物A53から、実施例12に準じて標記化合物102(収率70%)を得た。
1H-NMR (DMSO-D6, 400 MHz) δ: 9.37(s,1H), 8.62 (s, 1H), 8.46 (d, J = 4.9 Hz, 1H), 7.90 (s, 1H), 7.62-7.55 (m,2H),7.52 (s, 1H), 7.40 (s, 1H), 7.39-7.32 (m, 4H), 6.35-6.29 (m, 2H), 3.95 (s,3H),3.94 (s, 3H), 2.89 (m, 1H), 1.24 (d, J = 6.8 Hz, 6H).
ESI-MS: m/z 576[M+H]+
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)および参考例18に従って得られる化合物A53から、実施例12に準じて標記化合物102(収率70%)を得た。
1H-NMR (DMSO-D6, 400 MHz) δ: 9.37(s,1H), 8.62 (s, 1H), 8.46 (d, J = 4.9 Hz, 1H), 7.90 (s, 1H), 7.62-7.55 (m,2H),7.52 (s, 1H), 7.40 (s, 1H), 7.39-7.32 (m, 4H), 6.35-6.29 (m, 2H), 3.95 (s,3H),3.94 (s, 3H), 2.89 (m, 1H), 1.24 (d, J = 6.8 Hz, 6H).
ESI-MS: m/z 576[M+H]+
1-[2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-[1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-イル]ウレア (化合物103)
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物103(収率42%)を得た。
1H-NMR (DMSO-D6, 400 MHz) δ: 9.23(s,1H), 8.50 (d, J = 4.9 Hz, 1H), 8.17 (s, 1H), 7.65-7.57 (m, 2H), 7.49 (s,2H),7.45-7.34 (m, 3H), 7.24 (dd, J = 2.4, 9.3 Hz, 1H), 6.53 (d, J = 4.9 Hz,1H),6.34 (s, 1H), 3.95 (s, 3H), 3.93 (s, 3H), 2.89 (m, 1H), 1.23 (d, J = 6.8Hz,6H).
ESI-MS: m/z 576[M+H]+
参考例6に準じて得られる1-(4-フルオロフェニル)-3-イソプロピル-1H-ピラゾール-5-アミン(化合物A17-2)およびWO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンから、実施例12に準じて標記化合物103(収率42%)を得た。
1H-NMR (DMSO-D6, 400 MHz) δ: 9.23(s,1H), 8.50 (d, J = 4.9 Hz, 1H), 8.17 (s, 1H), 7.65-7.57 (m, 2H), 7.49 (s,2H),7.45-7.34 (m, 3H), 7.24 (dd, J = 2.4, 9.3 Hz, 1H), 6.53 (d, J = 4.9 Hz,1H),6.34 (s, 1H), 3.95 (s, 3H), 3.93 (s, 3H), 2.89 (m, 1H), 1.23 (d, J = 6.8Hz,6H).
ESI-MS: m/z 576[M+H]+
1-(5-tert-ブチル-1H-ピラゾール-3-イル)-3-[3-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物104)
参考例18に従って得られる化合物A53および参考例19に従って得られる化合物A54から、実施例1に準じて標記化合物104 (収率26%) を得た。
1H-NMR (CDCl3, 400 MHz) δ: 10.43(s,1H), 9.47 (s, 1H), 8.49 (d, J = 4.9 Hz, 1H), 7.86 (d, J = 2.9 Hz, 1H), 7.62(s,1H), 7.52 (dd, J = 2.9, 8.8 Hz, 1H), 7.44 (s, 1H), 7.19 (d, J = 8.8 Hz,1H),7.03 (s, 1H), 6.34 (d, J = 4.9 Hz, 1H), 5.68 (s, 1H), 4.07 (s, 3H), 4.05(s,3H), 1.36 (s, 9H).
ESI-MS: m/z 496[M+H]+
参考例18に従って得られる化合物A53および参考例19に従って得られる化合物A54から、実施例1に準じて標記化合物104 (収率26%) を得た。
1H-NMR (CDCl3, 400 MHz) δ: 10.43(s,1H), 9.47 (s, 1H), 8.49 (d, J = 4.9 Hz, 1H), 7.86 (d, J = 2.9 Hz, 1H), 7.62(s,1H), 7.52 (dd, J = 2.9, 8.8 Hz, 1H), 7.44 (s, 1H), 7.19 (d, J = 8.8 Hz,1H),7.03 (s, 1H), 6.34 (d, J = 4.9 Hz, 1H), 5.68 (s, 1H), 4.07 (s, 3H), 4.05(s,3H), 1.36 (s, 9H).
ESI-MS: m/z 496[M+H]+
1-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]-3-(5-イソプロピル-1-メチル-1H-ピラゾール-3-イル)]ウレア (化合物105)
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよび参考例20に従って得られる化合物A55から、実施例1に準じて標記化合物105(収率47%) を得た。
1H-NMR (CDCl3, 400 MHz) δ: 10.26(s,1H), 8.48 (d, J = 4.9 Hz, 1H), 7.68-7.62 (m, 2H), 7.58 (s, 1H), 7.42 (s,1H),7.19-7.13 (m, 2H), 6.77 (s, 1H), 6.47 (d, J = 4.9 Hz, 1H), 5.58 (s, 1H),4.06(s, 3H), 4.05 (s, 3H), 3.77 (s, 3H), 2.92 (m, 1H), 1.27 (d, J = 6.8 Hz,6H).
ESI-MS: m/z 461[M+H]+
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよび参考例20に従って得られる化合物A55から、実施例1に準じて標記化合物105(収率47%) を得た。
1H-NMR (CDCl3, 400 MHz) δ: 10.26(s,1H), 8.48 (d, J = 4.9 Hz, 1H), 7.68-7.62 (m, 2H), 7.58 (s, 1H), 7.42 (s,1H),7.19-7.13 (m, 2H), 6.77 (s, 1H), 6.47 (d, J = 4.9 Hz, 1H), 5.58 (s, 1H),4.06(s, 3H), 4.05 (s, 3H), 3.77 (s, 3H), 2.92 (m, 1H), 1.27 (d, J = 6.8 Hz,6H).
ESI-MS: m/z 461[M+H]+
1-(5-tert-ブチル-1-メチル-1H-ピラゾール-3-イル)-3-[2,3-ジメチル-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物106)
参考例21に従って得られる化合物A56および参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物106 (収率50%) を得た。
1H-NMR (CDCl3, 300 MHz) δ: 9.94(s,1H), 8.43 (d, J = 5.1 Hz, 1H), 7.87 (d, J = 8.8 Hz, 1H), 7.64 (s, 1H), 7.43(s,1H), 7.01 (d, J = 8.8 Hz, 1H), 6.87 (s, 1H), 6.30 (d, J = 5.1 Hz, 1H), 5.62(s,1H), 4.08 (s, 3H), 4.06 (s, 3H), 3.90 (s, 3H), 2.37 (s, 3H), 2.13 (s, 3H),1.39(s, 9H).
ESI-MS: m/z 504[M+H]+
参考例21に従って得られる化合物A56および参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物106 (収率50%) を得た。
1H-NMR (CDCl3, 300 MHz) δ: 9.94(s,1H), 8.43 (d, J = 5.1 Hz, 1H), 7.87 (d, J = 8.8 Hz, 1H), 7.64 (s, 1H), 7.43(s,1H), 7.01 (d, J = 8.8 Hz, 1H), 6.87 (s, 1H), 6.30 (d, J = 5.1 Hz, 1H), 5.62(s,1H), 4.08 (s, 3H), 4.06 (s, 3H), 3.90 (s, 3H), 2.37 (s, 3H), 2.13 (s, 3H),1.39(s, 9H).
ESI-MS: m/z 504[M+H]+
1-(5-tert-ブチル-1-メチル-1H-ピラゾール-3-イル)-3-[2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物107)
WO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよびおよび参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物107 (収率47%) を得た。
1H-NMR (CDCl3, 300 MHz) δ: 10.40(s,1H), 8.48 (d, J = 5.1 Hz, 1H), 7.85 (d, J = 2.6 Hz, 1H), 7.62 (s, 1H),7.54(dd, J = 2.6, 8.8 Hz, 1H), 7.43 (s, 1H), 7.20 (d, J = 8.8 Hz, 1H), 6.81(s,1H), 6.34 (d, J = 5.1 Hz, 1H), 5.59 (s, 1H), 4.08 (s, 3H), 4.05 (s, 3H),3.93(s, 3H), 1.39 (s, 9H).
ESI-MS: m/z 510[M+H]+
WO00/43366の製造例1に従って得られる2-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよびおよび参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物107 (収率47%) を得た。
1H-NMR (CDCl3, 300 MHz) δ: 10.40(s,1H), 8.48 (d, J = 5.1 Hz, 1H), 7.85 (d, J = 2.6 Hz, 1H), 7.62 (s, 1H),7.54(dd, J = 2.6, 8.8 Hz, 1H), 7.43 (s, 1H), 7.20 (d, J = 8.8 Hz, 1H), 6.81(s,1H), 6.34 (d, J = 5.1 Hz, 1H), 5.59 (s, 1H), 4.08 (s, 3H), 4.05 (s, 3H),3.93(s, 3H), 1.39 (s, 9H).
ESI-MS: m/z 510[M+H]+
1-(5-tert-ブチル-1-メチル-1H-ピラゾール-3-イル)-3-[3,5-ジクロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物108)
参考例22に従って得られる化合物A57および参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物108 (収率19%) を得た。
1H-NMR (CDCl3, 270 MHz) δ: 10.50(s,1H), 8.49 (d, J = 5.3 Hz, 1H), 7.74 (s, 2H), 7.65 (s, 1H), 7.44 (s, 1H),6.90(s, 1H), 6.27 (d, J = 5.3 Hz, 1H), 5.59 (s, 1H), 4.09 (s, 3H), 4.06 (s,3H),3.94 (s, 3H), 1.39 (s, 9H).
ESI-MS: m/z 544[M+H]+
参考例22に従って得られる化合物A57および参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物108 (収率19%) を得た。
1H-NMR (CDCl3, 270 MHz) δ: 10.50(s,1H), 8.49 (d, J = 5.3 Hz, 1H), 7.74 (s, 2H), 7.65 (s, 1H), 7.44 (s, 1H),6.90(s, 1H), 6.27 (d, J = 5.3 Hz, 1H), 5.59 (s, 1H), 4.09 (s, 3H), 4.06 (s,3H),3.94 (s, 3H), 1.39 (s, 9H).
ESI-MS: m/z 544[M+H]+
1-(5-tert-ブチル-1-メチル-1H-ピラゾール-3-イル)-3-[3-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア (化合物109)
参考例18に従って得られる化合物A53および参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物109 (収率29%) を得た。
1H-NMR (CDCl3, 300 MHz) δ: 10.40 (s,1H), 8.48 (d, J = 5.1 Hz, 1H), 7.85 (d, J = 2.6 Hz, 1H), 7.62 (s, 1H),7.54(dd, J = 2.6, 8.8 Hz, 1H), 7.43 (s, 1H), 7.20 (d, J = 8.8 Hz, 1H), 6.81(s,1H), 6.34 (d, J = 5.1 Hz, 1H), 5.59 (s, 1H), 4.08 (s, 3H), 4.05 (s, 3H),3.93(s, 3H), 1.39 (s, 9H).
ESI-MS: m/z 510[M+H]+
参考例18に従って得られる化合物A53および参考例1に従って得られる化合物A2から、実施例1に準じて標記化合物109 (収率29%) を得た。
1H-NMR (CDCl3, 300 MHz) δ: 10.40 (s,1H), 8.48 (d, J = 5.1 Hz, 1H), 7.85 (d, J = 2.6 Hz, 1H), 7.62 (s, 1H),7.54(dd, J = 2.6, 8.8 Hz, 1H), 7.43 (s, 1H), 7.20 (d, J = 8.8 Hz, 1H), 6.81(s,1H), 6.34 (d, J = 5.1 Hz, 1H), 5.59 (s, 1H), 4.08 (s, 3H), 4.05 (s, 3H),3.93(s, 3H), 1.39 (s, 9H).
ESI-MS: m/z 510[M+H]+
1-(5-tert-ブチル-1-メチル-1H-ピラゾール-3-イル)-3-[4-(6,7-ジメトキシキノリン-4-イルオキシ)フェニル]ウレア(化合物110)
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよび参考例1に従って得られる化合物A2から実施例1に準じて標記化合物110(収率76%) を得た。
1H-NMR (DMSO-D6, 300 MHz) δ: 9.58 (s,1H), 9.02 (s, 1H), 8.81 (d, J = 6.6 Hz, 1H), 7.77 (s, 1H), 7.74-7.66 (m,2H),7.63 (s, 1H), 7.40-7.28 (m, 2H), 6.88 (d, J = 6.6 Hz, 1H), 6.07 (s, 1H), 4.051 (s, 3H), 4.046 (s, 3H), 3.81 (s, 3H), 1.33 (s, 9H).
ESI-MS: m/z 476[M+H]+
参考例1
工程1
エチル 5-tert-ブチル-1-メチル-1H-ピラゾール-3-カルボキシレート(化合物A1)
エチル 5,5-ジメチル-2,4-ジオキソヘキサノエート(600 mg)をエタノール(30 mL)に溶解し、メチルヒドラジン硫酸塩(519 mg)および酢酸(0.3 mL)を加え50℃にて終夜加熱撹拌した。減圧下でエタノールを留去し、酢酸エチルおよび水を加えた後、酢酸エチルにて抽出し、有機層を水および飽和食塩水で洗浄した。有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A1(385 mg、収率61%)を得た。
工程2
5-tert-ブチル-1-メチル-1H-ピラゾール-3-カルボン酸(化合物A2)
工程1に従って得られた化合物A1 (385 mg)をTHF(10 mL)および水(10 mL)の混合溶媒に溶解し、水酸化リチウム一水和物(151 mg)を加え、5時間室温で撹拌した。1 mol/L塩酸を加えて中性とし、減圧下で溶媒を留去後、得られた残渣をクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A2(302 mg、収率92%)を得た。
参考例2
工程1
メチル 5-シクロプロピル-1-メチル-1H-ピラゾール-3-カルボキシレート(化合物A3)
メチル 4-シクロプロピル-2,4-ジオキソブタノエートから、参考例1の工程1に準じて、標記化合物A3を得た。
工程2
5-シクロプロピル-1-メチル-1H-ピラゾール-3-カルボン酸(化合物A4)
工程1に従って得られた化合物A3から、参考例1の工程2に準じて標記化合物A4を得た。
参考例3
工程1
エチル 3-メチル-2,4-ジオキソヘキサノエート(化合物A5)
ジエチルエーテル(60 mL)に、リチウムヘキサメチルジシラジド(1 mol/Lヘキサン溶液、12 mL)を加え、-78℃にした後、ペンタン-3-オン(1.0 g)のジエチルエーテル(15 mL)溶液を加えた。-78℃で45分間撹拌した後、シュウ酸ジエチル(1.8 mL)を加え、室温で終夜撹拌した。析出した固体をろ取し、ジエチルエーテル(100 mL)で洗浄し、減圧下で乾燥し、標記化合物A5(1.9 g、収率84%)を得た。
工程2
エチル 1,5-ジエチル-4-メチル-1H-ピラゾール-3-カルボキシレート(化合物A6)
工程1に従って得られた化合物A5から、参考例1の工程1に準じて、標記化合物A6を得た。
工程3
1,5-ジエチル-4-メチル-1H-ピラゾール-3-カルボン酸(化合物A7)
工程2に従って得られた化合物A6から、参考例1の工程2に準じて標記化合物A7を得た。
参考例4
工程1
5-[(3-メトキシフェニルアミノ)メチレン]-2,2'-ジメチル-[1,3]ジオキサン-4,6-ジオン(化合物A8)
3-メトキシアニリン(1.23 g)および5-メトキシメチレン-2,2'-ジメチル-[1,3]ジオキサン-4,6-ジオン(1.90 g)を2-プロパノール(40 mL)に溶解し、70℃にて1時間撹拌した。減圧下で溶媒を留去し、得られた残渣をエーテルで洗浄し、標記化合物A8(1.22 g、収率44%)を得た。
工程2
7-メトキシ-1H-キノリン-4-オン(化合物A9)
工程1に従って得られた化合物A8(1.22 g)およびビフェニル(5.1 g)をジフェニルエーテル(15 mL)に懸濁し、220℃にて1.5時間撹拌した。反応終了後、得られた反応混合物を、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A9(394 mg、収率51%)を得た。
工程3
4-クロロ-7-メトキシキノリン(化合物A10)
工程2に従って得られた化合物A9(394 mg)をジイソプロピルエチルアミン(3 mL)に懸濁し、オキシ塩化リン(1 mL)を加え、100℃にて1時間撹拌した。氷冷下、得られた反応混合物に水を加え、水層を炭酸水素ナトリウム水溶液で中和し、酢酸エチルで抽出した後、有機層を水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去して得られた残渣をクロロホルムおよびアセトンを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A10(312 mg、収率72%)を得た。
工程4
4-(7-メトキシキノリン-4-イルオキシ)アニリン(化合物A11)
水素化ナトリウム(165 mg)をDMSO(25 mL)に溶解し、4-アミノフェノール(451 mg)を加えた。室温で10分間撹拌した後、工程3で得られる化合物A10 (400 mg)のDMSO (4 mL)溶液を加え、100℃で3時間撹拌した。水を加えて反応を停止させ、クロロホルムで抽出し、有機層を1 mol/L水酸化ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、ヘキサンおよびアセトンを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、さらにアセトニトリルを用いてスラリー精製することで標記化合物A11(381 mg、収率69%)を得た。
参考例5
工程1
1-イソプロピル-1H-ピラゾール(化合物A12)
ピラゾール(2.7 g)にイソプロピルブロミド(7.4 g)を加えて、70℃で終夜撹拌した。飽和炭酸水素ナトリウム水溶液を加えて反応を停止させ、クロロホルムで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=5:1)にて精製し、標記化合物A12(3.7 g、収率83%)を得た。
工程2
1-イソプロピル-4-ニトロ-1H-ピラゾール(化合物A13)
工程1に従って得られた化合物A12 (1.1 g)に濃硫酸(4 mL)を加えた後、0℃にし、硝酸(2.4 mL)および濃硫酸(0.8 mL)の混合液を加えた。80℃で3時間撹拌した後、得られた反応混合物を氷水に注ぎ、10%水酸化ナトリウム水溶液を加えて塩基性にした後、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=5:1)にて精製し、標記化合物A13(0.9 g、収率56%)を得た。
工程3
1-イソプロピル-1H-ピラゾール-4-アミン塩酸塩(化合物A14)
工程2に従って得られた化合物A13 (0.9 g)をTHF(20 mL)に溶解させ、10%パラジウム-炭素(300 mg)を加え、水素雰囲気下にした後、室温で3時間撹拌した。得られた反応混合物をセライトろ過した後、ろ液が半分の量になるまで減圧下で溶媒を留去し、10% 塩化水素-メタノール溶液を加えて酸性にした。得られた溶液から減圧下で溶媒を留去し、ジエチルエーテルを加えて上澄み液を除去した後、減圧下で乾燥することにより標記化合物A14(0.12 g、収率13%)を得た。
参考例6
工程1
tert-ブチル 2-シアノ-4-メチル-3-オキソペンタノエート(化合物A15)
tert-ブチル 2-シアノアセテート(706 mg)をDMF(20 mL)に溶解し、2-メチルプロピオン酸(0.556 mL)を加え、さらに氷冷下でジエチルホスホロシアニデート(979 mg)およびトリエチルアミン(2.23 mL)を加え、室温で終夜撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、10%塩酸を加えて酢酸エチルで抽出し、有機層を飽和炭酸水素ナトリウム水溶液および飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A15(946 mg、収率90%)を得た。
工程2
4-メチル-3-オキソペンタンニトリル(化合物A16)
工程1に従って得られた化合物A15 (946 mg)をメタノール(5 mL)に溶解し、10% 塩酸(5 mL)を加えて80℃で3時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し標記化合物A16(476 mg、収率96%)を得た。
工程3
3-イソプロピル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17)
工程2に従って得られた化合物A16 (233 mg)およびフェニルヒドラジン塩酸塩(333 mg)をエタノール(2 mL)に溶解し、酢酸(0.020 mL)および水(0.1 mL)を加え加熱還流下で終夜撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、飽和炭酸水素ナトリウム水溶液を加えクロロホルムで抽出し、有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A17(313 mg、収率74%)を得た。
参考例7
工程1
5-[(4-メトキシフェニルアミノ)メチレン]-2,2-ジメチル-[1,3]ジオキサン-4,6-ジオン(化合物A18)
4-メトキシアニリン(1.27 g)および5-メトキシメチレン-2,2-ジメチル-[1,3]ジオキサン-4,6-ジオン(1.82 g)を2-プロパノール(40 mL)に溶解し、50℃にて2時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、得られた残渣をエーテルで洗浄することにより、標記化合物A18(1.98 g、収率73%)を得た。
工程2
6-メトキシ-1H-キノリン-4-オン(化合物A19)
工程1に従って得られた化合物A18 (1.28 g)およびビフェニル(5.2 g)をジフェニルエーテル(20 mL)に懸濁し、220℃にて1時間撹拌した。反応終了後、得られた反応混合物をそのままクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A19(398 mg、収率49%)を得た。
工程3
4-クロロ-6-メトキシキノリン(化合物A20)
工程2に従って得られた化合物A19 (398 mg)をジイソプロピルエチルアミン(3 mL)に懸濁し、オキシ塩化リン(1 mL)を加え、100℃にて1時間撹拌した。氷冷下、得られた反応混合物に水を加え、炭酸水素ナトリウム水溶液で中和し、酢酸エチルで抽出した後、有機層を水で洗浄し、無水硫酸ナトリウムで乾燥し、減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびアセトンを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A20 (375 mg、収率42%)を得た。
工程4
4-(6-メトキシキノリン-4-イルオキシ)アニリン(化合物A21)
水素化ナトリウム(372 mg)をDMSO(50 mL)に溶解し、4-アミノフェノール(1.0 g)を加え、室温で10分間撹拌した後、工程3で得られる化合物A20 (900 mg)のDMSO(6 mL)溶液を加え、100℃で3時間撹拌した。得られた反応混合物に水を加えて反応を停止させ、クロロホルムで抽出し、有機層を1 mol/L水酸化ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:アセトン=4:1-1:1)にて精製後、さらにアセトニトリルを用いてスラリー精製を行い標記化合物A21(338 mg、収率27%)を得た。
参考例8
工程1
6-ベンジルオキシ-4-クロロキノリン(化合物A22)
4-ベンジルオキシアニリン塩酸塩(1.18 g)、および5-メトキシメチレン-2,2-ジメチル-[1,3]ジオキサン-4,6-ジオン(1.03 g)を2-プロパノール(15 mL)に懸濁し、トリエチルアミン(0.78 mL)を加えて、70℃にて3時間撹拌した。室温に冷却後、得られた反応混合物をろ過し、得られた残渣をエーテルで洗浄し、精製することなく次の反応に用いた。
WO97/17329の実施例49に従って得られる4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリンおよび参考例1に従って得られる化合物A2から実施例1に準じて標記化合物110(収率76%) を得た。
1H-NMR (DMSO-D6, 300 MHz) δ: 9.58 (s,1H), 9.02 (s, 1H), 8.81 (d, J = 6.6 Hz, 1H), 7.77 (s, 1H), 7.74-7.66 (m,2H),7.63 (s, 1H), 7.40-7.28 (m, 2H), 6.88 (d, J = 6.6 Hz, 1H), 6.07 (s, 1H), 4.051 (s, 3H), 4.046 (s, 3H), 3.81 (s, 3H), 1.33 (s, 9H).
ESI-MS: m/z 476[M+H]+
参考例1
工程1
エチル 5-tert-ブチル-1-メチル-1H-ピラゾール-3-カルボキシレート(化合物A1)
エチル 5,5-ジメチル-2,4-ジオキソヘキサノエート(600 mg)をエタノール(30 mL)に溶解し、メチルヒドラジン硫酸塩(519 mg)および酢酸(0.3 mL)を加え50℃にて終夜加熱撹拌した。減圧下でエタノールを留去し、酢酸エチルおよび水を加えた後、酢酸エチルにて抽出し、有機層を水および飽和食塩水で洗浄した。有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A1(385 mg、収率61%)を得た。
工程2
5-tert-ブチル-1-メチル-1H-ピラゾール-3-カルボン酸(化合物A2)
工程1に従って得られた化合物A1 (385 mg)をTHF(10 mL)および水(10 mL)の混合溶媒に溶解し、水酸化リチウム一水和物(151 mg)を加え、5時間室温で撹拌した。1 mol/L塩酸を加えて中性とし、減圧下で溶媒を留去後、得られた残渣をクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A2(302 mg、収率92%)を得た。
参考例2
工程1
メチル 5-シクロプロピル-1-メチル-1H-ピラゾール-3-カルボキシレート(化合物A3)
メチル 4-シクロプロピル-2,4-ジオキソブタノエートから、参考例1の工程1に準じて、標記化合物A3を得た。
工程2
5-シクロプロピル-1-メチル-1H-ピラゾール-3-カルボン酸(化合物A4)
工程1に従って得られた化合物A3から、参考例1の工程2に準じて標記化合物A4を得た。
参考例3
工程1
エチル 3-メチル-2,4-ジオキソヘキサノエート(化合物A5)
ジエチルエーテル(60 mL)に、リチウムヘキサメチルジシラジド(1 mol/Lヘキサン溶液、12 mL)を加え、-78℃にした後、ペンタン-3-オン(1.0 g)のジエチルエーテル(15 mL)溶液を加えた。-78℃で45分間撹拌した後、シュウ酸ジエチル(1.8 mL)を加え、室温で終夜撹拌した。析出した固体をろ取し、ジエチルエーテル(100 mL)で洗浄し、減圧下で乾燥し、標記化合物A5(1.9 g、収率84%)を得た。
工程2
エチル 1,5-ジエチル-4-メチル-1H-ピラゾール-3-カルボキシレート(化合物A6)
工程1に従って得られた化合物A5から、参考例1の工程1に準じて、標記化合物A6を得た。
工程3
1,5-ジエチル-4-メチル-1H-ピラゾール-3-カルボン酸(化合物A7)
工程2に従って得られた化合物A6から、参考例1の工程2に準じて標記化合物A7を得た。
参考例4
工程1
5-[(3-メトキシフェニルアミノ)メチレン]-2,2'-ジメチル-[1,3]ジオキサン-4,6-ジオン(化合物A8)
3-メトキシアニリン(1.23 g)および5-メトキシメチレン-2,2'-ジメチル-[1,3]ジオキサン-4,6-ジオン(1.90 g)を2-プロパノール(40 mL)に溶解し、70℃にて1時間撹拌した。減圧下で溶媒を留去し、得られた残渣をエーテルで洗浄し、標記化合物A8(1.22 g、収率44%)を得た。
工程2
7-メトキシ-1H-キノリン-4-オン(化合物A9)
工程1に従って得られた化合物A8(1.22 g)およびビフェニル(5.1 g)をジフェニルエーテル(15 mL)に懸濁し、220℃にて1.5時間撹拌した。反応終了後、得られた反応混合物を、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A9(394 mg、収率51%)を得た。
工程3
4-クロロ-7-メトキシキノリン(化合物A10)
工程2に従って得られた化合物A9(394 mg)をジイソプロピルエチルアミン(3 mL)に懸濁し、オキシ塩化リン(1 mL)を加え、100℃にて1時間撹拌した。氷冷下、得られた反応混合物に水を加え、水層を炭酸水素ナトリウム水溶液で中和し、酢酸エチルで抽出した後、有機層を水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去して得られた残渣をクロロホルムおよびアセトンを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A10(312 mg、収率72%)を得た。
工程4
4-(7-メトキシキノリン-4-イルオキシ)アニリン(化合物A11)
水素化ナトリウム(165 mg)をDMSO(25 mL)に溶解し、4-アミノフェノール(451 mg)を加えた。室温で10分間撹拌した後、工程3で得られる化合物A10 (400 mg)のDMSO (4 mL)溶液を加え、100℃で3時間撹拌した。水を加えて反応を停止させ、クロロホルムで抽出し、有機層を1 mol/L水酸化ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥した後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、ヘキサンおよびアセトンを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、さらにアセトニトリルを用いてスラリー精製することで標記化合物A11(381 mg、収率69%)を得た。
参考例5
工程1
1-イソプロピル-1H-ピラゾール(化合物A12)
ピラゾール(2.7 g)にイソプロピルブロミド(7.4 g)を加えて、70℃で終夜撹拌した。飽和炭酸水素ナトリウム水溶液を加えて反応を停止させ、クロロホルムで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=5:1)にて精製し、標記化合物A12(3.7 g、収率83%)を得た。
工程2
1-イソプロピル-4-ニトロ-1H-ピラゾール(化合物A13)
工程1に従って得られた化合物A12 (1.1 g)に濃硫酸(4 mL)を加えた後、0℃にし、硝酸(2.4 mL)および濃硫酸(0.8 mL)の混合液を加えた。80℃で3時間撹拌した後、得られた反応混合物を氷水に注ぎ、10%水酸化ナトリウム水溶液を加えて塩基性にした後、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=5:1)にて精製し、標記化合物A13(0.9 g、収率56%)を得た。
工程3
1-イソプロピル-1H-ピラゾール-4-アミン塩酸塩(化合物A14)
工程2に従って得られた化合物A13 (0.9 g)をTHF(20 mL)に溶解させ、10%パラジウム-炭素(300 mg)を加え、水素雰囲気下にした後、室温で3時間撹拌した。得られた反応混合物をセライトろ過した後、ろ液が半分の量になるまで減圧下で溶媒を留去し、10% 塩化水素-メタノール溶液を加えて酸性にした。得られた溶液から減圧下で溶媒を留去し、ジエチルエーテルを加えて上澄み液を除去した後、減圧下で乾燥することにより標記化合物A14(0.12 g、収率13%)を得た。
参考例6
工程1
tert-ブチル 2-シアノ-4-メチル-3-オキソペンタノエート(化合物A15)
tert-ブチル 2-シアノアセテート(706 mg)をDMF(20 mL)に溶解し、2-メチルプロピオン酸(0.556 mL)を加え、さらに氷冷下でジエチルホスホロシアニデート(979 mg)およびトリエチルアミン(2.23 mL)を加え、室温で終夜撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、10%塩酸を加えて酢酸エチルで抽出し、有機層を飽和炭酸水素ナトリウム水溶液および飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A15(946 mg、収率90%)を得た。
工程2
4-メチル-3-オキソペンタンニトリル(化合物A16)
工程1に従って得られた化合物A15 (946 mg)をメタノール(5 mL)に溶解し、10% 塩酸(5 mL)を加えて80℃で3時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し標記化合物A16(476 mg、収率96%)を得た。
工程3
3-イソプロピル-1-フェニル-1H-ピラゾール-5-アミン(化合物A17)
工程2に従って得られた化合物A16 (233 mg)およびフェニルヒドラジン塩酸塩(333 mg)をエタノール(2 mL)に溶解し、酢酸(0.020 mL)および水(0.1 mL)を加え加熱還流下で終夜撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、飽和炭酸水素ナトリウム水溶液を加えクロロホルムで抽出し、有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A17(313 mg、収率74%)を得た。
参考例7
工程1
5-[(4-メトキシフェニルアミノ)メチレン]-2,2-ジメチル-[1,3]ジオキサン-4,6-ジオン(化合物A18)
4-メトキシアニリン(1.27 g)および5-メトキシメチレン-2,2-ジメチル-[1,3]ジオキサン-4,6-ジオン(1.82 g)を2-プロパノール(40 mL)に溶解し、50℃にて2時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、得られた残渣をエーテルで洗浄することにより、標記化合物A18(1.98 g、収率73%)を得た。
工程2
6-メトキシ-1H-キノリン-4-オン(化合物A19)
工程1に従って得られた化合物A18 (1.28 g)およびビフェニル(5.2 g)をジフェニルエーテル(20 mL)に懸濁し、220℃にて1時間撹拌した。反応終了後、得られた反応混合物をそのままクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A19(398 mg、収率49%)を得た。
工程3
4-クロロ-6-メトキシキノリン(化合物A20)
工程2に従って得られた化合物A19 (398 mg)をジイソプロピルエチルアミン(3 mL)に懸濁し、オキシ塩化リン(1 mL)を加え、100℃にて1時間撹拌した。氷冷下、得られた反応混合物に水を加え、炭酸水素ナトリウム水溶液で中和し、酢酸エチルで抽出した後、有機層を水で洗浄し、無水硫酸ナトリウムで乾燥し、減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびアセトンを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A20 (375 mg、収率42%)を得た。
工程4
4-(6-メトキシキノリン-4-イルオキシ)アニリン(化合物A21)
水素化ナトリウム(372 mg)をDMSO(50 mL)に溶解し、4-アミノフェノール(1.0 g)を加え、室温で10分間撹拌した後、工程3で得られる化合物A20 (900 mg)のDMSO(6 mL)溶液を加え、100℃で3時間撹拌した。得られた反応混合物に水を加えて反応を停止させ、クロロホルムで抽出し、有機層を1 mol/L水酸化ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:アセトン=4:1-1:1)にて精製後、さらにアセトニトリルを用いてスラリー精製を行い標記化合物A21(338 mg、収率27%)を得た。
参考例8
工程1
6-ベンジルオキシ-4-クロロキノリン(化合物A22)
4-ベンジルオキシアニリン塩酸塩(1.18 g)、および5-メトキシメチレン-2,2-ジメチル-[1,3]ジオキサン-4,6-ジオン(1.03 g)を2-プロパノール(15 mL)に懸濁し、トリエチルアミン(0.78 mL)を加えて、70℃にて3時間撹拌した。室温に冷却後、得られた反応混合物をろ過し、得られた残渣をエーテルで洗浄し、精製することなく次の反応に用いた。
上記で得られた残渣およびビフェニル(4.34g)をジフェニルエーテル(12 mL)に懸濁し、240℃にて終夜撹拌した。室温に冷却後、得られた反応混合物をそのままクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、得られた粗精製物をさらに精製することなく次の反応に用いた。上記で得られた粗精製物をジイソプロピルエチルアミン(3 mL)に懸濁し、オキシ塩化リン(0.5 mL)を加え、120℃にて3時間撹拌した。氷冷下、得られた反応混合物に水および炭酸水素ナトリウム水溶液を加えて中和し、酢酸エチルで抽出した後、有機層を水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A22(147 mg、収率3段階10%)を得た。
工程2
4-(6-ベンジルオキシキノリン-4-イルオキシ)アニリン(化合物A23)
水素化ナトリウム(593 mg)を、DMSO(80 mL)に溶解し、4-アミノフェノール(1.6 g)を加えた。室温で10分間撹拌した後、工程1で得られる化合物A22 (2.0 g)を加え、100℃で終夜撹拌した。得られた反応混合物に水を加えて、クロロホルムで抽出し、有機層を1 mol/L水酸化ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣にメタノールを加えた。析出した固体をろ取して標記化合物A23(1.08 g、収率43%)を得た。
参考例9
工程1
4-[2-(ジフェニルメチレン)ヒドラジニル]ピリジン(化合物A24)
4-ブロモピリジン塩酸塩(2.0 g)、酢酸パラジウム(46 mg)、2,2'-ビス(ジフェニルホスフィノ)-1,1'-ビナフチル(124 mg)、ベンゾフェノンヒドラゾン(1.61 g)およびナトリウムtert-ブトキシド(1.38 g)をトルエン(21 mL)に溶解させ、90℃で終夜撹拌した。反応終了後、得られた反応混合物をセライトでろ過し、ろ液に塩化アンモニウム水溶液を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、さらにイソプロピルアルコールを用いて再結晶することにより、標記化合物A24(1.47 g、収率52%)を得た。
工程2
4-ヒドラジニルピリジン塩酸塩(化合物A25)
工程1で得られる化合物A24 (1.55 g)を2 mol/L塩化水素-エタノール溶液(56 mL)に溶解し、水(10 mL)を加えて室温で2時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、クロロホルムを加え、水で抽出し、水層をクロロホルムで洗浄後、水層から減圧下で溶媒を留去し、2-プロパノールを加えて共沸を行い、減圧下で乾燥し、標記化合物A25(844 mg、収率82%)を得た。
工程3
tert-ブチル 2-シアノ-3-(1-メチルシクロプロピル)-3-オキソプロパノエート (化合物A26)
tert-ブチル 2-シアノアセテート(3.0 mL)をDMF(72 mL)に溶解し、1-メチルシクロプロパンカルボン酸(2.45 mL)を加え、さらに氷冷下でジエチルホスホロシアニデート(3.75 mL)およびトリエチルアミン(9.0 mL)を加えた。室温で4時間撹拌し、反応終了後に、得られた反応混合物から減圧下で溶媒を留去し、1 mol/L塩酸を加えて酢酸エチルで抽出後、有機層を飽和炭酸水素ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A26(4.68 g、収率94%)を得た。
工程4
3-(1-メチルシクロプロピル)-3-オキソプロパンニトリル(化合物A27)
化合物A26(2.32 g)をメタノール(16 mL)に溶解し、1 mol/L塩酸(16 mL)を加えて80℃で2時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、飽和炭酸水素ナトリウム水溶液を加えてpH 11とし、酢酸エチルで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し標記化合物A27(1.18 g、収率92%)を得た。
工程5
3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-アミン(化合物A28)
工程4に従って得られた化合物A27 (685 mg)および工程2に従って得られた化合物A25 (844 mg)をエタノール(18 mL)に溶解させ、酢酸(0.265 mL)および水(0.96 mL)を加え、加熱還流下5時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、飽和炭酸水素ナトリウム水溶液を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A28(420 mg、収率42%)を得た。
参考例10
工程1
2-シアノ-3,3-ビス(メチルチオ)アクリル酸エチル(化合物A29)
シアノ酢酸エチル(3.00 g)および二硫化炭素(2.02g)をエタノール(26.5 mL)に溶解し、水酸化ナトリウム(2.28g)を水(2.0 mL)に溶解させた溶液を0℃で滴下した。滴下終了後、室温で20分間撹拌し、0℃でジメチル硫酸(6.68g)を加え、室温で終夜撹拌し、反応終了後、反応混合物から減圧下で溶媒を留去した。得られた残渣にジエチルエーテルを加えて懸濁させ、シリカゲルパッドで濾過した後、ろ液から減圧下で溶媒を留去し、標記化合物A29(4.96 g、収率86%)を得た。
工程2
5-アミノ-3-メチルチオ-1-フェニル-1H-ピラゾール-4-カルボン酸エチル(化合物A30)
工程1に従って得られた化合物A29 (500 mg)および1,4-ジアザビシクロ[2,2,2]オクタン(309 mg)をTHF(10 mL)に溶解し、フェニルヒドラジン(274 mg)を加えて2時間加熱還流した。得られた反応混合物を室温に冷却し、減圧下で溶媒を留去し、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A30(381 mg、収率60%)を得た。
工程3
3-メチルチオ-1-フェニル-1H-ピラゾール-5-アミン(化合物A31)
工程2に従って得られた化合物A30 (150 mg)に6 mol/L塩酸 (5 mL)を加え、2日間加熱還流した。反応終了後、氷冷下で、得られた反応混合物を炭酸ナトリウム水溶液に加えて塩基性にし、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、ヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A31(92 mg、収率83%)を得た。
参考例11
工程1
3-ベンジルオキシ-2,2-ジメチルプロパン酸メチル(化合物A32)
3-ヒドロキシ-2,2-ジメチルプロパン酸メチル(1.00 g)をTHF(10 mL)に溶解し、0℃で水素化ナトリウム(200 mg)を少量ずつ加えて、0℃で1時間撹拌した後、ベンジルブロミド(1.94g)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し標記化合物A32(661 mg、収率39%)を得た。
工程2
3-ベンジルオキシ-2,2-ジメチルプロパン酸(化合物A33)
工程1に従って得られた化合物A32 (655 mg)をメタノール(5 mL)および水(5 mL)に懸濁し、水酸化リチウム一水和物(141mg)を加え、室温で終夜撹拌後、水酸化ナトリウム(560 mg)を加え、2時間加熱還流した。氷冷下、得られた反応混合物に2 mol/L塩酸を加えて酸性にし、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、標記化合物A33(556 mg、収率91%)を得た。
工程3
5-ベンジルオキシ-4,4-ジメチル-3-オキソペンタンニトリル(化合物A34)
工程2に従って得られた化合物A33 (555 mg)およびシアノ酢酸tert-ブチル(451 mg)のDMF(5mL)溶液に、0℃でシアノホスホン酸ジエチル(531 mg)およびトリエチルアミン(809 mg)を加え、0℃で2時間撹拌した後、室温で終夜撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を10%塩酸、飽和炭酸水素ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、得られた粗精製物をさらに精製することなく次の反応に用いた。上記反応で得られた粗精製物全量をメタノール(3.5 mL)に溶解し、10%塩酸(3.5 mL)を加え、80℃で6時間撹拌した。室温に冷却後、得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより標記化合物A34(387 mg、二段階収率63%)を得た。
工程4
3-(1-ベンジルオキシ-2-メチルプロパン-2-イル)-1-フェニル-1H-ピラゾール-5-アミン(化合物A35)
工程3に従って得られた化合物A34 (150 mg)をエタノール(3 mL)および水(0.15 mL)に溶解し、フェニルヒドラジン(70.1 mg)および酢酸(2.0 mg)を加えて90℃で終夜撹拌した。得られた反応混合物を室温に冷却した後、水を加えて酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A35(203 mg、収率97%)を得た。
参考例12
工程1
4-クロロ-N-(ジフェニルメチレン)キノリン-7-アミン(化合物A36)
7-ブロモ-4-クロロキノリン(1.2 g)をジオキサン(25 mL)に懸濁させ、ベンソフェノンイミン(1.0 mL)、炭酸セシウム(2.26 g)およびrac-BINAP(925 mg)を加えて反応系内をアルゴンガスで置換後、酢酸パラジウム(222 mg)を加えて加熱還流下で1.5時間撹拌した。得られた反応混合物に水および酢酸エチルを加えて、セライトでろ過した後、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=85:15-67:33)で精製し、標記化合物A36(1.30 g、収率76%)を得た。
工程2
4-(4-アミノフェノキシ)-N-(ジフェニルメチレン)キノリン-7-アミン(化合物A37)
工程1に従って得られた化合物A36 (600.0 mg)をDMSO(9.0 mL)に溶解し、4-アミノフェノール(382.0 mg)および炭酸カリウム(725.6 mg)を加え、マイクロウェーブ(Personal Chemistry、Emrys Optimizer)照射下、200℃で15分間撹拌した。反応終了後、得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を1 mol/L水酸化カリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去して得られた粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=40:60)で精製し、標記化合物A37(501.5 mg、収率69%)を得た。
工程3
1-{4-[7-(ジフェニルメチレンアミノ)キノリン-4-イルオキシ]フェニル}-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-イル]ウレア(化合物A38)
参考例9に従って得られる化合物A28 (125 mg)をクロロホルム(1.5 mL)に溶解し、室温でトリエチルアミン(570 μL)を加え、0℃でトリホスゲン(104 mg)および工程2に従って得られた化合物A37 (220 mg)のクロロホルム(1.5 mL)溶液を加えて室温で14時間撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィ(クロロホルム:アセトン=80:20-67:33)で精製し、標記化合物A38(197 mg、収率57%)を得た。
参考例13
工程1
3-ヒドラジニルピリジン二塩酸塩(化合物A39)
ヒドラジンカルボン酸tert-ブチル(1.55 g)、1,10-フェナントロリン(193 mg)、ヨウ化銅(I)(19 mg)および炭酸セシウム(4.45 g)にDMF(10 mL)および3-ヨウ化ピリジン(2.00 g)を加え、アルゴン雰囲気下、80℃で終夜撹拌した。反応終了後、得られた反応混合物を室温に冷却し、セライト濾過した後、ろ液から減圧下で溶媒を留去した。残渣に飽和食塩水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、減圧下で溶媒を留去した。得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、得られた残渣に、10%塩酸(3 mL)を加え、5時間加熱還流した。反応終了後、室温に冷却し、減圧下で溶媒を留去後、標記化合物A39(1.23 g、二段階収率69%)を得た。
工程2
3-(4-メトキシベンジルオキシ)-2,2-ジメチルプロパン酸メチル(化合物A40)
水素化ナトリウム(2.66 g)をTHF(40 mL)に懸濁し、0℃で3-ヒドロキシ-2,2-ジメチルプロパン酸メチル(1.00 g)を少量ずつ加えた後、1時間撹拌し、さらに4-メトキシベンジルクロリド(14.2 g)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A40(9.21 g、収率60%)を得た。
工程3
3-(4-メトキシベンジルオキシ)-2,2-ジメチルプロパン酸(化合物A41)
工程2に従って得られた化合物A40 (9.20 g)をエタノール(70 mL)に溶解し、水酸化ナトリウム(6.38 g)および水(78 mL)を加え、終夜加熱還流した。反応終了後、反応混合物から減圧下でエタノールを留去し、水層を混合溶媒(ヘキサン:酢酸エチル=1:1)で洗浄後、水層に2 mol/L塩酸を加えて酸性にし、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、標記化合物A41(6.26 g、収率72%)を得た。
工程4
5-ヒドロキシ-4,4-ジメチル-3-オキソペンタンニトリル(化合物A42)
工程3で得られる化合物A41 (6.40 g)およびシアノ酢酸tert-ブチル(4.60 g)のDMF(5 mL)溶液に、0℃でシアノホスホン酸ジエチル(5.35 g)およびトリエチルアミン(8.15 g)を加え、0℃で2時間撹拌した後、室温で4時間撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をメタノール(30 mL)に溶解し、10%塩酸(30 mL)を加え、4時間加熱還流した。室温に冷却後、得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A42(2.39 g、二段階収率63%)を得た。
工程5
2-[5-アミノ-1-(ピリジン-3-イル)-1H-ピラゾール-3-イル]-2-メチルプロパン-1-オール(化合物A43)
工程4に従って得られた化合物A42 (200 mg)および工程1に従って得られた化合物A39 (310 mg)をエタノール(3 mL)および水(0.3 mL)に溶解し、濃塩酸(1滴)を加えて終夜加熱還流した。反応終了後、得られた反応混合物を室温に冷却し、飽和炭酸水素ナトリウム水溶液で中和して、クロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し標記化合物A43(198 mg、収率60%)を得た。
工程6
3-[1-(tert-ブチルジメチルシリルオキシ)-2-メチルプロパン-2-イル]-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A44)
工程5に従って得られた化合物A43 (195 mg)をTHF(8 mL)に溶解し、0℃で水素化ナトリウム(50.4 mg)を加え、10分間撹拌後、さらにtert-ブチルジメチルシリルクロリド(232 mg)を加え、室温で終夜撹拌した。得られた反応混合物を0℃に冷却し、水素化ナトリウム(100 mg)を加えて10分間撹拌し、さらにtert-ブチルジメチルシリルクロリド(379 mg)を加え、室温で6時間撹拌した。得られた反応混合物に水を加えてクロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去した。得られた残渣を、ヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A44(237 mg、収率82%)を得た。
参考例14
工程1
4-(4-アミノフェノキシ)-6-メトキシキノリン-7-オール(化合物A45)
WO03/033472の製造例1に従って得られる4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)アニリン(20 g)にトリフルオロ酢酸(200 mL)およびメタンスルホン酸(10 mL)を加えて加熱還流下で1.5時間撹拌した。得られた反応混合物から減圧下で溶媒を留去し、得られた残渣に飽和炭酸水素ナトリウム水溶液を加えてpH 9とし、析出した固体をろ取し、減圧下で乾燥して標記化合物A45(7.2 g、収率47%)を得た。
工程2
4-{6-メトキシ-7-[2-(テトラヒドロ-2H-ピラン-2-イルオキシ)エトキシ]キノリン-4-イルオキシ}アニリン(化合物A46)
水素化ナトリウム(8 mg)をDMF(1.7 mL)に懸濁させ、工程1で得られる化合物A45 (50 mg)を加えて0℃で30分間撹拌後、さらに、2-(2-ブロモエトキシ)テトラヒドロ-2H-ピラン(29μL)を加えて室温で終夜撹拌し、50℃で2時間撹拌した。得られた反応混合物に水を加え酢酸エチルで抽出し、有機層を水および飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(クロロホルム:メタノール=20:1)で精製し、標記化合物A46(31 mg、収率42%)を得た。
参考例15
工程1
エチル 2-[4-(4-アミノフェノキシ)-6-メトキシキノリン-7-イルオキシ]アセテート(化合物A47)
参考例14の工程1に従って得られた化合物A45 (100 mg)にDMF(3.5 mL)を加えた後、0℃で水素化ナトリウム(16 mg)およびブロモ酢酸エチル(43 μL)を加えて室温で1 時間撹拌した。得られた反応混合物にメタノールおよび水を加えて反応を停止させ、析出した固体をろ取し、50℃で減圧乾燥して標記化合物A47(66 mg、収率51%)を得た。
工程2
2-[4-(4-アミノフェノキシ)-6-メトキシキノリン-7-イルオキシ]エタノール(化合物A48)
工程1に従って得られた化合物A47 (66 mg)をTHF(4 mL)に溶解し、0℃で水素化アルミニウムリチウム(10.2 mg)を加え、室温で30分間撹拌した。得られた反応混合物に飽和塩化アンモニウム水溶液を加え、セライトろ過した後、ろ液を酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去して標記化合物A48の粗生成物 (84 mg)を得た。
参考例16
工程1
3-イソプロピルチオ-1-フェニル-1H-ピラゾール-5-アミン(化合物A49)
シアノ酢酸tert-ブチル(400 mg)および二硫化炭素(2.02 g)をTHF(2.8 mL)に溶解し、水酸化ナトリウム(232 mg)および水(0.56 mL)の混合溶液を0℃で滴下後、室温で20分間撹拌し、さらに0℃で2-ヨウ化プロピル(0.987 mg)を加え、室温で終夜撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、2-シアノ-3,3-ビス(イソプロピルチオ)アクリル酸tert-ブチルの粗精製物を得た。得られた粗精製物を用いて、参考例10の工程2に準じて5-アミノ-3-イソプロピルチオ-1-フェニル-1H-ピラゾール-4-カルボン酸tert-ブチルの粗生成物を得た。得られた粗生成物に6 mol/L 塩酸(5 mL)を加え、80℃で3時間加熱還流した。反応終了後、氷冷下で得られた反応混合物に炭酸ナトリウム水溶液を加えて塩基性にし、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A49(68.8 mg、3段階収率10%)を得た。
工程2
3-イソプロピルスルホニル-1-フェニル-1H-ピラゾール-5-アミン(化合物A50)
工程1に従って得られた化合物A49 (68.0 mg)をジクロロメタン(10 mL)に溶解し、m-クロロ過安息香酸(148 mg)を少しずつ加え、室温で2時間撹拌した。得られた反応混合物に亜硫酸ナトリウム水溶液および食塩水を加えて反応停止後、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、ヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A50(53.3 mg、収率69%)を得た。
参考例17
工程1
4-(6-ブロモピリジン-3-イルオキシ)-6,7-ジメトキシキノリン(化合物A51)
ジャーナル・オブ・メディシナル・ケミストリー(J. Med. Chem.) 2006,49,2186-2192に従って得られる4-クロロ-6,7-ジメトキシキノリン(1.12 g)をクロロベンゼン(50 mL)に溶解し、6-ブロモピリジン-3-オール(1.74 g)およびジメチルアミノピリジン(1.83 g)を加え、100℃で終夜撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A51(1.57 g、収率87%)を得た。
工程2
5-(6,7-ジメトキシキノリン-4-イルオキシ)ピリジン-2-アミン(化合物A52)
工程1に従って得られた化合物A51 (1.57 g)、ジベンジリデンアセトンパラジウム(201 mg)およびジフェニル-2-イルジシクロヘキシルホスフィン(182 mg)に、リチウムヘキサメチルジシラジド(1.0 mol/L THF溶液、6.5 mL)を加え、65℃で2時間撹拌した。得られた反応混合物に1 mol/L 塩酸(25 mL)を加え、室温で5分間撹拌して反応を停止させ、続いて1 mol/L水酸化ナトリウム水溶液を加えて中性にし、クロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A52(1.29 g、収率100%)を得た。
参考例18
3-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(化合物A53)
DMSO(10 mL)に水素化ナトリウム(60重量%, 0.72 g)を加え、50℃で20分間撹拌後、4-アミノ-2-クロロフェノール塩酸塩(1.61g)を加え、室温で10分間撹拌した。得られた反応混合物に4-クロロ-6,7-ジメトキシキノリン(1.00 g)を加え100℃で一晩撹拌し、水を加えクロロホルムで抽出後、有機層を飽和炭酸水素ナトリウム水溶液で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去した。得られた残渣にメタノールを加え、析出した固体をろ取して標記化合物A53(0.80 g、収率60%)を得た。
ESI-MS: m/z 332[M+H]+
参考例19
5-tert-ブチル-1H-ピラゾール-3-カルボン酸(化合物A54)
参考例1に準じて、エチル 5,5-ジメチル-2,4-ジオキソヘキサノエートおよびヒドラジン塩酸塩から標記化合物A54(収率84%)を得た。
参考例20
5-イソプロピル-1-メチル-1H-ピラゾール-3-カルボン酸(化合物A55)
参考例1に準じて、エチル 5-メチル-2,4-ジオキソヘキサノエートおよびメチルヒドラジン硫酸塩から標記化合物A55(収率63%)を得た。
参考例21
2,3-ジメチル-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(化合物A56)
参考例18に準じて、4-アミノ-2,3-ジメチルフェノールおよび4-クロロ-6,7-ジメトキシキノリンから標記化合物A56(収率55%)を得た。
参考例22
3,5-ジクロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(化合物A57)
参考例18に準じて、4-アミノ-3,5-ジクロロフェノールおよび4-クロロ-6,7-ジメトキシキノリンから標記化合物A57(収率21%)を得た。
工程2
4-(6-ベンジルオキシキノリン-4-イルオキシ)アニリン(化合物A23)
水素化ナトリウム(593 mg)を、DMSO(80 mL)に溶解し、4-アミノフェノール(1.6 g)を加えた。室温で10分間撹拌した後、工程1で得られる化合物A22 (2.0 g)を加え、100℃で終夜撹拌した。得られた反応混合物に水を加えて、クロロホルムで抽出し、有機層を1 mol/L水酸化ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣にメタノールを加えた。析出した固体をろ取して標記化合物A23(1.08 g、収率43%)を得た。
参考例9
工程1
4-[2-(ジフェニルメチレン)ヒドラジニル]ピリジン(化合物A24)
4-ブロモピリジン塩酸塩(2.0 g)、酢酸パラジウム(46 mg)、2,2'-ビス(ジフェニルホスフィノ)-1,1'-ビナフチル(124 mg)、ベンゾフェノンヒドラゾン(1.61 g)およびナトリウムtert-ブトキシド(1.38 g)をトルエン(21 mL)に溶解させ、90℃で終夜撹拌した。反応終了後、得られた反応混合物をセライトでろ過し、ろ液に塩化アンモニウム水溶液を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とする分取薄層クロマトグラフィーで精製し、さらにイソプロピルアルコールを用いて再結晶することにより、標記化合物A24(1.47 g、収率52%)を得た。
工程2
4-ヒドラジニルピリジン塩酸塩(化合物A25)
工程1で得られる化合物A24 (1.55 g)を2 mol/L塩化水素-エタノール溶液(56 mL)に溶解し、水(10 mL)を加えて室温で2時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、クロロホルムを加え、水で抽出し、水層をクロロホルムで洗浄後、水層から減圧下で溶媒を留去し、2-プロパノールを加えて共沸を行い、減圧下で乾燥し、標記化合物A25(844 mg、収率82%)を得た。
工程3
tert-ブチル 2-シアノ-3-(1-メチルシクロプロピル)-3-オキソプロパノエート (化合物A26)
tert-ブチル 2-シアノアセテート(3.0 mL)をDMF(72 mL)に溶解し、1-メチルシクロプロパンカルボン酸(2.45 mL)を加え、さらに氷冷下でジエチルホスホロシアニデート(3.75 mL)およびトリエチルアミン(9.0 mL)を加えた。室温で4時間撹拌し、反応終了後に、得られた反応混合物から減圧下で溶媒を留去し、1 mol/L塩酸を加えて酢酸エチルで抽出後、有機層を飽和炭酸水素ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A26(4.68 g、収率94%)を得た。
工程4
3-(1-メチルシクロプロピル)-3-オキソプロパンニトリル(化合物A27)
化合物A26(2.32 g)をメタノール(16 mL)に溶解し、1 mol/L塩酸(16 mL)を加えて80℃で2時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、飽和炭酸水素ナトリウム水溶液を加えてpH 11とし、酢酸エチルで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し標記化合物A27(1.18 g、収率92%)を得た。
工程5
3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-アミン(化合物A28)
工程4に従って得られた化合物A27 (685 mg)および工程2に従って得られた化合物A25 (844 mg)をエタノール(18 mL)に溶解させ、酢酸(0.265 mL)および水(0.96 mL)を加え、加熱還流下5時間撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、飽和炭酸水素ナトリウム水溶液を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A28(420 mg、収率42%)を得た。
参考例10
工程1
2-シアノ-3,3-ビス(メチルチオ)アクリル酸エチル(化合物A29)
シアノ酢酸エチル(3.00 g)および二硫化炭素(2.02g)をエタノール(26.5 mL)に溶解し、水酸化ナトリウム(2.28g)を水(2.0 mL)に溶解させた溶液を0℃で滴下した。滴下終了後、室温で20分間撹拌し、0℃でジメチル硫酸(6.68g)を加え、室温で終夜撹拌し、反応終了後、反応混合物から減圧下で溶媒を留去した。得られた残渣にジエチルエーテルを加えて懸濁させ、シリカゲルパッドで濾過した後、ろ液から減圧下で溶媒を留去し、標記化合物A29(4.96 g、収率86%)を得た。
工程2
5-アミノ-3-メチルチオ-1-フェニル-1H-ピラゾール-4-カルボン酸エチル(化合物A30)
工程1に従って得られた化合物A29 (500 mg)および1,4-ジアザビシクロ[2,2,2]オクタン(309 mg)をTHF(10 mL)に溶解し、フェニルヒドラジン(274 mg)を加えて2時間加熱還流した。得られた反応混合物を室温に冷却し、減圧下で溶媒を留去し、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A30(381 mg、収率60%)を得た。
工程3
3-メチルチオ-1-フェニル-1H-ピラゾール-5-アミン(化合物A31)
工程2に従って得られた化合物A30 (150 mg)に6 mol/L塩酸 (5 mL)を加え、2日間加熱還流した。反応終了後、氷冷下で、得られた反応混合物を炭酸ナトリウム水溶液に加えて塩基性にし、クロロホルムで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、ヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A31(92 mg、収率83%)を得た。
参考例11
工程1
3-ベンジルオキシ-2,2-ジメチルプロパン酸メチル(化合物A32)
3-ヒドロキシ-2,2-ジメチルプロパン酸メチル(1.00 g)をTHF(10 mL)に溶解し、0℃で水素化ナトリウム(200 mg)を少量ずつ加えて、0℃で1時間撹拌した後、ベンジルブロミド(1.94g)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し標記化合物A32(661 mg、収率39%)を得た。
工程2
3-ベンジルオキシ-2,2-ジメチルプロパン酸(化合物A33)
工程1に従って得られた化合物A32 (655 mg)をメタノール(5 mL)および水(5 mL)に懸濁し、水酸化リチウム一水和物(141mg)を加え、室温で終夜撹拌後、水酸化ナトリウム(560 mg)を加え、2時間加熱還流した。氷冷下、得られた反応混合物に2 mol/L塩酸を加えて酸性にし、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、標記化合物A33(556 mg、収率91%)を得た。
工程3
5-ベンジルオキシ-4,4-ジメチル-3-オキソペンタンニトリル(化合物A34)
工程2に従って得られた化合物A33 (555 mg)およびシアノ酢酸tert-ブチル(451 mg)のDMF(5mL)溶液に、0℃でシアノホスホン酸ジエチル(531 mg)およびトリエチルアミン(809 mg)を加え、0℃で2時間撹拌した後、室温で終夜撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を10%塩酸、飽和炭酸水素ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、得られた粗精製物をさらに精製することなく次の反応に用いた。上記反応で得られた粗精製物全量をメタノール(3.5 mL)に溶解し、10%塩酸(3.5 mL)を加え、80℃で6時間撹拌した。室温に冷却後、得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより標記化合物A34(387 mg、二段階収率63%)を得た。
工程4
3-(1-ベンジルオキシ-2-メチルプロパン-2-イル)-1-フェニル-1H-ピラゾール-5-アミン(化合物A35)
工程3に従って得られた化合物A34 (150 mg)をエタノール(3 mL)および水(0.15 mL)に溶解し、フェニルヒドラジン(70.1 mg)および酢酸(2.0 mg)を加えて90℃で終夜撹拌した。得られた反応混合物を室温に冷却した後、水を加えて酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A35(203 mg、収率97%)を得た。
参考例12
工程1
4-クロロ-N-(ジフェニルメチレン)キノリン-7-アミン(化合物A36)
7-ブロモ-4-クロロキノリン(1.2 g)をジオキサン(25 mL)に懸濁させ、ベンソフェノンイミン(1.0 mL)、炭酸セシウム(2.26 g)およびrac-BINAP(925 mg)を加えて反応系内をアルゴンガスで置換後、酢酸パラジウム(222 mg)を加えて加熱還流下で1.5時間撹拌した。得られた反応混合物に水および酢酸エチルを加えて、セライトでろ過した後、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=85:15-67:33)で精製し、標記化合物A36(1.30 g、収率76%)を得た。
工程2
4-(4-アミノフェノキシ)-N-(ジフェニルメチレン)キノリン-7-アミン(化合物A37)
工程1に従って得られた化合物A36 (600.0 mg)をDMSO(9.0 mL)に溶解し、4-アミノフェノール(382.0 mg)および炭酸カリウム(725.6 mg)を加え、マイクロウェーブ(Personal Chemistry、Emrys Optimizer)照射下、200℃で15分間撹拌した。反応終了後、得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を1 mol/L水酸化カリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去して得られた粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=40:60)で精製し、標記化合物A37(501.5 mg、収率69%)を得た。
工程3
1-{4-[7-(ジフェニルメチレンアミノ)キノリン-4-イルオキシ]フェニル}-3-[3-(1-メチルシクロプロピル)-1-(ピリジン-4-イル)-1H-ピラゾール-5-イル]ウレア(化合物A38)
参考例9に従って得られる化合物A28 (125 mg)をクロロホルム(1.5 mL)に溶解し、室温でトリエチルアミン(570 μL)を加え、0℃でトリホスゲン(104 mg)および工程2に従って得られた化合物A37 (220 mg)のクロロホルム(1.5 mL)溶液を加えて室温で14時間撹拌した。得られた反応混合物に水を加え、クロロホルムで抽出し、有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた粗生成物をシリカゲルカラムクロマトグラフィ(クロロホルム:アセトン=80:20-67:33)で精製し、標記化合物A38(197 mg、収率57%)を得た。
参考例13
工程1
3-ヒドラジニルピリジン二塩酸塩(化合物A39)
ヒドラジンカルボン酸tert-ブチル(1.55 g)、1,10-フェナントロリン(193 mg)、ヨウ化銅(I)(19 mg)および炭酸セシウム(4.45 g)にDMF(10 mL)および3-ヨウ化ピリジン(2.00 g)を加え、アルゴン雰囲気下、80℃で終夜撹拌した。反応終了後、得られた反応混合物を室温に冷却し、セライト濾過した後、ろ液から減圧下で溶媒を留去した。残渣に飽和食塩水を加え、酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、減圧下で溶媒を留去した。得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、得られた残渣に、10%塩酸(3 mL)を加え、5時間加熱還流した。反応終了後、室温に冷却し、減圧下で溶媒を留去後、標記化合物A39(1.23 g、二段階収率69%)を得た。
工程2
3-(4-メトキシベンジルオキシ)-2,2-ジメチルプロパン酸メチル(化合物A40)
水素化ナトリウム(2.66 g)をTHF(40 mL)に懸濁し、0℃で3-ヒドロキシ-2,2-ジメチルプロパン酸メチル(1.00 g)を少量ずつ加えた後、1時間撹拌し、さらに4-メトキシベンジルクロリド(14.2 g)を加え、室温で終夜撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A40(9.21 g、収率60%)を得た。
工程3
3-(4-メトキシベンジルオキシ)-2,2-ジメチルプロパン酸(化合物A41)
工程2に従って得られた化合物A40 (9.20 g)をエタノール(70 mL)に溶解し、水酸化ナトリウム(6.38 g)および水(78 mL)を加え、終夜加熱還流した。反応終了後、反応混合物から減圧下でエタノールを留去し、水層を混合溶媒(ヘキサン:酢酸エチル=1:1)で洗浄後、水層に2 mol/L塩酸を加えて酸性にし、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、標記化合物A41(6.26 g、収率72%)を得た。
工程4
5-ヒドロキシ-4,4-ジメチル-3-オキソペンタンニトリル(化合物A42)
工程3で得られる化合物A41 (6.40 g)およびシアノ酢酸tert-ブチル(4.60 g)のDMF(5 mL)溶液に、0℃でシアノホスホン酸ジエチル(5.35 g)およびトリエチルアミン(8.15 g)を加え、0℃で2時間撹拌した後、室温で4時間撹拌した。得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をメタノール(30 mL)に溶解し、10%塩酸(30 mL)を加え、4時間加熱還流した。室温に冷却後、得られた反応混合物に水を加え、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A42(2.39 g、二段階収率63%)を得た。
工程5
2-[5-アミノ-1-(ピリジン-3-イル)-1H-ピラゾール-3-イル]-2-メチルプロパン-1-オール(化合物A43)
工程4に従って得られた化合物A42 (200 mg)および工程1に従って得られた化合物A39 (310 mg)をエタノール(3 mL)および水(0.3 mL)に溶解し、濃塩酸(1滴)を加えて終夜加熱還流した。反応終了後、得られた反応混合物を室温に冷却し、飽和炭酸水素ナトリウム水溶液で中和して、クロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し標記化合物A43(198 mg、収率60%)を得た。
工程6
3-[1-(tert-ブチルジメチルシリルオキシ)-2-メチルプロパン-2-イル]-1-(ピリジン-3-イル)-1H-ピラゾール-5-アミン(化合物A44)
工程5に従って得られた化合物A43 (195 mg)をTHF(8 mL)に溶解し、0℃で水素化ナトリウム(50.4 mg)を加え、10分間撹拌後、さらにtert-ブチルジメチルシリルクロリド(232 mg)を加え、室温で終夜撹拌した。得られた反応混合物を0℃に冷却し、水素化ナトリウム(100 mg)を加えて10分間撹拌し、さらにtert-ブチルジメチルシリルクロリド(379 mg)を加え、室温で6時間撹拌した。得られた反応混合物に水を加えてクロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去した。得られた残渣を、ヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A44(237 mg、収率82%)を得た。
参考例14
工程1
4-(4-アミノフェノキシ)-6-メトキシキノリン-7-オール(化合物A45)
WO03/033472の製造例1に従って得られる4-(7-ベンジルオキシ-6-メトキシキノリン-4-イルオキシ)アニリン(20 g)にトリフルオロ酢酸(200 mL)およびメタンスルホン酸(10 mL)を加えて加熱還流下で1.5時間撹拌した。得られた反応混合物から減圧下で溶媒を留去し、得られた残渣に飽和炭酸水素ナトリウム水溶液を加えてpH 9とし、析出した固体をろ取し、減圧下で乾燥して標記化合物A45(7.2 g、収率47%)を得た。
工程2
4-{6-メトキシ-7-[2-(テトラヒドロ-2H-ピラン-2-イルオキシ)エトキシ]キノリン-4-イルオキシ}アニリン(化合物A46)
水素化ナトリウム(8 mg)をDMF(1.7 mL)に懸濁させ、工程1で得られる化合物A45 (50 mg)を加えて0℃で30分間撹拌後、さらに、2-(2-ブロモエトキシ)テトラヒドロ-2H-ピラン(29μL)を加えて室温で終夜撹拌し、50℃で2時間撹拌した。得られた反応混合物に水を加え酢酸エチルで抽出し、有機層を水および飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を分取薄層クロマトグラフィー(クロロホルム:メタノール=20:1)で精製し、標記化合物A46(31 mg、収率42%)を得た。
参考例15
工程1
エチル 2-[4-(4-アミノフェノキシ)-6-メトキシキノリン-7-イルオキシ]アセテート(化合物A47)
参考例14の工程1に従って得られた化合物A45 (100 mg)にDMF(3.5 mL)を加えた後、0℃で水素化ナトリウム(16 mg)およびブロモ酢酸エチル(43 μL)を加えて室温で1 時間撹拌した。得られた反応混合物にメタノールおよび水を加えて反応を停止させ、析出した固体をろ取し、50℃で減圧乾燥して標記化合物A47(66 mg、収率51%)を得た。
工程2
2-[4-(4-アミノフェノキシ)-6-メトキシキノリン-7-イルオキシ]エタノール(化合物A48)
工程1に従って得られた化合物A47 (66 mg)をTHF(4 mL)に溶解し、0℃で水素化アルミニウムリチウム(10.2 mg)を加え、室温で30分間撹拌した。得られた反応混合物に飽和塩化アンモニウム水溶液を加え、セライトろ過した後、ろ液を酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去して標記化合物A48の粗生成物 (84 mg)を得た。
参考例16
工程1
3-イソプロピルチオ-1-フェニル-1H-ピラゾール-5-アミン(化合物A49)
シアノ酢酸tert-ブチル(400 mg)および二硫化炭素(2.02 g)をTHF(2.8 mL)に溶解し、水酸化ナトリウム(232 mg)および水(0.56 mL)の混合溶液を0℃で滴下後、室温で20分間撹拌し、さらに0℃で2-ヨウ化プロピル(0.987 mg)を加え、室温で終夜撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、得られた残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、2-シアノ-3,3-ビス(イソプロピルチオ)アクリル酸tert-ブチルの粗精製物を得た。得られた粗精製物を用いて、参考例10の工程2に準じて5-アミノ-3-イソプロピルチオ-1-フェニル-1H-ピラゾール-4-カルボン酸tert-ブチルの粗生成物を得た。得られた粗生成物に6 mol/L 塩酸(5 mL)を加え、80℃で3時間加熱還流した。反応終了後、氷冷下で得られた反応混合物に炭酸ナトリウム水溶液を加えて塩基性にし、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、残渣をヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製し、標記化合物A49(68.8 mg、3段階収率10%)を得た。
工程2
3-イソプロピルスルホニル-1-フェニル-1H-ピラゾール-5-アミン(化合物A50)
工程1に従って得られた化合物A49 (68.0 mg)をジクロロメタン(10 mL)に溶解し、m-クロロ過安息香酸(148 mg)を少しずつ加え、室温で2時間撹拌した。得られた反応混合物に亜硫酸ナトリウム水溶液および食塩水を加えて反応停止後、酢酸エチルで抽出し、有機層を無水硫酸ナトリウムで乾燥し、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、ヘキサンおよび酢酸エチルを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A50(53.3 mg、収率69%)を得た。
参考例17
工程1
4-(6-ブロモピリジン-3-イルオキシ)-6,7-ジメトキシキノリン(化合物A51)
ジャーナル・オブ・メディシナル・ケミストリー(J. Med. Chem.) 2006,49,2186-2192に従って得られる4-クロロ-6,7-ジメトキシキノリン(1.12 g)をクロロベンゼン(50 mL)に溶解し、6-ブロモピリジン-3-オール(1.74 g)およびジメチルアミノピリジン(1.83 g)を加え、100℃で終夜撹拌した。反応終了後、得られた反応混合物から減圧下で溶媒を留去し、得られた残渣をクロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A51(1.57 g、収率87%)を得た。
工程2
5-(6,7-ジメトキシキノリン-4-イルオキシ)ピリジン-2-アミン(化合物A52)
工程1に従って得られた化合物A51 (1.57 g)、ジベンジリデンアセトンパラジウム(201 mg)およびジフェニル-2-イルジシクロヘキシルホスフィン(182 mg)に、リチウムヘキサメチルジシラジド(1.0 mol/L THF溶液、6.5 mL)を加え、65℃で2時間撹拌した。得られた反応混合物に1 mol/L 塩酸(25 mL)を加え、室温で5分間撹拌して反応を停止させ、続いて1 mol/L水酸化ナトリウム水溶液を加えて中性にし、クロロホルムで抽出し、有機層を無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去し、得られた残渣を、クロロホルムおよびメタノールを展開溶媒とするシリカゲルカラムクロマトグラフィーで精製することにより、標記化合物A52(1.29 g、収率100%)を得た。
参考例18
3-クロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(化合物A53)
DMSO(10 mL)に水素化ナトリウム(60重量%, 0.72 g)を加え、50℃で20分間撹拌後、4-アミノ-2-クロロフェノール塩酸塩(1.61g)を加え、室温で10分間撹拌した。得られた反応混合物に4-クロロ-6,7-ジメトキシキノリン(1.00 g)を加え100℃で一晩撹拌し、水を加えクロロホルムで抽出後、有機層を飽和炭酸水素ナトリウム水溶液で洗浄し、無水硫酸ナトリウムで乾燥後、ろ過を行い、ろ液から減圧下で溶媒を留去した。得られた残渣にメタノールを加え、析出した固体をろ取して標記化合物A53(0.80 g、収率60%)を得た。
ESI-MS: m/z 332[M+H]+
参考例19
5-tert-ブチル-1H-ピラゾール-3-カルボン酸(化合物A54)
参考例1に準じて、エチル 5,5-ジメチル-2,4-ジオキソヘキサノエートおよびヒドラジン塩酸塩から標記化合物A54(収率84%)を得た。
参考例20
5-イソプロピル-1-メチル-1H-ピラゾール-3-カルボン酸(化合物A55)
参考例1に準じて、エチル 5-メチル-2,4-ジオキソヘキサノエートおよびメチルヒドラジン硫酸塩から標記化合物A55(収率63%)を得た。
参考例21
2,3-ジメチル-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(化合物A56)
参考例18に準じて、4-アミノ-2,3-ジメチルフェノールおよび4-クロロ-6,7-ジメトキシキノリンから標記化合物A56(収率55%)を得た。
参考例22
3,5-ジクロロ-4-(6,7-ジメトキシキノリン-4-イルオキシ)アニリン(化合物A57)
参考例18に準じて、4-アミノ-3,5-ジクロロフェノールおよび4-クロロ-6,7-ジメトキシキノリンから標記化合物A57(収率21%)を得た。
本発明により、例えば、FGFR阻害作用等を有し、FGFRが関与する疾患(例えば、胃がん、子宮内膜がん、下垂体腫瘍、骨髄増殖性疾患、腎がん、膀胱がん、大腸がん、頭頸部がん、皮膚がん、非ホジキンリンパ腫、脳腫瘍、乳がん、卵巣がん、多発性骨髄腫、骨肉腫、ウイルス感染、全身性エリテマトーデス等の自己免疫疾患、関節リウマチ、肝炎、腎疾患等)の治療および/または予防に有用な含窒素芳香族複素環誘導体またはその薬学的に許容される塩等が提供される。
Claims (32)
- 式(I)
Wは、CR3(式中、R3は、水素原子、低級アルコキシ、またはハロゲンを表す)、または窒素原子を表し、
R4およびR5は、同一または異なって、水素原子、またはハロゲンを表し、
R9は、置換基を有していてもよいピラゾリル、または、置換基を有していてもよいイソオキサゾリルを表し、
R12およびR13は、同一または異なって、水素原子、または低級アルキルを表す]
で表される含窒素芳香族複素環誘導体(ただし、N-[2-クロロ-4-(6,7-ジメトキシ-4-キノリルオキシ)フェニル]-N’-(5-メチル-3-イソオキサゾリル)ウレアを除く)
またはその薬学的に許容される塩を有効成分として含有する繊維芽細胞増殖因子受容体(FGFR) 阻害剤。 - R5が水素原子である請求項1記載の繊維芽細胞増殖因子受容体阻害剤。
- R1およびR2が、同一または異なって、置換基を有していてもよい低級アルコキシである請求項1または2記載の繊維芽細胞増殖因子受容体阻害剤。
- WがCR3(式中、R3は、前記と同義である)である請求項1~3のいずれかに記載の繊維芽細胞増殖因子受容体阻害剤。
- R9が、置換基を有していてもよいピラゾリルである請求項1~4のいずれかに記載の繊維芽細胞増殖因子受容体阻害剤。
- R12およびR13が水素原子である請求項1~5のいずれかに記載の繊維芽細胞増殖因子受容体阻害剤。
- 式(I-1)
WAは、CR3A(式中R3Aは、水素原子、低級アルコキシ、またはハロゲンを表す)または窒素原子を表し、
R4AおよびR5Aは、同一または異なって、水素原子、またはハロゲンを表し、
R9Aは、置換ピラゾリル(ただし、1-メチル-1H-ピラゾール-5-イル、および1,3-ジメチル-1H-ピラゾール-5-イルは除く)、または、置換イソオキサゾリル(該置換イソオキサゾリルにおける置換基は、同一または異なって、置換基を有していてもよい炭素数2以上の低級アルキルである)を表し、
R12AおよびR13Aは、同一または異なって、水素原子、または低級アルキルを表す]で表される含窒素芳香族複素環誘導体またはその薬学的に許容される塩。 - R1AおよびR2Aが、同一または異なって、置換基を有していてもよい低級アルコキシである請求項7記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
- WAが、CR3A(式中、R3Aは、前記と同義である)である請求項7または8記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
- R9Aが、置換ピラゾリル(ただし、1-メチル-1H-ピラゾール-5-イル、および1,3-ジメチル-1H-ピラゾール-5-イルは除く)である請求項7~9のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
- R9Aが、式(II)
Z1は、C-R28(式中、R28は、置換基を有していてもよい炭素数2以上の低級アルキル、低級アルキルスルファニル、低級アルキルスルフィニル、低級アルキルスルホニル、置換基を有していてもよいシクロアルキル、脂肪族複素環基を表す)、またはN-R29(式中、R29は、炭素数2以上の低級アルキルを表す)を表し、
Z2は、酸素原子、窒素原子、またはN-R27(式中、R27は、水素原子、低級アルキル、またはシクロアルキルを表す)を表し、
Z3は、窒素原子、N-R30(式中、R30は、低級アルキル、置換基を有していてもよいアリール、または置換基を有していてもよい芳香族複素環基を表す)またはCHを表し、
R31は、水素原子、または低級アルキルを表し、
(1) Z1がC-R28(式中、R28は、前記と同義である)であるとき、
(1-1) Z2が酸素原子であり、Z3が窒素原子であるか、
(1-2) Z2が窒素原子であり、Z3がN-R30(式中、R30は、前記と同義である)であるか、
(1-3) Z2がN-R27(式中、R27は、前記と同義である)であり、Z3が窒素原子であるか、
(2) Z1がN-R29(式中、R29は、前記と同義である)であるとき、
Z2が窒素原子であり、Z3がCHである]
で表される請求項7~9のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。 - Z1がC-R28A(式中、R28Aは、置換基を有していてもよい炭素数2以上の低級アルキルを表す)であり、Z2が窒素原子であり、Z3がN-R30(式中、R30は、前記と同義である)である請求項11記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
- Z1がC-R28A(式中、R28Aは、前記と同義である)であり、
Z2が窒素原子であり、Z3がN-R30A(式中、R30Aは、置換基を有していてもよいアリール、または置換基を有していてもよい芳香族複素環基を表す)である請求項11記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。 - R31が水素原子である請求項11~13のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
- R12AおよびR13Aが、水素原子である請求項7~14のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
- 請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する医薬。
- 請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する繊維芽細胞増殖因子受容体阻害剤。
- 請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する繊維芽細胞増殖因子受容体が関与する疾患の治療および/または予防剤。
- 請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する抗腫瘍剤。
- 請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩を有効成分として含有する胃癌の治療および/または予防剤。
- 請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含む繊維芽細胞増殖因子受容体阻害方法。
- 請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含む繊維芽細胞増殖因子受容体が関与する疾患の治療および/または予防方法。
- 請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含む癌の治療および/または予防方法。
- 請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の有効量を投与する工程を含む胃癌の治療および/または予防方法。
- 繊維芽細胞増殖因子受容体阻害剤の製造のための請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
- 繊維芽細胞増殖因子受容体が関与する疾患の治療および/または予防剤の製造のための請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
- 抗腫瘍剤の製造のための請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
- 胃癌の治療および/または予防剤の製造のための請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩の使用。
- 繊維芽細胞増殖因子受容体阻害に使用するための請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
- 繊維芽細胞増殖因子受容体が関与する疾患の治療および/または予防に使用するための請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
- 癌の治療および/または予防に使用するための請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
- 胃癌の治療および/または予防に使用するための請求項7~15のいずれかに記載の含窒素芳香族複素環誘導体またはその薬学的に許容される塩。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/JP2011/066186 WO2012008564A1 (ja) | 2010-07-16 | 2011-07-15 | 含窒素芳香族複素環誘導体 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010-161272 | 2010-07-16 | ||
| JP2010161272 | 2010-07-16 | ||
| PCT/JP2011/066186 WO2012008564A1 (ja) | 2010-07-16 | 2011-07-15 | 含窒素芳香族複素環誘導体 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2012008564A1 true WO2012008564A1 (ja) | 2012-01-19 |
Family
ID=49651712
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2011/066186 Ceased WO2012008564A1 (ja) | 2010-07-16 | 2011-07-15 | 含窒素芳香族複素環誘導体 |
Country Status (1)
| Country | Link |
|---|---|
| WO (1) | WO2012008564A1 (ja) |
Cited By (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9120789B2 (en) | 2010-02-01 | 2015-09-01 | Cancer Research Technology Limited | 1-(5-tert-butyl-2-phenyl-2H-pyrazol-3-yl)-3-[2-fluoro-4-(1-methyl-2-oxo-2,3-dihydro-1H-imidazo[4,5-b]pyridin-7-yloxy)-phenyl]-urea and related compounds and their use in therapy |
| US9133162B2 (en) | 2011-02-28 | 2015-09-15 | Sunshine Lake Pharma Co., Ltd. | Substituted quinoline compounds and methods of use |
| US9155737B2 (en) | 2007-12-19 | 2015-10-13 | Institute Of Cancer Research: Royal Cancer Hospital (The) | Pyrido[2,3-B]pyrazin-8-substituted compounds and their use |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| JP2016513108A (ja) * | 2013-02-15 | 2016-05-12 | カラ ファーマシューティカルズ インコーポレイテッド | 治療用化合物およびその使用 |
| US9388185B2 (en) | 2012-08-10 | 2016-07-12 | Incyte Holdings Corporation | Substituted pyrrolo[2,3-b]pyrazines as FGFR inhibitors |
| US9533954B2 (en) | 2010-12-22 | 2017-01-03 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of FGFR3 |
| US9533984B2 (en) | 2013-04-19 | 2017-01-03 | Incyte Holdings Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US9580423B2 (en) | 2015-02-20 | 2017-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US9611267B2 (en) | 2012-06-13 | 2017-04-04 | Incyte Holdings Corporation | Substituted tricyclic compounds as FGFR inhibitors |
| US9708317B2 (en) | 2013-11-25 | 2017-07-18 | Cancer Research Technology Limited | Process for the preparation of 8-(4-aminophenoxy)-4H-pyrido[2,3-B]pyrazin-3-one derivatives |
| US9708318B2 (en) | 2015-02-20 | 2017-07-18 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US9725447B2 (en) | 2013-11-25 | 2017-08-08 | Cancer Research Technology Limited | 1-(5-tert-butyl-2-aryl-pyrazol-3-yl)-3-[2-fluoro-4-[(3-oxo-4H-pyrido[2,3-b]pyrazin-8-yl)oxy]phenyl]urea derivatives as RAF inhibitors for the treatment of cancer |
| US9890156B2 (en) | 2015-02-20 | 2018-02-13 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| WO2018028591A1 (zh) * | 2016-08-09 | 2018-02-15 | 殷建明 | 一种喹啉衍生物及其用途 |
| WO2018137610A1 (zh) * | 2017-01-24 | 2018-08-02 | 四川大学 | 取代的1-(异恶唑-3-基)-3-(3-氟-4-苯基)脲衍生物及其制备方法和用途 |
| US10611762B2 (en) | 2017-05-26 | 2020-04-07 | Incyte Corporation | Crystalline forms of a FGFR inhibitor and processes for preparing the same |
| WO2020188015A1 (en) | 2019-03-21 | 2020-09-24 | Onxeo | A dbait molecule in combination with kinase inhibitor for the treatment of cancer |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| WO2021089791A1 (en) | 2019-11-08 | 2021-05-14 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for the treatment of cancers that have acquired resistance to kinase inhibitors |
| WO2021148581A1 (en) | 2020-01-22 | 2021-07-29 | Onxeo | Novel dbait molecule and its use |
| US11174257B2 (en) | 2018-05-04 | 2021-11-16 | Incyte Corporation | Salts of an FGFR inhibitor |
| US11407750B2 (en) | 2019-12-04 | 2022-08-09 | Incyte Corporation | Derivatives of an FGFR inhibitor |
| US11466004B2 (en) | 2018-05-04 | 2022-10-11 | Incyte Corporation | Solid forms of an FGFR inhibitor and processes for preparing the same |
| US11566028B2 (en) | 2019-10-16 | 2023-01-31 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US11607416B2 (en) | 2019-10-14 | 2023-03-21 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US11628162B2 (en) | 2019-03-08 | 2023-04-18 | Incyte Corporation | Methods of treating cancer with an FGFR inhibitor |
| US11897891B2 (en) | 2019-12-04 | 2024-02-13 | Incyte Corporation | Tricyclic heterocycles as FGFR inhibitors |
| US11939331B2 (en) | 2021-06-09 | 2024-03-26 | Incyte Corporation | Tricyclic heterocycles as FGFR inhibitors |
| US12012409B2 (en) | 2020-01-15 | 2024-06-18 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US12065494B2 (en) | 2021-04-12 | 2024-08-20 | Incyte Corporation | Combination therapy comprising an FGFR inhibitor and a Nectin-4 targeting agent |
| US12122767B2 (en) | 2019-10-01 | 2024-10-22 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US12428420B2 (en) | 2021-06-09 | 2025-09-30 | Incyte Corporation | Tricyclic heterocycles as FGFR inhibitors |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003033472A1 (en) * | 2001-10-17 | 2003-04-24 | Kirin Beer Kabushiki Kaisha | Quinoline or quinazoline derivatives inhibiting auto- phosphorylation of fibroblast growth factor receptors |
| WO2008093855A1 (ja) * | 2007-01-29 | 2008-08-07 | Eisai R & D Management Co., Ltd. | 未分化型胃癌治療用組成物 |
| JP2009500295A (ja) * | 2005-07-05 | 2009-01-08 | 武田薬品工業株式会社 | 縮合複素環誘導体およびその用途 |
| JP2009518298A (ja) * | 2005-12-01 | 2009-05-07 | バイエル ヘルスケア リミティド ライアビリティ カンパニー | 癌治療に有用な尿素化合物 |
| JP2010065041A (ja) * | 1997-12-22 | 2010-03-25 | Bayer Corp | 置換複素環式尿素を用いたrafキナーゼの阻害 |
-
2011
- 2011-07-15 WO PCT/JP2011/066186 patent/WO2012008564A1/ja not_active Ceased
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010065041A (ja) * | 1997-12-22 | 2010-03-25 | Bayer Corp | 置換複素環式尿素を用いたrafキナーゼの阻害 |
| WO2003033472A1 (en) * | 2001-10-17 | 2003-04-24 | Kirin Beer Kabushiki Kaisha | Quinoline or quinazoline derivatives inhibiting auto- phosphorylation of fibroblast growth factor receptors |
| JP2009500295A (ja) * | 2005-07-05 | 2009-01-08 | 武田薬品工業株式会社 | 縮合複素環誘導体およびその用途 |
| JP2009518298A (ja) * | 2005-12-01 | 2009-05-07 | バイエル ヘルスケア リミティド ライアビリティ カンパニー | 癌治療に有用な尿素化合物 |
| WO2008093855A1 (ja) * | 2007-01-29 | 2008-08-07 | Eisai R & D Management Co., Ltd. | 未分化型胃癌治療用組成物 |
Cited By (69)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9155737B2 (en) | 2007-12-19 | 2015-10-13 | Institute Of Cancer Research: Royal Cancer Hospital (The) | Pyrido[2,3-B]pyrazin-8-substituted compounds and their use |
| US9540372B2 (en) | 2007-12-19 | 2017-01-10 | Institute Of Cancer Research: Royal Cancer Hospital (The) | Pyrido[2,3-b]pyrazin-8-substituted compounds and their use |
| US9120789B2 (en) | 2010-02-01 | 2015-09-01 | Cancer Research Technology Limited | 1-(5-tert-butyl-2-phenyl-2H-pyrazol-3-yl)-3-[2-fluoro-4-(1-methyl-2-oxo-2,3-dihydro-1H-imidazo[4,5-b]pyridin-7-yloxy)-phenyl]-urea and related compounds and their use in therapy |
| US9820976B2 (en) | 2010-02-01 | 2017-11-21 | Cancer Research Technology Limited | 1-(5-tert-butyl-2-phenyl-2H-pyrazol-3-yl)-3-[2-fluoro-4-(1-methyl-2-oxo-2,3-dihydro-1H-imidazo[4,5-b]pyridin-7-yloxy)-phenyl]-urea and related compounds and their use in therapy |
| US9439893B2 (en) | 2010-02-01 | 2016-09-13 | Cancer Research Technology Limited | 1-(5-tert-butyl-2-phenyl-2H-pyrazol-3-yl)-3-[2-fluoro-4-(1-methyl-2-oxo-2,3-dihydro-1H-imidazo[4,5-B]pyridin-7-yloxy)-phenyl]-urea and related compounds and their use in therapy |
| US9533954B2 (en) | 2010-12-22 | 2017-01-03 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of FGFR3 |
| US10813930B2 (en) | 2010-12-22 | 2020-10-27 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of FGFR3 |
| US10213427B2 (en) | 2010-12-22 | 2019-02-26 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of FGFR3 |
| US9598400B2 (en) | 2011-02-28 | 2017-03-21 | Calitor Sciences, Llc | Substituted quinoline compounds and methods of use |
| US9133162B2 (en) | 2011-02-28 | 2015-09-15 | Sunshine Lake Pharma Co., Ltd. | Substituted quinoline compounds and methods of use |
| US10131667B2 (en) | 2012-06-13 | 2018-11-20 | Incyte Corporation | Substituted tricyclic compounds as FGFR inhibitors |
| US11840534B2 (en) | 2012-06-13 | 2023-12-12 | Incyte Corporation | Substituted tricyclic compounds as FGFR inhibitors |
| US9611267B2 (en) | 2012-06-13 | 2017-04-04 | Incyte Holdings Corporation | Substituted tricyclic compounds as FGFR inhibitors |
| US11053246B2 (en) | 2012-06-13 | 2021-07-06 | Incyte Corporation | Substituted tricyclic compounds as FGFR inhibitors |
| US9388185B2 (en) | 2012-08-10 | 2016-07-12 | Incyte Holdings Corporation | Substituted pyrrolo[2,3-b]pyrazines as FGFR inhibitors |
| US9745311B2 (en) | 2012-08-10 | 2017-08-29 | Incyte Corporation | Substituted pyrrolo[2,3-b]pyrazines as FGFR inhibitors |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| US20160237093A1 (en) * | 2013-02-15 | 2016-08-18 | Kala Pharmaceuticals, Inc. | Therapeutic compounds and uses thereof |
| US9877970B2 (en) * | 2013-02-15 | 2018-01-30 | Kala Pharmaceuticals, Inc. | Therapeutic compounds and uses thereof |
| US10398703B2 (en) | 2013-02-15 | 2019-09-03 | Kala Pharmaceuticals, Inc. | Therapeutic compounds and uses thereof |
| JP2016513108A (ja) * | 2013-02-15 | 2016-05-12 | カラ ファーマシューティカルズ インコーポレイテッド | 治療用化合物およびその使用 |
| US10947230B2 (en) | 2013-04-19 | 2021-03-16 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US11530214B2 (en) | 2013-04-19 | 2022-12-20 | Incyte Holdings Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US9533984B2 (en) | 2013-04-19 | 2017-01-03 | Incyte Holdings Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US10450313B2 (en) | 2013-04-19 | 2019-10-22 | Incyte Holdings Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US10040790B2 (en) | 2013-04-19 | 2018-08-07 | Incyte Holdings Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US9725447B2 (en) | 2013-11-25 | 2017-08-08 | Cancer Research Technology Limited | 1-(5-tert-butyl-2-aryl-pyrazol-3-yl)-3-[2-fluoro-4-[(3-oxo-4H-pyrido[2,3-b]pyrazin-8-yl)oxy]phenyl]urea derivatives as RAF inhibitors for the treatment of cancer |
| US10100053B2 (en) | 2013-11-25 | 2018-10-16 | Cancer Research Technology Limited | Process for the preparation of 8-(4-aminophenoxy)-4H-pyrido[2,3-b]pyrazin-3-one derivatives |
| US10167282B2 (en) | 2013-11-25 | 2019-01-01 | Cancer Research Technology Limited | 1-(5-tert-butyl-2-aryl-pyrazol-3-yl)-3-[2-fluoro-4-[(3-oxo-4H-pyrido [2, 3-B]pyrazin- 8-yl)oxy]phenyl]urea derivatives as RAF inhibitors for the treatment of cancer |
| US9708317B2 (en) | 2013-11-25 | 2017-07-18 | Cancer Research Technology Limited | Process for the preparation of 8-(4-aminophenoxy)-4H-pyrido[2,3-B]pyrazin-3-one derivatives |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US11667635B2 (en) | 2015-02-20 | 2023-06-06 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US11014923B2 (en) | 2015-02-20 | 2021-05-25 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US9890156B2 (en) | 2015-02-20 | 2018-02-13 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US11173162B2 (en) | 2015-02-20 | 2021-11-16 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US10016438B2 (en) | 2015-02-20 | 2018-07-10 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US10632126B2 (en) | 2015-02-20 | 2020-04-28 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US9708318B2 (en) | 2015-02-20 | 2017-07-18 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US10738048B2 (en) | 2015-02-20 | 2020-08-11 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US9580423B2 (en) | 2015-02-20 | 2017-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US10251892B2 (en) | 2015-02-20 | 2019-04-09 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US10214528B2 (en) | 2015-02-20 | 2019-02-26 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US9801889B2 (en) | 2015-02-20 | 2017-10-31 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US10689361B2 (en) | 2016-08-09 | 2020-06-23 | Jianming Yin | Quinoline derivative and use thereof |
| WO2018028591A1 (zh) * | 2016-08-09 | 2018-02-15 | 殷建明 | 一种喹啉衍生物及其用途 |
| CN107698562A (zh) * | 2016-08-09 | 2018-02-16 | 殷建明 | 一种喹啉衍生物及其用途 |
| WO2018137610A1 (zh) * | 2017-01-24 | 2018-08-02 | 四川大学 | 取代的1-(异恶唑-3-基)-3-(3-氟-4-苯基)脲衍生物及其制备方法和用途 |
| US11472801B2 (en) | 2017-05-26 | 2022-10-18 | Incyte Corporation | Crystalline forms of a FGFR inhibitor and processes for preparing the same |
| US10611762B2 (en) | 2017-05-26 | 2020-04-07 | Incyte Corporation | Crystalline forms of a FGFR inhibitor and processes for preparing the same |
| US11466004B2 (en) | 2018-05-04 | 2022-10-11 | Incyte Corporation | Solid forms of an FGFR inhibitor and processes for preparing the same |
| US11174257B2 (en) | 2018-05-04 | 2021-11-16 | Incyte Corporation | Salts of an FGFR inhibitor |
| US12473286B2 (en) | 2018-05-04 | 2025-11-18 | Incyte Corporation | Salts of an FGFR inhibitor |
| US12024517B2 (en) | 2018-05-04 | 2024-07-02 | Incyte Corporation | Salts of an FGFR inhibitor |
| US11628162B2 (en) | 2019-03-08 | 2023-04-18 | Incyte Corporation | Methods of treating cancer with an FGFR inhibitor |
| WO2020188015A1 (en) | 2019-03-21 | 2020-09-24 | Onxeo | A dbait molecule in combination with kinase inhibitor for the treatment of cancer |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US12122767B2 (en) | 2019-10-01 | 2024-10-22 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US11607416B2 (en) | 2019-10-14 | 2023-03-21 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US12083124B2 (en) | 2019-10-14 | 2024-09-10 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| US11566028B2 (en) | 2019-10-16 | 2023-01-31 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| WO2021089791A1 (en) | 2019-11-08 | 2021-05-14 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for the treatment of cancers that have acquired resistance to kinase inhibitors |
| US11407750B2 (en) | 2019-12-04 | 2022-08-09 | Incyte Corporation | Derivatives of an FGFR inhibitor |
| US11897891B2 (en) | 2019-12-04 | 2024-02-13 | Incyte Corporation | Tricyclic heterocycles as FGFR inhibitors |
| US12168660B2 (en) | 2019-12-04 | 2024-12-17 | Incyte Corporation | Derivatives of an FGFR inhibitor |
| US12012409B2 (en) | 2020-01-15 | 2024-06-18 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| WO2021148581A1 (en) | 2020-01-22 | 2021-07-29 | Onxeo | Novel dbait molecule and its use |
| US12065494B2 (en) | 2021-04-12 | 2024-08-20 | Incyte Corporation | Combination therapy comprising an FGFR inhibitor and a Nectin-4 targeting agent |
| US11939331B2 (en) | 2021-06-09 | 2024-03-26 | Incyte Corporation | Tricyclic heterocycles as FGFR inhibitors |
| US12428420B2 (en) | 2021-06-09 | 2025-09-30 | Incyte Corporation | Tricyclic heterocycles as FGFR inhibitors |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2012008564A1 (ja) | 含窒素芳香族複素環誘導体 | |
| JP5789259B2 (ja) | 含窒素芳香族複素環誘導体 | |
| JP6768857B2 (ja) | リジン特異的なデメチラーゼ−1の阻害剤 | |
| JP6833896B2 (ja) | リジン特異的なデメチラーゼ−1の阻害剤 | |
| JP5820882B2 (ja) | キナーゼインヒビターとしてのキノリン及びキノキサリン誘導体 | |
| JP6256771B2 (ja) | ヒストンデメチラーゼ阻害剤 | |
| JP4395823B2 (ja) | アリール及びヘテロアリール置換複素環式尿素を用いたrafキナーゼの阻害 | |
| WO2021087018A1 (en) | Pyridazinones as parp7 inhibitors | |
| JP2025522631A (ja) | Prmt5阻害剤及びその使用 | |
| JP2009511557A (ja) | 癌の処置のためのピリミジン誘導体 | |
| CA2903081A1 (en) | Histone demethylase inhibitors | |
| JP2002544194A (ja) | Mek酵素の阻害剤としてのキノリン誘導体 | |
| WO2012044090A2 (ko) | 단백질 키나제 억제 활성을 갖는 신규한 아미노퀴나졸린 화합물 | |
| CN102802419A (zh) | 刺猬(hedgehog)抑制剂 | |
| US20120309786A1 (en) | 3-amino-pyridine derivatives for the treatment of metabolic disorders | |
| EP3760633A1 (en) | Oxazino-quinazoline and oxazino-quinazoline type compound, preparation method therefor, and uses thereof | |
| WO2011093365A1 (ja) | 含窒素複素環化合物 | |
| JP4834441B2 (ja) | ピリミジニルアルキルチオ基を有する新規環式化合物 | |
| TW202517630A (zh) | 新穎苯并咪唑吡啶衍生物 | |
| US20230406838A1 (en) | Mutant selective egfr inhibitors and methods of use thereof | |
| HK1184447A (en) | Nitrogenated aromatic heterocyclic ring derivative |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 11806894 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 11806894 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: JP |