WO2008009841A1 - Nouveaux composes odorants, procede de synthese et utilisations - Google Patents
Nouveaux composes odorants, procede de synthese et utilisations Download PDFInfo
- Publication number
- WO2008009841A1 WO2008009841A1 PCT/FR2007/051627 FR2007051627W WO2008009841A1 WO 2008009841 A1 WO2008009841 A1 WO 2008009841A1 FR 2007051627 W FR2007051627 W FR 2007051627W WO 2008009841 A1 WO2008009841 A1 WO 2008009841A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- compound
- general formula
- cycle
- chain
- absent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C47/00—Compounds having —CHO groups
- C07C47/02—Saturated compounds having —CHO groups bound to acyclic carbon atoms or to hydrogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C31/00—Saturated compounds having hydroxy or O-metal groups bound to acyclic carbon atoms
- C07C31/02—Monohydroxylic acyclic alcohols
- C07C31/125—Monohydroxylic acyclic alcohols containing five to twenty-two carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C33/00—Unsaturated compounds having hydroxy or O-metal groups bound to acyclic carbon atoms
- C07C33/02—Acyclic alcohols with carbon-to-carbon double bonds
- C07C33/025—Acyclic alcohols with carbon-to-carbon double bonds with only one double bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/49—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reaction with carbon monoxide
- C07C45/50—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reaction with carbon monoxide by oxo-reactions
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C47/00—Compounds having —CHO groups
- C07C47/20—Unsaturated compounds having —CHO groups bound to acyclic carbon atoms
- C07C47/21—Unsaturated compounds having —CHO groups bound to acyclic carbon atoms with only carbon-to-carbon double bonds as unsaturation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/003—Esters of saturated alcohols having the esterified hydroxy group bound to an acyclic carbon atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/007—Esters of unsaturated alcohols having the esterified hydroxy group bound to an acyclic carbon atom
Definitions
- the present invention relates to novel odorant compounds which can be used in perfumery.
- the invention relates in particular to new aldehydes, the corresponding alcohols, esters and ethers, their synthesis process and their uses in perfumery.
- perfumery is used here to refer not only perfumery in the usual sense of the term, but also other areas in which the smell of products is important. It may be perfume compositions in the usual sense of the term, such as perfume bases and concentrates, colognes, toilet waters, perfumes and similar products; topical compositions - in particular cosmetics - such as creams for the face and body, talcum powder, hair oils, shampoos, hair lotions, bath salts and oils, shower and bath gels, toilet soaps, anti- body perspirants and deodorants, shaving lotions and creams, soaps, creams, dentifrices, mouthwashes, ointments, and the like; and cleaning products, such as fabric softeners, detergents, detergents, room deodorants, and the like.
- Aldehydes are one of the major families of odorous molecules used in perfumery. In this family, aldehydes having between eight and twelve carbon atoms play an important role. Among these aldehydes are terpenic aldehydes, which have floral scents. There are also linear aldehydes, derived from fatty acids, which have fresh notes, typical of fruits of the citrus family. The Applicant has recently described in the patent application FR 05 00551, compounds that can be used as odorants thanks to their fresh notes, orange zest and herbaceous accents of coriander leaf, including 6,8-dimethyl-non-7-enal .
- the new odorants described in the present application thus allow to extend the range of notes that can be made to a composition.
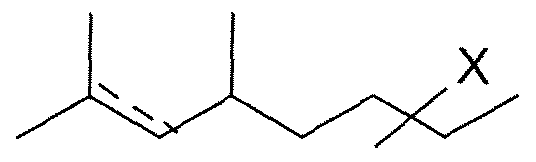
- X is CHO, CH 2 OH, CH 2 OR, CH 2 OC (O) R or CH (OR 1 ) (OR 2 ), and
- R, R 1, R 2 each represent an alkyl or alkenyl chain having 1, 2, 3, 4, 5 or 6 carbon atoms, said chain being linear or branched, or R 1 and R 2 may together form a ring, preferably a ring; at 5 or 6 atoms, and the dotted bond is present or absent, excluding the compound of the following formula wherein X is a CH 2 OH group and the dotted bond is absent.
- the compounds of the invention, in particular compounds of formula (I) may be present in the form of an isomer or of a mixture of isomers, in particular an enantiomer or a mixture of one enantiomer, or a racemic mixture, or a diastereoisomer or a mixture of diastereoisomers.
- the subject of the present invention is a compound corresponding to the general formula (II) below
- X is CHO, CH 2 OH, CH 2 OR, CH 2 OC (O) R or
- R f R A R 2 each represents an alkyl or alkenyl chain having 1, 2, 3, 4, 5 or 6 carbon atoms, said chain being linear or branched, or R and R 2 may together form a ring, preferably a ring at 5 or 6 atoms, and the dotted bond is present or absent.
- the present invention relates to a compound which is 2,5,7-trimethyl-oct-6-enal having the formula (IIa) below
- the compound of formula (IIa) may be present in the form of an isomer or a mixture of isomers, in particular an enantiomer or a mixture of enantiomers, or a racemic mixture, or of a diastereoisomer or a mixture of diastereoisomers.
- the compound of formula (IIa) may have several optical isomers such as 2 (R), 5 (R), 7-trimethyl-oct-6-enal, 2 (S), 5 (R), 7-trimethyl- oct- ⁇ -enal, 2 (R), 5 (S), 7-trimethyl-oct-6-enal and 2 (S), 5 (S), 7-trimethyl-oct-6-enal.
- the present invention also relates to another compound of formula (II 'a), 2,5,7-trimethyloctanal, that is to say the compound of formula (II) where the dotted bond is absent and X represents a CHO group.
- the subject of the present invention is also the unsaturated alcohol (Hb) and the saturated alcohol (II'b) derived from the compounds of formula (IIa) and (II 'a).
- the alcohols (Hb) and (II'b) of the present invention can be readily prepared by reducing the compounds of formula (IIa) under conditions well known to those skilled in the art.
- the unsaturated alcohol (Hb) is obtained by selective reduction of the aldehyde function of (IIa) by a reducing agent.
- a reducing agent such as sodium borohydride (NaBH 4 ) and saturated alcohol (II 'b) is synthesized by reducing the aldehyde function as well as the CC double bond of the compound (IIa) by hydrogen in the presence of a catalyst of the type in particular palladium on carbon or Raney nickel.
- the saturated aldehyde (II 'a) of the present invention can be prepared by oxidation of (II' b) according to methods well known to those skilled in the art such as, for example, by the Corey reagent (CrO3 / Pyridine / HCl).
- the present invention also relates to unsaturated (Ile) and saturated (II 'c) esters derived from alcohols
- R represents an alkyl or alkenyl chain having 1, 2, 3, 4, 5 or 6 carbon atoms, linear or branched and the dotted bond is present (Ile) or absent (II 'c )
- said OC (O) R ester group being preferably an acetate, propionate, butyrate, isobutyrate, pentanoate, 2-methyl-butyrate, 3-methyl-butyrate, hexanoate, 2-methylpentanoate, 3-methyl pentanoate group; , 4-methyl-pentanoate, 2,2-dimethyl-butyrate, 2,3-dimethyl-butyrate, 3,3-dimethyl-butyrate, 2-butenoate, 2-methyl-2-butenoate, 2-methyl-2-butenyl and 3-hexenyl.
- the present invention relates in particular to esters of 2,5,7-trimethyl-oct-6-en-1-ol (Hb) and esters.
- 2,5-7-trimethyl-oct-6-an-1-ol (II 'b) preferably acetate, propionate, butyrate, isobutyrate, pentanoate, 2-methyl-butyrate, 3-methyl-butyrate, hexanoate, 2-methylpentanoate, 3-methyl pentanoate, 4-methyl pentanoate, 2,2-dimethyl butyrate, 2,3-dimethyl butyrate, 3,3-dimethyl butyrate, 2-butenoate, 2 2-methyl-2-butenoate, and 2,5,7-trimethyl-oct-6-en-1-ol (Hb) or 2,5,7-trimethyl-oct-6-en-1-3-hexenoate; ol (Il'b).
- esters (IIc) and (II 'c) of the present invention may be respectively prepared from the alcohols (Hb) and (II'b), in particular by esterification of the acids or acyl chlorides having 1, 2, 3, 4, 5 or 6 linear or branched carbon atoms suitable, according to conditions well known to those skilled in the art.
- the present invention also relates to the ethers of general formula (I) in which X is CH 2 OR, R being preferably chosen from an ethyl, propyl, butyl, isobutyl, pentyl, 2-methyl-butyl or 3-methyl-butyl group.
- the invention relates to ethers of 2,5,7-trimethyl-oct-6-en-1-ol (Hb) and ethers of 2,5,7-trimethyloct-6-en-1-ol. (He b).
- the present invention also relates to a compound of general formula (I), corresponding to general formula (III) below wherein X is CHO, CH 2 OH, CH 2 OR, CH 2 OC (O) R or CH (OR 1 ) (OR 2 ), and Rf RiA R2 each represent an alkyl or alkenyl chain having 1, 2, 3, 4, 5 or 6 carbon atoms, said chain being linear or branched, or R 1 and R 2 may together form a ring, preferentially a ring at 5 or 6 atoms, and the dotted bond is present or absent, excluding the compound of the following formula wherein X is a CH 2 OH group and the dotted bond is absent.
- general formula (I) corresponding to general formula (III) below wherein X is CHO, CH 2 OH, CH 2 OR, CH 2 OC (O) R or CH (OR 1 ) (OR 2 ), and Rf RiA R2 each represent an alkyl or alkenyl chain having 1, 2, 3, 4, 5 or 6 carbon atoms
- the subject of the present invention is a compound having the formula (IIIa) below, which is 2-ethyl-4,6-dimethyl-hept-5-enal
- the present invention also relates to a compound of formula (III 'a) below, which is 2-ethyl-4,6-dimethylheptanal
- the present invention also relates to the unsaturated alcohol (HIb) and the saturated alcohol (IH'b) derived from the compounds of formula (HIa) and (IH'a).
- the compound of formula (HIb) below is 2-ethyl-4,6-dimethyl-hept-5-en-1-ol.
- the present invention also relates to esters of 2-ethyl-4,6-dimethyl-hept-5-en-1-ol (HIb) and 2-ethyl-4,6-dimethyl-heptan-1-ol (III).
- These compounds (IIIc) and (III'c), derived from alcohols (HIb) and (III'b) respectively, are compounds of general formula (III) in which X represents a group -CHaOC (O) R where R represents an alkyl or alkenyl chain having 1, 2, 3, 4, 5 or 6 carbon atoms, linear or branched and the dotted bond is present (IIIc) or absent (III'c),
- the subject of the present invention is a composition comprising at least one compound corresponding to the general formula (I), and preferably, said composition comprises at least one compound of general formula (II) and / or at least one compound of general formula ( III).
- alkyl within the meaning of the present invention, means all linear or branched saturated hydrocarbons, preferably having 1, 2, 3, 4, 5 or 6 carbon atoms, and especially methyl, ethyl, propyl, isopropyl, butyl, t-butyl, pentyl, said groups being optionally substituted by a reactive function such as for example an alcohol, acid, amine, amide, ester or ether.
- alkenyl within the meaning of the present invention, means all linear or branched mono- or poly-unsaturated hydrocarbons, preferably having 1, 2, 3, 4, 5 or 6 carbon atoms, and especially methylene groups. ethylene, propylene, butylene, pentylene, said groups being optionally substituted by a reactive function such as for example an alcohol, acid, amine, amide, ester or ether.
- the compounds according to the invention may be in the form of a pure optical isomer or in the form of a mixture of optical isomers.
- the present invention also relates to a process for preparing the compound of general formula (I) wherein X is CHO, CH 2 OH, CH 2 OR, CH 2 OC (O) R or CH (OR 1 ) (OR 2 ), and
- R, R 1, R 2 each represent an alkyl or alkenyl chain having 1, 2, 3, 4, 5 or 6 carbon atoms, said chain being linear or branched, or R 1 and R 2 may together form a ring, preferably a ring; at 5 or 6 atoms, and the dotted bond is present or absent, wherein hydroformylation is carried out by reaction of 5,7-dimethyl-octa-1,6-diene with carbon monoxide and hydrogen in the presence of a catalytic system.
- Hydroformylation is a reaction well known to those skilled in the art.
- reaction oxo this process involves reacting an olefin with carbon monoxide and hydrogen in the presence of a catalyst to yield an aldehyde.
- the catalyst is selected from Group VIII transition metals. Cobalt or rhodium complexes are generally used, with a preference for more active rhodium complexes.
- the ligands used are essentially phosphines.
- the catalyst system used comprises a rhodium catalyst, preferably [Rh (acac) (CO) 2 ], and a phosphine.
- Said phosphine is preferably triphenylphosphine.
- Other rhodium catalysts can also be used such as [Rh (OAc) (cod) 2] or [Rh (oMe) (cod) ⁇ l r as described by Piet WNM and Carmen Claver (eds) in "Rhodium Catalysed Hydroformylation »Catalysis by Metal Complexes Vol. 22, Kluwer Academy Publishers, Dordrecht, The Netherlands, (2000), ISBN 0-7923-6551-8.
- the hydroformylation reaction of 5,7-dimethyl-octa-1,6-diene can be carried out using a catalyst / olefin ratio of the order of 1000 to 4000, preferably from 1500 to 3000 and very preferably from 2000 to 2500. 3 to 20 equivalents, preferably 5 to 15 equivalents and very preferably 8 equivalents of triphenylphosphine ligand relative to the catalyst are used.
- the substrate and the catalyst system in solution in toluene are introduced into an autoclave under a nitrogen atmosphere.
- the autoclave is then purged several times with an equimolar mixture of carbon monoxide and hydrogen.
- the hydroformylation is then carried out using a pressure of equimolar mixture of CO and H2 in the range of 5 to 80 bar, preferably from 30 to 60 bar and a temperature of the order of 60 to 12O 0 C, preferably 90 0 C. Under these conditions, the hydroformylation of 5,7-dimethyl-octa-1,6-diene yields the compound of the general formula (I).
- the compound of general formula (I) comprises 2,5,7-trimethyl-oct-6-enal (IIa) and 2-ethyl-4,6-dimethylhept-5-enal (HIa).
- the compound 2,5,7-trimethyl-oct-6-enal (IIa) can then be isolated by fractional distillation.
- the catalyst system comprises a biphosphine.
- a biphosphine 1,2-bis (diphenylphosphino) ethane (dppe or Diphos) or 1,1'-bis (diphenylphosphino) ferrocene (dppf) are preferentially used.
- suitable phosphine ligands enables those skilled in the art to orient and increase the regioselectivity of the hydroformylation reaction to the compounds of general formula (I).
- said process further comprises a reduction step to obtain the alcohol derived from the compound of formula
- the alcohols (Hb) and (H'b) of the present invention can be readily prepared by reducing the compounds of formula (IIa) under conditions well known to those skilled in the art.
- the unsaturated alcohol (Hb) is obtained by selective reduction of the aldehyde function of
- said method further comprises a step of oxidizing the saturated alcohol obtained above to obtain the saturated aldehyde of general formula (I) in which the bond is absent.
- the saturated aldehyde (II 'a) of the present invention can be prepared by oxidation of (II'b) according to methods well known to those skilled in the art such as, for example, by Corey's reagent. (CrO3 / Pyridine / HCl).
- said process further comprises an esterification step to obtain the ester derived from the alcohol derived from the compound of formula (I).
- the conditions of the esterification step are well known to those skilled in the art.
- the compounds of general formula (I) find a very varied use in perfumery, in the sense previously detailed, in particular and in a nonlimiting manner in cosmetics and for cleaning products.
- the subject of the invention is also the use of at least one compound of general formula (I) or of a composition comprising at least one compound of formula general (I), as odorant, odor masking agent or odor neutralizing agent, alone or in admixture with one or more other odorant compounds known to those skilled in the art, that the skilled person is able to choose according to the desired effect.
- the additional odorant (s) may be compounds of formula (I) or other odorants known to those skilled in the art.
- the invention relates to compositions comprising a base product and an effective amount of a compound of general formula (I) or a composition comprising at least one compound of general formula (I).
- composition itself odorant, or a composition in which the odorant compound according to the invention is used to mask or neutralize certain odors.
- the base product will be readily determined by those skilled in the art depending on the composition envisaged and therefore the intended use, for which the usual components, such as solvent (s) and / or adjuvant (s), are well known. .
- the effective amount of a compound of general formula (I) or of a composition comprising at least one compound of general formula (I), will vary according to the nature of the composition, the desired odor effect, and the nature of other compounds odorous or not possibly present, and may be easily determined by those skilled in the art, knowing that it may vary over a very wide range, from 0.1 to 99% by weight, in particular 0.1 to 50% by weight , especially 0, 1 to 30% by weight.
- a composition comprising at least one compound of general formula (I) may be used as is or incorporated in or on an inert carrier material or may contain other active ingredients of the invention. finished composition.
- carrier materials can be employed including, for example, polar solvents, oils, greases, finely divided solids, cyclodextrins, maltodextrins, gums, resins and any other known carrier material for such a composition.
- the subject of the invention is therefore also the use of a compound of general formula (I) or of a composition comprising at least one compound of general formula (I), for the preparation of an odorous composition or a odorant article in the applications described above, especially in perfumery, in cosmetics, for example for shampoos or soaps, and for cleaning products, such as fabric softeners or detergents.
- the invention relates in particular to a perfumery composition, in particular a perfume base or concentrate, a cologne, a toilet water or a perfume, comprising at least one compound of general formula (I) or a composition comprising at least one compound of general formula (I).
- the invention also relates in particular to a cosmetic composition, in particular cream for the face and the body, talcum powder, hair or body oil, shampoo, hair lotion, bath salt, bath oil, shower gel, gel bath, toilet soap, body anti-perspirant, body deodorant, lotions, shaving cream, shaving soap, cream, toothpaste, mouthwash, ointment comprising at least one compound of general formula (I) or a composition comprising at least one less a compound of general formula (I).
- Another subject of the invention is a method of treatment or cosmetic care, preventive or not, using at least one compound of general formula (I) or a composition comprising at least one compound of general formula (I).
- the invention also relates to a care product, in particular a softener, detergent, detergent, air freshener, comprising at least one compound of general formula (I) or a composition comprising at least one compound of general formula (I).
- Example 1 Synthesis of 2,5,7-trimethyl-oct-6-enal (IIa) 35.3 g of 5,7-dimethylocta-1,6-diene are charged into a 150 ml autoclave under nitrogen. 12.9 g of toluene previously degassed with nitrogen, 210 mg of triphenylphosphine and 26 mg of catalyst [Rh (acac) (CO) 2 ]. The autoclave is closed and purged three times with an equimolar mixture of carbon monoxide and hydrogen. The internal pressure is set to 60 bar. It is slowly heated to 90 ° C. The reaction medium is heated for 16 hours under these conditions. The autoclave is then cooled to room temperature before being slowly depressurized.
- IIa 2,5,7-trimethyl-oct-6-enal
- the reaction crude is then transferred to a distillation apparatus and rectified (70-90 ° C / 7 Torr) to yield a mixture of aldehydes.
- the 2,5,7-trimethyl-oct-6-enal is separated from the previous mixture by fractionation using a spinning column (Tb: 64-65 ° C / 6 Torr). 8 g of 2,5,7-trimethyl-oct-6-enal are obtained. The yield is 19%.
- the reaction medium is acidified with 10 g of 10% hydrochloric acid without exceeding 10 0 C in the mass. Another 10 g of water are added, followed by 40 g of t-butyl methyl ether. The phases are separated and the organic phase is washed once with 10 g of water saturated with sodium bicarbonate and twice with 10 g of water and 10 g of salt water. The solvent is dried, filtered and evaporated under reduced pressure. 4.2 g of alcohol are obtained after distillation (Tb .: 82 ° C./1 Torr). The yield is 88%.
- EXAMPLE 3 Acetate of 2,5,7-Trimethyl-oct-6-en-1-ol A 4 g (24 ⁇ mol) of 4 g (24 ⁇ mol) is placed in a 100 ml flask equipped with a thermometer and an addition funnel. 2, 5, 7-Trimethyl-oct-6-en-1-ol, 3.3 g (33 mmol) of triethyl amine and 40 ml of t-butyl methyl ether. It is cooled to 5 ° C. and 2.6 g (33 mmol) of acetyl chloride diluted in 5 ml of t-butyl methyl ether are added, without exceeding 100 ° C. in the mass.
- the mixture is then stirred at room temperature for 14 hours. Cool to 5 ° C and add 15 ml of saturated sodium bicarbonate solution. The phases are separated and the organic phase is washed with 10 ml of water and then with salt water until neutral. It is dried over magnesium sulphate and then filtered. The solvent is then evaporated under reduced pressure. The acetate is purified by distillation under reduced pressure to give 3.7 g of pure product (Teb .: 54 0 CVO.4 Torr). The yield is 72%.
- the evaluation panel is composed of several professionals, qualitatively evaluating the compound.
- the compound (IIa) is described as floral, fruity, green, watery with a score of watermelon 'and having a fatty facet.
- Example 5 Olfactory evaluation of the compound (IIa) in a composition
- a perfume composition was created (test 2), in which the olfactory impact of the compound (IIa) was examined by comparison with a composition not containing the compound (test 1).
- This perfume composition can be used for topical cosmetic products including shampoo, shower gel, cream.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Cosmetics (AREA)
Abstract
Composé de formule générale (I) :dans laquelle X est un groupe CHO, CH<SUB>2</SUB>OH, CH<SUB>2</SUB>OR, CH<SUB>2</SUB>OC(O)R ou CH(OR<SUB>1</SUB>) (OR<SUB>2</SUB>), et R, R<SUB>1</SUB>, R<SUB>2</SUB> représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou R<SUB>1</SUB> et R<SUB>2</SUB> peuvent former ensemble un cycle préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, procédé de synthèse et utilisation en tant qu'agent odorant ou agent de masquage d'une odeur.
Description
NOUVEAUX COMPOSES ODORANTS, PROCEDE DE SYNTHESE ET
UTILISATIONS
La présente invention concerne de nouveaux composés odorants, qui peuvent être utilisés en parfumerie. L'invention concerne notamment de nouveaux aldéhydes, les alcools, esters et éthers correspondants, leur procédé de synthèse et leurs utilisations en parfumerie.
Le terme parfumerie est ici utilisé pour désigner non seulement la parfumerie au sens habituel du terme, mais également les autres domaines dans lesquels l'odeur des produits est importante. Il peut s'agir de compositions de parfumerie au sens habituel du terme, telles que bases et concentrés parfumants, eaux de Cologne, eaux de toilette, parfums et produits similaires ; de compositions topiques - en particulier cosmétiques - telles que crèmes pour le visage et le corps, poudres de talc, huiles pour cheveux, shampoings, lotions capillaires, sels et huiles de bain, gels de douche et de bain, savons de toilette, anti-transpirants et désodorisants corporels, lotions et crèmes de rasage, savons, crèmes, dentifrices, bains de bouche, pommades, et produits similaires ; et de produits d'entretien, tels qu'assouplissants, détergents, lessives, désodorisants d'ambiance, et produits similaires. Les aldéhydes représentent l'une des grandes familles de molécules odorantes utilisées en parfumerie. Dans cette famille, les aldéhydes possédant entre huit et douze atomes de carbone jouent un rôle important. Parmi ces aldéhydes, on trouve des aldéhydes terpéniques, qui possèdent des odeurs florales. On trouve également des aldéhydes linéaires, dérivés d'acides gras, qui ont des notes fraîches, typiques des fruits de la famille des agrumes.
La Demanderesse a récemment décrit dans la demande de brevet FR 05 00551, des composés utilisables comme agents odorants grâce à leurs notes fraîches, zestées orange et herbacées aux accents de feuille de coriandre, notamment le 6, 8-diméthyl-non-7-énal .
Après de nouvelles recherches, la Demanderesse a obtenu de nouveaux composés qui combinent des odeurs florales et des notes fraîches, notamment le 2, 5, 7-triméthyl-oct-6- énal qui présente des notes florales, fuitées, vertes et aqueuses avec une note de melon d'eau.
Les nouveaux agents odorants décrits dans la présente demande permettent ainsi d'étendre la gamme des notes pouvant être apportées à une composition.
La présente invention a pour objet un nouveau composé représenté par la formule générale (I) suivante :
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou CH(OR1) (OR2) , et
R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, à l'exclusion du composé de formule suivante
dans laquelle X est un groupe CH2OH et la liaison en pointillé est absente.
Les composés de l' invention, en particulier les composés de formule (I), peuvent être présents sous forme d'un isomère ou d'un mélange d'isomères, en particulier d'un énantiomère ou d'un mélange d1 énantiomères, ou d'un mélange racémique, ou d'un diastéréoisomère ou d'un mélange de diastéréoisomères .
En particulier, la présente invention a pour objet un composé répondant à la formule générale (II) ci- dessous
CH(ORi) (OR2) , et
Rf RiA R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente.
Plus particulièrement, la présente invention concerne un composé qui est le 2, 5, 7-triméthyl-oct-6-énal répondant à la formule (lia) ci-dessous
Le composé de formule (lia) peut être présent sous forme d'un isomère ou d'un mélange d'isomères, en particulier d'un énantiomère ou d'un mélange d' énantiomères, ou d'un mélange racémique, ou d'un diastéréoisomère ou d'un mélange de diastéréoisomères.
Le composé de formule (lia) peut présenter plusieurs isomères optiques tels que le 2 (R), 5 (R), 7- triméthyl-oct-6-énal, le 2 (S) , 5 (R) , 7-triméthyl-oct-β-énal, le 2 (R) , 5 (S) , 7-triméthyl-oct-6-énal et le 2 (S) , 5 (S) , 7-triméthyl- oct-6-énal .
La présente invention concerne également un autre composé de formule (II' a), le 2, 5, 7-triméthyl-octanal, c'est- à-dire le composé de formule (II) où la liaison en pointillé est absente et X représente un groupe CHO.
La présente invention a également pour objet l'alcool insaturé (Hb) et l'alcool saturé (Il'b) dérivés des composés de formule (lia) et (II' a) .
Le composé de formule (Hb) ci-dessous est le 2,5,7- triméthyl-oct-6-en-l-ol
Le composé de formule (Il'b) ci-dessous est le 2, 5, 7-triméthyl-oct-6-an-l-ol
Les alcools (Hb) et (Il'b) de la présente invention peuvent être aisément préparés par réduction des composés de formule (lia) dans des conditions bien connues de l'homme de l'art. Dans un mode de réalisation particulier de l'invention, l'alcool insaturé (Hb) est obtenu par réduction sélective de la fonction aldéhyde de (lia) par un réducteur
tel que le borohydrure de sodium (NaBH4) et l'alcool saturé (II' b) est synthétisé par réduction de la fonction aldéhyde ainsi que de la double liaison C-C du composé (lia) par l'hydrogène en présence d'un catalyseur du type notamment palladium sur charbon ou le nickel de Raney.
L'aldéhyde saturé (II' a) de la présente invention peut être préparé par oxydation de (II' b) selon des méthodes bien connues de l'homme de l'art comme, par exemple, par le réactif de Corey (CrO3/Pyridine/HCl) . La présente invention concerne également les esters insaturés (Ile) et saturés (II' c), dérivés des alcools
(Hb) et (Il'b) respectivement, qui sont des composés de formule générale (II) dans laquelle X représente un groupe -
CH2θC(O)R où R représente une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, linéaire ou branchée et la liaison en pointillé est présente (Ile) ou absente (II 'c),
ledit groupe ester OC(O)R étant de préférence un groupe acétate, propionate, butyrate, isobutyrate, pentanoate, 2- méthyl-butyrate, 3-méthyl-butyrate, l'hexanoate, 2-méthyl- pentanoate, 3-méthyl-pentanoate, 4-méthyl-pentanoate, 2,2- diméthyl-butyrate, 2, 3-diméthyl-butyrate, 3, 3-diméthyl- butyrate, 2-butenoate, 2-méthyl-2-butenoate, 2-méthyl-2- butenyle, et 3-hexenyle.
La présente invention concerne en particulier les esters du 2, 5, 7-triméthyl-oct-6-én-l-ol (Hb) et les esters
du 2, 5, 7-triméthyl-oct-6-an-l-ol (Il'b), de préférence les acétate, propionate, butyrate, isobutyrate, pentanoate, 2- méthyl-butyrate, 3-méthyl-butyrate, l'hexanoate, 2-méthyl- pentanoate, 3-méthyl-pentanoate, 4-méthyl-pentanoate, 2,2- diméthyl-butyrate, 2, 3-diméthyl-butyrate, 3, 3-diméthyl- butyrate, 2-butenoate, 2-méthyl-2-butenoate, et 3-hexenoate du 2, 5, 7-triméthyl-oct-6-én-l-ol (Hb) ou du 2, 5, 7-triméthyl- oct-6-an-l-ol (Il'b) .
Les esters (Ile) et (II' c) de la présente invention peuvent être respectivement préparés à partir des alcools (Hb) et (Il'b), notamment par estérification des acides ou chlorures d'acyle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone linéaires ou branchés adéquat, selon des conditions bien connues de l'homme de l'art. La présente invention concerne également les éthers de formule générale (I) dans laquelle X est CH2OR, R étant de préférence choisi parmi un groupe éthyle, propyle, butyle, isobutyle, pentyle, 2-méthyl-butyle, 3-méthyl-butyle, l'hexyle, 2-méthyl-pentyle, 3-méthyl-pentyle, 4-méthyl- pentyle, 2, 2-diméthyl-butyle, 2, 3-diméthyl-butyle, 3,3- diméthyl-butyle, 2-butenyle, 2-méthyl-2-butenyle, et 3- hexenyle .
L'invention concerne en particulier les éthers du 2, 5, 7-triméthyl-oct-6-én-l-ol (Hb) et les éthers du 2,5,7- triméthyl-oct-6-an-l-ol (Il'b).
La présente invention concerne également un composé de formule générale (I), répondant à la formule générale (III) ci-dessous
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou CH(OR1) (OR2) , et
Rf RiA R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, à l'exclusion du composé de formule suivante
dans laquelle X est un groupe CH2OH et la liaison en pointillé est absente.
En particulier, la présente invention a pour objet un composé répondant à la formule (HIa) ci-dessous, qui est le 2-éthyl-4, 6-diméthyl-hept-5-énal
La présente invention concerne également un composé répondant à la formule (III' a) ci-dessous, qui est le 2-éthyl-4, 6-diméthyl-heptanal
La présente invention a également pour objet l'alcool insaturé (HIb) et l'alcool saturé (IH'b) dérivés des composés de formule (HIa) et (IH'a).
Le composé de formule (HIb) ci-dessous est le 2-éthyl-4, 6- diméthyl-hept-5-en-l-ol
La présente invention concerne aussi les esters du 2-éthyl-4, 6-diméthyl-hept-5-en-l-ol (HIb) et du 2-éthyl- 4 , 6-diméthyl-heptan-l-ol (Ill'b). Ces composés (IIIc) et (III'c), dérivés des alcools (HIb) et (Ill'b) respectivement, sont des composés de formule générale (III) dans laquelle X représente un groupe -CHaOC(O)R où R représente une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, linéaire ou branchée et la liaison en pointillé est présente (IIIc) ou absente (III'c),
La présente invention a pour objet une composition comprenant au moins un composé répondant à la formule générale (I), et de préférence, ladite composition comprend au moins un composé de formule générale (II) et/ou au moins un composé de formule générale (III).
Le terme " alkyle ", au sens de la présente invention, signifie tous les hydrocarbures saturés linéaires ou ramifiés, ayant de préférence 1, 2, 3, 4, 5 ou 6 atomes de carbone, et notamment les groupes méthyle, éthyle, propyle,
isopropyle, butyle, t-butyle, pentyle, lesdits groupes étant optionnellement substitués par une fonction réactive telle que par exemple un alcool, acide, aminé, amide, ester ou éther . Le terme " alcényle ", au sens de la présente invention, signifie tous les hydrocarbures mono- ou poly- insaturés linéaires ou ramifiés, ayant de préférence 1, 2, 3, 4, 5 ou 6 atomes de carbone, et notamment les groupes méthylène, éthylène, propylène, butylène, pentylène, lesdits groupes étant optionnellement substitués par une fonction réactive telle que par exemple un alcool, acide, aminé, amide, ester ou éther.
Les composés selon l'invention peuvent être sous la forme d'un isomère optique pur ou sous la forme d'un mélange d'isomères optiques.
La présente invention a également pour objet un procédé de préparation du composé de formule générale (I)
dans laquelle dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou CH(OR1)(OR2), et
R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, dans lequel on effectue une hydroformylation par réaction du 5, 7-diméthyl-octa-l, 6-diène avec du monoxyde de carbone et de l'hydrogène en présence d'un système catalytique. L' hydroformylation est une réaction bien connue de l'homme du métier. Aussi connue sous le nom de réaction
oxo, ce procédé implique la réaction d'une oléfine avec du monoxyde de carbone et de l'hydrogène en présence d'un catalyseur pour conduire à un aldéhyde. Le catalyseur est choisi parmi les métaux de transition du groupe VIII. Les complexes de cobalt ou de rhodium sont généralement utilisés, avec une préférence pour les complexes de rhodium qui sont plus actifs. Les ligands utilisés sont essentiellement des phosphines .
Dans un mode de réalisation du procédé de l'invention, le système catalytique utilisé comprend un catalyseur de rhodium, de préférence le [Rh(acac) (CO) 2], et une phosphine. Ladite phosphine est de préférence la triphénylphosphine . D'autres catalyseurs de rhodium peuvent aussi être utilisés comme le [Rh(OAc) (cod) 2] ou le [Rh(oMe) (cod) ∑l r comme décrit par Piet W. N. M. et Carmen Claver (eds) dans « Rhodium Catalysed Hydroformylation » Catalysis by Métal Complexes Vol. 22, Kluwer Académie Publishers, Dordrecht, The Netherlands, (2000), ISBN 0-7923- 6551-8. Dans un mode de réalisation de l'invention, La réaction d' hydroformylation du 5, 7-diméthyl-octa-l, 6-diène peut être effectuée en utilisant un ratio catalyseur/oléfine de l'ordre de 1000 à 4000, de préférence de 1500 à 3000 et très préférentiellement de 2000 à 2500. 3 à 20 équivalents, de préférence 5 à 15 équivalents et très préférentiellement 8 équivalents de ligand triphénylphosphine par rapport au catalyseur sont utilisés.
Suivant ce mode de réalisation, le substrat et le système de catalyseur en solution dans le toluène sont introduits dans un autoclave sous atmosphère d'azote. L'autoclave est ensuite purgé plusieurs fois avec un mélange équimolaire de monoxyde de carbone et d'hydrogène. On procède ensuite à l' hydroformylation en utilisant une pression de
mélange équimolaire de CO et H2 de l'ordre de 5 à 80 bar, de préférence de 30 à 60 bar, et une température de l'ordre de 60 à 12O0C, de préférence 900C. Dans ces conditions, l' hydroformylation du 5, 7-diméthyl-octa-l, 6-diène conduit au composé de formule générale (I).
Le composé de formule générale (I) comprend le 2,5,7-triméthyl-oct-6-énal (lia) et le 2-éthyl-4, 6-diméthyl- hept-5-énal (HIa) . Le composé 2, 5, 7-triméthyl-oct-6-énal (lia) peut ensuite être isolé par distillation fractionnée.
Dans un autre mode de réalisation du procédé de l'invention, le système de catalyseur comprend une biphosphine. Parmi les biphosphines, le 1,2- bis (diphénylphosphino) éthane (dppe ou Diphos) ou le 1,1'- bis (diphénylphosphino) ferrocène (dppf) sont préférentiellement utilisés. L'utilisation de ligands phosphines adéquats permet à l'homme de l'art d'orienter et d'augmenter la régiosélectivité de la réaction d' hydroformylation vers les composés de formule générale (I).
Dans un mode de réalisation du procédé de l'invention, ledit procédé comprend en outre une étape de réduction pour obtenir l'alcool dérivé du composé de formule
(I) . Les conditions de cette étape de réduction sont bien connues de l'homme de l'art.
Par exemple, les alcools (Hb) et (H'b) de la présente invention peuvent être aisément préparés par réduction des composés de formule (lia) dans des conditions bien connues de l'homme de l'art. Dans un mode de réalisation
particulier de l'invention, l'alcool insaturé (Hb) est obtenu par réduction sélective de la fonction aldéhyde de
(lia) par un réducteur tel que le borohydrure de sodium
(NaBH4) et l'alcool saturé (H'b) est synthétisé par réduction de la fonction aldéhyde ainsi que de la double liaison C-C du composé (lia) par l'hydrogène en présence d'un catalyseur tel que le palladium sur charbon ou le nickel de
Raney.
Dans un autre mode de réalisation du procédé de l'invention, ledit procédé comprend en outre une étape d'oxydation de l'alcool saturé obtenu précédemment pour obtenir l'aldéhyde saturé de formule générale (I) dans laquelle la liaison est absente.
Par exemple, l'aldéhyde saturé (II' a) de la présente invention peut être préparé par oxydation de (Il'b) selon des méthodes bien connues de l'homme de l'art comme, par exemple, par le réactif de Corey (Cr03/Pyridine/HCl) .
Dans un autre mode de réalisation du procédé de l'invention, ledit procédé comprend en outre une étape d ' estérification pour obtenir l'ester dérivé de l'alcool dérivé du composé de formule (I) . Les conditions de l'étape d' estérification sont bien connues de l'homme de l'art.
Un schéma de synthèse du 2, 5, 7-triméthyl-non-7- énal (lia) et de ses dérivés est donné, à titre d'exemple non limitatif, ci-dessous :
De par leurs propriétés odorantes, les composés de formule générale (I) trouvent un emploi très varié en parfumerie, au sens détaillé précédemment, notamment et à titre non limitatif en cosmétique et pour les produits d'entretien.
L'invention a également pour objet l'utilisation d'au moins un composé de formule générale (I) ou d'une composition comprenant au moins un composé de formule
générale (I), comme agent odorant, agent de masquage d'odeur ou agent de neutralisation d'odeur, seul ou en en mélange avec un ou plusieurs autres composés odorants connus de l'homme du métier, que l'homme du métier est à même de choisir en fonction de l'effet recherché. Le ou les agents odorants supplémentaires peuvent être des composés de formule (I) ou d'autres agents odorants connus de l'homme du métier.
L'invention a pour objet les compositions comprenant un produit de base et une quantité efficace d'un composé de formule générale (I) ou d'une composition comprenant au moins un composé de formule générale (I) .
Il peut s'agir d'une composition elle-même odorante, ou d'une composition dans laquelle le composé odorant selon l'invention est utilisé pour masquer ou neutraliser certaines odeurs.
Le produit de base sera aisément déterminé par l'homme du métier en fonction de la composition envisagée et donc de l'utilisation envisagée, pour lesquelles les composants habituels, tels que solvant (s) et/ou adjuvant (s), sont bien connus.
La quantité efficace d'un composé de formule générale (I) ou d'une composition comprenant au moins un composé de formule générale (I), variera selon la nature de la composition, l'effet odorant souhaité, et la nature des autres composés odorants ou non éventuellement présents, et pourra être aisément déterminée par l'homme du métier, sachant qu'elle peut varier dans une plage très étendue, de 0,1 à 99% en poids, en particulier 0,1 à 50% en poids, notamment 0, 1 à 30% en poids. Une composition comprenant au moins un composé répondant à la formule générale (I), peut être utilisée telle quelle ou être incorporée dans ou sur un matériau support inerte ou qui peut contenir d'autres ingrédients actifs de la
composition finie. Une grande variété de matériaux supports peut être employée incluant, par exemple, les solvants polaires, les huiles, les graisses, les solides finement divisés, les cyclodextrines, les maltodextrines, les gommes, les résines et n'importe quel autre matériau support connu pour une telle composition.
L'invention a donc aussi pour objet l'utilisation d'un composé de formule générale (I) ou d'une composition comprenant au moins un composé de formule générale (I), pour la préparation d'une composition odorante ou d'un article odorant dans les applications décrites ci-dessus, en particulier en parfumerie, en cosmétique, par exemple pour des shampooings ou des savons, et pour des produits d'entretien, tels que des assouplissants ou des lessives. L'invention concerne en particulier une composition de parfumerie, notamment une base ou un concentré parfumant, une eau de Cologne, une eau de toilette ou un parfum, comprenant au moins un composé de formule générale (I) ou une composition comprenant au moins un composé de formule générale (I). L'invention concerne également en particulier une composition cosmétique, notamment crème pour le visage et le corps, poudre de talc, huile pour cheveux ou pour le corps, shampoing, lotion capillaire, sel de bain, huile de bain, gel de douche, gel de bain, savon de toilette, anti-transpirant corporel, désodorisant corporel, lotions, crème de rasage, savon de rasage, crème, dentifrice, bain de bouche, pommade comprenant au moins un composé de formule générale (I) ou une composition comprenant au moins un composé de formule générale (I) . Un autre objet de l'invention est une méthode de traitement ou de soin cosmétique, préventive ou non, mettant en œuvre au moins un composé de formule générale (I) ou une composition comprenant au moins un composé de formule générale (I) .
L' invention concerne encore un produit d'entretien, notamment assouplissant, détergent, lessive, désodorisant d'ambiance, comprenant au moins un composé de formule générale (I) ou une composition comprenant au moins un composé de formule générale (I) .
Les exemples suivants illustrent davantage les nouveaux composés odorants, leur procédés de synthèse, leur intérêt et leurs utilisations. Ces exemples ne sont présentés que dans un but d'illustration et ne peuvent être considérés comme limitatifs de l'invention.
Exemple 1 : Synthèse du 2, 5, 7-triméthyl-oct-6-énal (lia) Dans un autoclave de 150 ml sous azote, on charge 35,3 g de 5, 7-diméthyl-octa-l, 6-diène, 12,9 g de toluène préalablement dégazé à l'azote, 210 mg de triphénylphosphine et 26 mg de catalyseur [Rh(acac) (CO) 2]. L'autoclave est fermé et purgé trois fois avec un mélange équimolaire de monoxyde de carbone et d'hydrogène. La pression intérieure est réglée à 60 bar. On chauffe lentement à 90 °C. Le milieu réactionnel est chauffé pendant 16 heures sous ces conditions. L'autoclave est ensuite refroidi à température ambiante avant d'être lentement dépressurisé. Le brut de réaction est ensuite transféré dans un appareil de distillation et rectifié (70- 90°C/7 Torr) pour conduire à un mélange d'aldéhydes. Le 2, 5, 7-triméthyl-oct-6-énal est séparé du mélange précédent par fractionnement à l'aide d'une colonne à bande tournante (Téb : 64-65°C / 6 Torr). 8 g de 2, 5, 7-triméthyl-oct-6-énal sont obtenus. Le rendement est de 19%.
Les analyses des spectres infra rouges, RMN et de masse correspondent à la structure de l'aldéhyde (lia).
1H-RMN (500MHz, CDCl3, δ .ppm) : 0.914 / 0.918 (2d, J=6.7 Hz, 3H) ; 1.075 / 1.077 (2d, J=7 Hz, 3H) ; 1.13-1.37 (m, 4H) ; 1.60 (s, 3H) ; 1.68 (s, 3H) ; 2.29 (m, 2H) ; 4.86 (m,
IH) ; 9.59 (m, IH). 13C-RMN (125MHz, CDCl3, δ. ppm) : 13.3 / 13.4 (2q); 17.9 / 18.0 (2q) ; 21.3 / 21.4 (2q) ; 25.8 (q) ; 28. f / 28.6 (2t); 32.5 / 32.6 (2d) ; 35.0 (t) ; 46.5 / 46.6 (2d) ; 130.4 /130.5 (2s) ; 130.8 / 130.9 (2d) ; 205.4 (d) . MS: 168 (2), 96 (100), 83 (65), 69 (22), 55 (86), 41 (47). IR: 3434w, 2964s, 2928s, 2869s, 2707w, 281Ow, 1727s, 1454m, 1378m, 112Ow, 1071w, 921w, 842w.
Exemple 2 : Synthèse du 2, 5, 7-triméthyl-oct-6-en-l-ol (Hb) On place dans un ballon de 100 ml muni d'un thermomètre 0.6g de borohydrure de sodium (0.016 mol) dans 40g d'éthanol sec. On refroidit à l'aide d'un bain de glace puis on introduit 4.7g (0.03 mol) de 2, 5, 7-triméthyl-oct-6-énal sans dépasser 100C dans la masse. Le milieu réactionnel est agité à température ambiante pendant 16 heures. On refroidit à 5°C et on détruit l'excès du réducteur par addition lente de 6g d'acétone sans dépasser 100C dans la masse. Le milieu réactionnel est acidifié avec 10g d'acide chlorhydrique à 10% sans dépasser 100C dans la masse. On ajoute encore 10g d'eau, puis 40g de t-butyl-méthyl éther. Les phases sont séparées et la phase organique est lavée une fois avec 10 g d'eau saturée en bicarbonate de sodium et deux fois avec 10g d'eau et 10g d'eau salée. On sèche, filtre et évapore le solvent sous pression réduite. On obtient 4.2g d'alcool après distillation (Téb. : 82°C/1 Torr) . Le rendement est à 88%. 1H-RMN (200MHz, CDCl3, δ .ppm) : 0.89 (s, 3H) ; 0.92 (s, 3H) ; 1-1.6 (m, 6H) ; 1.59 (s, 3H); 1.68 (s, 3H); 2.28 (m, IH); 3.51 (m, 2H); 4.88 (m, IH). 13C-RMN (50MHz, CDCl3, δ. ppm): 17.0 /17.1 (2q); 18.3 (q) ; 21.6 / 21.8 (2q) ; 26.2 (q) ; 31.4 (t); 33.1 / 33.2 (2d); 35.4 /35.5 (2t) ; 36.3 / 36.4 (2d) ; 68.7 / 68.8 (2t) ; 130.1 /130.2 (2s) ; 131.7 / 131.8 (2d) . MS: 170 (2), 152, 83 (100), 55 (61), 41(28). IR : 3339br, 2960s, 2926s,
2872s, 2728w, 1453m, 1416m, 1376m, 1336m, 1041m, 985w, 842w
Exemple 3 : Acétate du 2, 5, 7-triméthyl-oct-6-en~-l-ol On place dans un ballon de 100 ml muni d'un thermomètre et d'une ampoule à addition, 4g (24 πunol) de 2, 5, 7-Triméthyl- oct-6-en-l-ol, 3.3g (33 mmol) de triéthyle aminé et 40 ml de t-butyl-méthyl éther. On refroidit à 5°C et on ajoute 2.6g (33 mmol) de chlorure d'acétyle dilué dans 5 ml de t-butyl- méthyl éther, sans dépasser 100C dans la masse. Le mélange est ensuite agité à température ambiante pendant 14 heures. On refroidit à 5°C et on ajoute 15 ml d'une solution saturée de bicarbonate de sodium. Les phases sont séparées et la phase organique est lavée avec 10 ml d'eau, puis avec de l'eau salée jusqu'à neutralité. On sèche sur sulfate de magésium puis on filtre. Le solvant est ensuite évaporé sous pression réduite. L'acétate est purifié par distillation sous pression réduite pour donner 3.7g de produit pur (Téb. : 540CVO.4 Torr) . Le rendement est de 72%. 1H-RMN (200MHz, CDCl3, δ .ppm) : 0.89-0.92 (m, 6H) ; 1.05-1.36 (m, 4H) ; 1.59 (s, 3H) ; 1.68 (s, 3H); 1.72 (m, IH); 2.05 (s, 3H); 2.27 (m, IH); 3.82 (m, IH); 3.94 (m, IH); 4.86 (m, IH). 13C-RMN (50MHz, CDCl3, δ. ppm): 16.9/17.0 (2q) ; 18.0 (q) ; 21.0 (q) ; 21.2/21.4 (2q); 25.8 (q) ; 31.2 (t) ; 32.6/32.7 (2d) ; 32.7/32.8 (2d) ; 34.9/35.0 (2t) ; 69.4/69.5 (2t) ; 129.9/130.0 (2s); 131.2 / 131.3 (2d) ; 171.2 (s). MS : 212 (1), 152 (14), 137 (10), 109 (24), 95 (28), 83 (100), 67 (14), 55 (58), 43 (50). IR: 2963s, 2926s, 2857m, 1"MSs, 1455m, 1375m, 1237s, 1037m, 984w, 842w.
Exemple 4 : Evaluation olfactive du composé pur (I_Iaj_
Dans un premier temps, les caractéristiques odorantes du composé (lia) pur ont été évaluées par un panel. Le panel d'évaluation est composé de plusieurs professionnels,
évaluant qualitativement le composé. Le composé (lia) a été décrit comme floral, fruité, vert, aqueux avec une note de melon d'eau 'et possédant une facette grasse.
Exemple 5 : Evaluation olfactive du composé (lia) dans une composition
Une composition parfumante a été créée (essai 2), dans laquelle l'impact olfactif du composé (lia) a été examiné par comparaison avec une composition ne contenant pas le composé (essai 1) . Cette composition parfumante peut être utilisée pour des produits cosmétiques topiques notamment shampoing, gel douche, crème.
L'utilisation du 2, 5, 7-triméthyl-oct-β- énal (contre équivalent DPG) dans une composition type melon d'eau (vert, aqueux) apporte de la puissance et de la largeur à la note. Elle est également moins montante, fraîche, verte et plus lactée. En dilution, l'utilisation du 2,5,7- triméthyl-oct-6-énal apporte une même impression de puissance et de largeur dans la note melon d'eau avec cette facette un peu grasse.
Claims
1. Composé de formule générale (I]
R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, à l'exclusion du composé de formule suivante
dans laquelle X est un groupe CH2OH et la liaison en pointillé est absente.
2. Composé selon la revendication 1, répondant à la formule générale (II) ci-dessous
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou
CH(OR1) (OR2; et R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, A1 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former
ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente.
3. Composé selon l'une quelconque des revendications 1 ou 2, qui est le 2, 5, 7-triméthyl-oct-6-énal de formule (lia) représenté ci-dessous
4. Composé selon l'une quelconque des revendications 1 ou 2, qui est le 2, 5, 7-triméthyl-octanal (II' a) représenté ci-dessous
5. Composé selon l'une quelconque des revendications 1 ou 2, qui est le 2, 5, 7-triméthyl-oct-6-en-l-ol (Hb) représenté ci-dessous
7. Composé de la formule générale (II) selon la revendication 2 dans laquelle X représente un groupe CH2OC(O)R où R représente une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, linéaire ou branchée et la liaison en pointillé est présente (Ile) ou absente (II'c),
8. Composé de formule générale (I) selon la revendication 1 ou de formule générale (II) selon la revendication 2, caractérisé en ce que X est CH2θC(O)R, où ledit groupe ester OC(O)R est un groupe acétate, propionate, butyrate, isobutyrate, pentanoate, 2-méthyl-butyrate, 3- méthyl-butyrate, l'hexanoate, 2-méthyl-pentanoate, 3-méthyl- pentanoate, 4-méthyl-pentanoate, 2, 2-diméthyl-butyrate, 2,3- diméthyl-butyrate, 3, 3-diméthyl-butyrate, 2-butenoate, 2- méthyl-2-butenoate, ou 3-hexenoate.
9. Composé selon la revendication 8, qui est un ester du 2, 5, 7-triméthyl-oct-6-én-l-ol (Hb) ou un ester du 2,5,7- triméthyl-oct-6-an-l-ol (Il'b).
10. Composé de formule générale (I) selon la revendication 1 ou de formule générale (II) selon la revendication 2, caractérisé en ce que X est CH2OR, dans lequel le R est choisi parmi un groupe méthyle, éthyle, propyle, butyle, isobutyle, pentyle, 2-méthyl-butyle, 3- méthyl-butyle, l'hexyle, 2-méthyl-pentyle, 3-méthyl-pentyle, 4-méthyl-pentyle, 2, 2-diméthyl-butyle, 2, 3-diméthyl-butyle, 3, 3-diméthyl-butyle, 2-butenyle, 2-méthyl-2-butenyle/ et 3- hexenyle .
11. Composé selon la revendication 10, qui est un éther du 2, 5, 7-triméthyl-oct-6-én-l-ol (Hb) ou un éther du 2,5,7-triméthyl-oct-6-an-l-ol (H'b) .
12. Composé selon la revendication 1, répondant à la formule générale (III) ci-dessous
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou
CH(OR1) (OR2) , et R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, à l'exclusion du composé de formule suivante
dans laquelle X est un groupe CH2OH et la liaison en pointillé est absente.
13. Composé selon l'une quelconque des revendications 1 à 12, caractérisé en ce qu'il se présente sous la forme d'un isomère optique pur ou sous la forme d'un mélange d'isomères optiques.
14. Composition comprenant au moins un composé répondant à la formule générale (I)
R/ Ri? R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes , et la liaison en pointillé est présente ou absente, et optionnellement , au moins un composé de formule générale (II) tel que décrit dans la revendication 2 et/ou au moins un composé de formule générale (III)
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou
CH(OR1) (OR2) , et
R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente.
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou CH(ORi) (OR2) , et
R? Ri/ R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Rx et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, procédé dans lequel on effectue une hydroformylation par réaction du 5, 7-diméthyl-octa-l, 6-diène avec du monoxyde de carbone et de l'hydrogène en présence d'un système catalytique .
16. Procédé selon la revendication 15, dans lequel le système catalytique comprend un catalyseur de rhodium, de préférence le [Rh(acac) (CO)2], et une phosphine, de préférence la triphénylphosphine.
17. Procédé selon la revendication 16, dans lequel le système catalytique comprend une bisphosphine, de préférence le 1, 2-bis (diphénylphosphino) éthane ou le 1,1'- bis (diphénylphosphino) ferrocène.
18. Procédé selon 15 à 17, comprenant en outre une étape de réduction pour obtenir l'alcool dérivé du composé de formule (I) .
19. Procédé selon 18, comprenant en outre une étape d ' estérification pour obtenir l'ester dérivé de l'alcool dérivé du composé de formule (I).
20. Composition selon la revendication 14 ou comprenant au moins un composé de formule générale (I)
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou CH(ORi) (OR2) , et R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, caractérisée en ce que le ou lesdits composés sont incorporés dans ou sur un matériau support inerte ou qui peut contenir d'autres ingrédients actifs, ledit support étant notamment choisi parmi les solvants polaires, les huiles, les graisses, les solides finement divisés, les cyclodextrines, les maltodextrines, les gommes, les résines.
21. Composition de parfumerie, notamment base ou concentré parfumant, eau de Cologne, eau de toilette ou parfum, caractérisée en ce qu'elle comprend au moins un composé de formule générale (I)
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou CH(ORi) (OR2) , et
R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, ou une composition telle que décrite dans la revendication
14.
22. Composition cosmétique, notamment crème pour le visage et le corps, poudre de talc, huile pour cheveux ou pour le corps, shampoing, lotion capillaire, sel de bain, huile de bain, gel de douche, gel de bain, savon de toilette, anti-transpirant corporel, désodorisant corporel, lotions, crème de rasage, savon de rasage, crème, dentifrice, bain de bouche, pommade, caractérisée en ce qu'elle comprend au moins un composé de formule générale (I)
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou CH(OR1) (OR2) , et
R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, ou une composition telle que décrite dans la revendication
14.
23. Produit d'entretien, notamment assouplissant, détergent, lessive, désodorisant d'ambiance, caractérisé en ce qu'il comprend au moins un composé de formule générale (I)
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou CH(OR1) (OR2) , et
R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, ou une composition telle que décrite dans la revendication 14.
24. Utilisation d'au moins un composé de formule générale (I)
dans laquelle X est un groupe CHO, CH2OH, CH2OR, CH2OC(O)R ou CH(ORx) (OR2) , et
R, Ri, R2 représentent chacun une chaîne alkyle ou alcényle ayant 1, 2, 3, 4, 5 ou 6 atomes de carbone, ladite chaîne étant linéaire ou ramifiée, ou Ri et R2 peuvent former ensemble un cycle, préférentiellement un cycle à 5 ou 6 atomes, et la liaison en pointillé est présente ou absente, ou d'une composition selon la revendication 14, comme agent odorant ou comme agent de masquage d'odeur ou comme agent de neutralisation d'odeur.
25. Utilisation selon la revendication 24, dans laquelle ledit au moins un composé de formule générale (I) ou ladite au moins une composition telle que décrite dans la revendication 14 est utilisé (e) en association avec d'autres agents odorants.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR0606966A FR2903982A1 (fr) | 2006-07-18 | 2006-07-18 | Nouveaux composes odorants, procede de synthese et utilisations |
| FR0606966 | 2006-07-18 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2008009841A1 true WO2008009841A1 (fr) | 2008-01-24 |
Family
ID=37964112
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/FR2007/051627 Ceased WO2008009841A1 (fr) | 2006-07-18 | 2007-07-10 | Nouveaux composes odorants, procede de synthese et utilisations |
Country Status (2)
| Country | Link |
|---|---|
| FR (1) | FR2903982A1 (fr) |
| WO (1) | WO2008009841A1 (fr) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3920752A (en) * | 1969-04-26 | 1975-11-18 | Givaudan Corp | Novel gamma, delta unsaturated aldehydes |
| US3959396A (en) * | 1966-08-03 | 1976-05-25 | Givaudan Corporation | Unsaturated alcohols and perfume compositions containing same |
| JPH05202378A (ja) * | 1992-01-23 | 1993-08-10 | T Hasegawa Co Ltd | 香料組成物 |
-
2006
- 2006-07-18 FR FR0606966A patent/FR2903982A1/fr active Pending
-
2007
- 2007-07-10 WO PCT/FR2007/051627 patent/WO2008009841A1/fr not_active Ceased
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3959396A (en) * | 1966-08-03 | 1976-05-25 | Givaudan Corporation | Unsaturated alcohols and perfume compositions containing same |
| US3920752A (en) * | 1969-04-26 | 1975-11-18 | Givaudan Corp | Novel gamma, delta unsaturated aldehydes |
| JPH05202378A (ja) * | 1992-01-23 | 1993-08-10 | T Hasegawa Co Ltd | 香料組成物 |
Non-Patent Citations (1)
| Title |
|---|
| ZAMBELLI A ET AL: "CARBON-13 NUCLEAR MAGNETIC RESONANCE ANALYSIS OF MODEL COMPOUNDS OFSATURATED END GROUPS IN POLYPROPYLENE", MACROMOLECULES, ACS, WASHINGTON, DC, US, 1979, pages 154 - 156, XP000667338, ISSN: 0024-9297 * |
Also Published As
| Publication number | Publication date |
|---|---|
| FR2903982A1 (fr) | 2008-01-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1838652B1 (fr) | Nouveaux composes odorants, procede de synthese et utilisations. | |
| EP0155591B1 (fr) | Dérivés hydroxylés de l'aldéhyde campholénique, leur utilisation à titre d'ingrédients parfumants et composition parfumante les contenant | |
| EP0392258A2 (fr) | Aldéhydes aromatiques nouveaux, leurs dérivés et leur utilisation à titre d'ingrédients parfumants, herbicides et fongicides | |
| CH653668A5 (fr) | Derives du cyclopropane, leur procede de preparation, agents parfumants constitues par lesdits composes et compositions parfumantes les renfermant. | |
| EP2903697B1 (fr) | Procédé de synthèse de cyclohexènones ainsi que leur utilisation en parfumerie | |
| EP2203417B1 (fr) | Octane(ène) nitriles substitués, leurs procédés de synthèses et leurs utilisations en parfumerie | |
| WO2008009841A1 (fr) | Nouveaux composes odorants, procede de synthese et utilisations | |
| EP1838653B1 (fr) | Nouveaux derives de trimethylcyclododecatriene, leur utilisation et produits parfumes les contenant | |
| CH657846A5 (fr) | Derives de l'acide cyclopropane carboxylique substitue en 3 par une chaine vinylique, leur preparation et les compositions parfumantes les renfermant. | |
| EP2766334B1 (fr) | Nouveaux aldehydes cycloalcaniques, leur procede de preparation ainsi que leur utilisation en parfumerie | |
| EP1773284B1 (fr) | Tetrahydropyran(on)es substitues en beta, leur procede de synthese et leur utilisation en parfumerie | |
| CA2773226C (fr) | Composes aldehydes et nitriles issus de l'isophorone, ainsi que leur utilisation en parfumerie | |
| EP3221290B1 (fr) | Acide 2-octylcyclopropyl-1-carboxylique et ses isomères et utilisations | |
| FR2528035A1 (fr) | Nouveaux derives du bicyclo (2.2.1) heptane, leur procede de preparation et leur utilisation pour la preparation de compositions parfumees | |
| WO2009056756A1 (fr) | Octane(ène) nitriles substitués, leurs procédés de synthèses et leurs utilisations en parfumerie | |
| HK1116158B (en) | Novel odorant compounds, synthesis method, and uses of said compounds | |
| EP2112132A1 (fr) | Nouveaux aldehydes a structures norbornane, leur preparation et utilisation en parfumerie | |
| HK1209075B (en) | Method for synthesising cyclohexenones and the use of same in the perfume industry |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 07804003 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| NENP | Non-entry into the national phase |
Ref country code: RU |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 07804003 Country of ref document: EP Kind code of ref document: A1 |