RU2736205C1 - 1-Сульфонил-2-(дифенилфосфорил)пирролидины, обладающие цитотоксичностью в отношении раковых клеток шейки матки, и способ их получения - Google Patents
1-Сульфонил-2-(дифенилфосфорил)пирролидины, обладающие цитотоксичностью в отношении раковых клеток шейки матки, и способ их получения Download PDFInfo
- Publication number
- RU2736205C1 RU2736205C1 RU2020117071A RU2020117071A RU2736205C1 RU 2736205 C1 RU2736205 C1 RU 2736205C1 RU 2020117071 A RU2020117071 A RU 2020117071A RU 2020117071 A RU2020117071 A RU 2020117071A RU 2736205 C1 RU2736205 C1 RU 2736205C1
- Authority
- RU
- Russia
- Prior art keywords
- sulfonyl
- pyrrolidines
- diphenylphosphoryl
- formula
- cells
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims abstract description 12
- 231100000135 cytotoxicity Toxicity 0.000 title claims description 11
- 230000003013 cytotoxicity Effects 0.000 title claims description 11
- 206010008342 Cervix carcinoma Diseases 0.000 title claims description 5
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 title claims description 4
- 201000010881 cervical cancer Diseases 0.000 title claims description 4
- 150000003235 pyrrolidines Chemical class 0.000 title abstract description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims abstract description 17
- 238000006243 chemical reaction Methods 0.000 claims abstract description 10
- XGRJZXREYAXTGV-UHFFFAOYSA-N chlorodiphenylphosphine Chemical compound C=1C=CC=CC=1P(Cl)C1=CC=CC=C1 XGRJZXREYAXTGV-UHFFFAOYSA-N 0.000 claims abstract description 7
- 239000002904 solvent Substances 0.000 claims abstract description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 claims description 12
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 claims description 9
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 8
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 239000008096 xylene Substances 0.000 claims description 3
- 238000002955 isolation Methods 0.000 claims 1
- 150000001875 compounds Chemical class 0.000 abstract description 26
- 206010028980 Neoplasm Diseases 0.000 abstract description 8
- 201000011510 cancer Diseases 0.000 abstract description 5
- 230000001472 cytotoxic effect Effects 0.000 abstract description 5
- 230000005907 cancer growth Effects 0.000 abstract description 4
- 230000000694 effects Effects 0.000 abstract description 4
- 206010067482 No adverse event Diseases 0.000 abstract description 3
- 231100000252 nontoxic Toxicity 0.000 abstract description 3
- 239000000126 substance Substances 0.000 abstract description 3
- 239000007795 chemical reaction product Substances 0.000 abstract 1
- 238000000605 extraction Methods 0.000 abstract 1
- 210000004027 cell Anatomy 0.000 description 29
- 230000015572 biosynthetic process Effects 0.000 description 17
- 238000003786 synthesis reaction Methods 0.000 description 16
- -1 Phosphorous organic compounds Chemical class 0.000 description 12
- 239000003814 drug Substances 0.000 description 12
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 10
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 10
- 229940079593 drug Drugs 0.000 description 10
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 7
- 238000013459 approach Methods 0.000 description 6
- 210000005229 liver cell Anatomy 0.000 description 6
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 6
- 108091005804 Peptidases Proteins 0.000 description 5
- 102000035195 Peptidases Human genes 0.000 description 5
- 229960004679 doxorubicin Drugs 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 210000004185 liver Anatomy 0.000 description 5
- 229910052698 phosphorus Inorganic materials 0.000 description 5
- 239000011574 phosphorus Substances 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 229960001603 tamoxifen Drugs 0.000 description 5
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 4
- 229960000583 acetic acid Drugs 0.000 description 4
- 231100000433 cytotoxic Toxicity 0.000 description 4
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 3
- 239000004365 Protease Substances 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 235000001014 amino acid Nutrition 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 238000002329 infrared spectrum Methods 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 238000001819 mass spectrum Methods 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 3
- 238000007363 ring formation reaction Methods 0.000 description 3
- 210000004881 tumor cell Anatomy 0.000 description 3
- LBUJPTNKIBCYBY-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoline Chemical compound C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 description 2
- ZVJHJDDKYZXRJI-UHFFFAOYSA-N 1-Pyrroline Chemical compound C1CC=NC1 ZVJHJDDKYZXRJI-UHFFFAOYSA-N 0.000 description 2
- 238000004679 31P NMR spectroscopy Methods 0.000 description 2
- 108010074860 Factor Xa Proteins 0.000 description 2
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 2
- 102000000424 Matrix Metalloproteinase 2 Human genes 0.000 description 2
- 108010016165 Matrix Metalloproteinase 2 Proteins 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 229930013930 alkaloid Natural products 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 229940041181 antineoplastic drug Drugs 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 229940125890 compound Ia Drugs 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 210000005260 human cell Anatomy 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000002427 irreversible effect Effects 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 2
- 235000019833 protease Nutrition 0.000 description 2
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- DWCLZPVTOUGAER-UHFFFAOYSA-N (1,2-dibromo-2,2-dichloroethyl) dihydrogen phosphate Chemical compound OP(O)(=O)OC(Br)C(Cl)(Cl)Br DWCLZPVTOUGAER-UHFFFAOYSA-N 0.000 description 1
- SDRLIJGZABUQRL-BYPYZUCNSA-N (2s)-1-phosphonopyrrolidine-2-carboxylic acid Chemical compound OC(=O)[C@@H]1CCCN1P(O)(O)=O SDRLIJGZABUQRL-BYPYZUCNSA-N 0.000 description 1
- XDCJHUIVYQHWJP-UHFFFAOYSA-N 1-(benzenesulfonyl)-2-ethoxypyrrolidine Chemical compound CCOC1CCCN1S(=O)(=O)C1=CC=CC=C1 XDCJHUIVYQHWJP-UHFFFAOYSA-N 0.000 description 1
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 1
- 150000004064 1-pyrrolines Chemical class 0.000 description 1
- OWVIKBRKPCTDEP-UHFFFAOYSA-N 2-methyl-n-[[4-(2-pyrrolidin-1-ylsulfonylphenyl)phenyl]methyl]propan-1-amine Chemical compound C1=CC(CNCC(C)C)=CC=C1C1=CC=CC=C1S(=O)(=O)N1CCCC1 OWVIKBRKPCTDEP-UHFFFAOYSA-N 0.000 description 1
- FDAMVVHYWSPPFN-UHFFFAOYSA-N 2-sulfonylpyrrolidine Chemical class O=S(=O)=C1CCCN1 FDAMVVHYWSPPFN-UHFFFAOYSA-N 0.000 description 1
- GFLPSABXBDCMCN-UHFFFAOYSA-N 4,4-diethoxybutan-1-amine Chemical compound CCOC(OCC)CCCN GFLPSABXBDCMCN-UHFFFAOYSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- NEJJTXMKXNJATM-UHFFFAOYSA-N C(C)OC(CCCNS(=O)=O)OCC Chemical class C(C)OC(CCCNS(=O)=O)OCC NEJJTXMKXNJATM-UHFFFAOYSA-N 0.000 description 1
- IKHXUJXPTUZNOK-UHFFFAOYSA-N COP(N)=O Chemical group COP(N)=O IKHXUJXPTUZNOK-UHFFFAOYSA-N 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 102100036968 Dipeptidyl peptidase 8 Human genes 0.000 description 1
- 102000003779 Dipeptidyl-peptidases and tripeptidyl-peptidases Human genes 0.000 description 1
- 108090000194 Dipeptidyl-peptidases and tripeptidyl-peptidases Proteins 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 206010014612 Encephalitis viral Diseases 0.000 description 1
- 101000804947 Homo sapiens Dipeptidyl peptidase 8 Proteins 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 1
- BVMWIXWOIGJRGE-UHFFFAOYSA-N NP(O)=O Chemical compound NP(O)=O BVMWIXWOIGJRGE-UHFFFAOYSA-N 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 102000003840 Opioid Receptors Human genes 0.000 description 1
- 108090000137 Opioid Receptors Proteins 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- GMZVRMREEHBGGF-UHFFFAOYSA-N Piracetam Chemical compound NC(=O)CN1CCCC1=O GMZVRMREEHBGGF-UHFFFAOYSA-N 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 208000001435 Thromboembolism Diseases 0.000 description 1
- 229910021627 Tin(IV) chloride Inorganic materials 0.000 description 1
- 229930183665 actinomycin Natural products 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 150000001371 alpha-amino acids Chemical class 0.000 description 1
- 235000008206 alpha-amino acids Nutrition 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 229940019748 antifibrinolytic proteinase inhibitors Drugs 0.000 description 1
- 238000009876 asymmetric hydrogenation reaction Methods 0.000 description 1
- 238000011914 asymmetric synthesis Methods 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- HQABUPZFAYXKJW-UHFFFAOYSA-N butan-1-amine Chemical class CCCCN HQABUPZFAYXKJW-UHFFFAOYSA-N 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- XAUWEBGFLMOONX-UHFFFAOYSA-N carbamic acid;pyrrolidine-1-sulfonamide Chemical class NC(O)=O.NS(=O)(=O)N1CCCC1 XAUWEBGFLMOONX-UHFFFAOYSA-N 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 208000019065 cervical carcinoma Diseases 0.000 description 1
- 210000003679 cervix uteri Anatomy 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229940126142 compound 16 Drugs 0.000 description 1
- 150000001470 diamides Chemical class 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000000855 fungicidal effect Effects 0.000 description 1
- 239000003540 gamma secretase inhibitor Substances 0.000 description 1
- 239000012362 glacial acetic acid Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 208000002672 hepatitis B Diseases 0.000 description 1
- 230000002363 herbicidal effect Effects 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 125000003387 indolinyl group Chemical class N1(CCC2=CC=CC=C12)* 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 238000003402 intramolecular cyclocondensation reaction Methods 0.000 description 1
- HPHUVLMMVZITSG-ZCFIWIBFSA-N levetiracetam Chemical compound CC[C@H](C(N)=O)N1CCCC1=O HPHUVLMMVZITSG-ZCFIWIBFSA-N 0.000 description 1
- 229960004002 levetiracetam Drugs 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 239000003771 matrix metalloproteinase inhibitor Substances 0.000 description 1
- 229940121386 matrix metalloproteinase inhibitor Drugs 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 239000002664 nootropic agent Substances 0.000 description 1
- 230000001777 nootropic effect Effects 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 239000003401 opiate antagonist Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- CDXVUROVRIFQMV-UHFFFAOYSA-N oxo(diphenoxy)phosphanium Chemical compound C=1C=CC=CC=1O[P+](=O)OC1=CC=CC=C1 CDXVUROVRIFQMV-UHFFFAOYSA-N 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 238000003408 phase transfer catalysis Methods 0.000 description 1
- 150000003053 piperidines Chemical class 0.000 description 1
- 229960004526 piracetam Drugs 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- DHNUAKOQUGJUGA-UHFFFAOYSA-N silicon;sulfane Chemical compound [Si].S DHNUAKOQUGJUGA-UHFFFAOYSA-N 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 238000011895 specific detection Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 238000005556 structure-activity relationship Methods 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- HPGGPRDJHPYFRM-UHFFFAOYSA-J tin(iv) chloride Chemical compound Cl[Sn](Cl)(Cl)Cl HPGGPRDJHPYFRM-UHFFFAOYSA-J 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 201000002498 viral encephalitis Diseases 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/553—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having one nitrogen atom as the only ring hetero atom
- C07F9/572—Five-membered rings
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
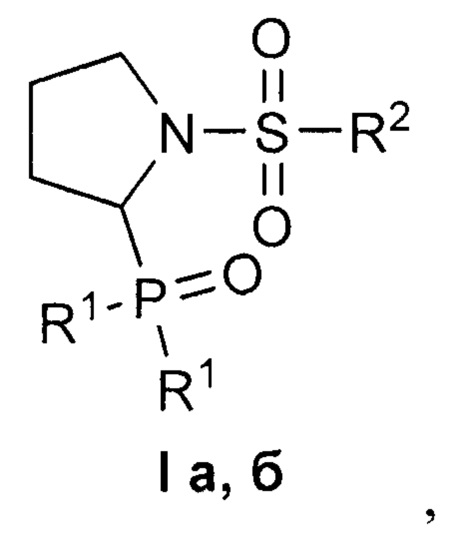
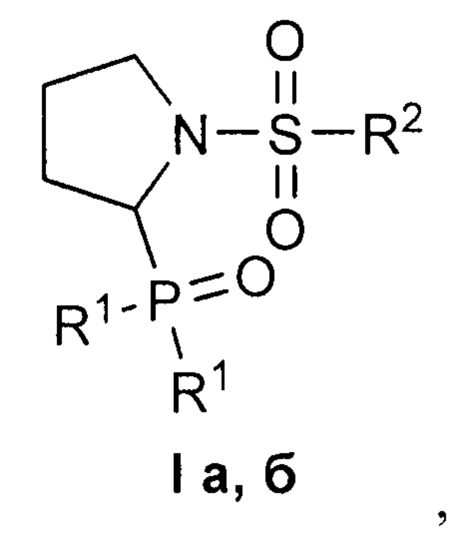
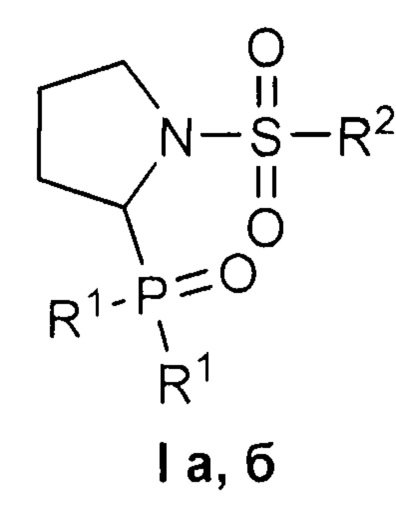
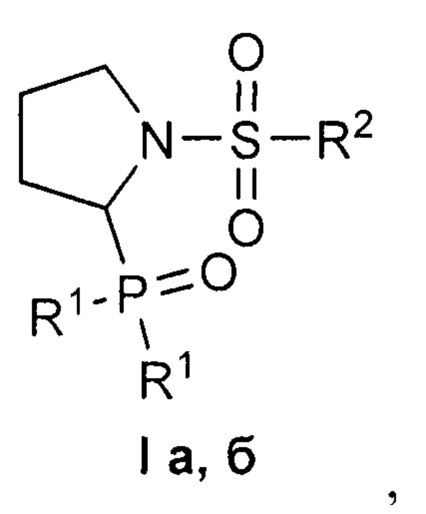
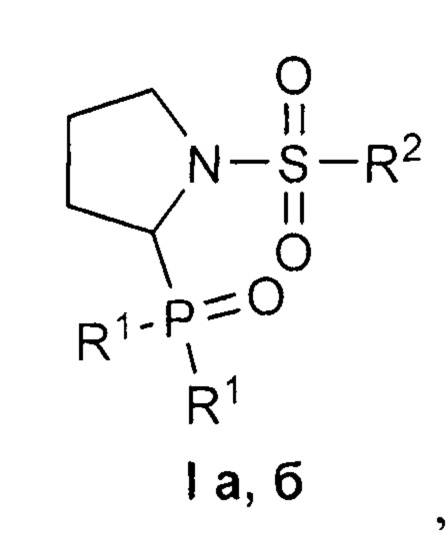
Изобретение относится к 1-сульфонил-2-(дифенилфосфорил)пирролидинам формулы I, обладающим цитотоксическим действием в отношении раковых клеток. В формуле I R1=Ph, R2=Me (a); R1=R2=Ph (б). Изобретение относится также к способу получения соединений формулы I. Способ заключается во взаимодействии 1-сульфонил-2-этоксипирролидинов представленной ниже общей формулы, для которых R = Me, Ph, с избытком дифенилхлорфосфина в присутствии уксусной кислоты в подходящем растворителе при комнатной температуре до завершения реакции и выделении целевого продукта известными способами. Технический результат: полученные соединения селективно подавляют рост раковых клеток при низком или отсутствующем токсическом действии на нормальные клетки. 3 н. и 1 з.п. ф-лы, 1 табл., 4 пр.
Description
Изобретение относится к области органической химии, в частности, к новым 1-сульфонил-2-(дифенилфосфорил)пирролидинам формулы I
где R1=Ph, R2=Me (a); R1=R2=Ph (б),
которые могут найти применение в фармакологии и медицине.
Пирролидиновый фрагмент входит в состав многих известных биологически активных соединений (Debnath В., Singh W.S., Das М., Goswami S., Singh M.K., Maiti D., Manna K. Role of plant alkaloids on human health: A review of biological activities, Mater. Today Chem., 2018, 9, 56-72; Singh P., Manda S.L.K., Samanta K., Panda G. α-Amino acids with electrically charged and polar uncharged side chains as chiral synthon: Application to the synthesis of bioactive alkaloids (1996-Dec, 2013), Tetrahedron, 2017, 73, 1911-2008; Gouliaev A.H., Senning A. Piracetam and other structurally related nootropics, Brain Res. Rev., 1994, 19, 180-222; Hollstein U. Actinomycin. Chemistry and mechanism of action, Chem. Rev., 1974, 74, 625-652). Согласно литературным данным, пирролидин является одним из наиболее часто встречающихся в составе лекарственных препаратов гетероциклов (Haria М., Balfour J.A. Levetiracetam, CNS Drugs, 1997, 7, 159-164). Следует особо отметить один из новых противораковых препаратов, содержащих фрагмент 2-замещенного пирролидина, «Акалабрутиниб» (Byrd J.С., Harrington В., O'Brien S., Jones J.A., Schuh A., Devereux S., Chaves J., Wierda W.G., Awan F.T., Brown J.R., Hillmen P., Stephens D.M., Ghia P., Barrientos J.C., Pagel J.M., Woyach J., Johnson D., Huang J., Wang X., et al. Acalabrutinib (ACP-196) in Relapsed Chronic Lymphocytic Leukemia, N. Engl. J. Med., 2016, 374, 323-332) компании «Астра Зенека» для взрослых пациентов с мантийноклеточной лимфомой, одобренный Управлением по контролю качества пищевых продуктов и лекарственных средств США в 2017 году.
Значительный интерес вызывают производные пирролидина, имеющие в своем составе фосфорорганический фрагмент - фосфорсодержащие аналоги аминокислоты пролина. В частности, представители этого класса соединений обладают бактерицидными, фунгицидными, гербицидными свойствами (Sirrenberg W., Hammann I., Homeyer В. O-(1,2-dibromo-2,2-dichloro-ethyl)-phosphoric acid diester-amides, 3911058, 1975; Sirrenberg W., Hammann I. O-(1-Methyl-2-alkylmercapto-vinyl)-phosphoric acid ester amides, 3856892, 1999; Hassan J. Phosphorous organic compounds and their use, 6812224, 2004); олигопептиды, содержащие фрагмент фосфопролина (2-фосфорилпирролидина) могут выступать в качестве ингибиторов различных протеаз (Vander Veken P., Soroka A., Brandt I., Chen Y.-S., Maes M.-B., Lambeir A.-M., Chen X., Haemers A., S., Augustyns K., DeMeester I. Irreversible Inhibition of Dipeptidyl Peptidase 8 by Dipeptide-Derived Diaryl Phosphonates, J. Med. Chem., 2007, 50, 5568-5570; Belyaev A., Zhang X., Augustyns K., Lambeir A.-M., DeMeester I., Vedernikova I., S., Haemers A. Structure-Activity Relationship of Diaryl Phosphonate Estersas Potent Irreversible Dipeptidyl Peptidasel VInhibitors, J. Med. Chem., 1999, 42, 1041-1052; Gilmore B.F., Carson L., McShane L.L., Quinn D., Coulter W.A., Walker B. Synthesis, kinetic evaluation, and utilization of abiotic nylateddipeptideproline diphenylphosphonate for the disclosure of dipeptidyl peptidase IV-likeserine proteases, Biochem. Biophys. Res. Commun., 2006, 347, 373-379; E., Т., Niessen S., Cravatt B.F., Giralt E. Activity-Based Probes for Monitoring Postproline Protease Activity, ChemBioChem, 2009, 10, 2361-2366) и протеиназы ВИЧ-1 (Camp N.P., Hawkins P.C.D., Hitchcock P.B., Gani D. Synthesis of stereochemically defined phosphonamidate-containing peptides: Inhibitors for the HIV-1 proteinase, Bioorg. Med. Chem. Lett., 1992, 2, 1047-1052; Camp N.P., Perrey D.A., Kinchington D., Hawkins P.C.D., Gani D. Synthesis of peptide analogues containing phosphonamidate methyl ester functionality: HIV-1 proteinase inhibitors possessing unique cell uptake properties, Bioorg. Med. Chem., 1995, 3, 297-312). Нуклеозид, содержащий фрагмент 2-фосфорилпирролидина, может быть использован при лечении гепатита, в частности, вирусного гепатита В (Das Н., Wang L., Kamath А., Bukowski J.F. Vgamma 2 V delta 2 T-cellreceptor-mediated recognition of aminobis phosphonates, Blood, 2001, 98, 1616-1618). Неменьший интерес вызывают производные 1-сульфонилпирролидина, предложенные для лечения тромбоэмболических (Noguchi Т., Tanaka N., Nishimata Т., Goto R., Hayakawa M., Sugidachi A., Ogawa Т., Asai F., Fujimoto K., Matsui Y., Fujimoto K. Indoline Derivatives I: Synthesisand Factor Xa (FXa) Inhibitory Activities, Chem. Pharm. Bull. (Tokyo)., 2006, 55, 1494-1504) и нейродегенеративных заболеваний, таких, как болезнь Паркинсона (Vincent M., W. 1-Sulfonylpyrrolidine derivatives, US 2003212066, 2013; Vincent M., Eric V., W. 1-arenesulfonyl-2-aryl-pyrrolidineand piperidine derivatives, US 6284785B1, 04.09.2001) и Альцгеймера (Guo Т., Gu H., Hobbs D.W., Rokosz L.L., Stauffer T.M., Jacob В., Clader J.W. Design, synthesis, and evaluation of tetrahydroquinoline and pyrrolidine sulfonamide carbamates as γ-secretase inhibitors, Bioorg. Med. Chem. Lett., 2007, 17, 3010-3013); а также способные выступать в качестве антагонистов опиоидных рецепторов (Verhoest P.R., Sawant Basak A., Parikh V., Hayward М., Kauffman G.W., Paradis V., McHardy S.F., McLean S., Grimwood S., Schmidt A.W., Vanase-Frawley M., Freeman J., VanDeusen J., Cox L., Wong D., Liras S. Designand Discovery of a Selective Small Molecule к Opioid Antagonist (2-Methyl-N-((2'-(pyrrolidin-1-ylsulfonyl)biphenyl-4-yl)methyl)propan-1-amine, PF-4455242), J. Med. Chem., 2011, 54, 5868-5877) и хемокинового рецептора CCR4 (Burdi D.F., Chi S., Mattia K., Flarrington C., Shi Z., Chen S., Jacutin-Porte S., Bennett R., Carson K., Yin W., Kansra V., Gonzalo J.-A., Coyle A., Jaffee В., Ocain Т., Hodge M., LaRosa G., Harriman G. Small molecule antagonists of the CC chemokinereceptor 4 (CCR4), Bioorg. Med. Chem. Lett., 2007, 17, 3141-3145). Кроме того, имеются сведения об ингибировании этими соединениями матриксной металлопротеиназы 2 (ММР2) (Cheng X.-С., Wang Q., Fang Н., Tang W., Xu W.-F. Synthesis of new sulfonylpyrrolidine derivatives as matrix metalloproteinase inhibitors, Bioorg. Med. Chem., 2008, 16, 7932-7938). В то же время, несмотря на интенсивные исследования в области химии и фармакологии производных 2-фосфорилпирролидина и 1-сульфонилпирролидина, сведения об их противораковой активности и цитотоксическом действии в отношении раковых клеток представлены в литературе единственным примером (Bagautdinova R.K., Vagapova L.I., Smolobochkin A.V., Gazizov A.S., Burilov A.R., Pudovik M.A., Voloshina A.D. Synthesis of 1-(2-aminoethylsulfonyl)-2-phosphorylpyrrolidines viaconsecutive Arbuzovandaza-Michaelre actions and theirantitumor activity, Mendeleev Commun., 2019, 29, 686-687).
Имеющиеся методы синтеза фосфорсодержащих производных пирролидина могут быть разделены на два основных подхода. Первый базируется на модификации уже имеющегося пирролидинового ядра. Наибольшее распространение в рамках этого подхода получили методы, основанные на взаимодействии производных 1-пирролина (Huang S., Chen Z., Du L., Tian Q., Liu Y., Zheng Y., Liu Y. Site-Specific Detection of Free Radicals in Membranes Using an Amphiphilic Spin Trap, Appl. Magn. Reson., 2015, 46, 489-504; Odinets I.L., Artyushin O.I., Lyssenko K.A., Shevchenko N.E., Nenajdenko V.G., G.-V. Facile synthesis of cyclic α-perfluoroalky 1-α-aminophosphonates, J. Fluor. Chem., 2009, ISO, 662-666; Odinets I., Artyushin O., Shevchenko N., Petrovskii P., Nenajdenko V., G.-V. Efficient Synthesis of Substituted Cyclic α-Aminophosphonates, Synthesis (Stuttg)., 2009, 2009, 577-582), либотримера 1-пирролина (Couture A., Deniau E., Lebrun S., Grandclaudon P., Carpentier J.-F. A new route to ene carbamates, precursors to benzoindolizinones through sequential asymmetric hydrogenation and cyclization, J. Chem. Soc. Perkin Trans. 1, 1998, 1403-1408; Borloo M., Jiao X.-Y., H., Rajan P., Verbruggen C, Augustyns K., Haemers A. A Convenient One-Pot Preparation of Disubstituted Phosphinic Acids Derived from Simple Amino Acids and Proline, Synthesis (Stuttg)., 1995, 1995, 1074-1076; Koeller K.J., Rath N.P., Spilling CD. Reactions of chiral phosphorus acid diamides: lewis acid catalyzed addition to imines and oxidation with SnCl4, Phosphorus. Sulfur. Silicon Relat. Elem., 1995, 103, 171-181) с гидрофосфорильными соединениями (реакция Пудовика). Основными ограничениями этого подхода являются доступность и стабильность соответствующим образом замещенных исходных производных пирролидина, многостадийность превращений, требуемых для получения целевых соединений. Второй подход включает в себя формирование пирролидинового цикла из ациклических предшественников. Чаще всего в качестве исходных соединений используются производные бутан-1-амина, содержащие фосфорильный заместитель (Qian R., Horak J., Hammerschmidt F. Conversion of nitriles to 1-aminophosphonic acids and preparation of phosphahomocysteines of high enantiomeric excess., Phosphorus, Sulfur Silicon Relat. Elem., 2017, 192, 737-744; O.A., Romero-Estudillo I.I., Viveros-Ceballos J.L.J. L., Cativiela С., M., Ramirez-Marroquin O.A., Romero-Estudillo I.I., Viveros-Ceballos J.L., Cativiela С., Ordonez M. Convenient Synthesis of Cyclic α-Aminophosphonates by Alkylation-Cyclization Reaction of Iminophosphoglycinates Using Phase-Transfer Catalysis., European J. Org. Chem., 2016, 2016, 308-313; Chen Q., Yuan C. A Facile Synthesis of Chiral 4-(tert-Butylsulfinylamino)-2-oxophosphonates and Their Conversion into 5,5-Disubstituted 2-Benzylidene-3-oxopyrrolidines, Synthesis (Stuttg)., 2008, 2008, 1085-1093; Davis F.A., Wu Y., Xu H., Zhang J. Asymmetric Synthesis of Cis-5-Substituted Pyrrolidine 2-Phosphonates Using Metal Carbenoid NH Insertion and δ-Amino β-Ketophosphonates., Org. Lett., 2004, 6, 4523-4525). Существенным недостатком этого подхода является необходимость предварительного введения в молекулы соединений-предшественников как фосфорильного фрагмента, так и функциональных групп, обеспечивающих возможность внутри- или межмолекулярной циклизации, что усложняет синтетическую схему и приводит к снижению выхода целевого соединения.
Задачей изобретения является создание новых средств, обладающих цитотоксичностью в отношении раковых клеток, и при этом оказывающих низкое токсическое влияние на нормальные клетки, расширяющих ассортимент средств указанного назначения.
Техническим результатом является свойство новых 1-сульфонил-2-фосфорилпирролидинов селективно подавлять рост раковых клеток при низком или отсутствующем токсическом действии на нормальные клетки. Технический результат также состоит в расширении арсенала средств указанного назначения.
Поставленная задача решается, и технический результат достигается заявляемыми новыми 1-сульфонил-2-(дифенилфосфорил)пирролидинами формулы I:
где R1=Ph, R2=Me (a); R1=R2=Ph (б).
Характеристики соединений формулы I приведены в соответствующих примерах, иллюстрирующих изобретение.
Для данных соединений определено свойство селективно подавлять рост раковых клеток при отсутствующем токсическом действии на нормальные клетки, что делает их перспективными в качестве новых противораковых препаратов. Заявленные соединения исследованы на цитотоксичность в отношении клеточных линий человека - нормальных клеток печени Chang liver и опухолевых М-Hela (рак шейки матки).
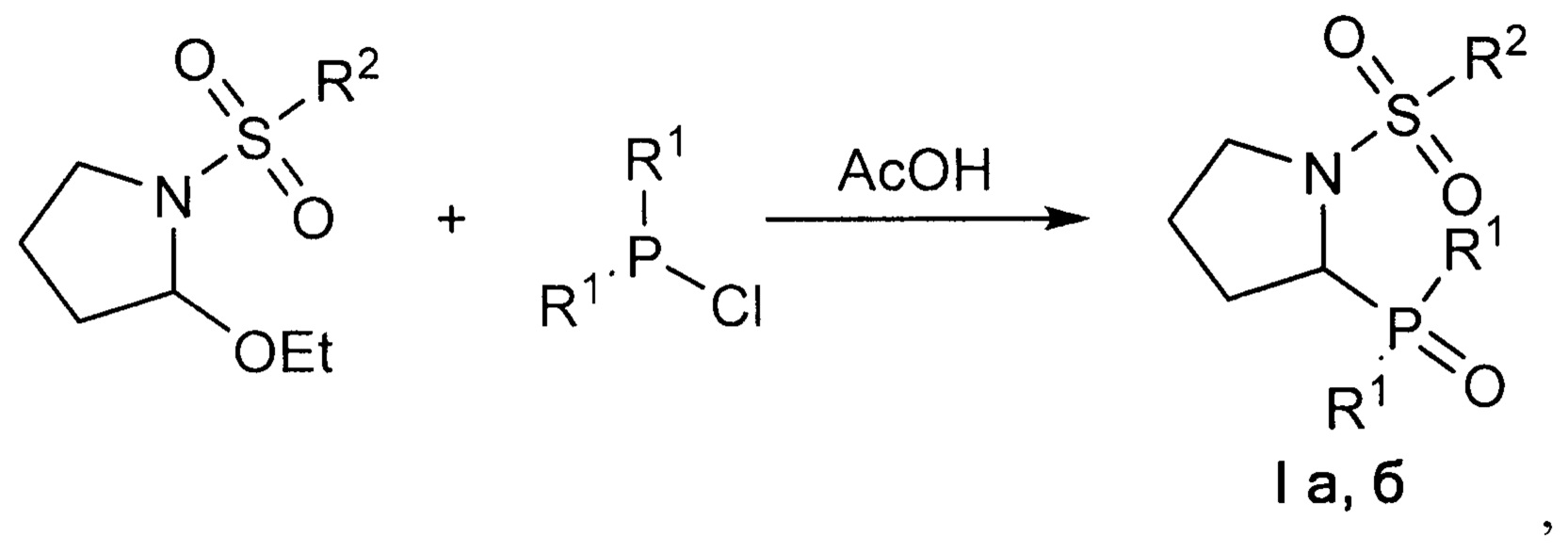
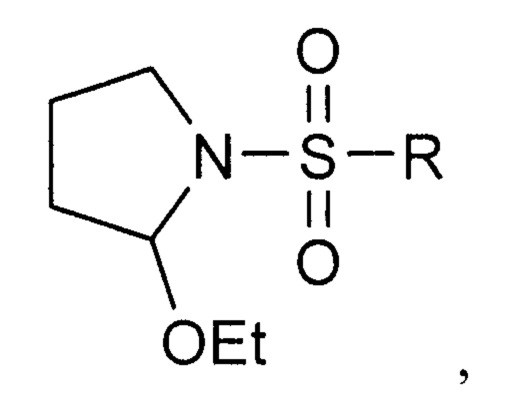
Кроме того поставленная задача решается, и технический результат достигается заявляемым способом получения 1-сульфонил-2-(дифенилфосфорил)пирролидинов формулы I, включающим взаимодействие при комнатной температуре 2-этокси-1-сульфонилпирролидинов с избытком дифенилхлорфосфина в присутствии уксусной кислоты в инертных растворителях, в качестве которых могут быть использованы хлороформ, бензол, толуол, ксилол. Далее выделяют целевой продукт известными способами. Контроль за прохождением реакции осуществляют методом 31Р ЯМР-спектроскопии. Отсутствие избытка дифенилхлорфосфина приводит к снижению выхода целевого продукта.
Ниже приведена схема получения 1-сульфонил-2-(дифенилфосфорил)пирролидинов формулы I
где R1=Ph, R2=Me (a); R1=R2=Ph (б).
Исходные 2-этокси-1-сульфонилпирролидины были синтезированы по известной методике исходя из соответствующего сульфонилхлорида и 4,4-диэтоксибутан-1-амина (Gazizov A.S., Smolobochkin A.V., Anikina Е.А., Voronina J.K., Burilov A.R., Pudovik M.A. Acid-catalized Intramolecular Cyclization of N-(4,4-diethoxybutyl)sulfonamides as a Novel Approach to the 1-Sulfonyl-2 aryl-pyrrolidines, Synth. Commun., 2017, 47, 44-52).
При осуществления заявленного способа были использованы коммерчески доступные растворители и реагенты: дифенилхлорфосфин (Tokyo Chemical Industry Co., чистота >97%), уксусная кислота (Tokyo Chemical Industry Co., чистота >99.5%), хлороформ, бензол, толуол, ксилол (ООО НПФ «ТатХимПродукт», марка ХЧ).
Изобретение иллюстрируется примерами получения заявляемых соединений формулы I и исследования их цитотоксичности в отношении нормальных клеток печени и опухолевых клеток шейки матки.
Пример 1.
Получение(1-(Метилсульфонил)пирролидин-2-ил)дифенилфосфин оксида (Ia).
В круглодонную колбу помещают 0.29 г 2-этокси-1-(метилсульфонил)пирролидина (1.52 ммоль) и 10 мл абсолютного хлороформа. Затем добавляют 0.39 г дифенилхлорфосфина (1.77 ммоль) и 0.1 мл ледяной уксусной кислоты (1.75 ммоль), перемешивают при температуре 20°С в течение 24 часов до окончания реакции. Контроль за прохождением реакции осуществляют методом 31Р ЯМР-спектроскопии. Затем от реакционной смеси отгоняют растворитель, остаток промывают диэтиловым эфиром (5 мл). Образовавшийся белый осадок отфильтровывают и сушат в вакууме (10 мм рт. ст., 20°С, 5 ч). Выход 0.34 г (65%), т.пл. 169°С. ИК спектр ν, см-1: 1341, 1438, 1591, 2938. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.78-1.89 м (1Н, СН2), 1.90-2.02 м (2Н, СН2), 2.08-2.20 м (1Н, СН2), 2.77 с (3Н, СН3), 3.21-3.31 м (1Н, СН2), 3.51-3.63 м (1Н, СН2), 5.00-5.10 м (1Н, СН), 7.45-7.63 м (6Н, CHAr), 7.79-7.85 м (2Н, CHAr), 7.88-7.95 м (2Н, CHAr). Спектр ЯМР 13С (ДМСО-d6), δ, м. д.: 25.03, 26.73, 36.76, 50.03, 58.32 д (J 85.6 Гц), 128.57 д (Л 1.5 Гц), 129.24 д (J 10.9 Гц), 131.45 д (J 8.5 Гц), 132.29 д (J 8.2 Гц). Спектр ЯМР 31Р (ДМСО-d6), δ, м. д.: 30.67. Масс-спектр (ESI-TOF), m/z: 372 [М+Na]+. Найдено, %: С, 58.55; Н, 5.90; N, 3.93; Р, 8.92; S, 9.33. C17H20NO3PS. Вычислено, %: С, 58.44; Н, 5.77; N, 4.01; Р, 8.87; S, 9.18.
Пример 2.
Дифенил(1-(фенилсульфонил)пирролидин-2-ил)фосфин оксид - Iб получают аналогично примеру 1 из 0.39 г 2-этокси-1-(фенилсульфонил)пирролидина (1.52 ммоль). Получают белый порошок. Выход 0.19 г (30%), т.пл. 138-139°С. ИК спектр ν, см-1: 1349, 1438, 1590, 2972. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:0.99-1.14 м (1Н, СН2), 1.50-1.63 м (1Н, СН2), 1.71-1.84 м (2Н, СН2), 3.22-3.31 м (1Н, СН2), 3.39-3.47 м (1Н, СН2), 5.14-5.24 м (1Н, СН), 7.50-7.60 м (6Н, CHAr), 7.69 т (1Н, CHAr, J 7.5 Гц), 7.71-7.76 м (2Н, CHAr), 7.84 д (2Н, CHAr, J 7.4 Гц), 7.86-7.93 м (2Н, CHAr), 7.94-7.99 м (2Н, CHAr). Спектр ЯМР 31Р (ДМСО-d6), δ, м. д.: 31.98. Спектр ЯМР 13С (ДМСО-d6), δ, м. д.: 24.35, 26.06, 50.04, 58.66 д (J 84.8 Гц), 128.00, 128.62 д (J 11.6 Гц), 124.29 д (J 11.0 Гц), 132.13 д (J 9.2 Гц), 132.33 д (J 27.5 Гц), 133.79, 138.31. Масс-спектр (ESI-TOF), m/z: 412 [М+Н]+, 434 [М+Na]+. Найдено, %: С, 64.51; Н, 5.65; N, 3.39; Р, 7.79; S, 7.87. C22H22NO3PS. Вычислено, %: С, 64.22; Н, 5.39; N, 3.40; Р, 7.53; S, 7.79.
Пример 3.
Дифенил(1-(фенилсульфонил)пирролидин-2-ил)фосфин оксид - Iб получают аналогично примеру 2, используя в качестве растворителя 10 мл абсолютного бензола. Получают белый порошок. Выход 0.21 г (34%), т.пл. 138-139°С. ИК спектр ν, см-1: 1349, 1438, 1590, 2972. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:0.99-1.14 м (1Н, СН2), 1.50-1.63 м (1Н, СН2), 1.71-1.84 м (2Н, СН2), 3.22-3.31 м (1Н, СН2), 3.39-3.47 м (1Н, СН2), 5.14-5.24 м (1Н, СН), 7.50-7.60 м (6Н, CHAr), 7.69 т (1Н, CHAr, J 7.5 Гц), 7.71-7.76 м (2Н, CHAr), 7.84 д (2Н, CHAr, J 7.4 Гц), 7.86-7.93 м (2Н, CHAr), 7.94-7.99 м (2Н, CHAr). Спектр ЯМР 31Р (ДМСО-d6), δ, м. д.: 31.98. Спектр ЯМР 13С (ДМСО-d6), δ, м. д.: 24.35, 26.06, 50.04, 58.66 д (J 84.8 Гц), 128.00, 128.62 д (J 11.6 Гц), 124.29 д (J 11.0 Гц), 132.13 д (J 9.2 Гц), 132.33 д (J 27.5 Гц), 133.79, 138.31. Масс-спектр (ESI-TOF), m/z: 412 [М+Н]+, 434 [М+Na]+. Найдено, %: С, 64.51; Н, 5.65; N, 3.39; Р, 7.79; S, 7.87. C22H22NO3PS. Вычислено, %: С, 64.22; Н, 5.39; N, 3.40; Р, 7.53; S, 7.79.
Пример 4.
Цитотоксичность заявляемых соединений
Соединения Ia и Iб были исследованы на цитотоксичность в отношении нормальных и опухолевых клеточных линий человека Chang liver и M-Hela (рак шейки матки). Оценку их цитотоксического действия проводят путем подсчета жизнеспособных клеток с помощью многофункциональной системы Cytell Cell Imaging (GE Helth care Life Science, Швеция), используя приложение Cell Viability Bio App, которое позволяет точно подсчитать количество клеток, оценить их жизнеспособность на основании интенсивности флуоресценции.
В экспериментах используют два флуоресцентных красителя, которые избирательно проникают в клеточные мембраны и флуоресцируют на разных длинах волн. Низкомолекулярный 4',6-диамидин-2-фенилиндол (DAPI) способен проникать через неповрежденные мембраны живых клеток и окрашивать ядра в синий цвет. Высокомолекулярный пропидий йодид способен проникает только в мертвые клетки с поврежденными мембранами, окрашивая их в желтый цвет. В результате живые клетки окрашиваются в синий цвет, а мертвые -в желтый. В исследовании использованы 4',6-Диамидин-2-фенилиндол и пропидий йодид производства фирмы Sigma-Aldrich (MerckK GaA, Германия).
Клетки культивируют в стандартной питательной среде «Игла», изготовленной в Институте полиомиелита и вирусных энцефалитов имени М.П. Чумакова (компания РаnЕсо), с добавлением 10% эмбриональной сыворотки теленка и 1% заменимых аминокислот. Клетки высевают в 96-луночный планшет (Eppendorf) в концентрации 100000 клеток/мл, 150 мкл среды на лунку и культивируют в CO2-инкубаторе при 37°С. Через 24 часа после посева клеток в лунки добавляют исследуемое соединение определенной концентрации (150 мкл/лунку). Растворы соединений (1-100μМ) готовят непосредственно в питательной среде с добавлением для лучшей растворимости 5% ДМСО, раствор которого не вызывает ингибирования клеток при этой концентрации. Каждый эксперимент повторяют три раза. В качестве контроля используют интактные клетки, культивируемые параллельно с экспериментальными клетками.
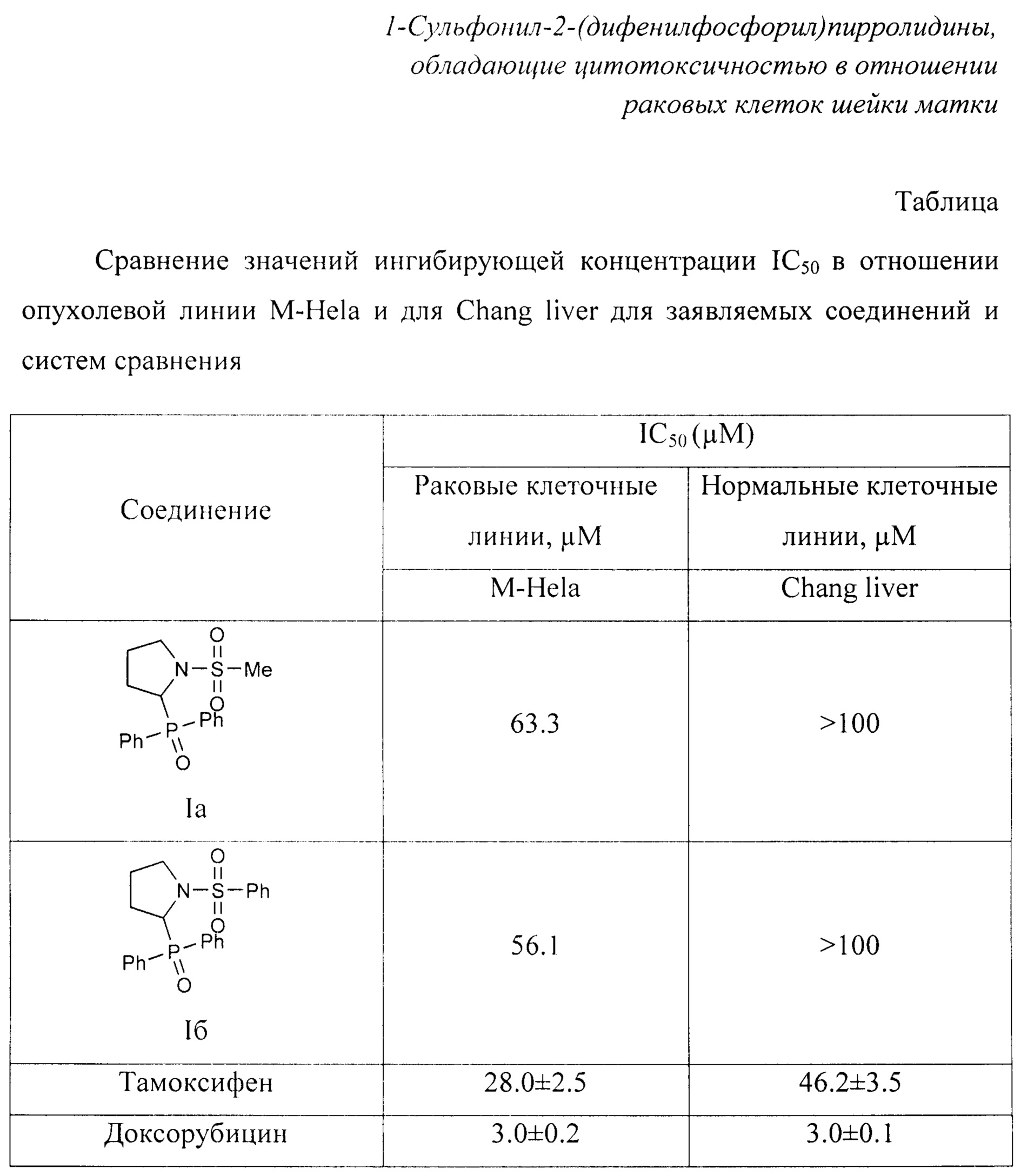
Для экспериментов используют опухолевую культуру клеток М-Hela клон 11 (эпителиоидная карцинома шейки матки, сублиния Hela, клон М-Hela), полученную из Федерального государственного бюджетного учреждения науки «Институт цитологии Российской академии наук», и культуру нормальных клеток печени (Chang liver), полученную из Федерального государственного бюджетного учреждения «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи». Полученные значения концентраций полумаксимального ингибирования (IC50) для соединений Ia и Iб приведены в таблице. В качестве препаратов сравнения используют известные препараты Тамоксифен и Доксорубицин.
Экспериментально определенное значение концентрации полумаксимального ингибирования (IC50) для соединения Ia составила 63.3 μМ, для соединения Iб - 56.1 μМ, для препаратов сравнения Тамоксифена и Доксорубицина - 28.0±2.5 и 3.0±0.2 μМ соответственно (для опухолевой культуры клеток линии М-Hela). Данные, представленные в таблице, показывают, что все исследованные соединения проявляют активность в отношении культуры клеток линии М-Hela, хотя значения IC50 препаратов сравнения оказались существенно ниже, чем для заявленных соединений: для соединения Ia значение IC50 в 2.2 раз выше, чем для препарата сравнения Тамоксифен, и в 21.1 раз выше, чем для препарата сравнения Доксорубицин, для соединения 16 значение IC50 в 2.0 раз выше, чем для Тамоксифена, и в 18.7 раз выше, чем для Доксорубицина.
В тоже время, в отличие от препаратов сравнения, заявленные соединения не проявили цитотоксичности по отношению к культуре нормальных клеток печени Chang liver в изученном диапазоне концентраций: значения IC50 для соединений Ia и Iб, составили >100 μМ, в том времени как для препарата сравнения Тамоксифен значение IC50 для нормальных клеток печени Chang liver составило 46.2±3.5 μМ, для препарата сравнения Доксорубицин - 3.0±0.1 μМ, что сравнимо со значениями цитотоксичности для раковых клеток. Значения таблицы свидетельствуют, что заявленные соединения демонстрируют селективность в диапазоне концентраций 1-100 μМ - проявляют цитотоксичность в отношении опухолевых клеток человека линии М-Hela и не проявляют цитотоксичности по отношению к нормальным клеткам печени Chang liver.
Таким образом, предложены новые 1-сульфонил-2-(дифенилфосфорил)пирролидины, обладающие цитотоксичностью в отношении раковых клеток линии М-Hela, при этом не оказывающие цитотоксического действия на нормальные клетки линии Chang liver. Заявляемые новые соединения благодаря свойству селективно подавлять рост раковых клеток при отсутствующем токсическом действии на нормальные клетки представляют интерес как новые противораковые препараты.
Предлагаемый способ получения заявляемых 1-сульфонил-2-(дифенилфосфорил)пирролидинов, основанный на взаимодействии избытка дифенилхлорфосфина с 2-этокси-1-сульфонилпирролидинамив присутствии уксусной кислоты, является новым и позволяет получать целевые соединения с выходом 30-65% в мягких условиях в одну стадию.
Claims (15)
1. 1-Сульфонил-2-(дифенилфосфорил)пирролидины формулы I
где R1=Ph, R2=Me (a); R1=R2=Ph (б).
2. 1-Сульфонил-2-(дифенилфосфорил)пирролидины формулы I
где R1=Ph, R2=Me (a); R1=R2=Ph (б),
обладающие цитотоксичностью в отношении раковых клеток шейки матки.
3. Способ получения 1-сульфонил-2-(дифенилфосфорил)пирролидинов формулы I
где R1=Ph, R2=Me (a); R1=R2=Ph (б),
включающий взаимодействие при комнатной температуре 1-сульфонил-2-этоксипирролидинов формулы
где R=Me, Ph,
с избытком дифенилхлорфосфина в присутствии уксусной кислоты в подходящем растворителе до завершения реакции и выделение целевого продукта известными способами.
4. Способ получения 1-сульфонил-2-(дифенилфосфорил)пирролидинов по п.3, отличающийся тем, что в качестве растворителя используют хлороформ, бензол, толуол, ксилол.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2020117071A RU2736205C1 (ru) | 2020-04-30 | 2020-04-30 | 1-Сульфонил-2-(дифенилфосфорил)пирролидины, обладающие цитотоксичностью в отношении раковых клеток шейки матки, и способ их получения |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2020117071A RU2736205C1 (ru) | 2020-04-30 | 2020-04-30 | 1-Сульфонил-2-(дифенилфосфорил)пирролидины, обладающие цитотоксичностью в отношении раковых клеток шейки матки, и способ их получения |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2736205C1 true RU2736205C1 (ru) | 2020-11-12 |
Family
ID=73460860
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2020117071A RU2736205C1 (ru) | 2020-04-30 | 2020-04-30 | 1-Сульфонил-2-(дифенилфосфорил)пирролидины, обладающие цитотоксичностью в отношении раковых клеток шейки матки, и способ их получения |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2736205C1 (ru) |
-
2020
- 2020-04-30 RU RU2020117071A patent/RU2736205C1/ru active
Non-Patent Citations (1)
| Title |
|---|
| А.В.СМОЛОБОЧКИН и др. Синтез 1-(арилсульфонил)пирролидинов из фенолов и 1-[(4-хлорфенил)сульфонил]-2-этоксипирролидина, ЖУРН. ОРГ. ХИМИИ, 2017, т.53, 2, с.209-212. Л.И.ВАГАПОВА и др. Первые представители арилзамещенных пирролидинов, содержащих этилфосфоновую и этилбис(фосфоновую) группу, в сборнике тезисов докладов VII МОЛОДЕЖНАЯ КОНФЕРЕНЦИЯ ИОХ РАН, М.:МАКС Пресс, 2017, с.126. А.В.СМОЛОБОЧКИН и др. Синтез 2-(дифенилфосфорил)пирролидин-1-карбоксамидов на основе реакции 1-(4,4-диэтоксибутил)мочевин с дифенилхлорфосфином, ЖУРН. ОБЩ. ХИМИИ, 2019, т.89, 10, с.1606-1610. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI593700B (zh) | 一種替諾福韋前藥及其在醫藥上的應用 | |
| CA3065178C (en) | Functionalized polymers | |
| ES2388969T3 (es) | Compuestos antivirales de fosfinato | |
| US9242941B2 (en) | Alkyl, fluoroalkyl-1,4-benzodiazepinone compounds | |
| PT1509537E (pt) | Acumulação celular de análogos de fosfonato de compostos inibidores da protease do vih e os próprios compostos | |
| KR20110066212A (ko) | 이치환된 프탈라진 헷지호그 경로 길항제 | |
| Cytlak et al. | Functionalization of α-hydroxyphosphonates as a convenient route to N-tosyl-α-aminophosphonates | |
| US20050171060A1 (en) | Phosphoramidates and methods therefor | |
| Sakla et al. | Dithiocarbamation of spiro-aziridine oxindoles: A facile access to C3-functionalised 3-thiooxindoles as apoptosis inducing agents | |
| Smolobochkin et al. | One-pot imination/Arbuzov reaction of 4-aminobutanal derivatives: Synthesis of 2-phosphorylpyrrolidines and evaluation of anticancer activity | |
| RU2736205C1 (ru) | 1-Сульфонил-2-(дифенилфосфорил)пирролидины, обладающие цитотоксичностью в отношении раковых клеток шейки матки, и способ их получения | |
| Bagautdinova et al. | Synthesis of 1-(2-aminoethylsulfonyl)-2-phosphorylpyrrolidines via consecutive Arbuzov and aza-Michael reactions and their antitumor activity | |
| RU2737085C2 (ru) | Новое соединение 2,4,6-тризамещенного s-триазина, способ его получения и его применение | |
| RU2697519C1 (ru) | Средство пептидной природы, включающее псма-связывающий лиганд на основе производного мочевины, способ его получения и применение для получения конъюгата с лекарственным и диагностическим агентом | |
| BRPI1005050B1 (pt) | precursores dendriméricos tris- e tetra-funcionalizados, com atividade antimicrobiana e antitumoral e processo de preparação e uso | |
| Hadváry et al. | Conformationally Restricted Analogs of Platelet‐Activating Factor (PAF) | |
| CA2328903C (en) | Compounds capable of cleaving double-stranded dna and method of utilization of the same | |
| CN109608492B (zh) | 一种用于骨质疏松的二膦酸化合物及其制备方法 | |
| US9663545B2 (en) | Organometallic 2-cyano-2-aminobenzoate-propyl derivates and their use as anthelmintics | |
| EP1678133A1 (en) | Sequence selective pyrrole and imidazole polyamide metallocomplexes | |
| Suresh et al. | Synthesis of antimalarial compounds fosmidomycin and FR900098 through N-or P-alkylation reactions | |
| US20210317158A1 (en) | Optically active segment for use in synthesis of stereocontrolled oligonucleotide, method for producing the same, and method for synthesizing stereocontrolled oligonucleotide using the same | |
| Wróblewski et al. | Synthesis of four enantiomers of 2-acetamido-1-hydroxypropylphosphonates | |
| US5543517A (en) | Substituted bicyclic phosphoramides and derivatives thereof | |
| JP2019531304A (ja) | 薬学的使用のための鏡像異性的に純粋なシス‐イミダゾリン化合物を生成するための合成方法 |