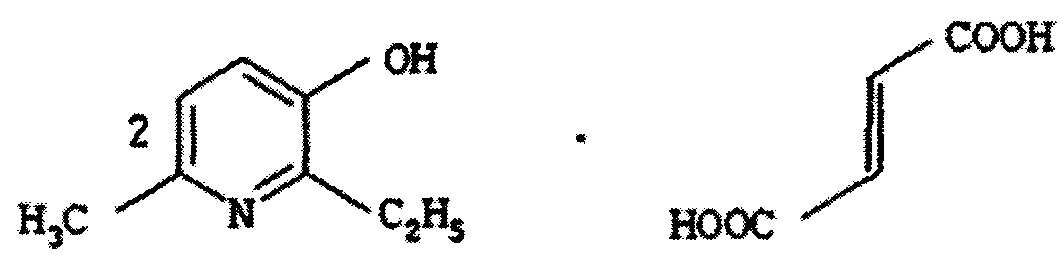RU2674286C1 - Agent for treatment of disease caused by oxidative stress - Google Patents
Agent for treatment of disease caused by oxidative stress Download PDFInfo
- Publication number
- RU2674286C1 RU2674286C1 RU2018109768A RU2018109768A RU2674286C1 RU 2674286 C1 RU2674286 C1 RU 2674286C1 RU 2018109768 A RU2018109768 A RU 2018109768A RU 2018109768 A RU2018109768 A RU 2018109768A RU 2674286 C1 RU2674286 C1 RU 2674286C1
- Authority
- RU
- Russia
- Prior art keywords
- disease
- hydroxypyridine
- ethyl
- methyl
- fumaric acid
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Abstract
Description
Изобретение относится к области медицины и химико-фармацевтической промышленности, а именно к созданию средства для лечения заболеваний, обусловленного окислительным стрессом.The invention relates to the field of medicine and the pharmaceutical industry, and in particular to the creation of an agent for the treatment of diseases caused by oxidative stress.
Окислительный (оксидативный) стресс - это результат, как правило, в следствии воспаления и/или гипоксических обстоятельств, при котором происходит нарушение в обменных процессах организма человека, что провоцирует накопление свободных радикалов (активных агентов), которые вызывают повреждение клеток, а также запускают первичные механизмы повреждающего действия в клетках, что в свою очередь вызывает различные патологические состояния и заболевания.Oxidative (oxidative) stress is the result, as a rule, as a result of inflammation and / or hypoxic circumstances, in which there is a violation in the metabolic processes of the human body, which provokes the accumulation of free radicals (active agents) that cause damage to cells and also trigger primary mechanisms of the damaging effect in the cells, which in turn causes various pathological conditions and diseases.
В настоящее время ключевым звеном окислительного повреждения клетки считается митохондриальная дисфункция. В митохондриях человека содержатся белки, кодируемые митохондриальной ДНК (м-ДНК), основная роль которых - построение дыхательной цепи и обеспечение энергетических потребностей клетки. Хорошо известно, что в процессе старения происходит<накопление мутаций м-ДНК, что нарушает структуру и функции митохондрий, приводя к дисбалансу между производством свободных радикалов и защитными возможностями организма [Chunyan Guo et al. Oxidative stress, mitochondrial damage and neurodegenerative diseases / Neural Regeneration Research, 2013, V. 8, N. 21, pp. 2003-2014].Currently, mitochondrial dysfunction is considered a key element in oxidative damage to cells. Human mitochondria contain proteins encoded by mitochondrial DNA (m-DNA), the main role of which is to build the respiratory chain and ensure the energy needs of the cell. It is well known that in the process of aging <accumulation of m-DNA mutations occurs, which violates the structure and functions of mitochondria, leading to an imbalance between the production of free radicals and the protective capabilities of the body [Chunyan Guo et al. Oxidative stress, mitochondrial damage and neurodegenerative diseases / Neural Regeneration Research, 2013, V. 8, N. 21, pp. 2003-2014].
Помимо митохондриальной дисфункции, одним из механизмов развития окислительного повреждения клеток может быть нарушение обмена глутатиона. Соотношение восстановленного и окисленного глутатиона отражает восстановительно-окислительный потенциал клетки, причем уменьшение этого потенциала является еще одним пусковым механизмом развития окислительного стресса [Ondrej Zitka et al. Redox status expressed as GSH:GSSG ratio as a marker for oxidative stress in paediatric tumour patients / Oncology Letters, 2012, V. 4, N 6, pp. 1247-1253].In addition to mitochondrial dysfunction, one of the mechanisms for the development of oxidative damage to cells can be a violation of glutathione metabolism. The ratio of reduced and oxidized glutathione reflects the redox potential of the cell, and a decrease in this potential is another trigger for the development of oxidative stress [Ondrej Zitka et al. Redox status expressed as GSH: GSSG ratio as a marker for oxidative stress in pediatric tumor patients / Oncology Letters, 2012, V. 4, No. 6, pp. 1247-1253].
Еще одним пусковым механизмом окислительного стресса рассматривается накопление железа в базальных ганглиях при ряде нейродегенеративных заболеваний [Jinze Xu et al. Iron Accumulation with Age, Oxidative Stress and Functional Decline / PLoS ONE, 2008, V.3, N 8, pp. e2865 (l-8)].Another trigger of oxidative stress is the accumulation of iron in the basal ganglia in a number of neurodegenerative diseases [Jinze Xu et al. Iron Accumulation with Age, Oxidative Stress and Functional Decline / PLoS ONE, 2008, V.3, N 8, pp. e2865 (l-8)].
Окислительный стресс является причиной или важной составляющей серьезных заболеваний, которые в настоящее время еще и могут называться, как митохондриальные заболевания, например, таких как болезнь Паркинсона, болезнь Альцгеймера, хорея Гентингтона [Васенина Е.Е. и др. Окислительный стресс в патогенезе нейродегенеративных заболеваний: возможности терапии / Нейропротективная терапия, 2013, №3-4, с. 39-46] и других.Oxidative stress is the cause or an important component of serious diseases, which at present can also be called mitochondrial diseases, for example, such as Parkinson's disease, Alzheimer's disease, Huntington’s chorea [Vasenina E.E. et al. Oxidative stress in the pathogenesis of neurodegenerative diseases: possibilities of therapy / Neuroprotective therapy, 2013, No. 3-4, p. 39-46] and others.
Болезнь Паркинсона (БП) является одним из наиболее частых нейродегенеративных заболеваний, клинически характеризующихся прогрессирующими гипокинезией, мышечной ригидностью, тремором покоя. В основе БП лежит гибель дофаминергических нейронов черной субстанции, при этом в выживших клетках находят тельца Леви, а в полосатом теле снижается содержание дофамина [Jenner P. et al. Oxidative stress in Parkinson's disease / Annals of neurology, 2003, V. 53, N 3, pp. S26-S38].Parkinson's disease (PD) is one of the most common neurodegenerative diseases that are clinically characterized by progressive hypokinesia, muscle rigidity, and resting tremor. BP is based on the death of dopaminergic neurons of the substantia nigra, while Levi bodies are found in the surviving cells, and dopamine levels are reduced in the striatum [Jenner P. et al. Oxidative stress in Parkinson's disease / Annals of neurology, 2003, V. 53, No. 3, pp. S26-S38].
Болезнь Альцгеймера (БА) - нейродегенеративное заболевание преимущественно позднего возраста, характеризующееся прогрессирующим когнитивным снижением. В основе заболевания лежит необратимая гибель клеток, особенно в коре головного мозга и гиппокампе. Ключевыми особенностями болезни являются накопление амилоидных бляшек и нейрофибриллярных клубков в тканях мозга. При БА окислительный стресс является одним из ключевых звеньев патогенеза. Именно окислительный стресс может приводить к нарушению метаболизма белка - предшественника амилоида [Дубинина Е.Е. и др. Окислительный стресс и его влияние на функциональную активность клеток при болезни Альцгеймера / Биомедицинская химия, 2015, Т. 61, №1, с. 57-69].Alzheimer's disease (AD) is a neurodegenerative disease of predominantly late age, characterized by progressive cognitive decline. The disease is based on irreversible cell death, especially in the cerebral cortex and hippocampus. Key features of the disease are the accumulation of amyloid plaques and neurofibrillary tangles in brain tissue. In AD, oxidative stress is one of the key links in pathogenesis. It is oxidative stress that can lead to a violation of the metabolism of the protein - the precursor of amyloid [Dubinina E.E. et al. Oxidative stress and its effect on the functional activity of cells in Alzheimer's disease / Biomedical Chemistry, 2015, V. 61, No. 1, p. 57-69].
Болезнь Гентингтона (БГ) (или синдром Гентингтона, или хорея Гентингтона, или хорея Хантингтона) - является аутосомно-доминантно наследуемым заболеванием, связанное с нестабильной экспансией полиглутаминового участка на N-терминальном конце белка, именуемого хантингтином. БГ характеризуется гибелью нейронов и прогрессирующей атрофией подкорковых структур, прежде всего хвостатого ядра. Различные доказательства указывают на то, что ключевым последствием изменения структуры белка является дефект митохондриальных цепей, что в результате приводит к нарушению энергетического обеспечения клетки. Нарушение структуры митохондрий и дисфункция дыхательной цепи в свою очередь приводит к избыточной продукции свободных радикалов, что, вероятно, и вызывает повреждение клетки [Browne S.E. et al. Oxidative damage and metabolic dysfunction in Huntington's disease: selective vulnerability of the basal ganglia / Annals of neurology, 1997, V. 41, N. 5, pp. 646-653].Huntington’s disease (BG) (or Huntington’s syndrome, or Huntington’s chorea, or Huntington’s chorea) is an autosomal dominant inherited disease associated with unstable expansion of the polyglutamine site at the N-terminal end of a protein called huntingtin. BG is characterized by the death of neurons and progressive atrophy of the subcortical structures, especially the caudate nucleus. Various evidence indicates that a key consequence of changes in the structure of the protein is a defect in the mitochondrial chains, which as a result leads to a violation of the energy supply of the cell. Violation of the structure of mitochondria and dysfunction of the respiratory chain in turn leads to excessive production of free radicals, which is likely to cause cell damage [Browne S.E. et al. Oxidative damage and metabolic dysfunction in Huntington's disease: selective vulnerability of the basal ganglia / Annals of neurology, 1997, V. 41, N. 5, pp. 646-653].
В литературе также имеются данные о том, что заболеваниями, обусловленными окислительным стрессом, также являются пигментный ретинит [Maria Miranda et al. Antioxidant therapy in retinitis pigmentosa / Novel Aspects of Neuroprotection, 2010: ISBN: 978-81-308-0394-4, 15 pages], митохондриальная энцефаломиопатия [Genki Hayashi et al. Oxidative Stress in Inherited Mitochondrial Diseases / HHS Public Access, 2015, V. 88, pp. 10-17], рассеянный склероз [Кротенко Н.В. и др. Окислительный стресс - характерная особенность патогенеза рассеянного склероза / Бюллетень сибирской медицины, 2008, №5, с. 208-214], инсульт [Луцкий М.А. и др. Формирование окислительного стресса, одного из звеньев сложного патогенеза социально значимых заболеваний нервной системы - инсульта и рассеянного склероза / Фундаментальные исследования, 2014, №10 (часть 5), с. 924-929], болезнь Крона [Iborra М. et al. Role of oxidative stress and antioxidant enzymes in Crohn's disease / Biochemical Society Transactions, 2011, V. 39, N. 4, pp. 1102-1106], неспецифический язвенный колит [Rana S.V. et al. Role of oxidative stress & antioxidant defence in ulcerative colitis patients from north India / Indian Journal of Medical Research, 2014, V. 139, N. 4, pp. 568-571], ревматоидный артрит [Celia Maria Quinonez-Flores et al. Oxidative Stress Relevance in the Pathogenesis of the Rheumatoid Arthritis: A Systematic Review / BioMed Research International, 2016, V. 2016, 14 pages], псориаз [Qiang Zhou et al. Oxidative stress in the pathogenesis of psoriasis / Free Radical Biology & Medicine, 2009, V. 47, pp. 891-905].There is also evidence in the literature that retinitis pigmentosa is also a disease due to oxidative stress [Maria Miranda et al. Antioxidant therapy in retinitis pigmentosa / Novel Aspects of Neuroprotection, 2010: ISBN: 978-81-308-0394-4, 15 pages], mitochondrial encephalomyopathy [Genki Hayashi et al. Oxidative Stress in Inherited Mitochondrial Diseases / HHS Public Access, 2015, V. 88, pp. 10-17], multiple sclerosis [Krotenko N.V. and other Oxidative stress - a characteristic feature of the pathogenesis of multiple sclerosis / Bulletin of Siberian medicine, 2008, No. 5, p. 208-214], stroke [Lutsky M.A. et al. Formation of oxidative stress, one of the links in the complex pathogenesis of socially significant diseases of the nervous system — stroke and multiple sclerosis / Fundamental Research, 2014, No. 10 (part 5), p. 924-929], Crohn’s disease [Iborra M. et al. Role of oxidative stress and antioxidant enzymes in Crohn's disease / Biochemical Society Transactions, 2011, V. 39, N. 4, pp. 1102-1106], ulcerative colitis [Rana S.V. et al. Role of oxidative stress & antioxidant defense in ulcerative colitis patients from north India / Indian Journal of Medical Research, 2014, V. 139, N. 4, pp. 568-571], rheumatoid arthritis [Celia Maria Quinonez-Flores et al. Oxidative Stress Relevance in the Pathogenesis of the Rheumatoid Arthritis: A Systematic Review / BioMed Research International, 2016, V. 2016, 14 pages], psoriasis [Qiang Zhou et al. Oxidative stress in the pathogenesis of psoriasis / Free Radical Biology & Medicine, 2009, V. 47, pp. 891-905].
Из уровня техники [патент RU 2218918 С1, опубл. 20.12.2003] известно, что диалкиловые эфиры и моноалкиловые эфиры фумаровой кислоты в форме свободной кислоты или ее солей могут быть применены для лечения заболевания, обусловленного нарушением окислительного фосфорилирования и выбранного из группы, включающей синдром Паркинсона, болезнь Альцгеймера, хорею Хантингтона, пигментный ретинит и митохондриальную энцефаломиопатию.The prior art [patent RU 2218918 C1, publ. December 20, 2003] it is known that dialkyl ethers and monoalkyl ethers of fumaric acid in the form of a free acid or its salts can be used to treat a disease caused by impaired oxidative phosphorylation and selected from the group including Parkinson's syndrome, Alzheimer's disease, Huntington’s chorea, retinitis pigmentosa and mitochondrial encephalomyopathy.
Однако согласно приведенным в указанном документе данным стимулирующее действие различных производных фумаровой кислоты на ферментативную активность сукцинатдегидрогеназы сильно варьируется и не всегда является высоким. Некоторые производные фумаровой кислоты демонстрируют среднее или даже слабое действие. С чем это может быть связано, в документе не обсуждается.However, according to the data presented in this document, the stimulating effect of various fumaric acid derivatives on the enzymatic activity of succinate dehydrogenase varies greatly and is not always high. Some derivatives of fumaric acid exhibit moderate or even weak effects. What this may be connected with is not discussed in the document.
Предлагаемое изобретение решает задачу расширения арсенала средств, эффективных для лечения заболеваний, обусловленных окислительным стрессом.The present invention solves the problem of expanding the arsenal of tools effective for the treatment of diseases caused by oxidative stress.
В качестве такого средства в настоящем изобретении предлагается использовать соль 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой.As such a tool, the present invention proposes to use a salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid.
В документе [патент RU 2365582 С1, опубл. 27.08.2009] раскрывается соль 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой следующей формулы:In the document [patent RU 2365582 C1, publ. August 27, 2009] a salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid of the following formula is disclosed:
, ,
которая обладает метаболической и кардиопротекторной активностью. Указанную соль получают взаимодействием 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой при их молярном соотношении 2:1 в среде растворителя (этанола).which has metabolic and cardioprotective activity. The specified salt is obtained by the interaction of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid at a molar ratio of 2: 1 in a solvent (ethanol) environment.
Однако в данном документе не обсуждается и даже не упоминается возможность применения указанной соли для лечения заболеваний, обусловленных окислительным стрессом.However, this document does not discuss or even mention the possibility of using this salt to treat diseases caused by oxidative stress.
Технический результат настоящего изобретения заключается в создании нового эффективного средства для лечения заболеваний, обусловленных окислительным стрессом, и в повышении эффективности такого лечения.The technical result of the present invention is to create a new effective tool for the treatment of diseases caused by oxidative stress, and to increase the effectiveness of such treatment.
Указанные задача и технический результат достигаются применением терапевтически эффективного количества соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой формулы (I):The specified task and technical result is achieved by using a therapeutically effective amount of a salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid of the formula (I):
для лечения заболевания, обусловленного окислительным стрессом и выбранного из группы, включающей болезнь Паркинсона, болезнь Альцгеймера, хорею Хантингтона, пигментный ретинит, митохондриальную энцефаломиопатию, рассеянный склероз, инсульт, болезнь Крона, неспецифический язвенный коллит, ревматоидный артрит, псориаз.for the treatment of a disease caused by oxidative stress and selected from the group including Parkinson's disease, Alzheimer's disease, Huntington’s chorea, retinitis pigmentosa, mitochondrial encephalomyopathy, multiple sclerosis, stroke, Crohn’s disease, ulcerative colitis, rheumatoid arthritis, psoriasis.
Терапевтически эффективное количество активного агента, соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой, предпочтительно составляет 100-300 мг.A therapeutically effective amount of an active agent, a salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid, is preferably 100-300 mg.
Указанная соль 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой может быть введена пациенту, нуждающемуся в этом, как в виде лекарственной формы для перорального введения, так и в виде лекарственной формы для парентерального введения.The specified salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid can be administered to a patient in need thereof, both in the form of a dosage form for oral administration and as a dosage form for parenteral administration.
При этом такие лекарственные формы могут дополнительно включать фармацевтически приемлемые носители, наполнители или эксципиенты.Moreover, such dosage forms may further include pharmaceutically acceptable carriers, excipients or excipients.
В качестве фармацевтически приемлемых носителей, наполнителей, эксципиентов могут быть использованы различные добавки, используемые при производстве готовых лекарственных форм, совместимые с активным агентом и с другими вспомогательными вещества и не оказывающие неблагоприятное воздействие на пациента, например, лубриканты, разбавители, связующие, стабилизаторы, дезинтегрирующие или суспендирующие агенты и др.As pharmaceutically acceptable carriers, excipients, excipients, various additives can be used that are used in the manufacture of finished dosage forms that are compatible with the active agent and other excipients and do not adversely affect the patient, for example, lubricants, diluents, binders, stabilizers, disintegrants or suspending agents, etc.
Помимо вышеотмеченного, дополнительные вспомогательные вещества могут обеспечивать контролируемое, пролонгированное, немедленное или модифицированное высвобождение активного агента.In addition to the foregoing, additional excipients may provide for controlled, prolonged, immediate or modified release of the active agent.
Лекарственная форма для перорального введения может быть выбрана из таблетки, капсулы, порошка, гранул, драже, геля, желе, диспергируемой в ротовой полости формы, буккальной или подъязычной формы в виде пластинки или таблетки, раствора, сиропа или суспензии.An oral dosage form can be selected from a tablet, capsule, powder, granules, dragee, gel, jelly, orodispersible form, buccal or sublingual form in the form of a plate or tablet, solution, syrup or suspension.
Таблетки и капсулы могут содержать стандартные наполнители, необходимые как для технологии их изготовления, так и для достижения необходимых качественных и количественных показателей, отвечающих требованиям соответствующей фармакопеи. Примерами наполнителей могут быть лактоза, маннит, крахмалы, модифицированные крахмалы, целлюлоза и ее производные, желатин, стеариновая кислота или ее соли, увлажнители, отдушки, красители и т.д.Tablets and capsules may contain standard excipients, necessary both for the technology of their manufacture, and to achieve the necessary qualitative and quantitative indicators that meet the requirements of the corresponding pharmacopeia. Examples of fillers may be lactose, mannitol, starches, modified starches, cellulose and its derivatives, gelatin, stearic acid or its salts, moisturizers, perfumes, colorants, etc.
Пероральные жидкие препараты могут быть изготовлены либо в виде растворов (водные или масляные суспензии, растворы, эмульсии, сиропы и др.), либо в виде сухих продуктов, которые перед непосредственным применением подлежат разведению водой или другими растворителями. Например, суспензии и растворы могут содержать эмульгирующие и суспендирующие агенты.Oral liquid preparations can be made either in the form of solutions (aqueous or oily suspensions, solutions, emulsions, syrups, etc.), or in the form of dry products that must be diluted with water or other solvents before direct use. For example, suspensions and solutions may contain emulsifying and suspending agents.
Лекарственная форма для парентерального введения может быть выбрана из раствора для инъекций, порошка для приготовления раствора для инъекций, геля, инфузионного раствора, депо формы. Такая форма должна изготавливаться в условиях стерильности и может содержать различные консерванты, буферирующие агенты, изотонические агенты.Dosage form for parenteral administration can be selected from a solution for injection, powder for the preparation of a solution for injection, gel, infusion solution, depot form. This form must be made under sterile conditions and may contain various preservatives, buffering agents, isotonic agents.
Нижеприведенные примеры иллюстрируют настоящее изобретение.The following examples illustrate the present invention.
Пример 1. Получение соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой.Example 1. Obtaining a salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid.
В отличие от технического решения, раскрытого в документе [патент RU 2365582 С1, опубл. 27.08.2009], в настоящем изобретении соль 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой получали при молярном соотношении исходных реагентов (2-этил-6-метил-3-гидроксипиридина и фумаровой кислоты), равном 1:1.In contrast to the technical solution disclosed in the document [patent RU 2365582 C1, publ. August 27, 2009], in the present invention, the salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid was obtained at a molar ratio of the starting reagents (2-ethyl-6-methyl-3-hydroxypyridine and fumaric acid) equal to 1: 1 .
Способ А. В реакционную колбу объемом 250 мл загружали 50 мл изопропилового спирта и 15,4 г (0,133 моль) фумаровой кислоты. Суспензию кипятили при перемешивании 30 минут до полного растворения. Параллельно в 50 мл изопропилового спирта растворяли 18,2 г (0,133 моль) 2-этил-6-метил-3-гидроксипиридина при нагревании. Полученные растворы смешивали и кипятили при перемешивании в течение 1 часа. Полученный продукт кристаллизовали при температуре от 0 до +5°С в течение 12 часов. После фильтрации, промывки и сушки получили 32,5 г целевого продукта (соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой формулы (I)) в виде белых кристаллов с температурой плавления 93-95°С. Выход 96,6%. Получение целевого продукта подтверждали высокоэффективной жидкостной хроматографией (ВЭЖХ) - хроматограмма водного раствора соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой, полученной способом А, показана на фиг. 1 (a).Method A. 50 ml of isopropyl alcohol and 15.4 g (0.133 mol) of fumaric acid were charged into a 250 ml reaction flask. The suspension was boiled with stirring for 30 minutes until completely dissolved. In parallel, 18.2 g (0.133 mol) of 2-ethyl-6-methyl-3-hydroxypyridine was dissolved in 50 ml of isopropyl alcohol with heating. The resulting solutions were mixed and boiled with stirring for 1 hour. The resulting product was crystallized at a temperature of from 0 to + 5 ° C for 12 hours. After filtration, washing and drying, 32.5 g of the expected product (salts of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid of formula (I)) was obtained in the form of white crystals with a melting point of 93-95 ° C. Yield 96.6%. The preparation of the desired product was confirmed by high performance liquid chromatography (HPLC) —the chromatogram of an aqueous solution of 2-ethyl-6-methyl-3-hydroxypyridine salt with fumaric acid obtained by Method A is shown in FIG. 1 (a).
Способ Б. В реакционную колбу объемом 500 мл загружали 300 мл ацетона, 15,4 г (0,133 моль) фумаровой кислоты и 18,2 г (0,133 моль) 2-этил-6-метил-3-гидроксипиридина. Суспензию кипятили при перемешивании 2 часа, охлаждали до комнатной температуры и кристаллизовали при температуре от 0 до +5°С в течение 6 часов, после фильтрации, промывки и сушки получали 31,4 г целевого продукта (соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой формулы (I)) в виде белых кристаллов с температурой плавления 94-97°С. Выход 93,3%. Получение целевого продукта подтверждали высокоэффективной жидкостной хроматографией (ВЭЖХ) - хроматограмма водного раствора соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой, полученной способом Б, показана на фиг. 1 (б).Method B. 300 ml of acetone, 15.4 g (0.133 mol) of fumaric acid and 18.2 g (0.133 mol) of 2-ethyl-6-methyl-3-hydroxypyridine were charged into a 500 ml reaction flask. The suspension was boiled with stirring for 2 hours, cooled to room temperature and crystallized at a temperature of 0 to + 5 ° C for 6 hours, after filtration, washing and drying, 31.4 g of the expected product (2-ethyl-6-methyl- 3-hydroxypyridine with fumaric acid of the formula (I)) in the form of white crystals with a melting point of 94-97 ° C. Yield 93.3%. The preparation of the target product was confirmed by high performance liquid chromatography (HPLC) —the chromatogram of an aqueous solution of 2-ethyl-6-methyl-3-hydroxypyridine salt with fumaric acid obtained by method B is shown in FIG. 1 (b).
Далее, приведены примеры, подтверждающие антиоксидантное действие соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой формулы (I) (ЭМГП фумарат), полученной в примере 1 (как способом А - ЭМГП фумаратА, так и способом Б - ЭМГП фумаратБ).The following are examples that confirm the antioxidant effect of the salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid of the formula (I) (EMHP fumarate) obtained in Example 1 (both method A - EMHP fumarate A , and method B - EMGP fumarate B ).
Пример 2. Оценка антиоксидантных свойств соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой in vitro и in vivo.Example 2. Evaluation of the antioxidant properties of a salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid in vitro and in vivo.
Оценку антиоксидантных свойств ЭМГП фумарата проводили в два этапа по методикам, описанным в [Гребенюк А.Н. и др. Оценка антиоксидантных свойств отечественного синтетического генистеина на моделях in vitro и in vivo / Экспериментальные исследования, 2013, Т. 2, №42, с. 83-87].Evaluation of the antioxidant properties of EMHP fumarate was carried out in two stages according to the methods described in [Grebenyuk A.N. et al. Evaluation of the antioxidant properties of domestic synthetic genistein on in vitro and in vivo models / Experimental Studies, 2013, V. 2, No. 42, p. 83-87].
На первом этапе для исследования антиоксидантной активности (АОА) ЭМГП фумарата на модели in vitro использовали хемилюминесцентную реакцию рибофлавина в присутствии ионов двухвалентного железа и перекиси водорода [Путилина Ф.Е. Практикум по свободнорадикальному окислению / Учебно-методическое пособие. - Изд-во СПбГУ, 2006. - С. 82-83]. В измерительную кювету биохемилюминометра для создания модельной системы вносили 710 мкл калий-фосфатного буфера рН 9,0; 40 мкл 10 мМ рибофлавина; 100 мкл дистиллированной воды; 50 мкл 25 мМ FeSO4×7H2O. Инициировали процесс окисления введением 100 мкл 0,1% раствора перекиси водорода. В опытную систему вместо 100 мкл дистиллированной воды вносили 100 мкг ЭМГП фумарата, который растворяли в воде до исходной концентрации 1000 мкг/мл. Затем готовили ряд серийных разведений препарата в концентрациях от 0,78 до 100 мкг/мл. Измерение светосуммы осуществляли в течение 60 с при комнатной температуре. Величину АОА рассчитывали как отношение светосумм опытной и модельной систем в процентах. Графически определяли концентрацию соединения, которая уменьшала интенсивность хемилюминесценции модели на 50%.At the first stage, in order to study the antioxidant activity (AOA) of EMHP fumarate in an in vitro model, the chemiluminescent reaction of riboflavin in the presence of ferrous ions and hydrogen peroxide was used [F. Putilina. Workshop on free radical oxidation / educational-methodical manual. - Publishing House of St. Petersburg State University, 2006. - S. 82-83]. To create a model system, 710 μl of potassium phosphate buffer pH 9.0 was added to the measuring cuvette of the biochemiluminometer; 40 μl of 10 mM riboflavin; 100 μl of distilled water; 50 μl of 25 mM FeSO 4 × 7H 2 O. The oxidation process was initiated by introducing 100 μl of a 0.1% hydrogen peroxide solution. Instead of 100 μl of distilled water, 100 μg EMHP fumarate was added to the test system, which was dissolved in water to an initial concentration of 1000 μg / ml. Then, a series of serial dilutions of the preparation was prepared in concentrations from 0.78 to 100 μg / ml. Light sum measurements were carried out for 60 s at room temperature. The AOA value was calculated as the ratio of the light sums of the experimental and model systems in percent. The concentration of the compound was determined graphically, which reduced the chemiluminescence intensity of the model by 50%.
Согласно проведенным исследованиям установлено, что среднеэффективная доза для ЭМГП фумаратаА и ЭМГП фумаратБ in vitro составляет 6,3 мкг/мл и 6,2 мкг/мл соответственно. Для сравнения величина этого показателя для кверцетина и аскорбиновой кислоты составляет 3,9 мкг/мл и 12,5 мкг/мл соответственно (по данным из [Гребенюк А.Н. и др. Оценка антиоксидантных свойств отечественного синтетического генистеина на моделях in vitro и in vivo / Экспериментальные исследования, 2013, Т. 2, №42, с. 83-87]). На фиг. 2 показана зависимость АОА ЭМГП фумаратаА, кверцетина и аскорбиновой кислоты от их концентраций (зависимость для ЭМГП фумаратБ не показана на фиг. 2, поскольку практически аналогична зависимости для ЭМГП фумаратаА).According to studies, it was found that the average effective dose for EMHP fumarate A and EMHP fumarate B in vitro is 6.3 μg / ml and 6.2 μg / ml, respectively. For comparison, the value of this indicator for quercetin and ascorbic acid is 3.9 μg / ml and 12.5 μg / ml, respectively (according to [Grebenyuk AN et al. Assessment of the antioxidant properties of domestic synthetic genistein in in vitro and in models vivo / Experimental studies, 2013, T. 2, No. 42, pp. 83-87]). In FIG. Figure 2 shows the dependence of AOA EMGP of fumarate A , quercetin and ascorbic acid on their concentrations (the dependence for EMGP fumarate B is not shown in Fig. 2, since the dependence for EMGP of fumarate A is almost the same).
Исследования, направленные на изучение антиоксидантных свойств ЭМГП фумарата in vivo выполнены на 52 белых беспородных крысах-самцах массой 160-220 г. При проведении исследования выполняли требования нормативно-правовых актов о порядке экспериментальной работы с использованием животных, в том числе по гуманному отношению к ним.Studies aimed at studying the antioxidant properties of EMHP fumarate in vivo were performed on 52 white outbred male rats weighing 160-220 g. During the study, the requirements of regulatory legal acts on the procedure for experimental work with animals, including the humane attitude to them, were fulfilled .
Перед введением ЭМГП фумарат предварительно растворяли в воде для инъекций. Растворы готовили непосредственно перед их введением крысам. Препарат в дозе 200 мг/кг вводили внутрибрюшинно. Объем вводимого животным раствора ЭМГП фумарата составлял 0,4 мл на 100 г массы тела животного. Особям контрольной группы тем же способом и в том же объеме вводили воду для инъекций.Before the introduction of EMHP, the fumarate was previously dissolved in water for injection. Solutions were prepared immediately before their administration to rats. The drug at a dose of 200 mg / kg was administered intraperitoneally. The volume of fumarate EMGP solution administered to the animals was 0.4 ml per 100 g of animal body weight. The control group was injected with water in the same manner and in the same volume.
Исследования показателей системы глутатиона и перекисного окисления липидов (ПОЛ) проводили через 1, 4, 24 и 72 ч после введения препарата. Кровь для исследований забирали у животных после декапитации, стабилизировали 4% раствором цитрата натрия, охлаждали и немедленно использовали в исследованиях. Эритроциты выделяли центрифугированием, затем гемолизировали 5 мМ ТРИС-НСl буфером с рН 7,6 в соотношении 1:9. Полученный гемолизат использовали для определения перечисленных ниже биохимических показателей.Studies of indicators of the glutathione system and lipid peroxidation (POL) were performed 1, 4, 24, and 72 hours after drug administration. Blood for research was taken from animals after decapitation, stabilized with 4% sodium citrate solution, cooled and immediately used in the studies. Red blood cells were isolated by centrifugation, then hemolysed with 5 mM TRIS-Hcl buffer with a pH of 7.6 in a 1: 9 ratio. The resulting hemolysate was used to determine the following biochemical parameters.
Концентрацию восстановленного глутатиона (ВГ), малонового диальдегида (МДА), активность глутатион-редуктазы (ГР), глутатион-S-трансферазы (ГТ), глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) в гемолизате эритроцитов оценивали с использованием общепринятых методик [Арутюнян А.В. Методы оценки свободнорадикального окисления и антиоксидантной системы организма: методические рекомендации. - СПб.: Фолиант, 2000. - 104 с.]. Расчет активности ферментов производили на 1 г гемоглобина. Концентрацию гемоглобина определяли гемиглобинцианидным методом и выражали в г/л.The concentration of reduced glutathione (HD), malondialdehyde (MDA), the activity of glutathione reductase (GR), glutathione S-transferase (GT), glucose-6-phosphate dehydrogenase (G-6-FDG) in erythrocyte hemolysate was evaluated using conventional methods [Harutyunyan A.V. Methods for assessing free radical oxidation and the antioxidant system of the body: guidelines. - St. Petersburg: Tome, 2000. - 104 p.]. The calculation of enzyme activity was performed per 1 g of hemoglobin. The hemoglobin concentration was determined by the hemiglobin cyanide method and expressed in g / l.
Статистическую обработку полученных результатов проводили на персональном компьютере с помощью пакета прикладных программ «Statistica 12,0». В каждой группе рассчитывали средние значения. Полученные результаты сведены в таблицу 1.Statistical processing of the obtained results was carried out on a personal computer using the Statistica 12.0 application package. In each group, average values were calculated. The results obtained are summarized in table 1.
Показано, что в эритроцитах периферической крови крыс через 4 ч после введения животным ЭМГП фумаратаА и ЭМГП фумаратБ концентрация ВГ повышалась на 45%, а спустя 1 сутки значение этого показателя превосходило контрольные величины уже более чем на 55%. Также выявлено индуцирующее влияние ЭМГП фумарата на активность ферментов системы глутатиона, таких как ГР и ГТ. Так, через 4 ч после введения ЭМГП фумарата отмечалась тенденция к увеличению активности ГР более чем в 1,5 раза для, а через 24 ч - в 2 раза по сравнению с контролем. Отмечено также, что введение ЭМГП фумарата характеризовалось повышением активности ГТ через 24 ч в ~1,2 раза по сравнению с контрольным уровнем. Через 1 ч после введения ЭМГП фумарата в 1,3 раза по сравнению с контролем снижался уровень МДА. Таким образом, достоверно подтверждено наличие антиоксидантных свойств соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой.It was shown that in the peripheral blood erythrocytes of rats 4 hours after the administration of EMGP fumarate A and EMGP fumarate B to animals, the concentration of GH increased by 45%, and after 1 day the value of this parameter exceeded the control values by more than 55%. The inducing effect of EMHP of the fumarate on the activity of enzymes of the glutathione system, such as GR and HT, was also revealed. So, 4 hours after the administration of EMHP of the fumarate, there was a tendency to increase the activity of GR by more than 1.5 times for, and after 24 hours - by 2 times compared with the control. It was also noted that the introduction of EMHP fumarate was characterized by an increase in HT activity after 24 hours by ~ 1.2 times compared with the control level. One hour after the administration of EMHP of fumarate, the level of MDA decreased by 1.3 times compared with the control. Thus, the presence of antioxidant properties of the salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid was reliably confirmed.
Пример 3. Влияние соли 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой на динамику окислительного стресса при воздействии активных форм кислорода (АФК).Example 3. The effect of salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid on the dynamics of oxidative stress when exposed to reactive oxygen species (ROS).
В примере также для сравнения приведены результаты антиоксидантной активности диметилфумарата (ДМФ), который в соответствии с данными, приведенными в [патент RU 2218918 С1, опубл. 20.12.2003], проявил наиболее высокое стимулирующее действие на ферментативную активность сукцинатдегидрогеназы по сравнению с другими исследованными производными фумаровой кислоты. Полученные результаты сравнивали с соответствующими данными для этилметилгидроксипиридина сукцината (ЭМГП сукцинат) [Соловьева А.Г. и др. Влияние Мексидола на систему липопероксидации консервированной крови при воздействии активных форм кислорода в эксперименте in vitro / Биорадикалы и Антиоксиданты, 2016, Т. 3, №3, с. 98-100].The example also shows for comparison the results of the antioxidant activity of dimethyl fumarate (DMF), which, in accordance with the data given in [patent RU 2218918 C1, publ. December 20, 2003], showed the highest stimulating effect on the enzymatic activity of succinate dehydrogenase in comparison with other studied derivatives of fumaric acid. The results were compared with the corresponding data for ethylmethylhydroxypyridine succinate (EMHP succinate) [Solovyova A.G. et al. Effect of Mexidol on the lipid peroxidation system of canned blood when exposed to reactive oxygen species in an in vitro experiment / Bioradicals and Antioxidants, 2016, Vol. 3, No. 3, p. 98-100].
Эксперимент проводили на образцах крови. Каждый образец был разделен на 9 проб: проба 1 - контроль (исходная кровь); проба 2 - кровь, барботированная кислород-озоновой смесью (О3); проба 3 - кровь, подвергнутая воздействию О3 и ЭМГП фумаратаА; проба 4 - кровь, подвергнутая воздействию О3 и ЭМГП фумаратаБ; проба 5 - кровь, подвергнутая воздействию О3 и ДМФ; проба 6 - кровь, обработанная газовым потоком, содержащим синглетный кислород (СК); проба 7 - кровь, обработанная СК и ЭМГП фумаратомА; проба 8 - кровь, обработанная СК и ЭМГП фумаратомБ; проба 9 - кровь, обработанная СК и ДМФ.The experiment was performed on blood samples. Each sample was divided into 9 samples: sample 1 - control (initial blood); sample 2 - blood sparged with oxygen-ozone mixture (O 3 ); sample 3 - blood exposed to O 3 and EMHP of fumarate A ; sample 4 - blood exposed to O 3 and EMHP of fumarate B ; sample 5 - blood exposed to O 3 and DMF; sample 6 - blood treated with a gas stream containing singlet oxygen (SC); sample 7 - blood treated with SC and EMHP with fumarate A ; sample 8 - blood treated with SC and EMHP with fumarate B ; sample 9 - blood treated with SC and DMF.
Интенсивность перекисного окисления липидов (ПОЛ) определяли по уровню содержания вторичного продукта свободнорадикального окисления (СРО) - малонового диальдегида (МДА) в плазме и эритроцитах методом [Uchiyama М. et al. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test / Analytical Biochemistry, 1978, V. 86, р. 271]. Активность супероксиддисмутазы (СОД) определяли в гемолизате отмытых эритроцитов (1:10) по ингибированию образования продукта аутоокисления адреналина [Сирота Т.В. Новый подход в исследовании процесса аутоокисления адреналина и использование его для измерения активности супероксиддисмутазы / Вопросы медицинской химии, 1999, Т. 45, №3, с. 109-116]. Концентрацию белка оценивали методом Лоури в модификации [Dawson J.M. et al. Lowry method of protein quantification Evidence for Photosensitivity / Analytical Biochemistry, 1984, V. 140, N. 2, pp. 391-393]. Полученные экспериментальные данные сведены в таблицу 2.The intensity of lipid peroxidation (POL) was determined by the level of the content of the secondary product of free radical oxidation (CPO) - malondialdehyde (MDA) in plasma and red blood cells by the method of [Uchiyama M. et al. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test / Analytical Biochemistry, 1978, V. 86, p. 271]. The activity of superoxide dismutase (SOD) was determined in the hemolysate of washed red blood cells (1:10) by inhibiting the formation of the product of the autooxidation of adrenaline [Sirota T.V. A new approach to the study of the process of autooxidation of adrenaline and its use for measuring the activity of superoxide dismutase / Questions of medical chemistry, 1999, V. 45, No. 3, p. 109-116]. Protein concentration was evaluated by the Lowry method in modification [Dawson J.M. et al. Lowry method of protein quantification Evidence for Photosensitivity / Analytical Biochemistry, 1984, V. 140, N. 2, pp. 391-393]. The obtained experimental data are summarized in table 2.
Приведенные данные о снижении ПОЛ при экспериментальном окислительном стрессе и повышении активности супероксиддисмутазы достоверно демонстрируют антиоксидантную эффективность этилметилгидроксипиридина фумарата. Причем исследуемое соединение характеризуется более высокими антиоксидантными свойствами по сравнению с диметилфумаратом и с этилметилгидроксипиридина сукцинатом.The data on the decrease in lipid peroxidation under experimental oxidative stress and an increase in the activity of superoxide dismutase reliably demonstrate the antioxidant effectiveness of ethyl methyl hydroxypyridine fumarate. Moreover, the test compound is characterized by higher antioxidant properties compared with dimethyl fumarate and ethyl methyl hydroxypyridine succinate.
* значения показателей взяты из [Соловьева А.Г. и др. Влияние Мексидола на систему липопероксидации консервированной крови при воздействии активных форм кислорода в эксперименте in vitro / Биорадикалы и Антиоксиданты, 2016, Т. 3, №3, с. 98-100].* values of indicators are taken from [Solovyova A.G. et al. Effect of Mexidol on the lipid peroxidation system of canned blood when exposed to reactive oxygen species in an in vitro experiment / Bioradicals and Antioxidants, 2016, Vol. 3, No. 3, p. 98-100].
Claims (9)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2018109768A RU2674286C1 (en) | 2018-03-20 | 2018-03-20 | Agent for treatment of disease caused by oxidative stress |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2018109768A RU2674286C1 (en) | 2018-03-20 | 2018-03-20 | Agent for treatment of disease caused by oxidative stress |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2674286C1 true RU2674286C1 (en) | 2018-12-07 |
Family
ID=64603535
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2018109768A RU2674286C1 (en) | 2018-03-20 | 2018-03-20 | Agent for treatment of disease caused by oxidative stress |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2674286C1 (en) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020191502A1 (en) * | 2019-03-27 | 2020-10-01 | Algernon Pharmaceuticals Inc. | Use of emoxypine and derivatives thereof for treating kidney disorders and inflammatory bowel disease |
| WO2021003553A1 (en) * | 2019-07-10 | 2021-01-14 | Algernon Pharmaceuticals Inc. | Compounds for treatment of diarrhea, inflammatory bowel disease and methods thereof |
| EP3920921A4 (en) * | 2019-02-07 | 2022-11-02 | Alsatech, Inc. | Polyvalent derivatives of emoxypine |
| RU2814495C1 (en) * | 2023-01-11 | 2024-02-29 | Акционерное общество "Всесоюзный научный центр по безопасности биологически активных веществ" АО "ВНЦ БАВ" | Agent possessing anti-inflammatory, antioxidant and antiulcerogenic action, ability to inhibit development of degenerative-destructive processes of tissues, which is 2-ethyl-6-methyl-3-hydroxypyridinium-4-isobutylphenylpropanoate |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2218918C1 (en) * | 2000-01-10 | 2003-12-20 | Фумафарм Аг | Application of fumaric acid derivatives for treatment of mitochondrial diseases |
| RU2365582C1 (en) * | 2008-07-03 | 2009-08-27 | Государственное образовательное учреждение высшего профессионального образования "Мордовский государственный университет им. Н.П. Огарева" | Salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid, possessing metabolic and cardioprotective activity, and method of its obtaining |
| EP2241310A2 (en) * | 2009-04-17 | 2010-10-20 | Sanovel Ilac Sanayi ve Ticaret A.S. | Modified release formulations of emoxypine |
| RU2444359C1 (en) * | 2010-12-06 | 2012-03-10 | Общество с ограниченной ответственностью "Научно-производственная компания "ФАРМАСОФТ" (ООО "НПК "ФАРМАСОФТ") | Pharmaceutical composition with 2-ethyl-6-methyl-3-hydroxypyridine succinate for oral administration and method for preparing it |
-
2018
- 2018-03-20 RU RU2018109768A patent/RU2674286C1/en active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2218918C1 (en) * | 2000-01-10 | 2003-12-20 | Фумафарм Аг | Application of fumaric acid derivatives for treatment of mitochondrial diseases |
| RU2365582C1 (en) * | 2008-07-03 | 2009-08-27 | Государственное образовательное учреждение высшего профессионального образования "Мордовский государственный университет им. Н.П. Огарева" | Salt of 2-ethyl-6-methyl-3-hydroxypyridine with fumaric acid, possessing metabolic and cardioprotective activity, and method of its obtaining |
| EP2241310A2 (en) * | 2009-04-17 | 2010-10-20 | Sanovel Ilac Sanayi ve Ticaret A.S. | Modified release formulations of emoxypine |
| RU2444359C1 (en) * | 2010-12-06 | 2012-03-10 | Общество с ограниченной ответственностью "Научно-производственная компания "ФАРМАСОФТ" (ООО "НПК "ФАРМАСОФТ") | Pharmaceutical composition with 2-ethyl-6-methyl-3-hydroxypyridine succinate for oral administration and method for preparing it |
Non-Patent Citations (1)
| Title |
|---|
| Лянг О.В. и др. Применение мексидола при ишемии головного мозга / Журнал неврологии и психиатрии, 2013, т.12, с.126-129. * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3920921A4 (en) * | 2019-02-07 | 2022-11-02 | Alsatech, Inc. | Polyvalent derivatives of emoxypine |
| WO2020191502A1 (en) * | 2019-03-27 | 2020-10-01 | Algernon Pharmaceuticals Inc. | Use of emoxypine and derivatives thereof for treating kidney disorders and inflammatory bowel disease |
| WO2021003553A1 (en) * | 2019-07-10 | 2021-01-14 | Algernon Pharmaceuticals Inc. | Compounds for treatment of diarrhea, inflammatory bowel disease and methods thereof |
| RU2814495C1 (en) * | 2023-01-11 | 2024-02-29 | Акционерное общество "Всесоюзный научный центр по безопасности биологически активных веществ" АО "ВНЦ БАВ" | Agent possessing anti-inflammatory, antioxidant and antiulcerogenic action, ability to inhibit development of degenerative-destructive processes of tissues, which is 2-ethyl-6-methyl-3-hydroxypyridinium-4-isobutylphenylpropanoate |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2674286C1 (en) | Agent for treatment of disease caused by oxidative stress | |
| Huang et al. | Autophagy signaling through reactive oxygen species | |
| Ginsberg et al. | Stilbazulenyl nitrone, a novel antioxidant, is highly neuroprotective in focal ischemia | |
| WO2019236890A1 (en) | Inhibitors of sarm1 | |
| JP7289375B2 (en) | Inhibitor of SARM1 | |
| Wang et al. | An effective NADPH oxidase 2 inhibitor provides neuroprotection and improves functional outcomes in animal model of traumatic brain injury | |
| Denny et al. | Are antioxidants a potential therapy for FSHD? A review of the literature | |
| Rogińska et al. | Depletion of the third complement component ameliorates age-dependent oxidative stress and positively modulates autophagic activity in aged retinas in a mouse model | |
| Kudryavtsev et al. | Pharmacological correction of stress-induced gastric ulceration by novel small-molecule agents with antioxidant profile | |
| JP2023113705A (en) | USE OF SCAVENGERS OF REACTIVE γ-KETOALDEHYDES TO EXTEND CELL LIFESPAN AND HEALTHSPAN | |
| RU2477722C1 (en) | Method for preparing lithium salt of comenic acid and using it as antioxidant, stress- and neuroprotective agent | |
| Aksar et al. | Neuroprotective effect of edaravone in experimental glaucoma model in rats: a immunofluorescence and biochemical analysis | |
| Jiang et al. | Effects of AGEs on oxidation stress and antioxidation abilities in cultured astrocytes | |
| US20220370472A1 (en) | New application of metal complex | |
| Zabłocka et al. | Effect of the proline-rich polypeptide complex/colostrinin™ on the enzymatic antioxidant system | |
| BRPI0714786A2 (en) | antioxidant for treatment and prophylaxis of diseases associated with oxidative stress and lack of oxygen in the body, production process of an anti-oxidant, granules for the production of medicinal or prophylactic medium for treatment and prevention of diseases associated with oxidative stress and lack of oxygen in the body, and preparation in tablet or encapsulated form for treatment and prevention of diseases associated with oxidative stress and lack of oxygen in the body | |
| Nikolaishvili et al. | Assessment of integrated antioxidant systems and hormezis effect of radon in experimental studies | |
| Kosolapov et al. | Condensed Benzimidazoles Are a Novel Scaffold for Antioxidant Agents’ Search and Development | |
| Kryl’skii et al. | 1-Benzoyl-6-hydroxy-2, 2, 4-trimethyl-1, 2-dihydroquinoline exerts a neuroprotective effect and normalises redox homeostasis in a rat model of cerebral ischemia/reperfusion | |
| RU2418580C1 (en) | Zinc-containing ethanol poisoning antidote and method of treatment with its application | |
| Ji et al. | Anticerebral ischemia-reperfusion injury activity of synthesized puerarin derivatives | |
| Karaca et al. | Erythrocyte oxidant/antioxidant status in essential hyperhidrosis | |
| CN110354126A (en) | The new application of UFP-512 | |
| EP3611157A1 (en) | Salicylic acid-based fumarate derivative and use in treatment of parkinson's disease and other neurodegenerative diseases | |
| CN113546092B (en) | Application of gold nanoclusters and medicine for reducing male reproductive toxicity of copper ions |