RU2659789C2 - Substituted 3-aryl-5-phenyl-3h-1,2,3,4-dithiadiazole-2-oxides and the method of their production - Google Patents
Substituted 3-aryl-5-phenyl-3h-1,2,3,4-dithiadiazole-2-oxides and the method of their production Download PDFInfo
- Publication number
- RU2659789C2 RU2659789C2 RU2016152037A RU2016152037A RU2659789C2 RU 2659789 C2 RU2659789 C2 RU 2659789C2 RU 2016152037 A RU2016152037 A RU 2016152037A RU 2016152037 A RU2016152037 A RU 2016152037A RU 2659789 C2 RU2659789 C2 RU 2659789C2
- Authority
- RU
- Russia
- Prior art keywords
- dithiadiazole
- phenyl
- oxide
- substituted
- oxides
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims description 10
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 claims abstract description 38
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 claims abstract description 8
- 238000002955 isolation Methods 0.000 claims abstract 2
- TYQGZLRHYFTSDD-UHFFFAOYSA-N C1(=CC=CC=C1)N1S(SC(=N1)C1=CC=CC=C1)=O Chemical compound C1(=CC=CC=C1)N1S(SC(=N1)C1=CC=CC=C1)=O TYQGZLRHYFTSDD-UHFFFAOYSA-N 0.000 claims description 5
- RZCSJYSPAMMGFU-UHFFFAOYSA-N FC1=CC=C(C=C1)N1S(SC(=N1)C1=CC=CC=C1)=O Chemical compound FC1=CC=C(C=C1)N1S(SC(=N1)C1=CC=CC=C1)=O RZCSJYSPAMMGFU-UHFFFAOYSA-N 0.000 claims description 5
- QNHVSYNNUBFBBC-UHFFFAOYSA-N C(C1=CC=CC=C1)N1S(SC(=N1)C1=CC=CC=C1)=O Chemical compound C(C1=CC=CC=C1)N1S(SC(=N1)C1=CC=CC=C1)=O QNHVSYNNUBFBBC-UHFFFAOYSA-N 0.000 claims description 4
- IOYWRIBJYLTACI-UHFFFAOYSA-N CC1=C(C=CC=C1)N1S(SC(=N1)C1=CC=CC=C1)=O Chemical compound CC1=C(C=CC=C1)N1S(SC(=N1)C1=CC=CC=C1)=O IOYWRIBJYLTACI-UHFFFAOYSA-N 0.000 claims description 4
- CGPHGVXWAMHOGG-UHFFFAOYSA-N FC=1C=C(C=C(C=1)F)N1S(SC(=N1)C1=CC=CC=C1)=O Chemical compound FC=1C=C(C=C(C=1)F)N1S(SC(=N1)C1=CC=CC=C1)=O CGPHGVXWAMHOGG-UHFFFAOYSA-N 0.000 claims description 4
- PJUKKRHSFDSKAT-UHFFFAOYSA-N [N+](=O)([O-])C1=CC=C(C=C1)N1S(SC(=N1)C1=CC=CC=C1)=O Chemical compound [N+](=O)([O-])C1=CC=C(C=C1)N1S(SC(=N1)C1=CC=CC=C1)=O PJUKKRHSFDSKAT-UHFFFAOYSA-N 0.000 claims description 3
- 238000006243 chemical reaction Methods 0.000 claims description 2
- 150000001875 compounds Chemical class 0.000 abstract description 11
- 239000000126 substance Substances 0.000 abstract description 8
- 239000004599 antimicrobial Substances 0.000 abstract description 5
- 239000003814 drug Substances 0.000 abstract description 4
- 238000002360 preparation method Methods 0.000 abstract description 2
- 230000000694 effects Effects 0.000 abstract 1
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 12
- 239000013078 crystal Substances 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 229950005499 carbon tetrachloride Drugs 0.000 description 6
- 238000010992 reflux Methods 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 4
- 229940125890 compound Ia Drugs 0.000 description 4
- 125000000623 heterocyclic group Chemical group 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- BLUWQNXNYPIOQE-UHFFFAOYSA-N N-[(2-oxodithiadiazolidin-5-ylidene)amino]aniline Chemical compound C1(=CC=CC=C1)NNC1=NNS(S1)=O BLUWQNXNYPIOQE-UHFFFAOYSA-N 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 241000222122 Candida albicans Species 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 230000000845 anti-microbial effect Effects 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 238000000132 electrospray ionisation Methods 0.000 description 2
- 238000000921 elemental analysis Methods 0.000 description 2
- 238000004896 high resolution mass spectrometry Methods 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- MYPYJXKWCTUITO-UHFFFAOYSA-N vancomycin Natural products O1C(C(=C2)Cl)=CC=C2C(O)C(C(NC(C2=CC(O)=CC(O)=C2C=2C(O)=CC=C3C=2)C(O)=O)=O)NC(=O)C3NC(=O)C2NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(CC(C)C)NC)C(O)C(C=C3Cl)=CC=C3OC3=CC2=CC1=C3OC1OC(CO)C(O)C(O)C1OC1CC(C)(N)C(O)C(C)O1 MYPYJXKWCTUITO-UHFFFAOYSA-N 0.000 description 2
- SUSBRIALKDOCCS-UHFFFAOYSA-N 1-amino-3-anilinothiourea Chemical compound NNC(=S)NNC1=CC=CC=C1 SUSBRIALKDOCCS-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- WYVYPCVATRQLLD-UHFFFAOYSA-N N'-(4-fluorophenyl)benzenecarbothiohydrazide Chemical compound FC1=CC=C(C=C1)NNC(C1=CC=CC=C1)=S WYVYPCVATRQLLD-UHFFFAOYSA-N 0.000 description 1
- -1 N'-2-methylphenyl-benzothiohydrazide Chemical compound 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- 108010053950 Teicoplanin Proteins 0.000 description 1
- 108010059993 Vancomycin Proteins 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940095731 candida albicans Drugs 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 1
- DDTDNCYHLGRFBM-YZEKDTGTSA-N chembl2367892 Chemical compound CC(=O)N[C@H]1[C@@H](O)[C@H](O)[C@H](CO)O[C@H]1O[C@@H]([C@H]1C(N[C@@H](C2=CC(O)=CC(O[C@@H]3[C@H]([C@H](O)[C@H](O)[C@@H](CO)O3)O)=C2C=2C(O)=CC=C(C=2)[C@@H](NC(=O)[C@@H]2NC(=O)[C@@H]3C=4C=C(O)C=C(C=4)OC=4C(O)=CC=C(C=4)[C@@H](N)C(=O)N[C@H](CC=4C=C(Cl)C(O5)=CC=4)C(=O)N3)C(=O)N1)C(O)=O)=O)C(C=C1Cl)=CC=C1OC1=C(O[C@H]3[C@H]([C@@H](O)[C@H](O)[C@H](CO)O3)NC(C)=O)C5=CC2=C1 DDTDNCYHLGRFBM-YZEKDTGTSA-N 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- WKHJZIRDAONVML-UHFFFAOYSA-N dichloromethane;tetrachloromethane Chemical compound ClCCl.ClC(Cl)(Cl)Cl WKHJZIRDAONVML-UHFFFAOYSA-N 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- YNFRZAVWAOGXDH-UHFFFAOYSA-N n'-benzylbenzenecarbothiohydrazide Chemical compound C=1C=CC=CC=1C(=S)NNCC1=CC=CC=C1 YNFRZAVWAOGXDH-UHFFFAOYSA-N 0.000 description 1
- AWAWNMNDLBQMDV-UHFFFAOYSA-N n'-phenylbenzenecarbothiohydrazide Chemical compound C=1C=CC=CC=1C(=S)NNC1=CC=CC=C1 AWAWNMNDLBQMDV-UHFFFAOYSA-N 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 238000011197 physicochemical method Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 229960001608 teicoplanin Drugs 0.000 description 1
- 229960003165 vancomycin Drugs 0.000 description 1
- MYPYJXKWCTUITO-LYRMYLQWSA-N vancomycin Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=C2C=C3C=C1OC1=CC=C(C=C1Cl)[C@@H](O)[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@H]3C(=O)N[C@H]1C(=O)N[C@H](C(N[C@@H](C3=CC(O)=CC(O)=C3C=3C(O)=CC=C1C=3)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)O2)=O)NC(=O)[C@@H](CC(C)C)NC)[C@H]1C[C@](C)(N)[C@H](O)[C@H](C)O1 MYPYJXKWCTUITO-LYRMYLQWSA-N 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D285/00—Heterocyclic compounds containing rings having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by groups C07D275/00 - C07D283/00
- C07D285/01—Five-membered rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
Группа изобретений относится к области органической и медицинской химии, а именно к новым индивидуальным соединениям класса гетероциклических систем - замещенным 3-арил-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксидам общей формулы I, и способу их получения, которые могут быть использованы для синтеза новых гетероциклических соединений и в медицине в качестве потенциального антимикробного средстваThe group of inventions relates to the field of organic and medical chemistry, namely to new individual compounds of the class of heterocyclic systems - substituted 3-aryl-5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxides of the general formula I, and the method their preparation, which can be used for the synthesis of new heterocyclic compounds and in medicine as a potential antimicrobial agent
гдеWhere
R=Ph (Ia - 3,5-дифенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = Ph (Ia - 3,5-diphenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=2-СН3С6Н4 (Iб - 3-(2-метилфенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = 2-CH 3 C 6 H 4 (Ib - 3- (2-methylphenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=Bn (Iв - 3-бензил-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = Bn (Ib - 3-benzyl-5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=4-FC6H4 (Iг - 3-(4-фторфенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = 4-FC 6 H 4 (Ig - 3- (4-fluorophenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=4-NO2C6H4 (Iд - 3-(4-нитрофенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = 4-NO 2 C 6 H 4 (Id - 3- (4-nitrophenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=3,5-ди FC6H4 (Ie - 3-(3,5-дифторфенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид).R = 3,5-di FC 6 H 4 (Ie - 3- (3,5-difluorophenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide).
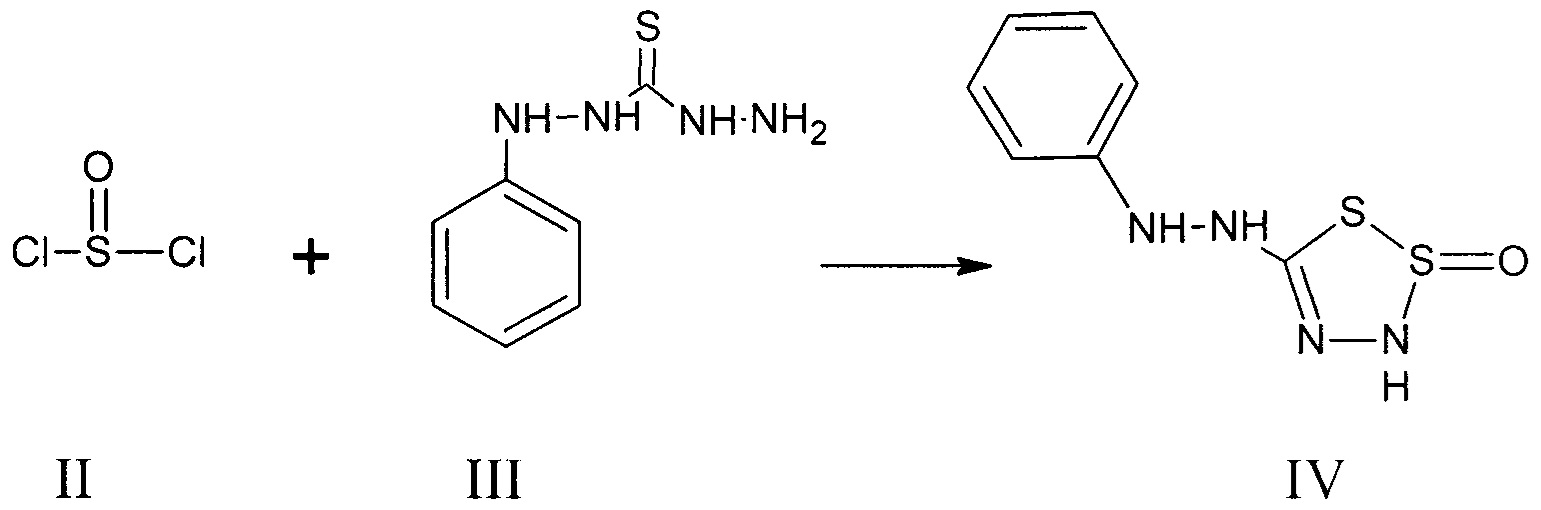
Описаны 5-фенилгидразино-1,2,3,4-дитиадиазол-2-оксида III, которые были получены взаимодействием тионилхлорида (II) и N-фенилтиокарбазида (III).Describes 5-phenylhydrazino-1,2,3,4-dithiadiazole-2-oxide III, which were obtained by the interaction of thionyl chloride (II) and N-phenylthiocarbazide (III).
Реакция, описанная Guha и Roy-Choudhury, является основной для получения 5-фенилгидразино-1,2,3,4-дитиадиазол-2-оксида (IV) [Guha and Roy-Choudhury // J. Indian Chem. Soc., 5, 163 (1928); Chem. Abstr., 23, 1398 (1929)]The reaction described by Guha and Roy-Choudhury, is the main to obtain 5-phenylhydrazino-1,2,3,4-dithiadiazole-2-oxide (IV) [Guha and Roy-Choudhury // J. Indian Chem. Soc., 5, 163 (1928); Chem. Abstr., 23, 1398 (1929)]
В литературе описан 3-фенил-5-фенилазо-1,2,3,4-дитиадиазол-2-оксид (VI), который получали взаимодействием тионилхлорида (II) и соединения (V) [Freund and Wischewiansky // Ber., 26, 2494 (1893)]The literature describes 3-phenyl-5-phenylazo-1,2,3,4-dithiadiazole-2-oxide (VI), which was obtained by the interaction of thionyl chloride (II) and compound (V) [Freund and Wischewiansky // Ber., 26. , 2494 (1893)]
Задачей группы изобретений является создание новых неописанных в литературе соединений - замещенных 3-арил-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксидов (I), что позволит расширить ассортимент потенциальных антимикробных средств.The objective of the group of inventions is to create new compounds not described in the literature - substituted 3-aryl-5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxides (I), which will expand the range of potential antimicrobial agents.
Техническим результатом, на решение которого направлена группа изобретений, является получение нового класса соединений - замещенных 3-арил-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксидов общей формулы I, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в медицине, например, в качестве антимикробных средств; разработка простого способа их получения.The technical result, to which the group of inventions is directed, is to obtain a new class of compounds - substituted 3-aryl-5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxides of the general formula I, which can be used as starting materials for the synthesis of new heterocyclic systems and in medicine, for example, as antimicrobial agents; developing a simple way to obtain them.
Поставленная задача осуществляется путем взаимодействия замещенного N'-арилтиобензгидразида (VII) с тионилхлоридом (II) по схеме:The task is carried out by the interaction of substituted N'-arylthiobenzhydrazide (VII) with thionyl chloride (II) according to the scheme:
гдеWhere
R=Ph (Ia - 3,5-дифенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = Ph (Ia - 3,5-diphenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=2-СН3С6Н4 (Iб - 3-(2-метилфенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = 2-CH 3 C 6 H 4 (Ib - 3- (2-methylphenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=Bn (Iв - 3-бензил-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = Bn (Ib - 3-benzyl-5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=4-FC6H4 (Iг - 3-(4-фторфенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = 4-FC 6 H 4 (Ig - 3- (4-fluorophenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=4-NO2C6H4 (Iд - 3-(4-нитрофенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид);R = 4-NO 2 C 6 H 4 (Id - 3- (4-nitrophenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide);
R=3,5-ди FC6H4 (Iе - 3-(3,5-дифторфенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид).R = 3,5-di FC 6 H 4 (Ie - 3- (3,5-difluorophenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide).
Способ получения замещенных 3-арил-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксидов изучен и проведен в лабораторных условиях на стандартном товарном сырье.The method of obtaining substituted 3-aryl-5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxides was studied and carried out in laboratory conditions using standard commercial raw materials.
Данные элементного анализа приведены в табл. 1, выходы продуктов реакций, температуры плавления и величины Rf приведены в табл. 2, спектральные характеристики полученных соединений сведены в табл. 3 и 4, антимикробная активность в табл. 5.The data of elemental analysis are given in table. 1, the yields of reaction products, melting points and R f values are given in table. 2, the spectral characteristics of the obtained compounds are summarized in table. 3 and 4, antimicrobial activity in the table. 5.
Величины длин связей, валентных и торсионных углов молекулы Iа приведены в таблицах 6, 7, 8 и 9.The values of bond lengths, valence and torsion angles of molecule Ia are shown in tables 6, 7, 8 and 9.
Группа изобретений проиллюстрирована снимком (чертежом) и примерами практического осуществления.The group of inventions is illustrated by a snapshot (drawing) and examples of practical implementation.
На чертеже представлен общий вид молекулы 3,5-дифенил-3Н-1,2,3,4-дитиадиазол-2-оксид (Iа).The drawing shows a General view of the molecule 3,5-diphenyl-3H-1,2,3,4-dithiadiazole-2-oxide (Ia).
Пример 1. 3,5-дифенил-3Н-1,2,3,4-дитиадиазол-2-оксид (Iа)Example 1. 3,5-diphenyl-3H-1,2,3,4-dithiadiazole-2-oxide (Ia)
В грушевидную круглодонную колбу емкостью 50 мл, снабженную магнитной мешалкой, обратным холодильником, загружают 5 мл (69 мМоль) тионилхлорида, постепенно прибавляют 3 г (13 мМоль) N'-фенил-бензтиогидразида, перекристаллизованного из четыреххлористого углерода. Происходит бурное выделение газа, раствор окрашивается в темно-зеленокоричневый цвет. Избыток тионилхлорида отгоняют в вакууме при 45°С. Остаток, светло-желтое вещество, перекристаллизовывают из циклогексана. Выход 2,58 г (86%), Т.пл. 97-98°С, желтоватые игольчатые пушистые кристаллы устойчивые на воздухе.5 ml (69 mmol) of thionyl chloride are charged into a 50 ml pear-shaped round-bottom flask equipped with a magnetic stirrer and reflux condenser, 3 g (13 mmol) of N'-phenylbenzothiohydrazide recrystallized from carbon tetrachloride are gradually added. Rapid gas evolution occurs, the solution turns dark green-brown. The excess thionyl chloride is distilled off in vacuo at 45 ° C. The residue, a light yellow substance, was recrystallized from cyclohexane. Yield 2.58 g (86%), mp. 97-98 ° C, yellowish needle-like fluffy crystals stable in air.
Продукт хроматографически однороден - Rf=0.49 (дихлорметан-тетрахлорметан 1:1).The product is chromatographically homogeneous - R f = 0.49 (dichloromethane-tetrachloromethane 1: 1).
Состав синтезированного соединения подтвержден элементным анализом. Брутто-Формула: C13H10N2OS2. Найдено %: С - 56.96, Н - 3.70, N - 10.17. Вычислено %: С - 56.91, Н - 3.67, N - 10.21.The composition of the synthesized compound is confirmed by elemental analysis. Gross Formula: C 13 H 10 N 2 OS 2 . Found%: C - 56.96, H - 3.70, N - 10.17. Calculated%: C - 56.91, H - 3.67, N - 10.21.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и 13С-спектроскопией.The structure of the synthesized substance was proved by physicochemical methods for the identification of organic compounds: 1 H NMR and 13 C spectroscopy.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов бензольных колец (δ 7.31 (t, J 7.4 Гц, 1H); 7.50-7.57 (m, 5Н); 7,67 (d, J 7,8 Гц, 2Н); 7.88 (m, 2Н)). В спектре отсутствуют сигналы NH групп исходного тиогидразина.The 1 H NMR spectrum of the compound obtained in DMSO-d 6, there are signals of protons of the benzene rings (δ 7.31 (t, J 7.4 Hz, 1H); 7.50-7.57 (m, 5H); 7,67 (d, J 7,8 Hz , 2H); 7.88 (m, 2H)). The spectrum contains no signals of NH groups of the starting thiohydrazine.
Спектр ЯМР 13С этого соединения характеризуется сигналами ядер углерода бензольных колец (δ 126.54-131.44 м.д.), присутствует слабопольный сигнал атома углерода гетероцикла (144,93 м.д.). 13 C NMR spectrum of this compound is characterized by the signals of the nuclei of carbon of benzene rings (δ 126.54-131.44 ppm) downfield signal is present the carbon atom of the heterocycle (144.93 ppm).
Масс-спектрометрия высокого разрешения (HRMS) выполнена с ионизацией электроспреем (ESI). Вычислено для C13H10N2NaOS2 [M+Na]+ 297,3513, найдено 297,3516.High Resolution Mass Spectrometry (HRMS) performed with electrospray ionization (ESI). Calculated for C 13 H 10 N 2 NaOS 2 [M + Na] + 297.3513, found 297.3516.
Структура соединения Iа однозначно установлена на основании данных рентгеноструктурного анализа. Монокристалл соединения Iа был изучен на дифрактометре Xcalibur, Eos. Обработка данных была проведена с помощью программы ShelXS прямым методом и уточнена ShelXL с использованием метода наименьших квадратов.The structure of compound Ia was unambiguously established based on the data of X-ray diffraction analysis. A single crystal of compound Ia was studied on a Xcalibur, Eos diffractometer. Data processing was carried out using the ShelXS program using the direct method and refined by ShelXL using the least squares method.
Пример 2. 3-(2-метилфенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид (Iб)Example 2. 3- (2-methylphenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide (IB)
В грушевидную круглодонную колбу емкостью 50 мл, снабженную магнитной мешалкой, обратным холодильником, загружали 5 мл тионилхлорида, постепенно прибавляли 3 г N'-2-метилфенил-бензтиогидразида, перекристаллизованного из четыреххлористого углерода. Происходит бурное выделение газа, раствор окрашивается в темно-зеленокоричневый цвет. Избыток тионилхлорида отгоняли в вакууме при 45°С. Остаток, светло-желтое вещество, перекристаллизовывали из циклогексана. Выход 2,67 г (89%), Т.пл. 88-89°С, желтоватые игольчатые пушистые кристаллы устойчивые на воздухе.A 50 ml pear-shaped round-bottom flask equipped with a magnetic stirrer and reflux condenser was charged with 5 ml of thionyl chloride, 3 g of N'-2-methylphenyl-benzothiohydrazide recrystallized from carbon tetrachloride were gradually added. Rapid gas evolution occurs, the solution turns dark green-brown. The excess thionyl chloride was distilled off in vacuo at 45 ° C. The residue, a light yellow substance, was recrystallized from cyclohexane. Yield 2.67 g (89%), mp. 88-89 ° С, yellowish needle-like fluffy crystals stable in air.
Пример 3. 3-бензил-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид (Iв)Example 3. 3-benzyl-5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide (Ic)
В грушевидную круглодонную колбу емкостью 50 мл, снабженную магнитной мешалкой, обратным холодильником, загружали 5 мл тионилхлорида, постепенно прибавляли 3 г N'-бензилбензтиогидразида, перекристаллизованного из четыреххлористого углерода. Происходит бурное выделение газа, раствор окрашивается в темно-зеленокоричневый цвет. Избыток тионилхлорида отгоняли в вакууме при 45°С. Остаток, светло-желтое вещество, перекристаллизовывали из циклогексана. Выход 2,31 г (77%), Т.пл. 87-88°С, желтоватые игольчатые пушистые кристаллы устойчивые на воздухе.A 50 ml pear-shaped round bottom flask equipped with a magnetic stirrer and reflux condenser was charged with 5 ml of thionyl chloride, 3 g of N'-benzylbenzothiohydrazide recrystallized from carbon tetrachloride were gradually added. Rapid gas evolution occurs, the solution turns dark green-brown. The excess thionyl chloride was distilled off in vacuo at 45 ° C. The residue, a light yellow substance, was recrystallized from cyclohexane. Yield 2.31 g (77%), mp. 87-88 ° С, yellowish needle-like fluffy crystals stable in air.
Пример 4. 3-(4-фторфенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид (Iг)Example 4. 3- (4-fluorophenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide (Id)
В грушевидную круглодонную колбу емкостью 50 мл, снабженную магнитной мешалкой, обратным холодильником, загружали 5 мл тионилхлорида, постепенно прибавляли 3 г N'-4-фторфенилбензтиогидразида, перекристаллизованного из четыреххлористого углерода. Происходит бурное выделение газа, раствор окрашивается в темно-зеленокоричневый цвет. Избыток тионилхлорида отгоняли в вакууме при 45°С. Остаток, светло-желтое вещество, перекристаллизовывали из циклогексана. Выход 2,49 г (83%), Т.пл. 124-125°С, желтоватые игольчатые пушистые кристаллы устойчивые на воздухе.A 50 ml pear-shaped round bottom flask equipped with a magnetic stirrer and reflux condenser was charged with 5 ml of thionyl chloride, 3 g of N'-4-fluorophenylbenzothiohydrazide recrystallized from carbon tetrachloride were gradually added. Rapid gas evolution occurs, the solution turns dark green-brown. The excess thionyl chloride was distilled off in vacuo at 45 ° C. The residue, a light yellow substance, was recrystallized from cyclohexane. Yield 2.49 g (83%), mp. 124-125 ° C, yellowish needle-like fluffy crystals stable in air.
Пример 5. 3-(4-нитрофенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид (Iд)Example 5. 3- (4-nitrophenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide (Id)
В грушевидную круглодонную колбу емкостью 50 мл, снабженную магнитной мешалкой, обратным холодильником, загружали 5 мл тионилхлорида, постепенно прибавляли 3 г N'-4-нитрофенилбензтиогидразида, перекристаллизованного из четыреххлористого углерода. Происходит бурное выделение газа, раствор окрашивается в темно-зеленокоричневый цвет. Избыток тионилхлорида отгоняли в вакууме при 45°С. Остаток, светло-желтое вещество, перекристаллизовывали из циклогексана. Выход 2,25 г (75%), Т.пл. 163-164°С, желтоватые игольчатые пушистые кристаллы устойчивые на воздухе.A 50 ml pear-shaped round-bottom flask equipped with a magnetic stirrer and reflux condenser was charged with 5 ml of thionyl chloride, 3 g of N'-4-nitrophenylbenziohydrazide recrystallized from carbon tetrachloride were gradually added. Rapid gas evolution occurs, the solution turns dark green-brown. The excess thionyl chloride was distilled off in vacuo at 45 ° C. The residue, a light yellow substance, was recrystallized from cyclohexane. Yield 2.25 g (75%), mp. 163-164 ° C, yellowish needle-like fluffy crystals stable in air.
Пример 6. 3-(3,5-дифторфенил)-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксид (Iе)Example 6. 3- (3,5-difluorophenyl) -5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxide (Ie)
В грушевидную круглодонную колбу емкостью 50 мл, снабженную магнитной мешалкой, обратным холодильником, загружали 5 мл тионилхлорида, постепенно прибавляли 3 г N'-3,5-дифторфенилбензтиогидразида, перекристаллизованного из четыреххлористого углерода. Происходит бурное выделение газа, раствор окрашивается в темно-зеленокоричневый цвет. Избыток тионилхлорида отгоняли в вакууме при 45°С. Остаток, светло-желтое вещество, перекристаллизовывали из циклогексана. Выход 2,52 г (84%), Т.пл. 147-148°С, желтоватые игольчатые пушистые кристаллы устойчивые на воздухе.A 50 ml pear-shaped round-bottom flask equipped with a magnetic stirrer and reflux condenser was charged with 5 ml of thionyl chloride, 3 g of N'-3,5-difluorophenylbenzothiohydrazide recrystallized from carbon tetrachloride were gradually added. Rapid gas evolution occurs, the solution turns dark green-brown. The excess thionyl chloride was distilled off in vacuo at 45 ° C. The residue, a light yellow substance, was recrystallized from cyclohexane. Yield 2.52 g (84%), mp. 147-148 ° C, yellowish needle-like fluffy crystals stable in air.
Пример 8. На примере соединения Iа проверена антимикробная активность.Example 8. The example of compound Ia tested antimicrobial activity.
Определение минимально ингибирующих концентраций (МИК) проводили методом серийных разведений в мясопептонном бульоне в отношении тест-культур микроорганизмов Staphylococcus aureus (штамм 209-Р), Escherichia coli (штамм 1257), Candida albicans (штамм АТСС 885-635), рекомендованных Государственной Фармакопеей [Государственная Фармакопея Российской Федерации XIII издание, Том 2. Метод предельных разведений с последующим высевом на жидкие или полужидкие питательные среды. - Москва, 2015. - С. 650-651]. Исследуемые соединения ограниченно растворяются в воде, поэтому в качестве растворителя использовали 20% раствор ДМСО, не подавляющий роста ни одной из использованных тест-культур в условиях эксперимента. Минимальная ингибирующая концентрация соединения Iа на Е. coli и C. albicans составляет 125 и 62,5 мкг/мл соответственно, а на St. aureus составляет 4 мкг/мл, что находится на уровне широко используемых на практике антибиотиков (эдицин - 10-20 мкг/мл, ванкомицин и тейкопланин - 0,3-12,5 мкг/мл).The minimum inhibitory concentrations (MICs) were determined by serial dilutions in meat and peptone broth for test cultures of microorganisms Staphylococcus aureus (strain 209-P), Escherichia coli (strain 1257), Candida albicans (strain ATCC 885-635) recommended by the State Pharmacopoeia [ The State Pharmacopoeia of the Russian Federation XIII edition,
Получены новые соединения - замещенные 3-арил-5-фенил-3Н-1,2,3,4-дитиадиазол-2-оксиды общей формулы I, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в медицине, например в качестве антимикробных средств. Разработан простой одностадийный способ их синтеза с высоким выходом. Способ занимает мало времени, не требует дорогого оборудования, основан на использовании доступного дешевого сырья.New compounds are obtained — substituted 3-aryl-5-phenyl-3H-1,2,3,4-dithiadiazole-2-oxides of the general formula I, which can be used as starting materials for the synthesis of new heterocyclic systems in medicine, for example as antimicrobial agents. A simple one-step method for their synthesis with a high yield has been developed. The method takes little time, does not require expensive equipment, based on the use of affordable cheap raw materials.
Claims (17)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2016152037A RU2659789C2 (en) | 2016-12-27 | 2016-12-27 | Substituted 3-aryl-5-phenyl-3h-1,2,3,4-dithiadiazole-2-oxides and the method of their production |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2016152037A RU2659789C2 (en) | 2016-12-27 | 2016-12-27 | Substituted 3-aryl-5-phenyl-3h-1,2,3,4-dithiadiazole-2-oxides and the method of their production |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2016152037A RU2016152037A (en) | 2018-06-27 |
| RU2016152037A3 RU2016152037A3 (en) | 2018-06-27 |
| RU2659789C2 true RU2659789C2 (en) | 2018-07-04 |
Family
ID=62713184
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016152037A RU2659789C2 (en) | 2016-12-27 | 2016-12-27 | Substituted 3-aryl-5-phenyl-3h-1,2,3,4-dithiadiazole-2-oxides and the method of their production |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2659789C2 (en) |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU1109396A1 (en) * | 1983-03-11 | 1984-08-23 | Горьковский Ордена Трудового Красного Знамени Политехнический Институт Им.А.А.Жданова | Process for preparing substituted compounds of perhydro-1,2,4,5-dithiadiazine-1,1,4,4-tetroxides |
| US4910019A (en) * | 1989-06-07 | 1990-03-20 | American Home Products Corporation | Oxathiadiazole growth promoters |
-
2016
- 2016-12-27 RU RU2016152037A patent/RU2659789C2/en active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU1109396A1 (en) * | 1983-03-11 | 1984-08-23 | Горьковский Ордена Трудового Красного Знамени Политехнический Институт Им.А.А.Жданова | Process for preparing substituted compounds of perhydro-1,2,4,5-dithiadiazine-1,1,4,4-tetroxides |
| US4910019A (en) * | 1989-06-07 | 1990-03-20 | American Home Products Corporation | Oxathiadiazole growth promoters |
Non-Patent Citations (2)
| Title |
|---|
| База данных СА [онлайн], TSUGE OTOHIKO et al.: "Studies of acyl and thioacyl isocyanates. XV. The reaction of thiobenzoyl isocyanates with N,N`-diphenylsulfur diimide", HETEROCYCLES, 1976, vol.5(1), p.189-194 (), RN 62002-24-8,Найдено в STN, AN 86:106486. * |
| База данных СА [онлайн], TSUGE OTOHIKO et al.: "Studies of acyl and thioacyl isocyanates. XV. The reaction of thiobenzoyl isocyanates with N,N`-diphenylsulfur diimide", HETEROCYCLES, 1976, vol.5(1), p.189-194 (реферат), RN 62002-24-8,Найдено в STN, AN 86:106486. * |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2016152037A (en) | 2018-06-27 |
| RU2016152037A3 (en) | 2018-06-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN111548320B (en) | 1,3,4-oxadiazole hydrazide compounds and preparation method and application thereof | |
| Hameed et al. | Me 3 N-promoted synthesis of 2, 3, 4, 4 a-tetrahydroxanthen-1-one: preparation of thiosemicarbazone derivatives, their solid state self-assembly and antimicrobial properties | |
| CN108314679B (en) | Bactericide containing 1,3, 4-oxadiazole ring stilbene amide and preparation method and application thereof | |
| RU2659789C2 (en) | Substituted 3-aryl-5-phenyl-3h-1,2,3,4-dithiadiazole-2-oxides and the method of their production | |
| CN113563281B (en) | Benzophenone compound containing 1,3, 4-thiadiazole thioether structure and application thereof | |
| US3177224A (en) | N-trichloromethylthiohydantoins | |
| RU2603958C1 (en) | Substituted 2-(1,3-benzothiazol-2-yl)-3-phenyl-1h-1,2,4-triazol-5-yl) propanoic acids and synthesis method thereof | |
| Madar et al. | Synthesis and characterization of coumarin-4-thiazolidinone scaffolds as new class of anti-tuberculosis and antibacterial agents | |
| RU2659574C2 (en) | 6-(3,5-diphenyl-1,3,4-thiadiazol-2(3h)-yliden)-2,4-diphenyl-4h-1,3,4-thiadiazin-5-one and method of its production | |
| RU2809098C1 (en) | Use of n-(4-(trifluoromethyl)phenyl)-[1,1':3',1''-terphenyl]-5'-amine as antibacterial agent against gram-positive microorganisms | |
| RU2808996C1 (en) | Use of n-[(3,5-diphenyl)phenyl]proline methyl ether as antibacterial agent against gram positive microorganisms | |
| DE69315069T2 (en) | PHENYL-SUBSTITUTED CYCLOALKYL HYDROXY URINE DERIVATIVES AS A LIPOXYGENASE INHIBITOR | |
| RU2776071C1 (en) | Application of 13,15- dimethoxy-4,7,14-trimethyl-7-(5-methyl-2-furyl)-3,11-dioxatetracyclo[8.7.0.0 2,6.012,17]heptadec-2(6),4,12,14,16- pentaene as a drug with antimicrobial activity | |
| RU2785141C1 (en) | Application of 1-(6-tosyl-5,6,7,8-tetrahydro-2,6-naphthiridin-3-yl)ethan-1-one as antibacterial agent against gram-positive microorganisms | |
| Singh et al. | Synthesis of some new 1, 3-thiazolyldiphenyl amine derivative and evaluation of their antibacterial effects | |
| RU2809052C1 (en) | Use of (z)-1,2-di([1,1':3',1''-terphenyl]-5'-yl)diazen-1-oxide as an antibacterial agent against gram positive microorganisms | |
| RU2255935C2 (en) | 5,7-disubstituted 4,6-dinitrobenzofuroxane of the general formula c6n4o6(r1)2 eliciting acaricidal and bactericidal activity | |
| RU2776069C1 (en) | Application of 2-[bis(5-methylfuran-2-il)methyl]phenol as an antibacterial agent against gram-positive microorganisms | |
| RU2705183C1 (en) | 2-substituted 5-hydroxypyrano[2,3-d][1,3]oxazine-4,7-diones and a method for production thereof | |
| RU2763735C1 (en) | Application of antimicrobial agent for golden staphylococcus with multiple drug resistance based on 2-((4-r1-5-r2-3-(ethoxicarbonyl)thiophene-2-yl)amino-4-r3-oxo-enoic acids | |
| Siddiqa et al. | Synthesis and antibacterial screening of S-substituted derivatives of 5-(3, 4-methylenedioxyphenyl)-1, 3, 4-oxadiazol-2-thiol. | |
| RU2653511C2 (en) | 4-methyl-n-2,4-dimethylphenyl-6-(3-fluorophenyl)-2-thyoxo-1,2,3,6-tetragydropyrimidine-5-carboxamide that has analgetic action | |
| RU2770598C1 (en) | Application of antifungal agent based on 2-((4-r1-5-r2-3-(ethoxycarbonyl)thiophene-2-il)amino)-4-oxo-4-r3-but-2-eno acids in relation to candida aldicans | |
| RU2809006C1 (en) | Use of 2,4-diphenyl-9h-carbazole as an antifungal agent against yeast fungi | |
| RU2771021C1 (en) | APPLICATION OF 2-[(5-METHYLFURAN-2-yl)PHENYLMETHYL]PHENOL AS AN ANTIBACTERIAL AGENT AGAINST GRAM-POSITIVE MICROORGANISMS |