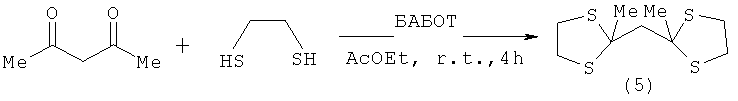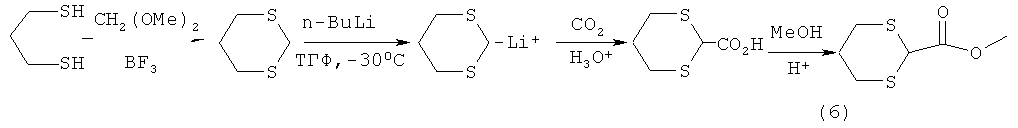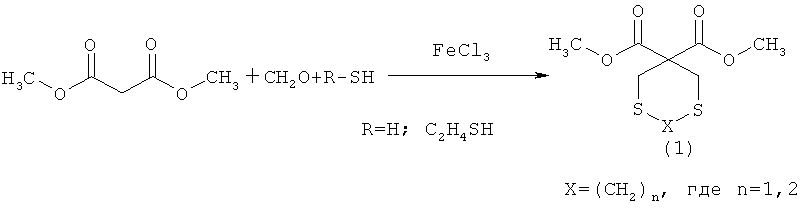RU2529503C2 - Способ получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов - Google Patents
Способ получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов Download PDFInfo
- Publication number
- RU2529503C2 RU2529503C2 RU2012147376/04A RU2012147376A RU2529503C2 RU 2529503 C2 RU2529503 C2 RU 2529503C2 RU 2012147376/04 A RU2012147376/04 A RU 2012147376/04A RU 2012147376 A RU2012147376 A RU 2012147376A RU 2529503 C2 RU2529503 C2 RU 2529503C2
- Authority
- RU
- Russia
- Prior art keywords
- methoxycarbonyl
- dithiacycloalkanes
- fecl
- dimethyl ether
- malonic acid
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims abstract description 21
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 claims abstract description 22
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 claims abstract description 22
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 claims abstract description 20
- VYMPLPIFKRHAAC-UHFFFAOYSA-N 1,2-ethanedithiol Chemical compound SCCS VYMPLPIFKRHAAC-UHFFFAOYSA-N 0.000 claims abstract description 12
- 239000003054 catalyst Substances 0.000 claims abstract description 10
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical compound S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 claims abstract description 7
- UXTMROKLAAOEQO-UHFFFAOYSA-N chloroform;ethanol Chemical compound CCO.ClC(Cl)Cl UXTMROKLAAOEQO-UHFFFAOYSA-N 0.000 claims abstract description 4
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 claims description 13
- 229910000037 hydrogen sulfide Inorganic materials 0.000 claims description 4
- 239000011877 solvent mixture Substances 0.000 claims description 3
- 230000003993 interaction Effects 0.000 abstract description 3
- 239000000203 mixture Substances 0.000 abstract description 3
- 239000002904 solvent Substances 0.000 abstract description 3
- 239000013543 active substance Substances 0.000 abstract description 2
- 125000000217 alkyl group Chemical group 0.000 abstract description 2
- 229910021578 Iron(III) chloride Inorganic materials 0.000 abstract 3
- RBTARNINKXHZNM-UHFFFAOYSA-K iron trichloride Chemical compound Cl[Fe](Cl)Cl RBTARNINKXHZNM-UHFFFAOYSA-K 0.000 abstract 3
- 239000000126 substance Substances 0.000 abstract 1
- 238000006243 chemical reaction Methods 0.000 description 8
- WQADWIOXOXRPLN-UHFFFAOYSA-N 1,3-dithiane Chemical class C1CSCSC1 WQADWIOXOXRPLN-UHFFFAOYSA-N 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- -1 lithium aluminum hydride Chemical compound 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- UNMGXVRDKDPTNK-UHFFFAOYSA-N 5-methyl-1,3-dithiane Chemical compound CC1CSCSC1 UNMGXVRDKDPTNK-UHFFFAOYSA-N 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- YRKCREAYFQTBPV-UHFFFAOYSA-N acetylacetone Chemical compound CC(=O)CC(C)=O YRKCREAYFQTBPV-UHFFFAOYSA-N 0.000 description 4
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- JGFWAJMNRMRNJW-UHFFFAOYSA-N dimethyl 1,4-dithiepane-6,6-dicarboxylate Chemical compound COC(=O)C1(C(=O)OC)CSCCSC1 JGFWAJMNRMRNJW-UHFFFAOYSA-N 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 238000006719 thioacetalization reaction Methods 0.000 description 3
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N 1,1-dimethoxyethane Chemical compound COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 2
- 150000004889 1,3-dithianes Chemical class 0.000 description 2
- IMLSAISZLJGWPP-UHFFFAOYSA-N 1,3-dithiolane Chemical compound C1CSCS1 IMLSAISZLJGWPP-UHFFFAOYSA-N 0.000 description 2
- UFEDUSRDUHKQFT-UHFFFAOYSA-N 2-methyl-2-[(2-methyl-1,3-dithiolan-2-yl)methyl]-1,3-dithiolane Chemical compound S1CCSC1(C)CC1(C)SCCS1 UFEDUSRDUHKQFT-UHFFFAOYSA-N 0.000 description 2
- RNJOKCPFLQMDEC-UHFFFAOYSA-N 4(R),8-dimethyl-trans-2-nonenoyl-CoA Chemical compound COC(=O)CC(=O)CC(=O)OC RNJOKCPFLQMDEC-UHFFFAOYSA-N 0.000 description 2
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 2
- KZMGYPLQYOPHEL-UHFFFAOYSA-N Boron trifluoride etherate Chemical compound FB(F)F.CCOCC KZMGYPLQYOPHEL-UHFFFAOYSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 229910004298 SiO 2 Inorganic materials 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 150000001241 acetals Chemical class 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 2
- 150000001728 carbonyl compounds Chemical class 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- MGOHDRDYKIDCRG-UHFFFAOYSA-N dimethyl 1,3-dithiane-5,5-dicarboxylate Chemical compound COC(=O)C1(C(=O)OC)CSCSC1 MGOHDRDYKIDCRG-UHFFFAOYSA-N 0.000 description 2
- 238000002329 infrared spectrum Methods 0.000 description 2
- 238000001819 mass spectrum Methods 0.000 description 2
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 2
- KAXSFBNZPWBKDH-UHFFFAOYSA-N methyl 1,3-dithiane-2-carboxylate Chemical compound COC(=O)C1SCCCS1 KAXSFBNZPWBKDH-UHFFFAOYSA-N 0.000 description 2
- 235000011056 potassium acetate Nutrition 0.000 description 2
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 1
- XMEPRJBZFCWFKN-UHFFFAOYSA-N 1,3-Butanedithiol Chemical compound CC(S)CCS XMEPRJBZFCWFKN-UHFFFAOYSA-N 0.000 description 1
- GVNVAWHJIKLAGL-UHFFFAOYSA-N 2-(cyclohexen-1-yl)cyclohexan-1-one Chemical compound O=C1CCCCC1C1=CCCCC1 GVNVAWHJIKLAGL-UHFFFAOYSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 101150065749 Churc1 gene Proteins 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- VWBYXJRDIQCSLW-UHFFFAOYSA-N O=[P](c1ccccc1)c1ccccc1 Chemical group O=[P](c1ccccc1)c1ccccc1 VWBYXJRDIQCSLW-UHFFFAOYSA-N 0.000 description 1
- 102100038239 Protein Churchill Human genes 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 1
- 239000012300 argon atmosphere Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 239000003694 chemoselective catalyst Substances 0.000 description 1
- 239000008139 complexing agent Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 150000004662 dithiols Chemical class 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000005265 energy consumption Methods 0.000 description 1
- DUYAAUVXQSMXQP-UHFFFAOYSA-N ethanethioic S-acid Chemical compound CC(S)=O DUYAAUVXQSMXQP-UHFFFAOYSA-N 0.000 description 1
- XYIBRDXRRQCHLP-UHFFFAOYSA-N ethyl acetoacetate Chemical compound CCOC(=O)CC(C)=O XYIBRDXRRQCHLP-UHFFFAOYSA-N 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 244000053095 fungal pathogen Species 0.000 description 1
- 230000000855 fungicidal effect Effects 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- ZIYVHBGGAOATLY-UHFFFAOYSA-N methylmalonic acid Chemical compound OC(=O)C(C)C(O)=O ZIYVHBGGAOATLY-UHFFFAOYSA-N 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- JPJIEXKLJOWQQK-UHFFFAOYSA-K trifluoromethanesulfonate;yttrium(3+) Chemical compound [Y+3].[O-]S(=O)(=O)C(F)(F)F.[O-]S(=O)(=O)C(F)(F)F.[O-]S(=O)(=O)C(F)(F)F JPJIEXKLJOWQQK-UHFFFAOYSA-K 0.000 description 1
- 239000003039 volatile agent Substances 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
- VWQVUPCCIRVNHF-UHFFFAOYSA-N yttrium atom Chemical compound [Y] VWQVUPCCIRVNHF-UHFFFAOYSA-N 0.000 description 1
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
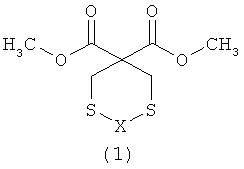
Изобретение относится к области органической химии, в частности к способу получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов общей формулы (I):
Х=(СН2)n, где n=1, 2,
заключающийся в том, что формальдегид (37%) подвергают взаимодействию с сероводородом или 1,2-этандитиолом и диметиловым эфиром малоновой кислоты в присутствии катализатора FeCl3 при мольном соотношении СН2О : сероводород : диметиловый эфир малоновой кислоты: FeCl3=3:2:1:(0.03-0.07) или СН2О : 1,2-этандитиол : диметиловый эфир малоновой кислоты: FeCl3=2:1:1:(0.03-0.07), при комнатной температуре (~20°С) и атмосферном давлении в течение 6-9 ч в смеси растворителей хлороформ-этанол (объемн. 1:1). Технический результат: разработан способ получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов, которые могут найти широкое применение в качестве биологически активных веществ. 1 табл., 1 пр.
Description
Предлагаемое изобретение относится к области органической химии, в частности, к способу получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов общей формулы (1):
X=(CH2)n где n=1,2
Подобные 0,8-содержащие гетероциклические соединения могут найти применение в качестве биологически активных веществ, обладающих фунгицидной активностью по отношению к патогенным грибам, а также селективных экстрагентов и комплексообразователей переходных металлов [J.Zabicky. The Chemistry of Metal Enolates (Chemistry of Functional Groups). 2009, Interscience, Part 1, 1249 p.; S.Schuiz, J.S.Dickschat, B.Kunze, I.Wagner-Dobler and other. Biological activity of volatiles from marine and terrestrial bacteria. Mar. Drugs, 2010, 8, p.2976-2987].
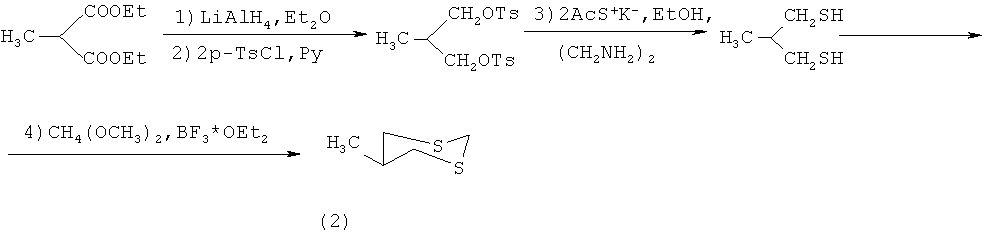
Известен четырехстадийный способ [Е.Juaristi, L.Valle, В.А.Valenzuela and M.A.Aguilar. S-C-P Anomeric Interactions. 4. Conformational Analysis of 2-(Diphenylphosphinoyl)-1,3-ditiane. J. Am. Chem. Soc., 1986, p.2000-2005] получения 5-метил-1,3-дитиана (2) взаимодействием диэтилового эфира 2-метилмалоновой кислоты с алюмогидридом лития в присутствии диэтилового эфира, затем с p-TsCl в пиридине с образованием тозилата 3-метилпропан-1,3-диола, который под действием калиевой соли ацетилмеркаптана в этаноле и этилендиамине превращается в 3-метилпропан-1,3-дитиол. На последней стадии под действием диметилацеталь формаля в присутствии эфирата трехфтористого бора образуется 5-метил-1,3-дитиан (2) с выходом 67% по схеме:
Известный способ не позволяет получать 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканы общей формулы (1).
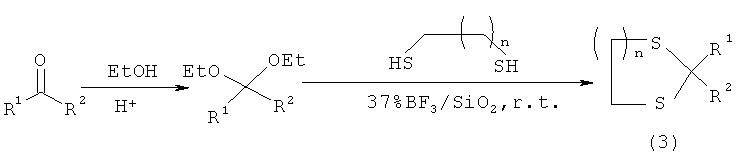
Известен способ [B.B.F.Mirjalili, A.Bamoniri, A.Akbari. Nano-BFs/SiO2: A reusable and eco-friendly catalyst for thioacetalization and trans-thioacetalization reactions. Iranian Journal of catalysis, 2011, 1(2), p.87-92] получения производных 1,3-дитиолана и 1,3-дитиана (3) реакцией транстиоацетализации ацеталей в присутствии ВР3, нанесенного на наночастицы SiO2, в растворителях CH2Cl2 или СНСl2 при комнатной температуре с выходом 83-94%, по схеме:
n=1,2
R1=Ph; 4-NO2-С6Н4; 4-Сl-С6Н4; 3-Вr-С6H4; 4-Вr-С6Н4; 2,6-di-Cl-С6Н3; 4-ОН-С6Н4; 4-Сl-С6Н4; 3,4-di-OH-C6H3
R2=Н; СН3
Известным способом не могут быть получены 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканы общей формулы (1).
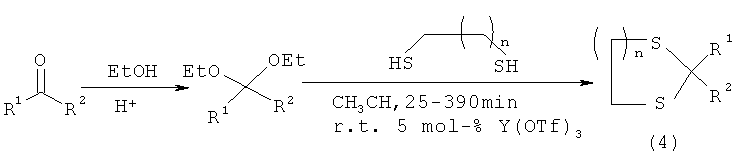
Известен аналогичный вышеописанному хемоселективный способ [S.K.De. Yttrium triflate as an efficient and useful catalyst for chemoselective protection of carbonyl compounds. Tetrahedron Lett., 2004, 45, p.2339-3241] получения производных 1,3-дитиолана и 1,3-дитиана (4) реакцией ацеталей с дитиолом в присутствии каталитического количества иттрия трифталата в среде ацетонитрила, при комнатной температуре, в течение 25-390 мин с выходом 83-93% по схеме:
R1=4-NO2-С6Н4; 4-МеО-С6Н4; С6Н11; C5H12; Ph; Ph-C2H2;
R2=H; СН3
Известный способ не позволяет получать 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканы общей формулы (1).
Известен способ [S.A.Pourmousavia, M.Hadavandkhani. Preparation of 1-benzyl-4-aza-l-azoniabicyclo[2.2.2]octane tribromide and its application as a mild and chemoselective catalyst for thioacetalization of carbonyl compounds. Journal of Sulfur Chemistry, 2009, vol.30, №1, p.37-45] получения бис-(2-метил-1,3-дитиолан-2-ил)метана (5) взаимодействием ацетилацетона с 1,2-этандитиолом в присутствии каталитического количества 1-бензил-4-аза-1-азониабицикло[2.2.2]-октана трибромида (БАБОТ) в среде этилацетата, в течение 4 ч, при комнатной температуре с выходом 90% по схеме:
Известным способом не могут быть получены 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканы общей формулы (1).
Известен способ [D.Seebach, E.J. Согеу, Generation and synthetic applications of 2-lithio-l,3-dithianes. J. Org. Chem., 1975, 40, p.231-237] получения метил-1,3-дитиан-2-ил-формиата (6) через промежуточное литий производное-1,3-дитиана, которое образуется при действии бутил лития на 1,3-дитиан в тетрагидрофуране при -30°С по схеме:
Известный способ не позволяет получать 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканы общей формулы (1).
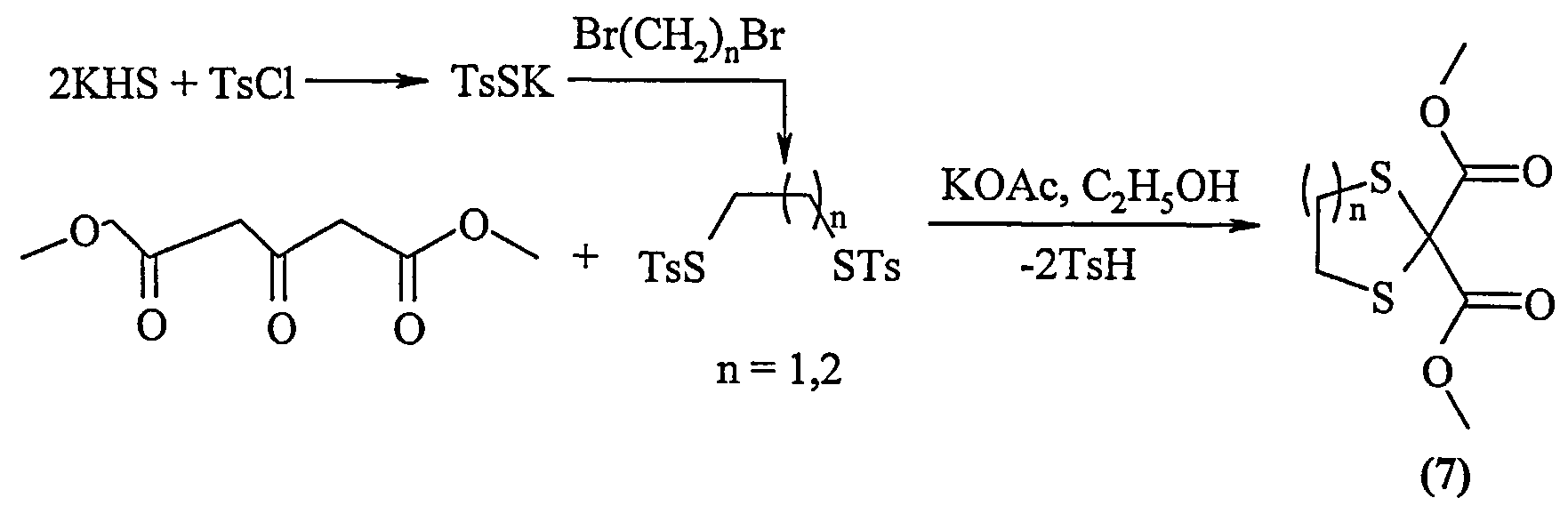
Известен способ [R.B.Woodward, I.J.Pachter, M.L.Scheinbaum. Dithiotosylates as reagents in organic synthesis. J.Org. Chem. 1971, vol. 36, №8, p.1137-1139] получения 1,3-дитиолан-2,2-диметоксикарбонила и 1,3-дитиан-2,2-диметоксикарбонила (7) реакцией 1,3-ди(метоксикарбонил)ацетона с дитиотозилатами в присутствии ацетата калия в среде этанола в течение 8 ч с выходом 68-71% по схеме:
Известным способом не могут быть получены 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканы общей формулы (1).
Таким образом, в литературе отсутствуют сведения по получению 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов общей формулы (1).
Предлагается новый способ получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов общей формулы (1).
Сущность способа заключается во взаимодействии формальдегида (37%) с сероводородом (H2S) или 1,2-этандитиолом и диметиловым эфиром малоновой кислоты (ДМЭМК) в присутствии катализатора FeCl3, взятыми в мольном соотношении СН2О: сероводород: ДМЭМК: FеС13=3:2:1: (0.03-0.07), предпочтительно 3:2:1: 0.05 или СН2О: 1,2-этандитиол: ДМЭМК: FеСl3=2:1:1: (0.03-0.07), предпочтительно 2:1:1: 0.05, в растворителе СНСl3: С2Н5OН (объемн. 1:1), при комнатной температуре (~20°С) и атмосферном давлении в течение 6-9 ч, предпочтительно 8 ч. Выход 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов общей формулы (1) составляет 63-83%. Реакция протекает по схеме:
3,3-Ди(метоксикарбонил)-1,5-дитиациклоалканы общей формулы (1) образуются только лишь с участием формальдегида, сероводорода (1,2-этандитиола) и диметилового эфира малоновой кислоты, взятыми в стехиометрическом соотношении 3(2):2(1):1. При другом соотношении исходных реагентов снижается селективность реакции. В присутствии других альдегидов (например, алкил-, арилзамещенные альдегиды), других 1,3-дикарбонильных соединений (например, ацетилацетон, ацетоуксусный эфир), а также в отсутствии катализатора, целевые продукты общей формулой (1) не образуются.
Проведение указанной реакции в присутствии катализатора FеСl3 больше 7 мол.% не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора FеСl3 менее 3 мол.% снижает выход (1). Реакции проводили при комнатной температуре (~20°С). При температуре выше 20°С (например, 70°С) увеличиваются энергозатраты, а при температуре ниже 20°С (например, 0°С) снижается скорость реакции. Опыты проводили в смеси растворителей хлороформ-этанол (1:1 объемн.), т.к. в указанной смеси хорошо растворяются исходные реагенты и целевые продукты (1).
Существенные отличия предлагаемого способа.
В предлагаемом способе в качестве исходных реагентов применяются диметиловый эфир малоновой кислоты, формальдегид, Н2S или 1,2-этандитиол, а в качестве катализатора - FеСl3. Способ позволяет получать однореакторным методом 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканы общей формулы (1). В известном способе синтеза 1,3-дитиациклоалканов в качестве исходных реагентов применяются 1,3-ди(метоксикарбонил)ацетон, дитиотозилаты, которые синтезируют в несколько стадий, а в качестве катализатора применяется ацетат калия.
Способ поясняется следующими примерами/
Пример 1: В стеклянный реактор, установленный на магнитной мешалке, снабженный газоподводящей трубкой при комнатной температуре (~20°С) помещают 2.21 мл (30 ммоль) формальдегида (37% водный раствор), насыщают сероводородом (20 ммоль) в течение 30 мин, добавляют 1.5 мл СНСl3 и 1.5 мл С2Н5OН, 1.32 г (10 ммоль) диметилового эфира малоновой кислоты и 0.0081 г (0.05 ммоль) FеСl3, перемешивают при ~20°С в течение 8 ч. Из реакционной массы выделяют 3,3-ди(метоксикарбонил)-1,5-дитиациклогексан с выходом 72%.
Пример 2: В сосуд Шленка, установленный на магнитной мешалке, в атмосфере аргона при комнатной температуре (~20°С) помещают 1.47 мл (20 ммоль) формальдегида (37% водный раствор), 0.94 г (10 ммоль) 1,2-этандитиола и перемешивают в течение 30 мин, добавляют 1.5 мл СНСl3 и 1.5 мл С2Н5OН, 1.32 г (10 ммоль) диметилового эфира малоновой кислоты и 0.0081 г (0.05 ммоль) FеСl3, перемешивают при -20°С в течение 8 ч. Из реакционной массы выделяют 3,3-ди(метоксикарбонил)-1,5-дитиациклогептан с выходом 77%.
Другие примеры, подтверждающие способ, приведены в таблице:
| № п/п | Исходный Н2S или 1,2-этандитиол | Соотношение ДМЭМК: формальдегид: H2S или 1,2-этандитиол: FеСl3, ммоль | Время реакции, ч | Выход (1), % |
| 1 | H2S | 1:3:2:0.05 | 8 | 72 |
| 2 | 1,2-этандитиол | 1:2:1:0.05 | 8 | 77 |
| 3 | 1:2:1:0.03 | 8 | 63 | |
| 4 | 1:2:1:0.07 | 8 | 83 | |
| 5 | 1:2:1:0.05 | 6 | 68 | |
| 6 | 1:2:1:0.05 | 9 | 80 |
Все опыты проводили в смеси растворителей хлороформ-этанол (1:1 объемн.) при комнатной температуре (~20°С).
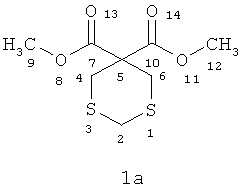
Спектральные характеристики соединений (1а,б).
3,3-Ди(метоксикарбонил)-1,5-дитиациклогексан (1а)
Масло желтого цвета. Rf=0.45
ИК-спектр (ν,cм-1): 714(C-S), 1025(C-O), 1419(CH2-), 1681(C=O), 3534 (O-Н).
Спектр ЯМР 1H (δ, м.д., J, Гц): 3.56 (с, 4Н, CH2 (4,6)); 3.74 (с, 6Н, СН3 (9,12));4.11(с,2Н,СН2(2)).
Спектр ЯМР 13С (δ, м.д.): 29.69 (С-4,6); 38.48 (С-2); 53.70 (С-9,12); 64.66 (С-5); 169.20 (С-7,10).
Масс-спектр, m/z (Iотн (%)): 236 [М]+ (6); 205 [М-СН3О]+ (8); 192 [М-CH3OCH]+(27); 173 (10); 159 [M-SCHS]+ (27); 147 [М-СН2CH2СООСН3]+ (64); 131 [M-CH2SCP2SCH]+ (66); 114 [М-СH2SCH2SСНОН]+ (72); 101 [M-CH2SCH2 CH2COOHCH3+2H]+(33); 87 [М-СН3ОСОСН2CH2SCH2О]+ (69); 77 [СН3ОСО СНСН2СН2СООСН3]+ (8); 55 (100). Найдено (%): С, 40.10; Н, 5.07; S, 27.00. C8H12O4S2. Мтеор=236. Вычислено (%): С, 40.66; Н, 5.12; S, 27.14.
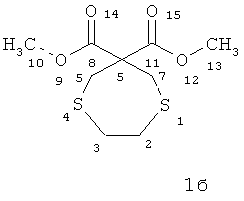
3,3-Ди(метоксикарбонил)-1,5-дитиациклогептан (1б)
Масло желтого цвета. Rf=0.48
ИК-спектр (ν,см-1): 702(C-S), 1031(С-O), 1436(СН2-), 1734(С=O), 3465 (O-Н).
Спектр ЯМР 1H (δ, м.д., J, Гц): 2.72 и 2.85 (м, 4Н, СН2 (2,3)); 3.05 и 3.19 (м, 4Н, СН2(5,7)); 3.61 (с, 6Н, СН3 (10,13)).
Спектр ЯМР 13С (δ, м.д.): 30.25 и 32.28 (С-5,7); 36.51 (С-2,3); 52.97 (С-10,13); 66.49 (С-6); 169.86 (С-8,11).
Масс-спектр, m/z (Iотн (%)): 251 [M+H]+(6); 238 [М-СН]+ (24); 204 [М-CH3S]+(48); 189 (28); 179 [М-CH2CH2SCH2C]+ (61); 159 [M-SCH2CH2S]+(44); 145 [M-SCH2CH2SСН2]+ (100); 132 [М-СН2СН2SСН2СООСН3]+ (33); 113 (72); 87 [СН3СООСН2СН2]+ (67); 73 [CH2CH2SCH2CH]+(69); 61 (54); 55 [М-СН3ОС=С] (57). Найдено (%): С, 42.15; Н, 6.11; S, 25.87. C9H14O4S2. Мтеор=250. Вычислено (%): С, 43.18; Н, 5.64; S, 25.62.
Claims (1)
- Способ получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов общей формулы (I):
Х=(СН2)n, где n=1, 2,
отличающийся тем, что формальдегид (37%) подвергают взаимодействию с сероводородом или 1,2-этандитиолом и диметиловым эфиром малоновой кислоты в присутствии катализатора FeCl3 при мольном соотношении СН2О : сероводород : диметиловый эфир малоновой кислоты : FeCl3=3:2:1:(0.03-0.07) или СН2О : 1,2-этандитиол : диметиловый эфир малоновой кислоты : FeCl3=2:1:1:(0.03-0.07), при комнатной температуре (~20°С) и атмосферном давлении в течение 6-9 ч в смеси растворителей хлороформ-этанол (объемн. 1:1).
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2012147376/04A RU2529503C2 (ru) | 2012-11-07 | 2012-11-07 | Способ получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2012147376/04A RU2529503C2 (ru) | 2012-11-07 | 2012-11-07 | Способ получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012147376A RU2012147376A (ru) | 2014-05-20 |
| RU2529503C2 true RU2529503C2 (ru) | 2014-09-27 |
Family
ID=50695395
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2012147376/04A RU2529503C2 (ru) | 2012-11-07 | 2012-11-07 | Способ получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2529503C2 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2551680C2 (ru) * | 2013-10-15 | 2015-05-27 | Федеральное Государственное Бюджетное Учреждение Науки Институт Нефтехимии И Катализа Ран | Способ получения дисульфанилтетрациклоалкенов |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3705908A (en) * | 1971-06-28 | 1972-12-12 | Minnesota Mining & Mfg | Process for preparing 2-formyl-2-lower alkyl 1,3-dithiolanes and 1,3-dithianes |
| SU586174A1 (ru) * | 1976-04-26 | 1977-12-30 | Уфимский Нефтяной Институт | Способ получени 1,3-дитиациклоалканов |
| RU2368607C2 (ru) * | 2007-09-11 | 2009-09-27 | Институт нефтехимии и катализа РАН | Способ получения 1-(5-бензоил-1,3-дитиан-5-ил)-1-этанона |
-
2012
- 2012-11-07 RU RU2012147376/04A patent/RU2529503C2/ru not_active IP Right Cessation
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3705908A (en) * | 1971-06-28 | 1972-12-12 | Minnesota Mining & Mfg | Process for preparing 2-formyl-2-lower alkyl 1,3-dithiolanes and 1,3-dithianes |
| SU586174A1 (ru) * | 1976-04-26 | 1977-12-30 | Уфимский Нефтяной Институт | Способ получени 1,3-дитиациклоалканов |
| RU2368607C2 (ru) * | 2007-09-11 | 2009-09-27 | Институт нефтехимии и катализа РАН | Способ получения 1-(5-бензоил-1,3-дитиан-5-ил)-1-этанона |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2551680C2 (ru) * | 2013-10-15 | 2015-05-27 | Федеральное Государственное Бюджетное Учреждение Науки Институт Нефтехимии И Катализа Ран | Способ получения дисульфанилтетрациклоалкенов |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2012147376A (ru) | 2014-05-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Terent'ev et al. | Phosphomolybdic and phosphotungstic acids as efficient catalysts for the synthesis of bridged 1, 2, 4, 5-tetraoxanes from β-diketones and hydrogen peroxide | |
| US20080171893A1 (en) | Isotopically labeled alpha-keto acids and esters | |
| JP6213417B2 (ja) | 2,2−ジフルオロアセトアルデヒドの保存安定性の向上方法 | |
| RU2529503C2 (ru) | Способ получения 3,3-ди(метоксикарбонил)-1,5-дитиациклоалканов | |
| RU2466999C1 (ru) | СПОСОБ ПОЛУЧЕНИЯ α,ω-БИС-(1,5,3-ДИТИАЗЕПИНАН-3-ИЛ)АЛКАНОВ | |
| RU2494102C1 (ru) | Способ получения замещенных 2,3,5,6-тетраоксабицикло[2.2.1]гептанов | |
| Narra et al. | Lewis-acid catalyzed synthesis and characterization of novel castor fatty acid-based cyclic carbonates | |
| RU2368607C2 (ru) | Способ получения 1-(5-бензоил-1,3-дитиан-5-ил)-1-этанона | |
| Nakai et al. | Tri (hetero) substituted Carbonium Ions. I. Neighboring-Group Participation of the N, N-Dimethyldithiocarbamate Function Involving the Intermediacy of 2-Dimethylamino-1, 3-dithiolanylium Ion | |
| RU2467000C1 (ru) | Способ получения 3-арил-тетрагидро-2н,6н-1,5,3-дитиазоцинов | |
| RU2466998C1 (ru) | СПОСОБ ПОЛУЧЕНИЯ 3-(о-,м-,п-МЕТОКСИФЕНИЛ)-1,5,-3-ДИТИАЗЕПАНОВ | |
| Grisin et al. | Diastereoselective construction of anti-4, 5-disubstituted-1, 3-dioxolanes via a bismuth-mediated two-component hemiacetal oxa-conjugate addition of γ-hydroxy-α, β-unsaturated ketones with paraformaldehyde | |
| Oparina et al. | Chemo-and regioselective reaction of vinyl furfuryl ethers with alcohols | |
| RU2556009C1 (ru) | СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИАЛКИЛ-ГЕКСАГИДРО-1Н,5Н-2,3А,4А,6,7А,8А-ГЕКСААЗАЦИКЛОПЕНТА[def]ФЛУОРЕН-4,8-ДИОНОВ | |
| RU2605450C2 (ru) | СПОСОБ ПОЛУЧЕНИЯ α-[(ПЕНТАН-2,4-ДИОН-3-ИЛ)МЕТОКСИ]-ω-[(ПЕНТАН-2,4-ДИОН-3-ИЛ)МЕТИЛСУЛЬФАНИЛ]АЛКАНОВ | |
| RU2551680C2 (ru) | Способ получения дисульфанилтетрациклоалкенов | |
| RU2541796C2 (ru) | Способ получения бис-(3-метоксибензамидил)-тетратиадиазациклоалканов | |
| RU2559367C2 (ru) | Способ получения (1,5,3-дитиазепан-3-ил)-алкандиолов | |
| RU2536205C2 (ru) | Способ получения 5-метоксикарбонил-1,3-дитиана, обладающего фунгицидной активностью | |
| RU2467001C1 (ru) | СПОСОБ ПОЛУЧЕНИЯ 3-(о-,м-,п-МЕТОКСИФЕНИЛ)-ТЕТРАГИДРО-2Н,6Н-1,5,3-ДИТИАЗОЦИНОВ | |
| Makhmutov | Photocatalytic Synthesis of 1, 3-Dioxacyclanes from Diols and Primary Alcohols Effected by a System FeCl3–NaNO2/O2 (Air) | |
| RU2478627C2 (ru) | Способ получения 2- и 4-(1,5,3-дитиазоцинан-3-ил)фенолов | |
| Wuitschik et al. | 13 Oxetan-3-one: Chemistry and Synthesis | |
| Shajari et al. | Vinyltriphenylphosphonium salt-mediated preparation of thiophene-containing electron-poor alkenes from acetylenic esters, 2-thienylmethanol and triphenylphosphine | |
| RU2523012C1 (ru) | Способ получения n-замещенных 2,5-дитиоцианато-1н-пирролов |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20141108 |